2'-замещенные 1,1'-бифенил-2-карбонамиды, способы их получения, их применение в качестве лекарственного средства, а также содержащие их фармацевтические композиции - RU2252214C2
Код документа: RU2252214C2
Описание
Изобретение относится к соединениям формулы (I):

где R(1), R(2), R(3), R(4), R(5), R(6), R(7), R(8), R(30) и R(31) имеют нижеуказанные значения, их получению и их применению, в особенности, в лекарственных средствах.
Предлагаемые согласно изобретению соединения формулы (I) до сих пор не были известны. Они воздействуют на так называемый Kv1.5-калиевый канал и ингибируют обозначаемый как "сверхбыстро активирующийся замедленный очиститель" калиевый ток в человеческом предсердии. Соединения поэтому в высшей степени пригодны в качестве нового рода антиаритмических биологически активных веществ, в особенности для лечения и профилактики аритмий предсердий, как, например, мерцание предсердий (фибрилляция предсердий, AF) или трепетание предсердий (предсердные трепетания).
Фибрилляция предсердий (AF) и трепетание предсердий представляют собой чаще всего встречающиеся мерцательные аритмии. Их появление с возрастом возрастает и часто приводит к фатальным последствиям, как, например, апоплексия. AF поражает примерно 1 миллион американцев ежегодно и приводит к более чем 80000 апоплексических ударов каждый год в США. Принятые в настоящее время антиаритмические средства класса I и класса III снижают частоту повторного появления AF, однако из-за их потенциальных проаритмических побочных действий находят только ограниченное применение. Вследствие этого в медицине существует большая потребность в получении лучших лекарственных средств для лечения мерцательных аритмий (S.Nattel, Am. Heart J., 130, 1094-1106 (1995); "Newer (developments in the management of atrial fibrillation").
Показано, что большинство суправентрикулярных аритмий зависимы от так называемых "циркулирующих" волн возбуждения. Такая циркуляция наступает тогда, когда ткань сердца обладает медленной проводимостью и одновременно очень короткими рефракторными периодами. Увеличение миокардиального рефракторного времени за счет удлинения потенциала действия является признанным механизмом для прекращения аритмий или, соответственно, для предотвращения их возникновения (T.J.Colatsky и др., Drug Dev. Res., 19, 129-140 (1990): "Potassium channels as targets for antiarrhythmic drug action"). Продолжительность потенциала действия по существу определяется объемом реполяризующих K+-токов, которые вытекают через различные К+-каналы из клетки. Особенно большое значение при этом приписывается так называемому "замедленному очистителю" Ik, который состоит из трех различных компонентов: IKr, IKs и IKur.
Большинство известных антиаритмических средств класса III (например, дофетилид, Е4031 и d-соталол) блокируют преобладающе или исключительно быстро активирующийся калиевый канал IKr, который может находиться как в клетках желудочка человека, так и также в предсердии. Однако оказалось, что эти соединения при незначительных или нормальных частотах сердечных сокращений обладают повышенным проаритмическим риском, причем в особенности наблюдают аритмии, обозначаемые как пируэтная тахикардия (D.M.Roden, Am. J.Cardiol. 72, 44B-49B (1993): "Current status of class III antiarrhythmic drug therapy"). Наряду с этим высоким, отчасти смертельным риском при низкой частоте, для IKr-блокаторов установлено ослабление активности в условиях тахикардии, при которой непосредственно необходимо действие ("отрицательная зависимость от использования").
В то время как некоторые из этих недостатков, пожалуй, можно преодолеть за счет блокаторов медленно активирующегося компонента (IKs), их эффективность до сих пор не доказана, так как неизвестны никакие клинические исследования с блокаторами IKs-каналов.
"Особенно быстро" активирующийся и очень медленно инактивирующийся компонент замедленного очистителя IKur (=сверхбыстро активирующийся замедленный очиститель), который соответствует Kv1.5-каналу, играет особенно большую роль в отношении продолжительности реполяризации в человеческом предсердии. Ингибирование направленного к периферии калиевого тока IKur по сравнению с ингибированием IKr или, соответственно, IKs, таким образом, представляет собой особенно эффективный метод удлинения предсердного потенциала действия и тем самым прекращения, соответственно, предотвращения мерцательных аритмий. Математическая модель человеческого потенциала действия показывает, что положительный эффект блокады IKur должен быть особенно выражен непосредственно в патологических условиях хронической фибрилляции предсердий (М.Courtemanche, R.J.Ramirez, S.Nattel, Cardiovascular Research, 42, 477-489 (1999): "Ionic targets for drug therapy and atrial fibrillation-induced electrical remodeling: insights from a mathematical model").
В противоположность IKr и IKs, которые также находятся в желудочке человека, IKur, правда, играет значительную роль в человеческом предсердии, но не в желудочке. На этом основании при ингибировании IKur-тока, в противоположность блокаде IKr или IKs, с самого начала исключен риск проаритмического воздействия на желудочек (Z.Wang и др., Circ. Res. 73, 1061-1076 (1993): "Sustained Depolarisation-Induced Outward Current in Human Atrial Myocytes"; G.-R. Li и др., Circ. Res., 78, 689-696 (1996): "Evidence for Two Components of Delayed Rectifier K+-Current in Human Ventricular Myocytes"; G.J.Amos и др., J.Physiol., 491, 31-50 (1996): "Differences between outward currents of human atrial and subepicardial ventricular myocytes").
Антиаритмические средства, которые действуют путем селективной блокады IKur-тока или Kv1.5-канала, до сих пор, однако, отсутствуют в продаже. Для многочисленных фармацевтических биологически активных веществ (как, например, тедисамил, бупивакаин или сертиндол), правда, описано блокирующее воздействие на Kv1.5-канал, однако Kv1.5-блокада в этом случае, соответственно, представляет собой только побочное действие наряду с другими основными действиями веществ.
В заявке WO-9804521 заявлены аминоинданы как блокаторы калиевых каналов, которые блокируют Kv1.5-канал. В заявках WO-9818475 и WO-9818476 описывается применение различных пиридазинонов и фосфиноксидов в качестве антиаритмических средств, которые должны воздействовать путем блокады IKur. Такие же соединения первоначально описаны, однако, также в качестве иммуносупрессоров (WO-9625936). Описанные в этих указанных заявках соединения обладают структурой совершенно другого рода, чем предлагаемые согласно изобретению соединения.
Неожиданно было показано, что описанные в настоящей заявке 2’-замещенные 1, 1’-бифенил-2-карбонамиды являются сильнодействующими блокаторами человеческого Kv1.5-канала. Поэтому их можно применять в качестве нового рода антиаритмических средств с особенно благоприятным профилем безопасности. Соединения в особенности пригодны для лечения суправентрикулярных аритмий, как, например, фибрилляция или трепетание предсердий.
Соединения можно использовать для прекращения существующей фибрилляции или трепетания предсердий с целью возвращения синусового ритма (кардиоверсия). Сверх того, вещества уменьшают предрасположенность к возникновению нового мерцания (достижение синусового ритма, профилактика).
Предлагаемые согласно изобретению соединения до сих пор были неизвестны. Некоторые структурно-родственные соединения описаны в Helv. Chim. Acta, (70) 70 (1994) и цитированной там литературе. Для описанных там пептидных соединений (например, соединение А), однако, не известно блокирующей калиевый канал активности. Сверх того, такого рода соединения из-за многочисленных пептидных связей должны обладать слишком незначительной метаболической стабильностью для применения в качестве антиаритмического средства.

Соединение А
Другое подобное соединение (соединение В) указано в заявке ЕР 0620216. Соединение В и все остальные соединения этой заявки отличаются тем, что в положении R (3) они содержат особый заместитель (например, бензоил-1,2,3,4-тетрагидроизохинолин), который в случае предлагаемых согласно изобретению соединений настоящей заявки не предусмотрен. Указанные в ЕР 0620216 соединения действуют как антагонисты вазопрессина и вместе с тем обладают совершенно другой биологической активностью, чем описанные в данном случае блокаторы Kv1.5-канала.

Соединение В
Настоящее изобретение относится к соединениям формулы (I):

где:
R(1) означает C(O)OR(9), SO2R(10), COR(11), C(O)NR(12)R(13) или C(S)NR(12)R(13);
R(9) означает CxH2x-R(14);
x означает 0, 1, 2, 3 или 4,
причем x не может означать 0, когда R(14) означает OR(15) или SO2СН3;
R(14) означает алкил с 1, 2, 3, 4, 5 или 6 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8, 9, 10 или 11 атомами углерода, СF3, C2F5, C3F7, CH2F, CHF2, OR(15), SO2СН3, фенил, нафтил, бифенилил, фурил, тиенил или N-содержащий гетероароматический остаток с 1, 2, 3, 4, 5, 6, 7, 8 или 9 атомами углерода;
причем фенил, нафтил, бифенилил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, I, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(15) означает алкил с 1, 2, 3, 4 или 5 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3 или фенил, который незамещен или замещен 1, 2 или 3 заместителями, выбираемыми из группы, состоящей из F, Cl, Br, I, СF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(10), R(11) и R(12), независимо друг от друга, имеют указанное для R(9) значение;
R(13) означает атом водорода, алкил с 1, 2, 3 или 4 атомами углерода или СF3;
R(2) означает атом водорода, алкил с 1, 2, 3 или 4 атомами углерода или СF3;
R(3) означает CyH2y-R(16);
y означает 0, 1, 2, 3 или 4,
причем y не может означать 0, когда R(16) означает OR(17) или SO2СН3;
R(16) означает алкил с 1, 2, 3, 4, 5 или 6 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8, 9, 10 или 11 атомами углерода, СF3, C2F5, С2F7, CH2F, CHF2, OR(17), SO2СН3, фенил, нафтил, фурил, тиенил или N-содержащий гетероароматический остаток с 1, 2, 3, 4, 5, 6, 7, 8 или 9 атомами углерода;
причем фенил, нафтил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, I, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы ;
R(17) означает атом водорода, алкил с 1, 2, 3, 4 или 5 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3, фенил или 2-, 3- или 4-пиридил;
причем фенил или 2-, 3- или 4-пиридил незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, I, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
или
R(3) означает CHR(18)R(19);
R(18) означает атом водорода или CzH2z-R(16), причем
R(16) имеет вышеуказанное значение;
z означает 0, 1, 2 или 3;
R(19) означает СООН, CONH2, CONR(20)R(21), COOR(22), CH2OH;
R(20) означает атом водорода, алкил с 1, 2, 3, 4 или 5 атомами углерода, СvН2v-СF3 или CwH2w-фенил;
причем фенильное кольцо незамещено или замещено одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, I, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
v означает 0, 1, 2 или 3;
w означает 0, 1, 2 или 3;
R(21) означает атом водорода или алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(22) означает алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(4) означает атом водорода, алкил с 1, 2, 3, 4, 5 или 6 атомами углерода или СF3;
или
R(3) и R(4) вместе означают цепь из 4 или 5 метиленовых групп, из которых одна метиленовая группа может быть заменена на -О-, -S-, -NH-, -N(метил)- или -N(бензил)-;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, Cl, Br, I, СF3, NO2, CN, СООСН3, СОNН2, СОСН3, NH2, ОН, алкил с 1, 2, 3 или 4 атомами углерода, алкоксил с 1, 2, 3 или 4 атомами углерода, диметиламиногруппу, сульфамоил, метилсульфонил или метилсульфониламиногруппу;
R(30) и R(31), независимо друг от друга, означают атом водорода или алкил с 1, 2 или 3 атомами углерода;
или
R(30) и R(31) вместе означают цепь из двух метиленовых групп;
а также к их фармацевтически приемлемым солям.
Предпочтительны соединения формулы (I), где:
R(1) означает C(O)OR(9), SO2R(10), COR(11) или C(O)NR(12)R(13);
R(9) означает CxH2x-R(14);
x означает 0, 1, 2, 3 или 4,
причем x не может означать 0, когда R(14) означает OR(15);
R(14) означает алкил с 1, 2, 3 или 4 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, C2 F5, OCF3, OR(15), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 1, 2, 3, 4, 5, 6, 7, 8 или 9 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(15) означает алкил с 1, 2, 3, 4 или 5 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, CF3 или фенил, который незамещен или замещен одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, CF3, NO2, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(10), R(11) и R(12), независимо друг от друга, имеют указанное для R(9) значение;
R(13) означает атом водорода, алкил с 1, 2, 3 или 4 атомами углерода или СF3;
R(2) означает атом водорода, алкил с 1, 2, 3 или 4 атомами углерода или СF3;
R(3) означает CyH2y-R(16);
y означает 0, 1, 2, 3 или 4,
причем y не может означать 0, когда R(16) означает OR(17);
R(16) означает алкил с 1, 2, 3 или 4 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, C2F5, OR(17), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 1, 2, 3, 4, 5, 6, 7, 8 или 9 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(17) означает алкил с 1, 2, 3, 4 или 5 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3, фенил или 2-, 3- или 4-пиридил;
причем фенил или 2-, 3- или 4-пиридил неэамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
или
R(3) означает CHR(18)R(19) ;
R(18) означает атом водорода или CzH2z-R(16), причем R(16) имеет вышеуказанное значение;
z означает 0, 1, 2 или 3;
R(19) означает CONH2, CONR(20)R(21), COOR(22), СН2ОН;
R(20) означает атом водорода, алкил с 1, 2, 3, 4 или 5 атомами углерода, Cv H2v-CF3 или СwН2w-фенил;
причем фенильное кольцо незамещено или замещено одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3 , NH2, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
v означает 0, 1, 2 или 3;
w означает 0, 1, 2 или 3;
R(21) означает атом водорода или алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(22) означает алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(4) означает атом водорода, алкил с 1, 2, 3, 4, 5 или 6 атомами углерода или СF3;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, Cl, Br, СF3, NO2, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкил с 1, 2, 3 или 4 атомами углерода, алкоксил с 1, 2, 3 или 4 атомами углерода, диметиламиногруппу, сульфамоил, метилсульфонил или метилсульфониламиногруппу;
R(30) и R(31), независимо друг от друга, означают атом водорода или алкил с 1, 2 или 3 атомами углерода;
или
R(30) и R(31) вместе означают цепь из двух метиленовых групп;
а также их фармацевтически приемлемые соли.
Особенно предпочтительны соединения формулы (I), где:
R(1) означает C(O)OR(9), SO2R(10), COR(11) или C(O)NR(12)R(13);
R(9) означает Cx H2x-R(14);
x означает 0, 1, 2, 3 или 4,
причем x не может означать 0, когда R(14) означает OR(15);
R(14) означает циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, OR(15), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 3, 4 или 5 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(15) означает алкил с 1 или 2 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3 или фенил, который незамещен или замещен одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(10), R(11) и R(12), независимо друг от друга, имеют указанное для R(9) значение;
R(13) означает атом водорода;
R(2) означает атом водорода или алкил с 1, 2 или 3 атомами углерода;
R(3) означает CHR(18)R(19);
R(18) означает атом водорода или CzH2z-R(16);
z означает 0, 1, 2 или 3;
R(19) означает CONH2, CONR(20)R(21), COOR(22) или СН2ОН;
R(20) означает атом водорода, алкил с 1, 2, 3, 4 или 5 атомами углерода, СvН2v-СF3 или СwН2w-фенил;
причем фенильное кольцо незамещено или замещено одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, CF3, OCF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
v означает О, 1, 2 или 3;
w означает О, 1, 2 или 3;
R(21) означает атом водорода или алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(22) означает алкил с 1, 2, 3, 4 или 5 атомами углерода;
R(16) означает алкил с 1, 2 или 3 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, OR(17), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 3, 4 или 5 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(17) означает алкил с 1, 2, 3 или 4 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3, фенил или 2-, 3- или 4-пиридил;
причем фенил или 2-, 3- или 4-пиридил незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, CF3, ОСF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(4) означает атом водорода или алкил с 1 или 2 атомами углерода;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, Cl, Br, СF3, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкил с 1, 2 или 3 атомами углерода, алкоксил с 1 или 2 атомами углерода, диметиламиногруппу, сульфамоил, метилсульфонил или метилсульфониламиногруппу;
R(30) и R(31), независимо друг от друга, означают атом водорода или метил;
или
R(30) и R(31) вместе означают цепь из двух метиленовых групп;
а также их фармацевтически приемлемые соли.
Особенно предпочтительны также соединения формулы (I), где:
R(1) означает C(O)OR(9), SO2R(10), COR(11) или C(O)NR(12)R(13);
R(9) означает CxH2x -R( 14) ;
x означает 0, 1, 2, 3 или 4,
причем x не может означать 0, когда R(14) означает OR(15);
R(14) означает алкил с 1, 2, 3 или 4 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, OR(15), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 3, 4 или 5 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(15) означает алкил с 1 или 2 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3 или фенил, который незамещен или замещен одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(10), R(11) и R(12), независимо друг от друга, имеют указанное для R(9) значение;
R(13) означает атом водорода;
R(2) означает атом водорода, алкил с 1, 2 или 3 атомами углерода;
R(3) означает CyH2y -R(16);
y означает 0, 1, 2, 3 или 4,
причем у не может означать 0, когда R(16) означает OR(17);
R(16) означает алкил с 1, 2 или 3 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, OR(17), фенил, фурил, тиенил или N-содержащий гетероароматический остаток с 3, 4 или 5 атомами углерода;
причем фенил, фурил, тиенил и N-содержащий гетероароматический остаток незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкила с 1, 2 или 3 атомами углерода, алкоксила с 1 или 2 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(17) означает алкил с 1, 2, 3, 4 или 5 атомами углерода, циклоалкил с 3, 4, 5 или 6 атомами углерода, СF3, фенил или 2-, 3- или 4-пиридил;
причем фенил или 2-, 3- или 4-пиридил незамещены или замещены одним, двумя или тремя заместителями, выбираемыми из группы, состоящей из F, Cl, Br, СF3, ОСF3, NO2, CN, СООСН3, CONH2, СОСН3, ОН, алкила с 1, 2, 3 или 4 атомами углерода, алкоксила с 1, 2, 3 или 4 атомами углерода, диметиламиногруппы, сульфамоила, метилсульфонила и метилсульфониламиногруппы;
R(4) означает атом водорода или алкил с 1 или 2 атомами углерода;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, Cl, Br, СF3, CN, СООСН3, CONH2, СОСН3, NH2, ОН, алкил с 1, 2 или 3 атомами углерода, алкоксил с 1 или 2 атомами углерода, диметиламиногруппу, сульфамоил, метилсульфонил или метилсульфониламиногруппу;
R(30) и R(31), независимо друг от друга, означают атом водорода или метил;
или
R(30) и R(31) вместе означают цепь из двух метиленовых групп;
а также их фармацевтически приемлемые соли.
В высшей степени предпочтительны соединения формулы (I), где:
R(1) означает C(O)OR(9), SO2R(10), COR(11) или C(O)NR(12)R(13);
R(9) означает CxH2x-R(14);
x означает 0, 1, 2 или 3;
R(14) означает алкил с 1, 2, 3 или 4 атомами углерода, циклоалкил с 3, 4, 5, 6, 7, 8 или 9 атомами углерода, СF3, фенил или пиридил;
причем фенил и пиридил незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, СF3, ОСF3, ОН, алкила с 1, 2 или 3 атомами углерода и алкоксила с 1 или 2 атомами углерода;
R(10), R(11) и R(12), независимо друг от друга, имеют указанное для R(9) значение;
R(13) означает атом водорода;
R(2) означает атом водорода;
R(3) означает CyH2y-R(16);
y означает 0, 1 или 2;
R(16)означает алкил с 1, 2 или 3 атомами углерода, циклоалкил с 5 или 6 атомами углерода, CF3, фенил или пиридил;
причем фенил или пиридил незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, СF3, ОСF3, ОН, алкила с 1, 2 или 3 атомами углерода и алкоксила с 1 или 2 атомами углерода;
R(4) означает атом водорода;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, СF3, CN, СООСН3, CONH2, NH2, ОН, алкил с 1, 2 или 3 атомами углерода или алкоксил с 1 или 2 атомами углерода;
R(30) и R(31), независимо друг от друга, означают атом водорода или метил;
или
R(30) и R(31) вместе означают цепь из двух метиленовых групп;
а также их фармацевтически приемлемые соли.
В особенности предпочтительны соединения формулы (I), где:
R(1) означает C(O)OR(9) или COR(11);
R(9) означает CxH2x-R(14);
x означает 0, 1, 2 или 3;
R(14) означает циклоалкил с 5 или 6 атомами углерода или фенил;
причем фенил незамещен или замещен одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, СF3, ОСF3, алкила с 1, 2 или 3 атомами углерода и алкоксила с 1 или 2 атомами углерода;
R(11) имеет указанное для R(9) значение;
R(2) означает атом водорода;
R(3) означает CyH2y-R(16);
y означает 0, 1 или 2;
R(16) означает алкил с 1, 2 или 3 атомами углерода, циклоалкил с 5 или 6 атомами углерода, СF3, фенил или пиридил;
причем фенил и пиридил незамещены или замещены одним или двумя заместителями, выбираемыми из группы, состоящей из F, Cl, СF3, ОСF3, алкила с 1, 2 или 3 атомами углерода и алкоксила с 1 или 2 атомами углерода;
R(4) означает атом водорода;
R(5), R(6), R(7) и R(8), независимо друг от друга, означают атом водорода, F, СF3, алкил с 1, 2 или 3 атомами углерода или алкоксил с 1 или 2 атомами углерода;
R(30) и R(31) означают атом водорода;
а также их фармацевтически приемлемые соли.
Алкильные остатки и алкиленовые остатки могут быть линейными или разветвленными. Это относится также к алкиленовым остаткам формул СхН2х, CyH2y, CzH2z, CvH2v и CwH2w. Алкильные остатки и алкиленовые остатки могут быть также линейными или разветвленными, если они замещены или содержатся в других остатках, например в алкоксильном остатке или во фторированном алкильном остатке. Примерами алкильных остатков являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3,3-диметилбутил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил, эйкозил. Производимые от этих остатков двухвалентные остатки, как, например, метилен, 1,1-этилен, 1,2-этилен, 1,1-пропилен, 1,2-пропилен, 2,2-пропилен, 1,3-пропилен, 1,1-бутилен, 1,4-бутилен, 1,5-пентилен, 2,2-диметил-1,3-пропилен, 1,6-гексилен и т.д., являются примерами алкиленовых остатков.
Циклоалкильные остатки также могут быть разветвленными. Примерами циклоалкильных остатков с 3-11 атомами углерода являются циклопропил, циклобутил, 1-метилциклопропил, 2-метилциклопропил, циклопентил, 2-метилциклобутил, 3-метилциклобутил, циклопентил, циклогексил, 2-метилциклогексил, 3-метилциклогексил, 4-метилциклогексил, ментил, циклогептил, циклооктил и т.д.
В качестве N-содержащих гетероароматических остатков с 1, 2, 3, 4, 5, 6, 7, 8 или 9 атомами углерода имеют значение в особенности 1-, 2- или 3-пирролил; 1-, 2-, 4- или 5-имидазолил; 1-, 3-, 4- или 5-пиразолил; 1,2,3-триазол-1-, -4- или 5-ил; 1,2,4-триазол-1-, -3- или -5-ил; 1- или 5-тетразолил; 2-, 4- или 5-оксазолил; 3-, 4- или 5-изоксазолил; 1,2, 3-оксадиазол-4- или 5-ил; 1,2,4-оксадиазол-3- или 5-ил; 1,3,4-оксадиазол-2- или -5-ил; 2-, 4- или 5-тиазолил; 3-, 4- или 5-изотиазолил; 1,3,4-тиадиазол-2- или -5-ил; 1,2,4-тиадиазол-3- или -5-ил; 1,2, 3-тиадиазол-4- или 5-ил; 2-, 3- или 4-пиридил; 2-, 4-, 5- или 6-пиримидинил; 3- или 4-пиридазинил; пиразинил; 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил; 1-, 2-, 4- или 5-бензимидазолил; 1-, 3-, 4-, 5-, 6- или 7-индазолил; 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил; 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил; 2-, 4-, 5-, 6-, 7- или 8-хиназолинил; 3-, 4-, 5-, 6-, 7- или 8-циннолинил; 2-, 3-, 5-, 6-, 7- или 8-хиноксалинил; 1-, 4-, 5-, 6-, 7- или 8-фталазинил. Далее, имеются в виду соответствующие N-оксиды этих соединений, следовательно, например, 1-окси-2-, 3- или 4-пиридил.
Особенно предпочтительны N-содержащие гетероциклические остатки пирролил, имидазолил, хинолил, пиразолил, пиридил, пиразинил, пиримидинил и пиридазинил.
Пиридил означает как 2-, 3-, так и также 4-пиридил. Тиенил означает как 2-, так и также 3-тиенил. Фурил означает как 2-, так и также 3-фурил.
Монозамещенные фенильные остатки могут быть замещены в 2-, 3- или 4-положении; дизамещенные - в 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-положениях; тризамещенные - в 2,3,4-, 2,3,5-, 2,3,6-, 2,4,5-, 2,4, 6- или 3,4,5-положениях. Соответствующее имеет значение также для N-содержащих гетероароматических остатков, тиофенового или фурильного остатка.
В случае ди-, соответственно, тризамещения остатка заместители могут быть одинаковыми или разными.
Когда R(3) и R(4) вместе означают цепь из 4 или 5 метиленовых групп, из которых одна метиленовая группа может быть заменена на -О-, -S-, -NH- и т.д., тогда эти остатки вместе с атомом азота согласно формуле (I) образуют 5- или 6-членный азотсодержащий гетероцикл, как, например, пирролидин, пиперидин, морфолин, тиоморфолин и т.д.
Если соединения формулы (I) содержат одну или несколько групп кислотного или основного характера, соответственно, один или несколько основных гетероциклов, то к изобретению относятся также соответствующие физиологически или токсикологически приемлемые соли, в особенности фармацевтически применимые соли. Так, соединения формулы (I), содержащие группы кислотного характера, например, одну или несколько СООН-групп, можно применять, например, в виде солей щелочных металлов, предпочтительно солей натрия или калия, или в виде солей щелочно-земельных металлов, например, солей кальция или магния, или в виде аммониевых солей, например, в виде солей с аммиаком или органическими аминами или аминокислотами. Соединения формулы (I), содержащие одну или несколько основных, то есть протонируемых, групп или один или несколько основных гетероциклов, можно применять также в виде их физиологически приемлемых аддитивных солей с неорганическими или органическими кислотами, например, в виде гидрохлоридов, фосфатов, сульфатов, метансульфонатов, ацетатов, лактатов, малеинатов, фумаратов, малатов, глюконатов и т.д. Если соединения формулы (I) содержат одновременно группы кислотного и основного характера в молекуле, то к изобретению относятся, наряду с описанными солевыми формами, также внутренние соли, так называемые бетаины. Соли соединений формулы (I) можно получать обычными способами, например, путем соединения с кислотой, соответственно, основанием в растворителе или диспергаторе или также из других солей путем анионного обмена.
Соединения формулы (I) при соответствующем замещении могут находиться в стереоизомерных формах. Если соединения формулы (I) содержат один или несколько асимметрических центров, то, независимо друг от друга, они могут иметь S-конфигурацию или R-конфигурацию. К изобретению относятся все возможные стереоизомеры, например энантиомеры или диастереомеры, и смеси двух или более стереоизомерных форм, например энантиомеров и/или диастереомеров, в любых соотношениях. К изобретению, следовательно, относятся, например, энантиомеры в чистой энантиомерной форме, как в виде левовращающих, так и также в виде правовращающих антиподов, или также в виде смесей обоих энантиомеров в различных соотношениях или в виде рацематов. Индивидуальные стереоизомеры в желательном случае можно получать путем разделения смеси обычными методами или, например, путем стереоселективного синтеза. При наличии подвижных атомов водорода к настоящему изобретению относятся также все таутомерные формы соединений формулы (I).
Соединения формулы (I) получают различными химическими способами, которые также относятся к настоящему изобретению. Некоторые типичные пути синтеза представлены в обозначаемых ниже в виде схем 1, 2, 3 и 4 реакционных последовательностях. Используемые при этом остатки R(1)-R(8) являются, соответственно, такими, как указанные выше, если в последующем не указано иное.
Так, например, соединение формулы (I) получают согласно схеме 1 из производных ангидрида дифеновой кислоты формулы (II) в качестве коммерчески доступных, соответственно, известных из литературы исходных соединений. Восстановление соединений формулы (II) с помощью боргидрида натрия с последующим взаимодействием с фталимидом калия, как описывается в Tetrahedron, 45, 1365-1376 (1989), приводит к бифенилкарбоновым кислотам формулы (IV). Путем взаимодействия с аминами формулы HNR(3)R(4) с последующим гидразинолизом фталимида получают аминометильные соединения формулы (VI), из которых путем введения во взаимодействие с пригодными производными формулы R(1)-X получают предлагаемые согласно изобретению соединения формулы (I), где R(2) означает атом водорода и R(1), R(3), R(4), R(5), R(6), R(7) и R(8) имеют вышеуказанные значения. Последующее алкилирование с помощью пригодных алкилирующих средств формулы R(2)-Y, где Y означает нуклеофугную удаляемую группу, например, Cl, Br или I, приводит к соответствующим соединениям формулы (I), где R(2) означает алкил с 1-4 атомами углерода.
Альтернативно, бифенилкарбоновые кислоты формулы (IV) также путем гидразинолиза можно превращать в аминокарбоновые кислоты формулы (VII), которые затем за счет реакции аминогруппы с соединениями формул R(1)-X и R(2)-Y с последующим амидированием карбоновой кислоты с помощью аминов формулы HNR(3)R(4) превращают в предлагаемые согласно изобретению соединения формулы (I) (схема 2).
В некоторых случаях может оказаться целесообразным сначала получать по одному из вышеуказанных способов предлагаемые согласно изобретению соединения формулы (Iа) (схема 3), в которой R(9) представляет собой легко отщепляющийся остаток, как, например, трет-бутил или бензил. После отщепления соответствующей защитной группы, например, с помощью трифторуксусной кислоты для Вос-группы или путем каталитического гидрирования для бензилоксикарбонильного остатка, получают соединения формулы (IX), которые затем снова путем введения во взаимодействие с соединениями формулы R(1)-X можно превращать в другие, предлагаемые согласно изобретению соединения формулы (I).
Другая возможность получения предлагаемых согласно изобретению соединений заключается в катализируемой палладием реакции сочетания фенилбромида или иодида формулы (X) с фенилбороновой кислотой формулы (XI) (реакция сочетания по Suzuki; схема 4), которую можно осуществлять, например, в присутствии Pd[(РС6Н5)3]4 в качестве катализатора, карбоната натрия в качестве основания и 1,2-диметоксиэтана в качестве растворителя.
Если R(9) означает легко отщепляющийся остаток, как, например, трет-бутил или бензил, то соединения формулы (Ib) затем, как описано выше и в схеме 3, можно превращать в другие, предлагаемые согласно изобретению соединения формулы (I).
Необходимые бороновые кислоты формулы (XI) можно получать из соединений формулы (XII), в которой Z означает атом водорода, брома или иода, путем введения лития в орто-положение, соответственно, обмена галогена на металл, с последующим взаимодействием с триметиловым эфиром борной кислоты.
Вышеуказанные взаимодействия соединений формул (VI), (VII) и (IX) с соединениями формулы R(1)-X соответствуют известному превращению амина в производное амида карбоновой кислоты, амида сульфокислоты, карбамата, мочевины или тиомочевины. Остаток Х при этом означает пригодную нуклеофугную удаляемую группу, как, например, F, Cl, Br, имидазолил, O-сукцинимидная группа.
Для получения соединений формулы (I) или (VIII), в которых R(1) означает С(О)OR(9), следовательно, карбаматов, используют, например, соединения формулы R(1)-X, в которых Х означает атом хлора или O-сукцинимидную группу, следовательно, хлорформиаты или сукцинимидкарбонаты.
Для получения соединений формулы (I) или (VIII), в которых R(1) означает SO2R(10), следовательно, сульфонамидов, как правило, используют соединения формулы R(1)-X, в которых Х означает атом хлора, следовательно, хлорангидриды сульфокислот.
Для получения соединений формулы (I) или (VIII), в которых R(1) означает COR(11), следовательно, амидов карбоновых кислот, используют, например, соединения формулы R(1)-X, в которых Х означает атом хлора, имидазолил или ацетоксигруппу, следовательно, хлорангидриды карбоновых кислот, имидазолиды карбоновых кислот или смешанные ангидриды. Однако также можно применять свободные кислоты формулы R(1)-OH в присутствии пригодного конденсирующего средства, как карбодиимиды или урониевые соли, как TOTU.
Для получения соединений формулы (I) или (VIII), в которых R(1) означает CONR(12)R(13) или С(S)NR(12)R(13), следовательно, мочевин или тиомочевин, вместо соединений формулы R(1)-X также можно использовать соединения формулы R(12)N(=C=O), или R(12)N(=C=S), следовательно, изоцианаты или тиоизоцианаты.
Вышеуказанные взаимодействия соединений формул (IV) или (VIII) с аминами формулы HNR(3)R(4) соответствуют известному превращению карбоновой кислоты в амид карбоновой кислоты. Для осуществления этих реакций в литературе описаны многочисленные способы. Особенно предпочтительно их можно осуществлять путем активирования карбоновой кислоты, например, с помощью дициклогексилкарбодиимида (DCC), в случае необходимости, при добавке гидроксибензотриазола (НОВТ) или диметиламинопиридина (DMAP), или с помощью О-[(циано(этокси-карбонил)метилен)амино]-1,1,3,3-тетраметилуронийтетрафторбората (TOTU). Однако также сначала можно синтезировать известными способами реакционноспособные производные кислот, например хлорангидриды кислот, путем введения во взаимодействие карбоновых кислот формулы (IV) или (VIII) с неорганическими галоидангидридами кислот, как, например, SOCl2, или имидазолиды кислоты путем введения во взаимодействие с карбонилдиимидазолом, которые затем, в случае необходимости, при добавлении вспомогательного основания, вводят во взаимодействие с аминами формулы HNR(3)R(4).
В случае всех способов может оказаться уместной на определенных стадиях реакций временная защита функциональных групп в молекуле. Такие способы с использованием защитных групп известны специалисту. Выбор защитной группы для рассматриваемых групп и способы их введения и отщепления описаны в литературе и, в случае необходимости, могут быть без затруднений использованы в конкретном случае.
Схема 1

Схема 2

Схема 3

Схема 4

Предлагаемые согласно изобретению соединения формулы (I) и их физиологически приемлемые соли, таким образом, можно применять в случае животного, предпочтительно в случае млекопитающего и в особенности в случае человека в качестве лекарственных средств индивидуально, в виде смесей друг с другом или в виде фармацевтических композиций. Объектом настоящего изобретения являются также соединения формулы (I) и их физиологически приемлемые соли для применения в качестве лекарственных средств, их применение для лечения и профилактики указанных картин заболеваний и их применение для получения лекарственных средств для этой цели и лекарственных средств с блокирующим К+-канал действием. Далее, объектом настоящего изобретения являются фармацевтические композиции, которые в качестве активной составной части содержат эффективную дозу по меньшей мере одного соединения формулы (I) и/или его физиологически приемлемой соли наряду с обычными, фармацевтически приемлемыми носителями и вспомогательными веществами. Фармацевтические композиции содержат обычно 0,1-90 масс.% соединений формулы (I) и/или их физиологически приемлемых солей. Фармацевтические композиции можно приготовлять само по себе известным образом. Для этого соединения формулы (I) и/или их физиологически приемлемые соли вместе с одним или несколькими, твердыми или жидкими, галеновыми носителями и/или вспомогательными веществами и, если желательно, в сочетании с другими биологически активными веществами лекарственных средств доводят до пригодной формы применения, или разовой дозы, которые затем можно применять в качестве лекарственных средств в медицине человека или животного.
Лекарственные средства, которые содержат предлагаемые согласно изобретению соединения формулы (I) и/или их физиологически приемлемые соли, можно вводить перорально, парентерально, например внутривенно, ректально, путем ингаляции или локально, причем предпочтительное введение зависит от конкретного случая, например от соответствующей картины проявления заболевания, подлежащего лечению.
Какие вспомогательные вещества пригодны для желательного состава лекарственного средства, специалисту известно на основании его специального знания. Наряду с растворителями, гелеобразующими компонентами, основами суппозиториев, вспомогательными веществами для получения таблеток и другими носителями биологически активных веществ можно использовать, например, антиоксиданты, диспергаторы, эмульгаторы, пеногасители, улучшающие вкус вещества, консерванты, агенты растворения, средства для достижения депо-эффекта, буферные вещества или красители.
Для достижения полезного терапевтического действия соединения формулы (I) можно также комбинировать с другими лекарственными биологически активными веществами. Так, при лечении сердечно-сосудистых заболеваний возможны комбинации с активными в отношении сердечно-сосудистой системы веществами. В качестве такого рода полезных для сердечно-сосудистых заболеваний компонентов комбинаций используют, например, другие антиаритмические средства, например антиаритмические средства класса I, класса II или класса III, как, например, блокаторы IKs- или IKr-каналов, например дофетилид, или, далее, снижающие кровяное давление вещества, как АСЕ-ингибиторы (например, эналаприл, каптоприл, рамиприл), антагонисты ангиотензина, активаторы К+-каналов, а также блокаторы альфа- и бета-рецепторов, однако, также симпатомиметические и адренергически действующие соединения, а также ингибиторы Na+ /H+-обмена, антагонисты кальциевых каналов, ингибиторы фосфодиэстеразы и другие, положительно инотропно действующие вещества, как, например, гликозиды дигиталиса, или диуретики.
Для оральной формы применения активные соединения смешивают с пригодными для этой цели добавками, как носители, стабилизаторы или инертные разбавители, и путем обычных методов доводят до пригодных форм применения, как таблетки, драже, разъемные капсулы, водные, спиртовые или масляные растворы. В качестве инертных носителей можно использовать, например, гуммиарабик, магнезию, карбонат магния, фосфат калия, молочный сахар, глюкозу или крахмалы, в особенности кукурузный крахмал. При этом приготовление можно осуществлять как в виде сухого, так и в виде влажного гранулята. В качестве масляных носителей или в качестве растворителей используют, например, растительные или животные масла, как подсолнечное масло или рыбий жир. В качестве растворителей для водных или спиртовых растворов используют, например, воду, этанол или растворы сахаров или их смеси. Другими вспомогательными веществами, также для других форм применения, являются, например, полиэтиленгликоли и полипропиленгликоли.
Для подкожного или внутривенного применения активные соединения, в желательном случае, вместе с обычными для этой цели веществами, как агенты растворения, эмульгаторы или другие вспомогательные вещества, переводят в раствор, суспензию или эмульсию. Соединения формулы (I) и их физиологически приемлемые соли можно также лиофилизировать и полученные лиофилизаты использовать, например, для приготовления препаратов для инъекций или инфузий. В качестве растворителей используют, например, воду, физиологический раствор хлорида натрия или спирты, например, этанол, пропанол, глицерин, наряду с этим также растворы сахаров, как растворы глюкозы или маннита, или также смеси из различных указанных растворителей.
В качестве фармацевтической композиции для введения в форме аэрозолей или спреев пригодны, например, растворы, суспензии или эмульсии биологически активных веществ формулы (I) или их физиологически приемлемых солей в фармацевтически приемлемом растворителе, как, в особенности, этанол или вода, или смеси таких растворителей. При необходимости композиция также может содержать еще другие фармацевтические вспомогательные вещества, как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также пропеллент. Такая композиция содержит биологически активное вещество обычно в концентрации от примерно 0,1 масс.% до 10 масс.%, в особенности от примерно 0,3 масс.% до 3 масс.%.
Дозировка вводимого биологически активного вещества формулы (I), соответственно, его физиологически приемлемых солей, зависит от конкретного случая и должна быть приспособлена, как обычно, для оптимального действия в данных условиях конкретного случая. Так, она зависит, естественно, от частоты введения и от силы и продолжительности действия используемых для терапии или профилактики соединений, однако, также от рода и интенсивности излечиваемого заболевания, а также от пола, возраста, массы и индивидуальной восприимчивости излечиваемого человека или животного и от того, вводят ли ее в случае обострения или профилактически. Обычно суточная доза соединения формулы (I) при введении пациенту массой примерно 75 кг составляет от 0,001 мг/кг массы тела до 100 мг/кг массы тела, предпочтительно, от 0,01 мг/кг массы тела до 20 мг/кг массы тела.
Дозу можно вводить в виде разовой дозы или разделять на несколько, например две, три или четыре, разовых доз. В особенности при лечении острых случаев нарушений сердечного ритма, например, в отделении интенсивной терапии, может оказаться предпочтительным также парентеральное введение путем инъекции или инфузии, например, путем внутривенной длительной инфузии.
Экспериментальная часть
Список сокращений
Предварительная стадия 1:
7Н-Дибензо[с,е]оксепин-5-он
К суспензии 50, 0 г (0,22 моль) ангидрида дифеновой кислоты в 220 мл диметилформамида при температуре 5°С в течение 10 минут порциями добавляют 9,0 г (0,24 моль) бораната натрия. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь выливают в 220 мл 6М соляной кислоты, разбавляют с помощью 750 мл воды и дополнительно перемешивают в течение 2 часов. Выпавший осадок отфильтровывают в вакууме и получают 35,0 г 7Н-дибензо[с,е]оксепин-5-она; т.пл. 131°С.
Предварительная стадия 2:
2’-Фталимидометилбифенил-2-карбоновая кислота
Смесь из 35 г (0,17 моль) 7Н-дибензо[с,е]оксепин-5-она и 30,8 г (0,17 моль) фталимида калия в 330 мл диметилформамида нагревают в течение 18 часов при температуре 170°С. После охлаждения выпавший осадок отфильтровывают в вакууме и вносят в 160 мл ледяной уксусной кислоты. После перемешивания в течение 1 часа разбавляют с помощью 650 мл воды со льдом и выпавший в осадок продукт отфильтровывают в вакууме и высушивают в вакууме. Получают 44,8 г 2’-фталимидометилбифенил-2-карбоновой кислоты; т.пл. 198°С.
Предварительная стадия 3:
2’-Аминометилбифенил-2-карбоновая кислота
Суспензию 10,0 г (28 ммоль) 2’-фталимидометилбифенил-2-карбоновой кислоты в 450 мл метанола смешивают с 20 мл гидразингидрата и в течение 1,5 часов нагревают при температуре 40°С. Реакционную смесь концентрируют и остаток обрабатывают с помощью 250 мл дихлорметана. После отфильтровывания нерастворимого 2,3-дигидрофталазин-1,4-диона маточный раствор концентрируют и получают 4,8 г 2’-аминометилбифенил-2-карбоновой кислоты.
Общая методика синтеза смешанных сукцинимидкарбонатов из спиртов (предварительные стадии 4a-4k)
К раствору 19,5 ммоль соответствующего спирта и 1,2 г (9,8 ммоль) DMAP в 30 мл дихлорметана и 30 мл ацетонитрила при температуре 0°С порциями добавляют 5,0 г (19,5 ммоль) дисукцинимидкарбоната. После перемешивания в течение от 2,5 часов до 10 часов при комнатной температуре добавляют 25 мл воды и органическую фазу еще 2 раза промывают водой. После высушивания и концентрирования получают соответствующие сукцинимидкарбонаты, чаще всего в виде твердых кристаллических веществ.
Предварительная стадия 4а:
Согласно общей методике получают 3,2 г 4-фторбензил-N-сукцинимидкарбоната; т.пл. 89°С (эфир).
Предварительная стадия 4b:
Из 11,7 ммоль 4-трифторметилбензилового спирта соответственно общей методике получают 2,3 г 4-трифторметилбензил-N-сукцинимидкарбоната; т.пл. 102°С (эфир).
Предварительная стадия 4с:
Из 10,5 ммоль α -метил-4-(трифторметил) бензилового спирта соответственно общей методике получают 1,6 г α-метил-4-(трифторметил)бензил-N-сукцинимидкарбоната; т.пл. 115°С (эфир).
Предварительная стадия 4d:
Из 19,5 ммоль 4,4,4-трифторбутанола соответственно общей методике получают 4,0 г 4,4,4-трифторбутил-N-сукцинимид-карбоната; т.пл. 72°С (эфир).
Предварительная стадия 4е:
Из 26,3 ммоль α-метил-3-(трифторметил)бензилового спирта соответственно общей методике получают 5,1 г α -метил-3-(трифторметил)бензил-N-сукцинимидкарбоната; т.пл. 77°С (эфир).
Предварительная стадия 4f:
Из 31,6 ммоль α-метил-2,6-дифторбензилового спирта соответственно общей методике получают 1,6 г α -метил-2,6-дифторбензил-N-сукцинимидкарбоната; т.пл. 108°С (эфир).
Предварительная стадия 4g:
Из 25 ммоль α-метил-2-(трифторметил)бензилового спирта соответственно общей методике получают 3,5 г α-метил-2-(трифторметил)бензил-N-сукцинимидкарбоната.
Предварительная стадия 4h:
Из 25 ммоль (S)-1-фенилэтанола соответственно общей методике получают 3,5 г (S)-α-метилбензил-N-сукцинимидкарбоната.
Предварительная стадия 4i:
Из 25 ммоль (R)-1-фенилэтанола соответственно общей методике получают 3,5 г (R)-α-метилбензил-N-сукцинимидкарбоната.
Предварительная стадия 4j:
Из 25 ммоль α-метил-4-фторбензилового спирта соответственно общей методике получают 4,3 г α-метил-4-фторбензил-N-сукцинимидкарбоната.
Предварительная стадия 4k:
Из 9,8 ммоль (S)-1-фенил-1-бутанола соответственно общей методике получают 1,7 г (S)-α-пропилбензил-N-сукцинимидкарбоната.
Предварительная стадия 5а:
Фенетиламид 2’-аминометилбифенил-2-карбоновой кислоты
Из 2’-фталимидометилбифенил-2-карбоновой кислоты (предварительная стадия 2) после активирования с помощью CDI и введения во взаимодействие с фенетиламином получают фенетиламид 2’-фталимидометилбифенил-2-карбоновой кислоты; т.пл. 156°С.
5,0 г (10,9 ммоль) продукта растворяют в 200 мл метанола и смешивают с 5 мл гидразингидрата. После перемешивания в течение 1 часа при температуре 40°С реакционную смесь концентрируют и остаток обрабатывают дихлорметаном. После отфильтровывания образовавшегося 2, 3-дигидрофталазин-1,4-диона маточный раствор концентрируют и остаток очищают путем флэш-хроматографии при использовании смеси дихлорметана и метанола в соотношении 20:1. Получают 3 г фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты.
Предварительная стадия 5b:
Бензиламид 2’-аминометилбифенил-2-карбоновой кислоты
Из 2’-фталимидометилбифенил-2-карбоновой кислоты (предварительная стадия 2) после переведения в хлорангидрид с помощью тионилхлорида и введения во взаимодействие с бензиламином получают бензиламид 2’-фталимидометилбифенил-2-карбоновой кислоты. 1,2 г (2,7 ммоль) продукта растворяют в 55 мл метанола и смешивают с 1,35 мл гидразингидрата. После перемешивания в течение 1 часа при температуре 40°С реакционную смесь концентрируют и остаток обрабатывают дихлорметаном. После отфильтровывания образовавшегося 2,3-дигидрофталазин-1,4-диона маточный раствор концентрируют и остаток очищают путем флэш-хроматографии при использовании смеси дихлорметана и метанола в соотношении 30:1. Получают 0,49 г бензиламида 2’-аминометилбифенил-2-карбоновой кислоты.
Предварительная стадия 5с:
Изопентиламид 2’-аминометилбифенил-2-карбоновой кислоты
Из 3 г (8,4 ммоль) 2’-фталимидометилбифенил-2-карбоновой кислоты (предварительная стадия 2) путем введения во взаимодействие с изопентиламином в присутствии НОВТ и DIC получают 3,2 г изопентиламида 2’-фталимидометилбифенил-2-карбоновой кислоты; т.пл. 169°С. Продукт растворяют в 100 мл метанола и смешивают с 5 мл гидразингидрата. После перемешивания в течение 1 часа при температуре 40°С охлажденную реакционную смесь фильтруют. Фильтрат концентрируют и остаток обрабатывают дихлорметаном. После промывки водой, высушивания и концентрирования получают 1,8 г изопентиламида 2’-аминометилбифенил-2-карбоновой кислоты.
Предварительная стадия 5d:
2-(2-Пиридил)этиламид 2’-аминометилбифенил-2-карбоновой кислоты
Из 10 г (28 ммоль) 2’-фталимидометилбифенил-2-карбоновой кислоты (предварительная стадия 2) путем введения во взаимодействие с 2-(2-пиридил)этиламином в присутствии НОВТ и DIC получают 13 г 2-(2-пиридил)этиламида 2’-фталимидометилбифенил-2-карбоновой кислоты; т.пл. 155°С. Продукт суспендируют в 300 мл метанола и смешивают с 20 мл гидразингидрата. После перемешивания в течение 1 часа при температуре 40°С охлажденную реакционную смесь фильтруют. Фильтрат концентрируют и остаток обрабатывают этилацетатом. Продукт экстрагируют 2 раза с помощью 2М соляной кислоты в водной фазе. Затем водную фазу подщелачивают с помощью карбоната калия и экстрагируют 2 раза этилацетатом. После промывки водой, высушивания и концентрирования получают 7,3 г 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты.
Предварительная стадия 6:
2’-(Бензилоксикарбониламинометил)бифенил-2-карбоновая кислота
К раствору 455 мг (2 ммоль) 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 3) и 336 мг (4 ммоль) гидрокарбоната натрия в 5 мл диоксана и 5 мл воды при температуре 0°С добавляют по каплям раствор 500 мг (2 ммоль) бензил-N-сукцинимидкарбоната в 2,5 мл диоксана. После перемешивания в течение 4 часов при комнатной температуре концентрируют в вакууме, разбавляют водой, подкисляют и экстрагируют этилацетатом. Получают 590 мг 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
Предварительная стадия 7:
2’-(трет-Бутоксикарбониламинометил)бифенил-2-карбоновая кислота
К раствору 12,0 г (53 ммоль) 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 3) в 130 мл 1,4-диоксана и 65 мл воды добавляют 65 мл 1М раствора гидроксида натрия и после полного растворения добавляют 12,6 г (58 ммоль) ди-трет-бутилдикарбоната. После перемешивания в течение 2 часов при комнатной температуре концентрируют в вакууме, разбавляют водой и экстрагируют 2 раза дихлорметаном. Водную фазу подкисляют с помощью 1М раствора гидросульфата калия и экстрагируют этилацетатом. После в значительной степени концентрирования, добавления н-гептана и выдерживания в течение ночи, продукт выпадает в осадок, и получают 7,6 г 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты; т.пл. 136°С.
Общая методика отщепления Вос-защитной группы:
К 30%-ному раствору трифторуксусной кислоты в дихлорметане добавляют N-Boc-защищенное аминометилбифенильное производное (1 г на 10 мл раствора). Смесь перемешивают в течение 30 минут при комнатной температуре и затем растворитель удаляют в вакууме в роторном выпарном аппарате. Остаток обрабатывают этилацетатом и промывают насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, растворитель удаляют в вакууме и получают соответствующие амиды 2’-аминометилбифенил-2-карбоновой кислоты.
Предварительная стадия 8а:
(2,4-Дифторбензил)амид 2’-аминометилбифенил-2-карбоновой кислоты
Соединение получают из Вос-защищенного соединения (пример 8с) согласно общей методике. Альтернативно, соединение можно также выделять непосредственно в виде трифторацетата и вводить во взаимодействие дальше.
Дальнейшие предварительные стадии 8:
Аналогичным образом из Вос-защищенных соединений примеров 8d-8o и 10а-10о высвобождают соответствующие амины.
Общая методика проведения взаимодействия аминометилбифенилов с сукцинимидкарбонатами до получения карбаматов
(примеры 1a-1u)
К раствору 0,45 ммоль соответствующего 2’-аминометилбифенила и 38 мг (0,45 ммоль) гидрокарбоната натрия в 2 мл диоксана и 2 мл воды медленно прикапывают раствор 0,45 ммоль соответствующего сукцинимидкарбоната в 2 мл диоксана. Перемешивают в течение 2-12 часов при комнатной температуре, концентрируют, разбавляют водой, экстрагируют этилацетатом и органическую фазу промывают водой. После высушивания и концентрирования получают соответствующие карбаматы.
Пример 1а
Фенетиламид 2’-(4-трифторметилбензилокси-карбониламинометил)бифенил-2-карбоновой кислоты

Из 0,45 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты и 4-трифторметилбензил-N-сукцинимидкарбоната (предварительная стадия 4b) согласно общей методике получают 226 мг фенетиламида 2’-(4-трифторметилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
Масс-спектр (ионизация электронным распылением с образованием положительных ионов) [МС (ES+)]: m/z=533 (M+1).
Пример 1b
Фенетиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты и бензил-N-сукцинимидкарбоната согласно общей методике получают 66 мг фенетиламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты в виде масла.
МС (ES+): m/z=456 (М+1).
Пример 1с
Фенетиламид 2’-(метилсульфонилэтилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0, 45 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и метилсульфонилэтил-N-сукцинимидкарбоната согласно общей методике получают 164 мг фенетиламида 2’-(метилсульфонилэтилоксикарбониламинометил)бифенил-2-карбоновой кислоты в виде масла.
МС (ES+): m/z=481 (М+1).
Пример 1d
2-(2-Пиридил)этиламид 2’-(4-трифторметилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и 4-трифторметилбензил-N-сукиинимидкарбоната (предварительная стадия 4b) согласно общей методике получают 170 мг 2-(2-пиридил) этиламида 2’-(4-трифторметилбензилоксикарбониламинометил)-бифенил-2-карбоновой кислоты.
МС (ES+): m/z=534 (М+1).
Пример 1е
2-(2-Пиридил)этиламид 2’-(4-фторбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и 4-фторбензил-N-сукцинимидкарбоната (предварительная стадия 4а) согласно общей методике получают 150 мг 2-(2-пиридил)этиламида 2’-(4-фторбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=484 (М+1).
Пример 1f
2-(2-Пиридил)этиламид (±)-2’-(α-метил-4-(трифторметил)бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и α -метил-4-(трифторметил)бензил-N-сукцинимидкарбоната (предварительная стадия 4с) согласно общей методике получают 170 мг 2-(2-пиридил)этиламида 2’-(α -метил-4-(трифторметил)бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты в виде рацемата.
МС (ES+): m/z=548 (М+1).
Пример 1g
2-(2-Пиридил)этиламид (S)-2’-(α-метил-4-(трифторметил)бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

S-энантиомер получают из соответствующего рацемата (пример 1f) путем препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке с Chiralpak AD размером 250×4,6 при использовании смеси н-гексана, этанола и изопропанола (10:1:1; по 0,3% трифторуксусная кислота/диэтиламин) в качестве растворителя.
Пример 1h
2-(2-Пиридил)этиламид (R)-2’-(α-метил-4-(трифторметил)бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты
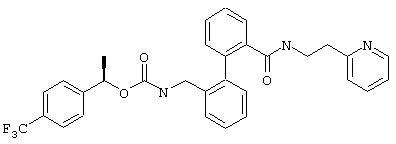
R-энантиомер получают из соответствующего рацемата (пример 1f) путем препаративной ВЭЖХ на колонке с Chiralpak AD размером 250×4, 6 при использовании смеси н-гексана, этанола и изопропанола (10:1:1; по 0,3% трифторуксусная кислота/диэтиламин) в качестве растворителя.
Пример 1i
2-(2-Пиридил)этиламид 2’-(4,4,4-трифторбутилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и 4,4,4-трифторбутил-N-сукцинимидкарбоната (предварительная стадия 4d) согласно общей методике получают 140 мг 2-(2-пиридил)-этиламида 2’-(4,4,4-трифторбутилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=486 (M+1).
Пример 1j
2-(2-Пиридил)этиламид (S)-2’-(α-метилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и (S)-(α -метилбензил-N-сукцинимидкарбоната (предварительная стадия 4h) согласно общей методике получают 60 мг 2-(2-пиридил)-этиламида (S)-2’-(α-метилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=480 (М+1).
Пример 1k
2-(2-Пиридил)этиламид (R)-2’-(α-метилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и (R)-α-метилбензил-N-сукцинимидкарбоната (предварительная стадия 4i) согласно общей методике получают 60 мг 2-(2-пиридил)этиламида (R)-2’-(α -метилбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=480 (М+1).
Примеры 1l-1u
Согласно общей методике и аналогично примерам 1a-1k получают следующие соединения из соответствующих соединений, полученных на предварительных стадиях:


Общая методика проведения взаимодействия аминометилбифенилов с эфирами хлормуравьиной кислоты до получения карбаматов
(примеры 2а-2m):
К раствору 0,3 ммоль соответствующего 2’-аминометилбифенила и 37 мг (0,36 ммоль) триэтиламина в 6 мл дихлорметана при температуре 5°C медленно добавляют по каплям раствор 0,32 ммоль соответствующего эфира хлормуравьиной кислоты в 1 мл дихлорметана. Выдерживают при перемешивании в течение ночи при комнатной температуре, смесь выливают в воду и органическую фазу промывают еще раз водой. После концентрирования остаток очищают путем флэш-хроматографии.
Пример 2а
2-(2-Пиридил)этиламид 2’-(бутоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и бутилового эфира хлормуравьиной кислоты согласно общей методике получают 69 мг 2-(2-пиридил)этиламида 2’-(бутоксикарбониламинометил)-бифенил-2-карбоновой кислоты в виде масла.
МС (ES+): m/z=432 (М+1).
Пример 2b
(3-Метилбутил)амид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,27 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и бензилового эфира хлормуравьиной кислоты согласно общей методике получают 44 мг (3-метилбутил)амида 2’-(бензилоксикарбониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 112°С.
МС (ES+): m/z=431 (М+1).
Пример 2с
2-(2-Пиридил) этиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,24 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и бензилового эфира хлормуравьиной кислоты согласно общей методике получают 59 мг 2-(2-пиридил)этиламида 2’-(бензилоксикарбониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 140°С (гептан/этилацетат).
МС (ES+): m/z=466 (M+1).
Пример 2d
(3-Метилбутил)амид 2’-(бутоксикарбониламинометил)бифенил-2-карбоновой кислоты
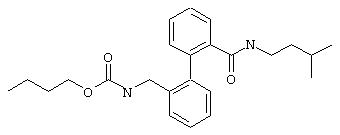
Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и бутилового эфира хлормуравьиной кислоты согласно общей методике получают 66 мг (3-метилбутил)амида 2’-(бутоксикарбониламинометил)бифенил-2-карбоновой кислоты в виде смолы.
МС (ES+): m/z=397 (M+1).
Пример 2е
(3-Метилбутил)амид 2’-(2-хлорбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и 2-хлорбензилового эфира хлормуравьиной кислоты согласно общей методике получают 75 мг (3-метилбутил)амида 2’-(2-хлорбензилоксикарбониламинометил)бифенил-2-карбоновой кислоты в виде смолы.
МС (ES+): m/z=465 (М+1).
Пример 2f
(3-Метилбутил)амид 2’-(метоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и метилового эфира хлормуравьиной кислоты согласно общей методике с последующей экстракцией этилацетатом и очисткой путем флэш-хроматографии получают 29 мг (3-метилбутил)амида 2’-(метоксикарбониламинометил) бифенил-2-карбоновой кислоты в виде смолы.
МС (ES+): m/z=355 (М+1).
Пример 2g
(3-Метилбутил)амид 2’-(феноксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и фенилового эфира хлормуравьиной кислоты согласно общей методике с последующей экстракцией этилацетатом и очисткой путем флэш-хроматографии получают 55 мг (3-метилбутил)амида 2’-(феноксикарбониламинометил)бифенил-2-карбоновой кислоты в виде смолы.
МС (ES+): m/z=417 (М+1).
Пример 2h
(3-Метилбутил)амид 2’-(4-карбометоксифеноксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0, 34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и (4-карбометокси)фенилового эфира хлормуравьиной кислоты согласно общей методике с последующей экстракцией этилацетатом и очисткой путем флэш-хроматографии получают 77 мг (3-метилбутил)-амида 2’-(4-карбометоксифеноксикарбониламинометил)бифенил-2-карбоновой кислоты в виде смолы.
МС (ES+): m/z=475 (М+1).
Пример 2i
Фенетиламид 2’-(2,2-диметилпропоксикарбониламинометил)бифенил-2-карбоновой кислоты
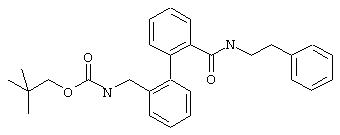
Из 0,45 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и неопентилхлорформиата согласно общей методике с последующей экстракцией этилацетатом и очисткой путем флэш-хроматографии получают 156 мг фенетиламида 2’-(2,2-диметилпропоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=445 (М+1).
Примеры 2j-2m
Аналогично примерам 2a-2i получают следующие соединения:
Общая методика проведения взаимодействия аминометилбифенилов с хлорангидридами сульфокислот до получения сульфонамидов
(примеры 3а-3t):
К раствору 0,61 ммоль соответствующего 2’-аминометилбифенила и 74 мг (0,73 ммоль) триэтиламина в 5 мл дихлорметана при температуре 0°С медленно добавляют по каплям 0,66 ммоль соответствующего хлорангидрида сульфокислоты. После перемешивания в течение 12 часов при комнатной температуре реакционную смесь концентрируют в вакууме, остаток перемешивают с 25 мл воды в течение 2 часов и выкристаллизовавшийся продукт отфильтровывают в вакууме.
Пример 3а
Фенетиламид 2’-(3-трифторметилфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и 3-трифторметилфенилсульфонилхлорида согласно общей методике получают 272 мг фенетиламида 2’-(3-трифторметилфенил-сульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 145°С.
МС (ES+): m/z=539 (М+1).
Пример 3b
Фенетиламид 2’-(4-ацетилфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и 4-ацетилфенилсульфонилхлорида согласно общей методике получают 258 мг фенетиламида 2’-(4-ацетилфенилсульфониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 145°С.
МС (ES+): m/z=513 (M+1).
Пример 3с
Фенетиламид 2’-(3-нитрофенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и 3-нитрофенилсульфонилхлорида согласно общей методике получают 272 мг фенетиламида 2’-(3-нитрофенилсульфониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 145°С.
МС (ES+): m/z=516 (М+1).
Пример 3d
Фенетиламид 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и фенилсульфонилхлорида согласно общей методике получают 224 мг фенетиламида 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 154°С.
МС (ES+): m/z=471 (М+1).
Пример 3e
Фенетиламид 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и 3-фторфенилсульфонилхлорида согласно общей методике получают 221 мг фенетиламида 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 153°С.
МС (ES+): m/z=489 (М+1).
Пример 3f
Фенетиламид 2’-(4-этилфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,61 ммоль фенетиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5а) и 4-этилфенилсульфонилхлорида согласно общей методике получают 250 мг фенетиламида 2’-(4-этилфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 163°С.
МС (ES+): m/z=499 (M+1).
Пример 3g
Бензиламид 2’-(3-трифторметилфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0, 28 ммоль бензиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5b) и 3-трифторметилфенилсульфонилхлорида согласно общей методике получают 131 мг бензиламида 2’-(3-трифторметилфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 126°С.
МС (ES+): m/z=525 (М+1).
Пример 3h
Бензиламид 2’-(3-ацетилфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль бензиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5b) и 3-ацетилфенилсульфонилхлорида согласно общей методике получают 110 мг бензиламида 2’-(3-ацетилфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 182°С.
МС (ES+): m/z=499 (М+1).
Пример 3i
Бензиламид 2’-(3-нитрофенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль бензиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5b) и 3-нитрофенилсульфонилхлорида согласно общей методике получают 115 мг бензиламида 2’-(3-нитрофенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 175°С.
МС (ES+): m/z=502 (М+1).
Пример 3j
Бензиламид 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты
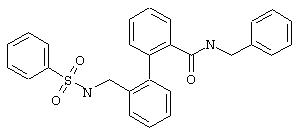
Из 0,28 ммоль бензиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5b) и фенилсульфонилхлорида согласно общей методике получают 95 мг бензиламида 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 162°С.
МС (ES+): m/z=457 (M+1).
Пример 3k
Бензиламид 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль бензиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5b) и 3-фторфенилсульфонилхлорида согласно общей методике получают 112 мг бензиламида 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 147°С.
МС (ES+): m/z=475 (М+1).
Пример 3l
(3-Метилбутил)амид 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты
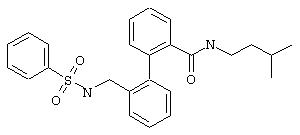
Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и фенилсульфонилхлорида согласно общей методике получают 100 мг (3-метилбутил)амида 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 127°С.
МС (ES+): m/z=437 (M+1).
Пример 3m
(3-Метилбутил) амид 2’-(4-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и 4-фторфенилсульфонилхлорида согласно общей методике получают 122 мг (3-метилбутил)амида 2’-(4-фторфенилсульфониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 149°С.
МС (ES+): m/z=455 (М+1).
Пример 3n
(3-Метилбутил)амид 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и 3-фторфенилсульфонилхлорида согласно общей методике получают 118 мг (3-метилбутил)амида 2’-(3-фторфенилсульфониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 141°С.
МС (ES+): m/z=455 (М+1).
Пример 3o
(3-Метилбутил)амид 2’-(изопропилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и изопропилсульфонилхлорида согласно общей методике с последующей очисткой путем флэш-хроматографии получают 16 мг (3-метилбутил)амида 2'-(изопропилсульфониламинометил)бифенил-2-карбоновой кислоты в виде масла.
МС (ES+): m/z=403 (M4-1).
Пример 3p
2-(2-Пиридил)этиламид 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты
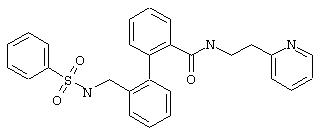
Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и фенилсульфонилхлорида согласно общей методике получают 117 мг 2-(2-пиридил)этиламида 2’-(фенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 131°С.
МС (ES+): m/z=472 (M+1).
Пример 3q
2-(2-Пиридил)этиламид 2’-(4-фторфенилсульфонил-аминометил)бифенил-2-карбоновой кислоты
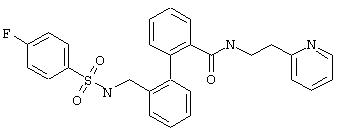
Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и 4-фторфенилсульфонилхлорида согласно общей методике получают 106 мг 2-(2-пиридил)этиламида 2’-(4-фторфенилсульфониламинометил)-бифенил-2-карбоновой кислоты. Т.пл. 130°С.
МС (ES+): m/z=490 (M+1).
Пример 3r
2-(2-Пиридил)этиламид 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-aминoмeтилбифeнил-2-карбоновой кислоты (предварительная стадия 5d) и 3-фторфенилсульфонилхлорида согласно общей методике получают 102 мг 2-(2-пиридил)этиламида 2’-(3-фторфенилсульфониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 123°С.
МС (ES+): m/z=490 (M+1).
Пример 3s
2-(2-Пиридил)этиламид 2’-(изопропилсульфониламинометил)бифенил-2-карбоновой кислоты
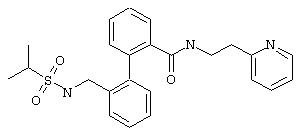
Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и изопропилсульфонилхлорида согласно общей методике и путем последующей экстракции этилацетатом получают 40 мг 2-(2-пиридил)этиламида 2’-(изопропилсульфониламинометил)-бифенил-2-карбоновой кислоты в виде масла.
МС (ES+): m/z=438 (М+1).
Аналогично примерам 3а-3s получают следующее соединение:
Общая методика проведения взаимодействия аминометилбифенилов с хлорангидридами карбоновых кислот до получения карбонамидов
(примеры 4а-4l)
К раствору 0,34 ммоль соответствующего 2’-аминометилбифенила и 41 мг (0,41 ммоль) триэтиламина в 5 мл дихлорметана при температуре 0°С медленно добавляют по каплям 0,36 ммоль соответствующего хлорангидрида сульфокислоты. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь концентрируют в вакууме, остаток перемешивают с 25 мл воды и выпавший в осадок продукт отфильтровывают в вакууме или выделяют путем экстракции этилацетатом.
Пример 4а
(3-Метилбутил)амид 2’-(бензоиламинометил)бифенил-2-карбоновой кислоты
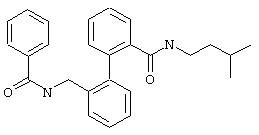
Из 0,34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и бензоилхлорида согласно общей методике получают 75 мг (3-метилбутил)амида 2’-(бензоиламинометил)бифенил-2-карбоновой кислоты. Т.пл. 147°С.
МС (ES+): m/z=401 (М+1).
Пример 4b
2-(2-Пиридил)этиламид 2’-(бензоиламинометил)бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и бензоилхлорида согласно общей методике получают 98 мг 2-(2-пиридил)этиламида 2’-(бензоиламинометил)бифенил-2-карбоновой кислоты. Т.пл. 135°С.
МС (ES+): m/z=436 (M+1).
Пример 4с
2,4-Дифторбензиламид 2’-{[2-(4-метоксифенил)-ацетиламино]метил}бифенил-2-карбоновой кислоты

Из 0, 5 ммоль (2,4-дифторбензил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 8а) и 4-метоксифенилацетилхлорида согласно общей методике получают 160 мг 2,4-дифторбензиламида 2’-{[2-(4-метоксифенил)ацетиламино]-метил}бифенил-2-карбоновой кислоты. Т.пл. 138°С.
МС (ES+): m/z=501 (M+1).
Аналогично примерам 4а-4с получают следующие соединения:

Общая методика проведения взаимодействия аминометилбифенилов с изоцианатами до получения мочевин (примеры 5а-5е)
К раствору 0,34 ммоль соответствующего 2’-аминометилбифенила и 41 мг (0,41 ммоль) триэтиламина в 5 мл дихлорметана при температуре 0°С медленно добавляют по каплям раствор 0,36 ммоль соответствующего изоцианата в 0,5 мл дихлорметана. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь концентрируют в вакууме, остаток перемешивают с 25 мл воды и выпавший в осадок продукт отфильтровывают в вакууме или выделяют путем экстракции этилацетатом.
Пример 5а
3-Метилбутил)амид 2’-[(3-фенилуреидо)метил]бифенил-2-карбоновой кислоты

Из 0, 34 ммоль (3-метилбутил)амида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5с) и фенилизоцианата согласно общей методике получают 85 мг (3-метилбутил)амида 2’-[(3-фенилуреидо)метил]бифенил-2-карбоновой кислоты. Т.пл. 194°С.
МС (ES+): m/z=416 (М+1).
Пример 5b
2-(2-Пиридил)этиламид 2’-[(3-фенилуреидо)метил]бифенил-2-карбоновой кислоты

Из 0,3 ммоль 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и фенилизоцианата согласно общей методике получают 101 мг 2-(2-пиридил)этиламида 2’-[(3-фенилуреидо)метил]бифенил-2-карбоновой кислоты. Т.пл. 99°С.
МС (ES+): m/z=451 (М+1).
Примеры 5с-5е
Аналогичным образом из 2-(2-пиридил)этиламида 2’-аминометилбифенил-2-карбоновой кислоты (предварительная стадия 5d) и соответствующих изоцианатов получают следующие соединения:
Общая методика проведения взаимодействия бифенилкарбоновых кислот с аминами до получения амидов (примеры 6a-6h)
К раствору 0,28 ммоль соответствующей бифенилкарбоновой кислоты, 0,3 ммоль НОВТ и 0,3 ммоль DIC в 5 мл тетрагидрофурана при температуре 0°С добавляют по каплям 0, 3 ммоль соответствующего амина и перемешивают в течение 12 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом и промывают разбавленной соляной кислотой и раствором гидрокарбоната натрия. После высушивания над сульфатом магния и концентрирования в вакууме получают соответствующий амид.
Пример 6а
Бензилметиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и бензилметиламина согласно общей методике получают 89 мг бензилметиламида 2’-(бензилоксикарбониламинометил) бифенил-2-карбоновой кислоты.
МС (ES+): m/z=465 (M+1).
Пример 6b
Циклогексиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и циклогексиламина согласно общей методике получают 99 мг циклогексиламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=443 (M+1).
Пример 6с
Фенидамид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и анилина согласно общей методике получают 66 мг фениламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=437 (M+1).
Пример 6d
{N-Метил-N-[2-(2-пиридил)этил]}амид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и 2-[2-(метиламиноэтил)]пиридина согласно общей методике и путем последующей очистки с помощью флэш-хроматографии получают 54 мг {N-метил-N-[2-(2-пиридил)этил]}амида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=480 (М+1).
Пример 6е
Дибутиламид 2’-(бензидоксикарбонидаминометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и дибутиламина согласно общей методике и путем последующей очистки с помощью флэш-хроматографии получают 82 мг дибутиламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=473 (М+1).
Пример 6f
2-(2-Пиридил)этиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и 2-(2-пиридил)этиламина согласно общей методике и путем последующей очистки с помощью флэш-хроматографии получают 85 мг 2-(2-пиридил)этиламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты. Т.пл. 140°С (гептан/этилацетат).
МС (ES+): m/z=466 (М+1).
Пример 6g
(2,4-Дифторбензил)амид 2’-(бензидоксикарбониламинометил)бифенид-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и 2,4-дифторбензиламина согласно общей методике и путем последующей очистки с помощью флэш-хроматографии получают 99 мг (2,4-дифторбензил)амида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=487 (М+1).
Пример 6h
(2,2,2-Трифторэтил)амид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и 2,2,2-трифторэтиламина согласно общей методике и путем последующей очистки с помощью флэш-хроматографии получают 19 мг (2,2,2-трифторэтил)амида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=443 (М+1).
Пример 7а
2-[2-(1-Оксипиридил)]этиламид 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты

К раствору 85 мг (0,18 ммоль) 2-(2-пиридил)этиламида 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (пример 6f) в 13 мл дихлорметана при температуре 0°С добавляют по каплям раствор 47 мг м-хлорнадбензойной кислоты в 2 мл дихлорметана и реакционную смесь перемешивают в течение 12 часов при комнатной температуре. Органическую фазу промывают 2 раза раствором гидрокарбоната натрия, сушат над сульфатом магния и концентрируют в вакууме. Получают 79 мг 2-[2-(1-оксипиридил)]этиламида 2’-[бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=482 (М+1).
Аналогично примеру 7а из соответствующих пиридинов получают следующие соединения:
Общая методика проведения взаимодействия бифенилкарбоновых кислот с аминами до получения амидов (примеры 8а-8ас)
К раствору 0,42 ммоль соответствующей бифенилкарбоновой кислоты, 0,44 ммоль НОВТ и 0,44 ммоль EDAC в 5 мл тетрагидрофурана при температуре 0°С добавляют по каплям 0,44 ммоль соответствующего амина и перемешивают в течение 4-12 часов при комнатной температуре. Реакционную смесь разбавляют этилацетатом и промывают разбавленной соляной кислотой и раствором гидрокарбоната натрия. После высушивания над сульфатом магния и концентрирования в вакууме получают соответствующий амид.
Пример 8а
Бензиловый эфир [2’-(1-карбамоил-3-метилбутилкарбамоил)бифенил-2-илметил]карбаминовой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и L-лейцинамидгидрохлорида/триэтиламина согласно общей методике получают 180 мг бензилового эфира [2’-(1-карбамоил-3-метилбутилкарбамоил)бифенил-2-илметил]карбаминовой кислоты.
МС (ES+): m/z=474 (М+1).
Пример 8b
Метиловый эфир 2-{[2’-(бензидоксикарбониламинометил)бифенил-2-карбонил]амино]-3-фенилпропионовой кислоты

Из 0,28 ммоль 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и гидрохлорида метилового эфира L-фенилаланина/триэтиламина согласно общей методике получают 230 мг метилового эфира 2-{[2'-(бензилоксикарбониламинометил)бифенил-2-карбонил]амино}-3-фенилпропионовой кислоты.
МС (ES+): m/z=523 (М+1).
Пример 8с
(2,4-Дифторбензил)амид 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты

Из 10 ммоль 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 7) и 2,4-дифторбензиламина согласно общей методике получают 3,8 г (2, 4-дифторбензил)амида 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты.
МС (ES+): m/z=453 (М+1).
Примеры 8d-8p
Из 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 7) и соответствующих аминов аналогично примерам 8а-8с получают следующие продукты:


Примеры 8р-8ас
Из 2’-(бензилоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 6) и соответствующих аминов аналогично примерам 8а-8с получают следующие продукты:


Общая методика проведения взаимодействия аминометилбифенилов с изотиоцианатами до получения тиомочевин (примеры 9а-9i):
К раствору 0,34 ммоль соответствующего 2’-аминометилбифенила и 41 мг (0,41 ммоль) триэтиламина в 5 мл дихлорметана при температуре 0°С медленно добавляют по каплям раствор 0,36 ммоль соответствующего изотиоцианата в 0,5 мл дихлорметана. После перемешивания в течение 3 часов при комнатной температуре реакционную смесь концентрируют в вакууме, остаток перемешивают с 25 мл воды и выпавший в осадок продукт отфильтровывают в вакууме или очищают путем препаративной ВЭЖХ.
Таким образом получают, в частности, следующие продукты:



Примеры 10а-10о
Путем реакции сочетания 2’-(трет-бутоксикарбониламинометил)бифенил-2-карбоновой кислоты (предварительная стадия 7) с соответствующими аминами аналогично описанным в примере 6 или 8 методикам получают, в частности, следующие продукты:


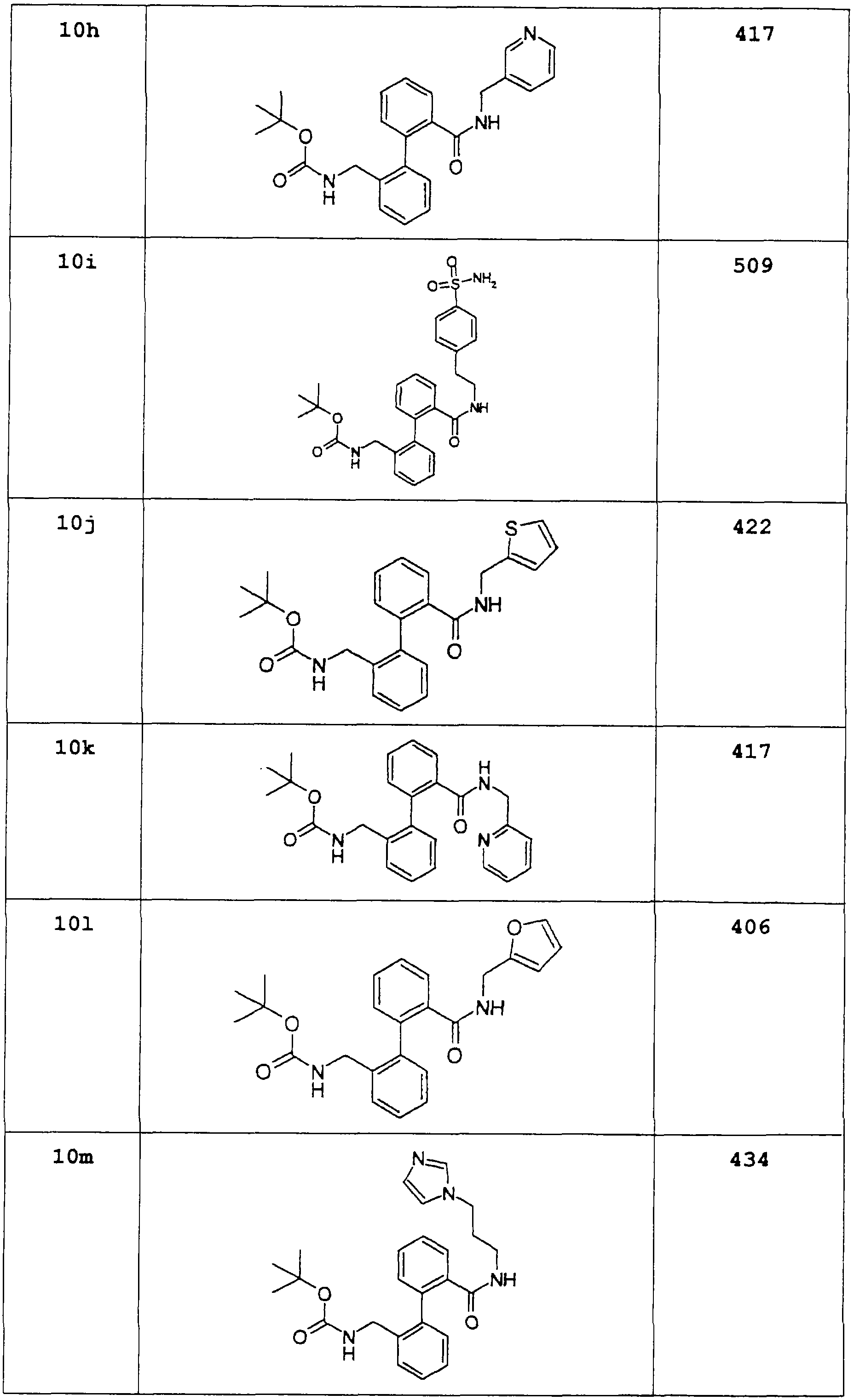

Примеры 11а-11r
Общая методика превращения Вос-производных согласно примерам 10 до мочевин
Для отщепления Вос-защитной группы 1 г соответствующего соединения согласно примеру 10 добавляют к 10 мл 30%-ного раствора трифторуксусной кислоты в дихлорметане. Смесь перемешивают в течение 30 минут при комнатной температуре и растворитель удаляют в вакууме роторного выпарного аппарата. Остаток обрабатывают этилацетатом и промывают насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме. Полученные амиды 2’-аминометилбифенил-2-карбоновых кислот затем согласно методике примеров 5 вводят во взаимодействие с изоцианатами при получении соответствующих мочевин.
Таким образом получают, в частности, следующие продукты:



Общая методика получения предлагаемых согласно изобретению соединений путем твердофазного синтеза
Количественные данные в методиках относятся, соответственно, всегда к нагрузке смолы, которые определяют УФ-фотометрически после отщепления Fmoc-защитной группы (см., например, "The Combinatorial Chemistry Catalog", Novabiochem).
Общая методика реакции сочетания α -Fmoc-аминокислот с амидной смолой Ринка
К амидополистирольной смоле Ринка (нагрузка 1,2 ммоль/г) добавляют раствор по 1,5 эквивалента НОВТ, TOTU, DIPEA и α-Fmoc-аминокислоты в диметилформамиде (5 мл/г смолы) и смесь выдерживают при встряхивании в течение 12 часов при комнатной температуре. Смолу отфильтровывают и промывают 3 раза по 10 мл диметилформамидом, один раз с помощью 10 мл толуола, один раз с помощью 10 мл метанола и 3 раза по 10 мл дихлорметаном. Определение нагрузки по Fmoc-методу дает нагрузку 0,9 ммоль/г носителя.
Отщепление Fmoc-защитной группы
Для отщепления Fmoc-защитной группы смолу предварительно подвергают набуханию в течение 5 минут в диметилформамиде при комнатной температуре. После добавления раствора диметилформамида/пиперидина (4 мл/г смолы; в соотношении 1:1) встряхивают в течение 20 минут при комнатной температуре. Раствор отфильтровывают в вакууме и процесс повторяют. Отщепление в случае аналитической пробы показывает полное превращение согласно исследованию ВЭЖХ/масс-спектрометрия. После полного превращения смолу три раза промывают дихлорметаном и используют непосредственно в реакции сочетания.
Общая методика реакции сочетания связанных со смолой аминокислот с 2’-фталимидметилбифенил-2-карбоновой кислотой (предварительная стадия 2)
К 100 г нагруженной аминокислотой (0,6-0,8 ммоль/г) смолы добавляют раствор 12,2 мг (0,09 ммоль) НОВТ, 29,5 мг (0,09 ммоль) TOTU, 16 мкл (0,09 ммоль) DIPEA и 0,09 ммоль 2'-фталимидметилбифенил-2-карбоновой кислоты (предварительная стадия 2) в 5 мл диметилформамида и смесь выдерживают при встряхивании в течение 12 часов при комнатной температуре. Смолу отфильтровывают и промывают 3 раза по 10 мл диметилформамидом, один раз с помощью 10 мл толуола, один раз с помощью 10 мл метанола и 3 раза по 10 мл дихлорметаном.
Общая методика отщепления фталимидной защитной труппы от носителя
К 1 г смолы, нагруженной защищенным Fmoc-группой аминосоединением, добавляют 5 мл 10%-ного раствора гидразина в диметилформамиде и смесь выдерживают при встряхивании в течение 2 часов при комнатной температуре. Смолу отфильтровывают в вакууме. Затем смолу промывают три раза по 10 мл диметилформамидом и дихлорметаном. Отщепление в случае аналитической пробы показывает полное превращение согласно исследованию ВЭЖХ/масс-спектрометрия.
Общая методика реакции сочетания с хлорангидридами сульфокислот
К 100 мг смолы, нагруженной функционализированной 2’-аминометилбифенил-2-карбоновой кислотой, добавляют раствор 0,16 мл (0,027 ммоль) DIPEA и 0,027 ммоль хлорангидрида сульфокислоты в 5 мл диметилформамида и смесь выдерживают при встряхивании в течение 12 часов при комнатной температуре. Смолу отфильтровывают и промывают 3 раза по 10 мл диметилформамидом, один раз с помощью 10 мл толуола, один раз с помощью 10 мл метанола и 3 раза с помощью 10 мл дихлорметана.
Общая методика отщепления смолы
Для отщепления смолу суспендируют в дихлорметане/трифторуксусной кислоте (3 мл/0,1 г смолы) и встряхивают в течение 1 часа. Смолу отфильтровывают и промывают с помощью 1 мл дихлорметана. Объединенный раствор после отщепления концентрируют в роторном концентраторе. Остаток обрабатывают дихлорметаном и с помощью дихлорметана и этилацетата хроматографируют на силикагеле или очищают путем препаративной ВЭЖХ.
Таким образом получают, в частности, следующие продукты:



Пример 13а
2-{[2’-(Бензилоксикарбониламинометил)бифенил-2-карбонил]амино}-4-метил-пентановая кислота

Соединение получают из метилового эфира, полученного согласно примеру 8r, путем омыления с помощью гидроксида калия в смеси метанола и воды при температуре 60°С.
Примеры 13b-13e
Путем реакции сочетания карбоновой кислоты согласно примеру 13а с соответствующими аминами по указанной в примере 8 общей методике получают следующие соединения:

Путем отщепления с помощью гидрогенолиза Z-защитной группы от соединения согласно примеру 13с и последующего введения во взаимодействие с соответствующими хлорангидридами кислот получают следующие соединения:
Исходя из соединения согласно примеру 8z, аналогично методикам примеров 13а-13е, путем гидролиза и введения во взаимодействие с изопропиламином получают следующее соединение:
Общая методика реакции сочетания (2,4-дифторбензил)амида 2’-аминометилбифенил-2-карбоновой кислоты с карбоновыми кислотами до получения карбонамидов (примеры 14a-14f)
Соответствующую карбоновую кислоту в количестве 0,27 ммоль вместе с 0,27 ммоль НОВТ и 0,27 ммоль EDAC в 1 мл тетрагидрофурана перемешивают в течение 30 минут при комнатной температуре. Затем добавляют раствор 0,26 ммоль трифторацетата (2,4-дифторбензил)амида 2’-аминометилбифенил-2-карбоновой кислоты в 1 мл тетрагидрофурана и перемешивают в течение ночи при комнатной температуре. Реакционную смесь разбавляют этилацетатом и промывают раствором гидрокарбоната натрия и водой. После концентрирования органической фазы продукты очищают путем препаративной ВЭЖХ.
Таким образом получают следующие соединения:
Общая методика синтеза бифенилов путем реакции сочетания по Suzuki (примеры 15а-15b)
К находящемуся в атмосфере аргона диметоксиэтану в количестве 10 мл добавляют 58 мг (0,05 ммоль) тетракис-(трифенилфосфин)палладия и 1 ммоль соответствующего бромида. Спустя 10 минут добавляют 1,5 ммоль соответствующей бороновой кислоты и, наконец, 1 мл 2М раствора карбоната натрия (2 ммоль). Кипятят с обратным холодильником в атмосфере аргона в течение 18 часов, охлаждают и разбавляют с помощью 30 мл дихлорметана. Смесь промывают водой и насыщенным раствором хлорида натрия, сушат над сульфатом натрия, концентрируют и очищают путем хроматографии на силикагеле.
Пример 15а
(3-Метилбутил)амид 2’-(трет-бутоксикарбониламинометил)-4-нитробифенил-2-карбоновой кислоты

Согласно общей методике получают 350 мг (выход 79%) замещенного нитрогруппой соединения в виде твердого вещества желтого цвета.
Пример 15b
(3-Метилбутил)амид 2’-(трет-бутоксикарбониламинометил)-4-метоксибифенил-2-карбоновой кислоты

Согласно общей методике получают 170 мг (выход 41%) замещенного метоксигруппой соединения в виде вязкого светлого масла.
Пример 16а
(3-Метилбутил)амид 2’-(трет-бутоксикарбониламинометил)-4-аминобифенил-2-карбоновой кислоты

330 мг (0,75 ммоль) замещенного нитрогруппой соединения согласно примеру 15а растворяют в этилацетате и после внесения на кончике шпателя 10%-ного палладия-на-угле гидрируют в атмосфере водорода (1 бар). Спустя 2 часа фильтруют через целит и прозрачный раствор концентрируют. Выход: 260 мг (84%).
Пример 16b
(3-Метилбутил)амид 2’-(бензилоксикарбониламинометил)-4-гидроксибифенил-2-карбоновой кислоты

150 мг (0,35 ммоль) замещенного метоксигруппой соединения согласно примеру 15b растворяют в 5 мл безводного дихлорметана и при температуре -70°С медленно смешивают с 1,4 мл (1,4 ммоль) 1М раствора трибромида бора в н-гексане. Спустя 10 минут реакционную смесь медленно нагревают до температуры 0°С. После выдерживания в течение 2 часов при этой температуре нейтрализуют с помощью насыщенного раствора гидрокарбоната натрия, экстрагируют в целом с помощью 40 мл дихлорметана, сушат над сульфатом натрия и концентрируют. Из полученного сырого продукта (88 мг) (3-метилбутил)амида 2’-аминометил-4-гидроксибифенил-2-карбоновой кислоты 30 г (0,1 ммоль) растворяют в дихлорметане, смешивают с 11 мг (0,11 ммоль) триэтиламина и 27 мг (0,11 ммоль) бензилоксикарбонилоксисукцинимида. Спустя 3 часа разбавляют дихлорметаном, промывают водой, органическую фазу сушат над сульфатом натрия и очищают путем ВЭЖХ с обращенной фазой. Получают 8 мг (3-метилбутил)амида 2’-(бензилоксикарбониламинометил)-4-гидроксибифенил-2-карбоновой кислоты в виде темного масла.
Пример 17а
трет-Бутиловый эфир {1-[2’-(3-метилбутилкарбамоил)бифенил-2-ил]этил}карбаминовой кислоты

2,2 г (10 ммоль) N-Boc-(R)-фенетиламина растворяют в 50 мл безводного тетрагидрофурана, охлаждают до температуры -78°С и по каплям смешивают с 14 мл (1,5М раствор в пентане; 21 ммоль) трет-бутиллития. В течение 2 часов нагревают до температуры -20°С, затем добавляют 4,5 мл (40 ммоль) триметилового эфира борной кислоты и нагревают до комнатной температуры. Раствор охлаждают до температуры 0°С, подкисляют до значения рН, равного 6, с помощью 10%-ной НСl, водную фазу экстрагируют дихлорметаном, объединенные органические фазы промывают с помощью насыщенного раствора хлорида натрия, сушат и концентрируют. Получают бороновую кислоту в виде светло-желтой твердой пены, которую используют без дальнейшей очистки.
Реакцию сочетания по Suzuki осуществляют согласно общей методике работы (см. пример 15) с 1 ммоль 2-бром-N-(3-метилбутил)бензамида и после хроматографической очистки получают 85 мг (0,2 ммоль) бифенила.
Примеры 17b-17е
Аналогично методике примера 17а получают энантиомер согласно примеру 17b. Путем отщепления Вос-группы и переведения в соответствующие карбаматы соединения согласно примерам 17а и 17b превращают в соединения согласно примерам 17с-17е.

Аналогично описанным в примерах 1-17 методикам получают следующие соединения:





Фармакологические исследования
Kv1.5-каналы человека экспрессировали в ооцитах Xenopus. Для этого сначала ооциты выделяли из Xenopus laevis и дефолликулировали. Затем в эти ооциты вводили путем инъекции синтезированную in vitro, кодирующую Kv1.5 РНК. После экспрессии Kv1.5-протеина в течение 1-7 дней в ооцитах измеряли Ку1.5-токи методом фиксированного напряжения смещения с двумя электродами. Kv1.5-каналы при этом, как правило, активировали с помощью длящихся 500 миллисекунд скачков напряжения в 0 милливольт и 40 милливольт. Ванну промывали раствором следующего состава: 96 ммоль NaCl, 2 ммоль КСl, 1,8 ммоль CaCl2, 1 ммоль MgCl2, 5 ммоль ГЕПЕС (титрованным с помощью раствора NaOH до рН=7,4). Эти эксперименты проводили при комнатной температуре. Для повышения (по величине) данных и анализа использовали усилитель Geneclamp (Axon Instruments, Foster City, США) и преобразователь MacLab D/A и программное обеспечение (ADInstruments, Castle Hill, Австралия). Предлагаемые согласно изобретению вещества тестировали тем, что их в различных концентрациях вводили в электролит. Действие веществ рассчитывали в виде ингибирования в процентах контрольного тока Kv1.5, который получали, когда к раствору не добавляли никакого вещества. Данные затем экстраполировали по уравнению Хилла, чтобы определить ингибирующую концентрацию ИК50 для соответствующих веществ.
Таким образом, для нижеуказанных соединений (см. таблицу) определили следующие значения ИК50:

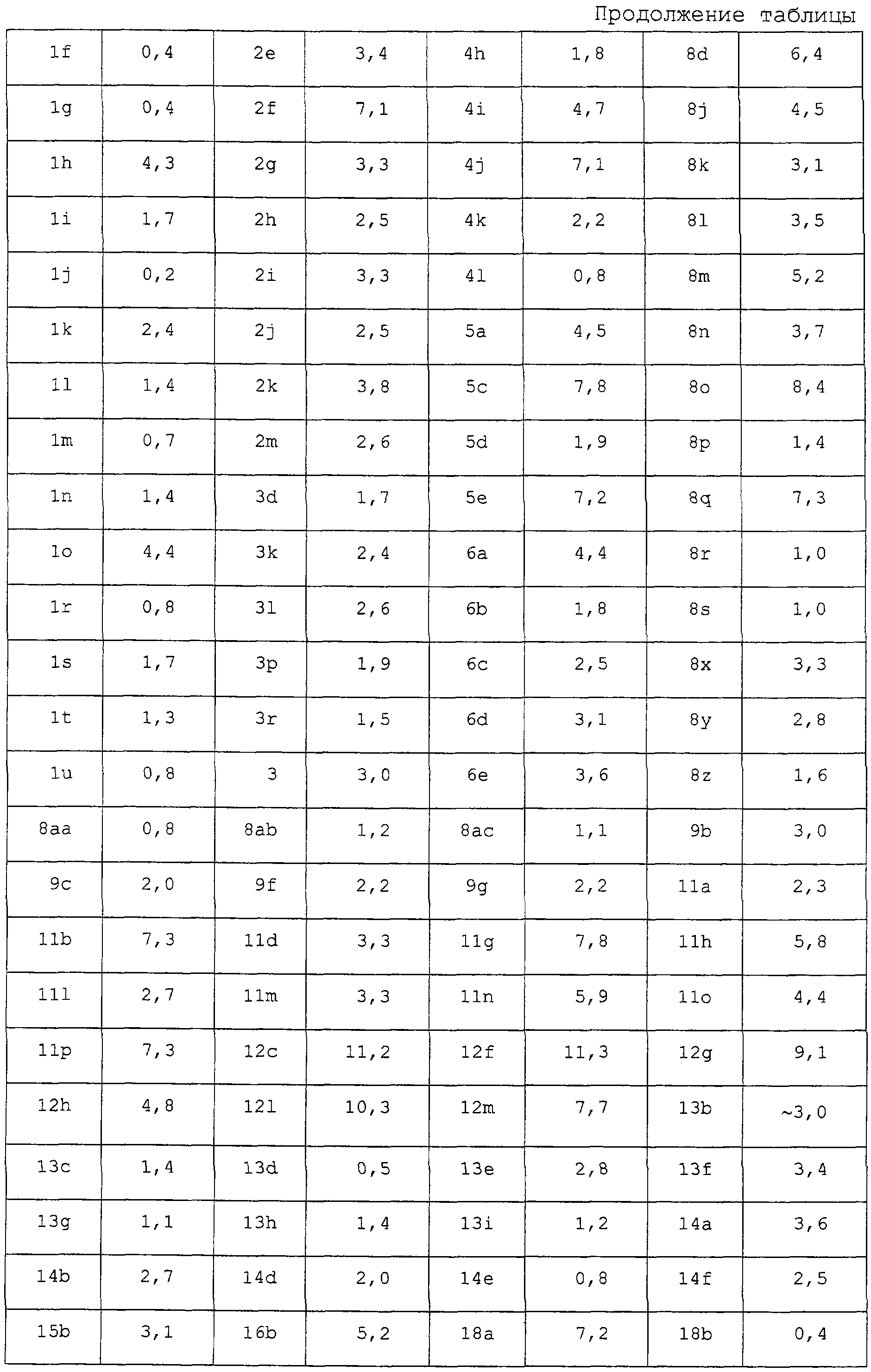

Реферат
Изобретение относится к органической химии, в частности к соединениям формулы (I):

где R(1), R(2), R(3), R(4), R(5), R(6), R(7), R(8), R(30) и R(31) имеют указанные в формуле изобретения значения, которые в высшей степени пригодны в качестве нового рода антиаритмических биологически активных веществ, в особенности для лечения и профилактики аритмий предсердий, как, например, мерцание предсердий (фибрилляция предсердий, AF) или трепетание предсердий (предсердные трепетания). 12 з.п. ф-лы, 1 табл.
Формула

Документы, цитированные в отчёте о поиске
Производные бензонитрила, или их рацематы, или фармацевтически приемлемые соли, обладающие антиаритмическим действием, и состав для лечения сердечной аритмии







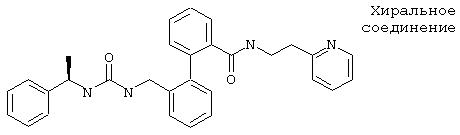









Комментарии