Производные бензонитрила, или их рацематы, или фармацевтически приемлемые соли, обладающие антиаритмическим действием, и состав для лечения сердечной аритмии - RU2024503C1
Код документа: RU2024503C1
Чертежи

Описание
Изобретение относится к новым производным бензонитрила формулы I

Y - группа -(CH2)m -, где: m = 0-1, или СНОН,
Z - водород или насыщенный неразветвленный алкил с 1-3 атомами углерода;
А - группа
-

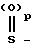


где Ra, Ra' и Ra'' - каждый независимо друг от друга неразветвленный оксиалкил или алкил с 1-5 атомами углерода
Rc - насыщенный неразветвленный алкил с 1-4 атомами углерода, который может быть замещен атомами фтора;
Р = 1-2
q = 2-5 из рацематов или фармацевтически приемлемых солей, которые обладают антиаритмическим действием, и составам, включающим соединения I, для лечения сердечной аритмии.
В литературе описаны аналоги новым соединениям, например 2-/2-/окси-/3-этилтио/-пропил/амино/пропокси/-бензо- нитрил /Н 244/15/ и 2-/2-/окси-/2-этилтио/-этил/амино/пропокси/-бензонитрил /H 244/14/, которые обладают антиаритмическим действием (1).
Целью изобретения является выявление новых соединений из класса производных бензонитрила, которые бы обладали эффективным антиаритмическим действием класса III, в отличие от известных аналогов, обладающих антиаритмическим действием класса II, т.е. проявляющие обычную β -адренергическую блокирующую активность, а также создание нового состава на основе новых соединений формулы I для лечения сердечной аритмии.
П р и м е р 1. 4-/3-Этил-/3-(пропилтио)пропил/амино/-2-оксипропокси/-бен-зонитрил.
а) 4-/3-(этиламино)-2-оксипропокси/бензонитрил, 86,0 г 4-/оксиранилметокси/бензонитрила растворяют в 250 мл ацетонитрила и смешивают с 29,7 г этиламина в автоклаве. Смесь нагревают на бане с кипящей водой всю ночь, выпаривают и остаток растворяют в 2-молярной хлористоводородной кислоте. Данный кислотный водный слой промывают дважды эфиром, подщелачивают 10 молями гидроокисью натрия и экстрагируют 3 порциями дихлорметана.
Объединенные органические слои высушивают над сульфатом натрия и выпаривают. Твердый остаток перекристаллизовывают дважды из смеси диизопропилового эфира: ацетонитрила /9:1/,) выход 57 г 4/3-(этиламино)-2-оксипропокси/бензонитрила.
ЯМР13 С в дейтерированном хлороформе: 14,88; 43,93; 51,28; 67,60; 70,77; 104.31; 115,26; 119,00; 133,93; 161,93; частей на млн.
в) 4-/3-/этил/3-(пропилтио)пропил/-амино/-2-оксипропокси/-бензонитрил.
4,7 г
4-/3-/Этиламино/-2-оксипропокси/-бензонитрила, 4,5 г 1-бром-/3-(пропилтио)пропана и 5,8
г карбоната калия смешивают в 50 мл изопропанола и нагревают с обратным холодильником всю ночь. Смесь фильтруют
и выпаривают. Остаточное масло, 8,3 г разделяют колоночной хроматографией. Выход 4,9 г
указанного в заголовке соединения:
ЯМР13 С в дейтерированном хлороформе 11,44, 13.47, 22,62,
26.84, 29,58, 34,63, 47,44, 62,27, 56,03, 65,81, 70,47, 103,74, 115,08, 118,78, 133,57,
161,87 (частей на 1 млн).
П р и м е р 2. 4-/3-/Этил/3-(пропилсульфонил)пропил/амино/-2-оксипропокси/-бензонитрил.
2,45 г 4-/3-/этил/3-(пропилтио)пропил/амино/-2-оксипропилокси/-бензони-трила и 1,4 п-толуолсульфокислоты смешивают в 50 мл этанола. Смесь охлаждают до минус 10оС и 1,7 г м-хлорбензойной кислоты добавляют малыми порциями. Смесь перемешивают 0,5 ч при минус 10оС и 1 ч при комнатной температуре, затем выпаривают. Остаток растворяют в дихлорметане и промывают 3 порциями, карбоната натрия и дважды водой, затем высушивают над сульфатом натрия, фильтруют и выпаривают. Остаток 2,3 г желтого масла очищают колоночной хроматографией. Выход 1,4 г указанного в заголовке, соединения ЯМР-13 С в дейтерированном хлороформе, 11,21, 11,33, 13,11, 16,02, 20,30, 20,43, 47,47, 47, 45, 49,69, 49,95, 52,18, 52,41, 54,29, 54,41, 56,06, 56,09, 66,08, 70,41, 70,41, 70,49, 103,76, 115,09, 118,83, 133,62, 161,88 ч/млн.
П р и м е р 3. 4-/3-Этил/-3-(пропилсульфонил)-пропил/амино/-2-оксипропилокси/-бензонитрил.
7,3 г 4-/3-/Этил/3-(пропилтио)пропил/амино/-2-оксипропилокси/бензони- трила смешивают с 4,2 г п-толуолсульфокислоты в 75 мл этанола. К этой смеси добавляют 10,1 г м-хлорбензойной кислоты малыми порциями. За время добавления температуре дают повыситься до 45оС. Затем смесь перемешивают при комнатной температуре 3 ч. По окончании реакции растворитель выпаривают и остаток растворяют в дихлорметане, промывают 3 раза в карбонате натрия и дважды водой. Органический слой выпаривают и остаток растворяют в 2 молярной хлористоводородной кислоте, затем 3-кратно промывают эфиром. Водный слой подщелачивают 1-молярным раствором гидроокиси натрия и экстрагируют дихлорметаном. Органические растворы высушивают над сульфатом натрия, фильтруют и выпаривают 5,4 г неочищенного продукта, очищают колоночной хроматографией. Выход 3,2 г в заголовке соединения.
ЯМР-13 С в дейтерированном хлороформе (CDCl3):11,41, 12,88, 15,64, 19,57, 47,44, 50,15, 51, 88, 54,68, 56,04, 66,19, 70,45, 104,0, 115,2, 118,94, 133,79, 161,91 ч/млн.
П р и м е р 4. 4-/3-/Этил-/3-(метилсульфинил)пропил/амино/-2-оксипропокси/-бензонитрил.
Указанное в заголовке соединение получают аналогично способам, описанным в примерах 1 и 2.
ЯМР-13 С в дейтерированном хлороформе (CDCl3): 11,16, 11,27, 20,18, 20, 31, 38,39, 38,50, 47,40, 51,87, 51,11, 52,17, 52,35, 56,02, 66,09, 70,37, 70,44, 103,68, 115,05, 118,79, 133,58, 161,83 ч/мин.
П р и м е р 5. 3-/4-Цианофенокси/-N, N-диэтил-2-окси-N-/3/-пропилсульфонил/пропил/-1-пропана монийодид.
5,0 г 4-/3-этил/3-/пропилсульфонил/пропил/амино/-2-оксипропокси/бен- зонитрила и 2,4 г этилиодида растворяют в 50 мл ацетонитрила и нагревают с обратным холодильником в течение 6 ч, другую порцию этилйодида 2,4 г добавляют и продолжают нагревать с обратным холодильником всю ночь. Раствор выпаривают и остаточное масло 6,6 г отделяют колоночной хроматографией.
Выход 4,0 г
указанного в заголовке соединения
ЯМР-13 С: в двуокиси дейтерия: 8,07, 13,42, 16,75, 47,73, 53,78, 55,53,
57,57, 60,38, 64,41, 67,42, 70,78, 104,00, 116,45, 120,7, 135,39, 162,35
ч/млн.
П р и м е р 6. 4-/3-/Этил-/3-/пропилтио/-пропил/амино/-2/R/оксипропокси/бензонитрил.
а) /4S/-2,2-Диметил-4-/4-цианофенокси/метил-1,3-диоксолан.
Раствор 4-оксибензонитрила (55 г) в метаноле (100 мл) обрабатывают гидроокисью калия (29 г) в воде (30 мл) и выпаривают при
пониженном давлении. Остаточную калийную соль растворяют в сухом
диметилформамиде (75 мл) и добавляют /4R/ /-2,2-диметил-4-метансульфонил-оксиме- тил-1,5-диоксолан (82,2 г). Смесь нагревают при
перемешивании при 110оС 20 ч, дают остыть), и распределяют
между эфиром и водой. Водную фазу экстрагируют 3-кратно эфиром, объединенные эфирные фазы промывают 3-кратно 10%-ной водной
гидроокисью калия и дважды водой, высушивают над безводным сульфатом натрия
и выпаривают. Выход 77 г указанного в заголовке соединения:
ЯМР-13 С в дейтерированном хлороформе
(CDCl3): 25,11, 26,57, 66,35, 68,85, 73,55, 104,30, 109,77, 116,17,
118,83, 133,79, 161,68.
в) /2R/-3-/4-Цианофенокси/пропан-1,2-диол.
77 г /4S/-2, 2-диметил-4-/4-цианофенокси/метил-1,3-диоксолана растворяют в метаноле (200 мл) и воде (75 мл).
Концентрированную хлористоводородную кислоту (0,5 мл) добавляют и смесь выдерживают при 50оС всю ночь, выпаривают при пониженном давлении и перекристаллизовывают из воды, что дает 46 г указанного в заголовке соединения в виде белого остатка, т.пл. 63-65оС.
ЯМР-13 С в CDCl3, 63,90, 70,72, 71,44, 104,70, 116,56, 120,07, 135,09, 163,86 ч/млн.
с) /2S/-1-/4-цианофенокси/-3-метансульфонилоксипропан-2-ол.
57,2 г /2R/-3-/4-цианофенокси/пропан-1,2-диола растворяют в сухом пиридине (300 мл) и обрабатывают вводимым по каплям метансульфонилхлорид (20,7 мл) при минус 10оС. Реакционную смесь выдерживают при минус 5оС всю ночь, выпаривают при пониженном давлении, выливают на лед и 2-молярную хлористоводородную кислоту. Твердый осадок перекристаллизовывают 3-кратно из метанола, что дает 12,3 г указанного в заголовке соединения, т.пл. 119-121оС /α/D20+9,7o/С 1,0, метанол/.
ЯМР13 С: в/CDCl3/: 37.26, 68,77, 69,92, 71,76, 105,19, 116,65, 119,99, 135,19, 163, 55 ч/млн.
d/4-/3-этил-/2-(пропилтио)пропил/ амино-2R/-оксипропокси/бензонитрил.
11, 7 г/2S/-1-/34-цианофенокси/-3-метансульфинил оксипропан-2-ола перемешивают и нагревают всю ночь с обратным холодильником с этил/3-пропилтио/пропиламином /13,9 г карбонатом калия /12,6 г/ и ацетонитрилом (100 мл), фильтруют и выпаривают, что дает 21,5 г неочищенного продукта, который распределяют между эфиром и 2-молярной, хлористоводородной кислотой.
Водный слой экстрагируют 3-кратно дихлорметаном, в котором он присутствует в виде пары ионов. Выпаривание и распределение между эфиром и 1-молярной гидроокисью натрия дает в эфирном слое свободное основание. Хроматография на силикагеле с применением метанола-дихлорметана 5:95 в качестве подвижной фазы дает 10,3 г указанного в заголовке соединения в виде бесцветного масла, /α/D20 - 24,2oC/C = 1,0 метанол/.
ЯМР13 С в CDCl3 : 11,53, 13,32, 22,76, 26,92, 29,71, 34,20, 47,56, 52,38, 56,20, 65,82, 70,53, 103,97, 115,17, 118, 95, 133,98, 161,95 ч/млн.
П р и м е р 7. 4-/3-/Этил/3-(пропилсульфонил)пропил/амино/-2/R/-оксипропокси/ бензонитрил.
Окисление 4-/3-/этил/3-/пропилтио/-пропил/амино/-2/R/оксипропокси/бензо- нитрила м-хлорнадбензойной кислотой проводят, как описано для рецемата в примере 2.
/α/D20
18,6/C 1,0 метанол
ЯМР13 С: в CDCl3: 11,35, 11,47, 13,80,
16,24, 20,47, 20,62, 47,59, 47,63, 49,83, 50,12, 52,30, 52,57, 54,53, 54,66, 56,28, 56,31, 66,13, 70,52, 70,60,
104,08, 115,24, 119,02, 133,85, 162,0 ч/млн.
П р и м е р 8. 4-/3-/Этил/3-(пропилтио)пропил/амино/2-/S/-оксипропоксибен-зонитрил.
Указанное в заголовке, соединение получают аналогично способу, описанному в примере 6.
/α
/D20+24,0о/C 1,0 метанол/
ЯМР13 С в CDCl3: 11,52, 13,27,
22,74, 26,93, 29,70, 34,19, 47,58, 52,40, 56,22, 65,85, 70,54, 103,96, 115,16,
118,89, 133,72, 161,95 ч/млн.
П р и м е р 9. 4-/3-/Этил/3-(пропилсульфинил)пропил/амино/-2/S/-оксипропокси/-бензонитрил.
Указанное в заголовке соединение получают аналогично способу, описанному в примере 7 и в примере 2/α /D20+18,0/C 1,0 метанол/.
ЯМР13 С в CDCl3: 11,31, 11,43, 13,26, 16,18, 20, 41, 20,57, 47,53, 47,58, 49,8, 50,08, 52,26, 52,53, 54,48, 4,61, 56,22, 56,24, 66,09, 70,48, 70,57, 104,0, 115,20, 118,87, 133,79, 161,96 ч/млн.
П р и м е р 10. 4-/3-/Этил/-4-(этилтио)-бутил/амино/-2-оксипропокси/-бензони- трил.
2 г
этил-/4-/(этилтио)бутил/амина и 2,17 г 4-(оксиpанилметокси/-бензонитрила перемешивают в 25 мл изопропанола и
нагревают с обратным холодильником ночь. Смесь выпаривают и остаточное масло растворяют в
3-молярной хлористоводородной кислоте. Этот кислотный водный слой промывают 3 порциями эфира, затем
хлористоводородную соль продуцента экстрагируют как спаренные ионы 3 порциями дихлорметана.
Органический слой, содержащий ионную пару, подщелачивают 2-молярной гидроокисью натрия и органический слой,
теперь содержащий основную форму продукта, высушивают над сульфатом натрия, выпаривают и
очищают колоночной хpоматографией. Выход: 3,7 г указанного в заголовке соединения,
ЯМР13 С
в CDCl3: 11,67, 14,65, 25,81, 26,31, 27,18, 31,40, 47,57, 53,16, 56,08, 65,69,
70,54, 104,03, 115,20, 118,97, 133,79, 162,01 ч/млн.
П р и м е р 11. 4-/3-Этил-/4-(этилсульфинил)эбурил/амино/-2-оксипропокси/бен-зонитрил.
1,68 г 4-/3-/этил-/4-)(этилтио)бутил/амино-2-оксипропокси/бензонитрила окисляют 1,1 г м-хлорнадбензойной кислоты аналогично примеру 2. Выход 0,7 г указанного в заготовке соединения.
ЯМР13 С в CDCl3: 6,66, 11,52, 20,41, 26,39, 45,67, 47,75, 51,25, 53,12, 56,24, 65,85, 70,54, 115,24, 119,0, 133,84, 104,0, 162,0 ч/млн.
П р и м е р 12. 4-/3-/(2-Оксиэтил)/-3-(пропилтио)пропил/амино/-пропокси/-бен-зонитрил.
а) 4-/3-/(2-Оксиэтил)/амино/пропокси/бензонитрил.
Раствор 3-бром-пропоксибензонитрила (10 г) и этаноламина (10 г) в 2-пропаноле (150 мл) нагревают с обратным холодильником 2 ч. После выдерживания всю ночь растворитель выпаривают. Остаток растворяют в 2-мол, водной хлористоводородной кислоте и промывают диэтиловым эфиром. Кислотный водный слой подщелачивают 10 мл, раствором гидроокиси натрия. Экстрагирование метиленхлоридом и выпаривание растворителя дает сырой материал (7,2 г). Перекристаллизация из диизопропилового эфира дает 7,0 г указанного в заголовке соединения с т.пл. 88оС.
ЯМР13: C в CDCl3: 29,15, 46,04, 51,09, 60,49, 66,39, 103,55, 115,02, 119,01, 133,74, 162,04 ч/силн.
в) 4-/3-/(2-оксиэтил)/3-(пропилтио)пропил/амино/-пропокси/бензонитрил.
Смесь 4-/3-/(2-оксиэтил)амино/пропокси/бензонитрила (3 г), 1-бром-3-(пропилтио)пропана (2,7 г) и карбоната калия (3, 7 г) в 2-пропаноле (50 мл) нагревают с обратным холодильником 28 ч. Растворитель выпаривают и остаток растворяют в 2-молярной водной хлористоводородной кислоте и экстрагируют метиленхлоридом с последующим высушиванием над сульфатом натрия, Выпаривание растворителя дает неочищенный остаток, который очищают колоночной хроматографией. Выход 2,6 г указанного в заголовке соединения в виде масла.
ЯМР13: C в CDCl3: 13,13, 22,61, 26,53, 26,73, 29, 60, 31,04, 50,11, 52,63, 55,67, 58,66, 66,06, 103,52, 114,92, 118,80, 133,60, 161,92 ч/млн.
П р и м е р 13. 4-/3-/(2-Оксиэтил//-3-(пропилсульфинил)пропил/амино/пропо-кси/бензонитрил/.
4 г 4-/3-/(2-оксиэтил)/3-(пропилтио)пропил/амино/пропокси/бензонитрила окисляют м-хлорнадбензойной кислотой (2,1 г) аналогично примеру 2. Выход после колоночной хроматографии составил 2,5 г указанного в заголовке соединения.
ЯМР13: C в CDCl3 : 13,37, 16,28, 20,69, 26,66, 50,03, 50,42, 52,92, 54,65, 55,94, 59,09, 66,29, 103,88, 115,21, 119,12, 133,94, 162,18 ч/млн.
П р и м е р 14. 4-/3-/(2-Оксиэтил)/3-(пропилсульфонил)пропил/амино/пропо- кси/-бензонитрил.
Смесь 4-/3-/(2-оксиэтил)амино/пропокси/бензонитрила 1,3 г /1-бром-3-/пропилсульфонил/пропана (1,3 г) карбоната калия (1,6 г) в ацетонитриле (100 мл) нагревают с обратным холодильником всю ночь, обрабатывают обычными способами, включая колоночную хроматографию. Выход 0,5 г указанного в заголовке соединения.
ЯМР13: С в CDCl3: 13,00, 15,82, 19,53, 26,51, 50,03, 50,20, 52,18, 54,71, 55,84, 59,98, 66,19, 103,75, 116,11, 119,02, 133,87, 162,01 ч/млн.
П р и м е р 14. 4-/3-/(2-Оксиэтил)/3-(метилтио)пропил/амино/пропокси/бензони- трил.
3 г 4-/3-/(2-оксиэтил)амино/-пропокси/бензонитрила, 2,2 г 1-бром-3-метилтио пропана и 3,7 г карбоната калия смешивают в 50 мл изопропанола и нагревают с обратным холодильником всю ночь. Смесь фильтруют, выпаривают и остаток растворяют в 2-молярной хлористоводородной кислоте. Этот водный кислотный слой промывают дважды эфиром, подщелачивают 10-молярной гидроокисью натрия и экстрагируют 3 порциями дихлорметана. Объединенные органические слои высушивают над сульфатом натрия и выпаривают. Остаточное масло очищают колоночной хроматографией. Выход 1,2 г указанного в заголовке соединения.
ЯМР13: СDCl3: 15,60, 26,50, 26,39, 32,13, 30,7, 52, 75, 55,99, 58,84, 86,30, 104,06, 115,18, 119,11, 133,98, 162,17 ч/млн.
П р и м е р 16. 4-/3-/(2-Оксиэтил)/3-(метилсульфинил)пропил/амино/пропокси/ бензонитрил.
1,1 г
4-/3-/(2-оксиэтил)/3-(метилтио)пропил/амино/пропокси/-бензонитри- ла окисляют 0,87 г м-хлорнадбензойной кислоты аналогично примеру 2. Выход: 0,7 г указанного в заголовке соединения
ЯМР13: CDCl3: 20,42, 26,43, 38,56, 50,28, 62,09, 52,74, 65,75, 58,94, 66,08, 103,67, 115,03, 118,98, 133,77, 161,98 ч/млн.
П р и м е р 17. 4-/3-Этил/3-/(2-фторпропил)тио/пропил/амино/-2-оксипропокси/-бензонитрил.
Раствор 1-окси-3-/(2-фторпропил)тио/пропана/5,5 г, 36,1 ммоля/ полученный обычными способами из 1-окси-3-тиопропана и 1-бром-2-фторпропана смешивают с триэтиламином /3,9 г 39,7 ммоля/ в метиленхлориде, затем перемешивают и охлаждают до 0оС.
Метансульфонилхлорид /4,1 г 36,1 ммоль/ добавляют за время 20 мин. Раствор фильтруют и промывают дважды бикарбонатом натрия с водой. Выход 8,2 г. Мезилат растворяют в ацетонитриле (100 мл) и добавляют 4-/3-/этиламино/2-оксипропокси/бензонитрил /8,7 г 39,4 ммоль/. Раствор нагревают с обратным холодильником всю ночь. Растворитель и остаток очищают колоночной хроматографией на силикагеле. Выход 5,75 г указанного в заголовке соединения.
ЯМР13: CDCl3: 11,46, 19,80, 20,06, 26,87, 30,58, 37,74, 37,92, 47,46, 52,19, 56,07, 65,84, 70,47, 89,52, 90,86, 103,82, 115, 11, 118,84, 133,64, 161,90.
П р и м е р 18. 34-/3-/Этил/3-/(6-фторпропил)сульфинил/пропил/амино/-2-окси- пропокси/-бензонитрил.
Раствор 4/-3-/этил/3-//Э2-фторпропил/тио/пропил/-амино-2-оксипропокси/-бензонитрила (5,1 г 14,4 ммоль) и толуол-4-сульфокислоты (2,73 г, 14,4 ммоль) в этаноле (100 мл) перемешивают и охлаждают до минус 15оС. К смеси добавляют раствор 3-хлорбензойной кислоты /4,5 г 14,4 ммоль/ в этаноле (10 мл). Раствор перемешивают при комнатной температуре 3 ч. Добавляют твердую гидроокись кальция /2,66 г 36 ммоль/ и суспензию перемешивают 15 ч. Суспензию фильтруют и выпаривают, что дает маслообразный остаток. Остаток растворяют в 2-молярной хлористоводородной кислоте и промывают диэтиловым эфиром. Кислотный раствор обрабатывают 2-молярной гидроокисью натрия до рН 12 и экстрагируют метиленхлоридом. Высушивание над сульфатом натрия и выпаривание досуха дает маслообразный остаток, который очищает колоночной хроматографией на силикагеле. Выход 3,2 г указанного в заголовке соединения.
ЯМР13: C в CDCl3: 11,07, 11,09, 11,20, 20,11, 20,25, 20,43, 20,32, 20,62, 20,66, 20,84, 47,44, 47,50, 49,87, 50,11, 50,65, 50,92, 51,32, 52,10, 52,35, 56,12, 56,82, 56,99, 59,56, 59,71, 66,03, 70,00, 70,44, 83,48, 83,67, 84,88, 85,01, 103,76, 115,09, 118,84, 136,48, 161, 86.
П р и м е р 19. 4-/3-/Этил/3-(пропилсульфинил)пропил/амино/-2-оксипропокси/ бензонитрил, соль образованная присоединением хлористоводородной кислоты.
К раствору 4-/3-/этил/3-(пропилсульфинил)пропил/амино/-2-оксипропокси/бензонитрила (1,06 г) в метиленхлориде (3 мл) добавляют насыщенный раствор хлористого водорода в диэтиловом эфире (3 мл) и далее - диэтиловый эфир (7 мл). Растворитель декантируют от полученного масла, которое промывают диэтиловым эфиром (3х10 мл) и высушивают в высоком вакууме. Выход 1,1 г в виде масла.
ЯМР13: C в двуокиси дейтерия относительно диоксана (67,4 ч/млн). 8,74, 9,17, 13,29, 16,67, 18,23, 18,37, 18,47, 48,01, 49,23, 49,35, 50,97, 51,10, 51,73, 53,32, 53,66, 55,30, 64,77, 64,94, 70,45, 104,01, 116, 36, 120,90, 135,36, 162,58 ч/млн.
П р и м е р 20. 4-/3-/Этил/3-/пропилсульфинил/пропил/амино/2-оксипропок-си/бензонитрил, соль, полученная присоединением бифонил-2, 2-диил кислого фосфата.
4-3-этил/-пропилсульфинил)пропил/ амино-2-оксипропокси/-бензонитрила (0,35 г) и бифенил-2,2-диилкислого фосфата (0,15 г) растворяют в метиленхлориде (2 мл).
Добавление диизопропилового эфира (10 мл) дает бесцветный осадок. Растворитель декантируют в твердый остаток, промывают диэтиловым эфиром: 0,84 г (90%) бесцветных кристаллов, т.пл. 147о С).
ЯМР13: C в CDCl3: 8,68, 13,25, 16,23, 18,14, 48,38, 48,47, 49,44, 52,50, 54,49, 56,14, 64,36, 69,96, 104,63, 115,39, 118,39, 121,63, 124,95, 129,42, 129,71, 133,98, 149,89, 149,96, 1 1,40 ч/млн.
П р и м е р 21. 4-/2-/Окси/(3-пропилтио/пропил/амино/пропокси/-бензонит-рил.
Раствор 4-/оксиранилметокси/-бензонитрила (1,32 г 7,5 ммоля) и 3-пропилтио-1-пропиламина (1 г 7,5 ммоля) в ацетонитриле (10 мл) и нагревают с обратным холодильником всю ночь. Раствор выпаривают и остаток растворяют в 2-молярной хлористоводородной кислоте. Кислотный раствор промывают диэтиловым эфиром, подщелачивают 10%-ной гидроокисью натрия и экстрагируют метиленхлоридом. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле. Выход 1,1 г указанного в заголовке соединения.
ЯMP13: C в СDCl3: 13,26, 22,67, 29,26, 29,55, 34,09, 48, 43, 51,44, 67,61, 70,63, 104,00, 115,15, 118,87, 133,78, 161,82.
П р и м е р 22. 4-/2-Окси-3-/(3-пропилсульфинил)пропил/амино/пропокси/бен-зонитрил.
Раствор 4-/2-окси-3-/(3-(пропилтио)пропил/амино/пропокси/бензонитри- ла (0,9 г 2,91 ммоль/ и толуол-4-сульфокислоты (0,55 г 2,91 ммоль) в этаноле (20 мл) перемешивают и охлаждают до минус 15оС. К этому раствору добавляют раствор 3-хлорнадбензойной кислоты (0,61 2,9 ммоль) в этаноле (10 мл) за период 10 мин. Смесь перемешивают при минус 10оС 0,5 ч и при комнатной температуре 3 ч. Добавляют твердую гидроокись кальция (0,54 м г 7,27 ммоль) и суспензию перемешивают 10 мин, фильтруют и выпаривают. Выход 0,9 г указанного в заголовке соединения в виде бесцветных кристаллов с т.пл. 76-77оС.
ЯМР13: C в CDCl3: 13,42, 16,34, 23,44, 48,38, 48,15, 50,19, 51,56, 54,68, 68,68, 70,73, 103,32, 115,34, 119,077, 133,99., 162,01.
Примеры фармацевтических композиций.
Следующие примеры поясняют приготовление фармацевтических композиций по изобретению. Термин "активное вещество" означает соединение, соответствующее настоящему изобретению если соль этого соединения.
Рецептура А. Мягкие желатиновые капсулы.
200 г активного вещества смешивают с 500 г кукурузного масла и полученной смесью дополняют мягкие желатиновые капсулы, причем каждая капсула содержит 100 мг смеси (т.е. 50 мг активного вещества).
Рецептура. В. Мягкие желатиновые капсулы.
500 г активного вещества смешивают с 750 г арахисового масла, после чего заполняют смесью мягкие желатиновые капсулы. Каждая капсула содержит 125 мг смеси (т.е. 5 мг активного вещества).
Рецептура С. Таблетки.
500 г активного вещества смешивают совместно с 200 г кремнекислоты с торговым наименованием Аэросил. 450 г картофельного крахмала и 500 г молочного сахара. Смесь увлажняют крахмальной пастой, приготовленной из 50 г картофельного крахмала и дистиллированной воды, после чего смесь гранулируют протиранием через сито. Гранулят высушивают и просеивают, после чего замешивают 20 г стеарата магния. В заключении смесь прессуют в таблетки, причем каждая весит 172 мг.
Рецептура D. Шипучие таблетки, выделяющие пузырьки газа.
Смешивают 100 г активного вещества, 140 г тонко измельченной лимонной кислоты, 100 г порошкообразного бикарбоната натрия, 3,5 г стеарата магния, вкусовые вещества и ароматические добавки (по надобности). Смесь прессуют в таблетки. Каждая содержит 100 м активного вещества.
Рецептура Е. Таблетки с замедленным высвобождением.
200 г активного вещества сплавляют совместно с 50 г стеариновой кислоты и 50 г карнаубского воска, полученную таким образом смесь охлаждают и измельчают до частиц диаметром не более 1 мм.
Полученную, как указано, смесь смешивают с 5 г стеарата магния и прессуют в таблетки, каждая содержит 200 мг активного вещества.
Рецептура F. Раствор для инъекции. Активное вещество
3,0 мг Пиросульфит натрия 0,5 мг
Двунатрия-эдетат 0,1 мг Хлорид натрия 8,5 мг Вода стерильная для инъекций до 1 мл
Рецептура С. Жесткие желатиновые капсулы.
10 г активного вещества смешивают с 400 г лактозы, затем добавляют 2 г стеарата магния. Смесью заполняют жесткие желатиновые капсулы. Каждая капсула содержит 206 мг смеси (т.е. 5 мг активного вещества).
Рецептура Н. Таблетки.
50 г активного вещества смешивают с 1500 г лактозы, 200 г микрокристаллической целлюлозы и 10 г стеарата магния. В заключение прессуют таблетки, каждая содержит 5 мг активного вещества, причем зернышко весит 176 мг.
Фармакология.
Лекарственные препараты, вызывающие замедление процесса реполяризации, тем самым пролонгирующие период, за время которого сердце неспособно отвечать на новые стимулы (так называемый промежуток времени, в течение которого после одного раздражения возбуждаемая ткань неспособна ответить на следующее раздражение), как говорят производят противо-аритмическое действие класса.
Такое действие можно зарегистрировать как пролонгированное действие, потенциальное относительно миокардиальных клеток. Это действие поддается непосредственному измерению трансмембраной, регистрирующей прямо или косвенно потенциал монофазного действия. Соединения, относящиеся к данному изобретению, исследуют последним указанным техническим приемом.
Самцов морских свинок анестезируют барбитуратами и вентилируют комнатным воздухом при контроле за содержанием газа в крови. Сердце обнажают торакотомией и обрезают блуждающие нервы. Регистрируют стандартную электрокардиограмму посредством электродов, наложенных на кожу. Монофазное потенциальное действие (МАР) регистрируют от эпикардиальной поверхности желудочков, обычно от левого, посредством специально сконструированного биполярного электрода, который осторожно прижимают к эпикардиальной поверхности или присоединяют посредством применения всасывающего действия. Также получают местную электрокардиограмму в области электрода МАР между периферийным электродом и сигналом от электродов, расположенных на коже (Артериальное кровяное давление регистрируют посредством артериального катетера в одной из бедренных артерий. Для введения барбитуратов и испытуемого вещества применяют внутривенный путь). Так как продолжительность деполяризации клеток сердца (МАР продолжительность) зависит от частоты, оценку эффективности лекарства следует производить с постоянной частотой. С этой целью задающий темп электрод присоединяют к левому предсердию, так, что сердце можно будет электрически стимулировать при постоянной частоте, несколько превышающей нормальную частоту у синусового узла Кис-Флака.
Для первичного отсеивания применяют потенциальную продолжительность монофизического действия при 65%-ной реполяризации.
Все опыты проводят при блокаде β -адреноцептора, достигаемой предварительной обработкой пропанолом 0,5 мг/кг.
Испытуемое вещество вводят с лечебной целью внутривенно в течение 30 с в возрастающих дозировках с точными заранее определенными интервалами. Регистрацию проводят при точных интервалах согласно дозированию, используя регистратор Мингограф, а также ленту для завершающего анализа сигналов посредством обычным образом и составленной компьютерной программы. Кривые для ответных реакций на дозе составляют для различных переменных величин. Дозировки, необходимые для достижения 10 и 20%-ного пролонгирования продолжительности МАР, получают интерполированием. Дозировка, дающая 20%-ное увеличение продолжительности МАР (D20 МАР), используется как показатель эффективного действия. Отобранные соединения подвергают дополнительному испытанию на анестезированных, находящихся в сознании собаках, постоянно несущих приборы, регистрирующие также невосприимчивость предсердия и желудочков.
D20 - МАР = -log дозы/моли/кг/, дающие 20%-ное увеличение продолжительности МАР и анестезированных морских свинок (см. способ отсеивания).
Изменение желудочковой невосприимчивости /VERP/ у анестезированных и находящихся в сознании собак, при уровнях дозировки у морских свинок эквивалентно D20 МАР. + = пролонгированное VERP, n.t = не испытано. Данные приведены в табл. 1.
Соединения-аналоги сравнили с соединениями настоящего изобретения. В качестве критерия была выбрана возможная длительность монофазного воздействия.
Оценка
тестируемых соединений проводилась согласно следующей методике:
Морские свинки массой 600-1000 г были использованы в этом исследовании. До начала
эксперимента (животные, по крайней мере, одну
неделю жили в виварии. Здесь у них был свободный доступ к пище (Ewoski пилюли) и водопроводной воде. Анестезию проводили путем внутрибрюшинной инъекции
пентабарбитала (NembutalR), 40-50
мг/кг массы, в одну сонную артерию вводились катетеры для записи давления крови и определения газа в крови, и в одну яремную вену для инфузии
лекарственных средств. Для измерения температуры тела в
прямую кишку вводили термометр, и животное помещали в обогреваемую корзинку (Swetron 3654M), держа его там, чтобы ректальная температура
находилась в температурном интервале 37,5-38,5оС.
Проводили трахеотомию и искусственную вентиляцию животного комнатным воздухом, используя для этих целей небольшой аппарат искусственного дыхания для животных, стараясь сохранять содержание газов на нормальном для особи уровне. Для уменьшения автономных влияний оба блуждающих нерва были перерезаны в районе шеи, а также за 15 мин до начала эксперимента внутривенно вводили 0,5 мг/кг массы пропанолола. Левый вентрикулярный эпикард был подвергнут левосторонней торакотомии и обычный электрод для записи возможного монофазного действия (был установлен и оставлен в таком положении до тех пор, пока принимаемый сигнал записывался, в противном случае его переносили в другое новое место. В левом предсердии для стимуляции были установлены биполярные электроды. Были использованы также круговые плоские электроды для записи электрокардиограммы. Стимуляцию осуществляли с помощью обычного стимулятора постоянного тока при постоянной частоте примерно нормального синусного ритма в течение одной минуты каждые пять минут на протяжении исследования.
Кровяное давление записывали, используя датчик кровяного давления Statham на полиграфе grass и одновременно контролировали частоту пульса на протяжении всего эксперимента. МАР сигнал и отведение II электрокардиограммы были записаны на Mingograph с чернильным самописцем (Siemens-Elems, Sweden). Все сигналы переписывались на кассетное устройство (TEACR-71) для последующего анализа по обычной компьютерной программе, в течение последних 20 с каждого акта стимуляции, а также последних 20 с следующей минуты синусного ритма.
Процедура тестирования включала две основных контрольных записи следующих через 5 мин в течение стимуляций и синусного ритма. После второй контрольной записи методом инфузии вводили тестируемое соединение в объеме 2 мл в течение 30 с через катетер яремной вены. Через 3 мин начинали стимуляцию и делали новую запись. Следующая доза тестируемого соединения вводилась через 5 мин после предыдущей. В течение одного эксперимента вводилось до десяти последовательных доз. Записанные результаты экспериментов были разобраны позже в 10-секундный период каждой части записанной ленты вводился в компьютер для дальнейшего анализа, другими словами, проводили определение МАР длительности при 75% реполяризации (МАРД75) в течение периода стимуляции.
Значения двух контрольных записей было взято за точку отсчета (нулевую точку), и результаты записанные после введения последовательных доз тестируемого соединения, выражали как процентное изменение этого значения. Можно построить кривые зависимости доз - ответ для МАРД 75 в координатах (значение в процентах + накопленная доза), введенная перед каждой записью). В качестве показателя, используемого для экспериментального выражения антиаритмической эффективности Класса III тестируемого соединения, был взят отрицательный логарифм дозы (моль/кг/массы внутривенно), которая продляла МАРД 75 на 20% (D20МАР). Эти значения Л20МАр были рассчитаны методом линейной интраполяции.
В качестве контрольных были проведены опыты с объемом, содержащим 0,2 микромоля винной кислоты, разбавленной изотоническим раствором, на килограмм массы. Всего было поставлено 5 контрольных опытов.
От двух до пяти опытов проводилось с соединениями данного изобретения, растворенным в эквимолярном количестве винной кислоты и разбавленными до используемой концентрации изотоническим раствором.
Два опыта были проведены с соединениями Н 244/25 и Н 244/14. Эти соединения были растворены в эквимолярном количестве винной кислоты и разбавлены до используемой концентрации изотоническим раствором. Значение рН всех растворов поддерживалось на уровне не ниже 4 путем добавления I M раствора.
Активность класса III, выраженная как К/D20МАР приведена в табл.2.
Соединения по изобретению пролонгировали длительность МАР на 20% при значении накопленной дозы, такой низкой как 10-7,3 мол/кг (рабочий пример 2). В противоположность им соединения Н 244/14 и H 244/15 оказались неэффективными в пролонгировании длительности МАР после накопленных доз. Таким образом известные соединения рассматриваются как соединения, не обладающие эффективным антиаритмическим действием класса III. Соединения Н 244/14 и H 244/15 являются обычными бета-адреноблокаторами (Антиаритмическая активность класса II), не обладающими каким-либо значительным влиянием на возможную длительность действия (антиаритмическая активность класса III). В противоположность им соединения данного изобретения обладают весьма эффективным действием типа класса III без какого-либо значительного действия по классу II антиаритмической активности.
Таким образом, соединения изобретения могут проявлять свою антиаритмическую активность по электрофизиологичному механизму, в основном отличающегося от механизма действия бета-адреноблокаторов, каковыми являются Н 244/14 и H 244/15. При пролонгировании возможной длительности действия и, как следствия, резистентности сердечной мышцы, лекарственные средства антиаритмического класса III могут оказаться эффективными в отношении аритмий, вызываемых так называемым механизмом повторного возвращения импульса в один и тот же участок миокарда. Можно, таким образом, ожидать, что эти лекарственные средства будут оказывать терапевтическое действие при аритмиях различного рода, как при предсердной аритмии, так и при вентрикулярной аритмии, причиной которых является циркуляция возбуждения, т.е. повторное возвращение импульса в один и тот же участок миокарда. Соединения, являющиеся бета-адреноблокаторами/антиаритмические средства класса II, с другой стороны оказывают терапевтическое действие на аритмии, зависящие от симпатического тонуса и связанной с ним активацией бета-адренорецепторов. Таким образом, лекарственные препараты класса III могут быть эффективны при лечении аритмий, при которых соединения класса II оказываются неэффективными.
Реферат
Использование: в медицине в качестве антиаритмического средства для лечения сердечной аритмии. Сущность изобретения: продукт - производные бензонитрила ф-лы: 4-CN-C6H4-O-(CH2)n-Y-CH(Z)-A , где п-1-2; Y-группа (CH2)m ; m-0-1, или Ch(OH); Z - H, C1-C3-алкил; A - группа -N(Ra)-(CH2)q-S(O)p-Rc или Ra′ Ra″ N(+)-(CH2)q-S(O)p-Rc, где Ra , Ra′ , Ra″ - окси-C1-C5-алкил и C1-C5-алкил, Rc-C1-C4-алкил, который может быть замещен F. Получение ведут в известных условиях. 2 табл.
Формула

где n = 1-2;
Y - группа (CH2)m - , где m = 0-1, или CHOH,
Z - водород или насыщенный неразветвленный C1-C3 - алкил,
А - группа
-



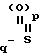
где Ra, Ra′ и Ra′′ - каждый независимо друг от друга неразветвленный оксиалкил или C1-C5-алкил;
Rc - насыщенный неразветвленный C1-C4-алкил, который может быть замещен атомами фтора;
p = 1-2;
q = 2-5;
или их рацематы, или фармацевтически приемлемые соли, обладающие антиаритмическим действием.




где Ra-CH3, C2H5, C3H7, CH2CH2OH или CH2CH(OH)CH3, Rc-C2H5, C3H7,
CH2CHFCH3; q = 3-4.
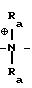



где Ra′ и Ra′′ - CH3, C2H5, C3H7; Rc-C2H5, C3H7 или CH2CHFCH3;
q = 3-4.

где n = 1-2;
Y - группа - (CH2)m, где m = 0-1, или CHOH;
Z - водород или насыщенный неразветвленный C1-C3-алкил;
A - группа


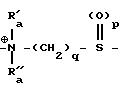

где Ra, Ra′ и Ra′′ - каждый независимо друг от друга неразветвленный оксиалкил или C1-C5-алкил;
Rc - насыщенный неразветвленный C1-C4-алкил, который может быть замещен атомами фтора;
p = 1-2;
q = 2-5,
или их рацематы, или фармацевтически приемлемые соли при следующем содержании инградиентов, мас.%:
Активный инградиент 0,1 - 99
Целевые добавки Остальное

Комментарии