Модифицированные дендритные клетки и их применение в лечении злокачественных опухолей - RU2711606C2
Код документа: RU2711606C2
Чертежи










Описание
Область изобретения
[0001] Настоящее изобретение относится к области генной терапии при лечении злокачественных опухолей. Согласно одному варианту реализации, настоящее изобретение относится к модификации дендритных клеток для обеспечения регулируемой экспрессии интерлейкина-12, и применению указанных клеток в терапии. Согласно другому варианту реализации, настоящее изобретение относится к модификации дендритных клеток для обеспечения регулируемой экспрессии интерлейкина-12 (IL-12) и/или интерферона-альфа (IFN-alpha), и применению указанных клеток в терапии.
Уровень техники
[0002] Описание различных патентов, патентных заявок и публикаций полностью включено в данное описание посредством ссылок. Тем не менее, упоминание любой ссылки в настоящей заявке не следует рассматривать как признание того, что указанная публикация доступна в качестве предшествующего уровня техники по отношению к настоящему изобретению.
[0003] Интерлейкин-12 принадлежит к семейству цитокинов 1-го типа, участвующих во множестве биологических процессов, включающих в себя (но не ограниченных) защитные иммунные реакции и подавление процессов образования опухолей (Abdi et al., 2006; Adorini, 1999; Adorini, 2001; Adorini et al., 2002; Adorini et al., 1996; Akhtar et al., 2004; Akiyama et al., 2000; Al-Mohanna et al., 2002; Aliberti et al., 1996; Allavena et al., 1994; Alii and Khar, 2004; Alzona et al., 1996; Amemiya et al., 2006; Araujo et al., 2001; Arulanandam et al., 1999; Athie et al., 2000; Athie-Morales et al., 2004; Bertagnolli et al., 1992; Bhardwaj et al., 1996; Biedermann et al., 2006; Brunda and Gately, 1994; Buchanan et al., 1995; Romani et al., 1997; Rothe et al., 1996; Satoskar et al., 2000; Schopf et al., 1999; Thomas et al., 2000; Tsung et al., 1997; Wolf et al., 1994; Yuminamochi et al., 2007). Увеличивающееся количество публикаций по данной тематике указывает на то, что воздействие на интерлейкин-12 может являться весьма многообещающим средством контроля заболеваний человека (например, рака).
[0004] Несмотря на то что интерлейкин-12 рассматривают в качестве потенциального терапевтического агента для лечения рака, благодаря его способности поддерживать активность противоопухолевых NK-клеток 1-го типа, CD4+ Т-клеток и CD8+ Т-клеток (Trinchiery, 2003), имеющиеся данные о токсичности рекомбинантного интерлейкина-12 человека (rhIL-12) по отношению к пациентам (Atkins et al., 1997), а также ограниченность источников получения рекомбинантного интерлейкина-12 человека по системе контроля качества GMP для клинического применения препятствуют успешному развитию способов терапии, основанных на использовании интерлейкина-12. Таким образом, разумно предположить, что способы генной терапии могут предоставить возможности более безопасного и надежного лечения. Действительно, первая фаза клинических испытаний внутри- или околоопухолевого введения рекомбинантной вирусной (Sangro et al., 2004; Triozzi et al., 2005) или плазмидной кДНК интерлейкина-12 (Heinzerling et al., 2005) или аутологичных фибробластов с модифицированным геном интерлейкина-12 (Kang et al., 2001) была показана и безопасность и хорошая переносимость.
[0005] Тем не менее, объективные клинические результаты у пациентов с меланомой или различными видами карциномы, которых подвергали указанной генной терапии, были редкими, многовариантными, временными и, в большинстве своем, локализированными в месте применения (Kang et al., 2001; Sangro et al., 2004; Triozzi et al., 2005; Heinzerling et al., 2005). В случаях, когда излечивание заболевания было частичным или полным, наблюдали повышенные количества противопоухолевых эффекторых лимфоцитов (Heinzerling et al., 2005; Sangro et al., 2004) и циркулирующих опухолеспецифических CD8+ Т-клеток (Heinzerling et al., 2005), что вполне согласуется с примированием перекрестно-реагирующим антигеном Т-клеток у таких пациентов.
[0006] Кроме того, имеется несколько дополнительных оснований для беспокойства, например: непредвиденная токсичность, связанная с генной терапией дендритных клеток (DC) интерлейкином-12, и возможные зависимые от интерлейкина-12 изменения в миграции терапевтических дендритных клетках, вырабатывающих интерлейкин-12 (DC. IL-12) после внутриопухолевого введения. Есть также опасения, касающиеся времени синтеза интерлейкина-12 в трансдуцированных дендритных клетках, что наиболее важно для эффективного лечения (Murphy et al., 2005).
[0007] Поскольку примирование перекрестно-реагирующим антигеном специфических Т-клеток наиболее эффективно осуществляется дендритными клетками, которые служат естественным, но регулируемым источником интерлейкина-12 (Berard et al., 2000), недавние отчеты о превосходной пре-клинической эффективности генной терапии с применением DC.IL-12, вызвали огромный интерес (Satoh et al., 2002; Tatsumi et al., 2003; Yamanaka et al., 2002). Так, оказалось, что внутриопухолевое введение дендритных клеток, модифицированных для выработки интерлейкин-12р70 (путем их инфицирования рекомбинантным аденовирусом), вызывает значительное повышение интенсивности примирования перекрестно реагирующим антигеном спектра высокоактивных опухолеспецифических CD8+ Т-клеток, вместе с отторжением опухолей у исследуемых мышей (Tatsumi et al., 2003). Ввиду применения рекомбинантного аденовируса, кодирующего интерлейкин-12 мыши под контролем CMV-промотора (rAd.cIL12, Tatsumi et al., 2003), экспрессия интерлейкина-12 модифицированными дендритными клетками была постоянной, вследствие этого, нельзя было определить относительное иммунологическое действие этого цитокина, поначалу в месте повреждения опухоли, а затем и внутри инфильтрованных опухолью (дренирующих опухоль) лимфатических узлах. Таким образом, существует необходимость в дендритных клетках, модифицированных для регулируемой экспрессии интерлекийна-12. Настоящее изобретение обеспечивает многообещающий терапевтический результат при использовании таких клетке.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Настоящее изобретение обеспечивает рекомбинантный вектор, который кодирует белок, обладающий функцией интерлейкина-12 под контролем регулируемого промотора. Согласно одному из вариантов реализации настоящего изобретения, указанный вектор представляет собой аденовирусный вектор, кодирующий интерлейкин-12р70 и под контролем регулируемого промотора, который активируется при условии присоединения к нему растворимого низкомолекулярного лиганда, такого, как диацилгидразин, например: RG-115819, RG-115830 или RG-115932. Такой вектор позволяет контролировать экспрессию интерлейкина-12 дендритными клетками (rAD.RheoIL12).
[0009] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функций интерлейкина-12, который содержит полинуклеотид, кодирующий переключатель гена, содержащий по меньшей мере одну последовательность транскрипционного фактора, причем указанная, по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функций интерлейкина-12 и/или интерферона-альфа, который содержит: (1) полинуклеотид, который кодирует переключатель гена, при этом, указанный переключатель содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0010] Например, настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, который содержит полинуклеотид, который кодирует переключатель гена, причем указанный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Также настоящее изобретение обеспечивает вектор для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, и содержащий полинуклеотид, кодирующий переключатель гена, причем указанный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0011] Кроме того, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12, посредством модификации указанных дендритных клеток рекомбинантным вектором, обеспечивающим регулируемую экспрессию белка, обладающего функцией интерлейкина-12, например: rAd.RheoIL12. Согласно другому варианту реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, путем модификации дендритных клеток рекомбинантным вектором, обеспечивающим регулируемую экспрессию белка, обладающего функцией интерлейкина-12 и/или интерферона-альфа.
[0012] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего: (1) полинуклеотид, кодирующий переключатель гена, который содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего: (1) полинуклеотид, кодирующий переключатель гена, который содержит по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0013] Например, настоящее изобретение обеспечивает способ получения популяции дендритных клеток, управляемо экспрессирующих белок, обладающий функцией интерлейкина-12, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего полинуклеотид, который кодирует переключатель гена, причем данный полинуклеотид содержит (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, при этом, данный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором. Настоящее изобретение также обеспечивает способ получения популяции дендритных клеток, управляемо экспрессирующих белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, включающий в себя модификацию по меньшей мере части дендритных клеток путем введения в них вектора, содержащего полинуклеотид, который кодирует переключатель гена, причем данный полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа белок, при этом, указанный полинуклеотид связан с промотором, который активируется вышеуказанным лиганд-зависимым транскрипционным фактором.
[0014] Также настоящее изобретение обеспечивает популяцию дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, с применением рекомбинантного вектора, обеспечивающего регулируемую экспрессию белка, который обладает функцией интерлейкина-12, например, вектора rAd.RheoIL12. Было показано, что дендритные клетки, инфицированные rAd.Rb.eoIL 12, вырабатывают повышенные количества интерлейкина-12 только после обработки активирующим лигандом. Другой вариант реализации относится к популяции дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, с применением рекомбинантного вектора, обеспечивающего регулируемую экспрессию белка, который обладает функцией интерлейкина-12 и/или белка, который обладает функцией интерферона-альфа. Подходящие лиганды включают в себя, но не ограничиваются следующими: RG-115830, RG-115932, RG-115819, RSLl и другими диацилгидразинами.
[0015] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, который содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, который содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0016] Например, настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, содержащий: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, обладающий функцией интерлейкина-12, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором. Настоящее изобретение обеспечивает модифицированные in vitro дендритные клетки, содержащие вектор, включающий в себя полинуклеотид, кодирующий переключатель гена, причем полинуклеотид содержит: (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12, и/или полинуклеотид, кодирующий белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором.
[0017] Также настоящее изобретение обеспечивает фармацевтическую композицию, содержащую популяцию дендритных клеток, модифицированных для регулируемой экспрессии, белка, который обладает функцией интерлейкина-12, с помощью рекомбинантного вектора, регулируемо экспрессирующего обладающий функцией интерлейкина-12 белок, например: вектора rAd.RheoIL12. Согласно другому варианту реализации, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую популяцию дендритных клеток, модифицированных для управляемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа с помощью рекомбинантного вектора, регулируемо экспрессирующего обладающий функцией интерлейкина-12 белок и/или обладающий функцией интерферона-альфа белок.
[0018] Также настоящее изобретение обеспечивает способ лечения злокачественных опухолей, таких как меланомы или глиомы. Лечение геном интерлейкина-12 показало противоопухолевую активность в исследованиях на модельных животных, при применении рекомбинантного кДНК-вектора (Faure et al., 1998; Sangro et al., 2005), и, еще в большее степени, при применении в форме генетически модифицированных дендритных клеток (Satoh et al., 2002; Svane et al., 1999; Tatsumi et al., 2003; Yamanaka et al., 2002). К настоящему моменту тем не менее процедуры первой фазы клинических испытаний на людях терапии геном интерлейкина-12, включающие в себя применения плазмидных или вирусных векторов, не обеспечили стойкого объективного клинического эффекта в контролировании злокачественных опухолей (Heinzerling et al., 2005; Kang et al., 2001; Sangro et al., 2004; Triozzi et al., 2005). Лечение геном интерлейкина-12, основанное на дендритных клетках (с или без интерферона-альфа) и описанное в данном материале, показало многообещающую терапевтическую перспективу.
[0019] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий:
(a) внутриопухолевое введение в микроокружение опухоли популяции модифицированных in vitro дендритных клеток, содержащих вектор, включающий полинуклеотид, кодирующий переключатель гена и содержащий (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий обладающий функцией интерлейкина-12 белок, и связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором, и
(b) введение указанному млекопитающему эффективного количество лиганда, активирующего указанный лиганд-зависимый транскрипционный фактор; что приводит к стимулированию экспрессии обладающего функцией интерлейкина-12 белка и излечиванию указанной опухоли.
[0020] Например, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий в себя следующие стадии:
(a) модификацию in vitro дендритных клеток для регулируемой экспрессии белка, обладающего функцией интерлейкина-12;
(b) внутриопухолевое введение в микроокружение опухоли, указанных, модифицированных in vitro дендритных клеток; и
(с) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда;
что приводит к стимулированию экспрессию белка, обладающего функцией интерлейкина-12, и излечиванию вышеуказанной опухоли.
[0021] Согласно следующим вариантам реализации, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий: (а) внутриопухолевое введение в микроокружение опухоли модифицированных in vitro дендритных клеток, причем указанные дендритные клетки содержат вектор, включающий полинуклеотид, кодирующий переключатель гена и содержащий (1) по меньшей мере одну последовательность транскрипционного фактора, функционально связанную с промотором, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, и (2) полинуклеотид, кодирующий белок, который обладает функцией интерлейкина-12 и/или белок, который обладает функцией интерферона-альфа, связанный с промотором, который активируется вышеуказанным лиганд-зависимым фактором транскрипции, и (b) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда; что приводит к стимулированию экспрессии белка, обладающего функцией интерлейкина-12, и/или белка, обладающего функцией интерферона-альфа, и излечиванию вышеуказанной опухоли.
[0022] Например, настоящее изобретение обеспечивает способ лечения опухоли у млекопитающего, включающий следующие стадии:
(a) модификация in vitro дендритных клеток для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа;
(b) внутриопухолевое введение в микроокружение опухоли, указанных, модифицированных in vitro дендритных клеток; и
(c) введение указанному млекопитающему терапевтически эффективной дозы активирующего лиганда;
что приводит к стимулированию экспрессию белка, обладающего функцией интерлейкина-12 и/или белка, обладающего функцией интерферона-альфа, и излечиванию вышеуказанной опухоли.
[0023] Также настоящее изобретение обеспечивает способ определения степени эффективности терапии модифицированными дендритными клетками посредством: определения контрольного уровня, который получают в результате измерения уровня экспрессии или активности интерферона-гамма у пациента до начала терапии;
введения дендритных клеток, модифицированных для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, и последующего введения эффективного количества активирующего лиганда; и затем
определения тестового уровня, который получают в результате, измерения уровня экспрессии интерферона-гамма;
сравнения указанного контрольного уровня с указанным тестовым для определения, является ли терапевтический режим эффективным.
[0024] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ определения эффективности терапевтического режима пациента, основанного на терапии модифицированными in vitro дендритными клетками, включающий:
(a) измерения экспрессии и/или активности интерферона-гамма в первом биологическом образце, полученном от нуждающегося в этом пациента перед введением модифицированных in vitro дендритных клеток с получением контрольного уровня;
(b) введение нуждающемуся в этом пациенту дендритных клеток, модифицированных in vitro для регулируемой экспрессии белка, обладающего функцией интерлейкина-12;
(c) введение пациенту терапевтически эффективной дозы активирующего лиганда;
(d) измерение экспрессии и/или активности интерферона-гамма во втором биологическом образце, полученном от нуждающегося в этом пациента, после введения модифицированных in vitro дендритных клеток и активирующего лиганда с получением тестового уровня;
(e) сравнение указанного контрольного и указанного тестового уровня экспрессии или активности интерферона-гамма, причем повышенный тестовый уровень экспрессии и/или активности, по сравнению с контрольным уровнем говорит об эффективности терапии для данного пациента.
[0025] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ стимуляции регулируемой экспрессии белка, обладающего функцией интерлейкина-12 в дендритных клетках, включающий: (1) введение нуждающемуся в этом млекопитающему эффективного количества популяции модифицированных in vitro дендритных клеток согласно настоящему изобретению; и (2) введение указанному млекопитающему эффективного количества активирующего лиганда для активации лиганд-зависимого транскрипционного фактора.
[0026] Для исследования клинической эффективности, были продолжены исследования, проведенные на модели саркомы CMS4 на мышах BALB/c, и оказалось, что внутриопухолевое введение изогенных дендритных клеток, взятых из костного мозга и предварительно инфицированных Ad.cIL12 (конститутивная экспрессия), привело к эффективному отторжению опухоли. (Tatsumi et al., 2003). Отторжение произошло в связи с системной CD8+ Т-клеточно опосредованной иммунной реакцией против опухолей CMS4 (Tatsumi et al., 2003).
ПОДРОБНОЕ ОПИСАНИЕ ФИГУР
[0027] На Фигуре 1 изображена структура вектора rAd.RheoIL12, из которого удалили области Е1 и Е3 и заменили область Е1 компонентами RheoSwitch® Therapeutic System (RTS)-IL-12. Мотив, обозначенный как "IL12", показывает кодирующие последовательности IL-12p40 и IL-12р35, разделенные участком внутренней посадки рибосомы (IRES).
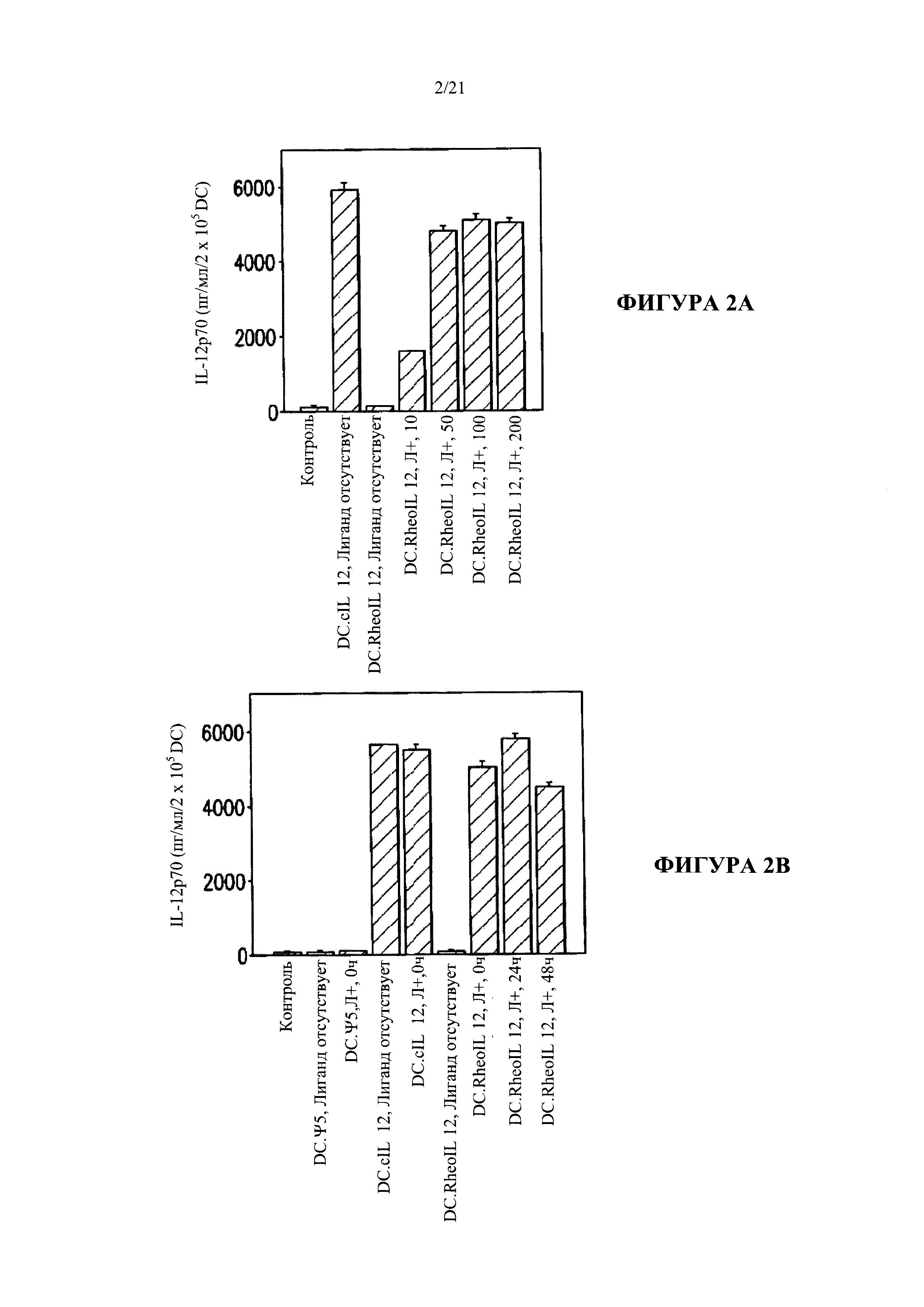
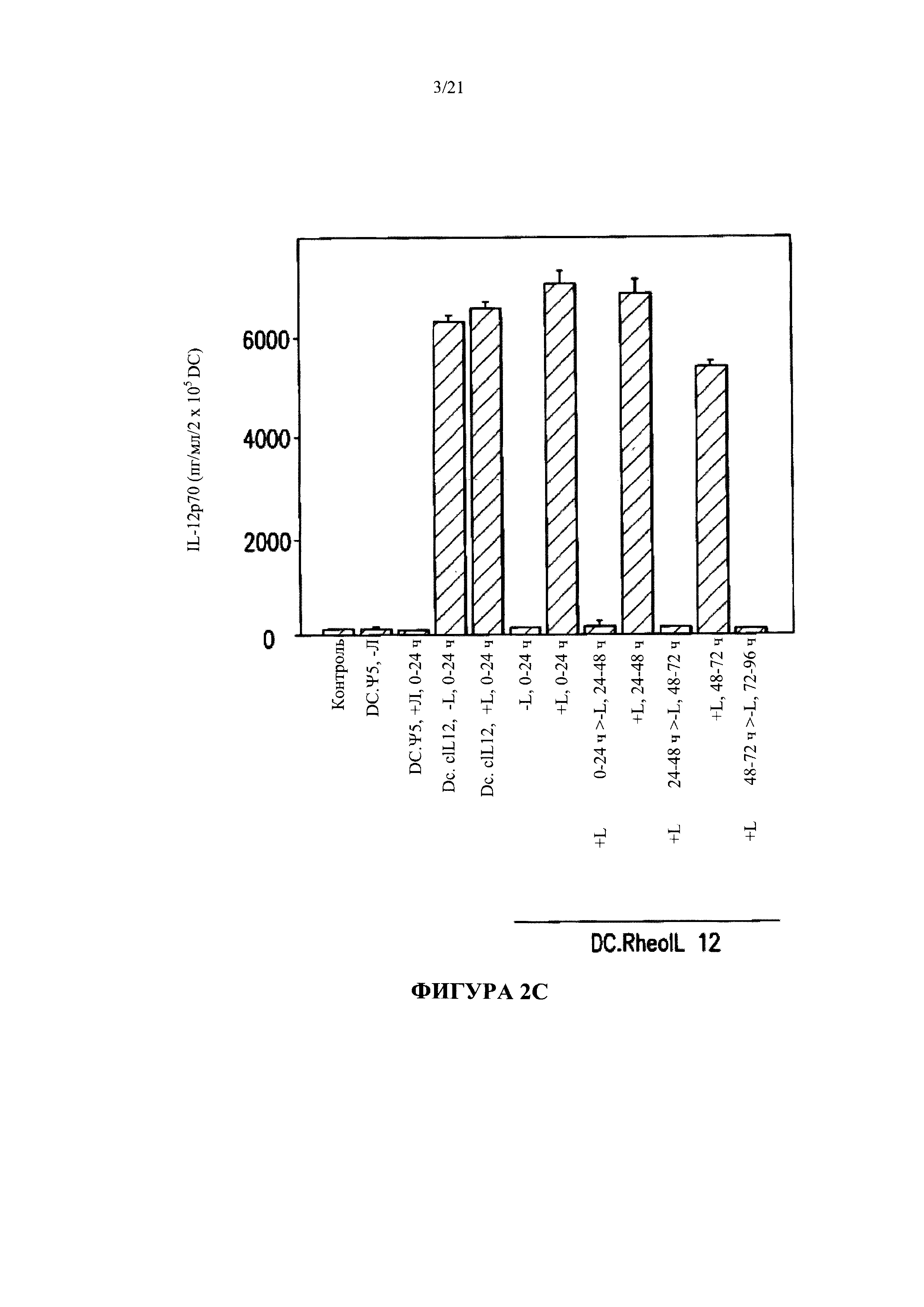
[0028] На Фигуре 2А-2С показано, что модифицированные дендритные клетки регулируемо вырабатывают белок интерлейкин-12 в присутствии RG-115830.
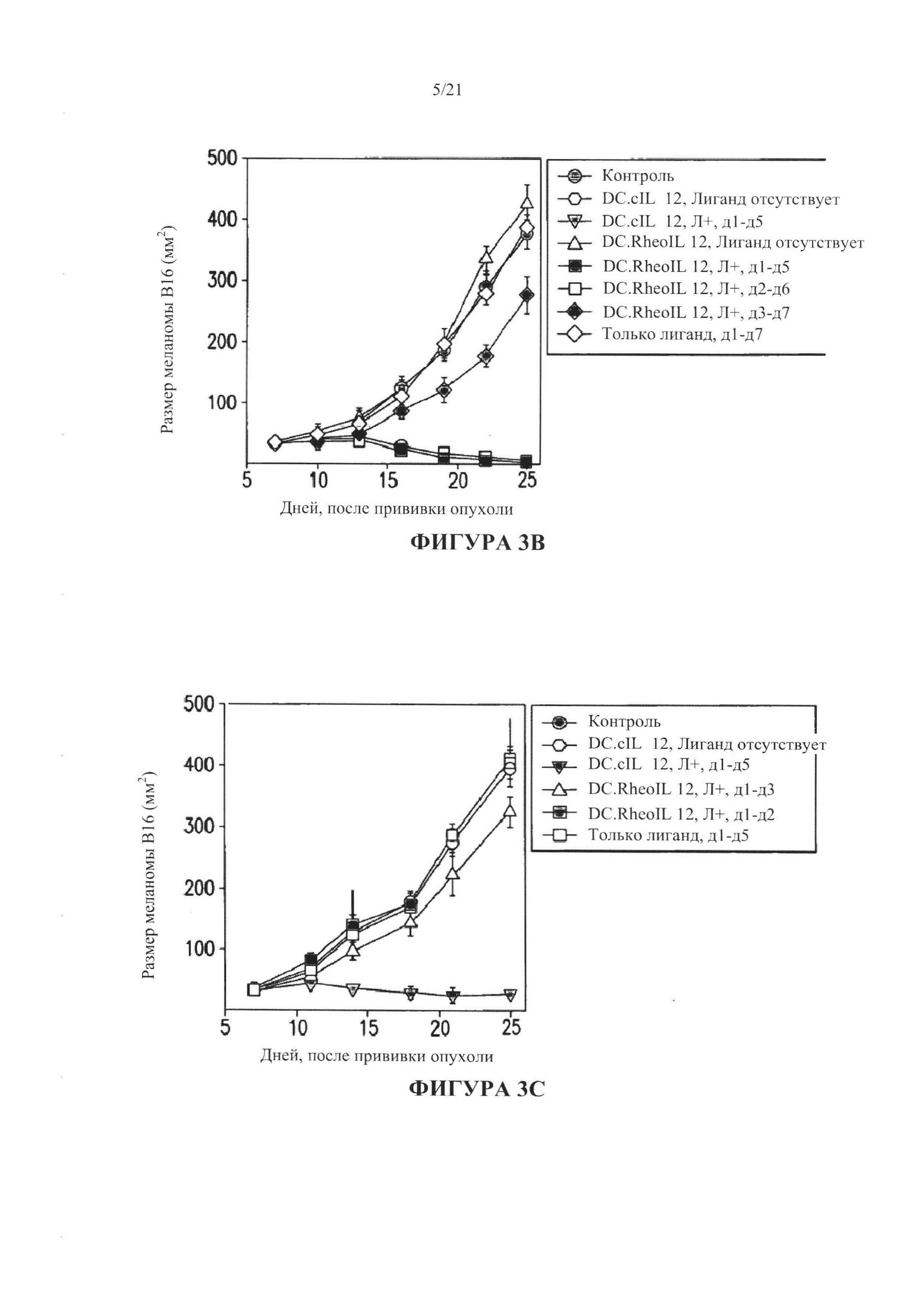
[0029] На Фигуре 3А показано, что модифицированные дендритные клетки, введенные в микроокружение меланомы, вызывают регресс опухоли у мышей C57B 1/6 на 7-й день после появления у них подкожных опухолей В16, при внутрибрюшинном введении RG-115830, в течение 24 часов после введения дендритных клеток. Фигура 3B-3C: регресс опухоли произошел при постоянном введении RG-115830 в течение суток 1-5, но не произошел при введении RG-115830 только в течение суток 1-2 или 1-3 после введения дендритных клеток.
[0030] На Фигуре 4 показано, что модифицированные дендритные клетки лучше выживают в опухоли и в инфильтрованных опухолью лимфатических узлах (ЛУ) после внутрибрюшинного введения активирующего лиганда, в случае, если введение было произведено в течение 24 часов после инъекции дендритных клеток, при этом выживаемость значительно ниже или равна нулю при введении лиганда в течение 48 и 72 часов после инъекции клеток, соответственно.
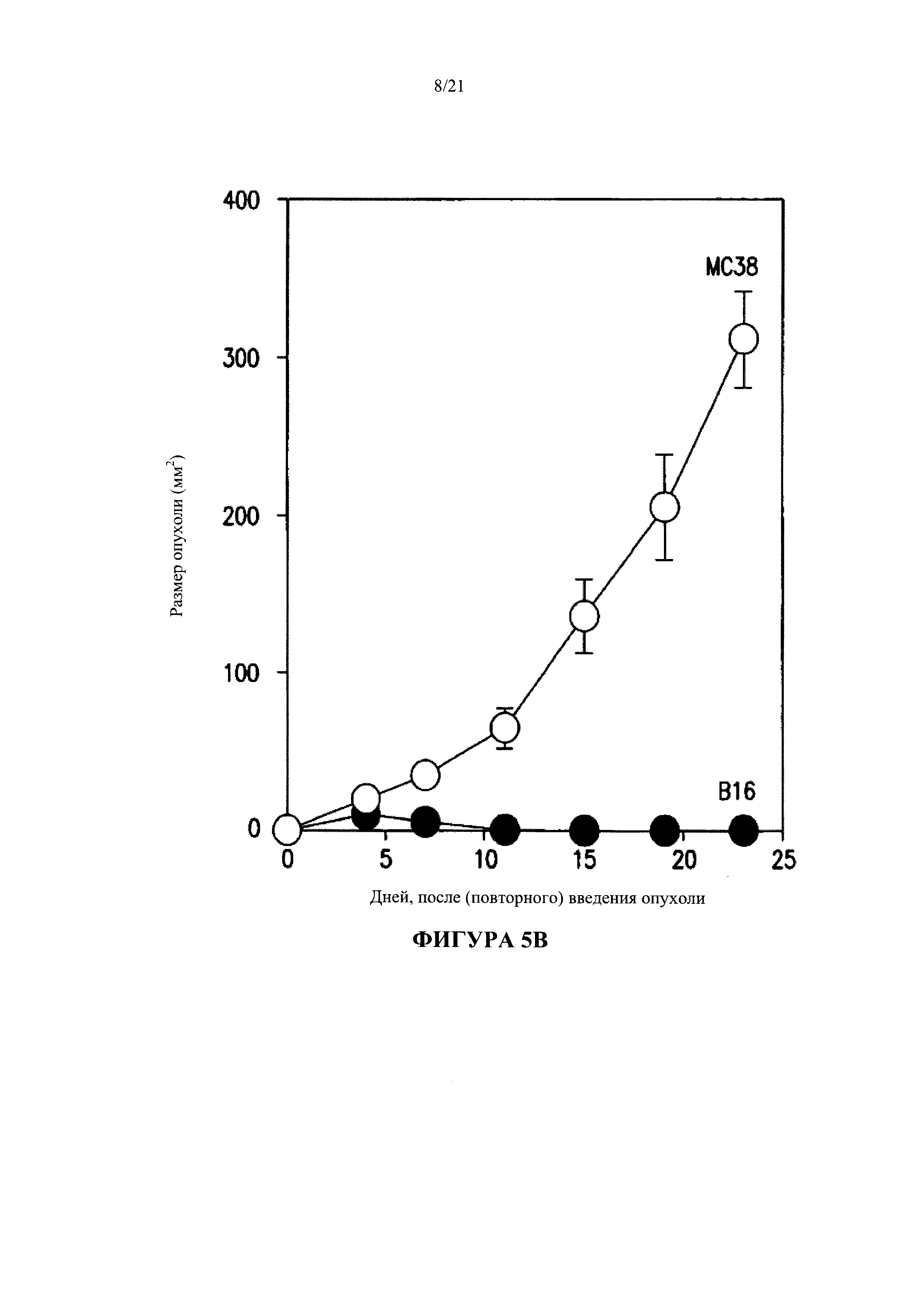
[0031] На Фигуре 5 А показано, что модифицированные дендритные клетки вызывают сильную периферическую активацию анти-В16 CD8+ Т-клеток после внутрибрюшинного введения активирующего лиганда, в случае, если введение было произведено в течение 24 часов после инъекции указанных дендритных клеток. Фигура 5 В показывает, что мыши, перед тем получавшие лечение от меланомы, обладают специфической защитой от опухолевых клеток В16, но не от опухолевых клеток МС38 карциномы прямой кишки, когда не зараженные опухолью животные были инфицированы соответствующими клетками В16 меланомы или клетками МС38 карциномы толстой кишки на 45-й день после первичного заражения В16.
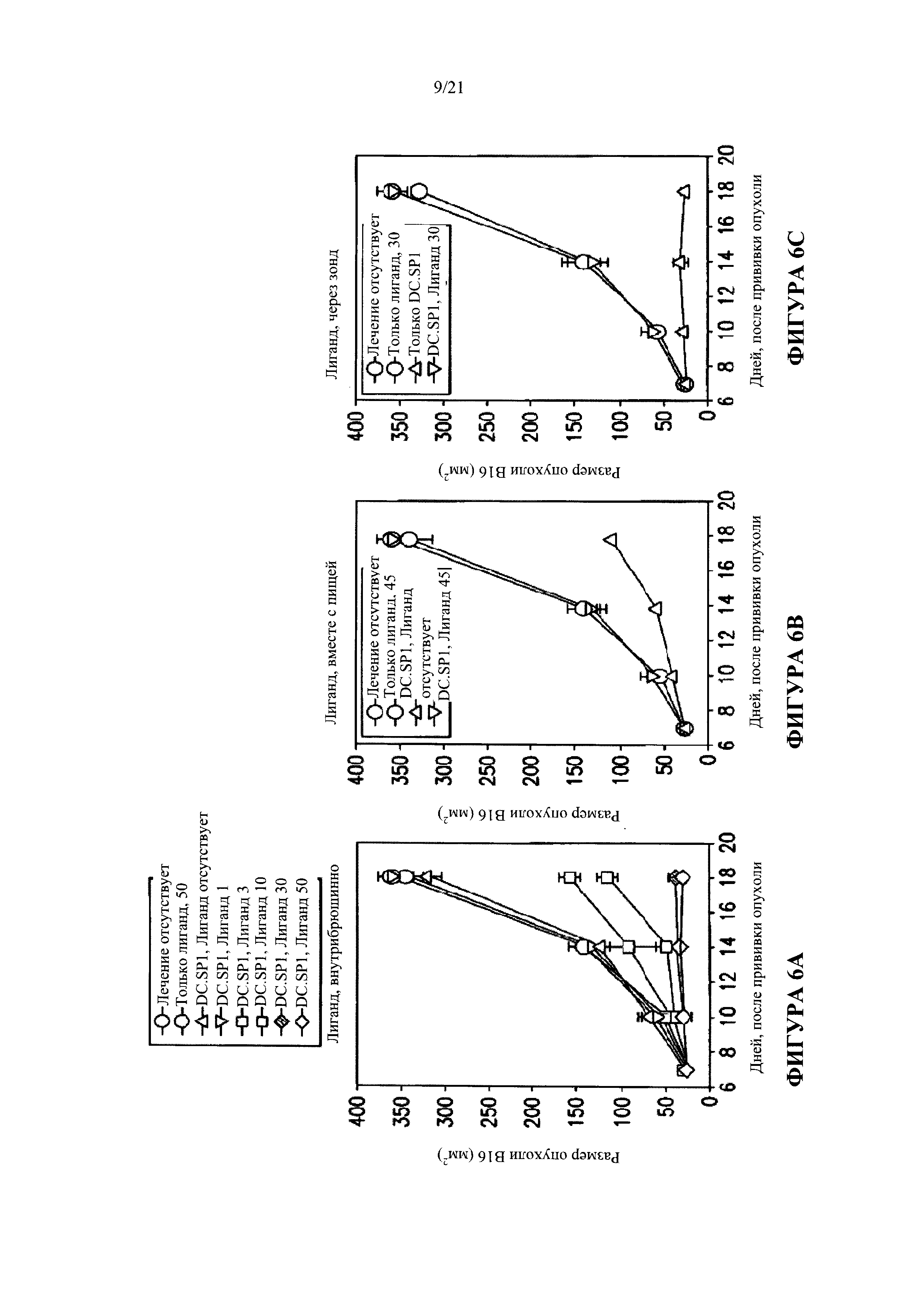
[0032] Фигура 6 показывает терапевтические преимущества, обусловленные введением лиганда внутрибрюшинно или орально.
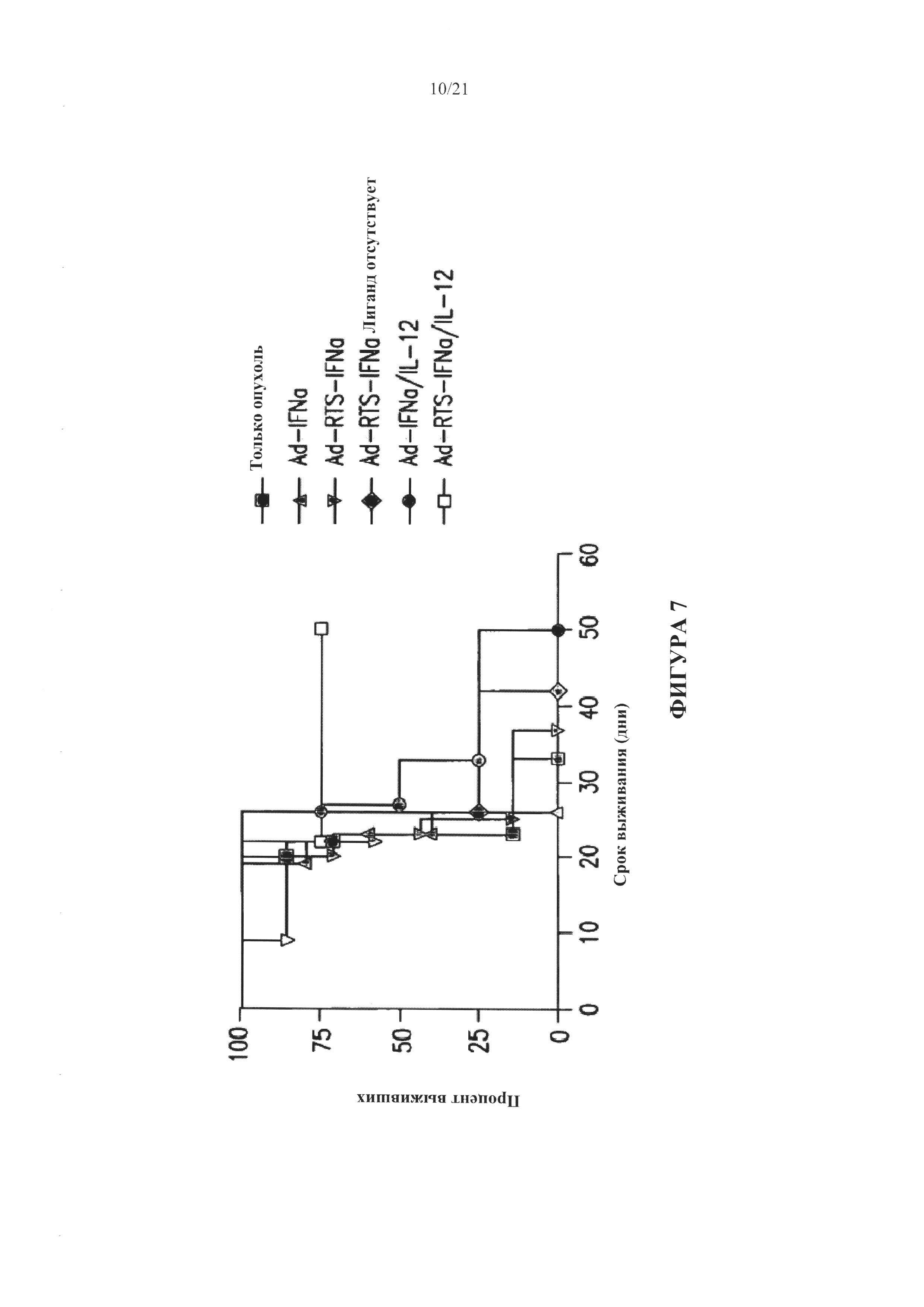
[0033] На Фигуре 7 изображены графики Каплана-Майера, иллюстрирующие динамику выживаемости мышей при глиоме мышей (GL261) в результате внутриопухолевой инъекции дендритных клеток, модифицированных полинуклеотидами, кодирующими интерлейкин-12 и/или интерферон-альфа под контролем RTS. Аббревиатуры на данном рисунке расшифровываются следующим образом: Ad-IFNa - аденовирусный вектор, регулируемо вырабатывающий интерферон-альфа; Ad-RTS-IFNa - аденовирусный вектор, кодирующий интерферон-альфа под контролем RTS; Ad-RTS-IFNa no ligand - аденовирусный вектор, содержащий RTS и интерферон-альфа при отсутствии активирующего лиганда; Ad-rFNa/IL-12 относится к дендритным клеткам, модифицированным аденовирусным вектором, кодирующим интерферон-альфа и интерлейкин-12; и Ad-RTS - EFNa/IL-12 относится к дендритным клеткам, модифицированным двумя аденовирусными векторами, кодирующими интерферон-альфа и интерлейкин-12 под контролем RTS.
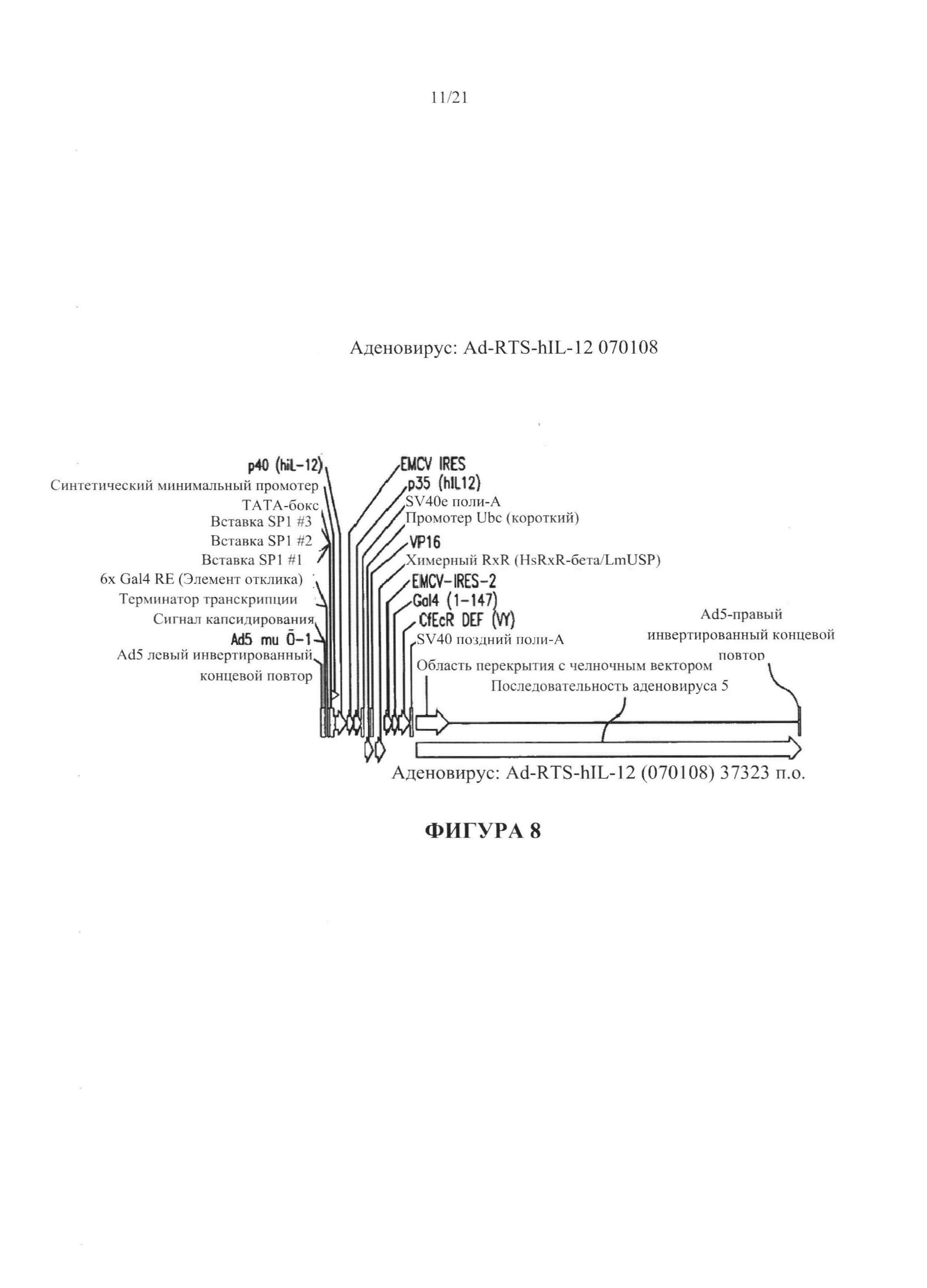
[0034] На Фигуре 8 изображена карта аденовирусного вектора Ad-RTS-hTL-12.
[0035] На Фигуре 9 показана выработка интерлейкина-12 дендритными клетками человека, модифицированными аденовирусным вектором Ad-RTS-IL-12 мыши, при разных значениях MOI и разной продолжительности адсорбции вирусов. Трансдукция дендритных клеток человека аденовирусом при разных значениях MOI и разной продолжительности адсорбции вирусов выявила эффективную трансдукцию клеток при 3-часовой адсорбции вирусов и значении MOI, равном 500. Активирующее вещество ("AD" или "активирующий лиганд") индуцировало экспрессию интерлейкина-12 указанными дендритными клетками человека.
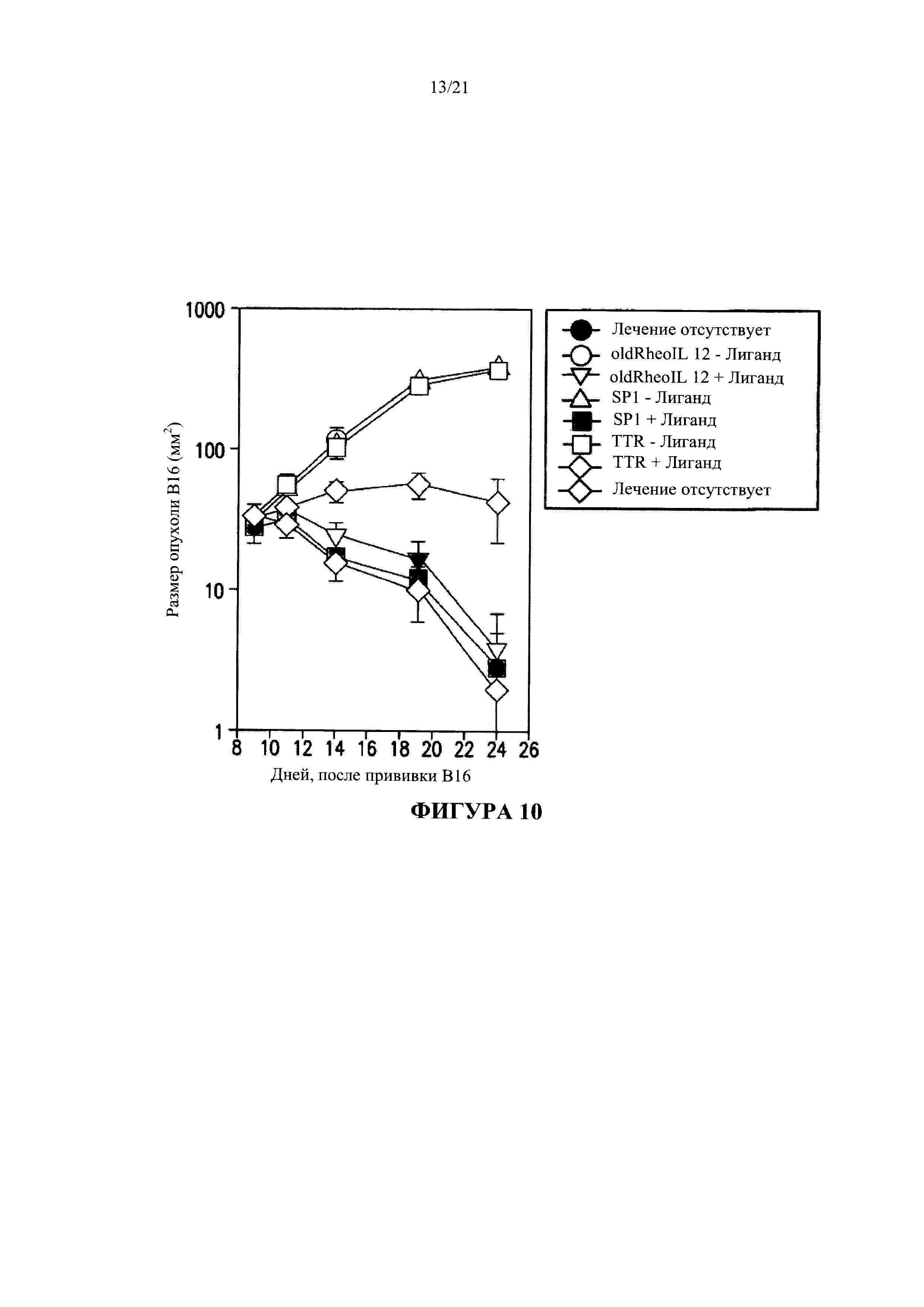
[0036] На Фигуре 10 показан результат сравнительного анализа эффекта различных, содержащих ген интерлейкина-12 аденовирусных векторов. Вариант SP1-RheoIL-12 оказался наиболее эффективным среди всех вариантов, содержащих Rheoswitch. Sp1-RheoIL-12 отличается от oldRheoIL-12 тем, что последовательность AdEasy-1 в нем заменена на последовательность RAP Ad (ViraQucst). Аналогичным образом, TTR-RheoIL-12 отличается от oldRheoIL-12 тем, что он содержит минимальный промотор TTR, по направлению транскрипции от сайтов связывания Gal4, который заменяет синтетический минимальный промотор и сайты связывания SpI, а основа последовательности вектора является последовательностью RAP Ad (ViraQuest). Как показано на Фигуре 10, Sp1-RheoIL-12 оказался аналогичным oldRheoIL-12 и более эффективным, чем TTR-RheoEL-12 в отношении уменьшения размера опухоли меланомы В16.
[0037] На Фигуре 11 показано отсутствие формирования опухоли меланомы В16 после повторной инициации опухоли у мышей, перед этим получивших лечение дендритными клетками, содержащими рекомбинантный аденовирусный Rheoswitch-индуцируемый интерлейкин-12. Это говорит о том, что опухолевый рост меланомы В16 блокируется в течение приблизительно 25 суток, когда мышей, обладающих иммунитетом к В16, подвергали повторной инокуляции через 45 дней после первичного заражения клетками В16. Дендритные клетки мыши были получены из костного мозга мышей В6 путем 7-дневного культивирования в полной среде (RPMI- 1640, 10% FBS), содержащей rmIL-4 и rmGM-CSF. Затем CD11c-положительные дендритные клетки выделяли с помощью специфичных частиц MACS согласно протоколу производителя (Miltenyi Biotech) и инфицировали при значении MOI, равном 100, с использованием rAd.IL-12 (RheoIL-12 vs. SP1 vs. TTR), в течение 24 часов до инъекции дендритных клеток 10E6 подкожно (s.c.) в образовавшиеся на 9-й день опухоли меланомы В16 (5 мышей в каждой группе, опухоль на правом боку). Затем часть мышей подвергли ежедневным внутрибрюшинным (i.p.) инъекциям активирующего лиганда RG-115830 (30 мг/кг в 50 мкл диметилсульфоксида, DMSO) в дни 0-4 после введения дендритных клеток. Размер опухоли контролировали каждые 3-4 дня и измеряли в мм2, как произведение ортогональных диаметров. Для оценки специфичности защиты, связанной с терапией, всех животных, у которых отсутствовала опухоль, подвергли повторным инъекциям клеток меланомы 10Е5 В16 в левый бок и клеток карциномы толстой кишки МС38 в правый бок на 45-е сутки после первичного инфицирования клетками опухоли В16. Опухоли МС38 были выявлены, в то время как опухоли В16 не образовались.
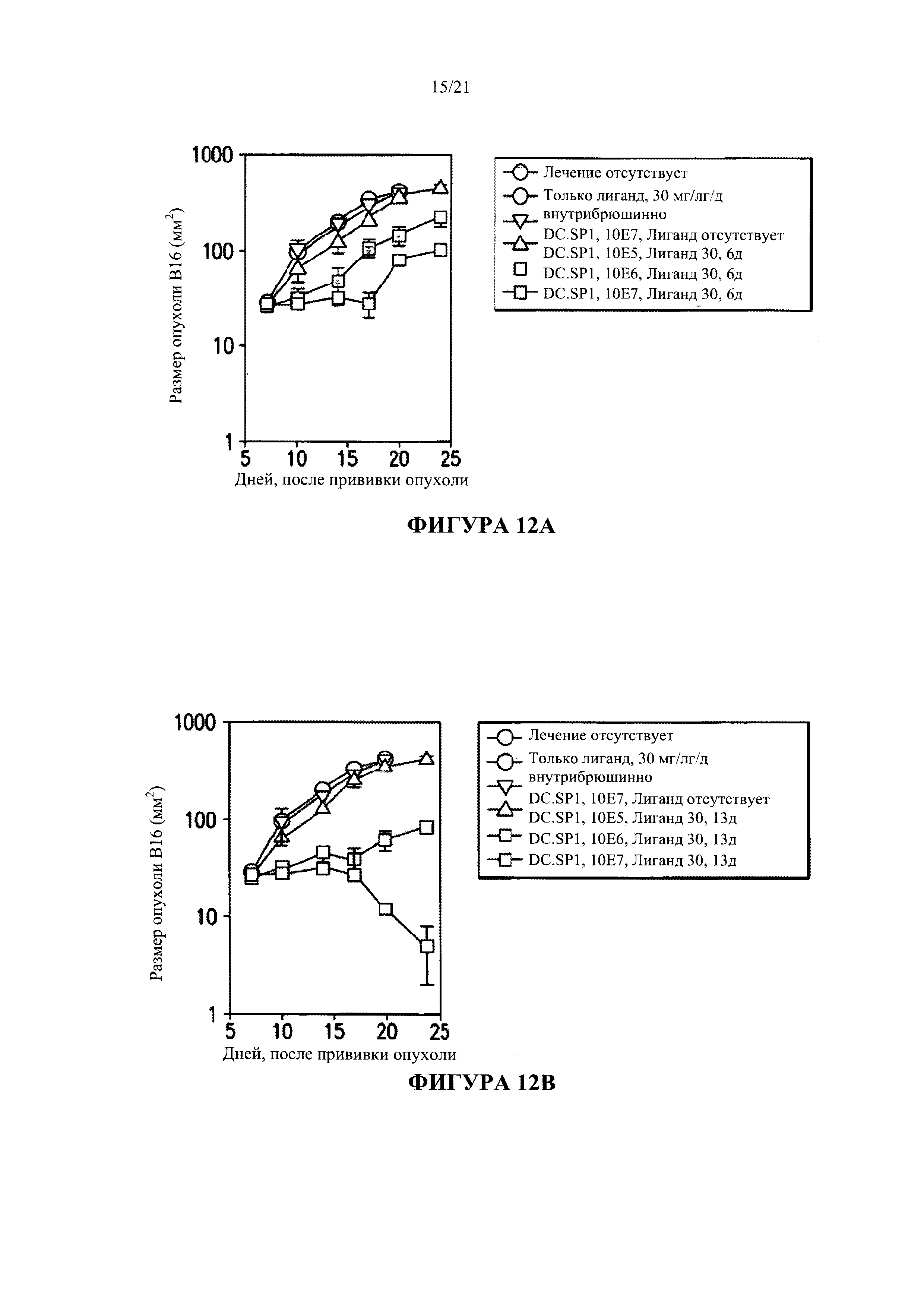
[0038] Фигура 12 показывает результат сравнительного анализа между количеством дендритных клеток, введенных в опухоль В16 (10Е5, 10Е6, 10Е7), продолжительностью введения лиганда (6 дней или 13 дней) и последующим регрессом опухоли у модельных мышей, зараженных меланомой В16. Лиганды, при введении ежедневно в течение 13 дней в комбинации с дендритными клетками 10E7, оказались наиболее эффективным средством, вызывающим регресс опухолей в течение 25 дней.
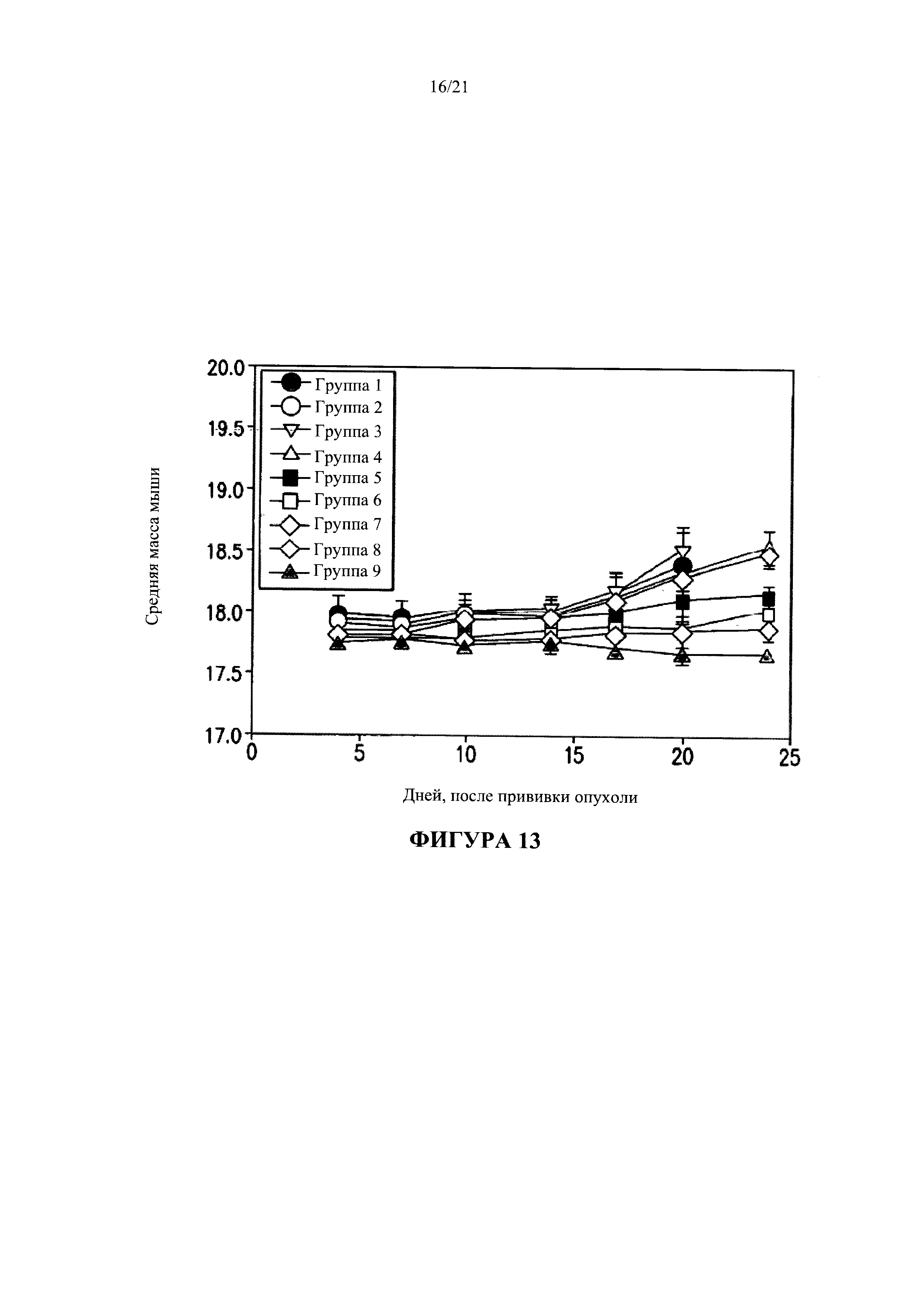
[0039] На Фигуре 13 показано, что описанная в данной заявке терапия не была причиной нежелательной потери веса вследствие изнуренного состояния. Изнуренное состояние и потеря веса часто связаны с высокими уровнями интерферона-гамма и фактора некроза опухолей-альфа (TNF-alpha), синтез которых положительно регулируется интерлейкином-12.
[0040] На Фигуре 14 показано, что в результате повторной инициации опухоли у мышей, перед этим получивших лечение дендритными клетками, содержащими рекомбинантный аденовирусный RheoSwitch-индуцируемый интерлейкин-12 и активизирующий лиганд RG-115932, опухоли меланомы В16 не формируются. Меланомы В16 развивались в течение 7 дней после подкожных инъекций пяти изогенным мышам В6 в правый бок. На седьмой день, внутриопухолево, в дозах 105, 106 или 107 ввели дендритные клетки DC.SP1-IL-12 (взятые из костного мозга дендритные клетки, инфицированные при значении MOI, равном 100, с применением оптимального переключателя SP1). RG-115932 вводили внутрибрюшинно в день введения дендритных клеток (и затем ежедневно в течение 6 или 13 дней). Каждая группа состояла из 5 животных, рост опухолей контролировали каждые 3-4 дня и протоколировали в виде среднего размера (кв. мм как произведение ортогональных измерений). Во время измерения размеров также оценивали индивидуальные массы животных (Фигура 13). Все животные, избавившиеся от болезни благодаря любому способу лечения, были повторно инокулированы на 50-й день (следующая за первичной прививка опухоли В16) 105 клетками меланомы В16 в противоположный бок (левый бок) относительно первичной опухоли и 105 клетками карциномы толстой кишки МС38 в правый бок. Рост опухолей контролировали каждые 3-4 дня и сравнивали с ростом, наблюдаемым у животных, ранее не получивших лечение (см. Фигура 12). Таким образом, Фигура 14 демонстрирует, что рост опухолей меланомы В16 был блокирован в течение около 24 дней, при повторном введении клеток меланомы В16 иммунным к В16 мышам. Фигура 14 также показывает, что мыши, не привитые В16, не были защищены от образования опухолей так же, как и МС38-иммунные мыши и мыши, не привитые МС38. МС38 - это вид карциномы толстой кишки, известный специалистам в данной области. Вышеописанное демонстрирует специфичность иммунизации, обусловленной введением в первичную опухоль В16 дендритных клеток, содержащих рекомбинантный аденовирусный Rheoswitch-индуцируемый интерлейкин-12.
[0041] Фигура 15 показывает экспрессию интерлейкина-12 в дендритных клетках мышей, модифицированных Ad-RTS-IL-12, зависимую от дозы активирующего вещества.
[0042] Фигура 16 показывает реакцию Включения/Выключения экспрессии интерлейкина-12 в присутствие или отсутствие RG-115932 в клетках НТ1080, модифицированных Ad-RTS-IL-12 мыши.
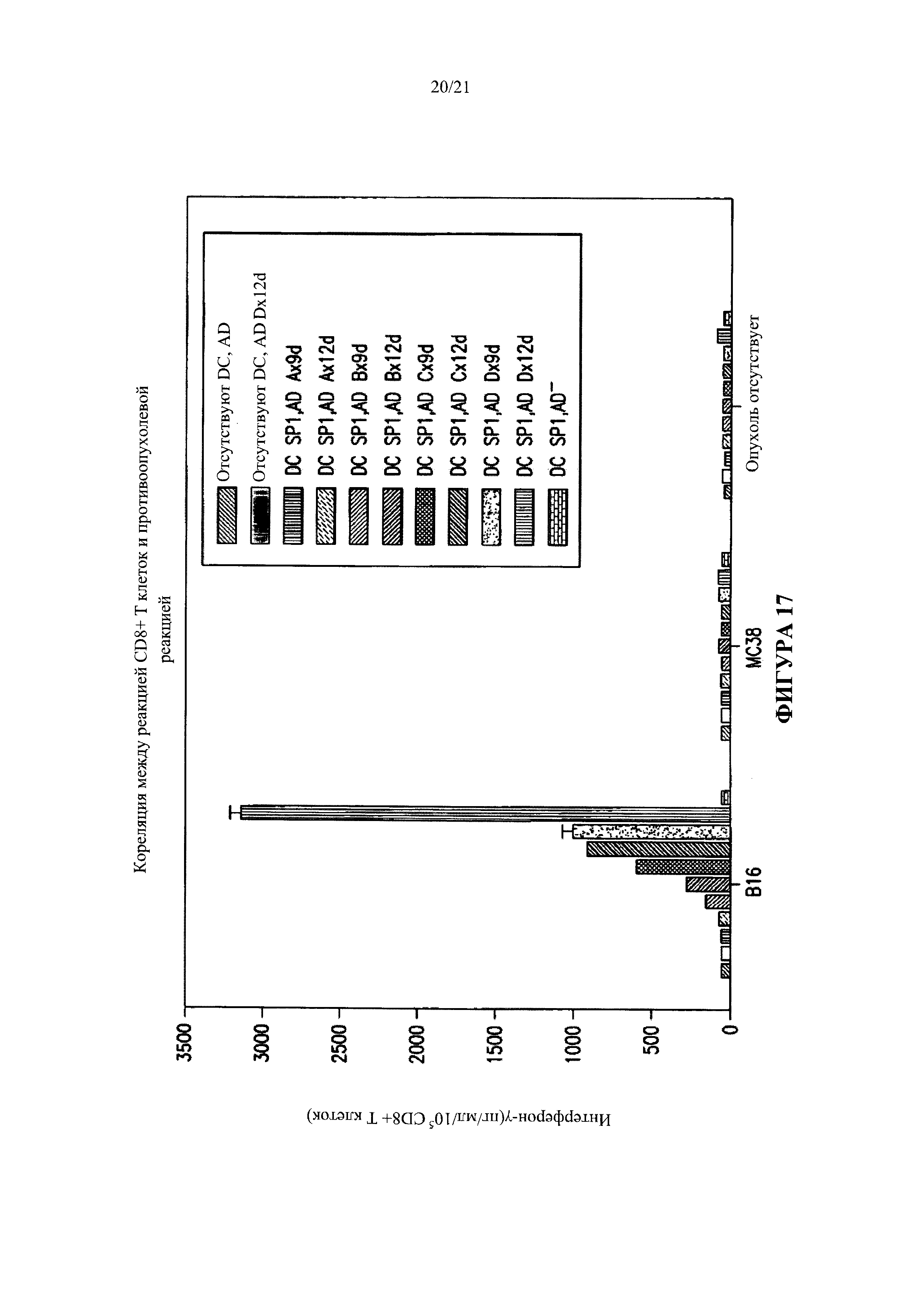
[0043] Фигура 17 показывает, что реакция CD8+ Т-клеток на иммунизацию путем внутриопухолевой инъекции аденовирусных модифицированных дендритных клеток в присутствие или отсутствие активирующего вещества (AD) соответствует противоопухолевой реакции.
[0044] Фигура 18 иллюстрирует активацию синтеза интерлейкина-12 человека во взятых от трех добровольцев дендритных клетках человека, модифицированных аденовирусным вектором, кодирующим интерлейкин-12 под контролем RTS.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0045] SEQ ID NO: 1 - полная нуклеотидная последовательность гена р35 интерлейкина-12 мыши дикого типа.
[0046] SEQ ID NO: 2 - полная нуклеотидная последовательность гена р40 интерлейкина-12 мыши дикого типа.
[0047] SEQ ID NO: 3 - полная нуклеотидная последовательность гена р35 интерлейкина-12 человека дикого типа.
[0048] SEQ ID NO: 4 - полная нуклеотидная последовательность гена р40 интерлейкина-12 человека дикого типа.
[0049] SEQ ID NO: 5 - полная полипептидная последовательность белка р35 интерлейкина-12 мыши дикого типа.
[0050] SEQ ID NO: 6 - полная аминокислотная последовательность белка р40 интерлейкина-12 мыши дикого типа.
[0051] SEQ ID NO: 7 - полная аминокислотная последовательность белка р35 интерлейкина-12 человека дикого типа.
[0052] SEQ ID NO: 8 - полная аминокислотная последовательность белка р40 интерлейкина-12 человека дикого типа.
[0053] SEQ ID NO: 9 - последовательность ДНК элемента отклика (элемент ответа, response element, RE) экдизона, найденного у Drosophila.
[0054] SEQ DD NO: 10 - последовательность ДНК элемента отклика (RE) экдизона, найденного у Drosophila melanogaster.
[0055] SEQ ID NO: 11 - последовательность ДНК элемента отклика (RE) экдизона, найденного у Drosophila melanogaster.
[0056] SEQ ID NO: 12 - Сайт рестрикции эндонуклеазы генной конверсии I-SceI.
[0057] SEQ ID NO: 13 - последовательность ДНК аденовирусного вектора, содержащего кодирующую последовательность человеческого интерлейкина-12: Ad-RTS-IL-12 человека (SP1-RheoIL-12).
[0058] Аминокислотная последовательность интерферона-альфа (IFN-alpha) доступна в публичных базах данных, ее регистрационный номер - ААА52724, данная последовательность включена в ссылки данного документа. См. также Capon et al., Mol. Cell. Biol. 5, 768-779 (1985).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0059] Если не оговорено иначе, все специальные термины и обозначения, а также научные термины и терминология, использованные в настоящей заявке, имеют значения, повсеместно принятые специалистами в области, к которой относится настоящее изобретение. В некоторых случаях, термины, с повсеместно принятыми значениями, пояснены в данном описании для уточнения и/или в качестве готовых справок и разъяснений. Значение таких определений в настоящей заявке необязательно должно различаться со значением этих определений, принятым в данной области техники. Повсеместно принятые определения терминов и/или методик и/или протоколов, относящихся к молекулярной биологии, могут быть найдены в Rieger et al., Glossary of Genetics: Classical and Molecular, 5th edition, Springer-Verlag: New York, 1991; Lewin, Genes V, Oxford University Press: New York, 1994; Sambrook et al., Molecular Cloning, A Laboratory Manual (3rd ed. 2001) и Ausubel et al., Current Protocols in Molecular Biology (1994). Предполагается, что процедуры, включающие в себя применение коммерчески доступных комплектов (kits) и/или реагентов, осуществляются стандартно, в соответствии с инструкциями и/или протоколами и/или параметрами, предоставленными производителем, если не оговорено иначе.
[0060] В настоящей заявке термин «выделенный/изолированный» относится к биологическому материалу (клетке, нуклеиновой кислоте или белку), извлеченному из его естественной среды (окружения, в которой он находится в природе). Например, полинуклеотид, присутствующий в естественном состоянии в растении или животном, не является изолированным, но этот же нуклеотид, отделенный от смежных нуклеиновых кислот, в состав которых он входит в природе, считается «изолированным».
[0061] Термин «очищенный», при использовании в отношении биологического материала, не обязательно требует, чтобы биологический материал находился в абсолютно чистой беспримесной форме, исключающей наличие других веществ в его составе. Это определение относительно.
[0062] Термины «нуклеиновая кислота», «молекула нуклеиновой кислоты», «олигонуклеотид» и «полинуклеотид» являются взаимозаменяемыми и относятся к полимерной форме сложных фосфатных эфиров рибонуклеозидов (аденозина, гуанозина, уридина или цитидина; «молекулы РНК») или дезоксирибонуклеозидов (дезоксиаденозина, дезоксигуанозина, дезокситимидина или дезоксицитидина; «молекулы ДНК») или любых их фосфоэфирных аналогов, таких как фосфоротиолаты и тиоэфира, либо в одноцепочечной форме, или в форме двухцепочечной спирали. Возможны двухцепочечные спирали ДНК-ДНК, ДНК-РНК и РНК-РНК. Термин молекула нуклеиновой кислоты, а в частности, молекула ДНК или РНК, относится только к первичной и вторичной структуре молекулы и не ограничивает ее (молекулу) до каких-либо конкретных третичных форм. Таким образом, этот термин охватывает двухцепочечную ДНК, существующую, в том числе, в линейных и кольцевых формах молекулы ДНК (например, фрагментах рестрикции), плазмидах, суперспирализованной ДНК и хромосомах. При рассмотрении структуры отдельных двухцепочечных молекул ДНК, последовательности могут быть описаны в настоящей заявке соответственно принятым условным обозначениям в направлении от 5' к 3' по нетранскрибируемой цепочке ДНК (т.е. цепочке, последовательность которой гомологична последовательности иРНК). «Рекомбинантная молекула ДНК» - это молекула ДНК, подвергшаяся молекулярно-биологической обработке. К ДНК относятся, однако не ограничивают это понятие: кДНК, геномная ДНК, плазмидная ДНК, синтетическая ДНК и полусинтетическая ДНК.
[0063] Термин «фрагмент», применяемый к полинуклеотидным последовательностям, относится к нуклеотидной последовательности, которая состоит из меньшего числа нуклеотидов по сравнению с исходной нуклеиновой кислотой и содержащей, кроме общей области, последовательность нуклеотидов, идентичную изначальной нуклеиновой кислоте. Согласно настоящему изобретению, такой фрагмент нуклеиновой кислоты, может, если необходимо, входить в больший полинуклеотид и являться, таким образом, составной частью последнего. Согласно изобретению, такие фрагменты включают в себя или, в качестве альтернативы могут состоять из олигонуклеотидов, размер которых варьирует от, по меньшей мере 6, 8, 9, 10, 12, 15, 18, 20, 21, 22, 23, 24, 25, 30, 39, 40, 42, 45, 48, 50, 51, 54, 57, 60, 63, 66, 70, 75, 78, 80, 90, 100, 105, 120, 135, 150, 200, 300, 500, 720, 900, 1000, 1500, 2000, 3000, 4000, 5000, или большего числа последовательных нуклеотидов нуклеиновой кислоты.
[0064] В настоящем описании, термин «изолированный фрагмент нуклеиновой кислоты» относится к одно- или двухцепочечному полимеру РНК или ДНК, факультативно содержащему синтетические, не встречающиеся в природе или измененные основания. Изолированный фрагмент нуклеиновой кислоты в форме полимера ДНК может содержать один или более сегмент кДНК, геномной ДНК или искуственной ДНК.
[0065] Под определение «Ген» попадает полинуклеотид, состоящий из нуклеотидов, кодирующих функциональную молекулу, а также функциональные молекулы, получаемые посредством одной лишь транскрипции (например, биологически активный вид РНК) или транскрипции и трансляции (например, полипептид). Термин «ген» охватывает кДНК и геномные ДНК. Под определение «Ген» также попадает фрагмент нуклеиновой кислоты, экспрессирующий специфическую РНК, белок или полипептид, и включающий в себя регуляторные последовательности, предшествующие (5' некодирующие последовательности) и следующие за (3' некодирующие последовательности) кодирующей последовательностью. Определение «Нативный ген» описывает ген в той форме, в которой он существует в природе, с его собственными регуляторными последовательностями. Определение «химерный ген» (рекомбинантный ген) относится к любому ненативному гену, содержащему регуляторные и/или кодирующие последовательности, не существующие вместе в естественном состоянии. Соответственно, химерный ген может содержать регуляторные последовательности и кодирующие последовательности, взятые из разных источников, или регуляторные последовательности и кодирующие последовательности, взятые из одного и того источника, но расположенные иначе, нежели они располагаются в естественном состоянии. Химерный ген может содержать кодирующие последовательности, которые были взяты из различных источников, и/или регуляторные последовательности, которые были взяты из различных источников. Определение «эндогенный ген» относится к нативному гену в его естественном расположении в геноме организма. Определение «чужеродный» ген или «гетерологичный» ген относится к гену, в нормальных обстоятельствах не присутствующему в организме хозяина, но искусственно введенному в организм хозяина с помощью переноса гена. К чужеродным генам могут относиться встречающиеся в природе гены, внедренные в чужеродный организм или рекомбинантные гены. «Трансген» - это ген, введенный в геном при помощи процедуры трансформации. Например, ген интерлейикна-12 (IL-12) кодирует белок интерлейкин-12 (IL-12). Интерлейкин-12 является гетеродимером состоящим из 35-kD субъединицы (р35) и 40-kD субъединицы (р40), которые, связываясь дисульфидным мостиком, формируют полнофункциональный IL-12p70. Ген IL-12 кодирует обе субъединицы: р35 и р40.
[0066] Термин «гетерологичная ДНК» относится к ДНК, в нормальных условиях не присутствующей в клетке или в хромосомном сайте клетки. В понятие гетерологичной ДНК может входить ген, чужеродный клетке.
[0067] Термин «геном» включает в себя хромосомную, митохондриальную, и вирусную ДНК или РНК, а также ДНК или РНК хлоропластов.
[0068] Молекула нуклеиновой кислоты является «гибридизующейся» с другой молекулой нуклеиновой кислоты, как, например, кДНК, геномной ДНК или РНК, когда одноцепочечная форма молекулы нуклеиновой кислоты может образовать комплекс с другой молекулой нуклеиновой кислоты при соответствующих значениях температуры и ионной силы раствора. Условия гибридизации и промывания хорошо известны и иллюстрированы в Sambrook et al. in Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor (1989), в частности, в Главе 11 и Таблице 11.1 этого описания. Температурные условия и ионная сила определяют «точность и безошибочность» гибридизации.
[0069] Условия жесткости гибридизации можно отрегулировать для выделения относительно сходных фрагментов, таких как гомологичные последовательности дальнеродственных организмов, а также фрагментов, обладающих высоким сходством, таких как гены, воспроизводящие функциональные ферменты близкородственных организмов. Для предварительного выявления гомологичных нуклеиновых кислот, применяют мягкие условия, соответствующие низкой жесткости (точности и безошибочности) гибридизации, например: при Tm=55°, в среде содержащей: 5Х SSC, 0.1% SDS, 0.25% молоко, без формамида; или в среде содержащей: 30% формамид, 5Х SSC, 0.5% SDS. Для получения более высоких значений жесткости гибридизации применяют Tm выше, чем в предыдущем примере, в среде содержащей 40% формамид, с 5Х или 6Х SSC. Для получения высоких значений жесткости гибридизации применяют высокую Tm, в среде содержащей: 50% формамид, 5Х или 6Х SSC.
[0070] Для успешной гибридизации необходимо, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя, в зависимости от условий жесткости гибридизации, возможно ошибочное спаривание оснований. Термин «комплементарный» применяют для описания соответствия между нуклетидными основаниями, которые способны гибридизоваться друг с другом. Например, в отношении ДНК, аденин комплементарен тимину и гуанин комплементарен цитозину. В соответствии с этим, изобретение также включает в себя изолированные фрагменты нуклеиновых кислот, комплементарные к полным последовательностям, как раскрыто или применено в настоящем описании, а также существенно сходные последовательности нуклеиновых кислот, о которых говорилось ранее.
[0071] Согласно одному из вариантов реализации, полинуклеотиды выявляют гибридизацией при Tm, равной 55°С, и обеспечении условий, описанных выше. Согласно другим вариантам реализации, значение Tm берется равным 60°С, 63°С или 65°С.
[0072] Пост-гибридизационные промывки также определяют жесткость гибридизации. Одна группа условий подразумевает серию промываний, начинающуюся с 6Х SSC, 0.5% SDS при комнатной температуре в течение 15 минут, затем 2Х SSC, 0.5% SDS при 45°С в течение 30 минут, а затем дважды 0.2Х SSC, 0.5% SDS при 50°С в течение 30 минут. Предпочитаемая совокупность более жестких условий подразумевает более высокие температуры, при тех же промываниях, с единственным отличием: температура двух последних 30-минутных промываний 0.2Х SSC, 0.5% SDS повышена до 60°С. Другая предпочитаемая совокупность жестких условий подразумевает два последних промывания 0.1 X SSC, 0.1% SDS при 65°С.
[0073] Жесткость, приемлемая для гибридизации нуклеиновых кислот, зависит от длины цепочки нуклеиновых кислот и степени комплементарности, значения этих переменных хорошо известны в данной области. Чем выше степень сродства и гомологичности между двумя нуклеотидными последовательностями, тем выше значение Tm для гибридизации нуклеиновых кислот, соответствующих данным последовательностям. Относительная стабильность (соответствующая более высокой Tm) гибридизации нуклеиновых кислот повышается в следующем ряду: РНК:РНК, ДНК:РНК, ДНК:ДНК. Для гибридов, длина которых превышает 100 нуклеотидов, разработаны уравнения для вычисления Tm (см. Sambrook et al., supra, 9.50-0.51). При гибридизации нуклеиновых кислот меньшей длины, т.е. олигонуклеотидов, количество позиций ошибочного спаривания приобретает большее значение, и специфичность олигонуклеотида определяется его длиной (см. Sambrook et al., supra, 11.7-11.8).
[0074] Согласно одному из вариантов реализации настоящего изобретения, полинуклеотиды распознаются путем применения условий гибридизации, включающих в себя стадию гибридизации при содержании солей менее чем 500 тМ и температуре не ниже 37°С, и стадию промывания в 2Х SSPE при температуре не ниже 63°С. Согласно другому варианту реализации, условия гибридизации подразумевают менее чем 200 мМ соли и, по меньшей мере 37°С для стадии гибридизации, согласно другому варианту гибридизации, условия подразумевают 2Х SSPE и 63°С для стадий гибридизации и промывания.
[0075] Согласно другому варианту реализации изобретения, длина подвергающейся гибридизации нуклеиновой кислоты составляет, как минимум, 10 нуклеотидов. Предпочтительно, чтобы минимальная длина нуклеиновой кислоты составляла по меньшей мере 15 нуклеотидов; например по меньшей мере 20 нуклеотидов; например по меньшей мере 30 нуклеотидов. Более того, опытный специалист учтет, что температура и соленость промывочного раствора может быть отрегулирована до необходимого значения, в зависимости от факторов, таких как длина образца.
[0076] Термин «образец» относится к молекуле одноцепочечной нуклеиновой кислоты, основания которой обладают способность связаться с соответствующими основаниями комплементарной одноцепочечной нуклеиновой кислоты-мишени с образованием двухцепочечной молекулы.
[0077] Термин «олигонуклеотид» в настоящем описании относится к короткой нуклеиновой кислоте, способной к гибридизации с молекулой геномной ДНК, кДНК, плазмидной ДНК или иРНК. Олигонуклеотиды могут быть помечены, например,32Р-нуклеотидами или нуклеотидами, к которым можно ковалентно присоединить метку, например, биотин. Меченый олигонуклеотид может быть использован в качестве зонда для выявления присутствия нуклеиновой кислоты. Олигонуклеотиды (один или оба из которых могут быть помечены) могут быть использованы в качестве праймеров ПНР при клонировании фрагмента или всей нуклеиновой кислоты, для определения последовательности ДНК, либо для выявления наличия ДНК. Олигонуклеотид также может быть использован для получения тройной спирали с молекулой ДНК. Обычно олигонуклеотиды получают синтетическим путем, предпочтительно, в синтезаторе нуклеиновых кислот. Соответственно этому, полученные олигонуклеотиды могут нести не встречающиеся в природе аналоги фосфодиэфирных связей, например, тиоэфирных связей и т.п.
[0078] Термин «праймер» относится к олигонуклеотиду, гибридизующемуся с последовательностью нуклеиновой кислоты-мишени с получением двухцепочечного участка нуклеиновой кислоты. Этот участок, в соответствующих условиях, может служить точкой инициации синтеза ДНК. Такие праймеры могут быть использованы в ПЦР или для определения последовательности ДНК.
[0079] Термин «полимеразная цепная реакция», в сокращении, ПЦР, относится к in vitro способу ферментативной амплификации специфических последовательностей нуклеиновых кислот. ПЦР включает в себя повторяющиеся серии температурных циклов, состоящих из трех стадий: денатурация матричной нуклеиновой кислоты с разделением цепочек молекулы-мишени, гибридизация одноцепочечного олигонуклеотидного праймера ПЦР с матричной нуклеиновой кислотой и удлинение гибридизованного примера(ов) ДНК-полимеразой. ПЦР обеспечивает обнаружение молекулы-мишени, а также определение относительного количества этой молекулы-мишени в первичной смеси нуклеиновых кислот в полуколичественных или количественных условиях,
[0080] Термин «полимеразная цепная реакция с обратной транскрипцией», в сокращении, ОТ-ПЦР (RT-PCR), относится к in vitro способу ферментативного синтеза молекулы-мишени или молекул-мишеней кДНК из молекулы или молекул РНК с последующей ферментативной амплификацией специфической последовательности или последовательностей в составе молекулы-мишени или молекул-мишеней кДНК, как описано выше. ОТ-ПЦР обеспечивает обнаружение молекулы-мишени, а также определение относительного количества этой молекулы-мишени в первичной смеси нуклеиновых кислот в полуколичественных или количественных условиях.
[0081] Термин «кодирующая последовательность» ДНК относится к последовательности двухцепочечной ДНК, кодирующей полипептид и поддающейся транскрипции и трансляции в полипептид в клетке in vitro или in vivo, под контролем соответствующих регуляторных последовательностей. Термин «соответствующие регуляторные последовательности» относится к нуклеотидным последовательностям, предшествующим (5' некодирующие последовательности), находящимся в составе или следующим за (3' некодирующие последовательности) кодирующей последовательностью, и влияющим на транскрипцию, процессинг, стабильность РНК, или трансляцию соответствующей кодирующей последовательности. К регуляторным последовательностям могут относиться промоторы, лидирующие последовательности трансляции, интроны, сайты распознавания полиаденилирования, сайты процессинга РНК, участки связывания эффекторов и структуры типа «стебель-петля». Границы кодирующих последовательностей определяются старт-кодоном на 5' (амино) конце и стоп-кодоном трансляции на 3' (карбоксильном) конце. Кодирующая последовательность может содержать (но не ограничена) прокариотические последовательности, кДНК из иРНК, геномные последовательности ДНК и даже искусственные последовательности ДНК. Если кодирующая последовательность предназначается для экспрессии в эукариотической клетке, сигнал полиаденилирования и терминации транскрипции, как правило, будет находиться в направлении 3' от кодирующей последовательности.
[0082] Термин «открытая рамка считывания», в сокращении, ОРС (ORF), относится к всей последовательности нуклеиновой кислоты, ДНК, кДНК или РНК, включающей в себя старт-сигнал трансляции, или кодон инициации, как АТГ(ATG) или АУГ(AUG), и кодон терминации. Может происходить трансляция этой последовательности в полипептидную последовательность.
[0083] Термин «голова к голове» (head-to-head) в настоящей заявке относится к пространственной ориентации двух полинуклеотидных последовательностей по отношению друг к другу. Полинуклеотиды позиционированы в ориентации «голова к голове», когда 5' конец кодирующей цепочки одного полинуклеотида прилегает к 5' концу кодирующей последовательности другого полинуклеотида, причем направление транскрипции каждого полинуклеотида идет от 5' конца другого полинуклеотида. Термин «голова к голове» может быть кратко представлен в виде (5')-к-(5') и может также обозначаться символами (←→) или (3'←5'5'→»3').
[0084] Термин «хвост к хвосту» в в настоящей заявке относится к пространственной ориентации двух полинуклеотидных последовательностей по отношению друг к другу. Полинуклеотиды позиционированы в ориентации «хвост к хвосту», когда 3' конец кодирующей последовательности одного полинуклеотида прилегает к 3' концу кодирующей последовательности другого полинуклеотида, причем направление транскрипции каждого полинуклеотида идет к другому полинуклеотиду. Термин «хвост к хвосту» может быть кратко представлен в виде (3')-к-(3') и может также обозначаться символами (→←) или (5'→3'3'←5').
[0085] Термин «голова к хвосту» в настоящей заявке относится к ориентации двух полинуклеотидных последовательностей по отношению друг к другу. Полинуклеотиды позиционированы в ориентации «голова к хвосту», когда 5' конец кодирующей последовательности одного полинуклеотида прилегает к 3' концу кодирующей последовательности другого полинуклеотида, причем направление транскрипции каждого полинуклеотида однонаправленно с направлением транскрипции другого полинуклеотида. Термин «голова к хвосту» может быть сформулирован в виде (5')-к-(3') и может также обозначаться символами (→→) или (5'→3'5'→3').
[0086] Термин, «находящийся по ходу транскрипции» («следующий за» кодирующей последовательностью) относится к нуклеотидной последовательности, расположенной в направлении 3' относительно рассматриваемой точки нуклеотидной последовательности. В частности, находящиеся по ходу транскрипции нуклеотидные последовательности обычно относятся к последовательностям, следующим за начальной точкой транскрипции. Например, кодон инициации трансляции гена следует за стартовой точкой транскрипции.
[0087] Термин, «находящийся против хода транскрипции» («предшествующий» кодирующей последовательности) относится к нуклеотидной последовательности, расположенной в направлении 5' относительно рассматриваемой точки нуклеотидной последовательности. В частности, находящиеся против хода транскрипции нуклеотидные последовательности обычно относятся к последовательностям, предшествующим начальной точке транскрипции. Например, большинство промоторов предшествуют стартовой точке транскрипции.
[0088] Термины «рестрикционная эндонуклеаза», «рестриктаза» взаимозаменяемы и относятся к ферменту, присоединяющемуся к специфической нуклеотидной последовательности в составе двухцепочечной ДНК и расщепляющему ее.
[0089] Термин «гомологичная рекомбинация» относится к встраиванию чужеродной последовательности ДНК в другую молекулу ДНК, например, внедрение вектора в хромосому. Предпочтительно, при гомологичной рекомбинации вектор нацеливается на специфический участок хромосомы. Для специфической гомологичной рекомбинации вектор должен содержать достаточно длинные участки гомологии к хромосомным последовательностям, чтобы обеспечить комплементарное присоединение и внедрение вектора в хромосому. Более длинные участки гомологии и более высокая степень сродства последовательностей могут повысить эффективность гомологичной рекомбинации.
[0090] В данной области техники известно несколько способов репродуцирования полинуклеотидов, пригодных для использования согласно изобретению. Как только предоставлена подходящая система хозяина и условия для роста, рекомбинантные векторы экспрессии могут быть репродуцированы и получены в нужном количестве. Согласно настоящему описанию, к векторам экспрессии, пригодным для использования, относятся (но не ограничивают) следующие векторы или их производные: вирусы человека или животных, как вирус осповакцины или аденовирус; вирусы насекомых, как бакуловирус; дрожжевые векторы; векторы-бактериофаги (например, фаг лямбда); и некоторые плазмидные и космидные ДНК-векторы.
[0091] Термин «вектор» относится к любому средству клонирования и/или транспорта нуклеиновой кислоты в клетку-хозяина. Вектор может быть репликоном, к которому можно присоединить другой сегмент ДНК для осуществления репликации такого сегмента. Термин «репликон» относится к любому генетическому элементу (например плазмиде, фагу, космиде, хромосоме, вирусу), функционирующему как автономная единица репликации ДНК in vivo, т.е. способному реплицироваться под собственным контролем. Термин «вектор» подразумевает как вирусные, так и невирусные средства введения нуклеиновой кислоты в клетку in vitro, ex vivo или in vivo. Большое количество векторов, известных в данной области техники, может быть использовано для различных операций с нуклеиновыми кислотами, внедрения в гены элементов отклика, промоторов и т.п. К возможным векторам относятся, например, плазмиды или модифицированные вирусы, включая, например, производные фага лямбда или такие плазмиды, как производные плазмид pBR322 и pUC, или вектор Bluescript. Другим примером векторов, пригодных для использования согласно изобретению, является UltraVector™ Production System (Intrexon Corp., Blacksburg, VA), описанный в WO 2007/038276. Например, внедрение фрагментов ДНК, соответствующих элементам отклика и промоторам, в подходящий вектор может быть осуществлено дотированием соответствующих фрагментов ДНК в выбранный вектор, обладающий комплементарными «липкими» концами. В качестве альтернативы, концы молекул ДНК могут быть ферментативно модифицированы, или любой участок может быть модифицирован путем лигирования нуклеотидных последовательностей (линкеров) в терминальные участки ДНК. Такие векторы могут быть модифицированы таким образом, чтобы нести произвольные маркерные гены, обеспечивающие возможность селекции клеток, в геном которых введен маркер. Такие маркеры позволяют идентифицировать и/или отбирать клетки, инкорпорировавшие и вырабатывающие белки, кодируемые маркером.
[0092] Вирусные, а особенно ретровирусные векторы применяют в широком спектре процедур по внедрению генов в клетки, а также в живые животные организмы. Пригодные к применению вирусные векторы включают в себя (но не ограничиваются) ретровирусы, адено-ассоциированные вирусы, вирусы оспы, бакуловирусы, вирус осповакцины, вирусы герпеса, вирус Эпштейна-Барра, аденовирусы, геминивирусы и каулимовирусы. К невирусным векторам относятся плазмиды, липосомы, катионные липосомы (цитофектины), ДНК-белковые комплексы и биополимеры. Кроме нуклеиновой кислоты, вектор также может содержать один или несколько регуляторных участков и/или селектируемые маркеры, удобные для селекции, количественного анализа и мониторинга результатов перемещения нуклеиновых кислот (например, в какую ткань происходит перемещение, продолжительности экспрессии и т.п.).
[0093] Термин «плазмида» относится к экстрахромосомному элементу, часто несущему ген, не являющийся компонентом центрального метаболизма клетки, и обычно имеющему форму кольцевой двухцепочечной ДНК. Такие элементы могут являться автономно реплицирующимися последовательностями, интегрирующимися в геном последовательностями, фаговыми или нуклеотидными последовательностями, линейными, циркулярными или сверхспиральными, состоящими из одно- или двухцепочечной ДНК или РНК, имеющими любое происхождение последовательности в которые было внедрено несколько нуклеотидных последовательностей, таким образом, что они рекомбинированы в уникальные конструкции, способные к внедрению в клетку фрагмента промотора и последовательности ДНК определенного генного продукта вместе с соответствующей нетранслируемой 3' последовательностью.
[0094] Термин «клонирующий вектор» относится к «репликону», который является единицей измерения длины нуклеиновой кислоты, предпочтительно ДНК, который последовательно реплицируется и включает в себя кодирующую последовательность, такую, как плазмиду, фаг или космиду, к которой может быть присоединен другой участок нуклеиновой кислоты таким образом, чтобы обеспечить репликацию присоединенного участка. Клонирующие векторы могут быть способны к репликации в одном типе клеток и экспрессии в другом (челночный вектор). Клонирующие векторы могут содержать одну или более последовательностей, пригодных к использованию при селекции клеток, в которых присутствует данный вектор и/или один или множество сайтов клонирования для введения последовательностей, представляющих интерес.
[0095] Термин «экспрессионный вектор» относится к вектору, плазмиде или носителю, предназначенному для экспрессии внедренной последовательности нуклеиновой кислоты в хозяине после трансформации. Клонированный ген, т.е. внедренная последовательность нуклеиновой кислоты обычно ставится под контроль контролирующих элементов, таких как промотор, минимальный промотор, энхансер и т.п. Участки контроля инициации или промоторы, которые используются при запуске экспрессии нуклеиновой кислоты в заданной клетке-хозяине, существуют в больших количествах и известны специалистам в данной области. Практически любой промотор, способный запустить экспрессию этих генов, может быть использован как вектор экспрессии, включая (но, не ограничиваясь): вирусные промоторы, бактериальные промоторы, промоторы животных, промоторы млекопитающих, синтетические промоторы, конститутивные промоторы, тканеспецифические промоторы, связанные с заболеваниями или патогенезом промоторы, промоторы, связанные с индивидуальным развитием, индуцируемые промоторы, фоторегулируемые промоторы; CYC1, HIS3, GAL1, GAL4, GALl1O, ADH1, PGK, РН05, GAPDH, ADC1, TRP1, URA3, LEU2, ENO, TPI, промоторы щелочной фосфатазы (эффективные для применения в Saccharomyces); АОХ1 промоторы (эффективные для применения в Pichia); промоторы β-лактамазы, lac, ara, tet, trp, IPL, IPR, T7, tac, и trc (эффективные для применения в Escherichia coli); фоторегулируемые-, семяспецифичные-, специфичные к пыльнику, специфичные к завязи, вируса мозаики цветной капусты 35S, минимальные промоторы CMV 35S, промоторы вируса мозаики маниоки (CsVMV), промотор хлорофилл a/b-связывающего белка, промоторы рибулоза 1,5-бифосфат карбоксилазы, специфичные к вегетативным побегам, специфичные к корням, промоторы хитиназы, стрессовые, промоторы бацилловидного вируса риса tungo (rice tungro bacilliform), суперпромоторы растений, промоторы лейциновой аминопептидазы картофеля, промоторы нитрат-редуктазы, промоторы маннопин-синтазы, промоторы нопалин-синтазы, промоторы убиквитина, промоторы зеина и антоцианина (эффективные для применения в растительных клетках); промоторы животных и млекопитающих, известные в данной области техники, включающие в себя (но не ограниченные), участок раннего промотора SV40 (SV40e), промотор, содержащий на 3' конце длинный концевой повтор (LTR) вируса саркомы Роуза (RSV), промоторы Е1А или гены главных поздних промоторов (MLP) аденовирусов (Ad), ранние промоторы цитомегаловируса (CMV), промоторы тимидинкиназы (TK) вируса простого герпеса (HSV), IE1 промоторы бакуловируса, промоторы фактора элонгации 1-альфа(EF1), промоторы фосфоглицераткиназы(PGK), промоторы убиквитина (Ubc), промоторы альбумина, регуляторные последовательности и участки контроля транскрипции промотора металлотионеина-L мыши, убиквитарные промоторы (HPRT, виментина, α-актина, тубулина и т.п.), промоторы промежуточных филаментов (десмина, нейрофиламентов, кератина, GFAP и т.п.), промоторы клинически важных генов (MDR, CFTR или фактора VIII и т.п.); связанные с заболеваниями или патогенезом промоторы и промоторы, обладающие тканевой специфичностью и используемые в трансгенных животных, как, например, регуляторный участок гена эластазы I, который активен в ацинарных клетках поджелудочной железы; регуляторный участок гена инсулина, который активен в бета-клетках поджелудочной железы; регуляторный участок гена иммуноглобулина, который активен в лимфоидных клетках; регуляторный участок вируса опухолей молочной железы мышей, который активен в тестикулярных, лимфоидных, тучных клетках и клетках молочной железы; регуляторный участки Аро AI и Аро АII гена альбумина, которые активны в печени; регуляторный участки гена альфа-фетопротеина, активные в печени; регуляторные участки гена бета-глобина, активные в миелоидных клетках; регуляторный участки гена основного белка миелина, активные в олигодендроцитах мозга; регуляторные участки гена легкой цепи миозина 2, активные в скелетных мышцах; регуляторные участки гонадотропного рилизинг-гормона, активные в гипоталамусе; промоторы пируваткиназы, промоторы виллина; промоторы интестинальных белков, связывающих жирные кислоты; промоторы альфа-актина клеток гладких мышц, и т.п. Кроме того, указанные экспрессируемые последовательности могут быть модифицированы с помощью энхансеров, регуляторных последовательностей и т.п.
[0096] Векторы можно вводить в указанную клетку-хозяина способами, известными в данной области тхники, например: трансфекцией, электропорацией, микроинъекцией, трансдукцией, слиянием клеток, трансфекцией, опосредованной диэтиламиноэтил декстраном, преципитацией фосфатом кальция, липофекцией (слиянием с лизосомами), с помощью «генной пушки» или транспортного ДНК-вектора (см., например., Wu et al., J. Biol. Chem. 267:963 (1992); Wu et al., J. Biol. Chem. 265:14621 (1988); и Hartmut et al., Canadian Patent Application No. 2,012,311).
[0097] Согласно настоящему изобретению, полинуклеотид также можно вводить липофекцией in vivo. За последние десять лет, заметно увеличилось использование липосом для инкапсуляции и трансфекции нуклеиновых кислот in vitro. Синтетические катионные липиды, созданные для ограничения трудностей и угроз, связанных с опосредованной липосомами трансфекцией, можно использовать для получения липосом, и применения последних для in vivo трансфекции генов, кодирующих маркеры. (Feigner et al., Proc. Natl. Acad. Sd. USA. 84:7413 (1987); Mackey et al., Proc. Natl. Acad. Sd. USA [0098] Для облегчения трансфекции нуклеиновых кислот in vivo можно также применять другие молекулы, например, катионные олигопептиды (например, WO 95/21931), пептиды-производные от ДНК-связывающих белков (например, WO 96/25508) или катионные полимеры (например, WO 95/21931). [0099] Также можно ввести вектор in vivo в форме «голой» ДНК-плазмиды (см. патенты США №5,693,622, 5,589,466 и 5,580,859). Кроме того, можно быть применены методы рецептор-опосредованной доставки ДНК (Curiel et al., Hum. Gene Ther. 5:147 (1992); и Wu et al., J. Biol. Chem. 262:4429(1987)). [0100] Термин «трансфекция» относится к поглощению экзогенной или гетерологичной РНК или ДНК клеткой. Клетка оказывается «трансфецированной» экзогенной или гетерологичной РНК или ДНК, когда такая РНК или ДНК проникает в клетку. Клетка считается «трансформированной» экзогенной или гетерологичной РНК или ДНК, когда трансфицированная РНК или ДНК вызывает изменение фенотипа. Трансформирующая РНК или ДНК может быть интегрирована (ковалентно связана) в хромосомную ДНК, меняя геном клетки. [0101] Термин «трансформация» относится к доставке фрагмента нуклеиновой кислоты в геном организма-хозяина, приводящей к генетически стойкому наследованию. Организмы-хозяева, содержащие трансформированные фрагменты нуклеиновых кислот, обозначаются как «трансгенные», или «рекомбинированные», или «трансформированные» организмы. [0102] Кроме того, рекомбинантный вектор, содержащий полинуклеотид согласно настоящему изобретению, может включать в себя одну или более точек инициации репликации в клеточных хозяевах, в которых будет выявляться амплификация или экспрессия данного вектора, маркеров или селектируемых маркеров. [0103] Термин «селектируемый маркер» относится к идентифицирующему фактору, обычно, антибиотику или гену химической устойчивости (резистентности), который можно выбрать соответственно эффекту гена-маркера, т.е., устойчивость к антибиотику, устойчивость к гербициду, колориметрические маркеры, ферменты, флуоресцентные маркеры и т.п., где эффект применяется для прослеживания наследования представляющей интерес нуклеиновой кислоты и/или для идентификации клетки или организма, унаследовавших эту нуклеиновую кислоту. Примеры селектируемых маркеров, известных и применяемых в данной области техники, включают в себя: гены устойчивости к ампициллину, стрептомицину, гентамицину, канамицину, гигромицину, гербициду биалафосу, сульфонамиду и т.п.; а также гены, применяемые как фенотипические маркеры, т.е. регуляторные гены антоцианина, ген изопентанил трансферазы и т.п. [0104] Термин «репортерный ген» относится к нуклеиновой кислоте, кодирующей идентифицирующий фактор, который можно выявить, основываясь на эффекте репортерного гена, где эффект используется для прослеживания наследования представляющей интерес нуклеиновой кислоты, и/или для идентификации клетки или организма, унаследовавших эту нуклеиновую кислоту, и/или для количественной оценки активации экспрессии гена или транскрипции. Примеры репортерных генов, известных и применяемых в данной области техники, включают в себя: люциферазу (Luc), зеленый флуоресцентный белок (GFP), хлорамфеникол ацетилтрансферазу (CAT), β-галактозидазу (LacZ), β-глюкуронидазу (Gus) и т.п. Гены селектируемых маркеров также можно отнести к репортерным генам. [0105] Термины «промотор» и «промоторная последовательность» взаимозаменимы и относятся к последовательности ДНК, способной контролировать экспрессию кодирующей последовательности или экспрессию функциональной РНК. Обычно кодирующая последовательность находиться в направлении 3' от промоторной последовательности. Промоторы, могут происходить от нативного гена или состоять из различных элементов, происходящих от различных промоторов, существующих в природе, и даже содержать сегменты синтетической ДНК. Специалисты в данной области понимают, что разные промоторы могут управлять экспрессией гена в разных тканях и типах клеток, либо на разных стадиях развития, либо при различных внешних или физиологических условиях. Промоторы, запускающие экспрессию гена в большинстве типов клеток и в большинстве случаев, обычно называются «конститутивными промоторами». Промоторы, запускающие экспрессию гена в специфических типах клеток, обычно называются «клеточно-специфичными промоторами» или «ткань-специфичными промоторами». Промоторы, запускающие экспрессию гена на определенной стадии развития или дифференцировки клетки, обычно называют «промоторы, специфичные к стадии развития» или «промоторы, специфичные к стадии дифференцировки клетки». Промоторы, индуцируемые и запускающие экспрессию гена после воздействия или обработки клетки агентом, биологической молекулой, химическим веществом, лигандом, светом или другим подобным фактором, индуцирующим промотор, обычно называются «индуцируемыми промоторами» или «регулируемыми промоторами». Кроме того, общепризнано, что поскольку в большинстве случаев точные границы регуляторных последовательностей не определены полностью, фрагменты ДНК различной длины могут обладать одинаковой промоторной активностью. [0106] Как правило, промоторная последовательность со своего 3' конца граничит с точкой инициации транскрипции и расположена по ходу транскрипции (в направлении 5') с тем, чтобы включать в себя минимальное количество оснований или элементов, необходимых для инициации транскрипции на уровне общего фона. В состав промотора входит точка инициации транскрипции (легко определимая, например, картированием нуклеазой S1), а также белок-связывающие домены (консенсусные последовательности), обеспечивающие присоединение РНК полимеразы. [0107] Кодирующая последовательность находится «под контролем» последовательностей, регулирующих транскрипцию и трансляцию в клетке, когда РНК полимераза транскрибирует кодирующую последовательность в иРНК, которая затем транс-сплайсируется (если в кодирующей последовательности есть интроны) и транслируется с получением белка, кодируемого кодирующей последовательностью. [0108] Термин «последовательности, регулирующие транскрипцию и трансляцию», относится к регуляторным последовательностям ДНК, таким как промоторы, энхансеры, терминаторы и т.п., обеспечивающим экспрессию кодирующей последовательности в клетке. В эукариотических клетках, сигналы полиаденилирования являются регуляторными последовательностями. [0109] Термин «элемент отклика» (элемент ответа, response element, RE) относится к одному или более действующему в цис-положении элементу ДНК, придающему промотору способность к реагированию через взаимодействие с ДНК-связывающими доменами транскрипционного фактора. Последовательность такового элемента ДНК может быть либо палиндромом (точным или неточным), либо состоящей из мотивов последовательностей, либо из половинных сайтов, разделенных различным количеством нуклеотидов. Половинные сайты могут быть схожими или идентичными, располагаться в виде прямых либо обратных повторов, в виде единичного полусайта либо в виде мультимеров прилегающих последовательных половинных сайтов. Элемент отклика может содержать минимальный промотор, полученный от различных организмов, в зависимости от природы клетки или организма, в который данный элемент отклика будет введен. ДНК-связывающий домен транскрипционного фактора присоединяется, в присутствии лиганда или без оного, к последовательности ДНК элемента отклика с тем, чтобы инициировать или подавлять транскрипцию гена(ов), расположенных по ходу транскрипции, под регуляцией этого элемента отклика. Примеры последовательностей ДНК элементов отклика природного рецептора экдизона включают в себя: RRGG/TTCANTGAC/ACYY (SEQ ID NO: 9) (см. Cherbas et. Al., Genes Dev. 5:120 (1991)); AGGTCAN(n)AGGTCA, где N(n) может быть одним или несколькими разделяющими нуклеотидами (SEQ K) NO: 10) (см. D'Avino et al., MoI. Cell. Endocrinol. 113:1 (1995)); and GGGTTGAATGAATTT (SEQ ID NO: 11) (см. Antoniewski et al., MoI. Cell Biol. 14:4465 (1994)). [0110] Термин «функционально связанный» относится к присоединению последовательностей нуклеиновых кислот к единичному фрагменту нуклеиновой кислоты таким образом, что функция одного элемента находится под влиянием другого. Например, промотор функционально связан с кодирующей последовательностью, когда он способен влиять на экспрессию этой кодирующей последовательности (т.е. кодирующая последовательность находится под транскрипционным контролем промотора). Кодирующие последовательности могут быть функционально связаны с регуляторными последовательностями в смысловой или антисмысловой ориентации. [0111] Термин «экспрессия» в настоящем описании относится к транскрипции и стойком накоплении смысловой РНК (иРНК) или антисмысловой РНК, синтезированной из нуклеиновой кислоты или полинуклеотида. Экспрессия также может относиться к трансляции иРНК с получением белка или полипептида. [0112] Термины «кассета», «экспрессионная кассета», «генная экспрессионная кассета» относятся к сегменту ДНК, который может быть вставлен в нуклеиновую кислоту или полинуклеотид в специфических сайтах рестрикции или путем гомологичной рекомбинации. Сегмент ДНК содержит полинуклеотид, который кодирует представляющий интерес полипептид, причем кассета и сайты рестрикции спланированы таким образом, чтобы гарантировать вставку кассеты в надлежащую рамку считывания для транскрипции и трансляции. «Кассета трансформации» относится к специфическому вектору, содержащему полинуклеотид, который кодирует представляющий интерес полипептид, и элементы помимо этого полинуклеотида, облегчающие трансформацию в определенной клетке-хозяине. Кассеты, экспрессионные кассеты, генные экспрессионные кассеты и кассеты трансформации согласно определению могут также содержать элементы, позволяющие осуществление повышенной экспрессии в клетке-хозяине полинуклеотида, который кодирует представляющий интерес полипептид. К таким элементам могут относиться (но не ограничивают): промотор, минимальный промотор, энхансер, элемент отклика, терминаторная последовательность, последовательность полиаденилирования и т.п. [0113] Согласно настоящему изобретению, термин «переключатель гена» относится к комбинации элемента отклика, связанного с промотором, и системы на основе лиганд-зависимого транскрипционного фактора, которая в присутствии одного или нескольких лигандов модулирует экспрессию гена, в который внедрены указанный элемент отклика и промотор. Термин «полинуклеотид, кодирующий переключатель гена», относится к комбинации элемента отклика, связанного с промотором, и системы лиганд-зависимого транскрипционного фактора, которая, в присутствии одного или нескольких лигандов, модулирует экспрессию гена, в который внедрены указанные элемент отклика и промотор. [0114] Термин «на базе рецептора экдизона», в отношении переключателя гена, относится к переключателю гена, содержащему, как минимум, функциональную часть лиганд-связывающего домена природного или синтетического рецептора экдизона, и регулирующему генную экспрессию в ответ на присоединение лиганда к лиганд-связывающему домену рецептора экдизона. Примеры экдизонреактивных (экдизонзависимых) систем описаны в Патентах США №7,091,038 и 6,258,603. Согласно одному из вариантов реализации, системой является RheoSwitch® Therapeutic System (RTS), в которую входят два рекомбинантных белка, домены DEF мутированных рецепторов экдизона (EcR), связанные с ДНК-связывающим доменом Gal4, и домены EF химерного RXR, связанные с доменом активации транскрипции VP 16, экспрессируемые под контролем конститутивного промотора, как иллюстрировано на Фигуре 1. [0115] Термины «модулировать» и «модулирует» относятся к стимуляции, снижению или подавлению экспрессии нуклеиновой кислоты или гена, приводящей к соответствующей стимуляции, снижению или подавлению выработки белка или полипептида. [0116] Полинуклеотиды или векторы согласно настоящему изобретению могут также содержать по меньшей мере один промотор, подходящий для управления экспрессией гена в клетке-хозяине. [0117] Энхансеры, которые можно использовать согласно вариантам реализации настоящего изобретения, включают в себя (но не ограничиваются): энхансер SV40, энхансер цитомегаловируса (CMV), энхансер фактора элонгации 1 (EF1), энхансер дрожжей, энхансеры вирусных генов и т.п. [0118] Участки, контролирующие терминацию, т.е. терминаторные или полиаденилирующие последовательности, могут также быть получены из различных генов, нативных для выбранных хозяев. При желании, терминальный участок можно исключить, однако его наличие является предпочтительным. Согласно одному из вариантов реализации, участок, контролирующий терминацию, может содержать или быть получен из синтетической последовательности, синтетического сигнала полиаденилирования, позднего сигнала полиаденилирования SV40, сигнала полиаденилирования SV40, сигнала полиаденилирования коровьего гормона роста (BGH), вирусных терминаторных последовательностей и т.п. [0119] Термины «3' некодирующая последовательность» или «3' нетранслируемый участок» (UTR) относятся к последовательностям ДНК, расположенным по ходу транскрипции (3') от кодирующей последовательности, и которые могут содержать последовательности распознавания полиаденилирования [poly(A)] и другие последовательности, кодирующие регуляторные сигналы, способные влиять на процессинг иРНК или экспрессию генов. Сигнал полиаденилирования обычно характеризуется влиянием на присоединение цепочек поли(А)к 3' концу предшественника иРНК. [0120] Термин «регуляторный участок» относится к последовательности нуклеиновой кислоты, регулирующей экспрессию последовательности второй (другой) нуклеиновой кислоты. Регуляторный участок может содержать последовательности, естественно отвечающие за экспрессию определенной нуклеиновой кислоты (гомологичный участок), либо последовательности иного происхождения, отвечающие за экспрессию других белков или даже синтетических белков (гетерологичный участок). В частности, такие последовательности могут быть последовательностями прокариотических, эукариотических или вирусных генов, либо их производными, стимулирующими или подавляющими транскрипцию гена специфично или неспецифично, индуцируемым или неиндуцируемым образом. К регуляторный участкам относятся точки начала репликации, сплайсинг-сайты РНК, промоторы, энхансеры, последовательности терминации транскрипции и сигнальные последовательности, направляющие полипептид по секреторным путям к целевой клетке. [0121] Регуляторный участок, взятый из «гетерологичного участка», относится к регуляторному участку, естественно не связанному с экспрессируемой нуклеиновой кислотой. К гетерологичным регуляторным участкам относятся регуляторные участки других видов, других генов, гибридные регуляторные последовательности и регуляторные последовательности, которые не существуют в природе, но которые может разработать рядовой специалист в данной области. [0122] Термин «РНК-транскрипт» относится к продукту, полученному в результате транскрипции последовательности ДНК, катализированной РНК-полимеразой. Если РНК-транскрипт является точной комплементарной копией последовательности ДНК, его называют первичным транскриптом. Также это может быть последовательность РНК, полученная в результате пост-транскрипционного процессинга первичного транскрипта, называемая зрелой РНК. Термин «информационная РНК (иРНК)» относится к РНК, не содержащей интронов и которая может быть транслирована клеткой с получением белка. Термин «кДНК» относится к двухцепочечной ДНК, комплементарной и полученной из иРНК. Термин «смысловая РНК» относится к РНК-транскрипту, содержащему иРНК и, таким образом, который может быть транслированным в белок клеткой. Термин «антисмысловая РНК» относится к РНК-транскрипту, комплементарному всему первичному транскрипту-мишени или его части, либо комплементарному иРНК, и блокирующему экспрессию гена-мишени. Комплементарность антисмысловой РНК может выражаться по отношению к любой части специфического транскрипта гена, т.е., в районе 5' некодирующей последовательности, 3' некодирующей последовательности или в области кодирующей последовательности. Термин «функциональная РНК» относится к антисмысловой РНК, рибозимной РНК или другой РНК, которая не транслируется, но оказывает эффект на клеточные процессы. [0123] Термины «полипептид», «пептид» и «белок» взаимозаменяемы и относятся к полимерному соединению, состоящему из ковалентно связанных остатков аминокислот. [0124] Термины «изолированный/выделенный полипептид», «изолированный/выделенный пептид» или «изолированный/выделенный белок» относятся к полипептиду или белку, практически свободному от соединений, обычно ассоциированных с ним в его естественной форме (например, другие белки или полипептиды, нуклеиновые кислоты, углеводы, липиды). Термин «Изолированный/выделенный» не означает исключение искусственных или синтетических смесей с другими веществами, либо наличие примесей, не влияющих на биологическую активность, каковые могут присутствовать вследствие, например, неполной очистки, добавления стабилизирующих веществ, либо превращения в фармацевтически приемлемую композицию. [0125] Термины «замещенный мутантный полипептид», «замещенный мутант» относятся к мутантному полипептиду, содержащему замену, по меньшей мере одной аминокислоты дикого типа или природной аминокислоты, аминокислотой, отличающейся от присутствующей в полипептиде дикого типа или природном полипептиде. Замещенный мутантный полипептид может содержать лишь одну замену аминокислоты дикого типа или природной аминокислоты и может называться полипептидом с «точечной мутацией» или «единичной точечной мутацией». В другом случае, в замещенном мутантном полипептиде может оказаться две или более замены аминокислот дикого типа или природных аминокислот, аминокислотами, отличающимся от присутствующих в полипептиде дикого типа или природном полипептиде. Согласно изобретению, полипептид лиганд-связывающего домена ядерного рецептора Группы Н, в котором наличествует мутация замены, содержит замену, по меньшей мере одной аминокислоты дикого типа или природной аминокислоты, аминокислотой, отличающейся от присутствующей в полипептиде дикого типа или природном полипептиде лиганд-связывающего домена ядерного рецептора Группы Н. [0126] Когда в замещенном мутантном полипептиде происходит замена двух или более аминокислот дикого типа или природных аминокислот, эта замена может подразумевать, либо эквивалентную делецию аминокислот дикого типа или природных аминокислот в процессе замены, т.е., 2 аминокислоты дикого типа или природной аминокислоты замещаются 2 отличными от дикого типа аминокислотами, или не встречающимися в природе аминокислотами, либо в процессе замены произошла делеция неэквивалентного числа аминокислот, т.е., произошла замена 2-х аминокислот дикого типа на 1 аминокислоту не дикого типа (мутация замещения+делеции), или 2 аминокислоты дикого типа заменили на 3 аминокислоты не дикого типа (мутация замены+вставки). [0127] Замещенные мутанты можно описать с помощью системы сокращенной номенклатуры для обозначения аминокислотного остатка и его позиции при замещении, в соответствии с эталонной полипептидной последовательностью, и указания заменившей новой аминокислоты. Например, замещенный мутант, в котором произошла замена 20-го аминокислотного остатка полипептидной цепи, может быть обозначен как «x20z», где «х» - это заменяемая аминокислота, 20 - это позиция или порядковый номер аминокислотного остатка в полипептиде, a «z» - это новая, заменившая старую аминокислота. Поэтому замещенный мутант, взаимозаменяемо обозначаемый как «Е20А» или «Glu20Ala», подразумевает, что мутант содержит остаток аланина (обычно обозначаемый в данной области техники как "А" или "Ala") вместо глутаминовой кислоты (обычно обозначаемой в данной области техники как "Е" или "GIu") на 20-й позиции полипептида. [0128] Мутация замены может быть осуществлена любым способом мутагенеза, известным в данной области, включая (но не ограничиваясь) сайт-направленный мутагенез in vitro (Hutchinson et al., J. Biol. Chem. 255:6551 (1978); Zoller et al., ДНК 5:479 (1984); Oliphant et al., Gene 44:117 (1986); Hutchinson et al., Proc. Natl. Acad. Sci USA 83:710 (1986)), использование линкеров TAB® (Pharmacia), расщепление рестриктивной эндонуклеазой/расщепление фрагмента и замещение, ПЦР-опосредованный/сайт-направленный мутагенез и т.п. Основанные на ПЦР методы предпочтительны при сайт-направленном мутагенезе (см. Higuchi, 1989, "Using PCR to Engineer ДНК", in PCR Technology: Principles and Applications for ДНК Amplification, H. Erlich, ed., Stockton Press, Chapter 6, pp. 61-70). [0129] Термин «фрагмент», применяемый к полипептиду, относится к полипептиду, аминокислотная последовательность которого короче таковой эталонного полипептида, и который содержит, на всем своем протяжении, аминокислотную последовательность, идентичную таковой эталонного полипептида. Такие фрагменты могут, если целесообразно, входить в состав большего полипептида, частью которого они являются. Фрагменты такого рода, согласно изобретению, могут состоять по меньшей мере из 2, 3, 4, 5, 6, 8, 10, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 25, 26, 30, 35, 40, 45, 50, 100, 200, 240 или 300 или более аминокислот. [0130] Термин «вариант» по отношению к полипептиду или белку относится к любому аналогу, фрагменту, производному или мутанту, полученному из полипептида или белка, сохранившему, по меньшей мере биологические особенности полипептида или белка. В природе могут существовать разные варианты полипептидов и белков. Эти варианты могут быть аллельными вариациями, характеризующимися различиями в нуклеотидной последовательности структурного гена, кодирующего белок, любо могут появиться в результате дифференциального сплайсинга или пост-трансляционной модификации. Опытный специалист может создать различные варианты, характеризующиеся единичными или множественными аминокислотными заменами, делециями, вставками или переносами. Среди всех прочих, эти варианты могут включать в себя: (а) варианты, где одна или несколько аминокислот замещаются консервативными (обычно встречающимися в белках) или неконсервативными аминокислотами, (b) варианты, где одна или несколько аминокислот вставляются в полипептид или белок, (с) варианты, где одна или несколько аминокислот содержат замещенную химическую группу, и (d) варианты, где полипептид или белок связывается с другим полипептидом, таким как сывороточный альбумин. Способы получения таких вариантов, включая генетические (супрессии, делеции, мутации и т.д.), химические и ферментативные способы, известны рядовым специалистам в данной области техники. Согласно одному из вариантов реализации, вариант полипептида состоит, по меньшей мере из приблизительно 14 аминокислот. [0131] Термин «гомология» относится к проценту идентичности между фрагментами двух полинуклеотидов или полипептидов. Соответствие между последовательностями может быть выявлено способами, известными в данной области техники. Например, гомология может быть установлена прямым сравнением информации о последовательностях двух полипептидных молекул путем сопоставления информации о последовательностях и применения легкодоступных компьютерных программ. В качестве альтернативы, гомология может быть установлена гибридизацией полинуклеотидов в условиях, когда гомологичные области формируют стабильные дуплексы (пары), и последующим расщеплением специфичной к одноцепочечным участкам нуклеазой(ами) и определением размера расщепленных фрагментов. [0132] В данном описании термин «гомологичный» во всех его грамматических формах и фонетических вариантах относится к связи между белками, имеющими «общее эволюционное происхождение», включая белки из суперсемейств (например, суперсемейство иммуноглобулинов) и гомологичные белки разных видов (например, легкая цепь миозина и т.п.) (Reeck et al., Cell 50:667 (1987)). Такие белки (и кодирующие их гены) обладают гомологичностью последовательностей, как показывает высокая степень сходства их последовательностей. Тем не менее в повсеместном использовании и применении, термин «гомологичный», при модификации его наречием «высоко», может относиться к сходству последовательностей, а не к общему эволюционному происхождению. [0133] В соответствии с этим, термин «сходство последовательностей» во всех его грамматических формах относится к степени идентичности или соответствия между последовательностями нуклеиновых кислот или аминокислот белков, которые могут иметь или не иметь общее эволюционное происхождение, (см. Reeck et al., Cell 50:667 (1987)). Согласно одному из вариантов реализации, две последовательности ДНК «существенно гомологичны» или «существенно схожи», когда, по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 75%, 90%, или 95%) нуклеотидов совпадают на протяжении определенной длины последовательностей ДНК. Существенно гомологичные последовательности могут быть выявлены путем сравнения последовательностей с применением стандартного программного обеспечения и доступа к базам данных последовательностей, либо с применением процедуры гибридизации по Саузерну в строгих условиях, задаваемых для каждой отдельной системы. Установка соответствующих условий гибридизации входит в данную область техники (см. например, Sambrook et al., 1989, supra). [0134] В настоящем описании, термин «существенно схожи» относится к фрагментам нуклеиновых кислот, где изменения в одном или нескольких основаниях нуклеотида приводят к замене одной или нескольких аминокислот, что, однако не влияет на функциональные особенности белка, кодируемого последовательностью ДНК. Термин «существенно схожи» также относится к фрагментам нуклеиновых кислот, где изменения в одном или нескольких основаниях нуклеотида не влияют на способность фрагмента нуклеиновой кислоты опосредовать изменения экспрессии гена антисмысловыми или ко-супрессионными технологиями. Термин «существенно схожи» также относится к модификациям фрагментов нуклеиновых кислот согласно изобретению, таким как делеции или вставки одной или нескольких оснований нуклеотида, не оказывающим существенного влияния на функциональные особенности полученного транскрипта. Поэтому очевидно, что изобретение охватывает не только специфические типовые последовательности. Каждая из представленных модификаций относится к обычным приемам в данной области знания, так же, как и оценка сохранения биологической активности кодируемых продуктов. [0135] Кроме того, опытный специалист учтет, что существенно схожие последовательности, охваченные настоящим изобретением, также характеризуются способностью гибридизироваться в строгих условиях (0.1Х SSC, 0.1% SDS, 65°С, с промыванием 2Х SSC, 0.1% SDS, а затем 0.1 X SSC, 0.1% SDS), с последовательностями, приведенными в примерах в настоящем описании. Существенно схожие фрагменты нуклеиновых кислот согласно настоящему изобретению - это такие фрагменты нуклеиновых кислот, последовательности ДНК которых, по меньшей мере приблизительно на 70%, 80%, 90% или 95% идентичны последовательностям ДНК фрагментов нуклеиновых кислот, указанных в настоящем описании. [0136] Две аминокислотные последовательности являются «существенно гомологичными» или «существенно схожими», когда более чем 40% аминокислот идентичны, либо более, чем 60% аминокислот схожи (функционально идентичны). Предпочтительно, схожие или гомологичные последовательности выявляются сопоставлением, с применением, например, программы наложения и выравнивания GCG (Genetics Computer Group, Program Manual for the GCG Package, Version 7, Madison, Wisconsin). [0137] Термин «соответствующие» в данном описании относится к схожим или гомологичным последовательностям, вне зависимости от того, совпадает ли их точная позиция в молекулах, схожесть или гомологичность которых оценивается. При выравнивании последовательности аминокислот или нуклеиновых кислот между сравниваемыми последовательностями возможны промежутки (пробелы). Таким образом, термин «соответствующий» относится к схожести последовательностей, но не порядковому номеру остатков аминокислот или оснований нуклеотида. [0138] «Существенная часть» аминокислотной или полинуклеотидной последовательности содержит достаточное количество аминокислот полипептида или нуклеотидов гена для предполагаемой идентификации этого полипептида или гена, либо неавтоматизированной оценки последовательности специалистом в данной области техники, либо компьютеризированным автоматизированным сравнением и идентификацией последовательностей с помощью таких алгоритмов, как BLAST (Basic Local Alignment Search Tool; Altschul et al., J. Mol. Biol. 215:403 (1993)); доступен у ncbi.nhn.nih.gov/BLAST/). Обычно последовательность, состоящая из 10 или более смежных аминокислот или тридцати или более смежных нуклеотидов необходима для ориентировочной идентификации полипептида или нуклеиновой кислоты как гомологичной известному полипептиду или гену. Более того, касательно нуклеотидных последовательностей, ген-специфичные зонды, содержащие 20-30 последовательно расположенных нуклеотидов, могут быть применены в зависимых от последовательности способах идентификации (например, гибридизация по Саузерну) и изоляции генов (например, in situ гибридизация бактериальных колоний или бляшек бактериофагов). Затем, небольшие олигонуклеотиды длиной в 12-15 оснований могут быть использованы в качестве амплификационных праймеров в ПЦР для получения определенного фрагмента нуклеиновой кислоты, содержащего праймеры. В соответствии с этим, «существенная часть» нуклеотидной цепочки содержит достаточную долю последовательности для специфичной идентификации и/или изоляции фрагмента нуклеиновой кислоты, содержащего эту последовательность. [0139] Термин «процент идентичности», известный в данной области техники, относится к соответствию двух или более полипептидных последовательностей, либо двух или более полинуклеотидных последовательностей, определенному сравнением последовательностей. В данной области, «идентичность» также подразумевает степень сродства полипептидных или полинуклеотидных последовательностей, определяемая совпадениями в цепочках этих последовательностей. «Идентичность» и «схожесть» может легко быть определена известными способами, включающими в себя (но не ограниченными) таковые, описанные в: Computational Molecular Biology (Lesk, A.M., ed.) Oxford University Press, New York (1988); Biocomputing: Informatics and Genome Projects (Smith, D. W., ed.) Academic Press, New York (1993); Computer Analysis of Sequence Data, Part I (Griffin, A. M., and Griffin, H. G., eds.) Humana Press, New Jersey (1994); Sequence Analysis in Molecular Biology (von Heinje, G., ed.) Academic Press (1987); and Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.) Stockton Press, New York (1991). Выбранные методы определения идентичности разработаны для получения наибольшего количества совпадений в исследуемых последовательностях. Способы определения идентичности и схожести кодированы в публично доступных компьютерных программах. Выравнивания и вычисления процента идентичности могут быть осуществлены с применением программного обеспечения для анализа последовательности, такого, как программа Megalign пакета LASERGENE bioinformatics computing suite (DNASTAR Inc., Madison, WI). Множественные выравнивания последовательностей могут быть осуществлены применением метода выравнивания «Clustal» (Higgins et al., CABIOS. 5:151 (1989)) с параметрами по умолчанию: (GAP PENALTY=IO, GAP LENGTH PENALTY=IO). По умолчанию параметры для попарного выравнивания с применением метода Clustal могут быть выбраны следующими: KTUPLE 1, GAP PENALTY=3, WIND0W=5 и DIAGONALS SAVED=5. [0140] Термин «программное обеспечение для анализа последовательности» относится к любого рода компьютерным алгоритмам и программам, применяемым для анализа последовательностей аминокислот и нуклеотидов. «Программное обеспечение для анализа последовательности» может быть коммерчески доступным или независимо разработанным. Типичное программное обеспечение для анализа последовательности включает в себя (но не ограничивается) пакетом the GCG suite of programs (Wisconsin Package Version 9.0, Genetics Computer Group (GCG), Madison, WI), BLASTP, BLASTN, BLASTX (Altschul et al., J. MoI. Biol. 215:403 (1990)), и DNASTAR (DNASTAR, Inc. 1228 S. Park St. Madison, WI 53715 USA). В контексте настоящего приложения, подразумевается, что в процессе исследования, когда применяется программное обеспечение для анализа последовательности, результаты анализа будут опираться на «значения по умолчанию» указанной программы, если не оговорено иначе. В настоящем описании, «значения по умолчанию» подразумевают любого рода совокупность значений или параметров, изначально загруженных вместе с программным обеспечением при первой инициализации (инсталляции). [0141] «Химически синтезированный» в отношении последовательностей ДНК означает, что составляющие нуклеотиды полимеризуются in vitro. Неавтоматизированный химический синтез ДНК может быть осуществлен применением надежных процедур, а автоматизированный химический синтез осуществляется с помощью одной из многих коммерчески доступных машин. В соответствии с этим, гены могут быть синтезированы с тем, чтобы экспрессия генов была оптимальной, благодаря оптимизации последовательности нуклеотидов для отражения погрешностей в кодонах клетки-хозяина. Опытные специалисты оценят высокую вероятность удачной экспрессии генов, в случае если подборка кодонов обеспечивает кодоны, благоприятные для хозяина. Определение предпочитаемых кодонов может быть основано на исследовании генов, экспрессируемых клеткой-хозяином, когда информация о последовательностях доступна. [0142] В настоящем описании, две или более индивидуально функционирующие системы регуляции генов обозначаются «ортогональными», когда а) в результате модуляции каждой из данных систем соответствующим лигандом в выбранной концентрации выявляется ощутимое изменение в величине экспрессии гена этой системы и b) изменение статистически значительно отличается от изменений в экспрессии всех других систем, одновременно функционирующих в клетке, ткани или организме, вне зависимости от спонтанности или последовательности данной модуляции. Предпочтительно, модуляция каждой индивидуально функционирующей системы регуляции генов вызывает изменение в экспрессии генов по меньшей мере вдвое превосходящее таковое для всех остальных функционирующих систем в клетке, ткани или организме, например, пятикратное, десятикратное, стократное или пятисоткратное. В идеале, модуляция каждой из данных систем соответствующим лигандом в выбранной концентрации приведет к значительному изменению в величине экспрессии гена этой системы, без значительного (измеримого) изменения в экспрессии всех остальных систем, функционирующих в клетке, ткани или организме. В таком случае, множественно индуцируемая система регуляции гена называется «полностью ортогональной». Применяемые ортогональные лиганды и ортогональные рецептор-опосредованные системы регуляции генов описаны в патенте США 2002/0110861 А. [0143] Термин «экзогенный ген» относится к гену, чужеродному по отношению к организму, другими словами, гену, введенному в организм путем процесса трансформации, либо не мутированной версии мутированного эндогенного гена, либо мутированной версии не мутированного эндогенного гена. Способ трансформации не является критичным относительно настоящего изобретения и может быть любым способом, применимым к субъекту и известным специалистам в данной области. Экзогенные гены могут быть природными или синтетическими, вводимыми в организм в форме ДНК или РНК, которая может функционировать посредством ДНК с помощью обратной транскриптазы. Такие гены можно вводить в клетки-мишени, вводить в организм напрямую, либо вводить не напрямую, посредством введения трансформированных клеток в организм. [0144] Термин «терапевтический продукт» относится к лечебному полипептиду или лечебному полинуклеотиду, оказывающему благотворный эффект по отношению к клетке-хозяину, в которой данный продукт экспрессируется. К лечебным полипептидам могут относиться, без каких-либо ограничений, пептиды малого размера, состоящие даже из трех аминокислот, одно- или многоцепочечные белки и рекомбинантные белки. К лечебным полинуклеотидам могут относиться, без каких-либо ограничений, антисмысловые олигонуклеотиды, малые интерферирующие РНК, рибозимы и внешние вспомогательные последовательности РНК. Терапевтический продукт может содержать последовательность, существующую в природе, синтетическую последовательность или комбинацию встречающихся в природе и синтетических последовательностей. [0145] Термин «комплекс рецептора экдизона» обычно относится к гетеродимерному белковому комплексу, состоящему из по меньшей мере двух членов семейства ядерных рецепторов: рецептора экдизона ("EcR") и белков Ultraspiracle ("USP") (см. Yao et al., Nature 366Λ16 (1993)); Yao et al., Cell 71:63 (1992)). Функциональный комплекс EcR может также содержать добавочный белок(ки), такие как иммунофилины. Другие, вспомогательные члены белкового семейства ядерных рецепторов, известные как транскрипционные факторы (например, DHR38, betaFTZ-1 или другие гомологи насекомых), могут также служить лиганд-зависимыми или лиганд-независимыми партнерами EcR и/или USP. Комплекс EcR может также являться гетеродимером белка EcR и аналога белка Ultraspiracle позвоночных, ретиноидного Х-рецептора ("RXR") или химерной комбинацией USP и RXR. Термин комплекс EcR также охватывает гомодимерные комплексы белка EcR или USP. [0146] Комплекс EcR может быть активирован активным экдистероидным или нестероидным лигандом, связывающимся с одним из белков комплекса, включающим EcR, но не исключающим другие белки комплекса. В данной заявке, термин «лиганд», примененный к основанным на EcR генным переключателям, описывает небольшие и растворимые молекулы, обладающие способностью активировать переключатель гена со стимуляцией экспрессии полипептида, кодируемого зависимым геном. Примеры лигандов включают в себя, без каких-либо ограничений, экдистероид, как, например, экдизон, 20-гидроксиэкдизон, понастерон А, муристерон А и т.п., 9-цис-ретиноидную кислоту, синтетические аналоги ретиноидной кислоты, N,N'-диацилгидразины, описанные в патентах США №6,013,836; 5,117,057; 5,530,028; и 5,378,726 и публикации заявки США №2005/0209283 и 2006/0020146; оксадиазолины, описанные в публикации заявки США №№2004/0171651; дибензилалкил циангидразины, подобные описанным в Европейской заявке №461,809; N-алкил-N,N'-диароилгидразины, подобные описанным в патенте США №5,225,443; N-ацил-N-алкилкарбонилгидразины, подобные описанным в Европейской заявке №234,994; N-ароил-N-алкил-N'-ароилгидразины, подобные описанным в патенте США №4,985,461; амидокетоны, подобные описанным в публикации заявки США №2004/0049037; и другие подобные материалы, включающие в себя 3,5-ди-трет-бутил-4-гидрокси-N-изобутил-бензамид, 8-О-ацетилгарпагид, оксистеролы, 22(R) гидроксихолестерин, 24(S) гидроксихолестерин, 25-эпоксихолестерин, Т0901317, 5-альфа-6-альфа-эпоксихолестерин-3-сульфат (ECHS), 7-кетохолестерин-3-сульфат, фарнезол, желчные кислоты, сложные эфиры 1,1-бифосфоната, ювенильный гормон III и т.п. Примеры лигандов диацилгидразина, применимых в изобретении, включают в себя RG-115819 (N-(1-этил-2,2-диметил-пропил)-N'-(2-метил-3-метокси-бензоил)- гидразид 3,5-диметил-бензойной кислоты), RG-115932 (N-(1-трет-бутил-бутил)-N'-(2-этил-3-метокси-бензоил)-гидразид ((R)-3,5-диметил-бензойной кислоты) и RG-115830 (N-(1-трет-бутил-бутил)-N'-(2-этил-3-метокси-бензоил)-гидразид 3,5-диметил-бензойной кислоты). См. заявку США №12/155,111, зарегистрированную 29 мая, 2008 и PCT/US2008/006757, зарегистрированный 29 мая 2008, где описаны другие диацилгидразины, применимые в практической реализации изобретения. [0147] Комплекс EcR включает в себя белки, являющиеся членами суперсемейства ядерных рецепторов, притом, что все члены этого суперсемейства характеризуются наличием амино-терминального домена трансактивации ("ТА"), ДНК-связывающего домена ("DBD") и лиганд-связывающего домена ("LBD"), которые разделены шарнирным участком. Некоторые члены семейства могут также содержать другой домен трансактивации на карбокси-терминальной стороне LBD. DBD характеризуется наличием двух цистеиновых цинковых пальцев, между которыми расположены два аминокислотных мотива, Р-box и D-box, придающие специфичность экдизоновым элементам отклика. Эти домены могут быть как естественными, так и модифицированными или химерными по отношению к различным доменам гетерологичных белков-рецепторов. [0148] Последовательности ДНК, составляющие экзогенный ген, элемент отклика и комплекс EcR могут быть интегрированы в архебактерии, прокариотические клетки, как, например, Escherichia coli, Bacillus subtilis или другие энтеробактерии, либо в эукариотические клетки, как клетки растений и животных. Тем не менее, ввиду того, что многие экспрессируемые геном белки не могут пройти правильный процессинг в бактериальной клетке, предпочтение отдается эукариотическим клеткам. Клетки могут быть в форме единичных клеток, либо многоклеточных организмов. Нуклеотидные последовательности экзогенного гена, элемент отклика и рецепторный комплекс могут также быть инкорпорированы в форме молекул РНК, предпочитаемо, в форме функциональных вирусных РНК, как, например, РНК вируса табачной мозаики. Среди эукариотических клеток предпочтение отдается клеткам позвоночных, ввиду того, что последние в естественном состоянии не несут молекул, реагирующих на лиганды EcR согласно настоящему изобретению. В результате, они являются «в значительной степени нечувствительными» к лигандам, которые обеспечивает настоящее изобретение. Так, лиганды, которые применяют согласно настоящему изобретению, будут оказывать незначительный, малый физиологический, которым можно пренебречь, или какой-либо другой эффект на трансформированные клетки и организм в целом. Поэтому клетки могут расти и вырабатывать желаемый продукт, не подвергаясь значительному влиянию присутствия самого лиганда. [0149] Лиганды EcR, применяемые вместе с комплексом EcR, который в свою очередь, связан с элементом отклика, который присоединен к экзогенному гену (например, IL- 12), обеспечивают средства внешней временной регуляции экспрессии экзогенного гена. Порядок, в котором различные компоненты связываются друг с другом, то есть лиганд к рецепторному комплексу, а рецепторный комплекс к элементу отклика, не является критичным. Обычно, модуляция экспрессии экзогенного гена происходит в ответ на присоединение комплекса EcR к специфическому контрольному, или регуляторному элементу ДНК. Белок EcR, как и другие члены семейства ядерных рецепторов, содержит, по меньшей мере три домена: домен трансактивации, ДНК-связывающий домен и лиганд-связывающий домен. Этот рецептор как подгруппа семейства ядерных рецепторов также содержит другие, менее определенные участки, ответственные за особенности гетеродимеризации. Присоединение лиганда к лиганд-связывающему домену белка EcR, после гетеродимеризации с белками USP или RXR, позволяют ДНК-связывающим доменам гетеродимерных белков присоединиться к активированной форме элемента отклика, таким образом, приводя к экспрессии или подавлению экзогенного гена. Этот механизм не исключает потенциального присоединения лиганда к EcR или USP, и, в результате, образования активных гомодимерных комплексов (например, EcR+EcR или USP+USP). Согласно одному из вариантов реализации, один или более рецепторных домена могут меняться с получением химерного переключателя гена. Как правило, один или более из трех доменов могут быть выбраны из источника, отличного от источника происхождения остальных доменов, таким образом, что химерный рецептор оказывается оптимальным для трансактивационной активности в выбранной клетке-хозяине или организме, для комплементарного присоединения лиганда и распознавания специфического элемента отклика. Кроме того, сам элемент отклика может быть модифицирован или заменен на элемент отклика для доменов других ДНК-связывающих белка, как, например, белок GAL-4 дрожжей (см. Sadowski et al., Nature 335:563 (1988) или белок LexA Е. coli (see Brent et al., Cell 43:129 (1985)), для взаимодействия с химерными комплексами EcR. Другим преимуществом химерных систем является то, что они позволяют выбрать промотор для экспрессии экзогенного гена в соответствии с желаемым конечным результатом. Такой двойной контроль может оказаться особенно важным в областях генной терапии, особенно когда происходит выработка цитотоксичных белков, потому, как и время экспрессии, и клетки, в которых эта экспрессия происходит, могут быть проконтролированы. Когда экзогенные гены, функционально связанные с соответствующим промотором, вводятся в клетки субъекта, экспрессия экзогенных генов контролируется наличием лиганда согласно настоящему изобретению. Промоторы могут быть конститутивно или индуцируемо регулированы, или могут быть тканеспецифичными (то есть экспрессируемыми лишь в особом типе клеток), или специфичными к определенным стадиям развития организма. [0150] Многие геномные последовательности и последовательности кДНК, кодирующие различные полипептиды, такие как: транскрипционные факторы и репортерные белки, хорошо известны в данной области техники. Специалисты в данной области имеют доступ к информации о последовательностях нуклеиновых кислот практически всех известных генов и могут получить молекулы нуклеиновых кислот либо прямо из публичного банка данных, либо из организации, опубликовавшей последовательность, либо применить рутинные методы для получения молекул. В качестве примера даны описания последовательностей, учетные номера которых также представлены выше. [0151] Переключатель гена может быть любой системой переключателя гена, которая регулирует экспрессию гена при добавлении или удалении специфического лиганда. Согласно одному из вариантов реализации, переключатель гена контролирует уровень экспрессии гена в соответствии с концентрацией присутствующего лиганда. Примеры лиганд-зависимых транскрипционных факторов, которые применяют в переключателях генов согласно настоящему изобретению, включают в себя (но не ограничиваются): члены суперсемейств ядерных рецепторов, которые активируются соответствующими им лигандами (например, глюкокортикоиды, эстроген, прогестины, ретиноиды, экдизон, аналоги и их миметики) и плазмидный вектор rTTA, активируемый тетрациклином. Согласно одному из вариантов реализации, переключатель гена представляет собой переключатель гена на основе EcR. Примерами таких систем являются (но не ограничиваются) системы, описанные в патентах США №6,258,603, 7,045,315, публикациях патентных заявок США №2006/0014711, 2007/0161086 и международной патентной заявке №WO 01/70816. Примеры химерных систем рецепторов экдизона описаны в патентах США №7,091,038, публикации патентной заявки №2002/0110861, 2004/0033600, 2004/0096942, 2005/0266457 и 2006/0100416, а также в международных патентных заявках №WO 01/70816, WO 02/066612, WO 02/066613, WO 02/066614, WO 02/066615, WO 02/29075 и WO 2005/108617. Примером агонист-регулируемой нестероидной экдизоновой системы является RheoSwitch® Mammalian Inducible Expression System (New England Biolabs, Ipswich, MA). [0152] Согласно одному из вариантов реализации, полинуклеотид, кодирующий переключатель гена, содержит одну последовательность транскрипционного фактора, кодирующую лиганд-зависимый транскрипционный фактор, под контролем промотора. Последовательность транскрипционного фактора может кодировать лиганд-зависимый транскрипционный фактор, существующий в природе, или искусственный транскрипционный фактор. Искусственный транскрипционный фактор - это такой фактор, природная последовательность которого была изменена, например, посредством мутации последовательности или комбинирования доменов, взятых у разных транскрипционных факторов. Согласно одному из вариантов реализации, транскрипционный фактор содержит лиганд-связывающий домен (LBD) ядерного рецептора группы Н. Согласно одному из вариантов реализации, лиганд-связывающий домен (LBD) ядерного рецептора группы Н берется от EcR, от убиквитарного рецептора, от орфанного рецептора 1, от NER-I, от ядерного рецептора 1 стероидных гормонов, от белка-15, взаимодействующего с ретиноидным рецептором X (a retinoid X receptor interacting protein-15), от печеночного X рецептора β, от белка, подобного рецептору стероидных гормонов, от печеночного X рецептора, от печеночного X рецептора α, от фарнезоидного X рецептора, от белка-14, взаимодействующего с рецептором, либо от рецептора фарнезола. Согласно другому варианту реализации, LBD Группы Н ядерного рецептора берется от рецептора экдизона. [0153] EcR и другие ядерные рецепторы Группы Н входят в суперсемейство ядерных рецепторов, все члены которого, как правило, характеризуются наличием амино-терминального трансактивационного домена (TD), ДНК-связывающего домена (DBD) и LBD, отделенного от DBD шарнирным участком. В данном описании, термин "ДНК-связывающий домен" описывает минимальную полипептидную последовательность ДНК-связывающего белка, достаточно длинную для того, чтобы ДНК-связывающий домен функционировал, обеспечивая соединение с определенным элементом отклика. Члены суперсемейства ядерных рецепторов также характеризуются наличием четырех или пяти доменов: А/В, С, D, Е и, в случае некоторых членов суперсемейства, F (см. патент США 4,981,784 и Evans, Science 240:889 (1988)). Домен "А/В" относится к трансактивационному домену, "С" относится к ДНК-связывающему домену, "D" относится к шарнирному участку, а "Е" относится к лиганд-связывающему домену. Некоторые члены семейства могут также включать в себя другой трансактивационный домен на карбоксильном терминале LBD, соответствующем "F". [0154] DBD характеризуется наличием двух цистеиновых цинковых пальцев, между которыми расположены два аминокислотных мотива, Р-box и D-box, придающих специфичность этих участков для элементов отклика. Эти домены могут быть либо нативными, либо модифицированными, либо химерными комплексами других доменов гетерологичных белковых рецепторов. EcR, как подгруппа семейства ядерных рецепторов, также содержит менее определенные участки, отвечающие за особенности гетеродимеризации. Так как домены ядерных рецепторов являются модулярными по природе, домены LBD, DBD и TD являются взаимозаменяемыми. [0155] Согласно другому варианту реализации, транскрипционный фактор содержит TD, DBD, распознающий элемент отклика, ассоциированный с экзогенным геном, экспрессия которого должна быть модулирована; и лиганд-связывающий домен ядерного рецептора Группы Н. Согласно определенным вариантам реализации, лиганд-связывающий домен ядерного рецептора Группы Н содержит заместительную мутацию. [0156] Согласно другим вариантам реализации, полинуклеотид, кодирующий переключатель гена содержит первую последовательность транскрипционного фактора под контролем первого промотора и вторую последовательность транскрипционного фактора под контролем второго промотора, причем белки, кодируемые указанными первой последовательностью транскрипционного фактора и второй последовательностью транскрипционного фактора, взаимодействуют с формированием белкового комплекса, который функционирует, как лиганд-зависимый транскрипционный фактор, то есть, как переключатель гена, обозначаемый, как «двойной переключатель» или «двугибридный» переключатель гена. Первый и второй промоторы могут быть одинаковыми или разными. [0157] Полинуклеотид, кодирующий переключатель гена, может также содержать первую последовательность транскрипционного фактора и вторую последовательность транскрипционного фактора под контролем промотора, причем белки, кодируемые первой последовательностью транскрипционного фактора и второй последовательностью транскрипционного фактора, взаимодействуют, формируя белковый комплекс, который функционирует как лиганд-зависимый транскрипционный фактор, то есть, в качестве «единичного переключателя гена». Последовательность первого транскрипицонного фактора и последовательность второго транскрипицонного фактора могут быть связаны внутренним сайтом посадки рибосомы, например, EMCV IRES. [0158] Согласно одному из вариантов реализации, первая последовательность транскрипционного фактора кодирует полипептид, содержащий TD, ДНК-связывающий домен, который распознает элемент отклика, ассоциированный с экзогенным геном, экспрессия которого будет модулироваться, а также лиганд-связывающий домен ядерного рецептора Группы Н; в то время как вторая последовательность транскрипционного фактора кодирует транскрипционный фактор, содержащий LBD ядерного рецептора, выбранного из лиганд-связывающих доменов RXR позвоночных, лиганд-связывающих доменов RXR беспозвоночных, лиганд-связывающих доменов белков ultraspiracle и химерных лиганд-связывающих доменов, содержащих два полипептидных фрагмента, причем первый из них происходит из лиганд-связывающего домена RXR позвоночных, лиганд-связывающего домена RXR беспозвоночных, либо LBD белка ultraspiracle, а второй полипептидный фрагмент происходит от другого LBD белка RXR позвоночных, беспозвоночных или другого LBD белка ultraspiracle. [0159] Согласно другому варианту реализации, переключатель гена содержит первую последовательность транскрипционного фактора, кодирующую первый полипептид, в который входят LBD ядерного рецептора и ДНК-связывающий домен, распознающий элемент отклика, который ассоциирован с экзогенным геном, экспрессия которого будет модулироваться, а также вторую последовательность транскрипционного фактора, кодирующую второй полипептид, в который входят трансактивационный домен TD и лиганд-связывающий домен ядерного рецептора, причем один из LBD ядерного рецептора является лиганд-связывающим доменом ядерного рецептора Группы Н. Согласно предпочтительному варианту реализации, первый полипептид по существу не содержит трансактивационный домен, а второй полипептид по существу не содержит ДНК-связывающий домен. В контексте настоящего изобретения фраза: «по существу не содержит» значит, что рассматриваемый белок не содержит последовательность рассматриваемого домена, достаточно длинную для обеспечения активации или связывания. [0160] Согласно другому аспекту настоящего изобретения, первая последовательность транскрипционного фактора кодирует белок, содержащий партнер гетеродимеризации и трансактивационный домен (TD), а вторая последовательность транскрипционного фактора кодирует белок, содержащий ДНК-связывающий домен и лиганд-связывающий домен. [0161] Когда один лиганд-связывающий домен (LBD) ядерного рецептора относится к Группе Н, другой лиганд-связывающий домен ядерного рецептора может принадлежать любому другому ядерному рецептору, формирующему димер с LBD Группы Н. Например, когда LBD ядерного рецептора Группы Н представляет собой лиганд-связывающий домен рецептора EcR, другой «партнер» ядерного рецептора LBD может происходить от EcR, RXR позвоночных, RXR беспозвоночных, быть белком ultraspiracle (USP), либо химерным ядерным рецептором, содержащим по меньшей мере два полипептидных фрагмента LBD ядерного рецептора, выбранных из RXR позвоночных или RXR беспозвоночных, или белка USP (см. WO 01/70816 А2, International Patent Application No. PCT/US02/05235 и US 2004/0096942 Al. Партнер LBD ядерного рецептора может также содержать укорачивающую мутацию, делецию, мутацию замещения, либо иную модификацию. [0162] Согласно одному из вариантов реализации, лиганд-связывающий домен белка RXR позвоночных происходит от белка RXR человека (Homo sapiens), мыши (Mus musculus), крысы (Rattus norvegicus), курицы (Gallus gallus), свиньи (Sus scrofa domestica), лягушки (Xenopus laevis), полосатого данио (Danio rerio), оболочника (Polyandrocarpa misakiensis), либо медузы (Tripedalia cysophora). [0163] Согласно одному из вариантов реализации, лиганд-связывающий домен белка RXR беспозвоночных берется из: полипептида ultraspiracle саранчи (Locusta migratoria - "LmUSP"), белка гомолога 1 RXR иксодового клеща (Amblyomma americanum - "AmaRXRl"), белка гомолога 2 RXR иксодового клеща (Amblyomma americanum - "AmaRXR2"), гомолога RXR атлантического песчаного краба (Celuca pugilator -"CpRXR"), гомолога RXR малого мучного хрущака (Tenebrio molitor- "TmRXR"), гомолога RXR пчелы (Apis mellifera -"AmRXR"), гомолога RXR персиковой тли (Myzus persicae - "MpRXR"), либо гомолога RXR не двукрылых/не чешуекрылых. [0164] Согласно одному из вариантов реализации, химерный лиганд-связывающий домен белка RXR содержит, по меньшей мере два полипептидных фрагмента, выбранных из полипептидного фрагмента RXR позвоночных животных и полипептидного фрагмента гомолога RXR у беспозвоночных животных, не относящихся к чешуекрылым или двукрылым. Химерный LBD белка RXR согласно настоящему изобретению может состоять из полипептидных фрагментов RXR, которые были взяты от по меньшей мере двух разных видов, либо, в случае если выбран лишь один вид, два или более полипептидных фрагмента могут быть получены от двух или более полипептидных фрагментов изоформ RXR этого вида. [0165] Согласно одному из вариантов реализации, химерный лиганд-связывающий домен RXR содержит по меньшей мере полипептидный фрагмент RXR позвоночного животного и полипептидный фрагмент RXR беспозвоночного. [0166] Согласно другому варианту реализации, химерный лиганд-связывающий домен RXR содержит по меньшей мере полипептидный фрагмент RXR позвоночного животного и полипептидный фрагмент гомолога RXR беспозвоночного животного, не принадлежащего к двукрылым или чешуекрылым. [0167] Лиганд, при присоединении к LBD ядерного(ых) рецептора(ов), который, в свою очередь, связан с элементом отклика, который связан с экзогенным геном, обеспечивает внешнюю временную регуляцию экспрессии экзогенного гена. Механизм связывания или порядок, в котором различные компоненты согласно настоящему изобретению присоединяются друг к другу, то есть, например, лиганд к LBD, ДНК-связывающий домен к элементу отклика, трансактивационный домен к промотору и т.п., не критичен. [0168] В конкретном примере, лиганд присоединяется к LBD ядерного рецептора Группы Н и этот «партнер» ядерного рецептора LBD запускает экспрессию экзогенного гена. Этот механизм не исключает возможность для ядерного рецептора Группы Н (GHNR) или с его «партнера» связываться с лигандом с формированием активных гомодимерных комплексов (например GHNR+GHNR или «партнер»+«партнер»). Предпочитаемо, один или более доменов рецептора заменены для получения гибридного переключателя гена. Как правило, один или более из трех доменов DBD, LBD, и TD может быть взят из источника, отличного от источников происхождения остальных доменов, так, что гибридные гены и получаемые гибридные белки оптимизируются в выбранной клетке-хозяине или организме для трансактивационной активности, комплементарного присоединение лиганда и распознавания специфического элемента отклика. Кроме того, сам элемент отклика может быть модифицирован или заменен элементами отклика для других доменов ДНК-связывающих белков, таких как белок GAL-4 дрожжей (см. Sadowski et al., Nature 335:563 (1988)), или белок LexA Escherichia coli (см. Brent et al., Cell 43:129 (1985)), или синтетические элементы отклика, специализированные для направленных взаимодействий с белками, созданные, модифицированные и выбранные для осуществления таких специфических взаимодействий (см., например, Kim et al., Proc. Natl. Acad. Sci. USA, 94:3616 (1997)) и функционирования с гибридными рецепторами. [0169] Функциональный комплекс EcR может также включать в себя вспомогательный белок (белки), такие как, например, иммунофилины. Вспомогательные члены белкового семейства ядерных рецепторов, известные как транскрипционные факторы (такие как DHR38 или betaFTZ-1), могут также быть лиганд-зависимыми или независимыми партнерами для EcR, USP, и/или RXR. Кроме того, могут требоваться и другие кофакторы, такие как белки, обычно называемые коактиваторами (а также адаптерами или медиаторами). Эти белки не присоединяется специфично к последовательности ДНК и не участвуют в собственно транскрипции. Они могут оказывать эффект на активацию транскрипции разными механизмами, включающими в себя стимуляцию ДНК-связывающей активности активаторов путем воздействия на структуру хроматина, либо посредством взаимодействия активатор-инициирующего комплекса. Примерами таких коактиваторов могут служить: RIP 140, TIF1, RAP46/Bag-1, ARA70, SRC-1/NCoA-I, TEF2/GRTP/NCoA-2, ACTR/AIBl/RACS/pCIP, а также в качестве случайного (неспецифичного) коактиватора, элемент отклика С связывающий белок В, СВР/p300 (для обзора, см. Glass et al., Curr. Opin. Cell Biol. 9:222 (1997)). Кроме того, для эффективного ингибирования активации транскрипции в отсутствие лиганда могут быть необходимы белковые кофакторы, обычно называемые корепрессорами (также называемые репрессорами, сайленсерами или сайленсинговыеми медиаторами). Эти корепрессоры могут взаимодействовать с EcR, который не связан с лигандом, для подавления активности элемента отклика. Существующие данные свидетельствуют о том, что присоединение лиганда меняет конформацию рецептора, приводя к отделению корепрессора и привлечению вышеуказанных коактиваторов, таким образом, выключая их подавляющую активность. Примеры корепрессоров включают в себя N-CoR и SMRT (для обзора, см. Horwitz et al., Mol Endocrinol. 70:1167 (1996)). Эти кофакторы могут быть либо эндогенными, присутствующими внутри клетки или организма, либо могут быть добавлены экзогенно в качестве трансгенов, экспрессируемых в регулируемом или нерегулируемом режиме. [0170] Экзогенный ген функционально связан с промотором, содержащим по меньшей мере один элемент отклика, который распознается ДНК-связывающим доменом лиганд-зависимого транскрипционного фактора, кодируемого переключателем гена. Согласно одному из вариантов реализации, промотор содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более копий элемента отклика. Промоторы, содержащие желаемые элементы отклика, могут быть промоторами естественного происхождения или искусственными промоторами, созданными с применением способов, хорошо известных в данной области техники, например, содержащими один или более элемент отклика, функционально связанный с минимальным промотором. [0171] Для введения полинуклеотидов в клетки можно применять вектор. Вектором может быть, например, плазмидный вектор, либо вирусный вектор, состоящий из одно- или двухцепочечной РНК или ДНК. Такие векторы можно вводить в клетки путем применения хорошо известных способов введения ДНК и РНК в клетки. Вирусные векторы могут быть способны или не способны к репликации. В другом случае, размножение вирусов, как правило, будет происходить только в комплементирующих клетках-хозяевах. В данном описании, термин «клетка-хозяин» или «хозяин» относится к клетке согласно изобретению, в которую вводится и функционирует один или более полинуклеотидов согласно изобретению. [0172] Таким образом, векторы по меньшей мере должны включать в себя полинуклеотиды согласно настоящему изобретению. Другими компонентами вектора могут быть (но, не ограничиваясь нижеперечисленным): селектируемые маркеры, домены модификации хроматина, дополнительные промоторы, запускающие экспрессию других полипептидов (например, апоптозный белок), которые могут быть представлены в векторе, геномные сайты интеграции, сайты рекомбинации и точки молекулярных вставок (полилинкер). Векторы могут содержать любое количество этих дополнительных элементов в составе полинуклеотидов или вне их таким образом, что вектор может выполнять необходимые специфические задачи терапевтических методов, которые применяются. [0173] Согласно одному из вариантов реализации векторы, которые вводят в клетку, содержат также «селектируемый ген-маркер», при обнаружении экспрессии которого можно говорить о том, что конструкт переключателя гена согласно настоящему изобретению интегрировался в геном клетки-хозяина. Таким образом, селектируемый ген может стать положительным маркером для интеграции в геном. В то же время наличие селективного гена-маркера, некритичное в отношении способов данного изобретения, позволяет выделить популяцию живых клеток, в геном которых интегрировалась векторная конструкция. Таким образом, определенные варианты реализации согласно настоящему изобретению включают в себя способ отбора клеток, в которых интеграция вектора прошла успешно. В данном описании, термин «отбирать» и его вариации, примененные в отношении клеток, подразумевают стандартные, хорошо известные способы отбора клеток со специфической генетической структурой или фенотипом. Обычные способы включают в себя (но, не ограничиваются нижеперечисленным): культивирование клеток в присутствии антибиотиков, как G418, неомицин и ампициллин. Другие примеры селектируемых генов-маркеров включают в себя (но, не ограничиваются нижеперечисленным) гены, придающие устойчивость к дигидрофолат-редуктазе, гигромицину или микофеноловой кислоте. Другие способы селекции включают в себя (но, не ограничиваются нижеперечисленным) селектируемый ген-маркер, позволяющий использовать тимидин-киназу, гипоксантин-гуанин-фосфорибозилтрансферазу, либо аденин-фосфорибозилтрансферазу в качестве агентов отбора. Клетки, содержащие векторный конструкт, в который входят ген(ы) устойчивости к антибиотику, будут, таким образом, способны выживать в присутствии антибиотика в культуре. Соответственно, клетки, не содержащие векторный конструкт, в который входит(ят) ген(ы) устойчивости к антибиотику, погибнут в присутствии антибиотика в культуре. [0174] В данном описании, термин «домен модификации хроматина» (CMD) относится к нуклеотидным последовательностям, взаимодействующим с различными белками, которые связаны процессом сохранения и/или изменения структуры хроматина, такие, как, например, с инсуляторы ДНК (но не ограничивающимися последними). См. Ciavatta et al., Proc. Nat 1 Acad. Sci. U.S.A., 103:9958 (2006). Примеры CMD включают в себя (но, не ограничиваются нижеперечисленным): инсулятор гена бета-глобулина курицы и сайт гиперчувствительности 4 (cHS4) курицы. Использование различных последовательностей CMD в отношении одной или более генных программ (т.е. промотора, кодирующей последовательности и 3' регуляторного участка), например, может облегчить применение различных CMD последовательностей ДНК в качестве «участков - «плеч» - «мини-гомологии» в комбинации с различными микроорганизмами, либо в рекомбинационных технологиях in vitro, для «переключения» программ генов между имеющимися мультигенными и моногенными челночными векторами. Другие примеры доменов модификации хроматина известны в данной области техники и могут быть легко идентифицированы. [0175] Конкретные векторы, которые можно применять в соответствии с настоящим изобретением, представляют собой векторы экспрессии, кодирующие белки или полинуклеотиды. Как правило, такие векторы содержат cw-активные контрольные участки (cw-acting control regions), эффективные для экспрессии в хозяине и функционально связанные с экспрессируемым полинуклеотидом. Соответствующие транс-активные факторы предоставляются хозяином, комплементарным вектором, либо самим вектором после введения в хозяина. [0176] Для экспрессии белков или полинуклеотидов можно примененять различные векторы. Такие векторы включают в себя хромосомные, эписомальные и вирусные векторы, например, векторы, происходящие от бактериальных плазмид, бактериофагов, дрожжевых эписом, хромосомных элементов дрожжей, вирусов, как, например, адено-ассоциированные вирусы, лентивирусы, бакуловирусы, паповавирусы (как SV40), вакциния, аденовирусы, вирусы птичьей оспы, вирусы псевдобешенства и ретровирусы, а также векторы, получающиеся при комбинации вышеперечисленных, например, из генетических элементов плазмид и фагов, таких как космиды и фагемиды. Все они могут использоваться для экспрессии, в соответствии с данным аспектом изобретения. Как правило, любой вектор, подходящий для сохранения, размножения и экспрессии полинуклеотидов или белков в клетке, можно применять при экспрессии в этом отношении. [0177] Полинуклеотидная последовательность в экспрессионном векторе функционально связана с соответствующей последовательностью (последовательностями) контроля экспрессии, включающей в себя, например, промотор для управления транскрипцией иРНК. К представителям вспомогательных промоторов относятся (но, не ограничиваются): конститутивные, ткане-специфичные и индуцирующие промоторы. Примеры конститутивных эукариотических промоторов включают в себя (но не ограничиваются): промотор гена металотионеина 1 мыши (Hamer et al., J. MoI. Appl. Gen. 1:273 (1982)); промотор TK вируса герпеса (McKnight, Cell 37:355 (1982)); ранний промотор SV40 (Benoist et al., Nature 290:304 (1981)); и промотор вакцинии. К другим промоторам, применимым для управления экспрессией белка или полинуклеотида, относятся (но, не ограничиваются) ткане-специфичные промоторы и другие эндогенные промоторы, такие как: промотор альбумина (гепатоциты), промотор проинсулина (панкреатические бета-клетки) и т.п. В целом, экспрессионные конструкты должны содержать сайты инициации и терминации транскрипции и, в составе транскрибируемого участка, сайт связывания рибосом для трансляции. Кодирующая часть зрелых транскриптов, экспрессируемых конструктами, могут содержать кодон инициации трансляции AUG в начале и кодон терминации (UAA, UGA или UAG), соответственно расположенный в конце транслируемого полипептида. [0178] Кроме этого, конструкты могут содержать контролирующие участки, регулирующие, а также активирующие экспрессию. Обычно, такие участки функционируют в качестве транскрипционных регуляторов, среди прочего, как сайты присоединения репрессоров или энхансеры. [0179] Примеры эукариотических векторов включают (но не ограничиваются нижеперечисленными): pW-LNEO, pSV2CAT, pOG44, pXT1 и pSG, доступные у Stratagene; pSVK3, pBPV, pMSG и pSVL, доступные у Amersham Pharmacia Biotech; а также pCMVDsRed2-express, pIRES2-DsRed2, pDsRed2-Mito и pCMV-EGFP, доступные у Clontech. Существует множество других хорошо известных и коммерчески доступных векторов. [0180] Особенно удобны в применении векторы, содержащие точки молекулярных вставок (полилинкеры) для быстрой вставки и удаления элементов генных программ, которые описаны в United States Published Patent Application No. 2004/0185556, United States Patent Application No. 11/233,246 и International Published Application Nos. WO 2005/040336 и WO 2005/116231. Примером таких векторов является Ultra Vector™ Production System (Intrexon Corp., Blacksburg, VA), описанный в WO 2007/038276. В данном описании, термин «генная программа» относится к комбинации генетических элементов, состоящей из промотора (Р), экспрессионной последовательности (Е) и 3' регуляторной последовательности (3), так, что «РЕ3» означает генную программу. Элементы, входящие в генную программу, могут быть легко перенесены в другие точки молекулярных вставок, расположенные по краям каждого элемента генной программы. Термин «точка молекулярной вставки» при использовании в данном описании, относится к полинуклеотиду, который содержит по меньшей мере два редко встречающихся или необычных сайта рестрикции, расположенные линейно. Согласно одному из вариантов реализации, точка молекулярной вставки (полилинкер) состоит из по меньшей мере трех редко встречающихся или необычных сайтов рестрикции, расположенных линейно. Как правило, одна точка молекулярной вставки не содержит редкий или необычный сайт рестрикции, принадлежащий другой точке молекулярной вставки, в составе одной и той же генной программы. Родственные последовательности, состоящие из более чем 6 нуклеотидов, по которым действует рестрикционный фермент, называют «редкими» сайтами рестрикции. Тем не менее существуют сайты рестрикции, состоящие из 6 пар оснований, встречающиеся реже, чем может быть статистически предсказано; такие сайты и эндонуклеазы, их расщепляющие, называются «необычными». Примеры редких и необычных рестрикционных ферментов включают в себя (но, не ограничиваются нижепредставленными): AsiS I, Рас I, Sbf I, Fse I, Asc I, MIu I, SnaB I, Not I, Sal I, Swa I, Rsr II, BSiW I, Sfo I, Sgr AI, AfIIII, Pvu I, Ngo MIV, Ase I, FIp I, Pme I, Sda I, Sgf I, Srf I и Sse8781 I. [0181] Вектор также может содержать рестрикционные сайты для второго класса рестрикционных ферментов, называемых эндонуклеазами генной конверсии (homing endonuclease) (НЕ). НЕ распознают большие, асимметричные сайты рестрикции (12-40 пар оснований), и их рестрикционные сайты редко встречаются в природе. Например, НЕ, известная, как I-Scel, распознает состоящий из 18 пар оснований сайт рестрикции (5 TAGGGAT А AC AGGGTAAT3' (SEQ ID NO: 12)) и статистически может встречаться один раз на каждые 7×1010 пар оснований в произвольной последовательности. Такая частота эквивалентна тому, что указанный сайт может встретиться лишь единожды в геноме, размер которого в 20 раз превышает размер генома млекопитающего. Редкая встречаемость НЕ-сайтов значительно повышает вероятность того, что генный инженер сможет вырезать генную программу без нарушения целостности этой программы, при условии, что сайты эндонуклеазы генной конверсии располагаются в соответствующих участках векторной плазмиды клонирования. [0182] Выбор соответствующих векторов и промоторов для экспрессии в клетке-хозяине является хорошо известной процедурой, а необходимые для создания и введения вектора в хозяина техники, вместе с техниками экспрессии таковых в хозяине, являются рутинными процедурами в данной области техники. [0183] Введение полинуклеотидов в клетки может выполняться в форме временной трансфекции, стойкой трансфекции, либо в форме локус-специфичной вставки вектора. Временная и стойкая трансфекция векторов в клетку хозяина может быть осуществлена путем трансфекции с использованием фосфата кальция, DEAE-декстран-опосредованной трансфекции, липофекции (опосредованной катионными липидами трансфекции), электропорации, трансдукции, инфекции или с применением других методов. Такие методы описаны во многих лабораторных справочниках, как, например, Davis et al., Basic Methods in Molecular Biology (1986); Keown et al., 1990, Methods Enzymol. 185: 527-37; Sambrook et al., 2001, Molecular Cloning, A Laboratory Manual, Third Edition, Cold Spring Harbor Laboratory Press, N.Y. Эти способы стабильной трансфекции приводят к произвольному встраиванию вектора в клеточный геном. Более того, количество копий и расположение векторов, в целом, также являются произвольными. [0184] Согласно одному из вариантов реализации, вектор вводят в биологически нейтральный сайт генома. Биологически нейтральный сайт - это участок генома, встраивание полинуклеотидов в который слабо влияет, либо не влияет вообще на нормальное функционирование клетки. Биологически нейтральные сайты могут быть определены с помощью доступной биоинформатики. Многие биологически нейтральные сайты известны в данной области, как, например, ROSA-эквивалентный локус (ROSA-equivalent locus). Другие биологически нейтральные сайты могут быть выявлены с помощью рутинных технологий, хорошо известных в данной области техники. Определение параметров геномных сайтов вставки выполняется с применением способов, известных в данной области. Для контроля расположения, количества копий и/или ориентации полинуклеотидов при введении вектора в клетки могут применяться методы локус-специфичной вставки. Методы локус-специфичной вставки хорошо известны в данной области и включают в себя (но не ограничиваются): гомологичную рекомбинацию и опосредованную рекомбиназой вставку в геном. Безусловно, в случае применения способов локус-специфичной вставки в составе методов, согласно изобретению, векторы могут содержать элементы, способствующие данной локус-специфичной вставки, включающей в себя (но не ограничивающейся) гомологическую рекомбинацию. Например, векторы могут содержать один, два, три, четыре или более геномных интеграционных сайтов (GIS). В данном описании, термин «геномный интеграционный сайт» относится к части векторной последовательности, идентичной или практически идентичной частям генома внутри клеток, позволяющим вставку вектора в геном. В частности, вектор может содержать по меньшей мере два сайта интеграции в геном, располагающихся по краям указанных полинуклеотидов. Безусловно, ГИСы могут находиться по краям вспомогательных элементов или даже всех элементов, наличествующих в составе вектора. [0185] Согласно другому варианту реализации, локус-специфичная вставка может быть осуществлена посредством специфичной по сайту рекомбиназы вставки гена. Вкратце, бактериальные рекомбиназы, такие как (но не ограничивающиеся данным ферментом) интеграза PhiC31, могут функционировать в «псевдорекомбинационных» областях человеческого генома. Такие псевдорекомбинационные сайты могут быть мишенями для локус-специфичной рекомбинации, опосредованной рекомбиназами. Специфичная к сайту рекомбиназы генная вставка описана в Thyagarajan et al., MoI. Cell Biol. 21:3926 (2001). Другие примеры рекомбиназ и соответствующих им сайтов, которые могут применяться для специфичной к рекомбинационному сайту генной вставки, включают в себя (но не ограничиваются) сериновыми рекомбиназами, как R4 и ТР901-1, а также рекомбиназами, описанными в WO 2006/083253. [0186] Согласно другому варианту реализации, вектор может содержать ген множественной устойчивости к лекарственным препаратам, например, ген mdrl, дигидрофолат-редуктазы или О6-алкилгуанин-ДНК алкилтрансферазы. Ген химической устойчивости может контролироваться конститутивным (например, CMV) или индуцируемым (например, RheoSwitch®) промотором. Согласно этому варианту реализации, если целью является лечение заболевания субъекта параллельно с присутствием модифицированных клеток в указанном субъекте, врач может применить хемотерапевтический агент для уничтожения пораженных клеток, в то время как модифицированные клетки будут защищены от этого агента благодаря экспрессии соответствующего гена химической устойчивости, а указанный агент может быть использован в дальнейшем для лечения заболевания, облегчения состояния пациента, либо профилактики этого заболевания или нарушения. Помещение гена химической устойчивости под контроль индуцируемого промотора позволяет избежать нежелательной экспрессии гена химической устойчивости, причем экспрессия этого гена может всегда быть возобновлена, в случае, если продолжение лечения окажется необходимым. В случае поражения самих модифицированных клеток, они могут быть уничтожены активацией экспрессии апоптозного полипептида, как описано ниже. [0187] Способы согласно настоящему изобретению осуществляют посредством введения полинуклеотидов, кодирующих переключатель гена, и экзогенного гена в клетки субъекта. Может быть применен любой из способов введения полинуклеотида в клетку, известный в данной области знания, подобный описанным ниже. [0188] Если полинуклеотиды вводят в клетки ex vivo, клетки могут быть получены у субъекта при помощи любого способа, известного в данной области, включающего в себя (но не ограничивающегося): биопсии, соскобы и хирургическое удаление ткани. Изолированные клетки можно культивировать в течение достаточного времени для того, чтобы позволить полинуклеотидам проникнуть в клетки, например, в течение 2, 4, 6, 8, 10, 12, 18, 24, 36, 48 часов или дольше. Способы культивирования первичных клеток за короткие промежутки времени хорошо известны в данной области. Например, клетки могут быть культивированы в чашках (например, в микроячеечных чашках), прикреплены или выращены в суспензии. [0189] В случае терапевтических методов ex vivo, клетки изолируются из ткани пациента и культивируются в условиях, пригодных для введения в них полинуклеотидов. Как только полинуклеотиды вводятся в клетки, последние инкубируют в течение времени, достаточного для экспрессии лиганд-зависимого транскрипционного фактора, например, в течение 0.5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 18 или 24 часов или дольше. В определенный момент после интеграции полинуклеотидов в клетки (до или после того, как будет выработано значительное количество лиганд-зависимого транскрипционного фактора), клетки вводят обратно индивидууму. Обратное (повторное) введение можно осуществлять любым способом, известным в данной области техники, например, внутривенным введением или прямой инъекцией в ткань или полость. Согласно одному из вариантов реализации, наличие полинуклеотидов в клетках определяется до повторного введения клеток субъекту. Согласно другому варианту реализации, клетки, содержащие полинуклеотиды, подвергаются селекции (например, основываясь на наличии селективного маркера в этих полинуклеотидах), и субъекту повторно вводятся только клетки, содержащие представляющий интерес полинуклеотид. После того, как клетки повторно вводятся индивидууму, для запуска экспрессии терапевтического полипептида или терапевтического полинуклеотида, вводится соответствующий лиганд. Согласно альтернативному варианту реализации, лиганд можно добавлять к клеткам даже до того, как их обратного введения субъекту, для того, чтобы терапевтический полипептид или полинуклеотид начал вырабатываться до повторного введения клеток субъекту. Лиганд может вводиться любым возможным способом, как системно (например, орально, внутривенно), так и локально (например, внутрибрюшинно, интратекально, интравентрикулярно или прямой инъекцией в ткань или орган, куда были повторно введены модифицированные клетки, например, внутриопухолево). Оптимальный временной режим введения лиганда может быть определен для каждого типа клеток, заболевания или нарушения, путем применения рутинных процедур. [0190] Терапевтические методы in vivo согласно настоящему изобретению включают в себя прямое введение полинуклеотидов in vivo в клетки субъекта. Полинуклеотиды можно вводить субъекту системно или локально (например, в пораженную заболеванием или нарушением область). Как только полинуклеотиды введены субъекту, для экспрессии терапевтического полинуклеотида или полипептида может быть введен и соответствующий лиганд. Введение лиганда может быть выполнено любым применимым способом, как системно (например, орально, внутривенно) так и локально (например, внутрибрюшинно, интратекально, интравентрикулярно или прямой инъекцией в ткань или орган, пораженный заболеванием или нарушением, например, внутриопухолево). Оптимальный временной режим введения лиганда можно определить для каждого типа клеток, заболевания или нарушения, путем применения рутинных процедур. [0191] При применении in vivo, описанные в данном изобретении, лиганды можно быть включены в фармацевтически приемлемые носители, такие, как, например, растворы, суспензии, таблетки, капсулы, мази, эликсиры и композиции, вводимые посредством инъекций. Фармацевтические композиции могут содержать от 0.01% до 99% лиганда по массе. Композиции могут быть в форме как единовременных, так и множественных доз. Содержание лиганда в какой-либо отдельной фармацевтической композиции зависит от эффективной дозы, иначе говоря, от дозы, необходимой для осуществления экспрессии или подавления гена, представляющего интерес. [0192] К пригодным путям введения фармацевтических препаратов относятся оральный, ректальный, топикальный (включая дермальный, буккальный и сублингвальный), вагинальный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутрикожный, интратекальный, внутриопухолевый и эпидуральный), а также способ с применением назогастральной трубки. Для специалистов в данной области техники очевидно, что предпочитаемый способ введения будет зависеть от условий, вызвавших необходимость лечения, и может меняться относительно различных факторов, как, например, состояние пациента. [0193] В данном описании, термин "rAD.RheoIL12" относится к аденовирусному полинуклеотидному вектору, в который входит ген интерлейкина-12, под контролем переключателя гена RheoSwitch® Therapeutic System (RTS), способного вырабатывать белок IL-12 в присутствии активирующего лиганда. [0194] В данном описании, термин "IL-12p70" относится к белку IL-12, который в природном состоянии состоит из двух субъединиц, обычно обозначаемых как р40 и р35. Термин IL-12p70 охватывает рекомбинантные белки, состоящие из двух субъединиц интерлейкина-12 (р40 и р35), притом, что рекомбинантный белок может содержать линкерные аминокислоты, связывающие субъединицы. [0195] В данном описании, термин "обладающий функцией интерлейкина-12 белок" относится к белку, обладающему по меньшей мере 20% (например по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100%) биологической активности интерлейкина-12 человека. Биоактивность IL-12 хорошо известна в данной области техники и включает в себя, без ограничений, дифференциацию нативных Т-клеток в Тh1-клетки, стимуляцию роста и функционирования Т-клеток, выработку интерферона-гамма (IFN-γ) и фактора некроза опухолей-альфа (TNF-α) Т-клетками и NK-клетками, подавление супрессии интерферона-гамма интерлейкином-4, повышение цитотоксической активности NK-клеток и CD8+ цитотоксических Т-лимфоцитов, стимуляцию экспрессии IL-12R β1 и IL-12R-β2, а также антиангиогенную активность. Термин "обладающий функцией интерлейкина-12 белок" охватывает мутированные последовательности IL-12 дикого типа, где последовательность дикого типа меняется добавлением, делецией или замещением аминокислот, а также белки, не являющиеся интерлейкином-12, имитирующие одну или несколько функций последнего. [0196] В данном описании, термин "rAd.cIL12" относится к аденовирусному полинуклеотидному контрольному вектору, содержащему ген интерлейкина-12 который регулируется конститутивным промотором. [0197] В данном описании, термины «активирующий» или «активировать» относятся к любому измеримому (значительному) повышению клеточной активности переключателя гена, приводящему к экспрессии гена, представляющего интерес (например, гена, кодирующего белок IL- 12). [0198] В данном описании, термины «лечение» или «излечение» заболевания относятся к осуществлению протоколов (лечения), которые могут включать в себя применение одного или нескольких лекарственных препаратов, либо модифицированных клеток по отношению к млекопитающему (человеку или отличному от человека млекопитающему), для облегчения признаков или симптомов заболевания. Таким образом, термин «лечение» или «излечение» не должен обязательно быть интерпретирован в качестве полного избавления от признаков или симптомов, не должен подразумевать полное излечение, и в частности, включает протоколы, оказывающие лишь минимальное действие на субъекта. [0199] В данном описании, термин «иммунные клетки» относится к дендритным клеткам, макрофагам, нейтрофилам, тучным клеткам, эозинофилам, базофилам, натуральным (естественным) киллерам и лимфоцитам (например, В и Т-клеткам). [0200] В данном описании, термины «дендритные клетки» и «DC» являются взаимозаменяемыми. [0201] В данном описании, термин «поддерживающие терапию клетки» (TSC) относится к клеткам, которые могут модифицироваться (например, трансфекцией), вектором согласно изобретению, для доставки одного или более белков, функционирующих в качестве иммуномодуляторов и, как альтернатива, белка, обладающего функцией интерлейкина-12, в отношении опухолевой микросреды. Такие TSC включают в себя (но не ограничиваются) стволовые клетки, фибробласты, эндотелиоциты и кератиноциты. [0202] В данном описании, термины «модифицированные in vitro дендритные клетки», или «популяция модифицированных дендритных клеток», или «DC, экспрессирующие IL-12», или «DC.RheoIL12» относятся к дендритным клеткам, регулируемо экспрессирующим интерлейкин-12 под контролем переключателя гена, который может быть активирован активирующим лигандом. [0203] В данном описании, термины «модифицированные in vitro TSC», или «популяция модифицированных in vitro TSC», или «TSC, экспрессирующие иммуномодулятор», или «TSC, экспрессирующие IL-12» относятся к поддерживающим терапию клеткам, например, стволовым клеткам, фибробластам, эндотелиоцитам и кератиноцитам, регулируемо экспрессирующим иммуномодулятор и/или IL-12, в зависимости от конкретного случая под контролем переключателя гена, активируемого активирующим лигандом. [0204] В данном описании, термины «М01» или «множественность инфицирования» относится к среднему количеству аденовирусных частиц, инфицирующих отдельную клетку в процессе отдельного эксперимента (например, рекомбинантных аденовирусов или контрольных аденовирусов). [0205] В данном описании, термин «опухоль» относится к любого рода доброкачественному или злокачественному разрастанию и пролиферации клеток, как in vivo, так и in vitro, и охватывает предраковые или раковые клетки и/или ткани. [0206] Примеры злокачественных опухолей, которые можно лечить согласно настоящему изобретению, включают: рак груди, рак простаты, лимфому, рак кожи, рак толстой кишки, рак поджелудочной железы, меланому, злокачественную меланому, рак яичников, злокачественные опухоли головного мозга, первичную карциному головного мозга, рак органов головы и шеи, глиому, глиобластому, рак печени, рак мочевого пузыря, не-мелкоклеточный рак легких, карциному органов головы и шеи, карциному легких, карциному яичников, карциному легких, мелкоклеточную карциному легких, опухоль Вильмса, цервикальную карциному (рак шейки матки), тестикулярную карциному, карциному мочевого пузыря, карциному поджелудочной железы, карциному желудка, карциному толстой кишки, карциному простаты, генитоуринарную карциному, карциному щитовидной железы, карциному пищевода, миелому, множественную миелому, карциному надпочечников, почечно-клеточную карциному, эндометриальную карциному, карциному мозгового вещества надпочечников, злокачественную панкреатическую инсулиному, злокачественную карциноидную карциному, хориокарциному, грибовидную гранулему (mycosis fungoides), злокачественную гиперкальциемию, цервикальную гиперплазию, лейкемию, острую лимфоцитарную лейкемию, хроническую лимфоцитарную лейкемию, острую миелогенную лейкемию, хроническую миелогенную лейкемию, хроническую гранулоцитарную лейкемию, острую гранулоцитарную лейкемию, лейкоз ворсистых клеток, нейробластому, рабдомиосаркому, саркому Капоши, истинную полицитемию, эссенциальный тромбоцитоз, ходжкинскую лимфому, не-ходжкинскую лимфому, саркому мягких тканей, остеогенную саркому, первичную макроглобулинемию, ретинобластому и т.п. [0207] Настоящее изобретение относится к модификации дендритных клеток для обеспечения регулируемой экспрессии интерлейкина-12 (IL-12), их терапевтическому использованию и/или применению при лечении рака, других опухолей, или и того, и другого. Модифицированные in vitro дендритные клетки, регулируемо экспрессирующие белок, обладающий функцией интерлейкина-12, являются безопасным усовершенствованием по отношению к средствам конститутивного синтеза белка IL-12. Кроме того, возможность контролировать продолжительность и уровень экспрессии интерлейкина-12 обеспечивает улучшенный контроль эффективности лечения. Потому, модифицированные in vitro дендритные клетки могут быть включены в фармацевтические композиции в качестве терапевтических препаратов для лечения рака или иных опухолей в организме человека или другого животного. В качестве альтернативы, модифицированные in vitro популяции дендритных клеток или их субпопуляции могут быть применены как средства регулируемой стимуляции выработки интерлейкина-12 в специфической области (здоровой, раковой ткани или в другой опухоли), в организме человека или любом другом организме. Также модифицированные дендритные клетки могут регулируемо синтезировать интерферон-альфа. Используемые дендритные клетки могут быть аутологичными или неаутологичными. Они могут быть изолированы из костного мозга, любо из циркулирующей периферической крови. В случае, когда пациент является человеком, популяции дендритных клеток могут быть изолированы процедурой лейкофореза, когда фракция белых кровяных клеток изолируется и удаляется, а остальные компоненты крови вновь вводятся пациенту. [0208] Также настоящее изобретение охватывает модификации отличающихся от дендритных клеток клеток иммунной системы, таких как макрофаги, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-клетки и лимфоциты (например, В и Т-клетки), для регулируемой экспрессии белка, обладающего функцией интерлейкина-12, их терапевтическому использованию и/или применению в лечении рака, других опухолей, или и того, и другого. Модифицированные in vitro, отличные от дендритных клеток клетки иммунной системы, например, макрофаги, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-клетки и лимфоциты (например, В и Т-клетки), регулируемо вырабатывающие белок, обладающий функцией IL-12, являются безопасным усовершенствованием средств конститутивного синтеза белка интерлейкина-12. Более того, возможность контролировать продолжительность и уровень экспрессии интерлейкина-12 обеспечивает улучшенный контроль эффективности лечения. Поэтому, модифицированные in vitro, клетки иммунной системы, отличные от дендритных клеток, например, макрофаги, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-клетки и лимфоциты (например, В и Т-клетки), могут быть включены в фармацевтические композиции в качестве терапевтических препаратов для лечения рака или иных опухолей в организме человека или другого животного. В качестве альтернативы, модифицированные in vitro популяции иммунных клеток, отличных от дендритных клеток, например, макрофагов, нейтрофилов, тучных клеток, эозинофилов, базофилов, NK-клеток и лимфоцитов (например, В и Т-клеток), или их субпопуляции могут быть применены как средства регулируемой стимуляции выработки интерлейкина-12 в специфической области (здоровой, раковой ткани или в другой опухоли), в организме человека или любом другом организме. Также, модифицированные иммунные клетки, отличные от дендритных клеток, например, макрофаги, нейтрофилы, тучные клетки, эозинофилы, базофилы, NK-клетки и лимфоциты (например, В и Т-клетки), могут регулируемо синтезировать интерферон-альфа. Используемые иммунные клетки могут быть аутологичными или неаутологичными. Они могут быть изолированы из костного мозга, любо из циркулирующей периферической крови. В случае, когда пациент является человеком, популяции иммунных клеток могут быть изолированы процедурой лейкофореза, когда фракция белых кровяных клеток изолируется и удаляется, а остальные компоненты крови вновь вводятся пациенту. [0209] Согласно другому варианту реализации, дендритные клетки могут быть получены путем трансфекции гематопоэтических стволовых клеток человека вектором согласно настоящему изобретению, экспрессирующим белок, обладающий функцией интерлейкина-12, и дифференциации трансфицированных стволовых клеток с получением дендритных клеток. См. патент США 6,734,014. [0210] Согласно одному из вариантов реализации, содержащий нуклеиновую кислоту аденовирусный вектор (rAd.Rb.eolL 12), содержащий переключатель гена, в котором кодирующие VP16-RXR и GaW-EcR последовательности разделены последовательностью внутреннего сайта посадки рибосомы вируса энцефаломиокардита EMCV, вставлены в аденовирусный челночный вектор под регуляцией промотора убиквитина С человека. Кодирующие субъединицы р40 и р35 интерлейкина-12 последовательности разделены последовательностью внутреннего сайта посадки рибосомы, помещены под контроль синтетического индуцируемого промотора и расположены в направлении 5' относительно промотора убиквитина С. [0211] Согласно другому варианту реализации, в настоящем изобретении предложен челночный вектор, несущий транскрипционные единицы (VP16-RXR и Gal4-EcR) двух рекомбинантных белков и индуцируемые субъединицы IL-12, рекомбинированные с последовательностью, происходящей от аденовируса (AdEasyl) в клетках Е. coli BJ5183. После проверки рекомбинантного клона, плазмиду, несущую геном rAd.RheoIL12, культивируют и подвергают очистке в клетках XLIO-Gold, затем отщепляют от основной кодирующей последовательности плазмиды и переносят в клетки НЕК 293 путем трансфекции. [0212] Согласно конкретному варианту реализации, полученный первичный препарат вирусов амплифицировали повторной инфекцией клеток НЕК 293 и подвергали очистке центрифугированием в градиенте концентрации хлорида цезия. [0213] Согласно одному из вариантов реализации, ген интерлейкина-12 представляет собой последовательность гена IL-12 дикого типа. Согласно другому варианту реализации, ген интерлейкина-12 представляет собой модифицированную генную последовательность, например, химерную последовательность или последовательность, модифицированную для использования предпочитаемых кодонов. [0214] Согласно одному из вариантов реализации, ген интерлейкина-12 представляет собой последовательность человеческого гена IL-12 дикого типа. Согласно другому варианту реализации, последовательность по меньшей мере на 85% идентична последовательности человеческого гена IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99%. Согласно другому варианту реализации, последовательность гена IL-12 кодирует полипептид интерлейкина-12 человека. Согласно другому варианту реализации, ген кодирует полипептид, по меньшей мере на 85% идентичный человеческому IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99%. [0215] Согласно одному из вариантов реализации, ген интерлейкина-12 представляет собой последовательность гена IL-12 мыши дикого типа. Согласно другому варианту реализации, последовательность по меньшей мере на 85% идентична последовательности мышиного гена IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99%. Согласно другому варианту реализации, последовательность гена IL-12 кодирует полипептид интерлейкина-12 мыши. Согласно другому варианту реализации, ген кодирует полипептид, по меньшей мере на 85% идентичный мышиному IL-12 дикого типа, например, по меньшей мере на 90%, 95% или 99%. [0216] Настоящее изобретение предлагает способ получения популяции модифицированных in vitro дендритных клеток, регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12. Данный способ включает следующие стадии: (а) модификацию по меньшей мере части дендритных клеток, например, взятых из костного мозга, посредством введения в указанные дендритные клетки вектора, который содержит переключатель гена, включающий последовательность нуклеиновой кислоты, кодирующая белок, обладающий функцией интерлейкина-12. Таким образом, данный способ обеспечивает получение популяции модифицированных in vitro дендритных клеток, способных излечить или предотвратить заболевание. [0217] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ получения популяции модифицированных in vitro клеток иммунной системы, отличных от дендритных клеток, например, макрофагов, нейтрофилов, тучных клеток, эозинофилов, базофилов, NK-клеток, лимфоцитов (например, В и Т-клеток), или поддерживающих терапию клеток (TSC), регулируемо экспрессирующих белок, обладающий функцией интерлейкина-12. Данный способ включает следующие стадии: (а) модификацию, по меньшей мере части клеток иммунной системы, отличных от дендритных клеток или поддерживающих терапию клеток, например, взятых из костного мозга, посредством введения в эти иммунные клетки, отличные от дендритных клеток или поддерживающих терапию клеток, вектора, содержащего переключатель гена, который содержит последовательность нуклеиновой кислоты, кодирующей белок, обладающий функцией интерлейкина-12. Таким образом, данный способ обеспечивает получение популяции модифицированных in vitro иммунных клеток, отличных от дендритных клеток или поддерживающих терапию клеток и способных излечить или предотвратить заболевание. [0218] Согласно другим вариантам реализации, настоящее изобретение предлагает способ выделения и обогащения дендритных клеток, а также клеток иммунной системы, отличных от дендритных клеток и поддерживающих терапию клеток. Дендритные клетки можно выделить из костного мозга человека, мыши или другого млекопитающего, а также из крови человека, мыши или другого млекопитающего. В случае с пациентами-людьми, популяции дендритных клеток могут быть изолированы с помощью лейкофореза, как описано в процедурах, известных в данной области техники, где фракция белых кровяных клеток изолируется и отделяется от остальных компонентов крови, которые повторно вводятся пациенту. Согласно одному из вариантов реализации, дендритные клетки получают из костного мозга мыши, как описано в предыдущих материалах (Tatsumi et al., 2003). Вкратце, костный мозг дикого типа, либо костный мозг мыши EGFP Tg культивируется в регулируемой среде, в которую добавляется 1000 ед./мл рекомбинантного гранулоцитарно-макрофагального колониестимулирующего фактора мыши и рекомбинантного IL-4 мыши (Peprotech, Rocky Hill, NJ), при 37°C в 5% СО2 инкубаторе в течение 7 дней. Затем, с помощью специальных гранул MACSTM, в соответствии с инструкциями производителя (Miltenyi Biotec, Auburn, СА), изолируются CD1 1 с+дендритные клетки. CD1 1 с+дендритные клетки, полученные таким способом, имеют степень очистки, превышающую 95%, в отношении морфологии и коэкспрессии CD1 lb, CD40, CD80, а также антигенов главного комплекса гистосовместимости 1-го и 2-го класса. [0219] Согласно одному из вариантов реализации настоящее изобретение обеспечивает модифицированные дендритные клетки, регулируемо вырабатывающие белок, обладающий функцией интерлейкина-12 и пригодные для терапевтического применения при лечении рака или иных злокачественных опухолей в процессе генной терапии в человеческом или другом организме. Согласно другому варианту реализации настоящее изобретение обеспечивает модифицированные дендритные клетки, регулируемо вырабатывающие белок, обладающий функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа и пригодный для терапевтического применения при лечении рака или иных злокачественных опухолей в процессе генной терапии в человеческом или другом организме. [0220] Согласно одному из вариантов реализации, в настоящем изобретении предлагаются модифицированные дендритные клетки, содержащие переключатель гена. [0221] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ лечения опухолей млекопитающих, включающий в себя введение эффективной дозы диацилгидразинового лиганда. [0222] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ лечения опухолей млекопитающих, включающий в себя введение эффективной дозы RG-115830 или RG-115932. [0223] Согласно другому варианту реализации, настоящее изобретение обеспечивает наборы, содержащие дендритные клетки, модифицированные таким образом, что указанные клетки содержат переключатель гена, а также настоящее изобретение обеспечивает лиганд, активирующий этот переключатель гена. [0224] Согласно другому варианту реализации, настоящее изобретение обеспечивает наборы, содержащие дендритные клетки, модифицированные таким образом, что указанные клетки содержат переключатель гена, а также настоящее изобретение обеспечивает композициии, содержащие RG-115830 или RG-115932. [0225] Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированные дендритные клетки и клетки, отличные от дендритных клеток и поддерживающих терапию клеток, которые содержат, по меньшей мере часть рецептора экдизона. Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированные дендритные клетки и клетки, отличные от дендритных клеток и поддерживающих терапию клеток, которые содержат зависимый от рецептора экдизона переключатель гена. Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированные дендритные клетки и клетки, отличные от дендритных клеток и поддерживающих терапию клеток, которые содержат RheoSwitch. Согласно другому варианту реализации, настоящее изобретение обеспечивает набор, содержащий модифицированные дендритные клетки и клетки иммунной системы, отличные от дендритных клеток и поддерживающих терапию клеток, которые содержат переключатель гена, и лиганд, модулирующий переключатель гена. Согласно другому варианту реализации, указанные наборы содержат также диацилгидразиновый лиганд. Согласно другому варианту реализации, эти наборы содержат RG-115830 или RG-115932. [0226] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает популяции модифицированных дендритных клеток. На 7-й день культивированные дендритные клетки были либо оставлены интактными, либо инфицированы рекомбинированным аденовирусом, кодирующим IL-12p70 мыши и регулируемым конститутивным (rAd.cIL12) или индуцируемым (rAd.RheoIL12) промотором, либо были инфицированы контрольным аденовирусом без вставки (rAd\|/5), в спектре множественного инфицирования (МОГ). Через 48 часов, инфицированные дендритные клетки собрали и провели анализ фенотипа, а также исследовали на предмет выработки IL-12p70 с применением специфического набора иммуноферментного анализа ИФА (ELISA kit, BD- PharMingen, San Diego, CA), причем нижний порог детекции составлял 62,5 пг/мл. [0227] Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированную in vitro популяцию дендритных клеток, клеток иммунной системы, отличных от дендритных клеток, либо содержащих вектор поддерживающих терапию клеток (TSC), например, содержащих ДНК вектор, включающий в себя переключатель гена, способный регулируемо вырабатывать белок, обладающий функцией интерлейкина-12, и содержащих активирующий лиганд. Согласно другому варианту реализации, настоящее изобретение обеспечивает модифицированную in vitro популяцию дендритных клеток, клеток иммунной системы, отличных от дендритных клеток, либо содержащих вектор поддерживающих терапию клеток (TSC), например, содержащих ДНК вектор, включающий в себя переключатель гена, способный к регулируемой экспрессии белка, обладающего функцией интерлейкина-12 и/или белок, обладающий функцией интерферона-альфа, и содержащих активирующий лиганд. [0228] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ лечения злокачественных опухолей, например, меланомы или глиомы, путем введения модифицированных дендритных клеток, клеток иммунной системы, отличных от дендритных клеток и поддерживающих терапию клеток пациенту, и последующим введением активирующего лиганда, как, например, RG-115919, RG- 115830 или RG-115932, указанному пациенту. Пациентом может быть пораженный злокачественной опухолью человек или животное. Способы и материалы, применяемые в лечении, модифицированные клетки, наборы и лиганды могут быть применены в лечении людей и в ветеринарии. Поэтому, применение способов и материалов рассматривается в отношении лечения людей и в ветеринарных целях. [0229] Настоящее изобретение предполагает, что регулируемая экспрессия белка IL-12 в дендритных клетках (обозначаются как DC.RheoIL12), в клетках иммунной системы, отличных от дендритных клеток или в поддерживающих терапию клетках может вызвать иммунный импульс в опухоли на раннем этапе и, позднее, в инфильтрованных опухолью лимфатических узлах, причем такой результат не может быть достигнут при применении традиционных схем генной терапии. Более того, оказалось, что согласование во времени экспрессии интерлейкина-12 после введения модифицированных дендритных клеток, отличных от дендритных клеток иммунных клеток или поддерживающих терапию клеток является критичным для успешного лечения злокачественных опухолей. [0230] В одном аспекте, настоящее изобретение обеспечивает фармацевтическую композицию, подходящую для введения человеку или другому животному и содержащую популяцию модифицированных in vitro дендритных клеток, отличных от дендритных клеток иммунной системы или поддерживающих терапию клеток, регулируемо вырабатывающих белок, обладающий функцией интерлейкина-12, либо регулируемо вырабатывающих IL-12 и/или интерферон-альфа, притом, что форма данной композиции является подходящей для внутриопухолевого введения. Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, содержащую активирующий лиганд, такой, как RG-115830 или RG-115932, причем эта композиция пригодна для внутрибрюшинного, орального или подкожного введения. [0231] Согласно конкретному варианту реализации, настоящее изобретение обеспечивает способ лечения опухоли, включающий: a) внутриопухолевое введение млекопитающему модифицированных in vitro дендритных клеток, описанных выше; и b) введение вышеуказанному млекопитающему терапевтически эффективного количества активирующего лиганда. [0232] Например, настоящее изобретение обеспечивает способ лечения опухоли, включающий в себя стадии, следующие в описанном ниже порядке: a) обеспечение модифицированных in vitro дендритных клеток; b) внутриопухолевое введение млекопитающему вышеуказанных модифицированных in vitro дендритных клеток; и c) введение вышеуказанному млекопитающему терапевтически эффективного количества активирующего лиганда. [0233] Согласно другому варианту реализации, настоящее изобретение обеспечивает способ лечения опухоли, включающий в себя: a) внутриопухолевое введение млекопитающему модифицированных in vitro отличных от дендритных клеток клеток иммунной системы, например, макрофагов, нейтрофилов, тучных клеток, эозинофилов, базофилов, NK-клеток и лимфоцитов (например, В и Т-клеток), либо поддерживающих терапию клеток, описанных выше; и b) введение вышеуказанному млекопитающему терапевтически эффективного количества активирующего лиганда. [0234] Согласно одному из вариантов реализации, модифицированные in vitro дендритные клетки, отличные от дендритных клеток клетки иммунной системы или поддерживающие терапию клетки вводят один раз. Согласно другому варианту реализации, дендритные клетки, отличные от дендритных клетки иммунной системы или поддерживающие терапию клетки вводят несколько раз, при условии, что единичное введение оказалось безопасным и хорошо переносимым, и что дополнительные введения принесут пользу пациенту. Критерием для повторного введения является то, что состояние пациента неизменно или характеризуется клиническими (т.е., результаты компьютерной томографии (регресс опухоли(ей)), химических исследований сыворотки, анализа мочи, гематологии, жизненных сигналов, уменьшение диаметра опухоли и т.п.), либо субъективными признаками улучшения (т.е. улучшающийся статус ECOG и т.п.). Повторное лечение может быть начато на 1, 2, 3 или 4-й неделе, на 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12-м месяце, либо на 1, 2, 3, 4 или 5-й год после первичного лечения. [0235] Эффективность и безопасность множественных доз трансгена можно оценить с помощью аспирационной биопсии опухоли и дренирующих ее лимфатических узлов тонкой иглой. Эти анализы могут быть получены на -12-й - -7-й и на 14-й день периода повторного лечения для получения данных об экспрессии трансгена IL-12 человека и о клеточном иммунном ответе in vivo. Результаты биопсии можно проанализировать с помощью стандартной световой микроскопии и иммуногистохимии для оценки клеточной инфильтрации Т-клеток в опухоль и дренирующие ее лимфатические узлы, а ОТ-ПЦР на РНК может быть проведена с соответственно приготовленными праймерами. Для получения цитокинового профиля сыворотки, кровь может быть взята в дни -12-й - -7-й, на 8-й и на 14-й дни периода повторного лечения. Профиль сывороточных цитокинов может быть получен для определения, оказало ли влияние лечение трансгеном IL-12 человека на экспрессию других цитокинов. Мультиплексный анализ цитокинов можно провести в сыворотке с помощью Luminex для IL- 12, интерферона-гамма, IP-10 и других цитокинов Thl/Th2, таких как IL- 1, фактора некроза опухолей-альфа, IL-4, IL-5 и IL-10. [0236] Согласно одному из вариантов реализации, активирующий лиганд вводят практически одновременно с модифицированными in vitro дендритными клетками, отличными от дендритных клеток клетками иммунной системы или поддерживающими терапию клетками, например, в течение одного часа до или после введения клеток. Согласно другому варианту реализации, активирующий лиганд вводят в течение приблизительно 24 часов после введения модифицированных in vitro дендритных клеток, клеток иммунной системы, отличных от дендритных клеток или поддерживающих терапию клеток. Согласно другому варианту реализации, активирующий лиганд вводят в течение приблизительно 48 часов после введения модифицированных in vitro дендритных клеток, клеток иммунной системы, отличных от дендритных клеток или поддерживающих терапию клеток. Согласно другому варианту реализации, лигандом является RG-115932. Согласно другому варианту реализации, лиганд вводят в дозе, равной приблизительно 1-50 мг/кг/в день. Согласно другому варианту реализации, лиганд вводят в дозе, равной приблизительно 30 мг/кг/в день. Согласно другому варианту реализации, лиганд вводят ежедневно в период с 5-й по 28-й день. Согласно другому варианту реализации, лиганд вводят ежедневно в течение 14 дней. Согласно другому варианту реализации, вводят от 1 × 106 до 1 × 108 клеток. Согласно другому варианту реализации, вводят 5 × 107 клеток. [0237] Для демонстрации эффективной IL-12-опосредованной генной терапии, применяют регулируемую IL-12 кДНК систему экспрессии, которая позволяет инициировать выработку IL- 12 клетками DC.RheoIL12 в различные временные моменты после внутриопухолевой инъекции. Основываясь на результатах, полученных в модели агрессивной меланомы В 16 в мышах C57BL/6, были сделаны следующие выводы: 1) клетки DC.RheoIL12 выделяют повышенные количества интерлейкина-12 в присутствии активирующего лиганда RG-115830, но в отсутствие лиганда этого не происходит; 2) эффективность внутриопухолевой DC.RheoIL12-опосредованнойl терапии соответствует эффективности внутриопухолевой DС.сЕL12-опосредованной терапии, когда RG-115830 вводится животным в течение 24 часов после введения дендритных клеток (в случаях, когда лиганд вводится позже, терапия DC.RheoIL12 оказывается неэффективной); 3) экспрессия IL-12 в дендритных клетках продлевает выживаемость этих клеток в микропространстве опухоли и связана с увеличенным количеством внутриопухолево введенных дендритных клеток, мигрирующих в дренирующие опухоль лимфатические узлы; и 4) главным иммунным коррелятом результата терапии является уровень опухоль-специфичных CD8+Т-клеток, перекрестно примированных терапией, а не количество введенных дендритных клеток, остающихся в микропространстве опухоли. В целом, эти данные указывают на то, что, скорее всего, DC.IL12-опосредованная терапия оказывается успешной благодаря ее положительному влиянию на афферентные (перекрестно примированные) эффекторные CD8+Т-клетки 1 Типа, но не на более поздние эфферентные процессы, такие как вызванный введением дендритных клеток рекрутинг противоопухолевых Т-клеток в микропространство опухоли и т.п. [0238] Перед внутриопухолевой инъекцией, клетки (иммунные клетки или поддерживающие терапию клетки) могут быть обработаны фактором, стимулирующим клеточную активность. Например, клетки можно обрабатывать костимуляторной молекулой, такой, как положительные костимуляторы, включая OX40L, 4- IBBL, CD40, CD40L, GITRL, CD70, LIGHT или ICOS-L или отрицательные костимуляторы, включая антитела aHra-CTLA4, анти-PD-Ll или aHTH-PD-L2. Например, клетки (дендритные клетки, иммунные клетки или поддерживающие терапию клетки) можно инкубировать с клеткой, вырабатывающей одну или несколько костимуляторных молекул, например, клетки лимфомы J588, которые экспрессируют молекулу лиганда CD40. Согласно другому варианту реализации, клетки (иммунные клетки или поддерживающие терапию клетки) могут быть обработаны молекулой контр-иммунодепрессанта (ингибитора толерантности), как, например, анти-трансформирующий фактор роста-бета (TGF-beta) антитела (для подавления сигнальной системы трансформирующего фактора роста в микропространстве), анти IL-10 антитела, трансформирующий фактор роста-бета RTI DN (для подавления сигнальной системы трансформирующего фактора роста в клетках с модифицированным геном), IL-IOR DN, dnFADD (для подавления в клетках путей гибели клетки), анти-SOCSl антитела, малые интерферирующие РНК (siPHK), либо «ловушки» (приманки) (для подавления супрессивной цитокиновой сигнальной системы в клетках), либо анти-трансформирующий фактор роста-альфа антитела. [0239] Выработка интерлейкина-12 дендритными клетками или другими антиген-презентирующими клетками, взаимодействующими с CD4+и CD8+Т-клетками, инициирует их получение фенотипа ТЫ или Tel, соответственно. Поэтому, эффект IL-12 на популяции клеток может быть оценен путем измерения уровня экспрессии или активности цитокинов типа Thl/Tcl, интерферона-гамма в биологическом образце, взятом у пациента. [0240] В целях настоящего изобретения также обеспечивается способ определения эффективности терапевтического режима онкологических больных, опосредованного модифицированными in vitro дендритными клетками, отличными от дендритных клеток клетками иммунной системы или поддерживающими терапию клетками (TSC), включающему: a) измерение уровня экспрессии и/или активности интерферона-гамма (IFN-y) в первом биологическом образце, полученном от пациента-человека до введения in vitro модифицированных дендритных клеток, отличных от дендритных клеток клеток иммунной системы или поддерживающих терапию клеток с получением контрольного уровня; b) внутриопухолевое введения указанному пациенту модифицированных in vitro дендритных клеток, отличных от дендритных клеток клеток иммунной системы или TSC; c) введение указанному пациенту эффективного количества активирующего лиганда; d) измерение уровня экспрессии и/или активности интерферона-гамма (IFN-y) во втором биологическом образце, полученном от указанного пациента после введения указанного активирующего лиганда с получением тестового уровня; и e) сравнение указанных контрольного и тестового уровня интерферона-гамма, причем данные, показывающие увеличение уровня экспрессии и/или активности интерферона-гамма, соответствующих тестовому уровню по сравнению с контрольным уровнем, говорят об эффективности терапевтического режима в отношении данного пациента. [0241] Согласно одному из вариантов реализации, настоящее изобретение обеспечивает способ определения эффективности терапевтического режима онкологических больных, опосредованного модифицированными in vitro отличными от дендритных клеток клетками иммунной системы или поддерживающими терапию клетками (TSC), включающий: a) измерение уровня экспрессии и/или активности интерферона-гамма (IFN-y) в первом биологическом образце, полученном от пациента-человека до введения модифицированных in vitro дендритных клеток, отличных от дендритных клеток клеток иммунной системы или поддерживающих терапию клеток с получением контрольного уровня; b) внутриопухолевое введения указанному пациенту модифицированных in vitro клеток иммунной системы, отличных от дендритных клеток или поддерживающих терапию клеток; c) введение данному пациенту эффективного количества активирующего лиганда; d) измерение уровня экспрессии и/или активности интерферона-гамма (IFN-y) во втором биологическом образце, полученном от указанного пациента после введения указанного активирующего лиганда с получением тестового уровня; и е) сравнение указанных контрольного и тестового уровня интерферона-гамма, причем данные, показывающие увеличение уровня экспрессии и/или активности интерферона-гамма, соответствующих тестовому уровню по сравнению с контрольным уровнем, говорят об эффективности терапевтического режима для данного пациента. [0242] Термины «субъект», «индивидуум» относятся к интактному насекомому, растению или животному. Также, подразумевается, что действие лигандов будет не менее эффективным, когда субъектом является гриб или дрожжи. Термин «субъект» относится к любому субъекту, в частности, млекопитающему, диагноз, прогноз или терапию по отношению к которому необходимо получить. Млекопитающие включают в себя (но не ограничиваются) людей, домашних животных, сельскохозяйственных животных, животных, обитающих в зоопарке таких, как медведи, животных, относящихся к спорту, домашних любимцев таких, как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, домашний скот, медведи, коровы; приматов таких, как низшие обезьяны, высшие обезьяны, орангутаны и шимпанзе; собачьих таких, как собаки и волки; кошачьих, как кошки, львы и тигры; непарнокопытных таких, как лошади, ослы и зебры; животных, принимающихся в пищу, как коровы, свиньи и овцы; копытных, как олени и жирафы; грызунов, как крысы, мыши, хомяки и морские свинки; и так далее. Согласно определенным вариантам реализации, животным является человек. [0243] Термин «животное» охватывает единичное «животное», а также некое количество «животных» и подразумевает млекопитающих и птиц, а также рыб, пресмыкающихся и амфибий. Также, термин животное охватывает модельных животных, например, животные модели заболеваний. Согласно некоторым вариантам реализации, к термину животное относятся ценные животные, в отношении экономики или в каком-либо ином смысле, например, экономически значимый племенной сток, участвующие в скачках животные, животные для представлений, переданные по наследству животные, редкие или исчезающие животные, животные-спутники. В частности, млекопитающим может быть человек, животное, принимающееся в пищу или животное-компаньон. [0244] В настоящем описании, термин «нуждающееся в лечении млекопитающее» относится к млекопитающему, которое необходимо вылечить, т.е., уменьшить размер опухоли, либо ликвидировать ее. [0245] Способ согласно настоящему изобретению зависит от захвата опухолевых антигенов из окружения опухоли внутриопухолево введенными дендритными клетками и примирование Т-клеток в дренирующих опухоль лимфатических узлах с развитием опухоль-специфичного Т-клеточного ответа. Поэтому, для оптимального положительного лечебного эффекта, во время внутриопухолевой инъекции дендритные клетки должны быть в статусе высокой эндоцитотической активности. Было показано, что незрелые дендритные клетки, полученные из CD 14+моноцитов путем их обработки гранул оцитарно-моноцитарным колониестимулирующим фактором (GM-CSF) и IL-4 в течение 6-7 часов, имеют незрелый фенотип и показывают высокую скорость эндоцитоза, т.е. обладают высокой эндоцитотической активностью (Cella et al., 1999; Gilboan, 2007). Созревание дендритных клеток связано с подавлением эндоцитотической активности. Имеющиеся данные свидетельствуют о том, что IL-12 оказывает влияние на незрелые дендритные клетки и дает сигнал к экспрессии факторов, индуцирующих созревание (Nagayama et al., 2000). Поэтому применение переключателя гена RheoSwitch® Therapeutic System (RTS), позволяет оптимизировать терапевтический результат у людей задержкой экспрессии интерлейкина-12 в трансдуцированных дендритных клетках до момента их введения в опухоль. Так как система конститутивной экспрессии не обладает способностью временного контроля экспрессии, аутокринное действие вырабатываемого IL-12 и вызванный этим процесс созревания не может регулироваться (Mazzolini et al., 2005). Кроме этого, изобретение, тестирующее производительность регулируемой системы экспрессии генов в человеке, может найти применение в других областях генной терапии человека. [0246] Без ограничения рамками какой-либо теории, предполагается, что настоящее изобретение будет способствовать применению терапии, опосредованной внутриопухолево вводимыми модифицированными in vitro дендритными клетками, отличными от дендритных клеток клетками иммунной системы или поддерживающими терапию клетками, в клинических ситуациях, фокусирующихся на объективном клиническом результате в качестве первого результата исследования, и на перекрестно примированных (инициированных) противоопухолевых CD8+Т-клетках (вырабатывающих интерферон-гамма) в качестве второго результата исследования. Согласно полученным данным, возможность включать и выключать экспрессию интерлейкина-12 in vivo привносит в лечение элемент безопасности и терапевтического контроля как за счет того, что введением лиганда можно контролировать время и уровень экспрессии IL-12, так и за счет того, что время экспрессии IL-12 считается критичным по отношению к терапевтической эффективности способа. [0247] Настоящее изобретение дополнительно способствует терапевтическому применению модифицированных in vitro клеток, регулируемо экспрессирующих представляющие интерес гены, в качестве инновационных средств для эффективного и успешного лечения заболеваний у людей. [0248] В случае выявления противоречий между любой идеей или предположением в любой ссылке, указанной в данном описании, и настоящей заявкой, в рамках настоящего изобретения последняя будет иметь преимущественную силу (превалировать). [0249] Специфические варианты реализации согласно способам настоящего изобретения описаны в нижеследующих примерах, которые являются исключительно иллюстративными и не ограничивают настоящее изобретение каким-либо образом. ПРИМЕРЫ Пример 1 DC.RheoIL12 регулируемо вырабатывает большие количества IL-12p70 под воздействием лиганда RG-115830 in vitro 1.1 Материалы и Методы 1.1.1 Мыши [0250] 6-8-недельных самок мышей C57BL/6 дикого типа и мышей C57BL/6-TgN(ACTbEGFP) 1 Osb/J EGFP Tg приобрели у Jackson Laboratory (Bar Harbor, ME) и содержали их в клетках микроизоляторных клетках. С животными обращались в соответствии с рекомендациями по правильному уходу и использованию лабораторных животных. 1.1.2 Клеточные линии [0251] Клеточные линии меланомы В16 и EL-4 тимомы Н-2b, изогенные по отношению к мышам C57BL/6, были описаны ранее (Itoh et al, 1994). Линии клеток инкубировали в питательной среде (RPMI 1640, вместе с 10% фетальной бычьей сывороткой, инактивированной нагреванием, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 10 мМ L-глутамина; все реагенты получены у Invitrogen, Carlsbad, СА) в увлажненном инкубаторе в 5% СО2 и 37°С. 1.1.3 Получение дендритных клеток (DC) [0252] Дендритные клетки получили из костного мозга мыши, как описано ранее (Tatsumi et al., 2003). Вкратце, костный мозг мыши дикого типа или мыши EGFP Tg культивировали в питательной среде, содержащей 1000 ед./мл рекомбинантного гранулоцитарно-макрофагального колониестимулирующего фактора мыши и рекомбинантного IL-4 мыши (Peprotech, Rocky Hill, NJ) при 37°C в увлажненном инкубаторе в 5% СО2 и 37°С в течение 7 дней. CD1 1 с+дендритные клетки затем отделили с помощью специфических гранул MACSTM, в соответствии с протоколом производителя (Miltenyi Biotec, Auburn, С A). CD1 1 с+дендритные клетки, полученные таким образом, были беспримесными на более чем 95%, как показала морфология и коэкспрессия CD1 lb, CD40, CD80 и антигенов главного комплекса гистосовместимости 1-го и 2-го класса. 1.1.4 Вирусные векторы [0253] Контрольные аденовирусные векторы rAd.ψ5 и rAd.cIL12, кодирующие IL-12 мыши и контролируемые промотором цитомегаловируса (Tatsumi et al., 2003), были созданы и предоставлены Векторным Центром (Vector Core Facility) Института Онкологии при Университете Питсбурга. [0254] Вектор rAd.RheoIL12 получили следующим образом. Кодирующие последовательности VP16-RXR и Gal4-EcR, разделенные участком внутренней посадки рибосомы (IRES) вируса энцефаломиокардита (EMCV), ввели в аденовирусный челночный вектор под контролем промотора убиквитина С человека. Затем, кодирующие последовательности субъединиц р40 и р35 IL-12, разделенные последовательностью участка внутренней посадки рибосомы и помещенные под контроль синтетического индуцируемого промотора, вставили в направлении 5' относительно промотора убиквитина С (См. Фигура 1). Применение системы, заключающееся в экспрессии двух рекомбинантных белков (VP-16 RXR v. Gal4-EcR) под контролем разных промоторов разной силы показала, что более высокое соотношение экспрессии VP16-RXR к экспрессии Gal4-EcR дает наилучшую производительность. Таким образом, расположение VP-16 RXR с 5' конца участка внутренней посадки рибосомы, a Gal-4 EcR с 3' конца участка внутренней посадки рибосомы обеспечило оптимальную производительность, в сравнении с обратным взаиморасположением. [0255] Челночный вектор, несущий единицы транскрипции двух рекомбинантных белков и индуцируемые субъединицы интерлейкина-12, рекомбинировали с основной кодирующей последовательностью аденовируса (AdEasyl, stratagene, La Jolla, CA) в клетках BJ5183 E.coli. После того, как выявили образование рекомбинантного клона, в клетках XLIO- GoId размножили плазмиду, несущую геном rAd.RheoIL12, которую затем выделили из клеток, после чего основную кодирующую последовательность плазмиды отщепили и путем трансфекции ввели в клетки НЕК 293. [0256] Полученный первичный препарат вирусов амплифицировали повторным инфицированием клеток НЕК 293, а затем очистили центрифугированием в градиенте концентрации хлорида цезия. 1.1.5 ИФА (ELISA) [0257] На 7 день необработанные дендритные клетки инфицировали рекомбинантным Ads кодирующим IL-I2p70 мыши, регулируемым конститутивным (rAd.cIL12) или индуцируемым (rAd.RheoIL12) промотором, либо инфицировали, контрольным вектором rAd.ψ5 в рамках MOI. Начиная с различных моментов времени после этого (0 - 48h) дендритные клетки культивировали в отсутствие или присутствие активирующего лиганда (10-200 мкг/мл) в течение еще 24 часов, после чего секрецию IL-12p70 измерили с помощью специфического набора иммуноферментного анализа (ELISA kit) (BDPharMingen, San Diego, CA; нижний порог детекции=62.5 pg/мл). В некоторых случаях, для выявления точности регулируемой выработки цитокинов, дендритные клетки инфицировали rAd.RheoIL12 (т.е., DC.RheoIL12), заранее обработанным активирующим лигандом, затем лиганд удалили промыванием, а клетки выращивали в контрольной питательной среде еще 24 часа для оценки выработки IL-12p70. В качестве альтернативы, через 48 часов инфицированные дендритные клетки выделили и проконтролировали в отношении фенотипа и синтеза IL-12p70 с помощью набора иммуноферментного анализа (ELISA kit) (BD-PharMingen, San Diego, CA), нижний порог детекции=62.5 pg/мл. 1.1.6 Поточная цитометрия [0258] Для анализа фенотипа инфицированных аденовирусом клеток, применили РЕ- или FITC-конъюгированные антитела (mAb), специфичные к поверхностным молекулам клеток мыши (CD1 lb, CD1 Ic, CD40, CD54, CD80, CD86, H-2Kd, I-Ad (все из BD-PharMingen)) и соответствующие изотипичные контроли, после чего провели цитометрический анализ с помощью поточного цитометра FACscan (Becton Dickinson, San Jose, CA). 1.2 Результаты 1.2.1 Взятые из костного мозга дендритные клетки мыши, инфицированные Rheo-ILl 2, регулируемо синтезировали большие количества IL-12p70 при обработке лигандом in vitro. [0259] Дендритные клетки из костного мозга мышей C57BL/6 (В6) культивировали в течение 7 дней в присутствии рекомбинантного IL-4 мыши и рекомбинантного гранулоцитарно- макрофагального колониестимулирующего фактора мыши, после чего часть оставили необработанными, а часть инфицировали различными MOI под контролем rAd.ψ5, rAd.cIL-12 (кодирующим р70 IL-12 мыши под регуляцией конститутивного цитомегаловирусного промотора) или rAd.RheoIL12 (кодирующим р70 IL- 12 под регуляцией регулируемого промотора, реагирующего на малый молекулярный лиганд RG-115830). Через 48 часов после инфицирования, дендритные клетки культивировали в отсутствие или присутствие RG-115830 еще 24 часа, после чего надосадочную жидкость культур собрали для количественного анализа выработки IL-12p70 с помощью иммуноферментного анализа. Как видно из Фигуры 2 А, контрольные неинфицированные дендритные клетки и дендритные клетки, инфицированные Ad.ψ5, в отсутствие или присутствие экзогенного препарата, не вырабатывали повышенных количеств IL-12р70 по сравнению с дендритными клетками, инфицированными rAd.cIL12 (DC.cIL12). Дендритные клетки, инфицированные rAd.RheoIL-12 (DC.RheoIL12), синтезировали IL-12p70 лишь после обработки RG-115830 (см. Фигура 2А и 2 В). Судя по результатам перекрестных экспериментов, оптимальная выработка ГЬ-12р70 дендритными клетками произошла при значении множественного инфицирования (MOI), равном 100, где клетки обработали 50-200 мкг/мл RG-115830 (Фигура. 2А). Отсроченное обеспечение RG-115830 для DC.RheoIL12, достигающее 48 часов, не привело к какому-либо значительному понижению выработки EL-12p70 по сравнению с тем, когда лиганд добавляли in vitro одновременно с инфицированием (Фигура 2 В). В заключение, удаление лиганда резко подавило способность DC.RheolL12 (до этого времени активируемый лигандом) продолжать выработку повышенного количества IL-12p70 in vitro (Фигура 2С). Пример 2 Внутриопухолевое введение модифицированных in vitro дендритных клеток животным 2.1 Материалы и методы 2.1.1 Опухолевая модель В16 [0260] Мышам В6 в правый бок подкожно ввели 1 × 105 клеток меланомы В16 в день 0. На 7 день, опухоли достигли диаметра, приблизительно равного 20-30 mm2, после чего мышам внутриопухолево ввели (PBS) или 1 × 106 контрольных либо трансдуцированных аденовирусом (множественное инфицирование MOI=100) дендритных клеток в общем объеме PBS, равном 50 мкл. Также, для инициации, мышам внутрибрюшинно ввели 200 мкг RG-115830 (в 50 мкл диметилсульфоксида (DMSO)), либо контрольного носителя DMSO, одновременно, через 24 ч или через 48 ч после введения дендритных клеток, как указано. После инициации, мышам в течение 5 дней ежедневно внутрибрюшинно вводили RG-115830 в тех же дозах. В дополнительных исследованиях, лиганд вводили, начиная со дня введения дендритных клеток, затем инъекции прекращали через 1, 3 или 5 дней после инъекции дендритных клеток для определения, понижает ли раннее прекращение стимуляции трансгена IL-12p70 терапевтическую эффективность данного способа. Во всех случаях, размер опухоли контролировали каждые 3 или 4 дня и фиксировали в мм2 путем вычисления произведения наибольших перпендикулярных диаметров, измеренных штангельциркулем с нониусом. Все данные запротоколировали в виде средней площади опухоли±стандартное отклонение. Группы животных включали в себя 5 особей. [0261] В указанных экспериментах, животных, избавившихся от опухоли, через 45 дней после проведения терапии повторно инфицировали клетками меланомы В16 (105 клеток ввели в левый бок, т.е. со стороны, противоположной месту первичной инфекции В16) и карциномы толстой кишки МС38 (105 клеток в правый бок) для определения наличия и специфичности иммунной памяти у этих мышей. Все данные протоколировали в виде средней площади опухоли±стандартное отклонение. Группы животных включали в себя 5 особей. [0262] Для оценки поведения и функции введенных дендритных клеток, 7-дневные дендритные клетки CD1 1 с+, взятые из костного мозга, выделили из мышей C57BL/6-TgN(ACTbEGFP) 1 Osb/J EGFP Tg. Дендритные клетки EGFP+CD1 Ic+не инфицировали или инфицировали вирусами rAd, как описано выше. Через 48 часов после заражения, собрали 1 х 106контрольных или зараженных вирусом дендритных клеток, промыли в PBS и ввели в места поражения 7-дневной опухолью В16 изогенных мышей В6. Через 3 дня после введения дендритных клеток, произвели резекцию опухоли и паховых лимфатических узлов, зафиксировали их выдерживанием в течение 1 часа в 2% параформальдегиде (на PBS) и подвергли криопротекции в 30% сахарозе на PBS перед шоковой заморозкой в изопентане, охлажденном жидким азотом. Изготовленные пятимикронные срезы контрастно окрасили трехминутным промыванием 2 мг/мл Hoechst 33258 (Sigma-Aldrich, St. Louis, МО). Промытые срезы заключили в Gelvatol (Monsanto Chemical Co., St. Louis, МО) и микроскопировали с помощью микроскопа Olympus ВХ51, снабженного охлаждаемой цветной камерой с полупроводниковым детектором света (с ПЗС-матрицей). 2.1.2 Оценка специфического CD8+Т-клеточного ответа в отношении меланомы В16 [0263] Объединенные CD8+Т-клетки выделяли до степени очистки, превышающей 95% из селезенок обработанных мышей 2 особи/группа через 25 дней после прививки опухолей, произведенной сортировки клеток с помощью магнитных гранул (MACSTM; Miltenyi Biotec), затем их повторно культивировали (1 х 105/ячейка) с 1 х 104 облученными (10,000 рад) опухолевыми клетками В16 или EL-4. После 48-часовой инкубации, надосадочную жидкость культур собрали и проконтролировали на предмет выработки интерферона-гамма с помощью коммерческого иммуноферментного анализа (BD-PharMingen), с нижним порогом детекции, равном 31,5 пг/мл. Все данные запротоколировали в виде средней площади опухоли±стандартное отклонение. 2.1.3 Статистический анализ [0264] Все исследования, проведенные с тремя или более группами, где лечение проводилось в абсолютно произвольном порядке, сначала анализировали с помощью одно- и двухфакторного дисперсионного анализа (ANOVA). Если полученное значение Р было намного ниже 3.05, специфические попарные отличия оценивали с применением Т-теста с коррекцией по Вельчу для неравных вариаций. Параметры распределения данных проверили, после чего применили соответствующие преобразования. Результаты анализа продукции интерферона-гамма Т-клеток, полученных из селезенки, подвергли точному тесту Краскала-Уоллиса. Если значение Р теста Краскала-Уоллиса было ниже 0.05, полученные ранее разницы оценивали тестом Вилкоксона. Анализ моделей лечения мыши единичной терапевтической прививки опухоли проводился со смешанными линейными моделями. Данные протокола откорректировали, в соответствии с ковариацией и постоянные эффекты лечения округлили с учетом произвольных индивидуальных эффектов. Необработанные значения Р для одновременного сравнения пар групп определили методом «расшнурованной» выборки (bootstrap method). Значения скорости отторжения опухоли привели к генерализованной линейной модели (с биномиальной связью), включающую в себя исследуемую группу, день наблюдения и их взаимосвязь. 2.2 Результаты 2.2.1 Внутриопухолевое введение только DC.cIL12 или DC.RheoIL12 вместе с внутрибрюшинным введением RG-115830 вызывает регресс образовавшихся подкожных поражений меланомой В16. [0265] Изогенным мышам H-2b В6 подкожно ввели клетки меланомы В16 (1 х 105), после чего опухоли позволили развиться. На 7 день, мышей разбили на группы, по 5 особей в каждой, со средним диаметром опухоли в группе, равным приблизительно 20-30 мм2. Затем, мышам провели инъекции PBS или 106 дендритных клеток (предварительно инфицированных in vitro rAd.ψ5, rAd.cIL12 или rAd.RheoIL12 48-часовой инкубацией) в общем объеме 50 мкл PBS. Также животным провели внутрибрюшинные инъекции диметилсульфоксида DMSO или RG-115830 (в DMSO) одновременно с введением дендритных клеток (т.е. на 1 день лечения), либо через 24 ч, либо через 48 ч после введения дендритных клеток (т.е. на 2 день лечения). Как показано на Фигуре 3А и 3В, лечение мышей одним RG- 115830 или одним DC.RheoIL12 в отсутствие RG-115830 не оказало никакого терапевтического эффекта. Напротив, опухоли, которые лечили DCcIL-12 или DC.RheoEL-12+RG-115830 (введенными в течение 24 ч после инъекции дендритных клеток 5-дневным курсом), уменьшились в размере в течение следующих 3 недель. Эти терапевтические методы оказались статистически одинаковыми, в отношении размера опухолей, и вызвали регресс опухолей в 100% (5 мышей из 5) случаев. Любопытно, что когда введение RG-115830 было отсрочено до 48 часов после внутриопухолевой инъекции DC (временной точки, когда этот агент может эффективно стимулировать выработку IL-12p70 DC.RheoIL-12 in vitro, см. Фигура 2 В), DC.RheoIL12-опопсредованная терапия привела к незначительному подавлению скорости роста опухоли (р<0.05 для всех временных точек после 10 дня), при этом, опухоль у всех животных прогрессировала, и их пришлось усыпить на 30 день (Фигура ЗА). Это предполагает, что лечебный эффект внутриопухолевого введения DC.IL12 находится в критической зависимости от выработки IL-12p70 особенно на раннем этапе (происходящей, судя по всему, в месте опухолевого поражения и/или в дренирующих опухоль лимфатических узлах). [0266] Также провели дополнительные эксперименты, в которых активирующий лиганд (RG-115830) вводили получившим DC.RheolL-12 мышам в течение 1, 3 или 5 дней после инъекции дендритных клеток (Фигура ЗВ-ЗС). Результаты этих исследований показали, что раннее прекращение введения лиганда влияет на противоопухолевую эффективность внутриопухолево введенного DC.RheolL-12, причем подавление роста опухоли ограничивается или прекращается, если введение лиганда отсрочено на 5 и более дней после введения генетически модифицированных дендритных клеток. Эти данные сходятся с данными, иллюстрированными на Фигурах 2 В и 2С, и подтверждают жесткую (лиганд-зависимую) регуляцию терапевтического воздействия, вызванного введенными DC.RheolL-12 в данной модели. Кроме того, рассмотренные в совокупности, результаты, иллюстрированные на Фигура 3, определенно подразумевают, что оптимальный противомеланомный эффект, обусловленный внутриопухолевым введением DC.RheoIL12, возникает благодаря введению лиганда в период с 1 по 5 день после инъекции дендритных клеток в опухоли В16. 2.2.2 Отсроченная активация регулируемой терапии DC.RheoIL12 является неэффективной ввиду очевидной неспособности дендритных клеток выживать in vivo. [0267] Наше предыдущее сообщение (Tatsumi et al, 2003) предполагает, что введение гена IL-12 в дендритные клетки способствует лучшей выживаемости этих клеток после их инъекции в микропространство опухоли, и вследствие этого, обеспечивает способность этих клеток перекрестно примировать (инициировать) противоопухолевые CD8+Т-клетки и рекрутировать циркулирующие эффекторные Т-клетки в опухолевое микропространство in vivo. Таким образом, следующая попытка была направлена на определение, была ли отрицательная эффективность DC-RheoIL12-опосредованной терапии, инициированной (внутрибрюшинным введением RG-115830) через 48 ч после инъекции дендритных клеток, обусловлена неспособностью дендритных клеток существовать в опухолевом микропространстве, неспособностью этих клеток проникать в дренирующие опухоль лимфатические узлы и/или неспособностью специфичных CD8+Т-клеток перекрестно примироваться (инициироваться) в результате лечения. Эксперименты, иллюстрированные на Фигуре 3 А, провели повторно, при этом усыпляли по 2 мыши на группу через 72 ч после внутриопухолевого введения дендритных клеток, с той лишь разницей, что источником костного мозга для получения дендритных клеток были мыши EGFP Tg (H-2b). Опухоль и лимфоузлы подвергли резекции, после чего для анализа дендритных клеток EGFP+флуоресцентной микроскопией приготовили срезы ткани. За оставшимися мышами (по 3 в группе) наблюдали в течение 25 дней, после чего их усыпили, а дендритные клетки объединили со спленоцитами, изолированными для анализа В16-специфичного CD8+Т-клеточного ответа. [0268] Как иллюстрировано на Фигуре 4, наличие EGFP+дендритных клеток в опухоли или лимфоузлах через 72 ч после внутриопухолевой инъекции строго зависело от активации трансгена IL-12 в течение 24-48 ч после введения этих клеток in vivo. Клетки EGFP+DC.cIL12 и DC.RheoIL12 могли быть легко обнаружены в зоне поражения В16, но реже наблюдались в лимфатических узлах мышей, которым внутриопухолево ввели DC.cIL12 или DC.RheoIL12 (если RG-115830 вводили внутрибрюшинно в течение 0-24 ч после введения дендритных клеток). В тканях, взятых у мышей, которым вводили контрольные дендритные клетки (неинфицированные) или DC.RheoIL12 (где введение RG-115830 было отсрочено на 48 после инъекции DC), дендритные клетки были обнаружены в очень малых количествах (или не обнаружены вообще). При сравнении тканей, взятых у мышей, которым ввели DC.RheoIL12 и после этого ввели RG-115830 через 0 ч и 24 ч, было больше EGFP1 дендритных клеток как в самой опухоли (р=0.001), так и в лимфоузлах (р=0.02), в случае, когда активирующий препарат ввели ранее. 2.2.3 Терапевтические преимущества введения DC.RheoIL12 связаны с активацией специфичных CD8+Т-клеток и стойким противоопухолевым иммунитетом [0269] Ввиду очевидной зависимости жизнеспособности введенных дендритных клеток от времени введения лиганда, мы можем предположить, что уровень перекрестного примирования (инициации) специфичных CD8+Т-клеток в случае с мышами, получившими DC.RheoIL12, активированный сразу (временная точка 0 ч), будет выше, по сравнению с мышами, получившими активирующий лиганд в более позднее время. Любопытно, что в то время, как это очевидно подтвердилось в случае, когда сравнивали группы DC.RheoIL-12 0 ч (DC.RheoIL-12, день 1-5) и 48 ч (DC.RheoIL-12, день 3-7), в случае, когда сравнивались группы 0 ч (DC.RheoIL-12, день 1-5) и 24 ч (DC.RheoIL- 12+L, день 2-6), предположение не подтвердилось (Фигура 5А). На самом деле, иммунный ответ селезеночных CD8+Т-клеток in vitro (выделение интерферона-гамма), направленный против соответствующих В16 опухолей и направленный против не соответствующих EL-4 опухолей, оказался сравнимым в отношении этих групп, и в обоих случаях реакция приблизительно соответствовала таковой, наблюдаемой у мышей, которым ввели DC.cIL12. В целом, оказалось, что эти профили CD8+Т-клеточного ответа прямо коррелировали с результатами терапии (Фигура 3А). Как и на Фигуре 5А, иммунная реакция, выражающаяся в выработке интерферона-гамма селезеночными Т-клетками по отношению к специфичным клеткам опухоли В16, по сравнению с реакцией к неспецифичным клеткам МС38, коррелировала с результатами терапии. [0270] Чтобы определить, была ли DС.RhеоIL12-опосредованная терапия эффективной ввиду возникновения стойкого противоопухолевого иммунитета, излеченным от опухоли животным повторно ввели соответствующие клетки меланомы В16 и клетки другой опухоли - карциномы толстой кишки М38 через 45 дней после первичного инфицирования В16. Как показано на Фигуре 5 В, все мыши, прошедшие до этого курс лечения от меланомы В16, показали наличие специфической защитной реакции на клетки В16, в то время как опухоли МС38 характеризовались прогрессирующим ростом. Это доказывает, что дендритные клетки, представленные в настоящем изобретении, обеспечивают дополнительную безопасность и потенциальный терапевтический контроль способа лечения (в том, что как время, так и уровень экспрессии интерлейкина-12 могут быть регулируемы введением лиганда). Пример 3 Сравнение зависимости терапевтического эффекта от пути введения/дозировки лиганда 3.1 Методы и материалы [0271] Клетки меланомы В16, введенные подкожно в правый бок изогенным мышам В6, развивались в течение 7 дней. На 7 день, внутриопухолево ввели 106 DC.SP1-IL12 (оптимальный переключатель показан в сравнении на Фигуре 10). Активирующий лиганд (RG-115932) ввели внутрибрюшинной инъекцией, либо орально через желудочный зонд в Лабразоле (Labrasol), либо с содержащей препарат пищей ad libitum, за день до начала введения дендритных клеток (и затем ежедневно в течение 6 дней). В каждую группу входило 5 животных, рост опухоли контролировали каждые 3-4 дня и протоколировали в виде среднего размера (в мм2, основываясь на произведении ортогональных измерений). Лечение, полученное каждой группой, описано ниже. 3.2 Результаты [0272] Результаты показали, что введение одного лишь лиганда в любых дозах любым путем не оказывает эффекта на рост опухоли В16 (Фигуре 6). DC-SP1 внутриопухолевая терапия эффективна в контроле роста В16, но только в присутствии лиганда, причем все пути введения обеспечивают некоторую степень эффективности. Внутриопухолевая терапия DC-SP1 с внутрибрюшинным введением лиганда дала профиль четкой зависимости между дозировкой и подавлением опухоли, с оптимальным противоопухолевым эффектом при дозировке лиганда, превышающей 30 мг/кг/день. Введение дозы лиганда, равной 30 мг/кг/день, при внутриопухолевой терапии DC-SP1 оказалось одинаково эффективным, если лиганд вводили внутрибрюшинно, орально через зонд или вместе с пищей. Более высокая доза лиганда, принимаемого вместе с пищей, оказалась несколько менее эффективной. Так как только R-оптический изомер (RG-115932) способен активировать RheoSwitch® Therapeutic System (RTS), пища, содержащая рацемическую смесь, обеспечивает лишь с. а. 20-22.5 мг/кг/день активного оптического изомера. В этом отношении, регресс опухоли, наблюдаемый у животных, получавших рацемическую смесь активирующего лиганда с пищей (т.е., -20-22.5 мг/кг/день активного энантиомера RG-115932), соответствовал таковому при внутрибрюшинном введении чистого RG-115932 при том, что противоопухолевый эффект в группе, принимающей препарат с пищей, по интенсивности оказался промежуточным наблюдаемому при внутрибрюшинном введении RG-115932 в группах с дозировками 10 и 30 мг/кг/день. Эти данные подтверждают то, что оральное введение лиганда эффективно в обеспечении терапевтического эффекта. Простота орального введения лиганда облегчит процесс лечения пациентов. [0273] Зависимый от активирующего препарата эффект был связан с (1) экспрессией трансгена в опухоли и дренирующих опухоль лимфоузлах, (2) пролонгируемой выживаемостью Ad-DC в микропространстве опухоли, (3) миграцией и персистенцией Ad-DCs в дренирующих опухоль лимфоузлах и (4) активацией специфичных к В16 CD8+Т-клеток. [0274] На Фигуре 10 показан результат сравнения эффективности различных аденовирусных векторов, содержащих IL -12. Вариант SP 1-RheoIL-12 был наиболее эффективным среди Rheoswitch-содержащих вариантов. SP 1-RheoIL-12 отличается от oldRheoIL-12 основной кодирующей последовательности вектора (AdEasyl в OldRheoIL-12 и RAP Ad в ViraQuest на SpI-RheoIL-12). TTR-RheoIL-12 отличается от oldRheoIL-12 содержанием минимального промотора TTR в направлении 3' относительно элемента отклика Gal4. Как иллюстрирует Фигура 10, SP1-RheoIL-12 был более эффективным, чем TTR-RheoIL-12 при уменьшении опухолевого размера меланому В16. [0275] Фигура 11 иллюстрирует, что опухоль меланомы В16 не развивается после повторного заражения у мышей, которые до этого получили лечение дендритными клетками, содержащими рекомбинантный аденовирусный Rheoswitch индуцируемый IL- 12 (DC-SP 1-RheoIL- 12). Это говорит о том, что рост опухоли меланомы В16 предотвращается на срок до 25 дней, когда В16-иммунные мыши подвергаются повторной прививке через 45 дней после первичного инфицирования клетками В16. DC мыши получили из костного мозга мышей В6 путем 7-дневного культивирования в полной питательной среде (RPMI-1640, 10% FBS), содержащей рекомбинантный IL-4 мыши и рекомбинантный гранулоцитарно-макрофагальный колониестимулирующий фактор GM-CSF. CD1 Ic-положительные дендритные клетки затем выделили с помощью специфических гранул MACS, следуя инструкциям производителя (Miltenyi Biotech), и инфицировали при множественном инфицировании МОI=100 вектором rAd.IL-12 (RheoIL-12 vs. SP1 vs. TTR) 24-часовой инкубацией до инъекции дендритных клеток 10Е6 в 9-дневные сформировавшиеся подкожные опухоли меланомы В16 (5 мышей в группе, опухоль на правом боку). Некоторым мышам делали ежедневные внутрибрюшинные инъекции активирующего лиганда RG-115830 (30 мг/кг в 50 мкл DMSO) на 0-4 дни после введения дендритных клеток. Размер опухоли контролировали каждые 3-4 дня и протоколировали в кв. мм в виде произведения ортогональных диаметров. Для оценки специфичности связанной с терапией защиты, всем избавившимся от опухоли животным в левый бок повторно ввели клетки меланомы 10Е5 В16, а в правый бок ввели клетки карциномы толстой кишки МС38 на 45 день после первичного заражения опухолью В16. Произошло формирование опухолей МС38, а опухоли В16 не развились. [0276] На Фигуре 12 приведены данные по сравнению между количеством дендритных клеток (DC-SP 1-RheoIL-12), введенных в опухоль В16 (105, 106, 107), продолжительностью введения лиганда, и регрессом опухоли в модели меланомы В16 мыши (6 дней, 13 дней). Фигура 12 иллюстрирует зависимость подавления опухолевого роста от дозы введенных в опухоль трансдуцированных дендритных клеток и длительности введения активирующего лиганда (внутрибрюшинные инъекции, 30 мг/кг/день). Зараженным опухолью мышам провели единичную внутриопухолевую инъекцию AdDC в дозировке 105, 106, и 107 клеток, а также ежедневные внутрибрюшинные инъекции активирующего препарата одной дозой 30 мг/кг/день в течение 6 или 13 дней, начиная со дня введения 107 клеток. Значительно более интенсивное подавление опухолевого роста наблюдали, когда активирующий препарат вводили в течение 13 дней, по сравнению с 6-дневным курсом. Лиганд (RG-115932), вводимый в течение 13 дней последовательно в комбинации с 107 дендритными клетками, оказался эффективным средством, вызвавшим регресс опухоли за 25-дневный период. Это позволяет предположить, что в противоположность мнению, что трансдуцированные ex vivo дендритные клетки живут всего лишь несколько дней после инъекции в опухоль, клетки AdDC, вырабатывающие IL-12 под контролем RheoSwitch® Therapeutic System RTS, с большой вероятностью останутся интактными в течение более, чем 1 недели после внутриопухолевой инъекции, и даже могут оставаться живыми и реагирующими на активирующий препарат через 13 дней после инъекции. Активирующий препарат в одиночку (без AdDC) не оказывал эффект на рост опухоли. [0277] В эксперименте, сходном с иллюстрированным на Фигуре 12, активирующий препарат вводили орально через зонд в течение 9 и 12 дней. Таким образом, оценили зависимость противоопухолевого иммунного ответа от дозы введенного в оральной форме в Labrasol активирующего лиганда. После наблюдения зависимого от дозировки противоопухолевого эффекта, обнаружили, что лучший иммунный ответ возникает у животных, принимающих 50 мг/кг/день активирующего лиганда орально в течение 12 дней. Как оказалось, из всех тестированных дозировок, 13 дней приема активирующего лиганда были эффективнее 9-дневного режима. Из этого можно заключить, что дендритные клетки, выжившие и способные вырабатывать IL-12 в течение, как минимум, 9-12 дней in vivo (в микропространстве опухоли или в лимфоидных органах), являются наиболее важными для оптимальной эффективности лечения. [0278] Фигура 13 иллюстрирует, что способ терапии, описанной в данной заявке, не связан с неблагоприятной потерей массы у животных ввиду истощения. Истощение и потеря массы часто связаны с высоким уровнем интерферона-гамма и фактора некроза опухолей-альфа, синтез которых, как известно, положительно регулируется интерлейкином-12. [0279] 5 изогенным В6 мышам в правый бок подкожно привили меланому В16. После 7-дневного развития опухоли, в дозах 10Е5, 10Е6 и 10Е7 внутриопухолево ввели DC.SP1-IL-12 (выделенные из костного мозга дендритные клетки, инфицированные при множественном инфицировании МОI=100, под оптимальным переключателем SP1). Начиная со дня инъекции дендритных клеток (и затем ежедневно в течение 6 или 13 дней) внутрибрюшинно вводили RG-115932. В каждую группу входило 5 животных, рост опухоли контролировали каждые 3-4 дня и протоколировали в виде среднего размера (кв. мм, как произведение ортогональных измерений). Во время оценки роста опухолей, каждое животное также взвешивали (Фигура 13). Всех животным, излеченным от опухоли любым видом терапии, на 50-й день (после первичной прививки опухолью В16) в противоположный бок (левый бок) повторно ввели клетки меланомы 10Е5 В16, а в правый бок ввели клетки 10Е5 МС38 карциномы толстой кишки. Рост опухоли контролировали каждые 3-4 дня и сравнивали с ростом, наблюдаемым у не получивших лечение животных (см.Фигура 12). [0280] На Фигуре 14 показано, что опухоль не формируется после повторного заражения клетками В16 мышей, до этого получивших лечение дендритными клетками, содержащими рекомбинантный аденовирусный Rheoswitch-индуцируемый IL-12 и активирующий лиганд RG-115932. Таким образом, Фигура 14 показывает, что рост меланомы В16 у В16-иммунных мышей подавляется в течение менее 24 дней после повторной прививки. На Фигуре 14 также показано, что не инфицированные В16 мыши не были защищены от формирования опухоли, как не были защищены МС38-иммунные и не инфицированные МС38 мыши. МС38 - это карцинома толстой кишки, известная в данной области техники. Таким образом, данная фигура свидетельствует о специфичности вызванной первичной инъекцией опухоли В16 иммунизации дендритными клетками, содержащими рекомбинантный аденовирусный Rheoswitch-индуцируемый IL-12. [0281] Дендритные клетки, полученные в результате дифференциации CD 14+клеток, обладают незрелым фенотипом и не вырабатывают выявляемых количеств IL-12 (Cella et al. 1999). Из Фигуры 15 видно, что дендритные клетки мыши, полученные путем 7-дневной обработки клеток костного мозга гранулоцитарно-макрофагальным колониестимулирующим фактором GM-CSF и IL-4 и последующего отбора CD1 Iс+ клеток, также характеризуются неспособностью экспрессировать выявляемые количества IL-12 после трансдукции аденовирусным вектором, кодирующим интерлейкин-12 под контролем RheoSwitch® Therapeutic System RTS. Обработка трансдуцированных клеток различными дозами активирующего препарата (RG-115932) привела к выработке IL-12 в зависимом от дозировки режиме. [0282] По имеющимся данным, аденовирусная трансдукция в некоторой степени стимулирует созревание дендритных клеток с помощью пентон-интегриновых взаимодействий, вызывающих синтез фактора некроза опухолей-альфа путем активации ядерного фактора каппа-В (NFkB). Известно, что аутокринное действие фактора некроза опухолей-альфа в этом случае служит стимулирующим созревание сигналом для дендритных клеток (Philpott et al. 2004). Считается, что краткая аденовирусная трансдукция (2-3 часа) и подборка минимального достаточного значения множественного инфицирования MOI ограничивают этот эффект раннего созревания. Пример 4 [0283] В этом примере, дендритные клетки выделили из костного мозга, модифицировали аденовирусными конструкциями, изображенными на Фигуре 7, а затем мышам, зараженным изогенной интракраниальной глиомой GL261, внутриопухолево ввели модифицированные дендритные клетки; RG-115830 был введен внутрибрюшинно. На Фигуре 7 показаны результаты внутриопухолевой инъекции дендритных клеток, трансдуцированных кодирующими IL-12 и/или интерферон-альфа под контролем RheoSwitch® Therapeutic System RTS или без него, полинуклеотидами. Данные показали, что лиганд-индуцированная экспрессия интерферона-альфа и IL-12, опосредованная активацией RheoSwitch® Therapeutic System RTS лигандом RG-115830, обеспечила 50-дневную выживаемость зараженных глиомой GL261 мышей в 75% случаев; в сравнении с экспрессией лишь одного интерферона-альфа. Более того, осуществляемая RheoSwitch и лигандом регуляция обеспечила повышенную выживаемость. Пример 5 [0284] Безопасность, переносимость, трансгенная функция и иммунологические эффекты внутриопухолевой инъекции трансдуцированных аденовирусом аутологичных дендритных клеток, модифицированных для экспрессии IL-12 человека под контролем RheoSwitch® Therapeutic System RTS, у субъектов с меланомой 3 и 4 стадии можно оценить с применением процедур, подобных описанным ниже. [0285] Исследование, включающее в себя изучение субъектов, пораженных меланомой 3 и 4 стадии, осуществляют на 4 группах субъектов, каждому из которых делают единичную внутриопухолевую инъекцию (в опухоль меланомы) трансдуцированных аденовирусом аутологичных (введенных субъекту, у которого они были взяты) дендритных клеток (DC), модифицированных для экспрессии интерлейкина-12 человека (IL-12 человека), в дозах 5 х 107, в комбинации с ежедневными оральными дозами активирующего препарата (активирующего лиганда). В исследовании применяют инъекции дендритных клеток, трансдуцированных ex vivo (после того, как клетки выведены из субъектов) аденовирусным вектором для индуцируемой экспрессии IL-12 человека. Выработка интерлейкина-12 введенными дендритными клетками «включается» (индуцируется) активацией RheoSwitch® Therapeutic System RTS, вызванной оральным приемом активирующего препарата (RG-115932). Безопасность и переносимость оценивают физическими исследованиями (включая статус ECOG), измерением показателей жизнедеятельности, химическим анализом сыворотки, анализом мочи, гематологических параметров, контролем нежелательных явлений (побочных эффектов), а также клеточному и гуморальному иммунному ответу на аденовирус, компоненты RheoSwitch® Therapeutic System RTS и активирующий препарат. Для оценки прогресса, измеряют фармакокинетику/всасывание, распределение, метаболизм и выведение (ADME) единичных доз и в стационарном состоянии, уровень интерлейкина-12 и клеточного иммунного ответа (Т-клеток) в биоптатах опухолей-мишеней, дренирующих опухоль лимфоузлов и периферической циркуляции, а также цитокиновый профиль сыворотки. [0286] Например, 16 субъектов с 3 и 4 стадией меланомы разделены на 4 группы, где в группы 1 и 2 входит по 3 человека, а в группы 3 и 4 - по 5 человек. Всем субъектам проводят единичную внутриопухолевую инъекцию 5x107 аутологичных дендритных клеток, трансдуцированных аденовирусным вектором, кодирующим IL-12 человека под контролем RheoSwitch® Therapeutic System RTS. Субъекты получают по единичной оральной ежедневной дозе активирующего препарата (группа 1: 0.01 мг/кг, группа 2: 0.1 мг/кг, группа 3: 1.0 мг/кг и группа 4: 3 мг/кг); первая доза принимается приблизительно за 3 часа до инъекции дендритных клеток в 1-й день, затем курс продолжается последовательно в течение 13 дней. Дополнительные инъекции трансдуцированных аденовирусом аутологичных дендритных клеток в комбинации с 14 единичными ежедневными оральными дозами активирующего препарата можно вводить подходящим субъектам, отвечающим условиям повторного лечения. Безопасность, переносимость и функция дендритных клеток для всех членов каждой группы оценивают в течение 1 месяца после инъекции модифицированных in vitro дендритных клеток перед тем, как субъекты начинают получать следующую по величине дозу активирующего препарата. Оценку безопасности у всех субъектов проводят в течение 3 месяцев после первичной инъекции модифицированных дендритных клеток, с возможным продолжением времени наблюдения до 6 месяцев для контроля безопасности субъектов, в случае если обнаружены признаки токсичности или субъект получает дополнительные инъекции дендритных клеток. [0287] Такое исследование наглядно демонстрирует безопасность и переносимость единичных или множественных внутриопухолевых инъекций трансдуцированных аденовирусом аутологичных дендритных клеток в комбинации с оральным применением активирующего препарата у субъектов, пораженных меланомой. Исследование обеспечивает фармакокинетику/всасывание, распределение, метаболизм и выведение (ADME) орального активирующего препарата в стационарном состоянии. Исследование демонстрирует функциональность RheoSwitch® Therapeutic System RTS у субъектов путем измерения экспрессии IL-12 человека трансдуцированными аденовирусом дендритными клетками в опухоли-мишени и/или дренирующих опухоль лимфоузлах в ответ на активацию RheoSwitch® Therapeutic System RTS оральным введением активирующего препарата. Более того, исследование демонстрирует иммунологические эффекты трансдуцированных аденовирусом аутологичных дендритных клеток по величине клеточного иммунного ответа в опухоли-мишени, дренирующих опухоль лимфоузлах и периферической циркуляции, возникающего после орального введения активирующего препарата. [0288] Меланома была выбрана в качестве примера злокачественной опухоли (для применения RheoSwitch® Therapeutic System RTS), поскольку для пациентов, находящихся на 3 и 4 стадии заболевания на сегодняшний день не существует способов эффективного лечения; по известным данным, меланома, в частности, среди опухолей твердых тканей, поддается иммунотерапевтическим методам; и опухоли меланомы легко доступны для внутриопухолевых инъекций и биопсии. Субъекты, участвующие в исследовании, находятся на неоперабельной 3 и 4 стадии меланомы, с размером опухоли, по меньшей мере равным 0,5 см в диаметре, с любой толщиной опухоли, с любым количеством включенных в процесс лимфатических узлов, близлежащих и отдаленных метастазов. 5.1. Получение аденовируса, несущего RheoSwitch Therapeutic System (RTS) и IL-12 [0289] Рекомбинантную ДНК вводят в дендритные клетки (DC) путем ex vivo трансдукции аденовирусным вектором. Рекомбинантная ДНК применяется для экспрессии IL-12(p70) человека внутриопухолево введенными незрелыми дендритными клетками, обеспечивает выживаемость и стимулирует созревание дендритных клеток в опухолевом пространстве, приводящее к последующей миграции дендритных клеток в дренирующие лимфатические узлы. Это, в свою очередь, обусловливает сдвиг дифференцировки Т-хэлперных клеток в сторону подтипа Тh1, а также активацию опухолеспецифических цитотоксических Т-клеток перекрестным примированием (инициацией) опухолевыми антигенами. [0290] Рекомбинантная ДНК, которую применяют в качестве аденовирусного вектора, позволяет вырабатывать 1L- 12 человека под контролем RheoSwitch® Therapeutic System (RTS). RheoSwitch® Therapeutic System RTS представляет собой бицистронную последовательность, экспрессируемую с промотора убиквитина С человека и кодирующую два рекомбинантных белка: GaW-EcR and VP16-RXR. Gal4-EcR является комплесом ДНК-связывающего домена (аминокислоты 1-147) Gal4 дрожжей и домена DEF рецептора экдизона насекомого Choristoneura fumiferana. Согласно другому варианту реализации, RheoSwitch® Therapeutic System RTS представляет собой бицистронную последовательность, экспрессируемую с промотора убиквитина С человека и кодирующую два рекомбинантных белка: GaW-EcR and VP16-RXR. Gal4-EcR комплексом ДНК-связывающего домена (аминокислоты 1-147) Gal4 дрожжей и домена DEF рецептора экдизона насекомого Choristoneura fumiferana. VP16-RXR представляет собой комплекс домена активации транскрипции HSV-VP 16 и домена EF химерного RXR, полученного из последовательностей человека и саранчи. Последовательности Gal4-EcR и VP16-RXR разделены участком внутренней посадки рибосомы (IRES) вируса энцефаломиокардита (EMCV). Эти два рекомбинантных белка димеризуются, когда Gal4-EcR связывается с низкомолекулярным препаратом (RG-115932) и активируют транскрипцию IL-12 человека под Саl4-зависимым промотором, содержащим 6 Gаl4-связывающих участков и синтетический минимальный промотор. Транскрипционная единица RheoSwitch® Therapeutic System RTS, описанная выше, расположена с 3' конца транскрипционной единицы IL-12 человека. Эта целая RTS-IL12 экспрессионная кассета встроена в геном аденовируса 5 на участке, откуда был удален участок Е1. Последовательность аденовируса, используемая в качестве основы для вектора, также не содержит ген ЕЗ. Карта аденовирусного вектора Ad-RTS-IL-12 человека изображена на Фигуре. 8. [0291] Рекомбинантный аденовирусный вектор, применяемый в данном исследовании, содержит следующие типичные регуляторные последовательности, кроме последовательностей вирусного вектора: промотор убиквитина С человека, участок внутренней посадки рибосомы (IRES) вируса энцефаломиокардита, индуцируемый промотор, содержащий 6 копией участков связывания Gal4, 3 копии участков связывания SP-I, последовательность синтетического минимального промотора, участки полиаденилирования вируса SV40 и последовательность терминации транскрипции из гена альфа-глобина человека. Следует иметь в виду, что в качестве альтернативы могут присутствовать другие регуляторные элементы. [0292] Типичный рекомбинантный аденовирусный вектор Ad-RTS-hDL-12 получили следующим способом. Кодирующие последовательности рецепторных рекомбинантных белков VP 16-RXR и Gal4-EcR, разделенные участком внутренней посадки рибосомы (IRES) вируса энцефаломиокардита EMCV-IRES, встраивали в аденовирусный челночный вектор под контролем промотора убиквитина С человека (конститутивный промотор). Затем, кодирующие последовательности субъединиц р40 и р35 IL-12 человека, разделенные участком внутренней посадки рибосомы (IRES) вируса энцефаломиокардита, поместили под контроль синтетического индуцируемого промотора, содержащего 6 копий Gal4-связывающего участка, и встроили с 5' конца промотора убиквитина С и рецепторных последовательностей. Челночный-вектор содержит последовательности серотипа 5 аденовируса с левого конца до 16-й точки карты

[0293] Типичный рекомбинантный аденовирусный вектор получили следующим способом: линеаризованный рекомбинантный аденовирусный челночный вектор, несущий элементы ДНК для индуцируемой экспрессии человеческого интерлейкина-12, и основную кодирующую последовательность аденовируса трансфицировали в клетки НЕK293. Рекомбинация между перекрывающимися последовательностями челночного вектора и основной кодирующей последовательностью вируса приводит к получению рекомбинантного аденовируса, который упаковали в вирусные частицы в клетки НЕK293. Клетки НЕK293 культивировали в питательной среде DMEM, содержащей фетальную бычью сыворотку.
[0294] Вирус, применяемый в предлагаемом исследовании, очистили центрифугированием в градиенте концентрации хлорида цезия. Рекомбинантный аденовирус подвергли двум циклам очистки бляшек, а полученный семенной препарат использовали для получения главного банка вирусов (MVB) амплификацией в клетках НЕK293 из главного банка полностью характеризованных клеток. Главный банк вирусов MVB подвергли расширенным тестам, выпуска cGMP/GLP, включая те сты на аденовирус без дефекта репликации (replication competent adenovirus, RCA), стерильность, микоплазмы, адвентициальные вирусы, ретровирусы, человеческие вирусе ВИЧ 1/2, Т-лимфотропные вирусы человека 1/2, вирус гепатита А, вирус гепатита В, вирус гепатита С, вирус Эгпптейна-Барра, парвовирус В19, цитомегаловирус, вирус герпеса 6, 7 и 8 вирусы, коров и свиные, полное секвенирование векторов и функциональное тестирование индуцируемой активирующим препаратом экспрессии IL-12 в клеточных линиях человека.
[0295] Вирус из полного банка вирусов MVB можно применять для получения чистого вируса в лаборатории cGMP, после чего может вновь быть подвергнут тестам выпуска, включая тесты на: целостность, аденовирус без дефекта репликации, стерильность, микоплазму, адвентициальные вирусы, соотношение вирусных частиц и инфекционных единиц, контаминацию ДНК клетки-хозяина, эндотоксин и белки, а также функциональным тестам индуцированной активирующим препаратом экспрессии интерлейкина-12 в клеточных линиях человека.
6.2. Трансдукция аутологичных дендритных клеток аденовирусом, содержащим трансген IL-12 человека и RheoSwitch® Therapeutic System (RTS)
[0296] Дендритные клетки, полученные от человека, подвергли трансдукции ex vivo и ввели в опухоль. Перед вирусной трансдукцией, дендритные клетки характеризовали в отношении жизнеспособности, степени очистки (как правило, более 80% клеток, обладающих фенотипом DC), стерильность, микоплазмы и эндотоксины. После вирусной трансдукции, клетки неоднократно промыли для удаления неабсорбированных вирусов. Надосадочную жидкость после последней промывки протестировали с помощью полимеразной цепной реакции для определения содержания остаточного вируса. Так как дендритные клетки трансдуцировали ex vivo аденовирусным вектором (неинтегрирующим вирусом), а продолжительность жизни дендритных клеток после внутриопухолевой инъекции и последующей миграции в дренирующие лимфатические узлы коротка, предполагается, что вирусная ДНК не попадает в не являющиеся мишенями клетки. Ожидается, что протокол, который применяли для трансдукции дендритных клеток аденовирусами, обеспечит 80-90% трансдукцию, поэтому он считается весьма эффективным.
[0297] Получение мононуклеарных клеток периферической крови (РВМС) лейкофорезом: пациентов подвергли стандартному 90-120-минутному лейкофорезу с помощью Аферезного блока UPCI Outpatient. Процедура включила в себя взятие крови из вены одной руки; центрифугирование крови (в сепараторе клеток), где происходит разделение ее компонентов, после которого один или более компонентов удаляются; и возвращение оставшихся компонентов в вену той же или другой руки пациента. За один цикл обработки крови сепаратором клеток у пациента брали не более 15% общего объема крови. В сепараторе клеток кровь разделили на плазму, тромбоциты, лейкоциты и эритроциты. Лейкоциты (белые клетки крови) отделили, а остальные компоненты возвратили в циркуляцию субъекта. Для этой процедуры желательно использовать две периферические линии 4. Если это невозможно, может возникнуть необходимость в использовании центральной линии. Перед лейкофорезом, пациент должен быть осмотрен врачом, также, как правило, берут его основные жизненные показатели (включая АД).
[0298] Обработка: после сбора, лейкоцитарную фракцию вручную перенесли на CPL и сразу же подвергли центрифугальной элютриации в приборе ELUTRA™. Эта закрытая система одобрена для клинического применения. Моноцитарную фракцию восстановили и, после того, как жизнеспособность клеток была установлена, их перенесли в картридж Aastrom для 6-дневной культивировании в присутствии IL-4 and гранулоцитарно-макрофагального колиниестимулирующего фактора GM-CSF. Все этапы обработки и промывки провели в условиях полной стерильности.
[0299] Первичный посев: моноциты, выделенные из одной лейкоцитарной фракции, подсчитали в трипановом синем для определения числа жизнеспособных (живых) клеток. Путем поточной цитометрии оценили чистота моноцитов. Затем, моноциты взвесили при 5-10 × 106клеток/мл в не содержащей сыворотку и антибиотики среде CellGenix, в которую входит 1,000 МЕ/мл IL-4 и 1,000 МЕ/мл GM-CSF в SOP-CPL-0166, и перенесли в картридж Aastrom. Минимальный объем загрузки, равный 50 мл, и минимальное количество клеток необходимы для прививки кассеты.
[0300] Культура: картридж Aastrom поместили в инкубатор Replicell System - полностью закрытый, cGMP-совместимый культивационный прибор для генерации незрелых дендритных клеток.
[0301] Сбор незрелых дендритных клеток: на 6 день, картридж Aastrom извлекли из инкубатора, после чего собрали незрелые дендритные клетки. Клетки восстановили центрифугированием при 1,500 об/мин, промыли средой CellGenix, подсчитали в трипановом синем и проверили на морфологические и фенотипические характеристики.
[0302] Жизнеспособность: определили путем подсчета клеток с помощью гемоцитометра в трипановом синем. Как правило, более 95% собранных клеток оказываются живыми, т.е. не окрашиваются трипановым синим. Если жизнеспособность составляет менее 70%, незрелые дендритные клетки отбраковываются.
[0303] Определение фенотипа: культивированные клетки подсчитали путем микроскопирования на гемоцитометре, получив предварительный дифференциальный (DC и лимфоциты) итог с применением трипанового синего. Поточной цитометрией подтвердили дифференциальный подсчет, фокусируясь на разделении дендритных клеток и лимфоцитов и используя высокие характеристики прямого и бокового рассеивания незрелых дендритных клеток в качестве критерия идентификации. Обычно незрелые дендритные клетки составляют более 80% клеток, обладающих морфологией и фенотипом дендритных клеток.
[0304] Оценка эффективности IL-12p70: установили, что зрелые дендритные клетки (mDC) обладают способностью вырабатывать IL-12p70 самопроизвольно или после активации CD40L с помощью сигналов врожденного иммунитета (например, липополисахаридов) или без нее. Недавно был разработан стандартизированный способ выработки IL-12p70, применимый для получения небольших образцов или больших количеств дендритноклеточных вакцин, получаемых при различных условиях. Современные способы оценки эффективности состоят из двух отдельных стадий, первая из которых включает в себя совместную инкубацию дендритных клеток-респондеров с клетками лимфомы J588, постоянно трансфицируемых геном лиганда CD40 человека в качестве стимулятора.
Вторая стадия включает в себя проверку надосадочной жидкости этих совместных культур на уровень секреции IL- 12р70 дендритными клетками, стимулированными J558/CD40L +/-липополисахарид LPS в системе Luminex. В этот способ оценки эффективности также входит промежуточная процедура с 18.5%-ным CV (n=30) и широкой областью динамических значений, облегчающая оценку различных продуктов дендритных клеток, характеризующихся весьма разными степенями выработки IL-12p70. Нормальная область значений процедуры, установленная с применением дендритных клеток, полученных из моноцитов 13 здоровых доноров, составляла 8-999 пг/мл, со средним значением, равным 270 пг/мл Критерия Продукции и Выработки для Дендритных Клеток.
[0305] Каждую группу полученных in vitro дендритных клеток протестировали на наличие контаминации микроорганизмами (аэробные и анаэробные бактерии, грибы и микоплазмы), на эндотоксин и на их фенотипические и функциональные характеристики. Все дендритные клетки, вводимые субъектам, должны быть свежими и не подвергавшимися заморозке.
[0306] Тестирование гарантии качества дендритных клеток: дендритные клетки, полученные, как описано выше, исследуются на стерильность, жизнеспособность, чистоту, эффективность и стабильность. Критерии выпуска клеточного продукта утверждены и тщательно контролируются.
[0307] Жизнеспособность: выращенные в культуре клетки подсчитали с помочью микроскопии на гемоцитометре, после чего в трипановом синем осуществили дифференциальный подсчет (дендритные клетки и лимфоциты). Этот подсчет обеспечивает оценку процентного содержания живых клеток. Для соответствия критерию клеточного выпуска, необходимо, чтобы выживаемость клеток была не ниже 70% при исключении трипановом синим, а также более 70% клеток экспрессировали HLA-DR и CD86 как маркеры полученных из моноцитов дендритных клеток. Также, для исследовательского анализа можно применять дополнительные маркеры, как, например, CD83 и CCR7 для оценки статуса зрелости и CD3 и CD 19 для оценки лимфоцитарной контаминации.
[0308] Чистота: для определения того, что морфологически идентифицированная популяция дендритных клеток экспрессирует поверхностные антигены, установленные для дендритных клеток, и не несет антигены семейств моноцитов, В- и Т-клеток, применили двухцветную поточную цитометрию клеток, окрашенных FITC- и РЕ-конъюгированными антителами. Для приготовления вакцин, генерированные дендритные клетки должны экспрессировать HLA-DR и CD86 и не должны экспрессировать CD3, CD 19 и CD 14. Для того чтобы считаться зрелыми дендритными клетками, клетки должны экспрессировать CD83+ и CCR7+.
[0309] Эффективность: для оценки степени эффективности дендритных клеток, определили их способность вырабатывать IL-12p70, как описано выше.
[0310] Стерильность: дендритные клетки тестировали на бактериальные (аэробные и анаэробные) и грибковые культуры с применением системы BD Bactec system (Becton Dickinson Co., Sparks, MD) в Микробиологической Лаборатории Медицинского Центра Питсбургского университета. Окончательные результаты в отношении культур микроорганизмов были получены в течение 14 дней. До выпуска дендритных клеток для применения их в вакцинах, производится окрашивание по Граму. Его результаты на наличие микроорганизмов должны быть отрицательными.
[0311] Тесты IMCPL для выявления микоплазмы, проводимые с применением системы Gen-Probe Mycoplasma Tissue Culture Rapid Detection System (Gen-Probe, Inc. San Diego, CA), основываются на технологии гибридизации нуклеиновых кислот.Тесты на эндотоксин провели с применением Limulus Amoebocyte Lysate Pyrogen Plus assay (Bio Whittaker, Inc., Walkerville, MD). Клеточную культуру исследовали на эндотоксин во время сбора и до выпуска окончательного продукта. Приемлемый уровень эндотоксина составляет менее 5 EU/кг веса тела. Для дальнейшего анализа трансдуцированные и нетрансдуцированные дендритные клетки замораживали.
[0312] Предполагается, что все трансдуцированные клетки экспрессируют трансген. Также предполагается, что более 80% дендритных клеток подверглись удачной трансдукции. Продукт является биологически активным, так как нативные кодирующие последовательности сохранены в трансгене. Трансдуцированные вирусом дендритные клетки, введенные в опухоль, обладают фенотипом незрелых дендритных клеток и не вырабатывают интерлейкин-12 до созревания, поэтому на данном этапе экспрессия IL-12 происходит, в основном, с трансгена. Так как экспрессия трансгена IL-12 индуцируется низкомолекулярным активирующим препаратом RG-115932 в зависимом от дозы режиме, уровень экспрессии трансгена трансдуцированными дендритными клетками может быть контролирован и удержан на нужном уровне. Небольшая часть трансдуцированных дендритных клеток, приготовленных для введения человеку, может быть исследована in vitro на зависимую от активирующего препарата активацию экспрессии IL-12. Процедурой, в данном случае, может быть иммуноферментный анализ с уровнем чувствительности, равном 4 нг/мл.
[0313] In vivo модель опухоли мыши является сходной с исследованиями человека в том аспекте, что мышей, пораженных подкожной меланомой В16, лечили так же, как предложено в протоколе исследования на людях, а именно, инъекцией трансдуцированных аденовирусом дендритных клеток и активацией трансгена IL-12 мыши. После выявления регресса опухоли, повторное инфицирование клетками такой же опухоли не привело к опухолевому росту, свидетельствуя о системном противоопухолевом иммунитете.
[0314] Предполагается, что активация выработки IL- 12 in vitro клетками, трансдуцированными вектором, применяемым в предложенном исследовании, обеспечивает приблизительно 500 нг IL-12/10 клеток/24 часа, как определено иммуноферментным анализом. В преклинических исследованиях с применением модели меланомы мыши, внутриопухолевое введение 106 или более трансдуцированных дендритных клеток оказалось эффективным. Однако, предполагается, что необходимая внутриопухолевая инъекция может быть эффективной при меньших количествах клеток, поэтому инъекции 5×107 трансдуцированных дендритных клеток могут быть взяты как начальная точка для определения, большие или меньшие количества трансдуцированных клеток будут необходимы.
[0315] Так, in vitro клеточные линии человека и мыши, а также первичные дендритные клетки, трансдуцированные рекомбинантным аденовирусным вектором, несущим гены IL-12, характеризовались активацией экспрессии интерлейкина-12 в ответ на действие активирующего препарата в зависимом от дозировки режиме.
[0316] Аденовирусная трансдукция дендритных клеток человека при различном множественном инфицировании MOI и при различной продолжительности вирусной адсорбции оказалась эффективной, когда процесс продолжался 3 часа, а значение множественного инфицирования МОI было равным 500. Активирующий препарат индуцировал экспрессию IL- 12 в таких трансдуцированных дендритных клетках человека (Фигура 9).
[0317] В экспериментах in vivo на модели меланомы мыши, описанной выше, мышам C57/BL6 проводили подкожные инъекции клеток В16 для формирования опухоли. Внутриопухолевая инъекция дендритных клеток, трансдуцированных несущим гены IL-12 мыши под контролем RheoSwitch® Therapeutic System RTS аденовирусным вектором, с последующим введением активирующего лиганда вызвала возникновение системного опухоль-специфического иммунитета. Лечение привело к регрессу опухоли. Повторное введение клеток В16 через 50 дней мышам, прошедшим терапию, показало, что клетки В16 не сформировали опухоль. Такого рода активация противоопухолевого иммунитета обусловливалась введением активирующего препарата и последующей экспрессии IL-12 трансдуцированными дендритными клетками. Активирующий препарат проявил эффект при введении как внутрибрюшинно, так и орально. См. Фигура 11 и Фигура 14.
6.3. Формы введения активирующего препарата
[0318] Активирующий препарат, в данном описании, может быть в любой из нижеперечисленных форм:
(1) 100% лабразол;
(2) Ароматизированный листерином лабразол (Latitude Pharmaceuticals Inc., USA), содержащий (а) ментол, (b) тимол, (с) эвкалиптол, (d) аспартам, (е) сахарин натрия, (f) лимонная кислота, (g) ароматизатор с запахом перечной мяты, (h) ароматизатор с запахом сливок, (i) лабразол;
(3) Миглиол 812 и фосфолипон 90G (Latitude Pharmaceuticals Inc., USA); или
(4) Миглиол 812, фосфолипон 90G и витамин Е токоферола полиэтиленгликоля сукцинат (Latitude Pharmaceuticals Inc., USA).
6.4. Введение
[0319] В то время как можно предложить различные концентрации и специфические протоколы, один из вариантов лечения пациентов включает в себя внутриопухолевую(ые) инъекцию(ии) трансдуцированных аутологичных дендритных клеток (AdDCs) в концентрации 5 х 107, взвешенных в стерильном солевом растворе и модифицированных для экспрессии IL-12 человека (интерлейкина-12 человека) под контролем RheoSwitch® Therapeutic System RTS, в комбинации с оральным введением активирующего препарата (RG-115932).
6.4.1. Первичное лечение
[0320] День 1. Осмотр стационарного больного: на 1 день проводят общее физическое обследование (включая жизненные параметры, вес и статус ECOG). Берут мочу и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). Приблизительно за 3 часа до внутриопухолевой инъекции in vitro модифицированных in vitro дендритных клеток, каждому пациенту вводят активирующий препарат (группа 1 - 0.01 мг/кг, 0.3 мг/кг, 1.0 мг/кг и 3 мг/кг) сразу после приема пищи. В 1 день для оценки фармакокинетики единичной дозы активирующего препарата и его основных метаболитов, кровь берут с определенными временными интервалами (перед дозой активирующего препарата, через 0.5, 1, 1.5, 2, 4, 6, 8, 12, 16 и 24 часа после введения дозы). Каждому субъекту делают единичную внутриопухолевую инъекцию 5×107 трансдуцированных аденовирусом аутологичных дендритных клеток, модифицированных для экспрессии IL-12 человека под контролем RheoSwitch® Therapeutic System RTS. За пациентами тщательно наблюдают на предмет возникновения локальных реакций в месте инъекции и/или реакций гиперчувствительности. Дни 2-14. Осмотр стационарного больного. Со 2 по 14 день каждому субъекту сразу после еды дают дозу активирующего препарата. Ежедневно, с 2 по 14 день протоколируются жизненные параметры и побочные реакции. На день 4±24 часа, у приблизительно половины пациентов берут биоптаты опухоли и/или дренирующих опухоль лимфоузлов для измерения уровня IL-12 человека и клеточной иммунной реакции. На 8 день проводят взвешивание. На день 8±24 часа, у пациентов, не прошедших биопсию на 4 день, берут биоптаты опухоли и/или дренирующих опухоль лимфоузлов для измерения уровня IL-12 человека и клеточной иммунной реакции. Для определения потенциональных антител и клеточной иммунной реакции на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS на 4 день ± 24 часа и 8 день ± 24 берут анализы крови. Также оценивают цитокиновый профиль сыворотки, чтобы выяснить, повлияло ли введение трансгена IL-12 на экспрессию других цитокинов. На 8 день, берут мочу и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). На 8 день для оценки фармакокинетики/ADME (всасывания, распределения, метаболизма и выведения) активирующего препарата и его основных метаболитов в стационарной фазе, кровь берется с определенными временными интервалами (перед дозой активирующего препарата, через 0.5, 1, 1.5, 2,4, 6, 8, 12, 16 и 24 часа после введения дозы).
[0321] День 14. Осмотр стационарного больного: На 14 день каждый пациент получает дозу активирующего препарата сразу после приема пищи. Каждый субъект проходит физическое обследование (включая жизненные параметры, вес и статус ECOG). Берется моча и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). Для определения потенциальных антител и клеточной иммунной реакции на аденовирус и/или компоненты RTS на 14 день±24 часа берут анализы крови. Также оценивают цитокиновый профиль сыворотки, чтобы выяснить, изменилась ли экспрессия других цитокинов.
[0322] Во время определенных стационарных или амбулаторных осмотров пациенты сдают кровь для определения потенциональных антител и клеточной иммунной реакции на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS. Также оценивают цитокиновый профиль сыворотки. Для выявления гуморальной иммунной реакции на аденовирусный вектор, применяют блокирующий инфицирующую способность протокол AdVeGFP (Gambotto, Robins et al. 2004). Оценить реакцию антител на компоненты RheoSwitch® Therapeutic System RTS можно, применяя вестерн блоттинг или иммуноферментный анализ сыворотки пациента и белков RheoSwitch® Therapeutic System RTS, синтезированных вектором экспрессии. Кроме того, для оценки уровня экспрессии IL- 12, интерферона-гамма, IР-10 и других цитокинов Th1/Th2, как IL-2, фактор некроза опухолей-альфа, IL-4, IL-5 и IL-10, проводят мультиплексный иммуноанализ с помощью Luminex. Такие исследования антител и цитокинов потребуют около 10 мл крови.
[0323] Анализы на клеточную иммунную реакцию требуют около 50-60 мл крови, из которой выделяют субпопуляции CD4 и CD8 Т-клеток. Выделенные Т-клетки смешивают с аутологичными дендритными клетками, трансдуцированными пустым вектором AdV, векторами AdV-RTS или AdV-RTS-hIL12 в процедуре иммуноферментного спот-анализа (ELISPOT) для оценки синтеза интерферона-гамма Т-клетками, активированными антигенами AdV-RTS, если таковые присутствуют. Подобные же анализы проводят с применением клеток опухоли и/или дендритных клеток, экспрессирующих перекрестно реагирующие антигены меланомы, для выявления раннего противоопухолевого ответа. При необходимости, проводят и другие дополнительные анализы.
[0324] На день 14±24 часа, при наличии доступной для исследования ткани, у всех пациентов берут биоптаты опухоли и/или дренирующих опухоль лимфоузлов для измерения IL-12 человека и клеточной иммунной реакции. Протоколируют побочные реакции. После окончания всех процедур, на 14 день все пациенты выписываются из стационара с просьбой придти на амбулаторный осмотр приблизительно через 3-4 недели.
[0325] Осмотр в целях раннего прекращения исследования: если пациент не может завершить фазу стационарного лечения, перед выпиской будут проведены процедуры ранней выписки. Каждый пациент проходит физическое обследование (включая жизненные параметры, вес и статус ECOG). Берут моча и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). Кровь берут для определения потенциальных антител и клеточной иммунной реакции на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS, как описано выше. Также кровь берут, чтобы выяснить, изменилась ли экспрессия других цитокинов, оценивают цитокиновый профиль сыворотки, как описано выше. При наличии доступной для исследования ткани, у всех пациентов берут биоптаты опухоли и/или дренирующих опухоль лимфоузлов для измерения уровня IL-12 человека и клеточной иммунной реакции. Протоколируются побочные реакции. После завершения всех процедур ранней терминации, каждый субъект выписывается из стационара с просьбой придти на амбулаторный осмотр через приблизительно 3-4 недели.
[0326] Месяц 1-4. Контрольные посещения: Во время контрольного периода в месяцы 1-4 протоколируют побочные эффекты. Во время посещений в месяцы 1, 2 и 3, пациент проходит физическое обследование (включая жизненные параметры, вес и статус ECOG), также берется моча и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). На 1 и 3 месяце кровь берут для определения потенциальных антител и клеточной иммунной реакции на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS. Также, в 1 месяц кровь берется, чтобы выяснить, изменилась ли экспрессия других цитокинов, оценивают цитокиновый профиль сыворотки. Во время посещения в 1 месяц, при наличии доступной для исследования ткани, у всех пациентов берут биоптаты опухоли и/или дренирующих опухоль лимфоузлов для измерения уровня IL-12 человека и клеточной иммунной реакции. Сканирование позитронной эмиссионной компьютерной томографией СТ/РЕТ проводится на 2 и 4 месяце для оценки общего прогресса или регресса заболевания.
[0327] Месяц 5-6. Контрольные посещения: если на 3 или 4 месяц обнаружены проявления токсичности, связанной с приемом препаратов, на 5 и 6 месяц проводят контрольные посещения. В течение 5 и 6 месяца протоколируются побочные реакции. Состояние каждого пациента может контролироваться по телефону персоналом клиники в течение 5 месяца вплоть до амбулаторного осмотра на 6 месяц. Если токсичность, связанная с приемом препаратов, возникает или продолжается в течение 5 месяца и расценивается лечащим врачом как серьезная, нестабильная или для гарантии дальнейшей адекватной оценки состояния, персонал клиники не только контролирует состояние пациента по телефону, но и просит этого пациента придти в клинику. Во время посещения на 6 месяц, пациент проходит контрольное физическое обследование (включая жизненные параметры, вес и статус ECOG), также берут мочу и кровь для общего химического анализа сыворотки, анализа мочи и гематологического анализа (профиль безопасности). На 6 месяц кровь берут для определения потенциальных антител и клеточной иммунной реакции на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS. Сканирование позитронной эмиссионной космпьютериой томографией СТ/РЕТ проводится для оценки общего прогресса или регресса заболевания.
[0328] Критерии дозировки и прекращения приема активирующего препарата: Если определена лимитруемая дозой токсичность (DLT; т.е. степень токсичности превышает 3 у более 2 из 3 пациентов, взятых из группы 1, по версии 3 общих терминологических критериев побочных эффектов (СТСАЕ)), на данном уровне дозировки следующей группе из 3 пациентов активирующий препарат будет вводиться именно в этой дозировке. Если лимитируемая дозой токсичность DLT наблюдается у 1 или нескольких субъектов в группе повышенной дозировки, повышение дозы приостанавливается, и максимально переносимой дозой (MTD) считается следующая низшая доза, в противном случае повышение дозы возобновляется, пока не достигнет максимально переносимой дозы или максимальной дозы 10 мг/кг (что бы ни произошло раньше).
[0329] Безопасность, переносимость и трансгенная функция для всех пациентов в каждой группе оценивается в течение 1 месяца после инъекции AdDC до приема следующей более высокой дозы активирующего препарата.
[0330] Если степень токсичности у субъекта превышает 3 по СТСАЕ v3.0, и это вероятно, возможно или определенно связано с лечением согласно исследованию, прием активирующего препарата этим субъектом будет прекращен, и пациент будет направлен на процедуры ранней выписки.
[0331] Критерии завершения исследования: Если степень токсичности у более 70% субъектов в группе превышает 3 по СТСАЕ v3.0, и это возможно, вероятно или определенно связано с лечением согласно исследованию, прием активирующего препарата всеми пациентами будет прекращен, и все пациенты будут направлены на процедуры ранней выписки.
[0332] Исследуемый экспериментальный препарат: комбинация двух способов лечения, относящихся к исследованию, оценивается на безопасность, переносимость, функцию трансгена и иммунологические эффекты данного процесса. Субъектам с меланомой 3 или 4 стадии орально, в форме раствора ежедневно, единичными дозами 0.01 мг/кг, 0.1 мг/кг, 1.0 мг/кг and 10.0 мг/кг, в течение 14 дней последовательно вводится низкомолекулярный активирующий препарат в комбинации с единовременной внутриопухолевой инъекцией 5 х 107 трансдуцированных аденовирусом аутологичных дендритных клеток, модифицированных для экспрессии IL-12. Также, у субъектов есть возможность получить дополнительную внутриопухолевую инъекцию аутологичных дендритных клеток в комбинации с 14-дневным приемом активирующего препарата.
6.5. Взаимосвязь оценки безопасности и оценки функции трансгена и иммунологических эффектов
[0333] Клеточную культуру исследовали на эндотоксин во время сбора и до выпуска окончательного продукта. Приемлемый уровень эндотоксина составляет менее 5 EU/кг веса тела. Для дальнейшего анализа трансдуцированные и нетрансдуцированные дендритные клетки замораживали.
[0334] Оценка безопасности: безопасность единичной внутриопухолевой инъекции трансдуцированных аденовирусом аутологичных дендритных клеток в комбинации с орально принимаемым активирующим препаратом оценивается физическим осмотром, жизненными параметрами, химическим анализом сыворотки, анализом мочи, гематологическим анализом, нежелательными реакциями, а также гуморальной и клеточной иммунной реакцией на аденовирус и компоненты RheoSwitch® Therapeutic System RTS в течение лечебного курса и последующих 12 месяцев. При наблюдении, женщинам, которые могут быть беременными, делают тесты на беременность. Во время наблюдения, а также в 0 день повторного лечения у субъектов берется список принимаемых лекарственных препаратов для выявления связи между принимаемыми лекарствами и потенциальными нежелательными реакциями. Примерное количество крови, равное 89 чайным ложкам (439 мл) берется у пациентов во время наблюдения и начальной фазы стационарного лечения (26 дней), помимо лейкофореза. Примерное количество крови, равное 75 чайным ложкам (370 мл), берется у пациентов во время фазы повторного стационарного лечения (26 дней, через 5-6 недель после начальной госпитализации), помимо лейкофореза. Примерное количество крови, равное 46 чайным ложкам (227 мл), берут у пациентов во время постамбулаторной фазы (1-6 месяцы).
[0335] Физическое обследование: Во время предусмотренных стационарных и амбулаторных осмотров проводят полное физическое обследование. Во время наблюдения также протоколируют историю болезни и демографические данные каждого пациента.
[0336] Жизненные параметры: В каждое запланированное физическое обследование включена оценка жизненных параметров, однако она проводится также и во время всех стационарных и амбулаторных обследований. К жизненным параметрам относят артериальной давление, пульс, температуру и характеристики дыхания. Во время предусмотренных обследований также измеряются рост и вес. Жизненные параметры (исключая рост и вес) протоколируются каждый час в течение первых двух, а затем каждые 8 часов после приема активирующего препарата.
[0337] Химический анализ крови: Во время каждого стационарного или амбулаторного приема, у каждого пациента не натощак берут произвольный образец крови и сыворотки. Проводится оценка следующих параметров: AST (аспартат аминотрансфераза), ALT (аланин аминотрансфераза), GGT (гаммаглутамил транспептидаза), LDH (лактат дегидрогеназа), LAP (лейцин аминопептидаза), щелочная фосфатаза, креатинин, общий билирубин, общий белок, альбумин, азот мочевины крови, общий холестерин, глюкоза и электролиты.
[0338] Анализ мочи: Во время каждого стационарного или амбулаторного приема, у каждого пациента берется произвольный образец средней струи мочи. Проводится оценка следующих параметров: описание цвета и вида, относительная плотность, рН, глюкоза, кетоновые тела, белок, количество эритроцитов и лейкоцитов и пиролурия.
[0339] Гематологический анализ: Во время каждого стационарного или амбулаторного приема, у каждого пациента не натощак берут произвольный образец крови. Проводится оценка следующих параметров: общий клинический анализ крови, включая количество лейкоцитов, дифференциальный подсчет лейкоцитов, подсчет эритроцитов, гематокрит, гемаглобин, индексы эритроцитов и подсчет тромбоцитов. Также оцениваются активированное парциальное тромбопластиновое время и протромбиновое время.
[0340] Нежелательные реакции: Для оценки токсичности во время курса и в пост-лечебный 3-6 месячный период применяются общие номенклатурные критерии токсичтости и побочных явлений NCI (СТСАЕ версия 3). Побочный эффект - это любая реакция, эффект или другое нежелательное явление (признаки, симптомы, изменения в лабораторных показателях), связанные с применением тестируемого объекта (препарат, биопрепарат или прибор), имеющий отношение к тестируемому объекту или нет. Серьезный побочный эффект/явление - это любой побочный эффект или явление, вызывающий любое из нижеперечисленных последствий: смерть, угрожающее жизни состояние, врожденная аномалия, госпитализация или продление настоящей госпитализации, либо стойкое или серьезное увечье/нетрудоспособность. Важные связанные с лечение случаи/явления, которые не могут привести к смерти, угрожать жизни или вызвать необходимость госпитализации, могут быть рассмотрены как серьезные нежелательные реакции, если на основании соответствующего медицинского заключения, они могут подвергнуть опасности пациента или могут вызвать необходимость медицинского или хирургического вмешательства во избежание исходов, перечисленных в данном определении.
[0341] Опасность нежелательных реакций классифицируют следующим образом: 1 степени (легкая), 2 степени (средняя), 3 степени (тяжелая), 4 степени (угрожающая жизни или увечащая), 5 степени (вызвавшая смерть). Связь между нежелательной реакцией и терапией исследования определяется на основе клинического заключения и следующих определений: а) определенно связанная - это нежелательная реакция, следующая согласно логичной временной последовательности после применения терапии исследования, возникшая в соответствии с известной реакцией на терапию исследования и, в случае соответствия протоколу, подтверждается наступлением улучшения после прекращения применения терапии исследования (положительная отмена препарата) и повторным возникновением после возобновления лечения (положительное повторное назначение препарата), но при этом не может быть удовлетворительно объяснена известными характеристиками клинического состояния пациента или другой проводимой терапией, b) вероятная - это нежелательная реакция, следующая согласно временной последовательности после применения терапии исследования, возникшая в соответствии с известной реакцией на терапию исследования и, в случае соответствия протоколу, подтверждается наступлением улучшения после прекращения применения терапии исследования, но при этом не может быть удовлетворительно объяснена известными характеристиками клинического состояния пациента или другой проводимой терапией, с) Возможная - это нежелательная реакция, следующая согласно временной последовательности после применения терапии исследования, возникшая в соответствии с известной реакцией на терапию исследования, но может быть вызвана известными характеристиками клинического состояния пациента или другой проводимой терапией, d) Не связанная - это нежелательная реакция, о которой существует достаточно достоверной информации для утверждения, что ее этиология не связана с механизмом исследования. Две или более из нижеперечисленных переменных применимы к не связанной нежелательной реакции: 1) Нежелательная реакция не следует согласно временной последовательности после применения терапии исследования, 2) Нежелательная реакция легко объяснима клиническим состоянием пациента или другой проводимой терапией, 3) Нежелательная реакция не исчезает после уменьшения дозы или прекращения терапии (предполагая, что резонно ожидать исчезновения нежелательной реакции во время периода наблюдения).
[0342] Все наблюдаемые или подтвержденные нежелательные явления, возникшие после приема пациентов на лечение, протоколируются. Любое состояние, имевшее место при приеме и ухудшившееся, протоколируется как нежелательное явление. Нежелательные явления определяются на основании возникших симптомов и клиническом обследовании во время осмотров. Во время каждого стационарного или амбулаторного осмотра, пациентам задаются непрямые вопросы на предмет нежелательных действий, например: «Как вы себя чувствуете?» Изменения в лабораторных параметрах протоколируются как нежелательные явления, в случае если они сочтутся клинически важными, либо если они вызывают необходимость клинических изменений или действий, как, например, начать соответствующее лечение.
[0343] Потенциальная гуморальная или клеточная иммунная реакция на аденовирус и/или компоненты RheoSwitch® Therapeutic System RTS:
Во время определенных стационарных или амбулаторных осмотров, у пациентов берется кровь для оценки потенциальной гуморальной или клеточной иммунной реакции на аденовирус, компоненты RheoSwitch® Therapeutic System RTS и опухолевые антигены. Для выявления гуморального иммунного ответа на аденовирусный вектор применяется процедура блокирования инфицирующей способности AdVeGFP (Nwanegbo, et al. 2004). Реакция антител на компоненты RheoSwitch® Therapeutic System RTS оценивается вестерн блоттингом и/или иммуноферментным анализом сыворотки пациентов и белками RheoSwitch® Therapeutic System RTS, синтезированными вектором экспрессии. Кроме того, для оценки уровня TL-12, интерферона-гамма, IP-10 и других цитокинов Th1/Th2, как IL-2, фактор некроза опухолей-альфа, IL-4, IL-5 и IL-10, проводят мультиплексный иммуноанализ с помощью Luminex. На эти анализы цитокинов и антител требуется приблизительно 10 мл крови.
[0344] Анализы на клеточную иммунную реакцию требуют около 50-60 мл крови, из которой выделяют субпопуляции CD4 и CD8 Т-клеток. Выделенные Т-клетки смешивают с аутологичными дендритными клетками, трансдуцированными пустым вектором AdV, векторами AdV-RTS или AdV-RTS-hIL12 в процедуре иммуноферментного спот-анализа (ELISPOT) для оценки синтеза интерферона-гамма Т-клетками, активированными антигенами AdV-RTS, если таковые присутствуют. Подобные же анализы проводят с применением клеток опухоли и/или дендритных клеток, экспрессирующих перекрестнореагирующие антигены меланомы, для выявления раннего противоопухолевого ответа. При необходимости, проводят дополнительные анализы.
[0345] ТЕСТ НА БЕРЕМЕННОСТЬ: Женщины, способные выносить плод, проходят тест на беременность, сдавая пробу мочи, при наблюдении и перед первым стационарным осмотром на стадии повторного лечения. Тест проводится, по меньшей мере за 72, 48, 24 или 12 часов до приема активирующего препарата, во время как первичной, так и повторной терапии. Если тест мочи дает положительный результат, его подтверждают тестом сыворотки. В случае подтверждения беременности, пациентке не разрешается начинать курс терапии или повторной терапии. Тестирование на беременность может быть повторено столько раз, сколько необходимо.
[0346] ОПРОС О СОПУТСТВУЮЩЕМ ЛЕЧЕНИИ: Во время наблюдения и до первого осмотра на стадии повторной терапии, у каждого пациента запрашивается список принимаемых препаратов и проводимых процедур для определения любой возможной связи с нежелательными реакциями, возникающими во время курса терапии и стадии контроля.
[0347] КРИТЕРИИ ПОВТОРНОЙ ТЕРАПИИ: Если пациент перенес начальную прививку AdDC без ограничивающих нежелательных реакций, а также у него не было замечено прогрессирования заболевания или спада симптомов во время потенциального повторного лечения, может быть рассмотрен вопрос о повторной терапии. Если, по мнению руководителя исследования и лечащего врача, существует потенциальная клиническая польза в проведении дополнительной(ых) внутриопухолевой(ых) инъекции(ий) аутологичных дендритных клеток в комбинации с активирующим препаратом (максимально переносимая доза группы 1) в течение 14 последовательных дней, данному пациенту предлагают повторную терапию, при соответствии следующим критериям:
1. Не было выявлено лимитирующей токсичности,
2. Заболевание пациента устойчиво, либо нет клинических или субъективных признаков улучшения и
3. Не получено подтверждения гуморальной или клеточной иммунной реакции на аденовирусные компоненты RheoSwitch® Therapeutic System.
[0348] ОЦЕНКА ТРАНСГЕННОЙ ФУНКЦИИ И ИММУНОЛОГИЧЕСКИХ ЭФФЕКТОВ: Для оценки in vivo трансгенной экспрессии интерлейкина-12 и клеточного иммунного ответа проводятся пункции и биопсии опухоли и дренирующих опухоль лимфоузлов во время наблюдения (дни -12 - -7), на 4, 8 и 14 дни курса терапии и на 1 месяце контрольного постстационарного периода (см. Таблицы 3-5). Биоптаты опухоли и инфильтрованных опухолью лимфоузлов берут с помощью аспирации тонкой иглой в дни -12 - -7 и день 14 периода повторной терапии для оценки in vivo трансгенной экспрессии интерлейкина-12 и клеточного иммунного ответа. Биоптаты исследуются микроскопически и иммуногистохимически для оценки клеточной инфильтрации Т-клеток в опухоль и дренирующие лимфоузлы. Срезы биоптатов исследуются патологом, не знающем о сущности объекта исследования. Чтобы различить эндогенную и индуцированную экспрессию интерлейкина-12 дендритными клетками в опухоли и инфильтрованных лимфатических узлах, применяется полимеразная цепная реакция с обратной транскрипцией ОТ-ПЦР на РНК с соответственно приготовленными праймерами. Для оценки цитокинового профиля сыворотки, во время наблюдения, на 4, 8 и 14 день курса терапии, через месяц во время постстационарного периода наблюдения, и в -12, -7, 8 и 14 день повторной терапии у пациентов берется кровь на анализ (см. Таблицы 3-5). Цитокиновый профиль позволяет выяснить, повлияло ли введение трансгена IL-12 на экспрессию других цитокинов. Для оценки уровня IL- 12, интерферона-гамма, ГР-10 и других цитокинов Th1/Th2, как 1L-2, фактора некроза опухолей-альфа, IL-4, IL-5 и IL-10, проводят мультиплексный иммуноанализ с помощью Luminex. На эти анализы цитокинов и антител требуется приблизительно 10 мл крови.
[0349] ФАРМАКОКИНЕТИКА АКТИВИРУЮЩЕГО ПРЕПАРАТА В СЛУЧАЕ ЕДИНИЧНОЙ ДОЗЫ И В СТАБИЛЬНОМ СОСТОЯНИИ:
Для оценки фармакокинетики/ADME (всасывания, распределения, метаболизма и выведения) единичной дозы, кровь берется в определенные временные фазы (перед приемом препарата, через 0.5, 1, 1.5, 2, 4, 6, 8, 12, 16 и 24 часа после утреннего приема), для их оценки в стационарном состоянии кровь берется на 8 день курса терапии.
Для получения нижеперечисленных фармакокинетических предельных значений активирующего лиганда и его основных метаболитов в стационарном состоянии плазма исследуется высокоэффективной жидкостной хроматографией:
Сmax (максимальная отмеченная концентрация плазмы), Тmax (время выявления максимальной концентрации плазмы), Cmmgh (минимальная отмеченная концентрация плазмы, вычисленная как среднее значение в интервале от 0 до 24 часов), C24h (концентрация плазмы при значении времени, равном 24 часам), AUC24h (площадь области под кривой зависимости концентрации плазмы от времени в интервале от 0 до 24 часов), Kе (наблюдаемая скорость элиминации) и Т112 (наблюдаемое время полувыведения). Следует иметь в виду, что приведенные выше примеры являются исключительно иллюстративными и не ограничивают настоящее изобретение каким-либо образом, а приведенные пункты охватывают все варианты реализации, описанные в деталях или теоретически осуществимые согласно изобретению.
ЛИТЕРАТУРА
Abdi K., et al. (2006). T-cell control of IL-12p75 production. Scand J Immunol 64: 83-92.
Adorini, L. (1999). Interleukin-12, a key cytokine in Th1-mediated autoimmune diseases. Cell MoI Life Sci 55: 1610-25.
Adorini, L., (2001). Interleukin 12 and autoimmune diabetes. Nat Genet 27: 131-2.
Adorini, L., et al. (2002). Understanding autoimmune diabetes: insights from mouse models. Trends MoI Med 8: 31-8.
Adorini, L., et al. (1996). The role of IL-12 in the pathogenesis of Th1 cell-mediated autoimmune diseases. Ann N Y Acad Sci 795: 208-15.
Akhtar, N., et al. (2004). Interleukin-12 inhibits tumor growth in a novel angiogenesis canine hemangiosarcoma xenograft model. Neoplasia 6: 106-16.
Akiyama, Y., et al. (2000). Enhancement of antitumor immunity against В16 melanoma tumor using genetically modified dendritic cells to produce cytokines. Gene Ther 7: 2113-21.
Al-Mohanna, F., et al. (2002). IL-12-dependent nuclear factor-kappaB activation leads to de no vo synthesis and release of IL-8 and TNF-alpha in human neutrophils. J Leukoc Biol 72: 995-1002.
Aliberti, J.C., et al. (1996). Interleukin-12 mediates resistance to Trypanosoma cruzi in mice and is produced by murine macrophages in response to live trypomastigotes. Infect Immun 64: 1961-7.
Allavena, P., et al. (1994). Interleukin-12 is chemotactic for natural killer cells and stimulates their interaction with vascular endothelium. Blood 84: 2261-8.
Alii, R.S. and Khar, A. (2004). Interleukin-12 secreted by mature dendritic cells mediates activation of NK cell function. FEBS Lett 559: 71-6.
Alzona, M., et al. (1996). Interleukin-12 activates interferon-gamma production by targeted activation of CD30+T cells. Ann N Y Acad Sci 795: 127-36.
Amemiya, K., et al. (2006). Interleukin-12 induces a Thl-like response to Burkholderia mallei and limited protection in BALB/c mice. Vaccine 24: 1413-20.
Anderson, R.D., et al. (2000). Ad-RTS-hIL-1. A simple method for the rapid generation of recombinant adenovirus vectors. Gene Therapy, 4,1034-1038.
Araujo, M.I., et al. (2001). Interleukin-12 promotes pathologic liver changes and death in mice coinfected with Schistosoma mansoni and Toxoplasma gondii. Infect Immun 69: 1454-62.
Arthur, F.F., et al. (1997). A comparison of gene transfer methods in human dendritic cells. Cancer Gene Therapy, 4,17-25.
Arulanandam, B.P., et al. (1999). IL-12 is a potent neonatal vaccine adjuvant. Eur J Immunol 29: 256-64.
Athie, M.V., et al. (2000). IL-12 selectively regulates STAT4 via phosphatidylinositol 3- kinase and Ras-independent signal transduction pathways. Eur J Immunol 30: 1425-34.
Athie-Morales, V., et al. (2004). Sustained IL-12 signaling is required for Th1 development. J Immunol 172: 61-9.
Atkins, M.B., et al. (1999). High-dose recombinant interleukin 2 therapy for patients with metastatic melanoma: analysis of 270 patients treated between 1985 and 1993. J Clin Oncol; 17: 2105-2116.
Atkins, MB., et al. (1997). Phase I evaluation of intravenous recombinant human interleukin 12 in patients with advanced malignancies. Clin Cancer Res 3: 409-17.
Balch, СМ., et al. (2001). Final version of the American joint committee on cancer staging system for cutaneous melanoma. Journal of Clinical Oncology, 19: 3635-3648, 2001.
Berard, F., et al. (2000). Cross-priming of naive CD8 T cells against melanoma antigens using dendritic cells loaded with killed allogeneic melanoma cells. J Exp Med 192: 1535-44.
Bertagnolli, M.M., et al. (1992). IL-12 augments antigen-dependent proliferation of activated T lymphocytes. J Immunol 149: 3778-83.
Bhardwaj, N., et al. (1996). IL-12 in conjunction with dendritic cells enhances antiviral CD8+CTL responses in vitro. J CHn Invest 98: 715-22.
Biedermann, Т., et al. (2006). BL-12 instructs skin homing of human Th2 cells. J Immunol 111: 3763-70.
Brunda, MJ, and Gately, M.K. (1994). Antitumor activity of interleukin- 12. Clin Immunol Immunopathol 71: 253-5.
Buchanan, J.M., et al. (1995). Interleukin 12 alters the isotype-restricted antibody response of mice to hen eggwhite lysozyme. Int Immunol 7: 1519-28.
Butterfield, L., et al. (2003). Determinant spreading associated with clinical response in dendritic cell-based immunotherapy for malignant melanoma. Clinical Cancer Research, 9, 998- 1008.
Cella M., et al, (1999) Maturation, Activation, and Protection of Dendritic Cells Induced by Double stranded РНК. J. Exp.Med. 189,821-829.
Chada, S., et al. (2003). Cytokine- and chemokine-based gene therapy for cancer. Curr Opin Mot Ther, 5: 463-474.
Faure, F., et al. (1998). Tumor-specific immune response: current in vitro analyses may not reflect the in vivo immune status. Crit Rev Immunol 18: 77-86.
Gambotto, Robins et al. 2004.
Gilboa, E. (2007). DC-based Clinical Vaccines. J. Clinic. Invest. 117: 1195-1203.
Gogas, H., et al. (2006). Prognostic significance of autoimmunity during treatment of melanoma with interferon. New England Journal of Medicine, 354, 709-718.
Heinzerling, L., et al. (2005). Intratumoral injection of DNA encoding human interleukin 12 into patients with metastatic melanoma: clinical efficacy. Hum Gene Ther 16: 35-48.
Itoh, Т., et al. (1994). Partial purification of murine tumor-associated peptide epitopes common to histologically distinct tumors, melanoma and sarcoma, that are presented by H-2Kb molecules and recognized by CD8+tumor-infiltrating lymphocytes. J Immunol 153: 1202-15.
Kaka, K.S., et al. (2008). Using Dendritic Cell Maturation and IL-12 Producing Capacity as Markers of Functin; A Cautionay Tale. J. Immunother, 31 (4): 359.
Kalinski, P., et al. (2005). Natural killer-dendritic cell cross-talk in cancer immunotherapy. Expert Opinion Biological Therapy, 1303-1315.
Kang, W.K., et al. (2001). Interleukin 12 gene therapy of cancer by peritumoral injection of transduced autologous fibroblasts: outcome of a phase I study. Hum Gene Ther 12: 671-84.
Karzenowski, D., et al. (2005). Inducible control of transgene expression with ecdysone receptor: gene switches with high sensitivity, robust expression, and reduced size. Biotechniques 39,191-192.
Kikuchi, T. (2006). Genetically modified dendritic cells for therapeutic immunity. Journal of Experimental Medicine, 208, 1-8.
Kumar, P., and Katakam. A. (2007). RheoSwitch® System: a highly sensitive ecdysone receptor-based gene regulation system induced by synthetic small-molecule ligands. In Gene Transfer: Delivery and Expression of DNA and RNA b Ed. Friedmann, T. and Rossi, J., Cold Spring Harbor Laboratory Press, 643-651.
Liu, Y., et al. (2002). In situ adenoviral interleukin 12 gene transfer confers potent and long-lasting cytotoxic in glioma. Cancer Gene Therapy, 9, 9-15.
Mazzolini, G., et al. (2005). Intratumoral injection of dendritic cells engineered to secrete interleukin-12 by recombinant adenovirus in patients with metastic gastrointestinal carcinomas. Journal of Clinical Oncology, 23, 999-1010.
Murphy, A., et al. (2005). Gene modification strategies to induce tumor immunity. Immunity, 22, 409-414.
Nagayama, H., et al. (2000). IL-12 Responsiveness and Expression of IL-12 Receptor in Human Peripheral Blood Monocyte-derived Dendritic Cells. J. Immunol. 165: 59-66.
Nwanegbo E., et al. (2004). Prevalence of neutralizing antibodies to adenoviral serotypes 5 and 35 in the adult populations of The Gambia, South Africa, and the United States. Clinical Diagnostic Lab Immunology. March, 11(2), 351-357.
Palli, S.R., et al. (2003). Improved ecdysone receptor-based inducible gene regulation system. European Journal of Biochemistry, 270, 1308-1315.
Philpott, NJ., et al. (2004). Adenovirus-induced maturation of Dendritic Cells through a PI3 kinase-mediated TNF-alpha induction pathway. PNAS 101, 6200-6205.
Ranieri, E., et al. (1999). Dendritic cells transduced with an adenovirus vector encoding epstein-barr virus latent membrane protein 2B: a new modality for vaccination. Journal of Virology, 73, 10416-10425.
Ribas, A., et al. (2002). Cancer immunotherapy using gene-modified dendritic cells. Cancer Gene Therapy, 2, 57-78.
Romani, N., et al. (1994). Proliferating dendritic cell progenitors in human blood. Journal of Experimental Medicine, 180, 83-93.
Romani L, et al. (1997). Interleukin-12 in infectious diseases. Clin Microbiol Rev 10: 611-36.
Rothe, H., et al. (1996). Interleukin-12 gene expression mediates the accelerating effect of cyclophosphamide in autoimmune disease. Ann N Y Acad Sci 795: 397-9.
Sangro, В., et al. (2004). Phase I trial of intratumoral injection of an adenovirus encoding interleukin-12 for advanced digestive tumors. J CHn Oncol 22: 1389-97.
Sangro, В., et al. (2005). Gene therapy of cancer based on interleukin 12. Curr Gene Ther 5: 573-
81.
Satoh, Y., et al. (2002). Local administration of IL-12-transfected dendritic cells induces antitumor immune responses to colon adenocarcinoma in the liver in mice. J Exp Ther Oncol 2: 337-49.
Satoskar, A.R., et al. (2000). IL-12 gene-deficient C57BL/6 mice are susceptible to Leishmania donovani but have diminished hepatic immunopathology. Eur J Immunol 30: 834-9.
Schopf, L.R., et al. (1999). Interleukin-12 is capable of generating an antigen-specific Th1 -type response in the presence of an ongoing infection-driven Th2-type response. Infect Immun ol: 2166-71.
Spatz, M., et al., (2000). Immune response to the Herpes Simplex Type I regulatory Proteins ICP8 and VP 16 in Infected Persons. J. Med. Virol. 62, 29-36.
Svane, I.M., et al. (1999). The role of cytotoxic T-lymphocytes in the prevention and immune surveillance of tumors-lessons from normal and immunodeficient mice. Med Oncol 16: 223-38.
Tang, H.L. and Cyster, J. G., (1999). Chemokine up-regulation and activated T cell attraction by maturing dendritic cells. Science, 284, 819-822.
Tatsumi, Т., et al. (2003). Intratumoral delivery of dendritic cells engineered to secrete both interleukin (IL)- 12 and IL- 18 effectively treats local and distant disease in association with broadly reactive Tel -type immunity. Cancer Res 63: 6378-86.
Thomas, G.R., et al. (2000). IL-12- and IL-2-induced tumor regression in a new murine model of oral squamous-cell carcinoma is promoted by expression of the CD80 co-stimulatory molecule and interferon-gamma. Int J Cancer 86: 368-74.
Trinchieri, G. (2003). Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol 3: 133-46.
Triozzi, P.L., et al. (2005). Phase I study of the intratumoral administration of recombinant canarypox viruses expressing B7.1 and interleukin 12 in patients with metastatic melanoma. Clin Cancer Res 11:4168-75.
Tsugawa, Т., et al. (2004). Sequential delivery of interferon-gene and DCs to intracranial gliomas promotes an effective anti-tumor response. Gene Therapy, 11,1551 -1558.
Tsung, K., et al. (1997). IL-12 induces T helper 1-directed antitumor response. J Immunol 158: 3359-65.
Vujanovic, L., et al. (2006). EL-12p70 and IL-18 gene-modified dendritic cells loaded with tumor antigen-derived peptides о recombinant protein effectively stimulate specific Type-1 CD4(+) T-cell responses from normal donors and melanoma patients in vitro. Cancer Gene Therapy, 13, 798-805.
Wigginton, J.M. and Wiltrout, R.H. (2002). IL-12/IL-2 combination cytokine therapy for solid tumours: translation from bench to bedside. Expert Opin Biol Ther, 2: 513-524.
Wolf, S.F., et al. (1994). Interleukin 12: a key modulator of immune function. Stem Cells 12: 154-68.
Yamanaka, R., et al. (2002). Marked enhancement of antitumor immune responses in mouse brain tumor models by genetically modified dendritic cells producing Semliki Forest virus-mediated interleukin-12. J Neurosurg 97: 611-8.
Yuminamochi, E., et al. (2007). Interleukin-12- and interferon-gamma-mediated natural killer cell activation by Agaricus blazei Murill. Immunology.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Braughler, J. Mark
Kumar, Prasanna
Storkus, Walter J.
Okada, Hideho
<120> Engineered Dendritic Cells And Uses For The Treatment Of Cancer
<130> 2584.007000E
<150> US 12/247,738
<151> 2008-10-08
<150> US 61/019,089
<151> 2008-01-04
<150> US 60/991,807
<151> 2007-12-03
<150> US 60/990,689
<151> 2007-11-28
<150> US 60/990,167
<151> 2007-11-26
<150> US 60/979,480
<151> 2007-10-12
<150> US 60/979,485
<151> 2007-10-12
<150> US 60/978,509
<151> 2007-10-09
<150> US 60/978,394
<151> 2007-10-08
<150> US 60/978,224
<151> 2007-10-08
<160> 13
<170> PatentIn version 3.3
<210> 1
<211> 648
<212> DNA
<213> Mus sp.
<220>
<223> IL-12 p35
<400> 1
atgtgtcaat cacgctacct cctctttttg gccacccttg ccctcctaaa ccacctcagt 60
ttggccaggg tcattccagt ctctggacct gccaggtgtc ttagccagtc ccgaaacctg 120
ctgaagacca cagatgacat ggtgaagacg gccagagaaa aactgaaaca ttattcctgc 180
actgctgaag acatcgatca tgaagacatc acacgggacc aaaccagcac attgaagacc 240
tgtttaccac tggaactaca caagaacgag agttgcctgg ctactagaga gacttcttcc 300
acaacaagag ggagctgcct gcccccacag aagacgtctt tgatgatgac cctgtgcctt 360
ggtagcatct atgaggactt gaagatgtac cagacagagt tccaggccat caacgcagca 420
cttcagaatc acaaccatca gcagatcatt ctagacaagg gcatgctggt ggccatcgat 480
gagctgatgc agtctctgaa tcataatggc gagactctgc gccagaaacc tcctgtggga 540
gaagcagacc cttacagagt gaaaatgaag ctctgcatcc tgcttcacgc cttcagcacc 600
cgcgtcgtga ccatcaacag ggtgatgggc tatctgagct ccgcctga 648
<210> 2
<211> 1008
<212> DNA
<213> Mus sp.
<220>
<223> IL-12 p40
<400> 2
atgtgtcctc agaagctaac catctcctgg tttgccatcg ttttgctggt gtctccactc 60
atggccatgt gggagctgga gaaagacgtt tatgttgtag aggtggactg gactcccgat 120
gcccctggag aaacagtgaa cctcacctgt gacacgcctg aagaagatga catcacctgg 180
acctcagacc agagacatgg agtcataggc tctggaaaga ccctgaccat cactgtcaaa 240
gagtttctag atgctggcca gtacacctgc cacaaaggag gcgagactct gagccactca 300
catctgctgc tccacaagaa ggaaaatgga atttggtcca ctgaaatttt aaaaaatttc 360
aaaaacaaga ctttcctgaa gtgtgaagca ccaaattact ccggacggtt cacgtgctca 420
tggctggtgc aaagaaacat ggacttgaag ttcaacatca agagcagtag cagttcccct 480
gactctcggg cagtgacatg tggaatggcg tctctgtctg cagagaaggt cacactggac 540
caaagggact atgagaagta ttcagtgtcc tgccaggagg atgtcacctg cccaactgcc 600
gaggagaccc tgcccattga actggcgttg gaagcacggc agcagaataa atatgagaac 660
tacagcacca gcttcttcat cagggacatc atcaaaccag acccgcccaa gaacttgcag 720
atgaagcctt tgaagaactc acaggtggag gtcagctggg agtaccctga ctcctggagc 780
actccccatt cctacttctc cctcaagttc tttgttcgaa tccagcgcaa gaaagaaaag 840
atgaaggaga cagaggaggg gtgtaaccag aaaggtgcgt tcctcgtaga gaagacatct 900
accgaagtcc aatgcaaagg cgggaatgtc tgcgtgcaag ctcaggatcg ctattacaat 960
tcctcatgca gcaagtgggc atgtgttccc tgcagggtcc gatcctag 1008
<210> 3
<211> 660
<212> DNA
<213> Homo sapiens
<220>
<223> IL-12 p35
<400> 3
atgtgtccag cgcgcagcct cctccttgtg gctaccctgg tcctcctgga ccacctcagt 60
ttggccagaa acctccccgt ggccactcca gacccaggaa tgttcccatg ccttcaccac 120
tcccaaaacc tgctgagggc cgtcagcaac atgctccaga aggccagaca aactctagaa 180
ttttaccctt gcacttctga agagattgat catgaagata tcacaaaaga taaaaccagc 240
acagtggagg cctgtttacc attggaatta accaagaatg agagttgcct aaattccaga 300
gagacctctt tcataactaa tgggagttgc ctggcctcca gaaagacctc ttttatgatg 360
gccctgtgcc ttagtagtat ttatgaagac ttgaagatgt accaggtgga gttcaagacc 420
atgaatgcaa agcttctgat ggatcctaag aggcagatct ttctagatca aaacatgctg 480
gcagttattg atgagctgat gcaggccctg aatttcaaca gtgagactgt gccacaaaaa 540
tcctcccttg aagaaccgga tttttataaa actaaaatca agctctgcat acttcttcat 600
gctttcagaa ttcgggcagt gactattgac agagtgacga gctatctgaa tgcttcctaa 660
<210> 4
<211> 987
<212> DNA
<213> Homo sapiens
<220>
<223> IL-12 p40
<400> 4
atgtgtcacc agcagttggt catctcttgg ttttccctgg tttttctggc atctcccctc 60
gtggccatat gggaactgaa gaaagatgtt tatgtcgtag aattggattg gtatccggat 120
gcccctggag aaatggtggt cctcacctgt gacacccctg aagaagatgg tatcacctgg 180
accttggacc agagcagtga ggtcttaggc tctggcaaaa ccctgaccat ccaagtcaaa 240
gagtttggag atgctggcca gtacacctgt cacaaaggag gcgaggttct aagccattcg 300
ctcctgctgc ttcacaaaaa ggaagatgga atttggtcca ctgatatttt aaaggaccag 360
aaagaaccca aaaataagac ctttctaaga tgcgaggcca agaattattc tggacgtttc 420
acctgctggt ggctgacgac aatcagtact gatttgacat tcagtgtcaa aagcagcaga 480
ggctcttctg acccccaagg ggtgacgtgc ggagctgcta cactctctgc agagagagtc 540
agaggggaca acaaggagta tgagtactca gtggagtgcc aggaggacag tgcctgccca 600
gctgctgagg agagtctgcc cattgaggtc atggtggatg ccgttcacaa gctcaagtat 660
gaaaactaca ccagcagctt cttcatcagg gacatcatca aacctgaccc acccaagaac 720
ttgcagctga agccattaaa gaattctcgg caggtggagg tcagctggga gtaccctgac 780
acctggagta ctccacattc ctacttctcc ctgacattct gcgttcaggt ccagggcaag 840
agcaagagag aaaagaaaga tagagtcttc acggacaaga cctcagccac ggtcatctgc 900
cgcaaaaatg ccagcattag cgtgcgggcc caggaccgct actatagctc atcttggagc 960
gaatgggcat ctgtgccctg cagttag 987
<210> 5
<211> 215
<212> PRT
<213> Mus sp.
<220>
<223> IL-12 p35
<400> 5
Met Cys Gln Ser Arg Tyr Leu Leu Phe Leu Ala Thr Leu Ala Leu Leu
1 5 10 15
Asn His Leu Ser Leu Ala Arg Val Ile Pro Val Ser Gly Pro Ala Arg
20 25 30
Cys Leu Ser Gln Ser Arg Asn Leu Leu Lys Thr Thr Asp Asp Met Val
35 40 45
Lys Thr Ala Arg Glu Lys Leu Lys His Tyr Ser Cys Thr Ala Glu Asp
50 55 60
Ile Asp His Glu Asp Ile Thr Arg Asp Gln Thr Ser Thr Leu Lys Thr
65 70 75 80
Cys Leu Pro Leu Glu Leu His Lys Asn Glu Ser Cys Leu Ala Thr Arg
85 90 95
Glu Thr Ser Ser Thr Thr Arg Gly Ser Cys Leu Pro Pro Gln Lys Thr
100 105 110
Ser Leu Met Met Thr Leu Cys Leu Gly Ser Ile Tyr Glu Asp Leu Lys
115 120 125
Met Tyr Gln Thr Glu Phe Gln Ala Ile Asn Ala Ala Leu Gln Asn His
130 135 140
Asn His Gln Gln Ile Ile Leu Asp Lys Gly Met Leu Val Ala Ile Asp
145 150 155 160
Glu Leu Met Gln Ser Leu Asn His Asn Gly Glu Thr Leu Arg Gln Lys
165 170 175
Pro Pro Val Gly Glu Ala Asp Pro Tyr Arg Val Lys Met Lys Leu Cys
180 185 190
Ile Leu Leu His Ala Phe Ser Thr Arg Val Val Thr Ile Asn Arg Val
195 200 205
Met Gly Tyr Leu Ser Ser Ala
210 215
<210> 6
<211> 335
<212> PRT
<213> Mus sp.
<220>
<223> IL-12 p40
<400> 6
Met Cys Pro Gln Lys Leu Thr Ile Ser Trp Phe Ala Ile Val Leu Leu
1 5 10 15
Val Ser Pro Leu Met Ala Met Trp Glu Leu Glu Lys Asp Val Tyr Val
20 25 30
Val Glu Val Asp Trp Thr Pro Asp Ala Pro Gly Glu Thr Val Asn Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Asp Ile Thr Trp Thr Ser Asp Gln
50 55 60
Arg His Gly Val Ile Gly Ser Gly Lys Thr Leu Thr Ile Thr Val Lys
65 70 75 80
Glu Phe Leu Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Thr
85 90 95
Leu Ser His Ser His Leu Leu Leu His Lys Lys Glu Asn Gly Ile Trp
100 105 110
Ser Thr Glu Ile Leu Lys Asn Phe Lys Asn Lys Thr Phe Leu Lys Cys
115 120 125
Glu Ala Pro Asn Tyr Ser Gly Arg Phe Thr Cys Ser Trp Leu Val Gln
130 135 140
Arg Asn Met Asp Leu Lys Phe Asn Ile Lys Ser Ser Ser Ser Ser Pro
145 150 155 160
Asp Ser Arg Ala Val Thr Cys Gly Met Ala Ser Leu Ser Ala Glu Lys
165 170 175
Val Thr Leu Asp Gln Arg Asp Tyr Glu Lys Tyr Ser Val Ser Cys Gln
180 185 190
Glu Asp Val Thr Cys Pro Thr Ala Glu Glu Thr Leu Pro Ile Glu Leu
195 200 205
Ala Leu Glu Ala Arg Gln Gln Asn Lys Tyr Glu Asn Tyr Ser Thr Ser
210 215 220
Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn Leu Gln
225 230 235 240
Met Lys Pro Leu Lys Asn Ser Gln Val Glu Val Ser Trp Glu Tyr Pro
245 250 255
Asp Ser Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Lys Phe Phe Val
260 265 270
Arg Ile Gln Arg Lys Lys Glu Lys Met Lys Glu Thr Glu Glu Gly Cys
275 280 285
Asn Gln Lys Gly Ala Phe Leu Val Glu Lys Thr Ser Thr Glu Val Gln
290 295 300
Cys Lys Gly Gly Asn Val Cys Val Gln Ala Gln Asp Arg Tyr Tyr Asn
305 310 315 320
Ser Ser Cys Ser Lys Trp Ala Cys Val Pro Cys Arg Val Arg Ser
325 330 335
<210> 7
<211> 219
<212> PRT
<213> Homo sapiens
<220>
<223> IL-12 p35
<400> 7
Met Cys Pro Ala Arg Ser Leu Leu Leu Val Ala Thr Leu Val Leu Leu
1 5 10 15
Asp His Leu Ser Leu Ala Arg Asn Leu Pro Val Ala Thr Pro Asp Pro
20 25 30
Gly Met Phe Pro Cys Leu His His Ser Gln Asn Leu Leu Arg Ala Val
35 40 45
Ser Asn Met Leu Gln Lys Ala Arg Gln Thr Leu Glu Phe Tyr Pro Cys
50 55 60
Thr Ser Glu Glu Ile Asp His Glu Asp Ile Thr Lys Asp Lys Thr Ser
65 70 75 80
Thr Val Glu Ala Cys Leu Pro Leu Glu Leu Thr Lys Asn Glu Ser Cys
85 90 95
Leu Asn Ser Arg Glu Thr Ser Phe Ile Thr Asn Gly Ser Cys Leu Ala
100 105 110
Ser Arg Lys Thr Ser Phe Met Met Ala Leu Cys Leu Ser Ser Ile Tyr
115 120 125
Glu Asp Leu Lys Met Tyr Gln Val Glu Phe Lys Thr Met Asn Ala Lys
130 135 140
Leu Leu Met Asp Pro Lys Arg Gln Ile Phe Leu Asp Gln Asn Met Leu
145 150 155 160
Ala Val Ile Asp Glu Leu Met Gln Ala Leu Asn Phe Asn Ser Glu Thr
165 170 175
Val Pro Gln Lys Ser Ser Leu Glu Glu Pro Asp Phe Tyr Lys Thr Lys
180 185 190
Ile Lys Leu Cys Ile Leu Leu His Ala Phe Arg Ile Arg Ala Val Thr
195 200 205
Ile Asp Arg Val Met Ser Tyr Leu Asn Ala Ser
210 215
<210> 8
<211> 328
<212> PRT
<213> Homo sapiens
<220>
<223> IL-12 p40
<400> 8
Met Cys His Gln Gln Leu Val Ile Ser Trp Phe Ser Leu Val Phe Leu
1 5 10 15
Ala Ser Pro Leu Val Ala Ile Trp Glu Leu Lys Lys Asp Val Tyr Val
20 25 30
Val Glu Leu Asp Trp Tyr Pro Asp Ala Pro Gly Glu Met Val Val Leu
35 40 45
Thr Cys Asp Thr Pro Glu Glu Asp Gly Ile Thr Trp Thr Leu Asp Gln
50 55 60
Ser Ser Glu Val Leu Gly Ser Gly Lys Thr Leu Thr Ile Gln Val Lys
65 70 75 80
Glu Phe Gly Asp Ala Gly Gln Tyr Thr Cys His Lys Gly Gly Glu Val
85 90 95
Leu Ser His Ser Leu Leu Leu Leu His Lys Lys Glu Asp Gly Ile Trp
100 105 110
Ser Thr Asp Ile Leu Lys Asp Gln Lys Glu Pro Lys Asn Lys Thr Phe
115 120 125
Leu Arg Cys Glu Ala Lys Asn Tyr Ser Gly Arg Phe Thr Cys Trp Trp
130 135 140
Leu Thr Thr Ile Ser Thr Asp Leu Thr Phe Ser Val Lys Ser Ser Arg
145 150 155 160
Gly Ser Ser Asp Pro Gln Gly Val Thr Cys Gly Ala Ala Thr Leu Ser
165 170 175
Ala Glu Arg Val Arg Gly Asp Asn Lys Glu Tyr Glu Tyr Ser Val Glu
180 185 190
Cys Gln Glu Asp Ser Ala Cys Pro Ala Ala Glu Glu Ser Leu Pro Ile
195 200 205
Glu Val Met Val Asp Ala Val His Lys Leu Lys Tyr Glu Asn Tyr Thr
210 215 220
Ser Ser Phe Phe Ile Arg Asp Ile Ile Lys Pro Asp Pro Pro Lys Asn
225 230 235 240
Leu Gln Leu Lys Pro Leu Lys Asn Ser Arg Gln Val Glu Val Ser Trp
245 250 255
Glu Tyr Pro Asp Thr Trp Ser Thr Pro His Ser Tyr Phe Ser Leu Thr
260 265 270
Phe Cys Val Gln Val Gln Gly Lys Ser Lys Arg Glu Lys Lys Asp Arg
275 280 285
Val Phe Thr Asp Lys Thr Ser Ala Thr Val Ile Cys Arg Lys Asn Ala
290 295 300
Ser Ile Ser Val Arg Ala Gln Asp Arg Tyr Tyr Ser Ser Ser Trp Ser
305 310 315 320
Glu Trp Ala Ser Val Pro Cys Ser
325
<210> 9
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic ecdysone receptor response element
<220>
<221> misc_feature
<222> (9)..(9)
<223> n is a,c,t,g, or t
<400> 9
rrggttcant gacacyy 17
<210> 10
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic ecdysone receptor response element
<220>
<221> misc_feature
<222> (7)..(7)
<223> n is a, c, g, or t
<400> 10
aggtcanagg tca 13
<210> 11
<211> 15
<212> DNA
<213> Artifical Sequence
<220>
<223> Synthetic ecdysone receptor response element
<400> 11
gggttgaatg aattt 15
<210> 12
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Synthetic I-SceI homing endonuclease restriction site
<400> 12
tagggataac agggtaat 18
<210> 13
<211> 37323
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Ad-RTS-hIL-12 (SP1-RheoIL-12)
<400> 13
catcatcaat aatatacctt attttggatt gaagccaata tgataatgag ggggtggagt 60
ttgtgacgtg gcgcggggcg tgggaacggg gcgggtgacg tagtagtgtg gcggaagtgt 120
gatgttgcaa gtgtggcgga acacatgtaa gcgacggatg tggcaaaagt gacgtttttg 180
gtgtgcgccg gtgtacacag gaagtgacaa ttttcgcgcg gttttaggcg gatgttgtag 240
taaatttggg cgtaaccgag taagatttgg ccattttcgc gggaaaactg aataagagga 300
agtgaaatct gaataatttt gtgttactca tagcgcgtaa tatttgtcta gggagatccg 360
gtaccggcgc gcgcgccgtt tggccgcctc gagtctagag atccggtgag tattaggcgc 420
gcaccaggtg ccgcaataaa atatctttat tttcattaca tctgtgtgtt ggttttttgt 480
gtgaatcgat agtactaaca tacgctctcc atcaaaacaa aacgaaacaa aacaaactag 540
caaaataggc tgtccccagt gcaagtgcag gtgccagaac atttctctat cgataatgca 600
ggtcggagta ctgtcctccg agcggagtac tgtcctccga gcggagtact gtcctccgag 660
cggagtactg tcctccgagc ggagtactgt cctccgagcg gagtactgtc ctccgagcgg 720
agactcttcg aaggaagagg ggcggggtcg atcgaccccg cccctcttcc ttcgaaggaa 780
gaggggcggg gtcgaagacc tagagggtat ataatgggtg ccttagctgg tgtgtgagct 840
catcttcctg tagatcacgc gtgccaccat gggtcaccag cagttggtca tctcttggtt 900
ttccctggtt tttctggcat ctcccctcgt ggccatatgg gaactgaaga aagatgttta 960
tgtcgtagaa ttggattggt atccggatgc ccctggagaa atggtggtcc tcacctgtga 1020
cacccctgaa gaagatggta tcacctggac cttggaccag agcagtgagg tcttaggctc 1080
tggcaaaacc ctgaccatcc aagtcaaaga gtttggagat gctggccagt acacctgtca 1140
caaaggaggc gaggttctaa gccattcgct cctgctgctt cacaaaaagg aagatggaat 1200
ttggtccact gatattttaa aggaccagaa agaacccaaa aataagacct ttctaagatg 1260
cgaggccaag aattattctg gacgtttcac ctgctggtgg ctgacgacaa tcagtactga 1320
tttgacattc agtgtcaaaa gcagcagagg ctcttctgac ccccaagggg tgacgtgcgg 1380
agctgctaca ctctctgcag agagagtcag aggggacaac aaggagtatg agtactcagt 1440
ggagtgccag gaggacagtg cctgcccagc tgctgaggag agtctgccca ttgaggtcat 1500
ggtggatgcc gttcacaagc tcaagtatga aaactacacc agcagcttct tcatcaggga 1560
catcatcaaa cctgacccac ccaagaactt gcagctgaag ccattaaaga attctcggca 1620
ggtggaggtc agctgggagt accctgacac ctggagtact ccacattcct acttctccct 1680
gacattctgc gttcaggtcc agggcaagag caagagagaa aagaaagata gagtcttcac 1740
ggacaagacc tcagccacgg tcatctgccg caaaaatgcc agcattagcg tgcgggccca 1800
ggaccgctac tatagctcat cttggagcga atgggcatct gtgccctgca gttaggttgg 1860
gcgagctcga attcattgat cccccgggct gcaggaattc gatatcaagc tcgggatccg 1920
aattccgccc cccccccccc ccccccccta acgttactgg ccgaagccgc ttggaataag 1980
gccggtgtgc gtttgtctat atgttatttt ccaccatatt gccgtctttt ggcaatgtga 2040
gggcccggaa acctggccct gtcttcttga cgagcattcc taggggtctt tcccctctcg 2100
ccaaaggaat gcaaggtctg ttgaatgtcg tgaaggaagc agttcctctg gaagcttctt 2160
gaagacaaac aacgtctgta gcgacccttt gcaggcagcg gaacccccca cctggcgaca 2220
ggtgcctctg cggccaaaag ccacgtgtat aagatacacc tgcaaaggcg gcacaacccc 2280
agtgccacgt tgtgagttgg atagttgtgg aaagagtcaa atggctctcc tcaagcgtat 2340
tcaacaaggg gctgaaggat gcccagaagg taccccattg tatgggatct gatctggggc 2400
ctcggtgcac atgctttaca tgtgtttagt cgaggttaaa aaaacgtcta ggccccccga 2460
accacgggga cgtggttttc ctttgaaaaa cacgatgata atatggccac aaccatgggt 2520
ccagcgcgca gcctcctcct tgtggctacc ctggtcctcc tggaccacct cagtttggcc 2580
agaaacctcc ccgtggccac tccagaccca ggaatgttcc catgccttca ccactcccaa 2640
aacctgctga gggccgtcag caacatgctc cagaaggcca gacaaactct agaattttac 2700
ccttgcactt ctgaagagat tgatcatgaa gatatcacaa aagataaaac cagcacagtg 2760
gaggcctgtt taccattgga attaaccaag aatgagagtt gcctaaattc cagagagacc 2820
tctttcataa ctaatgggag ttgcctggcc tccagaaaga cctcttttat gatggccctg 2880
tgccttagta gtatttatga agacttgaag atgtaccagg tggagttcaa gaccatgaat 2940
gcaaagcttc tgatggatcc taagaggcag atctttctag atcaaaacat gctggcagtt 3000
attgatgagc tgatgcaggc cctgaatttc aacagtgaga ctgtgccaca aaaatcctcc 3060
cttgaagaac cggattttta taaaactaaa atcaagctct gcatacttct tcatgctttc 3120
agaattcggg cagtgactat tgatagagtg atgagctatc tgaatgcttc ctaacgtacg 3180
tcgacatcga gaacttgttt attgcagctt ataatggtta caaataaagc aatagcatca 3240
caaatttcac aaataaagca tttttttcac tgcattctag ttgtggtttg tccaaactca 3300
tcaatgtatc ttatcatgtc tgggcgcgcc ggcctccgcg ccgggttttg gcgcctcccg 3360
cgggcgcccc cctcctcacg gcgagcgctg ccacgtcaga cgaagggcgc agcgagcgtc 3420
ctgatccttc cgcccggacg ctcaggacag cggcccgctg ctcataagac tcggccttag 3480
aaccccagta tcagcagaag gacattttag gacgggactt gggtgactct agggcactgg 3540
ttttctttcc agagagcgga acaggcgagg aaaagtagtc ccttctcggc gattctgcgg 3600
agggatctcc gtggggcggt gaacgccgat gattatataa ggacgcgccg ggtgtggcac 3660
agctagttcc gtcgcagccg ggatttgggt cgcggttctt gtttgtggat cgctgtgatc 3720
gtcacttggt gagtagcggg ctgctgggct gggtacgtgc gctcggggtt ggcgagtgtg 3780
ttttgtgaag ttttttaggc accttttgaa atgtaatcat ttgggtcaat atgtaatttt 3840
cagtgttaga ctagtaaatt gtccgctaaa ttctggccgt ttttggcttt tttgttagac 3900
gagctagcgc cgccaccatg ggccctaaaa agaagcgtaa agtcgccccc ccgaccgatg 3960
tcagcctggg ggacgagctc cacttagacg gcgaggacgt ggcgatggcg catgccgacg 4020
cgctagacga tttcgatctg gacatgttgg gggacgggga ttccccgggt ccgggattta 4080
ccccccacga ctccgccccc tacggcgctc tggatatggc cgacttcgag tttgagcaga 4140
tgtttaccga tgcccttgga attgacgagt acggtgggga attcgagatg cctgtggaca 4200
ggatcctgga ggcagagctt gctgtggaac agaagagtga ccagggcgtt gagggtcctg 4260
ggggaaccgg gggtagcggc agcagcccaa atgaccctgt gactaacatc tgtcaggcag 4320
ctgacaaaca gctattcacg cttgttgagt gggcgaagag gatcccacac ttttcctcct 4380
tgcctctgga tgatcaggtc atattgctgc gggcaggctg gaatgaactc ctcattgcct 4440
ccttttcaca ccgatccatt gatgttcgag atggcatcct ccttgccaca ggtcttcacg 4500
tgcaccgcaa ctcagcccat tcagcaggag taggagccat ctttgatcgg gtgctgacag 4560
agctagtgtc caaaatgcgt gacatgagga tggacaagac agagcttggc tgcctgaggg 4620
caatcattct gtttaatcca gaggtgaggg gtttgaaatc cgcccaggaa gttgaacttc 4680
tacgtgaaaa agtatatgcc gctttggaag aatatactag aacaacacat cccgatgaac 4740
caggaagatt tgcaaaactt ttgcttcgtc tgccttcttt acgttccata ggccttaagt 4800
gtttggagca tttgtttttc tttcgcctta ttggagatgt tccaattgat acgttcctga 4860
tggagatgct tgaatcacct tctgattcat aatctagcct agcccccctc tccctccccc 4920
ccccctaacg ttactggccg aagccgcttg gaataaggcc ggtgtgcgtt tgtctatatg 4980
ttattttcca ccatattgcc gtcttttggc aatgtgaggg cccggaaacc tggccctgtc 5040
ttcttgacga gcattcctag gggtctttcc cctctcgcca aaggaatgca aggtctgttg 5100
aatgtcgtga aggaagcagt tcctctggaa gcttcttgaa gacaaacaac gtctgtagcg 5160
accctttgca ggcagcggaa ccccccacct ggcgacaggt gcctctgcgg ccaaaagcca 5220
cgtgtataag atacacctgc aaaggcggca caaccccagt gccacgttgt gagttggata 5280
gttgtggaaa gagtcaaatg gctctcctca agcgtattca acaaggggct gaaggatgcc 5340
cagaaggtac cccattgtat gggatctgat ctggggcctc ggtgcacatg ctttacatgt 5400
gtttagtcga ggttaaaaaa cgtctaggcc ccccgaacca cggggacgtg gttttccttt 5460
gaaaaacacg atctctaggc gccaccatga agctactgtc ttctatcgaa caagcatgcg 5520
atatttgccg acttaaaaag ctcaagtgct ccaaagaaaa accgaagtgc gccaagtgtc 5580
tgaagaacaa ctgggagtgt cgctactctc ccaaaaccaa aaggtctccg ctgactaggg 5640
cacatctgac agaagtggaa tcaaggctag aaagactgga acagctattt ctactgattt 5700
ttcctcgaga agaccttgac atgattttga aaatggattc tttacaggat ataaaagcat 5760
tgttaacagg attatttgta caagataatg tgaataaaga tgccgtcaca gatagattgg 5820
cttcagtgga gactgatatg cctctaacat tgagacagca tagaataagt gcgacatcat 5880
catcggaaga gagtagtaac aaaggtcaaa gacagttgac tgtatcgccg gaattcccgg 5940
ggatccggcc tgagtgcgta gtacccgaga ctcagtgcgc catgaagcgg aaagagaaga 6000
aagcacagaa ggagaaggac aaactgcctg tcagcacgac gacggtggac gaccacatgc 6060
cgcccattat gcagtgtgaa cctccacctc ctgaagcagc aaggattcac gaagtggtcc 6120
caaggtttct ctccgacaag ctgttggtga caaaccggca gaaaaacatc ccccagttga 6180
cagccaacca gcagttcctt atcgccaggc tcatctggta ccaggacggg tacgagcagc 6240
cttctgatga agatttgaag aggattacgc agacgtggca gcaagcggac gatgaaaacg 6300
aagagtcgga cactcccttc cgccagatca cagagatgac tatcctcacg gtccaactta 6360
tcgtggagtt cgcgaaggga ttgccagggt tcgccaagat ctcgcagcct gatcaaatta 6420
cgctgcttaa ggcttgctca agtgaggtaa tgatgctccg agtcgcgcga cgatacgatg 6480
cggcctcaga cagtattctg ttcgcgaaca accaagcgta cactcgcgac aactaccgca 6540
aggctggcat ggccgaggtc atcgaggatc tactgcactt ctgccggtgc atgtactcta 6600
tggcgttgga caacatccat tacgcgctgc tcacggctgt cgtcatcttt tctgaccggc 6660
cagggttgga gcagccgcaa ctggtggaag agatccagcg gtactacctg aatacgctcc 6720
gcatctatat cctgaaccag ctgagcgggt cggcgcgttc gtccgtcata tacggcaaga 6780
tcctctcaat cctctctgag ctacgcacgc tcggcatgca aaactccaac atgtgcatct 6840
ccctcaagct caagaacaga aagctgccgc ctttcctcga ggagatctgg gatgtggcgg 6900
acatgtcgca cacccaaccg ccgcctatcc tcgagtcccc cacgaatctc taggcggcct 6960
ctagagcggc cgccaccgcg gggagatcca gacatgataa gatacattga tgagtttgga 7020
caaaccacaa ctagaatgca gtgaaaaaaa tgctttattt gtgaaatttg tgatgctatt 7080
gctttatttg taaccattat aagctgcaat aaacaagtta acaacaacaa ttgcattcat 7140
tttatgtttc aggttcaggg ggaggtgtgg gaggtttttt aaagcaagta aaacctctac 7200
aaatgtggta tggctgatta tgatccggct gcctcgcgcg tttcggtgat gacggtgaaa 7260
acctctgaca catgcagctc ccggagacgg tcacagcttg tctgtaagcg gatgccggga 7320
gcagacaagc ccgtcagggc gcgtcagcgg gtgttggcgg gtgtcggggc gcagccatga 7380
ggtcgactct agtccccgcg gtggcagatc tggaaggtgc tgaggtacga tgagacccgc 7440
accaggtgca gaccctgcga gtgtggcggt aaacatatta ggaaccagcc tgtgatgctg 7500
gatgtgaccg aggagctgag gcccgatcac ttggtgctgg cctgcacccg cgctgagttt 7560
ggctctagcg atgaagatac agattgaggt actgaaatgt gtgggcgtgg cttaagggtg 7620
ggaaagaata tataaggtgg gggtcttatg tagttttgta tctgttttgc agcagccgcc 7680
gccgccatga gcaccaactc gtttgatgga agcattgtga gctcatattt gacaacgcgc 7740
atgcccccat gggccggggt gcgtcagaat gtgatgggct ccagcattga tggtcgcccc 7800
gtcctgcccg caaactctac taccttgacc tacgagaccg tgtctggaac gccgttggag 7860
actgcagcct ccgccgccgc ttcagccgct gcagccaccg cccgcgggat tgtgactgac 7920
tttgctttcc tgagcccgct tgcaagcagt gcagcttccc gttcatccgc ccgcgatgac 7980
aagttgacgg ctcttttggc acaattggat tctttgaccc gggaacttaa tgtcgtttct 8040
cagcagctgt tggatctgcg ccagcaggtt tctgccctga aggcttcctc ccctcccaat 8100
gcggtttaaa acataaataa aaaaccagac tctgtttgga tttggatcaa gcaagtgtct 8160
tgctgtcttt atttaggggt tttgcgcgcg cggtaggccc gggaccagcg gtctcggtcg 8220
ttgagggtcc tgtgtatttt ttccaggacg tggtaaaggt gactctggat gttcagatac 8280
atgggcataa gcccgtctct ggggtggagg tagcaccact gcagagcttc atgctgcggg 8340
gtggtgttgt agatgatcca gtcgtagcag gagcgctggg cgtggtgcct aaaaatgtct 8400
ttcagtagca agctgattgc caggggcagg cccttggtgt aagtgtttac aaagcggtta 8460
agctgggatg ggtgcatacg tggggatatg agatgcatct tggactgtat ttttaggttg 8520
gctatgttcc cagccatatc cctccgggga ttcatgttgt gcagaaccac cagcacagtg 8580
tatccggtgc acttgggaaa tttgtcatgt agcttagaag gaaatgcgtg gaagaacttg 8640
gagacgccct tgtgacctcc aagattttcc atgcattcgt ccataatgat ggcaatgggc 8700
ccacgggcgg cggcctgggc gaagatattt ctgggatcac taacgtcata gttgtgttcc 8760
aggatgagat cgtcataggc catttttaca aagcgcgggc ggagggtgcc agactgcggt 8820
ataatggttc catccggccc aggggcgtag ttaccctcac agatttgcat ttcccacgct 8880
ttgagttcag atggggggat catgtctacc tgcggggcga tgaagaaaac ggtttccggg 8940
gtaggggaga tcagctggga agaaagcagg ttcctgagca gctgcgactt accgcagccg 9000
gtgggcccgt aaatcacacc tattaccggc tgcaactggt agttaagaga gctgcagctg 9060
ccgtcatccc tgagcagggg ggccacttcg ttaagcatgt ccctgactcg catgttttcc 9120
ctgaccaaat ccgccagaag gcgctcgccg cccagcgata gcagttcttg caaggaagca 9180
aagtttttca acggtttgag accgtccgcc gtaggcatgc ttttgagcgt ttgaccaagc 9240
agttccaggc ggtcccacag ctcggtcacc tgctctacgg catctcgatc cagcatatct 9300
cctcgtttcg cgggttgggg cggctttcgc tgtacggcag tagtcggtgc tcgtccagac 9360
gggccagggt catgtctttc cacgggcgca gggtcctcgt cagcgtagtc tgggtcacgg 9420
tgaaggggtg cgctccgggc tgcgcgctgg ccagggtgcg cttgaggctg gtcctgctgg 9480
tgctgaagcg ctgccggtct tcgccctgcg cgtcggccag gtagcatttg accatggtgt 9540
catagtccag cccctccgcg gcgtggccct tggcgcgcag cttgcccttg gaggaggcgc 9600
cgcacgaggg gcagtgcaga cttttgaggg cgtagagctt gggcgcgaga aataccgatt 9660
ccggggagta ggcatccgcg ccgcaggccc cgcagacggt ctcgcattcc acgagccagg 9720
tgagctctgg ccgttcgggg tcaaaaacca ggtttccccc atgctttttg atgcgtttct 9780
tacctctggt ttccatgagc cggtgtccac gctcggtgac gaaaaggctg tccgtgtccc 9840
cgtatacaga cttgagaggc ctgtcctcga gcggtgttcc gcggtcctcc tcgtatagaa 9900
actcggacca ctctgagaca aaggctcgcg tccaggccag cacgaaggag gctaagtggg 9960
aggggtagcg gtcgttgtcc actagggggt ccactcgctc cagggtgtga agacacatgt 10020
cgccctcttc ggcatcaagg aaggtgattg gtttgtaggt gtaggccacg tgaccgggtg 10080
ttcctgaagg ggggctataa aagggggtgg gggcgcgttc gtcctcactc tcttccgcat 10140
cgctgtctgc gagggccagc tgttggggtg agtactccct ctgaaaagcg ggcatgactt 10200
ctgcgctaag attgtcagtt tccaaaaacg aggaggattt gatattcacc tggcccgcgg 10260
tgatgccttt gagggtggcc gcatccatct ggtcagaaaa gacaatcttt ttgttgtcaa 10320
gcttggtggc aaacgacccg tagagggcgt tggacagcaa cttggcgatg gagcgcaggg 10380
tttggttttt gtcgcgatcg gcgcgctcct tggccgcgat gtttagctgc acgtattcgc 10440
gcgcaacgca ccgccattcg ggaaagacgg tggtgcgctc gtcgggcacc aggtgcacgc 10500
gccaaccgcg gttgtgcagg gtgacaaggt caacgctggt ggctacctct ccgcgtaggc 10560
gctcgttggt ccagcagagg cggccgccct tgcgcgagca gaatggcggt agggggtcta 10620
gctgcgtctc gtccgggggg tctgcgtcca cggtaaagac cccgggcagc aggcgcgcgt 10680
cgaagtagtc tatcttgcat ccttgcaagt ctagcgcctg ctgccatgcg cgggcggcaa 10740
gcgcgcgctc gtatgggttg agtgggggac cccatggcat ggggtgggtg agcgcggagg 10800
cgtacatgcc gcaaatgtcg taaacgtaga ggggctctct gagtattcca agatatgtag 10860
ggtagcatct tccaccgcgg atgctggcgc gcacgtaatc gtatagttcg tgcgagggag 10920
cgaggaggtc gggaccgagg ttgctacggg cgggctgctc tgctcggaag actatctgcc 10980
tgaagatggc atgtgagttg gatgatatgg ttggacgctg gaagacgttg aagctggcgt 11040
ctgtgagacc taccgcgtca cgcacgaagg aggcgtagga gtcgcgcagc ttgttgacca 11100
gctcggcggt gacctgcacg tctagggcgc agtagtccag ggtttccttg atgatgtcat 11160
acttatcctg tccctttttt ttccacagct cgcggttgag gacaaactct tcgcggtctt 11220
tccagtactc ttggatcgga aacccgtcgg cctccgaacg gtaagagcct agcatgtaga 11280
actggttgac ggcctggtag gcgcagcatc ccttttctac gggtagcgcg tatgcctgcg 11340
cggccttccg gagcgaggtg tgggtgagcg caaaggtgtc cctgaccatg actttgaggt 11400
actggtattt gaagtcagtg tcgtcgcatc cgccctgctc ccagagcaaa aagtccgtgc 11460
gctttttgga acgcggattt ggcagggcga aggtgacatc gttgaagagt atctttcccg 11520
cgcgaggcat aaagttgcgt gtgatgcgga agggtcccgg cacctcggaa cggttgttaa 11580
ttacctgggc ggcgagcacg atctcgtcaa agccgttgat gttgtggccc acaatgtaaa 11640
gttccaagaa gcgcgggatg cccttgatgg aaggcaattt tttaagttcc tcgtaggtga 11700
gctcttcagg ggagctgagc ccgtgctctg aaagggccca gtctgcaaga tgagggttgg 11760
aagcgacgaa tgagctccac aggtcacggg ccattagcat ttgcaggtgg tcgcgaaagg 11820
tcctaaactg gcgacctatg gccatttttt ctggggtgat gcagtagaag gtaagcgggt 11880
cttgttccca gcggtcccat ccaaggttcg cggctaggtc tcgcgcggca gtcactagag 11940
gctcatctcc gccgaacttc atgaccagca tgaagggcac gagctgcttc ccaaaggccc 12000
ccatccaagt ataggtctct acatcgtagg tgacaaagag acgctcggtg cgaggatgcg 12060
agccgatcgg gaagaactgg atctcccgcc accaattgga ggagtggcta ttgatgtggt 12120
gaaagtagaa gtccctgcga cgggccgaac actcgtgctg gcttttgtaa aaacgtgcgc 12180
agtactggca gcggtgcacg ggctgtacat cctgcacgag gttgacctga cgaccgcgca 12240
caaggaagca gagtgggaat ttgagcccct cgcctggcgg gtttggctgg tggtcttcta 12300
cttcggctgc ttgtccttga ccgtctggct gctcgagggg agttacggtg gatcggacca 12360
ccacgccgcg cgagcccaaa gtccagatgt ccgcgcgcgg cggtcggagc ttgatgacaa 12420
catcgcgcag atgggagctg tccatggtct ggagctcccg cggcgtcagg tcaggcggga 12480
gctcctgcag gtttacctcg catagacggg tcagggcgcg ggctagatcc aggtgatacc 12540
taatttccag gggctggttg gtggcggcgt cgatggcttg caagaggccg catccccgcg 12600
gcgcgactac ggtaccgcgc ggcgggcggt gggccgcggg ggtgtccttg gatgatgcat 12660
ctaaaagcgg tgacgcgggc gagcccccgg aggtaggggg ggctccggac ccgccgggag 12720
agggggcagg ggcacgtcgg cgccgcgcgc gggcaggagc tggtgctgcg cgcgtaggtt 12780
gctggcgaac gcgacgacgc ggcggttgat ctcctgaatc tggcgcctct gcgtgaagac 12840
gacgggcccg gtgagcttga acctgaaaga gagttcgaca gaatcaattt cggtgtcgtt 12900
gacggcggcc tggcgcaaaa tctcctgcac gtctcctgag ttgtcttgat aggcgatctc 12960
ggccatgaac tgctcgatct cttcctcctg gagatctccg cgtccggctc gctccacggt 13020
ggcggcgagg tcgttggaaa tgcgggccat gagctgcgag aaggcgttga ggcctccctc 13080
gttccagacg cggctgtaga ccacgccccc ttcggcatcg cgggcgcgca tgaccacctg 13140
cgcgagattg agctccacgt gccgggcgaa gacggcgtag tttcgcaggc gctgaaagag 13200
gtagttgagg gtggtggcgg tgtgttctgc cacgaagaag tacataaccc agcgtcgcaa 13260
cgtggattcg ttgatatccc ccaaggcctc aaggcgctcc atggcctcgt agaagtccac 13320
ggcgaagttg aaaaactggg agttgcgcgc cgacacggtt aactcctcct ccagaagacg 13380
gatgagctcg gcgacagtgt cgcgcacctc gcgctcaaag gctacagggg cctcttcttc 13440
ttcttcaatc tcctcttcca taagggcctc cccttcttct tcttctggcg gcggtggggg 13500
aggggggaca cggcggcgac gacggcgcac cgggaggcgg tcgacaaagc gctcgatcat 13560
ctccccgcgg cgacggcgca tggtctcggt gacggcgcgg ccgttctcgc gggggcgcag 13620
ttggaagacg ccgcccgtca tgtcccggtt atgggttggc ggggggctgc catgcggcag 13680
ggatacggcg ctaacgatgc atctcaacaa ttgttgtgta ggtactccgc cgccgaggga 13740
cctgagcgag tccgcatcga ccggatcgga aaacctctcg agaaaggcgt ctaaccagtc 13800
acagtcgcaa ggtaggctga gcaccgtggc gggcggcagc gggcggcggt cggggttgtt 13860
tctggcggag gtgctgctga tgatgtaatt aaagtaggcg gtcttgagac ggcggatggt 13920
cgacagaagc accatgtcct tgggtccggc ctgctgaatg cgcaggcggt cggccatgcc 13980
ccaggcttcg ttttgacatc ggcgcaggtc tttgtagtag tcttgcatga gcctttctac 14040
cggcacttct tcttctcctt cctcttgtcc tgcatctctt gcatctatcg ctgcggcggc 14100
ggcggagttt ggccgtaggt ggcgccctct tcctcccatg cgtgtgaccc cgaagcccct 14160
catcggctga agcagggcta ggtcggcgac aacgcgctcg gctaatatgg cctgctgcac 14220
ctgcgtgagg gtagactgga agtcatccat gtccacaaag cggtggtatg cgcccgtgtt 14280
gatggtgtaa gtgcagttgg ccataacgga ccagttaacg gtctggtgac ccggctgcga 14340
gagctcggtg tacctgagac gcgagtaagc cctcgagtca aatacgtagt cgttgcaagt 14400
ccgcaccagg tactggtatc ccaccaaaaa gtgcggcggc ggctggcggt agaggggcca 14460
gcgtagggtg gccggggctc cgggggcgag atcttccaac ataaggcgat gatatccgta 14520
gatgtacctg gacatccagg tgatgccggc ggcggtggtg gaggcgcgcg gaaagtcgcg 14580
gacgcggttc cagatgttgc gcagcggcaa aaagtgctcc atggtcggga cgctctggcc 14640
ggtcaggcgc gcgcaatcgt tgacgctcta gcgtgcaaaa ggagagcctg taagcgggca 14700
ctcttccgtg gtctggtgga taaattcgca agggtatcat ggcggacgac cggggttcga 14760
gccccgtatc cggccgtccg ccgtgatcca tgcggttacc gcccgcgtgt cgaacccagg 14820
tgtgcgacgt cagacaacgg gggagtgctc cttttggctt ccttccaggc gcggcggctg 14880
ctgcgctagc ttttttggcc actggccgcg cgcagcgtaa gcggttaggc tggaaagcga 14940
aagcattaag tggctcgctc cctgtagccg gagggttatt ttccaagggt tgagtcgcgg 15000
gacccccggt tcgagtctcg gaccggccgg actgcggcga acgggggttt gcctccccgt 15060
catgcaagac cccgcttgca aattcctccg gaaacaggga cgagcccctt ttttgctttt 15120
cccagatgca tccggtgctg cggcagatgc gcccccctcc tcagcagcgg caagagcaag 15180
agcagcggca gacatgcagg gcaccctccc ctcctcctac cgcgtcagga ggggcgacat 15240
ccgcggttga cgcggcagca gatggtgatt acgaaccccc gcggcgccgg gcccggcact 15300
acctggactt ggaggagggc gagggcctgg cgcggctagg agcgccctct cctgagcggc 15360
acccaagggt gcagctgaag cgtgatacgc gtgaggcgta cgtgccgcgg cagaacctgt 15420
ttcgcgaccg cgagggagag gagcccgagg agatgcggga tcgaaagttc cacgcagggc 15480
gcgagctgcg gcatggcctg aatcgcgagc ggttgctgcg cgaggaggac tttgagcccg 15540
acgcgcgaac cgggattagt cccgcgcgcg cacacgtggc ggccgccgac ctggtaaccg 15600
catacgagca gacggtgaac caggagatta actttcaaaa aagctttaac aaccacgtgc 15660
gtacgcttgt ggcgcgcgag gaggtggcta taggactgat gcatctgtgg gactttgtaa 15720
gcgcgctgga gcaaaaccca aatagcaagc cgctcatggc gcagctgttc cttatagtgc 15780
agcacagcag ggacaacgag gcattcaggg atgcgctgct aaacatagta gagcccgagg 15840
gccgctggct gctcgatttg ataaacatcc tgcagagcat agtggtgcag gagcgcagct 15900
tgagcctggc tgacaaggtg gccgccatca actattccat gcttagcctg ggcaagtttt 15960
acgcccgcaa gatataccat accccttacg ttcccataga caaggaggta aagatcgagg 16020
ggttctacat gcgcatggcg ctgaaggtgc ttaccttgag cgacgacctg ggcgtttatc 16080
gcaacgagcg catccacaag gccgtgagcg tgagccggcg gcgcgagctc agcgaccgcg 16140
agctgatgca cagcctgcaa agggccctgg ctggcacggg cagcggcgat agagaggccg 16200
agtcctactt tgacgcgggc gctgacctgc gctgggcccc aagccgacgc gccctggagg 16260
cagctggggc cggacctggg ctggcggtgg cacccgcgcg cgctggcaac gtcggcggcg 16320
tggaggaata tgacgaggac gatgagtacg agccagagga cggcgagtac taagcggtga 16380
tgtttctgat cagatgatgc aagacgcaac ggacccggcg gtgcgggcgg cgctgcagag 16440
ccagccgtcc ggccttaact ccacggacga ctggcgccag gtcatggacc gcatcatgtc 16500
gctgactgcg cgcaatcctg acgcgttccg gcagcagccg caggccaacc ggctctccgc 16560
aattctggaa gcggtggtcc cggcgcgcgc aaaccccacg cacgagaagg tgctggcgat 16620
cgtaaacgcg ctggccgaaa acagggccat ccggcccgac gaggccggcc tggtctacga 16680
cgcgctgctt cagcgcgtgg ctcgttacaa cagcggcaac gtgcagacca acctggaccg 16740
gctggtgggg gatgtgcgcg aggccgtggc gcagcgtgag cgcgcgcagc agcagggcaa 16800
cctgggctcc atggttgcac taaacgcctt cctgagtaca cagcccgcca acgtgccgcg 16860
gggacaggag gactacacca actttgtgag cgcactgcgg ctaatggtga ctgagacacc 16920
gcaaagtgag gtgtaccagt ctgggccaga ctattttttc cagaccagta gacaaggcct 16980
gcagaccgta aacctgagcc aggctttcaa aaacttgcag gggctgtggg gggtgcgggc 17040
tcccacaggc gaccgcgcga ccgtgtctag cttgctgacg cccaactcgc gcctgttgct 17100
gctgctaata gcgcccttca cggacagtgg cagcgtgtcc cgggacacat acctaggtca 17160
cttgctgaca ctgtaccgcg aggccatagg tcaggcgcat gtggacgagc atactttcca 17220
ggagattaca agtgtcagcc gcgcgctggg gcaggaggac acgggcagcc tggaggcaac 17280
cctaaactac ctgctgacca accggcggca gaagatcccc tcgttgcaca gtttaaacag 17340
cgaggaggag cgcattttgc gctacgtgca gcagagcgtg agccttaacc tgatgcgcga 17400
cggggtaacg cccagcgtgg cgctggacat gaccgcgcgc aacatggaac cgggcatgta 17460
tgcctcaaac cggccgttta tcaaccgcct aatggactac ttgcatcgcg cggccgccgt 17520
gaaccccgag tatttcacca atgccatctt gaacccgcac tggctaccgc cccctggttt 17580
ctacaccggg ggattcgagg tgcccgaggg taacgatgga ttcctctggg acgacataga 17640
cgacagcgtg ttttccccgc aaccgcagac cctgctagag ttgcaacagc gcgagcaggc 17700
agaggcggcg ctgcgaaagg aaagcttccg caggccaagc agcttgtccg atctaggcgc 17760
tgcggccccg cggtcagatg ctagtagccc atttccaagc ttgatagggt ctcttaccag 17820
cactcgcacc acccgcccgc gcctgctggg cgaggaggag tacctaaaca actcgctgct 17880
gcagccgcag cgcgaaaaaa acctgcctcc ggcatttccc aacaacggga tagagagcct 17940
agtggacaag atgagtagat ggaagacgta cgcgcaggag cacagggacg tgccaggccc 18000
gcgcccgccc acccgtcgtc aaaggcacga ccgtcagcgg ggtctggtgt gggaggacga 18060
tgactcggca gacgacagca gcgtcctgga tttgggaggg agtggcaacc cgtttgcgca 18120
ccttcgcccc aggctgggga gaatgtttta aaaaaaaaaa aagcatgatg caaaataaaa 18180
aactcaccaa ggccatggca ccgagcgttg gttttcttgt attcccctta gtatgcggcg 18240
cgcggcgatg tatgaggaag gtcctcctcc ctcctacgag agtgtggtga gcgcggcgcc 18300
agtggcggcg gcgctgggtt ctcccttcga tgctcccctg gacccgccgt ttgtgcctcc 18360
gcggtacctg cggcctaccg gggggagaaa cagcatccgt tactctgagt tggcacccct 18420
attcgacacc acccgtgtgt acctggtgga caacaagtca acggatgtgg catccctgaa 18480
ctaccagaac gaccacagca actttctgac cacggtcatt caaaacaatg actacagccc 18540
gggggaggca agcacacaga ccatcaatct tgacgaccgg tcgcactggg gcggcgacct 18600
gaaaaccatc ctgcatacca acatgccaaa tgtgaacgag ttcatgttta ccaataagtt 18660
taaggcgcgg gtgatggtgt cgcgcttgcc tactaaggac aatcaggtgg agctgaaata 18720
cgagtgggtg gagttcacgc tgcccgaggg caactactcc gagaccatga ccatagacct 18780
tatgaacaac gcgatcgtgg agcactactt gaaagtgggc agacagaacg gggttctgga 18840
aagcgacatc ggggtaaagt ttgacacccg caacttcaga ctggggtttg accccgtcac 18900
tggtcttgtc atgcctgggg tatatacaaa cgaagccttc catccagaca tcattttgct 18960
gccaggatgc ggggtggact tcacccacag ccgcctgagc aacttgttgg gcatccgcaa 19020
gcggcaaccc ttccaggagg gctttaggat cacctacgat gatctggagg gtggtaacat 19080
tcccgcactg ttggatgtgg acgcctacca ggcgagcttg aaagatgaca ccgaacaggg 19140
cgggggtggc gcaggcggca gcaacagcag tggcagcggc gcggaagaga actccaacgc 19200
ggcagccgcg gcaatgcagc cggtggagga catgaacgat catgccattc gcggcgacac 19260
ctttgccaca cgggctgagg agaagcgcgc tgaggccgaa gcagcggccg aagctgccgc 19320
ccccgctgcg caacccgagg tcgagaagcc tcagaagaaa ccggtgatca aacccctgac 19380
agaggacagc aagaaacgca gttacaacct aataagcaat gacagcacct tcacccagta 19440
ccgcagctgg taccttgcat acaactacgg cgaccctcag accggaatcc gctcatggac 19500
cctgctttgc actcctgacg taacctgcgg ctcggagcag gtctactggt cgttgccaga 19560
catgatgcaa gaccccgtga ccttccgctc cacgcgccag atcagcaact ttccggtggt 19620
gggcgccgag ctgttgcccg tgcactccaa gagcttctac aacgaccagg ccgtctactc 19680
ccaactcatc cgccagttta cctctctgac ccacgtgttc aatcgctttc ccgagaacca 19740
gattttggcg cgcccgccag cccccaccat caccaccgtc agtgaaaacg ttcctgctct 19800
cacagatcac gggacgctac cgctgcgcaa cagcatcgga ggagtccagc gagtgaccat 19860
tactgacgcc agacgccgca cctgccccta cgtttacaag gccctgggca tagtctcgcc 19920
gcgcgtccta tcgagccgca ctttttgagc aagcatgtcc atccttatat cgcccagcaa 19980
taacacaggc tggggcctgc gcttcccaag caagatgttt ggcggggcca agaagcgctc 20040
cgaccaacac ccagtgcgcg tgcgcgggca ctaccgcgcg ccctggggcg cgcacaaacg 20100
cggccgcact gggcgcacca ccgtcgatga cgccatcgac gcggtggtgg aggaggcgcg 20160
caactacacg cccacgccgc caccagtgtc cacagtggac gcggccattc agaccgtggt 20220
gcgcggagcc cggcgctatg ctaaaatgaa gagacggcgg aggcgcgtag cacgtcgcca 20280
ccgccgccga cccggcactg ccgcccaacg cgcggcggcg gccctgctta accgcgcacg 20340
tcgcaccggc cgacgggcgg ccatgcgggc cgctcgaagg ctggccgcgg gtattgtcac 20400
tgtgcccccc aggtccaggc gacgagcggc cgccgcagca gccgcggcca ttagtgctat 20460
gactcagggt cgcaggggca acgtgtattg ggtgcgcgac tcggttagcg gcctgcgcgt 20520
gcccgtgcgc acccgccccc cgcgcaacta gattgcaaga aaaaactact tagactcgta 20580
ctgttgtatg tatccagcgg cggcggcgcg caacgaagct atgtccaagc gcaaaatcaa 20640
agaagagatg ctccaggtca tcgcgccgga gatctatggc cccccgaaga aggaagagca 20700
ggattacaag ccccgaaagc taaagcgggt caaaaagaaa aagaaagatg atgatgatga 20760
acttgacgac gaggtggaac tgctgcacgc taccgcgccc aggcgacggg tacagtggaa 20820
aggtcgacgc gtaaaacgtg ttttgcgacc cggcaccacc gtagtcttta cgcccggtga 20880
gcgctccacc cgcacctaca agcgcgtgta tgatgaggtg tacggcgacg aggacctgct 20940
tgagcaggcc aacgagcgcc tcggggagtt tgcctacgga aagcggcata aggacatgct 21000
ggcgttgccg ctggacgagg gcaacccaac acctagccta aagcccgtaa cactgcagca 21060
ggtgctgccc gcgcttgcac cgtccgaaga aaagcgcggc ctaaagcgcg agtctggtga 21120
cttggcaccc accgtgcagc tgatggtacc caagcgccag cgactggaag atgtcttgga 21180
aaaaatgacc gtggaacctg ggctggagcc cgaggtccgc gtgcggccaa tcaagcaggt 21240
ggcgccggga ctgggcgtgc agaccgtgga cgttcagata cccactacca gtagcaccag 21300
tattgccacc gccacagagg gcatggagac acaaacgtcc ccggttgcct cagcggtggc 21360
ggatgccgcg gtgcaggcgg tcgctgcggc cgcgtccaag acctctacgg aggtgcaaac 21420
ggacccgtgg atgtttcgcg tttcagcccc ccggcgcccg cgccgttcga ggaagtacgg 21480
cgccgccagc gcgctactgc ccgaatatgc cctacatcct tccattgcgc ctacccccgg 21540
ctatcgtggc tacacctacc gccccagaag acgagcaact acccgacgcc gaaccaccac 21600
tggaacccgc cgccgccgtc gccgtcgcca gcccgtgctg gccccgattt ccgtgcgcag 21660
ggtggctcgc gaaggaggca ggaccctggt gctgccaaca gcgcgctacc accccagcat 21720
cgtttaaaag ccggtctttg tggttcttgc agatatggcc ctcacctgcc gcctccgttt 21780
cccggtgccg ggattccgag gaagaatgca ccgtaggagg ggcatggccg gccacggcct 21840
gacgggcggc atgcgtcgtg cgcaccaccg gcggcggcgc gcgtcgcacc gtcgcatgcg 21900
cggcggtatc ctgcccctcc ttattccact gatcgccgcg gcgattggcg ccgtgcccgg 21960
aattgcatcc gtggccttgc aggcgcagag acactgatta aaaacaagtt gcatgtggaa 22020
aaatcaaaat aaaaagtctg gactctcacg ctcgcttggt cctgtaacta ttttgtagaa 22080
tggaagacat caactttgcg tctctggccc cgcgacacgg ctcgcgcccg ttcatgggaa 22140
actggcaaga tatcggcacc agcaatatga gcggtggcgc cttcagctgg ggctcgctgt 22200
ggagcggcat taaaaatttc ggttccaccg ttaagaacta tggcagcaag gcctggaaca 22260
gcagcacagg ccagatgctg agggataagt tgaaagagca aaatttccaa caaaaggtgg 22320
tagatggcct ggcctctggc attagcgggg tggtggacct ggccaaccag gcagtgcaaa 22380
ataagattaa cagtaagctt gatccccgcc ctcccgtaga ggagcctcca ccggccgtgg 22440
agacagtgtc tccagagggg cgtggcgaaa agcgtccgcg ccccgacagg gaagaaactc 22500
tggtgacgca aatagacgag cctccctcgt acgaggaggc actaaagcaa ggcctgccca 22560
ccacccgtcc catcgcgccc atggctaccg gagtgctggg ccagcacaca cccgtaacgc 22620
tggacctgcc tccccccgcc gacacccagc agaaacctgt gctgccaggc ccgaccgccg 22680
ttgttgtaac ccgtcctagc cgcgcgtccc tgcgccgcgc cgccagcggt ccgcgatcgt 22740
tgcggcccgt agccagtggc aactggcaaa gcacactgaa cagcatcgtg ggtctggggg 22800
tgcaatccct gaagcgccga cgatgcttct gatagctaac gtgtcgtatg tgtgtcatgt 22860
atgcgtccat gtcgccgcca gaggagctgc tgagccgccg cgcgcccgct ttccaagatg 22920
gctacccctt cgatgatgcc gcagtggtct tacatgcaca tctcgggcca ggacgcctcg 22980
gagtacctga gccccgggct ggtgcagttt gcccgcgcca ccgagacgta cttcagcctg 23040
aataacaagt ttagaaaccc cacggtggcg cctacgcacg acgtgaccac agaccggtcc 23100
cagcgtttga cgctgcggtt catccctgtg gaccgtgagg atactgcgta ctcgtacaag 23160
gcgcggttca ccctagctgt gggtgataac cgtgtgctgg acatggcttc cacgtacttt 23220
gacatccgcg gcgtgctgga caggggccct acttttaagc cctactctgg cactgcctac 23280
aacgccctgg ctcccaaggg tgccccaaat ccttgcgaat gggatgaagc tgctactgct 23340
cttgaaataa acctagaaga agaggacgat gacaacgaag acgaagtaga cgagcaagct 23400
gagcagcaaa aaactcacgt atttgggcag gcgccttatt ctggtataaa tattacaaag 23460
gagggtattc aaataggtgt cgaaggtcaa acacctaaat atgccgataa aacatttcaa 23520
cctgaacctc aaataggaga atctcagtgg tacgaaacag aaattaatca tgcagctggg 23580
agagtcctaa aaaagactac cccaatgaaa ccatgttacg gttcatatgc aaaacccaca 23640
aatgaaaatg gagggcaagg cattcttgta aagcaacaaa atggaaagct agaaagtcaa 23700
gtggaaatgc aatttttctc aactactgag gcagccgcag gcaatggtga taacttgact 23760
cctaaagtgg tattgtacag tgaagatgta gatatagaaa ccccagacac tcatatttct 23820
tacatgccca ctattaagga aggtaactca cgagaactaa tgggccaaca atctatgccc 23880
aacaggccta attacattgc ttttagggac aattttattg gtctaatgta ttacaacagc 23940
acgggtaata tgggtgttct ggcgggccaa gcatcgcagt tgaatgctgt tgtagatttg 24000
caagacagaa acacagagct ttcataccag cttttgcttg attccattgg tgatagaacc 24060
aggtactttt ctatgtggaa tcaggctgtt gacagctatg atccagatgt tagaattatt 24120
gaaaatcatg gaactgaaga tgaacttcca aattactgct ttccactggg aggtgtgatt 24180
aatacagaga ctcttaccaa ggtaaaacct aaaacaggtc aggaaaatgg atgggaaaaa 24240
gatgctacag aattttcaga taaaaatgaa ataagagttg gaaataattt tgccatggaa 24300
atcaatctaa atgccaacct gtggagaaat ttcctgtact ccaacatagc gctgtatttg 24360
cccgacaagc taaagtacag tccttccaac gtaaaaattt ctgataaccc aaacacctac 24420
gactacatga acaagcgagt ggtggctccc gggctagtgg actgctacat taaccttgga 24480
gcacgctggt cccttgacta tatggacaac gtcaacccat ttaaccacca ccgcaatgct 24540
ggcctgcgct accgctcaat gttgctgggc aatggtcgct atgtgccctt ccacatccag 24600
gtgcctcaga agttctttgc cattaaaaac ctccttctcc tgccgggctc atacacctac 24660
gagtggaact tcaggaagga tgttaacatg gttctgcaga gctccctagg aaatgaccta 24720
agggttgacg gagccagcat taagtttgat agcatttgcc tttacgccac cttcttcccc 24780
atggcccaca acaccgcctc cacgcttgag gccatgctta gaaacgacac caacgaccag 24840
tcctttaacg actatctctc cgccgccaac atgctctacc ctatacccgc caacgctacc 24900
aacgtgccca tatccatccc ctcccgcaac tgggcggctt tccgcggctg ggccttcacg 24960
cgccttaaga ctaaggaaac cccatcactg ggctcgggct acgaccctta ttacacctac 25020
tctggctcta taccctacct agatggaacc ttttacctca accacacctt taagaaggtg 25080
gccattacct ttgactcttc tgtcagctgg cctggcaatg accgcctgct tacccccaac 25140
gagtttgaaa ttaagcgctc agttgacggg gagggttaca acgttgccca gtgtaacatg 25200
accaaagact ggttcctggt acaaatgcta gctaactata acattggcta ccagggcttc 25260
tatatcccag agagctacaa ggaccgcatg tactccttct ttagaaactt ccagcccatg 25320
agccgtcagg tggtggatga tactaaatac aaggactacc aacaggtggg catcctacac 25380
caacacaaca actctggatt tgttggctac cttgccccca ccatgcgcga aggacaggcc 25440
taccctgcta acttccccta tccgcttata ggcaagaccg cagttgacag cattacccag 25500
aaaaagtttc tttgcgatcg caccctttgg cgcatcccat tctccagtaa ctttatgtcc 25560
atgggcgcac tcacagacct gggccaaaac cttctctacg ccaactccgc ccacgcgcta 25620
gacatgactt ttgaggtgga tcccatggac gagcccaccc ttctttatgt tttgtttgaa 25680
gtctttgacg tggtccgtgt gcaccagccg caccgcggcg tcatcgaaac cgtgtacctg 25740
cgcacgccct tctcggccgg caacgccaca acataaagaa gcaagcaaca tcaacaacag 25800
ctgccgccat gggctccagt gagcaggaac tgaaagccat tgtcaaagat cttggttgtg 25860
ggccatattt tttgggcacc tatgacaagc gctttccagg ctttgtttct ccacacaagc 25920
tcgcctgcgc catagtcaat acggccggtc gcgagactgg gggcgtacac tggatggcct 25980
ttgcctggaa cccgcactca aaaacatgct acctctttga gccctttggc ttttctgacc 26040
agcgactcaa gcaggtttac cagtttgagt acgagtcact cctgcgccgt agcgccattg 26100
cttcttcccc cgaccgctgt ataacgctgg aaaagtccac ccaaagcgta caggggccca 26160
actcggccgc ctgtggacta ttctgctgca tgtttctcca cgcctttgcc aactggcccc 26220
aaactcccat ggatcacaac cccaccatga accttattac cggggtaccc aactccatgc 26280
tcaacagtcc ccaggtacag cccaccctgc gtcgcaacca ggaacagctc tacagcttcc 26340
tggagcgcca ctcgccctac ttccgcagcc acagtgcgca gattaggagc gccacttctt 26400
tttgtcactt gaaaaacatg taaaaataat gtactagaga cactttcaat aaaggcaaat 26460
gcttttattt gtacactctc gggtgattat ttacccccac ccttgccgtc tgcgccgttt 26520
aaaaatcaaa ggggttctgc cgcgcatcgc tatgcgccac tggcagggac acgttgcgat 26580
actggtgttt agtgctccac ttaaactcag gcacaaccat ccgcggcagc tcggtgaagt 26640
tttcactcca caggctgcgc accatcacca acgcgtttag caggtcgggc gccgatatct 26700
tgaagtcgca gttggggcct ccgccctgcg cgcgcgagtt gcgatacaca gggttgcagc 26760
actggaacac tatcagcgcc gggtggtgca cgctggccag cacgctcttg tcggagatca 26820
gatccgcgtc caggtcctcc gcgttgctca gggcgaacgg agtcaacttt ggtagctgcc 26880
ttcccaaaaa gggcgcgtgc ccaggctttg agttgcactc gcaccgtagt ggcatcaaaa 26940
ggtgaccgtg cccggtctgg gcgttaggat acagcgcctg cataaaagcc ttgatctgct 27000
taaaagccac ctgagccttt gcgccttcag agaagaacat gccgcaagac ttgccggaaa 27060
actgattggc cggacaggcc gcgtcgtgca cgcagcacct tgcgtcggtg ttggagatct 27120
gcaccacatt tcggccccac cggttcttca cgatcttggc cttgctagac tgctccttca 27180
gcgcgcgctg cccgttttcg ctcgtcacat ccatttcaat cacgtgctcc ttatttatca 27240
taatgcttcc gtgtagacac ttaagctcgc cttcgatctc agcgcagcgg tgcagccaca 27300
acgcgcagcc cgtgggctcg tgatgcttgt aggtcacctc tgcaaacgac tgcaggtacg 27360
cctgcaggaa tcgccccatc atcgtcacaa aggtcttgtt gctggtgaag gtcagctgca 27420
acccgcggtg ctcctcgttc agccaggtct tgcatacggc cgccagagct tccacttggt 27480
caggcagtag tttgaagttc gcctttagat cgttatccac gtggtacttg tccatcagcg 27540
cgcgcgcagc ctccatgccc ttctcccacg cagacacgat cggcacactc agcgggttca 27600
tcaccgtaat ttcactttcc gcttcgctgg gctcttcctc ttcctcttgc gtccgcatac 27660
cacgcgccac tgggtcgtct tcattcagcc gccgcactgt gcgcttacct cctttgccat 27720
gcttgattag caccggtggg ttgctgaaac ccaccatttg tagcgccaca tcttctcttt 27780
cttcctcgct gtccacgatt acctctggtg atggcgggcg ctcgggcttg ggagaagggc 27840
gcttcttttt cttcttgggc gcaatggcca aatccgccgc cgaggtcgat ggccgcgggc 27900
tgggtgtgcg cggcaccagc gcgtcttgtg atgagtcttc ctcgtcctcg gactcgatac 27960
gccgcctcat ccgctttttt gggggcgccc ggggaggcgg cggcgacggg gacggggacg 28020
acacgtcctc catggttggg ggacgtcgcg ccgcaccgcg tccgcgctcg ggggtggttt 28080
cgcgctgctc ctcttcccga ctggccattt ccttctccta taggcagaaa aagatcatgg 28140
agtcagtcga gaagaaggac agcctaaccg ccccctctga gttcgccacc accgcctcca 28200
ccgatgccgc caacgcgcct accaccttcc ccgtcgaggc acccccgctt gaggaggagg 28260
aagtgattat cgagcaggac ccaggttttg taagcgaaga cgacgaggac cgctcagtac 28320
caacagagga taaaaagcaa gaccaggaca acgcagaggc aaacgaggaa caagtcgggc 28380
ggggggacga aaggcatggc gactacctag atgtgggaga cgacgtgctg ttgaagcatc 28440
tgcagcgcca gtgcgccatt atctgcgacg cgttgcaaga gcgcagcgat gtgcccctcg 28500
ccatagcgga tgtcagcctt gcctacgaac gccacctatt ctcaccgcgc gtacccccca 28560
aacgccaaga aaacggcaca tgcgagccca acccgcgcct caacttctac cccgtatttg 28620
ccgtgccaga ggtgcttgcc acctatcaca tctttttcca aaactgcaag atacccctat 28680
cctgccgtgc caaccgcagc cgagcggaca agcagctggc cttgcggcag ggcgctgtca 28740
tacctgatat cgcctcgctc aacgaagtgc caaaaatctt tgagggtctt ggacgcgacg 28800
agaagcgcgc ggcaaacgct ctgcaacagg aaaacagcga aaatgaaagt cactctggag 28860
tgttggtgga actcgagggt gacaacgcgc gcctagccgt actaaaacgc agcatcgagg 28920
tcacccactt tgcctacccg gcacttaacc taccccccaa ggtcatgagc acagtcatga 28980
gtgagctgat cgtgcgccgt gcgcagcccc tggagaggga tgcaaatttg caagaacaaa 29040
cagaggaggg cctacccgca gttggcgacg agcagctagc gcgctggctt caaacgcgcg 29100
agcctgccga cttggaggag cgacgcaaac taatgatggc cgcagtgctc gttaccgtgg 29160
agcttgagtg catgcagcgg ttctttgctg acccggagat gcagcgcaag ctagaggaaa 29220
cattgcacta cacctttcga cagggctacg tacgccaggc ctgcaagatc tccaacgtgg 29280
agctctgcaa cctggtctcc taccttggaa ttttgcacga aaaccgcctt gggcaaaacg 29340
tgcttcattc cacgctcaag ggcgaggcgc gccgcgacta cgtccgcgac tgcgtttact 29400
tatttctatg ctacacctgg cagacggcca tgggcgtttg gcagcagtgc ttggaggagt 29460
gcaacctcaa ggagctgcag aaactgctaa agcaaaactt gaaggaccta tggacggcct 29520
tcaacgagcg ctccgtggcc gcgcacctgg cggacatcat tttccccgaa cgcctgctta 29580
aaaccctgca acagggtctg ccagacttca ccagtcaaag catgttgcag aactttagga 29640
actttatcct agagcgctca ggaatcttgc ccgccacctg ctgtgcactt cctagcgact 29700
ttgtgcccat taagtaccgc gaatgccctc cgccgctttg gggccactgc taccttctgc 29760
agctagccaa ctaccttgcc taccactctg acataatgga agacgtgagc ggtgacggtc 29820
tactggagtg tcactgtcgc tgcaacctat gcaccccgca ccgctccctg gtttgcaatt 29880
cgcagctgct taacgaaagt caaattatcg gtacctttga gctgcagggt ccctcgcctg 29940
acgaaaagtc cgcggctccg gggttgaaac tcactccggg gctgtggacg tcggcttacc 30000
ttcgcaaatt tgtacctgag gactaccacg cccacgagat taggttctac gaagaccaat 30060
cccgcccgcc taatgcggag cttaccgcct gcgtcattac ccagggccac attcttggcc 30120
aattgcaagc catcaacaaa gcccgccaag agtttctgct acgaaaggga cggggggttt 30180
acttggaccc ccagtccggc gaggagctca acccaatccc cccgccgccg cagccctatc 30240
agcagcagcc gcgggccctt gcttcccagg atggcaccca aaaagaagct gcagctgccg 30300
ccgccaccca cggacgagga ggaatactgg gacagtcagg cagaggaggt tttggacgag 30360
gaggaggagg acatgatgga agactgggag agcctagacg aggaagcttc cgaggtcgaa 30420
gaggtgtcag acgaaacacc gtcaccctcg gtcgcattcc cctcgccggc gccccagaaa 30480
tcggcaaccg gttccagcat ggctacaacc tccgctcctc aggcgccgcc ggcactgccc 30540
gttcgccgac ccaaccgtag atgggacacc actggaacca gggccggtaa gtccaagcag 30600
ccgccgccgt tagcccaaga gcaacaacag cgccaaggct accgctcatg gcgcgggcac 30660
aagaacgcca tagttgcttg cttgcaagac tgtgggggca acatctcctt cgcccgccgc 30720
tttcttctct accatcacgg cgtggccttc ccccgtaaca tcctgcatta ctaccgtcat 30780
ctctacagcc catactgcac cggcggcagc ggcagcaaca gcagcggcca cacagaagca 30840
aaggcgaccg gatagcaaga ctctgacaaa gcccaagaaa tccacagcgg cggcagcagc 30900
aggaggagga gcgctgcgtc tggcgcccaa cgaacccgta tcgacccgcg agcttagaaa 30960
caggattttt cccactctgt atgctatatt tcaacagagc aggggccaag aacaagagct 31020
gaaaataaaa aacaggtctc tgcgatccct cacccgcagc tgcctgtatc acaaaagcga 31080
agatcagctt cggcgcacgc tggaagacgc ggaggctctc ttcagtaaat actgcgcgct 31140
gactcttaag gactagtttc gcgccctttc tcaaatttaa gcgcgaaaac tacgtcatct 31200
ccagcggcca cacccggcgc cagcacctgt tgtcagcgcc attatgagca aggaaattcc 31260
cacgccctac atgtggagtt accagccaca aatgggactt gcggctggag ctgcccaaga 31320
ctactcaacc cgaataaact acatgagcgc gggaccccac atgatatccc gggtcaacgg 31380
aatacgcgcc caccgaaacc gaattctcct ggaacaggcg gctattacca ccacacctcg 31440
taataacctt aatccccgta gttggcccgc tgccctggtg taccaggaaa gtcccgctcc 31500
caccactgtg gtacttccca gagacgccca ggccgaagtt cagatgacta actcaggggc 31560
gcagcttgcg ggcggctttc gtcacagggt gcggtcgccc gggcagggta taactcacct 31620
gacaatcaga gggcgaggta ttcagctcaa cgacgagtcg gtgagctcct cgcttggtct 31680
ccgtccggac gggacatttc agatcggcgg cgccggccgc tcttcattca cgcctcgtca 31740
ggcaatccta actctgcaga cctcgtcctc tgagccgcgc tctggaggca ttggaactct 31800
gcaatttatt gaggagtttg tgccatcggt ctactttaac cccttctcgg gacctcccgg 31860
ccactatccg gatcaattta ttcctaactt tgacgcggta aaggactcgg cggacggcta 31920
cgactgaatg ttaagtggag aggcagagca actgcgcctg aaacacctgg tccactgtcg 31980
ccgccacaag tgctttgccc gcgactccgg tgagttttgc tactttgaat tgcccgagga 32040
tcatatcgag ggcccggcgc acggcgtccg gcttaccgcc cagggagagc ttgcccgtag 32100
cctgattcgg gagtttaccc agcgccccct gctagttgag cgggacaggg gaccctgtgt 32160
tctcactgtg atttgcaact gtcctaaccc tggattacat caagatctta ttccctttaa 32220
ctaataaaaa aaaataataa agcatcactt acttaaaatc agttagcaaa tttctgtcca 32280
gtttattcag cagcacctcc ttgccctcct cccagctctg gtattgcagc ttcctcctgg 32340
ctgcaaactt tctccacaat ctaaatggaa tgtcagtttc ctcctgttcc tgtccatccg 32400
cacccactat cttcatgttg ttgcagatga agcgcgcaag accgtctgaa gataccttca 32460
accccgtgta tccatatgac acggaaaccg gtcctccaac tgtgcctttt cttactcctc 32520
cctttgtatc ccccaatggg tttcaagaga gtccccctgg ggtactctct ttgcgcctat 32580
ccgaacctct agttacctcc aatggcatgc ttgcgctcaa aatgggcaac ggcctctctc 32640
tggacgaggc cggcaacctt acctcccaaa atgtaaccac tgtgagccca cctctcaaaa 32700
aaaccaagtc aaacataaac ctggaaatat ctgcacccct cacagttacc tcagaagccc 32760
taactgtggc tgccgccgca cctctaatgg tcgcgggcaa cacactcacc atgcaatcac 32820
aggccccgct aaccgtgcac gactccaaac ttagcattgc cacccaagga cccctcacag 32880
tgtcagaagg aaagctagcc ctgcaaacat caggccccct caccaccacc gatagcagta 32940
cccttactat cactgcctca ccccctctaa ctactgccac tggtagcttg ggcattgact 33000
tgaaagagcc catttataca caaaatggaa aactaggact aaagtacggg gctcctttgc 33060
atgtaacaga cgacctaaac actttgaccg tagcaactgg tccaggtgtg actattaata 33120
atacttcctt gcaaactaaa gttactggag ccttgggttt tgattcacaa ggcaatatgc 33180
aacttaatgt agcaggagga ctaaggattg attctcaaaa cagacgcctt atacttgatg 33240
ttagttatcc gtttgatgct caaaaccaac taaatctaag actaggacag ggccctcttt 33300
ttataaactc agcccacaac ttggatatta actacaacaa aggcctttac ttgtttacag 33360
cttcaaacaa ttccaaaaag cttgaggtta acctaagcac tgccaagggg ttgatgtttg 33420
acgctacagc catagccatt aatgcaggag atgggcttga atttggttca cctaatgcac 33480
caaacacaaa tcccctcaaa acaaaaattg gccatggcct agaatttgat tcaaacaagg 33540
ctatggttcc taaactagga actggcctta gttttgacag cacaggtgcc attacagtag 33600
gaaacaaaaa taatgataag ctaactttgt ggaccacacc agctccatct cctaactgta 33660
gactaaatgc agagaaagat gctaaactca ctttggtctt aacaaaatgt ggcagtcaaa 33720
tacttgctac agtttcagtt ttggctgtta aaggcagttt ggctccaata tctggaacag 33780
ttcaaagtgc tcatcttatt ataagatttg acgaaaatgg agtgctacta aacaattcct 33840
tcctggaccc agaatattgg aactttagaa atggagatct tactgaaggc acagcctata 33900
caaacgctgt tggatttatg cctaacctat cagcttatcc aaaatctcac ggtaaaactg 33960
ccaaaagtaa cattgtcagt caagtttact taaacggaga caaaactaaa cctgtaacac 34020
taaccattac actaaacggt acacaggaaa caggagacac aactccaagt gcatactcta 34080
tgtcattttc atgggactgg tctggccaca actacattaa tgaaatattt gccacatcct 34140
cttacacttt ttcatacatt gcccaagaat aaagaatcgt ttgtgttatg tttcaacgtg 34200
tttatttttc aattgcagaa aatttcaagt catttttcat tcagtagtat agccccacca 34260
ccacatagct tatacagatc accgtacctt aatcaaactc acagaaccct agtattcaac 34320
ctgccacctc cctcccaaca cacagagtac acagtccttt ctccccggct ggccttaaaa 34380
agcatcatat catgggtaac agacatattc ttaggtgtta tattccacac ggtttcctgt 34440
cgagccaaac gctcatcagt gatattaata aactccccgg gcagctcact taagttcatg 34500
tcgctgtcca gctgctgagc cacaggctgc tgtccaactt gcggttgctt aacgggcggc 34560
gaaggagaag tccacgccta catgggggta gagtcataat cgtgcatcag gatagggcgg 34620
tggtgctgca gcagcgcgcg aataaactgc tgccgccgcc gctccgtcct gcaggaatac 34680
aacatggcag tggtctcctc agcgatgatt cgcaccgccc gcagcataag gcgccttgtc 34740
ctccgggcac agcagcgcac cctgatctca cttaaatcag cacagtaact gcagcacagc 34800
accacaatat tgttcaaaat cccacagtgc aaggcgctgt atccaaagct catggcgggg 34860
accacagaac ccacgtggcc atcataccac aagcgcaggt agattaagtg gcgacccctc 34920
ataaacacgc tggacataaa cattacctct tttggcatgt tgtaattcac cacctcccgg 34980
taccatataa acctctgatt aaacatggcg ccatccacca ccatcctaaa ccagctggcc 35040
aaaacctgcc cgccggctat acactgcagg gaaccgggac tggaacaatg acagtggaga 35100
gcccaggact cgtaaccatg gatcatcatg ctcgtcatga tatcaatgtt ggcacaacac 35160
aggcacacgt gcatacactt cctcaggatt acaagctcct cccgcgttag aaccatatcc 35220
cagggaacaa cccattcctg aatcagcgta aatcccacac tgcagggaag acctcgcacg 35280
taactcacgt tgtgcattgt caaagtgtta cattcgggca gcagcggatg atcctccagt 35340
atggtagcgc gggtttctgt ctcaaaagga ggtagacgat ccctactgta cggagtgcgc 35400
cgagacaacc gagatcgtgt tggtcgtagt gtcatgccaa atggaacgcc ggacgtagtc 35460
atatttcctg aagcaaaacc aggtgcgggc gtgacaaaca gatctgcgtc tccggtctcg 35520
ccgcttagat cgctctgtgt agtagttgta gtatatccac tctctcaaag catccaggcg 35580
ccccctggct tcgggttcta tgtaaactcc ttcatgcgcc gctgccctga taacatccac 35640
caccgcagaa taagccacac ccagccaacc tacacattcg ttctgcgagt cacacacggg 35700
aggagcggga agagctggaa gaaccatgtt ttttttttta ttccaaaaga ttatccaaaa 35760
cctcaaaatg aagatctatt aagtgaacgc gctcccctcc ggtggcgtgg tcaaactcta 35820
cagccaaaga acagataatg gcatttgtaa gatgttgcac aatggcttcc aaaaggcaaa 35880
cggccctcac gtccaagtgg acgtaaaggc taaacccttc agggtgaatc tcctctataa 35940
acattccagc accttcaacc atgcccaaat aattctcatc tcgccacctt ctcaatatat 36000
ctctaagcaa atcccgaata ttaagtccgg ccattgtaaa aatctgctcc agagcgccct 36060
ccaccttcag cctcaagcag cgaatcatga ttgcaaaaat tcaggttcct cacagacctg 36120
tataagattc aaaagcggaa cattaacaaa aataccgcga tcccgtaggt cccttcgcag 36180
ggccagctga acataatcgt gcaggtctgc acggaccagc gcggccactt ccccgccagg 36240
aaccatgaca aaagaaccca cactgattat gacacgcata ctcggagcta tgctaaccag 36300
cgtagccccg atgtaagctt gttgcatggg cggcgatata aaatgcaagg tgctgctcaa 36360
aaaatcaggc aaagcctcgc gcaaaaaaga aagcacatcg tagtcatgct catgcagata 36420
aaggcaggta agctccggaa ccaccacaga aaaagacacc atttttctct caaacatgtc 36480
tgcgggtttc tgcataaaca caaaataaaa taacaaaaaa acatttaaac attagaagcc 36540
tgtcttacaa caggaaaaac aacccttata agcataagac ggactacggc catgccggcg 36600
tgaccgtaaa aaaactggtc accgtgatta aaaagcacca ccgacagctc ctcggtcatg 36660
tccggagtca taatgtaaga ctcggtaaac acatcaggtt gattcacatc ggtcagtgct 36720
aaaaagcgac cgaaatagcc cgggggaata catacccgca ggcgtagaga caacattaca 36780
gcccccatag gaggtataac aaaattaata ggagagaaaa acacataaac acctgaaaaa 36840
ccctcctgcc taggcaaaat agcaccctcc cgctccagaa caacatacag cgcttccaca 36900
gcggcagcca taacagtcag ccttaccagt aaaaaagaaa acctattaaa aaaacaccac 36960
tcgacacggc accagctcaa tcagtcacag tgtaaaaaag ggccaagtgc agagcgagta 37020
tatataggac taaaaaatga cgtaacggtt aaagtccaca aaaaacaccc agaaaaccgc 37080
acgcgaacct acgcccagaa acgaaagcca aaaaacccac aacttcctca aatcgtcact 37140
tccgttttcc cacgttacgt cacttcccat tttaagaaaa ctacaattcc caacacatac 37200
aagttactcc gccctaaaac ctacgtcacc cgccccgttc ccacgccccg cgccacgtca 37260
caaactccac cccctcatta tcatattggc ttcaatccaa aataaggtat attattgatg 37320
atg 37323
<---
Реферат
Изобретение относится к биохимии. Описано применениемодифицированных лимфоцитов, содержащих вектор для регулируемой экспрессии белка, обладающего функцией интерлейкина-12 (IL-12) для лечения опухоли у млекопитающего, причем указанный вектор содержит полинуклеотид, кодирующий переключатель гена, где указанный генный переключатель содержит: (a) по меньшей мере одну последовательность транскрипционного фактора, причем указанная по меньшей мере одна последовательность транскрипционного фактора кодирует лиганд-зависимый транскрипционный фактор, функционально связанный с промотором; и (b) полинуклеотид, кодирующий белок, обладающий функцией IL-12, связанный с промотором, который активируется указанным лиганд-зависимым транскрипционным фактором; причем указанный полинуклеотид, кодирующий указанный белок, обладающий функцией IL-12, кодирует белок, который по меньшей мере на 85% идентичен человеческому IL-12 дикого типа, и при этом указанный лиганд вводят в эффективном количестве через или менее чем через 24 часа после внутриопухолевой доставки эффективного количества указанных лимфоцитов. Изобретение расширяет арсенал средств для лечения животных, включая человека. 16 з.п. ф-лы, 18 ил., 5 пр.

Комментарии