Мутеин человеческого il-4, полинуклеотидная молекула, вектор, линия sf9, трансформированная вектором, способ выбора мутеина, фармацевтическая композиция для активирования т-клеток, способ лечения пациента, страдающего заболеванием, поддающимся лечению il- - RU2235728C2
Код документа: RU2235728C2
Чертежи
















































































Описание
Изобретение относится, главным образом, к областям фармакологии и иммунологии. Более конкретно, изобретение направлено на новые композиции вещества, избирательно активирующего Т-клетки и обладающего пониженным активирующим эффектом на эндотелиальные клетки или фибробласты. Новые композиции включают в себя варианты из семейства цитокинов и, в частности, человеческий интерлейкин-4 (IL-4).
Интерлейкин-4 (IL-4) представляет собой плейотропный цитокин, активирующий клетки иммунной системы, эндотелия и клетки фибробластного типа. Описанные эффекты, обнаруженные после введения IL-4 in vitro, включают в себя пролиферацию В-клеток, переключение иммуноглобулиновых классов в В-клетках. Что касается Т-клеток, IL-4 стимулирует пролиферацию Т-клеток после предварительной активации митогенами и оказывает понижающее регулирующее воздействие на продукцию IFN-γ. В моноцитах IL-4 индуцирует экспрессию молекул МНС II класса, секрецию липополисахаридиндуцированного tPA и экспрессию CD23. В эндотелиальных клетках (ЭК) IL-4 индуцирует экспрессию VCAM-1 и секрецию IL-6 и снижает экспрессию ICAM-1 (Maher, DW, et al., Human Interleukin-4: An Immunomodulator with Potential Therapeutic Applications, Progress in Growth Factor Research, 3:43-56 (1991)).
По причине его способности к стимулированию пролиферации Т-клеток, активированных воздействием IL-2, преследовались терапевтические приложения IL-4. Например, IL-4 проявлял противоопухолевую активность в животных моделях со злокачественными опухолями почки и вызывал регресс опухоли у мышей (Bosco, M., et al., Low Doses of IL-4 Injected Perilymphatically in Tumor-bearing Mice Inhibit the Growth of Poorly and Apparently Nonimmunogenic Tumors and Induce a Tumor Specific Immune Memory, J.Immunol., 145:3136-43 (1990)). Однако его токсичность ограничивает размер дозировки у людей (Margolin, К., et al., Phase II Studies of Human Recombinant Interleukin-4 in Advanced Renal Cancer and Malignant Melanoma, J.Immunotherapy, 15:147-153(1994)).
Вследствие иммунорегуляторной активности IL-4 для него предложен ряд клинических применений. Среди этих клинических применений находятся заболевания, вызванные дисбалансом в иммунной системе, в особенности заболевания, вызванные дисбалансом в реакциях Т-хелперной (Th) клетки на антиген. Данные заболевания включают в себя определенные аутоиммунные заболевания, ревматические заболевания, кожные заболевания и инфекционные заболевания. Большой объем экспериментальной работы позволил установить, что Th клетки подразделяются на два обширных класса, обозначаемых как Th1 и Th2 (Mosmann, T.R., Cherwinski, H., Bond, M.W., Giedlin, M.A. and Coffman, R.L., Two types of murine helper Т cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins, J. Immunol, 136:2348-2357 (1986); Mosmann, T.R., Cytokines, differentiation and functions of subsets of CD4 and CD8 Т cells, Behring Inst. Mitt., 1-6 (1995)). Данные классы Т-клеток определяются по цитокинам, которые они экспрессируют: Тh1-клетки продуцируют IL-2, IFN-γ и TNF-α, тогда как Тh2-клетки продуцируют IL-4 и IL-5. Th1-и Тh2-клетки образуются из не подвергнутых воздействию CD4+ Т-клеток. Дифференцировка на Th1-или Тh2-подгруппы зависит от цитокина, присутствующего во время антигенной стимуляции: IFN-γ и IL-12 направляют процесс дифференцировки не подвергнутых воздействию клеток в сторону фенотипа Th1, тогда как IL-4 направляет процесс дифференцировки в сторону фенотипа Th2. Несмотря на то, что в Th1-и Тh2-подгруппах среди множества фенотипов Th-клеток могут быть представлены крайние случаи (например, были описаны Th0-клетки, которые проявляют низкий уровень экспрессии как IFN-γ, так и IL-4), тем не менее, данная классификация является главенствующей в области иммунологии для описания характера иммунного ответа.
Были сделаны наблюдения, что определенные органоспецифичные аутоиммунные заболевания связаны с Т-клеточным ответом на аутоантиген, осуществляемый преимущественно Th1 (Liblau RS; Singer SM; McDevitt HO, Th1 and Th2 CD4+ Т cells in the pathogenesis of organ-specific autoimmune diseases, Immunol. Today, 16:34-38 (1995)). Одним таким аутоиммунным заболеванием является инсулинзависимый сахарный диабет (ИЗСД), заболевание, характеpизующееся опосредованным Т-клетками разрушением β-клеток поджелудочной железы. Некоторые данные позволяют предположить, что за разрушение β-клеток поджелудочной железы преимущественно ответственны клетки Th1-типа (обзор в Tisch, R. et al., Review: Insulin-dependent Diabetes Mellitus, Cell, 85:291-297 (1996)). Введение IL-4 мышам NOD, которые служат животной моделью ИЗСД, оказывает понижающее регулирующее воздействие на популяцию Th1 и значительно замедляет развитие диабета (Rapoport, et al., IL-4 Reverses T cell Proliferation Unresponsiveness and Prevents the Onset of Diabetes in NOD Mice, J.Exp.Med., 178:87-99 (1993)). Другим таким аутоиммунным заболеванием является рассеянный склероз (PC), заболевание, которое характеризуется аутоиммунной атакой на миелиновую оболочку, окружающую нервные клетки. Исследования, проведенные на людях с PC, продемонстрировали, что обострение PC связано с присутствием аутоантигенспецифичных Th1- и Th0-клеток и что ремиссия связана с присутствием аутоантигенспецифичных Th2- и Th0-клеток (Correale, J. et al., Patterns of cytokine secretion by autoreactive proteolipid protein-specific T cell clones during the course of multiple sclerosis, J. Immunol., 154:2959-2968 (1995)). У мышей с экспериментальным аутоиммунным энцефаломиелитом (ЭАЭ), животной моделью PC также проявляется поляризация Th1-клеток (Cua, DJ, Hinton, DR, and Stohlman, SA, J.Immunol., 155:4052-4059 (1995)). Косвенные данные, полученные при исследовании модели ЭАЭ, приводят к предположению, что IL-4 играет принципиальную роль в уменьшении тяжести заболевания, являющимся результатом лечения толерогенным пептидом (Brocke, S. et al., Treatment of experimental encephalomyelitis with a peptide analogue of myelin basic protein, Nature, 379:343-346 (1996)).
Другие аутоиммунные заболевания, такие как ревматоидный артрит (РА), также являются мишенями для терапии на основе IL-4. В животных моделях РА был показан дисбаланс показателей клеточных профилей, склоняющийся в сторону Th1-клеток, и было продемонстрировано, что у мышей с повышенным уровнем экспрессии TNF-α, анти-TNF-α антитела уменьшали тяжесть заболевания, что позволяет предположить, что курсы лечения на основе IL-4, результатом которых является понижающая регуляция популяций Th1-клеток, также могут обладать анти-TNF-α действием (смотри Feldmann, М., et al., Review: Rheumatoid Arthritis, Cell, 85:307-310 (1996)).
Псориаз представляет собой хроническое кожное заболевание, характеризующееся инфильтрацией пораженной кожи моноцитами и Т-клетками. В нескольких сообщениях указывается, что Т-клетки и ЛПК из псориатического кожного очага обладают преимущественно фенотипом Th1 (Uyemura К; Yamamura М; Fivenson DF; Modlin RL; NickolofT BJ, The cytokine network in lesional and lesion-free psoriatic skin in characterized by a T-helper type 1 cell-mediated response, J.Invest. Dermatol, 101:701-705 (1993); Schlaak JF; Buslau M; Jochum W; Hermann E; Girndt M; Gallati H; Meyer zum Buschenfelde KH; Fleischer В, Т cells involved in psoriasis vulgaris belong to the Th1 subset, J. Invest. Dermatol, 102:145-149 (1994)). К тому же, было показано, что монометилфумарат, лекарственное средство, о котором сообщалось, что оно приносит клиническое улучшение состояния пациентов, страдающих псориазом, избирательно стимулирует секрецию цитокинов МКПК Th2 (de Jong R; Bezemer AC; Zomerdijk TP; van de Pouw-Kraan T; Ottenhoff TH; Nibbering PH, Selective stimulation of T helper 2 cytokine responces by anti-psoriasis agent monomethylfumarate, Eur. J.Immunol., 26:2067-2074 (1996)). Таким образом, ожидается, что IL-4 будет обращать поляризацию Th и будет вызывать клиническое улучшение при псориазе.
Определенные инфекционные заболевания связаны с поляризованными Th-клеточными реакциями на инфекционный агент. Тh2-опосредованные реакции в некоторых случаях были связаны с невосприимчивостью к инфекционному агенту. Примером служит Borrelia burgdorferi, возбудитель болезни Lyme. У людей, инфицированных В. burgdorferi, наблюдается преимущественно Тh1-подобный профиль цитокинов (Oksi J; Savolainen J; Репе J; Bousquet J; Laipalla P; Viljanen MK, Decreased interleukin-4 and increased gamma interferon production by peripheral blood mononuclear cells of patients with Lyme borreliosis, Infect. Immun., 64:3620-3623 (1996)). В модели В. burgdorferi-индуцированного артрита у мышей сопротивляемость заболеванию связана с продукцией IL-4, тогда как подверженность связана с продукцией IFN-γ (Matyniak JE; Reiner SL, Т helper phenotype and genetic susceptibility in experimental Lyme disease, J.Exp.Med., 181(3):1251-1254 (1995); Keane-Myers A; Nickell SP, Role of IL-4 and IFN-gamma in modulation of immunity Borrelia burgdorferi in mice, J.Immunol., 155:2020-2028 (1995)). Лечение инфицированных В. burgdorferi мышей IL-4 увеличивает сопротивляемость инфекции (Keane-Myers A; Maliszewski CR; Finkelman FD; Nickell SP, Recombinant IL-4 treatment augments resistance to Borrelia burgdorferi infections in both normal susceptible and antibody-deficient susceptible mice, J. Immunol., 156:2488-2494 (1996)).
Сообщалось, что IL-4 обладает прямым ингибирующим действием на развитие лимфом и лейкозов (Akashi, К, The role of interleukin-4 in the negative regulation of leukemia cell growth, Leuk. Lymphoma, 9:205-9 (1993)). Например, сообщалось, что IL-4 индуцирует апоптоз клеток пациентов, страдающих острым лимфобластным лейкозом (Manabe, A., et al., Interleukin-4 induces programmed cell death (apoptosis) in cases of high-risk acute lymphoblastic leukemia, Blood, 83:1731-7 (1994)), и подавляет рост клеток пациентов, страдающих неходжкинской В-клеточной лимфомой (Defrance, Т., et al., Antiproliferative effects of interleukin-4 on freshly isolated non-Hodgkin malignant B-lymphoma cells, Blood, 79:990-6 (1992)).
Также сообщалось, что IL-4 проявляет активность, наличие которой предполагает, что он сможет вызывать клиническое улучшение при остеоартрите. Остеоартрит представляет собой заболевание, при котором основным патологическим процессом является разрушение хряща (Sack, KE, Osteoarthritis, A continuing challenge, West J. Med., 163:579-86 (1995); Oddis, CV, New perspectives on osteoarthritis, Am. J. Med., 100:10S-15S (1996)). IL-4 ингибирует продукцию TNF-α и IL-1 моноцитами и синовиоцитами пациентов, страдающих остеоартритом (Bendrups, A, Hilton, A, Meager, A and Hamilton, JA, Reduction of tumor necrosis factor alpha and interleukin-1 beta levels in human synovial tissue by interleukin-4 and glucocorticoid, Rheumatol. Int., 12:217-20 (1993); Seitz, M., et al., Production of interleukin-1 receptor antagonist, inflammatory chemotactic proteins, and prostaglandin E by rheumatoid and osteoarthritic synoviocytes-regulation by IFN-gamma and IL-4, J. Immunol., 152:2060-5 (1994)). Также сообщалось, что IL-4 непосредственно блокирует разрушение хряща в эксплантатах хряща ex vivo (Yeh, LA, Augustine, AJ, Lee, P, Riviere, LR and Sheldon, A, Interleukin-4, an inhibitor of cartilage breakdown in bovine articular cartilage explants, J. Rheumatol., 22:1740-6 (1995)). Данные активности предполагают, что IL-4 будет вызывать клиническое улучшение при остеоартрите.
Однако клиническое применение IL-4 было ограничено по причине его острой токсичности, которая проявляется в виде синдрома повышенной проницаемости сосудов (Margolin, К., et al., Phase II Studies of Human Recombinant Interleukin-4 in Advanced Renal Cancer and Malignant Melanoma, J. Immunotherapy, 15, 147-153 (1994)). В литературе не существует ни данных, которые описывали бы механизм острого токсического эффекта IL-4, ни данных, которые описывали бы аналоги или мутанты IL-4, у которых сохранена иммунорегуляторная активность, но которые обладают пониженной острой токсичностью.
Известны мутантные белки ("мутеины") IL-4. Мутеин IL-4 IL-4/Y124D представляет собой Т-клеточный антагонист (Kruse N, Tony HP, Sebald W, Conversion of human interleukin-4 into a high affinity antagonist by a single amino acid replacement, Embo J., 11:3237-44 (1992)).
Терапевтические применения IL-4, описанные в патентах или в заявках на патент, включают в себя следующие: применение IL-4 для потенцирования противораковых эффектов химиотерапевтических средств в особенности при лимфогранулематозе и неходжкинской лимфоме (смотри международную заявку на патент WO 9607422); применение антигенных фрагментов IL-4 для наработки антител для лечения заболеваний, связанных с IL-4, путем подавления или имитации связывающей активности IL-4 (смотри международную заявку на патент WO 9524481) и для определения, измерения и иммунологической очистки IL-4 (смотри международную заявку на патент WO 9317106); для индукции дифференцировки предшественников В-клеток в иммуноглобулинсекретирующие клетки, зрелые В-клетки, применимые для компенсации иммунной функции у пациентов с нарушенной деятельностью иммунной системы (смотри международную заявку на патент WO 9404658); будучи примененным в сочетании с IL-10, в качестве средства для лечения лейкоза, лимфомы, воспаления кишки и гиперчувствительности замедленного типа (например, язвенного колита и болезни Крона) (смотри международную заявку на патент WO 9404180); лечения ВИЧ-инфекции путем введения IL-4 для ингибирования репликации вируса в моноцитах и макрофагах и для повышения их цитотоксичности по отношению к некоторым опухолевым клеткам (смотри WO 9404179); для стимулирования пролиферации кожных фибробластов для лечения ран у пациентов, страдающих сахарным диабетом и иммунными нарушениями (смотри международную заявку на патент WO 9211861); для усиления первичного иммунного ответа при введении бактериальных, токсоидных и вирусных вакцин, особенно вакцины столбнячного анатоксина (смотри международную заявку на патент WO 9211030); для подавления IL-2-индуцированной пролиферации в В-клеточных злокачественных опухолях особенно при хроническом лимфолейкозе, неходжкинской злокачественной лимфоме (смотри международную заявку на патент WO 9210201); применение IL-4 для лечения меланом, злокачественных опухолей почки и базалиом (смотри международную заявку на патент WO 9204044).
В патентной литературе описаны белки и некоторые мутеины IL-4, но не направленные на лечение на основе IL-4 со сниженными побочными эффектами. Патент США №5017691 ("патент "691"), выданный Lee et al., направлен на продуцируемые млекопитающими белки и мутеины человеческого IL-4, которые обнаруживают как активность факторов роста В-клеток, так и активность факторов роста Т-клеток. В нем описаны нуклеиновые кислоты, кодирующие полипептиды, проявляющие активность IL-4, также сами полипептиды и способы их получения. Описаны мутеины IL-4 дикого типа по аминокислотным положениям, которые сохраняют in vitro свою способность стимулировать пролиферацию как В -, так и Т-клеток. Однако в патенте США 5017691 ничего не предложено по поводу каких-либо мутеинов IL-4, избирательно действующих на Т-клетки, ожидаемой активации ЭК или увеличения проницаемости эндотелиальных клеток, которая сопутствует введению IL-4. Таким образом, сам IL-4 не может использоваться в качестве лечебного воздействия по причине ограничивающей дозировку токсичности.
В патенте США №5013824 описаны пептидные производные hIL-4, содержащие от 6 до 40 аминокислот нативного hIL-4. Также описаны иммуногены, содержащие конъюгаты пептидов и носителей. Носители включают эритроциты, бактериофаги, белки, синтетические частицы или любое вещество, способное вызывать продукцию антител против конъюгированного пептида. Мутеинов IL-4 не описано.
В международной заявке на патент WO 96/04306-A2 описаны одиночные мутеины, которые являются антагонистами и частичными агонистами hIL-2 и hIL-13. Данных, касающихся IL-4, не приведено. В международной заявке на патент WO 95/27052 описаны сплайсинговые мутанты IL-2 и 1L-4, содержащие экзоны 1, 2 и 4.
Существует потребность в усовершенствованной молекуле IL-4, которая обладает пониженной токсичностью и в основном более толерантна.
Изобретение направлено на мутеины человеческого IL-4, пронумерованные в соответствии с IL-4 дикого типа, обладающие активирующей Т-клетки активностью, но обладающие пониженной активностью активирования эндотелиальных клеток. В частности, мутеины человеческого IL-4, где экспонированные поверхности на остатки D-спирали IL-4 дикого типа мутированы, в результате чего полученный мутеин вызывает пролиферацию Т-клеток и вызывает пониженную секрецию IL-6 ЭКПВЧ по сравнению с IL-4 дикого типа. Данное изобретение представляет менее токсичный мутеин IL-4, который делает возможным более широкое терапевтическое применение данного интерлейкина.
Кроме того, изобретение направлено на мутеины IL-4, содержащие одиночные, двойные и тройные мутации, представленные обозначениями R121A, R121D, R121E, R121F, R121H, R121I, R121K, R121N, R121P, R121T, R121W; Y124A, Y124Q, Y124S, Y124T, Y124A/S125A, T13D/R121E и R121T/E122F/Y124Q, при нумерации в соответствии с IL-4 дикого типа (His=1). Изобретение также включает в себя полинуклеотиды, кодирующие мутеины
этого изобретения, векторы, содержащие полинуклеотиды, трансформированные клетки-хозяева, фармацевтические композиции, содержащие мутеины, и терапевтические способы лечения.
Изобретение также направлено на вектор, содержащий полинуклеотид, кодирующий мутеин этого изобретения, вектор, направляющий экспрессию мутеина человеческого IL-4, обладающего активностью активирования Т-клетки, но обладающего пониженной активностью активирования эндотелиальных клеток, причем вектор обеспечивает возможность трансфекции организма-мишени и последующей экспрессии in vivo указанного мутеина человеческого IL-4, кодируемого указанным полинуклеотидом. Изобретение также направлено на способ выбора мутеина человеческого IL-4, пронумерованного в соответствии с IL-4 дикого типа, обладающего активностью активирования Т-клетки, но обладающего пониженной активностью активирования эндотелиальных клеток, включая мутацию поверхностных остатков D-спирали IL-4 дикого типа, посредством чего полученный мутеин вызывает пролиферацию Т-клеток и вызывает пониженную секрецию IL-6 ЭКПВЧ по сравнению с диким типом.
Изобретение также направлено на способ лечения пациента, страдающего состоянием, поддающимся лечению IL-4, путем введения терапевтически эффективного количества мутеина человеческого IL-4, пронумерованного в соответствии с IL-4 дикого типа, обладающего активирующей Т-клетки активностью, но обладающего пониженной активностью активирования эндотелиальных клеток. Данный способ применим, когда состояние, поддающееся лечению IL-4, представляет собой аутоиммунное заболевание, в частности рассеянный склероз, ревматоидный артрит, инсулинзависимый сахарный диабет, системную красную волчанку, инфекционное заболевание, в частности болезнь Lyme, Th1-поляризованное заболевание, в частности псориаз, злокачественную опухоль, в частности острый лимфобластный лейкоз и неходжкинскую лимфому, заболевание хрящевой ткани, в частности остеоартрит.
Краткое описание чертежей. На фиг.1 представлена аминокислотная последовательность (ПОСЛ. ИД. №:1) зрелого человеческого IL-4 дикого типа, применяемого в данном исследовании. Спирали подчеркнуты и последовательно помечены А, В, С и D. Положения, которые, будучи мутированы, позволяли получить агонисты IL-4, избирательно действующие на клетки, указаны жирньм шрифтом.
Фиг.2 является графическим представлением концепции агониста, избирательно действующего на Т-клетки.
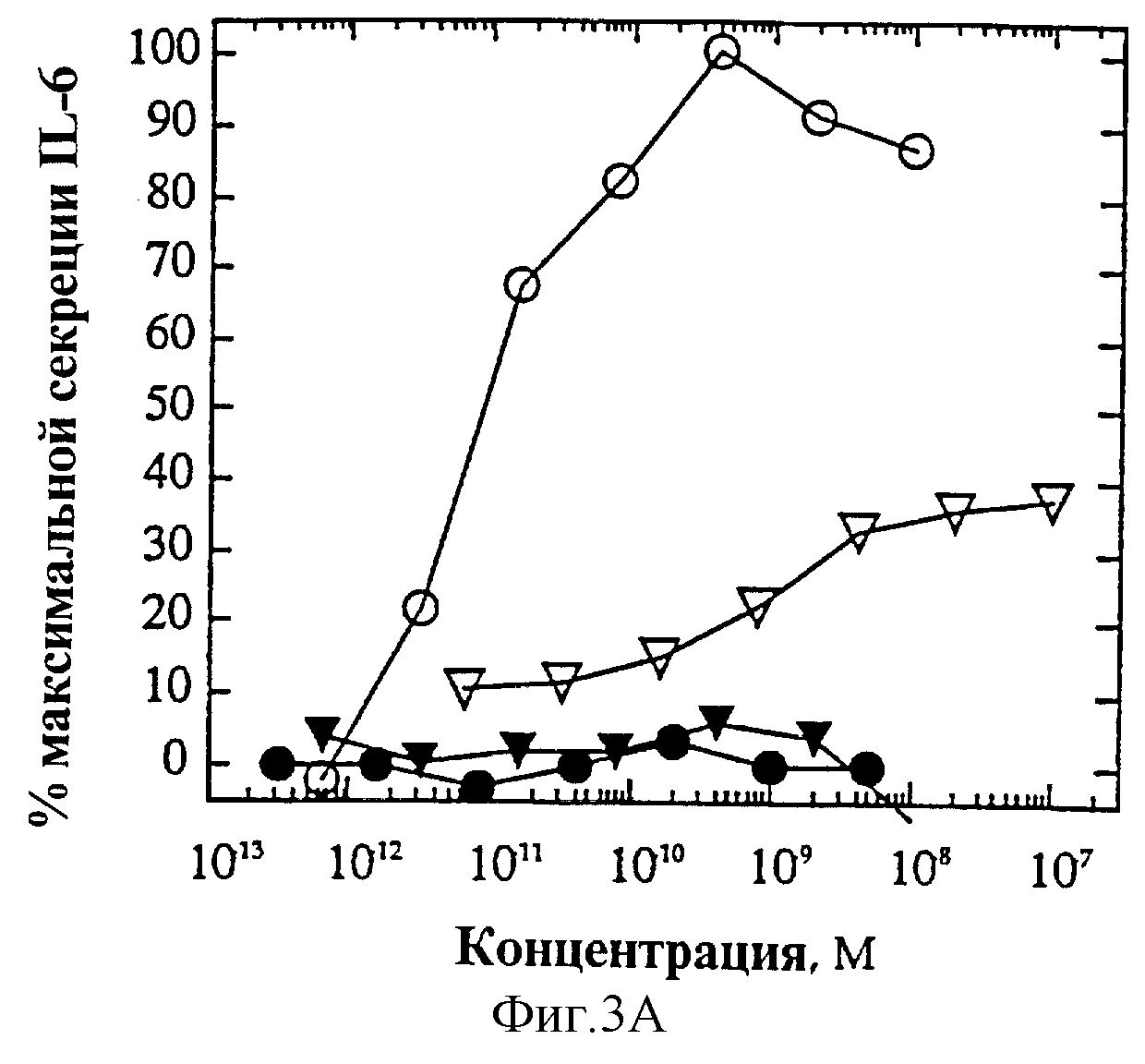
На фиг.3 представлена суммарная кривая "доза-ответ" мутеинов-избирательных агонистов в исследовании секреции IL-6 ЭКПВЧ. Панель А: О, IL-4 дикого типа; •, R121E; Σ, R121P;


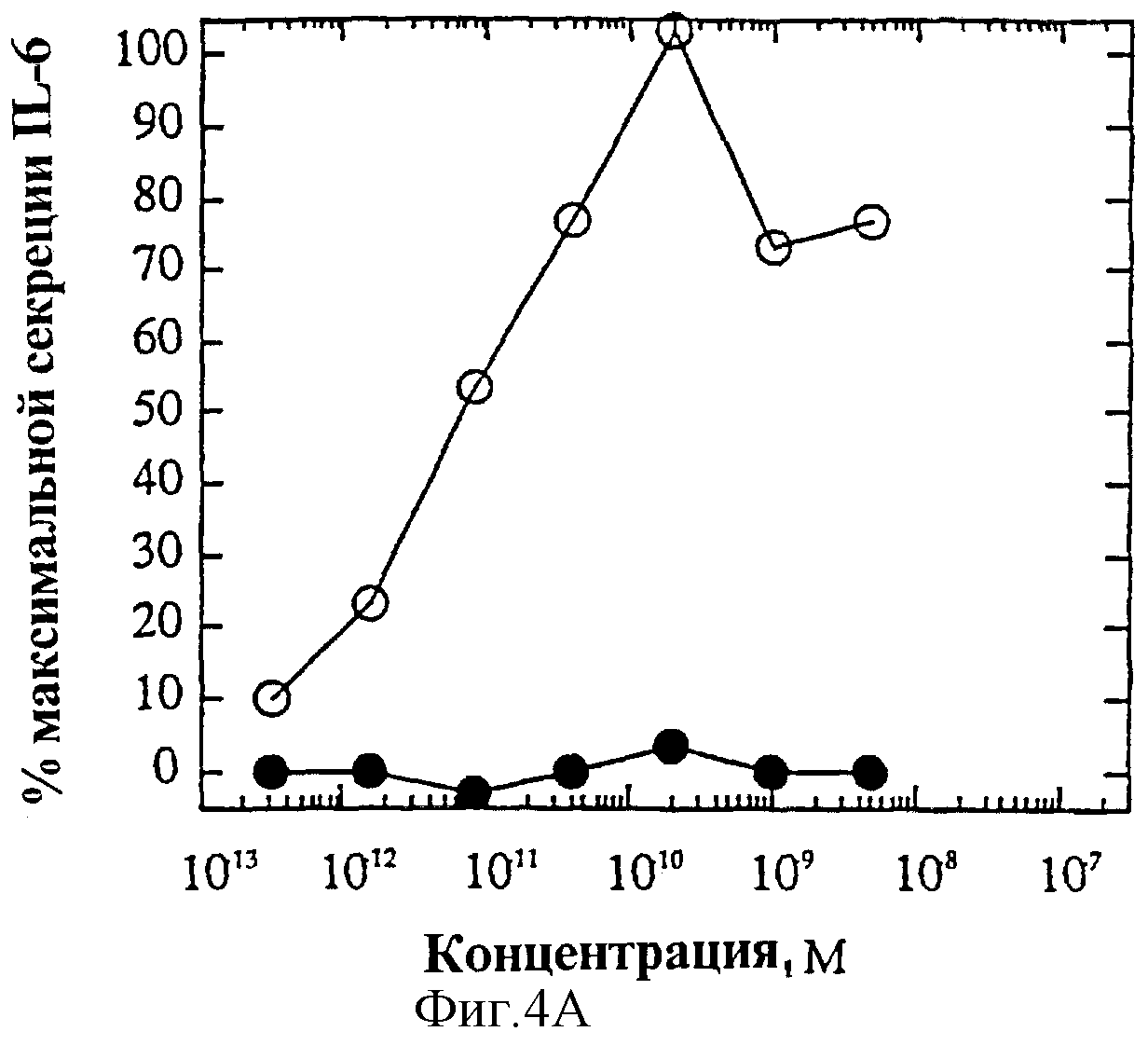
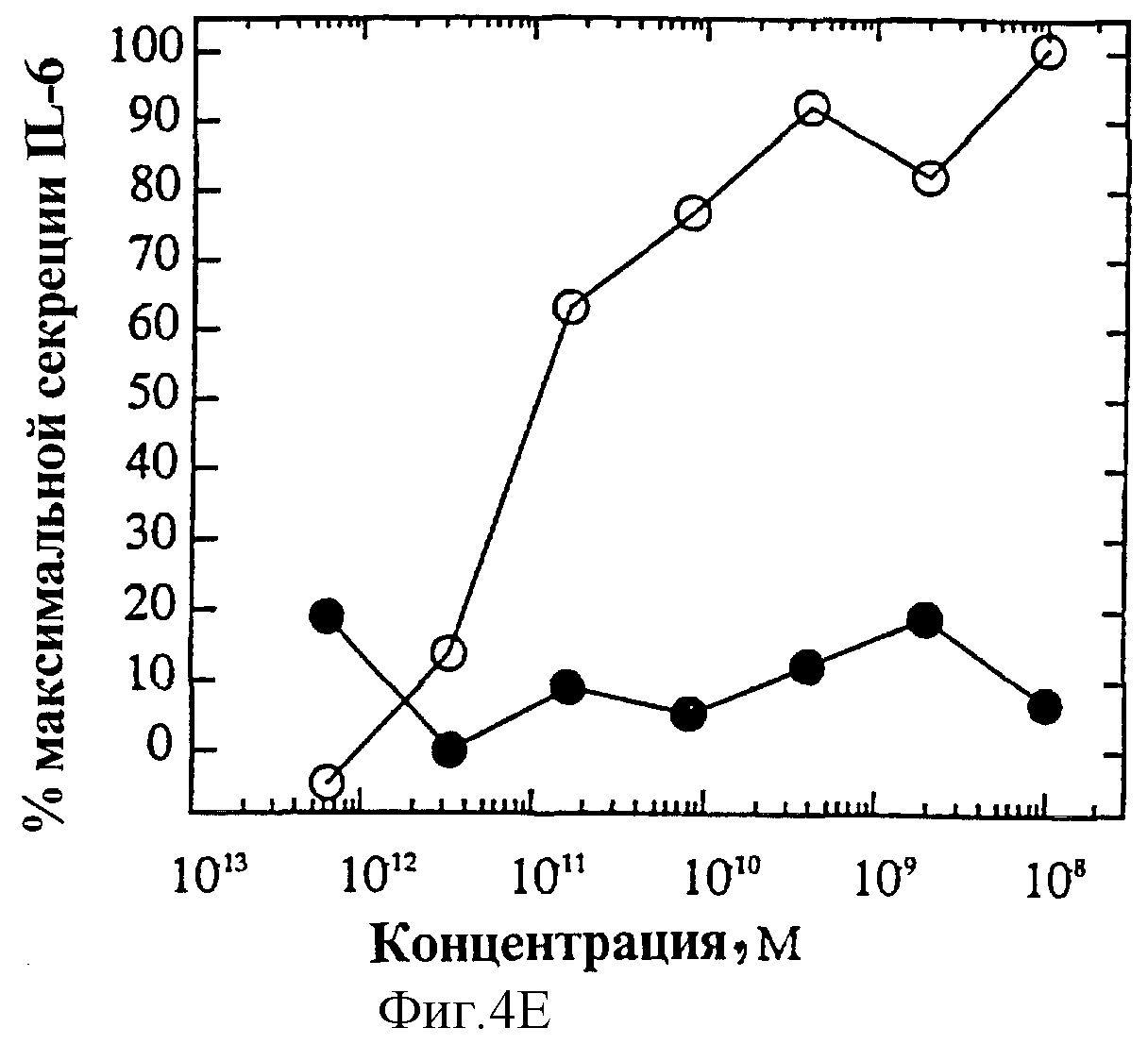
На фиг.4 представлены индивидуальные кривые "доза-ответ" мутеинов-избирательных агонистов в исследовании секреции IL-6 ЭКПВЧ. Панель А: О, IL-4 дикого типа; •, R121E. Панель В: О, IL-4 дикого типа; •, R121P. Панель С: О, IL-4 дикого типа; • Y124Q. Панель D: О, IL-4 дикого типа; •, Y124R. Панель Е: О, IL-4 дикого типа; •, Y124A/S125A. Панель F: О, IL-4 дикого типа; •, R121T/E122F/Y124Q.
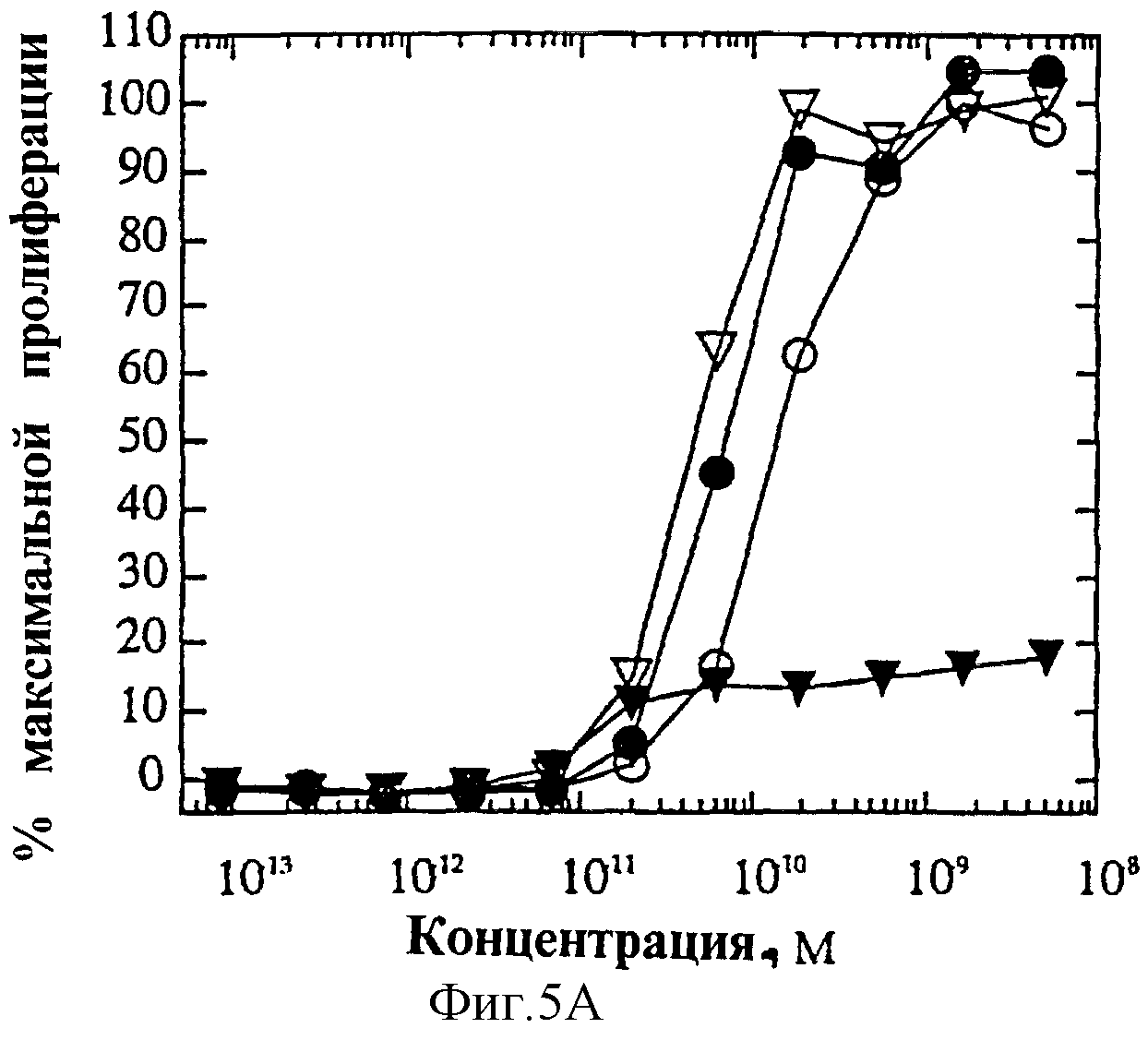
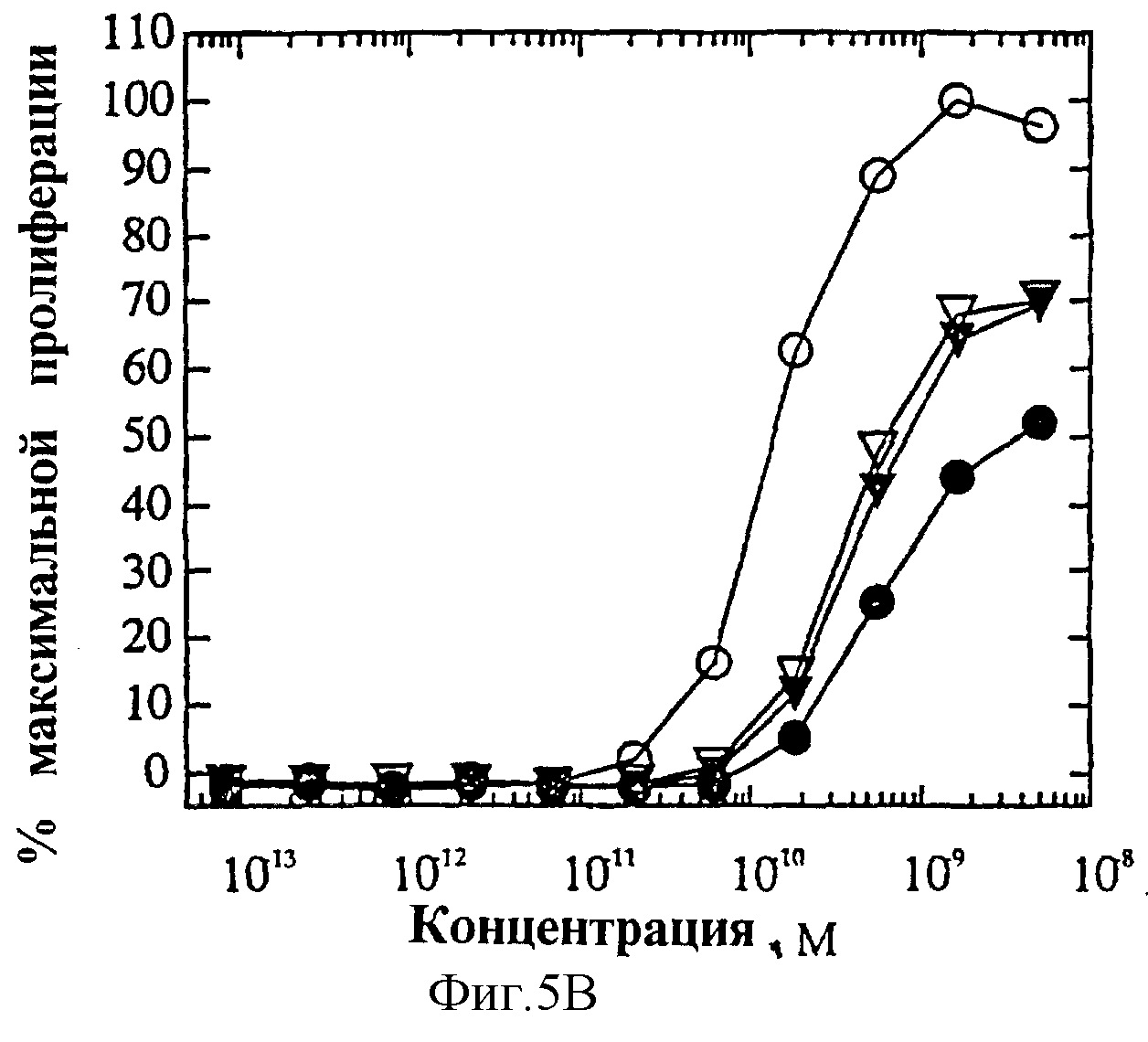
На фиг.5 представлена суммарная кривая "доза-ответ" мутеинов-избирательных агонистов для биологического ответа мутеинов IL-4 при анализе пролиферации 1° Т-клеток. Панель А: O, IL-4 дикого типа; •, R121E; Σ, R121P;


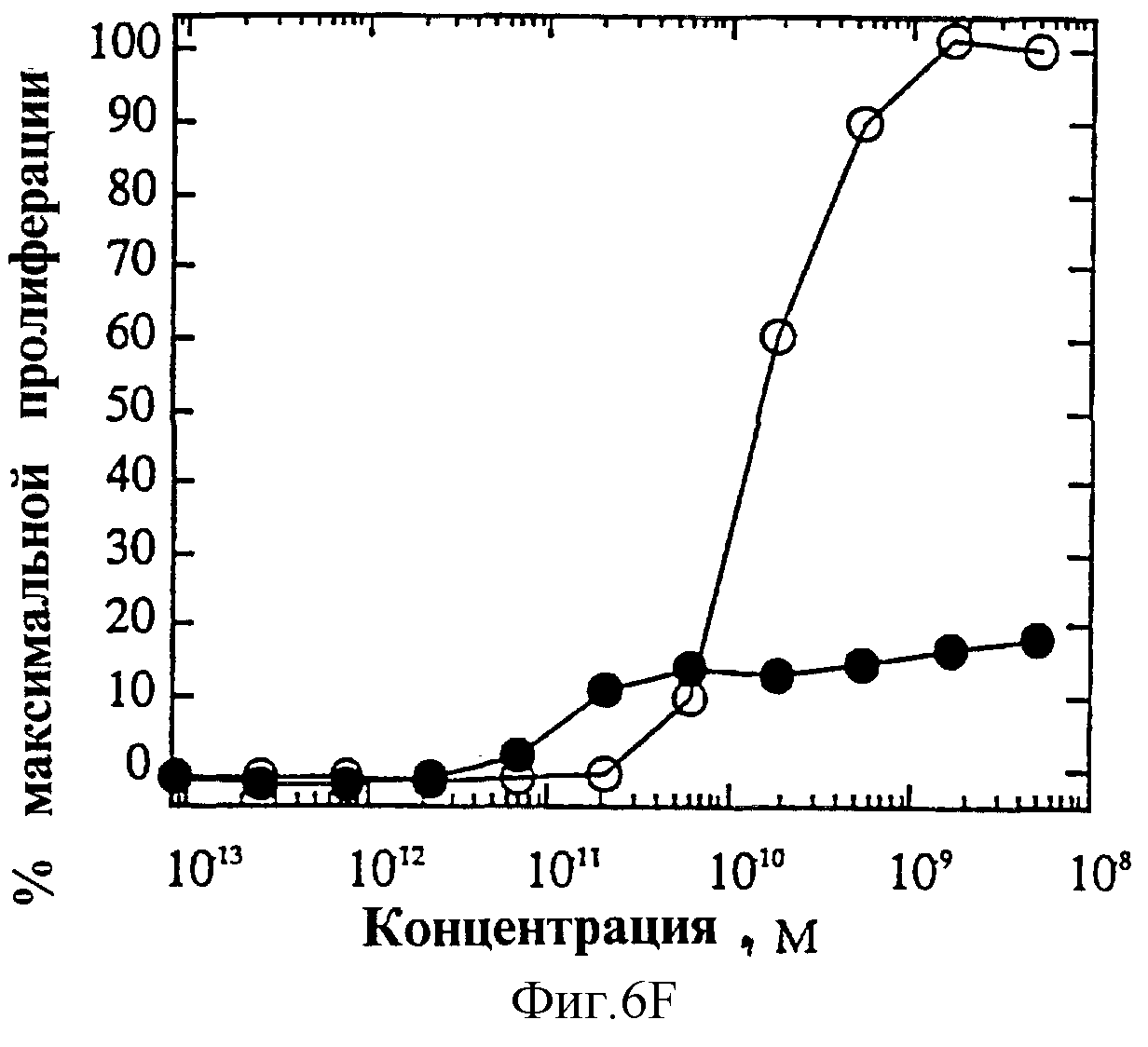
На фиг.6 представлены индивидуальные кривые "доза-ответ" в исследованиях пролиферации 1° Т-клеток. Панель А: О, IL-4 дикого типа; •, R121E. Панель В: О, IL-4 дикого типа; •, R121P. Панель С: O, IL-4 дикого типа; •, Y124Q. Панель D: О, IL-4 дикого типа; •, Y124R. Панель Е: O, IL-4 дикого типа; •, Y124A/S125A. Панель F: O, IL-4 дикого типа; •, R121T/E122F/Y124Q.
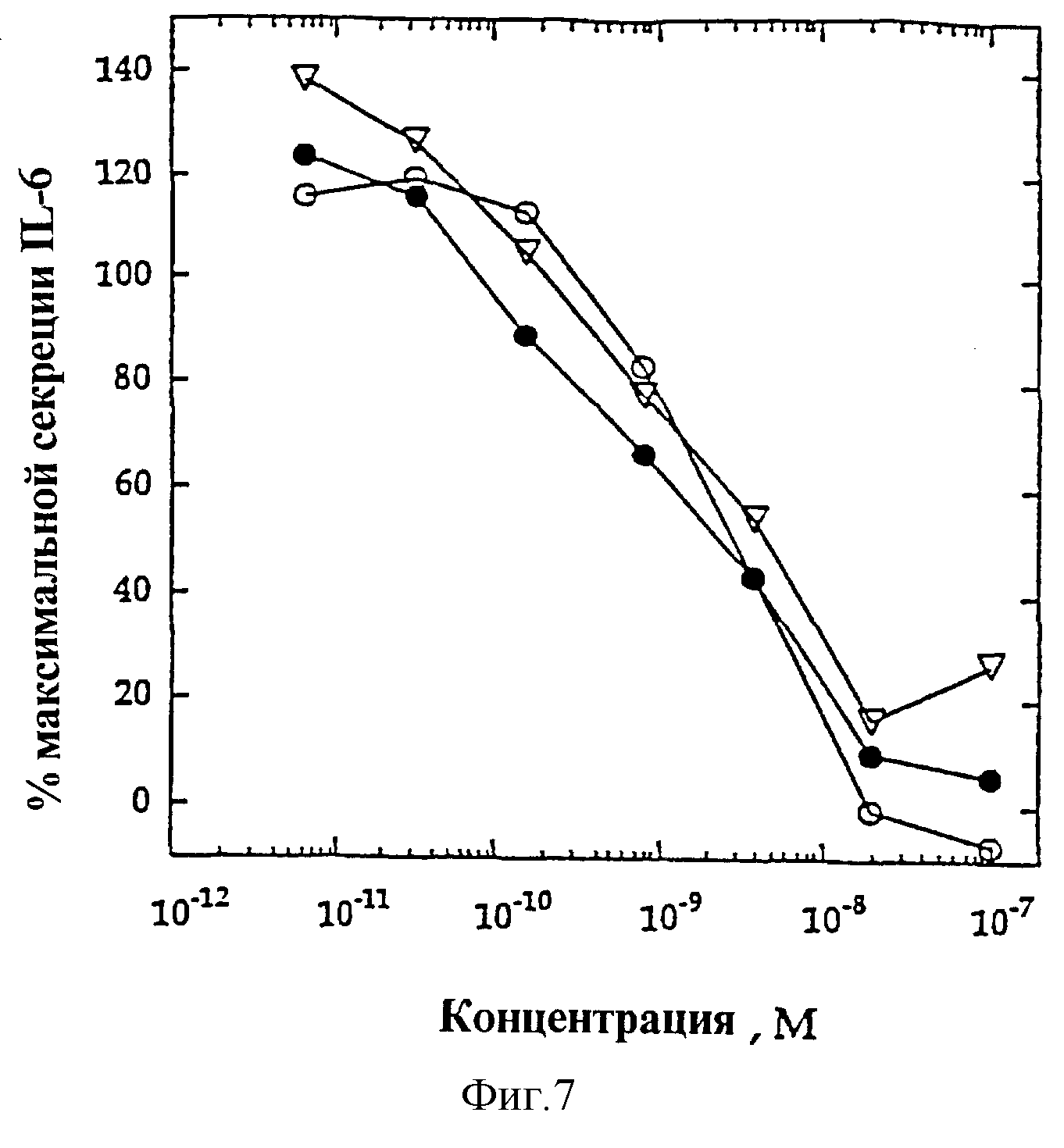
На фиг.7 представлены индивидуальные кривые "доза-ответ", показывающие антагонизм IL-4-индуцированной секреции IL-6 ЭКПВЧ и мутеинов-агонистов IL-4, избирательно действующих на Т-клетки, R121E (•) и Y124Q (2). Кривая "доза-ответ" антагониста IL-4 R121D/Y124D (O) включена в качестве контроля.
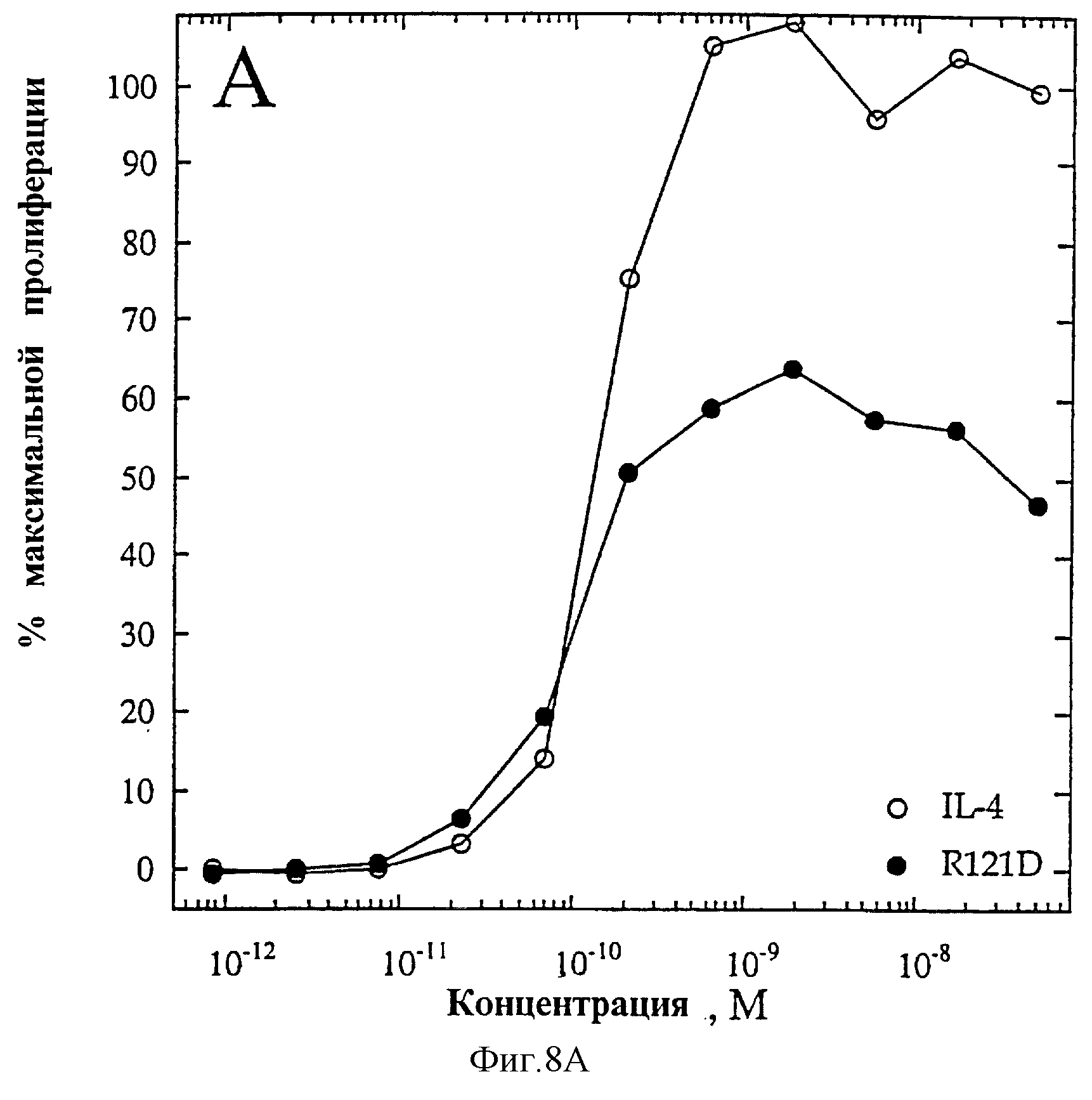
На фиг.8А, 8В представлены индивидуальные кривые "доза-ответ": на Панели В показан биологический ответ на мутеин R121D при анализе пролиферации 1° Т-клеток (O=IL-4, •=R121D); на Панели А показана неспособность R121D индуцировать секрецию IL-6 ЭКПВЧ (O=IL-4, •=R121D).
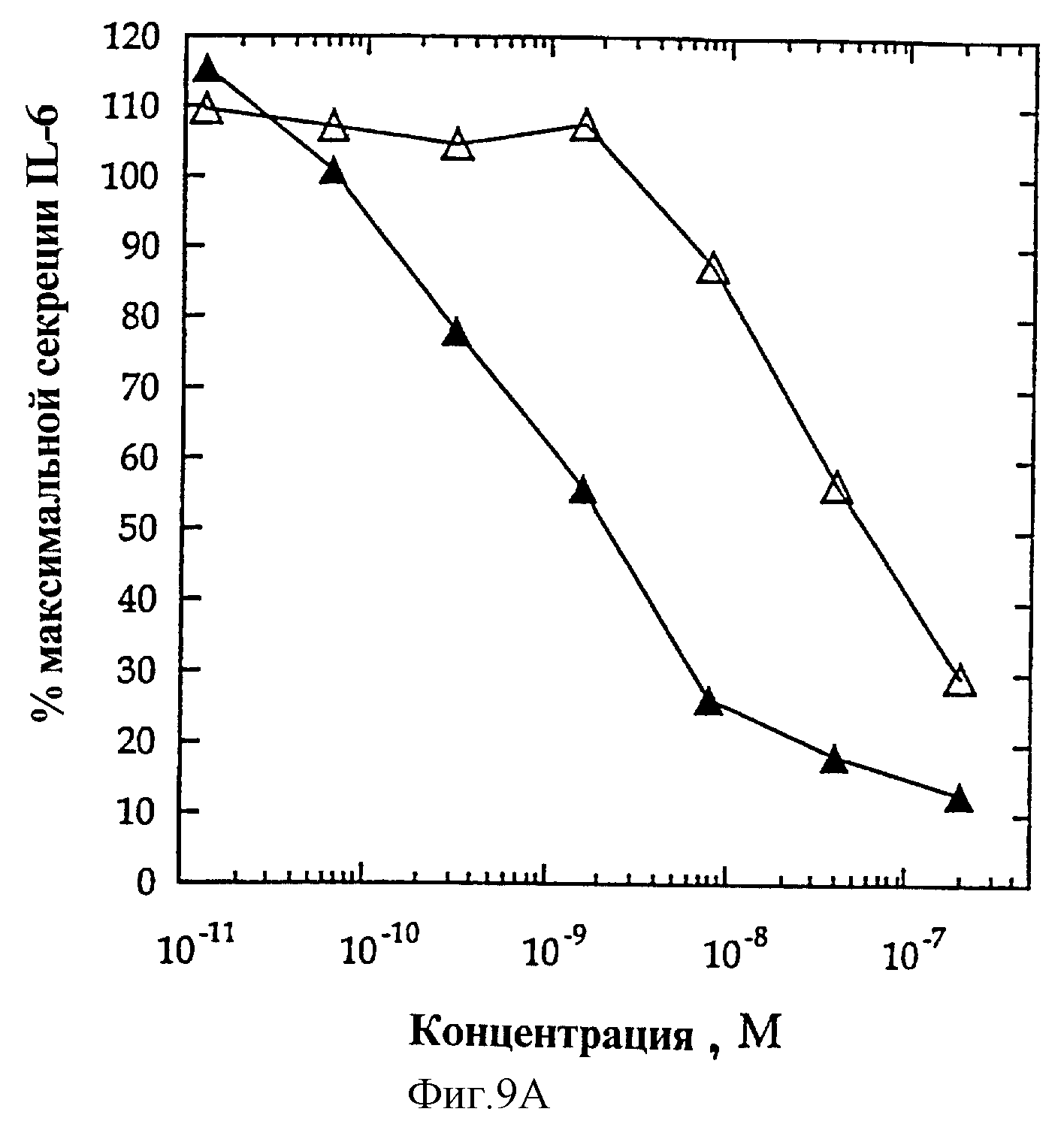
На фиг.9А представлены индивидуальные кривые "доза-ответ" для IL-4 (O) и для мутеинов-агонистов, избирательно действующих на Т-клетки, R121E (A) и T13D/R121E

На фиг.9В представлены индивидуальные кривые "доза-ответ", показывающие антагонизм IL-4-индуцированной секреции IL-6 ЭКПВЧ и мутеинов-агонистов IL-4, избирательно действующих на Т-клетки, R121E (А) и T13D/R121E

Описание предпочтительных вариантов осуществления изобретения
А. Предпосылки
Было показано, что IL-4 опосредует множество клеточных реакций in vitro, включая различные воздействия на В-клетки, Т-клетки и моноциты, равно как и на эндотелиальные клетки (Maher DW, Davis I, Boyd AW, Morstyn G: Human interleukin-4: an immunomodulator with potential therapeutic applications. Prog. Growth Factor Res. 3:43-56, 1991; Powrie F, Coffman RL: Cutokine regulation of Т cell function: potential for therapeutic intervention. Immunol. To day 14:270-4, 1993). В частности, повышающая регуляция молекулой адгезии сосудистых клеток-1 (VCAM-1; (Swerlick RA, Lee KH, Li LJ, Sepp NT, Caughman SW, Lawley TJ: Regulation of vascular cell adhesion molecule 1 on human dermal microvascular endothelial cells. J.Immunol. 149:698-705, 1992)) и индукция IL-6 (Colotta F, Sironi M, Borre A, Luini W, Maddalena F, Mantovani A: Interleukin 4 amplifies monocyte chemotactic protein and interleukin 6 production by endothelial cells. Cytokine 4:24-8, 1992) и моноцитарного хемоаттрактантного белка-1 (МСР-1; Colotta F, Sironi M, Borre A, Luini W, Maddalena F, Mantovani A: Interleukin 4 amplifies monocyte chemotactic protein and interleukin 6 production by endothelial cells. Cytokine 4:24-8, 1992; Rollins BJ, Pober JS: Interleukin-4 induces the synthesis and secretion of MCP-1/JE by human endothelial cells. Am.J.Pathol. 138:1315-9, 1991)) являются прямыми воздействиями IL-4 на культивируемые эндотелиальные клетки; повышающая регуляция VCAM-1 коррелирует с повышенной адгезией лимфоцитов как in vitro (Carlos TM, Schwartz BR, Kovach NL, Yee E, Rosa M, Osborn L, Chi-Rosso G, Newman B, Lobb R, Rosso M, et al.: Vascular cell adhesion molecule-1 mediates lymphocyte adherence to cytokine- activated cultured human endothelial cells. Blood 76:965-70, 1990; Thornhill MH, Wellicome SM, Mahiouz DL, Lanchbury JS, Kyan-Aung U, Haskard DO: Tumor necrosis factor combines with IL-4 or IFN-gamma to selectively enhance endothelial cell adhesiveness for Т cells. The contribution of vascular cell adhesion molecule-1-dependent and -independent binding mechanisms. J. Immunol. 146:592-8, 1991), так и in vivo (Briscoe DM, Cotran RS, Pober JS: Effects of tumor necrosis factor, lipopolysaccharide, and IL-4 on the expression of vascular cell adhesion molecule-1 in vivo. Correlation with CD3+ Т cell infiltration. J. Immunol. 149:2954-60, 1992).
Мутеин IL-4 IL-4/Y124D (замена тирозина на аспарагиновую кислоту в положении 124) представляет собой Т-клеточный антагонист (Kruse N, Tony HP, Sebald W: Conversion of human interleukin-4 into a high affinity antagonist by a single amino acid replacement. Embo J. 11:3237-44, 1992). Эксперименты in vivo, проведенные авторами настоящего изобретения, продемонстрировали, что IL-4/Y124D проявляет острую токсичность, сходную с таковой IL-4 дикого типа у обезьян, ранее не описанное наблюдение. Клеточные процессы, связанные как с токсичностью IL-4 дикого типа, так и с IL-4/Y124D-опосредованной токсичностью, включают в себя повышающую регуляцию VCAM-1, повышающую регуляцию МСР-1 в сыворотке, увеличения содержания циркулирующих моноцитов совместно с сопутствующим снижением содержания циркулирующих лимфоцитов и повышения гематокрита. Сходные клеточные процессы наблюдали в клинических испытаниях с применением IL-4 на людях (Wong HL, Lotze MT, Wahl LM, Wahl SM: Administration of recombinant IL-4 to humans regulates gene expression, phenotype, and function in circulating monocytes. J. Immunol. 148:2118-25, 1992). Поскольку он является антагонистом Т-клеток, данные результаты предполагают, что токсические эффекты, демонстрируемые IL-4/Y124D, обусловлены агонистической активностью и опосредуются через клетки, отличные от Т-клеток. Наблюдаемые in vivo токсические эффекты при применении IL-4/Y124D и известное воздействие IL-4 на эндотелиальные клетки согласуются с механизмом, состоящим в том, что токсичность IL-4 in vivo опосредуется через прямые воздействия IL-4 на эндотелий сосудов.
Благодаря этим (и родственным) исследованиям авторы настоящего изобретения установили, что на эндотелиальных клетках ("ЭК") может существовать новый рецептор IL-4. Данная возможность привела к попыткам синтеза мутеинов IL-4, которые избирательно активировали бы Т-клетки, но не ЭК. Тогда как Т-клетки экспрессируют рецептор IL-4, состоящий из субъединиц IL-4Rα и IL-2Rγ, авторы настоящего изобретения установили, что эндотелиальные клетки пупочной вены человека (ЭКПВЧ) экспрессируют IL-4Rα, но не экспрессируют IL-2Rγ. Исследования с применением поперечных сшивок показали, что на клеточной поверхности ЭКПВЧ экспрессируются две рецепторные цепи: молекулярная масса одной совпадает с IL-4Rα, и вторая цепь с меньшей молекулярной массой. Данные результаты позволяют предположить, что на ЭКПВЧ экспрессируется компонент нового рецептора IL-4, сходный по функции с IL-2Rγ, но отличающийся от него по последовательности. Различия в особых молекулярных структурах между этими двумя рецепторами были использованы для создания варианта IL-4, который является избирательным по отношению к одному рецептору перед другим (например, избирательно действующим на Т-клетки агонистом).
На фиг.2 графически представлена концепция избирательных агонистов. На ней показан Т-клеточный рецептор IL-4, содержащий субъединицу IL-4Rα/IL-2Rγ и рецептор IL-4 эндотелиальных клеток, содержащий IL-4Rα/γ-подобную рецепторную субъединицу. Несмотря на то, что два рецептора IL-4 изображены здесь вместе исключительно в целях иллюстрации, они экспрессируются на различных клеточных типах. Т-клеточный рецептор состоит из IL-4Rα и IL-2Rγ; связывание IL-4 индуцирует образование гетеродимерного рецептора, которое приводит к передаче клеточного сигнала. Индуцированное IL-4 образование гетеродимерного рецептора сходным образом происходит и на ЭК за исключением того, что рецептор IL-4 состоит из IL-4Rα и γ-подобного рецепторного компонента, γ-подобный рецепторный компонент отличен от IL-2Rγ. Избирательно действующие на Т-клетки агонисты IL-4 представляют собой такие варианты IL-4, которые сохраняют свою способность взаимодействовать с Т-клеточным рецептором IL-4Rα/IL-2Rγ, но не способны индуцировать гетеродимеризацию и, таким образом, передачу сигнала IL-4Rα/γ-подобной субъединицы не-Т-клеточного рецептора. Такие избирательно действующие на Т-клетки агонисты IL-4 сохраняют свою способность взаимодействовать с IL-4Rα; их способность различать IL-2Rγ и γ-подобную субъединицу обеспечивает их свойства избирательно активировать клетки.
Два компонента Т-клеточного рецептора, IL-4Rα и IL-2Rγ, взаимодействуют с различными участками молекулы IL-4 и, таким образом, авторы настоящего изобретения сосредоточились на модификации небольшого участка IL-4. Предположив, что новая рецепторная субъединица будет взаимодействовать с тем же участком IL-4, что и IL-2Rγ, авторы настоящего изобретения произвели ряд замен в D-спирали, в частности остатков 121, 124 и 125.
D-спираль вовлечена во взаимодействия как с IL-2Rγ, так и с предполагаемым новым рецептором на ЭКПВЧ (характерно, что мутеин IL-4 R121D/Y124D является антагонистом ЭКПВЧ). Мутеины, содержащие модификации D-спирали IL-4 (остатки со 110 по 126; His=1) подвергали скринингу на предмет их способности стимулировать либо пролиферацию Т-клеток, либо секрецию IL-6 эндотелиальными клетками пупочной вены человека (ЭКПВЧ). Мутеины, которые индуцировали ответ Т-клеток, отличный от ответа ЭКПВЧ, в дальнейшем характеризовали далее с применением мутагенеза.
Исходные данные сканирования D-спирали были взяты для определения потенциальных областей взаимодействия. В дополнение к этому, были проведены сканирующие замены аланина в АВ-петле, поскольку предполагается, что данный фрагмент вовлечен во взаимодействие цитокина-лиганда и рецепторной субъединицы, взаимодействующей с D-спиралью. В частности, экспонированные на поверхности остатки Glu-110, Asn-111, Glu-114, Arg-115, Lys-117, Thr-118, Arg-121, Glu-122, Туг-124, Ser-125 и Lys-126 были выбраны целью исследования и являются предпочтительными мишенями для мутационного анализа. Более предпочтительными являются сайты 118-126, а сайты 121-125 являются наиболее предпочтительными. Сравнения между IL-2, IL-4, IL-7 и IL-15 в данном фрагменте также выявляют различия между IL-4 и IL-2, IL-7 и IL-15, что, возможно, предполагает существование особых остатков, ответственных за взаимодействие с рецептором ЭКПВЧ. Специфичные замены, взятые из выравнивания, проведенного между IL-2 и IL-4, вносили в IL-4. Они включали в себя: Arg-115 на Phe; Lys-117 на Asn; Glu-122 на Phe; Lys-126 на Ilе; и три одновременные замены Arg-121 на Thr, Glu-122 на Phe и Туг-124 на Gln.
Мутации вносили, применяя сайтнаправленный мутагенез на кДНК человеческого IL-4 дикого типа. Подходящие клоны субклонировали в экспрессирующий вектор, подходящий для экспрессии в гетерологичной системе (например, Е. соli, бакуловирусе или клетках СНО). Очищенные белки тестировали в анализах пролиферации Т-клеток и секреции цитокинов ЭКПВЧ (IL-6). Различные ответы, вызванные отдельными мутеинами, полученные в данных анализах, либо в ЭК50, либо в максимальном ответе (плато), указывают мутации, которые влияют на данные активности. Конкретно, мутеины, которые стимулируют относительно более сильный ответ в Т-клеточном анализе (против IL-4 дикого типа) по сравнению с ответом ЭКПВЧ (против IL-4 дикого типа), вероятно предполагают наличие положений, которые более важны для взаимодействия IL-4 с IL-2Rγ, чем для взаимодействия IL-4 с новым рецептором IL-4 ЭКПВЧ. Дальнейший анализ и мутагенез (например, комбинаторные замены, замены всеми аминокислотами) определенных положений даст возможность получить мутеин IL-4, обладающий свойствами избирательного агониста по отношению к Т-клеточному рецептору IL-4. Данный белок также будет являться избирательным антагонистом IL-4-индуцированных реакций ЭКПВЧ.
Б. Определения
Здесь описаны новые мутеины и механизм получения новых мутеинов IL-4, обладающих свойствами избирательно действующих на Т-клетки агонистов и пониженной токсичностью. Сходная стратегия может быть применена для идентификации избирательно действующих на Т-клетки антагонистов.
Термин "IL-4 дикого типа" означает здесь IL-4, нативный или рекомбинантный, содержащий последовательность из 129 обычно встречающихся аминокислот нативного человеческого IL-4, состоящей, как показано, например, на фиг.1.
Термин "мутеин IL-4" означает здесь полипептид, полученный в результате того, что в человеческом зрелом белке интерлейкине-4 произведены особые замены.
В частности, как здесь описано, остаток аргинина (R) в положении 121 ("Arg-121"), пронумерованный в соответствии с IL-4 дикого типа, заменен аланином (А), аспартатом (D), глютаматом (Е), фенилаланином (F), гистидином (Н), изолейцином (I), лизином (К), аспарагином (N), пролином (Р), треонином (Т) или триптофаном (W); или остаток глютамата (Е) в положении 122 замещен фенилаланином (F); или остаток тирозина в положении 124 замещен аланином (А), глютамином (Q), аргинином (R), серином (S) или треонином (Т); или остаток серина (S) в положении 125 замещен аланином (А). Наиболее предпочитаемые авторами настоящего изобретения мутеины IL-4 обладают аминокислотной последовательностью, идентичной IL-4 дикого типа по остальным, незамещенным остаткам. Однако мутеины IL-4 этого изобретения также могут быть охарактеризованы вставками, делениями, заменами и модификациями аминокислот в одном или нескольких сайтах в других остатках полипептидной цепи нативного IL-4. В соответствии с данным изобретением любые такие вставки, делеции, замены и модификации приводят к образованию мутеина IL-4, который сохраняет избирательную активность по отношению к Т-клеткам, в то же время обладая пониженной способностью активировать эндотелиальные клетки.
Авторы настоящего изобретения предпочитают консервативные модификации и замены в других положениях IL-4 (т.е. в тех, которые обладают минимальным воздействием на вторичную и третичную структуру мутеина). Такие консервативные замены включают в себя таковые, описанные Dayhoff в The Atlas of Protein Sequence and Structure 5 (1978) и Argos в ЕМВО J., 8:779-785 (1989). Например, аминокислоты, относящиеся к одной из следующих групп, представляют собой консервативные замены:
- ala, pro, gly, gln, asn, ser, thr;
- cys, ser, tyr, thr;
- val, ile, leu, met, ala, phe;
- lys, arg, his;
- phe, tyr, trp, his; и
- asp, glu.
Авторы настоящего изобретения также предпочитают модификации или замены, которые не вносят сайтов дополнительных межмолекулярных сшивок или неправильного образования дисульфидных связей. Например, известно, что IL-4 содержит шесть остатков cys, в положениях 3, 24, 46, 65, 99 и 127 белка дикого типа.
Под термином "пронумерованный в соответствии с IL-4 дикого типа" авторы настоящего изобретения подразумевают идентификацию выбранной аминокислоты относительно положения, в котором данная аминокислота в норме находится в IL-4 дикого типа. Если в мутеине IL-4 произведены вставки или делеции, для специалиста в данной области представится ценным тот факт, что ser (S), в норме находящийся в положении 125 при нумерации в соответствии с IL-4 дикого типа, может быть смещен в положении в мутеине. Однако локализация смещенного ser (S) может быть с легкостью определена путем проверки и корреляции фланкирующих аминокислот с таковыми, фланкирующими ser в IL-4 дикого типа.
Мутеины IL-4 настоящего изобретения могут быть получены с помощью любого подходящего метода, известного в данной области. Такие методы включают в себя конструирование последовательности ДНК, кодирующей мутеины IL-4 данного изобретения, и экспрессирование данных последовательностей в подходящем трансформированном хозяине. Данный метод позволит получить рекомбинантные мутеины по данному изобретению. Однако мутеины по данному изобретению также могут быть получены, хотя и менее предпочтительно, с помощью химического синтеза или технологии рекомбинантных ДНК.
В одном из вариантов осуществления рекомбинантного метода получения мутеина данного изобретения последовательность ДНК конструируют путем выделения или синтеза последовательности ДНК, кодирующей IL-4 дикого типа, с последующей заменой кодона, кодирующего arg121, на кодон, кодирующий аланин (А), аспартат (D), глютамат (Е), фенилаланин (F), гистидин (Н), изолейцин (I), лизин (К), аспарагин (N), пролин (Р), треонин (Т) или триптофан (W) с помощью сайтспецифического мутагенеза. Данная методика хорошо известна. Смотри, например, Mark et al., "Site-specific Mutagenesis of the Human Fibroblast Interferon Gene", Proc. Natl. Acad. Sci. USA 81, pp.5662-66 (1984); патент Соединенных Штатов 4588585, включенные сюда в качестве ссылки.
Другой способ конструирования последовательности ДНК, кодирующей мутеины IL-4 по данному изобретению, представляет собой химический синтез. Например, ген, который кодирует желаемый мутеин IL-4, может быть синтезирован химическим путем с использованием синтезатора олигонуклеотидов. Такие олигонуклеотиды обозначаются на основе аминокислотной последовательности желаемого мутеина IL-4 и, предпочтительно, выбирая те кодоны, которые являются предпочтительными в клетке-хозяине, в которой будет продуцироваться рекомбинантный мутеин. Широко известно, что генетический код является вырожденным - что аминокислота может кодироваться несколькими кодонами. Например, phe (F) кодируется двумя кодонами, ТТС или ТТТ, tyr (Y) кодируется ТАС или TAT, a his (Н) кодируется САС или CAT. Trp (W) кодируется единственным кодоном, TGG. Соответственно ценным представляется то, что для данной последовательности ДНК, кодирующей конкретный мутеин IL-4, будет множество вырожденных последовательностей ДНК, которые будут кодировать данный мутеин IL-4. Например, ценным представляется то, что в дополнение к предпочтительной последовательности ДНК, кодирующей мутеин R121E, показанной в ПОСЛ, ИД. №:3, будет множество вырожденных последовательностей ДНК, которые кодируют показанный мутеин IL-4. Данные вырожденные последовательности ДНК рассматриваются в сфере данного изобретения. Таким образом, термин "его вырожденные варианты" в контексте данного изобретения означает все последовательности ДНК, которые кодируют конкретный мутеин.
Последовательность ДНК, кодирующая мутеин IL-4 по данному изобретению, полученная с помощью сайтспецифического мутагенеза, синтеза или других методов, может также включать или не включать последовательности ДНК, которые кодируют сигнальную последовательность. Такая сигнальная последовательность при наличии должна представлять собой последовательность, распознаваемую клеткой, выбранной для экспрессии мутеина IL-4. Она может являться прокариотической, эукариотической или представлять собой их комбинацию. Она также может представлять собой сигнальную последовательность нативного IL-4. Включение сигнальной последовательности зависит от того, является ли желаемой секреция мутеина IL-4 рекомбинантными клетками, в которых он продуцируется. Если выбранные клетки являются прокариотическими, как правило, предпочтительным является, чтобы последовательность ДНК не кодировала сигнальную последовательность. Если выбранные клетки являются эукариотическими, как правило, предпочтительным является, чтобы сигнальная последовательность кодировалась, и наиболее предпочтительно, чтобы использовалась сигнальная последовательность IL-4 дикого типа.
Для синтеза гена, кодирующего мутеин IL-4 по данному изобретению, могут быть применены стандартные методики. Например, для конструирования обратно-транслируемого гена может быть применена полная аминокислотная последовательность. Может быть синтезирован олигомер ДНК, содержащий нуклеотидную последовательность, кодирующую мутеин IL-4. Например, несколько небольших олигонуклеотидов, кодирующих части желаемого полипептида, могут быть синтезированы и затем лигированы. Отдельные олигонуклеотиды обычно содержат 5’- или 3’-концевые избыточности для комплементарной сборки.
Собранные (с помощью синтеза, сайтспецифичного мутагенеза или другого метода) последовательности ДНК, кодирующие мутеин IL-4 по данному изобретению, будут вставлены в экспрессирующий вектор и оперативно пришиты к контролирующей экспрессию последовательности, подходящей для экспрессии мутеина IL-4 в желаемом трансформированном хозяине. Правильность сборки может быть подтверждена с помощью секвенирования нуклеиновой кислоты, рестрикционного картирования и экспрессии биологически активного полипептида в подходящем хозяине. Как хорошо известно в данной области, в целях достижения высоких уровней экспрессии внесенного по методу трансфекции гена в хозяине ген должен быть оперативно сшит с транскрипционными и трансляционными контролирующими экспрессию последовательностями, которые функционируют в выбранном экспрессирующем хозяине.
Выбор контролирующей экспрессию последовательности и экспрессирующего вектора будет зависеть от выбора хозяина. Может быть применен широкий спектр комбинаций хозяин/вектор. Применимые экспрессирующие векторы для эукариотических хозяев включают в себя, например, векторы, содержащие контролирующие экспрессию последовательности из SV40, вируса папилломы крупного рогатого скота, аденовируса и цитомегаловируса. Применимые экспрессирующие векторы для бактериальных хозяев включают в себя известные бактериальные плазмиды, такие как плазмиды из Е. coli, включая col El, pCRl, pER32z, pMB9 и их производные, плазмиды из более широкого спектра хозяев, такие как RP4, фаговые ДНК, например многочисленные производные фага лямбда, например NM989, и другие ДНК-содержащие фаги, такие как М13, и нитчатые фаги, содержащие одноцепочечную ДНК. Применимые экспрессирующие векторы для дрожжевых клеток включают в себя плазмиду 2μ . и ее производные. Применимые векторы для клеток насекомых включают в себя pVL941. Авторы настоящего изобретения предпочитают pFastBacТМ1 (GibcoBRL, Gaithersburg, MD). Cate et al., "Isolation of the Bovine and Human Genes for Mullerian Inhibiting Substance and Expression of the Human Gene in Animal Cells", Cell, 45, pp.685-98 (1986).
В дополнение к этому, в данных векторах может быть применена любая из большого многообразия контролирующих экспрессию последовательностей. Такие применимые контролирующие экспрессию последовательности включают в себя контролирующие экспрессию последовательности, ассоциированные со структурными генами указанных выше экспрессирующих векторов. Примеры применимых контролирующих экспрессию последовательностей включают в себя, например, ранние и поздние промоторы SV40 или аденовируса, lac-систему, trp-систему, ТАС- или TRC-систему, главные операторные и промоторные участки фага лямбда, например PL, регулярные участки белка оболочки fd, промотор 3-фосфоглицераткиназы или других гликолитических ферментов, промоторы кислой фосфатазы, например PhoA, промоторы системы α-спаривания дрожжей, полиэдрон промотор бакуловируса и другие последовательности, контролирующие экспрессию генов прокариотических и эукариотических клеток или их вирусов, и различные их комбинации.
Для продукции мутеинов IL-4 по данному изобретению может быть применен любой подходящий хозяин, включая бактерии, грибы (включая дрожжевые), растение, насекомое, млекопитающее, или другие подходящие животные клетки или клеточные линии, равно как и трансгенные животные или растения. Более конкретно, данные хозяева могут включать в себя хорошо известные эукариотические и прокариотические хозяева, такие как штаммы Е. coli, Pseudomonas, Bacillus, Streptomyces, клетки грибов, дрожжей, насекомых, таких как Spodoptera frugiperda (Sf9), животные клетки, такие как яйцеклетки китайского хомячка (СНО), и мышиные клетки, такие как NS/O, клетки африканской зеленой мартышки, такие как COS 1, COS 7, BSC 1, BSC 40 и BNT 10, и человеческие клетки, равно как и растительные клетки в культуре клеток ткани. Для экспрессии в животных клетках авторы настоящего изобретения предпочитают применять клетки СНО и клетки COS 7 в культурах и в особенности СНО-клеточную линию СНО (D HFR-).
Разумеется, следует понимать, что не все векторы и контролирующие экспрессию последовательности будут функционировать одинаково эффективно в экспрессии последовательностей ДНК, описанных здесь. Также не все хозяева будут функционировать одинаково эффективно с одной и той же экспрессирующей системой. Однако специалист в данной области способен сделать выбор между данными векторами, контролирующих экспрессию последовательностей и хозяев без проведения излишней экспериментальной работы. Например, при выборе вектора должен приниматься во внимание фактор хозяина, поскольку вектору предстоит в нем реплицироваться. Также следует принимать во внимание факторы количества копий вектора, возможность контроля за данным количеством копий и экспрессии каких-либо других белков, кодируемых вектором, таких как маркеров антибиотиков. Например, предпочтительные векторы для применения по данному изобретению включают таковые, которые позволяют ДНК, кодирующей мутеины IL-4, быть амплифицированной в количестве копий. Такие многокопийные векторы хорошо известны в данной области. Они включают, например, векторы, способные амплифицироваться посредством DHFR амплификации (смотри, например, Kaufman, патент Соединенных Штатов 4470461, Kaufman and Sharp, "Construction of a Modular Dihydrofolate Reductase cDNA Gene: Analysis of Signals Utilized for Efficient Expression", Mol. Cell. Biol., 2, pp.1304-19 (1982)) или глютаминсинтетазной ("GS") амплификации (смотри, например, патент Соединенных Штатов 5122464 и Европейская опубликованная заявка 338841).
При выборе контролирующей экспрессию последовательности также следует учитывать множество факторов. Они включают в себя, например, относительную длину последовательности, ее контролируемость и ее совместимость с подлинной последовательностью ДНК, кодирующей мутеины IL-4 по данному изобретению, особенно, что касается потенциальных вторичных структур. Хозяев следует выбирать, учитывая их совместимость с выбранным вектором, токсичность продукта, кодируемого последовательностями ДНК по данному изобретению, их характеристики секреции, их способность правильно сворачивать полипептиды, требования к их ферментации или культивированию и простоту очистки продуктов, кодируемых последовательностями ДНК.
В пределах данных параметров специалист может избрать различные комбинации вектор/контролирующая экспрессию последовательность/хозяин, которые будут экспрессировать желаемые последовательности ДНК в процессе ферментации либо в ходе широкомасштабного культивирования животных клеток, например, применяя клетки СНО или клетки COS 7.
Мутеины IL-4, полученные в соответствии с настоящим изобретением, могут быть гликозилированными либо негликозилированными в зависимости от организма-хозяина, применяемого для продукции мутеина. Если в качестве хозяина выбраны бактерии, продуцируемый мутеин IL-4 будет негликозилированным. С другой стороны, эукариотические клетки будут гликозилировать мутеины IL-4, хотя, возможно, не таким же образом, как гликозилируется нативный IL-4.
Мутеин IL-4, продуцируемый трансформированным хозяином, может быть очищен в соответствии с любой подходящей методикой. Для очистки IL-4 известны различные методики. Смотри, например, патенты Соединенных Штатов 5013824; 5017691; и международную заявку на патент WO 9604306-A2. Авторы настоящего изобретения предпочитают применять иммуноафинную очистку. Смотри, например, Okamura et al., "Human Fibroblastoid Interferon: Immunosorbent Column Chromatography and N-Terminal Amino Acid Sequence", Biochem., 19, pp.3831-35 (1980).
Биологическая активность мутеинов IL-4 по данному изобретению может быть проанализирована с помощью любой подходящей методики, известной в данной области. Такие анализы включают в себя антительную нейтрализацию противовирусной активности, индукцию протеинкиназной, олигоаденилат-2,5-А-синтетазной или фосфодиэстеразной активностей, как описано в европейской заявке на патент ЕР-В1-41313. Такие анализы также включают в себя иммуномодуляторные анализы (смотри, например, патент Соединенных Штатов 4753795), анализы подавления роста, пролиферации Т-клеток, индукции IL-6 (МСР-1 или VCAM-1), ЭК и определение связывания с клетками, которые экспрессируют рецепторы интерлейкина-4. Смотри также Spits Н., Yssel Н., Takebe Y., et al., Recombinant Interleukin-4 Promotes the Growth of Human Т Cells, J.Immunol. 139:1142-47 (1987).
Мутеин IL-4 настоящего изобретения будет вводиться в дозировках, соответствующих либо превышающих таковые, применяемые в лечении нативным дикого типа IL-4 или рекомбинантным IL-4. Предпочтительно вводят эффективное количество мутеина IL-4. Термин "эффективное количество" означает количество, способное предотвратить либо уменьшить тяжесть или развитие состояния или симптома, подвергающегося лечению. Для специалиста в данной области будет очевидно, что эффективное количество мутеина IL-4 будет зависеть помимо прочего от заболевания, дозировки, схемы введения мутеина IL-4, от того, вводят ли мутеин IL-4 отдельно или в сочетании с другими лекарственными средствами, от времени полужизни композиции в сыворотке и общего состояния здоровья пациента.
Мутеин IL-4 предпочтительно вводят в композицию, включающую в себя фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" означает носитель, который не вызывает каких-либо неблагоприятных эффектов у пациентов, которым его вводят. Такие фармацевтически приемлемые носители хорошо известны в данной области. Авторы настоящего изобретения предпочитают применять 2% HSA/ФБР при рН 7,0.
Мутеины IL-4 по настоящему изобретению могут быть включены в состав фармацевтических композиций в соответствии с хорошо известными методиками. Смотри, например, подходящие составы описаны в Remington’s Pharmaceutical Science E.W. Martin, включенным сюда в качестве ссылки. Фармацевтическая композиция мутеина IL-4 может быть составлена в виде множества форм, включая жидкую, гелеобразную, лиофилизированную или любую другую подходящую форму. Предпочтительная форма будет зависеть от конкретного симптома, подвергающегося лечению, и будет очевидна для специалиста в данной области.
Фармацевтическая композиция мутеина IL-4 может быть введена перорально в виде аэрозоля внутривенно, внутримышечно, внутрибрюшинно, внутрикожно, или подкожно, или любым другим приемлемым образом. Предпочтительный способ введения будет зависеть от конкретного симптома, подвергающегося лечению, и будет очевиден для специалиста в данной области. Фармацевтическая композиция мутеина IL-4 может быть введена в сочетании с другими лекарственными средствами. Данные средства могут быть включены в виде части той же самой фармацевтической композиции или могут быть введены отдельно от мутеина IL-4 либо одновременно, либо в соответствии с любой другой приемлемой схемой лечения. К тому же, фармацевтическая композиция мутеина IL-4 может быть применена в качестве дополнения к другим курсам лечения.
Соответственно данное изобретение предлагает композиции и способы лечения иммунных заболеваний, разновидностей рака или опухолей, аномального клеточного роста или иммуномодуляции у любого подходящего животного, предпочтительно млекопитающего, наиболее предпочтительно человека. Как указано выше в разделе "Предпосылки", IL-4 обладает множеством эффектов. Некоторые из них представляют собой стимуляцию пролиферации Т-клеток, дифференцировки Т-хелперных клеток, индукцию активации и пролиферации человеческих В-клеток и лимфокиннаправленное переключение классов иммуноглобулина. Эффекты, оказываемые на лимфоидную систему, включают увеличение уровня экспрессии антигена МНС II класса (Noelle, R., et al., Increased Expression of la Antigens on Resting В Cells: a New Role for В Cell Growth Factor, PNAS USA, 81:6149-53 (1984)) и CD23 на В-клетках (Kikutani, H., et al., Molecular Structure of Human Lymphocyte Receptor for Immunoglobulin, Cell 47:657-61 (1986)). Т-хелперные клетки 1 типа (Th1) и 2 типа (Th2) вовлечены в иммунный ответ. Активированные клетки Th2 секретируют IL-4 и блокируют прогрессию Th1. Таким образом, любое Th1-опосредованное заболевание поддается лечению IL-4 или его аналогами.
Также рассматривается применение последовательностей ДНК, кодирующих мутеины IL-4 по данному изобретению, в геннотерапевтических приложениях. Рассматриваемые генотерапевтические приложения включают лечение таких заболеваний, при которых ожидается, что IL-4 обеспечит эффективное лечение благодаря своей иммуномодуляторной активности, например, рассеянного склероза (PC), инсулинзависимого сахарного диабета (ИЗСД), ревматоидного артрита (РА), системной красной волчанки (СКВ), увеита, орхита, первичного билиарного цирроза печени, малярии, лепры, болезни Lyme, контактного дерматита, псориаза, В-клеточной лимфомы, острого лимфобластного лейкоза, неходжкинской лимфомы, злокачественных опухолей, остеоартрита и заболеваний, которые так или иначе чувствительны к IL-4, или инфекционных агентов, чувствительных к IL-4-опосредованному иммунному ответу.
Местная доставка мутеинов IL-4 с применением генной терапии может обеспечить наличие лекарственного средства в области-мишени. Рассматриваются методики генной терапии как in vitro, так и in vivo. Известно несколько способов переноса потенциально лекарственных генов в определенные клеточные популяции. Смотри, например, Mulligan, "The Basic Science of Gene Therapy", Science, 260:926-31 (1993). Данные способы включают:
1) Прямой перенос генов. Смотри, например, Wolff et al., "Direct Gene Transfer into Mouse Muscle In Vivo", Science, 247:1465-68 (1990).
2) Перенос ДНК с применением липосом. Смотри, например, Caplen et al., "Liposome-mediated CFTR Gene Transfer to the Nasal Epithelium of Patients with Cystic Fibrosis", Nature Med., 3:39-46 (1995); Crystal, "The Gene As a Drug", Nature Med., 1:15-17 (1995); Gao and Huang, "A Novel Cationic Liposome Reagent for Efficient Transfection of Mammalian Cells", Biochem. Biophys. Res. Comm., 179:280-85 (1991).
3) Перенос ДНК с применением ретровирусов. Смотри, например, Кау et al., "In Vivo Gene Therapy of Hemophilia В: Sustained Partial Correction in Factor IX-Deficient Dogs", Science, 262:117-19 (1993); Andersen, "Human Gene Therapy", Science, 256:808-13 (1992).
4) Перенос ДНК с применением ДНК-содержащих вирусов. Такие ДНК-содержащие вирусы включают аденовирусы (предпочтительно векторы на основе Ad-2 или Ad-5), вирусы герпеса (предпочтительно векторы на основе вируса простого герпеса) и парвовирусы (предпочтительно векторы на основе не способного воспроизводиться без вируса-помощника или неавтономного парвовируса, более предпочтительно векторы на основе аденоассоциированного вируса, наиболее предпочтительно векторы на основе AAV-2). Смотри, например, Аli et al., "The Use of DNA Viruses As Vectors for Gene Therapy", Gene Therapy, 1:367-84 (1994); патенты Соединенных Штатов 4797368, 5139941.
Выбор конкретной векторной системы для переноса интересующего гена будет зависеть от множества факторов. Одним важным фактором является природа популяции клеток-мишеней. Хотя ретровирусные векторы были тщательно изучены и применены в ряде генотерапевтических приложений, данные векторы, как правило, не применимы для инфицирования неделящихся клеток. В дополнение к этому, ретровирусы обладают потенциальной онкогенностью.
Аденовирусы имеют то преимущество, что они обладают широким спектром хозяев, могут инфицировать покоящиеся или окончательно дифференцированные клетки, такие нейроны или гепатоциты, и являются, по существу, неонкогенными. Смотри, например, Ali et al., supra, p.367. Аденовирусы не интегрируются в геном хозяина. Поскольку они находятся вне хромосом, риск инсерционного мутагенеза резко снижен. Ali et al., supra, p.373.
Аденоассоциированные вирусы проявляют преимущества, аналогичные таковым векторам на основе аденовирусов. Однако AAV проявляют сайтспецифичную интеграцию в человеческую хромосому 19. Ali et al., supra, p.377.
В предпочтительном осуществлении ДНК, кодирующую мутеины IL-4, по данному изобретению применяют в генной терапии аутоиммунных заболеваний, таких как PC, ИЗСД и РА, инфекционных заболеваний, таких как болезнь Lyme и лепра, злокачественных опухолей, таких как неходжкинская лимфома и ОЛЛ, заболевания хрящевой ткани, такие как остеоартрит, и псориатические состояния, такие как псориаз.
Генную терапию ДНК, кодирующей мутеины IL-4 по данному изобретению, применяют к пациенту, нуждающемуся в ней, одновременно с или непосредственно после постановки диагноза.
В данном подходе используется избирательная активность мутеинов IL-4 по данному изобретению для предупреждения нежелательной аутоиммунной стимуляции. Для специалиста в данной области ценным представляется то, что любой подходящий для генной терапии вектор, содержащий ДНК, кодирующую мутеин IL-4, может быть применен в соответствии с данным осуществлением. Известны методики конструирования такого вектора. Смотри, например, Ohno et al., supra, p.784; Chang et al., supra, p.522. Введение вектора, содержащего ДНК, кодирующую мутеин IL-4, в сайт-мишень может быть проведено с применением известных методик, например, как описано в Ohno et al., supra, p.784.
Следующие примеры изложены в целях лучшего понимания данного изобретения. Данные примеры предназначены исключительно для иллюстрации и не должны быть истолкованы как ограничивающие каким-либо образом сферу изобретения.
Примеры
В целом.
Ниже показана аминокислотная последовательность зрелого человеческого IL-4, применяемого в данном исследовании. Аминокислоты, при заменах которых получали агонисты, избирательно действующие на Т-клетки, указаны жирным шрифтом:
Мутеины экспрессируют в бакуловирусной системе, очищенной до гомогенности, и исследуют в биологических анализах, которые отражают различные применения рецептора IL-4. Для тестирования на предмет активности избирательно действующего агониста используют два анализа, анализ IL-4-индуцированной секреции IL-6 ЭКПВЧ и анализ пролиферации 1°Т-клеток на предмет положительной активности IL-4. Соединения, которые обладают способностью индуцировать пролиферацию 1°Т-клеток, при этом обладая пониженной способностью индуцировать секрецию IL-6, являются агонистами IL-4, избирательно действующими на Т-клетки, и входят в сферу данного изобретения. Более конкретно, для оценки активности посредством альтернативного рецептора IL-4 (IL-4α /γ-подобного рецепторного компонента) используют эндотелиальные клетки пупочной вены человека (ЭКПВЧ).
Пример 1. Продукция мутеинов
Мутеины получают с помощью сайтспецифичного мутагенеза с применением праймеров, содержащих кодоны, соответствующие желаемой мутации, по существу, так, как описано Kunkel ТА, Roberts JD, and Zakour RA, "Rapid and efficient site-specific mutagenesis without phenotypic selection" (1987), Methods Enzymol. 154:367-382. Вкратце, кДНК человеческого IL-4, содержащую сайты рестрикции Bam HI и Хbа I, субклонируют в вектор М13 mр19 фага М13 (New England Biolabs, Beverly, MA), применяя те же сайты. кДНК IL-4 дикого типа получали, применяя полимеразную цепную реакцию (ПЦР, "PCR") с пула кДНК, полученного с мРНК, выделенной из лимфоцитов периферической крови человека, индуцированных в течение 24 часов форбол-12-миристат-13-ацетатом (10 нг/мл). Примененные праймеры ПЦР представляют собой для 5'- конца открытой рамки считывания IL-4
5’-CGC GGA TCC ATG GGT СТС АСС ТСС –3’ (ПОСЛ. ИД. №:22);
и для 3’- конца открытой рамки считывания IL-4
5’-CGC TCT AGA СТА GCT CGA АСА СТТ TGA АТ–3’ (ПОСЛ. ИД. №:23).
Сайты рестрикции Bam HI (5’- конец) и Хbа I (3’- конец) включают в каждый олигонуклеотид и обозначают курсивом. Примененные условия ПЦР представляют собой 1 минуту при 94°С, 1 минуту при 58,7°С и 1 минуту при 72°С в течение 25 циклов. Правильность полученной таким образом последовательности кДНК IL-4 подтверждают с помощью секвенирования с применением набора для секвенирования Sequenase® (Amersham Life Sciences, Arlington Heights, IL), как описано производителем. Урацилсодержащую одноцепочечную ДНК (U-ДНК) получают путем трансформации штамма Е. coli CJ236 (Bio-Rad Laboratories, Hercules, CA) M13 mpl9, содержащим кДНК IL-4. В сайтспецифичном мутагенезе главным образом применяются праймеры, содержащие 15 нуклеотидов, гомологичных матричной U-ДНК, расположен ной на 5’-конце от кодона(ов), подвергающихся мутагенезу, нуклеотиды, которые заключают в себе желаемую замену, и дополнительные 10 нуклеотидов, гомологичных матричной U-ДНК, расположенной на 3’-конце от последнего заменяемого нуклеотида. Примененные специфичные праймеры представляют собой:


Подчеркнуты участки мутированных нуклеотидов. Праймеры фосфорилируют, применяя полинуклеотидкиназу Т4 (New England Biolabs, Beverly, MA), используя протокол производителя. После гибридизации праймера с U-ДНК матрицей и удлинения цепи с помощью ДНК-полимеразы Т7 (Bio-Rad Laboratories, Hercules, CA) клетки Е. coli штамма DH5αТМ (GibcoBRL, Gaithersburg, MD) трансформируют 5 мкл реакционной смеси и высевают на планшет со средой LB, содержащей 0,7% агара. После инкубации при 37°С бляшки размножают путем взятия одной бляшки и переноса в 2 мл среды LB и культивируют в течение ночи при 37°С. Одноцепочечную ДНК выделяют, применяя набор для очистки М13 (Qiagen, Inc., Chatsworth, CA) в соответствии с протоколом производителя, и клоны, содержащие желаемую мутацию, идентифицируют путем секвенирования одноцепочечной ДНК, применяя набор для секвенирования Sequenase® (Amersham Life Sciences, Arlington Heights, IL) в соответствии с протоколом производителя. кДНК мутеина IL-4 с репликативной формой ДНК, соответствующей бляшкам, содержащим надлежащим образом мутировавшую последовательность, выделяют, применяя Bam HI и Хbа I, и субклонируют в плазмидный вектор pFastBacTM1 (GibcoBRL, Gaithersburg, MD). По завершении субклонирования получают рекомбинантную бакуловирусную ДНК (на которую здесь далее ссылаются как на Bacmid) путем трансформации pFastBacTM1, содержащим кДНК мутеина, штамма DHl0BacTMЕ. coli (GibcoBRL, Gaithersburg, MD), как описано производителем. Мутеины экспрессируют в Spodoptera frugiperda (Sf) 9 с применением бакуловирусной экспрессирующей системы Bac-to-Bac (GibcoBRL, Gaithersburg, MD). Все инкубации клеток насекомых проводят при 28С. Вкратце, объемы культур клеток Sf9 по 2 мл трансфицируют 5 мкл рекомбинантной Bacmid, применяя CellFECTIN (GibcoBRL, Gaithersburg, MD). Через 60 часов после трансфекции супернатант собирают и применяют для инфицирования 100-200 мл культуры 1×106 клеток Sf9/мл в среде Grace (GibcoBRL, Gaithersburg, MD). В соответствии с протоколом производителя через 48-60 ч после инфицирования супернатанты собирают путем центрифугирования при 5000 об/мин в течение 10 минут в центрифуге Sorvall® RC-5B. применяя ротор GSA (Dupont Instrument Co., Willmington, DE), и анализируют титр вируса (как правило, получают бляшкообразующее число 1×108/мл). В целях продукции белка 2-3×106 клеток Sf9/мл в 500 мл среды SF900 II (GibcoBRL, Gaithersburg, MD) инфицируют с множественностью заражения от 4 до 10 и через 60-72 ч после инфицирования супернатант собирают путем центрифугирования при 5000 об/мин в течение 10 минут в центрифуге Sorvall® RC-5B, применяя ротор GSA (Dupont Instrument Co., Willmington, DE), и фильтруют через стерильный фильтр с толщиной ячейки 0,2 мкм.
Пример 2. Очистка мутеинов
Моноклональные антитела С400.1 и С400.17 против человеческого IL-4 нарабатывают в организме мышей с применением стандартных протоколов с использованием в качестве иммуногена рекомбинантного человеческого IL-4 (Genzyme Diagnostics, Cambridge, МА), продуцируют в составе асцитической жидкости, подвергают очистке и присоединяют к CNBr-активированной сефарозе (Pharmacia, Uppsala, Sweden) в соответствии с протоколом производителя. Супернатанты клеток Sf9, полученные в результате инфицирования клеток Sf9 рекомбинантным бакуловирусом, содержащие соответствующий мутеин IL-4, наносят на 1 мл колонку афинного к IL-4 носителя, промывают 100 мМ NaHCO3, 500 мМ NaCl, pH 8,3, для удаления соли промывают водой и элюируют 8 объемами колонки 100 мМ глицина, pH 3,0. Фракции собирают в силиконизированные сосуды, содержащие 0,1 объема 1 М Триса, pH 8,0. Белок-мутеин далее очищают по методу обращенно-фазовой хроматографии, применяя колонку С18 Dynamax®-300

Пример 3. Анализ пролиферации 1°Т-клеток
Первичные Т-клетки получают из свежей крови здоровых доноров и очищают путем центрифугирования с применением Ficoll-Paque® Plus (Pharmacia, Uppsala, Sweden), по существу, как описано в Kruse, N., Tony, H.P. and Sebald, W. "Conversion of human interleukin-4 into a high affinity antagonist by a single amino acid replacement", Embo J. 11:3237-44 (1992). Очищенные мононуклеарные клетки периферической крови инкубируют в течение 7 суток с 10 мкг/мл фитогемагглютинина (Sigma Chemical Co., St. Louis, МО), собирают с помощью центрифугирования и промывают в среде RPMI 1640 (GibcoBRL, Gaithersburg, MD). 5×104 активированных Т-клеток/лунка (ФГА-бластов) инкубируют с варьирующими количествами IL-4 или мутеина в среде RPMI 1640, содержащей 10 околоплодной коровьей сыворотки, 10 мМ HEPES, рН 7,5, 2 мМ L-глютамин, 100 единиц/мл пенициллина G и 100 мкг/мл стрептомицина сульфата, в 96-луночных планшетах в течение 72 ч при 37°С, метят 1 мкКи3 H-тимидина (DuPont NEN®, Boston, МА)/лунка в течение 6 часов, собирают и радиоактивность измеряют с помощью сцинтилляционного счетчика TopCounTM (Packard Instrument Co., Meriden, CT).
Пример 4. Анализ секреции IL-6 ЭКПВЧ
Эндотелиальные клетки пупочной вены человека (ЭКПВЧ) получают от Clonetics® Corp. (San Diego, CA) и поддерживают в соответствии с протоколами поставщика. Клетки (3-6 пассаж) собирают путем инкубации с трипсином/ЭДТА, промывают и высевают с субнепрерывными плотностями посева на 48-луночные планшеты в среду EGM® (Clonetics® Corp., San Diego, CA), содержащую экстракт бычьего мозга (ЭБМ; Clonetics® Corp., San Diego, CA). По достижении непрерывности (3-4 суток при 37°С) среду удаляют и заменяют EGM® без ЭБМ. Через 24 часа к клеткам в свежей EGM® без ЭБМ добавляют варьирующие концентрации IL-4 или мутеина и оставляют инкубироваться в течение еще 24 ч. Супернатанты собирают и концентрацию IL-6 анализируют, применяя ELISA человеческого IL-6. Условия идентичны за исключением анализов антагонистов, варьирующие концентрации мутеина добавляют к постоянной концентрации IL-4 в 100 пМ. Вкратце, 96-луночные планшеты Immunolon® 2 (Dynatech Laboratories, Inc., Chantilly, VA) покрывают 5 мкг/мл MAT против человеческого IL-6 Cat#1618-01 (Genzyme Diagnostics, Cambridge, MA) в течение ночи при 4°С. Стандарт человеческого IL-6 (Genzyme Diagnostics, Cambridge, MA) или образцы титруют в двух экземплярах и инкубируют с покрытым планшетом; после промывок добавляют вторичные кроличьи ПАТ против человеческого IL-6 (Caltag Laboratories, South San Francisco, CA, Cat#PS-37) в разведении 1:1000. Наличие связанных кроличьих aнти-IL-6 ПАТ определяют, применяя ослиные ПАТ против кроличьего Ig, сшитые с щелочной фосфатазой (Jackson ImmunoResearch Laboratories, Inc., West Grove, PA, Cat#711-055-152) в разведении 1:2000, и проявляют, применяя pNPP (Sisma Chemical Co., St. Louis, МО, Cat#N2770 или N1891). Поглощение регистрируют при 405 нм, применяя кинетический микропланшет-ридер Vmax™ (Molecular Devices Corp., Menio Park, CA).
Пример 5. Активности мутеинов.
В таблице суммированы результаты по мутеинам в двух анализах, описанных выше. "ЭК50, пМ" представляет собой эффективную концентрацию, которая обеспечивает 50% реакцию от максимальной, измеряемую в концентрации пикомоль/литр. Активность является функцией как силы (ЭК50), так и максимальной реакции (Rmax). Избирательно действующие на клетки мутеины проявляют дифференцированную активность в относительном снижении Rmax и/или относительном снижении силы (снижении ЭК50) в анализе ЭКПВЧ по сравнению с Т-клеточным анализом. "Rmax, мас.%" представляет собой максимальную реакцию, измеренную относительно IL-4 дикого типа. По определению IL-4 дикого типа вызывает 100% реакцию. Все мутеины проявляют активность в анализе пролиферации Т-клеток. Мутеины R121D, R121E, R121P и R121T/E122F/Y124Q в данном анализе оказывают более сильное воздействие, чем IL-4 дикого типа, хотя мутеин R121T/E122F/Y124Q вызывает пониженную максимальную реакцию. Мутеины Y124Q, Y124R и Y124A/S125A проявляют значения ЭК50, превышающие в 2-3 раза таковые IL-4 дикого типа, равно как и пониженную максимальную реакцию. Однако они сохраняют значительную часть активности IL-4 по отношению к Т-клеткам. В анализе ЭКПВЧ мутеины R121E, Y124Q и R121T/E122F/Y124Q измеримой активностью не обладают, что, очевидно, свидетельствует об их избирательности по отношению к Т-клеткам и, таким образом, об избирательности по отношению к рецептору IL-4, экспрессируемому на Т-клетках (IL-4Rα/IL-2Rγ). Данные мутеины представляют собой антагонисты IL-4 по отношению к эндотелиальным клеткам, поскольку не смотря на то, что они нормально взаимодействуют с IL-4Rα, они не активируют комплекс IL-4Рα/γ-подобной частицы. Мутеины R121P и Y124R проявляют активность в анализе ЭКПВЧ, но их значения ЭК50 увеличены в 50-150 раз и вызывают пониженные максимальные реакции относительно их способности стимулировать Т-клетки. Хотя данные два белка не оказались абсолютно избирательно действующими на Т-клетки, они активируют рецептор IL-4 Т-клеток предпочтительно перед рецептором IL-4 ЭКПВЧ.

Пример 6. Биологический ответ на мутеины IL-4 в анализах ЭКПВЧ
На фиг.2А и Б представлен ряд графиков "доза-ответ" секреции IL-6 ЭКПВЧ под действием избирательно действующих на Т-клетки агонистов по сравнению с IL-4 дикого типа. На каждом планшете, применяемом для анализа активности мутеинов, IL-4 включают в качестве внутреннего контроля; приведена характерная кривая. На фиг.4А представлена кривая "доза-ответ" для R121E по сравнению с IL-4 дикого типа. Аналогично на фиг.4Б-Е представлены кривые "доза-ответ" для R121P, Y124Q, Y124R, Y124A/S125A и R121T/E122F/Y124Q соответственно по сравнению с IL-4 дикого типа. Значения активности приводят относительно контрольных значений реакции на IL-4. Мутеины R121E, Y124Q и R121T/E122F/Y124Q не проявляют активности в данном анализе. Мутеины R121P и Y124R, хоть и проявляют частичную агонистическую активность в данном анализе, являются относительно менее сильными по сравнению с IL-4 дикого типа, чем в 1° Т-клеточном анализе. Таким образом, несмотря на свою активность, они все же проявляют предпочтительную активацию рецептора IL-4 на Т-клетках.
Пример 7. Биологический ответ на мутеины IL-4 в 1°Т-клеточных анализах
На фиг.4А и Б показаны кривые "доза-ответ" мутеинов-агонистов, избирательно действующих на Т-клетки, в характерном анализе с применением клеток здорового донора. На каждом планшете, применяемом для анализа активности мутеинов, IL-4 включают в качестве внутреннего контроля; приведена характерная кривая. На фиг.6А представлена кривая "доза-ответ" для R121E по сравнению с IL-4 дикого типа. Аналогично на фиг.6Б-Е представлены кривые "доза-ответ" для R121P, Y124Q, Y124R, Y124A/S125A и R121T/E122F/Y124Q соответственно по сравнению с IL-4 дикого типа. Значения активности приводят относительно контрольных значений реакции на IL-4. Мутеины R121E, Y124Q и R121T/E122F/Y124Q оказывают более сильное воздействие, нежели IL-4 дикого типа несмотря на то, что R121T/E122F/Y124Q является лишь частичным агонистом в данном анализе. Хотя мутеины Y124Q, Y124R и Y124A/S125A оказывают в данном анализе не такое сильное воздействие, как IL-4 дикого типа, они все же являются эффективными частичными агонистами (значения Rmax составляют 60-70% от таковых IL-4 дикого типа). На фиг.6 активность соответствует реакции на IL-4, наблюдаемой на том же планшете на каждый мутеин. Особо заслуживают внимания мутеины R121E и Y124Q, которые проявляют значительную активность в Т-клеточном анализе, не проявляя видимой активности в анализе ЭКПВЧ. Каждый из данных мутеинов является несомненным агонистом, избирательно действующим на Т-клетки.
Пример 8. Антагонистический эффект мутеинов, избирательно действующих на Т-клетки, на IL-4-индуцированную секрецию IL-6 ЭКПВЧ
Мутеины IL-4, избирательно действующие на Т-клетки, R121E (•) и Y124Q (Σ ) и антагонист IL-4 R121D/Y124D (O) (фиг. 7) титровали против постоянной концентрации 100 пМ IL-4. В данных условиях антагонист IL-4 R121D/Y124D оказывает антагонистический эффект по отношению к IL-4 с KI ~1,5 нМ. ЭКПВЧ не экспрессируют IL-2Rγ, но экспрессируют γ-подобную субъединицу рецептора IL-4. Замещенные остатки R121E и Y124Q находятся в D-спирали IL-4 и, таким образом, влияют лишь на взаимодействия IL-4 с IL-2Rγ (функциональное взаимодействие) и с γ-подобной субъединицей (взаимодействие отсутствует или нефункциональное взаимодействие), но не влияют на способность данных мутеинов связываться с IL-4Rα. Таким образом, агонисты R121E и Y124Q, избирательно действующие на Т-клетки, благодаря своей способности избирательно взаимодействовать с IL-2Rγ на Т-клетках без стимулирования активации γ-подобной рецепторной субъединицы на эндотелиальных клетках, способны ингибировать IL-4-индуцированные реакции на данных эндотелиальных клетках (в данных условиях KI ~ 0,8-1 нМ). Такой антагонизм мутеинов IL-4, избирательно действующих на Т-клетки, может ингибировать эффекты эндогенно продуцируемого IL-4 на эндотелиальные клетки в процессе направленного на Т-клетки терапевтического воздействия указанными мутеинами.
Пример 9. Биологический ответ на мутеин IL-4 R121D
Мутеин IL-4 R121D (Arg-121 замещен Asp) получают, как описано, и анализируют в анализах 1°Т-клеток и ЭКПВЧ. На фиг.8А и 8Б приведены данные по IL-4 (O) и R121D (•) в анализах как Т-клеток (фиг.8А), так и ЭКПВЧ (фиг.8Б). В Т-клеточном анализе R121D проявляет ЭК50 ~100 пМ и значение Rmax ~60 от такового IL-4 дикого типа. В анализе ЭКПВЧ он оказывается неактивным (ЭК50=•; Rmax=O). Данные результаты показывают, что единственная замена Arg-121 человеческого IL-4 Asp позволяет получить белок, который обладает избирательной активностью по отношению к Т-клеткам и не обладает какой-либо видимой активностью по отношению к эндотелиальным клеткам. Хотя мутеин R121D является частичным агонистом в Т-клеточном анализе, он оказывает более сильное воздействие, чем IL-4 дикого типа. Однако, как и мутеин R121E, R121D не проявляет активности в анализе ЭКПВЧ, что свидетельствует о том, что он является несомненным агонистом, избирательно действующим на Т-клетки.
Пример 10. Биологический ответ на мутеин IL-4 T13D/R121E
Мутеин IL-4 T13D/R121E (Thr-13 замещен Asp, а также Arg-121 замещен Glu) получают, как описано, и анализируют в анализах 1°Т-клеток и ЭКПВЧ, Конкретно касательно фигур 9А-Б, в Т-клеточном анализе (Панель А) T13D/R121E


Пример 11. Оценка избирательного агониста IL-4 в модели патологии
Для данных исследований используют взрослых самцов макаков-крабоедов (Масаса fascicularis, Charles River Primate Imports, Boston, Mass.), весящих приблизительно от 4 до 6 кг. Животных помещают отдельно в комнатах с контролируемой внутренней средой в открытых ячеистых клетках и обеспечивают пищей дважды в сутки и водой ad libitum. Всех животных лишают пищи приблизительно за 12 ч до первого дня исследований.
При каждом исследовании животных анестезируют при помощи внутримышечной инъекции кетамина гидрохлорида (Ketaset, 10 мг/кг). Верхнюю часть спины каждого животного выстригают и очищают 70%-ным раствором спирта-бетадина. С помощью 1 мл туберкулинового шприца животным в спину внутрикожно в объеме 0,1 мл вводят IL-4, избирательный агонист IL-4 или носитель (0,2% человеческий сывороточный альбумин, HSA). Места инъекций разделяет, по крайней мере, 10 см, и их отмечают несмываемым маркером. Образцы биопсии тканей получают, применяя 6 мм инструмент для пункционной биопсии, и образцы помещают в ОСТ и быстро замораживают в жидком азоте. Образцы биопсии отбирали через 0, 4, 8 и 24 ч после инъекции.
Системную реакцию на IL-4, избирательный агонист IL-4 или носитель оценивают следующим образом. Тестируемое вещество вводят подкожно дважды в сутки (с промежутком приблизительно в 10-12 ч) в течение четырех последующих суток в объеме 0,1 мл/кг в дозировках 0, 2, 5, 25 или 250 мкг/кг в суммарной суточной дозе 0, 5, 50 и 500 мкг/кг соответственно. Образец периферической крови получают от каждого животного до первой инъекции носителя или IL-4 и в начале каждого дня исследования и проводят клинический анализ крови и определение лейкоцитарной формулы аликвот и анализ поверхностных маркеров мононуклеарных клеток периферической крови по методу проточной цитометрии. Остаток образца крови центрифугируют и аликвоты плазмы хранят при -70°С для дальнейшего анализа уровней содержания хемокинов.
Готовят замороженные срезы и позволяют им достичь комнатной температуры, сушат на воздухе и фиксируют в ацетоне при 4°С в течение 5 минут. VCAM-1 локализуют с помощью С313.3, моноклонального антитела против человеческой VCAM-1. В качестве отрицательного контроля применяют изотипически сходный иммуноглобулин с иной специфичностью в подходящей концентрации. Эндогенный биотин блокируют с помощью биотинблокирующего набора Vector (Vector Laboratories, Burlingame, CA). Срезы инкубируют в течение 1,5 ч при комнатной температуре во влажной камере с указанными антисыворотками, разбавленными в ФБР 0,1% BSA и 1 нормальной кроличьей сывороткой. После трех промывок ФБР срезы окрашивают с помощью набора Vector ABC Elite в соответствии с указаниями производителя и антительный конъюгат определяют путем инкубирования срезов в 3-амино-9-этилкарбазоле/пероксиде водорода (набор субстратов АЕС, Vector). Срезы тщательно промывают 0,1 М ацетатным буфером, промывают дистиллированной водой и закрепляли в Lerner AQUA-MOUNT (Lerner Laboratories, Pittsburgh, PA).
Образцы оценивают двумя независимыми наблюдателями слепым методом с применением шкал от 0 до 3+, предназначенных для оценки интенсивности, равно как и распределения окраски. Система оценки экспрессии VCAM-1 представляет собой: 0 отсутствующее или бледное окрашивание случайного сосуда; 1+ бледное окрашивание нескольких сосудов; 2+ окрашивание умеренной интенсивности большинства сосудов; 3+ интенсивное окрашивание большинства сосудов. Кровеносные сосуды определяют на серийных микропрепаратах, окрашенных на фактор фон Виллебранда (поликлональными кроличьими антителами против ФФВ; Dakoplatts, Carpinteria, CA).
Подсчет эритроцитов, определение гематокрита, подсчет лейкоцитов и подсчет тромбоцитов проводят на гепаринизированных образцах крови с помощью Serono 9000 Blood Analyzer (Baker Diagnostics, Allentown, PA). Лейкоцитарную формулу определяют на мазках крови, окрашенных Diff-Quick, где считают в общей сложности двести клеток и записывают процент каждого типа клеток.
Анализ поверхностных маркеров мононуклеарных клеток периферической крови (МКПК) проводят следующим образом. 4 мл образец гепаринизированной крови разводят в уравновешенном солевом растворе Хенкса (УСРХ, без Mg++ и Са++) и наслаивают на 4 мл Percoll (плотность 1,070 г/мл). Пробирки центрифугируют при 1800 об/мин (Beckman GS-6R) в течение 20 минут при 24°С. Лимфоцитсодержащий слой отсасывают и центрифугируют при 1100 об/мин в течение 10 минут. Полученный клеточный осадок ресуспендируют в 6 мл фосфатно-буферного раствора (ФБР), содержащего 0, 1 азида и 5 козьей сыворотки. 1 мл аликвоты применяют для анализа маркеров клеточной поверхности, как описано ниже.
Для анализа по методу проточной цитометрии используют антитела против CD2, CD4, CD8, CD1lb, CD16, CD25, CD49 и HLA-DR (R&D Systems, Minneapolis, MN). Аликвоты по двадцать мкл маркерных антител инкубируют с 1 мл аликвотами клеточной суспензии в темноте в течение 60 минут при 4°С и образцы центрифугируют (1000 об/мин, 10 мин при 4°С). Осадок трижды промывают 1 мл ФБР, содержащего 0,1% азида и 5 козьей сыворотки, с последующим анализом с помощью FACS. Образцы плазмы, получаемые во время каждого исследования, анализируют на предмет уровня содержания МСР-1 по методу специфичного ELISA. Вкратце, 96-луночные планшеты (Nunc, Kamstrup, Denmark) покрывают 50 мкл/лунка кроличьих антител против МСР-1 в течение 16 ч при 4°С и затем промывают ФБР, рН 7,5, 0,05 Tween-20 (промывочный буфер). Сайты неспецифического связывания блокируют 2% BSA в ФБР (200 мкл) и планшеты инкубируют в течение 90 минут при 37°С. Планшеты трижды промывают промывочным буфером и добавляют разбавленный (неразбавленный, 1:5 и 1:10) тестируемый образец (50 мкл) в двух экземплярах с последующей инкубацией в течение 1 ч при 37°С. Планшеты четырежды промывают, добавляют стрептавидин-пероксидазный конъюгат (100 мкг/мл) (Dakoplatts, Carpinteria, СА) и планшеты инкубируют в течение 30 минут при 37С. Планшеты трижды промывают и добавляют 100 мкл хромогенного субстрата (0, 67 мг/мл ортофенилендиаминдихлорида (Dakoplatts, Carpinteria, CA)). Планшеты инкубируют при 25°С в течение 6 минут и реакцию останавливают 50 мкл/лунка 3 М раствора H2SO4 в промывочном буфере с добавлением 2% ОКС. Планшеты прочитывают при 490 нм в ридере ELISA. Стандарты представляют собой 0,5 log разведения рекомбинантного МСР-1 от 100 нг/мл до 1 пг/мл (50 мкл/лунка). ELISA позволяет достоверно определять концентрации МСР-1>50 пг/мл.
Пример 12. Лечение рассеянного склероза избирательным агонистом IL-4
Применение животной модели в качестве способа предсказания фармакологической применимости у людей является общепринятым инструментом исследования. Первоначальное тестирование избирательного агониста IL-4 при рассеянном склерозе (PC) проводят в модели на игрунках, применяя рекомбинантный белокизбирательный агонист человеческого IL-4. Данные исследования проводят в целях исследования эффекта профилактического и терапевтического лечения на возникновение и тяжесть как острой симптоматики, так и хронического рецидивирующего-ремиттирующего заболевания.
Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) представляет собой опосредованное CD4+ Т-клетками аутоиммунное воспалительное заболевание центральной нервной системы. Возникновение ЭАЭ вызывают у игрунок (С. jacchus), весящих от 300 до 400 г, путем иммунизации 200 мг посмертно свежезамороженного гомогената белого вещества человеческого головного мозга (ГМ), эмульгированного в полном адъюванте Фройнда (ПАФ), содержащем 3 мг/мл убитой Mycobacterium tuberculosis, как описано Massacesi et al., Ann. NeuroL, 37:519 (1995). В день иммунизации и повторно через 2 суток 1010 инактивированных микроорганизмов Bordetella pertussis разводят в 10 мл солевого раствора и вводят внутривенно.
ЭАЭ оценивают по клиническим и патологическим критериям. Для регистрации тяжести клинического заболевания применяют стандартизованную оценочную систему: 0 = нормальные неврологические показатели; 1 = сонливость, анорексия, потеря веса; 2 = атаксия и либо парапарез/монопарез, потеря чувствительности, либо синдром стволовой части мозга, включая паралич взора, либо слепота; 3 = параплегия или гемиплегия; 4 = квадриплегия.
Было показано, что магнитно-резонансная томография (МРТ) является применимой методикой охарактеризования ранних, равно как и поздних иммунно-опосредованного повреждения при PC (Stewart et al., Brain, 114:1069 (1991)). МРТ применяют для оценки состояния животных после иммунизации для слежения за прогрессированием заболевания с течением времени. Данные МРТ получают на криогенной ‘2000’ ЯМР-системе Picker International, работающей при напряженности поля 0,15 тесла; для получения изображений применяют приемную катушку с апертурой 15 см. Применяют многослойные последовательности импульсов спинового эха и обращения-релаксации. В последовательностях спинового эха применяют время замедлений эха либо 40 и 60 мс, либо 40 и 80 мс. В последовательностях обращения-релаксации межимпульсная задержка составляет 400 мс.
Игрунок анестезируют кетамина гидрохлоридом и помещают в сканнер, применяя лазер, используемый для выравнивания пациента таким образом, что внутренние углы глазных щелей выровнены перпендикулярно направлению постоянного магнитного поля. Животных сканируют перед иммунизацией и затем ежедневно, начиная с 9 суток после иммунизации. До ежедневного сканирования животных проверяют на предмет знаков неврологического ухудшения.
Животных забивают через различные периоды времени после иммунизации. ЦНС выделяют и фиксируют в 10% формалине. Готовят парафиновые срезы головного и спинного мозга и окрашивают гематоксилином и эозином. Каждый коронарный срез головного мозга или горизонтальный срез спинного мозга анализируют на предмет гистопатологических признаков воспаления или демиелинизации в соответствии с условной шкалой: воспаление; 0 = воспаление отсутствует, + = редкие периваскулярные скопления лейкоцитов/средний цельный срез; ++ = умеренное количество периваскулярных скоплений лейкоцитов/срез; могут присутствовать воспаление оболочек головного мозга; +++ = широкораспространенные периваскулярные скопления лейкоцитов и инфильтрация паренхимы клетками воспаления. Оценка демиелинизации: 0 = демиелинизация отсутствует; + = редкие очаги демиелинизации; ++ = умеренная демиелинизация; +++ = обширная демиелинизация с крупными сливными очагами.
В исследованиях предварительного лечения острого заболевания тестируемое лекарственное средство вводят подкожно в интервале дозировок от 1 до 500 мкг/кг с последующей схемой введения от 1 введения в сутки до 1 введения в неделю до возникновения симптомов заболевания. Для терапевтического вмешательства при развившемся заболевании тестируемое вещество вводят подкожно в интервале дозировок от 1 до 500 мкг/кг с последующей расширенной схемой введения от 1 введения в сутки до 1 введения в неделю на протяжении нескольких месяцев.
Пример 13. Лечение ревматоидного артрита
Ревматоидный артрит (РА) представляет собой изнуряющее воспалительное заболевание, при котором хроническая активация резидентных и инфильтрирующих синовиальных клеток вызывает деструкцию хряща и кости и ведет к фиброзу и потере функции. Считается, что цитокины, секретируемые активированными Т-клетками, играют роль в поддержании хронической воспалительной реакции.
РА индуцируют у мышей DBA/1, применяя коллаген II типа, как описано в Joosten et al., Arthritis & Rheumatism; 39:797 (1996). Коллагениндуцированный артрит (КИА) вызывают путем иммунизации мышей посредством внутрикожной инъекции в основание хвоста 100 мкл эмульсии, содержащей 100 мкг коллагена. На 21 сутки животных подвергают вторичной иммунизации путем внутрибрюшинной инъекции коллагена II типа (100 мкг), растворенного в фосфатно-буферном растворе (ФБР).
Оценку КИА проводят путем визуального исследования мышей на предмет развития артрита в периферических суставах и выставляют оценки тяжести артрита. Мышей считают больными артритом, когда замечают значительные изменения красноты и/или отечности (0 = изменения отсутствуют, 0,5 = значительные, 1,0 = умеренные, 1,5 = выраженные и 2, 0 = тяжелые максимальные отечность и покраснение). Оценку проводят, по крайней мере, два исследователя слепым методом.
По окончании исследования некоторых животных забивают и получают ткани лап и суставов для патологического и гистопатологического исследований. Ткани подвергают иммуногистохимическому окрашиванию (замороженные срезы) или фиксируют и заключают в парафин, делают срезы и окрашивают Н&Е для анализа клеточной инфильтрации.
Оценку мышиного аналога избирательного агониста IL-4 по настоящему изобретению в модели КИА проводят с применением эквивалентной мышиной белковой молекулы. Специалист в данной области способен сравнить структуру мышиного IL-4 со структурой человеческого IL-4, получить аналогичные мутеины мышиного IL-4 и произвести любые необходимые корректировки, основанные на реакциях в анализах in vitro с применением клеточных линий, экспрессирующих либо IL-4Rα/IL-2Rγ или IL-4Rα/γ -подобную субъединицу, аналогично тем, применяемым для мутеинов человеческого IL-4 с Т-клетками и ЭКПВЧ. Животным вводят дозу за одни сутки до вторично-иммунизирующего введения коллагена и к ним применяют схему введения от ежесуточного до еженедельного на протяжении исследования (40+ суток). Животным вводят дозы в интервале концентраций избирательного агониста IL-4 от 1 до 100 мкг/кг.
Пример 14. Лечение инсулинзависимого сахарного диабета (ИЗСД)
В литературе существует несколько упоминаний о вовлечении Th1-клеток в ИЗСД у людей и в животных моделях заболеваний человека. Для проверки эффективности мышиного эквивалента избирательного агониста IL-4 в лечении ИЗСД применяют нетучных диабетических (NOD) мышей. Специалист в данной области способен сравнить структуру мышиного IL-4 со структурой человеческого IL-4, получить аналогичные мутеины мышиного IL-4 и произвести любые необходимые корректировки, основанные на реакциях в анализах in vitro с применением клеточных линий, экспрессирующих либо IL-4Rα/IL-2Rγ или IL-4Rα/γ-подобную субъединицу, аналогично тем, применяемым для мутеинов человеческого IL-4 с Т-клетками и ЭКПВЧ. Предиабетические мыши NOD (в возрасте приблизительно 7 недель) проявляют пролиферативную невосприимчивость in vitro после стимуляции Т-клеток. Выбор времени данной невосприимчивости не связан с инсулитом, и она персистирует до развития диабета, которое происходит в возрасте 24 недель.
Оценку избирательного агониста IL-4 у мышей NOD проводят сходно с исследованиями, описанными Rapoport et al., J.Exp.Med.; 178; p.87 (1993). Мышам NOD вводят тестируемое вещество в возрасте приблизительно 3 недель с последующей схемой введения в виде ежесуточного введения или еженедельного введения на протяжении 12 недель до тех пор, пока мыши не достигнут возраста 15 недель. Контрольная группа мышей будет получать лечение инертным белковым эквивалентом.
Мышей исследуют на предмет гликозурии в применением Tes-Tape и поставят диагноз диабета при определении гликозурии в течение двух последующих недель. По прошествии 52 недель животных забивают для взятия различных органов и тканей для оценки патологических изменений. Ткань поджелудочной железы, поднижнечелюстных слюнных желез и почки каждой мыши фиксируют и заключают в парафин, делают срезы и окрашивают. Окрашивание альдегидным фуксином срезов поджелудочной железы применяют для определения степени, в которой инсулитные инфильтраты снизили содержание гранулированных β-клеток. Лейкоциты селезенки подсчитывают путем анализов FACScan, применяя MAT асцитической жидкости против Thy-1.2, CD4 и CD8, как описано Zipris et al., J. Immunol. 146; р.3763 (1991).
Другие варианты реализации изобретения будут очевидны специалисту в данной области. Данное изобретение показывает, как получать мутеины, не описанные здесь особо, но обладающие активирующей Т-клетки способностью и сниженной активирующей эндотелиальные клетки способностью, и, таким образом, данные мутеины отвечают сущности и объему изобретения. Концепция и экспериментальный подход, описанные здесь, будут применимы к другим цитокинам, задействующим гетерологичные многомерные рецепторные системы, в частности IL-2 и родственные цитокины (например, IL-7, IL-9 и IL-15), IL-10, α-интерферон и γ-интерферон.
Последовательности
В данной заявке содержатся следующие последовательности:
ПОСЛ. ИД. №:1: hIL-4 (аминокислотная)
ПОСЛ. ИД. №:2: hIL-4 (аминокислотная, кДНК)
ПОСЛ. ИД. №:3: R121A (аминокислотная, кДНК)
ПОСЛ. ИД. №:4: R121D (аминокислотная, кДНК)
ПОСЛ. ИД. №:5: R121E (аминокислотная, кДНК)
ПОСЛ. ИД. №:6: R121F (аминокислотная, кДНК)
ПОСЛ. ИД. №:7: R121H (аминокислотная, кДНК)
ПОСЛ. ИД. №:8: R121I (аминокислотная, кДНК)
ПОСЛ. ИД. №:9: R121K (аминокислотная, кДНК)
ПОСЛ. ИД. №:10: R121N (аминокислотная, кДНК)
ПОСЛ. ИД. №:11: R121P (аминокислотная, кДНК)
ПОСЛ. ИД. №:12: R121T (аминокислотная, кДНК)
ПОСЛ. ИД. №:13: R121W (аминокислотная, кДНК)
ПОСЛ. ИД. №:14: Y124A (аминокислотная, кДНК)
ПОСЛ. ИД. №:15: Y124Q (аминокислотная, кДНК)
ПОСЛ. ИД. №:16: Y124R (аминокислотная, кДНК)
ПОСЛ. ИД. №:17: Y121S (аминокислотная, кДНК)
ПОСЛ. ИД. №:18: Y124T (аминокислотная, кДНК)
ПОСЛ. ИД. №:19: Y124A/S125A (аминокислотная, кДНК)
ПОСЛ. ИД. №:20: T13D/R121E (аминокислотная, кДНК)
ПОСЛ. ИД. №:21: R121T/E122F/Y124Q (аминокислотная, кДНК)
ПОСЛ. ИД. №:22: 5’- концевой праймер ПЦР, IL-4
ПОСЛ. ИД. №:23: 3’- концевой праймер ПЦР, IL-4
ПОСЛ. ИД. №:24: праймер мутагенеза для R121A
ПОСЛ. ИД. №:25: праймер мутагенеза для R121D
ПОСЛ. ИД. №:26: праймер мутагенеза для R121E
ПОСЛ. ИД. №:27: праймер мутагенеза для R121F
ПОСЛ. ИД. №:28: праймер мутагенеза для R121Н
ПОСЛ. ИД. №:29: праймер мутагенеза для R121I
ПОСЛ. ИД. №:30: праймер мутагенеза для R121К
ПОСЛ. ИД. №:31: праймер мутагенеза для R121N
ПОСЛ. ИД. №:32: праймер мутагенеза для R121Р
ПОСЛ. ИД. №:33: праймер мутагенеза для R121Т
ПОСЛ. ИД. №:34: праймер мутагенеза для R121W
ПОСЛ. ИД. №:35: праймер мутагенеза для Y124A
ПОСЛ. ИД. №:36: праймер мутагенеза для Y124Q
ПОСЛ. ИД. №:37: праймер мутагенеза для Y124R
ПОСЛ. ИД. №:38: праймер мутагенеза для Y124S
ПОСЛ. ИД. №:39: праймер мутагенеза для Y124T
ПОСЛ. ИД. №:40: праймер мутагенеза для Y124A/S125A
ПОСЛ. ИД. №:41: праймер мутагенеза для T13D
ПОСЛ. ИД. №:42: праймер мутагенеза для R121T/E122F/Y124Q
Примечание: для мутеина Т13D/R121Е применяют праймеры ПОСЛ. ИД. №№:26 и 41.
Реферат
Изобретение относится к биотехнологии и может быть использовано для получения мутеинов человеческого IL-4, обладающих активирующей Т-клетки активностью и пониженной активирующей эндотелиальные клетки активностью. Мутеин IL-4 человека, вызывающий пролиферацию Т-клеток и пониженную секрецию IL-6 ЭКПВЧ по сравнению с IL-4 дикого типа, получают путем мутации поверхностных остатков D-спирали IL-4 человека, пронумерованного в соответствии с IL-4 дикого типа. Мутеины IL-4 содержат одиночные, двойные и тройные мутации, представленные обозначениями R121A, R121D, R121E, R121F, R121H, R121I, R121K, R121N, R121P, R121T, R121W; Y124А, Y124Q, Y124S, Y124Т; Y124A/S125A, T13D/R121E и R121Т/Е122F/Y124Q, при нумерации в соответствии с IL-4 дикого типа (His=1). Полинуклеотиды, кодирующие мутеины по изобретению, клонируют в вектор, и трансформируют им клетки-хозяева с последующим культивированием. Фармацевтические композиции, содержащие мутеины, используют для лечения пациентов, страдающих состоянием, поддающимся лечению IL-4. Изобретение позволяет получать менее токсичный мутеин IL-4, который делает возможным более широкое терапевтическое применение интерлейкина. 7 н. и 36 з.п.ф-лы, 23 ил., 1 табл.


Комментарии