Композиции и способы лечения рака - RU2409579C2
Код документа: RU2409579C2
Чертежи











Описание
Описание
По данной заявке испрашивается приоритет по предварительной заявке на патент США No 60/650951, поданной 9 февраля 2005 г., содержание которой включено в данное описание посредством ссылки во всей своей полноте.
Рак представляет собой вторую ведущую причину смертности в Соединенных Штатах Америки, за исключением только сердечных заболеваний (Cancer Facts и Figures 2004, American Cancer Society, Inc.). Несмотря на недавние успехи в диагностике и лечении рака, излечение возможно с помощью хирургии и лучевой терапии при раннем выявлении рака, но существующая в настоящее время лекарственная терапия при метастатических заболеваниях большей частью является полумерой и редко предлагает длительные средства излечения. Даже при наличии новых химиотерапевтических средств, поступающих на рынок, сохраняется необходимость в новых лекарственных средствах, эффективных при монотерапии или в комбинации с существующими агентами в качестве первой терапии, а также в качестве вторичной и третичной терапии при лечении резистентных опухолей.
Раковые клетки по определению являются гетерогенными. Например, в рамках единственной ткани или типа клеток множество мутационных «механизмов» может приводить к развитию рака. По существу, гетерогенность часто существует между раковыми клетками, полученными из опухолей одной и той же ткани и одного и того же типа, возникших у различных индивидуумов. Часто наблюдаемые мутационные «механизмы», связанные с некоторыми видами рака, могут различаться между одними и другими типами тканей (например, часто наблюдаемые мутационные «механизмы», приводящие к раку толстой кишки, могут отличаться от часто наблюдаемых «механизмов», приводящих к лейкозу). По этой причине часто трудно предсказать, будет ли конкретный вид рака давать ответную реакцию на определенный химиотерапевтический агент (Cancer Medicine, 5th Edition, Bast et al. eds., B.C. Decker Inc., Hamilton, Ontario).
Рак молочной железы представляет собой наиболее часто диагностируемый некожный вид рака у женщин и расценивается как второй по числу смертей от рака у женщин после рака легких (Cancer Facts and Figures 2004, American Cancer Society, Inc.). Варианты выбора лечения при раке молочной железы в настоящее время включают хирургию, лучевую терапию и химиотерапию/гормональную терапию с использованием таких агентов, как тамоксифен, ингибиторы ароматазы, Herceptin® (трастузумаб), Taxol® (паклитаксель), циклофосфамид, метотрексат, доксорубицин (адриамицин) и 5-фторурацил. Несмотря на улучшения в диагностике рака и терапевтическом лечении, рост заболеваемости раком молочной железы продолжает увеличиваться с 1980-х годов. В 2004 г. ожидается примерно 215000 новых случаев возникновения рака молочной железы у женщин и примерно 1450 новых случаев рака молочной железы у мужчин (там же). Соответственно необходимы новые соединения и способы лечения рака молочной железы.
Компоненты клеточного сигнального пути трансдукции, которые регулируют рост и дифференциацию нормальных клеток, могут при нарушении регуляции приводить к развитию клеточного пролиферативного нарушения и рака. Мутации в клеточных сигнальных белках могут приводить к тому, что такие белки будут экспрессироваться или активироваться на неподходящих уровнях или в неподходящее время во время клеточного цикла, что, в свою очередь, может приводить к неконтролируемому росту клеток или изменениям в свойствах присоединения клетка-клетка. Например, нарушение регуляции рецепторных тирозинкиназ в результате мутации, перегруппировки генов, генной амплификации и сверхэкспресии как рецептора, так и лиганда, влечет за собой развитие и прогрессирование рака у людей.
Рецепторная тирозинкиназа c-Met является единственным известным высокоаффинным рецептором фактора роста гепатоцитов (HGF), также известного как фактор рассеяния. Связывание HGF с межклеточным лиганд-связывающим доменом c-Met приводит к мультимеризации рецептора и фосфорилированию множества остатков тирозина во внутриклеточной части c-Met. Активация c-Met приводит к связыванию и фосфорилированию переходных белков, таких как Gab-1, Grb-2, Shc и c-Cbl, и последующей активации сигнальных трансдукторов, таких как PI3K, PLC-γ, STAT, ERK1 и 2 и FAK. c-Met и HGF экспрессируются во множестве тканей и их экспрессия обычно ограничивается главным образом клетками эпителиального и мезенхимального происхождения соответственно. c-Met и HGF аномально регулируются при раке человека и могут вносить свой вклад в нарушение регуляции роста клеток, распространение опухолевых клеток и инвазию опухоли во время прогрессирования и метастазов заболевания (см., например, Journal of Clinical Investigation 109: 863-867 (2002) и Cancer Cell pp. 5-6, July, 2004). c-Met и HGF экспрессируются в большой степени относительно окружающих тканей при многочисленных видах рака и их экспрессия коррелирует с плохим прогнозом для пациента (см., например, Journal of Cellular Biochemistry 86: 665-677 (2002); Int. J. Cancer (Pred. Oncol.) 74: 301-309 (1997); Clinical Cancer Research 9: 1480-1488 (2003) и Cancer Research 62: 589-596 (2002)). Не связываясь с какой-либо теорией, c-Met и HGF могут защищать опухоли от клеточной смерти, индуцированной агентами, повреждающими ДНК, и как таковые могут вносить вклад в устойчивость опухолей к химиотерапии. Не ограничиваясь какой-либо теорией, ингибиторы c-Met могут быть полезными в качестве терапевтических агентов при лечении пролиферативных нарушений, включая рак молочной железы (см., например, Cancer and Metastasis Reviews 22: 309-325 (2003)).
Процитированные выше ссылки не признаются как являющиеся прототипом заявляемого изобретения.
Настоящее изобретение относится к соединениям пирролохинолинилпирролидин-2,5-диона формулы IVa, IVb, Va или Vb и к способам получения соединений формулы IVa, IVb, Va и Vb:


где R1, R2 и R3 независимо выбирают из группы, состоящей из водорода, F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила и замещенного -O-(C3-C9)циклоалкила, арила, гетероарила, гетероциклила;
R4 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, -CH2R7;
R5, R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила;
R7 независимо выбирают из группы, состоящей из -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил), -O-P(=O)(-O-(C1-C6)алкил)2, -O-P(=O)(-OH)(-O-(CH2)-фенил), -O-P(=O)(-O-(CH2)-фенил)2, группы карбоновой кислоты, группы аминокарбоновой кислоты и пептида;
Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила;
X выбирают из группы, состоящей из -(CH2)-, -(NR8)-, S и O;
R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила и -O-(C1-C6)алкила, -C(=O)-O-(C1-C6)алкила и замещенного -C(=O)-O-(C1-C6)алкила;
Y выбирают из группы, состоящей из -(CH2)- или связи;
где указанные арильная, гетероарильная, -O-арильная, -S-арильная, -O-гетероарильная и -S-гетероарильная группы могут быть замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -арил-(C1-C6)алкила, -арил-O-(C1-C6)алкила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла и -(S(=O)2)-(C1-C6)алкила; и
m равно 1 или 2.
В одном из вариантов осуществления R4 представляет собой -CH2R7, и R7 представляет собой -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил), -O-P(=O)(-O-(C1-C6)алкил)2, группу карбоновой кислоты, группу аминокарбоновой кислоты или пептид.
В одном из вариантов осуществления X выбирают из группы, состоящей из -(NR8)-, S и O.
В одном из вариантов осуществления m равно 2.
В предпочтительном варианте осуществления соединения пирролохинолинилпирролидин-2,5-диона выбирают из группы, состоящей из (+)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, (-)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. В следующем предпочтительном варианте осуществления соединение представляет собой (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион.
Настоящее изобретение также относится к соединениям пирролохинолинилпиррол-2,5-диона формулы IIIa и их синтезу.

где R1, R2 и R3 независимо выбирают из группы, состоящей из водорода, F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила и замещенного -O-(C3-C9)циклоалкила, арила, гетероарила, гетероциклила;
R4 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, -CH2R7;
R5, R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила;
R7 независимо выбирают из группы, состоящей из -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил), -O-P(=O)(-O-(C1-C6)алкил)2, -O-P(=O)(-OH)(-O-(CH2)-фенил), -O-P(=O)(-O-(CH2)-фенил)2, группы карбоновой кислоты, группы аминокарбоновой кислоты и пептида;
Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила, при условии, что когда R4 представляет собой водород, (C3-C4)циклоалкил или (C1-C4)алкил, Q не является 3-индолилом или замещенным 3-индолилом;
X выбирают из группы, состоящей из -(CH2)-, -(NR8)-, S и O;
R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, -C(=O)-O-(C1-C6)алкила и замещенного -C(=O)-O-(C1-C6)алкила;
Y выбирают из группы, состоящей из -(CH2)- или связи;
где указанные арильная, гетероарильная, -O-арильная, -S-арильная, -O-гетероарильная и -S-гетероарильная группы могут быть замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -арил-(C1-C6)алкила, -арил-O-(C1-C6)алкила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла и -(S(=O)2)-(C1-C6)алкила; и
m равно 1 или 2.
Настоящее изобретение также относится к фармацевтической композиции, содержащей одно или несколько соединений формулы IIIa, IVa, IVb, Va или Vb и один или несколько фармацевтически приемлемых носителей или эксципиентов. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение формулы IIIa, IVa, IVb, Va или Vb и один или несколько фармацевтически приемлемых носителей или эксципиентов.
Настоящее изобретение относится к способу лечения клеточного пролиферативного нарушения, причем указанный способ включает введение нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы IIIa, IVa, IVb, Va или Vb или его фармацевтически приемлемой соли, или пролекарства, метаболита, аналога или производного в сочетании с фармацевтически приемлемым носителем, где указанное клеточное пролиферативное нарушение подвергается лечению.
В одном из вариантов осуществления клеточное пролиферативное нарушение представляет собой рак.
В предпочтительном варианте осуществления соединение выбирают из группы, состоящей из (+)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, (-)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона; или их фармацевтически приемлемых солей, или пролекарств, метаболитов, аналогов или производных.
Настоящее изобретение также относится к способу модулирования активности c-Met, включающему контактирование клетки с эффективным количеством соединения формулы IIIa, IVa, IVb, Va или Vb или его фармацевтически приемлемой соли, или пролекарства, метаболита, аналога или производного, где указанное контактирование приводит к указанному модулированию активности c-Met.
В одном из вариантов осуществления модулирование заключается в ингибировании.
В одном из вариантов осуществления соединение модулирует активность c-Met без существенного модулирования указанной активности протеинкиназы С.
Настоящее изобретение также относится к способу селективного ингибирования активности c-Met в отсутствие ингибирования протеинкиназы С, включающему контактирование клетки с эффективным количеством соединения формулы IIIa, IVa, IVb, Va или Vb или его фармацевтически приемлемой соли, или пролекарства, метаболита, аналога или производного, где указанное контактирование приводит к указанному селективному ингибированию указанной активности c-Met без ингибирования указанной активности протеинкиназы С.
Настоящее изобретение также относится к способу селективного индуцирования клеточной смерти предраковых клеток или раковых клеток, включающему контактирование клетки с эффективным количеством соединения формулы IIIa, IVa, IVb, Va или Vb или его фармацевтически приемлемой соли, или пролекарства, метаболита, аналога или производного, где указанное контактирование приводит к указанному селективному индуцированию клеточной смерти указанных предраковых клеток или указанных раковых клеток.
Кроме того, настоящее изобретение относится к способу лечения рака, включающему селективное модулирование активности c-Met или обеих, без существенного модулирования активности протеинкиназы С.
Далее настоящее изобретение относится к способу скрининга соединений-кандидатов для лечения рака, включающему контактирование клетки с соединением-кандидатом, измерение активности c-Met, измерение активности протеинкиназы С и выбор соединения-кандидата, способного селективно ингибировать активность c-Met без существенного ингибирования активности протеинкиназы С, где указанное соединение-кандидат, способное селективно ингибировать активность c-Met без существенного ингибирования активности протеинкиназы С, представляет собой соединение-кандидат для лечения рака. В одном из вариантов осуществления активность протеинкиназы C измеряют in vitro.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из приведенного дополнительного описания, включая различные примеры. Приведенные примеры иллюстрируют различные компоненты и методики, полезные при практическом осуществлении настоящего изобретения. Примеры не ограничивают заявляемого изобретения. На основании настоящего описания специалист в данной области сможет идентифицировать и использовать другие компоненты и методики, полезные при практическом осуществлении настоящего изобретения.
Краткое описание фиг.1-12
На фиг.1 представлены химические структуры (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На фиг.2 показано действие (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на выживание клеток MDA-MB-231 или Paca-2 in vitro.
На фиг.3 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на выживание клеток MDA-MB-231 in vitro.
На фиг.4 показано действие (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на активность протеинкиназы C in vitro.
На фиг.5 показано ингибирование фосфорилирования c-Met и фосфорилирования ERK1/2 с помощью (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
На фиг.6 показано действие (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, вводимого индивидуально в дозе 160 мг/кг, на рост гетеротрансплантированных опухолей рака молочной железы MDA-MB-231 у не имеющих вилочковой железы голых самок мышей.
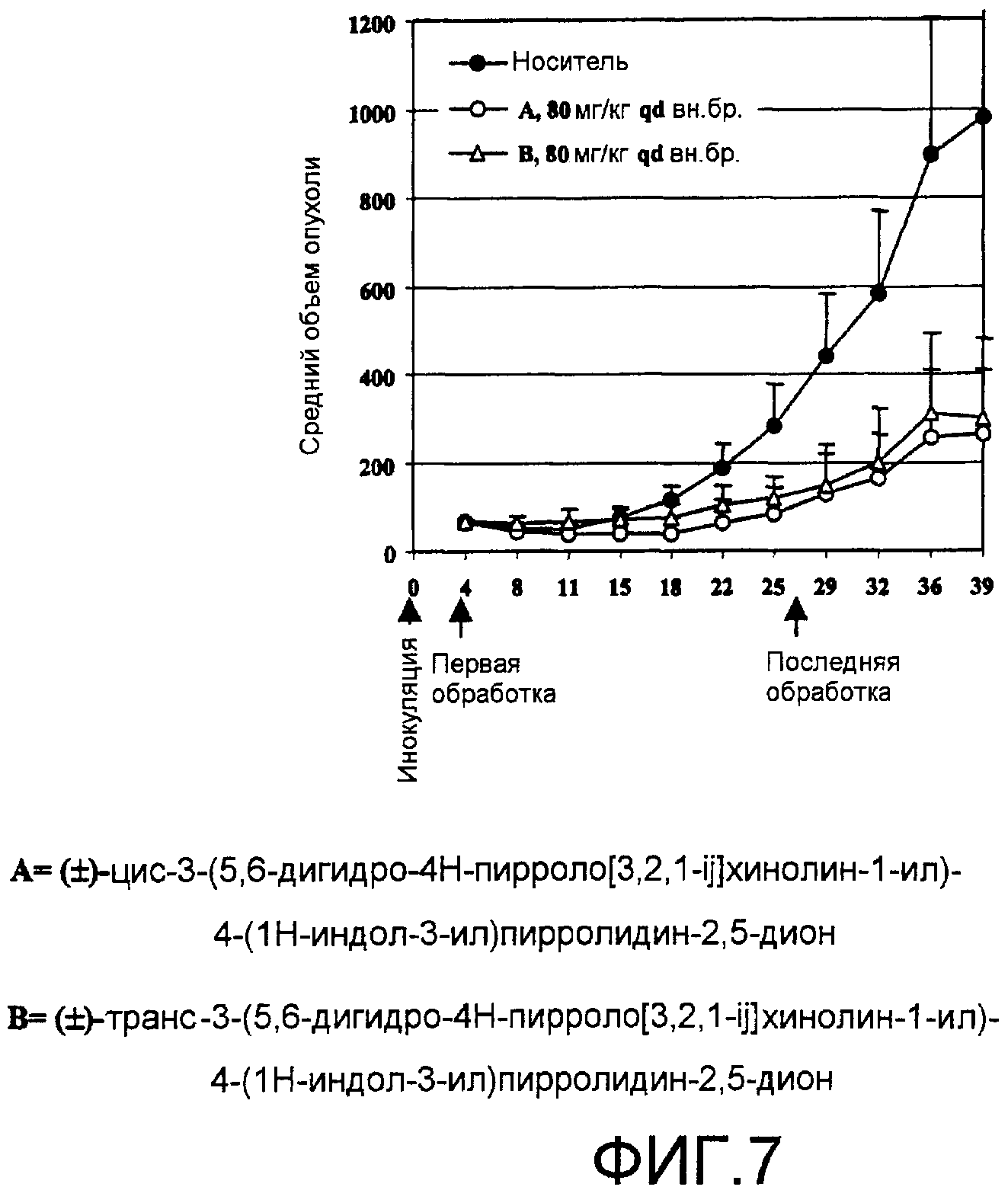
На фиг.7 показано действие (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, вводимого индивидуально в дозе 80 мг/кг, на рост гетеротрансплантированных опухолей рака молочной железы MDA-MB-231 у не имеющих вилочковой железы голых самок мышей.
На фиг.8 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на индуцирование апоптоза раковых клеток.
На фиг.9 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, ингибирующее метастатическую инвазию раковых клеток.
На фиг.10 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на гетеротрансплантированной модели рака молочной железы.
На фиг.11 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на гетеротрансплантированной модели рака толстой кишки.
На фиг.12 показано действие (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на гетеротрансплантированной модели рака поджелудочной железы.
1. Пирролохинолинилпиррол-2,5-дионы и пирролохинолинилпирролидин-2,5-дионы
Настоящее изобретение относится к соединениям пирролохинолинилпиррол-2,5-диона формулы III и IIIa и их синтезу

где R1, R2 и R3 независимо выбирают из группы, состоящей из водорода, F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила и замещенного -O-(C3-C9)циклоалкила, арила, гетероарила, гетероциклила;
R4 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, -CH2R7;
R5, R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила;
R7 независимо выбирают из группы, состоящей из -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил), -O-P(=O)(-O-(C1-C6)алкил)2, -O-P(=O)(-OH)(-O-(CH2)-фенил), -O-P(=O)(-O-(CH2)-фенил)2, группы карбоновой кислоты, группы аминокарбоновой кислоты и пептида;
Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила;
X выбирают из группы, состоящей из -(CH2)-, -(NR8)-, S и O;
R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, -C(=O)-O-(C1-C6)алкила и замещенного -C(=O)-O-(C1-C6)алкила;
Y выбирают из группы, состоящей из -(CH2)- или связи;
где указанные арильная, гетероарильная, -O-арильная, -S-арильная, -O-гетероарильная и -S-гетероарильная группы могут быть замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -арил-(C1-C6)алкила, -арил-O-(C1-C6)алкила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла и -(S(=O)2)-(C1-C6)алкила; и
m равно 1 или 2.
Для соединения формулы IIIa Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила, при условии, что когда R4 представляет собой водород, (C3-C4)циклоалкил или (C1-C4)алкил, Q не является 3-индолилом или замещенным 3-индолилом.
Настоящее изобретение также относится к соединениям пирролохинолинилпирролидин-2,5-диона формулы IVa, IVb, Va или Vb и к способам получения соединений формулы IVa, IVb, Va и Vb:


где R1, R2 и R3 независимо выбирают из группы, состоящей из водорода, F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила и замещенного -O-(C3-C9)циклоалкила, арила, гетероарила, гетероциклила;
R4 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, -CH2R7;
R5, R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила;
R7 независимо выбирают из группы, состоящей из -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил), -O-P(=O)(-O-(C1-C6)алкил)2, -O-P(=O)(-OH)(-O-(CH2)-фенил), -O-P(=O)(-O-(CH2)-фенил)2, группы карбоновой кислоты, группы аминокарбоновой кислоты и пептида;
Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила;
X выбирают из группы, состоящей из -(CH2)-, -(NR8)-, S и O;
R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, -C(=O)-O-(C1-C6)алкила и замещенного -C(=O)-O-(C1-C6)алкила;
Y выбирают из группы, состоящей из -(CH2)- или связи;
где указанные арильная, гетероарильная, -O-арильная, -S-арильная, -O-гетероарильная и -S-гетероарильная группы могут быть замещены одним или несколькими заместителями, независимо выбранными из группы, состоящей из F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -арил-(C1-C6)алкила, -арил-O-(C1-C6)алкила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла и -(S(=O)2)-(C1-C6)алкила; и
m равно 1 или 2.
1.1. Определения
Термин «алкил» относится к радикалам, содержащим углерод и водород и не являющимся ненасыщенными. Алкильные радикалы могут быть линейными или разветвленными. Иллюстративные алкильные радикалы включают, но без ограничения, метил, этил, пропил, изопропил, гексил, трет-бутил, втор-бутил и подобные. Алкильные группы могут быть обозначены с использованием цепи, так, например, (C1-C6)алкильная группа представляет собой алкильную группу, имеющую от одного до шести атомов углерода в линейной или разветвленной алкильной цепи. Замещенные и незамещенные алкильные группы могут независимо представлять собой (C1-C5)алкил, (C1-C6)алкил, (C1-C10)алкил, (C3-C10)алкил или (C5-C10)алкил. Если специально не указано иное, термин «алкил» не включает «циклоалкил».
Термин «циклоалкильная» группа относится к циклической алкильной группе, имеющей указанное число атомов углерода в «кольцевой части», где «кольцевая часть» может состоять из одной или нескольких кольцевых структур, которые являются конденсированными, спиро- или мостиковыми кольцевыми структурами. Например, C3-C6 циклоалкильная группа (например, (C3-C6)циклоалкил) представляет собой кольцевую структуру, имеющую от 3 до 6 атомов углерода в кольце. Когда диапазон не указан, циклоалкильная группа имеет от трех до девяти атомов углерода ((C3-C9)циклоалкил) в кольцевой части. Иллюстративные циклоалкильные группы включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и адамантил. Предпочтительные циклоалкильные группы имеют три, четыре, пять, шесть, семь, восемь, девять или от трех до девяти атомов углерода в кольцевой структуре.
Термины «замещенный алкил» и «замещенный циклоалкил» относятся к алкильным и циклоалкильным группам, как определено выше, замещенным одним или несколькими заместителями, независимо выбранными из группы, состоящей из фтора, арила, гетероарила, -O-(C1-C6)алкила и -NR5R6, где R5 и R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила.
Термин «арил» относится к ароматической карбоциклической группе, имеющей одно, два или три ароматических кольца. Иллюстративные арильные группы включают, но без ограничения, фенил, нафтил и подобные. Арильные группы включают одно, два или три ароматических кольца, конденсированные с одним или несколькими дополнительными неароматическими карбоциклическими или гетероциклическими кольцами, содержащими 4-9 членов. Примеры конденсированных арильных групп включают бензоциклобутанил, инданил, тетрагидронафтиленил, 1,2,3,4-тетрагидрофенантренил, тетрагидроантраценил, 1,4-дигидро-1,4-метанонафталенил, бензодиоксолил.
Термин «гетероарил» относится к гетероароматической (гетероарильной) группе, имеющей одно, два или три ароматических кольца, содержащей 1-4 гетероатома (таких как азот, сера или кислород) в ароматическом кольце. Гетероарильные группы включают одну, две или три ароматические кольцевые структуры, содержащие 1-4 гетероатома, конденсированные с одним или несколькими дополнительными неароматическими кольцами, содержащими 4-9 членов. Гетероарильные группы, содержащие гетероатом единственного типа в ароматическом кольце, обозначают по типу содержащегося в них гетероатома, так выражения азотсодержащий гетероарил, кислородсодержащий гетероарил и серусодержащий гетероарил означают гетероароматические группы, содержащие один или несколько атомов азота, кислорода или серы соответственно. Иллюстративные гетероарильные группы, включают, но без ограничения, пиридил, пиримидинил, тиазолил, хинолил, хиназолинил, тиазолил, бензо[b]тиофенил, фуранил, имидазолил, индолил и подобные.
Термины «гетероциклил» или «гетероцикл» относятся к либо насыщенным либо ненасыщенным стабильным неароматическим кольцевым структурам, которые могут быть конденсированными, спиро- или мостиковыми структурами с образованием дополнительных колец. Каждый гетероцикл состоит или одного или нескольких атомов углерода и от одного до четырех гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. «Гетероциклил» или «гетероцикл» включают стабильные неароматические 3-7-членные моноциклические гетероциклические кольцевые структуры и 8-11-членные бициклические гетероциклические кольцевые структуры. Гетероциклильный радикал может быть присоединен через любой эндоциклический атом углерода или азота, что приводит к созданию стабильной структуры. Предпочтительные гетероциклы включают 3-7-членные моноциклические гетероциклы (более предпочтительно 5-7-членные моноциклические гетероциклы) и 8-10-членные бициклические гетероциклы. Примеры таких групп включают пиперидинил, пиперазинил, пиранил, пирролидинил, морфолинил, тиоморфолинил, оксопиперидинил, оксопирролидинил, оксоазепинил, азепинил, изоксозолил, тетрагидропиранил, тетрагидрофуранил, диоксолил, диоксинил, оксатиолил, дитиолил, сульфоланил, диоксанил, диоксоланил, тетрагидрофуродигидрофуранил, тетрагидропиранодигидрофуранил, дигидропиранил, тетрагидрофурофуранил, тетрагидропиранофуран, хинуклидинил (1-азабицикло[2,2,2]октанил) и тропанил (8-метил-8-азабицикло[3,2,1]октанил).
Применительно к заместителю Q термин «замещенный 3-индолил» относится к 3-индолильной группе, замещенной одним или несколькими заместителями, выбранными из группы, состоящей из F, Cl, Br, I, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -арил-(C1-C6)алкила, -арил-O -(C1-C6)алкила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла и -(S(=O)2)-(C1-C6)алкила; где R5, R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила.
Применительно к заместителю R7 термин «группа карбоновой кислоты» относится к группе, имеющей форму -O-C(=O)-(C1-C6)алкила, -O-C(=O)-(C3-C9)циклоалкила, -O-C(=O)-арила, -O-C(=O)-гетероарила, -O-C(=O)-гетероцикла, -O-C(=O)-(C1-C6)алкиларила, -O-C(=O)-(C1-C6)алкилгетероарила или -O-C(=O)-(C1-C6)алкилгетероцикла. В «группу карбоновой кислоты» включены группы, имеющие форму -O-C(=O)-(C1-C6)алкила, -O-C(=O)-(C3-C9)циклоалкила, -O-C(=O)-арила, -O-C(=O)-гетероарила, -O-C(=O)-гетероцикла, -O-C(=O)-(C1-C6)алкиларила, -O-C(=O)-(C1-C6)алкилгетероарила или -O-C(=O)-(C1-C6)алкилгетероцикла, замещенные одним или несколькими заместителями, независимо выбранными из группы, состоящей из F, Cl, Br, I, -OH, -SH, -NR5R6, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила, -O-(C1-C6)алкила, замещенного -O-(C1-C6)алкила, -S-(C1-C6)алкила, -O-(C3-C9)циклоалкила, замещенного -O-(C3-C9)циклоалкила, -арила, -O-арила, -O-(C1-C4)алкиларила, гетероарила, гетероциклила, -O-(C1-C4)алкилгетероцикла, -(S(=O)2)-(C1-C6)алкила, -NH-C(=NH)-NH2 (т.е. гуанидино), -COOH и -C(=O)-NR5R6, где R5 и R6 независимо выбирают из группы, состоящей из водорода и -(C1-C6)алкила. Кроме того, применительно к заместителю R7 термин «группа аминокарбоновой кислоты» относится к группе карбоновой кислоты, включая группы карбоновых кислот, замещенные одним или несколькими вышеуказанными заместителями, которые содержат одну или несколько независимо выбранных аминогрупп типа -NR5R6, где R5 и R6 независимо выбирают из группы, состоящей из водорода и (C1-C6)алкила.
В одном варианте осуществления данного изобретения R7 представляет собой альфа-амино или иминокислоту, включая, но не ограничиваясь ими, аланин, аргинин, аспарагин, аспартамовую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, валин или их стереоизомерные или рацемические смеси. В другом варианте осуществления данного изобретения R7 представляет собой альфа-амино или иминокислоту, выбранную из группы, состоящей из L-аланина, L-аргинина, L-аспарагина, L-аспартамовой кислоты, L-цистеина, L-глутамина, L-глутаминовой кислоты, L-глицина, L-гистидина, L-изолейцина, L-лейцина, L-лизина, L-метионина, L-фенилаланина, L-пролина, L-серина, L-треонина, L-триптофана, L-тирозина, L-валина.
Применительно к заместителю R7 термин «пептид» относится к дипептиду, трипептиду, тетрапептиду или пентапептиду, который при гидролизе высвобождает две, три, четыре или пять амино или иминокислот (например, пролин) соответственно. Применительно к заместителю R7 пептиды связаны с остатком молекулы через сложноэфирную связь. В одном варианте осуществления пептиды R7 состоят из альфа-амино или иминокислот, включая, но, не ограничиваясь ими, аланин, аргинин, аспарагин, аспартамовую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин, валин или их стереоизомерные или рацемические смеси, и в более предпочтительном варианте данного варианта осуществления карбоксильная группа присоединена сложноэфирной связью к концевой карбоксильной COOH группе пептида в противоположность карбоксилам боковой цепи. В другом варианте осуществления данного изобретения R7 представляет собой альфа-амино или иминокислоту, выбранную из группы, состоящей из L-аланина, L-аргинина, L-аспарагина, L-аспартамовой кислоты, L-цистеина, L-глутамина, L-глутаминовой кислоты, L-глицина, L-гистидина, L-изолейцина, L-лейцина, L-лизина, L-метионина, L-фенилаланина, L-пролина, L-серина, L-треонина, L-триптофана, L-тирозина, L-валина, и в более предпочтительном варианте данного варианта осуществления карбоксильная группа присоединена сложноэфирной связью к концевой карбоксильной COOH группе пептида в противоположность карбоксилам боковой цепи.
1.2. Предпочтительные соединения
В предпочтительные варианты осуществления включены соединения формулы III, IVa, IVb, Va или Vb, где Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила, при условии, что Q не является 3-индолилом или замещенным 3-индолилом. В других предпочтительных вариантах осуществления Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила, при условии, что когда R4 представляет собой водород, циклоалкил или алкил, Q не является 3-индолилом или замещенным 3-индолилом. В других предпочтительных вариантах осуществления Q выбирают из группы, состоящей из арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила, при условии, что когда R4 представляет собой водород, (C3-C4)циклоалкил или (C1-C4)алкил, Q не является 3-индолилом или замещенным 3-индолилом. В другом предпочтительном варианте осуществления Q представляет собой 3-индолил или замещенный 3-индолил при условии, что R4 не является водородом, циклоалкилом или алкилом. Еще в одном предпочтительном варианте осуществления Q представляет собой 3-индолил или замещенный 3-индолил, при условии, что R4 не является водородом, (C3-C4)циклоалкилом или (C1-C4)алкилом.
Другие предпочтительные варианты осуществления включают соединения формулы IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -CH2R7. Данные соединения могут служить пролекарственными формами соответствующих соединений формулы IIIa, IVa, IVb, Va или Vb, где R4 представляет собой Н. Пролекарственная форма расщепляется при гидролизе с высвобождением соответствующего соединения, где R4 представляет собой Н. Гидролиз может протекать ферментативным или неферментативным образом, что приводит к соответствующим гидроксиметиленовым производным, которые при последующем гидролизе приводят к высвобождению соединений, где R4 представляет собой Н. В одном таком предпочтительном варианте осуществления R4 представляет собой -CH2R7, где R7 представляет собой -O-P(=O)(OH)2, -O-P(=O)(-OH)(-O-(C1-C6)алкил) или -O-P(=O)(-O-(C1-C6)алкил)2. В одном варианте осуществления, где R7 представляет собой -O-P(=O)(-O-(C1-C6)алкил)2, алкильные группы выбраны независимо. В другом предпочтительном варианте осуществления R4 представляет собой -CH2R7, где R7 представляет собой группу карбоновой кислоты или группу аминокарбоновой кислоты. Еще в одном предпочтительном варианте осуществления R7 представляет собой пептид, где в более предпочтительном варианте осуществления пептид связан посредством сложноэфирной связи, образованной карбоксильной концевой COOH группой пептидной цепи с остатком соединения. В других предпочтительных отдельных и независимых вариантах осуществления соединений формулы IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -CH2R7, и R7 представляет собой пептид, пептид может представлять собой дипептид, трипептид, тетрапептид или пентапептид. Предпочтительные композиции аминокислот для пептидов функциональной группы R7 описаны выше.
Варианты осуществления соединений формулы III, IIIa, IVa, IVb, Va или Vb включают такие, где X выбирают из группы, состоящей из -(NR8)-, S и O, где R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила и -O-(C1-C6)алкила. Другие варианты осуществления соединений формулы III, IIIa, IVa, IVb, Va или Vb включают такие, где X представляет собой -CH2-. В других вариантах осуществления соединений формулы III, IIIa, IVa, IVb, Va или Vb, X представляет собой кислород (O). В других вариантах осуществления соединений формулы III, IIIa, IVa, IVb, Va или Vb, X представляет собой серу (S). В следующих вариантах осуществления соединений формулы III, IIIa, IVa, IVb, Va или Vb, X представляет собой -(NR8)-, где R8 независимо выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила и -O-(C1-C6)алкила.
Другие предпочтительные варианты осуществления изобретения включают соединения формулы IIIa, где Q представляет собой гетероарильную или необязательно замещенную гетероарильную группу. В четырех отдельных альтернативных предпочтительных вариантах осуществления соединений формулы IIIa Q представляет собой необязательно замещенную моноциклическую гетероарильную группу, необязательно замещенную бициклическую гетероарильную группу, необязательно замещенную бициклическую гетероарильную группу при условии, что бициклическая гетероарильная группа не является индолильной группой или замещенным индолилом, или необязательно замещенную трициклическую гетероарильную группу. Необязательные заместители, в том случае когда они присутствуют, независимо выбирают из приведенных для арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила.
В предпочтительные варианты осуществления данного изобретения включены соединения формулы IVa, IVb, Va или Vb, где Q представляет собой гетероарильную или необязательно замещенную гетероарильную группу. В четырех отдельных альтернативных предпочтительных вариантах осуществления соединений формулы IVa, IVb, Va или Vb, Q представляет собой необязательно замещенную моноциклическую гетероарильную группу, необязательно замещенную бициклическую гетероарильную группу, необязательно замещенную бициклическую гетероарильную группу при условии, что бициклическая гетероарильная группа не является индолилом, или необязательно замещенную трициклическую гетероарильную группу. В более предпочтительном варианте осуществления Q представляет собой необязательно замещенную азотсодержащую гетероарильную группу. В связанном с этим варианте осуществления Q представляет собой необязательно замещенный индолил. Необязательные заместители, в том случае когда они присутствуют, независимо выбирают из приведенных для арила, гетероарила, -O-арила, -S-арила, -O-гетероарила и -S-гетероарила.
Предпочтительные варианты осуществления изобретения включают смеси соединений формулы IVa и IVb, включая рацемические смеси. В другом предпочтительном варианте осуществления соединения формулы IVa и IVb представляют собой индивидуальные энантиомеры (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. В данном варианте осуществления (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион получают в виде смеси, исходя из 1,2,3,4-тетрагидрохинолина и индол-3-ацетамида в качестве исходных веществ. 1,2,3,4-Тетрагидрохинолин преобразовывают в метиловый эфир 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты, как описано в примере 1, стадии 1-5. Метиловый эфир 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты подвергают взаимодействию с индол-3-ацетамидом, как описано в примере 1, стадия 6, получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-дион. Смесь (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона затем получают каталитическим гидрированием, как описано в примере 2, с использованием методики B.
Предпочтительные варианты осуществления изобретения также включают смеси соединений формулы Va и Vb, включая рацемические смеси. В другом предпочтительном варианте осуществления соединения формулы Va и Vb представляют собой индивидуальные энантиомеры (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. В таком варианте осуществления соединения получают в виде смеси, получая сначала (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, как описано выше. Смесь цис-соединений затем обрабатывают смесью трет-бутоксида калия в трет-бутаноле, получая смесь (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, как описано в примере 3.
Подразумеваются все стереоизомеры соединений по настоящему изобретению или в виде смеси или в чистой, или, по существу, чистой форме, включая кристаллические формы рацемических смесей и кристаллические формы индивидуальных изомеров. Определение соединений в соответствии с изобретением охватывает все возможные стереоизомеры (например, R и S конфигурации для каждого асимметрического центра) и их смеси. Изобретение, в частности, включает рацемические формы и выделенные оптические изомеры, обладающие специфической активностью. Рацемические формы могут быть разделены физическими методами, например дробной кристаллизацией, разделением или кристаллизацией диастереомерных производных, разделением с помощью хроматографии на хиральной колонке или сверхкритической жидкостной хроматографией. Индивидуальные оптические изомеры могут быть получены из рацематов с помощью общепринятых способов, таких, например, как образование соли с оптически активной кислотой с последующей кристаллизацией. Кроме того, все геометрические изомеры, такие как E- и Z-конфигурации при двойной связи, включены в объем изобретения, если не указано иное. Некоторые соединения по данному изобретению могут существовать в таутомерных формах. Подразумевается, что все такие таутомерные формы соединений входят в объем изобретения, если не указано иное. Настоящее изобретение также включает одну или несколько региоизомерных смесей аналога или производного.
Как использовано в данном описании, термин «соль» относится к фармацевтически приемлемой соли и может включать кислотно-аддитивные соли, включая гидрохлориды, гидробромиды, фосфаты, сульфаты, гидросульфаты, алкилсульфонаты, арилсульфонаты, ацетаты, бензоаты, цитраты, малеаты, фумараты, сукцинаты, лактаты и тартраты; соли с катионами щелочных металлов, таких как Na+, K+, Li+, щелочно-земельных металлов, таких как Mg или Са, или соли органических аминов.
Как использовано в данном описании, термин «метаболит» означает продукт метаболизма соединения по настоящему изобретению или его фармацевтически приемлемой соли, аналога или производного, который проявляет активность in vivo, аналогичную указанному соединению по настоящему изобретению.
Как использовано в данном описании, термин «пролекарство» означает соединение по настоящему изобретению, ковалентно связанное с одним или несколькими про-фрагментами, такими как фрагмент аминокислоты или другой фрагмент, способствующий солюбилизации в воде. Соединение по настоящему изобретению может высвобождаться из про-фрагмента с помощью гидролитических, окислительных и/или ферментативных механизмов высвобождения. В одном из вариантов осуществления композиция пролекарства по настоящему изобретению проявляет дополнительные преимущества, включающие повышенную растворимость в воде, улучшенную стабильность и улучшенный фармакокинетический профиль. Про-фрагмент может быть выбран таким образом, чтобы придать пролекарству желаемые характеристики. Например, про-фрагмент, т.е. фрагмент аминокислоты или другой фрагмент, способствующий солюбилизации в воде, такой как фосфат, в рамках R4, может быть выбран на основании растворимости, стабильности, биодоступности и/или доставки или поглощения in vivo.
2. Синтез пирролохинолинилпиррол-2,5-дионов и пирролохинолинилпирролидин-2,5-дионов
Стандартные способы синтеза и методики получения органических молекул и трансформации и преобразования функциональных групп, предусматривающие использование защитных групп, могут быть найдены в имеющей отношение научной литературе или в признанных справочных руководствах в данной области. Не ограничиваясь каким-либо одним или несколькими источниками, признанные справочные руководства в области органического синтеза включают: Smith, М.B.; March, J. March'c Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th ed.; John Wiley & Sons: New York, 2001; и Greene, Т.W.; Wuts, P.G.М. Protective Groups in Organic Synthesis, 3rd; John Wiley & Sons: New York, 1999. Следующее далее описание способов синтеза разработано для иллюстрации, но не ограничения общих методик получения соединений по изобретению.
2.1 Общие методики синтеза пирролохинолинилпиррол-2,5-дионов и пирролохинолинилпирролидин-2,5-дионов, где R4 представляет собой водород
Настоящее изобретение относится к соединениям пирролохинолинилпиррол-2,5-диона формулы IIIa, IVa, IVb, Va или Vb. Соединения формулы III, IIIa, IVa, IVb, Va и Vb могут быть получены рядом реакций, начиная с взаимодействия эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты формулы I с амидом формулы II с образованием 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона формулы III, включая соединения формулы IIIa, где R4 представляет собой водород, как показано на схеме 1:
Схема 1

2.1.1. Синтез 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-дионов формулы III, где R4 представляет собой водород
Конденсацию сложного эфира формулы I и соединения формулы II с образованием соединений формулы III, включая соединения формулы IIIa, где R4 представляет собой водород, проводят в любом подходящем безводном полярном апротонном растворителе, включая, но не ограничиваясь ими тетрагидрофуран (ТГФ), тетрагидропиран, диэтиловый эфир и подобные, в присутствии основания. Применительно к данной реакции подходящие сложные эфиры формулы I включают, но не ограничиваясь ими, сложные алкиловые эфиры, где R9 представляет собой (C1-C4)алкильную группу, и предпочтительные сложные эфиры включают сложные метиловый и этиловый эфиры. Подходящие основания для реакции включают соли щелочных металлов низкомолекулярных алкиловых спиртов, включая, но не ограничиваясь ими, соли щелочных металлов метанола, этанола, пропанола, изопропанола, н-бутанола, изобутанола и трет-бутанола. Предпочтительные соли щелочных металлов низкомолекулярных алкиловых спиртов включают соли натрия и калия, где трет-бутоксид калия (tBuOK) является предпочтительным основанием. Обычно реакции проводят при 0°C в течение 2 часов, однако как время, так и температура могут изменяться в зависимости от конкретных заместителей, присутствующих в соединениях формулы I и II, и используемого растворителя. Температура реакции может варьироваться от -78°C до 37°C и предпочтительно составляет от -35°C до 25°C, или более предпочтительно от -15°C до 10°C. Время реакции обычно будет изменяться обратно пропорционально используемой температуре, можно использовать примерно от 15 минут до 24 часов, более предпочтительно от 30 минут до 12 часов и более предпочтительно от 1 до 6 часов.
2.1.2. Получение соединений формулы IVa, IVb, Va и Vb, где R4 представляет собой водород
Восстановление соединения формулы III и IIIa, где R4 представляет собой водород, с получением соответствующих 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионов, имеющих формулу IVa, IVb, Va или Vb, может быть проведено с использованием многочисленных методик, включая, но не ограничиваясь ими, восстановление цинк-ртутью (методика А), каталитическое гидрирование (методика В) и восстановление магнием в метаноле (методика C). Как указано на схеме 1, в зависимости от выбранной реакции восстановления и условий реакция будет приводить главным образом к соединениям формулы IVa и IVb или главным образом к соединениям формулы Va и Vb, или альтернативно к смеси соединений формулы IVa, IVb, Va и Vb.
Смеси соединений формулы IVa, IVb, Va и Vb могут быть получены прямым восстановлением соединения формулы III или IIIa цинк-ртутьвосстанавливающим агентом. Реакцию обычно проводят с использованием свежеприготовленного восстановителя, полученного смешиванием порошкообразного Zn с HgCl2 в деионизированной воде с последующим подкислением с помощью HCl. После сушки твердый восстановитель (цинк-ртуть) является подходящим для восстановления соединения формулы III или IIIa в кипящем с обратным холодильником сухом этаноле в атмосфере сухого газообразного HCl, как описано в примере 2, методика А, для восстановления 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона.
Альтернативным способом получения пирролидин-2,5-дионов является каталитическое гидрирование, которое приводит к смеси, состоящей главным образом из (±)-цис-пирролидин-2,5-дионов формулы IVa и IVb. Каталитическое гидрирование соединений формулы III или IIIa может быть проведено в безводном спирте над катализатором благородного металла в атмосфере водорода при давлении в 1 атм в течение 48 часов. Для проведения восстановления можно использовать различные низкомолекулярные алкиловые спирты, включая н-пропиловый спирт, изопропиловый спирт, этанол или метанол. Предпочтительно спирт представляет собой этанол или метанол и наиболее предпочтительно метанол. Катализатор благородного металла (например, платины, палладия, родия, рутения и т.д.) на угле является предпочтительным для восстановления соединений формул III или IIIa. В более предпочтительных вариантах осуществления катализатор благородного металла представляет собой палладий на активированном угле. Хотя восстановление соединений формул IIIa или III в атмосфере водорода при давлении в 1 атмосферу, при комнатной температуре (25°C) в течение 12-48 часов обычно является подходящим для получения пирролидин-2,5-дионов, при этом давление водорода, время реакции и температура реакции могут изменяться. Каталитическое гидрирование 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона описано в примере 2, методика B.
Пиррол-2,5-дионы формулы IIIa или III могут быть восстановлены, давая смесь соединений формулы Va и Vb при восстановлении в безводном спирте с использованием металлического восстановителя. Предпочтительные металлы включают натрий, кальций и магний, где магний представляет собой более предпочтительный восстановитель. Реакцию обычно проводят в инертной атмосфере азота в течение от 30 минут до 2 часов при кипении с обратным холодильником соединения формулы III или формулы IIIa в спирте, выбранном из группы, состоящей из метанола, этанола н-пропанола и изопропанола, с магниевой стружкой. В предпочтительных вариантах осуществления реакцию проводят в течение примерно 40 минут в метаноле, как описано в примере 2, методика С, с получением (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона.
Соединения IVa и/или IVb, которые имеют заместители в пирролидиновом кольце в цис-конфигурации, могут быть преобразованы в смесь соединений Va и Vb, где заместители находятся в транс-конфигурации, или в смесь всех четырех изомеров формулы IVa, IVb, Va и Vb обработкой основанием в полярном протонном растворителе. Обычно в реакции используют соль щелочного металла (C1-C4)алкилового спирта в спиртовой среде (например, метоксид натрия или калия в метаноле, этоксид натрия или калия в этаноле, трет-бутоксид натрия или калия в трет-бутаноле) с использованием трет-бутоксида калия в трет-бутаноле в качестве смеси предпочтительной соли щелочного металла и растворителя. Реакции обычно проводят при температуре от 0°C до температуры кипения реакционной смеси с обратным холодильником в течение от 4 до 48 часов. В более предпочтительных вариантах осуществления реакцию проводят при температуре от комнатной температуры (25°C) до температуры кипения смеси с обратным холодильником в течение от 8 до 24 часов, и в еще более предпочтительном варианте осуществления реакцию проводят примерно при 50°C в смеси трет-бутоксида калия в трет-бутаноле в течение примерно 16 часов. Короткое время реакции и низкая температура способствуют образованию смесей, все еще содержащих соединения IVa и/или IVb.
2.1.3. Введение арильных или гетероарильных заместителей в соединения III, IIIa, IVa, IVb, Va и Vb
Введение дополнительных замещенных и незамещенных арильных или гетероарильных заместителей в ароматические кольца соединений формулы III, IIIa, IVa, IVb, Va или Vb может быть выполнено взаимодействием замещенной или незамещенной арил- или гетероарилбороновой кислоты с ароматическим галогеновым заместителем в соединениях формулы III, IIIa, IVa, IVb, Va или Vb. Реакцию обычно проводят с использованием нагревания смеси соединения формулы III, IIIa, IVa, IVb, Va или Vb, содержащего арил- или гетероарилбромид или иодид, более предпочтительно арилбромид или гетероарилбромид, с арил- или гетероарилбороновой кислотой в присутствии тетракистрифенилфосфинпалладия в смеси растворителей, состоящей из 5 частей толуола, 5 частей этанола, 1 части насыщенного NaHCO3 и 2 частей воды, при 100°C в атмосфере азота в течение 5 часов. После охлаждения до комнатной температуры смесь экстрагируют этилацетатом и концентрируют. Остаток очищают хроматографией на силикагеле. В предпочтительном варианте осуществления галогенированные соединения формулы III, IIIa, IVa, IVb, Va или Vb содержат галоген в арильной или гетероарильной функциональной группе Q, что приводит к введению замещенной арильной или гетероарильной группы, передаваемой бороновой кислотой к заместителю Q. В более предпочтительном варианте осуществления функциональная группа Q представляет собой бромированную ароматическую или гетероароматическую функциональную группу Q. В другом более предпочтительном варианте осуществления галогенированная функциональная группа Q, взаимодействующая с бороновой кислотой, представляет собой галогенированный 3-индолил. В примерах 31-34 описано введение замещенных и незамещенных ароматических групп в соединения формулы Va и Vb с использованием бромированной функциональной группы Q, где Q представляет собой бромированный 3-индолил.
Ароматические и гетероароматические бороновые кислоты, включающие 2-тиенилбороновую кислоту, 3-тиенилбороновую кислоту и 2-нафтилбороновую кислоту, доступны из множества коммерческих источников, включая Sigma-Aldrich (St. Louis, MO). Альтернативно, ароматические и гетероароматические бороновые кислоты могут быть получены из соответствующих арил- или гетероарилбромидов реакцией с триизопропилборатом в присутствии н-бутиллития с последующим гашением водной HCl (см., например, W. Li, et. al.,J. Organic Chem. 67: 5394-97 (2002) и C.М. Marson, et. al.,Tetrahedron 59: 4377-81 (2003).
2.1.4. Получение соединений формулы III, IIIa, IVa, IVb, Va и Vb, где R4 представляет собой -CH2R7
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой водород, могут быть преобразованы в соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -CH2R7. Преобразование начинают с получения гидроксиметиленовых производных соединений, как указано в их частичных структурах, показанных на схеме 2:
Схема 2

Получение гидроксиметиленовых производных осуществляют взаимодействием соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой Н, с водным формальдегидом в тетрагидрофуране (ТГФ). В обычных условиях реакции используют равные объемы ТГФ и 37% формальдегида в воде при перемешивании реакционной смеси в течение 14-16 часов при комнатной температуре. Время и температура реакции могут варьироваться от 1 часа до 48 часов, и температура может составлять от 0°C до 50°C или более предпочтительно от 10°C до 37°C. После завершения реакции реакционную смесь распределяют между водой и органическим растворителем, обычно этилацетатом. Органический слой сушат над сульфатом натрия, концентрируют и подвергают хроматографии на силикагеле, как это требуется, получая гидроксиметиленовый продукт. Получение гидроксиметиленового производного 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-диона, описано в примере 56, стадия 1.
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -CH2R7, и R7 представляет собой фосфат (-O-P(=O)(OH)2), моноалкилфосфат (например, -O-P(=O)(-OH)(-O-(C1-C6)алкил)), диалкилфосфат (например, -O-P(=O)(-O-(C1-C6)алкил)2), сложный монобензилфосфатный эфир (-O-P(=O)(-OH)(-O-(CH2)-фенил)) или сложный дибензилфосфатный эфир (-O-P(=O)(-O-(CH2)-фенил)2), может быть получено из желаемого гидроксиметиленового производного и подходящим образом замещенной фосфорной кислоты с помощью любой реакции, подходящей для образования фосфатной сложноэфирной связи между соединением фосфорной кислоты и гидроксиметиленовым производным. В предпочтительном способе образование сложных фосфатных эфиров проводят путем взаимодействия гидроксиметиленовых производных соединения формулы III, IIIa, IVa, IVb, Va или Vb с подходящим образом защищенным фосфорамидатом с последующим снятием защитных групп. Реакции с целевыми фосфорамидатами обычно проводят при комнатной температуре в безводном ТГФ. После добавления фосфорамидата реакционную смесь обрабатывают тетразолом (3% в ацетонитриле) и перемешивают в течение 5 минут до 1 часа, затем реакционную смесь охлаждают до -78°C. Охлажденную реакционную смесь обрабатывают м-хлорпербензойной кислотой и после перемешивания при -78°C в течение 5 минут реакционную смесь нагревают до комнатной температуры и дополнительно перемешивают в течение 5 минут. После удаления растворителя продукт очищают флэш-хроматографией на силикагеле с использованием смеси этилацетат-гексан. Защитные группы удаляют с помощью подходящих реакций снятия защитных групп. Когда используемый фосфорамидат представляет собой дибензилфосфорамидат, бензильные защитные группы могут быть удалены гидрированием соединения над Pd/C в атмосфере водорода при давлении в 1 атм при комнатной температуре. Получение моно[3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового]эфира фосфорной кислоты из 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-диона описано в примере 56, стадии 2-3.
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R7 представляет собой группу карбоновой кислоты или группу аминокарбоновой кислоты, могут быть получены конденсацией желаемого гидроксиметиленового производного с карбоновой кислотой или аминокарбоновой кислотой (аминокислотой) в условиях, подходящих для образования сложноэфирной связи. Различные дегидратирующие агенты, включающие DCC (дициклогексилкарбодиимид), HBTU (гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония) или BOP (гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония), можно использовать для управления образованием сложноэфирной связи. В предпочтительном варианте осуществления реакции проводят в безводном ТГФ в присутствии HBTU и DIEPA (N,N-диизопропилэтиламин) при комнатной температуре в течение от 10 до 24 часов. После завершения реакции дегидратации растворитель удаляют при пониженном давлении и соединения помещают в органический растворитель (например, этилацетат) и промывают водой. Органический слой сушат и остаток очищают хроматографией на силикагеле при необходимости.
Когда R7 представляет собой группу аминокарбоновой кислоты, исходные вещества для введения группы аминокарбоновой кислоты должны содержать подходящим образом защищенный амин. Преимущественно можно использовать различные подходящие аминозащитные группы, включая карбобензилоксизащищенные амины (например, реакции можно проводить с использованием N-карбобензилоксиглицина или N-карбобензилоксиаланина и т.д.). Последующее снятие защитных групп будет приводить к свободному продукту. Когда используемая защитная группа представляет собой карбобензилокси, снятие защитной группы может быть выполнено обработкой продукта с защищенной аминогруппой, суспендированного с метаноле, HCl (4M) в этилацетате в присутствии палладия-на-угле (Pd/C) в атмосфере водорода при давлении в 1 атм в течение 1-3 часов при комнатной температуре. В примерах 58-60 описано получение соединений, где R7 представляет собой группу карбоновой кислоты или группу аминокарбоновой кислоты.
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R7 представляет собой пептид, могут быть получены конденсацией желаемого гидроксиметиленового производного с пептидом, содержащим свободную группу карбоновой кислоты с образованием сложноэфирной связи. Связывание карбоксильной функциональной группы пептида и гидроксиметиленовой группы в сложноэфирную связь может быть проведено с использованием подходящим образом защищенного пептида, имеющего, например, защищенные свободные аминогруппы, защищенные подходящими N-защитными группами. Условия, подходящие для образования сложноэфирной связи, включают условия с использованием дегидратирующих агентов, таких, как описано для получения соединений формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -CH2R7, и R7 представляет собой группу карбоновой кислоты или группу аминокарбоновой кислоты.
2.1.5. Получение соединений формулы III, IIIa, IVa, IVb, Va и Vb, где R4 представляет собой -(C1-C6)алкил
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -(C1-C6)алкил, могут быть получены взаимодействием целевых соединений формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой Н, с (C1-C6)алкилгалогенидом, где галоген предпочтительно представляет собой Cl, Br или I, в присутствии подходящего основания при комнатной температуре. Подходящие основания включают органические основания, такие как трет-бутоксид калия, метоксид натрия, и неорганические основания, такие как KOH, NaOH и K2CO3. Подходящие растворители включают полярные апротонные растворители, такие как ДМСО, ТГФ, диоксан и другие простые эфиры, или ДМФА. В альтернативном варианте осуществления взаимодействие соединений формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой Н, проводят с органическим или неорганическим основанием, получая сопряженное основание соединения формулы III, IIIa, IVa, IVb, Va или Vb, и сопряженное основание затем подвергают взаимодействию с алкилгалогенидом. Когда алкильную группу вводят в соединение формулы III или IIIa, полученные алкилированные соединения могут быть восстановлены с получением соединений формулы IVa и IVb, Va и Vb или смеси соединений формулы IVa, IVb, Va и Vb, при использовании методик восстановления, описанных в разделе I(b)(1). В примере 61 описано получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпиррол-2,5-диона с использованием иодметана в качестве алкилирующего агента и его восстановление каталитическим гидрированием с получением (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпирролидин-2,5-диона.
Соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой -(C1-C6)алкильную группу, также может быть получено взаимодействием желаемого соединения формулы III, IIIa, IVa, IVb, Va или Vb, где R4 представляет собой Н, с (C1-C6)алкиловым спиртом в присутствии диэтилазодикарбоксилата (DEAD) и трифенилфосфина (см., например, Mitsunobu, O.; Wade, М.; Sano, Т.J. Am Chem. Soc. 94: 694 (1972); Hughes, D.L., Organic Reactions, 42; 335-656(1992)). Реакции могут быть проведены в различных растворителях, включающих тетрагидрофуран (ТГФ), дихлорметан, хлороформ, ацетонитрил и бензол, предпочтительно растворителем является ТГФ.
2.1.6. Разделение соединений формулы III, IIIa, IVa, IVb, Va и Vb
Когда необходимо выделение индивидуальных продуктов, имеющих структуры формулы III, IIIa, IVa, IVb, Va или Vb, продукты могут быть разделены хроматографией на одной или более хроматографических средах. Хроматография может быть проведена в препаративном масштабе или в аналитическом масштабе для установления идентичности и чистоты продуктов, присутствующих в образце. Хотя для разделения преимущественно можно использовать любую хроматографическую среду, включая, но не ограничиваясь ими, силикагель, обращенную фазу, ионообменную смолу, хиральную хроматографическую среду или любую их комбинацию, пригодность конкретной хроматографической среды и условия для разделения продуктов, формулы III, IIIa, IVa, IVb, Va и Vb, будет зависеть от заместителей, присутствующих в соединениях. В предпочтительных вариантах осуществления разделение проводят посредством ВЭЖХ. В других предпочтительных вариантах осуществления разделение проводят с использованием сверхкритической жидкостной хроматографии. Когда используется сверхкритическая жидкостная хроматография, CO2 или смеси CO2 с другими растворителями, включая ацетонитрил (ACN), метанол, этанол, изопропанол или гексан, являются предпочтительной подвижной фазой, при этом смеси CO2и метанола являются наиболее предпочтительными. При сверхкритической жидкостной хроматографии (стационарные фазы) можно использовать различные хроматографические среды, включая, но не ограничиваясь ими: ChiralCel OA, OB, OD или OJ; ChiralPak AD или AS; Cyclobond I, II, или III; и Chirobiotic Т, V и R.
В более предпочтительных вариантах осуществления, где продукты представляют собой индивидуальные изомеры формулы IVa, IVb, Va или Vb, смеси, содержащие две или больше изомерных форм, могут быть разделены с использованием сверхкритической жидкостной хроматографии на хиральной среде. В одном более предпочтительном варианте осуществления разделение проводят на колонках CHIRALPAK® AD (Daicel (U.S.A.) Inc. Fort Lee, NJ). В таком варианте осуществления продукты наносят на колонку AD в смеси метанола и ацетонитрила или в ацетонитриле, и колонку затем элюируют 35% метанолом в CO2 (65%). Разделение 3(R),4(S)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и 3(S),4(R)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона на колонке CHIRALPAK® AD представлено в примере 4. Разделение (+) транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (-) транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона представлено в примере 5.
Индивидуальные рацемические формы соединений формулы III, IIIa, IVa, IVb, Va или Va также могут быть разделены физическими методами, например, такими как дробная кристаллизация или кристаллизация диастереомерных производных. Дополнительно индивидуальные оптические изомеры могут быть получены из рацемических смесей обычными способами, например, такими как образование соли с оптически активной кислотой, где это применимо с последующей кристаллизацией.
2.2. Получение соединения формулы I и II, где Y представляет собой связь
Соединения формулы I и II, которые используются для синтеза пирролохинолинилпиррол-2,5-дионов формулы III и IIIa, могут быть куплены или получены с использованием различных путей синтеза, как указано ниже.
2.2.1. Получение соединения формулы I, где Y представляет собой связь
Соединения формулы I могут быть получены из соответствующего соединения формулы A, где X выбирают из группы, состоящей из -(CH2)-, -(NR8)-, S и O, R8 выбирают из группы, состоящей из водорода, -(C1-C6)алкила, замещенного -(C1-C6)алкила, -(C3-C9)циклоалкила, замещенного -(C3-C9)циклоалкила и -O-(C1-C6)алкила, и m равно 1 или 2. Иллюстративные соединения формулы A включают 1,2,3,4-тетрагидрохинолин, 1,2,3,4-тетрагидрохиноксалин, 3,4-дигидро-2H-бензо[1,4]оксазин, 3,4-дигидро-2H-бензо[1,4]тиазин, 2,3,4,5-тетрагидро-1H-бензо[b]азепин, 2,3,4,5-тетрагидро-1H-бензо[b][1,4]диазепин, 6,7,8,9-тетрагидро-5-окса-9-азабензоциклогептен или 2,3,4,5-тетрагидробензо[b][1,4]тиазепин. Получение начинают с преобразования соединения формулы А в соответствующий этиловый эфир 3-замещенной-2-оксопропионовой кислоты формулы В. Этиловый эфир формулы В подвергают циклизации с образованием соединения формулы С, которое преобразовывают в свободную кислоту D, которую декарбоксилируют, получая целевой трициклический продукт Е. Последующее взаимодействие трициклического продукта E с оксалилхлоридом и обработка спиртовым основанием приводят к соответствующему соединению формулы I. На схеме 3 проиллюстрирована последовательность реакций, начиная с соединения формулы A, которая дополнительно проиллюстрирована в примере 1, стадии 1-5, получения метилового эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты формулы I из 1,2,3,4-тетрагидрохинолина и бромэтилпирувата (этиловый эфир 3-бромпировиноградной кислоты).
Некоторые подходящие условия для преобразования соединения формулы A в соединения формулы I в соответствии с последовательностью реакций схемы 3 приведены в данном описании. Соединения формулы А могут быть преобразованы в соответствующий этиловый эфир 3-замещенной-2-оксопропионовой кислоты формулы В обработкой бромэтилпируватом в безводном простом эфире, таком как ТГФ, при комнатной температуре в течение примерно 24 часов. Обработка этилового эфира 3-замещенной-2-оксопропионовой кислоты формулы B безводным MgCl2 в 2-метоксиэтаноле при примерно 125°C в течение от 30 минут до 2 часов, предпочтительно в течение 1 часа, приводит к образованию соответствующего эфира трициклической карбоновой кислоты формулы С. Последующее преобразование данного соединения в свободную кислоту формулы D может быть осуществлено путем гидролиза в водном основании. В предпочтительных вариантах осуществления реакцию проводят в водном основании, включая, но не ограничиваясь ими, NaOH или KOH, в присутствии спирта в качестве сорастворителя. Предпочтительные спирты-сорастворители включают метанол, этанол, н-пропанол и изопропанол, где этанол является более предпочтительным сорастворителем. Реакции обычно проводят путем нагревания смеси при кипении с обратным холодильником в течение 2 часов, хотя время и температура реакции могут изменяться по необходимости. Окислительное декарбоксилирование соединения формулы D можно проводить с использованием различных методик, подходящих для декарбоксилирования ароматических кислот. В предпочтительных вариантах осуществления декарбоксилирование соединения формулы D проводят путем нагревания свободной кислоты с хромитом меди (CuO-Cr2O3) в хинолоне в течение примерно 2 часов, получая декарбоксилированный продукт формулы Е. Преобразование соединения формулы E в соединение формулы I может быть осуществлено реакцией с оксалилхлоридом с последующей обработкой смесью безводного спирта и соли щелочного металла со спиртом, предпочтительно метоксидом натрия или этоксидом натрия. Реакцию оксалилхлорида с соединением формулы E обычно проводят в безводных полярных апротонных растворителях, включая простые эфиры, при температуре примерно от -78°C до примерно 10°C. В предпочтительных вариантах осуществления реакцию проводят при температуре примерно от -25°C до примерно 5°C с использованием простого эфира в качестве растворителя. В более предпочтительных вариантах осуществления реакцию проводят при 0°C. Предпочтительные растворители для проведения реакции включают, но не ограничиваются ими, тетрагидрофуран (ТГФ), тетрагидропиран, диэтиловый эфир и подобные.
Схема 3. Получение соединений формулы I, где Y представляет собой связь:

2.2.2. Получение соединения формулы II
Соединения формулы II, которые представляют собой замещенные ацетамиды, могут быть закуплены или получены из коммерчески доступных исходных веществ. Коммерчески доступные ацетамиды, включающие индол-3-ацетамид, 2-(5-метил-1H-индол-3-ил)ацетамид, 2-(5-метокси-1H-индол-3-ил)ацетамид, 2-(4-гидрокси-1H-индол-3-ил)ацетамид, 2-фенилацетамид, 2-(4-метилфенил)ацетамид, 4-гидроксифенилацетамид, 4-гидроксифенилацетамид, N-циклопентил-2-(4-гидрокси-2-оксо-1,2-дигидро-3-хинолинил)ацетамид, 2-феноксиацетамид, 2-(2-метилфенокси)ацетамид, 2-(4-фторфенокси)ацетамид, 2-(4-пиридинил)ацетамид и 2-[(4-хлорфенил)сульфанил]ацетамид, доступны из различных источников, включая Sigma Aldrich Chemical Co., St. Louis Mo. Соединение формулы II также может быть получено из соответствующей свободной кислоты путем преобразования свободной кислоты в ее хлорангидрид с последующей реакцией с аммиаком.
2.3. Дополнительные пути получения пирролохинолинилпирролидин-2,5-дионов
В дополнение к путям получения пирролохинолинилпирролидин-2,5-дионов, описанным выше, дополнительные пути получения соединений, проиллюстрированные для (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, описаны в примерах 62-64.
3. Способы лечения
Как использовано в данном описании, термин «субъект» означает любое млекопитающее, например человека, примата, мышь, крысу, собаку, кошку, корову, лошадь, свинью, овцу, козу, верблюда. В предпочтительном аспекте субъектом является человек.
Как использовано в данном описании, выражение «нуждающийся в этом субъект» относится к субъекту, для которого существует повышенный риск развития клеточного пролиферативного нарушения по сравнению с популяцией в целом. В одном аспекте нуждающийся в этом субъект находится в предраковом состоянии. В предпочтительном аспекте у нуждающегося в этом субъекта имеется рак.
Как использовано в данном описании, термин «клеточное пролиферативное нарушение» относится к состояниям, при которых нарушенная регуляция или аномальный рост клеток, или и то и другое могут приводить к развитию нежелательного состояния или заболевания, которые могут иметь или не иметь раковый характер. В одном аспекте клеточное пролиферативное нарушение включает нераковые состояния, например ревматоидный артрит; воспаление; аутоиммунное заболевание; лимфопролиферативные состояния; акромегалию; ревматоидный спондилит; остеоартрит; подагру; другие артритные состояния; сепсис; септический шок; эндотоксический шок; грам-отрицательный сепсис; синдром токсического шока; астму; респираторный дистресс-синдром у взрослых; хроническое обструктивное заболевание легких; хроническое воспаление легких; воспалительное заболевание кишечника; болезнь Крона; псориаз; экзему; язвенный колит; панкреатический фиброз; гепатический фиброз; острое и хроническое заболевание почек; синдром воспаленного кишечника; изжогу; рестеноз; церебральную малярию; инсульт и ишемическое повреждение; нейтральную травму; болезнь Альцгеймера; болезнь Хантингтона; болезнь Паркинсона; острую и хроническую боль; аллергический ринит; аллергический конъюнктивит; хроническую сердечную недостаточность; острый коронарный синдром; кахексию; малярию; проказу; лейшманию; болезнь Лима; синдром Рейтера; острый синовит; дегенерацию мышц; бурсит; тендинит; теносиновит; грыжу, разрыв или выпадение межпозвонкового диска; остеопетроз; тромбоз; рестеноз; силикоз; саркоз легких; заболевания, связанные с резорбцией костной ткани, такие как остеопороз; реакцию отторжения трансплантата; рассеянный склероз; волчанку; фибромиалгию; СПИД и другие вирусные заболевания, такие как опоясывающий герпес; простой герпес типа I или II, вирус гриппа и цитомегаловирус; и сахарный диабет. В другом аспекте клеточное пролиферативное нарушение является предраковым или предракоподобным состоянием. В другом аспекте клеточное пролиферативное нарушение включает рак. Различные виды рака с целью лечения включают, но не ограничиваются ими, рак молочной железы, рак легких, проктологический рак, рак поджелудочной железы, рак яичника, рак предстательной железы, почечную карциному, гепатому, рак мозга, меланому, множественную миелому, хроническую миелогенную лейкемию, гематологическую опухоль и лимфоидную опухоль, включая метастатические патологические изменения других тканей и органов, расположенных в отдалении от первичного местоположения опухоли. Виды рака с целью лечения включают, но не ограничиваются ими, саркому, карциному и аденокарциному. В одном аспекте термин «предраковая клетка» или «предракоподобная клетка» относится к клетке, которая проявляет клеточное пролиферативное нарушение, которое является предраковым или предракоподобным состоянием. В другом аспекте термины «раковая клетка» или «ракоподобная клетка» относятся к клетке, проявляющей клеточное пролиферативное нарушение, которое представляет собой рак. Для идентификации раковых клеток или предраковых клеток можно использовать любые воспроизводимые способы измерения. В предпочтительном аспекте раковые клетки или предраковые клетки идентифицируют с помощью гистологической типизации или классификации образца ткани (например, образец биопсии). В другом аспекте раковые клетки или предраковые клетки идентифицируют с помощью подходящих молекулярных маркеров.
Выражение «клеточное пролиферативное нарушение гематологической системы» относится к клеточному пролиферативному нарушению, включающему клетки гематологической системы. В одном аспекте клеточное пролиферативное нарушение гематологической системы включает лимфому, лейкоз, миелоидные новообразования, новообразования тучных клеток, миелодисплазию, доброкачественную моноклональную гаммопатию, лимфоматоидный гранулематоз, лимфоматоидный папулез; истинную полицитемию, хроническую миелоцитную лейкемию, миелоидную метаплазию неясной этилогогии и эссенциальную тромбоцитопению. В другом аспекте клеточное пролиферативное нарушение гематологической системы включает гиперплазию, дисплазию и метаплазию клеток гематологической системы. В предпочтительном аспекте композиции по настоящему изобретению можно использовать для лечения рака, выбранного из группы, состоящей из гематологического рака по настоящему изобретению или гематологического клеточного пролиферативного нарушения по настоящему изобретению. В одном аспекте гематологический рак по настоящему изобретению включает множественную миелому, лимфому (включая лимфому Ходжкина, лимфому неходжкиновского типа, детские лимфомы и лимфомы лимфоцитного и кожного происхождения), лейкоз (включая детский лейкоз, лейкоз волосистых клеток, острый лимфоцитный лейкоз, острый миелоцитный лейкоз, хронический лимфоцитный лейкоз, хронический миелоцитный лейкоз, хронический миелогенный лейкоз и лейкоз тучных клеток), миелоидные новообразования и новообразования тучных клеток.
Выражение «клеточное пролиферативное нарушение легкого» относится к клеточному пролиферативному нарушению, включающему клетки легкого. В одном аспекте клеточные пролиферативные нарушения легких включают все виды клеточных пролиферативных нарушений, поражающих клетки легких. В одном аспекте клеточные пролиферативные нарушения легких включают рак легких, предраковое и предракоподобное состояние легкого, доброкачественные опухоли и патологические изменения легкого, злокачественные опухоли и патологические изменения легкого, и метастатические поражения тканей и органов организма, отличающихся от легких. В предпочтительном аспекте композиции по настоящему изобретению можно использовать для лечения рака легкого или клеточных пролиферативных нарушений легких. В одном аспекте рак легких включает все формы рака легкого. В другом аспекте рак легких включает злокачественные новообразования в легких, карциному in situ, типичные карциноидные опухоли и атипичные карциноидные опухоли. В другом аспекте рак легких включает мелкоклеточный рак легких (SCLC), немелкоклеточный рак легких (NSCLC), плоскоклеточную карциному, аденокарциному, карциному мелких клеток, карциному больших клеток, аденоплоскоклеточную карциному и мезотелиому. В другом аспекте рак легких включает травматическую карциному, бронхоальвеолярную карциному, гигантоклеточную карциному, карциному веретенообразных клеток и нейроэндокринную карциному больших клеток. В другом аспекте рак легких включает новообразования в легких, имеющие гистологическую и ультраструктурную гетерогенность (например, смешанные типы клеток).
В одном аспекте клеточные пролиферативные нарушения легких включают все формы клеточных пролиферативных нарушений, поражающих клетки легких. В одном аспекте клеточные пролиферативные нарушения легких включают рак легких, предраковое состояние легкого. В одном аспекте клеточные пролиферативные нарушения легких включают гиперплазию, метаплазию и дисплазию легкого. В другом аспекте клеточные пролиферативные нарушения легких включают индуцированную асбестом гиперплазию, чешуйчатую метаплазию и доброкачественную реактивную мезотелиальную метаплазию. В другом аспекте клеточные пролиферативные нарушения легких включают замену цилиндрического призматического эпителия многослойным чешуйчатым эпителием и слизистую дисплазию. В другом аспекте индивидуумы, подверженные воздействию повреждающих агентов окружающей среды, таких как сигаретный дым и асбест, могут обладать повышенным риском развития клеточных пролиферативных нарушений легких. В другом аспекте предшествующие заболевания легких могут вызвать предрасположенность у индивидуумов к развитию клеточных пролиферативных нарушений легких, включая хроническое внутритканевое заболевание легких, некрозное заболевание легких, склеродерму, ревматоидное заболевание, саркоидоз, внутритканевую пневмонию, туберкулез, рецидивирующие пневмонии, идиопатический фиброз легких, гранулематоз, асбестоз, фиброзный альвеолит и болезнь Ходжкина.
Выражение «клеточное пролиферативное нарушение толстой кишки» относится к клеточному пролиферативному нарушению, включающему клетки толстой кишки. В предпочтительном аспекте клеточное пролиферативное нарушение толстой кишки представляет собой рак толстой кишки. В предпочтительном аспекте композиции по настоящему изобретению можно использовать для лечения рака толстой кишки или клеточных пролиферативных нарушений толстой кишки. В одном аспекте рак толстой кишки включает все формы рака толстой кишки. В другом аспекте рак толстой кишки включает спорадический и наследственный рак толстой кишки. В другом аспекте рак толстой кишки включает злокачественные новообразования толстой кишки, карциному in situ, типичные карциноидные опухоли и атипичные карциноидные опухоли. В другом аспекте рак толстой кишки включает аденокарциному, карциному, плоскоклеточную карциному и аденоплоскоклеточную карциному. В другом аспекте рак толстой кишки связан с наследственным синдромом, выбранным из группы, состоящей из наследственного неполипозного проктологического рака, наследственного аденоматозного полипоза, синдрома Гарднера, синдрома Пейц-Джеггера, синдрома Таркота и ювенильного полипоза. В другом аспекте причиной рака толстой кишки является наследственный синдром, выбранный из группы, состоящей из наследственного неполипозного проктологического рака, наследственного аденоматозного полипоза, синдрома Гарднера, синдрома Пейц-Джеггера, синдрома Таркота и ювенильного полипоза.
В одном аспекте клеточные пролиферативные нарушения толстой кишки включают все виды клеточных пролиферативных нарушений, поражающих толстую кишку. В одном аспекте клеточные пролиферативные нарушения толстой кишки включают рак толстой кишки, предраковое состояние толстой кишки, аденоматозные полипы толстой кишки и метахронные патологические поражения толстой кишки. В одном аспекте клеточное пролиферативное нарушение толстой кишки включает аденому. В одном аспекте клеточные пролиферативные нарушения толстой кишки характеризуются гиперплазией, метаплазией и дисплазией толстой кишки. В другом аспекте предшествующие по времени заболевания толстой кишки, которые могут способствовать развитию у индивидуумов клеточных пролиферативных нарушений толстой кишки, включают предшествующий рак толстой кишки. В другом аспекте имеющееся в настоящее время заболевание, которое может способствовать развитию у индивидуумов клеточных пролиферативных нарушений толстой кишки, включает болезнь Крона и язвенный колит. В одном аспекте клеточное пролиферативное нарушение толстой кишки связано с мутацией гена, выбранного из группы, состоящей из p53, ras, FAP и DCC. В другом аспекте индивидуум имеет повышенный риск развития клеточного пролиферативного нарушения толстой кишки вследствие наличия мутации гена, выбранного из группы, состоящей из p53, ras, FAP и DCC.
Выражение «клеточное пролиферативное нарушение предстательной железы» относится к клеточному пролиферативному нарушению, включающему клетки предстательной железы. В одном аспекте клеточные пролиферативные нарушения предстательной железы включают все формы клеточных пролиферативных нарушений, поражающих клетки предстательной железы. В одном аспекте клеточные пролиферативные нарушения предстательной железы включают рак предстательной железы, предраковое или предракоподобное состояние предстательной железы, доброкачественные опухоли или патологические изменения предстательной железы, злокачественные опухоли или патологические изменения предстательной железы, и метастатические патологические изменения тканей и органов организма, отличных от предстательной железы. В другом аспекте клеточные пролиферативные нарушения предстательной железы включают гиперплазию, метаплазию и дисплазию предстательной железы.
Выражение «клеточное пролиферативное нарушение кожи» относится к клеточному пролиферативному нарушению, включающему клетки кожи. В одном аспекте клеточные пролиферативные нарушения кожи включают все формы клеточных пролиферативных нарушений, поражающих клетки кожи. В одном аспекте клеточные пролиферативные нарушения кожи включают предраковые или предракоподобные состояния кожи, доброкачественные опухоли или патологические изменения кожи, меланому, злокачественную меланому и другие злокачественные опухоли или патологические изменения кожи, и метастазные патологические изменения тканей и органов организма, отличных от кожи. В другом аспекте клеточные пролиферативные нарушения кожи включают гиперплазию, метаплазию и дисплазию кожи.
Выражение «клеточное пролиферативное нарушение яичника» относится к клеточному пролиферативному нарушению, включающему клетки яичника. В одном аспекте клеточные пролиферативные нарушения яичников включают все формы клеточных пролиферативных нарушений, поражающих клетки яичников. В одном аспекте клеточные пролиферативные нарушения яичников включают предраковое или предракоподобное состояние яичников, доброкачественные опухоли или патологические изменения яичников и метастатические патологические изменения тканей и органов организма, отличных от яичников. В другом аспекте клеточные пролиферативные нарушения кожи включают гиперплазию, метаплазию и дисплазию яичников.
Выражение «клеточное пролиферативное нарушение молочной железы» относится к клеточному пролиферативному нарушению, включающему клетки молочной железы. В одном аспекте клеточные пролиферативные нарушения молочной железы включают все формы клеточных пролиферативных нарушений, поражающих клетки молочной железы. В одном аспекте клеточные пролиферативные нарушения молочной железы включают рак молочной железы, предраковое или предракоподобное состояние молочной железы, доброкачественные опухоли или патологические изменения молочной железы и метастазные патологические изменения тканей и органов организма, отличных от молочной железы. В другом аспекте клеточные пролиферативные нарушения молочной железы включают гиперплазию, метаплазию и дисплазию молочной железы.
В одном аспекте клеточное пролиферативное нарушение молочной железы представляет собой предраковое состояние молочной железы. В одном аспекте композиции по настоящему изобретению можно использовать для лечения предракового состояния молочной железы. В одном аспекте предраковое состояние молочной железы включает атипичную гиперплазию молочной железы, карциному молочных протоков in situ (DCIS), внутрипротоковую карциному, лобулярную карциному in situ (LCIS), лобулярную неоплазию или 0 стадию роста или поражения молочной железы (например, 0 стадию или 0 степень рака молочной железы или карциномы in situ). В другом аспекте предраковое состояние молочной железы было классифицировано по стадии развития в соответствии со схемой классификации TNM, как принято Американским объединенным раковым комитетом (American Joint Committee on Cancer (AJCC)), где первичная опухоль (Т) отнесена к стадии T0 или Tis; и где местные лимфатические узлы (N) отнесены к стадии N0; и где отдаленные метастазы (М) отнесены к стадии M0.
В предпочтительном аспекте клеточное пролиферативное нарушение молочной железы представляет собой рак молочной железы. В предпочтительном аспекте композиции по настоящему изобретению можно использовать для лечения рака молочной железы. В одном аспекте рак молочной железы включает все формы рака молочной железы. В одном аспекте рак молочной железы включает первичный эпителиальный рак молочной железы. В другом аспекте рак молочной железы включает рак, в который молочная железа вовлечена посредством других опухолей, таких как лимфома, саркома или меланома. В другом аспекте рак молочной железы включает карциному молочной железы, карциному протоков молочной железы, лобулярную карциному молочной железы, недифференцированную карциному молочной железы, цистосаркому филлодия молочной железы, ангиосаркому молочной железы и первичную лимфому молочной железы. В одном аспекте рак молочной железы включает стадии I, II, IIIA, IIIB, IIIC и IV рака молочной железы. В одном аспекте карцинома протоков молочной железы включает инвазивную карциному in situ с доминирующей внутрипротоковой компонентой, воспалительный рак молочной железы и карциному протоков молочной железы, имеющей гистологический тип, выбранный из группы, состоящей из угревидного, слизеобразующего (коллоидного), медуллярного, медуллярного с лимфоцитным инфильтратом, папиллярного, скиррозного и тубулярного. В одном аспекте лобулярная карцинома молочной железы включает инвазивную лобулярную карциному с доминирующей in situ компонентой, инвазивную лобулярную карциному и инфильтрующую лобулярную карциному. В одном аспекте рак молочной железы включает болезнь Паджета, болезнь Паджета с внутрипротоковой карциномой и болезнь Паджета с инвазивной карциномой молочных проток. В другом аспекте рак молочной железы включает новообразования молочной железы, обладающие гистологической и ультраструктурной гетерогенностью (например, клетки смешанных типов).
В предпочтительном аспекте соединение по настоящему изобретению можно использовать для лечения рака молочной железы. В одном аспекте рак молочной железы, который будет подвергаться лечению, включает наследственный рак молочной железы. В другом аспекте рак, который будет подвергаться лечению, включает спорадический рак молочной железы. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъектов мужского пола. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъектов женского пола. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъектов женского пола в период перед менопаузой или у субъектов женского пола после менопаузы. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъекта в возрасте 30 лет или старше 30 лет или у субъекта моложе 30 лет. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъекта в возрасте 50 лет или старше 50 лет или у субъекта моложе 50 лет. В одном аспекте рак молочной железы, который будет подвергаться лечению, возникает у субъекта в возрасте 70 лет или старше 70 лет или у субъекта моложе 70 лет.
В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как идентифицированная наследственная или спонтанная мутация BRCA1, BRCA2 или p53. В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как имеющий амплификацию гена HER2/neu, сверхэкспрессию HER2/neu или низкий, промежуточный или высокий уровень экспрессии HER2/neu. В другом аспекте рак молочной железы, который будет подвергаться лечению, классифицирован в отношении маркера, выбранного из группы, состоящей из рецептора эстрогена (ER), рецептора прогестрона (PR), рецептора-2 эпителиального фактора роста человека Ki-67, CA15-3, CA 27-29 и c-Met. В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как ER-неизвестный, ER-обогащенный или ER-недостаточный. В другом аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как ER-отрицательный или ER-положительный. ER-классификация рака молочной железы может быть осуществлена с помощью любого воспроизводимого метода. В предпочтительном аспекте ER-классификация рака молочной железы может быть установлена, как указано в Onkologie 27: 175-179 (2004). В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как PR-неизвестный, PR-обогащенный или PR-недостаточный. В другом аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как PR-отрицательный или PR-положительный. В другом аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как рецептор-положительный или рецептор-отрицательный. В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как вязанный с повышенными уровнями в крови CA 15-3 или CA 27-29, или обоих.
В одном аспекте рак молочной железы, который будет подвергаться лечению, включает локализованную опухоль молочной железы. В одном аспекте рак молочной железы, который будет подвергаться лечению, включает опухоль молочной железы, которая связана с отрицательной биопсией лимфатической железой Вирхова (SLN). В одном аспекте рак молочной железы, который будет подвергаться лечению, включает опухоль молочной железы, которая связана с положительной биопсией лимфатической железой Вирхова (SLN). В другом аспекте рак молочной железы, который будет подвергаться лечению, включает опухоль молочной железы, которая связана с одним или несколькими положительными вспомогательными лимфатическими узлами, где стадии для вспомогательных лимфатических узлов определены любым применяемым способом. В другом аспекте рак молочной железы, который будет подвергаться лечению, включает опухоль молочной железы, которая была классифицирована как имеющая отрицательный узловой статус (то есть лимфатический узел-отрицательная) или положительный узловой статус (то есть лимфатический узел-положительная). В другом аспекте рак молочной железы, который будет подвергаться лечению, включает опухоль молочной железы, которая дала метастазы в другие области тела. В одном аспекте рак молочной железы, который будет подвергаться лечению, классифицирован как имеющий метастазы в органы, выбранные из группы, включающей кости, легкое, печень или мозг. В другом аспекте рак молочной железы, который будет подвергаться лечению, классифицирован в соответствии с характеристиками, выбранными из группы, состоящей из метастатического, локализованного, регионального, местно-регионального, локально развитого, удаленного, многоцентрового, билатерального, ипсилатерального, контралатерального, вновь диагностированного, рецидивирующего и неоперального рака.
В одном аспекте соединение по настоящему изобретению можно использовать для лечения или профилактики клеточного пролиферативного нарушения молочной железы или для лечения или профилактики рака молочной железы у субъекта, имеющего повышенный риск развития рака молочной железы относительно популяции в целом. В одном аспекте субъект, имеющий повышенный риск развития рака молочной железы относительно популяции в целом, является субъектом женского пола с наследственной или персональной историей рака молочной железы. В другом аспекте субъект, имеющий повышенный риск развития рака молочной железы относительно популяции в целом, является субъектом женского пола, имеющего зародышевую линию или спонтанную мутацию в BRCA1 или BRCA2, или в обеих. В одном аспекте субъект, имеющий повышенный риск развития рака молочной железы относительно популяции в целом, является субъектом женского пола с наследственной историей рака молочной железы и зародышевую линию или спонтанную мутацию в BRCA1 или BRCA2, или в обеих. В другом аспекте субъект, имеющий повышенный риск развития рака молочной железы относительно популяции в целом, является женщиной старше 30 лет, старше 40 лет, старше 50 лет, старше 60 лет, старше 70 лет, старше 80 лет или старше 90 лет. В одном аспекте субъект, имеющий повышенный риск развития рака молочной железы относительно популяции в целом, является субъектом с атипичной гиперплазией молочной железы, карциномой молочных протоков in situ (DCIS), внутрипротоковой карциной, лобулярной карциномой in situ (LCIS), лобулярной неоплазией или 0 стадией роста или поражения молочной железы (например, 0 стадией или 0 степенью рака молочной железы или карциномы in situ).
В другом аспекте рак молочной железы, который будет подвергаться лечению, гистологически классифицирован в соответствии с системой Скарффа-Блума-Ричардсона (Scarff-Bloom-Richardson), в соответствии с которой опухоли молочной железы приписывают количество баллов митозиза, равное 1, 2 или 3, количество баллов ядерного плейоморфизма, равное 1, 2 или 3, количество баллов образования канальцев, равное 1, 2 или 3, и общее количество баллов по Скарффу-Блуму-Ричардсону от 3 до 9. В другом аспекте раку молочной железы, который будет подвергаться лечению, приписана степень опухоли в соответствии с Международной согласительной комиссией по лечению рака молочной железы, выбранная из группы, состоящей из степени 1, степени 1-2, степени 2, степени 2-3 или степени 2.
В одном аспекте раку, который будет подвергаться лечению, приписана стадия в соответствии с системой классификации TNM Американского объединенного комитета по раковым заболеваниям (American Joint Committee on Cancer (AJCC)), где опухоли приписана стадия TX, T1, T1mic, T1a, T1b, T1c, T2, T3, T4, T4a, T4b, T4c или T4d; и где регионарным лимфатическим узлам (N) приписана стадия NX, N0, N1, N2, N2a, N2b, N3, N3a, N3b или N3c; и где удаленным метастазам (М) приписана стадия MX, M0 или M1. В другом аспекте раку, который будет подвергаться лечению, приписана стадия в соответствии с классификацией Американского объединенного комитета по раковым заболеваниям, соответствующая стадии I, стадии IIA, стадии IIB, стадии IIIA, стадии IIIB, стадии IIIC или стадии IV. В другом аспекте раку, который будет подвергаться лечению, приписана степень в соответствии с классификацией AJCC как степень GX (например, степень не может быть установлена), степень 1, степень 2, степень 3 или степень 4. В другом аспекте раку, который будет подвергаться лечению, приписана стадия в соответствии с патологической классификацией (pN) AJCC, представляющая собой pNX, pN0, PN0 (I-), PN0 (I+), PN0 (mol-), PN0 (mol+), PN1, PN1(mi), PN1a, PN1b, PN1c, pN2, pN2a, pN2b, pN3, pN3a, pN3b или pN3c.
В одном аспекте рак, который будет подвергаться лечению, включает опухоль, которая, как было определено, имеет менее или равна примерно 2 сантиметрам в диаметре. В другом аспекте рак, который будет подвергаться лечению, включает опухоль, которая, как было определено, имеет в диаметре примерно от 2 до примерно 5 сантиметров. В другом аспекте рак, который будет подвергаться лечению, включает опухоль, которая, как было определено, превышает или равна в диаметре примерно 3 сантиметрам. В другом аспекте рак, который будет подвергаться лечению, включает опухоль, которая, как было определено, превышает в диаметре 5 сантиметров. В другом аспекте рак, который будет подвергаться лечению, классифицирован по микроскопическим проявлениям как хорошо дифференцированный, среднедифференцированный, слабодифференцированный или недифференцированный. В другом аспекте рак, который будет подвергаться лечению, классифицирован по микроскопическим проявлениям относительно митозизного счета (например, количество делений клетки) или ядерного плейоморфизма (например, изменений в клетках). В другом аспекте рак, который будет подвергаться лечению, классифицирован по микроскопическим проявлениям как связанный с областями некроза (например, области умирающих или дегенерирующих клеток). В одном аспекте рак, который будет подвергаться лечению, классифицирован как имеющий аномальный кариотип, имеющий аномальное число хромосом или имеющий одну или несколько хромосом, которые имеют аномальный внешний вид. В одном аспекте рак, который будет подвергаться лечению, классифицирован как являющийся анеуплоидным, триплоидным, тетраплоидным или имеющий измененную плоидность. В одном аспекте рак, который будет подвергаться лечению, классифицирован как имеющий транслокацию хромосом или удаленную или дублированную полную хромосому или область делеции, дупликации или амплификации части хромосомы.
В одном аспекте рак, который будет подвергаться лечению, оценивают с помощью ДНК цитометрии, проточной цитометрии или визуальной цитометрии. В одном аспекте рак, который будет подвергаться лечению, был классифицирован как имеющий 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% клеток на синтетической стадии деления клеток (например, в С-фазе деления клеток). В одном аспекте рак, который будет подвергаться лечению, был классифицирован как имеющий низкую фракцию С-фазы или высокую фракцию С-фазы.
Как использовано в данном описании, термин «нормальная клетка» относится к клетке, которая не может быть классифицирована как часть «клеточного пролиферативного нарушения». В одном аспекте для нормальной клетки не характерен нерегулируемый или аномальный рост, или и то и другое, что может приводить к развитию нежелательного состояния или заболевания. Предпочтительно нормальная клетка имеет регулирующие механизмы контрольных точек нормально функционирующего клеточного цикла.
Как использовано в данном описании, термин «контактирующая клетка» относится к состоянию, при котором соединение или другая композиция вещества находятся в непосредственном контакте с клеткой или достаточно близко от нее, чтобы индуцировать желаемое биологическое действие в клетке.
Как использовано в данном описании, термин «соединение-кандидат» относится к соединению по настоящему изобретению, которое было или будет протестировано в одном или нескольких биологических анализах in vitro или in vivo с целью определения того, является ли соединение подходящим для того, чтобы вызывать желаемую биологическую или медицинскую реакцию в клетке, ткани, системе, организме животного или человека, которой добивается исследователь или лечащий врач. В одном аспекте соединение-кандидат представляет собой соединение формулы IIIa; в другом аспекте соединение-кандидат представляет собой соединение формулы IVa, IVb, Va, или Vb. В предпочтительном аспекте биологический или медицинский ответ представляет собой лечение рака. В другом аспекте биологический или медицинский ответ представляет собой лечение или профилактику клеточного пролиферативного нарушения. В одном аспекте биологические анализы in vitro или in vivo включают, но не ограничиваются ими, анализы ферментативной активности, анализы смещения электрофоретической подвижности, анализы с использованием репортерных генов, анализы жизнеспособности клетки in vitro и анализы, приведенные в примерах 65-73 данного описания.
Как использовано в данном описании, термин «монотерапия» относится к введению одного активного или лекарственного соединения нуждающемуся в этом субъекту. Предпочтительно монотерапия будет включать введение терапевтически эффективного количества активного соединения. Например, монотерапия рака с использованием (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона включает введение терапевтически эффективного количества (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного субъекту, нуждающемуся в лечении рака. Монотерапия может представлять собой противоположность комбинированной терапии, в процессе которой вводят множественную комбинацию активных соединений, предпочтительно, где каждый компонент комбинации присутствует в терапевтически эффективном количестве. В одном аспекте монотерапия с использованием соединения по настоящему изобретению является более эффективной по сравнению с комбинированной терапией в отношении индуцирования желаемого биологического эффекта.
Как использовано в данном описании, термин «лечение» описывает руководство и уход за пациентом с целью борьбы с заболеванием, состоянием или нарушением и включает введение соединения по настоящему изобретению для профилактики появления симптомов или осложнений, облегчения симптомов или осложнение или исключения заболевания, состояния или нарушения.
В другом аспекте лечение рака приводит к уменьшению размера опухоли. Уменьшение размера опухоли также может быть представлено как «регрессия опухоли». Предпочтительно после лечения размер опухоли уменьшается на 5% или больше по сравнению с ее размером перед лечением, более предпочтительно размер опухоли уменьшается на 10% или больше, более предпочтительно уменьшается на 20% или больше, более предпочтительно уменьшается на 30% или больше, более предпочтительно уменьшается на 40% или больше, еще более предпочтительно уменьшается на 50% или больше и наиболее предпочтительно уменьшается больше чем на 75% или больше. Размер опухоли может быть измерен с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте размер опухоли может быть измерен как диаметр опухоли.
В другом аспекте лечение рака приводит к уменьшению объема опухоли. Предпочтительно после лечения объем опухоли уменьшается на 5% или больше по сравнению с ее размером перед лечением, более предпочтительно объем опухоли уменьшается на 10% или больше, более предпочтительно уменьшается на 20% или больше, более предпочтительно уменьшается на 30% или больше, более предпочтительно уменьшается на 40% или больше, еще более предпочтительно уменьшается на 50% или больше и наиболее предпочтительно уменьшается больше чем на 75% или больше. Объем опухоли может быть измерен с помощью любого воспроизводимого способа измерения.
В другом аспекте лечение рака приводит к уменьшению числа опухолей. Предпочтительно после лечения число опухолей уменьшается на 5% или больше по сравнению с числом перед лечением, более предпочтительно число опухолей уменьшается на 10% или больше, более предпочтительно уменьшается на 20% или больше, более предпочтительно уменьшается на 30% или больше, более предпочтительно уменьшается на 40% или больше, еще более предпочтительно уменьшается на 50% или больше и наиболее предпочтительно уменьшается больше чем на 75%. Число опухолей может быть измерено любым воспроизводимым способом измерения. В предпочтительном аспекте число опухолей может быть измерено путем подсчета опухолей, видимых невооруженным глазом или при определенном увеличении. В предпочтительном аспекте определенное увеличение составляет 2×, 3×, 4×, 5×, 10× или 50×.
В другом аспекте лечение рака приводит к уменьшению числа метастатических поражений других тканей или органов, расположенных в отдалении от месторасположения первичной опухоли. Предпочтительно после лечения число метастатических поражений уменьшается на 5% или больше по сравнению с их числом перед лечением, более предпочтительно число метастатических поражений уменьшается на 10% или больше, более предпочтительно уменьшается на 20% или больше, более предпочтительно уменьшается на 30% или больше, более предпочтительно уменьшается на 40% или больше, еще более предпочтительно уменьшается на 50% или больше и наиболее предпочтительно уменьшается больше чем на 75%. Число метастатических поражений может быть измерено любым воспроизводимым способом измерения. В предпочтительном аспекте число метастатических поражений может быть измерено путем подсчета метастатических поражений, видимых невооруженным глазом или при определенном увеличении. В предпочтительном аспекте определенное увеличение составляет 2×, 3×, 4×, 5×, 10× или 50×.
В другом аспекте лечение рака приводит к увеличению среднего времени продолжительности жизни совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, получавших только носитель. Предпочтительно среднее время продолжительности жизни увеличивается более чем на 30 дней, более предпочтительно более чем на 60 дней; более предпочтительно более чем на 90 дней; и наиболее предпочтительно более чем на 120 дней. Увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено с помощью любых воспроизводимых способов измерения. В предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов перед началом лечения с использованием активного соединения. В другом предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов после завершения первого цикла лечения с использованием активного соединения.
В другом аспекте лечение рака приводит к увеличению среднего времени продолжительности жизни совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, не подвергавшихся лечению. Предпочтительно среднее время продолжительности жизни увеличивается более чем на 30 дней, более предпочтительно более чем на 60 дней; более предпочтительно более чем на 90 дней; и наиболее предпочтительно более чем на 120 дней. Увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено с помощью любых воспроизводимых способов измерения. В предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов перед началом лечения с использованием активного соединения. В другом предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов после завершения первого цикла лечения с использованием активного соединения.
В другом аспекте лечение рака приводит к увеличению среднего времени продолжительности жизни совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, получавших монотерапию с использованием лекарственного средства, которое не является соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, аналогом или производным. Предпочтительно среднее время продолжительности жизни увеличивается более чем на 30 дней, более предпочтительно более чем на 60 дней; более предпочтительно более чем на 90 дней; и наиболее предпочтительно более чем на 120 дней. Увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено с помощью любых воспроизводимых способов измерения. В предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов перед началом лечения с использованием активного соединения. В другом предпочтительном аспекте увеличение среднего времени продолжительности жизни совокупности субъектов может быть измерено, например, путем подсчета средней продолжительности жизни субъектов после завершения первого цикла лечения с использованием активного соединения.
В другом аспекте лечение рака приводит к снижению степени смертности совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, получавших только носитель. В другом аспекте лечение рака приводит к снижению степени смертности совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, не подвергшихся лечению. В следующем аспекте лечение рака приводит к снижению степени смертности совокупности субъектов, подвергшихся лечению, по сравнению с совокупностью субъектов, получавших монотерапию с использованием лекарственного средства, которое не является соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, аналогом или производным. Предпочтительно степень смертности снижается более чем на 2%, более предпочтительно более чем на 5%; более предпочтительно более чем на 10%; и наиболее предпочтительно более чем на 25%. В предпочтительном аспекте снижение степени смертности совокупности субъектов, подвергшихся лечению, может быть измерено с помощью любого воспроизводимого способа измерения. В другом предпочтительном аспекте снижение степени смертности совокупности субъектов может быть измерено, например, путем подсчета совокупности среднего числа смертей, относящихся к заболеванию, в единицу времени после начала лечения с использованием активного соединения. В другом предпочтительном аспекте снижение степени смертности совокупности субъектов также может быть измерено путем подсчета совокупности среднего числа смертей, относящихся к заболеванию, в единицу времени после завершения первого цикла лечения с использованием активного соединения.
В другом аспекте лечение рака приводит к уменьшению скорости роста опухоли. Предпочтительно после лечения скорость роста опухоли уменьшается по меньшей мере на 5% относительно числа перед лечением, более предпочтительно скорость роста опухоли уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Скорость роста опухоли может быть измерена с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте скорость роста опухоли измеряют в соответствии с изменением диаметра опухоли в единицу времени.
В другом аспекте лечение рака приводит к уменьшению повторного роста опухоли. Предпочтительно после лечения повторный рост опухоли становится меньше на 5%; более предпочтительно повторный рост опухоли становится меньше на 10%; более предпочтительно меньше на 20%; более предпочтительно меньше на 30%; более предпочтительно меньше на 40%; более предпочтительно меньше на 50%; и наиболее предпочтительно меньше на 75%. Повторный рост опухоли может быть измерен с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте повторный рост опухоли измеряют, например, путем измерения увеличения диаметра опухоли после уменьшения опухоли после лечения. В другом предпочтительном аспекте на уменьшение повторного роста опухоли указывает отсутствие повторного появления опухолей после прекращения лечения.
В другом аспекте лечение или профилактика клеточного пролиферативного нарушения приводят к уменьшению скорости клеточной пролиферации. Предпочтительно после лечения скорость клеточной пролиферации уменьшается по меньшей мере на 5%; более предпочтительно по меньшей мере на 10%; более предпочтительно по меньшей мере на 20%; более предпочтительно по меньшей мере на 30%; более предпочтительно по меньшей мере на 40%; более предпочтительно по меньшей мере на 50%; и наиболее предпочтительно по меньшей мере на 75%. Скорость клеточной пролиферации может быть измерена с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте скорость клеточной пролиферации измеряют, например, путем измерения числа делящихся клеток в образце ткани в единицу времени.
В другом аспекте лечение или профилактика клеточного пролиферативного нарушения приводят к уменьшению доли пролиферирующих клеток. Предпочтительно после лечения доля пролиферирующих клеток снижается по меньшей мере на 5%, более предпочтительно по меньшей мере на 10%, более предпочтительно по меньшей мере на 20%, более предпочтительно по меньшей мере на 30%, более предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, и наиболее предпочтительно по меньшей мере на 75%. Доля пролиферирующих клеток может быть измерена с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте долю пролиферирующих клеток измеряют, например, путем количественной оценки числа делящихся клеток относительно числа неделящихся клеток в образце ткани. В другом предпочтительном аспекте доля пролиферирующих клеток эквивалентна митотическому индексу.
В другом аспекте лечение или профилактика клеточного пролиферативного нарушения приводят к снижению размера площади или зоны клеточной пролиферации. Предпочтительно после лечения размер площади или зоны клеточной пролиферации уменьшается по меньшей мере на 5% относительно его размера до лечения; более предпочтительно уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Размер площади или зоны клеточной пролиферации может быть измерен с помощью любого воспроизводимого способа измерения. В предпочтительном аспекте размер площади или зоны клеточной пролиферации может быть измерен как диаметр или ширина площади или зоны клеточной пролиферации.
В другом аспекте лечение или профилактика клеточного пролиферативного нарушения приводят к уменьшению числа или доли клеток, имеющих аномальный внешний вид или морфологию. Предпочтительно после лечения число клеток, имеющих аномальный внешний вид или морфологию, уменьшается по меньшей мере на 5% относительно их размера до лечения; более предпочтительно уменьшается по меньшей мере на 10%; более предпочтительно уменьшается по меньшей мере на 20%; более предпочтительно уменьшается по меньшей мере на 30%; более предпочтительно уменьшается по меньшей мере на 40%; более предпочтительно уменьшается по меньшей мере на 50%; и наиболее предпочтительно уменьшается по меньшей мере на 75%. Аномальный внешний вид или морфология могут быть измерены с помощью любого воспроизводимого способа измерения. В одном аспекте аномальную клеточную морфологию измеряют с помощью микроскопии, например, с использованием инвертированного микроскопа для культуры тканей. В одном аспекте аномальная клеточная морфология принимает вид ядерного плейоморфизма.
Как использовано в данном описании, термин «селективно» означает тенденцию возникновения с большей частотой в одной популяции по сравнению с другой популяцией. В одном аспекте сравниваемые популяции представляют собой популяции клеток. В предпочтительном аспекте соединение по настоящему изобретению, его фармацевтически приемлемая соль, пролекарство, метаболит, аналог или производное действуют селективно на раковые или предраковые клетки, но не на нормальные клетки. В другом предпочтительном аспекте соединение по настоящему изобретению, его фармацевтически приемлемая соль, пролекарство, метаболит, аналог или производное действуют селективно в отношении модулировании одной молекулярной мишени (например, c-Met), но не модулируют существенно другую молекулярную мишень (например, протеинкиназу С). В другом предпочтительном аспекте изобретение относится к способу селективного ингибирования активности фермента, такого как киназа. Предпочтительно случаи происходят селективно в популяции А относительно популяции В, если они происходят более чем в два раза чаще в популяции А по сравнению с популяцией В. Более предпочтительно случаи происходят селективно, если они происходят более чем в пять раз чаще в популяции А. Более предпочтительно случаи происходят селективно, если они происходят чаще более чем в десять раз в популяции А, более предпочтительно более чем в пятьдесят раз, еще более предпочтительно более чем в 100 раз, и наиболее предпочтительно более чем в 1000 раз чаще в популяции А по сравнению с популяцией В. Например, можно говорить, что клеточная смерть селективно происходит в раковых клетках, если происходит более чем в два раза чаще в раковых клетках по сравнению с нормальными клетками.
В предпочтительном аспекте соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, аналог или производное модулируют активность молекулярной мишени (например, c-Met). В одном аспекте модулирование относится к стимуляции или ингибированию активности молекулярной мишени. Предпочтительно соединение по настоящему изобретению модулирует активность молекулярной мишени, если оно стимулирует или ингибирует активность молекулярной мишени по меньшей мере в 2 раза относительно активности молекулярной мишени в таких же условиях, но только в отсутствие указанного соединения. Более предпочтительно соединение по настоящему изобретению модулирует активность молекулярной мишени, если оно стимулирует или ингибирует активность молекулярной мишени по меньшей мере в 5 раз, по меньшей мере в 10 раз, по меньшей мере в 20 раз, по меньшей мере в 50 раз, по меньшей мере в 100 раз относительно активности молекулярной мишени в таких же условиях, но только в отсутствие указанного соединения. Активность молекулярной мишени может быть измерена с помощью любых воспроизводимых способов. Активность молекулярной мишени может быть измерена in vitro или in vivo. Например, активность молекулярной мишени может быть измерена in vitro с использованием анализа ферментативной активности или анализа связывания ДНК, или активность молекулярной мишени может быть измерена in vivo с помощью анализа экспрессии репортерного гена.
В одном аспекте соединение по настоящему изобретению или его фармацевтически приемлемая соль, пролекарство, метаболит, аналог или производное существенно не модулируют активность молекулярной мишени в том случае, если добавление соединения не стимулирует или не ингибирует активность молекулярной мишени больше чем на 10% по сравнению с активностью молекулярной мишени в таких же условиях, но в отсутствие указанного соединения. В предпочтительном аспекте соединение по настоящему изобретению существенно не модулирует активность протеинкиназы С.
Как использовано в данном описании, термин «изозим-селективный» означает предпочтительное ингибирование или стимулирование первой изоформы фермента по сравнению со второй изоформой фермента (например, предпочтительное ингибирование или стимулирование альфа-изозима киназы по сравнению с бета-изозимом киназы). Предпочтительно соединение по настоящему изобретению демонстрирует минимум разницы в четыре раза, предпочтительно разницу в десять раз, более предпочтительно разницу в пятьдесят раз в дозировке, требуемой для достижения биологического эффекта. Предпочтительно соединение по настоящему изобретению демонстрирует подобную разницу в диапазоне ингибирования, и разница проиллюстрирована как IC50, т.e. как 50% ингибирование для представляющей интерес молекулярной мишени.
В предпочтительном варианте осуществления применение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного для клетки или нуждающегося в этом субъекта приводит к модулированию (т.е. стимулированию или ингибированию) активности c-Met. Как использовано в данном описании, активность c-Met относится к любой биологической функции или активности, за которую отвечает c-Met. Например, функция c-Met включает фосфорилирование белков-мишеней в прямом направлении (5'-3'). Другие функции c-Met включают аутофосфорилирование, связывание адапторных белков, таких как Gab-1, Grb-2, Shc, SHP2 и c-Cbl, и активацию сигнальных трансдукторов, таких как Ras, Src, PI3K, PLC-γ, STAT, ERK1 и 2 и FAK.
В предпочтительном варианте осуществления применение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного для клеток или нуждающегося в этом субъекта приводит к модуляции (т.е. стимулированию или ингибированию) активности ERK 1 или ERK 2, или обоих. Как использовано в данном описании, активность ERK 1 или ERK 2 относится к любой биологической функции или активности, которая проявляется посредством ERK 1 или ERK 2. Например, функция ERK 1 или ERK 2 включает фосфорилирование белков-мишеней в прямом направлении (5'-3').
В одном аспекте термин «активация» относится к размещению композиции веществ (например, белка или нуклеиновой кислоты) в месте, подходящем для осуществления желаемой биологической функции. В одном аспекте композиция веществ, способная к активации, также обладает неактивированным состоянием. В одном аспекте активированная композиция веществ может обладать ингибирующей или стимулирующей биологической функцией, или обеими.
В одном аспекте термин «повышение» относится к увеличению желаемой биологической активности композиции веществ (например, белка или нуклеиновой кислоты). В одном аспекте повышение может происходить за счет повышения концентрации композиции веществ.
Как использовано в данном описании, термин «путь контрольной точки клеточного цикла» относится к биохимическому пути, который вовлечен в модулирование контрольной точки клеточного цикла. Путь контрольной точки клеточного цикла может оказывать стимулирующее или ингибирующее действие, или и то и другое на одну или несколько функций, включающих контрольную точку клеточного цикла. Путь контрольной точки клеточного цикла включает по меньшей мере две композиции веществ, предпочтительно белков, обе из которых вносят свой вклад в модулирование контрольной точки клеточного цикла. Путь контрольной точки клеточного цикла можно активировать путем активации одного или нескольких членов пути контрольной точки клеточного цикла. Предпочтительно путь контрольной точки клеточного цикла представляет собой биохимический сигнальный путь.
Как использовано в данном описании, термин «регулятор контрольной точки клеточного цикла» относится к композиции веществ, которая может функционировать, по меньшей мере, частично, модулируя контрольную точку клеточного цикла. Регулятор контрольной точки клеточного цикла может обладать стимулирующим или ингибирующим действием, или и тем и другим на одну или несколько функций, включающих контрольную точку клеточного цикла. В одном аспекте регулятор контрольной точки клеточного цикла представляет собой белок. В другом аспекте регулятор контрольной точки клеточного цикла не является белком.
В одном аспекте лечение рака или клеточного пролиферативного нарушения приводит к смерти клеток и предпочтительно смерть клеток приводит к уменьшению по меньшей мере на 10% числа клеток в популяции. Более предпочтительно смерть клеток означает уменьшение по меньшей мере на 20%; более предпочтительно уменьшение по меньшей мере на 30%; более предпочтительно уменьшение по меньшей мере на 40%; более предпочтительно уменьшение по меньшей мере на 50%; наиболее предпочтительно уменьшение по меньшей мере на 75%. Число клеток в популяции может быть измерено с помощью любого воспроизводимого способа. В одном аспекте число клеток в популяции измеряют с использованием флуоресцентно активированной сортировки клеток (FACS). В другом аспекте число клеток в популяции измеряют с использованием иммунофлуоресцентной микроскопии. В другом аспекте число клеток в популяции измеряют с использованием световой микроскопии. В другом аспекте способы измерения клеточной смерти являются такими, как показано в публикации Li et al., (2003) Proc Natl Acad Sci U S A. 100(5): 2674-8. В некотором аспекте смерть клеток происходит за счет апоптоза.
В предпочтительном аспекте эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного, по существу, не является цитотоксическим для нормальных клеток. Терапевтически эффективное количество соединения, по существу, не является цитотоксическим для обычных клеток, если введение соединения в терапевтически эффективном количестве не вызывает смерть более чем 10% нормальных клеток. Терапевтически эффективное количество соединения не влияет в значительной степени на жизнеспособность нормальных клеток, если введение соединения в терапевтически эффективном количестве не вызывает смерть более чем 10% нормальных клеток. В некотором аспекте смерть клеток происходит за счет апоптоза.
В одном аспекте контактирование клетки с соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, аналогом или производным селективно вызывает или активирует смерть клетки в раковых клетках. Предпочтительно введение нуждающемуся в этом субъекту соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного вызывает или активирует смерть клетки селективно в раковых клетках. В другом аспекте контактирование клетки с соединением по настоящему изобретению или его фармацевтически приемлемой солью, пролекарством, метаболитом, аналогом или производным селективно вызывает смерть клетки в одной или нескольких клетках, пораженных клеточным пролиферативным нарушением. Предпочтительно введение нуждающемуся в этом субъекту соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного селективно вызывает смерть клетки в одной или нескольких клетках, пораженных клеточным пролиферативным нарушением.
В предпочтительном аспекте настоящее изобретение относится к способу лечения или профилактики рака с помощью введения соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного нуждающемуся в этом субъекту, при этом введение соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного приводит к одному или нескольким из следующего: накоплению клеток в G1 и/или С фазе клеточного цикла, цитотоксичности, вызывающей смерть клетки в ряду раковых клеток без смерти существенного количества клеток среди нормальных клеток, противоопухолевой активности у животных с терапевтическим индексом, равным по меньшей мере 2, и активации контрольной точки клеточного цикла. Как использовано в данном описании, термин «терапевтический индекс» относится к максимально переносимой дозе, деленной на эффективную дозу.
Специалист в данной области может сослаться на общие справочные тексты с подробным описанием обсуждаемых в данном описании известных методик или эквивалентных методик. Данные тексты включают Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (2005); Sambrook et al., Molecular Cloning, A Laboratory Manual (3d ed.), Cold Spring Harbor Press, Cold Spring Harbor, New York (2000); Coligan et al., Current Protocols in Immunology, John Wiley & Sons, N.Y.; Enna et al., Current Protocols in Pharmacology, John Wiley & Sons, N.Y.; Fingl et al., The Pharmacological Basis of Therapeutics (1975), Remington'c Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 18th edition (1990). На данные тексты, конечно, можно также сослаться при осуществлении или применении аспектов по настоящему изобретению.
В дополнительных аспектах соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, аналог или производное можно вводить в сочетании со вторым химиотерапевтическим агентом. Второй химиотерапевтический агент может представлять собой таксан, ингибитор ароматазы, антрациклин, направляемое в микроканальцы лекарственное средство, ядовитое по отношению к топоизомеразе лекарственное средство, направляемое моноклональное или поликлональное антитело, ингибитор молекулярной мишени или фермент (например, ингибитор киназы) или лекарственное средство - аналог цитидина. В предпочтительных аспектах химиотерапевтический агент может представлять собой, но, не ограничиваясь ими, тамоксифен, ралоксифен, анастрозол, эксеместан, летрозол, HERCEPTIN® (трастузумаб), GLEEVEC® (иматаниб), TAXOL® (паклитаксель), циклофосфамид, ловастатин, минозин, араС, 5-фторурацил (5-FU), метотрексат (MTX), TAXOTERE® (доцетаксель), ZOLADEX® (гозерелин), винкристин, винбластин, нокодазол, тенипозид, этопозид, GEMZAR® (гемцитабин), эпотилон, навелбин, камптотецин, даунорубицин, дактиномицин, митоксантрон, амсакрин, доксорубицин (адриамицин), эпирубицин или идарубицин, или агенты, перечисленные на сайте www.cancer.org/docroot/cdg/cdg_0.asp. В другом аспекте второй химиотерапевтический агент может представлять собой цитокин, такой как G-CSF (гранулоцитный колониестимулирующий фактор). В другом аспекте соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, аналог или производное можно вводить в сочетании с лучевой терапией. Еще в одном аспекте соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, аналог или производное можно вводить в сочетании со стандартными химиотерапевтическими комбинациями, такими как, но не ограничиваясь ими, CMF (циклофосфамид, метотрексат и 5-фторурацил), CAF (циклофосфамид, адриамицин и 5-фторурацил), AC (адриамицин и циклофосфамид), FEC (5-фторурацил, эпирубицин и циклофосфамид), ACT или ATC (адриамицин, циклофосфамид и паклитаксель) или CMFP (циклофосфамид, метотрексат, 5-фторурацил и преднизон).
Соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, аналог или производное можно вводить в состав фармацевтических композиций, подходящих для введения. Такие композиции обычно содержат соединение (т.е. включая активное соединение) и фармацевтически приемлемый эксципиент или носитель. Как использовано в данном описании, предполагается, что термины «фармацевтически приемлемый эксципиент» или «фармацевтически приемлемый носитель» включают любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и абсорбционные агенты, замедляющие высвобождение активного вещества, и подобные, совместимые с фармацевтическим введением. Подходящие носители описаны в наиболее последнем издании Remington's Pharmaceutical Sciences, стандартном справочнике в данной области. Предпочтительные примеры таких носителей или разбавителей включают, но не ограничиваются ими, воду, физиологический раствор, раствор Рингера, раствор декстрозы и 5% сывороточный альбумин человека. Фармацевтически приемлемые носители включают твердые носители, такие как лактоза, белая трубчатая глина, сахароза, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния, стеариновая кислота и тому подобное. Иллюстративные жидкие носители включают сироп, арахисовое масло, оливковое масло, воду и тому подобное. Аналогично носитель или разбавитель может включать вещества, замедляющие высвобождение активного агента во времени, такие как глицерилмоностеарат или глицерилдистеарат, сами по себе или в сочетании с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой, метилметакрилатом или т.п. Другие наполнители, эксципиенты, ароматизаторы или другие вспомогательные добавки, такие как известно в данной области, также могут быть включены в фармацевтическую композицию согласно изобретению. Также можно использовать липосомы и неводные носители. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области. До тех пор, пока любая обычная среда или агент являются совместимыми с активным соединением, подразумевается их применение в данных композициях. Дополнительные активные соединения также могут быть введены в состав композиций.
В одном аспекте соединение по настоящему изобретению или его фармацевтически приемлемую соль, пролекарство, метаболит, аналог или производное вводят в виде подходящей дозированной формы, полученной путем объединения терапевтически эффективного количества (например, эффективного уровня, достаточного для достижения желаемого терапевтического эффекта путем ингибирования роста опухоли, смерти опухолевых клеток, лечения или профилактики клеточного пролиферативного нарушения и т.д.) соединения по настоящему изобретению или его фармацевтически приемлемой соли, пролекарства, метаболита, аналога или производного (в качестве активного ингредиента) со стандартными фармацевтическими носителями или разбавителями в соответствии со стандартными методами (т.е. путем получения фармацевтической композиции по изобретению). Такие методы могут включать смешивание, гранулирование и прессование или растворение ингредиентов, что является подходящим для получения желаемого препарата.
4. Фармацевтические композиции и препараты
Фармацевтическую композицию по изобретению составляют таким образом, чтобы она соответствовала предполагаемому пути введения. Примеры пути введения включают парентеральное, например внутривенное, внутрикожное, подкожное, пероральное (например, ингаляция), чрескожное (местно) и чресслизистое введение. Растворы или суспензии, используемые для парентерального, внутрикожного или подкожного применения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; комплексообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования изотоничности, такие как хлорид натрия или декстроза. рН можно отрегулировать с помощью кислот или оснований, таких как хлористоводородная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозовые пузырьки, изготовленные из стекла или пластика.
Соединение или фармацевтическую композицию по изобретению можно вводить субъекту с помощью многочисленных хорошо известных способов, используемых в настоящее время для химиотерапевтического лечения. Например, для лечения рака соединение по изобретению можно вводить в виде инъекции непосредственно в опухоли, вводить в виде инъекции в кровоток или полости тела, или принимать перорально или наносить через кожу с помощью пластырей. Выбранная доза должна быть достаточной для проведения эффективного лечения, но не слишком высокой, чтобы не вызывать неприемлемые побочные эффекты. Состояние заболевания (например, рака, предракового состояния и т.п.) и состояние здоровья пациента предпочтительно следует тщательно контролировать во время лечения и в течение разумного периода после лечения.
Термин «терапевтически эффективное количество», как использовано в данном описании, относится к количеству фармацевтического агента для лечения, облегчения состояния или профилактики выявленного заболевания, или состояния, или для обнаружения поддающегося обнаружению терапевтического или ингибирующего действия. Такое действие может быть обнаружено с помощью любого метода анализа, известного в данной области. Точное эффективное количество для субъекта будет зависеть от массы тела, размера и общего состояния здоровья субъекта, природы и степени тяжести состояния и лекарственного препарата или комбинации лекарственных препаратов, выбранных для введения. Терапевтически эффективные количества для данной ситуации могут быть определены обычным экспериментированием, что входит в компетенцию и усмотрение лечащего врача. В предпочтительном аспекте заболевание или состояние, подвергаемое лечению, представляет собой рак. В другом аспекте заболевание или состояние, подвергаемое лечению, представляет собой клеточное пролиферативное нарушение.
Для любого соединения терапевтически эффективное количество может быть первоначально оценено или в анализах на культуре клеток, например неопластических клеток, или на животных моделях, обычно на крысиных, мышиных, кроличьих, собачьих или свиных моделях. Животная модель также может быть использована для определения подходящего диапазона концентраций и пути введения. Такая информация затем может быть использована для определения полезных дозировок и путей введения людям. Терапевтическая/профилактическая эффективность и токсичность могут быть определены с использованием стандартных фармацевтических методик на клеточных культурах или экспериментальных животных, например ED50 (доза, терапевтически эффективная для 50% популяции) и LD50 (доза, летальная для 50% популяции). Соотношение дозы между токсическим и терапевтическим действием представляет собой терапевтический индекс и он может быть выражен как соотношение LD50/ED50. Предпочтительными являются фармацевтические композиции, которые проявляют высокие терапевтические индексы. Дозировка может варьироваться в данном диапазоне в зависимости от используемой единичной дозированной формы, чувствительности пациента и пути введения.
Дозировку и введение регулируют таким образом, чтобы обеспечить достаточные уровни активного(ых) агента(ов) или для поддержания желаемого эффекта. Факторы, которые могут приняты во внимание, включают тяжесть заболевания, общее состояние здоровья пациента, возраст, массу и пол пациента, режим питания, время и частоту введения, комбинацию(и) лекарственных средств, чувствительность реакции и переносимость/ответную реакцию на лечение. Длительно действующие фармацевтические композиции можно вводить каждые 3-4 дня, каждую неделю или один раз в две недели в зависимости от периода полувыведения и скорости выведения конкретного препарата.
Фармацевтические композиции, содержащие активные соединения по настоящему изобретению, могут быть изготовлены общеизвестным способом, например, с помощью обычного смешивания, растворения, гранулирования, изготовления драже, растирания в порошок во влажном состоянии, эмульгирования, инкапсулирования, способов получения соединений включения или лиофилизации. Рецептура фармацевтических композиций может быть составлена обычным образом с использованием одного или нескольких фармацевтически приемлемых носителей, включая эксципиенты и/или вспомогательные добавки, которые облегчают переработку активных соединений в препараты, которые можно использовать в фармацевтике. Конечно, подходящий препарат будет зависеть от выбранного пути введения.
Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (где препарат растворим в воде) или дисперсии и стерильные порошки для получения стерильных инъекционных растворов, или дисперсии для немедленного применения. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или забуференный фосфатом физиологический раствор (PBS). Во всех случаях композиция должна быть стерильной и должна быть текучей в такой степени, чтобы была возможность легкого применения с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т.п.) и их подходящие смеси. Правильную текучесть можно поддерживать, например, с использованием такой оболочки, как лецитин, за счет поддержания требуемого размера частиц в случае дисперсии или с помощью использования поверхностно-активных веществ. Предотвращения воздействия микроорганизмов можно достичь с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и т.п. Во многих случаях предпочтительно включение в композицию изотонических агентов, например сахаров, многоатомных спиртов, таких как маннит, сорбит, хлорида натрия. Пролонгированное всасывание инъекционной композиции можно осуществить путем включения в композицию агента, который замедляет всасывание, например моностеарата алюминия и желатина.
Стерильные инъекционные растворы могут быть получены путем введения активного соединения в требуемом количестве в подходящий растворитель вместе с одним из перечисленных выше ингредиентов или их комбинацией, при необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают путем введения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и требуемые другие ингредиенты, из числа перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов способами получения являются вакуумная сушка и сушка вымораживанием, что дает порошок активного ингредиента вместе с любым дополнительным ингредиентом из предварительно стерилизованного фильтрованием раствора.
Пероральные композиции обычно включают инертный разбавитель или пищевой фармацевтически приемлемый носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. В целях перорального терапевтического введения активное соединение может быть объединено с эксципиентами и использовано в виде таблеток, пилюль или капсул. Пероральные композиции также могут быть получены с использованием жидкого носителя для применения в виде жидкости для полоскания рта, где соединение в жидком носителе применяют перорально и полощут и выплевывают или проглатывают. Как часть композиции в нее могут быть включены фармацевтически совместимые связывающие агенты и/или вспомогательные вещества. Таблетки, пилюли, капсулы, пластинки и тому подобное могут содержать любой из следующих ингредиентов или соединений аналогичной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; лубрикант, такой как стеарат магния или Sterotes; глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как мята перечная, метилсалицилат или апельсиновый ароматизатор.
Для введения путем ингаляции доставку соединений осуществляют в виде аэрозольного спрея из контейнера при давлении или распределяющего устройства, которое содержит подходящий пропеллент, например газ, такой как диоксид углерода или небулайзер.
Системное введение также можно проводить чресслизистыми или чрескожными способами. Для введения через слизистые оболочки или кожу в препаратах используют агенты, усиливающие проницаемость через подходящий барьер. Такие усиливающие проницаемость агенты общеизвестны в данной области и включают, например, для чресслизистого введения детергенты, соли желчных кислот и производные фузидовой кислоты. Чресслизистое введение также может быть осуществлено с использованием назальных спреев или суппозиториев. Для чрескожного введения активные соединения вводят в состав мазей, целебных притираний, гелей или кремов, как это общеизвестно в данной области.
В одном аспекте активные соединения получают вместе с фармацевтически приемлемыми носителями, которые будут защищать соединение от быстрого выведения из организма, такими как препараты замедленного высвобождения, включая имплантаты и микроинкапсулированные системы доставки. Можно использовать биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы получения таких препаратов известны специалистам в данной области. Вещества также могут быть коммерчески доступны от компаний Alza Corporation и Nova Pharmaceuticals, Inc. Липосомные суспензии (включая липосомы, нацеленные на инфицированные клетки вместе с моноклональными антителами для вирусных антигенов) также можно использовать в качестве фармацевтически приемлемых носителей. Они могут быть получены в соответствии со способами, известными специалистам в данной области, например, как описано в патенте США 4522811.
Особенно полезным является получение рецептур пероральных или парентеральных композиций в виде единичной дозированной формы для легкости введения и единообразия дозировки. Термин «единичная дозированная форма», как использовано в данном описании, относится к физически дискретным единицам, подходящим в качестве единичной дозировки для подвергаемого лечению субъекта, каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для оказания желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Описание единичных дозированных форм по изобретению предписано и непосредственно зависит от уникальных характеристик активного соединения и определенного терапевтического эффекта, которого нужно достичь.
При терапевтическом применении дозировки фармацевтических композиций, используемых в соответствии с изобретением, изменяются в зависимости от агента, возраста, массы и клинического состояния реципиента, и опыта и решения клинического или лечащего врача, проводящего лечение, наряду с другими факторами, влияющими на выбранную дозировку. Обычно доза должна быть достаточной для того, чтобы вызвать замедление и предпочтительно регрессию роста опухолей, а также предпочтительно вызывать полную регрессию рака. Дозировки могут колебаться примерно от 0,01 мг/кг в день до примерно 3000 мг/кг в день. В предпочтительных аспектах дозировка может колебаться примерно от 1 мг/кг в день до примерно 1000 мг/кг в день. В одном из аспектов дозировка будет колебаться примерно от 0,1 мг/кг в день до примерно 50 г/день; примерно от 0,1 мг/кг в день до примерно 25 г/день; примерно от 0,1 мг/кг в день до примерно 10 г/день; примерно от 0,1 мг/кг в день до примерно 3 г/день; или примерно от 0,1 мг/кг в день до примерно 1 г/день в виде однократной, разделенной или непрерывной дозировки (указанную дозировку можно регулировать в зависимости от массы пациента в кг, поверхности тела в м2 и возраста в годах). Эффективное количество фармацевтического агента является таким, которое обеспечивает объективно наблюдаемые улучшения, что отмечается клиническим врачом или другим квалифицированным наблюдателем. Уменьшение диаметра опухоли указывает на регрессию. На регрессию также указывает отсутствие повторного появления опухолей после прекращения лечения. Как использовано в данном описании, термин «дозировка-эффективным образом» относится к количеству активного соединения, необходимого, чтобы вызвать желаемый биологический эффект у субъекта или клетки.
Фармацевтические композиции могут находиться в контейнере, упаковке или раздаточном устройстве вместе с инструкциями для применения.
Все патенты, патентные заявки и процитированные ссылки включены в данное описание посредством ссылки во всей своей полноте.
ПРИМЕРЫ
Далее приведены примеры для дополнительной иллюстрации различных отличительных признаков настоящего изобретения. Примеры также иллюстрируют полезную методику практической реализации изобретения. Данные примеры не ограничивают объем заявляемого изобретения.
Пример 1. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона:
Стадия 1

К раствору 1,2,3,4-тетрагидрохинолина (100 мл) в безводном тетрагидрофуране (300 мл) добавляли по каплям в течение 30 минут бромэтилпируват (53 мл). Смесь перемешивали в течение 24 часов при комнатной температуре. Реакционную смесь фильтровали и твердое вещество промывали тетрагидрофураном (100 мл). Фильтрат упаривали досуха, получая этиловый эфир 3-(3,4-дигидро-2H-хинолин-1-ил)-2-оксопропионовой кислоты в виде коричневого масла, 117 г.
Стадия 2

Безводный хлорид магния (29,4 г, 0,31 моль) суспендировали в 2-метоксиэтаноле (400 мл) и смесь перемешивали в течение 15 минут при 125°C. Затем добавляли раствор этилового эфира 3-(3,4-дигидро-2H-хинолин-1-ил)-2-оксопропионовой кислоты (76,57 г 0,31 моль) в 2-метоксиэтаноле (100 мл) и смесь перемешивали при 125°C в течение 60 минут. Смесь перемешивали дополнительно в течение 5 часов при кипении с обратным холодильником, охлаждали и упаривали досуха. Остаток затем подкисляли 2М хлористоводородной кислотой (500 мл) и экстрагировали дихлорметаном (3×500 мл). Объединенные органические слои затем промывали 5% раствором бикарбоната натрия и сушили над безводным сульфатом магния, затем упаривали досуха. Остаток затем очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:4), получая этиловый эфир 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-карбоновой кислоты (31,0 г, 47%).
1H ЯМР (CDCl3) 400 МГц δ: 7,9 (д, 1H, J=8 Гц), 7,79 (с, 1H), 7,17 (м, 1H), 6,99 (д, 1H, J=7,2 Гц), 4,37 (м, 2H), 4,18 (т, 2H, J=5,6 Гц), 3,0 (т, 2H, J=6 Гц), 2,24 (т, 2H, J=6 Гц), 1,42 (т, 3H, J=7,2 Гц).
Стадия 3
К раствору этилового эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-карбоновой кислоты (31 г, 0,14 моль) в смеси этанола (200 мл) и воды (200 мл) добавляли гидроксид натрия (30,8 г, 0,77 моль). Смесь нагревали при кипении с обратным холодильником в течение 2 часов, затем охлаждали до комнатной температуры и разбавляли водой (2,64 л). Смесь затем промывали дихлорметаном (2×300 мл) и водный слой подкисляли концентрированной хлористоводородной кислотой до pH 1,0. Образовавшийся осадок собирали фильтрованием, промывали водой и сушили, получая 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-карбоновую кислоту в виде темно-желтого твердого вещества (23 г, 85%).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,95 (уш.с, 1H), 7,96 (с, 1H), 7,69 (д, 1H, J=8,4 Гц), 7,06 (т, 1H, J=6,8 Гц), 6,92 (д, 1H, J=6,8 Гц), 4,19 (т, 2H, J=6 Гц), 2,91 (т, 2H, J=6 Гц), 2,11 (т, 2H, J=5,6 Гц).
Стадия 4

5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-карбоновую кислоту (37,5 г, 0,186 моль), хромит меди (13,5 г, 43 ммоль) и хинолин (180 мл) нагревали при перемешивании при 185°C в течение 2 часов. Смесь охлаждали, разбавляли дихлорметаном (1 л) и фильтровали через hyflo. Фильтрат промывали 2М хлористоводородной кислотой (2×600 мл) и дважды 2М гидроксидом натрия (150 мл), затем упаривали досуха. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:6), получая 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин (21 г, 72%) в виде бледно-желтого твердого вещества.
1H ЯМР (CDCl3) 400 МГц δ: 7,44 (дд, 1H, J=0,8 и 7,6 Гц), 7,07 (д, 1H, J=3,2 Гц), 7,01 (т, 1H, J=7,2 Гц), 6,9 (дд, 1H, J=0,8 и 6,8 Гц), 6,43 (д, 1H, J=3,2 Гц), 4,16 (т, 2H, J=6 Гц), 2,99 (т, 2H, J=6,4 Гц), 2,24 (м, 2H).
Стадия 5

К раствору 5,6-дигидро-4H-пирролохинолина (4,0 г, 25,3 ммоль) в безводном диэтиловом эфире (300 мл) при 0°C добавляли оксалилхлорид (2,22 мл, 25,3 ммоль). Смесь перемешивали в течение 30-45 минут при 0°C, затем охлаждали до -78°C. Затем медленно добавляли метоксид натрия в метаноле (0,5M) (60 мл) и смесь оставляли нагреваться до комнатной температуры. Смесь затем разбавляли этилацетатом (200 мл), промывали водой (100 мл) с последующим промыванием насыщенным водным раствором хлорида натрия (50 мл). Органический слой сушили над безводным сульфатом натрия и упаривали досуха. Остаток растворяли в этилацетате (100 мл), фильтровали через 2-дюймовый слой плотного силикагеля и упаривали, получая метиловый эфир 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты в виде желтого твердого вещества (5,3 г, 85%).
1H ЯМР (CDCl3) 400 МГц δ: 8,3 (с, 1H), 8,14 (д, 1H), 7,22 (т, 1H), 7,04 (д, 1H), 4,2 (т, 2H), 3,95 (с, 3H), 3,0 (т, 2H), 2,3 (т, 2H).
Стадия 6

К раствору метилового эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты (1,0 г, 4,12 ммоль) и индол-3-ацетамида (0,8 г, 4,5 ммоль) в безводном тетрагидрофуране при 0°C добавляли по каплям в течение 30 минут раствор трет-бутоксида калия (1M в тетрагидрофуране) (12,4 мл, 12,4 ммоль). Смесь перемешивали при 0°C в течение 2 часов. Затем добавляли концентрированную хлористоводородную кислоту (10 мл) и смесь перемешивали в течение 1 часа при комнатной температуре. Смесь затем разбавляли этилацетатом (200 мл), промывали дважды водой (50 мл) и насыщенным водным раствором хлорида натрия (50 мл) и органический слой сушили над безводным сульфатом натрия. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:4), получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-дион в виде ярко-красного твердого вещества (1,2 г, 80%).
1H ЯМР (CDCl3) 400 МГц δ: 8,5 (уш.с, 1H), 7,78 (с, 1H), 7,63 (д, 1H, J=2,8 Гц), 7,44 (с, 1H), 7,35 (д, 1H, J=8 Гц), 7,16 (д, 1H, J=8,4 Гц), 7,11 (т, 1H, J=7,6 Гц), 6,86 (т, 1H, J=7,6 Гц), 6,80 (д, 1H, J=7,2 Гц), 6,64 (т, 1H, J=8 Гц), 6,57 (д, 1H, J=8 Гц), 4,2 (т, 2H, J=6 Гц), 2,96 (т, 2H, J=6 Гц), 2,24 (м, 2H).
Пример 2. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона
Получение (±)-цис-соединений, (±)-транс-соединений или их смесей проводили с использованием восстановительных условий, как описано в каждой из методик А-М.
Методика А: Восстановление 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона с помощью Zn/Hg:
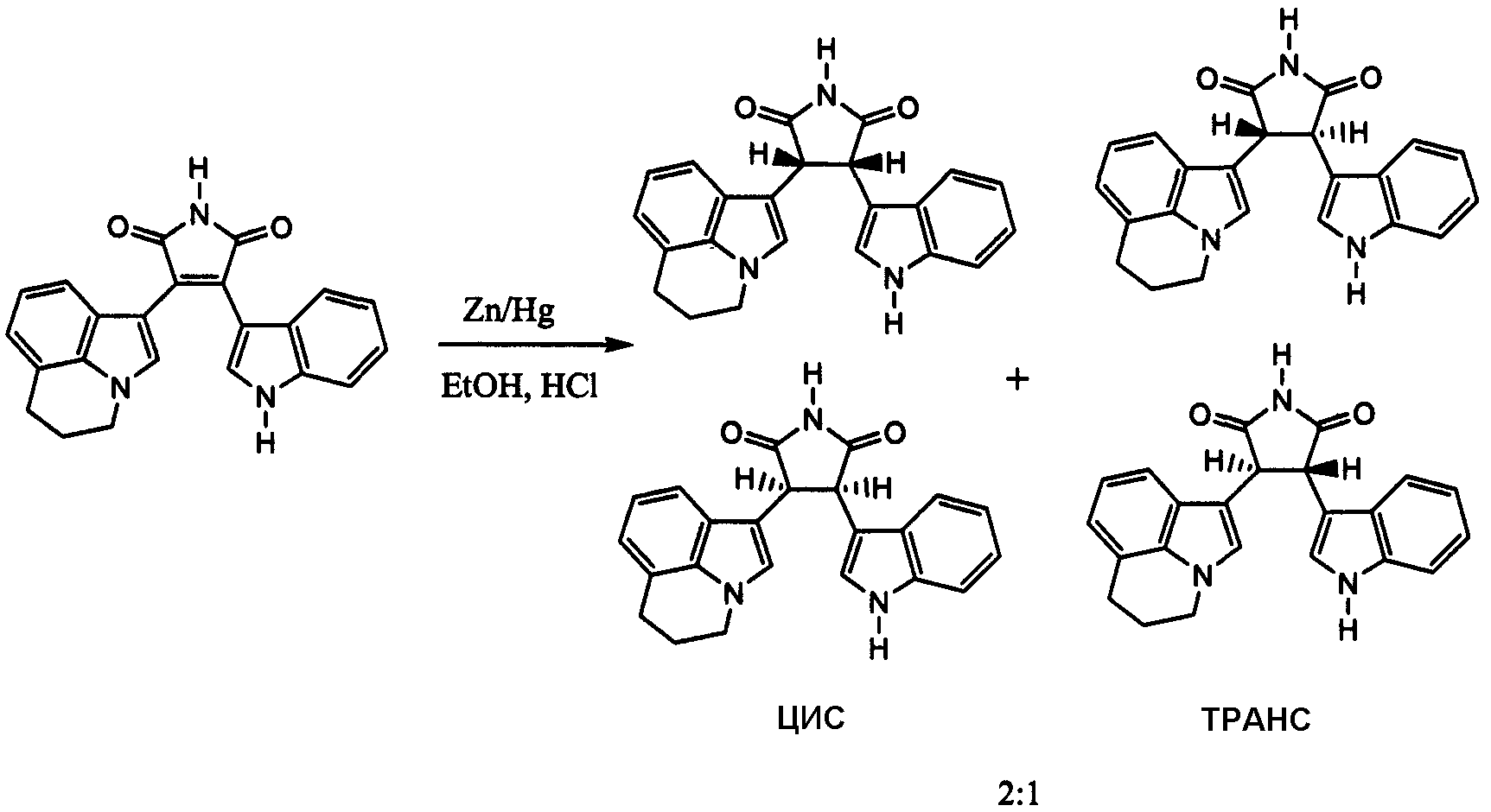
Активный восстановитель цинк-ртуть для восстановления 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона получали из металлического цинка и HgCl2. Порошкообразный цинк (2,5 г) и хлорид ртути (II) (0,25 г) суспендировали в деионизированной воде (3 мл) и перемешивали в течение 20 минут. Затем добавляли несколько капель концентрированной хлористоводородной кислоты и затем смесь перемешивали в течение нескольких минут. Твердое вещество отфильтровывали, промывали деионизированной водой (50 мл), этанолом (50 мл) и сушили.
К суспензии полученного, как описано выше, восстановителя Zn(Hg) в сухом этаноле (50 мл) добавляли 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-дион (0,35 г, 95,4 мкмоль). Смесь нагревали при кипении с обратным холодильником в течение 30-60 минут, при этом сухой газообразный хлористый водород медленно пропускали через смесь. Затем смесь охлаждали, фильтровали и упаривали досуха. Затем добавляли 5%-ный раствор карбоната калия (150 мл) и этилацетат (300 мл). Органический слой сушили над безводным сульфатом магния и упаривали, получая ~2:1 смесь (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (0,2 г).
Методика B: Восстановление 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона водородом в присутствии палладия-на-угле:

Суспензию 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона (16 г, 43,6 ммоль) и 10% палладия-на-угле (Pd/C, влажный катализатор) (8 г) перемешивали в атмосфере водорода при давлении 1 атм в метаноле (600 мл) при комнатной температуре в течение 48 часов. Катализатор затем отфильтровывали через слой целита и фильтрат упаривали досуха. Остаток повторно растворяли в метаноле и продукт осаждали добавлением холодной воды. Осадок отфильтровывали, промывали водой и сушили в вакууме, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион (9,2 г).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,56 (с, 1H), 10,66 (с, 1H), 7,43 (д, 1H, J=7,6 Гц), 7,14 (д, 2H, J=8 Гц), 6,86-6,97 (м, 4H), 6,78 (т, 1H, J=7,2 Гц), 6,69 (д, 1H, J=6,8 Гц), 4,88 (дд, 2H, J=9,2 и 45,6 Гц), 3,88 (м, 2H), 2,76 (т, 2H, J=5,6 Гц), 1,94 (т, 2H, J=6 Гц).
Методика C: Восстановление 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона с использованием магния в метаноле:

Магниевую стружку (3,05 г, 0,125 моль) добавляли к раствору 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона (2,56 г, 6,97 ммоль) в безводном метаноле (100 мл) и нагревали при кипении с обратным холодильником в атмосфере азота в течение 40 минут. После охлаждения до комнатной температуры смесь выливали в этилацетат (300 мл), промывали 1M хлористоводородной кислотой (300 мл) и водой (500 мл). Органический слой сушили над безводным сульфатом натрия и упаривали досуха. Остаток затем очищали хроматографией на силикагеле с использованием 40-50% этилацетата в гексанах, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в виде бледно-розового твердого вещества (2,3 г).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,54 (с, 1H), 11,03 (с, 1H), 7,32-7,4 (м, 4H), 7,17 (д, 1H, J=7,2 Гц), 7,07 (т, 1H, J=7,6 Гц), 6,96 (т, 1H, J=7,6 Гц), 6,82-6,89 (м, 2H), 4,5 (дд, 2H, J=7,2 и 20 Гц), 4,07 (т, 2H, J=5,2 Гц), 2,87 (т, 2H, J=6 Гц), 2,08 (м, 2H).
Пример 3. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона из (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона:

Полученный образец (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (378 мг, 1,02 ммоль) нагревали при 50°C в трет-бутаноле (10 мл) в присутствии трет-бутоксида калия (11 мг, 98 мкмоль) в течение 16 часов. Смесь выливали в этилацетат (100 мл) и промывали водой (100 мл). Органический слой сушили над безводным сульфатом натрия и упаривали досуха, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в виде золотисто-коричневого порошка (276 мг).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,54 (с, 1H), 11,03 (с, 1H), 7,32-7,4 (м, 4H), 7,17 (д, 1H, J=7,2 Гц), 7,07 (т, 1H, J=7,6 Гц), 6,96 (т, 1H, J=7,6 Гц), 6,82-6,89 (м, 2H), 4,5 (дд, 2H, J=7,2 и 20 Гц), 4,07 (т, 2H, J=5,2 Гц), 2,87 (т, 2H, J=6 Гц), 2,08 (м, 2H).
Пример 4. Хроматографическое разделение 3(R),4(S)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и 3(S),4(R)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона:

Смесь (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (135 мг) в метаноле (10 мл) и ацетонитриле (6 мл) подвергали препаративной жидкостной хроматографии в сверхкритических условиях с использованием хиральной колонки AD 20 мм×250 мм, элюируя 35% метанолом/CO2 со скоростью потока 3,5 мл/минуту. Получен более быстро элюируемый пик при 4,55 минутах (60 мг), отнесенный к 3(R),4(S)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону, и более медленно элюируемый пик при 6,05 минутах (56 мг), отнесенный к 3(S),4(R)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону. Распределение абсолютной стереохимической конфигурации было проведено исключительно на основании соответствующих времени удерживания родственных соединений и может быть обратным.
Пример 5. Хроматографическое разделение 3(R),4(R)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и 3(S),4(S)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона:

Смесь (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (200 мг) в ацетонитриле (1 мл) подвергали препаративной жидкостной хроматографии в сверхкритических условиях с использованием колонки CHIRALPAK® AD (Daicel, U.S.A.) 20 мм×250 мм, элюируя 35% метанолом/CO2 при скорости потока 3,5 мл/минуту. Хроматография давала более быстро элюируемый пик транс-изомера (82 мг), имеющий отрицательное оптическое вращение, отнесенный к (-)-3(R),4(R)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону, и более медленно элюируемый пик транс-изомера (86 мг), имеющий положительное оптическое вращение, отнесенный к (+)-3(S),4(S)-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону. Распределение абсолютной стереохимической конфигурации было проведено исключительно на основании соответствующих времени удерживания родственных соединений, и может быть обратным. Все измерения оптического вращения были проведены в хлороформе при 25°C при 589 нм.
Кристаллы хроматографически разделенных (+) или (-) изомеров транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона могут быть получены из 2,2,2-трифторэтанола с использованием метода парового удара и медленного упаривания при 49°C. Кристаллы данных изомеров также могут быть получены из этанола при комнатной температуре путем упаривания с использованием кристаллов для затравки, полученных методом парового удара.
Пример 6. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-трифторметилфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-трифторметилфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2'-трифторметилфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,16 (с, 1H), 7,83 (д, 2H, J=7,2 Гц), 7,58 (м, 2H), 7,37 (д, 1H, J=7,6 Гц), 7,33 (с, 1H), 6,85 (д, 1H, J=6,8 Гц), 6,66 (т, 1H, J=7,2 Гц), 5,96 (д, 1H, J=8,8 Гц), 4,2 (т, 2H, J=5,6 Гц), 2,95 (т, 2H, J=6,4 Гц), 2,22 (м, 2H).
Пример 7. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-тиофен-2-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-тиофен-2-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-тиенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 7,87 (с, 1H), 7,49 (д, 1H, J=5,2 Гц), 7,37 (с, 1H), 7,3 (д, 1H, J=4 Гц), 7,02 (т, 1H, J=4 Гц), 6,89-6,98 (м, 2H), 6,53 (д, 1H, J=7,6 Гц), 4,92 (т, 2H, J=6 Гц), 3,04 (т, 2H, J=6 Гц), 2,31 (м, 2H).
Пример 8. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 3-метоксифенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,01 (с, 1H), 7,31 (с, 1H), 7,23 (т, 1H, J=7,6 Гц), 7,09 (м, 2H), 6,87-6,92 (м, 2H), 6,73 (т, 1H, J=7,6 Гц), 6,14 (д, 1H, J=8 Гц), 4,25 (т, 2H, J=5,2 Гц), 2,99 (т, 2H, J=5,6 Гц), 2,67 (м, 2H).
Пример 9. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-2-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-2-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием пиридин-2-илацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,58 (д, 1H, J=4,4 Гц), 8,12 (с, 1H), 7,78 (дт, 1H, J=1,6 и 7,6 Гц), 7,68 (д, 1H, J=8 Гц), 7,31 (с, 1H), 7,25 (м, 1H), 6,87 (д, 1H, J=6 Гц), 6,68 (т, 1H, J=8 Гц), 5,91 (д, 1H, J=7,6 Гц), 4,24 (т, 2H, J=5,6 Гц), 2,97 (т, 2H, J=6 Гц), 2,25 (м, 2H).
Пример 10. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метоксифенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метоксифенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 4-метоксифенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 7,95 (с, 1H), 7,51 (м, 2H), 7,25 (с, 1H), 6,85-6,89 (м, 3H), 6,75 (т, 1H, J=8 Гц), 6,24 (д, 1H, J=8 Гц), 4,26 (т, 2H, J=5,6 Гц), 3,82 (с, 3H), 2,99 (т, 2H, J=6,4 Гц), 2,27 (м, 2H).
Пример 11. Получение 3-бензо[1,3]диоксол-5-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-диона
3-Бензо[1,3]диоксол-5-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 3,4-(метилендиокси)фенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 7,98 (с, 1H), 7,04-7,07 (м, 2H), 6,90 (д, 1H, J=7,2 Гц), 6,76-6,82 (м, 2H), 6,30 (д, 1H, J=8 Гц), 5,98 (с, 2H,), 4,26 (т, 2H, J=5,6 Гц), 2,99 (т, 2H, J=6 Гц), 2,28 (м, 2H).
Пример 12. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-фенилпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-фенилпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием фенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,01 (с, 1H), 7,52 (м, 2H), 7,35 (м, 3H), 7,27 (с, 1H), 6,87 (д, 1H, J=7,2 Гц), 6,7 (т, 1H, J=7,2 Гц), 6,08 (д, 1H, J=8 Гц), 4,26 (т, 2H, J=5,6 Гц), 2,99 (т, 2H, J=5,6 Гц), 2,27 (м, 2H).
Пример 13. Получение 3-бензо[b]тиофен-2-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-диона
3-Бензо[b]тиофен-2-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-бензотиофенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,11 (с, 1H), 8,14 (с, 1H), 8,01 (д, 1H, J=8 Гц), 7,84 (с, 1H), 7,45 (д, 1H, J=8 Гц), 7,3 (т, 1H, J=7,2 Гц), 7,15 (т, 1H, J=7,6 Гц), 6,71 (д, 1H, J=6,8 Гц), 6,43 (т, 1H, J=7,6 Гц), 5,99 (д, 1H, J=8 Гц), 4,26 (т, 2H, J=5,2 Гц), 2,86 (т, 2H, J=5,6 Гц), 2,1 (м, 2H).
Пример 14. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-феноксифенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-феноксифенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 3-феноксифенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,03 (с, 1H), 8,01 (с, 1H), 7,43 (т, 1H, J=7,6 Гц), 7,28 (д, 1H, J=7,6 Гц), 7,15 (т, 2H, J=7,6 Гц), 7,03 (т, 2H, J=7,6 Гц), 6,92 (д, 1H, J=6,8 Гц), 6,8 (с, 1H), 6,76 (т, 1H, J=8 Гц), 6,60 (д, 2H, J=7,6 Гц), 6,08 (д, 1H, J=8 Гц), 4,27 (т, 2H, J=5,6 Гц), 2,97 (т, 2H, J=6 Гц), 2,16 (м, 2H).
Пример 15. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-хлорфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-хлорфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 3-хлорфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,11 (с, 1H), 8,13 (с, 1H), 7,47-7,43 (м, 2H), 7,36 (т, 1H, J=7,6 Гц), 7,29 (д, 1H, J=7,6 Гц), 6,86 (д, 1H, J=6,8 Гц), 6,68 (т, 1H, J=7,6 Гц), 5,97 (д, 1H, J=8 Гц), 4,31 (т, 2H, J=5,6 Гц), 2,93 (т, 2H, J=5,6 Гц), 2,16 (м, 2H).
Пример 16. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлорфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлорфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-хлорфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,1 (с, 1H), 8,17 (с, 1H), 7,55 (д, 1H, J=8 Гц), 7,45-7,49 (м, 1H), 7,36 (д, 2H, J=4,4 Гц), 6,81 (д, 1H, J=7,2 Гц), 6,58 (т, 1H, J=8 Гц), 5,92 (д, 1H, J=8,4 Гц), 4,27 (м, 2H), 2,89 (т, 2H, J=6 Гц), 2,11 (м, 2H).
Пример 17. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,5-диметоксифенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,5-диметоксифенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2,5-диметоксифенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 10,93 (с, 1H), 8,06 (с, 1H), 6,97 (с, 2H), 6,81 (д, 1H, J=7,6 Гц), 6,77 (с, 1H), 6,6 (т, 1H, J=8 Гц), 5,92 (д, 1H, J=8 Гц), 4,26 (т, 2H, J=5,2 Гц), 3,63 (с, 3H), 3,3 (с, 3H), 2,9 (т, 2H, J=5,6 Гц), 2,11 (м, 2H).
Пример 18. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-хлор-4-фторфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,11 (с, 1H), 8,16 (с, 1H), 7,57 (дд, 1H, J=2,8 и 9,2 Гц), 7,44 (дд, 1H, J=6,8 и 8,4 Гц), 7,28 (дт, 1H, J=2,4 и 8,4 Гц), 6,84 (д, 1H, J=7,2 Гц), 6,66 (т, 1H, J=8 Гц), 5,98 (д, 1H, J=8 Гц), 4,27 (м, 2H), 2,9 (т, 2H, J=5,6 Гц), 2,11 (м, 2H).
Пример 19. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-нафталин-1-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-нафталин-1-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 1-нафтилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,1 (с, 1H), 8,17 (с, 1H), 8,02 (д, 1H, J=8 Гц), 7,97 (д, 1H, J=8 Гц), 7,75 (д, 1H, J=8 Гц), 7,43-7,55 (м, 3H), 7,37 (т, 1H, J=8 Гц), 6,66 (д, 1H, J=6,8 Гц), 6,27 (т, 1H, J=8 Гц), 5,57 (д, 1H, J=8 Гц), 4,24 (т, 2H, J=5,2 Гц), 2,83 (т, 2H, J=5,6 Гц), 2,08 (м, 2H).
Пример 20. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,6-дихлорфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,6-дихлорфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2,6-дихлорфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,23 (с, 1H), 8,27 (с, 1H), 7,53-7,62 (м, 3H), 6,85 (д, 1H, J=7,2 Гц), 6,64 (т, 1H, J=8,4 Гц), 6,01 (д, 1H, J=8 Гц), 4,27 (т, 2H, J=5,6 Гц), 2,9 (т, 2H, J=5,6 Гц), 2,11 (м, 2H).
Пример 21. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-бромфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-бромфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-бромфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,09 (с, 1H), 8,17 (с, 1H), 7,75 (м, 1H), 7,37 (м, 2H), 7,33 (м, 1H), 6,81 (д, 1H, J=7,2 Гц), 6,58 (т, 1H, J=8 Гц), 5,95 (д, 1H, J=8 Гц), 4,26 (т, 2H, J=5,6 Гц), 2,9 (т, 2H, J=5,6 Гц), 2,11 (м, 2H).
Пример 22. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-индол-1-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-индол-1-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием N-индолил-2-ацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,21 (с, 1H), 8,18 (с, 1H), 7,58 (д, 1H, J=8 Гц), 7,52 (д, 1H, J=3,2 Гц), 7,01 (м, 2H), 6,91 (т, 1H, J=6,8 Гц), 6,74 (д, 1H, J=2,8 Гц), 6,71 (д, 1H, J=7,2 Гц), 6,4 (т, 1H, J=8 Гц), 5,63 (д, 1H, J=8 Гц), 4,28 (т, 2H, J=4,8 Гц), 2,85 (т, 2H, J=5,6 Гц), 2,11 (м, 2H).
Пример 23. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-3-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-3-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием пиридин-3-илацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,14 (с, 1H), 8,53 (м, 2H), 8,12 (с, 1H), 7,78 (д, 1H, J=7,6 Гц), 7,41 (дд, 1H, J=4,8 и 8 Гц), 6,86 (д, 1H, J=7,2 Гц), 6,66 (т, 1H, J=7,6 Гц), 5,97 (д, 1H, J=8,4 Гц), 4,3 (т, 2H, J=5,2 Гц), 2,93 (т, 2H, J=5,6 Гц), 2,16 (м, 2H).
Пример 24. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 5-бром-1H-индолил-3-илацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,77 (с, 1H), 10,92 (с, 1H), 7,82 (с, 1H), 7,69 (д, 1H, J=2,4 Гц), 7,33 (д, 1H, J=8,4 Гц), 7,10 (дд, 1H, J=2 и 8,4 Гц), 6,99 (д, 1H, J=1,6 Гц), 6,76 (д, 1H, J=7,2 Гц), 6,55 (т, 1H, J=8 Гц), 6,36 (д, 1H, J=8 Гц), 4,25 (т, 2H, J=5,6 Гц), 2,92 (т, 2H, J=5,6 Гц), 2,17 (м, 2H).
Пример 25. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-4-илпиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-пиридин-4-илпиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием пиридин-4-илацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,17 (с, 1H), 8,53 (м, 2H), 8,54 (д, 2H, J=6 Гц), 8,17 (с, 1H), 7,32 (д, 2H, J=4,8 Гц), 6,88 (д, 1H, J=7,2 Гц), 6,69 (т, 1H, J=7,6 Гц), 5,93 (д, 1H, J=8 Гц), 4,31 (т, 2H, J=6 Гц), 2,94 (т, 2H, J=6 Гц), 2,16 (м, 2H).
Пример 26. Получение 3-бифенил-4-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-диона
3-Бифенил-4-ил-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 4-фенилфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (ацетон-d6) 400 МГц δ: 8,08 (с, 1H), 7,6-7,73 (м, 7H), 7,48 (т, 2H, J=6,8 Гц), 7,39 (д, 1H, J=7,2 Гц), 6,84 (д, 1H, J=8 Гц), 6,65 (т, 1H, J=8,4 Гц), 6,23 (т, 1H, J=7,2 Гц), 5,97 (д, 1H, J=8,4 Гц), 4,38 (м, 2H), 2,98 (м, 2H), 2,28 (м, 2H).
Пример 27. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метансульфонилфенил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метансульфонилфенил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 4-метансульфонилфенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,09 (с, 1H), 7,9 (д, 2H, J=8,4 Гц), 7,71 (д, 2H, J=8,4 Гц), 7,64 (с, 1H), 6,91 (д, 1H, J=7,2 Гц), 6,73 (т, 1H, J=7,6 Гц), 5,95 (д, 1H, J=8,4 Гц), 4,29 (т, 2H, J=5,6 Гц), 3,06 (с, 3H), 3,0 (т, 2H, J=6 Гц), 2,29 (м, 2H).
Пример 28. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-трифторметилхинолин-4-илсульфанил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-трифторметилхинолин-4-илсульфанил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 2-[[2-(трифторметил)-4-хинолинил]тио]ацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 8,3 (д, 1H, J=7,6 Гц), 8,11 (д, 1H, J=8,4 Гц), 8,05 (с, 1H), 7,68-7,82 (м, 4H), 7,23 (с, 1H), 6,83 (м, 2H), 4,21 (т, 2H, J=6 Гц), 2,92 (т, 2H, J=6 Гц), 2,21 (м, 2H).
Пример 29. Получение 3-(4-бензоилоксифенил)-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-диона
3-(4-Бензоилоксифенил)-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 4-бензилоксифенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 7,95 (с, 1H), 7,5 (д, 2H, J=8,8 Гц), 7,33-7,43 (м, 6H), 6,93 (д, 2H, J=8,8 Гц), 6,88 (д, 1H, J=7,2 Гц), 6,73 (т, 1H, J=7,2 Гц), 6,23 (д, 1H, J=8,4 Гц), 5,08 (с, 2H), 4,25 (т, 2H, J=5,6 Гц), 2,99 (т, 2H, J=6 Гц), 2,27 (м, 2H).
Пример 30. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-[4-(2-морфолин-4-илэтокси)фенил]пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-[4-(2-морфолин-4-илэтокси)фенил]пиррол-2,5-дион получали в соответствии с примером 1, стадии 1-6, с использованием 4-(2-морфолин-4-илэтокси)фенилацетамида вместо индол-3-ацетамида на стадии 6.
1H ЯМР (CDCl3) 400 МГц δ: 7,95 (с, 1H), 7,48 (м, 3H), 6,86 (м, 3H), 6,74 (т, 1H, J=8 Гц), 6,23 (д, 1H, J=8, Гц), 4,26 (т, 2H, J=5,2 Гц), 4,16 (т, 2H, J=5,6 Гц), 3,77 (т, 4H, J=4,8 Гц), 2,99 (т, 2H, J=6 Гц), 2,87 (т, 2H, J=5,2 Гц), 2,65 (м, 4H), 2,28 (м, 2H).
Пример 31. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(1-нафтил)-1H-индол-3-ил)пиррол-2,5-диона
Смесь 1-нафтилбороновой кислоты (41 мг, 0,24 ммоль), 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пиррол-2,5-диона (88 мг, 0,2 ммоль) (получен, как описано в примере 24), тетракистрифенилфосфинпалладия (5 моль%) в толуоле (4 мл), этаноле (4 мл), насыщенном растворе NaHCO3 (1 мл) и воде (2 мл) нагревали при 100°C в атмосфере азота в течение 5 часов. После охлаждения до комнатной температуре смесь экстрагировали этилацетатом (3×15 мл) и концентрировали. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:4), получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(1-нафтил)-1H-индол-3-ил)пиррол-2,5-дион в виде ярко-красного твердого вещества (70 мг, 71%).
1H ЯМР (CD3OD) δ: 1,80-1,92 (м, 2H), 2,72-2,80 (т, J=6,0 Гц, 2H), 3,94-3,99 (т, J=6,0 Гц, 2H), 6,50-6,58 (м, 3H), 6,66 (с, 1H), 6,72 (м, 1H), 6,98 (дд, J=8,4 Гц, J'=2,0 Гц, 1H), 7,00-7,50 (м, 2H), 7,28 (дд, J=6,8 Гц, J'=8,4 Гц, 1H), 7,38-7,43 (м, 2H), 7,61 (с, 1H), 7,72 (д, J=8,4 Гц, 1H), 7,82 (д, J=8,4 Гц, 1H), 7,97 (с, 1H).
Пример 32. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-фенил-1H-индол-3-ил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-фенил-1H-индол-3-ил)пиррол-2,5-дион получали в соответствии со способом примера 31 с использованием фенилбороновой кислоты вместо 1-нафтилбороновой кислоты.
1H ЯМР (CD3OD) δ: 2,10-2,18 (м, 2H), 2,90 (т, J=5,6 Гц, 2H), 4,18 (т, J=5,6 Гц, 2H), 6,63 (т, J=7,6 Гц, 1H), 6,75-6,83 (м, 5H), 7,11-7,20 (м, 3H), 7,22 (дд, J=8,4 Гц, J'=1,2 Гц, 1H), 7,38 (д, J=8,4 Гц, 1H), 7,59 (с, 1H), 7,93 (с, 1H).
Пример 33. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(4-метоксифенил)-1H-индол-3-ил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(4-метоксифенил)-1H-индол-3-ил)пиррол-2,5-дион получали в соответствии со способом примера 31 с использованием 4-метоксифенилбороновой кислоты вместо 1-нафтилбороновой кислоты.
1H ЯМР (CD3OD) δ: 2,09-2,18 (м, 2H), 2,90 (т, J=6,0 Гц, 2H), 4,15 (т, J=6,0 Гц, 2H), 6,62-6,68 (м, 2H), 6,73 (с, 4H), 6,77-6,82 (м, 2H), 7,18 (д, J=8,4 Гц, 1H), 7,33 (д, J=8,4 Гц, 1H), 7,53 (с, 1H), 7,91 (с, 1H).
Пример 34. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(3-метилфенил)-1H-индол-3-ил)пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(3-метилфенил)-1H-индол-3-ил)пиррол-2,5-дион получали в соответствии со способом примера 31 с использованием 3-метилфенилбороновой кислоты вместо 1-нафтилбороновой кислоты.
1H ЯМР (CD3OD) δ: 2,00-2,10 (м, 2H), 2,11 (с, 3H), 2,81-2,88 (т, J=6,0 Гц, 2H), 4,03-4,11 (т, J=5,6 Гц, 2H), 6,50 (д, J=7,2 Гц, 1H), 6,64 (т, J=7,6 Гц, 1H), 6,74-6,81 (м, 3H), 6,86 (д, J=8,0 Гц, 1H), 6,94 (д, J=7,6 Гц, 1H), 7,03 (т, J=7,2 Гц, 1H), 7,22 (дд, J=8,4 Гц, J'=2,0 Гц, 1H), 7,36 (д, J=8,8 Гц, 1H), 7,48 (с, 1H), 7,90 (с, 1H).
Пример 35. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пиррол-2,5-дион, полученный, как описано в примере 24, восстанавливали с использованием Mg в метаноле, как описано в примере 2, методика С, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-бром-1H-индол-3-ил)пирролидин-2,5-дион.
1H ЯМР (CD3OD) δ: 2,18-2,26 (м, 2H), 2,96 (т, J=6,0 Гц, 2H), 4,12 (т, J=6,4 Гц, 2H), 4,40 (д, J=6,8 Гц, 1H), 4,52 (д, J=6,8 Гц, 1H), 6,86-6,96 (м, 2H), 7,08 (с, 1H), 7,13-7,30 (м, 5H).
Пример 36. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-фенил-1H-индол-3-ил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-фенил-1H-индол-3-ил)пиррол-2,5-дион, полученный, как описано в примере 32, восстанавливали с использованием Mg в метаноле, как описано в примере 2, методика С, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-фенил-1H-индол-3-ил)пирролидин-2,5-дион.
1H ЯМР (CD3OD) δ: 2,00-2,16 (м, 2H), 2,94 (т, J=6,0 Гц, 2H), 3,92-3,99 (м, 1H), 4,00-4,08 (м, 1H), 4,36 (д, J=6,4 Гц, 1H), 4,68 (д, J=6,4 Гц 1H), 6,88-6,97 (м, 2H), 7,04 (с, 1H), 7,12-7,15 (м, 1H), 7,17-7,47 (м, 9H).
Пример 37. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(1-нафтил)-1H-индол-3-ил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(1-нафтил)-1H-индол-3-ил)пиррол-2,5-дион, полученный, как описано в примере 31, восстанавливали с использованием Mg в метаноле, как описано в примере 2, методика С, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(1-нафтил)-1H-индол-3-ил)пирролидин-2,5-дион.
1H ЯМР (CD3OD) δ: 1,85-1,95 (м, 1H), 1,95-2,05 (м, 1H), 2,74-2,88 (м, 2H), 3,72-3,83 (м, 1H), 3,88-3,98 (м, 1H), 4,40 (д, J=6,4 Гц, 1H), 4,62 (д, J=6,4 Гц, 1H), 6,80 (д, J=6,8 Гц, 1H), 6,78 (т, J=8,0 Гц, 1H), 7,46 (с, 1H), 7,07-7,13 (м, 2H), 7,18-7,23 (дд, J=8,4 Гц, J=1,6 Гц, 2H), 7,27-7,34 (м, 2H), 7,41-7,49 (м, 3H), 7,78-7,83 (дд, J=8,4 Гц, J=3,2 Гц, 2H), 7,86-7,90 (д, J=7,6 Гц, 1H).
Пример 38. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(4-метоксифенил)-1H-индол-3-ил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(4-метоксифенил)-1H-индол-3-ил)пиррол-2,5-дион, полученный, как описано в примере 33, восстанавливали с использованием Mg в метаноле, как описано в примере 2, методика С, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(4-метоксифенил)-1H-индол-3-ил)пирролидин-2,5-дион.
1H ЯМР (CD3OD) δ: 2,03-2,22 (м, 2H), 2,98 (т, J=6,0 Гц, 2H), 3,80 (с, 3H), 3,97-4,06 (м, 1H), 4,06-4,14 (м, 1H), 4,38 (д, J=6,8 Гц, 1H), 4,67 (д, J=6,8 Гц, 1H), 6,86 (д, J=8,4 Гц, 2H), 6,91-7,00 (м, 2H), 7,08 (с, 2H), 7,17-7,27 (м, 4H), 7,31 (д, J=8,4 Гц, 1H), 7,37 (д, J=8,8 Гц, 1H).
Пример 39. (±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(3-метилфенил)-1H-индол-3-ил)пирролидин-2,5-дион
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(3-метилфенил)-1H-индол-3-ил)пиррол-2,5-дион, полученный, как описано в примере 34, восстанавливали с использованием Mg в метаноле, как описано в примере 2, методика С, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(5-(3-метилфенил)-1H-индол-3-ил)пирролидин-2,5-дион.
1H ЯМР (CD3OD) δ: 1,98-2,18 (м, 2H), 2,34 (с, 3H), 2,85-3,00 (м, 2H), 3,90-3,98 (м, 1H), 3,98-4,09 (м, 1H), 4,35 (д, J=7,2 Гц, 1H), 4,64 (д, J=6,8 Гц, 1H), 6,88-6,99 (м, 2H), 7,00-7,10 (м, 3H), 7,13-7,26 (м, 5H), 7,36 (м, 2H).
Пример 40. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пирролидин-2,5-диона
К раствору метилового эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты (0,243 г, 1 ммоль) и 2-хлор-4-фторфенилацетамида (1 ммоль) в безводном тетрагидрофуране (5 мл) при 0°C добавляли раствор трет-бутоксида калия (1М в тетрагидрофуране) (2,5 мл, 2,5 ммоль). Смесь перемешивали при 0°C в течение 2 часов. Затем добавляли концентрированную хлористоводородную кислоту (0,5 мл) и смесь перемешивали в течение 1 часа при комнатной температуре. Смесь затем разбавляли этилацетатом (20 мл), промывали водой (2×15 мл) и насыщенным водным раствором хлорида натрия (15 мл). Органический слой затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, получая масло. Масло разбавляли безводным метанолом (15 мл), полученный раствор загружали к высушенным в печи магниевым стружкам (0,5 г, 20,5 ммоль) и перемешивали при 70°C в вентилируемом реакторе до полного растворения стружек Mg или в течение двух часов. Затем реактор охлаждали до комнатной температуры. Смесь разбавляли этилацетатом (25 мл) и промывали 10% хлористоводородной кислотой (2×25 мл) и насыщенным водным раствором хлорида натрия (20 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле, с использованием градиентного элюирования смесью этилацетат/гексаны (от 10% этилацетата до 50% этилацетата в течение 40 минут), получая (25,6 мг, 6,7%) (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пирролидин-2,5-диона.
1H ЯМР (ДМСО-d6) 400 МГц δ: 12,5 (с, 1H), 7,52 (т, 1H, J=6,4 Гц), 7,49 (дд, 1H, J=6,4 2,4 Гц), 7,34 (с, 1H), 7,21 (тд, 1H, J=6,0 2,8 Гц), 7,10 (д, 1H, J=7,6 Гц), 6,87 (м, 2H), 4,67 (д, 1H, J=8,0 Гц), 4,51 (д, 1H, J=7,2 Гц), 2,90 (т, 2H, J=5,6 Гц), 2,11 (т, 2H, J=5,2 Гц).
Пример 41. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,6-дихлорфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,6-дихлорфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 2,6-дихлорфенилацетамидом. Выход 52,2 мг, 13,0%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,82 (с, 1H), 7,34 (м, 3H), 7,10 (д, 1H, J=7,2 Гц), 6,87 (м, 2H), 5,16 (д, 1H J=7,6 Гц), 5,10 (д, 1H, J=7,6 Гц), 2,91 (т, 2H, J=6,0 Гц) 2,10 (м, 2H).
Пример 42. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-бромфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-бромфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 4-бромфенилацетамидом. Выход 33,1 мг, 8,1%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,55 (с, 1H), 7,53 (дт, 2H, J=8,8 2,0 Гц), 7,34 (дт, 3H, J=8,0 2,0 Гц), 7,15 (дд, 1H, J=7,6 1,0 Гц), 6,86 (м, 2H), 4,53 (д, 1H, J=8,0 Гц), 4,37 (д, 1H, J=8,0 Гц), 4,10 (т, 2H, J=1,6 Гц), 2,90 (т, 2H, J=2,0 Гц), 2,12 (т, 2H, J=1,8 Гц).
Пример 43. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-хлорфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-хлорфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 4-хлорфенилацетамидом. Выход 32,7 мг, 9,0%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,54 (с, 1H), 7,40 (м, 4H), 7,33 (с, 1H), 7,15 (дд, 1H, J=6,8, 0,8 Гц), 6,86 (м, 2H), 4,54 (д, 1H, J=8,0 Гц), 7,38 (д, 1H, J=7,6 Гц), 4,10 (т, 2H, J=5,6 Гц), 2,90 (т, 2H, J=6,0 Гц), 2,11 (м, 2H).
Пример 44. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-трифторметоксифенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-трифторметоксифенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 4-трифторметоксифенилацетамидом. Выход 67,8 мг, 16,4%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,56 (с, 1H), 7,52 (д, 2H, J=8,4 Гц), 7,35 (с, 1H), 7,33 (д, 2H, J=8,0 Гц), 7,15 (д, 1H, J=7,2 Гц), 6,86 (м, 2H), 4,58 (д, 1H, J=8,0 Гц), 4,45 (д, 1H, J=8,0 Гц), 4,10 (т, 2H, J=6,0 Гц), 2,90 (т, 2H, J=6,0), 2,10 (т, 2H, J=5,6).
Пример 45. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(тиофен-3-ил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(тиофен-3-ил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид тиофен-3-илацетамидом. Выход 50,3 мг, 15,0%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,50 (с, 1H), 7,52 (м, 1H), 7,49 (м, 1H), 7,35 (с, 1H), 7,21 (дд, 1H, J=4,0 1,2 Гц), 7,16 (д, 1H, 7,6 Гц), 6,89 (д, 1H, J=4,4 Гц), 6,85 (т, 1H, J=6,8 Гц), 4,56 (д, 1H, J=7,2 Гц), 4,41 (д, 1H, J=7,2 Гц), 4,10 (т, 2H, J=6,0 Гц), 2,90 (т, 2H, J=6,0 Гц), 2,10 (м, 2H).
Пример 46. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-фторфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-фторфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 2-фторфенилацетамидом. Выход 30,6 мг, 8,8%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,64 (с, 1H), 7,36 (м, 3H), 7,17 (м, 3H), 6,84 (м, 2H), 4,44 (д, 1H, J=7,2 Гц), 4,40 (д, 1H, J=7,6 Гц), 4,10 (с, 2H), 2,88 (с, 2H), 2,09 (с, 2H).
Пример 47. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-тиофен-2-ил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-тиофен-2-ил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 2-тиофен-2-илацетамидом. Выход 30,6 мг, 8,8%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,58 (с, 1H), 7,45 (дд, 1H, J=5,2 0,8 Гц), 7,40 (с, 1H), 7,22 (д, 1H, J=8,0 Гц), 7,12 (д, 1H, J=3,2 Гц), 6,99 (дд, 1H, J=5,2 и 3,6 Гц), 4,63 (д, 1H, J=8,0 Гц), 4,60 (д, 1H, J=7,6 Гц), 2,90 (т, 2H, J=6,0 Гц), 2,12 (т, 2H, J=6,0 Гц).
Пример 48. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,4-дихлорфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,4-дихлорфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 2,4-дихлорфенилацетамидом. Выход 20,9 мг, 5,2%.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,65 (с, 1H), 7,69 (с, 1H), 7,51 (д, 1H, J=8,0 Гц), 7,43 (д, 1H, J=8,0 Гц), 7,34 (с, 1H), 7,12 (м, 1H), 6,87 (м, 2H), 4,65 (д, 1H, J=7,6 Гц), 4,55 (д, 1H, J=7,6 Гц), 4,10 (т, 2H, J=6,0 Гц), 2,90 (т, 2H, J=6,0), 2,12 (т, 2H, J=6,0 Гц).
Пример 49. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-фенилпирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-фенилпирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид фенилацетамидом.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,511 (с, 1H), 7,24-7,36 (м, 6H), 7,13 (д, 1H, J=7,2), 6,8-6,88 (м, 2H), 4,49 (д, 1H, J=8,0 Гц), 4,3 (д, 1H, J=7,6 Гц), 4,08 (м, 2H), 2,88 (м, 2H), 2,088 (м, 2H).
Пример 50. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлорфенил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлорфенил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид 2-хлорфенилацетамидом.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,655 (с, 1H), 7,41-7,48 (м, 2H), 7,27-7,35 (м, 3H, J=7,2), 7,87 (д, 1H, J=7,6), 6,81-6,88 (м, 2H), 4,632 (д, 1H, J=7,6 Гц), 4,494 (д, 1H, J=7,2), 4,07-4,10 (м, 2H), 2,884 (м, 2H), 2,09 (м, 2H).
Пример 51. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(N-метилиндол-3-ил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(N-метилиндол-3-ил)пирролидин-2,5-дион получали, как описано в примере 40, заменяя 2-хлор-4-фторфенилацетамид N-метилиндол-3-илацетамидом.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,55 (с, 1H), 7,44-7,34 (м, 4H), 7,2-7,18 (м, 2H), 7,01 (т, 1H), 6,82-6,89 (м, 2H), 4,49 (дд, 2H), 4,093 (т, 2H), 4,093 (т, 2H), 3,73 (с, 3H), 2,89 (т, 2H), 2,07 (м, 2H).
Пример 52. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метоксифенил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метоксифенил)пиррол-2,5-дион, получали, как описано в примере 10, и восстанавливали с использованием способа примера 2, методика B, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-метоксифенил)пирролидин-2,5-дион.
1H ЯМР (CDCl3) 400 МГц δ: 8,62 (с, 1H), 7,15 (д, 1H, J=7,6 Гц), 6,8-6,93 (м, 4H), 6,7 (с, 1H), 6,55 (д, 2H, J=8,4 Гц), 4,8 (д, 1H, J=8,8 Гц), 4,48 (д, 1H, J=8,8 Гц), 3,96 (м, 2H), 3,63 (с, 3H), 2,87 (т, 2H, J=6 Гц), 2,10 (м, 2H).
Пример 53. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,5-диметоксифенил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,5-диметоксифенил)пиррол-2,5-дион, полученный, как описано в примере 17, восстанавливали с использованием способа примера 2, методика B, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2,5-диметоксифенил)пирролидин-2,5-дион.
1H ЯМР (CDCl3) 400 МГц δ: 8,0 (с, 1H), 7,19 (д, 1H, J=7,6 Гц), 6,89 (т, 1H, J=7,2 Гц), 6,77 (д, 2H, J=7,2 Гц), 6,44-6,51 (м, 3H), 4,84 (д, 2H, J=9,6 Гц), 3,88-4,00 (м, 2H), 3,6 (с, 3H), 3,49 (с, 3H), 2,8 (м, 2H), 2,05 (м, 2H).
Пример 54. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пиррол-2,5-дион, полученный, как описано в примере 18, восстанавливали с использованием способа примера 2, методика B, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(2-хлор-4-фторфенил)пирролидин-2,5-дион.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,82 (с, 1H), 7,02-7,18 (м, 4H), 6,7-6,85 (м, 3H), 5,01 (д, 1H, J=9,2 Гц), 4,79 (д, 2H, J=9,6 Гц), 3,96 (м, 2H), 2,79 (м, 2H), 1,97 (м, 2H).
Пример 55. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-хлорфенил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-хлорфенил)пиррол-2,5-дион, полученный, как описано в примере 15, восстанавливали с использованием способа примера 2, методика B, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-хлорфенил)пирролидин-2,5-дион.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,66 (с, 1H), 7,13 (д, 1H, J=8 Гц), 6,95-7,02 (м, 5H), 6,78 (т, 1H, J=7,6 Гц), 6,7 (д, 1H, J=7,2 Гц), 4,84 (д, 1H, J=9,2 Гц), 4,65 (д, 2H, J=8,8 Гц), 3,9-4,03 (м, 2H), 2,79 (т, 2H, J=5,6 Гц), 1,97 (м, 2H).
Пример 56. Получение моно[транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового]эфира (±)-фосфорной кислоты:
Стадия 1

(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион (3,0 г, 8,13 ммоль, получен, как описано в примере 2, методика C) и формальдегид (30 мл, 37% в воде) в тетрагидрофуране (30 мл) перемешивали в течение 14-16 часов при комнатной температуре. Смесь затем помещали в смесь этилацетата (50 мл) и воды (50 мл). Органический слой промывали насыщенным раствором соли и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью EtOAc/гексан 1:1, получая 2,5 г, 77%, (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-диона в виде оранжевого вспененного твердого вещества (2,5 г, 77%).
Стадия 2

(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-дион (0,06 г) в безводном тетрагидрофуране (5 мл) обрабатывали дибензилфосфорамидатом (0,156 мл, 3,5 эквивалента) с последующим добавлением тетразола (3% раствор в ацетонитриле, 2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут и охлаждали до -78°C. Добавляли при -78°C раствор м-хлорпербензойной кислоты (70%, 0,162 г) в дихлорметане (2 мл). После выдерживания в течение 5 минут при -78°C температуру реакции поднимали до комнатной температуры и перемешивали в течение 5 минут. Растворители удаляли при пониженном давлении и остаток очищали флэш-хроматографией на колонке с силикагелем, элюируя этилацетатом и гексаном, получая дибензиловый эфир транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира фосфорной кислоты в виде твердого вещества (70 мг).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,10 (с, 1H), 7,32-7,39 (м, 12H), 6,84-7,24 (м, 2H), 5,49 (уш.с, 2H), 5,03 (м, 4H), 4,61 (дд, 2H), 4,06 (уш.с, 2H), 2,87 (уш.с, 2H), 2,07 (уш.с, 2H).
Стадия 3

Дибензиловый эфир транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира фосфорной кислоты (0,160 г) в метаноле (2 мл) и Pd/C (10%, 20 мг) перемешивали при комнатной температуре в атмосфере водорода при давлении в 1 атмосферу в течение двух часов. Смесь фильтровали через целит и растворитель удаляли, получая (±)-моно[транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметиловый]эфир фосфорной кислоты (0,110 г).
Пример 57. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира (±)-транс-2-аминопропионовой кислоты:
Стадия 1

К раствору (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-диона (0,5 ммоль) в тетрагидрофуране (8 мл) добавляли N-карбобензилоксиаланин (1,1 эквивалента) с последующим добавлением HBTU (1,5 эквивалента) и DIPEA (2,2 эквивалента). Смесь перемешивали при комнатной температуре в течение 15 часов. Растворители удаляли при пониженном давлении и остаток помещали в смесь этилацетата и воды (1:1, 15 мл). Органический слой отделяли и сушили. Остаток очищали хроматографией на силикагеле, получая N-карбобензилоксизащищенный продукт.
Стадия 2

Раствор N-карбобензилоксизащищенного продукта со стадии 1 (0,5 ммоль) в метаноле (8 мл) и несколько капель 4М HCl в этилацетате и 10% Pd/C (10% мас./мас.) перемешивали при комнатной температуре в атмосфере водорода при давлении в 1 атм в течение 2 часов. Смесь затем фильтровали через целит и растворитель удаляли, получая конечный продукт 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметиловый эфир (±)-транс-2-аминопропионовой кислоты.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,10 (с, 1H), 8,57 (с, 2H), 6,84-7,41 (м, 9H), 5,61 (м, 2H), 4,62 (дд, 2H), 4,07 (уш.с, 2H), 3,72 (уш.м, 1H), 2,87 (уш.с, 2H), 2,23 (с, 6H), 2,08 (уш.с, 2H), 1,40 (д, J=6,4 Гц, 3H).
Пример 58. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира (±)-транс-2-аминоуксусной кислоты
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметиловый эфир (±)-транс-2-аминоуксусной кислоты получали, как описано в примере 57, заменяя N-карбобензилоксиаланин N-карбобензилоксиглицином.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,19 (с, 1H), 8,46 (с, 2H), 6,82-7,43 (м, 9H), 5,61 (с, 2H), 4,65 (дд, 2H), 4,08 (уш.т, J=5,6 Гц, 2H), 3,88 (уш.с, 2H), 2,87 (т, J=5,6 Гц, 2H), 2,48 (с, 2H), 2,08 (т, J=4,8 Гц, 2H).
Пример 59. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира (±)-транс-2-диметиламиноуксусной кислоты
К раствору (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1-гидроксиметил-4-(1H-индол-3-ил)пирролидин-2,5-диона (0,5 ммоль) в тетрагидрофуране (8 мл) добавляли N,N-диметилглицин (1,1 эквивалента) с последующим добавлением HBTU (1,5 эквивалента) и DIPEA (N,N-диизопропилэтиламин, 2,2 эквивалента). Смесь перемешивали при комнатной температуре в течение 15 часов. Растворитель удаляли при пониженном давлении и остаток помещали в смесь этилацетата и воды (1:1, 15 мл). Органический слой отделяли и сушили, получая остаток. Остаток очищали хроматографией на колонке с силикагелем, элюируя смесью этилацетата и гексанов, получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметиловый эфир (±)-транс-2-диметиламиноуксусной кислоты.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,10 (с, 1H), 6,82-7,41 (м, 9H), 5,70 (м, 2H), 4,62 (дд, 2H), 4,07 (уш.с, 2H), 3,23 (с, 2H), 2,87 (уш.с, 2H), 2,23 (с, 6H), 2,08 (уш.с, 2H).
Пример 60. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметилового эфира (±)-транс-изоникотиновой кислоты
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-2,5-диоксопирролидин-1-илметиловый эфир (±)-транс-изоникотиновой кислоты получали, как описано в примере 59, заменяя N,N-диметилглицин 4-карбоксипиридином.
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,19 (с, 1H), 8,83 (д, 2H), 7,83 (д, 2H), 6,83-7,42 (м, 9H), 5,88 (с, 2H), 4,65 (дд, 2H), 4,05 (уш.т, 2H), 2,86 (уш.с, 2H), 2,08 (уш.с, 2H).
Пример 61. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпиррол-2,5-диона и (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпирролидин-2,5-диона
Стадия 1: К раствору 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона (100 мг, см. пример 1) в безводном диметилформамиде (5 мл) добавляли карбонат калия (0,5 г) и метилиодид (0,1 мл). Смесь перемешивали при комнатной температуре в течение 48 часов, затем выливали в этилацетат (100 мл), промывали водой (100 мл), сушили над безводным сульфатом натрия и упаривали, получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпиррол-2,5-дион в виде красного твердого вещества (93 мг).
Стадия 2: К раствору 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпиррол-2,5-диона (93 мг) в метаноле (5 мл) и этилацетате (5 мл) добавляли 10% Pd-C (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода при давлении в 1 атм в течение 48 часов. Добавляли толуол (50 мл) и смесь снова перемешивали при комнатной температуре в атмосфере водорода при давлении в 1 атм в течение 2 часов. Смесь затем фильтровали через слой целита и упаривали досуха, получая остаток. Остаток очищали с использованием хроматографии на силикагеле, элюируя 35-40% этилацетатом в гексанах, получая (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1-метилиндол-3-ил)-1-метилпирролидин-2,5-дион в виде бледно-желтого твердого вещества (53 мг).
1H ЯМР (CDCl3) 400 МГц δ: 7,23 (с, 1H), 7,05-7,07 (м, 2H), 7,01 (д, 1H, J=7,2 Гц), 6,92-6,97 (м, 1H), 6,85 (т, 1H, J=7,2 Гц), 6,74 (д, 1H, J=6,8 Гц), 6,64 (д, 2H, J=6,4 Гц), 4,78 (м, 2H), 3,75-3,84 (м, 2H), 3,45 (с, 3H), 3,27 (с, 3H), 2,79 (т, 2H, J=5,6 Гц), 1,98 (м, 2H).
Пример 62. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион может быть получен взаимодействием 1H-индола и 3,4-дибром-1-фенилпиррол-2,5-диона в присутствии метилмагнийбромида, получая 3-бром-4-(1H-индол-3-ил)-1-фенилпиррол-2,5-дион. 3-Бром-4-(1H-индол-3-ил)-1-фенилпиррол-2,5-дион затем подвергали взаимодействию с 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолином и LiHMDS (гексаметилдисилан лития) в толуоле или (5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)борандиолом и Pd(PPh3)4 (тетракис(трифенилфосфин)палладий), получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-1-фенилпиррол-2,5-дион, который восстанавливали и снимали защитную группу обработкой Mg в метаноле, как описано в примере 2, методика C, с последующим каталитическим гидрированием над палладием-на-угле, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион. Bnz представляет собой бензил:

Пример 63. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона
(±)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион может быть получен взаимодействием 1-аллил-7-бром-1H-индола с (COCl)2 (оксалилхлорид) и метоксидом натрия в полярном апротонном растворителе, таком как дихлорметан, получая метиловый эфир (1-аллил-7-бром-1H-индол-3-ил)оксоуксусной кислоты, который затем подвергали взаимодействию с 2-(1H-индол-3-ил)ацетамидом и tBuOK (трет-бутоксид калия) в ТГФ, получая 3-(1-аллил-7-бром-1H-индол-3-ил)-4-(1H-индол-3-ил)пиррол-2,5-дион. Восстановление 3-(1-аллил-7-бром-1H-индол-3-ил)-4-(1H-индол-3-ил)пиррол-2,5-диона с использованием Mg в кипящем метаноле, как описано в примере 2, методика C, давало 3-(1-аллил-7-бром-1H-индол-3-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, который обрабатывали 9-BBN (9-борабицикло[3,3,1]нонан) и Pd(PPh3)4 (тетракис(трифенилфосфин)палладий), получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион:

Пример 64. Получение (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона
Цис- и транс- изомеры 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона могут быть получены, начиная с реакции метилового эфира (1H-индол-3-ил)оксоуксусной кислоты и метилового эфира (5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)уксусной кислоты в присутствии основания, такого как LDA (диизопропиламид лития) в полярном апротонном растворителе, таком как ТГФ, получая диметиловый эфир 2-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-3-(1H-индол-3-ил)бут-2-ендионовой кислоты. Альтернативно диметиловый эфир 2-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-3-(1H-индол-3-ил)бут-2-ендионовой кислоты может быть получен взаимодействием метилового эфира (1H-индол-3-ил)уксусной кислоты и метилового эфира (5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты в присутствии основания (например, LDA) в ТГФ. Диметиловый эфир 2-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-3-(1H-индол-3-ил)бут-2-ендионовой кислоты восстанавливают каталитическим гидрированием над катализатором благородного металла (например, Pd-на-угле), получая диметиловый эфир 2-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-3-(1H-индол-3-ил)бутандионовой кислоты, который подвергали взаимодействию с бензиламином (PhCH2NH2), получая смесь цис- и транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)-1-фенилпирролидин-2,5-дионов. Снятие защитных групп смеси цис- и транс-изомеров может быть проведено с помощью каталитического гидрирования над Pd-на-угле (Pd-C), приводя к образованию смеси цис- и транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионов. Цис- и транс-изомеры могут быть разделены с получением всех четырех цис- и транс-изомеров (например, с помощью хроматографии, как в примерах 4 и 5). После снятия защитных групп смесь цис- и транс-изомеров может быть обработана трет-бутоксидом калия в трет-бутаноле (как в примере 3) или смесью ТГФ и трет-бутанола при 50°C, с образованием смеси с преобладанием главным образом транс-изомеров. Альтернативно диметиловый эфир 2-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-3-(1H-индол-3-ил)бутандионовой кислоты может быть подвергнут взаимодействию с аммиаком в метаноле при повышенной температуре с получением, главным образом, цис-изомеров 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, которые могут быть подвергнуты изомеризации, давая, главным образом, транс-изомеры 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона при действии трет-бутоксида калия в трет-бутаноле (как в примере 3) или смеси ТГФ и трет-бутанола при 50°C:

Пример 65. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)-1H-пиррол-2,5-диона
К смеси метилового эфира 5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)оксоуксусной кислоты (0,50 г, 2,05 ммоль) и 2-(3-метоксифенил)ацетамида (0,37 г, 2,26 ммоль) в безводном тетрагидрофуране (5 мл) добавляли по каплям трет-бутоксид калия (1,0М в тетрагидрофуране, 6,17 мл, 6,17 ммоль) при 0°C. Смесь перемешивали при 0°C в течение 3 часов, затем добавляли при 0°C концентрированную хлористоводородную кислоту (1,5 мл). Полученную смесь перемешивали в течение 1 часа, разбавляли этилацетатом (150 мл), промывали водой (2×50 мл), сушили над безводным сульфатом натрия и концентрировали, получая 0,91 г оранжевого твердого вещества. Остаток очищали колоночной хроматографией, элюируя 20-40% этилацетатом в гексане, получая 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)-1H-пиррол-2,5-дион. Т.пл. 99-101°C;
1H ЯМР (CDCl3) 400 МГц δ: 8,01 (с, 1H), 7,81 (уш.с, 1H), 7,20-7,25 (м, 1H), 7,06-7,08 (м, 2H), 6,85-6,91 (м, 2H), 7,25 (т, 1H), 6,13 (д, J=8,0 Гц, 1H), 4,24 (т, 2H), 3,66 (с, 3H), 2,97 (т, J=6,0 Гц, 2H), 2,22-2,26 (м, 2H).
Пример 66. Получение 3-[4-(бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1H-пиррол-2,5-диона
3-[4-(Бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1H-пиррол-2,5-дион получали в соответствии с примером 65, с использованием 2-(4-(бензилокси)фенил)ацетамида вместо 2-(3-метоксифенил)ацетамида. Т.пл 262-265°C;
1H ЯМР (ДМСО-d6) 400 МГц δ: 10,96 (с, 1H), 8,01 (д, 1H), 7,33-7,45 (м, 7H), 6,99 (д, J=6,8 Гц, 2H), 6,83 (д, J=7,2 Гц, 1H), 6,63 (т, 1H), 6,09 (д, J=8,4 Гц, 1H), 5,13 (с, 2H), 4,27 (м, 2H), 2,92 (м, 2H), 2,15 (м, 2H).
Пример 67. Получение 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-фторфенил)-1H-пиррол-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-фторфенил)-1H-пиррол-2,5-дион получали в соответствии с примером 65, с использованием 2-(4-фторфенил)ацетамида вместо 2-(3-метоксифенил)ацетамида. Т.пл. 234-235°C;
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,05 (с, 1H), 8,07 (д, 1H), 7,42-7,46 (м, 2H), 7,71-7,22 (м, 2H), 6,83 (д, J=7,2 Гц, 1H), 6,65-6,69 (м, 1H), 6,00 (д, J=8,0 Гц, 1H), 4,21 (с, 2H), 2,92 (уш.с, 2H), 2,15 (уш.с, 2H).
Пример 68. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)пирролидин-2,5-диона
Смесь 3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)-1H-пиррол-2,5-диона (0,73 г, 2,04 ммоль), магния (0,89 г, 36,7 ммоль) в безводном метаноле нагревали при кипении с обратным холодильником в течение 1,5 часов. После охлаждения до комнатной температуре светло-желтый раствор разбавляли этилацетатом (200 мл), промывали 1,0М хлористоводородной кислотой (2×50 мл), водой (100 мл), сушили над сульфатом натрия и концентрировали, получая светло-коричневое твердое вещество. Остаток очищали колоночной хроматографией на силикагеле, элюируя 40-50% этилацетатом в гексане, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)пирролидин-2,5-дион в виде светло-желтого твердого вещества. Т.пл. 87-91°C;
1H ЯМР (CDCl3) 400 МГц δ: 8,73 (с, 1H), 7,25-7,30 (м, 1H), 7,14 (д, J=7,6 Гц, 1H), 6,93-7,01 (м, 3H), 6,77-6,86 (м, 3H), 4,36 (д, J=6,4 Гц, 1H), 4,24 (д, J=6,4 Гц, 1H), 4,18 (т, J=5,5 Гц, 2H), 3,78 (с, 3H), 2,97 (т, J=5,6 Гц, 2H), 2,19-2,24 (м, 2H).
Пример 69. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-гидроксифенил)пирролидин-2,5-диона
К раствору (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-метоксифенил)пирролидин-2,5-диона в дихлорметане (10 мл) при -78°C в атмосфере азота медленно добавляли трехбромистый бор (1,0М в дихлорметане) (5,2 мл). Полученную смесь перемешивали при -78°C в течение 30 минут и при комнатной температуре в течение 3 часов. Реакционную смесь охлаждали до -78°C, затем гасили добавлением метанола (5 мл). Смеси давали возможность нагреться до комнатной температуры и выдерживали при комнатной температуре в течение 30 минут. Реакционную смесь разбавляли дихлорметаном (80 мл), промывали насыщенным водным раствором бикарбоната натрия (15 мл), водой (15 мл) и насыщенным раствором хлорида натрия (15 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат:гексан:дихлорметан (5:5:1, об/об), получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(3-гидроксифенил)пирролидин-2,5-дион в виде коричневого твердого вещества (1,15 г, 63%). Т.пл. 108-110°C;
1H ЯМР (CDCl3) 400 МГц δ: 8,69 (с, 1H), 7,18 (т, 1H, J=8,0 Гц), 7,12 (д, 1H, J=8,0 Гц), 6,99 (д, 1H, J=6,8 Гц), 6,97 (д, 1H, J=2,0 Гц), 6,93 (д, 1H, J=6,4 Гц), 6,76 (м, 1H), 6,69 (д, 1H, J=1,6 Гц), 5,67 (уш.с, 1H), 4,32 (д, 1H, J=6,0 Гц), 4,20 (д, 1H, J=6,0 Гц), 4,07 (т, 2H, J=5,6 Гц), 2,96 (т, 2H, J=6,0 Гц), 2,19 (м, 2H).
Пример 70. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-фторфенил)пирролидин-2,5-диона
3-(5,6-Дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-фторфенил)-1H-пиррол-2,5-дион, полученный согласно примеру 67, восстанавливали с использованием способа, описанного в примере 68, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-фторфенил)пирролидин-2,5-дион. Т.пл. 208-210°C;
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,52 (с, 1H), 7,40-7,43 (м, 2H), 7,32 (м, 1H), 7,13-7,17 (м, 3H), 6,82-6,89 (м, 2H), 4,53 (м, 1H), 4,36 (м, 1H), 4,09 (т, J=5,2 Гц, 2H), 2,89 (т, J=6,0 Гц, 2H), 2,09-2,11 (м, 2H).
Пример 71. Получение (±)-транс-3-[4-(бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пирролидин-2,5-диона
3-[4-(Бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-1H-пиррол-2,5-дион, полученный согласно примеру 66, восстанавливали с использованием способа, описанного в примере 68, получая (±)-транс-3-[4-(бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пирролидин-2,5-дион. Т.пл. 91-93°C;
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,47 (с, 1H), 7,25-7,43 (м, 8H), 7,15 (д, J=7,6 Гц, 2H), 6,82-6,96 (м, 4H), 5,07 (с, 2H), 4,45 (д, J=7,6 Гц, 1H), 4,24 (д, J=7,6 Гц, 1H), 4,07-4,10 (м, 2H), 2,87-2,90 (м, 2H), 2,09-2,10 (м, 2H).
Пример 72. Получение (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-гидроксифенил)пирролидин-2,5-диона
Смесь (±)-транс-3-[4-(бензилокси)фенил]-4-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)пирролидин-2,5-диона (0,2 г) и Pd/C (10% вес./вес., 0,076 г) перемешивали в атмосфере газообразного водорода при давлении в 1 атм, в течение ночи. Катализатор отфильтровывали через слой целита и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле, элюируя 30-40% этилацетатом в гексане, получая (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(4-гидроксифенил)пирролидин-2,5-дион (0,07 г) в виде светло-желтого твердого вещества. Т.пл. 105-107°C;
1H ЯМР (ацетон-d6) 400 МГц δ: 10,27 (с, 1H), 8,34 (с, 1H), 7,17-7,21 (м, 4H), 6,80-6,91 (м, 4H), 4,39 (д, J=7,0 Гц, 1H), 4,22 (д, J=7,0 Гц, 1H), 4,13 (д, J=5,6 Гц, 2H), 2,92 (д, J=5,2 Гц, 2H), 2,15-2,19 (м, 2H).
Пример 73. Получение бензилового эфира 7-[4-(1H-индол-3-ил)-2,5-диоксо-2,5-дигидро-1H-пиррол-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты:
Стадия 1

К раствору 7-формилиндола (2,4 г, 16,6 ммоль) в 1,2-дихлорэтане (60 мл) добавляли аминоэтанол (1,2 мл, 19,8 ммоль) с последующим добавлением ледяной уксусной кислоты (2,0 мл) и триацетоксиборгидрида натрия (3,5 г, 16,6 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 16 часов. Реакционную смесь гасили добавлением воды (10 мл) и 1,0М гидроксида натрия (10 мл). Органический слой затем отделяли и водный слой экстрагировали 1,2-дихлорэтаном (40 мл). Объединенные органические экстракты промывали насыщенным раствором бикарбоната натрия (2×30 мл), водой (2×50 мл), сушили над безводным сульфатом натрия и упаривали досуха. 2-[(1H-Индол-7-илметил)амино]этанол (4,4 г) получали в виде масла. ЖХМС (М+H)=189.
Стадия 2

К раствору 2-[(1H-индол-7-илметил)амино]этанола (4,4 г) в 1,2-дихлорэтане (40 мл) добавляли триэтиламин (4,85 мл, 34,6 ммоль) с последующим добавлением бензилхлорформиата (3,57 мл, 25,34 ммоль). Смесь оставляли перемешиваться при комнатной температуре в течение 2 часов. Смесь гасили добавлением воды (20 мл) и 1,0М гидроксида натрия (10 мл). Органический слой отделяли и водный слой экстрагировали 1,2-дихлорэтаном (20 мл). Объединенные органические экстракты промывали 1,0М хлористоводородной кислотой (20 мл), водой (20 мл), сушили над безводным сульфатом натрия и упаривали досуха. Остаток очищали хроматографией на силикагеле, элюируя, начиная от 20%-ного этилацетата в гексанах до 40%-ного этилацетата в гексанах, получая бензиловый эфир (2-гидроксиэтил)-(1H-индол-7-илметил)карбаминовой кислоты (2,79 г, 52% объединенный выход по двум стадиям) в виде бесцветного масла.
1H ЯМР (CDCl3) 400 МГц δ: 9,97 (уш.с, 1H), 7,75-6,9 (м, 8H), 6,54 (уш.с, 1H), 5,21 (с, 2H), 4,9-4,6 (м, 3H), 3,85-3,57 (м, 2H), 3,55-3,23 (м, 3H);
ЖХМС М+H=325.
Стадия 3

К раствору бензилового эфира (2-гидроксиэтил)-(1H-индол-7-илметил)карбаминовой кислоты (2,79 г, 8,61 ммоль) в дихлорметане (50 мл) добавляли триэтиламин (1,56 мл, 11,2 ммоль). Смесь охлаждали до 0°C и добавляли по каплям метансульфонилхлорид (0,74 мл, 9,47 ммоль). Смесь нагревали до комнатной температуры и оставляли перемешиваться в течение 2 часов. Смесь затем гасили водой (30 мл) и 1,0М гидроксидом натрия (10 мл). Органический слой отделяли и водный слой экстрагировали дихлорметаном (20 мл). Объединенные экстракты промывали 1,0М хлористоводородной кислотой (20 мл), водой (30 мл), сушили над безводным сульфатом натрия и упаривали досуха. 2-[Бензилоксикарбонил(1H-индол-7-илметил)амино]этиловый эфир метансульфоновой кислоты (3,46 г) получали в виде масла.
Стадия 4

К раствору 2-[бензилоксикарбонил(1H-индол-7-илметил)амино]этилового эфира метансульфоновой кислоты (3,46 г, 8,61 ммоль) в диметилформамиде (20 мл), охлажденному до 0°C, добавляли гидрид натрия (60%) в минеральном масле. Реакционную смесь оставляли перемешиваться при 0°C в течение 1 часа и затем гасили добавлением воды (40 мл). Водный слой экстрагировали этилацетатом (4×20 мл). Объединенные органические экстракты промывали водой (3×30 мл), сушили над безводным сульфатом натрия и упаривали досуха. Остаток очищали хроматографией на силикагеле, элюируя дихлорметаном, получая бензиловый эфир 3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (1,95 г, 74% объединенный выход по двум стадиям) в виде бесцветного масла.
1H ЯМР (CDCl3) 400 МГц δ: 7,6-7,45 (м, 1H), 7,4-7,2 (м, 5H), 7,17-6,9 (м, 3H), 6,6-6,48 (м, 1H), 5,2-5,05 (м, 2H), 5,0-4,82 (м, 2H), 4,4-4,2 (м, 2H), 4,1-3,95 (м, 2H);
ЖХМС (М+H)=307.
Стадия 5

К раствору бензилового эфира 3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (557 мг, 1,8 ммоль) в безводном тетрагидрофуране (10 мл) при 0°C добавляли оксалилхлорид (238 мкл, 2,7 ммоль) с последующим добавлением следующей порции оксалилхлорида (340 мкл, 3,85 ммоль). Смесь перемешивали при 0°C до тех пор, пока все исходные вещества не израсходовались, затем охлаждали до -78°C. Затем медленно добавляли метоксид натрия в метаноле (0,5M) (10 мл) и смесь оставляли нагреваться до комнатной температуры. После выдерживания в течение 1 часа при комнатной температуре смесь затем разбавляли этилацетатом (200 мл) и промывали водой (300 мл). Органический слой сушили над безводным сульфатом натрия и упаривали досуха. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:1), получая бензиловый эфир 7-метоксиоксалил-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты в воде бледно-желтого твердого вещества (481 мг, 67%).
1H ЯМР (CDCl3) 400 МГц δ: 8,26-8,36 (м, 2H), 7,22-7,37 (м, 6H), 7,10 (дд, 1H, J=32,8 и 7,2 Гц), 5,11 (д, 2H, J=8,0 Гц), 4,94 (д, 2H, J=22,4 Гц), 4,41-4,48 (м, 2H), 4,01-4,05 (м, 2H), 3,93 (м, 3H).
Стадия 6

К раствору бензилового эфира 7-метоксиоксалил-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (481 мг, 1,22 ммоль) и индол-3-ацетамида (234 мг, 1,34 ммоль) в безводном тетрагидрофуране (14 мл) при 0°C добавляли трет-бутоксид калия (412 мг, 3,67 ммоль). Смесь перемешивали при 0°C в течение 2 часов. Затем добавляли концентрированную хлористоводородную кислоту (5 мл) и смесь перемешивали в течение 2 часов при комнатной температуре. Смесь затем разбавляли этилацетатом (300 мл), промывали водой (500 мл) и органический слой сушили над безводным сульфатом натрия. Остаток очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексаны (1:1), получая бензиловый эфир 7-[4-(1H-индол-3-ил)-2,5-диоксо-2,5-дигидро-1H-пиррол-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты в виде ярко-оранжевого/красного твердого вещества (1,2 г, 80%).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,66 (д, 1H, J=2,4 Гц), 10,94 (с, 1H), 7,69-7,75 (м, 2H), 7,19-7,38 (м, 6H), 6,98 (т, 1H, J=7,2 Гц), 6,73-6,89 (м, 3H), 6,60-6,66 (м, 2H), 4,90-5,08 (м, 2H), 4,50 (м, 2H), 3,95 (м, 2H).
Пример 74. Получение бензилового эфира (±)-транс-7-[4-(1H-индол-3-ил)-2,5-диоксопирролидин-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты:

Магниевую стружку (195 мг, 8,0 ммоль) добавляли к раствору бензилового эфира 7-[4-(1H-индол-3-ил)-2,5-диоксо-2,5-дигидро-1H-пиррол-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (230 мг, 0,44 ммоль) в безводном метаноле (20 мл) и нагревали при кипении с обратным холодильником в атмосфере азота в течение 1,5 часов. После охлаждения до комнатной температуры смесь выливали в этилацетат (200 мл) и промывали 1М хлористоводородной кислотой (100 мл). Органический слой сушили над безводным сульфатом натрия и упаривали досуха. Остаток затем очищали хроматографией на силикагеле с использованием 50-60% этилацетата в гексанах, получая бензиловый эфир (±)-транс-7-[4-(1H-индол-3-ил)-2,5-диоксопирролидин-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты в виде не совсем белого твердого вещества (205 мг).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,56 (с, 1H), 11,03 (д, 1H, J=2 Гц), 7,21-7,43 (м, 10H), 7,09 (т, 1H, J=7,2 Гц), 6,92-7,00 (м, 2H), 6,82-6,89 (м, 3H), 5,04 (с, 2H), 4,87 (д, 2H, J=7,6 Гц), 4,54 (дд, 2H, J=7,6 и 28,8 Гц), 4,30 (м, 2H), 3,92 (м, 2H).
Пример 75. Получение (±)-транс-3-(1H-индол-3-ил)-4-(1,2,3,4-тетрагидро[1,4]диазепино[6,7,1-hi]индол-7-ил)пирролидин-2,5-диона:

Бензиловый эфир (±)-транс-7-[4-(1H-индол-3-ил)-2,5-диоксопирролидин-3-ил]-3,4-дигидро-1H-[1,4]диазепино[6,7,1-hi]индол-2-карбоновой кислоты (161 мг, 0,31 ммоль) и 10% палладий-на-угле (100 мг) в безводном метаноле (15 мл) перемешивали в атмосфере водорода при давлении в 1 атм в течение 16 часов. Катализатор затем отфильтровывали через слой целита и фильтрат упаривали досуха, получая (±)-транс-3-(1H-индол-3-ил)-4-(1,2,3,4-тетрагидро[1,4]диазепино[6,7,1-hi]индол-7-ил)пирролидин-2,5-дион в виде не совсем белого твердого вещества (95 мг).
1H ЯМР (ДМСО-d6) 400 МГц δ: 11,04 (д, 1H, J=1,6 Гц), 7,35-7,42 (м, 4H), 7,24 (дд, 1H, J=2,8 и 5,6 Гц), 7,09 (т, 1H, J=7,2 Гц), 6,89-6,98 (м, 3H), 4,52 (дд, 2H, J=7,2 и 24,8 Гц), 4,11 (с, 2H), 4,07-4,10 (м, 2H), 3,14-3,17 (м, 2H).
Пример 76
Жизнеспособность клеток
Жизнеспособность клеток определяли путем измерения активности ферментов дегидрогеназы в метаболически активных клетках с использованием соединения тетразолия, MTS. Анализ проводили, как описано в Promega Technical Bulletin No. 169 (CellTiter 96 Aqueous Non-Radioactive Cell Proliferation Assay). Анализировали тринадцать раковых клеточных линий человека (см., например, таблица 1). Клетки выдерживали при 37°C, 5% CO2. Прилипшие клетки поддерживали в среде DMEM (модифицированная по способу Дульбекко среда Игла) (4,5 г/л глюкозы), дополненной 15% термически дезактивированной FBS, 10 мМ L-глутамина и 10 мМ Hepes pH 7,5. Суспензионные клетки поддерживали в среде RPMI 1640, дополненной 10% термически дезактивированной FBS и 10 мМ Hepes pH 7,5. Кратко клетки высевали в 96-луночных планшетах, как указано в таблице 1, и инкубировали в течение 16-24 часов. Соединения-кандидаты серийно разбавляли в ДМСО, дополнительно разбавляли в клеточной культуральной среде и затем добавляли к клеткам (конечная концентрация ДМСО 0,33%). Клетки инкубировали в присутствии соединения-кандидата в течение 72 часов. Исходные растворы MTS (MTS 2 г/л, PMS 46,6 мг/мл в PBS) добавляли к клеткам (конечная концентрация MTS 2 г/л и PMS 7,67 мг/л) и инкубировали в течение 4 часов. Добавляли SDS до конечной концентрации 1,4% и измеряли поглощение при 490 нМ в течение 2 часов с использованием планшет-ридера. Значения IC50 определяли как концентрацию соединения, которая приводила к 50%-ному сокращению числа жизнеспособных клеток по сравнению с контрольными лунками, обработанными только ДМСО (0,33%), и рассчитывали с использованием нелинейного регрессионного анализа. Значения IC50 приведены в таблице 2 для перечисленных соединений.
Пример 77
Экспоненциально растущие клетки MDA-MB-231 или Paca-2 высевали из расчета 1000 клеток на лунку в шестилуночных планшетах и давали возможность прикрепления в течение 24 часов. Клетки MDA-MB-231 и Paca-2 культивировали в среде DMEM (модифицированная по способу Дульбекко среда Игла), дополненной 10% (об./об.) фетальной телячьей сывороткой (FCS) и 5 мл пенициллин/стрептомицина при 37°C в 5% CO2. MDA-MB-231 и Paca-2 представляли собой развитые клеточные линии отрицательного в отношении рецептора эстрогена рака молочной железы и карциномы поджелудочной железы соответственно. Каждый из (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона растворяли в ДМСО в концентрации 10 мМ и по отдельности добавляли к клеткам в концентрации 0,1, 0,25, 0,5, 1 или 2 мкМ. В контрольные лунки добавляли только ДМСО, при таком же процентном соотношении от общего объема культуры, который был введен в сочетании с наиболее высокой концентрацией лекарственного средства. За культурами клеток затем ежедневно наблюдали в течение 10-15 дней, затем фиксировали и окрашивали модифицированным красителем Райта-Гиемза (Wright-Giemsa ((Sigma)). Обработка (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом приводила к смерти клеток MDA-MB-231 или клеток Paca-2. См., например, фиг.2. Найденное значение IC50 для (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляло 0,5 мкМ. Найденное значение IC50 для (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляло 0,5 мкМ.
Пример 78
Клетки MDA-MB-231 (ATCC# HTB-26), выращенные в среде DMEM (модифицированная по способу Дульбекко среда Игла) плюс 15% термически дезактивированной фетальной телячьей сыворотки плюс 10 мМ HEPES, pH 7,5, размещали в 60 мм чашках Петри (2×105 клеток на чашку). Через два дня соединения-кандидаты в ДМСО в различных концентрациях разводили в среде и добавляли в отдельные чашки таким образом, что конечная концентрация ДМСО в клеточной культуральной среде составляла 0,1%. Через два дня инкубирования культуру трипсинизировали, клетки промывали средой, подсчитывали с использованием гемоцитометра, и 500 клеток, включая тела клеток, размещали в 100 мм чашках в среде. Через две недели среду удаляли, клеточные колонии фиксировали метанолом в течение 10 минут, окрашивали с помощью 1% кристаллического фиолетового в течение 10 минут, промывали водой и сушили на воздухе. Колонии клеток подсчитывали визуально в том случае, когда они превышали 50 клеток, присутствующих в колонии. Определяли эффективность посева как среднее число образовавшихся колоний деленное на 500. Определяли выжившую фракцию как эффективность посева для соединения-кандидата деленную на эффективность посева в случае ДМСО, умноженную на 100. Для титрований соединений-кандидатов определяли концентрации IC50 путем подгонки уравнения y=AeBx к точкам данных и экстраполяции концентрации, при которой выжившая фракция была равна 50.
Обработка (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом приводила к смерти клеток MDA-MB-231. См., например, фиг.3. Найденное значение IC50 для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляло 0,62 мкМ. Найденное значение IC50 для (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона составляло 4,1 мкМ.
Пример 79
Рекомбинантную протеинкиназу С (Calbiochem) (100 нг) инкубировали вместе с (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в концентрации 0,05, 0,5 или 10 мкМ в течение 15 минут при комнатной температуре. Затем к каждому образцу добавляли радиоактивно меченую смесь в киназном буфере (20 мМ Tris-HCl pH 7,5, 10 мМ MgCl2), содержащую 20 мМ АТФ, 0,2 мкКи/мкл γ32P-АТФ, 0,2 мкг/мкл Histone H1 (Upstate). Реакцию киназы проводили в течение 5 минут при комнатной температуре. Продукты реакций анализировали с использованием 12% SDS-PAGE и ауторадиографии.
Обработка рекомбинантной протеинкиназы С в течение 15 минут при комнатной температуре (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в исследованных концентрациях не снижала активности киназы по сравнению с обработкой только носителем. См., например, фиг.4.
Пример 80
Клетки MDA-MB-231 выдерживали в течение ночи (16 часов) без сыворотки крови в отсутствие или в присутствии указанных концентраций отдельных энантиомеров (+)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона и (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона. Клетки обрабатывали 100 нг/мл рекомбинантным фактором роста гепатоцитов человека/фактором рассеяния (HGF/SF) (R&D Systems #294-HG) в течение 10 минут. Экстракты цельных клеток получали в лизисном буфере (20 мМ Trwas-HCl pH 7,5, 150 мМ NaCl, 1 мМ Na2EDTA, 1 мМ EGTA, 1% Triton X-100, 2,5 мМ пирофосфата натрия, 1 мМ бета-глицерофосфата, 1 мМ Na3VO4, 1 мкг/мл лейпептина, 1 мМ фенилметилсульфонилфторида) и обрабатывали ультразвуком. Концентрации белка измеряли с помощью анализа Бредфорда с использованием реагента BioRad (BioRad, Hercules, CA) в соответствии с инструкциями производителя. Образцы (50 мкг белка) растворяли в 8% SDS-PAGE в восстановительных условиях и переносили на мембрану PVDF (BioRad). Мембрану инкубировали в течение 1 часа в TBS-Т (50 мМ Trwas-HCl pH 7,6, 200 мМ NaCl, 0,05% Tween 20) с 5% молока. Белки обнаруживали путем инкубирования в течение ночи при 4°C в TBS с 5% молока и либо с поликлональным антителом против фосфорилированного c-Met (#3121), фосфорилированного Erk1/2 (#9101), общего белка Erk1/2 (#9102) (Cell Signaling Technology); либо с моноклональным антителом против β-актина (A-5441) (Sigma), которое использовали для контроля общей нагрузки белка. После интенсивного промывания в TBS-Т добавляли на 1 час конъюгированный с пероксидазой хрена антикроличий IgG (1:5000) или антимышиный IgG (1:2000) (Amersham Biosciences) и визуализировали специфичные полосы белка с использованием усиленной хемолюминесцентной системы обнаружения (Amersham Biosciences) в соответствии с инструкциями производителя. См., например, фиг.5.
Обработка (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом ингибировала как основное, так и HGF-индуцированное аутофосфорилирование c-Met в концентрации, равной по меньшей мере 500 нМ. (+)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион обладает частичным ингибирующим действием на фосфорилирование c-Met в более высоких концентрациях (от 10 до 20 мкМ). Кроме того (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион снижает фосфорилирование ERK1/2; хорошо известной мишени в прямом направлении в передаче сигнала рецептора c-Met тирозинкиназы. См., например, фиг.5.
Пример 81
Самкам голых мышей без щитовидной железы (CRL:NU/NU-nuBR) вводили в виде подкожной инъекции в бок между ребрами и бедром клетки рака молочной железы человека MDA-MB-231 (8×106 клеток/мышь). Перед инъекцией клетки MDA-MB-231 культивировали в среде DMEM (модифицированная по способу Дульбекко среда Игла, Invitrogen #11965-092), дополненной 10% (об./об.) термически дезактивированной фетальной телячьей сыворотки (FBS), 1% буферного раствора Hepes (Invitrogen #15630-080) и 1% пенициллин/стрептомицина (Invitrogen #15140-122), при 37°C в 5% CO2. Опухолям давали возможность расти до размера приблизительно 50 мм3. Животных произвольно распределяли на три группы, по пять животных на группу. На десятый день после инъекции проводили обработку внутрибрюшинно мышей с развившейся опухолью с использованием (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (160 мг/кг), (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (160 мг/кг), вводимыми в йодированном маковом масле (липиодол) в качестве носителя в концентрации 10 мг/мл, или с использованием носителя в качестве контроля. Лекарственное средство или носитель вводили каждые три дня, всего десять доз (3 дня ×10). Во время проведения исследования периодически оценивали размер опухолей. Для каждого субъекта объем опухоли рассчитывали по формуле (L×W2)/2, где L и W представляют собой длину и ширину опухоли соответственно. Для каждой группы обработки рассчитывали среднее арифметическое значение объема опухоли +/-стандартная ошибка для среднего значения (SEM). Средние значения для каждой группы нормализовали относительно среднего значения исходного объема опухоли для определения кратности увеличения объема опухоли. См., например, фиг.6.
Обработка (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в дозе 160 мг/кг снижала нормализованный средний объем опухоли гетеротрансплантата опухоли рака молочной железы человека на 80,5% (p=0,0037) и 43,5% (p=0,133) соответственно по сравнению с контролем, где проводили обработку носителем. См., например, фиг.6.
Пример 82
Самкам голых мышей без щитовидной железы (CRL:NU/NU-nuBR) вводили в виде подкожной инъекции в бок между ребрами и бедром клетки рака молочной железы человека MDA-MB-231 (8×106 клеток/мышь). Перед инъекцией клетки MDA-MB-231 культивировали в среде DMEM (модифицированная по способу Дульбекко среда Игла, Invitrogen #11965-092), дополненной 10% (об/об) термически дезактивированной фетальной телячьей сыворотки (FBS), 1% буферного раствора Hepes (Invitrogen #15630-080) и 1% пенициллин/стрептомицина (Invitrogen #15140-122), при 37°C в 5% CO2. Опухолям давали возможность расти до размера приблизительно 50 мм3. Животных произвольно распределяли на три группы, по восемь животных на группу. На четвертый день после инъекции проводили обработку внутрибрюшинно мышей с развившейся опухолью с использованием (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (80 мг/кг), (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (80 мг/кг), вводимым в среде ДМА/ПЭГ 400 (1:4 об/об) в качестве носителя в концентрации 50 мг/мл, или внутрибрюшинно с использованием носителя для контрольной группы. Лекарственное средство или носитель вводили один раз в день в течение пяти последовательных дней, затем в течение двух последующих дней обработку не проводили (один цикл введения дозы). Проводили всего четыре цикла обработки. Во время проведения исследования периодически оценивали размер опухолей. Для каждого субъекта объем опухоли рассчитывали по формуле (L×W2)/2, где L и W представляют собой длину и ширину опухоли соответственно. Для каждой группы обработки рассчитывали среднее арифметическое значение объема опухоли +/-стандартная ошибка для среднего значения (SEM). Для каждой точки на фиг.6 представлено среднеарифметическое значение +/-стандартная ошибка для среднего значения (SEM) для восьми опухолей.
Обработка с использованием (±)-цис-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или (±)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 80 мг/кг снижала средний объем гетеротрансплантата опухоли рака молочной железы человека на 73,4% (p=0,04) и 69,4% (p=0, 075) соответственно по сравнению с контролем, где проводили обработку носителем. См., например, фиг.7.
Пример 83. (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вызывает смерть клеток для широкого диапазона опухолевых клеток, что коррелирует с его способностью ингибирования фосфорилирования c-Met (см.табл.3)
Для определения ингибирования c-met экспоненциально растущие клетки MCF-7 и MDA-MB-231 рака молочной железы человека, клетки DLD1 и HT29 рака толстой кишки человека, клетки PACA2 и PANC-1 рака поджелудочной железы человека и клетки NCI-H441 немелкоклеточного рака легкого человека (H441) выращивали на минимальной среде без сыворотки в 0,5% FBS и обрабатывали увеличивающимися количествами (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 24 часов, как указано. Затем клетки оставляли нестимулированными или стимулировали с помощью 100 нг/мл HGF в течение 10 минут и готовили экстракты цельных клеток. Лизаты цельных клеток (50 мкг) растворяли в SDS-PAGE, переносили на мембрану PVDF и использовали систему анализа с усиленной хемолюминесценцией (ECL) для определения статуса фосфорилирования c-Met. Поликлональное антитело против фосфо(Y1349) c-Met (фосфо-c-Met) получали от Biosource International, и моноклональное антитело против β-актина получали от Invitrogen. Процент ингибирования определяли с помощью денситометрии с использованием Scion Image.
Для проведения анализов колониеобразования (CFA) экспоненциально растущие клетки высевали из расчета 2000 клеток на лунку в 6-луночных планшетах и давали возможность прикрепления в течение 24 часов. Затем в среду в течение следующих 24 часов добавляли повышающиеся концентрации (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона (от 0,01 до 30 мкМ). После экспозиции в течение 24 часов лекарственное средство удаляли и добавляли свежую среду на следующие 14-21 дня, давая возможность образования колоний. Клетки фиксировали и окрашивали GEMSA (Gibco BRL). Колонии, превышавшие 50 клеток, оценивали как уцелевшие, и строили график процента выживания клеток для определения IC50.
Было установлено, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион сильно ингибирует рост и вызывает апоптоз для широкого ряда опухолевых клеточных линий человека. Значения IC50 для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона для типов экспрессирующих c-Met солидных опухолей находились в диапазоне 0,1-0,7 мкМ после воздействия (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 24 часов, как определено анализом колониеобразования (CFA). Более примечательно, что клетки не имеющие c-Met, такие как NCI-H661 (клетки немелкоклеточного рака легких человека) и NCI-H446 (клетки мелкоклеточного рака легких человека) давали значения IC50 приблизительно в 10 раз выше для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона, что строго указывает на корреляцию между присутствием c-Met и цитотоксической чувствительностью клеток по отношению к (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диону. Следует отметить, что значения IC50 для (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона для ингибирования c-Met и клеточной цитотоксичности после обработки в течение 24 часов сопоставимы в высокой степени для раковых клеток, экспрессирующих c-Met.
Пример 84. (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вызывает апоптоз раковых клеток
Клетки рака легкого человека A549 в 96-луночном планшете (Costar 3603, 5000/лунка) обрабатывали либо A) ДМСО в качестве контроля; B) 1,2 мкМ (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в течение 38 часов, затем добавляли 1:200 флуоресцентный аннексин В (Annexin V, зеленый) и 1:500 иодид пропидия (фуксин, конечная концентрация 1 мкг/мл). Процедуру введения метки проводили при 37°C в течение 20 минут с последующим получением изображения и анализом с использованием цитометра изображения IC100 (Beckman Coulter, Inc) при увеличении 10×.
Для определения того, действительно ли (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион работает в первую очередь посредством цитостатического или апоптозного механизма, раковые клетки, подвергнутые воздействию (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион, окрашивали с помощью флуоресцентно меченого аннексина В (зеленая флуоресценция) и иодида пропидия (ярко-красная флуоресценция). Аннексин В представляет собой хорошо зарекомендовавший себя реагент, который специфически связывается с высокой аффинностью с внешним мембранным фосфатидилсерином, ранним маркером начала апоптоза, тогда как иодид пропидия представляет собой маркер мертвых клеток. Инкубирование клеток рака легкого человека (A549) с 1,2 мкМ (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 38 часов вызывало апоптоз клеток, доказательством чего является сильное окрашивание аннексином В. Небольшой процент клеток (~10-20%) окрашивался как аннексином В, так и йодидом пропидия, что указывало на то, что субпопуляция клеток, обработанных (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом, была уже мертва в течение 38 часов. Эти данные согласуются с тем, что (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вызывает смерть клеток главным образом путем активации механизмов апоптоза (см. фиг.8).
Пример 85. (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибирует инвазию метастатических раковых клеток
Клетки MDA-MB-231 предварительно обрабатывали указанными концентрациями (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в течение 24 часов. 300 мкл каждой клеточной суспензии (в концентрации 0,5 × 106клеток/мл в не содержащей сыворотки среде) помещали в индивидуальные вкладыши и инкубировали в течение 24 часов при 37°C. Нижние лунки, в которых размещались вкладыши, содержали 500 мкл 10% FBS среды. Через 24 часа среду из вкладышей удаляли и клетки, которые не смогли проникнуть, осторожно удаляли с внутренней части вкладышей с помощью тампона с хлопковой головкой. Каждый вкладыш затем переносили в чистую лунку, содержащую окрашивающий клетки раствор, и инкубировали в течение 10 минут при комнатной температуре. Со дна вкладыша удаляли окраску путем инкубирования в экстракционном растворе и измеряли ОП (оптическую плотность) при 560 нм. (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибировал миграцию через пустоты в кофлюентных культурах раковых клеток MDA-MB-231. Данные представляют собой среднее значение для двух независимых экспериментов (см. фиг.9).
Заболеваемость и смертность при большинстве видов рака являются результатом локальной инвазии и метастазов первичной опухоли в другие ткани. Данный процесс главным образом зависит от подвижности и роста опухолевых клеток. Активация c-Met с помощью HGF индуцирует множество клеточных ответных реакций, включая подвижность, инвазию, заживление ран и регенерацию тканей. Было установлено, что аберрантная активация c-Met играет решающую роль в развитии и прогрессировании первичных опухолей и вторичных метастазов. HGF обладает способностью диссоциировать эпителиальные слои, стимулировать подвижность клеток и проникновение через межклеточные матриксные субстраты и продуцирование HGF коррелирует с метастазами опухолей in vivo.
Как показано выше, (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион ингибировал инвазивный фенотип клеток рака молочной железы MDA-MB-231 при оцененном значении IC50, составляющем приблизительно 500 нМ. Аналогичные результаты наблюдались для клеток рака мозга и легких (данные не показаны).
Пример 86. Модель гетеротрансплантата рака молочной железы
(-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион демонстрирует эффективность на гетеротрансплантате рака молочной железы человека. Клетки рака молочной железы человека MDA-MB-231 вводили подкожно самкам, не имеющим вилочковой железы, голых мышей (8,0×106 клеток/мышь) и оставляли до образования пальпируемых опухолей. После того, как опухоли достигали размера приблизительно 60 мм3, животных обрабатывали перорально (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в дозе 200 мг/кг или носителем в качестве контроля ежедневно (5 последовательных дней с последующими 2 днями без введения дозы). (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили в виде препарата в ПЭГ 400:20% витамин E TPGS (60:40). Животные получали всего 20 доз (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или носителя в качестве контроля. Опухоли измеряли во время лечения и в период наблюдения после лечения. Каждая точка представляет собой среднее значение ±SEM для десяти опухолей (см. фиг.10).
Лечение с использованием (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в качестве монотерапии было эффективным для замедления роста опухоли. Ингибирование роста опухоли посредством (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона рассчитывали как составляющее 79% и оно было статистически значимым (p=0,009). Значительных изменений в массе тела вследствие перорального введения носителя или (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 200 мг/кг не наблюдалось.
Пример 87. Модель гетеротрансплантата рака толстой кишки
На данной модели гетеротрансплантата рака толстой кишки человека клетки HT29 рака толстой кишки человека вводили подкожно самкам, не имеющим вилочковой железы, голых мышей (5×106 клеток/мышь) и оставляли до образования пальпируемых опухолей. После того, как опухоли достигали размера приблизительно 60 мм3, животных обрабатывали перорально либо (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом при дозе 200 мг/кг или 300 мг/кг, либо носителем в качестве контроля ежедневно (5 последовательных дней с последующими 2 днями без введения дозы). (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили в виде препарата в ПЭГ 400:20% витамин E TPGS (60:40). Животные получали всего 20 доз (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или носителя в качестве контроля. Опухоли измеряли во время лечения и в период наблюдения после лечения. Каждая точка представляет собой среднее значение ±SEM для десяти опухолей (см. фиг.11).
На данной высокоагрессивной модели гетеротрансплантата толстой кишки животные, получавшие дозы 200 мг/кг или 300 мг/кг в качестве монотерапии, продемонстрировали значительное ингибирование роста опухоли, при этом доза в 300 мг/кг была более эффективной, чем доза 200 мг/кг. (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в дозе 200 мг/кг показал оптимальное ингибирование роста опухоли, равное 39% (p=0,006), тогда как при дозе 300 мг/кг он показал оптимальное ингибирование роста опухоли, равное 55% (p=0,00001). Значительных изменений в массе тела вследствие перорального введения или носителя, или (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 200 мг/кг и 300 мг/кг не наблюдалось.
Пример 88. Модель ксенотрансплантата рака поджелудочной железы
(-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион продемонстрировал эффективность на модели гетеротрансплантата рака поджелудочной железы человека. Раковые клетки PACA-2 поджелудочной железы человека вводили подкожно самкам, не имеющим вилочковой железы, голых мышей (5×106 клеток/мышь) и оставляли до образования пальпируемых опухолей. После того, как опухоли достигали размера приблизительно 60 мм3, животных обрабатывали перорально (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в дозе 200 мг/кг или 300 мг/кг, или носителем в качестве контроля ежедневно (5 последовательных дней с последующими 2 днями без введения дозы). (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион вводили в виде препарата в ПЭГ 400:20% витамин E TPGS (60:40). Животные получали всего 20 доз (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона или носителя в качестве контроля. Опухоли измеряли во время лечения и в период наблюдения после лечения. Каждая точка представляет собой среднее значение ±SEM для десяти опухолей (см. фиг.12).
Обработка (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дионом в качестве монотреапии в дозе или 200 мг/кг или 300 мг/кг показала значительное ингибирование роста опухоли, при этом дозы 200 мг/кг и 300 мг/кг были равно эффективны. (-)-Транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-дион в дозе 200 мг/кг показал оптимальное ингибирование роста опухоли, равное 58% (p=0,036), тогда как в дозе 300 мг/кг он показал оптимальное ингибирование роста опухоли, равное 60% (p=0,018). Значительных изменений в массе тела вследствие перорального введения или носителя или (-)-транс-3-(5,6-дигидро-4H-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1H-индол-3-ил)пирролидин-2,5-диона в дозе 200 мг/кг и 300 мг/кг не наблюдалось.
Другие варианты осуществления входят в объем следующей ниже формулы изобретения. Хотя несколько вариантов осуществления было показано и описано, могут быть выполнены различные модификации, не отступая от сущности и объема настоящего изобретения.
Реферат
Изобретение относится к новым пирролохинолинилпирролидин-2,5-дионам формулы IVa, IVb, Va или Vb или их фармацевтически приемлемым солям: ! ! ! где R1, R2, R3 и R4 независимо означает Н; Q означает бензоконденсированный 5-членный гетероарил с одним атомом N; Х означает -(СН2)-; Y означает -(СН2)-связи; m равно 1 или 2. Соединения ингибируют рост раковых клеток, что позволяет использовать их в фармацевтических композициях. 3 н. и 9 з.п. ф-лы, 3 табл., 12 ил.
Формула
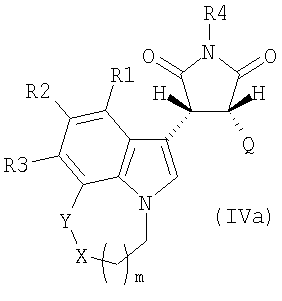



где R1, R2, R3 и R4 независимо означает водород;
Q означает бензоконденсированный 5-членный гетероарил с одним атомом азота;
Х означает -(СН2)-;
Уозначает -(СН2)- или связи;
m равно 1 или 2.
(+)-цис-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона,
(-)-цис-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона,
(+)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона и
(-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.
(+)-цис-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона,
(-)-цис-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона,
(+)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона и
(-)-транс-3-(5,6-дигидро-4Н-пирроло[3,2,1-ij]хинолин-1-ил)-4-(1Н-индол-3-ил)пирролидин-2,5-диона.

Комментарии