Способ лечения неврологических нарушений - RU2492137C2
Код документа: RU2492137C2
Чертежи




Описание
Область техники, к которой относится изобретение.
Данное изобретение относится к применению селената или его фармацевтически пригодной соли в способах и композициях для лечения или профилактики неврологических нарушений, не относящихся к таупатии. В некоторых воплощениях изобретение относится к применению селената или его фармацевтически пригодной соли в комбинации с другими видами лечения для применения в способах лечения или профилактики неврологических нарушений, не относящихся к таупатии.
Предшествующий уровень техники.
Неврологические нарушения являются нарушениями, касающимися центральной нервной системы, периферической нервной системы и автономной нервной системы.
Недавно в литературе были представлены некоторые доказательства того, что тау-белок вовлечен не только в нейродегенеративные нарушения, такие как болезнь Альцгеймера, но также и в другие неврологические нарушения [Satch et al., 2006; Wen et al., 2004; Roberson et al., 2007; Deutsch et al., 2006; Bartosik-Psujek, 2006, Ost et al., 2006].
Одним типом аномального тау-белка является гиперфосфорилированный тау-белок. Известно, что тау-белок фосфорилируется in vivo в ряде участков фосфорилирования киназой 3β гликоген-синтазы (GSK3β), включая остаток Ser396, специфичный для болезни Альцгеймера [Li and Paudel, 2006]. В свою очередь известно, что GSK3β фосфорилируется протеинкиназой Akt, и что активность Akt ослабляется протеинфосфатазой РР2А.
Недавно было показано, что активность РР2А составляет примерно 71% от общей тау-фосфатазной активности головного мозга человека [Liu et al., 2005]. Общая фосфатазная активность и активность РР2А по отношению к тау-белку существенно снижены в головном мозге пациентов, страдающих болезнью Альцгеймера, в то время как активность других фосфатаз, таких как РР2В, фактически возрастает в головном мозге при болезни Альцгеймера [Liu et al., 2005]. Отмечается отрицательная корреляция активности РР2А и уровня тау-фосфорилирования в большинстве участков фосфорилирования в головном мозге человека. Это указывает на то, что РР2А является главной тау-фосфатазой, регулирующей его фосфорилирование во множестве участков в головном мозге человека. Это позволяет предположить, что аномальное гиперфосфорилирование тау-белка частично обусловлено негативной регуляцией активности РР2А в головном мозге при болезни Альцгеймера, и что агенты, способные повысить активность РР2А, могут принести пользу при клиническом применении в лечении и/или профилактике развития некоторых неврологических нарушений.
Имеется потребность в агентах, снижающих количество тау-белка или влияющих на фосфорилирование тау-белка, и клинически пригодных для лечения или профилактики неврологических нарушений.
Краткое изложение сущности изобретения.
Данное изобретение основано, по крайней мере частично, на участии тау-белка, такого как гиперфосфорилированный тау-белок, в ряде неврологических нарушений, не относящихся к таупатии, и на том, что активность протеин-фосфатазы РР2А может быть усилена путем воздействия селената или его фармацевтически пригодной соли. Усиление активности РР2А может снижать или подавлять фосфорилирование тау-белка, особенно гиперфосфорилирование, двумя разнонаправленными способами: i) дефосфорилированием и инактивацией Akt, ведущими к снижению фосфорилирования GSK3β и последующему снижению фосфорилирования тау-белка, и ii) прямым дефосфорилированием тау-белка. Снижение фосфорилирования, включая гиперфосфорилирование тау-белка, уменьшает или предотвращает накопление или отложение аномального тау-белка в нейронах и глиальных клетках, и таким образом, является пригодным для лечения или профилактики неврологических нарушений.
Соответственно, в одном аспекте настоящее изобретение обеспечивает способ лечения или профилактики у субъекта неврологического нарушения, не относящегося к таупатии, включающий применение у субъекта эффективного количества селената или его фармацевтически пригодной соли, в котором неврологическое нарушение, не относящееся к таупатии, не является α-синуклеопатией. В некоторых воплощениях неврологическое нарушение, не относящееся к таупатии, выбрано из группы, состоящей из болезни Крейтцфельда-Якоба, болезни Хантингтона, инсульта, церебральной ишемии; деменции, связанной с инсультом или церебральной ишемией; деменции, связанной с ВИЧ; нарушений, связанных с эксцитотоксичностью, эпилепсией, судорогами, шизофренией, рассеянным склерозом, острой травмой головного мозга (тяжелым травматическим поражением головного мозга) и недостаточностью кислорода и глюкозы.
В другом аспекте изобретения обеспечивается применение селената или его фармацевтически пригодной соли в производстве медикамента для лечения или профилактики неврологического нарушения, не относящегося к таупатии, в котором неврологическое нарушение, не относящееся к таупатии, не является α-синуклеопатией.
В некоторых воплощениях способов и применений, широко описанных выше, селенат или его фармацевтически пригодную соль применяют в комбинации с другими средствами терапии, пригодными для лечения или профилактики неврологических нарушений, не относящихся к таупатии, или средствами терапии, пригодными для облегчения симптомов неврологических нарушений, не относящихся к таупатии.
В другом аспекте изобретения обеспечивается способ снижения количества тау-белка в клетке, включающий воздействие на клетку эффективного количества селената или его фармацевтически пригодной соли.
Описание изобретения.
1. Определения.
Если не указано иначе, все технические и научные термины, применяемые здесь, имеют то же самое значение, которое обычно понятно для рядового специалиста в области техники, к которой относится изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным, могут применяться при выполнении и анализе в настоящем изобретении, описаны предпочтительные способы и материалы. Для целей настоящего изобретения ниже определены следующие термины.
Артикли «а» и «an» применяются для обозначения одного или более, чем одного (т.е. по крайней мере одного) грамматического объекта предмета обсуждения. В качестве примера, «an element» означает один элемент или более чем один элемент.
Как применяется здесь, термин «около» относится к числу, уровню, значению, размеру, величине или количеству, отличающемуся на 30%, 20% или 10% от контрольного числа, уровня, значения, размера, величины или количества.
На протяжении описания и формулы изобретения, если контекст не требует иного, слово «включать» и его варианты, такие как «включает» и «включая», должны пониматься как подразумевающие включение установленного целого числа или этапа, или группы целых чисел или этапов, но не исключение любого другого целого числа или этапа, или группы целых чисел или этапов.
Термин «дефосфорилирование», как применяется здесь, относится к химическому удалению фосфатной группы (PO42-) из биохимического объекта, такого как белок. В клеточных условиях дефосфорилирование достигается ферментативно, за счет такого фермента, как фосфатаза.
Термин «гиперфосфорилирование» относится к условиям, когда участки фосфорилирования на биохимическом объекте, таком как белок, фосфорилируются на уровне, превышающем нормальный. Фраза «ингибирование или снижение гиперфосфорилирования» включает предотвращение фосфорилирования всех участков или некоторых участков на биохимическом объекте, и снижение числа биохимических объектов, в которых все или некоторые из участков фосфорилирования фосфорилированы.
Как применяется здесь, термин «в комбинации с» относится к лечению субъекта по крайней мере двумя агентами, так что их эффекты в отношении неврологического нарушения действуют, по крайней мере частично, на протяжении одного и того же периода времени. Применение по крайней мере двух агентов может осуществляться одновременно в одной композиции, или каждый агент может одновременно или последовательно применяться в отдельных композициях.
Термин «неврологическое нарушение, не относящееся к таупатии», как применяется здесь, относится к неврологическому нарушению без патологических проявлений классических таупатии. В целом таупатии считаются группой различных деменций и двигательных нарушений, обладающих общей патологической чертой, присутствием внутриклеточных агрегатов аномальных филаментов тау-белка. Тау-белок в агрегатах может быть гиперфосфорилированным тау-белком. Эти агрегаты филаментов тау-белка при таупатиях можно идентифицировать стандартными диагностическими методиками, такими как окрашивание и световая микроскопия. Напротив, неврологические нарушения, не относящиеся к таупатии, некоторые из которых связаны с аберрантным тау-белком, таким как гиперфосфорилированный тау-белок, или с аномальным количеством тау-белка, не характеризуются внутриклеточными агрегатами аномального тау-белка. Примеры неврологических нарушений, не относящихся к таупатии, включают болезнь Крейтцфельда-Якоба, болезнь Хантингтона, инсульт, церебральную ишемию, деменцию, связанную с инсультом или церебральной ишемией, деменцию, связанную с ВИЧ, нарушения, связанные с эксцитотоксичностью, эпилепсию, судороги, шизофрению, рассеянный склероз, острую травму головного мозга (тяжелое травматическое поражение головного мозга) и недостаточность кислорода и глюкозы.
Как применяется здесь, термин «α-синуклеопатия» относится к нейродегенеративному заболеванию или нарушению, включающему агрегацию α-синуклеина или аномального α-синуклеина в нервных клетках в головном мозге. Неврологические нарушения из настоящего изобретения, не относящиеся к таупатии, не являются α-синуклеопатиями.
Как применяется здесь, термин «заболевания, связанные с эксцитотоксичностью, относится к заболеваниям, включающим избыточную активацию глутаматных рецепторов в головном мозге. Заболевания, связанные с эксцитотоксичностью, включают ишемию при инсульте, травму, гипоксию, гипогликемию и печеночную энцефалопатию;
заболевания, связанные с долговременными пластическими изменениями в центральной нервной системе, такими, как хроническая боль, устойчивость к лекарственным препаратам, лекарственная зависимость, наркотическая зависимость и поздняя дискинезия, эпилепсия, шизофрения, тревога, депрессия, острая боль и звон в ушах.
Как применяется здесь, термин «диетическое количество» включает количество селена, которое меньше максимальной дозы пищевой добавки, ограниченной Управлением по контролю за продуктами питания и лекарственными средствами США. В Соединенных Штатах максимальная суточная доза для пищевой добавки составляет 400 мкг в сутки.
Термин «фармацевтическая соль», применяемый здесь по отношению к селенату, означает соли, которые являются токсикологически безопасными при применении у человека и животных. Например, подходящие фармацевтически пригодные соли включают без ограничения соли фармацевтически пригодных неорганических кислот, таких как соляная, серная, фосфорная, азотная, угольная, борная, сульфаминовая и бромоводородная кислота, или соли фармацевтически пригодных органических кислот, таких как уксусная, пропионовая, масляная, виннокаменная, малеиновая, гидроксималеиновая, фумаровая, лимонная, молочная, муциновая, глюконовая, бензойная, янтарная, щавелевая, фенилуксусная, метансульфоновая, толуолсульфоновая, бензолсульфоновая, салициловая, сульфаниловая, аспарагиновая, глутаминовая, эдетовая, стеариновая, пальмитиновая, олеиновая, лауриновая, пантотеновая, дигалловая, аскорбиновая и валериановая кислота.
Основные соли включают без ограничения те соли, которые образованы с фармацевтически пригодными катионами, такими как натрий, калий, литий, кальций, магний, железо, никель, цинк, аммоний и алкиламмоний.
Основные азот-содержащие группы могут быть переведены в четвертичные с такими агентами, как низшие алкил-галоиды, такие как метил-, этил-, пропил- и бутил-хлориды, бромиды и иодиды; диалкилсульфаты, такие как диметил и диэтилсульфат; и другие.
Подходящие соли селената и ионов металлов включают без ограничения соли натрия, калия, лития, магния, кальция, железа, никеля, цинка, аммония и алкиламмония. Предпочтительной солью селената является натриевая соль, Na2SeO4.
Термин «фосфорилирование», применяемый здесь, относится к химическому добавлению фосфатной группы (PO42-) к биохимическому объекту, такому как белок. В клеточных условиях фосфорилирование достигается ферментативно таким ферментом, как киназа. Термин «ингибирование или уменьшение фосфорилирования» включает предотвращение фосфорилирования одного или более участков фосфорилирования биохимического объекта, включая предотвращение фосфорилирования всех участков фосфорилирования, как при гиперфосфорилировании. Этот термин также включает снижение степени фосфорилирования биохимического объекта путем предотвращения фосфорилирования, происходящего в одном или более участках фосфорилирования, или в результате дефосфорилирования, происходящего в одном или более участках фосфорилирования биохимического объекта.
Термин «субъект» или «индивидуум» или «пациент», применяемый здесь, относится к любому субъекту, в частности позвоночному субъекту, и более конкретно, к млекопитающему субъекту, которому необходима профилактика или лечение. Подходящие позвоночные животные, относящиеся к объему изобретения, включают без ограничения приматов, птиц, сельскохозяйственных животных (например, свиней, овец, коров, лошадей, ослов), лабораторных животных (например, кроликов, мышей, крыс, морских свинок, хомячков), домашних животных (например, кошек и собак) и содержащихся в неволе диких животных (лисиц, оленей, собак динго). Предпочтительным субъектом является человек, нуждающийся в лечении или профилактике неврологического нарушения. Однако нужно понять, что вышеупомянутые термины не подразумевают наличия симптомов.
Термин «сверхдиетический», применяемый здесь, относится к количеству, превышающему количество, считающееся диетической потребностью. В Соединенных Штатах максимальная суточная доза для селеновой пищевой добавки, определенная Управлением по контролю за продуктами питания и лекарственными средствами, составляет 400 мкг в сутки. Сверхдиетическое количество селена обеспечивает селен для субъекта выше максимальной суточной дозы для пищевой добавки. Например, сверхдиетическое количество селена в сутки может быть от 5 мкг/кг до 1,0 мг/кг, от 5 мкг/кг до 0,5 мг/кг в сутки, от 5 мкг/кг до 0,3 мг/кг, от 0,01 мг/кг до 1,0 мг/кг, от 0,01 мг/кг до 0,5 мг/кг, от 0,025 мг/кг до 1,0 мг/кг, от 0,025 мг/кг до 0,5 мг/кг, от 0,05 мг/кг до 1,0 мг/кг, от 0,05 мг/кг до 0,5 мг/кг, от 0,05 мг/кг до 0,3 мг/кг, от 0,1 мг/кг до 1,0 мг/кг, от 0,1 мг/кг до 0,5 мг/кг или от 0,1 мг/кг до 0,3 мг/кг, особенно от 0,025 мг/кг до 0,3 мг/кг или от 0,01 мг/кг до 0,3 мг/кг в сутки.
Как применяется здесь, термин «эффективное количество» в контексте лечения или профилактики нейродегенеративного заболевания, или ингибирования или снижения фосфорилирования тау-белка, или ингибирования активности GSK3β, означает применение или добавление количества селената или его фармацевтически пригодной соли, в виде единичной дозы или части из серии доз, эффективного в повышении активности РР2А и особенно эффективного в профилактике проявления симптомов, контроле таких симптомов, и/или лечении существующих симптомов, связанных с неврологическим нарушением. Эффективное количество может варьировать в зависимости от здоровья и физического состояния индивидуума, подвергающегося лечению, таксономической группы индивидуумов, подвергающихся лечению, рецептуры композиции, оценки медицинских ситуаций и других существенных факторов. Предполагается, что количество находится в пределах относительно широкого диапазона. В конкретных воплощениях эффективное количество является диетическим или сверхдиетическим количеством.
1. Способы лечения или профилактики неврологических нарушений, не относящихся к таупатии.
Настоящее изобретение основано отчасти на том определении, что селенат или его фармацевтически пригодная соль эффективны в повышении активности РР2А, что в свою очередь может привести к снижению фосфорилирования тау-белка GSK3β или повышению скорости дефосфорилирования тау-белка. Также наблюдалось, что селенат или его фармацевтически пригодная соль эффективны в снижении уровня или количества тау-белка, присутствующего в клетках.
Настоящее изобретение может эффективно применяться для лечения или профилактики неврологических нарушений, не относящихся к таупатии. Соответственно, эффективное количество селената или его фармацевтически пригодной соли является диетическим или сверхдиетическим количеством селената. В некоторых воплощениях количество селената или его фармацевтически пригодной соли доставляет сверхдиетическую дозу селена в количестве от примерно 5 мкг/кг до примерно 1,0 мг/кг, обычно от примерно 0,01 мг/кг до 1,0 мг/кг или от 0,01 мг/кг до 0,5 мг/кг в сутки, или от 0,01 мг/кг до 0,3 мг/кг сутки. В предпочтительном воплощении селенат или его фармацевтически пригодная соль является натрия селенатом (Na2SeO4).
В некоторых воплощениях селенат или его фармацевтически пригодную соль применяют у субъекта в комбинации с другим средством для лечения или профилактики неврологического нарушения, не относящегося к таупатии. Иллюстративные примеры средств для лечения или профилактики неврологического нарушения, не относящегося к таупатии, которые могут применяться в комбинации с селенатом или его фармацевтически пригодной солью, включают без ограничения антитромбоцитарные агенты, такие как аспирин (например, 50-325 мг/сутки), клопидогрел (например, 75 мг/сутки), аспирин и дипиридамол (например, 25/200 мг дважды в сутки) и тиклопидин, антигипертензивные агенты, антидепрессанты, противосудорожные средства, такие как карбамазепин (Тегретол™), клобазам (Фризиум™), клоназепам (Клонопин™), этосуксимд (Заронтин™), фелбамат (Фелбатол™), фосфенитоин (церебикс™), флуразепам (Далман™), габапентин (Неуронтин™), ламотригин (Ланиктал™), леветирацетам (Кеппра™), окскарбазепин (Трилептал™), мефенитоин (Мезантоин™), фенобарбитал (Люминал™), фенитоин (Дилантин™), прегабалин (Лирика™), примидон (Мизолин™), натрия вальпроат (Эпилим™), тиагабин (Габитрил™), топирамат (Топамакс™), вальпроат семинатрий (Депакок™, Эпивал™), вальпроевая кислота (Депакен™, Конвулекс™), вигабатрин (Сабрил™), диазепам (Валиум™), лоразепам (Ативан™), паральдегид (Парал™) и фенобарбитал (Нембутал™); антипсихотические средства, включая типичные антипсихотические средства, такие как хлорпромазин (Торазин™), флуфеназин (Проликсин™), перфеназин (Трилафон™), прохлорперазин (Компазин™), тиоридазин (Мелларил™), трифлуоперазин (Стелазин™), мезоридазин, промазин, трифлупромазин (Весприн™) и левомепромазин (Новазин™); тиоксантены, такие как хлорпротиксен, флупентиксол (Депиксол™ и Флуанксол™), тиотиксен (Наван™) и зуклопентиксол (Клопиксол™ и Акуфаз™) и бутирофеноны, такие как галоперидол (Халдол™), дроперидол, пимозид (Орап™) и мелперон; атипичные антипсихотические средства, включая клозапин (Клозарил™), оланзапин (Зипрекса™), рисперидон (Риспердал™), кветиапин (Сероквел™), зипразидон (Геодон™), амисулприд (Солиан™) и палиперидон (Инвега™); частичные агонисты допамина, такие как арипипразол (Абилифай™), бифепрунокс и норклозапин АСР-104), интерфероны, такие как интерферон β-1а (Аронекс™, Ребиф™, ЦинноВекс™) и интерферон β-1b (Бетасерон™); глатирамер ацетат (Копаксон™); митоксантрон (Новантрон™); натализумаб (Тисабри™) и рилузол (Рилутек™).
Виды лечения, применяемые в комбинации, должны включать эффективные количества селената или его фармацевтически пригодной соли вместе с агентом, применяемым для лечения или профилактики неврологического нарушения, не относящегося к таупатии, в количестве, обычно применяемом при отсутствии селената. Альтернативно, количество агента, применяемого для лечения неврологических нарушений, не относящихся к таупатии, может быть снижено при совместном применении с селенатом или его фармацевтически пригодной солью. В некоторых воплощениях комбинация может проявлять синергетический эффект.
Некоторые воплощения настоящего изобретения направлены на способы лечения или профилактики неврологических нарушений, не относящихся к таупатии, у субъекта, где способы в целом включают применение у субъекта эффективного количества селената или его фармацевтически пригодной соли. Для осуществления этих способов лицо, осуществляющее лечение субъекта, может определить эффективную лекарственную форму селената или его фармацевтически пригодной соли для конкретного состояния и условий субъекта. Эффективное количество селената является таким, которое эффективно для лечения или профилактики неврологического нарушения, не относящегося к таупатии, включая профилактику возникновения симптома, контроль симптома и лечение симптома. В некоторых воплощениях эффективное количество является диетическим количеством. В других воплощениях эффективное количество является сверхдиетическим количеством. В специфических воплощениях селенат или его фармацевтически пригодная соль являются натрия селенатом.
Виды применения, количества применяемого селената, и рецептуры селената, для применения в способах настоящего изобретения, обсуждаются ниже. Не относящееся к таупатии неврологическое нарушение, подлежащее лечению, может определяться по оценке одного или более диагностических параметров, показательных для течения заболевания, по сравнению с подходящим контролем. В случае человеческого субъекта «подходящим контролем» может быть индивидуум до лечения, или может быть человек (например, в качестве соответствующего по возрасту или подобного контроля), получающий лечение плацебо. В соответствии с настоящим изобретением лечение не относящегося к таупатии неврологического нарушения включает и охватывает без ограничения: (i) профилактику не относящегося к таупатии неврологического нарушения у субъекта, который может быть предрасположен к развитию заболевания, но у которого не поставлен диагноз заболевания и, соответственно, лечение состоит в профилактическом лечении неврологического нарушения, не относящегося к таупатии; (ii) ингибирование не относящегося к таупатии неврологического нарушения, т.е. остановку развития не относящегося к таупатии неврологического нарушения; или (iii) облегчение симптомов вследствие не относящегося к таупатии неврологического нарушения.
Способы настоящего изобретения пригодны для лечения индивидуума, у которого поставлен диагноз не относящегося к таупатии неврологического нарушения, у которого предполагается наличие не относящегося к таупатии неврологического нарушения; или который, как известно, является восприимчивым, и у которого, как считается, может развиться не относящееся к таупатии неврологическое нарушение.
В конкретных воплощениях селенат является натрия селенатом.
Примерами субъектов для лечения способами настоящего изобретения являются позвоночные, особенно млекопитающие. В некоторых воплощениях субъект выбран из группы, состоящей из людей, овец, крупного рогатого скота, лошадей, коров, свиней, собак и кошек. Предпочтительным субъектом является человек.
Рецептуры селената или его фармацевтически пригодной соли могут быть выполнены путем любого числа методик, известных в области доставки лекарственных средств. Селенат или его фармацевтически пригодную соль, конечно, можно применять с помощью ряда средств, учитывая, что все рецептуры являются пригодными не для каждого пути применения. Селенат или его фармацевтически пригодную соль можно применять в твердой или жидкой форме. Применение может быть пероральным, ректальным, интраназальным, местным (включая буккальное и сублингвальное), или путем ингаляции. Селенат или его фармацевтически пригодную соль можно применять вместе с обычными фармацевтически пригодными адъювантами, носителями и/или разбавителями.
Твердые лекарственные формы включают таблетки, капсулы, порошки, пилюли, пастилки, суппозитории и гранулярные формы применения. Они также могут включать носители или добавки, такие как ароматизаторы, красители, разбавители, пластификаторы, связующие агенты, консерванты, закрепляющие агенты и/или материалы оболочки. Жидкие лекарственные формы включают растворы, суспензии и эмульсии. Они могут также быть выполнены с вышеупомянутыми добавками.
Растворы и суспензии селената или его фармацевтически пригодной соли, учитывая подходящую вязкость для удобства применения, могут вводиться путем инъекции. Слишком вязкие для инъекции суспензии могут быть имплантированы с применением устройств, сконструированных для таких целей, если необходимо. Формы с замедленным высвобождением в целом применяются с помощью парентеральных или энтеральных средств. Парентеральное применение является другим путем применения селената или его фармацевтически пригодной соли, применяемым для осуществления изобретения. «Парентеральные» включают рецептуры, подходящие для инъекции и для интраназального, вагинального, ректального и буккального применения.
Применение селената или его фармацевтически пригодной соли может включать рецептуру для перорального применения. Рецептуры для перорального применения предпочтительно применяют от одного раза в сутки до трех раз в сутки, в форме капсул или таблеток, или альтернативно в виде раствора на водной основе. Селенат или его фармацевтически пригодную соль можно вводить внутривенно ежедневно, непрерывно, один раз в неделю, или три раза в неделю.
Применение селената или его фармацевтически пригодной соли может включать ежедневное применение, предпочтительно один раз в сутки в форме капсулы или таблетки замедленного высвобождения, или один раз в сутки в форме водного раствора.
Комбинации селената или его фармацевтически пригодной соли и по крайней мере одного агента, который пригоден для лечения неврологического нарушения и может применяться в твердой или жидкой форме, находятся в виде единой рецептуры или композиции или в виде отдельных рецептур или композиций. В некоторых воплощениях селенат или его фармацевтически пригодную соль и агент для лечения неврологического нарушения применяют перорально в виде единой таблетки или капсулы, или в виде отдельных таблеток или капсул. В других воплощениях селенат или его фармацевтически пригодную соль и агент для лечения неврологического нарушения применяют внутривенно в виде единой композиции или отдельных композиций.
Настоящее изобретение также обеспечивает фармацевтические композиции для лечения или профилактики неврологического нарушения, включающие диетическое или сверхдиетическое количество селената или его фармацевтически пригодной соли. В некоторых воплощениях композиции содержат количество селената, доставляющее селен в количестве от примерно 40 мкг до примерно 80 мг, например, от 400 мкг до 80 мг, селена как части селената или его фармацевтически пригодной соли, и фармацевтически пригодный носитель. В некоторых воплощениях селенат или его фармацевтически пригодная соль доставляют селен в количестве от примерно 40 мкг до примерно 80 мг, или от 400 мкг до 80 мг. В иллюстративных примерах селенат или его фармацевтически пригодная соль доставляют селен в количестве от примерно 400 мкг до 80 мг, от 401 мкг до 80 мг, от 500 мкг до 40 мг, особенно от 800 мкг до 40 мг, в единой или разделенной суточной дозе.
Фармацевтические композиции, включающие селенат или его фармацевтически пригодную соль, могут дополнительно включать другой агент для лечения или профилактики неврологического нарушения. Например, композиция может содержать селенат или его фармацевтически пригодную соль и по крайней мере один антитромбоцитарный агент, такой как аспирин (например, 50-325 мг/сутки), клопидогрел (например, 75 мг/сутки), аспирин и дипиридамол (например, 25/200 мг дважды в сутки) и тиклопидин, антигипертензивные агенты, антидепрессанты, противосудорожные средства, такие как карбамазепин (Тегретол™), клобазам (Фризиум™), клоназепам (Клонопин™), этосуксимд (Заронтин™), фелбамат (Фелбатол™), фосфенитоин (церебикс™), флуразепам (Далман™), габапентин (Неуронтин™), ламотригин (Ланиктал™), леветирацетам (Кеппра™), окскарбазепин (Трилептал™), мефенитоин (Мезантоин™), фенобарбитал (Люминал™), фенитоин (Дилантин™), прегабалин (Лирика™), примидон (Мизолин™), натрия вальпроат (Эпилим™), тиагабин (Габитрил™), топирамат (Топамакс™), вальпроат семинатрий (Депакок™, Эпивал™), вальпроевая кислота (Депакен™, Конвулекс™), вигабатрин (Сабрил™), диазепам (Валиум™), лоразепам (Ативан™), паральдегид (Парал™) и фенобарбитал (Нембутал™); антипсихотические средства, включая типичные антипсихотические средства, такие как хлорпромазин (Торазин™), флуфеназин (Проликсин™), перфеназин (Трилафон™), прохлорперазин (Компазин™), тиоридазин (Мелларил™), трифлуоперазин (Стелазин™), мезоридазин, промазин, трифлупромазин (ВеспринТМ) и левомепромазин (Новазин™); тиоксантены, такие как хлорпротиксен, флупентиксол (ДепиксолТМ и Флуанксол™), тиотиксен (Наван™) и зуклопентиксол (Клопиксол™ и Акуфаз™) и бутирофеноны, такие как галоперидол (Халдол™), дроперидол, пимозид (Орап™) и мелперон; атипичные антипсихотические средства, включая клозапин (Клозарил™), оланзапин (Зипрекса™), рисперидон (Риспердал™), кветиапин (Сероквел™), зипразидон (Геодон™), амисулприд (Солиан™) и палиперидон (Инвега™); частичные агонисты допамина, такие как арипипразол (Абилифай™), бифепрунокс и норклозапин АСР-104), интерфероны, такие как интерферон β-1а (Аронекс™, Ребиф™, ЦинноВекс™) и интерферон β-1b (Бетасерон™); глатирамер ацетат (Копаксон™); митоксантрон (Новантрон™); натализумаб (Тисабри™) и рилузол (Рилутек™).
Фармацевтические композиции настоящего изобретения могут включать любые дополнительные компоненты, которые являются неиммуногенными и биосовместимыми с селенатом, а также способными к биоабсорбции, биодеградации, элиминации в виде интактной молекулы. Рецептура может поставляться в виде готовой к употреблению формы или может поставляться в виде стерильного порошка или жидкости, требующей добавления растворителя перед применением. Если необходима стерильность, рецептура может быть изготовлена в стерильных условиях, индивидуальные компоненты смеси могут быть стерильными, либо рецептура может быть подвергнута стерилизующей фильтрации перед применением. Таким образом, раствор может также содержать подходящее количество фармацевтически пригодных носителей, такие как, без ограничения, буферы, соли, наполнители, консерванты и т.д.
В некоторых воплощениях пероральные рецептуры используются для применения селената или его фармацевтически пригодной соли в способах изобретения. Эти рецептуры в целом включают селенат или его фармацевтически пригодную соль, обладающие сниженной растворимостью, чтобы замедлить абсорбцию в кровяное русло. Кроме того, эти рецептуры могут включать другие компоненты, агенты, носители и т.д., которые могут также служить для замедления абсорбции селената или его фармацевтически пригодной соли. Микроинкапсулирование, полимерные системы захвата, и осмотические насосы, которые могут быть или не быть биоэродируемыми, также могут применяться для обеспечения замедленной или контролируемой диффузии селената или его фармацевтически пригодной соли из капсулы или матрикса.
Селенат или его фармацевтически пригодную соль можно применять по отдельности или как часть другого агента. Соответственно, настоящее изобретение также подразумевает агент, включающий селенат или его фармацевтически пригодную соль для лечения неврологического нарушения.
В другом аспекте изобретения обеспечивается способ снижения количества тау-белка в клетке, включающий воздействие на клетку эффективного количества селената или его фармацевтически пригодной соли.
В некоторых воплощениях данного аспекта тау-белок аномально фосфорилирован, например, гиперфосфорилирован.
В других воплощениях тау-белок имеет нормальную степень фосфорилирования.
Не желая связываться теорией, тау-белок, как кажется, вовлечен в неврологические заболевания и является медиатором нейротоксических поражений. Снижение количества тау-белка при нормальных уровнях фосфорилирования или гиперфосфорилировании может оказывать нейропротективное действие.
Краткое описание чертежей.
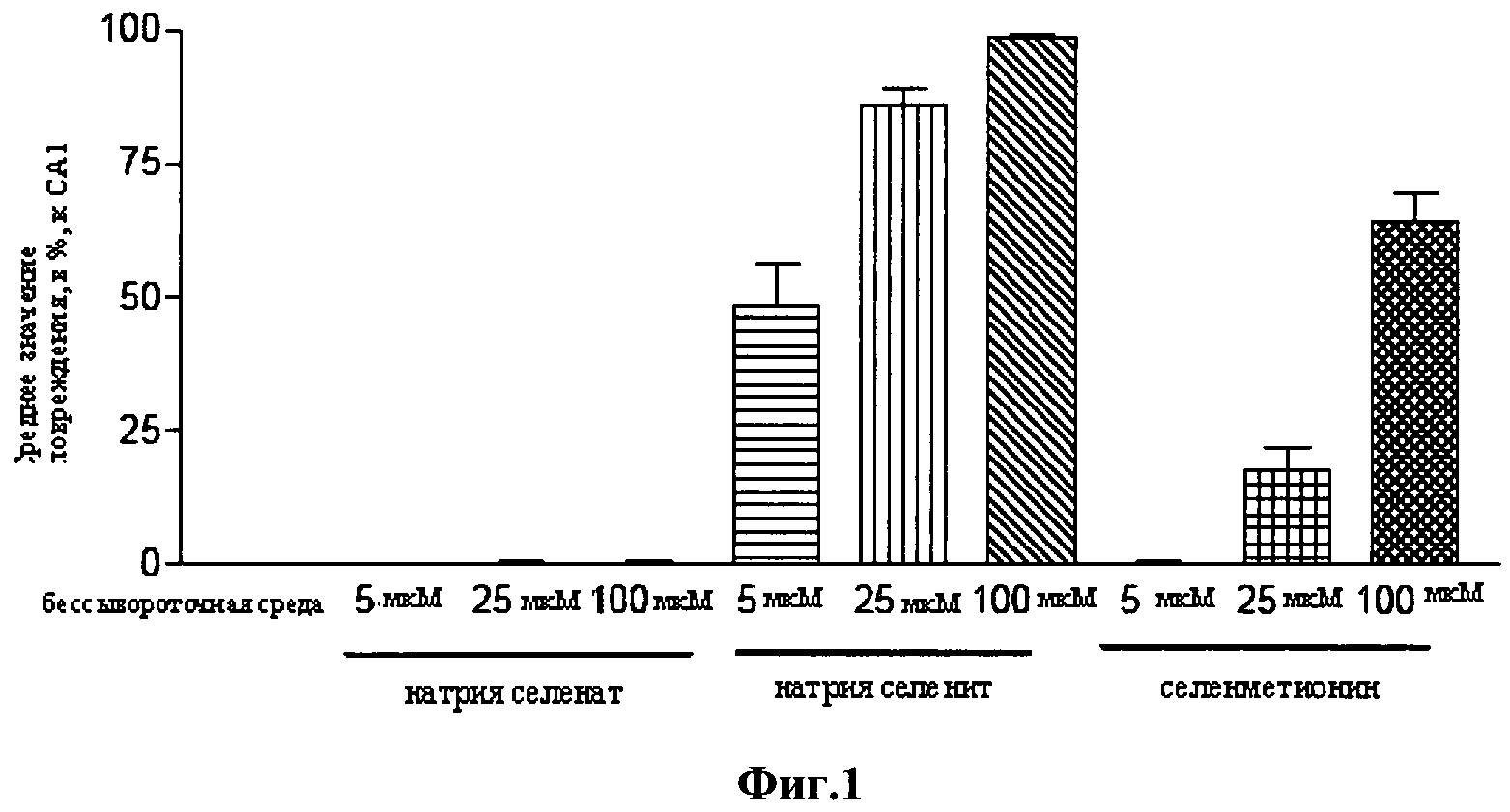
Фигура 1 является графическим представлением, демонстрирующим токсичность в тканевой культуре натрия селената, натрия селенита и селенметионина в бессывороточной среде при 5 мкМ, 25 мкМ и 100 мкМ после 24 часов воздействия.
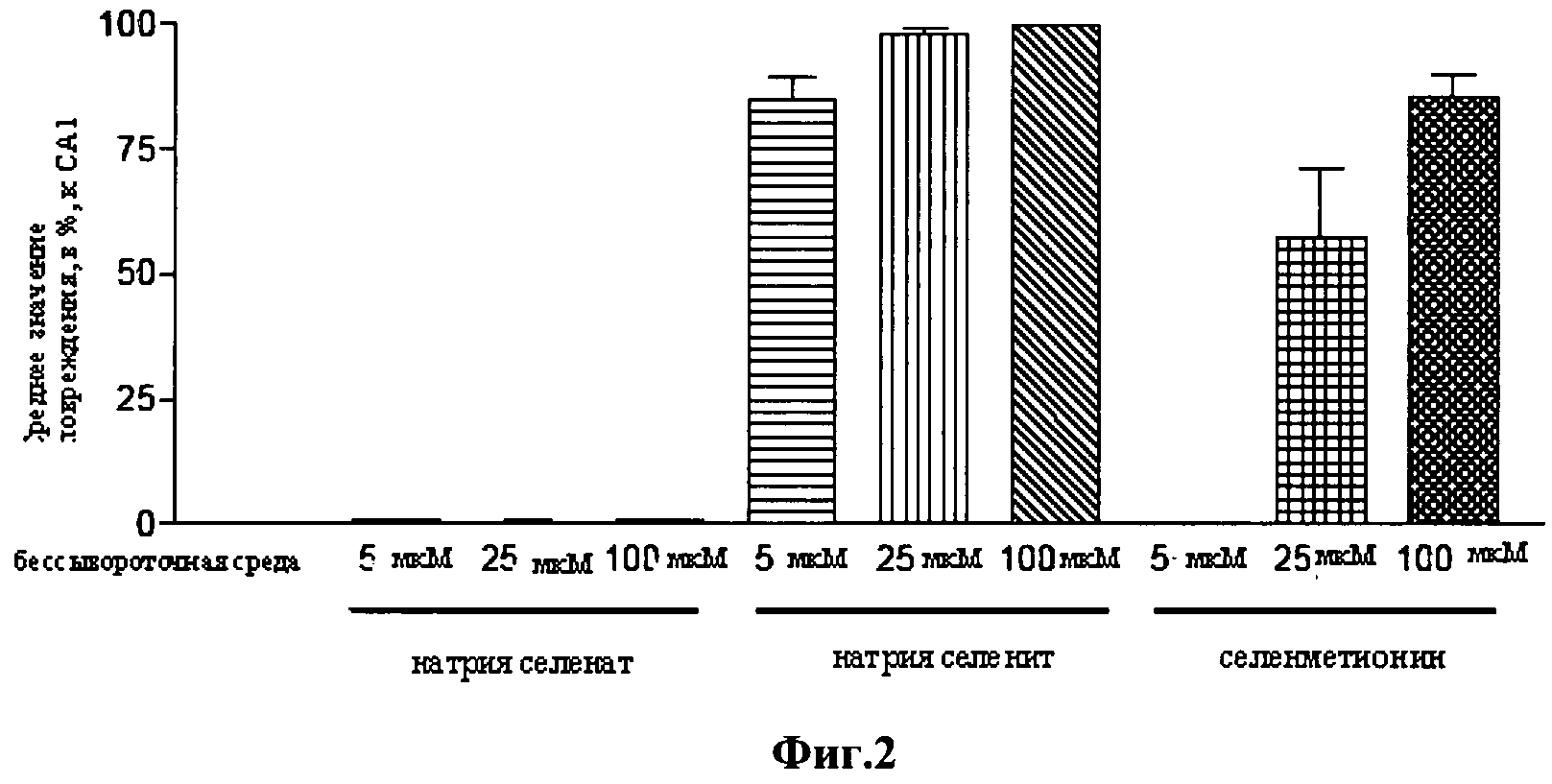
Фигура 2 является графическим представлением, демонстрирующим токсичность в тканевой культуре натрия селената, натрия селенита и селенметионина в бессывороточной среде при 5 мкМ, 25 мкМ и 100 мкМ после 48 часов воздействия.
Фигура 3 является графическим представлением в виде гистограммы, иллюстрирующей влияние натрия селената, натрия селенита и селенметионина на нейродегенерацию, индуцированную гипоксией, по сравнению с нейропротектором MnTBAP.
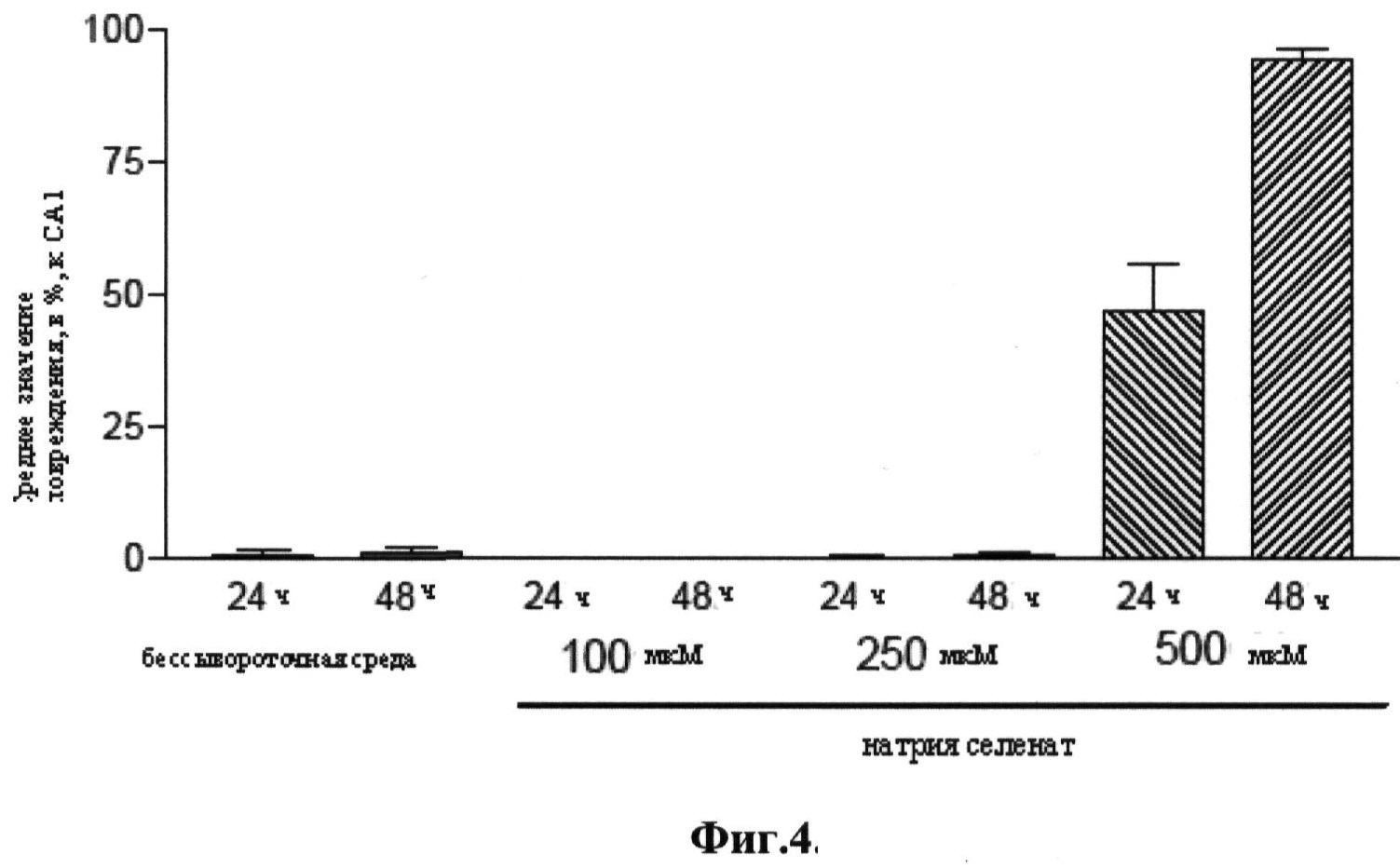
Фигура 4 является графическим представлением в виде гистограммы, иллюстрирующим токсичность натрия селената в тканевой культуре в количестве 100 мкМ, 250 мкМ и 500 мкМ.
Фигура 5 является графическим представлением в виде гистограммы, демонстрирующей влияние натрия селената, натрия селенита и селенметионина на нейродегенерацию, индуцированную ишемией.
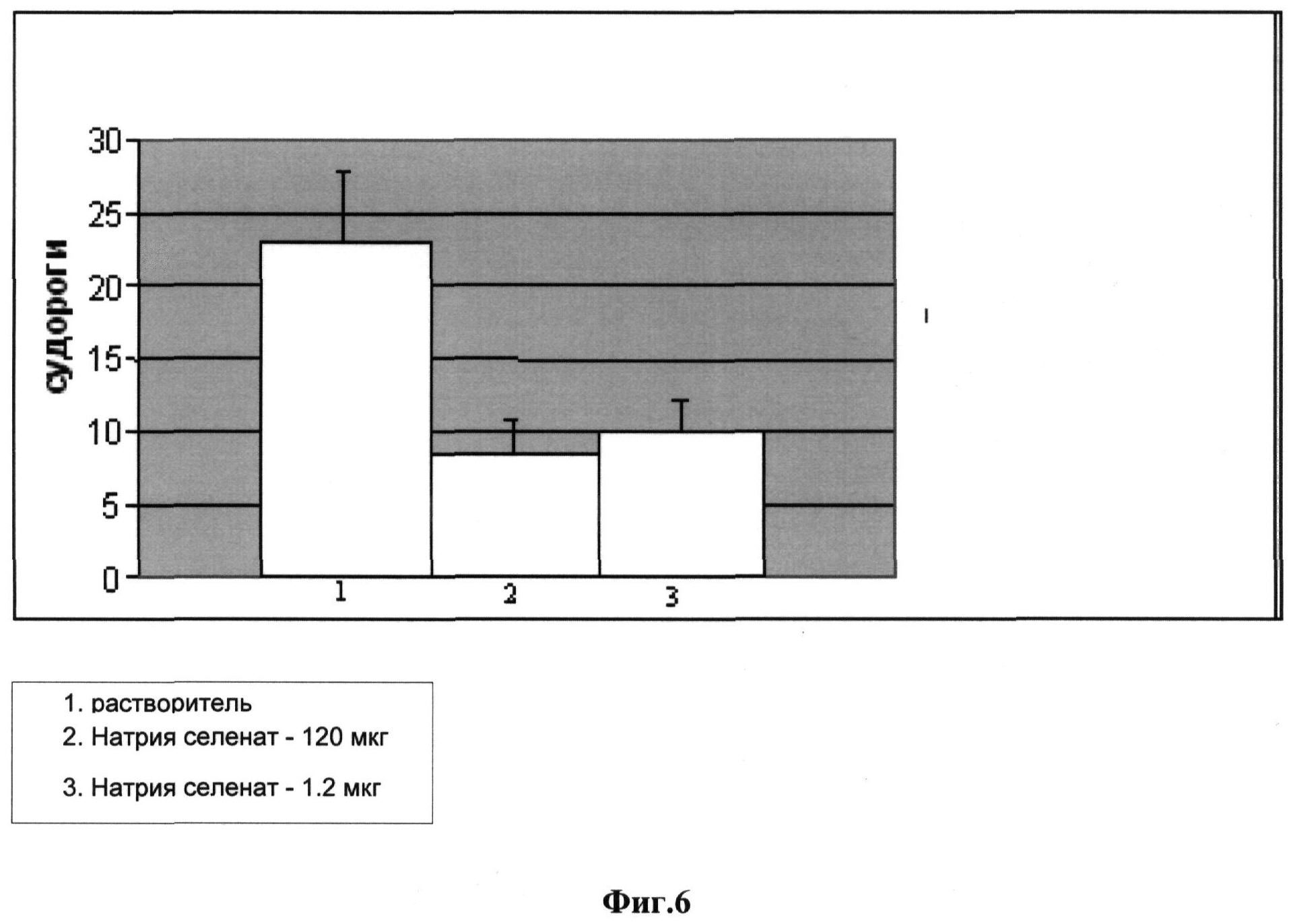
Фигура 6 является графическим представлением, иллюстрирующим число индуцированных ПТЗ (пентилентетразолом) судорог у крыс при воздействии 120 мкг и 1,2 мг натрия селената (среднее значение ±СОС (стандартная ошибка среднего)).
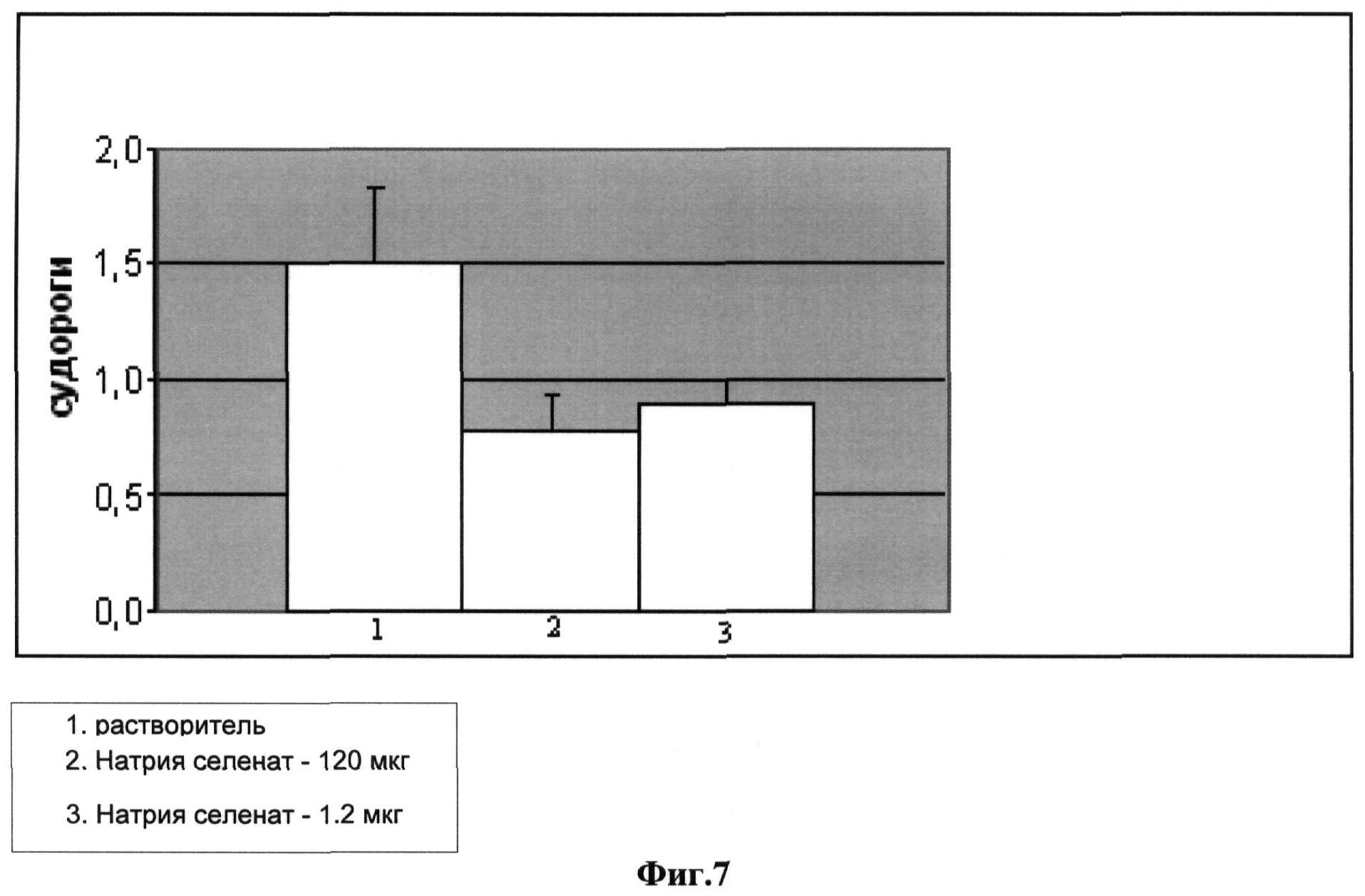
Фигура 7 является графическим представлением, иллюстрирующим число индуцированных ПТЗ судорог у крыс при воздействии 120 мкг и 1,2 мг натрия селената (среднее значение ±СОС).
Фигура 8 является графическим представлением, иллюстрирующим длительность судорожной активности, индуцированной ПТЗ у крыс при воздействии 120 мкг и 1,2 мг натрия селената (среднее значение ±СОС).
Фигура 9 является графическим представлением, иллюстрирующим инкубационный период судорог, индуцированных ПТЗ у крыс, при воздействии 120 мкг и 1,2 мг натрия селената (среднее значение ±СОС).
Для того, чтобы природа настоящего изобретения была более ясно понятой и могла принести практическую пользу, далее описаны его конкретные предпочтительные воплощения со ссылкой на следующие не-ограничивающие примеры.
Примеры.
Пример 1.
Исследование нейропротективных эффектов натрия селената, натрия селенита и селенметионина, против эксцитотоксичности, гипоксии и ишемии в культивированных срезах гиппокампа.
Методы:
Органотипические культуры срезов гиппокампа готовили с применением основного способа Pringle et al 1997, модифицированного следующим образом:
Детенышей крыс линии Wistar (в возрасте 8-11 суток) умерщвляли декапитацией, а гиппокампы быстро препарировали в холодном сбалансированном солевом растворе Гея с добавлением 4,5 мг/мл глюкозы. Поперечные секции (400 мкм) нарезали на устройстве для приготовления срезов тканей Мак-Илвейна и помещали назад в холодный сбалансированный солевой раствор Гея. Срезы разделяли и помещали на культуральные вставки Millicell CM (no 4 на ячейку) и хранили при 37°С/5% CO2 в течение 14 суток. Поддерживающая среда состояла из 25% инактивированной нагреванием лошадиной сыворотки, 25% сбалансированного солевого раствора Хенкса (HBSS) и 50% минимальной эссенциальной среды с добавлением солей Эрла (MEM), с добавлением 1 мМ глутамина и 4,5 мг/мл глюкозы. Среду заменяли каждые 3-4 дня.
Гипоксия.
Предварительно осуществляли экспериментальную гипоксию (Pringle et al., 1996; 1997). Вкратце, 14-суточные культуры переносили в бессывороточную среду (SFM - 75% MEM, 25% HBSS с добавлением 1 мМ глутамина и 4,5 мг/мл глюкозы), содержащую 5 мкг/мл дифференциального флуоресцентного красителя пропидиум-иодида (ПИ). Культуры оставляли для уравновешивания в SFM в течение 60 минут перед получением изображения. ПИ флуоресценцию выявляли с применением инвертированного микроскопа Leica DMIL, оснащенного родаминовым фильтром. Любые культуры, в которых выявляли ПИ флуоресценцию на данной стадии, исключали из дальнейшего исследования. Гипоксию индуцировали путем переноса культур в бессывороточную среду (SFM) (+ПИ), которую насыщали 95% N2/5% CO2. Культуральные планшеты (без крышек) запечатывали в герметичной камере, атмосферу в которой насыщали 95% N2/5% CO2 путем непрерывного продувания газа со скоростью 10 л/мин в течение 10 минут перед герметизацией, и помещали в инкубатор на 170 минут (таким образом, общее время гипоксии составило 180 минут). По окончании гипоксического периода культуры возвращали в нормоксическую SFM, содержащую ПИ, и помещали назад в инкубатор на 24 часа. В качестве положительного нейропротективного контроля применяли Mn(III)тетракис(4-бензойной кислоты)порфирин хлорид (MnTBAP) в количестве 100 мкМ. Эффективность исследуемых соединений оценивали с применением образцов до, во время и после гипоксии - соединения присутствовали в среде за 24 часа до гипоксии, на протяжении 3 часов гипоксии и 24 часа после гипоксии.
Ишемия.
Экспериментальную ишемию индуцировали путем переноса культур в глюкозо-дефицитную среду (GFM - 75% MEM, 25% HBSS с добавлением 1 мМ глутамина) + ПИ, которую насыщали 95% N2/5% CO2. Культуральные планшеты (без крышек) запечатывали в герметичной камере, атмосферу в которой насыщали 95% N2/5% CO2 путем постоянного продувания газа со скоростью 10 л/мин в течение 10 минут перед герметизацией и помещением в инкубатор на 50 минут (общее время ишемии составило, таким образом, 60 минут). По окончании периода ишемии культуры возвращали в нормоксическую SFM, содержащую ПИ, и помещали назад в инкубатор на 24 часа. В качестве положительного нейропротективного контроля применяли MnTBAP в количестве 100 мкМ. Эффективность исследуемых соединений оценивали с применением образцов до, во время и после гипоксии - соединения присутствовали в среде за 24 часа до ишемии, на протяжении 1 часа ишемии, и 24 часа после ишемии.
Определение нейронального повреждения.
Нейрональное повреждение оценивали с применением программного обеспечения ImageJ на ПК. Изображения получали с применением монохромной ПЗС камеры, и сохраняли для автономного анализа. Изображения в проходящем свете получали перед добавлением лекарств, а ПИ флуоресцентные изображения регистрировали в конце 24-часового периода восстановления. Площадь СА1 области затем определяли по изображению в проходящем свете. Площадь ПИ флуоресценции на СА1 измеряли с помощью пороговой функции на ImageJ, а нейрональное повреждение выражали в виде процента СА1, на которой выявляли ПИ флуоресценцию выше порогового уровня (Pringle et al., 1997).
Соединения.
Все анализированные экспериментальные соединения были получены от Sigma Aldrich.
Натрия селенат (кат. №S8295)
Натрия селенит (кат. №00163)
Селенметионин (кат. №S3132)
Предварительный анализ токсичности был проведен с соединениями для определения уровней воздействия в тканевой культуре, способных вызвать токсичность. Были приготовлены растворы каждого соединения по 5 мМ в SFM, затем применяли по 1 мкл/мл, 5 мкл/мл и 20 мкл/мл, до получения конечной концентрации 5 мкМ, 25 мкМ и 100 мкМ. Повреждение оценивали спустя 24 часа и 48 часов. (Результаты показаны на Фигурах 1 и 2). Было установлено, что натрия селенит токсичен при содержании выше 5 мкМ, а селенметионин токсичен при содержании выше 25 мкМ. Было установлено, что натрия селенат не является токсичным при какой-либо анализируемой концентрации вплоть до 100 мкМ. Эти результаты были использованы для определения концентраций, использованных в последующих экспериментах.
Были приготовлены растворы соединений в SFM с содержанием 10 мМ. Растворы натрия селената стерильно разбавляли SFM до 1 мМ, 100 мкМ и 5 мкМ, каждый из этих растворов применяли в количестве 10 мкл/мл, до получения конечных концентраций 50 нМ, 1 мкМ, 10 мкМ и 100 мкМ. Раствор натрия селенита разбавляли до 100 мкМ, селенметионина до 500 мкМ. Растворы затем применяли в количестве 10 мкл/мл до получения конечных концентраций 1 мкМ и 5 мкМ.
С учетом результатов, полученных в эксперименте с гипоксией (Результаты из фигуры 3), концентрации натрия селената, концентрации натрия селената, используемые в эксперименте с НКГ (недостаточностью кислорода и глюкозы), были увеличены.
В этом случае готовили раствор натрия селената в концентрации 50 мМ в SFM, затем готовили серийные разведения 25 мМ, 10 мМ и 1 мМ, каждое из которых затем использовали в количестве 10 мкг/мл до получения конечных концентраций 10 мкМ, 100 мкМ, 250 мкМ и 500 мкМ. Концентрации натрия селенита и селенметионина были такими, как указано выше. Эксперимент по оценке токсичности натрия селената при таких высоких концентрациях был проведен параллельно с НКГ (Результаты из фигуры 4).
Результаты.
В культурах, подвергавшихся воздействию только гипоксии, отмечалась ПИ флуоресценция 48%±4.4% СА1 участка (n=48), и она предотвращалась при добавлении 100 мкМ MnTBAP (n=24, P<0.01 по сравнению с одной гипоксией). Существенное ослабление повреждения также наблюдалось при использовании 100 мкМ натрия селената (Р<0,05 по сравнению с одной гипоксией, n=24), но не других анализируемых соединений. (Фигура 3).
В культурах, подвергавшихся воздействию только ишемии при недостаточности кислорода и глюкозы (НКГ), наблюдалась ПИ флуоресценция 47%±4.5% СА1 области (n=48), и она предотвращалась при добавлении 100 мкМ MnTBAP (n=24, Р<0,01 по сравнению с одной НКГ). Существенное ослабление повреждения отмечено при добавлении 100 мкМ натрия селената (Р<0,01 по сравнению с одной НКГ, n=24), и 250 мкМ натрия селената (Р<0,05 по сравнению с одной НКГ, n=24), но не других анализируемых соединений (см. Фигуру 5). Отмечено существенное повышение токсичности при использовании 500 мкМ натрия селената после гипоксии, но впоследствии было показано, что это обусловлено нейротоксичностью соединения при данной концентрации при отсутствии гипоксии (Фигура 4).
Пример 2.
ПТЗ-индуцированная судорожная активность у крыс.
Материалы и методы.
Животные.
Все эксперименты на животных проводились в соответствии с указаниями Национального Института здравоохранения (NIH) по содержанию и использованию лабораторных животных, и были утверждены Этическим комитетом Национального центра лабораторных животных, Куопио, Финляндия. Всего использовали 30 взрослых крыс-самцов линии Sprague-Dawley (Taconic, Дания) весом 200-240 г. Животных сдержали при стандартной температуре (22±1°С) в условиях контролируемого освещения (свет от 7.00 до 20.00) со свободным доступом к пище и воде.
Животных разделяли на группы следующим образом:
- 10 крыс лечили растворителем (стерильная вода в качестве питьевой воды).
- 10 крыс лечили безводным натрия селенатом (120 микрограмм в 100 мл стерильной воды), перорально с питьевой водой в течение 7 суток до введения ПТЗ.
- 10 крыс лечили безводным натрия селенатом (1,2 миллиграмм в 100 мл стерильной воды), перорально с питьевой водой в течение 7 суток до введения ПТЗ.
Судороги, индуцированные ПТЗ.
Пентилентетразол (ПТЗ) (60 мг/кг) вводили интраперитонеально (и/п, 2 мл/кг в физрастворе) крысам-самцам линии Sprague-Dawley.
Доставка лекарства.
Натрия селенат применяли перорально с питьевой водой в течение 7 суток до введения ПТЗ. Крысы имели свободный доступ к воде (нормальное суточное потребление воды составляет 30 мл/крысу/сутки).
Мониторинг судорожной активности.
Изменения поведения наблюдали в течение 30 минут после применения ПТЗ. Частоту судорог (приступы и тяжелые приступы), инкубационный период до появления первых судорог и длительность судорожной активности применяли в качестве показателей противосудорожного эффекта. Если животное погибало, число приступов не подсчитывали. Смертность типично была результатом одного очень тяжелого приступа судорог, который регистрировали как отдельные тяжелые судороги. У животных, которые погибли, максимальная длительность приступа составила 30 минут. В одном случае у животного (№1) был только один очень тяжелый и длительный приступ судорог, в этом случае был зарегистрирован только 1 отдельный приступ тяжелых судорог. Тяжелый приступ определялся как длительные судороги, включающие вытягивающие и скручивающие судороги.
Статистический анализ.
Значения представлены в виде процентов, и различия считали статистически значимыми при уровне Р<0,05. Статистический анализ проводили с применением программного обеспечения StatsDirect. Различия между группами анализировали с помощью однофакторного дисперсионного анализа с последующим тестом Даннета (сравнение с контрольной группой (крысами, леченными растворителем при воздействии ПТЗ)).
Результаты.
Смертность.
Смертность отмечена в группе, леченной растворителем (1 животное) и в группе, леченной 120 мкг натрия селената (1 животное).
Число приступов.
У животных, получавших растворитель, отмечено 22,8±4,9 приступов. Натрия селенат существенно снижал число приступов до 8,5±2,1 в группе 120 мкг и до 9,9±2,2 в группе 1,2 мг (Фигура 6).
Число тяжелых приступов.
У животных, получавших растворитель, отмечено 1,5±0,3 тяжелых приступов. Натрия селенат существенно уменьшал число приступов до 0,8±0,1 в группе 120 мкг. У животных, получавших 1,2 мг натрия селената, отмечено 0,9±0,1 тяжелых приступов (Фигура 7).
Длительность судорожной активности.
Длительность судорожной активности животных, получавших растворитель, составила 1443,4±166,3 секунд. Лечение натрия селенатом существенно снизило длительность судорожной активности как при 120 мкг (770,9±189,9 сек), так и при 1,2 мг (808,6±12б,1 сек) (Фигура 8).
Инкубационный период судорог.
У животных, получавших растворитель, развитие судорог отмечалось спустя 76,4±10,7 секунд. У животных, получавших натрия селенат в количестве 120 мкг и 1,2 мг, судороги развивались спустя 217,6±117,6 секунд и 107,6±26,9 секунд, соответственно. Не отмечалось существенных различий в развитии судорог между группами (Фигура 9).
Выводы.
Эти данные демонстрируют, что натрия селенат снижает число приступов и длительность судорожной активности в ответ на применение ПТЗ как при 120 мкг, так и при 1,2 мг. Натрия селенат в дозе 120 мкг также снижает число тяжелых приступов после применения ПТЗ. Ни одна из доз соединения не оказывала существенного влияния на длительность инкубационного периода при развитии судорог на данной модели.

Реферат
Данное изобретение относится к применению эффективного количества селената или его фармацевтически пригодной соли в способах и композициях для лечения или профилактики неврологических нарушений, не относящихся к таупатии. При этом неврологическое нарушение, не относящееся к таупатии, не является α-синуклеопатией. Эффективное количество селената или его фармацевтически пригодной соли доставляет сверхдиетическое количество селена. В некоторых воплощениях изобретение относится к применению селената или его фармацевтически пригодной соли в комбинации с другими средствами терапии для применения в способах лечения или профилактики неврологических нарушений, не относящихся к таупатии. 2 пр., 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ профилактики и лечения периферической невропатии, композиция, содержащая инсулин подобный фактор роста i

Комментарии