Способ профилактики и лечения периферической невропатии, композиция, содержащая инсулин подобный фактор роста i - RU2120803C1
Код документа: RU2120803C1
Чертежи


Описание
Настоящее изобретение относится к инсулинподобному фактору роста-I для профилактики или лечения периферической невропатии.
Инсулинподобный ростовой фактор роста-I (IGF-I; соматомедин C) входит в семейство структурно и функционально родственных полипептидов, которое включает также инсулин, инсулинподобные факторы роста-II (IGF-II) и III (IGF-III). Все эти факторы могут принимать участие в развитии и поддержании функционирования нейронов (Peciopinto, E., et al., 1988, Neurochem. lnt. 12: 397-414). К тому же имеются доказательства в пользу того, что уровни как IGF-I, так и IGF-II значительно повышаются в процессе регенерации после пересечения седалищного нерва (Hansson, Н.A., et al., 1966, Acta Physiol. Scand. , 126: 609-614). Было показано, что они способствуют выживанию культивируемых сенсорных и симпатических нейронов (Ishil, D.N., 1987, In: Insulin, IGF and Their Peceptors in the Central Nervous System, eds., Raizada, M. K., et al., Plenum Press, NY, pp. 315 - 348), а в случае IGF-I отмечалась также повышенная выживаемость кортикальных нейронов (AizenmanY., et al., 1987, Brai Res., 406:32-42). И, наконец, исследования как in vitro, так и in vivo показали, что IGF-I и IGF-II способствуют выживанию двигательных нейронов и отростков аксонов (Caroni, P. , et al., 1990, J. Cell Biol., 110: 1307-1317).
Периферическая невропатия рассматривается обычно в составе заболеваний, связанных с поражением периферических нервов, что наиболее часто находит выражение в виде двигательной, сенсорной, сенсорно-моторной дисфункции или в виде дисфункции, охватывающей автономную нервную систему, при этом указанные виды дисфункций могут проявляться как по отдельности, так и в сочетании друг с другом. Большое разнообразие морфологических проявлений периферической невропатии определяется, в свою очередь не меньшим разнообразием причин, лежащих в их основе. В частности, периферическая невропатия может быть наследственно приобретенной, может возникнуть как результат системного заболевания, а также может быть вызвана действием токсического вещества. Среди веществ, вызывающих нейротоксичность, встречаются лекарственные препараты, противоопухолевые средства, некоторые добавки или примеси пищевых продуктов или продуктов медицинского назначения, а также промышленные поллютанты и иного рода вещества, загрязняющие окружающую среду.
В частности, известно, что химиотерапевтические препараты способны вызвать сенсорную и/или двигательную невропатии, среди них такие средства, как винкристин-противоопухолевый препарат, применяемый для лечения злокачественных заболеваний крови и сарком. Нейротоксичность представляет собой зависимое от дозы явление и может проявляться в виде сниженной перистальтики кишечника и периферической невропатии, особенно применительно к периферическим мышцам рук и ног, в виде ортостатической гипертензии и атонии мочевого пузыря. Сходные проблемы были отмечены при использовании таксола и цисплатины (Mollman, J.E., 1990, New Eng Jour Med. 322:126-127), хотя вызванная цисплатиной нейротоксичность может быть несколько облегчена с помощью фактора роста нерва (NGF) (Apfel, S.C. et al., 1992, Annals of Neurology 31:76-80). Несмотря на то, что в некоторых случаях нейротоксичность представляет собой обратимый процесс и исчезает после удаления вызвавшего ее агента, как правило, восстановление проходит достаточно медленно (Legha, S., 1986, Medical Toxicology 1:421-427; Olesen, et al., 1991, Drug Safety 6:302-314).
Известно много видов невропатий, имеющих наследственную природу, среди них, в частности: синдром Рефсума, абеталипопротеинемия, болезнь Тангера, диффузный инфантильный склероз Краббе, метахроматическая лейкодистрофия, болезнь Фабри, синдром Дежерин-Сотта и другие. Наиболее распространенной среди всех видов наследственной невропатии является болезнь Шарко-Мари-Тута.
Болезнь Шарко-Мари-Тута (СМТ) (известная также как мышечная атрофия перонеального типа или наследственная невральная амиотрофия (HMSN) представляет собой самое распространенное наследственное неврологическое расстройство. Это заболевание характеризуется слабостью и атрофией, в первую очередь, перонеальных мышц, связанных с демиелинизацией сегментов перонеальных нервов и сопровождающей ее дегенерацией аксонов и клеток переднего роговидного отростка. Обычным для них является механизм аутосимно-доминантного наследования, при этом в качестве общего проявления отмечаются связанные дегенеративные расстройства ЦНС, такие, как наследственная атаксия Фридриха.
Выделяются две первичных формы заболеваний СТМ. Считается, что тип I (70% случаев) имеет в качестве инициирующего патофизиологического механизма демиенилизацию, однако отдаленные клинические наблюдения предполагают также вовлечение в этот процесс первичной дегенерации аксонов, как в случае типа II. Тип II (30% случаев) характеризуется развитием первичной дегенерации аксонов без демиенилизации и может представлять собой не столь тяжелую форму заболевания, как в случае типа I. При рождении часто отмечается нарушение нервной проводимости, однако этот фактор не может рассматриваться как прогностический относительно проявления с возрастом заболевания или усугубления его тяжести. Отмечаются также, как, впрочем, достаточно редкие, рецессивно-наследуемые формы типа III и типа IV.
Изобретение относится к способу снижения периферической невропатии, в основе которой лежит иной механизм, нежели аномальный уровень инсулина у млекопитающих. Этот способ включает введение млекопитающим достаточного для снижения невропатии количества инсулин-подобного фактора роста-I (IGF-I) или инсулинподобного фактора роста-III (ICF-lll).
В различных предпочтительных для применения вариантах роль таких млекопитающих выполняли либо человек, либо домашнее или сельскохозяйственное млекопитающее, у которых развилась невропатия в результате лечения новообразования химиотерапевтическим препаратом, IGF-I или IGF-III вводили способами, которые каждый, имеющий средний уровень знаний в данной области, сочтет эффективным; предпочтение отдавалось внутривенному и подкожному способам введения.
Используемый в настоящем изобретении термин "периферическая невропатия" относится к нарушениям, вызывающим поражение сегментов в периферической нервной системе. Настоящее изобретение включает использование IGF-I или IGF-III - представителей семейства факторов роста инсулинового типа - с целью снижения нейротоксичности, таких ее форм, которые не связаны напрямую или очевидным образом с аномальным уровнем инсулина, в их числе следующие виды, перечисление которых, однако, не является исчерпывающих: периферическая сенсорно- двигательная невропатия или автономные невропатии, включающие сниженную перистальтику желудочно-кишечного тракта или атонию мочевого пузыря. Виды невропатии, которые лучше всего поддаются лечению с помощью IGF-I или IGF-III, включают невропатии, ассоциированные с системными заболеваниями, такие, как последствия полиомиелита; генетически обусловленные невропатии, в том числе, болезнь Шарко-Мари-Тута; и невропатии, вызванные токсическими агентами, т.е. химиотерапевтическими препаратами, в частности, винкристином.
В том случае, если IGF-I или IGF-III используются для лечения невропатии, вызванной токсическим реагентом, каждый из этих факторов может вводиться перед, одновременно или после действия токсического агента и точно так же перед, одновременно или после введения химиотерапевтического препарата, Предпочтительно, чтобы IGF-I и химиотерапевтический препарат вводились с соблюдением эффективного интервала времени между ними в ходе процесса лечения. IGF-I или IGF-III могут вводиться млекопитающим после воздействия нейротоксического агента или после химиотерапии с целью хотя бы частичного восстановления нервных функций, пораженных нейротоксическим агентом или химиотерапевтическим веществом. Химиотерапевтическим веществом может быть любой химиотерапевтический реагент, вызывающий нейротоксичность, в предпочтительном варианте это винкристин, таксол, дидезоксиинозин или цисплатина. В примерах предпочтительных вариантов применения изобретения коэффициенты отношения IGF-I или IGF-III к винкристину (весовые соотношения) находятся в пределах между 1:400 и 75:1, а предпочтительно между 1:40 и 8:1.
Когда IGF-I и химиотерапевтический агент используются одновременно, изобретение предлагает фармацевтическую композицию, которая включает практически чистый IGF-I и химиотерапевтический агент в соотношении 1:400 или 75:1 (в весовых частях). Таким терапевтическим агентом предпочтительно может бить винкристин, цисплатина, дидезоксиинозин или таксол. Термин "практически чистый", используемый в настоящем изобретении, относится к IGF-I или IGF-III, каждый из которых перед смешиванием с другим компонентом композиции составляет не менее 50% (по весу) от присутствующего в препарате белка.
В предпочтительном варианте не менее 75%, более предпочтительно не менее 90% и наиболее предпочтительно не менее 99% (по весу) присутствующего в препарате белка должен составлять IGF-I или IGF-III. Наиболее предпочтительно, чтобы используемые композиции IGF-I или IGF-III настоящего изобретения были чистыми по результатам анализа аминотерминальной аминокислотной последовательности.
Под "токсическим агентом" или нейротоксическим агентом подразумевается вещество, химическое действие которого таково, что оно способно повредить, нарушить или ингибировать компонент нервной системы. Перечень нейротоксических агентов, способных вызвать невропатии, достаточно обширен и включает, не ограничиваясь, однако, ими, неопластические агенты, такие, как винкристин, винбластин, цислатина, таксол или дидезоксисоединения, в частности, дидезоксинозин; спирт; металлы; промышленные токсины, способные вызвать профессиональные заболевания или загрязнение окружающей среды; добавки или примеси к пищевым продуктам или продуктам медицинского назначения; или передозировки витаминов или лекарственных препаратов, в частности, антибиотиков, таких, как пенициллин или хлорамфеникол, а также мегадозы витаминов A, D или B6 . Обширный, хотя далеко не полный список химических соединений, имеющих нейротоксические побочные эффекты, приведен в таблице 5. Несмотря на то, что этот список приводит примеры нейротоксических соединений, он нацелен лишь на иллюстрацию, но никоим образом не на ограничение области применения настоящего изобретения. Другие токсические агенты, которые также способны вызвать невропатии, могут быть охарактеризованы с помощью методов, известных каждому, имеющему средний уровень знаний в этой области. Под "воздействием со стороны токсического агента" подразумевают ситуацию, при которой токсический агент становится доступным или входит в контакт с млекопитающим настоящего изобретения. Воздействие токсического агента может иметь форму непосредственного введения, т.е. при его проглатывании или введении в составе пищевого продукта, продукта медицинского назначения или терапевтического агента, например, химиотерапевтического агента, посредством случайной контаминации или при воздействии условий окружающей среды, в частности, воздушной или водной.
Термины IGF-I и IGF-III включают фрагменты или их аналоги, которые проявляют биологическую активность настоящего изобретения, т.е. способность снижать невропатию, вызванную токсическим агентом. Ниже приведены методы определения, обладают ли IGF-I или IGF-III фрагменты или их аналоги биологической активностью, настоящего изобретения. В общем случае, соответствующие аналоги и фрагменты имеют как минимум 65% гомологии с встречающимися в естественном состоянии IGF-I или IGF-III. Полипептидные фрагменты IGF-I или IGF-III представляют собой подмножество молекул IGF-I или IGF-III (соответственно), содержащими меньшее количество аминокислотных остатков, чем нативные молекулы. Применяемый в настоящем изобретении фрагмент IGF-I или IGF-III имеет обычно не менее 5 смежных аминокислот и может достигать как минимум около 30 - 40 аминокислот в длину, а предпочтительно около 50 - 65 аминокислот в длину. Предпочтительные последовательности состоят на 6 - 25 остатков. Часть аминокислот фрагмента может быть замещена с помощью консервативных замещений или делеций, которые улучшают химическую или биологическую стабильность пептидных продуктов. Предпочтительно, чтобы не более 35% и более предпочтительно не более 20% аминокислотных остатков были замещены или делетированы. Следующие примеры предпочтительных IGF-I последовательностей входят в область настоящего изобретения: 1) IGF-I (55-70) (SEQ ID NO: I), описанный в соответствующей заявке на патент Льюисом с соавт. (Lewis et al. USSN 07/869 913); и 2) длинный R3 IGF-I, который является гибридным белком, состоящим из 13-аминокислотного пептида на N-конце и имеющим замещение Arg на Glu в позиции 3 (Francis. G.L., et. al, 1992, Art to Sci. in Tissue Culture. HyClone Laboratories, Inc. 11:3-7; GROPEP PTY. ITD. PST Appl. WO 89/05822 US Patent No. 5164370; PST/AU90/00210). Перечисленные здесь фрагменты выполняют роль иллюстрирующих примеров и никоим образом не могут истолковываться в плане ограничения области применения пептидных фрагментов IGF-I настоящего изобретения.
"Гомология" в используемом здесь контексте относится к близости последовательностей двух полипептидных молекул. Когда позиция в обеих из двух сравниваемых последовательностей занята одной и той же аминокислотной мономерной субьединицей, например, если позиция в каждой из двух полипептидных молекул занята лизином, то эти молекулы являются гомологичными по данной позиции. Гомология между двумя последовательностями представляет собой функцию числа подборов или гомологичных позиций, разделяемых двумя последовательностями. Например, если 6 из 10 позиций в двух последовательностях подобраны или гомологичны, тогда эти две последовательности имеют 60% гомологию. К примеру, аминокислотные последовательности LTVSFR и IPVSAT имеют 50% гомологии.
Аналоги IGF-I или IGF-III могут
отличаться от естественно встречающихся IGF-I или IGF-III за счет различий в консервативной последовательности аминокислот или за счет модификаций, которые не затрагивают в значительной степени
последовательность или за счет обоих механизмов. Модификации включают получение химических производных полипептидов, например, за счет ацетилирования, карбоксилирования, гликозилирования; посредством
замещения или делеция аминокислотных остатков, которые изменяют аффинные свойства способных к связыванию протеинов, однако не меняют существенно аффинность к рецептору и/или не меняют биологическую
активность полипептида; это также могут быть химические изменения полипептида, которые повышают стабильность полипептида
Несмотря на большое различие в морфологии и причин, относящихся к
периферическим невропатиям in vivo, заявители предположили, что IGF-I может быть эффективным средством профилактики или лечения таких невропатий у млекопитающих, при условии, что эти невропатий не
связаны непосредственно или другим очевидным образом с недостатком или любым другим аномальным уровнем инсулина. Для иллюстрации этого положения заявители показали, что введение IGF-I животным,
которые получают препарат с нейротоксическими побочными эффектами, в частности, противоопухолевый препарат винкристин, снижает вызываемую им нейротоксичнооть. Это открытие не только смягчает побочный
нейротоксический эффект, но способно также существенно повысить использование винкристина в качестве противоопухолевого агента. Использование винкристина, эффективного в различных направлениях
химиотерапии, было до этого ограничено сопровождающей его применение нейротоксичностью. Сходным образом это открытие улучшает возможность использования других соединений, ограничиваемое проблемами
нейротоксичности. Совместное введение IGF-I или IGF-III может уменьшить встречаемость таких сопутствующих периферических невропатий.
Другие свойства и плюсы настоящего изобретения станут очевидными из приведенного ниже описания предпочтительных вариантов и из формулы изобретения.
Фигуры:
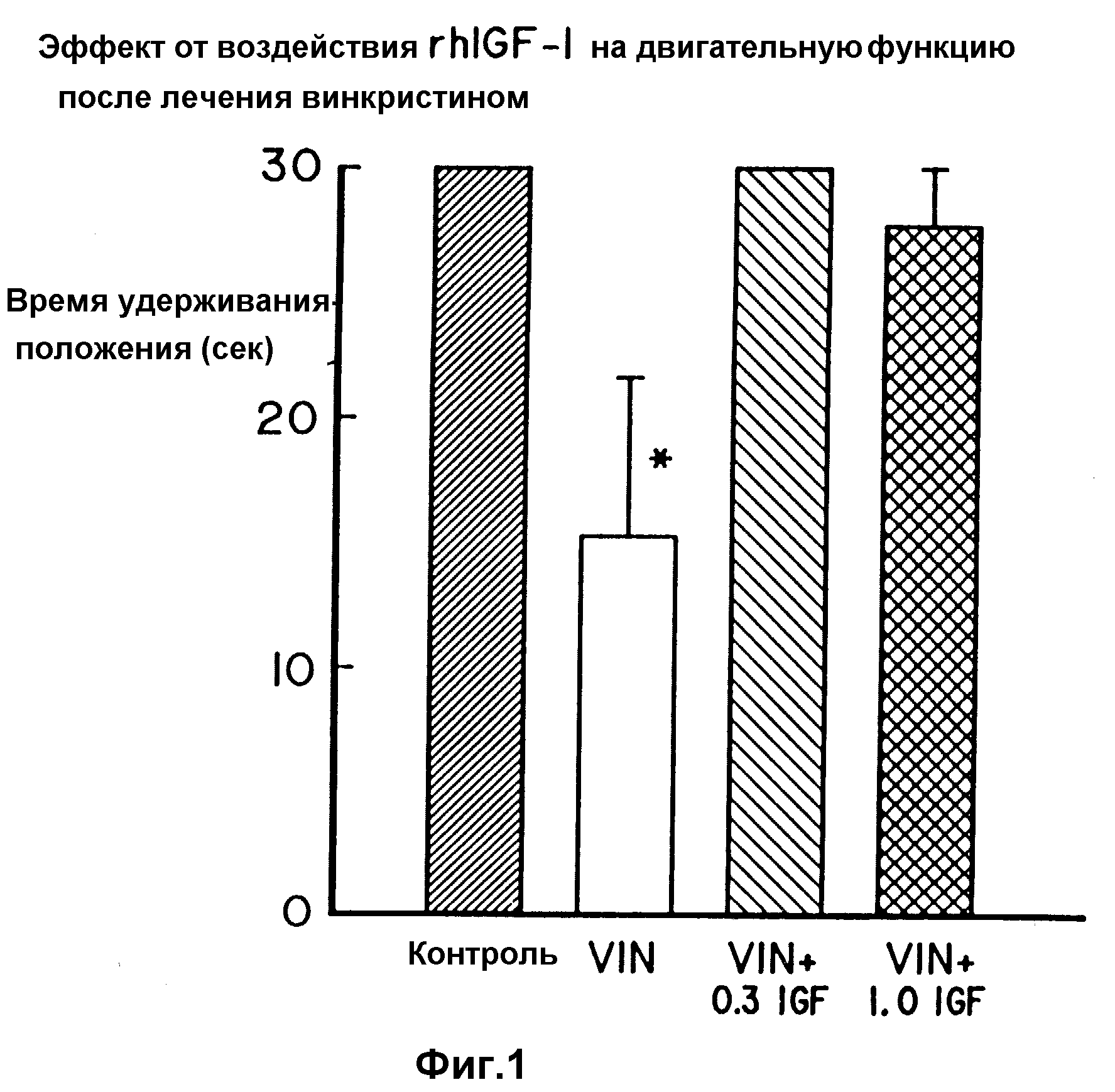
фиг. 1 представляет собой диаграмму, показывающую воздействие
rhIGF-I на двигательную функцию после лечения винкристином.
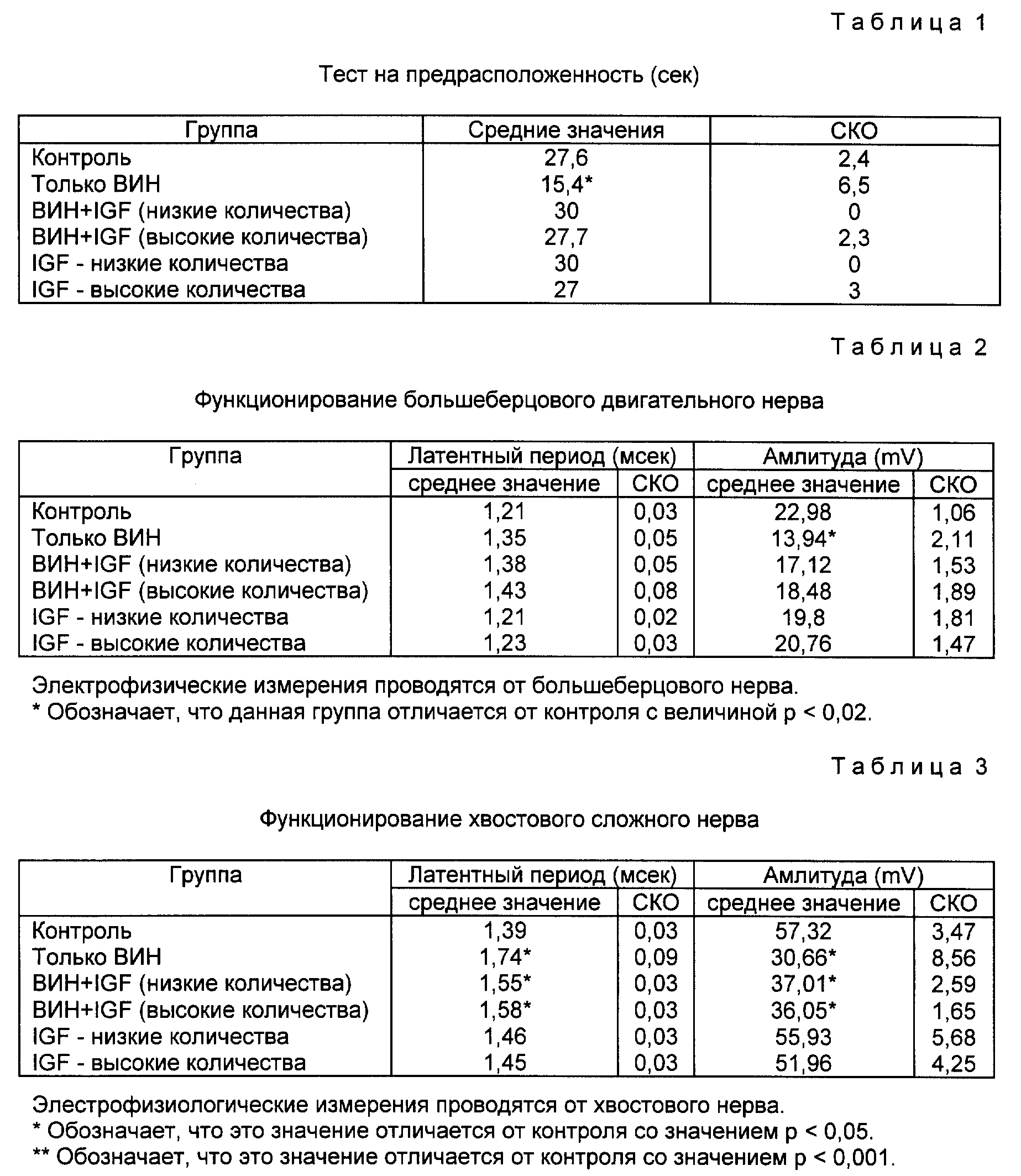
Фиг. 2 представляет собой диаграмму, показывающую воздействие rhIGF-l на большеберцовую нервную функцию после лечения винкристином.
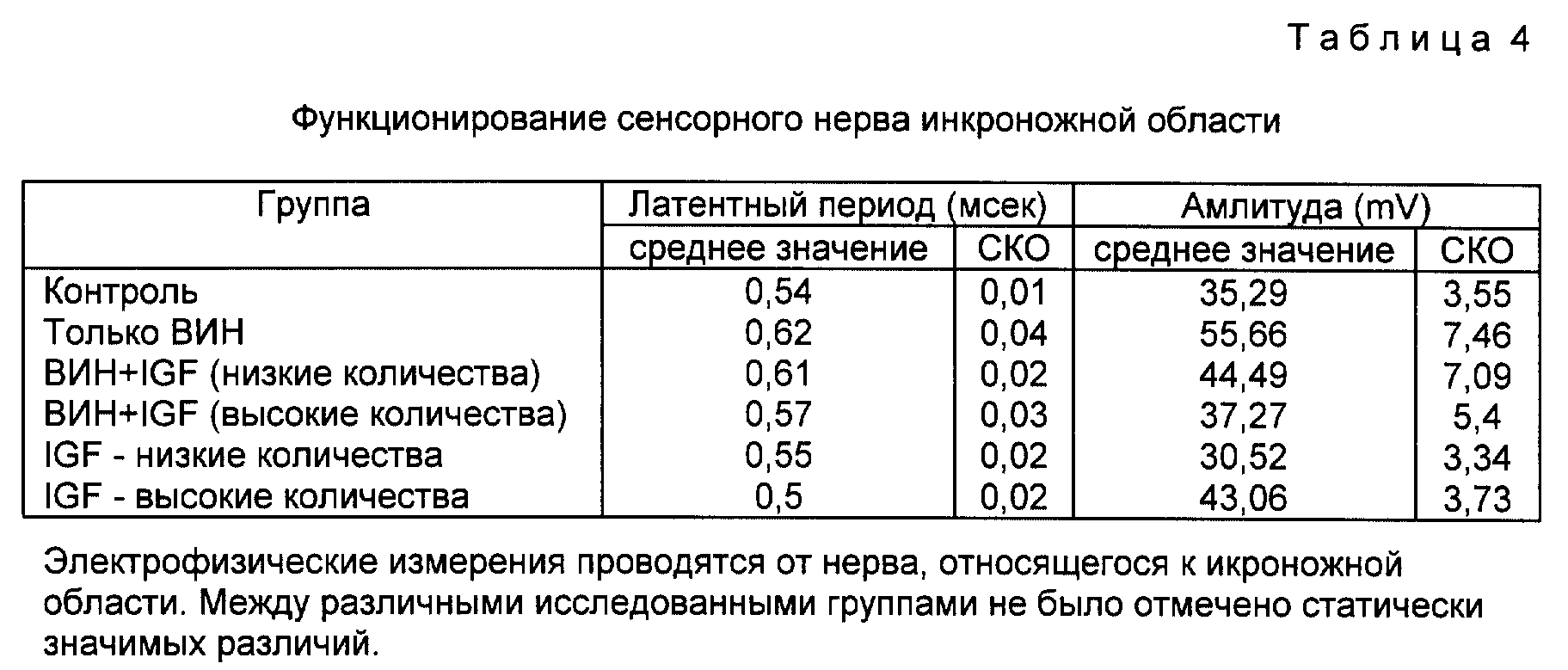
Фиг. 3 представляет собой диаграмму, показывающую воздействие rhIGF-I на хвостовую нервную функцию после лечения винкристином.
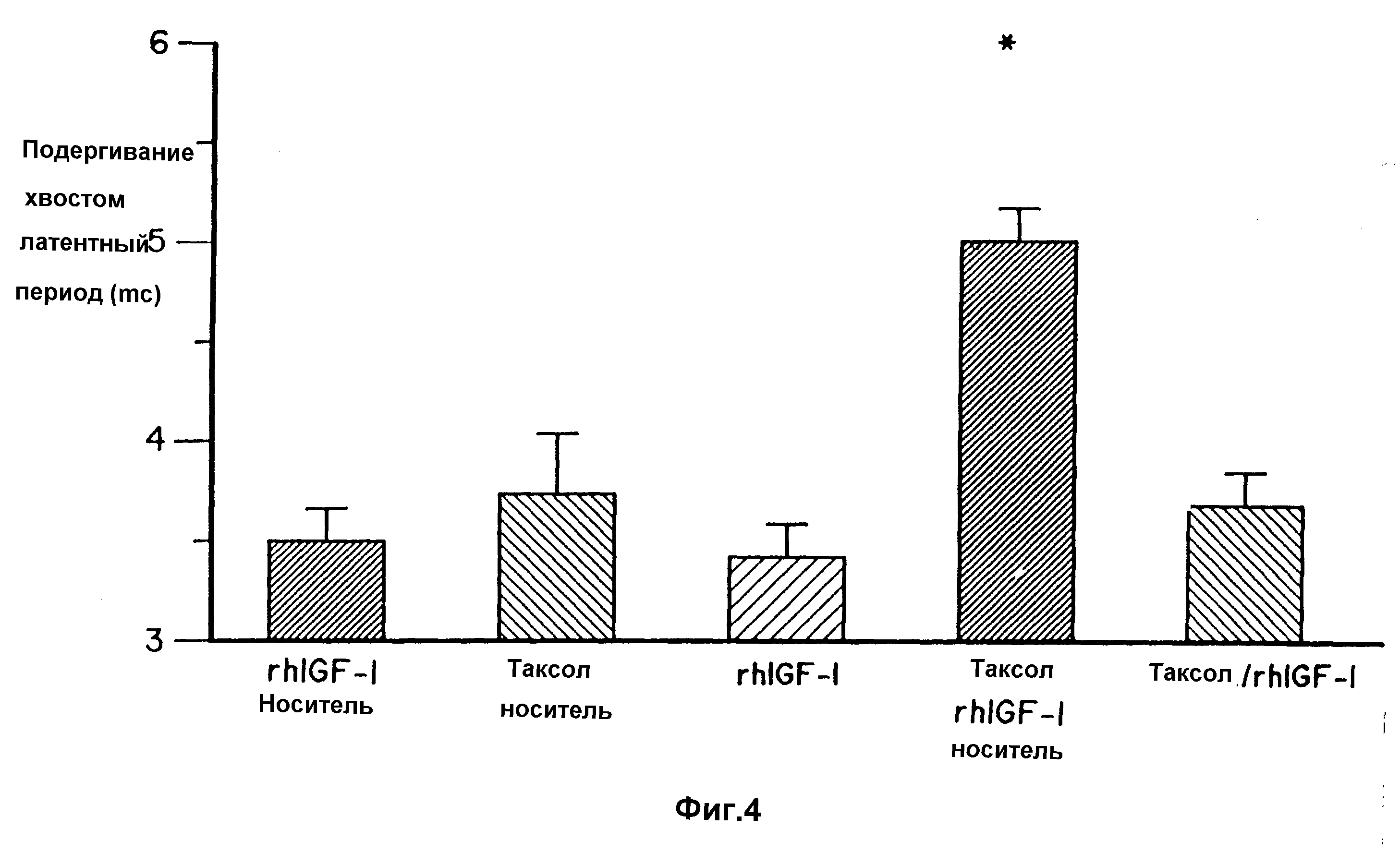
Фиг. 4. представляет собой диаграмму, показывающую воздействие таксола и rhIGF-I на латентность в тесте подергивания хвостом.
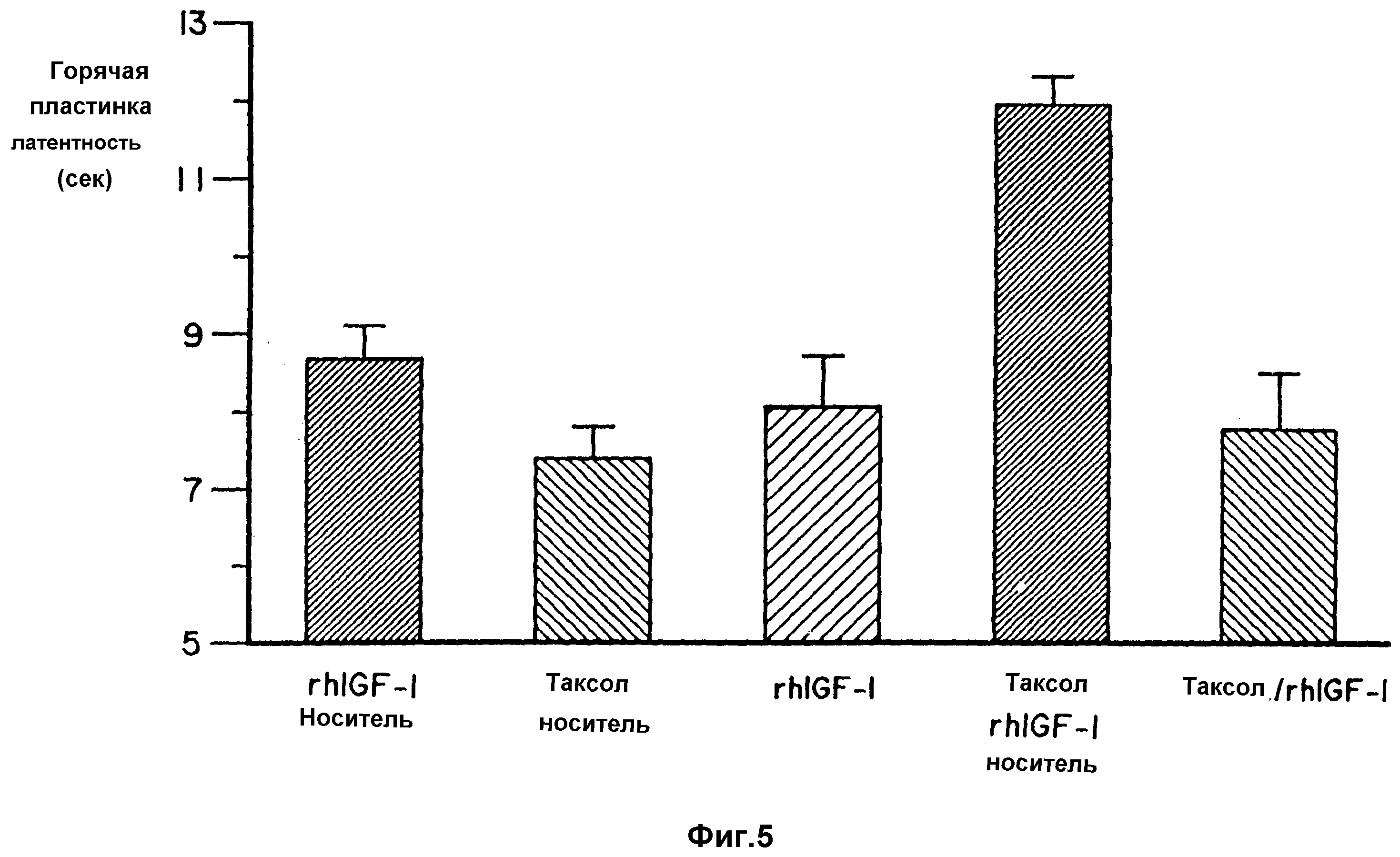
Фиг. 5 представляет собой диаграмму, показывающую воздействие таксола на латентность в тесте с горячей пластинкой.
Заявители полагают, что IGF-I, так же, как и родственные IGF-I белки и пептиды, могут поддерживать функционирование или выживание нейронов при риске потере функции и/или отмирания в связи с воздействием токсических агентов. Для проверки этой идеи в виде специфического теста заявители исследовали, способно ли введение IGF-I предотвратить нейротокcичность, возникающую после введения противоопухолевого агента винкристина животным. Клинически полезные свойства винкристина ограничиваются развитием полиневропатии с выраженной двигательной дисфункцией, равно как и сенсорной, а также развитием аномалий в автономной нервной системе (Iegha, S., выше). К настоящему времени отсутствуют эффективные способы предупреждения этой невропатии, за исключением ограничения вводимой дозы винкристина. Заявители показали, что введение IGF-I способно предотвратить это ослабляющее организм и требующее снижения дозы побочное действие винкристина.
Во втором тесте на проверку указанной выше идеи заявители исследовали, способно ли применение на модели животных IGF-I предупредить развитие нейротоксичности, возникающей после введения противоопухолевого агента таксола.
Экспериментальный пример: Винкристин
Методы
Введение препарата
Викристин сульфат (Sigma Chemical, Sf. Louis. MO) вводили в
дозе 2 мг/кг внутрибрюшинно дважды в неделю в течение шести последовательных недель. Препарат был приготовлен на основе нормального физиологического раствора с концентрацией 0,16 мг/мл раствора.
Рекомбинантный IGF-I (rhIGF-I) для экспериментальных целей был представлен Цефалон Инк. (Cephalon Inc., West Chester PA), кроме того, он также коммерчески доступен от РД Системс, Инк (RD Systems, Inc, Minneapolis, MN), Ю. Би.Ай (U.B.I. Lake Placid. NY) и Каби Фармация АС (Kabi Pharmacia AS, Stockholm, Sweden). rhIGF-I был сформулирован для групп с высокой дозой в концентрации, равной 1 мг/мл, а для групп с низкой дозой в концентрации, равной 0,3 мг/мл, в буферном растворе уксусной кислоты с pH 6,0. Группы с высокой дозой (группы 4 и 6) получали 1,0 мг/кг IGF-I 3 раза в неделю подкожно в течение шести последовательных недель. Группы с низкой дозой обработки (группы 3 и 5) получали 0,3 мг/кг IGF-I 3 раза в неделю подкожно в течение того же самого периода времени. Группам, не получавшим IGF-I, делали подкожные инъекции буфера на основе уксусной кислоты в том же самом объеме и по той же самой схеме, как и животным, получавшим IGF-I.
Животные
CDI
самцы мышей с весом около 15 - 20 г были отобраны для данного исследования. Такие животные были случайным образом распределены на следующие группы для лечения, по 12 животных в каждой группе:
Группа N 1: контроль, инъекции только носителя.
Группа N 2: винкристин + IGF-I и носитель.
Группа N 3: винкристин + низкая доза IGF-I.
Группа N 4: винкристин + высокая доза IGF-I.
Группа N 5: только низкая доза IGF-I.
Группа N 6: только высокая доза IGF-I.
Тестирование поведения
Тест на
предрасположенность: после шести недель лечения мыши тестировались слепым методом. Для этого теста каждую мышь помещали отдельно на доску из стирофома, которую затем поднимали до вертикального
положения. При этом отмечали время, в течение которого животные могли удерживаться на доске без падения. Через 30 секунд тест завершали. Лучший результат времени из трех попыток записывали.
Электрофизиологическое тестирование
После тестирования поведения мышей подвергли электрофизиологическому тестированию. Перед началом исследования каждую мышь анестеризовали с
помощью галотана. В опытах измеряли амплитуды колебания и дистальные латентные периоды в хвостовом нерве. Хвосты фиксировались и на дистальную часть хвостового нерва помещали платино-иридиевые
игольные электроды. Активный записывающий электрод помещали на фиксированном расстоянии в 40 мм дистально от стимулирующего катода. От анод-катодной пары, помещенной на ближайшем участке хвостового
нерва, распространялся короткоимпульсный постоянный ток. Записи двигательной активности проводили ортодромно от большеберцового нерва посредством помещения электрода на дистальный участок икроножной
мышцы. Записи сенсорной активности проводили ортодромно от нерва, относящегося к икроножной области, с расстоянием 10 мм между электродами. Для каждой записи требовалось в среднем от 5 до 10 стимулов,
а процедура повторялась. Латентный период определяли с момента начальной деполяризации и измеряли с точностью до 0,1 мсек. Амплитуду измеряли от базовой линии до пика с точностью до 0,1 μ В.
Ректальную температуру каждой мыши контролировали и поддерживали с точностью до 0,5oC.
Статистика.
Во всех случаях данные обрабатывали с использованием
метода анализа вариаций (ANOVA).)
Результаты
Тестирование поведения
Клинически винкристин вызывает смешанную сенсорно-моторную невропатию с выраженным ранним признаком
двигательной слабости дистальных участков. Исходя из этого, мы извлекли пользу из простого бихевиорального теста для выяснения способа придания двигательной силы животным в каждой группе. В таблице 1
и фиг. 1 суммированы данные по тесту предрасположенности. Животные, получавшие лишь винкристин, способны были удерживать свое положение только в течение половины максимального времени. Все другие
тестируемые группы способны были удерживать свое положение в течение примерно полных 30 разрешенных секунд. Группа, обрабатываемая только винкристином, отличалась от других групп с p < 0,0001
по методу ANOVA.
Результаты электрофизиологических исследований. Проведение двигательного импульса измеряли от большеберцового нерва, а полученные результаты суммированы в таблице 2 и фиг. 2 Группы, которые обрабатывали только винкристином, имела удлиненный латентный период и значительно сниженную амплитуду потенциального действия в сравнении с контрольной группой (p < 0,02 по методу ANOVA). Группы, получавшие одновременно также IGF-I, не показали значительных отличий.
Исследования соединения проводили из хвостового нерва, а результаты суммировали в таблице 3 и фиг. 3. Здесь также видно, что группы, получавшие только винкристин имеют значительно увеличенные латентные периоды и сниженные амплитуды (p < 0,001 и p < 0,05 соответственно). В каждом случае введение IGF-I, пусть не полно, но частично улучшает эти показатели.
Исследования сенсорной проводимости осуществляли от нерва, исходящего из икроножной области, а результаты суммированы в таблице 4. Как было определено в данном тестировании, в отношении чисто сенсорной функции отсутствуют статистически значимые различия между разными тестируемыми группами.
Представленные данные показывают, что совместное введение IGF-I и винкристина может предупредить проявления винкристиновой невропатии, отмечаемой на модели
животных. Заявители показали наличие невропатии при использовании как бихевиоральных, так и электрофизиологических методов измерения. Модель винкристиновой невропатии на животных представляется хорошо
коррелирующей с клиническими условиями, в которых находится человек, а именно в том, что двигательная дисфункция представляет собой наиболее заметное проявление. Поскольку введение винкристина
нарушает функцию периферического нерва, введение IGF-I приводит к значительному улучшению ситуации.)
Экспериментальный пример: Таксол
Для того, чтобы оценить способен ли г IGf-I
предупреждать развитие сенсорной невропатии, вызванной введением тексола, самцы мышей CDI принимали ежедневно дозу таксола (21,6 мг/кг), вводимую ежедневно внутрибрюшинно в течение шести дней с
помощью носителя - таксола (12% хромофора EL (Sigma, St. Louis, MO), 76% фосфатно-солевого буфера, 12% этанола). rhIGF-I и носитель (100 мМ уксусной кислоты, 50 мМ NaCl, 1% сывороточный альбумин
человека) или непосредственно rhIGF-I (1 мг/кг) вводили подкожно в течение десяти дней, начиная за один день до инъекций таксола. На последний день введения rhIGF-I и носителя или непосредственно
rhIGF-I способность мышей ощущать и отвечать на вредные стимулы оценивалась по определению латентных периодов в тестах на горячую пластинку (55oC) и подергивание хвостом (D'Amour et al. J.
Pharmacol. Exp. Ther. 72: 74 - 79, 1941, Eddy et al. J. Pharmacol. Exp. Ther. 107: 385 - 393, 1953, Vought et al. Life Sci. 48: 2233 - 2241, 1991). Для каждой мыши латентные периоды на горячую
пластинку и подергивание хвостом определяли дважды. Интервал времени, в течение которого животное облизывало задние лапы или трясло 3 раза задней лапой в тесте с горячей пластинкой, составляло 20 сек.,
а время, в течение которого животное отдергивало хвост от нагревательной спирали в тесте с подергиванием хвостом составляло 10 сек. В т-тесте Дюнетта были обнаружены значительные различия между
группами, принимавшими носитель или таксол (Dunnet's t-test, Fallarida et al., Manual of Pharmacologic Calculation with Computer Programs, 2nd ed. Springer Verlag NY, pp. 145 - 148, 1987), а также
различия между всеми группами по тесту Ньюмана-Койла (Newman-Keul's test, Fallarida et al., Supra pp. 121 - 125).
Только мыши, получавшие таксол/rhIGF-I и носитель, имели латентные периоды в тестах подергивания хвостом и с горячей пластиной значительно выше, чем таковые у мышей, получавших только носитель. Таксол значительно увеличивал латентные периоды в тестах подергивания хвостом и с горячей пластиной соответственно на 43% и 37%. К тому же, латентные периоды в тестах подергивания хвостом и с горячей пластиной у мышей, обработанных таксолом, были также значительно выше, чем таковые у мышей, обработанных с помощью rhIGF-I или с помощью таксола/rhIGF-I. Таким образом, как показывают данные по латентным периодам в тестах с подергиванием хвостом и с горячей пластиной, rhIGF-I предотвращал развитие сенсорной невропатии.
Эффект введения rhIGF-I на профилактику невропатии, индуцированной таксолом показан в таблице 6, на фиг. 4 (латентные периоды в тесте с подергиванием хвостом) и на фиг. 5 (латентные периоды в тесте с горячей пластиной). Результаты представлены как средние значения + СКО. Символ * означает, что данное значение существенно отличается как от теста только с носителем - rhGFI-l, так и от значений для групп, обработанных таксолом/rhlGF-I с показателем p < 0,05.
Терапия.
Любой из описанных здесь IGF-I агентов, снижающих невропатию, может быть введен пациенту в фармацевтически приемлемом буфере (т.е. в физиологическом растворе или уксуснокислом буфере). IGF-I или IGF- III удобны для введения подкожно, перорально, назально или местно, а также в виде жидкости или спрея, практически же данное лекарственное средство вводится с учетом условий лечения. Например, может возникнуть необходимость введения препарата внутривенно, а также во время оперативного вмешательства в соответствующую ткань или через катетер.
Соответствующей дозировкой принято определять то количество инсулинподобного фактора роста-I, его фрагмента или аналога, которое оказывает воздействие на снижение уровня невропатии. IGF-I может быть, например, введен в дозах 0,03 - 10 мг/кг/единицу дозы в виде шарика или посредством инфузии, либо ежедневно, либо в интермиттирующем режиме или в соответствии с потребностью. Эта дозировка соответствует отношению IGF-I к винкристину (вес: вес) от 1:400 до 75:1, предпочтительно от 1:40 до 8:1. Дозировки других инсулинподобных ростовых факторов, их фрагментов или аналогов или их весовые коэффициенты по отношению к применяемому агенту могут быть определены каждым, имеющим средний уровень профессиональных знаний в этой области, в соответствии с описанными здесь методами.
Эффективность лечения невропатий с помощью IGF-I может быть оценена по следующим признаках выздоровления: 1) Восстановление нормальной сенсорной функции, которая может быть оценена по термочувствительности конечностей; 2) Восстановление нормальной двигательной функции, которая может быть оценена по измерению мышечной недостаточности, по двигательному контролю, а также на основе глубокого сухожильного рефлекса; 3) Нормализация скорости нервного проведения, которая может быть оценена электрофизиологически. Методы оценки периферической невропатии описаны Асбери с соавторами (Asbury et al., 1992, in Diseases of the Nervous System, Clinical Neurobiology, cds., Asbury et al. , W.B. Sannders Inc. Philadelphia PA, 1:252-269) и могут быть использованы каждым, имеющим средний уровень знаний в данной области, для определения эффективности инсулинподобного ростового фактора роста-I для применения с целью смягчения проявлений невропатии.
Другие варианты
Другие варианты приведены в
нижеследующей формуле изобретения. Например, агенты, способные снижать токсическую невропатию, могут включать любого представителя семейства инсулинподобных факторов роста-I и родственных
нейротрофинов, молекулы, стимулирующие фактор нервного роста, цилиарный нервнотрофический фактор, IGF-I производные пептидных фрагментов, аналоги инсулинподобного ростового фактора-I или комбинации
этих агентов.
Винкристиновая нейротоксичность проявляется в типичном случае как периферическая невропатия, однако метод настоящего изобретения можно использовать для снижения других токсических невропатий, т.е. невропатии автономной нервной системы или мозговой нервной цепочки, а также может применяться для смягчения эффектов других токсических агентов.
Настоящее изобретение относится, кроме того, к невропатиям, связанным с системными заболеваниями, такими, как уремия, холестатическая детская болезнь печени, хроническая легочная недостаточность, алкогольная полиневропатия, множественное поражение органов, сепсис, гипоальбуминемия, синдром эозинофилин-миалгии, гепатит, порфирия, гипоглютемия, витаминная недостаточность, хроническое заболевание печени, нервичный билиарный цирроз, гиперлипидемия, болезнь Лайма, лепра, опоясывающий герпес, синдром Гийена-Барре, хроническая воспалительная демиелинизирующая полирадикулоневропатия, сенсорный периневрит, синдром приобретенного иммунодефицита (СПИД) - связанная с ним невропатия, синдром Шегрена, первичный васкулит (такой, как полиартериит нодозный), аллергический гранулематознный ангиит (Шурга-Страусса), ангиит гиперчувствительности, гранулематоз Вегенера, ревматоидный артрит, системная красная волчанка, смешанное заболевание соединительных тканей, склеродермия, саркоидоз, васкулит, системные васкулитиды, острые воспалительные демиелинизирующие полиневропатии, послеполиомиелитный синдром, запястный синдром, пандисаутономия, первичный системный амилоидоз, гипотиреоз, хроническая обструктивная болезнь легких, акромегалия, малабсорбция (спру, глютеновая болезнь), карциномы (сенсорные, сенсорно-двигательные, поздние и демиелинизирующие), лимфома (включая болезнь Ходжкина), истинная полицитемия, множественная миелома (литический тип, остеосклеротический или единичная плазмоцитома), доброкачественная моноклональная гаммапатия, макроглобулинемия, и криоглобулинемия, как это описано у Асбери с соавторами, выше, и включенные здесь в качестве ссылки.
Изобретение относится также к генетически приобретенным невропатиям, таким, как мышечная атрофия перонеального типа (болезнь Шарко-Мари-Тута, типы I, II, X), наследственные амилоидные невропатии, наследственная сенсорная невропатия (тип I и тип II), порфирическая невропатия, наследственная предрасположенность к параличу от сдавления нерва, болезнь Фабри, адреномиелоневропатия, синдром Райли-Дея, синдром Дежерина-Сотта (наследственная сенсорно- моторная невропатия-III), синдром Рефсума, атаксия-телеангиэктазия (синдром Луи-Бар), наследственная тирозинемия, анафалиопротеинемия, абеталипопротеинемия, невропатия гигантского аксона, метахроматическая лейкодистрофия, глобоидно-клеточная лейкодистрофия Краббе и наследственная атаксия Фридриха (Asbury et. al. Supra). Настоящее изобретение также относится к множественной мононевропатии, плексопатии и чисто двигательной невропатии, описанных у Асбери с соавторами, выше.
Данные для таблицы 1 получены при проведении теста на предрасположенность. Приведенные значения отражают время, в течение которого животные могут удерживаться в вертикальном положении на доске, при максимально допустимом в тесте значении в 30 сек.
* Означает, что данное значение отличается от значений других групп на величину p < 0,0001.
Реферат
Изобретение относится к медицине, а именно к неврологии. Больным, у которых невропатия вызвана иными причинами, нежели аномальный уровень инсулина, вводят инсулинподобный фактор роста-I в количестве, снижающем проявление невропатии. Композиция для снижения периферической невропатии, вызванной нейротоксическим агентом, содержащая практически чистый инсулинподобный фактор роста-I и нейротоксический химиотерапевтический агент в массовом соотношении от 1 : 400 до 75 : 1. Способ позволяет повысить эффективность лечения. 2 с. и 18 з.п.ф-лы, 6 табл., 5 ил.

Комментарии