Метаболиты (1r-транс)-n-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]-метил]пропанамида - RU2632889C2
Код документа: RU2632889C2
Описание
Перекрестные заявки
В настоящем изобретении испрашивается приоритет в связи с предварительной, одновременно рассматриваемой заявкой на выдачу US патента, поданной 18 мая 2012 г., которая включена в настоящее описание в качестве ссылки.
Область техники
Настоящее изобретение относится к метаболитам (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида и их применению.
Предпосылки создания настоящего изобретения
(1R-транс)-N-[[2-(2,3-Дигидро-4-бензофуранил)циклопропил]-метил]пропанамид является специфичным и эффективным агонистом рецепторов мелатонина MT1R и MT2R в супрахиазматическом ядре (SCN) и описан в патенте US №5856529, который в полном объеме включен в настоящее описание в качестве ссылки. Полагают, что занятость рецепторов MT1R и MT2R мелатонином регулирует суточные ритмы, включая цикл сон/бодрствование. (1R-транс)-N-[[2-(2,3-Дигидро-4-бензофуранил)циклопропил]метил]пропанамид характеризуется достаточно высокой переносимостью и проявляет высокую хронобиотическую активность в доклинических моделях острого фазосдвигающего и хронического восстановления суточного ритма.
Краткое описание сущности настоящего изобретения
В настоящем изобретении предлагаются метаболиты (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида, способы их применения и композиции, включающие метаболиты. Метаболиты включают аналог, включающий фенолкарбоновую кислоту (M9), и аналог, включающий гидроксипропил (M11). Каждый из указанных метаболитов образуется в организме человека после перорального введения (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида.
Объекты настоящего изобретения включают выделенные соединения формул II и III, включая их соли, сольваты и гидраты в аморфной или кристаллической форме. Термин «выделенные» означает, что соединения выделены из плазмы крови человека или получены синтетическим способом.

В то время как структуры представлены в R-транс-конфигурации, тем не менее в настоящее изобретение включены их стереоизомеры, то есть R-цис-, S-транс- и S-цис-конфигурации. Кроме того, настоящее изобретение включает пролекарства соединений формул II и III, включая, например, сложные эфиры таких соединений, а также их введение индивидууму в количестве, эффективном для лечения или профилактики нарушения сна у индивидуума.
Другой объект настоящего изобретения включает фармацевтическую композицию, включающую по крайней мере одно соединение, указанное выше, и фармацевтически приемлемый носитель.
Еще один объект настоящего изобретения включает способ лечения или профилактики нарушения сна у индивидуума, и указанный способ включает прямое введение индивидууму эффективного количества по крайней мере одного соединения, указанного выше. Термин «прямое» обозначает, что соединение не доставляют косвенно, например, при введении (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида.
Другой объект настоящего изобретения относится к способу лечения или профилактики нарушения суточного ритма или нарушения с суточной компонентой у индивидуума, и указанный способ включает прямое введение индивидууму эффективного количества по крайней мере одного соединения, указанного выше.
Иллюстративные объекты настоящего изобретения были созданы для решения описанных в данном контексте проблем и других проблем, которые не обсуждаются в данном контексте и которые представляются очевидными для специалиста в данной области техники.
Эти и другие признаки настоящего изобретения будут понятны в большей степени после прочтения следующего подробного описания различных вариантов осуществления настоящего изобретения.
Подробное описание настоящего изобретения
Как было указано выше, настоящее изобретение относится к выделенным из организма человека метаболитам (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида и к их применению. Формула I, показанная ниже, представляет структуру (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида, который иногда называют тазимелтеоном.

Полагают, не предполагая ограничиваться таким объяснением, что в организме человека тазимелтеон в ходе метаболизма напрямую превращается в M9 и M11. Предполагается также, что M11 затем превращается в ходе метаболизма в M9.
В результате окислительного дезалкилирования происходит раскрытие фуранового кольца в (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамиде с образованием метаболита M11, структура которого показана ниже в виде формулы II.

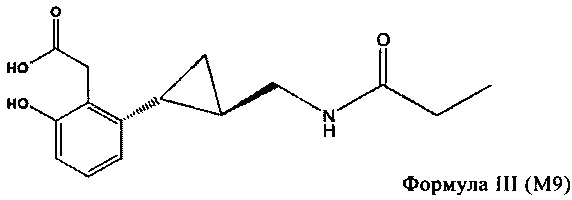
Дальнейшее окисление приводит к образованию метаболита M9, производному (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]-метил]пропанамида, включающему фенолкарбоновую кислоту, структура которого показана ниже в виде формулы III. Метаболит M9 может образоваться из метаболита M11.

Настоящее изобретение включает выделенные соединения формул II и III, их соли, сложные эфиры, сольваты, гидраты, энантиомеры, стереоизомеры, их аморфные и кристаллические формы, фармацевтические композиции, содержащие такие соединения, и способы применения таких соединений и фармацевтических композиций. Сами по себе ссылки на соединения формул II и III включают соль, сложный эфир, сольват, гидрат, энантиомер, стереоизомер, аморфные и кристаллические формы указанных соединений.
(1R-транс)-N-[[2-(2,3-Дигидро-4-бензофуранил)циклопропил]-метил]пропанамид, включающий метку14C, вводят здоровым субъектам мужского пола в дозе 100 мКи/100 мг. Затем у субъектов отбирают образцы плазмы крови, мочи и кала через предварительно определенные интервалы времени после введения (плазму через 0,5 ч, 1 ч, 2 ч, 8 ч и 24 ч, мочу через 0-6 ч, 6-12 ч, 12-24 ч и 24-72 ч и кал через 0-24 ч, 24-48 ч и 48-120 ч). Образцы плазмы и кала подвергали экстракции метанолом для удаления белков. Перед хроматографией с радиометрическим детектированием (методом ЖХВР) все образцы центрифугировали для удаления твердых веществ. Радиоактивность в каждой фракции определяли с использованием сцинтилляционного и люминисцентного счетчика микропланшет Packard TopCount® NXT™. Выбранные экстракты мочи, плазмы и кала анализировали методом ЖХ/МС, соединенным с монитором радиоактивности.
В таблице 1 ниже представлено процентное содержание (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]метил]пропанамида, и метаболитов M9 и M11 в плазме, моче и кале субъектов.

Как можно видеть, метаболит M9 является основным циркулирующим метаболитом и составляет приблизительно 20% от общей радиоактивности в плазме. В образцах плазмы были также детектированы неизмененный тазимелтеон (приблизительно 8%) и метаболит M11 (приблизительно 3,5%). (Остальная радиоактивность в плазме связана с другими метаболитами, которые не показаны.)
Ни неизмененный тазимелтеон, ни метаболит M11 не были обнаружены в образцах мочи через 0-72 ч. Основным метаболитом в моче является метаболит M9, который составляет приблизительно 30% от радиоактивности во введенной дозе. В образцах кала были обнаружены только неизмененный тазимелтеон и метаболит M9, которые представляют собой минорные метаболиты в кале. Все метаболиты в кале составляют менее 1% от радиоактивности во введенной дозе.
Метаболиты M9 и M11 можно также синтезировать. Более подробно, метаболит M11 можно синтезировать из тазимелтеона, а метаболит M9 можно синтезировать из метаболита M11. Реакции синтеза метаболитов M11 и M9 показаны ниже на схемах 1 и 2, соответственно.
Схема 1

Схема 2

Обычно композиции по настоящему изобретению вводят перорально, хотя можно использовать другие способы введения, например, парентерально, внутривенно, внутримышечно, трансбуккальным способом в виде пастилок для рассасывания, чрескожным способом, чресслизистым способом и т.п. Можно также использовать формы с замедленным высвобождением, например, с пролонгированным, пульсирующим или замедленным действием, включая депо-образующие формы.
Примеры таких форм, содержащий тазимелтеон, описаны в заявках WO 2003037337 и WO 20044006886, которые включены в настоящее описание в качестве ссылок. Пероральные стандартные лекарственные формы по изобретению включают обычно от приблизительно 5 мг до приблизительно 100 мг соединений формул II и III.
Термин «эффективное количество», использованный в данном контексте, включает количество, достаточное для проявления профилактического или терапевтического действия, при введении в отдельности или в комбинации с вспомогательным веществом. Такое эффективное количество зависит, например, от тяжести нарушения или симптома, которые требуется лечить, от индивидуума, которому вводят композицию, от самой композиции и от способа введения. В основном доза соединений формул II и III находится в интервале от приблизительно 1 мг/сут до приблизительно 500 мг/сут, например, от приблизительно 10 мг/сут до приблизительно 100 мг/сут. Такие дозировки могут содержаться в одной или более стандартных лекарственных форм.
Следует понимать, что протокол дозировок, включая количество (количества) действительно вводимых соединений формул II и/или III определяет лечащий врач в зависимости от соответствующих обстоятельств, включая, например, состояние, которое требуется лечить, выбранный способ (способы) введения, возраст, пол, массу тела и ответную реакцию индивидуума, которому введено (введены) соединение (соединения), и тяжесть симптома (симптомов) у индивидуума (индивидуумов).
Соединения формул II и/или III обычно вводят в виде фармацевтической композиции, включающей в качестве основного активного ингредиента (или один активный ингредиент) по крайней мере одно такое соединение в смеси с твердым или жидким фармацевтически приемлемым носителем и не обязательно с фармацевтически приемлемыми вспомогательными веществами и эксципиентами, с использованием стандартных и общепринятых методов.
Фармацевтические композиции, применяемые на практике осуществления настоящего изобретения, включают приемлемые лекарственные формы для перорального, парентерального (включая подкожное, внутримышечное, внутрикожное и внутривенное), чрескожного, внутрибронхиального или назального введения. Таким образом, если используется твердый носитель, препарат можно перерабатывать в таблетку, помещать в твердую желатиновую капсулу в виде порошка или пеллет или в форму пастилок или леденцов. Твердый носитель может содержать стандартные эксципиенты, такие как связующие агенты, наполнители, смазывающие вещества для таблетирования, дезинтегрирующие агенты, увлажнители и т.п. На таблетку, при необходимости, можно наносить пленочное покрытие с использованием стандартных методов. Если используется жидкий носитель, препарат может быть представлен в виде сиропа, эмульсии, мягкой желатиновой капсулы, стерильного носителя для инъекций, водной или неводной жидкой суспензии, или в виде высушенного продукта для растворения в воде или другом пригодном носителе непосредственно перед введением. Жидкие препараты могут содержать стандартные добавки, такие как суспензирующие агенты, эмульгаторы, увлажнители, неводный носитель (включая пищевые масла), консерванты, а также ароматизаторы и/или красители. Предназначенный для парентерального введения носитель обычно включает стерильную воду, составляющую по крайней большую часть, хотя можно использовать солевые растворы, растворы глюкозы и т.п. Можно также использовать суспензии для инъекции, и в этом случае можно использовать суспензирующие агенты. В парентеральные лекарственные формы можно также добавлять стандартные консерванты, буферные вещества и т.п. Прежде всего пригодным введением соединения формулы I являются пероральные лекарственные составы. Фармацевтические композиции можно получать по стандартным методикам в соответствии с требуемым препаратом, содержащим соответствующее количество соединений формул II и/или III. См., например, справочник Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 17-е изд. (1985).
При получении фармацевтических композиций для применения по настоящему изобретению активный ингредиент (ингредиенты) обычно смешивают с носителем, или разбавляют носителем, или включают в носитель, который может представлять собой капсулу, пакетик, бумагу или другой контейнер. Если носитель служит разбавителем, он может быть в форме твердого, полутвердого или жидкого материала, который действует в качестве носителя, эксципиента или среды для активного ингредиента. Таким образом, композиция может быть представлена в форме таблеток, пилюль, пастилок, пакетиков, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как в твердой, так и в жидкой среде), мазей, содержащих, например, вплоть до 10 мас. % активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков.
Некоторые примеры пригодных носителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты, тальк, стеарат магния и минеральное масло. Составы могут дополнительно включать смазывающие агенты, увлажнители, эмульгаторы и суспендирующие агенты, консерванты, подсластители и ароматизаторы. Композиции по настоящему изобретению можно перерабатывать в формы, обеспечивающие быстрое, замедленное или пролонгированное высвобождение активного ингредиента после введения пациенту.
Композиции по настоящему изобретению можно использовать для лечения или профилактики нарушений суточного ритма и/или нарушений с суточной компонентой, нарушений сна и любого другого нарушения, для лечения которого показан агонист мелатонина. Такие нарушения суточного ритма и/или нарушения с лежащей в основе суточной компонентой включают синдром смены часовых поясов (при перелете на самолете), нарушение сна в связи с посменной работой, генерализованное тревожное расстройство, клиническую депрессию, сезонное аффективное расстройство, синдром дефицита концентрации внимания с гиперактивностью, болезнь Альцгеймера, синдром Энгельмана, биполярное нарушение, шизофрению, аутизм, эпилепсию, мигрень, ночную гипертензию, ожирение и/или диабет типа 2, онкологию и недостаточность тестостерона. Можно также лечить или предотвратить нарушения сна, включая бессонницу, низкую общую продолжительность сна (быстрые движения глаз (REM) плюс стадии сна с медленными движением глазных яблок (NREM) 1, 2, 3 или 4), низкую эффективность сна ((эффективность сна = общее время сна / общее время пребывания в постели)* 100), общее время пробуждений после начала сна (WASO, измеренное в минутах бодрствования после наступления устойчивого сна или часть времени бодрствования после глубокого сна до «включения света») и увеличенная латентность до наступления устойчивого сна (LPS, время от «выключения света» до наступления сна).
Изложенное выше описание различных объектов настоящего изобретения представлено для иллюстрации и описания изобретения. Это описание не является исчерпывающим или не ограничивает изобретение точной формой, и очевидно, что существует множество его различных модификаций и вариантов. Для специалиста в данной области техники представляется очевидным, что такие модификации и варианты включены в объем настоящего изобретения, как определено в прилагаемой формуле настоящего изобретения
Реферат
Изобретение относится к метаболитам (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]-метил]пропанамида, представленным соединениями формулы II или формулы III. Также изобретение относится к фармацевтической композиции, обладающей агонистической активностью в отношении рецепторов мелатонина, включающей по крайней мере одно, соединение выбранное из группы, состоящей из соединения формулы II, соединения формулы III, и фармацевтически приемлемый носитель. Соединения по изобретению предназначены для лечения нарушения суточного ритма или нарушения с суточной компонентой, а также нарушений, при которых показан агонист мелатонина. Технический результат - метаболиты (1R-транс)-N-[[2-(2,3-дигидро-4-бензофуранил)циклопропил]-метил]пропанамида, предназначенные для лечения нарушений, при которых показан агонист мелатонина. 3 н. и 2 з.п. ф-лы, 1 табл.,
Формула




Документы, цитированные в отчёте о поиске
Производные n-ацил-2-арилциклоалкиламина, стимулирующие синтез мелатонина, фармацевтическая композиция, способ мелатонинстимулирующего связывания

Комментарии