Производные пиразола, медицинские композиции, содержащие их, их применение в медицине и промежуточные соединения для их получения - RU2369613C2
Код документа: RU2369613C2
Описание
Область техники
Настоящее изобретение относится к производным пиразола, их фармацевтически приемлемым солям или пролекарствам, которые могут использоваться в качестве лекарственного препарата, фармацевтических композиций, их содержащих, к их фармацевтическому применению и промежуточным соединениями для их получения.
Более конкретно настоящее изобретение относится к пиразольным производным, обладающим ингибиторной активностью в отношении SGLT1 человека, их фармацевтически приемлемым солям или пролекарствам, которые могут использоваться в качестве средств для профилактики или лечения заболевания, связанного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, нарушенная гликемия натощак, осложнения при диабете или ожирение, и заболевания, связанного с повышенным уровнем галактозы в крови, такого как галактоземия, к фармацевтическим композициям, их содержащим, их фармацевтическому применению и промежуточным соединениям для их получения.
Предпосылки изобретения
Диабет является одним из заболеваний, связанных с образом жизни, предпосылками которого являются привычки в питании и недостаток физических упражнений. Следовательно, больным диабетом показана диета и лечебная физкультура. Кроме того, если достаточный контроль и непрерывное соблюдение назначений является затруднительным, больным одновременно показано медикаментозное лечение. Дополнительно в широкомасштабных клинических испытаниях было подтверждено, что при лечении у больных диабетом необходимо осуществлять длительный строгий контроль уровня сахара в крови для того, чтобы предотвратить возникновение и развитие диабетических осложнений (смотри нижеследующие ссылки 1 и 2). Кроме того, большое количество эпидемиологических исследований нарушенной толерантности к глюкозе и макроангиопатии показали, что нарушенная толерантность к глюкозе, являющаяся пограничным типом, также является фактором риска макроангиопатии, а также диабета. Таким образом, было уделено внимание необходимости улучшения гипергликемии, возникающей после приема пищи (смотри нижеследующую ссылку 3).
В последние годы в связи с увеличением числа больных диабетом происходит усиленный поиск различных противодиабетических средств. Например, для улучшения гипергликемии, возникающей после приема пищи, используются ингибиторы α-глюкозидазы, которые замедляют ферментацию и всасывание углеводов в тонком кишечнике. Также сообщалось, что при применении пациентами с нарушенной толерантностью к глюкозе акарбозы, одного из ингибиторов α-глюкозидазы, эффективно предотвращается или замедляется заболеваемость диабетом (смотри нижеследующую ссылку 4). Однако так как ингибиторы α-глюкозидазы не вызывают снижение уровней глюкозы при приеме моносахаридов глюкозы (смотри нижеследующую ссылку 5), на которые в последнее время заменяют состав сахаров в пище, желательно создать средства, которые проявляют широкий спектр активности, ингибируя всасывание углеводов.
Между тем известно, что в тонком кишечнике находится SGLT1, натрий-зависимый переносчик 1 глюкозы, который контролирует всасывание углеводов. Также сообщалось, что у больных с дисфункцией вследствие врожденной аномалии SGLT1 человека возникает недостаток всасывания глюкозы и галактозы (смотри нижеследующие ссылки 6-8). Кроме того, было подтверждено, что SGLT1 вовлечен во всасывание глюкозы и галактозы (смотри нижеследующие ссылки 9 и 10).
Кроме того, было доказано, что у крыс OLETF и крыс с симптомами диабета, вызванными стрептозотоцином, увеличивается количество мРНК и белка SGLT1 и увеличивается скорость всасывания глюкозы (смотри нижеследующие ссылки 11 и 12). Обычно у пациентов с диабетом повышена ферментация и всасывание углеводов. Например, было доказано, что у человека значительно повышается количество мРНК и белка SGLT1 в тонком кишечнике (смотри нижеследующую ссылку 13).
Следовательно, ингибирование активности SGLT1 человека предотвращает всасывание углеводов, таких как глюкоза, в тонком кишечнике, что, следовательно, может предотвратить увеличение уровня сахара в крови. Главным образом, считается, что замедление всасывания глюкозы, основанное на вышеуказанных механизмах, является эффективным для нормализации гипергликемии, возникающей после приема пищи. Кроме того, так как полагают, что увеличение количества SGLT1 в тонком кишечнике способствует увеличению всасывания углеводов, то для профилактики и лечения диабета желательна скорейшая разработка средств, которые обладают ингибиторной активностью в отношении SGLT1 человека.
Ссылка 1: The Diabetes Control and Complications Trial Research Group, N. Engl. J. Med., 1993.9, Vol.329, No.14, pp.977-986;
Ссылка 2: UK Prospective Diabetes Study Group, Lancet, 1998.9, Vol.352, No.9131, pp.837-853;
Ссылка 3: Makoto, TOMINAGA, Endocrinology & Diabetology, 2001.11, Vol.13, No.5, pp.534-542;
Ссылка 4: Jean-Louis Chiasson and 5 persons, Lancet, 2002.6, Vol.359, No.9323, pp.2072-2077;
Ссылка 5: Hiroyuki, ODAKA and 3 persons, Journal of Japanese Society of Nutrition and Food Science, 1992, Vol.45, No.1, pp.27-31;
Ссылка 6: Tadao, BABA and 1 person, Supplementary volume of Nippon Rinsho, Ryoikibetsu Shokogun, 1998, No.19, pp.552-554;
Ссылка 7: Michihiro, KASAHARA and 2 persons, Saishin Igaku, 1996.1, Vol.51, No.1, pp.84-90;
Ссылка 8: Tomofusa, TSUCHIYA and 1 person, Nippon Rinsho, 1997.8, Vol.55, No.8, pp.2131-2139;
Ссылка 9: Yoshikatsu, KANAI, Kidney and Dialysis, 1998.12, Vol.45, extra edition, pp.232-237;
Ссылка 10: E. Turk and 4 persons, Nature, 1991.3, Vol.350, pp.354-356;
Ссылка 11: Y. Fujita and 5 persons, Diabetologia, 1998, Vol.41, pp.1459-1466;
Ссылка 12: J. Dyer and 5 persons, Biochemical Society Transactions, 1997, Vol.25, p.479S;
Ссылка 13: J. Dyer and 4 persons, American Journal of Physiology, 2002.2, Vol.282, No.2, pp.G241-G248
Описание изобретения
Авторами настоящего изобретения проводились подробные исследования с целью поиска соединений, обладающих ингибиторной активностью в отношении SGLT1 человека. В результате было обнаружено, что некоторые производные пиразола, представленные нижеследующей общей формулой (I), обладают ингибиторной активностью в отношении SGLT1 человека в тонком кишечнике и оказывают прекрасный ингибиторный эффект в отношении увеличения уровня глюкозы в крови, как показано ниже, что, следовательно, является основой настоящего изобретения.
Настоящее изобретение относится к новым производным пиразола, которые оказывают прекрасный ингибиторный эффект в отношении увеличения уровня глюкозы в крови, обладая ингибиторным действием на SGLT1 человека и ингибируя всасывание углеводов, таких как глюкоза, в тонком кишечнике, к их фармацевтически приемлемым солям или пролекарствам, и относится к фармацевтическим композициям, содержащим их, их фармацевтическому применению и промежуточным соединениям для их получения.
Таким образом, настоящее изобретение относится
[1] к производному пиразола, представленному общей формулой

где
R1 представляет собой атом водорода, C1-6 алкильную группу, C2-6 алкенильную группу, гидрокси(C2-6 алкил)группу, C3-7 циклоалкильную группу, C3-7 циклоалкил-замещенную (C1-6 алкил) группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, или арил(C1-6 алкил)группу, которая может содержать одинаковые или различные от 1 до 3 заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце;
один из Q и T представляет собой группу, представленную формулой

или группу, представленную формулой

тогда как другой представляет собой C1-6 алкильную группу, галоген(C1-6 алкил)группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу;
R2 представляет собой атом водорода, атома галогена, гидроксигруппу, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, галоген(C1-6 алкил)группу, галоген(C1-6 алкокси)группу, C1-6 алкокси-замещенную (C1-6 алкокси)группу, C3-7 циклоалкил-замещенную (C2-6 алкокси)группу или -A-RA, в которой А представляет собой единичную связь, атом кислорода, метиленовую группу, этиленовую группу, -OCH2- или -CH2O-; и RA представляет собой C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу, C1-6 алкоксигруппу, C2-6 алкенилоксигруппу, галоген(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, карбоксигруппу, C2-7 алкоксикарбонильную группу, цианогруппу и нитрогруппу, или гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена и C1-6 алкильную группу;
X представляет собой единичную связь, атом кислорода или атом серы;
Y представляет собой C1-6 алкиленовую группу, которая может быть замещена гидроксигруппой или C2-6 алкениленовой группой;
Z представляет собой -RB, -CORC, -SO2RC, -CON(RD)RE, -SO2NHRF или -C(=NRG)N(RH)RI;
RC представляет собой арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующих групп заместителей (i);
R4, RB, RD, RE и RF одинаковы или различны, и каждый представляет собой атом водорода, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителя, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i), или оба R4 и RB связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, или оба RD и RE связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу;
RG, RH и RI одинаковы или различны, и каждый представляет собой атом водорода, цианогруппу, карбамоильную группу, C2-7 ацильную группу, C2-7 алкоксикарбонильную группу, арил(C2-7 алкоксикарбонил)группу, нитрогруппу, C1-6 алкилсульфонильную группа, сульфамидную группу, карбомимидоильную группу или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i), или оба RG и RH связаны с образованием этиленовой группы, или оба RH и RI связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу;
R3, R5 и R6 одинаковы или различные, и каждый представляет собой атом водорода, атома галогена, C1-6 алкильную группу или C1-6 алкоксигруппу; и
группа заместителей (i) включает гидроксигруппу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, сульфамидную группу, моно или ди(C1-6 алкил)уреидогруппу, моно или ди(C1-6 алкил)сульфамидную группу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкилсульфонильную группу, карбоксигруппу, C2-7 алкоксикарбонильную группу, -CON(RJ)RK, в которой RJ и RK одинаковые или различные, и каждый представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, моно или ди(C1-6 алкил)уреидогруппу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу и карбамоильную группу, или оба RJ и RK связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, арил(C1-6 алкокси)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, арил(C1-6 алкилтио)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, C2-6 циклическую аминогруппу, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, и C1-4 ароматическую циклическую аминогруппу, которая в качестве заместителя может содержать C1-6 алкильную группу,
или его фармацевтически приемлемой соли;
[2] к производному пиразола, описанному в [1] выше, где R4 представляет собой атом водорода, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i); RB представляет собой арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i); RC представляет собой арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i); и
группа заместителей (i) включает гидроксигруппу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, сульфамидную группу, моно или ди(C1-6 алкил)уреидогруппу, моно или ди(C1-6 алкил)сульфамидную группу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкилсульфонильную группу, карбоксигруппу, C2-7 алкоксикарбонильную группу, -CON(RJ)RK, в которой RJ и RK являются одинаковыми или различными, и каждый представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, моно или ди(C1-6 алкил)уреидогруппу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу и карбамоильную группу, или оба RJ и RK связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, арил(C1-6 алкокси)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, арил(C1-6 алкилтио)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, C2-6 циклическую аминогруппу, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, и C1-4 ароматическую циклическую аминогруппу, которая в качестве заместителя может содержать C1-6 алкильную группу,
или его фармацевтически приемлемой соли;
[3] к производному пиразола, описанному в [2] выше, где Z представляет собой -RB; RB представляет собой арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i); и
группа заместителей (i) включает гидроксигруппу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, сульфамидную группу, моно или ди(C1-6 алкил)уреидогруппу, моно или ди(C1-6 алкил)сульфамидную группу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкилсульфонильную группу, карбоксигруппу, C2-7 алкоксикарбонильную группу, -CON(RJ)RK, в которой RJ и RK являются одинаковыми или различными, и каждый представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, уреидогруппу, моно или ди(C1-6 алкил)уреидогруппу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппы и карбамоильную группу, или оба RJ и RK связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группу, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, арил(C1-6 алкокси)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, арил(C1-6 алкилтио)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, C2-6 циклическую аминогруппу, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, и C1-4 ароматическую циклическую аминогруппу, которая в качестве заместителя может содержать C1-6 алкильную группу,
или его фармацевтически приемлемой соли;
[4] к производному пиразола, описанному в [3] выше, где R4 представляет собой атом водорода; RB представляет собой C1-6 алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (iA); и
группа заместителей (iA) включает гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, карбоксигруппу, C2-7 алкоксикарбонильную группу и -CON(RJA)RKA, в которой RJA и RKA одинаковые или различные, и каждый представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу и карбамоильную группу, или оба RJA и RKA связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей C1-6 алкильную группу и гидрокси(C1-6 алкил)группу,
или его фармацевтически приемлемой соли;
[5] к производному пиразола, описанному в [4] выше, где RB представляет собой C1-6 алкильную группу, которая содержит карбамоильную группу, или его фармацевтически приемлемой соли;
[6] к производному пиразола, описанному в [2] выше, где Z представляет собой -CON(RD)RE, или его фармацевтически приемлемой соли;
[7] к производному пиразола, описанному в [6] выше, где RD представляет собой атом водорода; RE представляет собой C1-6 алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (iB); и группа заместителей (iB) включает гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу и -CON(RJB)RKB, в которой RJB и RKB одинаковые или различные, и каждый представляет собой атом водорода, C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу и моно или ди(C1-6 алкил)аминогруппу,
или его фармацевтически приемлемой соли;
[8] к производному пиразола, описанному в [2] выше, где Z представляет собой -C(=NRG)N(RH)RI, или его фармацевтически приемлемой соли;
[9] к производному пиразола, описанному в [8] выше, где RG представляет собой атом водорода или C1-6 алкилсульфонильную группу; RH представляет собой атом водорода; RI представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (iC); и группа заместителей (iC) включает гидроксигруппу, аминогруппу, моно или ди(C1-6 алкил)аминогруппу, или фармацевтически приемлемой соли;
[10] к производному пиразола, описанному в [2] выше, где Z представляет собой -CORC; RC представляет собой C1-6 алкильную группу, которая содержит группу, выбранную из нижеследующей группы заместителей (iD); и группа заместителей (iD) включает аминогруппу и -CON(RJC)RKC, в которой обе RJC и RKC связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей C1-6 алкильную группу и гидрокси(C1-6 алкил)группу, или его фармацевтически приемлемой соли;
[11] к производному пиразола, описанному в любом из [1]-[10] выше, где X представляет собой единичную связь или атом кислорода; и Y представляет собой этиленовую группу или триметиленовую группу, или его фармацевтически приемлемой соли;
[12] к производному пиразола, описанному в любом из [1]-[11] выше, где R1 представляет собой атом водорода или гидрокси(C2-6 алкил)группу; T представляет собой группу, представленную формулой

или группу, представленную формулой

Q представляет собой C1-6 алкильную группу или галоген(C1-6 алкил)группу; и R3, R5 и R6 представляют атом водорода, или к его фармацевтически приемлемой соли;
[13] к производному пиразола, описанному в любом [1]-[11] выше, где один из Q и T представляет собой группу, представленную формулой

другой представляет собой C1-6 алкильную группу, галоген(C1-6 алкил)группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу, или его фармацевтически приемлемой соли;
[14] к производному пиразола, описанному выше в [12] или [13], где T представляет собой группу, представленную формулой

или его фармацевтически приемлемой соли;
[15] к производному пиразола, описанному выше в [12] или [14], где Q представляет собой изопропильную группу, или его фармацевтически приемлемой соли;
[16] к пролекарству производного пиразола, описанного в любом [1]-[15] выше, или его фармацевтически приемлемой соли;
[17] к пролекарству, описанному в [16] выше, где T представляет собой группу, представленную формулой

или группу, представленную формулой

в которой гидроксигруппа в 4-положении замещена глюкопиранозильной группой или галактопиранозильной группой, или гидроксигруппа в 6-положении замещена глюкопиранозильной группой, галактопиранозильной группой, C2-7 ацильной группой, C1-6 алкокси-замещенной (C2-7 ацил)группой, C2-7 алкоксикарбонил-замещенной (C2-7 ацил)группой, C2-7 алкоксикарбонильной группой, арил(C2-7 алкоксикарбонил)группой или C1-6 алкокси-замещенной (C2-7 алкоксикарбонил)группой;
[18] к производному пиразола, описанному в [1] выше, где соединение выбрано из группы, включающей соединения, описанные в нижеследующих номерах примеров, и его фармацевтически приемлемым солям,
пример 28, пример 29, пример 32, пример 33, пример 45, пример 48, пример 51, пример 52 (пример 111), пример 55, пример 56, пример 57, пример 59, пример 66, пример 67, пример 71, пример 77, пример 79, пример 81, пример 82, пример 83, пример 84, пример 87, пример 90, пример 94, пример 107, пример 108, пример 109, пример 114, пример 117, пример 118, пример 119, пример 121, пример 123, пример 124, пример 126, пример 127, пример 128, пример 129, пример 130, пример 134, пример 141, пример 147, пример 150, пример 151, пример 170, пример 175, пример 177, пример 178, пример 179, пример 180 и пример 181;
[19] к фармацевтической композиции, содержащей в качестве активного ингредиента производное пиразола, описанное в любом [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[20] к ингибитору SGLT1 человека, содержащему в качестве активного ингредиента производное пиразола, описанное в любом [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[21] к средству ингибирования гипергликемии после приема пищи, содержащему в качестве активного ингредиента производное пиразола, описанное в любом из [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[22] к средству для профилактики или лечения заболевания, связанного с гипергликемией, которое содержит в качестве активного ингредиента производное пиразола, описанное в любом из [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[23] к средству для профилактики или лечения заболевания, описанному в [22] выше, где заболевание, связанное с гипергликемией, представляет собой заболевание, выбранное из группы, включающей диабет, нарушенную толерантность к глюкозе, нарушенную гликемию натощак, осложнения диабета, ожерение, гиперинсулинемию, гиперлипидемию, гиперхолестеринемию, гипертриглицеридемию, нарушенный липидный метаболизм, атеросклероз, гипертензию, застойную сердечную недостаточность, отек, гиперурикемию и подагру;
[24] к средству для ингибирования прогрессирования нарушенной толерантности к глюкозе или нарушенной гликемии натощак до диабета у пациента, которое в качестве активного ингредиента содержит производное пиразола, описанное в любом [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[25] к средству для профилактики или лечения заболевания, связанного с повышенным уровнем галактозы в крови, которое в качестве активного ингредиента содержит производное пиразола, описанное в любом [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство;
[26] к средству для профилактики или лечения заболевания, описанному в [25] выше, где заболеванием, связанным с повышенным уровнем галактозы в крови, является галактоземия;
[27] к фармацевтической композиции, описанной в [19] выше, где лекарственная форма представляет собой лекарственный состав с замедленным высвобождением;
[28] к средству, описанному в любом [20]-[26] выше, где лекарственная форма представляет собой лекарственный состав с замедленным высвобождением;
[29] к способу для профилактики или лечения заболевания, связанного с гипергликемией, который заключается во введении эффективного количества производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства;
[30] к способу для ингибирования прогрессирования нарушенной толерантности к глюкозе или нарушенной гликемии натощак до диабета у пациента, который заключается во введении эффективного количества производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства;
[31] к способу для профилактики или лечения заболевания, связанного с повышенным уровнем галактозы в крови, который заключается во введении эффективного количества производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства;
[32] к применению производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства для получения фармацевтической композиции для профилактики или лечения заболевания, связанного с гипергликемией;
[33] к применению производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства для получения фармацевтической композиции для ингибирования прогрессирования нарушенной толерантности к глюкозе или нарушенной гликемии натощак до диабета у пациента;
[34] к применению производного пиразола, описанного в любом [1]-[18] выше, его фармацевтически приемлемой соли или пролекарства для получения фармацевтической композиции для профилактики или лечения заболевания, связанного с повышенным уровнем галактозы в крови;
[35] к фармацевтической комбинации, которая включает в себя (A) производное пиразола, описанное в любом [1]-[18] выше, его фармацевтически приемлемую соль или пролекарство, и (B) по крайней мере, один член, выбранный из группы, включающей препарат, повышающий чувствительность к инсулину, ингибитор всасывания глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов гликозилирования, ингибитор протеинкиназы C, антагонист рецептора γ-аминомасляной кислоты, антагонист натриевых каналов, ингибитор фактора транскрипции NF-κB, ингибитор липидпероксидазы, ингибитор N-ацетилированной-α-присоединенной-кислой-дипептидазы, инсулиноподобный фактор роста I, тромбоцитарный фактор роста, аналог тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервов, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, антидиарейные средств, слабительные средства, ингибитор редуктазы гидроксиметилглютарил коэнзима-А, производное фиброевой кислоты, агонист α3-адренорецептора, ингибитор ацил-коэнзим А холестеринацилтрансферазы, пробкол, агонист рецептора тиреоидного гормона, ингибитор всасывания холестерина, ингибитор липазы, ингибитор микросомального белка - переносчика триглицеридов, ингибитор липоксигеназы, ингибитор карнитинпальмитоилтрансферазы, ингибитор скваленсинтазы, энхансер рецептора липопротеинов низкой плотности, производное никотиновой кислоты, средство, усиливающее секрецию желчных кислот, ингибитор ко-переносчика натрия/желчных кислот, ингибитор белка - переносчика холестиринового эфира, подавитель аппетита, ингибитор ангиотензин-превращающего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелин-преобразующего фермента, антагонист рецептора эндотелина, диуретическое средство, антагонист кальция, сосудорасширяющее антигипертензивное средство, симпатикоблокирующий агент, антигипертензивное средство центрального действия, агонист α2-адренорецептора, антитромбоцитарное средство, ингибитор синтеза мочевой кислоты, средство, способствующего выведению мочевой кислоты, и препарат, подщелачивающий мочу;
[36] к способу для профилактики или лечения заболевания, связанного с гипергликемией, или заболевания, связанного с повышенным уровнем галактозы в крови, который заключается во введении эффективного количества лекарственного препарата, выбранного из группы (A) и, по крайней мере, одного члена, выбранного из вышеуказанной группы (B);
[37] к способу ингибирования прогрессирования нарушенной толерантности к глюкозе или нарушенной гликемии натощак до диабета у пациентов, который заключается во введении эффективного количества лекарственного препарата, выбранного из вышеуказанной группы (A) и, по крайней мере, одного члена, выбранного из вышеуказанной группы (B);
[38] к применению лекарственного препарата, выбранного из вышеуказанной группы (A) и, по крайней мере, одного члена, выбранного из вышеуказанной группы (B), для получения фармацевтической композиции для профилактики или лечения заболевания, связанного с гипергликемией, или заболевания, связанного с повышенным уровнем галактозы в крови;
[39] к применению лекарственного препарата, выбранного из вышеуказанной группы (A) и, по крайней мере, одного члена, выбранного из вышеуказанной группы (B), для получения фармацевтической композиции для ингибирования прогрессирования нарушенной толерантности к глюкозе или нарушенной гликемии натощак до диабета у пациента;
[40] к производному пиразола, представленному общей формулой

где
R11 представляет собой атом водорода, C1-6 алкильную группу, C2-6 алкенильную группу, гидрокси(C2-6 алкил)группу, которая может иметь защитную группу, C3-7 циклоалкильную группу, C3-7 циклоалкил-замещенную (C1-6 алкил)группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу и C1-6 алкоксигруппу, или арил(C1-6 алкил)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце;
один из Q2 и T2 представляет собой 2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилоксигруппу, 2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилоксигруппу, 2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилоксигруппу или 2,3,4,6-тетра-O-пивалоил-β-D-галактопиранозилоксигруппу, тогда как другой представляет собой C1-6 алкильную группу, галоген(C1-6 алкил)группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу;
R12 представляет собой атом водорода, атома галогена, гидроксигруппу, которая может иметь защитную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, галоген(C1-6 алкил)группу, галоген(C1-6 алкокси)группу, C1-6 алкокси-замещенную (C1-6 алкокси)группу, C3-7 циклоалкил-замещенную (C2-6 алкокси)группу или -A-R1A, в которой А представляет собой единичную связь, атом кислорода, метиленовую группу, этиленовую группу, -OCH2- или -CH2O-; и R1A представляет собой C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу, C1-6 алкоксигруппу, C2-6 алкенилоксигруппу, галоген(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу, карбоксигруппу, которая может иметь защитную группу, C2-7 алкоксикарбонильную группу, цианогруппу и нитрогруппу, или гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена и C1-6 алкильную группу;
X представляет собой единичную связь, атом кислорода или атом серы;
Y1 представляет собой C1-6 алкиленовую группу, которая может быть замещена гидроксигруппой, которая может иметь защитную группу, или C2-6 алкениленовую группу;
Z1 представляет собой -R1B, -COR1C, -SO2R1C, -CON(R1D)R1E, -SO2NHR1F или -C(=NR1G)N(R1H)R1I;
R1C представляет собой арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу, которая может иметь защитную группу, и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (ii);
R14, R1B, R1D, R1E и R1F одинаковые или различные, и каждый представляет собой атом водорода, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу, которая может иметь защитную группу, и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (ii), или оба R14 и R1B связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, которая может иметь защитную группу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, или оба R1D и R1E связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, которая может иметь защитную группу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу, и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу;
R1G, R1H и R1I одинаковые или различные, и каждый представляет собой атом водорода, цианогруппу, карбамоильную группу, C2-7 ацильную группу, C2-7 алкоксикарбонильную группу, арил(C2-7 алкоксикарбонил)группу, нитрогруппу, C1-6 алкилсульфонильную группу, сульфамидную группу, карбамимидоильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (ii), или оба R1G и R1H связаны с образованием этиленовой группы, или оба R1H и R1I связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, которая может иметь защитную группу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу, и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу;
R3, R5 и R6 одинаковые или различные, и каждый представляет собой атом водорода, атома галогена, C1-6 алкильную группу или C1-6 алкоксигруппу; и
группа заместителей (ii) включает гидроксигруппу, которая может иметь защитную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, аминогруппу, которая может иметь защитную группу, моно или ди(C1-6 алкил)аминогруппу, которая может иметь защитную группу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, которая может иметь защитную группу, уреидогруппу, сульфамидную группу, моно или ди(C1-6 алкил)уреидогруппу, моно или ди(C1-6 алкил)сульфамидную группу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкилсульфонильную группу, карбоксигруппу, которая может иметь защитную группу, C2-7 алкоксикарбонильную группу, -CON(R1J)R1K, в которой R1J и R1K одинаковые или различные, и каждый представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, моно или ди(C1-6 алкил)аминогруппу, которая может иметь защитную группу, моно или ди[гидрокси(C1-6 алкил)]аминогруппу, которая может иметь защитную группу, уреидогруппу, моно или ди(C1-6 алкил)уреидогруппу, C2-7 ациламиногруппу, C1-6 алкилсульфониламиногруппу и карбамоильную группу, или оба R1J и R1K связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, которая может иметь защитную группу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу, и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, арил(C1-6 алкокси)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, арил(C1-6 алкилтио)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, C3-7 циклоалкильную группу, C2-6 гетероциклоалкильную группу, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может иметь заместитель, выбранный из группы, включающей атом галогена, аминогруппу, которая может иметь защитную группу, и C1-6 алкильную группу, C2-6 циклическую аминогруппу, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, которая может иметь защитную группу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу, которая может иметь защитную группу, и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу, и C1-4 ароматическую циклическую аминогруппу, которая в качестве заместителя содержит C1-6 алкильную группу, или к его соли; и тому подобное.
В настоящем изобретении термин “C1-6 алкильная группа” обозначает алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или тому подобное; термин “C1-6 алкиленовая группа” обозначает алкиленовую группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, такую как метиленовая группа, этиленовая группа, триметиленовая группа, тетраметиленовая группа, пропиленовая группа, 1,1-диметилэтиленовая группа или тому подобное; термин “гидрокси(C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную гидроксигруппой; термин “C2-6 алкильную группу” обозначает алкильную группу с прямой или разветвленной цепью, содержащую от 2 до 6 атомов углерода, такую как этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или тому подобное; термин “гидрокси(C2-6 алкил) группа” обозначает вышеуказанную C2-6 алкильную группу, замещенную гидроксигруппой, такой как 2-гидроксиэтильная группа, 3-гидроксипропильная группа или тому подобное; термин “C1-6 алкоксигруппа” обозначает алкоксигруппу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, такую как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа, гексилоксигруппа или тому подобное; термин “C1-6 алкокси-замещенная (C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную вышеуказанной C1-6 алкоксигруппой; термин “C1-6 алкокси-замещенная (C1-6 алкокси)группа” обозначает вышеуказанную C1-6 алкоксигруппу, замещенную вышеуказанной C1-6 алкоксигруппой, такую как метоксиметоксигруппа или тому подобное; термин “C2-6 алкенильная группа” обозначает алкенильную группу с прямой или разветвленной цепью, содержащую от 2 до 6 атомов углерода, такую как винильная группа, аллильная группа, 1-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 2-метилаллильная группа или тому подобное; термин “C2-6 алкениленовая группа” обозначает алкениленовую группу с прямой или разветвленной цепью, содержащую от 2 до 6 атомов углерода, такую как виниленовая группа, 1-пропениленовая группа, 2-пропениленовая группа или тому подобное; термин “C2-6 алкенилокси группа” обозначает вышеуказанную C1-6 алкоксигруппу за исключением метоксигруппы, которая имеет ненасыщенную связь, такую как аллилокси группа или тому подобное; термин “C1-6 алкилтиогруппа” обозначает алкилтиогруппу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, такую как метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, пентилтиогруппа, изопентилтиогруппа, неопентилтиогруппа, трет-пентилтиогруппа, гексилтиогруппа или тому подобное; термин “карбамоил(C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную карбамоильной группой; термин “моно или ди(C1-6 алкил)аминогруппа” обозначает аминогруппу, моно-замещенную вышеуказанной C1-6 алкильной группой или ди-замещенную одинаковыми или различными C1-6 алкильными группами, как определено выше; термин “моно или ди[гидрокси(C1-6 алкил)]аминогруппа” обозначает аминогруппу, моно-замещенную вышеуказанной гидрокси(C1-6 алкил)группой или ди-замещенную одинаковыми или различными гидрокси(C1-6 алкил)группами, как определено выше; термин “моно или ди(C1-6 алкил)уреидогруппа” обозначает уреидогруппу, моно-замещенную вышеуказанной C1-6 алкильной группой или ди-замещенную одинаковыми или различными C1-6 алкильными группами, как определено выше; термин “моно или ди(C1-6 алкил)сульфамидная группа” обозначает сульфамидную группу, моно-замещенную вышеуказанной C1-6 алкильной группой или ди-замещенную одинаковыми или различными C1-6 алкильными группами, как определено выше; термин “C2-7 ацильная группа” обозначает ацильную группу с прямой или разветвленной цепью, содержащую от 2 до 7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, пивалоильная группа, гексаноильная группа или тому подобное; термин “C2-7 ациламиногруппа” обозначает аминогруппу, замещенную вышеуказанной C2-7 ацильной группой; термин “C1-6 алкилсульфонильная группа” обозначает алкилсульфонильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода, такую как метансульфонильная группа, этансульфонильная группа или тому подобное; термин “C1-6 алкилсульфониламиногруппа” обозначает аминогруппу, замещенную вышеуказанной C1-6 алкилсульфонильной группой; термин “C1-6 алкилсульфониламино-замещенная (C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную вышеуказанной C1-6 алкилсульфониламиногруппой; термин “C3-7 циклоалкильная группа” обозначает циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу или циклогептильную группу; термин “C3-7 циклоалкил-замещенная (C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную вышеуказанной C3-7 циклоалкильной группой; термин “C3-7 циклоалкил-замещенная (C2-6 алкокси)группа” обозначает вышеуказанную C1-6 алкоксигруппу за исключением метоксигруппы, замещенную вышеуказанной C3-7 циклоалкильной группой; термин “C2-6 гетероциклоалкильная группа” обозначает вышеуказанную C3-7 циклоалкильную группу, содержащую от 1 до 2 одинаковых или различных гетероатомов за исключением положения связывания, выбранных из атома азота, атома кислорода и атома серы в кольце, которая получена из морфолина, тиоморфолина, тетрагидрофурана, тетрагидропирана, азиридина, азетидина, пирролидина, имидазолидина, оксазолина, пиперидина, пиперазина, пиразолидина или тому подобное; термин “атом галогена” обозначает атом фтора, атом хлора, атом брома или атом йода; термин “галоген(C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную от 1 до 5 одинаковыми или различными атомами галогена, как определено выше, такую как трифторфторметильная группа, пентафторэтильная группа или тому подобное; термин “галоген(C1-6 алкокси)группа” обозначает вышеуказанную C1-6 алкоксигруппу, замещенную от 1 до 5 одинаковыми или различными атомами галогена, как определено выше; термин “C2-7 алкоксикарбонильная группа” обозначает алкоксикарбонильную группу с прямой или разветвленной цепью, содержащую от 2 до 7 атомов углерода, такую как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутилоксикарбонильная группа, втор-бутоксикарбонильная группа, трет-бутоксикарбонильная группа, пентилоксикарбонильная группа, изопентилоксикарбонильная группа, неопентилоксикарбонильная группа, трет-пентилоксикарбонильная группа, гексилоксикарбонильная группа или тому подобное; термин “арильная группа” обозначает от моно до три-циклическую ароматическую углеводородную группу, такую как фенильная группа, нафтильная группа или тому подобное; термин “арил(C1-6 алкил)группа” обозначает вышеуказанную C1-6 алкильную группу, замещенную вышеуказанной арильной группой; термин “арил(C1-6 алкокси)группа” обозначает вышеуказанную C1-6 алкоксигруппу, замещенную вышеуказанной арильной группой; термин “арил(C1-6 алкилтио)группа” обозначает вышеуказанную C1-6 алкилтиогруппу, замещенную вышеуказанной арильной группой; термин “арил(C2-7 алкоксикарбонил)группа” обозначает вышеуказанную C2-7 алкоксикарбонильную группу, замещенную вышеуказанной арильной группой, такую как бензилоксикарбонил группа или тому подобное; термин “гетероарильная группа” обозначает 5 или 6-членную гетероарильную группу, содержащую от 1 до 4 одинаковых или различных гетероатомов за исключением положений присоединения, выбранных из атома азота, атома кислорода или атома серы в кольце, которая получена из тиазола, оксазола, изотиазола, изооксазола, пиридина, пиримидина, пиразина, пиридазина, пиррола, тиофена, имидазола, пиразола, оксадиазола, тиодиазола, тетразола, фуразана или тому подобное; термин “C2-6 циклическая аминогруппа” обозначает 5 или 6-членную моноциклическую аминогруппу, содержащую от 2 до 6 атомов углерода, которая может содержать один гетероатом отличный от атома азота в положении присоединения, выбранный из атома азота, атома кислорода и атома серы в кольце, такую как морфолино группа, тиоморфолино группа, 1-азиридинильная группа, 1-азетидинильная группа, 1-пирролидинильная группа, пиперидино группа, 1-имиазолидинильная группа, 1-пиперазинильная группа, пиразолидильная группа или тому подобное; термин “C1-4 ароматическая циклическая аминогруппа” обозначает 5-членную ароматическую моноциклическую аминогруппу, содержащую от 1 до 4 атомов углерода, которая может содержать от 1 до 3 атома азота, отличных от атома азота в положении присоединения, такую как 1-имидазолильная группа, 1-пирролильная группа, пиразолильная группа, 1-тетразолильная группа или тому подобное; термин “гидрокси-защитная группа” обозначает гидрокси-защитную группу, используемую в обычном органическом синтезе, такую как бензильную группу, метоксиметильную группу, ацетильную группу, пивалоильную группу, бензоильную группу, трет-бутилдиметилсилильную группу, триизопропилсилильную группу, алилльную группу или тому подобное; термин “амино-защитная группа” обозначает амино-защитную группу, используемую в обычном органическом синтезе, такую как бензилоксикарбонильная группа, трет-бутоксикарбонильная группа, бензильная группа, трифторацетильная группа или тому подобное; и термин “карбокси-защитная группа” обозначает карбокси-защитная группа, используемую в обычном органическому синтезе, такую как бензильная группа, трет-бутилдиметилсилильная группа, аллильная группа или тому подобное.
В настоящем изобретении, например, R1 предпочтительно представляет собой атом водорода или гидрокси(C2-6 алкил)группу и более предпочтительно представляет собой атом водорода; T предпочтительно представляет собой группу формулы

или группу формулы

Q предпочтительно представляет собой C1-6 алкильную группу или галоген(C1-6 алкил)группу, и более представляет собой C1-6 алкильную группу; C1-6 алкильная группа в Q предпочтительно представляет собой этильную группу или изопропильную группу и более предпочтительно представляет собой изопропильную группу; X предпочтительно представляет собой единичную связь или атом кислорода; Y предпочтительно представляет собой C1-6 алкиленовую группу или C2-6 алкениленовую группу и более предпочтительно представляет собой C1-6 алкиленовую группу; C1-6 алкиленовая группа в Y предпочтительно представляет собой этиленовую группу, триметиленовую группу или тетраметиленовую группу и более предпочтительно представляет собой этиленовую группу или триметиленовую группу. Z предпочтительно представляет собой -RB, -CORC, -CON(RD)RE или -C(=NRG)N(RH)RI и более предпочтительно представляет собой -RB или -CON(RD)RE и наиболее предпочтительно -RB; RB в Z предпочтительно представляет собой C1-6 алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (iA) и более предпочтительно представляет собой C1-6 алкильную группу, содержащую карбамоильную группу; RD в Z предпочтительно представляет собой атом водорода; RE предпочтительно представляет собой C1-6 алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (iB); RG в Z предпочтительно представляет собой атом водорода или C1-6 алкилсульфонильную группу; RH предпочтительно представляет собой атом водорода; RI предпочтительно представляет собой атом водорода или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (iC); и RC в Z предпочтительно представляет собой C1-6 алкильную группу, которая имеет от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (iD). R4 предпочтительно представляет собой атом водорода; R2 предпочтительно представляет собой атом водорода, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкокси-замещенную (C1-6 алкокси)группу, C3-7 циклоалкил-замещенную (C2-6 алкокси)группу или группу общей формулы: -A-RA, в которой А и RA имеют одинаковые значения, как определено выше, и более предпочтительно представляет собой атом водорода, атом хлора, атом фтора или метильную группу; и R3, R5 и R6 предпочтительно представляет собой атом водорода или атома галогена, и все более предпочтительно представляют собой атом водорода.
В качестве конкретных соединений в настоящем изобретении, в качестве примеров приведены соединения, описанные в примерах 1-187. Конкретно предпочтительными являются нижеследующие соединения или их фармацевтически приемлемые соли.


























[Пример 181]
Например, соединения, представленные вышеуказанной общей формулой (I) по настоящему изобретению могут быть получены в соответствии с нижеследующим методом:

где L1 представляет собой удаляемую группу, такую как атом галогена, мезилоксигруппу, тозилоксигруппу или тому подобное; L2 представляет собой MgBr, MgCl, MgI, ZnI, ZnBr, ZnCl или атом лития; R представляет собой C1-6 алкильную группу, галоген(C1-6 алкил)группу, a C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу; R˚ представляет собой C1-6 алкильную группу; один из Q3 и T3 представляет собой гидроксигруппу, другой представляет собой C1-6 алкильную группу, галоген(C1-6 алкил)группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу; и R1, R2, R3, R4, R5, R6, R11, R12, R14, Q, Q2, T, T2, X, Y, Y1, Z и Z1 имеют те же значения, как определено выше.
Процесс 1-1
Соединение, представленное вышеуказанной общей формулой (VI), может быть получено конденсацией бензильного соединения, представленного вышеуказанной общей формулой (IV), с кетоацетатом, представленным вышеуказанной общей формулой (V), в присутствии основания, такого как гидрид натрия или трет-бутоксид калия, в инертном растворителе. В качестве примера инертного растворителя в этой реакции можно привести, например, 1,2-диметоксиэтан, тетрагидрофуран, N,N-диметилформамид, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от около 1 часов до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Процесс 1-2
Производное бензилпиразола, представленное вышеуказанной общей формулой (III), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (VI), с соединением гидразина, представленным вышеуказанной общей формулой (VII), или его моногидратом или солью, в присутствии или в отсутствие основания в инертном растворителе, и введением гидрокси-защитной группы обычным способом, по обстоятельствам. В качестве примера инертного растворителя, используемого в реакции конденсирования, можно привести, например, толуол, тетрагидрофуран, хлороформ, метанол, этанол, смесь этих растворителей и тому подобное, и в качестве примера основания, например, можно привести триэтиламин, N,N-диизопропилэтиламин, пиридин, метоксид натрия, этоксид натрия и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от около 1 часов до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции. Полученное производное бензилпиразола, представленное вышеуказанной общей формулой (III), также может использоваться в последующем процессе после подходящего преобразования в его соль обычным способом.
Процесс 1-3
Соединение, представленное вышеуказанной общей формулой (X), может быть получено конденсацией соединения дитиокарбонатного эфира, представленного вышеуказанной общей формулой (VIII), с соединением кетона, представленным вышеуказанной общей формулой (IX), в присутствии основания, такого как амид натрия, в инертном растворителе. В качестве примера инертного растворителя, используемого в этой реакции, можно привести, например, толуол и тому подобное. Температура реакции обычно находится в диапазоне от -20°C до комнатной температуры, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Процесс 1-4
Производное бензилоксипиразола, представленное вышеуказанной общей формулой (XI), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (X), с соединением гидразина, представленным вышеуказанной общей формулой (VII), или его моногидратом или солью, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин в инертном растворителе, и введением гидрокси-защитной группы обычным способом, по обстоятельствам. В качестве примера инертного растворителя, используемого в реакции конденсирования, можно привести, например, ацетонитрил и тому подобное. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции составляет от 1 часа до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Процесс 1-5
Производное альдегида пиразола, представленное вышеуказанной общей формулой (XII), может быть получено путем реакции Вилсмейера соединения, представленного вышеуказанной общей формулой (XI), используя оксихлорид фосфора и N,N-диметилформамид в различных растворителях. В качестве примера растворителя, используемого в этой реакции, можно привести, например, N,N-диметилформамид и тому подобное. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Процесс 1-6
Соединение, представленное вышеуказанной общей формулой (XIV), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (XII), с реагентом Гриньяра, реагентом Реформатски (Reformatsky) или литиевым реагентом, представленным вышеуказанной общей формулой (XIII), в инертном растворителе. В качестве примера инертного растворителя, используемого в этой реакции, можно привести, например, тетрагидрофуран, диэтиловый эфир, смесь этих растворителей и тому подобное. Температура реакции составляет обычно от -78°C до комнатной температуры, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Процесс 1-7
Производное бензилпиразола, представленное вышеуказанной общей формулой (III), может быть получено путем каталитического гидрирования соединения, представленного вышеуказанной общей формулой (XIV), используя палладиевый катализатор, такой как порошок палладия-углерода, или в присутствии или в отсутствие кислоты, такой как хлористоводородная кислота, в инертном растворителе, и в случае когда соединение, представленное вышеуказанной общей формулой (XIV), содержит атом серы, воздействие на результирующее соединение кислотой осуществляют в водном растворе трифторуксусной кислоты и диметилсульфида обычно при температуре от 0°C до температуры кипячения с обратным холодильником в течение от 30 минут до 1 дня по обстоятельствам. В качестве примера растворителя, используемого при каталитическом гидрировании, можно привести, например, метанол, этанол, тетрагидрофуран, этилацетат, уксусную кислоту, изопропанол, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от около комнатной температуры до температуры кипячения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции. Полученное производное бензилпиразола, представленное вышеуказанной общей формулой (III), также может использоваться в последующем процессе после соответствующего преобразования в его соль обычным способом.
Процесс 1-8
[1] В случае когда в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и T3 представляет собой C1-6 алкильную группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу, то соответствующее соединение, представленное вышеуказанной общей формулой (II) по настоящему изобретению, может быть получено гликозилированием соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), используя ацетобром-α-D-глюкозу, ацетобром-α-D-галактозу, бромид 2,3,4,6-тетра-O-пивалоил-α-D-глюкопиранозила или бромид 2,3,4,6-тетра-O-пивалоил-α-D-галактопиранозила в присутствии основания, такого как карбонат серебра, гидрид натрия или тому подобное, в инертном растворителе. В качестве примера инертного растворителя, используемого в реакции, можно привести, например, тетрагидрофуран, диметоксиэтан, N,N-диметилформамид, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от комнатной температуры до температуры кипячения с обратным холодильником, и время реакции обычно составляет от 1 часа до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
[2] В случае когда в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и T3 представляет собой галоген(C1-6 алкил)группу, соответствующее соединение, представленное вышеуказанной общей формулой (II) в настоящем изобретении, может быть получено гликозидированием соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), используя ацетобром-α-D-глюкозу, ацетобром-α-D-галактозу, бромид 2,3,4,6-тетра-O-пивалоил-α-D-глюкопиранозила или бромид 2,3,4,6-тетра-O-пивалоил-α-D-галактопиранозила, в присутствии основания, такого как карбонат калия или тому подобное, в инертном растворителе. В качестве примера инертного растворителя, используемого в этой реакции, можно привести, например, тетрагидрофуран, ацетонитрил, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
[3] В случае когда в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и T3 представляет собой C2-6 алкильную группу, C1-6 алкокси-замещенную (C1-6 алкил)группу или C3-7 циклоалкильную группу, соответствующее соединение, представленное вышеуказанной общей формулой (II) по настоящему изобретению, также может быть получено путем гликозидирования соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), используя ацетобром-α-D-глюкоза, ацетобром-α-D-галактоза, бромид 2,3,4,6-тетра-O-пивалоил-α-D-глюкопиранозила или бромид 2,3,4,6-тетра-O-пивалоил-α-D-галактопиранозила в присутствии основания, такого как гидрохлорид натрия, гидрохлорид калия, карбонат калия или тому подобное, и катализатор межфазного переноса, такой как хлорид бензилтри(н-бутил)аммония, бромид бензилтри(н-бутил)аммония, гидросульфат тетра(н-бутил)аммония или тому подобное, в инертном растворителе, содержащем воду. В качестве примера инертного растворителя, используемого в этой реакции, можно привести дихлорметан, толуол, бензотрифторид, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно равно от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Полученное гликозидированное производное бензилпиразола, представленное вышеуказанной общей формулой (II), также можно использовать в следующем процессе после соответствующего преобразования в его соль и отделения обычным способом.
Процесс 1-9
Производное пиразола, представленное вышеуказанной общей формулой (I) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (II), и снятием защитной группы или восстановлением нитрогруппы полученного соединения по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве примера основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно составляет от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции. Как указано выше, в случае, когда соединения имеют защитную группу в R11, R12, R14, Y1 и/или Z1 после гидролиза, защитная группа может быть соответственно удалена обычным способом. Кроме того, после завершения вышеуказанного взаимодействия соединения с нитрогруппой в R2, представленной вышеуказанной общей формулой (I), также могут быть преобразованы в соответствующее соединение, содержащее аминогруппу, путем каталитического восстановления, используя платиновый катализатор, такой как оксид платины, в инертном растворителе, таком как этилацетат, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником, обычно в течение от 30 минут до 1 дня обычным способом.
У соединений, представленных вышеуказанной общей формулой (III), в качестве исходных продуктов, в соединениях, где R11 представляет собой атом водорода могут быть три нижеследующие таутомера, изменения зависят от различия в условиях реакций, и соединения, представленные вышеуказанной общей формулой (III), включают все эти соединения:

где R, R3, R5, R6, R12, R14, X, Y1 и Z1 имеют те же значения, как определено выше.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 представляет собой C1-6 алкильную группу, C2-6 алкенильную группу, гидрокси(C2-6 алкил)группу, C3-7 циклоалкильную группу, C3-7 циклоалкил-замещенную (C1-6 алкил)группу или арил(C1-6 алкил)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце, например, может быть получено в соответствии с нижеследующим методом:

где L3 представляет собой удаляемую группу, такую как атом галогена, мезилоксигруппу, тозилоксигруппу или тому подобное; R21 представляет собой C1-6 алкильную группу, C2-6 алкенильную группу, гидрокси(C2-6 алкил)группу, которая может содержать защитную группу, C3-7 циклоалкильную группу, C3-7 циклоалкил-замещенную (C1-6 алкил)группу или арил(C1-6 алкил)группу, которая может иметь от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, которая может иметь защитную группу, аминогруппу, которая может иметь защитную группу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце; R31 представляет собой C1-6 алкильную группу, C2-6 алкенильную группу, гидрокси(C2-6 алкил)группу, C3-7 циклоалкильную группу, C3-7 циклоалкил-замещенную (C1-6 алкил)группу или арил(C1-6 алкил)группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу на кольце; и R2, R3, R4, R5, R6, R12, R14, Q, Q2, T, T2, X, Y, Y1, Z и Z1 имеют те же значения, как определено выше.
Процесс 2
Производное пиразола, представленное вышеуказанной общей формулой (Ia) по настоящему изобретению, может быть получено гидролизом соединения, представленного вышеуказанной общей формулой (IIa), в соответствии со способом, сходным способу, описанному выше для процесса 1-9, и N-алкилированием, используя алкилирующий агент, представленный вышеуказанной общей формулой (XV), в присутствии основания, такого как карбонат цезия или карбонат калия в инертном растворителе, и в случае соединений, имеющих защитную группу, соответствующим удалением защитной группы обычным способом по обстоятельствам. В качестве примера инертного растворителя, используемого в N-алкилировании, можно привести, например, ацетонитрил, этанол, 1,2-диметоксиэтан, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 10 минут до 1 дня, изменения основаны на используемом исходном продукте, растворителе и температуре реакции.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1, R4 и Z представляют атом водорода, например, может быть получено в соответствии с нижеследующей процедурой:

где L4 представляет собой удаляемую группу, такую как мезилоксигруппа, тозилоксигруппа или тому подобное; и R2, R3, R5, R6, R12, Q, Q2, T, T2, X, Y и Y1 имеют те же значения, как определено выше.
Процесс 3-1
Соединение, представленное вышеуказанной общей формулой (XVII), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (XVI), используя палладиевый катализатор, такой как порошок палладия-угля в инертном растворителе для удаления бензильной группы. В качестве примера растворителя, используемого в каталитическом гидрировании, можно привести, например, метанол, этанол, тетрагидрофуран, этилацетат, уксусную кислоту, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 2 дней, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 3-2
Соединение, представленное вышеуказанной общей формулой (XVIII), может быть получено введением удаляемой группы в соединение, представленное вышеуказанной общей формулой (XVII), используя хлорангидрид кислоты, такой как мезил хлорид или тозил хлорид, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе. В качестве примера растворителя, используемого в реакции введения, можно привести, например, дихлорметан, этилацетат, тетрагидрофуран, пиридин, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до комнатной температуры, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 3-3
Соединение, представленное вышеуказанной общей формулой (XIX), может быть получено азидированием соединения, представленного вышеуказанной общей формулой (XVIII), используя азидирующий агент, такой как азид натрия, в инертном растворителе. В качестве примера растворителя, используемого в азидировании, можно привести, например, дихлорметан, этилацетат, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, N,N-диметилимидазолидинон, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 3-4
Соединение, представленное вышеуказанной общей формулой (IIb) по настоящему изобретению, может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (XIX), используя палладиевый катализатор, такой как порошок палладия-угля, в инертном растворителе. В качестве примера растворителя, используемого в каталитическом гидрировании, можно привести, например, тетрагидрофуран, метанол, этанол, этилацетат, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 3-5
Соединение представленное вышеуказанной общей формулой (XX) может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (XIX), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве примера основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12 и/или Y1 после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Процесс 3-6
Производное пиразола, представленное вышеуказанной общей формулой (Ib) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIb), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве примера основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12 и/или Y1 после гидролиза, защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Процесс 3-7
Производное пиразола, представленное вышеуказанной общей формулой (Ib) по настоящему изобретению, может быть получено каталитическим гидролизом соединения, представленного вышеуказанной общей формулой (XX), используя палладиевый катализатор, такой как порошок палладия-угля, в инертном растворителе. В качестве примера растворителя, используемого в каталитическом гидрировании, можно привести, например, тетрагидрофуран, метанол, этанол, этилацетат, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 и R4 представляют атом водорода; и Z представляет собой -CORC, -SO2RC, -CON(RD)RE или -C(=NR2G)NHR2H, например, может быть получено в соответствии с нижеследующими методами:

где L5 представляет собой удаляемую группу, такую как пиразолильная группа, метилтиогруппа, бензотриазолильная группа или тому подобное; R2G и R2H одинаковые или различные, и каждый представляет собой атом водорода, бензилоксикарбонильную группу или трет-бутоксикарбонильную группу; Z2 представляет собой -COR1C, -SO2R1C, -CONHRID или -C(=NR2G)NHR2H; ZA представляет собой -CORC, -SO2RC, -CONHRD или -C(=NR2G)NHR2H; и R1C, R1D, R1E, R2, R3, R5, R6, R12, RD, RE, Q, Q2, T, T2, X, Y и Y1 имеют одинаковые значения, как определено выше.
Процесс 4-1
Соединение, представленное вышеуказанной общей формулой (IIc), может быть получено из соединения, представленного вышеуказанной общей формулой (IIb), обработкой в соответствии с нижеследующими способами 1-4 и удалением защитной группы обычным способом по обстоятельствам.
<Способ 1>
Соединению, представленному вышеуказанной общей формулой (IIb), давали взаимодействовать с хлорангидриром кислоты, представленным вышеуказанной общей формулой (XXI) или (XXII), в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как дихлорметан, этилацетат, тетрагидрофуран, пиридин, ацетонитрил или смесь этих растворителей, обычно при температуре от 0°C до температуры кипения с обратным холодильником обычно в течение от 30 минут до 1 дня.
<Способ 2>
Соединению, представленному вышеуказанной общей формулой (IIb), давали взаимодействовать с изоцианатным соединением, представленным вышеуказанной общей формулой (XXIII), в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как дихлорметан, этилацетат, тетрагидрофуран, пиридин, ацетонитрил, толуол или смесь этих растворителей, обычно при температуре от 0°C до температуры кипения с обратным холодильником в течение обычно от 30 минут до 1 дня.
<Способ 3>
Соединению, представленному вышеуказанной общей формулой (IIb), давали взаимодействовать с соединением карбоновой кислоты, представленным вышеуказанной общей формулой (XXIV), после соответствующего добавления 1-гидроксибензотриазола по обстоятельствам в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида или дициклогексилкарбодиимид, и в присутствии или в отсутствие основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе, таком как N,N-диметилформамид, дихлорметан или смесь этих растворителей, обычно при температуре от 0°C до температуры кипения с обратным холодильником в течение обычно от 1 часа до 2 дней.
<Способ 4>
Соединению, представленному вышеуказанной общей формулой (IIb), давали взаимодействовать с гуанидилирующим реагентом, представленным вышеуказанной общей формулой (XXV), таким как N-(бензилоксикарбонил)-1H-пиразол-1-карбоксамидин, в инертном растворителе, таком как тетрагидрофуран, метанол, этанол, толуол, N,N-диметилформамид или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником в течение обычно от 1 часа до 5 дней.
Процесс 4-2
Производное пиразола, представленное вышеуказанной общей формулой (Ic) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIc), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, вода, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12, Y1 и/или Z2 после гидролиза, защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Процесс 5-1
Активированное соединение сложного эфира, представленное вышеуказанной общей формулой (XXVII), может быть получено конденсированием соединения, представленного вышеуказанной общей формулой (IIb), с агентом для получения активированного сложного эфира, представленного вышеуказанной формулой (XXVI), в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе. В качестве примера растворителя, используемого в реакции конденсирования, можно привести, например, дихлорметан, тетрагидрофуран, этилацетат, ацетонитрил, пиридин, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 5-2
Производное пиразола, представленное вышеуказанной общей формулой (IId) по настоящему изобретению, может быть получено конденсированием соединения, представленного вышеуказанной общей формулой (XXVII), с соединением амина, представленного вышеуказанной общей формулой (XXVIII), или его солью, в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]унд-7-цен, гидрид натрия, трет-бутоксид калия, карбонат калия или карбонат цезия, в инертном растворителе, и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции конденсирования можно привести, например, дихлорметан, метанол, этанол, тетрагидрофуран, этилацетат, ацетонитрил, пиридин, N,N-диметилформамид, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 2 дней, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 5-3
Производное пиразола, представленное вышеуказанной общей формулой (Id) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IId), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве примера основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12, R1D, R1E и/или Y1 после гидролиза, защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 представляет собой атом водорода; и Z представляет собой RB, например, может быть получено в соответствии с нижеследующими методами:

где R14, R1B, R2, R3, R4, R5, R6, R12, RB, L4, Q, Q2, T, T2, X, Y и Y1 имеют те же значения, как определено выше.
Процесс 6
Производное пиразола, представленное вышеуказанной общей формулой (Ie) по настоящему изобретению, может быть получено конденсированием соединения, представленного вышеуказанной общей формулой (XVIII), с соединением амина, представленным вышеуказанной общей формулой (XXIX), или его солью, в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]унде-7-цен, гидрид натрия, трет-бутоксид калия, карбонат калия или карбонат цезия, в инертном растворителе после добавления йодида натрия по обстоятельствам, подвергая полученное соединение щелочному гидролизу, и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции конденсирования, можно привести, например, ацетонитрил, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, метанол, этанол, 2-пропанол, тетрагидрофуран, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 5 дней, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12, R14, R1B и/или Y1 после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 представляет собой атом водорода; R4 представляет C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп из вышеуказанной группы заместителей (i); и Z представляет собой атом водорода, C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (i), -CORC, -SO2RC, -CONHRD или -C(=NR2G)NHR2H, например, может быть получен в соответствии с нижеследующими методами:


где L6 представляет собой удаляемую группу, такую как атом галогена, мезилокси группа, тозилокси группа или тому подобное; W представляет собой 2-нитрогруппу, 4-нитрогруппу или 2,4-динитрогруппу; R24 представляет собой C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (ii); R34 и соседний атом углерода образуют R24 после восстановления; оба R4B и R5B связаны с соседним атомом углерода с образованием R24, содержащим разветвленную C3-6 алкильную группу после восстановления; R4A представляет собой C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (i); Z3 представляет собой C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (ii), -COR1C, -SO2R1C, -CONHR1D или -C(=NR2G)NHR2H; ZB представляет собой C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (i), -CORC, -SO2RC, -CONHRD или -C(=NR2G)NHR2H; и L5, R1C, R1D, R2G, R2H, R2, R3, R5, R6, R12, Q, Q2, T, T2, X, Y и Y1 имеют тем же значения, как определено выше.
Процесс 7-1
Соединение, представленное вышеуказанной общей формулой (IIe) по настоящему изобретению, может быть получено из соединения, представленного вышеуказанной общей формулой (IIb), путем обработки в соответствии с нижеследующими способами 1-3.
<Способ 1>
1) Соединению, представленному вышеуказанной общей формулой (IIb), давали взаимодействовать с хлорангидридом кислоты, представленным вышеуказанной общей формулой (XXX), в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как дихлорметан, этилацетат, тетрагидрофуран, пиридин, ацетонитрил или смесь этих растворителей, обычно при температуре от 0°C до комнатной температуры в течение обычно от 30 минут до 1 дня с получением соответствующего сульфонамидного соединения.
2) Полученное сульфонамидное соединение N-алкилировали, используя алкилирующий агент, представленный вышеуказанной общей формулой (XXXI), после добавления йодида натрия по обстоятельствам в присутствии основания, такого как карбонат калия, карбонат цезия или гидрид натрия, в инертном растворителе, таком как N,N-диметилформамид, ацетон, тетрагидрофуран, ацетонитрил или смесь этих растворителей обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником в течение обычно от 1 часа до 2 дней, или полученное сульфонамидное соединение N-алкилировали, используя соединение спирта, представленное вышеуказанной общей формулой (XXXII), в присутствии дисложного эфира азодикарбоновой кислоты, такого как диэтил азодикарбоксилат или диизопропил азодикарбоксилат, и трифенилфосфина в инертном растворителе, таком как тетрагидрофуран, этилацетат, ацетонитрил или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником в течение обычно от 30 минут до 1 дня с получением соответствующего N,N-дизамещенного сульфонамидного соединения.
3-4) У полученного N,N-дизамещенного сульфонамидного соединения удаляли защиту, используя тиольный реагент, такой как меркаптоуксусная кислота или тиофенол в присутствии основания, такого как карбонат цезия или карбонат калия в инертном растворителе, таком как N,N-диметилформамид, ацетонитрил или смесь этих растворителей обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником в течение обычно от 1 часа до 1 дня с получением соответствующего вторичного аминосоединения, и защитную группу удаляли обычным способом по обстоятельствам.
<Способ 2>
Альдегидное соединение, представленное вышеуказанной общей формулой (XXXIII), или соединение кетона, представленное вышеуказанной общей формулой (XXXIV), восстановительно аминировали, используя соединение, представленное вышеуказанной общей формулой (IIb), в присутствии восстановительного агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в инертном растворителе, таком как тетрагидрофуран, 1,2-дихлорэтан, уксусная кислота или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 1 часа до 1 дня.
<Способ 3>
Соединение, представленное вышеуказанной общей формулой (IIb), N-алкилировали, используя алкилирующий агент, представленный вышеуказанной общей формулой (XXXI), после добавления йодида натрия по обстоятельствам в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазаобицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как ацетонитрил, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, метанол, этанол, 2-пропанол или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 1 часа до 5 дней.
Процесс 7-2
1) Сульфонамидное соединение, представленное вышеуказанной общей формулой (XXXV), N-алкилировали, используя соединение, представленное вышеуказанной общей формулой (XVII), в присутствии дисложного эфира азодикарбоновой кислоты, такого как диэтил азодикарбоксилат или диизопропил азодикарбоксилат, и трифенилфосфина в инертном растворителе, таком как тетрагидрофуран, этилацетат, ацетонитрил или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 30 минут до 1 дня с получением соответствующего N,N-дизамещенного сульфонамидного соединения.
2-3) У полученного N,N-дизамещенного сульфонамидного соединения удаляли защиту, используя тиольный реагент, такой как меркаптоуксусная кислота или тиофенол, в присутствии основания, такого как карбонат цезия или карбонат калия, в инертном растворителе, таком как N,N-диметилформамид, ацетонитрил или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 1 часа до 1 дня с получением соответствующего соединения вторичного амина, и защитную группу удаляли обычным способом по обстоятельствам с получением производного пиразола, представленного вышеуказанной общей формулой (IIe) по настоящему изобретению.
Процесс 7-3
Производное пиразола, представленное вышеуказанной общей формулой (If) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIe), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой в R12, R24 и/или Y1 после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Процесс 7-4
Соединение, представленное вышеуказанной общей формулой (IIf) по настоящему изобретению, может быть получено из соединения, представленного вышеуказанной общей формулой (IIe), путем обработки в соответствии с нижеследующими способами 1-6, и удалением защитной группы обычным способом по обстоятельствам.
<Способ 1>
Соединению, представленному вышеуказанной общей формулой (IIe), давали взаимодействовать с хлорангидридом кислоты, представленным вышеуказанной общей формулой (XXI) или (XXII), в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как дихлорметан, этилацетат, тетрагидрофуран, пиридин, ацетонитрил или смесь этих растворителей, обычно при температуре от 0°C до температуры кипения с обратным холодильником обычно в течение 30 минут до 1 дня.
<Способ 2>
Соединению, представленному вышеуказанной общей формулой (IIe), давали взаимодействовать с изоцианатным соединением, представленным вышеуказанной общей формулой (XXIII), в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как дихлорметан, этилацетат, тетрагидрофуран, пиридин, ацетонитрил, толуол или смесь этих растворителей, обычно при температуре от 0°C до температуры кипения с обратным холодильником обычно в течение 30 минут до 1 дня.
<Способ 3>
Соединению, представленному вышеуказанной общей формулой (IIe), давали взаимодейстовать с соединением карбоновой кислоты, представленным вышеуказанной общей формулой (XXIV), после соответственного добавления 1-гидроксибензотриазола по обстоятельствам в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида или дициклогексилкарбодиимид, и в присутствии или в отсутствие основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе таком как N,N-диметилформамид, дихлорметан или смесь этих растворителей, обычно при 0°C до температуры кипения с обратным холодильником в течение обычно от 1 часа до 2 дней.
<Способ 4>
Соединению, представленному вышеуказанной общей формулой (IIe), давали взаимодействовать с гуанидилируемым реагентом, представленным вышеуказанной общей формулой (XXV), таким как N-(бензилоксикарбонил)-1H-пиразол-1-карбоксамидин, в инертном растворителе, таком как тетрагидрофуран, метанол, этанол, толуол, N,N-диметилформамид или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение 1 часа до 5 дней.
<Способ 5>
Альдегидное соединение, представленное вышеуказанной общей формулой (XXXIII), или соединение кетона, представленное вышеуказанной общей формулой (XXXIV), восстановительно аминировали, используя соединение, представленное вышеуказанной общей формулой (IIe), в присутствии восстановительного агента, такого как цианоборгидрид натрия или триацетоксиборгидрид натрия, в инертном растворителе, таком как тетрагидрофуран, 1,2-дихлорэтан, уксусная кислота или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 1 часа до 1 дня.
<Способ 6>
Соединение, представленное вышеуказанной общей формулой (IIe), N-алкилировали, используя алкилирующий агент, представленный вышеуказанной общей формулой (XXXI), после добавления йодида натрия по обстоятельствам в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин или 1,8-диазабицикло[5.4.0]унде-7-цен, в инертном растворителе, таком как ацетонитрил, N,N-диметилформамид, диметилсульфоксид, N-метилпирролидон, метанол, этанол, 2-пропанол или смесь этих растворителей, обычно при температуре от комнатной температуры до температуры кипения с обратным холодильником обычно в течение от 1 часа до 5 дней.
Процесс 7-5
Производное пиразола, представленное вышеуказанной общей формулой (Ig) по настоящему изобретению, может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIf), и удалением защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции гидролиза, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой на R12, R24, Y1 и/или Z3 после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 представляет собой атом водорода; X представляет собой атом кислорода; Y представляет собой -CH2CH(OH)CH2-; и Z представляет собой RB, например, может быть получено в соответствии с нижеследующими методами:

где L7 представляет собой удаляемую группу, такую как атом галогена, мезилокси группа, тозилокси группа, нозилокси группа или тому подобное; и R1B, R2, R3, R4, R5, R6, R12, R14, RB, Q, Q2, T и T2 имеет те же значения, как определено выше.
Процесс 8-1
Соединение, представленное вышеуказанной общей формулой (XXXVIII), может быть получено О-алкилированием соединения, представленного вышеуказанной общей формулой (XXXVI), используя алкилирующий агент, представленный вышеуказанной общей формулой (XXXVII), после соответственного добавления катализатора межфазного переноса, такого как бромид тетра(н-бутил)аммония или тому подобное, по обстоятельствам в присутствии основания, такого как карбонат цезия, карбонат калия, гидрид натрия, гидрохлорид натрия, фторид цезия или тому подобное, в инертном растворителе. В качестве примера растворителя, используемого в O-алкилировании, можно привести, N,N-диметилформамид, ацетон, тетрагидрофуран, хлорбензол, дихлорметан, воду, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 3 дней, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 8-2
Производное пиразола, представленное вышеуказанной общей формулой (Ih) по настоящему изобретению, может быть получено путем конденсирования соединения, представленного вышеуказанной общей формулой (XXXVIII), с аминосоединением, представленным вышеуказанной общей формулой (XXIX), или его солью, в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]унде-7-цен, гидрид натрия, трет-бутоксид калия, карбонат калия или карбонат цезия в инертном растворителе, подвергая полученное соединение щелочному гидролизу, и путем удаления защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции конденсирования, можно привести, например, ацетонитрил, N,N-диметилформамид, метанол, этанол, тетрагидрофуран, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В качестве примера растворителя, используемого в гидролизе, можно привести например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидроксид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой на R12, R14 и/или R1B после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
Из соединений, представленных вышеуказанной общей формулой (I) по настоящему изобретению, соединение, где R1 и R4 представляет собой атом водорода; и Z представляет собой -C(=NCN)N(R7)R8, например, могут быть получены в соответствии с нижеследующими методами:

где R7 и R8 одинаковые или различные и каждый представляет собой атом водорода, арильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей атом галогена, гидроксигруппу, аминогруппу, C1-6 алкилсульфониламиногруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, гетероарильную группу, которая может содержать заместитель, выбранный из группы, включающей атом галогена, аминогруппу и C1-6 алкильную группу, или C1-6 алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из вышеуказанной группы заместителей (i), или оба R7 и R8 связаны с соседним атомом азота с образованием C2-6 циклической аминогруппы, которая может содержать заместитель, выбранный из группы, включающей гидроксигруппу, карбамоильную группу, C1-6 алкильную группу, оксогруппу, карбамоил(C1-6 алкил)группу, гидрокси(C1-6 алкил)группу и C1-6 алкилсульфониламино-замещенную (C1-6 алкил)группу; и R1B, R2, R3, R5, R6, R12, R14, Q, Q2, T, T2, X, Y и Y1 имеют те же значения, как определено выше.
Процесс 9-1
Соединение, представленное вышеуказанной общей формулой (XXXX), может быть получено путем конденсирования соединения представленного вышеуказанной общей формулой (IIb) с изотиоуреидатным реагентом, представленным вышеуказанной общей формулой (XXXIX), в инертном растворителе. В качестве примера растворителя, используемого в реакции конденсирования, можно привести, например, метанол, этанол, 2-пропанол, тетрагидрофуран, толуол, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции.
Процесс 9-2
Соединение, представленное вышеуказанной общей формулой (Ii) по настоящему изобретению, может быть получено путем конденсирования соединения, представленного вышеуказанной общей формулой (XXXX), с аминосоединением, представленным вышеуказанной общей формулой (XXIX) или его солью, в присутствии или в отсутствие основания, такого как триэтиламин, N,N-диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]унде-7-цен, гидрид натрия, трет-бутоксида калия, карбоната калия или карбоната цезия в инертном растворителе, подвергая полученное соединение щелочному гидролизу, и путем удаления защитной группы обычным способом по обстоятельствам. В качестве примера растворителя, используемого в реакции конденсирования, можно привести, например, метанол, этанол, ацетонитрил, 2-пропанол, N,N-диметилформамид, тетрагидрофуран, смесь этих растворителей и тому подобное. Температура реакции обычно находится в диапазоне от комнатной температуры до температуры кипения с обратным холодильником, и время реакции обычно составляет от 1 часа до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В качестве примера растворителя, используемого в гидролизе, можно привести, например, метанол, этанол, тетрагидрофуран, воду, смесь этих растворителей и тому подобное. В качестве основания можно привести, например, гидрохлорид натрия, метоксид натрия, этоксид натрия, метиламин, диметиламин и тому подобное. Температура реакции обычно находится в диапазоне от 0°C до температуры кипения с обратным холодильником, и время реакции обычно составляет от 30 минут до 1 дня, изменения основаны на использующемся исходном продукте, растворителе и температуре реакции. В случае соединений с защитной группой на R1B, R12, R14 и/или Y1 после гидролиза защитная группа может быть соответственно удалена обычным способом, как в процессе 1-9.
В случае удаления защитной группы в вышеуказанных методах получения также могут использоваться способы, отличные от описанных выше способов обычным путем.
Соединения, представленные вышеуказанной общей формулой (I) по настоящему изобретению, полученные с помощью вышеуказанных методов получения, могут быть выделены и очищены обычными способами разделения, такими как фракционная перекристаллизация, очистка с помощью хроматографии, экстракция растворителем и твердофазная экстракция.
Производные пиразола, представленные вышеуказанной общей формулой (I) по настоящему изобретению, могут быть преобразованы в их фармацевтически приемлемые соли обычным способом. Примеры таких солей включают соли добавления кислот с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислотная, серная кислотная, азотная кислотная, фосфорная кислота и тому подобное, соли добавления кислот с органическими кислотами, такими как муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, пропионовая кислотная, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, глутаминовая кислота, аспарагиновая кислота и тому подобное, соли с неорганическими основаниями, такие как соль натрия, соль калия и тому подобное, и соли с органическими основаниями, такие как N-метил-D-глюкамин, N,N'-дибензилэтилендиамин, 2-аминоэтанол, трис(гидроксиметил)аминометан, аргинин, лизин и тому подобное.
Соединения, представленные вышеуказанной общей формулой (I) по настоящему изобретению, включают сольваты с фармацевтически приемлемыми растворителями, такими как этанол и вода.
Среди производных пиразола, представленных вышеуказанной общей формулой (I) по настоящему изобретению, и из пролекарств у каждого соединения с ненасыщенной связью существуют два геометрических изомера. В настоящем изобретении могут использоваться либо цис(Z)-изомер, либо транс(E)-изомер.
Среди производных пиразола, представленных вышеуказанной общей формулой (I) по настоящему изобретению, и их пролекарст у каждого соединения, имеющего ассиметричный атом углерода, кроме глюкопиранозилокси группы или галактопиранозилокси группы, существует два оптических изомера, R-изомер и S-изомер. В настоящем изобретении может использоваться любой изомер и может использоваться смесь обоих изомеров.
Пролекарство соединения, представленного вышеуказанной общей формулой (I) по настоящему изобретению, может быть получено введением подходящей группы, образующей пролекарство, в любую одну или несколько групп, выбранных из гидроксигруппы, аминогруппы и циклической аминогруппы (например, пиразольное кольцо, пиперазиновое кольцо), соединения, представленного вышеуказанной общей формулой (I), используя соответствующий реагент, с получением пролекарства, такого как галогенидное соединение или тому подобное, обычным способом и затем соответственно выделением и очисткой обычным способом по обстоятельствам. В качестве примера группы, образующей пролекарство, используемой в гидроксигруппе или аминогруппе, можно привести, например, C2-7 ацильную группу, C1-6 алкокси-замещенную (C2-7 ацил)группу, C2-7 алкоксикарбонил-замещенную (C2-7 ацил)группу, C2-7 алкоксикарбонильную группу, арил(C2-7 алкоксикарбонил)группу, C1-6 алкокси-замещенную (C2-7 алкоксикарбонил)группу или тому подобное. В качестве примера группы, образующей пролекарство, используемой в циклической аминогруппе, можно привести, например, C2-7 ацильную группу, C1-6 алкокси-замещенную (C2-7 ацил)группу, C2-7 алкоксикарбонил-замещенную (C2-7 ацил)группу, C2-7 алкоксикарбонильную группу, арил(C2-7 алкоксикарбонил)группу, C1-6 алкокси-замещенную (C2-7 алкоксикарбонил)группу, (C2-7 ацилокси)метильную группу, 1-(C2-7 ацилокси)этильную группу, (C2-7 алкоксикарбонил)оксиметильную группу, 1-[(C2-7 алкоксикарбонил)окси]этильную группу, (C3-7 циклоалкил)оксикарбонилоксиметильную группу, 1-[(C3-7 циклоалкил)оксикарбонилокси]этильную группу или тому подобное. Термин «C1-6 алкокси-замещенная (C2-7 ацил)группа» обозначает вышеуказанную C2-7 ацильную группу, замещенную вышеуказанной C1-6 алкоксигруппой; термин «C2-7 алкоксикарбонил-замещенная (C2-7 ацил)группа» обозначает вышеуказанную C2-7 ацильную группу, замещенную вышеуказанной C2-7 алкоксикарбонильной группой; термин «C1-6 алкокси-замещенная (C2-7 алкоксикарбонил)группа» обозначает вышеуказанную C2-7 алкоксикарбонильную группу, замещенную вышеуказанной C1-6 алкоксигруппой; термин «(C2-7 ацилокси)метильная группа» обозначает гидроксиметильную группу, O-замещенную вышеуказанной C2-7 ацильной группой; термин «1-(C2-7 ацилокси)этильная группа» обозначает 1-гидроксиэтильную группу, O-замещенную вышеуказанной C2-7 ацильной группой; термин «(C2-7 алкоксикарбонил)оксиметильная группа» обозначает гидроксиметильную группу, замещенную вышеуказанной C2-7 алкоксикарбонильной группой; и термин «1-[(C2-7 алкоксикарбонил)окси]этильная группу» обозначает 1-гидроэтильную группу, O-замещенную вышеуказанной C2-7 алкоксикарбонильной группой. Более того, термин «(C3-7 циклоалкил)оксикарбонильная группа» обозначает циклическую алкоксикарбонильную группу, содержащую вышеуказанную C3-7 циклоалкильную группу; термин «(C3-7 циклоалкил)оксикарбонилоксиметильная группа» обозначает гидроксиметильную группу, O-замещенную вышеуказанной (C3-7 циклоалкил)оксикарбонильной группой; и термин «1-[(C3-7 циклоалкил)оксикарбонилокси]этильная группа» обозначает 1-гидроксиэтильную группу, O-замещенную вышеуказанной (C3-7 циклоалкил)оксикарбонильной группой. Более того, в качестве примера группы, образующей пролекарство, может быть приведена глюкопиранозильная группа или галактопиранозильная группа. Например, эти группы предпочтительно вводят в гидроксигруппу в 4 или 6 положении глюкопиранозильной группы или галактопиранозильной группы и еще более предпочтительно вводят в гидроксигруппу в 4 или 6 положении глюкопиранозильной группы.
Производные пиразола, представленные вышеуказанной общей формулой (I) по настоящему изобретению, например, демонстрируют сильную ингибиторную активность в отношении SGLT1 человека в подтверждающем эксперименте на ингибиторную активность в отношении SGLT1 человека, как описано ниже, и оказывают прекрасную ингибиторную активность в отношении увеличения уровня глюкозы в крови в подтверждающем эксперименте на ингибиторную активность в отношении увеличения уровня глюкозы в крови у крыс. Таким образом, производные пиразола, представленные вышеуказанной общей формулой (I) по настоящему изобретению, демонстрируют прекрасную ингибиторную активность в отношении SGLT1 тонкого кишечника и могут значительно ингибировать увеличение уровня глюкозы в крови и/или снижать уровень галактозы в крови, ингибируя или замедляя всасывание глюкозы и галактозы. Следовательно, фармацевтическая композиция, содержащая в качестве активного ингредиента производное пиразола, представленное вышеуказанной общей формулой (I) по настоящему изобретению, его фармацевтически приемлемую соль и пролекарство, является чрезвычайно эффективным в качестве средства для ингибирования гипергликемии после приема пищи, в качестве средства для ингибирования прогрессирования нарушенной толерантности к глюкозе (IGT) или нарушенной гликемии натощак (IFG) до диабета у пациента и в качестве средства для профилактики или лечения заболевания, связанного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, нарушенная гликемия натощак, осложнения при диабете (например, ретинопатия, нейропатия, нефропатия, язва, макроангиопатия), ожирение, гиперинсулинемия, гиперлипидемия, гиперхолестеринемия, гипертриглицеридемия, нарушенный липидный обмен, атеросклероз, гипертензия, застойная сердечная недостаточность, отек, гиперурикемия, подагра и тому подобное, которое связано с активностью SGLT1 в тонком кишечнике, и в качестве средства для профилактики или лечения заболевания, связанного с повышенным уровнем галактозы в крови, такого как галактоземия.
Более того, соединения по настоящему изобретению могут соответственно использоваться в сочетании с, по крайней мере, одним членом, выбранным из группы препаратов, отличных от ингибиторов SGLT2. Примеры препаратов, которые могут использоваться в сочетании с соединениями по настоящему изобретению, включают препарат, повышающий чувствительность к инсулину, ингибитор всасывания глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов гликозилирования, ингибитор протеинкиназы C, антагонист рецептора γ-аминомасляной кислоты, антагонист натриевых каналов, ингибитор фактора транскрипции NF-κB, ингибитор липидной пероксидазы, ингибитор N-ацетилированной-α-присоединенной-кислой-дипептидазы, инсулиноподобный фактора роста I, тромбоцитарный фактор роста (PDGF), аналог тромбоцитарного фактора роста (PDGF) (например, PDGF-AA, PDGF-BB, PDGF-AB), эпидермальный фактор роста (EGF), фактор роста нервов, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, антидиарейные средства, слабительные средства, ингибитор гидроксиметлиглутарилкоэнзим А редуктазы, производное фиброевой кислоты, агонист β3-адренорецептора, ингибитор ацил-коэнзим А-холестерин-ацилтрансферазы, пробкол, агонист рецептора тиреоидного гормона, ингибитор всасывания холестерина, ингибитор липазы, ингибитор микросомального белка - переносчика триглицеридов, ингибитор липоксигеназы, ингибитор карнитинпальмитоилтрансферазы, ингибитор скваленсинтазы, энхансер рецептора липопротеинов низкой плотности, производное никотиновой кислоты, средство, усиливающее секрецию желчных кислот, ингибитор ко-переносчика натрия/желчных кислот, ингибитор белка - переносчика холестеринового эфира, подавитель аппетита, ингибитор ангиотензин-превращающего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелин-преобразующего фермента, антагонист рецептора эндотелина, диуретическое средство, антагонист кальция, сосудорасширяющее антигипертензивное средство, симпатикоблокирующее средство, антигипертензивное средство центрального действия, агонист α2-адренорецептора, антитромбоцитарное средство, ингибитор синтеза мочевой кислоты, средство, способствующее выведению мочевой кислоты, и препарат, подщелачивающий мочу.
В случае применения соединения по настоящему изобретению в сочетании с одним или несколькими вышеуказанными препаратами настоящее изобретение относится либо к лекарственным формам для одновременного введения в виде единого препарата, либо в виде отдельных препаратов с помощью одного и того же или различных путей введения и для введения с различными интервалами введения препаратов в виде отдельных препаратов с помощью одного и того же или различных путей введения. Фармацевтическая комбинация, включающая соединение по настоящему изобретению и вышеуказанное(ые) препарат(ы), включает обе лекарственные формы, как, например, единый препарат и отдельные препараты для комбинирования, как указано выше.
Соединения по настоящему изобретению могут давать более полезные эффекты, чем эффекты суммирования, для профилактики или лечения вышеуказанных заболеваний при использовании соответственно в сочетании с вышеуказанным одним или несколькими препаратами. Кроме того, вводимая доза может быть уменьшена по сравнению с введением любого препарата самостоятельно, или можно избежать или уменьшить нежелательные эффекты одновременного введения препаратов, отличных от ингибиторов SGLT1.
Конкретные соединения в качестве лекарственных препаратов, используемые в сочетании, и предпочтительные заболевания, на которое направлено лечение, приведены в качестве примера далее. Однако настоящее изобретение не ограничивается ими, и конкретные соединения включают их свободные соединения и их или другие фармацевтически приемлемые соли.
В качестве примеров препаратов, повышающих чувствительность к инсулину, можно привести агонистов рецептора γ, активируемого пролиферацией пероксисом, таких как троглитазон, пиоглитазон гидрохлорид, розиглитазон малеат, натрий дарглитазон, GI-262570, изаглитазон, LG-100641, NC-2100, T-174, DRF-2189, CLX-0921, CS-011, GW-1929, циглитазон, натрий энглитазон и NIP-221, агонистов рецептора α, активируемого пролиферацией пероксисом, таких как GW-9578 и BM-170744, агонистов рецептора α/γ, активируемого пролиферацией пероксисом, таких как GW-409544, KRP-297, NN-622, CLX-0940, LR-90, SB-219994, DRF-4158 и DRF-MDX8, агонистов ретиноидного рецептора X, таких как ALRT-268, AGN-4204, MX-6054, AGN-194204, LG-100754 и бексаротен, и других усилителей чувствительности к инсулину, таких как регликсан, ONO-5816, MBX-102, CRE-1625, FK-614, CLX-0901, CRE-1633, NN-2344, BM-13125, BM-501050, HQL-975, CLX-0900, MBX-668, MBX-675, S-15261, GW-544, AZ-242, LY-510929, AR-H049020 и GW-501516. Препараты, повышающие чувствительность к инсулину, используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете, ожирении, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушенном метаболизме липидов или атеросклерозе и более предпочтительно при диабете, нарушенной толерантности к глюкозе или гиперинсулинемии, в силу того что они улучшают нарушенную передачу инсулинового сигнала в периферические ткани и увеличивают поступление глюкозы в ткани из крови, что приводит к снижению уровня глюкозы в крови.
В качестве примеров ингибиторов всасывания глюкозы можно привести соединения, отличные от ингибиторов SGLT1, например ингибиторы α-глюкозидазы, такие как акарбоза, воглибоза, миглитол, CKD-711, эмиглитат, MDL-25,637, камиглибоза и MDL-73945, и ингибиторы α-амилазы, такие как AZM-127. Ингибиторы всасывания глюкозы используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете, ожирении или гиперинсулинемии и более предпочтительно при нарушенной толерантности к глюкозе, в силу того что они ингибируют желудочно-кишечное ферментативное переваривание углеводов, содержащихся в пище, и ингибируют или замедляют всасывания глюкозы в организме.
В качестве примеров бигуанидов можно привести фенформин, буформин гидрохлорид, метформин гидрохлорид или тому подобное. Бигуаниды используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете или гиперинсулинемии и более предпочтительно при диабете, нарушенной толерантности к глюкозе или гиперинсулинемии, в силу того что они снижают уровень глюкозы в крови путем ингибирующего эффекта на глюконеогенез в печени, ускоряющего эффекта на анаэробный гликолиз в тканях или улучшения эффектов на резистентность к инсулину в периферических тканях.
В качестве примеров стимуляторов секреции инсулина можно привести толбутамид, хлорпропамид, толазамид, ацетогексамид, гликопирамид, глюбурид (глибенкламид), гликлазид, 1-бутил-3-метанилилмочевина, карбутамид, глиборнурид, глипизид, гликуидон, глизоксапид, глибутиазол, глибузол, глигексамид, натрий глимидин, глипинамид, фенбутамид, толцикламид, глимепирид, натеглинид, митиглинид кальций гидрат, репаглинид или тому подобное. Дополнительно, стимуляторы секреции инсулина включают активаторы глюкокиназы, например RO-28-1675. Стимуляторы секреции инсулина используют предпочтительно при диабете, нарушенной толерантности к глюкозе или осложнения при диабете, и более предпочтительно при диабете или нарушенной толерантности к глюкозе, в силу того что они снижают уровень глюкозы в крови, действуя на β-клетки поджелудочной железы и увеличивая секрецию инсулина.
В качестве примеров ингибиторов SGLT2 можно привести T-1095 и соединения, описанные в японской патентной публикации №№ Hei10-237089 и 2001-288178 и в международных публикациях №№ WO01/16147, WO01/27128, WO01/68660, WO01/74834, WO01/74835, WO02/28872, WO02/36602, WO02/44192, WO02/53573 и тому подобное. Ингибиторы SGLT2 используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете, ожирении или гиперинсулинемии и более предпочтительно при диабете, нарушенной толерантности к глюкозе, ожирении или гиперинсулинемии, в силу того что они снижают уровень глюкозы в крови, ингибируя реабсорбцию глюкозы в проксимальных канальцах почек.
В качестве примеров инсулина или аналогов инсулина можно привести человеческий инсулин, инсулин животного происхождения, аналоги человеческого инсулина или инсулина животного происхождения или тому подобное. Эти препараты используют предпочтительно при диабете, нарушенной толерантности к глюкозе или осложнениях при диабете и более предпочтительно при диабете или нарушенной толерантности к глюкозе.
В качестве примеров антагонистов рецептора глюкагона можно привести BAY-27-9955, NNC-92-1687 или тому подобное; в качестве примеров стимуляторов киназы рецептора инсулина можно привести TER-17411, L-783281, KRX-613 или тому подобное; в качестве примеров ингибиторов трипептидилпептидазы II можно привести UCL-1397 или тому подобное; в качестве примеров ингибиторов дипептидилпептидазы IV можно привести NVP-DPP728A, TSL-225, P-32/98 или тому подобное; в качестве примеров ингибиторов протеинтирозинфосфатазы 1B можно привести PTP-112, OC-86839, PNU-177496 или тому подобное; в качестве примеров ингибиторов гликогенфосфорилазы можно привести NN-4201, CP-368296 или тому подобное; в качестве примера ингибиторов фруктозобисфосфатазы можно привести R-132917 или тому подобное; в качестве примера ингибиторов пируватдегидрогеназы можно привести AZD-7545 или тому подобное; в качестве примера ингибиторов глюконеогенеза в печени можно привести FR-225659 или тому подобное; в качестве примеров аналогов глюкагоноподобного пептида-1 можно привести эксендин-4, CJC-1131 или тому подобное; в качестве примеров агонистов глюкагоноподобного пептида 1 можно привести AZM-134, LY-315902 или тому подобное; и в качестве примера амилина, аналогов амилина или агонистов амилина можно привести прамлинтид ацетат или тому подобное. Эти препараты, ингибиторы глюкоза-6-фосфатазы, D-хироинзитол, ингибиторы гликогенсинтазы-киназы-3 и глюкагоноподобный пептид-1 используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете или гиперинсулинемии и более предпочтительно при диабете или нарушенной толерантности к глюкозе.
В качестве примеров ингибиторов альдозоредуктазы можно привести аскорбил гамоленат, толрестат, эпалрестат, ADN-138, BAL-ARI8, ZD-5522, ADN-311, GP-1447, IDD-598, фидарестат, сорбинил, поналрестат, ризарестат, зенарестат, миналрестат, метосорбинил, AL-1567, имирестат, M-16209, TAT, AD-5467, зополрестат, AS-3201, NZ-314, SG-210, JTT-811, линдолрестат или тому подобное. Ингибиторы альдозоредуктазы предпочтительно используют при осложнениях диабета, в силу того что они ингибируют альдозоредуктазу и снижают чрезмерное внутриклеточное накопление сорбитола в активированном полиоловом пути, которое возникает при продолжительном гипергликемическом состоянии в тканях при осложнениях диабета.
В качестве примеров ингибиторов образования конечных продуктов гликозилирования можно привести пиридоксамин, OPB-9195, ALT-946, ALT-711, пимагедин гидрохлорид или тому подобное. Ингибиторы образования конечных продуктов гликозилирования предпочтительно используют при осложнениях диабета, в силу того что они ингибируют образование продуктов повышенного гликозилирования, которые образуются при продолжительном гипергликемическом состоянии при диабете, и уменьшают повреждение клетки.
В качестве примеров ингибиторов протеинкиназы C можно привести LY-333531, мидостаурин или тому подобное. Ингибиторы протеинкиназы C предпочтительно используют при осложнениях диабета, в силу того что они ингибируют активность протеинкиназы C, которая активируется при продолжительном гипергликемическом состоянии при диабете.
В качестве примеров антагонистов рецептора γ-аминомасляной кислоты можно привести топирамат или тому подобное; в качестве примеров антагонистов натриевых каналов можно привести мексилетин гидрохлорид, окскарбазепин или тому подобное; в качестве примера ингибиторов фактора транскрипции NF-κB можно привести декслипотам или тому подобное; в качестве примера ингибиторов липидной пероксидазы можно привести тирилазад мезилат или тому подобное; в качестве примера ингибиторов N-ацетилированной-α-присоединенной-кислой-дипептидазы можно привести GPI-5693 или тому подобное; и в качестве примеров производных карнитина можно привести карнитин, левацекарнин гидрохлорид, левокарнитин хлорид, левокарнитин, ST-261 или тому подобное. Эти препараты, инсулиноподобный фактор роста-I, тромбоцитарный фактора роста, аналог тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервов, уридин, 5-гидрокси-1-метилнидантоин, EGB-761, бимокломол, сулодексид и Y-128 предпочтительно используют при осложнениях диабета.
Примерами антидиарейных или слабительных средств являются поликарбофил кальция, таннальбин, основной азотнокислый висмут или тому подобное. Эти препараты предпочтительно используют при диарее, запоре или тому подобное, сопровождающих диабет или тому подобное.
Примерами ингибиторов редуктазы гидроксиметилглютарил коэнзима-А являются натрий церивастатин, натрий правастатин, ловастатин, симвастатин, натрий флуфастатин, аторвастатин кальций гидрат, SC-45355, SQ-33600, CP-83101, BB-476, L-669262, S-2468, DMP-565, U-20685, BAY-x-2678, BAY-10-2987, кальций питавастатин, кальций розувастатин, колестолон, далвастатин, ацитемат, мевастатин, крилвастатин, BMS-180431, BMY-21950, гленвастатин, карвастатин, BMY-22089, бервастатин или тому подобное. Ингибиторы редуктазы гидроксиметилглютарил коэнзима-А используют предпочтительно при гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушенном липидном метаболизме или атеросклерозе и более предпочтительно при гиперлипидемии, гиперхолистеринемии или атеросклерозе, в силу того что они снижают уровни холестерина в крови, ингибируя гидроксиметилглутарилкоэнзим A редуктазу.
В качестве примеров производных фиброевой кислоты можно привести безафибрат, беклобрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат, алюминий клофибрат, клофиброевую кислоту, этофибрат, фенофибрат, гемфиброзил, никофибрат, пирифибрат, ронифибрат, симфибрат, теофибрат, AHL-157 или тому подобное. Производные фиброевой кислоты используют предпочтительно при гиперинсулинемии, гиперлипидемии, гиперхолистеринемии, гипертриглицеридемии, нарушении липидного метаболизма или атеросклероза и более предпочтительно при гиперлипидемии, гипертриглицеридемии или атеросклерозе, в силу того что они активируют липопротеиновую липазу в печени и усиливают окисление жирных кислоты, что приводит к уменьшению уровня триглицеридов в крови.
В качестве примеров агонистов β3-адренорецепторов можно привести BRL-28410, SR-58611A, ICI-198157, ZD-2079, BMS-194449, BRL-37344, CP-331679, CP-114271, L-750355, BMS-187413, SR-59062A, BMS-210285, LY-377604, SWR-0342SA, AZ-40140, SB-226552, D-7114, BRL-35135, FR-149175, BRL-26830A, CL-316243, AJ-9677, GW-427353, N-5984, GW-2696, YM178 или тому подобное. Агонисты β3-адренорецепторов используют предпочтительно при ожирении, гиперинсулинемии, гиперлипидемии, гиперхолистеринемии, гипертриглицеридемии или нарушенном липидном метаболизме и более предпочтительно при ожирении или гиперинсулинемии, в силу того что они стимулируют β3-адренорецепторы в жировой ткани и усиливают окисление жирных кислот, что приводит к индукции потребления энергии.
В качестве примеров ингибиторов ацил-коэнзим A холестеринацилтрансферазы можно привести NTE-122, MCC-147, PD-132301-2, DUP-129, U-73482, U-76807, RP-70676, P-06139, CP-113818, RP-73163, FR-129169, FY-038, EAB-309, KY-455, LS-3115, FR-145237, T-2591, J-104127, R-755, FCE-28654, YIC-C8-434, авацимиб, CI-976, RP-64477, F-1394, элдацимиб, CS-505, CL-283546, YM-17E, лецимибид, 447C88, YM-750, E-5324, KW-3033, HL-004, эфлюцимиб или тому подобное. Ингибиторы ацил-коэнзим A холестеринацилтрансферазы используют предпочтительно при гиперлипидемии, гиперхолистеринемии, гипертриглицеридемии или нарушении липидного метаболизма и более предпочтительно при гиперлипидемии или гиперхолистеринемии, в силу того что они снижают уровень холестерина в крови, ингибируя ацил-коэнзим A холестеринацилтрансферазу.
В качестве примеров агонистов рецептора тиреоидного гормона можно привести натрий лиотиронин, натрий левотироксин, KB-2611 или тому подобное; в качестве примеров ингибиторов всасывания холестерина можно привести эзетимиб, SCH-48461 или тому подобное; в качестве примеров ингибиторов липазы можно привести орлистат, ATL-962, AZM-131, RED-103004 или тому подобное; в качестве примера ингибиторов карнитинпальмитоилтрансферазы можно привести этомоксир или тому подобное; в качестве примеров ингибиторов скавленсинтазы можно привести SDZ-268-198, BMS-188494, A-87049, RPR-101821, ZD-9720, RPR-107393, ER-27856 или тому подобное; в качестве примеров производных никотиновой кислоты можно привести никотиновую кислоту, никотинамид, никомол, ницеритрол, аципимокс, никорандил или тому подобное; в качестве примеров средств, усиливающих секрецию желчных кислот, можно привести колестирамин, колестилан, колесевелам гидрохлорид, GT-102-279 или тому подобное; в качестве примеров ингибиторов ко-переносчика натрия/желчных кислот можно привести 264W94, S-8921, SD-5613 или тому подобное; и в качестве примеров ингибиторов белка - переносчика холестеринового эфира можно привести PNU-107368E, SC-795, JTT-705, CP-529414 или тому подобное. Эти препараты, пробкол, ингибиторы микросомального белка - переносчика триглицеридов, ингибиторы липоксигеназы и энхансеры рецептора липопротеинов низкой плотности предпочтительно используют при гиперлипидемии, гиперхолистеринемии, гипертриглицеридемии или нарушении липидного метаболизма.
В качестве примеров подавителей аппетита можно привести ингибиторов обратного захвата моноаминов, ингибиторов обратного захвата серотонина, стимуляторов высвобождения серотонина, агонистов серотонина (особенно 5HT2C-агонисты), ингибиторов обратного захвата норадреналина, стимуляторов высвобождения норадреналина, агонистов α1-адренорецептора, агонистов β2-адренорецепторов, агонистов допамина, антагонистов каннабиоидного рецептора, антагонистов γ-аминомасляной кислоты, антагонистов H3-гистамина, L-гистидин, лептин, аналоги лептина, агонистов рецептора лептина, агонистов рецептора меланокортина (особенно, агонисты MC3-R, агонисты MC4-R), α-меланоцитстимулирующий гормон, кокаин- и амфетамин-регулируемый транскрипт, белок красного дерева, агонистов энтеростатина, кальцитонин, кальцитонин-ген-регулируемый пептид, бомбезин, агонистов холецитокинина (особенно агонисты CCK-A), кортиколиберин, аналоги кортиколиберина, агонисты кортиколиберина, урокортин, соматостатин, аналоги соматостатина, агонисты рецептора соматостатина, пептид гипофиза, активирующий аденилатциклазу, нейротрофический фактор мозгового происхождения, цилиарный нейротрофический фактор, тиролиберин, нейротензин, sauvagine, антагонисты нейропептида Y, антагонисты опиоидного пептида, антагонисты галанина, антагонисты меланин-концентрирующего гормона, ингибиторы агути-связанного белка и антагонисты орексинового рецептора. Конкретно в качестве примера ингибиторов обратного захвата моноамина можно привести мазиндол или тому подобное; в качестве примера ингибиторов обратного захвата серотонина можно привести дексефенфлурамин гидрохлорид, фенфлурамин, сибутрамин гидрохлорид, флувоксамин малеат, сертралин гидрохлорид или тому подобное; в качестве примера агонистов серотонина можно привести инотриптан, (+)-норфенфлурамин или тому подобное; в качестве примера ингибиторов обратного захвата норадреналина можно привести бупропион, GW-320659 или тому подобное; в качестве примера стимуляторов высвобождения норадреналина можно привести ролипрам, YM-992 или тому подобное; в качестве примера агонистов β2-адренорецепторов можно привести амфетамин, декстроамфетамин, фентермин, бензфетамин, метамфетамин, фендиметразин, фенметразин, диэтилпропион, фенилпропаноламин, клобензорекс или тому подобное; в качестве примера агонистов допамина можно привести ER-230, допрексин, бромкриптин мезилат или тому подобное; в качестве примера антагонистов каннабиноидного рецептора можно привести римонабант или тому подобное; в качестве примера антагонистов γ-аминомасляной кислоты можно привести топирамат или тому подобное; в качестве примера антагонистов H3-гистамина можно привести GT-2394 или тому подобное; в качестве примера лептина, аналогов лептина или агонистов рецептора лептина можно привести LY-355101 или тому подобное; в качестве примера агонистов холецистокинина (особенно агонистов CCK-A) можно привести SR-146131, SSR-125180, BP-3.200, A-71623, FPL-15849, GI-248573, GW-7178, GI-181771, GW-7854, A-71378 или тому подобное; и в качестве примера антагонистов нейропептида Y можно привести SR-120819-A, PD-160170, NGD-95-1, BIBP-3226, 1229-U-91, CGP-71683, BIBO-3304, CP-671906-01, J-115814 или тому подобное. Подавители аппетита используют предпочтительно при диабете, нарушенной толерантности к глюкозе, осложнениях при диабете, ожирении, гиперлипидемии, гиперхолистеринемии, гипертриглицеридемии, нарушенном липидном метаболизме, атеросклерозе, гипертензии, застойной сердечной недостаточности, водянке, гиперурикимии или подагре и более предпочтительно при ожирении, в силу того что они стимулируют или ингибируют активность внутримозговых моноаминов или биоактивных пептидов в центральной системе регуляции аппетита и подавляют аппетит, что приводит к снижению потребления энергии.
В качестве ингибиторов ангиотензин-превращающего фермента можно привести каптоприл, эналаприл малеат, алацеприл, делаприл гидрохлорид, рамиприл, лизиноприл, имидаприл гидрохлорид, беназеприл гидрохлорид, церонаприл моногидрат, цилазаприл, натрий фозиноприл, перинодоприл эрбумин, кальций мовелтиприл, квинаприл гидрохлорид, спираприл гидрохлорид, темокаприл гидрохлорид, трандолаприл, кальций зофеноприл, моэксиприл гидрохлорид, рентиаприл или тому подобное. Ингибиторы ангиотензин-превращающего фермента предпочтительно используют при осложнениях при диабете или гипертензии.
В качестве примеров ингибиторов нейтральной эндопептидазы можно привести омапатрилат, MDL-100240, фазидотрил, сампатрилат, GW-660511X, миксанприл, SA-7060, E-4030, SLV-306, экадотрил или тому подобное. Ингибиторы нейтральной эндопептидазы предпочтительно используют при осложнениях диабета или гипертензии.
В качестве примеров антагонистов рецептора ангиотензина II можно привести кандезартан цилексетил, кандезартан цилексетил/гидрохлортиазид, калий лозартан, эпрозартан мезилат, валзартан, телмизартан, ирбезартан, EXP-3174, L-158809, EXP-3312, олмезартан, тазозартан, KT-3-671, GA-0113, RU-64276, EMD-90423, BR-9701 или тому подобное. Антагонисты рецептора ангиотензина II предпочтительно используют при осложнениях диабета или гипертензии.
В качестве примеров ингибитор эндотелин-преобразующего фермента можно привести CGS-31447, CGS-35066, SM-19712 или тому подобное; в качестве примера антагонистов рецептора эндотелина можно привести L-749805, TBC-3214, BMS-182874, BQ-610, TA-0201, SB-215355, PD-180988, натрий зитаксентан, BMS-193884, дарузентан, TBC-3711, бозентан, натрий тезозентан, J-104132, YM-598, S-0139, SB-234551, RPR-118031A, ATZ-1993, RO-61-1790, ABT-546, энлазентан, BMS-207940 или тому подобное. Эти препараты используют предпочтительно при осложнениях диабета или гипертензии и более предпочтительно при гипертензии.
В качестве примеров диуретических средств можно привести хлортиалидон, метолазон, циклопентиазид, трихлорметиазид, гидрохлортиазид, гидрофлуметиазид, бензилгидрохлортиазид, пенфлутизид, метиклотиазид, индапамид, трипамид, мефрузид, азоземид, этакриновую кислоту, тораземид, пиретанид, фуросемид, буметанид, метикран, калий канреноат, спиронолактон, триамтерен, аминофиллин, циклетанин гидрохлорид, LLU-α, PNU-80873A, изосорбид, D-маннитол, D-сорбитол, фруктозу, глицерин, ацетазоламид, метазоламид, FR-179544, OPC-31260, ликсиваптан, кониваптан гидрохлорид или тому подобное. Диуретические препараты используют предпочтительно при осложнениях диабета, гипертензии, застойной сердечной недостаточности или отеке и более предпочтительно при гипертензии, застойной сердечной недостаточности или отеке, в силу того что они снижают кровеносное давление или снижают отек, повышая мочевыделение.
В качестве примеров антагонистов кальция можно привести аранидипин, эфонидипин гидрохлорид, никардипин гидрохлорид, барнидипин гидрохлорид, бенидипин гидрохлорид, манидипин гидрохлорид, цилпидипин, низолдипин, нитрендипин, нифедипин, нилвадипин, фелодипин, амлодипин, безилат, пранидипин, лерканидипин гидрохлорид, израдипин, элгодипин, азелнипидипин, лацидипин, ватанидипин гидрохлорид, лемилдипин, дилтиазем гидрохлорид, клентиазем малеат, верапамил гидрохлорид, S-верапамил, фасудил гидрохлорид, бепридил гидрохлорид, галлопамил гидрохлорид или тому подобное; в качестве примеров сосудорасширяющех антигипертензивных средств можно привести андапамид, тодралазин гидрохлорид, гидралазин гидрохлорид, кадралазин, будралазин или тому подобное; в качестве примера симпатикоблокирующех средств можно привести амосулалол гидрохлорид, теразозин гидрохлорид, буназозин гидрохлорид, празозин гидрохлорид, доксазозин мезилат, пропранолол гидрохлорид, атенолол, метопролол тартрат, карведилол, нипрадилол, целипролол гидрохлорид, небиволол, бетаксолол гидрохлорид, пиндолол, тертатолол гидрохлорид, бевантолол гидрохлорид, тимолол малеат, картеолол гидрохлорид, бисопролол гемифумарат, бопиндолол малонат, нипрадилол, пенбутолол сульфат, ацетобутолол гидрохлорид, тилизолол гидрохлорид, надолол, урапидил, индорамин или тому подобное; в качестве примеров антигипертензивных средств центрального действия можно привести резерпин или тому подобное; и в качестве примеров агонистов α2-адренорецепторов можно привести клонидин гидрохлорид, метилдопа, CHF-1035, гуанабенз ацетат, гуанфацин гидрохлорид, моксонидин, лофексидин, талипексол гидрохлорид или тому подобное. Эти препараты предпочтительно используют при гипертензии.
В качестве примеров антитромбоцитарных средств можно привести тиклопидин гидрохлорид, дипиридамол, цилостазол, этил икозапентат, сарпогрелат гидрохлорид, дилазеп дигидрохлорид, трапидил, берапрост натрия, аспирин или тому подобное. Антитромбоцитарные средства предпочтительно используют при атеросклерозе или застойной сердечной недостаточности.
В качестве примеров ингибиторов синтеза мочевой кислоты можно привести аллопуринол, оксипуринол или тому подобное; в качестве примера средств, способствующих выведению мочевой кислоты, можно привести бензбромарон, пробенецид или тому подобное; и в качестве примеров препаратов, защелачивающих мочу, можно привести натрий гидрокарбонат, калий цитрат, натрий цитрат или тому подобное. Эти препараты предпочтительно используются при гиперурикимии или подагре.
В случае применения комбинации с препаратами, отличными от ингибиторов SGLT2, например, при применении при диабете, предпочтительным является комбинация с, по крайней мере, одним членом группы, включающей препарат, повышающий чувствительность к инсулину, ингибитор всасывания глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина, агонист амилина и подавитель аппетита; более предпочтительной является комбинация с, по крайней мере, одним членом группы, включающей препарат, повышающий чувствительность к инсулину, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина или агонист амилина; и наиболее предпочтительной является комбинация с, по крайней мере, одним членом группы, включающей препарат, повышающий чувствительность к инсулину, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2 и инсулин или аналог инсулина. Аналогично при применении при осложнениях диабета предпочтительной является комбинация с, по крайней мере, одним членом группы, включающей препарат, повышающий чувствительность к инсулину, ингибитор всасывания глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов гликозилирования, ингибитор протеинкиназы C, антагонист рецептор γ-аминомасляной кислоты, антагонист натриевых каналов, ингибитор фактора транскрипции NF-κB, ингибитор липидной пероксидазы, ингибитор N-ацетилированной-α-присоединенной-кислой-дипептидазы, инсулиноподобный фактор роста I, тромбоцитарный фактор роста, аналог тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервов, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, ингибитор ангиотензин-превращающего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелин-преобразующего фермента, антагонист рецептора эндотелина и диуретическое средств; и более предпочтительной является комбинация с, по крайней мере, одним членом из группы, включающей ингибитор альдозоредуктазы, ингибитор ангиотензин-превращающего фермента, ингибитор нейтральной эндопептидазы и антагонист рецептора ангиотензина II. Более того, при применении при ожирении предпочтительной является композиция с, по крайней мере, одним членом группы, включающей препарат, повышающий чувствительность к инсулину, ингибитор всасывания глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или аналог инсулина, антагонист рецептора глюкагона, стимулятор киназы рецептора инсулина, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеинтирозинфосфатазы-1B, ингибитор гликогенфосфорилазы, ингибитор глюкоза-6-фосфатазы, ингибитор фруктозобисфосфатазы, ингибитор пируватдегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинзитол, ингибитор гликогенсинтазы-киназы-3, глюкагоноподобный пептид-1, аналог глюкагоноподобного пептида-1, агонист глюкагоноподобного пептида-1, амилин, аналог амилина, агонист амилина, агонист β3-адренорецептора и подавитель аппетита; и наиболее предпочтительным является комбинация с, по крайней мере, одним членом из группы, включающей ингибитор SGLT2, агонист β3-адренорецептора и подавитель аппетита.
Если фармацевтические композиции по настоящему изобретению используют для практического применения, то в зависимости от их применения используются различные лекарственные формы. В качестве примеров лекарственных форм, которые вводятся перорально или парентерально, можно привести порошки, гранулы, мелкие гранулы, сухие сиропы, таблетки, капсулы, инъекции, растворы, мази, суппозитории, компрессы и тому подобное. Фармацевтические композиции по настоящему изобретению также включают в себя лекарственный состав с замедленным высвобождением, включая лекарственный состав для всасывания слизистой желудочно-кишечного тракта (например, как в международных публикациях №№ WO99/10010, WO99/26606, и японской патентной публикации № 2001-2567).
Эти фармацевтические композиции могут быть получены путем смешивания или разбавления или растворения с соответствующей фармацевтической добавкой, такой как инертные наполнители, разрыхлители, связующие вещества, смазывающие вещества, разбавители, буферы, вещества для достижения изотоничности, антисептики, увлажняющие вещества, эмульгирующие вещества, диспергирующие средства, стабилизаторы, вспомогательные агенты для растворения и тому подобное, и образования смеси в соответствии с обычными способами. В случае применения соединения по настоящему изобретению в сочетании с препаратом(ами), отличными от ингибиторов SGLT1, они могут быть получены путем составления рецептуры каждого активного ингредиента вместе или по отдельности.
Если фармацевтические композиции по настоящему изобретению используют для практического применения, то дозу соединения, представленного вышеуказанной общей формулой (I), его фармацевтически приемлемой соли или пролекарства в качестве активного ингредиента соответственно определяют в зависимости от возраста, пола, массы тела и выраженности симптомов и лечения каждого пациента и она находится в диапазоне приблизительно от 0,1 до 1,000 мг в день для взрослого человека в случае перорального введения и находится в диапазоне приблизительно от 0,01 до 300 мг в день для взрослого человека в случае парентерального применения и суточная доза может быть разделена на несколько доз в день и вводиться соответствующим образом. Также в случае применения соединения по настоящему изобретению в сочетании с препаратом(амии), отличными от ингибиторов SGLT1, доза соединения по настоящему изобретению может быть уменьшена в зависимости от дозы препарата(ов), отличных от ингибиторов SGLT1.
Примеры
Настоящее изобретение далее проиллюстрировано более подробно с помощью нижеследующих ссылочных примеров, примеров и экспериментальных примеров. Однако настоящее изобретение ими не ограничено.
Ссылочный пример 1
2-Амино-2-метилпропионамид
К раствору 2-бензилоксикарбониламино-2-метилпропионовой кислоты (1 г) в N,N-диметилформамиде (10 мл) добавляли 1-гидроксибензотриазол (0,63 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,21 г), триэтиламин (1,76 мл) и 28% водный раствор аммония (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатомом. Органический слой последовательно промывали 0,5 моль/л хлористоводородной кислотой, водой, 1 моль/л водным раствором гидрохлорида натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 2-бензилоксикарбониламино-2-метилпропионамида (0,26 г). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (30 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,11 г).
1H-ЯМР (ДМСO-d6) δ м.д.: 1,15 (6H, с), 1,9 (2H, ушир.с), 6,83 (1H, ушир.с), 7,26 (1H, ушир.с).
Ссылочный пример 2
2-(2-Нитробензолсульфониламино)ацетоамид
К суспензии гидрохлорида глицинамида (0,11 г) и триэтиламина (0,35 мл) в дихлорметане (3 мл) добавляли хлорид 2-нитробензолсульфонила (0,27 г) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в 0,5 моль/л хлористоводородную кислоту и полученную смесь экстрагировали этилацетатомом. Органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматграфией на колонке с силикагелем (элюент: дихлорметан/метанол = 20/1) с получением соединения, указанного в заголовке (72 мг).
1H-ЯМР (ДМСO-d6) δ м.д.: 3,57 (2H, д, J=5,9 Гц), 7,1 (1H, ушир.с), 7,33 (1H, ушир.с), 7,8-7,9 (2H, м), 7,95-8,1 (2H, м), 8,16 (1H, т, J=5,9 Гц).
Ссылочный пример 3
(S)-2-(2-Нитробензолсульфониламино)пропионамид
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 2, используя гидрохлорид L-аланинамида вместо гидрохлорида глицинамида.
1H-ЯМР (СD3OD) δ м.д.: 1,33 (3H, д, J=7,1 Гц), 4,03 (1H, кв, J=7,1 Гц), 7,75-7,85 (2H, м), 7,85-7,9 (1H, м), 8,05-8,15 (1H, м).
Ссылочный пример 4
2-Метил-2-(2-нитробензолсульфониламино)пропионамид
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 2, используя 2-амино-2-метилпропионамид вместо гидрохлорид глицинамида.
1H-ЯМР (ДМСO-d6) δ м.д.: 1,32 (6H, с), 7,2-7,3 (2H, м), 7,8-7,9 (2H, м), 7,92 (1H, с), 7,95-8,0 (1H, м), 8,05-8,15 (1H, м).
Ссылочный пример 5
3-(2-Нитробензолсульфониламино)пропионамид
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 2, используя гидрохлорид 3-аминопропионамид вместо гидрохлорида глицинамида.
1H-ЯМР (ДМСO-d6) δ м.д.: 2,27 (2H, т, J=7,3 Гц), 3,0-3,15 (2H, м), 6,85 (1H, ушир.с), 7,34 (1H, ушир.с), 7,8-7,9 (2H, м), 7,95-8,05 (3H, м).
Ссылочный пример 6
[4-(3-Бензилоксипропокси)фенил]метанол
К раствору 4-гидроксибензальдегида (2,44 г) в N,N-диметилформамиде (20 мл) добавляли карбонат цезия (7,17 г), бензил 3-бромпропиловый эфир (4,81 г) и каталитическое количество йодида натрия и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 4-(3-бензилоксипропокси)бензальдегида. Это вещество растворяли в этаноле (20 мл). К раствору добавляли боргидрид натрия (757 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли метанол и полученную смесь концентрировали при пониженном давлении. К остатку добавляли воду и смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 5/1 - 2/1) с получением соединения, указанного в заголовке (5,17 г).
1H-ЯМР (CDCl3) δ м.д.: 1,54 (1H, т, J=5,9 Гц), 2,05-2,15 (2H, м), 3,66 (2H, т, J=6,2 Гц), 4,09 (2H, т, J=6,2 Гц), 4,52 (2H, с), 4,61 (2H, д, J=5,9 Гц), 6,85-6,95 (2H, м), 7,2-7,35 (7H, м).
Ссылочный пример 7
[4-(2-Бензилоксиэтокси)фенил]метанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 6, используя бензил 2-бромэтиловый эфир вместо бензил 3-бромпропилового эфира.
1H-ЯМР (CDCl3) δ м.д.: 1,53 (1H, т, J=5,8 Гц), 3,8-3,85 (2H, м), 4,1-4,2 (2H, м), 4,62 (2H, д, J=5,8 Гц), 4,64 (2H, с), 6,85-6,95 (2H, м), 7,25-7,4 (7H, м).
Ссылочный пример 8
[4-(4-Бензилоксибутокси)фенил]метанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 6, используя бензил 4-бромбутиловый эфир вместо бензил 3-бромпропилового эфира.
1H-ЯМР (CDCl3) δ м.д.: 1,52 (1H, т, J=5,6 Гц), 1,75-1,95 (4H, м), 3,54 (2H, т, J=6,1 Гц), 3,98 (2H, т, J=6,3 Гц), 4,52 (2H, с), 4,61 (2H, д, J=5,6 Гц), 6,8-6,9 (2H, м), 7,2-7,4 (7H, м).
Ссылочный пример 9
[4-(3-Бензилоксипропокси)-2-метилфенил]метанол
К раствору 4-бром-3-метилфенола (2,5 г) в N,N-диметилформамиде (10 мл) добавляли карбонат цезия (4,79 г), бензил 3-бромпропиловый эфир (2,48 мл) и каталитическое количество йодида натрия и смесь перемешивали при комнатной температуре в течение 60 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 4-(3-бензилоксипропокси)-1-бром-2-метилбензола. Это вещество растворяли в тетрагидрофуране (100 мл). К раствору добавляли н-бутил лития (2,46 моль/л раствор н-гексана, 6 мл) при -78°C в атмосфере аргона и смесь перемешивали в течение 5 минут. В реакционную смесь добавляли N,N-диметилформамид (2,57 мл) и смесь оставляли нагреваться до 0°C и перемешивали в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 4-(3-бензилоксипропокси)-2-метилбензальдегида. Это вещество растворяли в этаноле (40 мл). К раствору добавляли боргидрид натрия (506 мг) и смесь перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли метанол и полученную смесь концентрировали при пониженном давлении. К остатку добавляли воду и смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 5/1 - 1,5/1) с получением соединения, указанного в заголовке (3,33 г).
1H-ЯМР (CDCl3) δ м.д.: 1,37 (1H, т, J=5,7 Гц), 2,0-2,15 (2H, м), 2,36 (3H, с), 3,66 (2Н, т, J=6,2 Гц), 4,08 (2H, т, J=6,3 Гц), 4,52 (2H, с), 4,63 (2H, д, J=5,7 Гц), 6,65-6,8 (2H, м), 7,15-7,4 (6H, м).
Ссылочный пример 10
[4-(2-Бензилоксиэтокси)-2-метилфенил]метанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 9, используя бензил 2-бромэтиловый эфир вместо бензил 3-бромпропилового эфира.
1H-ЯМР (CDCl3) δ м.д.: 1,39 (1H, т, J=5,8 Гц), 2,35 (3H, с), 3,8-3,85 (2H, м), 4,1-4,2 (2H, м), 4,6-4,65 (4H, м), 6,73 (1H, дд, J=8,2 Гц, 2,6 Гц), 6,78 (1H, д, J=2,6 Гц), 7,22 (1H, д, J=8,2 Гц), 7,25-7,4 (5H, м).
Ссылочный пример 11
4-{[4-(3-Бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
К раствору [4-(3-бензилоксипропокси)фенил]метанола (5,17 г) в тетрагидрофуране (25 мл) добавляли триэтиламин (3,04 мл) и метансульфонил хлорид (1,62 мл) при охлаждении на льду и смесь перемешивали в течение одного часа. Нерастворимое вещество удаляли фильтрацией. Полученный раствор [4-(3-бензилоксипропокси)фенил]метил мезилата в тетрагидрофуране добавляли к суспензии гидрида натрия (60%, 875 мг) и этил 4-метил-3-оксопентаноата (3,3 г) в тетрагидрофуране (50 мл) и смесь кипятили с обратным холодильником в течение 8 часов. К реакционной смеси добавляли 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении. К раствору остатка в толуоле (10 мл) добавляли моногидрат гидразина (2,76 мл) и смесь перемешивали при 100°C в течение ночи. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 50/1 - 20/1) с получением соединения, указанного в заголовке (5,22 г).
1H-ЯМР (CDCl3) δ м.д.: 1,14 (6H, д, J=6,8 Гц), 2,0-2,1 (2H, м), 2,8-2,95 (1H, м), 3,6-3,7 (4H, м), 4,04 (2H, т, J=6,5 Гц), 4,51 (2H, с), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м), 7,2-7,35 (5H, м).
Ссылочный пример 12
4-{[4-(2-Бензилоксиэтокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-(2-бензилоксиэтокси)фенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (CDCl3) δ м.д.: 1,14 (6H, д, J=7,3 Гц), 2,8-2,95 (1H, м), 3,66 (2H, с), 3,75-3,85 (2H, м), 4,05-4,15 (2H, м), 4,62 (2H, с), 6,75-6,85 (2H, м), 7,1-7,15 (2H, м), 7,25-7,4 (5H, м).
Ссылочный пример 13
4-{[4-(4-Бензилоксибутокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-(4-бензилоксибутокси)фенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (CDCl3) δ м.д.: 1,14 (6H, д, J=7,0 Гц), 1,7-1,9 (4H, м), 2,8-2,95 (1H, м), 3,53 (2H, т, J=6,1 Гц), 3,66 (2H, с), 3,93 (2H, т, J=6,3 Гц), 4,51 (2H, с), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м), 7,2-7,35 (5H, м).
Ссылочный пример 14
4-{[4-(3-Бензилоксипропокси)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-(3-бензилоксипропокси)-2-метилфенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (ДМСO-d6) δ м.д.: 1,04 (6H, д, J=7,0 Гц), 1,9-2,0 (2H, м), 2,24 (3H, с), 2,65-2,8 (1H, м), 3,44 (2H, с), 3,56 (2H, т, J=6,4 Гц), 3,97 (2H, т, J=6,1 Гц), 4,47 (2Н, с), 6,6 (1Н, дд, J=8,6 Гц, 2,6 Гц), 6,69 (1H, д, J=2,6 Гц), 6,78 (1H, д, J=8,6 Гц), 7,2-7,35 (5H, м).
Ссылочный пример 15
4-[(4-Бензилоксифенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя (4-бензилоксифенил)метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (ДМСO-d6) δ м.д.: 1,06 (6H, д, J=6,8 Гц), 2,75-2,9 (1H, м), 3,5 (2H, с), 5,03 (2H, с), 6,85-6,9 (2H, м), 7,0-7,1 (2H, м), 7,25-7,45 (5H, м).
Ссылочный пример 16
4-{[4-(2-Бензилоксиэтокси)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-(2-бензилоксиэтокси)-2-метилфенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (CDCl3) δ м.д.: 1,1 (6H, д, J=6,9 Гц), 2,3 (3H, с), 2,75-2,9 (1H, м), 3,6 (2H, с), 3,75-3,85 (2H, м), 4,05-4,15 (2H, м), 4,62 (2H, с), 6,64 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,74 (1H, д, J=2,5 Гц), 6,94 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Ссылочный пример 17
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразол
К раствору 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она (5,08 г), ацетобром-α-D-глюкозы (5,49 г) и бензилтри (н-бутил)аммоний хлорида (2,08 г) в дихлорметане (40 мл) добавляли 5 моль/л водного раствора гидрохлорида натрия (8 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали хроматографией на колонке с аминопропилированным силикагелем (элюент: н-гексан/этилацетат = 1/1 - 1/3 - 1/5). Очищенное вещество дополнительно очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 - 1/2 - 1/4) с получением соединения, указанного в заголовке (2,75 г).
1H-ЯМР (CDCl3) δ м.д.: 1,15 (6H, д, J=7,1 Гц), 1,87 (3H, с), 1,95-2,1 (11H, м), 2,85-2,95 (1H, м), 3,5-3,7 (4H, м), 3,8-3,9 (1H, м), 4,03 (2H, т, J=6,4 Гц), 4,15 (1H, дд, J=12,3 Гц, 2,4 Гц), 4,31 (1H, дд, J=12,3 Гц, 4,1 Гц), 4,51 (2H, с), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м), 7,2-7,35 (5H, м).
Ссылочный пример 18
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(2-бензилоксиэтокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H-ЯМР (CDCl3) δ м.д.: 1,14 (6H, д, J=6,8 Гц), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,8-2,95 (1H, м), 3,57 (1H, д, J=15,8 Гц), 3,63 (1H, д, J=15,8 Гц), 3,75-3,9 (3H, м), 4,05-4,2 (3H, м), 4,31 (1H, дд, J=12,4 Гц, 4,1 Гц), 4,62 (2H, с), 5,15-5,3 (3H, м), 5,55-5,6 (1H, м), 6,75-6,85 (2H, м), 7,0-7,05 (2H, м), 7,25-7,4 (5H, м).
Ссылочный пример 19
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-бензилоксибутокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(4-бензилоксибутокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H-ЯМР (CDCl3) δ м.д.: 1,15 (6H, д, J=6,7 Гц), 1,7-1,9 (7H, м), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,5-3,6 (3H, м), 3,62 (1H, д, J=16,3 Гц), 3,8-3,9 (1H, м), 3,92 (2H, т, J=6,5 Гц), 4,1-4,2 (1H, м), 4,31 (1H, дд, J=12,3 Гц, 4,1 Гц), 4,51 (2H, с), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 6,95-7,05 (2H, м), 7,2-7,4 (5Н, м).
Ссылочный пример 20
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,8 (3H, с), 1,9-2,15 (11H, м), 2,25 (3H, с), 2,75-2,85 (1H, м), 3,49 (1H, д, J=16,4 Гц), 3,59 (1H, д, J=16,4 Гц), 3,64 (2H, т, J=6,3 Гц), 3,8-3,9 (1H, м), 4,0-4,05 (2H, м), 4,1-4,15 (1H, м), 4,3 (1H, дд, J=12,2 Гц, 4,1 Гц), 4,51 (2H, с), 5,15-5,3 (3H,м), 5,55 (1H, д, J=7,8 Гц), 6,57 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,68 (1H, д, J=2,6 Гц), 6,79 (1H, д, J=8,4 Гц), 7,2-7,4 (5H, м).
Ссылочный пример 21
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-бензилоксифенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-[(4-бензилоксифенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H-ЯМР (CDCl3) δ м.д.: 1,16 (6H, д, J=7,1 Гц), 1,85 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,57 (1H, д, J=15,9 Гц), 3,63 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,1-4,2 (1H, м), 4,31 (1H, дд, J=12,6 Гц, 3,9 Гц), 5,02 (2H, с), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,8-6,9 (2H, м), 7,0-7,1 (2H, м), 7,25-7,45 (5H, м).
Ссылочный пример 22
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(2-бензилоксиэтокси)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,81 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,25 (3H, с), 2,7-2,85 (lH,м), 3,5 (1H, д, J=16,6 Гц), 3,59 (1H, д, J=16,6 Гц), 3,75-3,9 (3H, м), 4,05-4,2 (3H, м), 4,3 (1H, дд, J=12,2 Гц, 4,1 Гц), 4,62 (2H, с), 5,1-5,3 (3H, м), 5,55 (1H, д, J=8,0 Гц), 6,6 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,8 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Ссылочный пример 23
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразол (2,75 г) растворяли в смеси растворителей метанола (20 мл) и тетрагидрофурана (9 мл). К раствору добавляли 10% порошок палладия-угля (550 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением соединения, указанного в заголовке (2,4 г).
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 1,95-2,1 (11H, м), 2,85-2,95 (1H, м), 3,58 (1H, д, J=16,3 Гц), 3,63 (1H, д, J=16,3 Гц), 3,8-3,9 (3H, м), 4,05-4,1 (2H, м), 4,13 (1H, дд, J=12,1 Гц, 2,1 Гц), 4,3 (1H, дд, J=12,1 Гц, 4,1 Гц), 5,15-5,3 (3H, м), 5,58 (1H, д, J=7,3 Гц), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м).
Ссылочный пример 24
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,16 (6H, д, J=6,8 Гц), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,58 (1H, д, J=16,0 Гц), 3,63 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,0-4,1 (2H, м), 4,1-4,2 (1H, м), 4,25-4,35 (1H, м), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,75-6,85 (2H, м), 7,0-7,1 (2H, м).
Ссылочный пример 25
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-гидроксибутокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-бензилоксибутокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,65-1,8 (2H, м), 1,8-1,95 (5H, м), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,57 (1H, д, J=16,2 Гц), 3,63 (1H, д, J=16,2 Гц), 3,71 (2H, т, J=6,3 Гц), 3,8-3,9 (1H, м), 3,96 (2H, т, J=6,2 Гц), 4,14 (1H, дд, J=12,4 Гц, 2,4 Гц), 4,31 (1H, дд, J=12,4 Гц, 4,1 Гц), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м).
Ссылочный пример 26
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,95-2,1 (11H, м), 2,26 (3H, с), 2,75-2,9 (1H, м), 3,5 (1H, д, J=16,5 Гц), 3,58 (1H, д, J=16,5 Гц), 3,75-3,9 (3H, м), 4,0-4,15 (3H, м), 4,28 (1H, дд, J=12,3 Гц, 4,1 Гц), 5,1-5,3 (3H, м), 5,55 (1H, д, J=7,9 Гц), 6,59 (1H, дд, J=8,3 Гц, 2,5 Гц), 6,69 (1H, д, J=2,5 Гц), 6,81 (1H, д, J=8,3 Гц).
Ссылочный пример 27
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-гидроксифенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-бензилоксифенил)метил]-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,85-3,0 (1H, м), 3,57 (1H, д, J=16,2 Гц), 3,61 (1H, д, J=16,2 Гц), 3,8-3,9 (1H, м), 4,05-4,2 (1H, м), 4,29 (1H, дд, J=12,5 Гц, 4,0 Гц), 4,91 (1H, ушир.с), 5,15-5,3 (3H, м), 5,55-5,6 (1Н, м), 6,65-6,75 (2H, м), 6,95-7,05 (2H, м).
Ссылочный пример 28
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,26 (3H, с), 2,75-2,9 (1H, м), 3,51 (1H, д, J=16,9 Гц), 3,59 (1H, д, J=16,9 Гц), 3,8-3,85 (1H, м), 3,9-3,95 (2H, м), 4,0-4,1 (2H, м), 4,11 (1H, дд, J=12,5 Гц, 2,5 Гц), 4,28 (1H, дд, J=12,5 Гц, 4,1 Гц), 5,1-5,3 (3H, м), 5,55 (1H, д, J=7,9 Гц), 6,6 (1H, дд, J=8,3 Гц, 2,7 Гц), 6,71 (1H, д, J=2,7 Гц), 6,82 (1H, д, J=8,3 Гц).
Ссылочный пример 29
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола (2,21 г) в дихлорметане (35 мл) добавляли триэтиламин (0,65 мл) и метансульфонил хлорид (0,33 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатомом. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]фенил}метил)-1H-пиразола. Это вещество растворяли в N,N-диметилформамиде (20 мл). К раствору добавляли азид натрия (0,46 г) и смесь перемешивали при 100°C в течение 1,5 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатомом. Органический слой промывали водой три раза и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 - 1/3) с получением соединения, указанного в заголовке (1,6 г).
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 1,95-2,1 (11H, м), 2,85-2,95 (1H, м), 3,5 (2H, т, J=6,7 Гц), 3,57 (1H, д, J=15,9 Гц), 3,63 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,0 (2H, т, J=5,9 Гц), 4,1-4,2 (1H, м), 4,31 (1H, дд, J=12,2 Гц, 4,2 Гц), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 7,0-7,1 (2H, м).
Ссылочный пример 30
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 29, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,5-3,7 (4H, м), 3,8-3,9 (1H, м), 4,11 (2H, т, J=5,1 Гц), 4,14 (1H, дд, J=12,2 Гц, 2, 2 Гц), 4,31 (1H, дд, J=12,2 Гц, 4,0 Гц), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,75-6,85 (2H, м), 7,0-7,1 (2H, м).
Ссылочный пример 31
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-азидобутокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 29, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-гидроксибутокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,7-1,95 (7H, м), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,35 (2H, т, J=6,8 Гц), 3,57 (1Н, д, J=16,0 Гц), 3,63 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,94 (2H, т, J=6,0 Гц), 4,14 (1H, дд, J=12,6 Гц, 2,5 Гц), 4,31 (1H, дд, J=12,6 Гц, 4,1 Гц), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 7,0-7,1 (2H, м).
Ссылочный пример 32
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 29, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,81 (3H, с), 1,95-2,1 (11H, м), 2,26 (3H, с), 2,75-2,9 (1H, м), 3,45-3,55 (3H, м), 3,59 (1H, д, J=16,5 Гц), 3,8-3,9 (1H, м), 3,95-4,05 (2H, м), 4,05-4,15 (1H, м), 4,29 (1H, дд, J=12,6 Гц, 4,1 Гц), 5,1-5,3 (3H, м), 5,55 (1H, д, J=7,9 Гц), 6,57 (1H, дд, J=8,7 Гц, 2,6 Гц), 6,68 (1H, д, J=2,6 Гц), 6,8 (1H, д, J=8,7 Гц).
Ссылочный пример 33
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 29, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,2 (6H, м), 1,82 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,27 (3H, с), 2,75-2,9(1H, м), 3,45-3,65 (4H, м), 3,8-3,9 (1H, м), 4,05-4,15 (3H, м), 4,29 (1H, дд, J=12,2 Гц, 4,2 Гц), 5,1-5,3 (3H, м), 5,56 (1H, д, J=7,7 Гц), 6,6 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,71 (1H, д, J=2,6 Гц), 6,82 (1H, д, J=8,3 Гц).
Пример 1
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола (1,6 г) в тетрагидрофуране (25 мл) добавляли 10% порошок палладия-угля (300 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением соединения, указанного в заголовке (1,5 г).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,85-2,0 (8H, м), 2,01 (3H, с), 2,02 (3H, с), 2,8-3,0 (3H, м), 3,6 (2H,с), 3,9-4,0 (1H, м), 4,01 (2H, т, J=6,0 Гц), 4,11 (1Н, дд, J=12,4 Гц, 2,5 Гц), 4,29 (1H, дд, J=12,4 Гц, 3,9 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,2 Гц), 6,75-6,85 (2H, м), 7,0-7,05 (2H, м).
Пример 2
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,16 (6H, д, J=6,9 Гц), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,05 (2H, т, J=5,0 Гц), 3,57 (1H, д, J=16,0 Гц), 3,63 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,94 (2H, т, J=5,0 Гц), 4,1-4,2 (1H, м), 4,25-4,35 (1H, м), 5,15-5,3 (3H, м), 5,5-5,65 (1H, м), 6,75-6,8 (2H, м), 7,0-7,1 (2H, м).
Пример 3
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-аминобутокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-азидобутокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,15 (6H, д, J=6,8 Гц), 1,5-1,65 (2H, м), 1,7-1,85 (2H, м), 1,88 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,76 (2H, т, J=7,1 Гц), 2,85-2,95 (1H, м), 3,56 (1H, д, J=15,7 Гц), 3,62 (1H, д, J=15,7 Гц), 3,8-3,9 (1H, м), 3,92 (2H, т, J=6,5 Гц), 4,1-4,2 (1H, м), 4,31 (1H, дд, J=12,2 Гц, 4,1 Гц), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,8 (2H, м), 6,95-7,05 (2H, м).
Пример 4
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,82 (3H, с), 1,85-1,95 (2H, м), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,25 (3H, с), 2,75-2,95 (3H, м), 3,5 (1H, д, J=16,5 Гц), 3,58 (1H, д, J=16,5 Гц), 3,75-3,9 (1H, м), 3,9-4,05 (2H, м), 4,05-4,2 (1H, м), 4,29 (1H, дд, J=12,6 Гц, 4,0 Гц), 5,1-5,3 (3H, м), 5,5-5,6 (1H, м), 6,58 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,68 (1H, д, J=2,7 Гц), 6,8 (1H, д, J=8,4 Гц).
Пример 5
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,82 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,26 (3H, с), 2,75-2,85 (1H, м), 3,0-3,1 (2H, м), 3,5 (1H, д, J=16,3 Гц), 3,59 (1H, д, J=16,3 Гц), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,12 (1H, дд, J=12,4 Гц, 2, 4 Гц), 4,29 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,15-5,3 (3H, м), 5,55 (1H, д, J=7,9 Гц), 6,59 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,81 (1H, д, J=8,5 Гц).
Пример 6
4-{[4-(3-Аминопропокси)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (0,1 г) в метаноле (2 мл) добавляли метоксид натрия (28% раствор метанола, 0,062 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (57 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,8-1,95 (2H, м), 2,8 (2H, т, J=7,0 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,99 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,7-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 7
4-{[4-(2-Аминоэтокси)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,8-2,95 (1H, м), 2,96 (2H, т, J=5,4 Гц), 3,25-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 3,95 (2H, т, J=5,4 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 8
4-{[4-(4-Аминобутокси)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(4-аминобутокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,55-1,7 (2H, м), 1,7-1,85 (2H, м), 2,67 (2H, т, J=7,1 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,7 Гц), 3,8-3,9 (1H, м), 3,93 (2H, т, J=6,3 Гц), 5,0-5,15 (1H, м), 6,7-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 9
4-{[4-(3-Аминопропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,7-2,9 (3H, м), 3,25-3,45 (4H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=5,9 Гц), 4,95-5,1 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 10
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфониламино)пропокси]фенил}метил)-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (0,36 г) в дихлорметане (6 мл) добавляли триэтиламин (0,2 мл) и метансульфонил хлорид (0,05 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатомом. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/3 - этилацетат) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфониламино)пропокси]фенил}метил)-1H-пиразола (255 мг). Этот продукт растворяли в метаноле (6 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,11 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (0,16 г).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,05 (2H, м), 2,8-2,95 (4H, м), 3,24 (2H, т, J=7,0 Гц), 3,3-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 4,01 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 11
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-({4-[2-(метансульфониламино)этокси]фенил}метил)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 10, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,8-2,95 (1H, м), 2,97 (3H, с), 3,25-3,45 (6H, м), 3,6-3,7 (2H, м), 3,74 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,03 (2H, т, J=5,4 Гц), 5,0-5,15 (1H, м), 6,8-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 12
4-[(4-{3-[N-(Карбамоилметил)-N-(метансульфонил)амино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 10, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(карбамоилметиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,95-2,1 (2H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,0 (3H, с), 3,25-3,4 (4H, м), 3,46 (2H, т, J=7,1 Гц), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 3,95-4,05 (4H, м), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,3 Гц, 2,7 Гц), 6,72 (1H, д, J=2,7 Гц), 6,85 (1H, д, J=8,3 Гц).
Пример 13
4-({4-[3-(2-Аминоацетиламино)пропокси]фенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (0,1 г) в N,N-диметилформамиде (1 мл) добавляли 2-бензилоксикарбониламиноуксусную кислоту (51 мг), 1-гидроксибензотриазол (33 мг) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (93 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюент: этилацетат - дихлорметан/метанол = 30/1 - 20/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[2-(бензилоксикарбониламино)ацетиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразола (46 мг). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часов. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(2-аминоацетиламино)пропокси]фенил}метил)-5-изопропил-1H-пиразола (34 мг). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,01 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (23 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,9-2,0 (2H, м), 2,85-2,95 (1H, м), 3,23 (2H, с), 3,25-3,45 (6H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,0 Гц), 3,8-3,9(1H, м), 3,98 (2H, т, J=6,1 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 14
4-[(4-{3-[(S)-2-Аминопропиониламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя (S)-2-(бензилоксикарбониламино)пропионовую кислоту вместо 2-бензилоксикарбониламиноуксусной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2(6H,м), 1,24 (3H, д, J=6,9 Гц), 1,9-2,0 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (7H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,98 (2H, т, J=6,0 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,0-7,15 (2H, м).
Пример 15
4-({4-[3-(3-Аминопропиониламино)пропокси]фенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя 3-(бензилоксикарбониламино)пропионовую кислоту вместо 2-бензилоксикарбониламиноуксусной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-2,0 (2H, м), 2,33 (2H, т, J=6,6 Гц), 2,75-2,95 (3H, м), 3,25-3,45 (6H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,7-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 16
4-[(4-{3-[(S)-2-Амино-3-гидроксипропиониламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя (S)-2-бензилоксикарбониламино-3-гидроксипропионовую кислоту вместо 2-бензилоксикарбониламиноуксусной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,9-2,0 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (7H, м), 3,55-3,7 (4H, м), 3,73 (1H, д, J=15,6 Гц), 3,8-3,9 (1H, м), 3,99 (2H, т, J=6,2 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 17
4-[(4-{3-[(S)-2-Амино-3-(1H-имидазол-4-ил)пропиониламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя (S)-2-бензилоксикарбониламино-3-(1H-имидазол-4-ил)пропионовую кислоту вместо 2-бензилоксикарбониламиноуксусной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,8-1,95 (2H, м), 2,7-3,0 (3H, м), 3,25-3,45 (6H, м), 3,5-3,55 (1H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,7 Гц), 3,8-3,95 (3H, м), 5,0-5,15 (1H, м), 6,75-6,85 (3H, м), 7,05-7,15 (2H, м), 7,54 (1H, с).
Пример 18
4-[(4-{3-[2-Амино-2-(метил)пропиониламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя 2-бензилоксикарбониламино-2-метилпропионовую кислоту вместо 2-бензилоксикарбониламиноуксусной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,29 (6H, с), 1,9-2,0 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,1 Гц), 3,8-3,9 (1H, м), 3,98 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,2 (2H, м).
Пример 19
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[2-(морфолин-4-ил)этил]уреидо}пропокси)фенил]метил}-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (97 мг) в дихлорметане (3 мл) добавляли триэтиламин (0,035 мл) и 4-нитрофенил хлорформиат (35 мг) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 4-(2-аминоэтил)морфолин (41 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюент: этилацетат - дихлорметан/метанол = 10/1 - 5/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[2-(морфолин-4-ил)этил]уреидо}пропокси)фенил]метил}-1H-пиразола (58 мг). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,03 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (39 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,10-1,15 (6H, м), 1,85-1,95 (2H, м), 2,35-2,5 (6H, м), 2,85-2,95 (1H, м), 3,2-3,45 (8H, м), 3,6-3,7 (6H, м), 3,73 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,2 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 20
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[2-(диметиламино)этил]уреидо}пропокси)фенил]метил}-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя N,N-диметилэтилендиамин вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,85-1,95 (2H, м), 2,26 (6H, с), 2,43 (2H, т, J=6,7 Гц), 2,85-2,95 (1H, м), 3,2-3,4 (8H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,0 Гц), 5,0-5,1 (1Н, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 21
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1-(гидроксиметил)-1-(метил)этил]уреидо}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 2-амино-2-метил-1,3-пропандиол вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,8-2,95 (1H, м), 3,2-3,45 (6H, м), 3,5-3,8 (7H, м), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 22
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1-(гидроксиметил)этил]уреидо}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 2-амино-1,3-пропандиол вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-1,95 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,5-3,75 (8H, м), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,2 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 23
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[3-(2-гидроксиэтил)уреидо]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 2-аминоэтанол вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,85-2,95 (1H, м), 3,21 (2H, т, J=5,6 Гц), 3,25-3,45 (6H, м), 3,55 (2H, т, J=5,6 Гц), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,1 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,2 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 24
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1,1-ди(метил)этил]уреидо}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 2-амино-2-метил-1-пропанол вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,5 (6H, м), 1,22 (6H, с), 1,85-1,95 (2H, м), 2,8-2,95 (1H, м), 3,24 (2H, т, J=6,6 Гц), 3,25-3,45 (4H, м), 3,5 (2H, с), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 3,96 (2H, т, J=6,2 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 25
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[2-(пирролидин-1-ил)этил]уреидо}пропокси)фенил]метил}-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 1-(2-аминоэтил)пирролидин вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,75-1,85 (4H, м), 1,85-1,95 (2H, м), 2,5-2,65 (6H, м), 2,85-2,95 (1H, м), 3,2-3,45 (8H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 26
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1,1-бис(гидроксиметил)этил]уреидо}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя трис(гидроксиметил)аминометан вместо 4-(2-аминоэтил)морфолина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,8-2,95 (1H, м), 3,2-3,45 (6H, м), 3,55-3,7 (8H, м), 3,73 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,97 (2H, т, J=6,1 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 27
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбониламино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 1-(2-гидроксиэтил)пиперазин вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,4-2,55 (6H, м), 2,75-2,85 (1H, м), 3,25-3,45 (10H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 3,96 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 28
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1-(гидроксиметил)-1-(метил)этил]уреидо}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метил-1,3-пропандиол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,19 (3H, с), 1,85-1,95 (2H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,5-3,75 (7H, м), 3,75-3,85 (1H, м), 3,96 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,6 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,6 Гц).
Пример 29
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{3-[2-гидрокси-1,1-ди(метил)этил]уреидо}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метил-1-пропанол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,23 (6H, с), 1,8-1,95 (2H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,24 (2H, т, J=6,8 Гц), 3,25-3,4 (4H, м), 3,5 (2H, с), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,96 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,71 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 30
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[3-(2-гидроксиэтил)уреидо]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-аминоэтанол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-1,95 (2H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,22 (2H, т, J=5,7 Гц), 3,25-3,4 (6H, м), 3,55 (2H, т, J=5,7 Гц), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 3,96 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,2 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,2 Гц).
Пример 31
4-{[4-(2-{3-[1-Карбамоил-1-(метил)этил]уреидо}этокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метилпропионамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,44 (6H, с), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,44 (2H, т, J=5,3 Гц), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,95 (2H, т, J=5,3 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,72 (1H, д, J=2,6 Гц), 6,86 (1H, д, J=8,5 Гц).
Пример 32
3-(β-D-Глюкопиранозилокси)-4-{[4-(2-{3-[2-гидрокси-1-(гидроксиметил)-1-(метил)этил]уреидо}этокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метил-1,3-пропандиол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,2 (3H, с), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,43 (2H, т, J=5,3 Гц), 3,5-3,75 (7H, м), 3,75-3,85 (1Н, м), 3,94 (2H, т, J=5,3 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,3 Гц, 2,7 Гц), 6,73 (1H, д, J=2,7 Гц), 6,86 (1H, д, J=8,3 Гц).
Пример 33
3-(β-D-Глюкопиранозилокси)-4-{[4-(2-{3-[2-гидрокси-1,1-ди(метил)этил]уреидо}этокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 19, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метил-1-пропанол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 4-(2-аминоэтил)морфолина соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,23 (6H, с), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,42 (2H, т, J=5,3 Гц), 3,52 (2H, с), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,94 (2H, т, J=5,3 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,3 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,3 Гц).
Пример 34
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,29 г) в дихлорметане (5 мл) добавляли триэтиламин (0,08 мл) и метансульфонил хлорид (0,04 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола. Этот продукт растворяли в N,N-диметилформамиде (3 мл). К раствору добавляли 1-(2-гидроксиэтил)пиперазин (0,13 г) и смесь перемешивали при 60°C в течение 9 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой дваждый промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: этилацетат - дихлорметан/метанол = 10/1 - 5/1) с получением соединения, указанного в заголовке (91 мг).
1H-ЯМР (CDCl3) δ м.д.:1,05-1,2 (6H, м), 1,81 (3H, с), 1,9-2,0 (5H, м), 2,02 (3H, с), 2,07 (3H, с), 2,26 (3H, с), 2,3-2,75 (12H, м), 2,75-2,9 (1H, м), 3,49 (1H, д, J=16,4 Гц), 3,55-3,7 (3H, м), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,1-4,2 (1H, м), 4,3 (1H, дд, J=12,3 Гц, 3,8 Гц), 5,15-5,3 (3Н, м), 5,55 (1Н, д, J=8,3 Гц), 6,57 (1H, дд, J=8,6 Гц, 2,7 Гц), 6,68 (1H, д, J=2,7 Гц), 6,79 (1H, д, J=8,6 Гц).
Пример 35
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,28 (3H, с), 2,3-2,85 (13H, м), 3,25-3,4 (4H, м), 3,6-3,75 (5H, м), 3,75-3,85 (1H, м), 3,96 (2H, т, J=6,2 Гц), 4,95-5,1 (1H, м), 6,6 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,69 (1H, д, J=2,4 Гц), 6,84 (1H, д, J=8,5 Гц).
Ссылочный пример 34
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N'-(циано)-S-(метил)изотиоуреидо]пропокси}фенил)метил]-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (0,19 г) в 2-пропаноле (2 мл) добавляли S,S'-диметил-N-цианодитиоиминокарбонат (57 мг) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 - дихлорметан/метанол = 20/1) с получением соединения, указанного в заголовке (0,19 г).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,91 (3H, с), 1,97 (3H, с), 2,0-2,1 (8H, м), 2,56 (3H, с), 2,85-3,0 (1H, м), 3,5-3,65 (4H, м), 3,9-4,05 (3H, м), 4,11 (1H, дд, J=12,4 Гц, 2,3 Гц), 4,29 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,0 Гц), 6,75-6,85 (2H, м), 7,0-7,1 (2H, м).
Пример 36
4-({4-[3-(2-Циано-3-метилгуанидино)пропокси]фенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Метиламин (40% раствор метанола, 2 мл) добавляли к 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N'-(циано)-S-(метил)изотиоуреидо]пропокси}фенил)метил]-5-изопропил-1H-пиразолу (40 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (18 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,95-2,05 (2H, м) 2,76 (3H, с), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,2 Гц), 3,8-3,9 (1H, м), 4,0 (2H, т, J=5,9 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 37
4-[(4-{3-[2-Циано-3-(2-гидроксиэтил)гуанидино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N'-(циано)-S-(метил)изотиоуреидо]пропокси}фенил)метил]-5-изопропил-1H-пиразола (30 мг) в метаноле (1 мл) добавляли 2-аминоэтанол (0,5 мл) и смесь перемешивали при 50°C в течение ночи. После охлаждения до комнатной температуры в реакционную смесь добавляли метоксид натрия (28% раствор метанола, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (15 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,95-2,05 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,5-3,7 (6H, м), 3,73 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 4,0 (2H, т, J=5,9 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2Н, м).
Пример 38
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-({4-[3-(сульфамоиламино)пропокси]фенил}метил)-1H-пиразол
К раствору хлорсульфонил изоцианата (0,022 мл) в ацетонитриле (1 мл) добавляли воду (0,005 мл) и смесь перемешивали при комнатной температуре в течение 10 минут. Эту реакционную смесь добавляли к раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола (51 мг) и триэтиламина (0,052 мл) в дихлорметане (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 30/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(сульфамоиламино)пропокси]фенил}метил)-1H-пиразола (18 мг). Этот продукт растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,01 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (3 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,95-2,05 (2H, м), 2,8-2,95 (1H, м), 3,21 (2H, т, J=6,8 Гц), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,84 (1H, д, J=11,6 Гц), 4,02 (2H, т, J=6,0 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 39
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(карбамоилметиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (98 мг) в тетрагидрофуране (2 мл) добавляли 2-(2-нитробензолсульфониламино)ацетоамид (40 мг), трифенилфосфин (45 мг) и диэтил азодикарбоксилат (40% раствор толуола, 0,1 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: этилацетат - дихлорметан/метанол = 10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[N-(2-нитробензолсульфонил)-N-(карбамоилметил)амино]пропокси}-2-метилфенил)метил]-1H-пиразола (92 мг). Этот продукт растворяли в ацетонитриле (1 мл). К раствору добавляли карбонат цезия (0,14 г) и тиофенол (0,012 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1 - 5/1) с получением соединения, указанного в заголовке (57 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,83 (3H, с), 1,9-2,05 (11H, м), 2,26 (3H, с), 2,75-2,9 (3H, м), 3,28 (2H, с), 3,53 (1H, д, J=16,1 Гц), 3,58 (1H, д, J=16,1 Гц), 3,85-3,95 (1H, м), 4,01 (2H, т, J=6,3 Гц), 4,06 (1H, дд, J=12,4 Гц, 2,3 Гц), 4,27 (1H, дд, J=12,4 Гц, 4,2 Гц), 5,0-5,15 (2H, м), 5,2-5,3 (1H, м), 5,43 (1H, д, J=8,0 Гц), 6,61 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,71 (1H, д, J=2,6 Гц), 6,77 (1H, д, J=8,5 Гц).
Пример 40
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(карбамоилметиламино)пропокси]фенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 39, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,85-2,0 (8H, м), 2,01 (3H, с), 2,02 (3H, с), 2,78 (2H, т, J=6,9 Гц), 2,85-3,0 (1H, м), 3,27 (2H, с), 3,59 (2H, с), 3,9-4,0 (1H, м), 4,01 (2H, т, J=6,2 Гц), 4,11 (1H, дд, J=12,5 Гц, 2,3 Гц), 4,3 (1H, дд, J=12,5 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,47 (1H, д, J=8,4 Гц), 6,75-6,85 (2H, м), 7,0-7,05 (2H, м).
Пример 41
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбамоил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 39, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол и (S)-2-(2-нитробензолсульфониламино)пропионамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-(2-нитробензолсульфониламино)ацетоамида соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,27 (3H, д, J=6,9 Гц), 1,85-2,0 (8H, м), 2,01 (3H, с), 2,02 (3H, с), 2,65-2,8 (2H, м), 2,85-3,0 (1H, м), 3,59 (2H, с), 3,9-4,05 (3H, м), 4,11 (1H, дд, J=12,5 Гц, 2,2 Гц), 4,3 (1H, дд, J=12,5 Гц, 3,9 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=7,8 Гц), 6,75-6,85 (2H, м), 7,0-7,05 (2H, м).
Пример 42
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[1-карбамоил-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 39, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол и 2-метил-2-(2-нитробензолсульфониламино)пропионамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-(2-нитробензолсульфониламино)ацетоамида соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,31 (6H, с), 1,85-2,0 (8H, м), 2,01 (3H, с), 2,02 (3H, с), 2,6-2,8 (2H, м), 2,85-3,0 (1H, м), 3,59 (2H, с), 3,9-4,0 (1H, м), 4,02 (2H, т, J=6,1 Гц), 4,11 (1H, дд, J=12,5 Гц, 2,6 Гц), 4,3 (1H, дд, J=12,5 Гц, 4,l Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,2 Гц), 6,75-6,85 (2H, м), 7,0-7,05 (2H, м).
Пример 43
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[2-(карбамоилметиламино)этокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 39, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6Н, м), 1,83 (3Н, с), 1,96 (3Н, с), 2,0 (3Н, с), 2,02 (3Н, с), 2,26 (3Н, с), 2,75-2,9 (1Н, м), 2,96 (2H, т, J=5,2 Гц), 3,32 (2H, с), 3,53 (1H, д, J=16,6 Гц), 3,59 (1H, д, J=16,6 Гц), 3,85-3,95 (1H, м), 4,03 (2H, т, J=5,2 Гц), 4,06 (1H, дд, J=12,3 Гц, 2,0 Гц), 4,27 (1H, дд, J=12,3 Гц, 4,2 Гц), 5,0-5,15 (2H, м), 5,2-5,35 (1H, м), 5,43 (1H, д, J=8,0 Гц), 6,64 (1H, дд, J=8,5 Гц, 2,3 Гц), 6,74 (1H, д, J=2,3 Гц), 6,78 (1H, д, J=8,5 Гц).
Пример 44
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{2-[2-(карбамоил)этиламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 39, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 3-(2-нитробензолсульфониламино)пропионамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-(2-нитробензолсульфониламино)ацетоамида соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,83 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,47 (2H, т, J=6,7 Гц), 2,75-2,9 (1H, м), 2,9-3,05 (4H, м), 3,53 (1H, д, J=16,4 Гц), 3,59 (1H, д, J=16,4 Гц), 3,85-3,95(1H, м), 4,0-4,1 (3H, м), 4,27 (1H, дд, J=12,5 Гц, 4,1 Гц), 5,0-5,15 (2H, м), 5,25-5,35 (1H, м), 5,43 (1H, д, J=8,2 Гц), 6,64 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,75 (1H, д, J=2,6 Гц), 6,79 (1H, д, J=8,3 Гц).
Пример 45
4-({4-[3-(Карбамоилметиламино)пропокси]-2-метилфенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(карбамоилметиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,28 (3H, с), 2,7-2,85 (3H, м), 3,24 (2H, с), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 46
4-({4-[3-(Карбамоилметиламино)пропокси]фенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(карбамоилметиламино)пропокси]фенил}метил)-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-2,0 (2H, м), 2,75 (2H, т, J=6,9 Гц), 2,8-2,95 (1H, м), 3,25 (2H, с), 3,3-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,3 Гц), 3,8-3,9 (1H, м), 4,02 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 47
4-[(4-{3-[(S)-1-(Карбамоил)этиламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбамоил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,26 (3H, д, J=7,0 Гц), 1,85-2,0 (2H, м), 2,6-2,75 (2H, м), 2,8-2,95 (1H, м), 3,19 (1H, кв, J=7,0 Гц), 3,25-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 4,0 (2H, т, J=6,2 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 48
4-[(4-{3-[1-Карбамоил-1-(метил)этиламино]пропокси}фенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[1-карбамоил-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,29 (6H, с), 1,85-1,95 (2H, м), 2,65 (2H, т, J=7,1 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,02 (2H, т, J=5,9 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 49
4-({4-[2-(Карбамоилметиламино)этокси]-2-метилфенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[2-(карбамоилметиламино)этокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 2,94 (2H, т, J=5,2 Гц), 3,25-3,4 (6H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,02 (2H, т, J=5,2 Гц), 4,95-5,1 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,74 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 50
4-[(4-{2-[2-(Карбамоил)этиламино]этокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{2-[2-(карбамоил)этиламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,44 (2H, т, J=6,8 Гц), 2,7-2,85 (1H, м), 2,9 (2H, т, J=6,8 Гц), 2,95 (2H, т, J=5,1 Гц), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,03 (2H, т, J=5,1 Гц), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,5 Гц).
Пример 51
4-[(4-{3-[1-Карбамоил-1-(метил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,25 г) в тетрагидрофуране (2 мл) добавляли 2-метил-2-(2-нитробензолсульфониламино)пропионамид (0,14 г), трифенилфосфин (0,12 г) и диэтил азодикарбоксилат (40% раствор толуола, 0,26 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/4 -дихлорметан/метанол = 20/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{N-(2-нитробензолсульфонил)-N-[1-карбамоил-1-(метил)этил]амино}пропокси)-2-метилфенил]метил}-1H-пиразола (0,32 г). Этот продукт растворяли в ацетонитриле (3 мл). К раствору добавляли карбонат цезия (0,46 г) и тиофенол (0,038 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором последовательно и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/5-дихлорметан/метанол = 15/1 -10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[1-карбамоил-1-(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (20 мг). Этот продукт растворяли в метаноле (1 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,01 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (11 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,29 (6H, с), 1,85-1,95 (2H, м), 2,29 (3H, с), 2,65 (2H, т, J=6,9 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=6,1 Гц), 5 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 52
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя 3-(2-нитробензолсульфониламино)пропионамид вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,42 (2H, т, J=6,9 Гц), 2,7-2,9 (5H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 53
3-(β-D-Глюкопиранозилокси)-4-[(4-{(R)-2-гидрокси-3-[2-гидрокси-1-(гидроксиметил)-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Смесь 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-гидроксифенил)метил]-5-изопропил-1H-пиразола (0,55 г), (R)-1-(3-нитробензолсульфонилокси)-2,3-эпоксипропана (0,38 г) и карбоната цезия (0,57 г) в N,N-диметилформамиде (5 мл) перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[(R)-2,3-эпоксипропокси]фенил}метил)-5-изопропил-1H-пиразола (0,4 г). Этот продукт (43 мг) растворяли в этаноле (1,5 мл). К раствору добавляли 2-амино-2-метил-1,3-пропандиол (51 мг) и смесь перемешивали при 75°C в течение 14 часов. К реакционной смеси добавляли 1 моль/л водного раствора гидрохлорида натрия (0,28 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь тотчас очищали препаративной колоночной хроматографией с обратной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120 Ǻ, 20 x 50 мм, скорость потока 30 мл/минуту линейный градиент, вода/метанол = 90/10 -10/90) с получением соединения, указанного в заголовке (12 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,0 (3H, с), 1,05-1,15 (6H, м), 2,68 (1H, дд, J=11,6 Гц, 8,1 Гц), 2,78 (1H, дд, J=11,6 Гц, 3,8 Гц), 2,8-2,95 (1H, м), 3,25-3,55 (8H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,1 Гц), 3,8-4,0 (4H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 54
3-(β-D-Глюкопиранозилокси)-4-({4-[(R)-2-гидрокси-3-(2-гидроксиэтиламино)пропокси]фенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 53, используя 2-аминоэтанол вместо 2-амино-2-метил-1,3-пропандиола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 2,65-2,95 (5H, м), 3,25-3,45 (4H, м), 3,6-3,8 (5H, м), 3,8-3,9 (1H, м), 3,91 (2H, д, J=5,4 Гц), 4,0-4,1 (1H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 55
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-гуанидинопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (70 мг) в тетрагидрофуране (3 мл) добавляли N-(бензилоксикарбонил)-1H-пиразол-1-карбоксамидин (0,27 г) и смесь перемешивали при 60°C в течение 20 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 - этилацетат - этилацетат/этанол = 10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(N'-бензилоксикарбонилгуанидино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразола (50 мг). Этот продукт растворяли в метаноле (1 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,01 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением 4-({4-[3-(N'-бензилоксикарбонилгуанидино)пропокси]-2-метилфенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола (35 мг). Этот продукт растворяли в метаноле (2 мл). К раствору добавляли 10% порошок палладия-угля (15 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением соединения, указанного в заголовке (27 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,75-2,9 (1H, м), 3,25-3,45 (6H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=5,7 Гц), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,6 Гц, 2,5 Гц), 6,73 (1H, д, J=2,5 Гц), 6,87 (1H, д, J=8,6 Гц).
Пример 56
3-(β-D-Глюкопиранозилокси)-4-{[4-(2-гуанидиноэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 55, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,3 (3H, с), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,55 (2H, т, J=5,0 Гц), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,06 (2H, т, J=5,0 Гц), 5,02 (1H, д, J=7,0 Гц), 6,65 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,75 (1H, д, J=2,6 Гц), 6,88 (1H, д, J=8,5 Гц).
Пример 57
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (1 г) в дихлорметане (16 мл) добавляли триэтиламин (0,29 мл) и хлорид метансульфонила (0,15 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (1,12 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразол (0,2 г) растворяли в смеси растворителей ацетонитрила (2 мл) и этанола (2 мл). К раствору добавляли 2-амино-2-метил-1-пропанол (0,25 г) и каталитическое количество йодида натрия и смесь перемешивали при 60°C в течение 2 дней. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,16 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (0,13 г).
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,15 (12H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,65-2,85 (3H, м), 3,25-3,4 (6H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=5,6 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,71 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 58
3-(β-D-Глюкопиранозилокси)-4-({4-[3-(2-гидроксиэтиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 2-аминоэтанол вместо 2-амино-2-метил-1-пропанол.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,7-2,85 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=5,9 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 59
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-(гидроксиметил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 2-амино-1,3-пропандиол вместо 2-амино-2-метил-1-пропанол.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,65-2,9 (4H, м), 3,25-3,4 (4H, м), 3,54 (2H, дд, J=11,1 Гц, 5,8 Гц), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,6 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,6 Гц).
Пример 60
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-(гидроксиметил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол и 2-амино-1,3-пропандиол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,9-2,0 (2H, м), 2,65-2,75 (1H, м), 2,8-2,95 (3H, м), 3,25-3,45 (4H, м), 3,54 (2H, дд, J=11,2 Гц, 5,9 Гц), 3,55-3,7 (4H, м), 3,73 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 4,02 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 61
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-ди(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,15 (12H, м), 1,85-2,0 (2H, м), 2,65-2,8 (2H, м), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,95-4,05 (2H, м), 5,0-5,15 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 62
3-(β-D-Глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-(гидроксиметил)этиламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-1,3-пропандиол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,7-2,85 (2H, м), 3,04 (2H, т, J=5,2 Гц), 3,25-3,4 (4H, м), 3,55 (2H, дд, J=11,2 Гц, 5,8 Гц), 3,6-3,75 (5H, м), 3,75-3,85 (1H, м), 4,06 (2H, т, J=5,2 Гц), 4,95-5,1 (1H, м), 6,65 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,75 (1H, д, J=2,7 Гц), 6,87 (1H, д, J=8,5 Гц).
Пример 63
3-(β-D-Глюкопиранозилокси)-4-({4-[2-(2-гидроксиэтиламино)этокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-аминоэтанол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,75-2,85 (3H, м), 2,99 (2H, т, J=5,2 Гц), 3,25-3,4 (4H, м), 3,6-3,75 (5H, м), 3,75-3,85 (1H, м), 4,05 (2H, т, J=5,2 Гц), 4,95-5,1 (1H, м), 6,65 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,87 (1H, д, J=8,4 Гц).
Пример 64
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-({4-[3-(3-пиридилметиламино)пропокси]фенил}метил)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол и 3-пиколиламин вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола, соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,77 (2H, т, J=7,2 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,7 (2H, м), 3,73 (1H, д, J=16,3 Гц), 3,75-3,9 (3H, м), 4,0 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м), 7,35-7,45 (1H, м), 7,8-7,85 (1H, м), 8,4-8,45 (1H, м), 8,5-8,55 (1H, м).
Пример 65
4-{[4-(2-Аминоэтокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 6, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,7-2,85 (1H, м), 2,99 (2H, т, J=5,2 Гц), 3,25-3,4 (4H, м), 3,55-3,75 (3H, м), 3,75-3,85 (1H, м), 3,97 (2H, т, J=5,2 Гц), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,6 Гц, 2,7 Гц), 6,74 (1H, д, J=2,7 Гц), 6,86 (1H, д, J=8,6 Гц)
Пример 66
3-(β-D-Глюкопиранозилокси)-4-({4-[3-(3-гидроксипропиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-амино-1-пропанол вместо 2-амино-2-метил-1-пропанол.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,7-1,8 (2H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,65-2,85 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,7 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,5 Гц).
Пример 67
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-(гидроксиметил)-1-(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 2-амино-2-метил-1,3-пропандиол вместо 2-амино-2-метил-1-пропанола.
1H-ЯМР (CD3OD) δ м.д.: 1,01 (3H, с), 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,7-2,85 (3H, м), 3,25-3,4 (4H, м), 3,4-3,55 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,72 (1H, д, J=2,6 Гц), 6,84 (1H, д, J=8,3 Гц).
Пример 68
3-(β-D-Глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-(гидроксиметил)-1-(метил)этиламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 2-амино-2-метил-1,3-пропандиол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,01 (3Н, с), 1,05-1,15 (6Н, м), 2,29 (3Н, с), 2,7-2,85 (1Н, м), 2,92 (2H, т, J=5,3 Гц), 3,25-3,4 (4H, м), 3,4-3,55 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,02 (2H, т, J=5,3 Гц), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,74 (1H, д, J=2,7 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 69
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-бис(гидроксиметил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол и трис(гидроксиметил)аминометан вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,85-2,0 (2H, м), 2,75-2,95 (3H, м), 3,25-3,4 (4H, м), 3,56 (6H, с), 3,6-3,75 (3H, м), 3,8-3,9 (1H, м), 4,02 (2H, т, J=6,1 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 70
3-(β-D-Глюкопиранозилокси)-4-({4-[2-(3-гидроксипропиламино)этокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 3-амино-1-пропанол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-амино-2-метил-1-пропанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,7-1,8 (2H, м), 2,29 (3H, с), 2,65-2,85 (3H, м), 2,94 (2H, т, J=5,2 Гц), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 4,03 (2H, т, J=5,2 Гц), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,1 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,1 Гц).
Пример 71
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-бис(гидроксиметил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 57, используя трис(гидроксиметил)аминометан вместо 2-амино-2-метил-1-пропанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-1,95 (2H, м), 2,28 (3H, с), 2,75-2,85 (3H, м), 3,25-3,4 (4H, м), 3,56 (6H, с), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,01 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,5 Гц).
Ссылочный пример 35
2-[2-Амино-2-(метил)пропиониламино]этанол
К раствору 2-бензилоксикарбониламино-2-(метил)пропионовой кислоты (1 г) в тетрагидрофуране (5 мл) добавляли 1,1'-карбонилбис-1H-имидазол (889 мг) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2-аминоэтанол (0,38 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 20/1) с получением 2-[2-бензилоксикарбониламино-2-(метил)пропиониламино]этанола (973 мг). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (200 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением соединения, указанного в заголовке (505 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,31 (6H, с), 3,25-3,35 (2H, м), 3,6 (2H, т, J=5,7 Гц).
Ссылочный пример 36
4-Метил-1-[2-амино-2-(метил)пропионил]пиперазин
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 35, используя 1-метилпиперазин вместо 2-аминоэтанола.
1H-ЯМР (ДМСО-d6) δ м.д.: 1,24 (6H, с), 1,83 (2H, ушир.с), 2,16 (3H, с), 2,26 (4H, т, J=5,0 Гц), 3,5-3,95 (4H, ушир.).
Ссылочный пример 37
2-[2-Амино-2-(метил)пропиониламино]-2-метил-1-пропанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 35, используя 2-амино-2-метил-1-пропанол вместо 2-аминоэтанола.
1H-ЯМР (CD3OD) δ м.д.: 1,28 (12H, с), 3,55 (2H, с).
Ссылочный пример 38
3-[2-Амино-2-(метил)пропиониламино]-1-пропанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 35, используя 3-амино-1-пропанол вместо 2-аминоэтанола.
1H-ЯМР (ДМСО-d6) δ м.д.: 1,16 (6H, с), 1,5-1,6 (2H, м), 1,89 (2H, ушир.с), 3,05-3,15 (2H, м), 3,35-3,45 (2H, м), 4,43 (1H, т, J=5,3 Гц), 7,8-7,95 (1H, ушир.).
Ссылочный пример 39
N-[2-Амино-2-(метил)пропионил]морфолина
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 35, используя морфолин вместо 2-аминоэтанола.
1H-ЯМР (ДМСО-d6) δ м.д.: 1,25 (6Н, с), 1,75-2,3 (2Н, ушир.), 3,45-3,6 (4Н, м), 3,65-3,95 (4Н, ушир.).
Пример 72
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола (0,77 г) в дихлорметане (5 мл) добавляли триэтиламин (0,26 мл) и хлорид метансульфонила (0,12 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]фенил}метил)-1H-пиразола (0,85 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]фенил}метил)-1H-пиразол (0,2 г) растворяли в смеси растворителей ацетонитрила (1,5 мл) и этанола (1,5 мл). К раствору добавляли 2-[2-амино-2-(метил)пропиониламино]этанол (0,25 г) и каталитическое количество йодида натрия и смесь перемешивали при 60°C в течение 4 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 20/1 -10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразола (0,13 г). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,05 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (93 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,28 (6H, с), 1,8-1,95 (2H, м), 2,63 (2H, т, J=6,9 Гц), 2,85-2,95 (1H, м), 3,2-3,4 (6H, м), 3,55 (2H, т, J=5,8 Гц), 3,6-3,9 (4H, м), 4,03 (2H, т, J=6,2 Гц), 5,0-5,1 (1H, м), 6,7-6,85 (2H, м), 7,0-7,15 (2H, м).
Пример 73
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этиламино}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя 4-метил-1-[2-амино-2-(метил)пропионил]пиперазин вместо 2-[2-амино-2-(метил)пропиониламино]этанола.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,34 (6H, с), 1,8-1,95 (2H, м), 2,19 (3H, с), 2,3-2,4 (4Н, м), 2,66 (2Н, т, J=6,3 Гц), 2,8-2,95 (1H, м), 3,3-3,4 (4H, м), 3,55-4,15 (10H, м), 5,0-5,15 (1H, м), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м).
Пример 74
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-ди(метил)этилкарбамоил]-1-(метил)этиламино}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя 2-[2-амино-2-(метил)пропиониламино]-2-метил-1-пропанол вместо 2-[2-амино-2-(метил)пропиониламино]этанола.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6H, м), 1,24 (6H, с), 1,25 (6H, с), 1,85-1,95 (2H, м), 2,64 (2H, т, J=6,9 Гц), 2,8-2,95 (1H, м), 3,3-3,45 (4H, м), 3,48 (2H, с), 3,6-3,9 (4H, м), 4,03 (2H, т, J=6,1 Гц), 5,05-5,1 (1H, м), 6,75-6,8 (2H, м), 7,05-7,15 (2H, м).
Пример 75
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[1-(3-гидроксипропилкарбамоил)-1-(метил)этиламино]пропокси}фенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя 3-[2-амино-2-(метил)пропиониламино]-1-пропанол вместо 2-[2-амино-2-(метил)пропиониламино]этанола.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,15 (6Н, м), 1,27 (6Н, с), 1,55-1,7 (2Н, м), 1,85-1,95 (2Н, м), 2,62 (2Н, т, J=6,8 Гц), 2,8-2,95 (1H, м), 3,23 (2H, т, J=6,7 Гц), 3,3-3,4 (4H, м), 3,53 (2H, т, J=6,2 Гц), 3,6-3,85 (4H, м), 4,03 (2H, т, J=6,0 Гц), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 76
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{1-[(морфолин-4-ил)карбонил]-1-(метил)этиламино}пропокси)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя N-[2-амино-2-(метил)пропионил]морфолина вместо 2-[2-амино-2-(метил)пропиониламино]этанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,35 (6H, с), 1,8-1,95 (2H, м), 2,6-2,75 (2H, м), 2,8-2,95 (1H, м), 3,3-3,4 (4H, м), 3,45-4,15 (14H, м), 5,0-5,15 (1H, м), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м).
Пример 77
3-(β-D-Глюкопиранозилокси)-4-[(4-{2-[3-(2-гидроксиэтил)-2-метансульфонилгуанидино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
К раствору дихлорфеноксиметана (1 г) в ацетонитриле (10 мл) добавляли метансульфонамид (0,39 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 1-(N-метансульфонилимино)-1,1-дифеноксиметана (0,95 г). К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (50 мг) в тетрагидрофуране (1 мл) добавляли 1-(N-метансульфонилимино)-1,1-дифеноксиметан (26 мг) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2-аминоэтанол (49 мг) и смесь перемешивали при 60°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,008 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли уксусную кислоту (0,01 мл). Полученную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (38 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,28 (3H, с), 2,75-2,85 (1H, м), 2,9 (3H, с), 3,25-3,4 (6H, м), 3,6 (2H, т, J=5,3 Гц), 3,6-3,75 (5H, м), 3,8 (1H, д, J=12,0 Гц), 4,05 (2H, т, J=5,3 Гц), 4,95-5,05 (1H, м), 6,65 (1H, дд, J=8,1 Гц, 2,4 Гц), 6,76 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,1 Гц).
Пример 78
4-[(4-{3-[(S)-5-Бензилоксикарбониламино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и (S)-2-амино-6-(бензилоксикарбониламино)гексанамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола и 2-[2-амино-2-(метил)пропиониламино]этанола соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,3-1,45 (2H, м), 1,45-1,7 (4H, м), 1,85-2,0 (2H, м), 2,28 (3H, с), 2,6-2,85 (3H, м), 3,05-3,15 (3H, м), 3,25-3,4 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,1 (3H, м), 6,61 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,7 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,4 Гц), 7,2-7,4 (5H, м).
Пример 79
4-[(4-{3-[(S)-5-Амино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 4-[(4-{3-[(S)-5-бензилоксикарбониламино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола (0,17 г) в метаноле (4 мл) добавляли 10% порошок палладия-угля (30 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1 часа. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,13 г).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,3-1,7 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,6-2,9 (5H, м), 3,08 (1H, т, J=6,6 Гц), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=6,1 Гц), 5,01 (1H, д, J=7,0 Гц), 6,61 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 80
4-[(4-{3-[(S)-2,5-Диаминопентаноиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и (S)-2,5-бис(бензилоксикарбониламино)пентановую кислоту вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 2-бензилоксикарбониламиноуксусной кислоты соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,35-1,75 (4H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,59 (2H, т, J=6,9 Гц), 2,75-2,9 (1H, м), 3,2-3,5 (7H, м), 3,55-3,75 (3Н, м), 3,75-3,85,(1Н, м), 3,97 (2H, т, J=6,0 Гц), 5,01 (1H, д, J=7,3 Гц), 6,62 (1H, дд, J=8,5 Гц, 2,3 Гц), 6,72 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,5 Гц).
Ссылочный пример 40
1-Бензилоксикарбонил-4-[2-карбокси-2-(метил)пропионил]пиперазин
К раствору диэтил диметилмалоната (3 г) в этаноле (5 мл) добавляли раствор гидрохлорида натрия (0,64 г) в воде (2 мл) и смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь концентрировали при пониженном давлении и остаток подкисляли, добавляя 2 моль/л хлористоводородной кислоты. Полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением моноэтилдиметилмалоната (2,43 г). К раствору полученного моноэтилдиметилмалоната (1 г) в N,N-диметилформамиде (20 мл) добавляли 1-(бензилоксикарбонил)пиперазин (1,38 г), 1-гидроксибензотриазол (0,93 г), триэтиламин (1,31 мл) и 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (2,4 г) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 4/1 - 2/1) с получением 1-бензилоксикарбонил-4-[2-этоксикарбонил-2-(метил)пропионил]пиперазина (1,77 г). Этот продукт растворяли в этаноле (5 мл). К раствору добавляли 2 моль/л водного раствора гидрохлорида натрия (2,93 мл) и смесь перемешивали при 55°C в течение ночи. Реакционную смесь выливали в воду и полученную смесь промывали диэтиловым эфиром. Водный слой подкисляли, добавляя 2 моль/л хлористоводородной кислоты, и смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке (0,28 г).
1H ЯМР (CDC13) δ м.д.: 1,48 (6H, с), 3,25-3,7 (8H, м), 5,14 (2H, с), 7,3-7,4 (5H, м).
Пример 81
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(2-{2-метил-2-[(пиперазин-1-ил)карбонил]пропиониламино}этокси)-2-метилфенил]метил}-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 13, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 1-бензилоксикарбонил-4-[2-карбокси-2-(метил)пропионил]пиперазин вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-аминопропокси)фенил]метил}-5-изопропил-1H-пиразола и 2-бензилоксикарбониламиноуксусной кислоты соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,37 (6H, с), 2,3 (3H, с), 2,35-2,9 (5H, м), 3,1-3,75 (13H, м), 3,81 (1H, д, J=11,5 Гц), 4,02 (2H, т, J=5,4 Гц), 5,02 (1H, д, J=7,4 Гц), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Ссылочный пример 41
N,N-диметил-N'-(2-нитробензолсульфонил)-1,3-диаминопропан
К раствору N,N-диметил-1,3-диаминопропана (0,92 г) и триэтиламина (0,95 мл) в дихлорметане (10 мл) добавляли хлорид 2-нитробензолсульфонила (1 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1) с получением соединения, указанного в заголовке (1,26 г).
1H ЯМР (CDC13) δ м.д.: 1,7-1,8 (2H, м), 2,28 (6H, с), 2,46 (2H, т, J=5,9 Гц), 3,15-3,25 (2H, м), 7,65-7,75 (2H, м), 7,8-7,85 (1H, м), 8,05-8,15 (1H, м).
Ссылочный пример 42
Метил 3-(2-нитробензолсульфониламино)пропионат
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 2, используя гидрохлорид метил 3-аминопропионата вместо гидрохлорида глицинамида.
1H ЯМР (CDC13) δ м.д.: 2,61 (2Н, т, J=6,2 Гц), 3,37 (2H, кв, J=6,2 Гц), 3,69 (3H, с), 5,96 (1H, т, J=6,2 Гц), 7,7-7,8 (2H, м), 7,85-7,9 (1H, м), 8,1-8,2 (1H, м).
Ссылочный пример 43
4-Метил-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин
К раствору метил 3-(2-нитробензолсульфониламино)пропионата (6,15 г) в этаноле (20 мл) - метаноле (5 мл) добавляли 5 моль/л водного раствора гидрохлорида натрия (20 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь подкисляли, добавляя 2 моль/л хлористоводородной кислоты (55 мл), и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток обрабатывали н-гексаном и этилацетатом. Выпавшие в осадок кристаллы собирали фильтрацией, промывали н-гексаном и сушили при пониженном давлении с получением 3-(2-нитробензолсульфониламино)пропионовой кислоты (5,83 г). К раствору полученной 3-(2-нитробензолсульфониламино)пропионовой кислоты (0,5 г) в тетрагидрофуране (5 мл) добавляли 1,1'-карбонилбис-1H-имидазол (0,35 г) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 1-метилпиперазин (0,46 г) и смесь перемешивали при 50°C в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с аминопропилированным силикагелем (элюент: дихлорметан/метанол = 40/1) с получением соединения, указанного в заголовке (0,61 г).
1H ЯМР (CDC13) δ м.д.: 2,25-2,4 (7H, м), 2,61 (2H, т, J=5,7 Гц), 3,3-3,45 (4H, м), 3,55-3,65 (2H, м), 7,65-7,75 (2H, м), 7,8-7,9 (1H, м), 8,1-8,15 (1H, м).
Ссылочный пример 44
4-Бензил-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 43, используя 1-бензилпиперазин вместо 1-метилпиперазина.
1H ЯМР (CDC13) δ м.д.: 2,35-2,45 (4H, м), 2,59 (2H, т, J=5,8 Гц), 3,3-3,45 (4H, м), 3,52 (2H, с), 3,55-3,65 (2H, м), 7,2-7,35 (5H, м), 7,65-7,75 (2H, м), 7,8-7,9 (1H, м), 8,05-8,15 (1H, м).
Ссылочный пример 45
4-(2-Гидроксиэтил)-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 43, используя 1-(2-гидроксиэтил)пиперазин вместо 1-метилпиперазина.
1H ЯМР (CDC13) δ м.д.: 2,4-2,65 (8H, м), 3,37 (2H, т, J=5,8 Гц), 3,43 (2H, т, J=5,0 Гц), 3,55-3,7 (4H, м), 7,7-7,75 (2H, м), 7,8-7,9 (1H, м), 8,1-8,15 (1Н, м).
Ссылочный пример 46
4-(2-Ацетоксиэтил)-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин
К раствору 4-(2-гидроксиэтил)-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазина (1,15 г) и пиридина (1,47 мл) в дихлорметане (10 мл) добавляли уксусный ангидрид (1,72 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/2 - дихлорметан/метанол = 10/1) с получением соединения, указанного в заголовке (0,38 г).
1H ЯМР (CDC13) δ м.д.: 2,07 (3H, с), 2,4-2,55 (4H, м), 2,55-2,7 (4H, м), 3,3-3,45 (4H, м), 3,55-3,65 (2H, м), 4,05-4,15 (2H, м), 6,34 (1H, т, J=6,5 Гц), 7,7-7,75 (2H, м), 7,8-7,9 (1H, м), 8,1-8,15 (1H, м).
Пример 82
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-[(4-{3-[3-(диметиламино)пропиламино]пропокси}-2-метилфенил)метил]-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя N,N-диметил-N'-(2-нитробензолсульфонил)-1,3-диаминопропан вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,6-1,75 (2H, м), 1,85-2,0 (2H, м), 2,22 (6H, 5 с), 2,29 (3H, с), 2,3-2,4 (2H, м), 2,61 (2H, т, J=7,4 Гц), 2,7-2,85 (3H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,1 (1H, м), 6,61 (1H, дд, J=8,2 Гц, 2,5 Гц), 6,7 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,2 Гц).
Пример 83
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(метоксикарбонил)этиламино]пропокси}-2-метилфенил)метил]-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя метил 3-(2-нитробензолсульфониламино)пропионат вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,64 (2H, 20 т, J=6,5 Гц), 2,75-2,85 (1H, м), 2,9-3,1 (4H, м), 3,25-3,4 (4H, м), 3,6-3,7 (6H, м), 3,75-3,85 (1H, м), 4,03 (2H, т, J=6,0 Гц), 5,0-5,05 (1H, м), 6,64 (1H, дд, J=8,3 Гц, 2,3 Гц), 6,73 (1H, д, J=2,3 Гц), 6,87 (1H, д, J=8,3 Гц).
Пример 84
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(4-метилпиперазин-1-ил)карбонил]этиламино}пропокси)-2-метилфенил]метил}-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя 4-метил-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (6H, с), 2,35-2,45 (4H, м), 2,6 (2H, т, J=6,6 Гц), 2,75-2,9 (5H, м), 3,3-3,4 (4H, м), 3,5-3,7 (7H, м), 3,8-3,85 (1H, м), 4,0 (2H, т, J=6,0 Гц), 5,0-5,05 10 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 85
3-(β-D-Глюкопиранозилокси)-4-({4-[3-(2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}этиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя 4-(2-ацетоксиэтил)-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,46 (2H, т, J=5,1 Гц), 2,5-2,55 (4H, м), 2,6 (2H, т, J=6,6 Гц), 2,75-2,9 (5H, м), 3,25-3,4 (4H, м), 3,5-3,7 (9H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,72 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 86
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(пиперазин-1-ил)карбонил]этиламино}пропокси)-2-метилфенил]метил}-1H-пиразол
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(4-бензилпиперазин-1-ил)карбонил]этиламино}пропокси)-2-метилфенил]метил}-1H-пиразол получали тем же способом, который описан в примере 51, используя 4-бензил-1-[3-(2-нитробензолсульфониламино)пропионил]пиперазин вместо 2-метил-2-(2-нитробензолсульфониламино)пропионамида. Затем соединение, указанное в заголовке, получали тем же способом, который описан в примере 79, используя этот продукт вместо 4-[(4-{3-[(S)-5-бензилоксикарбониламино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,59 (2H, т, J=6,6 Гц), 2,7-2,9 (9H, м), 3,3-3,4 (4H, м), 3,45-3,55 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,72 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 87
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-(2-гидроксиэтилкарбамоил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
К раствору 3-бензилоксикарбониламинопропионовой кислоты (1 г) в тетрагидрофуране (10 мл) добавляли 1,1'-карбонилбис-1H-имидазол (0,94 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 2-аминоэтанол (0,81 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт последовательно промывали 0,5 моль/л хлористоводородной кислотой, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток промывали смесью растворителей н-гексана и этилацетата (2/1) и сушили при пониженном давлении с получением 2-[3-(бензилоксикарбониламино)пропиониламино]этанола (0,25 г). Полученный 2-[3-(бензилоксикарбониламино)пропиониламино]этанол (50 мг) растворяли в метаноле (3 мл). К раствору добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 2-(3-аминопропиониламино)этанола (24 мг). К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,81 г) и триэтиламина (0,21 мл) в дихлорметане (6 мл) добавляли хлорид метансульфонила (0,11 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (0,89 г). К раствору полученного 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (50 мг) в ацетонитриле (1 мл) - этаноле (1 мл) добавляли 2-(3-аминопропиониламино)этанол, описанный выше (23 мг), и йодид натрия (11 мг) и смесь перемешивали при 60°С в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1 - 5/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[2-(2-гидроксиэтилкарбамоил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (42 мг). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,03 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (18 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,41 (2H, т, J=6,7 Гц), 2,7-2,9 (5H,м), 3,25-3,4 (6H, м), 3,57 (2H, т, J=5,7 Гц), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,1 Гц), 4,95-5,05 (1Н, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 88
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-(3-гидроксипропилкарбамоил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 87, используя 3-амино-1-пропанол вместо 2-аминоэтанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,65-1,75 (2H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,4 (2H, т, J=6,8 Гц), 2,75-2,9 (5H, м), 3,24 (2H, т, J=6,9 Гц), 3,25-3,4 (4H, м), 3,56 (2H, т, J=6,3 Гц), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 89
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{2-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 87, используя 2-амино-1,3-пропандиол вместо 2-аминоэтанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,44 (2H, т, J=6,7 Гц), 2,75-2,85 (3H, м), 2,88 (2H, т, J=6,7 Гц), 3,25-3,4 (4H, м), 3,55-3,7 (7H, м), 3,75-3,85 (1H, м), 3,9-3,95 (1H, м), 4,0 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 90
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{2-[2-гидрокси-1-(гидроксиметил)-1-(метил)этилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 87, используя 2-амино-2-метил-1,3-пропандиол вместо 2-аминоэтанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,22 (3H, с), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,4 (2H, т, J=6,5 Гц), 2,75-2,9 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 91
3-(β-D-Глюкопиранозилокси)-4-{[4-(3-{2-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 87, используя трис(гидроксиметил)аминометан вместо 2-аминоэтанола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6Н, м), 1,9-2,0 (2Н, м), 2,29 (3Н, с), 2,44 (2Н, т, J=6,4 Гц), 2,75-2,9 (5H, м), 3,25-3,4 (4H, м), 3,6-3,75 (9H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,2 Гц), 6,71 (1H, д, J=2,2 Гц), 6,85 (1H, д, J=8,4 Гц).
Ссылочный пример 47
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он и ацетобром-α-D-галактозу вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она и ацетобром-α-D-глюкозы соответственно.
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,81 (3H, с), 1,98 (3H, с), 2,0-2,1 (5H, м), 2,22 (3H, с), 2,26 (3H, с), 2,75-2,85 (1H, м), 3,5 (1H, д, J=16,5 Гц), 3,55-3,7 (3H, м), 4,0-4,1 (3H, м), 4,1-4,2 (2H, м), 4,52 (2H, с), 5,07 (1H, дд, J=10,3 Гц, 3,3 Гц), 5,35-5,45 (2H, м), 5,52 (1H, д, J=7,8 Гц), 6,58(1H, дд, J=8,4 Гц, 2,7 Гц), 6,69(1H, д, J=2,7 Гц), 6,79 (1H, д, J=8,4 Гц), 7,2-7,35 (5H, м).
Ссылочный пример 48
3-(2,3,4,6-Тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-бензилоксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,95-2,05 (8H, м), 2,16 (3H, с), 2,27 (3H, с), 2,75-2,85 (1H, м), 3,51 (1H, д, J=16,6 Гц), 3,61 (1H, д, J=16,6 Гц), 3,8-3,9 (2H, м), 4,0-4,2 (5H, м), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,51 (1H, д, J=8,2 Гц), 6,6 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,7 (1H, д, J=2,7 Гц), 6,81 (1H, д, J=8,5 Гц).
Ссылочный пример 49
3-Бензиламинопропионамид
К раствору акриламида (32 г) в этаноле (450 мл) добавляли бензиламин (59 мл) и смесь перемешивали при 60°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 -дихлорметан/метанол = 50/1) с получением соединения, указанного в заголовке (73,2 г).
1H-ЯМР (CDCl3) δ м.д.: 2,35-2,45 (2Н, м), 2,9-2,95 (2Н, м), 3,81 (2Н, с), 5,15-5,6 (1Н, ушир.), 7,2-7,65 (6H, м).
Пример 92
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,1 г) и триэтиламина (0,026 мл) в дихлорметане (3 мл) добавляли метансульфонил хлорид (0,013 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (0,11 г). Этот продукт растворяли в растворе ацетонитрила (2 мл) и метанола (2 мл). К раствору добавляли 3-бензиламинопропионамид (46 мг) и йодид натрия (24 мг) и смесь перемешивали при 60°C в течение 3 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 20/1 - 10/1) с получением соединения, указанного в заголовке (78 мг).
1H-ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,83 (3H, с), 1,9-2,0 (5H, м), 2,02 (3H, с), 2,15 (3H, с), 2,26 (3H, с), 2,39 (2H, т, J=6,1 Гц), 2,67 (2H, т, J=7,0 Гц), 2,7-2,85 (3H, м), 3,5 (1H, д, J=16,6 Гц), 3,55-3,65 (3H, м), 3,91 (2H, т, J=6,1 Гц), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,21 (1H, ушир.с), 5,35-5,45 (2H, м), 5,53 (1H, д, J=8,2 Гц), 6,53 (1H, дд, J=8,6 Гц, 2,4 Гц), 6,63 (1H, д, J=2,4 Гц), 6,79 (1H, д, J=8,6 Гц), 7,2-7,35 (5H, м), 7,44 (1H, ушир.с).
Пример 93
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 92, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,1-1,15 (6H, м), 1,82 (3H, с), 1,9-2,1 (11H, м), 2,25 (3H, с), 2,39 (2H, т, J=6,1 Гц), 2,66 (2H, т, J=7,2 Гц), 2,7-2,9 (3H, м), 3,49 (1H, д, J=16,2 Гц), 3,58 (1H, д, J=16,2 Гц), 3,62 (2H, с), 3,8-3,95 (3Н, м), 4,05-4,15 (1Н, м), 4,29 (1H, дд, J=12,2 Гц, 4,0 Гц), 5,15-5,3 (4H, м), 5,56 (1H, д, J=7,6 Гц), 6,52 (1H, дд, J=8,2 Гц, 2,7 Гц), 6,62 (1H, д, J=2,7 Гц), 6,79 (1H, д, J=8,2 Гц), 7,2-7,35 (5H, м), 7,47 (1H, ушир.с).
Пример 94
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-галактопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (75 мг) в метаноле (3 мл) добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2,5 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-5-изопропил-1H-пиразола (66 мг). Этот продукт растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,03 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,04 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (43 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6Н, м), 1,9-2,0 (2Н, м), 2,28 (3Н, с), 2,42 (2Н, т, J=6,8 Гц), 2,7-2,9 (5H, м), 3,49 (1H, дд, J=9,7 Гц, 3,2 Гц), 3,55-3,8 (6H, м), 3,85 (1H, д, J=3,2 Гц), 3,99 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,7 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 95
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (45,3 г) в метаноле (400 мл) добавляли метоксид натрия (28% раствор метанола, 2,2 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 5/1 -4/1) с получением соединения, указанного в заголовке (33,2 г).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-1,95 (2H, м), 2,28 (3H, с), 2,4 (2H, т, J=6,9 Гц), 2,55-2,65 (2H, м), 2,75-2,85 (3H, м), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 3,92 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,55 (1H, дд, J=8,5 Гц, 2,8 Гц), 6,62 (1H, д, J=2,8 Гц), 6,83 (1H, д, J=8,5 Гц), 7,15-7,35 (5H, м).
Ссылочный пример 50
(4-Бензилокси-2-метилфенил)метанол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 9, используя бензил бромид вместо бензил 3-бромпропилового эфира.
1H-ЯМР (CDCl3) δ м.д.: 1,37 (1H, т, J=5,8 Гц), 2,36 (3H, с), 4,64 (2H, д, J=5,8 Гц), 5,06 (2H, с), 6,79 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,84 (1H, д, J=2,4 Гц), 7,23 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 51
[4-Бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метанол
К раствору тетрагидро-4H-пиран-4-ола (3,62 г) и триэтиламина (5,6 мл) в тетрагидрофуране (35 мл) добавляли метансульфонил хлорид (2,93 мл) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворимое вещество удаляли фильтрацией. К фильтрату добавляли N,N-диметилформамид (70 мл), 4-бензилокси-2-гидроксибензальдегид (5,39 г) и карбонат цезия (23 г) и смесь перемешивали при 80°C в течение 12 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 4/1 -2/1) с получением 4-бензилокси-2-(тетрагидро-4H-пиран-4-илокси)бензальдегида (4,58 г). Этот продукт растворяли в этаноле (70 мл). К раствору добавляли боргидрид натрия (0,28 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли метанол и полученную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали диэтиловым эфиром. Экстракт последовательно промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 3/1 - 1/1) с получением соединения, указанного в заголовке (4,45 г).
1H-ЯМР (CDCl3) δ м.д.: 1,75-1,85 (2H, м), 1,95-2,05 (2H, м), 2,11 (1H, т, J=6,3 Гц), 3,5-3,65 (2H, м), 3,9-4,0 (2H, м), 4,45-4,55 (1H, м), 4,63 (2H, д, J=6,3 Гц), 5,05 (2H, с), 6,5-6,6 (2H, м), 7,19 (1H, д, J=7,7 Гц), 7,3-7,45 (5H, м).
Ссылочный пример 52
4-[(4-Бензилокси-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя (4-бензилокси-2-метилфенил)метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (ДМСО-d6) δ м.д.:1,04 (6Н, д, J=6,8 Гц), 2,24 (3H, с), 2,65-2,8 (1H, м), 3,44 (2H, с), 5,02 (2H, с), 6,69 (1H, дд, J=8,7 Гц, 2,4 Гц), 6,75-6,85 (2H, м), 7,25-7,45 (5H, м).
Ссылочный пример 53
4-{[4-Бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H-ЯМР (CDCl3) δ м.д.: 1,16 (6H, д, J=7,1 Гц), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,9-3,05 (1H, м), 3,5-3,6 (2H, м), 3,64 (2H, с), 3,9-4,05 (2H, м), 4,4-4,5 (1H, м), 5,0 (2H, с), 6,45-6,55 (2H, м), 7,0 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 54
4-[(4-Бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-[(4-бензилокси-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он и 2,3,4,6-тетра-O-пивалоил-α-D-глюкопиранозил бромид (Kunz,H.; Harreus,A. Liebigs Ann. Chem. 1982, 41-48 Velarde,S.; Urbina,J.; Pena,M.R. J.Org.Chem. 1996, 61, 9541-9545) вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она и ацетобром-α-D-глюкозы соответственно.
1H-ЯМР (CDCl3) δ м.д.: 1,04 (9H, с), 1,05-1,2 (33H, м), 2,27 (3H, с), 2,7-2,85 (1H, м), 3,45-3,6 (2H, м), 3,8-3,9 (1H, м), 4,11 (1H, дд, J=12,6 Гц, 4,8 Гц), 4,17 (1H, дд, J=12,6 Гц, 1,8 Гц), 5,0 (2H, с), 5,15-5,3 (2H, м), 5,37 (1H, т, J=9,5 Гц), 5,65 (1H, д, J=7,8 Гц), 6,64 (1H, дд, J=8,4 Гц, 2,8 Гц), 6,77 (1H, д, J=2,8 Гц), 6,83 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 55
4-{[4-Бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он и бромид 2,3,4,6-тетра-O-пивалоил-α-D-глюкопиранозила вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он и ацетобром-α-D-глюкозы соответственно.
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 1,7-1,85 (2H,м), 1,95-2,05 (2H, м), 2,85-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,12 (1H, дд, J=12,4 Гц, 5,1 Гц), 4,19 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,4-4,5 (1H, м), 4,99 (2H, с), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,66 (1H, д, J=8,0 Гц), 6,42 (1H, дд, J=8,3 Гц, 2, 3 Гц), 6,47 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,3 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 56
1-(2-Бензилоксиэтил)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (2 г) в N,N-диметилацетоамиде (36 мл) добавляли гидрид натрия (55%, 0,26 г) и бензил 2-бромэтиловый эфир (0,76 мл) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт дважды промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 4/1) с получением соединения, указанного в заголовке (0,89 г).
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 2,28 (3H, с), 2,95-3,05 (1H, м), 3,52 (1H, д, J=17,0 Гц), 3,57 (1H, д, J=17,0 Гц), 3,75-3,85 (3H, м), 4,0-4,2 (4H, м), 4,46 (1H, д, J=12,1 Гц), 4,49 (1H, д, J=12,1 Гц), 4,99 (2H, с), 5,1-5,2 (2H, м), 5,34 (1H, т, J=9,5 Гц), 5,61 (1H, д, J=8,1 Гц), 6,6 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,73 (1H, д, J=8,5 Гц), 6,77 (1H, д, J=2,6 Гц), 7,2-7,45 (10H, м).
Ссылочный пример 57
4-[(4-Бензилокси-2-метилфенил)метил]-1-(3-бензилоксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 56, используя бензил 3-бромпропиловый эфир вместо бензил 2-бромэтилового эфира.
1H-ЯМР (CDCl3) δ м.д.: 1,03 (9H, с), 1,05-1,2 (33H, м), 2,05-2,15 (2H, м), 2,28 (3H, с), 2,9-3,0 (1H, м), 3,45-3,6 (4H, м), 3,7-3,8 (1H, м), 3,95-4,1 (3H, м), 4,12 (1H, дд, J=12,0 Гц, 1,9 Гц), 4,51 (2H, с), 5,0 (2H, с), 5,1-5,2 (2H, м), 5,33 (1H, т, J=9,5 Гц), 5,61 (1H, д, J=8,2 Гц), 6,61 (1H, дд, J=8,3 Гц, 2,7 Гц), 6,72 (1H, д, J=8,3 Гц), 6,77 (1H, д, J=2,7 Гц), 7,2-7,5 (10H, м).
Ссылочный пример 58
4-[(4-Гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
4-[(4-Бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол (5 г) растворяли в тетрагидрофуране (18 мл). К раствору добавляли 10% порошок палладия-угля (500 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворимое вещество удаляли фильтрацией и растворитель фильтрата удаляли при пониженном давлении с получением соединения, указанного в заголовке (4,45 г).
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 2,24 (3H, с), 2,7-2,85 (1H, м), 3,52 (2H, с), 3,8-3,9 (1H, м), 4,09 (1H, дд, J=12,4 Гц, 4,7 Гц), 4,15 (1H, дд, J=12,4 Гц, 1,9 Гц), 4,6 (1H, с), 5,15-5,25 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,65 (1H, д, J=8,0 Гц), 6,5 (1H, дд, J=8,3 Гц, 2,9 Гц), 6,61 (1H, д, J=2,9 Гц), 6,78 (1H, д, J=8,3 Гц).
Ссылочный пример 59
1-(2-Гидроксиэтил)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 58, используя 1-(2-бензилоксиэтил)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 2,26 (3H, с), 2,9-3,0 (1H, м), 3,51 (1H, д, J=17,0 Гц), 3,55 (1H, д, J=17,0 Гц), 3,75-3,9 (2H, м), 3,9-4,0 (2H, м), 4,0-4,15 (4H, м), 4,61 (1H, с), 5,15-5,25 (2H, м), 5,35 (1H, т, J=9,4 Гц), 5,53 (1H, д, J=8,1 Гц), 6,48 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,61 (1H, д, J=2,7 Гц), 6,67 (1H, д, J=8,4 Гц).
Ссылочный пример 60
4-[(4-Гидрокси-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 58, используя 4-[(4-бензилокси-2-метилфенил)метил]-1-(3-бензилоксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,03 (9H, с), 1,05-1,15 (24H, м), 1,19 (9H, с), 1,9-2,0 (2H, м), 2,25 (3H, с), 2,9-3,0 (1H, м), 3,5 (1H, д, J=17,3 Гц), 3,54 (1H, д, J-17,3 ГЦ), 3,6-3,7 (2H, м), 3,8-3,9 (1H, м), 3,93 (1H, т, J=6,4 Гц), 4,1-4,2 (3H, м), 4,22 (1H, дд, J=12,6 Гц, 1,7 Гц), 4,51 (1H, с), 5,15-5,25 (2H, м), 5,35 (1H, т, J=9,4 Гц), 5,52 (1H, д, J=8,1 Гц), 6,48 (1H, дд, J=8,3 Гц, 2,4 Гц), 6,61 (1H, д, J=2,4 Гц), 6,66 (1H, д, J=8,3 Гц).
Ссылочный пример 61
4-{[4-Гидрокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 58, используя 4-{[4-бензилокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,8-2,95 (1H, м), 3,52 (1H, д, J=16,5 Гц), 3,55-3,65 (3H, м), 3,8-3,9 (1H, м), 3,9-4,05 (2H, м), 4,05-4,2 (2H, м), 4,4-4,5 (1H, м), 5,14 (1H, ушир.с), 5,15-5,3 (2H, м), 5,3-5,4 (1H, м), 5,65 (1H, д, J=8,1 Гц), 6,22 (1H, дд, J=8,2 Гц, 2,3 Гц), 6,37 (1H, д, J=2,3 Гц), 6,78 (1H, д, J=8,2 Гц).
Ссылочный пример 62
4-{[4-(3-Хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (8,58 г), 1-бром-3-хлорпропана (2,85 мл) и бромида тетра(н-бутил)аммония (1,86 г) в тетрагидрофуране (43 мл) добавляли 5 моль/л водного раствора гидрохлорида натрия (5,76 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Экстракт последовательно промывали 1 моль/л хлористоводородной кислотой, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в н-гексане (15 мл) - диизопропиловом эфире (5 мл) при кипячении с обратным холодильником. Раствор охлаждали до комнатной температуры и к раствору добавляли н-гексан (25 мл). Выпавшие в осадок кристаллы собирали фильтрацией и кристаллы промывали н-гексаном и сушили при пониженном давлении с получением соединения, указанного в заголовке (6,06 г).
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 2,15-2,25 (2H, м), 2,27 (3H, с), 2,7-2,85 (1H, м), 3,51 (1H, д, J=16,7 Гц), 3,53 (1H, д, J=16,7 Гц), 3,73 (2H, т, J=6,4 Гц), 3,8-3,9 (1H, м), 4,05 (2H, т, J=5,9 Гц), 4,11 (1H, дд, J=12,4 Гц, 4,7 Гц), 4,17 (1H, дд, J=12,4 Гц, 1,9 Гц), 5,15-5,3 (2H, м), 5,3-5,4 (1H, м), 5,65 (1H, д, J=8,1 Гц), 6,57 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,68 (1H, д, J=2,7 Гц), 6,83 (1H, д, J=8,4 Гц).
Ссылочный пример 63
4-{[4-(3-Хлорпропокси)-2-метилфенил]метил}-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 1-(2-гидроксиэтил)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,69 г), 1-бром-3-хлорпропан (0,22 мл) и бромида тетра(н-бутил)аммония (0,14 г) в тетрагидрофуране (8 мл) добавляли 5 моль/л водного раствора гидрохлорида натрия (0,43 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным солевым раствором последовательно и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1) с получением соединения, указанного в заголовке (0,56 г).
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 2,15-2,25 (2H, м), 2,28 (3H, с), 2,9-3,0 (1H, м), 3,52 (1H, д, J=16,9 Гц), 3,57 (1H, д, J=16,9 Гц), 3,73 (2H, т, J=6,2 Гц), 3,75-4,0 (4H, м), 4,0-4,15 (6H, м), 5,15-5,25 (2H, м), 5,35 (1H, т, J=9,6 Гц), 5,54 (1H, д, J=8,1 Гц), 6,56 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,69 (1H, д, J=2,5 Гц), 6,72 (1H, д, J=8,5 Гц).
Ссылочный пример 64
4-{[4-(3-Хлорпропокси)-2-метилфенил]метил}-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 63, используя 4-[(4-гидрокси-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 1-(2-гидроксиэтил)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,02 (9H, с), 1,05-1,15 (24H, м), 1,19 (9H, с), 1,9-2,0 (2H, м), 2,15-2,25 (2H, м), 2,28 (3H, с), 2,9-3,0 (1H, м), 3,51 (1H, д, J=16,9 Гц), 3,55 (1H, д, J=16,9 Гц), 3,6-3,7 (2H, м), 3,73 (2H, т, J=6,3 Гц), 3,8-3,9 (1H, м), 3,96 (1H, т, J=6,4 Гц), 4,05 (2H, т, J=5,9 Гц), 4,1-4,2 (3H, м), 4,23 (1H, дд, J=12,6 Гц, 1,7 Гц), 5,15-5,25 (2H, м), 5,35 (1H, т, J=9,4 Гц), 5,52 (1H, д, J=8,1 Гц), 6,55 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,69 (1H, д, J=2,6 Гц), 6,71 (1H, д, J=8,4 Гц).
Ссылочный пример 65
4-{[4-(3-Хлорпропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 63, используя 4-{[4-гидрокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 1-(2-гидроксиэтил)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CDCl3) δ м.д.: 1,0-1,2 (42H, м), 1,75-1,9 (2H, м), 2,0-2,1 (2H, м), 2,15-2,25 (2H, м), 2,85-2,95(1H, м), 3,5-3,65 (4H, м), 3,73 (2H, т, J=6,4 Гц), 3,8-3,9 (1H, м), 3,9-4,1 (4H, м), 4,13 (1H, дд, J=12,4 Гц, 4,8 Гц), 4,19 (1H, дд, J=12,4 Гц, 1,9 Гц), 4,4-4,55 (1H, м), 5,15-5,3 (2H, м), 5,3-5,4 (1H, м), 5,66 (1H, д, J=8,1 Гц), 6,34 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,41 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Ссылочный пример 66
3-[N-Бензилоксикарбонил-N-(3-бромпропил)амино]пропионамид
К раствору акриламида (2 г) в этаноле (30 мл) добавляли 3-амино-1-пропанол (3,23 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли тетрагидрофуран (30 мл) и N-(бензилоксикарбонилокси)сукцинимид (14 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 40/1 - 20/1 - 5/1) с получением 3-[N-бензилоксикарбонил-N-(3-гидроксипропил)амино]пропионамида (3,51 г). К раствору полученного 3-[N-бензилоксикарбонил-N-(3-гидроксипропил)амино]пропионамида (0,5 г) и тетрабромида углерода (0,65 г) в дихлорметане (5 мл) добавляли трифенилфосфин (1,03 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/4 -дихлорметан/метанол = 10/1) с получением соединения, указанного в заголовке (0,41 г).
1H-ЯМР (CD3OD) δ м.д.: 2,0-2,2 (2H, м), 2,4-2,55 (2H, м), 3,35-3,5 (4H, м), 3,56 (2H, т, J=6,9 Гц), 5,12 (2H, с), 7,25-7,45 (5H, м).
Пример 96
4-[(4-{3-[N-Бензилоксикарбонил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,4 г), 3-[N-бензилоксикарбонил-N-(3-бромпропил)амино]пропионамида (0,28 г) и бромида тетра(н-бутил)аммония (87 мг) в дихлорметане (4 мл) добавляли 5 моль/л водного раствора гидрохлорида натрия (0,32 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали 1 моль/л хлористоводородной кислоты, водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/3 -1/6) с получением соединения, указанного в заголовке (0,42 г).
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,9-2,05 (2H, м), 2,25 (3H, с), 2,4-2,55 (2H, м), 2,75-2,85 (1H, м), 3,45-3,65 (6H, м), 3,85-4,0 (3H, м), 4,08 (1H, дд, J=12,5 Гц, 1,9 Гц), 4,16 (1H, дд, J=12,5 Гц, 4,4 Гц), 4,95-5,2 (4H, м), 5,35-5,45 (1H, м), 5,58 (1H, д, J=7,9 Гц), 6,45-6,75 (2H, м), 6,8 (1H, д, J=8,4 Гц), 7,25-7,4 (5H, м).
Пример 97
4-{[4-{3-[N-Бензилоксикарбонил-N-(2-карбамоилэтил)амино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 96, используя 4-{[4-гидрокси-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,7-1,85 (2H, м), 1,9-2,15 (4H, м), 2,4-2,55 (2H, м), 2,85-2,95 (1H, м), 3,35-3,65 (8H, м), 3,85-4,0 (5H, м), 4,11 (1H, дд, J=12,5 Гц, 1,9 Гц), 4,18 (1H, дд, J=12,5 Гц, 4,4 Гц), 4,45-4,6 (1H, м), 5,05-5,2 (4H, м), 5,35-5,4 (1H, м), 5,57 (1H, д, J=8,2 Гц), 6,2-6,6 (2H, м), 6,8 (1H, д, J=8,4 Гц), 7,2-7,45 (5H, м).
Пример 98
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Смесь 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (1,34 г), 3-бензиламинопропионамида (0,73 г), йодида натрия (0,24 г), этанола (6 мл) и ацетонитрила (6 мл) перемешивали при 70°C в течение 2 дней. К реакционной смеси добавляли йодид натрия (0,2 г) и смесь дополнительно перемешивали при 75°C в течение 24 часов. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/5 -дихлорметан/метанол = 15/1) с получением соединения, указанного в заголовке (0,97 г).
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,85-1,95 (2H, м), 2,26 (3H, с), 2,4 (2H, т, J=6,9 Гц), 2,62 (2H, т, J=6,9 Гц), 2,75-2,9 (3H, м), 3,52 (1H, д, J=16,4 Гц), 3,56 (1H, д, J=16,4 Гц), 3,62 (2H, с), 3,85-3,95 (3H, м), 4,08 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,16 (1H, дд, J=12,4 Гц, 4,4 Гц), 5,05-5,2 (2H, м), 5,35-5,45 (1H, м), 5,58 (1H, д, J=8,1 Гц), 6,52 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,61 (1H, д, J=2,5 Гц), 6,79 (1H, д, J=8,5 Гц), 7,15-7,35 (5H, м).
Пример 99
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 98, используя 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,85-1,95 (2H, м), 2,28 (3H, с), 2,4 (2H, т, J=7,1 Гц), 2,62 (2H, т, J=7,0 Гц), 2,8 (2H, т, J=7,1 Гц), 3,05-3,15 (1H, м), 3,5-3,65 (4H, м), 3,8-3,95 (5H, м), 4,0-4,2 (4H, м), 5,0-5,2 (2H, м), 5,36 (1H, т, J=9,5 Гц), 5,59 (1H, д, J=7,8 Гц), 6,5 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,62 (1H, д, J=2,7 Гц), 6,7 (1H, д, J=8,5 Гц), 7,15-7,4 (5H, м).
Пример 100
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 98, используя 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42Н, м), 1,85-2,05 (4H, м), 2,28 (3H, с), 2,4 (2H, т, J=7,0 Гц), 2,62 (2H, т, J=7,0 Гц), 2,8 (2H, т, J=7,0 Гц), 3,0-3,1 (1H, м), 3,5-3,65 (6H, м), 3,85-3,95 (3H, м), 4,0-4,2 (4H, м), 5,0-5,2 (2H, м), 5,37 (1H, т, J=9,4 Гц), 5,6 (1H, д, J=7,7 Гц), 6,5 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,62 (1H, д, J=2,6 Гц), 6,67 (1H, д, J=8,4 Гц), 7,15-7,35 (5H, м).
Пример 101
4-{[4-{3-[1-Карбамоил-1-(метил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 98, используя 4-{[4-(3-хлорпропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол и 2-амино-2-метилпропионамид вместо 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола и 3-бензиламинопропионамида соответственно.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (42H, м), 1,32 (6H, с), 1,7-1,85 (2H, м), 1,85-2,1 (4H, м), 2,69 (2H, т, J=7,0 Гц), 2,85-2,95 (1H, м), 3,53 (1H, д, J=16,6 Гц), 3,55-3,7 (3H, м), 3,85-4,05 (5H, м), 4,11 (1H, дд, J=12,4 Гц, 1,6 Гц), 4,18 (1H, дд, J=12,4 Гц, 4,3 Гц), 4,55-4,65 (1H, м), 5,05-5,2 (2H, м), 5,3-5,4 (1H, м), 5,56 (1H, д, J=8,2 Гц), 6,38 (1H, дд, J=8,4 Гц, 2,2 Гц), 6,53 (1H, д, J=2,2 Гц), 6,81 (1H, д, J=8,4 Гц).
Пример 102
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,96 г) в тетрагидрофуране (5 мл) добавляли 10% порошок палладия-угля (0,1 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (0,87 г).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (42H, м), 1,9-2,0 (2H, м), 2,27 (3H, с), 2,43 (2H, т, J=6,8 Гц), 2,75-2,9 (5H, м), 3,53 (1H, д, J=16,4 Гц), 3,56 (1H, д, J=16,4 Гц), 3,9-4,05 (3H, м), 4,08 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,16 (1H, дд, J=12,4 Гц, 4,4 Гц), 5,05-5,2 (2H, м), 5,35-5,45 (1H, м), 5,58 (1H, д, J=8,1 Гц), 6,59 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,81 (1H, д, J=8,4 Гц).
Пример 103
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 102, используя 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (42H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,42 (2H, т, J=6,9 Гц), 2,77 (2H, т, J=7,1 Гц), 2,85 (2H, т, J=6,9 Гц), 3,05-3,2 (1H, м), 3,56 (1H, д, J=16,8 Гц), 3,61 (1H, д, J=16,8 Гц), 3,8-4,2 (9H, м), 5,0-5,2 (2H, м), 5,37 (1H, т, J=9,4 Гц), 5,59 (1H, д, J=8,0 Гц), 6,56 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,65-6,75 (2H, м).
Пример 104
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 102, используя 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,9-2,05 (4H, м), 2,29 (3H, с), 2,44 (2H, т, J=6,8 Гц), 2,81 (2H, т, J=7,1 Гц), 2,88 (2H, т, J=6,8 Гц), 3,0-3,15 (1H, м), 3,5-3,65 (4H, м), 3,85-4,2 (7H, м), 5,0-5,2 (2H, м), 5,37 (1H,т, J=9,5 Гц), 5,6 (1H, д, J=8,4 Гц), 6,57 (1H, дд, J=8,3 Гц, 2,3 Гц), 6,65-6,75 (2H, м).
Пример 105
4-{[4-{3-[2-(Карбамоил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 102, используя 4-{[4-{3-[N-бензилоксикарбонил-N-(2-карбамоилэтил)амино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (42H, м), 1,7-1,85 (2H, м), 2,0-2,1 (2H, м), 2,1-2,2 (2H, м), 2,67 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,2-3,35 (4H, м), 3,54 (1H, д, J=16,5 Гц), 3,55-3,7 (3H, м), 3,9-4,0 (3H, м), 4,05-4,15 (3H, м), 4,19 (1H, дд, J=12,4 Гц, 4,4 Гц), 4,55-4,65 (1H, м), 5,05-5,2 (2H, м), 5,35-5,45 (1H, м), 5,58 (1H, д, J=8,1 Гц), 6,43 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,64 (1H, д, J=2,3 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 106
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-1H-пиразол
К раствору 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,3 г) в метаноле (6 мл) добавляли метоксид натрия (28% раствор метанола, 0,25 мл) и смесь перемешивали при 50°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (0,16 г).
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,9-2,05 (4H, м), 2,3 (3H, с), 2,42 (2H, т, J=6,8 Гц), 2,77 (2H, т, J=7,1 Гц), 2,84 (2H, т, J=6,8 Гц), 3,0-3,15 (1H, м), 3,2-3,4 (4H, м), 3,55-3,75 (5H, м), 3,8 (1H, дд, J=12,1 Гц, 2,1 Гц), 3,99 (2H, т, J=6,2 Гц), 4,11 (2H, т, J=7,2 Гц), 5,03 (1H, д, J=7,6 Гц), 6,6(1H, дд, J=8,3 Гц, 2,6 Гц), 6,72 (1H, д, J=2,6 Гц), 6,74 (1H, д, J=8,3 Гц).
Пример 107
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-1-(2-гидроксиэтил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 106, используя 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(2-гидроксиэтил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,1-1,2 (6H, м), 1,85-2,0 (2H, м), 2,3 (3H, с), 2,41 (2H, т, J=6,8 Гц), 2,77 (2H, т, J=7,1 Гц), 2,84 (2H, т, J=6,8 Гц), 3,05-3,2 (1H, м), 3,2-3,4 (4H, м), 3,6-3,75 (3H, м), 3,79 (1H, дд, J=12,0 Гц, 2,2 Гц), 3,85 (2H, т, J=5,7 Гц), 3,99 (2H, т, J=6,0 Гц), 4,09 (2H, т, J=5,7 Гц), 5,06 (1H, д, J=7,7 Гц), 6,6 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,72 (1H, д, J=2,7 Гц), 6,77 (1H, д, J=8,4 Гц).
Пример 108
4-{[4-{3-[1-Карбамоил-1-(метил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 106, используя 4-{[4-{3-[1-карбамоил-1-(метил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,29 (6H, с), 1,7-1,85 (2H, м), 1,85-1,95 (2H, м), 1,95-2,1 (2H, м), 2,64 (2H, т, J=6,9 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,55-3,75 (5H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,5-4,65 (1H, м), 5,0-5,1 (1H, м), 6,4 (1H, дд, J=8,4 Гц, 2,0 Гц), 6,53 (1H, д, J=2,0 Гц), 6,9 (1H, д, J=8,4 Гц).
Пример 109
4-{[4-{3-[2-(Карбамоил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 106, используя 4-{[4-{3-[2-(карбамоил)этиламино]пропокси}-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 4-[(4-{3-[2-(карбамоил)этиламино]пропокси}-2-метилфенил)метил]-1-(3-гидроксипропил)-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,7-1,85 (2H, м), 1,9-2,1 (4H, м), 2,43 (2H, т, J=6,8 Гц), 2,79 (2H, т, J=7,0 Гц), 2,8-2,95 (3H, м), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,8-3,85 (1H, м), 3,9-4,05 (4H, м), 4,55-4,65 (1H, м), 5,0-5,1 (1H, м), 6,41 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,54 (1H, д, J=2,4 Гц), 6,9 (1H, д, J=8,4 Гц).
Пример 110
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (1,25 г) в метаноле (13 мл) добавляли метоксид натрия (28% раствор метанола, 0,25 мл) и смесь перемешивали при 50°C в течение 6 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1 -5/1) с получением соединения, указанного в заголовке (0,5 г).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-1,95 (2H, м), 2,28 (3H, с), 2,4 (2H, т, J=6,9 Гц), 2,55-2,65 (2H, м), 2,75-2,85 (3H, м), 3,25-3,4 (4H, м), 3,55-3,75 (5H, м), 3,75-3,85 (1H, м), 3,92 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,55 (1H, дд, J=8,5 Гц, 2,8 Гц), 6,62 (1H, д, J=2,8 Гц), 6,83 (1H, д, J=8,5 Гц), 7,15-7,35 (5H, м).
Пример 111
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
4-[(4-{3-[N-Бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол (0,5 г) растворяли в метаноле (8 мл). К раствору добавляли 10% порошок палладия-угля (0,1 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Часть (0,1 г) остатка растворяли в смеси растворителей метанола (1 мл) и этилацетата (1,5 мл). К раствору добавляли затравочный кристалл и смесь перемешивали при комнатной температуре в течение 3 дней. Выпавшие в осадок кристаллы собирали фильтрацией. Кристаллы промывали смесью растворителей метанола и этилацетата (2/3) и сушили при пониженном давлении с получением соединения, указанного в заголовке (85 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,42 (2H, т, J=6,9 Гц), 2,7-2,9 (5H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц).
Точка плавления: 191-193°C.
Пример 112
4-[(4-{(S)-3-[2-(Карбамоил)этиламино]-2-гидроксипропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К суспензии 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,3 г) и карбоната калия (84 мг) в N,N-диметилформамиде (3 мл) добавляли (S)-1-(п-толуолсульфонилокси)-2,3-эпоксипропан (0,1 г) и каталитическое количество фторида цезия и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в метаноле (5 мл). К раствору добавляли 3-бензиламинопропионамид (0,14 г) и смесь перемешивали при 50°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/2-дихлорметан/метанол = 10/1) с получением 4-[(4-{(S)-3-[N-бензил-N-(2-карбамоилэтил)амино]-2-гидроксипропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,23 г). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (0,1 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 дней. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле (5 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,085 мл) и смесь перемешивали при 50°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток последовательно очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и препаративной колоночной хроматографией на колонке (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120 Ǻ, 20 x 50 мм, скорость потока 30 мл/мин линейный градиент, вода/метанол = 90/10 - 10/90) с получением соединения, указанного в заголовке (23 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,43 (2H, т, J=6,7 Гц), 2,65-2,95 (5H, м), 3,25-3,4 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,9 (2H, д, J=5,3 Гц), 3,95-4,05 (1H, м), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 113
4-[(4-{(R)-3-[2-(Карбамоил)этиламино]-2-гидроксипропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 112, используя (R)-1-(п-толуолсульфонилокси)-2,3-эпоксипропан вместо (S)-1-(п-толуолсульфонилокси)-2,3-эпоксипропана.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,43 (2H, т, J=6,7 Гц), 2,65-2,95 (5H, м), 3,25-3,4 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,9 (2H, д, J=5,3 Гц), 4,0-4,05 (1H, м), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,74 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Ссылочный пример 67
Бензил 3-бензиламинопропионат
К раствору бензил акрилата (2 г) в этаноле (15 мл) добавляли бензиламин (1,75 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1 -1/1) с получением соединения, указанного в заголовке (2,91 г).
1H-ЯМР (CDCl3) δ м.д.: 2,59 (2H, т, J=6,5 Гц), 2,92 (2H, т, J=6,5 Гц), 3,79 (2H, с), 5,13 (2H, с), 7,2-7,4 (10H, м).
Пример 114
4-{[4-(3-{2-[(S)-1-Карбамоил-2-гидроксиэтилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (1 г) и триэтиламина (0,29 мл) в дихлорметане (10 мл) добавляли метансульфонил хлорид (0,13 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (1,12 г). Этот продукт растворяли в ацетонитриле (7 мл) - этаноле (7 мл). К раствору добавляли бензил 3-бензиламинопропионат (1,27 г) и йодид натрия (240 мг) и смесь перемешивали при 60°C в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан /метанол = 30/1 -20/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-бензилоксикарбонилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (1,3 г). Этот продукт растворяли в метаноле (10 мл). К раствору добавляли 10% порошок палладия-угля (0,65 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(2-карбоксиэтиламино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразола (0,95 г). Этот продукт растворяли в 1,4-диоксане (10 мл). К раствору добавляли гидрокарбонат натрия (0,45 г) и воду (10 мл) и смесь перемешивали в течение 15 минут. В реакционную смесь добавляли бензилоксикарбонил хлорид (0,23 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли бензилоксикарбонил хлорид (0,23 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N-бензилоксикарбонил-N-(2-карбоксиэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,86 г). К раствору полученного 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[N-бензилоксикарбонил-N-(2-карбоксиэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,17 г) в N,N-диметилформамиде (3 мл) добавляли L-серин амид гидрохлорид (37 мг), 1-гидроксибензотриазол (30 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (77 мг) и триэтиламин (0,11 мл) и смесь перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан /метанол = 20/1 - 10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[3-(N-бензилоксикарбонил-N-{2-[(S)-1-карбамоил-2-гидроксиэтилкарбамоил]этил}амино)пропокси]-2-метилфенил}метил)-5-изопропил-1H-пиразола (81 мг). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (10 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле (4 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (38 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,0-1,2 (6H, м), 1,85-2,0 (2H, м), 2,28 (3H, с), 2,4-2,55 (2H, м), 2,7-2,95 (5H, м), 3,25-3,4 (4H, м), 3,55-3,85 (6H, м), 3,99 (2H, т, J=6,1 Гц), 4,35-4,45 (1H, м), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,2 Гц), 6,71 (1H, д, J=2,2 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 115
4-[(4-{3-[2-(Карбамоилметилкарбамоил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 114, используя глицинамид гидрохлорид вместо L-серин амид гидрохлорида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,46 (2H, т, J=6,6 Гц), 2,7-2,85 (3H, м), 2,88 (2H, т, J=6,6 Гц), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (3H, м), 3,99 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 116
4-{[4-(3-{2-[(S)-1-(Карбамоил)этилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 114, используя L-аланин амид гидрохлорид вместо L-серин амид гидрохлорида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,33 (3H, д, J=7,2 Гц), 1,9-2,0 (2H, м), 2,29 (3H, с), 2,35-2,5 (2H, м), 2,7-2,9 (5H, м), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,1 Гц), 4,32 (1H, кв, J=7,2 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 117
4-{[4-(3-{2-[(S)-5-Амино-1-(карбамоил)пентилкарбамоил]этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 114, используя (S)-2-амино-6-(бензилоксикарбониламино)гексанамид гидрохлорид вместо L-серин амид гидрохлорида.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6Н, м), 1,25-2,0 (8Н, м), 2,29 (3Н, с), 2,35-2,55 (2Н, м), 2,63 (2Н, т, J=7,0 Гц), 2,7-2,95 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (3Н, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,25-4,35 (1H, м), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,2 Гц), 6,71 (1H, д, J=2,2 Гц), 6,84 (1H, д, J=8,4 Гц).
Ссылочный пример 68
Бензил 3-амино-2,2-ди(метил)пропионат
К раствору 3-амино-2,2-диметил-1-пропанола (5 г) в метаноле (50 мл) добавляли ди-трет-бутил дикарбонат (12,7 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток (твердый) обрабатывали н-гексан-диэтиловым эфиром и собирали фильтрацией, промывали н-гексаном и сушили при пониженном давлении с получением 3-(трет-бутоксикарбониламино)-2,2-диметил-1-пропанола (7,48 г). К этому продукту последовательно добавляли тетрахлорид углерода (40 мл), ацетонитрил (40 мл), воду (48 мл), периодат натрия (38,8 г) и рутений трихлорид - н гидрат (1 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором. К органическому слою добавляли насыщенный водный раствор карбоната натрия и водный слой отделяли. Водный слой подкисляли 2 моль/л хлористоводородной кислотой и смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 3-(трет-бутоксикарбониламино)-2,2-ди(метил)пропионовой кислоты (2,78 г). Этот продукт растворяли в N,N-диметилформамиде (30 мл). К раствору добавляли карбонат калия (3,54 г) и бензил бромид (2,28 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1) с получением бензил 3-(трет-бутоксикарбониламино)-2,2-ди(метил)пропионата (2,72 г). К этому продукту добавляли хлористоводородную кислоту (4 моль/л раствора 1,4-диоксана, 10 мл) и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке (1,61 г).
1H-ЯМР (ДМСО-d6) δ м.д.: 1,09 (6H, с), 1,35-1,7 (2H, ушир.), 2,63 (2H, с), 5,09 (2H, с), 7,25-7,45 (5H, м).
Пример 118
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(пиперазин-1-ил)карбонил]-2-(метил)пропиламино}пропокси)-2-метилфенил]метил}-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (1 г) и триэтиламина (0,25 мл) в дихлорметане (5 мл) добавляли метансульфонил хлорид (0,13 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразола (1,12 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(метансульфонилокси)пропокси]-2-метилфенил}метил)-1H-пиразол (0,36 г) растворяли в 2-пропаноле (2 мл) - ацетонитриле (2 мл). К раствору добавляли бензил 3-амино-2,2-ди(метил)пропионат (0,26 г) и йодид натрия (75 мг) и смесь перемешивали при 60°C в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/5-дихлорметан/метанол = 20/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[2-бензилоксикарбонил-2-(метил)пропиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,35 г). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (0,1 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 5 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{3-[2-карбокси-2-(метил)пропиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,31 г). Этот продукт растворяли в тетрагидрофуране (4 мл). К раствору добавляли триэтиламин (0,094 мл) и N-(бензилоксикарбонилокси)сукцинимид (64 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 20/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-{N-бензилоксикарбонил-N-[2-карбокси-2-(метил)пропил]амино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,3 г). К раствору полученного 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-{N-бензилоксикарбонил-N-[2-карбокси-2-(метил)пропил]амино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,1 г) в N,N-диметилформамиде (2 мл) добавляли 1-бензилпиперазин (26 мг), 1-гидроксибензотриазол (17 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг) и триэтиламин (0,064 мл) и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 40/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-{N-бензилоксикарбонил-N-[2-(4-бензилпиперазин-1-ил)карбонил-2-(метил)пропил]амино}пропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (45 мг). Этот продукт растворяли в тетрагидрофуране (4 мл). К раствору добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. К реакционной смеси добавляли метанол (2 мл) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 5 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток последовательно очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и препаративной колоночной хроматографией с обратной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120 Ǻ, 20 x 50 мм, скорость потока 30 мл/минута линейный градиент, вода/метанол = 90/10 - 10/90) с получением соединения, указанного в заголовке (12 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,29 (6H, с), 1,85-2,0 (2H, м), 2,3 (3H, с), 2,65-2,9 (9H, м), 3,25-3,4 (4H, м), 3,5-3,75 (7H, м), 3,75-3,85 (1H, м), 4,0 (2H, т, J=5,8 Гц), 5,0-5,1 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,0 Гц), 6,72 (1H, д, J=2,0 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 119
4-{[4-(3-{2-[(S)-1-Карбамоил-2-гидроксиэтилкарбамоил]-2-(метил)пропиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 118, используя L-серин амид гидрохлорид вместо 1-бензилпиперазина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,17 (3H, с), 1,19 (3H, с), 1,9-2,0 (2H, м), 2,28 (3H, с), 2,7 (2H, с), 2,75-2,85 (3H, м), 3,25-3,4 (4H, м), 3,6-3,7 (3H, м), 3,76 (1H, дд, J=11,1 Гц, 4,7 Гц), 3,8-3,9 (2H, м), 4,0 (2H, т, J=6,1 Гц), 4,35-4,4 (1H, м), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 120
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(4-метилпиперазин-1-ил)карбонил]-2-(метил)пропиламино}пропокси)-2-метилфенил]метил}-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 118, используя 1-метилпиперазин вместо 1-бензилпиперазина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,29 (6H, с), 1,85-2,0 (2H, м), 2,26 (3H, с), 2,29 (3H, с), 2,3-2,45 (4H, м), 2,6-2,85 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 121
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-2-(метил)пропиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 118, используя 1-(2-гидроксиэтил)пиперазин вместо 1-бензилпиперазина.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,29 (6H, с), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,4-2,55 (6H, м), 2,65-2,85 (5H, м), 3,25-3,4 (4H, м), 3,55-3,75 (9H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=5,8 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,3 Гц, 1,9 Гц), 6,71 (1H, д, J=1,9 Гц), 6,85 (1H, д, J=8,3 Гц).
Ссылочный пример 69
Бензил 3-амино-3-метилбутират
К суспензии 3,3-диметилакриловой кислоты (1,3 г) и карбоната калия (2,07 г) в N,N-диметилформамиде (15 мл) добавляли бензил бромид (1,19 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в 2-пропаноле (20 мл). Газообразный аммиак барбатировали в раствор при -15°C до насыщения и смесь перемешивали при 80°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 15/1 - 7/1) с получением соединения, указанного в заголовке (0,31 г).
1H-ЯМР (ДМСО-d6) δ м.д.: 1,08 (6H, с), 1,78 (2H, ушир.с), 2,38 (2H, с), 5,08 (2H, с), 7,3-7,4 (5H, м).
Пример 122
3-(β-D-Глюкопиранозилокси)-4-[(4-{3-[2-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Смесь 4-{[4-(3-хлорпропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (1 г) и йодида натрия (0,27 г) в ацетонитриле (5 мл) кипятили с обратным холодильником в течение 10 часов. После охлаждения до 60°C к реакционной смеси добавляли раствор бензил 3-амино-3-метилбутирата (0,31 г) в 2-пропаноле (5 мл) и смесь перемешивали при 55°C в течение 6 дней. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате - воде. Органический слой отделяли. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/2-дихлорметан/метанол = 20/1) с получением 4-[(4-{3-[2-бензилоксикарбонил-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,63 г). Этот продукт растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (65 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 4-[(4-{3-[2-карбокси-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,52 г). К раствору 4-[(4-{3-[2-карбокси-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,1 г) в N,N-диметилформамиде (2 мл) добавляли 1-(2-гидроксиэтил)пиперазин (19 мг), 1-гидроксибензотриазол (17 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (43 мг) и триэтиламин (0,062 мл) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,1 мл) и смесь перемешивали при 50°C в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток последовательно очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и препаративной колоночной хроматографией с обратной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120 Ǻ, 20 x 50 мм, скорость потока 30 мл/минут линейный градиент, вода/метанол = 90/10 - 10/90) с получением соединения, указанного в заголовке (13 мг).
MS (ESI, m/z): 678 [M+H]+.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,18 (6H, с), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,42(2H, т, J=5,0 Гц), 2,45-2,55 (6H, м), 2,71 (2H, т, J=7,0 Гц), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,5-3,75 (9H, м), 3,75-3,85 (1H, м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 123
4-{[4-(3-{2-[(S)-1-Карбамоил-2-гидроксиэтилкарбамоил]-1,1-ди(метил)этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 122, используя L-серин амид гидрохлорид вместо 1-(2-гидроксиэтил)пиперазина.
MS (ESI, m/z): 652 [M+H]+.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,19 (6H, с), 1,85-2,0 (2H, м), 2,2-2,5 (5H, м), 2,7-2,95 (3H, м), 3,25-3,4 (4H, м), 3,55-3,9 (6H, м), 4,01 (2H, т, J=6,1 Гц), 4,35-4,45 (1H, м), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,3 Гц, 2,3 Гц), 6,72 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,3 Гц).
Пример 124
4-{[4-(3-{2-[(S)-5-Амино-1-(карбамоил)пентилкарбамоил]-1,1-ди(метил)этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
4-{[4-(3-{2-[(S)-5-Бензилоксикарбониламино-1-(карбамоил)пентилкарбамоил]-1,1-ди(метил)этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол получали тем же способом, который описан в примере 122, используя 2-амино-6-(бензилоксикарбониламино)гексанамид гидрохлорид вместо 1-(2-гидроксиэтил)пиперазина, и соединение, указанное в заголовке, получали тем же способом, который описан в примере 79, используя этот продукт вместо 4-[(4-{3-[(S)-5-бензилоксикарбониламино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола.
MS (ESI, m/z): 693 [M+H]+.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,17 (6H, с), 1,25-1,85 (6H, м), 1,85-2,0 (2H, м), 2,2-2,45 (5H, м), 2,55-2,9 (5H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H, м), 4,02 (2H, т, J=5,8 Гц), 4,25-4,35 (1H, м), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,72 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 125
3-(β-D-Глюкопиранозилокси)-5-изопропил-4-{[4-(3-{2-[(пиперазин-1-ил)карбонил]-1,1-ди(метил)этиламино}пропокси)-2-метилфенил]метил}-1H-пиразол
4-{[4-(3-{2-[(4-Бензилпиперазин-1-ил)карбонил]-1,1-ди(метил)этиламино}пропокси)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол получали тем же способом, который описан в примере 122, используя 1-бензилпиперазин вместо 1-(2-гидроксиэтил)пиперазина, и соединение, указанное в заголовке, получали тем же способом, который описан в примере 79, используя этот продукт вместо 4-[(4-{3-[(S)-5-бензилоксикарбониламино-1-(карбамоил)пентиламино]пропокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола.
MS (ESI, m/z): 634 [M+H]+.
1H-ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,19 (6H, с), 1,85-2,0 (2H, м), 2,29 (3H, с), 2,52 (2H, с), 2,6-2,9 (7H, м), 3,25-3,4 (4H, м), 3,4-3,55 (4H, м), 3,6-3,75 (3H, м), 3,75-3,85 (1H,м), 3,99 (2H, т, J=6,0 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,4 Гц).
Ссылочный пример 70
3-Аминобутирамид
К смеси 3-аминомасляной кислоты (0,52 г), 2 моль/л водного раствора гидрохлорида натрия (10 мл) и тетрагидрофурана (10 мл) добавляли хлорид бензилоксикарбонила (1,07 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 2 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток (твердый) обрабатывали н-гексаном. Кристаллы собирали фильтрацией, промывали н-гексаном и сушили при пониженном давлении с получением 3-бензилоксикарбониламиномасляной кислоты (0,59 г). Этот продукт растворяли в тетрагидрофуране (5 мл). К раствору добавляли 1,1'-карбонилбис-1H-имидазол (0,59 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 28% водный раствор аммония (5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли диэтиловым эфиром. Нерастворимое вещество собирали фильтрацией, промывали водой и диэтиловым эфиром и сушили при пониженном давлении с получением 3-бензилоксикарбониламинобутирамида (0,54 г). Полученный 3-бензилоксикарбониламинобутирамид (76 мг) растворяли в метаноле (3 мл). К раствору добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течением 2 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (32 мг).
1H-ЯМР (CD3OD) δ м.д.: 1,14 (3H, д, J=6,6 Гц), 2,2-2,35 (2H, м), 3,25-3,35 (1H, м).
Ссылочный пример 71
3-Амино-2-метилпропионамид
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 70, используя 3-амино-2-метилпропионовую кислоту вместо 3-аминомасляной кислоты.
1H-ЯМР (CD3OD) δ м.д.: 1,13 (3H, д, J=6,9 Гц), 2,4-2,5 (1H, м), 2,6-2,7 (1H, м), 2,8-2,9 (1H, м).
Ссылочный пример 72
3-Амино-2,2-ди(метил)пропионамид
К раствору 3-амино-2,2-диметил-1-пропанола (2 г) в тетрагидрофуране (20 мл) добавляли N-(бензилоксикарбонилокси)сукцинимид (7,25 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 3/1 -1/1) с получением 3-бензилоксикарбониламино-2,2-диметил-1-пропанола (4,6 г). К этому продукт последовательно добавляли тетрахлорид углерода (40 мл), ацетонитрил (40 мл), воду (48 мл), периодат натрия (11,6 г) и трихлорид рутения (0,2 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли периодат натрия (11,6 г) и трихлорид рутения (0,2 г) и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь разбавляли водой и полученную смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в насыщенном водном растворе карбоната калия. Раствор промывали этилацетатом и водный слой подкисляли 2 моль/л хлористоводородной кислоты. Смесь экстрагировали этилацетатом и экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-бензилоксикарбониламино-2,2-ди(метил)пропионовой кислоты (3,6 г). Этот продукт растворяли в тетрагидрофуране (25 мл). К раствору добавляли 1,1'-карбонилбис-1H-имидазол (3,39 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 28% водный раствор аммония (25 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли водой и полученную смесь экстрагировали этилацетатом. Экстракт промывали 1 моль/л хлористоводородной кислоты, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении с получением 3-бензилоксикарбониламино-2,2-ди(метил)пропионамида (3,35 г). Полученный 3-бензилоксикарбониламино-2,2-ди(метил)пропионамид (0,13 г) растворяли в метаноле (5 мл). К раствору добавляли 10% порошок палладия-угля (30 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (61 мг).
1H-ЯМР (ДМСО-d6) δ м.д.: 1,0 (6H, с), 1,4-2,0 (2H, ушир.), 2,52 (2H, с), 6,69 (1H, ушир.с), 7,36 (1H, ушир.с).
Примеры 126-137
Соединения, описанные в таблицах 1-2, получали тем же способом, который описан в примере 57 или примере 72, используя соответствующие исходные продукты.


Ссылочный пример 73
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-азидопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 29, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразол.
1H ЯМР (CDC13) δ м.д.: 1,05-1,2 (6H, м), 1,82 (3H, с), 1,95-2,1 (8H, м), 2,16 (3H, с), 2,27 (3H, с), 2,75-2,85 (1H, м), 3,45-3,55 (3H, м), 3,61 (1H, д, J=16,3 Гц), 3,95-4,1 (3H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,2 Гц), 6,58 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,69 (1H, д, J=2,6 Гц), 6,81 (1H, д, J=8,3 Гц).
Ссылочный пример 74
4-{[4-(3-Азидопропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
К раствору 4-{[4-(3-хлорпропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола (0,3 г) в N,N-диметилформамиде (5 мл) добавляли азид натрия (43 мг) и смесь перемешивали при 80°C в течение 3 часов. К реакционной смеси добавляли воду и выпавшие в осадок кристаллы собирали фильтрацией. Кристаллы промывали водой и н-гексаном и сушили при пониженном давлении с получением соединения, указанного в заголовке (0,3 г).
1H ЯМР (CDC13) δ м.д.: 1,0-1,2 (42H, м), 1,75-1,9 (2H, м), 1,95-2,1 (4H, м), 2,85-2,95 (1H, м), 3,45-3,65 (6H, м), 3,8-3,9 (1H, м), 3,95-4,05 (4H, м), 4,1-4,25 (2H, м), 4,4-4,55 (1H, м), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,67 (1H, д, J=8,0 Гц), 6,33 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,4 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,5 Гц).
Пример 138
3-(2,3,4,6-Тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-аминопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-азидопропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,84 (3H, с), 1,85-2,0 (8H, м), 2,14 (3H, с), 2,27 (3H, с), 2,75-2,9 (3H, м), 3,53 (1H, д, J=16,5 Гц), 3,59 (1H,д, J=16,5 Гц), 4,0 (2H, т, J=6,2 Гц),4,05-4,2 (3H, м), 5,1-5,2 (1Н, м), 5,2-5,3 (1Н, м), 5,35-5,45 (2Н, м), 6,61 (1Н, дд, J=8,3 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,78 (1H, д, J=8,3 Гц).
Пример 139
4-{[4-(3-Аминопропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 1, используя 4-{[4-(3-азидопропокси)-2-(тетрагидро-4H-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-азидопропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H ЯМР (CDC13) δ м.д.: 1,0-1,2 (42H, м), 1,75-1,95 (4H, м), 1,95-2,1 (2H, м), 2,8-3,0 (3H, м), 3,5-3,7 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,05-4,25 (2H, м), 4,4-4,55 (1H, м), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,3 Гц), 5,67 (1H, д, J=7,4 Гц), 6,3-6,45 (2H, м), 6,85 (1H, д, J=8,6 Гц).
Пример 140
3-(β-D-Глюкопиранозилокси)-4-{[4-(2-{3-[2-гидрокси-1,1-бис(гидроксиметил)этил]уреидо}этокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (60 мг) в дихлорметане (3 мл) добавляли триэтиламин (0,016 мл) и 4-нитрофенил хлорформиат (21 мг) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли трис(гидроксиметил)аминометан (35 мг) и метанол (3 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1-6/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-{3-[2-гидрокси-1,1-бис(гидроксиметил)этил]уреидо}этокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (36 мг). Этот продукт растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,018 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (22 мг).
1H ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,44 (2H, т, J=5,3 Гц), 3,6-3,75 (9H, м), 3,81 (1H, д, J=11,7 Гц), 3,95 (2H, т, J=5,3 Гц), 5,02 (1H, д, J=6,6 Гц), 6,63 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,73 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,5 Гц).
Примеры 141-151
Соединения, описанные в таблицах 3-4 получали тем же способом, который описан в примере 140, используя соответствующие исходные продукты. Синтез примера 151 проводили каталитическим гидрированием тем же способом, который описан в примере 79, после завершения процесса примера 140.


Ссылочный пример 75
4-(2-Бензилоксиэтил)-1-бромбензол
К суспензии гидрида натрия (60%, 1,09 г) в 1,2-диметоксиэтане (25 мл) добавляли 2-(4-бромфенил)этанол (5 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли бензил бромид (3,25 мл) и смесь перемешивали при 80°C в течение ночи. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан - н-гексан/этилацетат = 50/1 - 20/1) с получением соединения, указанного в заголовке (6,8 г).
1H ЯМР (CDCl3) δ м.д.: 2,86 (2H, т, J=6,8 Гц), 3,66 (2H, т, J=6,8 Гц), 4,5 (2H, с), 7,05-7,15 (2Н, м), 7,2-7,35 (5Н, м), 7,35-7,45 (2Н, м).
Ссылочный пример 76
[4-(2-Бензилоксиэтил)фенил]метанол
К раствору 4-(2-бензилоксиэтил)-1-бромбензола (6,8 г) в тетрагидрофуране (80 мл) добавляли н-бутил лития (2,6 моль/л раствор н-гексана, 8,98 мл) при -78°C в атмосфере аргона и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли N,N-диметилформамид (20 мл) и смесь оставляли нагреваться до 0°C и перемешивали в течение 2 часов. Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 4-(2-бензилоксиэтил)бензальдегида (5,6 г). Этот продукт растворяли в метаноле (80 мл). К раствору добавляли боргидрид натрия (1,77 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток (твердый) обрабатывали н-гексаном, собирали фильтрацией и сушили при пониженном давлении с получением соединения, указанного в заголовке (5,41 г).
1H ЯМР (CDCl3) δ м.д.: 2,93 (2Н, т, J=7,1 Гц), 3,68 (2H, т, J=7,1 Гц), 4,52 (2H, с), 4,65 (2H, с), 7,15-7,4 (9H, м).
Ссылочный пример 77
4-{[4-(2-Бензилоксиэтил)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя [4-(2-бензилоксиэтил)фенил]метанол вместо [4-(3-бензилоксипропокси)фенил]метанола.
1H ЯМР (ДМСO-d6) δ м.д.: 1,07 (6H, д, J=7,1 Гц), 2,75-2,9 (3H, м), 3,54 (2H, с), 3,59 (2H, т, J=6,9 Гц), 4,45 (2H, с), 7,0-7,15 (4H, м), 7,2-7,35 (5H, м).
Ссылочный пример 78
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтил)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(2-бензилоксиэтил)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,8-2,95 (3H, м), 3,55-3,7 (4H, м), 3,8-3,9 (1H, м), 4,14 (1H, дд, J=12,5 Гц, 2,4 Гц), 4,31 (1H, дд, J=12,5 Гц, 3,9 Гц), 4,5 (2H, с), 5,15-5,3 (3H, м), 5,5-5,6 (1H, м), 7,0-7,1 (4H, м), 7,2-7,35 (5H, м).
Ссылочный пример 79
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(2-бензилоксиэтил)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-{[4-(2-бензилоксиэтил)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он и ацетобром-α-D-галактоза вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она и ацетобром-α-D-глюкозы соответственно.
1H ЯМР (CDCl3) δ м.д.: 1,1-1,2 (6H, м), 1,85 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,85-2,95 (3H, м), 3,61 (1H, д, J=15,9 Гц), 3,65 (2H, т, J=7,2 Гц), 3,69 (1H, д, J=15,9 Гц), 4,0-4,25 (3H, м), 4,51 (2H, с), 5,09 (1H, дд, J=10,6 Гц, 3,3 Гц), 5,4-5,5 (2H, м), 5,55 (1H, д, J=8,2 Гц), 7,0-7,1 (4H, м), 7,2-7,35 (5H, м).
Ссылочный пример 80
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтил)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-бензилоксиэтил)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H ЯМР (CDCl3) δ м.д.: 1,18 (6H, д, J=7,2 Гц), 1,87 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,81 (2H, т, J=6,6 Гц), 2,85-3,0 (1H, м), 3,62 (1H, д, J=16,0 Гц), 3,67 (1H, д, J=16,0 Гц), 3,75-3,9 (3H, м), 4,12 (1H, дд, J=12,4 Гц, 2,4 Гц), 4,29 (1H, дд, J=12,4 Гц, 3,8 Гц), 5,15-5,3 (3H, м), 5,57 (1H, д, J=7,5 Гц), 7,05-7,15 (4H, м).
Ссылочный пример 81
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(2-гидроксиэтил)фенил]метил}-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 23, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(2-бензилоксиэтил)фенил]метил}-5-изопропил-1H-пиразол вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-бензилоксипропокси)фенил]метил}-5-изопропил-1H-пиразола.
1H ЯМР (CDCl3) δ м.д.: 1,15-1,2 (6H, м), 1,88 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,81 (2H, т, J=6,4 Гц), 2,85-3,0 (1H, м), 3,63 (1H, д, J=16,1 Гц), 3,7 (1H, д, J=16,1 Гц), 3,8-3,9 (2H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,08 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,56 (1H, д, J=8,1 Гц), 7,05-7,15 (4H, м).
Пример 152
4-{[4-(2-{3-[(S)-1-Карбамоил-2-(метил)пропил]уреидо}этил)фенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-гидроксиэтил)фенил]метил}-5-изопропил-1H-пиразола (2,13 г) и триэтиламина (0,65 мл) в дихлорметане (20 мл) добавляли хлорид метансульфонила (0,36 мл) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-метансульфонилоксиэтил)фенил]метил}-1H-пиразола (2,4 г). Этот продукт растворяли в N,N-диметилформамиде (20 мл). К раствору добавляли азид натрия (0,71 г) и смесь перемешивали при 80°C в течение 3 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 1/1 -1/2) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтил)фенил]метил}-5-изопропил-1H-пиразола (1,55 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-азидоэтил)фенил]метил}-5-изопропил-1H-пиразол (1 г) растворяли в тетрагидрофуране (5 мл). К раствору добавляли 10% порошок палладия-угля (0,15 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 6 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтил)фенил]метил}-5-изопропил-1H-пиразола (0,96 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтил)фенил]метил}-5-изопропил-1H-пиразол (0,48 г) растворяли в дихлорметане (5 мл). К раствору добавляли триэтиламин (0,13 мл) и 4-нитрофенил хлорформиат (0,18 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 2 часов. 1/6 часть реакционной смеси отделяли. К части реакционной смеси добавляли триэтиламин (0,084 мл), L-валин амид гидрохлорид (45 мг) и тетрагидрофуран (1 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: этилацетат -этилацетат/метанол = 10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-{3-[(S)-1-карбамоил-2-(метил)пропил]уреидо}этил)фенил]метил}-5-изопропил-1H-пиразола (48 мг). Этот продукт растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,013 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,2 мл). Полученную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (29 мг).
1H ЯМР (CD3OD) δ м.д.: 0,9 (3H, д, J=7,O Гц), 0,95 (3H, д, J=6,5 Гц), 1,1-1,2 (6H, м), 2,0-2,1 (1H, м), 2,71 (2H, т, J=7,1 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (6H, м), 3,6-3,75 (2H, м), 3,78 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 4,04 (1H, д, J=5,9 Гц), 5,04 (1H, д, J=7,4 Гц), 7,05-7,15 (4H, м).
Примеры 153-172
Соединения, описанные в таблицах 5-8, получали тем же способом, который описан в примере 152, используя соответствующие исходные продукты. Синтез примеров 171 и 172 проводили каталитическим гидрированием тем же способом, который описан в примере 79, после завершения процесса примера 152.




Ссылочный пример 82
4-Бром-2-метилбензиловый спирт
К раствору 4-бром-2-метилбензойной кислоты (10 г) в тетрагидрофуране (60 мл) добавляли комплекс боран-диметилсульфид (7,07 г) при охлаждении на льду. Реакционную смесь перемешивали при комнатной температуре в течение 5 минут и перемешивали при 75°C в течение 2 дня. Реакционную смесь охлаждали до комнатной температуры. Насыщенный водный раствор карбоната натрия добавляли к реакционной смеси и органический слой отделяли. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке (9,0 г).
1H ЯМР (CDCl3) δ м.д.: 1,55-1,65 (1H, м), 2,36 (3H, с), 4,64 (2H, д, J=5,4 Гц), 7,2-7,25 (1H, м), 7,3-7,35 (2H, м).
Ссылочный пример 83
4-{[4-(2-Аминоэтил)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-он
К раствору 4-бром-2-метилбензилового спирта (9,0 г) в дихлорметане (50 мл) добавляли тионил хлорид (3,8 мл) при охлаждении на льду и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением хлорид 4-бром-2-метилбензила (9,8 г). Гидрид натрия (55%, 0,84 г) суспендировали в тетрагидрофуране (80 мл). К суспензии добавляли метил 4-метил-3-оксопентаноат (2,94 г) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 4-бром-2-метилбензил хлорид (4,08 г) и смесь перемешивали при 60°C в течение 36 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали диэтиловым эфиром. Экстракт сушили над безводным сульфатом магния и растворитель удаляли при пониженном давлении. Остаток растворяли в ацетонитриле (24 мл). К раствору добавляли N-винилфталимид (3,29 г), ацетат палладия (II) (0,42 г), трис(o-метилфенил)фосфин (2,27 г) и N,N-диизопропилэтиламин (13 мл) и смесь перемешивали при 100°C в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан - н-гексан/этилацетат = 3/1 -3/2) с получением N-{(E)-2-[4-(2-метоксикарбонил-4-метил-3-оксoпентил)-3-метилфенил]винил}фталимида (6,45 г). К этому продукту добавляли метанол (50 мл) и 10% порошок палладия-угля (3 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Часть (1 г) остатка растворяли в этаноле (15 мл). К раствору добавляли гидразин моногидрат (1,38 мл) и смесь перемешивали при 80°C в течение 13 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении. Остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и полимер бензолсульфоновой кислоты (промывочный растворитель: метанол, элюент: 2 моль/л аммоний - раствор метанола) с получением соединения, указанного в заголовке (0,3 г).
1H ЯМР (ДМСО d6) δ м.д.: 1,04 (6H, д, J=6,7 Гц), 2,25 (3H, с), 2,53 (2H, т, J=7,2 Гц), 2,65-2,8 (3H, м), 3,47 (2H, с), 6,75-6,9 (2H, м), 6,93 (1H, с).
Ссылочный пример 84
4-({4-[2-(Бензилоксикарбониламино)этил]-2-метилфенил}метил)-1,2-дигидро-5-изопропил-3H-пиразол-3-он
К раствору 4-{[4-(2-аминоэтил)-2-метилфенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она (0,3 г) в тетрагидрофуране (5 мл) добавляли N-(бензилоксикарбонилокси)сукцинимид (0,33 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт дважды промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке (0,34 г).
1H ЯМР (CDCl3) δ м.д.: 1,11 (6H, д, J=6,7 Гц), 2,31 (3H, с), 2,65-2,95 (3H, м), 3,35-3,5 (2H, м), 3,63 (2H, с), 4,65-4,8 (1H, м), 5,09 (2H, с), 6,85-7,0 (3H, м), 7,25-7,4 (5H, м).
Пример 173
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбониламино)этил]-2-метилфенил}метил)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-({4-[2-(бензилоксикарбониламино)этил]-2-метилфенил}метил)-1,2-дигидро-5-изопропил-3H-пиразол-3-он вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она.
1H ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,79 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,26 (3H, с), 2,73 (2H, т, J=6,7 Гц), 2,75-2,9 (1H, м), 3,35-3,45 (2H, м), 3,53 (1H, д, J=16,5 Гц), 3,62 (1H, д, J=16,5 Гц), 3,75-3,85 (1H, м), 4,08 (1H, дд, J=12,5 Гц, 2,7 Гц), 4,27 (1H, дд, J=12,5 Гц, 4,1 Гц), 4,8-4,9 (1H, м), 5,09 (2H, с), 5,1-5,3 (3H, м), 5,55 (1H, д, J=7,7 Гц), 6,8-6,9 (2H, м), 6,93 (1H, с), 7,25-7,4 (5H, м).
Пример 174
4-{[4-(2-Аминоэтил)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
3-(2,3,4,6-Тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбониламино)этил]-2-метилфенил}метил)-5-изопропил-1H-пиразол (20 мг) растворяли в метаноле (1 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,005 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением 4-({4-[2-(бензилоксикарбониламино)этил]-2-метилфенил}метил)-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола. Этот продукт растворяли в метаноле (1 мл). К раствору добавляли 10% порошок палладия-угля (5 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 6 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (11 мг).
1H ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 2,31 (3H, с), 2,67 (2H, т, J=7,0 Гц), 2,75-2,9 (3H, м), 3,25-3,4 (4H, м), 3,6-3,85 (4H, м), 4,95-5,05 (1H, м), 6,85-7,0 (3H, м).
Пример 175
4-{[4-(2-{3-[(1S,2R)-1-Карбамоил-2-гидроксипропил]уреидо}этил)-2-метилфенил]метил}-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбониламино)этил]-2-метилфенил}метил)-5-изопропил-1H-пиразол (0,3 г) растворяли в тетрагидрофуране (2 мл). К раствору добавляли 10% порошок палладия-угля (20 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 6 часов. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтил)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,24 г). Полученный 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтил)-2-метилфенил]метил}-5-изопропил-1H-пиразол (0,13 г) растворяли в дихлорметане (2,6 мл). К раствору добавляли триэтиламин (0,042 мл) и 4-нитрофенил хлорформиат (52 мг) при охлаждении на льду и смесь перемешивали при комнатной температуре в течение 2 часов. 1/4 Часть реакционной смеси отделяли. К части реакционной смеси добавляли триэтиламин (0,028 мл) и L-треонин амид гидрохлорид (23 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: этилацетат - этилацетат/метанол = 10/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-{3-[(1S,2R)-1-карбамоил-2-гидроксипропил]уреидо}этил)-2-метилфенил]метил}-5-изопропил-1H-пиразола (30 мг). Этот продукт растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,006 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,005 мл). Полученную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением соединения, указанного в заголовке (21 мг).
1H ЯМР (CD3OD) δ м.д.: 1,1-1,2 (9H, м), 2,31 (3H, с), 2,7 (2H, т, J=7,0 Гц), 2,8-2,9 (1H, м), 3,2-3,45 (6H, м), 3,6-3,75 (3H, м), 3,8 (1H, дд, J=12,1 Гц, 2,1 Гц), 4,05-4,15 (1Н, м), 4,15-4,25 (1H, м), 4,97 (1H, д, J=7,0 Гц), 6,85-6,95 (2H, м), 7,0 (1H, с).
Примеры 176-181
Соединения, описанные в таблицах 9-10, получали тем же способом, который описан в примере 175, используя соответствующие исходные продукты. Синтез примеров 180 и 181 проводили каталитическим гидрированием тем же способом, который описан в примере 79, после завершения процесса примера 175.


Пример 182
3-(β-D-Галактопиранозилокси)-5-изопропил-4-[(4-{3-[3-(диметиламино)пропиламино]пропокси}-2-метилфенил)метил]-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 51, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и N,N-диметил-N'-(2-нитробензолсульфонил)-1,3-диаминопропан вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола и 2-метил-2-(2-нитробензолсульфониламино)пропионамида соответственно.
1Н ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,65-1,75 (2H, м), 1,9-2,0 (2H, м), 2,23 (6H, с), 2,28 (3H, с), 2,3-2,4 (2H, м), 2,61 (2H, т, J=7,3 Гц), 2,7-2,85 (3H, м), 3,49 (1H, дд, J=9,8 Гц, 3,5 Гц), 3,55-3,8 (6H, м), 3,84 (1H, д, J=3,5 Гц), 3,99 (2H, т, J=6,1 Гц), 5,03 (1H, д, J=7,9 Гц), 6,6 (1H, д, J=8,7 Гц, 2,4 ГЦ), 6,7 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,7 Гц).
Ссылочный пример 85
3-Амино-3-метилбутирамид
К раствору 3,3-диметилакриловой кислоты (5 г) в тетрагидрофуране (15 мл) добавляли 1,1'-карбонилбис-1H-имидазол (10,5 г) и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 28% водный раствор аммония (30 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1) с получением 3,3-диметилакриламида (2,05 г). Этот продукт растворяли в 2-пропаноле (20 мл). Газообразный аммоний барботировали в раствор при -15°C до насыщения и смесь перемешивали при 80°C в течение 40 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали полимером бензолсульфоновой кислоты (промывочный растворитель: метанол, элюент: 2 моль/л аммоний - раствор метанола) с получением соединения, указанного в заголовке (0,13 г).
1Н ЯМР (CD3OD) δ м.д.: 1,19 (6H, с), 2,27 (2H, с).
Пример 183
4-[(4-{3-[2-Карбамоил-1,1-ди(метил)этиламино]пропокси}-2-метилфенил)метил]-3-(β-D-галактопиранозилокси)-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в примере 72, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-{[4-(3-гидроксипропокси)-2-метилфенил]метил}-5-изопропил-1H-пиразол и 3-амино-3-метилбутирамид вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(3-гидроксипропокси)фенил]метил}-5-изопропил-1H-пиразола и 2-[2-амино-2-(метил)пропиониламино]этанола соответственно.
MS (ESI, m/z): 565 [M+H]+.
1Н ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,18 (6H, с), 1,85-2,0 (2H, м), 2,28 (3H, с), 2,32 (2H, с), 2,7-2,85 (3H, м), 3,49 (1H, дд, J=9,7 Гц, 3,3 Гц), 3,58 (1H, т, J=5,8 Гц), 3,6-3,8 (5H, м), 3,8-3,9 (1H, м), 4,0 (2H, т, J=5,9 Гц), 5,03 (1H, д, J=7,9 Гц), 6,55-6,65 (1H, м), 6,65-6,75 (1H, м), 6,8-6,9 (1H, м).
Ссылочный пример 86
4-[(4-Бензилокси-2-метилфенил)метил]-5-трифторметил-1,2-дигидро-3H-пиразол-3-он
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 11, используя (4-бензилокси-2-метилфенил)метанол и этил трифторацетоацетат вместо [4-(3-бензилоксипропокси)фенил]метанола и этил 4-метил-3-оксопентаноата соответственно.
1Н ЯМР (ДМСО-d6) δ м.д.: 2,24 (3H, с), 3,58 (2H, с), 5,02 (2H, с), 6,65 (1H, д, J=8,5 Гц), 6,7 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,81 (1H, д, J=2,7 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 87
3-(2,3,4,6-Тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-трифторметил-1H-пиразол
Суспензию 4-[(4-бензилокси-2-метилфенил)метил]-5-трифторметил-1,2-дигидро-3H-пиразол-3-она (0,5 г), ацетобром-α-D-галактозы (0,62 г) и карбоната калия (0,29 г) в ацетонитриле (5 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: н-гексан/этилацетат = 2/1 - 1/1) с получением соединения, указанного в заголовке (0,66 г).
1Н ЯМР (CDCl3) δ м.д.: 1,78 (3H, с), 1,98 (3H, с), 2,05 (3H, с), 2,17 (3H, с), 2,3 (3H, с), 3,67 (1H, д, J=16,4 Гц), 3,72 (1H, д, J=16,4 Гц), 3,98 (1H, т, J=6,3 Гц), 4,1-4,25 (2H, м), 5,0-5,1 (3H, м), 5,15-5,4 (2H, м), 5,42 (1H, дд, J=3,4 Гц, 1,0 Гц), 6,67 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,75 (1H, д, J=8,5 Гц), 6,8 (1H, д, J=2,6 Гц), 7,25-7,45 (5H, м).
Ссылочный пример 88
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-5-трифторметил-4-[(4-гидрокси-2-метилфенил)метил]-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 58, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-трифторметил-1H-пиразол вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола.
1Н ЯМР (CDCl3) δ м.д.: 1,83 (3H, с), 1,98 (3H, с), 2,05 (3H, с), 2,18 (3H, с), 2,27 (3H, с), 3,66 (1H, д, J=16,4 Гц), 3,71 (1H, д, J=16,4 Гц), 3,95-4,0 (1H, м), 4,05-4,2 (2H, м), 4, 84 (1H, ушир.с), 5,03 (1H, дд, J=10,3 Гц, 3,4 Гц), 5,2-5,4 (2H, м), 5,41 (1H, дд, J=3,4 Гц, 1,1 Гц), 6,54 (1H, дд, J=8,3 Гц, 2,7 Гц), 6,64 (1H, д, J=2,7 Гц), 6,72 (1H, д, J=8,3 Гц).
Пример 184
4-[(4-{3-[2-(Карбамоил)этиламино]пропокси}-2-метилфенил)метил]-5-трифторметил-3-(β-D-галактопиранозилокси)-1H-пиразол
3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{3-[N-бензилоксикарбонил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-трифторметил-1H-пиразол получали тем же способом, который описан в примере 96, используя 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-5-трифторметил-4-[(4-гидрокси-2-метилфенил)метил]-1H-пиразол вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилокси)-1H-пиразола и соединение, указанное в заголовке, получали тем же способом, который описан в примере 94, используя этот продукт вместо 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{3-[N-бензил-N-(2-карбамоилэтил)амино]пропокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола.
MS (ESI, m/z): 563 [M+H]+.
1Н ЯМР (CD3OD) δ м.д.: 1,95-2,1 (2H, м), 2,25 (3H, с), 2,41 (2H, т, J=6,9 Гц), 2,63 (2H, т, J=7,1 Гц), 2,83 (2H, т, J=6,9 Гц), 3,53 (1H, дд, J=9,8 Гц, 3,4 Гц), 3,55-3,8 (6H, м), 3,87 (1H, д, J=3,4 Гц), 4,21 (2H, т, J=6,7 Гц), 5,28 (1H, д, J=7,9 Гц), 6,45 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,55-6,65 (2H, м).
Пример 185
4-[(4-{2-[2-{[4-(Бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-{[4-(2-аминоэтокси)-2-метилфенил]метил}-5-изопропил-1H-пиразола (0,5 г) в N,N-диметилформамиде (10 мл) добавляли 1-бензилоксикарбонил-4-[2-карбокси-2-(метил)пропионил]пиперазин (0,28 г), 1-гидроксибензотриазол (0,22 г), триэтиламин (0,18 мл) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,46 г) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой последовательно промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 30/1) с получением 3-(2,3,4,6-тетра-O-ацетил-β-D-глюкопиранозилокси)-4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,3 г). Этот продукт растворяли в метаноле (4 мл). К раствору добавляли метоксид натрия (28% раствор метанола, 0,06 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли уксусную кислоту (0,035 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1 - 5/1) с получением соединения, указанного в заголовке (0,23 г).
1Н ЯМР (CD3OD) δ м.д.: 1,05-1,15 (6H, м), 1,37 (6H, с), 2,25 (3H, с), 2,7-2,85 (1H, м), 3,15-3,75 (17H, м), 3,81 (1H, д, J=12,0 Гц), 4,02 (2H, т, J=5,2 Гц), 5,02 (1H, д, J=7,4 Гц), 5,09 (2H, с), 6,55-6,65 (1H, м), 6,69 (1H, д, J=2,2 Гц), 6,84 (1H, д, J=8,7 Гц), 7,25-7,4 (5H, м).
Ссылочный пример 89
4-[(4-{2-[2-{[4-(Бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он
Смесь 4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-3-(β-D-глюкопиранозилокси)-5-изопропил-1H-пиразола (0,23 г), моногидрата п-толуолсульфоновой кислоты (0,41 г) и 2-пропанола (10 мл) перемешивали при 50°C в течение 2 дней. Реакционную смесь выливали в насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 10/1) с получением соединения, указанного в заголовке (0,18 г).
1Н ЯМР (CD3OD) δ м.д.: 1,06 (6Н, д, J=6,7 Гц), 1,37 (6H, с), 2,25 (3H, с), 2,7-2,85 (1H, м), 3,15-3,7 (12H, м), 4,02 (2H, т, J=5,3 Гц), 5,09 (2H, с), 6,6 (1H, дд, J=8,6 Гц, 2,3 Гц), 6,7 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,6 Гц), 7,25-7,4 (5H, м).
Пример 186
3-(2,3,4,6-Тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол
Соединение, указанное в заголовке, получали тем же способом, который описан в ссылочном примере 17, используя 4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3H-пиразол-3-он и ацетобром-α-D-галактозу вместо 4-{[4-(3-бензилоксипропокси)фенил]метил}-1,2-дигидро-5-изопропил-3H-пиразол-3-она и ацетобром-α-D-глюкозы соответственно.
1Н ЯМР (CDCl3) δ м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,83 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,15 (3H, с), 2,25 (3H, с), 2,7-2,85(1H,м), 3,25-3,7 (12H, м), 3,97 (2H, т, J=4,9 Гц), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,08 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,12 (2H, с), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,1 Гц), 5,92 (1H, т, J=5,7 Гц), 6,53 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,63 (1H, д, J=2,6 Гц), 6,81 (1H, д, J=8,4 Гц), 7,25-7,4 (5H, м).
Пример 187
3-(β-D-Галактопиранозилокси)-5-изопропил-4-{[4-(2-{2-метил-2-[(пиперазин-1-ил)карбонил]пропиониламино}этокси)-2-метилфенил]метил}-1H-пиразол
К раствору 3-(2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилокси)-4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразола (0,14 г) в метаноле (3 мл) добавляли метоксид натрия (28% раствор метанола, 0,015 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь очищали хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол = 5/1) с получением 4-[(4-{2-[2-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-2-(метил)пропиониламино]этокси}-2-метилфенил)метил]-3-(β-D-галактопиранозилокси)-5-изопропил-1H-пиразола (70 мг). Этот продукт растворяли в метаноле (4 мл). К раствору добавляли 10% порошок палладия-угля (10 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1 часа. Нерастворимое вещество удаляли фильтрацией и фильтрат концентрировали при пониженном давлении с получением соединения, указанного в заголовке (54 мг).
1Н ЯМР (CD3OD) δ м.д.: 1,05-1,2 (6H, м), 1,37 (6H, с), 2,3 (3H, с), 2,35-2,9 (5H, м), 3,1-3,8 (13H, м), 3,85 (1H, д, J=3,3 Гц), 4,02 (2H, т, J=5,5 Гц), 5,04 (1H, д, J=8,0 Гц), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,72 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Экспериментальный пример 1
Анализ ингибирования эффектов на активность SGLT1 человека
1) Клонирование и конструирование вектора экспрессии SGLT1 человека
Библиотеку кДНК получали для ПЦР амплификации с помощью обратной транскрипции из общей РНК, полученной из тонкого кишечника человека (Ori ген), используя в качестве праймера олиго-dT. Используя в качестве образца библиотеку кДНК фрагмент ДНК, кодирующий с 1 по 2005 п.о. SGLT1 человека (ACCESSION: M24847), что сообщалось Hediger et al., амплифицировали ПЦР методом и вставляли в мультиклональный сайт pcDNA3,1(-) (Invitrogen). Введенная последовательность ДНК хорошо подходила к ранее сообщенной последовательности.
2) Получение клеточной линии, стабильно экспрессирующей SGLT1 человека
Вектор экспрессии SGLT1 человека разрезали Sca I в линейную ДНК. Линейную ДНК трансфецировали в клетки CHO-K1 с помощью липофекции (Effectene трансфекторный реагент: QIAGEN). Клеточную линию, устойчивую к действию неомицина, выбирали посредством культуры в среде, содержащей G418 (1 мг/мл, LIFE TECHNOLOGIES), и затем способом, описанным ниже, измеряли активность поглощения метил-α-D-глюкопиранозида. Клеточную линию, которая показывала наибольшую активность поглащения, выбирали и обозначали как CS1-5-11D. Клетки CS1-5-11D культивировали в присутствии G418 при 200 мкг/мл.
3) Измерение ингибиторной активности в отношении поглощения метил-α-D-глюкопиранозида (α-MG)
Клетки CS1-5-11D сеяли в 96-луночные культуральные плашки с плотностью 3×104 клеток/лунку и культивировали в течение 2 дней и использовали для анализа поглощения. Смесь немеченого (Sigma) и меченного14C α-MG (Amersham Pharmcia Biotec) добавляли в буфер поглощения (pH 7,4; содержащий 140 мM хлорида натрия, 2 мM хлорида калия, 1 мM хлорида кальция, 1 мM хлорида магния, 10 мM 2-[4-(2-гидроксиэтил)-1-пиперазинил]этан сульфоновой кислоты, и 5 мM трис(гидроксиметил)аминометан), до конечной концентрацией 1 мM. Исследуемое соединение растворяли в диметилсульфоксиде и затем соответственно разбавляли дистиллированной водой. Раствор исследуемого соединения добавляли к буферу поглощения, содержащему 1 мM α-MG, и обозначали как буфер для измерения. В качестве контрольной группы получали буфер для измерения без исследуемого соединения. Для измерения базового поглощения готовили буфер для изменения базового поглощения, который содержал 140 мM холин хлорида вместо хлорида натрия. После удаления культуральной среды клеток CS1-5-11D cells в каждую лунку добавляли 180 мкл буфера предварительной обработки (буфер для измерения базального поглощения без α-MG) и инкубировали при 37°C в течение 10 минут. После повторения той же обработки буфер предварительной обработки удаляли. В каждую лунку добавляли 75 мкл буфера для изменения или буфера для измерения базального поглощения и инкубировали при 37°C в течение 1 часа. После удаления буфера для измерения клетки дважды промывали 180 мкл на лунку промывочным буфером (буфер для измерении базального поглощения, содержащий 10 мM немеченого α-MG). Клетки солюбилизировали с помощью 75 мкл на лунку 0,2 моль/л гидрохлорида натрия. Клеточные лизаты переносили в PicoPlates (Packard) и затем добавляли 150 мкл MicroScint-40 (Packard) и смешивали. Радиоактивность измеряли с помощью микро-сцинциляционного счетчика TopCount (Packard). Сто % устанавливали как разность поглощения контрольной группы и базового поглощения и рассчитывали поглощение метил α-D-глюкопиранозида при каждой концентрации препарата. Используя логит-преобразование, рассчитывали концентрацию препарата, при которой ингибировалось поглощение 50% метил α-D-глюкопиранoзида (значение IC50). Результаты показаны в таблице 11.
Экспериментальный пример 2
Анализ ингибиторных эффектов на повышение уровеня глюкозы в крови у крыс
1) Получение модели диабета у крыс
Самцам крыс Уистера (Japan Charles River) в возрасте 8 недель внутрибрюшинно вводили инъекцию никотинамид (230 мг/кг). Через пятнадцать минут после инъекции им делали внутривенную инъекцию стрептозотоцина (85 мг/кн) в хвостовую вену при анастезии эфиром. Через неделю крысам не давали пищу в течение ночи и затем проводили тест на толерантность к глюкозе (2 г/кг). Крыс, у которых было обнаружено, что концентрация глюкозы в плазме через 1 час после введения глюкозы была более 300 мг/дл, отбирали для эксперимента на толерантности при введении жидкой пищи.
2) Эксперимент на толерантность при введении жидкой пищи
После ночи без пищи диабетическим крысам из группы введения препарата перорально вводили исследуемое соединение (1 мг/кг), которое растворяли в дистиллированной воде или в 0,5% водном растворе карбоксиметилцеллюлозы, или из контрольной группы вводили только дистиллированную воду или 0,5% водный раствор карбоксиметилцеллюлозы. Сразу после введения соединения давали 17,25 ккал/кг жидкой пищи (No. 038, контрольная диета с декстрином и мальтозой; Oriental Yeast Co., Ltd.). Кровь собирали из хвостовой артерии сразу перед и после введения через определенное время и немедленно обрабатывали гепарином. Кровь центрифугировали и плазму собирали для количественной оценки концентрации глюкозы в плазме глюкозоксидазным способом. Концентрации глюкозы в плазме перед введением препарата (0 ч), через 0,5 и 1 час после введения препарата показаны в таблице 12. Значения в таблице выражены как среднее ± S.E.
Экспериментальный пример 3
Тест острой токсичности
Самцам мышей ICR (CLEA Japan, Inc.; 32-37 г, n = 5) в возрасте 6 недель не давали пищу в течение 4 часов. Исследуемое соединение, растворенное в дистиллированной воде, перорально вводили в дозе 1 г/кг, и затем мышей наблюдали в течение 24 часов. Результаты показаны в нижеследующей таблице 13.
Промышленное применение
Производные пиразола, представленные вышеуказанной общей формулой (I) по настоящему изобретению, их фармацевтически приемлемые соли и пролекарства оказывают ингибиторную активность в отношении SGLT1 человека и могут подавлять увеличение уровня глюкозы в крови, ингибируя всасывание углеводов, таких как глюкоза, в тонком кишечнике и, в частности, могут заметно подавлять увеличение уровня глюкозы в крови и/или могут снижать уровень галактозы в крови, задерживая всасывание глюкозы и галактозы на основании механизма действия и, например, могут нормализовать гипергликемию после приема пищи. Следовательно, настоящее изобретение может предоставить прекрасные средства для профилактики или лечения заболевания, связанного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, нарушенная гликемия натощак, осложнения при диабете, ожирение или тому подобное, и заболевания, связанного с повышенным уровнем галактозы в крови, такого как галактоземия. Дополнительно, так как производные пиразола, представленные вышеуказанной общей формулой (II) по настоящему изобретению, и их соли являются важными в качестве промежуточных продуктов пролучения производных пиразола, представленных вышеуказанной формулой (I), соединения, представленные вышеуказанной формулой (I) по настоящему изобретению, могут быть легко получены с помощью таких соединений.
Реферат
Настоящее изобретение относится к производным пиразола, представленным общей формулой ! ! где R1-R6 принимает значения, определенные в формуле изобретения; один из Q и Т представляет собой группу, представленную общей формулой ! ! или группу, представленную общей формулой ! ! тогда как другой представляет собой C1-6 алкильную группу, галоген(С1-6алкил)группу или Сз-7циклоалкильную группу; X, Y и Z принимает значения, определенные в формуле изобретения; к их фармацевтически приемлемым солям, которые обладают ингибиторной активностью в отношении SGLT1 человека и могут использоваться в фармацевтических композициях для профилактики или лечения заболевания, связанного с гипергликемией. 9 н. и 16 з.п. ф-лы, 12 табл.
Формула

где R1 представляет собой атом водорода, гидрокси(С2-6 алкил)группу;
один из Q и Т представляет собой группу, представленную формулой:
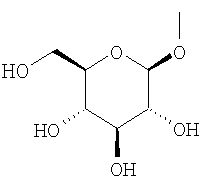
или группу, представленную формулой:

тогда как другой представляет собой C1-6алкильную группу, галоген(С1-6 алкил)группу или С3-7циклоалкильную группу;
R2 представляет собой атом водорода, C1-6алкильную группу,
или -A-RA, в которой А представляет собой атом кислорода; и RA представляет собой С5гетероциклоалкильную группу, содержащую кислород в качестве гетероатома;
Х представляет собой простую связь, атом кислорода;
Y представляет собой C1-6алкиленовую группу, которая может быть замещена гидроксигруппой;
Z представляет собой -RB -CORC, -SO2RC, -CON(RD)RE, -SO2NHRF или -C(=NRG)N(RH)RI;
RC представляет собой C1-6алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i);
R4, RB, RD, RE и RF одинаковые или различные, и каждый представляет собой атом водорода, 6-членную гетероарильную группу, содержащую азот в качестве гетероатома или C1-6алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i), или оба R4 и RB связаны с соседним атомом азота с образованием C4 циклической аминогруппы, содержащей дополнительно 1 атом азота в качестве гетероатома, отличный от атома азота в положении присоединения, которая может содержать заместитель, выбранный из группы, включающей гидроксигруппу, гидрокси(С1-6алкил)группу; или оба RD и RE связаны с соседним атомом азота с образованием C4 циклической аминогруппы, содержащей дополнительно атом азота в качестве гетероатома, отличный от атома азота в положении присоединения, которая может содержать заместитель, выбранный из группы, включающей гидроксигруппу, гидрокси(С1-6алкил)группу;
RG, RH и RI одинаковые или различные, и каждый представляет собой атом водорода, цианогруппу, C1-6алкилсульфонильную группу или C1-6алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i); R3, R5 и R6 одинаковые, и каждый представляет собой атом водорода; и
группа заместителей (i) включает гидроксигруппу, C1-6алкилтиогруппу, аминогруппу, моно или ди(С1-6алкил)аминогруппу, C1-6алкилсульфонильную группу, карбоксигруппу, С2-7алкоксикарбонильную группу, -CON(RJ)RK, в которой RJ и RK одинаковые или различные, и каждый представляет собой атом водорода или C1-6алкильную группу, которая может содержать от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6алкил)аминогруппу или карбамоильную группу, или оба RJ и RK связаны с соседним атомом азота с образованием C4 циклической аминогруппы, содержащей дополнительно 1 гетероатом, выбранный из атомов азота или кислорода, которая может содержать заместитель, выбранный из группы, включающей C1-6алкильную группу, и гидрокси C1-6алкильную группу, C5-6гетероциклоалкильную группу, содержащую от 1 до 2 гетероатомов, выбранных из кислорода или азота; фенил, C5-6гетероарильную группу, содержащую 2 атома азота в качестве гетероатомов, C4 циклическую аминогруппу, которая может содержать дополнительно атом азота или кислорода в качестве гетероатома, которая может иметь заместитель, выбранный из группы, включающей C1-6алкильную группу, или его фармацевтически приемлемая соль.
C1-6алкильную группу, C5-6гетероциклоалкильную группу, содержащую от 1 до 2 гетероатомов, выбранных из кислорода или азота; фенила, C5-6гетероарильную группу, содержащую 2 атома азота в качестве гетероатомов, C4 циклическую аминогруппу, которая может содержать дополнительно атом азота или кислорода в качестве гетероатома, которая может иметь заместитель, выбранный из группы, включающей C1-6алкильную группу,
или его фармацевтически приемлемая соль.
RB представляет собой 6-членную гетероарильную группу, содержащую азот в качестве гетероатома или C1-6алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (i), или оба R4 и RB связаны с соседним атомом азота с образованием C4 циклической аминогруппы, содержащей дополнительно 1 атом азота в качестве гетероатома, отличный от атома азота в положении присоединения, которая может содержать заместитель, выбранный из группы, включающей гидроксигруппу, гидрокси(C1-6алкил)группу; и алкилсульфонильную группу, карбоксигруппу, C2-7алкоксикарбонильную группу, -CON(RJ)RK, в которой RJ и RK одинаковые или различные, и каждый представляет собой атом водорода или C1-6алкильную группу, которая может содержать от 1 до 3 заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди (C1-6алкил) аминогруппу, или карбамоильную группу, или оба RJ и RK связаны с соседним атомом азота с образованием С4 циклической аминогруппы, содержащей дополнительно 1 гетероатом, выбранный из атомов азота или кислорода, которая может содержать заместитель, выбранный из группы, включающей C1-6 алкильную группу, и гидрокси C1-6алкильную группу, C5-6гетероциклоалкильную группу, содержащую от 1 до 2 гетероатомов, выбранных из кислорода или азота; фенила, C5-6гетероарильную группу, содержащую 2 атома азота в качестве гетероатомов, C4 циклическую аминогруппу, которая может содержать дополнительно атом азота или кислорода в качестве гетероатома, которая может иметь заместитель, выбранный из группы, включающей C1-6алкильную группу, или его фармацевтически приемлемая соль.
RB представляет собой C1-6алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (iA); и группа заместителей (iA) включает гидроксигруппу, моно или ди(C1-6алкил)аминогруппу, и -CON(RJA)RKA, в которой RJA и RKA одинаковые или различные, и каждый представляет собой атом водорода или C1-6алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу, моно или ди(C1-6алкил)аминогруппу или карбамоильную группу, или оба RJA и RKA связаны с соседним атомом азота с образованием C4 циклической аминогруппы, содержащей дополнительно 1 гетероатом, выбранный из атомов азота или кислорода, которая может содержать заместитель, выбранный из группы, включающей C1-6алкильную группу и гидрокси(C1-6алкил)группу, или его фармацевтически приемлемая соль.
RE представляет собой C1-6алкильную группу, которая содержит от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (iB); и группа заместителей (iB) включает гидроксигруппу, аминогруппу, моно или ди(C1-6алкил)аминогруппу и -CON(RJB)RKB, в которой RJB и RKB одинаковые или различные, и каждый представляет собой атом водорода, C1-6алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, аминогруппу и моно или ди(C1-6алкил)аминогруппу, или его фармацевтически приемлемая соль.

или группу, представленную формулой:

Q представляет собой C1-6алкильную группу или галоген(C1-6алкил)группу; и R3, R5 и R6 представляют атом водорода, или его фармацевтически приемлемая соль.

другой представляет собой C1-6алкильную группу, галоген(C1-6алкил)группу, или
C3-7циклоалкильную группу, или его фармацевтически приемлемая соль.

или его фармацевтически приемлемую соль.




















































где R11 представляет собой атом водорода, гидрокси(С2-6алкил)группу;
один из Q2 и Т2 представляет собой 2,3,4,6-тетра-О-ацетил-β-D-глюкопиранозилоксигруппу, 2,3,4,6-тетра-O-пивалоил-β-D-глюкопиранозилоксигруппу, 2,3,4,6-тетра-O-ацетил-β-D-галактопиранозилоксигруппу, тогда как другой представляет собой C1-6алкильную группу или С3-7циклоалкильную группу;
R12 представляет собой атом водорода, C1-6алкильную группу или -A-R1A, в которой А представляет собой атом кислорода; и R1A представляет собой
С5 гетероциклоалкильную группу, содержащую атом кислорода в качестве гетероатома;
Х представляет собой прямую связь, атом кислорода;
Y1 представляет собой C1-6алкиленовую группу;
Z1 представляет собой -R1B, -CON(R1D)R1E, или -C(=NR1G)N(R1H)R1I;
R14, R1B, R1D, R1E и R1F одинаковые или различные, и каждый представляет собой атом водорода или C1-6алкильную группу, которая может содержать от 1 до 5 одинаковых или различных групп, выбранных из нижеследующей группы заместителей (ii), или оба R14 и R1B связаны с соседним атомом азота с образованием
C4 циклической аминогруппы, содержащей дополнительно атом азота в качестве гетероатома, которая может иметь заместитель, выбранный из группы, включающей гидроксигруппу, гидрокси(C1-6алкил)группу;
R1G, R1H и R1I одинаковые или различные, и каждый представляет собой атом водорода, фенил(C2-7алкоксикарбонил)группу;
R3, R5 и R6 одинаковые, и каждый представляет собой атом водорода; и группа заместителей (ii) включает -CON(R1J)R1K, в которой R1J и R1K одинаковые или различные, и каждый представляет собой атом водорода, или C1-6алкильную группу, которая может содержать от 1 до 3 одинаковых или различных заместителей, выбранных из группы, включающей гидроксигруппу, фенил или его соль.
Документы, цитированные в отчёте о поиске
Α-замещенные производные карбоновых кислот

Комментарии