Модуляторы ror гамма (rorγ) - RU2730454C2
Код документа: RU2730454C2
Описание
Связанный с рецептором ретиноевой кислоты рецептор-сирота γt (RORγt) действует как главный регулятор развития клеток TH17, а также как критический компонент в не-TH17 клетках, производящих ИЛ-17, таких как, например, γδ T-клетки. Семейство генов ROR является частью суперсемейства ядерного гормонального рецептора и состоит из трех членов (RORα, RORβ и RORγ). Каждый ген экспрессируется в различных изоформах, различаясь, прежде всего, последовательностью N-окончания. Были идентифицированы две изоформы RORγ: RORγ1 и RORγ2 (также известная как RORγt). Термин RORγ в данном описании относится к обоим RORγ1 и/или RORγ2.
Данное изобретение относится к модуляторам RORγ, содержащим 4-[2-(4-сульфонилфенил)ацетамидо]бензамид остов, к фармацевтическим композициям, содержащим их, и к применению указанных соединений для лечения RORγ-медиированных заболеваний или состояний, в частности, аутоиммунных заболеваний и воспалительных состояний.
Данное изобретение относится к соединениям формулы I
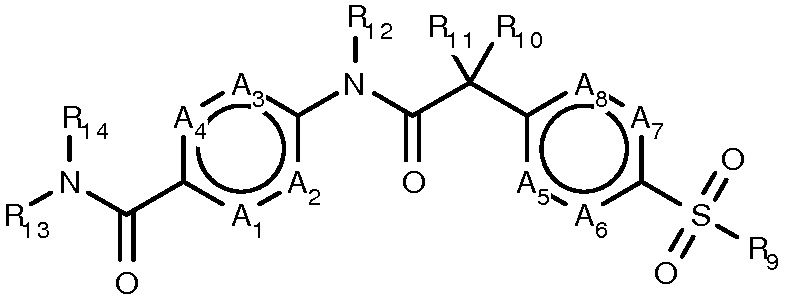
(формула I)
или их фармацевтически приемлемой соли, где:
- A1-A8 являются N или CR1-CR8, соответственно, при условии, что не более двух из четырех положений А в A1-A4 одновременно могут быть N и что не более двух из четырех положений А в A5-A8 одновременно могут быть N;
- R1-R8 независимо являются H, галогеном, амино, C(1-3)алкокси, (ди)C(1-3)алкиламино или C(1-6)алкилом;
- R9 является C(1-6)алкилом;
- R10 и R11 независимо являются H, F, метилом, этилом, гидрокси или метокси, или R10 и R11 вместе являются карбонилом, все алкильные группы, если присутствуют, необязательно замещены одним или более F;
- R12 является H или C(1-6)алкилом;
- R13 является C(3-6)циклоалкилом, C(3-6)циклоалкилC(1-3)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкилC(1-3)алкилом, C(6-10)арилом, C(6-10)арилC(1-3)алкилом, C(1-9)гетероарилом или C(1-9)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом;
- R14 является H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкилC(1-3)алкилом, C(2-5)гетероциклоалкилом, C(2-5)гетероциклоалкилC(1-3)алкилом, C(6-10)арилом, C(6-10)арилC(1-3)алкилом, C(1-9)гетероарилом или C(1-9)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более галоген, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом;
- или R13 и R14 конденсированы и образуют кольцо, содержащее от 5 до 7 атомов объединением R13, являющегося C(1-6)алкилом или C(2-6)алкенилом, с независимым заместителем в пределах определения R14, все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
Термин C(1-6)алкил в данном описании означает разветвленную или неразветвленную алкильную группу, содержащую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(1-3)алкил в данном описании означает алкильную группу, содержащую 1-3 атома углерода, т.е. метил, этил, пропил или изопропил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(2-6)алкенил в данном описании означает разветвленную или неразветвленную алкенильную группу, содержащую 2-6 атомов углерода, например, 4-гексенил, бут-2-енил, 1-метиленпропил, 2-пропенил (аллил) и этенил (винил). Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6-10)арил в данном описании означает ароматическую углеводородную группу, содержащую 6-10 атомов углерода, например, фенил или нафтил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6-10)арил-C(1-3)алкил в данном описании означает C(6-10)арильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(6)арил в данном описании означает ароматическую углеводородную группу, содержащую 6 атомов углерода, т.е. фенил. Все атомы углерода необязательно могут быть замещены одним или более галогеном.
Термин C(6)арил-C(1-3)алкил в данном описании означает C(6)арильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин гетероатом в данном описании относится к атому азота, серы или кислорода.
Термин амино в данном описании относится к NH2 группе.
Термин C(1-9)гетероарил в данном описании означает ароматическую группу, содержащую 1-9 атомов углерода и 1-4 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают имидазолил, тиадиазолил, пиридинил, пиримидинил, фурил, пиразолил, оксазолил, изоксазолил, тетразолил, тиофенил, тиазолил, тиадиазолил и хинолил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(1-9)гетероарил-C(1-3)алкил в данном описании означает C(1-9)гетероарильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(1-5)гетероарил в данном описании означает ароматическую группу, содержащую 1-5 атомов углерода и 1-4 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают имидазолил, тиадиазолил, пиридинил, пиримидинил, фурил, пиразолил, изоксазолил и тетразолил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(1-5)гетероарил-C(1-3)алкил в данном описании означает C(1-5)гетероарильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(3-6)циклоалкил в данном описании означает насыщенный циклический углеводород, содержащий 3-6 атомов углерода, т.е. циклопропил, циклобутил, циклопентил или циклогексил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(3-6)циклоалкил-C(1-3)алкил в данном описании означает C(3-6)циклоалкильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше. Примером является циклопропилметил.
Термин C(2-5)гетероциклоалкил в данном описании означает насыщенный циклический углеводород, содержащий 2-5 атомов углерода и 1-3 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают пиперазинил, пиразолидил, пиперидинил, морфолинил, оксоланил и пирролидинил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(4)гетероциклоалкил в данном описании означает насыщенный циклический углеводород, содержащий 4 атома углерода и 1-3 гетероатома, которые могут быть присоединены через атом азота, если возможно, или атом углерода. Примеры включают пиперазинил, оксоланил и пирролидинил. Все атомы углерода необязательно могут быть замещены одним или более галогеном или метилом.
Термин C(2-5)гетероциклоалкил-C(1-3)алкил в данном описании означает C(2-5)гетероциклоалкильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин C(4)гетероциклоалкилC(1-3)алкил в данном описании означает C(4)гетероциклоалкильную группу, присоединенную к C(1-3)алкильной группе, обе которые имеют значения, описанные выше.
Термин (ди)C(1-3)алкиламино в данном описании означает аминогруппу, которая монозамещена или дизамещена C(1-3)алкильной группой, где последняя имеет значение, определенное выше.
Термин C(1-3)алкокси означает алкоксигруппу, содержащую 1-3 атома углерода, где алкильная часть разветвлена или не разветвлена. Все атомы углерода необязательно замещены одним или более F.
Термин C(1-3)алкоксикарбонил означает карбонильную группу, замещенную C(1-3)алкокси, где последняя имеет значение, определенное выше.
Термин галоген в данном описании означает Br, Cl или F.
В представленных выше определениях с многофункциональными группами, место присоединения находится на последней группе.
Если, в определении заместителя, указано, что ʺвсе алкильные группыʺ указанного заместителя необязательно замещены, они также включают алкильную часть алкоксигруппы.
Термин ʺзамещенныйʺ означает, что один или более атомов водорода указанного атома/атомов замещены выбором из указанной группы, при условии, что нормальная валентность указанных атомов в существующих условиях не превышена, и что замещение дает стабильное соединение. Сочетания заместителей и/или переменных возможно, только если такие сочетания дают стабильные соединения. ʺСтабильное соединениеʺ или ʺстабильная структураʺ определены как соединение или структура, которые достаточно устойчивы для того, чтобы вынести выделение до полезной степени чистоты из реакционной смеси и составление в эффективный терапевтический агент.
Термин ʺнеобязательно замещенныйʺ означает необязательное замещение указанными группами, радикалами или частями.
Термин фармацевтически приемлемая соль означает такие соли, которые, с медицинской точки зрения, подходят для применения в контакте с тканями человека и низших животных, не вызывая нежелательной токсичности, раздражения, аллергической реакции и подобных, и соразмерны разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Они могут быть получены во время конечного выделения и очистки соединений в соответствии с данным изобретением или отдельно, взаимодействием функциональной группы свободного основания с подходящей минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобное. Функциональная группа кислоты может взаимодействовать с органическим или минеральным основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития.
В одном варианте, изобретение относится к соединению формулы I, где:
- A1-A4 соответственно являются CR1-CR4;
- или A1 и A4 соответственно являются CR1 и CR4, и A2 илиA3 является N, оставшееся положение A является CR2 или CR3;
- A5-A8 соответственно являются CR5-CR8;
- или A5 и A8 соответственно являются CR1 и CR4, и A6 илиA7 является N, оставшееся положение А является CR6 или CR7;
- R1-R4 независимо являются H, галогеном или C(1-6)алкилом;
- R5-R8 независимо являются H;
- R9 является C(1-3)алкилом;
- R10 и R11 независимо являются H;
- R12 является H;
- R13 является C(3-6)циклоалкилом, C(3-6)циклоалкилC(1-3)алкилом, C(2-5)гетероциклоалкилC(1-3)алкилом, C(6-10)арилом, C(6-10)арилC(1-3)алкилом, C(1-9)гетероарилом или C(1-9)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более C(1-3)алкилом;
- R14 является C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(2-5)гетероциклоалкилом, C(6-10)арилом или C(6-10)арилC(1-3)алкилом, все группы необязательно замещены одним или более галогеном, гидрокси или C(1-3)алкилом;
- или R13 и R14конденсированы с получением кольца, содержащего от 5 до 7 атомов, объединением R13, являющегося C(1-6)алкилом или C(2-6)алкенилом, с независимым заместителем в пределах определения R14, являющегося C(6-10)арилом или C(6-10)арилC(1-3)алкилом.
В другом варианте изобретение относится к соединению формулы I, где:
- A1-A4 соответственно являются CR1-CR4;
- или A1 и A4 соответственно являются CR1 и CR4, и A2 илиA3 является N, оставшееся положение А является CR2 или CR3;
- A5-A8 соответственно являются CR5-CR8;
- или A5 и A8 соответственно являются CR1 и CR4, и A6 илиA7 является N, оставшееся положение А является CR6 или CR7;
- R1-R4 независимо являются H, Cl, F или метилом;
- R5-R8 независимо являются H;
- R9 является этилом;
- R10 и R11 независимо являются H;
- R12 является H;
- R13 является циклобутилом, циклопропилметилом, оксоланилпропанилом, фенилом, бензилом, оксазолилом, пиразолилом, тиадиазолилом, тиазолилом, пиридинилом, оксазолилметилом или фуранилметилом, все группы необязательно замещены одним или более метилом;
- R14 является метилом, этилом, трет-бутилом, гидроксипропилом, пропилом, циклопропилом, циклобутилом, оксоланилом, фенилом или бензилом, все группы необязательно замещены одним или более F или метилом;
- или R13 и R14конденсированы и образуют 1,2,3,4-тетрагидрохинолин, фенилпирролидин или фенилпиперидин.
В одном варианте изобретение относится к соединению формулы I, где:
- A1-A4 соответственно являются CR1-CR4;
- A5 и A8 соответственно являются CR5 и CR8;
- A6 или A7 является N, оставшееся положение А является CR6 или CR7;
- R1-R4 независимо являются H или галогеном;
- R5-R8 независимо являются H;
- R9 является C(1-3)алкилом;
- R10 и R11 независимо являются H;
- R12 является H;
- R13 является C(6-10)арилом;
- и R14 является C(1-6)алкилом.
В другом варианте изобретение относится к соединению формулы I, где:
- A1-A4 соответственно являются CR1-CR4;
- A5 и A8 соответственно являются CR5 и CR8;
- A6 или A7 является N, оставшееся положение А является CR6 или CR7;
- R1-R4 независимо являются H, Cl или F;
- R5-R8 независимо являются H;
- R9 является этилом;
- R10 и R11 независимо являются H;
- R12 является H;
- R13 является фенилом;
- и R14 является этилом или трет-бутилом.
В одном варианте изобретение относится к соединению формулы I, где все положения A в A1-A4 являются CR1-CR4.
В другом варианте изобретение относится к соединению формулы I, где все положения А в A5-A8 являются CR5-CR8.
В другом варианте изобретение относится к соединению формулы I, где все положения А в A1-A8 являются углеродом.
В другом варианте изобретение относится к соединению формулы I, где одно из положений А в A1-A8 является N, оставшиеся положения А являются углеродом.
В другом варианте изобретение относится к соединению формулы I, где любое положение A1 или A2 является N и оставшиеся положения А в A1-A8 являются CR1-CR8.
В другом варианте изобретение относится к соединению формулы I, где любое положение A6 или A7 является N и оставшиеся положения A в A1-A8 являются CR1-CR8.
В другом варианте изобретение относится к соединению формулы I, где R1-R8 независимо являются H, галогеном, метокси или метилом.
В еще одном варианте изобретение относится к соединению формулы I, где R1-R8 независимо являются H, галогеном или метилом.
В другом варианте изобретение относится к соединению формулы I, где все положения R в R1-R4 являются H.
В другом варианте изобретение относится к соединению формулы I, где все положения R в R1-R4 являются галогеном или метилом.
В еще одном варианте изобретение относится к соединению формулы I, где R8 является метилом, и все положения R в R5-R7 являются H.
В другом варианте изобретение относится к соединению формулыI, где все положения R в R5-R8 являются H.
В еще одном варианте изобретение относится к соединению формулы I, где все положения R в R1-R8 являются H.
В одном варианте изобретение также относится к соединению формулы I, где R9 является C(1-3)алкилом.
В другом варианте изобретения изобретение также относится к соединению формулы I, где R9 является этилом.
В одном варианте изобретение относится к соединению формулы I, где R10 и R11 независимо являются H, метилом или гидроксилом.
В другом варианте изобретение относится к соединению формулы I, где R10 и R11 оба являются H.
Изобретение также относится к соединению формулы I, где R12 является H или C(1-3)алкилом.
В другом варианте изобретение относится к соединению формулы I, где R12 является H.
В одном варианте изобретение относится к соединению формулы I, где R13 является C(3-6)циклоалкилом, C(3)циклоалкилC(1-3)алкилом, C(2-5)гетероциклоалкилом, C(4)гетероциклоалкилC(1-3)алкилом, C(6)арилом, C(6)арилC(1-3)алкилом, C(1-5)гетероарилом или C(1-5)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более галоген, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В другом варианте изобретение относится к соединению формулы I, где R13 является C(3-6)циклоалкилом, C(3)циклоалкилC(1-3)алкилом, C(4)гетероциклоалкилC(1-3)алкилом, C(6)арилом, C(6)арилC(1-3)алкилом, C(1-5)гетероарилом или C(1-5)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более C(1-3)алкилом.
В еще одном варианте изобретение относится к соединению формулы I, где R14 является H, C(1-6)алкилом, C(2-6)алкенилом, C(3-6)циклоалкилом, C(3-6)циклоалкилC(1-3)алкилом, C(4)гетероциклоалкилом, C(2-5)гетероциклоалкилC(1-3)алкилом, C(6)арилом, C(6)арилC(1-3)алкилом, C(1-5)гетероарилом или C(1-5)гетероарилC(1-3)алкилом, все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В еще одном варианте изобретение относится к соединению формулы I, где R14 является C(1-6)алкилом, C(3-6)циклоалкилом, C(4)гетероциклоалкилом, C(6)арил или C(6)арилC(1-3)алкилом, все группы необязательно замещены одним или более галогеном, гидрокси или C(1-3)алкилом.
В другом варианте изобретение относится к соединению формулы I, где R14 является H или C(1-6)алкилом, все алкильные цепи необязательно замещены одним или более галогеном.
В еще одном варианте изобретение относится к соединению формулы I, где R13 и R14 конденсированы с получением кольца, содержащего от 5 до 7 атомов, объединением R13, являющегося C(1-6)алкилом или C(2-6)алкенилом, с независимым R14 заместителем, выбранным из C(3-6)циклоалкила, C(3-6)циклоалкилC(1-3)алкила, C(2-5)гетероциклоалкила, C(2-5)гетероциклоалкил-C(1-3)алкила, C(6)арила, C(6)арилC(1-3)алкила, C(1-5)гетероарила или C(1-5)гетероарил-C(1-3)алкила, все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В еще одном варианте изобретение относится к соединению формулы I, где R13 и R14 конденсированы с получением кольца, содержащего от 5 до 7 атомов, объединением R13, являющегося пропилом, с R14, выбранным из C(1-6)алкила, C(2-6)алкенила, C(2-5)гетероциклоалкила, C(2-5)гетероциклоалкилC(1-3)алкила, C(6)арила, C(6)арилC(1-3)алкила, C(1-5)гетероарила или C(1-5)гетероарилC(1-3)алкила, где все группы необязательно замещены одним или более галогеном, амино, гидрокси, циано, C(1-3)алкокси, C(1-3)алкоксикарбонилом, (ди)C(1-3)алкиламино или C(1-3)алкилом.
В еще одном варианте изобретение относится к соединению формулы I, где R13 и R14 конденсированы с получением кольца, содержащего от 5 до 7 атомов, объединением R13, являющегося пропилом, с R14, выбранным из C(6)арила или C(6)арилC(1-3)алкила.
Изобретение также относится к тем соединениям, в которых все конкретные определения для A1-A8, R1-R14 и всех замещающих групп в различных аспектах изобретения, определенных выше, существуют в любых сочетаниях в рамках определения соединения формулы I.
В другом аспекте соединение относится к соединениям формулы I, которые имеют pIC50 5 или выше. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 6. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 7. В еще одном аспекте изобретение относится к соединениям формулы I с pIC50 более 8.
В еще одном варианте изобретение относится к соединениям формулы I, выбранным как описано в примерах 1-45.
Соединения формулы I могут образовывать соли, которые также включены в объем данного изобретения. Ссылка на соединение формулы I здесь включает ссылку на его соли, если не указано иначе.
Соединения формулы I могут содержать асимметрические или хиральные центры и, поэтому, существуют в различных стереоизомерных формах. Подразумевается, что все стереоизомерные формы соединений формулы I, а также их смеси, включая рацемические смеси, образуют часть данного изобретения.
Диастереомерные смеси могут быть разделены на отдельные диастереомеры на основе их физико-химических различий, способами, хорошо известными специалистам в данной области техники, такими как, например, хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены превращением энантиомерной смеси в диастереомерную смесь взаимодействием с подходящим оптически активным соединением (например, хиральной добавкой, такой как хиральный спирт или хлорид кислоты Мошера), разделяя диастереомеры и превращая (например, гидролизом) отдельные диастереомеры в соответствующие чистые энантиомеры. Энантиомеры также могут быть разделены с применением хиральной ВЭЖХ колонки.
Специалисты в данной области техники понимают, что желаемые значения IC50 зависят от тестируемого соединения. Например, соединение со значением IC50 менее 10-5 M обычно считается кандидатом для отбора по чувствительности к лекарственному препарату. Предпочтительно, это значение ниже 10-6 M. Однако соединение, которое имеет более высокое значение IC50, но является селективным к конкретному рецептору, может быть даже лучшим кандидатом.
Соединения в соответствии с данным изобретением ингибируют активность RORγ. Модулирование активности RORγ может быть измерено с применением, например, исследований замещения биофизического (природного) лиганда, биохимическими анализами AlphaScreen или FRET, клеточными анализами гена-репортера GAL4, клеточным анализом промотора-репортера ИЛ-17 или функциональными ELISA анализами ИЛ-17 с применением, например, мышиных спленоцитов или мононуклеарных клеток периферической крови человека (МКПК), культивированных в TH17 поляризующих условиях.
В таких анализах взаимодействие лиганда с RORγ может быть определено измерением, например, лиганд-модулированного взаимодействия кофактор-производных пептидов со связывающим доменом лиганда RORγ или измерением генных продуктов лиганд-модулированной RORγ-медиированной транскрипции, с применением, например, исследований люциферазного репортера или ELISA исследований ИЛ-17.
Данное изобретение также относится к фармацевтической композиции, содержащей соединения или их фармацевтически приемлемые соли, имеющих общую формулу I, в смеси с фармацевтически приемлемыми наполнителями и, необязательно, другими терапевтически активными агентами.
Данное изобретение также относится к фармацевтической композиции, содержащей соединения или их фармацевтически приемлемые соли, имеющие общую формулу I, в смеси с фармацевтически приемлемыми наполнителями и одним или более фармацевтически приемлемыми наполнителями.
Наполнители должны быть ʺприемлемымиʺ в смысле совместимости с другими ингредиентами композиции и не вредящими реципиентам.
Данное изобретение также относится к фармацевтической композиции, содержащей, по крайней мере, один дополнительный терапевтически активный агент.
Изобретение также включает соединение формулы I в сочетании с одним или более другими лекарственными средствами.
Композиции включают, например, композиции, подходящие для перорального, подъязычного, подкожного, внутривенного, внутримышечного, назального, местного или ректального введения, и подобных, все которые имеют стандартную лекарственную форму для введения.
Для перорального введения активный ингредиент может присутствовать в виде отдельных единиц, таких как таблетки, капсулы, порошки, грануляты, растворы, суспензии и подобные.
Для парентерального введения фармацевтическая композиция в соответствии с данным изобретением может присутствовать в однодозных или многодозных контейнерах, например, жидкие инъекции в определенных количествах, например, в герметично закрытых флаконах или ампулах, а также могут храниться в высушенном вымораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды, перед применением.
При смешивании таких фармацевтически приемлемых добавок активный ингредиент может быть спрессован в твердые лекарственные формы, такие как пилюли, таблетки, или может быть переработан в капсулы или суппозитории. В виде фармацевтически приемлемых жидкостей активный ингредиент может быть нанесен в виде жидкой композиции, например, в виде препарата для инъекций, в форме раствора, суспензии, эмульсии, или в виде спрея, например, назального спрея.
Для получения твердых лекарственных форм рассматривается применение обычных добавок, таких как наполнители, красители, полимерные связующие агенты и подобные. В общем, могут применяться любые фармацевтически приемлемые добавки, которые не взаимодействуют с функциональными группами активных соединений. Подходящие носители, с которыми может вводиться активный агент в соответствии с данным изобретением в виде твердых композиций, включают лактозу, крахмал, производные целлюлозы и подобные, и их смеси, применяемые в подходящих количествах. Для парентерального введения могут применяться водные суспензии, изотонические солевые растворы и стерильные растворы для инъекций, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие агенты, такие как пропиленгликоль или бутиленгликоль.
Изобретение также включает фармацевтическую композицию, как описана выше, в сочетании с упаковкой, подходящей для указанной композиции, где указанная упаковка включает инструкции по применению композиции, для описанного выше применения.
Точная доза и режим введения активного ингредиента или его фармацевтической композиции может варьироваться в зависимости от конкретного соединения, способа введения и возраста и состояния пациента, которому вводят лекарство.
В общем, парентеральное введение требует более низких доз, чем другие способы введения, которые больше зависят от абсорбции. Однако доза для человека предпочтительно включает 0,0001-100 мг на кг массы тела. Желаемая доза может быть представлена в виде однократной дозы или множества субдоз, вводимых с подходящим интервалом в течение суток.
Соединения в соответствии с данным изобретением могут применяться в терапии.
Другой аспект изобретения относится к применению соединений в соответствии с данным изобретением или их фармацевтически приемлемой соли для лечения RORγ-медиированных заболеваний или RORγ-медиированных состояний.
Другой аспект изобретения относится к применению соединений общей формулы I или их фармацевтически приемлемой соли для лечения аутоиммунных заболеваний, в частности, таких заболеваний, в которых TH17 клетки и не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль. Оно включает, но не ограничено ими, лечение ревматоидного артрита, псориаза, воспалительного заболевания кишечника, болезнь Крона и рассеянный склероз.
В другом аспекте, соединения общей формулы I или их фармацевтически приемлемая соль могут применяться для лечения воспалительных заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, респираторные заболевания, остеоартрит и астма. Также соединения или их фармацевтически приемлемая соль формулы I могут применяться для лечения инфекционных заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, слизистый лейшманиоз.
Соединения общей формулы I или их фармацевтически приемлемая соль также могут применяться для лечения других заболеваний, в которых TH17 клетки и/или не-TH17 клетки, которые экспрессируют TH17 характерные цитокины, играют важную роль, таких как, но не ограниченных ими, болезнь Кавасаки и тиреоидит Хашимото.
В еще одном аспекте изобретения представлено применение соединений общей формулы I для лечения рассеянного склероза, воспалительного заболевания кишечника, болезни Крона, псориаза, ревматоидного артрита, астмы, остеоартрита, болезни Кавасаки, тиреоидита Хашимото, рака и слизистого лейшманиоза.
В другом аспекте соединение в соответствии с данным изобретением может применяться в терапии для лечения или профилактики рассеянного склероза, воспалительного заболевания кишечника, болезни Крона, псориаза и ревматоидного артрита, астмы, остеоартрита, болезни Кавасаки, тиреоидита Хашимото, рака и слизистого лейшманиоза.
В другом аспекте соединение в соответствии с данным изобретением может применяться для лечения или профилактики псориаза.
В другом аспекте соединение в соответствии с данным изобретением может применяться для лечения воспалительного заболевания кишечника.
Изобретение иллюстрировано следующими примерами.
ПРИМЕРЫ
Как изображено в примерах ниже, в определенных типовых вариантах соединения получают в соответствии со следующими общими методами. Должно быть понятно, что хотя в общих способах изображен синтез определенных соединений в соответствии с данным изобретением, следующие общие способы и другие способы, известные специалистам в данной области техники, могут применяться ко всем соединениям и подклассам и видам каждого из этих соединений, как описано здесь.
ОБЩИЕ СПОСОБЫ ПОЛУЧЕНИЯ
Описанные здесь соединения, включая соединения общей формулы I, могут быть легко получены согласно следующим реакционным схемам и примерам, или их модификациям, с применением легкодоступных исходных материалов, реагентов и обычных методов синтеза. Многие реакции также могут проводиться в микроволновых условиях или с применением обычного нагревания, или с применением других технологий, таких как твердофазные реагенты/акцепторы или поточная химия. В этих реакциях также возможно применять варианты, которые сами по себе известны специалистам в данной области техники, но не описаны подробно. Например, если указаны конкретные кислоты, основания, реагенты, сочетающие агенты, растворители и т.д., понятно, что могут применяться другие подходящие кислоты, основания, реагенты, сочетающие агенты, растворители и т.д., которые включены в объем данного изобретения. Более того, другие способы получения соединений в соответствии с данным изобретением очевидны специалисту в данной области техники с учетом следующих реакционных схем и примеров. В случае, когда промежуточные соединения синтеза и конечные продукты содержат потенциально реакционноспособные функциональные группы, например, амино, гидроксил, тиол и группы карбоновой кислоты, которые могут взаимодействовать с желаемой реакцией, может быть предпочтительно применять защищенные формы промежуточного соединения. Способы выбора, введения и последующего удаления защитных групп хорошо известны специалистам в данной области техники. Соединения, полученные с применением общих реакционных последовательностей, могут быть недостаточной чистоты. Соединения могут быть очищены с применением любого способа очистки органических соединений, например, кристаллизации или хроматографии на колонке с силикагелем или окисью алюминия, с применением различных растворителей в подходящих соотношениях. Все возможные стереоизомеры предусматриваются в объеме изобретения. В описании ниже переменные имеют значения, указанные выше, если не указано иначе.
Аббревиатуры, применяемые в этих экспериментах, перечислены ниже, и дополнительные аббревиатуры должны быть известны специалисту в области синтетической химии.
Применяемые аббревиатуры: к.т.: комнатная температура; ГАТУ: гексафторфосфат 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония; ДМФ: диметилформамид; ДИПЭА: диизопропилэтиламин; ДМАП: 4-(диметиламино)пиридин; ДЦК: N,N'-дициклогексилкарбодиимид; мХПБК: 3-хлорпероксибензойная кислота; ТФК: трифторуксусная кислота; ТГФ: Тетрагидрофуран; ДМСО: диметилсульфоксид; PyBOP: гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония; EtOH: этанол; ТСХ: тонкослойная хроматография; ЭДКИ: 1-Этил-3-(3-диметиламинопропил)карбодиимид; АИБН: азобисизобутиронитрил; NBS: N-бромсукцинимид; ФТБА: фторид тетра-n-бутиламмония; ЦНТМС: триметилсилилцианид.
Химическими наименованиями являются предпочтительные IUPAC наименования, полученные с применением MarvinSketch, версия 6.3.0.
Если химическое соединение описано с помощью химической структуры и химического наименования, и между структурой и наименованием имеется неясность, преимущественной является структура.
ОБЩИЕ МЕТОДЫ
Схема 1:

Как изображено на схеме 1, производные в соответствии с данным изобретением формулы I могут быть получены способами, известными в области органической химии. Соединения в соответствии с данным изобретением, например, могут быть получены амидным сочетанием между производным (гетеро)арилуксусной кислоты 1, где A5, A6, A7, A8,R9,R10 и R11 имеют описанные выше значения, и производным (гетеро)ариламино 2, где A1, A2, A3, A4, R12, R13 и R14 имеют описанные выше значения, которые могут быть легко получены специалистом в области органической химии с применением реагента, такого как ЭДКИ, ГАТУ, ДЦК или PyBOP или подобные, в присутствии подходящего основания, такого как ДИПЭА, или катализатора, такого как ДМАП.
Альтернативно, производное (гетеро)арилуксусной кислоты 1 может быть превращено в хлорангидрид, с применением, например, SOCl2 или оксалилхлорида, которые могут сочетаться в присутствии подходящего основания, такого как Et3N или подобное, с производным (гетеро)ариламино 2, с получением производных формулы I.
Альтернативно, производное (гетеро)арилуксусной кислоты 1 может быть конденсировано с защищенным подходящей кислотой производным (гетеро)ариламино 3, где A1, A2, A3, A4, и R12имеют описанные выше значения, с применением описанных выше способов. После удаления защитной группы полученное производное карбоновой кислоты 4 может быть конденсировано с подходящим амином 5, где R13 и R14имеют описанные выше значения, с применением способов, описанных выше, с получением производных формулы I.
Схема 2:

Условия: i) H2SO4, EtOH, 60°C; ii) Алкилгалогенид, K2CO3, CH3CN, к.т.; iii) мХПБК, CH2Cl2, к.т.; iv) 2N NaOH, EtOH, к.т.
Схема 2 иллюстрирует общий способ получения производных 2-[4-(алкилсульфонил)фенил]уксусной кислоты структурного элемента 1, где и R9, R10, R11, A5, A6, A7 и A8 имеют описанные выше значения.
Эстерификация производных 4-меркаптофенилуксусной кислоты 6 в кислых условиях с применением, например, H2SO4 в этаноле, дает производные этил 2-(4-меркаптофенил)ацетата 7. Алкилирование серной группы с применением алкилгалогенида в присутствии основания, такого как K2CO3, дает соответствующие производные этил 2-[4-(алкилсульфанил)фенил]ацетата 8. Окисление с применением, например, мХПБК, дает производные этил 2-(4-алкилсульфонилфенил)ацетата 9, которыепосле омыления части сложного эфира в основных условиях, например, NaOH в этаноле, дает соответствующие производные 2-[4-(алкилсульфонил)фенил]уксусной кислоты 1.
Схема 3:

Условия: (A6=N): i) Тиомочевина, HCl (водн.), кипение с обратным холодильником; ii)алкилгалогенид, K2CO3, CH3CN, к.т.; iii) мХПБК, CH2Cl2, 0°C→КТ; iv) NBS, АИБН, CH3CN, 60°C; v) ЦНТМС, ФТБА, CH3CN, кипение с обратным холодильником; vi) NaOH, EtOH, кипение с обратным холодильником.
Схема 3 демонстрирует общий способ получения производных 2-(6-алкилсульфонилпиридин-3-ил)уксусной кислоты структурного элемента 1, где A6 является N и R9, R10, R11, A5, A7 и A8 имеют описанные выше значения.
Реакция производных 2-бром-5-метилпиридина 10 с тиомочевиной в кислых условиях дает производные 5-метилпиридин-2-тиола 11, которые могут быть алкилированы в присутствии подходящего основания, такого как карбонат калия, с получением соответствующих производных 2-(алкилсульфанил)-5-метилпиридина 12. Окисляют с применением мХПБК, например, до соответствующих сульфоновых производных 13, которые при радикальном бромировании с NBS в присутствии радикального инициатора, такого как АИБН, дают производные 5-(бромалкил)-2-(этилсульфанил)пиридина 14. Эти бромидные производные могут быть превращены в соответствующие нитрильные производные 15 обработкой источником цианида, таким как ЦНТМС или цианид калия, или подобными. Если применяют ЦНТМС, требуется добавлять источник фторида, такой как ФТБА или подобные, для получения цианидного нуклеофила in situ. Гидролиз нитрильных производных 15 дает соответствующие производные карбоновой кислоты структурного элемента 1, где A6 является N.
Некоторые из структурных элементов 1 коммерчески доступны, известны или получены способами, известными специалистам в данной области техники.
Схема 4:
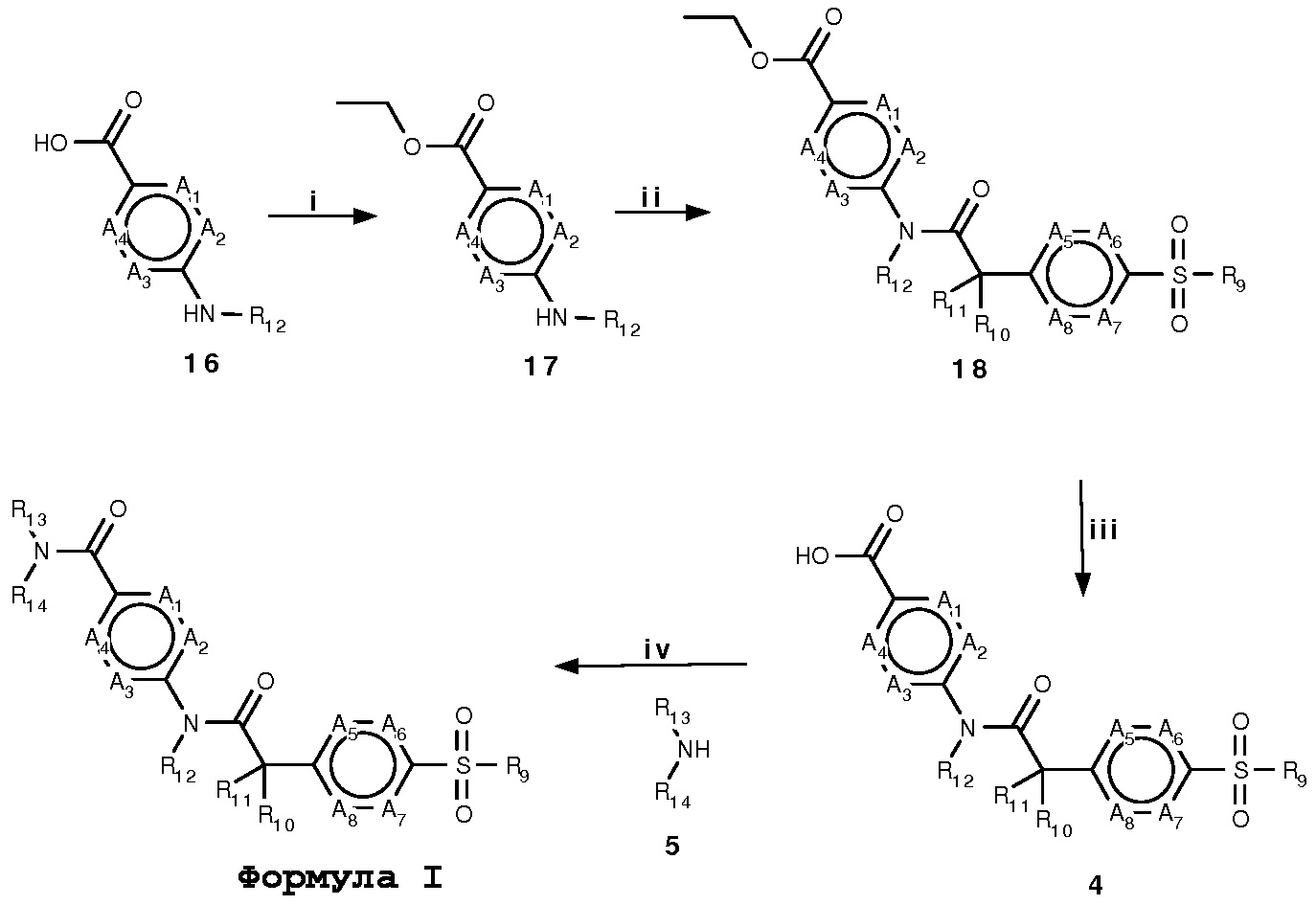
Условия: i) Этанол, HCl(конц.), к.т.; ii) подходящее производное 1, ЭДКИ, ДМАП, CH2Cl2, 60°C; iii) 2N NaOH, EtOH, кипение с обратным холодильником; iv) подходящий амин 5, ЭДКИ, ДМАП, CH2Cl2, 60°C.
Схема 4 демонстрирует общий способ получения амидных производных формулы I, где R9, R10, R11, R12, R13, R14, A1, A2, A3, A4, A5, A6, A7 и A8имеют описанные выше значения.
Взаимодействие производных карбоновой кислоты 16 с этанолом в кислых условиях дает соответствующие производные сложного эфира 17, которые могут быть конденсированы с производными 2-[4-(алкилсульфонил)фенил]уксусной кислоты 1, в присутствии, например, ЭДКИ и ДМАП, с получением производных 18. После омыления части сложного эфира в основных условиях с применением, например, NaOH в этаноле, полученные производные 4 могут быть конденсированы с аминовыми производными 5, в присутствии, например, ЭДКИ и ДМАП, с получением производных формулы I.
Схема 5:

Условия: i) SOCl2, CH2Cl2, к.т.; ii) подходящий амин 5, триэтиламин, CH2Cl2, к.т.; iii) подходящий амин 5, ЭДКИ, ДМАП, CH2Cl2, 60°C; iv) порошок цинка, NH4Cl, ТГФ, вода 65°C; v) подходящее производное 1, ЭДКИ, ДМАП, CH2Cl2, 60°C.
Схема 5 демонстрирует альтернативный способ получения производных амидных формулы I, где R9, R10, R11, R12, R13, R14, A1, A2, A3, A4, A5, A6, A7 и A8имеют описанные выше значения.
Производные 4-нитробензойной кислоты 19 могут быть конденсированы с подходящими аминами в присутствии, например, ЭДКИ и ДМАП, с получением производных 4-нитробензамида 21. Альтернативно, производные 4-нитробензойной кислоты могут быть легко превращены в соответствующие производные 4-нитробензоилахлорида 20 с применением, например, SOCl2 или оксалилхлорида, которые затем могут сочетаться с подходящими аминами в присутствии основания, такого как Et3N или подобные.
Нитрогруппа производных 21 может быть восстановлена с применением, например, NH4Cl, в присутствии цинка или железа, с получением производных 4-аминобензамида 22, которые могут быть конденсированы с производными 1, в присутствии, например, ЭДКИ и ДМАП, с получением производных формулы I, где R12 является водородом.
Примеры
Все применяемые структурные элементы коммерчески доступны, известны или получены способами, известными специалистам в данной области техники.
Примеры 1-45
1: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-метил-N-(5-метил-1,2-оксазол-3-ил)бензамид.

i) К раствору N,5-диметил-1,2-оксазол-3-амина (0,5 г) и триэтиламина (1,9 мл) в CH2Cl2 (5 мл) добавляют 4-нитробензоилхлорид (0,91 г) в CH2Cl2 (5 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре в атмосфере азота. Реакционную смесь промывают водой, водным раствором 1M HCl, водой, насыщенным водным раствором NaHCO3, водой, насыщенным раствором соли и сушат над MgSO4. Объединенные органические слои концентрируют при пониженном давлении и остаток очищают на SiO2, с применением 0%-6% CH3OH/этилацетата (1:1) in CH2Cl2 в качестве элюента, с получением N-метил-N-(5-метил-1,2-оксазол-3-ил)-4-нитробензамида (824 мг).
ii) К раствору продукта, полученного на предыдущей стадии, (0,82 г) в этаноле (20 мл) добавляют SnCl2 (2,99 г). Реакционную смесь перемешивают в течение 1 часа при 70°C. После охлаждения до комнатной температуры реакционную смесь гасят выливанием ее в лед, и pH устанавливают 14 добавлением водного раствора 2M NaOH. Водный слой промывают этилацетатом, и объединенные органические слои промывают насыщенным раствором соли и сушат над MgSO4. Растворитель удаляют при пониженном давлении с получением 4-амино-N-метил-N-(5-метил-1,2-оксазол-3-ил)бензамида (687 мг). Продукт применяют на следующей стадии без дальнейшей очистки.
iii) К раствору продукта, полученного на предыдущей стадии, (45 мг), по каплям добавляют 2-[4-(этансульфонил)фенил]уксусную кислоту (54 мг) и ДМАП (5 мг) в CH2Cl2 (2 мл) при 0°C раствор ЭДКИ (45 мг) в CH2Cl2. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Органический слой промывают насыщенным водным раствором NaHCO3, водой, затем насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают на SiO2 с применением 1%-10% метанола в CH2Cl2в качестве элюента, с получением указанного в заголовке соединения 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-метил-N-(5-метил-1,2-оксазол-3-ил)бензамида (42 мг) в виде белого твердого вещества. МС(ЭР+) m/z 442,1 (M+H)+.
По методике, аналогичной описанной в примере 1, получают следующие соединения.
2: N-(1,3-диметил-1H-пиразол-5-ил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этилбензамид.

3: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-(3-метил-1,2-оксазол-5-ил)бензамид.

4: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-(5-метил-1,3,4-тиадиазол-2-ил)бензамид.

5: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(5-метил-1,2-оксазол-3-ил)-N-пропилбензамид.

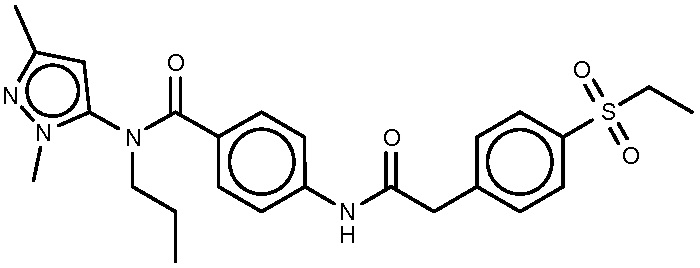
6: N-(1,3-диметил-1H-пиразол-5-ил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-пропилбензамид.
7: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-2-фтор-N-фенилбензамид.

8: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-3-фтор-N-фенилбензамид.

9: 2-хлор-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-фенилбензамид.

10: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-(1,2-оксазол-3-ил)бензамид.
11: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенил-N-(2,2,2-трифторэтил)бензамид.
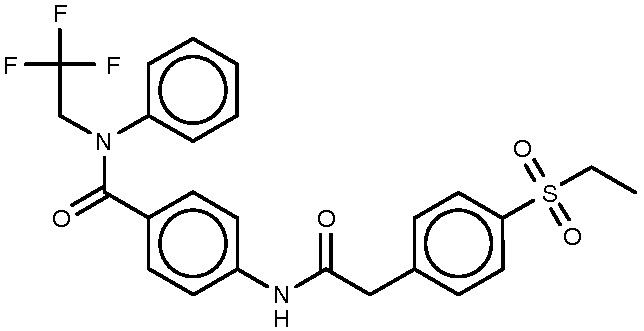
12: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-3-метил-N-фенилбензамид.

13: N-(4-метил-5-метил-1,3-тиазол-2-ил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этилбензамид.

14: N-(диметил-1,2-оксазол-4-ил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этилбензамид.

15: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-2-метил-N-фенилбензамид.

16: N-трет-бутил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенилбензамид.

17: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(4-метилфенил)-N-[2-(оксолан-2-ил)пропан-2-ил]бензамид.

18: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-[2-(оксолан-2-ил)пропан-2-ил]-N-фенилбензамид.

19: N-циклопропил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенилбензамид.
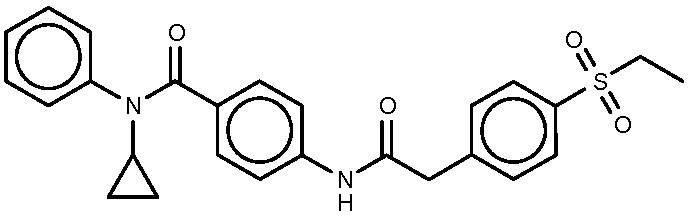
20: N-циклобутил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенилбензамид.

21: N-(3,3-дифторциклобутил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенилбензамид.

22: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-фенил-N-(1,1,1-трифторпропан-2-ил)бензамид.

23: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-метил-N-(пиридин-2-ил)бензамид.

i) К суспензии 4-аминобензойной кислоты (20 г) в метаноле (150 мл) добавляют концентрированную HCl (25 мл) и полученную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь гасят добавлением насыщенного водного раствора NaHCO3. Органический растворитель удаляют при пониженном давлении, и водный слой экстрагируют этилацетатом. Объединенные органические фазы промывают водой, насыщенным раствором соли, сушат над MgSO4 и концентрируют при пониженном давлении с получением метил 4-аминобензоата в виде беловатого твердого вещества (20 г). Продукт применяют на следующей стадии без дальнейшей очистки.
ii) По методике, аналогичной описанной в примере 1, стадия iii, с применением продукта, полученного на предыдущей стадии, (390 мг) и 2-[4-(этансульфонил)фенил]уксусной кислоты (500 мг) в качестве сходных материалов синтезируют метил 4-{2-[4-(этансульфонил)фенил]ацетамидо}бензоат (560 мг).
iii) К раствору продукта, полученного на предыдущей стадии, (560 мг) в этаноле добавляют водный раствор 2N NaOH (5 мл), и полученную смесь перемешивают в течение ночи при комнатной температуре. После добавления воды (100 мл) смесь промывают CH2Cl2 и подкисляют до pH=6 добавлением водного раствора 6M HCl. Осадок отфильтровывают, промывают водой и сушат при 40°C при пониженном давлении. Полученную 4-{2-[4-(этансульфонил)фенил]ацетамидо}бензойную кислоту (390 мг) применяют на следующей стадии без дальнейшей очистки.
iv) По методике, аналогичной описанной в примере1, стадия iii, с применением продукта, полученного на предыдущей стадии, (40 мг) и 2-(метиламино)пиридина (15 мг) в качестве исходных материалов, синтезируют метил 4-{2-[4-(этансульфонил)фенил]ацетамидо}бензоат (19 мг). МС(ЭР+) m/z 438,2 [M+H]+.
По методике, аналогичной описанной в примере 23, получают следующие соединения.
24: 6-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-фенилпиридин-3-карбоксамид.

25: N-бензил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-пропилбензамид.

26: N-бензил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-метилбензамид.

27: N-(циклопропилметил)-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-пропилбензамид.
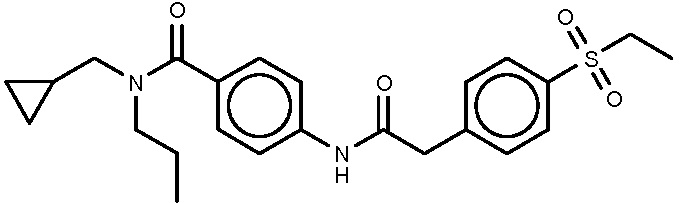
28: 2-[4-(этансульфонил)фенил]-N-[4-(1,2,3,4-тетрагидрохинолин-1-карбонил)фенил]ацетамид.
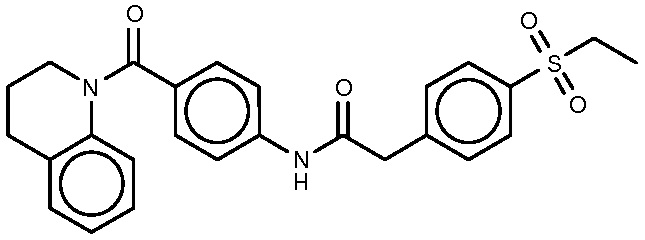
29: 2-[4-(этансульфонил)фенил]-N-[4-(2-фенилпирролидин-1-карбонил)фенил]ацетамид.

30: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-метил-N-фенилбензамид.
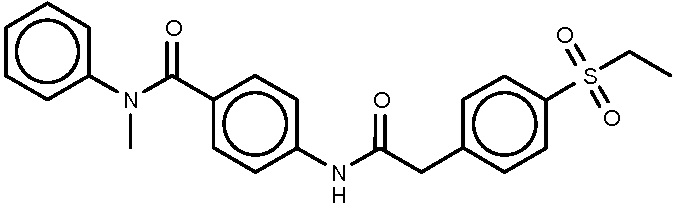
31: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-пропил-N-(пиридин-3-ил)бензамид.

32: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-(пиридин-3-ил)бензамид.

33: 2-[4-(этансульфонил)фенил]-N-[4-(2-фенилпиперидин-1-карбонил)фенил]ацетамид.

34: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-фенилбензамид.

35: N,N-дициклобутил-4-{2-[4-(этансульфонил)фенил]ацетамидо}бензамид.

36: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-этил-N-[(5-метил-1,2-оксазол-3-ил)метил]бензамид.

37: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(фуран-2-илметил)-N-метилбензамид.

38: N,N-дибензил-4-{2-[4-(этансульфонил)фенил]ацетамидо}бензамид.

39: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(оксолан-3-ил)-N-(пиридин-2-ил)бензамид.

40: N-циклопропил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(пиридин-2-ил)бензамид.

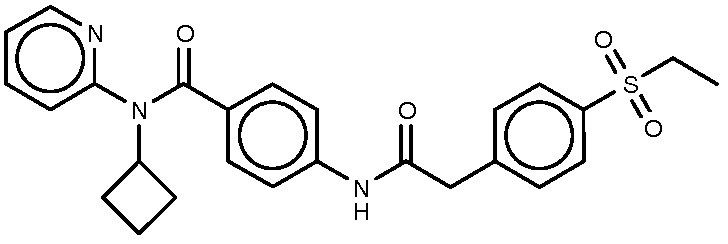
41: N-циклобутил-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(пиридин-2-ил)бензамид.
42: 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамид.

i) По методике, аналогичной описанной в примере 1, с применением подходящих исходных материалов, получают N-{1-[(трет-бутилдифенилсилил)окси]-2-метилпропан-2-ил}-4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(4-метилфенил)бензамид.
ii) Суспензию продукта, полученного на предыдущей стадии, (82 мг), и NH4F (41 мг) в метаноле (20 мл) перемешивают в течение ночи при 60°C. Реакционную смесь концентрируют в вакууме, и остаток растворяют в этилацетате. Этот раствор промывают водой, насыщенным раствором соли, сушат над сульфатом магния и концентрируют в вакууме. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения 4-{2-[4-(этансульфонил)фенил]ацетамидо}-N-(1-гидрокси-2-метилпропан-2-ил)-N-(4-метилфенил)бензамида (10 мг). МС(ЭР+) m/z 509,2 (M+H)+.
43: 4-{2-[6-(этансульфонил)пиридин-3-ил]ацетамидо}-N-этил-2-фтор-N-фенилбензамид.

i) К суспензии 2-бром-5-метилпиридина (10 г) в воде (70 мл) добавляют при комнатной температуре водный раствор 25% HCl, затем добавляют тиомочевину (9,6) до тех пор, пока реакционная смесь не станет прозрачным раствором. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 48 часов, в это время по каплям добавляют еще тиомочевину (7,3 г) до полного превращения. Реакционную смесь охлаждают до 0°C и гасят добавлением водного раствора 4N NaOH (51 мл). Полученный осадок растворяют в CH2Cl2 (200 мл) и органический слой промывают водой. Водный слой подкисляют до pH=3 и экстрагируют CH2Cl2 3 раза. Объединенные органические слои сушат над MgSO4 и концентрируют в вакууме. Остаток перекристаллизовывают из этанола с получением 5-метилпиридин-2-тиола (4,5 г) в виде белого твердого вещества.
ii) К суспензии продукта, полученного на предыдущей стадии, (2,3 г) и K2CO3 (600 мг) в ацетонитриле (45 мл) добавляют при комнатной температуре бромэтан (1,7 мл). После перемешивания в течение 17 часов реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт (2,8 г) очищают кислотно-основным экстрагированием. Органический слой сушат на MgSO4 и концентрируют при пониженном давлении с получением 2-(этилсульфанил)-5-метилпиридина (2,6 г)
iii) м-ХПБК (8,9 г) добавляют в ледяной раствор продукта, полученного на предыдущей стадии (2,6 г), в CH2Cl2 (75 мл). После перемешивания реакционной смеси на выходных при комнатной температуре, реакционную смесь фильтруют, и фильтрат промывают насыщенным водным раствором NaHCO3, водой и насыщенным раствором соли. Органический слой сушат на MgSO4 и концентрируют при пониженном давлении. Неочищенный продукт очищают на SiO2 с применением 0%-50% этилацетата в гептане в качестве элюента с получением 2-(этансульфонил)-5-метилпиридина (2,0 г) в виде белого твердого вещества.
iv) К раствору продукта, полученного на предыдущей стадии, (990 мг) в ацетонитриле (25 мл) добавляют NBS (950 мг) и АИБН (44 мг). Реакционную смесь перемешивают в течение 17 часов при температуре кипения с обратным холодильником в атмосфере азота. После охлаждения реакционную смесь фильтруют, и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают на SiO2 с применением 0%-50% этилацетата в гептане в качестве элюента с получением 5-(бромметил)-2-(этансульфонил)пиридина (817 мг).
v) Продукт, полученный на предыдущей стадии, (684 мг) добавляют в продуваемый азотом раствор триметилсилилцианида (486 мкл) и ФТБА (3375 мкл) в ацетонитриле (25 мл). Реакционную смесь перемешивают при 85°C в микроволновом реакторе в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь разбавляют 3 к 1 смесью CH2Cl2 и 2-пропанола. Полученную смесь промывают водой, насыщенным раствором соли, сушат на MgSO4, фильтруют и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают на SiO2 с применением 0%-70% этилацетата в гептане в качестве элюента с получением 2-[6-(этансульфонил)пиридин-3-ил]ацетонитрила (315 мг) в виде белого твердого вещества.
vi) К раствору продукта, полученного на предыдущей стадии, (315 мг) в этаноле (3 мл) добавляют 2N водный раствор NaOH. Реакционную смесь перемешивают в течение 2 часов в микроволновом реакторе при 100°C. После охлаждения до комнатной температуры реакционную смесь промывают CH2Cl2. Водный слой подкисляют до pH=3 и экстрагируют этилацетатом. Объединенные органические слои промывают водой, насыщенным раствором соли, сушат на MgSO4, фильтруют и концентрируют при пониженном давлении с получением 2-[6-(этансульфонил)пиридин-3-ил]уксусной кислоты в виде неочищенного продукта. Продукт применяют на следующей стадии без дальнейшей очистки.
vii) По методике, аналогичной описанной в примере 1, с применением продукта, полученного на предыдущей стадии, и подходящих исходных материалов получают указанное в заголовке соединение 4-{2-[6-(этансульфонил)пиридин-3-ил]ацетамидо}-N-этил-2-фтор-N-фенилбензамид (61 мг). МС(ЭР+) m/z 470,2 (M+H)+.
По методике, аналогичной описанной в примере 43, получают следующие соединения.
44: N-трет-бутил-4-{2-[6-(этансульфонил)пиридин-3-ил]ацетамидо}-N-фенилбензамид.

45: 2-хлор-4-{2-[6-(этансульфонил)пиридин-3-ил]ацетамидо}-N-этил-N-фенилбензамид.

Пример 46
RORγ GAL4 reporter gene assay
Ингибиторы из примеров 1-45 тестируют на способность ингибировать активность RORγ в анализе гена-репортера RORγ GAL4. Методика анализа и результаты описаны ниже.
Описание анализа гена-репортера RORγ GAL4
GAL4 одногибридная система репортера, применяющая люциферазное считывание разработана для определения ингибирования RORγ в клетках 293FT. Лиганд-связывающий RORγ домен (ЛСД) конденсируют с ДНК-связывающим доменом дрожжей GAL4 (ДСД) и помещают под контроль немедленно-раннего промотора цитомегаловируса человека (ЦМВ) с применением вектора экспрессии pFN26A (Promega) и стандартных методов клонирования рекомбинантной ДНК. В качестве контроля в анализе создают подобный вектор, в котором GAL4-ДСД конденсирован с белком 16 вируса простого герпеса (VP16), конститутивным транскрипционным активатором.
Для отслеживания ингибирующего действия соединений на RORγ применяют конструкцию транскрипционного репортера. Вектор pGL4.35 (Promega) содержит девять копий GAL4 активирующей последовательности (UAS). Эта последовательность управляет транскрипцией гена-репортера люциферазы luc2P в ответ на связывание слитого белка, содержащего GAL4 ДНК связывающий домен, такой как, например, экспрессируемый векторами экспрессии GAL4-RORγ-ЛСД и GAL4-VP16, описанными выше. Для того чтобы GAL4 слитый белок управлял экспрессией репортера люциферазы, вектор экспрессии pGL4.35 и подходящий вектор экспрессии GAL4 слитого белка массово трансфицируют в клетки 293FT с применением стандартных методов трансфекции.
Через день после трансфекции клетки помещают 96-луночные планшеты, добавляют тестируемое соединение и планшеты инкубируют в течение ночи. Затем активность люциферазы светляков количественно оценивают с применением реагента для определения люциферазы и считывания люминесцентности.
Подробное описание анализа
Клетки 293FT (Invitrogen) трансфицируют вектором экспрессии GAL4 слитого белка (как описано выше) и конструкцией транскрипционного репортера (pGL4.35, Promega). 60 мкл реагента трансфекции TransIT-293 (Mirus Bio) добавляют по каплям в 1500 мкл Opti-MEM I восстановленной сывороточной среды (Invitrogen) и инкубируют при комнатной температуре (КТ) в течение от 5 до 20 минут. 1500 мкл этого реагента добавляют к 5 мкг вектора экспрессии GAL4 слитого белка и 5 мкг конструкции транскрипционного репортера, и инкубируют при КТ в течение 20 минут.
Для сбора клеток 293FT из колбы T75, сначала культуральную среду убирают от клеток. Затем клетки промывают физиологическим раствором с фосфатным буфером (ФРФБ) (Lonza), затем ФРФБ удаляют. Для разъединения клеток 1 мл TrypLE Express (Invitrogen) добавляют в колбу, затем инкубируют при КТ до тех пор, пока клетки не начнут визуально разъединяться. Клетки собирают в 5 мл аналитической среды (культуральная среда DMEM (Lonza), 10% диализированного ФРФБ (Invitrogen) и Pen/Strep (Lonza)) для получения суспензии отдельных клеток. 10×106 клеток центрифугируют и ресуспендируют в 10 мл аналитической среды. Затем суспензию клеток добавляют в пробирку с трансфекционной смесью, и затем переносят как единое целое в колбу T75 (Greiner), затем инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Для скрининга соединения клетки собирают (как описано выше) и считают. 13×106 клетки центрифугируют, надосадочную жидкость отсасывают и клетки ресуспендируют в 17,3 мл аналитической среды с получением суспензии клеток 0,75×106 клеток/мл. 80 мкл суспензии клеток (60000 клеток) помещают на лунку в белые плоскодонные обработанные культурой тканей 96-луночные планшеты для скрининга (Greiner).
Тестируемые соединения разводят, начиная с 10 мМ исходного раствора диметилсульфоксида (ДМСО), до серийных разбавлений в ДМСО при 500× конечной тестируемой концентрации. Затем эти растворы разводят до 5× конечной тестируемой концентрации в две стадии с 10-кратным разведением в аналитической среде. Конечная концентрация ДМСО 5× раствора тестируемого соединения составляет 1%. 20 мкл 5× тестируемого соединения добавляют в каждую тестируемую лунку 96-луночного планшета, предварительно покрытого 80 мкл клеточной суспензии, с получением конечной тестируемой концентрации с 0,2% ДМСО.
Планшеты инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Для считывания люциферазы, люциферазный реагент (Britelite Plus, Perkin Elmer) доводят до КТ. В каждую тестируемую лунку планшетов для скрининга добавляют 100 мкл 2,5-кратно разведенного реагента Britelite Plus, затем инкубируют при КТ в течение 10 минут. Сигнал люциферазной люминесценции измеряют с применением микропланшетного ридера Wallac Victor Microplate Reader (Perkin Elmer).
Значения половины максимальной ингибирующей концентрации (IC50) для тестируемых соединений рассчитывают из сигнала люциферазы с применением программы GraphPad Prism (GraphPad Software).
Было найдено, что все представленные соединения формулы I (примеры 1-45) имеют средние значения pIC50 выше 5.
Было найдено, что примеры 1-22, 23-35, 37, 38 и примеры 40-44 имеют средние значения pIC50 выше или равные 6.
Было найдено, что примеры 2, 3, 5, 6, 7-9, 11, 13, 16-22, 25, 28, 30, 31, 33, 34, 38, 42 и 44 имеют средние значения pIC50 выше или равные 7.
Было найдено, что примеры 11, 13, 16, 18 и 34 имеют средние значения pIC50 выше или равные 8.
Пример 47
Анализ мононуклеарных клеток периферической крови (МКПК) ИЛ-17
Примеры ингибиторов 2, 5, 6, 11, 13, 16, 17, 18, 21 и 44 тестируют на способность ингибировать производство ИЛ-17A в анти-CD3/анти-CD28 стимулированных мононуклеарных клетках периферической крови (МКПК), выделенных из крови человека. Методика анализа и результаты описаны ниже.
Описание анализа МКПК ИЛ-17
Этот анализ разработан для измерения уровней ИЛ-17A, секретированного из анти-CD3/анти-CD28 стимулированных МКПК с целью измерения RORγ медиированного ингибирования производства ИЛ-17A.
Аналитическая среда состоит из 90% RPMI 1640 (Lonza), 10% термоинактивированной фетальной бычьей сыворотки (ФБС, Lonza) и 100 ед./мл раствора пенициллина/стрептомицина.
Описание анализа
Анта-CD3 антитело (BD Pharmingen) разводят до 10 мкг/мл в ФРФБ (Lonza). 30 мкл 10 мкг/мл раствора анти-CD3 добавляют во внутренние 60 лунок, исключая лунки с отрицательным контролем, 96-луночного обработанного культурой U-донного планшета (Greiner). Планшеты инкубируют в течение ночи (16-24 часов) при 37°C и 5% CO2.
Мононуклеарные клетки периферической крови отделяют из лейкоцитарной пленки (Sanquin) с применением среды для фракционирования Ficoll-Paque PREMIUM (GE Healthcare Life Sciences) согласно протоколу производителя и ресуспендируют в аналитической среде при 37°C.
Тестируемые соединения разводят, начиная с 10 мМ исходного раствора диметилсульфоксида (ДМСО), до серийных разведений в ДМСО при 200× конечной тестируемой концентрации. Затем эти растворы разводят в две стадии разведения в аналитической среде до 10x конечной тестируемой концентрации. Концентрация ДМСО 10× раствора тестируемого соединения составляет 5%.
Анти-CD28 антитело (BD Pharmingen) разводят до 20 мкг/мл в ФРФБ. МКПК разводят до концентрации 2,5×106 клеток/мл в аналитической среде при 37°C.
Для скрининга соединений покрытые анти-CD3 планшеты промывают три раза ФРФБ, лунки затем отсасывают с помощью вакуума. В каждую лунку для скрининга добавляют 80 мкл суспензии МКПК, 10 мкл раствора анти-CD28 и 10 мкл 10× раствора тестируемого соединения, с получением конечной тестируемой концентрации с 0,5% ДМСО. Все внешние лунки заполняют аналитической средой для предотвращения испарения. Планшеты инкубируют в течение 5 дней при 37°C и 5% CO2.
После инкубирования планшеты центрифугируют при 1500 об./мин в течение 4 минут, и надосадочную жидкость собирают. Затем уровни ИЛ-17A в надосадочных жидкостях определяют с помощью набора IL-17 ELISA (человеческий ИЛ-17 DuoSet, R&D systems) согласно протоколу производителя.
Значения половины максимальной ингибирующей концентрации (IC50) для тестируемых соединений рассчитывают из сигнала ИЛ-17A с применением программы GraphPad Prism (GraphPad Software).
Было найдено, что тестированные примеры 2, 5, 6, 11, 13, 16, 17, 18, 21 и 44 имеют средние значения pIC50 выше или равные 7.
Было найдено, что тестированные примеры 11 и 16 имеют средние значения pIC50 выше или равные 8.
Реферат
Изобретение относится к новым соединениям формулы I, а также фармацевтическим композициям на их основе. Технический результат: получены новые соединения, которые могут применяться в качестве ингибиторов RORγ, пригодные для лечения RORγ-опосредованных заболеваний или состояний. 2 н. и 18 з.п. ф-лы, 47 пр.(формула I)
Формула

Документы, цитированные в отчёте о поиске
Соединения, композиции и способы предупреждения метастазов раковых клеток

Комментарии