Соединения, композиции и способы предупреждения метастазов раковых клеток - RU2519123C2
Код документа: RU2519123C2
Чертежи








Описание
ПРИОРИТЕТ
В данной заявке заявлен приоритет к предварительной заявке на патент США, серийный номер 61/223260, поданной 6 июня 2009, полное описание этой заявки включено сюда в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Описаны соединения, которые предотвращают метастазы раковых опухолей и/или снижают рост опухоли. Также описаны композиции, особенно фармацевтические композиции, для предотвращения метастазов злокачественных опухолей и снижения роста опухолей. В понятие композиций включены композиции для комбинированной терапии для применения при лечении рака. Также описаны способы предотвращения метастазов раковых опухолей и других раковых клеток. Как таковые описанные соединения могут применяться для помощи при предотвращении роста опухоли у пациента, страдающего раком или у которого диагностирован рак.
УРОВЕНЬ ТЕХНИКИ
Одним из наиболее пугающих аспектов рака является его способность распространяться или давать метастазы. Изначально опухолевые клетки сгруппированы вместе, образуя одну или более опухолей. После формирования первичной опухоли раковые клетки приобретают способность отделяться от исходной опухоли и передвигаться в другие области тела. Клетки рака легкого, взятые в печени и образующие опухоли, все еще остаются клетками рака легкого. Таким образом, склонность одной конкретной формы рака давать метастазы зависит от многих факторов, включая тип рака; однако сам процесс того, как клетки начинают процесс образования метастазов, еще не понят до конца.
Если единичная локализованная опухоль обнаружена, до того, как она получает возможность давать метастазы, тогда прогноз выживания пациента лучше. Это возможно благодаря тому, что опухоль может быть эффективно иссечена или разрушена облучением или химиотерапией. Поэтому существует различие между ростом опухоли и метастазами опухолевых клеток; первое не всегда приводит ко второму. Рак, который дал метастазы, однако, трудноизлечим, так как степень распространения их в организме иногда не может быть определена.
Для того чтобы дать метастазы, раковая клетка должна оторваться от опухоли и попасть либо в кровоток, либо в лимфатическую систему. Затем свободные клетки переносятся в новые места, где они адаптируются. Хотя организм имеет природную защиту, которая препятствует выживанию клеток после отсоединения от их изначального местоположения, некоторые раковые клетки обладают способностью преодолевать такую защиту. Поэтому если остановить или значительно снизить метастазы, степень рака может быть определена, и затем заболевание лечат. Как таковое, лечение, применяемое после противораковой терапии, при которой опухоль удаляют оперативно, или подвергают радиационной терапии/химиотерапии, может включать лечение пациента агентами против метастазов. Уже давно существует потребность в способах предупреждения метастазов раковых клеток.
Рост первичной опухоли также затрудняет лечение. Если рост первичной опухоли проходит без контроля, исходная опухоль может вырасти до размера, который отрицательно влияет на функционирование органа в первичном месте и в близлежащих тканях. Метастазы первичной опухоли также вероятны, если рост первичной опухоли не контролируется. Существует необходимость в способах замедления или предотвращения роста опухоли.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описаны соединения, композиции и способы предупреждения метастазов раковых клеток. Также описаны соединения, композиции и способы, которые могут применяться при лечении рака, включая композиции для комбинированной терапии, где описанные соединения объединяют с одним или более лекарственными средствами для лечения рака или другими химиотерапевтическими агентами.
Другие преимущества описаны частично в представленном ниже описании, и частично становятся очевидными из описания или могут быть выявлены при практическом применении описанных ниже аспектов. Описанные ниже преимущества реализованы и достигнуты посредством элементов и комбинаций, особенно перечисленных в формуле изобретения. Должно быть понятно, что представленные общее описание и подробное описание являются примерными и объяснительными, но не ограничивающими.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фигуре 1 изображен график, показывающий повышение объема опухоли со временем на примере опухоли карциномы клеток почечного эпителия (Renca) у мышей; контрольный носитель (□); 100000 МЕ/дозу IL-2 два раза в сутки (◊); 40 мг/кг D91 два раза в сутки (Δ); 100000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (○).
На фигуре 2 показана гистограмма объема опухоли карциномы клеток почечного эпителия (Renca) у мышей на 25 день; контрольный носитель (A); 40 мг/кг D91 два раза в сутки (B); 100000 МЕ/дозу IL-2 два раза в сутки (C); 100000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (D).
На фигуре 3 изображен график, показывающий увеличение объема опухоли со временем на примере опухоли меланомы B16 у мышей; контрольный носитель (□); 300000 МЕ/дозу IL-2 два раза в сутки (◊); 300000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (○).
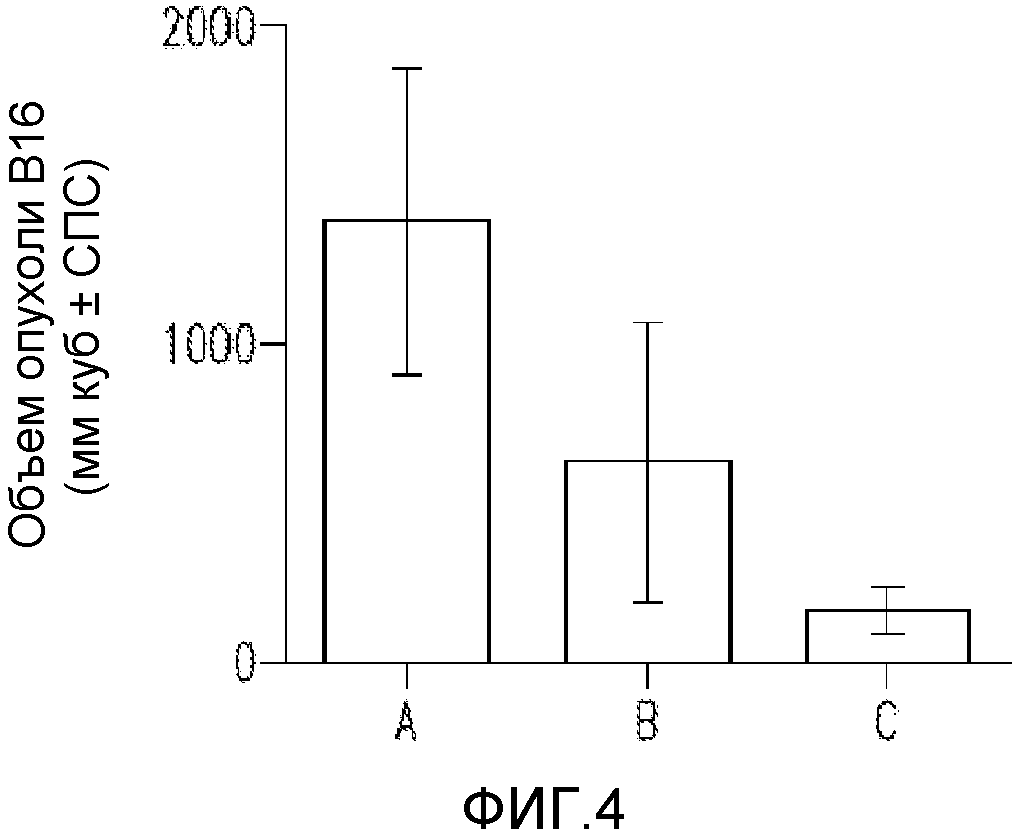
На фигуре 4 показана гистограмма объема опухоли меланомы B16 у мышей на 22 день; контрольный носитель (A); 300000 МЕ/дозу IL-2 два раза в сутки (B); 300000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (C).
На фигуре 5 изображен график массы тела мышей с опухолями меланомы B16; контрольный носитель (□); 100000 МЕ/дозу IL-2 два раза в сутки (◊); 300000 МЕ/дозу IL-2 два раза в сутки (Δ); 100000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (○); и 300000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (■).
На фигуре 6 изображен график, показывающий увеличение объема опухоли со временем на примере опухолей меланомы B16 у мышей; контрольный носитель (□); 100000 МЕ/дозу IL-2 два раза в сутки (◊); и 100000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (○).
На фигуре 7 изображена гистограмма объема опухолей меланомы B16 у мышей на 22 день; контрольный носитель (A); 100000 МЕ/дозу IL-2 два раза в сутки (B); и 100000 МЕ/дозу IL-2 и 40 мг/кг D91 два раза в сутки (C).
На фигуре 8 изображен график, показывающий увеличение объема опухоли со временем на примере опухолей меланомы B16 у мышей; контрольный носитель (□); и 40 мг/кг D91 два раза в сутки (○).
На фигуре 9 изображен размер опухоли поджелудочной железы, ортотопически имплантированной в NCr nu/nu мышам: контрольный носитель (◊); 100 мг/кг гемцитабина в.б. два раза в неделю (X); 150 мг/кг гемцитабина в.б. два раза в неделю (□); 20 мг/кг D91 два раза в сутки (○); 100 мг/кг гемцитабина в.б. два раза в неделю и 20 мг/кг D91 два раза в сутки (∗); и 150 мг/кг гемцитабина в.б. два раза в неделю и 20 мг/кг D91 два раза в сутки (Δ).
ПОДРОБНОЕ ОПИСАНИЕ
В данном описании и формуле изобретения представлено множество терминов, которые имеют следующие значения:
Все проценты, соотношения и пропорции являются массовыми, если не указано иначе. Все температуры даны в градусах Цельсия (°C), если не указано иначе.
Под "фармацевтически приемлемым" понимается материал, который не является биологически или другим образом нежелательным, т.е. материал может быть введен пациенту вместе с соответствующим активным соединением без оказания клинически неприемлемых биологических эффектов, или без неблагоприятного взаимодействия с любыми другими компонентами фармацевтической композиции, в которой он содержится.
В описании и формуле изобретения слово "содержать" и другие формы этого слова, такие как "содержащий" и "содержит", означают включение, но не ограничение и не исключение, например, других добавок, компонентов, целых чисел или стадий.
В данном описании и формуле изобретения единственное число существительного может включать множество обозначаемых существительных, если контекст четко не говорит обратное. Таким образом, например, "композиция" включает смеси двух или более таких композиций, "фенилсульфаминовая кислота" включает смеси двух или более таких фенилсульфаминовых кислот, "соединение" включает смеси двух или более таких соединений, и так далее.
"Необязательный" или "необязательно" означает, что описанное далее событие или обстоятельство может возникнуть или не возникнуть, и что описание включает случаи, когда событие или обстоятельство возникает, и случаи, когда не возникает.
Интервалы могут быть описаны в описании как от "около" одного конкретного значения и/или до "около" другого конкретного значения. Если такой интервал выражен, другой аспект включает от одного конкретного значения и/или до другого конкретного значения. Так же, если значения указаны как приблизительные, с применением антецедента "около," должно быть понятно, что конкретное значение образует другой аспект. Также должно быть понятно, что границы каждого интервала являются значимыми как в отношении другой границы, так и независимо от другой границы. Также должно быть понятно, что в описании описано множество значений, и что каждое значение также описано в описании как "около" этого конкретного значения в дополнение к самому значению. Например, если значение "10" описано как "около 10", оно также раскрыто. Также должно быть понятно, что "меньше или равно" значению, "больше или равно значению" и возможные интервалы между значениями также включены, что понятно специалисту в данной области техники. Например, если описано значение "10", то "меньше или равно 10" а также "больше или равно 10" также описаны. Также должно быть понятно, что представленные в описании данные представлены во множестве различных форматов, и что эти данные представляют конечные значения, начальные значения и интервалы для любого сочетания значений данных. Например, если описаны конкретное значение данного "10" и конкретное значение данного "15", понятно, также описаны значения больше, больше или равно, меньше, меньше или равно, и равно 10 и 15, и значения между 10 и 15. Также понятно, что каждая группа между двумя конкретными группами также описана. Например, если описаны 10 и 15, тогда также описаны 11, 12, 13 и 14.
В данном описании термины "управлять", "управляя" и "управление" относятся к благоприятным эффектам, получаемым пациентом при введении профилактического или терапевтического агента, которые не приводят к лечению заболевания или заболеваний. В определенных вариантах пациенту вводят один или более терапевтических или профилактических агентов для "управления" заболеванием, а также для предупреждения развития или ухудшения заболевания или заболеваний.
В данном описании термины "предотвращать", "предупреждать" и "предупреждение" относятся к способам предотвращения или предупреждения заболевания или расстройства, или задержки повторного проявления или наступления одного или более симптомов расстройства у пациента благодаря введению профилактического агента.
В данном описании термин "в сочетании" относится к применению одного или более из профилактических и/или терапевтических агентов. Применение термина "в сочетании" не ограничивает порядок, в котором вводят профилактические и/или терапевтические агенты пациенту с расстройством, например расстройством гиперпролиферации клеток, особенно, раком. Первый профилактический или терапевтический агент может вводиться до (например, за 1 минуту, за 5 минут, за 15 минут, за 30 минут, за 45 минут, за 1 час, за 2 часа, за 4 часа, за 6 часов, за 12 часов, за 24 часа, за 48 часов, за 72 часа, за 96 часов, за 1 неделю, за 2 недели, за 3 недели, за 4 недели, за 5 недель, за 6 недель, за 8 недель или за 12 недель), одновременно с, или после (например, через 1 минуту, через 5 минут, через 15 минут, через 30 минут, через 45 минут, через 1 час, через 2 часа, через 4 часа, через 6 часов, через 12 часов, через 24 часа, через 48 часов, через 72 часа, через 96 часов, через 1 неделю, через 2 недели, через 3 недели, через 4 недели, через 5 недель, через 6 недель, через 8 недель или через 12 недель) введения второго профилактического или терапевтического агента пациенту, который имел, имеет или у которого подозревают заболевание. Профилактические или терапевтические агенты вводят пациенту последовательно и с таким временным интервалом, чтобы агент в соответствии с данным изобретением мог действовать вместе с другим агентом с получением увеличенной пользы по сравнению с тем, если бы они вводились другим образом. Любой дополнительный профилактический или терапевтический агент может вводиться в любом порядке с другими дополнительными профилактическими или терапевтическими агентами.
В данном описании термины "вводить" в отношении дозы соединения означают однократную дозу или многократные дозы соединения.
В данном описании термин "лечение рака" означает любое лечение рака, известное в данной области техники, включающее, но не ограниченное ими, химиотерапию и радиационную терапию.
В данном описании "раковые клетки" означает клетки, полученные из опухолей, включая злокачественные опухоли, и клетки, умерщвленные in vitro. "Нормальные" клетки относятся к клеткам с нормальными характеристиками роста, которые не демонстрируют аномальной пролиферации.
В данном описании термины "пациент, у которого выявлен рак" и "пациент, страдающий раком" применяют взаимозаменяемо, и они относятся к пациенту, у которого был диагностирован рак. Существует множество хорошо известных методов идентификации пациентов с раком. В некоторых вариантах, диагностику рака проводят или подтверждают с применением визуализации ПЭТ. Некоторые варианты данного изобретения включают стадию идентификации пациентов, которые имеют рак.
В данном описании термин "терапевтически эффективное количество" относится к количеству активного агента или сочетания агентов, эффективному для облегчения или предупреждения симптомов, сокращения размера опухоли, или продления жизни лечимого пациента. Определение терапевтически эффективного количества находится в пределах компетенции специалиста в данной области техники, особенно в свете представленного в описании подробного описания.
В данном описании термин "ингибировать" или "ингибирование" относится к статистически значимому и измеряемому снижению активности, предпочтительно, снижению на, по крайней мере, около 10%, по сравнению с контролем, более предпочтительно, снижению на около 50% или более, еще более предпочтительно, снижению на около 80% или более.
В данном описании термин "повышение" или "улучшение" относится к статистически значимому и измеряемому увеличению активности, предпочтительно, увеличению на, по крайней мере, около 10%, по отношению к контролю, более предпочтительно, увеличению на около 50% или более, еще более предпочтительно, увеличению на около 80% или более.
Термин "предупреждать» или "предупреждение" при применении в отношении состояния, такого как местное повторное возникновение (например, боль), заболевания, такого как рак, комплекса синдромов, таких как сердечная недостаточность, или любого другого медицинского состояния, хорошо известен в данной области техники и включает введение композиции, которая снижает частоту, задерживает наступление симптомов медицинского состояния у пациента по сравнению с пациентом, который не получает композицию. Таким образом, профилактика рака включает, например, снижение количества определяемого роста рака у группы пациентов, получающих профилактическое лечение по сравнению с не леченной контрольной группой, и/или задержку определяемого роста рака у леченной группы по сравнению с не леченной контрольной группой, например, на статистически и/или клинически значимое количество. Профилактика инфекции включает, например, снижение количества диагнозов инфекции у леченной группы по сравнению с не леченной контрольной группой, и/или задержку наступления симптомов инфекции у леченной группы по сравнению с не леченной контрольной группой. Профилактика боли включает, например, снижение магнитуды или, альтернативно, задержку болевых ощущений, испытываемых пациентом, у леченной группы по сравнению с не леченной контрольной группой.
Термины "лечение", "лечить", "лечение" и подобные относятся к получению желаемого фармакологического и/или психологического эффекта. Эффект может быть профилактическим в смысле полного или частичного предупреждения заболевания или его симптома, и/или может быть терапевтическим в смысле частичного или полного излечивания заболевания и/или неблагоприятного действия, присущего заболеванию. "Лечение", в данном описании, охватывает любое лечение заболевания у млекопитающего, особенно человека, и включает: (a) профилактику возникновения заболевания у пациента, который может быть предрасположен к заболеванию, но у которого оно еще не диагностировано; (b) ингибирование заболевания, т.е. остановку его развития; и (c) ослабление заболевания, т.е. регрессию заболевания и/или ослабление одного или более симптомов заболевания. "Лечение" также охватывает доставку агента для получения фармакологического эффекта даже при отсутствии заболевания или состояния. Например, "лечение" охватывает доставку модулятора рецептора, который может давать улучшенное или желаемое действие у пациента (например, снижение патогенной нагрузки, благоприятное повышение физиологического параметра пациента, снижение болезненных симптомов и т.д.).
В данном описании представлены ссылки на различные публикации. Описания этих публикаций в полной мере включены в качестве ссылок в эту заявку для более полного описания известного уровня техники, к которому она относится. Описанные ссылки также индивидуально и специально включены в качестве ссылок, так как материал, содержащийся в них, обсуждается в предложении, к которому относится ссылка.
Представленная ниже химическая иерархия применяется в описании для описания и определения объема данного изобретения, и для конкретного указания и отчетливого определения пунктов формулы изобретения, которые включают соединения из данного описания, однако, если не указано иначе, применяемые в описании термины такие же, как приняты в данной области техники. Термин "гидрокарбил" описывает любую группу (органическую молекулу) на основе атома углерода, где указанные группы необязательно содержат одну или более органическую функциональную группу, включая неорганический атом, содержащий соли, кроме прочего, соли карбоксилата, соли четвертичного аммония. В широком смысле термин "гидрокарбил" включает классы "ациклический гидрокарбил" и "циклический гидрокарбил", где данные термины применяют для разделения гидрокарбильных групп на циклические и не циклические классы.
Так как они относятся к представленным ниже определениям, "циклические гидрокарбильные" группы могут содержать только атомы углерода в кольце (т.е. карбоциклические и арильные кольца) или могут содержать один или более гетероатомов в кольце (т.е. гетероциклическое и гетероарильное кольца). Для "карбоциклических" колец самое низкое число атомов углерода в кольце составляет 3 атома углерода; циклопропил. Для "арильных" колец самое низкое число атомов углерода в кольце составляет 6 атомов углерода; фенил. Для "гетероциклических" колец самое низкое число атомов углерода в кольце составляет 1 атом углерода; диазиринил. Этиленоксид содержит 2 атома углерода и является C2 гетероциклом. Для "гетероарильных" колец самое низкое число атомов углерода в кольце составляет 1 атом углерода; 1,2,3,4-тетразолил. Ниже представлено не ограничивающее описание терминов "ациклический гидрокарбил" и "циклический гидрокарбил", применяемое в описании.
A. Замещенный и незамещенный ациклический гидрокарбил:
Для целей данного описания термин "замещенный и незамещенный ациклический гидрокарбил" охватывает 3 категории групп:
1) линейный или разветвленный алкил, не ограничивающие примеры которого включают метил (C1), этил (C2), н-пропил (C3), изопропил (C3), н-бутил (C4), втор-бутил (C4), изобутил (C4), трет-бутил (C4) и подобные; замещенный линейный или разветвленный алкил, не ограничивающие примеры которого включают гидроксиметил (C1), хлорметил (C1), трифторметил (C1), аминометил (C1), 1-хлорэтил (C2), 2-гидроксиэтил (C2), 1,2-дифторэтил (C2), 3-карбоксипропил (C3) и подобные.
2) линейный или разветвленный алкенил, не ограничивающие примеры которого включают этенил (C2), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), бутен-4-ил (C4) и подобные; замещенный линейный или разветвленный алкенил, не ограничивающие примеры которого включают 2-хлорэтенил (также 2-хлорвинил) (C2), 4-гидроксибутен-1-ил (C4), 7-гидрокси-7-метилокт-4-ен-2-ил (C9), 7-гидрокси-7-метилокт-3,5-диен-2-ил (C9) и подобные.
3) линейный или разветвленный алкинил, не ограничивающие примеры которого включают этинил (C2), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3) и 2-метилгекс-4-ин-1-ил (C7); замещенный линейный или разветвленный алкинил, не ограничивающие примеры которого включают 5-гидрокси-5-метилгекс-3-инил (C7), 6-гидрокси-6-метилгепт-3-ин-2-ил (C8), 5-гидрокси-5-этилгепт-3-инил (C9) и подобные.
B. Замещенный и незамещенный циклический гидрокарбил:
Для целей данного описания термин "замещенный и незамещенный циклический гидрокарбил" охватывает 5 категорий групп:
1) Термин "карбоциклический" определен в описании как "включающий кольца, содержащие от 3 до 20 атомов углерода, где атомы, которые содержат такие кольца, ограничены атомами углерода, а также каждое кольцо может быть независимо замещено одной или более группами, способными замещать один или более атомов водорода." Представленные ниже не ограничивающие примеры "замещенных и незамещенных карбоциклических колец" охватывают следующие категории групп:
i) карбоциклические кольца, имеющие одно замещенное или незамещенное углеводородное кольцо, не ограничивающие примеры которых включают циклопропил (C3), 2-метилциклопропил (C3), циклопропенил (C3), циклобутил (C4), 2,3-дигидроксициклобутил (C4), циклобутенил (C4), циклопентил (C5), циклопентенил (C5), циклопентадиенил (C5), циклогексил (C6), циклогексенил (C6), циклогептил (C7), циклооктанил (C8), 2,5-диметилциклопентил (C5), 3,5-дихлорциклогексил (C6), 4-гидроксициклогексил (C6) и 3,3,5-триметилциклогекс-1-ил (C6);
ii) карбоциклические кольца, содержащие два или более замещенных или незамещенных конденсированных углеводородных колец, не ограничивающие примеры которых включают октагидропенталенил (C8), октагидро-1H-инденил (C9), 3a,4,5,6,7,7a-гексагидро-3H-инден-4-ил (C9), декагидроазуленил (C10);
iii) карбоциклические кольца, которые замещены или не замещены бициклическими углеводородными кольцами, не ограничивающие примеры которых включают бицикло[2.1.1]гексанил, бицикло[2.2.1]гептанил, бицикло[3.1.1]гептанил, 1,3-диметил[2.2.1]гептан-2-ил, бицикло[2.2.2]октанил и бицикло[3.3.3]ундеканил.
2) Термин "арил" определен в описании как "группы, включающие, по крайней мере, одно фенильное или нафтильное кольцо, и где не существует гетероарильных или гетероциклических колец, конденсированных с фенильным или нафтильным кольцом, а также каждое кольцо может быть независимо замещено одной или более группами, способными замещать один или более атомов водорода." Представленные ниже не ограничивающие примеры "замещенных и незамещенных арильных колец" охватывают следующие категории групп:
i) C6 или C10 замещенные или незамещенные арильные кольца; фенильные и нафтильные кольца, замещенные или незамещенные, не ограничивающие примеры которых включают фенил (C6), нафтилен-1-ил (C10), нафтилен-2-ил (C10), 4-фторфенил (C6), 2-гидроксифенил (C6), 3-метилфенил (C6), 2-амино-4-фторфенил (C6), 2-(N,N-диэтиламино)фенил (C6), 2-цианофенил (C6), 2,6-ди-трет-бутилфенил (C6), 3-метоксифенил (C6), 8-гидроксинафтилен-2-ил (C10), 4,5-диметоксинафтилен-1-ил (C10) и 6-цианонафтилен-1-ил (C10);
ii) C6 или C10 арильные кольца, конденсированные с 1 или 2 насыщенными кольцами с получением C8-C20 кольцевых систем, не ограничивающие примеры которых включают бицикло[4.2.0]окта-1,3,5-триенил (C8) и инданил (C9).
3) Термины "гетероциклический" и/или "гетероцикл" определены в описании как "группы, содержащие одно или более колец, имеющих от 3 до 20 атомов, где, по крайней мере, один атом в, по крайней мере, одном кольце является гетероатомом, выбранным из азота (N), кислорода (O) или серы (S), или смесей N, O и S, и где кольцо, которое содержит гетероатом, также не является ароматическим кольцом." Представленные ниже не ограничивающие примеры "замещенных и незамещенных гетероциклических колец" охватывают следующие категории групп:
i) гетероциклические группы, имеющие одно кольцо, содержащее один или более гетероатомов, не ограничивающие примеры которых включают диазиринил (C1), азиридинил (C2), уразолил (C2), азетидинил (C3), пиразолидинил (C3), имидазолидинил (C3), оксазолидинил (C3), изоксазолинил (C3), тиазолидинил (C3), изотиазолинил (C3), оксатиазолидинонил (C3), оксазолидинонил (C3), гидантоинил (C3), тетрагидрофуранил (C4), пирролидинил (C4), морфолинил (C4), пиперазинил (C4), пиперидинил (C4), дигидропиранил (C5), тетрагидропиранил (C5), пиперидин-2-онил (валеролакатам) (C5), 2,3,4,5-тетрагидро-1H-азепинил (C6), 2,3-дигидро-1H-индол (C8) и 1,2,3,4-тетрагидрохинолин (C9);
ii) гетероциклические группы, содержащие 2 или более колец, одно из которых является гетероциклическим кольцом, не ограничивающие примеры которых включают гексагидро-1Н-пирролизинил (C7), 3a,4,5,6,7,7a-гексагидро-1Н-бензо[d]имидазолил (C7), 3a,4,5,6,7,7a-гексагидро-1Н-индолил (C8), 1,2,3,4-тетрагидрохинолинил (C9) и декагидро-1Н-циклоокта[b]пирролил (C10).
4) Термин "гетероарил" определен в описании как "охватывающий одно или более колец, содержащих от 5 до 20 атомов, где, по крайней мере, один атом в, по крайней мере, одном кольце является гетероатомом, выбранным из азота (N), кислорода (O) или серы (S), или смесей N, O и S, и где, по крайней мере, одно кольцо, которое содержит гетероатом, является ароматическим кольцом." Следующие не ограничивающие примеры "замещенных и незамещенных гетероциклических колец" охватывают следующие категории групп:
i) гетероарильные кольца, содержащие одно кольцо, не ограничивающие примеры которых включают 1,2,3,4-тетразолил (C1), [1,2,3]триазолил (C2), [1,2,4]триазолил (C2), триазинил (C3), тиазолил (C3), 1Н-имидазолил (C3), оксазолил (C3), изоксазолил (C3), изотиазолил (C3), фуранил (C4), тиофенил (C4), пиримидинил (C4), 2-фенилпиримидинил (C4), пиридинил (C5), 3-метилпиридинил (C5) и 4-диметиламинопиридинил (C5);
ii) гетероарильные кольца, содержащие 2 или более конденсированных колец, одно из которых является гетероарильным кольцом, не ограничивающие примеры которых включают 7H-пуринил (C5), 9H-пуринил (C5), 6-амино-9H-пуринил (C5), 5H-пирроло[3,2-d]пиримидинил (C6), 7H-пирроло[2,3-d]пиримидинил (C6), пиридо[2,3-d]пиримидинил (C7), 2-фенилбензо[d]тиазолил (C7), 1H-индолил (C8), 4,5,6,7-тетрагидро-1-H-индолил (C8), хиноксалинил (C8), 5-метилхиноксалинил (C8), хиназолинил (C8), хинолинил (C9), 8-гидроксихинолинил (C9) и изохинолинил (C9).
5) C1-C6связанные циклические гидрокарбильные группы (карбоциклические группы, C6 или C10 арильные группы, гетероциклические группы или гетероарильные группы), которые связаны с другой группой, группой или сердцевиной молекулы через C1-C6алкиленовую группу. Не ограничивающие примеры связанных циклических гидрокарбильных групп включают бензил C1-(C6), имеющий формулу:

где Ra является необязательно одним или более независимо выбранными заместителями водорода. Другие примеры включают другие арильные группы, кроме прочего, (2-гидроксифенил)гексил C6-(C6); нафталин-2-илметил C1-(C10), 4-фторбензил C1-(C6), 2-(3-гидроксифенил)этил C2-(C6), а также замещенные и незамещенные C3-C10 алкиленкарбоциклические группы, например циклопропилметил C1-(C3), циклопентилэтил C2-(C5), циклогексилметил C1-(C6); в эту категорию также включены замещенные и незамещенные C1-C10 алкилен-гетероарильные группы, например 2-пиколил C1-(C6) группа, имеющая формулу:

где Ra такой, как определен выше. Кроме того, C1-C12 связанные циклические гидрокарбильные группы включают C1-C10 алкиленгетероциклические группы и алкилен-гетероарильные группы, не ограничивающие примеры которых включают азиридинилметил C1-(C2) и оксазол-2-илметил C1-(C3).
Для целей данного изобретения карбоциклические кольца содержат от C3 до C20; арильные кольца содержат C6 или C10; гетероциклические кольца содержат от C1 до C9; и гетероарильные кольца содержат от C1 до C9.
Для целей данного изобретения и для однородности описания данного изобретения, конденсированные кольцевые группы, а также спироциклические кольца, бициклические кольца и подобные, которые содержат один гетероатом, характеризуются и обозначены в описании как входящие в циклическое семейство, соответствующее кольцу, содержащему гетероатом, хотя специалист в данной области техники может давать альтернативные характеристики. Например, 1,2,3,4-тетрагидрохинолин, имеющий формулу:

для целей данного описания считается гетероциклической группой. 6,7-Дигидро-5H-циклопентапиримидин, имеющий формулу:

для целей данного описания считается гетероарильной группой. Если конденсированное кольцо содержит гетероатомы в насыщенном кольце (гетероциклическое кольцо) и арильном кольце (гетероарильное кольцо), арильное кольцо будет преобладать и определять тип категории, к которой кольцо принадлежит для целей описания данного изобретения. Например, 1,2,3,4-тетрагидро-[1,8]нафтпиридин, имеющий формулу:

для целей данного изобретения считается гетероарильной группой.
Термин "замещенный" применяют во всем описании. Термин "замещенный" применяют к группам, описанным в описании как "замещенная группа или часть является гидрокарбильной группой или частью, ациклической или циклической, которая содержит один или более атомов водорода, замещенных заместителем или несколькими заместителями, определенными ниже." Группы, замещающие атомы водорода, способны замещать один атом водорода, два атома водорода или три атома водорода гидрокарбильной группы одновременно. Кроме того, эти заместители могут замещать два атома водорода на двух соседних атомах углерода с получением указанного заместителя, новой группы или группы. Например, замещенная группа, которая требует одной замены атома водорода, включает галоген, гидроксил и подобные. Замещение двух атомов водорода включает карбонил, оксимино и подобные. Замещение двух атомов водорода соседних атомов углерода включает эпокси и подобные. Замещение трех атомов водорода включает циано и подобные. Термин «замещенный» применяется в данном описании для того, чтобы обозначить то, что гидрокарбильная группа, кроме прочего, ароматическое кольцо, алкильная цепь; может иметь один или более атомов водорода, замещенных заместителем. Если группа описана как "замещенная", может быть замещено любое число атомов водорода. Например, 4-гидроксифенил является "замещенным ароматическим карбоциклическим кольцом (арильным кольцом)", (N,N-диметил-5-амино)октанил является "замещенной C3 линейной алкильной группой", 3-гуанидинопропил является "замещенной C3 линейной алкильной группой" и 2-карбоксипиридинил является "замещенной гетероарильной группой."
Далее представлены не ограничивающие примеры групп, которые могут быть заместителями атомов водорода на карбоциклической, арильной, гетероциклической или гетероарильной группах:
i) C1-C12 линейный, разветвленный или циклический алкил, алкенил и алкинил; метил (C1), этил (C2), этенил (C2), этинил (C2), н-пропил (C3), изопропил (C3), циклопропил (C3), 3-пропенил (C3), 1-пропенил (также 2-метилэтенил) (C3), изопропенил (также 2-метилэтен-2-ил) (C3), проп-2-инил (также пропаргил) (C3), пропин-1-ил (C3), н-бутил (C4), втор-бутил (C4), изобутил (C4), трет-бутил (C4), циклобутил (C4), бутен-4-ил (C4), циклопентил (C5), циклогексил (C6);
ii) замещенный или незамещенный C6 или C10 арил; например, фенил, нафтил (также обозначенный в описании как нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенный или незамещенный C6 или C10 алкиленарил; например, бензил, 2-фенилэтил, нафтилен-2-илметил;
iv) замещенные или незамещенные C1-C9 гетероциклические кольца; такие как описано ниже;
v) замещенные или незамещенные C1-C9 гетероарильные кольца; такие как описано ниже;
vi) -(CR102aR102b)aOR101; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR102aR102b)aC(O)R101; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR102aR102b)aC(O)OR101; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
ix) -(CR102aR102b)aC(O)N(R101)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR102aR102b)aN(R101)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галоген; -F, -Cl, -Br и -I;
xii) -(CR102aR102b)aCN;
xiii) -(CR102aR102b)aNO2;
xiv) -CHjXk; где X является галогеном, индекс j равен целому числу от 0 до 2, j+k=3; например, -CH2F, -CHF2, -CF3, -CCl3 или -CBr3;
xv) -(CR102aR102b)aSR101; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR102aR102b)aSO2R101; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR102aR102b)aSO3R101; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R101 независимо является водородом, замещенным или незамещенным C1-C6 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или две группы R101 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R102a и R102b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс "a" равен от 0 до 4.
Для целей данного изобретения термины "соединение," "аналог" и "композиция вещества" являются равнозначными и применяются взаимозаменяемо в описании. Описанные соединения включают все энантиомерные формы, диастереомерные формы, соли и подобные.
Описанные в описании соединения включают все формы солей, например соли обеих щелочных групп, кроме прочего, амины, а также соли кислотных групп, кроме прочего, карбоновых кислот. Далее представлены не ограничивающие примеры анионов, которые могут образовывать соли с протонированными щелочными группами: хлорид, бромид, йодид, сульфат, бисульфат, карбонат, бикарбонат, фосфат, формиат, ацетат, пропионат, бутират, пируват, лактат, оксалат, малонат, малеат, сукцинат, тартрат, фумарат, цитрат и подобные. Далее представлены не ограничивающие примеры катионов, которые могут образовывать соли кислотных групп: аммоний, натрий, литий, калий, кальций, магний, висмут, лизин и подобные.
Описанные соединения имеют формулу (I):

где атом углерода, несущий аминогруппу, имеет (S) стереохимию, как показано в следующей формуле:

Группы, которые содержат R и Z, могут содержать группы, имеющие любую конфигурацию и, как таковые, описанные соединения могут быть одинарными энантиомерами, диастереомерными парами или их сочетаниями. Кроме того, соединения могут быть выделены в виде солей или гидратов. В случае солей, соединения могут содержать более одного катиона или аниона. В случае гидратов, может присутствовать любое количество молекул воды, или их фракционной части (например, менее 1 молекулы воды присутствует на каждую молекулу аналога).
R Группы
R является замещенным или незамещенным тиазолилом, имеющим формулу:

R2, R3 и R4 являются заместителями, которые могут быть независимо выбраны из широкого множества групп, содержащих атомы не углерода (например, водород, гидроксил, амино, галоген, нитро и подобные) или органические заместители, такие как замещенный и незамещенный ациклический гидрокарбил и циклический гидрокарбил, описанные в описании. Группы, содержащие углерод, могут содержать от 1 до 12 атомов углерода, или от 1 до 10 атомов углерода, или от 1 до 6 атомов углерода.
Пример соединений формулы (I) включает соединения, где R группами являются тиазол-2-ильные группы, имеющие формулу:

где R2 и R3 каждый независимо выбирают из:
i) водорода;
ii) замещенного или незамещенного C1-C6 линейного, разветвленного или циклического алкила;
iii) замещенного или незамещенного C2-C6 линейного, разветвленного или циклического алкенила;
iv) замещенного или незамещенного C2-C6 линейного или разветвленного алкинила;
v) замещенного или незамещенного C6 или C10 арила;
vi) замещенного или незамещенного C1-C9 гетероарила;
vii) замещенного или незамещенного C1-C9 гетероцикла; или
viii) R2 и R3 могут быть взяты вместе с получением насыщенного или ненасыщенного кольца, имеющего от 5 до 7 атомов; где от 1 до 3 атомов могут быть необязательно гетероатомами, выбранными из кислорода, азота и серы.
Ниже представлены не ограничивающие примеры групп, которые могут замещать один или более атомов водорода на группах R2 и R3 группы. Следующие заместители, а также другие, которые не описаны, выбирают независимо из:
i) C1-C9 линейного, разветвленного или циклического алкила, алкенила и алкинила; метила (C1), этила (C2), этенила (C2), этинила (C2), н-пропила (C3), изопропила (C3), циклопропила (C3), 3-пропенила (C3), 1-пропенила (также 2-метилэтенила) (C3), изопропенила (также 2-метилэтен-2-ила) (C3), проп-2-инила (также пропаргила) (C3), пропин-1-ила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), циклобутила (C4), бутен-4-ила (C4), циклопентила (C5), циклогексила (C6);
ii) замещенного или незамещенного C6 или C10 арила; например, фенила, нафтила (также обозначенного как нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенного или незамещенного C6 или C10 алкиленарила; например, бензила, 2-фенилэтила, нафтилен-2-илметила;
iv) замещенных или незамещенных C1-C9 гетероциклических колец; таких, как описаны в описании;
v) замещенных или незамещенных C1-C9 гетероарильных колец; таких, как описаны в описании;
vi) -(CR21aR21b)pOR20; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)pC(O)R20; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR21aR21b)pC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
x) -(CR21aR21b)pC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR21aR21b)pN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галогена; -F, -Cl, -Br и -I;
xii) -(CR21aR21b)pCN;
xiii) -(CR21aR21b)pNO2;
xiv) -(CHj'Xk')hCHjXk; где X является галогеном, индекс j равен целому числу от 0 до 2, j+k=3, индекс j' равен целому числу от 0 до 2, j'+k'=2, индекс h равен от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)pSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)pSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR21aR21b)pSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R20 независимо является водородом, замещенным или незамещенным C1-C4 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или две R20 группы могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс p равен от 0 до 4.
Пример соединений формулы (I) включает группы R, имеющие формулу:

где R3 является водородом и R2 является группой, выбранной из метила (C1), этила (C2), н-пропила (C3), изопропила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), н-пентила (C5), 1-метилбутила (C5), 2-метилбутила (C5), 3-метилбутила (C5), циклопропила (C3), н-гексила (C6), 4-метилпентила (C6) и циклогексила (C6).
Другой пример соединений формулы (I) включает группы R, имеющие формулу:

где R2 является группой, выбранной из метила (C1), этила (C2), н-пропила (C3), изопропила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4) и трет-бутила (C4); и R3 является группой, выбранной из метила (C1) или этила (C2). Не ограничивающие примеры этого аспекта R включают 4,5-диметилтиазол-2-ил, 4-этил-5-метилтиазол-2-ил, 4-метил-5-этилтиазол-2-ил и 4,5-диэтилтиазол-2-ил.
Другой пример соединений формулы (I) включает группы R, где R3 является водородом и R2 является замещенной алкильной группой, где указанные замещения выбирают из:
i) галогена: -F, -Cl, -Br и -I;
ii) -N(R11)2; и
iii) -OR11;
где каждый R11 независимо является водородом или C1-C4 линейным или разветвленным алкилом. Не ограничивающие примеры групп, которые могут быть заместителями R2 или R3 атома водорода в группах R, включают - CH2F, -CHF2, -CF3, -CH2CF3, -CH2CH2CF3, -CH2Cl, -CH2OH, -CH2OCH3, -CH2CH2OH, -CH2CH2OCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2 и -CH2NH(CH2CH3).
Другие не ограничивающие примеры групп, которые могут быть заместителями R2 или R3 атома водорода на группах R, включают 2,2-дифторциклопропил, 2-метоксициклогексил и 4-хлорциклогексил.
В другом примере соединений формулы (I), R группы включают группы, где R3 является водородом и R2 является фенилом или замещенным фенилом, где не ограничивающие примеры групп R2 включают фенил, 3,4-диметилфенил, 4-трет-бутилфенил, 4-циклопропилфенил, 4-диэтиламинофенил, 4-(трифторметил)фенил, 4-метоксифенил, 4-(дифторметокси)фенил, 4-(трифторметокси)фенил, 3-хлорфенил, 4-хлорфенил и 3,4-дихлорфенил, которые, при включении в определение R, дают следующие R группы: 4-фенилтиазол-2-ил, 3,4-диметилфенилтиазол-2-ил, 4-трет-бутилфенилтиазол-2-ил, 4-циклопропилфенилтиазол-2-ил, 4-диэтиламинофенилтиазол-2-ил, 4-(трифторметил)фенилтиазол-2-ил, 4-метоксифенилтиазол-2-ил, 4-(дифторметокси)фенилтиазол-2-ил, 4-(трифторметокси)фенилтиазол-2-ил, 3-хлорфенилтиазол-2-ил, 4-хлорфенилтиазол-2-ил и 3,4-дихлорфенилтиазол-2-ил.
Еще один пример соединений формулы (I) включает группы R, где R2 выбирают из водорода, метила, этила, н-пропила и изопропила, и R3 является фенилом или замещенным фенилом. Не ограничивающий пример группы R в соответствии с пятым аспектом первой категории групп R включает 4-метил-5-фенилтиазол-2-ил и 4-этил-5-фенилтиазол-2-ил.
Другой пример соединений формулы (I) включает группы R, где R3 является водородом и R2 является замещенной или незамещенной гетероарильной группой, выбранной из 1,2,3,4-тетразол-1-ил, 1,2,3,4-тетразол-5-ил, [1,2,3]триазол-4-ил, [1,2,3]триазол-5-ил, [1,2,4]триазол-4-ил, [1,2,4]триазол-5-ил, имидазол-2-ил, имидазол-4-ил, пиррол-2-ил, пиррол-3-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, [1,2,4]оксадиазол-3-ил, [1,2,4]оксадиазол-5-ил, [1,3,4]оксадиазол-2-ил, фуран-2-ил, фуран-3-ил, тиофен-2-ил, тиофен-3-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, [1,2,4]тиадиазол-3-ил, [1,2,4]тиадиазол-5-ил и [1,3,4]тиадиазол-2-ил.
Другие не ограничивающие примеры соединений формулы (I) включают группы R, где R2 является замещенным или незамещенным тиофен-2-илом, например тиофен-2-илом, 5-хлортиофен-2-илом и 5-метилтиофен-2-илом.
Еще один пример соединений формулы (I) включает группы R, где R2 является замещенным или не замещенным тиофен-3-илом, например тиофен-3-илом, 5-хлортиофен-3-илом и 5-метилтиофен-3-илом.
Другой пример соединений формулы (I) включает группы R, где R2 и R3 берут вместе с образованием насыщенного или ненасыщенного кольца, содержащего от 5 до 7 атомов. Не ограничивающие примеры шестого аспекта первой категории групп R включают 5,6-дигидро-4H-циклопента[d]тиазол-2-ил и 4,5,6,7-тетрагидробензо[d]тиазол-2-ил.
Другие примеры соединений формулы (I) включают группы R, которые являются группами тиазол-4-ила, имеющими формулу:

где R4 является группой, выбранной из:
i) водорода;
ii) замещенного или незамещенного C1-C6 линейного, разветвленного или циклического алкила;
iii) замещенного или незамещенного C2-C6 линейного, разветвленного или циклического алкенила;
iv) замещенного или незамещенного C2-C6 линейного или разветвленного алкинила;
v) замещенного или незамещенного C6 или C10 арила;
vi) замещенного или незамещенного C1-C9 гетероарила; или
vii) замещенного или незамещенного C1-C9 гетероцикла.
Далее представлены не ограничивающие примеры групп, которые могут замещать один или более атомов водорода в группах R4. Представленные ниже заместители, а также другие, не описанные в описании, независимо выбирают из:
i) C1-C12 линейного, разветвленного или циклического алкила, алкенила и алкинила; метила (C1), этила (C2), этенила (C2), этинила (C2), н-пропила (C3), изопропила (C3), циклопропила (C3), 3-пропенила (C3), 1-пропенила (также 2-метилэтенила) (C3), изопропенила (также 2-метилэтен-2-ила) (C3), проп-2-инила (также пропаргила) (C3), пропин-1-ила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), циклобутила (C4), бутен-4-ила (C4), циклопентила (C5), циклогексила (C6);
ii) замещенного или незамещенного C6 или C10 арила; например, фенила, нафтила (также названного в описании нафтилен-1-илом (C10) или нафтилен-2-илом (C10));
iii) замещенного или незамещенного C6 или C10 алкиленарила; например, бензила, 2-фенилэтила, нафтилен-2-илметила;
iv) замещенного или незамещенного C1-C9 гетероциклического кольца; как описано ниже;
v) замещенного или незамещенного C1-C9 гетероарильного кольца; как описано ниже;
vi) -(CR21aR21b)pOR20; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)pC(O)R20; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR21aR21b)pC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
xi) -(CR21aR21b)pC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR21aR21b)pN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галогена; -F, -C1, -Br и -I;
xii) -(CR21aR21b)pCN;
xiii) -(CR21aR21b)pNO2;
xiv) -(CHj'Xk')hCHjXk; где X является галогеном, индекс j равен целому числу от 0 до 2, j+k=3, индекс j' равен целому числу от 0 до 2, j'+k'=2, индекс h равен от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)pSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)pSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR21aR21b)pSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R20 независимо является водородом, замещенным или незамещенным C1-C4 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или две группы R20 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс p равен от 0 до 4.
Пример соединений формулы (I) включает группы R, где R4 является водородом.
Другой пример соединений формулы (I) включает группы R, где R4 является группой, выбранной из метила (C1), этила (C2), н-пропила (C3), изопропила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4) и трет-бутила (C4). Не ограничивающие примеры этого аспекта R включают 2-метилтиазол-4-ил, 2-этилтиазол-4-ил, 2-(н-пропил)тиазол-4-ил и 2-(изопропил)тиазол-4-ил.
Еще один пример соединений формулы (I) включает группы R, где R4 является замещенным или незамещенным фенилом, не ограничивающие примеры которого включают фенил, 2-фторфенил, 2-хлорфенил, 2-метилфенил, 2-метоксифенил, 3-фторфенил, 3-хлорфенил, 3-метилфенил, 3-метоксифенил, 4-фторфенил, 4-хлорфенил, 4-метилфенил и 4-метоксифенил.
Еще один пример соединений формулы (I) включает группы R, где R4 является замещенным или незамещенным гетероарилом, не ограничивающие примеры которого включают тиофен-2-ил, тиофен-3-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, 2,5-диметилтиазол-4-ил, 2,4-диметилтиазол-5-ил, 4-этилтиазол-2-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил и 3-метил-1,2,4-оксадиазол-5-ил.
Другой пример 5-членного кольца группы R включает замещенные или незамещенные имидазолильные группы, имеющие формулу:

Один пример имидазолильных групп R включает имидазол-2-ильные группы, имеющие формулу:

где R2 и R3 каждый независимо выбирают из:
i) водорода;
ii) замещенного или незамещенного C1-C6 линейного, разветвленного или циклического алкила;
iii) замещенного или незамещенного C2-C6 линейного, разветвленного или циклического алкенила;
iv) замещенного или незамещенного C2-C6 линейного или разветвленного алкинила;
v) замещенного или незамещенного C6 или C10 арила;
vi) замещенного или незамещенного C1-C9 гетероарила;
vii) замещенного или незамещенного C1-C9 гетероцикла; или
viii) R2 и R3 могут быть взяты вместе с получением насыщенного или ненасыщенного кольца, имеющего от 5 до 7 атомов; где от 1 до 3 атомов необязательно могут быть гетероатомами, выбранными из кислорода, азота и серы.
Далее представлены не ограничивающие примеры групп, которые могут замещать один или более атомов водорода в группах R2 и R3. Представленные ниже заместители, а также другие, не описанные в описании, каждый независимо выбирают из:
i) C1-C12 линейного, разветвленного или циклического алкила, алкенила и алкинила; метила (C1), этила (C2), этенила (C2), этинила (C2), н-пропила (C3), изопропила (C3), циклопропила (C3), 3-пропенила (C3), 1-пропенила (также 2-метилэтенила) (C3), изопропенила (также 2-метилэтен-2-ила) (C3), проп-2-инила (также пропаргила) (C3), пропин-1-ила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), циклобутила (C4), бутен-4-ила (C4), циклопентила (C5), циклогексила (C6);
ii) замещенного или незамещенного C6 или C10 арила; например, фенила, нафтила (также обозначенного как нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенного или незамещенного C6 или C10 алкиленарила; например, бензила, 2-фенилэтила, нафтилен-2-илметила;
iv) замещенного или незамещенного C1-C9 гетероциклического кольца; как описано ниже;
v) замещенного или незамещенного C1-C9 гетероарильного кольца; как описано ниже;
vi) -(CR21aR21b)zOR20; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR21aR21b)zC(O)R20; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR21aR21b)zC(O)OR20; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
xii) -(CR21aR21b)zC(O)N(R20)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR21aR21b)zN(R20)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галогена; -F, -C1, -Br и -I;
xii) -(CR21aR21b)zCN;
xiii) -(CR21aR21b)zNO2;
xiv) -(CHj'Xk')hCHjXk; где X является галогеном, индекс j равен целому числу от 0 до 2, j+k=3, индекс j' равен целому числу от 0 до 2, j'+k'=2, индекс h равен от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR21aR21b)zSR20; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR21aR21b)zSO2R20; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR21aR21b)zSO3R20; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R20 независимо является водородом, замещенным или незамещенным C1-C4 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или два R20 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R21a и R21b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс p равен от 0 до 4.
Один пример групп R включает соединения, где группы R имеют формулу:
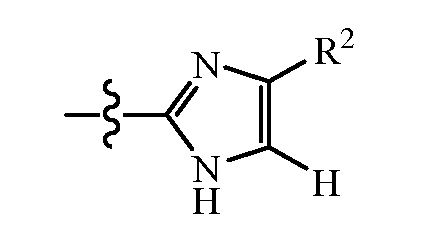
где R3 является водородом и R2 является группой, выбранной из метила (C1), этила (C2), н-пропила (C3), изопропила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4) и трет-бутила (C4).
Другой пример групп R включает соединения, где R2 является группой, выбранной из метила (C1), этила (C2), н-пропила (C3), изопропила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4) и трет-бутила (C4); и R3 является группой, выбранной из метила (C1) или этила (C2). Не ограничивающие примеры этого аспекта R включает 4,5-диметилимидазол-2-ил, 4-этил-5-метилимидазол-2-ил, 4-метил-5-этилимидазол-2-ил и 4,5-диэтилимидазол-2-ил.
Пример групп R включает соединения, где R3 является водородом и R2 является замещенным алкилом, где указанные заместители выбирают из:
i) галогена: -F, -C1, -Br и -I;
ii) -N(R11)2; и
iii) -OR11;
где каждый R11 независимо является водородом или C1-C4 линейным или разветвленным алкилом.
Не ограничивающие примеры групп, составляющих этот вариант R, включают: -CH2F, -CHF2, -CF3, -CH2CF3, -CH2Cl, -CH2OH, -CH2OCH3, -CH2CH2OH, -CH2CH2OCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2 и -CH2NH(CH2CH3).
Еще один пример групп R включает группы, где R3 является водородом и R2 является фенилом.
Еще один пример групп R включает группы, где R3 является водородом и R2 является гетероарильной группой, выбранной из 1,2,3,4-тетразол-1-ила, 1,2,3,4-тетразол-5-ила, [1,2,3]триазол-4-ила, [1,2,3]триазол-5-ила, [1,2,4]триазол-4-ила, [1,2,4]триазол-5-ила, имидазол-2-ила, имидазол-4-ила, пиррол-2-ила, пиррол-3-ила, оксазол-2-ила, оксазол-4-ила, оксазол-5-ила, изоксазол-3-ила, изоксазол-4-ила, изоксазол-5-ила, [1,2,4]оксадиазол-3-ила, [1,2,4]оксадиазол-5-ила, [1,3,4]оксадиазол-2-ила, фуран-2-ила, фуран-3-ила, тиофен-2-ила, тиофен-3-ила, изотиазол-3-ила, изотиазол-4-ила, изотиазол-5-ила, тиазол-2-ила, тиазол-4-ила, тиазол-5-ила, [1,2,4]тиадиазол-3-ила, [1,2,4]тиадиазол-5-ила и [1,3,4]тиадиазол-2-ила.
Группы Z
Z является группой, имеющей формулу:

R1 выбирают из:
i) водорода;
ii) гидроксила;
iii) амино;
iv) замещенного или незамещенного C1-C6 линейного, разветвленного или циклического алкила;
v) замещенного или незамещенного C1-C6 линейного, разветвленного или циклического алкокси;
vi) замещенного или незамещенного C6 или C10 арила;
vii) замещенного или незамещенного C1-C9 гетероциклического кольца; или
viii) замещенного или незамещенного C1-C9 гетероарильного кольца.
Далее представлены не ограничивающие примеры групп, которые могут замещать один или более атомов водорода на группах R1. Представленные ниже заместители, а также другие, не описанные в описании, независимо выбирают из:
i) C1-C12 линейного, разветвленного или циклического алкила, алкенила и алкинила; метила (C1), этила (C2), этенила (C2), этинила (C2), н-пропила (C3), изопропила (C3), циклопропила (C3), 3-пропенила (C3), 1-пропенила (также 2-метилэтенила) (C3), изопропенила (также 2- метилэтен-2-ила) (C3), проп-2-инила (также пропаргила) (C3), пропин-1-ила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), циклобутила (C4), бутен-4-ила (C4), циклопентила (C5), циклогексила (C6);
ii) замещенного или незамещенного C6 или C10 арила; например, фенила, нафтила (также обозначенного как нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенного или незамещенного C6 или C10 алкиленарила; например, бензила, 2-фенилэтила, нафтилен-2-илметила;
iv) замещенного или незамещенного C1-C9 гетероциклического кольца; как описано ниже;
v) замещенного или незамещенного C1-C9 гетероарильного кольца; как описано ниже;
vi) -(CR31aR31b)qOR30; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR31aR31b)qC(O)R30; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR31aR31b)qC(O)OR30; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
xiii) -(CR31aR31b)qC(O)N(R30)2; например, -CONH2, -CH2CONH2 -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR31aR31b)qN(R30)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галогена; -F, -C1, -Br и -I;
xii) -(CR31aR31b)qCN;
xiii) -(CR31aR31b)qNO2;
xiv) -(CHj'Xk')hCHjXk; где X является галогеном, индекс j является целым числом от 0 до 2, j+k=3, индекс j' является целым числом от 0 до 2, j'+k'=2, индекс h равен от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR31aR31b)qSR30; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR31aR31b)qSO2R30; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR31aR31b)qSO3R30; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R30 независимо является водородом, замещенным или незамещенным C1-C6 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или две группы R30 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов; R31a и R31b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс q равен от 0 до 4.
Один пример групп R1 включает замещенный или незамещенный фенил (C6 арил), где каждое замещение независимо выбирают из: галогена, C1-C4 линейного, разветвленного алкила или циклического алкила, -OR11, -CN, -N(R11)2, -CO2R11, -C(O)N(R11)2, -NR11C(O)R11, -NO2 и - SO2R11; каждый R11 независимо является водородом; замещенным или незамещенным C1-C4 линейным, разветвленным, циклическим алкилом, алкенилом или алкинилом; замещенным или незамещенным фенилом или бензилом; или две группы R11 могут быть взяты вместе с образованием кольца, содержащего 3-7 атомов.
Другой пример групп R1 включает замещенные C6 арильные группы, выбранные из фенила, 2-фторфенила, 3-фторфенила, 4-фторфенила, 2,3-дифторфенила, 3,4-дифторфенила, 3,5-дифторфенила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2,3-дихлорфенила, 3,4-дихлорфенила, 3,5-дихлорфенила, 2-гидроксифенила, 3-гидроксифенила, 4-гидроксифенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2,3-диметоксифенила, 3,4-диметоксифенила и 3,5-диметоксифенила.
Другой пример групп R1 включает замещенные или незамещенные C6 арильные группы, выбранные из 2,4-дифторфенила, 2,5-дифторфенила, 2,6-дифторфенила, 2,3,4-трифторфенила, 2,3,5-трифторфенила, 2,3,6-трифторфенила, 2,4,5-трифторфенила, 2,4,6-трифторфенила, 2,4-дихлорфенила, 2,5-дихлорфенила, 2,6-дихлорфенила, 3,4-дихлорфенила, 2,3,4-трихлорфенила, 2,3,5-трихлорфенила, 2,3,6-трихлорфенила, 2,4,5-трихлорфенила, 3,4,5-трихлорфенила и 2,4,6-трихлорфенила.
Еще один пример групп R1 включает замещенные C6 арильные группы, выбранные из 2-метилфенила, 3-метилфенила, 4-метилфенила, 2,3-диметилфенила, 2,4-диметилфенила, 2,5-диметилфенила, 2,6-диметилфенила, 3,4-диметилфенила, 2,3,4-триметилфенила, 2,3,5-триметилфенила, 2,3,6-триметилфенила, 2,4,5-триметилфенила, 2,4,6-триметилфенила, 2-этилфенила, 3-этилфенила, 4-этилфенила, 2,3-диэтилфенила, 2,4-диэтилфенила, 2,5-диэтилфенила, 2,6-диэтилфенила, 3,4-диэтилфенила, 2,3,4-триэтилфенила, 2,3,5-триэтилфенила, 2,3,6-триэтилфенила, 2,4,5-триэтилфенила, 2,4,6-триэтилфенила, 2-изопропилфенила, 3-изопропилфенила и 4-изопропилфенила.
Другой пример групп R1 включает замещенные C6 арильные группы, выбранные из 2-аминофенила, 2-(N-метиламино)фенила, 2-(N,N-диметиламино)фенила, 2-(N-этиламино)фенила, 2-(N,N-диэтиламино)фенила, 3-аминофенила, 3-(N-метиламино)фенила, 3-(N,N-диметиламино)фенила, 3-(N-этиламино)фенила, 3-(N,N-диэтиламино)фенила, 4-аминофенила, 4-(N-метиламино)фенила, 4-(N,N-диметиламино)фенила, 4-(N-этиламино)фенила и 4-(N,N-диэтиламино)фенила.
R1 может содержать гетероарильные группы. Не ограничивающие примеры гетероарильных групп включают:
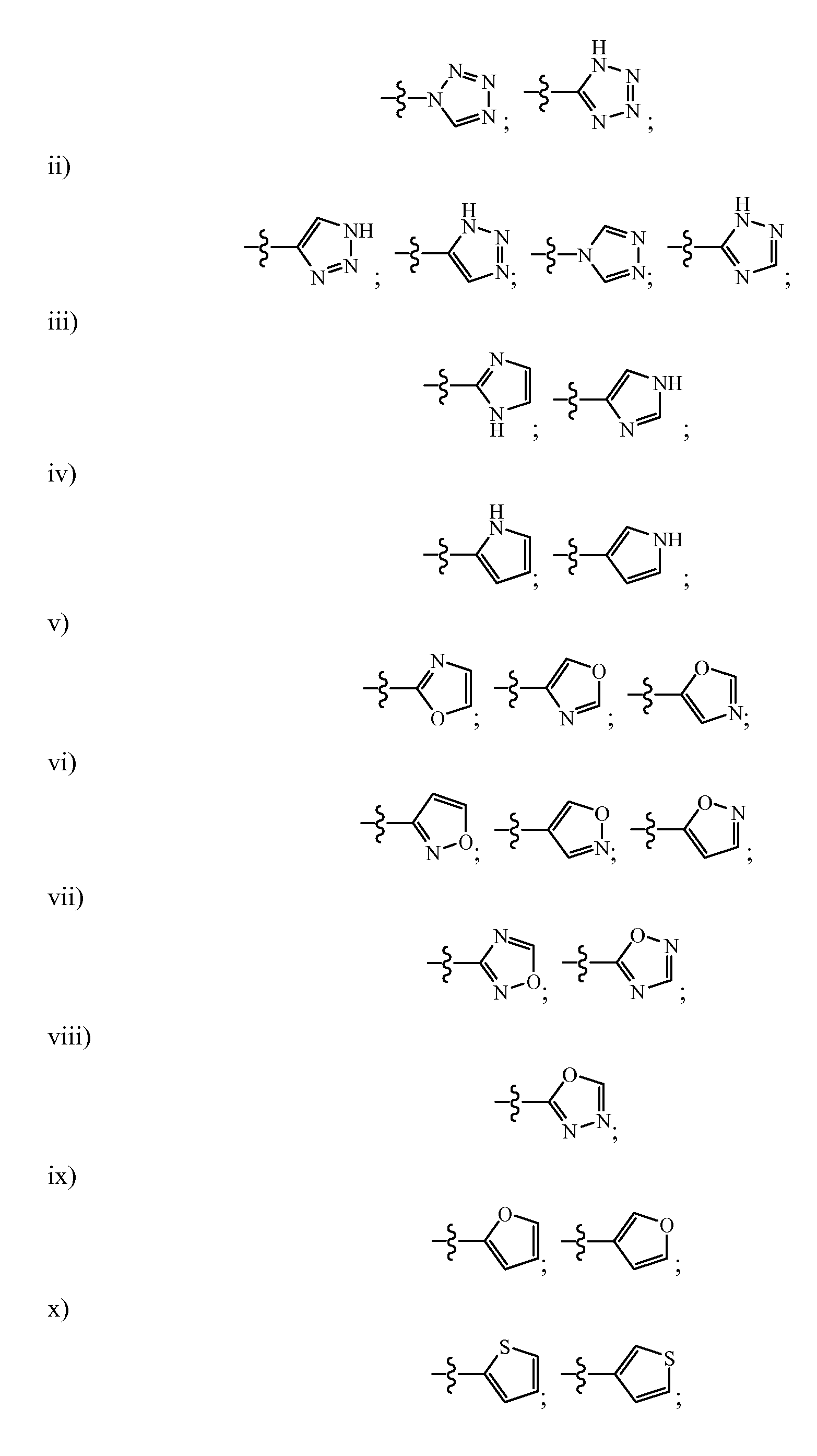

R1 гетероарильные группы могут быть замещены или не замещены. Не ограничивающие примеры групп, которые могут замещать водород, включают группы, выбранные из:
i) C1-C6 линейного, разветвленного и циклического алкила;
ii) замещенного или незамещенного фенила и бензила;
iii) замещенного или незамещенного C1-C9 гетероарила;
iv) -C(O)R9; и
v) -NHC(O)R9;
где R9 является C1-C6 линейным и разветвленным алкилом; C1-C6 линейным или разветвленным алкокси; или -NHCH2C(O)R10; R10 выбирают из водорода, метила, этила и трет-бутила.
Пример R1 относится к группам, замещенным алкильными группами, выбранными из метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила.
Другой пример R1 включает группы, которые замещены замещенным или незамещенным фенилом и бензилом, где фенильные и бензильные заместители выбирают из одного или более из:
i) галогена;
ii) C1-C3 алкила;
iii) C1-C3 алкокси;
iv) -CO2R11; и
v) -NHCOR16;
где R11 и R16 каждый независимо является водородом, метилом или этилом.
Другой пример R1 относится к фенильным и бензильным группам, замещенным карбоксигруппой, имеющей формулу -C(O)R9; R9 выбирают из метила, метокси, этила и этокси.
Другой пример R1 включает фенильные и бензильные группы, замещенные амидными группами, имеющими формулу -NHC(O)R9; R9 выбирают из метила, метокси, этила, этокси, трет-бутила и трет-бутокси.
Еще один пример R1 включает фенильные и бензильные группы, замещенные одной или более группами хлора.
Группы L
L является связывающей группой, которая присутствует, если индекс n равен 1, но отсутствует, если индекс n равен 0. Группы L имеют формулу:
-[Q]y[C(R5aR5b)]x[Q1]z[C(R6aR6b)]w-
где Q и Q1 каждый независимо является:
i) -C(O)-;
ii) -NH-;
iii) -C(O)NH-;
iv) -NHC(O)-;
v) -NHC(O)NH-;
vi) -NHC(O)O-;
vii) -C(O)O-;
viii) -C(O)NHC(O)-;
ix) -O-;
x) -S-;
xi) -SO2-;
xii) -C(=NH)-;
xiii) -C(=NH)NH-;
xiv) -NHC(=NH)-; или
xv) -NHC(=NH)NH-.
Если индекс y равен 1, Q присутствует. Если индекс y равен 0, Q отсутствует. Если индекс z равен 1, Q1 присутствует. Если индекс z равен 0, Q1 отсутствует.
R5a и R5b каждый независимо является:
i) водородом;
ii) гидрокси;
iii) галогеном;
iv) C1-C6 замещенным или незамещенным линейным или разветвленным алкилом; или
v) группой, имеющей формулу:
-[C(R7aR7b)]tR8
где R7a и R7b каждый независимо является:
i) водородом; или
ii) замещенным или незамещенным C1-C6 линейным, разветвленным или циклическим алкилом.
R8 является:
i) водородом;
ii) замещенным или незамещенным C1-C6 линейным, разветвленным или циклическим алкилом;
iii) замещенным или незамещенным C6 или C10 арилом;
iv) замещенным или незамещенным C1-C9 гетероарилом; или
v) замещенным или незамещенным C1-C9 гетероциклом.
R6a и R6b каждый независимо является:
i) водородом; или
ii) C1-C4 линейным или разветвленным алкилом.
Индексы t, w и x каждый независимо равен от 0 до 4.
Далее представлены не ограничивающие примеры групп, которые могут замещать один или более атомов водорода в группах R5a, R5b, R7a, R7b и R8. Представленные ниже заместители, так же как и другие, не описанные в описании, независимо выбирают из:
i) C1-C12 линейного, разветвленного или циклического алкила, алкенила и алкинила; метила (C1), этила (C2), этенила (C2), этинила (C2), н-пропила (C3), изопропила (C3), циклопропила (C3), 3-пропенила (C3), 1-пропенила (также 2-метилэтенила) (C3), изопропенила (также 2-метилэтен-2-ила) (C3), проп-2-инила (также пропаргила) (C3), пропин-1-ила (C3), н-бутила (C4), втор-бутила (C4), изобутила (C4), трет-бутила (C4), циклобутила (C4), бутен-4-ила (C4), циклопентила (C5), циклогексила (C6);
ii) замещенного или незамещенного C6 или C10 арила; например, фенила, нафтила (также обозначенного в описании как нафтилен-1-ил (C10) или нафтилен-2-ил (C10));
iii) замещенного или незамещенного C6 или C10 алкиленарила; например, бензила, 2-фенилэтила, нафтилен-2-илметила;
iv) замещенного или незамещенного C1-C9 гетероциклического кольца; как описано ниже;
v) замещенного или незамещенного C1-C9 гетероарильного кольца; как описано ниже;
vi) -(CR41aR41b)rOR40; например, -OH, -CH2OH, -OCH3, -CH2OCH3, -OCH2CH3, -CH2OCH2CH3, -OCH2CH2CH3 и -CH2OCH2CH2CH3;
vii) -(CR41aR41b)rC(O)R40; например, -COCH3, -CH2COCH3, -COCH2CH3, -CH2COCH2CH3, -COCH2CH2CH3 и -CH2COCH2CH2CH3;
viii) -(CR41aR41b)rC(O)OR40; например, -CO2CH3, -CH2CO2CH3, -CO2CH2CH3, -CH2CO2CH2CH3, -CO2CH2CH2CH3 и -CH2CO2CH2CH2CH3;
xiv) -(CR41aR41b)rC(O)N(R40)2; например, -CONH2, -CH2CONH2, -CONHCH3, -CH2CONHCH3, -CON(CH3)2 и -CH2CON(CH3)2;
x) -(CR41aR41b)rN(R40)2; например, -NH2, -CH2NH2, -NHCH3, -CH2NHCH3, -N(CH3)2 и -CH2N(CH3)2;
xi) галогена; -F, -Cl, -Br и -I;
xii) -(CR41aR41b)rCN;
xiii) -(CR41aR41b)rNO2;
xiv) -(CHj'Xk')hCHjXk; где X является галогеном, индекс j является целым числом от 0 до 2, j+k=3, индекс j' является целым числом от 0 до 2, j'+k'=2, индекс h равен от 0 до 6; например, -CH2F, -CHF2, -CF3, -CH2CF3, -CHFCF3, -CCl3 или -CBr3;
xv) -(CR41aR41b)rSR40; -SH, -CH2SH, -SCH3, -CH2SCH3, -SC6H5 и -CH2SC6H5;
xvi) -(CR41aR41b)rSO2R40; например, -SO2H, -CH2SO2H, -SO2CH3, -CH2SO2CH3, -SO2C6H5 и -CH2SO2C6H5; и
xvii) -(CR41aR41b)rSO3R40; например, -SO3H, -CH2SO3H, -SO3CH3, -CH2SO3CH3, -SO3C6H5 и -CH2SO3C6H5;
где каждый R40 независимо является водородом, замещенным или незамещенным C1-C6 линейным, разветвленным или циклическим алкилом, фенилом, бензилом, гетероциклом или гетероарилом; или две группы R40 могут быть взяты вместе с образованием кольца, содержащего 3-7 атома; R41a и R41b каждый независимо является водородом или C1-C4 линейным или разветвленным алкилом; индекс r равен от 0 до 4.
Один аспект групп L относится к группам, имеющим формулу:
-C(O)[C(R5aR5b)]xNHC(O)-
где R5a является водородом, замещенным или незамещенным C1-C4 алкилом, замещенным или незамещенным фенилом и замещенным или незамещенным гетероарилом; и индекс x равен 1 или 2. Один вариант относится к связующим группам, имеющим формулу:
i) -C(O)[C(R5aH)]NHC(O)O-;
ii) -C(O)[C(R5aЗ)][CH2]NHC(O)O-;
iii) -C(O)[CH2][C(R5aH)]NHC(O)O-;
iv) -C(O)[C(R5aH)]NHC(O)-;
v) -C(O)[C(R5aH)][CH2]NHC(O)-; или
vi) -C(O)[CH2][C(R5aH)]NHC(O)-;
где R5a является:
i) водородом;
ii) метилом;
iii) этилом;
iv) изопропилом;
v) фенилом;
vi) бензилом;
vii) 4-гидроксибензилом;
viii) гидроксиметилом; или
ix) 1-гидроксиэтилом.
Если индекс x равен 1, в этом варианте представлены следующие, не ограничивающие примеры групп L:

Если индекс x равен 2, в этом варианте представлены следующие, не ограничивающие примеры групп L:

Другой вариант групп L включает группы, где Q является -C(O)-, индексы x и z равны 0, w равен 1 или 2, первую группу R6a выбирают из фенила, 2-фторфенила, 3-фторфенила, 4-фторфенила, 2,3-дифторфенила, 3,4-дифторфенила, 3,5-дифторфенила, 2-хлорфенила, 3-хлорфенила, 4-хлорфенила, 2,3-дихлорфенила, 3,4-дихлорфенила, 3,5-дихлорфенила, 2-гидроксифенила, 3-гидроксифенила, 4-гидроксифенила, 2-метоксифенила, 3-метоксифенила, 4-метоксифенила, 2,3-диметоксифенила, 3,4-диметоксифенила и 3,5-диметоксифенила; вторая группа R6a является водородом и группы R6b являются водородом. Например, связующая группа имеет формулу:

Другой пример этого варианта L включает первую группу R6a, такую как изображена выше, которая является замещенной или незамещенной гетероарильной группой, как описано выше.
Еще один пример этого варианта L включает группы, имеющие формулу:
-C(O)[C(R6aR6b)]w-;
где R6a и R6b являются водородом, и индекс w равен 1 или 2; указанные группы выбирают из:
i) -C(O)CH2-; и
ii) -C(O)CH2CH2-.
Другой вариант групп L включает группы, имеющие формулу:
-C(O)[C(R5aR5b)]xC(O)-;
где R5a и R5b являются водородом, и индекс x равен 1 или 2; указанные группы выбирают из:
i) -C(O)CH2C(O)-; и
ii) -C(O)CH2CH2C(O)-.
Еще один вариант групп L включает группы, имеющие формулу:
-C(O)NH[C(R5aR5b)]x-;
где R5a и R5b являются водородом, и индекс w равен 0, 1 или 2; указанные группы выбирают из:
i) -C(O)NH-;
ii) -C(O)NHCH2-; и
iii) -C(O)NHCH2CH2-.
Еще один пример групп L включает группы, имеющие формулу:
-SO2[C(R6aR6b)]w-;
где R8a и R8b являются водородом или метилом, и индекс w равен 0, 1 или 2; указанные группы выбирают из:
i) -SO2-;
ii) -SO2CH2-; и
iii) -SO2CH2CH2-.
Контроль пропотевания жидкости через сосуды
Описанные соединения (аналоги) разделяют на несколько категорий для того, чтобы помочь разработчику рецептуры применить рациональную стратегию синтеза для получения аналогов, которые не представлены в описании. Группировка на категории не имеет в основе повышенную или пониженную эффективность для любой композиции описанного в описании вещества.
Описанные выше соединения включают все фармацевтически приемлемые соли. Соединение, имеющее формулу:
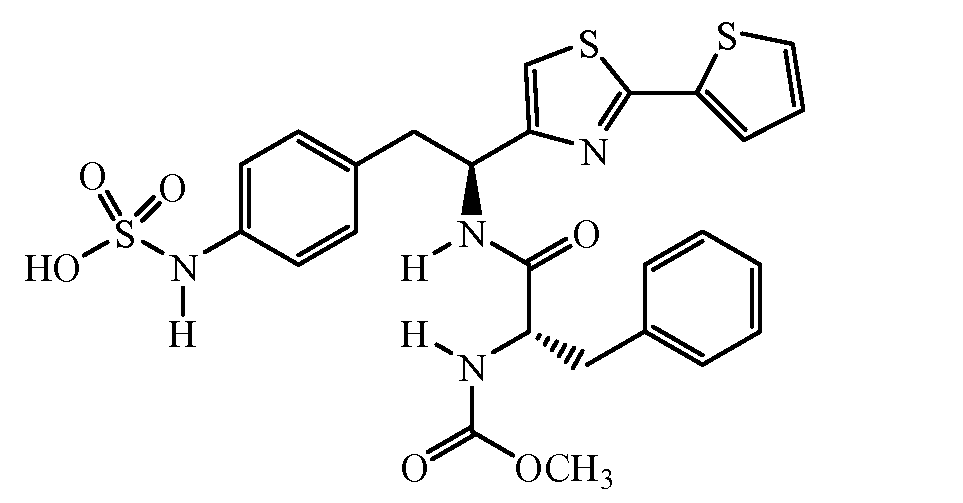
может образовывать соли, например, соль сульфаминовой кислоты:


Соединения также могут существовать в цвиттерионной форме, например:

в виде соли сильной кислоты, например:

Первый аспект категории I в соответствии с данным изобретением включает соединения, где R является замещенной или незамещенной тиазол-2-ильной группой, имеющей формулу:

один вариант которой относится к ингибиторам, имеющим формулу:

где группы R являются тиазол-2-ильными группами, которые, если замещены, замещены группами R2 и R3. Группы R и R5a описаны в таблице I.

Соединения, предусмотренные в рамках первого аспекта категории I настоящего описания изобретения, могут быть получены путем процедуры, описанной в схеме I и описанной в примере 1 ниже.

Реагенты и условия: (a)(i) (изобутил) OCOCl, NMM, ДМФ; 0°C, 20 мин.
(ii) NH3; 0°C в течение 30 мин.

Реагенты и условия: (b) реагент Ловессона, ТГФ; кт, 3 ч.

Реагенты и условия: (c) CH3CN; кипение с обратным холодильником, 3 ч.
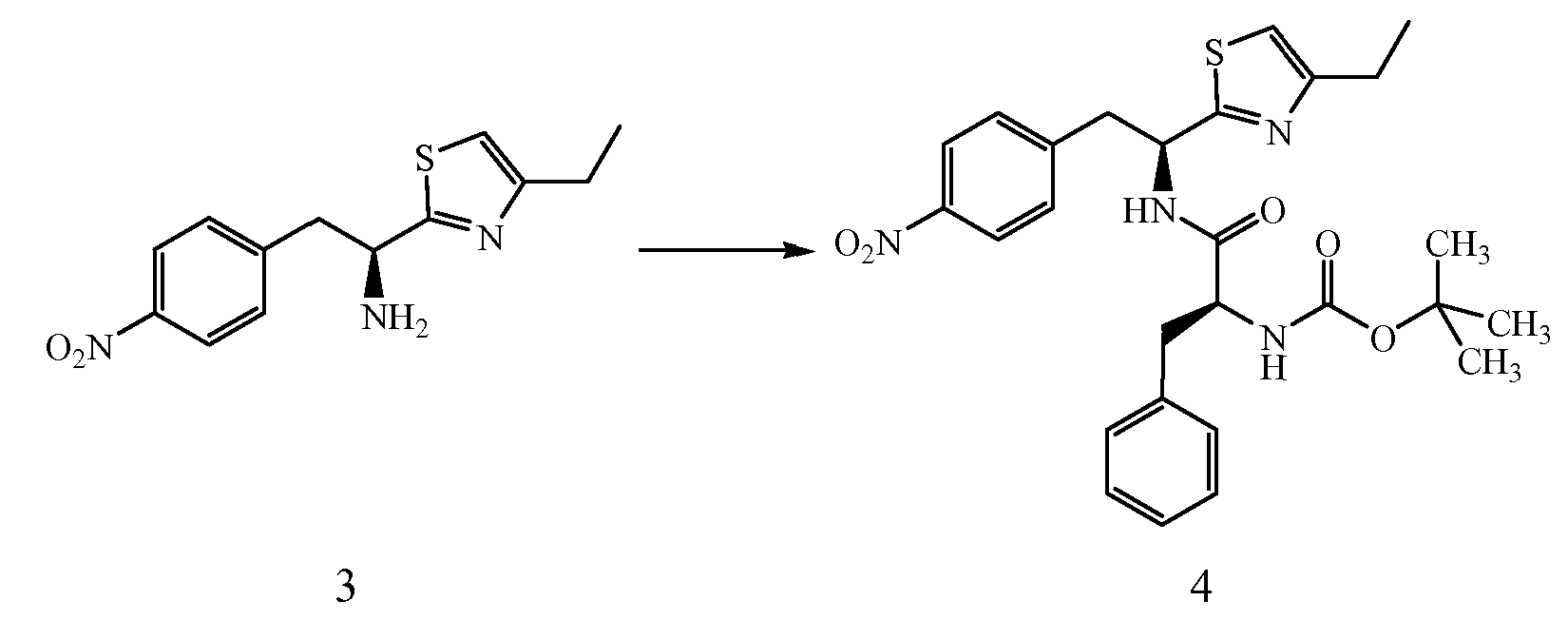
Реагенты и условия: (d) Boc-Phe, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (e)(i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 2 ч.
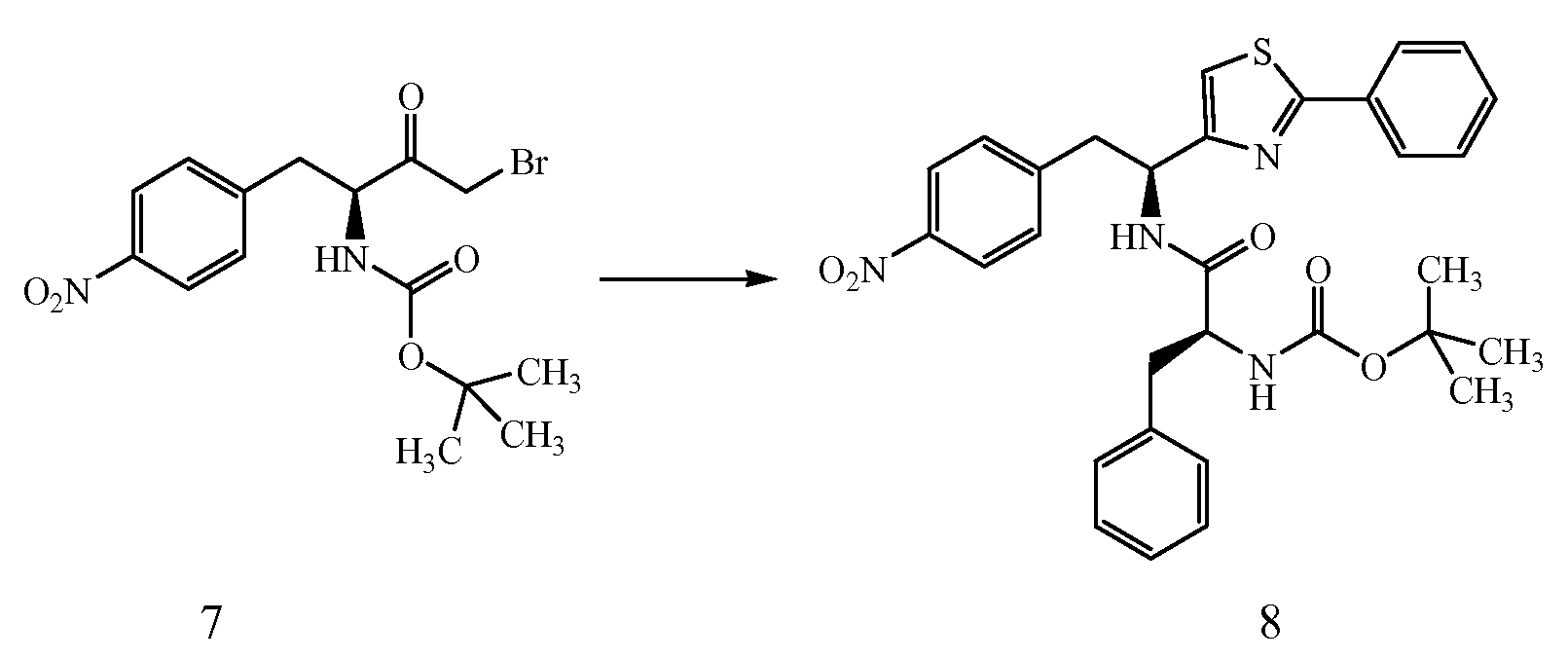
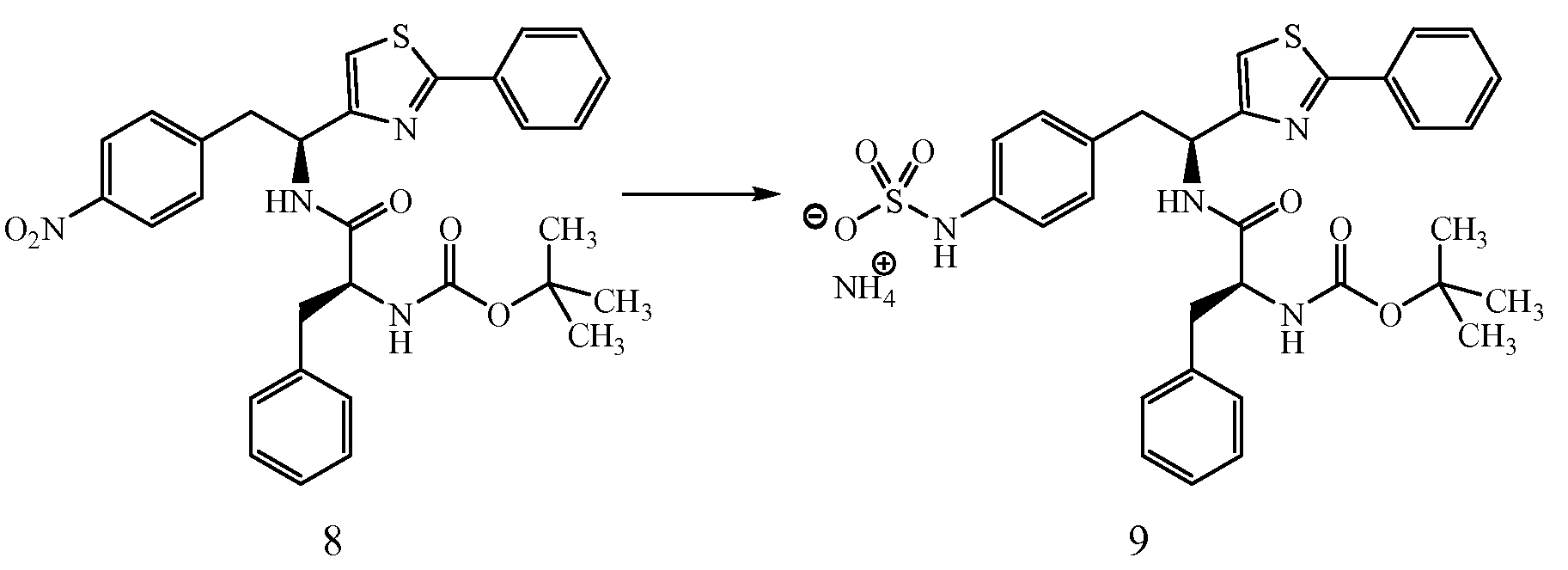
ПРИМЕР 1
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота (5)
Получение трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этилкарбаминовой кислоты (1): К раствору при 0°C 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты и N-метилморфолина (1,1 мл, 9,65 ммоль) в ДМФ (10 мл) по каплям добавляют изобутил хлорформиат (1,25 мл, 9,65 ммоль). Смесь перемешивают при 0°C в течение 20 минут, затем NH3 (г) пропускают через реакционную смесь в течение 30 минут при 0°C. Реакционную смесь концентрируют и остаток растворяют в EtOAc, промывают последовательно 5% лимонной кислотой, водой, 5% NaHCO3, водой и насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме до остатка, который растирают со смесью EtOAc/петролейного эфира с получением 2,2 г (74%) желаемого продукта в виде белого твердого вещества.
Получение трет-бутилового эфира [2-(4-нитрофенил)-1-(5)-тиокарбамоилэтил]карбаминовой кислоты (2): К раствору трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этилкарбаминовой кислоты, 1, (0,400 г, 1,29 ммоль) в ТГФ (10 мл) добавляют реагент Ловессона (0,262 г, 0,65 ммоль). Реакционную смесь перемешивают в течение 3 часов и концентрируют до остатка, который очищают над двуокисью кремния с получением 0,350 г (83%) желаемого продукта.1H ЯМР (300 МГц, CDCl3) δ 8,29 (с, 1Н), 8,10 (д, J=8,4 Гц, 2H), 8,01 (с, 1Н), 7,42 (д, J=8,4 Гц, 2H), 5,70 (д, J=7,2 Гц, 1Н), 4,85 (д, J=7,2 Гц, 1Н), 3,11-3,30 (м, 1Н), 1,21 (с, 9H).
Получение 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина (3): Смесь трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-тиокарбамоилэтил]карбаминовой кислоты, 2, (0,245 г, 0,753 ммоль), 1-бром-2-бутанона (0,125 г, 0,828 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир и полученный осадок удаляют фильтрацией. Твердое вещество сушат в вакууме с получением 0,242 г (90% выход) желаемого продукта. ИЭР+ МС 278 (M+1).
Получение трет-бутилового эфира {1-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты (4): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,393 г, 1,1 ммоль), (S)-(2-трет-бутоксикарбониламино)-3-фенилпропионовой кислоты (0,220 г, 0,828 ммоль) и 1-гидроксибензотриазола (HOBt) (0,127 г, 0,828 ммоль) в ДМФ (10 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,159 г, 0,828 ммоль), затем диизопропиламин (0,204 г, 1,58 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенные органические фазы промывают 1N водным HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,345 г желаемого продукта, который используют без дальнейшей очистки. ЖХ/МС ИЭР+ 525 (M+1).
Получение аммониевой соли 4-{(S)-2-[(S)-2-(трет-бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовой кислоты (5): трет-бутиловый эфир {1-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты, 4, (0,345 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,314 г). Ре6акционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (50 мл). Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,222 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD): δ 7,50-6,72 (м, 10H), 5,44-5,42 (д, 1Н, J=6,0 Гц), 4,34 (с, 1Н), 3,34-2,79 (м, 4H), 2,83-2,76 (кв., 2H, J=7,2 Гц), 1,40 (с, 9H), 1,31 (т, 3H, J=7,5 Гц).
Описанные ингибиторы также могут быть выделены в виде свободной кислоты. Не ограничивающие примеры этой методики описаны ниже, в примере 4.
Далее представлены не ограничивающие примеры соединений, включенных в данный вариант первого аспекта категории I в соответствии с данным изобретением.
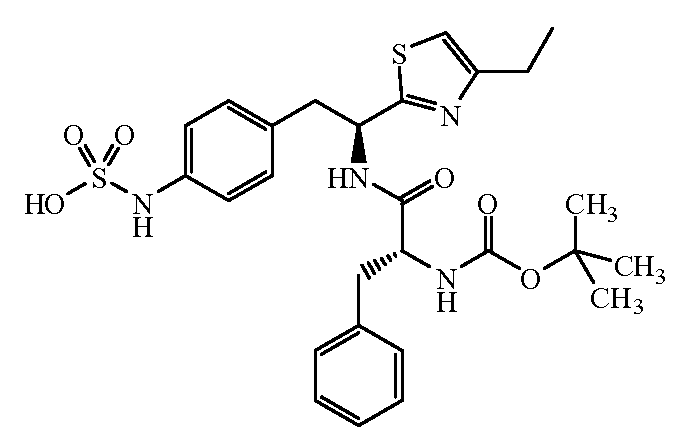
4-{(S)-2-[(R)-2-(трет-бутоксикарбониламино)-3-фенилпропанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD ): δ 7,22-7,02 (м, 10H), 5,39 (с, 1Н), 4,34 (с, 1Н), 3,24-2,68 (м, 6H), 1,37 (с, 9H), 1,30 (т, 3H, J=7,5 Гц).
Другой вариант этого аспекта категории I относится к ингибиторам, имеющим формулу:

где группы R и R5a описаны в таблице II.
Соединения в данном варианте могут быть получены по методике, описанной выше на схеме I и описанной в примере 1, заменяя подходящей Boc-в-аминокислотой (S)-(2-трет-бутоксикарбониламино)-3-фенилпропионовую кислоту на стадии (d).
Далее представлены не ограничивающие примеры соединений в соответствии с этим вариантом:

Трет-бутиловый эфир {1-[1-(4-этилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этилкарбамоил]-(S)-2-фенилэтил}метилкарбаминовой кислоты:1H ЯМР (300 МГц, MeOH-d4) δ 8,36 (д, J=8,1 Гц, 1Н), 7,04-7,22 (м, 9H), 5,45 (с, 1Н), 3,01-3,26 (м, 2H), 2,60-2,88 (м, 4H), 2,33 (с, 3H), 1,30 (с, 9H).

Трет-бутиловый эфир {1-[1-(4-фенилтиазол-2-ил)-(S)-2-(4-сульфоаминофенил)этилкарбамоил]-(S)-2-фенилэтил}метилкарбаминовой кислоты:1H ЯМР (300 МГц, MeOH-d4) δ 8,20 (д, J=8,1 Гц, 1Н), 7,96-7,99 (м, 2H), 7,48-7,52 (м, 3H), 7,00-7,23 (м, 7H), 6,89 (с, 1Н), 5,28 (кв., J=7,5 Гц, 1Н), 4,33 (т, J=6,6 Гц, 1Н), 3,09-3,26 (м, 2H), 3,34 (дд, J=13,2 и 8,4 Гц, 1Н), 2,82 (дд, J=13,2 и 8,4 Гц, 1Н), 1,38 (с, 9H).
Второй аспект категории I в соответствии с данным изобретением относится к соединениям, где R является замещенным или незамещенным тиазол-4-илом, имеющим формулу:
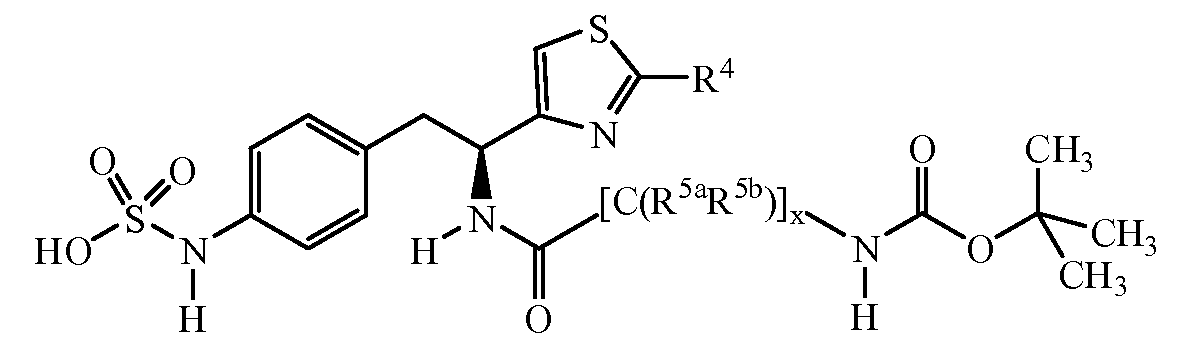
один вариант которого относится к ингибиторам, имеющим формулу:

где группы R и R5a описаны в таблице III.
Соединения, входящие во второй аспект категории I в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме II и описанной в примере 2 ниже.
Схема II

Реагенты и условия: (a) (i) (изобутил)OCOCl, Et3N, ТГФ; 0°C, 20 мин. (ii) CH2N2; комнатная темп. в течение 3 часов.

Реагенты и условия: (b) 48% HBr, ТГФ; 0°C, 1,5 ч.
Реагенты и условия: (c) (i) тиобензамид, CH3CN; кипение с обратным холодильником, 2 ч. (ii) Boc-Phe, HOBt, ДИПЭА, ДМФ; кт, 18 ч.
Реагенты и условия: (d) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 12 ч.
ПРИМЕР 2
4-{(S)-2-(S)-2-(трет-Бутоксикарбониламино)-3-фенилпропанамидо-2-(2-фенилтиазол-4-ил)}фенилсульфаминовая кислота (9)
Получение трет-бутилового эфира (S)-[3-диазо-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты (6): К 0°C раствору 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты (1,20 г, 4,0 ммоль) в ТГФ (20 мл) по каплям добавляют триэтиламин (0,61 мл, 4,4 ммоль), затем изобутилхлорформиат (0,57 мл, 4,4 ммоль). Реакционную смесь перемешивают при 0°C в течение 20 минут и фильтруют. Фильтрат обрабатывают эфирным раствором диазометана (~16 ммоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем концентрируют в вакууме. Полученный остаток растворяют в EtOAc и последовательно промывают водой и насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают над двуокисью кремния (гексан/EtOAc 2:1) с получением 1,1 г (82% выход) желаемого продукта в виде светло-желтого твердого вещества.1H ЯМР (300 МГц, CDCl3) δ 8,16 (д, J=8,7 Гц, 2H), 7,39 (д, J=8,7 Гц, 2H), 5,39 (с, 1Н), 5,16 (д, J=6,3 Гц, 1Н), 4,49 (с, 1Н), 3,25 (дд, J=13,8 и 6,6, 1Н), 3,06 (дд, J=13,5 и 6,9 Гц, 1Н), 1,41 (с, 9H).
Получение (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата (7): К 0°C раствору трет-бутилового эфира (S)-[3-диазо-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты, 6, (0,350 г, 1,04 ммоль) в ТГФ (5 мл) по каплям добавляют 48% водн. HBr (0,14 мл, 1,25 ммоль). Реакционную смесь перемешивают при 0°C в течение 1,5 часов, затем реакцию гасят при 0°C с применением насыщ. Na2CO3. Смесь экстрагируют EtOAc (3Ч25 мл) и объединенные органические экстракты промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют с получением 0,400 г продукта, который применяют на следующей стадии без дальнейшей очистки.1H ЯМР (300 МГц, CDCl3) δ 8,20 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 5,06 (д, J=7,8 Гц, 1Н), 4,80 (кв., J=6,3 Гц, 1Н), 4,04 (с, 2H), 1,42 (с, 9H).
Получение трет-бутил (S)-1-(5)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамата (8): Смесь тиобензамида (0,117 г, 0,85 ммоль) и (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (0,300 г, 0,77 ммоль) в CH3CN (4 мл) кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют диэтиловый эфир для осаждения промежуточного 2-(нитрофенил)-(S)-1-(4-фенилтиазол-2-ил)этиламина, который отделяют фильтрацией в виде гидробромида.
Гидробромид растворяют в ДМФ (3 мл) вместе с диизопропилэтиламином (0,42 мл, 2,31 ммоль), 1-гидроксибензотриазолом (0,118 г, 0,79 ммоль) и (S)-(2-трет-бутоксикарбониламино)-3-фенилпропионовой кислотой (0,212 г, 0,80 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,395 г (90% выход) желаемого продукта, который применяют без дальнейшей очистки. ЖХ/МС ИЭР+ 573 (М+1).
Получение (4-((S)-2-((S)-2-((трет-бутоксикарбонил)амино)-3-фенилпропанамидо-2-(2-фенилтиазол-4-ил)этил)фенил)-сульфаминовой кислоты (9): трет-бутил(S)-1-(S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 8, (0,360 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 12 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлений. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,296 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (10 мл). Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,050 г желаемого продукта в виде аммониевой соли.1Н ЯМР (300 МГц, MeOH-d4) δ 8,20 (д, J=8,1 Гц, 1Н), 7,96-7,99 (м, 2H), 7,48-7,52 (м, 3H), 7,00-7,23 (м, 7H), 6,89 (с, 1Н), 5,28 (кв., J=7,5 Гц, 1Н), 4,33 (т, J=6,6 Гц, 1Н), 3,09-3,26 (м, 2H), 3,34 (дд, J=13,2 и 8,4 Гц, 1Н), 2,82 (дд, J=13,2 и 8,4 Гц, 1Н), 1,38 (с, 9H).
Первый аспект категории II в соответствии с данным изобретением относится к соединениям, где R является замещенной или незамещенной тиазол-4-ильной группой, имеющей формулу:

один вариант которого относится к ингибиторам, имеющим формулу:

где группы R являются тиазол-4-ильными группами которые, если замещены, замещены группами R4. Группы R и R5a описаны в таблице IV.
Соединения, включенные во второй аспект категории II в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме III и описанной в примере 3 ниже.
Схема III

Реагенты и условия: (a)(i) пропантиоамид, CH3CN; кипение с обратным холодильником, 2 ч. (ii) Boc-Phe, HOBt, ДИПЭА, ДМФ; кт, 18 ч.
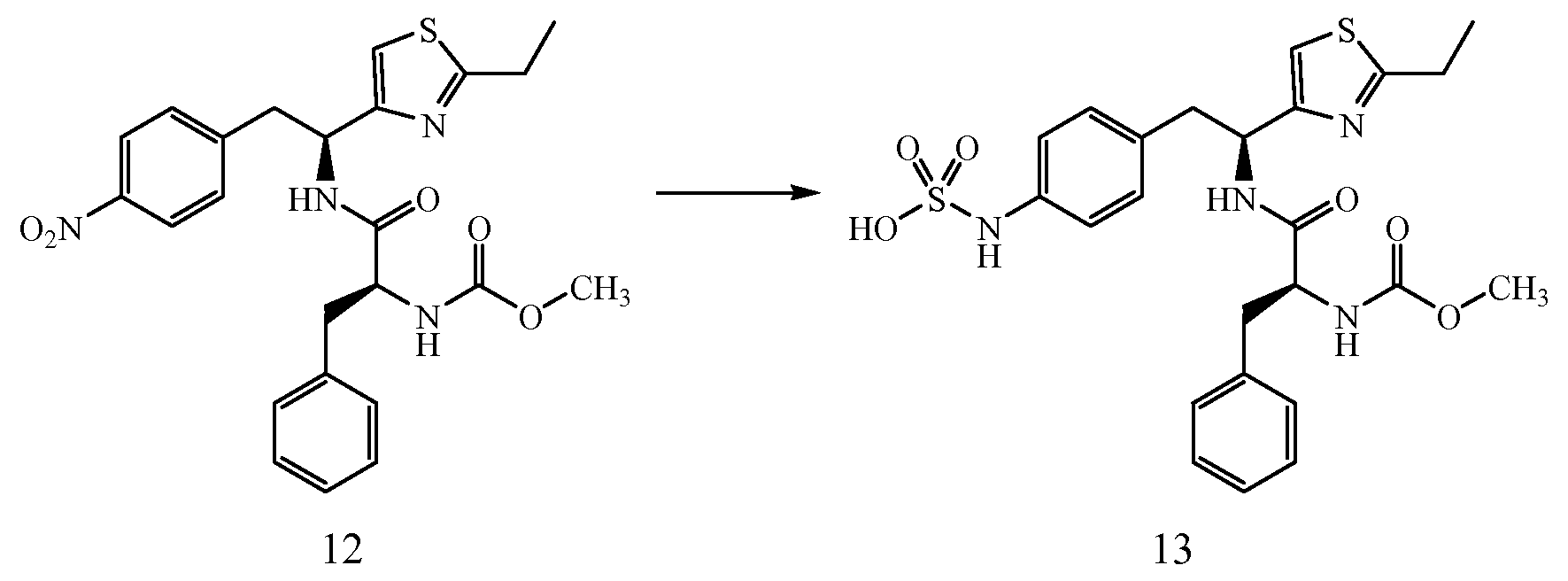
Реагенты и условия: (b)(i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 3
4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-этилтиазол-4-ил)этил}фенилсульфаминовая кислота (13)
Получение метил (S)-1-[(S)-1-(2-этилтиазол-4-ил)-2-(4-нитрофенил)этил]амино-1-оксо-3-фенилпропан-2-илкарбамата (12): Смесь пропантиоамида (69 мг, 0,78 ммоль) и (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (0,300 г, 0,77 ммоль) в CH3CN (4 мл) кипятят с обратным холодильником в течение 2 часов. Реакционную смесь охлаждают при комнатной температуре и добавляют диэтиловый эфир для осаждения промежуточного 2-(нитрофенил)-(S)-1-(4-этилтиазол-2-ил)этиламина, который отделяют фильтрацией в виде гидробромида. Гидробромид растворяют в ДМФ (8 мл) вместе с диизопропилэтиламином (0,38 мл, 2,13 ммоль), 1-гидроксибензотриазолом (107 мг, 0,71 ммоль) и (S)-(2-метоксикарбониламино)-3-фенилпропионовой кислотой (175 мг, 0,78 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,300 г (81% выход) желаемого продукта, который используют без дальнейшей очистки. ЖХ/МС ИЭР+МС 483 (M+1).
Получение аммониевой соли 4-((S)-2-((S)-2-(метоксикарбониламино)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовой кислоты (13): трет-бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-этилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 12, (0,300 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (223 мг, 1,40 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (12 мл). Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 25 мг желаемого продукта в виде аммониевой соли.1H ЯМР (300 МГц, MeOH-d4) δ 7,14-7,24 (м, 6H), 6,97-7,0 (м, 4H), 6,62 (с, 1Н), 5,10-5,30 (м, 1Н), 4,36 (т, J=7,2 Гц, 1Н), 3,63 (с, 3H), 3,14 (дд, J=13,5 и 6,3 Гц, 1Н), 2,93-3,07 (м, 5H), 2,81 (дд, J=13,5 и 6,3 ГЦ, 1Н), 1,39 (т, J=7,8 Гц, 3H).
В другом варианте способа в соответствии с данным изобретением, соединение 13, а также другие аналоги, которые содержит данное описание, могут быть выделены в виде свободной кислоты с применением адаптированной методики, описанной ниже.


Реагенты и условия: (a) H2:Pd/C, MeOH; кт, 40 ч.

Реагенты и условия: (b) SO3-пиридин, CH3CN; тепло, 45 мин.
ПРИМЕР 4
4-((S)-2-((S)-2-(Метоксикарбониламино)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовая кислота [свободная кислота] (13)
Получение метилового эфира {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты (12a): В аппарат для гидрирования Парра загружают трет-бутил (S)-1-(S)-2-(4-нитрофенил)-1-(2-этилтиазол-4-ил)этиламино-1-оксо-3-фенилпропан-2-илкарбамат, 12, (18,05 г, 37,4 ммоль, 1,0 экв.) и Pd/C (10% Pd на C, 50% масс., Degussa-тип E101 NE/W, 2,68 г, 15% масс.) в виде твердых веществ. Добавляют MeOH (270 мл, 15 мл/г) с получением суспензии. Сосуд помещают в аппарат для гидрирования Парра. Сосуд подвергают процессу наполнения/вакуумной очистки с применением N2 (3 · 20 ф/д2) до инертности, затем проводят ту же процедуру с применением H2 (3 · 40 ф/д2). Сосуд заполняют H2 и встряхивают в атмосфере 40 ф/д2 H2 в течение ~40 ч. Сосуд вынимают, и атмосферу продувают N2 (5 · 20 ф/д2). Аликвоту фильтруют и анализируют ВЭЖХ для подтверждения полного превращения. Суспензию фильтруют через целит для удаления катализатора, и гомогенный желтый фильтрат концентрируют роторным выпариванием с получением 16,06 г (95% выход) желаемого продукта в виде рыжевато-коричневого твердого вещества, которое применяют без дальнейшей очистки.
Получение 4-((S)-2-((S)-2-(метоксикарбонил)-3-фенилпропанамидо)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовой кислоты (13): В 100 мл КГК загружают метиловый эфир {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты, 12a, (10,36 г, 22,9 ммоль, 1,0 экв.), полученный на описанной выше стадии. Добавляют ацетонитрил (50 мл, 5 мл/г), и желтую суспензию перемешивают при комнатной температуре. Вторую 3-горлую 500 мл КГК загружают SO3.пир (5,13 г, 32,2 ммоль, 1,4 экв.) и ацетонитрилом (50 мл 5 мл/г), и белую суспензию перемешивают при комнатной температуре. Обе суспензии осторожно нагревают до тех пор, пока реакционный раствор, содержащий метиловый эфир {1-[2-(S)-(4-(S)-аминофенил)-1-(2-этилтиазол-4-ил)этилкарбамоил]-2-фенилэтил}карбаминовой кислоты, не станет красно-оранжевого цвета (обычно для этого примера около 44°C). Этот раствор, содержащий субстрат, выливают одной порцией в перемешиваемую суспензию SO3.пир при 35°C. Полученную оранжевую смесь (39°C) энергично перемешивают при медленном охлаждении до комнатной температуры. После перемешивания в течение 45 мин завершение реакции определяют ВЭЖХ. К оранжевой суспензии добавляют H2O (200 мл, 20 мл/г) с получением желто-оранжевого гомогенного раствора, имеющего pH приблизительно 2,4. Медленно добавляют концентрированную H3PO4 в течение более 12 минут для снижения pH до приблизительно 1,4. Во время этой корректировки pH образуется беловатый осадок, и раствор перемешивают при комнатной температуре в течение 1 ч. Суспензию фильтруют, и фильтровальную лепешку промывают фильтратом. Фильтровальную лепешку сушат на воздухе в течение ночи с получением 10,89 г (89% выход) желаемого продукта в виде рыжевато-коричневого твердого вещества.
Далее представлены не ограничивающие примеры второго аспекта категории II в соответствии с данным изобретением.

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-(2-метилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 8,15 (д, J=8,4 Гц, 1Н), 7,16-7,25 (м, 5H), 6,97-7,10 (м, 4H), 6,61 (с, 1Н), 5,00-5,24 (м, 1Н), 4,36 (т, J=7,2 Гц, 1Н), 3,64 (с, 2H), 3,11-3,19 (с, 1Н), 2,92-3,04 (с, 2H), 2,81 (дд, J=13,5 и 8,1 Гц, 1Н), 2,75 (с, 3H).

4-{(S)-2-(2-Этилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,16-7,29 (м, 5H), 7,02-7,12 (м, 4H), 6,83 (с, 1Н), 5,10-5,35 (м, 1Н), 3,52-3,67 (м, 3H), 3,18-3,25 (м, 2H), 3,05 (кв., J=7,5 Гц, 2H), 2,82-2,95 (м, 2H), 2,65 (с, 3H), 1,39 (т, J=7,5 Гц, 3H).

4-{(S)-2-(2-Изопропилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,16 (д, 1Н, J=8,7 Гц), 7,22-7,13 (м, 3H), 7,07 (д, 1Н, J=8,4 Гц), 6,96 (д, 1Н, J=8,1 Гц), 6,62 (с, 1Н), 5,19 (т, 1Н, J=7,2 Гц), 4,36 (т, 1Н, J=7,8 Гц), 3,63 (с, 3H), 3,08 (1Н, A ABX, J=3,6, 14,5 Гц), 2,99 (1Н, B ABX, J=7,2, 13,8 Гц), 2,85-2,78 (м, 1Н), 1,41 (д, 6H, J=6,9 Гц).

4-{(S)-2-(2-Циклопропилтиазол-4-ил)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,15-7,02 (м, 5H), 6,96-6,93 (д, 2H, J=8,4 Гц), 6,86-6,83 (д, 2H, J=8,3 Гц), 6,39 (с, 1Н), 5,01 (т, 1Н, J=5,0 Гц), 4,22 (т, 1Н, J=7,4 Гц), 3,51 (с, 3H), 2,98-2,69 (м, 2H), 2,22-2,21 (м, 1Н), 1,06-1,02 (м, 2H), 0,92-0,88 (м, 2H).

4-{(S)-2-{2-[(4-Хлорфенилсульфонил)метил]тиазол-4-ил}-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,96-7,93 (д, 2H, J=8,6 Гц), 7,83-7,80 (д, 2H, J=8,6 Гц), 7,44-7,34 (м, 5H), 7,29-7,27 (д, 2H, J=8,4 Гц), 7,14-7,11 (д, 2H, J=8,4 Гц), 6,97 (с, 1Н), 5,31 (т, 1H, J=6,8 Гц), 5,22-5,15 (м, 2H), 4,55 (т, 1Н, J=7,3 Гц), 3,84 (с, 3H), 3,20-2,96 (м, 4H).

4-{(S)-2-[2-(трет-Бутилсульфонилметил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD): δ 7,40-7,30 (м, 5H), 7,21-7,10 (м, 4H), 7,02 (с, 1Н), 5,37 (т, 1H, J=6,9 Гц), 5,01-4,98 (м, 2H), 4,51 (т, 1H, J=7,1 Гц), 3,77 (с, 3H), 3,34-2,91 (м, 4H), 1,58 (с, 9H).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропионамидо]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, DMSO-d6) δ 7,96-7,99 (м, 2H), 7,51-7,56 (м, 3H), 7,13-7,38 (м, 6H), 6,92-6,95 (м, 4H), 5,11-5,16 (м, 1Н), 4,32-4,35 (м, 1Н), 3,51 (с, 3H), 3,39-3,40 (м, 2H), 3,09-3,19 (м, 1Н), 2,92-3,02 (м, 2H), 2,75 (дд, J=10,5 Гц и 9,9 Гц, 1Н).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,61-7,56 (м, 2H), 7,25-7,01 (м, 10H), 6,75 (с, 1Н), 5,24-5,21 (кв., 1Н, J=7,2 Гц), 4,38 (т, 1Н, J=7,2 Гц), 3,60 (с, 3H), 3,23-3,14 (м, 1Н), 3,08-3,00 (м, 2H), 2,87-2,80 (м, 1Н).
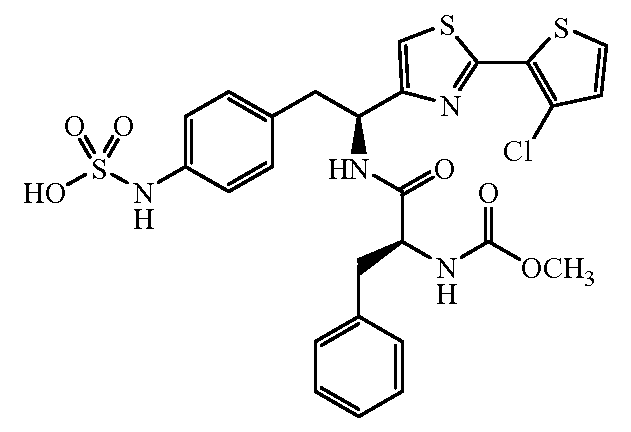
4-{(S)-2-[2-(3-Хлортиофен-2-ил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD): δ 7,78-7,76 (д, 1Н, J=5,4 Гц), 7,36-7,14 (м, 10H), 7,03 (с, 1Н), 5,39 (т, 1H, J=6,9 Гц), 4,54 (т, 1H, J=7,3 Гц), 3,80 (с, 3H), 3,39-2,98 (м, 4H).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(3-метилтиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,38 (д, 1Н, J=5,1 Гц), 7,15-6,93 (м, 10H), 6,73 (с, 1Н), 5,17 (т, 1H, J=6,9 Гц), 4,31 (т, 1Н, J=7,3 Гц), 3,57 (с, 3H), 3,18-3,11 (м, 1Н), 3,02-2,94 (м, 2H), 2,80-2,73 (м, 1Н), 2,46 (с, 3H).

4-{[(S)-2-(2-(Фуран-2-ил)тиазол-4-ил]-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,54-7,46 (м, 1Н), 7,02-6,79 (м, 10H), 6,55-6,51 (м, 1Н), 6,44-6,41 (м, 1Н), 5,02-5,00 (кв., 1Н, J=6,4 Гц), 4,16-4,14 (кв., 1Н, J=7,1 Гц), 3,43 (с, 3H), 2,96-2,58 (м, 4H).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(2-метилтиазол-4-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 8,27(д, J=5,4 Гц, 1Н), 7,97 (с, 1Н), 6,99-7,21(м, 8H), 5,18-5,30 (м, 1Н), 4,30-4,39 (м, 1Н), 3,64 (с, 3H), 3,20 (дд, J=14,1 и 6,6 Гц, 1Н), 2,98-3,08(м, 2H), 2,84 (дд, J=14,1 и 6,6 Гц, 1Н), 2,78 (с, 3H).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[(2-пиразин-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 9,34 (с, 1Н), 8,65 (с, 2H), 8,34 (д, J=8,1 Гц, 1Н), 7,00-5,16 (м, 9H), 5,30 (кв., J=7,2 Гц, 1Н), 4,41 (т, J=7,2 Гц, 1Н), 3,65 (с, 3H), 3,23 (дд, J=13,8 и 6,9 Гц, 1Н), 2,98-3,13 (м, 2H), 2,85 (дд, J=13,8 и 6,9 Гц, 1Н).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(6-метилпиридин-3-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,90 (с, 1Н), 8,19-8,13 (м, 1Н), 7,39-7,36 (д, 1Н, J=8,2 Гц), 7,07-6,88 (м, 9H), 6,79 (с, 1Н), 5,17 (т, 1Н, J=7,0 Гц), 4,29 (т, 1H, J=7,4 Гц), 3,54 (с, 3H), 3,10-2,73 (м, 4H), 2,53 (с, 3H).
Категория III в соответствии с данным изобретением включает соединения, где R является замещенной или незамещенной тиазол-2-ильной группой, имеющей формулу:

один вариант которого относится к ингибиторам, имеющим формулу:
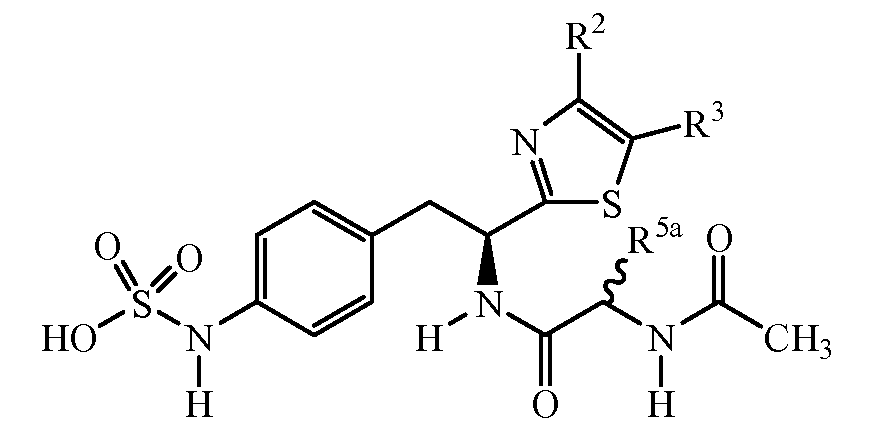
где группы R являются тиазол-2-ильными группами которые, если замещены, замещены группами R2 и R3. Группы R и R5a описаны в таблице V.
Соединения, попадающие в категорию III в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме IV и описанной в примере 5 ниже.
Схема IV

Реагенты и условия: (a) Ac-Phe, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 5
4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота (15)
Получение (S)-2-ацетамидо-N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)-этил]-3-фенилпропанамида (14): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,343 г, 0,957 ммоль), N-ацетил-L-фенилаланина (0,218 г), 1-гидроксибензотриазола (HOBt) (0,161 г), диизопропилэтиламина (0,26 г), в ДМФ (10 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,201 г). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,313 г (70% выход) желаемого продукта, который применяют без дальнейшей очистки. ЖХ/МС ИЭР+ 467 (M+1).
Получение 4-((S)-2-((S)-2-ацетамидо-3-фенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (15): (S)-2-Ацетамидо-N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-3-фенилпропанамид, 14, (0,313 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,320 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH (30 мл). Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,215 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD): δ 7,23-6,98 (м, 10H), 5,37 (т, 1Н), 4,64 (т, 1Н, J=6,3 Гц), 3,26-2,74 (м, 6H), 1,91 (с, 3H), 1,29 (т, 3H, J=7,5 Гц).
Далее представлены не ограничивающие примеры соединений, входящих в категорию III в соответствии с данным изобретением.

4-[(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-(4-трет-бутилтиазол-2-ил)этил]фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,22-7,17 (м, 5H), 7,06 (дд, J=14,1, 8,4 Гц, 4H), 6,97 (д, J=0,9 Гц, 1Н), 5,39 (дд, J=8,4, 6,0 Гц, 1Н), 4,65 (т, J=7,2 Гц, 1Н), 3,33-3,26 (м, 1Н), 3,13-3,00 (м, 3H), 2,80 (дд, J=13,5, 8,7 Гц, 1Н), 1,91 (с, 3H), 1,36 (с, 9H).

4-{(S)-2-((S)-2-Ацетамидо-3-фенилпропанамидо)-2-[4-(тиофен-3-ил)тиазол-2-ил]этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 8,58 (д, J=8,1 Гц, 1Н), 7,83-7,82 (м, 1Н), 7,57-7,46 (м, 3H), 7,28-6,93 (м, HH), 5,54-5,43 (м, 1Н), 4,69-4,55 (м, 2H), 3,41-3,33 (м, 1Н), 3,14-3,06 (3H), 2,86-2,79 (м, 1Н), 1,93 (с, 3H).
Первый аспект категории IV в соответствии с данным изобретением относится к соединениям, где R является замещенной или незамещенной тиазол-2-ильной группой, имеющей формулу:

один вариант которого относится к ингибиторам, имеющим формулу:

где группы R и R5a описаны в таблице VI.
Соединения, попадающие в категорию IV в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме V и описанной в примере 6 ниже.
Схема V

Реагенты и условия: (a) Boc-Val; EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.
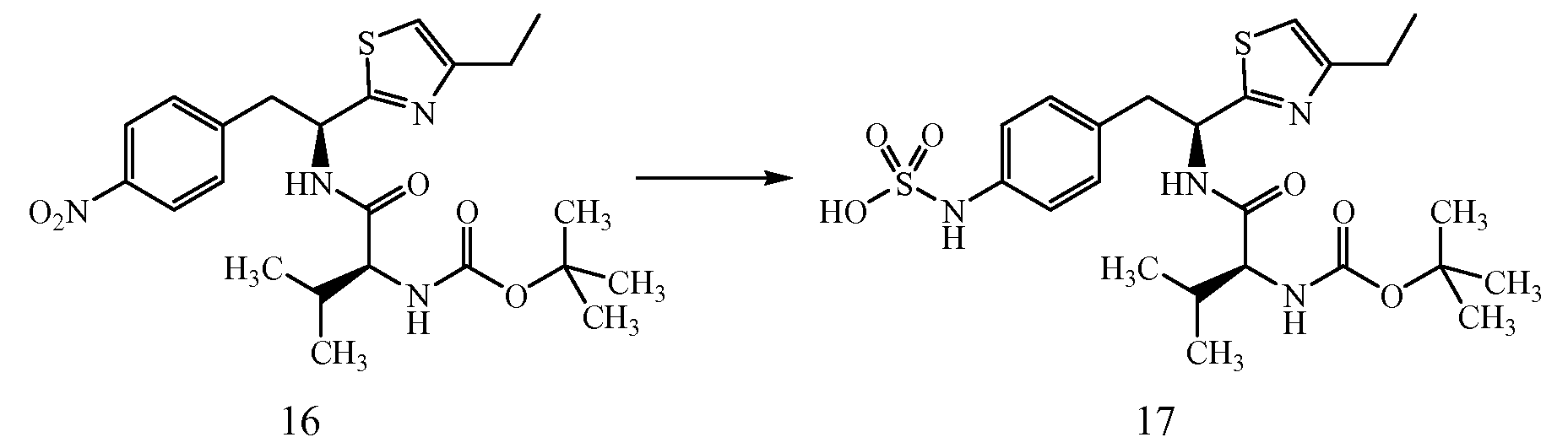
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 2 ч.
ПРИМЕР 6
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-3-метилбутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота (17)
Получение трет-бутил (S)-1-[(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино]-3-метил-1-оксобутан-2-илкарбамата (16): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,200 г, 0,558 ммоль), (S)-(2-трет-бутоксикарбониламино)-3-метилмасляной кислоты (0,133 г) и 1-гидроксибензотриазола (HOBt) (0,094 г) в ДМФ (5 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,118 г), затем диизопропиламин (0,151 г). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,219 г (82% выход) желаемого продукта, который применяют без дальнейшей очистки. ЖХ/МС ИЭР+ 477 (M+1).
Получение 4-{(S)-2-[(S)-2-(трет-бутоксикарбониламино)-3-метилбутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовой кислоты (17): трет-Бутил (S)-1-[(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино]-3-метил-1-оксобутан-2-илкарбамат, 16, (0,219 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 2 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (5 мл) и обрабатывают SO3-пиридином (0,146 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH (30 мл). Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,148 г желаемого продукта в виде аммониевой соли.1Н ЯМР (CD3OD ): δ 7,08 (с, 4H), 7,02 (с, 1Н), 5,43 (с, 1Н), 3,85 (с, 1Н), 3,28-2,77 (м, 4H), 1,94 (с, 1Н), 1,46 (с, 9H), 1,29 (с, 3H, J=7,3 Гц), 0,83 (с, 6H).
Далее представлены не ограничивающие примеры соединений, входящих в категорию IV в соответствии с данным изобретением.

(S)-4-{2-[2-(трет-Бутоксикарбонил)ацетамид]-2-(4-этилтиазол-2-ил)этил}-фенилсульфаминовая кислота:1H ЯМР (CD3OD ): δ 7,09-6,91 (м, 5H), 5,30 (т, 1Н, J=8,4 Гц), 3,60-2,64 (м, 6H), 1,34 (с, 9H), 1,16 (т, 3H, J=7,5 Гц).

4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-4-метилпентанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,19-7,00 (м, 4H), 5,50-5,40 (м, 1Н), 4,13-4,06 (м, 1Н), 3,32 (1Н, A ABX, J=7,5, 18 Гц), 3,12 (1Н, B ABX, J=8,1, 13,8 Гц), 2,79 (кв., 2H, J=7,8, 14,7 Гц), 1,70-1,55 (м, 1Н), 1,46 (с, 9H), 1,33 (т, 3H, J=2,7 Гц), 0,92 (кв., 6H, J=6, 10,8 Гц).
4-{(S)-2-[(S)-2-(трет-Бутоксикарбониламино)-4-метил-пентанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD) δ 8,06 (д, 1Н, J=8,4 Гц), 7,61-7,58 (м, 1Н), 7,57 (с, 1Н), 7,15 (т, 1Н, J=0,6 Гц), 7,09-6,98 (м, 6Н), 5,30-5,20 (м, 1Н), 4,10-4,00 (м, 1Н), 3,19-3,13 (м, 2Н), 1,63-1,55 (м, 2Н), 1,48-1,33 (м, 10Н), 0,95-0,89 (м, 6Н).

(S)-4-{2-[2-(трет-Бутоксикарбонил)амино]ацетамид-2-(4-этилтиазол-2-ил)этил}-фенилсульфаминовая кислота:1Н ЯМР (CD3OD): δ 7,09-6,91 (м, 5Н), 5,30 (т, 1Н, J=8,4 Гц), 3,60-2,64 (м, 6Н), 1,34 (с, 9Н), 1,16 (т, 3Н, J=7,5 Гц).
Другой вариант категории IV относится к ингибиторам, имеющим формулу:
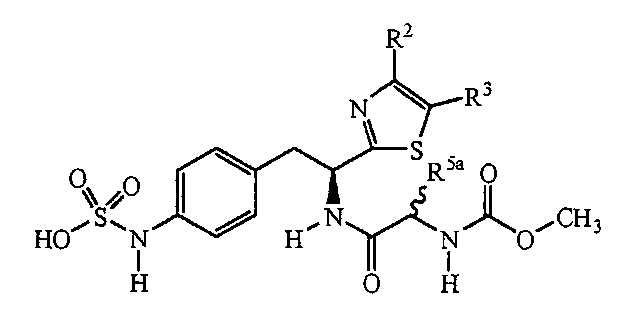
где группы R и группы R5a описаны в таблице VII.
Соединения, попадающие в этот вариант категории IV, могут быть получены по методике, представленной на схеме V и описанной в примере 6, заменяя соответствующим метилкарбаматом Boc-защищенный реагент. Далее представлены не ограничивающие примеры этого варианта.
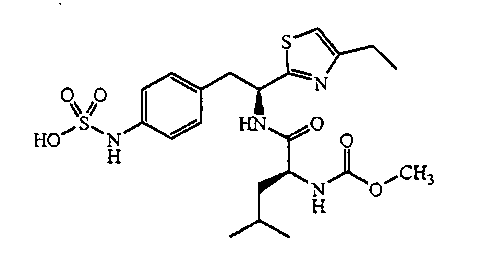
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-4-метилпентанамидо]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD) δ 7,12-7,03 (м, 5Н), 6,84 (д, 1Н, J=8,4 Гц), 5,40 (т, 1Н, J=5,7 Гц), 4,16 (т, 1Н, J=6,3 Гц), 3,69 (с, 3Н), 3,61-3,55 (м, 1Н), 3,29-3,27 (м, 1Н), 3,14-3,07 (м, 1Н), 2,81 (кв., 2Н, J=3,9, 11,2 Гц), 1,66-1,59 (м, 1Н), 1,48-1,43 (м, 2Н), 1,31 (т, 3Н, J=4,5 Гц), 0,96-0,90 (м, 6Н).

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(метоксикарбониламино)-ацетамидо]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD): δ 7,12-7,07 (м, 4Н), 7,03 (с, 1Н), 5,42 (т, 1Н, J=5,7 Гц), 3,83-3,68 (кв., 2Н, J=11,4 Гц), 3,68 (с, 3Н), 3,34-3,04 (м, 2Н), 2,83-2,76 (кв., 2Н, J=7,8 Гц), 1,31 (т, 3Н, J=7,5 Гц).
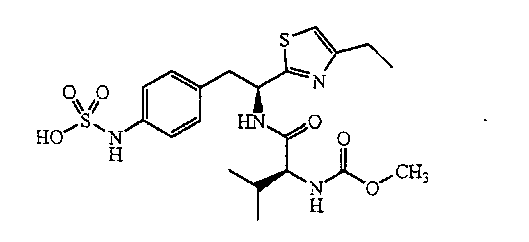
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[(S)-2-(метоксикарбониламино)-3-метилбутанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,56 (д, 1Н, J=7,8 Гц), 7,09 (с, 4Н), 7,03 (с, 1Н), 5,26-5,20 (м, 1Н), 3,90 (д, 1Н, J=7,8 Гц), 3,70 (с, 3Н), 3,30 (1Н, А АВХ, перекрыт растворителем), 3,08 (1Н, В АВХ, J=9,9, 9 Гц), 2,79 (кв., 2Н, J=11,1, 7,2 Гц), 2,05-1,97 (м, 1Н), 1,31 (т, 3Н, J=7,5 Гц), 0,88 (с, 3Н), 0,85 (с, 3Н), 0,79-0,75 (м, 1Н).

4-{(S)-2-[(S)-2-(Метоксикарбониламино)-4-метилпентанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1Н ЯМР (CD3OD) δ 8,22 (д, 1Н, J=9 Гц), 7,62-7,57 (м, Н), 7,15 (т, 1Н, J=0,6 Гц), 7,10-6,97 (м, 4Н), 5,30-5,20 (м, 1Н), 4,16-4,11 (м, 1Н), 3,67 (с, 2Н), 3,22 (1Н, А АВХ, J=6,9, 13,5 Гц), 3,11 (1Н, В АВХ, J=7,8, 13,6 Гц), 1,65-1,58 (м, 1Н), 1,50-1,45 (м, 2Н), 0,95-0,88 (м, 6Н).
Категория IV в соответствии с данным изобретением относится к соединениям, имеющим формулу:
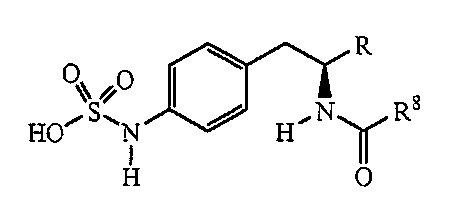
где R является замещенной или незамещенной тиофен-2-ильной или тиофен-4-ильной группой, и не ограничивающие примеры R2 описаны в таблице VIII.
Соединения, включенные в категорию IV в соответствии с данным изобретением, могут быть помечены по методике, представленной на схеме VI и описанной в примере 7 ниже.
Схема VI

Реагенты и условия: (a) (i) CH3CN; кипение с обратным холодильником, 1,5 ч. (ii) BoC2O, пиридин, CH2Cl2; кт, 2 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; кипение с обратным холодильником. (ii) SO3-пиридин, NH4OH; кт, 12 ч.
ПРИМЕР 7
трет-Бутиловый эфир [1-(S)-(Фенилтиазол-2-ил)-2-(4-сульфоаминофенил)этил]-карбаминовой кислоты (19)
Получение трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-(4-фенилтиазол-2-ил)этил]карбаминовой кислоты (18): Смесь трет-бутилового эфира [2-(4-нитрофенил)-1-(S)-тиокарбамоилэтил]карбаминовой кислоты, 2, (0,343 г, 1,05 ммоль), 2-бромацетофенона (0,231 г, 1,15 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 1,5 часов. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в CH2Cl2, затем добавляют пиридин (0,24 мл, 3,0 ммоль) и Boc2O (0,24 мл, 1,1 ммоль). Реакционную смесь перемешивают в течение 2 часов, и к раствору добавляют диэтиловый эфир, и полученный осадок отделяют фильтрацией. Органический слой сушат (Na2SO4), фильтруют и концентрируют до остатка, который очищают над двуокисью кремния с получением 0,176 г (39%) желаемого продукта. ИЭР+ МС 426 (M+1).
Получение трет-бутилового эфира [1-(S)-(фенилтиазол-2-ил)-2-(4-сульфоаминофенил)этил]карбаминовой кислоты (19): трет-бутиловый эфир [2-(4-нитрофенил)-1-(S)-(4-фенилтиазол-2-ил)этил]карбаминовой кислоты, 18, (0,176 г, 0,41 ммоль) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 12 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,195 г, 1,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, после чего добавляют 7% раствор NH4OH (10 мл). Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,080 г желаемого продукта в виде аммониевой соли.1H ЯМР (300 МГц, MeOH-d4) δ 7,93 (д, J=6,0 Гц, 2H), 7,68 (с, 1Н), 7,46-7,42 (м, 3H), 7,37-7,32 (м, 1Н), 7,14-7,18 (м, 3H), 5,13-5,18 (м, 1Н), 3,40 (дд, J=4,5 и 15,0 Гц, 1Н), 3,04 (дд, J=9,6 и 14,1 Гц, 1Н), 1,43 (с, 9H).
Далее представлены не ограничивающие примеры категории IV в соответствии с данным изобретением.

(S)-4-(2-(4-Метилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD ): δ 7,31 (с, 4H), 7,20 (с, 1Н), 5,61-5,56 (м, 1Н), 3,57-3,22 (м, 2H), 2,62 (с, 3H), 1,31 (с, 3H).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,92 (д, J=8,1 Гц, 1Н), 7,12-7,14 (м, 4H), 7,03 (с, 1Н), 5,38-5,46 (м, 1Н), 3,3-3,4 (м, 1Н), 3,08 (дд, J=10,2 и 13,8 Гц, 1Н), 2,79 (кв., J=7,2 Гц, 2H), 1,30 (т, J=7,2 Гц, 3H), 1,13 (с, 9H).

(S)-4-(2-(4-(Гидроксиметил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,92 (д, J=8,1 Гц, 1Н), 7,24 (с, 1Н), 7,08 (д, J=8,7 Гц, 2H), 7,00 (д, J=8,7 Гц, 2H), 5,29-5,37 (м, 1Н), 4,55 (с, 2H), 3,30 (дд, J=4,8 и 13,5 Гц, 1Н), 2,99 (дд, J=10,5 и 13,5 Гц, 1Н), 0,93 (с, 9H).

(S)-4-(2-(4-(Этоксикарбонил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 8,30 (с, 1Н), 8,04 (д, J=8,1 Гц, 1Н), 7,13 (с, 4H), 5,41-5,49 (м, 1Н), 4,41 (кв., J=7,2 Гц, 2H), 3,43 (дд, J=5,1 и 13,8 Гц, 1Н), 3,14 (дд, J=5,7 и 9,9 Гц, 1Н), 1,42 (т, J=7,2 Гц, 3H), 1,14 (с, 9H).

(S)-4-(2-(4-Фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,94-8,01 (м, 3H), 7,70 (с, 1Н), 7,42-7,47 (м, 2H), 7,32-7,47 (м, 1Н), 7,13-7,20 (м, 3H), 5,48-5,55 (м, 1Н), 3,50 (дд, J=5,1 и 14,1 Гц, 1Н), 3,18 (дд, J=10,2 и 14,1 Гц, 1Н), 1,17 (с, 9H).
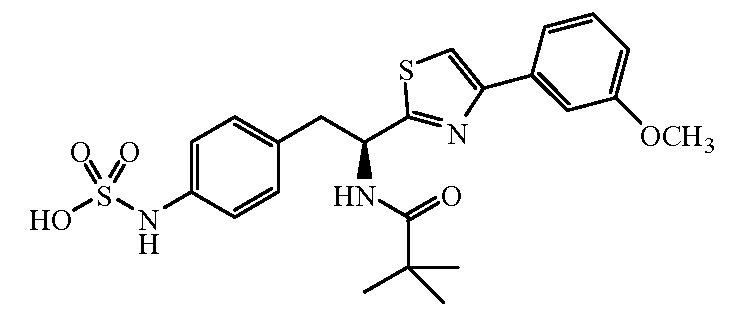
4-((S)-2-(4-(3-Метоксифенил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,96-7,93 (д, 1Н, J=8,1 Гц), 7,69 (с, 1Н), 7,51-7,49 (д, 2H, J=7,9 Гц), 7,33 (т, 1H, J=8,0 Гц), 7,14 (с, 4H), 6,92-6,90 (д, 1H, J=7,8 Гц), 5,50 (т, 1H, J=5,1 Гц), 3,87 (с, 3H), 3,50-3,13 (м, 2H), 1,15 (с, 9H).
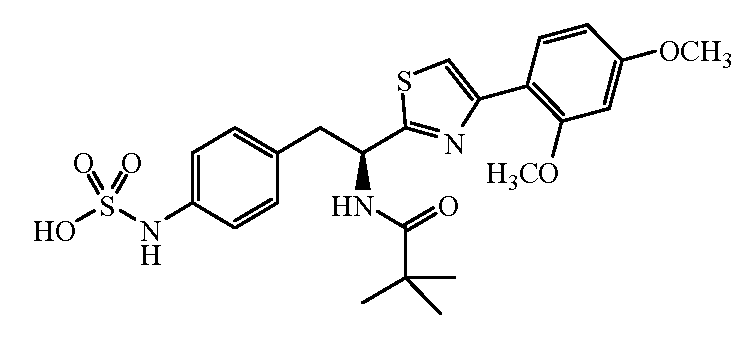
4-((S)-2-(4-(2,4-диметоксифенил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,11-8,09 (д, 1Н, J=7,8 Гц), 7,96-7,93 (д, 1Н, J=8,4 Гц), 7,74 (с, 1Н), 7,18-7,16 (м, 4H), 6,67-6,64 (д, 2H, J=9,0 Гц), 5,55-5,47 (м, 1Н), 3,95 (с, 3H), 3,87 (с, 3H), 3,52-3,13 (м, 2H), 1,17 (с, 9H).

(S)-4-(2-(4-Бензилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,85 (д, 1Н, J=8,4 Гц), 7,38-7,20 (м, 4H), 7,11-7,02 (м, 1Н), 7,00 (с, 1Н), 5,42-5,37 (м, 1Н), 4,13 (с, 2H), 3,13-3,08 (м, 2H), 1,13 (с, 9H).

(S)-4-(2-Пиваламидо-2-(4-(тиофен-2-илметил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,88-7,85 (д, 1Н), 7,38-7,35 (м, 1Н), 7,10-7,01 (м, 4H), 7,02 (с, 1Н), 5,45-5,38 (м, 1Н), 4,13 (с, 2H), 3,13-3,05 (м, 2H), 1,13 (2, 9H).

(S)-4-(2-(4-(3-Метоксибензил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,85 (д, 1Н, J=8,4 Гц), 7,25-7,20 (м, 1Н), 7,11-7,02 (м, 4H), 7,01 (с, 1Н), 6,90-6,79 (м, 2H), 5,45-5,40 (м, 1Н), 4,09 (с, 2H), 3,79 (с, 3H), 3,12-3,08 (м, 2H), 1,10 (с, 9H).

4-((S)-2-(4-(2,3-дигидробензо[b][1,4]диоксин-6-ил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H (CD3OD): δ 7,53 (с, 1Н), 7,45 (с, 1Н), 7,42-7,40 (д, 1Н, J=8,4 Гц), 7,19-7,15 (м, 4H), 6,91-6,88 (д, 2H, J=8,4 Гц), 5,51-5,46 (м, 1Н), 4,30 (с, 4H), 3,51-3,12 (м, 2H), 1,16 (с, 9H).

(S)-4-(2-(5-Метил-4-фенилтиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,63-7,60 (д, 2H, J=7,1 Гц), 7,49-7,35 (м, 3H), 7,14 (с, 4H), 5,43-5,38 (м, 1Н), 3,42-3,09 (м, 2H), 2,49 (с, 3H), 1,14 (с, 9H).

(S)-4-(2-(4-(Бифен-4-ил)тиазол-2-ил)-2-пиваламидоэтил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,04-8,01 (м, 2H), 7,72-7,66 (м, 5H), 7,48-7,35 (м, 3H), 7,15 (с, 4H), 5,50 (т, 1H, J=5,0 Гц), 3,57-3,15 (д, 2H), 1,16 (с, 9H).

(S)-4-(2-трет-Бутоксикарбонил-2-(2-метилтиазол-4-ил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, D2O) δ 6,99-7,002 (м, 4H), 6,82 (с, 1Н), 2,26 (дд, J=13,8 и 7,2 Гц, 1Н), 2,76 (дд, J=13,8 и 7,2 Гц, 1Н), 2,48 (с, 3H), 1,17 (с, 9H).

(S)-4-(2-(трет-Бутоксикарбонил)-2-(4-пропилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,18-7,02 (м, 5H), 5,06-5,03 (м, 1Н), 3,26 (дд, J=13,8, 4,8 Гц, 1Н), 2,95 (дд, J=13,8, 9,3 Гц, 1Н), 2,74 (дд, J=15,0, 7,2 Гц, 2H), 1,81-1,71 (м, 2H), 1,40 (с, 7H), 1,33 (ушир.с, 2H), 0,988 (т, J=7,5 Гц 3H).

(S)-4-(2-(трет-Бутоксикарбонил)-2-(4-трет-бутилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,12 (с, 4H), 7,01 (с, 1Н), 5,11-5,06 (м, 1Н), 3,32-3,25 (м, 1Н), 2,96 (м, 1Н), 1,42 (с, 8H), 1,38 (с, 9H), 1,32 (с, 1Н).

(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(метоксиметил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1Н ЯМР (300 МГц, CD3OD): δ 7,36 (с, 1Н), 7,14-7,05 (м, 4Н), 5,06 (дд, J=9,0, 5,1 Гц, 1Н), 4,55 (с, 2Н), 3,42 (с, 3Н), 3,31-3,24 (м, 1Н), 2,97 (дд, J=13,8, 9,9 Гц, 1Н), 1,47-1,31 (м, 9Н).

(S)-4-(2-трет-Бутоксикарбониламино)-2-(4-(2-гидроксиметил)-тиазол-2-ил)этил)фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,22-7,25 (м, 1Н), 7,09-7,15 (м, 4Н), 5,00-5,09 (м, 1Н), 4,32-4,35 (м, 1Н), 3,87 (т, J=6,6 Гц, 2Н), 3,23-3,29 (м, 1Н), 3,09-3,18 (м, 1Н), 2,98 (т, J=6,6 Гц, 2Н), 1,41 (с, 9Н).

(S)-(4-(2-трет-Бутоксикарбониламино)-2-(4-(2-этокси-2-оксоэтил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,29 (с, 1Н), 7,09-7,16 (м, 4Н), 5,04-5,09 (м, 1Н), 4,20 (кв., J=6,9 Гц, 2Н), 3,84 (с, 2Н), 3,30 (дд, J=4,8 и 14,1 Гц, 1Н), 2,97 (дд, J=9,6 Гц и 13,8 Гц, 1Н), 1,41 (с, 9Н), 1,29 (т, J=7,2 Гц, 3Н).

(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-(2-метокси-2-оксоэтил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,31 (с, 1Н), 7,01-7,16 (м, 4H), 5,04-5,09 (м, 1Н), 4,01 (с, 2H), 3,78 (с, 2H), 3,74 (с, 3H), 3,29 (дд, J=5,1 и 13,8 Гц, 1Н), 2,99 (дд, J=9,3 и 13,8 Гц, 1Н), 1,41 (с, 9H).

(S)-4-(2-(трет-Бутоксикарбониламино)-2-(2-(пивалоилокси)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, D2O) δ 6,95 (с, 4H), 6,63 (с, 1Н), 2,94 (дд, J=13,5 и 4,8 Гц, 1Н), 2,75 (дд, J=13,5 и 4,8 Гц, 1Н), 1,16 (с, 9H), 1,13 (с, 9H).

(S)-4-(2-(трет-Бутоксикарбониламино)-2-(5-фенилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,98 (с, 1Н), 7,62 (д, J=7,2 Гц, 2H), 7,46-7,35 (м, 4H), 7,14 (с, 4H), 5,09 (ушир.с, 1Н), 3,07-2,99 (м, 2H), 1,43 (с, 9H).

4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(3-(трифторметил)фенил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 8,28 (с, 1Н), 8,22-8,19 (м, 1H), 7,89 (с, 1Н), 7,65 (д, J=5,1 Гц, 2H), 7,45 (д, J=8,1 Гц, 1Н), 7,15 (с, 4H), 5,17-5,14 (м, 1Н), 3,43-3,32 (м, 1Н), 3,05 (дд, J=14,1, 9,6 Гц, 1Н), 1,42 (с, 9H).
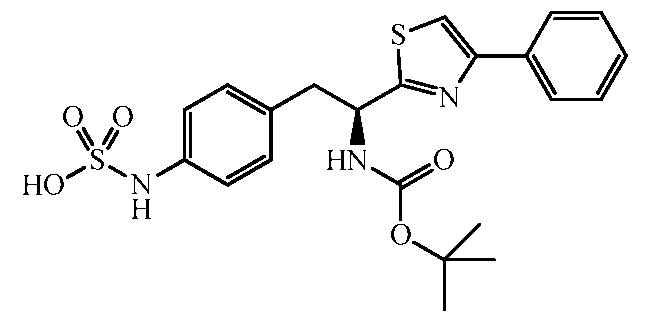
(S)-4-(2-(трет-Бутоксикарбониламино)-2-(4-фенилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,98 (с, 1Н), 7,94 (д, J=7,2 Гц, 2H), 7,46-7,35 (м, 4H), 7,14 (с, 4H), 5,09 (ушир.с, 1Н), 3,07-2,99 (м, 2H), 1,43 (с, 9H).
Метиловый эфир (S,S)-2-(2-{2-[2-трет-Бутоксикарбониламино-2-(4-сульфоаминофенил)этил]тиазол-4-ил}ацетиламидо)-3-фенилпропионовой кислоты:1H ЯМР (300 МГц, MeOH-d4) δ 6,85-6,94 (м, 9H), 6,64 (с, 1Н), 4,83 (с, 1Н), 4,54-4,58 (м, 1Н), 3,49 (с, 3H), 3,39 (с, 2H), 2,80-2,97 (м, 1Н), 2,64-2,78 (м, 1Н), 1,12 (с, 9H).
трет-Бутиловый эфир (S)-[1-{1-оксо-4-[2-(1-фенил-1H-тетразол-5-сульфонил)этил]-1H-1л4-тиазол-2-ил}-2-(4-сульфамино-фенил)этил]карбаминовой кислоты:1H ЯМР (300 МГц, MeOH-d4) δ 7,22-7,75 (м, 2H), 7,62-7,69 (м, 2H), 7,55 (с, 1Н), 7,10-7,20 (м, 5H), 5,25 (м, 1Н), 4,27-4,36 (м, 1Н), 4,11-4,21 (м, 1Н), 3,33-3,44 (м, 4H), 2,84-2,90 (м, 1Н), 1,33 (с, 9H).

4-((S)-2-(трет-Бутоксикарбониламино)-2-(4-(тиофен-3-ил)тиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, CD3OD): δ 7,84 (дд, J=3,0, 1,5 Гц, 1Н), 7,57-7,55 (м, 2H), 7,47 (дд, J=4,8, 3,0 Гц, 1Н), 7,15 (с, 4H), 5,15-5,10 (м, 1Н), 3,39-3,34 (м, 1Н), 3,01 (дд, J=14,1, 9,6 Гц, 1Н), 1,42 (с, 8H), 1,32 (с, 1Н).
(S)-4-(2-(Бензо[d]тиазол-2-иламино)-2-(трет-бутоксикарбонил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,86-7,82 (м, 2H), 7,42 (т, 2H, J=7,1 Гц), 7,33 (т, 1Н, J=8,2 Гц), 7,02 (с, 4H), 5,10-5,05 (м, 1Н), 2,99-2,91 (м, 2H), 1,29 (с, 9H).
(S)-4-(2-трет-Бутоксикарбониламино)-2-(2-метилтиазол-4-ил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, D2O) δ 6,99-7,002(м, 4H), 6,82 (с, 1Н), 2,26 (дд, J=13,8 и 7,2 Гц, 1Н), 2,76 (дд, J=13,8 и 7,2 Гц, 1Н), 2,48 (с, 3H), 1,17 (с, 9H).
Первый аспект категории V в соответствии с данным изобретением относится к 2-(тиазол-2-ил) соединениям, имеющим формулу:
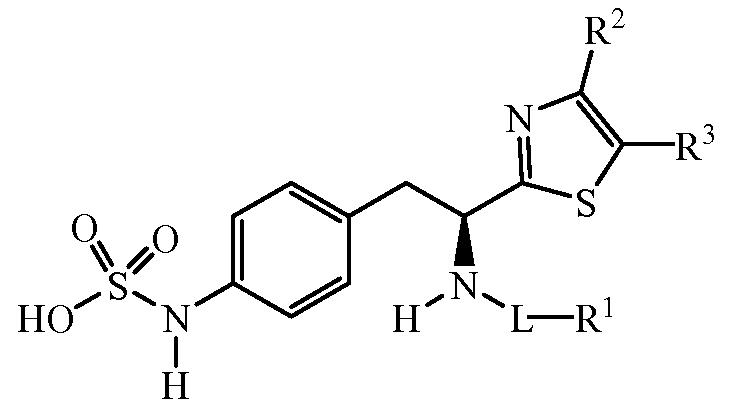
где R1, R2, R3 и L определены в таблице IX ниже.
Соединения, попадающие в первый аспект категории V в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме VII и описанной в примере 8 ниже.
Схема VII

Реагенты и условия: (a) C6H4CO2H, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 8
{4-[2-(S)-(4-Этилтиазол-2-ил)-2-(2-фенилацетиламидо)этил]фенил}сульфаминовая кислота (21)
Получение N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-фенилацетамида (20): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,393 г, 1,1 ммоль), фенилуксусной кислоты (0,190 г, 1,4 ммоль) и 1-гидроксибензотриазола (HOBt) (0,094 г, 0,70 ммоль) в ДМФ (10 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,268 г, 1,4 ммоль), затем триэтиламин (0,60 мл, 4,2 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,260 г (60% выход) желаемого продукта, который применяют без дальнейшей очистки. ИЭР+ МС 396 (M+1).
Получение {4-[2-(S)-(4-этилтиазол-2-ил)-2-(2-фенилацетиламидо)этил]фенил}сульфаминовая кислота (21): N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-фенилацетамид, 20, (0,260 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,177 г, 1,23). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH (10 мл). Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,136 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD) δ 8,60 (д, 1Н, J=8,1 Гц), 7,33-7,23 (м, 3H), 7,16-7,00 (м, 6H), 5,44-5,41 (м, 1Н), 3,28 (1Н, A ABX, перекрыт растворителем), 3,03 (1Н, B ABX, J=14,1, 9,6 Гц), 2,80 (кв., 2H, J=10,5, 7,8 Гц) 1,31 (т, 3H, J=4,6 Гц).
Далее представлены не ограничивающие примеры первого аспекта категории V в соответствии с данным изобретением.

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-фторфенил)ацетамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,65 (д, 1Н, J=8,4 Гц), 7,29-7,15 (м, 1Н), 7,13-7,03 (м, 7H), 5,46-5,42 (м, 1Н), 3,64-3,51 (м, 2H), 3,29 (1Н), 3,04 (1Н, B ABX, J=13,8, 9,6 Гц), 2,81 (кв., 2H, J=15,6, 3,9 Гц), 1,31 (т, 3H, J=7,8 Гц).19F ЯМР (CD3OD) δ 43,64.

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-фторфенил)ацетамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,74 (д, 1Н, J=8,4 Гц), 7,32 (кв., 1Н, J=6,6, 14,2 Гц), 7,10-6,91 (м, 8H), 5,47-5,40 (м, 1Н), 3,53 (с, 2H), 3,30 (1Н), 3,11 (1Н, B ABX, J=9,6, 14,1 Гц), 2,80 (кв., 2H, J=6,6, 15,1 Гц), 1,31 (т, 3H, J=7,8 Гц).19F ЯМР δ 47,42.
(S)-4-(2-(2-(2,3-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,16-7,05 (м, 5H), 6,85-6,80 (м, 1Н), 5,48-5,43 (м, 1Н), 3,63 (с, 2H), 3,38 (1Н, A ABX, перекрыт растворителем), 3,03 (1Н), 2,80 (кв., H, J=15,1, 7,8 Гц), 1,31 (т, 3H, J=7,5 Гц).
(S)-4-(2-(2-(3,4-Дифторфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,75 (д, 1Н, J=7,8 Гц), 7,23-7,04 (м, 6H), 6,88-6,84 (м, 1Н), 5,44-5,40 (м, 1Н), 3,49 (с, 2H), 3,34 (1Н), 3,02 (1Н, B ABX, J=14,1, 9,9 Гц), 2,80 (кв., 2H, J=15,1, 7,8 Гц), 1,31 (т, 1Н, J=7,5 Гц).19F ЯМР (CD3OD) δ 22,18, 19,45.

(S)-4-(2-(2-(2-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,39-7,36 (м, 1Н), 7,27-7,21 (м, 2H), 7,15-6,98 (м, 5H), 5,49-5,44 (м, 1Н), 3,69 (д, 2H, J=11,7 Гц), 3,32 (1Н), 3,04 (1Н, B ABX, J=9,3, 13,9 Гц), 2,80 (кв., 2H, J=7,8, 15,3 Гц), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-(2-(2-(3-Хлорфенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,33-7,23 (м, 3H), 7,13-7,03 (м, 5H), 5,43 (кв., 1Н, J=5,1, 9,6 Гц), 3,51 (с, 2H), 3,29 (1Н), 3,03 (1Н, B ABX, J=9,9, 14,1 Гц), 2,80 (кв., 2H, J=7,5, 15 Гц), 1,31 (т, 3H, J=7,8 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(3-гидроксифенил)ацетамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,16-7,08 (м, 3H), 7,03-7,00 (м, 3H), 6,70-6,63 (м, 2H), 5,42-5,40 (м, 1Н), 3,44 (с, 2H), 3,28 (1Н, A ABX, перекрыт растворителем), 3,04 (B ABX, J=14,1, 9,6 Гц), 2,89 (кв., 2H, J=15, 7,5 Гц), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(2-(2-метоксифенил)ацетамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,00 (д, 1Н, J=7,8 Гц), 7,26 (т, 1Н, J=13,2 Гц), 7,09-7,05 (м, 4H), 7,01 (с, 1Н), 6,91-6,89 (м, 4H), 5,44-5,39 (м, 1Н), 3,71 (с, 3H), 3,52 (с, 2H), 3,26 (1Н, A ABX, J=14,1, 5,1 Гц), 3,06 (1Н B ABX, J=13,8, 8,4 Гц), 2,80 (кв., 2H, J=8,1, 15,6 Гц), 1,31 (т, 3H, J=1,2 Гц).

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-метоксифенил)ацетамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,58 (д, 1Н, J=8,1 Гц), 7,21 (т, 1Н, J=7,8 Гц), 7,12-7,02 (м, 4H), 6,81 (с, 2H), 6,72 (д, 1Н, J=7,5 Гц), 5,45-5,40 (м, 1Н), 3,79 (с, 3H), 3,50 (с, 2H), 3,29 (1Н, A ABX, перекрыт растворителем), 3,08 (1Н, B ABX, J=11,8, 5,1 Гц), 2,80 (кв., 2H, J=15, 7,5 Гц), 1,31 (т, 3H, J=6,6 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-фенилпропанамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,56 (д, 1Н, J=8,4 Гц), 7,25-6,98 (м, 9H), 5,43-5,38 (м, 1Н), 3,26 (1Н, A ABX, J=14,1, 9,6 Гц), 2,97 (1Н, B ABX, J=10,9, 3 Гц), 2,58-2,76 (м, 3H), 2,98 (кв., 2H, J=13,8, 7,2 Гц), 1,29 (т, 3H, J=8,7 Гц).

(S)-4-(2-(2-(3,4-диметоксифенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,12-7,03 (м, 3H), 6,91 (д, 1Н, J=8,4 Гц), 6,82 (с, 1Н), 6,66 (д, 1Н, J=2,1 Гц), 6,63 (д, 1Н, J=2,1 Гц), 5,43 (м, 1Н), 3,84 (с, 3H), 3,80 (с, 3H), 3,45 (с, 2H), 3,30 (1Н), 3,03 (1Н, B ABX, J=14,1, 9,6 Гц), 2,79 (кв., 2H, J=15,1, 7,2 Гц), 1,30 (т, 3H, J=7,2 Гц).

(S)-4-(2-(2-(2,3-диметоксифенил)ацетамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,31 (д, 1Н, J=7,8 Гц), 7,11-6,93 (м, 6H), 6,68 (д, 1Н, J=7,5 Гц), 5,49-5,40 (м, 1Н), 3,87 (с, 3H), 3,70 (с, 3H), 3,55 (с, 2H), 3,26 (1Н, A ABX, перекрыт растворителем), 3,06 (1Н, B ABX, J=13,9, 9 Гц), 2,80 (кв., 2H, J=14,8, 7,5 Гц), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-(2-(3-(3-Хлорфенил)пропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,27-7,18 (м, 3H), 7,13-7,08 (м, 5H), 7,01 (с, 1Н), 5,39 (кв., 1Н, J=5,1, 9,4 Гц), 3,28 (1Н, A ABX, J=5,1, 14,1 Гц), 2,97 (1Н, B ABX, J=9,3, 13,9 Гц), 2,88-2,76 (м, 4H), 2,50 (т, 2H, J=8,1 Гц), 1,31 (т, 3H, J=7,8 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(2-метоксифенил)пропанамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,18-7,08 (м, 6H), 6,92 (д, 1Н, J=8,1 Гц), 6,82 (т, 1Н, J=7,5 Гц), 5,40-5,35 (м, 1Н), 3,25 (1Н, A ABX, J=15, 5,4 Гц), 3,00 (1Н, B ABX, J=10,5, 7,5 Гц), 2,88-2,76 (м, 4H), 2,47 (кв., 2H, J=9,1, 6 Гц), 1,31 (т, 3H, J=7,8 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(3-метоксифенил)пропанамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,19-7,00 (м, 5H), 6,75 (с, 1Н), 6,73 (с, 1Н), 5,42-5,37 (м, 1Н), 3,76 (с, 3H), 3,25 (1Н, A ABX, J=13,9, 5,4 Гц), 2,98 (1Н, B ABX, J=14,1, 9,6 Гц), 2,86-2,75 (м, 4H), 2,48 (кв., 2H, J=11,7, 1,2 Гц), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(3-(4-метоксифенил)пропанамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,13-6,99 (м, 7H), 6,82-6,78 (м, 2H), 5,42-5,37 (м, 1Н), 3,33 (с, 3H), 3,23 (1Н), 2,97 (1Н, B ABX, J=13,3, 11,4 Гц), 2,83-2,75 (м, 4H), 2,49 (кв., 2H, J=6,4, 3,3 Гц), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-{2-[2-(4-Этил-2,3-диоксопиперазин-1-ил)ацетамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,14 (с, 4H), 7,08 (с, 1Н), 5,56-5,51 (м, 1Н), 4,34 (д, 2H, J=16,2 Гц), 3,88 (д, 2H, J=17,6 Гц), 3,59-3,40 (м, 3H), 3,26-3,14 (м, 3H), 2,98 (1Н, B ABX, J=10,8, 13,9 Гц), 2,82 (кв., 2H, J=6,9, 15 Гц), 1,32 (т, 3H, J=7,5 Гц), 1,21 (т, 3H, J=7,2 Гц).

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)ацетамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,13 (с, 1Н), 7,06-7,02 (м, 4H), 6,95 (с, 1Н), 5,42-5,31 (м, 1Н), 4,43-4,18 (дд, 2H, J=16,5 Гц), 3,24-2,93 (м, 2H), 2,74-2,69 (кв., 2H, J=7,3 Гц), 1,79 (с, 3H), 1,22 (т, 3H, J=7,5 Гц).

(S)-4-[2-(бензо[d][1,3]диоксол-5-карбоксамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,25 (д, 1Н, J=6,5 Гц), 7,13 (с, 1Н), 7,06 (д, 2H, J=8,5 Гц), 7,00 (д, 2H, J=8,5 Гц), 6,91 (с, 1Н), 6,76 (д, 1Н, J=8,1 Гц), 5,90 (с, 2H), 5,48 (кв., 1Н, J=5,0 Гц), 3,32-3,24 (м, 2H), 3,07-2,99 (м, 2H), 2,72 (кв., 2H, J=7,5 Гц), 1,21 (т, 3H, J=7,5 Гц).
(S)-4-{2-[2-(2,5-диметилтиазол-4-ил)ацетамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,10-7,01 (м, 5H), 5,41 (т, 1Н, J=6,9 Гц), 3,58 (с, 2H), 3,33-3,01 (м, 2H), 2,82-2,75 (кв., 2H, J=7,5 Гц), 2,59 (с, 3H), 2,23 (с, 3H), 1,30 (т, 3H, J=7,5 Гц).

(S)-4-{2-[2-(2,4-диметилтиазол-5-ил)ацетамидо]-2-(4-метилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,71-8,68 (д, 1Н, J=8,4 Гц), 7,10-7,03 (м, 4H), 7,01 (с, 1Н), 5,41 (м, 1Н), 3,59 (с, 1Н), 3,34-2,96 (м, 2H), 2,59 (с, 3H), 2,40 (с, 3H), 2,23 (с, 3H).

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[3-(тиазол-2-ил)пропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,67-7,65 (м, 1Н), 7,49-7,47 (м, 1Н), 7,14-7,08 (м, 4H), 7,04 (с, 1Н), 5,46-5,41 (кв., 1H, J=5,1 Гц), 3,58 (с, 2H), 3,30-3,25 (м, 3H), 3,02-2,67 (м, 5H), 1,31 (т, 3H, J=7,5 Гц).

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(4-этилтиазол-2-ил)ацетамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,04-6,91 (м, 6H), 5,32 (т, 1Н, J=5,4 Гц), 3,25-2,90 (м, 2H), 2,71-2,61 (м, 4H) 1,93 (с, 2H) 1,22-1,14 (м, 6H).
Второй аспект категории V в соответствии с данным изобретением относится к 2-(тиазол-4-ил) соединениям, имеющим формулу:
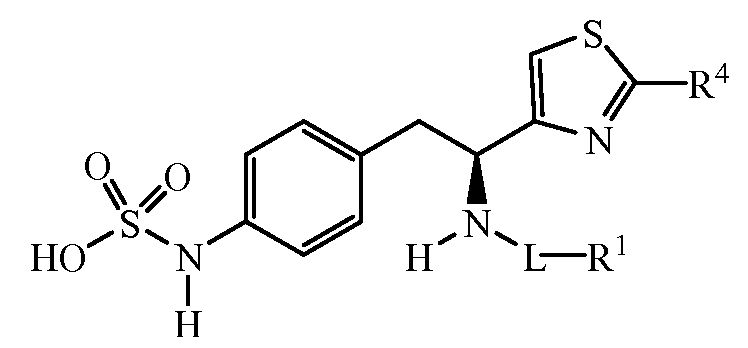
где R1, R4 и L определены в таблице X ниже.
Соединения, попадающие во второй аспект категории I в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме II и описанной в примере 9 ниже.
Схема VIII

Реагенты и условия: (a) CH3CN; кипение с обратным холодильником 5 ч.

Реагенты и условия: (b) (3-Cl)C6H4CO2H, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (c) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 9
4-((S)-2-(2-(3-хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота (23)
Получение гидробромида (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)тиазол-4-ил]этанамина (22): Смесь (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (7,74 г, 20 ммоль) и амида тиофен-2-карботиокислоты (3,14 г, 22 ммоль) в CH3CN (200 мл) кипятят с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры, и к раствору добавляют диэтиловый эфир (50 мл). Полученный осадок собирают фильтрацией. Твердое вещество сушат в вакууме с получением 7,14 г (87% выход) желаемого продукта. ИЭР+ МС 332 (M+1).
Получение 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}ацетамида (23): К раствору 2-(4-нитрофенил)-1-(2-тиофен-2-илтиазол-4-ил)этиламина, 22, (0,41 г, 1 ммоль), 3-хлорфенилуксусной кислоты (0,170 г, 1 ммоль) и 1-гидроксибензотриазола (HOBt) (0,070 г, 0,50 ммоль) в ДМФ (5 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,190 г, 1 ммоль), затем триэтиламин (0,42 мл, 3 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,290 г (60% выход) желаемого продукта, который применяют без дальнейшей очистки. ИЭР-МС 482 (М-1).
Получение (S)-(4-(2-(2-(3-хлорфенил)ацетиламино]-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовой кислоты (24): 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}ацетамид, 23, (0,290 г) растворяют в МеОН (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,157 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,078 г желаемого продукта в виде аммониевой соли.1Н ЯМР (CD3OD) δ 7,61 (д, 1Н, J=3,6 Гц), 7,58 (д, 1Н, J=5,1 Гц), 7,41-7,35 (м, 1Н), 7,28-7,22 (м, 2Н), 7,18-6,98 (м, 6Н), 5,33 (т, 1Н, J=6,6 Гц), 3,70 (д, 2Н, J=3,9 Гц), 3,23 (1Н, А АВХ, J=6,6, 13,8 Гц), 3,07 (1Н, В АВХ, J=8,1, 13,5 Гц).
Далее представлены не ограничивающие примеры первого аспекта категории V в соответствии с данным изобретением.

4-((S)-2-(2-(3-Метоксифенил)ацетамидо)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,35 (д, 1Н, J=8,7 Гц), 7,61-7,57 (м, 2H), 7,25-7,20 (м, 2H), 7,25-7,20 (м, 2H), 7,09 (с, 1Н), 7,05 (д, 2H, J=4,2 Гц), 6,99 (д, 1Н, J=8,7 Гц), 6,81 (д, 1Н, J=7,8 Гц), 6,77 (с, 1Н), 5,30-5,28 (м, 1Н), 3,76 (с, 3H), 3,51 (с, 2H), 3,20 (1Н, A ABX, J=6,3, 13,6 Гц), 3,06 (1H, B ABX, J=8,1, 13,8 Гц).
4-{(S)-2-(3-Фенилпропанамидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,30 (д, 1Н, J=9 Гц), 7,61-7,56 (м, 2H), 7,26-7,14 (м, 7H), 7,12 (д, 1Н, J=1,5 Гц), 7,09 (д, 1Н, J=2,1 Гц), 6,89 (с, 1Н), 5,28-5,26 (м, 1Н), 3,18 (1Н, A ABX, J=6,2, 13,8 Гц), 2,96 (1Н, B ABX, J=8,4, 13,6 Гц).

4-{(S)-2-(3-(3-Хлорфенил)пропанамидо)-2-[2-(тиофен2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,61-7,56 (м, 3H), 7,22-7,14 (м, 6H), 7,08 (д, 1Н), 7,00 (д, 1Н, J=77,5 Гц), 6,870 (с, 1Н), 5,25 (т, 1Н, J=7,8 Гц), 3,18 (1Н, A ABX, J=6,6, 13,8 Гц), 2,97 (1Н, B ABX, J=7,8, 13,8 Гц), 2,87 (т, 2H, J=7,5 Гц), 2,51 (т, 2H, J=7,2 Гц).
4-{(S)-2-[2-(3-Фторфенил)ацетамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,61-7,57 (м, 2H), 7,32-7,28 (м, 1Н), 7,19-7,16 (м, 2H), 7,08 (т, 1Н, J=4,5 Гц), 7,02-6,95 (м, 6H), 5,29 (т, 1Н, J=8,1 Гц), 3,53 (с, 2H), 3,22 (1Н, A ABX, J=6,6, 13,9 Гц), 3,06 (1Н, B ABX, J=8,4, 13,6 Гц).
(S)-4-{2-[2-(3-Метил-1,2,4-оксадиазол-5-ил)ацетамидо]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,98-7,95 (м, 2H), 7,48-7,46 (м, 3H), 7,23 (с, 1Н), 7,09-7,05 (м, 4H), 5,33 (т, 1Н, J=7,2 Гц), 3,33-3,06 (м, 2H), 2,35 (с, 3H).

4-{(S)-2-[2-(4-этил-2,3-диоксопиперазин-1-ил)ацетамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,62 (д, 1Н, J=3 Гц), 7,58 (д, 1Н, J=15,6 Гц), 7,27 (с, 1Н), 7,16 (т, 1Н, J=1,5 Гц), 5,42-5,32 (м, 1Н), 4,31 (д, 1Н, J=15,6 Гц), 3,91 (д, 1Н, J=15,9 Гц), 3,60-3,50 (м, 4H), 3,30-3,23 (м, 2H), 2,98 (1Н, B ABX, J=9,9, 13,8 Гц), 1,21 (т, 3H, J=6,9 Гц).
Третий аспект категории V в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где связывающая группа L содержит фенильную группу, где указанная связывающая группа имеет формулу:
-C(O)[(CR5З)][(CR6З)]-
R1 является водородом, R6a является фенилом, R5a является фенилом или замещенным фенилом и не ограничивающие примеры групп R2, R3 и R5a представлены в таблице XI.
Соединения, попадающие в третий аспект категории V в соответствии с данным изобретением, могут быть получены по методике, представленной на схеме IX и описанной в примере 10 ниже.
Схема IX
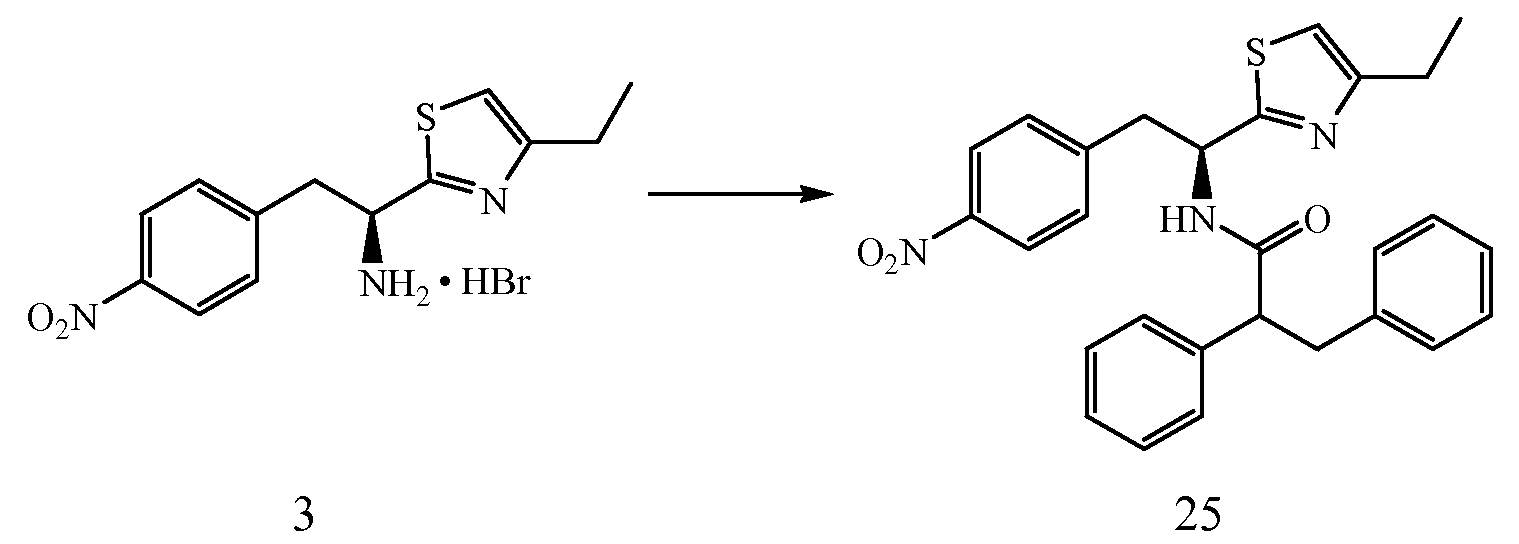
Реагенты и условия: (a) дифенилпропионовая кислота, EDCI, HOBt, TEA, ДМФ; 0°C до кт, 18 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 10
(S)-4-(2-(2,3-дифенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота (26)
Получение (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенилпропанамид (25): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,95 г, 2,65 ммоль), дифенилпропионовой кислоты (0,60 г, 2,65 ммоль) и 1-гидроксибензотриазола (HOBt) (0,180 г, 1,33 ммоль) в ДМФ (10 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,502 г, 2,62 ммоль), затем триэтиламин (1,1 мл, 7,95 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,903 г (70% выход) желаемого продукта, который применяют без дальнейшей очистки.
Получение (S)-4-(2-(2,3-дифенилпропанамидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (26) (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенилпропанамид, 25, (0,903 г) растворяют в MeOH (10 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (30 мл) и обрабатывают SO3-пиридином (0,621 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Смесь затем концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,415 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD) δ 8,59-8,52 (м, 1Н), 7,37-7,04 (м, 9H), 6,97-6,93 (м, 1Н), 6,89-6,85 (м, 2H), 5,36-5,32 (м, 1Н), 3,91-3,83 (м, 1Н), 3,29 (1Н, A ABX, перекрыт растворителем), 3,15 (1Н, B ABX, J=5,4, 33,8 Гц), 2,99-2,88 (м, 2H), 2,81-2,69 (м, 2H), 1,32-1,25 (м, 3H).
Предшественники многих групп Z, которые составляют третий аспект категории V, не являются легкодоступными. Представленная ниже методика иллюстрирует пример методики, которую применяют для получения различных групп R5a в соответствии с данным изобретением. Используя методику, представленную на Схеме X и описанную в примере 11, специалист в данной области техники сможет легко провести модификации без излишнего экспериментирования для получения групп R5a, включенных в данное изобретение.
Схема X

Реагенты и условия: (a) бензилбромид, LDA, ТГФ; 0°C до кт 18 ч.

Реагенты и условия: (b) NaOH, ТГФ/MeOH; кт, 18 ч.
ПРИМЕР 11
2-(2-Метоксифенил)-3-фенилпропановая кислота (28)
Получение метил 2-(2-метоксифенил)-3-фенилпропаноата (27): В 500 мл круглодонную колбу загружают метил 2-(2-метоксифенил)ацетат (8,496 г, 47 ммоль, 1 экв.) и ТГФ (200 мл). Гомогенную смесь охлаждают до 0°C на ледяной бане. Добавляют диизопропиламид лития (23,5 мл 2,0M раствор в гептане/ТГФ), сохраняя температуру менее 3°C. Реакционную смесь перемешивают в течение 45 минут при такой пониженной температуре. По каплям добавляют бензилбромид (5,6 мл, 47 ммоль, 1 экв.). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают в течение 18 часов. Реакцию гасят 1N HCl и экстрагируют 3 раза равными порциями EtOAc. Объединенные экстракты промывают H2O и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают над двуокисью кремния с получением 4,433 г (35%) желаемого соединения. ИЭР+ МС 293 (M+Na).
Получение 2-(2-метоксифенил)-3-фенилпропановой кислоты (28): Метил 2-(2-метоксифенил)-3-фенилпропаноат (4,433 г, 16 ммоль, 1 экв.) растворяют в 100 мл 1:1 (об.:об.) смеси ТГФ и метанола. Добавляют гидроксид натрия (3,28 г, 82 ммоль, 5 экв.), и реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Затем реакционную смесь выливают в H2O и pH доводят до 2 добавлением 1N HCl. Образуется белый осадок, который удаляют фильтрацией. Полученный раствор экстрагируют 3 порциями диэтилового эфира. Экстракты объединяют, промывают H2O и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученный остаток очищают над двуокисью кремния с получением 2,107 г (51%) желаемого соединения. ИЭР-МС 255 (M-1), 211 (M-CO2H).
Промежуточное соединение 28 может быть использовано в методике, представленной на Схеме IX и описанной в примере 10 для получения следующих соединений в соответствии с третьим аспектом категории V.

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(2-метоксифенил)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,32-7,12 (м, 7H), 7,05-7,02 (м, 1Н), 6,99-6,83 (м, 4H), 6,80-6,75 (м, 2H), 5,35-5,31 (м, 1Н), 4,31-4,26 (м, 1Н), 3,75 (с, 3H), 3,20-2,90 (м, 4H), 2,79-2,74 (м, 2H), 1,32-1,25 (м, 3H).
Далее представлены не ограничивающие примеры соединений в соответствии с третьим аспектом категории I в соответствии с данным изобретением.

(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-фторфенил)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,33-6,87 (м, 14H), 5,39-5,25 (м, 1Н), 3,95-3,83 (м, 1Н), 3,31-3,10 (м, 1Н), 3,05-2,88 (м, 2H), 2,80-2,70 (м, 2H), 1,32-1,23 (м, 3H).19F ЯМР δ 47,59.
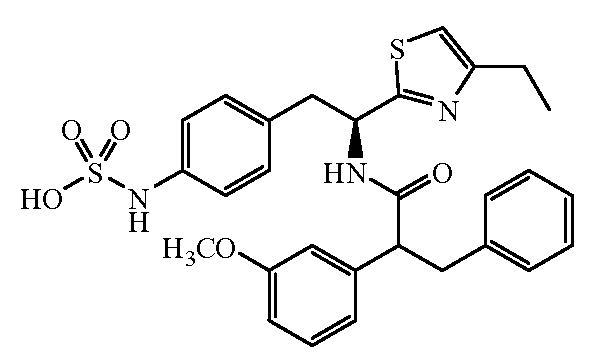
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[2-(3-метоксифенил)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,85 (д, 1Н, J=8,4 Гц), 7,25-7,20 (м, 1Н), 7,11-7,02 (м, 4H), 7,01 (с, 1Н), 6,90-6,79 (м, 2H), 5,45-5,40 (м, 1Н), 4,09 (с, 2H), 3,79 (с, 3H), 3,12-3,08 (м, 2H), 1,10 (с, 9H).
Четвертый аспект категории V в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где связующая группа L содержит фенильную группу, указанная связующая группа, имеет формулу:
-C(O)[(CR5З)][(CR6З]-
R1 является водородом, R6a является фенилом, R5a является замещенным или незамещенным гетероарилом, и группы R2, R3 и R5a представлены ниже в таблице XII.
Соединения, включенные в четвертый аспект категории V в соответствии с данным изобретением, могут быть получены по методике, представленной на Схеме V, и описанной в примере 5 ниже.
Схема XI
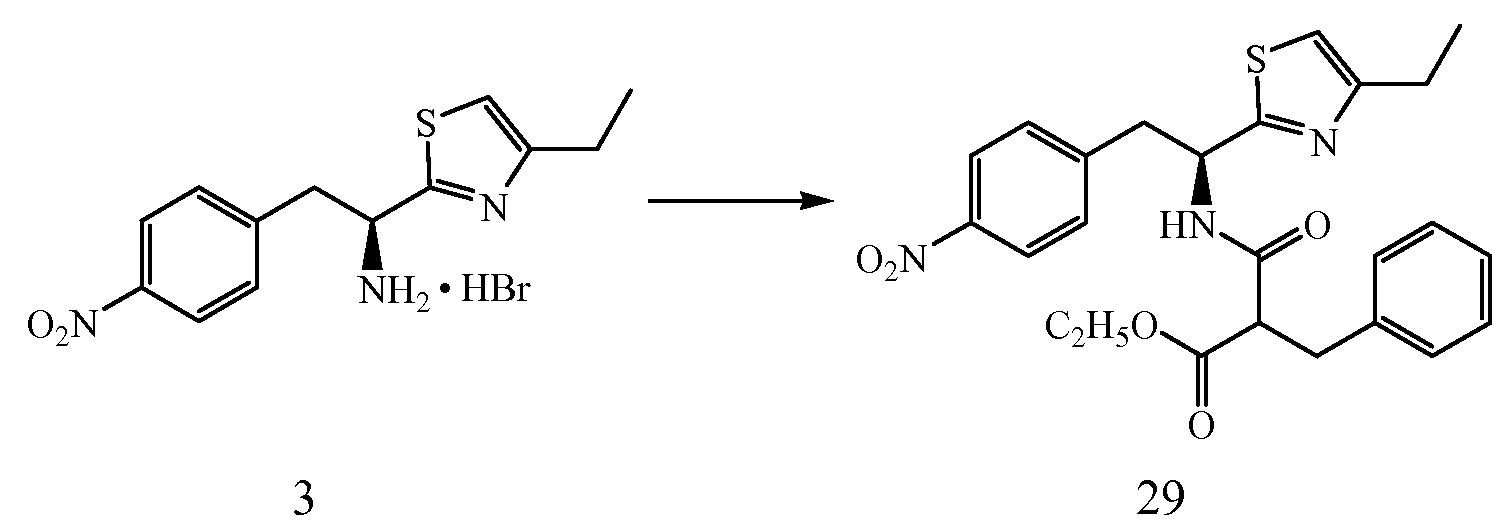
Реагенты и условия (a) 2-бензил-3-этокси-3-оксопропановая кислота, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (b) CH3C(=NOH)NH2, K2CO3, толуол; кипение с обратным холодильником, 18 ч

Реагенты и условия: (c) (i) хлорид олова (II), EtOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 12
4-{(S)-2-(4-Этилтиазол-2-ил)-2-[2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамидо]этил}фенилсульфаминовая кислота (31)
Получение этил-2-бензил-3-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино]-3-оксопропаноата (29): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,406 г, 1,13 ммоль), 2-бензил-3-этокси-3-оксопропановой кислоты (0,277 г) и 1-гидроксибензотриазола (HOBt) (0,191 г, 1,41 ммоль) в ДМФ (10 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (0,240 г, 1,25 ммоль), затем диизопропилэтиламин (ДИПЭА) (0,306 г). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением 0,169 г (31% выход) желаемого продукта, который применяют без дальнейшей очистки.
Получение N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамида (30): Этил 2-бензил-3-((S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламино)-3-оксопропаноат растворяют в толуоле (5 мл) и нагревают до температуры кипения с обратным холодильником. Добавляют карбонат калия (80 мг) и оксим ацетамида (43 мг) и обрабатывают 80 мг карбоната калия и 43 мг оксима ацетамида при кипении с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, фильтруют и концентрируют. Остаток подвергают хроматографии на двуокиси кремния с получением 0,221 г (94%) желаемого продукта в виде желтого масла.
Получение 4-{(S)-2-(4-этилтиазол-2-ил)-2-[2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамидо]этил}фенилсульфаминовой кислоты (31): N-[(S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2-(3-метил-1,2,4-оксадиазол-5-ил)-3-фенилпропанамид, 30, (0,221 г) и хлорид олова (II) (507 мг, 2,2 ммоль) растворяют в EtOH (25 мл), и раствор кипятят с обратным холодильником в течение 4 часов. Растворитель удаляют в вакууме, и полученный остаток растворяют в EtOAc. Добавляют насыщенный раствор NaHCO3 (50 мл), и раствор перемешивают в течение 1 часа. Органический слой отделяют, и водный слой дважды экстрагируют EtOAc. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют до остатка, который растворяют в пиридине (0,143 г) и обрабатывают SO3-пиридином (0,143 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,071 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD): δ 7,29-6,87 (м, 10H), 5,38-5,30 (м, 1Н), 4,37-4,30 (м, 1Н), 3,42-2,74 (м, 6H), 2,38-2,33 (м, 3H), 1,34-1,28 (м, 3H).
Категория VI в соответствии с данным изобретением относится к 2-(тиазол-2-ил) соединениям, имеющим формулу:

где R1, R2, R3 и L такие, как определены в таблице XIII ниже.
Соединения, включенные в категорию VI в соответствии с данным изобретением, могут быть получены по методике, представленной на Схеме XII и описанной в примере 13 ниже.
Схема VI

Реагенты и условия: (a) 3-бензоилпропионовая кислота, SOCl2, N-метилимидазол, CH2Cl2; кт, 18 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 13
(S)-4-[2-(4-Этилтиазол-2-ил)-2-(4-оксо-4-фенилбутанамидо)этил]фенилсульфаминовая кислота (33)
Получение (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-4-оксо-4-фенилбутанамида (32): 3-Бензоилпропионовую кислоту (0,250 г) растворяют в CH2Cl2 (5 мл), добавляют N-метилимидазол (0,333 мл), и полученный раствор охлаждают до 0°C, затем по каплям добавляют раствор тионилхлорида (0,320 г) в CH2Cl2 (2 мл). Через 0,5 часа добавляют (S)-1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этанамин, 3, (0,388 г). Реакционную смесь перемешивают в течение 18 часов при комнатной температуре и затем концентрируют в вакууме. Полученный остаток растворяют в EtOAc и промывают 1N HCl и насыщенным раствором соли. Раствор сушат над Na2SO4, фильтруют и концентрируют, и неочищенный материал очищают над двуокисью кремния с получением 0,415 г желаемого продукта.
Получение (S)-4-[2-(4-этилтиазол-2-ил)-2-(4-оксо-4-фенилбутанамидо)этил]фенилсульфаминовой кислоты (33): (S)-N-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]-2,3-дифенил-пропанамид, 32, (0,2 г) растворяют в MeOH (15 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (5 мл) и обрабатывают SO3-пиридином (0,153 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,090 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD) δ 8,68 (д, 1Н, J=8,2 Гц), 8,00 (д, 2H, J=7,2 Гц), 7,80-7,50 (м, 3H), 7,12 (с, 4H), 7,03 (с, 1Н), 5,46-5,38 (м, 1Н), 3,29-3,14 (м, 2H), 3,06-2,99 (м, 2H), 2,83 (кв., 2H, J=7,5 Гц), 2,69-2,54 (м, 2H), 1,33 (т, 3H, J=7,5 Гц).
Далее представлены не ограничивающие примеры соединений, включенных в категорию II в соответствии с данным изобретением. Промежуточные нитросоединения могут быть получены сочетанием подходящей 4-оксокарбоновой кислоты с промежуточным соединением 3 в условиях, описанных выше для получения промежуточного соединения 4 со схемы I.

(S)-4-(2-(4-Этилтиазол-2-ил)-2-(5-метил-4-оксогексанамидо)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,59 (д, 1Н, J=8,1 Гц), 7,14 (с, 4H), 7,08 (т, 1Н, J=13,0 Гц), 5,40-5,35 (м, 1Н), 3,37-3,27 (м, 2H), 3,04-2,97 (м, 1Н), 2,83-2,61 (м, 4H), 2,54-2,36 (м, 3H), 1,33 (т, 2H, J=7,3 Гц), 1,09 (дд, 6H, J=7,0, 2,2 Гц).

(S)-4-{2-[4-(3,4-дигидро-2H-бензо[b][1,4]диоксепин-7-ил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,64 (д, 1Н, J=8,4 Гц), 7,60 (д, 2H, J=10,6 Гц), 7,11 (с, 3H), 7,04 (д, 2H, J=5,5 Гц), 5,42-5,40 (м, 1Н), 4,30-4,22 (м, 4H), 3,20-2,98 (м, 4H), 2,82 (кв., 2H, J=7,3 Гц), 2,67-2,48 (м, 2H), 2,23 (т, 2H, J=5,5 Гц), 1,32 (т, 3H, J=7,3 Гц).

(S)-4-{2-[4-(2,3-диметоксифенил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD), δ 8,64 (?д, 1Н, J=8,1 Гц), 7,21-7,11 (м, 7H), 7,02 (с, 1Н), 5,42 (кв., 1Н, J=5,9 Гц), 3,90 (д, 3H, J=3,3 Гц), 3,88 (д, 3H, J=2,9 Гц), 3,22-3,18 (м, 2H), 3,07-2,99 (м, 2H), 2,83 (кв., 2H, J=7,3 Гц), 2,63-2,54 (м, 2H), 1,34 (т, 3H, J=7,69 Гц).
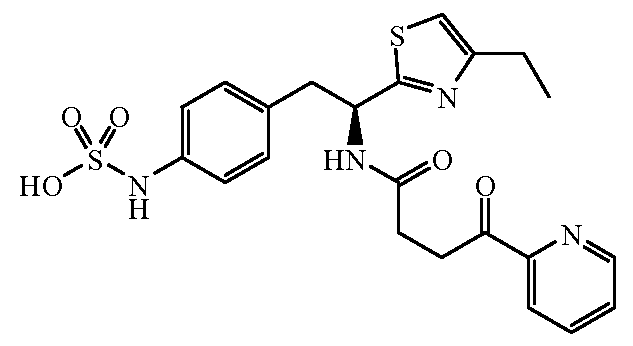
(S)-4-{2-(4-Этилтиазол-2-ил)-2-[4-оксо-4-(пиридин-2-ил)бутанамидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,60 (д, 1Н, J=12,8 Гц), 7,91-7,81 (м, 2H), 7,48-7,44 (м, 1Н), 7,22-7,21 (м, 1Н), 6,99 (с, 3H), 6,91 (с, 1Н), 5,30 (кв., 1Н, J=5,4 Гц), 3,36 (кв., 2H, J=7,0 Гц), 3,21-3,15 (м, 1Н), 2,91-2,85 (м, 1Н), 2,74 (кв., 2H, J=10,4 Гц), 2,57-2,50 (м, 2H), 1,20 (т, 3H, J=7,5 Гц).

(S)-4-{2-[4-(2,3-дигидробензо[b][1,4]диоксин-6-ил)-4-оксобутанамидо]-2-(4-этилтиазол-2-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,52-7,47 (м, 2H), 7,11 (с, 4H), 7,03 (с, 1H), 6,95 (д, 1Н, J=8,4 Гц), 5,41 (кв., 1Н, J=3,7 Гц), 4,31 (д, 4H, J=5,5 Гц), 3,24-3,12 (м, 2H), 3,06-2,98 (м, 2H), 2,83 (кв., 2H, J=7,3 Гц), 2,62-2,53 (м, 2H), 1,33 (т, 3H, J=7,3 Гц).

(S)-4-[2-(4-трет-бутокси-4-оксобутанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота:1H ЯМР (CD3OD), δ 7,10 (с, 4H), 7,02 (с, 1Н), 5,41 (кв., 1Н, J=3,7 Гц), 3,30-3,25 (м, 1Н), 3,06-2,99 (м, 1Н), 2,83 (кв., 2H, J=7,3 Гц), 2,52-2,40 (м, 4H), 1,42 (с, 9H), 1,33 (т, 3H, J=7,3 Гц).

(S)-4-[2-(4-этокси-4-оксобутанамидо)-2-(4-этилтиазол-2-ил)этил]фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 8,62 (д, 1Н, J=8,4 Гц), 7,10 (с, 4H), 7,02 (с, 1Н), 5,40 (кв., 1Н, 3,7 Гц), 4,15 (кв., 2H, J=7,3 Гц), 3,28-3,25 (м, 1Н), 3,05-3,02 (м, 1Н), 2,82 (кв., 2H, J=4,4 Гц), 2,54-2,48 (м, 2H), 1,33 (т, 3H, J=7,3 Гц), 1,24 (т, 3H, J=7,0 Гц).
Первый аспект категории VII в соответствии с данным изобретением относится к 2-(тиазол-2-ил) соединениям, имеющим формулу:
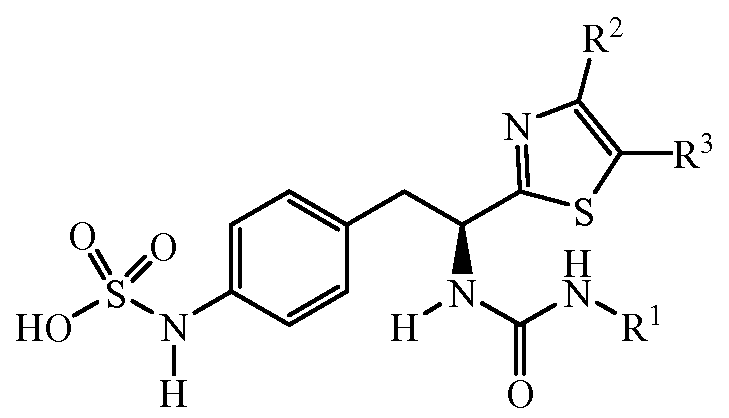
где не ограничивающие примеры R1, R2 и R3 описаны ниже в таблице XIV.
Соединения, входящие в категорию VII в соответствии с данным изобретением, могут быть получены по методике, представленной на Схеме XIII и описанной в примере 14 ниже.
Схема XIII

Реагенты и условия: (a) бензилизоцианат, ТЭА, CH2Cl2; кт, 18 ч.
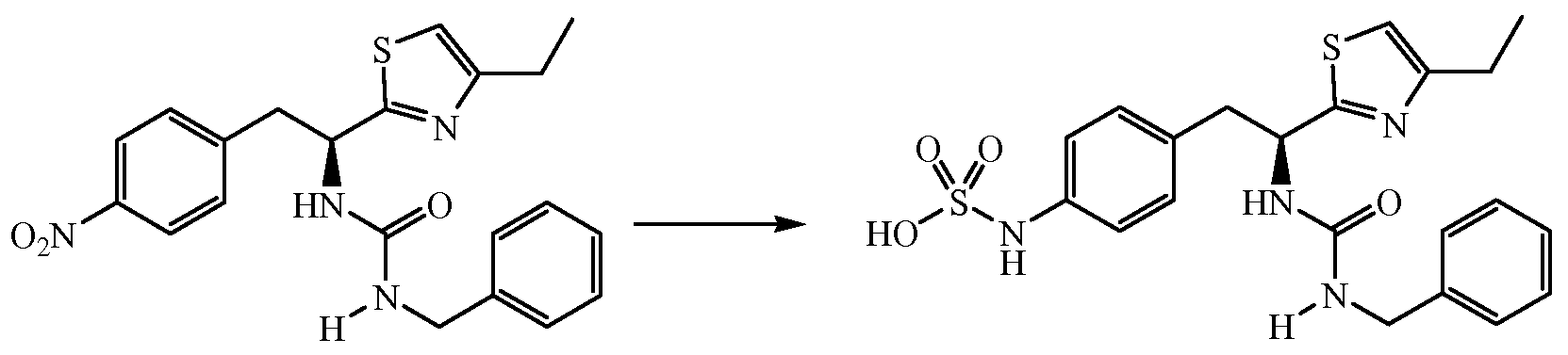

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 14
(S)-4-(2-(3-Бензилуреидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовая кислота (35)
Получение (S)-1-бензил-3-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]мочевины (34): К раствору гидробромида 1-(S)-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этиламина, 3, (0,360 г, 1 ммоль) и Et3N (0,42 мл, 3 ммоль) в 10 мл CH2Cl2 добавляют бензилизоцианат (0,12 мл, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Продукт выделяют фильтрацией с получением 0,425 г (96% выход) желаемого продукта, который применяют без дальнейшей очистки.
Получение (S)-4-(2-(3-бензилуреидо)-2-(4-этилтиазол-2-ил)этил)фенилсульфаминовой кислоты (35): (S)-1-бензил-3-[1-(4-этилтиазол-2-ил)-2-(4-нитрофенил)этил]мочевину, 34, (0,425 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,220 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,143 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD) δ 7,32-7,30 (м, 2H), 7,29-7,22 (м, 3H), 7,12-7,00 (м, 4H), 6,84 (д, 1Н, J=8,1 Гц), 5,35-5,30 (м, 1Н), 4,29 (с, 2H), 3,27-3,22 (м, 3H), 3,11-3,04 (м, 3H), 2,81 (кв., 2H, J=10,2, 13,0 Гц), 1,31 (т, 3H, J=4,5 Гц).
Далее представлены не ограничивающие примеры соединений, входящих в первый аспект категории VII в соответствии с данным изобретением.
4-{[(S)-2-(2-Этилтиазол-4-ил)-2-(3-(R)-метокси-1-оксо-3-фенилпропан-2-ил)уреидо]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD) δ 7,36-7,26 (м, 3H), 7,19-7,17 (м, 2H), 7,10-7,06 (м, 2H), 6,90-6,86 (м, 3H), 5,12-5,06 (м, 1Н), 4,60-4,55 (м, 1Н), 3,69 (с, 3H) 3,12-2,98 (м, 6H), 1,44-1,38 (м, 3H).
Второй аспект категории VII в соответствии с данным изобретением относится к 2-(тиазол-4-ил) соединениям, имеющим формулу:

где не ограничивающие примеры R1 и R4 описаны в таблице XV ниже.
Соединения, включенные во второй аспект категории VII в соответствии с данным изобретением, могут быть получены по методике, представленной на Схеме XIV и описанной в примере 14 ниже.
Схема XIV

Реагенты и условия (a) бензилизоцианат, ТЭА, CH2Cl2; кт, 18 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 15
4-{(S)-2-(3-Бензилуреидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота (37)
Получение 1-бензил-3-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}мочевина (36): К раствору гидробромида (S)-2-(4-нитрофенил)-1-[(2-тиофен-2-ил)тиазол-4-ил)этанамина, 8, и Et3N (0,42 мл, 3 ммоль) в 10 мл ДХМ добавляют изоцианат бензила (0,12 мл, 1 ммоль). Смесь перемешивают при комнатной температуре в течение 18 часов. Продукт выделяют фильтрацией с получением 0,445 г (96% выход) желаемого продукта, который применяют без дальнейшей очистки.
Получение 4-{(S)-2-(3-бензилуреидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовой кислоты (37): 1-Бензил-3-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}мочевину, 36, (0,445 г) растворяют в MeOH (10 мл) и CH2Cl2 (5 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,110 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,080 г желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD) δ 7,61 (д, 1Н, J=2,1 Гц), 7,58 (д, 1Н, J=6 Гц), 7,33-7,22 (м, 4H), 7,17-7,14 (м, 1Н), 7,09-6,94 (м, 6H), 5,16 (т, 1Н, J=6,6 Гц), 4,13 (с, 2H), 3,14-3,11 (м, 2H).
Категория VIII в соответствии с данным изобретением относится к 2-(тиазол-4-ил) соединениям, имеющим формулу:
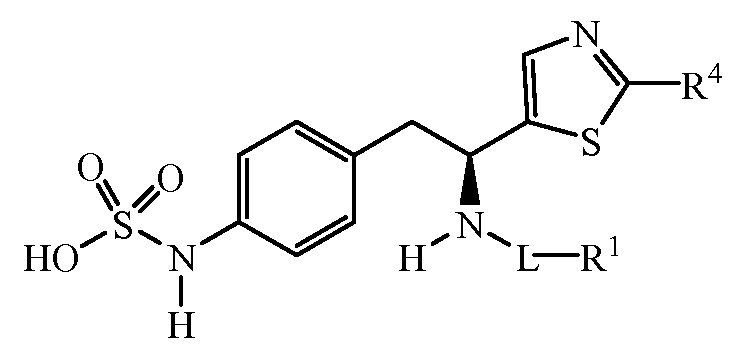
где R1, R4 и L определены в таблице XVI ниже.
Соединения, входящие в категорию VIII в соответствии с данным изобретением, могут быть получены методикой, представленной на Схеме XV и описанной в примере 16 ниже.
Схема XV

Реагенты и условия: (a) C6H4CH2SO2Cl, ДИПЭА, CH2Cl2; 0°C до кт, 14 ч.

Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 16
{4-(S)-[2-Фенилметансульфониламино-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота (39)
Получение (S)-N-{2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}-1-фенилметансульфонамида (38): К суспензии 2-(4-нитрофенил)-1-(2-тиофен-2-илтиазол-4-ил)этиламина, 8, (330 мг, 0,80 ммоль) в CH2Cl2 (6 мл) при 0°C добавляют диизопропилэтиламин (0,30 мл, 1,6 ммоль), затем хлорид фенилметансульфонила (167 мг, 0,88 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 14 часов. Смесь разбавляют CH2Cl2 и промывают насыщ. NaHCO3, затем насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток очищают над двуокисью кремния с получением 210 мг желаемого продукта в виде белого твердого вещества.
Получение {4-(S)-[2-фенилметансульфониламино-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовой кислоты (39): (S)-N-{2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}-1-фенилметансульфонамид, 38, (210 мг, 0,41 ммоль) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (197 мг, 1,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,060 г желаемого продукта в виде аммониевой соли.1H ЯМР (300 МГц, MeOH-d4) δ 7,52-7,63 (м, 6,70-7,28 (м, 11H), 4,75 (т, J=7,2 Гц, 1Н), 3,95-4,09 (м, 2H), 3,20 (дд, J=13,5 и 7,8 Гц, 1Н), 3,05 (дд, J=13,5 и 7,8 Гц, 1Н).
Промежуточные соединения для применения на стадии (a) Схемы XV могут быть подходящим образом получены по методике, представленной ниже на Схеме XVI и описанной в примере 17.
Схема XVI

Реагенты и условия: (a) Na2SO3, H2O; микроволны @ 200°C, 20 мин.

Реагенты и условия: (b) PCl5, POCl3; 50°C, 3 ч.
ПРИМЕР 17
Хлорид (2-метилтиазол-4-ил)метансульфонила (41)
Получение натрий (2-метилтиазол-4-ил)метансульфоната (40): 4-Хлорметил-2-метилтиазол (250 мг, 1,69 ммоль) растворяют в H2O (2 мл) и обрабатывают сульфитом натрия (224 мг, 1,78 ммоль). Реакционную смесь облучают микроволнами в течение 20 минут при 200°C. Реакционную смесь разбавляют H2O (30 мл) и промывают EtOAc (2 · 25 мл). Водный слой концентрируют с получением 0,368 г желаемого продукта в виде желтого твердого вещества. ЖХ/МС ИЭР+ 194 (M+1, свободная кислота).
Получение хлорида (2-метилтиазол-4-ил)метансульфонила (41): Натрий (2-метилтиазол-4-ил)метансульфонат, 40, (357 мг, 1,66 ммоль) растворяют в оксихлориде фосфора (6 мл) и обрабатывают пентахлоридом фосфора (345 мг, 1,66 ммоль). Реакционную смесь перемешивают при 50°C в течение 3 часов, затем охлаждают до комнатной температуры. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в CH2Cl2 (40 мл) и промывают насыщ. NaHCO3 и насыщенным раствором соли. Органический слой сушат над MgSO4, фильтруют и растворитель удаляют в вакууме с получением 0,095 г желаемого продукта в виде коричневого масла. ЖХ/МС ИЭР+ 211 (M+1). Промежуточные соединение получают с достаточной чистотой для дальнейшей обработки согласно Схеме IX без необходимости дальнейшей очистки.

(S)-(4-(2-((2-метилтиазол-4-ил)метилсульфонамидо]-2-(2-(2-(тиофен-2-ил)тиазол-4-ил]этил}фенил)сульфаминовая кислота:1Н ЯМР (CD3OD): δ 7,71-7,66 (м, 2Н), 7,27-7,10 (м, 7Н), 4,87 (т, 1Н, J=7,3 Гц), 4,30-4,16 (кв., 2Н, J=13, 2 Гц), 3,34-3,13 (м, 2Н), 2,70 (с, 3Н).
Далее описаны не ограничивающие примеры соединений, входящих в категорию VIII в соответствии с данным изобретением.

{4-(S)-[2-Фенилметансульфониламино-2-(2-этилтиазол-4-ил)этил]фенил}-сульфаминовая кислота:1Н ЯМР (300 МГц, МеОН-d4) δ 7,27-7,32 (м, 3Н), 7,16-7,20 (м, 3Н), 7,05-7,6 (м, 2Н), 6,96 (д, J=8,4 Гц, 2Н), 4,70 (т, J=9,0 Гц, 1Н), 3,91-4,02 (м, 2Н), 2,95-3,18 (м, 4Н), 1,41 (т, J=7,5 Гц, 3Н).

(S)-(4-(2-(2-этилтиазол-4-ил)-2-((3-этоксифенил)метилсульфонамидо)этил)фенил}сульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,20 (т, J=8,1 Гц, 1Н), 6,94-7,08 (м,4Н), 6,88-6,94 (м, 3Н), 6,75-6,80 (м, 1Н), 4,67 (т, J=7,2 Гц, 1Н), 3,90-4,0 (м, 2Н), 3,76 (с, 3Н), 2,95-3,16 (м, 4Н), 1,40 (т, J=7,5 ГЦ, 3Н).

Метиловый эфир (S)-4-{[1-(2-Этилтиазол-4-ил)-2-(4-сульфо-аминофенил)этилсульфамоил]метил}бензойной кислоты:1Н ЯМР (300 МГц, MeOH-d4) δ 7,90-7,94 - (м, 2Н), 7,27-7,30 (м, 2Н), 7,06-7,11 (м, 3Н), 6,97-7,00 (м, 2Н), 4,71 (т, J=7,2 Гц, 1Н), 3,95-4,08 (4, 2Н), 3,92 (с, 3Н), 2,80-3,50 (м, 4Н), 1,38-1,44 (м, 3Н).

(S)-4-[2-(2-Этилтиазол-4-ил)-2-(1-метил-1Н-имидазол-4-сульфонамидо)этил]фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,54 (с, 1Н, 7,20 (с, 1Н), 7,09 (с, 1Н), 6,92-7,00 (м, 4Н), 4,62 (т, J=5,4 Гц, 1Н), 3,70 (с, 3Н), 2,98-3,14 (м, 3Н), 2,79 (дд, J=9,3 и 15,0 Гц, 1Н), 1,39 (кв., J=7,5 Гц, 3Н).

4-{(S)-2-[2-(Тиофен-2-ил)тиазол-4-ил]-2-(2,2,2-трифторэтилсульфонамидо)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,62-7,56 (м, 2H), 7,22 (с, 1Н), 7,16-7,06 (м, 5H), 4,84 (т, 1Н, J=7,6 Гц), 3,71-3,62 (м, 2H), 3,32-3,03 (м, 2H).

{4-(S)-[2-(Фенилэтансульфониламино)-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,56-7,62 (м, 2H), 7,04-7,19 (м, 9H), 6,94-6,97 (м, 2H), 4,78 (т, J=7,8 Гц, 1Н), 3,22-3,30 (м, 2H), 3,11 (дд, J=13,5 и 7,8 Гц, 1Н), 2,78-2,87 (м, 4H).

{4-(S)-[3-(Фенилпропансульфониламино)-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,56-7,62 (м, 2H), 6,99-7,17 (м, 10H), 4,72 (т, J=7,8 Гц, 1Н), 3,21 (дд, J=13,5 и 7,2 Гц, 1Н), 3,02 (дд, J=13,5 и 7,2 Гц, 1Н), 2,39-2,64 (м, 4H), 1,65-1,86 (м, 2H).

(S)-{4-[2-(4-Метил-3,4-дигидро-2H-бензо[1,4]оксазин-7-сульфониламино)-2-(2-тиофен-2-илтиазол-4-ил)этил]фенил}сульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,53 (д, J=5,1 Гц, 1Н) 7,48 (д, J=5,1 Гц, 1Н), 7,13-7,10 (м, 1Н), 7,04 (д, J=8,4 Гц, 2H), 6,93-6,88 (м, 3H), 6,75 (д, J=8,1 Гц, 1Н), 6,54 (д, J=8,1 Гц, 1Н), 4,61 (т, J=7,5 Гц, 1Н), 4,20-4,08 (м, 2H), 3,14-3,00 (м, 4H), 2,69 (с, 3H).

4-{(S)-2-(4-ацетамидофенилсульфонамидо)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,67-7,52 (м, 6H), 7,24-7,23 (м, 1Н), 7,12-7,09 (м, 3H), 7,02-6,99 (м, 2H), 4,70 (т, 1Н, J=7,3 Гц), 3,25-3,00 (м, 2H), 2,24 (с, 3H).
Первый аспект категории IX в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где R1 является замещенным или незамещенным гетероарилом и R4 является C1-C6 линейным, разветвленным или циклическим алкилом, описанным ниже в таблице XVII.
Соединения в соответствии с первым аспектом категории IX, которые содержат замещенные или незамещенные тиазол-4-ильные группы для R1, могут быть получены по методике, представленной на схеме XVII и описанной в примере 18.
Схема XVII

Реагенты и условия: (a) CH3CN, кипение с обратным холодильником; 24 ч.

Реагенты и условия: (b) тиофосген, CaCO3, CCl4, H2O; кт, 18 ч.

Реагенты и условия: (c) KOtBu, ТГФ; кт, 2 ч.

Реагенты и условия: (d) (i) SnCl2-2H2O, EtOH; кипение с обратным холодильником, 4 часа, (ii) SO3-пиридин, NH4OH.
ПРИМЕР 18
(S)-4-(2-(2-Фенилтиазол-4-ил)2-(4-(метоксикарбонил)тиазол-5-иламино)этил)фенилсульфаминовая кислота (45)
Получение гидробромида (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина (42): Смесь (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (1,62 г, 4,17 ммоль) и тиобензамида (0,63 г, 4,60 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (50 мл). Полученный осадок собирают фильтрацией. Твердое вещество сушам в вакууме с получением 1,2 г (67% выход) желаемого продукта. ЖХ/МС ИЭР+ 326 (M+1).
Получение (S)-4-(1-изотиоцианато-2-(4-нитрофенил)этил)-2-фенилтиазола (43): К раствору гидробромида (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина, 42, (726 мг, 1,79 ммоль) и CaCO3 (716 мг, 7,16 ммоль) в H2O (2 мл) добавляют CCl4 (3 мл), затем тиофосген (0,28 мл, 3,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем разбавляют CH2Cl2 и водой. Слои разделяют, и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме до остатка, который очищают над двуокисью кремния (CH2Cl2) с получением 480 мг (73%) желаемого продукта в виде желтого твердого вещества.1H ЯМР (300 МГц, CDCl3) δ 8,15 (д, J=8,7 Гц, 2H), 7,97-7,99 (м, 2H), 7,43-7,50 (м, 3H), 7,34 (д, J=8,7 Гц, 2H), 7,15 (д, J=0,9 Гц, 1Н), 5,40-5,95 (м, 1Н), 3,60 (дд, J=13,8 и 6,0 Гц, 1Н), 3,46 (дд, J=13,8 и 6,0 Гц).
Получение (S)-метил 5-[1-(2-фенилтиазол-4-ил)-2-(4-нитрофенил)этиламино]тиазол-4-карбоксилата (44): К суспензии трет-бутоксида калия (89 мг, 0,75 ммоль) в ТГФ (3 мл) добавляют метилизоцианоацетат (65 мкл, 0,68 ммоль), затем (S)-2-фенил-4-(1-изотиоцианато-2-(4-нитрофенил)этил)тиазол, 43, (250 мг, 0,68 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 часов, затем выливают в насыщ. NaHCO3. Смесь экстрагируют EtOAc (3 · 25 мл), и объединенные органические слои промывают насыщенным раствором соли и сушат (Na2SO4), и концентрируют в вакууме. Неочищенный остаток очищают над двуокисью кремния с получением 323 мг (~100% выход) желаемого продукта в виде светло-желтого твердого вещества.1H ЯМР (300 МГц, CDCl3) δ 8,09-8,13 (м, 2H), 7,95-7,98 (м, 3H), 7,84 (д, J=1,2 Гц, 1Н), 7,44-7,50 (м, 3H), 7,28-7,31 (м, 2H), 7,96 (д, J=0,6 Гц, 1Н), 4,71-4,78 (м, 1Н), 3,92 (с, 3H), 3,60 (дд, J=13,8 и 6,0 Гц, 1Н), 3,45 (дд, J=13,8 и 6,0 Гц, 1Н).
Получение (S)-4-(2-(2-фенилтиазол-4-ил)2-(4-(метоксикарбонил)тиазол-5-иламино)этил)фенилсульфаминовой кислоты (45): (S)-метил 5-[1-(2-фенилтиазол-4-ил)-2-(4-нитрофенил)этиламино]тиазол-4-карбоксилат, 44, (323 мг, 0,68 ммоль) и хлорид олова (II) (612 мг, 2,72 ммоль) растворяют в EtOH, и раствор кипятят с обратным холодильником. Растворитель удаляют в вакууме и полученный остаток растворяют в EtOAc. Добавляют насыщенный раствор NaHCO3, и раствор перемешивают в течение 1 часа. Органический слой отделяют, и водный слой дважды экстрагируют EtOAc. Объединенные органические слои сушат (Na2SO4), фильтруют и концентрируют до остатка, который растворяют в пиридине (10 мл) и обрабатывают SO3-пиридином (130 мг, 0,82 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,071 г желаемого продукта в виде аммониевой соли.1Н ЯМР (300 МГц, MeOH-d4) δ 7,97-8,00 (м, 3H), 7,48-7,52 (м, 3H), 7,22 (с, 1Н), 7,03-7,13 (м, 4H), 4,74 (т, J=6,6 Гц, 1Н), 3,88 (с, 3H), 3,28-3,42 (м, 2H).
Соединения в соответствии с первым аспектом категории IX, которые содержат замещенные или незамещенные тиазол-2-ильные единицы для R1, могут быть получены по методике, представленной на Схеме XVIII и описанной ниже в примере 19. Промежуточное соединение 46 может быть получено по Схеме II и примеру 2 при замещении амида тиофен-2-карботиокислоты амидом циклопропанкарботиокислоты.
Схема XVIII

Реагенты и условия: (a) тиофосген,CaCO3, CCl4/H2O; кт, 18 ч.


Реагенты и условия: (b) CH3CN, кипение с обратным холодильником, 24 ч.

Реагенты и условия: (c) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 19
4-{(S)-2-(2-Циклопропилтиазол-4-ил)-2-[4-(3-метоксифенил)тиазол-2-иламино]этил}фенилсульфаминовая кислота (50)
Получение (S)-1-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиомочевины (47): К раствору гидробромида (S)-1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этанамина, 32, (4,04 г, 10,9 ммоль) и CaCO3 (2,18 г, 21,8 ммоль) в CCl4/воде (25 мл/20 мл) добавляют тиофосген (1,5 г, 13,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем разбавляют CH2Cl2 и водой. Слои разделяют, и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме до остатка, который затем обрабатывают аммиаком (0,5 M в 1,4-диоксане, 120 мл), который очищают над двуокисью кремния с получением 2,90 г желаемого продукта в виде красно-коричневого твердого вещества. ЖХ/МС ИЭР- 347 (M-1).
Получение (S)-4-(3-метоксибензил)-N-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиазол-2-амина (48): (S)-1-(1-(2-Циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиомочевину, 47, (350 мг, 1,00 ммоль) и 2-бром-3'-метоксиацетофенон (253 мг, 1,10 ммоль) объединяют в 3 мл CH3CN и нагревают до кипения с обратным холодильником в течение 24 часов. Смесь концентрируют и хроматографируют с получением 0,172 г продукта в виде желтого твердого вещества. ЖХ/МС ИЭР+ 479 (M+1).
Получение 4-{(S)-2-(2-циклопропилтиазол-4-ил)-2-[4-(3-метоксифенил)тиазол-2-иламино]этил}фенилсульфаминовой кислоты (49): (S)-4-(3-метоксибензил)-N-(1-(2-циклопропилтиазол-4-ил)-2-(4-нитрофенил)этил)тиазол-2-амин, 48, (0,172 г) растворяют в 10 мл MeOH. Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в 5 мл пиридина и обрабатывают SO3-пиридином (114 мг). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 10 мл 7% раствора NH4OH. Затем смесь концентрируют и полученный остаток очищают хроматографией с обращенной фазой с получением 0,033 г желаемого продукта в виде аммониевой соли.1Н ЯМР (CD3OD): δ 7,33-7,22 (м, 3H), 7,10-6,97 (м, 5H), 6,84-6,80 (м, 2H), 5,02 (т, 1H, J=6,9 Гц), 3,82 (с, 1Н), 3,18 (кв., 2H, J=7,1 Гц), 2,36 (кв., 1H, J=4,6 Гц), 1,20-1,13 (м, 2H), 1,04-0,99 (м, 2H).
Далее представлены не ограничивающие примеры соединений, входящих в первый аспект категории IX.
(S)-4-(2-(4-((2-Метокси-2-оксоэтил)карбамоил)тиазол-5-иламино)-2-(2-этилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,91 (с, 1Н), 7,08-7,10 (м, 3H), 6,99 (д, J=8,7 Гц, 2H), 4,58 (т, J=6,9 Гц, 1Н), 4,11 (д, J=2,7 Гц, 2H), 3,78 (с, 3H), 3,14-3,28 (м, 2H), 3,06 (кв., J=7,5 Гц, 2H), 1,41 (т, J=7,5 Гц, 3H).

(S)-4-(2-{5-[1-N-(2-Метокси-2-оксоэтилкарбамоил)-1-H-индол-3-ил]оксазол-2-иламино}-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,63 (д, J=7,8 Гц, 1Н), 7,37 (с, 1Н), 7,18-7,29 (м, 4H), 7,02-7,16 (м, 4H), 6,85 (с, 1Н), 5,04-5,09 (м, 1Н), 4,85 (с, 3H), 3,27 (дд, J=13,5 и 8,1 Гц, 1Н), 3,10 (м, J=13,5 и 8,1 Гц, 1Н), 2,69 (с, 3H).
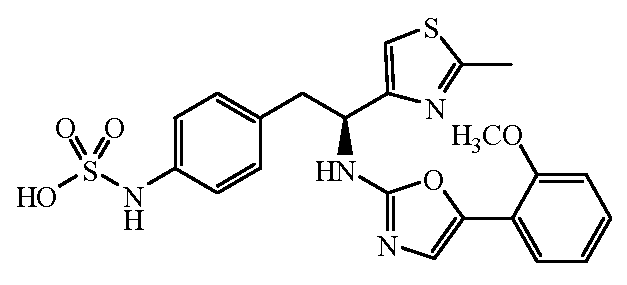
4-((S)-2-(5-(2-Метоксифенил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,52 (дд, J=7,5 и 1,2 Гц, 1Н), 6,95-7,24 (м, 10H), 5,04-5,09 (м, 1Н), 3,92 (с, 3H), 3,26 (дд, J=13,8 и 8,4 Гц, 1Н), 3,10 (дд, J=13,8 и 8,4 Гц, 1Н), 2,72 (с, 3H).

4-((S)-2-(5-((S)-1-(трет-Бутоксикарбонил)-2-фенилэтил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,03-7,27 (м, 10 H), 6,50 (с, 1Н), 4,95-5,00 (м, 1Н), 4,76 (т, J=6,9 Гц, 1Н), 3,22 (дд, J=14,1 и 6,9 Гц, 1Н), 3,00-3,10 (м, 2H), 2,90 (дд, J=14,1 и 6,9 Гц, 1Н), 2,72 (с, 3H), 1,37 (с, 9H).

(S)-{4-{2-[5-(4-Метоксикарбонил)фенил]оксазол-2-иламино}-2-(2-метилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,99 (д, J=7,5 Гц, 2H), 7,56-7,59 (м, 2H), 7,23-7,24 (м, 1Н), 7,08-7,14 (м, 4H), 6,83 (д, J=10,2 Гц, 1Н), 5,08 (т, J=6,0 Гц, 1Н), 3,91 (с, 3H), 3,25-3,35 (м, 1Н), 3,09-3,13 (м, 1Н), 2,73 (с, 3H).

(S)-4-(2-(5-(3-Метоксибензил)оксазол-2-иламино)-2-(2-метилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,03-7,28 (м, 8H), 6,79-6,83 (м, 1Н), 5,70 (с, 1Н), 4,99-5,06 (м, 2H), 4,41 (д, J=2,1 Гц, 2H), 3,80 (с, 3H), 3,27-3,37 (м, 1Н), 3,03-3,15 (м, 1Н), 2,71 (с, 3H).

(S)-4-(2-(2-Метилтиазол-4-ил)2-(5-фенилоксазол-2-иламино)этил)фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,45 (д, J=8,7 Гц, 2H), 7,33 (т, J=7,8 Гц, 2H), 7,18-7,22 (м, 1Н), 7,10-7,14 (м, 6H), 7,04 (с, 1Н), 5,04-5,09 (м, 1Н), 3,26 (дд, J=13,8 и 6,3 Гц, 1Н), 3,10 (дд, J=13,8 и 6,3 Гц, 1Н), 2,70 (с, 3H).

4-((S)-2-(2-Циклопропилтиазол-4-ил)-2-(4-(3-метоксифенил)тиазол-2-иламино)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,33-7,22 (м, 3H), 7,10-6,97 (м, 5H), 6,84-6,80 (м, 2H), 5,02 (т, 1H, J=6,9 Гц), 3,82 (с, 1Н), 3,18 (кв., 2H, J=7,1 Гц), 2,36 (кв., 1Н, J=4,6 Гц), 1,20-1,13 (м, 2H), 1,04-0,99 (м, 2H).

(S)-4-(2-(2-циклопропилтиазол-4-ил)-2-(4-(4-фторфенил)тиазол-2-иламино)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,79-7,74 (м, 2H), 7,14-7,03 (м, 7H), 7,21 (с, 1Н), 6,79 (с, 1Н), 5,08 (т, 1Н, J=6,6 Гц), 3,29-3,12 (м, 2H), 2,40 (кв., 2,40, J=5,1 Гц), 1,23-1,18 (м, 2H), 1,08-1,02 (м, 2H).

4-((S)-2-(2-циклопропилтиазол-4-ил)-2-(4-(2-метоксифенил)тиазол-2-иламино)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,89-7,87 (д, 1Н, J=7,6 Гц), 7,28 (т, 1Н, J=7,0 Гц), 7,10-6,96 (м, 8H), 5,03 (т, 1Н, J=6,9 Гц), 3,90 (с, 1Н), 3,19 (кв., 2H, J=6,6 Гц), 2,38 (кв., 1H, J=4,8 Гц), 1,21-1,14 (м, 2H), 1,06-1,00 (м, 2H).

4-((S)-2-(2-циклопропилтиазол-4-ил)-2-(4-(2,4-дифторфенил)тиазол-2-иламино)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,06-8,02 (кв., 2H, J=6,9 Гц), 7,12-6,95 (м, 7H), 6,88 (с, 1Н), 5,11 (т, 1H, J=6,9 Гц), 3,22-3,15 (м, 2H), 2,38 (кв., 1H, J=4,8 Гц), 1,22-1,15 (м, 2H), 1,06-1,02 (м, 2H).

(S)-4-(2-(4-(3-метоксибензил)тиазол-2-иламино)-2-(2-циклопропилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,22-7,17 (м, 3H), 7,09-6,97 (м, 5H), 6,78-6,66 (м, 3H), 3,77 (с, 2H), 3,75 (с, 3H), 3,20-3,07 (м, 2H), 2,35 (кв., 1H, J=4,8 Гц), 1,19-1,13 (м, 2H), 1,03-1,00 (м, 2H).

Метиловый эфир (S)-{5-[1-(2-этилтиазол-4-ил)-2-(4-сульфоаминофенил)этиламино]-2-метил-2H-[1,2,4]триазол-3-ил}карбаминовой кислоты:1H ЯМР (300 МГц, MeOH-d4) δ 6,97-7,08 (м, 5H), 3,71 (с, 3H), 3,51 (с, 3H), 3,15 (дд, J=13,5 и 6,3 Гц, 1Н), 3,02-3,07 (м, 3H), 1,40 (т, J=6,6 Гц, 3H).
Второй аспект категории V в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где R1 является замещенным или незамещенным гетероарилом, и R4 является замещенным или незамещенным фенилом и замещенным или незамещенным гетероарилом, как описано ниже в таблице XVIII.
Соединения в соответствии со вторым аспектом категории IX, которые содержат замещенную или незамещенную тиазол-4-ильную группу для R1, могут быть получены по методике, представленной на Схемах XIX, XX и XXI и описанной ниже в примерах 20, 21 и 22.
Схема XIX

Реагенты и условия: (a) (i) (изобутил)OCOCl, Et3N, ТГФ; 0°C, 20 мин. (ii) CH2N2; 0°C до комнатной температуры в течение 3 часов.

Реагенты и условия: (b) 48% HBr, ТГФ; 0°C, 1,5 ч.

Реагенты и условия: (c) CH3CN; кипение с обратным холодильником 2 ч.

Реагенты и условия: (d) тиофосген, CaCO3, CCl4, H2O; кт, 18 ч.

Реагенты и условия: (e) (i) CH3C(O)NHNH2, EtOH; кипение с обратным холодильником, 2 ч. (ii) POCl3, кт 18 ч; 50°C, 2 ч.

Реагенты и условия: (f) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH.
ПРИМЕР 20
(S)-4-(2-(5-Метил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота (55)
Получение трет-бутилового эфира [3-диазо-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты (50): К 0°C раствору 2-(S)-трет-бутоксикарбониламино-3-(4-нитрофенил)пропионовой кислоты (1,20 г, 4,0 ммоль) в ТГФ (20 мл) по каплям добавляют триэтиламин (0,61 мл, 4,4 ммоль), затем изобутилхлорформиат (0,57 мл, 4,4 ммоль). Реакционную смесь перемешивают при 0°C в течение 20 минут, затем фильтруют. Фильтрат обрабатывают эфирным раствором диазометана (~16 ммоль) при 0°C. Реакционную смесь перемешивают при комнатной температуре в течение 3 часов и концентрируют. Остаток растворяют в EtOAc и промывают последовательно водой и насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Полученный остаток очищают над двуокисью кремния (гексан/EtOAc 2:1) с получением 1,1 г (82% выход) желаемого продукта в виде светло-желтого твердого вещества.1H ЯМР (300 МГц, CDCl3) δ 8,16 (д, J=8,7 Гц, 2H), 7,39 (д, J=8,7 Гц, 2H), 5,39 (с, 1Н), 5,16 (д, J=6,3 Гц, 1Н), 4,49 (с, 1Н), 3,25 (дд, J=13,8 и 6,6, 1Н), 3,06 (дд, J=13,5 и 6,9 Гц, 1Н), 1,41 (с, 9H).
Получение трет-бутилового эфира [3-бром-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты (51): К 0°C раствору трет-бутилового эфира [3-диазо-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты, 50, (0,350 г, 1,04 ммоль) в ТГФ (5 мл) по каплям добавляют 48% водн. HBr (0,14 мл, 1,25 ммоль). Реакционную смесь перемешивают при 0°C в течение 1,5 часов и гасят при 0°C насыщенным водным Na2CO3. Смесь экстрагируют EtOAc (3 · 25 мл), и объединенные органические экстракты промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением 0,400 г желаемого продукта, который применяют на следующей стадии без дальнейшей очистки.1H ЯМР (300 МГц, CDCl3) δ 8,20 (д, J=8,4 Гц, 2H), 7,39 (д, J=8,4 Гц, 2H), 5,06 (д, J=7,8 Гц, 1Н), 4,80 (кв., J=6,3 Гц, 1Н), 4,04 (с, 2H), 1,42 (с, 9H).
Получение гидробромида (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина (52): Смесь трет-бутилового эфира [3-бром-1-(4-нитробензил)-2-оксопропил]карбаминовой кислоты, 51, (1,62 г, 4,17 ммоль) и бензотиоамида (0,630 г, 4,59 ммоль) в CH3CN (5 мл) кипятят с обратным холодильником в течение 24 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (50 мл), и полученный осадок собирают фильтрацией. Твердое вещество сушат в вакууме с получением 1,059 г (63%) желаемого продукта. ИЭР+МС 326 (M+1).
Получение (S)-4-[1-изотиоцианато-2-(4-нитрофенил)этил]-2-фенилтиазола (53): К раствору гидробромида (S)-2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этанамина, 52, (2,03 г, 5 ммоль) и CaCO3 (1 г, 10 ммоль) в CCl4/воде (10:7,5 мл) добавляют тиофосген (0,46 мл, 6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем разбавляют CH2Cl2 и водой. Слои разделяют, и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме до остатка, который очищают над двуокисью кремния (CH2Cl2) с получением 1,71 г (93% выход) желаемого продукта. ИЭР+ МС 368 (M+1).
Получение (S)-5-метил-Н-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]-1,3,4-тиадиазол-2-амина (54): Раствор (S)-4-[1-изотиоцианато-2-(4-нитрофенил)этил]-2-фенилтиазола, 53, (332 мг, 0,876 ммоль) и уксусного гидразида (65 мг, 0,876 ммоль) в EtOH (5 мл) кипятят с обратным холодильником в течение 2 часов. Растворитель удаляют при пониженном давлении, остаток растворяют в POCl3 (3 мл), и полученный раствор перемешивают при комнатной температуре в течение 18 часов, затем раствор нагревают до 50°C в течение 2 часов. Растворитель удаляют в вакууме, и остаток растворяют в EtOAc (40 мл), и полученный раствор обрабатывают 1N NaOH до тех пор, пока pH остается приблизительно 8. Раствор экстрагируют EtOAc. Объединенные водные слои промывают EtOAc, органические слои объединяют, промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют в вакууме с получением 0,345 г (93% выход) желаемого продукта в виде желтого твердого вещества.1H ЯМР (CDCl3) 8,09 (д, J=8,4 Гц, 2H), 7,91 (м, 2H), 7,46 (м, 4H), 7,44 (с, 1Н), 5,23 (м, 1Н), 3,59 (м, 2H), 2,49 (с, 3H), ESI+ MS 424 (M+1).
Получение (S)-4-[2-(5-метил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовой кислоты (55): (S)-5-Метил-N-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]-1,3,4-тиадиазол-2-амин, 54, (0,404 г, 0,954 ммоль) растворяют в MeOH (5 мл). Добавляют Pd/C (50 мг, 10% об./об.), и смесь перемешивают в атмосфере водорода до тех пор, пока реакция не будет завершена. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (4 мл) и обрабатывают SO3-пиридином (0,304 г, 1,91 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH (50 мл). Смесь затем концентрируют и полученный остаток очищают препаративной ВЭЖХ с обращенной фазой с получением 0,052 г (11% выход) желаемого продукта в виде аммониевой соли.1H ЯМР (CD3OD): δ 8,00-7,97 (м, 2H), 7,51-7,47 (м, 3H), 7,23 (с, 1Н), 7,11-7,04 (кв., 4H, J=9,0 Гц), 5,18 (т, 1H, J=7,2 Гц), 3,34-3,22 (м, 2H), 2,50 (с, 3H), ESI- MS 472 (M-1).
Схема XX

Реагенты и условия: (a) тиофосген, CaCO3, CCl4/H2O; кт, 18 ч.
Реагенты и условия: (b) CH3CN, кипение с обратным холодильником, 5 часов.

Реагенты и условия: (c) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 21
4-{(S)-2-[4-(2-Метоксифенил)тиазол-2-иламино)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота (58)
Получение (S)-1-[1-(тиофен-2-илтиазол-4-ил)-2-(4-нитрофенил)этил]тиомочевины (56): К раствору гидробромида (S)-2-(4-нитрофенил)-1-(тиофен-2-илтиазол-4-ил)этанамина, 8, (1,23 г, 2,98 ммоль) и CaCO3 (0,597 г, 5,96 ммоль) в CCl4/воде (10 мл/5 мл) добавляют тиофосген (0,412 г, 3,58 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 часов, затем разбавляют CH2Cl2 и водой. Слои разделяют, и водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют в вакууме до остатка, который затем последовательно обрабатывают аммиаком (0,5M в 1,4-диоксане, 29,4 мл, 14,7 ммоль), очищают над двуокисью кремния с получением 0,490 г желаемого продукта в виде красно-коричневого твердого вещества. ИЭР+ МС 399 (M+1).
Получение 4-(2-метоксифенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}тиазол-2-амина (57): (S)-1-[1-(тиофен-2-илтиазол-4-ил)-2-(4-нитрофенил)этил]тиомочевину, 56, (265 мг, 0,679 ммоль) обрабатывают бром-2'-метоксиацетофеноном (171 мг, 0,746 ммоль) с получением 0,221 г продукта в виде желтого твердого вещества. ИЭР+ МС 521 (M+1).
Получение 4-{(S)-2-[4-(2-метоксифенил)тиазол-2-иламино)-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовой кислоты (58): 4-(2-метоксифенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)тиазол-4-ил]этил}тиазол-2-амин, 57, (0,229 г) растворяют в 12 мл MeOH. Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в 6 мл пиридина и обрабатывают SO3-пиридином (140 мг). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 10 мл 7% раствор NH4OH. Затем смесь концентрируют и полученный остаток очищают хроматографией с обращенной фазой с получением 0,033 г желаемого продукта в виде аммониевой соли.1H MR (CD3OD): δ 7,96-7,93 (м, 1Н), 7,60-7,55 (м, 2H), 7,29-7,23 (м, 1Н), 7,18-6,95 (м, 9H), 5,15 (т, 1H, J=6,9 Гц), 3,90 (с, 3H), 3,35-3,24 (м, 2H).
Соединения в соответствии со вторым аспектом категории IX, которые содержат замещенные или незамещенные оксазол-2-ильные группы для R1, могут быт получены по методике, представленной на схеме XXI и описанной ниже в примере 22. Промежуточное соединение 39 может быть получено в соответствии со Схемой XVII и примером 18.
Схема XXI
Реагенты и условия: (a) 1-азидо-1-(3-метоксифенил)этанон, PPh3, диоксан, 90°C 20 минут.
Реагенты и условия: (b) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH; кт, 18 ч.
ПРИМЕР 22
4-{(S)-2-[5-(3-Метоксифенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота (61)
Получение [5-(3-метоксифенил)оксазол-2-ил]-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]амин (60): Смесь (S)-4-(изотиоцианато-2-(4-нитрофенил)этил)-2-фенилтиазола, 53, (300 мг, 0,81 ммоль), 1-азидо-1-(3-метоксифенил)этанона (382 мг, 2,0 ммоль) и PPh3 (0,8 г, полимерная связь, ~3 ммоль/г) в диоксане (6 мл) нагревают при 90°C в течение 20 минут. Реакционный раствор охлаждают до комнатной температуры, и растворитель удаляют в вакууме, и полученный остаток очищают над двуокисью кремния с получением 300 мг (74% выход) желаемого продукта в виде желтого твердого вещества.1H ЯМР (300 МГц, MeOH-d4) δ 8,02 (д, J=7,2 Гц, 2H), 7,92-7,99 (м, 2H), 7,42-7,47 (м, 3H), 7,22-7,27 (м, 3H), 6,69-7,03 (м, 4H), 6,75-6,78 (м, 1Н), 5,26 (т, J=6,3 Гц, 1Н), 3,83 (с, 4H), 3,42-3,45 (м, 2H).
Получение 4-{(S)-2-[5-(3-метоксифенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовой кислоты (61): [5-(3-метоксифенил)оксазол-2-ил]-[2-(4-нитрофенил)-1-(2-фенилтиазол-4-ил)этил]амин, 60, (300 мг, 0,60 ммоль) растворяют в MeOH (15 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (10 мл) и обрабатывают SO3-пиридином (190 мг, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Затем смесь концентрируют, и полученный остаток очищают хроматографией с обращенной фазой с получением 0,042 г желаемого продукта в виде аммониевой соли.1Н ЯМР (300 МГц, MeOH-d4) δ 7,99 (д, J=7,5 Гц, 2H), 7,46-7,50 (м, 3H), 7,23-7,29 (м, 3H), 7,04-7,12 (м, 6H), 6,78 (дд, J=8,4 и 2,4 Гц, 1Н), 5,16 (т, J=6,6 Гц, 1Н), 3,81 (с, 3H), 3,29-3,39 (м, 1Н), 3,17 (дд, J=13,8 и 8,1 Гц, 1Н).
Далее представлены не ограничивающие примеры второго аспекта категории IX в соответствии с данным изобретением.

(S)-4-(2-(5-Фенил-1,3,4-тиадиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,97-7,94 (м, 2H), 7,73-7,70 (м, 2H), 7,44-7,39 (м, 6H), 7,25 (с, 1Н), 7,12 (с, 4H), 5,29 (т, 1H, J=6,9 Гц), 3,35-3,26 (м, 2H).
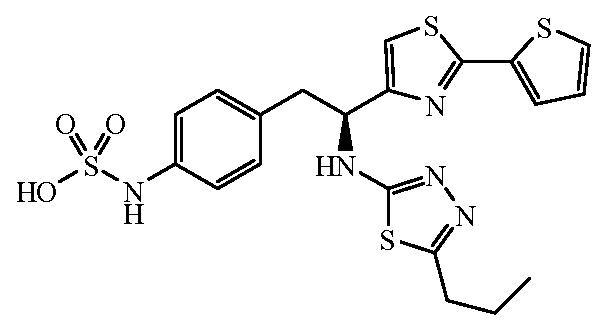
4-((S)-2-(5-Пропил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,59-7,54 (м, 2H), 7,17-7,03 (м, 6H), 5,13 (т, 1Н, J=7,2 Гц), 3,32-3,13 (м, 2H), 2,81 (т, 2H, J=7,4 Гц), 1,76-1,63 (h, 6H, J=7,4 Гц), 0,97 (т, 3H, J=7,3 Гц).

4-((S)-2-(5-Бензил-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ (м, 2H), 7,49-7,45 (м, 2H), 7,26-7,16 (м, 5H), 7,05-6,94 (м, 6H), 5,04 (т, 1Н, J=7,1 Гц), 4,07 (с, 2H), 3,22-3,04 (м, 2H).

4-((S)-2-(5-(Нафталин-1-илметил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,08-8,05 (м, 1Н), 7,89-7,80 (м, 2H), 7,55-7,43 (м, 6H), 7,11-7,00 (м, 6H), 5,08 (т, 1H, J=7,1 Гц), 4,63 (с, 2H), 3,26-3,08 (м, 2H).

4-((S)-2-(5-((Метоксикарбонил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,48-7,44 (м, 2H), 7,03-6,92 (м, 6H), 5,02 (т, 1Н, J=7,2 Гц), 4,30 (с, 2H), 3,55 (с, 3H), 3,22-3,02 (м, 2H).

4-((S)-2-(5-((2-Метилтиазол-4-ил)метил)-1,3,4-тиадиазол-2-иламино)-2-(2-(тиофен-2-ил)тиазол-4-ил)этил)фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,60-7,56 (м, 2H), 7,19 (с, 1Н), 7,15- 7,12 (м, 2H), 7,09-7,03 (кв., 4H, J=8,7 Гц), 5,14 (т, 1H, J=7,2 Гц), 4,28 (с, 2H), 3,33-3,14 (м, 2H), 2,67 (с, 3H).
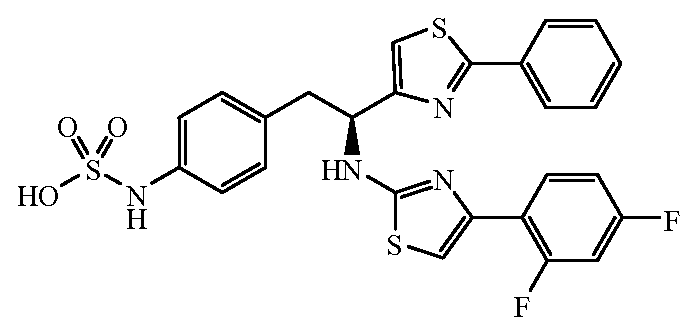
4-{(S)-2-[4-(2,4-Дифторфенил)тиазол-2-иламино]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,06-8,02 (кв., 1Н, J=6,8 Гц), 7,59-7,54 (м, 2H), 7,16-7,08 (м, 6H), 7,01-6,88 (м, 4H), 5,20 (т, 1Н, J=7,0 Гц), 3,36-3,17 (м, 2H).
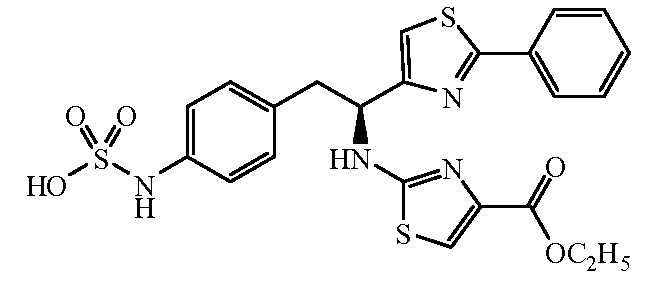
(S)-4-{2-[4-(Этоксикарбонил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,02-7,99 (м, 2H), 7,54-7,45 (м, 4H), 7,26 (с, 1Н), 7,08 (с, 4H), 5,26 (т, 1H, J=6,9 Гц), 4,35-4,28 (кв., 2H, J=6,9 Гц), 3,38-3,18 (м, 2H), 1,36 (т, 3H, J=7,2 Гц).

(S)-4-{2-[4-(2-Этокси-2-оксоэтил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,96 (м, 2H), 7,50-7,46 (м, 3H), 7,21 (с, 1Н), 7,10-7,04 (м, 4H), 6,37 (с, 1Н), 5,09 (т, 1H, J=6,9 Гц), 4,17-4,10 (кв., 2H, J=7,1 Гц), 3,54 (с, 2H), 3,35-3,14 (м, 2H), 1,22 (т, 3H, J=7,1 Гц).

(S)-4-{2-[4-(4-ацетамидофенил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,11 (м, 2H), 7,82-7,80 (м, 2H), 7,71-7,61 (м, 6H), 7,40 (с, 1Н), 7,23 (с, 4H), 5,32 (т, 1Н, J=7,0 Гц), 3,51-3,35 (м, 2H), 2,28 (с, 3H).

(S)-4-[2-(4-фенилтиазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовая кислота:1H (CD3OD): δ 8,03-7,99 (м, 2H), 7,75-7,72 (д, 2H, J=8,4 Гц), 7,53-7,48 (м, 3H), 7,42 (м, 4H), 7,12 (с, 4H), 6,86 (с, 1Н), 5,23 (т, 1Н, J=7,2 Гц), 3,40-3,27 (м, 2H).

(S)-4-{2-[4-(4-(метоксикарбонил)фенил)тиазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 8,04-8,00 (м, 4H), 7,92-7,89 (д, 2H, J=9,0 Гц), 7,53-7,49 (м, 3H), 7,30 (с, 1Н), 7,15 (с, 4H), 7,05 (с, 1Н), 5,28 (т, 1Н, J=6,9 Гц), 3,93 (с, 3H), 3,35-3,24 (м, 2H).

4-{(S)-2-[4-(Этоксикарбонил)тиазол-2-иламино]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (CD3OD): δ 7,43-7,38 (м, 2H), 7,26 (с, 1Н), 7,00-6,94 (м, 3H), 6,89 (с, 4H), 5,02 (т, 1Н, J=7,0 Гц), 4,16-4,09 (кв., 2H, J=7,1 Гц), 3,14-2,94 (м, 2H), 1,17 (т, 3H, J=7,1 Гц).

(S)-4-[2-(4-(Метоксикарбонил)тиазол-5-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,97-8,00 (м, 3H), 7,48-7,52 (м, 3H), 7,22 (с, 1Н), 7,03-7,13 (м, 4H), 4,74 (т, J=6,6 Гц, 1Н), 3,88 (с, 3H), 3,28-3,42 (м, 2H).

(S)-4-[2-(5-Фенилоксазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил]фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,94-7,96 (м, 2H), 7,45-7,49 (м, 5H), 7,32 (т, J=7,8 Гц, 2H), 7,12 (с, 1Н), 7,19 (т, J=7,2 Гц, 1Н), 7,12 (с, 4H), 7,05 (с, 1Н), 5,15 (т, J=6,4 Гц, 1Н), 3,34 (дд, J=14,1 и 8,4 Гц, 1Н), 3,18 (дд, J=14,1 и 8,4 Гц, 1Н).

(S)-4-{2-[5-(4-Ацетамидофенил)оксазол-2-иламино]-2-(2-фенилтиазол-4-ил)этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,92-7,94 (м, 2H), 7,55-7,58 (м, 2H), 7,39-7,50 (м, 5H), 7,26 (с, 1Н), 7,12 (с, 4H), 7,02 (с, 1Н0), 5,14 (т, J=7,8 Гц, 1Н), 3,13-3,38 (м, 2H), 2,11 (с, 3H).

4-((S)-2-(5-(2,4-Дифторфенил)оксазол-2-иламино)-2-(2-фенилтиазол-4-ил)этил)фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,97-7,99 (м, 2H), 7,54-7,62 (м, 1Н), 7,45-7,50 (м, 3H), 7,28 (с, 1Н), 7,12 (с, 4H), 6,97-7,06 (м, 3H), 5,15-5,20 (м, 1Н), 3,28-3,40 (м, 1Н), 3,20 (дд, J=13,8 и 8,4 Гц, 1Н).

4-{(S)-2-[5-(3-Метоксифенил)оксазол-2-иламино]-2-[(2-тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота:1H ЯМР (300 МГц, MeOH-d4) δ 7,55-7,60 (м, 2H), 7,26 (т, J=8,1 Гц, 1Н), 7,21 (с, 1Н), 7,04-7,15 (м, 8H), 6,77-6,81 (м, 1Н), 5,10 (т, J=6,3 Гц, 1Н), 3,81 (с, 3H), 3,29-3,36(м, 1Н), 3,15 (дд, J=14,1 и 8,4 Гц, 1Н).

(S)-4-[2-(4,6-диметилпиримидин-2-иламино)-2-(2-метилтиазол-4-ил)этил]фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,00-7,10 (м, 5H), 6,44 (с, 1Н), 5,50 (т, J=7,2 Гц, 1Н), 3,04-3,22 (м, 2H), 2,73 (с, 3H), 2,27 (с, 6H).

(S)-4-[2-(4-Гидрокси-6-метилпиримидин-2-иламино)-2-(2-метилтиазол-4-ил)этил]фенилсульфаминовая кислота:1Н ЯМР (300 МГц, MeOH-d4) δ 7,44 (д, J=8,4 Гц, 2H), 6,97-7,10 (м, 4H), 5,61 (с, 1Н), 5,40-5,49 (м, 1Н), 3,10-3,22 (м, 2H), 2,73 (с, 3H), 2,13 (с, 3H).
Первый аспект категории X в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где R1 является гетероарилом и R4 описан ниже в таблице XIX.
Соединения в соответствии с первым аспектом категории X могут быть получены по методике, представленной на Схеме XXII и описанной ниже в примере 23.
Схема XXII
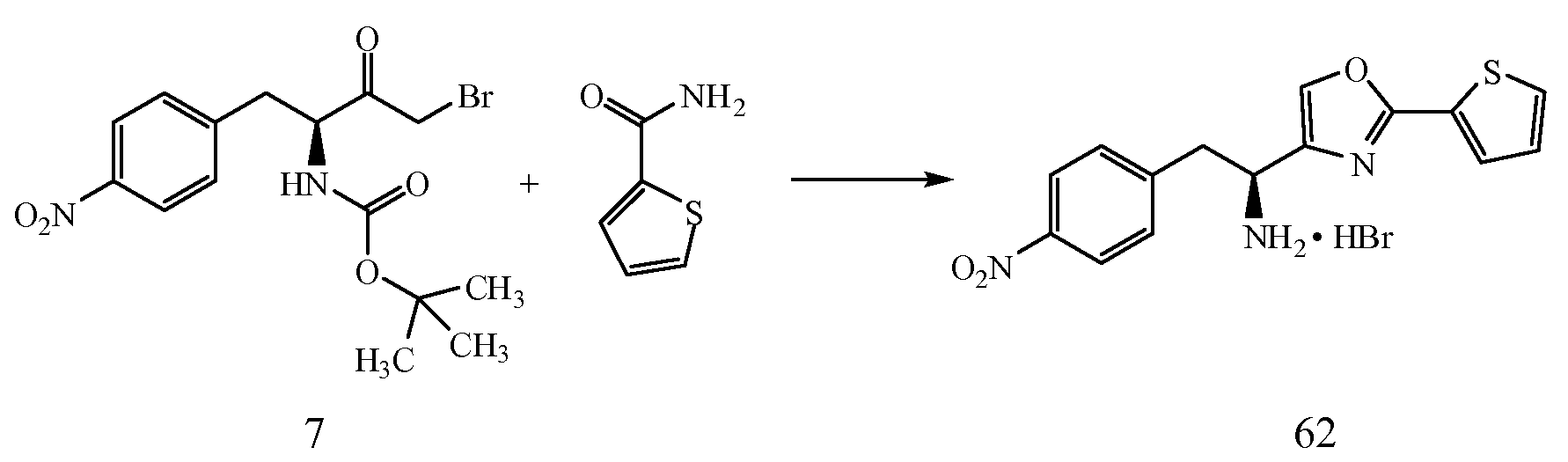
Реагенты и условия: (a) CH3CN; кипение с обратным холодильником 2 ч.
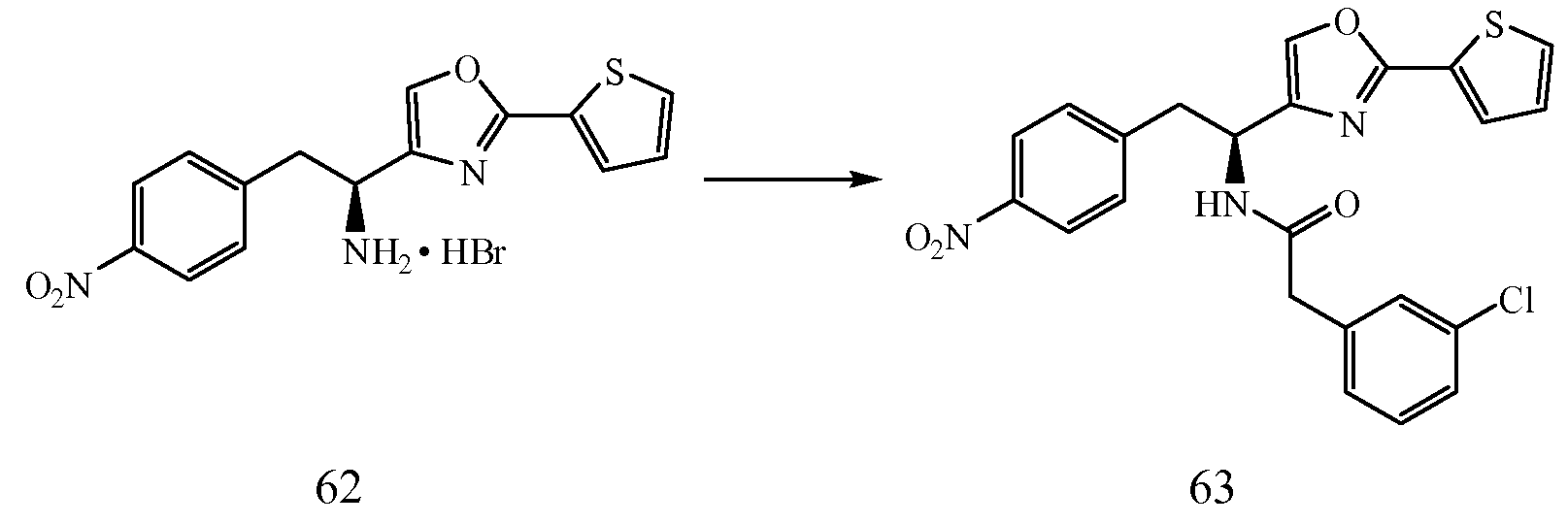
Реагенты и условия: (b) (3-Cl)C6H4CO2H, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.
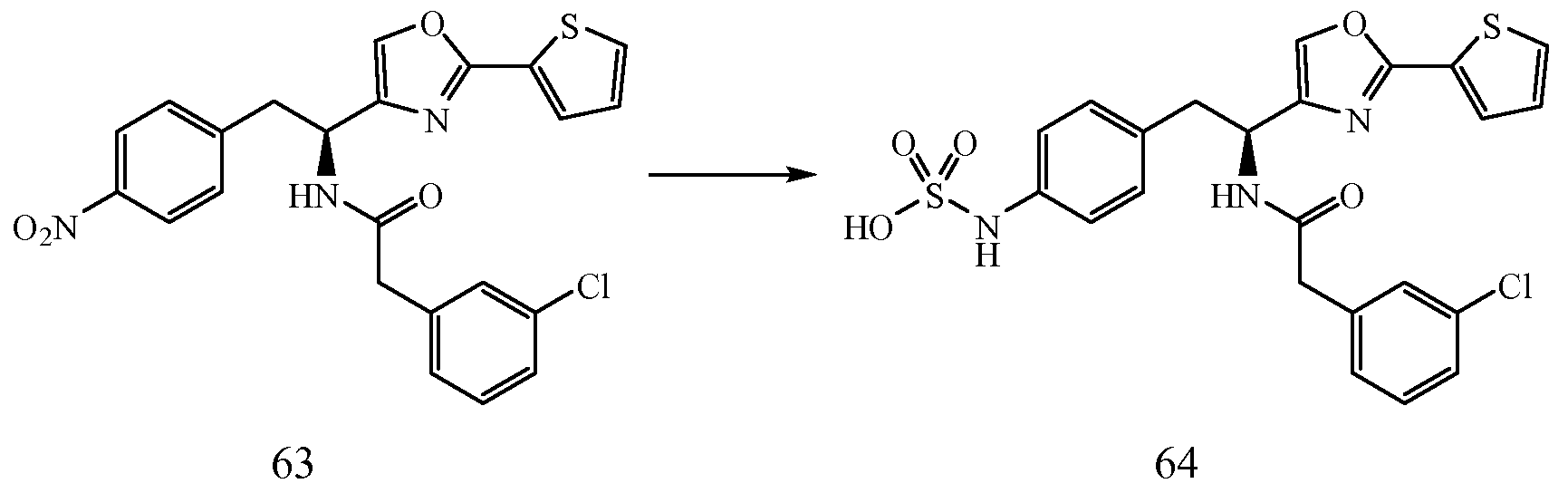
Реагенты и условия: (c) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 23
4-((S)-2-(2-(3-Хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)оксазол-4-ил)этил)фенилсульфаминовая кислота (64)
Получение гидробромида (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)оксазол-4-ил]этанамина (62): Смесь (S)-трет-бутил 4-бром-1-(4-нитрофенил)-3-оксобутан-2-илкарбамата, 7, (38,7 г, 100 ммоль) и тиофен-2-карбоксамида (14 г, 110 ммоль) (доступен от Alfa Aesar) в CH3CN (500 мл) кипятят с обратным холодильником в течение 5 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир (200 мл). Полученный осадок собирают фильтрацией. Твердое вещество сушат в вакууме с получением желаемого продукта, который может применяться на следующей стадии без дальнейшей очистки.
Получение 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)оксазол-4-ил]этил}ацетамида (63): К раствору HBr (S)-2-(4-нитрофенил)-1-[(тиофен-2-ил)оксазол-4-ил]этанамина, 47, (3,15 г, 10 ммоль), 3-хлорфенилуксусной кислоты (1,70 г, 10 ммоль) и 1-гидроксибензотриазола (HOBt) (0,70 г, 5,0 ммоль) в ДМФ (50 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (1,90 г, 10 ммоль), затем триэтиламин (4,2 мл, 30 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением желаемого продукта, который применяют без дальнейшей очистки.
Получение -((S)-2-(2-(3-хлорфенил)ацетамидо)-2-(2-(тиофен-2-ил)оксазол-4-ил)этил)фенилсульфаминовой кислоты (64): 2-(3-хлорфенил)-N-{(S)-2-(4-нитрофенил)-1-[2-(тиофен-2-ил)оксазол-4-ил]этил}ацетамид, 63, (3 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,157 г). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH. Смесь затем концентрируют и полученный остаток очищают хроматографией с обращенной фазой с получением желаемого продукта в виде аммониевой соли.
Второй аспект категории X в соответствии с данным изобретением относится к соединениям, имеющим формулу:

где R1 является арилом и R2 и R3 описаны ниже в таблице XX.
Соединения в соответствии со вторым аспектом категории X могут быть получены по методике, представленной на Схеме XXIII и описанной ниже в примере 24.
Схема XXIII

Реагенты и условия: (a) CH3CN; кипение с обратным холодильником, 2 ч.

Реагенты и условия: (b) C6H4CO2H, EDCI, HOBt, ДИПЭА, ДМФ; кт, 18 ч.

Реагенты и условия: (c) (i) H2:Pd/C, MeOH; (ii) SO3-пиридин, NH4OH, кт, 18 ч.
ПРИМЕР 24
{4-[2-(S)-(4-Этилоксазол-2-ил)-2-фенилацетиламиноэтил]фенил}сульфаминовая кислота (67)
Получение (S)-1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этанамин (65): Смесь трет-бутилового эфира [1-(S)-карбамоил-2-(4-нитрофенил)этилкарбаминовой кислоты, 1, (10 г, 32,3 ммоль) и 1-бром-2-бутанона (90%, 4,1 мл, 36 ммоль) в CH3CN (500 мл) кипятят с обратным холодильником в течение 18 часов. Реакционную смесь охлаждают до комнатной температуры и к раствору добавляют диэтиловый эфир, и полученный осадок удаляют фильтрацией и используют без дальнейшей очистки.
Получение N-[1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этил]-2-фенилацетамида (66): К раствору (S)-1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этанамина, 65, (2,9 г, 11 ммоль), фенилуксусной кислоты (1,90 г, 14 ммоль) и 1-гидроксибензотриазола (HOBt) (0,94 г, 7,0 ммоль) в ДМФ (100 мл) при 0°C добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDCI) (2,68 г, 14 ммоль), затем триэтиламин (6,0 мл, 42 ммоль). Смесь перемешивают при 0°C в течение 30 минут, затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют водой и экстрагируют EtOAc. Объединенную органическую фазу промывают 1N водной HCl, 5% водным NaHCO3, водой и насыщенным раствором соли, и сушат над Na2SO4. Растворитель удаляют в вакууме с получением желаемого продукта, который применяют без дальнейшей очистки.
Получение {4-[2-(S)-(4-этилоксазол-2-ил)-2-фенилацетиламиноэтил]фенил}сульфаминовой кислоты (67): N-[1-(4-этилоксазол-2-ил)-2-(4-нитрофенил)этил]-2-фенилацетамид, 66, (0,260 г) растворяют в MeOH (4 мл). Добавляют каталитическое количество Pd/C (10% об./об.), и смесь перемешивают в атмосфере водорода в течение 18 часов. Реакционную смесь фильтруют через слой CELITE™, и растворитель удаляют при пониженном давлении. Неочищенный продукт растворяют в пиридине (12 мл) и обрабатывают SO3-пиридином (0,177 г, 1,23). Реакционную смесь перемешивают при комнатной температуре в течение 5 минут, затем добавляют 7% раствор NH4OH (10 мл). Затем смесь концентрируют и полученный остаток очищают хроматографией с обращенной фазой с получением желаемого продукта в виде аммониевой соли.
СПОСОБЫ
Описанные соединения могут применяться для предупреждения, ослабления, минимизации, контроля и/или снижения метастазов опухоли у человека и животных. Описанные соединения также могут применяться для снижения скорости роста первичной опухоли. Описанные соединения, при введении пациенту, нуждающемуся в лечении, могут применяться для остановки распространения раковых клеток. Как таковые, описанные в описании соединения могут вводиться как часть комбинированной терапии с одним или более лекарственными средствами или другими фармацевтическими агентами. При применении в качестве части комбинированной терапии, снижение метастазов и уменьшение роста первичной опухоли, вызываемые описанными соединениями, позволяют более эффективно и оптимально применять любую фармацевтическую или лекарственную терапию, которую используют для лечения пациента. Кроме того, контроль метастазов описанными соединениями позволяет в большей степени концентрировать болезнь пациента в одном месте.
Далее описаны способы предупреждения метастазов злокачественных опухолей или других раковых клеток, а также снижения скорости роста опухоли. Способы включают введение эффективного количества одного или более описанных соединений пациенту, у которого диагностирована злокачественная опухоль или раковые клетки, или пациенту, имеющему опухоль или раковые клетки.
Далее представлено применение описанных соединений для получения лекарственного средства для предупреждения метастазов злокачественных опухолей или других раковых клеток, и для снижения скорости роста опухоли.
Далее представлены не ограничивающие примеры видов рака, которые могут подвергаться лечению описанными способами и композициями: острый лимфобластный лейкоз; острая миелоидная лейкемия; карцинома коры надпочечников; карцинома коры надпочечников у детей; рак аппендикса; базальноклеточная карцинома; рак желчного протока, внепеченочный; рак костей; остеосаркома и злокачественная фиброзная гистиоцитома; глиома ствола мозга у детей; рак мозга у взрослых; рак мозга, глиома ствола мозга у детей; опухоль мозга, опухоль атипичного тератоида/рабдоида центральной нервной системы у детей; опухоли центральной нервной системы у эмбриона; астроцитома мозжечка; астроцитома головного мозга/злокачественная глиома; краниофарингиома; эпендимобластома; эпендимома; медуллобластома; медуллоэпителиома; пинеальная паренхиматозная опухоль промежуточной дифференциации; супратенториальные примитивные нейроэктодермальные опухоли и пинкобластома; глиома зрительного пути и гипоталамуса; опухоли мозга и спинного мозга; рак молочной железы; опухоли бронхов; лимфома Беркитта; карциноидная опухоль; карциноидная опухоль желудочно-кишечного тракта; опухоль атипичного тератоида/рабдоида центральной нервной системы; опухоли центральной нервной системы эмбриона; лимфома центральной нервной системы; астроцитома мозжечка; астроцитома головного мозга/злокачественная глиома у детей; рак шейки матки; хордома у детей; хроническая лимфоцитная лейкемия; хроническая миелогенная лейкемия; хронические миелопролиферативные расстройства; рак толстой кишки; рак ободочной и прямой кишки; краниофарингиома; лимфома Т-клеток кожи; рак пищевода; семейство опухолей Эвинга; внегонадная эмбрионально-клеточная опухоль; внепеченочный рак желчных протоков; рак глаза, внутриглазная меланома; рак глаза, ретинобластома; рак желчного пузыря; рак желудка; желудочно-кишечная карциноидная опухоль; желудочно-кишечная стромальная опухоль (ЖКСО); опухоль стволовых клеток, экстракраниальная; опухоль стволовых клеток, экстрагонадальная; опухоль стволовых клеток, яичники; гестационная трофобластическая опухоль; глиома; глиома ствола мозга у детей; глиома, церебральная астроцитома у детей; глиома, зрительный путь и гипоталамус у детей; лейкемия клеток Плейна; рак головы и шеи; печеночно-клеточный (печеночный) рак; гистоцитоз, клетки Лангерганса; лимфома Ходжкина; http://www.cancer.gov/cancertopics/typcs/hodgkinslymphoma/гипофарингеальный рак; глиома гипоталамуса и зрительного пути; внутриглазная меланома; опухоли островковых клеток; рак почек (клеток почек); гистоцитоз клеток Лангерганса; рак гортани; лейкемия, острая лимфобластная; лейкемия, острая миелоидная; лейкемия, хроническая лимфоцитная; лейкемия, хроническая миелогенная; лейкемия, волосатые клетки; рак губ и ротовой полости; рак печени; рак легких, не мелкоклеточный; рак легких, мелкоклеточный; лимфома, связанная со СПИД; лимфома, Беркитта; лимфома, Т-клетки кожи; лимфома, Ходжкина; лимфома, не Ходжкина; лимфома, первичная центральная нервная система; макроглобулинемия, Вальденсторм; злокачественная фиброзная гистиоцитома костей и остеосаркома; медуллобластома; меланома; меланома, внутриглазная (глаз); карцинома клеток Меркеля; мезотелиома; метастатический сквамозный рак шеи, скрытый первичный; рак рта; синдром множественной эндокринной неоплазии, (дети); множественная миелома/неоплазм клеток плазмы; грибовидный микоз; миелодиспластические синдромы; миелодиспластические/миелопролиферативные заболевания; миелогенная лейкемия, хроническая; миелоидная лейкемия, острая у взрослых; миелоидная лейкемия, острая, у детей; миелома, множественная; миелопролиферативные расстройства, хронические; рак носовой полости и параназального синуса; рак носоглотки; нейробластома; не мелкоклеточный рак легких; рак рта; рак ротовой полости; рак ротоглотки; остеосаркома и злокачественная фиброзная гистиоцитома костей; рак яичников; рак эпителия яичников; рак стволовых клеток яичников; злокачественная низкопотенциальная опухоль яичников; рак поджелудочной железы; рак поджелудочной железы, опухоли островковых клеток; папилломатоз; рак паращитовидной железы; рак пениса; рак глотки; феохромоцитома; пинеальные паренхиматозные опухоли промежуточной дифференциации; пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли; опухоль гипофиза; неоплазм клеток плазмы/множественная миелома; плевролегочная бластома; первичная лимфома центральной нервной системы; рак простаты; рак прямой кишки; рак клеток почек (почек); почечные лоханки и уретра, рак «переходных» клеток; карцинома дыхательных путей, включающая NUT ген на хромосоме 15; ретинобластома; рабдомиосаркома; рак слюнных желез; саркома, семейство опухолей Юинга; саркома, Капоши; саркома, мягкие ткани; саркома, матка; синдром Сезари; рак кожи (не меланома); рак кожи (меланома); карцинома кожи, клетки Меркеля; мелкоклеточный рак легких; рак тонкого кишечника; саркома мягких тканей; карцинома плоских клеток, скрытый первичный сквамозный рак шеи, метастатический; рак желудка; супратенториальные примитивные нейроэктодермальные опухоли; лимфома Т-клеток, кожа; рак яичников; рак горла; тимома и тимусная карцинома; рак щитовидной железы; рак «переходных клеток» почечной лоханки и уретры; трофобластическая опухоль, гестационная; рак уретры; рак матки, эндометриальный; саркома матки; рак влагалища; рак вульвы; макроглобулинемия Вальденстрема; и опухоль Уилмса.
Анти-метастазное исследование In Vivo
50 NCr nu/nu самцов мышей в возрасте 5-6 недель отбирают для следующего in vivo теста. H460-GFP человеческие опухолевые клетки выращивают подкожно у NCr nu/nu самцов мышей, после чего собирают полученные опухоли. После сбора NCr nu/nu мыши из этого исследования имеют фрагменты опухоли, трансплантированные с применением хирургической ортотопической имплантации (ХОИ). Каждое животное анестезируют изофураном и область операции стерилизуют йодом и спиртом. Поперечный разрез длиной приблизительно 1,5 см делают в левой грудной стенке мыши с применением пары хирургических ножниц. Межреберный разрез делают между третьим и четвертым ребром, и обнажают левое легкое. Два куска фрагментов опухоли H460-GFP трансплантируют на поверхность легкого с применением 8-0 хирургической нейлоновой нити. Грудную стенку закрывают 6-0 шелковой нитью. Легкое повторно наполнят воздухом через внутригрудную пункцию с применением шприца 3 см3 с 25 G 1Ѕ иглой для отвода оставшегося воздуха в грудной полости. Грудную стенку закрывают 6-0 шелковой нитью. Все процедуры описанной выше операции проводят с применением микроскопа с 7-кратным увеличением (Olympus) под HEPA фильтрованным ламинарным шкафом.
Обработанных мышей делят на пять групп, по десять мышей в каждой. Группа I (контрольная) получает 100 мкл лекарственного носителя два раза в сутки в течение 15 дней. Группа II получает 15 мг/кг таксола внутривенно в дни 6, 9, 12 и 15. Группа III получает 15 мг/кг таксола внутривенно в дни 6, 9, 12 и 15, и 15 мг/кг 4-{(S)-2-[(S)-2-(метоксикарбониламино)-3-фенил-пропанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовой кислоты, D91, (тестируемое соединение) два раза в сутки с 3 до 15 дни. Группа IV получает 10 мг/кг таксола внутривенно в дни 6, 9, 12 и 15, и 15 мг/кг тестируемого соединения дважды в сутки с 3 по 15 дни. Группа V получает 15 мг/кг тестируемого соединения два раза в сутки с 3 по 15 дни. Всех животных умерщвляют на 28 день.
Каждое животное проверяют два раза в неделю на первичную опухоль и метастазы через открытое изображение ЗФБ медиастинальных лимфатических узлов. Метастазы не были найдены ни в одном из других органов. Шесть мышей из контрольной группы умерли до конца исследования, но их также оценивали на предмет опухоли и/или клеточных метастазов. В таблице XXI ниже суммированы результаты исследования метастазов in vivo.
Противораковые исследования In Vivo
Меланома B16
Изучают эффективность описанных соединений в качестве лечения для меланомы. Мышам C57BL/6 (возраст 6-8 недель, самки, Taconic Farm) инокулируют клетки меланомы B16 (5 · 104 клеток/место, п.к.). На 4 день после инокуляции мышей (5/группу) обрабатывают (5 дней/неделю, M-F) контрольным носителем (2/сутки, в.б.), низкой дозой IL-2 (100000 МЕ/мышь, 2/сутки, в.б.), высокой дозой IL-2 (300000 МЕ/мышь, 2/сутки, в.б.) или их сочетаниями с D91 (40 мг/кг, 2/сутки, п.к., вводят за 30 минут до IL-2). Записывают объемы опухолей. В отдельном эксперимента мышей, которым также инокулируют клетки меланомы B16, обрабатывают (5 дней/неделю, M-F) контрольным носителем (2/сутки, в.б.), IL-2 (300000 МЕ/мышь, 2/сутки, в.б.), высокой дозой D91 (40 мг/кг, 2/сутки, в.б.), низкой дозой D91 (10 мг/кг, 2/сутки, в.б.) или сочетанием IL-2 (300000 МЕ/мышь, 2/сутки, в.б.) с низкой дозой D91 (10 мг/кг, 2/сутки, в.б., вводят за 30 минут до IL-2). Записывают объемы опухолей.
Как изображено на Фигуре 3, хотя высокая доза IL-2 (◊) снижает объем опухоли по сравнению с контролем (□), лечение высокой дозой IL-2 в сочетании с высокой дозой D91 (○) значительно снижает объем опухоли по сравнению с только высокой дозой IL-2 (◊). На Фигуре 4 представлена гистограмма, представляющая объем опухоли животных, получающих контроль (A), высокую дозу IL-2 (B) и высокую дозу IL-2/высокую дозу D91 (C). Данные, изображенные на Фигуре 5, показывают, что увеличение массы тела животных во время исследования было характерно для каждой группы и не является признаком эффективности выбора лечения.
Как изображено на Фигуре 6, лечение низкой дозой IL-2 в сочетании с высокой дозой D91 (○) значительно снижает объем опухоли по сравнению с контролем (□), в то время как только низкая доза IL-2 (◊) не демонстрирует измеряемое снижение объема опухоли при окончании исследования на 22 день. На Фигуре 7 представлена гистограмма, представляющая объем опухоли животных, получающих контроль (A), низкую дозу IL-2 (B) и низкую дозу IL-2/высокую дозу D91 (C). На Фигуре 8 показана эффективность лечения 40 мг/кг 2 раза в сутки D91 (○) по отношению к контрольному носителю (□) на примере объема опухоли меланомы B16.
Карцинома клеток почек
Изучают эффективность описанных соединений в качестве лечения карциномы клеток почек. Мышам Balb/c (возраст 6-8 недель, самки, Taconic Farm) инокулируют раковыми клетками почек Renca (5 · 105 клеток/место). На 4 день после инокуляции мышей произвольно делят на 4 группы (4 мыши/группу) и обрабатывают (5 дней/неделю, M-F) контрольным носителем (2/сутки, в.б.), IL-2 (100000 МЕ/мышь, 2/сутки, в.б.), D91 (40 мг/кг, 2/сутки, в.б., вводят за 30 минут до IL-2) или сочетанием. Записывают объемы опухолей.
Как изображено на Фигуре 1 и Фигуре 2, 4-{(S)-2-[(S)-2-(метоксикарбониламино)-3-фенилпропанамидо]-2-[2-(тиофен-2-ил)тиазол-4-ил]этил}фенилсульфаминовая кислота, D91, значительно снижает рост опухоли почек и является таким же эффективным, как IL-2, для снижения объема опухоли. Кроме того, сочетание D91 и IL-2 также снижает объем опухоли.
Рак поджелудочной железы
Рак поджелудочной железы представляет собой злокачественную неоплазму поджелудочной железы. Каждый год в США около 42000 человек диагностируют это состояние и 35000 умирают от заболевания ("Pancreatic Cancer - National Cancer Institute. U.S. National Institutes of Health" (2009)). Прогноз относительно плохой, но улучшается; трехлетняя выживаемость в настоящее время составляет около тридцати процентов, но менее 5 процентов людей, которым диагностировали заболевание, все еще живы через 5 лет после диагностики. Полная ремиссия все еще является большой редкостью (Ghaneh P et al., (August 2007). "Biology and management of pancreatic cancer". Gut 56 (8): 1134-52).
Исследуют эффективность описанных соединений в качестве лечения рака поджелудочной железы. 60 самцам NCr nu/nu возрастом 5-6 недель трансплантируют с применением хирургической ортотопической имплантации (ХОИ) с применением MiaPaCa-2 фрагменты опухоли -RFP, выращенные у скота. Животных анестезируют изофлураном и хирургическую область стерилизуют йодом и спиртом. Поперечный разрез длиной приблизительно 1,5 см делают в левой верхней брюшине голой мыши с применением пары хирургических ножниц. Поджелудочную железу обнажают и затем два куска фрагмента опухоли MiaPaCa-2-RFP по 2 мм3 трансплантируют в поджелудочную железу мыши с применением 8-0 хирургической нити (нейлон) после того, как капсула места трансплантации обнажена. Брюшину закрывают 6-0 хирургической нитью (шелк). Все процедуры описанной выше операции проводят с применением микроскопа с 7-кратным увеличением (Olympus) под HEPA фильтрованным ламинарным шкафом.
Дозирование животным начинают через три дня после имплантации опухоли. Высокая доза гемцитабина составляет 150 мг/кг. Низкая доза гемцитабина составляет 100 мг/кг. D91 дают в дозе 20 мг/кг. Гемцитабин вводят в.б., D91 вводят п.к.
Животных делят на следующие группы из десяти животных, которые указаны в таблице XXII. Как показано в таблице XXII, D91 вводят два раза в сутки, гемцитабин вводят два раза в неделю.
Как изображено на Фигуре 9, D91, вводимый в дозе 20 мг/кг, показал значительное снижение объема опухоли поджелудочной железы на 28 день (○). Кроме того, сочетание низкой дозы гемцитабина и 20 мг/кг D91 (∗) показало значительное снижение объема опухоли, по сравнению с только низкой дозой гемцитабина (X) или D91 (○).
Далее описан способ лечения карциномы у пациента, включающий введение пациенту, имеющему карциному, эффективного количества одного или более из описанных соединений.
Также описан способ лечения пациента, у которого диагностирован рак, включающий введение пациенту эффективного количества одного или более описанных соединений.
Также описан способ лечения карциномы у пациента, включающий введение пациенту, имеющему карциному, композиции, включающей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество противоракового лекарственного средства.
Также описан способ лечения карциномы у пациента, включающий введение пациенту, имеющему карциному, композиции, включающей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество соединения, которое ингибирует рост опухоли.
Также описан способ лечения пациента, у которого диагностирован рак, включающий введение пациенту, у которого диагностирован рак, композиции, включающей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество противоракового лекарственного средства.
Также описан способ лечения пациента, у которого диагностирован рак, включающий введение пациенту, у которого диагностирован рак, композиции, включающей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество соединения, которое ингибирует рост опухоли.
КОМПОЗИЦИИ
Описаны композиции, которые могут применяться для предупреждения метастазов раковых клеток у пациента, где композиции содержат эффективное количество одного или более соединений, описанных в описании. Также описаны композиции, которые могут применяться для лечения опухолей у человека или других млекопитающих.
Один аспект относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) один или более фармацевтически приемлемых ингредиентов.
Другой аспект относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество одного или более химиотерапевтических агентов;
где описанные соединения и химиотерапевтические агенты могут вводиться вместе или в любом порядке.
Один вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество таксола;
где описанные соединения и таксол могут вводиться вместе или в любом порядке.
Другой вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество гемцитабина;
где описанные соединения и гемцитабин могут вводиться вместе или в любом порядке.
Другой вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество эрлотиниба;
где описанные соединения и эрлотиниб могут вводиться вместе или в любом порядке.
Другой вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество доксила;
где описанные соединения и доксил могут вводиться вместе или в любом порядке.
Другой вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество иринотекана;
где описанные соединения и иринотекан могут вводиться вместе или в любом порядке.
Другой вариант относится к композиции, содержащей:
a) эффективное количество одного или более описанных соединений, и
b) эффективное количество бевацизумаба;
где описанные соединения и бевацизумаб могут вводиться вместе или в любом порядке.
"Химиотерапевтическим агентом" или "химиотерапевтическим соединением" является химическое соединение, применяемое для лечения рака. Химиотерапевтические противораковые агенты, которые могут применяться в сочетании с описанными в описании соединениями, включают, но не ограничены ими, ингибиторы митоза (алкалоиды барвинка). Они включают винкристин, винбластин, виндезин и Navelbine™ (винорелбин-5'-норангидробластин). В еще одном варианте химиотерапевтические противораковые агенты включают ингибиторы топоизомеразы I, такие как соединения камптотецина. В данном описании "соединения камптотецина" включают Camptosar™ (иринотекан HCL), Hycamtin™ (топотекан HCL) и другие соединения, полученные из камптотецина и его аналогов. Другая категория химиотерапевтических противораковых агентов, которые могут применяться в способах и композициях в соответствии с данным изобретением, включает производные подофиллотоксина, такие как этопозид, тенипозид и митопозид. Данное изобретение также включает другие химиотерапевтические противораковые агенты, известные как алкилирующие агенты, которые алкилируют генетический материал в опухолевых клетках. Они включают цисплатин, циклофосфамид, хлорметин, триметилен тиофосфорамид, кармустин, бусульфан, хлорамбуцил, белустин, урамустин, хломафазин и дакарбазин. Данное изобретение включает антиметаболиты в качестве химиотерапевтических агентов. Примеры этого типа агентов включают цитозин арабинозид, фторурацил, метотрексат, меркаптопурин, азатиоприм и прокарбазин. Дополнительная категория химиотерапевтических противораковых агентов, которые могут применяться в способах и композициях в соответствии с данным изобретением, включает антибиотики. Примеры включают, без ограничений, доксорубицин, блеомицин, дактиномицин, даунорубицин, митрамицин, митомицин, митомицин C и дауномицин. Существует множество липосомных композиций, коммерчески доступных для данных соединений. Данное описание также охватывает другие химиотерапевтические противораковые агенты, включающие, без ограничений, противоопухолевые антитела, дакарбазин, азацитидин, амсакрин, мелфалан, ифосфамид и митоксантрон.
Описанные в описании соединения могут вводиться отдельно или в сочетании с другими противоопухолевыми агентами, включая цитотоксические/антинеопластические агенты и антиангиогенные агенты. Цитотоксические/антинеопластические агенты являются агентами, которые атакуют и убивают раковые клетки. Некоторые цитотоксические/антинеопластические агенты являются алкилирующими агентами, которые алкилируют генетический материал в опухолевых клетках, например цисплатин, циклофосфамид, хлорметин, триметилен тиофосфорамид, кармустин, бусульфан, хлорамбуцил, белустин, урамустин, хломафазин и дакарбазин. Другие цитотоксические/антинеопластические агенты являются антиметаболитами для раковых клеток, например цитозин арабинозид, фторурацил, метотрексат, меркаптопурин, азатиоприм и прокарбазин. Другие цитотоксические/антинеопластические агенты являются антибиотиками, например доксорубицин, блеомицин, дактиномицин, даунорубицин, митрамицин, митомицин, митомицин C и дауномицин. Существует множество липосомных композиций, коммерчески доступных для данных соединений. Другие цитотоксические/антинеопластические агенты являются ингибиторами митоза (алкалоиды барвинка). Они включают винкристин, винбластин и этопозид. Различные цитотоксические/антинеопластические агенты включают таксол и его производные, L-аспарагиназу, противоопухолевые антитела, дакарбазин, азацитидин, амсакрин, мелфалан, VM-26, ифосфамид, митоксантрон и виндезин.
Антиангиогенные агенты хорошо известны специалистам в данной области техники. Подходящие антиангиогенные агенты для применения в способах и композициях в соответствии с данным изобретением включают анти-VEGF антитела, включая гуманизированные и химерные антитела, анти-VEGF аптамеры и антисмысловые олигонуклеотиды. Другие известные ингибиторы ангиогенеза включают ангиостатин, эндостатин, интерфероны, интерлейкин 1 (включая б и в), интерлейкин 12, ретиноевую кислоту и тканевые ингибиторы металлопротеиназы-1 и -2. (TIMP-1 и -2). Также могут применяться маленькие молекулы, включая топоизомеразы, такие как разоксан, ингибитор топоизомеразы II с анти-ангиогенной активностью.
Другие противораковые агенты, которые могут применяться в сочетании с описанными соединениями, включают, но не ограничиваются ими: ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелезин; альдеслейкин; альтретамин; амбомицин; аметантрон ацетат; аминоглутетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бисантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; бреквинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карзелезин; цедефингол; хлорамбуцил; циролемицин; цисплатин; кладрибин; кризнатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазиквон; доцетаксел; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбулозол; эзорубицин гидрохлорид; эстрамустин; эстрамустин фосфат натрия; этанидазол; этопозид; этопозид фосфат; этоприн; фадрозол гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабин фосфат; фторурацил; флуроцитабин; фосквидон; фостриецин натрий; гемцитабин; гемцитабин гидрохлорид; гидроксимочевина; идарубицин гидрохлорид; ифосфамид; илмофозин; интерлейкин II (включая рекомбинантный интерлейкин II или rIL2), интерферон альфа-2a; интерферон альфа-2b; интерферон альфа-n1; интерферон альфа-n3; интерферон бета-I a; интерферон гамма-I b; ипроплатин; иринотекан гидрохлорид; лантреотид ацетат; летрозол; лейпролид ацетат; лиарозол гидрохлорид; лометрексол натрий; ломустин; лозоксантрон гидрохлорид; мазопрокол; майтанзин; мехлоретамин гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрий; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофенольная кислота; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пегаспаргаза; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамицин; пломестан; порфимер натрий; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; роглетимид; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфосат натрий; спарсомицин; спирогерманиум гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрий; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; торемифен цитрат; трестолон ацетат; трицирибин фосфат; триметрексат; триметрексат глюкуронат; трипторелин; тубулозол гидрохлорид; урамустин; уредепа; вапреотид; вертепорфин; винбластин сульфат; винкристин сульфат; виндезин; виндезин сульфат; винепидин сульфат; винглицинат сульфат; винлейрозин сульфат; винорелбин тартрат; винрозидин сульфат; винзолидин сульфат; ворозол; зениплатин; зиностатин; зорубицин гидрохлорид. Другие противораковые лекарственные средства включают, но не ограничены ими: 20-эпи-1,25 дигидроксивитамин D3; 5-этинилурацил; абиратерон; акларубицин; ацилфульвен; адеципенол; адозелезин; альдеслейкин; антагонисты ALL-TK; альтретамин; амбамустин; амидокс; амифостин; аминолевулиновая кислота; амрубицин; амсакрин; анагрелид; анастрозол; андрографолид; ингибиторы ангиогенеза; антагонист D; антагонист G; антареликс; антидорсализирующий морфогенетический протеин-1; антиандроген, карцинома простаты; антиэстроген; антинеопластон; антисмысловые алигонуклеотиды; афидиколин глицинат; модуляторы гена апоптоза; регуляторы апоптоза; апуриновая кислота; ара-CDP-DL-PTBA; аргинин деаминаза; азулакрин; атаместан; атримустин; аксинастатин 1; аксинастатин 2; аксинастатин 3; азастерон; азатоксин; азатирозин; производные баккатина III; баланол; батимастат; антагонисты BCR/ABL; бензохлорины; бензоилстауроспорин; производные бета лактама; бета-алетин; бетакламицин B; бетулиновая кислота; ингибитор bFGF; бикалутамид; бисантрен; бисазиридинилспермин; биснафид; бистратен A; бизелезин; брефлат; бропиримин; будотитан; бутионин сульфоксимин; кальципотриол; кальфостин C; производные камптотецина; канарипокс IL-2; капецитабин; карбоксамидаминотриазол; карбоксиамидотриазол; CaRest M3; CARN 700; ингибитор, производный из хряща; карзелезин; ингибиторы казеинкиназы (ICOS); кастаноспермин; цекропин B; цетрореликс; хлорлнс; хлорхиноксалин сульфонамид; цикапрост; циспорфирин; кладрибин; аналоги кломифена; клотримазол; коллисмицин A; коллисмицин B; комбретастатин A4; аналог комбретастатина; конагенин; крамбесцидин 816; криснатол; криптофицин 8; производные криптофицина A; курацин A; циклопентантраквиноны; циклоплатам; ципемицин; цитарабин окфосфат; цитолитический фактор; цитостатин; дакликсимаб; децитабин; дегидродидемнин B; деслорелин; дексаметазон; дексифосфамид; дексразоксан; дексверапамил; диазиквон; идемнин B; дидокс; диэтилнорспермин; дигидро-5-азацитидин; дигидротаксол, 9-; диоксамицин; дифенил спиромустин; доцетаксел; докозанол; долазетрон; доксифлуридин; дролоксифен; дронабинол; дуокармицин SA; эбзелен; экомустин; эдельфозин; эдреколомаб; эфлорнитин; элемен; эмитефур; эпирубицин; эпристерид; аналоги эстрамустина; агонисты эстрогенаантагонисты эстрогена; этанидазол; этопозид фосфат; экземестан; фадрозол; фазарабин; фенретинид; филграстин; финастерид; флавопиридол; флезеластин; флуастерон; флударабин; фтордауноруницин гидрохлорид; форфенимекс; форместан; фостриецин; фотемустин; гадолиний тексафирин; нитрат галлия; галоцитабин; ганиреликс; ингибиторы желатиназы; гемцитабин; ингибиторы глутатиона; гепсульфам; герегулин; гексаметилен бисацетамид; гиперицин; ибандроновая кислота; идарубицин; идоксифен; идрамантон; илмофозин; иломастат; имидазоакридоны; имиквимод; иммуностимулирующие пептиды; ингибитор инсулиноподобного рецептора фактора роста-1; агонисты интерферона; интерфероны; интерлейкины; иобенгуан; йододоксорубицин; ипомеанол, 4-; ипроплакт; ирсогладин; изобенгазол; изогомогаликондрин B; итазетрон; джасплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинан сульфат; лептолстатин; летрозол; фактор, ингибирующий лейкемию; лейкоцитарный альфа интерферон; лейпролид+эстроген+прогестерон; лейпрорелин; левамизол; лиарозол; линейный аналог полиамина; липофильный пептид дисахарида; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидаминин; лозоксантрон; ловастатин; локсорибин; лутротекан; лутетий тексафирин; лизофиллин; литические пептиды; маитанзин; манностатин A; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матричной металлопротеиназы; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; несопряженная двухцепочечная РНК; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксин фибробластный фактор роста-сапорин; митоксантрон; мофаротен; молграмостим; моноклональное антитело, хорионический гонадотропин человека; монофосфорильный липид A+стенка миобактериальной клетки sk; мопидамол; ингибитор резистентного с лекарственным средствам гена; терапия на основе супрессора множества опухолей 1; ипритный противораковый агент; микапероксид B; экстракт стенки микобактериальной клетки; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтеприн; нартограстим; недеплатин; неморубицин; неридроновая кислота; нейтральная эндопептидаза; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; нитруллин; O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; онданзетрон; орацин; пероральный индуктор цитокина; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоксин; памидроновая кислота; панакситриол; паномифен; парабактин; пазеллиптин; пегаспаргаза; пелдезин; пентозан полисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин гидрохлорид; пирарубицин; пиритрексим; плацетин A; плацетин B; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платина-триамин; порфимер натрий; порфиромицин; преднизон; пропил бис-акридон; простагландин J2; ингибиторы протеазомы; иммунный модулятор на основе протеина A; ингибитор протеинкиназы C; ингибиторы протеинкиназы C, микроводоросли; ингибиторы протеинтирозинфосфатазы; ингибиторы пурин нуклеозид фосфорилазы; пурпурины; пиразолоакридин; пиридоксилированный конъюгат гемоглобина полиоксиэтилена; интагонисты raf; ралтитрексед; рамозетрон; ингибиторы ras фарнезилпротеинтрансферазы; ингибиторы ras; ингибитор ras-GAP; деметилированный ретеллиптин; этидронат рения Re 186; ризоксин; рибозимы; RII ретинамид; роглетимид; рохитукин; ромиртид; роквинимекс; рубигинон B1; рубоксил; сафингол; саинтопин; SarCNU; саркофитол A; сарграмостим; миметики Sdi 1; семустин; полученный при старении ингибитор 1; смысловые олигонуклеотиды; ингибиторы трансдукции сигнала; модуляторы трансдукции сигнала; одноцепочечный связывающий антиген протеин; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; связывающий соматомедин протеин; сонермин; спарфозовая кислота; спикамицин D; спиромустин; спленопентин; спонгистатин 1; скваламин; ингибитор стволовых клеток; ингибиторы деления стволовых клеток; стипиамид; ингибиторы стромелизина; сульфнозин; суперактивный вазоактивный антагонист кишечного пептида; сурадиста; сурамин; свайнзонин; синтетические глюкозаминогликаны; таллимустин; тамоксифен метиодид; тауромустин; тазаротен; текогалан натрий; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; темозоломид; тенипозид; тетрахлордекаоксид; тетразомин; талибластин; тиокоралин; тромбопоэтин; миметики тромбопоэтина; тималфазин; агонист рецептора тимопоэтина; тимотринан; стимулирующий гормон щитовидной железы; этил этиопурпурин олова; тирапазамин; титаноцен бихлорид; топсентин; торемифен; тотипотентный фактор стволовой клетки; ингибиторы трансляции; третиноин; триацетилуредин; трицирибин; триметрексат; трипторелин; тропизетрон; туростерид; ингибиторы тирозинкиназы; тирфостины; ингибиторы UBC; убенимекс; фактор ингибирования роста производный от урогенитального синуса; антагонисты рецептора урокиназы; вапреотид; вариолин B; векторная система, эритроцитная генная терапия; веларезол; верамин; вердины; вертепорфин; винорелбин; винксалтин; витаксин; ворозол; занотерон; зениплатин; зиласкорб; и стимуламер зиностатина. В одном варианте, противораковым лекарственным средством является 5-фторурацил, таксол или лейковорин.
Термин "эффективное количество" в данном описании означает "количество одной или более фенилсульфаминовых кислот, эффективное в данных дозах и периодах времени, необходимых для достижения желаемого или терапевтического результата." Эффективное количество может варьироваться в зависимости от факторов, известных в данной области техники, таких как состояние заболевания, возраст, пол и масса тела лечимого человека или животного. Хотя в описании в примерах описаны конкретные режимы дозирования, специалист в данной области техники поймет, что режим дозирования может быть изменен для получения оптимальной терапевтической реакции. Таким образом, невозможно определить точное "эффективное количество." Например, несколько разделенных доз может быть введено в сутки, или доза может быть пропорционально снижена в соответствии с конкретной терапевтической ситуацией. Кроме того, композиции в соответствии с данным изобретением могут вводиться так часто, как необходимо для достижения терапевтического количества.
Хотя в описании иллюстрированы и описаны конкретные варианты данного изобретения, для специалиста в данной области техники очевидно, что другие изменения и модификации могут быть сделаны, не выходя за суть и объем данного изобретения. Поэтому формула изобретения включает все такие изменения и модификации, которые включены в объем данного изобретения.
Реферат
Изобретение относится к медицине и представляет собой способ предупреждения метастазов раковых клеток и способ лечения рака с помощью введения эффективного количества соединения, являющегося производным фенилсульфаминовой кислоты, либо комбинации соединения, являющегося производным фенилсульфаминовой кислоты, и химиотерапевтического агента. 4 н. и 5 з.п. ф-лы, 24 пр., 9 ил., 22 табл.
Формула
i)

ii)

iii)
iv)

или
его фармацевтически приемлемой соли.
i)

ii)

iii)

iv)

или его фармацевтически приемлемой соли.
А) эффективное количество одного или более соединений, имеющих формулу:

ii)
iii)
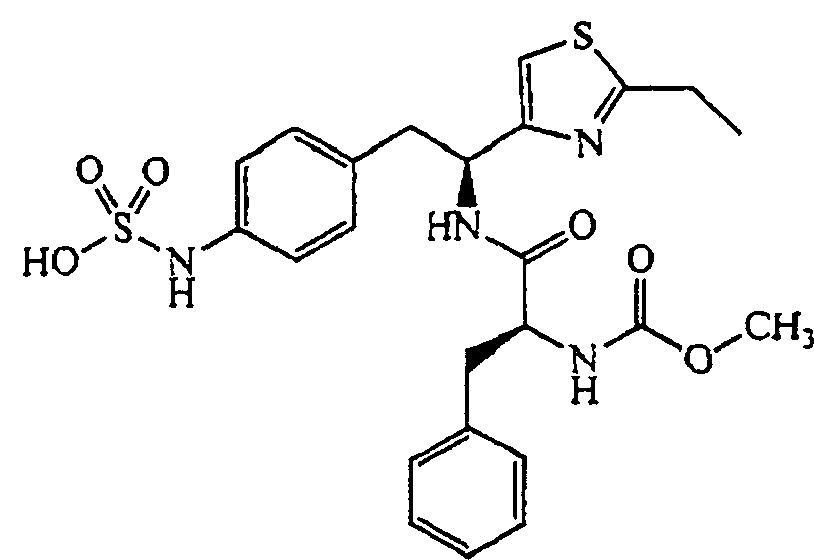
iv)

его фармацевтически приемлемой соли; и
В) эффективное количество одного или более химиотерапевтических агентов.
а) эффективное количество одного или более соединений, имеющих формулу:
i)

ii)
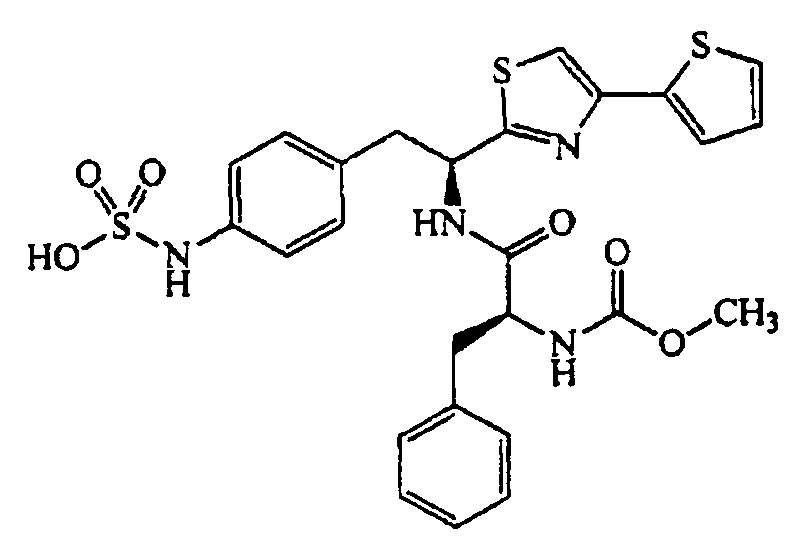
iii)

iv)

или
его фармацевтически приемлемой соли; и
b) эффективное количество одного или более химиотерапевтических агентов, где химиотерапевтический агент выбирают из таксола, IL-2 и гемцитабина;
где одно или более соединений и химиотерапевтические агенты могут вводиться вместе или в любом порядке.
Документы, цитированные в отчёте о поиске
Способы лечения опухолей и метастазов с использованием комбинации антиангиогенной терапии и иммунотерапии

Комментарии