Композиции интенсивного проникновения и их применение - RU2630577C2
Код документа: RU2630577C2
Чертежи

































































































Описание
ЗАЯВЛЕНИЕ О ПРИОРИТЕТЕ
[0001] Настоящая заявка испрашивает приоритет согласно Предварительной заявке на патент США 61/120052, поданной 4 декабря 2008 года, которая полностью включена в настоящую заявку посредством ссылки.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к области композиций и фармацевтических композиций, способных проникать через один или более биологических барьеров, и к способам применения фармацевтических композиций для предотвращения, диагностики и/или лечения состояния или заболевания человека, животных и растений.
Уровень техники
[0003] Активные агенты или лекарственные средства, эффективные in vitro, могут не быть такими же эффективными in vivo по причине трудности доставки in vivo, в частности, по причине ограниченной способности проникать через один или более биологических барьеров для достижения места действия, при проявлении болезни in vivo.
[0004] В настоящее время многие лекарственные средства вводят посредством системного пути введения, такого как пероральное или парентеральное введение, для достижения места проявления состояния или заболевания. Поскольку при системном введении для достижения периферического участка необходимы более высокие дозировки лекарственных средств, лекарства, вводимые таким путем, могут вызывать нежелательные реакции.
[0005] Например, нестероидные противовоспалительные средства (НПВС) широко применяют для лечения острых или хронических состояний, при которых присутствуют боль и воспаление. Несмотря на то, что НПВС всасываются в слизистой желудка и кишечника, пероральное введение обычно сопровождается нежелательными реакциями на лекарственное средство, такими как действия на желудочно-кишечный тракт (ЖКТ) и действия на почки. Например, известно, что аспирин вызывает повреждение клеток слизистой оболочки желудка. Побочные действия НПВС, вероятно, являются дозозависимыми, и во многих случаях являются достаточно тяжелыми, чтобы представлять риск диспепсии, гастродуоденального кровотечения, язв желудка, гастрита, прободения язвы, и даже смерти.
[0006] Как сообщают, модификации известных НПВС улучшают их эффективность и уменьшают их побочные действия. Однако для лечения воспаления или боли в периферических областях при пероральном введении лекарственного средства необходимы гораздо более высокие концентрации НПВС в плазме, чем при введении лекарственного средства в конкретное место боли или повреждения (Fishman; Robert, патент США № 7052715).
[0007] Фишман (Fishman) и многие другие (Van Engelen с соавторами, патент США № 6416772; Macrides с соавторами, патент США № 6346278; Kirby с соавторами, патент США № 6444234, Pearson с соавторами, патент США № 6528040 и Botknecht с соавторами, патент США № 5885597) предпринимали попытки разработать систему доставки для трансдермального применения за счет состава лекарственного средства, с целью уменьшения побочных действий, связанных с пероральным введением, и достижения локализованного введения лекарственного средства с уменьшенным системным воздействием. Однако очень трудно обеспечивать терапевтически эффективные концентрации указанных лекарственных средств в плазме за счет состава.
[0008] Простагландины и аналоги простагландинов имеют широкий диапазон физиологических функций и действий, и поэтому имеют многочисленные применения в медицине. Например, простагландины и аналоги простагландинов можно применять для индуцирования родов или аборта; предотвращения закрытия открытого артериального протока у новорожденных с частичными цианотичными пороками сердца; предотвращения и лечения пептических язв; в качестве вазодилататора для лечения феномена Рейно или ишемии конечностей, или для лечения легочной гипертензии, причем указанные состояния обычно лечат путем внутривенного, подкожного или ингаляционного введения; для лечения глаукомы (например, в форме аналогов, таких как офтальмический раствор биматопроста, который представляет собой синтетический аналог простамида, обладающий способностью понижать внутриглазное давление); и для лечения эректильной дисфункции или при восстановлении пениса после хирургического вмешательства (например, PGE1 в виде алпростадила). Однако простагландины и аналоги простагландинов быстро метаболизируются и инактивируются за счет различных окислительных и восстановительных путей. Например, при пероральном приеме, лекарственные средства могут быть разрушены и/или инактивированы в течение нескольких минут посредством метаболизма первого прохождения.
[0009] Иприты (mustards) и ипритоподобные соединения применяют для лечения различных видов рака и опухолей. Однако иприты и ипритоподобные соединения также вызывают нежелательные действия, такие как тошнота, рвота, диарея, потеря аппетита, облысение и повышенная восприимчивость к инфекциям. Часто такие побочные действия дозозависимы.
[0010] Пептиды играют различные роли у биологических субъектов. Например, пептиды и пептидоподобные соединения можно применять для лечения таких состояний, как ожирение, инфекции, боль и половые дисфункции. Однако пептиды и пептидоподобные соединения быстро подвергаются протеолизу под действием протеолитических ферментов. Если пептиды и пептидоподобные соединения принимают перорально, они могут подвергаться протеолизу в течение нескольких минут. Другие виды системного введения пептидов и пептидоподобных соединений болезненны и во многих случаях требуют частых и дорогостоящих посещений врача для лечения хронических состояний.
[0011] Бета-лактамы и родственные соединения представляют собой широко применяемые антибиотики. Недостатком перорального применения является плохое всасывание антибиотиков из желудочно-кишечного (ЖК) тракта. Внутривенный, подкожный и внутримышечный пути введения не только болезненны, но также требуют введения квалифицированным персоналом, и могут нести другие риски, такие как повреждения от инъекций, инфекции, и другие травмы. При широком применении противомикробных средств устойчивость к лекарственным средствам становится распространенной и серьезной проблемой, поскольку патогены со временем мутируют.
[0012] Таким образом, существует потребность в разработке новых композиций, которые возможно доставлять рационально и эффективно для действия в месте проявления состояния (например, заболевания), для предотвращения, уменьшения или лечения состояния у биологического субъекта с минимальным побочным действием. Кроме того, можно обнаружить новые показания благодаря рациональной и эффективной доставке композиций и фармацевтических композиций через биологические барьеры, пересечение которых затруднено.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0013] Один из аспектов настоящего изобретения относится к композициям интенсивного проникновения (КИП), содержащим функциональный элемент, ковалентно связанный с транспортным элементом посредством линкера.
[0014] Согласно некоторым из вариантов осуществления, КИП исходного соединения содержит функциональный элемент, содержащий фрагмент агента, причем необходимой является доставка агента внутрь биологического субъекта и/или перенос через один или более биологических барьеров. Указанный агент содержит исходное лекарственное средство или соединение, родственное исходному лекарственному средству. Соединение, родственное исходному лекарственному средству, представляет собой метаболит исходного лекарственного средства, миметик/аналог исходного лекарственного средства или соединение, которое можно в процессе метаболизма превратить в исходное лекарственное средство, метаболит или миметик/аналог исходного лекарственного средства.
[0015] Согласно некоторым из вариантов осуществления, исходное лекарственное средство или соединение, родственное к исходному лекарственному средству, содержит по меньшей мере функциональную группу, такую как карбоксильная, гидроксильная, тиольная, амино, фосфатная/фосфонатная, карбонильная или гуанидиновая группа. Согласно некоторым из вариантов осуществления, исходное лекарственное средство или соединение, родственное исходному лекарственному средству, содержит более одной функциональной группы. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой нестероидное противовоспалительное средство (НПВС). Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой стероид, такой как прогестерон, дезогестрел и этинилэстрадиол. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой пептид. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой иприт. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой бета-лактамный антибиотик. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой антидиабетическое средство, такое как глиборнурид. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой атенолол.
[0016] Согласно некоторым из вариантов осуществления, функциональный элемент может быть гидрофильным, липофильным или амфифильным (гидрофильным и липофильным). Липофильный фрагмент функционального элемента может быть изначально находиться в структуре или может быть получен путем превращения гидрофильных фрагментов в липофильные фрагменты. Например, липофильный фрагмент функционального элемента получают путем превращения одной или более гидрофильных групп функционального элемента в липофильные группы посредством традиционного органического синтеза. Примеры гидрофильных групп включают, без ограничений, карбоксильные, гидроксильные, тиольные, аминные, фосфатные/фосфонатные и карбонильные группы. Липофильные фрагменты, полученные посредством модификации указанных гидрофильных групп, включают, без ограничения, простые эфиры, простые тиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, карбаматы, амиды, фосфаты и оксимы.
[0017] Примеры НПВС включают, без ограничения, аспирин, дифлунизал, салсалат, салициловую кислоту, ибупрофен, кетопрофен, фенопрофен, напроксен, супрофен, ацетаминофен, α-метил(пара-хлорбензоил)-5-метокси-2-метилиндол-3-уксусную кислоту, флурбипрофен, карпрофен, пранопрофен, беноксапрофен, алминопрофен, тиапрофеновую кислоту, пирпрофен, залтопрофен, бермопрофен, локсопрофен, индопрофен, фенклорак, оксапрозин, фенбуфен, орпаноксин, кеторолак, клиданак, толметин, зомепирак, этодолак, амфенак, бромофенак, алклофенак, фенклофенак, ацеметацин, фентиазак, индометацин, сулиндак, лоназолак, бендазак, 6МНУК (6-метокси-2-нафтилуксусная кислота), диклофенак, мефенамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, нифлумовую кислоту, флуниксин, пироксикам, судоксикам, лорноксикам, теноксикам, ампироксикам, ломоксикам, изоксикам, цинноксикам и мелоксикам.
[0018] Примеры простагландинов и аналогов простагландинов включают, без ограничения, PGA1, PGA2, PGA3, PGB1, PGB2, PGB3, PGD1, PGD2, PGD3, PGE1, PGE2, PGE3, PGF1α, PGF1β, PGF2α, PGF2β, PGF3α, PGG2, PGH1, PGH2, PGI2 (простациклин), PGI3, PGJ2, PGK1, PGK2, карбопрост, простален, мизопростол, гемепрост, сульпростон, флупростенол, клопростенол, биматопрост {(Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[1E,3S]-3-гидрокси-5-фенил-1-пентенил]циклопентил}-5-N-этилгептенамид}, латанопрост (13,14-дигидро-17-фенил-18,19,20-тринор PGF2α изопропиловый сложный эфир), травопрост {(Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(1E,3R)-3-гидрокси-4-[(α,α,α-трифтор-м-толил)окси]-1-бутенил]циклопентил]-5-гептеноат} и унопростон (13,14-дигидро-15-кето-20-этил Простагландин F2α).
[0019] Примеры ипритов включают, без ограничения, азотистые иприты, нитробензил-иприты, фосфорамид-иприты, изофосфорамид-иприты и альдофосфамид.
[0020] Примеры пептидов включают, без ограничения, пептидные гормоны (например, гиротропин-высвобождающий гормон, тафцин (Thr-Lys-Pro-Arg), мет-энкефалин (Tyr-Gly-Gly-Phe-Met), окситоцин, ангиотензин, гастрин, соматостатин, динорфин, эндотелин, секретин, кальцитонин и инсулин), энтеростатины (например, Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR) и Ala-Pro-Gly-Pro-Arg (APGPR)), меланокортин II (цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg-Trp-Lys-OH), опиоидные пептиды (например, мет-энкефалин (H-Tyr-Gly-Gly-Phe-Met-OH), лей-энкефалин (H-Tyr-Gly-Gly-Phe-Leu-OH), H-Tyr-D-Ala-Gly-N-Me-Phe-Met(O)-OL и H-Tyr-D-Ala-Gly-Phe-Leu-OH), антимикробные пептиды (например, тахиплезины, гистатиновые пептиды и производные), пептиды, связывающие кальций, пептиды, стимулирующие компетенцию, пептидные вакцины и пептидомиметики (например, α-спиральные миметики и β-складчатые миметики).
[0021] Примеры бета-лактамных антибиотиков включают, без ограничения, производные пенициллина, цефалоспорины, пенемы, монобактамы, карбапенемы, ингибиторы бета-лактамазы и комбинации указанных соединений. Примеры производных пенициллина включают, без ограничения, аминопенициллины (например, амоксициллин, ампициллин и эпициллин); карбоксипенициллины (например, карбенициллин, тикарциллин и темоциллин); уреидопенициллины (например, азлоциллин, пиперациллин и мезлоциллин); мециллинам, сульбенициллин, бензатин пенициллин, пенициллин G (бензилпенициллин), пенициллин V (феноксиметилпенициллин), пенициллин O (аллилмеркаптометилпенициллин), прокаин пенициллин, оксациллин, метициллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, пивампициллин, гетациллин, бекампициллин, метампициллин, талампициллин, ко-амоксиклав (амоксициллин плюс клавулановая кислота) и пиперациллин. Примеры цефалоспоринов включают, без ограничения, цефалексин, цефалотин, цефазолин, цефаклор, цефуроксим, цефамандол, цефотетан, цефокситин, цефоранид, цефтриаксон, цефотаксим, цефподоксим проксетил, цефтазидим, цефепим, цефоперазон, цефтизоксим, цефиксим и цефпиром. Примеры пенемов включают, без ограничения, фаропенем. Примеры монобактамов включают, без ограничения, азтреонам и тигемонам. Примеры карбапенемов включают, без ограничения, биапенем, дорипенем, эртапенем, имипенем, меропенем и панипенем. Примеры ингибиторов бета-лактамазы включают, без ограничения, тазобактам ([2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1H-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты 4,4-диоксида натриевую соль), сульбактам (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты 4,4-диоксида натриевую соль), и клавулановую кислоту ((2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-аза-бицикло[3.2.0]гептан-2-карбоновую кислоту). Другие примеры антибиотиков включают, без ограничения, [(N-бензилоксикарбониламино)метил]фосфоновой кислоты моно-(4-нитрофенил) сложного эфира натриевую соль, [(N-бензилоксикарбониламино)метил]фосфоновой кислоты моно-(3-пиридинил) сложного эфира натриевую соль, сульфаниламид (4-аминобензолсульфонамид), сульфасалазин (6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)-циклогекса-1,4-диенкарбоновую кислоту), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-ил-хинолин-3-карбоновую кислоту, налидиксовую кислоту (1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновую кислоту).
[0022] Согласно некоторым из вариантов осуществления, транспортный элемент КИП содержит протонируемую аминогруппу, которая может способствовать переносу или проникновению КИП через один или более биологических барьеров (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 300 раз, > примерно в 500 раз, > примерно в 1000 раз, > примерно в 10000 раз быстрее исходного лекарственного средства). Согласно некоторым из вариантов осуществления, протонируемая аминогруппа, по существу, протонируется при pH биологического барьера, который пересекает КИП. Согласно одному из вариантов осуществления, аминогруппа может быть обратимо протонируемой.
[0023] Согласно некоторым из вариантов осуществления, линкер, ковалентно связывающий функциональный элемент и транспортный элемент КИП, содержит связь, способную расщепляться после проникновения КИП через один или более биологических барьеров. Способная к расщеплению связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, тиосложноэфирную, карбонатную, карбаматную, фосфатную или оксимную связь.
[0024] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей одну КИП и фармацевтически приемлемый носитель.
[0025] Другой аспект настоящего изобретения относится к применению композиции согласно настоящему изобретению для проникновения через биологический барьер, такой как кожа, гематоэнцефалический барьер, гематомолочный барьер, гематоликворный барьер (ГЛБ) и гематосиновиальный барьер (ГСБ).
[0026] Другой аспект настоящего изобретения относится к способу диагностики возникновения, развития или ремиссии состояния у биологического субъекта при помощи применения КИП согласно настоящему изобретению. Согласно некоторым из вариантов осуществления, возможно детектирование КИП или функционального элемента КИП композиции. Согласно некоторым из вариантов осуществления, КИП или функциональный элемент КИП имеет в своем составе метку или помечен или конъюгирован с детектируемым агентом.
[0027] Другой аспект настоящего изобретения относится к способам скрининга исследуемого функционального элемента, исследуемого линкера или исследуемого транспортного элемента с желаемыми характеристиками.
[0028] Другой аспект настоящего изобретения относится к способу лечения состояния у биологического субъекта путем введения субъекту композиции согласно настоящему изобретению. Согласно некоторым из вариантов осуществления, способ относится к лечению состояния у субъекта, поддающегося лечению исходным лекарственным средством, путем введения субъекту терапевтически эффективного количества КИП исходного лекарственного средства, или фармацевтической композиции, содержащей указанную КИП. Согласно некоторым из вариантов осуществления, КИП или фармацевтическую композицию указанной КИП вводят биологическому субъекту при помощи различных путей введения, включая, без ограничения, пероральный, энтеральный, трансбуккальный, назальный, топический, ректальный, вагинальный, аэрозольный, чресслизистый, эпидермальный, трансдермальный, кожный, офтальмический, легочный, подкожный и/или парентеральный пути введения. Согласно некоторым из вариантов осуществления, КИП или фармацевтическую композицию КИП вводят пероральным, трансдермальным, топическим, подкожным и/или парентеральным путем.
[0029] Согласно некоторым из вариантов осуществления, состояния, поддающиеся лечению КИП исходного лекарственного средства согласно настоящему изобретению, или фармацевтической композицией указанной КИП, включают лечение состояний в месте, трудно достижимом для исходного лекарственного средства по причине его недостаточной проникающей способности. Примеры таких состояний включают, без ограничения, повреждения спинного мозга, миелиновую инфекцию и родственные состояния (например, мышечные нарушения, такие как амиотрофический боковой склероз (АБС), окулофарингеальная мышечная дистрофия (ОФМД), миотоническая дистрофия (МД), мышечная дистрофия Дюшенна (МДД), полимиозит (ПМ), дерматомиозит (ДМ) и миозит с включенными тельцами (МВТ). Согласно некоторым из вариантов осуществления, состояния, поддающиеся лечению при помощи КИП, включают аутоиммунные нарушения (например, псориаз, болезнь Крона, красная волчанка, дискоидная красная волчанка, системная красная волчанка, множественный склероз, фиброз (например, кистозный фиброз, фиброз печени, легочный фиброз, фиброз поджелудочной железы, фиброз селезенки, фиброз ЖКТ и фиброз других органов), метаболические нарушения (например, диабет (типа II), аномальный уровень липидов в крови), состояния, связанные с тромбозом (например, инсульт), нейродегенеративное заболевание (например, болезнь Альцгеймера и болезнь Паркинсона), цирроз, воспаление печени, гипертиреоидизм, желчные камни, старение, нежелательные состояния кожи (например, витилиго, солнечный кератоз, аномальные сосудистые повреждения кожи, родимые пятна, бородавки (невусы), папилломы, старческие пятна (печеночные пятна), гнойные или красные прыщи, комедоны, папулы, пустулы, узелки, эпидермоидные кисты, волосяной кератоз, обвисшая кожа, морщины, «гусиные лапки», телесного цвета прыщи на коже, розацеа, кожа после лечения), макулярную дегенерацию и возрастную макулярную дегенерацию (ВМД), кашель, отторжение трансплантированного органа, рак и опухоли (например, рак желудка, множественная миелома, опухоль головного мозга, рак простаты и рак кости), седые и/или белые волосы, выпадение волос, облысение, недостаток волос или ресниц, беременность у женщины, имплантацию эмбриона, травму головного мозга и состяния у растений, связанные с заражением вирусами, грибами или насекомыми.
[0030] Согласно некоторым из вариантов осуществления, состояния, поддающиеся лечению КИП НПВС или фармацевтической композицией указанной КИП, включают, без ограничения, миелиновую инфекцию и родственные состояния, цирроз, воспаление печени, гипертиреоидизм, желчные камни, старение, нежелательные состояния кожи (например, лучевой кератоз, аномальные сосудистые повреждения кожи, родимые пятна, бородавки (невусы), папилломы, старческие пятна (печеночные пятна), гнойные или красные прыщи, комедоны, папулы, пустулы, узелки, эпидермоидные кисты, волосяной кератоз, обвисшая кожа, морщины, «гусиные лапки», прыщи телесного цвета на коже, розацеа, кожа после лечения), кашель, отторжение трансплантированного органа, рак и опухоли (например, рак простаты и рак кости), седые и/или белые волосы, выпадение волос, облысение, старение, и состяния у растений, связанные с заражением вирусами, грибами или насекомыми.
[0031] Согласно преимуществам настоящего изобретения, не намереваясь ограничиться каким-то конкретным механизмом, терапевтически эффективное количество КИП можно вводить локально в место проявления состояния с меньшей дозировкой для достижения более высокой локальной концентрации. Преимущества включают, например, исключение системного введения и уменьшение побочных эффектов (например, боли от инъекции, желудочно-кишечных/почечных эффектов, и других побочных эффектов), возможность нового лечения благодаря высокой локальной концентрации КИП или соответствующего исходного лекарственного средства или активного метаболита указанного лекарственного средства. КИП могут проникать через кожу, гематоэнцефалический, гематомолочный, и другие мембранные барьеры, во много раз быстрее, и имеют фармакологическое действие, во много раз более сильное по сравнению с исходными лекарственными средствами КИП. Настоящее изобретение дополнительно включает, например, системное введение КИП биологическому субъекту для получения более быстрой и более эффективной биодоступности, проникновения через биологические барьеры (например, гематоэнцефалический барьер), через которые исходные лекарственные средства не проникают в значительной степени, и новые показания для лекарственных средств.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0032] Фиг.1: Примеры структур функционального элемента F1.
[0033] Фиг.2: Примеры структур функционального элемента F2.
[0034] Фиг.3: Примеры структур функционального элемента F3.
[0035] Фиг.4: Примеры структур функционального элемента F4.
[0036] Фиг.5: Примеры структур КИП с функциональными элементами F1, F2 и F4.
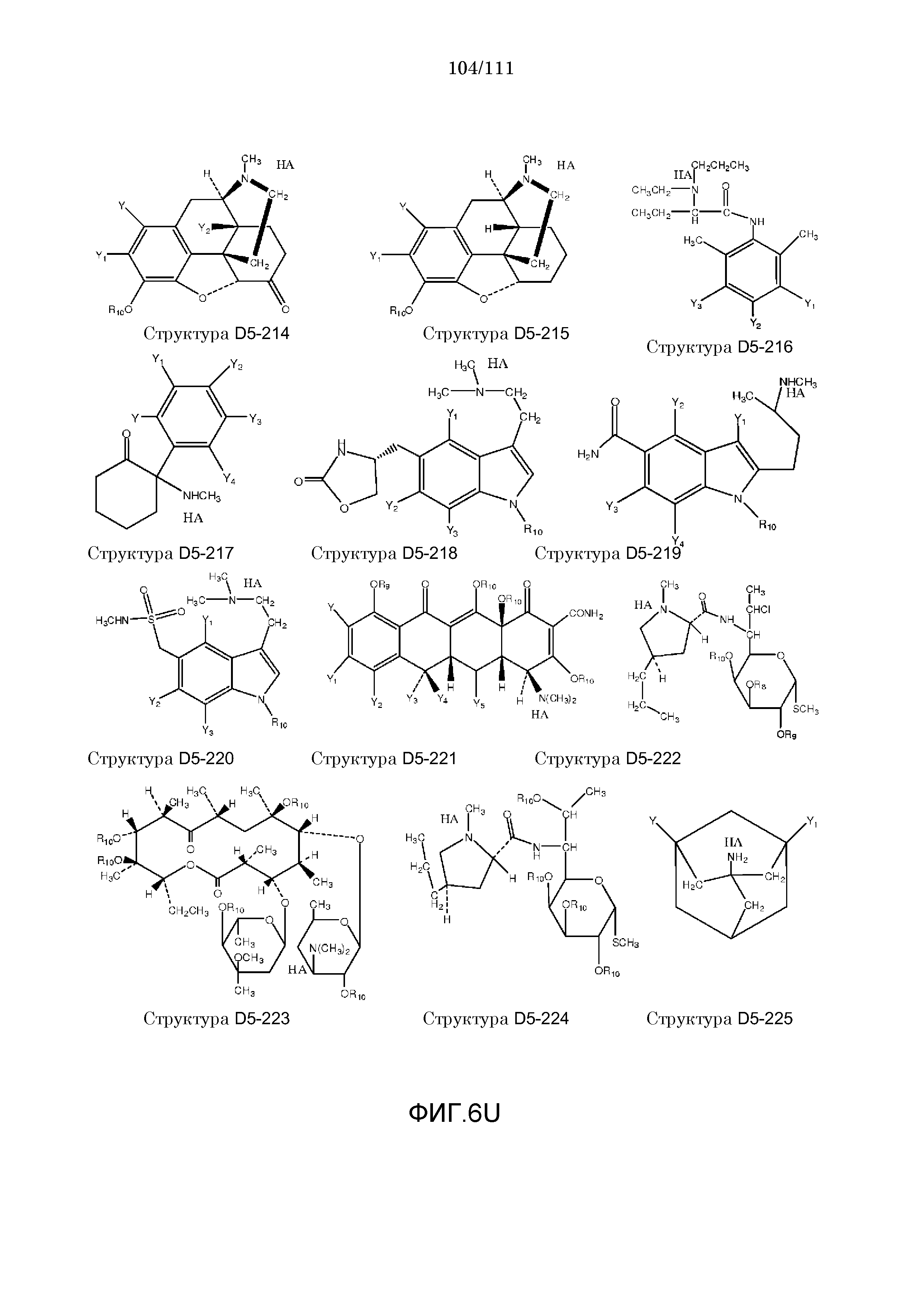
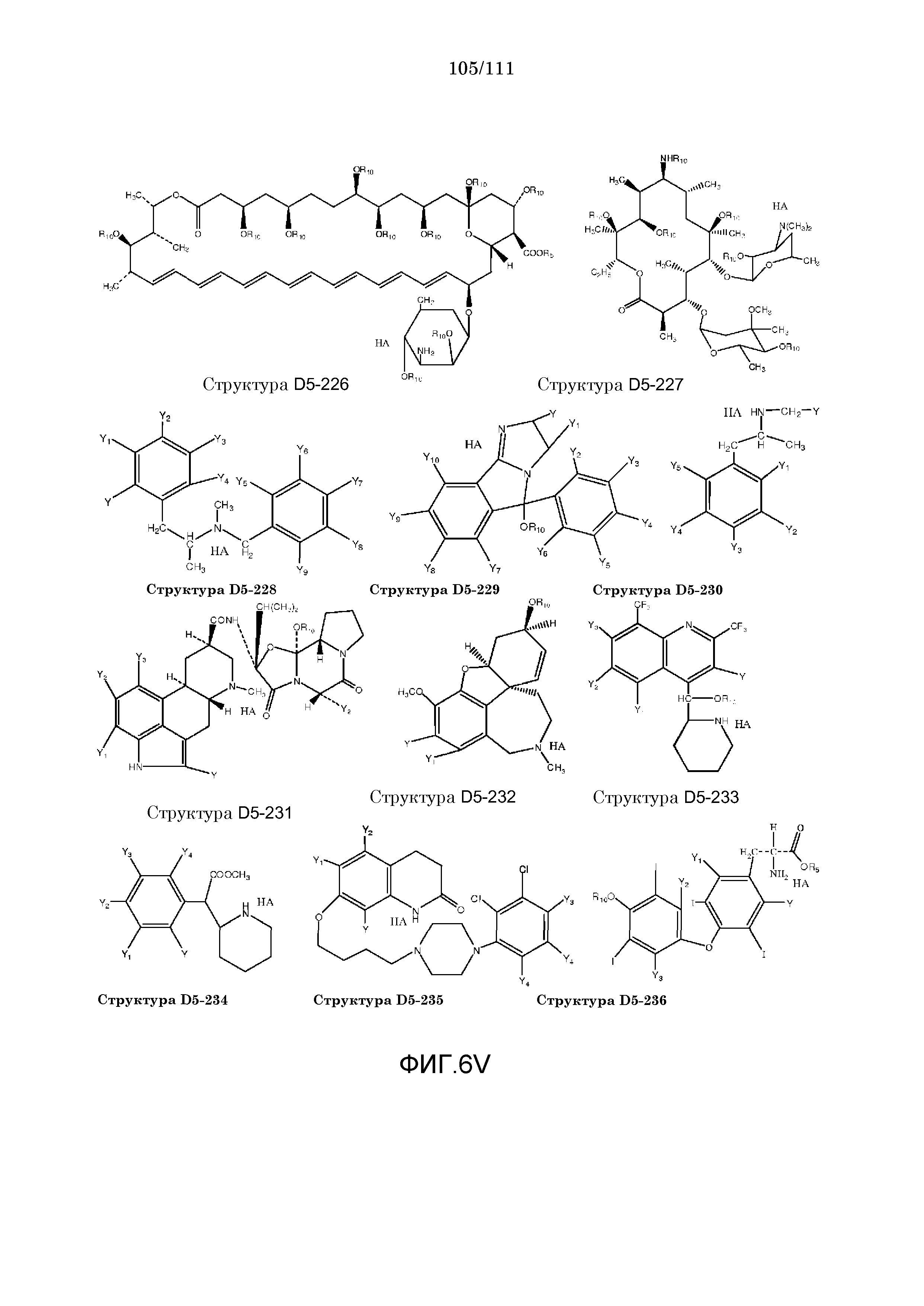
[0037] Фиг.6: Примеры структур КИП.
[0038] Фиг.7: Примеры структур транспортного элемента T.
[0039] Фиг.8: кумулятивные количества соли диэтиламиноэтил-N-ацетил-3-(3,4-диацетилокси-фенил-L-аланинового эфир·HCl (A), соли диэтиламинопропил-N-ацетил-D-3,5,3’,5’-тетрайодтиронин·HCl (B), соли 1-пиперидинэтил-2-[4-(4-хлорбензоил)фенокси]-2-метилпропионат·HCl (C), соли 3-пиперидинметил-5-(2,5-диметилфенокси)-2,2-диметилпентаноат·HCl (D), соли диэтиламиноэтил-(S)-3-(бензоиламинометил)-5-метилгексаноат·HCl (E), натриевой соли N-ацетил-3-(3,4-диацетилокси-фенил-L-аланина (F), натриевой соли N-ацетил-D-3,5,3’,5’-тетрайодтиронина (G), натриевой соли 2-[4-(4-хлорбензоил)фенокси]-2-метилпропионовой кислоты (H), натриевой соли 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (I) и натриевой соли (S)-3-(бензоиламинометил)-5-метилгексановой кислоты (J), пересекающие изолированную ткань кожи человека в ячейках Франца (n=5). В каждом случае средой являлась чистая вода.
[0040] Фиг.9: Ткани, окрашенные ГЭ (рисунок 1: головной мозг, рисунок 2: мышцы, рисунок 3: печень) через 15 минут после нанесения на спину крыс 30 мг КИП соли N-2-диэтиламиноэтил-5-диметиламино-1-нафталинсульфонамид·HCl, в 0,5 мл 75% этанола; ткани, окрашенные ГЭ (рисунок 4: головной мозг, рисунок 5: мышцы, рисунок 6: печень) через 3 часа после нанесения на спину крыс 30 мг КИП соли N-2-диэтиламиноэтил 5-диметиламино-1-нафталинсульфонамид·HCl, в 0,5 мл 75% этанола; ткани, окрашенные ГЭ (рисунок 7: головной мозг, рисунок 8: мышцы, рисунок 9: печень) через 3 часа после нанесения на спину крыс 30 мг 5-(диметиламино)нафталин-1-сульфоновой кислоты в 0,5 мл 75% этанола.
[0041] Фиг.10: Степень опухания (%) после инъекции каррагинина. За 1 час до инъекции каррагинина вводили перорально 100 мг/кг ибупрофена (B), 100 мг/кг (G) и 50 мг/кг (H) соли диэтиламиноэтил 2-(пара-изобутилфенил)пропионат·лимонная кислота, или трансдермально 1 мг/кг (C), 2 мг/кг, 5 мг/кг (D), 10 мг/кг (E) и 20 мг/кг (F) соли диэтиламиноэтил-2-(пара-изобутилфенил)пропионат·лимонная кислота. A представляла собой контрольную группу.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. СТРУКТУРЫ КОМПОЗИЦИЙ ИНТЕНСИВНОГО ПРОНИКНОВЕНИЯ (КИП) ИСХОДНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
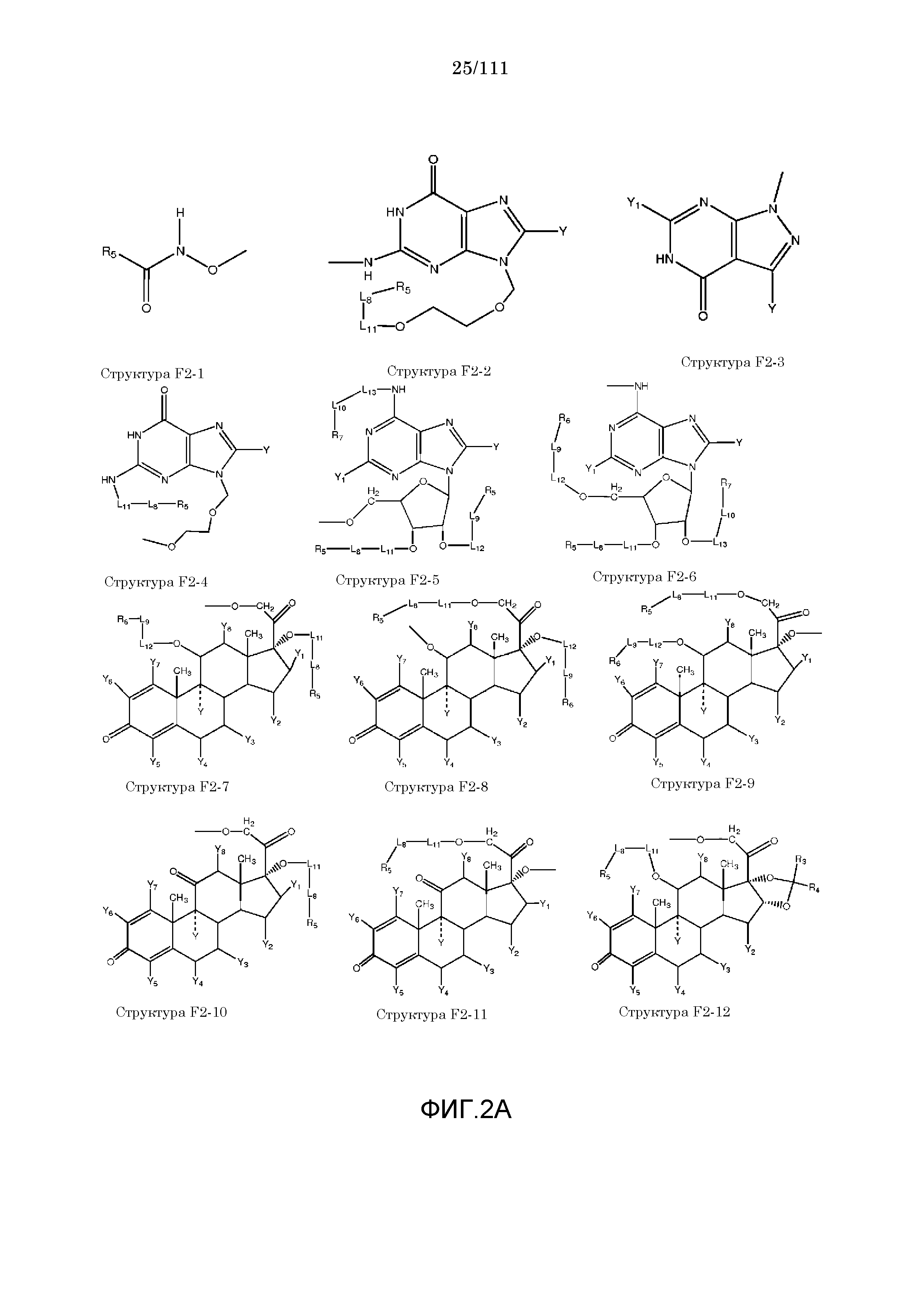
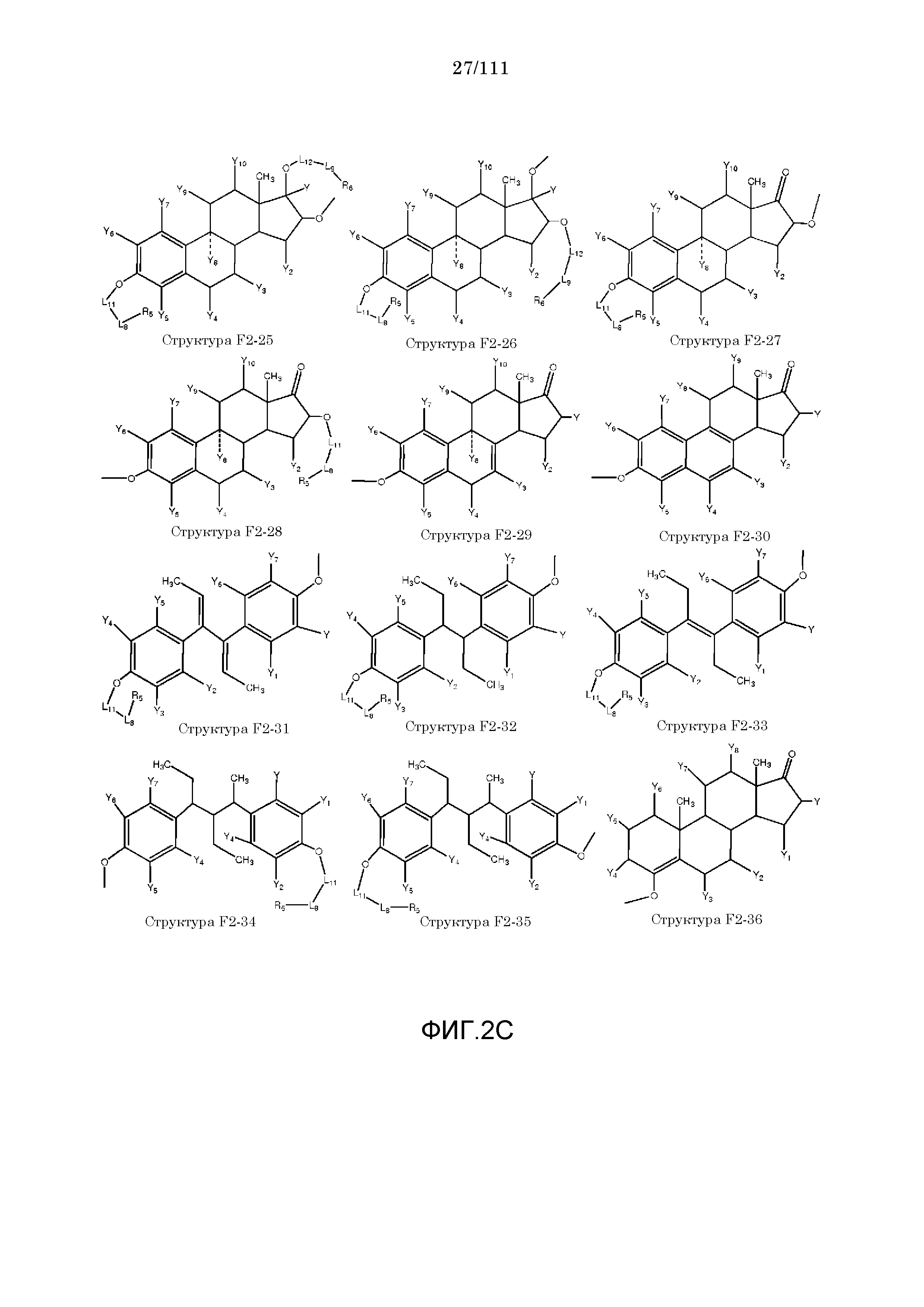
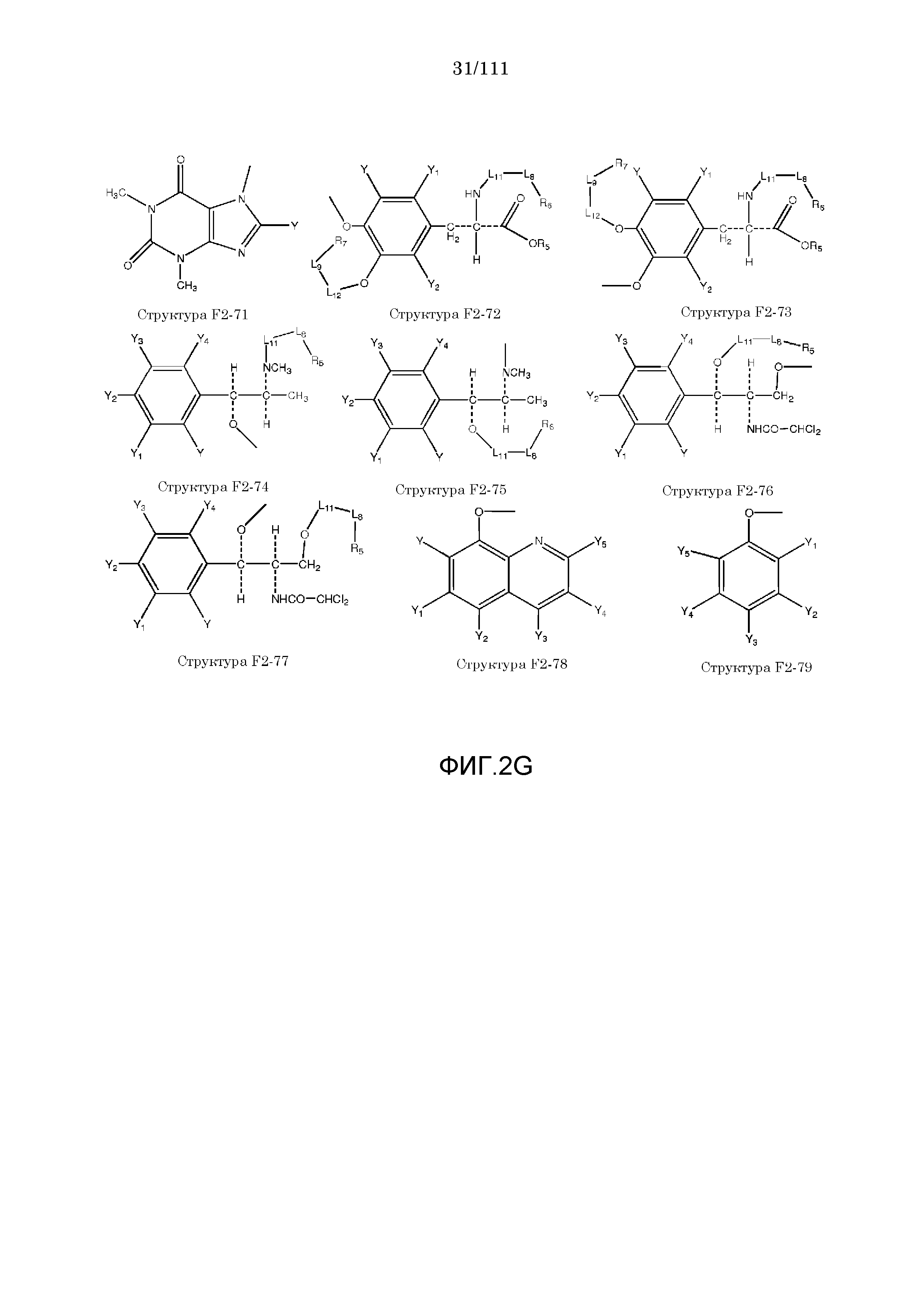
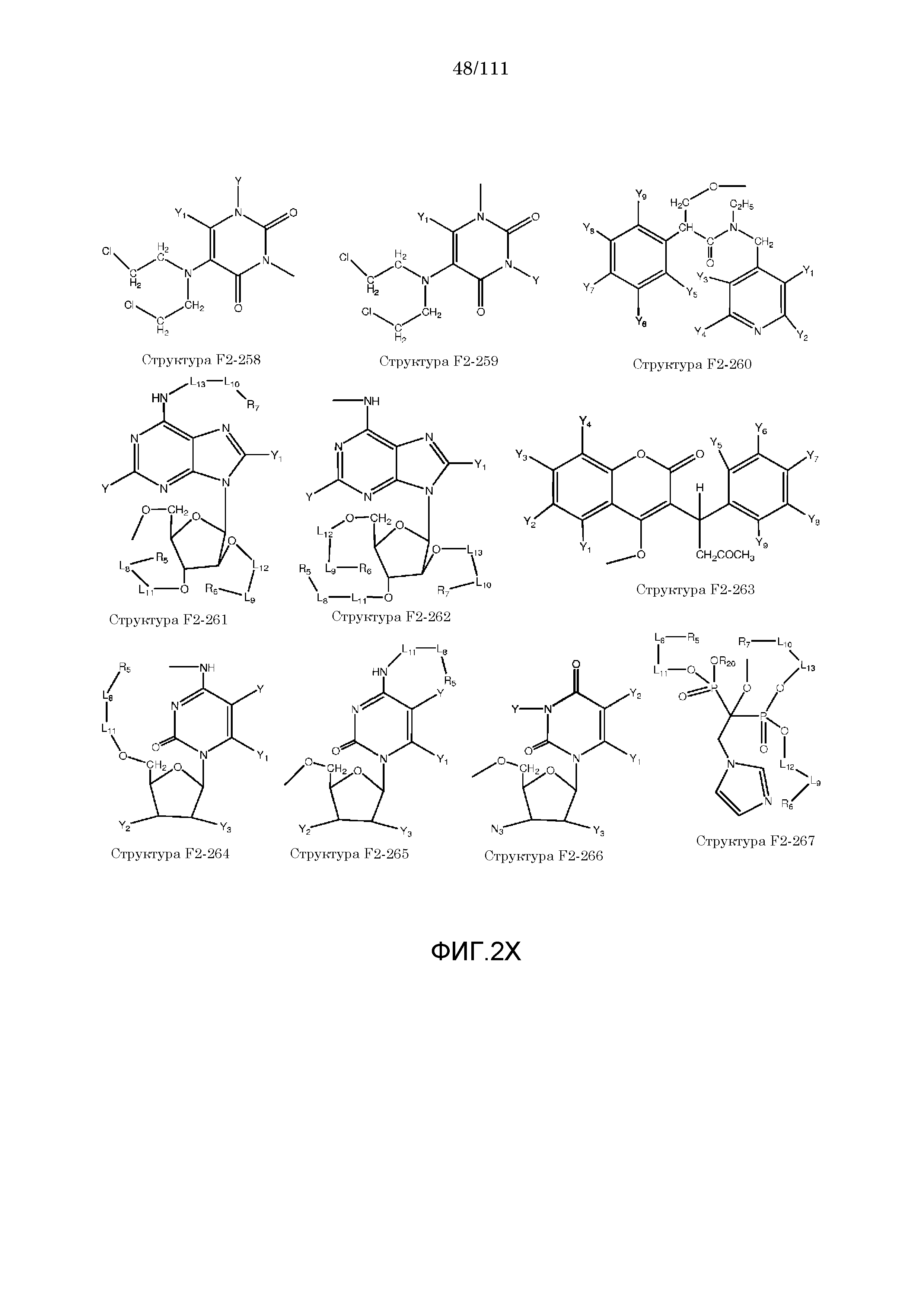
[0042] КИП, способные проникать через один или более биологических барьеров, были ранее описаны в следующих описаниях, полностью включенных в настоящую заявку посредством ссылок: номера международных заявок: PCT/IB2006/052732, PCT/IB2006/052318, PCT/IB2006/052461, PCT/IB2006/052815, PCT/IB2006/052563, PCT/IB2006/052575, PCT/IB2006/053091, PCT/IB2006/053090, PCT/IB2006/053594, PCT/IB2006/052549, PCT/IB2006/053619 PCT/IB2006/054170, PCT/IB2006/054724, PCT/IB2006/053741, PCT/IB2007/050122, PCT/IB2007/050322, PCT/IB2007/052090.
[0043] Один из аспектов настоящего изобретения относится к композициям интенсивного проникновения (КИП). Термин «композиция интенсивного проникновения» или «КИП» в настоящем описании относится к композиции, содержащей функциональный элемент, ковалентно связанный с транспортным элементом посредством линкера. Термин «композиция интенсивного проникновения исходного лекарственного средства» или «КИП исходного лекарственного средства» в настоящем описании относится к КИП, в которой функциональный элемент КИП содержит фрагмент исходного лекарственного средства, или соединения, родственное исходному лекарственному средству. Термин «соединение, родственное исходному лекарственному средству» в настоящем описании относится к соединению, содержащему фрагмент исходного лекарственного средства или метаболит/миметик/аналог исходного лекарственного средства, или соединение, способное в ходе метаболизма превращаться в исходное лекарственное средство или в метаболит/миметик/аналог исходного лекарственного средства. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит по меньшей мере функциональную группу, такую как карбоксильная, гидроксильная, тиольная, аминная, фосфатная/фосфонатная, карбонильная или гуанидиновая группа. Согласно некоторым из вариантов осуществления, исходное лекарственное средство или соединение, родственное исходному лекарственному средству, содержит более одной функциональной группы. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой нестероидное противовоспалительное средство (НПВС), и КИП представляет собой КИП НПВС. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой пептид, и КИП представляет собой КИП пептида. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой иприт, и КИП представляет собой КИП иприта. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой бета-лактамный антибиотик, и КИП представляет собой КИП бета-лактамного антибиотика. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой глиборнурид, и КИП представляет собой КИП глиборнурида. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой стероид, такой как прогестерон, дезогестрел и этинилэстрадиол, И КИП представляет собой КИП стероида, такую как КИП прогестерона, КИП дезогестрела и КИП этинилэстрадиола. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП представляет собой атенолол, и КИП представляет собой КИП атенолола.
[0044] Функциональный элемент КИП исходного лекарственного средства имеет следующие свойства: 1) желательно, чтобы исходное лекарственное средство, соединение, родственное исходному лекарственному средству, или КИП можно было доставлять в биологический субъект и/или транспортировать исходное лекарственное средство/соединение, родственное исходному лекарственному средству, через биологический барьер, 2) желательно, чтобы КИП была способна проникать или пересекать один или более биологических барьеров, и 3) желательно, но не обязательно, чтобы КИП была способна расщепляться таким образом, чтобы превращать функциональный элемент в исходное лекарственное средство или соединение, родственное исходному лекарственному средству.
[0045] Согласно некоторым из вариантов осуществления, функциональный элемент может быть гидрофильным, липофильным или амфифильным (гидрофильным и липофильным). Липофильный фрагмент функционального элемента может быть частью структуры или может быть получен путем превращения гидрофильных фрагментов структуры в липофильные фрагменты. Например, липофильный фрагмент функционального элемента получают, превращая одну или более гидрофильных групп функционального элемента в липофильные группы путем традиционного органического синтеза. Примеры гидрофильных групп включают, без ограничения, карбоксильную, гидроксильную, тиольную, амино, фосфатную/фосфонатную, карбонильную и гуанидиновую группы. Липофильные фрагменты, полученные посредством модификации указанных гидрофильных групп, включают, без ограничения, простые эфиры, простые тиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, карбаматы, амиды, фосфаты и оксимы, содержащие липофильную структуру, такую как алкильная, алкоксильная, алкенильная, перфторалкильная, галогеналкильная, алкинильная, арильная или гетероарильная группа.
[0046] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит карбоксильную группу или фосфатную/фосфонатную группу. Примеры исходных лекарственных средств, содержащих карбоксильную группу, включают, без ограничения, металленестрил, аминосалициловую кислоту, баклофен, карбидопа, леводопа, аминобензойную кислоту, буметанид, капторпил [1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин], циластатин [(Z)-7-[[(R)-2-амино-2-карбоксиэтил]тио]-2-[(S)-2,2-диметилциклопропанкарбоксамидо]-2-гептеновую кислоту], левотироксин [D-3,5,3',5'-тетрайодтиронин], амфотерицин B, этретинат, эфлорнитин, 10-ундеценовую кислоту, циноксацин, клоразепат, ципрофлоксацин [1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-3-хинолинкарбоновую кислоту], кромолин, дегидрохолевую кислоту, эналаприл [(S)-1-[N-(1-карбокси-3-фенилпропил)-L-аланил]-L-пролин], эноксацин, этакриновую кислоту, фуросемид, гемфиброзил, олеиновую кислоту, 2-[4-(4-хлорбензоил)-фенокси]-2-метилпропионовую кислоту (фенофибриновую кислоту), 7-[(1S,3R,7S,8S,8aR)-1-(2S)-2-метилбутирилокси-3,7-диметил-1,2,3,7,8,8a-гексагидронафталин-1-ил][(3R,5R)-3,4-дигидроксигептановую кислоту, габапентин, фозиноприл, правастатин, аргатробан, теофиллинуксусную кислоту, иопаноевую кислоту, лиотиронин, лоталамат, лодоксамид [N, N'-(2-хлор-5-циано-мета-фенилен)диоксамовую кислоту], пробенецид, лизиноприл [(S)-1-[N-(1-карбокси-3-фенилпропил)-L-лизил]-L-пролин], метотрексат, ацетиламинопропансульфонат, недокромил, тиосалициловую кислоту, хинаприл, рамиприл, норфлоксацин, локсаглат, сульфасалазин, правастатин, вальпроевую кислоту, олмесартан, амбрисентан (летаирис), дарусентан, нонандиовую кислоту (азелаиновую кислоту), урсодиол, офлоксацин, TAK-044 {цикло[D-аспартил-3-[(4-фенилпиперазин-1-ил)карбонил]-L-аланил-L-аспартил-D-2-(2-тиенил)глицил-L-лейцил-D-триптофил]}, BQ123 {цикло[D-Trp-D-Asp-Pro-D-Val-Leu]}, аторвастатин (липитор), флутиказона фуроат, лубипростон (амитиза), прегабалин (лирика), преметрексед (алимта), трепростинил, розувастатин (крестор), метилдопа, валзартан, телмизартан, (E)-5-[[-4-(2-карбоксиэтил)аминокарбонил]фенил]азо]-2-гидроксибензойную кислоту, эрпросартан, флувастатин (лескол), (E)-5-[[-4-(2-карбоксиэтил)аминокарбонил]фенил]азо]-2-гидроксибензойную кислоту, Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln, 2-нафталинуксусную кислоту, супрофен, 3-(2-тиенилкарбонил)бензолуксусную кислоту, ибупрофен, флурбипрофен, аспирин, карпрофен, пранопрофен, альминопрофен, беноксапрофен, индопрофен, гексапрофен, 10,11-дигидро-10-оксо-дибензо[b,f]тиепин-2-карбоновую кислоту, [4-(2-оксоциклопентил)метил]бензойную кислоту, [5-фенил-(2-тиенил)]карбоновую кислоту, (3-феноксифенил)уксусную кислоту, 4-(4-хлорфенил)-2-фенил-5-тиазолуксусную кислоту, 4-(2,5-дигидропиррол-1-ил)бензолуксусную кислоту, 4,5-дифенил-2-оксазолпропионовую кислоту, [4-2-оксоциклопентил)-метил]бензолуксусную кислоту, 10,11-дигидро-10-оксо-дибензо[b,f]тиепин-2-уксусную кислоту, 5-циклогексил-2,3-дигидро-1H-инден-1-карбоновую кислоту, 5-фенил-2-фуранпропионовую кислоту, гамма-оксо-(1,1'-бифенил)-4-бутановую кислоту, 5-бензоил-2,3-дигидро-1H-пирролизинкарбоновую кислоту, фенилметилен-1H-инден-3-уксусную кислоту, 1-бензоил-5-метокси-2-метил-1H-индол-3-уксусную кислоту, 4-бензоил-1H-пиррол-2-уксусную кислоту, 1,3,4,9-тетрагидропирано[3,4-b]индол-1-уксусную кислоту, 3-фениламинобензолуксусную кислоту, 2-фениламинобензолуксусную кислоту, 3-(4-хлорфенил)-1-фенил-1H-пиразол-4-уксусную кислоту, 4-(2-пропенилокси)бензолуксусную кислоту, 2-фенил-5-тиазолуксусную кислоту, 4-(6-метокси-2-нафталин-3-пропионовую кислоту, ацетилсалициловую кислоту, 3-фенилбензойную кислоту, салицилсалициловую кислоту, [(1-бензил-1H-индазол-3-ил)окси]уксусную кислоту, салицилсалицилсалициловую кислоту, сульфасалазин, 2-фениламинопиридин-3-карбоновую кислоту, промакта (элтромбопаг), монтелукаст, треанда (бендамустин), простагландин E2, простагландин F2альфа, карбопрост (15-метил PGF2альфа), Простагландин D2, Простагландин E1 (алпростадил), Простагландин F1альфа, (Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(E,3S)-3-гидрокси-5-фенил-1-пентенил]циклопентил]-5-гептеновую кислоту, (E)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(3R)-3-гидрокси-5-фенилпентил]циклопентил]-5-гептеновую кислоту, Простагландин GI2(простациклин), (Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(E,3R)-3-гидрокси-4-[3-(трифторметил)фенокси]бут-1-енил]циклопентил]-5-гептеновую кислоту, (E)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-(-3-оксодецил)циклопентил]-5-гептеновую кислоту, мизопростол, гемепрост, 7-[3-гидрокси-2-3(3-гидрокси-4-фенокси-1-бутенил)-5-оксоциклопентил]-5-гептеновую кислоту, фенпростален, Простагландин A1, Простагландин A2, Простагландин B1, Простагландин A2, ретиноевую кислоту, бексаротен, 9-цис-ретиноевую кислоту (алитретиноин), аналоги ретиноидов, 13-цис-ретиноевую кислоту (изоретиноин), аналоги бексаротена, бензилпенициллин, феноксиметилпенициллин, метициллин, оксациллин, пиперациллин, мезлоциллин, карбенициллин, тикарциллин, ампициллин, мециллинам, цефалотин, цефапирин, цефазолин, цефадроксил, цефрадин, цефоницид, цефамандол, цефуроксим, цефокситин, цефоранид, цефотетан, цефуроксим, лоракарбеф, цефотаксим, цефтриаксон, цефоперазон, моксалактам, ливало (питавастатин), тивасо (трепростинил), фолотин (пралатрексат), тамифлю (осельтамивир), берапрост.
[0047] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП имеет следующую структуру P-F1:
F1-OH (структура P-F1)
включая стереоизомеры и соли указанных соединений.
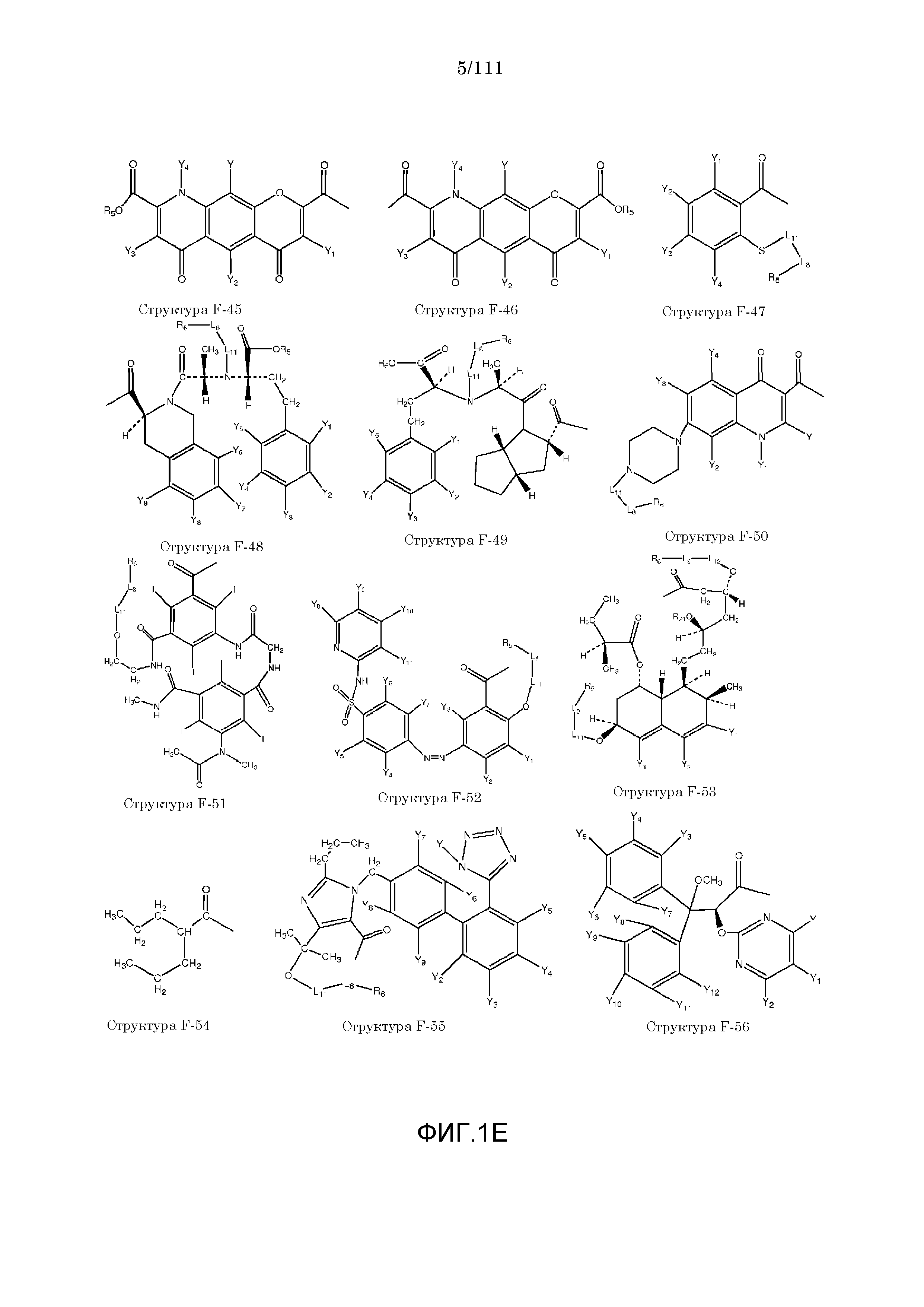
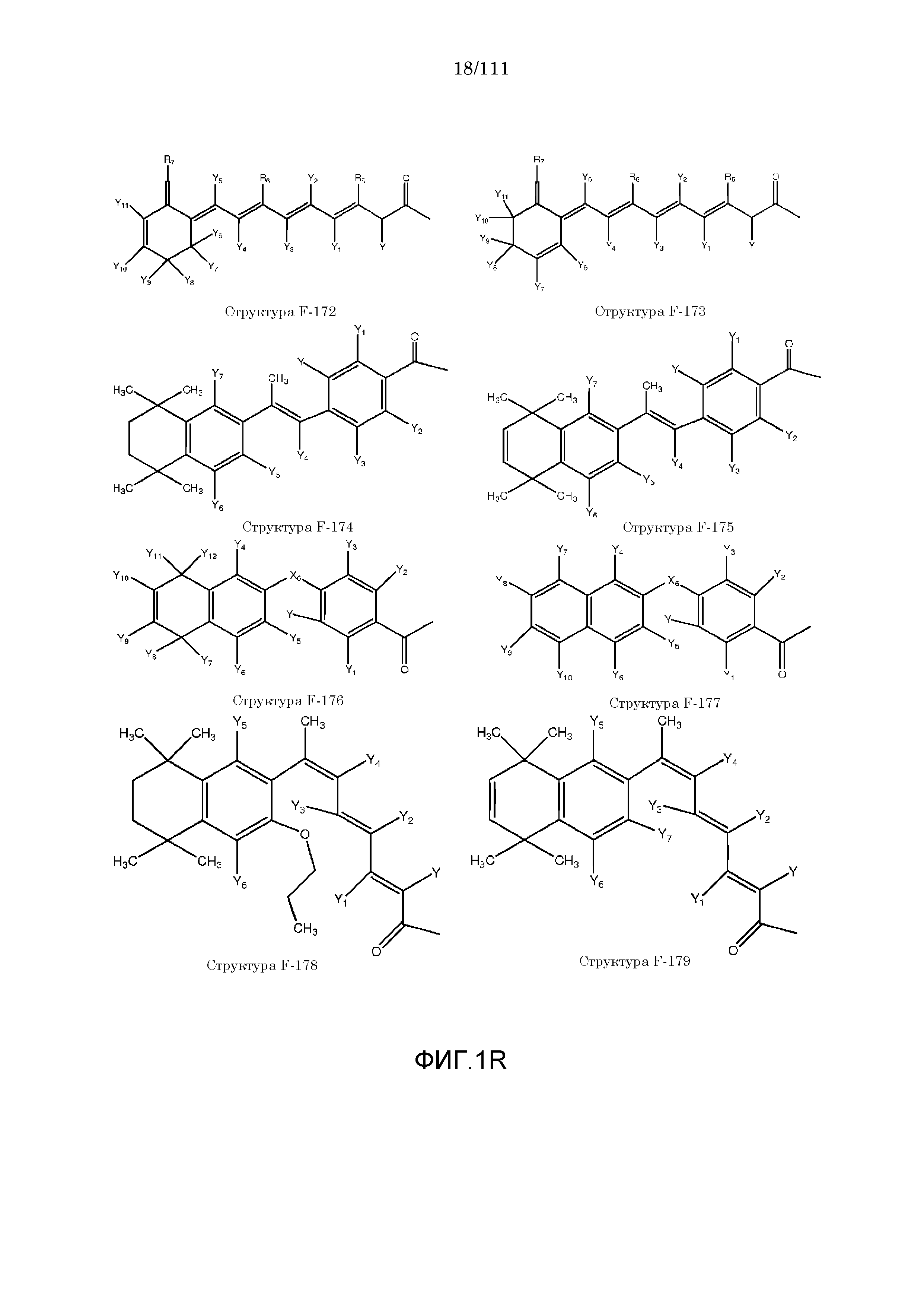
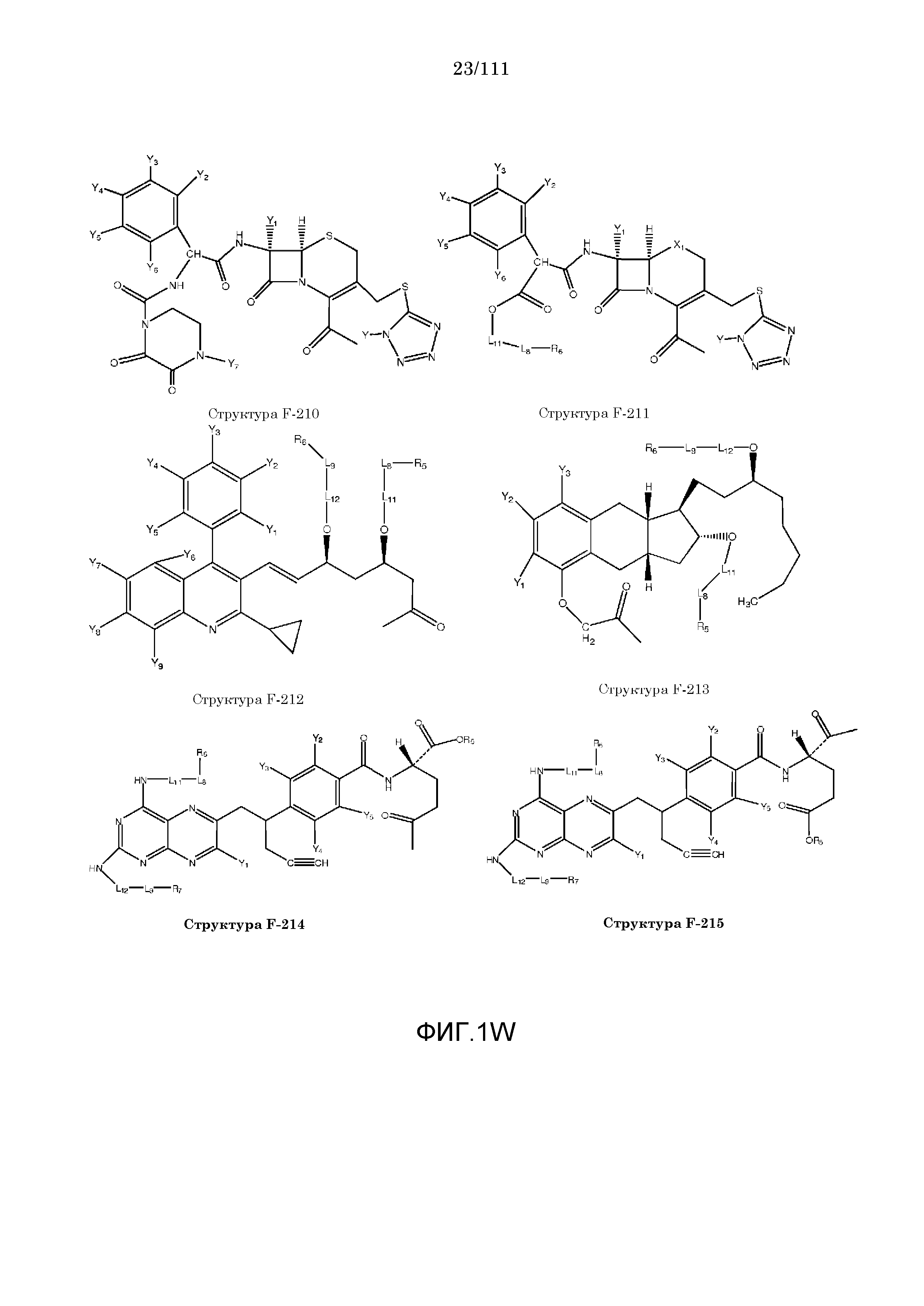
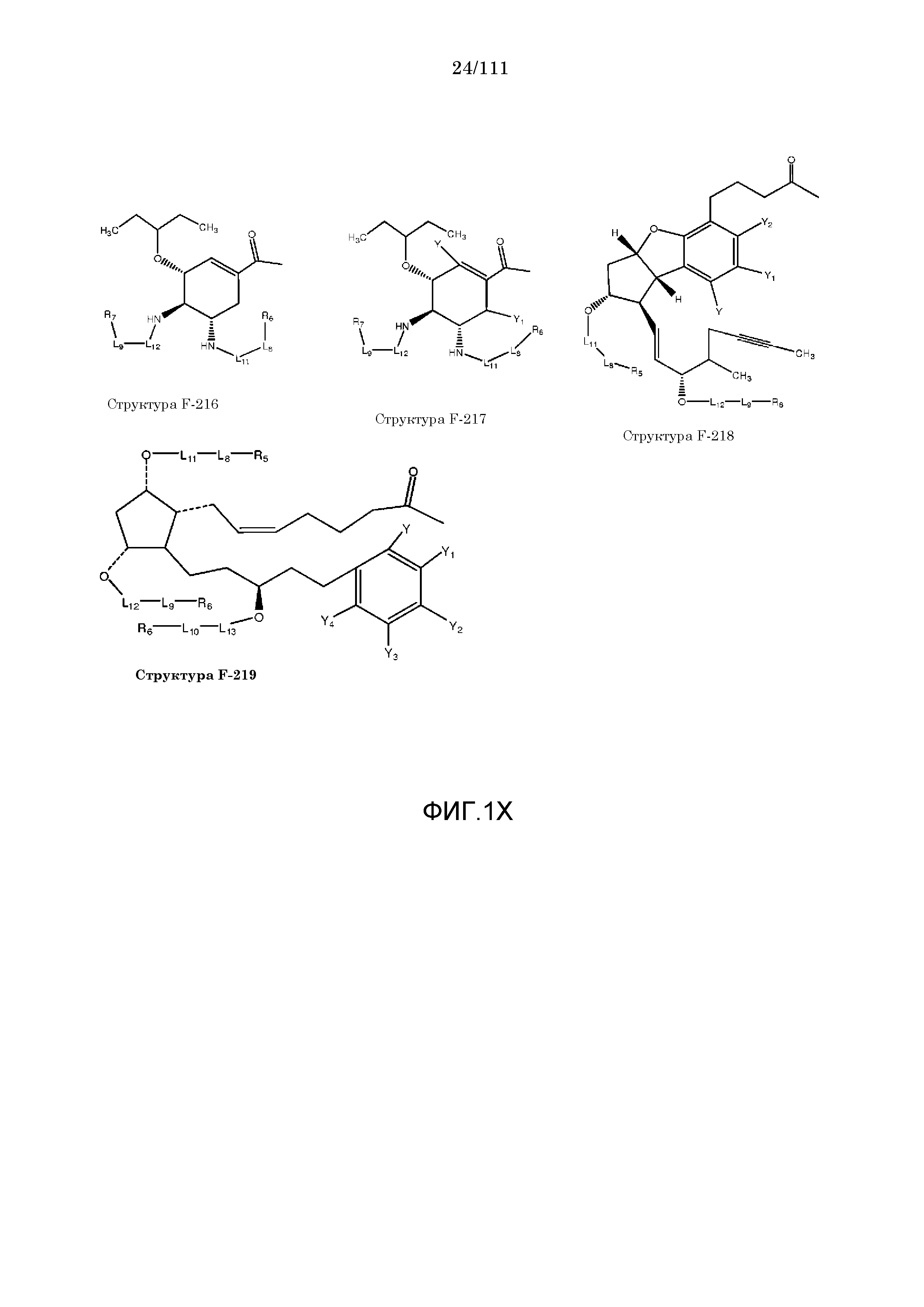
[0048] В настоящем описании термин «F1» или «F1» включает структуру, выбранную из группы, состоящей из структуры F-1, структуры F-2, структуры F-3, структуры F-4, структуры F-5, структуры F-6, структуры F-7, структуры F-8, структуры F-9, структуры F-10, структуры F-11, структуры F-12, структуры F-13, структуры F-14, структуры F-15, структуры F-16, структуры F-17, структуры F-18, структуры F-19, структуры F-20, структуры F-21, структуры F-22, структуры F-23, структуры F-24, структуры F-25, структуры F-26, структуры F-27, структуры F-28, структуры F-29, структуры F-30, структуры F-31, структуры F-32, структуры F-33, структуры F-34, структуры F-35, структуры F-36, структуры F-37, структуры F-38, структуры F-39, структуры F-40, структуры F-41, структуры F-42, структуры F-43, структуры F-44, структуры F-45, структуры F-46, структуры F-47, структуры F-48, структуры F-49, структуры F-50, структуры F-51, структуры F-52, структуры F-53, структуры F-54, структуры F-55, структуры F-56, структуры F-57, структуры F-58, структуры F-59, структуры F-60, структуры F-61, структуры F-62, структуры F-63, структуры F-64, структуры F-65, структуры F-66, структуры F-67, структуры F-68, структуры F-69, структуры F-70, структуры F-71, структуры F-72, структуры F-73, структуры F-74, структуры F-75, структуры F-76, структуры F-77, структуры F-78, структуры F-79, структуры F-80, структуры F-81, структуры F-82, структуры F-83, структуры F-84, структуры F-85, структуры F-86, структуры F-87, структуры F-88, структуры F-89, структуры F-90, структуры F-91, структуры F-92, структуры F-93, структуры F-94, структуры F-95, структуры F-96, структуры F-97, структуры F-98, структуры F-99, структуры F-100, структуры F-101, структуры F-102, структуры F-103, структуры F-104, структуры F-105, структуры F-106, структуры F-107, структуры F-108, структуры F-109, структуры F-110, структуры F-111, структуры F-112, структуры F-113, структуры F-114, структуры F-115, структуры F-116, структуры F-117, структуры F-118, структуры F-119, структуры F-120, структуры F-121, структуры F-122, структуры F-123, структуры F-124, структуры F-125, структуры F-126, структуры F-127, структуры F-128, структуры F-129, структуры F-130, структуры F-131, структуры F-132, структуры F-133, структуры F-134, структуры F-135, структуры F-136, структуры F-137, структуры F-138, структуры F-139, структуры F-140, структуры F-141, структуры F-142, структуры F-143, структуры F-144, структуры F-145, структуры F-146, структуры F-147, структуры F-148, структуры F-149, структуры F-150, структуры F-151, структуры F-152, структуры F-153, структуры F-154, структуры F-155, структуры F-156, структуры F-157, структуры F-158, структуры F-159, структуры F-160, структуры F-161, структуры F-162, структуры F-163, структуры F-164, структуры F-165, структуры F-166, структуры F-167, структуры F-168, структуры F-169, структуры F-170, структуры F-171, структуры F-172, структуры F-173, структуры F-174, структуры F-175, структуры F-176, структуры F-177, структуры F-178, структуры F-179, структуры F-180, структуры F-181, структуры F-182, структуры F-183, структуры F-184, структуры F-185, структуры F-186, структуры F-187, структуры F-188, структуры F-189, структуры F-190, структуры F-191, структуры F-192, структуры F-193, структуры F-194, структуры F-195, структуры F-196, структуры F-197, структуры F-198, структуры F-199, структуры F-200, структуры F-201, структуры F-202, структуры F-203, структуры F-204, структуры F-205, структуры F-206, структуры F-207, структуры F-208, структуры F-209, структуры F-210, структуры F-211, структуры F-212, структуры F-213, структуры F-214, структуры F-215, структуры F-216, структуры F-217, структуры F-218, структуры F-219 (фиг.1), включая стереоизомеры и соли указанных соединений.
[0049] В настоящем описании, если не указано иное:
каждый Y и Y1-Y14 независимо выбран из группы, состоящей из H, Cl, F, Br, I, CN, R10, CH3C≡C, CR6≡C, P(O)OR6, CF3, CF3O, CH3, CF3CF2, R5, R6, R7, R8,CF3CF2O, CH3CH2, CH3CH2CH2, (CH3)2CH, (CH3)2CHCH2, CH3CH2CH(CH3), (CH3)3C, C4H9, C5H11,CH3CO, CH3CH2CO, R5CO, CH3OC(=O), CH3CH2OC(=O), R5OC(=O), R6C(=NOR5), R6C(=NR5), CH3COO, R5COO, R5COOCH2, R6NHCOOCH2, CH3COS, CH3O, R5O, HO, R10O, CF3CH2SCH2, CHCl2, CH2COOR6, CH3S, R5S, HS, R10S, CH3OCH2CH2, R5OCH2, R10OCH2CH2, R5O(C=O), C2H5OCONH, CH2NHR8, CH3OCONH, CH3SO2, CH3SO, R5SO2, R5SO, NH2SO2, C6H5CH2, NH2, NHR10, циклобутила, циклопропила, 4-хлорфенила, 4-фторфенила, CH2=CH, CH2=CHCH2, CH3CH=CH, NHR5SO2, N(R5)2SO2, R5OCH2CH2CH2 и NO2;
каждый X, X1-X6 независимо выбран из группы, состоящей из H, CH3, R5, CH2, CHR6, S, O, NR6, CO, CH, CR6, P(O)OR6, N, CH2=C, CH=CH, C≡C, CONH, CSNH, COO, OCO, COS, COCH2 и CH2CO;
каждый R1и R2 независимо выбран из группы, состоящей из отсутствия заместителя, H, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, P, NR6 или любые другие фармацевтически приемлемые группы;
каждый R3,R4,R5,R6, R7,R8 и R9независимо выбран из группы, состоящей из H, OH, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила и замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, N, P(O)OL7, CH=CH, C≡C, CHL7,CL5L7, арильную, гетероарильную или циклическую группы;
каждый R, R11-R16 независимо выбран из группы, состоящей из отсутствия заместителя, H, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, P, NR5 или любые другие фармацевтически приемлемые группы;
L1 выбран из группы, состоящей из отсутствия заместителя, O, S, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-CH(L3)-O и -S-CH(L3)-O-;
каждый L2, L8, L9и L10 независимо выбран из группы, состоящей из отсутствия заместителя, -O-, -S-, -N(L3)-, -O-N(L3)-, -N(L3)-O-, -N(L3)-N(L5)-, -N(L3)-CH2-O-, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-CH(L3)-O-, -S-CH(L3)-O-, -O-L3-, -S-L3-, -N(L3)-L5- и L3;
L4 выбран из группы, состоящей из отсутствия заместителя, C=O, C=S,


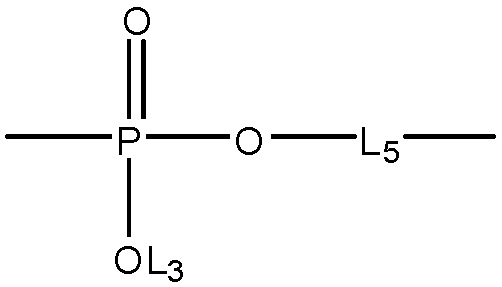
каждый L11, L12и L13 независимо выбран из группы, состоящей из отсутствия заместителя, -C(=O)-, -C(=S)-, -C(=N(L3))-,


в каждом L1, L2, L4, L8, L9,L10, L11, L12 и L13каждый L3и L5независимо выбран из группы, состоящей из отсутствия заместителя, H, CH2COOL6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, P, NL3 или любые другие фармацевтически приемлемые группы;
L6 независимо выбран из группы, состоящей из H, OH, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила и замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, N, P(O)OL7, CH=CH, C≡C, CHL7,CL5L7, арильную, гетероарильную или циклическую группы;
L7 независимо выбран из группы, состоящей из H, OH, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила и замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного перфторалкила и замещенного и незамещенного галогеналкила, причем любой из атомов углерода и водорода может быть, в свою очередь, независимо заменен на O, S, N, P(O)OL6, CH=CH, C≡C, CHL6,CL6L5, арильную, гетероарильную или циклическую группы;
каждый R10, R20, R21, R22, R23, R24, R25, R26, R27, R28 и R29 независимо выбран из группы, состоящей из отсутствия заместителя, H, R1, R2, R3, R4, R5, R6, R7, R8,R6CO, R6NHC(=O), R6OC(=O), R6C(=NOR5), R6C(=NR5), R6C(=S), CNR6 и R6OC(=O)(CH2)nC(=O), R6(O=)CO(CH2)nC(=O);
каждый m и n независимо выбран из группы, состоящей из 0 и целого числа, например, m или n=0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20,...;
W выбран из группы, состоящей из NH, NR5, O, S; CH2 и NH;
Z представляет собой H,


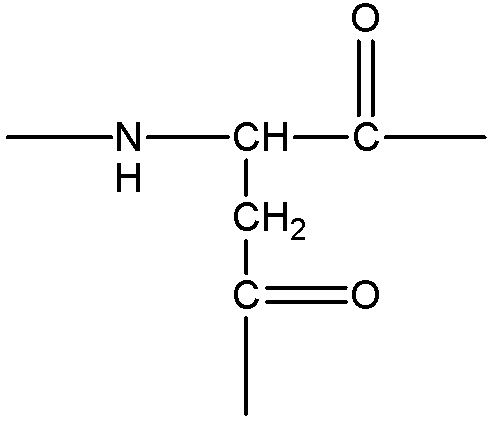
каждый -AA- и -AA1- представляет собой один или более природных или неприродных аминокислотных остатков или родственный остаток, в котором одна или более гидрофильных групп, таких как карбоксильная, гидроксильная, тиольная, аминная, фосфатная/фосфонатная, карбонильная или гуанидиновая группа, превращена/превращены в липофильные группы, как описано в абзаце 0045, пример -AA- включает, без ограничения, структуру, содержащую одну из следующих структур:













каждый Bx- и By- независимо выбран из группы, состоящей из оснований ДНК и оснований РНК, в которых любая гидрофильная группа может быть превращена в липофильную группу, как описано в абзаце 0045, примеры оснований ДНК и оснований РНК включают, без ограничения, аденин, гуанин, цитозин, тимин, урацил и родственные соединения, имеющие следующие структуры:
каждый -B1- или -B- независимо представляет собой остатки аденина, гуанина или цитозина, имеющие следующие структуры:
термин «HA» или «AH» представляет собой кислоту. Согласно некоторым из вариантов осуществления, кислота представляет собой фармацевтически приемлемую кислоту.
[0050] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит функциональную группу, такую как аминогруппа, гидроксильная группа, фенольная группа, тиольная группа или гуанидиновая группа. Примеры исходного лекарственного средства, содержащего аминогруппу, гидроксильную группу, фенольную группу, тиольную группу или гуанидиновую группу, включают, без ограничения, ацетогидроксамовую кислоту, ацикловир {2-амино-1,9-дигидро-9-[(2-гидроксиэтокси)метил]-6H-пурин-6-он}, аллопуринол, аденозин (6-амино-9-бета-D-рибофуранозил-9-H-пурин), преднизолон, преднизон, триамицинолон ацетонид, кортизол (гидрокортизон), кортизон, эстрадиол, эстрон, эстратриол, 16-гидроксиэстрон, эквиллин, эквиленин, диенэстрол, гексэстрол, диэтилстильбэстрол, бензэстрол, 4-гидроксиандростендион, ICI 164384, аминоглютетимид, ICI 182780, 7-аминофенилтиоандрост-4-ен-3,17-дион, мегестрол, хлормадинон, норгестрел, линестренол, метандростенолон, мифепристон, онапристон, даназол, метенолон, станозолол, амикацин (D-стрептамин), 9-аминоакридин, атовакуон, баклофен, кальцифедиол, кальцитриол, фенилпропаноламин, капторпил [1-[(2S)-3-меркапто-2-метилпропионил]-L-пролин], бутабарбитал, карбамазепин, карбидопа, теофиллин, леводопа, псевдоэфедрин, хлорамфеникол, хлороксин, клиохинол, хлороксиленол, хлорфенезин карбамат, хлорталидон, клонидин [2-(2,6-дихлорфениламино)-2-имидазолин], кладрибин, клоназепам, цитарабин [4-амино-1-бета-D-арабинофуранозил-2-(1H)-пиримидинон], даназол, декспантенол гвайфенезин, даунорубицин, доксорубицин, идарубицин, декстротироксин [D-3,5,3',5'-тетрайодтиронин], диданозин, дезоцин, допамин, дигидротахистерол, дикумарол, дронабинол, дифиллин, эноксацин, эналаприл [(S)-1-[N-(1-карбокси-3-фенилпропил)-L-аланил]-L-пролин], диенэстрол, кальципотриен [(5Z,7E,22E,24S)-24-циклопропил-9,10-секохола-5,7,10(19),22-тетран-1альфа,3бета,24-триол], эргокальциферол [9,10-секоэргста-5,7,10(19),22-тетраен-3-ол,(3бета,5Z,7E,22E)], левоноргестрел, норгестрел, норетиндрон, прокарбазин, фамцикловир, фелодипин, норгестимат, флоксуридин, идоксуридин, этопозид, монобензон, флударабин фосфат, дигидротахистерол, финастерид, флуконазол, флударабин, фторурацил, флуцитозин, этхлорвинол, фторметолон, галобетазол, мометазон, флувоксамин, флурандренолид, ганцикловир, флутиказон, дезогестрел, этинилэстрадиол, местранол, дезоксиметазон, дексаметазон, гентамицин, гидроксипрогестерон, медроксипрогестерон, индапамид, леводопа, метилдопа, гидралазин, гидрохлоротиазид, гидрофлуметиазид, йодохинол, канамицин, ловастатин, мазопрокол, лоразепам, оксазепам, медризон, мефобарбитал, метолазон, метаксалон, метокарбамол, метилклотиазид, метронидазол, меркаптопурин, метимазол, метотрексат, милринон, нандролон, нафазолин, мексилетин, нитрофурантион, никлозамид, нифедипин, нимодипин, норэпинефрин, новобиоцин, омепразол, оксандролон, пемолин, пентамидин, оксиметолон, норгидрогуайретовая кислота, зафирлукаст, банзел (руфинамид), фенацемид, фенелзин, феназопиридин, фенобарбитал, сульфизоксазол, фенетоламин, фенитоин, подофилокс, прокарбазин, политиазид, трихлорметиазид, примидон, пробукол, пропофол, пропилтиоурацил, сульфадоксин, хинетазон, рибавирин, стрептозоцин, римексолон, симвастатин, статицин, станозол, сульфаметизол, сульфаметоксазол, сульфизоксазол, сульфаниламид, сульфадиазин, сульфасалазин, темазепам, теразосин, такрин, тиабендазол, тиопентал, толазолин, тиогуанин, олмесартан, медоксомил [(5-метил-2-оксо-1,3-диоксол-4-ил)метил-5-(1-гидрокси-1-метил-этил)-2-пропил-3-[[4-[2-(2H-тетразол-5-ил)-фенил]-фенил]метил]-3H-имидазол-4-карбоксилат], тенипозид, торсемид, триамтерен, трифлуридин, триметоприм, триметрексат, урамустин, тропикамид, видарабин, варфарин, залцитабин, зидовудин, флутиказон фуроат, Ro 46-2005, бозентан, клазозентан, тезозентан, изентресс {N-[(4-фторфенил)метил]-1,6-дигидро-5-гидрокси-1-метил-2-[1-метил-1-[[(5-метил-1,3,4-оксадиазол-2-ил)карбонил]амино]этил]-6-оксо-4-пиримидинкарбоксамид}, алискирен (2S,4S,5S,7R)-5-амино-N-(2-карбамоил-2-метил-пропил)-4-гидрокси-7-{[4-метокси-3-(3-метоксипропокси)-фенил]метил}-8-метил-2-пропан-2-ил-нонанамид, эфавиренц, декстроамфетамин, финастерид, армодафнил, эраксис (анидулафунгин), презиста (дарунавир), типранавир, ампренавир, бреканавир, телбивудин (тизека), леналидомид, талидомид, энтекавир, кониваптан, сорафениб (нексавар), энтекавир (бараклуд), азацитидин (видаза), пеметрексед (алимта), рамелтеон, эзетимиб, клофарабин (клофар), неларабин (арнон), эрлотиниб (тарцева), тадалафил (циалис), ампренавир, атазанавир (рейатаз), ацетаминофен, глиборнурид, этравирин, абакавир (зиаген), N-[1-[(2R,3R,4S,5R)-3,4-дигидрокси-5-метилоксолан-2-ил]-5-фтор-2-оксопиримидин-4-ил]амин, тенофовир, вориконазол, гидрохлоротиазид, золедроновая кислота, мелатонин, 3-аминопропан-1-сульфоновая кислота, фулвестрант, резвератрол, ловастатин, тенофовир дизопроксил, тенофовир, симвастатин, пентил N-[1-[(2R,3R,4S,5R)-3,4-дигидрокси-5-метилоксолан-2-ил]-5-фтор-2-оксопиримидин-4-ил]карбамат (капецитабин), эргокальциферол (витамин D2), холекальциферол (витамин D3), 1,25-дигидроксихолекальциферол, ламивудин, доксеркальциферол (1a-гидрокси витамин D2), дигидротахистерол (витамин D4), лопинавир, 3-[4-(4-хлорфенил)циклогексил-4-гидроксинафталин-1,2-дион, цидофовир, ритонавир, энтакарпон, тадалафил (циалис), финастерид, зилеутон, мелатонин, тамифлю (оселтамивир), парикальцитол, метронидазол, дифлунизал, аспирин, оксикамс, жанувиа (ситаглиптин), эмтрицитабин (5-фтор-1-(2R,5S)-[2-(гидроксиметил)-1,3-оксатиолан-5-ил]цитозин, пропофол, аналоги витамина А, афинитор [эверолимус, (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-аза-трицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон], куркумин, аптивус (типранавир), интеленс (этранавир), адцирка (тадалафил), самска (толваптан), пептиды, ДНК, РНК, аденин, гуанин, цитозин, тимин и урацил.
[0051] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП имеет следующую структуру P-F2:
F2-H (структура P-F2)
включая стереоизомеры и соли указанных соединений.
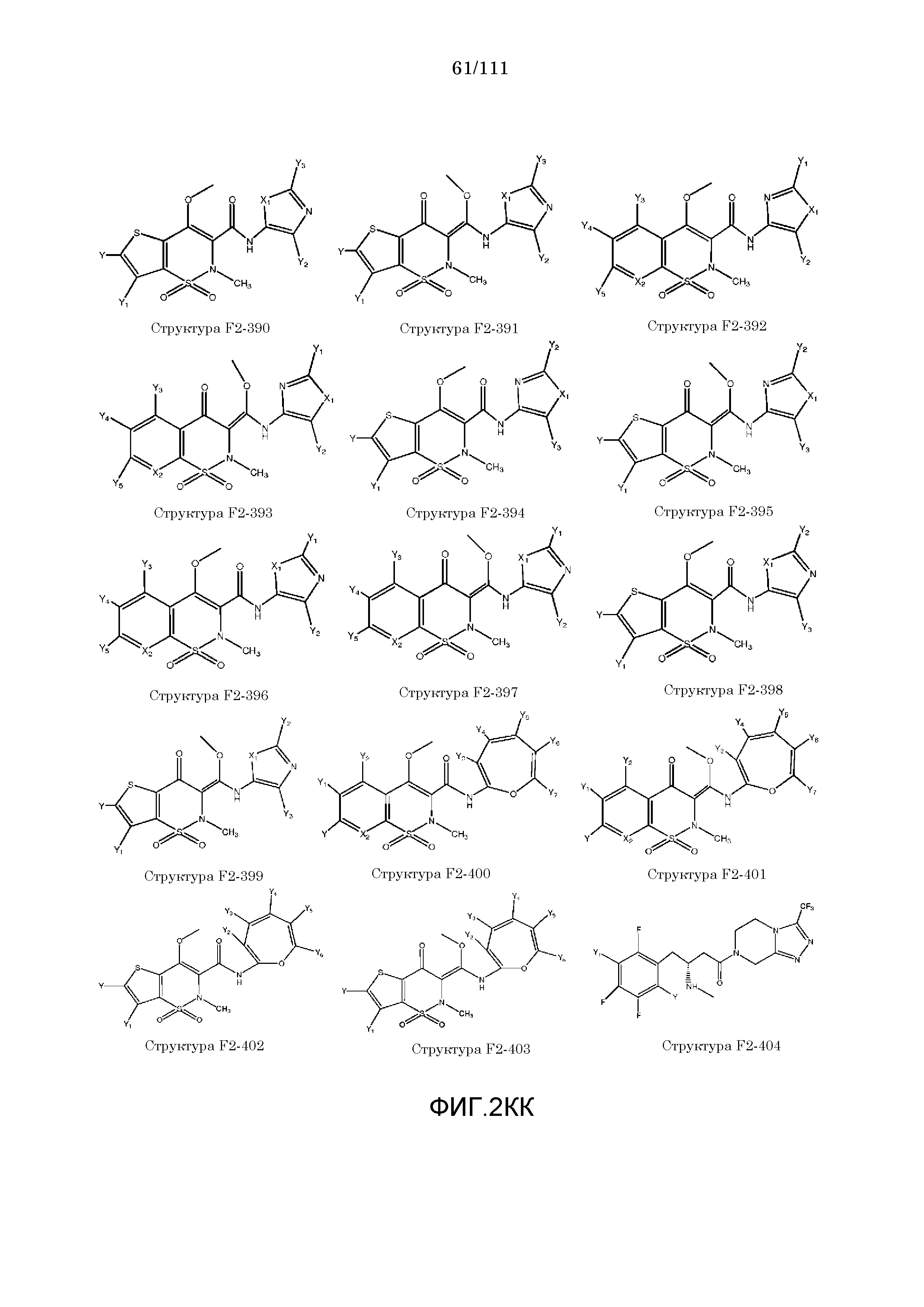
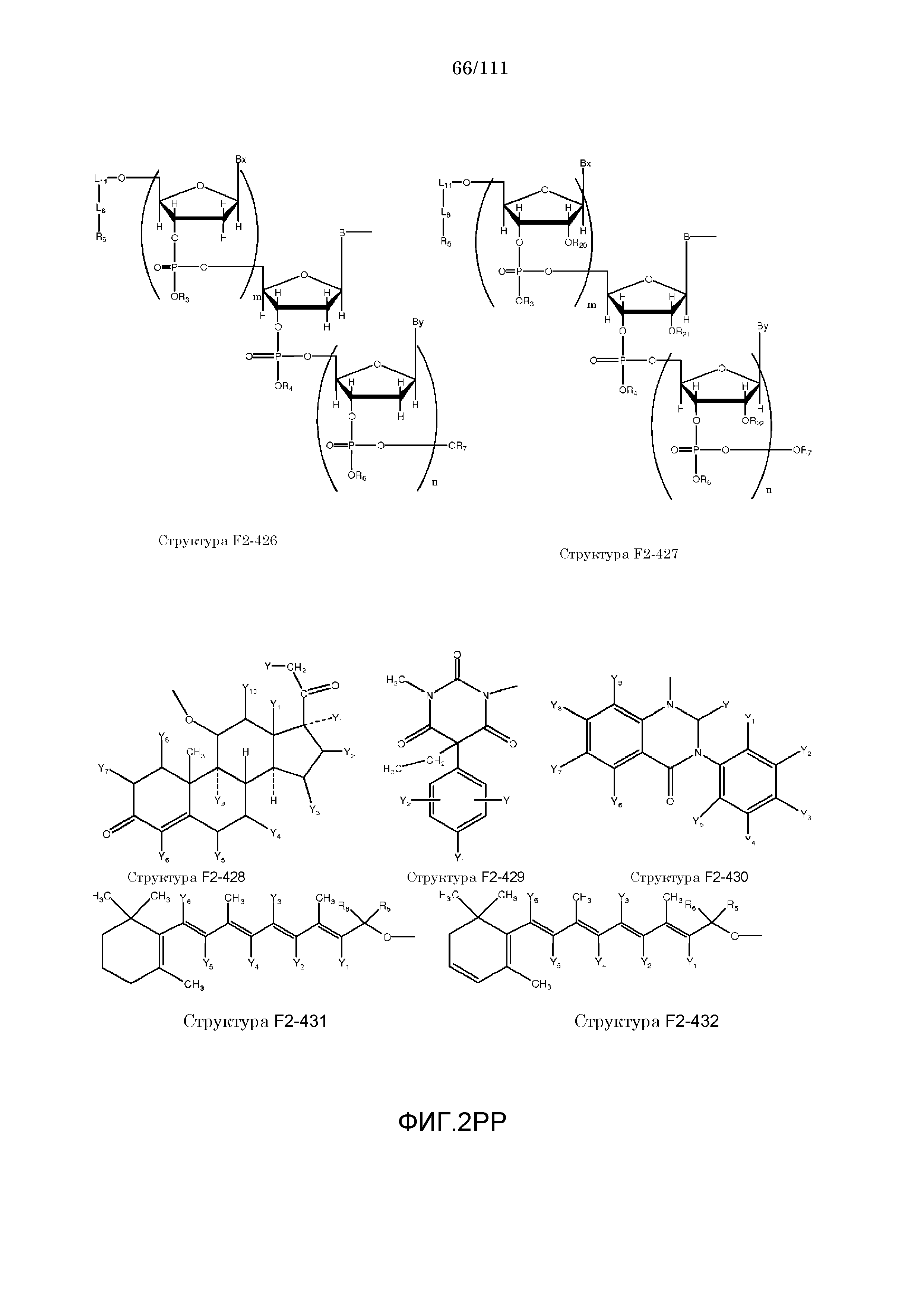
[0052] В настоящем описании термин «F2» или «F2» включает структуру, выбранную из группы, состоящей из структуры F2-1, структуры F2-2, структуры F2-3, структуры F2-4, структуры F2-5, структуры F2-6, структуры F2-7, структуры F2-8, структуры F2-9, структуры F2-10, структуры F2-11, структуры F2-12, структуры F2-13, структуры F2-14, структуры F2-15, структуры F2-16, структуры F2-17, структуры F2-18, структуры F2-19, структуры F2-20, структуры F2-21, структуры F2-22, структуры F2-23, структуры F2-24, структуры F2-25, структуры F2-26, структуры F2-27, структуры F2-28, структуры F2-29, структуры F2-30, структуры F2-31, структуры F2-32, структуры F2-33, структуры F2-34, структуры F2-35, структуры F2-36, структуры F2-37, структуры F2-38, структуры F2-39, структуры F2-40, структуры F2-41, структуры F2-42, структуры F2-43, структуры F2-44, структуры F2-45, структуры F2-46, структуры F2-47, структуры F2-48, структуры F2-49, структуры F2-50, структуры F2-51, структуры F2-52, структуры F2-53, структуры F2-54, структуры F2-55, структуры F2-56, структуры F2-57, структуры F2-58, структуры F2-59, структуры F2-60, структуры F2-61, структуры F2-62, структуры F2-63, структуры F2-64, структуры F2-65, структуры F2-66, структуры F2-67, структуры F2-68, структуры F2-69, структуры F2-70, структуры F2-71, структуры F2-72, структуры F2-73, структуры F2-74, структуры F2-75, структуры F2-76, структуры F2-77, структуры F2-78, структуры F2-79, структуры F2-80, структуры F2-81, структуры F2-82, структуры F2-83, структуры F2-84, структуры F2-85, структуры F2-86, структуры F2-87, структуры F2-88, структуры F2-89, структуры F2-90, структуры F2-91, структуры F2-92, структуры F2-93, структуры F2-94, структуры F2-95, структуры F2-96, структуры F2-97, структуры F2-98, структуры F2-99, структуры F2-100, структуры F2-101, структуры F2-102, структуры F2-103, структуры F2-104, структуры F2-105, структуры F2-106, структуры F2-107, структуры F2-108, структуры F2-109, структуры F2-110, структуры F2-111, структуры F2-112, структуры F2-113, структуры F2-114, структуры F2-115, структуры F2-116, структуры F2-117, структуры F2-118, структуры F2-119, структуры F2-120, структуры F2-121, структуры F2-122, структуры F2-123, структуры F2-124, структуры F2-125, структуры F2-126, структуры F2-127, структуры F2-128, структуры F2-129, структуры F2-130, структуры F2-131, структуры F2-132, структуры F2-133, структуры F2-134, структуры F2-135, структуры F2-136, структуры F2-137, структуры F2-138, структуры F2-139, структуры F2-140, структуры F2-141, структуры F2-142, структуры F2-143, структуры F2-144, структуры F2-145, структуры F2-146, структуры F2-147, структуры F2-148, структуры F2-149, структуры F2-150, структуры F2-151, структуры F2-152, структуры F2-153, структуры F2-154, структуры F2-155, структуры F2-156, структуры F2-157, структуры F2-158, структуры F2-159, структуры F2-160, структуры F2-161, структуры F2-162, структуры F2-163, структуры F2-164, структуры F2-165, структуры F2-166, структуры F2-167, структуры F2-168, структуры F2-169, структуры F2-170, структуры F2-171, структуры F2-172, структуры F2-173, структуры F2-174, структуры F2-175, структуры F2-176, структуры F2-177, структуры F2-178, структуры F2-179, структуры F2-180, структуры F2-181, структуры F2-182, структуры F2-183, структуры F2-184, структуры F2-185, структуры F2-186, структуры F2-187, структуры F2-188, структуры F2-189, структуры F2-190, структуры F2-191, структуры F2-192, структуры F2-193, структуры F2-194, структуры F2-195, структуры F2-196, структуры F2-197, структуры F2-198, структуры F2-199, структуры F2-200, структуры F2-201, структуры F2-202, структуры F2-203, структуры F2-204, структуры F2-205, структуры F2-206, структуры F2-207, структуры F2-208, структуры F2-209, структуры F2-210, структуры F2-211, структуры F2-212, структуры F2-213, структуры F2-214, структуры F2-215, структуры F2-216, структуры F2-217, структуры F2-218, структуры F2-219, структуры F2-220, структуры F2-221, структуры F2-222, структуры F2-223, структуры F2-224, структуры F2-225, структуры F2-226, структуры F2-227, структуры F2-228, структуры F2-229, структуры F2-230, структуры F2-231, структуры F2-232, структуры F2-233, структуры F2-234, структуры F2-235, структуры F2-236, структуры F2-237, структуры F2-238, структуры F2-239, структуры F2-240, структуры F2-241, структуры F2-242, структуры F2-243, структуры F2-244, структуры F2-245, структуры F2-246, структуры F2-247, структуры F2-248, структуры F2-249, структуры F2-250, структуры F2-251, структуры F2-252, структуры F2-253, структуры F2-254, структуры F2-255, структуры F2-256, структуры F2-257, структуры F2-258, структуры F2-259, структуры F2-260, структуры F2-261, структуры F2-262, структуры F2-263, структуры F2-264, структуры F2-265, структуры F2-266, структуры F2-267, структуры F2-268, структуры F2-269, структуры F2-270, структуры F2-271, структуры F2-272, структуры F2-273, структуры F2-274, структуры F2-275, структуры F2-276, структуры F2-277, структуры F2-278, структуры F2-279, структуры F2-280, структуры F2-281, структуры F2-282, структуры F2-283, структуры F2-284, структуры F2-285, структуры F2-286, структуры F2-287, структуры F2-288, структуры F2-289, структуры F2-290, структуры F2-291, структуры F2-292, структуры F2-293, структуры F2-294, структуры F2-295, структуры F2-296, структуры F2-297, структуры F2-298, структуры F2-299, структуры F2-300, структуры F2-301, структуры F2-302, структуры F2-303, структуры F2-304, структуры F2-305, структуры F2-306, структуры F2-307, структуры F2-308, структуры F2-309, структуры F2-310, структуры F2-311, структуры F2-312, структуры F2-313, структуры F2-314, структуры F2-315, структуры F2-316, структуры F2-317, структуры F2-318, структуры F2-319, структуры F2-320, структуры F2-321, структуры F2-322, структуры F2-323, структуры F2-324, структуры F2-325, структуры F2-326, структуры F2-327, структуры F2-328, структуры F2-329, структуры F2-330, структуры F2-331, структуры F2-332, структуры F2-333, структуры F2-334, структуры F2-335, структуры F2-336, структуры F2-337, структуры F2-338, структуры F2-339, структуры F2-340, структуры F2-341, структуры F2-342, структуры F2-343, структуры F2-344, структуры F2-345, структуры F2-346, структуры F2-347, структуры F2-348, структуры F2-349, структуры F2-350, структуры F2-351, структуры F2-352, структуры F2-353, структуры F2-354, структуры F2-355, структуры F2-356, структуры F2-357, структуры F2-358, структуры F2-359, структуры F2-360, структуры F2-361, структуры F2-362, структуры F2-363, структуры F2-364, структуры F2-365, структуры F2-366, структуры F2-367, структуры F2-368, структуры F2-369, структуры F2-370, структуры F2-371, структуры F2-372, структуры F2-373, структуры F2-374, структуры F2-375, структуры F2-376, структуры F2-377, структуры F2-378, структуры F2-379, структуры F2-380, структуры F2-381, структуры F2-382, структуры F2-383, структуры F2-384, структуры F2-385, структуры F2-386, структуры F2-387, структуры F2-388, структуры F2-389, структуры F2-390, структуры F2-391, структуры F2-392, структуры F2-393, структуры F2-394, структуры F2-395, структуры F2-396, структуры F2-397, структуры F2-398, структуры F2-399, структуры F2-400, структуры F2-401, структуры F2-402, структуры F2-403, структуры F2-404, структуры F2-405, структуры F2-406, структуры F2-407, структуры F2-408, структуры F2-409, структуры F2-410, структуры F2-411, структуры F2-412, структуры F2-413, структуры F2-414, структуры F2-415, структуры F2-416, структуры F2-417, структуры F2-418, структуры F2-419, структуры F2-420, структуры F2-421, структуры F2-422, структуры F2-423, структуры F2-424, структуры F2-425, структуры F2-426, структуры F2-427, F2-428, структуры F2-429, структуры F2-430, структуры F2-431, структуры F2-432, структуры F2-433, структуры F2-434, структуры F2-435, структуры F2-436, структуры F2-437 и структуры F2-438 (фиг.2), включая стереоизомеры и соли указанных соединений.
[0053] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит одновременно аминогруппу и дополнительно содержит карбоксильную или фосфатную/фосфонатную группу. Примеры исходного лекарственного средства КИП, содержащего одновременно аминогруппу и карбоксильную/фосфатную/фосфонатную группу, включают, без ограничения, моксифлоксацин, акривастин, моэксиприл, (4-амино-1-гидрокси-бутилиден)бифосфоновую кислоту, бензеприл [3-[[1-(этоксикарбонил)-3-фенил-(1S)-пропиламино]-2,3,4,5-тетрагидро-2-оксо-1H-1-(3S)-бензазепин-1-уксусную кислоту], эноксацин, ципрофлоксацин [1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-3-хинолинкарбоновую кислоту], левокабастин, леводопа, эналаприл [(S)-1-[N-(1-карбокси-3-фенилпропил)-L-аланил]-L-пролин], нистатин, ломефлоксацин, норфлоксацин, амфотерицин B, офлоксацин, хинаприл, рамиприл, (2-{1-[2-(хлорфенил)-2-метокси-2-оксоэтил]-4-сульфанил-3-пиперидинилиден}-уксусную кислоту}, R-138727, 2-оксо-клопидогрел, золедроновую кислоту, метилдопа, левоцетиризин (ксизал), цетиризин (зиртек), левофлоксацин, гатифлоксацин, олопатадин, ибандронат (бонива), габапентин, 3-аминопропан-1-сульфоновую кислоту, пептиды, аминокислоты, H-Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln-OH, H-Val-Pro-Gly-Pro-Arg-OH, H-Val-Pro-Gly-Pro-Arg(NO2)-OH, H-Trp-Ala-Gly-Gly-Asp(OBz)-Ala-Ser(Ac)-Gly-Glu(OEt)-OH, бепреве (бепотастин безилат), безивансе (безифлоксацин), энтерег {алвимопан, [[2(S)-[[4(R)-(3-гидроксифенил)-3(R),4-диметил-1-пиперидинил]метил]-1-оксо-3-фенилпропил]амино]уксусной кислоты дегидрат} и сабрил (вигабатрин).
[0054] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит следующую структуру P-F3:
F3-OH (структура P-F3)
включая стереоизомеры и соли указанных соединений.
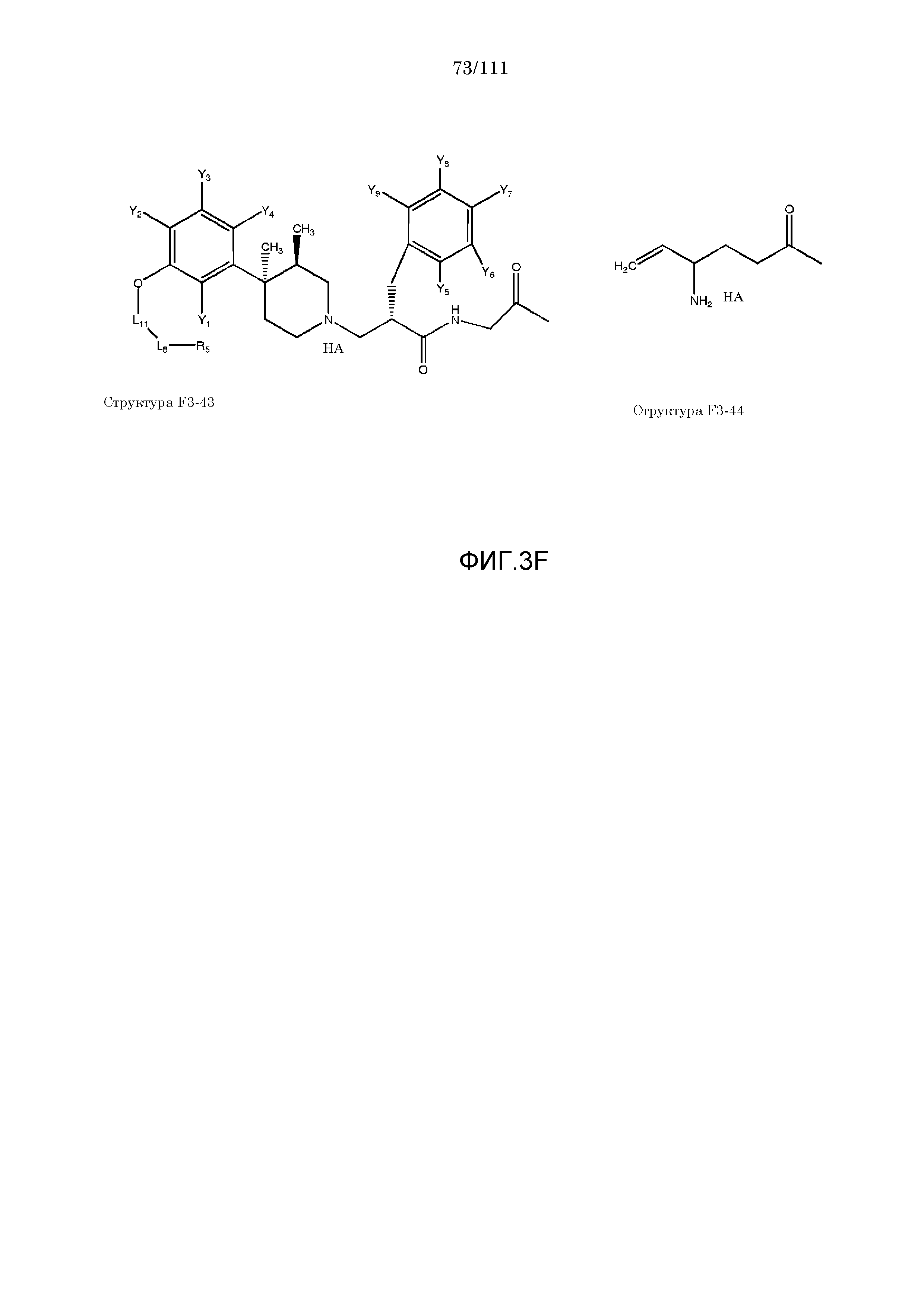
[0055] В настоящем описании термин «F3» или «F3» включает структуру, выбранную из группы, состоящей из структуры F3-1, структуры F3-2, структуры F3-3, структуры F3-4, структуры F3-5, структуры F3-6, структуры F3-7, структуры F3-8, структуры F3-9, структуры F3-10, структуры F3-11, структуры F3-12, структуры F3-13, структуры F3-14, структуры F3-15, структуры F3-16, структуры F3-17, структуры F3-18, структуры F3-19, структуры F3-20, структуры F3-21, структуры F3-22, структуры F3-23, структуры F3-24, структуры F3-25, структуры F3-26, структуры F3-27, структуры F3-28, структуры F3-29, структуры F3-30, структуры F3-31, структуры F3-32, структуры F3-33, структуры F3-34, структуры F3-35, структуры F3-36, структуры F3-37, структуры F3-38, структуры F3-39, структуры F3-40, структуры F3-41, структуры F3-42, структуры F3-43 и структуры F3-44 (фиг.3), включая стереоизомеры и соли указанных соединений.
[0056] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит карбонильную группу. Примеры исходного лекарственного средства КИП, содержащего карбонильную группу, включают, без ограничения, альдегид витамина А, андростендион, прогестерон, 1-метиландроста-1,4-диен-3,17-дион, 10β-пропинилэст-4-ен-3,17-дион, 6-метиленандрост-4-ен-3,17-дион, 7a-аминофенилтиоандрост-4-ен-3,17-дион и 7a-аминофенилтиоандрост-1,4-диен-3,17-дион.
[0057] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП содержит следующую структуру P-F4:
F4=O (структура P-F4)
включая стереоизомеры и соли указанных соединений.
[0058] В настоящем описании термин «F4» или «F4» включает структуру, выбранную из группы, состоящей из структуры F4-1, структуры F4-2, структуры F4-3, структуры F4-4, структуры F4-5, структуры F4-6, структуры F4-7, структуры F4-8, структуры F4-9, структуры F4-10, структуры F4-11, структуры F4-12, структуры F4-13, структуры F4-14, структуры F4-15, структуры F4-16, структуры F4-17 и структуры F4-18 (фиг.4), включая стереоизомеры и соли указанных соединений.
[0059] Термин «нестероидное противовоспалительное средство» или «НПВС» хорошо известен в данной области техники и представляет собой нестероидное средство, применяемое для лечения состояний, связанных с воспалением. НПВС обладает противовоспалительным действием, а некоторые примеры НПВС также обладают анальгетическим и/или антипиретическим действиями. Примеры НПВС включают, без ограничения, ацетилсалициловую кислоту (аспирин), 5-(2,4-дифторфенил)салициловую кислоту (дифлунизал), салицилсалициловую кислоту (салсалат), салициловую кислоту, N-ацетил-пара-аминофенол (ацетаминофен) 2-(пара-изобутилфенил)пропионовую кислоту (ибупрофен), 2-(3-бензоилфенил) пропионовую кислоту (кетопрофен), 2-(3-феноксифенил)пропионовую кислоту (фенопрофен), 2-(6-метокси-2-нафтил)пропионовую кислоту (напроксен), α-метил-4-(2-тиенилкарбонил)бензолуксусную кислоту (супрофен), α-метил-(пара-хлорбензоил)-5-метокси-2-метилиндол-3-уксусную кислоту, 2-(2-фтор-4-бифенилил)пропионовую кислоту (флурбипрофен), 6-хлор-α-метил-9H-карбазол-2-уксусную кислоту (карпрофен), α-метил-5H-[1]бензопирано[2,3-b]пиридин-7-уксусную кислоту (пранопрофен), 2-(4-хлорфенил)-α-метил-5-бензоксазолуксусную кислоту (беноксапрофен), α-метил-4-[(2-метил-2-пропенил)амино]бензолуксусную кислоту (алминопрофен), 5-бензоил-α-метил-2-тиофенуксусную кислоту (тиапрофеновую кислоту), 3-хлор-4-(2,5-дигидро-1H-пиррол-1-ил)-α-метилбензолуксусную кислоту (пирпрофен), 2-(10,11-дигидро-10-оксодибензо(b,f)тиепин-2-ил)пропионовую кислоту (залтопрофен), 2-(8-метил-10, 11-дигидро-11-оксодибенз(b,f)оксепин-2-ил)пропионовую кислоту (бермопрофен), 2-[4-(2-оксоциклопентилметил)фенил]пропионовую кислоту (локсопрофен), 4-(1,3-дигидро-1-оксо-2H-изоиндол-2-ил)-α-метилбензолуксусную кислоту (индопрофен), α,3-дихлор-4-циклогексилбензолуксусную кислоту (фенклорак), 2-арил и гетероарилпропионовые кислоты, 4,5-дифенил-2-оксазолпропионовую кислоту (оксапрозин), 3-(4-бифенилилкарбонил)пропионовую кислоту (фенбуфен), 5-(4-хлорфенил)-бета-гидрокси-2-фуранпропионовую кислоту (орпаноксин), 3-арил и гетероарилпропионовые кислоты, 5-бензоил-2,3-дигидро-1H-пирролизин-1-карбоновую кислоту (кеторолак), 6-хлор-5-циклогексил-2,3-дигидро-1H-инден-1-карбоновую кислоту (клиданак), 1-метил-5-(4-метилбензоил)-1H-пиррол-2-уксусную кислоту (толметин), 5-(4-хлорбензоил)-1,4-диметил-1H-пиррол-2-уксусную кислоту (зомепирак), 1,8-диэтил-1,3,4,9-тетрагидропирано-[3,4-b]индол-1-уксусную кислоту (этодолак), 2-амино-3-бензоилбензолуксусную кислоту (амфенак), 2-амино-3-(4-бромбензоил)бензолуксусную кислоту (бромофенак), 3-хлор-4-(2-пропенилокси)бензолуксусную кислоту (алклофенак), 2-(2,4-дихлорфенокси)бензолуксусную кислоту (фенклофенак), 1-(4-хлорбензоил-5-метокси-2-метил-1H-индол-3-уксусной кислоты карбоксиметиловый эфир (ацеметацин), 4-(4-хлорфенил)-2-фенил-5-тиазолуксусную кислоту (фентиазак), 1-(пара-хлорбензоил)-5-метокси-2-метилиндол-3-уксусную кислоту (индометацин), (Z)-5-фтор-2-метил-1-[(4-метилсульфинил)фенилметилен]-1H-инден-3-уксусную кислоту (сулиндак), 3-(4-хлорфенил)-1-фенил-1H-пиразол-4-уксусную кислоту (лоназолак), [(1-бензил-1H-индазол-3-ил)окси]уксусную кислоту (бендазак), 6-метокси-2-нафталин-2-уксусную кислоту (6МНУК), 2[(2,6-дихлорфенил)амино]бензолуксусную кислоту (диклофенак), 2-[(2,3-диметилфенил)амино]бензойную кислоту (мефенамовую кислоту), 2-[(2,6-дихлор-3-метилфенил)амино]бензойную кислоту (меклофенамовую кислоту), 2-[[(3-трифторметил)фенил]амино]бензойную кислоту (флуфенамовую кислоту), 2-[[3-(трифторметил)фенил]амино]-3-пиридинкарбоновую кислоту (нифлумовую кислоту), 2-[[2-метил-3-(трифторметил)фенил]амино]-3-пиридинкарбоновую кислоту (флуниксин), 4-гидрокси-2-метил-N-2-пиридинил-2H,1,2-бензотиазин-3-карбоксамида 1,1-диоксид (пироксикам), судоксикам, 6-хлор-4-гидрокси-2-метил-N-2-пиридинил-2H-тиено[2,3-e]-1,2-тиазин-3-карбоксамида 1,1-диоксид (лорноксикам), 4-гидрокси-2-метил-N-2-пиридинил-2H-тиено[2,3-e]-1,2-тиазин-3-карбоксамида 1,1-диоксид (теноксикам), этил 1-[2-метил-1,1-диоксо-3-(пиридин-2-илкарбамоил)бензо[e]тиазин-4-ил]оксиэтилкарбонат (ампироксикам), 8-хлор-(4-гидрокси-4-пиридин-2-иламино-метилиден)-3-метил-2,2-диоксо-2λ6,7-дитиа-3-азабицикло[4,3,0]нона-8,10-диен-5-он (ломоксикам), 4-гидрокси-2-метил-N-[5-метил-3-изоксолил-2H-1,2-бензотиазин-3-карбоксамида 1,1-диоксид] (изоксикам), цинноксикам и N-(2-тиазолил)-4-гидрокси-2-метил-2H,1,2-бензотиазин-3-карбоксамида 1,1-диоксид (мелоксикам).
[0060] Согласно некоторым из вариантов осуществления, функциональный элемент КИП НПВС содержит фрагмент, имеющий структуру, выбранную из группы, состоящей из структуры F-2, от структуры F-82 до структуры F-125 и от структуры F2-360 до структуры F2-403.
[0061] В настоящем описании простагландин или «аналог простагландина» представляет собой соединение, содержащее пятичленное кольцо и группу жирной кислоты, причем указанное пятичленное кольцо может являться частью полициклической структуры. Примеры простагландинов и аналогов простагландинов включают, без ограничения, PGA1, PGA2, PGA3, PGB1, PGB2, PGB3, PGD1, PGD2, PGD3, PGE1, PGE2, PGE3, PGF1α, PGF1β, PGF2α, PGF2β, PGF3α, PGG2, PGH1, PGH2, PGI2 (простациклин), PGI3, PGJ2, PGK1, PGK2, карбопрост, простален, мизопростол, гемепрост, сульпростон, флупростенол, клопростенол, биматопрост, {(Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[1E,3S]-3-гидрокси-5-фенил-1-пентенил]циклопентил}-5-N-этилгептенамид}, латанопрост (13,14-дигидро-17-фенил-18,19,20-тринор PGF2α изопропиловый сложный эфир), травопрост {(Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(1E,3R)-3-гидрокси-4-[(α,α,α-трифтор-мета-толил)окси]-1-бутенил]циклопентил]-5-гептеноат} и унопростон (13,14-дигидро-15-кето-20-этил простагландин F2α ).
[0062] Согласно некоторым из вариантов осуществления, функциональный элемент КИП простагландина содержит фрагмент, имеющий структуру, выбранную из группы, состоящей из структур от структуры F-132 до структуры F-151.
[0063] Иприты хорошо известны в данной области техники и применяются по отношению к различным состояниям. Примеры ипритов включают, без ограничения, азотистые иприты, нитробензил-иприты, фосфорамид-иприты, изофосфорамид-иприты и альдофосфамид.
[0064] Согласно некоторым из вариантов осуществления, функциональный элемент КИП представляет собой иприт или родственное иприту соединение, содержащее фрагмент, имеющий структуру, выбранную из группы, состоящей из структуры F-MA и структуры F-MB:
включая стереоизомеры и соли указанных соединений, где:


каждый Xm1 и Xm2 независимо выбран из группы, состоящей из Cl, Br, F, I и OSO2Rm4;
каждый Rm4 и Rm6 независимо выбран из группы, состоящей из замещенной и незамещенной алкильной, замещенной и незамещенной алкоксильной, замещенной и незамещенной перфторалкильной, замещенной и незамещенной галогеналкильной, замещенной и незамещенной арильной и замещенной и незамещенной гетероарильной групп;
каждый Xm3-Xm7 независимо выбран из группы, состоящей из NHCORm4, ORm4, SRm4, NHRm4, OCORm4, Rm4, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио, замещенного и незамещенного алкиламино, замещенного и незамещенного галогеналкила, H, F, Cl, Br, I, NO2, CN, CF3, NHCOCH3,OCH3, SCH3,NH2,NHCH3,OCOCH3, OCOC2H5,OC2H5,OC3H7,CH3, C2H5 и C3H7;
n представляет собой целое число;
Ym1 выбран из группы, состоящей из CH2, O, S и NH;
Ym2 и Ym3 каждый независимо выбраны из группы, состоящей из NHCORm4, H, OH, NHCOCH3, NHCOC2H5, Cl, F, Br и I, или вместе представляют собой =O;
Ym4выбран из группы, состоящей из Rm4, CH2, (CH2)n, O, S и NH;
Am выбран из группы, состоящей из α-аминокислот, β-аминокислот и аминокислотных остатков;
любые группы CH2 можно заменить на O, S или NH; и
если связь не присоединена к конкретному атому в арильном или гетероарильном кольце, указанную связь можно поместить в любое положение кольца.
[0065] Пептиды и аминокислоты хорошо известны в данной области техники и применяются по отношению к различным состояниям. В настоящем описании пептид обозначает соединение, образованное путем соединения нескольких аминокислот посредством амидных связей. Примеры пептидов включают, без ограничения, пептидные гормоны (например, гиротропин-высвобождающий гормон, тафцин (Thr-Lys-Pro-Arg), мет-энкефалин (Tyr-Gly-Gly-Phe-Met), окситоцин, ангиотензин, гастрин, соматостатин, динорфин, эндотелин, секретин, кальцитонин и инсулин), энтеростатины (например, Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR) и Ala-Pro-Gly-Pro-Arg (APGPR)), меланокортин II (цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg-Trp-Lys-OH), опиоидные пептиды (например, мет-энкефалин (H-Tyr-Gly-Gly-Phe-Met-OH), лей-энкефалин (H-Tyr-Gly-Gly-Phe-Leu-OH), H-Tyr-D-Ala-Gly-N-Me-Phe-Met(O)-OL и H-Tyr-D-Ala-Gly-Phe-Leu-OH), антимикробные пептиды (например, тахиплезины, гистатиновые пептиды и производные), пептиды, связывающие кальций, пептиды, стимулирующие компетенцию, пептидные вакцины и пептидомиметики (например, α-спиральные миметики и β-складчатые миметики).
[0066] Согласно некоторым из вариантов осуществления, функциональный элемент пептидной КИП содержит фрагмент, имеющий структуру, выбранную из группы, состоящей из структур от структуры F-79 до структуры F-81, структуры F2-418, структуры F2-419, от структуры F3-35 до структуры F3-40, как определено выше.
[0067] РНК, ДНК, нуклеозиды и нуклеотиды хорошо известны в данной области техники и применяются по отношению к различным состояниям. В настоящем описании РНК и ДНК обозначают соединения, образованные путем соединения нескольких нуклеотидов посредством ковалентных связей.
[0068] Согласно некоторым из вариантов осуществления, функциональный элемент КИП РНК или КИП ДНК содержит фрагмент, имеющий структуру, выбранную из группы, состоящей из структур от структуры F2-420 до структуры F2-427.
[0069] В настоящем описании бета-лактамные антибиотики обозначают соединения, содержащие бета-лактамное ядро. Примеры бета-лактамных антибиотиков включают, без ограничения, производные пенициллина, цефалоспорины, пенемы, монобактамы, карбапенемы, ингибиторы бета-лактамазы и комбинации указанных соединений. Примеры производных пенициллина включают, без ограничения, аминопенициллины (например, амоксициллин, ампициллин и эпициллин); карбоксипенициллины (например, карбенициллин, тикарциллин и темоциллин); уреидопенициллины (например, азлоциллин, пиперациллин и мезлоциллин); мециллинам, сульбенициллин, бензатинпенициллин, пенициллин G (бензилпенициллин), пенициллин V (феноксиметилпенициллин), пенициллин O (аллилмеркаптометилпенициллин), прокаинпенициллин, оксациллин, метициллин, нафциллин, клоксациллин, диклоксациллин, флуклоксациллин, пивампициллин, гетациллин, бекампициллин, метампициллин, талампициллин, ко-амоксиклав (амоксициллин плюс клавулановая кислота) и пиперациллин. Примеры цефалоспоринов включают, без ограничения, цефалексин, цефалотин, цефазолин, цефаклор, цефуроксим, цефамандол, цефотетан, цефокситин, цефоранид, цефтриаксон, цефотаксим, цефподоксим проксетил, цефтазидим, цефепим, цефоперазон, цефтизоксим, цефтиксим и цефпиром. Примеры пенемов включают, без ограничения, фаропенем. Примеры монобактамов включают, без ограничения, азтреонам и тигемонам. Примеры карбапенемов включают, без ограничения, биапенем, дорипенем, эртапенем, имипенем, меропенем и панипенем. Примеры ингибиторов бета-лактамазы включают, без ограничения, тазобактам ([2S-(2альфа,3бета,5альфа)]-3-метил-7-оксо-3-(1H-1,2,3-триазол-1-илметил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты 4,4-диоксида натриевая соль), сульбактам (2S,5R)-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты 4,4-диоксида натриевая соль) и клавулановую кислоту ((2R,5R,Z)-3-(2-гидроксиэтилиден)-7-оксо-4-окса-1-азабицикло[3.2.0]гептан-2-карбоновая кислота). Другие примеры антибиотиков включают, без ограничения, [(N-бензилоксикарбониламино)метил]фосфоновой кислоты моно-(4-нитрофенилового) эфира натриевую соль, [(N-бензилоксикарбониламино)метил]фосфоновой кислоты моно-(4-пиридинилового) эфира натриевую соль, сульфаниламид (4-аминобензолсульфонамид), сульфасалазин (6-оксо-3-(2-[4-(N-пиридин-2-илсульфамоил)фенил]гидразоно)циклогекса-1,4-диенкарбоновую кислоту), 1-циклопропил-6-фтор-4-оксо-7-пиперазин-1-илхинолин-3-карбоновую кислоту, налидиксовую кислоту (1-этил-7-метил-4-оксо-[1,8]нафтиридин-3-карбоновую кислоту).
[0070] Согласно некоторым из вариантов осуществления, функциональный элемент КИП бета-лактамного антибиотика содержит фрагмент, имеющий структуру, выбранную из группы, состоящей из структур со структуры F-184 по структуру F-211.
[0071] Согласно некоторым из вариантов осуществления, фрагмент исходного лекарственного средства или соединения, родственное исходному лекарственному средству, в КИП можно дополнительно превратить в липофильный фрагмент, как описано выше.
[0072] Согласно некоторым из вариантов осуществления, транспортный элемент КИП содержит протонируемую аминогруппу, которая способна содействовать переносу или пересечению КИП через один или более биологических барьеров (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 300 раз, > примерно в 500 раз, > примерно в 1000 раз, > примерно в 10000 раз быстрее, чем исходное лекарственное средство). Согласно некоторым из вариантов осуществления, протонирование протонируемой аминогруппы по существу происходит при pH, при котором КИП проникает через один или более биологических барьеров. Согласно некоторым из вариантов осуществления, аминогруппа может быть обратимо протонируемой и депротонируемой. Согласно некоторым из вариантов осуществления, транспортный элемент может отщепляться или не отщепляться от функционального элемента после проникновения КИП через один или более биологических барьеров.
[0073] Согласно некоторым из вариантов осуществления, протонируемая аминогруппа выбрана из группы, состоящей из замещенных и незамещенных первичных аминных групп, замещенных и незамещенных вторичных аминных групп, и замещенных и незамещенных третичных аминных групп.
[0074] Согласно некоторым из вариантов осуществления, аминогруппа выбрана из группы, состоящей из структуры T-1, структуры T-2, структуры T-3, структуры T-4, структуры T-5, структуры T-6, структуры T-7, структуры T-8, структуры T-9, структуры T-10, структуры T-11, структуры T-12, структуры T-13, структуры T-14, структуры T-15, структуры T-16, структуры T-17 и структуры T-18, показанных на фиг.7, включая стереоизомеры и соли указанных соединений.
[0075] Согласно некоторым из вариантов осуществления, линкер, ковалентно связывающий функциональный элемент и транспортный элемент КИП, содержит связь, способную расщепляться после проникновения КИП через один или более биологических барьеров. Способная к расщеплению связь содержит, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, сложную тиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связь.
[0076] Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства имеет следующую общую структуру L:

Структура L
включая стереоизомеры и соли указанных соединений, где:
T представляет собой транспортный элемент КИП. Например, T выбран из группы, состоящей из структуры T-1, структуры T-2, структуры T-3, структуры T-4, структуры T-5, структуры T-6, структуры T-7, структуры T-8, структуры T-9, структуры T-10, структуры T-11, структуры T-12, структуры T-13, структуры T-14, структуры T-15, структуры T-16, структуры T-17 и структуры T-18; и
Fg представляет собой функциональный элемент КИП исходного лекарственного средства. Примеры Fg включают структуры, выбранные из группы, состоящей из F1, F2, F-MA и F-MB.
[0077] Согласно некоторым из вариантов осуществления, КИП содержит структуру L, включая стереоизомеры и соли указанных соединений, где Fg представляет собой F1, а L1 и L4 отсутствуют.
[0078] Согласно некоторым из вариантов осуществления, КИП содержит структуру L, включая стереоизомеры и соли указанных соединений, где Fg представляет собой F2, а L1 отсутствует.
[0079] Согласно некоторым из вариантов осуществления, КИП содержит структуру L-3:
F3-L2-R (структура L-3)
включая стереоизомеры и соли указанных соединений.
[0080] Согласно некоторым из вариантов осуществления, функциональный элемент, содержащий карбонильную группу (например, кетон и альдегид), связан с транспортным элементом посредством иминной связи, оксимной связи или гидразоновой связи, с образованием КИП, имеющей следующую структуру L-4:

Структура L-4
включая стереоизомеры и соли указанных соединений, где:
L41 выбран из группы, состоящей из отсутствия заместителя, N, N-O, N-N(L3), N-S, N-O-CH2-O, N-S-CH2-O, N-L3, N-O-L3, N-N(L3)-L5 и L3; и
T такой, как определено в абзаце 0076.
[0081] Согласно некоторым из вариантов осуществления, КИП выбрана из группы, состоящей из структуры P-44, P2-428, структуры P2-429, структуры P2-430, структуры P2-431, структуры P2-432, структуры P-4-1, структуры P4-2, структуры P4-3, структуры P4-4, структуры P4-5, структуры P4-6, структуры P4-7, структуры P4-8, структуры P4-9, структуры P4-10, структуры P4-11, структуры P4-12, структуры P4-13, структуры P4-14, структуры P4-15, структуры P4-16, P4-17, структуры P4-18, структуры P4-19, структуры P4-20, структуры P4-21, структуры P4-22, структуры P4-23, структуры P4-24, структуры P4-25 и структуры P4-26, P4-27, структуры P4-28, структуры P4-29, структуры P4-30, структуры P4-31 и структуры P4-32, показанных на фиг.5, включая стереоизомеры и соли указанных соединений, где:
T такой, как определено в абзаце 0076; и
L41 такой, как определено в абзаце 0080.
[0082] Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП уже содержит как липофильную часть, так и первичную, вторичную или третичную аминогруппу, которая может быть протонируемой и депротонируемой при pH одного или нескольких биологических барьеров. Примеры исходных лекарственных средств, содержащих как липофильную часть, так и первичную, вторичную или третичную аминогруппу, включают, без ограничения, бета-блокаторы (например, пропранолол, атенолол, ацебутолол, бизопролол, эсмолол, надолол, пиндолол, соталол, сальметерол, тимолол), местные анестетики (прокаин, мепивакаин, хлорпрокаин, этидокаин), противотревожные/антипсихотические агенты (например, хлорпромазин, метотримепразин, трифлупромазин и тримепразин), противошизофренические агенты (например, перфеназин, прохлорперазин, рифлуоперазин) релаксанты скелетных мышц (например, циклобензаприн) и ингибиторы агрегации тромбоцитов (например, тиклопидин).
[0083] Согласно некоторым из вариантов осуществления, липофильная часть КИП исходного лекарственного средств, содержащего как липофильную часть, так и первичную, вторичную или третичную аминогруппу, получена путем превращения гидрофильной группы при помощи органического синтеза, как описано выше. Согласно некоторым из вариантов осуществления, КИП выбрана из группы, состоящей из структуры D5-1, структуры D5-2, структуры D5-3, структуры D5-4, структуры D5-5, структуры D5-6, структуры D5-7, структуры D5-8, структуры D5-9, структуры D5-10, структуры D5-11, структуры D5-12, структуры D5-13, структуры D5-14, структуры D5-15, структуры D5-16, структуры D5-17, структуры D5-18, структуры D5-19, структуры D5-20, структуры D5-21, структуры D5-22, структуры D5-23, структуры D5-24, структуры D5-25, структуры D5-26, структуры D5-27, структуры D5-28, структуры D5-29, структуры D5-30, структуры D5-31, структуры D5-32, структуры D5-33, структуры D5-34, структуры D5-35, структуры D5-36, структуры D5-37, структуры D5-38, структуры D5-39, структуры D5-40, структуры D5-41, структуры D5-42, структуры D5-43, структуры D5-44, структуры D5-45, структуры D5-46, структуры D5-47, структуры D5-48, структуры D5-49, структуры D5-50, структуры D5-51, структуры D5-52, структуры D5-53, структуры D5-54, структуры D5-55, структуры D5-56, структуры D5-57, структуры D5-58, структуры D5-59, структуры D5-60, структуры D5-61, структуры D5-62, структуры D5-63, структуры D5-64, структуры D5-65, структуры D5-66, структуры D5-67, структуры D5-68, структуры D5-69, структуры D5-70, структуры D5-71, структуры D5-72, структуры D5-73, структуры D5-74, структуры D5-75, структуры D5-76, структуры D5-77, структуры D5-78, структуры D5-79, структуры D5-80, структуры D5-81, структуры D5-82, структуры D5-83, структуры D5-84, структуры D5-85, структуры D5-86, структуры D5-87, структуры D5-88, структуры D5-89, структуры D5-90, структуры D5-91, структуры D5-92, структуры D5-93, структуры D5-94, структуры D5-95, структуры D5-96, структуры D5-97, структуры D5-98, структуры D5-99, структуры D5-100, структуры D5-101, структуры D5-102, структуры D5-103, структуры D5-104, структуры D5-105, структуры D5-106, структуры D5-107, структуры D5-108, структуры D5-109, структуры D5-110, структуры D5-111, структуры D5-112, структуры D5-113, структуры D5-114, структуры D5-115, структуры D5-116, структуры D5-117, структуры D5-118, структуры D5-119, структуры D5-120, структуры D5-121, структуры D5-122, структуры D5-123, структуры D5-124, структуры D5-125, структуры D5-126, структуры D5-127, структуры D5-128, структуры D5-129, структуры D5-130, структуры D5-131, структуры D5-132, структуры D5-133, структуры D5-134, структуры D5-135, структуры D5-136, структуры D5-137, структуры D5-138, структуры D5-139, структуры D5-140, структуры D5-141, структуры D5-142, структуры D5-143, структуры D5-144, структуры D5-145, структуры D5-146, структуры D5-147, структуры D5-148, структуры D5-149, структуры D5-150, структуры D5-151, структуры D5-152, структуры D5-153, структуры D5-154, структуры D5-155, структуры D5-156, структуры D5-157, структуры D5-158, структуры D5-159, структуры D5-160, структуры D5-161, структуры D5-162, структуры D5-163, структуры D5-164, структуры D5-165, структуры D5-166, структуры D5-167, структуры D5-168, структуры D5-169, структуры D5-170, структуры D5-171, структуры D5-172, структуры D5-173, структуры D5-174, структуры D5-175, структуры D5-176, структуры D5-177, структуры D5-178, структуры D5-179, структуры D5-180, структуры D5-181, структуры D5-182, структуры D5-183, структуры D5-184, структуры D5-185, структуры D5-186, структуры D5-187, структуры D5-188, структуры D5-189, структуры D5-190, структуры D5-191, структуры D5-192, структуры D5-193, структуры D5-194, структуры D5-195, структуры D5-196, структуры D5-197, структуры D5-198, структуры D51-199, структуры D5-200, структуры D5-201, структуры D5-202, структуры D5-203, структуры D5-204, структуры D5-205, структуры D5-206, структуры D5-207, структуры D5-208, структуры D5-209, структуры D5-210, структуры D5-211, структуры D5-212, структуры D5-213, структуры D5-214, структуры D5-215, структуры D5-216, структуры D5-217, структуры D5-218, структуры D5-219, структуры D5-220, структуры D5-221, структуры D5-222, структуры D5-223, структуры D5-224, структуры D5-225, структуры D5-226, структуры D5-227, структуры D5-228, структуры D5-229, структуры D5-230, структуры D5-231, структуры D5-232, структуры D5-233, структуры D5-234, структуры D5-235, структуры D5-236, структуры D5-237, структуры D5-238, структуры D5-239, структуры D5-240, структуры D5-241, структуры D5-242 и структуры D5-243, (фиг.6), включая стереоизомеры и соли указанных соединений.
[0084] Согласно некоторым из вариантов осуществления, соль КИП представляет собой фармацевтически приемлемую соль.
[0085] В настоящем описании термин «фармацевтически приемлемая соль» обозначает такие соли соединений согласно настоящему изобретению, которые безопасны при применении у субъекта. Фармацевтически приемлемые соли включают соли кислотных или основных групп, присутствующих в соединениях согласно настоящему изобретению. Фармацевтически приемлемые соли присоединения кислот включают, без ограничения, соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат и памоат (т.е. 1,11-метилен-бис-(2-гидрокси-3-нафтоат)). Некоторые соединения согласно настоящему изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли оснований включают, без ограничения, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Для обзора фармацевтически приемлемых солей смотрите BERGE ET AL., 66 J. PHARM. SCI. 1-19 (1977), включенный в настоящую заявку посредством ссылки.
[0086] В настоящем описании термин «фармацевтически приемлемая кислота» обозначает кислоты, способные образовывать соли с соединениями согласно настоящему изобретению, безопасные при применении у субъекта. Примеры фармацевтически приемлемых кислот включают, без ограничения, соляную кислоту, бромоводородную кислоту, йодоводородную кислоту, азотную кислоту, серную кислоту, фосфорную кислоту, фосфористую кислоту, фосфоновую кислоту, изоникотиновую кислоту, уксусную кислоту, молочную кислоту, салициловую кислоту, лимонную кислоту, винную кислоту, пантотеновую кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, гентизиновую кислоту, фумаровую кислоту, глюконовую кислоту, глюкуроновую кислоту, сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, пара-толуолсульфоновую кислоту и памовую кислоту.
[0087] В настоящем описании, если не указано иное, термин «алкил» обозначает разветвленную или линейную, насыщенную или ненасыщенную, одновалентную или многовалентную углеводородную группу, включая насыщенные алкильные группы, алкенильные группы и алкинильные группы. Примеры алкилов включают, без ограничения, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, этенил, пропенил, бутенил, изобутенил, пентенил, гексенил, гепетнил, октенил, ноненил, деценил, ундеценил, додеценил, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, ундецинил, додецинил, метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, трет-бутилен, пентилен, гексилен, гептилен, октилен, нонилен, децилен, ундецилен и додецилен. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 30 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 20 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 12 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 6 атомов углерода.
[0088] В настоящем описании, если не указано иное, термин «циклоалкил» обозначает алкил, содержащий, по меньшей мере, одно кольцо, и не содержащий ароматических колец. Согласно некоторым из вариантов осуществления, циклоалкил представляет собой насыщенные циклоалкильные группы. Согласно некоторым из вариантов осуществления, циклоалкильная группа содержит ненасыщенные связи. Примеры циклоалкила включают, без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. Согласно некоторым из вариантов осуществления, углеводородная цепь содержит от 1 до 30 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 20 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 12 атомов углерода. Согласно некоторым из вариантов осуществления, углеводородная группа содержит от 1 до 6 атомов углерода.
[0089] В настоящем описании, если не указано иное, термин «гетероциклоалкил» обозначает циклоалкил, в котором, по меньшей мере, один атом в кольце не является атомом углерода. Примеры атомов, не являющихся атомами углерода, включают, без ограничения, S, O и N.
[0090] В настоящем описании, если не указано иное, термин «алкоксил» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов кислорода. Примеры алкоксилов включают, без ограничения, -CH2-OH, -OCH3, -O-алкил, -алкил-OH, -алкил-O-алкил-, причем два алкила могут быть одинаковыми или различными.
[0091] В настоящем описании, если не указано иное, термин «галогеналкил» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов галогенов, причем атомы галогенов могут быть одинаковыми или различными. T-термин «галоген» обозначает фтор, хлор, бром или йод. Примеры галогеналкилов включают, без ограничения, -алкил-F, -алкил-Cl, -алкил-Br, -алкил-I, -алкил(F)-, -алкил(Cl)-, -алкил(Br)- и -алкил(I)-.
[0092] В настоящем описании, если не указано иное, термин «алкилтио» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов серы. Примеры тиоалкилов включают, без ограничения, -CH2-SH, -SCH3, -S-алкил, -алкил-SH, -алкил-S-алкил-, причем два алкила могут быть одинаковыми или различными.
[0093] В настоящем описании, если не указано иное, термин «алкиламино» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов азота. Примеры алкиламинов включают, без ограничения, -CH2-NH, -NCH3, -N(алкил)-алкил, -N-алкил, -алкил-NH2, -алкил-N-алкил и -алкил-N(алкил)-алкил, причем алкилы могут быть одинаковыми или различными.
[0094] В настоящем описании, если не указано иное, термин «алкилкарбонил» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий одну или более карбонильных групп. Примеры алкилкарбонильной группы включают, без ограничения, альдегидную группу (-R'-C(O)-H), кетонную группу (-R'-C(O)-R''), группу карбоновой кислоты (R'-COOH), сложноэфирную группу (-R''-COO-R'), карбоксамид, (-R'''-COO-N(R')R''), еноновую группу (-R''''-C(O)-C(R')=C(R'')R'''), ацилгалогенидную группу (-R'-C(O)-X) и группу ангидрида кислоты (-R''-C(O)-O-C(O)-R'), где R', R'', R''' и R'''' представляют собой одинаковые или различные алкилы, циклоалкилы или гетероциклоалкилы.
[0095] В настоящем описании, если не указано иное, термин «перфторалкил» обозначает алкил, циклоалкил или гетероциклоалкил, содержащий одну или более фторированных групп, включая, без ограничения, перфторметил, перфторэтил, перфторпропил.
[0096] В настоящем описании, если не указано иное, термин «арил» обозначает химическую структуру, содержащую одно или более ароматических колец. Согласно некоторым из вариантов осуществления, все атомы в кольце представляют собой атомы углерода. Согласно некоторым из вариантов осуществления, один или более атомов в кольце не являются атомами углерода, например, атомами кислорода, азота или серы («гетероарил»). Примеры арила включают, без ограничения, фенил, бензил, нафтил, антраценил, пиридил, хинолил, изохинолил, пиразинил, хиноксалил, акридинил, пиримидил, хиназолил, пиридазинил, циннолил, имидазолил, бензимидазолил, пуринил, индолил, фуранил, бензофуранил, изобензофуранил, пирролил, индолил, изоиндолил, тиофенил, бензотиофенил, пиразолил, индазолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, тиаксолил, гуанидино и бензотиазолил.
Примеры КИП аспирина и родственных соединений
[0097] Согласно некоторым из вариантов осуществления, КИП имеет следующую структуру P-НПВС-1 или структуру P-НПВС-2:
включая стереоизомеры и соли указанных соединений.
[0098] Согласно некоторым из вариантов осуществления, КИП имеет структуру P-НПВС-1 или структуру P-НПВС-2, включая стереоизомеры и соли указанных соединений:
Za выбран из группы, состоящей из O, S, NORa5 и NRa5;
Xa выбран из группы, состоящей из отсутствия заместителя, O, P(O)ORa1, NH, NRa1 и S;
Ra выбран из группы, состоящей из отсутствия заместителя, алкильного, циклоалкильного, алкоксильного, циклоалкоксильного, алкенильного, циклоалкенильного, перфторалкильного, циклоперфторалкильного, галогеналкильного, циклогалогеналкильного, алкинильного, циклоалкинильного, арильного и гетероарильного фрагментов, в которых любой CH2 можно независимо заменить на O, S, CH=CH, C≡C, CHRa5, CRa5Ra6, арильный или гетероарильный фрагменты, и любые другие фармацевтически приемлемые фрагменты;
Ra1 и Ra2 независимо выбраны из группы, состоящей из H, алкильного, циклоалкильного, алкоксильного, циклоалкоксильного, алкенильного, циклоалкенильного, перфторалкильного, циклоперфторалкильного, галогеналкильного, циклогеналкильного, алкинильного, циклоалкинильного, арильного и гетероарильного фрагментов, в которых любой CH2 можно независимо заменить на O, S, CH=CH, C≡C, CHRa5, CRa5Ra6, арильный или гетероарильный фрагменты, и любые другие фармацевтически приемлемые фрагменты;
Ra5 и Ra6 независимо выбраны из группы, состоящей из H, OH, Cl, F, Br, I, алкильного, циклоалкильного, алкоксильного, циклоалкоксильного, алкенильного, циклоалкенильного, перфторалкильного, циклоперфторалкильного, галогеналкильного, циклогеналкильного, алкинильного, циклоалкинильного остатков, арильного и гетероарильного фрагментов;
Ra7 выбран из группы, состоящей из алкильного, циклоалкильного, алкоксильного, циклоалкоксильного, алкенильного, циклоалкенильного, перфторалкильного, циклоперфторалкильного, галогеналкильного, циклогеналкильного, алкинильного, циклоалкинильного остатков, несущих арильные или гетероарильные фрагменты;
T такой, как указано в абзаце 0076;
Xa1 выбран из группы, состоящей из O и следующих структур:


каждый Ya1, Ya2, Ya3, Ya4, Ya5, Ya6, Ya7 и Ya8независимо выбран из группы, состоящей из H, HO, CH3COO, R8COO, HS, NO2, CN, CH3COS, NH2, CH3CONH, R8CONH, CH3, CH3CH2, C3H7, C4H9, CH3O, CH3CH2O, C3H7O, Cl, F, Br, I, CH3S, CHF2O, CF3O, CF3CF2O, C3F7O, CF3, CF3CF2, C3F7, C4F9, CH3SO2, Ra8SO2, CH3SO, Ra8SO, CH3CO и CH3CH2CO;
Ra8 выбран из группы, состоящей из алкильного, циклоалкильного, алкоксильного, циклоалкоксильного, алкенильного, циклоалкенильного, перфторалкильного, циклоперфторалкильного, галогеналкильного, циклогеналкильного, алкинильного, циклоалкинильного остатков, несущих арильные или гетероарильные фрагменты.
[0099] Согласно некоторым из вариантов осуществления, КИП аспирина имеет следующую структуру P-НПВС-1-a:
Структура P-НПВС-1a
включая стереоизомеры и соли указанных соединений.
[0100] Согласно некоторым из вариантов осуществления, КИП имеет структуру P-НПВС-1a, включая стереоизомеры и соли указанных соединений, где:
Rt, Rt1 и Rt2 такие же, как R, R1 и R2 соответственно в абзаце 0049;
Rt7 представляет собой CH3, C2H5, C3H7 или другие низшие алкильные группы; и
X представляет собой O, S, NOR4 или NR4.
КИП ибупрофена и родственных соединений
[0101] Согласно некоторым из вариантов осуществления, КИП имеет следующую структуру P-НПВС-5

Структура P-НПВС-5
включая стереоизомеры и фармацевтически приемлемые соли указанных соединений.
[0102] Согласно некоторым из вариантов осуществления, КИП имеет структуру P-НПВС-5, включая стереоизомеры и фармацевтически приемлемые соли указанных соединений, где:
T такой, как указано в абзаце 0076;
Ya1, Ya2,Ya3и Ya4 такие, как указано в абзаце 98; и
Ya такой, как указано для Ya1, Ya2,Ya3и Ya4.
II. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КИП
[0103] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей, по меньшей мере, КИП. Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель.
[0104] Термин «фармацевтически приемлемый носитель» в настоящем описании обозначает фармацевтически приемлемый материал, композицию или среду, такую как жидкий или твердый наполнитель, разбавитель, формообразующее, растворитель или капсулирующий материал, участвующий в доставке или транспортировке КИП из одного местоположения, жидкости организма, ткани, органа (внутреннего или внешнего) или части тела, в другое местоположение, жидкость организма, ткань, орган или часть тела.
[0105] Каждый носитель является «фармацевтически приемлемым» с точки зрения совместимости с другими ингредиентами, например, КИП, состава, и подходит для применения в контакте с тканью или органом биологического субъекта без избыточной токсичности, раздражения, аллергической реакции, иммуногенности, или других проблем и осложнений, соразмерно с разумным соотношением риск/польза.
[0106] Некоторые примеры материалов, способных служить фармацевтически приемлемыми носителями, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и производные целлюлозы, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) формообразующие, такие как кокосовое масло и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) спирт, такой как этиловый спирт и пропиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах, такие как ацетон.
[0107] Фармацевтические композиции могут содержать приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как регуляторы pH и буферные агенты, агенты, регулирующие токсичность и тому подобное, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное.
[0108] Согласно некоторым из вариантов осуществления, фармацевтически приемлемый носитель представляет собой водный носитель, например, буферный солевой раствор и тому подобное. Согласно некоторым из вариантов осуществления, фармацевтически приемлемый носитель представляет собой полярный растворитель, например, ацетон и спирт.
[0109] Концентрацию КИП в указанных составах можно варьировать в широких пределах, и выбирать в первую очередь исходя из объемов жидкостей, вязкостей, массы тела субъекта и тому подобное, в соответствии с выбранным конкретным путем введения и потребностями биологического субъекта. Например, концентрация может составлять от 0,0001% до 100%, от 0,01% до 100%, от 0,1% до 100%, от 0,1% до 50%, от 1% до 50%, от 1% до 30%, от 1% до 20%, от 5% до 10%, от 6% до 8% масс.
[0110] Композиции согласно настоящему изобретению можно вводить для профилактического, терапевтического и/или гигиенического применения. Указанное введение можно осуществлять посредством топического, чресслизистого, например, перорального, назального, вагинального, ректального, парентерального трансдермального, подкожного, внутримышечного, внутривенного, ингаляционного, офтальмического и других обычных путей введения. Фармацевтические композиции можно вводить в виде разнообразных дозированных лекарственных форм, в зависимости от способа введения. Например, дозированные лекарственные формы, подходящие для перорального введения, включают порошок, таблетки, пилюли, капсулы и леденцы.
[0111] Соответственно, типичная фармацевтическая композиция для внутривенного введения может составлять примерно от 10-9 г примерно до 100 г, примерно от 10-6 г примерно до 100 г, примерно от 0,001 г примерно до 100 г, примерно от 0,01 г примерно до 10 г, или примерно от 0,01 г примерно до 1 г на субъекта в сутки. Можно применять дозировки примерно от 0,01 мг примерно до 5 г на субъекта в сутки. Современные способы получения композиций, подходящих для парентерального введения, хорошо известны или понятны опытному специалисту в данной области техники и более подробно описаны в таких публикациях, как Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pa. (1980).
III. ПРИМЕНЕНИЯ КИП
[0112] i) Способы проникновения через биологический барьер
[0113] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению для проникновения через один или более биологических барьеров у биологического субъекта. Указанный способ включает стадию введения биологическому субъекту КИП или фармацевтической композиции, содержащей КИП. Согласно одному из вариантов осуществления, КИП демонстрирует скорость проникновения через один или более биологических барьеров, более чем примерно в 10 раз или выше, более чем примерно в 50 раз или выше, более чем примерно в 100 раз или выше, более чем примерно в 200 раз или выше, более чем примерно в 300 раз или выше, более чем примерно в 500 раз или выше, более чем примерно в 1000 раз или выше, более чем примерно в 10000 раз или выше, чем исходное лекарственное средство.
[0114] Термин «биологический барьер» в настоящем описании относится к биологическому слою, разделяющему окружающую среду на две различных пространственных области или камеры, причем указанное разделение способно модулировать (например, сокращать, ограничивать, усиливать или не оказывать воздействия) прохождение сквозь, проникновение или перенос вещества или материи из одной камеры/области в другую. Различные пространственные области или камеры, упоминаемые в настоящем описании, могут иметь одинаковые или различные химические или биологические среды (среду). Упоминаемый в настоящем описании биологический слой включает, без ограничения, биологическую мембрану, слой клеток, биологическую структуру, внутреннюю поверхность субъектов, организмов, органов или полостей тела, внешнюю поверхность субъектов, организмов, органов или полостей тела, или любую комбинацию или множество указанных объектов.
[0115] Примеры биологической мембраны включают структуру липидного бислоя, мембрану эукариотических клеток, мембрану прокариотических клеток и внутриклеточную мембрану (например, мембрану ядра или органеллы, такой как мембрана или оболочка аппарата Гольджи, гладкий и шероховатый эндоплазматический ретикулум (ЭПР), рибосомы, вакуоли, везикулы, липосомы, митохондрии, лизосомы, ядро, хлоропласты, пластиды, пероксисомы или микротельца).
[0116] Упоминаемый в настоящем описании липидный бислой представляет собой двойной слой молекул из класса липидов, включая, без ограничения, фосфолипиды и холестерин. Согласно конкретному варианту осуществления, липиды бислоя представляют собой амфифильные молекулы, состоящие из полярных головных групп и неполярных жирнокислотных хвостов. Бислой состоит из двух слоев липидов, расположенных так, что их углеводородные хвосты направлены друг к другу, образуя маслянистое ядро, удерживаемое гидрофобным эффектом, тогда как их заряженные головы обращены к водным растворам по обе стороны мембраны. Согласно другому конкретному варианту осуществления, липидный бислой может содержать одну или более включенных молекул белка или сахара.
[0117] Примеры клеточного слоя включают выстилку из эукариотических клеток (например, эпителий, собственную пластинку и гладкую мышцу или мышечную пластинку слизистой (в желудочно-кишечном тракте)), выстилку из прокариотических клеток (например, поверхностный слой или S-слой, то есть двухмерный мономолекулярный слой, состоящий из идентичных белков или гликопротеинов, в частности, S-слой относится к части клеточной оболочки, обычно наблюдающейся у бактерий и архебактерий), биопленку (структурированное сообщество микроорганизмов, заключенных в выделяемую ими полимерную основу и прикрепленным к живой или инертной поверхности), слою растительных клеток (например, эпидермис). Клетки могут представлять собой нормальные клетки или патологические клетки (например, больные клетки, раковые клетки).
[0118] Примеры биологических структур включают структуры, закрытые герметичными или непроницаемыми границами, обеспечивающими барьер для проникновения токсинов, бактерий и вирусов, например, гематомолочный барьер, гематоликворный барьер, гематосиновиальный барьер и гематоэнцефалический барьер (ГЭБ). В частности, ГЭБ состоит из непроницаемого класса эндотелия, который представляет собой как физический барьер благодаря непроницаемой границе, объединяющей соседние эндотелиальные клетки, так и транспортный барьер, состоящий из эффлюксных насосов. Биологическая структура может также содержать смесь клеток, белков и сахаров (например, сгустки крови), например, миелиновая оболочка, представляющая собой слой, окружающий аксон нейрона, образованный диэлектрическим материалом - миелином.
[0119] Примеры внутренней поверхности субъектов, организмов, органов или полостей тела включают слизистую оболочку щеки, слизистую оболочку пищевода слизистую оболочку желудка, слизистую оболочку кишечника, слизистую оболочку носа, слизистую оболочку полости рта, слизистую оболочку бронхов, слизистую оболочку матки и эндометрий (слизистая оболочка матки, внутренний слой стенки пыльцевого зерна или внутренний слой стенки споры), или комбинацию или множество указанных объектов.
[0120] Примеры наружной поверхности субъектов, организмов, органов или полостей тела включают капилляры (например, капилляры в ткани сердца), слизистые мембраны, являющиеся продолжением кожи (например, такие как ноздри, губы, уши, область гениталий и анус), внешнюю поверхность органа (например, печени, легкого, желудка, головного мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, ободочной кишки, кишечника, вены, дыхательной системы, сосудов и анального отверстия), кожу, кутикулу (например, отмершие слои эпидермальных клеток или кератиноцитов, или поверхностный слой перекрывающихся клеток, покрывающий стержень волоса животного, многослойная структура снаружи эпидермиса у многих беспозвоночных, кутикулы растений или полимеры кутин и/или кутан), наружный слой стенки пыльцевого зерна или наружный слой стенки споры), или комбинацию или множество указанных объектов.
[0121] Кроме того, биологический барьер дополнительно содержит слой сахара, слой белка и/или любой другой биологический слой, или комбинацию или множество указанных объектов. Например, кожа представляет собой биологический барьер, имеющий множество биологических слоев. Кожа состоит из слоя эпидермиса (внешняя поверхность), слоя дермы и подкожного слоя. Слой эпидермиса содержит несколько слоев, включая слой базальных клеток, слой шиповатых клеток, слой зернистых клеток и роговой слой. Клетки эпидермиса называют кератиноцитами. Роговой слой (stratum corneum) представляет собой самый удаленный от центра слой эпидермиса, клетки в котором плоские и имеют форму чешуек («сквамозные»). Указанные клетки содержат много кератина и расположены в виде находящих друг на друга слоев, что придает поверхности кожи плотный жиростойкий и водостойкий характер.
[0122] ii) Способы диагностики состояний у биологического субъекта
[0123] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему описанию для диагностики состояния у биологического субъекта. Указанный способ включает следующие стадии:
1) введение биологическому субъекту композиции, содержащей КИП;
2) детектирование наличия, местонахождения или количества КИП, функционального элемента КИП или метаболита указанного соединения у биологического субъекта; и
3) определение состояния у биологического субъекта.
[0124] Согласно некоторым из вариантов осуществления, КИП (или агент, отщепляемый из КИП) накапливается в месте действия, в котором наблюдается состояние. Согласно некоторым из вариантов осуществления, также детектируют присутствие, местонахождение или количество функционального элемента КИП. Согласно некоторым из вариантов осуществления, также определяют наступление, развитие, прогресс или ремиссию связанного состояния (например, рака).
[0125] Согласно некоторым из вариантов осуществления, КИП помечена или конъюгирована с поддающимся обнаружению агентом. Как вариант, получают КИП, содержащую радиоизотопы для детектирования.
[0126] Доступны многочисленные детектируемые агенты, которые можно, в общем случае, разделить на следующие категории:
(a) Радиоизотопы, такие как35S,14C,13C,15N,125I,3H и131I. Диагностический агент можно пометить радиоизотопом при помощи методик, известных в данной области техники, и измерить радиоактивность при помощи сцинтилляционного счетчика; кроме того, диагностические агенты могут иметь спиновые метки для электронного парамагнитного резонанса на атомах углерода и азота.
(b) Флуоресцентные агенты, такие как BODIPY, аналоги BODIPY, редкоземельные хелаты (хелаты европия), флуоресцеин и его производные, ФИТЦ, 5,6-карбоксифлуоресцеин, родамин и его производные, дансил, лиссамин, фикоэритрин, зеленый флуоресцентный белок, желтый флуоресцентный белок, красный флуоресцентный белок и техасский красный. Флуоресценцию можно измерять количественно при помощи флуорометра.
(c) Различные агенты фермент-субстрат, такие как люциферазы (например, люцифераза светлячка и бактериальная люцифераза), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, такая как пероксидаза хрена (ПОХ), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклооксидазы (такие как уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза и тому подобное. Примеры комбинаций фермент-субстрат включают, например: (i) пероксидаза хрена (ПОХ) и пероксид водорода в качестве субстрата, причем пероксид водорода окисляет предшественник красителя (например, ортофенилендиамин (ОФД) или 3,3',5,5'-тетраметилбензидина гидрохлорид (ТМБ)); (ii) щелочная фосфатаза (ЩФ) и пара-нитрофенилфосфат в качестве хромогенного субстрата; и (iii) β-D-галактозидаза (β-D-Гал) с хромогенным субстратом (например, пара-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом 4-метилумбеллиферил-β-D-галактозидазой.
[0127] Согласно некоторым из вариантов осуществления, детектируемый агент не обязательно конъюгирован с диагностическим агентом, но способен распознавать присутствие диагностического агента, и диагностический агент можно детектировать.
[0128] Согласно некоторым из вариантов осуществления, КИП согласно настоящему изобретению можно изготовить в виде набора, например, упакованной комбинации реагентов в заранее определенных количествах, с инструкцией для проведения диагностического анализа. Если КИП помечена ферментом, набор будет включать субстраты и кофакторы, необходимые для фермента (например, субстрат-предшественник, обеспечивающий детектируемый хромофор или флуорофор). Кроме того, можно включить другие добавки, такие как стабилизаторы, буферные агенты (например, блокирующий буферный раствор или лизисный буферный раствор) и тому подобное. Относительные количества различных агентов можно широко варьировать для получения таких концентраций растворов реагентов, которые по существу оптимизируют чувствительность теста. В частности, реагенты можно обеспечить в виде сухих порошков, обычно лиофилизированных, включая формообразующие, которые при растворении будут обеспечивать раствор реагента, имеющий соответствующую концентрацию.
[0129] iii) Способы скрининга вещества с заданным свойством
[0130] Другой аспект настоящего изобретения относится к способу скрининга КИП с заданным свойством.
[0131] Согласно некоторым из вариантов осуществления, указанный способ включает:
1) ковалентное связывание исследуемого функционального элемента с транспортным элементом посредством линкера с образованием исследуемой композиции (или ковалентно связывая функциональный элемент с транспортным элементом посредством линкера, или ковалентно связывая функциональный элемент с транспортным элементом посредством исследуемого линкера);
2) введение исследуемой композиции биологическому субъекту; и
3) определение, имеет ли исследуемая композиция необходимую природу или свойство.
[0132] Согласно одному из вариантов осуществления, заданное свойство может включать, например, 1) способность исследуемого функционального элемента образовывать композицию интенсивного проникновения или превращаться обратно в исходное лекарственное средство, 2) проникающую способность и/или скорость исследуемой композиции, 3) эффективность или действенность исследуемой композиции, 4) транспортную способность исследуемого транспортного элемента, и 5) способность исследуемого линкера к расщеплению.
[0133] iv) Способы лечения состояния у биологического субъекта
[0134] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению для лечения состояния у биологического субъекта. Способ включает введение фармацевтической композиции биологическому субъекту.
[0135] Термин «лечащий» в настоящем описании обозначает излечивающий, облегчающий, подавляющий или предотвращающий. Термин «лечить» в настоящем описании обозначает излечивать, облегчать, подавлять или предотвращать. Термин «лечение» в настоящем описании обозначает излечение, облегчение, подавление или предотвращение.
[0136] Термин «биологический субъект» или «субъект» в настоящем описании обозначает орган, группу органов, работающих совместно для осуществления определенной задачи, организм или группу организмов. Термин «организм» в настоящем описании обозначает совокупность молекул, функционирующих как более или менее стабильное целое и имеющих свойства живого, такую как животное, растение, гриб или микроорганизм.
[0137] Термин «животное» в настоящем описании обозначает эукариотический организм, характеризующийся произвольным движением. Примеры животного включают, без ограничения, позвоночных (например, человек, млекопитающие, птицы, амфибии, рыбы, бесчелюстные и бесчерепные), оболочников (например, сальпы, аппендикулярии, сорберации и асцидии), членистых (например, насекомые, многоножки, мягконогие, паукообразные, пикногониды, меростомовые, ракообразные и кольчатые черви), gehyrea (anarthropoda) и гельминтов (например, коловратки).
[0138] Термин «растения» в настоящем описании обозначает организмы, относящиеся к царству Растения (Plantae). Примеры растений включают, без ограничения, семенные растения, мхи, папоротники и родственные папоротникам виды. Примеры семенных растений включают, без ограничения, саговники, гинкго, хвойные, гнетовидные, покрытосеменные. Примеры мхов включают, без ограничения, печеночники, роголистники и мхи. Примеры папоротников включают, без ограничения, ужовниковые (например, ужовники, лунники и гроздовники), мараттиевые и настоящие папоротники. Примеры родственных папоротникам видов включают, без ограничения, плауновидные (например, плауны, селагинелловые и полушниковые), псилотовые (например, ликоподиевые и псилотумы) и хвощевые (например, хвощи).
[0139] Термин «гриб» в настоящем описании обозначает эукариотический организм, принадлежащий к царству Грибы (Fungi). Примеры грибов включают, без ограничения, хитридиомицеты, бластокладиевые, неокаллимастиговые, зигомицеты, гломеромицеты, аскомицеты и базидиомицеты.
[0140] Термин «микроорганизм» в настоящем описании обозначает микроскопический (т.е. имеющий длину, измеряемую в микрометрах) организм. Примеры микроорганизмов включают, без ограничения, бактерии, грибы, архебактерии, простейшие и микроскопические растения (например, зеленые водоросли) и микроскопические животные (например, планктон, планарии и амебы).
[0141] Некоторые примеры состояний, которые можно лечить указанным способом, включают состояния, которые можно лечить при помощи исходных лекарственных средств КИП.
[0142] v) Способы применения КИП и фармацевтических композиций, содержащих КИП, для лечения
[0143] Другой аспект настоящего изобретения относится к способу применения КИП исходного лекарственного средства или фармацевтических композиций КИП, для лечения состояния у биологического субъекта или субъекта путем введения КИП исходного лекарственного средства или фармацевтических композиций КИП биологическому субъекту или субъекту. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП, применяемой в указанном способе, представляет собой НПВС. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП, применяемой в указанном способе, представляет собой простагландин. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП, применяемой в указанном способе, представляет собой иприт. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП, применяемой в указанном способе, представляет собой пептид. Согласно некоторым из вариантов осуществления, исходное лекарственное средство КИП, применяемой в указанном способе, представляет собой бета-лактам.
[0144] Состояния, которые можно лечить способом с применением КИП исходного лекарственного средства или фармацевтических композиций КИП, включают состояния, которые можно лечить при помощи исходного лекарственного средства или соединения, родственное исходному лекарственному средству. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства также имеет новые показания, обусловленные ее лучшей проникающей способность при пересечении биологического барьера (барьеров), которые исходное лекарственное средство пересекает с трудом.
[0145] Согласно некоторым из вариантов осуществления, состояния, поддающиеся лечению при помощи КИП исходного лекарственного средства или фармацевтических композиций КИП, включают лечение состояний в том месте, которое труднодостижимо для исходного лекарственного средства по причине его малой проникающей способности. Примеры указанных состояний включают, без ограничения, повреждения спинного мозга, миелиновые инфекции и родственные состояния (например, мышечные нарушения, такие как амиотрофический боковой склероз (АБС), окулофарингеальная мышечная дистрофия (ОФМД), миотоническая дистрофия (МД), мышечная дистрофия Дюшенна (МДД), полимиозит (ПМ), дерматомиозит (ДМ) и миозит с включенными тельцами (МВТ)). Согласно некоторым из вариантов осуществления, состояния, поддающиеся лечению КИП, включают аутоиммунные нарушения (например, псориаз, болезнь Крона, красная волчанка, дискоидная красная волчанка, системная красная волчанка, множественный склероз, фиброз (например, кистозный фиброз, фиброз печени, легочный фиброз, фиброз поджелудочной железы, фиброз селезенки, фиброз ЖКТ и фиброз других органов)), метаболические нарушения (например, диабет (типа II), аномальный уровень липидов в крови), состояния, связанные с тромбозом (например, инсульт), нейродегенеративное заболевание (например, болезнь Альцгеймера и болезнь Паркинсона), цирроз, воспаление печени, гипертиреоидизм, желчные камни, старение, нежелательные состояния кожи (например, витилиго, лучевой кератоз, аномальные сосудистые повреждения кожи, родимые пятна, бородавки (невусы), папилломы, старческие пятна (печеночные пятна), гнойные или красные прыщи, комедоны, папулы, пустулы, узелки, эпидермоидные кисты, волосяной кератоз, обвисшая кожа, морщины, «гусиные лапки», телесного цвета прыщи на коже, розацеа, кожа после лечения), макулярная дегенерация и возрастная макулярная дегенерация (ВМД), кашель, отторжение трансплантированного органа, рак и опухоли (например, рак желудка, множественная миелома, опухоль головного мозга, рак простаты и рак кости), седые и/или белые волосы, выпадение волос, облысение, недостаток волос или ресниц, беременность у женщины, имплантацию эмбриона, травму головного мозга и состояния у растений, связанные с заражением вирусами, грибами или насекомыми.
[0146] Примеры состояний, поддающихся лечению при помощи способа с применением КИП НПВС, включают:
1) метаболические нарушения, например, аномальный уровень липидов в крови, сахарный диабет (типа I и/или типа II) и диабетические осложнения, включая диабетическую ретинопатию, некробиотческие язвы и диабетическую протеинурию;
2) аномальное кровяное давление, например, гипертония и гипотония;
3) опухоли, например, доброкачественная опухоль, рак молочной железы, колоректальный рак, рак полости рта, рак легкого или другие виды рака дыхательной системы, разные виды рака кожи, рак матки, рак поджелудочной железы, рак простаты, рак гениталий, рак органов мочевыделения, лейкемия или другие виды рака крови и лимфатической ткани;
4) сердечнососудистые заболевания, например, инфаркт, нестабильная стенокардия, окклюзионное поражение периферических артерий и инсульт;
5) нейродегенеративное заболевание, например, болезнь Альцгеймера и болезнь Паркинсона;
6) состояние кожи, например, псориаз и псориатические нарушения, акне, кистозное акне, гнойные или красные прыщи, комедоны, папулы, пустулы, узелки, кисты кожи, волосяной кератоз, аномальные поражения сосудов кожи, родимые пятна, бородавки (невусы), папилломы, склеродермия, витилиго и родственные заболевания, или старческие пятна (печеночные пятна);
7) аутоиммунное заболевание, например, дискоидная красная волчанка, системная красная волчанка (СКВ), аутоиммунный гепатит, склеродермия, синдром Шегрена, ревматоидный артрит, полимиозит, тироидит Хасимото, юношеский сахарный диабет, болезнь Аддисона, витилиго, пернициозная анемия, гломерулонефрит, легочный фиброз, множественный склероз (МС) и болезнь Крона;
8) заболевания глаз, например, глаукома, повышенное внутриглазное давление, потеря зрения после хирургического вмешательства на глазах, зрение теплокровного животного, нарушенное в результате кистозного макулярного отека и катаракты;
9) боль;
10) повреждения;
11) состояния, связанные с воспалением, например, воспаление предстательной железы (простатит), простатоцистит, фиброзное увеличение простаты, геморроиды, синдром Кавасаки, гастроэнтерит, мембранопролиферативный гломерулонефрит типа I, синдром Барттера, хронический увеит. Анкилозирующий спондилит, гемофильная артропатия, воспаленные геморроиды, лучевой (искусственный) проктит, хронический язвенный колит, воспалительное заболевание кишечника, криптит, периодонтит, артрит, и воспалительное состояние в органе, выбранном из группы, состоящей из печени, легкого, желудка, головного мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, ободочной и прямой кишки, кишечника, вены, дыхательной системы, сосудов и анального отверстия;
12) лихорадка;
13) состояния, связанные с агрегацией тромбоцитов, например, тромбоэмболии после хирургического вмешательства, каротидная эндартереэктомия, рецидив стеноза после коронарной ангиопластики, тромбоэмболические осложнения хронической артериальной фибрилляции, закупорка аортокоронарного шунта, инфаркт, инсульт, мультиинфарктная деменция, деменция, тромбоз гемодиализного шунта и артериально-эмболические осложнения у пациентов с протезами клапанов сердца;
14) дисменорея;
15) аллергия;
16) астма;
17) поздний токсикоз у беременных из группы высокого риска;
18) маточное кровотечение, связанное с ВМС;
19) состояния, вызванные облучением, и
20) заболевания костей, такие как остеопороз, болезнь Пагета и метастазы в кости.
[0147] Согласно некоторым из вариантов осуществления, состояния, подающиеся лечению способом с применением КИП НПВС или фармацевтической композиции указанной КИП, дополнительно включают воспаления в участках биологического субъекта, труднодостижимых для НПВС, например, повреждение спинного мозга, миелиновые инфекции и родственные состояния (например, мышечные нарушения, такие как амиотрофический боковой склероз (АБС), окулофарингеальная мышечная дистрофия (ОФМД), миотоническая дистрофия (МД), мышечная дистрофия Дюшенна (МДД), полимиозит (ПМ), дерматомиозит (ДМ) и миозит с включенными тельцами (МВТ); седые волосы, белые волосы, выпадение волос и облысение; старение, и состояния у растений, связанные с заражением вирусами, грибами или насекомыми.
[0148] Согласно некоторым из вариантов осуществления, состояния, подающиеся лечению способом с применением КИП НПВС или фармацевтической композиции указанной КИП, включают, без ограничения, миелиновую инфекцию и родственные состояния, цирроз, воспаление печени, гипертиреоидизм, камни в желчном пузыре, старение, нежелательные состояния кожи (например, лучевой кератоз, аномальные поражения сосудов кожи, родимые пятна, бородавки (невусы), папилломы, старческие пятна (печеночные пятна), гнойные или красные прыщи, комедоны, папулы, пустулы, узелки, эпидермоидные кисты, волосяной кератоз, обвисшую кожу, морщины, «гусиные лапки», телесного цвета прыщи на коже, розацеа, состояние кожи после лечения), кашель, отторжение трансплантированного органа, рак и опухоли (например, рак простаты и рак кости) седые и/или белые волосы, выпадение волос и облысение, старение, и состояния у растений, связанные с заражением вирусами, грибами или насекомыми.
[0149] Примеры состояний, подающихся лечению способом с применением КИП простагландина, включают, без ограничения:
1) аномальные роды или репродукцию и человека или животного, например, включая родовой акт (родоразрешение) или аборт (например, PGE2 или PGF2, применяемый отдельно или совместно с мифепристоном, являющимся антагонистом прогестерона) и лечение задержки яиц у мелких птиц;
2) пептические язвы (PGE и аналоги);
3) тяжелый феномен Рейно или ишемия конечности (например, илопрост, цизапрост);
4) аномальное кровяное давление, например, гипертония, гипотония и легочная гипертония;
5) сердечно-сосудистое состояние или дисфункция, например, ингибирование агрегации тромбоцитов, закрытие незаращенного Боталлова протока у новорожденных с частичными цианотичными пороками сердца (PGE1), инфаркт, нестабильная стенокардия, окклюзионное заболевание периферических артерий и инсульт;
6) заболевание глаз, например, глаукома (например, в форме биматопроста офтальмического раствора, представляющего собой синтетический аналог простамида, обладающий действием понижать внутриглазное давление), повышенное внутриглазное давление, потеря зрения после хирургического вмешательства на глазах, нарушение зрения у теплокровного животного, вызванное кистозным макулярным отеком, и катаракта;
7) половые дисфункции, например, эректильная дисфункция, восстановление функции пениса после хирургического вмешательства (например, PGE1 в виде алпростадила) или половая дисфункция у женщин;
8) заболевания костей, например, остеопороз, болезнь Пагета и метастазы кости;
9) желудочно-кишечные состояния;
10) воспаление;
11) шок;
12) бесплодие;
13) стимуляция роста волос;
14) стимуляция роста ресниц.
[0150] Состояния, подающиеся лечению способом с применением КИП простагландина или фармацевтической композиции указанной КИП, дополнительно включают травму головного мозга, инсульт, поддержание имплантации эмбриона и ранней беременности, лечение дискоидной или системной красной волчанки и МС.
[0151] Примеры состояний, поддающихся лечению способом с применением КИП иприта или фармацевтической композиции указанной КИП, включают псориаз и опухоль, например, доброкачественную опухоль, опухоль головного мозга, рак молочной железы, колоректальный рак, рак желудка, рак полости рта, рак легкого или других органов дыхательной системы, рак кожи, рак матки, рак поджелудочной железы, рак простаты, рак гениталий, рак мочевыводящих органов, миелома, лейкемия или другие виды рака крови и лимфатических тканей.
[0152] Пептиды и аминокислоты играют важную роль во всей живой материи. Аминокислотами и пептидами можно лечить любые состояния. Примеры состояний, поддающихся лечению способом с применением КИП пептида или фармацевтической композиции указанной КИП, включают, без ограничения, ожирение, боль и половые дисфункции у мужчин и женщин.
[0153] Состояния, подающиеся лечению способом с применением КИП пептида или фармацевтической композиции указанной КИП, дополнительно включают болезнь Альцгеймера.
[0154] РНК, ДНК, нуклеозиды и нуклеотиды играют огромное множество ролей во всей живой материи. Примеры состояний, подающихся лечению способом с применением КИП РНК, ДНК, нуклеозида или нуклеотида, или фармацевтической композиции указанной КИП, включают, без ограничения, рак, опухоли, гипертонию, ожирение, генетические заболевания или нарушения, такие как ахондроплазия, хорея Гентингтона, нейрофиброматоз 1, синдром Марфана, наследственный неполипозный колоректальный рак и наследственные множественные экзостозы, врожденная аномалия кистозный фиброз, серповидноклеточная анемия, частичная серповидноклеточная анемия, болезнь Тея-Сакса, болезнь Ниманна-Пика, спинальная мышечная атрофия, синдром Ретта, синдром недержания пигмента типа 2, синдром Айкарди, синдром Клайнфельтера, гемофилия A, мышечная дистрофия Дюшенна, красно-зеленая цветовая слепота, мышечная дистрофия, андрогенная алопеция, мужское бесплодие и гипертрихоз ушной раковины, и наследственная оптическая нейропатия Лебера.
[0155] Примеры состояний, поддающихся лечению способом с применением КИП бета-лактама или фармацевтической композиции указанной КИП, включают, без ограничения, инфекции, связанные с микроорганизмами, и инфекции связанные с устойчивыми к бета-лактамам микроорганизмами, например, метициллин-резистентным золотистым стафилококком (МРЗС).
[0156] Примеры состояний, подающихся лечению способом с применением КИП стероида (например, прогестерона, дезогестрела, этинилэстрадиола, холестерина, адренокортикоидов и половых гормонов) или фармацевтической композиции указанной КИП, включают, без ограничения, ревматоидный артрит, рак молочной железы, рак простаты и другие виды рака, гипоадренализм, удаленные надпочечники, удаленный гипофиз, ревматоидные заболевания, аллергические проявления, бурсит, спонтанную гипогликемию, подагру, спру, аллергический язвенный колит, дерматомиозит, узелковый периартериит, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру, региональный илеит, женские контрацептивы и абортивные средства, антагонисты прогестина, контроль рождаемости, приобретенную гемолитическую анемию, нефроз, цирротический асцит, нейродермит, псориаз, пневмонию, перитонит, тифоидную лихорадку и менингококкемию.
[0157] Примеры состояний, подающихся лечению способом с применением КИП глиборнурида или фармацевтической композиции указанной КИП, включают, без ограничения, диабет (типа I и II) и связанные с диабетом состояния.
[0158] Примеры состояний, подающихся лечению способом с применением КИП атенолола или фармацевтической композиции указанной КИП, включают, без ограничения, гипертонию и связанные с ней состояния.
[0159] Согласно некоторым из вариантов осуществления, способ лечения состояния у субъекта с использованием КИП включает введение субъекту терапевтически эффективного количества КИП или фармацевтической композиции, содержащей КИП.
[0160] КИП или фармацевтическую композицию, содержащую КИП, можно вводить биологическому субъекту при помощи любого известного в данной области техники пути введения, включая, без ограничения, пероральное, энтеральное, трансбуккальное, назальное, топическое, ректальное, вагинальное, аэрозольное, чресслизистое, эпидермальное, трансдермальное, дермальное, офтальмическое, легочное, подкожное и/или парентеральное введение. Фармацевтические композиции можно вводить в виде разнообразных дозированных лекарственных форм, в зависимости от способа введения.
[0161] Парентеральное введение относится к пути введения, который обычно относится к инъекциям, включая, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, внутрисуставную, субарахноидальную, интраспинальную и/или интрастернальную инъекцию и/или инфузию.
[0162] КИП или фармацевтическую композицию, содержащую КИП, можно вводить субъекту в виде составов или препаратов, подходящих для каждого из путей введения. Составы, подходящие для способов согласно настоящему изобретению, включают одну или более КИП, один или более фармацевтически приемлемых носителей для указанных КИП, и, возможно, другие терапевтические ингредиенты. Составы может быть удобно получать в виде дозированных лекарственных форм, и можно готовить любыми известными в области фармацевтики способами. Количество активного ингредиента, которое можно комбинировать с материалом-носителем, для получения одной дозированной лекарственной формы, будет меняться в зависимости от субъекта, лечение которого проводят, и от конкретного пути введения. Количество КИП, которое можно комбинировать с материалом-носителем, для получения фармацевтически эффективной дозы, может в общем случае представлять собой такое количество КИП, которое оказывает терапевтическое действие. В общем случае, из расчета на сто процентов по массе, указанное количество КИП можно варьировать в диапазоне примерно от 0,0001 процента примерно до 100 процентов, примерно от 0,001 процента примерно до 99 процентов КИП, примерно от 0,001 процента примерно до 50 процентов, примерно от 0,01 процента примерно до 30 процентов, примерно от 0,1 процента примерно до 99,5 процентов, примерно от 0,1 процента примерно до 50 процентов, примерно от 0,1 процента примерно до 10 процентов, примерно от 1 процента примерно до 50 процентов, примерно от 1 процента примерно до 30 процентов, примерно от 1 процента примерно до 10 процентов, примерно от 10 процентов примерно до 70 процентов, примерно от 5 процентов примерно до 20 процентов, примерно от 5 процентов примерно до 10 процентов и примерно от 6 процентов примерно до 8 процентов.
[0163] Способы получения указанных составов или композиций включают стадию осуществления ассоциации КИП с одним или несколькими фармацевтически приемлемыми носителями и, возможно, с одним или несколькими вспомогательными ингредиентами. В общем случае, составы получают путем однородного и тщательного осуществления ассоциации КИП с жидкими носителями, или с мелкодисперсными твердыми носителями, или с обоими видами носителей, и, при необходимости, придания продукту формы.
[0164] Составы, подходящие для перорального введения, могут быть в форме капсул, саше, пилюль, таблеток, леденцов (на ароматизированной основе, обычно сахарозе с гуммиарабиком или трагакантом), порошков, гранул, или в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой суспензии типа масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (на инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик), и/или ополаскивателей для полости рта, и тому подобное, причем каждая из указанных форм содержит заранее заданное количество КИП в качестве активного ингредиента. Соединение можно также вводить в виде болюса, кашицы или пасты.
[0165] В твердых дозированных лекарственных формах для перорального введения (например, капсулах, таблетках, пилюлях, драже, порошках, гранулах и тому подобное) КИП смешана с одним или несколькими фармацевтически приемлемыми носителями, такими как цитрат натрия или фосфат дикальция. и/или любым из следующих: (1) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремнекислота; (2) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или гуммиарабик; (3) увлажнителями, такими как глицерин; (4) дезинтегрантами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, (5) агентами, замедляющими растворение, такими как парафин, (6) ускорителями всасывания, такими как четвертичные аммониевые соединения; (7) смачивающими агентами, такими как, например, цетиловый спирт и глицерилмоностеарат; (8) абсорбентами, такими как каолин и бентонитовая глина; (9) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смеси указанных веществ; и (10) красителями. Для капсул, таблеток и пилюль фармацевтические композиции могут также содержать буферные агенты. Твердые композиции аналогичного типа можно также выполнить в виде наполнителей в мягких и твердых желатиновых капсулах, с использованием таких разбавителей, как лактоза или молочные сахара, а также высокомолекулярных полиэтиленгликолей и тому подобного.
[0166] Таблетку можно изготовить путем прессования или отливки, возможно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получить с использованием связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, дезинтегранта (например, натрия крахмала гликолата или сшитой карбоксиметилцеллюлозы натрия), поверхностно-активного или диспергирующего агента. Отлитые таблетки можно изготовить путем отливки на подходящей машине смеси порошкообразного пептида или пептидомиметика, увлажненного инертным жидким разбавителем. Таблетки и другие твердые дозированные лекарственные формы, такие как драже, капсулы, пилюли и гранулы, можно, возможно, снабдить насечками или изготовить с покрытиями и оболочками, такими как растворимое в кишечнике покрытие и другие покрытия, хорошо известные в области фармацевтических составов. Их можно также изготовить так, чтобы обеспечить медленное или контролируемое высвобождение КИП, например, с использованием гидроксипропилметилцеллюлозы в различных соотношениях, с образованием выбранного профиля освобождения, других полимерных основ, липосом и/или микросфер. Их можно стерилизовать, например, фильтрованием через задерживающий бактерии фильтр, или путем включения в состав стерилизующих агентов в форме стерильных твердых композиций, способных растворяться в стерильной воде или какой-то другой стерильной среде для инъекций, непосредственно перед применением. Указанные композиции могут также содержать успокаивающие агенты, и могут представлять собой композиции, высвобождающие КИП исключительно, или преимущественно, в определенной части желудочно-кишечного тракта, возможно, отсроченно. Примеры вмещающих композиций, которые можно применять, включают полимерные вещества и воски. КИП также могут находиться в форме микрокапсул, при необходимости, с одним или несколькими описанными выше формообразующими.
[0167] Жидкие дозированные лекарственные формы для перорального применения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Кроме КИП, указанные жидкие дозированные лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, зародышей пшеницы, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана, и смеси указанных веществ. Кроме инертных разбавителей, композиции для перорального применения могут включать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусоароматические добавки, красители, парфюмы и консерванты.
[0168] Суспензии, помимо КИП, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленовые сложные эфиры сорбитола и сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант, и смеси указанных веществ.
[0169] Составы для ректального или вагинального введения могут быть представлены в виде суппозитория, который можно получить путем смешивания одной или нескольких КИП с одним или несколькими подходящими нераздражающими формообразующими или носителями, содержащими, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, твердыми при комнатной температуре, но жидкими при температуре тела, и следовательно, плавящимися в полости прямой кишки или влагалища и высвобождающими активный агент. Составы, подходящие для вагинального введения, также включают составы в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащие известные в данной области техники подходящие носители.
[0170] Составы для топического или трансдермального или эпидермального или дермального введения композиции КИП включат порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляционные составы. Активный компонент можно смешать в стерильных условиях с фармацевтически приемлемым носителем и с любыми консервантами, буферными агентами или пропеллентами, которые могут быть необходимы. Мази, пасты, кремы и гели могут содержать, кроме композиции КИП, формообразующие, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремнекислоту, тальк и оксид цинка, или смеси указанных веществ. Порошки и спреи могут содержать, кроме композиции КИП, формообразующие, такие как лактоза, тальк, кремнекислота, гидроксид алюминия, силикаты кальция и полиамидный порошок, или смеси указанных веществ. Спреи могут дополнительно содержать общеупотребительные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
[0171] Как вариант, КИП или фармацевтическую композицию КИП можно вводить посредством аэрозоля. Это можно осуществить путем приготовления водного аэрозоля, липосомного препарата или твердых частиц, содержащих КИП. Можно применять неводную (например, фторуглеродный пропеллент) суспензию. Также можно применять ультразвуковые небулайзеры. Водный аэрозоль готовят путем приготовления состава водного раствора или суспензии агента совместно с обычными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы меняют в зависимости от требований конкретного соединения, но обычно они включат неионогенные поверхностно-активные вещества (Твины, Плюроники или полиэтиленгликоль), безопасные белки, такие как сывороточный альбумин, сложные эфиры сорбитана, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферные вещества, соли, сахара или сахарные спирты. Аэрозоли в общем случае готовят на основе изотонических растворов.
[0172] Также для доставки композиций КИП в место нахождения опухоли можно применять трансдермальные пластыри. Указанные составы можно приготовить путем растворения или диспергирования агента в соответствующей среде. Также можно применять усилители абсорбции для увеличения поступления КИП сквозь кожу. Скорость указанного поступления можно контролировать либо предусматривая контролирующую скорость мембрану, либо диспергируя КИП в полимерной основе или геле.
[0173] Офтальмические составы, глазные мази, порошки, растворы и тому подобное, также включены в качестве составной части в объем настоящего изобретения.
[0174] Составы, подходящие для парентерального введения, содержат КИП в сочетании с одним или несколькими фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть восстановлены до стерильных растворов или дисперсий для инъекций непосредственно перед применением, которые могут содержать антиокислители буферные вещества, бактериостатические вещества, растворенные вещества, придающие составу изотоничность по отношению к крови предполагаемого реципиента, или суспендирующие или загущающие агенты.
[0175] Примеры подходящих водных или неводных носителей, которые можно применять в составах, подходящих для парентерального введения, включают воду, этанол, полиолы (например, такие как глицерин, пропиленгликоль, полиэтиленгликоль, и тому подобное) и подходящие смеси указанных веществ, растительные масла, такие как оливковое масло, и подходящие для инъекций органические сложные эфиры, такие как этилолеат. Необходимую текучесть можно обеспечить, например, за счет применения покрывающих материалов, таких как лецитин, обеспечением требуемого размера частиц в случае дисперсий, и за счет применения поверхностно-активных веществ.
[0176] Составы, подходящие для парентерального введения, могут также содержать вспомогательные вещества, такие как консерванты, увлажнители, эмульгаторы и диспергаторы. Предотвращение действия микроорганизмов можно гарантировать путем включения в состав различных антибактериальных и антигрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты, и тому подобное. Также может быть желательно включить в композиции изотонические агенты, такие как сахара, хлорид натрия и тому подобное. Кроме того, можно обеспечить пролонгированное всасывание фармацевтического препарата для инъекций путем включения агентов, замедляющих всасывание, таких как моностеарат алюминия и желатин.
[0177] Формы депо для инъекций также можно изготовить путем создания основы из микрокапсул для КИП или в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения КИП к полимеру и природы конкретного применяемого полимера можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Составы депо для инъекций также получают путем включения КИП в липосомы или микроэмульсии, совместимые с тканями организма.
[0178] Согласно некоторым из вариантов осуществления, КИП или фармацевтическую композицию КИП, доставляют в место заболевания или опухоли в терапевтически эффективной дозе. Как известно в области фармакологии, точное количество терапевтически эффективной дозы КИП, которая даст наиболее эффективные результаты с точки зрения эффективности лечения у конкретного пациента, будет зависеть, например, от активности, конкретной природы, фармакокинетики, фармакодинамики и биодоступности конкретной КИП, физиологического состояния субъекта (включая расу, возраст, пол, массу тела, питание, тип и стадию заболевания, общее состояние здоровья, чувствительность к данной дозировке и типу лекарственного средства), природы фармацевтически приемлемых носителей в составе, применяемых пути и частоты введения, и тяжести или предрасположенности заболевания, вызванного целевыми патогенными микроорганизмами. Однако вышеуказанные основные принципы можно применять как основу для корректировки лечения, например, определения оптимальной дозы введения, которая может требовать только обычных исследований, заключающихся в наблюдении за субъектом и подборе дозировки. Remington: The Science and Practice of Pharmacy (Gennaro ed. 20.sup.th edition, Williams & Wilkins PA, USA) (2000).
IV. ПРЕИМУЩЕСТВА
[0179] Согласно некоторым из вариантов осуществления, поскольку КИП согласно настоящему изобретению усиливает способность проникать через один или более биологических барьеров, КИП можно вводить местно (например, топически или трансдермально) для достижения места, в котором наблюдается состояние, без необходимости системного введения (т.е. перорального или парентерального введения). Местное введение и проникновение КИП позволяет КИП достигнуть того же уровня местной концентрации агента или лекарственного средства с гораздо меньшей дозировкой КИП по сравнению с системным введением исходного агента или лекарственного средства; как вариант, более высокого уровня местной концентрации, который не может быть получен при системном введении, или, если возможен, требует значительно более высокой концентрации при системном введении агента. Высокая местная концентрация КИП или ее исходного агента при отщеплении делает возможным лечение состояния более эффективно или гораздо быстрее, чем при системном введении исходного агента, и лечение новых состояний, невозможное или отсутствовавшее ранее. Местное введение КИП может позволить биологическому субъекту уменьшить потенциальный ущерб от системного введения, например, побочные действия, связанные с системным воздействием агента, желудочно-кишечные/почечные эффекты. Кроме того, местное введение может дать возможность КИП пересекать множество биологических барьеров и достигать системного уровня через, например, общий кровоток, и таким образом устраняет необходимость системного введения (например, инъекции) и позволяет избежать боли, связанной с парентеральной инъекцией.
[0180] Согласно некоторым из вариантов осуществления, КИП или фармацевтическую композицию согласно настоящему изобретению можно вводить системно (например, перорально или парентерально). КИП или активный агент (например, лекарственное средство или метаболит) КИП могут достигать общего кровотока с более высокой скоростью, чем исходный агент, и обеспечивать более быстрое поступление к месту действия состояния. Кроме того, КИП может пересекать биологический барьер (например, гематоэнцефалический барьер), через который не может проникнуть при введении исходного агента отдельно, и следовательно появляется возможность нового лечения состояний, невозможного или отсутствовавшего ранее.
[0181] Согласно некоторым из вариантов осуществления, КИП НПВС согласно настоящему изобретению демонстрируют высокую скорость проникновения через биологический барьер (например, > примерно в 20 раз, > примерно в 100 раз, > примерно в 200 раз, > примерно в 300 раз выше, чем отдельно НПВС) не наблюдалось желудочно-кишечного кровотечения у субъектов, перорально получавших КИП НПВС, тогда как у субъектов, принимавших исходное НПВС в аналогичной дозировке, наблюдалось желудочно-кишечное кровотечение.
[0182] Согласно некоторым из вариантов осуществления, КИП простагландина согласно настоящему изобретению демонстрируют высокую скорость проникновения через биологический барьер (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 200 раз, > примерно в 300 раз, > примерно в 500 раз, > примерно в 1000 раз, > примерно в 10000 раз или выше по сравнению со скоростью проникновения простагландина или аналога простагландина при введении отдельно). У субъектов, которым вводили КИП простагландина, не наблюдалось побочных эффектов, тогда как у субъектов, которым вводили в аналогичной дозировке исходный простагландин или родственное соединение или аналог указанного соединения, наблюдались побочные эффекты.
[0183] Согласно некоторым из вариантов осуществления, КИП ипритов согласно настоящему изобретению демонстрируют высокую скорость проникновения через биологический барьер (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 200 раз, > примерно в 300 раз выше, чем иприты или ипритоподобные соединения, вводимые отдельно). У субъектов, которым вводили КИП иприта, не наблюдалось серьезных побочных эффектов, тогда как у субъектов, которым вводили в аналогичной дозировке исходный иприт, наблюдались побочные эффекты (такие как тошнота, выпадение волос и повышенная восприимчивость к инфекциям).
[0184] Согласно некоторым из вариантов осуществления, КИП пептидов согласно настоящему изобретению демонстрируют высокую скорость проникновения через биологический барьер (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 200 раз, > примерно в 500 раз, > примерно в 1000 раз, > примерно в 10000 раз выше, чем при введении пептидов или пептидоподобных соединений в отдельности). У субъектов, принимавших КИП пептидов, не наблюдалось или наблюдалось мало побочных эффектов, тогда как у субъектов, принимавших исходные пептиды в аналогичной дозировке, наблюдались побочные эффекты (такие как тошнота и повышенная восприимчивость к инфекциям).
[0185] Согласно некоторым из вариантов осуществления, КИП бета-лактамных антибиотиков согласно настоящему изобретению демонстрируют высокую скорость проникновения через биологический барьер (например, > примерно в 10 раз, > примерно в 50 раз, > примерно в 100 раз, > примерно в 200 раз, > примерно в 300 раз, > примерно в 1000 раз выше, чем при введении исходного бета-лактамного антибиотика или связанного с бета-лактамным антибиотиком соединения в отдельности). У субъектов, принимавших КИП бета-лактамных антибиотиков, не наблюдалось или наблюдалось мало побочных эффектов, тогда как у субъектов, принимавших исходные бета-лактамные антибиотики в аналогичной дозировке, наблюдались побочные эффекты
[0186] Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в более низкой дозировке по сравнению с исходным лекарственным средством. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 50% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 25% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 10% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 5% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 2% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 1% или менее от применяемой дозировки исходного лекарственного средства. Согласно некоторым из вариантов осуществления, КИП исходного лекарственного средства терапевтически эффективна в дозировке примерно 0,1% или менее от применяемой дозировки исходного лекарственного средства.
V. ПРИМЕРЫ
[0187] Следующие примеры приведены с целью лучшей иллюстрации заявляемого изобретения и никоим образом не должны быть истолкованы как ограничивающие объем изобретения. Все конкретные композиции, материалы и способы, описанные ниже, полностью или частично, входят в объем изобретения. Указанные конкретные композиции, материалы и способы не предназначены ограничивать изобретение, но лишь иллюстрировать конкретные варианты осуществления, входящие в объем изобретения. Опытный специалист в данной области техники может разработать эквивалентные композиции, материалы и способы, не изменяя изобретательский замысел и не отклоняясь от объема изобретения. Следует понимать, что можно осуществить множество изменений в методиках, описанных в настоящей заявке, по-прежнему оставаясь в рамках изобретения. Намерением заявителей является включить указанные вариации в объем изобретения.
Пример 1. Получение КИП из исходного лекарственного средства
Получение КИП из исходного лекарственного средства, содержащего по меньшей мере одну карбоксильную группу
[0188] Согласно некоторым из вариантов осуществления, исходное соединение, имеющее структуру F1-OH, превращали в КИП, имеющую структуру L-1
F1-L2-T
Структура L-1
включая стереоизомеры и фармацевтически приемлемые соли указанного соединения, где T такой, как определено в абзаце 0076.
[0189] Согласно некоторым из вариантов осуществления, КИП, имеющую структуру L-1 (F1-L2-T), получали путем органического синтеза при взаимодействии исходных соединений или производных исходных соединений, имеющих структуру F1-Wa (например, галогенидов кислот, смешанных ангидридов исходных соединений, и т.д.), с соединением, имеющим структуру T-L2-H, как показано на схеме 1, где Wa выбран из группы, состоящей из OH, галогена, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси и арилоксикарбонилокси; а T такой, как определено в абзаце 0076:
T-L2-H+F1-Wa+основание→F1-L2-T+основание+HWa
Схема 1. Получение КИП из исходного соединения
[0190] Согласно некоторым из вариантов осуществления, КИП, имеющую структуру L-1, получали путем органического синтеза при взаимодействии соли исходного соединения или производного исходного соединения, имеющих структуру F-O- Ba+ (например, соли натрия, соли калия, соли триэтиламина или связанной с полимером соли органического или неорганического основания, и т.д.), с соединением, имеющим структуру T-L2-Wb·HWb, как показано на схеме 2, где Wb выбран из группы, состоящей из пара-толуолсульфонила, галогена, алкилкарбонила, арилкарбонила, алкоксикарбонила и арилоксикарбонилокси; а T такой, как определено в абзаце 0076:
F1-O-Ba++T-L2-Wb·HWb→F1-L2-T+HWb+BaWb
Схема 2. Получение КИП из исходного соединения
Получение N,N-диэтиламиноэтил 9-цис-ретиноата·HBr
[0191] 30 г (0,1 моль) 9-цис-ретиноата натрия растворяли в 100 мл ацетонитрила. Добавляли к реакционной смеси 26,1 г (0,1 моль) 2-бром-N,N-диэтилэтиламина·HBr. Перемешивали поученную смесь при комнатной температуре (КТ) в течение ночи. Выпаривали растворители. Добавляли к полученному остатку 200 мл этанола. Твердый остаток удаляли фильтрованием. Полученный раствор выпаривали досуха. Добавляли к реакционной смеси 100 мл этилацетата. Добавляли гексан (100 мл). Полученный твердый продукт собирали путем фильтрования. После высушивания получали 36 г целевого продукта (выход 75%). Гигроскопичный продукт; растворимость в воде: 30 мг/мл; элементный анализ: C26H42BrNO2; MW: 480,52; вычислено % C: 64,99; H: 8,81; Br: 16,63; N: 2,91; O: 6,66; найдено % C: 65,03; H: 8,80; Br: 16,60; N: 2,89; O: 6,68.
Получение КИП из исходного соединения, содержащего по меньшей мере одну гидроксильную группу или аминогруппу
[0192] Согласно некоторым из вариантов осуществления, исходное соединение, имеющее структуру F2-H, превращали в КИП, имеющую структуру L-2
F2-L4-L2-T
Структура L-2
включая стереоизомеры и фармацевтически приемлемые соли указанного соединения, где T такой, как определено в абзаце 0076.
[0193] Согласно некоторым из вариантов осуществления, КИП, имеющую структуру L-2 (F2-L4-L2-T), получали путем органического синтеза при взаимодействии исходного соединения, имеющего структуру F2-H (например, спирта или амина), с соединением, имеющим структуру T-L2-L4-Wc, как показано на схеме 3, где Wc выбран из группы, состоящей из OH, галогена, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси и арилоксикарбонилокси; а T такой, как определено в абзаце 0076:
T-L2-L4-Wc+F2-H+основание→F2-L4-L2-T+основание+HWc
Схема 3. Получение КИП из исходного соединения
Получение ретинил N,N-диметил-2-аминоацетата·HCl
[0194] 28,6 г (0,1 моль) ретинола растворяли в 300 мл ацетонитрила. Добавляли к реакционной смеси 25 мл триэтиламина. Добавляли к реакционной смеси 16 г N,N-диметиламиноацетилхлорида гидрохлорида. Полученную смесь перемешивали в течение 5 ч при КТ. Твердое вещество удаляли путем фильтрования. Полученный раствор выпаривали досуха. К остатку добавляли 500 мл этилацетата. К полученной смеси добавляли при перемешивании 200 мл 5% раствора карбоната натрия. Органический раствор собирали и промывали водой. После высушивания получали 31 г целевого продукта (выход 75,5%). Гигроскопичный продукт; элементный анализ: C H ClNO; MW: 408,02; вычислено % C: 70,65; H: 9,39; Cl: 8,69; N: 3,43; O: 7,84; найдено % Q70,60; H: 9,46; Cl: 8,71; N: 3,42; O: 7,81.
Получение КИП из исходного соединения, содержащего одновременно карбоксильную группу и аминогруппу
[0195] Согласно некоторым из вариантов осуществления, исходное соединение, имеющее структуру F3-OH, превращали в КИП, имеющую структуру L-3
F3-L2-R
Структура L-3
включая стереоизомеры и фармацевтически приемлемые соли указанного соединения.
[0196] Согласно некоторым из вариантов осуществления, КИП, имеющую структуру L-3 (F3-L2-R), получали путем органического синтеза при взаимодействии исходного соединения, имеющего структуру F3-Wd (например, галогениды кислот, смешанные ангидриды исходных соединений, и т.д.), с соединением, имеющим структуру R-L2-H (например, спирт или амин), как показано на схеме 4, где Wd выбран из группы, состоящей из OH, галогена, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси и арилоксикарбонилокси:
R-L2-H+F3-Wd+основание/кислота→F3-L2-R+основание/кислота+HWd
Схема 4. Получение КИП из исходного соединения
Получение изопропилового эфира 3-фтор-L-фенилаланина·HCl
[0197] 18,3 г (0,1 моль) 3-фтор-L-фенилаланина суспендировали в 150 мл изопропанола. Добавляли к полученной смеси 25 г моногидрата пара-толуолсульфоновой кислоты и 100 мл бензола. Полученную смеси кипятили с обратным холодильником до прекращения образования воды (может потребоваться больше свежего бензола и изопропанола). После охлаждения до КТ к реакционной смеси добавляли при перемешивании 500 мл этилацетата и 5% NaHCO3 (600 мл). Этилацетатный слой собирали и промывали 5% NaHCO3 (1×200 мл) и водой (3×100 мл). Полученный раствор высушивали над безводным Na2SO4, удаляли сульфат натрия путем фильтрования и промывали этилацетатом. Полученный раствор выпаривали досуха. К полученному остатку добавляли раствор газообразного HCl (4 г) в этилацетате (100 мл). Образовавшееся твердое вещество собирали путем фильтрования и промывали этилацетатом. После высушивания получали 23 г целевого продукта (выход 87,9%). Элементный анализ: C12H17ClFNO2; MW: 261,73; вычислено % C: 55,07; H: 6,55; Cl: 13,54; F: 7,26; N: 5,35; O: 12,23; найдено % C: 55,02; H: 6,57; Cl: 13,57; F: 7,24; N: 5,33; O: 12,27.
Получение КИП из исходного соединения, содержащего карбонильные группы, такие как кетон или альдегид
[0198] Согласно другому варианту осуществления, исходные лекарственные средства содержат карбонильные группы, такие как кетоны или альдегиды, и исходное лекарственное средство связано с транспортным элементом (T) посредством иминной связи, оксимной связи или гидразоновой связи.
[0199] Согласно некоторым из вариантов осуществления, исходное соединение, имеющее структуру F4=O, превращали в КИП, имеющую структуру L-4
F4=L41-T
Структура L-4
включая стереоизомеры и фармацевтически приемлемые соли указанного соединения, где:
L41 такой, как определено в абзаце 0041; а T такой, как определено в абзаце 0076;
[0200] Согласно некоторым из вариантов осуществления, КИП, имеющую структуру L-4 (F4=L41-T), получали путем органического синтеза при взаимодействии исходного соединения, имеющего структуру F4=O (например, альдегид или кетон), с соединением, имеющим структуру H2-L1-T, как показано на схеме 5, где T такой, как определено в абзаце 0076:
T-L1-H2+F4=O=F4=L1-T+H2O
Схема 5. Получение КИП из исходного соединения
Получение соли N-диэтиламиноэтил прогестеронимин.уксусная кислота
[0201] 11,7 г N,N-диэтилэтилендиамина, 8 г уксусной кислоты и 31,5 г прогестерона растворяли в 500 мл толуола. Полученную смесь кипятили с обратным холодильником для удаления воды. После удаления воды полученную смесь выпаривали досуха и получали 40 г соли N-диэтиламиноэтилпрогестеронимина и уксусной кислоты (выход 85%). C29H48N2O3. Элементный анализ: C29H48N2O3; MW: 472,71; вычислено % C: 73,68; H: 10,23; N: 5,93; O: 10,15; найдено % C: 73,62; H: 10,27; N: 5,91; O: 10,28.
Получение соли N-(N,N-диметиламинопропионоксил)прогестеронимин.уксусная кислота
[0202] 13,2 г соли N-(N’,N’-диметиламинопропионоксил)амин.уксусная кислота [(CH3)2NCH2CH2COONH2.CH3COOH] и 31,5 г прогестерона растворяли в 200 мл ацетонитрила. Добавляли к полученной смеси 100 г высушенных молекулярных сит. Полученную смесь перемешивали в течение ночи при КТ. Удаляли молекулярные сита и выпаривали полученный раствор досуха. Получали 42 г соли N-(N,N-диметиламинопропионоксил)прогестеронимин.уксусная кислота (выход 85,9%). Элементный анализ: C28H44N2O5; MW: 488,66; вычислено % C: 68,82; H: 9,07; N: 5,73; O: 16,37; найдено % C: 68,78; H: 9,09; N: 5,71; O: 16,42.
Получение соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенилпрогестеронимин·HCl
[0203] 25 г соли 4-аминобензоата N,N-диэтиламиноэтиловый эфир·HCl [4-(CH3CH2)2NCH2CH2OCOC6H4NH2·HCl] и 31,5 г прогестерона растворяли в 200 мл ацетонитрила. Добавляли к полученной смеси 100 г высушенных молекулярных сит. Полученную смесь перемешивали в течение ночи при КТ. Удаляли молекулярные сита и выпаривали полученный раствор досуха. Получали 48 г соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенилпрогестеронимин·HCl (84%); Элементный анализ: C34H49ClN2O3; MW: 569,22; вычислено % C: 71,74; H: 8,68; N: 4,92; O: 8,43; Cl: 6,23; найдено % C: 71,70; H: 8,70; N: 4,89; O: 8,46; Cl: 6,25.
Пример 2. КИП способны проникать через биологические барьеры
[0204] Скорости проникновения КИП через кожу человека измеряли in vitro в ячейках Франца. Ячейка Франца состоит из двух камер - верхней камеры образца и нижней камеры рецептора. Ткань кожи человека (толщиной 360-400 мкм), разделяющую верхнюю и рецепторную камеры, получали с передней или задней поверхности бедра.
[0205] Исследовали следующие соединения: соль диэтиламиноэтил-N-ацетил-3-(3,4-диацетилоксифенил-L-аланиновый эфир·HCl (A), соль диэтиламинопропил-N-ацетил-D-3,5,3’,5’-тетрайодтиронин·HCl (B), соль 1-пиперидинэтил-2-[4-(4-хлорбензоил)фенокси]-2-метилпропионат·HCl (C), соль 3-пиперидинметил-5-(2,5-диметилфенокси)-2,2-диметилпентаноат·HCl (D), соль диэтиламиноэтил-(S)-3-(бензоиламинометил)-5-метилгексаноат·HCl (E), соль N-ацетил-3-(3,4-диацетилокси-фенил-L-аланина натриевая (F), натриевая соль N-ацетил-D-3,5,3’,5’-тетрайодтиронина (G), натриевая соль 2-[4-(4-хлрбензоил)фенокси]-2-метил-пропионовой кислоты (H), натриевая соль 5-(2,5-диметилфенокси)-2,2-диметилпентановой кислоты (I), и натриевая соль (S)-3-(бензоиламинометил)-5-метилгексановой кислоты (J).
[0206] Применяли 10% раствор исследуемого соединения в воде. Количество КИП или исходного лекарственного средства КИП, проникающего через кожу, определяли методом высокоэффективной жидкостной хроматографии. Полученные результаты показаны на фиг.8, а кажущиеся величины потока КИП и соответствующих исходных лекарственных средств КИП приведены в таблице 2.
[0207] Полученные результаты позволяют предположить, что КИП диффундируют через кожу человека более чем в 400 раз быстрее, чем соответствующее исходное лекарственное средство.
Пример 3. Трансдермальные введения КИП, приводящие к распределению in vivo исходного лекарственного средства и родственных соединений
[0208] В настоящем примере применяли КИП ибупрофена, представляющую собой соль диэтиламиноэтил-2-(пара-изобутилфенил)пропионат·лимонная кислота. In vivo КИП быстро превращалась в исходное лекарственное средство КИП, так что концентрация соответствовала концентрации исходного лекарственного средства или родственного соединения.
3.1. Трансдермальные введения КИП ибупрофена, приводящие к распределению in vivo исходного лекарственного средства и родственных соединений у крыс
[0209] 0,3 ммоль/кг КИП ибупрофена (10% водный раствор) наносили на выбритую спину (10 см2) самцов крыс. В таблице 3 показано распределение ибупрофена и диэтиламиноэтил-2-(пара-изобутилфенил)пропионата·HCl (ибупрофенамина) в органах крыс через 2 часа после нанесения.
3.2 Трансдермальные введения КИП ибупрофена, приводящие к распределению исходного лекарственного средства и родственных соединений в органах кроликов.
[0210] 0,3 моль/кг КИП ибупрофена (10% водный раствор) наносили на выбритую спину (30 см2) самцов кроликов (2,5-3,0 кг). В таблице 3.2 показаны количества ибупрофена и ибупрофенамина в органах кроликов через 2 часа после введения.
[0211] Полученные результаты показывают, что КИП проникает через биологические барьеры, достигая простаты, хрящевых пластинок, яичек, миелина и других органов. Следовательно, КИП должна быть весьма полезна при лечении артрита, простатита и фиброзного увеличения простаты, и других состояний, таких как мышечные нарушения, связанные с воспалением миелина, у биологического субъекта.
Пример 4. КИП способна проникать через биологические барьеры, гематомолочный барьер, гематоэнцефалический барьер, гематоликворный барьер и гематосиновиальный барьер
[0212] In vivo КИП быстро превращалась в исходное лекарственное средство, так что концентрация соответствовала концентрации исходного лекарственного средства или родственного соединения.
4.1. Трансдермальные введения КИП ибупрофена, приводящие к распределению исходного лекарственного средства и родственных соединений в молоке овец
[0213] 0,3 ммоль/кг соли диэтиламиноэтил-2-(пара-изобутилфенил)пропионат·лимонная кислота (10% водный раствор) наносили на спину (100 см2) самок овец. Через 2 часа после нанесения в молоке было обнаружено 30±8 нмоль/мл ибупрофена и 5±3 нмоль/мл ибупрофенамина. Полученный результат показывает, что КИП, несомненно, может проникать через гематомолочный барьер.
4.2. Изучение проникновения через гематоэнцефалический барьер крыс КИП и исходного лекарственного средства КИП
[0214] 20 самцов крыс разделяли на 4 группы (n=5). Крысам вводили 0,5 ммоль/кг соли диэтиламиноэтил-ацетилсалицилат·HCl внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину, 10 см2) или 0,5 ммоль/кг аспирина внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину, 10 см2). Через 30, 60, 120, 240, 480 минут после введения исследуемого соединения крыс обезглавливали и промывали нормальным буферным раствором Кребса-Хенселейта (с гепарином натрия, pH 7,4) (10 мл/мин) для удаления крови. Ткань головного мозга немедленно гомогенизировали в 3-5 мл метанола при помощи измельчителя тканей при 30000 об/мин (примерно 2 мин). Полученную смесь центрифугировали в течение 5 мин при 16000 об/мин. Надклеточную жидкость (2 мл) собирали и выпаривали досуха. Полученный остаток разбавляли до соответствующих концентраций и определяли количества салициловой кислоты при помощи ЖХ-МС-МС. Полученные результаты показаны в таблице 4.2a. Полученные результаты показывают, что КИП аспирина очень эффективно проникает через гематоэнцефалический барьер, тогда как аспирин не проникает.
[0215] 20 самцов крыс разделяли на 4 группы (n=5). Крысам вводили 0,3 ммоль/кг соли диэтиламиноэтил-ацетилсалицилат·HCl внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину крыс, 10 см2) или 0,3 ммоль/кг аспирина внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину крыс, 10 см2). Через 1, 8 и 18 часов после введения исследуемого соединения крыс умерщвляли и отбирали 1 мл плазмы и головной мозг. Плазму или ткань головного мозга (цельный головной мозг промывали 3 раза буферным раствором с pH 7,4) немедленно гомогенизировали в 3-5 мл метанола при помощи измельчителя тканей при 30000 об/мин (примерно 2 мин). Количества салициловой кислоты в плазме и головном мозге определяли при помощи ЖХ-МС-МС. Полученные результаты показаны в таблице 4.2b. Через 1 час после введения аспирина большая часть аспирина оставалась в кровеносной системе. Однако КИП аспирина распределялась между другими тканями гораздо быстрее, чем аспирин. Кроме того, полученные результаты показывают, что КИП аспирина очень эффективно проникает через гематоэнцефалический барьер, тогда как аспирин не проникает.
[0216] Самцам крыс вводили 0,3 ммоль/кг соли диэтиламиноэтил 2-(пара-изобутилфенил)пропионат·HCl внутримышечно (20% в 70% этаноле) или трансдермально (на выбритую спину, 10% в 70% этаноле) и 0,3 ммоль/кг 2-(пара-изобутилфенил)пропионовой кислоты (ибупрофена) внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле). Через 1, 8 и 18 часов после введения исследуемого соединения крыс умерщвляли и отбирали 1 мл плазмы и головной мозг. Плазму или ткань головного мозга (цельный головной мозг промывали 3 раза буферным раствором с pH 7,4) немедленно гомогенизировали в 3-5 мл метанола при помощи измельчителя тканей при 30000 об/мин (примерно 2 мин). Количества ибупрофена в плазме и головном мозге определяли при помощи ЖХ-МС-МС. Полученные результаты показаны в таблице 4.2c. Через 1 час после введения ибупрофена большая часть ибупрофена оставалась в кровеносной системе. Однако КИП ибупрофена распределялась между другими тканями гораздо быстрее, чем ибупрофен. Кроме того, полученные результаты показывают, что КИП ибупрофена очень эффективно проникает через гематоэнцефалический барьер, тогда как ибупрофен не проникает.
4.3. КИП проникает через гематоликворный барьер крыс
[0217] 27 самцов крыс разделяли на 4 группы (n=7). Крысам вводили 0,3 ммоль/кг соли диэтиламиноэтил-ацетилсалицилат·HCl внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину крыс, 10 см2) или 0,3 ммоль/кг аспирина внутримышечно (20% в 70% этаноле) или трансдермально (10% в 70% этаноле, на выбритую спину крыс, 10 см2). Через 1, 8 и 18 часов после введения исследуемого соединения крыс умерщвляли и отбирали цереброспинальную жидкость (ЦСЖ). Определяли количества салициловой кислоты в ЦСЖ крыс. Полученные результаты показаны в таблице 4.3. Полученные результаты показывают, что КИП аспирина очень эффективно проникает через гематоликворный барьер, тогда как аспирин не проникает.
4.4. КИП проникает через гематосиновиальный барьер собак породы бигль
[0218] 12 самцов собак породы бигль разделяли на 4 группы (n=3). Собакам породы бигль вводили 0,3 ммоль/кг соли диэтиламиноэтил-2-(пара-изобутилфенил)пропионат·HCl внутримышечно (20% в 70% этаноле) или трансдермально (на спину собак, 100 см2, 10% в 70% этаноле) и 0,3 ммоль/кг 2-(пара-изобутилфенил)пропионовой кислоты (ибупрофена) внутримышечно (20% в 70% этаноле) или трансдермально (на спину собак, 100 см2, 10% в 70% этаноле). Через 1, 8 и 18 часов после введения исследуемого соединения отбирали синовиальную жидкость и определяли соответственно количества ибупрофена в СЖ собак породы бигль. Полученные результаты показаны в таблице 4.4a. полученные результаты показывают, что КИП ибупрофена очень эффективно проникает через гематосиновиальный барьер, тогда как ибупрофен не проникает.
[0219] Через 18 часов после введения ибупрофена или КИП ибупрофена собак породы бигль умерщвляли, отбирали ткань суставного хряща (цельный сустав промывали 3 раза буферным раствором с pH 7,4) и немедленно гомогенизировали в 3-5 мл метанола при помощи измельчителя тканей при 30000 об/мин (примерно 5 мин). Количества ибупрофена в суставном хряще собак породы бигль определяли при помощи ЖХ-МС-МС. Полученные результаты показаны в таблице 4.4b.
Пример 5. Флуоресцентные микроскопические исследования КИП, проникающей через кожу крыс, головной мозг и другие органы
[0220] Для флуоресцентных микроскопических исследований 30 мг 5-(диметиламино)нафталин-1-сульфоновой кислоты или соответствующей КИП, N-2-диэтиламиноэтил 5-диметиламино-1-нафталинсульфонамида·соли HCl растворяли в 0,5 мл 75% этанола и наносили на выбритую спину крыс (3×3 см). через 15 минут или 3 часа крыс умерщвляли, извлекали органы и замораживали. Готовили срезы замороженных тканей (головной мозг, печень и мышцы) и окрашивали при помощи гематоксилина и эозина (ГЭ). Полученные результаты показаны на рисунках 1-9 фиг.9.
[0221] Полученные результаты показывают, что всего через 15 минут после введения 30 мг N-2-диэтиламиноэтил 5-диметиламино-1-нафталинсульфонамида·соли HCl в 0,5 мл 75% этанола, большое количество флуоресцирующего химического вещества проникает в головной мозг, мышцы и печень, тогда как даже через 3 часа после нанесения на спину крыс 30 мг 5-(диметиламино)нафталин-1-сульфоновой кислоты в 0,5 мл 70% этанола флуоресцентное химическое вещество не проникает в головной мозг, мышцы и печень. КИП демонстрирует улучшенную способность проникновения через кожу, гематоэнцефалический барьер и другие биологические барьеры, по сравнению с исходным лекарственным средством.
Пример 6. Трансдермальные введения композиций, содержащих КИП, приводящие к распределению по всему организму КИП и родственных соединений в отсутствии общего кровотока
[0222] 0,3 ммоль/кг соли диэтиламиноэтил-ацетилсалицилат·HCl (10% в чистой воде) наносили на спину крыс (10 см2), умерщвленных при помощи CO2. Крыс встряхивали в течение 5 ч, после чего определяли КИП и исходные лекарственные средства в органах крыс. Полученные результаты (таблица 6) показывают, что КИП распределяется по всему организму биологического субъекта через межклеточную и внутриклеточную жидкости, и отсутствует необходимость в общем кровотоке.
Пример 7. Трансдермальные или пероральные введения КИП ибупрофена или аспирина показали более сильную антипиретическую активность, чем соответствующие им исходные лекарственные средства.
[0223] Результаты, приведенные в настоящем описании, показывают, что КИП, эффективно проникающая через кожу, также эффективно проникает через гематоэнцефалический, гематомолочный и другие биологические барьеры. Скорость проникновения лекарственных средств через мембрану возрастает в сотни раз, фармакологический эффект и клинический ответ лекарственных средств можно существенно увеличить, таким образом, значительно уменьшая необходимую дозировку лекарственных средств и побочные эффекты, и обеспечивая новые показания.
[0224] Исследование A: Крысам вводили стерилизованную суспензию E. coli в качестве пирогена. Через 2 часа вводили ибупрофен (100 мг/кг, перорально, группа B), соль диэтиламиноэтил-2-(пара-изобутилфенилпропионат·HCl (КИП ибупрофена, 100 мг/кг, перорально, группа C), ибупрофен (50 мг/кг, перорально, группа D), соль диэтиламиноэтил-2-(пара-изобутилфенилпропионат·HCl (50 мг/кг, перорально, группа E), ибупрофен (20 мг/кг, перорально, группа F), диэтиламиноэтил-2-(пара-изобутилфенилпропионат·соль HCl (20 мг/кг, перорально, группа G), ибупрофен (100 мг/кг, трансдермально, группа H), соль диэтиламиноэтил-2-(пара-изобутилфенилпропионат·HCl (100 мг/кг, трансдермально, группа I), ибупрофен (50 мг/кг, трансдермально, группа J), соль диэтиламиноэтил-2-(пара-изобутилфенилпропионат·HCl (50 мг/кг, трансдермально, группа K), ибупрофен (20 мг/кг, трансдермально, группа L) и соль диэтиламиноэтил-2-(пара-изобутилфенилпропионат·HCl (20 мг/кг, трансдермально, группа M). Группа A представляла собой контрольную группу. Измеряли температуру тела крыс через 90-минутные интервалы до и после введения исследуемых соединений. Полученные результаты показаны в таблице 7a.
[0225] Полученные результаты показывают, что КИП демонстрирует более сильную антипиретическую активность, чем соответствующее исходное лекарственное средство, ибупрофен. При пероральном введении 20 мг/кг КИП ибупрофена (эквивалентно 12 мг ибупрофена) оказывает почти такое же действие, что и 100 мг/кг ибупрофена. При трансдермальном введении ибупрофен не показал никакой антипиретической активности, поскольку ибупрофен не способен проникать через кожу, а КИП ибупрофена имеет даже более высокую антипиретическую активность при трансдермальном введении, чем при пероральном.
[0226] Исследование B: Крысам вводили стерилизованную суспензию E. coli в качестве пирогена. Через 2 часа вводили аспирин (100 мг/кг, перорально, группа B), соль диэтиламиноэтил-ацетилсалицилат·HCl (КИП аспирина, 100 мг/кг, перорально, группа C), аспирин (50 мг/кг, перорально, группа D), соль диэтиламиноэтил-ацетилсалицилат·HCl (50 мг/кг, перорально, группа E), аспирин (20 мг/кг, перорально, группа F), соль диэтиламиноэтил-ацетилсалицилат·HCl (20 мг/кг, перорально, группа G), аспирин (50 мг/кг, трансдермально, группа H), соль диэтиламиноэтил-ацетилсалицилат·HCl (50 мг/кг, трансдермально, группа I), аспирин (20 мг/кг, трансдермально, группа J), соль диэтиламиноэтил-ацетилсалицилат·HCl (20 мг/кг, трансдермально, группа K), аспирин (10 мг/кг, трансдермально, группа L) и соль диэтиламиноэтил-ацетилсалицилат·HCl (10 мг/кг, трансдермально, группа M). Группа A представляла собой контрольную группу. Измеряли температуру тела крыс через 90-минутные интервалы до и после введения исследуемых соединений. Полученные результаты показаны в таблице 7b.
[0227] При пероральном введении 20 мг/кг КИП аспирина (эквивалентно 11,4 мг аспирина) оказывает почти такое же действие, что и 100 мг/кг аспирина. При трансдермальном введении аспирин не показывает никакой антипиретической активности, поскольку аспирин не способен проникать через кожу, а КИП аспирина имеет даже более высокую антипиретическую активность при трансдермальном введении, чем при пероральном.
Пример 8. Трансдермальные или пероральные введения КИП ибупрофена показали более сильную противовоспалительную активность, чем соответствующие исходное лекарственное средство ибупрофен.
[0228] Водные растворы диэтиламиноэтил-2-(пара-изобутилфенил)пропионата·лимонной кислоты вводили трансдермально через подушечки лап крысам в группах C (2 мг/кг КИП), D (5 мг/кг КИП), E (10 мг/кг КИП) и F (20 мг/кг КИП) соответственно, и 100 мг/кг ибупрофена (группа B), 100 мг/кг (группа G) и 50 мг/кг (группа H) диэтиламиноэтил-2-(пара-изобутилфенил)пропионата·лимонной кислоты перорально. Через 1 час 0,05 мл раствора каррагинина вводили подкожно в подушечки лап крыс. Через 1 час водные растворы диэтиламиноэтил 2-(пара-изобутилфенил)пропионата·лимонной кислоты наносили трансдермально на подушечки лап крысам в группах C (2 мг/кг КИП), D (5 мг/кг КИП), E (10 мг/кг КИП) и F (20 мг/кг КИП) соответственно.
[0229] Объем задней лапы измеряли каждый час после введения каррагинина, вычисляли скорость увеличения объема лапы и обозначали ее как степень опухания лапы (%). Полученные результаты показаны на фиг.10.
[0230] Противовоспалительная активность 20 мг/кг (2×10 мг) диэтиламиноэтил 2-(пара-изобутилфенил)пропионата·лимонной кислоты (MW: 497,5, трансдермально) [эквивалентно ~8 мг/кг ибупрофена (MW: 206,2)] и 50 мг/кг диэтиламиноэтил 2-(пара-изобутилфенил)пропионата·лимонной кислоты (перорально) [эквивалентно ~20 мг/кг ибупрофена] была значительно сильнее, чем в случае 100 мг/кг ибупрофена (перорально). Аналогичные результаты были показаны в других моделях на животных.
[0231] Трансдермальное и пероральное введение композиций, содержащих КИП ибупрофена, показало противовоспалительную активность более чем в 5 раз сильнее, чем соответствующее исходное лекарственное средство, ибупрофен.
Пример 9. КИП аспирина показала более сильную противодиабетическую активность, чем аспирин
[0232] Исследования гипогликемического действия аспирина и КИП аспирина, диэтиламиноэтил ацетилсалицилата·соли HCl, проводили в модели на крысах диабета типа 2 [SLAC/GK(Goto and Kakisaki)]. 300 мг/кг, 200 мг/кг, 100 мг/кг и 50 мг/кг аспирина и соли диэтиламиноэтил-ацетилсалицилат·HCl (КИП) вводили крысам GK (n=5×8) перорально и 100 мг/кг, 50 мг/кг и 30 мг/кг (10% в 70% этаноле) аспирина и соли диэтиламиноэтилацетилсалицилат·HCl вводили трансдермально на спину (примерно 7 см2) крыс [(n=5×6) с выбритым мехом] один раз в день в течение 6 недель. Уровни глюкозы в крови измеряли трижды в неделю (без голодания) с третьей по шестую неделю. Полученные результаты показаны в таблице 9.
[0233] Полученные результаты показывают, что КИП аспирина имеет гораздо более сильное (более чем в 5 раз при пероральном введении) противодиабетическое действие, чем аспирин. При трансдермальном введении аспирин не демонстрирует никакого противодиабетического действия, поскольку аспирин не способен проникать через кожу, а КИП аспирина имеет даже более сильное противодиабетическое действие при трансдермальном введении, чем при пероральном.
Пример 10. Противодиабетическое (тип II) действие КИП НПВС
[0234] КИП согласно настоящему изобретению понижает уровни глюкозы в крови в моделях на крысах (SLAC/GK, диабет типа 2, n=7). 30 мг/кг 8% соли диэтиламинометил-ацетилсалицилата·HCl (P-1, в 25% этаноле); 4-ацетамидофенил-салицилилдиметиламинобутирата·HCl (P-6, в 25% этаноле), соли диэтиламиноэтил-5-(2,4-дифторфенил)-ацетилсалицилат·5-(2,4-дифторфенил)-ацетилсалициловая кислота (P-8, в 25% этаноле), соли диэтиламиноэтил-салицилсалицилата·HCl (P-9, в 25% этаноле), диэтиламиноэтил салицилата·AcOH (P-10, в 25% этаноле), соли диэтиламиноэтил-5-ацетамидосалицилат·HCl (P-58, в 25% этаноле), соли диэтиламиноэтил-ацетилсалицилсалицилат·HCl (P-59, в 25% этаноле), соли диэтиламиноэтил-ацетилсалицилсалицилсалицилат·HCl (P-60, в 25% этаноле) вводили трансдермально в спины (6 см2 с выбритым мехом) крыс GK (SLAC/GK, в возрасте 14-16 недель) и нормальных крыс SD (SLAC/SD, в возрасте 14-16 недель) один раз в день (в 8 утра) в течение 6 недель.
[0235] Уровни глюкозы в крови измеряли один раз в 3 дня в 4:30 вечера (без голодания), с третьей по шестую неделю, как показано в таблицах 10a и 10b. Полученные результаты показывают, что КИП НПВС эффективно понижают уровни глюкозы в крови у диабетических крыс и не влияют на уровни глюкозы в крови у нормальных крыс. Кроме того, уровни глюкозы у крыс остаются на нормальном уровне (6-9 ммоль/л, без голодания) в течение 40 дней после прекращения лечения. Это позволяет предположить, что КИП НПВС также могут излечивать диабет у крыс.
[0236] КИП согласно настоящему изобретению понижают уровни глюкозы в крови и уровни липидов в крови в моделях на мышах (SLAC/DB/DB, мыши с ожирением, n=7). 30 мг/кг 8% соли диэтиламинометил-ацетилсалицилат·HCl (P-1, в 25% этаноле); 4-ацетамидофенил-салицилилдиметиламинобутирата·HCl (P-6, в 25% этаноле), соли диэтиламиноэтил-5-(2,4-дифторфенил)ацетилсалицилат·5-(2,4-дифторфенил)ацетилсалициловой кислоты (P-8, в 25% этаноле), соли диэтиламиноэтил-салицилсалицилат·HCl (P-9, в 25% этаноле), диэтиламиноэтил-салицилат·AcOH (P-10, в 25% этаноле), соли диэтиламиноэтил-5-ацетамидосалицилат·HCl (P-58, в 25% этаноле), соли диэтиламиноэтил-ацетилсалицилсалицилат·HCl (P-59, в 25% этаноле), соли диэтиламиноэтил-ацетилсалицилсалицилсалицилат·HCl (P-60, в 25% этаноле) вводили трансдермально в спины (6 см2 с выбритым мехом) мышей DB/DB (SLAC/DB/DB, в возрасте 10-12 недель) один раз в день (в 8 утра) в течение 5 недель. Уровни глюкозы в крови измеряли один раз в неделю, а уровни липидов в крови измеряли один раз в две недели. Полученные результаты показаны в таблицах 10c, 10d, 10e и 10f.
[0237] Полученные результаты показывают, что КИП НПВС могут очень эффективно понижать уровень глюкозы в крови и уровни липидов в крови (общий холестерин и триглицериды) в модели на мышах с ожирением (SLAC/DB/DB).
Пример 11. Противодиабетическая (тип I) активность КИП НПВС
[0238] КИП показали сильную противодиабетическую (тип 1) активность в моделях на крысах (SLAC:NOD-IDDM, диабет типа 1, n=7). 10% водный раствор соли диэтиламиноэтил-ацетилсалицилат. ацетилсалициловая кислота (P-1, в ацетоне); 4-ацетамидофенил салицилилдиметиламинобутирата·HCl (P-6), соли диэтиламиноэтил-5-(2,4-дифторфенил) ацетилсалицилат·5-(2,4-дифторфенил) ацетилсалициловая кислота (P-8), диэтиламиноэтил-салицилсалицилата·AcOH (P-9), соли диэтиламиноэтил-5-ацетамидосалицилат·HCl (P-58), соли диэтиламиноэтил-2-(пара-изобутилфенил)пропионата·лимонная кислота (P-59), соли диэтиламиноэтил-ацетилсалицилсалицилат·ацетилсалицилсалицилсалициловая кислота (P-60) (эквивалентные 20 мг/кг НПВС) вводили трансдермально в выбритые спины (примерно 1,5 см2) мышей дважды в день (в 8 утра и 5 вечера) в течение 7 недель.
[0239] Уровни глюкозы в крови измеряли один раз в 3 дня в 4:30 вечера (без голодания), с четвертой по седьмую неделю, как показано в таблице 11. Полученные результаты показывают, что КИП НПВС эффективно понижают уровни глюкозы в крови в моделях на диабетических (тип I) мышах.
Пример 12. Лечение диабета (тип II)
[0240] Примерно 0,8 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения диабета (возможно, на протяжении всей жизни).
Пример 13. Предотвращение диабета (тип II)
[0241] Для людей с высоким риском развития диабета (тип II), таких как люди с избыточным весом, люди с диабетом (тип II) в семейном анамнезе, люди с мутациями в генах, связанных с диабетом (тип II), примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 14. Лечение диабета (тип I)
[0242] Примерно 0,8 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения диабета (возможно, на протяжении всей жизни).
Пример 15. Предотвращение диабета (тип I)
[0243] Для людей с высоким риском развития диабета (тип I), таких как люди, брат или сестра-близнец которых страдает диабетом (тип I), люди с диабетом (тип II) в семейном анамнезе, люди с мутациями в генах, связанных с диабетом (тип II), примерно 0,4 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 16. Лечение аномальных уровней липидов в крови (аномального уровня холестерина в крови и/или аномального уровня триглицеридов в крови)
[0244] Примерно 0,8 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения аномальных уровней липидов в крови (возможно, на протяжении всей жизни).
Пример 17. Предотвращение аномальных уровней липидов в крови (аномального уровня холестерина в крови и/или аномального уровня триглицеридов в крови)
Для людей с высоким риском развития диабета (тип I), таких как люди, брат или сестра-близнец которых страдает диабетом (тип I), люди с диабетом (тип II) в семейном анамнезе, люди с мутациями в генах, связанных с диабетом (тип II), примерно 0,4 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день
Пример 18. Антипсориатическая активность КИП НПВС
[0245] Не ограничиваясь конкретным механизмом, ЦОГ-1 и ЦОГ-2 играют весьма важную роль в иммунном ответе у животных. НПВС ингибируют ЦОГ-1 и ЦОГ-2. КИП НПВС могут быть весьма полезны для лечения псориаза, дискоидной красной волчанки, системной красной волчанки (СКВ) и других аутоиммунных заболеваний.
[0246] Густые суспензии дрожжей Malassezia [Rosenberg, E.W., et al., Mycopathologia, 72, 147-154 (1980)] наносили на выбритую кожу спины китайских белых кроликов (n=4×6) дважды (в 8 утра и в 5 вечера) в сутки в течение 2 недель для получения поражений, аналогичных псориазу. КИП (5% водн.) наносили на те же области через 3 часа (10 утра и 6 вечера) после нанесения Malassezia (7 утра и 3 вечера). Поражения лечили в течение 10 дней после нанесения одной из КИП, выбранной из группы, состоящей из 3-пиперидинметил-2-(пара-изобутилфенил)пропионата·HCl, диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетата·HCl, диэтиламиноэтил-5-(4-хлорбензоил)-1,4-диметил-1H-пиррол-2-ацетата·HCl, диэтиламиноэтил-1,8-диэтил-1,3,4,9-тетрагидропирано-[3,4-b]индол-1-ацетата·HCl, диэтиламиноэтил-2-амино-3-(4-бром-бензоил)бензолацетата·HCl, диэтиламиноэтил-3-хлор-4-(2-пропенилокси)бензолацетата·HCl, диэтиламиноэтил-1-(4-хлорбензоил-5-метокси-2-метил-1H-индол-3-ацетоксиацетата·HCl, диэтиламиноэтил-4-(4-хлорфенил)-2-фенил-5-тиазолацетата·HCl и диэтиламиноэтил-3-(4-хлорфенил)-1-фенил-1H-пиразол-4-ацетата·HCl
Пример 19. Лечение псориаза
[0247] Примерно 1,5 мл (в зависимости от области, пораженной псориазом) 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную псориазом кожу или вокруг пораженных псориазом областей дважды в день. Лечение продолжали до исчезновения псориаза (возможно, на протяжении всей жизни).
Пример 20. Лечение обыкновенных угрей и других заболеваний кожи
[0248] Примерно 1 мл (в зависимости от размера пораженной области) 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области обыкновенных угрей или области вокруг обыкновенных угрей дважды в день. Лечение продолжали до исчезновения обыкновенных угрей.
Пример 21. Предотвращение псориаза и/или других заболеваний кожи
[0249] Для людей с высоким риском развития псориаза и/или других заболеваний кожи, таких как люди, брат или сестра-близнец которых страдает псориазом и/или другими заболеваниями кожи, люди с псориазом и/или другими заболеваниями кожи в семейном анамнезе, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 22. Применение КИП НПВС для смягчения и сокращения шрамов у кроликов
[0250] 25 китайским белым кроликам надрезали выбритую спину для получения ран одинакового размера. Кроликов разделяли на две группы, одна группа получала лечение КИП, а другая группа представляла собой контрольную группу, не получавшую лечения. В группе, получавшей лечение, КИП (5% водн.) наносили на область вблизи ран (5×5 см2). Средняя площадь шрама у кроликов, получавших лечение, составляла одну треть по сравнению с кроликами, не получавшими лечения, и шрамы были такие же мягкие, как и ткани без шрамов.
[0251] Исследованными КИП были 3-пиперидинметил 2-(пара-изобутилфенил) пропионат·HCl, диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетат·HCl, диэтиламиноэтил-5-(4-хлорбензоил)-1,4-диметил-1H-пиррол-2-ацетат·HCl, диэтиламиноэтил-1,8-диэтил-1,3,4,9-тетрагидропирано-[3,4-b]индол-1-ацетат·HCl, диэтиламиноэтил-2-амино-3-(4-бромбензоил)бензолацетат·HCl, диэтиламиноэтил-3-хлор-4-(2-пропенилокси)бензолацетат·HCl, диэтиламиноэтил-1-(4-хлорбензоил-5-метокси-2-метил-1H-индол-3-ацетоксиацетат·HCl, диэтиламиноэтил-4-(4-хлорфенил)-2-фенил-5-тиазолацетат·HCl и диэтиламиноэтил-3-(4-хлорфенил)-1-фенил-1H-пиразол-4-ацетат·HCl.
Пример 23. Лечение ран (порезов, ожогов и других повреждений)
[0252] Примерно 0,7 мл (в зависимости от размера пораженной области) 5% диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетата·HCl в 25% этаноле наносили на кожу вокруг повреждения дважды в день. Лечение продолжали до исчезновения состояния.
Пример 24. Применение КИП для лечения повреждения спинного мозга
[0253] Большинство НПВС не способны проникать через рубцовый барьер в терапевтически эффективном количестве, но КИП согласно настоящему изобретению способны проникать через рубцовый барьер, обладают противовоспалительной активности и способны содействовать заживлению ран.
[0254] Крыс, первоначально парализованных при помощи анестезии хлоралгидратом, ударяли по позвоночнику, вызывая повреждения спинного мозга. На следующий день полностью парализованных крыс разделяли на две группы. В группе A (n=10), на область повреждения (~2×3 см2) наносили 0,2 мл чистой воды трансдермально дважды в день в течение 1 месяца. В группе B (n=10), на область повреждения (~2×3 см2) наносили 5 мг диэтиламинопропил-ацетилсалицилата·HCl в 0,2 мл чистой воды трансдермально дважды в день в течение 1 месяца. После лечения все крысы (10/10) в группе A все еще были полностью парализованы. В то же время все крысы (10/10) в группе B могли ходить. 4 крысы в группе B двигались совершенно нормально, а другие 6 крыс ходили медленнее и менее уверенно, чем до повреждения.
Пример 25. Лечение повреждения спинного мозга
[0255] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, лицо или другую часть кожи тела дважды в день. Процесс продолжали до излечения повреждения спинного мозга (возможно, на протяжении всей жизни).
Пример 26. Действие против красной волчанки соли диэтиламиноэтил-ацетилсалицилата и лимонной кислоты (КИП диэтиламиноэтил-ацетилсалицилата)
[0256] Воспаление - когда иммунная система организма атакует собственные клетки - связано с дискоидной красной волчанкой, системной красной волчанкой (СКВ), множественным склерозом (МС), псориазом и другими аутоиммунными заболеваниями.
[0257] КИП, диэтиламиноэтил-ацетилсалицилат·HCl (10%, водн., 30 мг/кг) наносили на кожу спины (~5 см2) мышей SLAC/MRL/LPR дважды в день (8:00 утра и 6:00 вечера). За развитием волчанки наблюдали один раз в неделю путем измерения гематурии, массы тела и выживаемости. Эксперименты проводили на двух группах мышей. Одну группу составляли мыши в возрасте 8 недель, не имевшие признаков СКВ (таблица 26a). Другую группу составляли мыши в возрасте 16 недель с признаками СКВ (таблица 26b).
[0258] Полученные результаты показывают, что диэтиламиноэтил ацетилсалицилат (КИП аспирина) полностью предохраняет мышей MRL/LPR от развития волчанки, если мыши получают лечение начиная с возраста 8 недель. Лечение КИП диэтиламиноэтил ацетилсалицилата вызывает обратное развитие волчанки у мышей MRL/LPR, если мыши получают лечение начиная с возраста 16 недель.
[0259] Полученные результаты позволяют предположить, что КИП НПВС являются перспективными средствами для лечения псориаза, дискоидной красной волчанки, системной красной волчанки (СКВ), множественного склероза (МС, вызываемого воспалением миелина, поскольку КИП НПВС согласно настоящему изобретению способны проникать за миелиновую мембрану) и других аутоиммунных заболеваний у человека.
Пример 27. Лечение дискоидной красной волчанки
[0260] Примерно 2 мл (в зависимости от размера пораженной области) 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу, пораженную дискоидной красной волчанкой или области вокруг поражений дискоидной красной волчанки дважды в день. Лечение продолжали до исчезновения дискоидной красной волчанки (возможно, на протяжении всей жизни)
Пример 28. Лечение системной красной волчанки
[0261] Примерно 1,5 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу вблизи пораженных органов или на кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояния (возможно, на протяжении всей жизни).
Пример 29. Предотвращение дискоидной или системной красной волчанки
[0262] Для людей с высоким риском развития дискоидной или системной красной волчанки, таких как люди, брат или сестра-близнец которых страдает дискоидной или системной красной волчанкой, люди с дискоидной или системной красной волчанкой в семейном анамнезе, люди с мутациями в генах, связанных с дискоидной или системной красной волчанкой, примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 30. Лечение множественного склероза (МС)
[0263] Примерно 0,7 мл 8% N,N-диэтиламиноэтил ацетилсалицилата·HCl в 25% этанола распыляли на кожу вблизи органов, пораженных множественным склерозом, или на кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояния (МС) (возможно, на протяжении всей жизни).
Пример 31. Предотвращение множественного склероза (МС)
[0264] Для людей с высоким риском развития множественного склероза, таких как люди, брат или сестра-близнец которых страдает множественным склерозом, люди с множественным склерозом в семейном анамнезе, люди с мутациями в генах, связанных с множественным склерозом, примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 32. Противоопухолевая активность КИП НПВС
[0265] Хорошо известна связь между воспалением и раком. Dr. Thea D. Tlsty описал в своем докладе (Keystone Symposia: Inflammation and Cancer, Breckenridge, Colorado, USA, Feb. 27-March 3, 2005), что циклооксигеназа-2 (ЦОГ-2) стимулирует активность ароматазы, ангиогенез, пролиферацию, инвазию и синтез простагландинов. Увеличение простагландинов ведет к ингибированию апоптоза. Аспирин и другие НПВС ингибируют ЦОГ-1 и ЦОГ-2. Общий относительный риск развития колоректального рака, рака пищевода, рака яичников или других видов кара, у людей, длительное время принимающих аспирин, снижен. Однако раковые клетки могут изменять структуру своих мембран, предотвращая проникновение НПВС в раковые клетки. Новые КИП согласно настоящему изобретению могут проникать через любые мембранные барьеры и могут применяться топически на внешнюю область кожи в месте расположения раковой опухоли, и в раковые клетки могут проникать большие количества КИП при очень малом системном воздействии.
A) клетки рака молочной железы человека
[0266] Проводили подкожную ксенотрансплантацию клеток рака молочной железы человека (BCAP-37, для каждой мыши применяли 2-3 мм3 опухолевой ткани) безтимусным мышам (BALB, 12 групп, по 7 мышей в каждой группе). Через 14 дней опухоли вырастали до размера 50±10 мм3 (0,05 мл). 50 мкл 5% (эквивалентно 2,5 мг КИП) диэтиламиноэтил ацетилсалицилата·HCl (P-1, в чистой воде); 1-пиперидинпропил 2-[(2,6-дихлорфенил)амино]бензолацетата·HCl (P-2, в воде), 1-пирролидинпропил 2-(3-бензоилфенил)пропионата·HCl (P-3, в воде), 4-пиперидинметил 2-(3-феноксифенил)пропионата·HCl (P-4, в воде), 3-пиперидинметил 2-(пара-изобутилфенил)пропионата·HCl (P-5, в воде), диэтиламиноэтил 1-(пара-хлорбензоил)-5-метокси-2-метилиндол-3-ацетата·HCl (P-11, в воде), 2-(4-морфолинил)этил (Z)-5-фтор-2-метил-1-[(4-метилсульфинил) фенилметилен]-1H-инден-3-ацетата·HCl (P-12, в воде), диэтиламиноэтил 2-(2,4-дихлорфенокси)бензолацетата·HCl (P-19, в воде), диэтиламиноэтил 2-(8-метил-10,11-дигидро-11-оксодибенз(b,f)оксепин-2-ил)пропионата·HCl (P-37, в воде), 1-пирролидинпропил 2-[[(3-(трифторметил)фенил)амино]бензоата·HCl (P-48, в воде), 4-N,N-диметиламинобутирилокси-2-метил-N-2-пиридинил-2H,1,2-бензотиазин-3-карбоксамида 1,1-диоксида·HCl (P-51, в воде) наносили топически на область имплантации клеток рака молочной железы человека (возле передней ноги) каждые 8 часов. Полученные в день 42 данные о размерах опухолей и массах, показанные в таблице 32a-1 и таблице 32a-2, показывают, что КИП являются эффективными противоопухолевыми агентами с малыми побочными эффектами, такими как потеря массы.
B) клетки рака толстой кишки человека
[0267] Проводили подкожную ксенотрансплантацию клеток рака толстой кишки человека (LS174J, 2 для каждой мыши применяли 2-3 мм3 опухолевой ткани) безтимусным мышам (BALB). Через 7 дней опухоли вырастали до размера 65±10 мм3 (0,065 мл). Примерно 50 мкл 5% (эквивалентно 1,5 мг КИП) соли диэтиламиноэтил ацетилсалицилата·HCl (P-1, в воде); 1-пиперидинпропил 2[(2,6-дихлорфенил)амино]бензолацетата·HCl (P-2, в воде), 1-пирролидинпропил 2-(3-бензоилфенил)пропионата·HCl (P-3, в воде), 4-пиперидинметил 2-(3-феноксифенил)пропионата·HCl (P-4, в воде), 3-пиперидинметил 2-(пара-изобутилфенил)пропионата·HCl (P-5, в воде), диэтиламиноэтил 1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетата·HCl (P-13, в воде), 2-(4-морфолинил)этил 2-амино-3-бензоилбензолацетата·HCl (P-16, в воде), диэтиламиноэтил 2-(10,11-дигидро-10-оксодибензо(b,f)тиепин-2-ил)пропионата·HCl (P-36), диэтиламиноэтил 2-[(2,3-диэтилфенил)амино]бензоата·HCl (P-46, в воде), диэтиламиноэтил 2-[(2,6-дихлор-3-метилфенил)амино]бензоата·HCl (P-47, в воде), N-(2-тиазолил)-4-N,N-диметиламинобутирилокси-2-метил-2H,1,2-бензотиазин-3-карбоксамида 1,1-диоксида·HCl (P-52, в воде) наносили топически на область имплантации клеток рака толстой кишки человека (возле передней ноги) каждые 12 часов. Полученные в день 30 данные о размерах опухолей и массах, показанные в таблице 32b-1 и таблице 32b-2, показывают, что КИП являются эффективными противоопухолевыми агентами с малыми побочными эффектами, такими как потеря массы.
Пример 33. Лечение рака молочной железы
[0268] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную раком молочную железу дважды в день. Процесс продолжали до исчезновения опухоли.
Пример 34. Лечение рака молочной железы
[0269] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли молочной железы, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли или на любой участок кожи тела дважды в день. Процесс продолжали, пока не убеждались, что рецидива рака не происходит (возможно, на протяжении всей жизни).
Пример 35. Лечение рака простаты
[0270] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли дважды в день. Процесс продолжали до излечения рака.
Пример 36. Лечение рака простаты
[0271] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли или на любой участок кожи тела дважды в день.
Пример 37. Лечение рака легкого
[0272] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области грудной клетки дважды в день, и продолжали лечение до излечения рака.
Пример 38. Лечение рака легкого
[0273] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области грудной клетки дважды в день, и продолжали лечение до излечения рака.
Пример 39. Лечение рака толстой кишки
[0274] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области ануса или на любой участок кожи тела дважды в день. Процесс продолжали до излечения рака.
Пример 40. Лечение рака толстой кишки
[0275] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области ануса или на любой участок кожи тела дважды в день. Процесс продолжали до излечения рака.
Пример 41. Лечение рака кожи
[0276] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на пораженную раком кожу или на близлежащий участок дважды в день. Процесс продолжали до излечения рака.
Пример 42. Лечение рака кожи
[0277] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на пораженную раком кожу или на близлежащий участок дважды в день. Процесс продолжали до излечения рака.
Пример 43. Лечение рака кости
[0278] Примерно 0,8 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли кости дважды в день. Процесс продолжали до излечения рака.
Пример 44. Лечение рака кости
[0279] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли кости или на любой участок кожи тела дважды в день. Процесс продолжали до излечения рака.
Пример 45. Лечение любых видов рака
[0280] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли или на любой участок кожи тела дважды в день. Процесс продолжали до излечения рака.
Пример 46. Лечение любых видов рака
[0281] После хирургического удаления или сокращения при помощи другой терапии раковой опухоли, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле наносили на кожу в области раковой опухоли или на любой участок кожи тела дважды в день. Процесс продолжали до излечения рака.
Пример 47. Предотвращение любых видов рака
[0282] Для людей с высоким риском развития рака, таких как люди, брат или сестра-близнец которых страдает раком, люди с раком в семейном анамнезе, люди с мутациями в генах, связанных с раком, примерно 0,5 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 48. Противотромботическая активность КИП НПВС
[0283] Отбирали восемнадцать белых китайских кроликов массой от 3,0 до 3,5 кг (возраст 6-7 месяцев) и разделяли на три группы (контроль, группы P-1 и P-10, n=6). За один час до опыта получали тромбы путем отбора венозной крови (1 мл) в стерилизованный сосуд для свертывания. Чтобы избежать фрагментации и медленного растворения, аутологичные кровяные сгустки стабилизировали в дистиллированной воде с контролируемой температурой (70°С) в течение 10 минут. После анестезии вскрывали бедренную вену, дистально изолировали и инъецировали аутологичные кровяные сгустки (0,05 г/кг) через постоянный катетер (20GA), который помещали в изолированную ранее бедренную вену. 50 мг/кг диэтиламиноэтил ацетилсалицилата·соли HCl (P-1, 10% в 25% этаноле) и диэтиламиноэтил ацетилсалицилсалицилата·соли HCl (P-59, 10% в 25% этаноле) наносили топически на спину кроликов дважды в день. Через 5 дней кроликов безболезненно умерщвляли путем внутривенной инъекции избытка амобарбитала натрия (60 мг/кг). Извлекали легкие и сердца и осматривали на предмет наличия тромбов в легочных артериях. Замачивали легкие в 10% формалине в течение 24 часов. Последовательные поперечные срезы закупоренных легочных артерий заключали в парафин и окрашивали гематоксилином и эозином.
[0284] В контрольной группе наблюдались окруженные тромбоцитарным тромбом и смешанным тромбом внедренные сгустки, присутствовавшие в крупных сосудах, а также растянутые стенки сосудов как в проксимальном, так и в дистальном направлениях. В указанных сосудах наблюдалась избыточная пролиферация эндотелиальных клеток и фиброцитов. Кроме того, наблюдалась острая закупорка легких. В группах P-1 и P-59 как ткани легкого, так и кровеносные сосуды были нормальными. Полученные результаты показывают, что тромботическую активность и связанное с эмболизацией распространение тромбов можно предотвратить при помощи указанных КИП НПВС. КИП могут быть очень полезны для предотвращения и лечения кровяных сгустков - основной причины инсультов, инфарктов и отторжения трансплантированных органов.
Пример 49. Противотромботическая активность соли диэтиламиноэтил-ацетилсалицилат·лимонная кислота
[0285] Последние данные позволяют предположить, что воспаление тесно связано с сердечными заболеваниями, и аспирин широко применяют для предотвращения сердечных заболеваний.
[0286] Тромбоз индуцировали электрической стимуляцией (1 мА в течение 3 минут) сонной артерии у крыс при помощи инструмента для образования тромбов (YLS-14A, Shandong Academy of Medical Sciences, Shandong, China). Крыс (Sprague Dawley, в возрасте 25 недель, массой 380-450 г) разделяли на 3 группы, группа A представляла собой контрольную группу, группы B и C получали лечение диэтиламиноэтил ацетилсалицилатом. В группе B 100 мг/кг соли диэтиламиноэтил-ацетилсалицилат·HCl (10% в воде) наносили на выбритую кожу спины крыс (~9 см2, мех выстригали) за 2 часа перед операцией и через 1 час после операции, после чего 50 мг/кг КИП наносили на спину крыс дважды в день. В группе C 50 мг/кг диэтиламиноэтил-ацетилсалицилата·HCl наносили на спину крыс дважды в день, начиная через 24 часа после операции. Восстановление моторной функции у крыс оценивали ежедневно. Полученные результаты показаны в таблицах 49a и 49b. Результаты, приведенные в таблице 49a, показывают, что аспирин защищает крыс от инсульта, не вызывая проблем с кровотечением. Результаты, приведенные в таблице 49b. показывают, что диэтиламиноэтил ацетилсалицилат·HCl вызывает обратное развитие паралича после инсульта в модели на крысах, не вызывая проблем с кровотечением.
Пример 50. Лечение инсульта
[0287] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, грудную клетку, ноги, руки, или на любой участок кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения инсульта (возможно, на протяжении всей жизни).
Пример 51. Предотвращение инсульта
[0288] Для людей с высоким риском развития инсульта, таких как люди с избыточным весом, люди, у брата или сестры-близнеца которых случился инсульт, люди с инсультом в семейном анамнезе, люди с мутациями в генах, связанных с инсультом, примерно 0,5 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 52. Лечение инфаркта
[0289] Примерно 1,5 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, грудную клетку, ноги, или на любой участок кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения инфаркта (возможно, на протяжении всей жизни).
Пример 53. Предотвращение инфаркта
[0290] Для людей с высоким риском развития инфаркта, таких как люди с избыточным весом, люди, у брата или сестры-близнеца которых случился инфаркт, люди с инфарктом в семейном анамнезе, люди с мутациями в генах, связанных с инфарктом, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 54. Антигипертензивная активность
A) диэтиламиноэтил-ацетилсалицилат·лимонная кислота (соль диэтиламиноэтил-ацетилсалицилат·лимонная кислота)
[0291] 20 спонтанно гипертензивных крыс (SLAC/SHR, в возрасте 19 недель, с массой 300-350 г) случайным образом распределяли по двум группам. В группе A наносили на кожу спины крыс (~5 см2, с выстриженным мехом) чистую воду (0,5 мл) один раз в день в течение 6 недель. В группе B наносили на кожу спины крыс (~5 см2, с выстриженным мехом) 50 мг/кг соли диэтиламиноэтил-ацетилсалицилат·лимонная кислота (10% в воде) один раз в день. Полученные результаты показаны в таблице 54a. Полученные результаты показывают, что КИП диэтиламиноэтил ацетилсалицилата обладает очень сильной антигипертензивной активностью.
B) Соль атенолол·HCl
[0292] Кровяное давление у пациентов с гипертонией контролировали путем трансдермального введения 100 мг атенолола соли HCl в 1 мл чистой воды в сутки, без побочных эффектов или гипотонии. 20 пациентов с гипертонией распределяли по 2 группам. Группа A представляла собой контрольную группу (n=10, 1 мл воды наносили на грудную клетку пациентов один раз в сутки). Группа B представляла собой группу, получавшую атенолол (n=10, 100 мг атенолола соли HCl наносили на грудную клетку пациентов один раз в сутки). Полученные результаты показаны в таблице 54b.
Пример 55. Лечение гипертонии
[0293] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, грудную клетку, ноги, или на любой участок кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения гипертонии (возможно, на протяжении всей жизни).
Пример 56. Лечение гипертонии
[0294] Примерно 1 мл 10% атенолола в 25% этаноле (доводили pH до 4-7 при помощи HCl) распыляли на шею, грудную клетку, ноги, или на любой участок кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день.
Пример 57. Предотвращение гипертонии
[0295] Для людей с высоким риском развития гипертонии, таких как люди с избыточным весом, люди, брат или сестра-близнец которых страдают гипертонией, люди с гипертонией в семейном анамнезе, люди с мутациями в генах, связанных с гипертонией, примерно 0,5 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 58. Лечение амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний
[0296] Патогенез гибели клеток при амиотрофическом боковом склерозе (АБС) может включать опосредуемую глутаматом эксайтотоксичность, окислительное повреждение и апоптоз. Циклооксигеназа-2, присутствующая в нейронах спинного мозга и астроцитах, катализирует синтез простагландина E2. Простагландин E2 стимулирует высвобождение глутамата из астроцитов, поэтому циклооксигеназа-2 также играет ключевую роль в производстве воспалительных цитокинов, активных форм кислорода и свободных радикалов. Лечение селективным ингибитором циклооксигеназы-2, целекоксибом, заметно ингибирует производство простагландина E2 в спинном мозге мышей с АБС. Лечение целекоксибом значительно задерживает развитие слабости и потери веса и продлевает срок жизни на 25%. В спинном мозгу мышей с АБС, получавших лечение, показано значительное сохранение нейронов спинного мозга и уменьшенный астроглиоз и микробная активация (Merit. E. Cudkowicz, et al., Annals of neurology, 52, 771-778, 2002). Полученные результаты позволяют предположить, что ингибирование циклооксигеназы-2 может быть полезно для пациентов с АБС. КИП НПВС согласно настоящему изобретению могут проникать через кожу и мембрану нервных клеток в очень высоком соотношении (большинство НПВС не способны эффективно проникать в нервные клетки) и могут вводиться трансдермально, не повреждая ЖК тракт, вот почему КИП представляют собой перспективные агенты для лечения амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний.
[0297] Для лечения амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний, примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, грудную клетку, ноги, или на любой участок кожи тела (каждый раз меняя место во избежание повреждения кожи) дважды в день.
Пример 59. Предотвращение амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний
[0298] Для людей с высоким риском развития амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний, таких как люди, брат или сестра-близнец которых страдают одним или несколькими из указанных заболеваний, люди с одним или несколькими из указанных заболеваний в семейном анамнезе, люди с мутациями в генах, связанных с одним или несколькими из указанных заболеваний, примерно 0,5 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 60. Активность соли диэтиламиноэтил-ацетилсалицилат·HCl против выпадения волос и облысения
[0299] 30 экспериментальных лысых крыс Lesional Dundee (DEBR) разделяли на 3 группы. В группе A (n=10) крысы получали 2 мл чистой воды на всю поверхность тела один раз в день в течение 10 недель. В группе B (n=10) крысы получали 50 мг/кг диэтиламиноэтил-ацетилсалицилата лимонной кислоты (1% в чистой воде на всю поверхность тела один раз в день в течение 10 недель. В группе C (n=10) крысы получали перорально циклоспорин A (CsA) (10 мг/кг в день) в течение 10 недель. В контрольной группе A без лечения в результате применения среды не наблюдалось роста волос и продолжалось выпадение волос. В получавшей диэтиламиноэтил ацетилсалицилат лимоннокислый группе B наблюдалось возобновление роста волос на всей поверхности тела в течение 2-4 недель. В группе C, получавшей перорально CsA, наблюдалось возобновление роста волос на всей поверхности тела в течение 2-4 недель в значительно меньшей степени (~40%) чем в группе B.
Пример 61. Лечение облысения
[0300] Примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на поверхность кожи головы дважды в день. Процесс продолжали до излечения облысения (возможно, на протяжении всей жизни).
Пример 62. Лечение выпадения волос
[0301] Примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на поверхность кожи головы один или два раза в день. Процесс продолжали до излечения выпадения волос (возможно, на протяжении всей жизни).
Пример 63. Активность соли диэтиламиноэтил-ацетилсалицилата·HCl против витилиго
[0302] 20 цыплят Smyth (модель витилиго на животных) разделяли на 2 группы. Цыплята в группе A (n=10) получали 1 мл чистой воды на обесцвеченные поражения один раз в день в течение 10 недель. Цыплята Smyth в группе B (n=10) получали 50 мг/кг диэтиламиноэтил-ацетилсалицилата лимоннокислого (5% в чистой воде) на обесцвеченные поражения один раз в день в течение 10 недель. В контрольной группе A без лечения поражения усиливались и продолжалось выпадение перьев. В получавшей диэтиламиноэтил-ацетилсалицилат лимоннокислый группе B наблюдалось исчезновение обесцвеченных поражений и возобновление роста перьев в течение 3-6 недель.
Пример 64. Лечение витилиго
[0303] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу или волосы в области витилиго дважды в день. Процесс продолжали до излечения витилиго (возможно, на протяжении всей жизни).
Пример 65. Предотвращение витилиго
[0304] Для людей с высоким риском развития витилиго, таких как люди, брат или сестра-близнец которых страдают витилиго, люди с витилиго в семейном анамнезе, люди с мутациями в генах, связанных с витилиго, примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 66. Активность диэтиламиноэтил-ацетилсалицилата·HCl против болезни Альцгеймера, исследованная в модели на мышах Tg2576 болезни Альцгеймера
[0305] Воспалительные механизмы были предложены на роль важных медиаторов в патогенетическом каскаде болезни Альцгеймера (McGeer PL, McGeer EG. The inflammatory response system of brain implications for the therapy of Alzheimer and other neurodegenerative diseases. Brain Res. Rev., 1995; 21: 195-218). В исследовании, проведенном in’t Veld et al. (the New England Journal of Medicine, 2001; 345, 1515), наблюдали почти 7000 человек с риском развития болезни Альцгеймера около семи лет. Полученные результаты позволяют предположить, что НПВС уменьшают относительный риск у людей, принимавших НПВС в сумме на протяжении, по меньшей мере, двух лет и за два или более года до наступления деменции. Когда нейропротективная способность НПВС заканчивалась непосредственно перед наступлением деменции, указанные соединения не оказывали защитного действия в отношении развития заболевания у большинства людей в продромальной стадии заболевания. Полагают, что причиной этого является то, что ткани вокруг поврежденных нервных клеток будут образовывать шрамы, предохраняющие нервные клетки от дальнейшего повреждения. Большинство НПВС имеет очень низкие скорости проникновения через гематоэнцефалический и нейроцитарный барьеры, и не могут проникать через рубцовый барьер. КИП согласно настоящему изобретению имеют очень высокие скорости проникновения через кожу, гематоэнцефалический барьер, мембрану нервных клеток и рубцовый барьер, и являются очень перспективными агентами для лечения болезни Альцгеймера, болезни Паркинсона и других прогрессирующих нейродегенеративных заболеваний.
[0306] Патология болезни Альцгеймера (БА) показывает значительную корреляцию между конформацией β-амилоидного пептида (AβP) и клинической тяжестью деменции. Многие годы исследования были направлены на разработку ингибиторов образования β-амилоида (Aβ) и связанных с ним нейротоксических эффектов. Для определения действия диэтиламиноэтил ацетилсалицилата·HCl на накопление in vivo Aβ вводили трансдермально диэтиламиноэтил ацетилсалицилат·HCl (50 мг/кг в воде) мышам Tg2576 в модели БА свыше 2 месяцев, получив в результате значительное, неперекрывающееся 70-80% уменьшение числа сенильных бляшек, одного из патологических признаков БА. Для исследования действия диэтиламинопропил ацетилсалицилата·HCl in vivo применяли трехмесячных самок трансгенных мышей со сверхэкспрессией гена APP человека, содержащего шведскую мутацию, вызывающую семейную БА (линия Tg2576). 20 мышей Tg2576 разделяли на две группы. В группе A (n=10) на спину мыши наносили трансдермально 0,2 мл чистой воды один раз в день в течение 2 месяцев. В группе B (n=10) на спину мыши наносили 50 мг/кг диэтиламинопропил ацетилсалицилата·HCl в 0,2 мл чистой воды один раз в день в течение 2 месяцев. Затем животных умерщвляли и извлекали головной мозг для анализа. Для анализа на Aβ полушария мозга гомогенизировали в гомогенизаторе Даунса в 70% муравьиной кислоте в соотношении 150 мг ткани/мл раствора муравьиной кислоты. Гомогенизаты переносили в охлажденную ультрацентрифугу и центрифугировали при 100000 g в течение 1 ч при 4°С. Собирали надклеточные жидкости и нейтрализовали при помощи буферного раствора для нейтрализации муравьиной кислоты (1,0 М основы Трис, 0,5 M NaH2PO4 и 0,05% NaN3; 1:20)для количественного определения Aβ методом ELISA. Aβ40 и Aβ42анализировали методом ELISA. Проводили четыре отдельных эксперимента. Для сравнения исследований значения, полученные в отдельных экспериментах, нормализовывали с использованием значений, полученных для контрольных животных, включенных в каждое из исследований. Значения, представленные в виде среднее±СО для числа n, после нормализации, показаны в таблице 66a. Результатом трансдермального применения диэтиламинопропил ацетилсалицилата·HCl (50 мг/кг) было значительное уменьшение (70%) концентрацииAβ42 в головном мозге.
[0307] Исследования в модели на мышах Tg2576показали, что трансдермальное введение 50 мг/кг диэтиламинопропил-ацетилсалицилата·HCl приводит к значительному уменьшению (70%) количества Aβ, обнаруживаемого в головном мозге указанных животных после 2 месяцев введения. Для определения, оказывает ли трансдермальное введение диэтиламинопропил-ацетилсалицилата·HCl благотворное воздействие на функциональные последствия, исследовали в течение 2 месяцев диэтиламинопропил-ацетилсалицилат·HCl (50 мг/кг) в модели болезни Альцгеймера на трансгенных мышах, в которой по мере накопления амилоида у мышей развивается нарушение обучения. Полученные результаты показали, что диэтиламинопропил-ацетилсалицилат·HCl защищает трансгенных мышей от нарушений обучения и возрастных нарушений памяти, обычно наблюдающихся у мышей в указанной модели болезни Альцгеймера. В группе, получавшей диэтиламинопропил-ацетилсалицилат·HCl (50 мг/кг) все мыши прекрасно проходили тест радиального водного лабиринта на работу памяти, тогда как контрольные трансгенные мыши демонстрировали нарушение памяти. Трансгенные мыши, получавшие диэтиламинопропил-ацетилсалицилат·HCl демонстрировали когнитивную деятельность, превосходную по сравнению с когнитивной деятельностью контрольных трансгенных мышей, и, в конечном итоге, действовали так же хорошо, как не трансгенные мыши. Следовательно, указанный терапевтический подход способен предотвращать и лечить деменцию при болезни Альцгеймера.
Пример 67. Лечение болезни Альцгеймера и других нейродегенеративных заболеваний
[0308] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу или волосы в области витилиго дважды в день. Процесс продолжали до излечения витилиго (возможно, на протяжении всей жизни).
Пример 68. Предотвращение болезни Альцгеймера и других прогрессирующих нейродегенеративных заболеваний
[0309] Для людей с высоким риском развития болезни Альцгеймера и других прогрессирующих нейродегенеративных заболеваний, таких как люди, брат или сестра-близнец которых страдают болезнью Альцгеймера и другими прогрессирующими нейродегенеративными заболеваниями, люди с болезнью Альцгеймера и другими прогрессирующими нейродегенеративными заболеваниями в семейном анамнезе, люди с мутациями в генах, связанных с болезнью Альцгеймера и другими прогрессирующими нейродегенеративными заболеваниями, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 69. Активность диэтиламиноэтил ацетилсалицилата·HCl против болезни Паркинсона, исследованная в модели на мышах МФТП - индуцированной болезни Паркинсона
[0310] 30 самцов мышей C57/BL6 (массой 24-26 г) разделяли на 3 группы. Мыши в группе A получали внутрибрюшинную (ip) инъекцию 0,4% раствора карбоксиметилцеллюлозы (15 мл/кг в день) в течение 7 дней. Мыши в группах B и C получали ip инъекцию N-метил-4-фенил-1,2,3,6-тетрагидропиридина (МФТП, 30 мг/кг в день) в течение 7 дней. Затем мышей разделяли на 2 группы. В группах A и B на шею мышей наносили трансдермально 0,1 мл чистой воды один раз в день в течение 14 дней. В группе C на шею мышей наносили трансдермально 30 мг/кг соли диэтиламиноэтил-ацетилсалицилата·HCl в 0,1 мл воды один раз в день в течение 14 дней. После последней обработки всех мышей умерщвляли и быстро замораживали ткани головного мозга при -80°С. Определяли при помощи спектрофлуорофотометра содержание в стриатуме допамина (ДА) (λEx=310 нм, λEm=390 нм, RF-5000), 5-HT (λEx=355 нм, λEm=495 нм) и норадреналина (НА) (λEx=400 нм, λEm=500 нм). Измеряли содержание малонового диальдегида (МДА) в ЧВ при помощи реакции с тиобарбитуровой кислотой, чтобы показать LPO, и содержание глутатиона (GSH) в черном веществе (ЧВ) на основании определения дитионитробензойной кислоты (ДТНБ). Содержание ГАМК и Glu в стриатуме и ЧВ определяли при помощи автоматического анализатора аминокислот высокого разрешения. Полученные результаты показаны в таблице 69a. Действие диэтиламиноэтил-ацетилсалицилата·лимоннокислого на содержание ДА, НА и 5-HT. Содержание ДА, НА и 5-HT в стриатуме было значительно снижено в группе, получавшей МФТП, по сравнению с контрольной группой (P<0,05, n=10). Диэтиламиноэтил-ацетилсалицилат·лимоннокислый (30 мг/кг трансдермально) увеличивал содержание ДА, НА и 5-HT по сравнению с модельной группой (P<0,05, n=10) (таблица 69a).
Действие диэтиламиноэтил-ацетилсалицилата·лимоннокислого на содержание МДА и GSH
[0311] Уровень GSH в ЧВ в модельной группе был заметно снижен (P<0,01, n=10) а содержание МДА в ЧВ повышено по сравнению с аналогичными величинами в контрольной группе (P<0,01, n=10). Диэтиламиноэтил-ацетилсалицилат·лимоннокислый значительно понижал уровень МДА, одновременно относительно повышая уровень GSH в модели БП (P<0,01, n=10). Полученные результаты показаны в таблице 69b.
Действие диэтиламиноэтил-ацетилсалицилата·лимоннокислого на содержание ГАМК и Glu
[0312] МФТП значительно увеличивал уровень ГАМК в стриатуме (P<0,01, n=10), одновременно уменьшая ГАМК в ЧВ (P<0,05, n=10) по сравнению с контрольной группой, диэтиламиноэтил-ацетилсалицилат·лимоннокислый (30 мг/кг) оказывал на эти величины обратное действие. Однако модафинил не влиял на увеличение высвобождения Glu в ЧВ и стриатуме, вызванное МФТП (таблица 69c).
[0313] Полученные результаты показывают, что содержание в стриатуме НА и 5-HT у мышей, получавших МФТП, значительно ниже, чем указанное содержание у обычных мышей, а диэтиламиноэтил ацетилсалицилат увеличивает уровни ДА, НА и 5-HT в стриатуме. Это может улучшить состояние или вызвать обратное развитие болезни Паркинсона. Полученные результаты также показывают, что диэтиламиноэтил-ацетилсалицилат ингибирует высвобождение ГАМК в стриатуме в модели БП. В заключение, диэтиламиноэтил-ацетилсалицилат предохраняет от нейротоксичности МФТП благодаря антиокислительному действию и модулированию содержания НА и 5-HT в стриатуме и ГАМКэргической активности в ЧВ и стриатуме. Поэтому диэтиламиноэтил-ацетилсалицилат может быть чрезвычайно полезным нейропротективным агентом для лечения болезни Паркинсона.
Пример 70. Лечение болезни Паркинсона и родственных заболеваний
[0314] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, лицо или любую часть кожи тела дважды в день. Процесс продолжали до излечения заболевания (возможно, на протяжении всей жизни).
Пример 71. Предотвращение болезни Паркинсона и родственных заболеваний
[0315] Для людей с высоким риском развития болезни Паркинсона и родственных заболеваний, таких как люди, брат или сестра-близнец которых страдают болезнью Паркинсона и родственными заболеваниями, люди с болезнью Паркинсона и родственными заболеваниями в семейном анамнезе, люди с мутациями в генах, связанных с болезнью Паркинсона и родственными заболеваниями, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 72. Активность диэтиламиноэтил-ацетилсалицилата·HCl против глаукомы
[0316] Способность диэтиламиноэтил-ацетилсалицилата·HCl снижать внутриглазное давление (ВГД) оценивали на кошках с повышенным внутриглазным давлением, полученным путем предварительной лазерной трабекулопластики. ВГД определяли при помощи пневмотонометра после легкой анестезии роговицы разбавленным пропакаином. 14 кошек разделяли на 2 группы. Перед лечением водным раствором исследуемого соединения определяли нулевую линию ВГД. В группе A наносили трансдермально на область вокруг глаза (снаружи) кошки 0,5 мл воды дважды в день в течение 10 дней. В группе B наносили трансдермально на область вокруг глаза (снаружи) кошки 30 мг/кг of диэтиламиноэтил-ацетилсалицилата·HCl. Полученные результаты, приведенные в таблице 72, показывают, что КИП диэтиламиноэтил-ацетилсалицилата·HCl обладает сильной активностью против глаукомы в модели на животных.
[0317] Диэтиламиноэтил-ацетилсалицилат·HCl показал сильную активность против глаукомы в модели на животных.
Пример 73. Лечение глаукомы
[0318] Примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу в области глаз дважды в день. Процесс продолжали до излечения глаукомы (возможно, на протяжении всей жизни).
Пример 74. Лечение катаракты
[0319] Примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу в области глаз дважды в день. Процесс продолжали до излечения катаракты (возможно, на протяжении всей жизни).
Пример 75. Предотвращение катаракты
[0320] Для людей с высоким риском катаракты, таких как люди, брат или сестра-близнец которых страдают катарактой, люди с катарактой в семейном анамнезе, люди с мутациями в генах, связанных с катарактой, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу в области глаз один или два раза в день.
Пример 76. КИП НПВС увеличивают продолжительность жизни мышей
[0321] НПВС не очень эффективны для лечения описанных выше состояний или имеют серьезные побочные эффекты, поскольку они не могут очень эффективно проникать через мембраны клеток, особенно клеток головного мозга и нервных клеток, и остаются в общем кровотоке слишком долго, благодаря чему большая часть лекарственного средства будет подвергаться метаболизму в слизистой кишечника, печени, почках и легких, до того, как достигнет «места действия». Указанная ситуация не только приводит к очень низкому фармакологическому эффекту, но также вызывает токсическую нагрузку на слизистую кишечника, печени, почек, легких и других частей организма. КИП согласно настоящему изобретению способны проникать через биологические барьеры и являются более эффективными, чем соответствующие исходные лекарственные средства. Необходимо несколько десятых или сотых от обычной дозировки, и будет вызвано гораздо меньше побочных эффектов. Это даст преимущество не только трансдермальной доставке лекарственного средства, но также любой другой системе доставки лекарственного средства (такой как пероральная, подкожная, внутримышечная, ингаляционная и назальная) и может лечить многие состояния лучше, чем их можно лечить соответствующими исходными лекарственными средствами, и даже некоторые состояния, которые невозможно лечить соответствующими исходными лекарственными средствами.
[0322] Полагают, что увеличенное воспаление и замедленный метаболизм являются двумя основными причинами, влияющими на процесс старения животных и человека. КИП аспирина и других НПВС, способные проникать через одну или более биологических мембран и оказывать очень сильное противовоспалительное действие, должны увеличивать продолжительность жизни животных.
[0323] 60 мышей (в возрасте 10 недель, массой 30,3±3,5 г) разделяли на группы A и B. В группе A (n=30) на спину мышей (~2 см2) наносили 0,05 мл дистиллированной воды один раз в день. В группе B (n=30) на спину мышей (~2 см2) наносили 0,5 мг диэтиламиноэтил-ацетилсалицилата·лимоннокислого (КИП аспирина) в 0,05 мл (10%) дистиллированной воды один раз в день. Полученные результаты показывают, что КИП аспирина увеличивает продолжительность жизни мышей на 27% (таблица 76).
Пример 77. Лечение, направленное против старения, и увеличение продолжительности жизни
[0324] Примерно 0,4 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу любой части тела дважды в день. Процесс продолжали на протяжении всей жизни.
Пример 78. Лечение болезни Крона и других аутоиммунных заболеваний
[0325] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на область вокруг ануса, живот или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояний (возможно, на протяжении всей жизни).
Пример 79. Предотвращение болезни Крона и других аутоиммунных заболеваний
[0326] Для людей с высоким риском развития болезни Крона и других аутоиммунных заболеваний, таких как люди, брат или сестра-близнец которых страдают болезнью Крона и другими аутоиммунными заболеваниями, люди с болезнью Крона и другими аутоиммунными заболеваниями в семейном анамнезе, люди с мутациями в генах, связанных с болезнью Крона и другими аутоиммунными заболеваниями, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 80. Лечение гипертиреоидизма
[0327] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на область шеи или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояния гипертиреоидизма (возможно, на протяжении всей жизни).
Пример 81. Предотвращение гипертиреоидизма
[0328] Для людей с высоким риском развития гипертиреоидизма и других аутоиммунных заболеваний, таких как люди, брат или сестра-близнец которых страдают гипертиреоидизмом и другими аутоиммунными заболеваниями, люди с гипертиреоидизмом и другими аутоиммунными заболеваниями в семейном анамнезе, люди с мутациями в генах, связанных с гипертиреоидизмом и другими аутоиммунными заболеваниями, примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 82. Лечение аутоиммунного воспаления печени, печеночного фиброза и/или цирроза
[0329] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на живот или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояния аутоиммунного воспаления печени, печеночного фиброза и/или цирроза (возможно, на протяжении всей жизни).
Пример 83. Предотвращение аутоиммунного воспаления печени, печеночного фиброза и/или цирроза
[0330] Для людей с высоким риском развития аутоиммунного воспаления печени, печеночного фиброза и/или цирроза, таких как люди, брат или сестра-близнец которых страдают аутоиммунным воспалением печени, печеночным фиброзом и/или циррозом, люди с аутоиммунным воспалением печени, печеночным фиброзом и/или циррозом в семейном анамнезе, люди с мутациями в генах, связанных с аутоиммунным воспалением печени, печеночным фиброзом и/или циррозом, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 84. Лечение кистозного фиброза, легочного фиброза, фиброза поджелудочной железы, фиброза селезенки, желудочно-кишечного фиброза и фиброза других органов
[0331] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу в области пораженных органов или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояний кистозного фиброза, легочного фиброза, фиброза поджелудочной железы, фиброза селезенки, желудочно-кишечного фиброза и фиброза других органов (возможно, на протяжении всей жизни)
Пример 85. Предотвращение кистозного фиброза, легочного фиброза, фиброза поджелудочной железы, фиброза селезенки, желудочно-кишечного фиброза и фиброза других органов
[0332] Для людей с высоким риском развития кистозного фиброза, легочного фиброза, фиброза поджелудочной железы, фиброза селезенки, желудочно-кишечного фиброза и фиброза других органов, таких как люди, брат или сестра-близнец которых страдают кистозным фиброзом, легочным фиброзом, фиброзом поджелудочной железы, фиброзом селезенки, желудочно-кишечным фиброзом и фиброзом других органов, люди с кистозным фиброзом, легочным фиброзом, фиброзом поджелудочной железы, фиброзом селезенки, желудочно-кишечным фиброзом и фиброзом других органов в семейном анамнезе, люди с мутациями в генах, связанных с кистозным фиброзом, легочным фиброзом, фиброзом поджелудочной железы, фиброзом селезенки, желудочно-кишечным фиброзом и фиброзом других органов, примерно 0,3 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 86. Лечение камней в желчном пузыре
[0333] Холестериновые желчные камни развиваются, когда желчь содержит слишком много холестерина и недостаточно желчных солей. Воспаление желчного протока может играть очень важную роль в образовании желчных камней. КИП НПВС могут понижать уровни липидов в крови и обладают противовоспалительной активностью. Один из вариантов лечения камней в желчном пузыре следующий: примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на живот или кожу любой части тела дважды в день. Лечение продолжали до исчезновения камней в желчном пузыре.
Пример 87. Лечение лучевого кератоза
[0334] Примерно 0,7 мл 8% N,N-диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на кожу в области лучевого кератоза или кожу любой части тела дважды в день. Лечение продолжали до излечения лучевого кератоза.
Пример 88. Предотвращение лучевого кератоза
[0335] Для людей с высоким риском развития лучевого кератоза, таких как люди, брат или сестра-близнец которых страдают болезнью Крона и другими аутоиммунными заболеваниями, люди, длительное время работающие вне помещений, примерно 0,4 мл 8% диэтиламиноэтил ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 89. Лечение аномальных сосудистых поражений кожи, родимых пятен, бородавок (невусов), папиллом, старческих пятен (печеночных пятен) и других заболеваний кожи
[0336] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную кожу или кожу любой части тела дважды в день. Лечение продолжали до излечения заболеваний кожи.
Пример 90. Лечение аллергического ринита (назальной аллергии), аллергических поражений глаз, аллергической экземы (атопического дерматита), крапивницы, аллергического шока (анафилаксии или анафилактического шока) и/или других видов аллергии (которые могут быть вызваны пыльцой, пылевым клещом, плесенью, перхотью, пищей, лекарственными средствами и/или другими аллергенами)
[0337] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженные области или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояний аллергического ринита (назальной аллергии), аллергических поражений глаз, аллергической экземы (атопического дерматита), крапивницы, аллергического шока (анафилаксии или анафилактического шока) и/или других видов аллергии (которые могут быть вызваны пыльцой, пылевым клещом, плесенью, перхотью, пищей, лекарственными средствами и/или другими аллергенами).
Пример 91. Лечение для более долгой и здоровой жизни
[0338] Примерно 0,4 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу любой части тела дважды в день. Лечение продолжали на протяжении всей жизни.
Пример 92. Лечение акне, кистозного акне, гнойных или красных прыщей, комедонов, папул, пустул, узелков, эпидермоидных кист, волосяного кератоза и других заболеваний кожи
[0339] Примерно 0,5 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную область или кожу любой части тела дважды в день. Лечение продолжали до излечения акне, кистозного акне, гнойных или красных прыщей, комедонов, папул, пустул, узелков, эпидермоидных кист, волосяного кератоза и других заболеваний кожи.
Пример 93. Лечение обвисшей кожи, морщин, «гусиных лапок», кожных прыщей телесного цвета, розацеа, кожи после лечения и других заболеваний кожи
[0340] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную область или кожу любой части тела дважды в день. Лечение продолжали до излечения обвисшей кожи, морщин, «гусиных лапок», кожных бугорков телесного цвета, розацеа, кожи после лечения и других заболеваний кожи.
Пример 94. Лечение для улучшения здоровья кожи
[0341] Примерно 0,4 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на кожу любой части тела дважды в день. Лечение продолжали на протяжении всей жизни.
Пример 95. Лечение макулярной дегенерации и возрастной макулярной дегенерации (ВМД)
[0342] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на пораженную область или кожу любой части тела дважды в день. Лечение продолжали до излечения состояний.
Пример 96. Лечение как острого, так и хронического кашля
[0343] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на область шеи (возле гортани) или кожу любой части тела дважды в день. Лечение продолжали до излечения состояния.
Пример 97. Лечение амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных нарушений
[0344] Патогенез гибели клеток при амиотрофическом боковом склерозе (АБС) может включать опосредуемую глутаматом эксайтотоксичность, окислительное повреждение и апоптоз. Циклооксигеназа-2, присутствующая в нейронах спинного мозга и астроцитах, катализирует синтез простагландина E2. Простагландин E2 стимулирует высвобождение глутамата из астроцитов, поэтому циклооксигеназа-2 также играет ключевую роль в производстве воспалительных цитокинов, активных форм кислорода и свободных радикалов. Лечение селективным ингибитором циклооксигеназы-2, целекоксибом, заметно ингибирует производство простагландина E2 в спинном мозге мышей с АБС. Лечение целекоксибом значительно задерживает развитие слабости и потери веса и продлевает срок жизни на 25%. В спинном мозгу мышей с АБС, получавших лечение, показано значительное сохранение нейронов спинного мозга и уменьшенный астроглиоз и микробная активация (Merit. E. Cudkowicz, et al., Annals of neurology, 52, 771-778, 2002). Полученные результаты позволяют предположить, что ингибирование циклооксигеназы-2 может быть полезно для пациентов с АБС. КИП НПВС согласно настоящему изобретению могут проникать через кожу и мембрану нервных клеток в очень высоком соотношении (большинство НПВС не способны эффективно проникать в нервные клетки) и могут вводиться трансдермально, не повреждая ЖК тракт, вот почему КИП представляют собой многообещающие агенты для лечения амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний. Одним из вариантов лечения указанных заболеваний является: Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на шею, голову, лицо, грудную клетку или кожу любой части тела дважды в день. Лечение продолжали до исчезновения состояний (возможно, на протяжении всей жизни).
Пример 98. Предотвращение амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний
[0345] Для людей с высоким риском развития амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний, таких как люди, брат или сестра-близнец которых страдают амиотрофическим боковым склерозом (АБС), окулофарингеальной мышечной дистрофией (ОФМД), миотонической дистрофией (МД), мышечной дистрофией Дюшенна (МДД), полимиозитом (ПМ), дерматомиозитом (ДМ), миозитом с включенными тельцами (МВТ) и другими мышечными заболеваниями, люди с амиотрофическим боковым склерозом (АБС), окулофарингеальной мышечной дистрофией (ОФМД), миотонической дистрофией (МД), мышечной дистрофией Дюшенна (МДД), полимиозитом (ПМ), дерматомиозитом (ДМ), миозитом с включенными тельцами (МВТ) и другими мышечными заболеваниями в семейном анамнезе, люди с мутациями в генах, связанных с амиотрофическим боковым склерозом (АБС), окулофарингеальной мышечной дистрофией (ОФМД), миотонической дистрофией (МД), мышечной дистрофией Дюшенна (МДД), полимиозитом (ПМ), дерматомиозитом (ДМ), миозитом с включенными тельцами (МВТ) и другими мышечными заболеваниями, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 99. Лечение отторжения трансплантированного органа
[0346] Отторжение трансплантата наблюдается, когда организм реципиента трансплантата не принимает трансплантированный орган или ткань. Это объясняется концепцией, что иммунная система реципиента атакует трансплантированный орган или ткань. Это ожидаемое явление, поскольку целью иммунной системы является распознавание чужеродного материала в организме и попытка разрушить его, так же как она пытается разрушить инфицирующие организмы, такие как бактерии и вирусы. Если это возможно, отторжение трансплантата можно уменьшить, проводя серотипирование для определения наиболее соответствующей пары донор-реципиент, и используя иммунодепрессивные лекарственные средства, которые имеют серьезные побочные эффекты. Острое отторжение обычно начинается в течение недели после трансплантации (в отличие от сверхострого отторжения, немедленного). Риск острого отторжения наиболее высок в первые три месяца после трансплантации. Однако острое отторжение может также наблюдаться через месяцы или годы после трансплантации. Единичный случай острого отторжения не вызывает опасений, если его вовремя распознать и правильно лечить, он редко приводит к органной недостаточности. Но повторяющиеся случаи связаны с хроническим отторжением, обусловленным хроническим воспалением и иммунной реакцией на трансплантированную ткань. Длительное применение иммунодепрессивных лекарственных средств будет вызывать серьезные побочные эффекты. Обычные НПВС находят небольшое применение, а высокие дозировки НПВС также будут вызывать серьезные побочные эффекты. КИП НПВС согласно настоящему изобретению должны быть хорошим выбором для лечения отторжения трансплантированного органа.
А). Лечение и предотвращение отторжения трансплантата руки
[0347] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и 0,1 мл 1% соли N,N-диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетат·HCl (КИП монтелукаста) в 25% этаноле распыляли на руку или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
B). Лечение и предотвращение отторжения трансплантата руки
[0348] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и распыляли на руку или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
C). Лечение и предотвращение отторжения трансплантата ноги
[0349] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и 0,1 мл 1% соли N,N-диэтиламиноэтил 2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетат·HCl (КИП монтелукаста) в 25% этаноле распыляли на ногу или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
D). Лечение и предотвращение отторжения трансплантата лица
[0350] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и распыляли на лицо или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
E). Лечение и предотвращение отторжения трансплантата кожи
[0351] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и распыляли на трансплантированную кожу или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
F). Лечение и предотвращение отторжения трансплантата легкого
[0352] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и 0,1 мл 1% соли N,N-диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетат·HCl (КИП монтелукаста) в 25% этаноле распыляли на грудную клетку или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
G). Лечение и предотвращение отторжения трансплантата легкого
[0353] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и 1 мг 1% соли N,N-диэтиламиноэтил 2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетат·HCl (КИП монтелукаста) ингалировали в легкие или в верхние дыхательные пути дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
H). Лечение и предотвращение отторжения трансплантата печени
[0354] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и 0,1 мл 1% соли N,N-диэтиламиноэтил-2-[1-[[(1R)-1-[3-[2-(7-хлорхинолин-2-ил)этенил]фенил]-3-[2-(2-гидроксипропан-2-ил)фенил]пропил]сульфанилметил]циклопропил]ацетат·HCl (КИП монтелукаста) в 25% этаноле распыляли на область вокруг печени или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
I). Лечение и предотвращение отторжения трансплантата почки
[0355] Примерно 0,7 мл 8% N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле и распыляли на область вокруг почки или другую часть кожи тела дважды в день. Лечение продолжали до остановки отторжения (возможно, на протяжении всей жизни).
Пример 100. Лечение остеопороза
[0356] Остеопороз представляет собой заболевание костей, приводящее к повышенному риску перелома. При остеопорозе уменьшается минеральная плотность кости (МПК), разрушается микроархитектура кости и изменяется количество и состав белков кости. Полагают, что в регуляции ремоделирования кости принимают участие местное производство эйкозаноидов и интерлейкинов, и избыточное или сниженное производство указанных медиаторов может лежать в основе развития остеопороза [Raisz L (2005). J Clin Invest 115 (12): 3318-25]. Образование кости и резорбция кости контролируются физиологически благодаря активности остеобластов и остеокластов. Дисбаланс указанных активностей может возникать по причине различных гормональных или воспалительных нарушений, приводя к аномалиям скелета, характеризующимся уменьшением костной массы, как при остеопорозе, или увеличением костной массы, при остеопетрозе [Yang, S., Chen, W., Stashenko, P. and Li, Y-P, Journal of Cell Science. Oct. 1; 120:3362-71, (2007)]. Инфекции полости рта, такие как периодонтит и пульповое/прикорневое заболевание, вызывают врожденные и адаптационные иммунные ответы, защищающие хозяина от более обширной инфекции, но делают это ценой местного разрушения ткани и кости. Разрушение кости при описанных и других состояниях опосредуется остеокластами [Battaglino R, etc. J. Cell Biochem. 200(6):1387-94(2007)]. НПВС обладают противовоспалительным действием, благодаря чему КИП НПВС можно применять для лечения остеопороза, болезни Пагета, метастазов в кости, периодонтита и ревматоидного артрита у человека и животных. Новые клинические и молекулярные открытия позволяют предположить, что воспаление также оказывает значительное влияние на ремоделирование костей, включая остеопороз. Многочисленные воспалительные цитокины вовлечены в регуляцию остеобластов и остеокластов, и предполагают, что смещение иммунного профиля в сторону повышенной активности является важным фактором риска. Хроническое воспаление и иммунная система, управляющие характеристиками старения, а также другими патологическими состояниями, обычно связанными с остеопорозом, могут являться определяющими патогенетическими факторами [Lia Ginaldi, Maria Cristina Di Benedetto, and Massimo De Martinis (2005). Immunity & ageing, 2:14]. КИП НПВС можно применять для лечения остеопороза без побочных эффектов или с небольшими побочными эффектами.
Пример 101. Лечение остеопороза
[0357] Примерно 0,8 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на руки, ноги или любую другую часть кожи (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения остеопороза (возможно, на протяжении всей жизни).
Пример 102. Лечение остеопороза
[0358] Примерно 0,8 мл 8% диэтиламиноэтил-2-(пара-изобутилфенил) пропионата·HCl в 25% этаноле распыляли на руки, ноги или любую другую часть кожи (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения остеопороза (возможно, на протяжении всей жизни).
Пример 103. Лечение остеопороза
[0359] Примерно 0,8 мл 8% диэтиламиноэтил-1-метил-5-(4-метилбензоил)-1H-пиррол-2-ацетата·соли HCl в 25% этаноле распыляли на руки, ноги или любую другую часть кожи (каждый раз меняя место во избежание повреждения кожи) дважды в день. Процесс продолжали до излечения остеопороза (возможно, на протяжении всей жизни).
Пример 104. Предотвращение остеопороза
[0360] Для людей с высоким риском развития остеопороза, таких как пожилые люди, люди, брат или сестра-близнец которых страдают остеопорозом, люди с остеопорозом в семейном анамнезе, люди с мутациями в генах, связанных с остеопорозом, примерно 0,3 мл 8% диэтиламиноэтил-ацетилсалицилата·HCl в 25% этаноле распыляли на любую часть кожи тела (каждый раз меняя место во избежание повреждения кожи) один или два раза в день.
Пример 105. Действие N,N-диэтиламиноэтил-ацетилсалицилата и/или N,N-диэтиламиноэтил-жасмоната·лимоннокислого против вирусов, грибков и насекомых на персиковых деревьях
[0361] 240 персиковых дерева разделяли на 4 группы. Все полевые работы, касающиеся подготовки земли и применения удобрений, были одинаковыми для всех групп. Группа A (n=60) представляла собой контрольную группу без химических воздействий. Группа B (n=60) получала традиционную обработку фунгицидами и инсектицидами. Группа C (n=60) получала N,N-диэтиламиноэтил ацетилсалицилат плюс некоторые инсектициды. Группа D (n=60) получала N,N-диэтиламиноэтил-ацетилсалицилат и N,N-диэтиламиноэтил-жасмонат·лимоннокислый. В группе A были обнаружены курчавость листьев персика, парша персика, бурая гниль, черный сучок и другие грибковые болезни, и широкий ассортимент насекомых, заболонник морщинистый, стеклянница персиковая, стеклянница малая персиковая, плодожорка и другие заболевания и насекомые. Хороших (съедобных) плодов собрано не было. В группе B, на персиковые деревья группы B наносили 15 ноября 100 г фебрама [железа трис(диметилдитиокарбамат)] 76% смачивающийся порошок (СП) в 50 кг воды; на персиковые деревья группы B наносили 15 декабря 160 г сельскохозяйственной извести и 80 г серы 95% СП в 50 кг воды; на персиковые деревья группы B наносили 1 марта 100 г Даконила 2787 (хлорталонил) в 50 кг воды; на персиковые деревья группы B наносили 15 марта 80 г дифеноконазола [30% эмульгируемый концентрат (ЭК)] и 80 г пропиконазола (30% ЭК) в 50 кг воды; на персиковые деревья группы B наносили 2 апреля (начало покраснения) 125 г Каптана 50% СП, 95 г фебрама 76% смачивающийся порошок, 80 г серы 95% смачивающийся порошок, 60 г тиофанат-метила 50% СП в 50 кг воды; на персиковые деревья группы B наносили 15 апреля 125 г малатиона 50% ЭК, 125 г 1-нафтил-метилкарбамата 50% СП и 100 г диметоморфа 50% СП в 50 кг воды; на персиковые деревья группы B наносили 20 апреля 125 г каптана 50% СП и 60 г тиофанат-метила 50% СП в 50 кг воды; на персиковые деревья группы B наносили 25 апреля 1,5 кг M-Pede 49% жидкости в 50 кг воды; на персиковые деревья группы B наносили 8 мая 125 г каптана 50% СП, 100 г фебрама 76% смачивающийся порошок, 80 г серы 95% 5 смачивающийся порошок и 60 г тиофанат-метила 50% СП в 50 кг воды; на персиковые деревья группы B наносили 15 мая 125 г малатиона 50% ЭК, 125 г 1 нафтил-метилкарбамата 50% СП и 50 г миклобутанила (12,5% ЭК) в 50 кг воды; на персиковые деревья группы B наносили 8 июня 125 г каптана 50% смачивающийся порошок, 100 г фебрама 76% смачивающийся порошок, 80 г серы 95% 5 смачивающийся порошок и 60 г тиофанат-метила 50% СП в 50 кг воды; на персиковые деревья группы B наносили 16 июня 125 г малатиона 50% ЭК, 125 г 1-нафтил-метилкарбамата 50% СП и 100 г диметоморфа 50% СП в 50 кг воды; на персиковые деревья группы B наносили 26 июня 125 г каптана 50% СП и 60 г тиофанат-метила 50% СП в 50 кг воды; собрали 2500 кг хороших (съедобных) персиков. Группа C получала обработку N,N-диэтиламиноэтил ацетилсалицилатом. 50 г N,N-диэтиламиноэтил-ацетилсалицилата в 50 кг воды наносили на персиковые деревья группы C 15 ноября, 1 марта, 20 марта и 20 июня, 50 г N,N-диэтиламиноэтил ацетилсалицилата, 125 г малатиона 50% ЭК, 125 г 1-нафтил-метилкарбамата 50% СП и 60 г тиофанат-метила 50% СП в 50 кг воды наносили на персиковые деревья группы C 1 апреля, 20 апреля, 10 мая и 30 мая. Собрали 3000 кг хороших (съедобных) персиков. Группа D представляла собой группу, получавшую обработку N,N-диэтиламиноэтил-ацетилсалицилатом·HCl и N,N-диэтиламиноэтил-жасмонатом·лимоннокислым. 50 г N,N-диэтиламиноэтил-ацетилсалицилата в 50 кг воды наносили на персиковые деревья группы C 15 ноября, 1 марта и 20 марта. 50 г N,N-диэтиламиноэтил-ацетилсалицилата, 125 г малатиона 50% ЭК и 25 г N,N-диэтиламиноэтил-жасмоната·лимоннокислого в 50 кг воды наносили на персиковые деревья группы C 1 апреля, 20 апреля, 10 мая, 30 мая и 20 июня. Собрали 3200 кг хороших (съедобных) персиков. Полученные результаты показывают, что диэтиламиноэтил-ацетилсалицилат·HCl и N,N-диэтиламиноэтил-жасмонат·лимоннокислый обладают сильной активностью против бактерий, грибков и насекомых на персиковых деревьях. Требовалось лишь немного инсектицидов и фунгицидов, и был собран гораздо более высокий урожай в группах C и D по сравнению с другими группами. Трудозатраты в группах C и D были гораздо меньше, а даты сбора урожая в группах C и D наступили на 1 неделю раньше.
Пример 106. Действие N,N-диэтиламиноэтил-ацетилсалицилата и/или N,N-диэтиламиноэтил-жасмоната·лимоннокислого против вирусов, грибков и насекомых на красной виноградной лозе
[0362] 2 акра (8094 м2) виноградной лозы разделяли на 4 группы (по 1/2 акра каждая). Все полевые работы, касающиеся подготовки земли и применения удобрений, были одинаковыми для всех групп. Группа A представляла собой контрольную группу без химических воздействий. Группа B получала традиционную обработку фунгицидами и инсектицидами. Группа C получала N,N-диэтиламиноэтил-ацетилсалицилат. Группа D получала N,N-диэтиламиноэтил-ацетилсалицилат и N,N-диэтиламиноэтил-жасмонат·лимоннокислый. В группе A были обнаружены черная гниль, ложная мучнистая роса, настоящая мучнистая роса, антракноз, фомопсис, и другие грибковые болезни, и листовертка виноградная, стеклянница, бронзовка золотистая, хрущик японский, виноградный галл, и другие заболевания и насекомые. Хорошего (съедобного) винограда собрано не было. В группе B, на виноградные лозы группы B наносили 15 ноября 200 г фебрама 76% СП в 100 кг воды; на виноградные лозы группы B наносили 15 декабря 160 г серы 95% СП и 600 г гашеной извести в 100 кг воды; на виноградные лозы группы B наносили 10 марта 200 г Даконила 2787 в 100 кг воды; на виноградные лозы группы B наносили 20 марта 250 г каптана 50% СП и 200 г диметоморфа 50% СП в 100 кг воды; на виноградные лозы группы B наносили 30 марта 30 г (4’’R)-4’’-дезокси-4’’-(метиламино)авермектина B1 бензоата [proclaim®(banleptm)] 2% СП и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 10 апреля 200 г диметоморфа 50% СП и 200 г манкозеба 80% СП в 100 кг воды; на виноградные лозы группы B наносили 20 апреля 160 г дифеноконазола [30% эмульгируемый концентрат (ЭК)] и 160 г пропиконазола (30% ЭК) в 100 кг воды; на виноградные лозы группы B наносили 30 апреля 30 г (4’’R)-4’’-дезокси-4’’-(метиламино)авермектина B1 бензоата [proclaim®(banleptm)] 2% СП, 250 г 1-нафтил-метилкарбамата 50% СП и 100 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 10 мая 160 г дифеноконазола [30% эмульгируемый концентрат (ЭК)] и 160 г пропиконазола (30% ЭК) в 100 кг воды; на виноградные лозы группы B наносили 20 мая 250 г малатиона 50% ЭК, 250 г 1-нафтил-метилкарбамата 50% СП и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 30 мая 250 г каптана 50% смачивающийся порошок и 30 г (4’’R)-4’’-дезокси-4’’-(метиламино)авермектина B1 бензоата [proclaim®(banleptm)] 2% СП в 100 кг воды; на виноградные лозы группы B наносили 8 июня 250 г малатиона 50% ЭК, 250 г 1-нафтил-метилкарбамата 50% СП и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 18 июня 250 г каптана 50% смачивающийся порошок и 200 г фебрама 76% смачивающийся порошок в 100 кг воды; на виноградные лозы группы B наносили 25 июня 160 г серы 95% смачивающийся порошок и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 2 июля 250 г малатиона 50% ЭК, 250 г 1-нафтил-метилкарбамата 50% СП и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 10 июля 160 г дифеноконазола [30% эмульгируемый концентрат (ЭК)] и 160 г пропиконазола (30% ЭК) в 100 кг воды; на виноградные лозы группы B наносили 17 июля 250 г каптана 50% смачивающийся порошок, 200 г фебрама 76% смачивающийся порошок, 95% смачивающийся порошок и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 24 июля 250 г малатиона 50% ЭК, 250 г 1-нафтил-метилкарбамата 50% СП и 120 г тиофанат-метила 50% СП в 100 кг воды; на виноградные лозы группы B наносили 30 июля каптана 50% смачивающийся порошок, 200 г фебрама 76% смачивающийся порошок, 95% смачивающийся порошок и 120 г тиофанат-метила 50% СП в 100 кг воды. Собрали 5000 кг хорошего (съедобного) винограда. Группа C получала обработку N,N-диэтиламиноэтил ацетилсалицилатом. 100 г N,N-диэтиламиноэтил ацетилсалицилата в 100 кг воды наносили на виноградные лозы группы C 15 ноября, 20 февраля, 15 марта, 5 апреля, 15 мая и 25 июля. 100 г N,N-диэтиламиноэтил ацетилсалицилата и 200 г малатиона 50% эмульгируемого концентрата в 100 кг воды наносили на виноградные лозы группы C 25 апреля, 5 июня и 30 июня. Собрали 6300 кг хорошего (съедобного) винограда. Группа D представляла собой группу, получавшую обработку N,N-диэтиламиноэтил ацетилсалицилатом·HCl и N,N-диэтиламиноэтил жасмонатом·лимоннокислым. 100 г N,N-диэтиламиноэтил ацетилсалицилата·HCl в 100 кг воды наносили на виноградные лозы группы C 1 ноября, 20 февраля и 20 марта; 100 г N,N-диэтиламиноэтил ацетилсалицилата·HCl и 50 г N,N-диэтиламиноэтил жасмоната·лимоннокислого в 100 кг воды наносили на виноградные лозы группы D 5 апреля, 20 апреля, 5 мая, 20 мая, 5 июня, 20 июня, 5 июля и 20 июля. Собрали 6700 кг хорошего (съедобного) винограда. Полученные результаты показывают, что N,N-диэтиламиноэтил ацетилсалицилат·HCl и N,N-диэтиламиноэтил жасмонат·лимоннокислый обладают сильной активностью против бактерий, грибков и насекомых на виноградной лозе. Требовалось лишь немного инсектицидов и фунгицидов, и был собран гораздо более высокий урожай в группах C и D по сравнению с другими группами. Трудозатраты в группах C и D были гораздо меньше, а даты сбора урожая в группах C и D наступили на 10 дней раньше.
Пример 107. Действие N,N-диэтиламиноэтил-ацетилсалицилата против вирусов, грибков и насекомых на рисе
[0363] 2 акра (8094 м2) риса разделяли на 4 группы (по 1/2 акра каждая). Все полевые работы, касающиеся подготовки земли и применения удобрений, были одинаковыми для всех групп. Группа A представляла собой контрольную группу без химических воздействий. Группа B получала традиционную обработку фунгицидами и инсектицидами. Группа C получала N,N-диэтиламиноэтил-ацетилсалицилат. Группа D получала N,N-диэтиламиноэтил-ацетилсалицилат и N,N-диэтиламиноэтил-жасмонат·лимоннокислый. В группе A были обнаружены пирикуляриоз риса, ризоктониоз стеблей риса, пятнистость эпидермиса, гниль эпидермиса, стеблевая гниль, бурая пятнистость листьев, головня листьев риса, буроватая пятнистость листьев, твердая головня риса, пирикуляриоз метелок риса, и другие заболевания и насекомые. Собрали 200 кг некачественного риса. В группе B, на рис группы B наносили 1 июля 200 г валидамицина A 5% водный раствор в 100 кг воды; на рис группы B наносили 5 июля 30 г имидаклоприда 10% СП в 100 кг воды; на рис группы B наносили 12 июля 30 г имидаклоприда 10% СП и 200 г карбендазима 50% СП в 100 кг воды; на рис группы B наносили 20 июля 250 г малатиона 50% ЭК и 120 г пропиконазола (11,7%) в 100 кг воды; на рис группы B наносили 30 июля 200 г валидамицина A 5% водный раствор в 100 кг воды; на рис группы B наносили 8 августа 180 г хлорталонила 70% СП в 100 кг воды; на рис группы B наносили 17 августа 250 г малатиона 50% ЭК и 200 г валидамицина A 5% водный раствор в 100 кг воды; на рис группы B наносили 26 августа и 8 сентября 30 г имидаклоприда 10% СП и 200 г карбендазима 50% СП в 100 кг воды; на рис группы B наносили 20 сентября и 10 октября 250 г малатиона 50% ЭК и 200 г валидамицина A 5% водный раствор в 100 кг воды. Собирали 1500 кг хорошего риса. Группа C получала обработку N,N-диэтиламиноэтил-ацетилсалицилатом·HCl. 30 г имидаклоприда 10% СП и 100 г N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 100 кг воды наносили на рис группы C 1 июля, 12 июля, 25 июля, 10 августа, 25 августа, 10 сентября и 25 сентября. Собрали 1800 кг хорошего риса. Группа D представляла собой группу, получавшую обработку N,N-диэтиламиноэтил-ацетилсалицилатом·HCl и N,N-диэтиламиноэтил-жасмонатом·лимоннокислым, 50 г N,N-диэтиламиноэтил-жасмоната·лимоннокислого и 100 г N,N-диэтиламиноэтил-ацетилсалицилата·HCl в 100 кг воды наносили на рис группы D 1 июля, 12 июля, 25 июля, 10 августа, 25 августа, 10 сентября и 25 сентября. Собрали 1850 кг хорошего риса. Полученные результаты показывают, что N,N-диэтиламиноэтил-ацетилсалицилат·HCl и N,N-диэтиламиноэтил-жасмонат·лимоннокислый обладают сильной активностью против бактерий, грибков и насекомых на рисе. Требовалось лишь немного инсектицидов и фунгицидов, и был собран гораздо более высокий урожай в группах C и D по сравнению с другими группами. Даты сбора урожая в группах C и D наступили на 5 дней раньше.
Пример 108. Применение КИП простагландинов для стимуляции роста волос и роста ресниц
[0364] Примерно 0,2 мл 1% КИП N,N-диэтиламиноэтил 11,15-дигидрокси-9-оксопрост-13-ен-1-оата·HBr (КИП простагландина E1), N,N-диэтиламиноэтил-(Z)-7-{[(1R,2R,3R,5S)-3,5-дигидрокси-2-[1E,3S]-3-гидрокси-5-фенил-1-пентенил]-циклопентил}-5-N-этилгептеноата·HBr (КИП биматопроста), (13,14-дигидро-17-фенил-18,19,20-тринор PGF2αN,N-диэтиламиноэтилового сложного эфира, N,N-диэтиламиноэтил (Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(1E,3R)-3-гидрокси-4-[(α,α,α-трифтор-мета-толил)окси]-1-бутенил]циклопентил]-5-гептеноата·HBr или 13,14-дигидро-15-кето-20-этил PGF2αN,N-диэтиламиноэтилового сложного эфира в чистой воде наносили на область кожи вблизи ресниц (0,1 мл раствора на каждый глаз). После более чем 1 месяца лечения ресницы стали расти длиннее и обильнее.
[0365] Примерно 1 мл 1% КИП N,N-диэтиламиноэтил 11,15-дигидрокси-9-оксопрост-13-ен-1-оата·HBr (КИП простагландина E1), N,N-диэтиламиноэтил (Z)-7-{[(1R,2R,3R,5S)-3,5-дигидрокси-2-[1E,3S]-3-гидрокси-5-фенил-1-пентенил] циклопентил}-5-N-этилгептеноата·HBr (КИП биматопроста), (13,14-дигидро-17-фенил-18,19,20-тринор PGF2αN,N-диэтиламиноэтилового сложного эфира, N,N-диэтиламиноэтил (Z)-7-[(1R,2R,3R,5S)-3,5-дигидрокси-2-[(1E,3R)-3-гидрокси-4-[(α,α,α-трифтор-мета-толил)окси]-1-бутенил]циклопентил]-5-гептеноата·HBr или 13,14-дигидро-15-кето-20-этил PGF2αN,N-диэтиламиноэтилового сложного эфира в чистой воде наносили на кожу головы (передняя и боковые области). После более чем 1 месяца лечения волосы стали расти длиннее и обильнее.
[0366] Описанные выше КИП и другие КИП простагландинов могут стимулировать рост волос и рост ресниц, и могут быть очень полезны в косметический индустрии.
Пример 109. Применения КИП прогестерона
[0367] Прогестерон играет множество ролей, относящихся к развитию плода, нервной системе, иммунной системе и многим другим системам. Он может действовать как противовоспалительный агент и регулировать иммунные ответы. По причине плохой биодоступности прогестерона при пероральном приеме предпочтительным является трансдермальное введение. Вагинальное и ректальное применение также эффективны. ЭНДОМЕТРИН (прогестерон) вагинальный вкладыш 100 мг, одобрен FDA в июне 2007 для поддержания имплантации эмбриона и ранней беременности. Другими продуктами являются КРАЙНОН и PROCHIEVE биоадгезивные вагинальные гели с прогестероном, одобренные FDA для применения при бесплодии и ведении беременности. Прогестерон можно вводить при помощи инъекций. Его можно применять при лечении множественного склероза, поскольку характерное разрушение миелиновой оболочки нерва останавливается во время беременности, когда уровни прогестерона повышены. Его можно применять для предотвращения преждевременных родов у женщин с риском преждевременных родов. Его можно применять для поддержания молодости у мужчин и женщин. В моделях на животных наблюдали, что у самок понижена восприимчивость к травматическим повреждениям головного мозга [Roof RL, Hall ED (May 2000). “gender differences in acute CNS trauma and Stroke: neuroprotective effects of estrogen and progesterone”. J. Neurotrauma 17(5): 367-88.]. В клинических испытаниях на людях также были получены обнадеживающие результаты [Wright DW, et.al. (2007), Ann Emerg Med 49 (4): 391-402, 402 e1-2.; Xiao G, et. al. (2008) Crit Care 12(2): R61.]. механизмом эффективного действия прогестерона может быть уменьшение воспаления, следующего за травмой головного мозга [Pan DS, et. al. (2007), Biomed. Environ. Sci. 20(5): 432-8.]].
A). Лечение травмы головного мозга
[0368] Примерно 0,5 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимина·HCl в изопропаноле распыляли на шею, грудную клетку, лицо или любую часть кожи трижды в день. Процесс продолжали до излечения повреждения головного мозга.
B). Лечение инсульта
[0369] Примерно 0,5 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимина·HCl в изопропаноле распыляли на шею, грудную клетку, лицо или любую часть кожи трижды в день. Процесс продолжали до излечения инсульта.
C). Поддержка имплантации эмбриона и ранней беременности
[0370] Примерно 0,3 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимина·HCl в изопропаноле распыляли на любую часть кожи трижды в день. Процесс продолжали столько, сколько необходимо.
D). Лечение дискоидной красной волчанки
[0371] Примерно 0,3 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимин·HCl в изопропаноле распыляли на пораженную кожу трижды в день. Процесс продолжали до излечения дискоидной красной волчанки.
E). Лечение системной красной волчанки
[0372] Примерно 0,5 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимина·HCl в изопропаноле распыляли на кожу вблизи пораженных органов трижды в день. Процесс продолжали до излечения системной красной волчанки
F). Лечение множественного склероза (МС)
[0373] Примерно 0,5 мл 2% соли N-(4-N,N-диэтиламиноэтоксикарбонил)фенил-прогестеронимина·HCl в изопропаноле распыляли на кожу вблизи пораженных органов трижды в день. Процесс продолжали до излечения МС.
Пример 110. Транспорт КИП in vivo и применение КИП ипритов и родственных соединений для лечения рака
[0374] Исследование A: блокирование пролиферации клеток рака желудка человека HGC-27 под действием хлорамбуцила и соли N,N-диэтиламиноэтил 4-[бис(2-хлорэтил)амино]бензолбутират·HCl
[0375] Ингибирование пролиферации клеток измеряли при помощи теста с модифицированной солью диметил-тиазолил-дифенил-тетразолия (MTT) [3-(4,5-диметилтиазол-2-ил)-2,5-бифенилтетразолия бромид], основанном на способности живых клеток превращать голубой тетразолий в темно-синий формазан. Приблизительно 3500клеток HGC-27 (в 100 мкл культурального раствора) высевали на 96-луночные культуральные планшеты и культивировали в течение 16 часов при 37°С. Добавляли растворы (100 мкл) таксола (положительный контроль), хлорамбуцила или соли N,N-диэтиламиноэтил 4-[бис(2-хлорэтил)амино]бензолбутират·HCl (КИП хлорамбуцила) в различных концентрациях и продолжали инкубирование еще 72 часа при 37°С. Затем добавляли MTT, продолжали инкубирование при 37°С 4 часа и добавляли при помощи пипетки 100 мкл ДМСО для солюбилизации формазанового продукта в течение 30 минут при комнатной температуре. Измеряли поглощение при 570 нм при помощи считывающего устройства Bio-Rad micro-plate reader, хранившегося при -20°С до применения при электрофорезе. Полученные результаты приведены в таблице 110a.
[0376] Полученные результаты показали, что КИП хлорамбуцила обладает гораздо более сильным ингибирующим действием на рост раковых клеток, чем ее исходное лекарственное средство, хлорамбуцил.
[0377] Исследование B: для оценки противоопухолевой активности имплантировали мышам линию клеток миеломы человека, полученную из асцита пациента с множественной миеломой. Эксперимент проводили на 17 группах мышей. Контрольная группа (A, перорально), хлорамбуцил (группа B1: 1 мг/кг, перорально, группа B2: 3 мг/кг, перорально, группа B3: 1 мг/кг, трансдермально и группа B4: 3 мг/кг, трансдермально), мелфалан (группа C1: 1 мг/кг, перорально, группа C2: 3 мг/кг, перорально, группа C3: 1 мг/кг, трансдермально и группа C4: 3 мг/кг, трансдермально), N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутират·HBr (КИП хлорамбуцила) (группа D1: 1 мг/кг, перорально, группа D2: 3 мг/кг, перорально, группа D3: 1 мг/кг, трансдермально и группа D4: 3 мг/кг, трансдермально), и 4-[бис(2-хлорэтил)амино]-N-ацетил-L-фениламина N,N-диэтиламиноэтиловый эфир гидробромид (КИП мелфалана) (группа E1: 1 мг/кг, перорально, группа E2: 3 мг/кг, перорально, группа E3: 1 мг/кг, трансдермально и группа E4: 3 мг/кг, трансдермально). Полученные результаты приведены в таблице 110b.
[0378] Полученные результаты показывают, что КИП проявляют значительно более сильную противоопухолевую активность, чем исходные лекарственные средства КИП, и трансдермальное введение КИП лучше, чем пероральное введение КИП.
Пример 111. Противоопухолевая активность КИП ипритов
[0379] Согласно современным данным, существует очень мало различий между опухолевыми клетками и нормальными клетками. Почти все противораковые лекарственные средства разрушают как раковые, так и нормальные клетки, особенно быстро делящиеся нормальные клетки организма, такие как волосяные фолликулы, клетки, выстилающие желудочно-кишечный тракт, и клетки костного мозга, участвующие в системе иммунной защиты. Наиболее распространенными побочными эффектами современной химиотерапии являются тошнота, выпадение волос и повышенная восприимчивость к инфекции. Кроме того, существует множество других побочных эффектов, которые испытывают пациенты, страдающие раком.
[0380] КИП согласно настоящему изобретению можно вводить трансдермально. Трансдермальная доставка противоракового лекарственного средства имеет несколько преимуществ. Указанный способ помогает избежать непосредственного повреждения противораковыми лекарственными средствами желудочно-кишечного тракта и печени, и инактивирования лекарственных средств, вызываемого эффектом первого прохождения через печень и желудочно-кишечный тракт. Он может обеспечит местную доставку соответствующих концентраций лекарственного средства в предназначенное место действие без системного воздействия. В способах топического ведения можно применять гораздо меньшие количества лекарственных средств по сравнению с количествами, применяемыми в системных способах, и таким образом уменьшить побочные действия противораковых лекарственных средств.
[0381] Мышам имплантировали линию клеток миеломы человека, полученную из асцита пациента с множественной миеломой. Мышей разделяли на 11 групп: контрольная группа (A, перорально), мелфалан (B1 и B2, перорально), хлорамбуцил (C1 и C2, перорально), N,N-диэтиламиноэтил 4-[бис(2-хлорэтил)амино]бензолбутират·HBr (D1 и D2, трансдермально), 4-[бис(2-хлорэтил)амино]-N-ацетил-L-фенилаланина N,N-диэтиламиноэтиловый эфир гидробромид (E1 и E2, трансдермально в 5% водном растворе) и диэтиламиноэтил 4-[бис(2-метилсульфонилэтил)амино]бензолбутират·HCl (F1 и F2, трансдермально в 5% водном растворе). Потерю массы тела мышей определяли на 21 день.
[0382] Полученные результаты (таблица 111) показывают, что КИП ипритов имеют сильную противоопухолевую активность в дозе 1,5 мг/кг и вызывают меньше побочных эффектов (меньшую потерю массы) при трансдермальном введении КИП.
Пример 112. Лечение множественной миеломы
[0383] Примерно 0,2 мл 2% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в 50% этаноле распыляли на любой участок кожи тела (наносили каждый раз на новое место во избежание повторного повреждения кожи) дважды в день. Процесс продолжали до исчезновения состояния (множественной миеломы) (возможно, на протяжении всей жизни).
Пример 113. Лечение опухолей головного мозга
[0384] Примерно 0,1 мл 2% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в 50% этаноле наносили на кожу вблизи опухоли (наносили каждый раз на новое место во избежание повторного повреждения кожи) дважды в день. Процесс продолжали до исчезновения опухоли головного мозга.
Пример 114. Лечение опухолей головного мозга
[0385] Примерно 0,01 мл 5% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в чистой воде инъецировали в опухоль дважды в неделю. Процесс продолжали до исчезновения опухоли головного мозга.
Пример 115. Лечение рака кожи
[0386] Примерно 0,5 мл 0,1% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в 50% этаноле наносили на кожу с опухолью или на участок кожи вблизи опухоли дважды в день. Процесс продолжали до исчезновения рака кожи.
Пример 116. N,N-диэтиламиноэтил 4-[бис(2-хлорэтил)амино]бензолбутират·HBr для лечения рака молочной железы
[0387] 0,2 мл 5% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в чистой воде (или 50% этаноле) наносили непосредственно на поверхность кожи в области опухоли молочной железы, и повторяли указанный процесс каждые 3 дня. 0,2 мл 20% диэтиламиноэтил ацетилсалицилата в чистой воде (или 50% этаноле) наносили на ту же область дважды в день (не смешивая с первым лекарственным средством).
Пример 117. N,N-диэтиламиноэтил 4-[бис(2-хлорэтил)амино]бензолбутират·HBr для лечения лейкемий
[0388] 0,2 мл 20% N,N-диэтиламиноэтил-4-[бис(2-хлорэтил)амино]бензолбутирата·HBr в чистой воде (или 50% этаноле) наносили непосредственно на кожу любой части тела дважды в неделю (наносили каждый раз на новое место во избежание повреждения одного и того же участка кожи при длительном применении).
Пример 118. КИП против ожирения
КИП против ожирения у крыс Sprague Dawley
[0389] Пептиды играют огромное множество ролей в живой материи. Пептидные гормоны представляют собой самую большую группу гормонов. Они играют интереснейшую роль в жизненно важных процессах. К сожалению, пептиды и родственные соединения быстро подвергаются протеолизу под действием протеолитических ферментов. При пероральном приеме пептидов они разрушаются за несколько минут. Что касается инъекции, введение пептидов болезненно, и во многих случаях требует частых и дорогостоящих посещений врача для лечения хронических состояний.
[0390] Энтеростатины [Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR) и Ala-Pro-Gly-Pro-Arg (APGPR)] представляют собой пентапептиды, полученные с NH2-конца проколипазы после трипсинового отщепления и относятся к группе «кишечно-мозговых» пептидов. Они регулируют всасывание жира и могут применяться для лечения ожирения (Erlanson-Albertsson C, York D, Obes. Rev. 1997 Jul; 5(4): 360-72 и Sorhede M, Mei J, Erlanson-Albertsson C., J Physiol. 87:273-275, 1993).
[0391] 20 самок крыс Sprague Dawley (SD) (в возрасте 20 недель, массой 320-345 г) разделяли на 2 группы. В группе A на спину крыс (n=10) вводили 0,2 мл воды дважды в день в течение 30 дней. В группе B вводили трансдермально на спину крыс (n=10) 10 мг/кг H-Val-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3·HCl в 0,2 мл воды дважды в день в течение 30 дней. Полученные результаты приведены в таблице 118a.
[0392] Полученные результаты показывали, что пептид H-Val-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3·HCl эффективно уменьшает массу тела крыс. Крысы из контрольной группы были примерно на 17% тяжелее, чем крысы в группе, получавшей пептид.
КИП пептида против ожирения у мышей с ожирением (SLAC/DB/DB)
[0393] 20 мышей DB/DB с ожирением (SLAC/DB/DB) (в возрасте 16 недель, массой 55-60 г) разделяли на 2 группы. В группе A на спину мыши (n=10) вводили 0,1 мл воды дважды в день в течение 30 дней. В группе B на спину мыши (n=10) вводили трансдермально 15 мг/кг H-Val-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3·HCl в 0,2 мл воды дважды в день в течение 30 дней. Полученные результаты приведены в таблице 118b.
[0394] Полученные результаты показывают, что пептид H-Val-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3·HCl эффективно уменьшает массу тела мышей с ожирением. Мыши из контрольной группы были примерно на 26% тяжелее, чем мыши в группе, получавшей пептид.
Пример 119. Лечение ожирения
[0395] Примерно 0,3 мл 5% H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3·HCl в 25% этаноле наносили на шею, лицо, спину или любую другую часть кожи трижды в день. Дозировку необходимо регулировать для достижения здоровой массы.
Пример 120. HCl·H-Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln-OCH2CH3 для лечения болезни Альцгеймера
20 мг H-Asn-Ala-Pro-Val-Ser-Ile-Pro-Gln-OCH2CH3соли HCl растворяли в 0,5 мл чистой воды. Полученный раствор наносили трансдермально на шею, лицо, или любую часть кожи дважды в день, для лечения болезни Альцгеймера.
Пример 121. Минимальные ингибирующие концентрации (МИК) антимикробных средств и КИП антимикробных средств
[0396] Минимальные ингибирующие концентрации (МИК) антимикробных средств и КИП антимикробных средств оценивали согласно Jennifer M. Andrews, Journal of Antimicrobial Chemotherapy 48, suppl. S1, 5-16 (2001). Полученные результаты (таблицы 21) показывают, что КИП антимикробных средств способны преодолевать устойчивость к β-лактамам метициллин-резистентного золотистого стафилококка (МРЗС) согласно Минимальным ингибирующим концентрациям (МИК), и гораздо лучше, чем соответствующие исходные лекарственные средства. Исследовали следующие соединения: 6-феноксиацетацетамидопенициллановой кислоты 1-пиперидинэтилового эфира гидрохлорид (пенициллин V-PEE), пенициллин V, 6-(2,6-диметоксибензамидо)пенициллиновой кислоты 2-пирролидинметилового эфира гидрохлорид (метициллин-PME), метициллин, 7-[[(2-ацетиламино-4-тиазолил)(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты 2-диэтиламиноэтиловый эфир гидрохлорид (цефтизоксим-DEE), и цефтизоксим). КИП показали более сильное антимикробное действие, чем соответствующие исходные лекарственные средства.
Пример 122. Глиборнуридил-N,N-диметиламиноацетат·HCl для лечения диабета
A. Получение глиборнуридил-N,N-диметиламиноацетата·HCl
[0397] 367 г глиборнурида {N-[[(3-гидрокси-4,7,7-триметилбицикло[2.2.1]гепт-2-ил)амино]карбонил]-4-метилбензолсульфонамида и 120 мл триэтиламина растворяли в этилацетате (2 литра). Добавляли к реакционной смеси 150 г N,N-диметиламиноацетилхлорида. Полученную смесь перемешивали в течение 2 часов. Промывали полученную смесь водой (1×1 литр), 5% NaHCO3 (1×1 литр), водой (1×1 литр), 10% лимонной кислотой (1×1 литр) и водой (3×1 литр). Высушивали полученный раствор над сульфатом натрия. После удаления сульфата натрия через раствор пропускали 35 г газообразного HCl, выпавшее твердое вещество собирали при помощи фильтрования и промывали этилацетатом (3 x).
B. Система контролируемого высвобождения лекарственного средства
[0398] 1 мл 20% глиборнуридил-N,N-диметиламиноацетата·HCl в чистой воде (или 50% этаноле) помещали в резервуар, приспособленный для ношения вокруг руки, ноги или любой другой части тела, и имеющий проницаемое дно (площадью примерно 4 см2), обращенное к коже. Благодаря контролю скорости высвобождения раствора, указанная система делает возможным обеспечение постоянных терапевтических уровней глиборнуридил-N,N-диметиламиноацетата·HCl в крови для поддержания оптимального уровня глюкозы в крови.
Пример 123. Атенолол для управления гипертонией
[0399] 100 мг атенолола соли HCl растворяли в 1 мл чистой воды в резервуаре, приспособленном для ношения вокруг руки, ноги или любой другой части тела, и имеющем проницаемое дно (площадью примерно 4 см2), обращенное к коже. Благодаря контролю скорости высвобождения раствора, указанная система делает возможным обеспечение постоянных терапевтических уровней атенолола в крови для поддержания оптимального кровяного давления.
Пример 124. Дезогестрелил-N,N-диметиламиноацетат·HCl и этинилэстрадиолил-N,N-диметиламиноацетат·HCl для предотвращения беременности у женщин
[0400] 2 мг дезогестрелил-N,N-диметиламиноацетата·HCl и 0,4 мг этинилэстрадиолил-N,N-диметиламиноацетата·HCl смешивали с полиэтиленгликолем с образованием геля. Полученный гель помещали в пластырь (примерно 3 см2) для постоянного обеспечения оптимального уровня дезогестрела и этинилэстрадиола в крови для предотвращения беременности у женщин.
Пример 125. Применение КИП НПВС для лечения АБС
[0401] Не ограничиваясь конкретным механизмом, патогенез гибели клеток при амиотрофическом боковом склерозе (АБС) может включать опосредуемую глутаматом эксайтотоксичность, окислительное повреждение и апоптоз. Циклооксигеназа-2, присутствующая в нейронах спинного мозга и астроцитах, катализирует синтез простагландина E2. Простагландин E2 стимулирует высвобождение глутамата из астроцитов, поэтому циклооксигеназа-2 также играет ключевую роль в производстве воспалительных цитокинов, активных форм кислорода и свободных радикалов. Лечение селективным ингибитором циклооксигеназы-2, целекоксибом, заметно ингибирует производство простагландина E2 в спинном мозге мышей с АБС. Лечение целекоксибом значительно задерживает развитие слабости и потери веса и продлевает срок жизни на 25%. В спинном мозгу мышей с АБС, получавших лечение, показано значительное сохранение нейронов спинного мозга и уменьшенный астроглиоз и микробная активация (Merit. E. Cudkowicz, et al., Annals of neurology, 52, 771-778, 2002). Полученные результаты позволяют предположить, что ингибирование циклооксигеназы-2 может быть полезно для пациентов с АБС.
[0402] КИП НПВС согласно настоящему изобретению могут проникать через кожу и мембрану нервных клеток в очень высоком соотношении и могут вводиться трансдермально, не повреждая ЖК тракт, вот почему КИП представляют собой перспективные агенты для лечения амиотрофического бокового склероза (АБС), окулофарингеальной мышечной дистрофии (ОФМД), миотонической дистрофии (МД), мышечной дистрофии Дюшенна (МДД), полимиозита (ПМ), дерматомиозита (ДМ), миозита с включенными тельцами (МВТ) и других мышечных заболеваний.
Пример 126. Лечение седых волос или белых волос
[0403] Примерно 0,3 мл 8% соли диэтиламиноэтил-ацетилсалицилат·HCl в 25% этаноле распыляли на поверхность кожи под волосами или вокруг волос дважды в день. Процесс продолжали до восстановления нормального цвета волос.
Реферат
Группа изобретений относится к медицине. Описаны композиции интенсивного проникновения (КИП) исходного соединения, способные пересекать биологические барьеры с высокой эффективностью проникновения. КИП способны достигать областей, недостижимых для соответствующих исходных лекарственных средств или соединений, родственных исходным лекарственным средствам, или обеспечивать достаточные концентрации в целевых областях. КИП нестероидных противовоспалительных средств (НПВС показали эффективность при таких показаниях, как лечение выпадения волос. 2 н. и 2 з.п. ф-лы, 10 ил., 42 табл., 126 пр.
Формула





Документы, цитированные в отчёте о поиске
Противогрибковое покрытие для ногтей и способ егопроменения


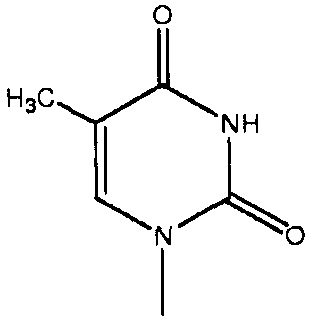










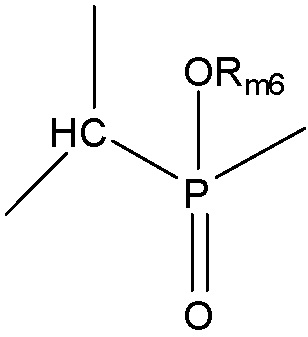












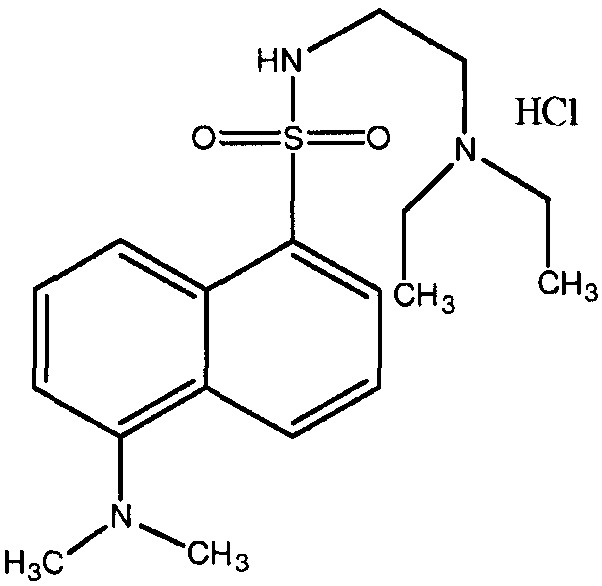

Комментарии