Аналоги бикалутамида или (s)-бикалутамид в качестве активирующих экзоцитоз соединений для применения в лечении расстройства лизосомного накопления или гликогеноза - RU2685269C2
Код документа: RU2685269C2
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение принадлежит области биомедицинской химии. Конкретнее, настоящее изобретение относится к области болезней лизосомного накопления и гликогеноза и, более конкретно, к их фармакологическому лечению молекулами, которые усиливают экзоцитоз.
УРОВЕНЬ ТЕХНИКИ
Болезни лизосомного накопления (LSD) и гликогеноз представляют собой генетические расстройства, связанные с накоплением макромолекул в клетках. При LSD накопление происходит внутри лизосом, также как в случае некоторых типов гликогеноза.
Болезни лизосомного накопления подробно задокументированы, как например, в Lysosomal Storage Disorders: Principles and Practice, byPastores, G.M., World Scientific (2009) или в Lysosomal Storage Diseases: Early Diagnosis & New Treatments by Rossella Parini et al., John Libbey Eurotext (2010)
Болезни лизосомного накопления по традиции классифицируют на основании их продукта накопления (сфинголипидозы и дефициты активатора сфинголипидов, мукополисахаридозы, гликопротеинозы и дефициты других ферментов) или природы их молекулярного нарушения (нарушение пост-трансляционной обработки лизосомных ферментов, нарушения лизосомальной мембраны и транспорта, нейронные липофусцинозы и нарушение биогенеза органелл, связанное с лизосомами). Существует более 50 LSD, которые наследуются аутосомно-рецессивным путем или сцеплены с X-хромосомой. Уровень заболеваемости LSD по всему миру составляет приблизительно 1 на 5000 живорожденных детей. Большая их часть обусловлена недостаточностью конкретного лизосомного гидролитического фермента, вовлеченного в расщепление специфичного субстрата, что ведет к его токсическому накоплению. В нескольких случаях патологические процессы обусловлены дефектным белком лизосомальной мембраны, неверным нацеливанием фермента или дефектной функцией активатора фермента [Hers HG, The role of lysosomes in the pathogeny of storage diseases. Biochimie. (1972), 54(5), 753-757; Scriver CR, Human genetics: lessons from Quebec populations. Annu. Rev. Genomics Hum. Genet. (2001), 2, 69-101; Tomanin etai, Gene therapy approaches for lysosomal storage disorders, a good model for the treatment of mendelian diseases. Acta Paediatr. (2012), 101(7), 692-701]. Разнообразие симптомов и изменчивость фенотипа при LSD лежат в широком диапазоне, в основном вследствие высокой аллельной гетерогенности, что приводит к серьезным нейродегенеративным и мультисистемным клиническим симптомам.
Гликогенозы представляют собой врожденные расстройства, которые поражают белки, вовлеченные в синтез или расщепление гликогена. Было описано более 9 различных типов гликогеноза в соответствии с хронологическим порядком идентификации ферментной недостаточности. Ткани, которые характеризуются более высоким содержанием гликогена, такие как мышцы или печень, в наибольшей степени поражаются этими заболеваниями. Наиболее типичными симптомами являются увеличение печени, гипогликемия, мышечные судороги, непереносимость физической нагрузки, подверженность утомляемости и прогрессирующая мышечная слабость. Гликогенозы имеют различные прогнозы от умеренных симптомов до тяжелых форм с ранней смертью. Также как в случае LSD, большая часть существующих способов лечения являются паллиативными. За последние годы появились различные стратегии лечения, такие как поддержание нормальной концентрации глюкозы в крови с помощью строгих диетических режимов (парентеральное или назогастральное питание) или трансплантации почки и/или печени при гликогенозе I и III типов, а также высокоуглеводной и белковой диеты при гликогенозах IV, VI и IX типов. Однако применимость этих видов лечения является ограниченной и не существует удовлетворительных видов лечения для прогрессирующей миопатии [Scriver CR, Human genetics: lessons from Quebec populations. Annu. Rev. Genomics Hum. Genet. (2001), 2, 69-101].
Отсутствие активности фермента, который ответственен за расщепление субстрата, приводит к токсическому накоплению указанного субстрата. Механизм, посредством которого накопленные материалы вызывают сильно выраженный каскад клеточных изменений (таких как, например, измененные гомеостаз кальция, пути передачи сигнала, направленное перемещение, воспаление и оксидативный стресс), является общим для LSD, но патофизиология этих заболеваний до сих пор не полностью понятна. Однако остаточная ферментативная активность зависит в основном от мутации, и в большинстве случаев тяжесть заболевания коррелирует со степенью ферментной недостаточности. Считается, что остаточная ферментативная активность, составляющая только 10-20% от нормальных значений, может быть достаточной для восстановления функции, что приводит к фенотипу дикого типа [Bidou et al, Premature stop codons involved in muscular dystrophies show a broad spectrum of readthrough efficiencies in response to gentamicin treatment Gene Ther (2004), 11(7), 619-627].
В течение многих лет лечение пациентов, страдающих от этих заболеваний, в основном заключалось в симптоматическом лечении. В последнее время появились новые стратегии лечения. На протяжении 90-х годов начали внедрять трансплантацию гемопоэтических стволовых клеток (HSCT), первую заместительную ферментную терапию (ERT) применили в 1991 году для болезни Гоше, начиная с 2000 года появились новые ERT для большего количества липосомных болезней и, впоследствии, субстрат-редуцирующая терапия (SRT). [Parenti, Treating lysosomal storage diseases with pharmacological chaperones: from concept to clinics. EMBO Mol Med (2009), 1(5), 268-279]. Эти виды лечения привели к определенным улучшениям при некоторых заболеваниях.
Трансплантация гемопоэтических стволовых клеток (HSCT) ограничивается конкретными заболеваниями и связана с высокими уровнями осложнений и смертности вследствие отторжения, токсичности, инфекций, вторичных опухолей или побочных явлений. Успеху этого вида лечения препятствует в основном возможность обнаружения идентичного донора. Этот вид лечения был протестирован на нескольких липосомных болезнях, но в большинстве из них были достигнуты незначительные клинические результаты; более того, некоторые из них показали сомнительные или отрицательные результаты. Этот вид лечения с некоторым успехом применялся только при мукополисахаридозе I типа (болезнь Гурлер), метахроматической лейкодистрофии, болезни Краббе, α-маннозидозе и мукополисахаридозе VI типа (синдром Марото-Лами), в числе прочего.
Заместительная ферментная терапия (ERT) применяется, когда присутствует ферментная недостаточность. Она подходит только для некоторых заболеваний и ограничена системным воздействием, так как ферменты не способны пересечь гематоэнцефалический барьер, и поэтому этот вид лечения не способен устранить проявления в центральной нервной системе. Более того, ERT не способна к улучшению симптомов со стороны костей и клапанов сердца или к действию при апоптозе или воспалении. В целом, она представляет собой хорошо переносимый вид лечения с низкой токсичностью и умеренными побочными эффектами. В свою очередь, требуется непрерывное внутривенное введение, кроме того она представляет собой очень дорогой и не такой уж эффективный вид лечения. На данный момент доступные виды лечения на основе ERT существуют для болезней Гоше, Фабри, Помпе и мукополисахаридоза I, II и VI типов.
Субстрат-редуцирующая терапия (SRT) стремится предотвратить накопление субстрата и восстановить метаболическое равновесие. Этот вид лечения на данный момент доступен только для болезней Гоше и Ниманна-Пика типа С.
Ограниченные результаты этих видов лечения являются результатом применения несовместимых доноров, возможной ошибки при пересадке и неспособности соединений пересекать гематоэнцефалический барьер. Эти виды лечения не являются на 100% эффективными, и в большинстве случаев наблюдается только частичное улучшение симптомов. Таким образом, существует потребность в разработке более эффективных и универсальных видов лечения, поскольку для большей части этих заболеваний не существует реального лечения.
В связи с этим недавно появились другие потенциальные стратегии, такие как применение фармакологических шаперонов или соединений, способных индуцировать сквозное прочитывание кодонов преждевременной терминации (РТС) [Kuzmiak et al, Applying nonsense-mediated mRNA decay research to the clinic: progress and challenges. Trends Mol Med. (2006), 12(7), 306-16; Floquet et al, Allele-specific therapy: suppression of nonsense mutations by readthrough inducers. Med. Sci. (Paris). (2012), 28(2), 193-199; Parenti G. Treating lysosomal storage diseases with pharmacological chaperones: from concept to clinics. EMBO Mol Med. (2009), 1(5), 268-279; Boyd et al, Pharmacological chaperones as therapeutics for lysosomal storage diseases. J. Med. Chem. (2013), 56(7), 2705-2725]. Также значительные успехи были получены в генной терапии, но она все еще далека от реализации в реальном клиническом применении [Tomanin et al., Gene therapy approaches for lysosomal storage disorders, a good model for the treatment of mendelian diseases. Acta Paediatr. (2012), 101(7), 692-701; Haurigot et al., Whole body correction of mucopolysaccharidosis III A by intracerebrospinal fluid gene therapy. J. Clin. Invest. (2013), in press]
Лечение с помощью фармакологических шаперонов было предложено и исследовано в качестве потенциального вида лечения многих генетических заболеваний, которые возникают в результате миссенс-мутаций, приводящих к неправильно свернутым и/или нестабильным белкам без вредного воздействия на активный сайт фермента, который сохраняет определенную остаточную активность. Фармакологические шапероны являются молекулами с малой молекулярной массой, способными связывать и стабилизировать мутантные белки, что содействует, тем самым, правильному сворачиванию и транспортировке к их месту действия. Некоторые фармакологические шапероны способны пересекать гематоэнцефалический барьер и большая их часть представляют собой обратимые конкурентные ингибиторы фермента, которые связываются с его каталитическим сайтом до тех пор, пока они не достигнут лизосомы, где они могут отделяться, сужая терапевтическое окно. Этот вид лечения ограничен специфическим типом мутации и, поскольку фармакологические шапероны представляют собой молекулы с малой молекулярной массой, они могут вмешиваться в другие метаболические пути. К настоящему времени было описано несколько фармакологических шаперонов для лечения нескольких лизосомных болезней (Фабри, Гоше, ганглиозидоза I и II типов, Помпе, Краббе, Баттена и Санфилиппо С) [Valenzano et al, Identification and characterization of pharmacological chaperones to correct enzyme deficiencies in lysosomal storage disorders. Assay Drug Dev. Technol. (2011), 9(3), 213-235], но реальность такова, что на рынке до сих пор нет доступного вида лечения.
Другой возможной стратегией лечения такого типа заболеваний, которую разрабатывают в данный момент, является применение соединений, способных индуцировать сквозное прочитывание кодонов преждевременной терминации (РТС). Этот вид лечения является зависимым от мутации и ограничен теми случаями, когда мутация белка представляет собой нонсенс-мутацию, другими словами, аминокислотную мутацию в преждевременный стоп-кодон и мутации, которые приводят к преждевременным стоп-кодонам путем сдвига рамки считывания, такие как делеции, вставки или сплайсинговые мутации. Был описан ряд соединений, аминогликозидов, в том числе гентамицин, которые способны индуцировать сквозное прочитывание РТС, что позволяет обеспечить полный синтез белка и избежать опосредуемого нонсенс-мутацией контролируемого пути распада укороченной мРНК, нонсенс-опосредованного распада мРНК (NMD). Эта стратегия была протестирована in vitro на двух болезнях лизосомного накопления: болезни Гурлер [Keeling et al., Gentamicin-mediated suppression of Hurler syndrome stop mutations restores a low level of alpha-L-iduronidase activity and reduces lysosomal glycosaminoglycan accumulation. Hum Mol Genet. (2001), 10(3):291-299] и цистинозе [Helip-Wooley et al., Expression of CTNS alleles: subcellular localization and aminoglycoside correction in vitro. Mol. Genet. Metab. (2002), 75(2): 128-133] с обнадеживающими результатами. К сожалению, аминогликозиды вызывают тяжелые побочные эффекты, в том числе ото- и нефротоксичность, что делает невозможным их длительное применение [Nudelman et al, Repairing faulty genes by aminoglycosides: development of new derivatives ofgeneticin (G418) with enhanced suppression of diseases-causing nonsense mutations. Bioorg. Med. Chem. (2010), 18(11):3735-46].
В документе WO 2010/015 816 A2 предложено лечение расстройств лизосомного накопления с применением различных иминосахаров, которые либо ингибируют синтез субстрата, не допуская его токсического накопления, либо действуют в качестве фармакологических шаперонов посредством стабилизации дефектного фермента и, тем самым, улучшают его активность.
В документе US 2013/0023488 А1 заявлен способ скрининга высокой производительности для идентификации соединений, способных снижать внутриклеточное накопление липидов. Этот документ основан на модели миопатии, вызванной патологическим накоплением нейтральных липидов, для идентификации соединений, способных активировать энергетический обмен окисления жирных кислот в направлении гликолиза. Хотя это означает, что показанные можно было бы применять для поиска видов лечения при определенных расстройствах, связанных с накоплением липидов и/или гликогена, но в этом направлении не было предусмотрено никаких исследований.
В документе WO 2011/109448 А1 раскрыт способ диагностики болезни Фабри с применением андрогеновых рецепторов, а также применение ингибитора синтеза андрогенов для лечения болезни Фабри. Этот документ посвящен исключительно патологической активности метаболического пути андроген/RA и количественной оценке его метаболитов, но не катаболизму гликосфинголипидов.
В некоторых документах описано применение соединений, способных активировать лизосомальный экзоцитоз для лечения определенных болезней лизосомного накопления. Например, в документе [Fannie W. Chen et al. Cyclodextrin induces calcium-dependent lysosomal exocytosis, PlosOne (2010), 5 (11), e15054] предполагается, что механизм экзоцитоза является путем, с помощью которого аналог циклодекстрина снижает накопление эндолизосомного холестерина в клетках пациентов, страдающих от болезни Ниманна-Пика типа С. В документе [Miao Xu et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type storage C1 and Wolman cholesterol disorders, JBC (2012), 287 (47), 39349-39360] описано снижение накопления холестерина и других липидов в лизосомах, возможно, путем увеличения лизосомального экзоцитоза с помощью лечения δ-токоферолом.
Таким образом, в существующем уровне техники имеется проблема, связанная с отсутствием универсальных активных соединений для лечения болезней лизосомного накопления и гликогеноза, поскольку к настоящему времени не было описано активного соединения, способного действовать посредством общего механизма, для лечения любого вида болезни лизосомного накопления.
Бикалутамид представляет собой пероральный нестероидный антиандроген, применяемый в лечении рака предстательной железы и гирсутизма. Изначально его применяли в 1995 году в комбинации с химической или хирургической кастрацией для лечения поздней стадии рака предстательной железы, а позже его также применяли в качестве монотерапии для лечения более ранних стадий указанного заболевания. Бикалутамид действует как настоящий антиандроген путем связывания с андрогеновыми рецепторами, а также путем предотвращения их активации и последующей положительной регуляции андроген-чувствительных генов с помощью андрогенных гормонов. Бикалутамид также ускоряет деградацию андрогеновых рецепторов. Бикалутамид вводят клинически в рацемической форме, а антиандрогенная активность обнаружена исключительно у (R)-энантиомера, в то время как (S)-энантиомер неактивен [Mukherjee, A. et al. Enantioselective binding of Casodex to the androgen receptor. Xenobiotica (1996), 26 (2), 117-22]. (R)-бикалутамид всасывается медленно и в виде насыщаемой формы, и не подвержен влиянию приема пищи. Его период полужизни в плазме составляет 1 неделю. (S)-бикалутамид всасывается быстрее, и он выводится из плазмы. Концентрация (R)-бикалутамида в плазме в состоянии равновесия в 100 раз превышает концентрацию (S)-бикалутамида [Cockshott Ian D. Bicalutamide: clinical pharmacokinetics and metabolism. Clinical pharmacokinetics (2004), 43 (13), 855-878]. Хотя отсутствие активности (S)-бикалутамида в качестве антиандрогена является известным, его вводят совместно с (R)-энантиомером в связи с его низкой токсичностью.
Парадоксальным образом, в настоящем изобретении показано, что лечение различных болезней лизосомного накопления с помощью (S)-бикалутамида и/или его структурных аналогов, соединений без какой-либо антиандрогенной активности, способно увеличивать клеточный экзоцитоз, уменьшая, тем самым, токсическое накопление субстратов внутри клеток, в основном внутри лизосом. Несмотря на то, что применение андрогеновых рецепторов для лечения болезни лизосомного накопления предложено в документе WO 2011/109448 А1, в существующем уровне техники нет и косвенного упоминания, что соединения, описанные в настоящем изобретении, соединения без антиандрогенной активности, будут действовать с увеличением клеточного экзоцитоза и, конкретнее, лизосомального экзоцитоза, поскольку (R)-бикалутамид представляет собой изомер с антиандрогенной активностью, в то время как (S)-бикалутамид не обладает активностью в качестве антиандрогена.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении решены некоторые из вышеупомянутых проблем существующего уровня техники и предусмотрено решение давно назревшей потребности в эффективных видах лечения болезней и/или расстройств лизосомного накопления и/или гликогеноза. В настоящем изобретении предусмотрено лечение болезней и/или расстройств лизосомного накопления и/или гликогеноза с помощью применения соединений, содействующих экзоцитозу, предпочтительно лизосомальному экзоцитозу.
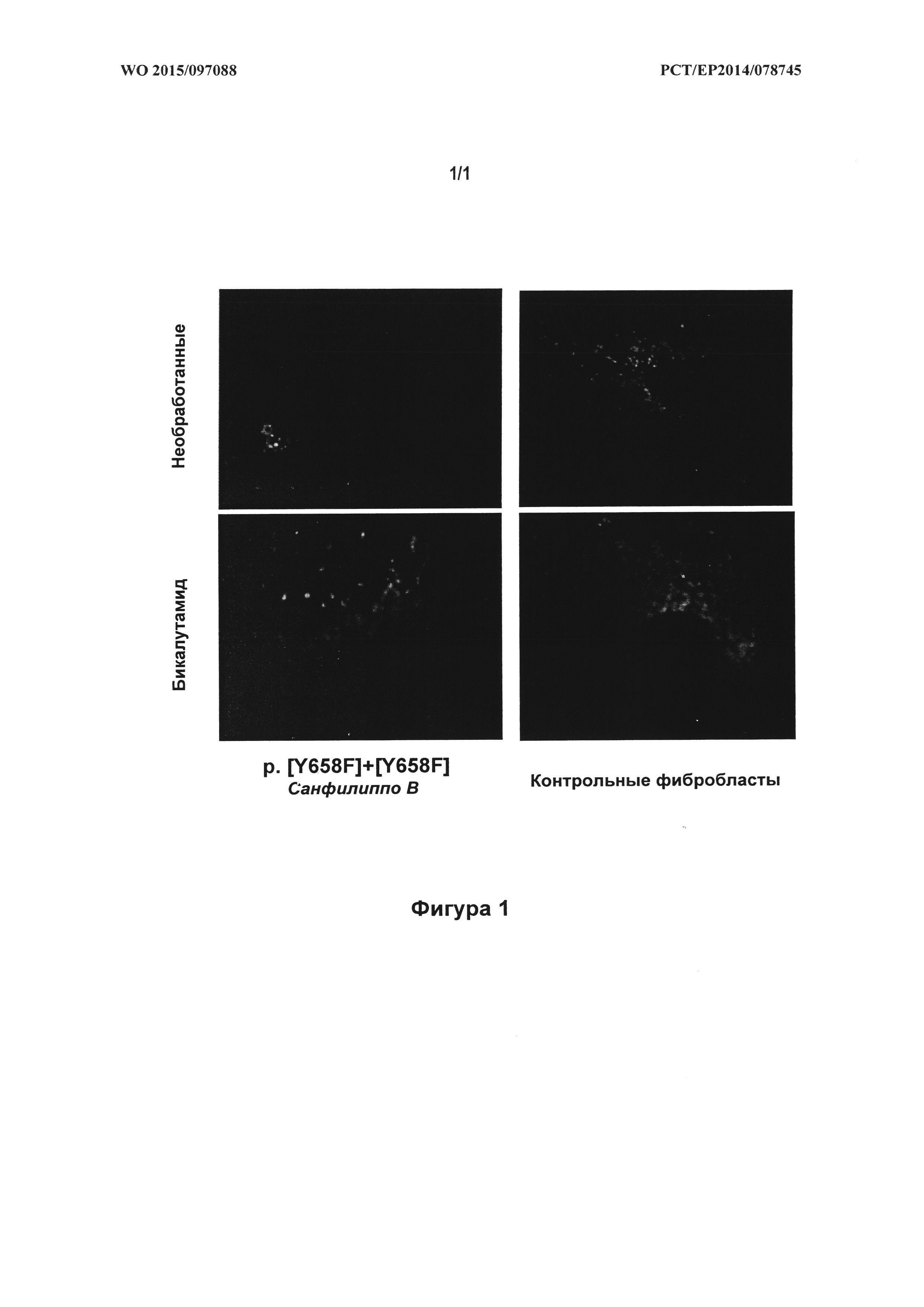
В настоящем изобретении описано универсальное лечение болезней и/или расстройств лизосомного накопления и/или гликогеноза с помощью применения (S)-бикалутамида и/или его структурных аналогов. В настоящем изобретении продемонстрировано, что обработка фибробластов у пациентов, пораженных различными типами болезней лизосомного накопления, с помощью (S)-бикалутамида и/или его структурных аналогов усиливает клеточный экзоцитоз и снижает токсическое накопление субстратов внутри клетки, в частности, в лизосомах. Снижение токсического накопления субстратов в лизосомах создает возможность для лечения и/или предотвращения клинических симптомов расстройств лизосомного накопления и, тем самым, в настоящем изобретении предусмотрено решение текущей потребности в существующем уровне техники в эффективных видах лечения этого типа расстройств и/или заболеваний.
Таким образом, в настоящем изобретении предусмотрено новое решение текущих потребностей, которое включает применение активности (S)-бикалутамида и/или его структурных аналогов для лечения болезней и/или расстройств лизосомного накопления и/или гликогеноза с помощью эффективной активации клеточного экзоцитоза. Универсальность лечения с помощью (S)-бикалутамида и/или его структурных аналогов в настоящем документе продемонстрирована с помощью обнадеживающих результатов, полученных при тестировании в отношении различных расстройств, что отличает его от известных в уровне техники видов лечения, которые специфичны в отношении каждого расстройства. В настоящем изобретении также показана важность стереохимии хирального центра бикалутамида и/или его структурных аналогов, что ясно исходя из эффективности (S)-энантиомера в сравнении с (R)-энантиомером. Парадоксальным образом, (S)-бикалутамид способствует экзоцитозу более эффективным образом, чем его энантиомер (R)-бикалутамид. Таким образом, (R)-бикалутамид является неэффективным при большинстве протестированных заболеваний и показывает слабую эффективность при остальных (хотя этот энантиомер показывает эффективность при некоторых из протестированных заболеваниях, его активность не является статистически значимой), в то время как (S)-бикалутамид эффективен при всех протестированных заболеваниях. В настоящем изобретении также продемонстрировано, что (S)-бикалутамид и/или его структурные аналоги (соединения без антиандрогенной активности) можно применять для лечения и/или предотвращения вредоносных клинических симптомов болезней и/или расстройств лизосомного накопления и/или гликогеноза. Это является преимуществом для лечения LSD у детей, поскольку лечение бикалутамидом (рацемической смесью) приостанавливает их половое развитие, в связи с антиандрогенным действием энантиомера (R)-бикалутамида. Более того, отсутствие антиандрогенной активности у (S)-бикалутамида будет предотвращать разрушительные побочные эффекты, обнаруженные при продолжительном лечении рака предстательной железы с помощью рацемической смеси вследствие антиандрогенной активности энантиомера (R)-бикалутамида.
Определения
В данный документ включены значения некоторых терминов и выражений, как они используются в контексте настоящего изобретения, с целью оказания содействия в понимании настоящего изобретения.
В контексте настоящего изобретения термин "бикалутамид" относится ко всем формам бикалутамида, таким как его рацемическая смесь или его отдельные энантиомеры (S)-бикалутамид (1) и (R)-бикалутамид (2), или их фармацевтически приемлемые соли, гидрат или сольват. Структуры (S)-бикалутамида [(2S)-N-[4-циано-3-(трифторметил)фенил]-3-[(4-фторфенил)сульфонил]-2-гидрокси-2-метилпропанамид] (1) и (R)-бикалутамида [(2R)-N-[4-циано-3-(трифторметил)фенил]-3-[(4-фторфенил)сульфонил]-2-гидрокси-2-метилпропанамид] (2) описаны ниже:

Термин "индивидуум" относится к любому организму, в отношении которого могут применяться соединения, описанные в настоящем изобретении, при этом их применяют с экспериментальными, диагностическими и/или терапевтическими целями. Индивидуум может представлять собой клетку, животное или человека.
Используемый в данном документе термин "лечение" означает введение соединения согласно настоящему изобретению для облегчения неблагоприятных клинических симптомов, вызванных заболеванием и/или расстройством, или уменьшения или устранения возникновения или тяжести одного или нескольких симптомов или физиологических эффектов, связанных с указанным заболеванием или расстройством. Лечение применяют до, во время и/или после появления первичных симптомов. Лечение можно применять в отношении индивидуума, у которого не проявляется никакой симптом заболевания и/или расстройства, в отношении индивидуума, у которого наблюдаются первичные симптомы заболевания и/или расстройства, или в отношении индивидуума, у которого наблюдается множество симптомов в поздней стадии заболевания и/или расстройства.
В контексте настоящего изобретения термин "диагностика" относится к способам диагностики, проводимым в отсутствие человеческого организма.
Используемый в данном документе термин "предотвращение" относится к способности соединения по настоящему изобретению откладывать или затруднять развитие заболевания и/или расстройства, а также как к его способности откладывать проявление симптомов или к их ослаблению.
В контексте настоящего изобретения термин "терапевтическая доза" относится к необходимому количеству соединения, раскрытого в настоящем изобретении, которое следует вводить индивидууму для получения медицинского или биологического положительного ответа, причем индивидуум представляет собой клетку, животное или человека, и при этом соединение вводится исследователем, врачом, ветеринаром или индивидуумом самостоятельно.
В контексте настоящего изобретения термин "терапевтическое средство" относится к любому средству или соединению, которое приводит к требуемому фармакологическому эффекту у индивидуума.
Используемый в данном документе термин "комбинированное лечение" относится к таким ситуациям, при которых два или более различных терапевтических средств вводят вместе индивиду, при этом индивидуум подвергается воздействию обоих терапевтических средств. Например, соединение по настоящему изобретению можно вводить совместно с другим терапевтическим средством либо одновременно, либо последовательно, в отдельных единичных дозах или в одной единичной дозе. Термин "последовательный" означает, что терапевтическое средство по настоящему изобретению можно вводить до, во время или после введения другого терапевтического средства. Термины "комбинированное лечение" и применение соединений "в комбинации" являются равнозначными терминами и они используются в настоящем изобретении для обозначения соединений или средств, которые вводят как часть одного и того же лечения.
В контексте настоящего изобретения термины "активность" или "фармакологическая активность" относятся к биологическому или медицинскому ответу вследствие обработки индивидуума соединением, раскрытым в настоящем изобретении, причем индивидуум представляет собой клетку, животное или человека и при этом соединение вводится исследователем, врачом, ветеринаром или индивидуумом самостоятельно. В конкретном варианте осуществления настоящего изобретения термин "ферментативная активность" относится к биологическому или медицинскому ответу фермента вследствие обработки индивидуума соединением, раскрытым в настоящем изобретении. Активность выражает количество преобразованного субстрата в единицу времени, с учетом объема реакционной смеси.
В контексте настоящего изобретения химический термин "энантиомер" относится к одному из двух стереоизомеров молекулы, каждый из которых является зеркальным отражением другого, и вследствие этого они являются ненакладываемыми (они не идентичны). Два возможных энантиомера молекулы с одним хиральным центром определяют как (R)- или (S)-энантиомеры и их определения можно найти в правилах IUPAC [international Union of Pure and Applied Chemistry, Basic terminology of stereochemistry, РАС (1996), 68(12), 2193-2222)]. Специалист в данной области может однозначно идентифицировать энантиомеры хиральной молекулы.
В контексте настоящего изобретения химический термин "структурный аналог" относится к соединению, которое имеет структуру, аналогичную другому соединению, но отличается определенными компонентами. Компоненты, по которым отличаются оба аналога могут представлять собой атомы, функциональные группы или подструктуры, которые заменены другими атомами, другими функциональными группами или другими подструктурами.
В контексте настоящего изобретения химический термин "функциональный аналог" относится к структурному аналогу, который обладает таким же типом фармакологической активности, что и соединение, с которым его сравнивают.
В контексте настоящего изобретения химический термин "структура" относится к группе атомов и связей, которые образуют молекулу.
В контексте настоящего изобретения химический термин "подструктура" относится к специфической части структуры, причем указанная структура образована четко выраженной и совершенно определенной группой из подструктур.
В контексте настоящего изобретения химический термин "функциональная группа" относится к группе атомов или связей внутри молекулы, которые имеют характерную реакционную способность и дополнительно обеспечивают молекулу характерными химическими свойствами. Одна и та же функциональная группа обладает аналогичными свойствами реакционной способности независимо от размера молекулы, которая ее содержит.
Термин "нециклическая алифатическая группа" используется в данном изобретении для охвата неразветвленных или разветвленных алкильных, алкенильных и алкинильных групп.
Термин «алкильная группа» относится к насыщенной, неразветвленной или разветвленной группе, имеющей от 1 до 24, предпочтительно от 1 до 16, более предпочтительно от 1 до 14, еще более предпочтительно от 1 до 12, еще более предпочтительно 1, 2, 3, 4, 5 или 6 атомов углерода, и которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к метильной, этильной, изопропильной, изобутильной, трет-бутильной, гептильной, октильной, децильной, додецильной, лаурильной, гексадецильной, октадецильной, амильной, 2-этилгексильной, 2-метилбутильной, 5-метилгексильной группе и т.п.
Термин "алкенильная группа" относится к неразветвленной или разветвленной группе, имеющей от 2 до 24, предпочтительно от 2 до 16, более предпочтительно от 2 до 14, еще более предпочтительно от 2 до 12, еще более предпочтительно 2, 3, 4, 5 или 6 атомов углерода, с одной или несколькими углерод-углеродными двойными связями, предпочтительно с 1, 2 или 3 углерод-углеродными двойными связями, сопряженными или несопряженными, которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к винильной (-СН2-CH2), аллильной (-CH2-СН=CH2), олеильной, линолеильной группам и т.п.
Термин "алкинильная группа" относится к неразветвленной или разветвленной группе, имеющей от 2 до 24, предпочтительно от 2 до 16, более предпочтительно от 2 до 14, еще более предпочтительно от 2 до 12, еще более предпочтительно 2, 3, 4, 5 или 6 атомов углерода, с одной или несколькими углерод-углеродными тройными связями, предпочтительно с 1, 2 или 3 углерод-углеродными тройными связями, сопряженными или несопряженными, которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к этинильной, 1-пропинильной, 2-пропинильной, 1-бутинильной, 2-бутинильной, 3-бутинильной, пентинильной группе, такой как 1-пентинильная группа, и т.п. Алкинильные группы также могут содержать одну или несколько углерод-углеродных двойных связей, в том числе, например и без ограничения, представлять собой бут-1-ен-3-инильную, пент-4-ен-1-инильную группу и т.п.
Термин "галоген" относится к атому фтора (F), хлора (Cl), брома (Br) или иода (I).
Термин "галогеналкановая группа" относится к насыщенной, неразветвленной или разветвленной группе, имеющей от 1 до 24, предпочтительно от 1 до 16, более предпочтительно от 1 до 14, еще более предпочтительно от 1 до 12, еще более предпочтительно 1, 2, 3, 4, 5 или 6 атомов углерода, полученной из алкановой группы путем замещения одного или нескольких атомов водорода атомами галогена, которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к трифторметильной, трихлорметильной, трифторбутильной, трибромпропильной, дибромметильной группам и т.п. Термин "перфторалкильная группа" относится к группе, где все атомы водорода были замещены атомами галогена.
Термин "алициклическая группа" используется в данном изобретении для охвата, например и без ограничения, циклоалкильных, или циклоалкенильных, или циклоалкинильных групп.
Термин "циклоалкил" относится к насыщенной моно- или полициклической алифатической группе, имеющей от 3 до 24, предпочтительно от 3 до 16, более предпочтительно от 3 до 14, еще более предпочтительно от 3 до 12, еще более предпочтительно 3, 4, 5 или 6 атомов углерода, и которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к циклопропильной, циклобутильной, циклопентильной, циклогексильной, циклогептильной, метилциклогексильной, диметилциклогексильной, октагидроинденовой, декагидронафталиновой, додекагидрофеналеновой группе и т.п.
Термин "циклоалкенил" относится к неароматической моно- или полициклической алифатической группе, имеющей от 5 до 24, предпочтительно от 5 до 16, более предпочтительно от 5 до 14, еще более предпочтительно от 5 до 12, еще более предпочтительно 5 или 6 атомов углерода, с одной или несколькими углерод-углеродными двойными связями, предпочтительно с 1, 2 или 3 углерод-углеродными двойными связями, сопряженными или несопряженными, которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к циклопент-1-ен-1-ильной группе и т.п.
Термин «циклоалкинил» относится к неароматической моно- или полициклической алифатической группе, имеющей от 8 до 24, предпочтительно от 8 до 16, более предпочтительно от 8 до 14, еще более предпочтительно от 8 до 12, еще более предпочтительно 8 или 9 атомов углерода, с одной или несколькими тройными углерод-углеродными связями предпочтительно с 1, 2 или 3 углерод-углеродными тройными связями, сопряженными или несопряженными, которая связана с остальной частью молекулы одинарной связью, в том числе, например и без ограничения, к циклоокт-2-ин-1-ильной группе и т.п. Циклоалкинильные группы также могут содержать одну или несколько углерод-углеродных двойных связей, в том числе, например и без ограничения, представлять собой циклоокт-4-ен-2-инильную группу и т.п.
Термин «арильная группа» относится к ароматической группе, имеющей от 6 до 30, предпочтительно от 6 до 18, более предпочтительно от 6 до 10, еще более предпочтительно 6 или 10 атомов углерода, которая содержит 1, 2, 3 или 4 ароматических кольца, связанных углерод-углеродной связью или конденсированных, в том числе, например и без ограничения, к фенильной, нафтильной, дифенильной, инденильной, фенантрильной или антранильной группе, среди прочего; или аралкильной группе.
Термин "аралкильная группа" относится к алкильной группе, замещенной ароматической группой, имеющей от 7 до 24 атомов углерода, и в том числе, например и без ограничения, к-(СН2)1-6-фенилу, -(CH2)1-6-(1-нафтилу), -(СН2)1-6-(2-нафтилу), -(СН2)1-6-СН(фенил)2 и т.п.
Термин "гетероциклильная группа" относится к углеводородному кольцу из 3-10 членов, в котором один или несколько атомов кольца, предпочтительно 1, 2 или 3 атома кольца, представляет собой элемент, отличающийся от углерода, такой как азот, кислород или сера, и которое может быть насыщенным или ненасыщенным. Для целей настоящего изобретения гетероцикл может быть циклической, моноциклической, бициклической или трициклической системой, которая может включать системы конденсированных колец; а атомы азота, углерода или серы могут быть необязательно окислены в гетероциклильном радикале; атом азота может необязательно быть кватернизован; а гетероциклильный радикал может быть частично или полностью насыщенным или может быть ароматическим. Более предпочтительно термин гетероциклил относится к кольцу из 5 или 6 членов. Примерами насыщенных гетероциклильных групп являются диоксан, пиперидин, пиперазин, пирролидин, морфолин и тиоморфолин. Примерами ароматических гетероциклильных групп, также известных как гетероароматические группы, являются пиридин, пиррол, фуран, тиофен, бензофуран, имидазолин, хинолеин, хинолин, пиридазин и нафтиридин.
Термин "гетероарилалкильная группа" относится к алкильной группе, замещенной с помощью замещенной или незамещенной ароматической гетероциклильной группы, где алкильная группа имеет от 1 до 6 атомов углерода, а ароматическая гетероциклильная группа от 2 до 24 атомов углерода и от 1 до 3 атомов, отличных от углерода, в том числе, например и без ограничения, к -(СН2)1-6-имидазолилу, -(СН2)1-6-триазолилу, -(СН2)1-6-тиенилу, -(СН2)1-6-фурилу, -(СН2)1-6-пирролидинилу и т.п.
Как понятно из данной области техники, определенная степень замещения может присутствовать в определенных выше группах. Следовательно, замещение может присутствовать в группах по настоящему изобретению, где это точно указано. Упоминания в данном документе замещенных групп в группах по настоящему изобретению указывают, что определенный радикал может быть замещен в одном или нескольких доступных положениях одним или несколькими заместителями, предпочтительно в 1, 2 или 3 положениях, более предпочтительно в 1 или 2 положениях, еще более предпочтительно в 1 положении.
Соединения для применения в настоящем изобретении
Таким образом, в первом аспекте настоящее изобретение относится к соединению (S)-бикалутамид и/или структурному аналогу в совокупности определяемым общей формулой (I),
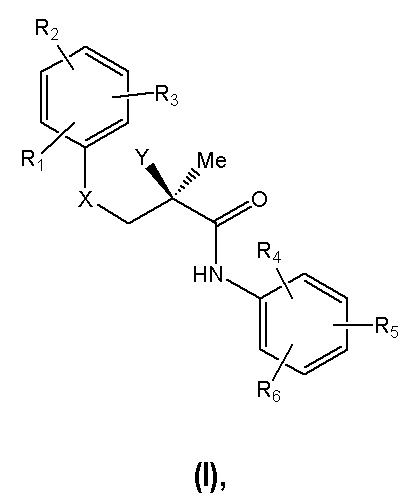
их фармацевтически приемлемым солям, их гидратам и/или их сольватам, где:
R1, R2 и R3 независимо выбраны из группы, состоящей из Н, замещенной или незамещенной нециклической алифатической группы, замещенной или незамещенной алициклильной группы, замещенной или незамещенной гетероциклильной группы, замещенной или незамещенной гетероарилалкильной группы, замещенной или незамещенной арильной группы, замещенной или незамещенной аралкильной группы, амино, аминоалкила, алкиламидо, замещенного или незамещенного ациламидо, алкоксила, замещенного или незамещенного алкилсульфонила, алкилтио, аминоацила, алканоиламино, аминодиацила, диалканоиламино, арилоксила, азидо, карбонилоксила, нитрила, замещенного или незамещенного диациламидо, галогена, изотиоцианата, замещенного или незамещенного нециклического галогеналкана, замещенного или незамещенного циклического галогеналкана, перфторалкана, гидроксила, изотиоцианата, нитро, оксикарбонила, тиола, замещенного или незамещенного тиоэфира;
R4, R5 и R6 независимо выбраны из группы, состоящей из Н, замещенной или незамещенной нециклической алифатической группы, замещенной или незамещенной алициклильной группы, замещенной или незамещенной гетероциклильной группы, замещенной или незамещенной гетероарилалкильной группы, замещенной или незамещенной арильной группы, замещенной или незамещенной аралкильной группы, амино, аминоалкила, алкиламидо, замещенного или незамещенного ациламидо, алкоксила, замещенного или незамещенного алкилсульфонила, алкилтио, аминоацила, арилоксила, азидо, карбонилоксила, нитрила, замещенного или незамещенного диациламидо, галогена, изотиоцианата, замещенного или незамещенного нециклического галогеналкана, замещенного или незамещенного циклического галогеналкана, перфторалкана, гидроксила, изотиоцианата, нитро, оксикарбонила, тиола, замещенного или незамещенного тиоэфира;
X выбран из группы, состоящей из S, SO, SO2 или О;
Y выбран из группы, состоящей из водорода, -ОН, -OR или -CONHR, где R представляет собой алкильную, галогеналкильную, дигалогеналкильную, тригалогеналкильную, арильную, фенильную группу, галоген, алкенильную или гликозильную группу или полимер полиэтиленгликоль;
для применения в диагностике, предотвращении клинических симптомов и/или лечении болезней и/или расстройств лизосомного накопления и/или гликогеноза.
Предпочтительно, R1, R2 и R3 независимо выбраны из группы, состоящей из Н, алкила, галогена, галогеналкана, амино, аминоалкила, аминоацила, алканоиламино, ациламидо, алкиламидо, аминодиацила, диациламидо, диалканоиламино, азидо, карбонилоксила, нитрила, нитро и гидроксила. Более предпочтительно, R1, R2 и R3 независимо выбраны из группы, состоящей из Н, галогена, амино, аминоацила, алканоиламино, диациламидо, диалканоиламино, нитрила, изотиоцианата и гидроксила. Еще более предпочтительно, R1, R2 и R3 независимо выбраны из группы, состоящей из Н, галогена, амино, ацетамидо, алкиламидо, галогеналкиламидо, алканоиламино, диалканолиламино, нитрила и изотиоцианата.
Предпочтительно, R4, R5 и R6 независимо выбраны из группы, состоящей из Н, алкила, галогена, галогеналкана, перфторалкана, нитрила, изотиоцианата, нитро, азидо, аминоацила, ациламидо, карбонилоксила и гидроксила. Более предпочтительно, R4, R5 и R6 независимо выбраны из группы, состоящей из Н, галогена, галогеналкана, перфторалкана, нитрила, изотиоцианата, нитро и гидроксила. Еще более предпочтительно, R4, R5 и R6 независимо выбраны из группы, состоящей из Н, галогена, трифторметила, нитрила, изотиоцианата и нитро.
Предпочтительно, Y выбран из группы, состоящей из -ОН, -OR или -CONHR, где R представляет собой алкильную, галогеналкильную или гликозильную группой или полимер полиэтиленгликоль.
Согласно предпочтительному варианту осуществления в соединении общей формулы (I) R1 выбран из группы, состоящей из водорода (Н), галогена (F, CI, Br или I), амино (-NH2), ацетамидо (-NHCOCH3), пропионамидо (-NHCOEt), N,N-диацетамидо (-NAc2), N,N-дипропионамидо (-N(COEt)2), 2-хлорацетамидо (-NHCOCH2Cl), нитрильной (-CN) или изотиоцианатной (-NCS) группы; R2 и R3 представляют собой водород (Н); R4 представляет собой трифторметильную группу (-CF3) или водород (Н); R5 представляет собой нитрильную (-CN) или нитро (-NO2) группу; R6 представляет собой водород (Н), X представляет собой тиоэфир (S), сульфоксид (SO), сульфон (SO2) или кислород (О), a Y представляет собой гидроксильную группу (ОН). Предпочтительно, R4 находится в мета-положении, a R5 находится в пара-положении, и соединения описываются общей формулой (II):

Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к соединению (S)-бикалутамид и/или структурному аналогу, в совокупности определяемым общей формулой (II),

их фармацевтически приемлемым солям, их гидратам и/или их сольватам, где:
R1 представляет собой водород (Н), галоген (F, Cl, Br или I), амино (-NH2), ацетамидо (-NHCOCH3), пропионамидо (-NHCOEt), N,N-диацетамидо (-NAc2), N,N-дипропионамидо (-N(COEt)2), 2-хлорацетамидо (-NHCOCH2Cl), нитрильную (-CN) или изотиоцианатную (-NCS) группу;
R4 представляет собой трифторметильную группу (-CF3) или водород (Н);
R5 представляет собой нитрильную (-CN) или нитро (-NO2) группу;
X представляет собой тиоэфир (S), сульфоксид (SO), сульфон (SO2) или кислород (О);
для применения в диагностике, предотвращении клинических симптомов и/или лечении болезней и/или расстройств лизосомного накопления и/или гликогеноза.
В более предпочтительном варианте осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), сульфоксид (SO) или сульфон (SO2), a Y представляет собой гидроксильную группу (ОН). Аналогичным образом в соединении общей формулы (II) R1 представляет собой фтор (F) в пара-положении, R4 представляет собой трифторметильную группу (CF3), R5 представляет собой нитрильную группу (CN), а X представляет собой тиоэфир (S), сульфоксид (SO) или сульфон (SO2).
Согласно еще более предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН), что соответствует структуре (5)-бикалутамида [(2S)-N-[4-циано-3-(трифторметил)фенил]-3-[(4-фторфенил)сульфонил]-2-гидрокси-2-метилпропанамид] (1). Аналогичным образом в соединении общей формулы (II) R1 представляет собой фтор (F) в пара-положении, R4 представляет собой трифторметильную группу (CF3), R5 представляет собой нитрильную группу (CN), а X представляет собой сульфон (SO2), что соответствует (S)-бикалутамиду (1). Таки м образом, в предпочтительном варианте осуществления настоящее изобретение относится к (S)-бикалутамиду для применения в диагностике, предотвращении клинических симптомов и/или лечении болезней и/или расстройств лизосомного накопления и/или гликогеноза.

Согласно еще более предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфоксид (SO), a Y представляет собой гидроксильную группу (ОН) (3). Аналогичным образом в соединении общей формулы (II) R1 представляет собой фтор (F) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой сульфоксид (SO) (3).

Согласно еще более предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (4). Аналогичным образом в соединении общей формулы (II) R1 представляет собой фтор (F) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (4).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой иод (I) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН) (5). Аналогичным образом в соединении общей формулы (II) R1 представляет собой иод (I) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой сульфон (SO2) (5).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН) (6). Аналогичным образом в соединении общей формулы (II) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой сульфон (SO2) (6).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН) (7). Аналогичным образом в соединении общей формулы (II) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой сульфон (SO2) (7).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН) (8). Аналогичным образом в соединении общей формулы (II) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой сульфон (SO2) (8).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой сульфон (SO2), a Y представляет собой гидроксильную группу (ОН) (9). Аналогичным образом в соединении общей формулы (II) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой сульфон (SO2) (9).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой иод в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (10). Аналогичным образом в соединении общей формулы (II) R1 представляет собой иод (I) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (10).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой изотиоцианатную группу (-NCS) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (11). Аналогичным образом в соединении общей формулы (II) R1 представляет собой изотиоцианатную группу (-NCS) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (11).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой изотиоцианатную группу (-NCS) в мета-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (12). Аналогичным образом в соединении общей формулы (II) R1 представляет собой изотиоцианатную группу (-NCS) в мета-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (12).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой аминогруппу (NH2) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (13). Аналогичным образом в соединении общей формулы (II) R1 представляет собой аминогруппу (NH2) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (13).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой аминогруппу (NH2) в мета-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (14). Аналогичным образом в соединении общей формулы (II) R1 представляет собой аминогруппу (NH2) в мета-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (14).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (15). Аналогичным образом в соединении общей формулы (II) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (15).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (16). Аналогичным образом в соединении общей формулы (II) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (16).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой N,N-диацетамидогруппу (NAc2) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (17). Аналогичным образом в соединении общей формулы (II) R1 представляет собой N,N-диацетамидогруппу (NAc2) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (17).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой пропионамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (18). Аналогичным образом в соединении общей формулы (II) R1 представляет собой пропионамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (18).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой N,N-дипропионамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (19). Аналогичным образом в соединении общей формулы (II) R1 представляет собой N,N-диацетамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой тиоэфир (S) (19).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой аминогруппу (NH2) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (20). Аналогичным образом в соединении общей формулы (II) R1 представляет собой аминогруппу (NH2) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (20).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (21). Аналогичным образом в соединении общей формулы (II) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (21).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (22). Аналогичным образом в соединении общей формулы (II) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (22).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой аминогруппу (NH2) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой нитрогруппу (NO2) в пара-положении, R5 и R6 представляют собой водород (Н), X представляет собой тиоэфир (S), а Y представляет собой гидроксильную группу (ОН) (23). Аналогичным образом в соединении общей формулы (II) R1 представляет собой аминогруппу (NH2) в пара-положении, R4 представляет собой водород (Н), R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (23).

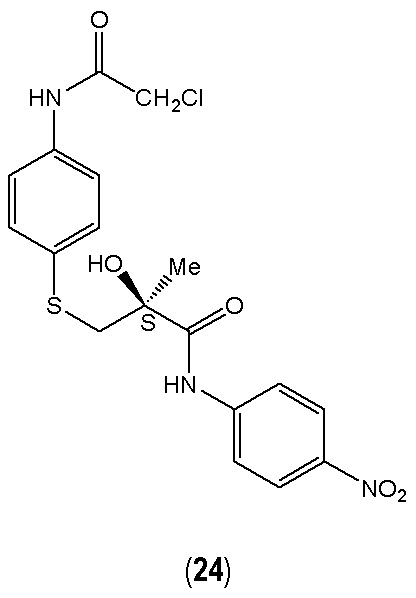
Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой нитрогруппу (NO2) в пара-положении, R5 и R6 представляют собой водород (Н), X представляет собой тиоэфир (S), а Y представляет собой гидроксильную группу (ОН) (24). Аналогичным образом в соединении общей формулы (II) R1 представляет собой 2-хлорацетамидогруппу в пара-положении, R4 представляет собой водород (Н), R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (24).
Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой изотиоцианатную группу (SCN-) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой нитрогруппу (NO2) в пара-положении, R5 и R6 представляют собой водород (Н), X представляет собой тиоэфир (S), а Y представляет собой гидроксильную группу (ОН) (25). Аналогичным образом в соединении общей формулы (II) R1 представляет собой изотиоцианатную группу (SCN-) в пара-положении, R4 представляет собой водород (Н), R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой тиоэфир (S) (25).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1, R2 и R3 представляют собой водород (Н), R4 представляет собой нитрильную группу (CN) в мета-положении, R5 представляет собой трифторметильную группу (CF3) в пара-положении, R6 представляет собой водород (Н), X представляет собой тиоэфир (S), a Y представляет собой гидроксильную группу (ОН) (26). Аналогичным образом в соединении общей формулы (II) R1 представляет собой водород (Н) в пара-положении, R4 представляет собой нитрильную группу (CN) в мета-положении, R5 представляет собой трифторметильную группу (CF3) в пара-положении, а X представляет собой тиоэфир (S) (26).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой нитрильную группу (CN) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой кислород (О), a Y представляет собой гидроксильную группу (ОН) (27). Аналогичным образом в соединении общей формулы (II) R1 представляет собой нитрильную группу (CN) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой кислород (О) (27).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой кислород (О), a Y представляет собой гидроксильную группу (ОН) (28). Аналогичным образом в соединении общей формулы (II) R1 представляет собой ацетамидогруппу (NHAc) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, а X представляет собой кислород (О) (28).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой хлор (Cl) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой метильную группу (СН3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой кислород (О), a Y представляет собой гидроксильную группу (ОН) (29). Аналогичным образом в соединении общей формулы (II) R1 представляет собой хлор (Cl) в пара-положении, R4 представляет собой метильную группу (СН3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой кислород (О) (29).

Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в пара-положении, R2 и R3 представляют собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, R6 представляет собой водород (Н), X представляет собой кислород (О), a Y представляет собой гидроксильную группу (ОН) (30). Аналогичным образом в соединении общей формулы (II) R1 представляет собой фтор (F) в пара-положении, R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрильную группу (CN) в пара-положении, а X представляет собой кислород (О) (30).

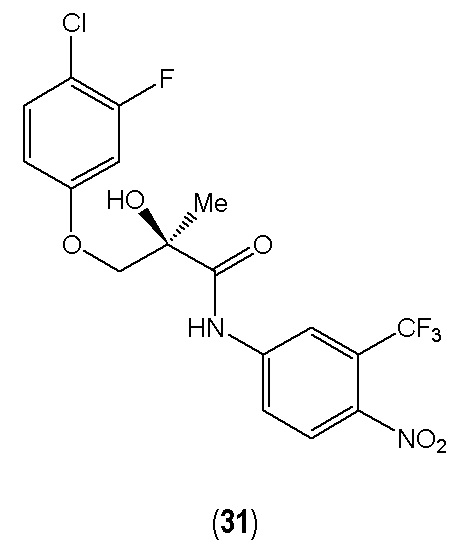
Согласно другому предпочтительному варианту осуществления в соединении общей формулы (I) R1 представляет собой фтор (F) в мета-положении, R2 представляет собой хлор (Cl) в пара-положении, R3 представляет собой водород (Н), R4 представляет собой трифторметильную группу (CF3) в мета-положении, R5 представляет собой нитрогруппу (NO2) в пара-положении, R6 представляет собой водород (Н), X представляет собой кислород (О), a Y представляет собой гидроксильную группу (ОН) (31).
Соединения по настоящему изобретению могут содержать в своей структуре детектируемый компонент или радиотерапевтический компонент. Под детектируемым компонентом понимают любой радиоактивный или флуоресцентный компонент, или позитивный контрастный компонент для визуализации магнитного резонанса, предпочтительно ион металла, который проявляет свойство детектируемости при диагностической методике in vivo. Под радиотерапевтическим компонентом понимают любой компонент, излучающий α-излучение, β-излучение или γ-излучение.
Настоящее изобретение относится к способу лечения, предотвращения клинических симптомов и/или диагностики болезней и/или расстройств лизосомного накопления и/или гликогеноза, который включает введение фармацевтически эффективного количества соединения (SJ-бикалутамид и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов.
Настоящее изобретение относится к применению соединения (S)-бикалутамид и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов в получении фармацевтической композиции для диагностики, предотвращения клинических симптомов и/или лечения болезней и/или расстройств лизосомного накопления и/или гликогеноза.
Во втором аспекте настоящее изобретение относится к соединению (S)-бикалутамид и/или структурному аналогу, в совокупности определяемым общей формулой (I) или общей формулой (II), их фармацевтически приемлемым солям, их гидратам и/или их сольватам для применения в диагностике, предотвращении клинических симптомов и/или лечении заболеваний и/или расстройств, при которых требуется стимуляция экзоцитоза и, более предпочтительно, лизосомального экзоцитоза.
Настоящее изобретение также относится к способу лечения, предотвращения клинических симптомов и/или диагностике заболеваний и/или расстройств, при которых требуется стимуляция экзоцитоза и, более предпочтительно, лизосомального экзоцитоза, который включает введение фармацевтически эффективного количества соединения (S)-бикалутамид и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов.
Настоящее изобретение относится к применению соединения (S)-бикалутамид и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов в получении фармацевтической композиции для предотвращения клинических симптомов и/или лечения заболеваний и/или расстройств, при которых требуется стимуляция экзоцитоза и, более предпочтительно, лизосомального экзоцитоза.
Соединения для применения по настоящему изобретению можно вводить в энантиомерно чистой форме или в качестве смеси энантиомеров, либо как рацемическую смесь, либо как смеси, содержащие энантиомерный избыток любого из двух энантиомеров. Предпочтительно соединения для применения по настоящему изобретению находятся в энантиомерно чистой форме или в смесях с энантиомерным избытком, превышающим 99%, превышающим 98%, превышающим 97%, превышающим 96%, превышающим 95%, превышающим 94%, превышающим 93%, превышающим 92%, превышающим 91%, превышающим 90%, превышающим 85%, превышающим 80%, превышающим 75%, превышающим 70%, превышающим 65%, превышающим 60%, превышающим 55% или превышающим 50%.
В контексте настоящего изобретения находятся фармацевтически приемлемые соли соединений для применения по настоящему изобретению. Термин «фармацевтически приемлемые соли» относится к соли, одобренной для применения ее у животных и, более конкретно, у человека, и включает в себя соли, которые применяют для образования солей присоединения основания, независимо от того, являются ли они неорганическими, например и без ограничения: литиевой, натриевой, калиевой, кальциевой, магниевой, марганцевой, медной, цинковой или алюминиевой, среди прочего, или органическими, например и без ограничения: этиламиновой, диэтиламиновой, этилендиаминовой, этаноламиновой, диэтаноламиновой, аргининовой, лизиновой, гистидиновой или пиперазиновой, среди прочего, или для образования солей присоединения кислоты, независимо от того, являются ли они органическими, например и без ограничения: ацетатной, цитратной, лактатной, малонатной, малеатной, тартратной, фумаратной, бензоатной, аспартатной, диаспартатной, триаспартатной, глутаматной, сукцинатной, олеатной, трифторацетатной, оксалатной, памоатной или глюконатной, среди прочего, или неорганическими, например и без ограничения: хлоридной, сульфатной, боратной или карбонатной, среди прочего. Природа соли не имеет решающего значения, при условии что она является фармацевтически приемлемой. Фармацевтически приемлемые соли соединений по настоящему изобретению можно получать с помощью общепринятых способов, хорошо известных в области техники [Berge S.M. et al., Pharmaceutical salts. J. Pharm. Sci. (1977), 66, 1-19].
В контексте настоящего изобретения термины болезнь лизосомного накопления и "расстройство лизосомного накопления" относятся к заболеваниям и/или расстройствам, вызванным или связанным с излишним и, следовательно, патологическим накоплением соединения в лизосомах. Термины "расстройства накопления гликогена" или "гликогеноз" относятся к группе заболеваний, вызванных накоплением гликогена вследствие нарушения в синтезе или расщеплении гликогена и, следовательно, гликоген накапливается в клетке в токсических количествах. Все клетки в организме могут поражаться болезнями лизосомного накопления или гликогенозом. Специалисту в данной области может быть известно, что снижение токсического накопления субстратов в клетке может приводить к лечению, предотвращению и/или облегчение клинических симптомов многих болезней лизосомного накопления и/или гликогеноза. Болезни и/или расстройства лизосомного накопления включают без ограничения α-маннозидоз, аспартилглюкозаминурию, β-маннозидоз, цистиноз, недостаточность α-N-ацетилгалактозаминидазы (болезнь Шиндлера), недостаточность аспартоацилазы или аминоацилазы (болезнь Канаван), множественную сульфатазную недостаточность (MSD), недостаточность стероидной сульфатазы, болезнь накопления сложных эфиров холестерина, болезнь Вольмана, болезнь Фабри, болезнь Фарбера, болезнь Гоше (I, II и III типа), болезнь Краббе (в том числе дебют в младенческом возрасте, поздний дебют и недостаточность активатора), болезнь Ниманна-Пика (типа А/В и С), фукозидоз, галактосиалидоз, GMI-ганглиозидоз (например, младенческий, детский/юношеский и взрослый/хронический), СМ2-ганглиозидоз (в том числе недостаточность активатора, болезнь Сандхоффа, болезнь Тея-Сакса), гликогеноз (например, гликогеноз I типа или болезнь фон Гирке, гликогеноз II типа или болезнь Помпе, гликогеноз IIb типа или болезнь Данона, гликогеноз V типа или болезнь Мак-Ардла и гликогеноз VII типа или болезнь Таруи), метахроматическую лейкодистрофию (в том числе все ее варианты и метахроматическую лейкодистрофию, вызванную недостаточностью активатора), нейрональные цероидлипофусцинозы (в том числе все их варианты от NCL1 до NCL10), муколипидоз I типа (сиалидоз, в том числе все его варианты, такие как младенческий или болезнь Салла и юношеский), муколипидоз II типа (болезнь I-клеток), муколипидоз IIIA типа или α/β (псевдогурлеровская полидистрофия), муколипидоз IIIC типа или γ, муколипидоз IV типа, мукополисахаридозы I типа (синдромы Гурлер, Шейе и Гурлер-Шейе), мукополисахаридозы II типа (синдром Хантера), мукополисахаридозы III типа (синдром Санфилиппо типа A/MPS IIIA, синдром Санфилиппо типа B/MPS IIIB, синдром Санфилиппо типа C/MPS NIC и синдром Санфилиппо типа D/MPS IIID), мукополисахаридозы IV типа (болезнь Моркио типа A/MPS IVA и болезнь Моркио типа B/MPS IVB), мукополисахаридозы VI типа (болезнь Марото-Лами), мукополисахаридозы VII типа (синдром Слая), мукополисахаридозы IX типа (недостаточность гиалуронидазы) и пикнодизостоз.
Предпочтительно болезни и/или расстройства лизосомного накопления выбраны без ограничения из синдрома Санфилиппо типа А, синдрома Санфилиппо типа В, синдрома Гурлер, болезни Тея-Сакса, болезни Гоше, болезни Фабри и болезни Ниманна-Пика типа А/В.
В контексте настоящего изобретения термины "экзоцитоз" или "клеточный экзоцитоз" относятся к клеточным процессам, с помощью которых клетка, посредством энергозависимого механизма, направляет секреторные везикулы за пределы клеточной мембраны и высвобождает их содержимое во внеклеточную среду. Более конкретно, термин "лизосомальный экзоцитоз" относится к тем процессам экзоцитоза, где везикулами экзоцитоза являются лизосомы.
В контексте настоящего изобретения термин "увеличение лизосомального экзоцитоза" относится к увеличению лизосомального экзоцитоза по сравнению с эталонным значением, обычно по сравнению со значением экзоцитоза у необработанной клетки. В некоторых вариантах осуществления обработка соединением (S)-бикалутамид и/или структурным аналогом, в совокупности определяемым общей формулой (I) или общей формулой (II), их фармацевтически приемлемыми солями, их гидратами и/или их сольватами, приводит к повышению лизосомального экзоцитоза по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95%, или по меньшей мере приблизительно удваивается, утраивается или даже увеличивает в большее число раз по сравнению со значением контроля, не обработанного упомянутым соединением.
Увеличение лизосомального экзоцитоза может количественно определить специалист в данной области, например in vitro, путем измерения ферментативной активности лизосомного фермента β-гексозаминидазы в культуральной среде [Xu М, et al, δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. J. Biol. Chem. (2012) 287(47), 39349-39360]. В других вариантах осуществления увеличение лизосомального экзоцитоза можно количественно определять с помощью анализа снижения гликозаминогликанов с применением анализа с 1,9-диметилметиленовым синим (DMB) по материалам Barbosa et al. [Barbosa et al, Improved and simple micro assay for sulfated glycosaminoglycans quantification in biological extracts and its use in skin and muscle tissue studies. Glycobiology. (2003), 13(9), 647-653]. В других вариантах осуществления лизосомальный экзоцитоз также можно наблюдать с помощью конфокальной микроскопии, отслеживая движение лизосом с помощью селективного мечения антителом кролика к LAMP1 с последующей инкубацией со вторичным антителом к антителу кролика, связанным с FITC [Medina D.L et al., Transcriptional activation of lysosomal exocytosis promotes celular clearance. Dev. Cell (2011) 21(3), 421-430].
В контексте настоящего изобретения термин "снижение гликозаминогликанов (GAG)" относится к снижению уровней гликозаминогликанов по сравнению с эталонным уровнем, причем эталонный уровень, как правило, представляет собой значение уровня гликозаминогликанов у индивидуума, не обработанного соединением. В некоторых вариантах осуществления обработка индивидуума соединением (S)-бикалутамид и/или структурным аналогом, в совокупности определяемым общей формулой (I) или общей формулой (II), их фармацевтически приемлемыми солями, их гидратами и/или их сольватами приводит к снижению уровней гликозаминогликанов по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% по сравнению со значением контроля, не обработанного упомянутым соединением.
"Фармацевтически эффективное количество" (S)-бикалутамида и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов, которое следует вводить, а также их дозировка, будут зависеть от многочисленных факторов, в том числе возраста, состояния пациента, природы или тяжести расстройства или заболевания, подлежащего лечению или предотвращению, пути и частоты введения, а также от особенностей соединений, подлежащих применению.
"Фармацевтически эффективное количество" следует понимать как нетоксическое, но достаточное для обеспечения требуемого эффекта количество соединения по настоящему изобретению. Для достижения требуемого эффекта соединения по настоящему изобретению применяют в фармацевтически эффективных концентрациях. В каждой дозе общее количество (S)-бикалутамида и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов, которые следует вводить, является эффективным для увеличения лизосомального экзоцитоза. Как правило, терапевтическая доза этих соединений находится в диапазоне от 0,1 до 125 мг на кг веса тела в сутки, при этом вводится количество от 1 до 2000 мг в сутки. Предпочтительно терапевтическая доза находится в диапазоне от 0,5 до 100 мг/кг, от 1 до 50 мг/кг, от 5 до 25 мг/кг, от 10 до 20 мг/кг. Предпочтительно количество соединения, вводимого в сутки, составляет от 0,1 до 2000 мг, от 0,5 до 1500 мг, от 1 до 1000 мг, от 5 до 750 мг, от 10 до 600 мг, от 20 до 400 мг, от 30 до 300 мг, и более предпочтительно составляет 50,100 или 150 мг.
Фармацевтические композиции и комбинированное лечение
Таким образом, в другом аспекте настоящее изобретение относится к фармацевтической композиции, которая содержит соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты для диагностики, предотвращения клинических симптомов и/или лечения болезней и/или расстройств лизосомного накопления и/или гликогеноза.
Фармацевтические композиции для применения по настоящему изобретению могут содержать по меньшей мере один фармацевтически приемлемый наполнитель. Количество и природа фармацевтически приемлемых наполнителей зависит от требуемого пути введения. Фармацевтически приемлемые наполнители хорошо известны специалистам в данной области [Rowe R.C., Sheskey P.J., Quinn, М.Е. (2009) "Handbook of Pharmaceutical Excipients, 6th Edition", Pharmaceutical Press and American Pharmacists Association]. Указанные композиции можно получать с применением стандартных способов, известных в данной области техники.
Фармацевтические композиции, которые содержат соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты, можно вводить любым подходящим путем, например, местным, энтеральным или парентеральным путем, и будут включены фармацевтически приемлемые наполнители, необходимые для состава, вводимого с помощью требуемого пути введения. Используемый в данном документе термин "местный" путь включает кожный и глазной пути, термин "энтеральный" путь включает введение в пищеварительную систему, такое как пероральный, трансбуккальный, желудочный, сублингвальный и ректальный пути, а термин "парентеральный" относится к назальному, ушному, глазному, вагинальному путям, подкожным инъекциям, внутрикожному, внутри сосудистому, например внутривенному, внутримышечному, внутриглазному, интраспинальному, внутричерепному, внутрисуставному, интратекальному и внутрибрюшному путям, а также к любой другой подобной методике инъекций и инфузий. Также рассматривается обработка in vitro, например, с помощью культивирования поврежденных клеток и/или стволовых клеток, а также обработка ex vivo. В более предпочтительном варианте осуществления обработку проводят in vivo, причем энтеральный путь является предпочтительным путем введения.
Фармацевтические композиции, содержащие соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты можно применять в различных типах составов для их энтерального введения, таких как без ограничения капсулы, в том числе желатиновые капсулы, мягкие капсулы, твердые капсулы, таблетки, в том числе таблетки с сахарным покрытием, пилюли, порошки, гранулированные формы, жевательные резинки, растворы, суспензии, эмульсии, сиропы, эликсиры, полисахаридные пленки, гели или желе, а также любых других лекарственных формах, известных из уровня техники. Соединения по настоящему изобретению можно составлять с обычными наполнителями и вспомогательными средствами для пероральных композиций, такими как без ограничения, жировые компоненты, водные компоненты, смачивающие средства, консерванты, структурирующие средства, отдушки, ароматизаторы, антиоксиданты и красящие средства.
Соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты также можно включать в системы доставки и/или системы пролонгированного высвобождения, такие как липосомы, милличастицы, микрочастицы и наночастицы, губчатые материалы, везикулы, мицеллы, миллисферы, микросферы и наносфефы, липосферы, милликапсулы, микрокапсулы и нанокапсулы, а также микроэмульсии и наноэмульсии, которые можно добавлять для достижения большей биодоступности действующего начала и/или улучшения его фармакокинетических и фармакодинамических свойств. Составы пролонгированного высвобождения можно получить с помощью способов, известных из уровня техники, и можно вводить, например, путем местного применения, в том числе пластырей, перорального, трансбуккального, сублингвального, желудочного, ректального, внутривенного, внутримышечного или подкожного введения, или путем непосредственной имплантации в определенную часть тела, и предпочтительно будет высвобождаться относительно постоянное количество соединений по настоящему изобретению. Количество соединения, содержащееся в составе пролонгированного высвобождения, будет зависеть, например, от места введения, кинетики и длительности высвобождения соединения, а также от природы состояния, подлежащего лечению или предотвращению.
Совместное введение соединения (S)-бикалутамид и/или структурного аналога, в совокупности определяемых общей формулой (I) или общей формулой (II), их фармацевтически приемлемых солей, их гидратов и/или их сольватов в комбинации с другими терапевтически активными средствами и фармацевтическими вспомогательными средствами можно осуществлять либо в одной фармацевтической композиции, либо в различных фармацевтических композициях. Комбинацию можно осуществлять как в одной, так и в различных фармацевтических формах.
Соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты можно вводить в комбинации по меньшей мере с одним вспомогательным средством, таким как без ограничения другие соединения, которые активируют лизосомальный экзоцитоз, такие как 5-токоферол или циклодекстрины, такие как 2-гидроксипропил-β-циклодекстрин, фармакологические шапероны, которые содействуют стабилизации белка, соединения, применяемые в видах субстрат-редуцирующей терапии (SRT), такие как N-бутил-дезоксиноиримицин или миглустат (Zavesca®), мигаластата гидрохлорид или дивоглустата гидрохлорид, ферменты, применяемые в видах заместительной ферментной терапии (ERT), антиоксидантные соединения, соединения, применяемые в генной терапии болезней и/или расстройств лизосомного накопления, и/или гликогеноза, и/или их смеси.
Фармацевтические композиции, содержащие соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты, могут содержать по меньшей мере одно вспомогательное средство, такое как без ограничения другие соединения, которые активируют лизосомальный экзоцитоз, такие как δ-токоферол или циклодекстрины, такие как 2-гидроксипропил-β-циклодекстрин, фармакологические шапероны, которые содействуют стабилизации белка, соединения, применяемые в видах субстрат-редуцирующей терапии (SRT), такие как N-бутил-дезоксиноиримицин или миглустат (Zavesca®), мигаластата гидрохлорид или дивоглустата гидрохлорид, ферменты, применяемые в видах заместительной ферментной терапии (ERT), антиоксидантные соединения, соединения, применяемые в генной терапии болезней и/или расстройств лизосомного накопления, и/или гликогеноза, и/или их смеси.
Примеры фармакологических шаперонов включают без ограничения 1-дезоксиноиримицин, ноиримицин-1-сульфоновую кислоту, N-(7-оксадецил)-1-дезоксиноиримицин, 2-ацетамидо-дезоксиноиримицин, 2-ацетамидо-1,2-дидезоксиноиримицин, 1-дезоксигалактоноиримицин, N-бутил-дезоксигалактоноиримицин, кастаноспермин, N-ацетилглюкозамин-тиазолин, галактозу, нитроинданон, пириметамин, миглустат, мигаластата гидрохлорид, дивоглустата гидрохлорид, 2,5-дидезокси-2,5-имино-D-альтритол, изофагомин, амброксол, дилтиазем, глюкозамин, их структурные аналоги, их соли и/или их смеси.
Примеры ферментов, применяемых в видах заместительной ферментной терапии (ERT) включают без ограничения природные ферменты, и/или их рекомбинантные синтетические формы, и/или их синтетических рекомбинантных мутантов N-аспартил-β-глюкозаминидазу, ацетил-СоА-α-глюкозаминид-N-ацетилтрансферазу, N-ацетилглюкозамин-6-сульфатазу, N-ацетилглюкозамин-1-фосфотрансферазу, α-N-ацетилглюкозаминидазу, α-N-ацетилнейраминидазу, сиалидазу, кислую церамидазу, кислую α-глюкозидазу, кислую мальтазу, аспартоацилазу, лизосомную кислую липазу, кислую сфингомиелиназу, арилсульфатазу А, арилсульфатазу В, α-L-фукозидазу, галактоцереброзидазу, галактозамин-6-сульфатазу, α-галактозидазу А, α-галактозидазу В, β-галактозидазу, галактозилцерамидазу, β-глюкоронидазу, β-глюкозидазу, β-глюкоцереброзидазу, гепаран N-сульфатазу, β-гексозаминидазу А, β-гексозаминидазу А/В, гиалуронидазу-1, α-L-идуронидазу, идуронат-2-сульфатазу, α-D-маннозидазу, β-маннозидазу и α-нейраминидазу и/или их смеси. Некоторые из этих ферментов являются коммерчески доступными, такие как Fabrazyme®, Replagal®, VPRIV®, Cerezyme®, Ceredase®, ELELYSO™, UPLYSO™, Aldurazyme®, Elaprase®, Naglazyme®, Lumizyme® или Myozyme®.
Примеры антиоксидантных соединений включают без ограничения некоторые витамины и их производные, а именно витамин А или ретинол, такие как ретин ил пал ьмитат и ретин ил ацетат, витамин С или аскорбиновую кислоту, такие как аскорбилпальмитат и аскорбилацетат, или витамин Е, в том числе токотриенол и токоферолы, такие как токоферолацетат; кофакторы витаминов и минералы, такие как кофермент Q10, марганец или иодид; идебенон; некоторые гормоны, такие как мелатонин; каротеноид-терпеноиды, такие как α-каротин, астаксантин, β-каротин, кантаксантин, лютеин, ликопен или зеаксантин; флавоны, такие какапигенин, лютеолин или танжеритин; флавонолы, такие как изорамнетин, кемпферол, мирицетин, проантоцианидины, кверцетин или рутин; флаваноны, такие как эриодиктиол, гесперитин или нарингенин; флаванолы и их полимеры, такие как катехин, галлокатехин, эпикатехин, эпигаллокатехин, теафлавин или теарубигин; фитоэстрогены-изофлавоны, такие как даидзеин, генистеин или глицитеин; стильбеноиды, такие как ресвератрол или птеростильбен; антоцианины, такие как цианидин, дельфинидил, мальвидин, пеларгонидин, пеонидин или петунидин; феноловые кислоты и их сложные эфиры, такие как цикориевая кислота, хлорогеновая кислота, коричная кислота, феруловая кислота, эллаговая кислота, эллагитаннин, галловая кислота, галлотаннины, розмариновая кислота или салициловая кислота; флавонолигнаны, такие как силимарин; ксантоны или эвгенол; другие органические антиоксиданты, такие как капсаицин, билирубин, лимонная кислота, щавелевая кислота, фитиновая кислота, N-ацетилцистеин, R-α-липоевая кислота, мочевая кислота, карнозин и их производные; липохроман-6 (диметилметоксихроманол), тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота), трет-бутилгидрохинон (TBHQ) и/или их смеси.
В другом конкретном варианте осуществления соединение (S)-бикалутамид и/или структурный аналог, в совокупности определяемые общей формулой (I) или общей формулой (II), их фармацевтически приемлемые соли, их гидраты и/или их сольваты можно вводить совместно с другими активными веществами лекарственных препаратов и/или вспомогательными средствами. Конкретнее, активные вещества лекарственных препаратов и/или вспомогательные средства выбирают без ограничения из группы, включающей антацидные средства, средства против пептических язв и гастроэзофагеальной рефлюксной болезни, спазмолитические средства, анальгетики, антихолинергические лекарственные средства, пропульсивные лекарственные средства, противорвотные средства, лекарственные средства от тошноты, средства для лечения желчевыводящих путей, средства для лечения печени, липотропные вещества, слабительные средства, средства против диареи, кишечные адсорбенты, антипропульсивные средства, противовоспалительные лекарственные средства, активные вещества против ожирения, ферменты, гипогликемические лекарственные средства, инсулин и аналоги, витамины, белки, минералы, анаболические стероиды, антитромботические средства, антифибринолитики, гемостатические средства, антиаритмические средства, сердечные стимуляторы, сердечные гликозиды, сосудорасширяющие средства, антиадренергические средства, гипотензивные лекарственные средства, диуретики, калийсберегающие средства, антигеморроидальные средства, лекарственные средства антиварикозной терапии, средства, стабилизирующие капилляры, средства, действующие на ренин-ангиотензиновую систему, бета-блокаторы, селективные блокаторы кальциевых каналов, неселективные блокаторы кальциевых каналов, ингибиторы АПФ, ингибиторы ангиотензина II, липид-модифицирующие средства, противогрибковые средства, лечебные средства, противозудные средства, антигистаминные средства, анестезирующие средства, антипсориазные средства, лекарственные средства для химиотерапии, кортикостероиды, антисептики, дезинфицирующие средства, средства против угрей, продукты для гинекологического применения, средства, стимулирующие родовую деятельность, противозачаточные средства, андроген, эстроген, прогестаген, стимуляторы овуляции, гонадотропины, антиандрогены, продукты для урологического применения, спазмолитики, лекарственные средства, применяемые при доброкачественной гипертрофии предстательной железы, гормоны, антагонисты гормонов, антибиотики, тетрациклины, амфениколы, бета-лактамные антибактериальные средства, пенициллин, сульфаниламидные средства, триметоприм, макролиды, линкозамиды, стрептограмины, антибактериальные аминогликозиды, антибактериальные хинолоны, противовирусные средства, иммунную сыворотку, иммуноглобулины, противоопухолевые средства, иммуномодулирующие средства, алкилирующие средства, антиметаболиты, растительные алкалоиды и другие природные продукты, цитотоксические антибиотики, иммуносупрессорные средства, лекарственные средства для лечения расстройств опорно-двигательного аппарата, противоревматические средства, миорелаксантные средства, средства, которые влияют на структуру и минерализацию кости, лекарственные средства, действующие на нервную систему, анестезирующие средства общего действия, местные анестетики, опиоиды, средства против мигрени, противосудорожные средства, антихолинергические средства, дофаминергические средства, антипсихотические средства, анксиолитики, снотворные средства, седативные средства, антидепрессанты, психостимуляторы, лекарственные препараты против деменции, парасимпатомиметики, лекарственные средства, применяемые при аддиктивных расстройствах, средства против головокружения, противопаразитарные средства, инсектициды, средства, отпугивающие насекомых, назальные противоотечные средства, муколитические средства, подавители кашля, офтальмологические активные вещества, отологические активные вещества, противоглаукомные лекарственные средства, миотические средства, мидриатические средства, средства для расширения зрачка и/или их смеси.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Фотографии, полученные с помощью конфокальной микроскопии фибробластов кожного происхождения от пациента, пораженного болезнью Санфилиппо В, и контрольных фибробластов от здорового индивидуума, обработанных антителом к LAMP-1 лизосомы.
ПРИМЕРЫ
Следующие конкретные примеры, представленные в данном документе, иллюстрируют природу настоящего изобретения. Эти примеры включены только в иллюстративных целях и не должны интерпретироваться как ограничивающие изобретение, заявленное в данном документе.
Экспериментальные процедуры
Культура фибробластов. Фибробласты от тринадцати пациентов, пораженных семью различными болезнями лизосомного накопления (Фабри, Гоше, Гурлер, Ниманна-Пика типа А/В, Санфилиппо А, Санфилиппо В и Тея-Сакса), культивировали в DMEM (среда Игла в модификации Дульбекко) с 10% фетальной бычьей сыворотки и в присутствии антибиотиков (пенициллин и стрептомицин) при 37°C с 5% СО2. Все реагенты были приобретены в РАА Laboratories (Велизи-Вилакубле, Франция). Фибробласты пациентов выбирали на основе доступности фибробластов и измеряемой остаточной активности. Использование образцов от человека было одобрено Комитетом по этике клиники больницы, Барселона.
Обработка и определение жизнеспособности клеток. Фибробласты раннего пассажа (от 5 до 9 пассажей) высевали в 6- или 24-луночные планшеты, в зависимости от теста, и на протяжении 72 часов обрабатывали возрастающими концентрациями (10 нмоль/л, 100 нмоль/л, 1 мкмоль/л, 10 мкмоль/л, 50 мкмоль/л и 100 мкмоль/л) бикалутамида (Sigma-Aldrich, Сент-Луис, США) и (R)- и (S)-бикалутамида (Toronto Research Chemicals Inc., Торонто (Онтарио), Канада). Жизнеспособность клеток оценивали в каждой линии клеток для каждой концентрации с применением анализа с 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромидом (МТТ) (Sigma-aldrich, Сент-Луис, США), описанного Sumantran V.N. Cellular chemosensitivity assays: an overview. Methods Mol. Biol. (2011), 731, 219-236.
Ферментативные активности. Фибробласты, которые культивировали в течение 72 ч. в 24-луночных планшетах в присутствии или отсутствии бикалутамида, (S)-бикалутамида, аналогов (S)-бикалутамида или (R)-бикалутамида при различных концентрациях в трех повторностях (10 нмоль/л, 100 нмоль/л, 1 мкмоль/л, 10 мкмоль/л, 50 мкмоль/л и 100 мкмоль/л), промывали физиологическим раствором. Клетки лизировали с помощью 3 циклов замораживание-оттаивание. Затем определяли концентрацию белка с помощью метода Лоури. Белковые лизаты (10 мкг) распределяли в 96-луночные планшеты и ферментативную активность фермента, вовлеченного в каждое заболевание, определяли в трех повторностях с помощью флуориметрических искусственных субстратов: 4-метилумбеллиферил-α-N-сульфоглюкозаминида в случае болезни Санфилиппо А, 4-метилумбеллиферил-2-ацетамидо-2-дезокси-α-D-глюкопиранозида в случае болезни Санфилиппо В, 4-метилумбеллиферил-α-L-идуронида в случае болезни Гурлер, 4-метилумбеллиферил-N-ацетил-р-0-глюкозамида в случае болезни Тея-Сакса, 4-метилумбеллиферил-β-D-глюкопиранозида в случае болезни Гоше, 4-метилумбеллиферил-α-галактопиранозида в случае болезни Фабри и 6-гексадеканоиламино-4-метилумбеллиферил-β-коллина в случае болезни Ниманна-Пика типа АВ. Активность фермента β-гексозаминидазы анализировали с помощью 4-метилумбеллиферил-2 ацетамидо-2 дезокси-β-D-глюкопиранозида в качестве искусственного субстрата [Annunziata etai, Study of influence of sex and age on human serum lysosomal enzymes by using 4-methylumbelliferyl substrates. Clin. Chim. Acta. (1978), 90(2), 101-106].
Определение лизосомального экзоцитоза. Лизосомальный экзоцитоз отслеживали путем измерения ферментативной активности лизосомного фермента β-гексозаминидазы в культуральной среде [Xu М, et al, δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. J. Biol. Chem. (2012) 287(47), 39349-39360]. Фибробласты предварительно обрабатывали различными концентрациями бикалутамида, (S)-бикалутамида или (R)-бикалутамида (10 нмоль/л, 100 нмоль/л, 1 мкмоль/л, 10 мкмоль/л, 50 мкмоль/л и 100 мкмоль/л) в трех повторностях в 24-луночных планшетах. Через 0, 24, 48 и 72 часов отбирали аликвоты по 30 мкл культуральной среды для последующего анализа активности β-гексозаминидазы.
Анализ LAMP1 на поверхности в качестве маркера экзоцитоза. Образцы фибробластов культивировали на покровных стеклах и обрабатывали 50 мкМ раствором бикалутамида, (S)-бикалутамида, аналогов (S)-бикалутамида или (R)-бикалутамида в течение 24 и 48 часов. Затем клетки инкубировали с антителами кролика к LAMP1 в течение 30 мин. при 4°C. Затем их промывали PBS и фиксировали 2% параформальдегидом. Клетки, обработанные антителами к LAMP1, инкубировали со вторичными антителами к антителам кролика, связанными с флуоресцеином (FITC), в течение 30 мин. при комнатной температуре [Medina D.L et al, Transcriptional activation of lysosomal exocytosis promotes cellular clearance. Dev. Cell. (2011) 21(3), 421-430]. В конечном итоге, клетки наблюдали на конфокальном микроскопе (Leica TCS-NT).
Определение гликозаминогликанов (GAG). Количественную оценку GAG осуществляли с помощью анализа с 1,9-диметилметиленовым синим (DMB), адаптированным из Barbosa et al (2003) [Barbosa et al, Improved and simple micro assay for sulphated glycosaminoglycans quantification in biological extracts and its use in skin and muscle tissue studies. Glycobiology. (2003), 13(9), 647-653]. Фибробласты культивировали в трех повторностях в 6-луночных планшетах и их собирали через 72 часа после обработки. Оптическую плотность DMB измеряли в двух повторностях при 656 нм с помощью считывающего устройства для микропланшетов (POLARstar Omega, BMG LABTECH, Оффенбург, Германия).
Сокращения
Сокращения, используемые в настоящем описании, имеют следующие значения:
Ас, ацетил; Br, бром; Cl, хлор; CF3; трифторметил; CN, нитрил; СО2, двуокись углерода; DMEM, среда Игла в модификации Дульбекко; DMB, 1,9-диметилметиленовый синий; F, фтор; FITC, флуоресцеинизотиоцианат; GAG, гликозаминогликаны; I, иод; кг, килограмм; л, литр; LAMP1, лизосома-ассоциированный мембранный белок 1; мг, миллиграмм; МТТ, 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид; нмоль, наномоль; NO2, нитро; -NHAc, ацетамидо; -NAc2, N,N-диацетамидо; PBS, забуференный фосфатом физиологический раствор; SCN-, изотиоцианат; мкг, микрограмм; мкл, микролитр; мкМ, микромолярный; мкмоль, микромоль;
ПРИМЕР 1. Увеличение лизосомального экзоцитоза в фибробластах пациентов, пораженных различными болезнями лизосомного накопления, после обработки бикалутамидом (рацемическая смесь).
Фибробласты от двух пациентов, пораженных болезнями Санфилиппо В и Гурлер, обрабатывали различными концентрациями бикалутамида (рацемическая смесь при возрастающих концентрациях 0,01, 0,1, 1, 10 и 100 мкМ). При этом увеличение лизосомального экзоцитоза определяли с помощью анализа ферментативной активности лизосомного фермента β-гексозамидазы в культуральной среде. Результаты, выраженные в виде процентного увеличения относительно значений активности, полученных для необработанных фибробластов, показали увеличение ферментативной активности в культуральной среде от 23 до 100% в фибробластах пациента, пораженного болезнью Санфилиппо В, и от 3 до 14% в фибробластах пациента, пораженного болезнью Гурлер. Обработка бикалутамидом увеличивает активность лизосомного фермента β-гексозамидазы в культуральной среде, что, таким образом, указывает на увеличение лизосомального экзоцитоза.

ПРИМЕР 2. Снижение гликозаминогликанов (GAG) в фибробластах от различных пациентов, пораженных несколькими болезнями лизосомного накопления, обработанных бикалутамидом (рацемическая смесь).
Фибробласты от трех пациентов, пораженных болезнью Санфилиппо В, и одного пациента, пораженного болезнью Гурлер, обрабатывали возрастающими концентрациями бикалутамида (рацемическая смесь при возрастающих концентрациях 0,01, 0,1,1,10 и 100 мкМ). Уровни гликозаминогликанов (GAG) количественно определяли с помощью анализа с 1,9-диметилметиленовым синим (DMB). Результаты, выраженные в виде процентного снижения относительно значения активности, полученного для необработанных фибробластов, показали сниженное накопление GAG в фибробластах троих пациентов, пораженных болезнью Санфилиппо В, обработанных бикалутамидом, от 17 до 54% в случае первого пациента, от 16 до 20% в случае второго пациента и от 13 до 53% в случае третьего пациента. GAG не были обнаружены в фибробластах пациента, пораженного болезнью Гурлер. Таким образом, обработка бикалутамидом фибробластов разных пациентов, пораженных различными болезнями лизосомного накопления, снижает уровни накопленных GAG, что выявляет повышение лизосомального экзоцитоза.

ПРИМЕР 3. Жизнеспособность клеток у фибробластов от девяти пациентов, пораженных различными болезнями лизосомного накопления, обработанных энантиомерно чистым бикалутамидом. Сравнение эффективности двух энантиомеров.
Фибробласты от тринадцати пациентов с различными болезнями лизосомного накопления (четыре пациента, пораженные болезнью Санфилиппо В, при этом пациенты с различным генотипом, три пациента с болезнью Санфилиппо А с различными генотипами, два пациента с болезнью Тея-Сакса с одинаковым генотипом, один пациент с болезнью Гоше, один пациент с болезнью Ниманна-Пика А/В, один пациент с болезнью Гурлер и один пациент с болезнью Фабри) независимо обрабатывали различными концентрациями (R)- и (S)- бикалутамида (50 и 100 мкМ). Жизнеспособность клеток оценивали для каждой обработки в каждой клеточной линии с помощью МТТ-анализа. Пять культур фибробластов пациентов, обработанных (R)-бикалутамидом, показали значительное снижение жизнеспособности их клеток (от 10 до 52%). В противоположность этому, обработка (S)-бикалутамидом в тринадцати культурах фибробластов не показала какого-либо значительного снижения жизнеспособности клеток, что указывает на более высокую токсичность энантиомера (R) и нетоксичный эффект энантиомера (S).


ПРИМЕР 4. Увеличение экзоцитоза в фибробластах от пациентов, пораженных различными болезнями лизосомного накопления, обработанных энантиомерно чистым бикалутамидом. Сравнение эффективности обоих энантиомеров.
Фибробласты от тринадцати пациентов, пораженных различными болезнями лизосомного накопления (четыре пациента с болезнью Санфилиппо В с различными генотипами, три пациента с болезнью Санфилиппо А с различными генотипами, два пациента с болезнью Тея-Сакса с одинаковым генотипом, один пациент с болезнью Гоше, один пациент с болезнью Ниманна-Пика А/В, один пациент с болезнью Гурлер и один пациент с болезнью Фабри), независимо обрабатывали различными концентрациями (R)- и (S)- бикалутамида (50 и 100 мкМ) в течение 72 часов. Результаты показывают, что (S)-бикалутамид способен значительно увеличивать лизосомальный экзоцитоз у десяти из тринадцати обработанных клеточных культур, в то время как (R)-бикалутамид был способен значительно увеличить лизосомальный экзоцитоз только в одной из протестированных клеточных культур. Обработка (S)-бикалутамидом является более эффективной и универсальной, чем обработка (R)-бикалутамидом. У фибробластов, обработанных (S)-бикалутамидом, показано увеличение экзоцитоза через 72 ч., которое было значимым и зависимым от дозы. Обработка (R)-бикалутамидом привела к некоторому увеличению экзоцитоза, но оно не было зависимым от дозы и статистически значимым (таблица 4).
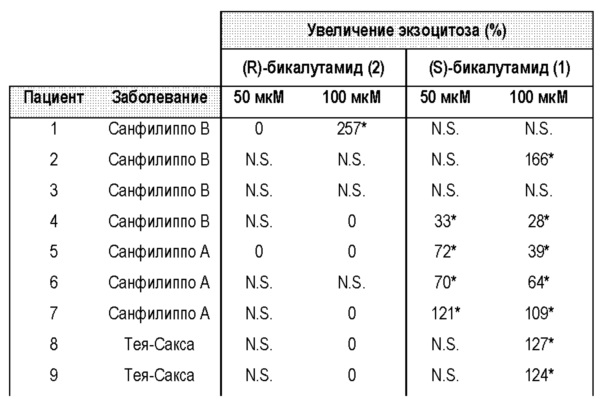

ПРИМЕР 5. Снижение гликозаминогликанов (GAG) в фибробластах от девяти различных пациентов, пораженных различными болезнями лизосомного накопления, обработанных энантиомерно чистым бикалутамидом. Сравнение активности двух энантиомеров.
Фибробласты от семи пациентов, пораженных различными болезнями, проистекающими в результате лизосомного накопления (три пациента с болезнью Санфилиппо В с различным генотипом, один пациент с болезнью Санфилиппо А, один пациент с болезнью Тея-Сакса, один пациент с болезнью Ниманна-Пика А/В и один пациент с болезнью Гурлер), независимо обрабатывали различными концентрациями (R)- и (S)- бикалутамида (50 и 100 мкМ). У фибробластов, обработанных (S)-энантиомером, показано значимое и зависимое от дозы снижение гликозаминогликанов, при этом достигается снижение уровней GAG до контрольных уровней. Результаты с (R)-энантиомером показали снижение уровней GAG в некоторых случаях, однако с более низкой интенсивностью и не универсально, в отличие от обработки (S)-энантиомером (таблица 5).


ПРИМЕР 6. Анализ LAMP1 на поверхности в качестве маркера экзоцитоза в фибробластах, обработанных бикалутамидом.
Фибробласты от пациента, пораженного болезнью Санфилиппо В (p. [Y658F]+[Y658F]), и контрольные фибробласты от здорового пациента высевали на покровных стеклах и обрабатывали 50 мкМ бикалутамидом. Фибробласты инкубировали с антителами кролика к LAMP1 в течение 30 мин. при 4°C. После этого их отмывали PBS и фиксировали 2% параформальдегидом. Фибробласты, обработанные антителами к LAMP1, инкубировали со вторичными антителами к антителам к LAMP1, связанными с FITC, в течение 30 минут при комнатной температуре и наблюдали их с помощью конфокального микроскопа. Как показано на фигуре 1, обработка рацемическим бикалутамидом повышает слияние лизосомы с плазматической мембраной, что выявляет повышение экзоцитоза.
Реферат
Изобретение относится к применению соединения (S)-бикалутамида и/или структурного аналога, которые в совокупности определяются общей формулой (II), а также их фармацевтически приемлемых солей, гидратов и/или сольватов для предотвращения клинических симптомов и/или лечения болезней и/или расстройств лизосомного накопления и/или гликогеноза. В формуле (II) Rпредставляет собой галоген (F, Cl, Br или I), Rпредставляет собой трифторметильную группу (-CF), Rпредставляет собой нитрильную (-CN) группу, X представляет собой тиоэфир (S), сульфоксид (SO), сульфон (SO) или кислород (О). Изобретение относится также к применению указанных соединений в диагностике болезней и/или расстройств лизосомного накопления и/или гликогеноза и применению фармацевтической композиции, содержащей эти соединения. 3 н. и 8 з.п. ф-лы, 1 ил., 5 табл., 6 пр.
Формула

Документы, цитированные в отчёте о поиске
Биологически рассасывающаяся композиция с контролируемым высвобождением

Комментарии