Биологически рассасывающаяся композиция с контролируемым высвобождением - RU2405537C2
Код документа: RU2405537C2
Чертежи





Описание
Область, к которой относится изобретение
Настоящее изобретение относится к новому способу получения высокоуплотненного и, по меньшей мере, частично, предпочтительно полностью или почти полностью, гидратированного керамического материала для использования при получении фармацевтической композиции, особенно для контролируемого высвобождения одного или более терапевтически, профилактически и/или диагностически активного вещества. Способ включает сопутствующую стадию гидратирования и уплотнения биологически рассасывающегося и гидратирующегося керамического материала. Изобретение также относится к композициям, включающим такой высокоуплотненный керамический материал. Фармацевтическую композицию можно применять для нацеленного и контролируемого местного длительного высвобождения активных веществ, например противораковых средств, посредством чего минимизируются спектр и тяжесть побочных эффектов ввиду оптимизированного профиля местной разовой концентрации.
Предпосылки изобретения
В прошлом был разработан ряд систем доставки лекарственных средств для местной, контролируемой и/или нацеленной доставки для терапии. Многие из них основаны на биологически рассасывающихся (или биологически разлагаемых) полимерах, биологически рассасывающемся керамическом материале и/или гидрогеле(ях) в качестве носителей для терапевтически активного вещества. Обычно используемые биологически разлагаемые полимеры представляют собой полимолочные кислоты и сополимеры молочной и гликолевой кислоты. Различный керамический материал на основе солей кальция, например системы фосфата кальция или сульфата кальция, или гидроксиапатит были описаны в форме шариков, гранул, каркасов или формуемых паст для переноса и высвобождения лекарственных средств и в активной, и в неактивной форме, например гормонов, антибиотиков, антивирусных, противораковых, анальгетических, антикоагулянтных средств и костных ростовых факторов, в окружающие ткани. Эти керамические материалы часто именуются гидратируемыми или гидратирующимися керамическими материалами ввиду их способности вступать в химическую реакцию с водой для образования гидратов. См., например, патенты США № 6391336, 6630486, выданные Royer, и заявку на патент США 2003/0170307.
Когда используются биологически рассасывающиеся (или биологически разлагаемые) и гидратируемые керамические носители, то механизмы высвобождения основываются на присущих свойствах гидратируемых керамических материалов после отверждения посредством гидратации. Например, сульфат кальция в форме его полугидрата быстро связывает дополнительную воду и образует дигидросульфат кальция. Когда смесь керамического порошка и активного лекарственного средства контактирует с водой и гидратами, активное лекарственное средство или пролекарство связывается с включением в матрицу/носитель гидратированного материала. Ввиду комбинации факторов, таких как ограниченное количество воды, которая может быть связана при реакциях гидратации, ограничивающее возможное количество гидратных фаз, образованных для заполнения зазоров между зернами порошка, и необходимость, по меньшей мере, в некотором транспорте воды для продолжения гидратации, после гидратации остается некоторая степень пористости. Пористость, образованная в результате нормальной гидратации, часто именуется остаточной микропористостью. После нормальной гидратации полугидрата сульфата кальция микропористость составляет примерно 30-50% об. Активное лекарственное средство или пролекарство in vivo высвобождается из носителя, поступая в окружающую среду, механизмами, включающими, например, диффузию через систему пор и/или эрозию материала носителя.
Керамические вещества, как, например, сульфат кальция, были предложены в качестве материалов имплантатов для контролируемого высвобождения активных веществ (см., например, патенты США № 6391336, 6630486, выданные Royer, и заявку на патент США 2003/0170307). Для получения более медленного и контролируемого высвобождения активного вещества(веществ) из керамических материалов Royer использует комплексообразующий агент, который представляет собой полимерное вещество, которое образует комплекс с активным веществом, посредством чего можно получить более медленное высвобождение лекарственного средства.
Биологически рассасывающиеся керамические материалы имеют множество благоприятных свойств для фармацевтических препаративных форм при применениях с контролируемым высвобождением по сравнению с полимерами, таких как биологическая совместимость и способность к биологическому разложению. В целом, биологически рассасывающиеся керамические материалы являются нетоксичными и основаны на молекулах, которые обычно встречаются в живых тканях млекопитающих. Сульфат кальция является особенно привлекательным, поскольку он является рассасывающимся и биологически совместимым материалом, т.е. он со временем исчезает.
Однако оказалось, что скорость высвобождения терапевтических веществ из керамических носителей трудно регулировать. Для керамических систем на основе как фосфата кальция, так и сульфата кальция скорость высвобождения слишком высока для системы длительной доставки лекарственного средства. Кроме того, в некоторых случаях желательны препаративные формы, которые обеспечивают комбинацию немедленной и/или быстрой, подобной ударной, терапевтической дозы в комбинации с введением более медленным и контролируемым высвобождением в течение длительного периода времени.
В публикации РСТ WO 05/039537 раскрыта фармацевтическая композиция, включающая биологически рассасывающийся, гидратируемый керамический материал, сорбированную водную среду и активное вещество. В описанной композиции скорость высвобождения регулируется герметичным закрытием пористости.
Изобретение предлагает методику снижения и регулирования скорости высвобождения лекарственного средства из биологически рассасывающегося и гидратируемого керамического материала при его использовании в качестве носителя терапевтических средств. При использовании изобретения можно также достигнуть комбинаций характеристик более быстрого высвобождения и более медленного высвобождения в одной и той же фармацевтической препаративной форме.
Краткое описание сущности изобретения
Настоящее изобретение обеспечивает в первом аспекте способ получения высокоуплотненного и, по меньшей мере, частично гидратированного керамического материала. В определенных вариантах осуществления керамический материал, полученный этим способом, является полностью или почти полностью гидратированным. Способ включает воздействие на один или более гидратируемых и биологически рассасывающихся керамических материалов процесса, который включает гидратацию керамического материала при внешнем давлении. Гидратация представляет собой химический процесс, например, в случае сульфата кальция гидратация трансформирует полугидрат сульфата кальция в дигидрат сульфата кальция. Процесс обычно инициируется добавлением к керамическому материалу в порошковой или кристаллической форме не более чем молярного эквивалентного количества воды (в частности, в форме водной среды, необязательно включающей одну или более добавок). Однако, как описано в настоящем документе, в водную среду могут добавляться добавки, которые задерживают начало процесса гидратации и/или длительность процесса гидратации и, соответственно, время до отверждения керамического материала. В зависимости от устройства, используемого для обеспечения внешнего давления, воду можно добавить перед (например, вплоть до нескольких часов до), или непосредственно перед воздействием внешнего давления на керамический материал, или, если устройство предназначено для этого, во время приложения внешнего давления.
Гидратируемые керамические материалы способны связывать воду и образовывать богатые водой кристаллы. Когда вода добавляется к порошку гидратируемого керамического материала, зерна порошка трансформируются в новую кристаллическую форму, более обогащенную водой. Эта реакция гидратации, которая представляет собой перекристаллизацию, часто приводит к отверждению порошково-водной смеси в твердый материал. Скорость гидратации, а также способность поглощения воды варьируется в зависимости от типа гидратации керамических материалов, а также от таких параметров системы, как размер зерен, температура, величина рН и т.д. Исходный керамический материал может быть свободным от воды или в полугидратированной форме. Некоторые керамические материалы образуют промежуточные гидраты между безводной и полностью гидратированной формой. Для каждого гидратируемого керамического материала имеется также определенная полностью гидратированная форма, которая не может связывать дополнительную воду. Для представляющего особый интерес случая сульфата кальция имеется лишенная воды безводная форма, промежуточный гидрат с 0,5 единицами воды на единицу сульфата кальция и полностью гидрированный дигидрат сульфата кальция с 2 единицами воды на единицу сульфата кальция.
В другом аспекте изобретение относится к фармацевтической композиции, включающей один или более гидратируемых и биологически рассасывающихся керамических материалов и одно или более терапевтически, профилактически и/или диагностически активных веществ, где эти одно или более активных веществ, по меньшей мере, частично присутствуют в керамическом материале, который является высокоуплотненным и, по меньшей мере, частично гидратированным.
Фармацевтическая композиция в соответствии с изобретением предназначена для высвобождения активного вещества в течение длительного периода времени, в частности в течение, по меньшей мере, 3 дней или более, например, по меньшей мере, 5 дней, по меньшей мере, 1 недели, по меньшей мере, 2 недель, по меньшей мере, 3 недель, по меньшей мере, 1 месяца, по меньшей мере, 2 месяцев, по меньшей мере, 3 месяцев или, по меньшей мере, 6 месяцев.
Детальное описание изобретения
Заявители обнаружили, что скорость высвобождения лекарственного средства из фармацевтической композиции на основе керамического носителя можно регулировать и снижать воздействием на керамический материал, включающий активное вещество, уплотнения и гидратации в несколько стадий. Уплотнение керамического материала достигается воздействием на керамическую композицию внешнего давления, уплотнение можно необязательно, кроме того, оптимизировать, по меньшей мере, частичной гидратацией, т.е. реакцией с водой для образования дигидрата сульфата кальция (в случае сульфата кальция в качестве керамического материала) во время подачи давления. В определенном варианте осуществления почти полная гидратация достигается во время стадии уплотнения. Гидратация во время уплотнения имеет преимущество в отношении задержки высвобождения активного вещества, см. примеры в настоящем документе. И регулируемое давлением уплотнение, и гидратация вносят вклад в образование высокоуплотненной структуры, которая лучше захватывает одно или более активное вещество(а) и посредством этого снижает скорость высвобождения лекарственного средства.
Фармацевтическая композиция для контролируемого высвобождения
В одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей один или более гидратируемых и биологически рассасывающихся керамических материалов и одно или более терапевтически, профилактически и/или диагностически активных веществ, где активные вещества, по меньшей мере, частично присутствуют в керамическом материале, который является высокоуплотненным и, по меньшей мере, частично гидратированным.
Под термином «высокоуплотненный керамический материал» подразумевается керамический материал, который был подвергнут воздействию давления, внешне прикладываемому давлению, например прессованию, необязательно, в комбинации, по меньшей мере, с частичной гидратацией в условиях внешнего давления, посредством чего размер пор и пористость, по меньшей мере, частично гидратированного керамического материала уменьшаются, приводя к высокоуплотненной структуре керамического материала. С помощью настоящего способа уплотнение проводится в то же время, когда происходит гидратация керамического материала для получения высокоуплотненной структуры. Полученная высокоуплотненная структура (проиллюстрированная сульфатом кальция) характеризуется типичным размером пор не более чем примерно 100 нм, например не более чем примерно 75 нм, не более чем примерно 50 нм или не более чем примерно 10 нм; и пористостью не более чем примерно 10%, например не более чем примерно 5%, не более чем примерно 3%, не более чем примерно 2% или не более чем примерно 1%. Например, гидратация в условиях прилагаемого давления, по меньшей мере, 100 МПа, а предпочтительно 200 МПа или более, снижает пористость до уровня ниже 10% и уменьшает размер пор до уровня менее 100 нм.
В соответствии с изобретением несколько методик можно использовать для приложения внешнего давления, например одноосевое прессование или изостатическое прессование (горячее или холодное). Было обнаружено, что холодное изостатическое прессование (CIP), прилагаемое к предварительно образованным телам из сульфата кальция, содержащим выбранные активные компоненты, является эффективным способом для получения высокоуплотненных и однородных тел. Для оптимального уплотнения керамические тела могут быть покрыты, например, капсулой (например, эластичным баллоном) во время прессования. Обычно прилагаемое давление должно составлять, по меньшей мере, 50 МПа, например, по меньшей мере, 100 МПа, по меньшей мере, примерно 200 МПа, предпочтительно 300 МПа или выше. Однако требуемое давление зависит от используемого сжимающего устройства. Таким образом, указанные выше величины давления подходят для использования в случае CIP, тогда как в случае, например, равномерного одноосевого прессования обычно прикладываются величины давления выше, например, не более чем примерно 200 МПа, предпочтительно примерно 300 МПа или более, примерно 400 МПа или более или примерно 500 МПа или более.
В одном варианте осуществления изобретения высокоуплотненный керамический материал был подвергнут воздействию внешнего давления или сжатию. Подходящее давление составляет, по меньшей мере, 100 МПа, а предпочтительно, по меньшей мере, 200 МПа или выше, например, по меньшей мере, 300 МПа.
Как видно из приведенных в настоящем документе примеров, высокоуплотненный и, по меньшей мере, частично гидратированный керамический материал может быть частично или полностью гидратирован во время использования внешнего давления и/или, в случае частичной гидратации во время уплотнения он может быть подвергнут полной или почти полной гидратации после использования внешнего давления.
В настоящем контексте термин «гидратация» относится к химическому процессу трансформации, например, полугидрата сульфата кальция в дигидрат сульфата кальция. Процесс гидратации обычно начинается добавлением водной среды к полугидрату сульфата кальция, и в зависимости от количества добавленной воды и количества полугидрата сульфата кальция гидратация может быть частичной или полной. В настоящем контексте термин «частично гидратированная» предназначен для обозначения керамического материала, где количество добавленной водной среды соответствует, по меньшей мере, примерно 20% стехиометрического количества, необходимого для гидратации одного или более гидратируемых и биологически рассасывающихся керамических материалов, тогда как термин «полностью гидратированная» предназначен для обозначения керамического материала, где количество добавленной водной среды соответствует, по меньшей мере, 90%, по меньшей мере, 95% или, по меньшей мере, 99%, в частности 100% стехиометрического количества, необходимого для гидратации одного или более гидратируемых и биологически рассасывающихся керамических материалов.
В настоящем контексте термин «биологически рассасывающийся» предназначен для обозначения материала, который может растворяться и/или разрушаться в биологических жидкостях или органах или выводиться другим путем человеческим организмом.
В одном варианте осуществления один или более гидратируемых и биологически рассасывающихся керамических материалов при воздействии внешнего давления, по меньшей мере, 100 МПа имеют пористость не более чем примерно 10%, например не более чем примерно 5%, не более чем примерно 3%, не более чем примерно 2% или не более чем примерно 1%.
Термин «пористость» или «микропористость» относится к порам микрометрового размера, распределенным внутри материала. Этот тип пористости можно измерить, например, сравнением плотности определенного тела с плотностью идеально плотного тела, или измерением увеличения плотности, вызванного инфильтрацией пор средой известной удельной массы, или использованием такого способа, как способ измерения пористости Hg (например, Micrometrics AutoPore III 9410), или использованием микроскопии.
Заявители обнаружили, что приложение внешнего давления к смеси керамического порошка, активного вещества(веществ) и сорбированной водной среды дает более благоприятную микроструктуру, характеризуемую низкой пористостью и сетью пор, которая уже по своим размерам. Альтернативно смесь керамического порошка и активного вещества(веществ) может быть подвергнута первой стадии, на которой смесь сжимается использованием более низкого прессования, например при 20 МПа, с последующей второй стадией при более высоком давлении, например, по меньшей мере, 100 МПа. Гидратация обычно происходит во время подачи более высокого давления (т.е. обычно не во время прессования более низким давлением). Эта более низкая пористость снижает высвобождение лекарственного средства из активного и/или пролекарственного вещества(веществ), залитых в высокоуплотненную микроструктуру. Считается, что высвобождение лекарственного средства из уплотненной структуры происходит преимущественно посредством эрозии и/или резорбции/растворения всей фармацевтической композиции, а не просачиванием через пористость имплантата. Чем меньше размер пор и более снижена пористость, тем меньше ожидается высвобождение активного вещества, происходящее диффузией активного и пролекарственного вещества(веществ) из керамического носителя. Высокоуплотненный керамический материал (иллюстрируемый сульфатом кальция) характеризуется типичным размером пор не более чем примерно 100 нм, например не более чем примерно 75 нм, не более чем примерно 50 нм или не более чем примерно 10 нм, а пористость не более чем примерно 10%, например не более чем примерно 5%, не более чем примерно 3%, не более чем примерно 2% или не более чем примерно 1%. Например, гидратация под прилагаемым давлением, по меньшей мере, 100 МПа, а предпочтительно 200 МПа или более, снижает пористость до уровня ниже 10% и уменьшает размер пор до уровня ниже 100 нм. Предусматривается, что в зависимости от рассматриваемого керамического материала могут быть отклонения от указанных выше значений.
В соответствии с изобретением один или более биологически рассасывающихся гидратируемых керамических материалов можно выбрать из нескольких биологически рассасывающихся и биологически совместимых гидратируемых керамических материалов, керамический материал может быть негидратированным, гидратированным, т.е. полностью гидратированным, полугидратированным или частично гидратированным. Подходящие гидратируемые керамические материалы можно выбрать из группы, состоящей из сульфата кальция, такого как, например, сульфат α-кальция, сульфат β-кальция; полугидрат сульфата кальция; дигидрата сульфата кальция; фосфата кальция; карбоната кальция; фторида кальция; силиката кальция; сульфата магния; фосфата магния; карбоната магния; фторида магния; силиката магния; сульфата бария, фосфата бария; карбоната бария; фторида бария и силиката бария и их смесей. Любая комбинация этих керамических материалов является подходящей для изобретения.
В предпочтительном варианте осуществления изобретения один или более биологически рассасывающихся и гидратируемых керамических материалов представляет собой негидратированный, гидратированный, полугидратированный или частично гидратированный сульфат кальция, такой как, например, сульфат α-кальция, сульфат β-кальция; полугидрат сульфата кальция или дигидрат сульфата кальция.
Кроме того, как будет представлено в описанном ниже способе уплотнения биологически рассасывающегося и гидратируемого керамического материала и детально описанных примерах, уплотнение и посредством этого снижение скорости высвобождения лекарственного средства можно дополнительно усилить несколькими возможными процедурами. Например, эффект давления улучшается, если исходный керамический порошок имеет мелкий размер зерен, предпочтительно ниже 10 мкм, например не более чем примерно 8 мкм, не более чем примерно 7 мкм, не более чем примерно 6 мкм или не более чем примерно 4 мкм. Соответственно, в одном предпочтительном варианте осуществления изобретения перед уплотнением биологически рассасывающийся и гидратируемый керамический материал, используемый при получении высокоуплотненного керамического материала, подвергается помолу с получением среднего размера частиц не более чем 10 мкм. В другом предпочтительном варианте осуществления изобретения биологически рассасывающийся и гидратируемый керамический материал, используемый при получении высокоуплотненного керамического материала, и измельчается, и гранулируется, например, процедурой грануляции замораживанием. Другие способы грануляции, подходящие для использования, представляют собой, например, влажную грануляцию или сухую грануляцию.
В соответствии с настоящим изобретением общее количество воды, используемое для гидратации одного или более керамических материалов, предпочтительно соответствует стехиометрическому количеству, необходимому для полной или почти полной гидратации одного или более биологически рассасывающихся и гидратируемых керамических материалов. Альтернативно, общее количество воды в высокоуплотненном одном или более керамических материалах соответствует, по меньшей мере, примерно 50% стехиометрического количества, необходимого для гидратации одного или более гидратируемых и биологически рассасывающихся керамических материалов, такого как, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95% или, по меньшей мере, 99%.
Однако неожиданно было обнаружено, что добавление водной среды одно- или двухстадийной процедурой для получения одно- или двухстадийной гидратации дополнительно улучшает уплотнение. Одностадийная процедура включает добавление водной среды перед уплотнением, тогда как двухстадийная процедура обычно включает добавление части водной среды перед или во время уплотнения, а другая часть добавляется после стадии уплотнения, то уплотнение дополнительно улучшается. Соответственно, эффект оптимизированного уплотнения достигается прессованием предварительно образованного тела, например, из сульфата кальция с менее чем стехиометрическим количеством водной среды (например, меньше воды, чем та, которая связана при идеальной полной гидратации). Остающаяся водная среда благоприятно добавляется на стадии после гидратации после снятия давления. Высказывается гипотеза, что более чем стехиометрическое или даже стехиометрическое количество, например, воды ведет к образованию карманов свободной, не связанной воды, не участвующей в гидратации, предотвращающей идеальное уплотнение. В определенном варианте осуществления изобретения количество водной среды, добавляемое к керамическому материалу перед или во время уплотнения, меньше, чем стехиометрическое количество, и остающаяся водная среда добавляется на стадии после гидратации после первоначального уплотнения, для обеспечения возможности полной гидратации. В настоящем контексте термин «после гидратации» используется для описания добавления воды после стадии уплотнения, т.е. дальнейшая гидратация происходит после процедуры уплотнения высоким давлением.
В определенном варианте осуществления изобретения исходный материал для изготовления биологически рассасывающегося и гидратируемого керамического материала представляет собой полугидрат сульфата кальция и общее количество сорбированной водной среды составляет не более чем 1,5±0,015 эквивалентов воды. Кристаллы полугидрата сульфата кальция содержат 0,5 моль воды на 1,0 моль сульфата кальция для полной гидратации, поэтому для образования дигидрата сульфата кальция требуются дополнительные 1,5 моля воды.
Композиция по изобретению может быть в форме стержней, цилиндров, таблеток, шариков или в форме материала в виде частиц. В некоторых вариантах осуществления композиция предназначена для смешивания с водной средой перед введением. Такая композиция может быть предназначена для отверждения in situ после введения in vivo.
Одно или более терапевтически, профилактически и/или диагностически активных веществ могут быть диспергированы (включая однородное диспергирование) в высокоуплотненном и, по меньшей мере, частично гидратированном керамическом материале, или керамический материал может полностью или, по меньшей мере, частично, инкапсулировать одно или более терапевтически, профилактически и/или диагностически активных веществ.
В фармацевтической композиции в соответствии с настоящим изобретением одно или более терапевтически, профилактически и/или диагностически активных веществ равномерно диспергированы в высокоуплотненном керамическом материале. Лекарственная нагрузка указанного активного вещества в уплотненном керамическом материале составляет не более чем примерно 50% мас./мас., например не более чем примерно 40% мас./мас., не более чем примерно 35% мас./мас., не более чем примерно 25% мас./мас., не более чем примерно 20% мас./мас.
Как описано в предшествующем уровне техники, микропористость можно частично герметично закрыть фармацевтическими добавками гидрофобного характера. Заявители настоящего изобретения, к удивлению, обнаружили, что одно или более лекарственных веществ, содержащихся в композиции в соответствии с изобретением, сами по себе могут снизить свою собственную скорость высвобождения. Как видно из представленных ниже примеров, возросшая лекарственная нагрузка дала, к удивлению, значительно более низкую скорость высвобождения. Возможная гипотеза этого эффекта может состоять в том, что лекарственное вещество функционирует как гидрофобный агент, частично герметично закрывающий микропористость. Например, путем изменения количества активного вещества с 50 мг 2-гидроксифлутамида на 1 г полугидрата сульфата кальция (5% мас./мас.) до 100 мг на 1 г полугидрата сульфата кальция (10% мас./мас.), скорость высвобождения регулируется в течение более длительного периода времени. Соответственно, в предпочтительном варианте осуществления изобретения лекарственная нагрузка одного или более терапевтически, профилактически и/или диагностически активных веществ составляет не более чем примерно 50%, например не более чем 40% мас./мас., не более чем 35% мас./мас., не более чем 25% мас./мас., не более чем 20% мас./мас.
Фармацевтические композиции в соответствии с настоящим изобретением можно применять с любыми терапевтически, профилактически и/или диагностически активными веществами, которые могут потребовать контролируемого высвобождения, особенно длительного контролируемого высвобождения. Примеры релевантных фармакологических классов представляют собой, например, противораковые средства. В отношении противораковых средств, т.е. антинеопластических средств, изобретение можно использовать для нацеленного и контролируемого местного высвобождения гормонального, антигормонального, химиотерапевтического и/или другого фармакологического средства(средств).
В предпочтительном варианте осуществления изобретения одно или более терапевтически, профилактически и/или диагностически активных веществ в высокоуплотненном керамическом материале подходят для использования при заболеваниях или состояниях, связанных с предстательной железой. Кроме того, в более специфическом варианте осуществления изобретения активное вещество представляет собой андроген или его производное, антиандроген или его производное, эстроген или его производное, антиэстроген или его производное, гестаген или его производное, антигестаген или его производное, олигонуклеотид, прогестаген или их производное, гонадотропинвысвобождающий гормон или его аналог или производное, ингибитор гонадотропина или его производное, ингибитор надпочечниковых и/или простатических ферментов, белок выходящего мембранного тока и/или мембранного транспорта, модулятор иммунной системы, ингибитор ангиогенеза или их комбинации.
Композиция по изобретению может также включать любое другое подходящее активное вещество, подходящее для введения в мягкие ткани или органы для местного или системного длительного высвобождения лекарственного средства. Композиции замедленного высвобождения лекарственного средства по изобретению можно также использовать при других способах лечения, например, боли, неврологических заболеваний (Альцгеймера, Паркинсона), аутоиммунных заболеваний, иммунологических заболеваний и заболеваний, реагирующих на иммунологическую и иммуномодулирующую терапию (гепатит, рассеянный склероз, опухоли), инфекции, воспаления, метаболические заболевания, ожирение, заболевания мочеполовой системы, сердечно-сосудистые заболевания (включая гипертонию), гематопоэтические заболевания, заболевания, требующие антикоагулянтной, тромболитической и антитромбоцитарной терапии, паразитарные инфекции, требующие химиотерапии, микробные заболевания и неопластические заболевания, гиперхолестеринемия, дислипидемия, гематопоэтические заболевания, респираторные заболевания (астма, хроническая легочная обструкция), заболевания почек, желудочно-кишечные заболевания, заболевания печени, прерывание гормональной регуляции, заместительная или восполняющая гормональная терапия, заместительная или восполняющая витаминотерапия. Примеры активных веществ из различных фармакологических классов для использования в настоящем клиническом контексте включают, например, антибактериальные средства, антиастматические средства и противоотечные средства, противовоспалительные средства, антипаразитические средства, антивирусные средства, местные анестетики, противогрибковые средства, амебицидные средства или трихомоноцидные средства, анальгетики, средства против тревоги, средства против свертывания, средства против артрита, антиастматические средства, антикоагулянты, противосудорожные средства, антидепрессанты, антидиабетические средства, средства против глаукомы, средства против малярии, антимикробные средства, антинеопластические средства, средства против ожирения, антипсихотические средства, гипотензивные средства, средства против аутоиммунных расстройств, средства против импотенции, средства против паркинсонизма, средства против болезни Альцгеймера, антипиретические средства, антихолингергические средства, противоязвенные средства, средства против анорексии, бета-2 агонисты, антагонисты и агонисты альфа-рецепторов, средства, снижающие уровень глюкозы в крови, бронхолитики, средства, воздействующие на центральную нервную систему, сердечно-сосудистые средства, усилители когнитивной функции, контрацептивные средства, средства, снижающие уровень холестерина, средства против дислипидемии, цитостатические средства, диуретики, гермицидные средства, Н-2 блокаторы, гормональные средства, антигормональные средства, снотворные средства, инотропные средства, мышечные релаксанты, средства, вызывающие мышечное сокращение, средства, повышающие физическую энергию, седативные средства, симпатомиметики, сосудорасширяющие средства, сосудосуживающие средства, транквилизаторы, электролитные добавки, витамины, средства, способствующие выделению мочевой кислоты, сердечные гликозиды, ингибиторы выходящего мембранного тока, ингибиторы мембранных транспортных белков, отхаркивающие средства, слабительные средства, контрастные материалы, радиофармацевтические агенты, визуализирующие агенты, пептиды, ферменты, ростовые факторы, вакцины, минеральные микроэлементы и т.д.
Терапевтически, профилактически и/или диагностически активное лекарственное вещество(а) могут также быть представлены в форме их фармацевтически приемлемой соли, сольвата или комплекса или в любой подходящей кристаллической или аморфной форме или в форме пролекарства.
В определенном варианте осуществления активное вещество представляет собой одно или более цитостатических средств, таких как один или более алкилирующих агентов, один или более антиметаболитов, одно или более антимитотических средств, один или более ингибиторов топоизомеразы, один или более биологических циторегуляторов, один или более гормонов или антигормонов и им подобные.
Конкретнее, одно или более активных веществ могут представлять собой
алкилирующий агент, такой как, например, мефалан, бусульфан, карбоплатин, цисплатин, циклофосфамид, дакарбазин, хлорамбуцил, ломустин, карбоплатин, темозоломид, треосульфан;
антиметаболит, такой как, например, пеметрексед, цитарабин, азатиоприн, флударабинфосфат, фторурацил, гидроксимочевина, кладрибин, метотрексат, тегафур, урацил, капецитабин;
антимикотическое средства, такие как, например, винорелбин, винкристин, паклитаксел, доцетаксел, винбластин;
ингибитор топоизомеразы, такой как, например, доксорубицин, амсакрин, иринотекан, даунорубицин, эпирубицин, этопозид, идарубицин, топотекан, митомицин, митоксантрон;
биологический циторегулятор, такой как, например, блеомицин;
гормон или антигормон, такой как, например, полиэстрадиолфосфат, эстрадиол, анастрозол, эксеместан, флувестрант, летрозол, тамоксифен, мегестролацетат, медроксипрогестеронацетат, октреотид, трипторелин, лейпрорелин, бузерелин, гозерелин;
аспарагиназа,
ингибитор тирозинкиназы, такой как, например, иматиниб;
другие средства, такие как, например, митотан, целекоксиб, ленограстим, интерферон γ-1b, интерферон α-2b, пегфиграстим, фиграстим, алдеслейкин, бевакизумаб, цетуксимаб, трастузумаб, алемтузумаб, ритуксимаб, бортезомиб, темопорфин, метиламинолевулинат, анагрелид, эстрамустинфосфат.
В предпочтительном аспекте активное вещество подходит для лечения заболеваний, связанных с предстательной железой, или состояний, включая состояния, указанные ниже в настоящем описании.
В определенном варианте осуществления, представляющем особый интерес, композиция по изобретению подходит для применения при лечении заболеваний предстательной железы, конкретнее доброкачественной гиперплазии предстательной железы, рака предстательной железы и/или простатита. Для лечения заболеваний, связанных с предстательной железой, особенно полезно может быть применение противораковых средств, таких как специфические антиандрогены. В более предпочтительном варианте осуществления изобретения одно или более терапевтически, профилактически и/или диагностически активные вещества представляют собой флутамид, гидроксифлутамид, ципротерон, нилутамид или бикалутамид или им подобные. Кроме того, в некоторых случаях может быть благоприятно применять комбинацию антиандрогена и гонадотропинвысвобождающего гормона или его аналога.
Композиции по изобретению, включающие активное вещество(а), можно применять местно минимально инвазивными методиками и можно получить профиль длительного (контролируемого) местного высвобождения в течение продолжительного периода времени. Такая местная и длительная доставка активных веществ оптимизирует профиль изменения местной концентрации активных веществ во времени и их местные фармакологические эффекты и минимизирует системное воздействие и, таким образом, снижает побочные эффекты и, следовательно, увеличивает безопасность и возможность использования активного вещества и фармацевтической композиции, содержащей активное вещество. Кроме того, усиливается соблюдение предписанной терапии.
В другом варианте осуществления изобретения терапевтически, профилактически и/или диагностически активное вещество в высокоуплотненном керамическом материале представляет собой андроген или его производное, антиандроген или его производное, эстроген или его производное, антиэстроген или его производное, гестаген или его производное, антигестаген или его производное, олигонуклеотид, прогестаген или его производное, гонадотропинвысвобождающий гормон или его аналог или производное, ингибитор гонадотропина или его производное, ингибитор ферментов надпочечников и/или предстательной железы, белок мембранного выходящего тока и/или мембранного транспорта, ингибитор иммунной системы, ингибитор ангиогенеза или их комбинации.
Заявители, кроме того, обнаружили, что высокоуплотненный керамический материал можно использовать отдельно в целях контролируемого высвобождения или его можно использовать в комбинации со второй частью. Путем заливки высокоуплотненного керамического материала во второй части можно дополнительно модифицировать и снизить высвобождение. Соответственно, фармацевтическая композиция в соответствии с изобретением может, необязательно, кроме того, содержать вторую часть, включающую один или более фармацевтически приемлемых эксципиентов, терапевтически, профилактически и/или диагностически активное вещество (оно может быть таким же или отличным от вещества, содержащегося в высокоуплотненном керамическом материале), один или более биологически рассасывающихся керамических материалов (они могут быть такими же или отличными от материалов, содержащихся в высокоуплотненном керамическом материале, или могут представлять собой смеси различных керамических материалов), или один или более уплотненных или высокоуплотненных керамических материалов, например, содержащих различные активные вещества и/или имеющих различные характеристики высвобождения по сравнению с первой частью. В случае, когда вторая часть включает биологически рассасывающийся керамический материал, он может быть в негидратированной, полугидратированной, частично гидратированной или полностью гидратированной форме. Выбор зависит от конкретного применения. В некоторых случаях подходящим может быть применение формы, которая является гидратируемой, например, для дополнительной задержки высвобождения активного вещества, тогда как в других ситуациях подходящим является применение гидратированной формы. Кроме того, активное вещество, содержащееся во второй части, может быть предназначено для немедленного высвобождения. Таким образом, настоящее изобретение предоставляет гибкую систему доставки, где части уплотненных, высокоуплотненных и неуплотненных керамических материалов, все или некоторые из которых содержат одно или более, такое же или отличное активное вещество, можно комбинировать для получения желаемой скорости высвобождения и времени высвобождения.
В тех случаях, когда готовый к применению продукт получен гидратацией второй части, включающей биологически рассасывающийся и гидратируемый керамический материал, может иметь преимущество или включение органической кислоты, включающей функцию карбоновой кислоты в композиции, или добавление к воде, которая используется для инициации гидратации. Считают, что такое соединение задерживает процесс гидратации и, таким образом, обеспечивает возможность введения готового к применению продукта в течение определенного периода времени перед тем, как он подвергнется отверждению (т.е. нет необходимости введения готового к применению продукта сразу после его получения).
Кроме того, вторая часть может включать желатинизирующий агент, агент, вызывающий набухание, или второй биологически рассасывающийся и гидратируемый керамический материал, который, по меньшей мере, частично окружает высокоуплотненный керамический материал. Используемый в настоящем описании термин «по меньшей мере, частично окружает» используется для описания, например, покрытия слоя второй части, покрывающего уплотненную часть, или матрицу, в которую залита уплотненная часть, или носитель, который используется для введения уплотненной части. Вторая часть может также представлять собой гель, или пасту, или вязкую среду.
Подходящий желатинизирующий или вызывающий набухание агент может быть выбран из группы, состоящей из альгиновой кислоты, альгинатов, карбоксиметилцеллюлозы кальция, карбоксиметилцеллюлозы натрия (Ac-Di-Sol), кросповидона, гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы (HPMS), низкозамещенной гидроксипропилцеллюлозы (L-HPC), микрокристаллической целлюлозы, полакрилина калия, полиакриловой кислоты, поликарбофила, полиэтиленгликоля, поливинилацетата, поливинилпирролидона, пласдона, кроскармеллозы натрия, крахмалгликолята натрия (Explotab) и крахмалов и их смесей.
Когда необязательная вторая часть фармацевтической композиции в соответствии с изобретением включает второй биологически рассасывающийся и гидратируемый керамический материал, он может, кроме того, содержать вторую сорбированную водную среду. Предпочтительная указанная вторая сорбированная водная среда представляет собой воду. Указанный второй биологически рассасывающийся и гидратируемый керамический материал может быть выбран из любого подходящего гидратируемого керамического материала, такого как негидратированный, гидратированный, полугидратированный или частично гидратированный керамический материал, выбранный из группы, состоящей из сульфата кальция, такого как, например, сульфат α-кальция, сульфат β-кальция; полугидрат сульфата кальция; фосфата кальция; карбоната кальция; фторида кальция; силиката кальция; сульфата магния; фосфата магния; карбоната магния; фторида магния; силиката магния; сульфата бария, фосфата бария; карбоната бария; фторида бария и силиката бария; и их смесей. В предпочтительном варианте осуществления изобретения второй биологически рассасывающийся и гидратируемый керамический материал является негидратированным, гидратированным, полугидратированным или частично гидратированным сульфатом кальция, таким как сульфат α-кальция, сульфат β-кальция или полугидрат сульфата кальция или их смеси. Второй биологически рассасывающийся и гидратируемый керамический материал в соответствии с изобретением можно использовать в виде включения в фармацевтическую композицию или, альтернативно, он может быть уплотнен, как описано выше для высокоуплотненного керамического материала.
Фармацевтическая композиция в соответствии с изобретением, которая содержит вторую часть, может, кроме того, включать терапевтически, профилактически и/или диагностически активные вещества в указанной второй части. Эти активные вещества могут быть такими же или отличными от одного или более активных веществ, включенных в высокоуплотненный керамический материал.
В фармацевтической композиции в соответствии с изобретением высокоуплотненный керамический материал может быть измельчен на меньшие фрагменты/гранулы (обычно 50-500 мкм), и эти гранулы/фрагменты могут быть включены во вторую часть. Представленную настоящим изобретением фармацевтическую композицию можно использовать в качестве инъецируемой пасты, которая затвердевает in vivo, или, альтернативно, может быть формована и отверждена in vitro и размещена в качестве предварительно отвержденных тел in vivo. Особенно полезно залить высокоуплотненный керамический материал во второй керамический материал, такой как полугидрат сульфата кальция. Высказывается гипотеза, что модифицированная и/или сниженная скорость высвобождения лекарственного средства, достигаемая заливкой высокоуплотненного керамического материала, содержащего активное лекарственное средство(а), объясняется дополнительным осаждением дигидрата сульфата кальция на поверхность и в щели уплотненной части. Соответственно, в одном варианте осуществления изобретения фрагменты высокоуплотненного керамического материала залиты во вторую часть. Такие фрагменты высокоуплотненного керамического материала могут дополнительно быть покрыты керамическим или полимерным слоем.
Однако другой путь получения фармацевтической композиции контролируемого высвобождения и с высокоуплотненной частью, и со второй частью является покрытием предварительно уплотненных и гидратированных тел, например зерен, палочек, лепешек или имеющих любую другую геометрию, вторым слоем, например слоем второго биологически рассасывающегося и гидратируемого керамического материала, указанному слою дают возможность гидратироваться при нахождении в тесном контакте с предварительно уплотненными телами. Достигнутый таким образом гидратированный слой вносит вклад в герметичное закрытие высокоуплотненного керамического материала.
Путем комбинирования высокоуплотненного керамического материала, содержащего активное вещество, со второй частью, дополнительно содержащей такое же или другое активное вещество, кроме того, возможно достижение получения фармацевтической композиции, характеризуемой типом высвобождения, имеющего две стадии. Активное вещество, содержащееся во второй части, может обеспечить усиленное высвобождение, в то время как активное вещество, включенное в высокоуплотненный керамический материал, дает длительное контролируемое высвобождение.
Фармацевтическую композицию в соответствии с настоящим изобретением можно использовать в полутвердой и твердой форме в нескольких различных вариантах осуществления, например, для парентерального применения, т.е., например:
а) в виде высокоуплотненного керамического материала, например, в форме таблеток, шариков, булавок, палочек, зерен, иголок и т.д., которые подлежат размещению в подходящем положении в живом организме;
b) в виде высокоуплотненного керамического материала, например, в форме таблеток, шариков, булавок, палочек, зерен и т.д., покрытых слоем или залитых во вторую часть, которая обеспечивает дополнительное герметичное закрытие, подвергаясь гидратации при контакте с уплотненной частью;
с) в виде высокоуплотненного керамического материала, например, в форме зерен или гранул, которые размещаются в теле, например инъекцией вместе с жидким носителем, и посредством этого диспергируются в ткани;
d) в виде высокоуплотненного керамического материала, например, в форме зерен или гранул, которые смешиваются со второй частью, содержащей подходящий желатинизирующий или вызывающий набухание агент, или вторым биологически рассасывающимся и гидратируемым керамическим материалом, необязательно, вместе со второй водной средой, для образования пасты, которая помещается в тело или до, или после гидратации, т.е. она может отверждаться или in vitro, или in vivo.
Фармацевтическая композиция в соответствии с изобретением может, кроме того, включать другие добавки или другие фармацевтические эксципиенты для модификации микроструктуры и скорости высвобождения, например гидрофобные модификаторы, такие как стеариновая кислота и стеараты Mg- (Na-), гидрогели, биологически рассасывающиеся полимеры или другие полимерные соединения, которые могут дополнительно снизить пористость и модифицировать скорость высвобождения из носителя.
Необязательно, фармацевтическая композиция по изобретению может также содержать негидратируемые керамические материалы и металлические добавки. Назначением такого дополнительного компонента является увеличение рентгеноконтрастности, улучшенная механическая прочность или контроль скорости отверждения. Принятыми добавками, увеличивающими рентгеноконтрастность, являются соли бария или металлы, такие как золото, цирконий или тантал, и их оксиды. Кроме того, процесс гидратации и посредством этого свойства гидратированных материалов можно контролировать подходящими добавками. Например, такие свойства, как реология неотвержденной пасты, скорость отверждения и механические свойства отвержденного материала, можно регулировать для того, чтобы сделать их наиболее полезными для медицинских назначений фармацевтической композиции.
Способ получения композиции в соответствии с изобретением
Другой аспект настоящего изобретения относится к способу получения композиций в соответствии с настоящим изобретением, причем существенным признаком указанного способа является одновременное уплотнение и гидратация, посредством чего получается высокоуплотненный керамический материал. Способ включает стадии
i) смешивания одного или более биологически рассасывающихся и гидратируемых керамических материалов с одним или более терапевтически, профилактически и/или диагностически активными веществами и
ii) уплотнения смеси, полученной на стадии i), приложением внешнего давления, и
iii) гидратации керамического материала во время уплотнения на стадии ii) добавлением воды к полученной смеси со стадии i) в количестве, соответствующем от примерно 20% до примерно 110% стехиометрического количества, необходимого для полной гидратации одного или более керамических материалов,
посредством чего получается высокоуплотненный и, по меньшей мере, частично гидратированный керамический материал с пористостью не более чем 10%.
Гидратация или частичная гидратация гидратируемых керамических материалов происходит во время уплотнения добавлением воды перед или во время стадии ii). Как описано ранее, заявители обнаружили, что добавление воды (например, в форме водной среды) может осуществляться процедурой из одной или двух стадий для получения гидратированного керамического материала. Гидратация в одну или две стадии дополнительно улучшает уплотнение. Процедура в одну стадию включает добавление водной среды перед уплотнением, тогда как процедура из двух стадий обычно включает добавление части водной среды перед или во время уплотнения, а другая часть добавляется после стадии прессования, затем можно дополнительно улучшить уплотнение. Соответственно, оптимизированный эффект уплотнения достигается прессованием предварительно образованного тела, например, из сульфата кальция менее чем стехиометрическим количеством водной среды (например, меньшим количеством воды, чем связывается при идеальной полной гидратации). Остающаяся водная среда благоприятно добавляется на стадии после гидратации после снятия давления.
Для достижения высокой степени уплотнения материалов давление на стадии ii) удерживается в течение, по меньшей мере, 10 минут, например, по меньшей мере, примерно 15 минут, по меньшей мере, примерно 20 минут, по меньшей мере, примерно 30 минут или, по меньшей мере, примерно 45 минут, для достижения гидратации или частичной гидратации при уплотнении.
Необязательно, органические кислоты, содержащие группу карбоновых кислот, таких как уксусная кислота, лимонная кислота, янтарная кислота и винная кислота и им подобные, можно добавить к гидратируемым керамическим материалам перед уплотнением на стадии ii) для задержки химической реакции между гидратируемыми керамическими материалами и водной средой, т.е. задерживается отверждение керамического материала.
Можно использовать несколько методик для приложения внешнего давления, например одноосевое прессование или изостатическое прессование (горячего или холодного). Было обнаружено, что холодное изостатическое прессование (CIP), прикладываемое к предварительно образованному телу из сульфата кальция, содержащему выбранные активные компоненты, является эффективным способом получения высокоуплотненных и однородных тел. Для оптимального уплотнения керамические тела во время прессования могут быть покрыты, например, капсулой (например, эластичным баллончиком). Прилагаемое давление должно составлять, по меньшей мере, 100 МПа, например, по меньшей мере, 200 МПа, предпочтительно 300 МПа или выше. Однако требуемое давление зависит от используемого устройства для прессования. Таким образом, указанные выше уровни давления подходят для использования в случае CIP, тогда как в случае, например, равномерного одноосевого прессования обычно прилагается давление, которое выше, например не более чем 200 МПа, предпочтительно примерно 300 МПа или более, примерно 400 МПа или более или примерно 500 МПа или более.
Необязательно, распад (разрушение) гидратированного керамического материала для получения материала в виде частиц, который подходит для использования при получении фармацевтических композиций (например, также двойных или множественных композиций), можно, например, использовать для изготовления инъецируемой пасты, которая отверждается in vivo или, альтернативно, может быть подвергнута формовке и отверждению in vitro и размещена в виде предварительно отвержденных тел in vivo. Распавшийся гидратированный материал может также смешиваться с одним или более фармацевтически приемлемыми эксципиентами.
В одном варианте осуществления способа в соответствии с изобретением гидратация выполняется в виде стадии iii) после стадии гидратации. В предпочтительном варианте осуществления гидратация выполняется в виде смешивания с водной средой на стадии i), а в более предпочтительном варианте осуществления гидратация выполняется в виде смешивания с водной средой на стадии i) вместе со стадией iii) после стадии гидратации.
В способе в соответствии с изобретением прилагаемое внешнее давление на стадии ii) может составлять, по меньшей мере, 50 МПа, например по меньшей мере, 100 МПа, по меньшей мере, 200 МПа или, по меньшей мере, 300 МПа.
В зависимости от размера частиц закупленного биологически рассасывающегося и гидратируемого керамического материала способ может, кроме того, как описано выше, включать стадию измельчения одного или более биологически рассасывающихся и гидратируемых керамических материалов перед стадией i) или, необязательно, стадию измельчения и гранулирования одного или более биологически рассасывающихся и гидратируемых керамических материалов перед стадией i), с тем чтобы дополнительно усилить уплотнение. Измельчение можно выполнять диспергированием керамического материала в органическом растворителе, например спирте, подобном этанолу или изопропанолу. В таком случае активное вещество можно растворить в том же растворителе и добавить во время или после процесса измельчения для обеспечения подходящего однородного распределения активного вещества в керамическом материале. В некоторых вариантах осуществления активное вещество может быть инкапсулировано в керамическом материале, например, смешиванием активного вещества с частью керамического материала, подвергая эту смесь частичной гидратации, а затем добавлением остающейся части керамического материала. В предпочтительном варианте осуществления изобретения средний размер частиц одного или более биологически рассасывающихся и гидратируемых керамических материалов, используемых на стадии i), составляет не более чем примерно 10 мкМ. Пористость высокоуплотненного керамического материала, полученного на стадии ii), составляет предпочтительно не более чем примерно 5%.
Как описано выше, высокоуплотненный керамический материал можно использовать отдельно в целях контролируемого высвобождения или его можно использовать в комбинации со второй частью. Поэтому в другом варианте осуществления изобретения высокоуплотненный керамический материал залит во вторую часть, и способ в соответствии с изобретением, соответственно, кроме того, включает iv) смешивание высокоуплотненного керамического материала со второй частью, как определено выше.
Третий аспект настоящего изобретения относится к способу лечения заболеваний, включающему введение пациенту фармацевтической композиции в соответствии с изобретением. В предпочтительном варианте осуществления указанного способа заболевание представляет собой рак, а в более предпочтительном варианте осуществления заболевание представляет собой заболевание, связанное с предстательной железой, такое как доброкачественная гиперплазия предстательной железы, рак предстательной железы или простатит. Фармацевтическую композицию можно вводить парентерально или путем имплантации.
Кроме того, настоящее изобретение предоставляет набор, как определено в прилагаемой формуле изобретения, для получения композиции в соответствии с изобретением.
Все детали и признаки, указанные в основных аспектах изобретения, относятся также ко всем другим аспектам изобретения.
Описание чертежей
Фиг.1
Микроструктура (а) неуплотненного и (b) уплотненного гидратированного сульфата кальция.
Фиг.2
Динамика во времени скорости высвобождения in vitro для трех типов композиций сульфата кальция/2-гидроксифлутамида, K, L и M.
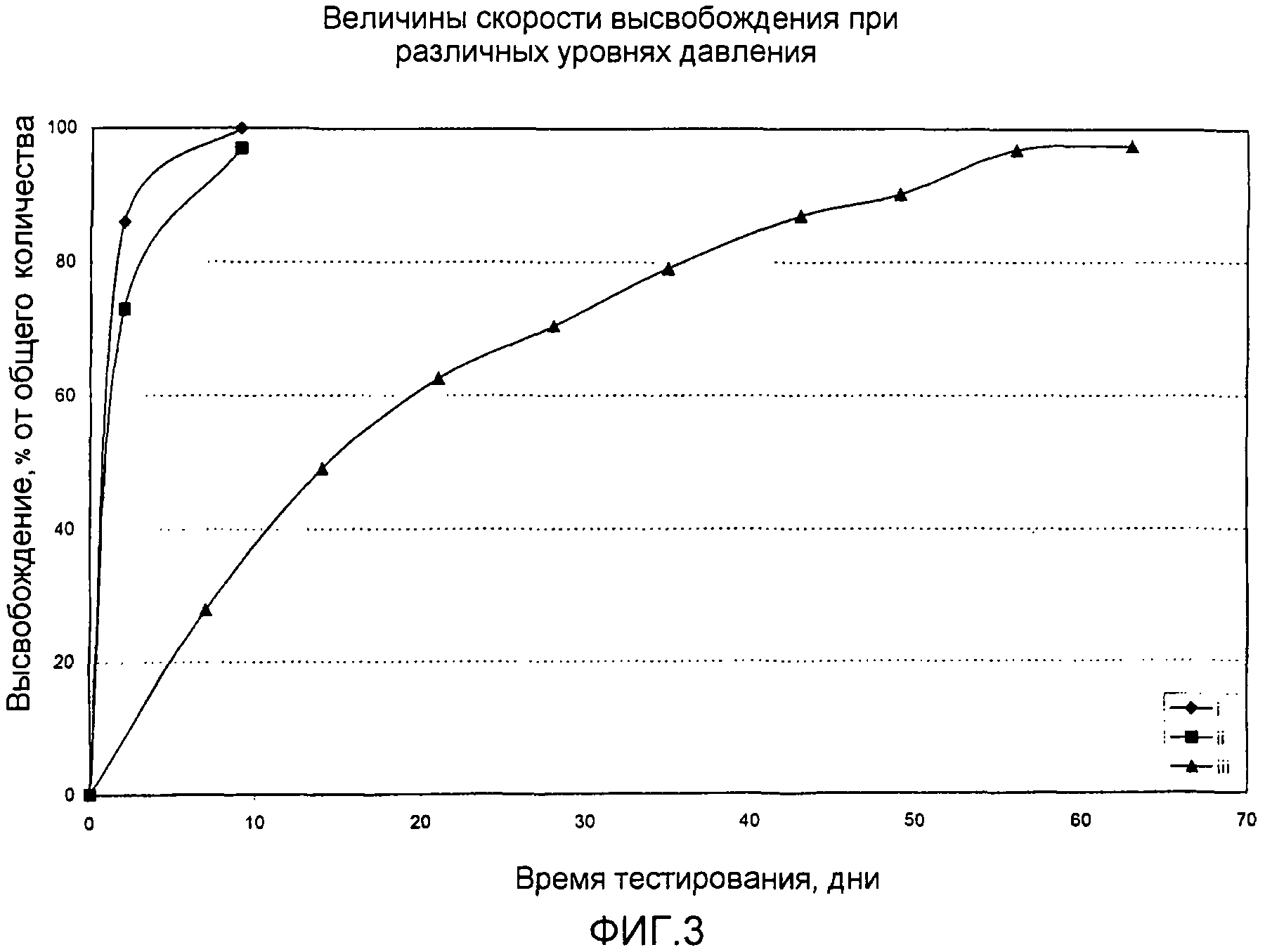
Фиг.3
Динамика во времени скорости высвобождения in vitro различным образом уплотненных композиций сульфата кальция/2-гидроксифлутамида (i), (ii) и (iii).
Фиг.4
Индивидуальные профили динамики во времени концентрации в плазме 2-гидроксифлутамида после однократного внутривенного болюсного введения 25 мг 2-гидроксифлутамида четырем собакам (Н1, Н2, Н3 и Н4).
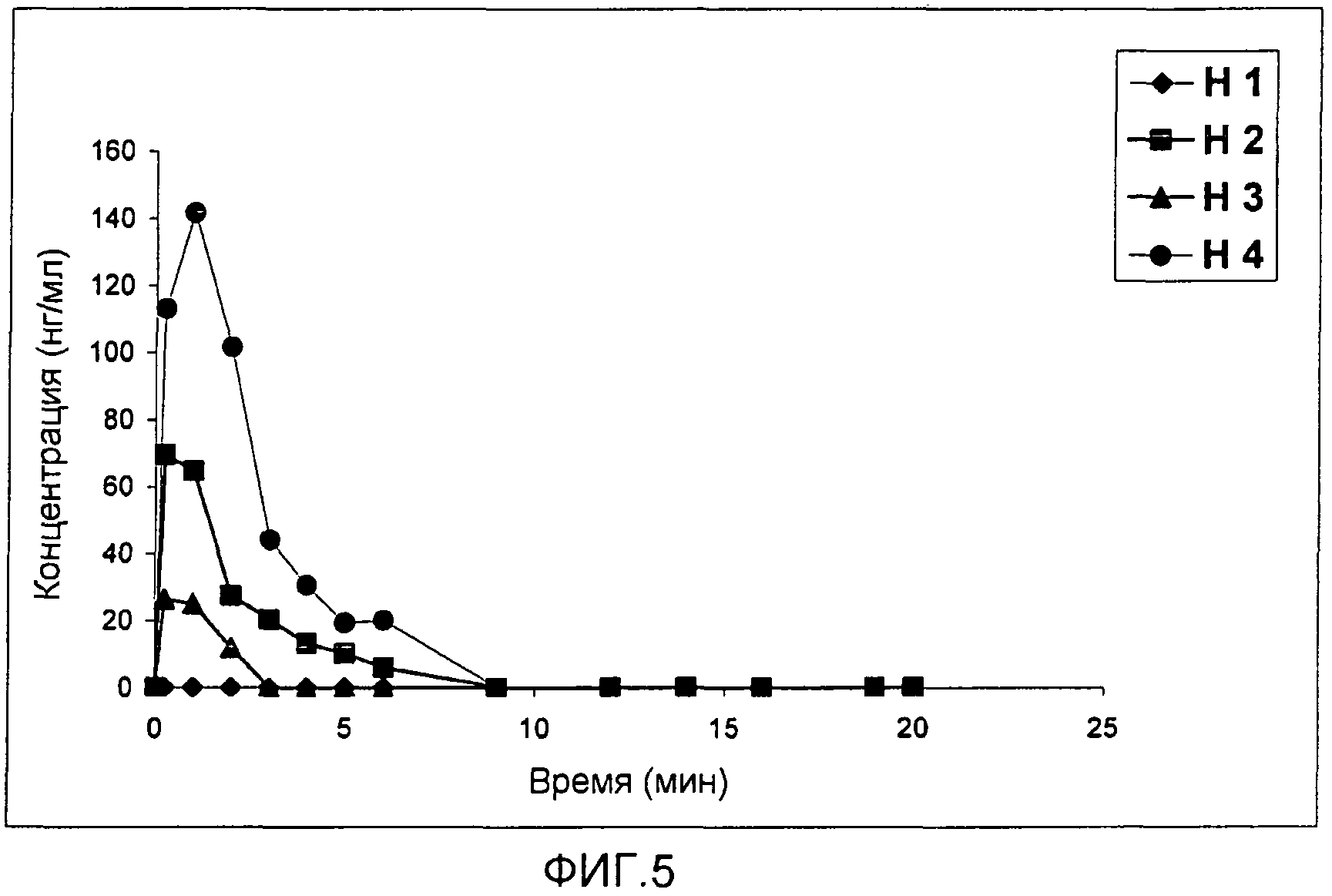
Фиг.5
Индивидуальные профили динамики во времени концентрации в плазме 2-гидроксифлутамида (F-OH) после однократного введения имплантатов контролируемого высвобождения с различными дозами 2-гидроксифлутамида в предстательную железу четырех собак (Н1-контроль, Н2-60 мг F-OH, Н3-30 мг F-OH и Н4-120 мг F-OH).
Фиг.6
Отобранные примеры индивидуальных профилей динамики во времени концентрации в плазме 2-гидроксифлутамида после однократного введения имплантатов контролируемого высвобождения в предстательную железу баранов, получавших лечение, соответственно 500 мг (3) и 250 мг (1 и 2) 2-гидроксифлутамида.
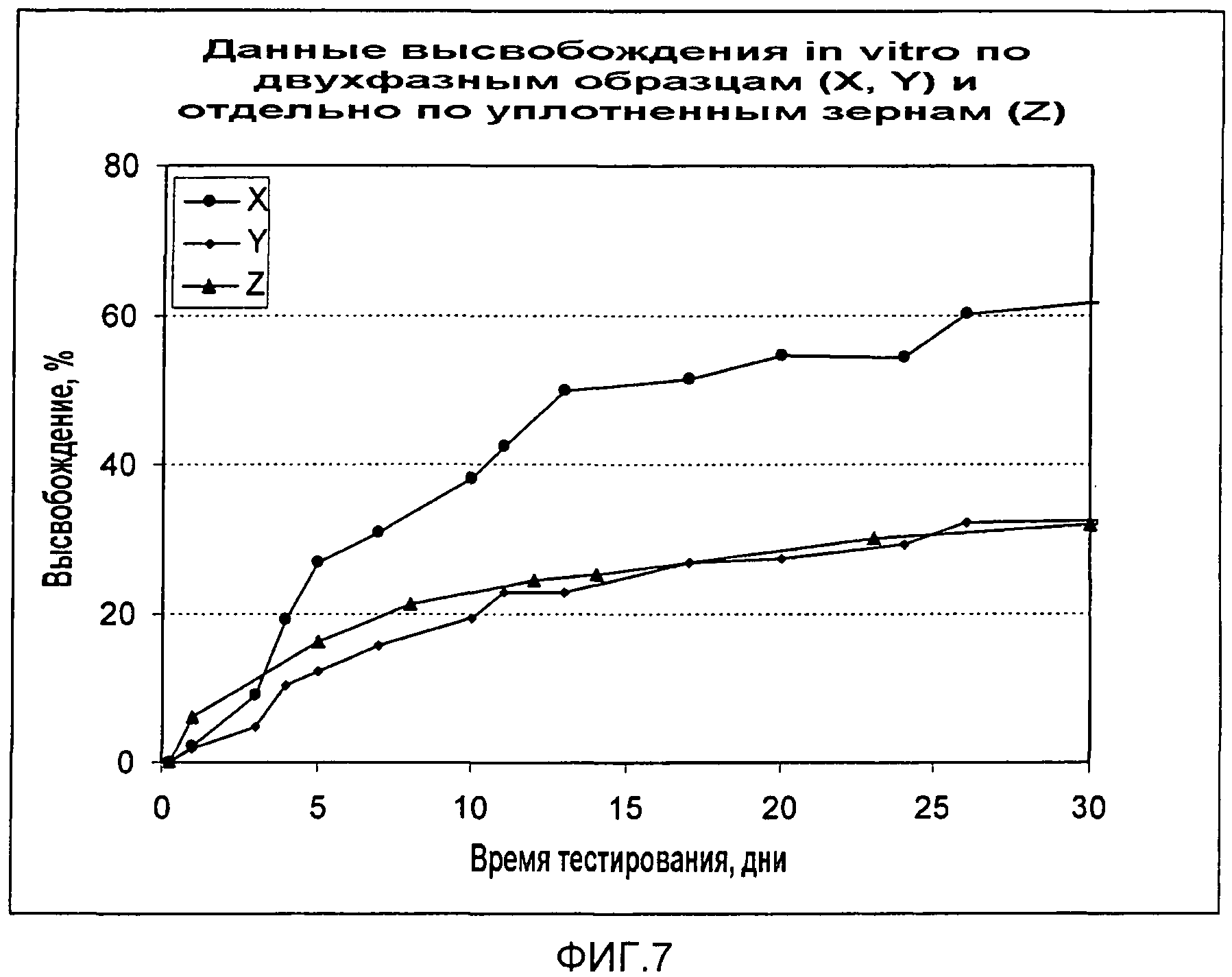
Фиг.7
Динамика во времени кумулятивного высвобождения in vitro трех типов композиций/микроструктур сульфата кальция/2-гидроксифлутамида: X, Y и Z.
Фиг.8
Описание схемы изготовления
Следующие примеры предназначены для иллюстрации изобретения без ограничения ими.
Примеры
Пример 1
Этот пример иллюстрирует влияние давления на пористость тел сульфата кальция. Три образца (маркированные как А, В и С) были изготовлены из порошка полугидрата сульфата кальция от компании Sigma-Aldrich (№ по каталогу 30,766-1) и деионизированной воды:
А: 1,0 г порошка полугидрата сульфата кальция в полученном (необработанном) виде смешивали с 2,0 г воды до образования пасты. Пасту использовали для формирования цилиндров диаметром 12 мм и высотой 3 мм, используя форму, и оставляли для отверждения. Изображение поверхности разлома образца типа А, полученное сканирующей электронной микроскопией, представлено на фиг.1а.
В: 1 г порошка полугидрата сульфата кальция в полученном виде сжимали по оси в сухом состоянии при 100 МПа в цилиндрической головке экструдера диаметром 12 мм. Прессованные таблетки вымачивали в воде и оставляли для отверждения.
С: 1,0 г порошка сульфата кальция в полученном виде сжимали по оси в сухом состоянии при 200 МПа в цилиндрической головке экструдера диаметром 12 мм. Прессованные таблетки вымачивали в воде и оставляли для отверждения.
Следующие величины пористости измеряли взвешиванием таблеток и сравнением с табличной теоретической величиной полной плотности полностью прессованного дигидрата сульфата кальция, 2,32 г/мл.
Пример 2
Этот пример иллюстрирует влияние методики гидратации на пористость гидратированного и уплотненного сульфата кальция. Пример показывает, что частичная гидратация под приложенным давлением увеличивает получаемую плотность фармацевтического материала. В этом примере используемый порошок измельчали перед уплотнением. Порошок полугидрата сульфата кальция от компании Sigma-Aldrich (№ по каталогу 30,766-1) мололи в течение 1 часа в шаровой мельнице. Образцы D-F изготавливали из этого порошка.
Процедура помола была следующей: 100 г порошка сульфата кальция смешивали с 55,8 г изопропанола и 500 г мельничных алюминиевых шаров диаметром 16 мм вращали при 100 об/мин в полиэтиленовом цилиндрическом контейнере емкостью 500 мл. Помол должен выполняться в неводной среде, такой как спирт.
Размер частиц анализировали седиграфом. Результаты представлены в таблице 2. Для порошка в полученном виде 50% зерен имеют диаметр менее чем 10,5 мкм, т.е. d50=10,5 мкм. Через 1 час помола размер зерен характеризуется d50=5,5 мкм; и после 2 часов помола порошок характеризуется d50=2,7 мкм. См. таблицу 2.
Получали три типа образцов (маркированных D, E, F):
D: 1,0 г порошка полугидрата сульфата кальция подвергали прессованию по одной оси в форме цилиндрического профиля диаметром 12 мм при осевом давлении 200 МПа. К таблеткам после прессования добавляли 0,19 г деионизированной воды. Вода поглощалась сухим керамическим материалом. 0,186 г воды представляет собой оптимальное стехиометрическое количество, всасываемое в процессе гидратации, для 1,0 г порошка полугидрата сульфата кальция, по мере того как он полностью образует дигидрат, в соответствии с
CaSO4·0,5H2O (s)+H2O (l)→Ca2++SO42- (раствор)→CaSO4·2H2O (s)
Е: Таблетки получали из тех же количеств порошка полугидрата сульфата кальция и деионизированной воды в том же прессующем оборудовании при 200 МПа, как для образца D, но теперь сначала добавлением воды к порошку и смешиванием их вместе и затем прессованием смоченного порошка в таблетки. Воду после этого не добавляли. Таблетки отверждались во время приложения внешнего давления. Изображение поверхности разлома образца типа Е, полученное сканирующей электронной микроскопией, представлено на фиг.1b.
F: Таблетки получали из тех же количеств полугидрата сульфата кальция и деионизированной воды сначала добавлением половины общего количества воды (0,093) к порошку и смешиванием и затем прессованием в таблетки по одной оси. После процесса прессования к таблетке добавляли вторую половину воды на стадии после гидратации.
Следующие величины пористости были измерены взвешиванием таблеток и сравнением с табличной теоретической величиной полной плотности полностью уплотненного дигидрата сульфата кальция, 2,32 г/мл.
Этот пример иллюстрирует, что гидратация под прилагаемым давлением дает более высокую конечную плотность материала по сравнению с гидратацией предварительно уплотненного материала. Однако добавление всей воды перед прессованием не является оптимальным. Вместо этого частичная гидратация под давлением и добавление воды после сдавливания более эффективны при получении плотного материала.
Высказывается гипотеза, что этот эффект объясняется тем, что лишь ограниченное количество воды может оставаться в уплотненном образце при его прессовании прилагаемым давлением и, следовательно, доступно для реакции гидратации. Избыток воды создает остаточную пористость при проведении гидратации под прилагаемым давлением.
Пример 3
Этот пример иллюстрирует величины пористости, достигаемые при помоле порошка в течение двух часов с использованием холодного изостатического прессования, в качестве альтернативы прессованию по одной оси, и удерживанием давления во время гидратации для достижения материалов с высокой степенью прессования. Данный пример также иллюстрирует применение гранулирования замораживанием для получения сухого и гранулированного порошка и добавление жирной органической добавки (стеариновой кислоты) к композиции. Для этого примера были получены четыре образца, маркированные G, H, I, J.
G: Эти образцы были получены изостатическим прессованием с использованием пресса Loomis при 200 МПа. Каждый образец в виде таблетки изготавливали из 1,0 г полугидрата сульфата кальция в виде порошка, полученного от компании Sigma-Aldrich (№ по каталогу 30,766-1). Сначала использовали прессование по одной оси (примерно 20 МПа) для формирования рыхло прессованной таблетки диаметром 12 мм и толщиной примерно 2 мм. Полученные таким образом образцы смачивали 0,186 г деионизированной воды и помещали отдельно в герметично запаянные баллоны. Сразу после нанесения воды образцы помещали в пресс и подвергали воздействию изостатического давления 200 МПа при комнатной температуре (20°С). Давление удерживали в течение 30 минут. Следовательно, образцы были гидратированы под изостатическим давлением. Изостатическое давление значительно уменьшает и диаметр, и толщину образцов.
Н: Эти образцы были получены такой же процедурой, как образцы G, с использованием изостатического прессования, но из порошка, подвергнутого помолу в течение 1 часа, методикой помола, описанной в примере 2, и при добавлении лишь половины воды (0,93 г) во время цикла изостатического прессования. Остающаяся вода была точно добавлена к таблеткам после прессования прикапыванием на таблетки, помещенные на весы.
I: Эти образцы были получены, как образцы G и H, снова с использованием изостатического прессования, но из порошка, подвергнутого помолу в течение 2 часов, как описано в примере 2, и при добавлении лишь половины воды (0,93 г) во время изостатического прессования. Далее порошок гранулировали перед прессованием методикой гранулирования замораживанием. Остающаяся вода была добавлена к таблеткам прикапыванием на таблетки, помещенные на весы после изостатического прессования.
Процесс гранулирования замораживанием выполняли следующим образом. Суспензию порошковой смеси и изопропанол распыляли струей воздуха в контейнер с жидким азотом. Капли порошковой суспензии моментально замерзали при их попадании в азот, образуя гранулы однородной композиции. На последующей стадии лиофилизации лед удаляли сублимацией в вакуумной камере без какой-либо сегрегации микроструктуры гранул. В результате получали сферические гранулы с композицией исходной порошковой смеси.
J: Эти образцы получали, как образцы I, но с добавкой 0,5 или 1,0% стеариновой кислоты к исходному порошку.
Следующие величины пористости были измерены сравнением с табличной теоретической величиной полной плотности дигидрата сульфата кальция.
Этот пример иллюстрирует положительный эффект уменьшенного размера зерен порошка, в данном случае достигаемого помолом, на достигаемую низкую пористость уплотненного материала. Однако при сравнении примеров 2 и 3 не было поддающегося измерению различия между помолом в течение 1 ч и 2 ч, хотя различие между отсутствием помола и помолом в течение 1 ч было значимым (по данным измерения седиграфом).
Пример также иллюстрирует возможность использования методики гранулирования замораживанием. Это имеет преимущество получения порошков с лучшей текучестью по сравнению с негранулированным порошком. Однако его воздействие на плотность материала было низким. Этот пример, кроме того, показывает, что данная добавка в виде стеариновой кислоты может быть включена в композицию. Однако ее воздействие на пористость было низким в этих тестах. Однако добавка делает испытуемые образцы более гидрофобными.
Пример 4
Этот пример служит для верификации величин пористости предыдущих примеров выполнением дополнительных измерений отобранных образцов более точным способом измерения размера пор.
Структуру пор отобранных образцов измеряли способом измерения пористости Hg (Micrometrics AutoPore III 9410). Этот способ количественно определяет общую пористость и размеры пор.
При использовании ртутного способа пористость образца F из примера 2 составила 4,8%, образца Н из примера 3 составила 4,0% и образца I из примера 3 составила 2,8%, см. таблицу 5.
Это подтверждает порядок величин пористости по данным измерения по размерам образцов и теоретической, полной плотности.
Пример 5
Этот пример иллюстрирует, как можно достичь добавления 2-гидроксифлутамида, фармакологического активного метаболита флутамида, к уплотненному материалу сульфата кальция. 2-гидроксифлутамид представляет особый интерес для настоящего изобретения. Этот пример также представляет типичные данные скорости высвобождения лекарственного средства для такой композиции, полученные на модели in vitro.
Получение образца
Получали три различных типа образцов, маркированных K, L и M с 2-гидроксифлутамидом в матрице/носителе сульфата кальция и оценивали в отношении высвобождения лекарственного средства in vitro/in vivo и фармакокинетики in vivo.
К: Эти образцы представляют собой неуплотненные, полностью гидратированные образцы сульфата кальция с 2-гидроксифлутамидом. Для каждого образца 4,5 мг кристаллизованного 2-гидроксифлутамида в форме мелкозернистого порошка добавляли к 0,5 г полугидрата сульфата кальция в полученном виде и смешивали. Добавляли 1,0 г стерильной воды (соотношение 2:1 по массе) для образования пасты и формовали таблетки диаметром 12 мм и оставляли для отверждения.
L: В качестве образцов К в этом примере эти образцы представляют собой изостатически прессованные таблетки с таким же количеством 2-гидроксифлутамида на образец.
Для получения образцов порошок в полученном виде подвергали помолу в течение 2 часов способом, описанным в примере 3.
2-гидроксифлутамид растворяли в изопропаноле (Европейская Фармакопея от Merck, CAS 6-63-0). Подвергнутый помолу порошок полугидрата сульфата кальция добавляли к раствору. Ультразвуковую баню (Elma Trans-sonic T700) использовали для деагломерации порошка.
Дисперсию сушили испарителем типа Buchi Roravapor R110 для образования порошка полугидрата сульфата кальция с осажденным 2-гидроксифлутамидом. Пропорции составляли 4,5 мг 2-гидроксифлутамида к 0,5 г порошка сульфата кальция. (Также успешно оценивали гранулирование замораживанием для получения смеси полугидрата сульфата кальция и 2-гидроксифлутамида).
Одноосевое прессование примерно при 20 МПа использовали для формирования рыхло прессованной таблетки 0,5 г полугидрата сульфата кальция при низком давлении, диаметром примерно 12 мм и толщиной 2 мм. Для уплотнения образцов каждую таблетку смачивали 0,046 г стерильной воды и помещали отдельно в баллончики. На образцы воздействовали изостатическим давлением 200 МПа сразу после смачивания в прессовочном оборудовании на основе масла (изостатический пресс Loomis). Давление удерживали в течение 30 минут. Таким образом, образцы гидратировали под изостатическим давлением. Изостатическое давление значительно уменьшает и диаметр, и толщину образцов. Затем для достижения полной гидратации добавляли еще 0,046 г стерильной воды.
М: Образцы типа L измельчали (Fritsch Pulverisette типа 1) и просеивали (мелкими ситами от Retsch) до измельченных зерен размером 100-500 мкм.
Для создания пасты сульфата кальция, содержащей уплотненные зерна, зерна смешивали с порошком негидратированного и в полученном виде полугидрата сульфата кальция в пропорциях 1:2 по массе. Пасту этого порошка использовали для формовки образцов, создавая двухфазную композицию с гидрированными и уплотненными зернами, содержащими 2-гидроксифлутамид, в матрице неуплотненного и гидратированного сульфата кальция. Испытуемые образцы, содержащие 4,5 мг 2-гидроксифлутамида (т.е. 0,5 г уплотненных зерен), получали для тестов высвобождения in vitro.
Тесты высвобождения лекарственного средства in vitro
Полученные таблетки по 0,5 г с 4,5 мг 2-гидроксифлутамида и формованные образцы с измельченными зернами в неуплотненной матрице помещали в стеклянные контейнеры, содержащие 60 мл стерильного солевого раствора NaCl (9 мг/мл), инкубировали в водяной бане при 37°С.
В каждом случае взятия образца брали 4 мл солевого раствора и замещали 4 мл свежего стерильного солевого раствора. Перед взятием пробы сосуд для определения высвобождения in vitro осторожно встряхивали.
Образцы хранили в пластических капсулах, замораживали непосредственно после взятия и хранили при -20°С до анализа. Жидкие образцы анализировали в отношении концентрации в них 2-гидроксифлутамида с использованием LC-MS-MS хроматографии (жидкостной хроматографии - масс-спектрометрии).
Результаты определения высвобождения лекарственного средства in vitro
Данные высвобождения лекарственного средства in vitro пересчитаны и представлены в виде высвобождения в процентах 2-гидроксифлутамида относительно общего количества 2-гидроксифлутамида в препаративной форме в течение времени. Данные показаны на фиг.2.
- Непрессованная препаративная форма высвобождает более чем 90% 2-гидроксифлутамида примерно за 10 дней (образец К).
- Прессованные таблетки (L) высвобождают 2-гидроксифлутамид с одинаково высокой скоростью в течение первых 10-15 дней, затем скорость высвобождения снижалась. Через 40 дней из препаративной формы (образца L) высвобождается примерно 70% общего количества 2-гидроксифлутамида.
- Образец М уплотненных гранул в неуплотненной матрице обеспечивает очень быстрое высвобождение в течение первого дня, но затем скорость высвобождения ниже, чем для других образцов. Через 40 дней высвобождение достигло примерно 40%, что явно ниже, чем для препаративной формы L.
Пример 6
Этот пример иллюстрирует влияние прилагаемого внешнего давления на величины скорости высвобождения 2-гидроксифлутамида из уплотненных различным образом тел сульфата кальция. Этот пример также иллюстрирует, как можно достичь добавления 2-гидроксифлутамида, фармакологического активного метаболита флутамида, к уплотненному материалу сульфата кальция. Особый интерес представляет 2-гидроксифлутамид. Пример предоставляет данные типичной скорости высвобождения лекарственного средства для таких композиций, полученных на модели in vitro.
Три различных образца (маркированные i, ii и iii) были изготовлены из порошка полугидрата сульфата кальция от компании Sigma-Aldrich (№ по каталогу 30,766-1), стерильной воды и 2-гидроксифлутамида. Способ изготовления был следующий.
Порошок полугидрата сульфата кальция от компании Sigma-Aldrich (№ по каталогу 30,766-1) подвергали измельчению для уменьшения размера зерен (галтованием в пластиковом контейнере емкостью 1,0 литр) в течение 48 часов в изопропаноле (Европейская Фармакопея от Merck, CAS 6-63-0) керамическими мельничными шарами до размера зерен, соответствующего величине на 50% меньше 3 мкм и на 80% меньше 6 мкм. Первоначальный порошок имел размер зерен на 50% меньше 10 мкм.
10 г 2-гидроксифлутамида полностью растворяли в 75 г изопропанола. Растворение ускоряли ультразвуковой баней (Elma Trans-sonic T700). 100 г подвергнутого помолу полугидрата сульфата кальция добавляли к раствору 2-гидроксифлутамида-изопропанола и перемешивали до образования однородной кашицеобразной суспензии. Ультразвуковую баню использовали для деагломерации порошка. Дисперсию сушили испарителем (типа Buchi Rotavapor R110) для образования порошка полугидрата сульфата кальция с осажденным 2-гидроксифлутамидом. Высушенную порошковую смесь пропускали через сито с размером отверстий 355 мкм для достижения деагломерации и получения легко текучего порошка.
Альтернативные способы оценивали для образования смеси полугидрата сульфата кальция и 2-гидроксифлутамида. В качестве одной альтернативы была проведена успешная оценка гранулирования замораживанием для получения смеси полугидрата сульфата кальция и 2-гидроксифлутамида. В качестве второй альтернативы была проведена успешная оценка сухого смешивания. Кристаллизованный 2-гидроксифлутамид пропускали в сухом виде через сито 20 мкм для образования мелкозернистого порошка, который можно непосредственно смешивать с полугидратом сульфата кальция. Однако выпаривание (неводного) растворителя, подходящего для 2-гидроксифлутамида (такого как изопропанол), представляется осуществляемым способом получения.
Полученную таким образом порошковую смесь использовали для изготовления трех типов образцов одноосевым прессованием. Стержни массой 10 г прессовали в прессующем инструменте из нержавеющей стали с размерами полости 8×60 мм. Высота стержней стала примерно 8-10 мм, в зависимости от прилагаемого давления. Стержни уплотняли нагрузками 0,75 кН и 10 кН, соответствующими 1,5 МПа и 20 МПа.
Стержни сжимали при 1,5 и 20 МПа соответственно, образцы (i) и (ii) смачивали 1,5 г воды и оставляли для гидратации под дисковой крышкой Петри в течение ночи. Воду добавляли пипеткой, по 0,375 мг на каждую длинную сторону стержня. От гидратированных стержней отрезали кусочки по 0,1 г. Эти кусочки использовали для тестов высвобождения, как далее описано ниже.
Для изготовления образца (iii) использовали вторую стадию прессования. Стержень, предварительно уплотненный при 20 МПа, обрабатывали при более высоком давлении на второй стадии после смачивания. Стержень смачивали всего 1,5 г воды так же, как описано выше, но сразу после смачивания стержень инкапсулировали в баллон и подвергали воздействию внешнего изостатического давления 300 МПа в течение 30 минут, используя холодовой пресс на основе масла от компании Jemtab AB. Все циклы уплотнения выполняли при комнатной температуре.
Высокоуплотненный материал, образованный внешним изостатическим давлением, испытывали в гранулярной форме. Для получения зерен или гранул из уплотненного стержня его дробили, используя ультрацентрифужную мельницу от компании Retsch. После дробления зерна размером 125-500 мкм отбирали просеиванием. Просеянные зерна смешивали с первоначальным немолотым порошком полугидрата сульфата кальция от компании Sigma-Aldrich (№ по каталогу 30,766-1) в пропорциях 1:2 по массе, образуя посредством этого гидратируемую порошковую смесь.
Из этой порошковой смеси формовали и отверждали образцы для тестов высвобождения in vitro. Для формовки образцов 4,0 г порошка смешивали с 2,5 г раствора, содержащего 1,0% мас. уксусной кислоты и 1,0% мас. метилцеллюлозы для образования однородной пасты. Шприц использовали для формирования комков пасты массой 1,0 г. Формованные комки пасты оставляли для гидратации в течение ночи с образованием твердых кусочков, использованных для тестов высвобождения.
Гранулярная форма уплотненного и одновременно гидратированного керамического носителя с активным агентом, использованная в виде пасты с разбавителем на основе воды, представляет особый интерес, и ее оценка также проводилась после стерилизации. Порошковую смесь стерилизовали гамма-облучением, а водные разбавители - термической обработкой в автоклаве.
Образцы (i), (ii) и (iii) оценивали в отношении величин скорости высвобождения на модели in vitro. Тесты высвобождения выполняли помещением тестируемых кусочков в стеклянные контейнеры, содержащие 100 мл стерильного солевого раствора NaCl (9 мг/мл), инкубируемые при 37°С. Образцы солевого раствора брали через заданные интервалы и анализировали в отношении концентрации в них 2-гидроксифлутамида с использованием жидкостной хроматографии - масс-спектрометрии (LC-MS-MS). В каждом случае взятия образца брали 20 мл солевого раствора и замещали 20 мл свежего солевого раствора. Перед взятием образца сосуд для высвобождения in vitro осторожно встряхивали. Образцы хранили в пластиковых капсулах, замораживали сразу после взятия и хранили до анализа при -20°С.
Результаты высвобождения представлены на фиг.3. На модели in vitro, и образец (i), и образец (ii), изготовленные с одной стадией уплотнения при 1,5 и 20 МПа, высвобождали большую часть инкапсулированного 2-гидроксифлутамида примерно после 10 дней. Тестируемые образцы на основе материала, уплотненного и гидратированного при 300 МПа, высвобождают 2-гидроксифлутамид в течение примерно 60 дней.
Этот пример иллюстрирует влияние гидратации в условиях прилагаемого внешнего прессования на скорость высвобождения активных агентов из керамической, гидратируемой и рассасывающейся матрицы. Этот пример также иллюстрирует интересную альтернативу получения уплотненной и гидратированной керамической композиции в виде инъецируемой пасты с уплотненными гранулами.
Пример 7
Описание способа изготовления
Высокоуплотненный керамический материал в соответствии с изобретением
Схема изготовления высокоуплотненного керамического материала в соответствии с изобретением представлена на Фиг.8.
Ниже представлено описание процесса изготовления материала.
Контроль материалов
Изопропанол (анализ >99,8%, содержание воды <0,1%) и вода для инъекций, использованные в способе изготовления, удовлетворяют соответствующим требованиям Европейской Фармакопеи.
Получение компонентов
Порошок 2-гидроксифлутамида взвешивают и растворяют в изопропаноле.
Порошок полугидрата сульфата кальция взвешивают, смешивают с изопропанолом и перемалывают в порошковой мельнице в мелкие частицы. Изопропанол выпаривают и высушенный порошок пропускают через сито.
Смешивание и сушка
Мелко молотый и высушенный порошок полугидрата сульфата кальция добавляют к раствору 2-гидроксифлутамида в соотношении 1,0 г порошка сульфата кальция к 0,1 г 2-гидроксифлутамида, растворенного в изопропаноле.
Порошок деагломерируют в ультразвуковой бане. Смесь сушат в испарителе и высушенный порошок пропускают через сито.
Изготовление стержней
Стержни массой приблизительно 10 г, размерами приблизительно 60×8×10 мм изготавливают из высушенной смеси сухим прессованием.
Гидратация под давлением
Приблизительно 1,5 г воды для инъекций по каплям добавляют к каждому стержню и дают возможность впитаться в пористый стержень. В пределах одной минуты от момента добавления воды смоченный стержень заворачивают в алюминиевую фольгу и инкапсулируют в баллон, погружают в масляную баню пресса и подвергают воздействию давления 300 МПа. Давление 300 МПа поддерживается в течение 30 минут.
Баллон удаляют и стержни оставляют для сушки.
Гранулирование
Твердые стержни дробят в мелкие гранулы и пропускают через два сита с размерами отверстий, соответствующими верхнему и нижнему пределам желаемого диапазона размера гранул. Материал, проходящий через отверстия меньшего размера (125 мкм), удаляют. Удаленный материал составляет приблизительно 50% общего количества.
За один цикл изготавливают, гидратируют и прессуют приблизительно два стержня и процедуру повторяют до тех пор, пока весь материал не будет подвергнут прессованию и гранулированию.
Распределение по флакончикам
Гранулы вручную распределяют по флакончикам, используя весы, оборудованные принтером, по 1,33 г на флакончик. В каждый флакончик добавляют дополнительное количество 2,66 г полугидрата сульфата кальция в полученном виде (пропорции по массе 1:2).
Флакончики закупоривают пробкой и закрывают колпачком. Гранулы смешивают с полугидратом сульфата кальция встряхиванием флакончика.
Маркировка
Флакончики маркируют. Три флакончика удаляют для теста биологического груза.
Стерилизация
Порошок Liproca стерилизуют гамма-облучением.
Упаковка
Образцы берут для теста стерильности и флакончики визуально осматривают перед упаковкой в коробки вместе с Liproca Diluent MC (т.е. водой, содержащей метилцеллюлозу) и Liproca Diluent HAc (т.е. водой, содержащей уксусную кислоту).
Пример 8
Этот пример иллюстрирует сниженную скорость высвобождения, достигаемую уплотнением сульфата кальция, по данным оценки на экспериментальных моделях (in vivo). 2 различные экспериментальные модели (самцы лабрадоров и бараны) использовали при оценке характеристик высвобождения in vivo лекарственного средства, имплантатов контролируемого высвобождения на основе сульфата кальция, содержащих 2-гидроксифлутамид.
Внутривенное болюсное введение
Сначала выполняли исследование на 4 половозрелых собаках-лабрадорах в возрасте 1 года при одобрении Комитета по этике в отношении животных Гетенбергского университета.
Сначала самцам собак (лабрадоров) внутривенно вводили болюсную дозу 2-гидроксифлутамида или 25 мг (10 мл раствора) на животное в течение 30 секунд. Композиция раствора для внутривенного введения представляла собой стерильный солевой раствор 54%, стерильный полиэтиленгликоль 400, 46% и 6% этанол (95%).
После инъекции в яремную вену образцы крови брали в заданные точки времени в течение 10 часов.
2-гидроксифлутамид быстро выводился после внутривенного болюсного введения, и период полувыведения составил 1,75±0,2 часа. Профиль динамики во времени концентрации 2-гидроксифлутамида в плазме по каждой собаке представлен на фиг.4. Примерно через 10 часов концентрация 2-гидроксифлутамида в плазме была ниже предела выявления.
Неуплотненный сульфат кальция как носитель лекарственного средства у собак
Через одну неделю тем же животным, которым внутривенно вводили дозу 2-гидроксифлутамида, вводили смесь 2-гидроксифлутамида и неуплотненного полугидрата сульфата кальция в ткань предстательной железы в качестве имплантата контролируемого высвобождения. Дозы 2-гидроксифлутамида составляли 0 (контроль), 30, 60 и 120 мг, и их вводили вместе с сульфатом кальция в виде одной инъекции имплантата ректальным путем. Контрольному животному вводили имплантат сульфата кальция без 2-гидроксифлутамида.
Для изготовления имплантата порошок полугидрата сульфата кальция смешивали со стерильной водой и активным агентом для образования пасты. Отношение стерилизованного порошка полугидрата сульфата кальция к воде составляло 1:2, и дозу активного агента смешивали всего с 0,8 мл пасты. Пасту инъецировали в предстательную железу и отверждали in vivo. Настоящая композиция имплантата имеет профиль высвобождения in vitro, который равен профилю высвобождения К на фиг.2.
Систему подачи лекарственного препарата в виде имплантата вводили в ткань предстательной железы через прямую кишку путем применения иголок и ультразвукового контроля. Во время процедуры введения животные находились под общей анестезией. Иголку (длиной 15 см с наружным диаметром 0,9 мм) вводили в подготовленную прямую кишку через ректальную и брюшную стенку и помещали в ткань предстательной железы под ультразвуковым контролем. Дозу имплантата помещали в ткань предстательной железы в виде двух тонких пружин длиной приблизительно 12 мм и диаметром 1-2 мм. Каждому животному вводили антибиотик в течение одной недели.
Пробы крови брали каждый день в течение первой недели и затем через день в течение двух оставшихся недель. Концентрацию 2-гидроксифлутамида в плазме количественно определяли способом HPLC-MS-MS хроматографии (высокоэффективной жидкостной хроматографии - масс-спектрометрии).
Препаративную форму получали под наблюдением ответственного фармацевта. Введение и дозировка имплантата на основе стерильного керамического материала в ткань предстательной железы выполнялись ответственным урологом.
Результаты - неуплотненный сульфат кальция
Отдельные профили динамики во времени концентрации 2-гидроксифлутамида в плазме для неуплотненных образцов иллюстрируются на фиг.5. Для использованных композиций концентрации 2-гидроксифлутамида в плазме через девять дней после введения имплантата контролируемого высвобождения в предстательную железу были ниже предела выявления (LOQ). Это интерпретировали тем, что высвобождение лекарственного средства было, по меньшей мере, почти полным через девять дней после введения в предстательную железу. Это означает, что профиль высвобождения лекарственного средства in vitro с достаточно высокой точностью прогнозирует профиль высвобождения лекарственного средства in vivo. Он также демонстрирует, что способ высвобождения in vitro, разработанный для этого способа имплантата, можно использовать при разработке этих составов имплантатов.
Кроме того, были сделаны следующие выводы.
- Имплантат длительного высвобождения был успешно имплантирован в ткань предстательной железы принятыми хирургическими методиками, т.е. иголками и ультразвуковым контролем.
Для двух более высоких одиночных доз имплантата (60 и 120 мг) масса ткани была снижена по сравнению с животными, которым вводили плацебо и одну низкую дозу имплантата (30 мг). Ткань предстательной железы также была мягче, чем у контрольного животного, а также животного, получавшего низкую дозу имплантата.
- Было также показано, что сульфат кальция пролонгировал высвобождение активного лекарственного средства и что его концентрация в плазме была низкой и после введения дозы имплантата не наблюдались острые системные опосредованные побочные эффекты, такие как диарея. Скорость высвобождения in vivo удлинялась в 40-45 раз, о чем можно было судить по удлиненному периоду полувыведения 2-гидроксифлутамида из плазмы по сравнению с соответствующей фармакокинетической переменной величиной после внутривенного болюсного введения.
- Патогистология показала, что имплантат был хорошо переносим и что процедура не вызывала никаких инфекций. Керамический имплантат вызывал минимальные воспалительные реакции в ткани предстательной железы.
Уплотненный сульфат кальция в качестве имплантата контролируемого высвобождения у баранов
Во-вторых, было выполнено экспериментальное исследование in vivo с уплотненным сульфатом кальция у 15 баранов в возрасте от 1 до 6 лет. Исследование было одобрено Региональным комитетом по этике животных в Упсале, Швеция.
15 половозрелых баранов делили на три отдельные группы. Двум группам вводили 2-гидроксифлутамид местной системой доставки в виде имплантата в ткань предстательной железы. Каждое животное получало одно введение, и период наблюдения составлял 2 месяца. Каждый баран в этих двух группах лечения получал имплантат в предстательную железу однократной дозой 250 мг или 500 мг 2-гидроксифлутамида. Контрольная группа из пяти животных получала имплантат на основе керамического материала без 2-гидроксифлутамида. Систему доставки лекарственного средства в виде имплантата вводили в один участок ткани предстательной железы через прямую кишку путем использования игл и ультразвукового контроля. Во время процедуры введения животные находились под общей анестезией. Иглу 13 калибра (длиной 15 см) вводили в подготовленную прямую кишку через прямокишечную и брюшную стенку и размещали в ткани предстательной железы. Дозу имплантата вводили в предстательную железу в виде одного ограниченного объема приблизительно 2 и 4 мл в каждую долю предстательной железы.
Для изготовления композиций имплантатов порошок уплотняли вместе с 2-гидроксифлутамидом, используя холодное изостатическое прессование. Сначала полугидрат сульфата кальция подвергали одноосевому прессованию в образцы рыхло спрессованных стержней низким давлением. Образцы смачивали, помещали в баллоны и сразу подвергали воздействию изостатического давления 200 МПа в течение 30 минут. Затем добавляли стерильную воду для достижения полной гидратации. Всего на каждый грамм сульфата использовали 0,19 г воды. Получали образцы, содержащие (50 или) 100 мг 2-гидроксифлутамида в 1,0 г сульфата кальция.
Уплотненные образцы дробили до зерен размером 125-500 мкм, используя устройство Fritsch Pulverisette типа 1, и смешивали с негидратированным и молотым порошком сульфата кальция в пропорциях 1:2 по массе. Для тестов на животных получали партии порошка, содержащего 2,5 г молотых зерен и 5,0 г неуплотненного полугидрата сульфата кальция.
Порошок смешивали со стерильной водой, 1% метилцеллюлозы и 1% уксусной кислоты. Каждую такую партию порошка смешивали с 3,5 мл водной жидкости и смешивали для получения пасты.
Количественное определение концентрации 2-гидроксифлутамида в плазме проводили обоснованным способом HPLC-MS-MS.
Результаты - уплотненный сульфат кальция
Концентрация 2-гидроксифлутамида в плазме как функция времени проиллюстрирована на фиг.6 для уплотненных образцов. Для использованных композиций количество 2-гидроксифлутамида было снижено.
Очевидно, что скорость высвобождения лекарственного средства дополнительно снижается при уплотненном составе, поскольку период полувыведения снижающейся концентрации в плазме составляет 20 дней. Это представляет собой пролонгацию высвобождения in vivo лекарственного средства в 5 раз по сравнению с неуплотненным составом, использованным у собак. По фармакокинетическим исследованиям аппроксимировано, что примерно 40% дозы высвобождается через 25 дней, и поэтому местное высвобождение лекарственного средства будет продолжаться и генерировать местную концентрацию, которая приведет к фармакологическому и клиническому эффекту. Также очевидно, что способ высвобождения in vitro с высокой точностью также прогнозирует профиль высвобождения лекарственного средства in vivo.
После умерщвления животных через 50 дней имплантаты почти полностью исчезли.
Было также ясно, что объем ткани предстательной железы был значительно снижен у баранов, которым вводили имплантат контролируемого высвобождения, содержащий фармакологически активный 2-гидроксифлутамид. У баранов, которым вводили состав без фармакологически активного 2-гидроксифлутамида, не было воздействия на объем предстательной железы. Концентрация 2-гидроксифлутамида в плазме была низкой, и, соответственно, не наблюдались побочные эффекты, связанные с активными лекарственными средствами.
Пример 9
Этот пример дополнительно иллюстрирует воздействие уплотнения на скорость высвобождения 2-гидроксифлутамида из составов на основе сульфата кальция. Представлены структуры с зернами подвергнутого прессованию высокоплотного сульфата кальция, содержащими захваченный 2-гидроксифлутамид.
На фиг.7 показаны величины скорости высвобождения из уплотненных зерен, содержащих 100 мг или 50 мг 2-гидроксифлутамида на 1 г полугидрата сульфата кальция исходного порошка. И зерна, включенные в отвержденную пасту сульфата кальция-воды (X, Y), или зерна отдельно испытываются в тесте высвобождения in vitro на водной основе (Z).
Подвергнутые прессованию зерна были изготовлены, как в примере 6 с использованием изостатического прессования при 200 МПа с последующим дроблением уплотненного материала. Зерна просеивали до диапазона размера 125-500 мкм, и они содержали 50 мг или 100 мг 2-гидроксифлутамида на 1 г полугидрата сульфата кальция так же, как в примере 6.
Получали партии порошка, содержащего 2,5 г дробленых зерен (с 50 или 100 мг/г 2-гидроксифлутамида) и 5,0 г неуплотненного полугидрата сульфата кальция (без 2-гидроксифлутамида). Порошок смешивали с 3,5 мл воды, содержащей 1% уксусной кислоты и 1% метилцеллюлозы, образуя пасту, которую разделяли на 5 отдельных блоков и оставляли для отверждения. Таким образом, каждый образец содержал 0,5 г уплотненных зерен и 1,0 г непрессованного сульфата кальция. Таким образом, образцы, полученные из зерен со 100 мг/г 2-гидроксифлутамида, содержат общее количество 50 мг 2-гидроксифлутамида, и образцы, полученные с зернами, содержащими 50 мг/г, удерживают общее количество 25 мг 2-гидроксифлутамида.
Образцы, отобранные для тестов высвобождения, представляют собой:
X: Зерна уплотненного сульфата кальция с 50 мг/г 2-гидроксифлутамида в матрице пасты гидратированного сульфата кальция.
Y: Зерна уплотненного сульфата кальция со 100 мг/г 2-гидроксифлутамида в матрице пасты гидратированного сульфата кальция.
Z: Прессованные зерна со 100 мг/г 2-гидроксифлутамида, анализированные отдельно, без заливки в керамическую матрицу. Всего испытывали 0,5 г зерен (таким образом, содержащих 50 мг 2-гидроксифлутамида).
Для тестов высвобождения in vitro образцы помещали в стеклянные контейнеры, содержащие 100 мл стерильного солевого раствора NaCl (9 мг/мл), инкубировали в водяной бане при 37°С в течение периода до 30 дней. Через заданные интервалы брали 4 мл раствора и замещали 4 мл свежего стерильного солевого раствора.
Проводили количественный анализ образцов солевого раствора в отношении концентрации 2-гидроксифлутамида использованием аналитической хроматографии LC-MS-MS.
Результаты
На фиг.7 видно, что все образцы высвобождают 2-гидроксифлутамид со скоростью, которая исходно выше и которая падает до более низкого уровня после первых 15-20 дней. Еще через 30 дней значительная часть 2-гидроксифлутамида еще остается в керамическом носителе. Характеристика скорости высвобождения в целом одинакова для обоих двухфазных образцов, хотя образец, захватывающий более высокую концентрацию 2-гидроксифлутамида, высвобождает более низкую долю общей нагрузки лекарственного средства. Свободные зерна исходно высвобождают с более высокой скоростью в течение первых 5-10 дней, затем скорость высвобождения почти равна скорости высвобождения композитных образцов примерно до 30 дней. Таким образом, проиллюстрировано, что отвержденная матрица, окружающая уплотненные зерна, снижала скорость высвобождения в течение первых примерно 10 дней, и, вероятно, также в перспективе в течение более 30 дней.
Реферат
Изобретение относится к медицине. Описан новый способ получения высоко уплотненного и, по меньшей мере, частично, предпочтительно полностью или почти полностью, гидратированного керамического материала для использования при получении фармацевтической композиции, особенно для контролируемого высвобождения одного или нескольких терапевтически, профилактически и/или диагностически активных веществ. Способ включает сопутствующую стадию гидратации и уплотнения биологически рассасывающегося и гидратируемого керамического материала, такого как сульфат кальция. Изобретение также относится к композициям, включающим такой высокоуплотненный керамический материал. Фармацевтическую композицию можно применять для нацеленного и контролируемого местного продолжительного высвобождения активных веществ, например противораковых средств, посредством чего минимизируются спектр и тяжесть побочных эффектов ввиду оптимизированного профиля динамики во времени местной концентрации. 6 н. и 71 з.п. ф-лы, 8 ил., 5 табл.
Формула
i) смешивания одного или более гидратируемых и биологически рассасывающихся керамических материалов с одним или более терапевтически, профилактически и/или диагностически активными веществами, составляющими менее чем, примерно, 50% мас/мас.,
ii) уплотнения смеси, полученной на стадии i), посредством приложения внешнего давления,
iii) гидратации керамического материала во время уплотнения на стадии ii) добавлением воды к полученной смеси со стадии i), в количестве, соответствующем от примерно 20% до примерно 120% стехиометрического количества, необходимого для полной гидратации одного или более керамических материалов,
посредством чего получается высокоуплотненный и, по меньшей мере, частично гидратированный керамический материал с пористостью не более чем 10%.
Документы, цитированные в отчёте о поиске
Пористые частицы гидроксиапатита в качестве носителей для лекарственных веществ

Комментарии