Ионизируемые соединения и композиции и их применения - RU2776478C2
Код документа: RU2776478C2
Чертежи



























Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к областям биофармацевтических и терапевтических средств. Более конкретно, настоящее изобретение относится к соединениям, композициям и способам получения наночастиц для доставки и распределения действующих агентов или лекарственных соединений в клетках, тканях, органах или субъектах.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Терапевтические средства, такие как лекарственные соединения, молекулы нуклеиновых кислот и другие действующие агенты, действуют после поглощения клетками, тканями и органами субъекта. Трансфекция клеток средствами и молекулами часто является лимитирующим этапом терапевтического действия.
[0003] Если молекулы действующего агента чувствительны к воздействию или разрушению в сыворотке или других биологических условиях, то возникает необходимость защищать молекулы с целью достижения ими медицинского эффекта.
[0004] Например, один из путей проведения трансфекции нуклеиновыми кислотами представляет собой заключение действующих молекул внутрь липидной наночастицы. Недостатки этой методики включают в себя потенциальную токсичность при различных способах доставки, таких как внутривенная инъекция, и низкие скорости проникновения в клетку.
[0005] Существует давняя потребность в молекулах для обеспечения наночастиц, которые обладают выигрышными параметрами трансфекции для доставки действующих агентов в клетку.
[0006] Существует потребность в композициях и соединениях для формирования наночастиц для действующих агентов. Существует постоянная потребность в липидоподобных молекулах и композициях для эффективной трансфекции и распределения молекул нуклеиновых кислот и других агентов в клетках и субъектах.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0007] Настоящее изобретение относится к молекулам и их композициям для применения в биофармацевтических и терапевтических средствах. Более конкретно, настоящее изобретение относится к соединениям, композициям и способам получения наночастиц для доставки и распределения действующих агентов или лекарственных соединений в клетках, тканях, органах и субъектах.
[0008] Настоящее изобретение относится к целому ряду ионизируемых соединений. Ионизируемые соединения согласно настоящему изобретению могут быть использованы для формирования наночастиц для доставки и распределения действующих агентов.
[0009] Варианты осуществления настоящего изобретения включают в себя широкий ряд соединений, обладающих липидоподобными свойствами или способностью к формированию липосом.
[0010] Согласно некоторым вариантам осуществления, соединение может характеризоваться структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из







где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси и аминоалкила;
каждый R7 независимо выбирают из H, алкила и гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7;
p равен от 1 до 4.
[0011] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой II

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 представляет собой C(12-20)алкильную группу или C(12-20)алкенильную группу, которая замещена карбоксильной или сложноэфирной группой.
[0012] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой III
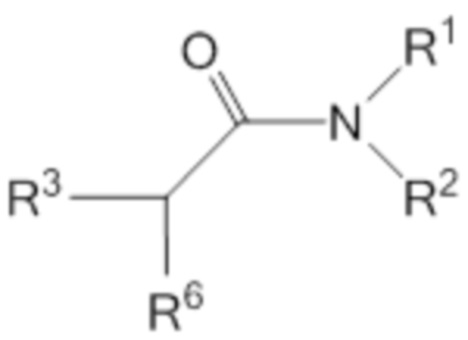
где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из алкила, гидроксиалкила, алкоксиалкокси и карбоксиалкила;
где R6 выбирают из NR72, N+HR72 и N+R73;
где R7 выбирают из H, алкила, гидроксиалкила.
[0013] Соединение согласно настоящему изобретению может характеризоваться структурой, представленной формулой IV

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из







где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7;
p равен от 1 до 4.
[0014] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой IV-B

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой S или O;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
p равен от 1 до 4.
[0015] Согласно дополнительным аспектам, соединение может характеризоваться структурой, представленной формулой V

где R1=NHC(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из







где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[0016] Соединение согласно настоящему изобретению может характеризоваться структурой, представленной формулой VI

где R1=OC(=O)R4,
где R2 и R4 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из аминоалкила, четвертичного аминоалкила.
[0017] Согласно определенным вариантам осуществления, соединение согласно настоящему изобретению может характеризоваться структурой, представленной формулой VII

где R1=OC(=O)R4, и R2=OC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из H, алкила, аминоалкила, четвертичного аминоалкила, гидроксиалкила, алкоксиалкила, алкоксиалкоксиалкила.
[0018] Согласно дополнительным аспектам, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH или O;
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из амино, четвертичного амино, аминоалкила, четвертичного аминоалкила,


где R10 выбирают из







карбоксиалкила, аминоалкила,


где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[0019] Согласно определенным аспектам, соединение может характеризоваться структурой, представленной формулой VIII-B

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2;
R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой N, O;
где R3 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила,

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
p равен от 1 до 4.
[0020] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой IX

где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из







где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[0021] Соединение согласно настоящему раскрытию может характеризоваться структурой, представленной формулой X
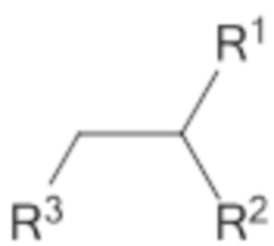
где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из амино, четветичного амино, аминоалкила, четвертичного аминоалкила, гидроксиалкиламино.
[0022] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой XI

где R1=C(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой O или NH;
где p равен от 1 до 4;
где R3 выбирают из







где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[0023] Настоящее изобретение дополнительно предусматривает композиции, содержащие представленное выше ионизируемое соединение и фармацевтически приемлемый носитель. Согласно некоторым вариантам осуществления, композиция может содержать наночастицы. Настоящее раскрытие включает в себя фармацевтические композиции, содержащие представленное выше ионизируемое соединение, действующий агент и фармацевтически приемлемый носитель. Содержание ионизируемого соединения может составлять от 15 мол.% до 40 мол.% липидов композиции. Согласно некоторым вариантам осуществления, композиция может содержать наночастицы.
[0024] Действующий агент согласно настоящему раскрытию может представлять собой одну или несколько RNAi-молекул. Действующий агент может представлять собой одну или несколько RNAi-молекул, выбранных из малых интерферирующих РНК (siRNA), двуспиральных РНК (dsRNA), которые представляют собой субстраты для Dicer, микроРНК (miRNA), коротких шпилечных РНК (shRNA), ДНК-ориентированных РНК (ddRNA), взаимодействующих с Piwi РНК (piRNA), ассоциированных с повторами siRNA (rasiRNA), и их модифицированных форм.
[0025] Действующий агент согласно настоящему раскрытию, может представлять собой один или несколько действующих фармацевтических ингредиентов.
[0026] Согласно определенным вариантам осуществления, настоящее изобретение включает в себя композиции для применения при распределении действующего агента для лечения у субъекта состояния или заболевания, композицию, содержащую представленное выше ионизируемое соединение, структурный липид, стабилизирующий липид и липид для снижения иммуногенности композиции. Действующий агент может представлять собой одну или несколько RNAi-молекул, и композиция может содержать наночастицы, которые заключают в себе RNAi-молекулы.
[0027] Настоящее изобретение дополнительно предусматривает композиции, содержащие ионизируемые соединения, и один или несколько фармацевтически приемлемых наполнителей. Согласно некоторым вариантам осуществления, композиция согласно настоящему изобретению может представлять собой наночастицу, составленную, по меньшей мере, частично, из ионизируемого соединения.
[0028] Соединения согласно настоящему изобретению могут быть использованы для приготовления композиций для применения при распределении действующего агента у субъекта, где композиция включает в себя ионизируемое соединение.
[0029] Композиция согласно настоящему изобретению может быть использована при распределении действующего агента для лечения состояния или заболевания у субъекта.
[0030] Композиция для применения при распределении действующего агента для лечения состояния или заболевания у субъекта может включать в себя ионизируемое соединение, структурный липид и липид для снижения иммуногенности композиции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0031] Фиг. 1: На Фиг. 1 представлена схема получения соединения A6.
[0032] Фиг. 2: На Фиг. 2 представлена схема получения соединения AB.
[0033] Фиг. 3: На Фиг. 3 представлена схема получения соединения A4.
[0034] Фиг. 4: На Фиг. 4 представлена схема получения соединения B8.
[0035] Фиг. 5: На Фиг. 5 представлена схема получения соединения A9.
[0036] Фиг. 6: На Фиг. 6 представлена схема получения соединения AA.
[0037] Фиг. 7: На Фиг. 7 представлена схема получения соединения A5.
[0038] Фиг. 8: На Фиг. 8 представлена схема получения соединения A1.
[0039] Фиг. 9: На Фиг. 9 представлена схема получения соединения D22.
[0040] Фиг. 10: На Фиг. 10 представлена схема получения соединений A7 и A8.
[0041] Фиг. 11: На Фиг. 11 представлена схема получения соединений C3 и C2.
[0042] Фиг. 12: На Фиг. 12 представлена схема получения соединения DD.
[0043] Фиг. 13: На Фиг. 13 представлена схема получения соединения E4.
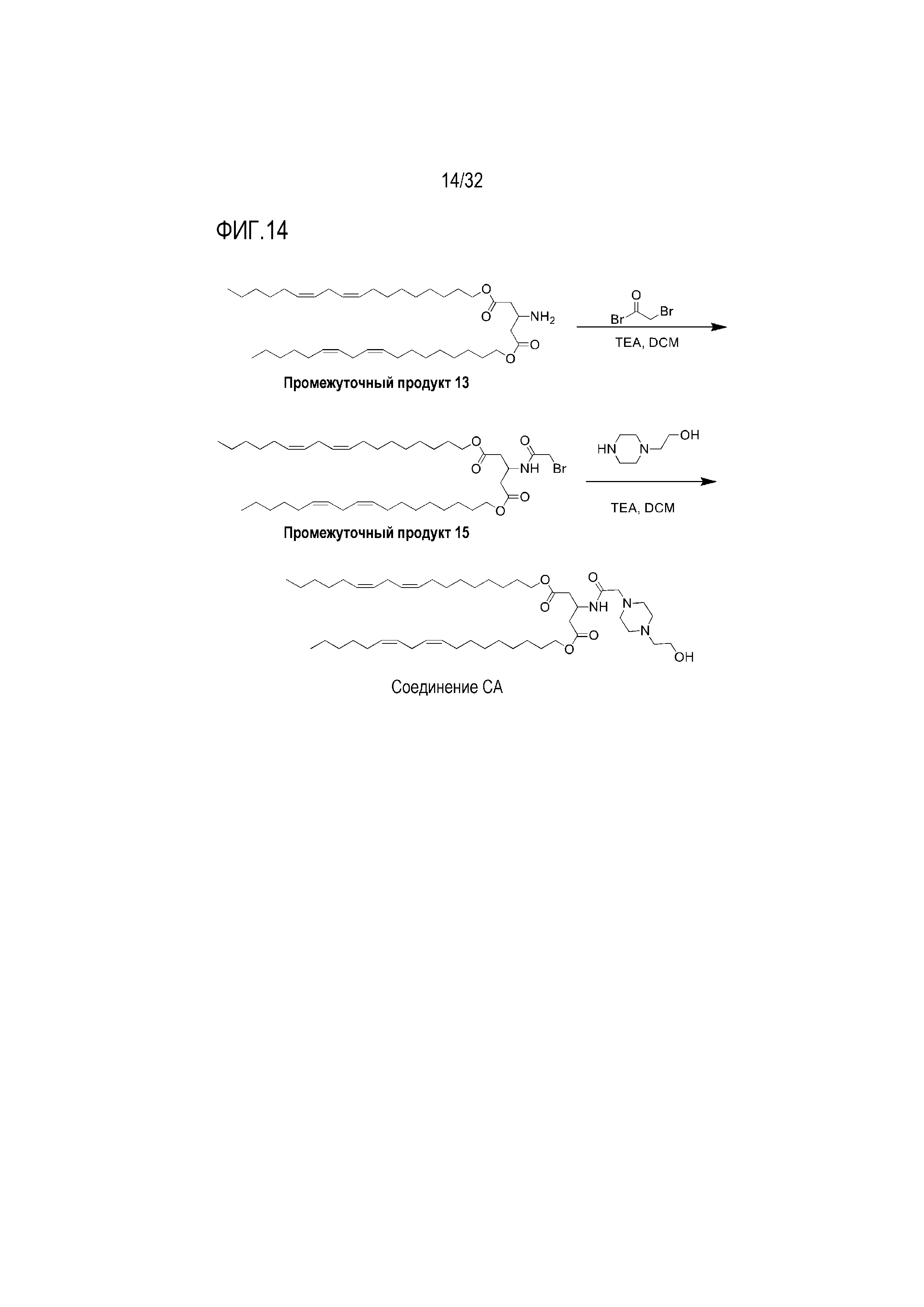
[0044] Фиг. 14: На Фиг. 14 представлена схема получения соединения CA.
[0045] Фиг. 15: На Фиг. 15 представлена схема получения соединения D1.
[0046] Фиг. 16: На Фиг. 16 представлена схема получения соединения D7.
[0047] Фиг. 17: На Фиг. 17 представлена схема получения соединения F6.
[0048] Фиг. 18: На Фиг. 18 представлена схема получения соединений F5 и F7.
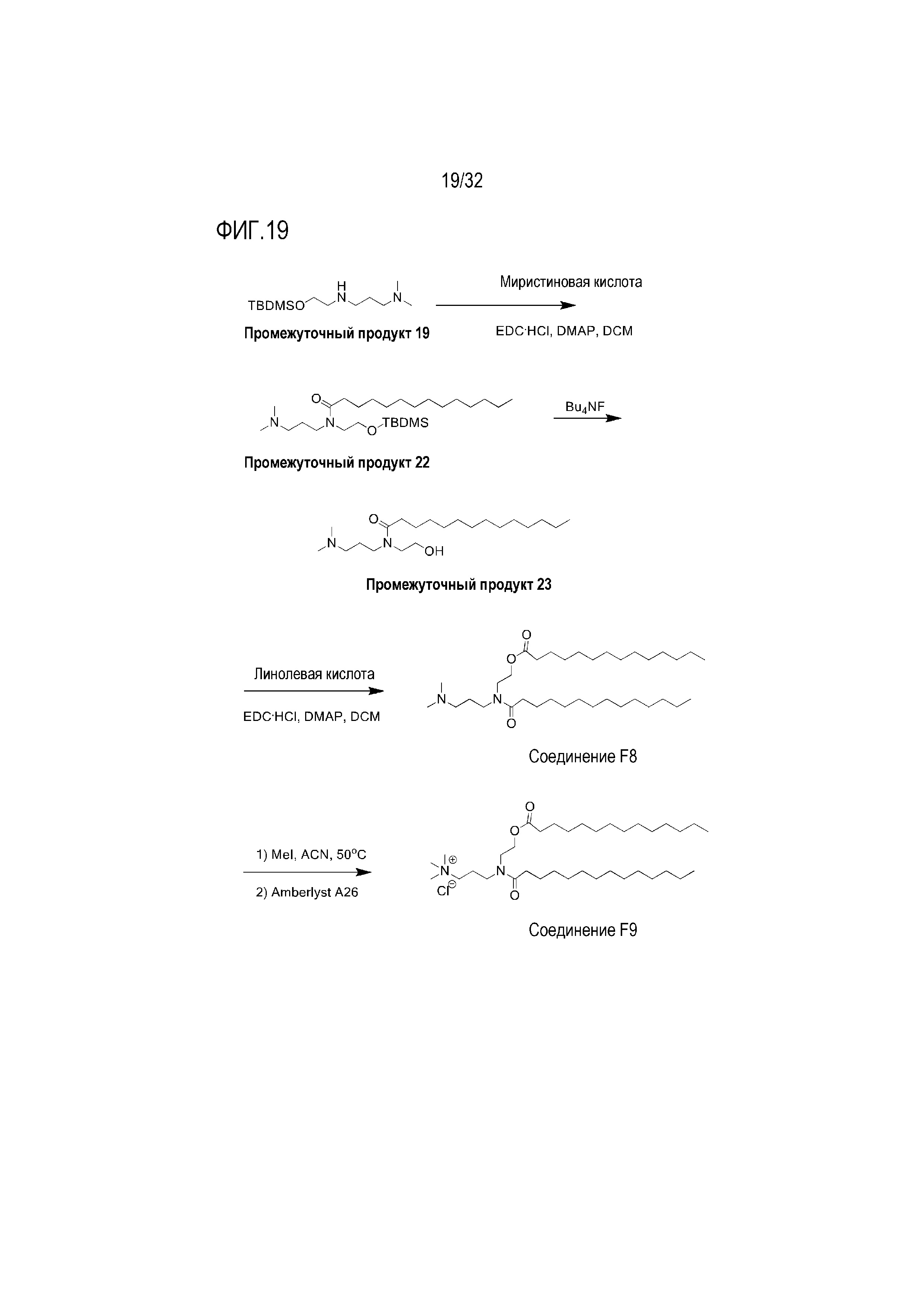
[0049] Фиг. 19: На Фиг. 19 представлена схема получения соединений F8 и F9.
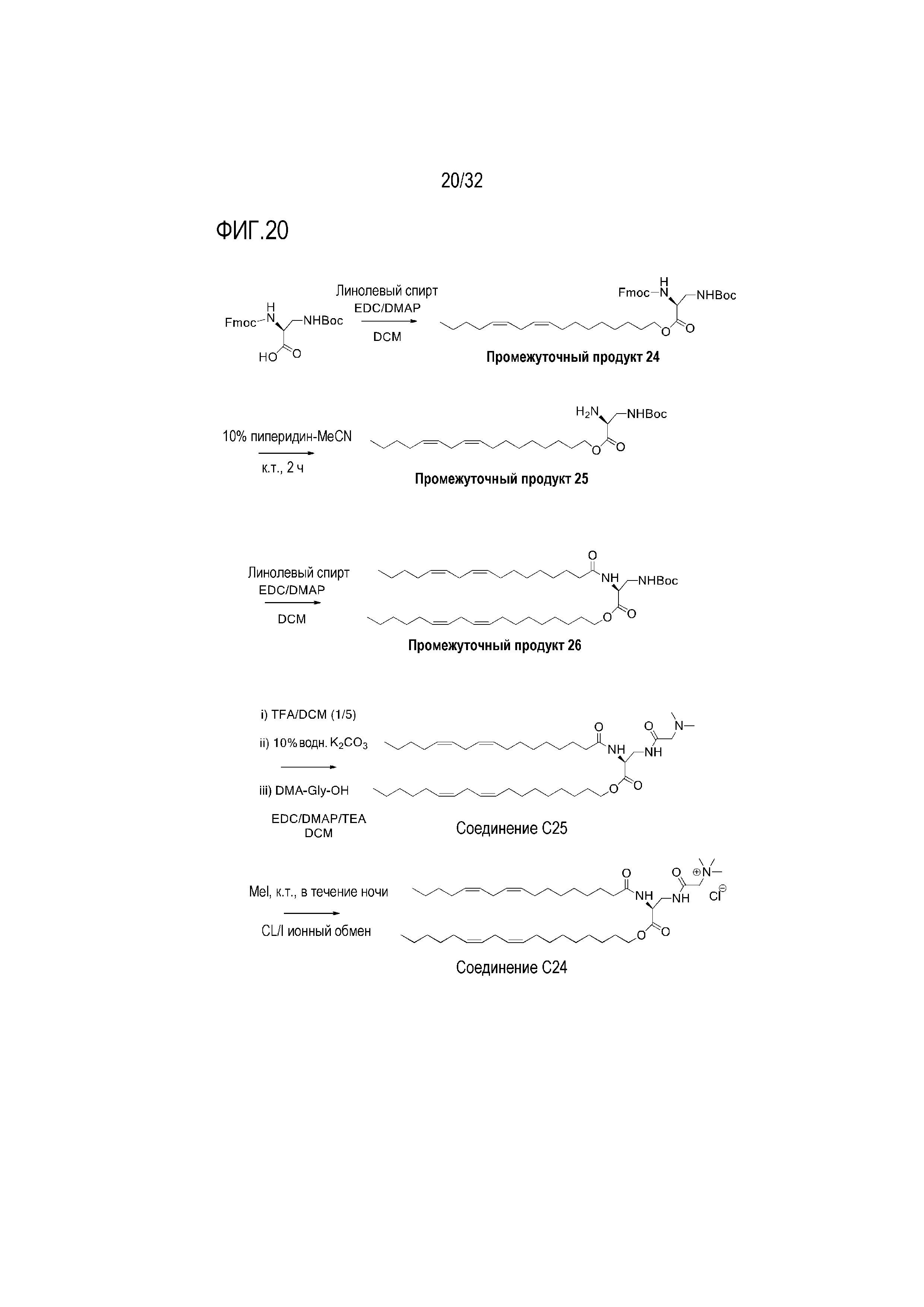
[0050] Фиг. 20: На Фиг. 20 представлена схема получения соединений C25 и C24.
[0051] Фиг. 21: На Фиг. 21 представлена схема получения соединения D16.
[0052] Фиг. 22: На Фиг. 22 представлена схема получения соединения D17.
[0053] Фиг. 23: На Фиг. 23 представлена схема получения соединения D18.
[0054] Фиг. 24: На Фиг. 24 представлена схема получения соединения D19.
[0055] Фиг. 25: На Фиг. 25 представлена схема получения соединения D20.
[0056] Фиг. 26: На Фиг. 26 представлена схема получения соединения D21.
[0057] Фиг. 27: На Фиг. 27 представлена схема получения соединения E37.
[0058] Фиг. 28: На Фиг. 28 представлена схема получения соединений E38 и E39.
[0059] Фиг. 29: На Фиг. 29 представлена схема получения соединения E40.
[0060] Фиг. 30: На Фиг. 30 представлена схема получения соединения A23.
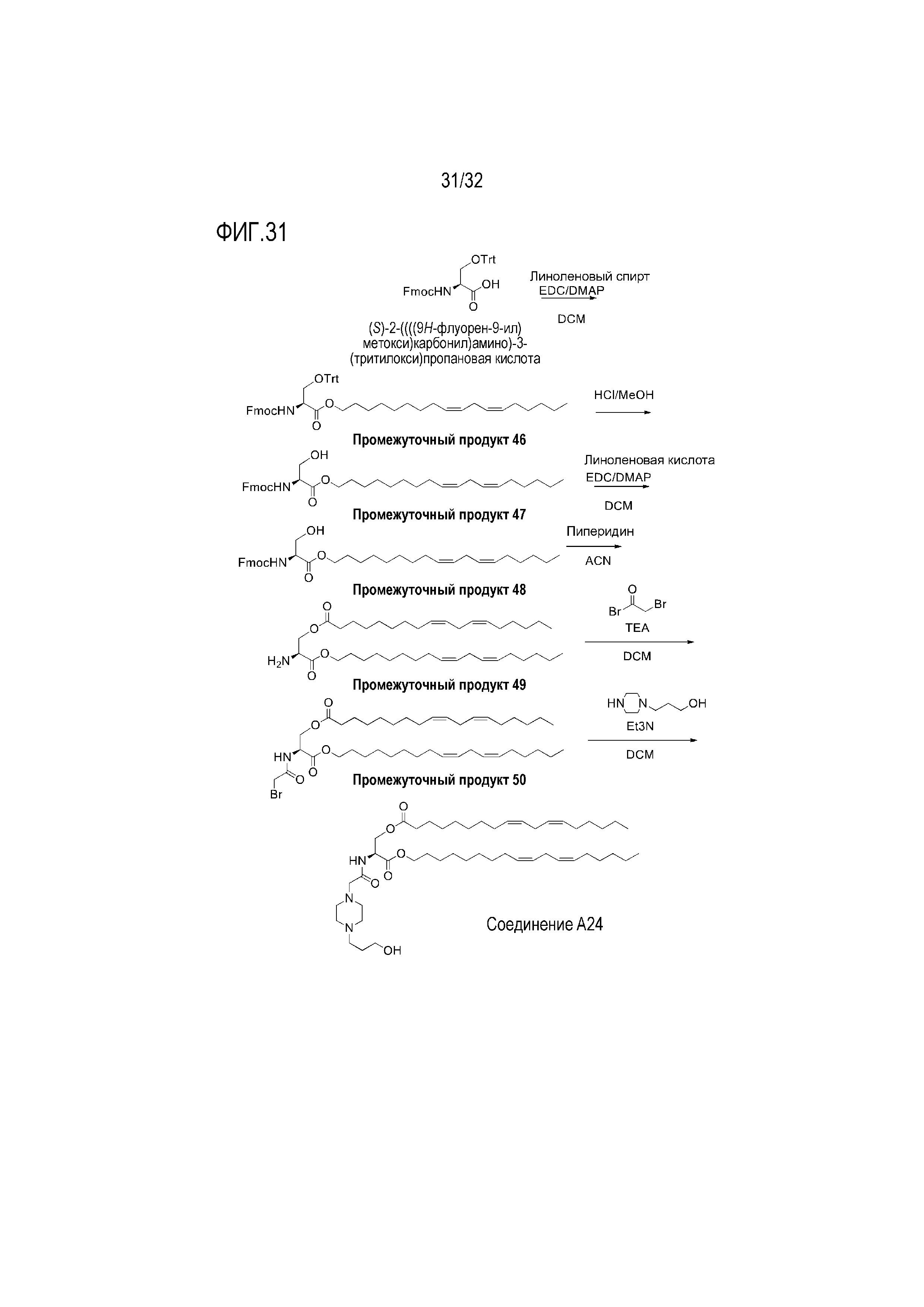
[0061] Фиг. 31: На Фиг. 31 представлена схема получения соединения A24.
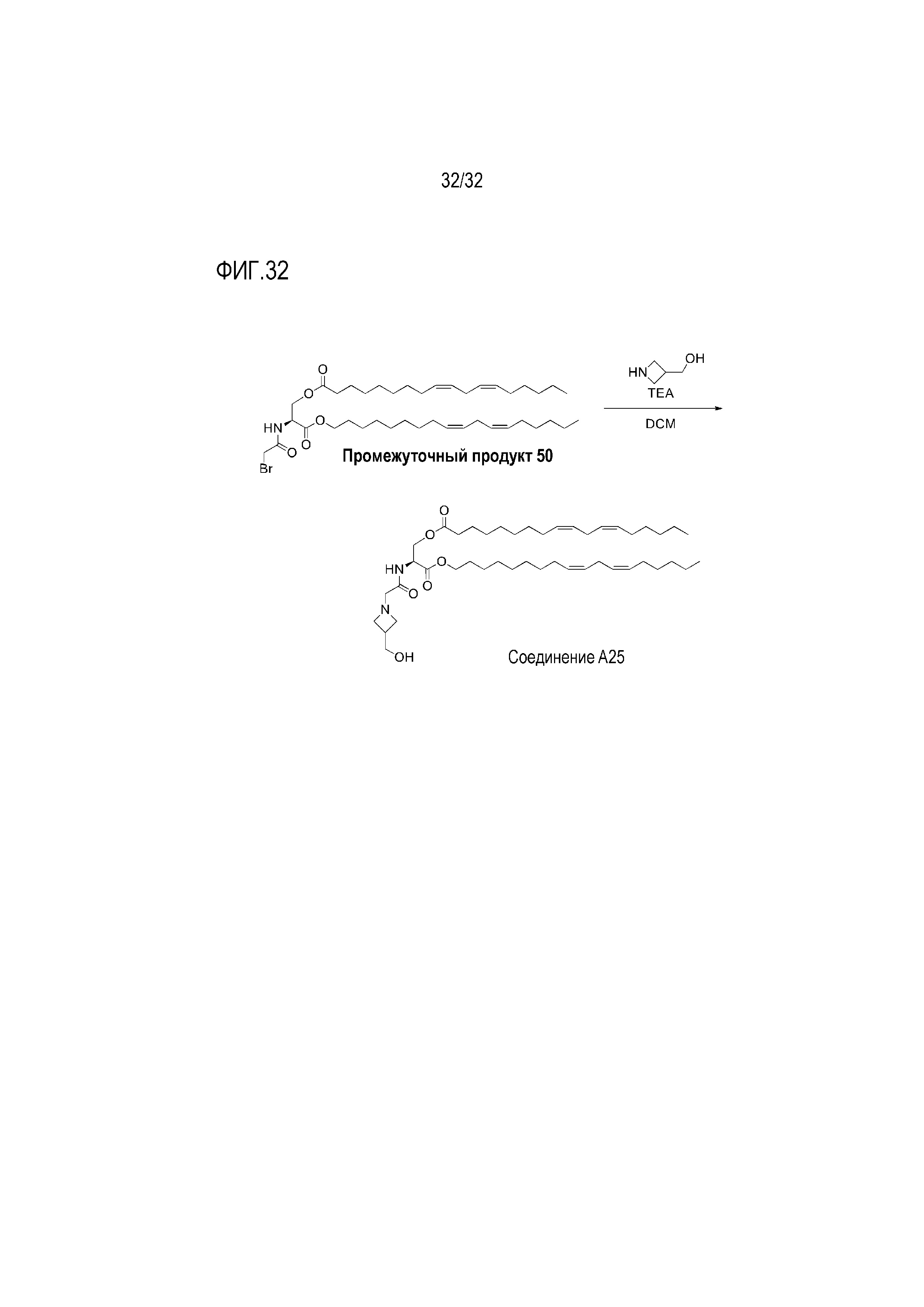
[0062] Фиг. 32: На Фиг. 32 представлена схема получения соединения A25.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0063] Настоящее изобретение относится к целому ряду ионизируемых молекул, которые являются амфифилами с липидоподобными свойствами. Ионизируемые соединения согласно настоящему изобретению можно применять при доставке терапевтических средств в клетки, ткани или органы, организмы и субъекты.
[0064] Согласно некоторым аспектам, настоящее изобретение относится к соединениям для формирования липидных наночастиц для заключения в капсулу и доставки действующих агентов, таких как молекулы нуклеиновых кислот, в клетки и субъекты.
[0065] Настоящее изобретение может относиться к композиции для применения при распределении действующего агента в клетках, тканях или органах, организмах и субъектах, где композиция включает в себя одну или несколько ионизируемых молекул согласно настоящему изобретению.
[0066] Композиции согласно настоящему изобретению могут включать в себя одну или несколько ионизируемых молекул вместе со структурным липидом и одним или несколькими липидами для снижения иммуногенности композиции.
[0067] Содержание ионизируемой молекулы согласно настоящему изобретению может составлять любой мол.% композиции согласно настоящему изобретению.
[0068] Композиции согласно настоящему изобретению могут включать в себя одну или несколько ионизируемых молекул вместе со структурным липидом и одним или несколькими липидами для снижения иммуногенности композиции.
[0069] Композиции согласно настоящему изобретению могут включать в себя одну или несколько ионизируемых молекул вместе со структурным липидом, одним или несколькими стабилизирующими липидами и одним или несколькими липидами для снижения иммуногенности композиции.
[0070] Композиции из трех компонентов
[0071] Используемый в настоящем документе компонент состава, такой как «липид», может представлять собой одно соединение, или может представлять собой сочетание одного или нескольких подходящих липидных соединений. Например, термин «стабилизирующий липид» может относиться к одному стабилизирующему липиду или к сочетанию одного или нескольких подходящих стабилизирующих липидов. Специалист в данной области техники сможет без труда понять, что определенные сочетания соединений, описанных в настоящем документе, можно использовать без проведения дополнительных экспериментов, и что различные сочетания соединений подпадают под объем описания компонента состава.
[0072] Содержание ионизируемых соединений композиции согласно настоящему изобретению может составлять от 50 мол.% до 80 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, содержание ионизируемых молекул композиции может составлять от 55 мол.% до 65 мол.% липидных компонентов композиции. Согласно дополнительным вариантам осуществления, содержание ионизируемых молекул композиции может составлять приблизительно 60 мол.% липидных компонентов композиции.
[0073] Содержание структурного липида композиции согласно настоящему изобретению может составлять от 20 мол.% до 50 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, содержание структурного липида композиции может составлять от 35 мол.% до 45 мол.% липидных компонентов композиции.
[0074] Содержание одного или нескольких липидов для снижения иммуногенности композиции может составлять от 1 мол.% до 8 мол.% из суммы липидных компонентов композиции. Согласно определенным вариантам осуществления, содержание одного или нескольких липидов для снижения иммуногенности композиции может составлять от 1 мол.% до 5 мол.% из суммы липидных компонентов композиции.
[0075] Согласно дополнительным аспектам, композиция согласно настоящему изобретению может дополнительно содержать катионный липид, количество которого может составлять от 5 мол.% до 25 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, композиция согласно настоящему изобретению может дополнительно содержать катионный липид, количество которого может составлять от 5 мол.% до 15 мол.% липидных компонентов композиции. Согласно указанным аспектам, молярное соотношение концентраций катионного липида и ионизируемых молекул композиции согласно настоящему изобретению может составлять от 5:80 до 25:50.
[0076] В композициях согласно настоящему изобретению комплекс липидных компонентов может включать в себя один или несколько молекулярных компонентов ионизируемого соединения, структурный липид и один или несколько липидов для снижения иммуногенности композиции.
[0077] Композиции из четырех компонентов
[0078] Содержание ионизируемых молекул композиции согласно настоящему изобретению может составлять от 15 мол.% до 40 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, содержание ионизируемых молекул композиции может составлять от 20 мол.% до 35 мол.% липидных компонентов композиции. Согласно дополнительным вариантам осуществления, содержание ионизируемых молекул композиции может составлять от 25 мол.% до 30 мол.% липидных компонентов композиции.
[0079] Содержание структурного липида композиции согласно настоящему изобретению может составлять от 25 мол.% до 40 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, содержание структурного липида композиции может составлять от 30 мол.% до 35 мол.% липидных компонентов композиции.
[0080] Суммарное содержание стабилизирующих липидов композиции согласно настоящему изобретению может составлять от 25 мол.% до 40 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, суммарное содержание стабилизирующих липидов композиции могут составлять от 30 мол.% до 40 мол.% липидных компонентов композиции.
[0081] Согласно некоторым вариантам осуществления, композиция согласно настоящему изобретению может включать в себя два или несколько стабилизирующих липидов, где содержание каждого из стабилизирующих липидов в отдельности может составлять от 5 мол.% до 35 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, композиция согласно настоящему изобретению может включать в себя два или несколько стабилизирующих липидов, где содержание каждого из стабилизирующих липидов в отдельности может составлять от 10 мол.% до 30 мол.% липидных компонентов композиции.
[0082] Согласно определенным вариантам осуществления, суммарное содержание одного или нескольких стабилизирующих липидов может составлять от 25 мол.% до 40 мол.% липидов композиции, где содержание каждого из стабилизирующих липидов в отдельности может составлять от 5 мол.% до 35 мол.%.
[0083] Согласно определенным вариантам осуществления, суммарное содержание одного или нескольких стабилизирующих липидов может составлять от 30 мол.% до 40 мол.% липидов композиции, где содержание каждого из стабилизирующих липидов в отдельности может составлять от 10 мол.% до 30 мол.%.
[0084] Суммарное содержание одного или нескольких липидов для снижения иммуногенности композиции может составлять от 1 мол.% до 8 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, суммарное содержание одного или нескольких липидов для снижения иммуногенности композиции могут составлять от 1 мол.% до 5 мол.% липидных компонентов композиции.
[0085] Согласно дополнительным аспектам, композиция согласно настоящему изобретению может дополнительно включать в себя катионный липид, содержание которого может составлять от 5 мол.% до 25 мол.% липидных компонентов композиции. Согласно определенным вариантам осуществления, композиция согласно настоящему изобретению может дополнительно включать в себя катионный липид, содержание которого может составлять от 5 мол.% до 15 мол.% липидных компонентов композиции. Согласно указанным аспектам, молярное соотношение концентраций катионного липида и ионизируемых молекул композиции согласно настоящему изобретению может составлять от 5:35 до 25:15.
[0086] Согласно определенным вариантам осуществления, комплекс липидных компонентов может включать в себя один или несколько молекулярных компонентов ионизируемого соединения, структурный липид, один или несколько липидов для снижения иммуногенности композиции и один или несколько стабилизирующих липидов.
[0087] Примеры липидных композиций
[0088] Согласно некоторым вариантам осуществления, три липидоподобных компонента, т. е. одна или несколько ионизируемых молекул, структурный липид и один или несколько липидов для снижения иммуногенности композиции, могут составлять 100% липидных компонентов композиции. Согласно определенным вариантам осуществления, в состав может быть включен катионный липид.
[0089] Примеры композиций согласно настоящему изобретению представлены в таблице 1.
Таблица 1: Композиции липидных компонентов (каждый в мол.% от суммарного содержания)
[0090] Согласно определенным вариантам осуществления, четыре липидоподобных компонента, т. е. одна или несколько ионизируемых молекулы, структурный липид и один или несколько липидов для снижения иммуногенности композиции, и один или несколько стабилизирующих липидов, могут составлять 100% липидных компонентов композиции.
[0091] Примеры композиций согласно настоящему изобретению представлены в таблице 2.
Таблица 2: Композиции липидных компонентов (каждый в мол.% от суммарного содержания)
[0092] Композиции для селективного биораспределения
[0093] Аспекты настоящего изобретения могут относиться к целому ряду композиций для применения при распределении действующего агента в различных органах или тканях субъекта.
[0094] Например, композиции согласно настоящему изобретению могут содержать ионизируемый липид, структурный липид и липид для снижения иммуногенности композиции.
[0095] Согласно некоторым вариантам осуществления, композиции согласно настоящему изобретению могут содержать ионизируемый липид, структурный липид, один или несколько стабилизирующих липидов и липид для снижения иммуногенности композиции.
[0096] Композиции согласно настоящему изобретению могут обеспечивать необычайно селективное биораспределение действующего агента в конкретном органе или ткани.
[0097] Согласно некоторым вариантам осуществления, композиция согласно настоящему изобретению может обеспечивать необычайно селективное биораспределение действующего агента в легком субъекта.
[0098] Согласно дополнительным вариантам осуществления, композиция согласно настоящему изобретению может обеспечивать необычайно селективное биораспределение действующего агента в печени субъекта.
[0099] Согласно некоторым вариантам осуществления, композиция согласно настоящему изобретению может обеспечивать необычайно селективное биораспределение действующего агента в толстом кишечнике субъекта.
[00100] Согласно некоторым вариантам осуществления, композиция согласно настоящему изобретению может обеспечивать необычайно селективное биораспределение действующего агента в поджелудочной железе субъекта.
[00101] Согласно определенным вариантам осуществления, соотношение распределения действующего агента в легком к распределению действующего агента в печени субъекта может составлять, по меньшей мере, 1,5.
[00102] Согласно дополнительным вариантам осуществления, соотношение распределения действующего агента в легком к распределению действующего агента в печени субъекта может составлять, по меньшей мере, 5.
[00103] Ионизируемые соединения
[00104] Ионизируемые соединения согласно настоящему изобретению могут обладать липидоподобными свойствами, например, в качестве амфифилов.
[00105] Примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов, где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть замещены,



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси и аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7;
p равен от 1 до 4.
[00106] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00107] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00108] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00109] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00110] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00111] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00112] Согласно некоторым вариантам осуществления, примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из




где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
Q представляет собой O или NR7.
[00113] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00114] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00115] Согласно некоторым вариантам осуществления, примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из




где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила;
Q представляет собой O или NR7.
[00116] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00117] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00118] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00119] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00120] Согласно некоторым вариантам осуществления, n и m могут быть независимо равны от 3 до 6.
[00121] Согласно некоторым вариантам осуществления, примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила.
[00122] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00123] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00124] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00125] Согласно некоторым вариантам осуществления, примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой I

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из

где
каждый R6 независимо представляет собой гидроксил; каждый R7 независимо выбирают из H, алкила.
[00126] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00127] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00128] Примеры ионизируемого соединения включают в себя следующее соединение A1:
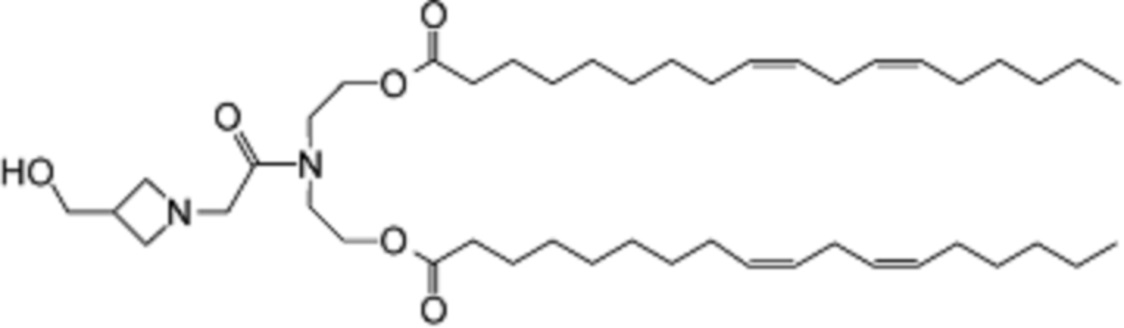
которое представляет собой ((2-(3-(гидроксиметил)азетидин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00129] Примеры ионизируемого соединения включают в себя следующее соединение A2:

[00130] Примеры ионизируемого соединения включают в себя следующее соединение A3:

[00131] Примеры ионизируемого соединения включают в себя следующее соединение A4:

которое представляет собой ((2-((3S,4S)-3,4-дигидроксипирролидин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)дитетрадеканоат.
[00132] Примеры ионизируемого соединения включают в себя следующее соединение A5:
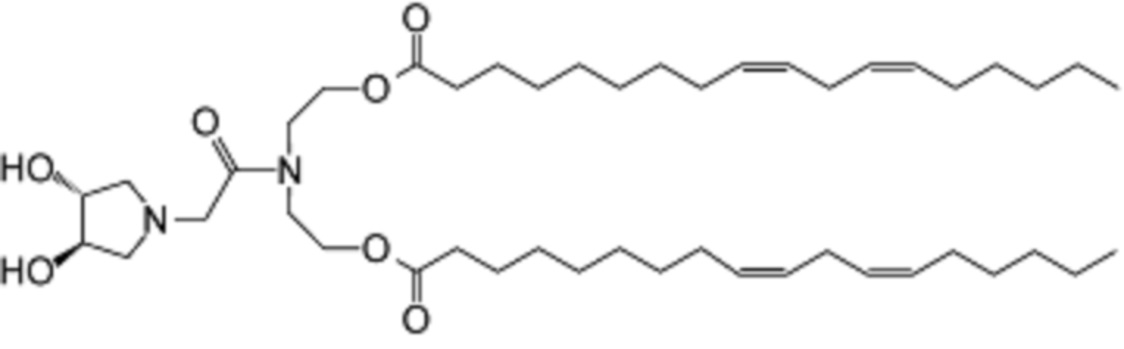
которое представляет собой ((2-((3R,4R)-3,4-дигидроксипирролидин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00133] Примеры ионизируемого соединения включают в себя следующее соединение A6:

которое представляет собой ((2-((3S,4R)-3,4-дигидроксипирролидин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00134] Примеры ионизируемого соединения включают в себя следующее соединение A7:

которое представляет собой (((2-(диметиламино)этокси)карбонил)-азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00135] Примеры ионизируемого соединения включают в себя следующее соединение A8:
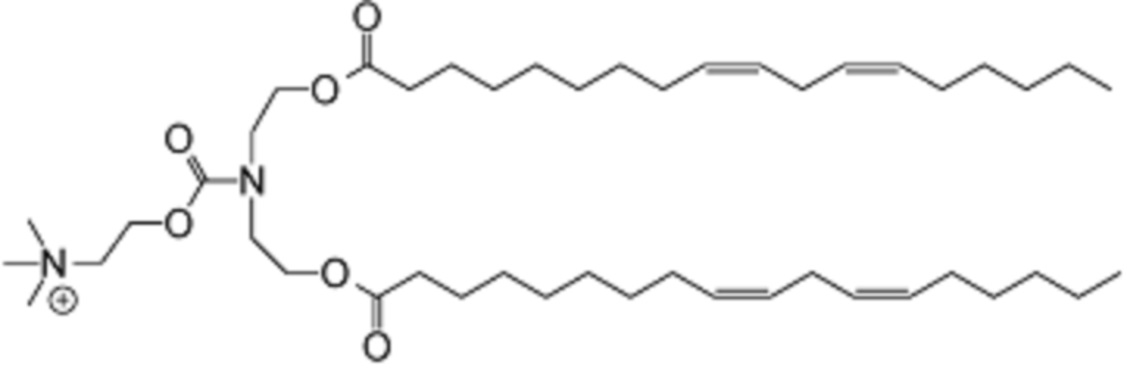
которое представляет собой 2-((бис(2-(((9Z,12Z)-октадека-9,12-диеноил)окси)этил)карбамоил)окси)-N,N,N-триметилэтан-1-аминий.
[00136] Примеры ионизируемого соединения включают в себя следующее соединение A9:

которое представляет собой ((2-(3-(гидроксиметил)азетидин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)дитетрадеканоат.
[00137] Примеры ионизируемого соединения включают в себя следующее соединение AA:

которое представляет собой ((2-(4-(2-гидроксиэтил)пиперазин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00138] Примеры ионизируемого соединения включают в себя следующее соединение AB:
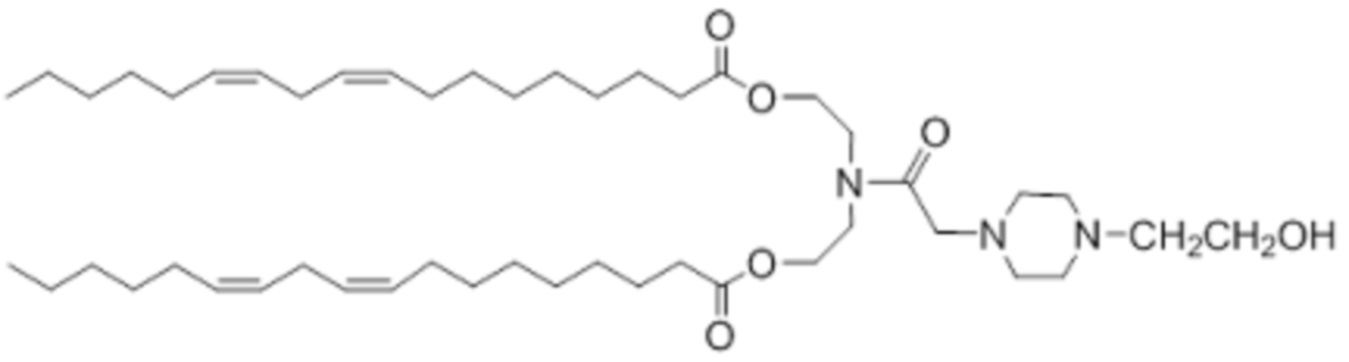
которое представляет собой ((2-(4-(2-гидроксиэтил)пиперазин-1-ил)ацетил)азандиил)бис(этан-2,1-диил)(9Z,9'Z,12Z,12'Z)-бис(октадека-9,12-диеноат).
[00139] Примеры ионизируемого соединения включают в себя следующее соединение AC:

[00140] Примеры ионизируемого соединения включают в себя следующее соединение AD:

[00141] Примеры ионизируемого соединения включают в себя следующее соединение AE:
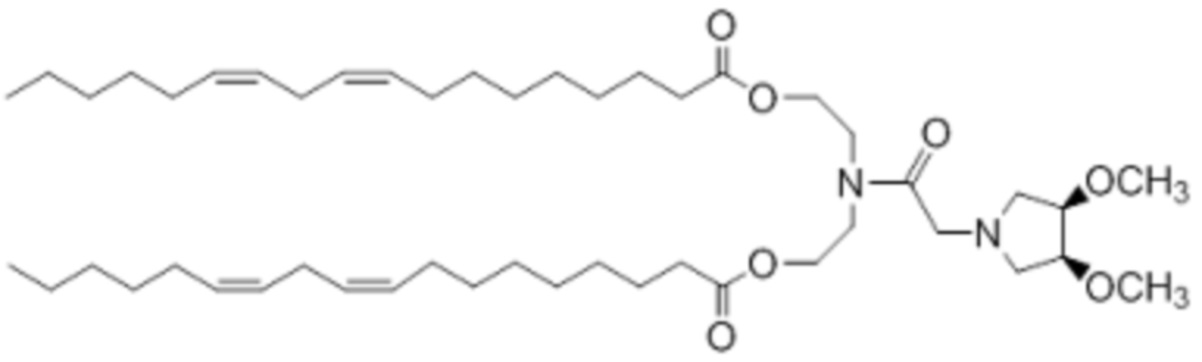
[00142] Примеры ионизируемого соединения включают в себя следующее соединение AF:

[00143] Примеры ионизируемого соединения включают в себя следующее соединение B1:

[00144] Примеры ионизируемого соединения включают в себя следующее соединение B2:
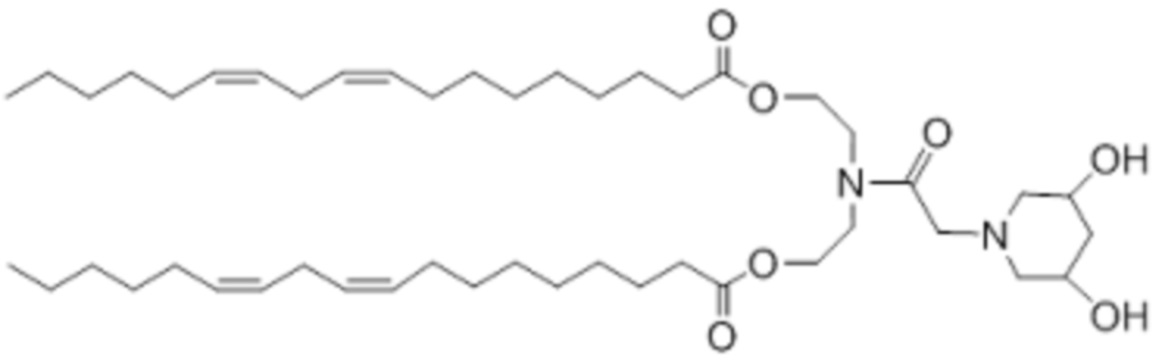
[00145] Примеры ионизируемого соединения включают в себя следующее соединение B3:
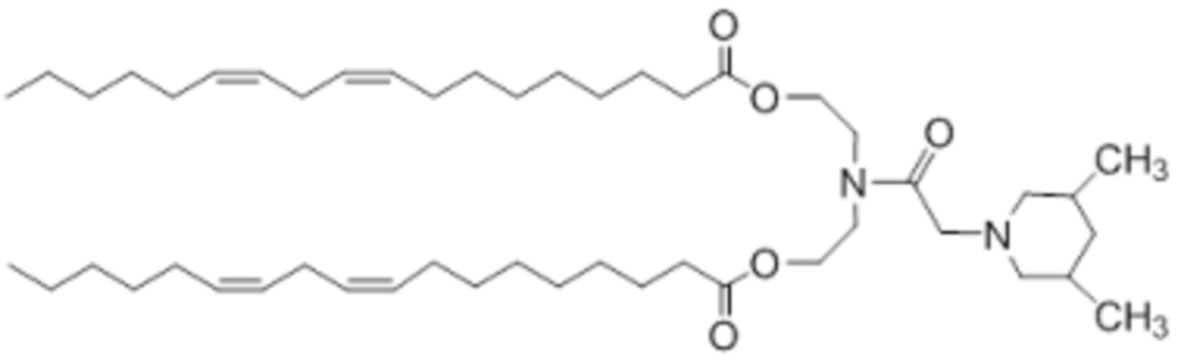
[00146] Примеры ионизируемого соединения включают в себя следующее соединение B4:

[00147] Примеры ионизируемого соединения включают в себя следующее соединение B5:
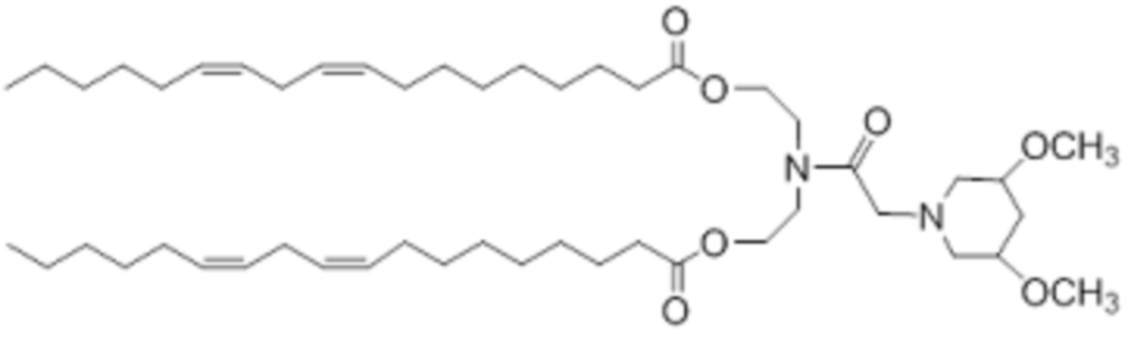
[00148] Примеры ионизируемого соединения включают в себя следующее соединение B6:
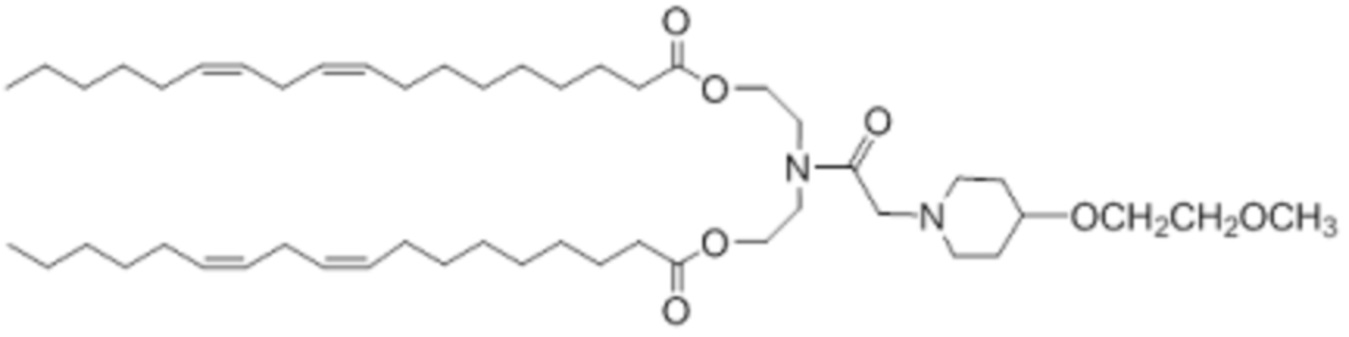
[00149] Примеры ионизируемого соединения включают в себя следующее соединение B7:

[00150] Примеры ионизируемой молекулы включают в себя соединения, характеризующиеся структурой, представленной формулой II

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 представляет собой C(12-20)алкильную группу или C(12-20)алкенильную группу, которая замещена карбоксильной или сложноэфирной группой.
[00151] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00152] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00153] Согласно некоторым вариантам осуществления, R3 представляет собой C(14-18)алкильную группу или C(14-18)алкенильную группу, которая замещена карбоксильной или сложноэфирной группой.
[00154] Примеры ионизируемого соединения включают в себя следующее соединение B8:

[00155] Примеры ионизируемого соединения включают в себя следующее соединение B9:

[00156] Примеры ионизируемого соединения включают в себя следующее соединение BA:

[00157] Примеры ионизируемого соединения включают в себя следующее соединение BB:
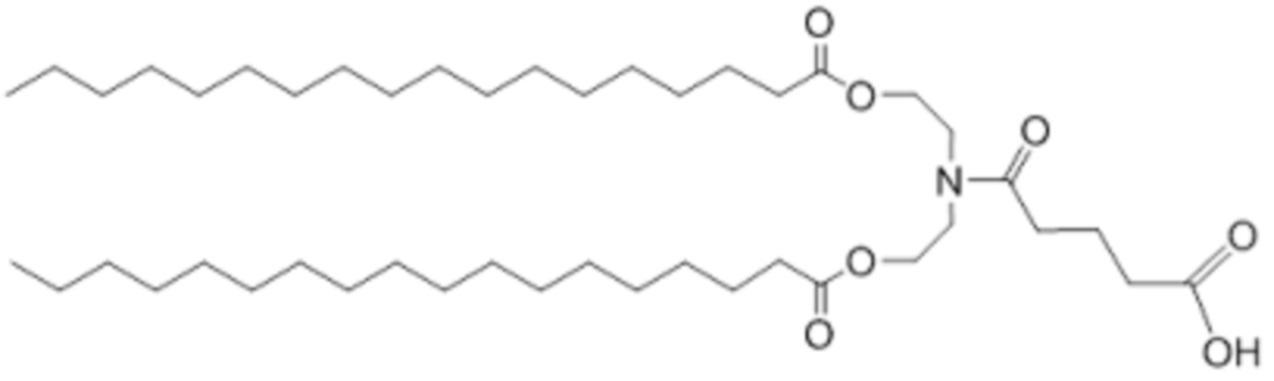
[00158] Согласно определенным вариантам осуществления, примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой III

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из алкила, гидроксиалкила, алкоксиалкокси и карбоксиалкила;
где R6 выбирают из NR72, N+HR72 и N+R73;
где R7 выбирают из H, алкила, гидроксиалкила и аминоалкила.
[00159] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00160] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00161] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00162] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00163] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00164] Примеры ионизируемого соединения включают в себя следующее соединение BC:

[00165] Примеры ионизируемого соединения включают в себя следующее соединение BD:
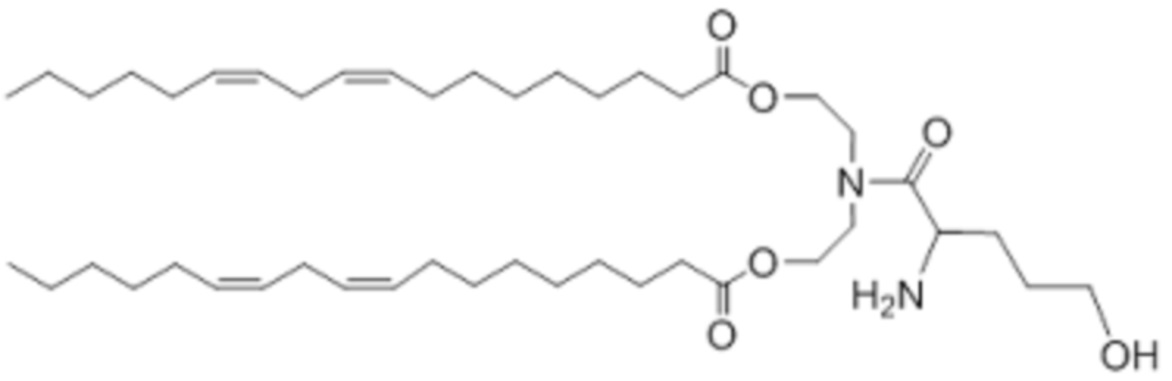
[00166] Примеры ионизируемого соединения включают в себя следующее соединение BE:

[00167] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00168] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой IV

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов, где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть дополнительно замещены,



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7;
p равен от 1 до 4.
[00169] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00170] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00171] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00172] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00173] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00174] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00175] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой IV

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
p равен от 1 до 4.
[00176] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00177] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00178] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00179] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00180] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00181] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00182] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой IV

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
p равен от 1 до 4.
[00183] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00184] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00185] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00186] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой IV

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, гидроксила, гидроксиалкила, аминоалкила;
каждый R7 независимо выбирают из H, алкила;
p равен от 1 до 4.
[00187] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00188] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00189] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00190] Примеры ионизируемого соединения включают в себя следующее соединение BF:

[00191] Примеры ионизируемого соединения включают в себя следующее соединение C1:

[00192] Примеры ионизируемого соединения включают в себя следующее соединение C2:

которое представляет собой 2-((1-(((9Z,12Z)-гептадека-9,12-диен-1-ил)окси)-5-(((9Z,12Z)-октадека-9,12-диен-1-ил)окси)-1,5-диоксопентан-3-ил)амино)-N,N,N-триметил-2-оксоэтан-1-аминий.
[00193] Примеры ионизируемого соединения включают в себя следующее соединение C3:

которое представляет собой 1-((9Z,12Z)-гептадека-9,12-диен-1-ил)-5-((9Z,12Z)-октадека-9,12-диен-1-ил)-3-(2-(диметиламино)ацетамидо)пентандиоат.
[00194] Примеры ионизируемого соединения включают в себя следующее соединение C4:

[00195] Примеры ионизируемого соединения включают в себя следующее соединение C5:

[00196] Примеры ионизируемого соединения включают в себя следующее соединение C6:

[00197] Примеры ионизируемого соединения включают в себя следующее соединение C7:
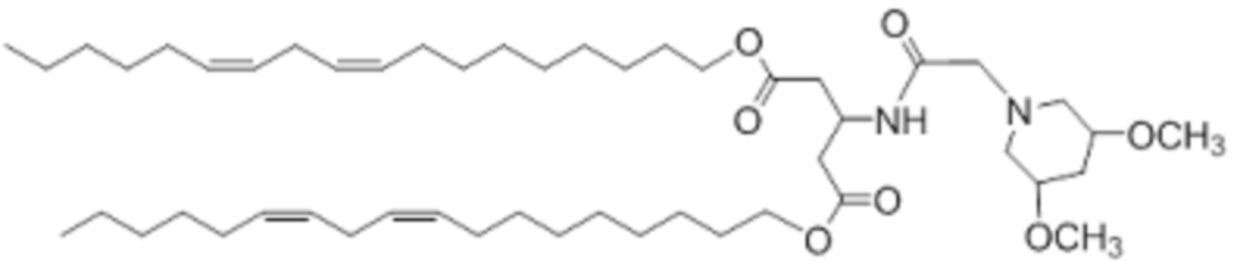
[00198] Примеры ионизируемого соединения включают в себя следующее соединение C8:

[00199] Примеры ионизируемого соединения включают в себя следующее соединение C9:

[00200] Примеры ионизируемого соединения включают в себя следующее соединение CA:
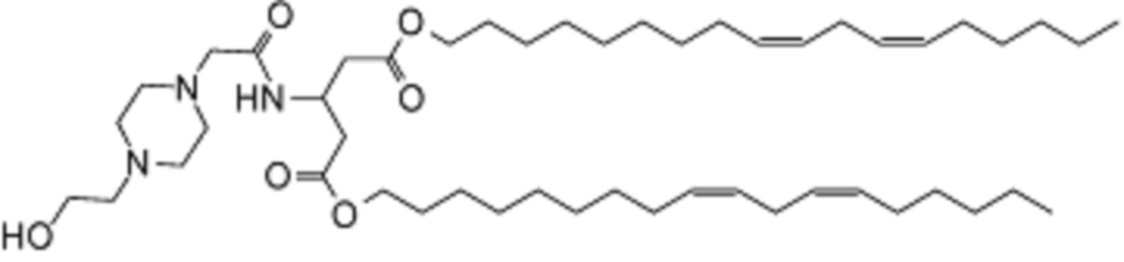
которое представляет собой ди((9Z,12Z)-октадека-9,12-диен-1-ил)-3-(2-(4-(2-гидроксиэтил)пиперазин-1-ил)ацетамидо)пентандиоат.
[00201] Примеры ионизируемого соединения включают в себя следующее соединение CB:

[00202] Примеры ионизируемого соединения включают в себя следующее соединение CC:
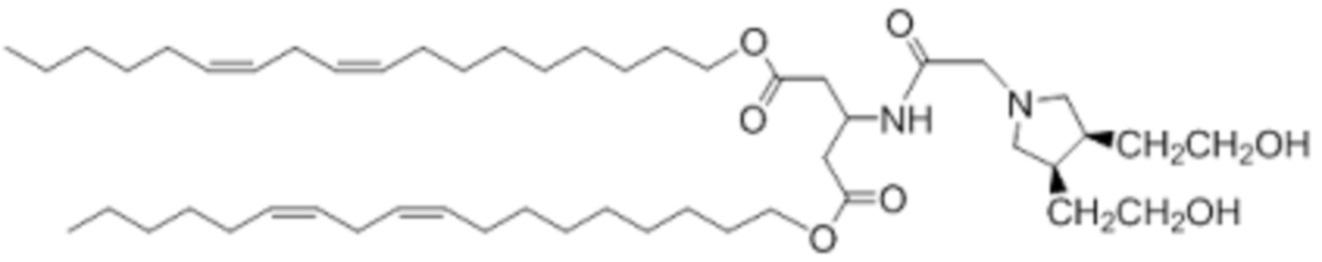
[00203] Примеры ионизируемого соединения включают в себя следующее соединение CD:

[00204] Примеры ионизируемого соединения включают в себя следующее соединение CE:

[00205] Примеры ионизируемого соединения включают в себя следующее соединение CF:
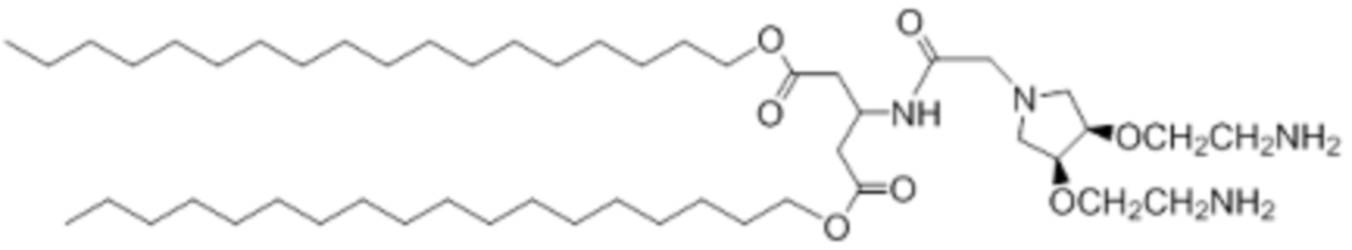
[00206] Примеры ионизируемого соединения включают в себя следующее соединение D1:

которое представляет собой ди((9Z,12Z)-октадека-9,12-диен-1-ил)-3-(2-((3S,4R)-3,4-дигидроксипирролидин-1-ил)ацетамидо)пентандиоат.
[00207] Примеры ионизируемого соединения включают в себя следующее соединение D2:

[00208] Примеры ионизируемого соединения включают в себя следующее соединение D3:

[00209] Примеры ионизируемого соединения включают в себя следующее соединение D4:

[00210] Примеры ионизируемого соединения включают в себя следующее соединение D5:

[00211] Примеры ионизируемого соединения включают в себя следующее соединение D6:

[00212] Примеры ионизируемого соединения включают в себя следующее соединение D7:

[00213] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой IV-B

где R1=C(=O)OR4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой S или O;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
p равен от 1 до 4.
[00214] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00215] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00216] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00217] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00218] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00219] Примеры ионизируемого соединения включают в себя следующее соединение D8:

[00220] Примеры ионизируемого соединения включают в себя следующее соединение D9:

[00221] Примеры ионизируемого соединения включают в себя следующее соединение DA:

[00222] Примеры ионизируемого соединения включают в себя следующее соединение DB:
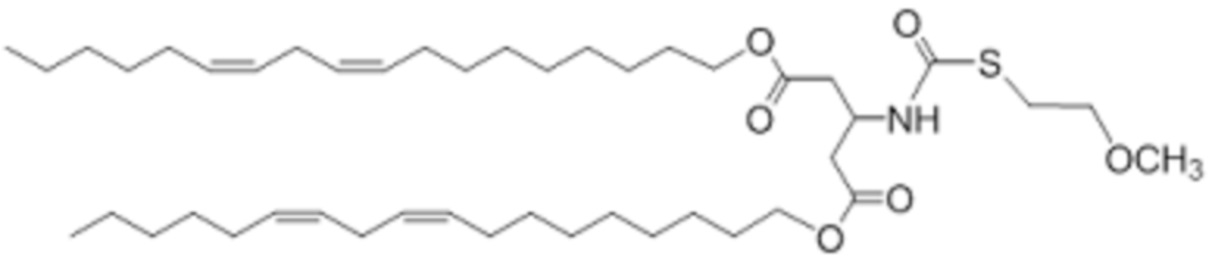
[00223] Примеры ионизируемого соединения включают в себя следующее соединение DC:

[00224] Примеры ионизируемого соединения включают в себя следующее соединение DD:

которое представляет собой ди((9Z,12Z)-октадека-9,12-диен-1-ил)-3-((((2-(диметиламино)этил)тио)карбонил)амино)пентандиоат.
[00225] Примеры ионизируемого соединения включают в себя следующее соединение DE:

[00226] Примеры ионизируемого соединения включают в себя следующее соединение DF:

[00227] Примеры ионизируемого соединения включают в себя следующее соединение E1:

[00228] Примеры ионизируемого соединения включают в себя следующее соединение E2:

[00229] Примеры ионизируемого соединения включают в себя следующее соединение E3:

[00230] Примеры ионизируемого соединения включают в себя следующее соединение E4:

которое представляет собой ((9Z,12Z)-октадека-9,12-диен-1-ил)-3-(((2-(диметиламино)этокси)карбонил)амино)пентандиоат.
[00231] Варианты осуществления настоящего изобретения включают в себя соединения, характеризующиеся структурой, представленной формулой V

где R1=NHC(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов, где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть замещены,



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[00232] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00233] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00234] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00235] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00236] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00237] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00238] Варианты осуществления настоящего изобретения включают в себя соединения, характеризующиеся структурой, представленной формулой V

где R1=NHC(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из




где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
Q представляет собой O или NR7.
[00239] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00240] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00241] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00242] Примеры ионизируемого соединения включают в себя следующее соединение E5:

[00243] Примеры ионизируемого соединения включают в себя следующее соединение E6:

[00244] Примеры ионизируемого соединения включают в себя следующее соединение E7:

[00245] Примеры ионизируемого соединения включают в себя следующее соединение E8:

[00246] Примеры ионизируемого соединения включают в себя следующее соединение E9:

[00247] Примеры ионизируемого соединения включают в себя следующее соединение EA:

[00248] Примеры ионизируемого соединения включают в себя следующее соединение EB:

[00249] Примеры ионизируемого соединения включают в себя следующее соединение EC:

[00250] Примеры ионизируемого соединения включают в себя следующее соединение ED:

[00251] Примеры ионизируемого соединения включают в себя следующее соединение EE:

[00252] Примеры ионизируемого соединения включают в себя следующее соединение EF:

[00253] Примеры ионизируемого соединения включают в себя следующее соединение F1:

[00254] Примеры ионизируемого соединения включают в себя следующее соединение F2:

[00255] Примеры ионизируемого соединения включают в себя следующее соединение F3:

[00256] Примеры ионизируемого соединения включают в себя следующее соединение F4:

[00257] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой VI

где R1=OC(=O)R4,
где R2 и R4 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из аминоалкила, четвертичного аминоалкила.
[00258] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00259] Согласно некоторым вариантам осуществления, R2 и R4 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00260] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00261] Примеры ионизируемого соединения включают в себя следующее соединение F5:

которое представляет собой 2-((9Z,12Z)-N-(3-(диметиламино)-пропил)октадека-9,12-диенамидо)этил-(9Z,12Z)-октадека-9,12-диеноат.
[00262] Примеры ионизируемого соединения включают в себя следующее соединение F6:
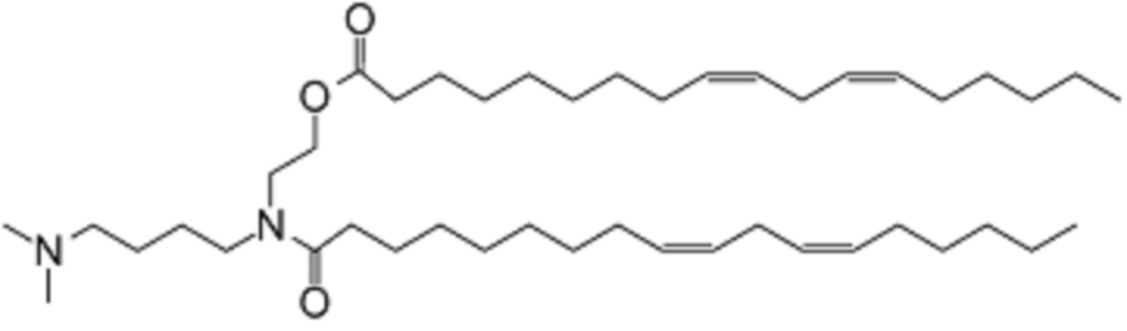
которое представляет собой 2-((9Z,12Z)-N-(4-(диметиламино)-бутил)октадека-9,12-диенамидо)этил-(9Z,12Z)-октадека-9,12-диеноат.
[00263] Примеры ионизируемого соединения включают в себя следующее соединение F7:

которое представляет собой N,N,N-триметил-3-((9Z,12Z)-N-(2-(((9Z,12Z)-октадека-9,12-диеноил)окси)этил)октадека-9,12-диенамидо)пропан-1-аминий.
[00264] Примеры ионизируемого соединения включают в себя следующее соединение F8:

которое представляет собой 2-(N-(3-(диметиламино)пропил)-тетрадеканамидо)этилтетрадеканоат.
[00265] Примеры ионизируемого соединения включают в себя следующее соединение F9:
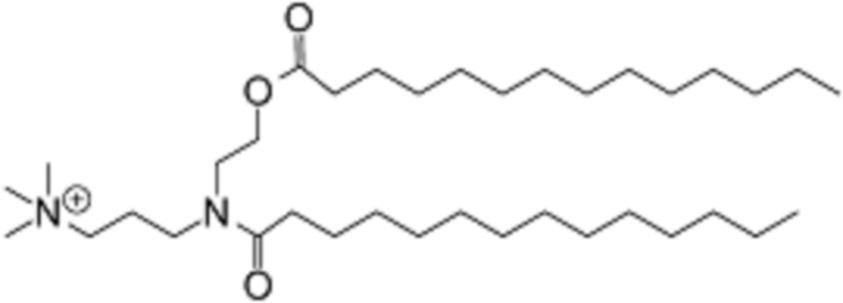
которое представляет собой N,N,N-триметил-3-(N-(2-(тетрадеканоилокси)этил)тетрадеканамидо)пропан-1-аминий.
[00266] Примеры ионизируемого соединения включают в себя соединения, характеризующиеся структурой, представленной формулой VII

где R1=OC(=O)R4, и R2=OC(=O)R5,
где n и m независимо равны 1 или 2; и R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из H, алкила, аминоалкила, четвертичного аминоалкила, гидроксиалкила, алкоксиалкила, алкоксиалкоксиалкила.
[00267] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00268] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00269] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00270] Примеры ионизируемого соединения включают в себя следующее соединение FA:

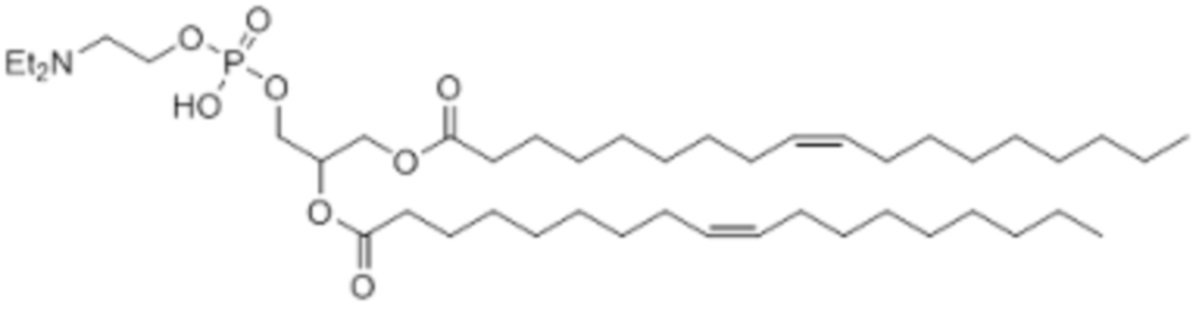
[00271] Примеры ионизируемого соединения включают в себя следующее соединение FB:

[00272] Примеры ионизируемого соединения включают в себя следующее соединение FC:

[00273] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00274] Согласно определенным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH или O;
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из амино, четвертичного амино, аминоалкила, четвертичного аминоалкила,


где R10 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть замещены


карбоксиалкила, аминоалкила,


где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
p равен от 1 до 4;
Q представляет собой O или NR7.
[00275] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00276] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00277] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00278] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00279] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00280] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00281] Согласно определенным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH или O;
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из


где R10 выбирают из







карбоксиалкила, аминоалкила;


где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
p равен от 1 до 4;
q равен от 0 до 4;
Q представляет собой O или NR7.
[00282] Согласно определенным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH или O;
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из NHC(=O)(CH2)pR10; NHC(=O)SR9;
где R10 выбирают из







карбоксиалкила, аминоалкила;


где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
p равен от 1 до 4;
q равен от 0 до 4;
Q представляет собой O или NR7.
[00283] Согласно определенным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH или O;
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из NHC(=O)(CH2)pR10; NHC(=O)SR9;
где R10 выбирают из






где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
Q представляет собой O или NR7.
[00284] Согласно определенным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII

где R1=OC(=O)R4, и R2=C(=O)ZR5,
где Z представляет собой NH,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из NHC(=O)(CH2)pR10; NHC(=O)SR9;
где R10 выбирают из






где R9 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
и где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
Q представляет собой O или NR7.
[00285] Примеры ионизируемого соединения включают в себя следующее соединение FD:

[00286] Примеры ионизируемого соединения включают в себя следующее соединение FE:

[00287] Примеры ионизируемого соединения включают в себя следующее соединение FF:

[00288] Примеры ионизируемого соединения включают в себя следующее соединение A11:

[00289] Примеры ионизируемого соединения включают в себя следующее соединение A12:

[00290] Примеры ионизируемого соединения включают в себя следующее соединение A13:

[00291] Примеры ионизируемого соединения включают в себя следующее соединение A14:

[00292] Примеры ионизируемого соединения включают в себя следующее соединение A15:

[00293] Примеры ионизируемого соединения включают в себя следующее соединение A16:

[00294] Примеры ионизируемого соединения включают в себя следующее соединение A17:

[00295] Примеры ионизируемого соединения включают в себя следующее соединение A18:

[00296] Примеры ионизируемого соединения включают в себя следующее соединение A19:

[00297] Примеры ионизируемого соединения включают в себя следующее соединение A20:

[00298] Примеры ионизируемого соединения включают в себя следующее соединение A21:
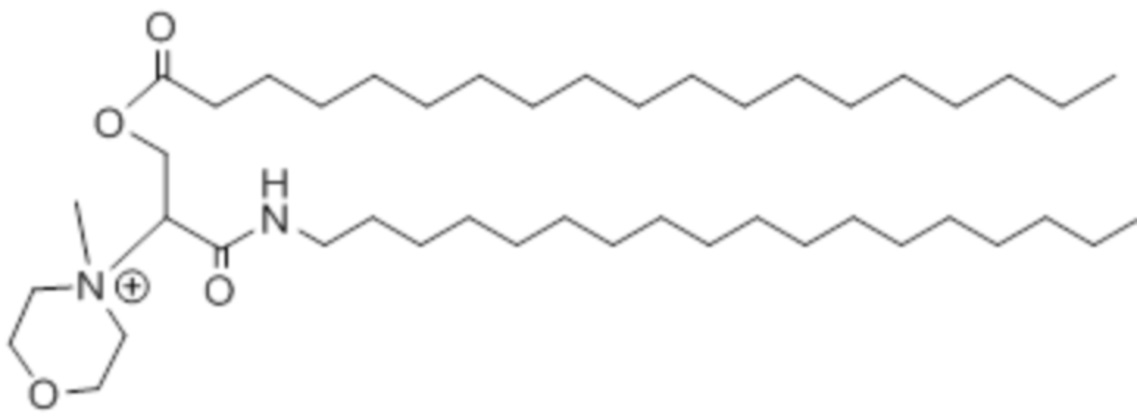
[00299] Примеры ионизируемого соединения включают в себя следующее соединение A22:

[00300] Примеры ионизируемого соединения включают в себя следующее соединение A23:

которое представляет собой (S)-4-оксо-4-((1-оксо-3-(тетрадеканоилокси)-1-(тетрадециламино)пропан-2-ил)амино)бутановую кислоту.
[00301] Примеры ионизируемого соединения включают в себя следующее соединение A24:

которое представляет собой (S)-2-(2-(4-(3-гидроксипропил)-пиперазин-1-ил)ацетамидо)-3-(((9Z,12Z)-октадека-9,12-диен-1-ил)окси)-3-оксопропил-(9Z,12Z)-октадека-9,12-диеноат.
[00302] Примеры ионизируемого соединения включают в себя следующее соединение A25:

[00303] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00304] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой VIII-B

где R1=CH2(CH2)nOC(=O)R4, и R2=CH2(CH2)mOC(=O)R5,
где n и m независимо равны 1 или 2;
R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой N, O;
где R3 выбирают из алкила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила,

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
p равен от 1 до 4.
[00305] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00306] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00307] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00308] Примеры ионизируемого соединения включают в себя следующее соединение B11:

[00309] Примеры ионизируемого соединения включают в себя следующее соединение B12:
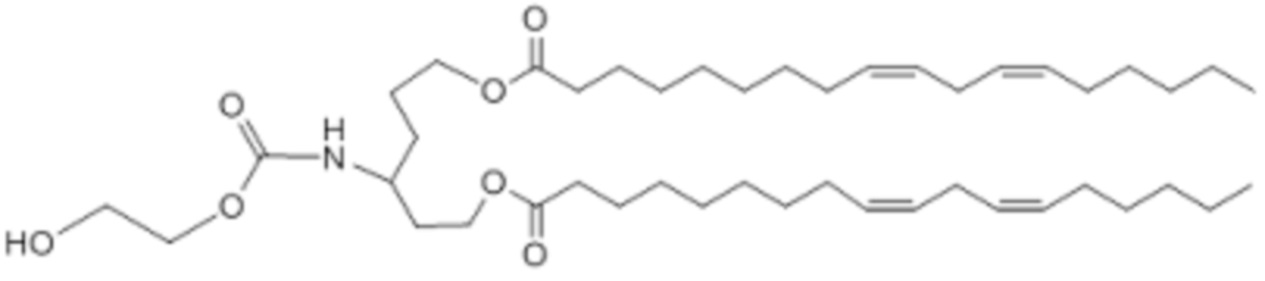
[00310] Примеры ионизируемого соединения включают в себя следующее соединение B13:

[00311] Примеры ионизируемого соединения включают в себя следующее соединение B14:

[00312] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой IX

где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов, где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть замещены,



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[00313] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00314] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00315] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00316] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00317] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00318] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00319] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой IX

где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4.
[00320] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00321] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00322] Согласно дополнительным вариантам осуществления, соединение может характеризоваться структурой, представленной формулой IX

где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где p равен от 1 до 4;
где R3 выбирают из

где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4.
[00323] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00324] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00325] Примеры ионизируемого соединения включают в себя следующее соединение C11:

[00326] Примеры ионизируемого соединения включают в себя следующее соединение C12:
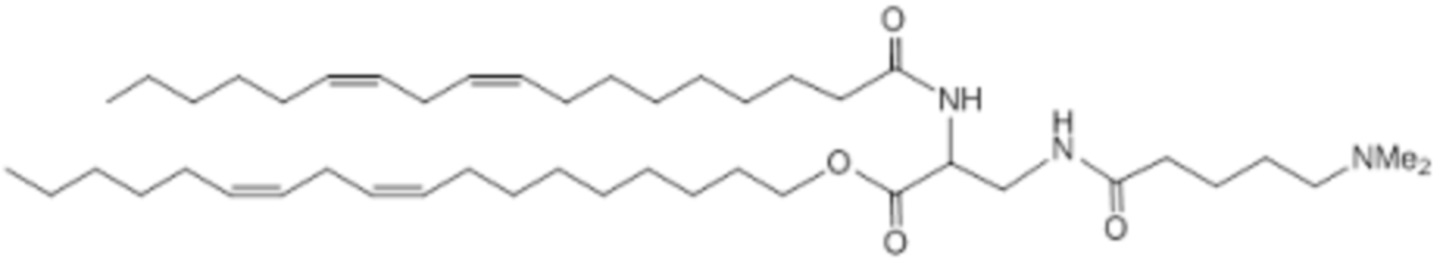
[00327] Примеры ионизируемого соединения включают в себя следующее соединение C13:
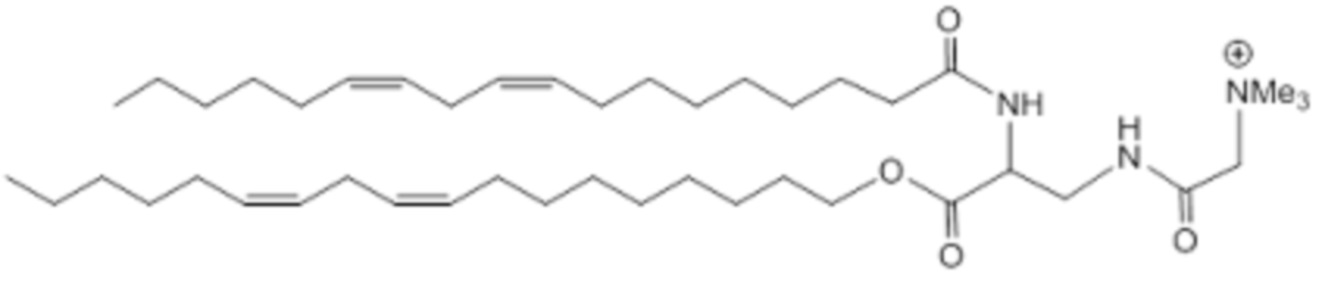
[00328] Примеры ионизируемого соединения включают в себя следующее соединение C14:

[00329] Примеры ионизируемого соединения включают в себя следующее соединение C15:

[00330] Примеры ионизируемого соединения включают в себя следующее соединение C16:

[00331] Примеры ионизируемого соединения включают в себя следующее соединение C17:

[00332] Примеры ионизируемого соединения включают в себя следующее соединение C18:

[00333] Примеры ионизируемого соединения включают в себя следующее соединение C19:

[00334] Примеры ионизируемого соединения включают в себя следующее соединение C20:

[00335] Примеры ионизируемого соединения включают в себя следующее соединение C21:
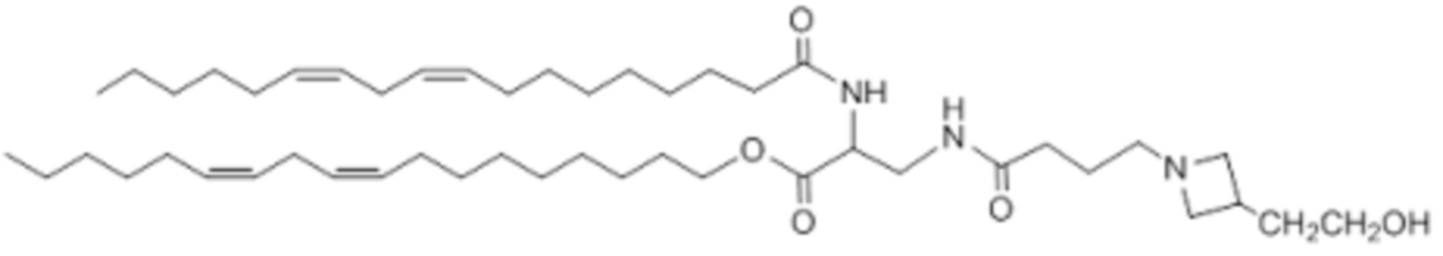
[00336] Примеры ионизируемого соединения включают в себя следующее соединение C22:

[00337] Примеры ионизируемого соединения включают в себя следующее соединение C23:

[00338] Примеры ионизируемого соединения включают в себя следующее соединение C24:

которое представляет собой N,N,N-триметил-2-(((S)-3-(((9Z,12Z)-октадека-9,12-диен-1-ил)окси)-2-((9Z,12Z)-октадека-9,12-диенамидо)-3-оксопропил)амино)-2-оксоэтан-1-аминий.
[00339] Примеры ионизируемого соединения включают в себя следующее соединение C25:

которое представляет собой (9Z,12Z)-октадека-9,12-диен-1-ил-(S)-3-(2-(диметиламино)ацетамидо)-2-((9Z,12Z)-октадека-9,12-диенамидо)пропаноат.
[00340] Согласно некоторым вариантам осуществления, соединение может характеризоваться структурой, представленной формулой X

где R1=C(=O)OR4, и R2=NHC(=O)R5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где R3 выбирают из амино, четвертичного амино, аминоалкила, четвертичного аминоалкила, гидроксиалкиламино.
[00341] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00342] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00343] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00344] Примеры ионизируемого соединения включают в себя следующее соединение D11:

[00345] Примеры ионизируемого соединения включают в себя следующее соединение D12:

[00346] Примеры ионизируемого соединения включают в себя следующее соединение D13:

[00347] Примеры ионизируемого соединения включают в себя следующее соединение D14:

[00348] Варианты осуществления настоящего изобретения включают в себя соединения, характеризующиеся структурой, представленной формулой XI

где R1=C(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой O или NH;
где p равен от 1 до 4;
где R3 выбирают из 1-азетидинов, 1-пирролидинов, 1-пиперидинов, 4-морфолинов и 1,4-пиперазинов где кольца могут быть замещены по любому положению атома углерода,




и также могут быть выбраны из амино- и аминоалкильных групп, которые могут быть замещены,



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4;
Q представляет собой O или NR7.
[00349] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00350] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00351] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00352] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(16-18)алкильную группу или C(16-18)алкенильную группу.
[00353] Согласно некоторым вариантам осуществления, p равен 1, 2, 3 или 4.
[00354] Согласно некоторым вариантам осуществления, q равен 0, 1, 2, 3 или 4.
[00355] Варианты осуществления настоящего изобретения включают в себя соединения, характеризующиеся структурой, представленной формулой XI

где R1=C(=O)R4, и R2=C(=O)OR5,
где R4 и R5 в каждом случае независимо представляют собой C(12-20)алкильную группу или C(12-20)алкенильную группу;
где Z представляет собой O или NH;
где p равен от 1 до 4;
где R3 выбирают из



где
каждый R6 независимо выбирают из H, алкила, гидроксила, гидроксиалкила, алкокси, алкоксиалкокси, аминоалкила;
каждый R7 независимо выбирают из H, алкила;
каждый R8 независимо выбирают из H, алкила, гидроксиалкила и аминоалкила, и любые два R8 могут формировать кольцо;
q равен от 0 до 4.
[00356] Согласно некоторым вариантам осуществления, каждая из алкенильных групп может содержать одну или две двойных связи.
[00357] Согласно некоторым вариантам осуществления, R4 и R5 в каждом случае независимо представляют собой C(14-18)алкильную группу или C(14-18)алкенильную группу.
[00358] Согласно некоторым вариантам осуществления, термины «алкил», «гидроксиалкил» и «аминоалкил» относятся к C(1-6)алкилу, гидрокси[C(1-6)алкилу] и амино[C(1-6)алкилу].
[00359] Примеры ионизируемого соединения включают в себя следующее соединение E11:
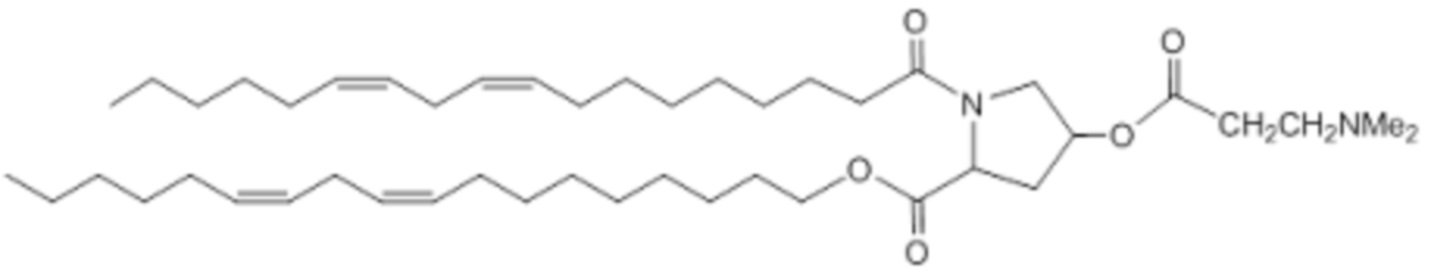
[00360] Примеры ионизируемого соединения включают в себя следующее соединение E12:

[00361] Примеры ионизируемого соединения включают в себя следующее соединение E13:

[00362] Примеры ионизируемого соединения включают в себя следующее соединение E14:
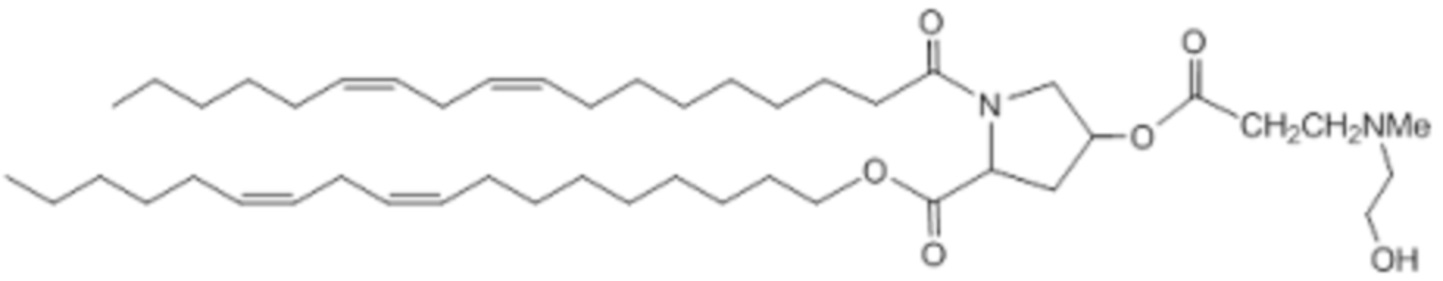
[00363] Примеры ионизируемого соединения включают в себя следующее соединение E15:

[00364] Примеры ионизируемого соединения включают в себя следующее соединение E16:

[00365] Примеры ионизируемого соединения включают в себя следующее соединение E17:
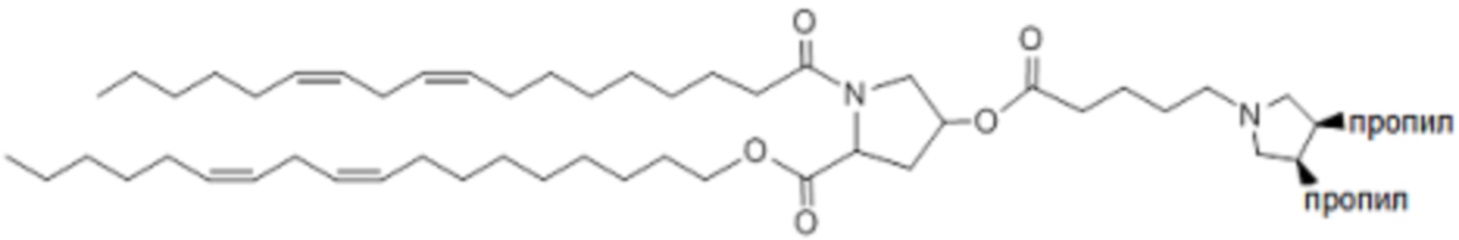
[00366] Примеры ионизируемого соединения включают в себя следующее соединение E18:

[00367] Примеры ионизируемого соединения включают в себя следующее соединение E19:

[00368] Примеры ионизируемого соединения включают в себя следующее соединение E20:

[00369] Примеры ионизируемого соединения включают в себя следующее соединение E21:

[00370] Примеры ионизируемого соединения включают в себя следующее соединение E22:
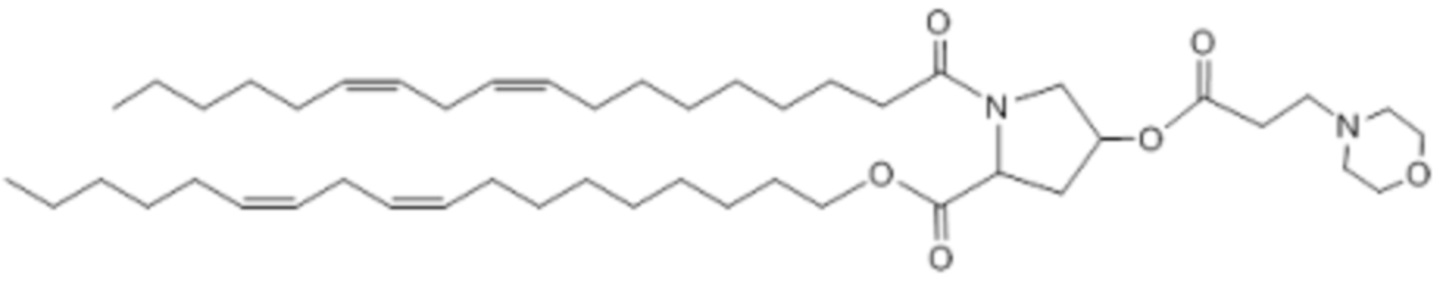
[00371] Примеры ионизируемого соединения включают в себя следующее соединение E23:

[00372] Примеры ионизируемого соединения включают в себя следующее соединение E24:

[00373] Примеры ионизируемого соединения включают в себя следующее соединение E25:

[00374] Примеры ионизируемого соединения включают в себя следующее соединение E26:
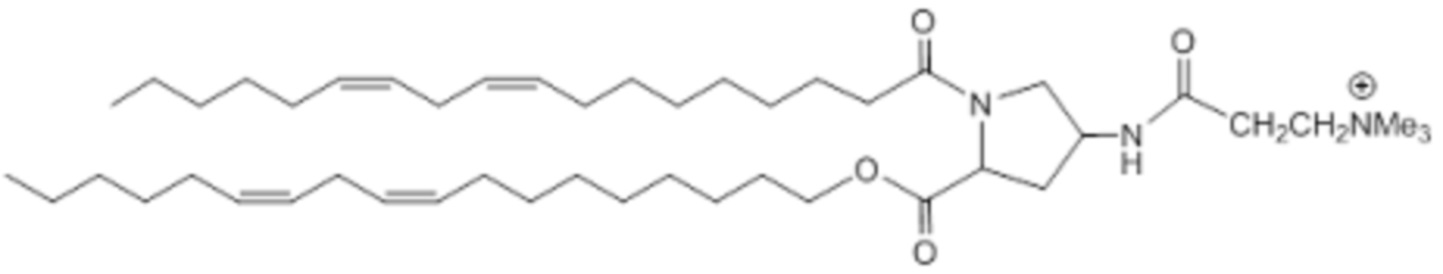
[00375] Примеры ионизируемого соединения включают в себя следующее соединение E27:

[00376] Примеры ионизируемого соединения включают в себя следующее соединение E28:

[00377] Примеры ионизируемого соединения включают в себя следующее соединение E29:

[00378] Примеры ионизируемого соединения включают в себя следующее соединение E30:

[00379] Примеры ионизируемого соединения включают в себя следующее соединение E31:

[00380] Примеры ионизируемого соединения включают в себя следующее соединение E32:

[00381] Примеры ионизируемого соединения включают в себя следующее соединение E33:
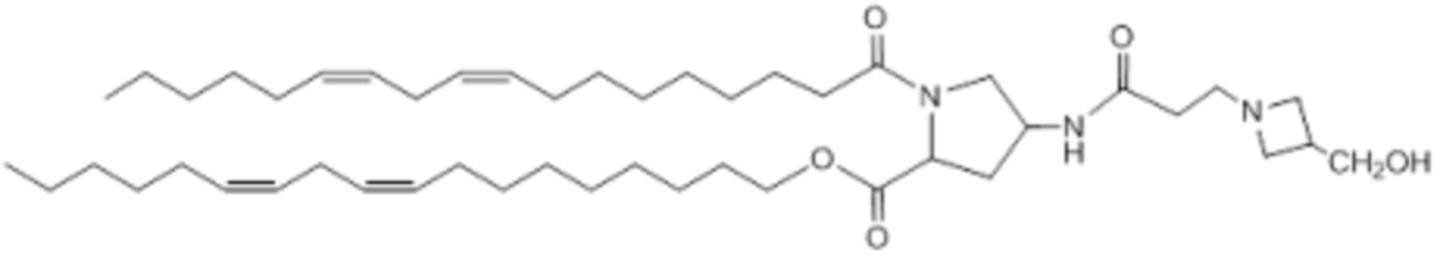
[00382] Примеры ионизируемого соединения включают в себя следующее соединение E34:
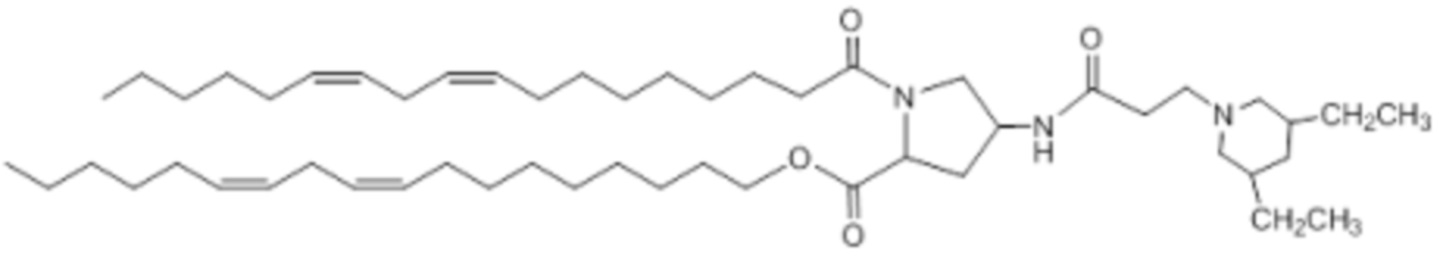
[00383] Примеры ионизируемого соединения включают в себя следующее соединение E35:

[00384] Примеры ионизируемого соединения включают в себя следующее соединение E36:

[00385] Примеры ионизируемого соединения включают в себя следующее соединение E37:

которое представляет собой (9Z,12Z)-октадека-9,12-диен-1-ил-(2S,4R)-4-(3-(диметиламино)пропанамидо)-1-((9Z,12Z)-октадека-9,12-диеноил)пирролидин-2-карбоксилат.
[00386] Примеры ионизируемого соединения включают в себя следующее соединение E38:

которое представляет собой (9Z,12Z)-октадека-9,12-диен-1-ил-(2S,4R)-4-(4-(диметиламино)бутанамидо)-1-((9Z,12Z)-октадека-9,12-диеноил)пирролидин-2-карбоксилат.
[00387] Примеры ионизируемого соединения включают в себя следующее соединение E39:

которое представляет собой N,N,N-триметил-4-(((3R,5S)-5-((((9Z,12Z)-октадека-9,12-диен-1-ил)окси)карбонил)-1-((9Z,12Z)-октадека-9,12-диеноил)пирролидин-3-ил)амино)-4-оксобутан-1-аминий.
[00388] Примеры ионизируемого соединения включают в себя следующее соединение E40:

[00389] Структурные липиды
[00390] Примеры структурных липидов включают в себя холестерины, стерины и стероиды.
[00391] Примеры структурных липидов включают в себя холаны, холестаны, эргостаны, кампестаны, пориферастаны, стигмастаны, горгостаны, ланостаны, гонаны, эстраны, андростаны, прегнаны и циклоартаны.
[00392] Примеры структурных липидов включают в себя стерины и зоостерины, такие как холестерин, ланостерин, зимостерин, зимостенол, дасмостерин, стигмастанол, дигидроланостерин и 7-дегидрохолестерин.
[00393] Примеры структурных липидов включают в себя пегилированные холестерины и соединения 3-оксо-(С1-22)ацилхолестана, например, холестерила ацетат, холестерила арахидонат, холестерила бутират, холестерила гексаноат, холестериламиристат, холестерила пальмитат, холестерила бегенат, холестерила стеарат, холестерила каприлат, холестерила n-деканоат, холестерила додеканоат, холестерила нервонат, холестерила пеларгонат, холестерила n-валерат, холестерила олеат, холестерила элаидат, холестерила эрукат, холестерила гептаноат, холестерилалинолелаидат и холестерила линолеат.
[00394] Примеры структурных липидов включают в себя стерины, такие как фитостерины, бета-ситостерин, кампестерин, эргостерин, брассикастерин, дельта-7-стигмастерин и дельта-7-авенастерин.
[00395] Стабилизирующие липиды
[00396] Примеры стабилизирующих липидов включают в себя цвиттерионные липиды.
[00397] Примеры стабилизирующих липидов включают в себя такие соединения, как фосфолипиды.
[00398] Примеры фосфолипидов включают в себя фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин и ордилинолеоилфосфатидилхолин.
[00399] Примеры стабилизирующих липидов включают в себя соединения фосфатидилэтаноламина и соединения фосфатидилхолина.
[00400] Примеры стабилизирующих липидов включают в себя 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC).
[00401] Примеры стабилизирующих липидов включают в себя дифитаноилфосфатидилэтаноламин (DPhPE) и 1,2-дифитаноил-sn-глицеро-3-фосфохолин(DPhPC).
[00402] Примеры стабилизирующих липидов включают в себя 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин(DPPC), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (DPPE) и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE).
[00403] Примеры стабилизирующих липидов включают в себя 1,2-дилауроил-sn-глицерол (DLG); 1,2-димиристоил-sn-глицерол (DMG); 1,2-дипальмитоил-sn-глицерол (DPG); 1,2-дистеароил-sn-глицерол (DSG); 1,2-диарахидоил-sn-глицеро-3-фосфохолин (DAPC); 1,2-дилауроил-sn-глицеро-3-фосфохолин (DLPC); 1,2-димиристоил-sn-глицеро-3-фосфохолин (DMPC); 1,2-дипальмитоил-sn-глицеро-O-этил-3-фосфохолин (DPePC); 1,2-дилауроил-sn-глицеро-3-фосфоэтаноламин (DLPE); 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин (DMPE); 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE); 1-пальмитоил-2-линолеоил-sn-глицеро-3-фосфохолин; 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (POPC); 1-пальмитоил-2-лизо-sn-глицеро-3-фосфохолин (P-Lyso-PC); и 1-стеароил-2-лизо-sn-глицеро-3-фосфохолин (S-Lyso-PC).
[00404] Липиды для снижения иммуногенности
[00405] Примеры липидов для снижения иммуногенности включают в себя полимерные соединения и полимер-липидные конъюгаты.
[00406] Примеры липидов для снижения иммуногенности включают в себя пегилированные липиды, содержащие полиэтиленгликолевые (PEG) области. PEG-области могут характеризоваться любой молекулярной массой. Согласно некоторым вариантам осуществления, PEG-область может характеризоваться молекулярной массой, составляющей 200, 300, 350, 400, 500, 550, 750, 1000, 1500, 2000, 3000, 3500, 4000 или 5000 Да.
[00407] Примеры липидов для снижения иммуногенности включают в себя соединения, содержащие метокси-полиэтиленгликолевую область.
[00408] Примеры липидов для снижения иммуногенности включают в себя соединения, содержащие карбонилметокси-полиэтиленгликолевую область.
[00409] Примеры липидов для снижения иммуногенности включают в себя соединения, содержащие разветвленную PEG-область.
[00410] Примеры липидов для снижения иммуногенности включают в себя соединения, содержащие полиглицериновую область.
[00411] Примеры липидов для снижения иммуногенности включают в себя полимерные липиды, такие как DSPE-mPEG, DMPE-mPEG, DPPE-mPEG и DOPE-mPEG.
[00412] Примеры липидов для снижения иммуногенности включают в себя PEG-фосфолипиды и PEG-церамиды.
[00413] Катионные липиды
[00414] Примеры катионных липидов включают в себя катионные HEDC-соединения, описанные в US 2013/0330401 A1. Некоторые примеры катионных липидов представлены в US 2013/0115274 A1.
[00415] Липидные композиции
[00416] Согласно некоторым вариантам осуществления, композиция может содержать ионизируемое соединение A6, структурный липид холестерин, стабилизирующие липиды DOPC и DOPE и липид для снижения иммуногенности DPPE-mPEG. Согласно определенным вариантам осуществления, содержание соединения А6 может составлять от 15 до 25 мол.% композиции; суммарное содержание холестерина, DOPC и DOPE может составлять от 75 до 85 мол.% композиции; и содержание DPPE-mPEG может составлять 5 мол.% композиции.
[00417] Согласно одному варианту осуществления, содержание соединения А6 может составлять 25 мол.% композиции; содержание холестерина может составлять 30 мол.% композиции, содержание DOPC может составлять 20 мол.% композиции, содержание DOPE может составлять 20 мол.% композиции; и содержание DPPE-mPEG (2000) может составлять 5 мол.% композиции.
[00418] Наночастицы
[00419] Варианты осуществления настоящего изобретения могут относиться к композициям липосомных наночастиц. Ионизируемые молекулы согласно настоящему изобретению можно применять для формирования липосомных композиций, которые могут содержать одну или несколько бислойных структур липидоподобных молекул.
[00420] Композиция наночастиц может содержать одну или несколько ионизируемых молекул согласно настоящему изобретению в липосомальной структуре, бислойной структуре, мицелле, ламеллярной структуре или в их смесях.
[00421] Согласно некоторым вариантам осуществления, композиция может включать в себя один или несколько компонентов жидкой основы. Жидкая основа, подходящая для доставки действующих агентов согласно настоящему изобретению, может представлять собой фармацевтически приемлемую жидкую основу. Жидкая основа может содержать органический растворитель или сочетание воды и органического растворителя.
[00422] Варианты осуществления согласно настоящему изобретению могут относится к липидным наночастицам с размером от 10 до 1000 нм. Согласно некоторым вариантам осуществления, липосомные наночастицы могут иметь размер от 10 до 150 нм.
[00423] Фармацевтические композиции
[00424] Настоящее изобретение дополнительно относится к способам распределения в органе субъекта действующего агента для лечения фиброза, путем введения субъекту композиции согласно настоящему изобретению. Органы, которые можно подвергать такому лечению, включают в себя легкие, печень, поджелудочную железу, почки, толстый кишечник, сердце, костный мозг, кожу, тонкий кишечник, головной мозг и глаза.
[00425] Согласно некоторым вариантам осуществления, настоящее изобретение относится к способам лечения фиброза легких путем введения субъекту композиции согласно настоящему изобретению.
[00426] Примеры фиброзного заболевания включают в себя идиопатический фиброз легких и цирроз печени.
[00427] Согласно дополнительным аспектам, настоящее изобретение относится к ряду фармацевтических составов.
[00428] Фармацевтический состав в настоящем документе может включать в себя действующий агент, а также лекарственный носитель или липид согласно настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. В целом, действующие агенты согласно настоящему описанию включают в себя siRNA, действующие агенты против фиброза, а также любое низкомолекулярное лекарство.
[00429] Фармацевтический состав согласно настоящему изобретению может содержать одно или несколько из следующих веществ: поверхностно-активное средство, разбавитель, наполнитель, консервант, стабилизатор, краситель и средство, способствующее суспендированию.
[00430] Некоторые фармацевтические носители, разбавители и компоненты фармацевтического состава, а также способы составления и введения соединений и композиций согласно настоящему изобретению, описаны в Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co., Easton, Penn. (1990).
[00431] Примеры консервантов включают в себя бензоат натрия, аскорбиновую кислоту и сложные эфиры пара-гидроксибензойной кислоты.
[00432] Примеры поверхностно-действующих агентов включают в себя спирты, сложные эфиры, сульфатированные алифатические спирты.
[00433] Примеры наполнителей включают в себя сахарозу, глюкозу, лактозу, крахмал, кристаллическую целлюлозу, маннит, легкий безводный силикат, алюминат магния, алюминатметасиликат магния, синтетический силикат алюминия, карбонат кальция, кислый карбонат натрия, гидрофосфат кальция и карбоксиметилцеллюлозу кальция.
[00434] Примеры средств, способствующих суспендированию, включают в себя кокосовое масло, оливковое масло, кунжутное масло, арахисовое масло, сою, ацетатфталат целлюлозы, сополимер метилацетат-метакрилат и фталаты сложных эфиров.
[00435] Структуры молекулярных хвостов
[00436] Соединение согласно настоящему изобретению может иметь один или несколько липофильных хвостов, содержащих одну или несколько алкильных или алкенильных групп. Примеры липофильных хвостов, содержащих алкенильные группы, включают в себя C(14:1(5))алкенил, C(14:1(9))алкенил, C(16:1(7))алкенил, C(16:1(9))алкенил, C(18:1(3))алкенил, C(18:1(5))алкенил, C(18:1(7))алкенил, C(18:1(9))алкенил, C(18:1(11))алкенил, C(18:1(12))алкенил, C(18:2(9,12))алкенил, C(18:2(9,11))алкенил, C(18:3(9,12,15))алкенил, C(18:3(6,9,12))алкенил, C(18:3(9,11,13))алкенил, C(18:4(6,9,12,15))алкенил, C(18:4(9,11,13,15))алкенил, C(20:1(9))алкенил, C(20:1(11))алкенил, C(20:2(8,11))алкенил, C(20:2(5,8))алкенил, C(20:2(11,14))алкенил, C(20:3(5,8,11))алкенил, C(20:4(5,8,11,14))алкенил, C(20:4(7,10,13,16))алкенил, C(20:5(5,8,11,14,17))алкенил, C(20:6(4,7,10,13,16,19))алкенил, C(22:1(9))алкенил, C(22:1(13))алкенил и C(24:1(9))алкенил. Некоторые примеры хвостовых структур можно найти в Donald Voet and Judith Voet, Biochemistry, 3rd Edition (2005), p. 383.
[00437] Некоторые примеры липофильных хвостов включают в себя следующие структуры:
[00438] Любые из указанных примерных структур липофильных хвостов могут иметь одну или несколько дополнительных химических ветвей.
[00439] Химические определения
[00440] Используемый в настоящем документе термин «алкил» относится к алкильному радикалу насыщенной алифатической группы, которая может характеризоваться любой длиной. Алкильная группа может представлять собой разветвленную или неразветвленную, замещенную или незамещенную алифатическую группу, содержащую от 1 до 22 атомов углерода. Такое определение также применимо к алкильной части других групп, таких как, например, циклоалкил, алкокси, алканоил и аралкил.
[00441] Используемый в настоящем документе термин, такой как, например, «C(1-5)алкил» включает в себя C(1)алкил, C(2)алкил, C(3)алкил, C(4)алкил и C(5)алкил. По аналогии, например, термин «C(3-22)алкил» включает в себя C(1)алкил, C(2)алкил, C(3)алкил, C(4)алкил, C(5)алкил, C(6)алкил, C(7)алкил, C(8)алкил, C(9)алкил, C(10)алкил, C(11)алкил, C(12)алкил, C(13)алкил, C(14)алкил, C(15)алкил, C(16)алкил, C(17)алкил, C(18)алкил, C(19)алкил, C(20)алкил, C(21)алкил и C(22)алкил.
[00442] Используемый в настоящем документе термин «алкильная группа» может означать термин, такой как Me (метил, -CH3), Et (этил, -CH2CH3), Pr (любая пропильная группа),nPr (n-Pr, н-пропил),iPr (i-Pr, изопропил), Bu (любая бутильная группа),nBu (n-Bu, н-бутил),iBu (i-Bu, изобутил),sBu (s-Bu, втор-бутил) иtBu (t-Bu, трет-бутил).
[00443] Используемый в настоящем документе термин «алкенил» относится к алкильному радикалу, содержащему, по меньшей мере, одну углерод-углеродную двойную связь. Алкенильная группа может представлять собой разветвленный или неразветвленный, замещенный или незамещенный алкильный радикал, содержащий от 2 до 22 атомов углерода и, по меньшей мере, одну углерод-углеродную двойную связь. «Алкенильная» группа содержит одну или несколько углерод-углеродных двойных связей.
[00444] Используемый в настоящем документе термин «замещенный» относится к атому, содержащему один или несколько заместителей или замещающих групп, которые могут быть одинаковыми или разными и могут включать в себя водородный заместитель. Таким образом, термины алкил, циклоалкил, алкенил, алкокси, алканоил и арил, например, относятся к группам, которые включают в себя замещенные варианты. Замещенные варианты включают в себя линейные, разветвленные и циклические варианты, и группы, содержащие заместитель или замещающие группы, которые замещают один или несколько водородов, присоединенных к любому атому углерода группы.
[00445] В общем, соединение может содержать один или несколько хиральных центров. Соединения, содержащие один или несколько хиральных центров, могут включать в себя соединения, описанные как «изомер», «стереоизомер», «диастереоизомер», «энантиомер», «оптический изомер» или как «рацемическая смесь». Общепринятые нормы стереохимической номенклатуры, например, правила именования стереоизомера по Кану, Ингольду и Прелогу, а также способы определения стереохимии и разделения стереоизомеров известны в данной области техники (см., например, Michael B. Smith and Jerry March, March's Advanced Organic Chemistry, 5th edition, 2001). Предполагается, что соединения и структуры согласно настоящему раскрытию охватывают все возможные изомеры, стереоизомеры, диастереоизомеры, энантиомеры и/или оптические изомеры, которые считаются потенциально существующими для конкретного соединения или структуры, включая их любые смеси, рацемические или иные.
[00446] Настоящее изобретение охватывает абсолютно все таутомерные, сольватированные или несольватированные, гидратированные или негиратированные формы, а также содержащие любые изотопные атомы формы соединений и композиций, раскрытых в настоящем документе.
[00447] Настоящее изобретение охватывает абсолютно все кристаллические полиморфы или различные кристаллические формы соединений и композиций, описанных в настоящем документе.
[00448] Использованные сокращения:
DMAP - 4-N,N-диметиламинопиридин
DCM - дихлорметан
TEA - триэтиламин
EDC - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
Na2SO4 -сульфат натрия
EtOAc - этилацетат
DMF - N,N-диметилформамид
ELSD - испарительный детектор светорассеяния
NaCl -хлорид натрия
K2CO3 -карбонат калия
MeOH - метанол
TFA - трифторуксусная кислота
DIEA - N,N-диизопропилэтиламин
MgSO4-сульфат магния
LCMS - жидкостная хроматография/масс-спектрометрия
NaHCO3-бикарбонат натрия
H2O- вода
HCl- гидрохлорид
KI- калия йодид
DMSO - диметилсульфоксид
TBAF -фторид тетра-N-бутиламмония
NaBH4-боргидрид натрия
THF- тетрагидрофуран
TBDMS- трет-бутилдиметилсилил
LiOH -гидроксид лития
MeI - метилйодид
BOC - трет-бутилоксикарбонил
Fmoc - флуоренилметилоксикарбонил
[00449] ПРИМЕРЫ
[00450] Пример 1: Схема получения соединения A6 представлена на фиг. 1.
[00451] Промежуточный продукт 1: В высушенной в печи колбе (1 л) с магнитным мешальником к линолевой кислоте (50,0 г, 178,30 ммоль), N-Boc-диэтаноламину (18,3 г, 89,10 ммоль) и DMAP (1,1 г, 8,90 ммоль) добавляли безводный DCM (400 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли EDC (35,9 г, 187,20 ммоль), и перемешивали смесь при комнатной температуре в течение ночи (17 часов). В завершение, реакционную смесь гасили добавлением насыщенного водного раствора NaCl (400 мл) и дважды экстрагировали DCM (400 мл, 100 мл). Органические слои объединяли, сушили над Na2SO4 (20 г) и фильтровали. Фильтрат концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 50 мл DCM и очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента, состоящего из гексана в течение 5 мин, затем 0-20% EtOAc в гексане в течение 40 мин, со скоростью потока 100 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 1 (59 г, выход 91%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,32-5,33 (8H, м, CH=), 4,13-4,17 (4H, м, OCH2), 3,43-3,49 (4H, м, NCH2), 2,73-2,74 (4H, м, =CHCH2CH=), 2,03-2,28 (4H, м, CH2CO), 2,00-2,01 (8H, м, =CHCH2), 1,60-1,70 (4H, м, CH2CH2CO), 1,43 (9H, с, C(CH3)3), 1,28-1,31 (28H, м, CH2), 0,85-0,86 (6H, м, CH3).
[00452] Промежуточный продукт 2: В высушенной в печи колбе (1000 мл) с магнитным мешальником к промежуточному продукту 1 (50,0 г, 68,50 ммоль) добавляли безводный DCM (100 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (100 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали насыщенным водным раствором NaHCO3 (300 мл). Затем, смесь экстрагировали DCM (2×200 мл), органические слои объединяли, сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого промежуточного продукта, который затем растворяли в безводном DCM (300 мл) и охлаждали до 0°C на бане со льдом в воде. Затем, при 0°C медленно добавляли хлорацетилхлорид (6,0 мл, 75,30 ммоль), а затем DIEA (14,3 мл, 82,20 ммоль). После завершения добавления, баню со льдом в воде удаляли, и перемешивали смесь при температуре окружающей среды в течение 2 часов. Затем, реакционную смесь концентрировали с использованием роторного испарителя, промывали насыщенным водным раствором NaHCO3 (300 мл) и экстрагировали DCM (300 мл, 200 мл). Затем, объединенные органические слои сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 20 мл DCM и очищали на колонке с 330 г силикагеля с использованием градиента, состоящего из гексана в течение 5 мин, затем 10% EtOAc в гексане в течение 20 мин, затем 20% EtOAc в гексане в течение 20 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 2 (41,4 г, выход 82%) в виде прозрачной желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,35-5,33 (8H, м, CH=), 4,24-4,22 (4H, м, OCH2),4,14 (2H, с, CH2Cl), 3,67-3,63 (4H, м, NCH2), 2,78-2,75 (4H, м, =CHCH2CH=), 2,30-2,29 (4H, м, CH2CO), 2,03-2,05 (8H, м, =CHCH2), 1,60-1,56 (4H, м, CH2CH2CO), 1,33-1,29 (28H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00453] Соединение A6: В высушенном в печи флаконе (200 мл) с магнитным мешальником к промежуточному продукту 2 (5,0 г, 7,07 ммоль), KI (1,2 г, 7,07 ммоль) и гидрохлориду цис-3,4-дигидроксипирролидина (1,3 г, 9,20 ммоль) добавляли безводный DMF (20 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли DIEA (3,0 мл, 9,91 ммоль), и перемешивали смесь при 30°C в течение 2,5 часов. После удаления растворителя на роторном растворителе в условиях высокого вакуума, к остатку добавляли насыщенный раствор NaHCO3 (100 мл), и экстрагировали DCM (100 мл, 50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 120 г силикагеля с использованием градиента, состоящего из гексана в течение 5 мин, затем 0-50% EtOAc в гексане в течение 10 мин, затем 50% EtOAc в гексане в течение 10 мин, затем DCM в течение 5 мин, затем 5% MeOH в DCM в течение 30 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A6 (3,5 г, выход 64%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,34-5,29 (8H, м, CH=), 4,22-4,20 (6H, м, OCH2, OCH), 3,59-3,49 (6H, м, NCH2, COCH2N), 2,95-2,74 (6H, м, =CHCH2CH=, NCH2), 2,30-2,29 (4H, м, CH2CO), 2,05-2,03 (8H, м, =CHCH2), 1,60 (4H, м, CH2CH2CO), 1,33-1,29 (28H, м, CH2), 0,90-0,88 (6H, м, CH3).
[00454] Пример 2: Схема получения соединения AB представлена на фиг. 2.
[00455] Промежуточный продукт 3: В высушенной в печи колбе (200 мл) с магнитным мешальником к промежуточному продукту 1 (10,0 г, 13,70 ммоль) добавляли безводный DCM (15 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (15 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя. Остаток разбавляли DCM (~50 мл), добавляли 10% K2CO3(15 мл), и перемешивали в течение 10-15 минут на бане со льдом. Проверяли значение pH водного слоя, чтобы удостовериться в том, что значение pH>8. Затем, смесь переносили в делительную воронку, экстрагировали DCM (50 мл, 25 мл), сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления с получением маслянистого промежуточного продукта, который затем растворяли в безводном DCM (30 мл), затем медленно добавляли бромацетилбромид (1,2 мл, 13,70 ммоль), а затем TEA (2,1 мл, 15,07 ммоль). После завершения добавления, смесь перемешивали при температуре окружающей среды в течение ночи. Затем, реакционную смесь концентрировали с использованием роторного испарителя, промывали водой (30 мл) и экстрагировали DCM (30 мл, 20 мл). Затем, объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 20 мл DCM и очищали на колонке с 330 г силикагеля с использованием градиента, состоящего из гексана в течение 0,5 мин, затем градиента 0-20% EtOAc в гексане 30 мин, затем 30% EtOAc в гексане в течение 5 мин, со скоростью потока 130 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 3 (8,1 г, выход 79%) в виде прозрачной желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,35-5,33 (8H, м, CH=), 4,24-4,22 (4H, м, OCH2), 3,93 (2H, с, CH2Br), 3,69-3,61 (4H, м, NCH2), 2,78-2,74 (4H, м, =CHCH2CH=), 2,32-2,28 (4H, м, CH2CO), 2,06-2,02 (8H, м, =CHCH2), 1,62-1,60 (4H, м, CH2CH2CO), 1,36-1,26 (28H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00456] Соединение AB: В высушенном в печи флаконе (100 мл) с магнитным мешальником к промежуточному продукту 3 (460 мг, 0,61 ммоль) и 1-пиперазинпропанолу (89 мг, 0,61 ммоль) добавляли безводный DCM (10 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли TEA (103 мкл, 0,74 ммоль), и перемешивали смесь при температуре окружающей среды в течение ночи. После удаления растворителя с использованием роторного испарителя в условиях высокого вакуума, к остатку добавляли насыщенный 10% раствор K2CO3 (50 мл), и экстрагировали DCM (50 мл, 25 мл). Затем, органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на системе очистки методом флэш-хроматографии. Вещество наносили непосредственно на колонку с 24 г силикагеля и элюировали с использованием градиента, состоящего из DCM в течение 3 мин, затем 0-8% MeOH в DCM в течение 7 мин, затем 8% MeOH в DCM в течение 20 мин, со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения AB (379 мг, выход 76%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,39-5,29 (8H, м, CH=), 4,22-4,21 (4H, м, OCH2), 3,74-3,71 (2H, м, CH2OH), 3,59-3,49 (4H, м, NCH2), 3,23 (2H, с, COCH2), 2,78-2,75 (2H, м, CH2CH2OH), 2,59-2,57 (8H, м, NCH2CH2N), 2,32-2,27 (4H, м, CHCH2CH), 2,05-2,03 (8H, м, =CHCH2CH2), 1,60 (4H, м, CH2CH2CO), 1,33-1,29 (28H, м, CH2), 0,90-0,88 (6H, м, CH3).
[00457] Пример 3: Схема получения соединения A4 представлена на фиг. 3.
[00458] Промежуточный продукт 4: В высушенной в печи колбе (1 л) с магнитным мешальником к миристиновой кислоте (50,0 г, 218,90 ммоль), N-Boc-диэтаноламину (21,4 г, 218,90 ммоль) и DMAP (3,8 г, 65,70 ммоль) добавляли безводный DCM (300 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли EDC (44,0 г, 481,70 ммоль), и перемешивали смесь при комнатной температуре в течение ночи (17 часов). В завершение, реакционную смесь гасили добавлением насыщенного раствора NaCl (400 мл) и дважды экстрагировали DCM (400 мл, 100 мл). Органические слои объединяли, сушили над Na2SO4 (20 г) и фильтровали. Фильтрат концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 50 мл DCM и очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента 5-50% EtOAc в гексане в течение 40 мин со скоростью потока 100 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 4 (50,0 г, выход 71%) в виде белого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 4,14-4,17 (4H, м, OCH2), 3,44-3,50 (4H, м, NCH2), 2,27-2,30 (4H, м, CH2CO), 1,60-1,70 (4H, м, CH2CH2CO), 1,45 (9H, с, C(CH3)3), 1,20-1,25 (40H, м, CH2), 0,81-0,88 (6H, м, CH3).
[00459] Промежуточный продукт 5: В высушенной в печи колбе (200 мл) с магнитным мешальником к промежуточному продукту 4 (10,0 г, 16,00 ммоль) добавляли безводный DCM (15 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (15,0 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (100 мл). Затем, смесь экстрагировали DCM (2×100 мл), органические слои объединяли, сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления с получением остатка, который затем растворяли в безводном DCM (50 мл) и охлаждали до 0°C на бане со льдом в воде. Затем, при 0°C медленно добавляли триэтиламин (2,5 мл, 17,60 ммоль), а затем бромацетилбромид (1,4 мл, 16,00 ммоль). После завершения добавления, баню со льдом в воде удаляли, и перемешивали смесь при температуре окружающей среды в течение 2 часов. Затем, реакционную смесь концентрировали с использованием роторного испарителя. Неочищенный остаток растворяли в 10 мл DCM и очищали на колонке с 220 г силикагеля с использованием градиента 0-50% EtOAc в гексане в течение 40 мин со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 5 (8,2 г, выход 79%) в виде бледно-желтого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 4,23-4,24 (4H, м, OCH2), 3,93 (2H, с, ClCH2), 3,60-3,69 (4H, м, NCH2), 2,28-2,30 (4H, м, CH2CO), 1,57-1,59 (4H, м, CH2CH2CO), 1,24-1,27 (40H, м, CH2), 0,85-0,89 (6H, м, CH3).
[00460] Соединение A4: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 5 (1,7 г, 2,57 ммоль) и (3S,4S)-дигидроксипирролидину (0,3 г, 2,57 ммоль) добавляли безводный DCM (20 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли триэтиламин (0,4 мл, 2,57 ммоль), и перемешивали смесь при температуре окружающей среды в течение ночи (17 часов). После удаления растворителя на роторном растворителе в условиях высокого вакуума, остаток добавляли к 10% раствору K2CO3 (50 мл), и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A4 (870 мг, выход 51%) в виде белого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 4,09-4,21 (6H, м, OCH2, OCH), 3,56-3,63 (6H, м, NCH2, COCH2N), 3,28-3,29 (2H, м, NCH2CH), 2,74-2,76 (2H, м, NCH2CH), 2,26-2,30 (4H, м, CH2CO), 1,59-1,60 (4H, м, CH2CH2CO), 1,24-1,27 (40H, м, CH2), 0,85-0,88 (6H, м, CH3).
[00461] Пример 4: Схема получения соединения B8 представлена на фиг. 4.
[00462] Соединение B8: В высушенном в печи флаконе (20 мл) с магнитным мешальником к промежуточному продукту 4 (1,0 г, 1,60 ммоль) добавляли безводный DCM (3 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (3 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (20 мл). Затем, смесь экстрагировали DCM (2×20 мл), органические слои объединяли, сушили над Na2SO4 (2 г), фильтровали и концентрировали в условиях пониженного давления с получением промежуточного продукта, который затем растворяли в безводном DCM (7 мл). Затем, при температуре окружающей среды добавляли глутаровый ангидрид (0,3 г, 2,40 ммоль), а затем триэтиламин (0,3 мл, 2,40 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Затем, реакционную смесь концентрировали с использованием роторного испарителя. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-10% MeOH в DCM в течение 20 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения B8 (667 мг, выход 65%) в виде белого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 4,18-4,23 (4H, м, OCH2), 3,59-3,62 (4H, м, NCH2), 2,44-2,49 (4H, м, CH2CO), 2,29-2,31 (4H, м, CH2CO), 1,97-2,00 (4H, м, CH2CO), 1,57-1,62 (8H, м, CH2CH2CO, CH2), 1,26-1,31 (40H, м, CH2), 0,87-0,89 (6H, м, CH3).
[00463] Пример 5: Схема получения соединения A9 представлена на фиг. 5.
[00464] Соединение A9: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 5 (2,4 г, 3,72 ммоль) и гидрохлориду 3-азетидинметанола (1,0 г, 8,09 ммоль) добавляли безводный DCM (20 мл) и DMSO (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли триэтиламин (1,6 мл, 11,12 ммоль), и перемешивали смесь при температуре окружающей среды в течение 1 часа. Реакционную смесь гасили добавлением насыщенного 10% раствора K2CO3 (100 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (20 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A9 (1,2 г, выход 49%) в виде бледно-желтого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 4,18-4,21 (4H, м, OCH2), 3,76-3,77 (2H, м, CH2OH), 3,60-3,50 (4H, м, NCH2), 3,46-3,47 (2H, м, NCH2), 3,38 (2H, с, COCH2N), 3,25-3,26 (2H, м, NCH2), 2,64-2,70 (1H, м, CH), 2,28-2,31 (4H, м, CH2CO), 1,59 (4H, м, CH2CH2CO), 1,24-1,26 (40H, м, CH2), 0,85-0,87 (6H, м, CH3).
[00465] Пример 6: Схема получения соединения AA представлена на фиг. 6.
[00466] Соединение AA: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 3 (460 мг, 0,61 ммоль) и 1-пиперазинпропанолу (88,5 мг, 0,61 ммоль) добавляли безводный DCM (10 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли триэтиламин (0,1 мл, 0,74 ммоль), и перемешивали смесь при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь гасили добавлением 10% раствора K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над MgSO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 12 г силикагеля с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения AA (389 мг, выход 78%) в виде бесцветного масла.1H-ЯМР (400 МГц, CDCl3) δ: 5,29-5,34 (8H, м, CH=), 4,20-4,23 (4H, м, OCH2), 3,58-3,80 (6H, м, CH2OH,NCH2), 3,21 (2H, с, COCH2N), 2,75-2,78 (4H, м, =CHCH2CH=), 2,35-2,65 (8H, м, NCH2), 2,27-2,31 (4H, м, CH2CO), 2,02-2,06 (8H, м, =CHCH2), 1,70-1,73 (4H, м, CH2), 1,59-1,61 (4H, м, CH2CH2CO), 1,25-1,36 (28H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00467] Пример 7: Схема получения соединения A5 представлена на фиг. 7.
[00468] Соединение A5: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 3 (200 мг, 0,27 ммоль) и транс-3,4-пирролидиндиолу (28 мг, 0,27 ммоль) добавляли безводный DCM (10 мл) и DMSO (1 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли триэтиламин (50 мкл, 0,32 ммоль), и перемешивали смесь при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь гасили добавлением 10% раствора K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над MgSO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 12 г силикагеля с использованием градиента, состоящего из EtOAc в течение 5 мин и 0-30% MeOH в DCM в течение 30 мин, со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A5 (389 мг, выход 78%) в виде бесцветной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,29-5,39 (8H, м, CH=), 4,20-4,25 (4H, м, OCH2), 4,10-4,11 (2H, м, CHOH), 3,55-3,62 (4H, м, NCH2,COCH2N), 3,28-3,31 (2H, м, NCH2), 2,75-2,76 (6H, м, NCH2,=CHCH2CH=), 2,60 (2H, м, NCH2), 2,27-2,32 (4H, м, CH2CO), 2,02-2,06 (8H, м, =CHCH2), 1,60-1,61 (4H, м, CH2CH2CO), 1,25-1,36 (28H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00469] Пример 8: Схема получения соединения A1 представлена на фиг. 8.
[00470] Соединение A1: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 3 (1,0 г, 1,33 ммоль) и гидрохлориду 3-азетидинметанола (0,3 г, 2,66 ммоль) добавляли безводный DCM (20 мл) и DMSO (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 минут до получения прозрачного раствора. Затем, добавляли триэтиламин (0,7 мл, 5,32 ммоль), и перемешивали смесь при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь гасили добавлением 10% раствора K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента, состоящего из 0-50% EtOAc в гексане в течение 10 мин и 0-15% MeOH в DCM в течение 20 мин, со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A1 (130 мг, выход 13%) в виде бледно-желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,29-5,35 (8H, м, CH=), 4,18-4,21 (4H, м, OCH2), 3,40-3,77 (12H, м, CH2OH, CONCH2, NCH2,NCH2CO), 2,74-2,77 (5H, м, CH, =CHCH2CH=), 2,28-2,30 (4H, м, CH2CO), 2,04-2,05 (8H, м, =CHCH2), 1,60 (4H, м, CH2CH2CO), 1,24-1,26 (40H, м, CH2), 0,85-0,87 (6H, м, CH3).
[00471] Пример 9: Схема получения соединения D22 представлена на фиг. 9.
[00472] Промежуточный продукт 6: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 1 (11,4 г, 15,6 моль) добавляли безводный DCM (10 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (10,0 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя, и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого остатка, который затем растворяли в безводном DCM (100 мл), и последовательно добавляли Fmoc-Glu(OtBu)-OH (6,6 г, 15,60 ммоль), EDC (4,5 г, 23,40 ммоль) и DMAP (0,4 г, 3,10 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). На следующий день, реакционную смесь промывали солевым раствором (100 мл), экстрагировали DCM (2×50 мл), сушили над Na2SO4, фильтровали и концентрировали на роторном растворителе. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 220 г силикагеля с использованием градиента 0-50% EtOAc в гексане в течение 30 мин со скоростью потока 50 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 6 (8,3 г, выход 47%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,75-7,76 (2H, д, J=6,4 Гц, ArH), 7,59 (2H, т, J=4,8 Гц, ArH), 7,38-7,41 (2H, м, ArH), 7,26-7,33 (2H, м, ArH), 5,62-5,64 (1H, д, J=6,8 Гц, COCH2), 5,30-5,39 (8H, м, OCH2, =CH), 4,76-4,79 (1H, м, COCH2), 4,11-4,41 (6H, м, CH, OCH2), 3,35-3,98 (6H, м, NCH2), 2,74-2,78 (4H, м, =CHCH2CH=), 2,25-2,36 (8H, м, CH2,CH2CO), 2,00-2,06 (8H, м, =CHCH2), 1,54-1,77 (4H, м, CH2CH2CO), 1,45 (9H, с, O(CH3)3), 1,24-1,37 (28H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00473] Промежуточный продукт 7: В высушенном в печи флаконе (100 мл) с магнитным мешальником промежуточный продукт 6 (4,3 г, 4,14 ммоль) растворяли в ацетонитриле (18 мл), а затем добавляли пиперидин (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Затем, растворитель удаляли в условиях вакуума. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 80 г силикагеля с использованием градиента 0-5% MeOH в DCM в течение 30 мин со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 7 (2,1 г, выход 64%) в виде прозрачной жидкости. Анализ методом LCMS подтверждал продукт: m/z [M+H]+=816,17.
[00474] Промежуточный продукт 8: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 7 (2,1 г, 2,58 моль) последовательно добавляли безводный ацетонитрил (30 мл), цианоборгидрид натрия (0,9 г, 1,48 ммоль), формальдегид (37% в воде, 50 мл) и уксусную кислоту (2 мл). Смесь перемешивали в течение 2 часов. Затем, реакционную смесь обрабатывали 10% водным раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 30 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 8 (1,4 г, выход 64%) в виде прозрачной жидкости. Анализ методом LCMS подтверждал продукт: m/z [M+H]+=844,22.
[00475] Соединение D22: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 8 (1,4 г, 1,66 ммоль) добавляли безводный DCM (10 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (10,0 мл), и перемешивали смесь при температуре окружающей среды в течение 4 часов. Затем, реакционную смесь концентрировали с использованием роторного испарителя. Неочищенный остаток растворяли в 5 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 25 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением Lp09 (200 мг, выход 15%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,30-5,39 (8H, м, OCH2, =CH), 4,59-4,61 (1H, м, COCHN), 4,23-4,34 (4H, м, OCH2), 3,54-3,77 (4H, м, NCH2), 2,90 (6H, с, NCH3), 2,76 (4H, т, J=5,2 Гц, =CHCH2CH=), 2,50-2,55 (2H, м, CH2CO), 2,31-2,34 (4H, м,CH2CO), 2,22-2,27 (2H, м, CH2), 2,03-2,07 (8H, м, =CHCH2), 1,59-1,60 (4H, м, CH2CH2CO), 1,26-1,37 (28H, м, CH2), 0,88-0,90 (6H, м, CH3).
[00476] Пример 10: Схема получения соединений A7 и A8 представлена на фиг. 10.
[00477] Промежуточный продукт 9: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 1 (1,0 г, 1,37 ммоль) добавляли безводный DCM (10 мл). Смесь перемешивали в течение 2 минут до получения прозрачного раствора. Затем, добавляли TFA (10,0 мл), и перемешивали смесь при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя, и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением промежуточного продукта 9 в виде масла, которое затем использовали без дополнительной очистки.
[00478] Промежуточный продукт 10: К 2-(диметиламино)этан-1-олу (0,1 мл, 1,39 ммоль) в безводном DCM (10 мл) добавляли 4-нитрофенилкарбонохлоридат (0,3 г, 1,39 ммоль), а затем DIEA (0,5 мл, 2,76 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов) с получением раствора промежуточного соединения 10, который сразу использовали без дополнительной очистки.
[00479] Соединение A7: Промежуточный продукт 9 растворяли в DCM (10 мл), и переносили в колбу к раствору промежуточного продукта 10. Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). На следующий день, реакционную смесь концентрировали с использованием роторного испарителя. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента, состоящего из 0-50% EtOAc в гексане в течение 10 мин и 2-20% MeOH в DCM в течение 20 мин, со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A7 (540 мг, выход 54%) в виде прозрачной желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,30-5,40 (8H, м, CH=), 4,20-4,40 (6H, м, OCH2), 3,45-3,55 (6H, м, NCH2), 2,75-2,78 (4H, м, =CHCH2CH=), 2,25-2,30 (10H, м, NCH3,CH2CO), 2,03-2,05 (8H, м, =CHCH2), 1,56-1,60 (4H, м, CH2CH2CO), 1,29-1,33 (28H, м, CH2), 0,86-0,90 (6H, м, CH3).
[00480] Соединение A8: В высушенном в печи флаконе (20 мл) с магнитным мешальником соединение A7 (160 мг, 0,22 ммоль) добавляли к метилйодиду (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Затем, метилйодид удаляли в условиях вакуума. Неочищенный остаток растворяли в 1 мл DCM и очищали на колонке с 12 г силикагеля с использованием градиента 2-20% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и проводили ионный обмен йодид→хлорид с использованием смолы Amberlyst 26. В завершение, полученный раствор концентрировали в условиях пониженного давления с получением соединения A8 (100 мг, выход 59%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,29-5,34 (8H, м, CH=), 4,60-4,65 (2H, м, OCH2), 4,10-4,20 (6H, м, NCH2,OCH2), 3,50-3,55 (13H, м, NCH3,NCH2), 2,75-2,78 (4H, м, =CHCH2CH=), 2,25-2,30 (4H, м, CH2CO), 2,02-2,06 (8H, м, =CHCH2), 1,59-1,61 (4H, м, CH2CH2CO), 1,25-1,36 (28H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00481] Пример 11: Схема получения соединений C3 и C2 представлена на фиг. 11.
[00482] Промежуточный продукт 11: Boc-бета-H-Asp(OBz)-OH (35,0 г, 10,20 ммоль) растворяли в MeOH (45 мл) в круглодонной колбе и продували аргоном. Добавляли 10% Pd/C (350 мг), и еще раз продували колбу аргоном. Затем, весь воздух удаляли с использованием вакуумного насоса, и подсоединяли баллон с водородом. Реакционную смесь оставляли перемешиваться в течение ~2 часов при температуре окружающей среды. Баллон с водородом удаляли, затем через слой целита из смеси отфильтровывали Pd/C катализатор, а затем промывали большими объемами MeOH. В завершение, фильтрат концентрировали с использованием роторного испарителя с получением промежуточного продукта 11 (2,5 г, выход 100%), который использовали без дополнительной очистки.
[00483] Промежуточный продукт 12: В высушенной в печи колбе (200 мл) с магнитным мешальником к промежуточному продукту 11 (2,5 г, 10,11 ммоль), EDC (5,8 г, 30,30 ммоль) и DMAP (494 мг, 4,04 ммоль) добавляли безводный DCM (50 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли линолеиловый спирт (6,5 г, 24,20 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. В завершение, реакционную смесь гасили добавлением H2O (50 мл) и дважды экстрагировали DCM (2×50 мл). Органические слои объединяли, сушили над MgSO4 и фильтровали. Фильтрат концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из гексана в течение 2 мин, затем 0-25% EtOAc в гексане в течение 15 мин, затем 25% EtOAc в гексане в течение 5 мин, затем 75% EtOAc в гексане в течение 5 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 12 (7,0 г, выход 93%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,38-5,31 (8H, м, CH=), 4,28 (1H, ушир. с, NH), 4,08-4,05 (4H, м, OCH2), 2,78-2,75 (4H, м, =CHCH2CH=), 2,69-2,59 (4H, м, COCH2N), 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00484] Промежуточный продукт 13: Промежуточный продукт 12 (2,3 г, 3,09 ммоль) растворяли в DCM (20 мл) и охлаждали на бане со льдом. Добавляли TFA (20 мл), и оставляли смесь перемешиваться в течение ~1 часа под слоем аргона. После этого, вещество концентрировали в условиях вакуума. Остаток растворяли в DCM (20 мл), а затем добавляли 10% K2CO3 (20 мл). После перемешивания смеси на бане со льдом в течение ~1/2 часа, ее распределяли, и проверяли значение pH водного слоя, чтобы убедиться, что оно является щелочным. Мутный водный слой экстрагировали DCM (3×20 мл). К объединенным органическим слоям добавляли MgSO4, еще раз перемешивали на бане со льдом в течение ~20 минут и фильтровали. Фильтрат, промежуточный продукт 13, затем переносили на следующую стадию без какой-либо дополнительной очистки (2,0 г, предположительно количественный выход).
[00485] Соединение C3: В высушенной в печи колбе (50 мл) с магнитным мешальником к гидрохлориду N,N-диметилглицина (260 мг, 1,86 ммоль), EDC (447 мг, 2,33 ммоль) и DMAP (38 мг, 0,31 ммоль) добавляли безводный DCM (15 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут. Затем, добавляли промежуточный продукт 13 (1,0 г, 1,55 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. В завершение, реакционную смесь гасили добавлением H2O (50 мл) и дважды экстрагировали DCM (2×50 мл). Органические слои объединяли, сушили над MgSO4 и фильтровали. Фильтрат концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 40 г силикагеля) с использованием градиента, состоящего из гексана в течение 1 мин, затем 0-50% EtOAc в гексане в течение 25 мин, затем 50% EtOAc в гексане в течение 5 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением Lp12 (890 мг, выход 79%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,76-7,74 (1H, д, NH), 5,40-5,30 (8H, м, CH=), 4,28 (1H, м, CHN), 4,08-4,05 (4H, м, OCH2), 2,92 (2H, с, COCH2N), 2,78-2,75 (4H, м, =CHCH2CH=), 2,732,62 (4H, м, COCH2N), 2,27 (6H, с, N(CH3)2), 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00486] Соединение C2: Соединение C3 (890 мг, 1,22 ммоль) растворяли в ацетонитриле (9 мл), и добавляли йодометан (1 мл). Флакон продували аргоном, и оставляли перемешиваться при 50°C в течение ночи. На следующий день, реакционную смесь концентрировали в условиях вакуума и очищали на флэш-хроматографической системе очистки (колонка с 40 г силикагеля) с использованием градиента, состоящего из DCM в течение 2 мин, затем 0-8% MeOH в DCM в течение 20 мин, затем 8% MeOH в DCM в течение 5 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали, концентрировали и подвергали анионообмену на смоле Amberlyst A26 с получением соединения C2 (623 мг, выход 66%) в виде масла.1H-ЯМР (400 МГц, CDCl3) δ: 9,69-9,66 (1H, д, NH), 5,40-5,30 (8H, м, CH=), 4,67 (1H, м, CHN), 4,57 (2H, с, COCH2N), 4,08-4,05 (4H, м, OCH2), 3,43 (9H, с, N(CH3)3), 2,78-2,75 (4H, м, =CHCH2CH=), 2,73-2,62 (4H, м, COCH2N),, 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00487] Пример 12: Схема получения соединения DD представлена на фиг. 12.
[00488] Промежуточный продукт 14: Промежуточный продукт 12 (4,4 г, 5,93 ммоль) растворяли в DCM (20 мл) и охлаждали на бане со льдом. Добавляли TFA (20 мл), и оставляли смесь перемешиваться в течение ~1 часа под слоем аргона. Затем, реакционную смесь концентрировали в условиях вакуума. Остаток растворяли в DCM (20 мл), а затем добавляли 10% K2CO3 (20 мл). После перемешивания смеси на бане со льдом в течение ~1/2 часа, ее распределяли, и проверяли значение pH водного слоя, чтобы убедиться, что оно является щелочным. Мутный водный слой экстрагировали DCM (3×20 мл). К объединенным органическим слоям добавляли MgSO4, еще раз перемешивали на бане со льдом в течение ~20 минут и фильтровали. Затем, к фильтрату добавляли дифосген (1,1 мл, 8,90 ммоль). Реакционную смесь оставляли перемешиваться в течение ночи при температуре окружающей среды под слоем аргона. На следующий день, DCM и избыток дифосгена удаляли в условиях вакуума. Остаток, промежуточный продукт 14, полностью высушивали, после чего переносили на следующую стадию без какой-либо дополнительной очистки (4,6 г, предположительно количественный выход).
[00489] Соединение DD: Гидрохлорид 2-(диметиламино)-этантиола (2,1 г, 14,90 ммоль) суспендировали в DCM (25 мл) и добавляли к промежуточному продукту 14 (2,3 г, 2,97 ммоль) в DCM (25 мл). К смеси медленно добавляли TEA (2,7 мл, 19,30 ммоль). Реакционную смесь оставляли перемешиваться в течение ночи при температуре окружающей среды под слоем аргона. На следующий день, реакционную смесь разбавляли DCM (100 мл) и промывали H2O (100 мл), а затем 10% K2CO3 (100 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×40 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из 10% EtOAc в гексане в течение 3 мин, затем 10-100% EtOAc в гексане в течение 15 мин, затем EtOAc в течение 5 минут, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения DD (300 мг, выход 39%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 6,53-6,51 (1H, д, NH), 5,34-5,30 (8H, м, CH=), 4,57 (1H, м, CHN), 4,08-4,05 (4H, м, OCH2), 2,75-2,68 (2H, м, SCH2CH2), 2,78-2,75 (4H, м, =CH-CH2CH=), 2,73-2,62 (4H, м, COCH2N), 2,30-2,25 (2H, м, SCH2CH2) 2,15 (6H, с, N(CH3)2), 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00490] Пример 13: Схема получения соединения E4 представлена на фиг. 13.
[00491] Соединение E4: В круглодонной колбе (500 мл) с магнитным мешальником промежуточный продукт 14 (6,4 г, 8,22 ммоль) суспендировали в DCM (75 мл). К смеси медленно добавляли 2-(диметиламино)этанол (4,1 мл, 41,1 ммоль), а затем TEA (7,4 мл, 53,4 ммоль). Реакционную смесь оставляли перемешиваться под слоем аргона в течение ночи при температуре окружающей среды. На следующий день, реакционную смесь разбавляли DCM (100 мл) и промывали H2O (100 мл), а затем 10% K2CO3 (100 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×40 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из 10% EtOAc в гексане в течение 3 мин, затем 10-100% EtOAc в гексане в течение 15 мин, затем EtOAc в течение 5 минут, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения E4 (3,3 г, выход 53%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 6,53-6,51 (1H, ушир. с, NH), 5,40-5,20 (8H, м, CH=), 4,35 (1H, м, CHN), 4,20-4,10 (2H, м, COOCH2), 4,10-4,00 (4H, м, COOCH2), 2,78-2,75 (4H, м, =CHCH2CH=), 2,732,62 (4H, м, COCH2N), 2,60-2,50 (2H, м, OCH2CH2) 2,25 (6H, с, N(CH3)2), 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00492] Пример 14: Схема получения соединения CA представлена на фиг. 14.
[00493] Промежуточный продукт 15: Промежуточный продукт 13 (1,0 г, 1,55 ммоль) растворяли в безводном DCM (15 мл), затем медленно добавляли бромацетилбромид (135 мкл, 1,55 ммоль), а затем TEA (238 мкл, 1,71 ммоль). После завершения добавления, смесь перемешивали при температуре окружающей среды в течение ночи. На следующий день, смесь разбавляли DCM (50 мл) и промывали H2O (50 мл) и 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×25 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на колонке с 40 г силикагеля на оснащенной ESLD-детектором флэш-хроматографической системе с использованием градиента, состоящего из гексана в течение 0,5 мин, затем 0-50% EtOAc в гексане 30 мин, затем 50% EtOAc в гексане в течение 5 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 15 (950 мг, выход 80%) в виде бесцветной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,44-7,42 (1H, ушир. с, NH), 5,40-5,32 (8H, м, CH=), 4,62-4,57 (1H, м, CHN), 4,10-4,07 (4H, м, COOCH2), 3,83 (2H, с, CH2Br), 2,78-2,75 (4H, м, =CH-CH2CH=), 2,73-2,62 (4H, м, COCH2N), 2,60-2,50 (2H, м, OCH2CH2) 2,25 (6H, с, N(CH3)2), 2,06-2,02 (4H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,43 (9H, с, C(CH3)3), 1,35-1,26 (36H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00494] Соединение CA: В круглодонной колбе (50 мл) с магнитным мешальником промежуточный продукт 16 (400 мг, 0,52 ммоль) суспендировали в DCM (10 мл), и добавляли 1-(2-гидроксиэтил)пиперазин (70 мкл, 0,58 ммоль), а затем TEA (91 мкл, 0,65 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды под слоем аргона. На следующий день, смесь разбавляли DCM (25 мл) и промывали H2O (25 мл), а затем 10% K2CO3 (25 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×25 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 40 г силикагеля) с использованием DCM в течение 1 мин, а затем 10% MeOH в DCM в течение 15 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения CA (400 мг, выход 94%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,82-7,80 (1H, ушир. с, NH), 5,40-5,29 (8H, м, CH=), 4,61-4,57 (1H, м, CHN), 4,07-4,04 (4H, м, COOCH2), 3,63-3,61 (2H, м, CH2CH2OH), 2,97 (2H, с, COCH2N), 2,78-2,75 (4H, м, =CHCH2CH=), 2,73-2,62 (4H, м, COCH2N), 2,62-2,59 (2H, м, NCH2CH2OH), 2,59-2,50 (8H, м, N(CH3)2N), 2,06-2,02 (8H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,35-1,26 (32H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00495] Пример 15: Схема получения соединения D1 представлена на фиг. 15.
[00496] Соединение D1: В сцинтилляционном флаконе с магнитным мешальником промежуточный продукт 15 (500 мг, 0,653 ммоль) суспендировали в DCM (8,5 мл). Добавляли цис-пирролидин-3,4-диала гидрохлорид (100 мг, 0,72 ммоль) в DMSO (1 мл), а затем TEA (229 мкл, 1,64 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды под слоем аргона. На следующий день, смесь разбавляли DCM (25 мл) и промывали H2O (25 мл), а затем 10% K2CO3 (25 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×10 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 40 г силикагеля) с использованием DCM в течение 1 мин, а затем 10% MeOH в DCM в течение 15 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D1 (437 мг, выход 87%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,82-7,80 (1H, ушир. с, NH), 5,40-5,29 (8H, м, CH=), 4,61-4,57 (1H, м, CHN), 4,07-4,04 (4H, м, COOCH2), 3,63-3,61 (2H, м, CH2CH2OH), 3,10 (2H, с, CH2CHOH), 2,78-2,75 (4H, м, =CHCH2CH=), 2,73-2,62 (4H, м, COCH2N), 2,62-2,58 (4H, м, N(CH2)2CHOH), 2,06-2,02 (8H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,35-1,29 (32H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00497] Пример 16: Схема получения соединения D7 представлена на фиг. 16.
[00498] Соединение D7: В круглодонной колбе (50 мл) с магнитным мешальником промежуточный продукт 15 (750 мг, 0,98 ммоль) суспендировали в DCM (10 мл), и добавляли азетидин-3-илметанола гидрохлорид (149 мг, 1,18 ммоль), а затем TEA (341 мкл, 2,45 ммоль). Смесь перемешивали в течение ночи при температуре окружающей среды под слоем аргона. На следующий день, смесь разбавляли DCM (25 мл) и промывали H2O (25 мл), а затем 10% K2CO3 (25 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×10 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 40 г силикагеля) с использованием DCM в течение 2 мин, а затем 10% MeOH в DCM в течение 20 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D7 (350 мг, выход 46%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,71-7,68 (1H, ушир. с, NH), 5,35-5,33 (8H, м, CH=), 4,57-4,55 (1H, м, CHN), 4,07-4,04 (4H, м, COOCH2), 3,77 (2H, с, COCH2N), 3,38-3,35 (2H, м, CHCH2OH), 3,20-3,00 (4H, м, N(CH3)2CH), 2,78-2,75 (4H, м, =CHCH2CH=), 2,73-2,62 (4H, м, COCH2N), 2,06-2,02 (8H, м, CH2CH2CH), 1,62-1,58 (4H, м, CH2CH2O), 1,35-1,26 (32H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00499] Пример 17: Схема получения соединения F6 представлена на фиг. 17.
[00500] Промежуточный продукт 16: N,N-Диметил-1,4-бутандиамин (1,0 г, 8,60 ммоль) растворяли в MeOH (15 мл). Смесь помещали на баню со льдом, добавляли (трет-бутил)-диметилсилокси)ацетальдегид (1,7 мл, 9,03 ммоль), и перемешивали в течение 1 часа. Затем, добавляли NaBH4 (522 мг, 13,8 ммоль), и перемешивали смесь дополнительно в течение 1 часа при 0°C. Затем, реакционную смесь гасили добавлением H2O (1 мл) и концентрировали в условиях вакуума с получением промежуточного продукта 16. Вещество переносили на следующую стадию без какой-либо дополнительной очистки (2,4 г, предположительно количественный выход).
[00501] Промежуточный продукт 17: В высушенной в печи колбе (50 мл) с магнитным мешальником к линолевой кислоте (1,2 г, 4,37 ммоль), EDC (1,1 г, 5,46 ммоль) и DMAP (89 мг, 0,73 ммоль) добавляли безводный DCM (15 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 16 (1,0 г, 3,64 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. В завершение, реакционную смесь гасили добавлением H2O (50 мл) и дважды экстрагировали DCM (2×50 мл). Органические слои объединяли, сушили над MgSO4 и фильтровали. Фильтрат концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента, состоящего из DCM в течение 1 мин, затем 0-10% MeOH в DCM в течение 2 мин, затем 10% MeOH в DCM в течение 7 мин, затем 10-30% MeOH в DCM в течение 2 мин, затем 30% MeOH в DCM в течение 7 мин, со скоростью потока 35 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 17 (460 мг, выход 24%) в виде прозрачной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии.
[00502] Промежуточный продукт 18: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 17 (460 мг, 0,86 ммоль), растворенному в THF (5 мл), добавляли 1,0M TBAF в THF (2,6 мл, 2,57 ммоль), и оставляли смесь перемешиваться при температуре окружающей среды в течение ночи под слоем аргона. На следующий день, смесь концентрировали в условиях вакуума и переносили на следующую стадию без какой-либо дополнительной очистки (361 мг, предположительно количественный выход). Продукт верифицировали методом LCMS перед проведением следующей стадии.
[00503] Соединение F6: В высушенной в печи колбе (50 мл) с магнитным мешальником к линолевой кислоте (289 мг, 1,0 ммоль), EDC (247 мг, 1,29 ммоль) и DMAP (21 мг, 0,171 ммоль) добавляли безводный DCM (20 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 18 (361 мг, 0,86 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. На следующий день, смесь разбавляли DCM (50 мл) и промывали H2O (50 мл), а затем 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×20 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из гексана в течение 2 мин, затем 0-25% EtOAc в гексане в течение 15 мин, затем 25% EtOAc в гексане в течение 5 мин, затем 75% EtOAc в гексане в течение 5 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения F6 (385 мг, выход 65%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,40-5,30 (8H, м, CH=), 4,20-4,17 (2H, м, NCH2CH2O), 3,56-3,50 (2H, м, NCH2 CH2O), 3,38-3,27 (2H, м, CO NCH2), 2,77-2,75 (2H, м, =CHCH2CH=), 2,66-2,56 (4H, м, N(CH3)2CH2), 2,40-2,27 (10H, м, COCH2, & N(CH3)2), 2,06-2,02 (8H, м, CH2CH2CH), 1,85-1,58 (8H, м, CH2CH2CO & NCH2(CH2)2CH2N), 1,36-1,26 (28H, м, CH2), 0,90-0,86 (6H, м, CH3).
[00504] Пример 18: Схема получения соединений F5 и F7 представлена на фиг. 18.
[00505] Промежуточный продукт 19: 3-(Диметиламино)-1-пропиламин (4,4 мл, 30,50 ммоль) растворяли в MeOH (20 мл). Смесь помещали на баню со льдом, добавляли (трет-бутил-диметилсилил)ацетальдегид (6,1 мл, 32,00 ммоль), и оставляли перемешиваться в течение 1 часа. Затем, добавляли NaBH4 (1,9 г, 48,79 ммоль), и перемешивали смесь дополнительно в течение 1 часа при 0°C. Затем, реакционную смесь гасили добавлением H2O (5 мл), отфильтровывали осадок, и концентрировали в условиях вакуума с получением промежуточного продукта 19. Вещество переносили на следующую стадию без какой-либо дополнительной очистки (8,1 г, предположительно количественный выход).
[00506] Промежуточный продукт 20: В высушенной в печи колбе (200 мл) с магнитным мешальником к линолевой кислоте (10,4 г, 37,10 ммоль), EDC (8,9 г, 46,42 ммоль) и DMAP (755 мг, 6,22 ммоль) добавляли безводный DCM (50 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 19 (8,1 г, 30,91 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. На следующий день, разбавляли DCM (50 мл) и промывали H2O (50 мл), а затем 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×25 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента, состоящего из DCM в течение 5 мин, затем 0-10% MeOH в DCM в течение 25 мин, затем 10% MeOH в DCM в течение 15 мин, со скоростью потока 200 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 20 (9,8 г, выход 60%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,37-5,29 (4H, м, CH=), 3,75-3,67 (2H, м, NCH2CH2O), 3,46-3,35 (4H, м, CONCH2), 2,77-2,74 (2H, м, =CHCH2CH=), 2,36-2,23 (4H, м, COCH2 & (CH3)2NCH2), 2,21-2,20 (6H, д, (CH3)2N), 2,04-2,00 (4H, м, CH2CH2CH), 1,71-1,59 (2H, м, NCH2CH2CH2N), 1,36-1,26 (14H, м, CH2), 0,89-0,86 (12H, с, SiC(CH3)3& CH3), 0,36-0,28 (6H, м, Si(CH3)2).
[00507] Промежуточный продукт 21: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 20 (9,6 г, 18,43 ммоль) добавляли 1,0 M TBAF в THF (55,2 мл, 55,21 ммоль), и оставляли перемешиваться в течение 3 часов под слоем аргона. Затем, смесь концентрировали в условиях вакуума и переносили на следующую стадию без какой-либо дополнительной очистки (7,5 г, предположительно количественный выход). Продукт верифицировали методом LCMS перед проведением следующей стадии.
[00508] Соединение F5: В высушенной в печи колбе (50 мл) с магнитным мешальником к линолевой кислоте (6,2 г, 22,13 ммоль), EDC (5,3 г, 27,64 ммоль) и DMAP (450 мг, 3,68 ммоль) добавляли безводный DCM (20 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 21 (7,5 г, 18,42 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. На следующий день, разбавляли DCM (50 мл) и промывали H2O (50 мл), а затем 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×40 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента, состоящего из DCM в течение 10 мин, затем 0-5% MeOH в DCM в течение 5 мин, затем 5% MeOH в DCM в течение 15 мин, затем 5-20% MeOH в DCM в течение 10 мин, затем 20% MeOH в DCM в течение 2 минут, со скоростью потока 200 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения F5 (8,0 г, выход 65%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,40-5,20 (8H, м, CH=), 4,20-4,17 (2H, м, NCH2CH2O), 3,90-4,10 (2H, м, NCH2CH2O), 3,50-3,60 (2H, м, CONCH2), 2,77-2,75 (4H, м, =CHCH2CH=), 2,40-2,10 (14H, м, CH2CH2CH & N(CH3)2), 2,10-1,90 (8H, м, COCH2, & N(CH2)& OCOCH2CH2), 2,06-2,02 (4H, м, CH2CH2CH), 1,80-1,50 (4H, м, NCH2CH2CH2N & NCOCH2CH2), 1,40-1,00 (28H, м, CH2), 0,99-0,71 (6H, м, CH3).
[00509] Соединение F7: Соединение F5 (6,1 г, 9,04 ммоль) растворяли в ацетонитриле (18 мл), и добавляли метилйодид (2 мл). Флакон продували аргоном, и оставляли смесь перемешиваться при 40°C в течение 4 часов. После этого, смесь концентрировали в условиях вакуума и очищали методом флэш-хроматографии с нанесением неочищенного масла непосредственно на колонку с 120 г силикагеля и с использованием градиента, состоящего из DCM в течение 2 мин, затем 0-10% MeOH в DCM в течение 10 мин, затем 10% MeOH в DCM в течение 5 мин, затем 10-15% MeOH в DCM в течение 5 мин, затем 15% MeOH в DCM в течение 5 мин, со скоростью потока 85 мл/мин. Содержащие продукт фракции собирали, концентрировали и подвергали анионообмену на смоле Amberlyst A26 с получением соединения F7 (3,2 г, выход 50%) в виде масла.1H-ЯМР (400 МГц, CDCl3) δ: 5,40-5,20 (8H, м, CH=), 4,30-4,20 (2H, м, NCH2CH2O), 3,80-3,60 (4H, м, NCH2CH2O & CONCH2), 3,68-3,39 (9H, м, N(CH3)3), 2,77-2,73 (4H, м, =CHCH2CH=), 2,40-2,30 (2H, м, COCH2), 2,30-2,20 (2H, м, (CH3)2NCH2), 2,20-1,10 (2H, м, OCOCH2CH2), 2,10-1,90 (8H, м, CH2CH2CH), 1,70-1,50 (4H, м, NCH2CH2CH2N & NCOCH2CH2), 1,40-1,10 (28H, м, CH2), 0,90-0,85 (6H, м, CH3).
[00510] Пример 19: Схема получения соединений F8 и F9 представлена на фиг. 19.
[00511] Промежуточный продукт 22: В высушенной в печи колбе (100 мл) с магнитным мешальником к миристиновой кислоте (2,0 г, 8,82 ммоль), EDC (2,1 г, 11,02 ммоль) и DMAP (180 мг, 1,47 ммоль) добавляли безводный DCM (20 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 19 (1,9 г, 7,35 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. На следующий день, реакционную смесь разбавляли DCM (50 мл) и промывали H2O (50 мл), а затем 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×25 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из DCM в течение 1 мин, затем 0-10% MeOH в DCM в течение 15 мин, затем 10% MeOH в DCM в течение 5 мин, затем 30% MeOH в DCM в течение 5 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 22 (1,5 г, выход 39%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 3,75-3,67 (2H, м, NCH2CH2O), 3,44-3,35 (4H, м, CONCH2), 2,36-2,21 (4H, м, COCH2 & (CH3)2NCH2), 2,26-2,21 (6H, д, (CH3)2N), 1,71-1,59 (2H, м, NCH2CH2CH2N), 1,63-1,59 (2H, м, COCH2CH2), 1,28-1,24 (20H, м, CH2), 0,88-0,85 (12H, м, SiC(CH3)3& CH3), 0,38-0,30 (6H, м, Si(CH3)2).
[00512] Промежуточный продукт 23: В высушенной в печи колбе (25 мл) с магнитным мешальником к промежуточному продукту 22 (1,0 г, 2,12 ммоль), растворенному в THF (5 мл), добавляли 1,0 M TBAF в THF (6,4 мл, 6,36 ммоль), и оставляли перемешиваться в течение 3 часов под слоем аргона. Затем, смесь концентрировали в условиях вакуума и переносили на следующую стадию без какой-либо дополнительной очистки (728 мг, предположительно количественный выход). Продукт верифицировали методом LCMS перед проведением следующей стадии.
[00513] Соединение F8: В высушенной в печи колбе (25 мл) с магнитным мешальником к линолевой кислоте (659 мг, 2,35 ммоль), EDC (631 мг, 3,29 ммоль) и DMAP (54 мг, 0,44 ммоль) добавляли безводный DCM (5 мл). Смесь перемешивали при температуре окружающей среды в течение ~5 минут до получения прозрачного раствора. Затем, добавляли промежуточный продукт 23 (781 мг, 2,19 ммоль), и перемешивали смесь при комнатной температуре в течение ночи. На следующий день, разбавляли DCM (50 мл) и промывали H2O (50 мл), а затем 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×40 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 80 г силикагеля) с использованием градиента, состоящего из DCM в течение 1 мин, затем 0-30% MeOH в DCM в течение 30 мин, со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения F8 (225 мг, выход 68%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 4,20-4,15 (2H, м, NCH2CH2O), 3,57-3,54 (2H, м, NCH2CH2O), 3,40-3,33 (4H, м, CONCH2), 2,42-2,21(12H, м, CH2CH2CH & CH2N(CH3)2), 1,80-1,71 (2H, м, NCH2CH2CH2N), 1,70-1,58 (4H, м, COCH2CH2), 1,29-1,15 (20H, м, CH2), 0,93-0,86 (6H, м, CH3).
[00514] Соединение F9: Соединение F8 (620 мг, 1,09 ммоль) растворяли в ацетонитриле (9 мл), и добавляли метилйодид (1 мл). Флакон продували аргоном и оставляли перемешиваться при 40°C в течение 4 часов. После этого, смесь концентрировали в условиях вакуума и очищали методом флэш-хроматографии с нанесением неочищенного масла непосредственно на колонку с 24 г силикагеля и с использованием градиента, состоящего из DCM в течение 1 мин, затем 0-25% MeOH в DCM в течение 25 мин, со скоростью потока 32 мл/мин. Содержащие продукт фракции объединяли, концентрировали и подвергали анионообмену на смоле Amberlyst A26 с получением соединения F9 (325 мг, выход 48%) в виде прозрачного масла.1H-ЯМР (400 МГц, CDCl3) δ: 4,21-4,19 (2H, м, NCH2CH2O), 3,86-3,81 (2H, м, NCH2CH2O), 3,47-3,44 (2H, м, CONCH2), 3,41 (9H, с, N(CH3)3), 2,38-2,35 (2H, м, CH2N(CH3)3), 2,28-2,25 (2H, м, NCH2CH2CH2N), 2,13-2,08 (2H, м, NCOCH2CH2N), 1,58-1,56 (4H, м, COCH2CH2), 1,29-1,17 (44H, м, CH2), 0,87-0,85 (6H, м, CH3).
[00515] Пример 20: Схема получения соединений C25 и C24 представлена на фиг. 20.
[00516] Промежуточный продукт 24: В высушенной в печи колбе (250 мл) с магнитным мешальником к Fmoc-Dap(Boc)·H2O (10,0 г, 22,50 ммоль) последовательно добавляли безводный DCM (100 мл), линолевую кислоту (7,7 мл, 24,79 ммоль), EDC (6,5 г, 33,80 ммоль) и DMAP (0,6 г, 4,52 ммоль). Смесь перемешивали при температуре окружающей среды и перемешивали в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления, растворяли в 5 мл DCM и очищали на флэш-хроматографической системе очистки (колонка с 220 г силикагеля) с использованием градиента 0-50% EtOAc в гексане в течение 30 мин со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 24 (15,2 г, выход 100%) в виде прозрачной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=675,98.
[00517] Промежуточный продукт 25: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 24 (3,0 г, 4,44 ммоль) добавляли безводный ацетонитрил (20 мл) и пиперидин (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. Реакционную смесь концентрировали, растворяли в 2 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-50% EtOAc в гексане в течение 10 мин, а затем 0-15% MeOH в DCM в течение 20 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 25 (1,3 г, выход 65%) в виде прозрачной желтой жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=453,82.
[00518] Промежуточный продукт 26: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 25 (1,3 г, 2,87 ммоль) последовательно добавляли безводный DCM (30 мл), линолевую кислоту (0,9 мл, 2,87 ммоль), EDC (0,7 г, 3,44 ммоль) и DMAP (0,1 г, 0,57 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Затем, реакционную смесь концентрировали в условиях пониженного давления, растворяли в 2 мл DCM и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-20% EtOAc в гексане в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 26 (2,0 г, выход 97%) в виде прозрачной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=716,16.
[00519] Соединение C25: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 26 (2,0 г, 2,80 ммоль) последовательно добавляли безводный DCM (20 мл) и TFA (4 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого остатка, который растворяли в безводном DCM (20 мл), и последовательно добавляли DMA-Gly-OH·HCl (0,5 г, 3,37 ммоль), EDC·HCl (0,8 г, 4,22 ммоль), DMAP (0,2 г, 1,64 ммоль) и TEA (0,2 мл, 1,50 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2,5 часов. Затем, реакционную смесь промывали 10% водным раствором K2CO3 (50 мл), экстрагировали DCM (2×50 мл), сушили над Na2SO4 и концентрировали на роторном растворителе. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения C25 (1,5 г, выход 76,6%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,50 (1H, ушир. с, NH), 6,75 (1H, ушир. с, NH), 5,33-5,35 (8H, м, CH=), 4,60-4,65 (1H, м, COCHN), 4,10-4,15 (2H, м, OCH2), 3,70-3,75 (2H, м, NCH2), 2,90 (2H, с, NCH2), 2,74-2,76 (4H, м, =CHCH2CH=), 2,25 (6H, с, NCH3), 2,23-2,24 (2H, м, CH2CO), 2,03-2,04 (8H, м, =CHCH2), 1,65-1,66 (4H, м, CH2CH2CO), 1,29-1,31 (30H, м, CH2), 0,86-0,88 (6H, м, CH3).
[00520] Соединение C24: В высушенном в печи флаконе (20 мл) с магнитным мешальником соединение C25 (1,5 г, 2,14 ммоль) добавляли к метилйодиду (2 мл). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Затем, избыток реагента удаляли в условиях вакуума. Неочищенный остаток растворяли в 1 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 30 мл/мин. Содержащие продукт фракции объединяли, концентрировали и подвергали анионообмену на смоле Amberlyst A26 с получением соединения C24 (1,6 г, выход 96%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 8,80 (1H, ушир. с, NH), 6,90 (1H, ушир. с, NH), 5,33-5,35 (8H, м, CH=), 4,80-4,85 (2H, м, COCH2N), 4,25-4,26 (1H, м, COCHN), 4,10-4,18 (2H, м,OCH2), 3,80-3,81 (1H, м, NCH2), 3,60-3,61 (1H, м, NCH2), 3,45 (9H, с, NCH3), 2,74-2,76 (4H, м, =CHCH2CH=), 2,37-2,38 (2H, м, CH2CO), 2,03-2,04 (8H, м, =CHCH2), 1,65-1,66 (4H, м, CH2CH2CO), 1,29-1,31 (30H, м, CH2), 0,86-0,88 (6H, м, CH3).
[00521] Пример 21: Схема получения соединения D16 представлена на фиг. 21.
[00522] Промежуточный продукт 27: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 26 (10,3 г, 14,44 ммоль) последовательно добавляли безводный DCM (20 мл) и TFA (4 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого остатка, который затем растворяли в безводном DCM (30 мл), и последовательно медленно добавляли бромацетилбромид (1,3 мл, 14,44 ммоль) и TEA (2,2 мл, 15,85 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2,5 часов. Затем, реакционную смесь концентрировали на роторном растворителе. Неочищенный остаток растворяли в 10 мл DCM и очищали на колонке с 220 г силикагеля с использованием градиента 0-50% EtOAc в гексане в течение 30 мин со скоростью потока 60 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 27 (8,0 г, выход 76%) в виде прозрачной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=736,03.
[00523] Соединение D16: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 27 (1,0 г, 1,36 ммоль) добавляли безводный DCM (20 мл) и DMSO (1 мл). Затем, добавляли цис-пирролидин-3,4-диола гидрохлорид (cDHP•HCl) (0,3 г, 2,03 ммоль) и TEA (0,5 мл, 3,41 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D16 (0,8 г, выход 78%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 8,264 (1H, ушир. с, NH), 6,71 (1H, д, J=5,2 Гц, NH), 5,34-5,37 (8H, м, CH=), 4,60-4,70 (1H, м, COCHN), 4,15-4,24 (4H, м, OCH2, OCH), 3,83-3,86 (1H, м, COCH2N), 3,36-3,40 (1H, м, COCH2N), 3,16 (2H, ушир. с, COCH2N), 3,09 (1H, д, J=8,4 Гц, NCH2), 2,92 (1H, д, J=8,4 Гц, NCH2), 2,77-2,93 (4H, м, =CHCH2CH=), 2,61 (2H, ушир. с, NCH2), 2,28-2,31 (2H, м, CH2CO), 2,03-2,07 (8H, м, =CHCH2), 1,64-1,67 (4H, м, CH2CH2CO), 1,30-1,37 (30H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00524] Пример 22: Схема получения соединения D17 представлена на фиг. 22.
[00525] Соединение D17: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 27 (1,0 г, 1,36 ммоль) добавляли к безводному DCM (20 мл) и DMSO (1 мл). Затем, добавляли транс-пирролидин-3,4-диола гидрохлорид (tDHP•HCl) (0,3 г, 2,03 ммоль) и TEA (0,5 мл, 3,41 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D17 (1,1 г, выход 100%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 8,23 (1H, ушир. с, NH), 6,68 (1H, д, J=5,2 Гц, NH), 5,30-5,37 (8H, м, CH=), 4,64-4,67 (1H, м, COCHN), 4,12-4,18 (4H, м, OCH2, OCH), 3,91-3,94 (1H, м, COCH2N), 3,17-3,31 (3H, м, COCH2N), 3,09-3,12 (2H, м, CH2OH), 2,76-2,78 (4H, м, =CHCH2CH=), 2,67-2,71 (2H, м, CH2OH), 2,25-2,28 (2H, м, CH2CO), 2,03-2,07 (8H, м, =CHCH2), 1,63-1,77 (4H, м, OCH2CH2), CH2CH2CO), 1,27-1,37 (30H, м, CH2), 0,87-0,90 (6H, м, CH3).
[00526] Пример 23: Схема получения соединения D18 представлена на фиг. 23.
[00527] Соединение D18: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 27 (1,0 г, 1,36 ммоль) добавляли к безводному DCM (20 мл). Затем, добавляли 1-(2-гидрокси)этилпиперазин (0,2 мл, 1,63 ммоль) и TEA (0,2 мл, 1,5 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D18 (0,9 г, выход 84%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,48-7,50 (1H, м, NH), 6,68-6,70 (1H, с, NH), 5,29-5,35 (8H, м, CH=), 4,59-4,62 (1H, м, COCHN), 4,10-4,12 (2H, м, OCH2), 3,59-3,66 (4H, м, CH2OH, COCH2N), 2,99 (2H, с, COCH2N), 2,75-2,76 (4H, м, =CHCH2CH=), 2,53-2,55 (10H, м, CH2N), 2,20-2,21 (2H, м, CH2CO), 2,03-2,05 (8H, м, =CH-CH2), 1,61-1,63 (4H, м, OCH2CH2), CH2CH2CO), 1,29-1,30 (30H, м, CH2), 0,86-0,89 (6H, м, CH3).
[00528] Пример 24: Схема получения соединения D19 представлена на фиг. 24.
[00529] Соединение D19: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 27 (1,0 г, 1,36 ммоль) добавляли к безводному DCM (20 мл). Затем, добавляли 1-(2-гидрокси)пропилпиперазин (HPPip) (0,2 мл, 1,63 ммоль) и TEA (0,2 мл, 1,50 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D19 (0,9 г, выход 84%) в виде желтой жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,48-7,50 (1H, м, NH), 6,68-6,70 (1H, с, NH), 5,29-5,35 (8H, м, CH=), 4,59-4,62 (1H, м, COCHN), 4,10-4,12 (2H, м, OCH2), 3,59-3,66 (4H, м, CH2OH, COCH2N), 2,99 (2H, с, COCH2N), 2,75-2,76 (4H, м, =CHCH2CH=), 2,53-2,55 (10H, м, CH2N), 2,20-2,21 (2H, м, CH2CO), 2,03-2,05 (8H, м, =CHCH2), 1,61-1,63 (4H, м, OCH2CH2), CH2CH2CO), 1,29-1,30 (30H, м, CH2), 0,86-0,89 (6H, м, CH3).
[00530] Пример 25: Схема получения соединения D20 представлена на фиг. 25.
[00531] Промежуточный продукт 28: В высушенной в печи колбе (100 мл) с магнитным мешальником к гидрохлориду N,N-диметилглицина (0,6 г, 3,94 ммоль) последовательно добавляли безводный DCM (20 мл), H-Dap(Boc)-OMe•HCl (1,0 г, 3,94 ммоль), EDC (1,0 г, 4,73 ммоль) и DMAP (0,1 г, 0,80 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 2-20% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 28 (1,0 г, выход 84%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=304,51.
[00532] Промежуточный продукт 29: В высушенном в печи флаконе (40 мл) с магнитным мешальником к промежуточному продукту 28 (1,0 г, 3,30 ммоль) добавляли метанол (10 мл) и LiOH (87 мг, 3,60 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали для переноса неочищенного промежуточного продукта 29 на следующую стадию без очистки. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=209,44.
[00533] Промежуточный продукт 30: В высушенной в печи колбе (100 мл) с магнитным мешальником к неочищенному промежуточному продукту 29 (~1,1 г, ~2,87 ммоль) последовательно добавляли безводный DCM (20 мл), линолевую кислоту (1,1 мл, 3,60 ммоль), EDC (0,9 г, 4,80 ммоль) и DMAP (0,1 г, 0,64 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 30 (22 мг, выход 13%) в виде прозрачной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=538,84.
[00534] Соединение D20: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 30 (220 мг, 0,41 ммоль) последовательно добавляли безводный DCM (15 мл) и TFA (1 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого остатка, который затем растворяли в безводном DCM (30 мл), и последовательно добавляли безводный DCM (20 мл), линолевую кислоту (0,2 мл, 0,49 ммоль), EDC (118 мг, 0,62 ммоль) и DMAP (10 мг, 0,08 ммоль). Смесь перемешивали при температуре окружающей среды в течение 4 часов. Реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% водным раствором K2CO3 (50 мл). Затем, смесь экстрагировали DCM (2×50 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. В завершение, неочищенный остаток очищали на колонке с 12 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D20 (140 мг, выход 49%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 7,90 (1H, ушир. с, NH), 6,10 (1H, ушир. с, NH), 5,60-5,70 (8H, м, CH=), 4,65 (1H, ушир. с, COCHN), 4,20-4,25 (2H, м, OCH2), 3,58-3,71 (2H, м, CH2N), 2,90-2,91 (2H, м, COCH2N), 2,75-2,76 (4H, м, =CHCH2CH2), 2,30 (6H, с, NCH3), 2,10-2,11 (2H, м, COCH2), 2,0-2,1 (8H, м, =CHCH2), 1,54-1,69 (4H, м, OCH2CH2), CH2CH2CO), 1,10-1,30 (30H, м, CH2), 0,80-0,82 (6H, м, CH3).
[00535] Пример 26: Схема получения соединения D21 представлена на фиг. 26.
[00536] Соединение D21: В высушенном в печи флаконе (40 мл) с магнитным мешальником к (2R)-3-(((2-(диметиламино)-этокси)(гидрокси)фосфорил)окси)пропан-1,2-диилдиолеату (450 мг, 0,58 ммоль) последовательно добавляли безводный DCM (8 мл), 2-метоксиэтоксиметилхлорид (133 мкл, 1,16 ммоль) и карбонат калия (332 мг, 2,32 ммоль). Смесь перемешивали при температуре окружающей среды в течение 1 недели. Реакционную смесь фильтровали, концентрировали в условиях пониженного давления и очищали на колонке с 12 г силикагеля с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 20 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения D21 (150 мг, выход 30%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 75,29-5,33 (8H, м, CH=), 5,20 (1H, ушир. с, OCH), 4,92 (2H, с, OCH2O), 4,31-4,40 (2H, м, OCH2), 3,98-4,04 (4H, м, OCH2), 3,70-3,71 (2H, м, OCH2), 3,56-3,57 (2H, м, OCH2), 3,36 (3H, с, OCH3), 3,24 (6H, с, NCH3), 2,27-2,90 (2H, м, COCH2), 1,99-2,00 (8H, м, =CHCH2), 1,54-1,69 (4H, м, COCH2CH2), 1,20-1,30 (40H, м, CH2), 0,85-0,88 (6H, м, CH3).
[00537] Пример 27: Схема получения соединения E37 представлена на фиг. 27.
[00538] Промежуточный продукт 31: В высушенной в печи колбе (100 мл) с магнитным мешальником к гидрохлориду 1-(трет-бутил)-2-метил-(2S,4R)-4-аминопирролидин-1,2-дикарбоксилата (2,0 г, 7,12 ммоль) последовательно добавляли безводный DCM (25 мл), 3-(диметиламино)пропановую кислоту (1,3 г, 8,55 ммоль), 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (4,1 г, 10,68 ммоль) и DIEA (2,6 мл, 14,96 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 31 (1,5 г, выход 85%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=344,57.
[00539] Промежуточный продукт 32: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 31 (1,5 г, 4,25 ммоль) добавляли гидроксид лития (1,2 мг, 5,10 ммоль), воду (5 мл) и MeOH (5 мл). Смесь перемешивали при температуре окружающей среды в течение ночи. Затем, растворители удаляли в условиях пониженного давления, и осушали влажное вещество посредством лиофилизации с получением неочищенного промежуточного продукта 32 (1,3 г, выход 95%) в виде белого твердого вещества, которое использовали без дополнительной очистки. Неочищенный остаток верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=330,00.
[00540] Промежуточный продукт 33: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 32 (1,3 г, 3,95 ммоль) последовательно добавляли безводный DMF (20 мл), линолеиловый спирт (1,4 г, 5,14 ммоль), EDC (1,5 г, 7,90 ммоль) и DMAP (0,5 г, 3,95 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (25 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 33 (1,9 г, выход 85%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=578,91.
[00541] Промежуточный продукт 34: В высушенной в печи колбе (25 мл) с магнитным мешальником к промежуточному продукту 33 (1,9 г, 3,33 ммоль) последовательно добавляли безводный DCM (10 мл) и TFA (2 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% раствором Na2CO3 (20 мл). Затем, смесь экстрагировали DCM (2×20 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением маслянистого промежуточного продукта 34 (1,5 г, выход 92%), который использовали на следующей стадии без дополнительной очистки. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=478,82.
[00542] Соединение E37: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 34 (1,5 г, 3,14 ммоль) последовательно добавляли безводный DMF (10 мл), линолевую кислоту (1,3 г, 4,71 ммоль) и гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (2,3 г, 6,28 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения E37 (2,0 г, выход 92%) в виде прозрачного масла.1H-ЯМР (400 МГц, CDCl3) δ: 8,0 (1H, ушир. с, NH) 5,54-5,25 (8H, м, CH=), 4,65-4,29 (2H, м, NHCH, NCHCO), 4,30-3,90 (2H, м, OCH2), 3,80-3,62 (2H, м, NCH2CHNH-), 3,60-3,45 (2H, м, (CH3)2NCH2), 2,84 (6H, с, N(CH3)2), 2,80-2,60 (6H, м, CH2), 2,40-1,90 (12H, м, CH2CONH, CH2CH=), 1,65-1,48 (4H, м, CH2), 1,45-1,20 (30H, м, CH2), 0,86-0,85 (6H, м, CH3).
[00543] Пример 28: Схема получения соединений E38 и E39 представлена на фиг. 28.
[00544] Промежуточный продукт 35: В высушенной в печи колбе (100 мл) с магнитным мешальником к гидрохлориду 1-(трет-бутил)-2-метил-(2S,4R)-4-аминопирролидин-1,2-дикарбоксилата (5,0 г, 17,81 ммоль) последовательно добавляли безводный DCM (25 мл), 3-(диметиламино)бутановую кислоту (3,6 г, 21,37 ммоль), EDC (6,8 г, 35,62 ммоль), DMAP (2,2 г, 17,81 ммоль) и DIEA (8,1 г, 62,34 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Затем, реакционную смесь разбавляли DCM (25 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 35 (6,1 г, выход 80%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=358,59.
[00545] Промежуточный продукт 36: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 35 (6,1 г, 17,03 ммоль) добавляли гидроксид лития (0,5 г, 20,44 ммоль), воду (5 мл) и MeOH (20 мл). Смесь перемешивали при температуре окружающей среды в течение ночи. Затем, растворители удаляли в условиях пониженного давления, и осушали влажное вещество посредством лиофилизации с получением неочищенного промежуточного продукта 36 (5,6 г, выход 95%) в виде белого твердого вещества, которое использовали без дополнительной очистки. Неочищенный остаток верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=344,55.
[00546] Промежуточный продукт 37: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 36 (2,8 г, 8,11 ммоль) последовательно добавляли безводный DMF (10 мл), линолеиловый спирт (2,6 г, 9,73 ммоль), и гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (4,6 г, 12,16 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (25 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 37 (3,9 г, выход 82%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=592,91.
[00547] Промежуточный продукт 38: В высушенной в печи колбе (25 мл) с магнитным мешальником к промежуточному продукту 37 (1,4 г, 2,31 ммоль) последовательно добавляли безводный DCM (20 мл) и TFA (5 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% раствором Na2CO3 (20 мл). Затем, смесь экстрагировали DCM (2×20 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления с получением светло-желтого маслянистого промежуточного продукта 38 (580 мг, выход 51%), который использовали на следующей стадии без дополнительной очистки. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=492,81.
[00548] Соединение E38: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 38 (580 мг, 1,18 ммоль) последовательно добавляли безводный DMF (5 мл), линолевую кислоту (460 мг, 1,53 ммоль) и гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (898 мг, 2,36 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 24 г силикагеля) с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения E38 (750 мг, выход 95%) в виде прозрачного масла.1H-ЯМР (400 МГц, CDCl3) δ: 5,45-5,25 (8H, м, CH=), 4,70-4,29 (2H, м, NHCH, NCHCO), 4,20-4,00 (2H, м, OCH2), 3,90-3,78 (2H, м, NCH2CHNH-), 3,75-3,62 (2H, м, Me2NCH2), 2,84 (6H, с, N (CH3)2), 2,90-2,70 (4H, м, CH2), 2,60-2,55 (2H, м, CH2), 2,10-1,90 (12H, м, CH2CONH, CH2CH=), 1,65-1,40 (6H, м, CH2), 1,40-1,20 (30H, м, CH2), 0,90-0,80 (6H, м, CH3).
[00549] Соединение E39: В высушенном в печи флаконе (20 мл) с магнитным мешальником соединение E38 (350 мг, 0,46 ммоль) добавляли к метилйодиду (2 мл). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Затем, избыток реагента удаляли в условиях вакуума. Неочищенный остаток растворяли в 1 мл DCM и очищали на колонке с 40 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 30 мл/мин. Содержащие продукт фракции объединяли, концентрировали и подвергали анионообмену на смоле Amberlyst A26 с получением соединения E39 (165 мг, выход 82%) в виде прозрачной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 5,45-5,25 (8H, м, CH=), 4,70-4,35 (2H, м, NHCH, NCHCO), 4,20-4,00 (2H, м, OCH2), 3,90-3,40 (4H, м, NCH2CH2CH2CO-, NCH2CHNH-), 3,30 (9H, с, N+ (CH3)3), 2,85-2,70 (4H, м, CH2), 2,60-2,45 (2H, м, CH2), 2,45-2,10 (8H, м, CH2CH2CH=), 2,10-2,00 (6H, м, CH2), 1,70-1,40 (4H, м, CH2), 1,40-1,20 (30H, м, CH2), 0,90-0,70 (6H, м, CH3).
[00550] Пример 29: Схема получения соединения E40 представлена на фиг. 29.
[00551] Промежуточный продукт 39: В высушенной в печи колбе (100 мл) с магнитным мешальником к (2S,4R)-1-(трет-бутоксикарбонил)-4-гидроксипирролидин-2-карбоновой кислоте (5,0 г, 21,62 ммоль) последовательно добавляли безводный ацетонитрил (500 мл), TBDPS-Cl (11,9 г, 43,24 ммоль) и 1,8-диазабициклоундец-7-ен (11,5 г, 75,67 ммоль). Смесь нагревали с обратным холодильником при 50°C в течение 4 часов. Затем, растворитель удаляли в условиях пониженного давления. Остаток растворяли в 0,2н HCl (50 мл), экстрагировали DCM (2×50 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента 0-5% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 39 (9,9 г, выход 97%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=470,49.
[00552] Промежуточный продукт 40: В высушенной в печи колбе (250 мл) с магнитным мешальником к промежуточному продукту 39 (9,9 г, 21,29 ммоль) последовательно добавляли безводный DCM (100 мл), линолеиловый спирт (6,8 г, 25,55 ммоль), EDC (8,2 г, 42,58 ммоль) и DMAP (1,3 г, 10,65 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (25 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 40 (12,8 г, выход 98%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=718,75.
[00553] Промежуточный продукт 41: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 40 (5,8 г, 6,96 ммоль) добавляли 4н раствор HCl в 1,4-диоксане (20 мл). Затем, смесь перемешивали при температуре окружающей среды в течение 3 часов. Затем, реакционную смесь концентрировали в условиях пониженного давления с получением прозрачного масла, которое затем растворяли в безводном DCM (20 мл), и последовательно добавляли линолевую кислоту (2,3 г, 8,36 ммоль), EDC (2,0 г, 10,45 ммоль) и DMAP (0,6 г, 4,87 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (25 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием градиента 0-20% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 41 (5,8 г, выход 94%) в виде бесцветного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=880,91.
[00554] Промежуточный продукт 42: В высушенной в печи колбе (250 мл) с магнитным мешальником к промежуточному продукту 41 (5,8 г, 6,58 ммоль) последовательно добавляли THF (100 мл) и тригидрофторид триэтиламина (10,6 г, 65,8 ммоль). Затем, смесь перемешивали при температуре окружающей среды в течение 17 часов. Затем, реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием градиента 0-30% EtOAc в гексане в течение 10 мин, а затем 0-10% MeOH в DCM в течение 20 мин, со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 42 (4,3 г, выход 78%) в виде бесцветного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=642,91.
[00555] Промежуточный продукт 43: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 42 (2,3 г, 7,16 ммоль) последовательно добавляли DCM (10 мл), 2-бромацетилбромид (0,9 г, 4,66 ммоль) и TEA (0,7 г, 7,16 ммоль). Затем, смесь перемешивали при температуре окружающей среды в течение 3 часов. Затем, реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием градиента 0-30% EtOAc в гексане в течение 10 мин, а затем 0-10% MeOH в DCM в течение 20 мин, со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 43 (2,4 г, выход 82%) в виде бесцветного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=764,74.
[00556] Соединение E40: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 43 (300 мг, 0,39 ммоль) добавляли к безводному DCM (5 мл). Затем, последовательно добавляли гидрохлорид 3-азетидинметанола (97 мг, 0,79 ммоль) и TEA (0,2 мл, 1,18 ммоль). Смесь перемешивали при температуре окружающей среды в течение 17 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-15% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения E40 (196 мг, выход 65%) в виде желтой жидкости. Идентичность липида подтверждали методом LCMS-анализа: m/z [M+H]+=769,17.
[00557] Пример 30: Схема получения соединения A23 представлена на фиг. 30.
[00558] Промежуточный продукт 44: В высушенной в печи колбе (100 мл) с магнитным мешальником к O-бензоил-N-(трет-бутоксикарбонил)-L-серину (3,0 г, 10,16 ммоль) последовательно добавляли безводный DCM (40 мл), миристиламин (2,4 г, 11,17 ммоль), EDC (2,9 г, 15,24 ммоль) и DMAP (0,6 г, 5,08 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли EtOAc (300 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 330 г силикагеля) с использованием EtOAc в гексане (1/2 об./об.) в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 44 (4,4 г, выход 89%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=491,61.
[00559] Промежуточный продукт 45: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 44 (2,0 г, 4,08 ммоль) добавляли MeOH (30 мл) и палладированный уголь (120 мг). Затем, колбу продували водородом с использованием баллона с водородом. Смесь перемешивали при температуре окружающей среды в течение 5 часов и фильтровали через слой целита. Фильтрат затем концентрировали в условиях пониженного давления с получением промежуточного продукта 45 (1,7 г, 95%) в виде белого твердого вещества, который использовали на следующей стадии без дополнительной очистки. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=401,44.
[00560] Промежуточный продукт 46: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 45 (1,7 г, 4,28 ммоль) последовательно добавляли безводный DCM (20 мл), миристиновую кислоту (1,3 г, 5,56 ммоль), EDC (1,6 г, 8,55 ммоль) и DMAP (0,5 г, 4,28 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли EtOAc (100 мл), промывали 1н HCl (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием EtOAc в гексане (1/2 об./об.) в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 46 (2,4 г, выход 94%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=612,02.
[00561] Соединение A23: В высушенной в печи колбе (25 мл) с магнитным мешальником к промежуточному продукту 46 (435 мг, 0,85 ммоль) последовательно добавляли безводный DCM (20 мл) и TFA (5 мл). Смесь перемешивали при температуре окружающей среды в течение 2 часов. В процессе перемешивания, цвет раствора менялся с прозрачного на красный. Затем, реакционную смесь концентрировали с использованием роторного испарителя и промывали 10% раствором Na2CO3 (20 мл). Затем, смесь экстрагировали DCM (2×20 мл), органические слои объединяли, сушили над Na2SO4 (5 г), фильтровали и концентрировали до маслянистого остатка, который затем растворяли в DCM (10 мл), и добавляли янтарный ангидрид (118 мг, 1,17 ммоль) и TEA (118 мг, 1,17 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (100 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием 0-20% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A23 (338 мг, выход 92%) в виде белого твердого вещества.1H-ЯМР (400 МГц, CDCl3) δ: 6,76-6,70 (1H, м, CHNHCO), 6,40-6,35 (1H, м, CH2NHCO), 4,70-4,60 (1H, м, NHCHCO), 4,42-4,20 (2H, м, CH2 O), 3,26-3,12 (2H, м, NHCH2), 2,80-2,60 (2H, м, CH2CO2H), 2,57-2,50 (2H, м, CH2CONH), 2,30-2,20 (2H, м, CH2CO2), 1,60-1,50 (2H, м, CH2CH2CO2), 1,50-1,40 (2H, CH2CH2NH), 1,35-1,15 (42H, м, NH(CH2)2(CH2)11Me, CO(CH2)2(CH2)10Me,), 0,90-0,83 (6H, м, CH3).
[00562] Пример 31: Схема получения соединения A24 представлена на фиг. 31.
[00563] Промежуточный продукт 46: В высушенной в печи колбе (100 мл) с магнитным мешальником к N-(((9H-флуорен-9-ил)метокси)карбонил)-O-тритил-L-серину (3,0 г, 5,27 ммоль) последовательно добавляли безводный DCM (40 мл), линолеиловый спирт (1,5 г, 5,79 ммоль), EDC (2,0 г, 10,54 ммоль) и DMAP (3,7 г, 0,70 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (100 мл), промывали бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием EtOAc в гексане (1/2 об./об.) в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 46 (4,3 г, выход 90%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+NH4]+=835,00.
[00564] Промежуточный продукт 47: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 46 (4,3 г, 5,19 ммоль) добавляли 3н раствор HCl в MeOH (40 мл). Затем, смесь перемешивали при температуре окружающей среды в течение 3 часов. Затем, реакционную смесь концентрировали в условиях пониженного давления с получением промежуточного продукта 47 (2,5 г, выход 86%) в виде прозрачного масла, которое затем использовали на следующей стадии без дополнительной очистки. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=576,68.
[00565] Промежуточный продукт 48: В высушенной в печи колбе (100 мл) с магнитным мешальником к промежуточному продукту 47 (2,5 г, 4,34 ммоль) последовательно добавляли безводный DCM (50 мл), линолевую кислоту (1,3 г, 4,78 ммоль), EDC (1,7 г, 8,68 ммоль) и DMAP (0,3 г, 2,17 ммоль). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь разбавляли DCM (100 мл), промывали 1н бикарбонатом натрия (20 мл), сушили над Na2SO4 (5 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием EtOAc в гексане (1/2 об./об.) в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 48 (2,1 г, выход 82%) в виде белого твердого вещества. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+NH4]+=856,06.
[00566] Промежуточный продукт 49: В высушенной в печи колбе (50 мл) с магнитным мешальником к промежуточному продукту 48 (2,9 г, 3,40 ммоль) добавляли безводный ацетонитрил (20 мл) и пиперидин (4 мл). Смесь перемешивали при температуре окружающей среды в течение ночи (17 часов). Реакционную смесь концентрировали в условиях пониженного давления и очищали на флэш-хроматографической системе очистки (колонка с 120 г силикагеля) с использованием 0-50% EtOAc в гексане в течение 30 мин со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 49 (1,3 г, выход 90%) в виде прозрачного масла. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=617,06.
[00567] Промежуточный продукт 50: Промежуточный продукт 49 (500 мг, 0,81 ммоль) растворяли в безводном DCM (10 мл), затем медленно добавляли бромацетилбромид (0,1 мл, 0,81 ммоль), а затем TEA (0,1 мл, 0,89 ммоль). После завершения добавления, смесь перемешивали при температуре окружающей среды в течение ночи. На следующий день, смесь разбавляли DCM (50 мл) и промывали H2O (50 мл) и 10% K2CO3 (50 мл). Для обоих водных смывов проводили обратное экстрагирование DCM (2×25 мл). Органические слои объединяли, сушили над MgSO4, фильтровали и концентрировали в условиях вакуума. Неочищенный остаток очищали на колонке с 40 г силикагеля на флэш-хроматографической системе очистки, оснащенной ESLD-детектором, с использованием градиента, состоящего из гексана в течение 0,5 мин, затем 0-50% EtOAc в гексане 30 мин, затем 50% EtOAc в гексане в течение 5 мин, со скоростью потока 40 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением промежуточного продукта 50 (445 мг, выход 80%) в виде бесцветной жидкости. Продукт верифицировали методом LCMS перед проведением следующей стадии: m/z [M+H]+=737,01.
[00568] Соединение A24: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 50 (150 мг, 0,20 ммоль) добавляли к безводному DCM (5 мл). Затем, добавляли 3-(пиперазин-1-ил)пропан-1-ол (33 мг, 0,22 ммоль) и TEA (40 мкл, 0,25 ммоль). Смесь перемешивали при температуре окружающей среды в течение 4 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 10-15% EtOAc в гексане в течение 10 мин, а затем 0-10% MeOH в DCM в течение 30 мин, со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A24 (128 мг, выход 70%) в виде бесцветной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 6,50-6,40 (1H, м, NHCO), 5,45-5,20 (8H, м, CH=), 4,90-4,60 (2H, м, NHCHCO, HO) 4,60-4,50 (1H, м, CH2CHOC(O)), 4,45-4,30 (1H, м, CH2CHOC(O)), 4,20-4,10 (2H, м, C(O)OCH2CH2), 3,80-3,70 (2H, м, HOCH2CH2), 3,47 (2H, с, NCH2C(O)NH), 2,85-2,70 (4H, м, =CHCH2CH=), 2,70-2,45 (8H, м, HOCH2CH2CH2N, CH2NCH2C(O), O(CO)CH2CH2), 2,30-1,90 (12H, м, NCH2CH2NCH2C(O), CH2CH2CH=), 1,60-1,10 (36H, м, CH2), 0,90-0,75 (6H, м, CH3).
[00569] Пример 32: Схема получения соединения A25 представлена на фиг. 32.
[00570] Соединение A25: В высушенном в печи флаконе (40 мл) с магнитным мешальником промежуточный продукт 50 (208 мг, 0,28 ммоль) добавляли к безводному DCM (5 мл). Затем, добавляли гидрохлорид 3-азетидинметанола (70 мг, 0,26 ммоль) и TEA (120 мкл, 0,85 ммоль). Смесь перемешивали при температуре окружающей среды в течение 2 часов. После удаления растворителя на роторном растворителе в условиях вакуума, остаток обрабатывали 10% раствором K2CO3 (50 мл) и экстрагировали DCM (2×50 мл). Затем, органические слои объединяли, сушили над Na2SO4 (10 г), фильтровали и концентрировали в условиях пониженного давления. Неочищенный остаток растворяли в 2 мл DCM и очищали на колонке с 24 г силикагеля с использованием градиента 0-10% MeOH в DCM в течение 30 мин со скоростью потока 25 мл/мин. Содержащие продукт фракции собирали и концентрировали с получением соединения A25 (66 мг, выход 31%) в виде бесцветной жидкости.1H-ЯМР (400 МГц, CDCl3) δ: 6,60-6,50 (1H, м, NHCO), 5,40-5,20 (8H, м, CH=), 4,90-4,80 (2H, м, CH2CH2OC(O)), 4,52-4,45 (1H, м, NHCHCO), 4,13-4,02 (2H, м, CH2OC(O)), 3,60-3,40 (2H, м, CH2OH), 3,70-3,30 (4H, м, CHCH2N), 3,20 (2H, с, CH2N), 2,80-2,65 (5H, м, =CHCH2CH=, -OH), 2,70-2,40 (3H, м, CH2CH2CO(O), HOCH2CH), 2,30-1,90 (8H, м, CH2CH2CH=), 1,60-1,10 (34H, м, CH2), 0,90-0,83 (6H, м, CH3).
[00571] Пример 33: Составы, содержащие пример соединения, приготавливали для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA), как представлено в таблице 3.
Таблица 3: Липидные составы для siRNA
* Эффективность заключения в капсулу siRNA.
[00572] Пример 34: Составы, содержащие пример соединения, приготавливали для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA), как представлено в таблице 4.
Таблица 4: Липидные составы для siRNA
* Эффективность заключения в капсулу siRNA.
[00573] Пример 35: Составы, содержащие пример соединения, приготавливали для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA), как представлено в таблице 5.
Таблица 5: Липидные составы для siRNA
* Эффективность заключения в капсулу siRNA.
[00574] Пример 36: Составы, содержащие пример соединения, приготавливали для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA), как представлено в таблице 6.
Таблица 6: Липидные составы для siRNA
* Эффективность заключения в капсулу siRNA.
[00575] Пример 37: Для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA), приготавливали составы, представленные в таблице 7.
Таблица 7: Липидные составы для siRNA
* Эффективность заключения в капсулу siRNA.
[00576] Пример 38: Приготавливали составы для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA).
[00577] Содержащие липидные наночастицы составы приготавливали в следующих композициях:
[00578] (Ионизируемое соединение/DOPE/DOPC/Холестерин/DMPE-PEG), мол.%:
50/28/0/21/1
50/28/0/20/2
26/21/21/31/1.
[00579] Характеристики содержащих наночастицы составов представлены в таблице 8. Составы обладают лучшей способностью заключать в капсулу siRNA и характеризуются малым размером частиц.
Таблица 8: Липидные составы для siRNA
[00580] * Эффективность заключения в капсулу siRNA.
[00581] Пример 39: Приготавливали составы для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA).
[00582] Содержащие липидные наночастицы составы приготавливали в следующих композициях:
[00583] (Ионизируемое соединение/DOPE/Холестерин/DMPE-PEG), мол.%:
50/28/21/1.
[00584] Для содержащих наночастицы составов измеряли стабильность в сыворотке и EC50, и результаты представлены в таблице 9. Составы способны заключать siRNA в капсулу и сохраняют стабильность в сыворотке человека.
Таблица 9: Липидные составы для siRNA
[00585] Пример 40: Приготавливали составы для заключения в капсулу действующих малых интерферирующих нуклеиновых кислот (siRNA).
[00586] Содержащие липидные наночастицы составы приготавливали в следующих композициях:
[00587] (Ионизируемое соединение/DOPE/Холестерин/DMPE-PEG), мол.%:
50/28/21/1.
[00588] Для содержащих наночастицы составов измеряли стабильность в сыворотке, и результаты представлены в таблице 10. Составы способны заключать siRNA в капсулу и сохраняют стабильность в сыворотке человека.
Таблица 10: Липидные составы для siRNA
[00589] Варианты осуществления, описанные в настоящем документе, не являются ограничивающими, и специалисту в данной области техники может быть совершенно понятно, что могут быть протестированы конкретные сочетания модификаций, описанных в настоящем документе, без постановки излишних экспериментов, направленных на идентификацию молекул нуклеиновых кислот с улучшенной активностью RNAi.
[00590] Все публикации, патенты и печатные материалы, прямо упомянутые в настоящем документе, включены в него во всей своей полноте посредством ссылки во всех отношениях.
[00591] Следует понимать, что настоящее изобретение не ограничивается конкретной методологией, описанными методиками, веществами и реагентами, которые могут варьировать. Также следует понимать, что использованная в настоящем документе терминология предназначена исключительно для описания конкретных вариантов осуществления, и не предназначена для ограничения объема настоящего изобретения. Специалисту в данной области техники будет совершенно очевидно, что в описание, раскрытое в настоящем документе, могут быть внесены различные замены и модификации без выхода за рамки объема и сущности настоящего описания, и что такие варианты осуществления подпадают под объем настоящего описания и приложенной формулы изобретения.
[00592] Следует отметить, что используемые в настоящем описании и приложенной формуле изобретения неопределенные и определенные формы единственного числа также включают в себя ссылки на множественное число, если иное прямо не определено контекстом. Также, неопределенные формы единственного числа, термины «один или несколько» и «по меньшей мере, один» могут использоваться в настоящем документе взаимозаменяемо. Также следует отметить, что термины «содержит», «заключающий в себе», «содержащий», «включающий в себя» и «характеризующийся» могут использоваться взаимозаменяемо, и должны пониматься расширительно и без ограничений.
[00593] Если иное не определено особо, то указание в настоящем документе диапазонов значений призваны служить исключительно в качестве сокращенного способа индивидуальной ссылки на каждое отдельное значение внутри диапазона, и каждое отдельное значение включено в настоящее описание, как если бы оно было индивидуально процитировано в нем. Применительно к группам Маркуша, специалистам в данной области техники следует понимать, что настоящее описание включает в себя как отдельных представителей, так и подгруппы представителей группы Маркуша.
[00594] Соединение, молекула или композиция согласно настоящему изобретению могут характеризоваться ионной формой, для которой соответствующий противоион или противоионы не показаны. Специалисту в данной области техники будет сразу понятно, что противоион или противоины при необходисомти будут существовать. Примеры противоионов включают в себя ионы щелочных металлов, Cl- и фармацевтически приемлемые противоионы.
[00595] Например, если представлен перечень примеров или компонентов, такой как перечень соединений, молекул или композиций, соответствующих настоящему изобретению, то специалистам в данной области техники будет очевидно, что смеси перечисленных соединений, молекул или композиций также могут ему соответствовать.
[00596] Без дополнительной проработки, считается, что основываясь на настоящем описании, специалист в данной области техники сможет применять настоящее изобретение в его максимальной степени. Поэтому, конкретные варианты осуществления должны истолковываться исключительно как иллюстративные, а не ограничивающие каким бы то ни было образом остальную часть описания.
[00597] Все характерные черты, раскрытые в настоящем описании, могут быть объединены в любой комбинации. Каждая характерная черта, раскрытая в настоящем описании, может быть заменена альтернативной характерной чертой, служащей той же самой, эквивалентной или сходной цели.
Реферат
Изобретение относится к области биофармацевтических и терапевтических средств. Предложены ионизируемые соединения, а также фармацевтическая композиция на основе ионизируемых соединений. Технический результат – получение ионизируемых соединений, которые используются для доставки и распределения действующих агентов или лекарственных средств. 12 н. и 16 з.п. ф-лы, 32 ил., 10 табл., 40 пр.
Формула

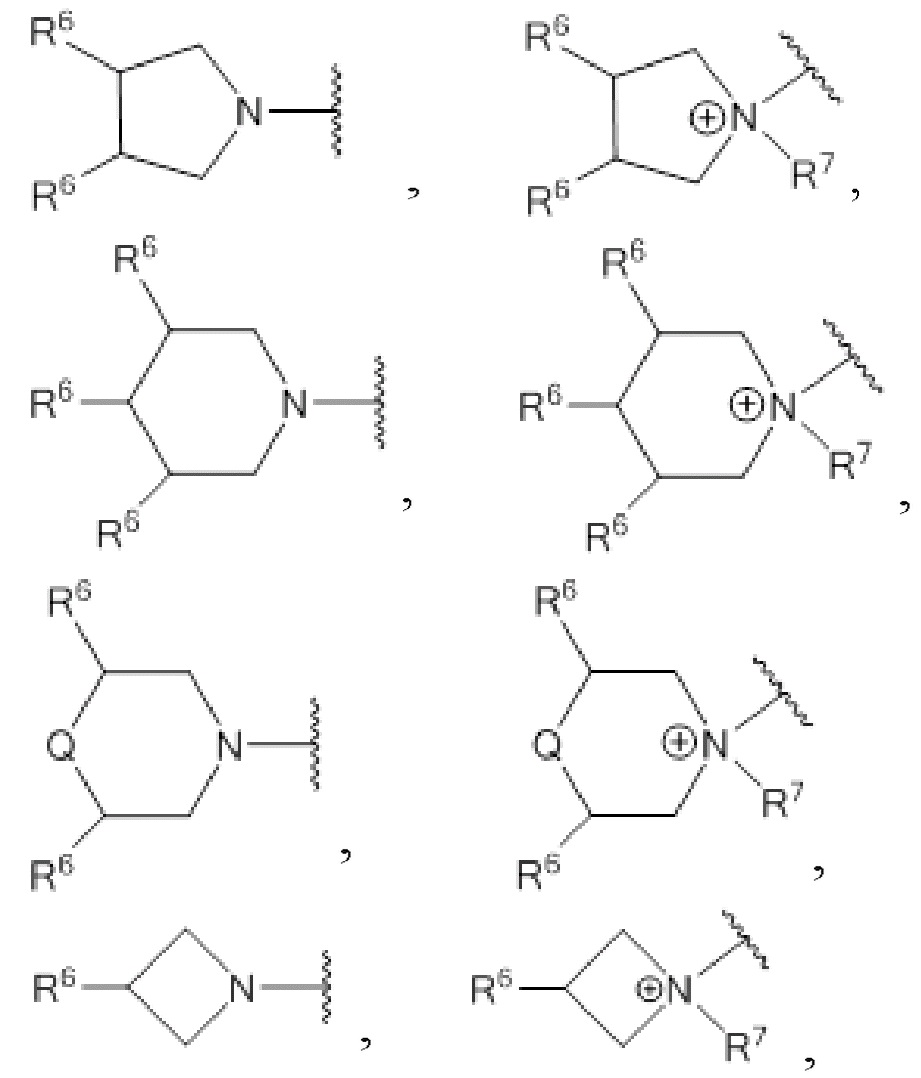












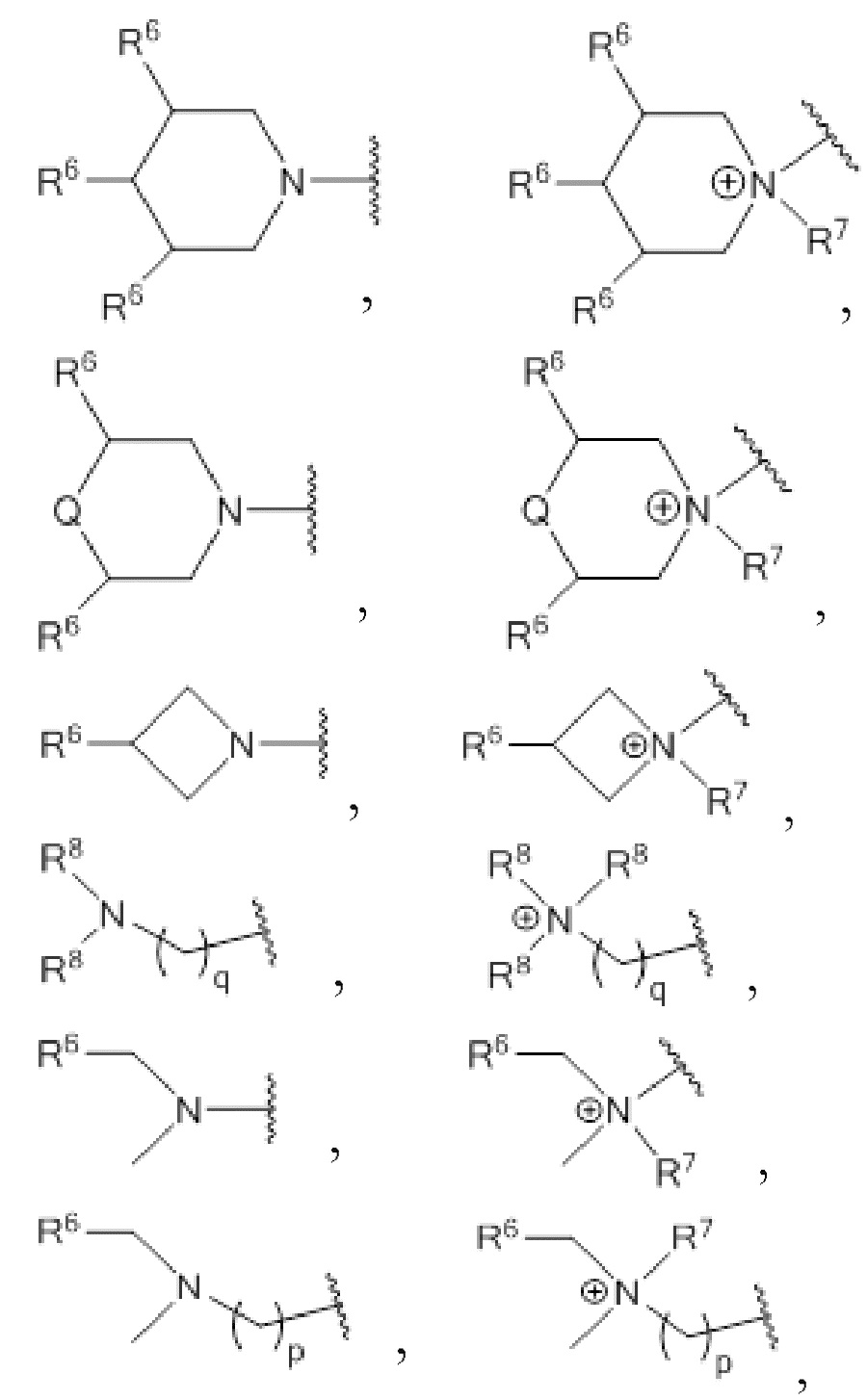

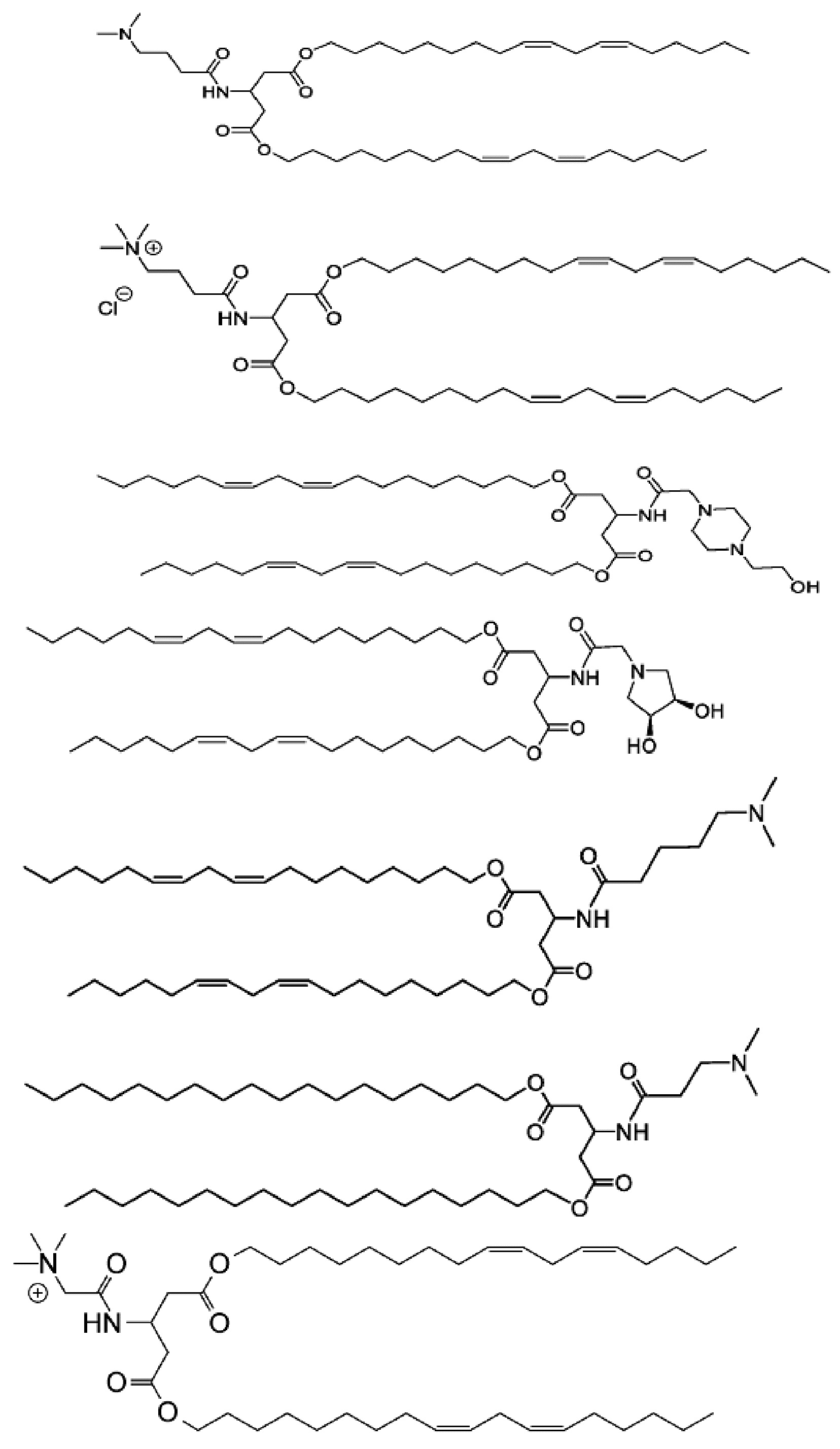













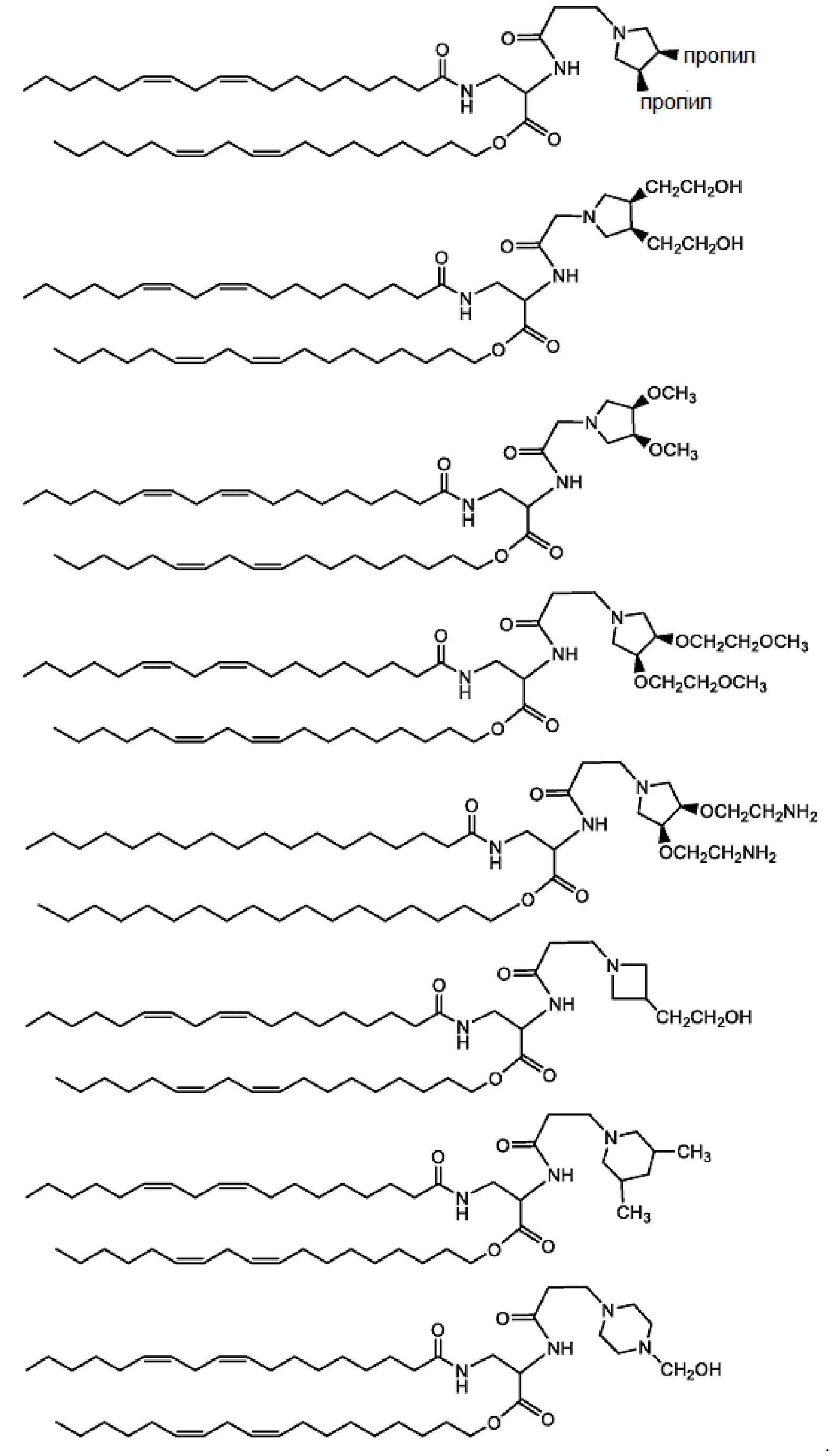


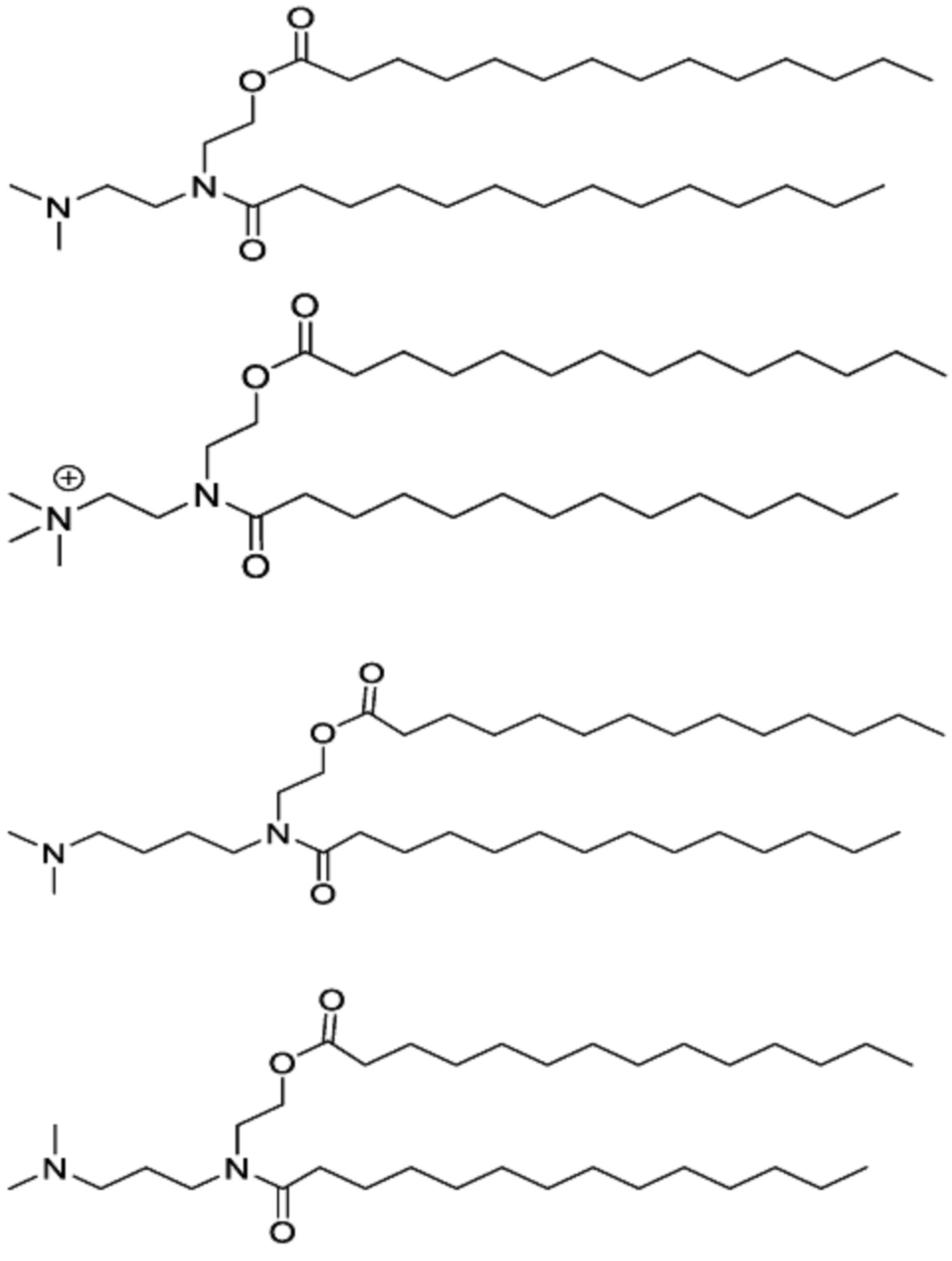

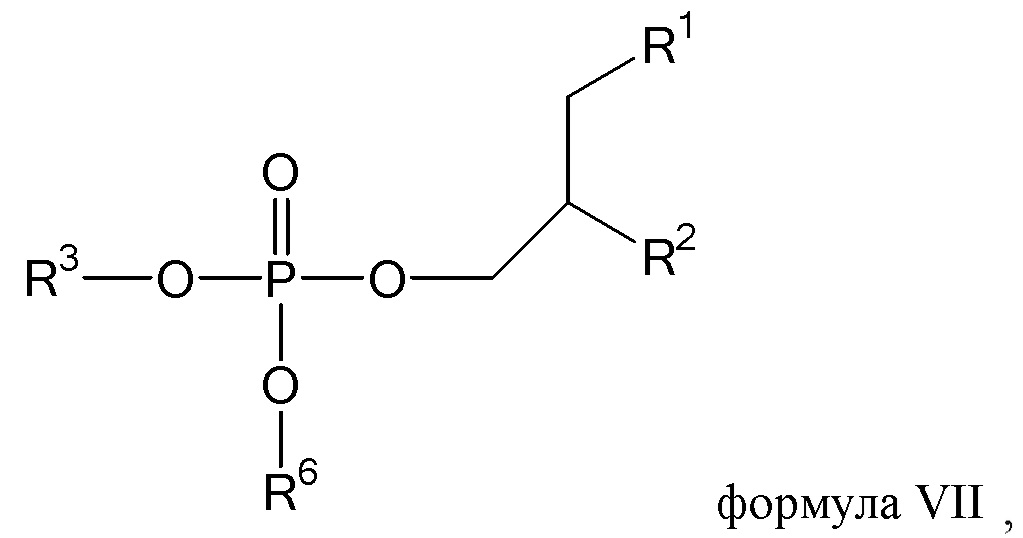

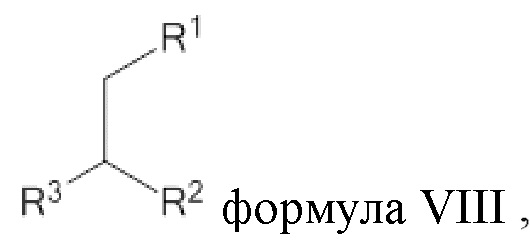













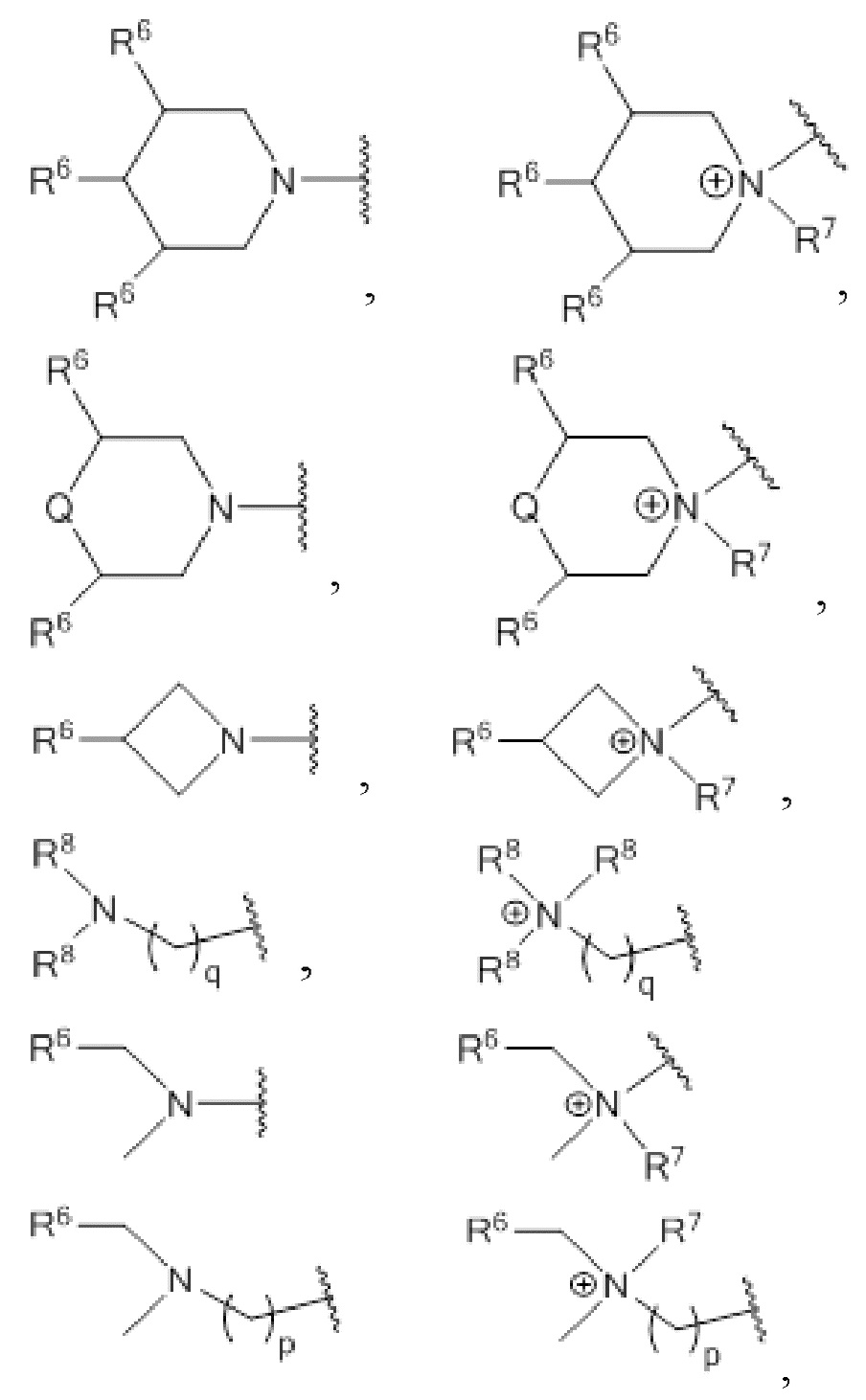






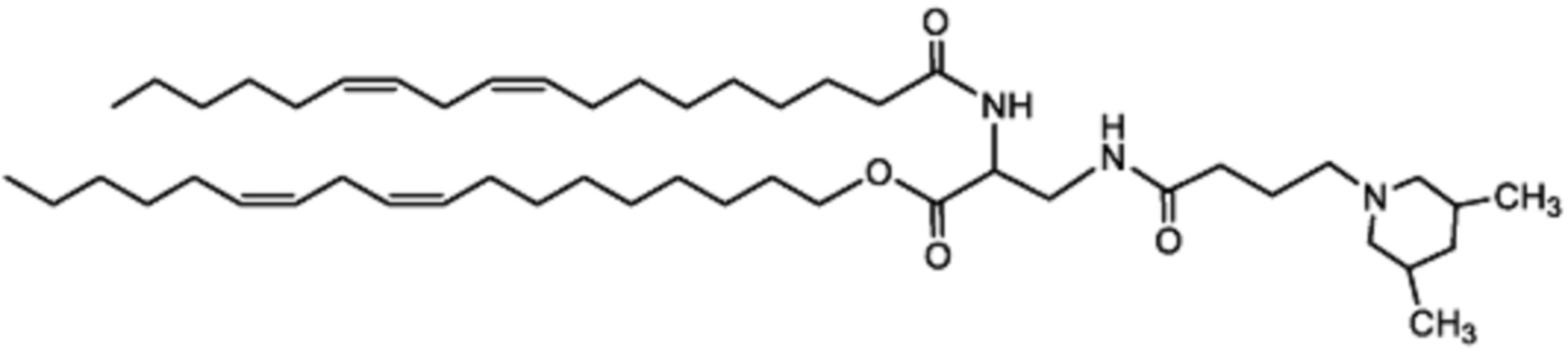
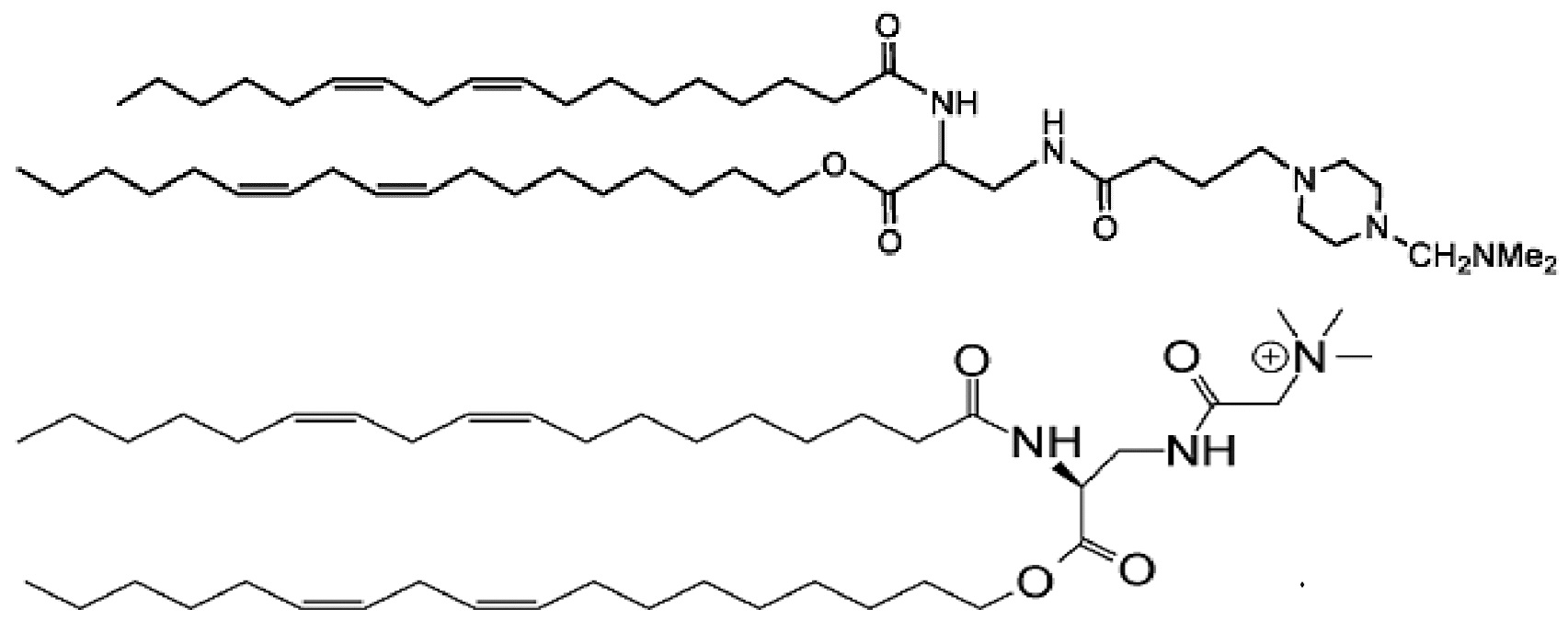

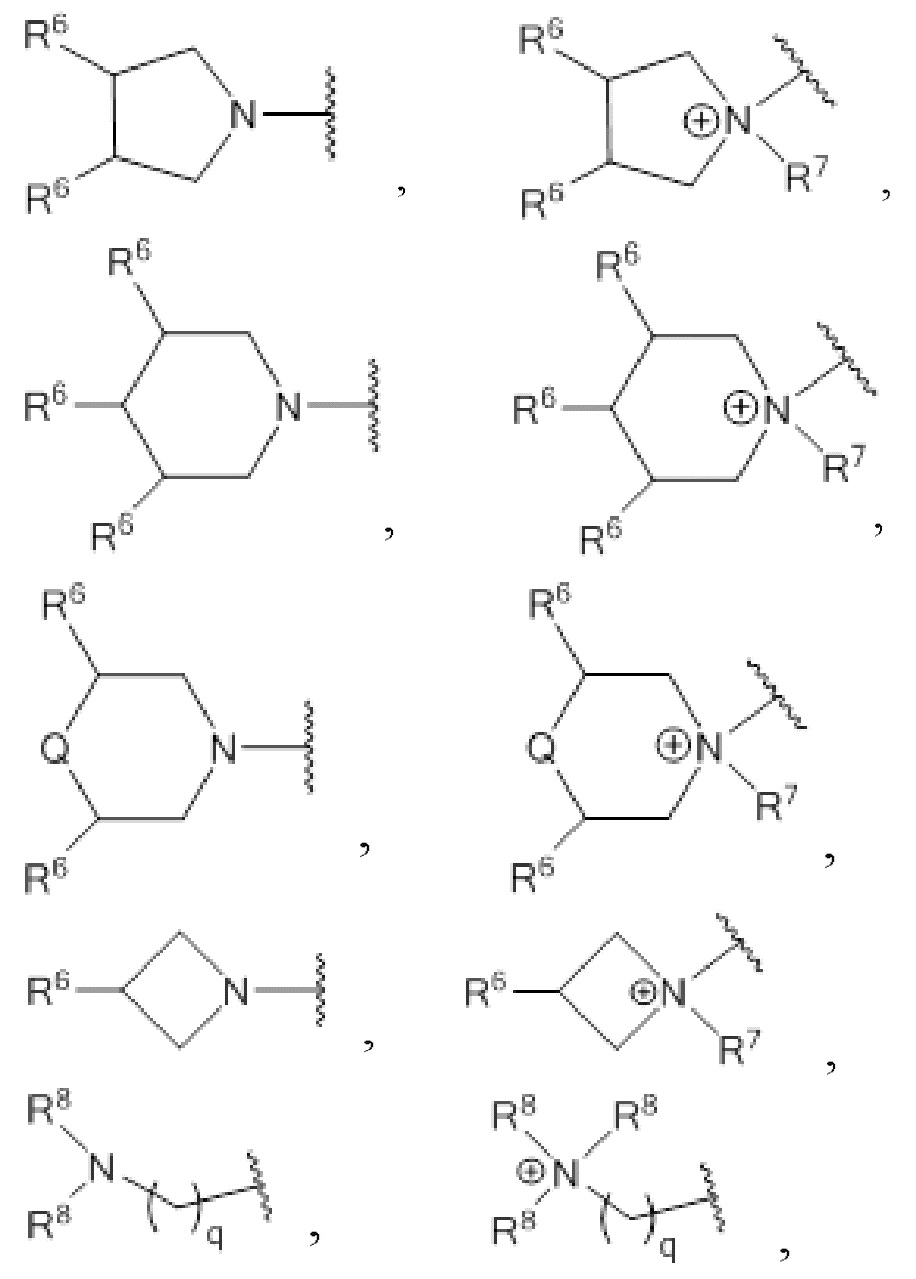












Документы, цитированные в отчёте о поиске
Фармацевтическое средство, содержащее ингибитор rho-киназы

Комментарии