Кристаллическая форма моногидрата гидрохлорида (r)-7-хлор-n-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида - RU2577334C2
Код документа: RU2577334C2
Чертежи




Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 61/352092, поданной 7 июня 2010, и предварительной патентной заявки США № 61/345363, поданной 17 мая 2010, которые включены явно в настоящее изобретение во всей своей полноте с помощью ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к кристаллическим формам моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида и их композициям, способам получения и терапевтическим применениям.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Эндогенный нейромедиатор ацетилхолин (Ach) опосредует различные физиологические функции в периферической и центральной нервной системе (CNS) через мускариновые и никотиновые подклассы ацетихолиновых рецепторов (AChR). Никотиновые ацетилхолиновые рецепторы (nAChR) представляют собой лиганд-зависимые ионные каналы на поверхности клеток, которые селективно активируются природными производными никотина. Различные молекулярные подтипы или варианты никотинового ацетилхолинового рецептора основаны на пентамерной структуре рецептора. nAChR подтипы образуются различными пентамерными комбинациями девяти молекулярно отличных альфа субъединиц и четырех молекулярно отличных бета субъединиц. Особенно интересной молекулярной мишенью для терапевтического вмешательства является альфа-7 подтип никотинового рецептора, который состоит из пяти альфа-7 мономерных субъединиц. Таким образом, агонисты, которые являются селективными для альфа-7 рецептора, потенциально способны лечить ряд заболеваний. Ожидается, что альфа-7 агонисты будут особенно пригодны для лечения ЦНС заболеваний, связанных с когнитивными расстройствами. Данный ожидаемый результат основан на полезных эффектах активации альфа-7 рецептора на познавательные способности, обучение и память. В то же время ожидают, что селективные альфа-7 агонисты будут вызывать меньшие серьезные нежелательные побочные эффекты, например тошноту, рвоту, тахикардию, которые являются опосредованными активацией других определенных подтипов никотиновых рецепторов, как, например, неселективным агонистическим никотином.
В связи с этим существует необходимость в дополнительных селективных альфа-7 агонистах для лечения ЦНС заболеваний, связанных с когнитивными расстройствами.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Соответственно, настоящее изобретение относится к новым кристаллическим соединениям для применения для лечения ЦНС заболеваний, связанных с когнитивными расстройствами. В частности, настоящее изобретение относится к кристаллическим формам, т.е. форме I и форме II, моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, имеющего следующую формулу.

Кроме того, настоящее изобретение относится к (a) фармацевтическим композициям, содержащим одну из кристаллических форм, (b) способам лечения и/или профилактики заболевания, для которых можно ожидать, что введение α7 никотинового рецепторного агониста будет представлять собой терапевтическое применение одной из кристаллических форм, и (c) способам получения кристаллических форм.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой фазовую диаграмму формы I и формы II.
Фигура 2 показывает спектр рентгеновской дифракции на порошке (XRPD) для формы X.
Фигура 3 представляет собой график, показывающий соотношение между активностью воды и объемной концентрации воды в системах ацетонитрил/вода при различных температурах.
Фигура 4 показывает диаграмму формы I и формы II, применяя графическое изображение температуры относительно степени активности воды.
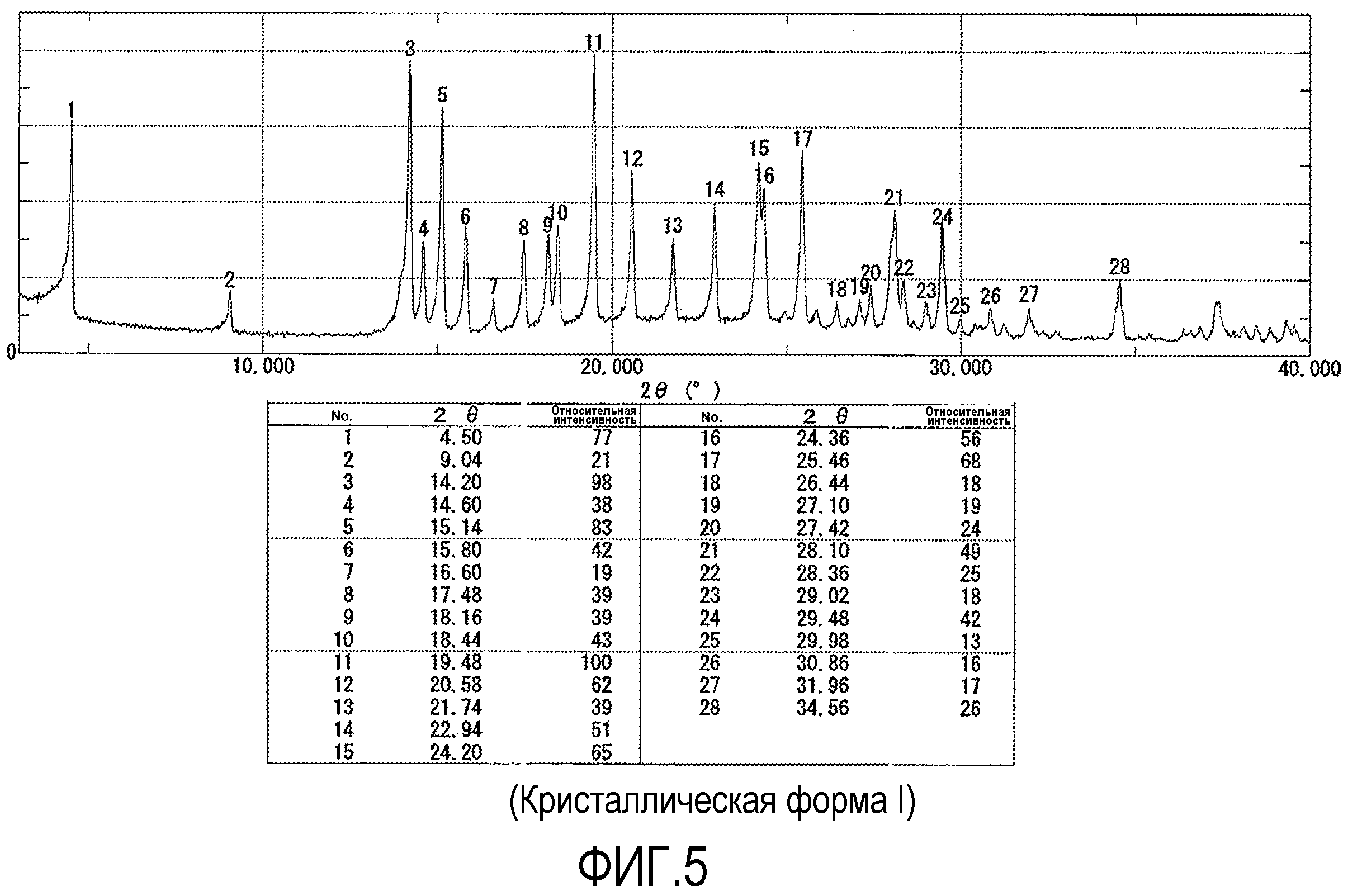
Фигура 5 показывает спектр рентгеновской дифракции на порошке (XRPD) для формы I.
Фигура 6 показывает спектр рентгеновской дифракции на порошке (XRPD) для формы II.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение, включая кристаллические формы, способы и фармацевтические композиции, будут описаны со ссылкой на следующие определения, которые, для удобства, указаны ниже. Если не указано иное, термины, применяемые ниже в настоящем изобретении, имеют следующие значения:
I. Определения
Как применяют в настоящем изобретении и если не указано иное, термин "кристаллические формы" и родственные термины в настоящем изобретении относятся к твердым формам, которые являются кристаллическими. Кристаллические формы включают однокомпонентные кристаллические формы и многокомпонентные кристаллические формы и включают, но не ограничиваются этим, полиморфы, сольваты, гидраты и/или другие молекулярные комплексы. В одном варианте осуществления кристаллические формы настоящего изобретения представляют собой моногидраты. В определенных вариантах осуществления кристаллическая форма является практически чистой, выделенной или обогащенной одной кристаллической формой, и/или является практически не содержащей аморфных форм и/или других кристаллических форм.
Как применяют в настоящем изобретении и если не указано иное, термин "кристаллическая" и родственные термины, применяемые в настоящем изобретении, при применении для описания соединения, вещества, модификации, материала, компонента или продукта, если не указано иное, обозначает то, что соединение, вещество, модификация, материал, компонент или продукт является в значительной степени кристаллическим, как определено дифракцией рентгеновских лучей. См., например, Remington: The Science and Practice of Pharmacy, 21.sup.st edition, Lippincott, Williams and Wilkins, Baltimore, Md. (2005); The United States Pharmacopeia, 23.sup.rd ed, 1843-1844 (1995).
Более того, более подробные методики определения характеристик для получения характеристик кристаллических форм и аморфных форм могут включать, но не ограничиваются этим, термический гравиметрический анализ (TGA), дифференциальную сканирующую калориметрию (DSC), порошковую дифрактометрию рентгеновских лучей (XRPD), монокристаллическую дифрактометрию рентгеновских лучей, колебательную спектроскопию, например инфракрасную (IR) и рамановскую спектроскопию, спектроскопию на основе твердофазного ядерного магнитного резонанса (NMR) и ядерного магнитного резонанса (NMR) в растворе, оптическую микроскопию, оптическую микроскопию с горячим зеркалом, сканирующую электронную микроскопию (SEM), электронную кристаллографию и количественный анализ, анализ размера частиц (PSA), анализ площади поверхности, измерение растворяемости, измерение растворимости, элементный анализ и анализ Карла-Фишера. Характерные параметры элементарной ячейки можно определить, применяя одну или более методик, таких как, но не ограничиваясь этим, дифракция рентгеновских лучей и дифракция нейтронов, включая монокристаллическую дифракцию и порошковую дифракцию. Способы, пригодные для анализа данных порошковой дифракции, включают уточнение графиков, такое как уточнение методом Ритвельда, которое можно применять, например, для анализа дифракционных пиков, связанных с одной фазой в образце, содержащем более одной твердой фазы. Другие способы, пригодные для анализа данных порошковой дифракции, включают индексацию элементарной ячейки, которая позволяет специалисту в данной области определить параметры элементарной ячейки для образца, содержащего кристаллический порошок. Более того, специалисту в данной области ясно, что идентификацию кристалла можно осуществлять, применяя один из данных способов, например порошковую дифрактометрию рентгеновских лучей, и его можно подтверждать, применяя дополнительные указанные способы получения характеристик.
Как применяют в настоящем изобретении и если не указано иное, образец, содержащий конкретную кристаллическую форму или аморфную форму, которая является "в значительной степени чистой", содержит конкретную кристаллическую форму или аморфную форму с химической и/или физической чистотой, большей чем приблизительно 75%, например, 80%, например, 85%, например, 90%, например, 91%, например, 92%, например, 93%, например, 94%, например, 95%, например, 96%, например, 97%, например, 98%, например, 99%, например, 99,25%, например, 99,50%, например, 99,75%, например, 99,9%, например, 100%. В определенных вариантах осуществления конкретная кристаллическая форма или аморфная форма имеет физическую или химическую чистоту, большую, чем приблизительно 90%, например, 91%, например, 92%, например, 93%, например, 94%, например, 95%, например, 96%, например, 97%, например, 98%, например, 99%, например, 99,25%, например, 99,50%, например, 99,75%, например, 99,9%, например, 100%. В конкретных вариантах осуществления конкретная кристаллическая форма или аморфная форма имеет физическую или химическую чистоту, большую, чем приблизительно 95%, например, 96%, например, 97%, например, 98%, например, 99%, например, 99,25%, например, 99,50%, например, 99,75%, например, 99,9%, например, 100%. В конкретных вариантах осуществления конкретная кристаллическая форма или аморфная форма имеет физическую или химическую чистоту, большую, чем приблизительно 99%, например, 99,25%, например, 99,50%, например, 99,75%, например, 99,9%, например, 100%.
Как применяют в настоящем изобретении и если не указано иное, образец или композиция, которая "практически не содержит" одну или более других твердых форм и/или других химических соединений, обозначает то, что композиция содержит, в конкретных вариантах осуществления, меньше чем приблизительно 25%, например, 20%, например, 15%, например, 10%, например, 9%, например, 8%, например, 7%, например, 6%, например, 5%, например, 4%, например, 3%, например, 2%, например, 1%, например, 0,75%, например, 0,5%, например, 0,25%, например, или 0,1% по весу одной или более аморфных форм и/или других кристаллических форм. В определенных вариантах осуществления композиция содержит меньше чем 10%, например, 9%, например, 8%, например, 7%, например, 6%, например, 5%, например, 4%, например, 3%, например, 2%, например, 1%, например, 0,75%, например, 0,5%, например, 0,25%, например, или 0,1% по весу одной или более аморфных форм и/или других кристаллических форм. В конкретных вариантах осуществления композиция содержит меньше чем 5%, например, 4%, например, 3%, например, 2%, например, 1%, например, 0,75%, например, 0,5%, например, 0,25%, например, или 0,1% по весу одной или более аморфных форм и/или других кристаллических форм. В конкретных вариантах осуществления композиция содержит меньше чем 1%, например, 0,75%, например, 0,5%, например, 0,25%, например, или 0,1% по весу одной или более аморфных форм и/или других кристаллических форм. В определенных вариантах осуществления кристаллическая форма вещества может быть физически и/или химически чистой.
Как применяют в настоящем изобретении и если не указано иное, термины "полиморфы", "полиморфные формы" и родственные термины в настоящем изобретении относятся к двум или более кристаллическим формам, которые состоят практически из той же самой молекулы, молекул и/или ионов. Различные полиморфы могут иметь различные физические свойства, такие как, например, температура плавления, теплота плавления, растворимость, свойства растворимости и/или колебательный спектр, как результат расположения или конформации молекул и/или ионов в кристаллической решетке. Различия физических свойств могут влиять на фармацевтические параметры, такие как стабильность при хранении, коэффициент сжатия и плотность (важные для формулирования и получения продукта), и скорость растворения (важный фактор для биодоступности). Различия в стабильности могут быть результатом изменений химический реакционноспособности (например, неодинаковое окисление, так что лекарственная форма обесцвечивается более быстро, когда она содержит один полиморф, чем в случае, когда она содержит другой полиморф) или механических изменений (например, таблетки крошатся при хранении, по мере того как кинетически предпочтительный полиморф превращается в термодинамически более стабильный полиморф) или обоих (например, таблетки одного полиморфа подвержены большему разложению при высокой влажности). Как результат различий в растворяемости/растворимости, в предельном случае, некоторые твердофазные переходы могут приводить в результате к недостаточной эффективности или, в другом предельном случае, токсичности. Кроме того, физические свойства могут быть важными для обработки (например, более вероятно, что один полиморф образует сольваты или его может быть сложно фильтровать и отмывать от примесей, и конкретная форма и распределение по размерам могут различаться между полиморфами).
Термины "гидрат" и "гидратированный" относится к сольвату, где сольват содержит воду. Термин "полиморфы сольватов" относится к существованию более чем одной кристаллической формы для конкретной сольватной композиции. Аналогично, термин "полиморфы гидратов" относится к существованию более чем одной кристаллической формы для конкретной гидратной композиции.
Как применяют в настоящем изобретении и если не указано иное, термин "аморфная", "аморфная форма" и родственные термины, применяемые в настоящем изобретении, описывают то, что указанное вещество, компонент или продукт является в значительной степени некристаллическим, как определено дифракцией рентгеновских лучей. В частности, термин "аморфная форма" описывает неупорядоченную твердую форму, т.е. твердую форму, не имеющую дальний кристаллический порядок. В определенных вариантах осуществления аморфная форма вещества может практически не содержать другие аморфные формы и/или кристаллические формы. В других вариантах осуществления аморфная форма вещества может содержать меньше чем приблизительно 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45% или 50% по весу одной или более других аморфных форм и/или кристаллических форм. В определенных вариантах осуществления аморфная форма вещества может быть физически и/или химически чистой. В определенных вариантах осуществления аморфная форма вещества может иметь физическую и/или химическую чистоту приблизительно 99%, 98%, 97%, 96%, 95%, 94%, 93%, 92%, 91% или 90%.
Как применяют в настоящем изобретении и если не указано иное, термины "приблизительно" при применении с числовым значением или диапазоном величин, которые даются для получения характеристик конкретной твердой формы, например конкретная температура или диапазон температур, такие как, например, конкретная температура или диапазон температур, описывающие DSC или TGA термические процессы, включая, например, плавление, дегидратацию, десольватацию или процессы перехода в стеклообразное состояние; изменение массы, такое как, например, изменение массы как функция температуры или влажности; содержание растворителя или воды при пересчете, например, на массу или проценты; или положение пиков, такое как, например, в анализе IR или рамановской спектроскопии или XRPD; показывают, что величина или диапазон величин может изменяться до степени, признаваемой разумной специалистом в данной области при описании по-прежнему конкретной твердой формы. Например, в конкретных вариантах осуществления термины "приблизительно", при применении в данном контексте и если не указано иное, показывают, что числовое значение или диапазон величин может изменяться в пределах 25%, 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1,5%, 1%, 0,5% или 0,25% указанной величины или диапазона величин.
Как применяют в настоящем изобретении и если не указано иное, термины "лечить" и "лечение" относятся к ликвидации или улучшению состояния при заболевании или расстройстве, или одного или более симптомов, связанных с заболеванием или состоянием. В определенных вариантах осуществления термины относятся к сведению до минимума развития или усугубления заболевания или расстройства, являющемуся результатом введения соединения настоящего изобретения пациенту с данным заболеванием или расстройством. В некоторых вариантах осуществления термины относятся к введению соединения, относящегося к настоящему изобретению, с или без других дополнительных активных агентов, после возникновения симптомов конкретного заболевания. Термины "лечение" или подобные, как применяют в настоящем изобретении, включают лечение болезненного состояния у субъекта, например млекопитающего, и включают по меньшей мере одно из: (i) ингибирования болезненного состояния, т.е. частичной или полной остановки его развития; (ii) облегчения болезненного состояния, т.е. вызывания облегчения симптомов болезненного состояния, или облегчения симптома заболевания; и (iv) обращения или облегчения болезненного состояния, предпочтительно устранения или излечения заболевания. В конкретном варианте осуществления термины "лечение" или подобные включают лечение болезненного состояния у млекопитающего, например примата, например человека, и включают по меньшей мере одно из (ii), (i) и (iv) выше. Как известно в данной области техники, могут быть необходимы поправки на системную доставку по сравнению с локализованной доставкой, возраст, вес тела, состояние здоровья, пол, рацион, время введения, взаимодействие лекарственных средств и тяжесть заболевания, и они будут определяться стандартным экспериментированием специалистом в данной области.
Как применяют в настоящем изобретении и если не указано иное, термины "предотвращать" и "предотвращение" относятся к предотвращению возникновения, рецидива или распространения заболевания или состояния, или одного или более из их симптомов. В определенных вариантах осуществления термины относятся к введению соединения, относящегося к настоящему изобретению, субъекту, с или без другого дополнительного активного соединения, перед возникновением симптомов, в частности, пациентам с риском возникновения заболеваний или расстройств, описанных в настоящем изобретении. Термины включают ингибирование или облегчение симптома конкретного заболевания. Субъекты с семейной историей заболевания в особенности являются кандидатами для режимов приема лекарственных средств для предотвращения в определенных вариантах осуществления. Кроме того, субъекты, которые имеют историю рецидива симптомов, также являются потенциальными кандидатами для предотвращения. В связи с этим, термин "предотвращение" можно применять взаимозаменяемо с термином "профилактическое лечение". В определенных вариантах осуществления предотвращения достигают введением профилактически эффективного количества соединения настоящего изобретения.
Как применяют в настоящем изобретении и если не указано иное, "терапевтически эффективное количество" соединения представляет собой количество, достаточное для оказания терапевтического полезного эффекта при лечении или регулировании заболевания или расстройства, или для задержки или сведения к минимуму одного или более симптомов, связанных с заболеванием или состоянием. Терапевтически эффективное количество соединения обозначает количество терапевтического агента, одного или в комбинации с другими терапиями, которое оказывает терапевтический полезный эффект при лечении или регулировании заболевания или расстройства. Термин "терапевтически эффективное количество" может включать количество, которое улучшает общую терапию, облегчает или избегает симптомов или причин заболевания или расстройства, или увеличивает терапевтическую эффективность другого терапевтического агента.
Как применяют в настоящем изобретении и если не указано иное, термины "регулировать" и "регулирование" относится к предотвращению или замедлению развития, распространения или усугубления заболевания или расстройства или одного или более его симптомов. Часто, полезные эффекты, которые субъект получает при введении профилактического и/или терапевтического агента, не приводят в результате к излечению заболевания или расстройства. В связи с этим, термин "регулирование" включает лечение субъекта, который страдает от конкретного заболевания в попытке предотвратить или снизить до минимума рецидив заболевания.
Как применяют в настоящем изобретении и если не указано иное, "профилактически эффективное количество" соединения представляет собой количество, достаточное для предотвращения заболевания или расстройства или предотвращения его рецидива. Профилактически эффективное количество соединения относится к количеству терапевтического агента, отдельно или в комбинации с другими агентами, которое оказывает профилактический полезный эффект при предотвращении заболевания. Термин "профилактически эффективное количество" может включать количество, которое улучшает общую профилактику или усиливает профилактическую эффективность другого профилактического агента.
Предполагается, что термин "композиция", как применяют в настоящем изобретении, включает продукт, содержащий указанные ингредиенты (и в указанных количествах, если указано), а также любой продукт, который является результатом, прямо или косвенно, смешивания указанных ингредиентов в указанных количествах. Термин "фармацевтическая композиция" включает композиции, содержащие соединение настоящего изобретения, например кристаллическую форму I или II, и фармацевтически приемлемый носитель. "Фармацевтически приемлемый носитель" представляет собой разбавитель, вспомогательное вещество или носитель, который является совместимым с другими ингредиентами состава и является не вредным для его реципиента.
II. Соединения настоящего изобретения
В одном варианте осуществления настоящее изобретение относится к кристаллической форме I и форме II моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, имеющего следующую формулу.

Для ясности, альфа-7 рецепторное агонистическое соединение, гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, описывают в опубликованной патентной заявке США № US 2005-01 19325. Однако, в противоположность настоящему изобретению, данное описание не раскрывает или предполагает настоящее изобретение, моногидрат гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, и не описывает любые кристаллические формы моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
В одном варианте осуществления настоящее изобретение относится к кристаллической форме I моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, характеризующейся рентгеновской дифрактограммой на порошке, имеющей пики, выраженные в виде 2Θ при одном или обоих 17,48 и 20,58 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение относится к кристаллической форме I, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере один пик, выраженный в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение включает кристаллическую форму I, как определено выше, характеризующуюся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере два пика, выраженные в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В еще другом варианте осуществления настоящее изобретение относится к кристаллической форме I, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере четыре пика, выраженные в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
Кроме того, настоящее изобретение включает кристаллическую форму I, как определено выше, характеризующуюся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере шесть пиков, выраженных в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
Кроме того, настоящее изобретение включает кристаллическую форму I, как определено выше, характеризующуюся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере восемь пиков, выраженных в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
Кроме того, настоящее изобретение относится к кристаллической форме I, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей пики, выраженные в виде 2Θ при 4,50, 9,04, 14,60, 15,14, 15,80, 16,60, 18,16, 18,44, 19,48, 21,74 и 25,46 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение относится к кристаллической форме II моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, характеризующейся рентгеновской дифрактограммой на порошке, содержащей пики, выраженные в виде 2Θ при одном или обоих 21,16 и 21,38 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение относится к кристаллической форме II, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере один пик, выраженный в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,20 градуса при измерении относительно внутреннего кремниевого стандарта.
В еще другом варианте осуществления настоящее изобретение относится к кристаллической форме II, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере два пика, выраженные в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,2 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение включает кристаллическую форму II, как определено выше, характеризующуюся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере четыре пика, выраженные в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,2 градуса при измерении относительно внутреннего кремниевого стандарта.
Настоящее изобретение также относится к кристаллической форме II, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере шесть пиков, выраженных в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,2 градуса при измерении относительно внутреннего кремниевого стандарта.
Настоящее изобретение также относится к кристаллической форме II, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей по меньшей мере восемь пиков, выраженных в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,2 градуса при измерении относительно внутреннего кремниевого стандарта.
В другом варианте осуществления настоящее изобретение относится к кристаллической форме II, как определено выше, характеризующейся рентгеновской дифрактограммой на порошке, дополнительно содержащей пики, выраженные в виде 2Θ при 4,48, 9,00, 13,58, 15,62, 16,48, 19,02, 19,44, 22,46 и 25,00 ±0,2 градуса при измерении относительно внутреннего кремниевого стандарта.
III. Способы настоящего изобретения
A. Способы применения
В одном варианте осуществления настоящее изобретение относится к кристаллической форме I для лечения и/или профилактики заболевания, которое можно лечить или предотвращать активацией альфа-7 рецептора. В другом варианте осуществления настоящее изобретение относится к кристаллической форме II для лечения и/или профилактики заболевания, которое можно лечить или предотвращать активацией альфа-7 рецептора.
В другом варианте осуществления настоящее изобретение относится к способу лечения или предотвращения заболевания, которое можно лечить или предотвращать активацией альфа-7 рецептора, включающему введение субъекту кристаллической формы I. В другом варианте осуществления обеспечивают способ лечения или предотвращения заболевания, которое можно лечить или предотвращать активацией альфа-7 рецептора, включающий введение субъекту кристаллической формы II.
В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности у субъекта, включающему введение субъекту кристаллической формы I. В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности введением субъекту кристаллической формы I, где субъект страдает от заболевания, выбранного из: синдрома дефицита внимания, синдрома гиперактивности с дефицитом внимания и болезни Паркинсона. В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности введением кристаллической формы I, где субъект страдает от заболевания, выбранного из болезни Альцгеймера и шизофрении.
В другом варианте осуществления настоящее изобретение относится к способу лечения заболевания, выбранного из синдрома дефицита внимания, синдрома гиперактивности с дефицитом внимания, болезни Паркинсона, болезни Альцгеймера и шизофрении, причем способ включает введение субъекту кристаллической формы I. В другом варианте осуществления настоящее изобретение включает способ лечения субъекта, который подвергается риску развития заболевания, выбранного из: болезни Альцгеймера, болезни Паркинсона и шизофрении, причем способ включает введение субъекту кристаллической формы I. В еще другом варианте осуществления настоящее изобретение включает способ лечения субъекта старше 60 лет, включающий введение субъекту кристаллической формы I. В следующем варианте осуществления настоящее изобретение включает способ лечения субъекта от возрастной потери памяти, включающий введение субъекту кристаллической формы I. В другом варианте осуществления настоящее изобретение включает способ лечения субъекта от возрастной потери памяти, включающий введение субъекту кристаллической формы I, где субъект старше 60 лет.
В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности у субъекта, включающему введение субъекту кристаллической формы II. В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности введением кристаллической формы II субъекту, где субъект страдает от заболевания, выбранного из: синдрома дефицита внимания, синдрома гиперактивности с дефицитом внимания и болезни Паркинсона. В другом варианте осуществления настоящее изобретение относится к способу улучшения познавательной способности или лечения пониженной познавательной способности введением кристаллической формы II субъекту, где субъект страдает от заболевания, выбранного из болезни Альцгеймера и шизофрении.
В другом варианте осуществления настоящее изобретение относится к способу лечения заболевания, выбранного из синдрома дефицита внимания, синдрома гиперактивности с дефицитом внимания, болезни Паркинсона, болезни Альцгеймера и шизофрении, причем способ включает введение субъекту кристаллической формы II. В другом варианте осуществления настоящее изобретение включает способ лечения субъекта, который подвергается риску развития заболевания, выбранного из: болезни Альцгеймера, болезни Паркинсона и шизофрении, причем способ включает введение субъекту кристаллической формы II. В еще другом варианте осуществления настоящее изобретение включает способ лечения субъекта старше 60 лет, включающий введение субъекту кристаллической формы II. В следующем варианте осуществления настоящее изобретение включает способ лечения субъекта от возрастной потери памяти, включающий введение субъекту кристаллической формы II. В другом варианте осуществления настоящее изобретение включает способ лечения субъекта от возрастной потери памяти, включающий введение субъекту кристаллической формы II, где субъект старше 60 лет.
B. Способы получения
Было бы полезно предоставить моногидрат гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в стабильной кристаллической форме. После обширных исследований были обнаружены два типа стабильных кристаллических форм: форма I и форма II. Одна кристаллическая форма не превращается легко в другую в твердом состоянии, поскольку каждая из двух кристаллических форм является стабильной. С другой стороны, было обнаружено, что, когда одну кристаллическую форму растворяют в водном растворителе и осуществляют кристаллизацию из данного раствора, было трудно предсказать, какая кристаллическая форма предпочтительно образовывалась. Кроме того, одна форма может превращаться в другую или смесь двух форм достаточно легко в растворе в определенных условиях. Следовательно, механизм кристаллизации был неясен, и было трудно разработать способы получения каждой формы с высокой чистотой. После обширных исследований авторы настоящего изобретения разработали способы селективного получения каждой чистой кристаллической формы. Способы можно осуществлять, применяя ряд различных растворителей.
Кристаллическую форму соединения обычно получают: 1) растворением соединения в растворителе при высокой температуре, где растворимость продукта является высокой, 2) понижением температуры раствора, вызывая кристаллизацию соединения и 3) выделением полученных в результате кристаллов.
Однако твердофазные исследования обнаружили, что существует две энантиотропные кристаллические формы моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, и авторы настоящего изобретения обнаружили, что обычный способ кристаллизации склонен давать смесь двух кристаллических форм соединения. Это является результатом того, что при большей температуре одна кристаллическая форма соединения является немного более стабильной в системе растворителей, тогда как при более низкой температуре другая кристаллическая форма соединения является немного более стабильной в той же системе растворителей. Данный эффект можно наблюдать в примерах 5, 6, 7 и 8.
Кроме того, было найдено, что пограничная температура для превращения одной формы в другую изменяется в зависимости от системы растворителей, в которой растворяют соединение.
Авторы настоящего изобретения подробно исследовали стабильные кристаллические формы при различных температурах и в различных системах растворителей и пришли к выводу, что форму I и форму II моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида можно получить отдельно на основании соотношения температуры и активности воды растворителя, независимо от конкретного органического растворителя. Данные результаты привели к разработке новых способов отдельного получения чистой формы I и чистой формы II.
В одном варианте осуществления настоящее изобретение относится к способу получения фармацевтической композиции, причем способ включает смешивание кристаллической формы I со вспомогательным веществом или фармацевтически приемлемым носителем. В одном варианте осуществления способ дополнительно включает смешивание кристаллической формы I с жидкостью. В следующем варианте осуществления способ включает заполнение капсулы композицией, содержащей кристаллическую форму I.
В другом варианте осуществления настоящее изобретение включает способ получения фармацевтической композиции, включающий смешивание кристаллической формы II со вспомогательным веществом или фармацевтически приемлемым носителем. В одном варианте осуществления способ дополнительно включает смешивание кристаллической формы II с жидкостью. В следующем варианте осуществления способ включает заполнение капсулы композицией, содержащей кристаллическую форму II.
Способ получения кристаллической формы I включает: (1) перемешивание гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида (в настоящем изобретении далее "гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида" включает любую форму ангидрида, гидрата и сольвата, предпочтительно ангидрида и гидрата) в водном органическом растворителе в диапазоне I температура-активность воды, при необходимости со снижением его температуры и/или активности воды, получая практически чистую кристаллическую форму I; и (2) выделение полученной в результате кристаллической формы I, где диапазон I температура-активность воды определяют следующим соотношением температуры и активности воды водного органического растворителя, активность воды (x) водного органического растворителя составляет от 0,16 до 0,73; и температура (T) водного органического растворителя является большей, чем (183x-64,2), и меньшей, чем температура кипения водного органического растворителя.
В одном варианте осуществления способ получения кристаллической формы I включает способ, где на стадии (1) первоначальное состояние гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе является раствором, и раствор перемешивают в диапазоне I температура-активность воды с понижением его температуры и/или активности воды. В другом варианте осуществления способ получения кристаллической формы I включает способ, где на стадии (1) первоначальное состояние гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе является суспензией, и суспензию перемешивают в диапазоне I температура-активность воды, при необходимости с понижением ее температуры и/или активности воды. В следующем варианте осуществления способ получения кристаллической формы I включает способ, где на стадии (1) к раствору добавляют зародыши кристаллов гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. В еще следующем варианте осуществления способ получения кристаллической формы I включает способ, где зародыши кристаллов представляют собой форму I моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
В одном варианте осуществления способ получения кристаллической формы I включает способ, где активность воды составляет от 0,29 до 0,59. В другом варианте осуществления способ получения кристаллической формы I включает способ, где температура составляет от -10°C до 60°C и является большей, чем следующая T: T=183x-57,6; где x представляет собой активность воды водного органического растворителя и T представляет собой температуру (°C). В еще другом варианте осуществления способ получения кристаллической формы I включает способ, где конечная температура на стадии (1) составляет от 0°C до 35°C.
В одном варианте осуществления способ получения кристаллической формы I включает способ, где водный органический растворитель представляет собой смесь воды и одного или более из органических растворителей, которые смешиваются с водой и выбраны из спиртов, кетонов, нитрилов и эфиров. В другом варианте осуществления способ получения кристаллической формы I включает способ, где водный органический растворитель представляет собой смесь воды и одного или более из органических растворителей, которые смешиваются с водой и выбраны из пропанола, бутанола, бутанона и ацетонитрила.
Настоящее изобретение также включает способ получения кристаллической формы II, включающий: (1) перемешивание гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе в диапазоне II температура-активность воды, при необходимости с понижением его температуры и/или активности воды, получая кристаллическую форму II, и (2) выделение полученной в результате кристаллической формы II, где диапазон II температура-активность воды определяют следующим соотношением температуры и активности воды водного органического растворителя, активность воды (x) водного органического растворителя составляет от 0,16 до 0,73; и температура (T) водного органического растворителя является меньшей, чем (183x-64,2), и большей, чем температура замерзания водного органического растворителя.
В одном варианте осуществления способ получения кристаллической формы II включает способ, где на стадии (1) первоначальное состояние гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе является раствором, и раствор перемешивают в диапазоне II температура-активность воды с понижением его температуры и/или активности воды. В одном варианте осуществления способ получения кристаллической формы II включает способ, где на стадии (1) первоначальное состояние гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе является суспензией, и суспензию перемешивают в диапазоне II температура-активность воды, необязательно понижая ее температуру и/или активность воды.
В другом варианте осуществления способ получения кристаллической формы II включает способ, где на стадии (1) к раствору добавляют зародыши кристаллов гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. В еще другом варианте осуществления способ получения кристаллической формы II включает способ, где зародыши кристаллов представляют собой форму II моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. В еще другом варианте осуществления способ получения кристаллической формы II включает способ, где активность воды составляет от 0,29 до 0,59. В следующем варианте осуществления способ получения кристаллической формы II включает способ, где температура составляет от -10°C до 60°C и является меньшей, чем следующая T: T=183x-70,8; где x представляет собой активность воды водного органического растворителя и T представляет собой температуру (°C). В одном варианте осуществления способ получения кристаллической формы II включает способ, где конечная температура на стадии (1) составляет от 0°C до 35°C. В одном варианте осуществления способ получения кристаллической формы II включает способ, где водный органический растворитель представляет собой смесь воды и одного или более из органических растворителей, которые смешиваются с водой и выбраны из спиртов, кетонов, нитрилов и эфиров.
В другом варианте осуществления способ получения кристаллической формы II включает способ, где водный органический растворитель представляет собой смесь воды и одного или более из органических растворителей, которые смешиваются с водой и выбраны из пропанола, бутанола, бутанона и ацетонитрила.
Настоящее изобретение также относится к другому способу получения кристаллической формы I, включающему: (a) нагревание 10-30% по весу гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в ацетонитриле или водном ацетонитриле до от 60°C до температуры кипения раствора, (b) необязательно добавление воды к смеси для полного растворения гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида; (c) охлаждение раствора до того момента, как только кристаллы становятся видимыми; (d) если содержание воды является большим чем 3% об./об., когда кристаллы только становятся видимыми, добавление ацетонитрила к смеси так, чтобы содержание воды было меньшим чем 3% об./об.; (e) охлаждение полученной в результате смеси ниже 15°C и (f) выделение кристаллического моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
В одном варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где вода, добавленная на стадии (a), не доводит содержание воды смеси до величины выше 30% об./об. В другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида присутствует в количестве 15-25% по весу на стадии (a). В другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида присутствует в количестве 16-20% по весу на стадии (a). В другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида присутствует в количестве 17-19% по весу на стадии (a). В еще другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, дополнительно включающий добавление формы I моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида к смеси после того, как кристаллы только становятся видимыми.
В еще другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где стадия (c) включает охлаждение раствора ниже 55°C. В еще другом варианте осуществления способ получения кристаллической формы I включает способ, как определено на стадиях (a)-(f) выше, где стадия (c) включает охлаждение раствора ниже 50°C.
Также включенным в настоящее изобретение является способ получения кристаллической формы II, причем способ включает: (a) нагревание 5-15% по весу гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в 2-бутаноле или водном 2-бутаноле до от 60°C до температуры кипения раствора; (b) если содержание воды является меньшим чем 5% об./об., добавление воды к смеси так, чтобы содержание воды было не меньшим чем 5% об./об.; (c) охлаждение раствора ниже 10°C; (d) выдерживание полученной в результате смеси ниже 10°C и (e) выделение кристаллического моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
Настоящее изобретение дополнительно включает способ получения кристаллической формы II, где способ включает: (a) добавление гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида к (i) ацетонитрилу или (ii) водному ацетонитрилу, получая композицию, которая содержит 10-20% по весу гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида; (b) необязательно добавление воды к композиции, получая содержание воды 6-10%; (c) необязательно охлаждение раствора ниже 10°C; (d) обеспечение образования кристаллов и (e) выделение кристаллического моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
Кристаллические формы I и II являются очень стабильными во многих аспектах. Обе формы являются стабильными в условиях хранения. Продукты разложения для обеих форм в условиях хранения не обнаруживали: 11% RH при 40°C, 75% RH при 40°C, 11% RH при 60°C и 75% RH при 60°C через 2 недели, и обнаруживали продукты разложения для обеих форм в условиях хранения при свете: воздействие света (D65 lamp) 1,2 миллион лк·ч при 25°C. Обе формы были также стабильными при механической нагрузке. XRD графики обеих форм не изменялись после испытаний на сжатие плоским пестиком (1000 кгс/см2).
Чистые кристаллические формы I и II можно получить специальными способами, которые описаны в настоящем изобретении.
Чистую кристаллическую форму I можно получить способом, который включает:
(1) перемешивание гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе в диапазоне I температура-активность воды (как показано на фигуре 4), при необходимости с понижением его температуры и/или активности воды, получая практически чистую кристаллическую форму I, и (2) выделение полученной в результате кристаллической формы I.
Чистую кристаллическую форму II можно получить способом, который включает:
(1) перемешивание гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в водном органическом растворителе в диапазоне II температура-активность воды (как показано на фигуре 4), при необходимости с понижением его температуры и/или активности воды, получая кристаллическую форму II, и (2) выделение полученной в результате кристаллической формы II.
Активность воды представляет собой термодинамический коэффициент, применяемый для отражения энергетического статуса воды в системе, и он определяется как давление паров воды над образцом, разделенное на давление паров чистой воды при той же температуре. Ее можно измерить измерителем емкости или конденсационным гигрометром. Ее можно также предсказать COSMO-RS способом (Fluid Phase Equilibria, 172 (2000) 43-72).
Гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида получали, например, способом, описанным в WO03/55878. 7-Хлор-бензо[b]тиофен-2-карбоновая кислота реагировала с карбонилдиимидазолом, давая 7-хлор-2-имидазолилкарбонилбензо[b]тиофен, с последующей реакцией с дигидрохлоридом (R)-3-аминохинуклидина, давая гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
Гидрохлорид (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида, применяемый в способах получения выше, может представлять собой, например, кристаллы (например, формы I, II и их смеси), аморфные продукты, масло или раствор, и предпочтительно раствор. Кристаллизацию можно осуществлять в той же колбе после гидрохлорирования. Водный органический растворитель представляет собой смесь воды и одного или более органических растворителей. Предпочтительные органические растворители представляют собой смешивающиеся с водой органические растворители, и более предпочтительно представляют собой, например, спирты (например, C1-6алканолы, такие как метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, и C2-6алкандиолы, такие как этиленгликоль, пропиленгликоль), кетоны (например, C3-6алканоны, такие как ацетон, бутанон), нитрилы (например, ацетонитрил, пропаннитрил) и эфиры (например, диметоксиэтан, тетрагидрофуран). Предпочтительными растворителями являются спирты, нитрилы и кетоны, и более предпочтительными являются пропанолы, бутанолы, бутанон и ацетонитрил.
В настоящем изобретение раствор перенасыщают перед образованием кристаллов. Граница между диапазонами температура-активность воды для форм I и II показана на фигуре 4 в виде линии, которая разделяет области форм I и II.
Кристаллические формы можно отслеживать в процессе получения. Любые аналитические способы можно применять для контролирования при условии, что они могут различать кристаллические формы, и XRD является одним из более предпочтительных способов. Для того чтобы получить чистую форму, перемешивание смеси продолжают до того, как нежелательная форма полностью превратится в требуемую форму.
В способе получения формы I, форма X, которая отличается от обеих форм I и II, может появляться временно, но форма X может превращаться в форму I и исчезает при продолжении перемешивания смеси.
IV. Фармацевтические композиции настоящего изобретения
Настоящее изобретение также относится к фармацевтической композиции, содержащей кристаллическую форму I. Настоящее изобретение также относится к фармацевтической композиции, содержащей кристаллическую форму II.
Кристаллические формы I и II можно применять для получения лекарственного средства для лечения заболевания или состояния у нуждающегося в лечении млекопитающего, где у млекопитающего будет протекать облегчение симптомов в результате введения терапевтически эффективного количества кристаллической формы I или II. Кристаллические формы I и II можно вводить в комбинации с другими лекарственными средствами для дополнительной или синергической терапевтической пользы для указанного заболевания. Заболевания включают, но не ограничиваются этим, заболевания, описанные ниже. Лекарственные средства включают, но не ограничиваются этим, лекарственные средства, которые одобрены для указанного заболевания, например ацетилхолинэстеразные ингибиторы для болезни Альцгеймера.
Поскольку форма I является очень стабильной и может храниться в течение значительного периода времени перед ее применением для получения лекарственного продукта, форма I является пригодной для получения лекарственного продукта, даже когда способ получения, т.е. формулирование активного ингредиента, вызывает частичное или полное превращение формы I в другую форму.
Кристаллические формы I и II можно формулировать в виде растворов или суспензий, в форме таблеток, капсул (каждая содержит составы с постепенным или замедленным высвобождением), пилюль, масел, порошков, гранул, эликсиров, настоек, суспензий, сиропов, эмульсий, микроэмульсий, или со вспомогательными веществами. Аналогично, их можно также вводить любым общепринятым способом, например внутривенно (и болюсом, и вливанием), внутрибрюшинно, внутриглазно, подкожно, внутримышечно, энтерально, предпочтительно перорально (например, в форме таблеток или капсул), или назально, буккально, сублингвально, трансдермально или в виде суппозитория, применяя хорошо известные составы для специалистов в фармацевтической области. Кроме того, кристаллические формы I и II можно вводить в форме липосом или подобных. Разрыхлители включают, без ограничений, системы доставки, такие как небольшие монослойные везикулы, большие монослойные везикулы и многослойные везикулы. Липосомы можно получить из ряда фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины.
Для перорального введения в форме таблетки или капсулы, кристаллические формы I и II можно смешивать с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и подобные. Более того, когда это желательно или необходимо, подходящие связующие, смазывающие агенты, разрыхлители и красители можно также вводить в данную смесь. Подходящие связующие включают крахмал, желатин, натуральные сахара, такие как глюкоза или бета-лактоза, сахарное вещество из кукурузы, натуральные и синтетические камеди, такие как камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полипропиленгликоль, воски и подобные. Подходящие смазывающие агенты, применяемые в данных лекарственных формах, включают, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и подобные. Подходящие разрыхлители представляют собой, например, крахмалы, карбоксиметилкрахмал натрия, кросскармелозу натрия и подобные. Примерами подходящих красителей являются полуторные окиси железа, желтая полуторная окись железа, амарант, эритрозин, тартразин, желтый солнечный закат FCF и подобные.
Режим дозирования для кристаллических форм I и II выбирают согласно ряду факторов, включая тип, вид, возраст, вес, пол и заболевание пациента; тяжесть заболевания, которое подвергают лечению; путь введения; функцию почек и печени пациента. Лечащий врач или ветеринар могут легко определить и прописать эффективное количество лекарственного средства, требуемое для предотвращения, противодействия или остановки развития заболевания.
В одном варианте осуществления показано, что удовлетворительные результаты на животных были получены при ежедневной дозе от приблизительно 0,1 до приблизительно 600 мг или от приблизительно 0,01 до приблизительно 5 мг на кг веса тела животного.
Вводимые внутривенно, подкожно или внутримышечно дозы кристаллических форм I и II, при применении для указанных эффектов, будут находиться в диапазоне от приблизительно 0,001 до 1,0 мг/кг. Кроме того, кристаллические формы I и II можно вводить в интраназальной форме посредством местного применения подходящих интраназальных сред, или трансдермальными путями, применяя формы трансдермальных пластырей, которые являются хорошо известными специалисту в данной области. При введении в форме трансдермальной системы доставки, введение дозы может быть непрерывным, а не периодическим в течение режима дозирования. Трансдермальную доставку можно также осуществлять, применяя подходы, известные в данной области техники.
Заболевания, которые можно лечить, применяя кристаллические формы I и II, включают, но не ограничиваются этим: симптомы нарушения познавательной способности и дефицита внимания болезни Альцгеймера, нейродегенерацию, связанную с заболеванием, таким как болезнь Альцгеймера, пресенильную деменцию (умеренные когнитивные нарушения), сенильную деменцию, шизофрению, психоз, синдром дефицита внимания, синдром гиперактивности с дефицитом внимания, аффективное расстройство и расстройство настроения, амиотрофический латеральный склероз, пограничное личностное расстройство, травматическое повреждение мозга, поведенческие и когнитивные проблемы, связанные с опухолью мозга, СПИД-деменцию, деменцию, связанную с синдромом Дауна, деменцию, связанную с тельцами Леви, болезнь Хантингтона, депрессию, общее тревожное расстройство, возрастную дегенерацию макулы, болезнь Паркинсона, позднюю дискинезию, болезнь Пика, посттравматическое стрессовое расстройство, нарушение потребления пищи, включая булимию и нервную анорексию, синдромы отмены, связанные с отказом от курения и отказом от наркотических средств с зависимостью, синдром Жиля де ла Туретта, глаукому, нейродегенерацию, связанную с глаукомой, или симптомы, связанные с болью, или данные кристаллические формы можно применять для лечения и/или профилактики для улучшения восприятия, концентрации, обучения и/или памяти.
ПРИМЕРЫ
Настоящее изобретение иллюстрируется следующими примерами, которые, как предполагается, не являются ограничивающими любым способом.
Пример 1
Получение кристаллической формы I
Гидрохлорид (R)-7-Хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида получали способом, описанным в US 2005-0119325. Для получения формы I, 1,0 кг соединения растворяли в ацетонитриле (5 л) и нагревали до 72-78°C. При данной температуре добавляли воду (0,5 л). Смесь охлаждали до 50-60°C, когда кристаллы только становились видимыми, и вводили затравку в виде зародышей кристаллов формы I. Смесь выдерживали в течение минимум 2 часов, и затем добавляли ацетонитрил (20 л), поддерживая внутреннюю температуру равной 50-60°C. Материал охлаждали до 5-10°C. Кристаллы выделяли вакуумной фильтрацией и промывали ацетонитрилом (2 л). Материал сушили при 40°C в вакуумной печи с контролированием влажности, получая 0,8 кг чистой формы I.
Пример 2
Получение кристаллической формы I
Ацетонитрил (90 мл) и воду (10 мл) смешивали при комнатной температуре. 1,0 мл данного раствора добавляли к 100,7 мг кристаллической формы I моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. Данную суспензию перемешивали при 80°C до растворения твердых компонентов, затем температуру понижали до 40°C в течение 80 минут. В процессе охлаждения наблюдали спонтанную кристаллизацию в районе 52°C. К суспензии медленно прикапывали 2,40 мл ацетонитрила, и затем температуру понижали до 10°C в течение 60 минут. Суспензию перемешивали при той же температуре в течение 15 часов, и затем твердое вещество фильтровали и промывали 0,20 мл ацетонитрила. После вакуумной сушки получали 81,1 мг кристаллической формы I.
Пример 3
Получение кристаллической формы II
Ацетонитрил (90 мл) и воду (10 мл) смешивали при комнатной температуре. 1,0 мл данного раствора добавляли к 100,9 мг кристаллической формы I моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. Данную суспензию перемешивали при 80°C до растворения твердых компонентов, затем температуру понижали до 10°C в течение 140 минут. В процессе охлаждения наблюдали спонтанную кристаллизацию в районе 51°C. Суспензию перемешивали при той же температуре в течение 15 часов, затем твердое вещество фильтровали и промывали 0,20 мл ацетонитрила. После вакуумной сушки получали 48,7 мг кристаллической формы II.
Пример 4
Получение кристаллической формы II
Моногидрат гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида (462 г) растирали в 2308,5 мл ацетонитрила и 230,85 мл воды при температуре окружающей среды в течение 4,75 часов. Продукт выделяли фильтрацией и сушили, получая 314 г выделенной чистой формы II.
Пример 5
Фазовая диаграмма в водном ацетонитриле
(1) Измерение растворимости форм I и II
Растворимость форм I и II измеряли при различных температурах от 5°C до 45°C в водном ацетонитриле, в котором концентрация воды составляли от 0 до 10 об./об.%, соответственно.
Растворимость измеряли согласно следующему способу. Кристаллы формы I или II и водный ацетонитрил добавляли в стеклянную колбу. Смесь перемешивали с магнитной мешалкой, покрытой тефлоном, при определенной температуре, контролируемой алюминиевым термоблоком. Жидкую фазу периодически отбирали и измеряли концентрацию соединения высокоэффективной жидкостной хроматографией (ВЭЖХ). Твердые вещества также собирали в те же моменты времени для определения кристаллической формы, применяя XRPD. В анализе динамики изменения концентрации определяли зону плато как равновесное состояние и определяли среднее значение данных концентраций как "растворимость" в данных условиях. Измеренная растворимость приведена в таблице 1.
(2) Уравнения для растворимости моделировали, применяя JMP 6 (SAS Institute). С помощью способа анализа отклика измеренные величины растворимости применяли в уравнении (1), получая модели растворимости в виде функции температуры и концентрации воды. W' и T' определяли как уравнения (2) и (3), соответственно. Здесь, C*x, W и T обозначают растворимость определенной кристаллической формы, концентрацию воды в водном ацетонитриле (об./об.%) и температуру (°C), соответственно. Постоянные величины из a, b, c, d и f определяли применением измеренных величин растворимости в способе выравнивания методом наименьших квадратов в диапазоне 2-10 об./об.% концентрации воды и в диапазоне 5-45°C. Для устранения дефектов или для точности, измеренные величины растворимости при 2% - 45°C обеих форм, 3,5% - 37,5°C формы II и 10% - 10,0°C формы I исключают для получения математических формул.

Результаты аппроксимации показали, что константы были определены правильно, и данные модели могут описывать растворимость в диапазоне только с небольшим отклонением. Полученные уравнения для растворимости форм I и II показаны уравнениями (4) и (5), соответственно.
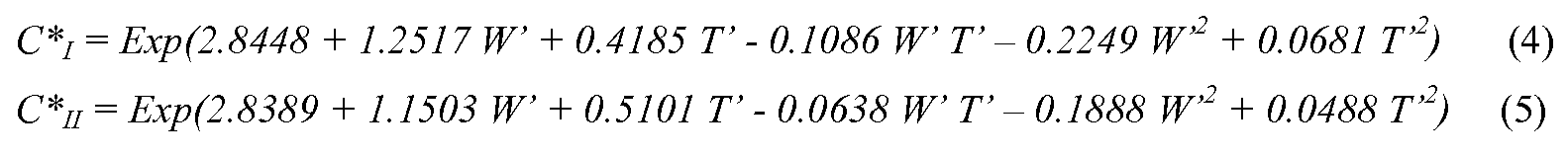
(3) Построение фазовой диаграммы
Термодинамическое соотношение между полиморфными кристаллическими фазами находятся в соответствии с растворимостью. На основании результатов измерений растворимости, ясно, что термодинамическое соотношение между кристаллами формы I и II является энантиотропным. Граница стабильной кристаллической формы должна существовать в диапазоне, в котором проводили измерения растворимости. При граничных условиях, растворимость форм I и II должна быть одинаковой. Следовательно, граничные условия можно получить из уравнения (4) и (5) и сократить, как показано в уравнении (6).
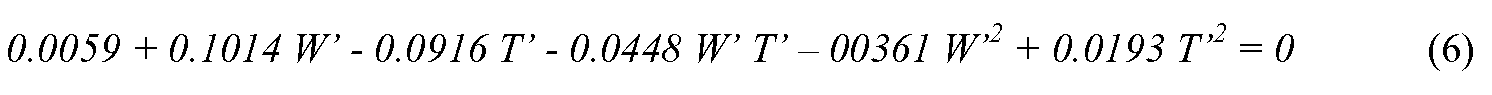
Решив граничное уравнение (6), можно определить граничные условия. Полученные величины показаны в таблице 2. Построив график на основе данных результатов, фазовая диаграмма показана на фигуре 1. Для удобства, данную граничную линию, которую получили из уравнения (6), аппроксимировали уравнением четвертой степени концентрации воды. Данная приближенная формула и ее полученные величины показаны в уравнении (7) и таблице 2, соответственно.

Пример 6
Испытания на взаимопревращение
Также проводили испытания на взаимопревращение, для того чтобы подтвердить надежность полученной фазовой диаграммы примера 5 (фигура 1).
Растворитель добавляли в стеклянную колбу, и температуру контролировали алюминиевым термоблоком. Одинаковые количества кристаллов формы I и II добавляли в колбу. Растворы перемешивали в течение 13-40 часов магнитной мешалкой, покрытой тефлоном. Твердый компонент отбирали и анализировали XRPD для определения его кристаллической формы.
Результаты приведены в таблице 3. Полученные результаты согласуются с фазовой диаграммой примера 5.
Пример 7
Характер кристаллизации в водном ацетонитриле
(1) Форма X
Форма X была обнаружена как другая твердая форма в исследованиях растворимости. Типичная XRPD дифрактограмма формы X показана на фигуре 2.
(2) Характер кристаллизации в 98 об./об.% водном ацетонитриле
Кристаллы формы I добавляли к 98 об./об.% водному ацетонитрилу в стеклянной колбе. Затем, добавляли 98 об./об.% водный ацетонитрил для получения смеси 40 об./мас., кратной, относительно кристаллов формы I. Смесь перемешивали магнитной мешалкой, покрытой тефлоном, и нагревали до 80°C алюминиевым термоблоком. После растворения кристаллов смесь охлаждали до определенной температуры при скорости 30°C в час. После определенного времени выдержки кристаллы формы I добавляли в качестве зародышей кристаллов согласно цели эксперимента. Осадки отбирали периодически и анализировали XRPD.
Первоначальные осадки в системе 98 об./об.% водного ацетонитрила подтверждались как форма X. Спонтанный переход формы X в форму I не наблюдали в пределах 16 часов. Из результатов экспериментов с внесением затравки, оценивали, что форма I является более стабильной, чем форма X, независимо от температуры. Форму X можно получить с выходом 84,7%.
(3) Характер перехода в 98 об./об.% водном ацетонитриле
Кристаллы формы I и 40 об./мас. кратный объем 98 об./об.% водного ацетонитрила добавляли в стеклянную колбу. Смесь перемешивали магнитной мешалкой, покрытой тефлоном, и нагревали до 80°C алюминиевым термоблоком. После растворения, раствор охлаждали до 5°C при скорости 30°C в час. К суспензии формы X добавляли 10 мас./мас.% кристаллов формы I в качестве зародышей кристаллов при 5°C, затем контролировали, поддерживая определенную температуру. Образцы твердого вещества периодически анализировали XRPD.
Переход формы X в форму I наблюдали выше температуры окружающей среды. Данную тенденцию перехода наблюдали также при 5°C. В системе 98 об./об.% водного ацетонитрила оценивали, что форма I является более стабильной, чем форма X, несмотря на температуру, хотя кинетика перехода была очень медленной при низкой температуре.
(4) Характер перехода в 97 об./об.% водном ацетонитриле
Кристаллы формы X и 97 об./об.% водный ацетонитрил добавляли в стеклянную колбу. Смесь перемешивали магнитной мешалкой, покрытой тефлоном, при температуре, контролируемой алюминиевым термоблоком. Твердый компонент отбирали периодически и анализировали XRPD, определяя кристаллическую форму.
Спонтанный переход формы X в форму I наблюдали во всех экспериментах. Оценивали, что форма I является более стабильной, чем форма X, несмотря на температуры, в 97 об./об.% водном ацетонитриле.
Пример 8
Испытания на взаимопревращение в различных растворителях
Смесь кристаллических форм I и II (25 мг/25 мг) перемешивали в 0,5 мл каждого органического растворителя/воде, показанные в таблице 7 в течение 3 дней при 5, 25, 40 и 60°C, соответственно, и осадки фильтровали, затем кристаллические формы подтверждали XRPD. Результаты показаны в таблице 7.
Пример 9
Соотношения между концентрациями воды и величинами активности воды при различных температурах
Величины активности воды различных концентраций воды (т.е. 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и 20 об./об.%) в различных органических растворителях (т.е. 1-пропаноле, 2-пропаноле, 1-бутаноле, 2-бутаноле, ацетоне, 2-бутаноне и ацетонитриле) при различных температурах (т.е. 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 и 60°C), соответственно, рассчитывали, применяя COSMOTHERME версия 2.1 на основе способа Cosmo-RS. Величины концентрации воды (об./об.%) рассчитывали на граничной линии (уравнение (6)) между формой I и формой II при различных температурах (т.е. 0, 5, 10, 15, 20, 25, 30 и 35°C) и переводили в величины активности воды, применяя кривую регрессии кубического уравнения для графиков величин активности воды относительно концентраций воды при различных температурах (фигура 3). Таблица 8 показывает соотношение между содержанием воды (об./об.%) и величинами активности воды на граничной линии фазовой диаграммы. Величины активности воды и соответствующие температуры аппроксимировали уравнением (7) с хорошей корреляцией (коэффициент корреляции: 0,997).

Результаты испытаний на взаимопревращение наносили на график, и граничную линию из уравнения (7) наносили на фазовую диаграмму формы I и формы II, как показано на фигуре 4. Граничная линия приблизительно разделяет форму I и форму II во всех испытуемых системах растворителей.
Пример 10
Кристаллизация кристаллической формы I
(1) 1-Пропанол
Кристаллическую форму I (100,1 мг) растворяли в 1 мл 1-пропанол/вода (9:1 (об./об.)) при 70°C. Смесь постепенно охлаждали до 60°C в течение 20 минут и добавляли к ней 1 мл 1-пропанола. Смесь снова постепенно охлаждали до 5°C в течение 110 минут при перемешивании. Затем добавляли к смеси 3 мл 1-пропанола и смесь перемешивали при 5°C в течение ночи. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (11,1 мг).
(2) 2-Пропанол
Кристаллическую форму I (100,1 мг) растворяли в 1 мл 2-пропанол/вода (9:1 (об./об.)) при 90°C. Смесь постепенно охлаждали до 25°C в течение 130 минут и добавляли к смеси 1 мл 2-пропанола. Смесь снова постепенно охлаждали до 5°C и добавляли 3 мл 2-пропанола. Смесь перемешивали при 5°C в течение 4 дней. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (48,9 мг).
(3) 1-Бутанол
Кристаллическую форму I (100,0 мг) растворяли в 1 мл 1-бутанол/вода (9:1 (об./об.)) при 60°C и добавляли к смеси 1 мл 1-бутанола. Смесь постепенно охлаждали до 25°C в течение 70 минут и добавляли к смеси 3 мл 1-бутанола. Смесь снова постепенно охлаждали до 5°C, и перемешивали при 5°C в течение ночи. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (29,0 мг).
(4) 2-Бутанол
Кристаллическую форму I (100,0 мг) растворяли в 1 мл 2-бутанол/вода (9:1 (об./об.)) при 90°C. Смесь постепенно охлаждали до 60°C в течение 60 минут и добавляли к смеси 1 мл 2-бутанола. Смесь постепенно охлаждали до 25°C в течение 70 минут и добавляли к смеси 3 мл 2-бутанола. Смесь снова постепенно охлаждали до 5°C и перемешивали при 5°C в течение ночи. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (52,1 мг).
(5) Ацетон
Кристаллическую форму I (100,2 мг) растворяли в 1,3 мл ацетон/вода (9:1 (об./об.)) при кипячении с обратным холодильником. Смесь постепенно охлаждали до 25°C в течение 70 минут и добавляли к смеси 1,3 мл ацетона. Смесь постепенно охлаждали до 5°C и добавляли к смеси 3,9 мл ацетона. Смесь перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (74,5 мг).
(6) 2-Бутанон
Кристаллическую форму I (100,3 мг) растворяли в 1 мл 2-бутанон/вода (9:1 (об./об.)) при 60°C. Добавляли к смеси 4 мл 2-бутанона. Смесь постепенно охлаждали до 25°C в течение 70 минут и смесь перемешивали при комнатной температуре в течение 4 дней. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму I (70,0 мг).
Пример 11
Кристаллизация кристаллической формы II
(1) 1-Пропанол
Кристаллическую форму I (100,0 мг) растворяли в 1 мл 1-пропанол/вода (9:1 (об./об.)) при 60°C. Смесь постепенно охлаждали до 5°C в течение 110 минут и перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (11,0 мг).
(2) 2-Пропанол
Кристаллическую форму I (100,3 мг) растворяли в 1 мл 2-пропанол/вода (9:1 (об./об.)) при 90°C. Смесь постепенно охлаждали до 5°C в течение 170 минут, и перемешивали в течение 5 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (40,2 мг).
(3) 1-Бутанол
Кристаллическую форму I (100,1 мг) растворяли в 1 мл 1-бутанол/вода (9:1 (об./об.)) при 70°C. Смесь постепенно охлаждали до 5°C в течение 130 минут и добавляли к смеси 1 мл 1-бутанола. Смесь перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (31,6 мг).
(4) 2-Бутанол
Кристаллическую форму I (100,2 мг) растворяли в 1 мл 2-бутанол/вода (9:1 (об./об.)) при 90°C. Смесь постепенно охлаждали до 5°C в течение 170 минут и добавляли к смеси 1 мл 2-бутанола. Смесь перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (54,7 мг).
(5) Ацетон
Кристаллическую форму I (100,3 мг) растворяли в 1,2 мл ацетон/вода (9:1 (об./об.)) при кипячении с обратным холодильником. Смесь постепенно охлаждали до 5°C в течение 110 минут и добавляли к смеси 1 мл ацетона. Смесь перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (36,4 мг).
(6) 2-Бутанон
Кристаллическую форму I (100,2 мг) растворяли в 1 мл 2-бутанон/вода (9:1 (об./об.)) при 60°C. Смесь охлаждали до 5°C в течение 110 минут. Затем к смеси добавляли 4 мл 2-бутанона. Смесь перемешивали в течение 4 дней при 5°C. Кристаллы выделяли фильтрацией в вакууме и сушили на воздухе при комнатной температуре, получая кристаллическую форму II (76,7 мг).
Пример 12
Физические данные форм I и II
(1) Порошковая дифракция рентгеновских лучей (XRD)
Дифрактограммы получали при комнатной температуре и влажности, применяя дифрактометр Rigaku RTNT-TTRIII с Cu Kα излучением. Угол дифракции, 2Θ, сканировали от 3 до 40 при скорости 2°/минута при размере шага 0,02°. Результаты данного анализа показаны на фигурах 5 и 6, которые являются такими же, как результаты, измеренные относительно внутреннего кремниевого стандарта.
(2) Растворимость
Избыточные количества образцов, форм I и II, суспендировали в воде и уравновешивали встряхиванием в течение 20 минут при 25°C или 37°C, соответственно. Количества растворенного соединения определяли, применяя Waters alliance ВЭЖХ систему 2695, с обнаружением при УФ 210 нм. Результаты данного анализа показаны в таблице 9.
(3) Гигроскопичность
Гигроскопичность форм I и II исследовали, применяя измерительные системы Surface, DVS-1, между 10% RH и 90% RH при 25°C. Гигроскопичность отсутствовала у формы I. С другой стороны, форма II обладала гигроскопичностью, и количество воды приблизительно 4% увеличивалось и снижалось между 10% RH и 90% RH поглощением и десорбцией приблизительно 1 моль канальной воды.
Включение с помощью ссылки
Полное содержание всех патентов, опубликованных патентных заявок и других ссылочных материалов, цитируемых в настоящем изобретении, включено явно в настоящее изобретение во всей своей полноте с помощью ссылки.
Эквиваленты
Специалисту в данной области ясно или он способен установить, применяя не более чем стандартные эксперименты, большое количество эквивалентов для конкретных способов, описанных в настоящем изобретении. Считают, что данные эквиваленты включены в объем настоящего изобретения и включены следующей формулой изобретения. Более того, полагают, что любые числовые или буквенные диапазоны, приведенные в настоящем изобретении, включают как верхнюю, так и нижнюю величину данных диапазонов. Кроме того, предполагается, что любое перечисление и группирование по меньшей мере в одном варианте осуществления представляет сокращенный или подходящий способ перечисления независимых вариантов осуществления; как таковой, каждый член списка следует считать отдельным вариантом осуществления.
Реферат
Изобретение относится к кристаллическим формам I и II моногидрата гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида. Также изобретение относится к фармацевтической композиции для лечения заболеваний ЦНС, связанных с когнитивными расстройствами, содержащей кристаллическую форму I или II, к способу получения фармацевтической композиции и к способу получения кристаллической формы I. Технический результат: получены новые кристаллические формы гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в виде моногидрата, которые стабильны и имеют низкую гигроскопичность. 5 н. и 5 з.п. ф-лы, 6 ил., 9 табл., 12 пр.
Формула
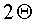
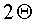
(a) нагревание 10-30% по весу гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида в ацетонитриле или водном ацетонитриле до температуры от 60°C и до температуры кипения раствора;
(b) необязательно добавление воды к смеси для полного растворения гидрохлорида (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида;
(c) охлаждение раствора до того момента, как только кристаллы становятся видимыми;
(d) если содержание воды составляет больше чем 3% объем/объем, когда кристаллы только становятся видимыми, добавление ацетонитрила к смеси так, чтобы содержание воды составляло меньше чем 3% объем/объем;
(e) охлаждение полученной в результате смеси ниже 15°C; и
(f) выделение кристаллического моногидрата гидрохлорида, (R)-7-хлор-N-(хинуклидин-3-ил)бензо[b]тиофен-2-карбоксамида.
Документы, цитированные в отчёте о поиске
Индазолы, бензотиазолы, бензоизотиазолы, бензизоксазолы и их получение и применение

Комментарии