Новые пиррольные соединения, способ их получения и фармацевтические композиции, содержащие их - RU2607788C2
Код документа: RU2607788C2
Описание
Настоящее изобретение относится к новым пиррольным соединениям, к способу их получения и к фармацевтическим композициям, содержащих их.
Соединения настоящего изобретения являются новыми и обладают чрезвычайно ценными фармакологическими характеристиками в области апоптоза и онкологии.
Апоптоз, или запрограммированная гибель клеток, является ключевым физиологическим процессом для эмбрионального развития и поддержания тканевого гомеостаза.
Гибель клеток по типу апоптоза вызывает морфологические изменения, такие как конденсация ядра, фрагментация ДНК, а также биохимический феномен, такой как активация каспаз, которые вызывают повреждение ключевых структурных компонентов клетки, вызывая, таким образом ее разборку и смерть.
Регуляция процесса апотоза является комплексной и задействует активацию или репрессию нескольких внутриклеточных путей передачи сигналов (Cory S. и др., Nature Review Cancer, 2002, 2, 647-656).
Дерегулирование апоптоза вовлечено в определенные патологии. Повышенный апоптоз связан с нейродегенеративными заболеваниями, такими как болезнь Паркинсона, болезнь Альцгеймера и ишемия. Наоборот, недостаточности осуществления апоптоза играют важную роль в развитии злокачественных новообразований и их резистентности к химиотерапии, в аутоиммунных заболеваниях, воспалительных заболеваниях и вирусных инфекциях. Следовательно, отсутствие апоптоза является одним из характерных фенотипических признаков злокачественного новообразования (Hanahan D. и др. Cell 2000, 100, 57-70).
Антиапоптозные белки семейства Bcl-2 связаны с многочисленными патологиями. Задействование белков семейства Bcl-2 описано для многочисленных видов злокачественных новообразований, таких как колоректальный рак, рак молочной железы, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак мочевого пузыря, рак яичников, рак предстательной железы, хронический лимфоидный лейкоз, фолликулярная лимфома, миелома, и т.д. Сверхэкспрессия антиапоптозных белков семейства Bcl-2 связана с онкогенезом, с устойчивостью к химиотерапии и с клиническим прогнозом пациентов, страдающих злокачественным новообразованием. Таким образом, существует терапевтическая потребность в соединениях, которые ингибируют антиапоптотическую активность белков семейства Bcl-2.
Помимо того, что соединения настоящего изобретения являются новыми, они обладают проапоптотическими свойствами, что позволяет их применение при патологиях, в которые вовлечен дефект апоптоза, как, например, для лечения злокачественного новообразования, аутоиммунных заболеваний и заболеваний иммунной системы.
Более конкретно, настоящее изобретение относится к соединениям формулы (I):

в которой:
- A1 и А2 каждый независимо от другого представляет собой водород или атом галогена, линейную или разветвленную (С1-С6) полигалогеналкильную группу, линейную или разветвленную (С1-С6) алкильную группу или циклоалкильную группу,
- Т представляет собой атом водорода, линейную или разветвленную (С1-С6) алкильную группу, необязательно замещенную одним-тремя атомами галогена, группу (C1-C4)алкил-NR1R2, или группу (С1-С4)алкил-OR6,
- R1 и R2 каждый независимо от другого представляет собой атом водорода или линейную или разветвленную (С1-С6) алкильную группу,
или R1 и R2 образуют с атомом азота, несущим их, гетероциклоалкил,
- R3 представляет собой линейную или разветвленную (C1-С6) алкильную группу, линейную или разветвленную (С2-С6) алкенильную группу, линейную или разветвленную (С2-С6) алкинильную группу, циклоалкильную группу, (С3-С10)циклоалкил-(С1-С6) алкильную группу, где алкильный фрагмент является линейным или разветвленным, гетероциклоалкильную группу, арильную группу или гетероарильную группу, при этом предполагается, что один или несколько атомов углерода предыдущих групп, или их возможных заместителей, могут быть дейтерированными,
- R4 представляет собой арильную группу, гетероарильную группу, циклоалкильную группу или линейную или разветвленную (С1-С6) алкильную группу, при этом предполагается, что один или несколько атомов углерода предыдущих групп, или их возможных заместителей, могут быть дейтерированными,
- R5 представляет собой водород или атом галогена, линейную или разветвленную (С1-С6) алкильную группу, или линейную или разветвленную (C1-С6) алкокси группу,
- R6 представляет собой атом водорода или линейную или разветвленную (С1-С6) алкильную группу,
- Ra, Rb, Rc и Rd каждый независимо от других представляет собой R7, атом галогена, линейную или разветвленную (С1-С6) алкокси группу, гидрокси группу, линейную или разветвленную (C1-С6) полигалогеналкильную группу, трифторметокси группу, группу , нитро, R7-СО-(С0-С6)алкил-, R7-CO-NH-(С0-С6)алкил-, , , R7-SO2-NH-(С0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил-, R7-O-СО-NH-(С0-С6)алкил-, гетероциклоалкильную группу, или заместители одной из пар (Ra, Rb), (Rb, Rc) или (Rc, Rd) образуют вместе с атомами углерода, несущими их, кольцо, состоящее из 5-7 кольцевых членов, которое может содержать от 1 до 2 гетероатомов, выбранных из кислорода и серы, при этом также предполагается, что один или несколько атомов углерода кольца, определенного выше, могут быть дейтерированными или замещенными 1-3 группами, выбранными из галогена и линейного или разветвленного (С1-С6)алкила,
- R7 и каждый независимо от другого представляет собой водород, линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, линейный или разветвленный (С2-С6)алкинил, арил или гетероарил, или R7 и , вместе с атомом азота, несущим их, образуют гетероцикл, состоящий из 5-7 кольцевых членов,
при этом предполагается, что:
- "арил" означает фенильную, нафтильную, бифенильную или инденильную группу,
- "гетероарил" означает любую моно- или бициклическую группу, состоящую из 5-10 кольцевых членов, имеющую по меньшей мере один ароматический фрагмент и содержащую от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота (включая четвертичные атомы азота),
- "циклоалкил" означает любую моно- или бициклическую, неароматическую, карбоциклическую группу, содержащую от 3 до 10 кольцевых членов,
- "гетероциклоалкил" означает любую моно- или бициклическую, неароматическую, конденсированную или спиро группу, состоящую из 3-10 кольцевых членов и содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы, SO, SO2 и азота,
причем арильные, гетероарильные, циклоалкильные и гетероциклоалкильные группы, таким образом определенные, и группы алкил, алкенил, алкинил и алкокси могут быть замещены посредством 1-3 групп, выбранных из необязательно замещенного, линейного или разветвленного (C1-С6)алкила, (С3-С6)спиро, необязательно замещенного, линейного или разветвленного (С1-С6)алкокси, (С1-С6)алкил-S-, гидрокси, оксо (или N-оксида, в соответствующих случаях), нитро, циано, -COOR', -OCOR', NR'R'', линейного или разветвленного (С1-С6)полигалогеналкила, трифторметокси, (C1-С6)алкилсульфонила, галогена, необязательно замещенного арила, гетероарила, арилокси, арилтио, циклоалкила, гетероциклоалкила, необязательно замещенного одним или несколькими атомами галогена или алкильными группами, при этом предполагается, что R' и R'' каждый независимо от другого представляет собой атом водорода или необязательно замещенную, линейную или разветвленную (С1-С6) алкильную группу,
к их энантиомерам и диастереоизомерам, и к их солям присоединения с фармацевтически приемлемой кислотой или основанием.
Среди фармацевтически приемлемых кислот могут быть упомянуты, без какого-либо ограничения, соляная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота, щавелевая кислота, метансульфоновая кислота, камфорная кислота и т.д.
Среди фармацевтически приемлемых оснований могут быть упомянуты, без какого-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д.
Преимущественно, A1 представляет собой атом водорода или метильную группу.
Кроме того, А2 предпочтительно представляет собой линейную или разветвленную (С1-С6) алкильную группу, необязательно замещенную группой, выбранной из галогена, гидрокси, линейной или разветвленной (С1-С6)алкокси, NR'R'' и морфолина.
В другом варианте осуществления изобретения, А2 представляет собой линейную или разветвленную (С1-С6) полигалогеналкильную группу или циклопропильную группу.
Еще более предпочтительно, А1 и А2оба представляют собой метильную группу.
В предпочтительном варианте осуществления изобретения, Т представляет собой линейный или разветвленный (С1-С6)алкил. В другом предпочтительном варианте, Т представляет собой группу алкил(C1-C4)-NR1R2 и, более конкретно, группу алкил(C1-C4)-NR1R2, где R1 и R2 образуют с атомом азота, несущим их, гетероциклоалкил.
В предпочтительных соединениях изобретения, Т представляет собой метильную, аминометильную, (морфолин-4-ил)метильную, (4-метилпиперазин-1-ил)метильную, 2-(морфолин-4-ил)этильную, [2-(морфолин-4-ил)этокси]метильную, гидроксиметильную, [2-(диметиламино)этокси]метильную, гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметильную, 1-окса-6-азаспиро[3.3]гепт-6-илметильную, 3-(морфолин-4-ил)пропильную или трифторметильную группу. Еще более предпочтительно, Т представляет собой (морфолин-4-ил)метильную, метильную или 3-(морфолин-4-ил)пропильную группу.
Предпочтительно, Ra и Rd каждый представляет собой атом водорода и (Rb, Rc), вместе с атомами углерода, несущими их, образуют 1,3-диоксолановую группу или 1,4-диоксановую группу; или Ra, Rc и Rd каждый представляет собой атом водорода и Rb представляет собой водород или атом галогена или метокси группу. Еще более предпочтительно, Ra и Rd каждый представляет собой атом водорода и (Rb, Rc), вместе с атомами углерода, несущими их, образуют 1,3-диоксолановую группу; или Ra, Rc и Rd каждый представляет собой атом водорода и Rb представляет собой галоген, предпочтительно атом хлора или фтора.
В другом варианте осуществления изобретения, Ra и Rd каждый представляет собой атом водорода, Rb представляет собой водород или атом галогена и Rc гидрокси или метокси группу, или: Ra и Rd каждый представляет собой атом водорода, Rb представляет собой гидрокси или метокси группу и Rc атом галогена.
Альтернативно, Ra, Rb и Rd преимущественно каждый представляет собой атом водорода и Rc представляет собой группу, выбранную из групп R7-CO-NH-(С0-С6)алкил-, R7-SO2-NH-(С0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил- и R7-O-СО-NH-(С0-С6)алкил-. Для таких особых соединений, R3 предпочтительно представляет собой линейный или разветвленный (С1-С6)алкил или гетероарил, необязательно замещенный линейным или разветвленным (С1-С6)алкилом, и R4 представляет собой 4-гидроксифенильную группу. Еще более предпочтительно, R3 представляет собой метил.
Предпочтительными группами R4 являются следующие: фенил; 4-гидроксифенил; 3-фтор-4-гидроксифенил; 2-гидроксипиримидин; 3-гидроксипиридин. Еще более предпочтительно, R4 представляет собой 4-гидроксифенильную группу.
В предпочтительных соединениях изобретения, R3 представляет собой линейную или разветвленную (С1-С6) алкильную группу (предпочтительно метил), арил или гетероарил, все необязательно замещенные. Арильные и гетероарильные группы являются особенно предпочтительными. В заключение, R3 предпочтительно представляет собой группу, выбранную из фенила, 1Н-пиразола, 1H-индола, 1H-индазола, пиридина, пиримидина, 1H-пирроло[2,3-b]пиридина, 2,3-дигидро-1H-пирроло[2,3-b]пиридина, 1H-бензимидазола, 1Н-пиррола, 1H-пирроло[2,3-с]пиридина, 1H-пирроло[3,2-b]пиридина, 5Н-пирроло[3,2-d]пиримидина, тиофена, пиразина, 1H-пиразоло[3,4-b]пиридина, 1,2-оксазола, и 1H-пиразоло[1,5-а]пиримидина, причем эти группы необязательно имеют один или несколько заместителей, выбранных из галогена, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкокси, циано, циклопропила, оксетана, тетрагидрофурана, -СО-О-СН3, тридейтерометила, 2-(морфолин-4-ил)этила и 2-(морфолин-4-ил)этокси. Более предпочтительно, R3 представляет собой группу 1-метил-1H-пиразол-4-ил, пиридин-4-ил, 1-метил-1H-пирроло[2,3-b]пиридин-5-ил, 5-циано-1-метил-1Н-пиррол-3-ил, 5-циано-1,2-диметил-1H-пиррол-3-ил, 1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил, 5-циано-2-метил-1-(тридейтерометил)-1H-пиррол-3-ил.
Предпочтительные соединения в соответствии с изобретением включены в следующую группу:
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1Н-пиррол-3-карбоксамид,
- N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид,
- N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пиразол-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- N-(5-циано-1-метил-1H-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид,
- N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[5-циано-2-метил-1-(тридейтерометил)-1H-пиррол-3-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
их энантиомеры и диастереоизомеры, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
Изобретение относится также к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используют соединение формулы (II):
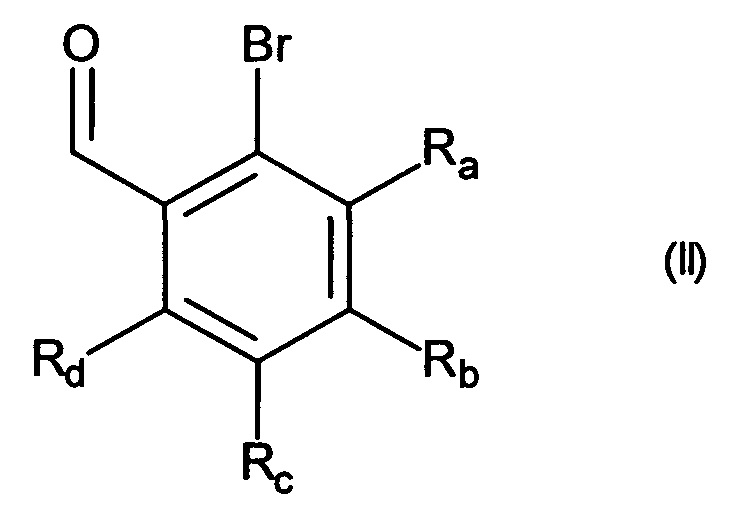
в которой Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I),
причем указанное соединение формулы (II) подвергают реакции Хека, в водной или органической среде, в присутствии палладиевого катализатора, основания, фосфина и соединения формулы (III):
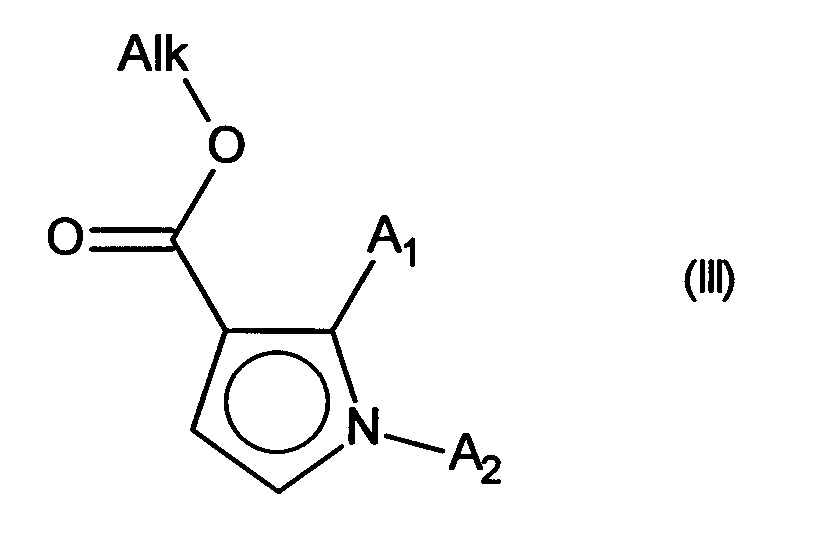
в которой группы A1 и А2 принимают значения, определенные для формулы (I) и Alk представляет собой линейный или разветвленный (С1-С6)алкил,
с получением соединения формулы (IV):
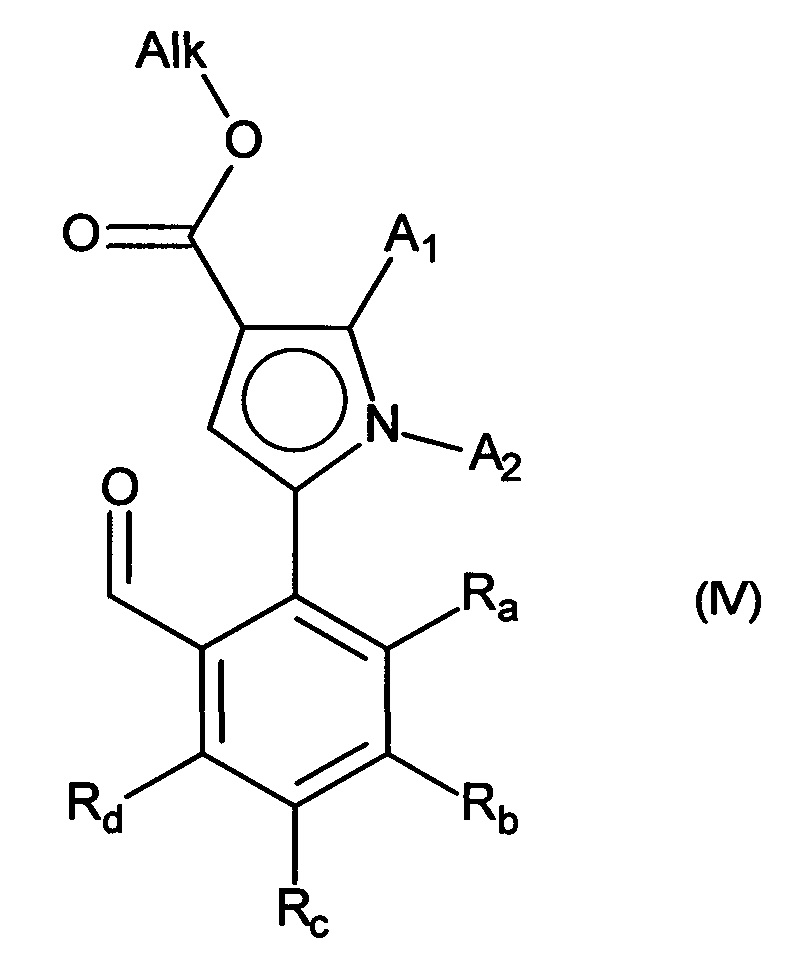
в которой A1, A2, Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I) и Alk принимает значения, определенные выше,
альдегидную функцию указанного соединения формулы (IV) окисляют до карбоновой кислоты с образованием соединения формулы (V):

в которой A1, А2, Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I) и Alk принимает значения, определенные выше,
указанное соединение формулы (V) затем подвергают пептидному сочетанию с соединением формулы (VI):
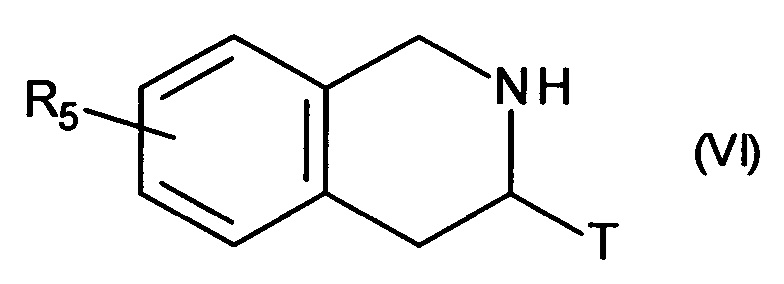
в которой Т и R5 принимают значения, определенные для формулы (I),
с получением соединения формулы (VII):

в которой A1, А2, Ra, Rb, Rc, Rd, T и R5 принимают значения, определенные для формулы (I), и Alk принимает значения, определенные выше,
сложноэфирную функцию указанного соединения формулы (VII) гидролизуют с получением соответствующей карбоновой кислоты или карбоксилата, которую(-ый) можно превратить в производное по кислотной группе, такое как соответствующий ацилхлорид или ангидрид, перед сочетанием с амином NHR3R4, где R3 и R4 имеют те же значения, что и для формулы (I), с получением соединения формулы (I),
указанное соединение формулы (I) может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделено на его изомеры в соответствии с обычными методами разделения,
при этом предполагается, что в любое время, признанное подходящим в ходе описанного выше способа, определенные группы (гидрокси, амино…) реагентов или промежуточных соединений синтеза могут быть защищены и затем лишены защиты в соответствии с требованиями синтеза.
Более конкретно, когда одна из групп R3 или R4 амина NHR3R4 замещена гидроксильной функцией, последнюю можно заранее подвергнуть реакции защиты, перед любым сочетанием с карбоновой кислотой, образованной из соединения формулы (VII), или с ее соответствующим производным по кислотной группе, причем получающееся защищенное соединение формулы (I) впоследствии подвергают реакции снятия защиты и затем необязательно превращают в одну из его солей присоединения с фармацевтически приемлемой кислотой или основанием.
Настоящее изобретение также относится к альтернативному способу получения соединений формулы (I'), которые являются частными случаями соединений формулы (I), как определено выше:

в которой:
- A1, А2, Ra, Rd, R3, R4, Т и R5 принимают значения, определенные для формулы (I),
- Rb и Rc являются такими, что одна группа представляет собой водород, а другую группу выбирают из группы R7-СО-NH-(С0-С6)алкил-, R7-SO2-NH-(C0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил- и R7-O-СО-NH-(С0-С6)алкил-,
причем в указанном способе получения в качестве исходного вещества используют соединение формулы (II'):

в которой:
- Ra и Rd принимают значения, определенные для формулы (I),
- Hal представляет собой атом галогена,
- X1 и X2 являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (II') подвергают пептидному сочетанию с соединением формулы (VI):

в которой Т и R5 принимают значения, определенные для формулы (I),
с получением соединения формулы (III'):
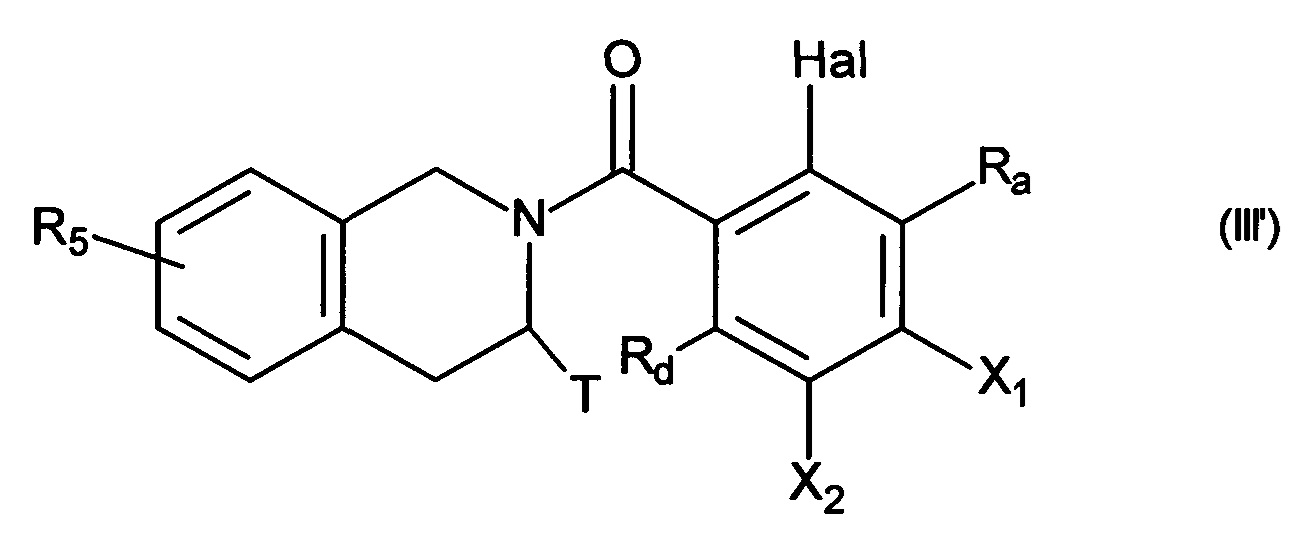
в которой:
- Ra, Rd, Т и R5 принимают значения, определенные для формулы (I),
- Hal представляет собой атом галогена,
- X1 и Х2 являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (III') подвергают реакции Хека, в водной или органической среде, в присутствии палладиевого катализатора, основания, фосфина и соединения формулы (IV'):

в которой A1, A2, R3 и R4 принимают значения, определенные для формулы (I),
с образованием соединения формулы (V'):

в которой:
- A1, А2, Ra, Rd, R3, R4, Т и R5 принимают значения, определенные для формулы (I),
- X1 и Х2, являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (V') затем подвергают реакции ацилирования или сульфонилирования с получением соединения формулы (I'),
указанное соединение формулы (I') может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделено на его изомеры в соответствии с обычными методами разделения,
при этом предполагается, что, в любое время, признанное подходящим в ходе описанного выше способа, определенные группы (гидрокси, амино…) реагентов или промежуточных соединений синтеза могут быть защищены и затем лишены защиты в соответствии с требованиями синтеза.
Соединения формул (II), (III), (II'), (IV'), (VI) и амин NHR3R4 либо доступны для приобретения могут быть получены специалистом в данной области техники с использованием обычных химических реакций, описанных в литературы.
Фармакологическое исследование соединений настоящего изобретения показало, что они обладают проапоптотическими свойствами. Способность реактивировать процесс апоптоза в раковых клетках имеет большой терапевтический интерес для лечения злокачественных новообразований, аутоиммунных заболеваний и заболеваний иммунной системы.
Более конкретно, соединения в соответствии с изобретением будут полезны для лечения хемо- или радиорезистентных злокачественных новообразований, и при злокачественных заболеваниях крови и мелкоклеточном раке легкого.
Среди намеченных для лечения злокачественных заболеваний могут быть упомянуты, без какого-либо ограничения, рак мочевого пузыря, головного мозга, молочной железы и матки, хронические лимфоидные лейкозы, колоректальный рак, рак пищевода и печени, лимфобластные лейкозы, неходжкинские лимфомы, меланомы, злокачественные заболевания крови, миеломы, рак яичников, немелкоклеточный рак легкого, рак предстательной железы и мелкоклеточный рак легкого. Среди неходжкинских лимфом, более предпочтительно, могут быть упомянуты фолликулярные лимфомы, лимфомы из клеток мантийной зоны, диффузные В-крупноклеточные лимфомы, мелкоклеточные лимфоцитарные лимфомы и В-клеточные лимфомы из клеток маргинальной зоны.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение формулы (I) в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями.
Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты особенно те, которые подходят для перорального, парентерального, назального, чрес- или транскожного, ректального, перлингвального, офтальмологического или респираторного введения, главным образом таблетки или драже, сублингвальные таблетки, саше, пакеты, капсулы, глоссеты, лепешки, суппозитории, кремы, мази, кожные гели, и питьевые или инъекционные ампулы.
Дозировка варьируется в зависимости от пола, возраста и веса пациента, пути введения, природы терапевтического показания, или каких-либо связанных лечений, и находится в диапазоне от 0.01 мг до 1 г в 24 часа за одно или несколько введений.
Кроме того, настоящее изобретение также относится к ассоциации соединения формулы (I) с противоопухолевым средством, выбранным из генотоксичных средств, митотических ядов, антиметаболитов, ингибиторов протеосом, ингибиторов киназ и антител, а также к фармацевтическим композициям, содержащим такой тип ассоциации, и к их применению для изготовления лекарственных средств для применения для лечения злокачественного новообразования.
Соединения настоящего изобретения также могут применяться в ассоциации с радиотерапией для лечения злокачественного новообразования.
В заключение, соединения настоящего изобретения могут быть связаны с моноклональными антителами или их фрагментами, или связаны с каркасными белками, которые могут относиться или не относиться к моноклональным антителам.
Фрагменты антител следует понимать как фрагменты Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc типа или диатела, которые обычно имеют такую же специфичность связывания, что и антитело из которого они происходят. В соответствии с настоящим изобретением, фрагменты антител изобретения могут быть получены исходя из антител с помощью методов, таких как переваривание ферментами, такими как пепсин или папаин, и/или посредством расщепления дисульфидных мостиков с помощью химического восстановления. Другим образом, фрагменты антител по настоящему изобретению могут быть получены с использованием методик генетической рекомбинации также хорошо известных специалисту в данной области техники или даже посредством пептидного синтеза с помощью, например, автоматических пептидных синтезаторов, таких как те, которые поставляются компанией Applied Biosystems, и т.д.
Под каркасными белками, которые могут относиться или не относиться к моноклональным антителам, следует понимать белок, который содержит или не содержит укладку цепи иммуноглобулинов и который обеспечивает способность к связыванию такую же, как и у моноклонального антитела. Специалисту в данной области техники известно, каким образом выбрать каркас белка. Более конкретно, известно, что должен быть выбран такой каркас, который будет демонстрировать несколько следующих отличительных признаков (Skerra A., J. Mol. Recogn., 13, 2000, 167-187): хорошая филогенетическая консервативность, прочная архитектура с известной трехмерной молекулярной организацией (как, например, на основании кристаллографии или ЯМР), небольшой размер, отсутствие или лишь низкая степень посттрансляционных модификаций, простота получения, экспрессии и очистки. Таким каркасным белком может быть, без ограничения перечисленным, структура, выбранная из группы, состоящей из фибронектина и предпочтительно 10-го домена фибронектина типа III (FNfn10), липокалина, антикалина (Skerra A., J. Biotechnol., 2001, 74(4): 257-75), белка Z, производного из домена В стафилококкового белка А, тиоредоксина А или любого белка с повторяющимся доменом, таким как "анкириновый повтор" (Kohl и др., PNAS, 2003, т. 100, №4, 1700-1705), "армадилло повтор", "богатый лейцином повтор" или "тетратрикопептидный повтор". Также можно упомянуть каркас, производный от токсинов (таких как, например, токсины скорпионов, насекомых, растений или моллюсков) или белковых ингибиторов нейрональной синтазы оксида азота (PIN).
Следующие методики получения и примеры иллюстрируют изобретение, не ограничивая его каким-либо образом.
Методика получения 1: 4-Хлор-2-[4-(этоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Стадия А: Этил 1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 10 г этил 2-метил-1H-пиррол-3-карбоксилата (65.3 ммоль) и 8.95 мл (130.6 ммоль) метилйодида в 70 мл диметилформамида, помещенному на баню с температурой 0°С, добавляют, тремя порциями, 2.61 г (65.3 ммоль) 60%-ного гидрида натрия (NaH). Загрузочную порцию затем перемешивают при 0°С в течение 1 часа. Затем, реакционную смесь гидролизуют путем добавления 420 мл ледяной воды. Реакционную смесь затем разбавляют этилацетатом, последовательно промывают 0.1М водным раствором соляной кислоты (HCl), насыщенным водным раствором LiCl и затем соляным раствором. Органическую фазу затем сушат над MgSO4, фильтруют, концентрируют досуха и очищают с помощью хроматографии на силикагеле (градиент петролейный эфир/AcOEt).
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 6.65 (d, 1H пиррол); 6.3 (1d, 1H пиррол); 4.1 (1q, 2H, ОСН2СН3); 3.5 (s, 3H N-пиррол); 2.4 (s, 3H пиррол); 1.5 (1t, 3Н ОСН2СН3)
ИК: v: >С=O: 1688 см-1; v: С-О-С: 1172 см-1
Стадия В: Этил 5-(5-хлор-2-формилфенил)-1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 10.5 г соединения, полученного на стадии А, (62.8 ммоль) в 65 мл N-диметилацетамида последовательно добавляют 15.2 г 2-бром-4-хлорбензальдегида (69 ммоль), 12.3 г ацетата калия (125.6 ммоль), и затем загрузочную порцию перемешивают под аргоном в течение 20 минут. К ней затем добавляют 2.2 г палладиевого катализатора PdCl2(PPh3)2 (3.14 ммоль). Реакционную смесь затем нагревают при 130°С в течение ночи. Температуре смеси позволяют вернуться к температуре окружающей среды, и смесь затем разбавляют дихлорметаном. Добавляют животный уголь (2 г на г продукта), и загрузочную порцию перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют. Органическую фазу затем промывают водой, сушат над MgSO4 и концентрируют досуха. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле (градиент петролейный эфир/AcOEt). Указанный в заголовке продукт получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 9.8 (s, 1H, формил); 7.91-7.69-7.61 (d, 3Н, ароматические Н); 6.5 (s, 1H пиррол); 4.2 (q, 2H, OCH2CH3); 3.4 (s, 3H, СН3-N-пиррол); 2.55 (s, 3Н пиррол); 1.28 (t, 3H, ОСН2СН3)
Стадия С: 4-Хлор-2-[4-(этоксикарбонил)-1,5-диметил-1Н-пиррол-2-ил]бензойная кислота
Получают раствор, содержащий 12.85 г соединения, полученного на стадии В, (42 ммоль) и 35.7 мл (336 ммоль) 2-метил-2-бутена в смеси, содержащей 20 мл ацетона и 20 мл тетрагидрофурана. К нему по каплям добавляют 200 мл водного раствора, содержащего смесь 13.3 г хлорита натрия (NaClO2) (147 ммоль) и 14.5 г вторичного кислого фосфата натрия (NaHPO4) (105 ммоль). Загрузочную порцию затем энергично перемешивают при температуре окружающей среды в течение 7 часов. Реакционную смесь затем концентрируют для удаления ацетона. Добавляют этилацетат, и органическую фазу промывают водой, сушат над MgSO4 и затем концентрируют досуха. Остаток затем переносят в минимальное количество этилового эфира. Полученное твердое вещество затем отфильтровывают, промывают эфиром и затем сушат в вакууме при 40°С в течение ночи. Указанный в заголовке продукт получают в виде твердого вещества, которое впоследствии используют без очистки иным способом.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 13 (m, 1H СООН); 7.85-7.6-7.41 (d,dd, wd, 3Н, ароматические Н); 6.3 (s, 1H, Н пиррол); 4.15 (q, 2H, ОСН2СН3); 3.25 (s, 3Н, СН3-N-пиррол); 2.5 (s, 3Н, СН3-пиррол); 1.25 (t, 3Н, ОСН2СН3)
ИК: v: -ОН: 3100-2500 см-1 кислота; v: >С=O: 1681 см-1 сложный эфир + кислота
Методика получения 2: 2-[4-(Этоксикарбонил)-1-метил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бромбензальдегид.
Методика получения 3: 4-Хлор-2-[4-(этоксикарбонил)-1-метил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат.
Методика получения 4: 6-[4-(Этоксикарбонил)-1-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 1, с заменой, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, 2-бром-4-хлорбензальдегида, используемого на стадии В, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
ИК: v: -ОН: 3500-2300 см-1 кислота; v: >С=O: 1688-1670 см-1 сложный эфир + кислота
Методика получения 5: 4-Хлор-2-[4-(этоксикарбонил)-1-этил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на этилйодид (см. протокол, описанный в US 6,258,805 B1).
Методика получения 6: 4-Хлор-2-[1-циклопропил-4-(этоксикарбонил)-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на циклопропилбороновую кислоту (см. протокол, описанный в Benard S. и др. Journal of Organic Chemistry 73(16), 6441-6444, 2008).
Методика получения 7: 4-Хлор-2-[4-(этоксикарбонил)-1-(пропан-2-ил)-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на изопропилйодид (см. протокол, описанный в Okada E. и др., Heterocycles 34(7), 1435-1441, 1992).
Методика получения 8: 4-Фтор-2-(4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бром-4-фторбензальдегид.
ИК: v: -ОН: 2727-2379 см-1 кислота; v: >С=O: 1687 см-1
Методика получения 9: 6-{1-(2-(Бензилокси)этил]-4-(этоксикарбонил)-5-метил-1H-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Этил 1-[2-(бензилокси)этил]-2-метил-1Н-пиррол-3-карбоксилат
Методика соответствует способу стадии А методики получения 1, с заменой метилйодида, используемого в качестве алкилирующего агента, на бензил 2-бромэтиловый эфир.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.32 (t, 2H, ароматические Н, Н мета бензиловый эфир); 7.3 (t, 1H, ароматический Н, Н пара бензиловый эфир); 7.23 (d, 2H, ароматические Н, Н орто бензиловый эфир); 6.72 (d, 1H, Н-пиррол); 6.35 (d, 1H, Н- пиррол); 4.48 (s, 2H, алифатические Н, О-СН2-Ph); 4.15 (q, 2H, алифатические Н, О-СН2-СН3); 4.1 (t, 2H, алифатические Н, CH2-O-CH2-Ph); 3.7 (t, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 2.45 (s, 3Н, СН3- пиррол); 1.25 (t, 3Н, алифатические Н, O-СН2-СН3)
ИК: v: >C=O: 1689 см-1
Стадия В: 6-{1-[2-(Бензилокси)этил]-4-(этоксикарбонил)-5-метил-1Н-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует способам стадий В и С методики получения 1, с заменой 2-бром-4-хлорбензальдегида на 6-бром-1,3-бензодиоксол-5-карбальдегид.
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.35 (s, 1H, ароматический Н, Н бензодиоксол); 7.30 (m, 3Н, ароматические Н, Н бензиловый эфир); 7.25 (s, 1H, ароматический Н, Н бензодиоксол); 7.10 (d, 2H, ароматические Н, Н орто бензиловый эфир); 12.55 (широкий s, 1H, СООН); 6.75 (s, 1H, Н-пиррол); 6.15 (широкий s, 2H, алифатические Н, О-СН2-О); 4.30 (s, 2H, алифатические Н, O-CH2-Ph); 4.15 (q, 2H, алифатические Н, О-СН2-СН3); 3.9 (m, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 3.40 (t, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 2.50 (s, 3Н, СН3- пиррол); 1.25 (t, 3Н, алифатические Н, О-СН2-СН3)
ИК: v: -ОН: 3200-2300 см-1 кислота; v: >С=O: 1687 см-1 кислота
Методика получения 10: 2-{1-[3-(Бензилокси)пропил]-4-(этоксикарбонил)-5-метил-1H-пиррол-2-ил}-4-фторбензойная кислота
Методика соответствует методике получения 9, с заменой бензил 2-бромэтилового эфира, используемого на стадии А, на бензил 3-бромпропиловый эфир, а также 6-бром-1,3-бензодиоксол-5-карбальдегида, используемого на стадии В, на 2-бром-4-фторбензальдегид.
ИК: v: -ОН: 3200-2305 см-1 кислота; v: >С=O: 1690 см-1 кислота
Методика получения 11: 6-[4-(Этоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии В, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 12: 4-Метокси-2-[4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бром-4-метоксибензальдегид.
ИК: v: -ОН: 3000-2500 см-1 кислота; v: >С=O: 1693+1670 см-1 кислота + сложный эфир
Методика получения 13: 7-(4-(Метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]-2,3-дигидро-1,4-бензодиоксин-6-карбоновая кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 7-бром-2,3-дигидро-1,4-бензодиоксин-6-карбальдегид.
ИК: v: -ОН: 3100-2500 см-1 кислота; v: >С=O: 1690+1674 см-1 кислота + сложный эфир
Методика получения 14: 4-Фтор-5-метокси-2-[4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бром-4-фтор-5-метоксибензальдегид.
Методика получения 15: 4-Фтор-5-гидрокси-2-[4-(метоксикарбонил)-1,5-диметил-1Н-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бром-4-фтор-5-гидроксибензальдегид.
Методика получения 16: 6-[4-(Этоксикарбонил)-1-метил-5-трифторметил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на этил 2-(трифторметил)-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 17: 6-[4-(Этоксикарбонил)-1-этил-5-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 11, с заменой метилйодида на этилйодид (см. протокол, описанный в US 6,258,805 B1).
Методика получения 18: 6-[4-(Этоксикарбонил)-1-метил-5-(трифторметил)-1H-пиррод-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Этил 1-метил-2-(трифторметил)пиррол-3-карбоксилат
Этил 4,4,4-трифтор-3-оксобутаноат (29 мл, 0.219 ммоль) добавляют к метиламину (40%-ному раствору в воде) (50 мл, 0.580 ммоль), охлажденному до 10°С; образуется белый осадок. По каплям добавляют 1,2-дибромэтилацетат (получен в соответствии с Molecules, 16, 9368-9385; 2011). Реактор затем герметизируют и нагревают при 70°С в течение 45 минут. Реакционную смесь охлаждают, затем экстрагируют этилацетатом, сушат над сульфатом натрия (Na2SO4) и упаривают досуха. Полученный сырой продукт реакции очищают с помощью хроматографии на силикагеле, используя гептан и этилацетат в качестве элюантов. Ожидаемое соединение получают в виде кристаллов.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.11 (d, 1H), 6.52 (d, 1H), 4.21 (quad, 2H), 3.8 (s, 3H), 1.27 (t, 3H)
19F ЯМР (400 МГц, дмсо-d6) δ м.д.: -53.9
ИК (АТР) см-1: 3145+312S v -CH, 1711 v >C=O, 1183+1117+1078 v -CF3
Стадия В: 6-[4-(Этоксикарбонил)-1-метил-5-(трифторметил)-1Н-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует протоколу, описанному на стадиях В и С методики получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии В, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 19: 6-[1-(2-Бензилоксиэтил)-4-этоксикарбонил-5-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Этил 1-(2-бензилоксиэтил)-2-метилпиррол-3-карбоксилат
Этил 2-метил-1H-пиррол-3-карбоксилат (10 г, 65.3 ммоль) растворяют в 100 мл диметилформамида под аргоном, охлажденного до 0°С, и затем весь сразу добавляют 2-бромэтоксиметилбензол (28.1 г, 130.6 ммоль). Осуществляют перемешивание реакционной смеси. Затем, при 0°С, тремя порциями к ней в течение 15 минут добавляют NaH (1.72 г, 71.83 ммоль). Реакционную смесь перемешивают в течение 15 минут при 0°С, и затем в течение 15 часов при температуре окружающей среды. Смесь затем выливают на ледяную баню и затем 3 раза экстрагируют этилацетатом. Органическую фазу промывают 3 раза насыщенным водным раствором хлорида лития, сушат над MgSO4, фильтруют и затем упаривают досуха. Полученный таким образом остаток очищают с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов. Ожидаемое соединение получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.32 (t, 2Н), 7.3 (t, 1H), 7.23 (d, 2H), 6.72 (d, 1H), 6.35 (d, 1H), 4.48 (s, 2H), 4.15 (quad., 2H), 4.1 (t, 2H), 3.7 (t, 2H), 2.45 (s, 3H), 1.25 (t, 3H)
ИК (ATR) см-1: 1689 v -C=O
Стадия В: Этил 1-(2-бензилоксиэтил)-5-(6-формил-1,3-бензодиоксол-5-ил)-2-метилпиррол-3-карбоксилат
Методика соответствует способу стадии В методики получения 1, с заменой 2-бром-4-хлорбензальдегида на 6-бром-1,3-бензодиоксол-5-карбальдегид.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 9.5 (s, 1H), 7.3 (s, 1H), 7.25 (m, 3H), 7.05 (m, 2H), 7 (s, 1H), 6.4 (s, 1H), 6.2 (bs, 2H), 4.25 (s, 2H), 4.2 (quad, 2H), 4.05 (m, 2H), 3.4 (m, 2H), 2.55 (s, 3H), 1.25 (t, 3H)
Стадия С: 6-[1-(2-Бензилоксиэтил)-4-этоксикарбонил-5-метил-1Н-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует способу стадии С методики получения 1.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.55 (bs, 1H), 7.35 (s, 1H), 7.3 (m, 3H), 7.2 (m, 3H), 6.75 (s, 1H), 6.15 (s, 2H), 4.3 (s, 2H), 4.15 (quad., 2H), 3.9 (m, 2H), 3.4 (t, 2H), 2.5 (s, 3H), 1.25 (t, 3H)
ИК (ATR) см-1: 3200-2300 v -ОН, 1687 (+ плечо) v -C=O карбоновая кислота + сопряженный сложный эфир
Методика получения 20: 6-[4-(Этоксикарбонил)-1-этил-5-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует протоколу, описанному в методике получения 11, с заменой метилйодида на этилйодид.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.49 (bs, 1H), 7.33 (s, 1H), 6.89 (s, 1H), 6.17 (s, 2H), 6.13 (s, 1H), 4.15 (quad, 2H), 3.69 (quad, 2H), 2.51 (s, 3H), 1.24 (t, 3H), 1.01 (t, 3H)
Методика получения 21: 6-[4-(Этоксикарбонил)-1-(2-фторэтил)-5-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 11, с заменой метилйодида на 1-бром-2-фторэтан.
1H ЯМР (400 МГц, дмсо-d6, 300K) δ м.д.: 12.53 (bs, 1H), 7.34 (s, 1H), 6.9 (s, 1H), 6.16 (s, 1H), 6.16 (s, 2H), 4.4 (dt, 2H), 4.15 (quad, 2H), 4.01 (m, 2H), 2.51 (s, 3H), 1.24 (t, 3H)
19F ЯМР (400 МГц, дмсо-d6, 300K) δ м.д.: -222
ИК: v: -ОН: 3700-2400 см-1 кислота; v: >С=O: 1689 см-1 кислота; v: >CF: 1213 см-1
Методика получения 22: 6-{4-(Этоксикарбонил)-1-метил-5-[2-(морфолин-4-ил)этил]-1H-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: 3,3-Диэтоксипропановая кислота
К раствору 25 г этил 3,3-диэтоксипропионата (131 ммоль) в 79 мл метанола добавляют 13.1 мл 35%-ного водного раствора гидроксида натрия (452 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов. Реакционную смесь затем концентрируют для удаления метанола. После растворения нерастворенного вещества путем добавления воды, добавляют водный 5 н. раствор HCl до достижения значения pH 5. Добавляют дихлорметан и затем органическую фазу промывают соляным раствором. После сушки над MgSO4 и концентрирования досуха, указанный в заголовке продукт получают в виде масла, которое используют на следующей стадии без очистки иным способом.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.2 (s, 1Н), 4.8 (t, 1Н), 3.58/3.47 (2m, 4Н), 2.5 (d, 2Н), 1.09 (t, 6H)
Стадия В: Этил 5,5-диэтокси-3-оксопентаноат
К раствору 16 мл 3-этокси-3-оксомалоновой кислоты (135 ммоль) в 40 мл тетрагидрофурана добавляют, под аргоном, 21.9 г порошкообразного магния (90.4 ммоль). Полученную смесь затем нагревают при 80°С в течение 7 часов. После возвращения к температуре окружающей среды, эту смесь переносят с помощью канюли в раствор 10 г соединения, полученного на стадии А, (61.7 ммоль) в 64 мл тетрагидрофурана, к которому предварительно было порциями добавлено 11 г карбонилдиимидазола (66 ммоль). Реакционную смесь перемешивают в течение 3 дней при температуре окружающей среды. После концентрирования остаток переносят в смесь этилацетата и водного раствора бисульфата натрия (NaHSO4). Смесь энергично перемешивают до прекращения выделения газа. После разделения фаз, органическую фазу последовательно промывают водой, насыщенным водным раствором NaHCO3 и в заключение соляным раствором. После сушки над MgSO4 и концентрирования досуха, указанный в заголовке продукт получают в виде масла, которое используют на следующей стадии без очистки иным способом.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 4.84 (t, 1Н), 4.08 (q, 2Н), 3.59 (s, 2Н), 3.56/3.46 (2m, 4Н), 2.8 (d, 2Н), 1.18 (t, 3Н), 1.09 (t, 6Н)
Стадия С: Этил 2-(2,2-диэтоксиэтил)-1-метилпиррол-3-карбоксилат
К раствору 11.8 г соединения, полученного на стадии В, (50.8 ммоль) в 76 мл воды добавляют, по каплям при 0°С, 6.6 мл водного 40%-ного раствора метиламина (76.2 ммоль). Реакционную смесь перемешивают и осторожно повторно нагревают до температуры окружающей среды в течение 5 часов. После возвращения до 0°С, добавляли 8.8 мл водного 40%-ного раствора метиламина (102 ммоль) и затем 16.6 мл водного 50%-ного раствора хлорацетальдегида (127 ммоль), каждого по каплям при температуре ниже 10°С. Реакционную смесь перемешивают при температуре окружающей среды в течение 16 часов и затем разбавляют этилацетатом. Органическую фазу промывают соляным раствором, сушат над MgSO4 и концентрируют досуха. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов. Указанный в заголовке продукт получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.7 (d, 1H), 6.33 (d, 1H), 4.55 (t, 1H), 4.15 (q, 2H), 3.6 (m, 2H), 3.6 (s, 3H), 3.3 (m, 2H), 3.15 (d, 2H), 1.25 (t, 3H), 1.05 (t, 6H)
Стадия D: Этил 1-метил-2-(2-морфолиноэтил)пиррол-3-карбоксилат
К раствору 3.8 г соединения, полученного на стадии C, (14.05 ммоль) в 28 мл тетрагидрофурана добавляют 58 мл водного 10%-ного раствора серной кислоты. Реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов и затем разбавляют смесью этилацетата и воды. После отделения, органическую фазу промывают соляным раствором, сушат над MgSO4 и концентрируют досуха. К раствору полученного таким образом остатка в 70 мл дихлорэтана добавляют раствор 13.5 мл морфолина (14.5 ммоль) в смеси, состоящей из 30 мл дихлорэтана и 3.6 мл 4 н. водного раствора HCl в диоксане (14.5 ммоль), и затем 7.4 г триацетоксиборогидрида натрия (NaBH(OAc)3) (35.13 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 часов и затем разбавляют смесью дихлорметана и насыщенного водного раствора NaHCO3. После разделения фаз и экстрагирования водной фазы дихлорметаном, органические фазы сушат над MgSO4 и концентрируют досуха. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Указанный в заголовке продукт выделяют в виде масла.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.66 (d, 1H), 6.31 (d, 1H), 4.14 (q, 2H), 3.58 (s, 3H), 3.57 (m, 4 H), 3.05 (m, 2H), 2.45-2.38 (m, 6H), 1.24 (t, 3H)
Стадия Е: 6-{4-(Этоксикарбонил)-1-метил-5-[2-(морфолин-4-ил)этил]-1Н-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует стадиям B и C методики получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 23: 6-[4-(Этоксикарбонил)-1-метил-5-(морфолин-4-илметил)-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Этил 4,4-диэтокси-3-оксобутаноат
К раствору 40 г этилдиэтоксиацетата (227 ммоль) в 67 мл этилацетата под аргоном порциями добавляют 6 г натрия (261 ммоль). Реакционную смесь затем перемешивают при температуре окружающей среды в течение 48 часов. Добавляют 10 мл метанола, и затем смесь гидролизуют с помощью 65 мл воды. Значение рН реакционной смеси доводят до pH 6 путем добавления 1 н. водного раствора HCl. Смесь разделяют и затем экстрагируют этилацетатом. Органические фазы объединяют, промывают соляным раствором, сушат над MgSO4, фильтруют и концентрируют досуха. Указанный в заголовке продукт получают в виде масла, которое используют на следующей стадии без очистки иным способом.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3.6 (s, 2H), 1.28 (t, 9H), 3.7-3.6 (2m, 4H), 4.7 (s, 1H), 4.2 (quad, 2H)
Стадия B: Этил 2-(2,2-диэтоксиметил)-1-метилпиррол-3-карбоксилат
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии C методики получения 22, исходя из этил 4,4-диэтокси-3-оксобутаноата, полученного на предыдущей стадии.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.73 (d, 1H), 6.32 (d, 1H), 6.23 (s, 1H), 4.17 (q, 2H), 3.7 (s, 3H), 3.68/3.43 (2m, 4H), 1.26 (t, 3H), 1.13 (t, 6H)
Стадия C: Этил 1-метил-2-(2-морфолинометил)пиррол-3-карбоксилат
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии D методики получения 22, исходя из этил 2-(2,2-диэтоксиметил)-1-метилпиррол-3-карбоксилата, полученного на предыдущей стадии.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.74 (d, 1H), 6.32 (d, 1H), 4.15 (q, 2H), 3.8 (s, 2H), 3.65 (s, 3H), 3.5 (m, 4H), 2.32 (m, 4H), 1.22 (t, 3H)
Стадия D: 6-[4-(Этоксикарбонил)-1-метил-5-(морфолин-4-илметил)-1Н-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует протоколу, описанному на стадиях B и C методики получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 24: 6-[4-(Метоксикарбонил)-5-(2-метоксиэтил)-1-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Метил 2-(2-метоксиэтил)-1-метилпиррол-3-карбоксилат
Указанное в заголовке соединение получают в соответствии с протоколом стадии C методики получения 22 с использованием метил 5-метокси-3-оксовалерата.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.69 (wd, 1H), 6.31 (wd, 1H), 3.69 (s, 3H), 3.59 (s, 3H), 3.49 (t, 2H), 3.2 (s, 3H), 3.11 (t, 2H)
Стадия B: 6-[4-(Метоксикарбонил)-5-(2-метоксиэтил)-1-метил-1Н-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует протоколу, описанному на стадиях B и C методики получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
Методика получения 25: 2-[4-(Этоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 2-бромбензальдегид.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.81 (m, 1H), 7.84 (m, 1H), 7.59 (m, 1H), 7.51 (m, 1H), 7.35 (m, 1H), 6.23 (s, 1H), 4.16 (q, 2H), 3.24 (s, 3H), 2.5 (s, 3H), 1.25 (t, 3H)
Методика получения 26: 5-Фтор-2-[4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии A этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии B, на 2-бром-5-фторбензальдегид.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.6 (dd, 1H), 7.42 (m, 2H), 6.22 (s, 1H), 4.15 (q, 2H), 3.21 (s, 3H), 2.5 (s, 3H), 1.23 (t, 3H)
19F ЯМР (400 МГц, дмсо-d6) δ м.д.: -113
Методика получения 27: 2-[4-(Этоксикарбонил)-1,5-диметил-1Н-пиррол-2-ил]-5-фтор-4-метоксибензойная кислота
Методика соответствует методике получения 1, с заменой на стадии A этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии B, на 2-бром-4-метокси-5-фторбензальдегид.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 9.65 (d, 1H), 7.67 (d, 1H), 7.24 (d, 1H), 6.48 (s, 1H), 4.19 (q, 2H), 3.97 (s, 3H), 3.38 (s, 3H), 2.56 (s, 3H), 1.26 (t, 3H).
Методика получения 28: 2-(4-Этоксикарбонил-1,5-диметил-1H-пиррол-2-ил)-4-фтор-5-метоксибензойная кислота
Методика соответствует методике получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 4-фтор-5-метоксибензальдегид.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.9 (m, 1H), 7.6 (d, 1H), 7.22 (d, 1H), 6.23 (s, 1H), 4.2 (quad, 2H), 3.95 (s, 3H), 3.25 (s, 3H), 2.5 (s, 3H), 1.25 (t, 3H)
Методика получения 29: 5-Хлор-2-[4-(этоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой 2-бром-4-хлорбензальдегида, используемого на стадии B, на 2-бром-5-хлорбензальдегид.
Методика получения 30: 2-{1-[2-(Бензилокси)этил]-4-(этоксикарбонил)-5-метил-1H-пиррол-2-ил}-4-хлорбензойная кислота
Методика соответствует методике получения 19, с заменой 6-бром-1,3-бензодиоксол-5-карбальдегида на 2-бром-4-хлорбензальдегид.
Методика получения 31: 5-Метокси-2-[4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии A этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии B, на 2-бром-5-метоксибензальдегид.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.8 (bs, 1H), 7.34 (wd, 1H), 7.26 (d, 1H), 7.15 (dd, 1H), 6.19 (s, 1H), 3.84 (s, 3H), 3.69 (s, 3H), 3.22 (s, 3H), 2.5 (s, 3H)
Методика получения 32: 6-[1-(2,2-Дифторэтил)-4-(этоксикарбонил)-5-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует протоколу методики получения 19, с заменой 2-бромэтоксиметилбензола, используемого на стадии А, на 2-бром-1,1-дифторэтан.
Методика получения 1': Гидрохлорид (3R)-3-метил-1,2,3,4-тетрагидроизохинолина
Стадия A: {(3S)-2-[(4-Метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин-3-ил}метил 4-метилбензолсульфонат
К раствору 30.2 г [(3S)-1,2,3,4-тетрагидроизохинолин-3-ил]метанола (185 ммоль) в 750 мл дихлорметана последовательно добавляют 91.71 г тозилхлорида (481 ммоль) и затем, по каплям, 122.3 мл N,N,N-триэтиламина (740 ммоль). Реакционную смесь затем перемешивают при температуре окружающей среды в течение 20 часов. Смесь затем разбавляют дихлорметаном, последовательно промывают 1М раствором HCl, насыщенным водным раствором NaHCO3 и затем соляным раствором до нейтральной среды. Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют досуха. Полученное твердое вещество затем растворяют в минимальном объеме дихлорметана, и затем добавляют циклогексан до тех пор, пока не образуется осадок. Этот осадок затем отфильтровывают и промывают циклогексаном. После сушки, указанный в заголовке продукт получают в виде кристаллов.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.75 (d, 2H, ароматические Н, орто O-тозил); 7.6 (d, 2H, ароматические Н, орто N-тозил); 7.5 (d, 2H, ароматические Н, мета O-тозил); 7.3 (d, 2H, ароматические Н, мета N-тозил); 7.15-6.9 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.4-4.15 (dd, 2H, алифатические Н, тетрагидроизохинолин); 4.25 (m, 1H, алифатический Н, тетрагидроизохинолин); 4.0-3.8 (2dd, 2H, алифатические Н, СН2-О-тозил); 2.7 (2dd, 2H, алифатические Н, тетрагидроизохинолин); 2.45 (s, 3Н, O-SO2-Ph-СН3); 2.35 (s, 3H, N-SO2-Ph-СН3)
ИК: v: -SO2: 1339-1165 см-1
Стадия В: (3R)-3-Метил-2-[(4-метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин
К суспензии 8.15 г (214.8 ммоль) алюмогидрида лития (LiAlH4) в 800 мл метил-трет-бутилового эфира (МТВЕ) добавляют 101.2 г дитозильного соединения, полученного на стадии А, (214.8 ммоль), растворенного в 200 мл МТВЕ. Загрузочную порцию затем нагревают при 50°С в течение 2 часов. Ей позволяют охладиться и помещают на баню с температурой 0°С, и затем по каплям добавляют 12 мл 5 н. раствора NaOH. Загрузочную порцию перемешивают при температуре окружающей среды в течение 45 минут. Таким образом полученное твердое вещество затем отфильтровывают и промывают с помощью МТВЕ и затем дихлорметаном. Фильтрат затем концентрируют досуха. Указанный в заголовке продукт затем получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.70 (d, 2Н, ароматические Н, орто N-тозил); 7.38 (d, 2Н, ароматические Н, мета N-тозил); 7.2-7.0 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.4 (m, 2Н, алифатические Н, тетрагидроизохинолин); 4.3 (m, 1H, алифатический Н, тетрагидроизохинолин); 2.85-2.51 (2dd, 2Н, алифатические Н, тетрагидроизохинолин); 2.35 (s, 3H, N-SO2-Ph-СН3); 0.90 (d, 3H, тетрагидроизохинолин-СН3)
ИК: v: -SO2: 1332-1154 см-1
Стадия С: (3R)-3-Метил-1,2,3,4-тетрагидроизохинолин
К раствору 31.15 г (103.15 ммоль) монотозильного соединения, полученного на стадии В, в 500 мл безводного метанола порциями добавляют 3.92 г (161 ммоль) магниевых стружек. Загрузочную порцию перемешивают под воздействием ультразвука в течение 96 часов. Реакционную смесь затем фильтруют и твердое вещество промывают несколько раз метанолом. Фильтрат затем концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-этаноле в качестве элюантов, указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.05 (m, 4H, ароматические Н, тетрагидроизохинолин); 3.90 (m, 2Н, алифатические Н, тетрагидроизохинолин); 2.85 (m, 1H, алифатический Н, тетрагидроизохинолин); 2.68-2.4 (2dd, 2Н, алифатические Н, тетрагидроизохинолин); 1.12 (d, 3H, тетрагидроизохинолин-СН3); 2.9-2.3 (m, широкий, 1H, HN (тетрагидроизохинолин))
ИК: v: -NH: 3248 см-1
Стадия D: Гидрохлорид (3R)-3-метил-1,2,3,4-тетрагидроизохинолина
К раствору 14.3 г (97.20 ммоль) соединения, полученного на стадии C, в 20 мл безводного этанола по каплям добавляют 100 мл 1М раствора HCl в эфире. Загрузочную порцию перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют. Полученные таким образом кристаллы промывают этиловым эфиром. После сушки, указанный в заголовке продукт получают в виде кристаллов.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 9.57 (m, широкий, 2Н, (тетрагидроизохинолин); 7.22 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.27 (s, 2Н, алифатические Н, тетрагидроизохинолин); 3.52 (m, 1H, алифатический Н, тетрагидроизохинолин); 3.03-2.85 (2dd, 2Н, алифатические Н, тетрагидроизохинолин); 1.39 (d, 3H, тетрагидроизохинолин-СН3)
ИК: v: : 3000-2300 см-1; v: ароматическая -СН: 766 см-1
Методика получения 21: трет-Бутил [(3S)-1,2,3,4-тетрагидроизохинолин-3-илметил)карбамат
Стадия АA Бензил (3S)-3-(гидроксиметил)-3,4-дигидро-1Н-изохинолин-2-карбоксилат
Это соединение получают, используя протокол из литературы (R.В. Kawthekar и др. South Africa Journal of Chemistry 63, 195, 2009), исходя из 15 г (3S)-1,2,3,4-тетрагидроизохинолин-3-илметанола (91,9 ммоль) в присутствии бензилхлорформиата и триэтиламина в растворе в дихлорметане. После очистки с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов, указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (300 МГц; ДМСО-d6; 300K): 7.33 (m, 5H, ароматические Н, O-бензил); 7.15 (s, 4H, ароматические Н, Н тетрагидроизохинолин); 5.13 (s, 2Н, СН2-Ph); 4.73 (d, 1H, Н тетрагидроизохинолин); 4.47 (m, Н, CH2OH); 4.36 (m, 1H, Н тетрагидроизохинолин); 4.28 (d, 1H, Н тетрагидроизохинолин); 3.39 (dd, 1H, СН2ОН); 3.23 (dd, 1H, CH2OH); 2.93 (dd, 1H, Н тетрагидроизохинолин); 2.86 (dd, 1H, Н тетрагидроизохинолин)
ИК: v: ОН: 3416 см-1; v: <С=O 1694 см-1; v: ароматическая >С-Н: 754 см-1
Стадия B: Бензил (3S)-3-(азидометил)-3,4-дигидроизохинолин-2(1Н)-карбоксилат
Это соединение получают, используя протокол из литературы (D. Page и др. J. Med. Chem, 44, 2387, 2001), исходя из 23 г соединения, полученного на стадии A, (77.3 ммоль) в присутствии дифенилфосфорилазида и трифенилфосфина в растворе в ТГФ. После очистки с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов, указанный в заголовке продукт получают в виде масла.
1Н ЯМР: δ (400 МГц; ДМСО-d6; 300K): 7.36 (m, 5H, ароматические Н, O-бензил); 7.19 (m, 4H, ароматические Н, Н тетрагидроизохинолин); 5.16 (s, 2H, CH2-Ph); 4.76 (d, 1H, Н тетрагидроизохинолин); 4.53 (m, 1H, H тетрагидроизохинолин); 4.30 (m, 1H, Н тетрагидроизохинолин); 3.28 (m, 2H, CH2N3); 3.06 (dd, 1H, Н тетрагидроизохинолин); 2.78 (dd, 1H, H тетрагидроизохинолин)
ИК: v: N3: 2095 см-1; v:
Стадия C: Бензил (3S)-3-(аминометил)-3,4-дигидроизохинолин-2(1Н)-карбоксилат
К раствору 20.9 г (64.5 ммоль) азидосоединения, полученного на стадии B, в 650 мл ТГФ последовательно добавляют 25.5 г (97.2 ммоль) трифенилфосфина и 157 мл воды. Загрузочную порцию нагревают с обратным холодильником в течение 2 часов 30 минут. Реакционную смесь затем концентрируют досуха и остаточное масло затем переносят в изопропиловый эфир. Появляется белый осадок; его отфильтровывают и промывают изопропиловым эфиром. Фильтрат затем концентрируют досуха и затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (400 МГц; ДМСО-d6; 300K): 7.40 (m, 5H, ароматические Н, O-бензил); 7.20 (m, 4H, ароматические Н, Н тетрагидроизохинолин); 5.15 (s, 2H, CH2-Ph); 4.75-4.3 (m, 2H, H тетрагидроизохинолин); 4.30 (d, 1H, H тетрагидроизохинолин); 2.90 (m, 2H, CH2NH2); 2.45 (m, 2H, H тетрагидроизохинолин); 1.40 (m, 2H, NH2)
ИК: v: NH2: 3400-3300 см-1; v: -C=O: 1688 см-1
Стадия D: Бензил (3S)-3-{[(трет-бутоксикарбонил)амино]метил}-3,4-дигидроизохинолин-2(1Н)-карбоксилат
К раствору 18.4 г (62.1 ммоль) соединения, полученного на стадии C, в 630 мл дихлорметана последовательно добавляют 17.5 мл (124 ммоль) триэтиламина и, порциями, 14.9 г (68.3 ммоль) ди-трет-бутил дикарбоната. Загрузочную порцию перемешивают при температуре окружающей среды в течение 2 ч. Реакционную смесь затем концентрируют и затем добавляют этилацетат. Органическую фазу последовательно промывают 1М раствором HCl, соляным раствором, насыщенным водным раствором NaHCO3 и затем соляным раствором. После сушки, концентрирования досуха и очистки с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов, указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (400 МГц; ДМСО-d6; 300K): 7.35 (m, 5H, ароматические Н, O-бензил); 7.15 (m, 4Н, ароматические Н, Н тетрагидроизохинолин); 6.51 (m, 1H, NHBoc); 5.12 (s, 2H, CH2-Ph); 4.76 (d, 1H, Н тетрагидроизохинолин); 4.51 (m, 1H, Н тетрагидроизохинолин); 4.36 (d, 1H, Н тетрагидроизохинолин); 2.95 (m, 3Н, Н тетрагидроизохинолин + CH2NHBoc); 2.71 (d, 1H, Н тетрагидроизохинолин); 1.34 (s, 9H, NHBoc)
ИК: v: NH: 3351 см-1; v:
Стадия E: трет-Бутил [(3S)-1,2,3,4-тетрагидроизохинолин-3-илметил]карбамат
К раствору 21 г (53 ммоль) соединения, полученного на стадии D, в 600 мл этилацетата добавляют 2.1 г 10%-ного палладия-на-угле. Загрузочную порцию перемешивают при температуре окружающей среды под давлением 1.3 бар водорода в течение 5 часов. Реакционную смесь затем фильтруют и затем концентрируют досуха. Указанный в заголовке продукт получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; ДМСО-d6; 300K): 7.15 (m, 4Н, ароматические Н, Н тетрагидроизохинолин); 6.85 (t, 1H, NHBoc); 3.90 (m, 2H, Н тетрагидроизохинолин); 3.00 (m, 2H, CH2NHBoc); 2.80 (m, 1H, H тетрагидроизохинолин); 2.65 (dd, 1H, H тетрагидроизохинолин); 2.40 (dd, 1H, H тетрагидроизохинолин); 1.40 (s, 9H, NHBoc)
ИК: v: NH: 3386-3205 см-1 (NH амид); v:
Методика получения 3': (3S)-3-(4-Морфолинилметил)-1,2,3,4-тетрагидроизохинолин
Стадия A: Бензил (3S)-3-(4-морфолинилкарбонил)-3,4-дигидро-2(1Н)-изохинолинкарбоксилат
К раствору 5 г (3S)-2-[(бензилокси)карбонил]-1,2,3,4-тетрагидро-3-изохинолинкарбоновой кислоты (16 ммоль) в 160 мл дихлорметана добавляют 1.5 мл морфолина (17.6 ммоль), затем 9 мл N,N,N-триэтиламина (64 ммоль), 3.3 г 1-этил-3-(3'-диметиламинопропил)-карбодиимида (EDC) (19.2 ммоль) и 2.6 г гидроксибензотриазола (HOBt) (19.2 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи; затем ее выливают в раствор хлорида аммония и экстрагируют этилацетатом. Органическую фазу затем сушат над MgSO4, и затем фильтруют и упаривают досуха. Полученный таким образом сырой продукт затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Продукт получают в виде пены.
1H ЯМР: δ (400 МГц; дмсо-d6; 353 K): 7.30 (m, 5H бензил); 7.15 (m, 4H, ароматические H); 5.2-5.0 (m, 3Н, 2H бензил, 1H дигидроизохинолин); 4.75-4.5 (2d, 2H дигидроизохинолин); 3.55-3.3 (m, 8H морфолин); 3.15-2.9 (2dd, 2H дигидроизохинолин)
ИК: v: >С=O: 1694; 1650 см-1
Стадия B: Бензил (3S)-3-(4-морфолинметил)-3,4-дигидро-2(1H)-изохинолинкарбоксилат
К раствору 5.3 г полученного на стадии A продукта (13.9 ммоль) в 278 мл тетрагидрофурана добавляют 14 мл комплекса боран-диметилсульфид (BH3Me2S) (27.8 ммоль) при температуре окружающей среды. Загрузочную порцию нагревают в течение 4 часов при 80°С. Ей позволяют возвратиться к температуре окружающей среды и затем добавляют 7 мл (14 ммоль) BH3Me2S. Реакционную смесь вновь нагревают при 80°С в течение 2 часов. Затем тетрагидрофуран упаривают, и затем медленно добавляют метанол и затем 5.6 мл 5 н. водного раствора HCl (27.8 ммоль). Смесь перемешивают при температуре окружающей среды в течение ночи, и затем при 80°С в течение 1 часа. Затем к реакционной смеси, помещенной на баню с температурой 0°С, добавляют насыщенным водный раствор NaHCO3 до тех пор, пока не достигают значения рН 8, и затем осуществляют экстрагирование этилацетатом. Органическую фазу затем сушат над MgSO4, и затем фильтруют и упаривают досуха. Указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (400 МГц; дмсо-d6; 353K): 7.43-7.30 (неразрешенный пик, 5Н бензил); 7.19 (m, 4Н, ароматические Н); 5.16 (m, 2Н, 2Н бензил); 4.79-4.29 (d, 2H дигидроизохинолин); 4.58 (m, 1H дигидроизохинолин); 3.50 (m, 4Н морфолин); 3.02-2.80 (dd, 2Н дигидроизохинолин); 2.42-2.28 (неразрешенный пик, 5Н, 4Н морфолин, 1H морфолин); 2.15 (dd, 1H морфолин)
ИК: v: >СН: 2810 см-1; v: >С=O: 1694 см-1; v: >С-O-С<: 1114 см-1; v: >СН-Ar: 751:697 см-1
Стадия C: (3S)-3-(4-Морфолинилметил)-1,2,3,4-тетрагидроизохинолин
К раствору 4.9 г соединения стадии В (13.4 ммоль) в 67 мл этанола добавляют 0.980 г дигидроксида палладия (20 мас. %) при температуре окружающей среды. Реакционную смесь помещают под давление водорода 1.2 бар при температуре окружающей среды на 4 часа. Ее затем пропускают через фильтр Whatman и палладий затем промывают несколько раз этанолом. Фильтрат упаривают досуха. Указанный в заголовке продукт получают в виде масла.
1H ЯМР: δ (400 МГц; дмсо-d; 300K): 7.12-7.0 (неразрешенный пик, 4Н, ароматические Н); 3.92 (s, 2Н тетрагидроизохинолин); 3.60 (t, 4Н морфолин); 2.98 (m, 1H тетрагидроизохинолин); 2.68 (dd, 1H тетрагидроизохинолин); 2.5-2.3 (неразрешенный пик, 8Н, 1H тетрагидроизохинолин, 6Н морфолин, 1H NH)
ИК: v: >NH: 3322 см-1; v: >C-O-C<: 1115 см-1; v: >CH-Ar: 742 см-1
Методика получения 4': (3S)-3-[(4-Метил-1-пиперазинил)метил]-1,2,314-тетрагидроизохинолин
Методика соответствует методике получения 3', с заменой морфолина, используемого на стадии А, на 1-метилпиперазин.
Методика получения 5': Гидрохлорид (3S)-3-[2-(морфолин-4-ил)этил]-1,2,3,4-тетрагидроизохинолина
Стадия А: трет-Бутил (3S)-3-(2-морфолино-2-оксоэтил)-3,4-дигидро-1Н-изохинолин-2-карбоксилат
К раствору 3 г (10.30 ммоль) [(3S)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3-ил]уксусной кислоты в 100 мл дихлорметана, добавляют по каплям 1.10 мл (11.32 ммоль) морфолина, по-прежнему по каплям 4.3 мл (30.9 ммоль) триэтиламина, 2.20 г (12.40 ммоль) EDC и 1.70 г (1.68 ммоль) HOBt (гидроксибензотриазола). Загрузочную порцию перемешивают при температуре окружающей среды в течение 15 часов. Реакционную смесь затем разбавляют дихлорметаном, последовательно промывают 1М раствором HCl, насыщенным водным раствором NaHCO3 и затем соляным раствором до нейтральной среды. Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, указанный в заголовке продукт получают в виде масла.
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.20-7.10 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.70 (m, 1Н, алифатические Н, СН тетрагидроизохинолин); 4.75-4.20 (2m, 2H, алифатические Н, СН2 альфа относительно N тетрагидроизохинолина); 3.60 (m, 8H, алифатические Н, морфолин); 3.00 и 2.70 (2dd, 2H, алифатические Н, тетрагидроизохинолин); 2.50-2.20 (2d, 2H, алифатические Н, СН2СО); 1.40 (s, 9H,tBu)
ИК: v: С=O: 1687; 1625 см-1
Стадия B: Гидрохлорид 1-(морфолин-4-ил)-2-[(3S)-1,2,3,4-тетрагидроизохинолин-3-ил]этанона
К раствору 2.88 г (7.18 ммоль) соединения, полученного на стадии А, в 16 мл дихлорметана добавляют по каплям 80 мл (80 ммоль) 1М раствора HCl в эфире. Загрузочную порцию перемешивают при температуре окружающей среды в течение 15 часов, и затем суспензию фильтруют и осадок промывают эфиром. После сушки, указанный в заголовке продукт получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 9.80-9.50 (m, 2H, ; 7.30-7.10 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.30 (m, 2H, алифатические Н, СН2 альфа относительно N тетрагидроизохинолина); 3.80 (m, 1H, алифатические Н, СН тетрагидроизохинолин); 3.70-3.40 (2m, 8H, алифатические Н, морфолин); 3.15 и 2.8 (m, 4H, алифатический Н, СН2 тетрагидроизохинолин и СН2СО)
ИК: v: : 2800-1900 см-1; v: С=O: 1620 см-1
Стадия С: Гидрохлорид (3S)-3-[2-(морфолин-4-ил)этил]-1,2,3,4-тетрагидроизохинолина
Получают раствор 2.2 г (7.44 ммоль) соединения, полученного на стадии В, в 22 мл МТВЕ и 5 мл дихлорметана. После охлаждения на ледяной бане при 0°С, по каплям добавляют 15 мл (15 ммоль) 1М раствора LiAlH4 в тетрагидрофуране. Загрузочную порцию затем перемешивают при температуре окружающей среды в течение 6 часов. Ее помещают на баню с температурой 0°С, и затем по каплям добавляют 1 мл 5 н. раствора NaOH. Загрузочную порцию перемешивают при температуре окружающей среды в течение 45 минут. Твердое вещество затем отфильтровывают и промывают с помощью МТВЕ и затем дихлорметаном, и фильтрат концентрируют досуха. Таким образом полученное масло разбавляют дихлорметаном и по каплям добавляют 6.3 мл 1М раствора HCl в эфире. Загрузочную порцию перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют. Полученные таким образом кристаллы промывают этиловым эфиром. После сушки, указанный в заголовке продукт получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 11.35+9.80 (2m, 2H, ); 10.00 (m, Н, NH+); 7.20 (m, 4H, ароматические Н, тетрагидроизохинолин); 4.30 (s, 2H, алифатические Н, СН2 альфа относительно N тетрагидроизохинолина); 4.00+3.85 (2m, 4H, алифатические Н, СН2 альфа относительно N морфолина); 3.70 (m, 1Н, алифатические Н, СН тетрагидроизохинолин); 3.55-3.30 (m, 4H, алифатические Н, СН альфа относительно О морфолина и СН2-морфолин); 3.15 (dd, 1Н, алифатический Н, СНз тетрагидроизохинолин); 3.10 (m, 2H, алифатический Н, СН альфа относительно О морфолина); 2.90 (dd, 1H, алифатический Н, СН2 тетрагидроизохинолин); 2.30+2.15 (2m, 2H, алифатический Н, СН2-тетрагидроизохинолин)
ИК: v: NH+/ : между 3500 и 2250 см-1; v: С=С: слабая 1593 см-1; v: ароматическая С-Н: 765 см-1
Методика получения 6': (3R)-3-13-(Морфолин-4-ил)пропил]-1,2,3,4-тетрагидроизохинолин
Стадия А: {(3S)-2-[(4-Метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин-3-ил}метил 4-метилбензолсульфонат
Способ является таким же, что и на стадии А методики получения 1'.
Стадия В: трет-Бутил 2-({(3R)-2-[(4-метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин-3-ил}метил)-3-(морфолин-4-ил)-3-оксопропаноат
К суспензии 1 г NaH (60%) (25.08 ммоль) в 30 мл МТВЕ по каплям добавляют раствор 5 г трет-бутил 3-морфолино-3-оксопропаноата (21.81 ммоль) в 20 мл безводного МТВЕ. Эту суспензию перемешивают при температуре окружающей среды в течение 1 часа, и затем в виде порошка добавляют соединение, полученное на стадии А. Загрузочную порцию перемешивают при 60°С в течение 30 часов. Добавляют 100 мл насыщенного водного раствора хлорида аммония. Получающийся раствор экстрагируют дихлорметаном. Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя дихлорметан и МеОН в качестве элюантов, ожидаемый продукт получают в виде масла.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.63/7.59 (2d, 2Н), 7.3/7.26 (2d, 2Н), 7.13 (m, 2Н), 7.09/6.97 (2t, 2Н), 4.64/4.55/4.36/4.28 (2АВ, 2Н), 4.25/4.11 (2m, 1Н), 3.81 (m, 1H), 3.73-3.48 (m, 4 H), 3.57-3.32 (m, 4H), 2.51 (m, 2H), 2.32/2.31 (2s, 3H), 1.88/1.79 (2m, 2H), 1.39/1.38 (2s, 9H)
ИК (ATR) см-1: v: >C=O: 1731 (сложный эфир); v: >C=O: 1644 (амид); v: -SO2: 1334-1156; v: >C-O-C<: 1115; γ: >CH-Ar: 815-746-709
Стадия С: 2-({(3R)-2-[(4-Метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин-3-ил}метил)-3-(морфолин-4-ил)-3-оксопропановая кислота
К раствору 9.5 г (17.97 ммоль) соединения, полученного на стадии В, в 40 мл диоксана по каплям добавляют 20 мл 4М раствора HCl в диоксане. Загрузочную порцию перемешивают при температуре окружающей среды в течение 48 часов, и затем раствор концентрируют досуха. После сушки, ожидаемый продукт получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 12.75 (m, 1H), 7.6 (2*d, 2H), 7.3 (2*d, 2H), 7.1/6.95 (2*m, 4H), 4.7-4.2 (d, 2H), 4.25/4.12 (2*m, 1H), 3.9-3.3 (m, 9H), 2.55 (d, 2H), 2.3 (2*s, 3H), 1.8 (t, 2H)
ИК (ATR) см-1: v: -ОН: 3500-2000; v: >C=O: 1727 (кислота); v: >С=O: 1634 (амид); v: -SO2: 1330-1155
Стадия D: 3-{(3R)-2-[(4-Метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин-3-ил}-1-(морфолин-4-ил)пропан-1-он
К раствору 7.80 г (16.51 ммоль) соединения, полученного на стадии С, в 100 мл ДМСО добавляют 1.16 г (19.83 ммоль) твердого хлорида натрия (NaCl) и затем, по каплям, 5 мл воды. Загрузочную порцию перемешивают при 130°С в течение 1 часа, и затем раствор концентрируют до ¾. Реакционную смесь затем разбавляют дихлорметаном и последовательно промывают насыщенным водным раствором хлорида лития и затем соляным раствором. Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя циклогексан и этилацетат в качестве элюантов, ожидаемый продукт получают в виде масла.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.65 (d, 2H), 7.3 (d, 2H), 7.15/7 (2m, 4H), 4.6 (d, 1H), 4.25 (d, 1H), 4.2 (m, 1H), 3.5 (m, 4H), 3.4 (2 m, 4H), 2.6 (2 dd, 2H), 2.35 (s, 3H), 2.3 (m, 2H), 1.5 (quad., 2H)
ИК(ATR) см-1: v: >C=O: 1639; v: -SO2: 1331-1156; γ: >CH-Ar: 815-675
Стадия E: (3R)-2-[(4-Метилфенил)сульфонил]-3-[3-(морфолин-4-ил)пропил]-1,2,3,4-тетрагидроизохинолин
К раствору 6.0 г (14.0 ммоль) соединения, полученного на стадии D, в 60 мл МТВЕ и 14 мл дихлорметана порциями добавляют 1.06 г (28 ммоль) LAH в течение 5 минут. Загрузочную порцию перемешивают при температуре окружающей среды в течение 15 часов. К ней по каплям добавляют 1.5 мл воды, и перемешивание осуществляют в течение 15 минут. К ней затем по каплям добавляют 1.5 мл 5М раствора гидроксида натрия, и перемешивание осуществляют в течение 15 минут. Реакционную смесь затем разбавляют с помощью МТВЕ и дихлорметана. Суспензию затем фильтруют и осадок промывают с помощью МТВЕ и дихлорметана. Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-этаноле в качестве элюантов, ожидаемый продукт получают в виде масла.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.68 (d, 2H), 7.32 (d, 2H), 7.1 (неразрешенный пик, 4 H), 4.65/4.23 (AB, 2H), 4.2 (m, 1H), 3.55 (t, 4H), 2.7/2.6 (ABX, 2H), 2.35 (s, 3H), 2.25 (t, 4H), 2.2 (t, 2H), 1.4/1.3 (2m, 4H).
ИК (ATR) см-1: v: -SO2: 1333-1158
Стадия F: (3R)-3-[3-(Морфолин-4-ил)пропил]-1,2,3,4-тетрагидроизохинолин
К раствору 1.50 г (3.62 ммоль) соединения, полученного на стадии Е, в 20 мл безводного метанола порциями добавляют 2.0 г (82.3 ммоль) магниевых стружек. Загрузочную порцию перемешивают под воздействием ультразвука в течение 96 часов. Реакционную смесь затем фильтруют, твердое вещество промывают несколько раз метанолом, и фильтрат концентрируют досуха. После очистки с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-этаноле в качестве элюантов, ожидаемый продукт получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.3 (d, 2H), 7.1 (t, 2H), 7.1 (d+t, 3H), 7 (d, 2H), 3.9 (s, 2H), 3.55 (t, 4H), 2.75 (m, 1H), 2.72/2.45 (dd, 2H), 2.35 (t, 4H), 2.25 (t, 2H), 1.6 (m, 2H), 1.45 (m, 2H)
ИК (ATR) см-1: v: >NH2+/NH+: 3500-2300; v: >C-O-C<: 1115
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR):
Эмпирическая формула: C16H24N2O
[М+Н]+ рассчитано: 261.1961
[М+Н]+ найдено: 261.1959
Методика получения 7': Тригидрохлорид (3S)-3-[(9aS)-октагидропиперазино[2,1-с]морфолин-8-илметил]-1,2,3,4-тетрагидроизохинолина
Стадия А: трет-Бутил (9aS)-4-оксооктагидропиперазино[2,1-с]морфолин-8-карбоксилат
Синтез этого соединения известен из литературы (J. Med. Chem. 2012, 55, 5887 для противоположного энантиомера).
Стадия В: Гидрохлорид (9aS)-октагидропиперазино[2,1-с]морфолин-4-она
4М раствор HCl в диоксане (60 мл, 240 ммоль) добавляют к соединению трет-бутил (9aS)-4-оксооктагидропиперазино[2,1-с]морфолин-8-карбоксилата (11.8 г, 46.0 ммоль), охлажденному на ледяной бане. Раствор затем перемешивают при температуре окружающей среды в течение 2 часов, и затем при 50-60°С в течение 1.5 часов. Раствор затем упаривают досуха. Остаток упаривают совместно с диоксаном (3×20 мл) и затем сушат в вакууме с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 2.80-2.94 (m, 2H), 2.94-3.05 (m, 1H), 3.23-3.37 (m, 2H), 3.59-3.69 (m, 1H), 3.83-3.93 (m, 1H), 3.95-4.04 (m, 1H), 4.02-4.13 (m, 2H), 4.45-4.55 (m, 1H), 9.58 (br s, 2H)
Стадия С: трет-Бутил (3S)-3-[(9aS)-4-оксооктагидропиперазино[2,1-с]морфолин-8-карбонил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
EDC (3.90 г, 20.3 ммоль) добавляют к раствору соединения стадии В (3.02 г, 15.7 ммоль), (3S)-2-[(трет-бутокси)карбонил]-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоте (4.6 г, 16.6 ммоль), триэтиламину (8.0 мл, 57.4 ммоль) и HOBt (2.72 г, 20.1 ммоль) в дихлорметане (150 мл). Смесь перемешивают при температуре окружающей среды в течение 21 часа. Добавляют 1 н. водный раствор HCl (105 мл), и образованный осадок отфильтровывают с использованием воронки Бюхнера. Фазы фильтрата разделяют. Водную фазу экстрагируют дихлорметаном (2×10 мл). Объединенные органические фазы промывают 3 н. водным раствором HCl (35 мл), затем 5%-ным водным раствором бикарбоната калия (2×35 мл) и в заключение соляным раствором (35 мл). Органическую фазу сушат над Na2SO4, фильтруют и затем концентрируют при пониженном давлении. Продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1.38-1.57 (m, 9H), 2.39-2.89 (m, 2H), 2.89-3.34 (m, 3H), 3.34-3.70 (m, 2H), 3.90-4.06 (m, 1H), 4.09-4.27 (m, 2H), 4.30-5.00 (m, 5H), 5.20-5.37 (m, 1H), 7.03-7.24 (m, 4H)
Стадия D: Тригидрохлорид (3S)-3-[(9aS)-октагидропиперазино[2,1-с]морфолин-8-илметил]-1,2,3,4-тетрагидроизохинолина
4М HCl раствор в диоксане (45 мл, 180 ммоль) добавляют к соединению стадии С (6.6 г, 46.0 ммоль), охлажденному на ледяной бане. Суспензию затем перемешивают при температуре окружающей среды в течение 24 часов и затем ее упаривают досуха. Остаток упаривают совместно с МТВЕ и затем сушат в вакууме. Таким образом полученное твердое вещество суспендируют в тетрагидрофуране (160 мл), и затем добавляют LiAlH4 (3,0 г, 79.1 ммоль). Суспензию нагревают с обратным холодильником в течение 6.5 часов, и ее затем охлаждают на ледяной бане. Затем в течение 7 минут добавляют воду (3 мл). Спустя 0.5 часа добавляют 2 н. водный раствор гидроксида натрия (6 мл). Через 0.25 часа вновь добавляют воду (6 мл). В заключение, через 0.5 часа добавляют целит (7 г) и Na2SO4 (25 г). Суспензию фильтруют через целит и промывают тетрагидрофураном (2×100 мл). Фильтрат концентрируют досуха. Таким образом полученное масло растворяют в МТВЕ (50 мл). Получающийся раствор фильтруют и фильтрат концентрируют. Остаток растворяют в метаноле (60 мл), и затем добавляют 4М HCl раствор в диоксане (20 мл). Раствор нагревают до 40°С и обрабатывают активированным углем (0.66 г), при перемешивании в течение 1 часа. Суспензию фильтруют через целит и промывают горячим метанолом. Фильтрат концентрируют до тех пор, пока не начнется кристаллизоваться продукт. Кристаллизации позволяют продолжаться в течение 16 часов при температуре окружающей среды. Полученное твердое вещество отфильтровывают и промывают смесью 2-пропанол/МТВЕ (4/6) (2×20 мл), и затем с помощью МТВЕ (2×20 мл). После сушки получают ожидаемое соединение.
1H ЯМР (400 МГц, D2O) δ м.д.: 2.28-2.44 (m, 1H), 2.74-3.00 (m, 4Н), 3.08-3.27 (m, 3Н), 3.27-3.42 (m, 2Н), 3.43-3.56 (m, 2Н), 3.56-3.69 (m, 2Н), 3.76-3.95 (m, 2Н), 4.00-4.22 (m, 2Н), 4.35-4.50 (m, 2Н), 7.20-7.41 (m, 4Н)
13С ЯМР (100 МГц, D2O) δ м.д.: 29.00, 44.58, 50.30, 51.08, 51.17, 52.75, 53.17, 58.08, 61.60, 64.61, 66.37, 127.14, 127.71, 128.00, 128.77, 129.55, 131.15
MC(ESI): [М+Н]+ 288.16
Методика получения 8': (3S)-3-(1-Окса-6-азаспиро[3.3]гепт-6-илметил)-1,2,3,4-тетрагидроизохинолин
Стадия А: (3S)-3-(Йодметил)-2-[(4-метилфенил)сульфонил]-1,2,3,4-тетрагидроизохинолин
Соединение стадии А методики получения 6' (4.0 г; 8.48 ммоль) в ацетонитриле (10 мл) помещают в 27-мл пробирку для микроволнового реактора и затем добавляют йодид натрия (1.40 г; 9.33 ммоль). Реакционную смесь нагревают в течение 5 часов при 100°С, используя микроволновое излучение (200 Вт). Смесь затем фильтруют, и твердое вещество промывают дихлорметаном. Фильтрат упаривают досуха, и затем остаток очищают с помощью хроматографии на силикагеле, используя гептан и этилацетат в качестве элюантов. Указанное в заголовке соединение получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.64 (d, 2Н), 7.28 (d, 2H), 7.15-7 (m, 4H), 4.5/4.3 (2d, 2H), 4.14 (m, 1H), 3.22 (m, 2H), 2.82 (m, 2H), 2.31 (s, 3H)
ИК (ATR) см-1: 1897 v -Ar, 1333+1156 v -SO2
Стадия B: (3S)-2-[(4-Метилфенил)сульфонил]-3-(1-окса-6-азаспиро[3.3]гепт-6-илметил)-1,2,3,4-тетрагидроизохинолин
Йодированное соединение (2.5 г; 5.85 ммоль), полученное на предыдущей стадии, растворяют в ацетонитриле (50 мл). Добавляют 1-окса-6-азаспиро[3.3]гептаноксалат (1.21 г; 6.36 ммоль) с последующим добавлением карбоната калия (1.61 г; 11.7 ммоль). Реакционную смесь нагревают в течение 15 часов с обратным холодильником. Реакционную смесь фильтруют и промывают ацетонитрилом, и затем упаривают досуха.
Соединение очищают с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-метаноле в качестве элюантов. Указанное в заголовке соединение получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.68 (d, 2H), 7.32 (d, 2H), 7.14-7 (m, 4H), 4.53/4.2 (dd, 2H), 4.34 (t, 2H), 3.95 (m, 1H), 3.5/3.4/2.98 (3m, 4H), 2.7 (t, 2H), 2.68-2.58 (m, 2H), 2.34 (s, 3H), 2.31-2.24 (m, 2H)
ИК (ATR) см-1: 1333+1156 v -SO2
Стадия С: (3S)-3-(1-Окса-6-азаспиро[3.3]гепт-6-илметил)-1,2,3,4-тетрагидроизохинолин
Тозилированное соединение вышеприведенной стадии (1.3 г; 3.26 ммоль) растворяют в 10 мл метанола. Каждые 3 часа порциями по 160 мг добавляют порошкообразный магний (633 мг; 26.08 ммоль). Реакционную смесь перемешивают на ультразвуковой бане 15 часов. Реакционную смесь затем фильтруют через целит, промывают большим количеством метанола, и затем упаривают досуха. Соединение очищают с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-метаноле в качестве элюантов. Соединение получают в виде масла.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.01 (m, 4H), 4.46 (t, 2H), 3.85 (s, 2H), 3.51/3.05 (dd, 2H), 2.73 (t, 2H), 2.61/2.4 (m, 4H), 2.4 (m, 1H), 2.4 (m, 1H)
ИК (ATR) см-1: 3325 v >NH
Методика получения 9': Тригидрохлорид (3S)-3-[(9aR)-октагидропиперазино[2,1-с]морфолин-8-илметил]-1,2,3,4-тетрагидроизохинолина
Стадия А: трет-Бутил (9aR)-4-оксооктагидропиперазино[2,1-с]морфолин-8-карбоксилат
Синтез этого соединения описывается в литературе (J. Med. Chem. 2012, 55, 5887).
Стадия В: Гидрохлорид (9aR)-октагидропиперазино[2,1-с]морфолин-4-она
4М раствор HCl в диоксане (39 мл, 154 ммоль) добавляют к соединению стадии А (11.3 г, 44.1 ммоль). Раствор затем перемешивают при температуре окружающей среды в течение 5 часов, и затем вновь добавляют 4М раствор HCl в диоксане (12 мл, 48 ммоль). Смесь перемешивают в течение 16 часов. Раствор затем упаривают досуха с получением ожидаемого продукта в виде твердого вещества.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 2.79-2.93 (m, 2H), 3.02 (td, J=13.1, 2.7 Гц, 1H), 3.22-3.34 (m, 2H), 3.59-3.67 (m, 1H), 3.86-3.96 (m, 1H), 3.96-4.01 (m, 1H), 4.05 (AB q, J=13.3 Гц, 2H), 4.48 (dd, J=14.1, 2.5 Гц, 1H), 9.71 (br. s, 1H), 9.91 (br. s, 1H)
Стадия С: трет-Бутил (3S)-3-[(9aR)-4-оксооктагидропиперазино[2,1-с]морфолин-8-карбонил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
EDC (5.17 г, 27.0 ммоль) добавляют к раствору соединения вышеприведенной стадии (4.0 г, 20.7 ммоль), (3S)-2-[(трет-бутокси)карбонил]-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (6.04 г, 21.8 ммоль), триэтиламина (11.6 мл, 83.1 ммоль) и HOBt (3.65 г, 27.0 ммоль) в дихлорметане (100 мл). Смесь перемешивают при температуре окружающей среды в течение 16 часов. Добавляют 1 н. водный раствор HCl (70 мл) и образованный осадок отфильтровывают с использованием воронки Бюхнера. Фазы фильтрата разделяют. Органическую фазу промывают насыщенным водным раствором карбоната калия и затем концентрируют при пониженном давлении. Остаток предварительно абсорбируют на силикагеле и очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 1.25-1.58 (m, 9Н), 2.50-2.76 (m, 2Н), 2.76-3.25 (m, 3Н), 3.37-3.76 (m, 2Н), 3.92-4.50 (m, 5Н), 4.06 (s, 2Н), 4.66 (d, J=15.6 Гц, 1Н), 4.76-5.28 (m, 1Н), 7.05-7.31 (m, 4Н)
Стадия D: Тригидрохлорид (3S)-3-[(9aR)-октагидропиперазино[2,1-с]морфолин-8-илметил1-1,2,3,4-тетрагидроизохинолина
4М раствор HCl в диоксане (24.0 мл, 96.2 ммоль) добавляют к раствору соединения стадии С (8.00 г, 12.25 ммоль) в дихлорметане (25 мл). Смесь перемешивают при температуре окружающей среды в течение 16 часов и затем концентрируют досуха. Полученный сырой продукт добавляют к суспензии LiAlH4 (1.97 г, 51.91 ммоль) в тетрагидрофуране (140 мл). Смесь нагревают с обратным холодильником до тех пор, пока реакция (контролируемая с помощью ЖХ-МС) не завершиться, и ее затем охлаждают до 0°С. По каплям добавляют воду (2.5 мл). После перемешивания в течение 10 минут по каплям добавляют 2М водный раствор гидроксида натрия (5 мл). После перемешивания в течение 10 минут вновь добавляют воду (5 мл). В заключение, после перемешивания в течение дополнительных 10 минут, добавляют целит (4 г) и Na2SO4 (12 г). Суспензию фильтруют через целит и фильтрат концентрируют досуха. Таким образом полученный сырой остаток растворяют в метаноле (80 мл), и затем добавляют 4М раствор HCl в диоксане (16.75 мл, 67.0 ммоль). Смесь перемешивают при температуре окружающей среды в течение 3 часов, и затем концентрируют досуха. Остаток растворяют в минимальном количестве горячего метанола (70 мл), и затем добавляют МТВЕ (3-5 мл). Раствор охлаждают при 0°С в течение 1 часа на ледяной водяной бане, и продукт выпадает в осадок. Вновь добавляют небольшое количество МТВЕ (2-3 мл), и смеси позволяют стоять в течение дополнительного 1 часа при 0°С. Полученное твердое вещество отфильтровывают на воронке Бюхнера и сушат в вакууме с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CD3OD) δ м.д.: 2.65 (t, J=11.1 Гц, 1H), 2.74-2.97 (m, 4 H), 3.10 (d, J=12.5 Гц, 1H), 3.19 (dd, J=17.6, 4.8 Гц, 1H), 3.25-3.55 (m, 5Н), 3.59-3.74 (m, 2H), 3.82-4.15 (m, 4H), 4.45 (AB q, J=15.9 Гц, 2H), 7.21-7.35 (m, 4H).
13С ЯМР (100 МГц, CD3OD) δ м.д.: 30.21, 45.67, 50.22, 51.99, 52.90, 53.58, 53.71, 59.25, 62.58, 65.30, 67.07, 127.76, 128.40, 129.08, 129.36, 130.16, 131.95
MC(ESI): [M+H]+ 288.2
Методика получения 1'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-метилпиразол-4-амин
Стадия А: 4-{[трет-Бутил(диметил)силил1окси}анилин
Указанное в заголовке соединение получают исходя из 4-аминофенола в ТГФ в присутствии имидазола и трет-бутил(диметил)силилхлорида в соответствии с протоколом, описанным в литературе (S. Knaggs и др., Organic & Biomolecular Chemistry, 3(21), 4002-4010; 2005).
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 6.45-6.55 (dd, 4H, ароматические Н); 4.60 (m, 2Н, NH2-Ph); 0.90 (s, 9Н, Si (СН2)2СН(СН3)2); 0.10 (s, 6H, Si (СН2)2СН(СН3)2)
ИК: v: : 3300-3400 см-1
Стадия В: N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-метилпиразол-4-амин
К раствору 30.8 г (0.137 моль) соединения стадии А в 525 мл безводного толуола последовательно добавляют 29.8 г трет-бутилата натрия (0.310 моль), 4.55 г Pd2(dba)3 (также называемого трис(дибензилиденацетон)дипалладием(0)) (4.96 ммоль), 4.81 г 2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенила (9.91 ммоль) и 12.8 мл 4-бром-1-метил-1H-пиразола (0.124 моль). Загрузочную порцию дегазируют под аргоном в течение 30 минут и затем нагревают с обратным холодильником в течение 3 часов. Ей позволяют охладиться. Реакционную смесь концентрируют досуха и затем переносят в дихлорметан, фильтруют через целит и затем вновь концентрируют досуха. Остаток затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и этилацетат в качестве элюантов, с обеспечением ожидаемого продукта в виде твердого вещества.
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.55 (s, 1H, пиразол); 7.23 (s, 1H, пиразол); 7.18 (широкий s, 1H, NH2-Ph); 6.64 (m, 4H, ароматические Н); 3.77 (s, 3Н, СН3-пиразол); 0.90 (s, 9Н, Si (СН2)2СН(СН3)2); 0.12 (s, 6H, Si (СН2)2СН(СН3)2)
ИК: v -NH+: 3275 см-1; v Ar и C=N: 1577 и 1502 см-1; v -Si-C-: 1236 см-1; v -Si-O-: 898 см-1; v -Si-C-: 828, 774 см-1
Методика получения 2'': 4-{[трет-Бутил(диметил)силил]окси}-N-фениланилин
К раствору 12 г 4-анилинофенола (64.7 ммоль) в 200 мл ацетонитрила добавляют, при температуре окружающей среды, 6.7 г имидазола (97.05 ммоль) и 11.7 г трет-бутил(диметил)силилхлорида (77.64 ммоль). Загрузочную порцию перемешивают при 70°С в течение 4 часов. Реакционную смесь затем выливают в воду и экстрагируют эфиром. Органическую фазу затем сушат над MgSO4, затем фильтруют и упаривают досуха. Полученный таким образом сырой продукт затем очищают с помощью хроматографии на силикагеле, используя петролейный эфир и дихлорметан в качестве элюантов. Указанный в заголовке продукт получают в виде порошка.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.84 (s, 1H NH); 7.17 (t, 2H анилин); 6.98 (d, 2H фенокси); 6.94 (d, 2H анилин); 6.76 (d, 2H фенокси); 6.72 (t, 1H анилин); 0.95 (s, 9Н трет-бутил); 0.15 (s, 6H диметил)
ИК: v: >NH: 3403 см-1; v: >Ar: 1597 см-1
Методика получения 3'': трет-Бутил 5-[(4-{[трет-бутил(диметил)силил]окси}фенил)амино]-1H-индол-1-карбоксилат
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на трет-бутил 5-бром-1H-индол-1-карбоксилат.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.85 (d, 1Н); 7.78 (s, 1H); 7.55 (d, 1H); 7.15 (d, 1H); 6.95 (m, 3H); 6.75 (d, 2H); 6.58 (d, 1H); 1.65 (s, 9H); 1.00 (s, 9H); 0.2 (s, 6H)
Методика получения 4'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-метил-1H-индол-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-метил-1H-индол.
Методика получения 5'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-метил-1H-индазол-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-метил-1H-индазол.
Методика получения 6'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-3-фтор-4-метиланилин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 4-бром-2-фтор-1-метилбензол.
Методика получения 7'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-3-фторанилин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 1-бром-3-фторбензол.
Методика получения 8'': 4-Бензилокси-N-фениланилин
К раствору 4-гидрокси-N-фениланилина (30 г; 162 ммоль) в ацетонитриле (400 мл) добавляют 58 г Cs2CO3 (178 ммоль), и перемешивание осуществляют в течение 15 минут при температуре окружающей среды. Затем по каплям добавляют бензилбромид (22.5 мл; 178 ммоль), и затем реакционную смесь нагревают с обратным холодильником в течение 4 часов. После фильтрования и промывания ацетонитрилом, фильтрат концентрируют и очищают с помощью хроматографии на силикагеле, используя петролейный эфир и этилацетат в качестве элюантов. Указанный в заголовке продукт затем получают в виде бесцветного твердого вещества.
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.80 (m, 1Н, NH); 7.45 (m, 2H, арил); 7.40 (m, 2H, арил); 7.30 (m, 1Н, арил); 7.15 (s, 2H, арил); 7.05 (d, 2H, арил); 6.9-7.0 (m, 4H, арил); 6.70 (t, 1Н, арил); 5.05 (s, 2H, бензил).
ИК: v: >NH: 3408 см-1
Методика получения 9'': N-(4-{{трет-Бутил(диметил)силил]окси}фенил)пиридин-4-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1Л-пиразола, используемого на стадии В, на 4-бромпиридин.
ИК: v -NH-: 3200 и 2500 см-1; v: -Si-O-: 902 см-1; v: -Si-C-: 820 см-1
Методика получения 10'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-4-фторанилин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 1-бром-4-фторбензол.
Методика получения 11'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-метил-1H-пирроло[2,3-b]пиридин-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-метил-1H-пирроло[2,3-b]пиридин (получен в соответствии с протоколом из литературы: Heterocycles, 60(4), 865, 2003).
ИК: v: -NH-: 3278 см-1; v: ароматические -С=С- фрагменты: 1605 см-1
Методика получения 12'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-2-метоксипиримидин-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-2-метоксипиримидин.
Методика получения 13'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин.
Методика получения 14'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-метил-1H-бензимидазол-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1 -метил- 1H-бензимидазол.
Методика получения 15'': N4-(4-{[трет-Бутил(диметил)силил]окси}фенил)-N2,N2-диметилпиридин-2,4-диамин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 4-бром-N,N-диметилпиридин-2-амин.
Методика получения 16'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)пиразоло(1,5-a]ииримидин-6-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 6-бромпиразоло[1,5-a]пиримидин.
ИК: v -NH-: 3272 см-1; v -C=N-: 1634 см-1; v -C=C-: 1616 см-1
Методика получения 17'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-метилпиразоло[3,4-b]пиридин-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-метилпиразоло[3,4-b]пиридин (получен в соответствии с протоколом из литературы: WO 2006/052568, исходя из 2-метилпиразол-3-амина и 2-бромпропандиаля).
Методика получения 18'': 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1,5-диметил-1H-пиррол-2-карбонитрил
Стадия А: 4-Бром-1,5-диметил-1Н-пиррол-2-карбонитрил
Раствор брома (6.58 мл, 0.13 моль) в уксусной кислоте (60 мл) добавляют по каплям с помощью капельной воронки к раствору 1,5-диметил-1H-пиррол-2-карбонитрила (15.0 г, 0.12 моль) в уксусной кислоте (300 мл). Загрузочную порцию перемешивают при температуре окружающей среды в течение 24 часов. Реакционную смесь затем выливают в лабораторный стакан, содержащий 300 мл воды. Образованное твердое вещество отфильтровывают и промывают водой. Его затем растворяют в дихлорметане (300 мл), и органическую фазу промывают соляным раствором, сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением ожидаемого продукта в виде твердого вещества.
1H ЯМР (CDCl3) δ м.д.: 2.25 (s, 3H), 3.67 (s, 3H), 6.74 (s, 1H)
Стадия В: 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1,5-диметил-1Н-пиррол-2-карбонитрил
Раствор соединения вышеприведенной стадии (1.5 г, 7.53 ммоль), 4-[(трет-бутилдиметилсилил)окси] анилина (2.02 г, 9.04 ммоль), трет-бутилата натрия (1.45 г, 15.06 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила (0.13 г, 0.30 ммоль) в толуоле (20 мл) продувают азотом. Добавляют трис(дибензилиденацетон)дипалладий(0) (0.28 г, 0.30 ммоль), и затем реакционную смесь нагревают при 90°С до тех пор, пока реакция (контролируемая с помощью ТСХ) не завершится. Нагревание прекращают и температуре смеси позволяют вернуться к температуре окружающей среды. Добавляют воду (75 мл), и смесь экстрагируют этилацетатом (3×75 мл). Объединенные органические фазы промывают соляным раствором и затем концентрируют. Сырой продукт абсорбируют на силикагеле и очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов. Таким образом полученный продукт растворяют в гептане в горячем состоянии и позволяют выпасть в осадок при перемешивании, при температуре окружающей среды и затем при 0°С. Твердое вещество отфильтровывают и операцию повторяют на фильтрате с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.15 (s, 6H), 0.97 (s, 9H), 2.13 (s, 3H), 3.66 (s, 3H), 4.68 (br. s, 1H), 6.49 (d, J=8.5 Гц, 2H), 6.64 (s, 1H), 6.66 (d, J=8.7 Гц, 2H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: 4.34, 9.72, 18.30, 25.88, 32.94, 101.27, 114.37, 114.70, 116.41, 120.73, 124.52, 131.23, 141.54, 148.27
MC (ESI+): [М+Н]+ найдено: 342.3
Методика получения 19'': 4-[(4-{[трет-Бутил(диметил)силил]окси}фенил)амино]-1-метил-1H-пиррол-2-карбонитрил
Стадия А: 1-Метил-1Н-пиррол-2-карбонитрил
N,N-Диметилформамид (3 мл) и 1,4-диазабицикло[2.2.2]октан (0.49 г, 4.3 ммоль) добавляют к раствору пиррол-2-карбонитрила (4 г, 43.4 ммоль) в диметилкарбонате (56 мл). Раствор перемешивают при 90°С в течение 15 часов и затем нагревают при 110°С в течение 8 часов. Смесь охлаждают до температуры окружающей среды, и затем добавляют этилацетат (80 мл). Фазы разделяют, и органическую фазу промывают водой (2×80 мл) и 1 н. водным раствором HCl (1×80 мл). Объединенные водные фазы вновь экстрагируют этилацетатом (1×80 мл). Объединенные органические фазы промывают соляным раствором (1×80 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме с получением ожидаемого продукта в виде жидкости.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3.78 (m, 2H), 6.12-6.18 (m, 1H), 6.74-6.82 (m, 1H)
Стадия В: 4-Бром-1-метил-1Н-пиррол-2-карбонитрил
N-Бромсукцинимид (6.2 г, 34.9 ммоль) добавляют к раствору 1-метил-1Н-пиррол-2-карбонитрила (3.7 г, 34.9 ммоль) в N,N-диметилформамиде (150 мл). Раствор перемешивают в течение 15 часов при температуре окружающей среды. Добавляют иное количество N-бромсукцинимида (2.0 г, 11 ммоль) и смесь перемешивают в течение 3 часов. Затем добавляют кремнезем (7 г), и суспензию затем упаривают досуха. Вещество, предварительно абсорбированное на кремнеземе, помещают на колонку с силикагелем, и продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого продукта в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 3.77 (s, 3H), 6.75 (d, J=1.7 Гц, 1H), 6.80 (d, J=1.7 Гц, 1Н)
Стадия С: 4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1-метил-1Н-пиррол-2-карбонитрил
Через раствор 4-бром-1-метил-1H-пиррол-2-карбонитрила (2.82 г, 15.2 ммоль) и 4-[(трет-бутилдиметилсилил)окси]анилина (4.08 г, 18.3 ммоль) в толуоле (55 мл) в течение 5 минут барботируют азот. Затем к реакционной смеси добавляют трет-бутилат натрия (2.92 г, 30.4 ммоль), трис(дибензилиденацетон)дипалладий(0) (556 мг, 0.6 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (255 мг, 0.6 ммоль). Смесь перемешивают в течение 1 часа при 80°С под азотом. Суспензию затем охлаждают до температуры окружающей среды и фильтруют через целит. Осадок на целите затем промывают этилацетатом. Фильтрат промывают водой и затем соляным раствором. Органическую фазу сушат над MgSO4, фильтруют и концентрируют в вакууме. Продукт очищают дважды с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, и затем с помощью растирания в гептане с получением ожидаемого продукта в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.16 (s, 6Н), 0.97 (s, 9Н), 3.73 (s, 3H), 6.57 (d, J=1.9 Гц, 1H), 6.64-6.66 (m, 1H), 6.70 (s, 4Н); ЯМР
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.48, 18.17, 25.72, 35.46, 103.01, 113.56, 113.69, 115.92, 119.55, 120.67, 129.04, 139.94, 148.85
MC (ESI+): [М+H]+ 328.25
Методика получения 20'': N-{4-[трет-Бутил(диметил)силил]окси-3-фторфенил]-1-метил-1H-пиразол-4-амин
Методика соответствует протоколу методики получения 1'', с заменой 4-аминофенола, используемого на стадии А, на 2-фтор-4-аминофенол.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.59 (bs, 1H), 7.39 (m, 1H), 7.24 (d, 1H), 6.74 (dd, 1H), 6.52 (dd, 1H), 6.42 (ddd, 1H), 3.76 (s, 3H), 0.92 (s, 9H), 0.1 (d, 6H)
Методика получения 21'': 2-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)пиридин-4-карбонитрил
Раствор, состоящий из 2-бром-4-пиридинкарбонитрила (5.00 г, 36.1 ммоль), 4-[(трет-бутилдиметилсилил)окси]анилина (8.06 г, 36.1 ммоль), трет-бутилата натрия (4.50 г, 46.9 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила (0.458 г, 1.08 ммоль) в толуоле (50 мл), продувают азотом. Затем к реакционной смеси добавляют трис(дибензилиденацетон)дипалладий(0) (0.99 г, 1.08 ммоль), и затем загрузочную порцию нагревают при 50°С в течение 1.5 часов. Смеси затем позволяют охладиться до температуры окружающей среды. Добавляют воду, и реакционную смесь экстрагируют этилацетатом (3×20 мл). Объединенные органические фазы промывают соляным раствором, и затем концентрируют при пониженном давлении. Сырой продукт абсорбируют на силикагеле и очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов. Полученный продукт растворяют в горячем состоянии в гептане и осаждают при перемешивании, при температуре окружающей среды и затем при 0°С. После фильтрования, ожидаемое соединение получают в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.22 (s, 6H), 1.00 (s, 9H), 6.61 (br. s, 1H), 6.81-6.84 (m, 2H), 6.84-6.89 (m, 2H), 7.12-7.17 (m, 2H), 8.26 (dd, J=5.1, 0.9 Гц, 1H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.29, 18.31, 25.78, 109.11, 114.73, 117.23, 121.17, 121.74, 124.93, 132.12, 149.79, 153.45, 158.00
MC (ESI+): [М+H]+ 326.19
Методика получения 22'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-тетрагидрофуран-3-ил-пиразол-4-амин
4-[трет-Бутил(диметил)силил]оксианилин (0.92 г, 3.48 ммоль) и 4-йод-1-тетрагидрофуран-3-илпиразол (0.78 г, 3.48 ммоль), растворенные в безводном тетрагидрофуране (20 мл), перемешивают в течение одного часа при температуре окружающей среды в присутствии трет-бутилата натрия (1.7 мл, 2М раствор в ТГФ) и хлор(2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2-аминоэтил)фенил]палладия(II) (84 мг, 0.122 ммоль). Реакционную смесь фильтруют через целит и затем упаривают досуха. Остаток кристаллизуют из смеси гептан/этилацетат, фильтруют и промывают гептаном, и затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением ожидаемого продукта.
1H ЯМР (500 МГц, дмсо-d6, 300K) δ м.д.: 7.62 (d, 1H, пиразол-Н5), 7.29 (d, 1H, пиразол-Н3), 7.26 (s, 1H, NH), 6.68 (d, 2H, Ar-H), 6.64 (d, 2H, Ar-H), 4.93 (m, 1H, ТГФ-3'Н), 3.95 (m, 1H, ТГФ-5'Н), 3.94 (m, 1H, ТГФ-2'Н), 3.87 (m, 1H, ТГФ-2'Н), 3.80 (m, 1H, ТГФ-5'Н), 2.33 (m, 1H, ТГФ-4'Н), 2.27 (m, 1H, ТГФ-4'Н), 0.93 (s, 9Н,tBu), 0.12 (s, 6Н, Ме)
ИК: v С-Н: 2857 см-1; v ароматическая: 1505 см-1; v Si-C: 1249 см-1
Методика получения 23'': 6-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)пиридин-2-карбонитрил
4-Аминофенол (3.3 г, 30.2 ммоль) добавляют к раствору 6-хлорпиридин-2-карбонитрила (3.5 г, 25.3 ммоль) в 1-метил-2-пирролидиноне (70 мл). Реакционную смесь нагревают при 140-150°С в течение 16 часов в герметизированной колбе. Загрузочную порцию затем охлаждают до температуры окружающей среды. Впоследствии добавляют имидазол (3.4 г, 49.9 ммоль) и трет-бутил(диметил)силилхлорид (7.6 г, 50.4 ммоль), и смесь перемешивают в течение 16 часов при температуре окружающей среды. Смесь разбавляют водой (140 мл), и продукт экстрагируют с помощью AcOEt (4×50 мл). Органические фазы объединяют и промывают водой (3×50 мл), и затем соляным раствором (1×50 мл). Органическую фазу затем сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением указанного в заголовке продукта.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.20 (s, 6H), 0.99 (s, 9H), 6.74 (dd, J=7.6, 4.9 Гц, 1H), 6.81-6.88 (m, 3H), 7.36-7.42 (m, 2H), 7.74 (dd, J=7.6, 1.9 Гц, 1H), 8.34 (dd, J=4.9, 1.9 Гц, 1H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.38, 18.21, 25.73, 92.58, 113.50, 116.53, 120.30, 123.20, 131.97, 141.67, 152.42, 152.45, 156.51
MC (ESI): [M+H]+ 326.24
Методика получения 24'': 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)пиримидин-2-карбонитрил
Стадия А: N-{4-[(трет-Бутилдиметилсилил)окси]фенил}-2-хлорпиримидин-4-амин
4-Аминофенол (8.8 г, 80.6 ммоль) и триэтиламин (18.6 мл, 133.4 ммоль) добавляют к раствору 2,4-дихлорпиримидина (10.0 г, 67.1 ммоль) в этаноле (150 мл). Реакционную смесь нагревают при 150°С в течение 14 часов в герметизированной колбе. Загрузочную порцию затем охлаждают до температуры окружающей среды, и растворитель упаривают в вакууме. К остатку добавляют дихлорметан (200 мл) и затем добавляют имидазол (9.1 г, 133.7 ммоль) и трет-бутил(диметил)силилхлорид (12.1 г, 80.3 ммоль). Смесь перемешивают в течение 15 часов при температуре окружающей среды. Реакционную смесь разбавляют водой (200 мл). Фазы разделяют и органическую фазу промывают соляным раствором (1×100 мл). Ее затем сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением твердого вещества. Последнее растирают в гептане, отфильтровывают и промывают гептаном с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 0.22 (s, 6Н), 0.99 (s, 9H), 6.42 (d, J=5.9 Гц, 1H), 6.81 (br. s, 1H), 6.85-6.90 (m, 1H), 7.13 (d, J=8.7 Гц, 2Н), 8.07 (d, J=5.9 Гц, 2Н)
Стадия В: 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)пиримидин-2-карбонитрил
Безводный N,N-диметилформамид (10 мл) помещают под азотом в колбу, и затем добавляют соединение стадии А (670 мг, 2.0 ммоль). Впоследствии добавляют цианид цинка (468 мг, 4.0 ммоль) и тетракис(трифенилфосфин)палладий(0) (404 мг, 0.3 ммоль). Через раствор в течение 5 минут барботируют азот, и затем реакционную смесь перемешивают при 120°С в течение 2 часов в атмосфере азота. Реакция, контролируемая с помощью ЖХ-МС, завершается. Смесь охлаждают до температуры окружающей среды, и затем к ней добавляют воду (15 мл). Продукт экстрагируют с помощью AcOEt (3×25 мл). Органические фазы объединяют и промывают водой (4×25 мл), и затем соляным раствором (1×25 мл). Органическую фазу сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.22 (s, 6Н), 0.99 (s, 9Н), 6.63 (d, J=6.1 Гц, 1H), 6.86-6.92 (m, 2Н), 7.03 (br. s, 1H), 7.17 (d, J=8.5 Гц, 2Н), 8.22 (d, J=6.1 Гц, 1H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.51, 18.10, 25.55, 106.32, 115.92, 121.00, 125.22, 129.73, 144.55, 154.16, 156.07, 161.56
Методика получения 25'': N-{4-[(трет-Бутилдиметилсилил)окси]фенил}-1-тридейтерометил-1H-пиразол-4-амин
Стадия А: 4-Бром-1-тридейтерометил-1Н-пиразол
4-Бром-1H-пиразол (9.05 г, 61.6 ммоль) порциями добавляют к суспензии NaH (60% в масле) (2.83 г, 70.8 ммоль) в тетрагидрофуране (90 мл), охлажденной на ледяной бане. После удаления ледяной бани, раствор перемешивают при температуре окружающей среды в течение 0.5 часа. Его вновь охлаждают на ледяной бане и добавляют йодметан-d3 (5.0 мл, 80.3 ммоль). Раствор перемешивают при температуре окружающей среды в течение 19 часов. Суспензию затем концентрируют. Остаток после упаривания растирают с МТВЕ (90 мл) и фильтруют. Фильтрат концентрируют в вакууме с получением ожидаемого соединения в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 7.37 (s, 1H), 7.43 (s, 1H)
Стадия В: N-{4-[(трет-Бутилдиметилсилил)окси]фенил}-1-тридейтерометил-1H-пиразол-4-амин
4-Бром-1-тридейтерометил-1H-пиразол (9.6 г, 58.5 ммоль), 4-[(трет-бутилдиметилсилил)окси] анилин (14.4 г, 64.6 ммоль) и толуол (150 мл) добавляют в 500-мл трехгорлую колбу. Раствор дегазируют азотом в течение 15 минут, и затем последовательно добавляют трет-бутилат натрия (11.4 г, 0.12 моль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (0.77 г, 1.81 ммоль) и трис(дибензилиденацетон)дипалладий(0) (1.64 г, 1.79 ммоль). Суспензию нагревают при 85°С в течение 1.5 часов. Реакционную смесь затем охлаждают до температуры окружающей среды и добавляют воду (270 мл). Смесь перемешивают в течение 30 минут. Затем добавляют целит (30 г), и суспензию фильтруют через набивку целита. Фазы фильтрата разделяют, и водную фазу экстрагируют этилацетатом (3×200 мл). Объединенные органические фазы сушат над Na2SO4 и фильтруют. К фильтрату добавляют кремнезем (36 г), и загрузочную порцию упаривают досуха. Продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов. Полученный продукт перекристаллизовывают из гептана (80 мл) с получением ожидаемого соединения.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 0.16 (s, 6H), 0.97 (s, 9H), 4.92 (s, 1H), 6.61-6.73 (m, 4H), 7.25 (s, 1H), 7.36 (s, 1H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.37, 18.28, 25.86, 38.67 (sept,1JC-D=21.0 Гц), 115.12, 120.73, 123.76, 126.52, 134.74, 141.07, 148.43
MC (ESI): [M+H]+ 307.08
Методика получения 26'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-(оксетан-3-ил)-1H-пиразол-4-амин
Стадия А: 4-Бром-1-(оксетан-3-ил)-1Н-пиразол
4-Бром-1H-пиразол (1.53 г, 10.7 ммоль) растворяют в безводном диметилформамиде (15 мл). К раствору последовательно добавляют 3-бромоксетан (2.0 г, 14.6 ммоль) и карбонат цезия (4.7 г, 14 ммоль). Реакционную смесь нагревают в течение 8 часов при 130°С в герметизированной колбе. В конце реакции растворитель упаривают в вакууме, и остаток очищают с помощью хроматографии на силикагеле, используя дихлорметан, содержащий диэтиламин, и метанол в качестве элюантов, с получением ожидаемого соединения.
Стадия В: N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-(оксетан-3-ил)-1Н-пиразол-4-амин
4-[трет-Бутил(диметил)силил]оксианилин (1.5 г, 7.2 ммоль) и 4-бром-1-(оксетан-3-ил)пиразол (1.6 г, 7.2 ммоль), растворенные в безводном тетрагидрофуране (25 мл), перемешивают в течение 3 часов при температуре окружающей среды в присутствии трет-бутилата натрия (3.7 мл, 2М раствор в ТГФ) и хлор(2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2-аминоэтил)фенил]палладия(II) (101 мг, 0.145 ммоль). Реакционную смесь фильтруют через целит и затем упаривают досуха. Остаток очищают с помощью хроматографии на силикагеле, используя дихлорметан, содержащий диэтиламин, и этилацетат в качестве элюантов, с получением ожидаемого продукта.
1H ЯМР (500 МГц, дмсо-d6, 300K) δ м.д.: 7.76 (s, 1Н, пиразол-5'Н), 7.40 (s, 1H, пиразол-3'Н), 7.34 (br s, 1Н, NH), 6.70 (d, 2H, Ar-H), 6.65 (d, 2H, Ar-H), 5.49 (m, 1Н, оксетан), 4.89 (d, 4H, оксетан), 0.93 (s, 9H,tBu), 0.13 (s, 6H, Me)
ИК: v: C-H: 2955 см-1; ароматическая: 1505 см-1; Si-C: 1237 см-1
Методика получения 27'': Смесь N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,5-диметил-1H-пиразол-4-амина и N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,3-диметил-1H-пиразол-4-амина
Стадия А: Смесь 4-бром-1,5-диметил-1Н-пиразола и 4-бром-1,3-диметил-1H-пиразола
К суспензии 60%-ного NaH в масле (0.3 г; 7.45 ммоль) в тетрагидрофуране (150 мл) при 10°С по каплям добавляют 4-бром-3-метил-1H-пиразол, растворенный в 15 мл тетрагидрофурана, в течение 15 минут. После перемешивания в течение 40 минут при температуре окружающей среды, добавляют по каплям йодметан (0.45 мл; 7.45 ммоль), и затем реакционную смесь перемешивают в течение ночи. После добавления воды, реакционную смесь упаривают и переносят в дихлорметан. Органическую фазу отделяют и сушат над MgSO4, фильтруют и концентрируют досуха. Остаток очищают с помощью хроматографии на силикагеле с получением смеси указанных в заголовке соединений (4-бром-1,3-диметилпиразола и 4-бром-1,5-диметилпиразола, соответственно, в соотношении 4:6).
4-бром-1,5-диметил-1H-пиразол:
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.41 (s, 1H), 3.76 (s, 3H), 2.22 (s, 3H)
4-бром-1,3-диметил-1H-пиразол:
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.81 (s, 1H), 3.74 (s, 3H), 2.09 (s, 3H)
Стадия В: Смесь N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,5-диметил-1Н-пиразол-4-амина и N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,3-диметил-1Н-пиразол-4-амина
Методика соответствует стадии В методики получения 1'', с заменой 4-бром-1-метил-1H-пиразола на смесь изомеров из стадии А. Получают смесь изомеров в соотношении 4:6 (N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,5-диметил-1H-пиразол-4-амина и N-(4-{[трет-бутил(диметил)силил]окси}фенил)-1,3-диметил-1H-пиразол-4-амина, соответственно).
Методика получения 28'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-циклопропил-1H-пиразол-4-амин
Стадия А: 4-Бром-1-циклопропил-1Н-пиразол
4-Бром-1H-пиразол (1.76 г, 12 ммоль) растворяют в безводном диметилформамиде (15 мл). К раствору последовательно добавляют циклопропилбромид (2.9 мл, 36 ммоль) и карбонат цезия (7.8 г, 24 ммоль). Реакционную смесь нагревают в течение 15 часов при 160°С в герметизированной колбе. В конце реакции растворитель упаривают в вакууме, и остаток очищают с помощью хроматографии на силикагеле, используя гептан и дихлорметан в качестве элюантов, с получением ожидаемого соединения.
Стадия В: N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-циклопропил-1Н-пиразол-4-амин
4-[трет-Бутил(диметил)силил]оксианилин (1.64 г, 7.3 ммоль) и 4-бром-1-циклопропил-1H-пиразол (1.4 г, 7.3 ммоль), растворенные в безводном тетрагидрофуране (30 мл), перемешивают в течение 3 часов при температуре окружающей среды в присутствии трет-бутилата натрия (3.7 мл, 2М раствор в ТГФ) и хлор(2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2-аминоэтил)фенил]палладия(II) (101 мг, 0.146 ммоль). Реакционную смесь фильтруют через целит и затем упаривают досуха. Остаток очищают с помощью хроматографии на силикагеле, используя гептан и этилацетат в качестве элюантов, с получением ожидаемого продукта.
1H ЯМР (500 МГц, дмсо-d6, 300K) δ м.д.: 7.61 (s, 1Н, пиразол-5'Н), 7.23 (s, 1H, пиразол-3'Н), 7.22 (br s, 1Н, NH), 6.65 (d, 2H, Ar-H), 6.63 (d, 2H, Ar-H), 3.64 (m, 1Н, циклопропил-Н), 1.00-0.91 (m, 4H, циклопропил), 0.93 (s, 9H,tBu), 0.12 (s, 6H, Me)
ИК: v: C-H: 2930 см-1; ароматическая: 1504 см-1; Si-C: 1237 см-1
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C18H27N3OSi
[М+Н]+ рассчитано: 330.2003
[М+Н]+ найдено: 330.1989
Методика получения 29'': 1,5-Диметил-4-(фениламино)-1H-пиррол-2-карбонитрил
Методика соответствует протоколу методики получения 1'', с заменой 4-{[трет-бутил(диметил)силил]окси}анилина, используемого на стадии В, на анилин.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 7.19 (s, 1H), 7.05 (t, 2H), 6.79 (s, 1H), 6.6 (m, 3H), 3.61 (s, 3H), 2.1 (s, 3H)
Методика получения 30'': 1-Метил-N-фенил-1H-пирроло[2,3-b]пиридин-6-амин
Методика соответствует протоколу стадии В методики получения 1'' с использованием анилина и 5-бром-1-метил-1H-пирроло[2,3-b]пиридина (полученного в соответствии с протоколом из литературы: Heterocycles, 60(4), 865, 2003).
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.1 (d, 1H), 7.9 (s, 1H), 7.7 (d, 1H), 7.45 (d, 1H), 7.17 (t, 2H), 6.9 (d, 2H), 6.7 (t, 1H), 6.38 (d, 1H), 3.8 (s, 3H)
Методика получения 31'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-тридейтерометил-1H-пирроло[2,3-b]пиридин-5-амин
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 5-бром-1-(тридейтерометил)-1H-пирроло[2,3-b]пиридин (получен в соответствии с протоколом из литературы: Heterocycles, 60(4), 865, 2003, с заменой метилйодида на тридейтерированный метилйодид).
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.05 (d, 1H), 7.6 (m+d, 2H), 7.4 (d, 1H), 6.85/6.7 (2d, 4H), 6.3 (d, 1H), 0.95 (s, 9 H), 0.15 (s, 6H)
Методика получения 32'': 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1-тридейтерометил-1H-пиррол-2-карбонитрил
Стадия А: 1-Тридейтерометил-1Н-пиррол-2-карбонитрил
NaH (60% в масле) (2.61 г, 65.2 ммоль) суспендируют в тетрагидрофуране (110 мл) при 0°С. В течение 10 минут по каплям добавляют 1H-пиррол-2-карбонитрил (5 г, 54.3 ммоль). Реакционную смесь затем нагревают до температуры окружающей среды в течение 30 минут. Смесь вновь охлаждают до 0°С, и затем добавляют йодметан-d3 (10.23 г, 70.6 ммоль). Реакционную смесь перемешивают в течение 16 часов под азотом при температуре окружающей среды. Реакционную смесь затем упаривают при пониженном давлении, и затем добавляют этилацетат (200 мл) и воду (200 мл). Фазы разделяют, и водную фазу экстрагируют этилацетатом (2×200 мл). Объединенные органические фазы промывают соляным раствором (1×80 мл), сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов. Фракции объединяют и упаривают в вакууме с получением ожидаемого соединения.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 6.13 (dd, J=2.7, 3.9 Гц, 1H), 6.75 (dd, J=1.5, 4.1 Гц, 1H), 6.79 (dd, J=1.7, 2.6 Гц, 1H)
Стадия В: 4-Бром-1-тридейтерометил-1H-пиррол-2-карбонитрил
N-Бромсукцинимид (6.68 г, 37.5 ммоль) добавляют к раствору соединения вышеприведенной стадии (4.09 г, 37.5 ммоль) в N,N-диметилформамиде (188 мл). Раствор перемешивают в течение 16 часов при температуре окружающей среды. Остаток очищают с помощью хроматографии, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 6.75 (d, J=1.7 Гц, 1Н), 6.80 (d, J=1.7 Гц, 1Н)
Стадия С: 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1-тридейтерометил-1Н-пиррол-2-карбонитрил
Через раствор, состоящий из соединения, полученного на вышеприведенной стадии (5.85 г, 31.1 ммоль), 4-[(трет-бутилдиметилсилил)окси]анилина (8 г, 35.8 ммоль), трет-бутилата натрия (3.88 г, 40.4 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила (662 мг, 1.56 ммоль) в толуоле (260 мл), в течение 5 минут барботируют азот. Затем добавляют трис(дибензилиденацетон)дипалладий(0) (1.43 г, 1.56 ммоль). Смесь перемешивают в течение 1 часа при 70°С под азотом. Суспензию затем охлаждают до температуры окружающей среды, разбавляют этилацетатом и фильтруют через целит. Осадок на целите затем промывают этилацетатом. Фильтрат промывают водой (3 раза), и затем соляным раствором (один раз). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме. Продукт очищают дважды с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, и затем с помощью хроматографии с обращенной фазой, используя метанол и воду в качестве элюантов, с получением ожидаемого соединения в виде порошка.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.17 (s, 6H), 0.98 (s, 9H), 4.96 (br. s, 1H), 6.57 (d, J=1.9 Гц, 1H), 6.64 (d, J=1.8 Гц, 1H), 6.70 (br. s, 4H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.38, 18.26, 25.83, 34.83, 102.96, 113.69, 113.71, 115.95, 119.58, 120.75, 129.14, 140.10, 148.84
MC(ESI): [М+Н]+ 331.09
Методика получения 33'': 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1-тридейтерометил-5-метил-1H-пиррол-2-карбонитрил
Стадия А: 5-Метил-1Н-пиррол-2-карбонитрил
Соединение получают в соответствии с протоколом, описанным в Heterocycles 2011, 82, 1503.
Стадия В: 1-Тридейтерометил-5-метил-1Н-пиррол-2-карбонитрил
Раствор 5-метил-1H-пиррол-2-карбонитрила (0.30 г, 2.82 ммоль) в N,N-диметилформамиде (5 мл) охлаждают до 0°С. Порциями добавляют NaH (60% в масле) (0.118 г, 2.96 ммоль), и реакционную смесь перемешивают при 0°С в течение 30 минут. Одной порцией добавляют йодметан-d3 (4.15 мл, 67.2 ммоль), и реакционную смесь перемешивают при температуре окружающей среды до тех пор, пока реакция не завершится. Ее затем разбавляют водой (30 мл) и этилацетатом (15 мл). Фазы разделяют, и водную фазу экстрагируют второй раз этилацетатом (15 мл). Объединенные органические фазы промывают водой (1×50 мл), и затем соляным раствором, и сушат над Na2SO4. После фильтрования и концентрирования при пониженном давлении, остаток очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2.25 (s, 3Н), 5.91 (dd, J=3.9, 0.6 Гц, 1H), 6.69 (d, J=3.9 Гц, 1H)
Стадия С: 4-Бром-1-тридейтерометил-5-метил-1H-пиррол-2-карбонитрил
Раствор брома (0.133 мл, 2.60 ммоль) в уксусной кислоте (1.5 мл) добавляют по каплям к раствору соединения, полученного на вышеприведенной стадии (0.305 г, 2.48 ммоль), в уксусной кислоте (5.5 мл), предварительно охлажденному до 0°С. Реакционную смесь перемешивают и постепенно нагревают до температуры окружающей среды в течение 20 часов. Реакционную смесь выливают в воду (50 мл) и смесь экстрагируют дихлорметаном (2×50 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 2.24 (s, 3Н), 6.73 (s, 1H)
Стадия D: 4-({4-1(трет-Бутилдиметилсилил}окси]фенил}амино}-1-тридейтерометил-5-метил-1Н-пиррол-2-карбонитрил
Раствор, состоящий из полученного на вышеприведенной стадии соединения (7.00 г, 34.6 ммоль), 4-[(трет-бутилдиметилсилил)окси]анилина (8.90 г, 39.8 ммоль), трет-бутилата натрия (4.33 г, 45.0 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенила (0.441 г, 1.04 ммоль) в толуоле (70 мл) продувают азотом. Добавляют трис(дибензилиденацетон)дипалладий(0) (0.951 г, 1.04 ммоль), и затем реакционную смесь нагревают при 65°С до тех пор, пока реакция, контролируемая с помощью ТСХ, не будет завершена. Нагревание прекращают, и смесь охлаждают до температуры окружающей среды. Добавляют воду (200 мл), и смесь экстрагируют этилацетатом (3 раза). Объединенные органические фазы промывают соляным раствором, и затем концентрируют. Сырой продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов. Полученный продукт растворяют в гептане в горячем состоянии; ему, при температуре окружающей среды и затем при 0°С, позволяют выпасть в осадок с получением ожидаемого продукта в виде кристаллов.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.15 (s, 6Н), 0.96 (s, 9H), 2.12 (s, 3H), 4.66 (br. s, 1H), 6.46-6.51 (m, 2H), 6.64 (s, 1H), 6.64-6.69 (m, 2H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.37, 9.64, 18.26, 25.84, 31.62-32.87 (m), 101.14, 114.35, 114.66, 116.33, 120.68, 124.51, 131.17, 141.53, 148.18
MC (ESI): [M+H]+ 345.13
Методика получения 34'': 5-[(4-{[трет-Бутил(диметил)силил]окси}фенил)амино]-1-метил-1H-пиразол-3-карбонитрил
Стадия А: 5-Амино-1-метил-1Н-пиразол-3-карбонитрил
К суспензии 1-метил-5-нитро-1H-пиразол-3-карбонитрила (2 г; 13.1 ммоль) в смеси воды (14 мл) и этанола (120 мл) добавляют HCl 37% (170 мкл) и железные опилки (5.1 г; 91 ммоль). Реакционную смесь нагревают в течение 5 часов при 50°С. После охлаждения до температуры окружающей среды, реакционную смесь фильтруют. Фильтрат концентрируют досуха и затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и этилацетат в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 5.8 (s, 1H), 5.7 (m, 2H), 3.6 (s, 3H)
Стадия В: 5-[(4-{[трет-Бутил(диметил)силил]окси}фенил)амино]-1-метил-1Н-пиразол-3-карбонитрил
Методика соответствует протоколу стадии В методики получения 1'', с заменой 4-бром-1-метил-1H-пиразола на (4-бромфекокси)-(трет-бутил)диметилсилан и 4-{[трет-бутил(диметил)силил]окси}анилина на соединение из стадии А.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.15 (s, 1H), 6.9 (d, 2H), 6.75 (d, 2H), 6.45 (s, 1H), 3.75 (s, 3H), 0.95 (s, 9H), 0.15 (s, 6H)
Методика получения 35'': 4-[(4-{[трет-Бутил(диметил)силил]окси}фенил)амино]-5-метил-1-[2-(морфолин-4-ил)этил]-1H-пиррол-2-карбонитрил
Методика соответствует методике получения 33'', с заменой йодметана-d3 на стадии В на гидрохлорид 2-(хлорэтил)морфолина.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.85 (s, 1H), 6.75 (s, 1H), 6.6 (d, 2H), 6.5 (d, 2H), 4.1 (t, 2H), 3.55 (t, 4H), 2.6 (t, 2H), 2.4 (t, 4H), 2.1 (s, 3H), 0.9 (s, 9H), 0.1 (s, 6H)
Методика получения 36'': N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-2-[2-(морфолин-4-ил)этокси]пиримидин-5-амин
Стадия А: 4-[2-(5-Бромпиримидин-2-ил)оксиэтил]морфолин
NaH (1.0 г, 25.0 ммоль, 60% в масле), суспендированный в безводном тетрагидрофуране, охлаждают при 0°С на ледяной бане под аргоном, и затем добавляют по каплям 2-морфолиноэтанол (2.7 г, 20.7 ммоль). Ледяную баню удаляют, и суспензию перемешивают в течение 1 часа при температуре окружающей среды. Затем при температуре окружающей среды добавляют 5-бром-2-хлорпиримидин (4.0 г, 20.7 ммоль), и реакционную смесь перемешивают в течение 16 часов при температуре окружающей среды. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония (10 мл) и воду (10 мл); рН доводят до 9 путем добавления насыщенного водного раствора NaHCO3. Получающийся раствор 3 раза экстрагируют этилацетатом, органическую фазу затем промывают соляным раствором, сушат над MgSO4, и затем упаривают досуха. Ожидаемое соединение осаждается с помощью добавления петролейного эфира.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.75 (s, 2Н), 4.4 (t, 2H), 3.55 (t, 4H), 2.7 (t, 2H), 2.45 (t, 4H)
ИК (ATR) см-1: 1562 v >C=C< и C=N, 787 v -C-H Ar
Стадия B: N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-2-[2-(морфолин-4-ил)этокси]пиримидин-5-амин
Методика соответствует протоколу стадии В методики получения 1'', с заменой 4-бром-1-метил-1H-пиразола на соединение из стадии А.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.3 (s, 2H), 7.8 (s, 1H), 6.9/6.75 (2d, 4H), 4.35 (t, 2H), 3.55 (t, 4H), 2.7 (t, 2H), 2.45 (t, 4H), 0.95 (s, 9H), 0.15 (s, 6H)
ИК (ATR) см-1: 3300 v -NH, 1506 v -NH, 837 v -Si-Me, 837 и 778 v -CH Ar
Методика получения 37'': 4-({4-[(трет-Бутилдиметилсилил)окси]фенил}амино)-1,3-диметил-1H-пиррол-2-карбонитрил
Стадия А: 4-Метил-N-(проп-2-ен-1-ил)бензол-1-сульфонамид
Аллиламин (10.6 мл, 0.14 моль) добавляют в течение 4 минут к раствору тозилхлорида (25.1 г, 0.13 моль) в дихлорметане (250 мл), охлажденному на ледяной бане. Добавляют триэтиламин (24 мл, 0.18 моль), и затем раствор перемешивают при температуре окружающей среды в течение 1.25 часа. Добавляют 3 н. водный раствор HCl (60 мл), и фазы затем разделяют. Органическую фазу промывают другой порцией 3 н. водного раствора HCl (60 мл), и затем 5%-ным водным раствором бикарбоната натрия (60 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2.43 (s, 3H), 3.54-3.63 (m, 2H), 4.50 (1s, 1H), 5.05-5.22 (m, 2H), 5.66-5.79 (m, 1H), 7.31 (d, J=8.1 Гц, 2H), 7.76 (d, J=8.1 Гц, 2Н)
Стадия В: 4-Метил-N-(2-метилпроп-2-ен-1-ил)-N-(проп-2-ен-1-ил)бензол-1-сульфонамид
3-Хлор-2-метилпропен (20 мл, 0.20 моль) добавляют в течение 5 минут к суспензии 4-метил-N-(проп-2-ен-1-ил)бензол-1-сульфонамида (27.9 г, 0.13 моль) и карбоната калия (28.1 г, 0.20 моль) в N,N-диметилформамиде (200 мл), охлажденной на ледяной бане. Через 20 минут суспензию перемешивают при температуре окружающей среды в течение 18 часов. Суспензию концентрируют досуха. Остаток переносят в этилацетат (250 мл) и воду (110 мл). Водную фазу экстрагируют этилацетатом (2×50 мл). Объединенные органические фазы последовательно промывают 3 н. водным раствором HCl (50 мл), водой (3×50 мл), 5%-ным водным раствором бикарбоната калия (50 мл), и в заключение соляным раствором (50 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют с получением ожидаемого соединения в виде масла.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 1.69 (s, 3H), 2.43 (s, 3H), 3.70 (s, 2H), 3.75-3.79 (m, 2H), 4.87 (d, J=25.1 Гц, 1H), 5.04-5.09 (m, 1H), 5.09-5.12 (m, 1H), 5.45-5.59 (m, 1H), 7.29 (d, J=8.1 Гц, 2H), 7.71 (d, J=8.1 Гц, 2H)
Стадия С: 3-Метил-1-(4-метилбензолсульфонил)-1Н-пиррол
Раствор соединения, полученного на стадии В, (15.2 г, 57.3 ммоль) в толуоле (550 мл) нагревают при 80°С в присутствии (1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(фенилметилен)(трициклогексилфосфин)рутения (катализатор Граббса 2-го поколения) (150 мг, 0.18 ммоль) в течение 1 часа. Затем одной порцией добавляют 2,3-дихлор-5,6-дициано-n-бензохинон (16.1 г, 70.9 ммоль), и раствор нагревают при 80°С в течение 24 часов. Раствор фильтруют через целит, и фильтрат концентрируют в вакууме. Продукт очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 2.02 (d, J=1.0 Гц, 3Н), 2.39 (s, 3H), 6.09-6.13 (m, 1H), 6.85-6.90 (m, 1H), 7.03-7.07 (m, 1H), 7.27 (d, J=8.4 Гц, 2H), 7.72 (d,J=8.4 Гц, 2H)
Стадия D: 3-Метил-1-(4-метилбензолсульфонил)-1Н-пиррол-2-карбонитрил
Хлорид алюминия (19.4 г, 0.15 моль), весь сразу, добавляют к раствору 3-метил-1-(4-метилбензолсульфонил)-1H-пиррола (13.0 г, 55.3 ммоль) в 1,2-дихлорэтане (230 мл) при температуре окружающей среды. После перемешивания в течение 20 минут, порциями в течение 20 минут добавляют бромциан (11.11 г, 0.10 моль). Спустя 4.5 часа добавляют дополнительное количество бромциана (1.94 г, 18.3 ммоль). После перемешивания в течение 17 часов при температуре окружающей среды, реакционную смесь медленно выливают в смесь дихлорметана (300 мл) и воды (600 мл), охлажденную до 0°С. Получающуюся смесь перемешивают в течение 1 часа. Впоследствии фазы разделяют, и водную фазу экстрагируют дихлорметаном (3×150 мл). Объединенные органические фазы промывают водой (2×150 мл) и соляным раствором (150 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 2.18 (s, 3H), 2.43 (s, 3H), 6.17 (d, J=3.2 Гц, 1H), 7.33-7.39 (m, 3H), 7.90 (d, J=8.5 Гц, 2H)
Стадия Е: 4-Бром-3-метил-1-(4-метилбензолсульфонил)-1Н-пиррол-2-карбонитрил
N-Бромсукцинимид (12.0 г, 67.4 ммоль), весь сразу, добавляют к суспензии 3-метил-1-(4-метилбензолсульфонил)-1H-пиррол-2-карбонитрила (14.45 г, 55.6 ммоль) в N,N-диметилформамиде (60 мл) при температуре окружающей среды. Смесь перемешивают при температуре окружающей среды в течение 29 часов и затем охлаждают на ледяной бане. Затем добавляют насыщенный водный раствор бисульфита натрия (90 мл), воду (90 мл) и этилацетат (250 мл). Фазы разделяют, и затем водную фазу экстрагируют этилацетатом (2×70 мл). Объединенные органические фазы промывают 5%-ным водным раствором бикарбоната калия (90 мл), водой (3×90 мл), и затем соляным раствором (3×90 мл). Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле, используя толуол и гептан в качестве элюантов, с получением ожидаемого соединения в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3) δ м.д.: 2.13 (s, 3H), 2.45 (s, 3H), 7.38 (d, J=8.4 Гц, 2H), 7.43 (s, 1H), 7.92 (d, J=8.4 Гц, 2H)
Стадия F: 4-Бром-1,3-диметил-1Н-пиррол-2-карбонитрил
Гидроксид калия (3.65 г, 65.1 ммоль), весь сразу, добавляют к суспензии 4-бром-3-метил-1-(4-метилбензолсульфонил)-1H-пиррол-2-карбонитрила (4.66 г, 13.7 ммоль) в метаноле (95 мл), охлажденной на ледяной бане. Через 15 минут суспензию перемешивают при температуре окружающей среды в течение 17 часов. Метанол упаривают досуха. Остаток после упаривания переносят в МТВЕ (25 мл) и промывают водой (25 мл). Водную фазу экстрагируют с помощью МТВЕ (2×25 мл). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученный остаток растворяют в тетрагидрофуране (50 мл), и раствор охлаждают на ледяной бане. Добавляют NaH (60% в масле) (1.02 г, 25.5 ммоль). Через 10 минут также добавляют йодметан (2.4 мл, 38.6 ммоль). Смесь перемешивают при температуре окружающей среды в течение 1.5 часов. Тетрагидрофуран упаривают досуха. Остаток переносят в дихлорметан и промывают водой. Водную фазу экстрагируют дихлорметаном. Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 2.16 (s, 3H), 3.71 (s, 3H), 6.74 (s, 1H)
Стадия G: 4-({4-Ктрет-Бутилдиметилсилил)окси]фенил}амино)-1,3-диметил-1Н-пиррол-2-карбонитрил
4-Бром-1,3-диметил-1H-пиррол-2-карбонитрил (2.03 г, 10.2 ммоль) и 4-[(трет-бутилдиметилсилил)окси]анилин (3.41 г, 15.3 ммоль) растворяют в толуоле (40 мл). Раствор дегазируют азотом в течение 10 минут. Затем добавляют трет-бутилат натрия (1.18 г, 12.2 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (0.17 г, 0.41 ммоль) и трис(дибензилиденацетон)дипалладий(0) (0.187 г, 0.2 ммоль). Смесь нагревают при 100°С в течение 30 минут и затем охлаждают до температуры окружающей среды. Добавляют воду (50 мл) и целит (6 г). Суспензию фильтруют через целит, и фильтрат разбавляют с помощью МТВЕ. Фазы разделяют, и водную фазу экстрагируют с помощью МТВЕ (2×50 мл). Объединенные органические фазы сушат над Na2SO4 и фильтруют. Остаток очищают с помощью хроматографии на силикагеле, используя этилацетат и гептан в качестве элюантов, и, далее, хроматографии с обращенной фазой, используя метанол и воду в качестве элюантов. Полученный продукт лиофилизируют с обеспечением ожидаемого соединения в виде твердого вещества.
1H ЯМР (400 МГц, CDCl3) δ м.д.: 0.15 (s, 6H), 0.98 (s, 9H), 2.05 (s, 3H), 3.70 (s, 3H), 4.69 (br. s, 1H), 6.55-6.57 (m, 2H), 6.64-6.69 (m, 3H)
13С ЯМР (100 МГц, CDCl3) δ м.д.: -4.37, 9.42, 18.27, 25.84, 35.50, 102.59, 113.77, 115.13, 120.72, 121.91, 126.77, 126.94, 140.98, 148.39
Методика получения 38'': 4-[(4-{[трет-Бутил(диметил)силил]окси}фенил)амино]-1-этил-5-метил-1H-пиррол-2-карбонитрил
Методика соответствует методике получения 33'', с заменой йодметана-d3 на стадии В на йодэтан.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 6.85 (s, 1H), 6.75 (s, 1H), 6.6/6.5 (2d, 4H), 4 (quad, 2H), 2.1 (s, 3H), 1.3 (s, 3H), 0.9 (s, 9H), 0.1 (s, 6H)
Методика получения 39'': N-[4-[трет-Бутил(диметил)силил]оксифенил]-2-этоксипиримидин-5-амин
Стадия А: 5-Бром-2-этоксипиримидин
5-Бром-2-хлорпиримидин (5.0 г, 25 ммоль) растворяют в этаноле (55 мл) и порциями добавляют этилат натрия (1.81 г, 26.6 ммоль). Реакционную смесь перемешивают в течение 15 часов при температуре окружающей среды. Когда реакция завершится, растворитель упаривают, добавляют воду (200 мл), и затем реакционную смесь экстрагируют дихлорметаном (2×100 мл). Органическую фазу сушат над Na2SO4, и затем упаривают досуха с получением 5-бром-2-этоксипиримидина.
Стадия В: N-[4-[трет-Бутил(диметил)силил]оксифенил]-2-этоксипиримидин-5-амин
4-[трет-Бутил(диметил)силил]оксианилин (1.8 г, 8 ммоль) и 5-бром-2-этоксипиримидин (1.6 г, 8 ммоль), растворенные в безводном тетрагидрофуране (30 мл), перемешивают в течение 1 часа при температуре окружающей среды в присутствии трет-бутилата натрия (4 мл, 2М раствор в ТГФ) и хлор(2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенил)[2-(2-аминоэтил)фенил]палладия(II) (111 мг, 0.16 ммоль). Реакционную смесь фильтруют через целит и затем упаривают досуха. Остаток растирают в гептане с получением ожидаемого соединения после фильтрования.
1H ЯМР (500 МГц, дмсо-d6, 300K) δ м.д.: 8.31 (s, 2H, пиримидин-Н), 7.80 (s, 1H, NH), 6.73 (d, 2H, Ar-H), 6.68 (d, 2H, Ar-H), 4.26 (q, 2H, СН2СН3), 1.31 (t, 3Н, СН2СН3), 0.94 (s, 9H,tBu), 0.15 (s, 6H, Me)
ИК: v: ароматическая: 1504 см-1; Si-C: 1247 см-1; С-О-С: 1057 см-1
Методика получения 40'': трет-Бутил 6-[(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)амино]пиридин-3-ил карбонат
Стадия А: 6-Бромпиридин-3-ил трет-бутил карбонат
К раствору 5 г 6-бромпиридин-3-ола (28.7 ммоль) и 7.53 г ди-трет-бутил дикарбоната (34.5 ммоль) в 50 мл тетрагидрофурана добавляют 0.18 г 4-диметиламинопиридина (1.4 ммоль). Смесь перемешивают при температуре окружающей среды в течение 6 часов и затем концентрируют. Полученный остаток растворяют в смеси этилового эфира и воды. После разделения фаз, отделенную органическую фазу сушат над MgSO4 и концентрируют досуха. Указанный в заголовке продукт получают в виде твердого вещества, которое используют на следующей стадии без очистки иным способом.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.4 (s, 1H), 7.71 (s, 2H), 1.5 (s, 9H)
Стадия В: трет-Бутил 6-[(1-метил-1Н-пирроло[2,3-b]пиридин-5-ил)амино]пиридин-3-ил карбонат
К раствору 2.79 г соединения, полученного на стадии А, (10.2 ммоль) в 15 мл толуола и 15 мл тетрагидрофурана добавляют 1.18 г трет-бутилата натрия (12.2 ммоль), и затем загрузочную порцию перемешивают под аргоном в течение 15 минут. К ней затем добавляют 0.35 г палладиевого катализатора (0.5 ммоль). Реакционную смесь затем перемешивают при температуре окружающей среды в течение 16 часов и затем фильтруют. Фильтрат концентрируют и переносят в смесь дихлорметана и воды. Органическую фазу отделяют и затем промывают водой, сушат над MgSO4, фильтруют и концентрируют досуха. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и этилацетат в качестве элюантов. Остаток затем переносят в минимальное количество изопропилового эфира. Полученное твердое вещество затем отфильтровывают, промывают эфиром и затем сушат. Указанный в заголовке продукт получают в виде твердого вещества, которое впоследствии используют без очистки иным способом.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 9 (s, 1H), 8.35 (wd, 1H), 8.3 (wd, 1H), 8 (wd, 1H), 7.45 (dd, 1H), 7.45 (wd, 1H), 6.8 (d, 1H), 6.4 (wd, 1H), 3.8 (s, 3H), 1.5 (s, 9H)
Методика получения 41'': 3-[4-[трет-Бутил(диметил)силил)оксианилино]бензонитрил
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 3-бромбензонитрил.
1H ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.3 (s, 1H), 7.3 (t, 1H), 7.2/7.1 (2 dd, 2H), 7.15 (t, 1H), 7.05 (d, 2H), 6.8 (d, 2H), 0.95 (s, 9H), 0.2 (s, 6H)
Методика получения 42'': 4-[4-[трет-Бутил(диметил)силил]оксианилино]тиофен-2-карбонитрил
Методика соответствует методике получения 1'', с заменой 4-бром-1-метил-1H-пиразола, используемого на стадии В, на 4-бромтиофен-2-карбонитрил.
1Н ЯМР (400 МГц, дмсо-d6) δ м.д.: 8.35 (s, 1H), 7.59 (wd, 1H), 7.08 (wd, 1H), 6.95 (d, 2H), 6.75 (d, 2H), 0.94 (s, 9H), 0.16 (s, 6H)
Амины NHR3R4, где R3 и R4 каждый независимо от другого представляет собой арильную или гетероарильную группу, получают в соответствии со способами, описанными в литературе (Surry D.S. и др., Chemical Science, 2011, 2, 27-50, Charles M.D. и др.. Organic Letters, 2005, 7, 3965-3968). Реакция защиты гидрокси функции 4-анилинофенола, описанная в методике получения 2'', может применяться для различных вторичных аминов NHR3R4 (как определено выше), содержащих одну или несколько гидроксильных функций, когда они доступны для приобретения. Альтернативно, вторичные амины, содержащие по меньшей мере один гидрокси заместитель, могут быть синтезированы непосредственно в защищенной форме, то есть, исходя из реагентов, чья гидроксильная функция была защищена заранее. Среди защитных групп, трет-бутил(диметил)силилокси и бензилокси являются особенно предпочтительными.
Среди аминов NHR3R4, содержащих гидроксильный заместитель, которые используют для синтеза соединений согласно изобретению, могут быть упомянуты: 4-(4-толуидино)фенол, 4-(4-хлоранилино)фенол, 4-(3-фтор-4-метиланилино)фенол, 4-[4-(трифторметокси)анилино]фенол, 4-[4-гидроксианилино]фенол, {4-[(1-метил-1H-индол-6-ил)амино]фенил}метанол, 4-(2,3-дигидро-1H-индол-6-иламино)фенол, 4-[(1-метил-2,3-дигидро-1H-индол-6-ил)амино]фенол, 4-[(1-метил-1H-индол-6-ил)амино]фенол, 4-[(1-метил-1H-индол-6-ил)амино]циклогексанол, 4-[(1-метил-1,2,3,4-тетрагидро-6-хинолинил)амино]фенол, 4-[(4-метил-3,4-дигидро-2H-1,4-бензоксазин-7-ил)амино] фенол, 4-[4-(диэтиламино)анилино]фенол, 4-(2,3-дигидро-1H-инден-5-иламино)фенол, 4-[(1-метил-1H-индазол-5-ил)амино]фенол, 4-[(1'-метил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-5'-ил)амино]фенол, 4-[(1,3,3-триметил-2,3-дигидро-1H-индол-5-ил)амино]фенол, 4-[4-метокси-3-(трифторметил)анилино]фенол, 4-[4-(метилсульфанил)-3-(трифторметил)анилино]фенол, 2-фтор-4-[(1-метил-1Н-индол-5-ил)амино]фенол, 4-[(1-этил-1H-индол-5-ил)амино]фенол, 4-[(1-этил-2,3-дигидро-1H-индол-5-ил)амино]фенол, 4-[(1-изопропил-2,3-дигидро-1H-индол-5-ил)амино]фенол, 4-(бутиламино)фенол, 3-[(1-метил-1H-индол-5-ил)амино]-1-пропанол, 4-[(1-метил-1H-индол-5-ил)амино]-1-бутанол, 4-[(3-фтор-4-метилфенил)амино]фенол, 4-[(3-хлор-4-метилфенил)амино]фенол, 4-[(4-фторфенил)амино]фенол, 4-[(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)амино]фенол, 4-[(4-фторфенил)амино]фенол, 4-[(2-фторфенил)амино]фенол, 4-[(3-фторфенил)амино]фенол, 4-[(2,4-дифторфенил)амино] фенол, 4-[(3,4-дифторфенил)амино]фенол, 3-[(4-гидроксифенил)амино]бензонитрил, 4-[(3-метоксифенил)амино]фенол, 4-[(3,5-дифторфенил)амино] фенол, 4-[(3-метилфенил)амино]фенол, 4-[(4-гидроксифенил)амино]бензонитрил, 4-[(3-хлорфенил)амино]фенол, 4-(пиримидин-2-иламино)фенол, 4-[(циклобутилметил)амино]фенол, 2-[(4-гидроксифенил)амино]бензонитрил, 4-{[(1-метил-1H-пиразол-4-ил)метил]амино}фенол, 4-[(циклопропилметил)амино]фенол, 4-{[(1-метил-1H-пиразол-3-ил)метил]амино}фенол, 4-(бут-2-ин-1-иламино)фенол, 4-(пиразин-2-иламино)фенол, 4-(пиридин-2-иламино)фенол, 4-(пиридазин-3-иламино)фенол, 4-(пиримидин-5-иламино)фенол, 4-(пиридин-3-иламино)фенол, 4-[(3,5-дифтор-4-метоксифенил)амино]фенол, 4-(пиридин-4-иламино)фенол, 4-[(3-фтор-4-метоксифенил)амино]фенол, 2-(фениламино)пиримидин-5-ол, 5-[(4-гидроксифенил)амино]-2-метоксибензонитрил, 4-{[3-(трифторметил)фенил]амино}фенол и 4-(метиламино)фенол.
Гидроксильную(-ые) функцию(-и) вторичных аминов, перечисленных выше, защищают заранее с помощью подходящих защитных групп перед любым сочетанием с производным соединения формулы (VII) по кислотной группе, как определено в предшествующем общем способе.
Методика получения I: трет-Бутил 12-(3-йод-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)этил]карбамат
Стадия А: 4-[2-(трет-Бутоксикарбониламино)этил]бензойная кислота
трет-Бутил дикарбонат (1.64 г; 7.5 ммоль) растворяют в 1,4-диоксане (5 мл), и раствор добавляют к хорошо перемешиваемому раствору 4-(2-аминоэтил)бензойной кислоты (1.0 г; 5 ммоль) в 1М водном растворе гидроксида натрия (25 мл) и 1,4-диоксане (10 мл), и смесь затем перемешивают при температуре окружающей среды в течение 3 часов. 1,4-Диоксан удаляют путем упаривания в вакууме, и затем к остатку добавляют этилацетат (200 мл). Значение pH водной фазы доводят до 1.5 с помощью 2М водного раствора HCl. Органическую фазу отделяют, и водную фазу затем экстрагируют этилацетатом (100 мл). Объединенные органические экстракты промывают водой, сушат над Na2SO4 и упаривают до объема 10 мл. К остатку добавляют гептан, и затем твердый осадок отфильтровывают с получением указанного в заголовке соединения.
1H ЯМР (500 МГц, дмсо-d6, 300K): 12.81 (br s, 1H, СООН), 7.85 (m, 2H, Ar-2' и 6'Н), 7.31 (m, 2H, Ar-3' и 5'Н), 6.91 и 6.51 (2× br s, 1H, NH), 3.16 (m, 2H, СН2), 2.75 (t, 2H, СН2), 1.35 и 1.31 (2× br s, 9H, But);13С ЯМР (125 МГц, дмсо-d6, 300K): 167.8 (q), 156.0 (CH), 145.3 (q), 129.8 (2×СН), 129.3 (2×CH), 129.1 (q), 78.0 (q), 41.5 (СН2), 35.9 (СН2), 28.7 (СН3)
Стадия В: 4-[2-(трет-Бутоксикарбониламино)этил]-2-йодбензойная кислота
Соединение вышеприведенной стадии (0.88 г; 3.31 ммоль), диацетат йодбензола (1.07 г; 3.31 ммоль), йодид тетрабутиламмония (1.22 г; 3.31 ммоль), йод (0.84 г; 3.31 ммоль) и диацетоксипалладий (0.04 г; 0.165 ммоль) растворяют в 1,2-дихлорэтане (8 мл), и смесь затем нагревают в микроволновом реакторе при 80°С в течение 90 минут. Охлажденную смесь распределяют между насыщенным водным раствором Na2CO3 (30 мл) и начальным растворителем. Органическую фазу отделяют, и водный остаток экстрагируют диэтиловым эфиром (2×15 мл). Значение pH получающегося водного раствора доводят до 2 с помощью 2М водного раствора HCl, и продукт затем экстрагируют этилацетатом (2×75 мл). Органическую фазу сушат над Na2SO4 и упаривают. Сырой продукт очищают с помощью хроматографии на силикагеле с получением смеси региоизомеров, которую разделяют с помощью препаративной ВЭЖХ с использованием смеси вода-ТФУ и ацетонитрила в качестве элюантов. Значение pH подходящих объединенных фракций доводят до 5 с помощью NaHCO3, и затем ацетонитрил упаривают при пониженном давлении. Осадок извлекают путем фильтрования и затем сушат с получением указанного в заголовке соединения.
1H ЯМР (500 МГц, дмсо-d6, 300K): 13.16 (широкий s, 1H, СООН), 7.81 (s, 1Н, Ar-3'H), 7.66 (d, 1H, Ar-6'H), 7.29 (d, 1H, Ar-5'Н), 6.89 (t, 1H, NH), 3.14 (t, 1H, CH2), 2.69 (t, 1H, CH2), 1.35 (s, 9H, Boc)
Стадия С: трет-Бутил[2-(3-йод-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)этил]карбамат
Соединение вышеприведенной стадии (0.714 г; 1.82 ммоль), TBTU (0.73 г; 2.28 ммоль), N-этил-N-изопропилпропан-2-амин (0.94 мл; 5.46 ммоль) и N,N-диметилпиридин-4-амин (22 мг) перемешивают в дихлорметане (20 мл) в течение 5 минут, и затем добавляют (3R)-3-метил-1,2,3,4-тетрагидроизохинолин (0.282 г; 1.92 ммоль) (см. также методику получения 1'). Смесь перемешивают еще три часа. Реакционную смесь разбавляют дихлорметаном (150 мл) и затем промывают водой (25 мл), сушат над Na2SO4 и упаривают. Сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C24H29IN2O3
[М+Н]+ рассчитано: 521.1303
[М+Н]+ найдено: 521.1282
ИК: v: С-Н: 2931 см-1; >С=O: 1706, 1627 см-1; амид: 1505 см-1; С-О-С: 1248, 1166 см-1
Методика получения II: трет-Бутил (4-йод-3-{[(3R)-3-метил-3,4-дигидроизохинолнн-2(1H)-ил]карбонил}бензил)карбамат
Стадия А: 2-Йод-5-метилбензойная кислота
3-Метилбензойную кислоту (6.12 г; 45 ммоль), диацетат йодбензола (14.49 г; 45 ммоль), йодид тетрабутиламмония (16.62 г, 45 ммоль), йод (11.43 г; 45 ммоль) и диацетоксипалладий (0.5 г; 2.2 ммоль) растворяют в 1,2-дихлорэтане, и затем смесь нагревают в запаянной трубке при 85°С в течение 1 часа и 45 минут. Охлажденный раствор очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением указанного в заголовке соединения.
Стадия В: Метил 2-йод-5-метилбензоат
Соединение вышеприведенной стадии (6.25 г, 23.9 ммоль) растворяют в безводном метаноле (100 мл), и затем к хорошо перемешиваемому раствору добавляют по каплям SOCl2 (3.6 мл, 49 ммоль). Раствор нагревают с обратным холодильником в течение 18 часов и затем упаривают до объема 25 мл, и затем выливают в дробленый лед (100 г). Получающуюся смесь экстрагируют диэтиловым эфиром (2×75 мл). Органическую фазу промывают насыщенным водным раствором NaHCO3 и затем соляным раствором, сушат над Na2SO4 и упаривают досуха с получением указанного в заголовке соединения.
Стадия С: Метил 5-(бромметил)-2-йодбензоат
Соединение вышеприведенной стадии (5.7 г; 20.7 ммоль), N-бром-сукцинимид (3.67 г; 20.7 ммоль) и дибензоилпероксид (0.24 г; 1 ммоль) растворяют в четыреххлористом углероде (40 мл) и затем нагревают с обратным холодильником в течение 5 часов. Затем добавляют новые порции N-бромсукцинимида (1.0 г; 5.6 ммоль) и дибензоилпероксида (0.05 г; 0.2 ммоль), и нагревание продолжают в течение еще 4 часов. Реакционную смесь охлаждают до температуры окружающей среды. Нерастворимые части удаляют с помощью фильтрования, и концентрированный фильтрат затем очищают с помощью хроматографии на силикагеле, используя гептан и этилацетат в качестве элюантов, с получением указанного в заголовке соединения.
Стадия D: Метил 5-(аминометил)-2-йодбензоат
Соединение вышеприведенной стадии (0.53 г; 1.5 ммоль) растворяют в 7М метанольном аммиаке (20 мл) и затем перемешивают при температуре окружающей среды в течение 1 часа. Раствор упаривают досуха с получением указанного в заголовке соединения, которое используют на следующей стадии без очистки.
Стадия Е: 5-[(трет-Бутоксикарбониламино)метил]-2-йодбензойная кислота
Гидробромид метил 5-(аминометил)-2-йодбензоата (0.56 г; 1.5 ммоль) растворяют в пиридине (10 мл), затем добавляют ди-трет-бутил дикарбонат (0.80 г; 3.6 ммоль), и смесь перемешивают при температуре окружающей среды в течение 30 минут и затем упаривают досуха. Остаток повторно растворяют в метаноле (10 мл), и затем добавляют 2М водный раствор NaOH (3 мл) и 2 мл воды. Получающийся раствор перемешивают в течение 2 часов при 50°С, затем разбавляют водой (20 мл), и метанол упаривают при пониженном давлении. Значение рН получающегося водного раствора доводят до 3 с помощью 2М водного раствора HCl; продукт затем экстрагируют этилацетатом. Органическую фазу промывают соляным раствором, и затем сушат над Na2SO4 и упаривают досуха. Сырой продукт растирают с ДХМ. Образованное твердое вещество извлекают путем фильтрования с получением указанного в заголовке соединения.
1H ЯМР (500 МГц, дмсо-d6, 300K): 13.24 (широкий s, 1H, СООН), 7.91 (d, 1Н, Ar-3'Н), 7.58 (d, 1H, Ar-6'H), 7.47 (t, 1H, NH), 7.09 (d, 1H, (Ar-5'H), 4.09 (d, 2H, CH2), 1.38 (s, 9H, Boc);13С ЯМР (125 МГц, дмсо-d6, 300K): 168.6 (q), 156.3 (q), 141.1 (q), 140.9 (CH), 137.1 (q), 131.6 (CH), 129.1 (СН), 92.2 (q), 78.5 (q), 28.7 (СН3)
Стадия F: трет-Бутил (4-йод-3-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}бензил)карбамат
Соединение вышеприведенной стадии (1.62 г; 4.3 ммоль), TBTU (2.76 г; 8.59 ммоль), N-этил-N-изопропилпропан-2-амин (1.48 мл; 8.59 ммоль) и N,N-диметилпиридин-4-амин (10 мг) перемешивают в ДХМ (50 мл) в течение 5 минут; затем добавляют (3R)-3-метил-1,2,3,4-тетрагидроизохинолин (0.76 г; 5.15 ммоль) (см. также методику получения 1'), и смесь перемешивают еще в течение 15 минут. Нерастворимые части удаляют с помощью фильтрования, и затем концентрированный фильтрат очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением указанного в заголовке соединения.
Методика получения III: трет-Бутил (3-бром-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}бензил)карбамат
Стадия А: Метил 4-(аминометил)-2-бромбензоат
Раствор метил 2-бром-4-(бромметил)бензоата (4.57 г; 14.84 ммоль) в 50 мл метанола добавляют по каплям к хорошо перемешиваемому раствору аммиака в метаноле (7М; 315 мл) при температуре окружающей среды, и раствор затем перемешивают в течение 3 часов. Все растворители упаривают, и остаток очищают с помощью хроматографии на силикагеле, используя дихлорметан-метанол в качестве элюантов, с получением указанного в заголовке соединения.
Стадия В: 2-Бром-4-[(трет-бутоксикарбониламино)метил]бензойная кислота
Соединение вышеприведенной стадии (4.04 г; 16.6 ммоль) растворяют в пиридине (55 мл) и затем добавляют ди-трет-бутил дикарбонат (5.43 г; 24.9 ммоль), и смесь перемешивают при температуре окружающей среды в течение 16 часов; затем ее упаривают досуха. Остаток повторно растворяют в метаноле (100 мл), и затем добавляют 1М водный раствор NaOH (54 мл). Получающийся раствор перемешивают в течение 1.5 часов при 50°С, и затем ему позволяют охладиться до температуры окружающей среды. Значение рН раствора доводят до 7 с использованием 2М водного раствора HCl; метанол затем упаривают при пониженном давлении. Получающийся водный раствор разбавляют водой (50 мл), и затем рН доводят до 3 с использованием 2М водного раствора HCl. Продукт экстрагируют дихлорметаном (2×100 мл). Органическую фазу промывают соляным раствором, затем сушат над Na2SO4 и упаривают досуха с получением указанного в заголовке соединения, которое используют на следующей стадии без очистки.
ИК: v: N-H: 3359 см-1; С-Н: 2983 см-1; >С=O: 1685, 1603 см-1; амид: 1519 см-1; С-О-С: 1248, 1162, 1057 см-1
Стадия С: трет-Бутил (3-бром-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}бензил)карбамат
Соединение вышеприведенной стадии (3.7 г; 11.2 ммоль), TBTU (7.19 г; 22.4 ммоль), N-этил-N-изопропилпропан-2-амин (3.86 мл; 22.4 ммоль) и N,N-диметилпиридин-4-амин (48 мг) перемешивают в дихлорметане (100 мл) в течение 5 минут, и затем добавляют (3R)-3-метил-1,2,3,4-тетрагидроизохинолин (1.98 г, 13.44 ммоль) (см. также методику получения 1'), и смесь перемешивают еще в течение 1 часа. Нерастворимые части удаляют с помощью фильтрования, и затем концентрированный фильтрат очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C23H27BrN2O3
[М+Н]+ рассчитано: 459.1285
[М+Н]+ найдено: 459.1282
1H ЯМР (500 МГц, дмсо-d6, 300K, присутствие амидных ротамеров): 7.66-6.87 (m, 7H, ароматические), 5.34 и 4.12 (d, 2H, СН2-изохинолин), 5.02 и 4.97 и 3.87 и 3.83 (m, 1Н, СН2-изохинолин), 4.17 (d, 2H, СН2-бензил), 3.18-2.48 (m, 1H, СН2-изохинолин), 1.16 и 1.14 и 1.10 и 0.98 (d, 3H, изохинолин-СН3), 1.31 и 1.41 (s, 9H, Boc).
Пример 1. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроиэохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Стадия А: Этил 5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 1.4 г соединения, полученного в методике получения 1, (4.35 ммоль) в 50 мл дихлорметана последовательно добавляют 0.7 г соединения, полученного в методике получения 1', (4.79 ммоль), 0.7 г НОВТ (5.22 ммоль), 0.81 г EDC (5.22 ммоль) и 1.6 мл триэтиламина (21.7 ммоль). Загрузочную порцию затем перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь затем разбавляют дихлорметаном и 3 раза промывают насыщенным водным раствором NaHCO3. Органическую фазу затем сушат над MgSO4, фильтруют, концентрируют досуха, и затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов.
1Н ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.6-7.3 (m, 3Н, ароматические Н, 4-хлорфенил); 7.2-6.85 (m, 4Н, ароматические Н, тетрагидроизохинолин); 6.45-6.3 (m, 1Н, Н пиррол); 5.0-4.8-3.8 (m, 1H, алифатический Н, тетрагидроизохинолин); 5.3-3.75 (dd, 2H, алифатические Н, тетрагидроизохинолин); 4.2-4.0 (m, 2H, OCH2CH3); 3.25 (s, 3Н, СН3-N-пиррол); 3.0-2.2 (m, 2H, алифатические Н, тетрагидроизохинолин); 2.5 (s, 3Н, СН3-пиррол); 1.25 (t, 3Н, ОСН2СН3); 1.05 (d, 3Н, тетрагидроизохинолин-СН3)
ИК: v: >С=O: 1693 см-1 сложный эфир; v: >С=O: 1625 см-1 амид
Стадия В: 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-1Н-пиррол-3-карбоновая кислота
К раствору 1.7 г соединения, полученного на стадии А, (3.77 ммоль) в 5 мл диоксана добавляют 0.317 г LiOH (7.5 ммоль), растворенного в 5 мл воды. Загрузочную порцию нагревают в микроволновом приборе в течение 4 часов при 100°С (мощность 140 Вт). Реакционную смесь затем фильтруют и концентрируют досуха. Полученный таким образом остаток переносят в дихлорметан (50 мл), и затем к нему добавляют насыщенный водный раствор NH4Cl. Органическую фазу промывают водой и затем соляным раствором, сушат над MgSO4, фильтруют и концентрируют досуха. Указанный в заголовке продукт получают в виде твердого вещества и непосредственно используют на следующей стадии.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 11.05 (широкий s, 1H, СООН), 7.5-7.2 (m, 3Н, ароматические Н, 4-хлорфенил); 7.2-6.9 (m, 4Н, ароматические Н, тетрагидроизохинолин); 6.45-6.2 (m, 1H, алифатический Н, Н пиррол); 5.3-3.75 (dd, 2H, алифатические Н, тетрагидроизохинолин); 5.0-4.8-3.8 (m, 1H, алифатический Н, тетрагидроизохинолин); 3.5-3.2 (s, 3Н, СН3-N-пиррол); 3.0-2.1 (алифатические Н, СН3-тетраизохинолин); 2.5-2.4-1.98 (m, 3Н, СН3-пиррол); 1.05-0.52 (m, 3Н, алифатические Н, СН3-тетраизохинолин)
ИК: v: -ОН: 3500-2000 см-1 карбоновая кислота; v: >С=O: 1699+1658 см-1 карбоновая кислота; v: >C=N-: 1625 см-1 амид
Стадия С: N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 0.65 г соединения, полученного на стадии В, (1.54 ммоль) в 15 мл дихлорэтана по каплям добавляют 0.244 мл 1-хлор-N,N,2-триметилпроп-1-ен-1-амина. Реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа, и затем добавляют 0.56 г соединения методики получения 1'' (1.84 ммоль), 10 мл дихлорэтана и 0.376 г 4-диметиламинопиридина (DMAP) (3.07 ммоль). Загрузочную порцию перемешивают при 110°С в течение ночи. Реакционную смесь концентрируют, растворяют в дихлорметане и промывают насыщенным водным раствором NaHCO3. Указанный в заголовке продукт получают в виде масла и непосредственно используют на следующей стадии.
Стадия D: 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 0.8 г соединения, полученного на стадии С, (1.03 ммоль) в 2 мл метанола добавляют 1.55 мл 1М раствора гидроксида калия в метаноле (1.55 ммоль). Загрузочную порцию перемешивают при температуре окружающей среды в течение 30 минут. Реакционную смесь затем разбавляют дихлорметаном и последовательно промывают 1М водным раствором HCl, насыщенным водным раствором NaHCO3 и затем соляным раствором до нейтральной среды. Органическую фазу затем сушат над MgSO4, фильтруют и упаривают. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Таким образом полученное твердое вещество растворяют в смеси вода/ацетонитрил до тех пор, пока растворение не завершится, фильтруют и затем лиофилизируют.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.74:68.25; %Н=5.43:5.69; %N=11.79:11.66; %Cl=5.97:5.95
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C34H32ClN5O3
[М+Н]+ рассчитано: 594.2266
[М+Н]+ найдено: 594.2289
Пример 2. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинелин-2(1H)-ил]карбонил)фенил)-1-метил-N,N-дифенил-1H-пиррол-3-карбоксамид
Стадия А: трет-Бутил {[(3S)-2-{2-[4-(дифенилкарбамоил)-1-метил-1Н-пиррол-2-ил]бензоил}-1,2,3,4-тетрагидроизохинолин-3-ил]метил}карбамат
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 2 и трет-бутил [(3S)-1,2,3,4-тетрагидроизохинолин-3-илметил]карбамата (см. методику получения 2') на стадии А, и N-фениланилина на стадии С.
Стадия В: 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1-метил-N,N-дифенил-1H-пиррол-3-карбоксамид
Раствор NH-Boc соединения стадии А в дихлорметане помещают на баню с температурой 0°С. К раствору по каплям добавляют 10 молярных эквивалентов трифторуксусной кислоты. Загрузочную порцию перемешивают при температуре окружающей среды в течение 4 часов, до тех пор, пока исходное вещество полностью не исчезнет. Реакционную смесь затем концентрируют досуха, остаток дважды вносят в толуол и упаривают совместно с ним, затем вносят в смесь ацетонитрил/H2O и, в заключение, лиофилизируют. Затем указанный в заголовке продукт получают после стадии нейтрализации.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=77.75:77.27: %H=5.97:5.73; %N=10.36:10.44
Пример 3. 5-(5-Хлор-2-{[(3S)-3-1(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-(1H-индол-5-ил)-1-метил-1H-пиррол-3-карбоксамид
Стадия A: трет-Бутил 5-[(4-{[трет-бутил(диметил)силил]окси}фенил){[5-(5-хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1-метил-1Н-пиррол-3-ил]карбонил}амино]-1Н-индол-1-карбоксилат
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 3 и (3S)-3-[(4-метил-1-пиперазинил)метил]-1,2,3,4-тетрагидроизохинолина (см. методику получения 4') на стадии А, и соединения методики получения 3'' на стадии С.
Стадия В: 5-(5-Хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-(1Н-индол-5-ил)-1-метил-1Н-пиррол-3-карбоксамид
К раствору 455 мг (0.49 ммоль) полученного на стадии А продукта в 5 мл метанола добавляют 135 мг (2.5 ммоль) КОН. После перемешивания в течение 3 часов при температуре окружающей среды, реакционную смесь концентрируют, обрабатывают насыщенным водным раствором NaHCO3 и экстрагируют метиленхлоридом. Органическую фазу затем сушат над MgSO4, фильтруют и упаривают досуха. Полученный таким образом сырой продукт затем очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением ожидаемого продукта в виде пены.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=70.72:68.54; %Н=5.79:5.37; %N=11.78:11.41; %Cl=4.97:4.79
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H41ClN6O3
[М+Н]+ рассчитано: 713.3007
[М+Н]+ найдено: 713.2973
Пример 4. N-(4-Гидроксифенил)-N-(1H-индол-5-ил)-1-метил-5-(6-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 3 с использованием соединения методики получения 4 на стадии А.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=71.45:69.32; %Н=5.86:5.22; %N=11.63:11.08
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H42N6O5
[М+Н]+ рассчитано: 723.3295
[М+Н]+ найдено: 723.3262
Если не указано иное, соединения следующих примеров синтезируют в соответствии со способом примера 1 с использованием на стадии A: (i) подходящей кислоты, полученной в соответствии с одной из методик получения 1-32 и (ii) подходящего тетрагидроизохинолинового соединения, полученного в соответствии с одной из методик получения 1'-9' и, на стадии С: (iii) подходящего NHR3R4 амина (неполный перечень предлагается в методиках получения 1''-42''. Таким образом полученные соединения необязательно подвергают стадии превращения в солевую форму в присутствии HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода, получают гидрохлорид ожидаемого соединения.
Пример 5. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-индол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.54:64.9; %Н=5.67:5.49; %N=10.5:10.4; %Cl=l3.29:12.52; %Cl-=8.86:7.39
Пример 6. 5-(5-Хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолии-2(1H)-ил]карбонил}фенил)-1-этил-N-(4-гидроксифенил)-N-(1-метил-1H-индол-5-ил)-1H-пиррол-3-карбоксамид
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C44H45ClN6O3
[М+Н]+ рассчитано: 741.3320
[М+Н]+ найдено: 741.3326
Пример 7. 5-(5-Хлор-2-{[(3S)-3-1(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолии-2(1H)-ил]карбонил}фенил)-1-циклопропил-N-(4-гидроксифенил)-N-(1-метил-1H-индол-5-ил)-1H-пиррол-3-карбоксамид
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C45H45ClN6O3
[M+H]+ рассчитано: 753.3320
[М+Н]+ найдено: 753.3306
Пример 8. 5-(5-Хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-(1-метил-1H-индол-5-ил)-1-(пропан-2-ил)-1H-пиррол-3-карбоксамид
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C45H47ClN6O3
[М+Н]+ рассчитано: 755.3476
[M+H]+ найдено: 755.3466
Пример 9. Гидрохлорид N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-индол-5-ил)-5-(6-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.26:65.8; %Н=5.73:5.47; %N=10.38:10.48; %Cl=8.76:8.46; %Cl-=8.76:8.02
Пример 10. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=69.11:68.56; %Н=5.8:5.31; %N=8.06:8.13; %Cl-=5.1:4.68
Пример 11. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(3-гидроксипропил)-2-метил-N-фенил-1H-пиррол-3-карбоксамида
Стадия А: 1-[3-(Бензилокси)пропил]-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-фенил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 10 и соединения методики получения 3' на стадии А, и соединения методики получения 2'' на стадии С.
Стадия В: Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(3-гидроксипропил)-2-метил-N-фенил-1Н-пиррол-3-карбоксамида
Соединение стадии А подвергают реакции снятия защиты в соответствии с протоколом, аналогичным описанному на стадии В примера 23.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=68.24:67.96; %Н=6:5.79; %N=7.58:7.61; %Cl-=4.8:4.75
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H43FN4O5
[М+Н]+ рассчитано: 703.3296
[М+Н]+ найдено: 703.33294
Пример 12. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-индазол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.33:67.39; %Н=5.65:5.18; %N=11.22:11.52; %Cl-=4.73:3.82
Пример 13. Гидрохлорид N-(3-фтор-4-метилфенил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.97:66.72; %Н=5.62:5.21; %N=7.44:7.59; %Cl-=4.71:4.54
Пример 14. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-иидазол-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.б2:66.59; %Н=5.59:4.67; %N=10.84:10.85; %Cl-=4.57:4.24
Пример 15. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.28:67.07; %Н=5.73:5.09; %N=7.77:7.75; %Cl-=4.92:5.71
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H40N4O6
[M+H]+ рассчитано: 685.3026
[M+H]+ найдено: 685.3033
Пример 16. Гидрохлорид N-(3-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.62:66.11; %Н=5.45:5.2; %N=7.58:7.89; %Cl-=4.8:5.59
Пример 17. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.51:66.91; %Н=5.66:5.05; %N=7.87:7.88; %Cl-=4.98:5.75
Пример 18. Гидрохлорид 1-(2-гидроксиэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3S)-3-[2-(морфолин-4-ил)этил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамида
Стадия А: 1-[2-(Бензилокси)этил]-N-[4-(бензилокси)фенил]-2-метил-5-(6-{[(3S)-3-[2-(морфолин-4-ил)этил]-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 9 и (3S)-3-[2-(морфолин-4-ил)этил]-1,2,3,4-тетрагидроизохинолина (см. методику получения 5') на стадии А, и 4-(бензилокси)-N-фениланилина (см. методику получения 8'') на стадии С.
Стадия В: Гидрохлорид 1-(2-гидроксиэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3S)-3-[2-(морфолин-4-ил)этил]-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1Н-пиррол-3-карбоксамида
Соединение стадии А подвергают реакции снятия защиты в соответствии с протоколом, аналогичным описанному на стадии В примера 23.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C38H40N6O5
[М+Н]+ рассчитано: 729.3283
[М+Н]+ найдено: 729.3282
Пример 19. Гидрохлорид N-(4-гидроксифенил)-5-(5-метокси-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=69.63:69.45; %Н=6.13:5.94; %N=7.92:7.79; %Cl-=5.01:4.58
Пример 20. Гидрохлорид N-(4-гидрокcифенил)-5-(5-метокси-2-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=69.39:69.б6; %Н=5.66:5.46; %N=8.99:8.92; %Cl-=5.69:5.29
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C36H35N4O4
[M+H]+ рассчитано: 587.2653
[M+H]+ найдено: 587.2649
Пример 21. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(7-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-2,3-дигидро-1,4-бензодиоксин-6-ил)-1H-пиррол-3-карооксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.99:64.67; %Н=5.86:5.67; %N=11.37:11.27; %Cl-=4.8:4.71
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H43N6O6
[M+H]+ рассчитано: 703.3236
[M+H]+ найдено: 703.3239
Пример 22. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(7-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-2,3-дигидро-1,4-бензодиоксин-6-ил)-N-фенил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.61:67.97; %Н=5.89:5.59; %N=7.62:7.55; %Cl-=4.82:4.27
Пример 23. 1-(2-Гидроксиэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Стадия А: 1-[2-(Бензилокси)этил]-N-(4-{[трет-бутил(диметил)силил]окси}фенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 9 и соединения методики получения 1'' на стадии С.
Стадия В: N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1-(2-гидроксиэтил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 6.86 г (8.19 ммоль) соединения стадии А в 70 мл безводного метанола добавляют 1.37 г Pd/C 10%. Загрузочную порцию дегазируют в течение 0.5 часа и затем перемешивают при температуре окружающей среды под давлением водорода (1.5 бар) в течение 12 часов. Реакционную смесь затем фильтруют и затем концентрируют досуха. Ожидаемый продукт получают в виде твердого вещества.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.7-7.4 (s, 1H, Н пиразол); 7.1-6.8 (s, 1Н, Н пиразол); 7.3-6.9 (m, 4H, ароматические Н, Н тетрагидроизохинолин); 7.0-6.7 (m, 2Н, ароматические Н); 6.9-6.4 (m, 2Н, ароматические Н); 6.8-6.4 (m, 2H, ароматические Н); 6.1 (m, 2Н, ОСН2О); 5.2, 5.0, 4.7 (4s, Н, Н-пиррол (наличие конформационных изомеров); 5.15 (d, 1H, алифатический Н, Н тетрагидроизохинолин); 4.9 (m, 1H, алифатический Н, Н тетрагидроизохинолин); 4.9-4.8 (m, 1H, СН2ОН); 4.7 (m, 1H, алифатический Н, Н тетрагидроизохинолин); 3.9 (d, 1H, алифатический Н, Н тетрагидроизохинолин); 3.85 (m, 1H, алифатический Н, Н тетрагидроизохинолин); 3.7 (m, 2H, алифатические Н, CH2CH2OH); 3.75 (2s, 3Н,); 3.5-3.2 (m, 2H, алифатические Н, CH2CH2OH); 3.0-2.4 (m, 2H, алифатический Н, Н тетрагидроизохинолин); 2.4-2.3 (4s, 3H, СН3-пиррол); 1.5, 0.95, 0.75 (4 d, 3H, СН3-THIQ); 0.85 (широкий s, 9H, Si(СН3)2(СН(СН3)2); 0.15 (m, 6H, Si(СН3)2(СН(СН3)2)
ИК: v: -ОН: 3346 см-1 карбоновая кислота; v:>С=O: 1621 см-1
Стадия С: 1-(2-Гидроксиэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
Снимают защиту с фенольной функции соединения стадии В, следуя способу стадии D примера 1.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.23:68.12; %Н=5.57:5.29; %N=11.05:10.79
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C36H36N5O6
[М+Н]+ рассчитано: 634.2662
[М+Н]+ найдено: 634.2660
Пример 24. Гидрохлорид N-(4-гидроксифенил)-5-(5-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.86:64.47; %Н=6.09:5.88; %N=11.82:11.45; %Cl-=4.98:6.7
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H42N6O5
[М+Н]+ рассчитано: 675.3289
[М+Н]+ найдено: 675.3287
Пример 25. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.77:62.S3; %H=5.63:5.83; %N=11.74:11.29; %Cl-=4.95:5.42
Пример 26. Гидрохлорид N-(4-гидроксифенил)-2-метил-1-[2-(метиламино)этил]-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-нл)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Методика соответствует стадиям А, В и С способа примера 30 с заменой азида натрия, используемого на стадии В, на метиламин. После очистки на силикагеле (градиент CH2Cl2/MeOH/NH3), полученное соединение, 0.3 г (0.46 ммоль), растворяют в 5 мл безводного метанола и по каплям добавляют 0.464 мл (0.47 ммоль) 1М раствора HCl в эфире. Загрузочную порцию перемешивают в течение 0.5 часа при температуре окружающей среды. Таким образом полученный осадок отфильтровывают и сушат и затем растворяют в смеси CH3CN/H2O перед лиофилизацией при низкой температуре. Ожидаемый продукт получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.05:64.64; %Н=5.75:5.43; %N=12.3:12.3; %Cl-=5.19:5.39
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C37H38N6O5
[М+Н]+ рассчитано: 647.2903
[М+Н]+ найдено: 647.2922
Пример 27. Гидрохлорид 1-(2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Методика соответствует способу Примера 26, с заменой метиламина на стадии В на диметиламин.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.46:65.07; %Н=5.93:5.87; %N=12.05:12.06; %Cl-=5.08:5.55
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C38H40N6O5
[M+H]+ рассчитано: 661.3060
[M+H]+ найдено: 661.3045
Пример 28. Гидрохлорид 5-(5-хлор-2-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридии-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.99:66.88; %Н=5.14:5.28; %N=8.93:8.87; %Cl-=5.65:4.98
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H32ClN4O3
[M+H]+ рассчитано: 591.2157
[M+H]+ найдено: 591.2178
Пример 29. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-{[2-(морфолин-4-ил)этокси]метил}-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Стадия А: Метил 5-(5-хлор-2-{[(3S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 4.9 г соединения методики получения 1 в смеси 40 мл диметилформамида и 40 мл тетрагидрофурана добавляют 2.73 г (1.1 эквивалента) (3S)-3-гидроксиметил-1,2,3,4-тетрагидроизохинолина, 7.95 мл диизопропилэтиламина и 9.84 г (1.7 эквивалента) HATU. После перемешивания в течение 2 часов при температуре окружающей среды, реакционную смесь сушат, переносят в этилацетат и затем промывают 10% водным раствором лимонной кислоты и водой. Объединенные водные фазы экстрагируют этилацетатом. Таким образом полученные органические фазы объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и этанол в качестве элюантов, с получением указанного в заголовке соединения.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.6-7.4 (m, 3H, Cl-Ph); 7.2-6.9 (m, 4H, Ar(THIQ); 6.5-6.15 (широкий 4s, 1H, пиррол); 4.9-3.8 (6 d, 2H, NCH2 THIQ); 4.85-3.6 (m, 1H, NCH THIQ); 4.2-4.0 (m, 2H, ОСН2 сложный эфир), 3.45-3.2 (3s, 3H, N-СН3); 3.35-3.0 (3m, 2H, НОСН2); 3.0-2.0 (m, 2H, THIQ); 2.5-2.1 (m, 3H, СН3 пиррол); 1.25-1.1 (m, 3H, СН3 сложный эфир)
ИК: v -ОН: 3388 см-1, v >C=O: 1693 см-1 (сопряженный сложный эфир), v >С=O: 1620 см-1 (амид)
Стадия В: Метил 5-(5-хлор-2-{[(3S)-3-{[2-(морфолин-4-ил)этокси]метил}-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-1Н-пиррол-3-карбоксилат
Раствор 1.7 г (3.2 ммоль) соединения, полученного на вышеприведенной стадии, в 20 мл диметилформамида по каплям при 0°С добавляют к суспензии 0.280 г 60%-ного NaH в масле (2.2 эквивалента) в 10 мл диметилформамида. После перемешивания в течение 5 минут при температуре окружающей среды, по каплям добавляют суспензию 0.68 г гидробромида 4-(2-бромэтил)морфолина (1.1 эквивалента). Реакционную смесь перемешивают при температуре окружающей среды в течение 45 минут. Затем добавляют, в два приема в течение 20 часов, 2.2 эквивалента гидробромида 4-(2-бромэтил)морфолина, и затем 3 эквивалента 60%-ного NaH в масле. Реакционную смесь затем выливают в смесь 10% водного хлорида аммония и этилацетата. Получающуюся органическую фазу последовательно промывают водой, и затем насыщенным водным раствором LiCl и соляным раствором. Ее затем сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученное масло очищают с помощью хроматографии на силикагеле, используя дихлорметан и этанол в качестве элюантов, с обеспечением ожидаемого продукта.
1Н ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.6-7.3 (m, 3H, Cl-Ph); 7.2-6.85 (m, 4H, Ar (THIQ); 6.5-6.15 (широкий s, 1Н, пиррол); 5.25-3.8 (m, 2H, NCH2 THIQ); 5.05-3.75 (m, 1Н, NCH THIQ); 4.2-4.0 (m, 2H, ОСН2 сложный эфир), 3.5-3.25 (m, 3H, N-СН3); 3.6-2.75 (m, 8H, ОСН2 морфолиноэтоксиметил); 2.95-2.05 (m, 2H, THIQ); 2.55-2.15 (m, 6H, NCH2 морфолиноэтоксиметил); 2.55-2.05 (m, 3H, СН3 пиррол), 1.25-1.1 (m, 3H, СН3 сложный эфир)
ИК: v >С=O: 1694 см-1 (сопряженный сложный эфир), v >C=O: 1629 см-1 (амид)
Стадия С: 5-(5-Хлор-2-{[(3S)-3-{[2-(морфолин-4-ил)этокси]метил}-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-1Н-пиррол-3-карбоновая кислота
К раствору 1.46 г соединения вышеприведенной стадии в 5 мл диоксана добавляют 5 мл 1М водного раствора LiOH. Загрузочную порцию нагревают в микроволновом приборе (100 Вт) при 100°С в течение 2 часов. Реакционную смесь выливают в воду и затем экстрагируют этиловым эфиром. Эфирную фазу вновь экстрагируют 10 мл воды. Водные фазы подкисляют до pH 5-6 путем добавления насыщенного водного раствора хлорида аммония и затем дважды экстрагируют дихлорметаном. Дихлорметановую фазу сушат над Na2SO4, фильтруют и концентрируют досуха. Указанный в заголовке продукт получают в виде безе.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 11.4 (широкий s, 1Н, CO2H), 7.6-7.3 (m, 3H, Cl-Ph); 7.2-6.8 (m, 4H, Ar(THIQ); 6.5-6.2 (широкий 4s, 1Н, пиррол); 5.25-3.75 (m, 2H, NCH2 THIQ); 5.05-3.7 (3m, 1Н, NCH THIQ); 3.5-3.2 (3s, 3H, N-СН3); 3.6-2.7 (m, 8H, ОСН2 морфолиноэтоксиметил); 2.5-2.2 (m, 6H, NCH2 морфолиноэтоксиметил); 3.0-2.0 (m, 2H, THIQ), 2.5-2.0 (3s, 3H, СН3 пиррол)
ИК: v -ОН: 3300-2200 см-1, v >С=O: 1697-1662 см-1 (двойная полоса, карбоновая кислота), v >С=O: 1628 см-1 (амид)
Стадия D: N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-5-(5-хлор-2-{[(3S)-3-{[2-(морфолин-4-ил)этокси]метил}-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-димети-N-фенил-1Н-пиррол-3-карбоксамид
Кислоту, полученную на стадии С, (1.48 г) суспендируют в 15 мл 1,2-дихлорэтана. К суспензии добавляют 1.1 эквивалента 1-хлор-N,N,2-триметилпропениламина. После перемешивания в течение 1 часа при температуре окружающей среды, добавляют 15 мл толуола и 1.05 эквивалентов соединения методики получения 2''. Реакционную смесь нагревают в течение 14 часов при 110°С и затем сушат. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и этанол в качестве элюантов, с получением ожидаемого продукта.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.55-7.25 (m, 3H, Cl-Ph); 7.25-6.6 (m, 9H, Ar (ТН10) + фенил); 6.8-6.5 (m, 2H, фенокси); 7.0-6.6 (m, 2H, фенокси); 5.7-5.05 (широкий 4s, 1H, пиррол); 5.2-3.6 (8d, 2H, THIQ); 5.05-3.6 (4m, 1H, NCH THIQ), 3.6-2.9 (m, 8H, алифатический морфолиноэтоксиметил); 3.4-3.2 (широкий 3s, 3H, N-СН3); 3.0-2.1 (m, 2H, THIQ), 2.35 (m, 2H, NCH2 морфолиноэтоксиметил); 2.4-2.2 (m, 4H, NCH2 морфолин); 2.4-2.15 (широкий 3s, 3H, СН3 пиррол); 0.8 (широкий 2s, 9H, SiC (СН3)3); 0.1 (4s, 6 Н, SiCH3)
ИК: v>С=0: 1635-1595 см-1 (двойная полоса), v Si-O: 1117 см-1, v Si-C: 837 см-1
Стадия Е: Гидрохлорид 5-(5-хлор-2-{[(3S)-3-{[2-(морфолин-4-ил)этокси]метил}-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-димети-N-фенил-1Н-пиррол-3-карбоксамида
К раствору 0.7 г соединения стадии D в 5 мл метанола добавляют 0.92 мл 1М раствора гидроксида калия в метаноле. После перемешивания в течение 1 часа 10 минут при температуре окружающей среды добавляют насыщенный водный раствор бикарбоната натрия. Продукт, который осаждается, экстрагируют этилацетатом и затем промывают водой и соляным раствором. Получающиеся водные фазы вновь экстрагируют этилацетатом. Таким образом полученные органические фазы сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-этаноле в качестве элюантов, с обеспечением 0.536 г указанного в заголовке продукта в форме основания. Последнее растворяют в ацетонитриле и превращают в солевую форму, используя 1М водный раствор HCl. После стадии лиофилизации, ожидаемый продукт получают в виде твердого вещества.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=66.4 (66.75); %H=5.98 (5.87); %N=7.38 (7.41); %Cl=9.42 (9.38); %Cl-=4.57(4.69)
Пример 30. Гидрохлорид 1-(2-аминоэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Стадия А: 2-{3-[(4-{[трет-Бутил(диметил)силил]окси}фенил)(1-метил-1Н-пиразол-4-ил)карбамоил]-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1Н-пиррол-1-ил}этил метансульфонат
Раствор 4.65 г соединения, полученного на стадии В примера 23, (6.22 ммоль) в 100 мл безводного ТГФ помещают на баню с температурой 0°С. К нему последовательно добавляют 3.5 мл (12.44 ммоль) триэтиламина и затем, по каплям, 0.722 мл хлорангидрида метансульфокислоты (9.33 ммоль), растворенного в 20 мл ТГФ. Загрузочную порцию затем перемешивают при температуре окружающей среды в течение 2 часов. Реакционную смесь гидролизуют путем добавления насыщенного водного раствора NaHCO3 и затем дважды экстрагируют этилацетатом. Органические фазы объединяют, сушат над MgSO4 и концентрируют досуха. Ожидаемое соединение получают в виде стеклообразного твердого вещества.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.7-7.45 (s, 1H, Н пиразол); 7.1-6.9 (s, 1Н, Н пиразол); 7.2-6.4 (m, 8H, ароматические Н); 6.95-6.65 (m, 2H, ароматические Н); 6.1 (m, 2H, OCH2O); 5.2, 4.6 (4s, Н, Н-пиррол (наличие конформационных изомеров); 4.9, 4.6, 3.9, 3.8 (m, 1H), 5.05-3.75 (m, 1H, алифатический Н, Н тетрагидроизохинолин); 4.3-4.05 (m, 2H, алифатические Н, CH2CH2OSO2CH3); 4.2-3.95 (m, 2H, алифатические Н, CH2CH2OSO2CH3); 3.75-2.7 (2s, 3H, СН3-пиразол); 3.0 (несколько s, 3H, CH2OSO2CH3); 3.05-2.5 (несколько m, 2H, алифатические Н, Н тетрагидроизохинолин); 2.45-2.3 (несколько s, 3H, СН3-пиррол); 1.05, 0.75 (несколько d, 3H, СН3-тетраизохинолин); 0.9 (несколько s, 9Н, Si(СН3)2(СН(СН3)2); 0.1 (m, 6H, Si(СН3)2(СН(СН3)2)
ИК: v: >С=O: 1626 см-1, v: -SO2: 1349 и 1172 см-1
Стадия В: 1-(2-Азидоэтил)-N-(4-{[трет-бутил(диметил)силил]окси}фенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 2 г (2.42 ммоль) соединения стадии А в 20 мл безводного ДМФА добавляют 0.472 г (7.26 ммоль) азида натрия. Загрузочную порцию перемешивают при 65°С в течение 4 часов 30 минут. Реакционную смесь выливают в насыщенный водный раствор NaHCO3 и затем дважды экстрагируют этилацетатом. Органические фазы объединяют и промывают насыщенным водным раствором LiCl, сушат над MgSO4 и концентрируют досуха. После очистки на силикагеле с использованием дихлорметана и аммиака-в-метаноле в качестве элюантов, ожидаемый продукт получают в виде пены.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 7.65-7.45 (несколько s, 1H, Н пиразол); 7.1-6.9 (несколько s, 1H, Н пиразол); 7.3-6.4 (несколько m, 6H, ароматические Н); 7.1-6.9 (несколько s, 1H, ароматический Н); 6.8, 6.5 (2m, 2H, ароматические Н); 6.1 (несколько s, 2H, OCH2O); 5.25-4.65 (несколько s, 1H, Н-пиррол (наличие конформационных изомеров); 4.9, 4.6,3.8 (несколько m, 1H); 5.05-3.7 (несколько m, 4Н, алифатические Н, H-THIQ + CH2CH2N3); 3.7 (несколько s, 3H, Н СН3-пиразол); 3.5-3.25 (m, 2H, CH2CH2N3); 3.1-2.4 (несколько m, 3H, СН3-пиррол); 2.45-2.3 (несколько s, 3H, СН3-пиррол); 1.0-0.75 (несколько d, 3H, СН3-THIQ); 0.9 (несколько s, 9H, Si(СН3)2(СН(СН3)2); 0.1 (несколько s, 6H, Si(СН3)2(СН(СН3)2)
ИК: v: -N=N=N: 2100 см-1, v: >С=O: 1630 см-1, v: -Si-O-: 1035 см-1
Стадия С: 1-(2-Азидоэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодионсол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
К раствору 1.12 г соединения, полученного на стадии В, (14.49 ммоль) в 5 мл метанола по каплям добавляют 7.24 мл 1М метанольного раствора гидроксида калия (72.45 ммоль). Загрузочную порцию перемешивают при температуре окружающей среды в течение 3 часов. Реакционную смесь затем концентрируют досуха, переносят в дихлорметан, гидролизуют насыщенным водным раствором NaHCO3 и затем дважды экстрагируют дихлорметаном. Органические фазы затем объединяют, промывают водой, сушат над MgSO4 и концентрируют досуха. Ожидаемый продукт получают в виде пены и непосредственно используют на следующей стадии.
1H ЯМР: δ (500 МГц; дмсо-d6; 300K): 9.60((s, 1H, CH2CH2OH); 7.65-7.45 (несколько s, 1H, Н пиразол); 7.1-6.9 (несколько s, 1H, Н пиразол); 7.3-6.4 (несколько m, 6H, ароматические Н); 7.1-6.9 (несколько s, 1H, ароматический Н); 6.8, 6.5 (2m, 2Н, ароматические Н); 6.15 (несколько s, 2H, OCH2O); 5.35-4.8 (несколько s, 1H, Н-пиррол (наличие конформационных изомеров); 4.9, 4.6, 3.8 (несколько m, 1H, алифатический Н, Н тетрагидроизохинолин); 3.7 (несколько s, 3H, Н СН3-пиразол); 3.5-3.25 (m, 2H, CH2CH2N3); 3.1-2.4 (несколько m, 3H, СН3-пиррол); 2.45-2.3 (несколько s, 3H, Н THIQ); 2.45-2.3 (несколько s, 3H, СН3-пиррол); 1.0-0.75 (несколько d, 3H, СН3-THIQ)
ИК: v: -ОН: 3171 см-1, v: -N=N=N: 2100 см-1, v: >C=O: 1617 см-1
Стадия D: Гидрохлорид 1-(2-аминоэтил)-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1Н-пиррол-3-карбоксамида
К раствору 1.27 г соединения, полученного на вышеприведенной стадии, (1.93 ммоль) в 15 мл безводного этанола добавляют 0.154 г Pd/C 10%. Загрузочную порцию дегазируют в течение 0.5 часа. Ее затем перемешивают в течение 12 часов при температуре окружающей среды под давлением водорода (1.5 бар). Реакционную смесь затем фильтруют и затем концентрируют досуха. После очистки с помощью хроматографии на силикагеле (градиент CH2Cl2/MeOH/NH3), получают маслянистый остаток. Остаток растворяют в 10 мл безводного этанола и затем превращают в солевую форму путем добавления двух молярных эквивалентов 1 н. раствора HCl в этаноле. Продукт затем сушат перед растворением в минимальном количестве смеси воды и ацетонитрила. После стадии лиофилизации при низкой температуре, ожидаемый продукт получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.62:63.84; %Н=5.57:5.55; %N=12.56:12.36; %Cl-=5.3:5.56
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C36H36N6O5
[М+Н]+ рассчитано: 633.2820
[М+Н]+ найдено: 633.2808
Пример 31. N-(4-Гидроксифенил)-5-(5-метокси-2-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=71.29:70.17; %Н=5.98:5.98; %N=11.88-11.49
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H36N5O4
[М+Н]+ рассчитано: 590.2762
[М+Н]+ найдено: 590.2778
Пример 32. Фенил (4-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1H-пиррол-2-ил}-3-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}бензил)карбамат
Стадия А: N-(4-Бензилоксифенил)-N,1,2-триметилпиррол-3-карбоксамид
Способ является аналогичным описанному на стадии А примера 45.
Стадия В: трет-Бутил [4-(4-{[4-(бензилокси)фенил](метил)карбамоил}-1,5-диметил-1Н-пиррол-2-ил)-3-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}бензил]карбамат
Соединение методики получения II (1.5 г; 2.96 ммоль) и соединение стадии А (1.1 6 г; 3.44 ммоль) растворяют в диметилацетамиде (25 мл) и затем через раствор барботируют азот в течение 5 минут. Ацетат калия (0.586 г; 5.92 ммоль) и дихлорид бис(трифенилфосфин)палладия(II) (0.2 г; 0.295 ммоль) добавляют к смеси, которую затем нагревают до 100°С и, после перемешивания в течение 20 минут, добавляют воду (10 мкл). Перемешивание при 100°С в атмосфере азота продолжают еще в течение 2 часов. Реакционной смеси позволяют охладиться до температуры окружающей среды и затем упаривают до объема 15 мл. Получающуюся смесь фильтруют через короткую целитную колонку и затем очищают с помощью препаративной ВЭЖХ с использованием смеси вода-ТФУ и ацетонитрила в качестве элюантов. Значение pH подходящих фракций доводят до 7 с помощью NaHCO3, и затем ацетонитрил упаривают при пониженном давлении. Водный остаток экстрагируют с помощью ДХМ. Органическую фазу промывают соляным раствором, сушат над Na2SO4 и упаривают досуха с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41N5O4
[М+Н]+ рассчитано: 713.3705
[М+Н]+ найдено: 713.3709
Стадия С: Гидрохлорид 5-[4-(аминометил)-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил]-N-[4-(бензилокси)фенил]-N,1,2-триметил-1Н-пиррол-3-карбоксамида
Соединение вышеприведенной стадии (1.18 г, 1.66 ммоль) растворяют/суспендируют в 4М HCl в диоксане (20 мл). Гетерогенную смесь перемешивают в течение 30 минут при температуре окружающей среды и затем упаривают досуха с получением 1.19 г указанного в заголовке соединения, которое используют на следующей стадии без очистки.
Стадия D: Фенил (4-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1Н-пиррол-2-ил}-3-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}бензил)карбамат
Указанное в заголовке соединение получают исходя из соединения вышеприведенной стадии в соответствии с протоколом стадии D примера 45.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=72.83 (72.88); %H=6.01 (5.96); %N=8.02 (8.72)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H38N4O5
[M+H]+ рассчитано: 643.2922
[М+Н]+ найдено: 643.2916
Пример 33. Гидрохлорид 5-(5-хлор-2-{((3S)-3-(морфолии-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил)фенил)-N-(4-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=65.75 (65.84); %H=5.38 (5.39); %N=7.62 (7.68); %Cl=9.77 (9.72); %Cl-=4.84 (4.86)
Пример 34. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=65.61 (65.84); %H=5.09 (5.39); %N=7.76 (7.68); %Cl-=4.83 (4.86)
Пример 35. N-(4-Гидроксифенил)-N,1,2-триметил-5-(2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-4-{[(феноксиацетил)амино]метил}фенил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 32 с использованием 2-феноксиацетилхлорида в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=72.53 (73.15); %H=5.76 (6.14); %N=8.31 (8.53)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H40N4O5
[М+Н]+ рассчитано: 657.3079
[М+Н]+ найдено: 657.3061
Пример 36. 5-(4-{[(Этилкарбамоил)амино]метил}-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 32 с использованием этилизоцианата в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=70.88 (70.8); %H=6.02 (6.62); %N=11.17 (11.8)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H39H5O4
[М+Н]+ рассчитано: 594.3100
[М+Н]+ найдено: 594.3083
Пример 37. 5-(4-{[(Бензилкарбамоил)амино]метил}-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 32 с использованием бензилизоцианата в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=73.21 (73.26); %Н=5.98 (6.3); %N=10.23 (10.68)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41N5O4
[M+H]+ рассчитано: 656.3239
[М+Н]+ найдено: 656.3256
Пример 38. 5-(5-Хлор-2-{[(3S)-3-(гидроксиметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=70.97 (71.34); %H=5.2 (5.32); %N=6.96 (6.93)
Пример 39. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохииголин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=69.81 (69.64); %H=5.6 (5.51); %N=11.55 (11.6)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H34N5O5
[М+Н]+ рассчитано: 604.2554
[M+H]+ найдено: 604.2565
Пример 40. Фенил (3-{4-{(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1H-пиррол-2-ил}-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)бензил)карбамат
Стадия А: N-(4-Бензилоксифенил)-N,1,2-триметилпиррол-3-карбоксамид
Способ является аналогичным описанному на стадии А примера 45.
Стадия В: Гидрохлорид 5-[5-(аминометил)-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил]-N-[4-(бензилокси)фенил]-N,1,2-триметил-1Н-пиррол-3-карбоксамида
Соединение методики получения III (1.84 г; 3.99 ммоль) и соединение стадии А (1.60 г; 4.48 ммоль) растворяют в диметилацетамиде (20 мл), и затем через раствор барботируют азот в течение 5 минут. Ацетат калия (0.78 г; 7.48 ммоль) и дихлорид бис(трифенилфосфин)палладия(II) (0.28 г; 0.4 ммоль) добавляют к смеси, которую затем нагревают до 105°С и, после перемешивания в течение 10 минут, добавляют воду (11 мкл). Перемешивание при 105°С в атмосфере азота продолжают еще в течение 6 часов. Реакционной смеси позволяют охладиться до температуры окружающей среды, получающуюся смесь фильтруют через короткую целитную колонку и затем очищают с помощью препаративной ВЭЖХ с использованием смеси вода-ТФУ и ацетонитрила в качестве элюантов. Значение рН подходящих фракций доводят до 7 с помощью NaHCO3, и затем ацетонитрил упаривают при пониженном давлении. Твердый осадок удаляют путем фильтрования и затем сушат (5 мбар, 45°С, 16 часов) с образованием трет-бутил [3-(4-{[4-(бензилокси)фенил](метил)карбамоил}-1,5-диметил-1H-пиррол-2-ил)-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}бензил]карбамата, который растворяют/суспендируют в 4М HCl в диоксане (35 мл). Гетерогенную смесь перемешивают в течение 30 минут при температуре окружающей среды и затем упаривают досуха с получением указанного в заголовке соединения, которое используют на следующей стадии без очистки.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H40N4O3
[М+Н]+ рассчитано: 613.3180
[М+Н]+ найдено: 613.3194
ИК: v: N-H+: 2854 см-1; >С=O: 1621 см-1; С-О-С: 1234, 1120, 1011 см-1
Стадия С: Фенил (3-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1Н-пиррол-2-ил}-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}бензил)карбамат
Указанное в заголовке соединение получают исходя из соединения вышеприведенной стадии в соответствии со способом Стадии D примера 45.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=73.2 (72.88); %H=5.83 (5.96); %N=8.13 (8.72)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H38N4O5
[М+Н]+ рассчитано: 643.2922
[M+H]+ найдено: 643.2902
Пример 41. N-(3-Фторфенил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=71.44 (71.95); %H=4.95 (5.22); %N=6.8 (6.8)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C37H33FN3O5
[M+H]+ рассчитано: 618.2399
[М+Н]+ найдено: 618.2392
Пример 42. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=71.32 (71.65); %H=5.17 (5.4); %N=10.67 (10.71)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H36N5O5
[М+Н]+ рассчитано: 654.2711
[М+Н]+ найдено: 654.2710
Пример 43. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=73.9 (74.11); %H=5.16 (5.55); %N=6.81 (7.01)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C37H34N3O5
[M+H]+ рассчитано: 600.2493
[М+Н]+ найдено: 600.2495
Пример 44. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-иирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=66.41 (66.62); %H=5.08 (5.59); %N=10.85 (10.84); %Cl-=4.68 (4.57)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H42N6O6
[M+H]+ рассчитано: 739.3239
[М+Н]+ найдено: 739.3246
Пример 45. Фенил 12-(3-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1H-пиррол-2-ил}-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)этил]карбамат
Стадия А: N-(4-Бензилоксифенил)-N,1,2-триметилпиррол-3-карбоксамид
К суспензии 1,2-диметилпиррол-3-карбоновой кислоты (2.085 г; 15 ммоль) в 1,2-дихлорэтане (40 мл) добавляют 1-хлор-N,N,2-триметилпроп-1-ен-1-амин (2.37 мл; 17.9 ммоль), и образованный раствор перемешивают в течение 1 часа. К получающемуся раствору по каплям добавляют ледяной раствор 4-бензилокси-N-метиланилина (3.73 г; 15 ммоль) и N-этил-N-изопропилпропан-2-амина (7.75 мл; 45 ммоль) в 1,2-дихлорэтане (40 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа; затем ее разбавляют дихлорметаномом (250 мл) и промывают водой (2×30 мл), сушат над Na2SO4 и упаривают. Сырой продукт растирают с диэтиловым эфиром и образованное твердое вещество отфильтровывают с получением указанного в заголовке соединения.
ИК: v: >С=O: 1616 см-1; амид: 1508 см-1; С-О-С: 1230, 1172, 1009 см-1
Стадия В: трет-Бутил {2-[3-(4-{[4-(бензилокси)фенил](метил)карбамоил}-1,5-диметил-1Н-пиррол-2-ил)-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил]этил}карбамат
Соединение методики получения I (0.869 г; 1.67 ммоль) и соединение стадии А (0.558 г; 1.67 ммоль) растворяют в диметилацетамиде (8 мл), и затем в течение 5 минут через раствор барботируют азот. Ацетат калия (0.33 г; 3.34 ммоль) и дихлорид бис(трифенилфосфин)палладия(II) (0.117 г; 0.167 ммоль) добавляют к смеси, которую затем нагревают до 140°С и, после перемешивания в течение 10 минут, добавляют воду (80 мкл). Перемешивание при 140°С в атмосфере азота продолжают еще в течение 16 часов. Реакционной смеси позволяют охладиться до температуры окружающей среды и затем упаривают. Остаток распределяют между дихлорметаном (100 мл) и водой (20 мл). Органическую фазу промывают водой (20 мл), сушат над Na2SO4 и упаривают. Остаток очищают с помощью препаративной ВЭЖХ с использованием смеси вода-ТФУ и ацетонитрила в качестве элюантов. Значение pH подходящих фракций доводят до 12, используя водный раствор NaOH, и затем при пониженном давлении упаривают ацетонитрил. Водный остаток экстрагируют дихлорметаном (2×100 мл). Органическую фазу сушат над Na2SO4 и упаривают досуха с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C45H50N4O5
[М+Н]+ рассчитано: 727.3861
[М+Н]+ найдено: 727.3852
ИК: v: >С=O: 1705, 1618 см-1; амид: 1509 см-1; С-О-С: 1242, 1166, 1012 см-1
Стадия С: Гидрохлорид 5-[5-(2-аминоэтил)-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил]-N-[4-(бензилокси)фенил]-N,1,2-триметил-1Н-пиррол-3-карбоксамида
Соединение стадии В (0.35 г; 0.48 ммоль) растворяют/суспендируют в 4М HCl в диоксане (3 мл). Гетерогенную смесь перемешивают в течение 30 минут при температуре окружающей среды и затем упаривают досуха с получением указанного в заголовке соединения, которое используют на следующей стадии без очистки иным способом.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H42N4O3
[М+Н]+ рассчитано: 627.3337
[М+Н]+ найдено: 627.3309
ИК: v: С-Н: 2931 см-1; >С=O: 1608 см-1; амид: 1508 см-1; С-О-С: 1233, 1012 см-1
Стадия D: Фенил 2-(3-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1Н-пиррол-2-ил}-4-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)этил]карбамат
Соединение стадии С (0.10 г; 0.15 ммоль) растворяют в дихлорметане. К раствору добавляют фенилхлорформиат (0.027 г; 0.17 ммоль) и диизопропилэтиламин (0.097 г, 0.75 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 30 минут. После разбавления дихлорметаном (100 мл), органическую фазу промывают водой (20 мл), упаривают и концентрируют. Остаток затем растворяют в этаноле и добавляют Pd/C катализатор (10 мг). Реакционную смесь гидрируют при атмосферном давлении при температуре окружающей среды. Когда реакция завершится, катализатор удаляют путем фильтрования, фильтрат концентрируют и сырой продукт очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов, с получением указанного в заголовке продукта.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=72.36 (73.15); %Н=6.15 (6.14); %N=8.14 (8.53)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H40N4O5
[М+Н]+ рассчитано: 657.3077
[М+Н]+ найдено: 657.3062
Пример 46. N-(4-Гидроксифеиил)-N,1,2-триметил-5-(2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-{2-[(феноксиацетил)амино]этил}фенил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 45 с использованием 2-феноксиацетилхлорида в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=72.74 (73.41); %H=6.38 (6.31); %N=7.65 (8.35)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H42N4O5
[М+Н]+ рассчитано: 671.3235
[М+Н]+ найдено: 671.3226
Пример 47. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=64.25 (64.59); %H=5.4 (5.7); %N=11.41 (11.59); %Cl-=4.93 (4.89)
Пример 48. N-(4-Гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=68.07 (68.45); %H=5 (5.27); %N=10.74 (11.09)
Пример 49. Дигидрохлорид N-(4-гидроксифенил)-1,2-диметил-N(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Стадия А: N-(4-{[трет-Бутил(диметил)силил]окси}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1Н-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 11 и (3S)-3-(4-морфолинилметил)-1,2,3,4-тетрагидроизохинолина (см. методику получения 3') на стадии А, и соединения методики получения 11'' на стадии С.
Стадия В: Дигидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1Н-пиррол-3-карбоксамида
К раствору 0.21 г (0.2 ммоль) соединения стадии А в 3 мл уксусной кислоты добавляют 85 мг цианоборогидрида натрия (5 эквивалентов). Реакционную смесь перемешивают в течение 3 часов при температуре окружающей среды и затем в течение ночи при 50°С. Затем добавляют 2.6 эквивалента цианоборогидрида натрия, и реакционную смесь нагревают при 50°С в течение 3 часов. Операцию повторяют второй раз (добавление 2.6 эквивалента цианоборогидрида натрия и затем нагревание при 50°С в течение 3 часов). После совместного упаривания уксусной кислоты в присутствии толуола, остаток переносят в 3 мл метанола. Значение pH раствора доводят до 12 с использованием 1М метанольного раствора гидроксида калия. После перемешивания в течение ночи при температуре окружающей среды, реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют дихлорметаном. Получающуюся органическую фазу промывают соляным раствором, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный продукт очищают с помощью хроматографии на силикагеле (дихлорметан/этанол/аммиак 94/6/0.6) и затем на колонке Lichroprep RP18 (вода/ацетонитрил/трифторуксусная кислота). После упаривания ацетонитрила, продукт нейтрализуют бикарбонатом натрия. Продукт затем экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток растворяют в ацетонитриле и превращают в солевую форму с помощью 1М водного раствора HCl. После лиофилизации, указанный в заголовке продукт получают в виде твердого вещества.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H44N6O6
[М+Н]+ рассчитано: 741.3395
[М+Н]+ найдено: 741.3400
Пример 50. Гидрохлорид N-(4-гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H40N6O7
[М+Н]+ рассчитано: 717.3031
[М+Н]+ найдено: 717.3031
Пример 51. 5-(5-{[(Бензилкарбамоил)амино]метил}-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 40 с использованием бензилизоцианата в качестве ацилирующего реагента на стадии С.
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=73.39 (73.26); %Н=6.16 (6.3); %N=10.08 (10.68)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41N5O4
[М+Н]+ рассчитано: 656.3239
[М+Н]+ найдено: 656.3226
Пример 52. 5-(5-{[(Этилкарбамоил)амино]метил}-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 40 с использованием этилизоцианата в качестве ацилирующего реагента на стадии С.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=71.4 (70.8); %H=6.41 (6.62); %N=11.24 (11.8)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H39N5O4
[М+Н]+ рассчитано: 594.3082
[М+Н]+ найдено: 594.3069
Пример 53. N-(4-Гидроксифенил)-N,1,2-триметил-5-(2-{[(3R)-3-метил-3,4-дигвдроизохинолин-2(1H)-ил]карбонил}-5-{[(феноксиацетил)амино]метил}фенил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 40 с использованием 2-феноксиацетилхлорида в качестве ацилирующего реагента на стадии С.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=72.32 (73.15); %H=6.21 (6.14); %N=7.84 (8.53)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H40N4O5
[М+Н]+ рассчитано: 657.3079
[М+Н]+ найдено: 657.3105
Пример 54. N-(4-Гидроксифенил)-1,2-диметил-5-(2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-{[(феноксиацетил)амино]метил}фенил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=73.87 (73.04); %H=5.47 (5.74); %N=10.26 (10.87)
Пример 55. 5-(5-[2-({[2-(4-фторфенил)этил]сульфонил}амино)этил]-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 45 с использованием 2-(4-фторфенил)этансульфонилхлорида в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=67.42 (68.12); %H=5.76 (6); %N=7.27 (7.75); S=3.68 (4.44)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H43FN4O5S
[М+Н]+ рассчитано: 723.3018
[М+Н]+ найдено: 723.3011
Пример 56. 5-(5-{2-[(Бензилкарбамоил)амино]этил}-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 45 с использованием бензилизоцианата в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=71.14 (73.52); %H=6.47 (6.47); %N=9.42 (10.46)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H43N5O4
[М+Н]+ рассчитано: 670.3395
[М+Н]+ найдено: 670.3390
Пример 57. N-(4-Гидроксифенил)-N,1,2-триметил-5-(2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-{2-[(фенилацетил)амино]этил}фенил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 45 с использованием фенилацетилхлорида в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=75.46 (75.21); %H=6.11 (6.46); %N=8.31 (8.56)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H42N4O4
[М+Н]+ рассчитано: 655.3286
[М+Н]+ найдено: 655.3285
Пример 58. N-(4-Гидроксифенил)-N,1,2-триметил-5-(2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил)карбонил}-5-{2-[(фенилкарбамоил)амино]этил}фенил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 45 с использованием фенилизоцианата в качестве ацилирующего реагента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%С=71.25 (73.26); %Н=6.12 (6.3); %N=9.61 (10.68)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41N5O4
[М+Н]+ рассчитано: 656.3239
[М+Н]+ найдено: 656.3226
Пример 59. 5-(4-[({[2-(4-Фторфенил)этил]сульфонил}амино)метил]-2-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 32 с использованием 2-(4-фторфенил)этансульфонилхлорида в качестве сульфонилирующего агента на стадии D.
Элементный микроанализ: (%, найдено (теоретическое значение))
%H=5.19 (5.83); %N=7.28 (7.9); S=4.45 (4.52); %C=66.17 (67.78)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41FN4O5S
[М+Н]+ рассчитано: 709.2866
[М+Н]+ найдено: 709.2866
Пример 60. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-{[2-(диметиламино)этокси]метил}-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Используют способ примера 29, с одной стороны, с заменой гидробромида 4-(2-бромэтил)морфолина, используемого на стадии В, на гидрохлорид 2-хлорэтилдиметиламина, и, с другой стороны, с добавлением каталитического количества йодида тетрабутиламмония.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41ClN4O4
[М+Н]+ рассчитано: 677.2890
[М+Н]+ найдено: 677.2887
Пример 61. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C36H32N4O5
[М+Н]+ рассчитано: 601.2445
[М+Н]+ найдено: 601.2424
Пример 62. 5-(5-Фтор-4-метокси-2-([(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифеннл)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1Н-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=68.99 (69.18); %H=5.89 (5.64); %N=11.35 (11.52)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C35H34FN5O4
[M+H]+ рассчитано: 608.2668
[М+Н]+ найдено: 608.2640
Пример 63. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил)карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=70.48 (70.85); %H=5.67 (5.32); %N=11.2 (10.87)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C38H34ClN5O3
[M+H]+ рассчитано: 666.2242
[M+H]+ найдено: 666.2235
Пример 64. Гидрохлорид N,1,2-триметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C38H40N6O5
[M+H]+ рассчитано: 661.3133
[М+Н]+ найдено: 661.3125
Пример 65. Гидрохлорид 1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H42N6O5
[M+H]+ рассчитано: 723.3289
[М+Н]+ найдено: 723.3287
Пример 66. 4-Метилфенил (4-{4-[(4-гидроксифенил)(метил)карбамоил]-1,5-диметил-1H-пиррол-2-ил}-3-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}бензил)карбамат
Указанное в заголовке соединение получают в соответствии со способом примера 32 с использованием 4-метилфенилхлорформиата в качестве ацилирующего реагента на стадии D.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H40N4O5
[М+Н]+ рассчитано: 657.3079
[М+Н]+ найдено: 657.3076
Пример 67. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-ил]метил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=65.69 (65.28); %H=5.38 (5.77); %N=11.18 (12.02); %Cl-=5.61 (5.07)
Пример 68. 5-(5-Фтор-4-гидрокси-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
1 н. раствор трибромборана (1.3 эквивалента) в дихлорметане быстро выливают, при температуре окружающей среды, в раствор соединения примера 62 в дихлорметане. Эту операцию повторяют дважды для того, чтобы завершить реакцию в течение 5 часов. Реакционную смесь выливают в безводный этанол при 5°С. После перемешивания в течение 10 минут добавляют насыщенный водный раствор NaHCO3. Смесь экстрагируют дихлорметаном, сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают с помощью препаративной ВЭЖХ, используя воду, ТФУ и ацетонитрил в качестве элюантов. Значение pH подходящих фракций доводят до 12 с помощью насыщенного водного раствора NaHCO3, и затем ацетонитрил упаривают при пониженном давлении. Водный остаток экстрагируют дихлорметаном. Органическую фазу сушат над Na2SO4 и упаривают досуха с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C34H32FN5O4
[М+Н]+ рассчитано: 594.2511
[М+Н]+ найдено: 594.2517
Пример 69. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C44H45N7O5
[M+H]+ рассчитано: 752.3555
[М+Н]+ найдено: 752.3552
Пример 70. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H42N6O5
[M+H]+ рассчитано: 699.3289
[М+Н]+ найдено: 699.3293
Пример 71. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H41ClN6O4
[M+H]+ рассчитано: 723.3289
[М+Н]+ найдено: 723.3287
Пример 72. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметид-N-(1-метил-1H-бензимидазол-5-ил)-1H-пиррол-3-карбоксамид
Элементный микроанализ: (%, найдено (теоретическое значение))
%C=68.90 (69.17); %H=5.32 (5.67); %N=11.40 (11.52)
Пример 73. Дигидрохлорид N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H39N5O6
[M+H]+ рассчитано: 686.2973
[М+Н]+ найдено: 686.2971
Пример 74. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил)карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H38ClN5O4
[М+Н]+ рассчитано: 676.2685
[M+H]+ найдено: 676.2684
Пример 75. Гидрохлорид N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=60.12:59.77; %Н=4.92:4.76; %N=10.79:10.39 %Cl-=4.55:5.17
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H37F3N6O6
[М+Н]+ рассчитано: 743.2799
[M+H]+ найдено: 742.2802
Пример 76. 2-(Дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 77. N-(4-Гидроксифени)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 78. 2-(2,2-Дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 79. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 80. N-(4-Гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 81. Гидрохлорид N-(4-гидроксифенил)-1-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием соединения методики получения 22 на стадии А. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H42N6O6
[М+Н]+ рассчитано: 703.3239
[М+Н]+ найдено: 703.3236
Пример 82. N-(4-Гидроксифенил)-1-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Методика соответствует общему протоколу примера 1 с использованием соединения методики получения 23 на стадии А.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H40N6O6
[М+Н]+ рассчитано: 689.3082
[М+Н]+ найдено: 689.3085
Пример 83. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 84. 2-(Дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-меткл-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 85. N-(4-Гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 86. 2-(2,2-Дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 87. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 88. Гидрохлорид N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.97:66.15; %Н=5.78:5.46; %N=10.26:10.24; %Cl-=4.33:4.76
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C45H46N6O7
[М+Н]+ рассчитано: 783.3501
[М+Н]+ найдено: 783.3502
Пример 89. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-[2-(морфолин-4-ил)этил]-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 90. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(морфолин-4-илметил)-5-(6-{[(3R)-3-метил-3,4-дигидроиаохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 91. N-(4-Гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 92. Гидрохлорид 1-этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бвнзодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному в примере 1 с использованием соединений из методик получения 20 и 3' на стадии А и соединения из методики получения 1'' на стадии С. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.99:65.61; %Н=5.86:5.39; %N=11.37:11.43; %Cl=4.80:4.42
[М+Н]+ найдено: 703.3236
Пример 93. Гидрохлорид N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.01:64.10; %H=5.90:5.63; %N=10.92:10.88; %Cl-=4.61:4.70.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H44N6O7
[М+Н]+ рассчитано: 733.3344
[М+Н]+ найдено: 733.3345
Пример 94. Гидрохлорид 1-(2-фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному на стадиях A-D примера 1, с использованием соединений из методик получения 21 и 3' на стадии А и соединения из методики получения 1'' на стадии С. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.44:63.25; %Н=5.59:5.09; %N=11.10:11.02; %Cl=4.68:4.74
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H41FN6O6
[М+Н]+ рассчитано: 721.3144
[М+Н]+ найдено: 721.3147
Пример 95. Гидрохлорид 1-(2,2-дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 32 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=61.97:61.89; %Н=5.33:5.04; %N=10.84:10.85; %Cl-=4.57:4.55
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C40H40F2N6O6
[M+H]+ рассчитано: 739.3050
[М+Н]+ найдено: 739.3052
Пример 96. Гидрохлорид N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамида
Стадия А: N-[4-[трет-Бутил(диметил)силил{оксифенил]-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил}-1,3-бензодиоксол-5-ил]-(1-метил-1Н-пиразол-4-ил)-1-(2-морфолиноэтил)пиррол-3-карбоксамид
Соединение, полученное на стадии Е примера 99, растворяют в 6 мл тетрагидрофурана. Добавляют йодид натрия (100 мг, 0.67 ммоль) и, далее, по каплям морфолин (0.21 мл, 2.53 ммоль). Реакционную смесь нагревают в герметизированной колбе при 90°С в течение 72 часов. После охлаждения, раствор упаривают досуха, и остаток очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Ожидаемый продукт получают в виде пены.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.7-7.45 (4 bs, 1H), 7.2-6.9 (m, 4H), 7.1-6.4 (m, 2H), 7.1-6.9 (4 bs, 1H), 7-6.8 (4 m, 2 H), 6.75/6.48 (d+bs, 2H), 6.1 (4 bs, 2H), 5.25-4.7 (4 bs, 1H), 5.2-3.8 (m, 2H), 4.9/4.65/3.8 (3 m, 1H), 3.75 (4 s, 3H), 3.5 (bs, 4H), 3-2 (m, 10H), 2.41/2.3 (2 bs, 3H), 1.02/0.95/0.78 (3 bd, 3H), 0.88 (m, 9H), 0.1 (m, 6H)
ИК (ATR) см-1: 1626 δ >C=O амиды
Стадия В: Гидрохлорид N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1Н-пиразол-4-ил)-1-[2-(морфолин-4-ил)этил}-1Н-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному на стадии D примера 1. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H42N6O6
[М+Н]+ рассчитано: 703.3239
[М+Н]+ найдено: 703.3238
Пример 97. Гидрохлорид N(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1-[2-(морфолин-4-ил)этил]-N-фенил-1H-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному в примере 96 с заменой соединения методики получения 1'' на соединение методики получения 2''.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.61:68.12; %Н=5.89:5.23; %N=7.62:7.54; %Cl-=4.82:4.66
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C42H42N4O6
[М+Н]+ рассчитано: 699.3177
[М+Н]+ найдено: 699.3173
Пример 98. Гидрохлорид 1-(2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному в примере 27, с заменой соединения методики получения 1'' на соединение методики получения 2''. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=69.30:69.20; %Н=5.96:5.48; %N=8.08:8.08; %Cl-=5.11:5.03
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C40H40N4O5
[M+H]+ рассчитано: 657.3071
[М+Н]+ найдено: 657.3066
Пример 99. Гидрохлорид N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Стадия А: Этил 1-(2-бензилоксиэтил)-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]пиррол-3-карбоксилат
Методика соответствует протоколу, описанному на стадии А примера 1, с заменой соединения методики получения 1 на соединение методики получения 19.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.35-6.95 (m, 9Н), 7-6.8 (несколько s, 2H), 6.35-5.85 (несколько s, 1Н), 6.15 (несколько s, 2Н), 5.15-3.5 (несколько m, 4Н), 4.9/4.7/3.95 (несколько m, 1Н), 4.4 (m, 2Н), 4.2-3.95 (m, 2Н), 3.55 (m, 2Н), 3.1-2.35 (несколько m, 2Н), 2.5-2.2 (несколько s, 3Н), 1.25-1.1 (несколько m, 3Н), 1.05-0.7 (несколько d, 3Н)
Стадия В: 1-(2-Бензилоксиэтил)-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]пиррол-3-карбоновая кислота
Методика соответствует протоколу, описанному на стадии В примера 1.
ИК (ATR) см-1: 3000-2500 v -ОН, 1675-1625 v -C=O карбоновая кислота + амид
Стадия С: 1-(2-Бензилоксиэтил)-N-[4-[трет-бутил(диметил)силил]оксифенил]-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]-N-(1-метил-1Н-пиразол-4-ил)пиррол-3-карбоксамид
Методика соответствует протоколу, описанному на стадии С примера 1.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.:7.7-7.5 (несколько s, 1H), 7.35-6.5 (несколько m, 11H), 7.1-6.9 (несколько s, 1H), 6.95-6.5 (несколько s, 2H), 6.8/6.5 (m, 2H), 6.05 (несколько s, 2 H), 5.25-4.7 (несколько s, 1H), 5.1-3.6 (несколько m, 4H), 4.85/4.6/3.75 (несколько m, 1H), 4.3 (m, 2H), 3.7 (2×s, 3H), 3.4 (m, 2H), 3.05-2.4 (несколько m, 2H), 2.4-2.25 (несколько s, 3H), 1-0.75 (несколько d, 3H), 0.9 (несколько s, 9H), 0.1 (несколько s, 6H)
ИК (ATR) см-1: 1629 v >C=O амиды
Стадия D: N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-(2-гидроксиэтил)-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]-N-(1-метил-1Н-пиразол-4-ил)пиррол-3-карбоксамид
В реакторе гидрирования соединение вышеприведенной стадии растворяют в 30 мл метанола. Раствор дегазируют путем барботирования в него аргона, и добавляют палладий-на-угле 10% (550 мг). Получающуюся суспензию перемешивают под давлением водорода 1 бар в течение 15 часов, и затем пропускают через фильтр Whatman®. Катализатор промывают метанолом и фильтрат упаривают в вакууме. Полученный таким образом остаток очищают с помощью хроматографии на силикагеле, используя дихлорметан и метанол в качестве элюантов. Ожидаемый продукт получают в виде масла.
1H ЯМР (500 МГц, пиридин-d5) δ м.д.: 7.7-7.4 (4 s, 1H), 7.3-6.9 (m, 4H), 7.1-6.8 (4 s, 1H), 7-6.7 (m, 2H), 6.9-6.4 (m, 2H), 6.8-6.4 (4 m, 2H), 6.1 (m, 2H), 5.2/5/4.7 (4 s, 1H), 5.15-3.9 (8 d, 2H), 4.9-4.8 (m, 1H), 4.9/4.7/3.85 (3 m, 1H), 3.9-3.7 (m, 2H), 3.75 (2 s, 3H), 3.5-3.2 (m, 2H), 3-2.4 (m, 2H), 2.4-2.3 (4 s, 3H), 1.05/0.95/0.75 (4 d, 3H), 0.85 (bs, 9H), 0.15-0 (m, 6H)
ИК (ATR) см-1: 3346 v -ОН первичный спирт, 1621 v -C=O амиды
Стадия Е: 2-[3-[[4-[трет-Бутил(диметил)силил]оксифенил]-(1-метил-1H-пиразол-4-ил)карбамоил]-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]пиррол-1-ил/этил метансульфонат
Соединение вышеприведенной стадии (2.37 г, 3.17 ммоль) растворяют в 30 мл тетрагидрофурана. Реакционную смесь охлаждают до 0°С и к ней последовательно добавляют триэтиламин (1.8 мл, 13.9 ммоль) и, по каплям, метансульфонилхлорид (0.40 мл, 5.17 ммоль). Реакционную смесь перемешивают в течение 2 часов при 0°С. Реакционную смесь затем выливают в насыщенный водный раствор гидрокарбоната натрия и 3 раза экстрагируют этилацетатом. Органическую фазу промывают 3 раза соляным раствором, сушат над MgSO4, фильтруют и затем упаривают досуха. Остаток после упаривания используют без очистки на следующей стадии.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 7.7-7.45 (несколько s, 1H), 7.25-6.4 (m, 8H), 7.1-6.9 (несколько s, 1H), 6.95-6.65 (несколько s, 2H), 6.1 (несколько s, 2H), 5.2-4.6 (несколько s, 1H), 5.05-3.75 (несколько d, 2H), 4.9/4.6/3.9/3.8 (несколько m, 1H), 4.3-4.05 (m, 2H), 4.2-3.95 (m, 2H), 3.75/3.7 (2 s, 3H), 3.05-2.5 (несколько m, 2H), 3 (несколько s, 3H), 2.45-2.3 (несколько s, 3H), 1.05-0.75 (несколько d, 3H), 0.9 (несколько s, 9H), 0.1 (несколько s, 6H)
ИК (ATR) см-1: 1626 v -C=O, 1349 v -SO2, 1249 δ -CH3, 1172 v -SO2
Стадия F: N-[4-[трет-Бутил(диметил)силил]оксифенил]-1-[2-[2-метоксиэтил(метил)амино]этил]-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]-N-(1-метил-1Н-пиразол-4-ил)пиррол-3-карбоксамид
Соединение вышеприведенной стадии (1.33 мг, 1.61 ммоль) растворяют в 6 мл тетрагидрофурана. Добавляют йодид натрия (100 мг, 0.67 ммоль) и, далее, по каплям диметиламин (0.172 г, 1.932 ммоль). Реакционную смесь нагревают в герметизированной колбе при 60°С в течение 36 часов. После охлаждения, смесь упаривают досуха и очищают с помощью хроматографии на силикагеле, используя дихлорметан и аммиак-в-метаноле в качестве элюантов. Ожидаемый продукт получают в виде пены.
1H ЯМР (500 МГц, дмсо-d6) δ м.д. 7.7-7.45 (4 bs, 1H), 7.2-6.9 (m, 4H), 7.1-6.9 (4 bs, 1H), 7-6.7 (4 m, 2H), 7/6.45 (2 m, 2H), 6.8/6.45 (2 m, 2H), 6.1 (m, 2H), 5.22/5.05/4.7 (4 bs, 1H), 5.2-3.8 (m, 2H), 4.91/4.65/3.9 (3 m, 1H), 3.75 (2 bs, 3H), 3.7 (m, 2H), 3.2 (bs, 3H), 3-2 (m, 2H), 2.7-2 (ml, 6H), 2.7-2 (m, 3H), 2.45/2.35 (2 bs, 3H), 1.05/0.95/0.8 (3 bd, 3H), 0.9 (m, 9H), 0.1 (m, 6Н)
ИК (ATR) см-1: 1628 (плечо) δ -С=O амиды
Стадия G: Гидрохлорид N-(4-гидроксифенил)-1-[2-[2-метоксиэтил(метил)амино]этил]-2-метил-5-[6-[(3R)-3-метил-3,4-дигидро-1Н-изохинолин-2-карбонил]-1,3-бензодиоксол-5-ил]-N-(1-метил-1Н-пиразол-4-ил)пиррол-3-карбоксамида
Методика соответствует протоколу, описанному на стадии D примера 1. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
ИК (ATR) см-1: 2000-3500 v -NH+/OH, 1615 v >C=O амиды, 1237-1161 δ >C-O-C<, 745 v >CH-Ar
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H44N6O6
[М+Н]+ рассчитано: 705.3395
[М+Н]+ найдено: 705.3391
Пример 100. Гидрохлорид 5-(5-фтор-4-метокси-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-нл)-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.23:64.31; %Н=3.80:5.43; %N=11.52:11.46; %Cl-=4.86:4.95
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H41FN6O5
[M+H]+ рассчитано: 693.3195
[М+Н]+ найдено: 693.3194
Пример 101. Гидрохлорид 5-(4-фтор-5-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 27 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=64.23:63.12; %Н=5.80:5.20; %N=11.52:11.38. %Cl-=4.86:5.03
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C39H41FN6O5
[М+Н]+ рассчитано: 693.3195
[М+Н]+ найдено: 693.3195
Пример 102. Тригидрохлорид 5-(5-хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H44ClN7O3
[M+H]+ рассчитано: 742.3267
[М+Н]+ найдено: 742.3268
Пример 103. 5-(5-Хлор-2-{[(3S)-3-[(4-метилпиперазин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 104. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразоло[3,4-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 105. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-23-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 106. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения, при этом предполагается, что стадию D не осуществляют. Ожидаемый продукт получают в форме свободного основания.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=70.72:69.77; %Н=5.79:5.96; %N=11.78:11.43
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H41ClN6O3
[М+Н]+ рассчитано: 713.3001
[М+Н]+ найдено: 713.2998
Пример 107. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-фторфенил)-1,2-димети-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 108. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и (3S)-3-(4-морфолинилметил)-1,2,3,4-тетрагидроизохинолина (см. методику получения 3') на стадии А, и соединения методики получения 19'' на стадии С. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.95:65.09; %Н=5.45:5.20; %N=11.36:11.26; %Cl-=4.79:4.62
Масс-спектрометрия высокого разрешения (ESI/+):
Эмпирическая формула: C40H39ClN6O4
[М+Н]+ рассчитано: 703.2794
[М+Н]+ найдено: 703.2789
Пример 109. Гидрохлорид 5-(5-хлор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(6-цианопиридин-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 23'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C40H37ClN6O4
[М+Н]+ рассчитано: 701.2638
[М+Н]+ найдено: 701.2639
Пример 110. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-циаиопиридин-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.13:65.72; %Н=5.19:4.76; %N=11.39:12.04; %Cl-=4.81:4.45
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C40H37ClN6O4
[M+H]+ рассчитано: 701.2638
[М+Н]+ найдено: 701.2643
Пример 111. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-цианопиримидин-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 112. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[2-(диметиламино)пиридин-4-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 113. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-бензимидазол-5-ил)-1H-пиррол-3-карбоксамид
Пример 114. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиразоло[1,5-а]пиримидин-6-ил)-1H-пиррол-3-карбоксамид
Пример 115. Дигидрохлорид 5-(5-хлор-2-{[(3S)-3-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)илметил]-3,4-дигидроизохинолин-2(1H)-ил]кар6онил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 7' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=61.01:60.17; %Н=5.74:5.09; %N=12.15:12.02; %Cl-=8.78:9.81
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C41H44ClN7O4
[М+Н]+ рассчитано: 734.3216
[М+Н]+ найдено: 734.3220
Пример 116. Дигидрохлорид 5-(5-хлор-2-{[(3S)-3-[(9aR)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррод-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 9' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=61.01:61.90; %Н=3.74:5.65; %N=12.15:12.14; %Cl=13.15:11.51
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C41H44ClN7O4
[M+H]+ рассчитано: 734.3216
[М+Н]+ найдено: 734.3218
Пример 117. 5-(5-Хлор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил) фенил)-N(4-гидроксифенил)-1,2-диметил-N(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 118. 5-(5-Хлор-2-{[(3S)-3-(дифторметил)-3,4-дигидроигохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 119. 5-(5-Хлор-2-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 120. 5-(5-Хлор-2-{[(3S)-3-[(3-цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 121. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(1-этил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 122. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(1-циклопропил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 28'' на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.12:б7.94; %Н=5.86:5.77; %N=11.92:11.65
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C40H41ClN6O4
[М+Н]+ рассчитано: 705.2951
[M+H]+ найдено: 705.2952
Пример 123. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(трифторметил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 124. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохииолин-2(1H)-ил]карбонил}фенил)-N-[1-(дифторметил)-1H-пиразол-4-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 125. 5-(5-Хлор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-[1-(2-метоксиэтил)-1H-пиразол-4-ил]-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 126. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(оксетан-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 26'' на стадии С.
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C40H41ClN6O5
[М+Н]+ рассчитано: 721.2900
[М+Н]+ найдено: 721.2902
Пример 127. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тетрагидрофуран-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 22'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%063.81:63.63; %Н=5.75:5.74; %N=10.89:10.71; %Cl-=4.59:4.52
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C41H43ClN6O5
[М+Н]+ рассчитано: 735.3056
[М+Н]+ найдено: 735.3061
Пример 128. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[1-(2-гидрокси-2-метилпропил)-1H-пиразол-4-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 129. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49 с использованием примера 106 в качестве исходного вещества, при этом предполагается, что продукт не подвергают стадии превращения в солевую форму.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=70.53:70.51; %Н=6.06:5.81; %N=11.75:11.71
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C42H43ClN6O3
[M+H]+ рассчитано: 715.3158
[М+Н]+ найдено: 715.3159
Пример 130. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-фторфенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 131. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Пример 132. 5-(5-Хлор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамид
Пример 133. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 134. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 135. 5-(5-Хлор-2-{1(3S)-3-(морфодин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 136. 5-(5-Хлор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 137. 5-(5-Хлор-2-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 138. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 139. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 140. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохииолии-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 141. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 142. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 143. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 144. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1-этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 145. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 146. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 147. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 148. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-(2-фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 149. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-(2-фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 150. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил}фенил)-1-(2-фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 151. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-(2,2-дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 152. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-(2,2-дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло|2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 153. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил)фенил)-1-(2,2-дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 154. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 155. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 156. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2,2,2-трифторэтил)-1Н-пиррол-3-карбоксамид
Пример 157. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 158. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 159. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-[2-(морфолии-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 160. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил)карбонил)фенил)-N-(4-гидроксифенил)-2-метил-1-[2-(морфолин-4-ил)этил]-N-фенил-1H-пиррол-3-карбоксамид
Пример 161. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1-[2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 162. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1-[2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-N-фенил-1H-пиррол-3-карбоксамид
Пример 163. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1-(2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 164. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1-[2-(диметиламино)этил]-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 165. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 166. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 167. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил]фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 168. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 169. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 170. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 171. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-2-(дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 172. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-2-(дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 173. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-2-(дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 174. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 175. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 176. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 177. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 178. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 179. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 180. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-2-(2,2-дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 181. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-2-(2,2-дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 182. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-2-(2,2-дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 183. 5-(5-Хлор-2-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 184. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 185. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 186. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 187. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 188. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 189. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 190. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 191. 5-(5-Хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 192. 5-(5-Хлор-2-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 193. 5-(5-Хлор-2-{[(3S)-3-(трифторметил)-3,4-дигмдроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 194. 5-(5-Хлор-2-{[(3S)-3-(дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 195. 5-(5-Хлор-2-{[(3S)-3-(дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 196. 5-(5-Хлор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 197. 5-(5-Хлор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 198. 5-(5-Хлор-2-{[(3S)-3-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-Дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 199. 5-(5-Хлор-2-{[(3S)-3-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 200. 5-(5-Хлор-2-{[(3S)-3-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 201. 5-(5-Хлор-2-{[(3S)-3-[(9aR)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 202. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-5-хлорфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 203. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-хлорфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 204. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-хлорфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 205. 5-(5-Хлор-2-{[(3S)-3-[(3-цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 206. 5-(5-Хлор-2-{[(3S)-3-((3-цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 207. 5-(5-Хлор-2-{[(3S)-3-(1-окса-6-азаспиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(l-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 8' на стадии А, и соединения методики получения 1'' на стадии С.
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C39H39ClN6O4
[М+Н]+ рассчитано: 691.2794
[М+Н]+ найдено: 691.2796
Пример 208. 5-(5-Хлор-2-{[(3S)-3-(1-окса-6-азаспиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 209. Гидрохлорид 5-(5-фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-Дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=6б.27:66.84; %Н=5.69:5.15; %N=10.78:10.71; %Cl-=4.55:4.46
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C43H43FN6O5
[М+Н]+ рассчитано: 743.3352
[М+Н]+ найдено: 743.3353
Пример 210. Гидрохлорид 5-(5-фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Стадия А: 5-(5-Фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1Н-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием соединения методики получения 14 и (3S)-3-(4-морфолинилметил)-1,2,3,4-тетрагидроизохинолина (см. методику получения 3') на стадии А, и соединения методики получения 11'' на стадии С.
Стадия В: Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49, исходя из соединения вышеуказанной стадии, при этом предполагается, что продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемый продукт.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=60.12:57.77; %Н=4.92:4.76; %N=10.79:10.39; %Cl-=4.55:5.17
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C40H40N4O5
[М+Н]+ рассчитано: 657.3071
[М+Н]+ найдено: 657.3066
Пример 211. 5-(4-Фтор-5-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 212. 5-(4-Фтор-5-метокси-2-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 213. N-(1-Этил-1H-пиразол-4-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 214. Гидрохлорид N-(1-циклопропил-1H-пиразол-4-ил)-5-(5-фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 28'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.24:б6.53; %Н=5.84:5.39; %N=10.59:10.92 %Cl-=4.89:5.68
Пример 215. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(трифторметил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 216. N-[1-(Дифторметил)-1H-пиразол-4-ил]-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 217. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-[1-(2-метоксиэтил)-1H-пиразол-4-ил]-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 218. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(оксетан-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 219. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-гидроксифенил)-1,2-диметил-N-[1-(тетрагидрофуран-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 220. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[1-(2-гидрокси-2-метилпропил)-1H-пиразол-4-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Пример 221. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 222. 5-(5-Фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 223. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-фторфенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 224. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-фторфенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 225. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N,1,2-триметил-1H-пиррол-3-карбоксамид
Пример 226. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамид
Пример 227. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 228. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(2-гидрокипиримидин-5-ил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 229. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(2-гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 230. Гидрохлорид N-(5-циано-1-метил-1H-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 19'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=66.43:67.09; %Н=5.57:5.21; %N=11.62:11.48 %Cl-=4.90:4.75
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C40H39FN6O4
[М+Н]+ рассчитано: 687.3097
[М+Н]+ найдено: 687.3073
Пример 231. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 232. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 233. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пнррол-3-карбоксамид
Пример 234. 5-(5-Фтор-2-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 235. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 236. 5-(5-Фтор-2-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 237. 1-Этил-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 238. 1-Этил-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 239. 1-Этил-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 240. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 241. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 242. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 243. 1-(2-Фторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]кар6онил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 244. 1-(2-Фторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 245. 1-(2-Фторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 246. 1-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 247. 1-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 248. 1-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 249. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 250. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 251. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 252. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 253. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 254. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 255. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-1-[2-(морфолин-4-ил)этил]-N-фенил-1H-пиррол-3-карбоксамид
Пример 256. 1-[2-(Диметиламино)этил]-5-(5-фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 257. 1-[2-(Диметиламино)этил]-5-(5-фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-метил-N-фенил-1H-пиррол-3-карбоксамид
Пример 258. 1-[2-(Диметиламино)этил]-5-(5-фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 259. 1-[2-(Диметиламино)этил]-5-(5-фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 260. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(l-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 261. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 262. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 263. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 264. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 265. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 266. 2-(Дифторметил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 267. 2-(Дифторметил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 268. 2-(Дифторметил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 269. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 270. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 271. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло(2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 272. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 273. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил{фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 274. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 275. 2-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 276. 2-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 277. 2-(2,2-Дифторэтил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 278. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 279. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметид)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 280. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 281. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 282. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 283. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 284. 5-(5-Фтор-2-{[(3R)-3-метил--3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 285. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 286. 5-(5-Фтор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-(2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 287. 5-(5-Фтор-2-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 288. 5-(5-Фтор-2-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 289. 5-(5-Фтор-2-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-нл)-1H-пиррол-3-карбоксамид
Пример 290. 5-(2-{((3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-Т-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 291. 5-(2-{[(3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 292. 5-(2-{1(3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-N-пиррол-3-карбоксамид
Пример 293. 5-(5-Фтор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 294. 5-(5-Фтор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 295. 5-(5-Фтор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 296. 5-(5-Фтор-2-{[(3S)-3-(фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 297. 5-(5-Фтор-2-{[(3S)-3-[(9aS)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил)карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 298. 5-(5-Фтор-2-{[(3S)-3-[(9aS)-гексагидропиразнно[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 299. 5-(5-Фтор-2-{[(3S)-3-[(9aR)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 300. 5-(5-Фтор-2-{[(3S)-3-[(9aR)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 301. 5-(5-Фтор-2-{[(3S)-3-[(9aR)-гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил)карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 302. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 303. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 304. 5-(2-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 305. 5-(2-{[(3S)-3-[(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 306. 5-(2-{[(3S)-3-[(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил)карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 307. 5-(2-{[(3S)-3-[(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-5-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррод-3-карбоксамид
Пример 308. 5-(5-Фтор-2-{[(3S)-3-(1-окса-6-азаспиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 309. 5-(5-Фтор-2-{[(3S)-3-(1-окса-6-азаепиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 310. N-(1-Этил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 311. N-(1-Циклопропил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 312. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил)карбонил)-1,3-бензодиоксол-5-ил)-N-[1-(трифторметил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 313. N-[1-(Дифторметил)-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 314. N-(4-Гидроксифенил)-N-[1-(2-метоксиэтил)-1H-пиразол-4-ил]-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 315. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-[1-(оксетан-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 316. N-(4-Гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-[1-(тетрагидрофуран-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Пример 317. N-[1-(2-Гидрокси-2-метилпропил)-1H-пиразол-4-ил]-N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 318. 1,2-Диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 319. 1,2-Диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 320. N-(4-Фторфенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 321. N-(4-Фторфенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 322. N-(4-Гидроксифенил)-N,1,2-триметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 323. N-(2-Гидроксипиримидин-5-ил)-1,2-диметил-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Пример 324. N-(2-Гидроксипиримидин-5-ил)-1,2-диметнл-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бенэодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 325. N-(2-Гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1Н-пиррол-3-карбоксамид
Пример 326. N-(2-Гидроксипиримидин-5-ил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 327. N-(5-Циано-1-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(6-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 328. N-(4-Гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 329. N-(4-Гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 330. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 331. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил)карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 332. N-(4-Гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-идметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 333. 1-Этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[23-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 334. 1-Этил-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 335. N-(4-Гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 336. N-(4-Гидроксифенил)-1-(2-метоксиэтил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 337. 1-(2-Фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 338. 1-(2-Фторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 339. 1-(2,2-Дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 340. 1-(2,2-Дифторэтил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 341. N-(4-Гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-13-бензодиоксол-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 342. N-(4-Гидроксифенил)-2-метил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 343. N-(4-Гидроксифенил)-2-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 344. N-(4-Гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 345. N-(4-Гидроксифенил)-2-метид-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-13-бензодиоксол-5-ил)-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-(2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 346. 1-(2-(Диметиламино)этил]-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 347. 1-[2-(Диметиламино)этил]-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 348. 1-[2-(Диметиламино)этил]-N-(4-гидроксифенил)-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 349. N-(4-Гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-5-(6-([(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 350. N-(4-Гидроксифенил)-1-{2-[(2-метоксиэтил)(метил)амино]этил}-2-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 351. N-(4-Гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(трифторметил)-1H-пиррол-3-карбоксамид
Пример 352. 2-(Дифторметил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 353. N-(4-Гидроксифенил)-2-(метоксиметил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 354. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-идметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 355. N-(4-Гидроксифенил)-1-метил-N-(1-метил-1H-пирроло[2,3-b]пиридии-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 356. N-(4-Гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-2-(2,2,2-трифторэтил)-1H-пиррол-3-карбоксамид
Пример 357. 2-(2,2-Дифторэтил)-N-(4-гидроксифенил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 358. Гидрохлорид N-(4-гидрксифенил)-2-(2-метоксиэтил)-1-метил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49 с использованием примера 88 в качестве исходного вещества, при этом предполагается, что продукт в заключение растворяют в ацетонитриле и превращают в солевую форму в 0.1М водном растворе HCl. После стадии лиофилизации, ожидаемый продукт получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.80:64.71; %Н=6.01:5.74; %N=10.23:10.03; %Cl-=4.32:6.47
Масс-спектрометрия высокого разрешения (ESI/+):
Эмпирическая формула: C45H48N6O7
[М+Н]+ рассчитано: 785.3657
[М+Н]+ найдено: 785.3658
Пример 359. N-(4-Гидроксифенил)-1-метил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пириднн-5-ил)-2-(морфолин-4-илметил)-1H-пиррол-3-карбоксамид
Пример 360. N-(4-Гидроксифенил)-1-метил-5-(6-{((3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-2-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамид
Пример 361. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ид)-1H-пиррол-3-карбоксамид
Пример 362. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 363. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 364. 5-(6-{[(3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил}карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 365. 5-(6-{[(3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 366. 5-(6-{[(3S)-3-(Дифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 367. 5-(6-{[(3S)-3-(Фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 368. 5-(6-{[(3S)-3-(Фторметил)-3,4-дигидроизохмнолин-2(1H)-ил]карбонил)-1,3-бенэодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 369. 5-(6-{((3S)-3-(Фторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 370. 5-(6-{[(3S)-3-[(9aS)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 371. 5-(6-{[(3S)-3-[(9aS)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 372. 5-(6-{[(3S)-3-[(9aS)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 373. 5-(6-{[(3S)-3-[(9аR)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-нл)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 374. 5-(6-{[(3S)-3-[(9aR)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 375. 5-(6-{[(3S)-3-1(9aR)-Гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 376. 5-(6-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 377. 5-(6-{((3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 378. 5-(6-{[(3S)-3-(Аминометил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 379. 5-(6-{[(3S)-3-[(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-l,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид
Пример 380. 5-(6-([(3S)-3-1(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 381. 5-(6-{[(3S)--3-[(3-Цианоазетидин-1-ил)метил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Пример 382. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(1-окса-6-азаепиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 383. N-(4-Гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(1-окса-6-азаспиро[3.3]гепт-6-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид
Пример 384. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.28:67.73; %Н=5.65:5.30; %N=10.06:9.41 %Cl-=5.09:5.79
Пример 385. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H41ClN6O4
[М+Н]+ рассчитано: 713.3253
[М+Н]+ найдено: 713.3272
Пример 386. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Стадия А: N-[4-[трет-Бутил(диметил)силил]оксифенил]-5-[5-хлор-2-[(3S)-3-(морфолинометил)-3,4-дигидро-1H-изохинолин-2-карбонил]фенил]-N-(5-циано-1,2-диметилпиррол-3-ил)-1,2-диметилпиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С.
ИК: v -CN-: 2210 см-1; v -C=O-: 1631 см-1
Стадия В: Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1Н-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1Н-пиррол-3-карбоксамида
Снимают защиту с соединения стадии А в соответствии с протоколом, описанным на стадии D примера 1. Таким образом полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемый продукт.
1H ЯМР (500 МГц, дмсо-d6) δ м.д.: 11.2 (bs, 1Н), 9.39 (bs, 1H), 7.83 (d, 1H), 7.54 (d, 1H), 7.33 (s, 1H), 7.14 (m, 2H), 7 (m, 2H), 6.8 (d, 2H), 6.62 (d, 2H), 6.57 (bs, 1H), 5.26 (s, 1H), 5.26 (m, 1H), 4.64/4.03 (AB, 2H), 4.01/3.92 (2m, 4H), 3.75/3.43/3.15/3.02 (4m, 4H), 3.59 (s, 3H), 3.3/3.15 (2m, 2H), 2.97 (s, 3H), 2.69/2.52 (dd+d, 2H), 2.06 (s, 3H), 1.91 (s, 3H)
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.34:65.50; %Н=5.62:5.15; %N=11.15:10.84 %Cl-=4.70:4.44
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H41ClN6O4
[М+Н]+ рассчитано: 717.2952
[М+Н]+ найдено: 717.2951
Пример 387. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.62:66.36; %Н=5.59:5.62; %N=10.84:10.72 %Cl-=4.57:4.55
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C43H42N6O6
[М+Н]+ рассчитано: 739.3239
[М+Н]+ найдено: 739.3241
Пример 388. Дигидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49 с использованием примера 71 в качестве исходного вещества, при этом предполагается, что продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=62.73:62.96; %Н=5.64:4.95; %N=10.45:10.32; %Cl=13.23:12.91
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H43ClN6O4
[М+Н]+ рассчитано: 731.3107
[М+Н]+ найдено: 731.3111
Пример 389. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксефенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.88:66.28; %Н=5.53:5.15; %N=10.98:10.95; %Cl-=4.63:4.47
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C42H41ClN6O4
[М+Н]+ рассчитано: 729.2951
[М+Н]+ найдено: 729.2954
Пример 390. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения, при этом предполагается, что стадию D не осуществляют. Ожидаемый продукт получают в форме свободного основания.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=70.72:69.77; %Н=5.79:5.96; %N=11.78:11.43
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C42H41ClN6O3
[М+Н]+ рассчитано: 713.3001
[М+Н]+ найдено: 713.2998
Пример 391. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[3,2-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.88:65.69; %Н=5.33:4.87; %N=10.98:10.86; %Cl-=4.63:4.51
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C42H41ClN6O4
[М+Н]+ рассчитано: 729.2951
[M+H]+ найдено: 729.2953
Пример 392. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-[3-(морфолии-4-ил)пропил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1Н-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.19:68.33; %H=6.00:5.49; %N=10.78:10.71; %Cl-=4.55:4.46; %Cl=9.58:9.78
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C42H43ClN4O4
[M+H]+ рассчитано: 703.3046
[М+Н]+ найдено: 703.3042
Пример 393. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-[3-(морфолин-4-ил)пропил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C44H45ClN6O4
[М+Н]+ рассчитано: 757.3264
[M+H]+ найдено: 757.3263
Пример 394. 5-(5-Хлор-2-{[(3R)-3-[3-(морфолин-4-ил)пропил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49 с использованием примера 393 в качестве исходного вещества, при этом предполагается, что продукт не подвергают стадии превращения в солевую форму.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=69.60:69.56; %Н=6.21:6.24; %N=11.07:11.08
Масс-спектрометрия высокого разрешения (ESI+-/FIA):
Эмпирическая формула: C44H47ClN6O4
[М+Н]+ рассчитано: 759.3420
[М+Н]+ найдено: 759.3422
Пример 395. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-циано-4-метоксифенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Методика соответствует общему протоколу примера 1 с использованием подходящих методик получения. Полученный продукт в заключение растворяют в ацетонитриле и превращают в солевую форму, используя 0.1М водный раствор HCl. После стадии лиофилизации, ожидаемое соединение получают в виде твердого вещества.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C42H40ClN5O5
[М+Н]+ рассчитано: 730.2791
[М+Н]+ найдено: 730.2790
Пример 396. Гидрохлорид N-(3-фтор-4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{((3S)-3-(морфолин-4-илметид)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 11 и (3S)-3-(4-морфолинилметил)-1,2,3,4-тетрагидроизохинолина (см. методику получения 3') на стадии А, и соединения методики получения 20'' на стадии С. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.79:65.43; %Н=5.39:5.19; %N=11.31:11.21; %Cl-=4.77:4.34
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C39H39FN6O6
[М+Н]+ рассчитано: 707.2988
[М+Н]+ найдено: 707.2988
Пример 397. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-1H-пиррол-3-карбоксамид
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C39H39ClN6O5
[M+H]+ рассчитано: 707.2743
[М+Н]+ найдено: 707.2746
Пример 398. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-цианофенил)-N-(4-гидроксифенил)-N-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.85:66.75; %Н=5.34:5.42; %N=9.51:9.73; %Cl=9.62:9.67; %Cl-=4.81:4.71
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C41H38ClN5O4
[M+H]+ рассчитано: 700.2685
[М+Н]+ найдено: 700.2686
Пример 399. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-фтор-4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и (3S)-3-(4-морфолинилметил)-1,2,3,4-тетрагидроизохинолина (см. методику получения 3') на стадии А, и соединения методики получения 20'' на стадии С. Полученный продукт в заключение подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают ожидаемое соединение.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=62.21:61.32; %Н=5.36:5.18; %N=11.46:11.14; %Cl=9.66:10.16; %Cl-=4.83:5.23
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C38H38ClFN6O4
[M+H]+ рассчитано: 697.2700
[М+Н]+ найдено: 697.2704
Пример 400. Гидрохлорид метил 2-[{[5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1,2-диметил-1H-пиррол-3-ил]карбонил}(4-гидроксифенил)амино]пиридин-4-карбоксилата
Указанное в заголовке соединение является вторичным продуктом, который образует в ходе синтеза примера 110 (на конечной стадии перед стадией превращения в солевую форму) вследствие гидролиза нитрильной функции в функцию сложного метилового эфира. Соединение отделяют от примера 110 с помощью хроматографии на силикагеле смесью метанола и дихлорметана.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.90:64.43; %Н=5.36:5.01; %N=9.09:9.34; %Cl-=4.60:4.46
Масс-спектрометрия высокого разрешения (ESI+/HR и ESI-/LR):
Эмпирическая формула: C41H40ClN5O6
[М+Н]+ рассчитано: 734.2740
[М+Н]+ найдено: 734.2743
Пример 401. Гидрохлорид 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-циано-4-фторфенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.25:64.23; %Н=5.07:4.71; %N=9.28:9.36; %Cl=9.40:9.59; %Cl-=4.70:4.50
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C41H37ClFN5O4
[M+H]+ рассчитано: 718.2591
[М+Н]+ найдено: 718.2593
Пример 402. Гидрохлорид 5-(5-фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолии-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-{1-((3S или R)-тетрагидрофуран-3-ил]-1H-пиразол-4-ил}-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.20:65.92; %Н=5.87:5.78; %N=11.13:10.36 %Cl-=4.69:4.79)
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H43FN6O5
[М+Н]+ рассчитано: 719.3359
[M+H]+ найдено: 719.3362
и
Пример 403. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-{1-[(3R или S)-тетрагидрофуран-3-ил]-1H-пиразол-4-ил}-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.20:66.04; %H=5.87:5.87; %N=11.13:10.62; %Cl-=4.69:4.76
Масс-спектрометрия высокого разрешения (ESI/+):
Эмпирическая формула: C41H43FN6O5
[M+H]+ рассчитано: 719.3359
[М+Н]+ найдено: 719.3350
Соединения примеров 402 и 403 получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 22'' на стадии С. Полученные диастереоизомеры разделяют с помощью хиральной хроматографии и затем превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанных в заголовке соединений.
Пример 404. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(2-цианопиримидин-4-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Пример 405. Дигидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил{карбонил)фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]ииридин-5-ил)-N-(пиридазин-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С, при этом предполагается, что стадию D не осуществляют. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C40H39ClN8O3
[М+Н]+ рассчитано: 715.2906
[М+Н]+ найдено: 715.2909
Пример 406. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 25 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=68.46:68.27; %Н=6.03:5.12; %N=11.68:11.75; %Cl-=4.93:4.73
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C41H42N6O4
[М+Н]+ рассчитано: 683.3340
[М+Н]+ найдено: 683.3334
Пример 407. Гидрохлорид N-(3-фтор-4-гидроксифенил)-5-(5-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 12 и соединения методики получения 3' на стадии А, и соединения методики получения 20'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.23:63.94; %Н=5.80:5.00; %N=11.52:11.56; %Cl-=4.86:4.99
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C39H41FN6O5
[М+Н]+ рассчитано: 693.3195
[М+Н]+ найдено: 693.3191
Пример 408. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-ЛГ-(4-гидроксифенил)-5-(5-метокси-2-{((3S)-3-(морфолии-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-1№пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 12 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.32:67.30; %H=6.05:5.28; %N=11.22:11.15; %Cl-=4.73:4.59
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR и ESI-/FIA):
Эмпирическая формула: C42H44N6O5
[М+Н]+ рассчитано: 713.3446
[М+Н]+ найдено: 713.3443
Пример 409. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 25 и соединения методики получения 3' на стадии А, и соединения методики получения 11'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.98:68.95; %Н=5.93:4.76; %N=11.49:11.43
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C42H42N6O4
[М+Н]+ рассчитано: 695.3340
[М+Н]+ найдено: 695.3341
Пример 410. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49, с использованием примера 409 в качестве исходного вещества. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и ESI-/FIA):
Эмпирическая формула: C42H44N6O4
[М+Н]+ рассчитано: 697.3497
[М+Н]+ найдено: 697.3497
Пример 411. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохииолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-2-метил-N-(1-метил-1H-пиразол-4-ил)-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 96 с использованием кислоты методики получения 30, соединения методики получения 1', и соединения методики получения 1''. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C39H41ClN6O4
[М+Н]+ рассчитано: 693.2951
[М+Н]+ найдено: 693.2947
Пример 412. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-[3-(морфолин-4-ил)пропил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гвдроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 6' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.06:65.61; %Н=5.93:5.22; %N=10.75:10.69; %Cl-=4.53:4.68
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C43H45ClN6O4
[М+Н]+ рассчитано: 745.3264
[М+Н]+ найдено: 745.3260
Пример 413. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(7-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-2,3-дигидро-1,4-бензодиоксин-6-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 13 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.44:66 АО; %Н=5.83:4.84; %N=10.81:10.79; %Cl-=4.56:4.22
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C43H44N6O6
[М+Н]+ рассчитано: 741.3395
[M+H]+ найдено: 741.3397
Пример 414. Гидрохлорид 5-(5-хлор-2-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(5-метил-5H-пирроло[3,2-d]пиримидин-2-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.23:64.38; %Н=5.39:5.25; %N=12.79:12.62; %Cl-=4.62:4.39
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C41H40ClN7O4
[М+Н]+ рассчитано: 730.2903
[М+Н]+ найдено: 730.2904
Пример 415. Гидрохлорид 5-(5-хлор-2-{1(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1-метил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 3 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.95:65.14; %Н=5.45:5.34; %N=11.36:11.36; %Cl-=4.79:4.67
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C40H39ClN6O4
[M+H]+ рассчитано: 703.2794
[М+Н]+ найдено: 703.2795
Пример 416. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тридейтерометил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 25'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.51:63.41; %Н=5.63:5.42; %N=11.69:11.61; %Cl-=4.93:4.85
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C38H36ClD3N6O4
[М+Н]+ рассчитано: 682.2982
[М+Н]+ найдено: 682.2986
Пример 417. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-5-(4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 31 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.32:67.56; %Н=6.05:5.84; %N=11.22:11.21; %Cl-=4.73:4.71
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C42H44N6O5
[М+Н]+ рассчитано: 713.3446
[М+Н]+ найдено: 713.3446
Пример 418. Гидрохлорид N-(4-гидроксифенил)-5-(4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 31 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.86:65.51; %Н=6.09:6.09; %N=11.82:11.73; %Cl-=4.98:5.14
Масс-спектрометрия высокого разрешения (ESI/FIA/HR, ESI-/FIA):
Эмпирическая формула: C39H42N6O5
[М+Н]+ рассчитано: 675.3289
[М+Н]+ найдено: 675.3286
Пример 419. Гидрохлорид N-(3-цианофенил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 41'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H38FN5O4
[М+Н]+ рассчитано: 684.2988
[М+Н]+ найдено: 684.2975
Пример 420. Гидрохлорид 5-(5-фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тридейтерометил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 25'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI/+):
Эмпирическая формула: C38D3H36FN6O4
[М+Н]+ рассчитано: 666.3285
[М+Н]+ найдено: 666.3265
Пример 421. Гидрохлорид N-(5-циано-1,2-диметил-1Н-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C41H41FN6O4
[М+Н]+ рассчитано: 701.3246
[М+Н]+ найдено: 701.3282
Пример 422. Гидрохлорид N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 25 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=67.00:67.47; %Н=6.07:5.54; %N=12.34:12.46; %Cl-=5.20:4.58
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C38H40N6O4
[М+Н]+ рассчитано: 645.3184
[М+Н]+ найдено: 645.3182
Пример 423. 5-(5-Фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(оксетан-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 26'' на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.17:67.82; %Н=5.86:5.97; %N=11.92:11.48
Масс-спектрометрия высокого разрешения (ESI/FIA/HR иМС/МС):
Эмпирическая формула: C40H41FN6O5
[М+Н]+ рассчитано: 705.3202
[М+Н]+ найдено: 705.3207
Пример 424. Гидрохлорид N-(4-гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 25 и соединения методики получения 3' на стадии А, и соединения методики получения 12'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.05:65.63; %Н=5.83:5.45; %N=11.85:11.93; %Cl-=5.00:4.91
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C39H40N6O5
[М+Н]+ рассчитано: 673.3133
[М+Н]+ найдено: 673.3129
Пример 425. Гидрохлорид N-(3-циано-5-метоксифенил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H--пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.25:66.55; %Н=5.51:5.28; %N=9.33:8.55 %Cl-=4.73:4.67
Пример 426. 5-(5-Фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 12'' на стадии С.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C39H39FN6O5
[М+Н]+ рассчитано: 691.3038
[M+H]+ найдено: 691.3060
Пример 427. Гидрохлорид N-(3-циано-4-метоксифенил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.24:66.41; %Н=5.51:5.35; %N=9.33:8.97% Cl-=4.73:4.81
Пример 428. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-5-(4-фтор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 26 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.79:66.97; %Н=5.74:5.36; %N=11.40:11.45; %Cl-=4.81:4.53
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C41H41FN6O4
[М+Н]+ рассчитано: 701.3246
[М+Н]+ найдено: 701.3245
Пример 429. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-5-(4-фтор-5-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 27 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.75:65.43; %Н=5.78:5.57; %N=10.95:10.81; %Cl-=4.62:4.54
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C42H43FN6O5
[M+H]+ рассчитано: 731.3352
[М+Н]+ найдено: 731.3351
Пример 430. 5-(5-Хлор-2-{[3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и рацемического 3-(трифторметил)-1,2,3,4-тетрагидроизохинолина на стадии А, и соединения методики получения 11'' на стадии С.
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C38H31ClF3N5O3
[М+Н]+ рассчитано: 698.2140
[М+Н]+ найдено: 698.2144
Пример 431. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(1,3-диметил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.19:64.37; %Н=5.80:5.18; %N=11.52:11.55; %Cl-=4.86:4.68
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C39H41ClN6O4
[M+H]+ рассчитано: 693.2951
[M+H]+ найдено: 693.2952
и
Пример 432. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил)карбонил}фенил)-N-(1,5-диметил-1H-пиразол-4-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.19:64.43; %Н=5.80:5.22; %N=11.52:11.60; %Cl-=4.86:4.66
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C39H41ClN6O4
[M+H]+ рассчитано: 693.2951
[M+H]+ найдено: 693.2953
Соединения примеров 431 и 432 получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и смеси методики получения 27'' на стадии С. В конце стадии D изомеры разделяют с помощью препаративной ВЭЖХ, используя ацетонитрил и смесь вода-ТФУ в качестве элюантов. После упаривания растворителя и нейтрализации бикарбонатом натрия, продукты подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают указанные в заголовке продукты.
Пример 433. Гидрохлорид N-(5-циано-1-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-5-(2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 25 и соединения методики получения 3' на стадии А, и соединения методики получения 19'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.12:68.29; %Н=5.86:5.40; %N=11.92:12.05; %Cl-=5.03:4.92
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C40H40N6O4
[М+Н]+ рассчитано: 669.3184
[М+Н]+ найдено: 669.3184
Пример 434. Гидрохлорид 5-(5-фтор-2-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом, описанным на стадии В примера 49, с использованием примера 385 в качестве исходного вещества. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.15:68.03; %Н=5.90:5.50; %N=11.19:10.59 %Cl-=4.72:5.55
Пример 435. Гидрохлорид N-(4-цианопиридин-2-ил)-5-(5-фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 14 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+-/FIA/HR, ESI-/FIA):
Эмпирическая формула: C41H39FN6O5
[М+Н]+ рассчитано: 715.3039
[М+Н]+ найдено: 715.3040
Пример 436. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-цианотиофен-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=63.07:63.09; %Н=5.02:4.78; %N=9.43:9.35; %S=4.32:4.09; %Cl-=4.77:4.59
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI+-/FIA):
Эмпирическая формула: C39H36ClN5O4S
[М+Н]+ рассчитано: 706.2249:
[М+Н]+ найдено: 706.2250
Пример 437. Гидрохлорид N-(3-циано-4-фторфенил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ES+):
Эмпирическая формула: C41H37F2N5O4
[М+Н]+ рассчитано: 702.2894
[М+Н]+ найдено: 702.2886
Пример 438. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиразин-2-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.95:63.96; %Н=5.37:5.17; %N=11.78:11.61; %Cl-=4.97:4.57
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C38H37ClN6O4
[М+Н]+ рассчитано: 677.2638
[М+Н]+ найдено: 677.2639
Пример 439. Гидрохлорид 5-(5-фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-N-(2-метоксипиримидин-5-ил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 14 и соединения методики получения 3' на стадии А, и соединения методики получения 12'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС, ESI-/FIA):
Эмпирическая формула: C40H41FN6O6
[М+Н]+ рассчитано: 721.3144
[М+Н]+ найдено: 721.3144
Пример 440. Гидрохлорид N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-5-(5-фтор-4-метоксси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 14 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.75:65.98; %Н=5.78:5.50; %N=10.95:10.S7; %Cl-=4.62:4.42
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C42H43FN6O5
[М+Н]+ рассчитано: 731.3352
[М+Н]+ найдено: 731.3353
Пример 441. Гидрохлорид 5-(5-хлор-2-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 29'' на стадии С, при этом предполагается, что стадию D не осуществляют. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.75:6б.44; %Н=5.74:5.59; %N=11.39:11.45; %Cl-=4.81:4.43
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C41H41ClN6O3
[М+Н]+ рассчитано: 701.3001
[М+Н]+ найдено: 701.2998
Пример 442. Гидрохлорид 5-(5-хлор-2-{((3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-цианотиофен-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 42'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.07:63.14; %Н=5.02:4.87; %N=9.43:9.41; %S=4.32:4.24; %Cl-=4.77:4.57
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C39H36ClN5O4S
[М+Н]+ рассчитано: 706.2249
[М+Н]+ найдено: 706.2252
Пример 443. 5-(5-Фтор-4-гидрокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамил
Стадия А: 5-(5-Фтор-4-метокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-1,2-диметил-N-(1-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1Н-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 (стадии А-С) с использованием кислоты методики получения 28 и соединения из методики получения 3' на стадии А, и соединения методики получения 30'' на стадии С.
Стадия В: 5-(5-Фтор-4-гидрокси-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-N-фенил-1H-пиррол-3-карбоксамид
К раствору соединения стадии А (1 г; 1.37 ммоль) в безводном дихлорметане (10 мл) добавляют, по каплям при 0°С, 1М раствор трибромида бора в дихлорметане (1.8 мл; 1.8 ммоль). После перемешивания в течение 15 часов при температуре окружающей среды, реакционную смесь по каплям выливают в раствор этанола (15 мл) при -10°С. После перемешивания в течение одного часа добавляют насыщенный водный раствор бикарбоната натрия, и реакционную смесь экстрагируют дихлорметаном. После сушки над MgSO4, остаток очищают на колонке с силикагелем, используя смесь дихлорметана и метанола в качестве элюанта, с получением ожидаемого продукта.
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C42H41FN6O4
[М+Н]+ рассчитано: 713.3246
[М+Н]+ найдено: 713.3244
Пример 444. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-N-(5-метоксипиразин-2-ил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=62.99:62.72; %Н=5.42:5.24; %N=11.30:11.19; %Cl-=4.77:4.67
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C39H39ClN6O5
[M+H]+ рассчитано: 707.2743
[M+H]+ найдено: 707.2747
Пример 445. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тридейтерометил)-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил]-1H-пиррол-3-карбоксамида
Стадия А: 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тридейтерометил)-1Н-пирроло[2,3-b]пиридин-5-ил]-1Н-пиррол-3-карбоксамид
Промежуточное соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 31'' на стадии С.
Стадия В: Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1Н)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тридейтерометил)-2,3-дигидро-1Н-пирроло[2,3-b]пиридин-5-ил]-1Н-пиррол-3-карбоксамида
Методика соответствует протоколу, описанному на стадии В примера 49, при этом предполагается, что продукт затем подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода, получают указанный в заголовке продукт.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65А5:65.33; %Н=5.78:5.59; %N=10.90:10.82; %Cl-=4.60:4.28
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C42H40ClD3N6O4
[М+Н]+ рассчитано: 734.3295
[M+H]+ найдено: 734.3300
Пример 446. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-фторпиразин-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=62.28:62.16; %Н=5.10:4.97; %N=11.04:11.35; %Cl-=4.S5-AAS
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C38H36ClFN6O4
[М+Н]+ рассчитано: 695.2543
[М+Н]+ найдено: 695.2545
Пример 447. Гидрохлорид 5-(4-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 26 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.28:65.27; %Н=5.77:5.51; %N=12.02:1.90; %Cl-=5.07:4.74
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C38H39FN6O4
[M+H]+ рассчитано: 663.3090
[М+Н]+ найдено: 663.3084
Пример 448. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[5-циано-1-(тридейтерометил)-1H-пиррол-3-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 32'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=64.69:64.23; %Н=5.45:5.47; %N=11.32:11.16; %Cl-=4.77:4.56
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C40H36ClD3N6O4
[М+Н]+ рассчитано: 706.2982
[М+Н]+ найдено: 706.2985
Пример 449. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-[5-циано-2-метил-1-(тридейтерометил)-1H-пиррол-3-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 33'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.07:64.55; %Н=5.62:5.51; %N=11.11:10.98; %Cl-=4.68:4.58
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C41H38ClD3N6O4
[М+Н]+ рассчитано: 720.3139
[М+Н]+ найдено: 720.3143
Пример 450. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(3-циано-1-метил-1H-пиразол-5-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 34'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.24:62.62; %Н=5.31:5.09; %N=13.24:13.04; %Cl-=4.79:4.37
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C39H38ClN7O4
[М+Н]+ рассчитано: 704.2747
[М+Н]+ найдено: 704.2747
Пример 451. Гидрохлорид 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразоло[3,4-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 17'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.64:66.28; %Н=5.51:5.45; %N=13.07:12.17% Cl-=4.73:5.51
Пример 452. Гидрохлорид N-(1,3-диметил-1H-пиразол-4-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.68:64.77; %Н=5.94:5.55; %N=11.78:10.69 %Cl-=4.97:6.48
и
Пример 453. Гидрохлорид N-(1,5-диметил-1H-пиразол-4-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.68:65.43; %Н=5.94:5.б2; %N=11.78:10.95 %Cl-=4.97:5.60
Соединения примеров 452 и 453 получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и смеси методики получения 27'' на стадии С. В конце стадии D изомеры разделяют с помощью препаративной ВЭЖХ, используя ацетонитрил и смесь вода-ТФУ в качестве элюантов. После упаривания растворителя и нейтрализации бикарбонатом натрия, продукты подвергают стадии превращения в солевую форму в присутствии 1М HCl в эфире. После фильтрования и лиофилизации в смеси ацетонитрил/вода получают указанные в заголовке продукты.
Пример 454. 5-(5-Хлор-2-{[3-(трифторметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты из методики получения 1 и рацемического 3-(трифторметил)-1,2,3,4-тетрагидроизохинолина на стадии А, и соединения методики получения 18'' на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.77:64.81; %Н=4.55:4.52; %N=10.21:10.33
Масс-спектрометрия высокого разрешения (ESI+/HR):
Эмпирическая формула: C37H31ClF3N5O3
[М+Н]+ рассчитано: 686.2140
[М+Н]+ найдено: 686.2145
Пример 455. Гидрохлорид 5-(5-хлор-2-([(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-{5-циано-2-метил-1-[2-(морфолин-4-ил)этил]-1H-пиррол-3-ил}-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 1' на стадии А, и соединения методики получения 35'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%C=65.71:66.07; %H=5.78:5.82; %N=10.95:10.66; %Cl-=4.б2:4.45
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C42H43ClN6O4
[М+Н]+ рассчитано: 731.3107
[М+Н]+ найдено: 731.3109
Пример 456. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-{2-[2-(морфолин-4-ил)этокси]пиримидин-5-ил}-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 1' на стадии А, и соединения методики получения 36'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=63.41:63.51; %Н=5.59:5.26; %N=11.09:11.10; %Cl-=4.68:4.46
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C40H41ClN6O5
[М+Н]+ рассчитано: 721.2900
[M+H]+ найдено: 721.2907
Пример 457. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(6-циано-5-метоксипиридин-2-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.15:б3.95; %Н=5.25:4.79; %N=10.95:10.97; %Cl-=4.62:4.22
Масс-спектрометрия высокого разрешения (ESI+/HR):
Эмпирическая формула: C41H39ClN6O5
[М+Н]+ рассчитано: 731.2743
[М+Н]+ найдено: 731.2746
Пример 458. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,4-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 37'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.34:65.68; %Н=5.62:5.31; %N=11.15:11.15; %Cl-=4.70:4.33
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C41H41ClN6O4
[М+H]+ рассчитано: 717.2951
[М+Н]+ найдено: 717.2954
Пример 459. Гидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1-этил-2-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 38'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.71:65.29; %Н=5.78:5.51; %N=10.95:10.95; %Cl-=4.62:4.39
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C42H43ClN6O4
[М+Н]+ рассчитано: 731.3107
[М+Н]+ найдено: 731.3109
Пример 460. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-[3-(морфолин-4-ил)пропил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-[1-(тетрагидрофуран-3-ил)-1H-пиразол-4-ил]-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 6' на стадии А, и соединения методики получения 22'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=64.58:64.24; %Н=6.05:5.88; %N=10.51:10.53; %Cl-=4.43:4.39
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C43H47ClN6O5
[М+Н]+ рассчитано: 763.3369
[М+Н]+ найдено: 763.3371
Пример 461. Гидрохлорид 5-(5-хлор-2-{[(3R)-3-[3-(морфолин-4-ил)пропил]-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 6' на стадии А, и соединения методики получения 29'' на стадии С, при этом предполагается, что стадию D не осуществляют. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.44:66.68; %Н=6.05:5.80; %N=10.97:10.95; %Cl-=4.63:4.57
Масс-спектрометрия высокого разрешения (ESI+/HR):
Эмпирическая формула: C43H45ClN6O3
[М+Н]+ рассчитано: 729.3314
[М+Н]+ найдено: 729.3316
Пример 462. 5-(5-Хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(5-метил-1,2-оксазол-3-ил)-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и подходящего амина на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=67.10:66.64; %Н=5.63:5.40; %N=10.30:10.24
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C38H38ClN5O5
[М+Н]+ рассчитано: 680.2634
[М+Н]+ найдено: 680.2637
Пример 463. N-(2-Этоксипиримидин-5-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 8 и соединения методики получения 3' на стадии А, и соединения методики получения 39'' на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=68.17:67.52; %H=5.S6:5.60; %N=11.92:11.43
Пример 464. Дигидрохлорид 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(5-гидроксипиридин-2-ил)-1,2-диметил-N-(1-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и соединения методики получения 3' на стадии А, и соединения методики получения 40'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C41H40ClN7O4
[М+Н]+ рассчитано: 730.2903
[М+Н]+ найдено: 730.2907
Пример 465. Гидрохлорид 5-(4-хлор-2-([(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил)фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 29 и соединения методики получения 3' на стадии А, и соединения методики получения 18'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=65.34:64.81; %Н=5.62:5.27; %N=11.15:10.95 %Cl-=4.70:5.09
Масс-спектрометрия высокого разрешения (ESI+):
Эмпирическая формула: C41H41ClN6O4
[М+H]+ рассчитано: 717.2951
[М+Н]+ найдено: 717.2952
Пример 466. Гидрохлорид 5-(4-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамида
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 29 и соединения методики получения 3' на стадии А, и соединения методики получения 1'' на стадии С. Полученное соединение превращают в солевую форму и лиофилизируют, как описано в общем способе, с получением указанного в заголовке соединения.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=66.77:62.82; %Н=5.63:5.29; %N=11.74:11.75; %Cl-=5.01:5.23
Масс-спектрометрия высокого разрешения (ESI+/HR, ESI-/LR):
Эмпирическая формула: C38H39ClN6O4
[М+Н]+ рассчитано: 679.2794
[М+Н]+ найдено: 679.2796
Пример 467. 5-(5-Хлор-2-{[3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-фенил-1H-пиррол-3-карбоксамид
Указанное в заголовке соединение получают в соответствии со способом примера 1 с использованием кислоты методики получения 1 и 1,2,3,4-тетрагидроизохинолина на стадии А, и соединения методики получения 2'' на стадии С.
Элементный микроанализ: (%, теоретическое значение: найдено)
%С=72.97:72.93; %Н=5.25:5.08; %N=7.29:7.34
Масс-спектрометрия высокого разрешения (ESI/FIA/HR и МС/МС):
Эмпирическая формула: C35H30ClN3O3
[М+Н]+ рассчитано: 576.2048
[М+Н]+ найдено: 576.2067
ФАРМАКОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
ПРИМЕР А: Ингибирование Bcl-2 с использованием методики поляризации флуоресценции
Исследования с использованием поляризации флуоресценции осуществляют на микропланшетах (384 луночных). Белок Bcl-2, меченый (histag-Bcl-2, такой что Bcl-2 соответствует UniProtKB®, первичный номер доступа: Р10415), в конечной концентрации 2.50×10-8 М, смешивают с флуоресцентным пептидом (Fluorescein-REIGAQLRRMADDLNAQY) в конечной концентрации 1.00×10-8 M в буферном растворе (Hepes 10 нМ, NaCl 150 нМ, Tween20 0.05%, pH 7.4), в присутствии или отсутствии возрастающих концентраций исследуемых соединений. После инкубирования в течение 2 часов, измеряют поляризацию флуоресценции.
Результаты выражены в IC50 (концентрация соединения, которая ингибирует поляризацию флуоресценции на 50%) и приведены в таблице 1 ниже.
Результаты показывают, что соединения настоящего изобретения ингибируют взаимодействие между белком Bcl-2 и флуоресцентным пептидом, описанным выше.
ПРИМЕР В: In vitro цитотоксичность
Исследования на цитотоксичность осуществляют на линии клеток лейкозной опухоли RS4;11.
Клетки распределяют на микропланшетах и подвергают воздействию исследуемых соединений в течение 48 часов. Жизнеспособность клеток затем определяют количественно путем колориметрического анализа, Microculture Tetrazolium Assay (Cancer Res., 1987, 47, 939-942).
Результаты выражены в IC50 (концентрация соединения, которая ингибирует жизнеспособность клеток на 50%) и приведены в таблице 1 ниже.
Результаты показывают, что соединения настоящего изобретения являются цитотоксичными.

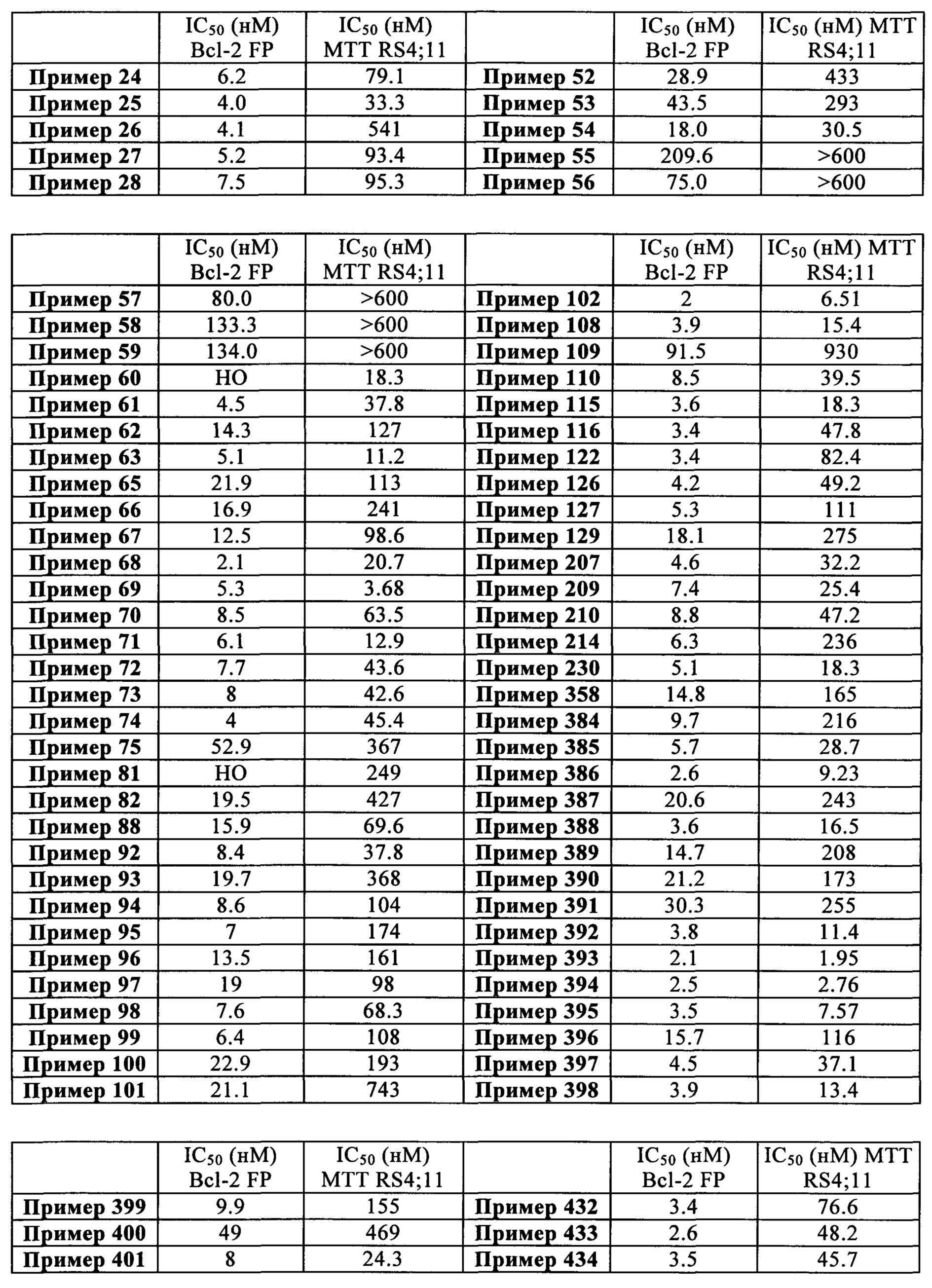

ПРИМЕР С: Индукция активности каспазы in vivo.
Способность соединений настоящего изобретения активировать каспазу 3 оценивают на ксенотрансплантатной модели лейкозных клеток RS4;11.
1×107 клеток RS4;11 трансплантируют под кожу иммуносупрессивным мышам (штамм SCID). Через 25-30 дней после трансплантации, животные перорально получают лечение различными соединениями. Через шестнадцать часов после введения, опухолевые массы извлекают и лизируют, и в опухолевых лизатах измеряют активность каспазы 3.
Ферментативное измерение осуществляют путем анализа появления флуоригенного продукта расщепления (DEVD-азная активность, Promega). Оно выражается в виде фактора активации, который равняется соотношению между двумя активностями каспазы: активности у мышей, получающих лечение, деленной на активность у контрольных мышей.
Полученные результаты показывают, что соединения настоящего изобретения способны индуцировать апоптоз in vivo в опухолевых клетках RS4;11.
ПРИМЕР D: Количественное определение расщепленной формы каспазы 3 in vivo
Способность соединений настоящего изобретения активировать каспазу 3 оценивают на ксенотрансплантатной модели лейкозных клеток RS4;11.
1×107 клеток RS4;11 трансплантируют под кожу иммуносупрессивным мышам (штамм SCID). Через 25-30 дней после трансплантации, животные перорально получают лечение различными соединениями. После лечения, опухолевые массы извлекают и лизируют, и количественно определяют расщепленную (активированную) форму каспазы 3 в опухолевых лизатах.
Количественное определение осуществляют с использованием исследования "Meso Scale Discovery (MSD) ELISA platform", которое предназначено для специфического оценивания расщепленной формы каспазы 3. Оно выражается в виде фактора активации, который равняется соотношению между количеством расщепленной каспазы 3 у мышей, получающих лечение, и количеством расщепленной каспазы 3 у контрольных мышей.
Результаты показывают, что соединения настоящего изобретения способны индуцировать апоптоз in vivo в опухолевых клетках RS4;11.

ПРИМЕР Е: Антиопухолевая активность in vivo
Антиопухолевую активность соединений настоящего изобретения оценивают на ксенотрансплантатной модели лейкозных клеток RS4;11.
1×107 клеток RS4;11 трансплантируют под кожу иммуносупрессивным мышам (штамм SCID). Через 25-30 дней после трансплантации, когда масса опухоли достигнет приблизительно 150 мм, мышей лечат перорально различными соединениями в двух различных режимах (ежедневное введение в течение пяти дней в неделю в течение двух недель, или два введения в неделю в течение двух недель). Массу опухоли измеряют дважды в неделю с начала лечения.
Полученные результаты, соответственно, показывают, что соединения настоящего изобретения способны индуцировать значительную регрессию опухоли, которая в течение периода лечения может быть полной.
ПРИМЕР F: Фармацевтическая композиция: Таблетки
1000 таблеток, содержащих соединение, выбранное из
Реферат
Изобретение относится к соединению формулы (I), обладающего ингибирующей активностью в отношении белков семейства Bcl-2. В формуле (I)Aпредставляет собой водород, (C-С)полигалогеналкильную группу или (C-С)алкильную группу, Aпредставляет собой водород, (C-С)полигалогеналкильную группу, (C-С)алкильную группу или циклоалкильную группу, Т представляет собой атом водорода, (С-С)алкильную группу, необязательно замещенную одним-тремя атомами галогена, группу (С-С)алкил-NRRили группу (С-С)алкил-OR, Rи Rкаждый независимо от другого представляет собой атом водорода или (С-С)алкильную группу, или Rи Rобразуют с атомом азота, несущим их, гетероциклоалкил, Rпредставляет собой (C-С)алкильную группу, циклоалкильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, где один или несколько атомов углерода предыдущих групп или их возможных заместителей могут быть дейтерированными, Rпредставляет собой арильную группу или гетероарильную группу, где один или несколько атомов углерода предыдущих групп или их возможных заместителей могут быть дейтерированными, Rпредставляет собой водород или атом галогена, Rпредставляет собой атом водорода или линейную или разветвленную (С-С)алкильную группу, R, R, Rи Rкаждый независимо от других представляет собой водород, линейный или разветвленный (С-С)алкил, атом галогена, линейную или разветвленную (С-С)алкоксигруппу, гидроксигруппу, R-CO-NH-(C-С)алкил-, R-SO-NH-(C-C)алкил-, R-NH-CO-NH-(C-C)алкил-, R-O-CO-NH-(С-С)алкил-, или заместители пары (R, R) образуют вместе с атомами углерода, несущими их, кольцо, состоящее из 5-6 кольцевых членов, которое может содержать от 1 до 2 атомов кислорода, Rпредставляет собой водород, линейный или разветвленный (C-С)алкил, арил или гетероарил.
Формула












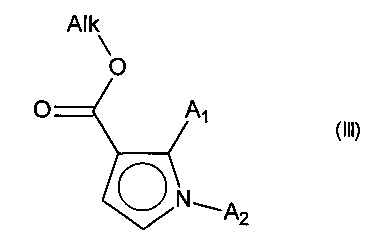

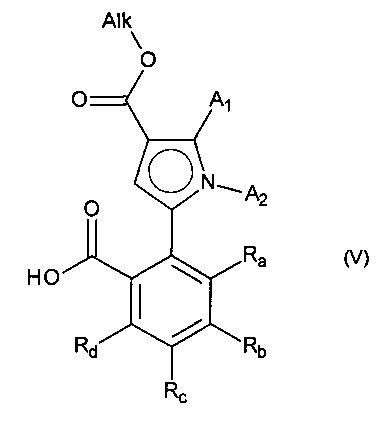


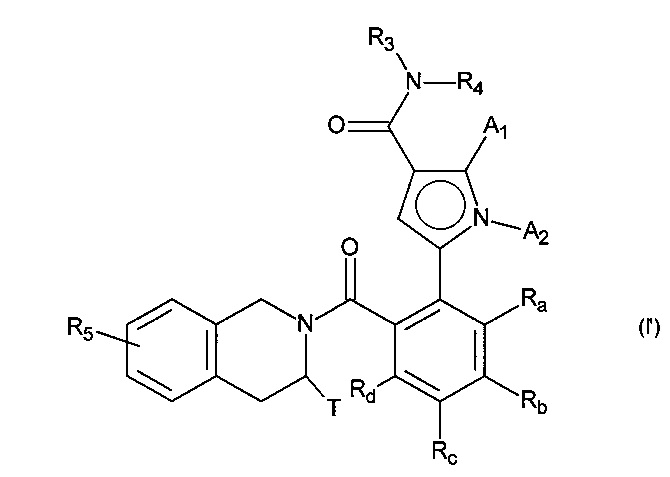


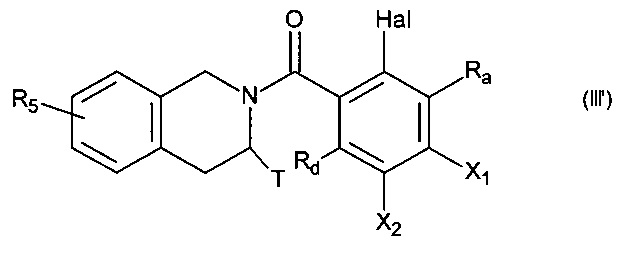


Документы, цитированные в отчёте о поиске
3,4-дигидро-1н-изохинолин-2-карбоновой кислоты 5-аминопиридин-2-2-иловые эфиры

Комментарии