Способ секвенирования полинуклеотида и устройство для его осуществления - RU2198221C2
Код документа: RU2198221C2
Чертежи





Описание
Изобретение касается способа определения последовательности полинуклеотида.
Предпосылки для изобретения
Возможность установления последовательности полинуклеотида имеет огромное научное значение. Например, проект "Геном человека" является амбициозным международным проектом, усилия которого
направлены на картирование и секвенирование трех миллиардов пар нуклеотидов, составляющих кодирующие сегменты молекул ДНК в геноме человека. По завершении этого проекта полученная в результате база
данных по нуклеотидным последовательностям станет не имеющим аналогов инструментом для биомедицинских исследований. Основной проблемой в успешном завершении данного проекта остается методология,
применяемая для нуклеотидного секвенирования.
В целом, принципиальным подходом для решения задачи крупномасштабного секвенирования ДНК является метод "терминации цепи", известный как "метод Сэйнджера". Этот метод впервые был разработан Сэйнджером и Коулсоном (Sanger et al. , 1977, Proc. Natl. Acad. Sci. USA, 74, 5463-5467): он направлен на использование дидезоксипроизводных четырех нуклеозидтрифосфатов, которые инкорпорируются в нарастающую полинуклеотидную цепочку в ходе полимеразной реакции. В результате такой инкорпорации дидезоксипроизводное останавливает ("терминирует") полимеразную реакцию, а полученные продукты затем разделяют методом гель-электрофореза и анализируют с целью определения позиции, по которой конкретное дидезоксипроизводное инкорпорировалось в данную полинуклеотидную цепь.
Хотя данный метод широко применяется и дает приемлемые результаты, ясно, что он является медленным, очень трудоемким и дорогостоящим.
Альтернативный способ секвенирования предложен в европейском патенте ЕР А-0-471732, который основан на использовании спектроскопического способа выявления инкорпорации нуклеотида в синтезируемую полинуклеотидную цепь, комплементарную мишени. Этот способ основан на формировании иммобилизованного комплекса матрицы и затравки, который подвергают воздействию потока, содержащего только один из различных нуклеотидов. Затем спектроскопические методики используются для измерения зависимого от времени сигнала, возникающего в ходе роста матрицы, катализируемом полимеразой. Спектроскопические методики, описанные к настоящему времени, - это спектроскопия резонанса плазмонов на поверхности (SPR), с помощью которой измеряют изменения в аналите (в анализируемой среде) в пределах быстро затухающих волновых полей, а также методики измерения флуоресценции. Однако данный способ характеризуется рядом ограничений: наиболее серьезным ограничением метода SPR является то, что по мере роста нуклеотидной цепи абсолютная величина сигнала также увеличивается вследствие перемещения цепи за пределы слабого волнового поля, что затрудняет определение величины прироста. Недостатки методик измерения флуоресценции связаны с увеличением уровня фоновых помех, обусловленных флуорофорами, инкорпорированными в состав растущей новосинтезируемой полинуклеотидной цепи. По мере роста цепи фоновый "шум" нарастает, соответственно должно увеличиваться и время, необходимое для выявления каждой инкорпорации нуклеотида. Это в существенной степени ограничивает применение данного способа для целей секвенирования крупных полинуклеотидов.
Таким образом, имеется необходимость в улучшенном способе установления последовательности полинуклеотида, который существенно увеличил бы скорость секвенирования полинуклеотида и который по преимуществу бил бы автоматизированным, что должно снизить сложность и затратность, характерные для методов, существующих в настоящее время.
Резюме изобретения
Настоящее изобретение базируется на реализации того факта, что измерение электромагнитного или какого-либо иного излучения
может быть использовано для выявления изменения конформации и (или) массы полимеразы, происходящего тогда, когда в новосинтезируемую полинуклеотидную цепочку встраивается нуклеотид.
В
соответствии с настоящим изобретением способ секвенирования полинуклеотида включает следующие этапы:
(1) реагирование полинуклеотида-мишени с иммобилизованной на твердую подложку полимеразой
и различными нуклеотидами в условиях, достаточных для прохождения полимеразной реакции, и
(2) выявление инкорпорации конкретного нуклеотида, комплементарного полинуклеотиду-мишени, путем
измерения излучения.
Воздействие излучения на какие-либо образцы используют в целом ряде методик, включая поверхностно-чувствительные методы детектирования, в которых изменение оптической реакции, отражения от оптически непрозрачной поверхности используется в качестве индикатора связеобразующих взаимодействий на этой поверхности. В предпочтительном варианте настоящего изобретения применяемой методикой является спектроскопия слабых волн, в частности спектроскопия резонанса плазмонов на поверхности (SPR).
В варианте настоящего изобретения нуклеотиды, используемые в данном способе, включают блокирующую группу по 3'-концу и необязательно по 5'-концу, которые предотвращают инкорпорацию нуклеотидов в состав полинуклеотидной цепи. Однако блокирующие группы могут быть избирательно удалены для того, чтобы открыть возможность инкорпорации. Путем использования заблокированных нуклеотидов возможным становится осуществление данного способа с использованием всех нуклеотидов, присутствующих в данной реакции в любой момент времени. Избирательное удаление блокирующих групп осуществляется таким образом, чтобы имелась возможность выявления каждого инкорпорированного нуклеотида. Следовательно, данный способ может осуществляться в режиме "реального времени", что обеспечит высокую скорость проведения секвенирования.
Описание чертежей
Настоящее изобретение будет описано примерами, в качестве которых выступают исключительно нижеследующие фигуры.
Фигура 1 схематически показывает процесс секвенирования полинуклеотидной последовательности с помощью SPR-спектроскопии.
Фигура 2 a,b,c показывает различные сигналы, выявляемые при полимеризации для каждого из различных нуклеотидов.
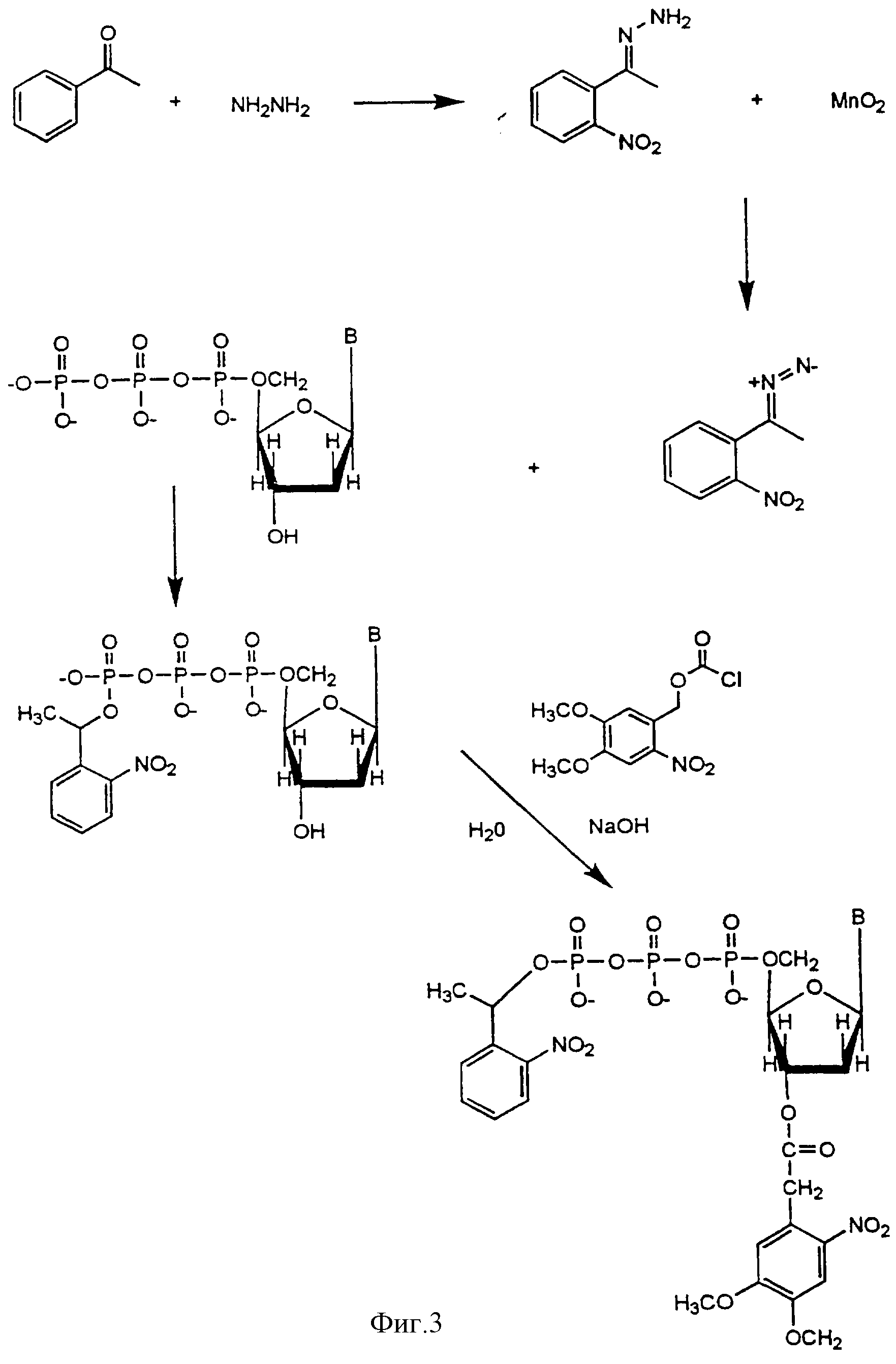
Фигура 3 показывает процедуру синтеза для дважды заблокированных нуклеотидов.
Описание изобретения
Представляемый способ секвенирования
полинуклеотида включает анализ кинетического взаимодействия между полимеразой, полинуклеотидом-мишенью и комплементарным нуклеотидом. Измерение кинетического взаимодействия осуществляется путем
мониторинга изменений параметров или поглощения электромагнитного или какого-либо иного излучения, которое имеет место тогда, когда проходит данная реакция.
По использованию в данном тексте термин "полинуклеотид" призван пониматься в широком смысле: он включает ДНК и РНК, включая модифицированные ДНК и РНК, а также другие гибридизующие молекулы, сходные с нуклеиновыми кислотами, например нуклеопротеины.
Обычно данный способ осуществляется путем применения электромагнитного излучения с включением методик спектроскопии резонанса плазмонов на поверхности или ядерно-магнитного резонанса. Однако могут применяться и другие методики, которые используются для измерения изменений в уровне излучения, например спектроскопия по полной внутренней ответной флуоресценции (TIRF), по ослаблению полного отражения (ATR), по частотному изменению полного отражения (FTR), по рассеянию полного отражения (STIR), угловая рефлектометрия по Брюстеру или эллипсометрия слабых волн.
Также могут быть рассмотрены методики, отличные от тех, в которых используется электромагнитное излучение, такие как фотохимические методики, базирующиеся на хемолюминесценции; гравиметрические методики, включающие резонансные системы на основе использования поверхностных акустических волн (SAW), или методики с использованием частотного микробаланса кварцевых кристаллов (QCM).
Спектроскопия резонанса плазмонов на поверхности (SPR) является предпочтительным методом; с ее помощью определяют свойства раствора путем установления различий по индексу отражения между основной частью объема раствора и зоной слабого маломощного излучения. Падающий монохроматический свет отражается под конкретным углом от оптически непрозрачной поверхности (сенсорный чип) на противоположную сторону, где находится анализируемый образец. Свет проникает внутрь образца на очень короткое расстояние и сильно изменяется в результате взаимодействия на поверхности.
Подходящие сенсорные чипы (датчики) хорошо известны в данной области техники. Обычно они состоят из оптически прозрачного материала, например стекла, и тонкой отражающей пленки, например серебряной или золотой. Для получения обзорной информации по методу SPR-спектроскопии см. европейскую патентную публикацию 0-648328 (она полностью включена в данный текст для сведения в виде библиографической ссылки).
Спектроскопия по ядерно-магнитонму резонансу (ЯМР) является другим предпочтительным методом: в этом методе измеряются магнитные свойства исследуемых соединений. Ядра элементов, входящих в состав таких соединений, становятся энергетически ориентированными за счет совместного воздействия магнитного поля и радиочастотного излучения. Когда энергия, воздействующая на ядро, равна разнице энергий спиновых состояний (разница между ориентацией, параллельной или антипараллельной по отношению к направлению применямых полей), то достигается состояние резонанса. Процессы поглощения и последующей эмиссии энергии, связанные со сменой одного спинового состояния на другое, выявляются с помощью радиочастотного приемника.
Важным аспектом способа по настоящему изобретению является применение полимеразного фермента (полимеразы), иммобилизованного на твердой подложке. Иммобилизация полимеразы обеспечивает ряд важных преимуществ в достижении успеха применения данного способа. Во-первых, в значительной степени снижена проблема белого "шума", связанная с заметным поглощением энергии растворенными молекулами. Во-вторых, проблема "шума", обусловливаемого взаимодействием любого субстрата (например, нуклеотидов), не вовлекающим напрямую полимеразу, снижается, поскольку полимераза может быть поддержана в пределах участка, конкретно установленного относительно общего поля измерений. Это особенно важно тогда, когда методика, используемая для измерения изменений параметров излучения, основывается на измерении параметров флуоресценции, например, в методе TIRF, когда фоновая флуоресценция возрастает в процессе удлинения синтезируемой цепи. Кроме того, при использовании метода SPR-спектроскопии, полимеразные реакции происходят в пределах полей распространения слабых волн, вследствие чего точные измерения могут быть выполнены вне зависимости от размера полинуклеотида. Наконец, поскольку ни полинуклеотид-мишень, ни олигонуклеотидная затравка не являются необратимым образом присоединенными в твердой подложке, то эта поверхность может быть легко обновлена, что позволит проводить последующее секвенирование с использованием той же самой иммобилизованной полимеразы.
Иммобилизация может быть осуществлена с использованием стандартных процедур, хорошо известных в данной области техники. В частности, может быть осуществлена иммобилизация с использованием стандартной процедуры аминового сочетания, в соответствии с чем осуществляется присоединение ассоциированных с лигандом аминов, например, к активированной декстраном или N-гидроксисукцинимидоэфиром поверхности. В предпочтительном варианте настоящего изобретения полимеразу иммобилизуют на поверхность сенсорного SPR-чипа, который обеспечивает пространственную близость полимеразы с чувствительной поверхностью, на которой могут быть измерены коэффициенты отражения. Примеры процедур, применяемых для иммобилизации биологических молекул на оптические датчики, можно найти в европейском патенте ЕР А 0-589867 и в статье Lofas et al., 1995, Biosens. Bioelectron., 10, 813-822.
Полимеразой, используемой в настоящем изобретении, может быть полимераза любого из известных типов. Например, этой полимеразой может быть любая ДНК-зависимая ДНК-полимераза. Если полинуклеотид-мишень является молекулой РНК, то такой полимеразой может быть РНК-зависимая ДНК-полимераза, т.е. обратная транскриптаза, или же РНК-зависимая РНК-полимераза, т.е. РНК-репликаза. В предпочтительном варианте настоящего изобретения полимеразой является полимераза Taq. В другом предпочтительном варианте настоящего изобретения полимеразой является голофермент полимеразы III E.coli (McHenry, 1988, Ann. Rev. Biochem. , 57, 519), полимераза Т7 (Schwager et al., 1989/1990, "Methods in Molecular & Cellular Biology", Vol. 1 [4], 155-159) или полимераза, кодируемая геном 5 фага Т7, в комплексе с тиоредоксином кишечной палочки (Tabor et al., 1987, J. Biol. Chem., 262, 1612-1623). Каждая из этих полимераз обеспечивает связывание с полинуклеотидом-мишенью, сообщая ему высокую подвижность, что тем самым обеспечивает поддержание комплекса "полинуклеотид-полимераза" даже тогда, когда активная реакция полимеризации и не происходит.
Голофермент пслимеразы III составлен тремя компонентами, которые в сочетании формируют активный фермент: (I) полимеразный кор, включающий α-субъединицу полимеразы; (II) димер β-субъединицы, который выполняет роль своеобразного "браслета", образующегося вокруг ДНК; и (III) подкомплекс, образуемый двумя субъединицами - τ и γ, роль которых связана со связыванием и гидролиза АТФ, с образованием β-димера вокруг ДНК.
На первом этапе процесса секвенирования полинуклеотид-мишень может быть проконтактирован c подходящей затравкой в гибридизационно-полимеризационном буфере. Обычно буфер должен иметь температуру, достаточно высокую для того, чтобы разрушить (или расплавить) любые вторичные структуры, которые могут иметься в полинуклеотиде-мишени. После охлаждения затравка претерпит отжиг на свой комплемент в составе мишени. Полученный образец затем может быть проконтактирован с иммобилизованной полимеразой с образованием комплекса "полинуклеотид-мишень/полимераза".
В одном из вариантов настоящего изобретения добавление нуклеотидов контролируется таким образом, чтобы различные нуклеотиды добавлялись к комплексу "полимераза/мишень" последовательно. Например, может быть добавлен и оставлен для протекания через комплекс "полимераза/полинуклеотид" нуклеотид дГТФ: любая произошедшая инкорпорация затем выявляется. Несвязанный дГТФ выходит из реактивного сайта и тогда же вносится следующий нуклеотид. Таким образом, выявление кинетического взаимодействия может быть связано с конкретным, присутствующим в данный момент нуклеотидом, соответственно может быть определена последовательность полинуклеотида.
Данный способ также может быть осуществлен с использованием всех имеющихся нуклеотидов. Для успешного осуществления такого варианта необходимым является внесение в нуклеотиды блокирующих (защитных) групп, по крайней мере, по 3'-положению, а предпочтительно по 3' и по 5'-положениям. Блокирующие группы могут быть светочувствительными и могут быть удалены путем обработки светом определенной длины волны с выходом активной молекулы. Если нуклеотиды несут блокирующие группы по обоим 3'- и 5'-положениям, то блокирующие группы должны быть различимы по своим спектральным характеристикам, т.е. должна иметься возможность избирательного удаления одной из блокирующих групп путем применения света конкретной длины волны, которая бы не приводила к удалению другой блокирующей группы. Также является желательным, чтобы расположенная по 3'-положению блокирующая группа нуждалась для своего удаления в более продолжительной обработке светом по сравнению с таковой характеристикой 5'-блокирующей группы. Это обеспечивает различение блокирующих групп как по спектральным свойствам, так и по временной характеристике.
В целом, светочувствительные блокирующие группы претерпевают протеолиз при длинах волн в пределах от 200 до 450 нм. Блокирующие группы обычно являются производными соединения формулы R1[O-СО-]Х, где R1 представлен фотолабильной группой, а Х является отщепляемой группой. Например, R1 является о-нитробензилом. Конкретными предпочтительными блокирующими группами являются о-нитробензильные защитные группы, описанные в международных патентных заявках WO A-92/10092 и WO A-97/39151. Эти группы включают нитровератрилоксикарбонил (NVOC), нитропиперонилоксикарбонил (NPOC), α-метилнитровератрилоксикарбонил (MeNVOC), α-метилнитропиперонилоксикарбонил (MeNPOC) и 1-пиренилметилоксикарбонил (PYMOC).
Подходящей 3'-блокирующей группой является (4/5-диметокси-2-нитро-бензил)оксикарбонильная группа, которая может быть получена в реакции нуклеотида с соединением формулы I
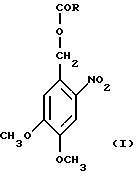
где R является любой подходящей этерифицирующей группой, например метилом. Эта блокирующая группа может быть избирательным образом удалена с помощью пульсирующего освещения при длине волны 360 нм.
Подходящей блокирующей группой по 5'-положению является
1-(2-нитрофенил)этиловая группа (II):

где R является любой подходящей функциональной группой, например галогеном. Эта блокирующая группа может быть избирательным образом удалена светом с длиной волны 260 нм.
В качестве примера дважды заблокированные нуклеотиды были внесены в затравочный полинуклеотид-мишень (поддерживаемый в характеризующемся высокой степенью гибкости комплексе с полимеразой), а монохроматическое освещение было сфокусировано выше сайта полимеразы и имело длину волны, достаточную для удаления блокирующей группы от концевого фосфата каждого нуклеотида. Затем нуклеотиды имели возможность протечь мимо связанной полимеразы: соответственно могло иметь место встраивание нуклеотида в растущую полинуклеотидную цепь. Однако в тех случаях, когда блокирующая группа по 3'-положению оставалась связанной, инкорпорировался только один нуклеотид. Тогда измерение кинетических параметров взаимодействия позволит получить информацию по конкретному нуклеотиду, встроившемуся в растущую цепь. Используемой полимеразой может быть высоколабильная полимераза, которая не диссоциируется из комплекса сразу после того, как реакция полимеризации останавливается. С другой стороны, может быть использован конкурентный ингибитор, который бы предотвращал диссоциацию полимеразы из мишени.
После определения встроившегося нуклеотида пульс монохроматического света фокусируют на блокирующей группе каталитического полимеразного сайта с целью удаления блокирующей группы по 3'-положению. Пульсация монохроматического света может быть более продолжительной по сравнению с требуемой для удаления 5'-блокирующей группы, в результате только ассоциированная с нуклеотидом блокирующая группа в полимеразном комплексе будет удалена. Это снижает вероятность добавления нуклеотидов, не связанных с полимеразным комплексом.
Как только блокирующая группа по 3'-положению удалена, полимеразная реакция может быть продолжена по мере появления следующих нуклеотидов в сайте полимеразной реакции. Неконтролируемая полимеризация предотвращается путем чередования пульсов, необходимых для удаления блокирующих групп.
Хотя предпочтительным является использование дважды заблокированных нуклеотидов (в соответствии с описанным выше), тем не менее данная процедура также может быть осуществлена с использованием нуклеотидов, характеризующихся наличием только 3'-блокирующей группы. В этом случае желательным является использование конкурентного ингибитора полимеразы, который бы снижал вероятность встраивания нуклеотида, лишенного блокирующей группы по 3'-положению, в состав растущей нуклеотидной цепи. Подходящим конкурентным ингибитором полимеразы является карбонилдифосфонат (COMDP).
Нижеследующий пример илюстрирует настоящее изобретение вкупе с прилагаемыми чертежами.
Пример
Нижеследующий анализ был проведен с применением модифицированной системы BIAcore (BIAcore АВ, Uppsala, Швеция), включающей сенсорный чип СМ5 (экспериментальный тип: BIAcore АВ) в качестве оптической
сенсорной поверхности. Аппаратура была оснащена интегрированным мкм-струйным картриджем (IFC), который позволял анализировать четыре камеры за одно внесение образца.
Получение
полимеразы
Голофермент полимеразы III E.coli был получен в соответствии с Millard et al. , 1995, Methods Enzymol., 262, 22) с использованием гидрофобной хроматографии взаимодействия на
валил-сефарозных колонках с целью очистки голофермента при высоких солевых концентрациях. После очистки голофермент концентрировали с использованием метода ионной фильтрации, описанного Киркгаардом с
соавт. (Kirkegaard et al., 1972, Anal. Biochem., 50, 122).
Иммобилизация полимеразы
Иммобилизацию полимеразы на поверхность сенсорного чипа осуществляли в соответствии с
Jonsson et al., 1991, Biotechniques, 11, 620-627. Вкратце, среду сенсорного чипа уравновешивали буфером HEPES (10 мМ HEPES, 150 мМ NaCl, 0,05% сурфактанта Р20 [BIAcore AB, Uppsala, Швеция], рН=7,4).
Равные объемы N-гидроксисукцинимида (0,1 М в воде) и N-этил-N'-(диметиламинопропил)карбодиимида (EDC) (0,1 М в воде) смешивали друг с другом и наносили на поверхность чипа СМ5 с целью активации
карбоксиметилированного декстрана. Частично собранный кор фрагмента полимеразы III (160 мкл, 500 ед.) смешивали с 10 мМ ацетата натрия (100 мкл, рН=5) и наносили на активированную поверхность. Наконец,
остаточные N-гидроксисукцинимидоэфиры, имеющиеся на поверхности сенсорного чипа, реагировали с этаноламином (35 мкл, 1 М в воде; рН=8,5) и смывали с поверхности несвязавшуюся полимеразу. Процедуру
иммобилизации осуществляли в непрерывном потоке буфера HEPES (5 мкл/мин) при температуре 25oС.
Олигонуклеотиды
Два олигонуклеотида были синтезированы с применением
стандартных методов фосфорамидитного синтеза. Олигонуклеотид, обозначенный как SEQ ID NО 1, был использован в качестве полинуклеотида-мишени, а олигонуклеотид, обозначенный как SEQ ID NO 2, был
использован в качестве затравки.
CAАGGAGAGGACGCTGTCTGTCGAAGGTAAGGAACGGACGAGAGAAGGGAGAG
(SEQ ID NO 1)
CTCTCCCTTCTCTCGTC
(SEQ ID NO 2)
Два
олигонуклеотида реагировали в необходимых для гибридизации условиях с образованием комплекса "мишень-затравка".
Затем подвергнутую праймингу ДНК суспендировали в буфере (20 мМ Трис-HCl, рН=7,5; 8 мМ МgСl2, 4% [объемные проценты] глицерина, 5 мМ дитиотреитола [DDT], 40 мкг бычьего сывороточного альбумина), содержащем 21 мкг связывающегося с одноцепочечной ДНК белка и частично собранную ДНК-полимеразу III, необходимые для образования структуры типа "браслета" (1,6 пкМ β-димера и 195 фМ γ-субъединицы). Также присутствовали 0,5 мМ АТФ наряду с 60 мкМ карбонилдифосфоната (COMDP). В этой реакции γ-субъединица действует как молекулярный "бикфордов шнур", гидролизуя АТФ, что обеспечивает размещение субъединиц β-димера вокруг ДНК с образованием частично собранной полимеразы (Studwell et al., 1990, UCLA Symp. Mol, Cell. Biol., New Series, 127, 153).
Комплекс, образованный подвергнутой праймингу ДНК и частично собранной полимеразой, затем наносили поверх полимеразы III на поверхности сенсорного чипа при скорости потока 5 мкм/мин и оставляли для обеспечения связывания полимеразы, опосредуемое через действие γ-субъединиц.
В этом эксперименте необходимыми для связывания полимеразы III с праймированной ДНК являются ионы магния и АТФ. Однако ионы магния также ускоряют удаление затравки за счет корректировки активности экзонуклеазы 5'-->3'. Эта проблема может быть решена путем включения карбонилдифосфоната, который является конкурентным ингибитором полимеразной активности (полимераза III, не имеющая активности экзонуклеазы 5'-->3', может быть использована для решения данной конкретной проблемы).
На поверхности чипа поддерживается непрерывный поток 60 мМ карбонилдифосфоната, целью чего является предотвращение экзонуклеазной активности по удалению в ее результате затравки от ДНК-мишени.
Инкорпорация нуклеотидов с двумя блокирующими группами.
Каждый нуклеотид (дЦТФ, дТТФ, дГТФ и дАТФ) включал 1-(2-нитрофенил)этиловую блокирующую группу по 5' положению и (4,5-диметокси-2-нитробензил) оксикарбонильную блокирующую группу по 3'-положению, что показано на фиг.3. Синтез дважды заблокированных нуклеотидов проводился следующим образом.
Стадия 1. Синтез (4, 5-диметоксинитробензил)-оксикарбонилнуклеозидтрифосфата.
Один и тот же подход был применен в отношении нуклеотидов дЦТФ, дТТФ, дГТФ и дАТФ. Смесь дАТФ-дигидрата (0,4 ммоль) и приблизительно 3 ммоль 4,5-диметокси-2-нитрофенилдиазометана, свежеприготовленного из 900 мг (4 ммоль) 4,5-диметокси-2-нитрофенилгидразона (синтезированного путем обработки 6-нитроверальдегида гидразинмоногидратом в хлороформе в соответствии с процедурой Wootton & Trentham, 1989, "Photochemical Probes in Biochem.", ed. P.E.Nielsen, NATO ASI Ser. C, Vol., 272, 277-296), перемешивали в 15 мл ДМСО при комнатной температуре в темноте в течение 40 часов. Контроль за ходом реакции с помощью тонкослойной хроматографии в смеси хлороформа и метанола (5: 1 - объемное соотношение) подтвердил появление пятна с Rf=0,54, что соответствует данному нуклеотиду. ДМСО, непрореагировавшее диазосоединение и продукты реакции с низким показателем полярности были удалены путем повторной экстракции в 60 мл эфира. Оставшийся материал, который помимо других соединений включал непрореагировавший нуклеотид и желаемый продукт, был растворен в минимальном количестве хлороформа и разделен методом тонкослойной хроматографии на силикагеле (3х30 см). С помощью элюции 100%-ным хлороформом и смесью метанола и хлороформа (95:5 - объемное соотношение) удаляли с колонки гидрофобные побочные продукты 4, 5-диметокси-2-нитрофенилдиазометана. Фракции высушивали с использованием роторного испарителя. Лиофилизации подвергали 78 мг собранного продукта. Общий выход составил 45%. дАТФ с 4, 5-диметилокси-2-нитробензилоксикарбонильной 3'-блокирующей группой выделяли напрямую из неочищенного продукта с высокой степенью чистоты с помощью препаративной ВЭЖХ с обращенной фазой.
Стадия 2. Добавление 5'-1-(2-нитрофенил)этиловой группы к 3'-4,5-диметокси-2-нитробензилоксикарбонила блокированного дАТФ.
Смесь 4,5-диметокси-2-нитробензилоксикарбонил-5'-дАТФ (0,4 ммоль) и приблизительно 3 ммоль 1-(2-нитрофенил)диазоэтана, свежеприготовленного из 716,7 мг (4 ммоль) гидразона 2-нитроацетофенона (синтезированного путем обработки 2-нитроацетофенона гидразинмоногидратом в этаноле) и 2,9 г (30 ммоль) МnО2 (90%) в 20 мл хлороформа в соответствии с процедурой, описанной ранее (Walker et al., 1989, Methods Enzymol., 172, 288-301), перемешивали в 15 мл ДМСО при комнатной температуре в темноте в течение 40 часов. Контроль за реакцией, осуществлявшийся с помощью ТСХ в системе хлороформ/ метанол (объемное соотношение 5:1), показал появление пары зон с величинами Rf=0,68 и Rf=0,58, соответствующих двух диастереоизомерам аксиальной и двум диастереоизомерам экваториальной форм 1-(2-нитрофенил)этилового эфира 4, 5-диметокси-2-нитробензилоксикарбонил-5'- дАТФ соответственно. ДМСО, непрореагировавшее диазосоединение и продукты реакции с низким показателем полярности были удалены путем повторной экстракции в 50 мл эфира.
Оставшийся материал, который помимо прочего включал непрореагировавший 4,5-диметокси-2-нитробензилоксикарбонил-5'- дATФ и искомый дважды заблокированный дАТФ, растворяли в минимальном количестве хлороформа и разделяли методом тонкослойной хроматографии на силикагелевой колонке размером 3х30 см. С помощью элюции 100%-ным хлороформом удаляли с этой колонки гидрофобные побочные продукты 1-(2-нитрофенил)диазоэтана. Полученный продукт высушивали в роторном испарителе. Лиофилизация позволила получить 74 мг итогового соединения. Общий выход составил 57%.
В полимеризационном буфере (1 мМ Трис-HC1 - рН=8,8; 5 мМ KCI, 0,15 мМ MgCl2, 0,01% желатина (весовые проценты)) присутствовало по 0,2 мМ каждого из нуклеотидов.
Секвенирование ДНК
На фиг. 1 показана SPR-система и проточная камера [7], оснащенная приспособлением для применения электромагнитного излучения [1] в сторону сенсорного чипа [2] с
иммобилизованной на его поверхности полимеразой [3], имеющим входное отверстие [4] для внесения нуклеотидов в камеру и два фокусирующих узла [5 и 6], предназначенные для подачи пульсов
монохроматического света в камеру.
Различные нуклеотиды вносили через проточную камеру при скорости протока в ней 30 мкл/мин при температуре 25oС и интенсивности сбора данных 10 Гц. По мере прохождения нуклеотидов мимо фокусирующего узла [5] осуществляется пульсация монохроматического света с длиной волны 260 нм, что имеет целью удаление блокирующей группы по 5'-положению. Затем нуклеотиды протекают по сенсорным чипам [2] и контактируют с комплексом, образованным полинуклеотидом-мишенью и полимеразой [3], который удерживается на месте за счет неполной сборки β-димера. Поскольку 3'-положение в затравочной последовательности свободно для реагирования, полимеризация может иметь место тогда, когда нуклеотид встраивается в свой комплемент на целевом полинуклеотиде. Это встраивание затем выявляется с помощью монохроматического р-поляризованного света SPR-устройства. Дальнейшая полимеризация уже невозможна, поскольку инкорпорировавшийся нуклеотид защищен по своему 3'-положению блокирующей группой. Затем через фокусирующий узел [6] осуществляют воздействие пульсами монохроматаческого света с длиной волны 360 нм по сайту реакции полимеризации. Высокая скорость потока в проточной камере обеспечивает удаление несвязавшихся полимеразой нуклеотидов из камеры до того, как будет накоплена достаточная энергия, которой бы хватило для удаления у них 3'-блокирующих групп.
Как только 3'-блокирующая группа удаляется из полимеризовавшегося нуклеотида, может происходить дальнейшая реакция полимеризации.
На фиг.2 показаны результаты экспериментального секвенирования, в котором каждый из встраивающихся в растущую полинуклеотидную цепь нуклеотидов был определен. Полученные результаты подтвердили, что полученная последовательность комплементарна той, которая показана в SEQ ID NO 1.
Список последовательностей приведен в конце описания.
Реферат
Изобретение относится к генной инженерии. Проводят реагирование полинуклеотида-мишени с иммобилизованной на твердую подложку полимеразой и различными нуклеотидами в условиях, достаточных для прохождения полимеразной реакции. Выявляют инкорпорации конкретного нуклеотида, комплементарного полинуклеотиду-мишени, путем измерения излучения. Подложка представляет собой сенсорный чип. Оба этапа могут проводить с каждым из различных нуклеотидов по очереди до того момента, как происходит выявление инкорпорации, с последующим повтором этих этапов. Первый этап могут проводить в присутствии всех нуклеотидов. Нуклеотиды могут включать 3'-блокирующую группу, которую удаляют после прохождения реакции полимеризации. Блокирующая группа может быть удалена воздействием пульсирующего монохроматического света. Первый этап может включать дополнительно внесение конкурентного ингибитора полимеразы. Полимеразой может быть ДНК-полимераза III из Е. coli или Taq-полимераза, или обратная транскриптаза. Излучение может быть электромагнитным и относиться к инфракрасной области спектра или относиться к спектру радиочастот. Устройство состоит из оптического сенсорного чипа, несущего иммобилизованную на нем полимеразу. Чип используется в резонансе плазмонов на поверхности или в ядерно-магнитном резонансе источника света. Устройство включает устройство считывания изображения и светочувствительный элемент. Изобретение позволяет ускорить секвенирование полинуклеотида, сделать его менее трудоемким и более дешевым. 2 с. и 20 з.п. ф-лы, 3 ил.

Формула
Документы, цитированные в отчёте о поиске
Способ иммобилизации водорастворимых биоорганических соединений на капиллярно-пористый носитель

Комментарии