Детекция нуклеиновокислотных последовательностей-мишеней в анализе с расщеплением и удлинением рто - RU2566562C2
Код документа: RU2566562C2
Чертежи































Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к детекции нуклеиновокислотной последовательности-мишени в анализе с PTOCE (расщеплением и удлинением PTO).
СВЕДЕНИЯ О РОДСТВЕННОМ УРОВНЕ ТЕХНИКИ
Гибридизация ДНК представляет собой фундаментальный процесс в молекулярной биологии, и на него влияют ионная сила, состав оснований, длина фрагмента, до которого укорочена нуклеиновая кислота, степень ошибочного спаривания и присутствие денатурирующих агентов. Основанные на гибридизации ДНК технологии были бы чрезвычайно полезным средством в определении конкретной нуклеиновокислотной последовательности и были бы, несомненно, необходимы в области клинической диагностики, генетических исследований и лабораторной судебно-медицинской экспертизы.
Однако, в традиционных методах и способах, основанных главным образом на гибридизации, с большой вероятностью получаются ложноположительные результаты вследствие неспецифической гибридизации между зондами и последовательностями, не являющимися мишенями. Ввиду этого, остаются проблемы, которые требуют разрешения с целью повышения надежности этих способов.
Помимо гибридизационных способов с использованием зондов были предложены различные подходы с использованием дополнительных ферментативных реакций, например, способ с применением TaqMan™-зондов.
В способе с применением TagMan™-зондов меченый зонд, гибридизованный с нуклеиновокислотной последовательностью-мишенью, расщепляется под действием 5'-нуклеазной активности ДНК-полимеразы, зависимой от располагающегося "вверх по течению" праймера, генерируя сигнал, указывающий на присутствие последовательности-мишени (патенты США №№5210015, 5538848 и 6326145). Согласно способу с применением TagMan™-зондов предлагается два подхода для генерации сигнала: зависимое от полимеризации расщепление и не зависимое от полимеризации расщепление. При зависимом от полимеризации расщеплении удлинение располагающегося "вверх по течению" праймера должно происходить до того, как полимераза нуклеиновых кислот встретится с 5'-концом меченого зонда. По мере продолжения реакции удлинения полимераза постепенно расщепляет 5'-конец меченого зонда. При не зависимом от полимеризации расщеплении располагающийся "вверх по течению" праймер и меченый зонд гибридизуются с нуклеиновокислотной последовательностью-мишенью в непосредственной близости, так что связывание полимеразы нуклеиновых кислот с 3'-концом располагающегося "вверх по течению" праймера приводит ее в контакт с 5'-концом меченого зонда, результатом чего является высвобождение метки. Кроме того, в способе с применением TaqMan™-зондов описывается, что меченый зонд, имеющий на своем 5'-конце 5'-хвостовой участок, не гибридизующийся с последовательностью-мишенью, также расщепляется с образованием фрагмента, содержащего данный 5'-хвостовой участок.
Сообщалось о некоторых способах, в которых зонд, имеющий 5'-хвостовой участок, некомлементарный последовательности-мишени, расщепляется под действием 5'-нуклеазы с высвобождением фрагмента, содержащего данный 5'-хвостовой участок.
Например, в патенте США №5691142 описывается расщепляемая структура, которая должна перевариваться под действием 5'-нуклеазной активности ДНК-полимеразы. Приводится пример данной расщепляемой структуры, в которой олигонуклеотид, содержащий 5'-участок, некомплементарный матрице, и 3'-участок, комплементарный матрице, гибридизуется с данной матрицей, и в непосредственной близости, с этой матрицей гибридизуется располагающийся "вверх по течению" олигонуклеотид. Такая расщепляемая структура расщепляется ДНК-полимеразой, обладающей 5'-нуклеазной активностью, или модифицированной ДНК-полимеразой со сниженной способностью к синтезу с высвобождением 5'-участка, некомплементарного данной матрице. Высвободившийся 5'-участок далее гибридизуется с олигонуклеотидом, имеющим шпилечную структуру с образованием расщепляемой структуры, индуцируя ввиду этого прогрессирующие реакции расщепления, необходимые для детекции последовательности-мишени.
В патенте США №7381532 описывается способ, в котором расщепляемая структура, содержащая располагающийся "вверх по течению" олигонуклеотид с блокированным 3'-концом, расщепляется ДНК-полимеразой, обладающей 5'-нуклеазной активностью, или нуклеазой FEN (флэп-эндонуклеазой; от англ. Flap EndoNuclease) с высвобождением некомплементарного 5'-концевого одноцепочечного "свисающего" участка (флэпа), и детекцию этого высвободившегося 5'-концевого "свисающего" участка осуществляют, используя анализ по размеру или систему двух взаимодействующих меток. В патенте США №6893819 описывается, что детектируемые высвободившиеся "свисающие" участки получаются в результате применения зависимого от синтеза нуклеиновой кислоты, флэп-опосредованного способа амплификации последовательностей. В этом способе высвободившийся из первой расщепляемой структуры "свисающий" участок опосредует зависимым от синтеза нуклеиновой кислоты образом расщепление второй расщепляемой структуры, что необходимо для высвобождения "свисающего" участка из второй расщепляемой структуры, и высвободившиеся "свисающие" участки детектируют.
Используя гибридизацию меченных флуоресцентной меткой зондов в жидкой фазе, можно осуществить одновременную детекцию множества нуклеиновокислотных последовательностей-мишеней с применением флуоресцентной метки даже одного типа путем анализа кривой плавления. Однако, традиционные технологии детекции последовательностей-мишеней с применением 5'-нуклеаза-опосредованного расщепления зондов, содержащих систему двух взаимодействующих меток, требуют наличия флуоресцентных меток различных типов для различных последовательностей-мишеней при детекции множественных мишеней, что ограничивает число детектируемых последовательностей-мишеней ввиду ограниченного количества типов флуоресцентных меток.
В публикации заявки на патент США 2008/0241838 описывается способ детекции мишени с использованием расщепления зонда, содержащего 5'-концевой участок, некомплементарный нуклеиновокислотной последовательности-мишени, и гибридизации зонда захвата. Метка расположена на некомплементарном 5'-концевом участке. Меченый зонд, гибридизованный с последовательностью-мишенью, расщепляется с высвобождением фрагмента, после чего этот фрагмент далее гибридизуется с зондом захвата для детекции присутствия последовательности-мишени. В этом способе необходимо, чтобы нерасщепленный/интактный зонд не гибридизовался с зондом захвата. Для этого зонд захвата, имеющий меньшую длину, должен быть иммобилизован на твердой подложке. Однако такое ограничение приводит к снижению эффективности гибридизации на твердой подложке, а также к затруднениям в оптимизации реакционных условий.
Таким образом, в данной области сохраняется давно назревшая необходимость в разработке новых подходов к детекции последовательности-мишени, предпочтительно множественных последовательностей-мишеней, в жидкой фазе и на твердой фазе, не только посредством гибридизации, но также с использованием ферментативных реакций, таких как 5'-нуклеолитическая реакция, более удобным, надежным и воспроизводимым образом. Кроме того, в данной области также существует необходимость в новом способе детекции мишени, не ограниченном количеством типов меток (в частности, флуоресцентными метками).
По всей этой заявке сделаны ссылки на различные патенты и публикации, и упоминания о них приведены в круглых скобках. Тем самым описание этих патентов и публикаций во всей своей полноте включено в эту заявку посредством ссылок с целью более полного описания данного изобретения и состояния области, к которой это изобретение имеет отношение.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения провели интенсивные исследования с целью разработки новых подходов для детекции последовательностей-мишеней, характеризующихся более высокой точностью и удобством, помимо прочего, в режиме множественной детекции. В результате авторы изобретения разработали новые протоколы для детекции последовательностей-мишеней, в которых детекция мишени осуществляется посредством гибридизации зонда, ферментативного расщепления зонда, удлинения и детекции удлиненного дуплекса. Протоколы по настоящему изобретению хорошо адаптированы как к реакциям в жидкой фазе, так и к реакциям на твердой фазе, и дают возможность осуществлять детекцию множественных последовательностей-мишеней с более высокой точностью и более удобно.
Соответственно, данным изобретением решается задача разработки способа детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO).
Другой задачей данного изобретения является разработка набора для детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO).
Другие задачи и преимущества настоящего изобретения станут очевидны из следующего далее подробного описания в сочетании с прилагаемой формулой изобретения и графическими материалами.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 схематически показаны структуры PTO (зондирующего и метящего олигонуклеотида (probing and tagging oligonucleotide)) и CTO (захватывающего и матричного олигонуклеотида (capturing and templating oligonucleotide)), использованных в анализе с расщеплением и удлинением PTO (PTOCE-анализе). Предпочтительно, чтобы 3'-концы PTO и CTO были блокированы, чтобы препятствовать их удлинению.
На Фиг.2 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке (templating portion).
На Фиг.3 схематически представлен РТОСЕ-анализ, включающий в себя анализ плавления. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке. Репортерная молекула необходима для того, чтобы демонстрировать различную интенсивность сигнала в зависимости от ее присутствия на одноцепочечной форме или двухцепочечной форме.
На Фиг.4 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. CTO содержит остаток изо-dC (изодезоксицитозина) и репортерную молекулу на своем матричном участке. Структура гаситель-изо-dGTP (дезоксигуанозин-трифосфат) встраивается в удлиненный дуплекс во время реакции удлинения.
На Фиг.5 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке (5'-tagging portion), а СТО содержит остаток изо-dC на своем матричном участке. Структура гаситель-изо-dGTP встраивается в удлиненный дуплекс во время реакции удлинения.
На Фиг.6 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. PTO содержит репортерную молекулу и молекулу-гаситель на своем 5'-концевом метящем участке.
На Фиг.7 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке. Репортерная молекула необходима для того, чтобы демонстрировать различную интенсивность сигнала в зависимости от ее присутствия на одноцепочечной форме или двухцепочечной форме.
На Фиг.8 схематически представлен PTOCE-анализ, включающий в себя анализ плавления. PTO содержит молекулу-гаситель на своем 5'-концевом метящем участке, а CTO содержит репортерную молекулу на своем захватывающем участке (capturing portion).
На Фиг.9 схематически представлен PTOCE-анализ, включающий в себя детекцию при предварительно заданной температуре. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке. CTO иммобилизован на твердой подложке через свой 3'-конец.
На Фиг.10 схематически представлен PTOCE-анализ, включающий в себя детекцию при предварительно заданной температуре. Меченный репортерной молекулой dATP (дезоксиаденозин-трифосфат) встраивается в удлиненный дуплекс во время реакции удлинения. CTO иммобилизован на твердой подложке через свой 3'-конец.
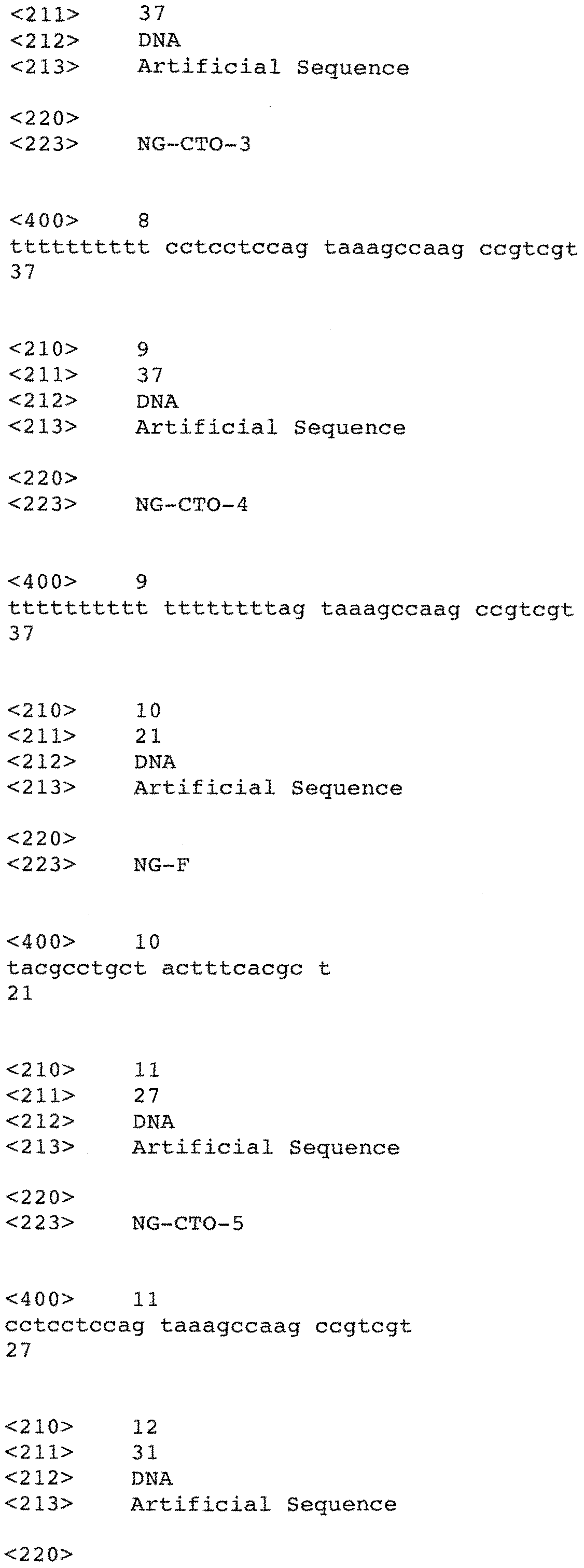
На Фиг.11 схематически представлен PTOCE-анализ, включающий в себя детекцию при предварительно заданной температуре. CTO содержит остаток изо-dC на своем матричном участке, а структура репортер-изо-dGTP встраивается в удлиненный дуплекс во время реакции удлинения. СТО иммобилизован на твердой подложке через свой 3'-конец.
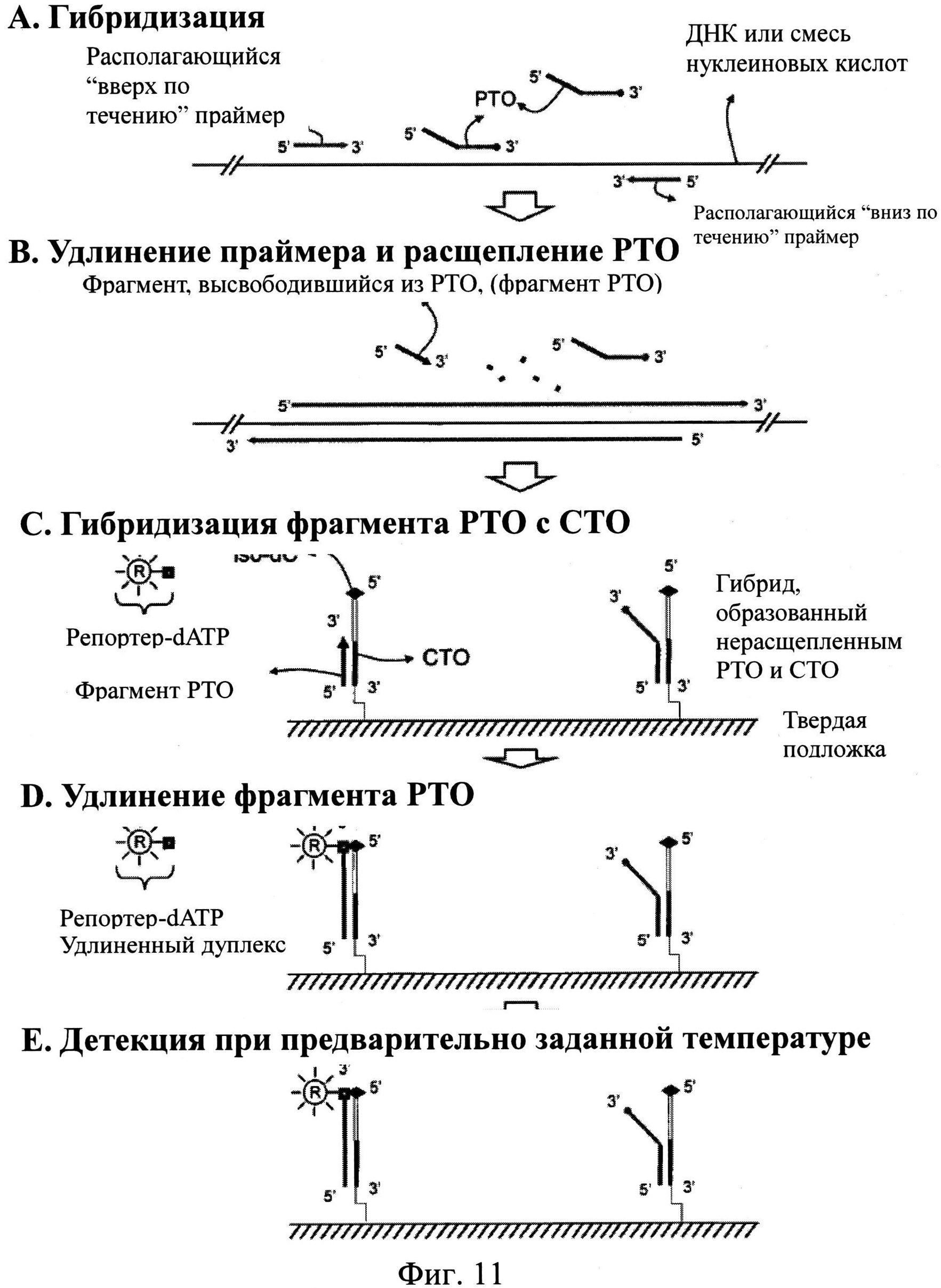
На Фиг.12 схематически представлен PTOCE-анализ, включающий в себя детекцию при предварительно заданной температуре. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке. CTO иммобилизован на твердой подложке через свой 5'-конец.
На Фиг.13 схематически представлен PTOCE-анализ, включающий в себя детекцию при предварительно заданной температуре с использованием интеркалирующего красителя. CTO иммобилизован на твердой подложке через свой 5'-конец.
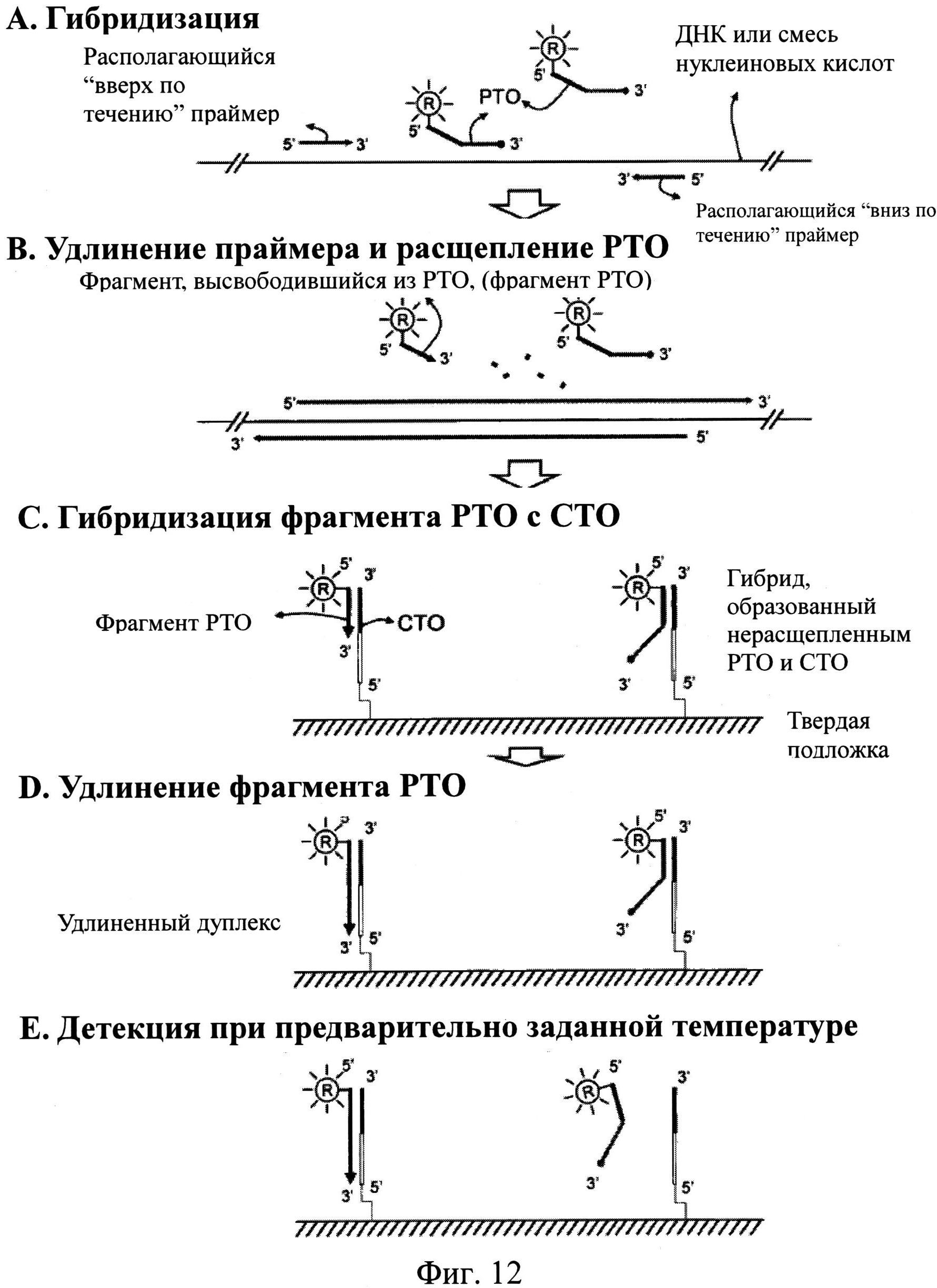
На Фиг.14 показаны результаты детекции гена Neisseria gonorrhoeae с использованием PTOCE-анализа, включающего анализ плавления. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке.
На Фиг.15 показаны результаты детекции гена Neisseria gonorrhoeae с использованием PTOCE-анализа, включающего анализ плавления. PTO содержит молекулу-гаситель на своем 5'-конце, а CTO содержит репортерную молекулу на своем 3'-конце.
На Фиг.16 показаны результаты, свидетельствующие о том, что величины Tпл для удлиненных дуплексов согласуются с последовательностями CTO.
На Фиг.17 показаны результаты детекции гена Neisseria gonorrhoeae посредством PTOCE-анализа с использованием ПЦР-амплификации. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке. На Фиг.17A показаны результаты PTOCE-анализа, включающего детекцию с использованием ПЦР в режиме реального времени, а на Фиг.17B показаны результаты PTOCE-анализа, включающего анализ плавления после проведения ПЦР.
На Фиг.18 показаны результаты детекции гена Neisseria gonorrhoeae посредством PTOCE-анализа с использованием ПЦР-амплификации. CTO содержит остаток изо-dC и репортерную молекулу на своем 5'-конце. Структура гаситель-изо-dGTP встраивается в удлиненный дуплекс во время реакции удлинения. На Фиг.18A показаны результаты PTOCE-анализа, включающего детекцию с использованием ПЦР в режиме реального времени, а на Фиг.18B показаны результаты PTOCE-анализа, включающего анализ плавления после проведения ПЦР.
На Фиг.19 показаны результаты детекции гена Neisseria gonorrhoeae посредством PTOCE-анализа с использованием ПЦР-амплификации. PTO содержит молекулу-гаситель на своем 5'-конце, а CTO содержит репортерную молекулу на своем 3'-конце. На Фиг.19A показаны результаты PTOCE-анализа, включающего детекцию с использованием ПЦР в режиме реального времени, а на Фиг.19B показаны результаты PTOCE-анализа, включающего анализ плавления после проведения ПЦР.
На Фиг.20 показаны результаты одновременной детекции гена Neisseria gonorrhoeae (NG) и гена Staphylococcus aureus (SA) с использованием PTOCE-анализа, включающего анализ плавления после проведения ПЦР. CTO содержит репортерную молекулу и молекулу-гаситель на своем матричном участке.
На Фиг.21 показаны результаты детекции гена Neisseria gonorrhoeae с использованием PTOCE-анализа, включающего анализ плавления на микрочипе. CTO иммобилизован через свой 5'-конец. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке.
На Фиг.22 показаны результаты детекции гена Neisseria gonorrhoeae с использованием PTOCE-анализа, включающего детекцию в режиме реального времени при предварительно заданной температуре на микрочипе. CTO иммобилизован через свой 5'-конец. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке.
На Фиг.23 показаны результаты детекции гена Neisseria gonorrhoeae с использованием PTOCE-анализа, включающего детекцию в режиме реального времени при предварительно заданной температуре на микрочипе. CTO иммобилизован через свой 3'-конец и содержит репортерную молекулу и молекулу-гаситель на своем матричном участке.
На Фиг.24 показаны результаты детекции одной мишени и множественных мишеней с использованием PTOCE-анализа, включающего детекцию в режиме конечной точки при предварительно заданной температуре на микрочипе. CTO иммобилизован через свой 5'-конец. PTO содержит репортерную молекулу на своем 5'-концевом метящем участке. В качестве нуклеиновокислотных последовательностей-мишеней использовали ген Neisseria gonorrhoeae (NG) и ген Staphylococcus aureus (SA).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому способу детекции нуклеиновокислотной последовательности-мишени в анализе с PTOCE (расщеплением и удлинением PTO) и набору для детекции нуклеиновокислотной последовательности-мишени в PTOCE-анализе.
Настоящее изобретение включает не только реакции гибридизации, но также и ферментативные реакции, протекание которых зависит от присутствия нуклеиновокислотной последовательности-мишени.
I. Способ детекции мишени в PTOCE-анализе, включающем в себя анализ плавления
В одном из аспектов настоящего изобретения предложен способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO), включающий:
(a) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и PTO (зондирующим и метящим олигонуклеотидом); при этом располагающийся "вверх по течению" олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; PTO содержит (1) 3'-концевой узнающий мишень участок (S'-targeting portion), содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно PTO;
(b) приведение в контакт продукта со стадии (a) с ферментом, обладающим S'-нуклеазной активностью, в условиях, подходящих для расщепления PTO; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO;
(c) гибридизацию фрагмента, высвободившегося из PTO, с CTO (захватывающим и матричным олигонуклеотидом); при этом CTO содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO; при этом фрагмент, высвободившийся из PTO, гибридизуется с захватывающим участком CTO;
(d) осуществление реакции удлинения с использованием продукта со стадии (c) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком CTO, удлиняется, и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Tпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной CTO либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной CTO;
(e) плавление удлиненного дуплекса в диапазоне температур с получением сигнала от мишени (target signal), указывающего на присутствие удлиненного дуплекса; при этом сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или CTO, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, или (4) интеркалирующей метки; и
(f) детекцию удлиненного дуплекса путем измерения сигнала от мишени; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
Авторы настоящего изобретения провели интенсивные исследования с целью разработки новых подходов для детекции последовательностей-мишеней, характеризующихся более высокой точностью и удобством, помимо прочего, в режиме множественной детекции. В результате авторы изобретения разработали новые протоколы для детекции последовательностей-мишеней, в которых детекция мишени осуществляется посредством гибридизации зонда, ферментативного расщепления зонда, удлинения и детекции удлиненного дуплекса. Протоколы по настоящему изобретению хорошо адаптированы как к реакциям в жидкой фазе, так и к реакциям на твердой фазе, и дают возможность осуществлять детекцию множественных последовательностей-мишеней с более высокой точностью и более удобно.
В настоящем изобретении реализуются поочередные события в такой последовательности: гибридизация зонда; расщепление PTO (зондирующего и метящего олигонуклеотида) и удлинение; образование мишень-зависимого удлиненного дуплекса; и детекция удлиненного дуплекса. Поэтому способ называется анализом PTOCE (с расщеплением и удлинением PTO).
В настоящем изобретении удлиненный дуплекс характеризуется присутствием метки(меток), обеспечивающей(их) получение сигнала, указывающего на присутствие удлиненного дуплекса, в результате анализа плавления или детекции при предварительно заданной температуре. При этом данный удлиненный дуплекс характеризуется регулируемой величиной Tпл, что играет решающую роль при детекции множественных мишеней или для того, чтобы провести отличие от сигнала, не относящегося к мишени (non-target signal).
Поскольку удлиненный дуплекс образуется только тогда, когда имеется нуклеиновая кислота-мишень, присутствие удлиненного дуплекса указывает на присутствие этой нуклеиновой кислоты-мишени.
PTOCE-анализ, включающий в себя анализ плавления, далее будет описан более подробно.
Стадия (а). Гибридизация располагающегося "вверх по течению" олигонуклеотида и PTO с нуклеиновокислотной последовательностью-мишенью
Согласно настоящему изобретению нуклеиновокислотная последовательность-мишень первоначально гибридизуется с располагающимся "вверх по течению" олигонуклеотидом и PTO (зондирующим и метящим олигонуклеотидом).
Используемый в данном описании термин "нуклеиновая кислота-мишень", "нуклеиновокислотная последовательность-мишень" или "последовательность-мишень" относится к представляющей интерес для детекции нуклеиновокислотной последовательности, на которой отжигают праймер, либо которую гибридизуют с праймером в условиях гибридизации, отжига или амплификации.
Используемый в данном описании термин "зонд" относится к молекуле одноцепочечной нуклеиновой кислоты, содержащей участок или участки, по существу комплементарный(ые) нуклеиновокислотной последовательности-мишени.
Термин "праймер", как он использован в данном описании, относится к олигонуклеотиду, который способен действовать в качестве точки инициации синтеза в случае его помещения в условия, при которых индуцируется синтез продукта удлинения праймера, комплементарного цепи нуклеиновой кислоты (матрице), то есть, в присутствии нуклеотидов и агента для полимеризации, такого как ДНК-полимераза, и при подходящих значениях температуры и pH.
Предпочтительно, чтобы зонд и праймер представляли собой молекулы одноцепочечных дезоксирибонуклеотидов. Зонды и праймеры, используемые в данном изобретении, могут содержать природный dNMP (дезоксинуклеозид-монофосфат) (то есть dAMP (дезоксиаденозин-монофосфат), dGMP (дезоксигуанозин-монофосфат), dCMP (дезоксицитидин-монофосфат) и dTMP (дезокситимидин-монофосфат)), модифицированный нуклеотид или неприродный нуклеотид. Зонды и праймеры также могут включать рибонуклеотиды.
Праймер должен иметь достаточную длину, чтобы праймировать синтез продуктов удлинения в присутствии агента для полимеризации. Точная длина праймеров будет зависеть от многих факторов, включая температуру, способ применения и источник праймера. Термин "отжиг" или "праймирование", как он использован в данном описании, относится к присоединению олигодезоксинуклеотида или нуклеиновой кислоты к являющейся матрицей нуклеиновой кислоте, при этом данное присоединение позволяет полимеразе осуществлять полимеризацию нуклеотидов с образованием молекулы нуклеиновой кислоты, которая является комплементарной к являющейся матрицей нуклеиновой кислоте или ее части.
Термин "гибридизация", используемый в данном описании, относится к образованию двухцепочечной нуклеиновой кислоты из комплементарных одноцепочечных нуклеиновых кислот. Гибридизация может осуществляться между двумя цепями нуклеиновой кислоты, полностью спаренными или по существу спаренными с некоторым числом ошибочных спариваний. Комплементарность, необходимая для гибридизации, может зависеть от условий гибридизации, в частности от температуры.
Гибридизация нуклеиновокислотной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и PTO может быть осуществлена в подходящих условиях гибридизации, определенных в установленном порядке путем оптимизации методик. Такие условия, как температура, концентрация компонентов, продолжительность гибридизации и промывки, компоненты буферов, их pH и ионная сила, могут быть изменены в зависимости от различных факторов, включая длину и GC-состав олигонуклеотида (располагающегося "вверх по течению" олигонуклеотида и PTO) и нуклеотидной последовательности-мишени. Например, когда используется относительно короткий олигонуклеотид, предпочтительно, чтобы были приняты условия низкой жесткости. Подробные условия гибридизации можно найти в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001); и M.L.M. Anderson, Nucleic Acid Hybridization, Springer-Verlag New York Inc. N.Y. (1999).
He предполагается различия между терминами "отжиг" и "гибридизация", и эти термины будут использованы взаимозаменяемо.
Располагающийся "вверх по течению" олигонуклеотид и PTO содержат гибридизующиеся нуклеотидные последовательности, комплементарные нуклеиновокислотной последовательности-мишени. Термин "комплементарный" используется в данном описании для указания на то, что праймеры или зонды являются в достаточной степени комплементарными, чтобы селективно гибридизоваться с нуклеиновокислотной последовательностью-мишенью в намеченных условиях отжига или в жестких условиях, охватывая термины "по существу комплементарный" и "полностью комплементарный", предпочтительно "полностью комплементарный".
5'-Концевой метящий участок PTO имеет нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени. Матричный участок CTO (захватывающего и матричного олигонуклеотида) имеет нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO. Термин "некомплементарный" используется в данном описании для указания на то, что праймеры или зонды являются в достаточной степени некомплементарными, чтобы селективно гибридизоваться с нуклеиновокислотной последовательностью-мишенью в намеченных условиях отжига или в жестких условиях, охватывая термины "по существу некомплементарный" и "полностью некомплементарный", предпочтительно "полностью некомплементарный".
Используемый в данном описании термин "PTO (зондирующий и метящий олигонуклеотид)" означает олигонуклеотид, содержащий (1) S'-концевой узнающий мишень участок, служащий в качестве зонда, и (2) 5'-концевой метящий участок с нуклеотидной последовательностью, некомплементарной нуклеиновокислотной последовательности-мишени, который высвобождается в результате нуклеолитической реакции из PTO после гибридизации с нуклеиновокислотной последовательностью-мишенью. 5'-концевой метящий участок и 3'-концевой узнающий мишень участок в PTO должны располагаться в направлении 5'→3'. PTO схематически показан на Фиг.1.
Гибридизацию на стадии (a) предпочтительно проводят в жестких условиях, так что 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью.
Для PTO не предусматривается какой-либо конкретной длины. Например, длина PTO может составлять 15-150 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 20-150 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-60 нуклеотидов, 20-50 нуклеотидов, 30-150 нуклеотидов, 30-100 нуклеотидов, 30-80 нуклеотидов, 30-60 нуклеотидов, 30-50 нуклеотидов, 35-100 нуклеотидов, 35-80 нуклеотидов, 35-60 нуклеотидов или 35-50 нуклеотидов. 3'-концевой узнающий мишень участок PTO может быть любой длины при условии, что он специфически гибридизуется с нуклеиновокислотными последовательностями-мишенями. Например, длина 3'-концевого узнающего мишень участка PTO может составлять 10-100 нуклеотидов, 10-80 нуклеотидов, 10-50 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-50 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-50 нуклеотидов, 20-40 нуклеотидов или 20-30 нуклеотидов. 5'-концевой метящий участок может быть любой длины при условии, что он специфически гибридизуется с матричным участком CTO и далее удлиняется. Например, длина 5'-концевого метящего участка PTO может составлять 5-50 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 5-20 нуклеотидов, 10-50 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 10-20 нуклеотидов, 15-50 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов или 15-20 нуклеотидов.
На 3'-конце PTO может находиться группа 3'-OH. Предпочтительно, 3'-конец PTO "блокирован", чтобы не допустить его удлинения.
Блокирование может быть достигнуто традиционными методами. Например, блокирование можно осуществить путем добавления к 3'-гидроксильной группе последнего нуклеотида химической группировки, такой как биотин, метка, фосфатная группа, алкильная группа, ненуклеотидный линкер, фосфоротионат или алкандиол. Альтернативно, блокирование может быть выполнено посредством удаления 3'-гидроксильной группы последнего нуклеотида или путем использования нуклеотида, лишенного 3'-гидроксильной группы, такого как дидезоксинуклеотид.
Альтернативно, PTO может быть сконструирован так, чтобы принимать шпилечную структуру.
Отсутствие гибридизации между 5'-концевым метящим участком PTO и нуклеиновокислотной последовательностью-мишенью означает отсутствие образования из них стабильной двухцепочечной структуры в определенных условиях гибридизации. Согласно предпочтительному воплощению 5'-концевой метящий участок PTO, не вовлеченный в гибридизацию с нуклеиновокислотной последовательностью-мишенью, образует одноцепочечную структуру.
Располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно PTO.
Помимо этого, располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь, гибридизованная с нуклеиновокислотной последовательностью-мишенью, индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью.
Индукция расщепления PTO при посредстве располагающегося "вверх по течению" олигонуклеотида может протекать двумя путями: (1) как индукция расщепления, не зависимая от удлинения располагающегося "вверх по течению" олигонуклеотида; и (2) как индукция расщепления, зависимая от удлинения располагающегося "вверх по течению" олигонуклеотида.
В том случае, когда располагающийся "вверх по течению" олигонуклеотид локализован достаточно близко от PTO, чтобы индуцировать расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, фермент, связавшийся с располагающимся "вверх по течению" олигонуклеотидом, расщепляет PTO без реакции удлинения. В отличие от этого, когда располагающийся "вверх по течению" олигонуклеотид локализован в отдалении от PTO, фермент, обладающий полимеразной активностью, (например, матричная полимераза) катализирует удлинение располагающегося "вверх по течению" олигонуклеотида (например, располагающегося "вверх по течению" праймера), а фермент, обладающий 5'-нуклеазной активностью, связавшийся с удлиненным продуктом, расщепляет PTO.
Следовательно, располагающийся "вверх по течению" олигонуклеотид может быть локализован относительно PTO двумя способами. Располагающийся "вверх по течению" олигонуклеотид может быть локализован достаточно близко от PTO, чтобы индуцировать расщепление PTO не зависимым от удлинения образом. Альтернативно, располагающийся "вверх по течению" олигонуклеотид может быть локализован достаточно далеко от PTO, чтобы индуцировать расщепление PTO зависимым от удлинения образом.
Используемый в данном описании термин "близлежащий" в отношении расположений или локализаций означает, что располагающийся "вверх по течению" олигонуклеотид локализован вблизи 3'-концевого узнающего мишень участка PTO с образованием "ника" (одноцепочечного разрыва). Кроме того, этот термин означает, что располагающийся "вверх по течению" олигонуклеотид локализован на расстоянии 1-30 нуклеотидов, 1-20 нуклеотидов или 1-15 нуклеотидов от 3'-концевого узнающего мишень участка PTO.
Используемый в данном описании термин "отдаленный" в отношении расположений или локализаций, включает в себя любые расположения или локализации, достаточные для обеспечения протекания реакций удлинения.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид локализован на достаточном отдалении от PTO, чтобы индуцировать расщепление PTO зависимым от удлинения образом.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид представляет собой располагающийся "вверх по течению" праймер или располагающийся "вверх по течению" зонд. Располагающийся "вверх по течению" праймер подходит для индукции не зависимого от удлинения расщепления или для индукции зависимого от удлинения расщепления, а располагающийся "вверх по течению" зонд подходит для индукции не зависимого от удлинения расщепления.
Альтернативно, располагающийся "вверх по течению" олигонуклеотид может иметь последовательность, частично перекрывающуюся с 5'-концевой частью 3'-концевого узнающего мишень участка PTO. Предпочтительно, чтобы длина перекрывающейся последовательности составляла 1-10 нуклеотидов, более предпочтительно 1-5 нуклеотидов, еще более предпочтительно 1-3 нуклеотида. В том случае, когда располагающийся "вверх по течению" олигонуклеотид имеет последовательность, частично перекрывающуюся с 5'-концевой частью 3'-концевого узнающего мишень участка PTO, этот 3'-концевой узнающий мишень участок частично переваривается вместе с 5'-концевым метящим участком в реакции расщепления на стадии (b). Помимо этого, присутствие перекрывающейся последовательности позволяет расщеплять желаемый сайт 3'-концевого узнающего мишень участка.
Согласно предпочтительному воплощению располагающийся "вверх по течению" праймер индуцирует посредством своей удлиненной цепи расщепление PTO ферментом, обладающим 5'-нуклеазной активностью.
В настоящем изобретении могут быть применены традиционные технологии для реакций расщепления с использованием располагающихся "вверх по течению" олигонуклеотидов при условии, что располагающийся "вверх по течению" олигонуклеотид индуцирует расщепление PTO, гибридизованного с нуклеиновокислотной последовательностью-мишенью с высвобождением фрагмента, содержащего 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO. Например, в настоящем изобретении могут быть применены патенты США №№5210015, 5487972, 5691142, 5994069 и 7381532 и публикация заявки на патент США №2008/0241838.
Согласно предпочтительному воплощению выполнение данного способа осуществляют в присутствии располагающегося "вниз по течению" праймера. Располагающийся "вниз по течению" праймер дополнительно генерирует нуклеиновокислотную последовательность-мишень, которая будет гибридизоваться с PTO, повышая чувствительность детекции мишени.
Согласно предпочтительному воплощению, когда используют располагающийся "вверх по течению" праймер и располагающийся "вниз по течению" праймер, дополнительно для удлинения этих праймеров применяют матричную полимеразу нуклеиновых кислот.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид (располагающийся "вверх по течению" праймер или располагающийся "вверх по течению" зонд), располагающийся "вниз по течению" праймер и/или 5'-концевой метящий участок PTO имеют структуру олигонуклеотида с двойным праймированием (DPO), разработанную авторами настоящего изобретения. Олигонуклеотиды, имеющие структуру DPO, демонстрируют значительно улучшенную специфичность к мишени по сравнению с традиционными праймерами и зондами (см. WO 2006/095981; Chun et. al., Dual priming oligonucleotide system for the multiplex detection of respiratory viruses and SNP genotyping of CYP2C19 gene, Nucleic Acid Research, 35: 6e40 (2007)).
Согласно предпочтительному воплощению 3'-концевой узнающий мишень участок PTO имеет структуру модифицированного олигонуклеотида с двойной специфичностью (mDSO), разработанную авторами настоящего изобретения. Модифицированный олигонуклеотид с двойной специфичностью (mDSO) демонстрирует значительно улучшенную специфичность к мишени по сравнению с традиционными зондами (см. WO 2011/028041).
Стадия (b). Высвобождение фрагмента из PTO
Далее, продукт со стадии (a) приводят в контакт с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления PTO. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается ферментом, обладающим 5'-нуклеазной активностью, высвобождая фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO.
Используемый в данном описании термин "условия для расщепления PTO" означает условия, достаточные для переваривания PTO, гибридизованного с нуклеиновокислотной последовательностью-мишенью, ферментом, обладающим 5'-нуклеазной активностью, такие как температура, pH, ионная сила, буфер, длина и последовательность олигонуклеотидов и ферменты. Например, когда в качестве фермента, обладающего 5'-нуклеазной активностью, используют Taq ДНК-полимеразу, условия для расщепления PTO включают трис-HCl буфер, KCl, MgCl2 и температуру.
Когда PTO гибридизуется с нуклеиновокислотной последовательностью-мишенью, его 3'-концевой узнающий мишень участок вовлечен в гибридизацию, а 5'-концевой метящий участок образует одноцепочечную структуру без гибридизации с нуклеиновокислотной последовательностью-мишенью (см. Фиг.2). По существу, олигонуклеотид, содержащий как одноцепочечную, так и двухцепочечную структуры, может быть переварен с использованием фермента, обладающего 5'-нуклеазной активностью, с применением разнообразных технологий, известных специалисту в данной области.
Сайты расщепления PTO варьируют в зависимости от типа располагающихся "вверх по течению" олигонуклеотидов (располагающегося "вверх по течению" зонда или располагающегося "вверх по течению" праймера), сайтов гибридизации располагающихся "вверх по течению" олигонуклеотидов и условий расщепления (см. патенты США №№5210015, 5487972, 5691142, 5994069 и 7381532 и публикацию заявки на патент США №2008/0241838).
Большое число традиционных технологий может быть применено для проведения реакции расщепления PTO, приводящей к высвобождению фрагмента, содержащего 5'-концевой метящий участок или часть 5'-концевого метящего участка.
Кратко, на стадии (b) могут присутствовать три сайта расщепления. Во-первых, сайтом расщепления является соединительный сайт (junction site) между участком гибридизации PTO (3'-концевым узнающим мишень участком) и негибридизующимся участком (5'-концевым метящим участком). Второй сайт расщепления представляет собой сайт локализации нескольких нуклеотидов в 3'-направлении от 3'-конца 5'-концевого метящего участка PTO. Второй сайт расщепления локализован в 5'-концевой части 3'-концевого узнающего мишень участка PTO. Третий сайт расщепления представляет собой сайт локализации нескольких нуклеотидов в 5'-направлении от 3'-конца 5'-концевого метящего участка PTO.
Согласно предпочтительному воплощению первоначальным сайтом расщепления PTO матричной полимеразой, обладающей 5'-нуклеазной активностью, после удлинения располагающегося "вверх по течению" праймера является исходная точка двойной цепи между PTO и нуклеиновокислотной последовательностью-мишенью или сайт на расстоянии 1-3 нуклеотида от этой исходной точки.
В связи с этим, используемый в данном описании термин "фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO" в отношении расщепления PTO ферментом, обладающим 5'-нуклеазной активностью, применяется для обозначения (1) 5'-концевого метящего участка, (2) 5'-концевого метящего участка и 5'-концевой части 3'-концевого узнающего мишень участка и (3) части 5'-концевого метящего участка. В данной заявке термин "фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO" также можно описать как "фрагмент РТО".
Термин "часть", используемый в отношении PTO или CTO, как части 5'-концевого метящего участка PTO, 5'-концевой части 3'-концевого узнающего мишень участка PTO и 5-'концевой части захватывающего участка CTO, относится к нуклеотидной последовательности, содержащей 1-40, 1-30, 1-20, 1-15, 1-10 или 1-5 нуклеотидов, предпочтительно 1, 2, 3 или 4 нуклеотида.
Согласно предпочтительному воплощению фермент, обладающий 5'-нуклеазной активностью, представляет собой ДНК-полимеразу, обладающую 5'-нуклеазной активностью, или нуклеазу FEN, более предпочтительно термостабильную ДНК-полимеразу, обладающую 5'-нуклеазной активностью, или нуклеазу FEN.
Подходящей ДНК-полимеразой, обладающей 5'-нуклеазной активностью, в данном изобретении является термостабильная ДНК-полимераза, полученная из ряда бактериальных видов, включая Thermus aquaticus (Taq), Thermus thermophilus (Tth), Thermus filiformis, Thermus flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species Z05, Thermus species sps 17, Thermus thermophilus, Thermotoga maritime, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Thermotoga maritima, Thermotoga neapolitana, Thermosiphoafricanus, Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. Наиболее предпочтительно, чтобы термостабильная ДНК-полимераза представляла собой Taq полимеразу.
Альтернативно, в настоящем изобретении можно использовать ДНК-полимеразы, обладающие 5'-нуклеазной активностью, модифицированные с целью уменьшения полимеразной активности.
Используемая нуклеаза FEN (флэп-эндонуклеаза) представляет собой флэп-специфичную 5'-нуклеазу.
Подходящая для настоящего изобретения нуклеаза FEN включает нуклеазы FEN, полученные из ряда бактериальных видов, включая Sulfolobus solfataricus, Pyrobaculum aerophilum, Thermococcus litoralis, Archaeaglobus veneficus, Archaeaglobus profundus, Acidianus brierlyi, Acidianus ambivalens, Desulfurococcus amylolyticus, Desulfurococcus mobilis, Pyrodictium brockii, Thermococcus gorgonarius, Thermococcus zilligii, Methanopyrus kandleri, Methanococcus igneus, Pyrococcus horikoshii, Aeropyrum pernix и Archaeaglobus veneficus.
Когда располагающийся "вверх по течению" праймер используют на стадии (a), предпочтительно, чтобы условия для расщепления PTO представляли собой условия для осуществления реакции удлинения располагающегося "вверх по течению" праймера.
Согласно предпочтительному воплощению на стадии (a) используют располагающийся "вверх по течению" праймер, для удлинения располагающегося "вверх по течению" праймера используют матричную полимеразу и эта матричная полимераза идентична ферменту обладающему 5'-нуклеазной активностью.
В некоторых случаях на стадии (a) используют располагающийся "вверх по течению" праймер, для удлинения располагающегося "вверх по течению" праймера используют матричную полимеразу и эта матричная полимераза отличается от фермента, обладающего 5'-нуклеазной активностью.
Стадия (c). Гибридизация фрагмента, высвободившегося из PTO, с CTO
Фрагмент, высвободившийся из PTO, гибридизуется с CTO (захватывающим и матричным олигонуклеотидом).
CTO содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO.
CTO действует в качестве матрицы для удлинения фрагмента, высвободившегося из PTO. Этот фрагмент, служащий в качестве праймера, гибридизуется с CTO и удлиняется с образованием удлиненного дуплекса.
Матричный участок может содержать любую последовательность при условии, что он некомплементарен 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO. Кроме того, матричный участок может содержать любую последовательность при условии, что он может действовать в качестве матрицы для удлинения фрагмента, высвободившегося из PTO.
Как описано выше, когда фрагмент, содержащий 5'-концевой метящий участок PTO, высвобождается, предпочтительно, чтобы захватывающий участок CTO был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому метящему участку. Когда фрагмент, содержащий 5'-концевой метящий участок и 5'-концевую часть 3'-концевого узнающего мишень участка, высвобождается, предпочтительно, чтобы захватывающий участок CTO был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому метящему участку и 5'-концевой части 3'-концевого узнающего мишень участка. Когда фрагмент, содержащий часть 5'-концевого метящего участка PTO высвобождается, предпочтительно, чтобы захватывающий участок CTO был сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную части 5-концевого метящего участка.
Кроме того, возможно конструирование захватывающего участка CTO с предполагаемыми сайтами расщепления PTO. Например, если захватывающий участок CTO сконструирован так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому метящему участку, тогда либо фрагмент, содержащий часть 5'-концевого метящего участка, либо фрагмент, содержащий 5'-концевой метящий участок, мог бы гибридизоваться с захватывающим участком и затем удлиняться. Когда фрагмент, содержащий 5'-концевой метящий участок и 5'-концевую часть 3'-концевого узнающего мишень участка высвобождается, он может гибридизоваться с захватывающим участком CTO, сконструированным так, чтобы он содержал нуклеотидную последовательность, комплементарную 5'-концевому метящему участку, и затем успешно удлиняться, несмотря на присутствие ошибочно спаренных нуклеотидов на 3'-концевом участке фрагмента. Это возможно, потому что праймеры могут удлиняться в зависимости от реакционных условий, несмотря на то, что их 3'-конец содержит некоторое количество ошибочно спаренных нуклеотидов (например, 1-3 ошибочно спаренных нуклеотида).
Когда высвобождается фрагмент, содержащий 5'-концевой метящий участок и 5'-концевую часть 3'-концевого узнающего мишень участка, 5'-концевая часть захватывающего участка CTO может быть сконструирована так, чтобы она содержала нуклеотидную последовательность, комплементарную расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, в результате чего преодолеваются проблемы, связанные с ошибочно спаренными нуклеотидами (см. Фиг.1).
Предпочтительно, нуклеотидная последовательность 5'-концевой части захватывающего участка CTO, комплементарная расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, может быть выбрана в зависимости от предполагаемых сайтов расщепления на 3'-концевом узнающем мишень участке PTO. Предпочтительно, чтобы нуклеотидная последовательность 5'-концевой части захватывающего участка CTO, комплементарная расщепляемой 5'-концевой части 3'-концевого узнающего мишень участка, составляла 1-10 нуклеотидов, более предпочтительно 1-5 нуклеотидов, еще более предпочтительно 1-3 нуклеотида.
На 3'-конце CTO могут содержаться дополнительные нуклеотиды, не вовлеченные в гибридизацию с фрагментом. Кроме того, захватывающий участок CTO может содержать нуклеотидную последовательность, комплементарную только части фрагмента (например, части фрагмента, содержащей его 3'-концевой участок), при условии, что она стабильно гибридизуется с этим фрагментом.
Используемый термин "захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка" охватывает в данном описании различные конструкции и составы захватывающего участка CTO, как обсуждалось выше.
CTO может быть сконструирован так, чтобы принимать шпилечную структуру
Длина CTO может варьироваться в широких пределах. Например, длина CTO составляет 7-1000 нуклеотидов, 7-500 нуклеотидов, 7-300 нуклеотидов, 7-100 нуклеотидов, 7-80 нуклеотидов, 7-60 нуклеотидов, 7-40 нуклеотидов, 15-1000 нуклеотидов, 15-500 нуклеотидов, 15-300 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 20-1000 нуклеотидов, 20-500 нуклеотидов, 20-300 нуклеотидов, 20-100 нуклеотидов, 20-80 нуклеотидов, 20-60 нуклеотидов, 20-40 нуклеотидов, 30-1000 нуклеотидов, 30-500 нуклеотидов, 30-300 нуклеотидов, 30-100 нуклеотидов, 30-80 нуклеотидов, 30-60 нуклеотидов или 30-40 нуклеотидов. Захватывающий участок CTO может иметь любую длину при условии, что он специфически гибридизуется с фрагментом, высвободившимся из РТО. Например, длина захватывающего участка CTO составляет 5-100 нуклеотидов, 5-60 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 5-20 нуклеотидов, 10-100 нуклеотидов, 10-60 нуклеотидов, 10-40 нуклеотидов, 10-30 нуклеотидов, 10-20 нуклеотидов, 15-100 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов, 15-30 нуклеотидов или 15-20 нуклеотидов. Матричный участок CTO может иметь любую длину при условии, что он может действовать в качестве матрицы при удлинении фрагмента, высвободившегося из PTO. Например, длина матричного участка CTO составляет 2-900 нуклеотидов, 2-400 нуклеотидов, 2-300 нуклеотидов, 2-100 нуклеотидов, 2-80 нуклеотидов, 2-60 нуклеотидов, 2-40 нуклеотидов, 2-20 нуклеотидов, 5-900 нуклеотидов, 5-400 нуклеотидов, 5-300 нуклеотидов, 5-100 нуклеотидов, 5-80 нуклеотидов, 5-60 нуклеотидов, 5-40 нуклеотидов, 5-30 нуклеотидов, 10-900 нуклеотидов, 10-400 нуклеотидов, 10-300 нуклеотидов, 15-900 нуклеотидов, 15-100 нуклеотидов, 15-80 нуклеотидов, 15-60 нуклеотидов, 15-40 нуклеотидов или 15-20 нуклеотидов.
На 3'-конце CTO может находиться группа 3'-OH. Предпочтительно, 3'-конец CTO блокирован, чтобы не допустить его удлинения. Не допускающее удлинения блокирование CTO может быть достигнуто традиционными методами. Например, блокирование можно осуществить путем добавления химической группировки, такой как биотин, метка, фосфатная группа, алкильная группа, ненуклеотидный линкер, фосфоротионат или алкандиол, к 3'-гидроксильной группе последнего нуклеотида CTO. Альтернативно, блокирование может быть выполнено посредством удаления 3'-гидроксильной группы последнего нуклеотида или путем использования нуклеотида, лишенного 3'-гидроксильной группы, такого как дидезоксинуклеотид.
Фрагмент, высвободившийся из PTO, гибридизуется с CTO, в результате чего получается структура, подходящая для удлинения фрагмента. Несмотря на то, что непереваренный PTO также гибридизуется с захватывающим участком CTO через свой 5'-концевой метящий участок, его 3'-концевой узнающий мишень участок не гибридизуется с CTO, что препятствует образованию удлиненного дуплекса.
Гибридизация на стадии (c) может быть описана более подробно со ссылкой на описания, приведенные на стадии (a).
Стадия (d). Удлинение фрагмента
Реакцию удлинения проводят, используя продукт со стадии (c) и матричную полимеразу нуклеиновых кислот. Фрагмент, гибридизованный с захватывающим участком CTO, удлиняется с образованием удлиненного дуплекса. В отличие от этого, нерасщепленный PTO, гибридизованный с захватывающим участком CTO, не удлиняется, и в результате этого не образуется удлиненного дуплекса.
Используемый в данном описании термин "удлиненный дуплекс" обозначает дуплекс, образованный путем реакции удлинения, в которой фрагмент, гибридизованный с захватывающим участком CTO, удлиняется с использованием матричного участка CTO в качестве матрицы и матричной полимеразы нуклеиновых кислот.
Удлиненный дуплекс имеет величину Tпл, отличающуюся от таковой для гибрида, образованного нерасщепленным PTO и CTO.
Предпочтительно, чтобы удлиненный дуплекс имел более высокую величину Tпл, чем гибрид, образованный нерасщепленным PTO и CTO.
Величина Tпл такого удлиненного дуплекса регулируется в зависимости от (1) последовательности и/или длины фрагмента, (2) последовательности и/или длины CTO или (3) последовательности и/или длины фрагмента и последовательности и/или длины CTO.
Поразительным признаком настоящего изобретения является то, что возможность регулировать величину Tпл удлиненного дуплекса используется для получения сигнала от мишени, указывающего на присутствие удлиненного дуплекса, в результате плавления удлиненного дуплекса на стадии (e).
Используемый в данном описании термин "Tпл" относится к температуре плавления, при которой половина популяции двухцепочечных молекул нуклеиновой кислоты диссоциирует до одноцепочечных молекул. Величина Tпл определяется длиной и содержанием G/C-пар в гибридизованных нуклеотидах. Величина Tпл может быть рассчитана традиционными методами, такими как правило Wallace (R.B. Wallace et al., Nucleic Acids Research, 6: 3543-3547(1979)) и метод ближайших соседей (SantaLucia J. Jr., et al., Biochemistry, 35: 3555-3562(1996)); Sugimoto N., et al., Nucleic Acids Res., 24: 4501-4505(1996)).
Согласно предпочтительному воплощению величина Tпл относится к фактическим величинам Tпл в реакционных условиях, реально используемых на практике.
Матричная полимераза нуклеиновых кислот, используемая на стадии (a), может включать любую полимеразу нуклеиновых кислот, например, кленовский фрагмент ДНК-полимеразы I из Е.coli, термостабильную ДНК-полимеразу и ДНК-полимеразу бактериофага Т7. Предпочтительно, полимераза представляет собой термостабильную ДНК-полимеразу, которая может быть получена из ряда бактериальных видов, включая Thermus aquaticus (Taq), Thermus thermophilus (Tth), Thermus filiformis, Thermis flavus, Thermococcus literalis, Thermus antranikianii, Thermus caldophilus, Thermus chliarophilus, Thermus flavus, Thermus igniterrae, Thermus lacteus, Thermus oshimai, Thermus ruber, Thermus rubens, Thermus scotoductus, Thermus silvanus, Thermus species Z05, Thermus species sps 17, Thermus thermophilus, Thermotoga maritime, Thermotoga neapolitana, Thermosipho africanus, Thermococcus litoralis, Thermococcus barossi, Thermococcus gorgonarius, Thermotoga maritime, Thermotoga neapolitana, Thermosiphoafricanus, Pyrococcus furiosus (Pfu), Pyrococcus woesei, Pyrococcus horikoshii, Pyrococcus abyssi, Pyrodictium occultum, Aquifex pyrophilus и Aquifex aeolieus. Наиболее предпочтительно, матричная полимераза нуклеиновых кислот представляет собой Taq полимеразу. Наиболее предпочтительно, чтобы матричная полимераза нуклеиновых кислот представляла собой Taq полимеразу.
Согласно предпочтительному воплощению, фермент, обладающий 5'-нуклеазной активностью, используемый на стадии (b), идентичен матричной полимеразе нуклеиновых кислот, используемой на стадии (d). Более предпочтительно, чтобы фермент, обладающий 5'-нуклеазной активностью, используемый на стадии (b), матричная полимераза нуклеиновых кислот, используемая для удлинения располагающегося "вверх по течению" праймера, и матричная полимераза нуклеиновых кислот, используемая на стадии (d), были идентичны друг другу.
Удлиненный дуплекс содержит метку, происходящую из (1) по меньшей мере одной метки, соединенной с фрагментом PTO и/или с CTO, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом PTO и/или с CTO, или (4) интеркалирующей метки.
Присутствие удлиненного дуплекса может указывать на присутствие нуклеиновокислотной последовательности-мишени, потому что удлиненный дуплекс образуется, когда присутствует нуклеиновокислотная последовательность-мишень. Чтобы детекцию присутствия удлиненного дуплекса проводить непосредственно, образование удлиненного дуплекса, содержащего метку, обеспечивающую получение детектируемого сигнала, осуществляют на стадии (a). Метка, используемая в удлиненном дуплексе, обеспечивает регистрацию изменения сигнала в зависимости от того, представляет ли удлиненный дуплекс двухцепочечную структуру или одноцепочечную структуру, окончательно предоставляя сигнал от мишени, указывающий на присутствие удлиненного дуплекса, в результате плавления этого удлиненного дуплекса.
Стадия (e). Плавление удлиненного дуплекса
По завершении реакции удлинения удлиненный дуплекс подвергают плавлению в диапазоне температур с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса.
Сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или CTO, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, или (4) интеркалирующей метки.
Используемый в данном описании термин "сигнал от мишени" означает любой сигнал, способный указать на присутствие удлиненного дуплекса. Например, термин "сигнал от мишени" включает в себя сигнал от меток (генерацию или гашение сигнала), изменение сигнала от меток (усиление или ослабление сигнала), кривую плавления, картину плавления и температуру плавления (или величину Tпл).
Согласно предпочтительному воплощению сигнал от мишени представляет собой изменение сигнала от метки на удлиненном дуплексе на стадии плавления. Изменение сигнала может быть получено путем измерения сигналов не менее чем при двух различных температурах. Альтернативно, сигнал от мишени представляет собой кривую плавления, картину плавления и температуру плавления (или величину Tпл), полученные путем измерения сигналов от метки на удлиненном дуплексе в диапазоне температур. Предпочтительно, чтобы диапазон температур представлял собой диапазон температур для анализа кривой плавления или представлял собой температуры вблизи величины Tпл удлиненного дуплекса.
Удлиненный дуплекс имеет более высокую величину Tпл, чем гибрид, образованный нерасщепленным PTO и CTO. Ввиду этого удлиненный дуплекс и гибрид демонстрируют отличающиеся друг от друга картины плавления. Такие разные картины плавления позволяют провести отличие сигнала от мишени от сигналов, не относящихся к мишени. Иная картина плавления или температура плавления описывает сигнал от мишени совместно с подходящей системой меток.
Плавление может быть осуществлено с использованием традиционных технологий, включая, но не ограничиваясь этим, нагревание, обработку щелочью, формамидом, мочевиной и глиоксалем, ферментативные методы (например, действие геликазы) и применение связывающих белков, но этим не ограничиваются. Например, плавления можно достичь посредством нагревания при температуре, изменяющейся в диапазоне от 80°C до 105°C. Общие способы осуществления такой обработки приведены в Joseph Sambrook, et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001).
Подходящие системы меток, используемые в этом изобретении, различаются с точки зрения их типов, расположения и способа генерации сигнала.
Системы меток, полезные в этом изобретении, будут обсуждены более подробно ниже.
(1) Метка, соединенная с фрагментом и/или CTO
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается по меньшей мере одной меткой, соединенной с фрагментом и/или CTO. Как только произойдет образование удлиненного дуплекса между фрагментом PTO и CTO, на удлиненном дуплексе появится метка либо от фрагмента PTO, либо от CTO, обеспечивающая сигнал от мишени на стадии плавления.
Такая метка включает систему двух взаимодействующих меток и одиночную метку.
(1-1) Система двух взаимодействующих меток
Система взаимодействующих меток представляет собой генерирующую сигнал систему в которой энергия передается от донорной молекулы к акцепторной молекуле без участия радиоактивности. В качестве репрезентативной системы взаимодействующих меток система меток при FRET (резонансном переносе энергии флуоресценции) включает флуоресцентную репортерную молекулу (донорную молекулу) и молекулу-гаситель (акцепторную молекулу). При FRET донор энергии является флуоресцентным, а акцептор энергии может быть флуоресцентным или не быть флуоресцентным. Для другой формы систем взаимодействующих меток донор энергии не является флуоресцентным, например, является хромофором, а акцептор энергии является флуоресцентным. Для еще одной другой формы систем взаимодействующих меток донор энергии является люминесцентным, например биолюминесцентным, хемилюминесцентным, электрохемилюминесцентным, а акцептор является флуоресцентным. Донорная молекула и акцепторная молекула могут быть описаны в настоящем изобретения как репортерная молекула и молекула-гаситель, соответственно.
Предпочтительно, чтобы сигнал, указывающий на присутствие удлиненного дуплекса (то есть, на присутствие нуклеиновокислотной последовательности-мишени), генерировался системами взаимодействующих меток, более предпочтительно системой FRET-меток (то есть, системой двух взаимодействующих меток).
Первое воплощение (внутрицепочечная система двух взаимодействующих меток)
В первом воплощении системы двух взаимодействующих меток фрагмент или CTO содержит систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом плавление удлиненного дуплекса на стадии (e) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени на стадии (e). Первое воплощение такой системы двух взаимодействующих меток проиллюстрировано на Фиг.2, 6 и 9. Первое воплощение называется внутрицепочечной системой двух взаимодействующих меток.
Первое воплощение, приведенное на Фиг.2, (внутрицепочечная система двух взаимодействующих меток)
Поясненное примером воплощение описано со ссылкой на Фиг.2. Матричный участок CTO содержит репортерную молекулу и молекулу-гаситель. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент, этот фрагмент гибридизуется с захватывающим участком CTO и удлиняется с образованием удлиненного дуплекса.
Если на стадии (d) образуется удлиненный дуплекс, то репортерная молекула и молекула-гаситель на CTO конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы; при этом если на стадии (e) этот удлиненный дуплекс подвергают плавлению, то репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Используемое в данном описании выражение "репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу" означает, что репортерная молекула и молекула-гаситель пространственно приближены друг к другу благодаря конформационной структуре фрагмента или CTO, такой как случайная спираль и шпилечная структура.
Используемое в данном описании выражение "репортерная молекула и молекула-гаситель конформационно разделяются" означает, что репортерная молекула и молекула-гаситель пространственно разделяются в результате изменения конформационной структуры фрагмента или CTO после образования двойной цепи.
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала флуоресценции, генерированного на стадии (d).
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель могут быть расположены в любом месте на CTO, при условии, что гашение и негашение сигнала от репортерной молекулы осуществляется в зависимости от плавления удлиненного дуплекса.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель обе соединены с матричным участком или с захватывающим участком CTO.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель расположены на 5'-конце и 3'-конце CTO.
Согласно предпочтительному воплощению одна из молекул на CTO, репортерная молекула или молекула-гаситель, расположена на его 5'-конце или на расстоянии 1-5 нуклеотидов от его 5'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации CTO.
Согласно предпочтительному воплощению одна из молекул на CTO, репортерная молекула или молекула-гаситель, расположена на его 3'-конце или на расстоянии 1-5 нуклеотидов от его 3'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации CTO.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель расположены на расстоянии не более 80 нуклеотидов, более предпочтительно не более 60 нуклеотидов, еще более предпочтительно не более 30 нуклеотидов, существенно более предпочтительно не более 25 нуклеотидов друг от друга. Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель разделены по меньшей мере 4 нуклеотидами, более предпочтительно по меньшей мере 6 нуклеотидами, еще более предпочтительно по меньшей мере 10 нуклеотидами, существенно более предпочтительно по меньшей мере 15 нуклеотидами.
В настоящем изобретении возможно получение гибрида, образованного нерасщепленным PTO и CTO.
Если матричный участок CTO помечен с использованием системы двух взаимодействующих меток, как показано на Фиг.2, то индукции изменения сигнала от метки на гибриде, образованном нерасщепленным PTO и CTO, не происходит. Ввиду этого гибрид не дает сигнал, не относящийся к мишени.
Если захватывающий участок CTO помечен с использованием системы двух взаимодействующих меток, то гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида.
Первое воплощение, приведенное на Фиг.6 (внутрицепочечная система двух взаимодействующих меток)
Поясненное примером воплощение описано со ссылкой на Фиг.6. 5'-Концевой метящий участок PTO содержит репортерную молекулу и молекулу-гаситель. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент, содержащий 5'-Концевой метящий участок с репортерной молекулой и молекулой-гасителем. Этот фрагмент гибридизуется с захватывающим участком CTO.
Если на стадии (d) образуется удлиненный дуплекс, то репортерная молекула и молекула-гаситель на фрагменте конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы; при этом если на стадии (e) этот удлиненный дуплекс подвергают плавлению, то репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель могут быть расположены в любом месте на фрагменте, при условии, что гашение и негашение сигнала от репортерной молекулы осуществляется в зависимости от плавления удлиненного дуплекса.
Согласно предпочтительному воплощению одна из молекул на фрагменте, репортерная молекула или молекула-гаситель, расположена на его 5'-конце или на расстоянии 1-5 нуклеотидов от его 5'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации фрагмента.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель расположены на расстоянии не более 50 нуклеотидов, более предпочтительно не более 40 нуклеотидов, еще более предпочтительно не более 30 нуклеотидов, существенно более предпочтительно не более 20 нуклеотидов друг от друга. Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель разделены по меньшей мере 4 нуклеотидами, более предпочтительно по меньшей мере 6 нуклеотидами, еще более предпочтительно по меньшей мере 10 нуклеотидами, существенно более предпочтительно по меньшей мере 15 нуклеотидами.
Как представлено на Фиг.6, гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида.
Второе воплощение (межцепочечная система двух взаимодействующих меток)
Во втором воплощении системы взаимодействующих меток фрагмент содержит одну из двух взаимодействующих меток, включащих репортерную молекулу и молекулу-гаситель, а CTO содержит другую из двух взаимодействующих меток; при этом плавление удлиненного дуплекса на стадии (e) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени на стадии (e).
Поясненное примером воплощение описано со ссылкой на Фиг.8.
Если на стадии (a) образуется удлиненный дуплекс, то сигнал от репортерной молекулы, соединенной с CTO, гасится молекулой-гасителем, соединенной с PTO. Если на стадии (e) удлиненный дуплекс подвергают плавлению, то репортерная молекула и молекула-гаситель разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала флуоресценции от системы двух взаимодействующих меток.
Репортерная молекула и молекула-гаситель могут быть расположены в любом месте фрагмента PTO и CTO, при условии, что сигнал от репортерной молекулы гасится молекулой-гасителем в удлиненном дуплексе.
Согласно предпочтительному воплощению репортерная молекула или молекула-гаситель на фрагменте PTO расположена на 5'-конце 5'-концевого метящего участка.
Согласно предпочтительному воплощению репортерная молекула или молекула-гаситель на CTO расположена на его 3'-конце.
Как представлено на Фиг.8, гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида.
Репортерная молекула и молекула-гаситель, полезные в настоящем изобретении, могут включать любые молекулы, известные в данной области техники. Примерами их являются: Cy2™ (506), YO-PRO™-1 (509), YOYO™-1 (509), кальцеин (517), FITC (флуоресцеинизотиоцианат) (518), FluorX™ (519), Alexa™ (520), родамин 110 (520), Oregon Green™ (орегон зеленый) 500 (522), Oregon Green™ 488 (524), RiboGreen™ (525), Rhodamine Green™ (родаминовый зеленый) (527), родамин 123 (529), Magnesium Green™ (531), Calcium Green™ (533), TO-PRO™-1 (533), TOTO1 (533), JOE (2',7'-диметокси-4',5'-дихлорофлуоресцеин) (548), BODIPY530/550 (550), Dil (565), BODIPY TMR (568), BODIPY558/568 (568), BODIPY564/570 (570), Cy3™ (570), Alexa™ 546 (570), TRITC (тетраметилродамин-изотиоцианат) (572), Magnesium Orange™ (575), фикоэритрин R&B (575), родамин-фаллоидин (575), Calcium Orange™ (576), пиронин Y (580), родамин B (580), TAMRA (тетраметилродамин) (582), Rhodamine Red™ (родамин красный) (590), Cy3.5™ (596), ROX (6-карбокси-X-родамин) (608), Calcium Crimson™ (615), Alexa™ 594 (615), техасский красный (615), нильский красный (628), YO-PRO™-3 (631), YOYO™-3 (631), R-фикоцианин (642), C-фикоцианин (648), TO-PRO™-3 (660), TOTO3 (660), DiD DilC(5) (665), Cy5™ (670), тиадикарбоцианин (671) и Cy5.5 (694), HEX (556), TET (536), Biosearch Blue (447), CAL Fluor Gold 540 (544), CAL Fluor Orange 560 (559), CAL Fluor Red 590 (591), CAL Fluor Red 610 (610), CAL Fluor Red 635 (637), FAM (карбоксифлуоресцеин) (520), флуоресцеин (520), флуоресцеин-C3 (520), Pulsar 650 (566), Quasar 570 (667), Quasar 670 (705) и Quasar 705 (610). Числа в скобках представляют собой длину волны, соответствующую максимуму излучения, в нанометрах. Предпочтительно, чтобы репортерная молекула и молекула-гаситель представляли собой JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина.
Подходящие пары репортер-гаситель описаны в ряде публикаций, которые указаны ниже: Pesce et al., editors, Fluorescence Spectroscopy (Marcel Dekker, New York, 1971); White et al., Fluorescence Analysis: A Practical Approach (Marcel Dekker, New York, 1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd Edition (Academic Press, New York, 1971); Griffiths, Color and Constitution of Organic Molecules (Academic Press, New York, 1976); Bishop, editor, Indicators (Pergamon Press, Oxford, 1972); Haugland, Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Eugene, 1992); Pringsheim, Fluorescence and Phosphorescence (Interscience Publishers, New York, 1949); Haugland, R.P., Handbook of Fluorescent Probes and Research Chemicals, 6th Edition, Molecular Probes, Eugene, Oreg., 1996; патенты США №№3996345 и 4351760.
Стоит отметить, что в настоящем изобретении может быть использована нефлуоресцентная "черная" молекула-гаситель, способная гасить флуоресценцию в широком диапазоне длин волн или на конкретной длине волны. Примерами таких гасителей являются BHQ (Black Hole 1) и DABCYL (4-((4-(диметиламино)фенил)-азо)бензойная кислота).
Для FRET-меток, адаптированных к CTO, термин "репортерная молекула" включает в себя донора FRET, а термин "гаситель" включает в себя другого партнера (акцептора) FRET. Например, в качестве репортерной молекулы используют флуоресцентный краситель, а в качестве гасителя родаминовый краситель.
(1-2) Одиночная метка
Настоящее изобретение также превосходно осуществляется с использованием систем с одиночной меткой для получения сигналов, указывающих на присутствие нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению фрагмент или CTO содержит одиночную метку, и плавление удлиненного дуплекса на стадии (e) индуцирует изменение сигнала от этой одиночной метки с получением сигнала от мишени на стадии (е).
Первое воплощение, приведенное на Фиг 3 (система с одиночной меткой)
Поясненное примером воплощение описано со ссылкой на Фиг.3. Матричный участок CTO содержит одиночную флуоресцентную метку. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент. Этот фрагмент гибридизуется с захватывающим участком CTO и удлиняется с образованием удлиненного дуплекса. В результате образования удлиненного дуплекса интенсивность флуоресценции от одиночной флуоресцентной метки увеличивается. Если на стадии (e) удлиненный дуплекс подвергают плавлению, то интенсивность флуоресценции от одиночной флуоресцентной метки уменьшается, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Согласно предпочтительному воплощению одиночная метка может быть расположена в любом месте CTO, при условии, что уровень сигнала от одиночной метки изменяется в зависимости от плавления удлиненного дуплекса.
Согласно предпочтительному воплощению одиночная метка соединена с матричным участком или с захватывающим участком CTO.
Если матричный участок CTO помечен одиночной меткой, как показано на Фиг.3, то индукции изменения сигнала от метки на гибриде, образованном нерасщепленным PTO и CTO, не происходит. Ввиду этого гибрид не дает сигнала, не относящегося к мишени.
Если захватывающий участок CTO помечен одиночной меткой, то гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида.
Второе воплощение, приведенное на Фиг.7 (система с одиночной меткой)
Поясненное примером воплощение описано со ссылкой на Фиг.7. 5'-Концевой метящий участок PTO содержит одиночную флуоресцентную метку PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент, содержащий 5'-Концевой метящий участок с одиночной флуоресцентной меткой. В результате гибридизации интенсивность сигнала от одиночной флуоресцентной метки на 5'-концевом метящем участке увеличивается. Если на стадии (e) удлиненный дуплекс подвергают плавлению, то интенсивность сигнала от одиночной флуоресцентной метки уменьшается, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Согласно предпочтительному воплощению одиночная метка может быть расположена в любом месте фрагмента PTO, при условии, что уровень сигнала от одиночной метки изменяется в зависимости от плавления удлиненного дуплекса.
Как представлено на Фиг.7, гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида.
Использование в данном изобретении одиночной метки должно обеспечить получение разных сигналов в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре. Одиночная метка представляет собой флуоресцентную метку люминесцентную метку, хемилюминесцентную метку, электрохимическую метку и металлическую метку. Предпочтительно, чтобы одиночная метка представляла собой флуоресцентную метку.
Типы и предпочтительные сайты связывания одиночных флуоресцентных меток, используемых в данном изобретении, описаны в патентах США №№7537886 и 7348141, идеи которых включены в данное описание посредством ссылки во всей своей полноте. Предпочтительно, чтобы одиночная флуоресцентная метка представляла собой JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина. Меченый нуклеотидный остаток предпочтительно расположен в позициивнутреннего нуклеотидного остатка в пределах олигонуклеотида, а не на 5'-конце или 3'-конце.
Одиночная метка, используемая в настоящем изобретении, может быть описана со ссылкой на указанные выше описания для репортерной молекулы и молекулы-гасителя.
В частности, если настоящее изобретение осуществляют на твердой фазе с применением одиночной метки, то можно использовать обычную флуоресцентную метку, и не требуется специальной флуоресцентной метки, способной обеспечить получение сигналов флуоресценции с различными интенсивностями в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре. Сигнал от мишени, создаваемый на твердой подложке, измеряют. Такое воплощение системы с одиночной меткой вместе с иммобилизованным CTO проиллюстрировано на Фиг.12.
В том случае, когда применяют CTO, иммобилизованный на твердой подложке, можно использовать химические метки (например, биотин) или ферментативные метки (например, щелочную фосфатазу, пероксидазу, β-галактозидазу и β-глюкозидазу).
В системах с меткой, использующих "метку, соединенную с фрагментом и/или CTO", эти метки могут быть расположены таким образом, что если получается гибрид, образованный нерасщепленным PTO и CTO, то этот гибрид на стадии (e) не дает сигнала, не относящегося к мишени. Альтернативно, метки могут быть расположены таким образом, что если получается гибрид, образованный нерасщепленным PTO и CTO, то этот гибрид на стадии (e) дает сигнал, не относящийся к мишени; при этом величина Tпл для удлиненного дуплекса больше таковой для гибрида, образованного нерасщепленным PTO и CTO.
В частности, если метки расположены таким образом, что гибрид, образованный нерасщепленным PTO и CTO, не дает сигнала, не относящегося к мишени, то для выбора величины Tпл удлиненного дуплекса с целью детекции нуклеиновокислотной последовательности-мишени можно использовать диапазон, включающий величину Tпл для гибрида.
(2) Метка, встраиваемая в удлиненный дуплекс
В настоящем изобретении можно применять метку, встраиваемую в удлиненный дуплекс во время реакции удлинения, для получения сигнала от мишени, указывающего на присутствие удлиненного дуплекса.
Несмотря на то, что фрагмент PTO или CTO не содержит никакой метки, успешно используется метка, встраиваемая в удлиненный дуплекс во время реакции удлинения, что дает возможность сделать удлиненный дуплекс меченным. На Фиг.10 и 11 проиллюстрировано воплощение, в котором нуклеотид с одиночной меткой встраивается в удлиненный дуплекс во время реакции удлинения (см. C и D на Фиг.10 и 11). Это воплощение также применимо к другим воплощениям с использованием анализа плавления.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством одиночной метки, встраиваемой в удлиненный дуплекс во время реакции удлинения; причем встраиваемая одиночная метка соединена с нуклеотидом, встраиваемым во время реакции удлинения; при этом плавление удлиненного дуплекса на стадии (е) индуцирует изменение сигнала от одиночной метки с получением сигнала от мишени на стадии (e).
Поясненное примером воплощение описано со ссылкой на Фиг.10. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент. Этот фрагмент гибридизуется с захватывающим участком CTO, иммобилизованного на твердой подложке, и удлиняется в присутствии нуклеотидов, меченных одиночной флуоресцентной меткой, с образованием удлиненного дуплекса. Флуоресцентный сигнал от удлиненного дуплекса можно детектировать в пятне на твердой подложке с иммобилизованным CTO. Когда удлиненный дуплекс подвергают плавлению, цепь, содержащая флуоресцентную метку, высвобождается, и флуоресцентный сигнал в этом пятне более не детектируется (на Фиг.10 не показано). Таким образом, изменение сигнала в пятне может быть получено посредством плавления удлиненного дуплекса. При этом доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Сигнал от мишени, доставляемый на стадии (e), представляет собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала флуоресценции в пятне с иммобилизованным CTO.
Согласно предпочтительному воплощению нуклеотид, встраиваемый во время реакции удлинения, содержит первое неприродное основание, а CTO содержит нуклеотид, содержащий второе неприродное основание с аффинностью специфического связывания (specific binding affinity) с первым неприродным основанием, как показано на Фиг.11. Нуклеотид, содержащий второе неприродное основание, предпочтительно расположен в любом сайте на матричном участке CTO.
Используемый в данном описании термин "неприродное основание" относится к производным природных оснований, таких как аденин (A), гуанин (G), тимин (T), цитозин (C) и урацил (U), которые способны к образованию связанных водородными связями пар оснований. Используемый в данном описании термин "неприродное основание" включает в себя основания, характеризующиеся другими картинами образования пар оснований по сравнению с природными основаниями как исходными соединениями (mother compounds), как описано, например, в патентах США №№5432272, 5965364, 6001983 и 6037120. Образование пар оснований между неприродными основаниями заключается в образовании двух или трех водородных связей, как и у природных оснований. Образование пар оснований между неприродными основаниями также происходит с учетом специфичности.
Конкретные примеры неприродных оснований включают следующие основания в комбинациях пар оснований изо-C/изо-G, изо-dC/изо-dG, K/X, H/J и M/N (см. патент США №7422850).
Поясненное примером воплощение описано со ссылкой на Фиг.11. Фрагмент гибридизуется с CTO, содержащим нуклеотид, имеющий второе неприродное основание (например, изо-dC) с аффинностью специфического связывания с первым неприродным основанием (например, изо-dG). Удлинение осуществляют в присутствии нуклеотида, содержащего первое неприродное основание, меченное одиночной флуоресцентной меткой, с образованием удлиненного дуплекса. В реакции удлинения нуклеотид, содержащий первое неприродное основание, встраивается в сайт, расположенный напротив нуклеотида, содержащего второе неприродное основание.
Флуоресцентный сигнал от удлиненного дуплекса можно детектировать в пятне на твердой подложке с иммобилизованным CTO. Когда удлиненный дуплекс подвергают плавлению, цепь, содержащая флуоресцентную метку, высвобождается, и флуоресцентный сигнал в этом пятне более не детектируется (на Фиг.11 не показано). Таким образом, изменение сигнала в пятне может быть получено посредством плавления удлиненного дуплекса. При этом доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Если применяется метка, встраиваемая в удлиненный дуплекс во время реакции удлинения, то эта метка не встраивается в гибрид, образованный нерасщепленным PTO и CTO, поскольку гибрид не удлиняется. Таким образом, данный гибрид не дает сигнала, не относящегося к мишени.
Типы и характеристики используемых одиночных меток могут быть описаны со ссылкой на описания для системы меток, в которой используется "метка, соединенная с фрагментом и/или CTO", как указано выше.
(3) Метка, встраиваемая в удлиненный дуплекс, и метка, соединенная с фрагментом или CTO
В настоящем изобретении можно применять систему меток, в которой используется совместное действие метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, как показано на Фиг.4 и 5.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, и такая встраиваемая метка соединена с нуклеотидом, встраиваемым во время реакции удлинения; причем эти две метки представляют собой систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом плавление удлиненного дуплекса на стадии (e) индуцирует изменение сигнала от этой системы двух взаимодействующих меток с получением сигнала от мишени на стадии (e).
Более предпочтительно, чтобы нуклеотид, встраиваемый во время реакции удлинения, содержал первое неприродное основание, а CTO содержал нуклеотид, содержащий второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием.
Поясненное примером воплощение описано со ссылкой на Фиг.4. Фрагмент гибридизуется с CTO, содержащим репортерную молекулу или молекулу-гаситель и нуклеотид, имеющий второе неприродное основание (например, изо-dC) с аффинностью специфического связывания с первым неприродным основанием (например, изо-dG). Удлинение осуществляют в присутствии нуклеотида, содержащего первое неприродное основание, меченное молекулой-гасителем или репортерной молекулой, с образованием удлиненного дуплекса, в котором сигнал от репортерной молекулы гасится молекулой-гасителем. В реакции удлинения нуклеотид, содержащий первое неприродное основание, встраивается в сайт, расположенный напротив нуклеотида, содержащего второе неприродное основание.
Если на стадии (e) удлиненный дуплекс подвергают плавлению, то репортерная молекула и молекула-гаситель разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала флуоресценции от системы двух взаимодействующих меток.
Местоположение метки на CTO и сайта встраивания встраиваемой метки определяется в той мере, в какой эти две метки действуют как система двух взаимодействующих меток для индукции изменения сигнала на стадии плавления.
Еще более предпочтительно, чтобы матричный участок СТО содержал репортерную молекулу или молекулу-гаситель и нуклеотид, имеющий второе неприродное основание. Реакцию удлинения на стадии (d) проводят в присутствии нуклеотида, содержащего молекулу-гаситель или репортерную молекулу и первое неприродное основание с аффинностью специфического связывания со вторым неприродным основанием в CTO. Эти два неприродных основания в удлиненном дуплексе на стадии (d) образуют пару оснований, вызывая гашение сигнала от репортерной молекулы посредством молекулы-гасителя, и индуцируя изменение сигнала, в силу чего обеспечивается получение сигнала от мишени. Альтернативно, фрагмент содержит репортерную молекулу или молекулу-гаситель, а матричный участок CTO содержит нуклеотид, имеющий второе неприродное основание. Реакцию удлинения на стадии (d) проводят в присутствии нуклеотида, содержащего молекулу-гаситель или репортерную молекулу и первое неприродное основание с аффинностью специфического связывания со вторым неприродным основанием в CTO. Эти два неприродных основания в удлиненном дуплексе на стадии (d) образуют пару оснований, индуцируя изменение сигнала от репортерной молекулы посредством гашения, в силу чего обеспечивается получение сигнала от мишени.
Другое поясненное примером воплощение описано со ссылкой на Фиг.5. В этом воплощении фрагмент, содержащий репортерную молекулу или молекулу-гаситель, гибридизуется с CTO, содержащим нуклеотид, имеющий второе неприродное основание (например, изо-dC) с аффинностью специфического связывания с первым неприродным основанием (например, изо-dG). Удлинение осуществляют в присутствии нуклеотида, содержащего первое неприродное основание, меченное молекулой-гасителем или репортерной молекулой, с образованием удлиненного дуплекса, в котором сигнал от репортерной молекулы гасится молекулой-гасителем. В реакции удлинения нуклеотид, содержащий первое неприродное основание, встраивается в сайт, расположенный напротив нуклеотида, содержащего второе неприродное основание.
Если на стадии (d) образуется удлиненный дуплекс, то репортерная молекула и молекула-гаситель конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы; при этом если на стадии (e) этот удлиненный дуплекс подвергают плавлению, то репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы, так что доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала флуоресценции от системы двух взаимодействующих меток.
Местоположение метки на PTO и сайта встраивания встраиваемой метки определяется в той мере, в какой эти две метки действуют как система двух взаимодействующих меток для индукции изменения сигнала на стадии плавления.
Если применяется метка, встраиваемая в удлиненный дуплекс во время реакции удлинения, то эта метка не встраивается в гибрид, образованный нерасщепленным PTO и CTO, поскольку гибрид не удлиняется. Таким образом, данный гибрид не дает сигнала, не относящегося к мишени.
(4) Интеркалирующая метка
В настоящем изобретении можно применять интеркалирующую метку для получения сигнала от мишени, указывающего на присутствие удлиненного дуплекса. Интеркалирующая метка более полезна в реакции на твердой фазе с использованием иммобилизованных CTO, ввиду того, что генерировать сигналы могут двухцепочечные молекулы нуклеиновых кислот, присутствующие в образцах.
Примеры интеркалирующих красителей, полезных в данном изобретении, включают SYBR™ Green I, PO-PRO™-1, BO-PRO™-1, SYTO™43, SYTO™44, SYTO™45, SYTOX™Blue, POPO™-1, POPO™-3, BOBO™-1, BOBO™-3, LO-PRO™-1, JO-PRO™-1, YO-PRO™1, TO-PRO™1, SYTO™11, SYTO™13, SYTO™15, SYTO™16, SYTO™20, SYTO™23, TOTO™-3, YOYO™3, GelStar™ и триазоловый оранжевый. Эти интеркалирующие красители специфически интеркалируют в двухцепочечные молекулы нуклеиновых кислот, генерируя сигналы.
На Фиг.13 проиллюстрировано воплощение, в котором интеркалирующие красители интеркалируют между парами оснований удлиненного дуплекса (C и D на Фиг.13). Данное воплощение также применимо к другому воплощению с использованием анализа плавления.
Поясненное примером воплощение описано со ссылкой на Фиг.13. Фрагмент гибридизуется с захватывающим участком CTO, иммобилизованного на твердой подложке. Удлинение осуществляют в присутствии интеркалирующего красителя (например, SYBR™ Green) и получают удлиненный дуплекс с интеркалирующими красителями. Флуоресцентный сигнал от удлиненного дуплекса в пятне на твердой подложке с иммобилизованным CTO можно детектировать с использованием интеркалирующих флуоресцентных красителей. Когда удлиненный дуплекс подвергают плавлению, интеркалирующие флуоресцентные красители высвобождаются, и флуоресцентный сигнал в этом пятне более не детектируется (на Фиг.13, не показано). При этом доставляется сигнал от мишени, указывающий на присутствие удлиненного дуплекса на стадии (e).
Гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени, на стадии плавления. В этом случае разница в величинах Tпл для удлиненного дуплекса и гибрида позволяет отличить относящийся к мишени сигнал от удлиненного дуплекса от не относящегося к мишени сигнала от гибрида (Фиг.13, не показано).
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой кривую плавления, картину плавления или величину Tпл, полученную путем измерения изменения сигнала от системы двух взаимодействующих меток.
Стадия (f). Детекция сигнала от мишени
Окончательно, детекцию удлиненного дуплекса осуществляют путем измерения сигнала от мишени, доставляемого на стадии (e); тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
Детекция может быть осуществлена различными способами в зависимости от типов сигнала от мишени.
Согласно предпочтительному воплощению детекцию сигнала от мишени осуществляют с использованием анализа плавления.
Используемый в данном описании термин "анализ плавления" означает метод, с использованием которого сигнал от мишени, указывающий на присутствие удлиненного дуплекса, получают в результате плавления удлиненного дуплекса, включая метод измерения сигналов при двух различных температурах, анализ кривой плавления, анализ картины плавления и анализ пиков плавления. Предпочтительно, анализ плавления представляет собой анализ кривой плавления.
Согласно предпочтительному воплощению за плавлением, осуществляемым на стадии (e), следует гибридизация с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса. В этом случае детекцию удлиненного дуплекса осуществляют с использованием анализа кривой гибридизации.
Кривая плавления или кривая гибридизации может быть получена с использованием традиционных технологий, например, как описано в патентах США №№6174670 и 5789167, Drobyshev et al., Gene 188: 45 (1997); Kochinsky and Mirzabekov, Human Mutation, 19: 343 (2002); Livehits et al., J. Biomol. Structure Dynam., 11: 783 (1994) и Howell et al., Nature Biotechnology, 17: 87 (1999). Например, кривая плавления или кривая гибридизации может представлять собой графическое изображение или отображение изменения выходного сигнала в зависимости от изменения такого параметра, как жесткость условий гибридизации. Можно построить график зависимости выходного сигнала непосредственно от параметра гибридизации. В типичном случае кривая плавления или кривая гибридизации будут характеризоваться выходным сигналом, например флуоресценцией, который указывает на относительное количество дуплексной структуры (то есть на степень гибридизации), отложенным по оси Y, и параметром гибридизации, отложенным по оси X.
PTO и CTO могут состоять из природных dNMP. Альтернативно, PTO и CTO могут состоять из модифицированных нуклеотидов или неприродных нуклеотидов, таких как PNA (пептидо-нуклеиновая кислота (peptide nucleic acid), см. публикацию PCT № WO 92/20702) и LNA ("закрытая" нуклеиновая кислота (locked nucleic acid), см. публикации PCT №№ WO 98/22489, WO 98/39352и WO 99/14226). PTO и CTO могут содержать универсальные основания, такие как дезоксиинозин, инозин, 1-(2'-дезокси-бета-D-рибофуранозил)-3-нитропиррол и 5-нитроиндол. Термин "универсальное основание" относится к основанию, способному образовывать пары оснований с каждым из природных оснований ДНК/РНК с небольшим отличием между ними.
Как описано выше, PTO может расщепляться в сайте, локализованом в 3'-направлении от 3'-конца 5'-концевого метящего участка PTO. Этот сайт расщепления может быть расположен в 5'-концевой части 3'-концевого узнающего мишень участка PTO. В том случае, когда фрагмент PTO содержит 5'-концевую часть 3'-концевого узнающего мишень участка PTO, сайт CTO, гибридизуемый с 5'-концевой частью 3'-концевого узнающего мишень участка, может содержать универсальное основание, вырожденную последовательность или их комбинацию. Например, если РТО расщепляется в сайте, локализованном на расстоянии одного нуклеотида в 3'-направлении от 3'-конца 5'-концевого метящего участка PTO, то выгодно, чтобы 5'-концевая часть захватывающего участка CTO содержала универсальное основание для гибридизации с данным нуклеотидом. Если PTO расщепляется в сайте, локализованном на расстоянии двух нуклеотидов в 3'-направлении от 3'-конца 5'-концевого метящего участка РТО, то выгодно, чтобы 5'-конец захватывающего участка CTO содержал вырожденную последовательность, а его смежный в 3'-направлении нуклеотид содержал универсальное основание. Соответственно, в том случае, когда расщепление PTO происходит в различных сайтах 5'-концевой части 3'-концевого узнающего мишень участка, использование универсальных оснований и вырожденных последовательностей в CTO является полезным. В дополнение к этому, когда для скрининга множественных нуклеиновокислотных последовательностей-мишеней в условиях индукции расщепления, зависимого от удлинения располагающегося "вверх по течению" праймера, используют PTO, содержащие один и тот же 5'-концевой метящий участок, могут быть созданы фрагменты PTO, содержащие различные 5'-концевые части 3'-концевого узнающего мишень участка. В таких случаях полезно использование в CTO универсальных оснований и вырожденных последовательностей. Стратегии с использованием универсальных оснований и вырожденных последовательностей в CTO позволяют применять один тип или минимальное количество типов CTO для скрининга множественных нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(f) с денатурацией между повторяющимися циклами, предпочтительно с использованием располагающегося "вниз по течению" праймера. Это повторение позволяет амплифицировать нуклеиновокислотную последовательность-мишень и/или сигнал от мишени.
Согласно предпочтительному воплощению стадии (a)-(f) осуществляют в реакционном сосуде или в отдельных реакционных сосудах. Например, стадии (a)-(b), (c)-(d) или (e)-(f) могут быть осуществлены в отдельных реакционных сосудах.
Согласно предпочтительному воплощению стадии (a)-(b) и (c)-(f) могут быть проведены одновременно или по отдельности даже в одном реакционном сосуде в зависимости от реакционных условий (в частности, температуры).
В настоящем изобретении не требуется, чтобы нуклеиновокислотные последовательности-мишени, подлежащие детекции и/или амплификации, имели какую-либо определенную последовательность или длину, включая любые молекулы ДНК (гДНК и кДНК) и РНК.
Если в качестве исходного материала используют мРНК, перед проведением стадии отжига необходима стадия обратной транскрипции, детали которой можно найти в Joseph Sambrook, et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001); и Noonan, К.F. et al., Nucleic Acids Res., 16: 10366 (1988)). Для обратной транскрипции можно использовать случайный гексамер или олигонуклеотид dT в качестве праймера, способный гибридизоваться с мРНК.
Нуклеиновокислотные последовательности-мишени, которые могут подлежать детекции и/или амплификации, включают любую прокариотическую, эукариотическую (например, из простейших и паразитов, грибов, дрожжей, высших растений, низших и высших животных, в том числе млекопитающих и человека), вирусную (например, из вируса герпеса, ВИЧ (вируса иммунодефицита человека), вируса гриппа, вируса Эпштейна-Барр, вируса гепатита, полиовируса и т.д.) или вироидную нуклеиновую кислоту природного происхождения.
Кроме того, настоящее изобретение является полезным для детекции вариабельности нуклеотидов. Предпочтительно, нуклеиновокислотная последовательность-мишень имеет вариабельность нуклеотидов. Термин "вариабельность нуклеотидов", используемый в данном описании, относится к любым одиночным или множественным нуклеотидным заменам, делециям или вставкам в последовательности ДНК в конкретном положении среди непрерывных сегментов ДНК, которые в других случаях являются одинаковыми в последовательности. Такие непрерывные сегменты ДНК включают ген или любую другую часть хромосомы. Такие вариабельности нуклеотидов могут быть результатом мутации или представлять собой вариабельности полиморфных аллелей. Например, вариабельность нуклеотидов, детектируемая в настоящем изобретении, включает SNP (однонуклеотидный полиморфизм), мутацию, делецию, вставку, замену и транслокацию. Примером вариабельности нуклеотидов являются многочисленные вариации в геноме человека (например, вариации в гене MTHFR (метилентетрагидрофолат-редуктазы)), вариации, вовлеченные в возникновение лекарственной устойчивости у патогенных микроорганизмов, и приводящие к онкогенезу вариации.
В настоящем изобретении для детекции вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени в том случае, когда используемые праймеры или зонды содержат последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени, эта нуклеиновокислотная последовательность-мишень, имеющая вариабельность нуклеотидов, описывается в настоящем изобретении как сопоставимая матрица (matching template). В том случае, когда используемые праймеры или зонды содержат последовательность, некомплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени, эта нуклеиновокислотная последовательность-мишень, имеющая вариабельность нуклеотидов, описывается в настоящем изобретении как несопоставимая матрица (mismatching template).
Для детекции вариабельностей нуклеотидов 3'-конец располагающегося "вверх по течению" праймера можно сконструировать таким образом, чтобы он располагался напротив сайта с вариабельностью нуклеотидов в нуклеиновокислотной последовательности-мишени. Согласно предпочтительному воплощению 3'-конец располагающегося "вверх по течению" праймера содержит последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени. 3'-Конец располагающегося "вверх по течению" праймера, содержащего последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени, отжигают с сопоставимой матрицей и удлиняют, чтобы индуцировать расщепление PTO. Полученный фрагмент PTO гибридизуется с CTO с получением сигнала от мишени. В отличие от этого, когда 3'-Конец располагающегося "вверх по течению" праймера не соответствует вариабельности нуклеотидов в несопоставимой матрице, он не удлиняется в условиях, необходимых для отжига 3'-конца праймеров и являющихся существенными для удлинения, даже когда располагающийся "вверх по течению" праймер гибридизуется с несопоставимой матрицей, ввиду этого никакого сигнала от мишени не генерируется.
Альтернативно, можно использовать расщепление PTO в зависимости от гибридизации PTO, содержащего последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени. Например, в регулируемых условиях PTO, содержащий последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени, гибридизуется с сопоставимой матрицей и затем расщепляется. Полученный фрагмент PTO гибридизуется с CTO с получением сигнала от мишени. Вместе с тем в регулируемых условиях PTO не гибридизуется с несопоставимой матрицей, содержащей некомплементарную последовательность в месте расположения вариабельности нуклеотидов, и не расщепляется. В этом случае предпочтительно, чтобы последовательность, комплементарная с учетом данной вариабельности нуклеотидов в PTO, была расположена в середине его 3'-концевого узнающего мишень участка PTO.
Альтернативно, предпочтительно, чтобы 5'-концевая часть 3'-концевого узнающего мишень участка PTO была ориентирована по отношению к вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени для детекции этой вариабельности нуклеотидов, а 5'-концевая часть 3'-концевого узнающего мишень участка PTO содержала последовательность, комплементарную с учетом данной вариабельности нуклеотидов в нуклеиновокислотной последовательности-мишени.
В одном из воплощений для детекции однонуклеотидной вариабельности 5'-конец 3'-концевого узнающего мишень участка PTO содержит последовательность, комплементарную с учетом этой однонуклеотидной вариабельности в нуклеиновокислотной последовательности-мишени. Как описано выше, расщепление PTO, гибридизованного с сопоставимой матрицей, может быть индуцировано в сайте, непосредственно примыкающем в 3'-направлении к 5'-концу 3'-концевого узнающего мишень участка РТО, например, в условиях индукции расщепления, зависимого от удлинения располагающегося "вверх по течению" праймера. 3'-Конец фрагмента PTO содержит нуклеотид, комплементарный с учетом данной однонуклеотидной вариабельности. Фрагмент PTO гибридизуется с CTO, содержащим захватывающий участок, содержащий последовательность, соответствующую вариабельности нуклеотидов, и затем удлиняется с образованием удлиненного дуплекса, обеспечивая получение сигнала от мишени. Если с несопоставимой матрицей, содержащей последовательность, идентичную сопоставимой матрице, за исключением однонуклеотидной вариабельности, гибридизуется один и тот же PTO, то расщепление PTO может происходить в сайте, расположенном на расстоянии двух нуклеотидов в 3'-направлении от 5'-конца 3'-концевого узнающего мишень участка PTO. 3'-Конец фрагмента PTO содержит еще один расщепляемый нуклеотид помимо нуклеотида, комплементарного с учетом данной однонуклеотидной вариабельности. Когда сайт CTO, гибридизованного с дополнительным расщепляемым нуклеотидом, конструируют таким, чтобы он содержал последовательность, некомплементарную этому дополнительному расщепляемому нуклеотиду, 3'-Конец фрагмента PTO не гибридизуется с CTO, результатом чего является отсутствие какого-либо удлинения фрагмента PTO в регулируемых условиях. Даже если фрагмент PTO удлиняется с образованием удлиненного дуплекса, данный дуплекс характеризуется величиной Tпл, отличной от таковой для дуплекса, получающегося в результате гибридизации между PTO и несопоставимой матрицей.
Согласно предпочтительному воплощению сайт расщепления PTO, содержащего последовательность, комплементарную с учетом данной вариабельности нуклеотидов в своей 5'-концевой части 3'-концевого узнающего мишень участка, будет разным в зависимости от того, происходит ли гибридизация с сопоставимой матрицей или с несопоставимой матрицей, в связи с чем фрагмент PTO, высвобождаемый в результате любого из этих двух событий гибридизации, имеет разную последовательность, предпочтительно, в своей 3'-концевой части, более предпочтительно, на своем 3'-конце.
Согласно предпочтительному воплощению выбор нуклеотидной последовательности в CTO с учетом разницы в 3'-концевых частях фрагментов PTO позволяет отличить сопоставимую матрицу от несопоставимой матрицы.
Согласно предпочтительному воплощению используемая в настоящем изобретении нуклеиновокислотная последовательность-мишень представляет собой предварительно амплифицированную нуклеиновокислотную последовательность. Использование предварительно амплифицированной нуклеиновокислотной последовательности дает возможность значительно повысить чувствительность и специфичность детекции мишени по настоящему изобретению.
Согласно предпочтительному воплощению способ осуществляют в присутствии располагающегося "вниз по течению" праймера.
Преимущества настоящего изобретения могут быть особо отмечены при одновременной (множественной) детекции по меньшей мере двух нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ осуществляют с целью детекции по меньшей мере двух типов (более предпочтительно по меньшей мере трех типов, еще более предпочтительно по меньшей мере пяти типов) нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению способ осуществляют с целью детекции по меньшей мере двух типов (более предпочтительно по меньшей мере трех типов, еще более предпочтительно по меньшей мере пяти типов) нуклеиновокислотных последовательностей-мишеней; причем располагающийся "вверх по течению" олигонуклеотид включает по меньшей мере два типа (более предпочтительно по меньшей мере три типа, еще более предпочтительно по меньшей мере пять типов) олигонуклеотидов, PTO включает по меньшей мере два типа (более предпочтительно по меньшей мере три типа, еще более предпочтительно по меньшей мере пять типов) PTO, а CTO включает по меньшей мере один тип (предпочтительно, по меньшей мере два типа, более предпочтительно по меньшей мере три типа, еще более предпочтительно по меньшей мере пять типов) CTO; при этом когда присутствуют по меньшей мере два типа нуклеиновокислотных последовательностей-мишеней, данный способ обеспечивает получение по меньшей мере двух типов сигналов от мишеней, соответствующих по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней.
5'-Концевые метящие участки по меньшей мере двух PTO могут иметь идентичную друг другу последовательность. Например, если настоящее изобретение осуществляют для скрининга нуклеиновокислотных последовательностей-мишеней, то 5'-концевые метящие участки PTO могут иметь идентичную последовательность.
Кроме того, один тип CTO можно использовать для детекции множества нуклеиновокислотных последовательностей-мишеней. Например, когда для скрининга нуклеиновокислотных последовательностей-мишеней применяют PTO, содержащие идентичную последовательность в своих 5'-концевых метящих участках, можно использовать один тип CTO.
Согласно предпочтительному воплощению удлиненные дуплексы, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, имеют отличающиеся друг от друга величины Tпл.
Согласно предпочтительному воплощению по меньшей мере два типа сигналов от мишеней, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, создаются посредством отличающихся друг от друга типов меток.
Согласно предпочтительному воплощению по меньшей мере два типа сигналов от мишеней, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, создаются посредством меток одного и того же типа.
Согласно предпочтительному воплощению по меньшей мере два типа сигналов от мишеней, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, создаются посредством меток одного и того же типа; при этом удлиненные дуплексы, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, имеют отличающиеся друг от друга величины Tпл.
Используемый в данном описании термин "различные типы меток" относится к меткам с различными характеристиками детектируемых сигналов. Например, FAM и TAMRA как флуоресцентные репортерные метки, рассматриваются как различные типы меток, поскольку длины волн возбуждения и эмиссии для них отличаются друг от друга.
Когда настоящее изобретение осуществляют с целью одновременной детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней с использованием анализа кривой плавления и удлиненные дуплексы, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, имеют отличающиеся друг от друга величины Tпл, можно осуществить детекцию по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней с применением метки даже одного типа (например, FAM).
Детекция мишени с использованием CTO, иммобилизованного на твердой фазе
Значительное преимущество настоящего изобретения заключается в эффективной детекции нуклеиновокислотных последовательностей-мишеней даже на твердой фазе, такой как микрочип.
Согласно предпочтительному воплощению настоящее изобретение осуществляют на твердой фазе, и СТО иммобилизуют на твердой подложке через его 5'-конец или 3'-конец. В случае использования твердой фазы проводят измерение сигнала, создаваемого на твердой подложке.
Когда применяют иммобилизованный CTO, анализ плавления, в котором используются описанные выше системы меток, применим к реакции на твердой фазе по настоящему изобретению.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством одиночной метки, соединенной с фрагментом, или посредством одиночной метки, встраиваемой в удлиненный дуплекс во время реакции удлинения. В частности, если настоящее изобретение осуществляют на твердой фазе с применением одиночной метки, то можно использовать обычную флуоресцентную метку, и не требуется специальной флуоресцентной метки, способной обеспечить сигналы флуоресценции с различными интенсивностями в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре.
В том случае, когда применяют CTO, иммобилизованный на твердой подложке, можно использовать химические метки (например, биотин) или ферментативные метки (например, щелочную фосфатазу пероксидазу (β-галактозидазу и (β-глюкозидазу).
Для проведения реакции на твердой фазе CTO иммобилизуют непосредственно или опосредованно (предпочтительно опосредованно) через его 5'-конец или 3'-конец (предпочтительно 3'-конец) на поверхности твердой подложки. Кроме того, иммобилизацию CTO на поверхности твердой подложки можно проводить ковалентным или нековалентным образом. В тех случаях, когда иммобилизованные CTO представляют собой CTO, иммобилизованные на поверхности твердой подложки опосредованно, используют подходящие линкеры. Линкеры, полезные в данном изобретении, могут включать любые линкеры, используемые для иммобилизации зондов на поверхности твердой подложки. Например, алкильные или арильные соединения с аминной функциональной группой либо алкильные или арильные соединения с тиоловой функциональной группой служат в качестве линкеров для иммобилизации CTO. Помимо этого, в качестве линкеров может служить поли(T)-хвост или поли(A)-хвост.
Согласно предпочтительному воплощению твердая подложка, используемая в настоящем изобретении, представляет собой микрочип. Микрочип, обеспечивающий соблюдение условий реакции в данном изобретении, может включать любой из микрочипов, которые известны специалисту в данной области. Все процессы в настоящем изобретении, то есть гибридизацию с нуклеиновокислотными последовательностями-мишенями, расщепление, удлинение, плавление и детекцию флуоресценции осуществляют на микрочипе. Иммобилизованные на микрочипе CTO служат в качестве гибридизуемых элементов чипа. Твердая подложка для изготовления микрочипа включает металлы (например, золото, сплав золота и меди, аллюминий), оксид металла, стекло, керамику, кварц, кремний, полупроводник, пластинку из Si/SiO2, германий, арсенид галия, углерод, углеродную нанотрубку, полимеры (например, полистирол, полиэтилен, полипропилен и полиакриламид), сефарозу агарозу и коллоиды, но этим не ограничивается. Большинство используемых в данном изобретении иммобилизованных CTO может быть иммобилизовано на доступном участке или двух или более доступных участках на твердой подложке, которая может содержать 2-1000000 доступных участков. Чтобы получить микрочип или микрочипы для заданного применения, иммобилизованные CTO могут быть изготовлены с использованием традиционных технологий изготовления, таких как фотолитография, технология струйной печати, механическое точечное нанесение пятен и их производные.
Согласно настоящему изобретению, осуществляемому на твердой фазе, можно проводить одновременную детекцию множества нуклеиновокислотных последовательностей-мишеней с использованием метки даже одного типа, поскольку метки на иммобилизованных CTO физически отделены друг от друга. В этом отношении, количество подлежащих детекции нуклеиновокислотных последовательностей-мишеней по настоящему изобретению на твердой фазе является неограниченным.
II. Предпочтительное воплощение с амплификацией нуклеиновокислотной последовательности-мишени
Настоящее изобретение предпочтительно осуществляют одновременно с амплификацией нуклеиновокислотной последовательности-мишени, используя пару праймеров, состоящую из располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, способных участвовать в синтезе данной нуклеиновокислотной последовательности-мишени.
В другом аспекте данного изобретения предложен способ детекции нуклеиновокислотных последовательностей-мишеней из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO), включающий:
(a) гибридизацию нуклеиновокислотных последовательностей-мишеней с парой праймеров, состоящей из располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, и РТО (зондирующим и метящим олигонуклеотидом); при этом каждый из праймеров, располагающийся "вверх по течению" праймер и располагающийся "вниз по течению" праймер, содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; PTO содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; PTO локализован между располагающимся "вверх по течению" праймером и располагающимся "вниз по течению" праймером; при этом PTO блокирован по его 3'-концу, чтобы не допустить его удлинения;
(b) приведение в контакт продукта со стадии (a) с матричной полимеразой нуклеиновых кислот, обладающей 5'-нуклеазной активностью, в условиях, подходящих для удлинения праймеров и для расщепления PTO; при этом когда РТО гибридизуется с нуклеиновокислотными последовательностями-мишенями, располагающийся "вверх по течению" праймер удлиняется и удлиненная цепь индуцирует расщепление PTO матричной полимеразой нуклеиновых кислот, обладающей 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO;
(c) гибридизацию фрагмента, высвободившегося из PTO, с CTO (захватывающим и матричным олигонуклеотидом); при этом CTO содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку; при этом фрагмент, высвободившийся из PTO, гибридизуется с захватывающим участком CTO;
(d) осуществление реакции удлинения с использованием продукта со стадии (c) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком CTO, удлиняется, и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Tпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной CTO либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной CTO;
(e) плавление удлиненного дуплекса в диапазоне температур с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса; при этом сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или CTO, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, или (4) интеркалирующей метки; и
(f) детекцию удлиненного дуплекса путем измерения сигнала от мишени; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
Поскольку в предпочтительном воплощении настоящего изобретения применяются стадии способа по настоящему изобретению, описанного выше, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Согласно предпочтительному воплощению способ дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(f) с денатурацией между повторяющимися циклами. Повторение реакций сопровождается амплификацией нуклеиновокислотной последовательности-мишени. Амплификацию предпочтительно осуществляют в соответствии с ПЦР (полимеразной цепной реакцией), описанной в патентах США №№4683195, 4683202 и 4800159.
Согласно предпочтительному воплощению способ осуществляют для детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению по меньшей мере два типа сигналов от мишеней, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, создаются посредством меток одного и того же типа; при этом удлиненные дуплексы, соответствующие по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней, имеют отличающиеся друг от друга величины Tпл.
III. Способ детекции мишени с использованием PTOCE, включающий детекцию при предварительно заданной температуре
Настоящее изобретение может быть модифицировано с целью использования сигнала от мишени, генерированного совместно с образованием удлиненного дуплекса.
Еще в одном аспекте данного изобретения предложен способ детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO), включающий:
(a) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и PTO (зондирующим и метящим олигонуклеотидом); при этом располагающийся "вверх по течению" олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; PTO содержит (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно PTO;
(b) приведение в контакт продукта со стадии (a) с ферментом, обладающим 5'-нуклеазной активностью, в условиях, подходящих для расщепления PTO; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO;
(c) гибридизацию фрагмента, высвободившегося из PTO, с CTO (захватывающим и матричным олигонуклеотидом); при этом CTO содержит в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO; при этом фрагмент, высвободившийся из PTO, гибридизуется с захватывающим участком CTO;
(d) осуществление реакции удлинения с использованием продукта со стадии (c) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком CTO, удлиняется, и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Tпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной CTO либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной CTO; при этом удлиненный дуплекс обеспечивает получение сигнала от мишени посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или CTO, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) по меньшей мере одной метки, соединенной с фрагментом и/или CTO, и метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, или (4) интеркалирующей метки; и
(e) детекцию удлиненного дуплекса путем измерения сигнала от мишени при предварительно заданной температуре, при которой удлиненный дуплекс сохраняет свою двухцепочечную форму; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
Поскольку в предпочтительном воплощении настоящего изобретения применяются стадии описанного выше способа по настоящему изобретению за исключением стадии плавления, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
В настоящем изобретении, использующем описанный выше анализ плавления, необходима детекция сигналов от меток не менее чем при двух различных температурах, потому что сигнал от мишени получают в виде изменения сигнала, наблюдаемого при плавлении удлиненного дуплекса.
В этом аспекте данного изобретения маловероятно, что удлиненный дуплекс как таковой выдаст сигнал, с помощью которого можно отличить произошло или не произошло образование удлиненного дуплекса, и этот сигнал детектируют при предварительно заданной температуре, при которой удлиненный дуплекс сохраняет свою двухцепочечную форму; тем самым устанавливают присутствие нуклеиновокислотной последовательности-мишени.
Настоящее изобретение относится к измерению сигнала от мишени, связанного с образованием удлиненного дуплекса, для детекции присутствия нуклеиновокислотной последовательности-мишени.
В настоящем изобретении удлиненный дуплекс содержит метку, ввиду чего удлиненный дуплекс обеспечивает получение сигнала от мишени.
Предпочтительно сигнал от мишени представляет собой сигнал (генерацию сигнала или гашение сигнала) от метки на удлиненном дуплексе при предварительно заданной температуре.
Введение метки в настоящем изобретении может быть выполнено таким же образом, как и для описанного выше способа с использованием анализа плавления. Этот аспект настоящего изобретения с небольшим изменением в отношении детекции при предварительно заданной температуре может быть проиллюстрирован на Фиг.2-13.
Рабочий принцип, лежащий в основе получения сигнала от мишени от удлиненного дуплекса, выглядит следующим образом:
(1) удлинение фрагмента индуцирует изменение сигнала от метки, что дает сигнал от мишени; или
(2) гибридизация фрагмента и CTO индуцирует изменение сигнала от метки, что дает сигнал от мишени, и удлиненный дуплекс сохраняет сигнал от мишени.
Поясненное примером воплощение рабочего принципа (1) можно описать со ссылкой на Фиг.9. Если используют иммобилизованные CTO, то в настоящем изобретении детектируют множество нуклеиновокислотных последовательностей-мишеней существенно более эффективным образом. Матричный участок иммобилизованного CTO содержит репортерную молекулу и молекулу-гаситель. Репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. В том случае, когда этот фрагмент гибридизуется с захватывающим участком CTO, молекула-гаситель гасит сигнал от репортерной молекулы. В результате образования удлиненного дуплекса репортерная молекула и молекула-гаситель конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. Сигнал от мишени доставляется на стадии удлинения (C и D на Фиг.9).
Изображенный на Фиг.9 гибрид, образованный нерасщепленным PTO и CTO, не образует удлиненного дуплекса. Ввиду этого, молекула-гаситель по-прежнему может гасить сигнал от репортерной молекулы. Этот гибрид не дает сигнала, не относящегося к мишени.
Поясненное примером воплощение рабочего принципа (2) можно описать со ссылкой на Фиг.6. На данном рисунке проиллюстрирован аспект настоящего изобретения, а также способ с использованием анализа плавления. 5'-Концевой метящий участок PTO содержит репортерную молекулу и молекулу-гаситель. Репортерная молекула и молекула-гаситель конформационно располагаются близко друг к другу, что позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент, содержащий 5'-Концевой метящий участок с репортерной молекулой и молекулой-гасителем, и этот фрагмент гибридизуется с захватывающим участком CTO. В результате гибридизации репортерная молекула и молекула-гаситель конформационно разделяются, что не позволяет молекуле-гасителю гасить сигнал от репортерной молекулы. Сигнал от мишени доставляется на стадии гибридизации фрагмента, и удлиненный дуплекс сохраняет сигнал от мишени (C и D на Фиг.6).
Изображенный на Фиг.6 гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени (C и D на Фиг.6), и необходимо провести диссоциацию этого гибрида, чтобы исключить сигнал, не относящийся к мишени. Ввиду этого температура для измерения сигнала от мишени определяется температурой, необходимой для диссоциации гибрида. Согласно предпочтительному воплощению далее эту температуру определяют с учетом величины Tпл для гибрида.
Согласно предпочтительному воплощению детекцию удлиненного дуплекса можно осуществлять при температурах, при которых гибрид диссоциирован частично.
Предварительно заданная температура превышает величину Tпл для гибрида минус 10°C, предпочтительно превышает величину Tпл для гибрида минус 5°C, более предпочтительно превышает величину Tпл для гибрида и еще более предпочтительно превышает величину Tпл для гибрида плюс 5°C.
Согласно предпочтительному воплощению сигнал от мишени, обеспечиваемый удлиненным дуплексом, доставляется во время стадии удлинения (d); при этом гибрид, образованный нерасщепленным PTO и CTO, не дает сигнала, не относящегося к мишени, как представлено на Фиг.2-4 и 9-11.
Согласно предпочтительному воплощению сигнал от мишени обеспечиваемый удлиненным дуплексом, доставляется в результате гибридизации фрагмента и CTO на стадии (c), и образование удлиненного дуплекса сохраняет сигнал от мишени на стадии (d); при этом гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени; при этом предварительно заданная температура превышает величину Tпл для гибрида, как представлено на Фиг.5-8 и 12-13.
Когда гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени (панель D на Фиг.6), необходимо провести диссоциацию этого гибрида, чтобы исключить сигнал, не относящийся к мишени. Ввиду этого температура для измерения сигнала от мишени определяется температурой, необходимой для диссоциации гибрида.
Системы меток, полезные в этом изобретении, будут обсуждены более подробно ниже.
(1) Метка, соединенная с фрагментом и/или CTO
(1-1) Система двух взаимодействующих меток
В воплощении, относящемся к системе двух взаимодействующих меток, CTO содержит систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом удлинение фрагмента на стадии (d) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени. Первое воплощение такой системы двух взаимодействующих меток проиллюстрировано на Фиг.2. Сигнал от мишени доставляется синхронизированно с генерацией сигнала при удлинении.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель могут быть расположены на матричном участке CTO.
Согласно предпочтительному воплощению одна из молекул на CTO, репортерная молекула или молекула-гаситель, расположена на его 5'-конце или на расстоянии 1-5 нуклеотидов от его 5'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации CTO.
В воплощении, относящемся к системе двух взаимодействующих меток, CTO содержит систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом гибридизация фрагмента и CTO на стадии (c) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени, и удлиненный дуплекс сохраняет сигнал от мишени.
Согласно предпочтительному воплощению репортерная молекула и молекула-гаситель могут быть расположены на захватывающем участке CTO.
Согласно предпочтительному воплощению одна из молекул на CTO, репортерная молекула или молекула-гаситель, расположена на его 3'-конце или на расстоянии 1-5 нуклеотидов от его 3'-конца, а другая расположена так, чтобы гашение и негашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации CTO.
В этом воплощении гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени; причем температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
В воплощении, относящемся к системе двух взаимодействующих меток, фрагмент содержит систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом гибридизация фрагмента и CTO на стадии (c) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени, и удлиненный дуплекс сохраняет сигнал от мишени. Первое воплощение такой системы двух взаимодействующих меток проиллюстрировано на Фиг.6.
Согласно предпочтительному воплощению одна из молекул на фрагменте, репортерная молекула или молекула-гаситель, расположена на его 5'-конце или на расстоянии 1-5 нуклеотидов от 5'-конца фрагмента, а другая расположена так, чтобы гашение сигнала от репортерной молекулы осуществлялось в зависимости от конформации фрагмента.
В этом воплощении гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени; причем температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
В воплощении, относящемся к системе взаимодействующих меток, фрагмент содержит одну из двух взаимодействующих меток, включащих репортерную молекулу и молекулу-гаситель, а CTO содержит другую из двух взаимодействующих меток; при этом гибридизация фрагмента и CTO на стадии (c) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени, и удлиненный дуплекс сохраняет сигнал от мишени. Такое воплощение системы двух взаимодействующих меток проиллюстрировано на Фиг.8.
Репортерная молекула и молекула-гаситель могут быть расположены в любом месте фрагмента PTO и CTO, при условии, что сигнал от репортерной молекулы гасится молекулой-гасителем.
Согласно данному воплощению репортерная молекула или молекула-гаситель на фрагменте PTO расположена предпочтительно на его 5'-конце.
Согласно данному воплощению репортерная молекула или молекула-гаситель на CTO расположена предпочтительно на его 5'-конце.
В этом воплощении гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени; причем температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
(1-2) Одиночная метка
В воплощении, относящемся к системе с одиночной меткой, CTO содержит одиночную метку, и удлинение фрагмента на стадии (d) индуцирует изменение сигнала от этой одиночной метки с получением сигнала от мишени. Такое воплощение системы с одиночной меткой проиллюстрировано на Фиг.3. Сигнал от мишени доставляется синхронизированно с генерацией сигнала при удлинении.
Согласно данному воплощению матричный участок CTO помечен одиночной меткой.
В воплощении, относящемся к системе с одиночной меткой, CTO содержит одиночную метку, и гибридизация фрагмента и CTO на стадии (d) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени, и удлиненный дуплекс сохраняет сигнал от мишени.
Согласно данному воплощению захватывающий участок CTO помечен одиночной меткой.
В этом воплощении гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени; причем температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
В воплощении, относящемся к системе с одиночной меткой, фрагмент содержит одиночную метку, и гибридизация фрагмента и CTO на стадии (c) индуцирует изменение сигнала от системы двух взаимодействующих меток с получением сигнала от мишени, и удлиненный дуплекс сохраняет сигнал от мишени. Такое воплощение системы с одиночной меткой проиллюстрировано на Фиг.12.
В этом воплощении гибрид, образованный нерасщепленным PTO и CTO, обеспечивает получение сигнала, не относящегося к мишени; причем температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
Использование в данном изобретении одиночной метки должно обеспечить получение разных сигналов в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре. Одиночная метка представляет собой флуоресцентную метку, люминесцентную метку хемилюминесцентную метку, электрохимическую метку и металлическую метку. Предпочтительно, чтобы одиночная метка представляла собой флуоресцентную метку. Типы и предпочтительные сайты связывания одиночных флуоресцентных меток, используемых в данном изобретении, описаны в патентах США №№7537886 и 7348141, идеи которых включены в данное описание посредством ссылки во всей своей полноте. Предпочтительно, чтобы одиночная флуоресцентная метка представляла собой JOE, FAM, TAMRA, ROX и другую метку на основе флуоресцеина. Меченый нуклеотидный остаток предпочтительно расположен в позиции внутреннего нуклеотидного остатка в пределах олигонуклеотида, а не на 5'-конце или 3'-конце.
Одиночная метка, используемая в настоящем изобретении, может быть описана со ссылкой на указанные выше описания для репортерной молекулы и молекулы-гасителя.
В частности, если настоящее изобретение осуществляют на твердой фазе с применением одиночной метки, то можно использовать обычную флуоресцентную метку, и не требуется специальной флуоресцентной метки, способной обеспечить получение сигналов флуоресценции с различными интенсивностями в зависимости от ее присутствия на двухцепочечной или одноцепочечной структуре.
В том случае, когда применяют CTO, иммобилизованный на твердой подложке, можно использовать химические метки (например, биотин) или ферментативные метки (например, щелочную фосфатазу пероксидазу β-галактозидазу и β-глюкозидазу).
В предпочтительном воплощении метки, соединенные с фрагментом и/или CTO, расположены таким образом, что если получается гибрид, образованный нерасщепленным PTO и CTO, то этот гибрид не дает сигнала, не относящегося к мишени, на стадии (d), как представлено на Фиг.2-3 и 9.
Альтернативно, метки могут быть расположены таким образом, что если получается гибрид, образованный нерасщепленным PTO и CTO, то этот гибрид дает сигнал, не относящийся к мишени, на стадии (d); при этом величина Tпл для удлиненного дуплекса превышает таковую для гибрида, образованного нерасщепленным PTO и CTO, как представлено на Фиг.6-8 и 12.
(2) Метка, встраиваемая в удлиненный дуплекс
В частности, когда настоящее изобретение осуществляют на твердой фазе с использованием иммобилизованного CTO, эта система меток более полезна для получения сигнала от мишени, как показано на Фиг.10 и 11.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством одиночной метки, встраиваемой в удлиненный дуплекс во время реакции удлинения; причем встраиваемая одиночная метка соединена с нуклеотидом, встраиваемым во время реакции удлинения; при этом удлинение фрагмента на стадии (d) индуцирует изменение сигнала от одиночной метки с получением сигнала от мишени на стадии (d).
Согласно предпочтительному воплощению нуклеотид, встраиваемый во время реакции удлинения, содержит первое неприродное основание, а CTO содержит нуклеотид, содержащий второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием, как показано на Фиг.11. Нуклеотид, содержащий второе неприродное основание, предпочтительно расположен в любом сайте на матричном участке CTO.
Если применяется метка, встраиваемая в удлиненный дуплекс во время реакции удлинения, то эта метка не встраивается в гибрид, образованный нерасщепленным PTO и CTO, поскольку гибрид не удлиняется. Таким образом, данный гибрид не дает сигнала, не относящегося к мишени.
(3) Метка, встраиваемая в удлиненный дуплекс, и метка, соединенная с фрагментом или CTO
В настоящем изобретении можно применять систему меток, в которой используется совместное действие метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO, как показано на Фиг, 4 и 5.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или CTO; причем встраиваемая метка соединена с нуклеотидом, встраиваемым во время реакции удлинения; причем эти две метки представляют собой систему двух взаимодействующих меток, состоящую из репортерной молекулы и молекулы-гасителя; при этом удлинение фрагмента на стадии (d) индуцирует изменение сигнала от этой системы двух взаимодействующих меток с получением сигнала от мишени.
Более предпочтительно, чтобы нуклеотид, встраиваемый во время реакции удлинения, содержал первое неприродное основание, а CTO содержал нуклеотид, содержащий второе неприродное основание с аффинностью специфического связывания с первым неприродным основанием.
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой сигнал от системы двух взаимодействующих меток на стадии (d).
Если применяется метка, встраиваемая в удлиненный дуплекс во время реакции удлинения, то эта метка не встраивается в гибрид, образованный нерасщепленным PTO и CTO, поскольку гибрид не удлиняется. Таким образом, данный гибрид не дает сигнала, не относящегося к мишени.
(4) Интеркалирующая метка
В настоящем изобретении можно применять интеркалирующую метку для получения сигнала от мишени, указывающего на присутствие удлиненного дуплекса. Интеркалирующая метка более полезна в реакции на твердой фазе с использованием иммобилизованных CTO ввиду того, что генерировать сигналы могут двухцепочечные молекулы нуклеиновых кислот, присутствующие в образцах.
Поясненное примером воплощение описано со ссылкой на Фиг.13. PTO, гибридизованный с нуклеиновокислотной последовательностью-мишенью, переваривается, высвобождая фрагмент. Фрагмент гибридизуется с CTO. Удлинение осуществляют в присутствии интеркалирующего красителя (например, SYBR™ Green), и образуется удлиненный дуплекс с интеркалирующими красителями.
Изображенный на Фиг.13 гибрид, образованный нерасщепленным РТО и CTO, дает сигнал, не относящийся к мишени (C и D на Фиг.13), и необходимо провести диссоциацию этого гибрида, чтобы исключить сигнал, не относящийся к мишени. Ввиду этого температуру для измерения сигнала от мишени определяют с учетом величины Tпл для гибрида.
Предпочтительно, чтобы сигнал от мишени, доставляемый на стадии (e), представлял собой сигнал от интеркалирующего красителя.
Согласно предпочтительному воплощению PTO и/или CTO блокирован по его 3'-концу, чтобы не допустить его удлинения.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид представляет собой располагающийся "вверх по течению" праймер или располагающийся "вверх по течению" зонд.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид локализован вблизи PTO таким образом, что этот располагающийся "вверх по течению" олигонуклеотид индуцирует расщепление PTO ферментом, Обладающим 5'-нуклеазной активностью.
Согласно предпочтительному воплощению располагающийся "вверх по течению" праймер индуцирует посредством своей удлиненной цепи расщепление PTO ферментом, обладающим 5'-нуклеазной активностью.
Согласно предпочтительному воплощению способ дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(e) с денатурацией между повторяющимися циклами.
Согласно предпочтительному воплощению стадии (a)-(b) и (c)-(e) осуществляют в реакционном сосуде или в отдельных реакционных сосудах.
Согласно предпочтительному воплощению способ осуществляют с целью детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней; причем располагающийся "вверх по течению" олигонуклеотид включает по меньшей мере два типа олигонуклеотидов, PTO включает по меньшей мере два типа PTO, а CTO включает по меньшей мере один тип CTO; при этом когда присутствуют по меньшей мере два типа нуклеиновокислотных последовательностей-мишеней, данный способ обеспечивает получение по меньшей мере двух типов сигналов от мишеней, соответствующих по меньшей мере двум типам нуклеиновокислотных последовательностей-мишеней.
Согласно предпочтительному воплощению располагающийся "вверх по течению" олигонуклеотид представляет собой располагающийся "вверх по течению" праймер, и на стадии (b) для удлинения располагающегося "вверх по течению" праймера используют матричную полимеразу нуклеиновых кислот.
Согласно предпочтительному воплощению CTO иммобилизован на твердой подложке через свой 5'-конец или 3'-конец, и сигнал от мишени, создаваемый на твердой подложке, измеряют.
Согласно предпочтительному воплощению получение сигнала от мишени обеспечивается посредством одиночной метки, соединенной с фрагментом, или посредством одиночной метки, встраиваемой в удлиненный дуплекс во время реакции удлинения.
Согласно предпочтительному воплощению способ осуществляют в присутствии располагающегося "вниз по течению" праймера.
Детекция на стадии (e) может быть осуществлена в режиме реального времени, в режиме конечной точки или в режиме предварительно заданного интервала времени. Когда настоящее изобретение дополнительно включает повторение стадий (a)-(b), (a)-(d) или (a)-(e), предпочтительно, чтобы детекция сигналов осуществлялась для каждого цикла такого повторения при предварительно заданной температуре (то есть в режиме реального времени), в конце повторения при предварительно заданной температуре (то есть в режиме конечной точки) или в каждый из предварительно заданных интервалов времени в процессе повторения при предварительно заданной температуре. Предпочтительно, чтобы детекция могла быть осуществлена для каждого цикла повторения в режиме реального времени для улучшения точности и количественной оценки детекции.
IV. Наборы для детекции мишени
В другом аспекте данного изобретения предложен набор для детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с PTOCE (расщеплением и удлинением PTO), содержащий:
(a) располагающийся "вверх по течению" олигонуклеотид, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени;
(b) PTO (зондирующий и метящий олигонуклеотид), содержащий (1) 3'-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5'-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3'-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5'-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно PTO; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5'-концевой метящий участок или часть 5'-концевого метящего участка PTO; и
(c) CTO (захватывающий и матричный олигонуклеотид), содержащий в направлении 3'→5' (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5'-концевому метящему участку или части 5'-концевого метящего участка PTO, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5'-концевому метящему участку и 3'-концевому узнающему мишень участку PTO; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком CTO; и фрагмент, гибридизованный с захватывающим участком CTO, удлиняется под действием матричной полимеразы нуклеиновых кислот с образованием удлиненного дуплекса.
Поскольку набор по данному изобретению составлен для осуществления описанного выше способа детекции по настоящему изобретению, общее для них описание опущено, чтобы избежать излишнего дублирования, приводящего к усложнению данного описания.
Согласно предпочтительному воплощению набор дополнительно содержит фермент, обладающий 5'-нуклеазной активностью.
Согласно предпочтительному воплощению набор дополнительно содержит матричную полимеразу нуклеиновых кислот.
Согласно предпочтительному воплощению PTO и/или CTO содержит по меньшей мере одну метку.
Согласно предпочтительному воплощению набор дополнительно содержит метку, встраиваемую в удлиненный дуплекс во время реакции удлинения.
Согласно предпочтительному воплощению набор дополнительно содержит метку встраиваемую в удлиненный дуплекс во время реакции удлинения, и PTO и/или CTO содержит по меньшей мере одну метку
Согласно предпочтительному воплощению набор дополнительно содержит интеркалирующую метку.
Согласно предпочтительному воплощению метка представляет собой одиночную метку или систему двух взаимодействующих меток.
Согласно предпочтительному воплощению набор используют для детекции по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней, располагающийся "вверх по течению" олигонуклеотид включает по меньшей мере два типа олигонуклеотидов, PTO включает по меньшей мере два типа PTO, и CTO включает по меньшей мере два типа CTO.
Согласно предпочтительному воплощению CTO иммобилизован на твердой подложке через свой 5'-конец или 3'-конец.
Согласно предпочтительному воплощению набор дополнительно содержит располагающийся "вниз по течению" праймер.
Все наборы по настоящему изобретению, описанные выше, возможно могут содержать реагенты, необходимые для проведения амплификации мишени с использованием реакций ПЦР (например, ПЦР-реакций), такие как буферы, кофакторы ДНК-полимеразы и дезоксирибонуклеотид-5-трифосфаты. Возможно, что данные наборы также могут содержать молекулы различных полинуклеотидов, обратную транскриптазу, различные буферы и реагенты, и антитела, ингибирующие ДНК-полимеразную активность. Наборы также могут содержать реагенты, необходимые для проведения реакций положительного и отрицательного контроля. Оптимальные количества реагентов, которые будут использоваться в заданной реакции, могут быть легко определены специалистом на основе информации, содержащейся в данном описании. Эти наборы обычно устроены так, чтобы содержать описанные выше компоненты в разных упаковках или отделах.
Признаки и преимущества данного изобретения будут обобщены ниже.
(a) Согласно настоящему изобретению образуется мишень-зависимый удлиненный дуплекс, в котором PTO (зондирующий и метящий олигонуклеотид), гибридизованный с нуклеиновокислотной последовательностью-мишенью, расщепляется с высвобождением фрагмента, и этот фрагмент гибридизуется с CTO (захватывающим и матричным олигонуклеотидом) с образованием удлиненного дуплекса. Удлиненный дуплекс обеспечивает получение сигнала (генерацию или гашение сигнала) или изменение сигнала (усиление или ослабление сигнала), указывающее на присутствие нуклеиновокислотной последовательности-мишени.
(b) Присутствие удлиненного дуплекса определяют с использованием ряда методов или способов, таких как анализ кривой плавления и детекция при предварительно заданной температуре (например, в режиме реального времени и в режиме конечной точки).
(c) Настоящее изобретение дает возможность осуществить одновременную детекцию по меньшей мере двух типов нуклеиновокислотных последовательностей-мишеней посредством анализа кривой плавления с использованием метки даже одного типа (например, FAM). В отличие от этого традиционный способ множественной детекции в режиме реального времени, осуществляемый в жидкой фазе, действительно страдает от ограничений, связанных с количеством детектируемых флуоресцентных меток. Настоящее изобретение позволяет успешно преодолеть такие недостатки и расширить область применения способа множественной детекции в режиме реального времени.
(d) Настоящее изобретение может быть осуществлено с использованием большого числа систем меток. Например, метки, соединенные с любым сайтом PTO и/или CTO, можно использовать для получения сигнала от мишени, указывающего на присутствие удлиненного дуплекса. Кроме того, в настоящем изобретении могут быть использованы метки, встраиваемые в удлиненный дуплекс во время реакции удлинения. Помимо этого можно использовать комбинацию таких меток. Разносторонние системы меток, применимые в настоящем изобретении, дают возможность авторам изобретения выбирать подходящую систему меток в зависимости от экспериментальных условий или целей исследования.
(e) Согласно настоящему изобретению образуется мишень-зависимый удлиненный дуплекс, имеющий предварительно заданную величину Tпл, регулируемую (1) последовательностью и/или длиной фрагмента, (2) последовательностью и/или длиной CTO или (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной CTO.
(f) Традиционный анализ кривой плавления с использованием амплифицированного продукта зависит от последовательности этого амплифицированного продукта, поэтому трудно получить желаемую величину Tпл для амплифицированного продукта. В отличие от этого, в настоящем изобретении прослеживается зависимость от последовательности удлиненного дуплекса, а не от последовательности амплифицированного продукта, что дает возможность выбора желаемой величины Tпл для удлиненного дуплекса. Ввиду этого, настоящее изобретение легко может быть адаптировано для детекции множественных последовательностей-мишеней.
(g) В традиционном анализе кривой плавления с использованием непосредственной гибридизации между мечеными зондами и нуклеиновокислотными последовательностями-мишенями с большой вероятностью получаются ложноположительные сигналы вследствие неспецифической гибридизации зондов. В отличие от этого, в настоящем изобретении применяется не только гибридизация PTO, но также ферментативное расщепление и удлинение, что позволяет полностью преодолеть проблемы, связанные с ложноположительными сигналами.
(h) На величину Tпл в традиционном анализе кривой плавления влияет вариабельность последовательности в нуклеиновокислотных последовательностях-мишенях. Однако наличие удлиненного дуплекса в настоящем изобретении обеспечивает постоянную величину Tпл независимо от вариабельности последовательности в нуклеиновокислотных последовательностях-мишенях, позволяя обеспечить исключительную точность в анализе кривой плавления.
(i) Следует отметить, что последовательность 5'-концевого метящего участка PTO и последовательность CTO могут быть выбраны без учета нуклеиновокислотных последовательностей-мишеней. Это позволяет предварительно конструировать пул последовательностей для 5'-концевого метящего участка PTO и CTO. Несмотря на то, что 3'-концевой узнающий мишень участок PTO должен быть получен с учетом нуклеиновокислотных последовательностей-мишеней, CTO можно получить стандартным образом без учета или сведений о нуклеиновокислотных последовательностях-мишенях. Такие признаки обеспечивают помимо прочего значительные преимущества при множественной детекции мишеней в анализе на микрочипах с использованием CTO, иммобилизованных на твердой подложке.
Настоящее изобретение далее более подробно будет описано в примерах. Специалистам в данной области техники будет очевидно, что эти примеры предназначены для более конкретного иллюстрирования, и объем настоящего изобретения, как он изложен в прилагаемой формуле изобретения, не ограничивается данными примерами.
ПРИМЕРЫ
ПРИМЕР 1. Оценка применимости анализа с расщеплением и удлинением зондирующего и метящего олигонуклеотида (PTOCE)
Проводили оценку нового анализа - анализа с расщеплением и удлинением зондирующего и метящего олигонуклеотида (PTOCE) - в отношении того, может ли удлиненный дуплекс обеспечивать сигнал от мишени, достаточный для детекции нуклеиновокислотной последовательности-мишени.
Для проведения этой оценки выполняли PTOCE-анализ с детекцией присутствия удлиненного дуплекса посредством анализа плавления (PTOCE-анализ, включающий в себя анализ плавления). Для удлинения располагающегося "вверх по течению" праймера, расщепления PTO и удлинения фрагмента PTO авторы изобретения использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
Планировалось, чтобы удлиненный дуплекс, образуемый в процессе анализа, содержал систему двух взаимодействующих меток. Наличие системы двух взаимодействующих меток в удлиненном дуплексе обеспечивалось посредством (1) CTO, меченного репортерной молекулой и молекулой-гасителем, (CTO с двумя метками) или (2) PTO, содержащего молекулу-гаситель, и CTO, содержащего репортерную молекулу PTO и CTO блокируют углеродным спейсером по их 3'-концам. В качестве матрицы-мишени использовали синтетический олигонуклеотид для гена Neisseria gonorrhoeae (NG).
1-1. PTOCE-анализ с использованием CTO с двумя метками
PTO не содержит метки. CTO содержит молекулу-гаситель (BHQ-1) и флуоресцентную репортерную молекулу (FAM) в своем матричном участке. Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
Реакцию проводили в конечном объеме 20 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 5 пмоль PTO (SEQ ID NO: 3), 2 пмоль CTO (SEQ ID NO: 4) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 30 циклам по 30 с при 95°C и 60 с при 60°C. По окончании реакции получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показывает Фиг.14, пик при температуре 76,5°C, соответствующей ожидаемой величине Tпл удлиненного дуплекса, детектировали в присутствии матрицы. В отсутствие матрицы никакого пика не детектировали. Поскольку гибрид, образованный нерасщепленным PTO и CTO, не дает какого-либо сигнала в этом способе мечения, никакого пика, соответствующего гибриду, образованному нерасщепленным PTO и CTO, не отмечено. В случае отсутствия PTO или отсутствия CTO не наблюдали какого-либо пика.
1-2. PTOCE-анализ с использованием меченного молекулой-гасителем PTO и меченного репортерной молекулой CTO
PTO помечен молекулой-гасителем (BHQ-1) по своему 5'-концу. CTO помечен флуоресцентной репортерной молекулой (FAM) по своему 3'-концу.
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
Реакцию проводили в конечном объеме 20 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1), для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 5 пмоль РТО (SEQ ID NO: 5), 2 пмоль СТО (SEQ ID NO: 6) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 30 циклам по 30 с при 95°C, 60 с при 60°C и 30 с при 72°C. По окончании реакции получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показывает Фиг.15, пик при температуре 77,0°C, соответствующей ожидаемой величине Tпл удлиненного дуплекса, детектировали в присутствии матрицы. Поскольку гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени, в этом способе мечения, наблюдали пик при температуре 64,0°C~64,5°C, соответствующей ожидаемой величине Tпл гибрида, образованного нерасщепленным PTO и CTO. В случае отсутствия РТО или отсутствия СТО не наблюдали какого-либо пика.
Эти результаты указывают на то, что образуется мишень-зависимый удлиненный дуплекс и что тот удлиненный дуплекс обеспечивает получение сигнала от мишени, указывающего на присутствие нуклеиновокислотной последовательности-мишени.
ПРИМЕР 2. Регулируемость величины Tпл удлиненного дуплекса
Далее авторы изобретения исследовали, существует ли возможность регуляции величины Tпл удлиненного дуплекса в зависимости от последовательности CTO в PTOCE-анализе.
Для этого исследования авторы изобретения использовали три типа CTO, содержащих разные последовательности на своих матричных участках. PTO не содержит метки. Все три типа CTO содержат молекулу-гаситель (BHQ-1) и флуоресцентную репортерную молекулу (FAM) на своих матричных участках. PTO и CTO блокированы углеродным спейсером по своим 3'-концам.
PTOCE-анализ, включающий в себя анализ плавления, проводили с каждым из трех типов CTO.
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO.)
Реакцию проводили в конечном объеме 20 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1), для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO 2), 5 пмоль РТО (SEQ ID NO: 7), 2 пмоль СТО (SEQ ID NO: 4, 8 или 9) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 30 циклам по 30 с при 95°C и 60 с при 60°C. По окончании реакции получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг.16, пик детектировали при температурах 76,0°C, 69,0°C или 64,5°C в присутствии матрицы. Каждый пик соответствует ожидаемой величине Tпл удлиненного дуплекса, образованного из исследуемого CTO. В случае отсутствия матрицы не наблюдали никакого пика.
Эти результаты указывают на то, что существует возможность регуляции величины Tпл удлиненного дуплекса в зависимости от последовательности CTO.
ПРИМЕР 3. Детекция нуклеиновокислотной последовательности-мишени в PTOCE-анализе, включающем в себя детекцию в режиме реального времени или анализ плавления
Далее авторы изобретения исследовали, можно ли в PTOCE-анализе осуществлять детекцию нуклеиновокислотной последовательности-мишени посредством ПЦР в режиме реального времени (1) или посредством пост-ПЦР анализа плавления (2). (1) Расщепление РТО и удлинение фрагмента РТО дополняли амплификацией нуклеиновой кислоты-мишени, используя процесс ПЦР, и детекцию присутствия удлиненного дуплекса осуществляли при предварительно заданной температуре в каждом цикле (PTOCE-анализ, включающий в себя детекцию в режиме реального времени при предварительно заданной температуре); или (2) расщепление PTO и удлинение фрагмента PTO дополняли амплификацией нуклеиновой кислоты-мишени, используя процесс ПЦР, и детекцию присутствия удлиненного дуплекса осуществляли посредством пост-ПЦР анализа плавления (PTOCE-анализ, включающий в себя анализ плавления).
Располагающийся "вверх по течению" праймер вовлечен в расщепление PTO ферментом, обладающим 5'-нуклеазной активностью, и также вовлечен в амплификацию нуклеиновокислотной последовательности-мишени с участием располагающегося "вниз по течению" праймера в результате процесса ПЦР. Для удлинения располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, расщепления PTO и удлинения фрагмента PTO использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
Планировалось, чтобы удлиненный дуплекс содержал систему двух взаимодействующих меток. Наличие системы двух взаимодействующих меток в удлиненном дуплексе обеспечивалось посредством (1) CTO, меченного репортерной молекулой и молекулой-гасителем, (2) структуры гаситель-изо-dGTP, встраиваемой во время реакции удлинения, и CTO, содержащего репортерную молекулу и остаток изо-dC, или (3) PTO, содержащего молекулу-гаситель, и CTO, содержащего репортерную молекулу. PTO и CTO блокируют углеродным спейсером по их 3'-концам.
В качестве нуклеиновой кислоты-мишени использовали геномную ДНК из Neisseria gonorrhoeae (NG).
3-1. PTOCE-анализ с использованием CTO с двумя метками
PTO не содержит метки, а CTO помечен молекулой-гасителем (BHQ-1) и флуоресцентной репортерной молекулой (FAM) в своем матричном участке.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок РТО).
3-1-1. PTOCE-анализ, включающий в себя детекцию в режиме реального времени при предварительно заданной температуре
Реакцию проводили в конечном объеме 20 мкл, содержащем 100 пг геномной ДНК из NG, 10 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO: 10), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 5 пмоль PTO (SEQ ID NO: 7), 2 пмоль CTO (SEQ ID NO: 4) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 60 циклам по 30 с при 95°C, 60 с при 60°C и 30 с при 72°C. Детекцию сигнала осуществляли при 60°C каждого цикла. Температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму
Как показано на Фиг.17A, сигнал от мишени (Ct (порог насыщения реакции (cycle threshold)) 31,36) детектировали в присутствии матрицы. В отсутствие матрицы никакого сигнала не детектировали.
3-1-2. PTOCE-анализ, включающий в себя анализ плавления
По окончании реакции в примере 3-1-1 получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг.17B, пик при температуре 76,0°C, соответствующей ожидаемой величине Tпл удлиненного дуплекса, детектировали в присутствии матрицы. В отсутствие матрицы никакого пика не детектировали. Поскольку гибрид, образованный нерасщепленным PTO и CTO, не дает какого-либо сигнала в этом способе мечения, не наблюдали никакого пика, соответствующего гибриду образованному нерасщепленным PTO и CTO.
3-2. PTOCE-анализ с использованием структуры гаситель-изо-dGTP и меченного репортерной молекулой CTI, содержащего остаток изо-dC
PTO не содержит метки, CTO содержит флуоресцентную репортерную молекулу (FAM) и остаток изо-dC на своем 5'-конце. Во время реакции удлинения фрагмента PTO, изо-dGTP, меченный молекулой-гасителем (DABCYL), встраивается в положение, комплементарное остатку изо-dC.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
3-2-1. PTOCE-анализ, включающий в себя детекцию в режиме реального времени при предварительно заданной температуре
Реакцию проводили в конечном объеме 20 мкл, содержащем 100 пг геномной ДНК из NG, 10 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO: 10), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 5 пмоль PTO (SEQ ID NO: 3), 2 пмоль CTO (SEQ ID NO: 11) и 10 мкл смеси 2× Plexor® Master Mix (кат. №A4100, Promega, USA); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 60 циклам по 30 с при 95°C, 60 с при 60°C, 30 с при 72°C и 5 циклам по 30 с при 72°C, 30 с при 55°C. Детекцию сигнала осуществляли при 60°C каждого цикла. Температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму
Для удлинения располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, расщепления PTO и удлинения фрагмента РТО использовали ДНК-полимеразу, обладающую 5'-нуклеазной активностью, в составе Plexor® Master Mix.
Как показано на Фиг.18A, сигнал от мишени (Ct 33,03) детектировали в присутствии матрицы. В отсутствие матрицы никакого сигнала не детектировали.
3-2-2. PTOCE-анализ, включающий в себя анализ плавления
По окончании реакции в примере 3-2-1 получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг.18B, пик при температуре 70,0°C, соответствующей ожидаемой величине Tпл удлиненного дуплекса, детектировали в присутствии матрицы. В отсутствие матрицы никакого пика не детектировали. Поскольку гибрид, образованный нерасщепленным PTO и CTO, не дает какого-либо сигнала в этом способе мечения, не наблюдали никакого пика, соответствующего гибриду, образованному нерасщепленным PTO и CTO.
3-3. PTOCE-анализ с использованием меченного гасителем PTO и меченного репортерной молекулой CTO
PTO помечен молекулой-гасителем (BHQ-1) по своему 5'-концу. CTO помечен флуоресцентной репортерной молекулой (FAM) по своему 3'-концу.
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
3-3-1. PTOCE-анализ, включающий в себя детекцию в режиме реального времени при предварительно заданной температуре
Реакцию проводили в конечном объеме 20 мкл, содержащем 100 пг геномной ДНК из NG, 10 пмоль располагающегося "вниз по течению" праймера (SEQ ID NO: 10), 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 5 пмоль PTO (SEQ ID NO: 12), 2 пмоль СТО (SEQ ID NO: 6) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 60 циклам по 30 с при 95°C, 60 с при 60°C и 30 с при 72°C. Детекцию сигнала осуществляли при 60°C каждого цикла. Температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму, и эта температура превышает величину Tпл гибрида, образованного нерасщепленным PTO и CTO.
Как показано на Фиг.19A, сигнал от мишени (Ct 29,79) детектировали в присутствии матрицы. В отсутствие матрицы никакого сигнала не детектировали.
3-3-2. PTOCE-анализ. включающий в себя анализ плавления
По окончании реакции в примере 3-3-1 получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг.19B, пик при температуре 76,5°C, соответствующей ожидаемой величине Tпл удлиненного дуплекса, детектировали в присутствии матрицы. Поскольку гибрид, образованный нерасщепленным PTO и CTO, дает сигнал, не относящийся к мишени, в этом способе мечения, при 48,0°C в отсутствие матрицы детектировали пик, соответствующий величине Tпл гибрида, образованного нерасщепленным PTO и CTO.
Эти результаты указывают на то, что детекцию нуклеиновокислотной последовательности-мишени можно осуществлять в PTOCE-анализе, включающем в себя детекцию в режиме реального времени или анализ плавления.
ПРИМЕР 4. Детекция множественных нуклеиновокислотных последовательностей-мишеней в PTOCE-анализе, включающем в себя анализ плавления
Авторы изобретения также исследовали, возможно ли в PTOCE-анализе, включающем в себя анализ плавления, осуществлять детекцию множественных нуклеиновокислотных последовательностей-мишеней с использованием репортерной молекулы одного и того же типа.
Расщепление PTO и удлинение фрагмента PTO дополняли амплификацией нуклеиновокислотных последовательностей-мишеней, используя процесс ПЦР, и детекцию присутствия удлиненных дуплексов осуществляли посредством пост-ПЦР анализа плавления (PTOCE-анализ, включающий в себя анализ плавления).
Планировалось, чтобы удлиненные дуплексы, образуемые в процессе анализа, содержали систему двух взаимодействующих меток. Наличие системы двух взаимодействующих меток в удлиненном дуплексе обеспечивалось посредством CTO, меченного репортерной молекулой и молекулой-гасителем в своем матричном участке. CTO содержат флуоресцентную репортерную молекулу (FAM) одного и того же типа, но имеют различные последовательности для получения разных величин Tпл удлиненных дуплексов. PTO и CTO блокированы углеродным спейсером по своим 3'-концам.
В качестве нуклеиновых кислот-мишеней использовали геномные ДНК из Neisseria gonorrhoeae (NG) и Staphylococcus aureus (SA).
Последовательности располагающегося "вверх по течению" праймера, располагающегося "вниз по течению" праймера, PTO и CTO, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
Реакцию проводили в конечном объеме 20 мкл, содержащем 100 пг геномной ДНК из NG, 100 пг геномной ДНК из SA, по 10 пмоль каждого располагающегося "вниз по течению" праймера (SEQ ID NO: 10 и 13), по 10 пмоль каждого располагающегося "вверх по течению" праймера (SEQ ID NO: 2 и 14), по 5 пмоль каждого РТО (SEQ ID NO: 7 и 15), по 2 пмоль каждого СТО (SEQ ID NO: 4 и 16) и 10 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 1,6 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 60 циклам по 30 с при 95°C, 60 с при 60°C и 30 с при 72°C. По окончании реакции получали кривую плавления, охлаждая реакционную смесь до 35°C, выдерживая при 35°C в течение 30 с и медленно нагревая от 35°C до 90°C. Флуоресценцию измеряли непрерывно в процессе повышения температуры для мониторинга диссоциации двухцепочечных ДНК. Из данных кривой плавления получали данные о пике плавления.
Как показано на Фиг.20, множественные сигналы от мишеней (Tпл для NG: 75,5°C; и Tпл для SA: 63,5°C) детектировали в присутствии матриц. В отсутствие матриц никакого сигнала не детектировали.
Эти результаты указывают на то, что PTOCE-анализ, включающий в себя анализ плавления, дает возможность авторам изобретения осуществлять детекцию множественных нуклеиновых кислот-мишеней с использованием репортерной молекулы одного и того же типа (например, FAM) в условиях, когда удлиненные дуплексы, соответствующие этим нуклеиновым кислотам-мишеням, имеют различные величины Tпл.
ПРИМЕР 5. Оценка применимости PTOCE-анализа, включающего в себя анализ плавления на микрочипе
Далее авторы изобретения исследовали применимость PTOCE-анализа, включающего в себя анализ плавления на микрочипе. Расщепление PTO проводили в отдельном сосуде и аликвоту полученного продукта переносили в микрочип с иммобилизованным CTO. По окончании реакции удлинения присутствие удлиненного дуплекса определяли путем детекции в анализе плавления.
Для удлинения располагающегося "вверх по течению" праймера, расщепления PTO и удлинения фрагмента PTO использовали Taq ДНК-полимеразу обладающую 5'-нуклеазной активностью. Планировалось, чтобы удлиненный дуплекс, образуемый в процессе анализа, содержал одиночную метку. Наличие одиночной метки в удлиненном дуплексе обеспечивалось посредством PTO, меченного Quasar570 в качестве флуоресцентной репортерной молекулы по своему 5'-концу. PTO и CTO блокируют углеродным спейсером по их 3'-концам. CTO содержит поли(T)5 в качестве линкерной ножки, и его иммобилизовали на поверхности стеклянной пластинки, используя аминогруппу (аминоC7) на его 5'-конце. Маркерный зонд, содержащий флуоресцентную репортерную молекулу (Quasar570) на своем 5'-конце, был иммобилизован на поверхности стеклянной пластинки с использованием аминогруппы на его 3'-конце.
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO, CTO и маркера, использованных в этом примере, представляют собой:

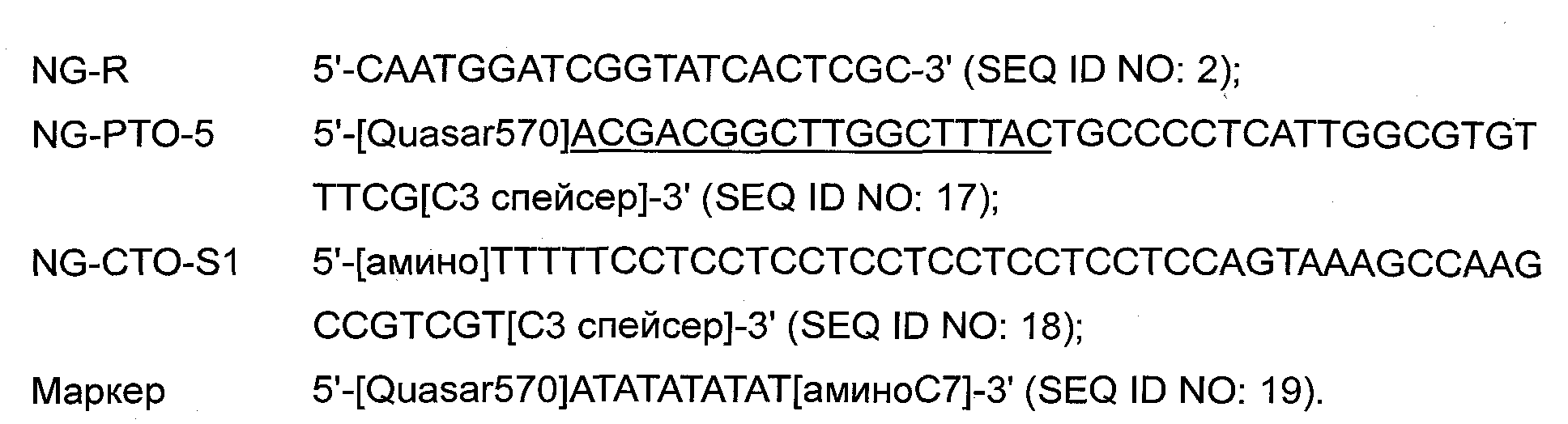
(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
Для изготовления CTO и маркера (SEQ ID NO: 18 и 19) использовали NHS-пластинки (N-гидроксисукцинимид) NSB9 (NSBPOSTECH (NanoSurface Biosciences at Pohang University of Science and Technology), Korea). CTO и маркер, растворенные в NSB-буфере для точечного нанесения в конечной концентрации 10 мкм, печатали на NSB9 NHS-пластинках с использованием споттера для микрочипов (microarray spotter) PersonalArrayer™ 16 (CapitalBio, China). СТО и маркер наносили в виде пятен по одной линии в формате 2×1 (пятна в двух повторах) и полученный микрочип инкубировали в камере с поддержанием ~85%-ной влажности в течение ночи. Затем пластинки промывали в буферном растворе, содержащем 2×SSPE (0,3 М хлорид натрия; 0,02 М гидрофосфат натрия и 2,0 мМ EDTA (этилендиаминтетрауксусная кислота)), pH 7,4 и 7,0 мМ SDS (додецилсульфат натрия), при 37°C в течение 30 мин для удаления неспецифически связавшихся CTO и маркера и промывали дистиллированной водой. Затем ДНК-функционализированные пластинки сушили с применением центрифуги для пластинок и хранили в темноте при 4°C до применения.
Реакцию расщепления проводили в конечном объеме 50 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 1 пмоль РТО (SEQ ID NO: 17) и 25 мкп смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 4 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 30 циклам по 30 с при 95°C и 60 с при 63°C.
30 мкл полученной смеси помещали в камеру, собранную на поверхности стеклянной пластинки NSB, к которой был пришит CTO (SEQ ID NO: 18). Пластинку располагали на блоке в термоциклере (Genepro B4I, China). Для анализа плавления готовили шесть одинаковых пластинок. Реакцию удлинения проводили в течение 20 мин при 55°C. Затем полученные пластинки инкубировали в течение 1 мин при комнатной температуре, В конце каждую пластинку промывали дистиллированной водой в течение 1 мин при 44°C, 52°C, 60°C, 68°C, 76°C или 84°C. Получение изображений осуществляли с применением конфокального лазерного сканирующего устройства Axon GenePix4100A (Molecular Device, US) со сканированием при разрешении с размером пикселя 5 мкм. Интенсивность флуоресценции анализировали с применением программного обеспечения для количественного анализа микрочипов GenePix pro6.0 (Molecular Device, US). Интенсивность флуоресценции выражали в виде средних значений по пятнам после вычитания локального фона. Для проверки воспроизводимости каждое пятно анализировали в двух повторах. Интенсивность флуоресценции указывает среднюю величину для дублированных пятен.
Как показано на Фиг.21A и 21B, кривую плавления получали путем измерения интенсивности флуоресценции от пятен, полученных с использованием различных температур промывки. Присутствие удлиненного дуплекса определяли на основании данных кривой плавления.
ПРИМЕР 6. Оценка применимости PTOCE-анализа, включающего в себя детекцию в режиме реального времени на микрочипе
Далее авторы изобретения исследовали применимость PTOCE-анализа, включающего в себя детекцию в режиме реального времени при предварительно заданной температуре на микрочипе.
Осуществляли повторное расщепление PTO и удлинение фрагмента PTO на микрочипе с иммобилизованным CTO. Присутствие удлиненного дуплекса детектировали при предварительно заданной температуре в нескольких заданных циклах.
Для удлинения располагающегося "вверх по течению" праймера, расщепления PTO и удлинения фрагмента PTO использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
Планировалось, чтобы удлиненный дуплекс, образуемый в процессе анализа, содержал одиночную метку или систему двух взаимодействующих меток. Наличие одиночной метки в удлиненном дуплексе обеспечивалось посредством PTO, меченного репортерной молекулой (меченного репортером PTO). Наличие системы двух взаимодействующих меток в удлиненном дуплексе обеспечивалось посредством CTO, меченного репортерной молекулой и молекулой-гасителем, (CTO с двумя метками). PTO и CTO блокируют углеродным спейсером по их 3'-концам.
CTO содержит поли(T) в качестве линкерной ножки. CTO иммобилизовали на поверхности стеклянной пластинки, используя аминогруппу (аминоC7) на его 5'-конце или его 3'-конце. Маркерный зонд, содержащий флуоресцентную репортерную молекулу (Quasar570) на своем 5'-конце, был иммобилизован на поверхности стеклянной пластинки с использованием аминогруппы на его 3'-конце, Интенсивность флуоресценции на стеклянной пластинке измеряли при предварительно заданной температуре. Температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму. В качестве матриц использовали синтетический олигонуклеотид для Neisseria gonorrhoeae (NG).
6-1. PTOCE-анализ с использованием меченного репортером PTO
PTO содержит Quasar570 в качестве флуоресцентной репортерной молекулы на своем 5'-конце. CTO иммобилизовали через его 5'-конец. В этом способе мечения температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму, и эта температура превышает величину Tпл гибрида, образованного нерасщепленным PTO и CTO.
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO, CTO и маркера, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок РТО).
Подготовку пластинок проводили в соответствии с протоколом, аналогичным использованному в Примере 5.
Реакцию с PTOCE проводили в конечном объеме 30 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 1 пмоль PTO (SEQ ID NO: 17) и 15 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 2,4 единицы H-Taq ДНК-полимеразы (Solgent, Korea); эту смесь целиком помещали в камеру, собранную на поверхности стеклянной пластинки NSB, к которой был пришит CTO (SEQ ID NO: 18). Пластинку располагали на блоке в термоциклере (Genepro B4I, China). Для проводимого циклами анализа (cycling analysis) готовили пять одинаковых пластинок. Реакцию с PTOCE проводили следующим образом: денатурация в течение 15 мин при 95°C и затем 0, 5, 10, 20 или 30 циклов по 30 с при 95°C, 60 с при 60°C, 60 с при 55°C. После прохождения соответствующего числа циклов этой реакции пластинки промывали дистиллированной водой при 64°C в течение 1 мин. Получение изображений осуществляли после каждой промывки с применением конфокального лазерного сканирующего устройства Axon GenePix4100A (Molecular Device, US) со сканированием при разрешении с размером пикселя 5 мкм. Интенсивность флуоресценции анализировали с применением программного обеспечения для количественного анализа микрочипов GenePix pro6.0 (Molecular Device, US). Интенсивность флуоресценции выражали в виде средних значений по пятнам после вычитания локального фона. Для проверки воспроизводимости каждое пятно анализировали в двух повторах. Интенсивность флуоресценции указывает среднюю величину для дублированных пятен.
Как показано на Фиг.22A и 22B, интенсивность флуоресценции для нуклеиновокислотной последовательности-мишени увеличивалась в зависимости от числа циклов (0 циклов_RFU (относительные единицы флуоресценции): 1304±0,7; 5 циклов_RFU: 18939±1342,1; 10 циклов_RFU: 30619±285,0; 20 циклов_RFU: 56248±2208,3 и 30 циклов_RFU: 64645±1110,2) в присутствии матрицы. Не наблюдали никакого изменения интенсивности флуоресценции в зависимости от числа циклов в отсутствие матрицы.
6-2. PTOCE-анализ с использованием CTO с двумя метками
CTO иммобилизовали через его 3'-конец, и он содержит молекулу-гаситель (BHQ-2) и флуоресцентную репортерную молекулу (Quasar570) в своем матричном участке.
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO, CTO и маркера, использованных в этом примере, представляют собой:


(Подчеркнутыми буквами отмечен 5'-концевой метящий участок PTO).
Подготовку пластинок проводили в соответствии с протоколом, аналогичным использованному в Примере 5.
Реакцию с PTOCE проводили в конечном объеме 30 мкл, содержащем 2 пмоль синтетической матрицы (SEQ ID NO: 1) для гена NG, 10 пмоль располагающегося "вверх по течению" праймера (SEQ ID NO: 2), 1 пмоль РТО (SEQ ID NO: 20) и 15 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 2,4 единицы H-Taq ДНК-полимеразы (Solgent, Korea); эту смесь целиком помещали в камеру, собранную на поверхности стеклянной пластинки NSB, к которой был пришит CTO (SEQ ID NO: 21). Пластинку располагали на блоке в термоциклере (Genepro B4I, China). Для проводимого циклами анализа готовили пять одинаковых пластинок. Реакцию с PTOCT проводили следующим образом: денатурация в течение 15 мин при 95°C и затем 0, 5, 10, 20 или 30 циклов по 30 с при 95°C, 60 с при 60°C, 60 с при 50°C. После прохождения соответствующего числа циклов этой реакции осуществляли получение изображений с применением конфокального лазерного сканирующего устройства Axon GenePix4100A (Molecular Device, US) со сканированием при разрешении с размером пикселя 5 мкм. Интенсивность флуоресценции анализировали с применением программного обеспечения для количественного анализа микрочипов GenePix pro6.0 (Molecular Device, US). Интенсивность флуоресценции выражали в виде средних значений по пятнам после вычитания локального фона. Для проверки воспроизводимости каждое пятно анализировали в двух повторах. Интенсивность флуоресценции указывает среднюю величину для дублированных пятен.
Как показано на Фиг.23A и 23B, интенсивность флуоресценции для нуклеиновокислотной последовательности-мишени увеличивалась в зависимости от числа циклов (0 циклов_RFU: 28078±460,3; 5 циклов_RFU: 35967±555,1; 10 циклов_RFU: 44674±186,0; 20 циклов_RFU: 65423±2,1; и 30 циклов_RFU: 65426±2,8) в присутствии матрицы. Не наблюдали никакого изменения интенсивности флуоресценции в зависимости от числа циклов в отсутствие матрицы.
ПРИМЕР 7. Детекция множественных нуклеиновокислотных последовательностей-мишеней в PTOCE-анализе, включающем в себя детекцию при предварительно заданной температуре в режиме конечной точки на микрочипе
Далее авторы изобретения исследовали детекцию множественных мишеней в PTOCE-анализе, включающем в себя детекцию при предварительно заданной температуре в режиме конечной точки на микрочипе.
Расщепление PTO проводили в отдельном сосуде с процессом ПЦР и аликвоту полученного продукта переносили в микрочип с иммобилизованным CTO. По окончании реакции удлинения присутствие удлиненного дуплекса определяли путем детекции в режиме конечной точки при предварительно заданной температуре.
Для удлинения располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, расщепления PTO и удлинения фрагмента PTO использовали Taq ДНК-полимеразу, обладающую 5'-нуклеазной активностью.
Планировалось, чтобы удлиненный дуплекс, образуемый в процессе анализа, содержал одиночную метку. Наличие одиночной метки в удлиненном дуплексе обеспечивалось посредством PTO, меченного Quasar570 в качестве флуоресцентной репортерной молекулы по своему 5'-концу PTO. PTO и CTO блокируют углеродным спейсером по их 3'-концам.
CTO содержит поли(T)5 в качестве линкерной ножки, и его иммобилизовали на поверхности стеклянной пластинки, используя аминогруппу (аминоC7) на его 5'-конце. Маркерный зонд, содержащий флуоресцентную репортерную молекулу (Quasar570) на своем 5'-конце, был иммобилизован стеклянной пластинке с использованием аминогруппы на его 3'-конце.
Интенсивность флуоресценции на стеклянной пластинке измеряли при предварительно заданной температуре. Температуру детекции определяли таким образом, чтобы удлиненный дуплекс сохранял двухцепочечную форму, и эта температура превышает величину Tпл гибрида, образованного нерасщепленным PTO и CTO. Использовали геномные ДНК Staphylococcus aureus (SA) и Neisseria gonorrhoeae (NG).
Последовательности синтетической матрицы, располагающегося "вверх по течению" праймера, PTO, CTO и маркера, использованных в этом примере, представляют собой:

(Подчеркнутыми буквами отмечен 5'-концевой метящий участок РТО).
Подготовку пластинок проводили в соответствии с протоколом, аналогичным использованному в Примере 5.
Реакцию расщепления проводили в конечном объеме 50 мкл, содержащем по 100 пг каждой геномной ДНК SA и/или NG, по 10 пмоль каждого располагающегося "вниз по течению" праймера (SEQ ID NO: 10 и/или 13), по 10 пмоль каждого располагающегося "вверх по течению" праймера (SEQ ID NO: 2 и/или 22), по 1 пмоль каждого РТО (SEQ ID NO: 17 и/или 23) и 25 мкл смеси 2× Master Mix, содержащей 2,5 мМ MgCl2, 200 мкМ dNTP и 4 единицы H-Taq ДНК-полимеразы (Solgent, Korea); пробирку, содержащую реакционную смесь, помещали в термоциклер для проведения ПЦР в режиме реального времени (CFX96, Bio-Rad); реакционную смесь подвергали денатурации в течение 15 мин при 95°C и подвергали 60 циклам по 30 с при 95°C и 60 с при 63°C. 30 мкл полученной смеси помещали в камеру, собранную на поверхности стеклянной пластинки NSB, к которой были пришиты СТО (SEQ ID NO: 18 и 24). Пластинку располагали на блоке в термоциклере (Genepro B4I, China). Реакцию удлинения проводили в течение 20 мин при 55°C. Затем пластинки промывали дистиллированной водой при 64°C в течение 1 мин. Получение изображений осуществляли после каждой промывки с применением конфокального лазерного сканирующего устройства Axon GenePix4100A (Molecular Device, US) со сканированием при разрешении с размером пикселя 10 мкм. Интенсивность флуоресценции анализировали с применением программного обеспечения для количественного анализа микрочипов GenePix pro6.0 (Molecular Device, US). Интенсивность флуоресценции выражали в виде средних значений по пятнам после вычитания локального фона. Для проверки воспроизводимости каждое пятно анализировали в двух повторах. Интенсивность флуоресценции указывает среднюю величину для дублированных пятен.
Как показано на Фиг.24, сигнал от мишени для SA (RFU: 65192±198,7) детектировали в присутствии матрицы SA. Сигнал от мишени для NG (RFU: 65332±1,4) детектировали в присутствии матрицы NG. Детекцию обоих сигналов от мишеней для SA (RFU: 65302±0,7) и NG (RFU: 65302±0,7) осуществляли в присутствии обеих матриц.
Основываясь на описании предпочтительного воплощения настоящего изобретения, следует понимать, что его варианты и модификации, соответствующие сущности изобретения, могут стать очевидными специалистам в данной области, и объем данного изобретения следует определять прилагаемой формулой изобретения и ее эквивалентами.
Реферат
Изобретение относится к биотехнологии, а именно к способам детекции нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот в анализе с РТОСЕ (расщеплением и удлинением РТО). Способ включает детекцию нуклеиновокислотной последовательности-мишени, при этом PTO (зондирующий и метящий олигонуклеотид), гибридизованный с нуклеиновокислотной последовательностью-мишенью, расщепляется с высвобождением фрагмента. Фрагмент гибридизуется с CTO (захватывающим и матричным олигонуклеотидом) с образованием удлиненного дуплекса. Детектируют присутствие удлиненного дуплекса. Удлиненный дуплекс обеспечивает получение сигналов от меток, указывающих на присутствие удлиненного дуплекса, и имеет регулируемую величину T, что хорошо подходит для детекции присутствия нуклеиновокислотной последовательности-мишени. Предложенное изобретение позволяет проводить детекцию нуклеиновокислотной последовательности-мишени из ДНК или смеси нуклеиновых кислот с высокой эффективностью. 4 н. и 53 з.п. ф-лы, 30 ил., 7 пр.
Формула
(a) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и РТО (зондирующим и метящим олигонуклеотидом); при этом располагающийся "вверх по течению" олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; РТО содержит (1) 3′-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5′-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3′-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5′-концевой метящий участок, не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно РТО;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5′-нуклеазной активностью для расщепления РТО; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5′-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5′-концевой метящий участок или часть 5′-концевого метящего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с СТО (захватывающим и матричным олигонуклеотидом); при этом СТО содержит в направлении 3′→5′ (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5′-концевому метящему участку или части 5′-концевого метящего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5′-концевому метящему участку и 3′-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется и образуется удлиненный дуплекс; при этом удлиненный дуплекс имеет величину Тпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной СТО либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной СТО;
(e) плавление удлиненного дуплекса с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса; при этом сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или СТО, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или СТО, или (4) интеркалирующей метки; и
(f) детекцию удлиненного дуплекса путем детекции сигнала от мишени; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
(а) гибридизацию нуклеиновокислотных последовательностей-мишеней с парой праймеров, состоящей из располагающегося "вверх по течению" праймера и располагающегося "вниз по течению" праймера, и РТО (зондирующим и метящим олигонуклеотидом); при этом каждый из праймеров, располагающийся "вверх по течению" праймер и располагающийся "вниз по течению" праймер, содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; РТО содержит (1) 3′-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5′-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3′-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5′-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; РТО локализован между располагающимся "вверх по течению" праймером и располагающимся "вниз по течению" праймером; при этом РТО блокирован по его 3′-концу, чтобы не допустить его удлинения;
(b) приведение в контакт продукта со стадии (а) с матричной полимеразой нуклеиновых кислот, обладающей 5′-нуклеазной активностью для удлинения праймеров и для расщепления РТО; при этом когда РТО гибридизуется с нуклеиновокислотной последовательностью-мишенью, располагающийся "вверх по течению" праймер удлиняется и удлиненная цепь индуцирует расщепление РТО под действием матричной полимеразы нуклеиновых кислот, обладающей 5′-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5′-концевой метящий участок или часть 5′-концевого метящего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с СТО (захватывающим и матричным олигонуклеотидом); при этом СТО содержит в направлении 3′→5′ (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5′-концевому метящему участку или части 5′-концевого метящего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5′-концевому метящему участку и 3′-концевому узнающему мишень участку; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Тпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной СТО либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной СТО;
(e) плавление удлиненного дуплекса с получением сигнала от мишени, указывающего на присутствие удлиненного дуплекса; при этом сигнал от мишени обеспечивается посредством (1) по меньшей мере одной метки, соединенной с фрагментом и/или СТО, (2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, (3) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, и метки, соединенной с фрагментом и/или СТО, или (4) интеркалирующей метки; и
(f) детекцию удлиненного дуплекса путем детекции сигнала от мишени; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
(а) гибридизацию нуклеиновокислотной последовательности-мишени с располагающимся "вверх по течению" олигонуклеотидом и РТО (зондирующим и метящим олигонуклеотидом); при этом располагающийся "вверх по течению" олигонуклеотид содержит гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени; РТО содержит (1) 3′-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5′-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; при этом 3′-концевой узнающий мишень участок гибридизуется с нуклеиновокислотной последовательностью-мишенью, а 5′-концевой метящий участок не гибридизуется с нуклеиновокислотной последовательностью-мишенью; располагающийся "вверх по течению" олигонуклеотид локализован "вверх по течению" относительно РТО;
(b) приведение в контакт продукта со стадии (а) с ферментом, обладающим 5′-нуклеазной активностью для расщепления РТО; при этом располагающийся "вверх по течению" олигонуклеотид или его удлиненная цепь индуцирует расщепление РТО ферментом, обладающим 5′-нуклеазной активностью, так что в результате расщепления высвобождается фрагмент, содержащий 5′-концевой метящий участок или часть 5′-концевого метящего участка РТО;
(c) гибридизацию фрагмента, высвободившегося из РТО, с СТО (захватывающим и матричным олигонуклеотидом); при этом СТО содержит в направлении 3′→5′ (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5′-концевому метящему участку или части 5′-концевого метящего участка РТО, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5′-концевому метящему участку и 3′-концевому узнающему мишень участку РТО; при этом фрагмент, высвободившийся из РТО, гибридизуется с захватывающим участком СТО;
(d) осуществление реакции удлинения с использованием продукта со стадии (с) и матричной полимеразы нуклеиновых кислот; при этом фрагмент, гибридизованный с захватывающим участком СТО, удлиняется и образуется удлиненный дуплекс; причем удлиненный дуплекс имеет величину Тпл, регулируемую (1) последовательностью и/или длиной этого фрагмента, (2) последовательностью и/или длиной СТО либо (3) последовательностью и/или длиной фрагмента и последовательностью и/или длиной СТО; при этом удлиненный дуплекс обеспечивает получение сигнала от мишени посредством
(1) по меньшей мере одной метки, соединенной с фрагментом и/или СТО,
(2) метки, встраиваемой в удлиненный дуплекс во время реакции удлинения,
(3) по меньшей мере одной метки, соединенной с фрагментом и/или СТО, и метки, встраиваемой в удлиненный дуплекс во время реакции удлинения, или
(4) интеркалирующей метки; и
(e) детекцию удлиненного дуплекса путем детекции сигнала от мишени при предварительно заданной температуре, при которой удлиненный дуплекс сохраняет свою двухцепочечную форму; тем самым присутствие удлиненного дуплекса указывает на присутствие нуклеиновокислотной последовательности-мишени.
(a) располагающийся "вверх по течению" олигонуклеотид, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени;
(b) РТО (зондирующий и метящий олигонуклеотид), содержащий (1) 3′-концевой узнающий мишень участок, содержащий гибридизующуюся нуклеотидную последовательность, комплементарную нуклеиновокислотной последовательности-мишени, и (2) 5′-концевой метящий участок, содержащий нуклеотидную последовательность, некомплементарную нуклеиновокислотной последовательности-мишени; и
(c) СТО (захватывающий и матричный олигонуклеотид), содержащий в направлении 3′→5′ (1) захватывающий участок, содержащий нуклеотидную последовательность, комплементарную 5′-концевому метящему участку или части 5′-концевого метящего участка РТО, определенного в любом из пп. 1-49, и (2) матричный участок, содержащий нуклеотидную последовательность, некомплементарную 5′-концевому метящему участку и 3′-концевому узнающему мишень участку РТО.
Документы, цитированные в отчёте о поиске
Способ анализа мишени, содержащей гетерополимерную последовательность нуклеиновой кислоты или аналога нуклеиновой кислоты, и комплекс, содержащий мишень

Комментарии