Способ анализа мишени, содержащей гетерополимерную последовательность нуклеиновой кислоты или аналога нуклеиновой кислоты, и комплекс, содержащий мишень - RU2304169C2
Код документа: RU2304169C2
Чертежи






















Описание
Область техники, к которой относится изобретение
Изобретение касается связывания нуклеотидных оснований в комплексы - двойные (дуплексы), тройные (триплексы) или четверные (квадруплексы), в частности оно касается способов, которыми эти комплексы образуются путем специфического связывания между одноцепочечными или двухцепочечными, содержащими нуклеотидные основания зондами и одноцепочечными или двухцепочечными, содержащими нуклеотидные основания последовательностями-мишенями.
Уровень техники
Модель Уотсона-Крика для нуклеиновых кислот была общепринятым стандартом в молекулярной биологии на протяжении почти 50 лет. Как рассказал Джеймс Уотсон в своей книге под названием "Личный рассказ об открытии структуры ДНК" (1968), модель Уотсона-Крика, которая принесла Уотсону и Крику Нобелевскую премию, возникла на развалинах отброшенной ими теории о том, что основания связываются с подобными основаниями на противоположных цепях (Watson, p.125). Там же Уотсон описал, как он отказался от своей модели "спаривания подобного с подобным, рассматриваемой какое-то время", когда он понял преимущества модели, основанной на связывании А:Т и G:C.
Несмотря на то, что антипараллельные двойные комплексы нуклеиновых кислот, существование которых впервые предположили Уотсон и Крик, являются наиболее широко изученным типом многоцепочечных структур нуклеиновых кислот, однако было обнаружено, что нуклеиновые кислоты также образуют тройные (триплексы) и четверные структуры (квадруплексы) в определенных условиях.
До недавнего времени считалось, что связывание между тремя цепями нуклеиновой кислоты с образованием триплекса ограничивается очень узким кругом нуклеиновых кислот (например, полипуриновыми или полипиримидиновыми последовательностями). К примеру, см. Floris et al., "Effect of cations on purine-purine-polypyrimidine triple helix formation in mixed-valence salt solutions," 260 Eur. J. Biochem. 801-809 (1999). Более того, предполагалось, что каноническое тройное связывание или гибридизация основывается на образовании связи по Хугстину (Hoogsteen) между ограниченным набором смежных оснований, а не на спаривании оснований по Уотсону-Крику. К примеру, см. Boris et al. и U.S. Patent No. 5874555 to Dervan et al. Между тем, в последнее время авторы изобретения в ряде патентных заявок раскрыли, что возможно создание специфически связанных тройных комплексов нуклеиновых кислот с последовательностями из смешанных оснований на основе спаривания оснований по Уотсону-Крику и использование их как основы для высокоточного и чувствительного анализа специфического связывания. См. U.S. Patent Applications Nos. 09/613, 263 и 09/468, 679, поданных соответственно 10 июля 2000 г. и 21 декабря 1999 г.
Zhurkin et al., 239 J. Mol. Biol. 181 (1994) описали возможность получения параллельных тройных комплексов ДНК, однако они полагают, что триплексы образуются при связывании третьей цепи в большой бороздке дуплекса в присутствии рекомбинационных белков типа белка RecA.
Как и в случае с тройными комплексами нуклеиновых кислот, относительно квадруплексных нуклеиновых кислот сложилось мнение, что такие необычные структуры существуют только в относительно экстремальных условиях и для узкого класса нуклеиновых кислот. В частности, Sen et al. (Nature 334: 364-366 (1988)) показали, что богатые гуанином олигонуклеотиды могут спонтанно образовывать четырехцепочечные спирали in vitro. Далее Sen et al. (Biochemistry 31: 65-70 (1992)) показали, что такие четырехцепочечные комплексы могут далее ассоциировать в суперструктуры, состоящие из 8, 12 или 16 олигомеров.
Marsh et al. (Biochemistry 33: 10718-10724 (1994) и Nucleic Acids Research 23: 696-700 (1995) показали, что некоторые богатые гуанином олигонуклеотиды также могут выстраиваться в смещенные, параллельные порядки с образованием длинных "G-проводов (G-wires)". Эти структуры высшего порядка стабилизируются G-квартетами, состоящими из четырех остатков гуанозина, расположенных в одной плоскости и удерживаемых вместе по принципу спаривания оснований по Хугстину. Согласно Sen et al. (Biochemistry 31: 65-70 (1992) необходимо, по меньшей мере, три смежных гуанина внутри олигомера для формирования таких структур высшего порядка.
Было предположено, что четырехцепочечные ДНК играют роль в целом ряде биологических процессов, таких как ингибирование интегразы ВИЧ-1 (Mazumder et al., Biochemistry 35: 13762-13771 (1996), образование перекреста хромосом в мейозе (Sen et al., Nature 334: 364-366 (1988) и поддержание теломеров (Williamson et al., Cell 59: 871-880 (1989); Baran et al., Nucleic Acids Research 25: 297-303 (1997). В дальнейшем было предположено, что контроль за образованием богатых гуанином квадруплексов может служить ключом к контролю за этими биологическими процессами. Например, в U.S. Patent No. 6, 017, 709 на имя Hardin et al. предусматривается, что можно контролировать теломеразную активность с помощью препаратов, ингибирующих образование гуаниновых квартетов.
U.S. Patent No. 5888739 на имя Pitner et al. раскрывает, что квадруплексы на основе G-квартетов можно использовать при анализе на детектирование нуклеиновых кислот. При гибридизации с комплементарным олигонуклеотидом G-квартетная структура разворачивается или линеаризуется, при этом увеличивается расстояние между донорными и акцепторными частями в различных областях G-квартетной структуры, что приводит к уменьшению взаимодействия и детектируемому изменению сигнала (например, флуоресценции), испускаемого структурой.
В U.S. Patent No. 5912332 на имя Agrawal et al. описан способ очистки синтетических олигонуклеотидов, в котором синтетические олигонуклеотиды специфически гибридизуются с заданным полноразмерным олигонуклеотидом и при этом образуется мультимерный агрегат, к примеру, квадруплексная ДНК. Затем выделяют мультимерный агрегат, содержащий олигонулеотид, подлежащий очистке, с применением методов исключения по размеру.
Несмотря на предшествующие разработки, все еще существует необходимость в систематическом изучении и классифицировании всех специфических взаимодействий между нуклеиновыми кислотами с последовательностями из смешанных оснований и в создании новых, эффективных и быстрых методов выработки и анализа специфических взаимодействий между нуклеиновыми кислотами и/или их аналогами.
Все процитированные ссылки включены в настоящее изобретение путем отсылки во всей своей полноте.
Раскрытие изобретения
Изобретение предусматривает комплекс, включающий: (1) зонд, содержащий гетерополимерную последовательность зонда из нуклеиновой кислоты или аналога нуклеиновой кислоты; и (2) мишень, содержащую гетерополимерную последовательность мишени из нуклеиновой кислоты или аналога нуклеиновой кислоты; причем (а) по меньшей мере, зонд или, по меньшей мере, мишень была очищена или является синтетической и (b) гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством комплементарного взаимодействия оснований по Уотсону-Крику или гомологичного взаимодействия оснований, при условии, что в случае, когда комплекс представлен дуплексом, и гетерополимерная последовательность зонда антипараллельна гетерополимерной последовательности мишени, то гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством гомологичного взаимодействия оснований, а в случае, когда комплекс представлен триплексом, то он свободен от рекомбинационных белков.
Также представлен способ анализа мишени, включающий: (1) обеспечение образца, включающего мишень, содержащую гетерополимерную последовательность мишени из нуклеиновой кислоты или аналога нуклеиновой кислоты; (2) обеспечение зонда, содержащего гетерополимерную последовательность зонда из нуклеиновой кислоты или аналога нуклеиновой кислоты; (3) обеспечение гибридизационной смеси, включающей мишень, зонд, воду и буфер; (4) инкубирование гибридизационной смеси в течение времени инкубации, необходимого для связывания гетерополимерной последовательности мишени с гетерополимерной последовательностью зонда с образованием комплекса; и (5) детектирование сигнала, коррелирующего со сродством связывания между зондом и мишенью, с целью анализа мишени, причем гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством комплементарного взаимодействия оснований по Уотсону-Крику или гомологичного взаимодействия оснований, при условии, что в случае, когда комплекс представлен дуплексом, и гетерополимерная последовательность зонда антипараллельна гетерополимерной последовательности мишени, то гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством взаимодействия гомологичных оснований, а в случае, когда комплекс представлен триплексом, то он свободен от рекомбинационных белков.
Краткое описание чертежей
Далее изобретение будет описано в сочетании со следующими чертежами, на которых одинаковые цифры обозначают одинаковые элементы.
Фиг.1А, 1В, 1C, 2А, 2В, 3А, 3В, 4, 5А, 5В, 6, 7, 8, 9, 10А, 10В, 11А, 11В, 12А, 12В, 13А и 13В представляют собой составные графики, на которых представлена интенсивность флуоресценции в зависимости от длины волны для каждого анализируемого образца.
Фиг.14А, 14В и 14С представляют собой составные графики, на которых представлена интенсивность флуоресценции в зависимости от времени для каждого анализируемого образца.
Осуществление изобретения
Изобретение вытекает из нашего исследования специфических свойств связывания гетерополимерных цепей нуклеиновых кислот. Ранее мы раскрыли специфическое связывание гетерополимерной цепи с дуплексной нуклеиновой кислотой и специфическое связывание дуплексной нуклеиновой кислоты с другой дуплексной нуклеиновой кислотой. Теперь мы раскрываем, что гетерополимерные нуклеиновые кислоты (и/или их аналоги) могут специфически связываться друг с другом посредством гомологичного связывания оснований, а также взаимодействий оснований по Уотсону-Крику, и что связывание оснований не ограничивается цепями, имеющими антипараллельную ориентацию относительно друг друга. Так, гетерополимерные нуклеиновые кислоты (и/или их аналоги) могут специфически связываться друг с другом в параллельной или антипараллельной ориентации, при этом основания образуют связи посредством связывания гомологичных оснований и/или по правилам связывания оснований по Уотсону-Крику.
Изобретение не является простым раскрытием неортодоксальных свойств связывания нуклеиновых кислот. Изобретение охватывает новые соединения, а также способы анализа нуклеиновых кислот, способы диагностики, способы лечения, способы профилактики, генной терапии и генной инженерии.
Изобретение охватывает новые двойные (дуплексы), тройные (триплексы) и четверные комплексы (квадруплексы) нуклеиновых кислот (и/или их аналогов).
Цепи нуклеиновых кислот обладают присущей изначально направленностью. Согласно общепринятому мнению цепи противоположной направленности, то есть имеющие антипараллельную ориентацию относительно друг друга, могут образовывать дуплексы посредством комплементарного связывания соответствующих оснований по Уотсону-Крику.
Определенные дуплексы по настоящему изобретению, с другой стороны, включают две цепи нуклеиновой кислоты (и/или аналогов нуклеиновой кислоты), которые гибридизовались в параллельной ориентации относительно друг друга, при этом специфическое связывание осуществляется либо посредством гомологичного спаривания оснований, либо посредством спаривания оснований по Уотсону-Крику. Распространено мнение, будто такие дуплексы не существуют или, по крайней мере, будут крайне неустойчивыми вследствие, к примеру, нарушений формы остова, возникающих из-за конформационных требований при параллельном спаривании оснований. Тем более удивительно совершенное нами открытие, что при надлежащих условиях гибридизации гомологичное спаривание обладает специфичностью и стабильностью, сравнимыми с таковыми у комплементарных антипараллельных дуплексов по Уотсону-Крику.
Изобретение также охватывает дуплексы, содержащие две цепи нуклеиновой кислоты (и/или аналогов нуклеиновой кислоты), гибридизованные в антипараллельной ориентации относительно друг друга, в которых специфическое связывание осуществляется посредством спаривания гомологичных оснований.
В применении к настоящему изобретению термины "спаривание оснований по Уотсону-Крику", "комплементарное спаривание оснований" и им подобные служат для обозначения специфической ассоциации между противолежащими или смежными парами цепей нуклеиновой кислоты и/или аналога нуклеиновой кислоты через соответствующие основания (к примеру, А:Т, G:C и/или A:U). В связи с неканоническими комплексами, описанными в настоящем изобретении, включая параллельные дуплексы, параллельные и антипараллельные триплексы, параллельные и антипараллельные квадруплексы, термины типа "спаривание оснований по Уотсону-Крику" и "комплементарное спаривание оснований" служат для обозначения связи между А и Т, А и U и/или G и С, однако не обязательно в боковой, планарной конформации, впервые описанной Уотсоном и Криком. Наряду с традиционным принципом связывания, впервые выдвинутым Уотсоном и Криком ("принципом У-К"), и его конформационными вариантами, подпадающими под приведенное выше определение спаривания оснований по Уотсону-Крику, настоящее изобретение охватывает комплексы, образованные при гомологичном спаривании оснований. При гомологичном спаривании основания образуют связи специфически с идентичными основаниями, а не с комплементарными основаниями. Так, по "гомологическому принципу" к гомологичным парам оснований относятся А:А, G:G, C:C, Т:Т и U:U.
На связывание оснований в цепях нуклеиновой кислоты влияет или сказывается целый ряд факторов, в частности, потенциал связывания цепей по принципу У-К или гомологическому принципу и ионные условия (например, концентрация и/или тип соли). Солевые условия способствуют образованию связей по Уотсону-Крику по сравнению с гомологичным связыванием. Квадруплексы по гомологическому принципу преобладают над квадруплексами по принципу У-К в идентичных буферных условиях, вероятно потому, что локальное окружение становится сравнительно низкосолевым вследствие присутствия заряженных остовов двух дуплексных нуклеиновых кислот.
Каждая цепь в комплексе по изобретению может включать любую последовательность нуклеотидных оснований и/или аналогов нуклеотидных оснований при условии, что они родственны нуклеотидным основаниям, с которыми они должны связаться специфически по принципу У-К или по гомологическому принципу. В противоположность некоторым положениям предшествующего уровня техники, мишень и зонд не обязательно должны быть гомополимерными для осуществления связывания, даже в случае образования триплекса или квадруплекса. Так, в определенных воплощениях нуклеотидные основания зонда организованы в гетерополимерную последовательность зонда из перемежающихся пуринов и пиримидинов, а нуклеотидные основания мишени образуют последовательность мишени, которая, по меньшей мере, частично комплементарна или частично гомологична последовательности зонда. Например, последовательность зонда может содержать от 25% до 75% пуриновых оснований и от 75% до 25% пиримидиновых оснований в любом порядке. Комплексы по изобретению могут образовываться из гетерополимерных последовательностей, что, согласно приведенному определению, означает последовательности, содержащие, по меньшей мере, одно пуриновое основание или аналог пурина и, по меньшей мере, одно пиримидиновое основание или аналог пиримидина, по крайней мере, в их гибридизирующихся отрезках. В гетерополимерных последовательностях предпочтительно отсутствуют гомополимерные фрагменты длиной свыше 5 оснований. Прочие нуклеотидные основания также пригодны для настоящего изобретения, например, синтетические аналоги существующих в природе оснований, обладающие специфическим по Уотсону-Крику или гомологичным сродством связывания с другими основаниями.
Наряду с дуплексами комплексы по изобретению также включают триплексы и квадруплексы, в которых противолежащие гетерополимерные цепи соединяются посредством комплементарных оснований Уотсона-Крика или посредством гомологичных оснований, а относительная ориентация связанных последовательностей может быть параллельной или антипараллельной друг другу.
Цепь зонда может специфически связываться в большой или малой бороздке двухцепочечной мишени. Кроме того, основания одноцепочечного зонда могут специфически взаимодействовать с основаниями одной или обеих цепей двухцепочечной мишени. Аналогичным образом основания каждой цепи двухцепочечного зонда могут специфически взаимодействовать с основаниями одной или обеих цепей двухцепочечной мишени в четверных комплексах по изобретению.
В определенных воплощениях триплексов и квадруплексов каждое основание связывается с одним или двумя другими основаниями. Так, наряду с традиционными дуплексами из пар оснований по Уотсону-Крику и дуплексами из гомологичных пар оснований, описанными выше, такие воплощения включают следующие триплеты со связыванием оснований по Уотсону-Крику: А:Т:А, Т:А:Т, U:A:T, T:A:U, A:U:A, U:A:U, G:C:G и/или C:G:C (включая C+:G:C и/или любые другие ионизированные формы основания), и/или следующие триплеты гомологичных оснований: А:А:Т, Т:Т:А, U:U:A, T:U:A, A:A:U, U:T:A, G:G:C и/или C:C:G (включая C:C+:G и/или любые другие ионизированные формы основания).
Так, в определенных воплощениях квадруплексов, в которых зонд определяется как дуплекс из первой и второй цепей и мишень определяется как дуплекс из третьей и четвертой цепей, предполагается, что основания первой и третьей цепей также связываются друг с другом, в дополнение к: (а) связыванию между противолежащими основаниями первой и второй цепей; (b) связыванию между противолежащими основаниями третьей и четвертой цепей; и (с) связыванию между противолежащими основаниями второй и четвертой цепей.
В определенных воплощениях тройных и четверных структур по изобретению ни одна связывающаяся последовательность оснований не следует непосредственно за другой связывающейся последовательностью оснований. Иными словами, имеются, по меньшей мере, три отдельные цепи. Несмотря на то, что свернутые конформации и им подобные (к примеру, "шпильки" и т.п.) входят в рамки изобретения, свернутые участки одной цепи не засчитываются как отдельные цепи более одного раза при минимуме в три отдельные цепи.
Комплексы по изобретению предпочтительно не зависят от связей Хугстина или квартетов G-G в поддержании структуры комплекса, хотя связи Хугстина и/или квартеты G-G могут присутствовать. Иными словами, комплексы по изобретению предпочтительно, по существу, свободны от связей Хугстина и, по существу, свободны от квартетов G-G.
Каждая цепь комплекса независимо включает нуклеиновую кислоту с дезоксирибозофосфатным или рибозофосфатным остовом (к примеру, ДНК, РНК, мРНК, гяРНК, рРНК, тРНК или кДНК) или аналог нуклеиновой кислоты. Предпочтительно аналоги нуклеиновой кислоты имеют незаряженный или частично заряженный остов (то есть остов, заряд которого менее отрицателен, чем у остова природной ДНК) и к ним относятся, к примеру, ПНК и ЛНК. Определенные воплощения свободны от ПНК.
По крайней мере, часть комплекса является выделенной, очищенной, искусственной или синтетической.
В воплощениях часть комплекса является продуктом ПЦР-амплификации.
Комплексы по изобретению могут находиться в растворе, на твердой подложке, in vitro, in vivo или in silico. Твердая подложка может проводить (например, электрод) или не проводить электричество. Кроме того, комплексы могут быть картированы оптически или секвенированы после элонгации, как изложено в U.S. Patents Nos. 6147198 и 5720928 to Schwartz.
Комплексы по изобретению могут быть получены способом, включающим: (а) обеспечение гибридизационной смеси, включающей мишень, содержащую гетерополимерную последовательность мишени из нуклеиновой кислоты или аналога нуклеиновой кислоты, зонд, содержащий гетерополимерную последовательность зонда из нуклеиновой кислоты или аналога нуклеиновой кислоты, воду и буфер; и (b) инкубирование указанной гибридизационной смеси в течение времени инкубации, необходимого для гибридизации указанной гетерополимерной последовательности мишени с указанной гетерополимерной последовательностью зонда с образованием комплекса.
Гибридизационная смесь может включать любую стандартную среду, пригодную для сохранения нуклеотидов. См., например, Sambrook et al., "Molecular Cloning: A Lab Manual", Vol.2 (1989). Например, среда может содержать нуклеотиды, воду, буферы и соли в стандартных концентрациях. Когда для усиления образования триплекса или квадруплекса применяются исключительно двухвалентные катионы, не следует включать хелаторы типа ЭДТА или ЭГТА в реакционную смесь.
Специфическое связывание между комплементарными основаниями происходит в широком диапазоне условий, отличающихся температурой, концентрацией соли, ионной силой и составом буфера. Примеры таких условий и способы их применения известны в данной области. В нашей параллельной заявке U.S. Patent Application No. 09/885731, поданной 20 июня 2001 г., раскрыты условия, особенно подходящие для настоящего изобретения.
В отличие от многих комплексов Хугстиновского типа, которые неустойчивы или не существуют при значениях рН выше приблизительно 7,6, комплексы по изобретению стабильны в широком диапазоне значений рН, предпочтительно от рН около 5 до рН около 9.
Комплексы по изобретению могут быть обеспечены в целях анализа, диагностики, терапии и/или инженерии. Эти комплексы могут применяться для анализа, диагностики и/или лечения заболеваний, связанных с заражением каким-либо организмом или вирусом. При желании можно количественно определить этот организм или вирус.
Комплексы по изобретению могут образовываться при стандартных условиях гибридизации, в условиях гибридизации триплексов, в условиях гибридизации квадруплексов или в условиях гибридизации in situ. Предпочтительно комплексы образуются при температуре от около 2°С до около 55°С в течение около 2 часов или меньше. В определенных воплощениях время инкубации предпочтительно составляет менее 5 минут, даже при комнатной температуре. Большая продолжительность реакции не требуется, но в большинстве случаев инкубация вплоть до 24 часов не наносит вреда комплексам. Короткое время связывания комплексов по изобретению контрастирует со значительно более длительным временем связывания, необходимым для связывания комплексов по Хугстину.
Промотором в гибридизационной среде предпочтительно служит интеркалирующий агент или катион, как описано в U.S. Patent Application No. 09/613263, подано 10 июня 2000 г. Интеркалирующие агенты при необходимости являются флуоресцентными. Интеркалирующий агент может, к примеру, представлять собой флуорофор, например, выбранный из группы, состоящей из YOYO-1, TOTO-1, YOYO-3, ТОТО-3, РОРО-1, ВОВО-1, РОРО-3, ВОВО-3, LOLO-1, JOJO-1, димеров цианина, YO-PRO-1, TO-PRO-1, YO-PRO-3, TO-PRO-3, TO-PRO-5, PO-PRO-1, BO-PRO-1, PO-PRO-3, BO-PRO-3, LO-PRO-1, JO-PRO-1, мономеров цианина, бромида этидия, гомодимера-1 этидия, гомодимера-2 этидия, производных этидия, акридина, акридинового оранжевого, производных акридина, гетеродимера этидия-акридина, моноазида этидия, иодида пропидия, красителей SYTO, SYBR Green 1, красителей SYBR, Pico Green, красителей SYTOX и 7-аминоактиномицина D.
К подходящим катионам относятся, к примеру, одновалентные катионы, такие как Na+ (предпочтительно в концентрации от 40 мМ до 200 мМ), К+ (предпочтительно в концентрации от 40 мМ до 200 мМ) и другие катионы щелочных металлов; двухвалентные катионы, такие как ионы щелочноземельных металлов (например, Mg2+ и Са2+) и двухвалентные ионы переходных металлов (например, Mn2+, Ni2+, Cd2+, Co2+ и Zn2+); катионы с положительным зарядом не менее 3, такие как Co(NH3)63+, трехвалентный спермидин и четырехвалентный спермин. Mn2+ предпочтительно обеспечивают в концентрации от 10 до 45 мМ. Mg2+ предпочтительно обеспечивают в концентрации от 10 до 45 мМ. Ni2+ предпочтительно обеспечивают в концентрации около 20 мМ. В воплощениях Mg2+ и Mn2+ добавляют совместно в концентрации по 1 мМ каждого, по 2 мМ каждого, по 3 мМ каждого... по 40 мМ каждого (то есть по 1-40 мМ каждого).
Количество катиона, добавляемого в среду, в которой образуется комплекс, зависит от ряда факторов, включая природу катиона, концентрацию зонда, концентрацию мишени, присутствие дополнительных катионов и содержание оснований в зонде и мишени. Предпочтительные концентрации катионов и смеси обычно можно установить опытным путем. Для триплексов катион(ы) предпочтительно добавляют в среду в следующих количествах: (а) 10 мМ - 30 мМ Mn2+, (b) 10 мМ - 20 мМ Mg2+, (с) 20 мМ Ni2+ или (а) по 1 мМ - 30 мМ Mn2+ и Mg2+ каждого. Для квадруплексов катион(ы) предпочтительно добавляют в среду в следующих количествах: (а) 10 мМ - 45 мМ Mn2+, (b) 10 мМ - 45 мМ Mg2+ или (с) по 10 мМ - 40 мМ Mn2+ и Mg2+ каждого.
К другим промоторам, хотя они и не требуются, относятся, к примеру, белки, связывающие одноцепочечные НК, такие как белок Rec А, белок гена 32 фага Т4, связывающий одноцепочечные НК белок Е. coli, белки, связывающиеся в области большой или малой бороздки нуклеиновых кислот, виологен и такие интеркалирующие вещества, как актиномицин D, псорален и ангелицин. Такие способствующие реагенты могут оказаться полезными при работе в экстремальных условиях, например, при необычных значениях рН или чрезвычайно высоких температурах. Определенные способы получения комплексов по изобретению выполняются в отсутствие белковых промоторов типа Rec А и/или других рекомбинационных белков.
Изобретение обеспечивает быстрый, чувствительный, экологически дружественный и безопасный способ анализа связывания. Анализ по изобретению может применяться, к примеру, для идентификации доступных участков в свернутых нуклеотидных последовательностях, для определения числа неправильно спаренных пар оснований в гибридизационном комплексе и для картирования генома.
Анализ по изобретению не только выявляет наличие специфического связывания зонда и мишени, но также обеспечивает качественную и количественную информацию о природе взаимодействия между зондом и мишенью. Так, изобретение позволяет отличить идеальное соответствие, ошибочное спаривание (мисматч) по одной паре оснований, ошибочное спаривание (мисматч) по двум парам оснований, ошибочное спаривание (мисматч) по трем парам оснований, делецию одной пары оснований, делецию двух пар оснований, делецию трех пар оснований, возникающие между последовательностью двухцепочечного зонда или одноцепочечного зонда и последовательностью двухцепочечной или одноцепочечной мишени.
Воплощения изобретения включают калибровку измеряемого сигнала (например, оптического сигнала, флуоресценции, хемилюминесценции, электрохемилюминесценции, электрических или электромеханических свойств) для первой смеси зонда и мишени относительно сигнала того же типа, проявляемого другими зондами в сочетании с той же мишенью, при этом каждый из остальных зондов отличается от первого зонда, по меньшей мере, одним основанием.
Можно построить калибровочную кривую, в которой величина измеряемого сигнала (например, интенсивность флуоресценции) является функцией сродства связывания между мишенью и зондом. Поскольку сродство связывания между мишенью и несколькими различными зондами изменяется в зависимости от числа ошибочно спаренных оснований, природы ошибочного спаривания (мисматча) (например, A:G или А:С, или T:G, или Т:С и т.д. по принципу У-К), расположения ошибочно спаренного(ых) основания(й) в пределах комплекса и т.п., то способ анализа по изобретению можно использовать для секвенирования мишени.
В воплощениях измеряемый сигнал может представлять собой интенсивность флуоресценции флуорофора, включенного в тестируемый образец. В таких воплощениях сродство связывания между зондом и мишенью может быть прямо или обратно пропорционально интенсивности в зависимости от того, сигнализирует ли флуорофор о гибридизации тушением сигнала или усилением сигнала. В определенных условиях интенсивность флуоресценции, создаваемая интеркалирующими агентами, может быть прямо пропорциональна сродству связывания зонда и мишени, тогда как в предпочтительных воплощениях с применением неинтеркалирующих флуорофоров, ковалентно связанных с зондом, интенсивность может быть обратно пропорциональна сродству связывания зонда и мишени. Интенсивность флуоресценции уменьшается у неинтеркалирующих флуорофоров с увеличением степени соответствия (например, количество соответствий против количества мисматчей и/или типа мисматчей) между зондом и мишенью, предпочтительно в интервале 0-2 мисматчей и/или делеций включительно, более предпочтительно в интервале 0-3 мисматчей и/или делеций включительно.
Изобретение позволяет количественно определять сродство связывания между зондом и мишенью. Такая информация может оказаться ценной для целого ряда применений, включая разработку антисмысловых препаратов с оптимизированными характеристиками связывания.
Анализ по изобретению предпочтительно является гомогенным. Анализ может проводиться без отделения свободного зонда и свободной мишени от гибридизационного комплекса перед определением величины измеряемого сигнала. Анализ не требует стадии разделения в геле, что позволяет сильно увеличить производительность тестирования. Количественные анализы простые и точные, поэтому анализ связывания экономит много времени и денег и может легко быть автоматизирован. Кроме того, он позволяет быстро определить такие переменные параметры связывания, как буфер, рН, концентрация ионов, температура, вермя инкубации, относительные концентрации зонда и мишени, концентрацию интеркалирующего агента, длину последовательности мишени, длину последовательности зонда и возможную потребность в кофакторах (то есть промоторе).
Анализ может проводиться, к примеру, в растворе в лунках или в микроканалах, на непроницаемой поверхности или на биочипе. В определенных воплощениях мишень вносят в среду гибридизации перед зондом, а зонд обеспечивают в безводной форме с регидратацией при контакте с гибридизационной средой.
В определенных воплощениях анализ по изобретению проводится без добавления тушителя сигнала на мишени или на зонде.
Изобретение не требует денатурации мишени перед анализом. Неожиданно оказалось, что авторы изобретения способны проводить специфический анализ гетерополимерных триплексов и квадруплексов, в которых взаимодействие между зондом и мишенью основывается на взаимодействии по Уотсону-Крику или взаимодействии гомологичных оснований (по крайней мере, в том смысле, что А связывается с Т (или U, в случает РНК) и G связывается с С), а не на очень ограниченной модели гибридизации комплексов Хугстина, например, см. Pitner et al., supra.
Подходящие мишени предпочтительно имеют длину от 8 до 3,3×109 пар оснований и могут быть одноцепочечными или двухцепочечными.
Зонды по изобретению предпочтительно имеют длину от 2 до 75 оснований (более предпочтительно от 5 до 30 оснований) и могут быть одноцепочечными или двухцепочечными. Так, к подходящим зондам для анализа по изобретению относятся одноцепочечная ДНК (оцДНК), РНК, оцПНК, ЛНК, двухцепочечная ДНК (дцДНК), дцРНК, гибриды ДНК:РНК, дцПНК, гибриды РНК:ДНК и другие одноцепочечные или двухцепочечные нуклеиновые кислоты и аналоги нуклеиновых кислот с незаряженным, частично заряженным, сахарофосфатным и/или пептидным остовом. Длину зонда можно выбирать так, чтобы она соответствовала длине мишени.
Настоящее изобретение не требует применения радиоактивных зондов, которые небезопасны, трудоемки, требуют много времени и должны постоянно возобновляться. Зонды по изобретению предпочтительно безопасны в применении и стабильны в течение многих лет. Соответственно, зонды можно получать или заказывать в больших количествах и хранить.
Комплекс предпочтительно детектируют по изменению, по меньшей мере, одной метки. По меньшей мере, одна метка может быть присоединенной к зонду и/или мишени и/или может быть свободной в среде измерения. По меньшей мере, одна метка может включать, по меньшей мере, две части.
Метка предпочтительно представляет собой, по меньшей мере, один член, выбранный из группы, состоящей из спиновой метки, флуорофора, хромофора, хемилюминесцентного агента, электрохемилюминесцентного агента, радиоизотопа, фермента, гаптена, антитела и меченого антитела. Предпочтительно комплекс детектируют, по меньшей мере, по одному виду излучения от метки или по измерению электронной характеристики комплекса.
Меченое антитело может представлять собой, к примеру, меченое антитело против нуклеиновой кислоты, которое может быть помечено детектируемой молекулой, выбранной из группы, состоящей из флуорофора, хромофора, спиновой метки, радиоизотопа, фермента, гаптена, хемилюминесцентного агента и электрохемилюминесцентного агента.
Комплекс можно детектировать при варьировании, по меньшей мере, одного параметра, как раскрыто в U.S. Patent Application No. 09/490273, подано 24 января 2000 г. К подходящим варьируемым параметрам относятся, к примеру, (а) изменение неводных компонентов среды измерения, (b) изменение рН среды измерения, (с) изменение концентрации соли в среде измерения, (d) изменение содержания органического растворителя в среде измерения, (е) изменение содержания формамида в среде измерения, (f) изменение температуры среды измерения и (g) изменение концентрации хаотропной соли в среде измерения. Кроме того, варьируемым параметром может быть приложение воздействия, например, электрического тока (постоянного и/или переменного тока), фотонного облучения (например, лазера) или электромагнитной силы. Воздействие может быть непрерывным или прерывистым. Детектирование может осуществляться при использовании одного вариабельного параметра или комбинации из нескольких параметров, варьируемых последовательно.
Для детектирования комплекса можно регистрировать реакцию характеристики комплекса в среде измерения на изменение параметра или воздействие. Такой характеристикой может служить, к примеру, электропроводность или Q (резонансная структура линии передачи или изменения фазы или амплитуды сигнала, распространяющегося по линии передачи в среде измерения).
В воплощениях способ детекции включает: (а) детектирование сигнала от метки, при этом сигнал коррелирует со сродством связывания между указанным зондом и указанной мишенью, (b) варьирование параметра среды измерения, (с) детектирование последующего сигнала и (d) сравнение сигнала и последующего сигнала. Варьирование и детектирование можно повторять, по меньшей мере, один раз или проводить только один раз.
Метка предпочтительно представляет собой флуорофор. Как интеркалирующие, так и неинтеркалирующие флуорофоры пригодны для применения в изобретении. Флуорофор может быть свободным в растворе, ковалентно связанным с зондом и/или ковалентно связанным с мишенью. Когда флуорофор ковалентно связан с зондом, то он предпочтительно связан с ним по любому из концов. К предпочтительным флуоресцентным маркерам относятся биотин, родамин, акридин и флуоресцеин, а также другие маркеры, флуоресцерующие при облучении вобуждающей энергией. К подходящим неинтеркалирующим флуорофорам относятся красители alexa, красители BODIPY, конъюгаты биотина, реагирующие с тиолами зонды, флуоресцеин и его производные (включая «зонды в клетке» ("caged probes" зонды)), Oregon Green, Rhodamin Green и красители QSY (которые тушат флуоресценцию флуорофоров, возбуждаемых видимым светом).
Длину волны возбуждения выбирают (опытным путем и/или на основании общепринятого знания) так, чтобы она соответствовала максимуму возбуждения используемого флуорофора, и она предпочтительно составляет от 200 до 1000 нм. Флуорофоры предпочтительно выбирают так, чтобы длина волны испускания равнялась от 200 до 1000 нм. В предпочтительных воплощениях применяется лазер на ионах аргона для облучения флуорофора светом с длиной волны в пределах от 400 до 540 нм, а детекция флуоресцентного излучения осуществляется в пределах от 500 до 750 нм.
Анализ по изобретению может осуществляться в широком диапазоне температур, например, от 2 до 60°С. Некоторые предшествующие способы анализа требуют повышенных температур, что увеличивает стоимость и продолжительность анализа. С другой стороны, изобретение может осуществляться при комнатной температуре или ниже (к примеру, при температуре ниже 25°С).
Надежность изобретения не зависит от содержания гуанина и цитозина в зонде или в мишени. В традиционной модели У-К, поскольку пары оснований G:C образуют три водородные связи, а пары оснований А:Т образуют только две водородные связи, последовательности мишеней и зондов с повышенным содержанием G или С более устойчивы и обладают более высокой температурой плавления. Вследствие этого ошибочные спаривания (мисматчи) пар оснований, повышающие содержание GC в области гибридизации зонда и мишени свыше того, что имеется у гибридов с идеальным соответствием, может компенсировать слабость связывания, ассоциированную с ошибочно-спаривающимся зондом.
Анализ по изобретению чрезвычайно чувствителен, что устраняет необходимость в проведении ПЦР-амплификации мишени. Например, можно анализировать образец объемом 20 мкл, содержащий около 10 фемтомоль мишени и 10 фемтомоль зонда. Воплощения изобретения достаточно чувствительны для анализа мишени в концентрации 5×10-9 М, предпочтительно в концентрации не более 5×10-10 M. Воплощения изобретения достаточно чувствительны для применения зондов в концентрации 5×10-9 М, предпочтительно в концентрации не более 5×10-10 М. Разумеется, вышеуказанные значения не следует понимать так, будто этот способ не позволяет детектировать более высокие концентрации.
Соотношение зонда и мишени предпочтительно составляет от 1:1 до 1000:1.
В отличие от некоторых предшествующих способов анализа, изобретение не только выявляет наличие гибридизации (то есть связывания), но также дает качественную и количественную информацию о природе связывания между зондом и мишенью. Так, изобретение позволяет специалисту: (а) выявлять присутствие мишени в среде измерения, (b) выявлять аллельные или гетерозиготные варианты мишени, (с) количественно определять мишень, (d) выявлять степень комплементарности (в случае связывания по принципу У-К) или гомологичности (в случае связывания по гомологическому принципу) между зондом и мишенью, и (е) выявлять гаплотипы.
Мы заметили, что дуплексы, в которых в комплексе находятся параллельные цепи нуклеиновой кислоты, содержащие комплементарные последовательности оснований, связываются с образованием триплексов с различной скоростью, и связывание является результатом совсем другого процесса, чем связывание оснований в двойной спирали, образованной цепями нуклеиновой кислоты противоположной направленности. Цепи противоположной направленности (то есть антипараллельные цепи) легко предоставляют расположенные с равными интервалами основания в планарной ориентации противолежащим основаниям с минимальным искажением остова.
Разнообразные комплексы по изобретению включают зонд, содержащий гетерополимерную последовательность зонда из нуклеотидных оснований и/или аналогов оснований, и мишень, содержащую гетерополимерную последовательность мишени из нуклеотидных оснований и/или аналогов оснований. Комплекс является синтетическим или очищенным в том смысле, что либо зонд, либо мишень, по меньшей мере, является синтетической или очищенной. Остовом зонда служит дезоксирибозофосфатный остов, как в ДНК, или пептидоподобный остов, такой как в ПНК, или состоит из каких-то других незаряженных или частично заряженных (отрицательно или положительно) остатков.
В определенных воплощениях зонд и мишень являются одноцепочечными, а комплекс представлен дуплексом. Когда зонд и мишень образуют дуплекс, то они имеют параллельную ориентацию с У-К комплементарным или гомологичным связыванием или имеют антипараллельную ориентацию с гомологичным связыванием.
В других воплощениях либо зонд, либо мишень одноцепочечны, а другой из указанных зонда или мишени является двухцепочечным, и образующийся комплекс представлен триплексом. Такой комплекс может быть свободным от ПНК.
В определенных воплощениях триплекс содержит гетерополимерную последовательность зонда, параллельную гетерополимерной последовательности мишени, при этом гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством гомологичного связывания оснований или комплементарного связывания оснований по Уотсону-Крику. В некоторых других воплощениях гетерополимерная последовательность зонда антипараллельна гетерополимерной последовательности мишени, и при этом гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством гомологичного связывания оснований или комплементарного связывания оснований по Уотсону-Крику.
В определенных воплощениях тройного комплекса мишень включает первую цепь, содержащую гетерополимерную последовательность мишени, и вторую цепь, содержащую вторую гетерополимерную последовательность мишени, которая комплементарна по Уотсону-Крику и антипараллельна первой гетерополимерной последовательности мишени. Гетерополимерная последовательность зонда образует связи с первой гетерополимерной последовательностью мишени посредством гомологичного связывания оснований, а также образует связи со второй гетерополимерной последовательностью мишени посредством комплементарного связывания оснований по Уотсону-Крику.
В некоторых других воплощениях тройного комплекса мишень включает первую цепь, содержащую гетерополимерную последовательность мишени, и вторую цепь, содержащую вторую гетерополимерную последовательность мишени, которая комплементарна по Уотсону-Крику и антипараллельна первой гетерополимерной последовательности мишени. Гетерополимерная последовательность зонда образует связи с первой гетерополимерной последовательностью мишени посредством комплементарного связывания оснований по Уотсону-Крику, а также образует связи со второй гетерополимерной последовательностью мишени посредством гомологичного связывания оснований.
В определенных воплощениях зонд и мишень являются двухцепочечными, а образующийся комплекс является квадруплексом. Такой комплекс может быть свободным от ПНК.
В определенных воплощениях квадруплекс содержит гетерополимерную последовательность зонда, параллельную или антипараллельную гетерополимерной последовательности мишени, при этом гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством гомологичного связывания оснований или комплементарного связывания оснований по Уотсону-Крику. В таких воплощениях четверной комплекс содержит первую цепь зонда, содержащую гетерополимерную последовательность зонда, и вторую цепь зонда, содержащую вторую гетерополимерную последовательность зонда, которая комплементарна и антипараллельна первой последовательности зонда. Мишень включает первую цепь мишени, содержащую гетерополимерную последовательность мишени, и вторую цепь мишени, содержащую вторую гетерополимерную последовательность мишени, которая комплементарна и антипараллельна первой.
В таких воплощениях квадруплекса гетерополимерная последовательность зонда может образовывать связи с гетерополимерной последовательностью мишени посредством комплементарного связывания по Уотсону-Крику или гомологичного связывания оснований, и гетерополимерная последовательность зонда может при необходимости и дополнительно образовывать связи со второй гетерополимерной последовательностью мишени посредством гомологичного связывания или комплементарного связывания оснований по Уотсону-Крику, соответственно. Так, когда гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством гомологичного связывания оснований, то гетерополимерная последовательность зонда при необходимости образует связи со второй гетерополимерной последовательностью мишени посредством комплементарного связывания оснований по Уотсону-Крику, а когда гетерополимерная последовательность зонда образует связи с гетерополимерной последовательностью мишени посредством комплементарного связывания оснований по Уотсону-Крику, то гетерополимерная последовательность зонда при необходимости образует связи со второй гетерополимерной последовательностью мишени посредством гомологичного связывания оснований.
Далее изобретение будет раскрыто более подробно на следующих примерах, но следует иметь в виду, что настоящее изобретение не должно ограничиваться ими.
ПРИМЕРЫ
Пример 1
Комплементарные смысловые и антисмысловые 50-мерные оцДНК-последовательности мишени, происходящей из экзона 10 гена кистозного фиброза человека (Nature 380, 207 (1996), синтезировали на ДНК-синтезаторе (Expedite 8909, PerSeptive Biosystems) и очищали методом ВЭЖХ. оцДНК-олигонуклеотиды растворяли в бидистиллированной воде (б/д Н2О) и разбавляли до концентрации 1 пмоль/мкл. Эквимолярные количества комплементарных олигонуклеотидов нагревали при 95°С в течение 10 мин и оставляли постепенно отжигаться по мере снижения температуры до 21°С на протяжении 1,5 часов в присутствии 10 мМ Трис, рН 7,5, 1 мМ ЭДТА и 100 мМ NaCl. дцДНК-олигонуклеотиды растворяли в б/д Н2О до концентрации 1 пмоль/мкл.
Последовательность смысловой цепи ДНК-мишени дикого типа (SEQ ID No. 1): 5'-TGG CAC CAT TAA AGA AAA TAT CAT CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи ДНК-мишени дикого типа (SEQ ID No. 1): 5'-TAT ATT CAT CAT AGG AAA CAC CAA AGA TGA TAT TTT CTT TAA TGG TGC CA-3'.
SEQ ID No. 2 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No. 1), за исключением мутации по одной паре оснований (подчеркнуто) в положении аминокислоты 507, в которой последовательность смысловой цепи дикого типа CAT была изменена на CGT.
Последовательность смысловой цепи SEQ ID No. 2: 5'-TGG CAC CAT TAA AGA ААА TAT CGT CTT TGG TGT TTC СТА TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No. 2: 5'-TAT ATT CAT CAT AGG ААА CAC CAA AGA CGA TAT TTT CTT TAA TGG TGC CA-3'.
SEQ ID No. 3 - это 50-мерная последовательность дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No. 1), за исключением мутации по двум последовательным парам оснований (подчеркнуто) в положении аминокислот 506 и 507, в которой последовательность смысловой цепи дикого типа CAT была изменена на ACT.
Последовательность смысловой цепи SEQ ID No. 3: 5'-TGG CAC CAT TAA AGA ААА TAT ACT CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No. 3: 5'-TAT ATT CAT CAT AGG ААА CAC CAA AGA GTA TAT TTT CTT TAA TGG TGC CA-3'.
SEQ ID No. 4 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No. 1), за исключением мутации по трем последовательным парам оснований (подчеркнуто) в положении аминокислот 506 и 507, в которой последовательность смысловой цепи дикого типа CAT была изменена на ACG.
Последовательность смысловой цепи SEQ ID No. 4: 5'-TGG CAC CAT TAA AGA ААА TAT ACG CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No. 4: 5'-TAT ATT CAT CAT AGG ААА CAC CAA AGCGTA TAT TTT CTT TAA TGG TGC CA-3'.
SEQ ID No. 5 - это 50-мерная последовательность мутантной дцДНК-мишени, модифицированная относительно SEQ ID No. 1, в которой содержание GC было изменено с 30% до 52%.
Последовательность смысловой цепи ДНК-мишени дикого типа (SEQ ID No. 5): 5'-GAG CAC CAT GAC AGA CAC TGT CAT CTC TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи ДНК-мишени дикого типа (SEQ ID No. 5): 5'-CAG AGT CAT CGT AGG АСА CAC CAG AGA TGA CAG TGT CTG TCA TGG TGC TC-3'.
SEQ ID No. 6 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная SEQ ID No. 5, за исключением мутации по одной паре оснований (подчеркнуто), в которой последовательность смысловой цепи CAT была изменена на CGT.
Последовательность смысловой цепи мутантной SEQ ID No. 6: 5'-GAG CAC CAT GAC AGA CAC TGT CGT CTC TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи мутантной SEQ ID No. 6: 5'-CAG AGT CAT CGT AGG АСА CAC CAG AGA CGA CAG TGT CTG TCA TGG TGC TC-3'.
SEQ ID No. 7 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная SEQ ID No. 5, за исключением мутации по одной паре оснований (подчеркнуто), в которой последовательность смысловой цепи CTC была изменена на СТТ.
Последовательность смысловой цепи мутантной SEQ ID No. 7: 5'-GAG CAC CAT GAC AGA CAC TGT CAT СТТ TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи мутантной SEQ ID No. 7: 5'-CAG AGT CAT CGT AGG АСА CAC CAA AGA TGA CAG TGT CTG TCA TGG TGC TC-3'.
SEQ ID No. 8 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная SEQ ID No. 5, за исключением мутации по двум последовательным парам оснований (подчеркнуто), в которой последовательность CAT смысловой цепи была изменена на ACT.
Последовательность смысловой цепи мутантной SEQ ID No. 8: 5'-GAG CAC CAT GAC AGA CAC TGT ACT CTC TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи мутантной SEQ ID No. 8: 5'-CAG AGT CAT CGT AGG АСА CAC CAG AGA GTA CAG TGT CTG TCA TGG TGC TC-3'.
SEQ ID No. 9 - это 47-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No. 1), за исключением делеции трех последовательных пар оснований (обозначено тремя точками) в положении аминокислот 507 и 508, в которой последовательность смысловой цепи дикого типа СТТ была делегирована.
Последовательность смысловой цепи SEQ ID No. 9: 5'-TGG CAC CAT TAA AGA AAA TAT CAT... TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No. 9: 5'-TAT ATT CAT CAT AGG AAA CAC CA... A TGA TAT TTT СТТ TAA TGG TGC CA-3'.
SEQ ID No. 10 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная SEQ ID No. 5, за исключением мутации по одной паре оснований (подчеркнуто), в которой последовательность CAT смысловой цепи была изменена на СТТ.
Последовательность смысловой цепи мутантной SEQ ID No. 10: 5'-GAG CAC CAT GAC AGA CAC TGT СТТ CTC TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи мутантной SEQ ID No. 10: 5'-CAG AGT CAT CGT AGG АСА CAC CAG AGA AGA CAG TGT CTG TCA TGG TGC TC-3'.
SEQ ID No. 11 - это 50-мерная последовательность мутантной дцДНК-мишени, идентичная SEQ ID No. 5, за исключением мутации по одной паре оснований (подчеркнуто), в которой последовательность смысловой цепи CTC была изменена на ССС.
Последовательность смысловой цепи мутантной SEQ ID No. 11: 5'-GAG CAC CAT GAC AGA CAC TGT CAT ССС TGG TGT GTC СТА CGA TGA CTC TG-3'.
Последовательность антисмысловой цепи мутантной SEQ ID No. 11: 5'-CAG AGT CAT CGT AGG АСА CAC CAG GGA TGA CAG TGT CTG TCA TGG TGC TC-3'.
ПНК-зонды были синтезированы, очищены методом ВЭЖХ и проверены методом масс-спектроскопии фирмой Commonwealth Biotechnologies, Inc. (Richmond, VA, США). ПНК-зонды сначала растворяли в 0,1% TFA (трифторуксусной кислоте) до концентрации 10 мг/мл, а затем разбавляли до 1 мг/мл добавлением б/д Н2О. Конечные растворы ПНК в б/д Н2О доводили до концентрации 1 пмоль/мкл.
Зонд №1 - это 15-мерный ПНК-зонд, сконструированный таким образом, что он полностью комплементарен отрезку в 15 нуклеотидов смысловой цепи 50-мерной ДНК-мишени дикого типа (SEQ ID No. 1), перекрывая положения аминокислот 505-510 (Nature 380, 207 (1996). Направленность зонда противоположна, то есть антипараллельна, направленности смысловой цепи мишени.
Последовательность зонда №1 (SEQ ID No. 12): 5'-Н-САС САА AGA TGA TAT-Lys-CONH2-3'.
Зонд №2 - это 15-мерный ПНК-зонд, последовательность которого идентична зонду №1, но направленность одинакова, то есть параллельна, направленности смысловой цепи дцДНК-мишени.
Последовательность зонда №2 (SEQ ID No. 13): 5'-Н-ТАТ AGT AGA AAC CAC-Lys-CONH2-3'.
оцДНК-зонды (15-меры) были синтезированы и очищены методом ВЭЖХ, как описано выше. оцДНК-зонды растворяли в б/д Н2О в концентрации 1 пмоль/мкл.
Зонд №3 - это 15-мерный оцДНК-зонд, сконструированный таким образом, что он полностью комплементарен отрезку в 15 нуклеотидов смысловой цепи 50-мерной ДНК-мишени дикого типа (SEQ ID No. 5). Направленность зонда противоположна, то есть антипараллельна, направленности смысловой цепи мишени.
Последовательность зонда №3 (SEQ ID No. 14): 5'-САС CAG AGA TGA CAG-3'.
Зонд №4 - это 15-мерный оцДНК-зонд, последовательность которого идентична зонду №3, но направленность одинакова, то есть параллельна, направленности смысловой цепи дцДНК-мишени.
Последовательность зонда №4 (SEQ ID No. 15): 5'-GAC AGT AGA GAC CAC-3'.
Зонд №5 - это антипараллельный 15-мерный оцДНК-зонд, идентичный зонду №3 за исключением того, что к нему прикреплена молекула флуоресцеина в положении 5'.
Последовательность зонда №5 (SEQ ID No. 16); 5'-Flu-CAC CAG AGA TGA CAG-3'.
Зонд №6 - это параллельный 15-мерный оцДНК-зонд, идентичный зонду №4 за исключением того, что к нему прикреплена молекула флуоресцеина в 5'-положении.
Последовательность зонда №6 (SEQ ID No. 17): 5'-Flu-GAC AGT AGA GAC CAC-3'.
Зонд №7 - это 15-мерный оцДНК-зонд с прикрепленной молекулой флуоресцеина в положении 5', сконструированный таким образом, что он полностью комплементарен отрезку в 15 нуклеотидов смысловой цепи 50-мерной ДНК-мишени дикого типа (SEQ ID No. 1). Направленность зонда противоположна, то есть антипараллельна, направленности смысловой цепи мишени.
Последовательность зонда №7 (SEQ ID No. 18): 5'-Flu-CAC САА AGA TGA TAT-3'.
Зонд №8 - это 15-мерный оцДНК-зонд, сконструированный таким образом, что он полностью комплементарен отрезку в 15 нуклеотидов смысловой цепи 50-мерной ДНК-мишени дикого типа (SEQ ID No. 1). Направленность зонда антипараллельна направленности смысловой цепи мишени.
Последовательность зонда №8 (SEQ ID No. 19): 5'-САС САА AGA TGA ТАТ-3'.
Зонд №9 и зонд №10 - это 15-мерные мутантные оцДНК-зонды, последовательность которых идентична зонду дикого типа №8, за исключением мутации одного основания (подчеркнуто).
Последовательность зонда №9 (SEQ ID No. 20): 5'-САС GAA AGA TGA ТАТ-3'.
Последовательность зонда №10 (SEQ ID No. 21): 5'-САС САА АСА TGA ТАТ-3'.
Хорошо известно, что цепи оцДНК с последовательностями из смешанных оснований охотно образуют дуплексы оцПНК:оцДНК по принципу спаривания оснований по Уотсону-Крику при реакции с антипараллельными или параллельными синтетическими цепями оцПНК при комнатной температуре. Ранее мы показали, что такие комплексы оцПНК:оцДНК, содержащие последовательности с идеальным соответствием, можно легко отличить от комплексов оцПНК:оцДНК, содержащих мисматч по 1 паре оснований (п.о.), при проведении анализа в присутствии интеркалирующего агента YOYO-1 (Molecular Probes, Eugene, OR, США), а порядок сборки цепи ПНК оказывает значительное влияние на ее способность к специфическому связыванию с оцДНК-мишенью. В примере 1 сравнивали эффективность образования дуплексов дцДНК при реакции оцДНК-мишени, имеющей последовательность дикого типа или мутантную, с антипараллельными, комплементарными по Уотсону-Крику оцДНК-зондами, или с гомологичными, то есть идентичными параллельными оцДНК-зондами.
Все реакционные смеси для гибридизации, на которых получены данные, представленные на фиг.1А, содержали следующую смесь: 2 пмоль оцДНК-мишени, 2 пмоль оцДНК-зонда, 0,5×ТВЕ и 500 нМ YOYO-1 в конечном объеме 40 мкл. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
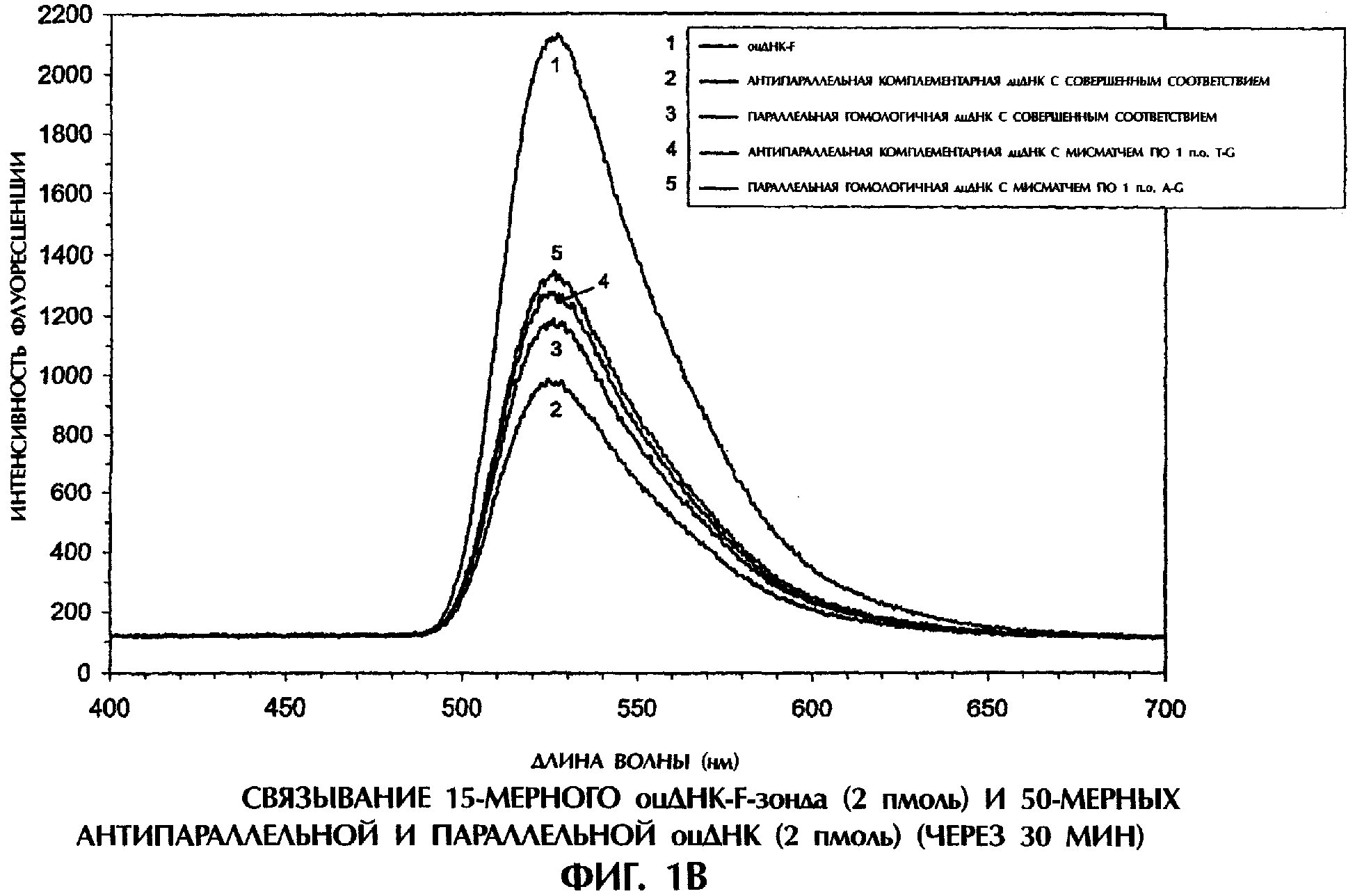
На фиг.1В и 1C реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль оцДНК-мишени, 2 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и 1 мМ ЭДТА. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 30 минут или 90 минут. После инкубации каждый образец помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Максимум интенсивности флуоресценции наблюдался при длине волны 525 нм, на которой излучает флуоресцеин. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
При реакции оцДНК-зонда №3 с 50-мерной смысловой цепью дикого типа SEQ ID No. 5 или с 50-мерной мутантной смысловой цепью SEQ ID No. 7 в присутствии YOYO-1 происходило образование антипараллельных комплементарных дуплексов оцДНК:оцДНК (фиг.1А). Интенсивность флуоресценции антипараллельного комплементарного дуплекса с мисматчем по 1 п.о. T-G (смысловая цепь SEQ ID No. 7+ зонд №3) была на 56% ниже, чем у идеально соответствующего антипараллельного комплементарного дуплекса (смысловая цепь SEQ ID No. 5+ зонд №3).
При реакции оцДНК-зонда №3 с 50-мерной антисмысловой цепью дикого типа SEQ ID No. 5 в присутствии YOYO-1 эффективность образования параллельного гомологичного дуплекса оцДНК:оцДНК была лишь на 3% ниже, чем эффективность образования антипараллельного комплементарного дуплекса оцДНК:оцДНК (фиг.1А). Этот результат был совершенно неожиданным. Параллельный гомологичный дуплекс с мисматчем по 1 п.о., образовавшийся при реакции 50-мерной мутантной антисмысловой цепи SEQ ID No. 7 с оцДНК-зондом №3 в присутствии YOYO-1, давал флуоресценцию, интенсивность которой была на 56% ниже, чем у идеального параллельного гомологичного дуплекса (фиг.1А). Контрольные образцы, содержащие каждый 50-мерную оцДНК-мишень плюс 500 нМ YOYO-1, проявляли уровень флуоресценции, который был на 91-92% ниже, чем у идеально соответствующих дуплексов (фиг.1А). Уровень флуоресценции, испускаемой 15-мерным оцДНК-зондом №3 плюс 500 нМ YOYO-1, слегка превышал уровень флуоресценции самого YOYO-1. Смещение длины волны испускания флуоресценции, наблюдавшееся в присутствии оцДНК-мишеней и зонда, типично для спектра испускания YOYO-1 в присутствии оцДНК.
YOYO-1 способствовал образованию ДНК-комплекса между оцДНК-зондом и комплементарной последовательностью оснований антипараллельной оцДНК-мишени или между оцДНК-зондом и идентичной последовательностью оснований параллельной оцДНК-мишени с одинаковой эффективностью, что позволяет отличить совершенные комплексы и комплексы, содержащие мисматч по 1 п.о. В параллельных гомологичных комплексах мисматч по 1 п.о. представляет собой негомологичную пару оснований.
Далее исследовали относительную эффективность образования антипараллельных комплементарных и параллельных гомологичных дуплексов дцДНК, используя оцДНК-мишени и оцДНК-F-зонды в отсутствие способствующих образованию комплекса агентов типа YOYO-1 или катионов. При инкубации оцДНК-F-зонда №5 в течение 30 минут в Трис-буфере при комнатной температуре с 50-мерной смысловой цепью дикого типа SEQ ID No. 5 происходило очень эффективное образование комплементарных по Уотсону-Крику антипараллельных дуплексов оцДНК-оцДНК-F, что приводило к снижению флуоресценции на 53% по сравнению с флуоресценцией, испускаемой самим зондом №5 (фиг.1В). Напротив, антипараллельные комплементарные комплексы оцДНК-оцДНК-F, содержащие мисматч по 1 п.о. T-G (смысловая цепь SEQ ID No. 7+ зонд №5), были менее устойчивы, что приводило к снижению флуоресценции только на 40% по сравнению с флуоресценцией, испускаемой самим зондом №5 после 30 минут инкубации (фиг.1В).
Образование параллельных гомологичных комплексов оцДНК-оцДНК-F происходило при реакции оцДНК зонда №5 с 50-мерной антисмысловой цепью дикого типа SEQ ID No. 5 или с 50-мерной мутантной антисмысловой цепью SEQ ID No. 7, что вызывало снижение интенсивности флуоресценции на 44% и 37%, соответственно, по сравнению с флуоресценцией, испускаемой самим оцДНК-зондом №5 после 30-минутной инкубации (фиг.1В). Легкость образования параллельных гомологичных комплексов оцДНК-оцДНК-F в отсутствие активирующих агентов была совершенно неожиданной. Дискриминация между сигналами, испускаемыми от идеально спаренных дуплексов и от дуплексов с мисматчем по 1 п.о. в отсутствие агентов, стимулирующих образование комплексов, была не столь выраженной, как в присутствии YOYO-1, служившего стимулятором и сигнальным агентом (ср. фиг.1А и 1В). Это наблюдалось как в случае антипараллельных, так и в случае параллельных дуплексов. Несколько худшая дискриминация между идеально спаренными комплексами и комплексами с мисматчем по 1 п.о. наблюдалась при использовании параллельной гомологичной оцДНК-мишени, чем при использовании антипараллельной комплементарной оцДНК-мишени для получения комплексов оцДНК:оцДНК-F (фиг.1В).
После 90-минутной инкубации антипараллельные комплексы оцДНК:опДНК-F по Уотсону-Крику, состоящие из совершенно комплементарных последовательностей (смысловая цепь SEQ ID No. 5+ зонд №5) или из последовательностей с мисматчем по 1 п.о. T-G (смысловая цепь SEQ ID No. 7+ зонд №5), давали снижение интенсивности флуоресценции на 39% и 30%, соответственно, по сравнению с флуоресценцией, испускаемой самим зондом №5 (фиг.1C). Замечательно, что параллельные гомологичные комплексы оцДНК:оцДНК-F проявляли такую же степень стабильности после инкубации в течение 90 мин, как и антипараллельные комплексы опДНК:оцДНК-F по Уотсону-Крику. Интенсивность флуоресценции у совершенно параллельного гомологичного дуплекса (антисмысловая цепь SEQ ID No. 5+ зонд №5) и у параллельного гомологичного дуплекса с мисматчем по 1 п.о. A-G (антисмысловая цепь SEQ ID No. 7+ зонд №5) была на 40% и 25% ниже, соответственно, чем флоуресценция, испускаемая самим зондом №5 после 90-минутной инкубации (фиг.1C).
Механизм распознавания и связывания гомологичных оснований в параллельных дуплексах дцДНК в настоящее время неизвестен. Тем не менее, распознавание и связывание параллельных гомологичных последовательностей оцДНК происходит в конфигурации, позволяющей дискриминировать идеально спаренные комплексы оцДНК:оцДНК от комплексов, содержащих мисматчи по 1 п.о. или 2 п.о. В таких параллельных гомологичных комплексах мисматч по 1 п.о. представляет собой негомологичную пару оснований.
Пример 2
В примере 1 замечательная эффективность образования параллельных гомологичных дуплексов оцДНК:оцДНК была продемонстрирована как в присутствии способствующего образованию комплекса агента типа YOYO-1, так и в отсутсвие каких-либо способствующих образованию комплекса агентов. Распознавание и связывание гомологичных оснований в параллельных дуплексах дцДНК было таким, что позволяло легко отличить совершенно гомологичные последовательности оснований от параллельных гомологичных последовательностей, содержащих мисматч по 1 п.о. Такие параллельные гомологичные мисматчи по 1 п.о. также четко узнавались, как мисматчи по правилам комплементарного распознавания и связывания Уотсона-Крика. В примере 2 исследовали эффективность распознавания и связывания параллельных гомологичных дуплексов дпДНК, содержащих пары оснований А-Т или G-C, чтобы установить, будут ли эти комплементарные по Уотсону-Крику пары проявляться как мисматчи в реакции параллельного гомологичного связывания.
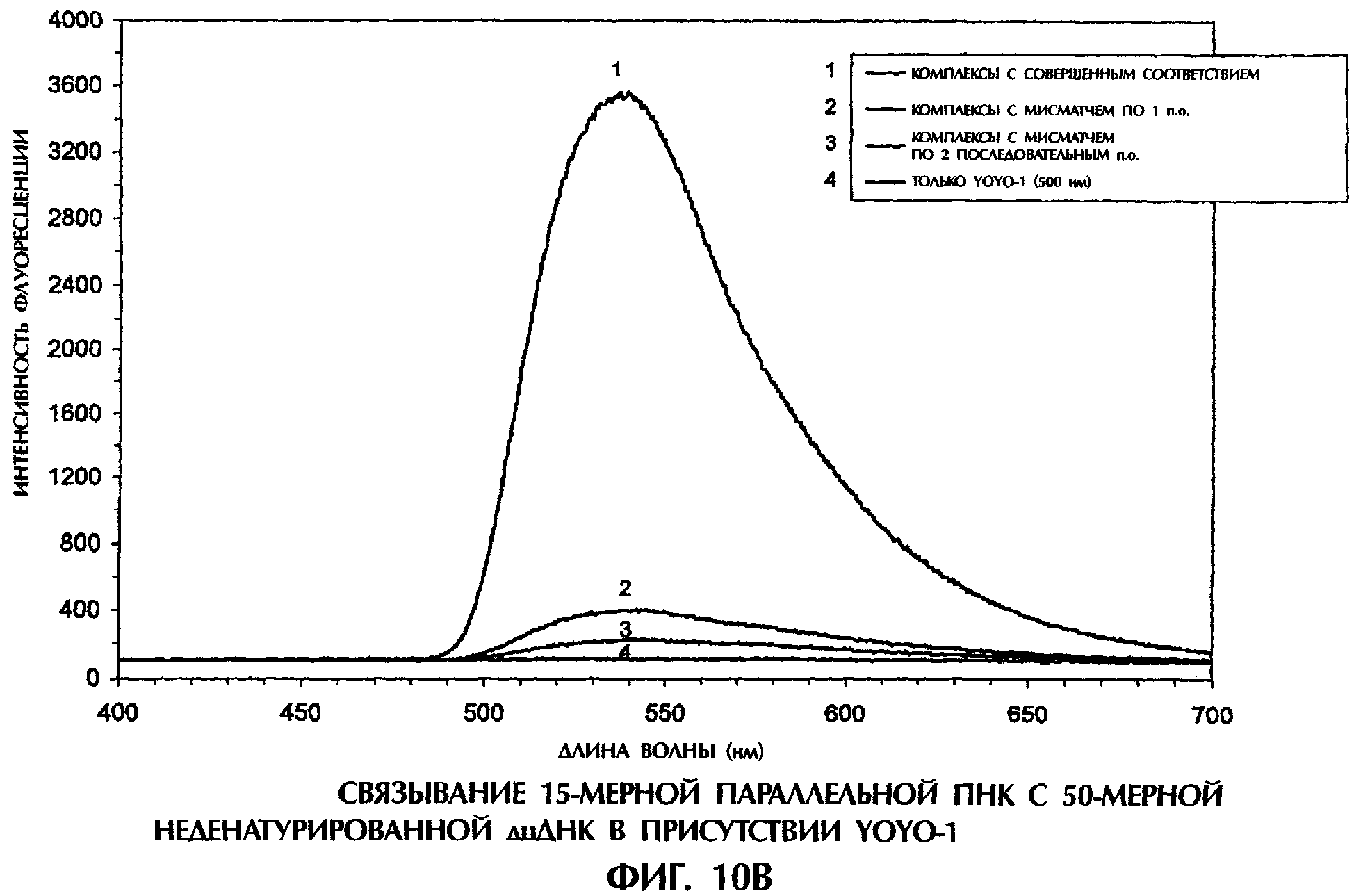
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль оцДНК-мишени, 2 пмоль опДНК-зонда, 0,5×ТВЕ и 500 нМ YOYO-1. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
При реакции опДНК-зонда №3 (содержащего 53% GC) с 50-мерной антисмысловой цепью дикого типа SEQ ED No. 5 или с 50-мерной мутантной антисмысловой цепью SEQ ID No. 10 в присутствии YOYO-1 происходило образование параллельных гомологичных дуплексов оцДНК:оцДНК (фиг.2А). Интенсивность флуоресценции от параллельного гомологичного дуплекса с мисматчем по 1 п.о. А-Т (антисмысловая цепь SEQ ID No. 10+ зонд №3) была на 72% ниже, чем у совершенно параллельного гомологичного дуплекса (антисмысловая цепь SEQ ID No. 5+ зонд №3) (фиг.2А). Такое резкое снижение флуоресценции у параллельного гомологичного дуплекса, содержащего 1 пару оснований А-Т, свидетельствует о том, что связыванию А-Т по Уотсону-Крику препятствует пространственная конфигурация и/или конфигурация зарядов, налагаемая на основания А и Т при попытке участка параллельных гомологичных цепей образовать устойчивый дуплекс. Контрольные образцы, содержащие каждую 50-мерную оцДНК-мишень плюс 500 нМ YOYO-1, проявляли уровень флуоресценции, который был на 96-97% ниже того, что наблюдался у совершенно соответствующих дуплексов (фиг.2А). Уровень флуоресценции, испускаемой 50-мерным оцДНК-зондом №3 плюс 500 нМ YOYO-1, слегка превышал уровень флуоресценции самого YOYO-1. Смещение длины волны испускания флуоресценции, наблюдавшееся в присутствии оцДНК-мишеней и зонда, типично для спектра испускания YOYO-1 в присутствии оцДНК.
Параллельные гомологичные дуплексы оцДНК:оцДНК также образовывались при реакции 50-мерной антисмысловой цепи дикого типа SEQ ID No. 1 (содержащей 33% GC) с оцДНК-зондом №8 дикого типа или с мутантными оцДНК-зондами №9 и 10 в присутствии YOYO-1 (фиг.2В). Интенсивность флуоресценции от параллельного гомологичного дуплекса с мисматчем по 1 п.о. GC (антисмысловая цепь SEQ ID No. 1+ зонд №9) и параллельного гомологичного дуплекса с мисматчем по 1 п.о. CG (антисмысловая цепь SEQ ID No. 1+ зонд №10) была на 67% и 66% ниже, соответственно, чем у совершенно параллельного гомологичного дуплекса (антисмысловая цепь SEQ ID No. 1+ зонд №8) (фиг.2В). Конфигурация взаимодействующих оснований в параллельных гомологичных дуплексах была неблагоприятна для комплементарного связывания G-C по Уотсону-Крику, что приводило к снижению интенсивности флуоресценции, указывающему на мисматч по 1 п.о. Контрольные образцы, содержащие 50-мерную опДНК-мишень плюс 500 нМ YOYO-1, или каждый 15-мерный оцДНК-зонд плюс 500 нМ YOYO-1, давали уровни флуоресценции, слегка превышавшие уровень флуоресценции самого YOYO-1 (фиг.2В).
Следовательно, взаимодействующие пары оснований в параллельных гомологичных дуплексах дцДНК, образующихся в присутствии YOYO-1, принимают конфигурацию, неблагоприятную для связываний комплементарных пар оснований по Уотсону-Крику, что ведет к образованию таких дуплексов, которые содержат мисматчи по 1 п.о.
Теперь мы подходим к представлению о том, как мисматчи в связывающихся последовательностях, имеющие место как часть "шпильки" или многоцепочечного комплекса, могут вызвать энергичное и повторяемое движение по мере того, как последовательности оснований стремятся достичь устойчивости идеальной конфигурации связывания в любой из моделей связывания. Следует ожидать, что сила связывания пар оснований выше (upstream) или ниже (downstream) от сайтов нуклеации, ионы металлов и другие факторы будут оказывать влияние на это стремление к осуществлению связывания.
Пример 3
В этом примере исследовали эффективность образования антипараллельных гомологичных дуплексов оцДНК:оцДНК, стимулируемого YOYO-1 или одновалентными катионами.
Все реакции гибридизации, на основании которых получены данные, представленные на фиг.3А, имели следующий состав: 2 пмоль оцДНК-мишени, 2 пмоль оцДНК-зонда, 0,5×ТВЕ и 500 нМ YOYO-1 в конечном объеме 40 мкл. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
На фиг.3В реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль оцДНК-мишени, 2 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и 50 мМ NaCl. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение различных промежутков времени от 1 минуты до 60 минут. После инкубации образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Инкубация оцДНК-зонда №4 с 50-мерной антисмысловой цепью дикого типа SEQ ID No. 5 в присутствии YOYO-1 приводила к образованию антипараллельного гомологичного комплекса оцДНК:оцДНК (фиг.3А). Хотя эффективность образования антипараллельного гомологичного комплекса составляла лишь 65% от таковой при образовании обычной антипараллельной комплементарной дпДНК (ср. фиг.1А и 3А), распознавание и связывание антипараллельных гомологичных последовательностей оцДНК все-таки происходило, чему способствовал YOYO-1. Такой результат был совершенно неожиданным. Более того, антипараллельные гомологичные комплексы оцДНК:оцДНК, содержащие последовательности дикого типа, четко отличались от комплексов, содержащих мисматчи по 1 п.о. или 2 п.о. Интенсивность флуоресценции от ДНК-комплекса с мисматчем по 1 п.о. A-G (антисмысловая цепь SEQ ID No. 7 плюс зонд №4), ДНК-комплекса с мисматчем по 1 п.о. С-Т (антисмысловая цепь SEQ ID No. 6 плюс зонд №4) и ДНК-комплекса с мисматчем по последовательным 2 п.о. (антисмысловая цепь SEQ ID No. 8 плюс зонд №4) была на 25%, 65% и 71% ниже, соответственно, чем у совершенного антипараллельного гомологичного комплекса (антисмысловая цепь SEQ ID No. 5 плюс зонд №4) (фиг.3А). По мере уменьшения степени гомологичности между зондом и мишенью снижался уровень флуоресценции. Контрольные образцы, содержащие каждую 50-мерную оцДНК-мишень плюс 500 нМ YOYO-1, проявляли уровни флуоресценции, которые были на 88-90% ниже, чем у совершенно соответствующих комплексов (фиг.3А). Уровень флуоресценции от 15-мерного оцДНК-зонда №4 плюс 500 нМ YOYO-1 слегка превышал уровень флуоресценции самого YOYO-1.
Далее исследовали образование антипараллельных гомологичных комплексов оцДНК:оцДНК, используя оцДНК-мишени и оцДНК-F-зонды как в присутсвии, так и в отсутствие 50 мМ NaCl. После 15-минутной инкубации оцДНК-F-зонда №6 с 50-мерной антисмысловой цепью дикого типа SEQ Ю No. 5 в присутствии 50 мМ NaCl происходило образование антипараллельных гомологичных комплексов оцДНК:оцДНК-F, как показывает снижение флуоресценции на 34% по сравнению с флуоресценцией самого зонда №6 (фиг.3В). Эффективность образования антипараллельного гомологичного комплекса составила 62% от эффективности образования антипараллельного комплементарного комплекса после 15-минутной инкубации (данные не приводятся). Напротив, антипараллельные гомологичные комплексы оцДНК:оцДНК-F, содержащие мисматч по 1 п.о. A-G (антисмысловая цепь SEQ ID No. 7 плюс зонд №6), мисматч по 1 п.о. С-Т (антисмысловая цепь SEQ ID No. 6 плюс зонд №6), мисматч по 1 п.о. А-Т (антисмысловая цепь SEQ ID No. 10 плюс зонд №6) и мисматч по последовательным 2 п.о. (антисмысловая цепь SEQ ID No. 8 плюс зонд №6) давали снижение флуоресценции на 24%, 26%, 23% и 13%, соответственно, по сравнению с флуоресценцией самого зонда №6 после 15-минутной инкубации (фиг.3В). Конфигурация взаимодействующих оснований в антипараллельных гомологичных дуплексах, очевидно, была неблагоприятна для комплементарного связывания А-Т по Уотсону-Крику, что приводило к изменению интенсивности флуоресценции, указывающему на мисматч по 1 п.о. Меньше антипараллельных гомологичных комплексов образовывалось после 30-минутной инкубации в присутствии 50 мМ NaCl (данные не приводятся). Не наблюдалось образования комплексов после 45-минутной инкубации. Сходные показатели образования антипараллельных гомологичных комплексов и стабильности наблюдались в Трис-буфере без NaCl (данные не приводятся).
Промотированное YOYO-1 или NaCl, распознавание и связывание антипараллельных гомологичных последовательностей оцДНК происходило в конфигурации, позволяющей дискриминировать совершенно спаренные комплексы оцДНК:оцДНК от комплексов, содержащих мисматч по 1 п.о. или 2 п.о. Взаимодействие пар оснований в антипараллельном гомологичном дуплексе приводит к тому, что стандартная пара оснований А-Т Уотсона-Крика оказывает дестабилизирующее воздействие как мисматч.
Пример 4
В этом примере продемонстрировано увеличение эффективности образования параллельных комплементарных комплексов оцДНК:оцДНК при содействии одновалентных катионов. Реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль оцДНК-мишени, 2 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и 50 мМ NaCl. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение различных промежутков времени от 1 минуты до 60 минут. После инкубации образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
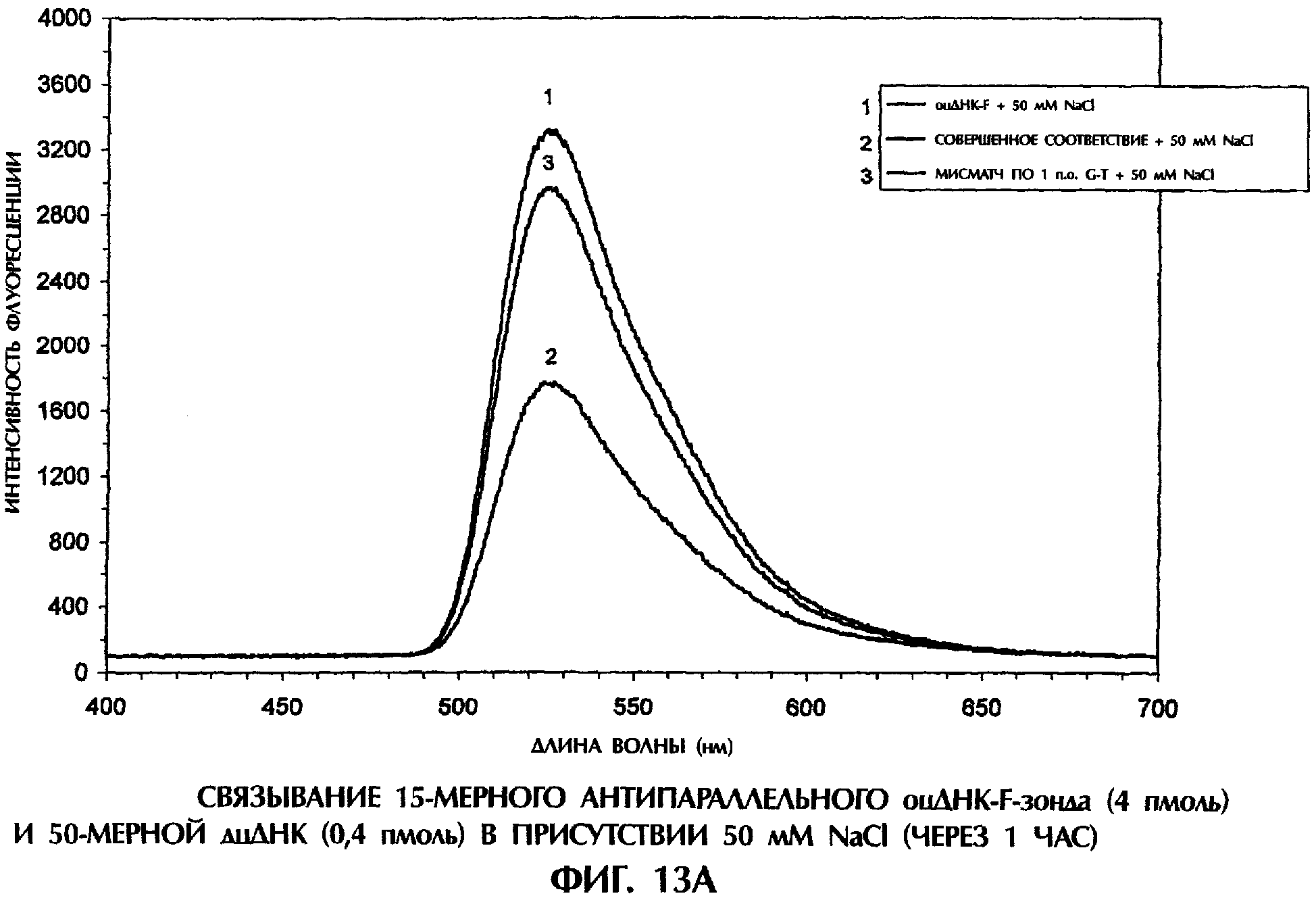
После 15-минутной инкубации в присутствии 50 мМ NaCl с готовностью образовались дуплексы оцДНК:оцДНК-F, состоящие из совершенно комплементарных последовательностей (смысловая цепь SEQ ID No. 5+ зонд №6), что вело к снижению интенсивности флуоресценции на 41% по сравнению с флуоресценцией самого зонда №6 (фиг.4). Такая высокая эффективность образования параллельных комплементарных дуплексов была совершенно неожиданной. Напротив, неполностью комплементарные комплексы оцДНК:оцДНК-F, содержащие мисматч по 1 п.о. T-G (смысловая цепь SEQ ID No. 7+ зонд №6), мисматч по 1 п.о. G-T (смысловая цепь SEQ ID No. 6+ зонд №6), мисматч по 1 п.о. Т-Т (смысловая цепь SEQ ID No. 10+ зонд №6) и мисматч по 2 последовательным п.о. (смысловая цепь SEQ ID No. 8+ зонд №6) давали снижение интенсивности флуоресценции на 18%, 20%, 10% и 16%, соответственно, по сравнению с флуоресценцией самого зонда №6 (фиг.4).
После того, как они образовались в присутствии 50 мМ NaCl, совершенно спаренные параллельные комплементарные дуплексы были очень стабильными, давая снижение интенсивности флуоресценции на 40% и 47% после 30 минут и 45 минут инкубации, соответственно, по сравнению с флуоресценцией самого зонда №6 (данные не приводятся). Параллельные комплементарные комплексы с мисматчем по 1 п.о. и 2 п.о. были намного менее стабильны после 30 минут и 45 минут инкубации в присутствии 50 мМ NaCl (данные не приводятся). Скорость и эффективность образования параллельных комплементарных комплексов оцДНК:оцДНК-F были очень близки таковым при образовании антипараллельных комплементарных комплексов оцДНК:оцДНК-F за первые 45 минут инкубации в присутствии 50 мМ NaCl (данные не приводятся). Хотя антипараллельные комплементарные комплексы продолжали легко образовываться и после 60 минут инкубации в 50 мМ NaCl, образования параллельных комплементарных комплексов в это время не обнаруживалось (данные не приводятся).
NaCl способствовал образованию комплексов ДНК между оцДНК-F-зондом и антипараллельной комплементарной оцДНК-мишенью или между оцДНК-F-зондом и параллельной комплементарной оцДНК-мишенью с одинаковой эффективностью, что позволяет отличить совершенно спаренные комплексы от комплексов, содержащих мисматч по 1 п.о. или 2 п.о.
Пример 5
В примерах 1-4 было показано, что имеют место альтернативные модели распознавания и связывания оснований между антипараллельными или параллельными оцДНК-зондами и комплементарными или гомологичными оцДНК-мишенями с образованием дуплексов оцДНК:оцДНК, отличные от стандартных антипараллельных комплементарных комплексов дцДНК Уотсона-Крика. Данный пример показывает, что основания способны распознавать и взаимодействовать как с комплементарными, так и с гомологичными основаниями в одно и то же время.
Образцы, содержащие 2 пмоль оцДНК-зонда №3, нагревали при 95°С в течение 10 минут и охлаждали до комнатной температуры в течение 30 минут в присутствии различных концентраций свободного основания, получая оцДНК-зонды, содержащие конъюгированные основания. Парные образцы оцДНК-зонда №3 аналогичным образом денатурировали и охлаждали в отсутствие добавленных свободных оснований для получения неконъюгированных оцДНК-зондов. Затем 2 пмоль этих конъюгированных или неконъюгированных опДНК-зондов смешивали с 2 пмоль оцДНК-мишени в присутствии 500 нМ YOYO-1 и 0,5×ТВЕ в конечном объеме 40 мкл. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
При реакции неконъюгированного оцДНК-зонда №3 с 50-мерной смысловой цепью дикого типа SEQ ID No. 5 или с 50-мерной мутантной смысловой цепью SEQ ID No. 7 в присутствии YOYO-1 происходило образование антипараллельных комплементарных комплексов оцДНК:оцДНК (фиг.5А). Интенсивность флуоресценции, испускаемой антипараллельным комплементарным дуплексом с мисматчем по 1 п.о. T-G (смысловая цепь SEQ ID No. 7+ зонд №3) была на 45% ниже, чем у совершенно спаренного антипараллельного комплементарного дуплекса (смысловая цепь SEQ ID No. 5+ зонд №3). Контрольные образцы, содержащие каждую 50-мерную оцДНК-мишень плюс 500 нМ YOYO-1, проявляли уровни флуоресценции, которые были на 92-93% ниже, чем у совершенно спаренных дуплексов (фиг.5А). Уровень флуоресценции, испускаемой 15-мерным оцДНК-зондом №3 плюс 500 нМ YOYO-1, слегка превышал флуоресценцию самого YOYO-1.
При реакции оцДНК-зонда №3 с 50-мерной антисмысловой цепью дикого типа SEQ ID No. 5 в присутствии YOYO-1 эффективность образования параллельного гомологичного дуплекса оцДНК:оцДНК была на 14% ниже, чем эффективность образования антипараллельного комплементарного дуплекса оцДНК:оцДНК (ср. фиг.5А и 5В). Параллельный гомологичный дуплекс с мисматчем по 1 п.о. A-G, образовавшийся при реакции 50-мерной мутантной антисмысловой цепи SEQ ID No. 7 с оцДНК-зондом №3 в присутствии YOYO-1, давал интенсивность флуоресценции, которая была на 47% ниже, чем испускаемая совершенно параллельным гомологичным дуплексом (фиг.5В).
15-мерный оцДНК-зонд №3 содержит 6 адениновых оснований. Конъюгирование 2 пмоль оцДНК-зонда №3 с 3 пмоль свободного тимина может привести к связыванию 25% комплементарного А или 100% гомологичного Т в зонде №3 с добавленным тимином. Комплементарное связывание А-Т является энергетически предпочтительным. Реакция 2 пмоль оцДНК зонда №3 (конъюгированного с 3 пмоль тимина) с 2 пмоль антисмысловой цепи дикого типа SEQ ID No. 5 в присутствии YOYO-1 приводила к резкому усилению образования параллельного гомологичного комплекса оцДНК:оцДНК (фиг.5В). Конъюгирование на 25% оцДНК-зонда с 3 пмоль тимина повышало образование параллельного гомологичного комплекса между совершенно гомологичными последовательностями на 78%. Такое усиление образования параллельного гомологичного комплекса может быть связано со способностью аденинов в зонде №3 к одновременному взаимодействию с конгъюгированными комплементарными тиминовыми основаниями и с гомологичными аденинами в оцДНК-мишени. Более того, взаимодействие с доступными комплементарными основаниями не ухудшало конфигурации гомологичного связывания, принимаемой гомологичными основаниями и их соседями.
Напротив, эффективность образования параллельных гомологичных комплексов, содержащих мисматч по 1 п.о. A-G (антисмысловая цепь SEQ ID No. 7+ зонд №3), повышалась на 16%, когда зонд №3 подвергали конъюгации на 25% с тимином, чем при использовании неконъюгированного зонда №3 (фиг.5В). Это соответствует снижению интенсивности флуоресценции на 65% у параллельного гомологичного комплекса с мисматчем по 1 п.о. A-G по сравнению с совершенно спаренным параллельным гомологичным комплексом при использовании Т-конъюгированного зонда №3. Конъюгирование оцДНК-зонда повышало специфичность при дискриминации между совершенно спаренными параллельными гомологичными комплексами и параллельными гомологичными комплексами с мисматчем по 1 п.о.
Следует отметить, что образование совершенно спаренного антипараллельного комплементарного комплекса оцДНК:оцДНК повышалось на 48%, когда зонд №3, конъюгированный на 25% с тимином, подвергали реакции со смысловой цепью SEQ ID No. 5 в присутствии YOYO-1 (фиг.5А). Одновременное взаимодействие аденина в зонде №3 с конъюгированным комплементарным тимином и комплементарным Т в опДНК-мишени усиливало образование совершенно спаренного антипараллельного комплементарного комплекса. Следует отметить, что образование антипараллельного комплементарного комплекса с мисматчем по 1 п.о. T-G было очень неэффективным при использовании Т-конъюгированного зонда №3, что приводило к снижению интенсивности флуоресценции на 88% по сравнению с флуоресценцией совершенно спаренного антипараллельного комплементарного комплекса, содержащего конъюгированный Т (фиг.5А). Следует также отметить, что дискриминация между совершенно спаренным антипараллельным комплементарным комплексом оцДНК:оцДНК и комплексом с мисматчем по 1 п.о. сильно повышалось при использовании конъюгированных оцДНК-зондов в присутствии YOYO-1.
Конъюгация зонда №3 на 25% с цитозином или гуанозином также повышала эффективность образования антипараллельных комплементарных комплексов и параллельных гомологичных комплексов оцДНК:оцДНК в присутствии YOYO-1, а также увеличивало специфичность в различении совершенно спаренных комплексов и комплексов с мисматчем по 1 п.о. (данные не приводятся).
Образование комплексов оцДНК:оцДНК, содержащих конъюгированные основания, доказывают, что основания в последовательности могут распознавать и взаимодействовать специфически и одновременно как с комплементарными, так и с гомологичными основаниями при условии, что конъюгированное основание комплементарно по Уотсону-Крику какому-нибудь основанию той цепи, которая связывается специфически с другой цепью. Конфигурации распознавания и связывания между основаниями в оцДНК-зонде, конъюгированными основаниями и основаниями в оцДНК-мишени могут быть сходными с конфигурацией оснований, возникающей в антипараллельных и параллельных комплексах дцДНК:оцДНК, описанных в настоящем изобретении.
Пример 6
В примере 6 продемонстрировано образование квадруплексов ДНК между дцДНК-мишенями, содержащими последовательности смешанных оснований, и гомологичными дцДНК-зондами, меченными флуоресцеином. Образование квадруплексов ДНК повышается в присутствии одновалентных катионов, добавленных в реакционную смесь.
Были синтезированы комплементарные 15-мерные смысловые и антисмысловые оцДНК-последовательности, очищены методом ВЭЖХ и подвергнуты отжигу, как описано выше, получая 15-мерные дцДНК-зонды. дцДНК-зонды разбавляли б/д Н2O до концентрации 1 пмоль/мкл.
Зонд №11 - это 15-мерный дцДНК-зонд с присоединенной молекулой флуоресцеина в 5'-положении, сконструированный таким образом, что он полностью гомологичен центральному отрезку в 15 п.о. 50-мерной ДНК-мишени дикого типа (SEQ ID No. 5).
Последовательность смысловой цепи зонда №11 (SEQ ID No. 22): 5'-Flu-CTG TCA ТСТ CTG GTG-3'.
Последовательность антисмысловой цепи зонда №11 (SEQ ID No. 22): 5'-Flu-CAC CAG AGA TGA CAG-3'.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль 5'-меченного флуоресцеином дцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и 100 мМ KCl. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 1 часа без предварительной денатурации. Образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Максимум интенсивности флуоресценции наблюдался при длине волны 525 нм, соответствующей длине волны испускания флуоресцеина. На фиг.6 представлен график зависимости интенсивности флуоресценции от длины волны для каждого анализируемого образца.
В отсутствие KCl не наблюдалось связывания между дцДНК мишенями и зондом №11, при этом наблюдались близкие интенсивности флуоресценции при смешивании дцДНК-мишени дикого типа (SEQ ID No. 5) или мутантной дцДНК-мишени (SEQ ID No. 7) с дцДНК-зондом №11, или в присутствии одного дпДНК-зонда №11 (данные не приводятся).
После 1-часовой инкубации при 21°С в присутствии 100 мМ KCl легко образовывались квадруплексы дцДНК:дцДНК-F, состоящие из совершенно гомологичных последовательностей на дцДНК-мишени (SEQ ID No. 5) и дцДНК-зонде №11, что приводило к снижению интенсивности флуоресценции на 62% по сравнению с флуоресценцией одного дцДНК-зонда №11 (меченная дцДНК-F) (фиг.6). Напротив, неполностью гомологичные квадруплексы дцДНК:дцДНК-F (SEQ ID No. + зонд №11), содержащие мисматч по 1 п.о., были менее устойчивы при этих условиях реакции, давая снижение интенсивности флуоресценции только на 18% по сравнению с флуоресценцией самого дцДНК-зонда №11.
Присутствие одновалентных катионов типа K+ в определенных концентрациях было достаточным для образования квадруплексов между дцДНК-мишенями и дцДНК-зондами, меченными флуоресцеином, в отсутствие предварительной денатурации. Образование квадруплексов происходило в соответствии со сродством гомологичных пар оснований при измеримой и значительно большей степени образования квадруплексов между полностью гомологичными цепями дуплексов. Более того, реакция протекала при комнатной температуре всего лишь за 1 час инкубации при соотношении зонда к мишени 10:1 при использовании природной дцДНК. Используемые в этом примере дцДНК-мишени и дцДНК-зонд были гомологичными, содержали 53% GC и не содержали гомопуриновых или гомопиридиновых участков ни на одной из цепей ДНК. Способ анализа по изобретению оказался способным идентифицировать совершенно гомологичные последовательности дпДНК и последовательности, содержащие пару ошибочно спаренных оснований, с помощью дцДНК-зонда.
Пример 7
Анализ квадруплексов ДНК, проводившийся в примере 6, облегчался при добавлении одновалентных катионов в реакционные смеси. Далее исследовали специфичность анализа, используя двухвалентные катионы для облегчения образования квадруплексов ДНК из дцДНК-мишеней и дцДНК-F-зондов, содержащих 53% GC.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль 5'-меченного флуоресцеином дцДНК-зонда №11, 10 мМ Трис-HCl, рН 7,5, 20 мМ MnCl2 и 20 мМ MgCl2. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 1 часа без предварительной денатурации. Образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. На фиг.7 представлен график зависимости интенсивности флуоресценции от длины волны для каждого анализируемого образца.
При инкубации дцДНК-F зонда №11 (содержащего 53% GC) с 50-мерной дцДНК-мишенью дикого типа (SEQ ID No. 5) или мутантной дцДНК-мишенью (SEQ ID No. 7) в присутствии 20 мМ MnCl2 и 20 мМ MgCl2 происходило образование квадруплексов при комнатной температуре в неденатурирующих условиях. Тогда как идеально гомологичные квадруплексы ДНК давали максимальное снижение интенсивности флуоресценции на 34%, менее благоприятные квадруплексы дцДНК:дцДНК-F, содержащие мисматч по 1 п.о. (SEQ ID No. 7+ зонд №11), давали почти такую же интенсивность флуоресценции, как сам дцДНК-зонд №11 (фиг.7).
Присутствие таких двухвалентных катионов, как Mn+ и Mg2+, способствовало образованию квадруплексов в неденатурирующих условиях и позволяло точно отличить полностью гомологичные квадруплексы из дцДНК-мишени и дцДНК-зонда, а также последовательности квадруплексов, содержащих мисматч по одной паре оснований.
Пример 8
Анализ квадруплексов ДНК, проводившийся в примерах 6 и 7, облегчался при добавлении либо одновалентных, либо двухвалентных катионов в реакционные смеси. В следующем примере продемонстрирована специфичность анализа гомологичных квадруплексов ДНК при применении ДНК-интеркалирующего агента YOYO-1.
Были синтезированы комплементарные 15-мерные смысловые и антисмысловые последовательности оцДНК, очищены методом ВЭЖХ и подвергнуты отжигу, как описано выше, получая 15-мерные дцДНК-зонды. дцДНК-зонды разбавляли б/д Н2O до концентрации 1 пмоль/мкл.
Зонд №12 - это 15-мерный дцДНК-зонд, последовательность которого идентична зонду №11, только без прикрепленной молекулы флуоресцеина.
Последовательность смысловой цепи зонда №12 (SEQ ID No. 23): 5'-CTG TCA ТСТ СТО GTG-3'.
Последовательность антисмысловой цепи зонда №12 (SEQ ID No. 23): 5'-CAC CAG AGA TGA CAG-3'.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль дцДНК-зонда №12, 0,5×ТВЕ и 100 нМ YOYO-1. Реакционные смеси инкубировали при 21°С в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Интенсивность флуоресценции, наблюдавшаяся в отсутствие мишени или зонда (только YOYO-1), приведены на фиг.8. На фиг.8 также представлена интенсивность флуоресценции, наблюдавшаяся при совместном присутствии в реакционной смеси дцДНК-зонда №12 и 50-мерной дцДНК-мишени дикого типа (SEQ ID No. 5), содержащих гомологичные последовательности, или четырех других дцДНК-мишеней, которые, за исключением мисматча по 1 паре оснований, содержали последовательности, гомологичные последовательности оснований дцДНК-зонда №12. Гомологичная дцДНК-мишень дикого типа (SEQ ID No. 5) при совместном присутствии в реакционной смеси дцДНК-зонда №12, давала наибольшую интенсивность флуоресценции. дцДНК-мишени с мисматчем при инкубации с дцДНК-зондом №12 в реакционной смеси давали меньшие значения интенсивности флуоресценции, при этом уменьшение составляло от 20% для одной дцДНК-мишени (SEQ ID No. 10) до 80% для другой дцДНК-мишени по сравнению с флуоресценцией совершенно спаренных квадруплексов (фиг.8).
При этом наблюдалось, что гомологичные комплексы, стабилизованные при интеркаляции YOYO-1, образовывались с большей легкостью между дцДНК-мишенью и дцДНК-зондом, если зонд содержал идеально гомологичные последовательности, чем при наличии хотя бы одной пары оснований, не гомологичной, то есть не идентичной, паре оснований в дцДНК-мишени. Четверные комплексы, описанные в 3 предыдущих примерах, мы назвали зеркально гомологичными.
Пример 9
В данном примере 50-мерные дцДНК-мишени подвергали реакции с 15-мерным дцДНК-зондом, содержащим 53% GC (зонд №13), в котором существует комплементарность Уотсона-Крика между основаниями цепей зонда и проксимальными основаниями цепей мишени, когда большая бороздка одного дуплекса располагается в малой бороздке другого дуплекса. Последовательности оснований в дуплексном зонде негомологичны, а инвертированы относительно оснований в дуплексной мишени. Эти дуплексы при вложении большой бороздки в малую бороздку будут параллельными друг другу, что обозначается нами как вложенная комплементарность.
Были синтезированы комплементарные 15-мерные смысловые и антисмысловые последовательности оцДНК, очищены методом ВЭЖХ и подвергнуты отжигу, как описано выше, получая 15-мерные дцДНК-зонды. дцДНК-зонды разбавляли б/д Н2О до концентрации 1 пмоль/мкл.
Последовательность смысловой цепи зонда №13 (SEQ ID No. 24): 5'-GAC AGT AGA GAC CAC-3'.
Последовательность антисмысловой цепи зонда №13 (SEQ ID No. 24): 5'-GTG GTC TCT ACT GTC-3'.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль дцДНК-зонда №13, 0, 5×ТВЕ и 100 нМ YOYO-1. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Из фиг.9 видно, что в отсутствие предварительной денатурации самая высокая интенсивность флуоресценции наблюдалась при реакции 50-мерной дцДНК-мишени дикого типа (SEQ ID No. 5) с 15-мерным дцДНК-зондом №13, который обладал совершенным соответствием по принципу вложенной комплементарности с дцДНК-мишенью (SEQ ID No. 5). Интенсивность флуоресценции указывает на то, что имеет место связывание ДНК, в данном случае образование квадруплекса между дцДНК-мишенью и дцДНК-зондом со вложенной комплементарностью.
Мутантные дцДНК-мишени с мисматчем по одной паре оснований относительно дуплексного зонда, если оценивать соответствие по принципу инвертированной гомологии вложенной комплементарности, образовывали значительно меньше четверных комплексов с дцДНК-зондом, чем полностью комплементарная дцДНК-мишень дикого типа. В данном примере разнообразные мисматчи оснований, проанализированные по принципу зеркальной гомологии в примере 8, анализировали по принципу вложенной комплементарности.
Как видно из фиг.9, интенсивность флуоресценции при образовании квадруплексов с мисматчем по 1 п.о. из дцДНК-мишени + дцДНК-зонда №13 была на 8-16% меньше, чем у совершенно спаренных квадруплексов (SEQ ID No. 5+ зонд №13).
Большая дискриминация по флуоресценции наблюдалась между совершенно гомологичными и частично гомологичными квадруплексами в примере 8. Это свидетельствует о том, что полностью комплементарные или вложено комплементарные с мисматчем по 1 п.о. дцДНК-зонды связываются с дцДНК-мишенями с меньшей дискриминацией, чем дцДНК-зонды с зеркальной гомологией, которые связываются с большей специфичностью.
Данный пример свидетельствует, что связывание в квадруплексы по Уотсону-Крику между дуплексами ДНК со вложенной комплементарностью легко происходит в присутствии YOYO-1.
Пример 10
В примере 10 продемонстрировано, что способ анализа по изобретению способен дискриминировать совершенно спаренные комплементарные комплексы дцДНК:оцПНК по Уотсону-Крику и комплексы дцДНК:оцПНК с мисматчами по 1 п.о., 2 п.о. и 3 п.о. в присутствии такого катионного деконденсирующего агента, как ДНК-интеркалирующий агент YOYO-1.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль дцДНК-мишени, 2 пмоль оцПНК-зонда, 0,5×ТВЕ и 500 нМ YOYO. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Интенсивность флуоресценции, наблюдавшаяся в отсутствие ДНК или ПНК (только YOYO-1) или при реакции ДНК дикого типа SEQ ID No. 1, мутантной ДНК SEQ ID No. 2 или SEQ ID No. 3 с антипараллельным ПНК-зондом №1 или параллельным ПНК-зондом №2, представлена на фиг.10 А и 10 В, соответственно. Комплексы дцДНК:оцПНК, состоящие из совершенно комплементарных последовательностей (SEQ ID No. 1+ зонд №1) позволяли максимальное взаимодействие между YOYO-1 и этими комплексами, что приводило к наибольшей интенсивности флуоресценции (фиг.10А). Интенсивность флуоресценции у комплекса дцДНК:оцПНК с мисматчем по 1 п.о. (SEQ ID No. 2+ зонд №1) и комплекса дцДНК:оцПНК с мисматчем по 2 п.о. (SEQ ID No. 3+ зонд №1) была на 97% и 99% меньше, соответственно, чем у совершенно спаренного комплекса дцДНК:оцПНК (фиг.10А). Аналогичным образом, при связывании параллельного ПНК-зонда №2 с последовательностями дцДНК-мишени комплексы дцДНК:оцПНК с мисматчами по 1 и 2 п.о. проявляли меньшую на 92% и 97% интенсивность флуоресценции, соответственно, чем у совершенно комплементарных комплексов дцДНК:оцПНК (SEQ ID No. 1+ зонд №2) (фиг.10В). Комплексы дцДНК:оцПНК с мисматчем по 3 п.о., состоящие из SEQ ID No. 4 и зонда №1 или SEQ ID No. 4 и зонда №2, давали на 99% и 97% меньшую интенсивность флуоресценции, соответственно, чем у совершенно спаренных комплексов дцДНК:оцПНК (данные не приводятся). Контрольные образцы, содержащие 50-мерные дцДНК-мишени плюс 500 нМ YOYO-1, проявляли уровни флуоресценции, равные или меньше уровня флуоресценции у комплексов с мисматчем по 3 п.о. (данные не приводятся). Уровень флуоресценции, испускаемой каждым из оцПНК-зондов плюс 500 нМ YOYO-1, был идентичен флуоресценции самого YOYO-1 (данные не приводятся). По мере повышения степени несоответствия между зондом и мишенью уменьшалась степень взаимодействия YOYO-1 с ошибочно спаренными комплексами. Вследствие этого снижалась интенсивность флуоресценции. Такое соотношение наблюдалось независимо от того, использовался антипараллельный или параллельный ПНК-зонд. Уровень флуоресценции, характерный для каждого комплекса, регистрировали по времени, и он оказался стабильным в промежутке от 5 минут до 24 часов.
Интересно, что при реакции 15-мерных последовательностей дцДНК-мишеней с 15-мерными последовательностями ПНК-зондов наблюдались большие отличия по уровню флуоресценции между совершенно спаренными комплексами и комплексами с мисматчами по 1 п.о. или 2 п.о. при использовании параллельных ПНК-зондов, чем при использовании антипараллельных ПНК-зондов (данные не приводятся).
Следовательно, измерение образования комплексов дцДНК:оцПНК по анализу интенсивности флуоресценции позволяет отличить последовательности дикого типа от последовательностей, содержащих мутации по 1 п.о., 2 п.о. или 3 п.о., без предварительной денатурации дуплексной ДНК-мишени.
Пример 11
Далее исследовали специфичность метода измерения образования триплексов, промотированного YOYO-1, подвергая реакции дцДНК-мишени дикого типа и мутантные со смешанной последовательностью оснований с антипараллельными и параллельными оцДНК-зондами в отсутствие предварительной денатурации дпДНК-мишеней.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 2 пмоль дцДНК-мишени, 2 пмоль оцДНК-зонда, 0,5×ТВЕ и 500 нМ YOYO. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение 5 минут, помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
При реакции антипараллельного оцДНК-зонда №3 (содержащего 53% GC) с 50-мерной дцДНК-мишенью дикого типа (SEQ ID No. 5) и мутантными дцДНК-мишенями (SEQ ID No. 6 и SEQ ID No. 8) происходило образование комплексов дцДНК:оцДНК при комнатной температуре в неденатурирующих условиях (фиг.11А). Тогда как совершенно спаренные комплексы ДНК обладали наибольшей интенсивностью флуоресценции, неполностью комплементарные комплексы с мисматчем по 1 п.о. (SEQ ID No. 6+ зонд №3) и с мисматчем по 2 последовательным п.о. (SEQ ID No. 8+ зонд №3) давали меньшую на 63% и 95% интенсивность флуоресценции, соответственно, чем у совершенно спаренных последовательностей (фиг.11А). Уровень флуоресценции уменьшался при возрастании степени несоответствия между зондом и мишенью. Интенсивность флуоресценции, характерную для каждого комплекса, регистрировали по времени, и она оказалась стабильной в промежутке от 5 минут до 24 часов. Контрольные образцы, содержащие 50-мерные дцДНК-мишени плюс 500 нМ YOYO-1, проявляли уровни флуоресценции, которые были ниже уровня флуоресценции у комплексов ДНК с мисматчем по 2 п.о. (данные не приводятся). Уровень флуоресценции, даваемый опДНК-зондом плюс 500 нМ YOYO-1, был идентичен флуоресценции самого YOYO-1 (данные не приводятся). Очень близкие результаты были получены при реакции 15-мерных антипараллельных оцДНК-зондов с 50-мерными дцДНК мишенями дикого типа или мутантными с содержанием GC в 33% и 73% при одинаковых условиях реакции, что свидетельствует о надежности анализа образования комплексов дцДНК:оцДНК с использованием антипараллельных оцДНК-зондов, независимо от содержания GC в оцДНК-зондах и дцДНК-мишенях (данные не приводятся).
Аналогичным образом, в присутствии YOYO-1 происходило образование комплексов дцДНК:оцДНК при реакции параллельного оцДНК-зонда №4 с 50-мерной дцДНК-мишенью дикого типа (SEQ ID No. 5) и мутантными дцДНК-мишенями (SEQ ID No. 6 и SEQ ID No. 8). Интенсивность флуоресценции у комплекса ДНК с мисматчем по 1 п.о. (SEQ ID No. 6+ зонд №4) и с мисматчем по 2 последовательным п.о. (SEQ ID No. 8+ зонд №4) была на 48% и 65% ниже, соответственно, чем у совершенно спаренных последовательностей (фиг.11В). По мере повышения степени несоответствия между зондом и мишенью уменьшался уровень флуоресценции. Несколько меньшая дискриминация между совершенно спаренными и ошибочно спаренными комплексами ДНК наблюдалась при использовании параллельного оцДНК-зонда, чем при использовании антипараллельного оцДНК-зонда для образования комплексов дцДНК:оцДНК.
YOYO-1 способствовал образованию комплекса ДНК между антипараллельным оцДНК-зондом и дцДНК-мишенями, а также между параллельным оцДНК-зондом и дцДНК-мишенями, что позволяет отличить совершенно спаренные комплексы и комплексы с мисматчами по 1 п.о. или 2 п.о., причем не требуется предварительня денатурация дцДНК-мишеней.
Пример 12
Комплексы, образованные в примерах 10 и 11, стабилизировались в присутствии ДНК-интеркалирующего агента YOYO-1 в реакционных смесях. Далее исследовали специфичность метода, используя двухвалентные катионы для промотирования и стабилизации образования комплексов между дцДНК-мишенями и оцДНК-F-зондами.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5, и от 1 мМ до 20 мМ MgCl2 и MnCl2. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение различных промежутков времени от 1 минуты до 2 часов без предварительной денатурации дцДНК-мишеней. После инкубации образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Максимум интенсивности флуоресценции наблюдался при длине волны 525 нм, соответствующей длине волны эмиссии флуоресцеина. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
При инкубации антипараллельного оцДНК-F-зонда №5 в течение 1 часа с 50-мерной дцДНК-мишенью дикого типа (SEQ ID No. 5) в присутствии 15 мМ MgCl2 и 15 мМ MnCl2 происходило очень эффективное образование совершенно комплементарных комплексов дцДНК:оцДНК-F, что приводило к снижению флуоресценции на 74% по сравнению с флуоресценцией самого зонда №5 (фиг.12А). Напротив, комплексы дцДНК:оцДНК-F с мисматчем по 1 п.о. T-G (SEQ ID No. 7+ зонд №5) были значительно менее устойчивы в присутствии 15 мМ MgCl2 и 15 мМ MnCl2, давая снижение флуоресценции на 15% по сравнению с флуоресценцией самого зонда №5 после 1-часовой инкубации (фиг.12А). При реакции зонда №5 (содержащего 53% GC) с дцДНК-мишенью SEQ ID No. 9 (содержащей 33% GC) наблюдалось повышение флуоресценции на 3% по сравнению с флуоресценцией самого зонда №5 (фиг.12А), что указывает на отсутствие образования комплекса ДНК. Такой результат был ожидаем, учитывая, что данная комбинация зонда и мишени ведет к мисматчу в 5 п.о.
В присутствии 10 мМ MgCl2 и 10 мМ MnCl2 комплексы дцДНК:оцДНК-Е, содержащие 53% GC и имеющие совершенно комплементарные последовательности (SEQ ID No. 5+ зонд №5) или мисматч по 1 п.о. T-G (SEQ ID No. 7+ зонд №5), давали на 68% и 20% меньшую интенсивность флуоресценции, соответственно, после 1-часовой инкубации, и меньшую на 76% и 16%, соответственно, после 30-минутной инкубации, чем флуоресценция самого зонда №5 (данные не приводятся). Добавление 5 мМ MgCl2 и 5 мМ MnCl2 (или меньших концентраций) было недостаточным для образования комплексов между антипараллельным оцДНК-F-зондом №5 и всеми тестируемыми дцДНК-мишенями после 1-часовой инкубации (данные не приводятся).
Образование комплексов дцДНК:оцДНК также происходило при реакции параллельного оцДНК-зонда №6 с 50-мерными дцДНК мишенями дикого типа (SEQ ID No. 5) и мутантной (SEQ ID No. 7). В этом случае образование комплексов ДНК усиливалось при значительно меньших концентрациях MgCl2 и MnCl2 (т.е. 1-5 мМ каждого) и требовалось более короткое время инкубации. Инкубация в присутствии 1 мМ MgCl2 и 1 мМ MnCl2 или 2 мМ MgCl2 и 2 мМ MnCl2 в течение 15 минут была достаточной для образования комплексов ДНК (данные не приводятся). Интенсивность флуоресценции у совершенно спаренного комплекса ДНК (SEQ ID No. 5+ зонд №6) и комплекса с мисматчем по 1 п.о. (SEQ ID No. 7+ зонд №6) была на 29% и 6% меньше, соответственно, чем у самого параллельного оцДНК-зонда №6 в присутствии 3 мМ MgCl2 и 3 мМ MnCl2 после 45-минутной инкубации (фиг.12В).
Несмотря на то, что комплексы ДНК легко образовались при 10 мМ MgCl2 и 10 мМ MnCl2 после 1-часовой инкубации, не наблюдалось дискриминации между совершенно спаренными и ошибочно спаренными комплексами при использовании параллельного оцДНК-зонда. Концентрации свыше 15 мМ MgCl2 и 15 мМ MnCl2 вызывали ингибирование образования комплекса ДНК с параллельным оцДНК-зондом (данные не приводятся).
Добавление образующих солевые мостики конденсирующих агентов типа двухвалентных катионов усиливало образование комплексов ДНК между неденатурированными дцДНК-мишенями и флуоресцентно меченными антипараллельными или параллельными оцДНК-зондами, что позволяет точно и надежно отличить совершенно комплементарные последовательности от последовательностей с мутацией по 1 п.о. Реакции протекали при комнатной температуре в течение 15-60 минут инкубации при соотношении зонда к мишени 10:1. дцДНК-мишени и оцДНК-зонды не содержали гомопуриновых или гомопиримидиновых цепочек ДНК. Несмотря на присутствие 5 пиримидиновых оснований, рассредоточенных по длине 15-нуклеотидных оцДНК-зондов, комплексы ДНК легко образовывали последовательности специфичным образом.
Пример 13
Пригодность зондов различной направленности также исследовали при использовании одновалентных катионов для усиления и стабилизации образования комплексов с дцДНК-мишенями.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль дцДНК-мишени, 4 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и от 10 мМ до 150 мМ NaCl. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение различных промежутков времени от 1 минуты до 2 часов без предварительной денатурации дцДНК-мишеней. После инкубации образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Максимум интенсивности флуоресценции наблюдался при длине волны 525 нм, соответствующей длине волны эмиссии флуоресцеина. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
В отсутствие NaCl либо в присутствии 10 мМ или 25 мМ NaCl не наблюдалось связывания между дцДНК-мишенями (SEQ ID No. 1 или SEQ ID No. 2) и антипараллельным оцДНК-F-зондом №7 при всех интервалах времени инкубации (данные не приводятся).
После 1-часовой инкубации в присутствии 50 мМ NaCl легко образовывались комплексы дцДНК:оцДНК-Р, состоящие из совершенно комплементарных последовательностей (SEQ ID No. 1+ зонд №7), что приводило к снижению интенсивности флуоресценции на 49% по сравнению с флуоресценцией контрольного зонда №7, который подвергали аналогичной инкубации в реакционной среде (фиг.13А). Напротив, неполностью комплементарные комплексы дцДНК:оцДНК-F с мисматчем по 1 п.о. G-T (SEQ ID No. 2+ зонд №7) давали снижение интенсивности флуоресценции на 11% по сравнению с флуоресценцией контрольного образца зонда №7.
Присутствие 75 мМ, 100 мМ и 125 мМ NaCl в реакционной среде также приводило к тушению флуоресценции, что согласуется со значительной степенью образования комплекса между совершенно спаренной мишенью SEQ ID No. 1 и антипараллельным зондом №7, и приводило к значительно меньшему тушению в присутствии мишени с мисматчем по 1 п.о. G-T SEQ ID No. 2 и зонда №7, давая интенсивность флуоресценции, близкую к тем, что наблюдались в присутствии 50 мМ NaCl (данные не приводятся).
Образование комплексов дцДНК:оцДНК также происходило при реакции параллельного оцДНК-зонда №6 с 50-мерными дцДНК-мишенью дикого типа (SEQ ID No. 5) и мутантной дцДНК-мишенью (SEQ ID No. 7) в присутствии 50 мМ, 75 мМ, 100 мМ или 150 мМ NaCl. Оптимальные результаты были получены в присутствии 100 мМ NaCl. После 75-минутной инкубации при комнатной температуре в реакционной среде, содержащей 100 мМ NaCl, интенсивность флуоресценции совершенно спаренного комплекса ДНК (SEQ ID No. + зонд №5) и комплекса ДНК с мисматчем по 1 п.о. (SEQ ID No. 7+ зонд №6) была на 53% и 9% ниже, соответственно, чем у контрольного параллельного оцДНК-зонда №6 при реакции в тех же условиях (фиг.13В). 50 мМ NaCl обеспечивают максимальную дискриминацию между совершенно спаренными и ошибочно спаренными комплексами в течение времени инкубации в 45 минут (данные не приводятся). В общем, комплексы, содержащие антипараллельные или параллельные оцДНК-зонды, по-видимому, образуются с близкой эффективностью при одинаковых концентрациях NaCl и времени инкубации.
Применение одновалентных катионов, которые известны как ДНК-конденсирующие агенты, способствовало образованию комплексов ДНК между неденатурированными дцДНК-мишенями и флуоресцентно меченными антипараллельными или параллельными оцДНК-зондами, что позволяет надежно отличить комплексы, содержащие совершенно комплементарные последовательности, от комплексов с мисматчем по 1 п.о.
Пример 14
Комплексы дцДНК:оцДНК легко образуются под воздействием YOYO-1 при комнатной температуре за 5 минут инкубации и дают один и тот же уровень интенсивности флуоресценции в течение нескольких часов. Комплексы, содержащие мисматчи оснований, аналогичным образом дают устойчивые сигналы флуоресценции, что указывает на одинаковую степень образования комплексов во времени. Для исследования скорости образования, стабильности и скорости распада комплексов дцДНК:оцДНК, образованных в присутствии таких конденсирующих агентов, как катионы, проводили эксперименты по временной зависимости.
Все реакционные смеси для гибридизации (40 мкл) имели следующий состав: 0,4 пмоль неденатурированной дцДНК мишени, 4 пмоль 5'-меченного флуоресцеином оцДНК-зонда, 10 мМ Трис-HCl, рН 7,5 и 10 мМ MgCl2 и 10 мМ MnCl2. Реакционные смеси инкубировали при комнатной температуре (21°С) в течение различных промежутков времени от 1 минуты до 2 часов. После инкубации образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции. Дальнейшее измерение флуоресценции тех же образцов проводили после последующего многократного облучения лазером в указанные промежутки времени (фиг.14). Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Флуоресценция контрольных образцов, содержащих 4 пмоль зонда №5 плюс 10 мМ MgCl2 и 10 мМ MnCl2 в отсутствие дцДНК-мишени, резко уменьшалась в 3 раза всего лишь за 5 минут инкубации (данные не приводятся), а затем монотонно снижалась со значительно меньшей скоростью в течение следующих нескольких часов (фиг.14А). Этот эффект мы обозначаем как "катионное тушение". Такое ингибирование флуоресценции, связанное с увеличенным временем инкубации оцДНК-F-зондов с определенными катионами, обычно происходило в присутствии двухвалентных катионов, но не в присутствии одновалентных катионов (данные не приводятся). Это наблюдение подчеркивает важность инкубирования контрольного образца в опыте точно в тех же условиях, при которых происходит реакция в тестируемых образцах эксперимента. Неоднократное облучение лазером контрольных образцов оцДНК-F после различного времени инкубации подавляло дальнейшее тушение флуорофора, что приводило к постоянному уровню флуоресценции после этого (фиг.14А). Такой результат был совершенно неожиданным.
При инкубации антипараллельного оцДНК-F-зонда №5 с 50-мерной дцДНК-мишенью дикого типа (SEQ ID No. 5) в присутствии 10 мМ MgCl2 и 10 мМ MnCl2 образование комплекса дцДНК:оцДНК-Р проявлялось после 15 минут инкубации, вызывая снижение флуоресценции, которое было на 6% больше, чем прогрессирующее катионное тушение контрольного зонда №5 (ср. фиг.14А и 14В). Образование комплекса сильно проявлялось после 30 и 60 минут инкубации SEQ ID No. 5 с зондом №5 в присутствии 10 мМ MgCl2 и 10 мМ MnCl2, давая снижение флуоресценции на 76% и 61%, соответственно, по сравнению с флуоресценцией самого зонда №5, испытавающего катионное тушение (фиг.14В). После 90 и 120 минут инкубации в присутствии 10 мМ MgCl2 и 10 мМ MnCl2 не было признаков образования комплекса (фиг.14В). Уровень флуоресценции, наблюдавшийся через 90 и 120 минут, был полностью объясним эффектом катионного тушения (ср. фиг.14А и 14В).
Напротив, комплексы дцДНК:оцДНК-Р с мисматчем по 1 п.о. T-G (SEQ ID No. 7+ зонд №5) образовывались с меньшей скоростью и были значительно менее стабильны после образования в присутствии 10 мМ MgCl2 и 10 мМ MnCl2. Комплекс с мисматчем по 1 п.о. T-G впервые наблюдался после 30 минут инкубации и, по-видимому, исчезал после 60 минут инкубации (фиг.14С). И в этом случае зонд был антипараллельным комплементарной цепи дуплекса (фиг.14С).
Неоднократное облучение лазером совершенно комплементарных комплексов дцДНК:оцДНК (SEQ ID No. 5+ зонд №5), образовавшихся после 30 минут или 60 минут инкубации в присутствии 10 мМ MgCl2 и 10 мМ MnCl2, приводило к такому уровню флуоресценции, который согласуется с разрушением этих комплексов со скоростью, характерной для комплексов ДНК, содержащих антипараллельный оцДНК-зонд (фиг.14В). При последующем измерении через 45 минут после облучения лазером совершенно комплементарного комплекса в точке 30 минут уровень флуоресценции составил 1869, что свидетельствует о быстроте разрушения комплекса (данные не приводятся). Уровень флуоресценции после неоднократного облучения лазером возвращался к значениям, наблюдавшимся при катионном тушении самого контрольного не находящегося в комплексе зонда №5 (ср. фиг.14А и 14В). Единственным исключением были совершенно спаренные комплексы, образовавшиеся после 15 минут инкубации и подвергавшиеся неоднократному облучению после этого (фиг.14В). В этом случае уровень флуоресценции не соответствовал разрушению комплексов (фиг.14В), несмотря на то, что дальнейшее катионное тушение зонда №5, подвергавшегося неоднократному облучению после 15-минутной инкубации, полностью подавлялось. Комплексы дцДНК:оцДНК с мисматчем по 1 п.о. T-G (SEQ ID No. 7+ зонд №5) аналогичным образом разрушались при многократном облучении лазером (фиг.14С).
Был проведен эксперимент для определения основы эффекта многократного облучения лазером на комплексы. Оказалось, что при повторном добавлении катионов в реакционную смесь, дважды подвергавшуюся лазерному облучению, подавление катионного тушения флуоресценции оцДНК-F-зонда было необратимым, а при дальнейшей инкубации не происходило дополнительного катионного тушения, что свидетельствует о том, что оцДНК-F-зонд был инактивирован неоднократным облучением по неизвестному механизму (данные не приводятся). Аналогичным образом при добавлении новой порции оцДНК-F-зондов в реакционную смесь, дважды подвергавшуюся лазерному облучению, после нормализации на повышение флуоресценции при внесении новой порции зонда, не наблюдалось дальнейшего прогрессирующего катионного тушения при дальнейшей инкубации реакционной смеси, что свидетельствует о том, что подвергавшиеся лазерному облучению катионы были каким-то образом выведены из строя (данные не приводятся).
В предыдущих примерах и описании мы установили, что гетерополимерные цепи нуклеиновой кислоты могут специфически связываться по принципу гомологичного спаривания оснований. Такое связывание может происходить между параллельными или антипараллельными цепями.
Мы также установили, что нуклеиновые основания, связанные в комплементарный дуплекс Уотсона-Крика, не являются неподвижными в отношении оснований ближайших цепей нуклеиновой кислоты, и что с такими основаниями возможно взаимодействовать по принципу комплементарного спаривания оснований Уотсона-Крика или гомологичного спаривания оснований, в зависимости от потенциала связывания проксимальной последовательности оснований в соответствии с любым из возможных принципов связывания. Это справедливо независимо от того, взаимодействуют основания в дуплексе с основаниями третьей цепи с образованием специфически связанной структуры триплекса или взаимодействуют основания дуплекса специфически с проксимальными основаниями, которые сами уже объединены в комплементарный дуплекс по Уотсону-Крику. Соответственно, изобретение включает открытие того, что сопряженные по Уотсону-Крику основания сохраняют способность к реакции как специфические основания для взаимодействия и связывания с проксимальными основаниями на других цепях и делают это с большой специфичностью и готовностью. Все это замечательно, однако особенно замечательно то, что спаривания А:Т и G:C проявляются как мисматчи в тех реакциях связывания, в которых преобладает принцип гомологичного связывания, и распространяется на все пары оснований по всей цепи. Равно замечательно и то, что связывание в гомологичных квадруплексах более специфично, чем связывание в комплементарных квадруплексах Уотсона-Крика. По необходимости образование квадруплекса происходит со стороны большой бороздки сопряженного в дуплекс основания или пары оснований и со стороны малой бороздки сопряженного в дуплекс основания или пары оснований. Ранее, хотя возможность дополнительного связывания основанием, уже объединенным в дуплекс, была неизвестна, однако постулировалось, что распознавание оснований дуплекса третьей цепью имеет место только в большой бороздке дуплекса. Мы показали, что это не так. Мы также показали, что предполагаемое отталкивание остовов не является барьером для взаимодействия дуплекс:дуплекс.
Наше изобретение касается легко осуществимых реакций связывания, которые обычно проводятся за короткое время инкубации при комнатной температуре и не зависят от молярного избытка реагента для прохождения реакции. Соответственно, было показано, что изобретение не только легко осуществимо, но и важно в биологическом смысле.
Наконец, мы показали, что частично комплементарная по Уотсону-Крику конъюгация со свободными основаниями может способствовать усилению связывания в дуплексе и повышению специфичности.
Изобретение представляет значительный вклад в знания о связывании оснований и как таковое будет играть центральную роль в выяснении многих биологических функций, механизмы которых остаются загадочными, таких как выключение генов (silencing).
Более всего оно замечательно тем, что позволяет выявлять специфическое гомологичное распознавание и связывание основаниями, уже входящими и стабильно конъюгированными в комплементарный дуплекс Уотсона-Крика.
Мы полагаем, что то, что мы открыли, потребует отбросить многие канонические идеи и снова поднять вопрос о связывающей способности нуклеиновых кислот.
Несмотря на то, что изобретение описано подробно и на конкретных примерах, специалисты в этой области должны понимать, что в нем можно осуществлять различные изменения и модификации, не отходя от его духа и не выходя за его рамки.
Реферат
Изобретение относится к области биохимии и может быть использовано для анализа последовательностей нуклеиновых кислот или аналогов нуклеиновых кислот. Анализ гетерополимерной последовательности мишени, представляющей собой нуклеиновую кислоту или ее аналог, проводят путем формирования комплекса мишени с зондом в присутствии флуоресцентной метки, облучения комплекса с детектированием возникающего сигнала и установления степени сродства последовательностей зонда и мишени. Комплекс, получаемый в процессе указанного способа, представляет собой либо квадруплекс, либо дуплекс или триплекс, стабилизированный гомологичным связыванием оснований. Применение изобретения позволяет провести быстрый и эффективный анализ последовательностей нуклеиновых кислот или их аналогов. 2 н. и 56 з.п. ф-лы, 14 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ идентификации вирусов и бактерий, основанный на сэндвич-гибридизации нуклеиновых кислот

Комментарии