Способ получения продуктов ферментации - RU2486235C2
Код документа: RU2486235C2
Чертежи







Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам получения продуктов ферментации из содержащего лигноцеллюлозу материала с использованием одного или нескольких ферментирующих организмов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Из-за ограниченных ресурсов горючих полезных ископаемых и опасений относительно выделения газов, создающих парниковый эффект, увеличивается внимание к использованию возобновляемых источников энергии.
Получение продуктов ферментации из содержащего лигноцеллюлозу материала известно в данной области и включает предварительную обработку, гидролиз и ферментацию содержащего лигноцеллюлозу материала.
Стадию ферментации проводят с использованием ферментирующего организма, способного превращать поддающиеся ферментации сахара в желаемый продукт ферментации. После того, как ферментирующий организм инокулируют в среду для ферментации, он проходит через ряд фаз. Начальную фазу обозначают как «латентная фаза», и она представляет собой период адаптации, когда не продуцируется значительного количества продукта ферментации. Во время следующих двух фаз, обозначаемых как «экспоненциальная фаза» с увеличивающимся ростом и «стационарная фаза», представляющая собой фазу после максимального роста, продуцируются значительные количества продукта ферментации. Циклы ферментации, как правило, могут проходить в течение вплоть до 96 часов или более, что делает каждый цикл требующим больших затрат времени и дорогостоящим.
Способ получения продуктов ферментации из содержащих лигноцеллюлозу материалов или целлюлозной «биомассы» является также ограниченным устойчивостью ферментирующего организма к множеству токсинов, обнаруженных в неочищенных гидролизатах, применяемых в способе ферментации. Удаление токсинов из гидролизата является сложным, требующим больших затрат времени и дорогостоящим. Чтобы исключить дорогостоящую стадию удаления токсинов, процентное содержание твердых веществ в гидролизатах обычно поддерживают ниже 10% общего содержания твердых веществ (масс./масс.), таким образом минимизируя эффект токсинов на ферментирующий организм. К сожалению, ограничение общей концентрации твердых веществ означает меньшее количество доступного для ферментации субстрата и меньший выход продукта ферментации на партию.
Таким образом, является очень желательным использовать неочищенные гидролизаты с высокой общей концентрацией и уменьшать время ферментации, необходимое для получения желаемого продукта ферментации из содержащего лигноцеллюлозу материала.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к способам получения продуктов ферментации из содержащего лигноцеллюлозу материала с использованием одного или нескольких ферментирующих организмов.
Изобретение относится к способам получения продуктов ферментации из содержащего лигноцеллюлозу материала, где способ включает:
i) предварительную обработку содержащего лигноцеллюлозу материала;
ii) гидролиз предварительно обработанного содержащего лигноцеллюлозу материала;
iii) ферментацию с использованием ферментирующего организма;
где ферментацию начинают и проводят при:
a) количестве клеток ферментирующего организма в диапазоне 10-250×1010 клеток на 1 л среды для ферментации; или
b) концентрации ферментирующего организма в диапазоне 2-90 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 показан эффект различных количеств растворов сахара и фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) на продукцию этанола при периодической ферментации в двух различных штаммах дрожжей через 96 часов.
На Фиг.2 показан эффект высокой плотности клеток RED STAR™ на периодическую ферментацию этанола в фильтрованном ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей.
На Фиг.3 показан эффект высокой плотности клеток дрожжей RWB218 на периодическую ферментацию этанола в ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей.
На Фиг.4 показан эффект высокой плотности клеток RED STAR™ и повторного использования клеток при рН5 на продукцию этанола при периодической ферментации в фильтрованном ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при исходной концентрации клеток дрожжей 40 г/л.
На Фиг.5 показан эффект высокой плотности клеток RED STAR™ и повторного использования клеток при рН 6 на продукцию этанола при периодической ферментации в фильтрованном ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при исходной концентрации клеток дрожжей 40 г/л.
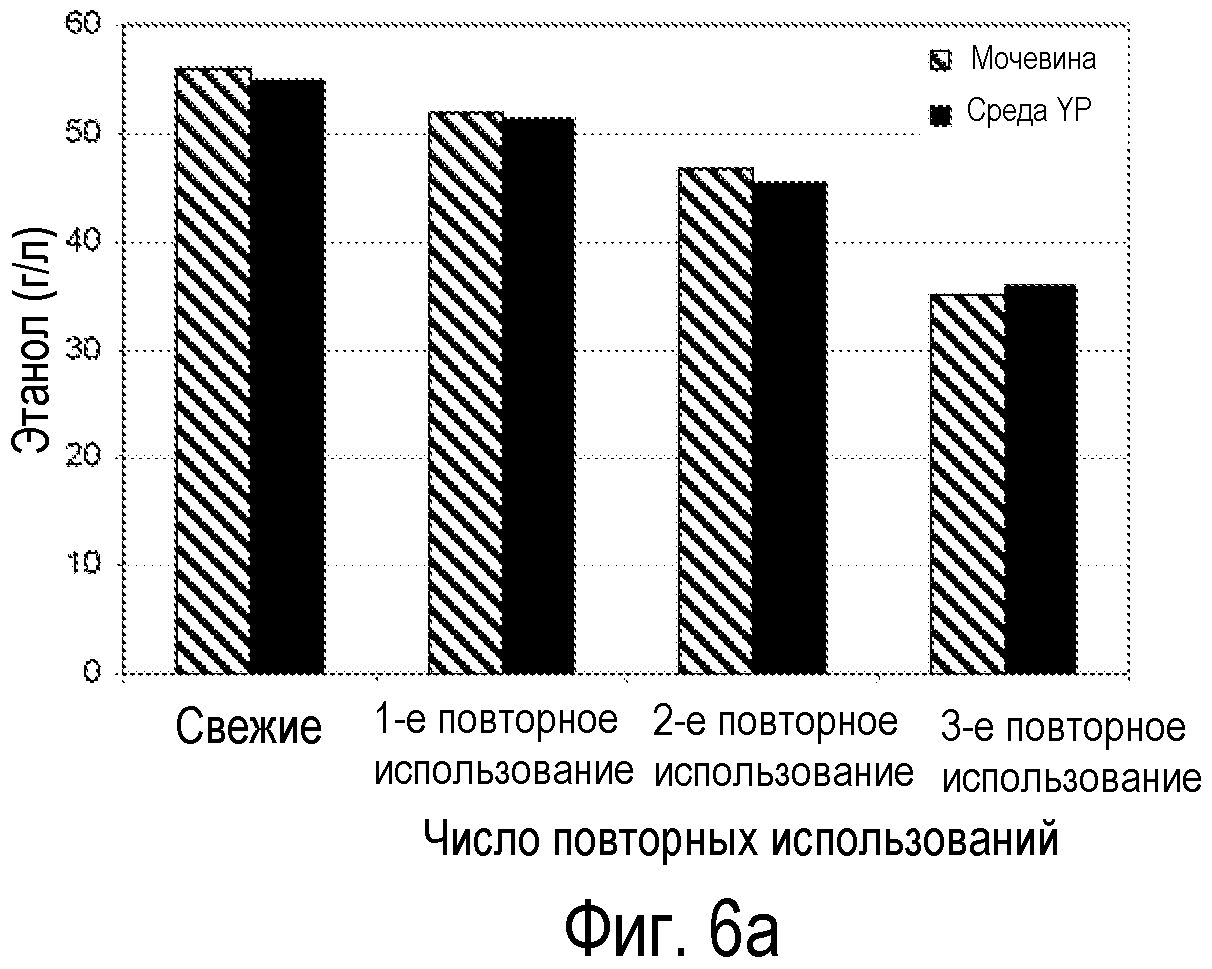
На Фиг.6а показан эффект высокой плотности клеток дрожжей RWB218 и повторного использования клеток на продукцию этанола при периодической ферментации с подпиткой в центрифугированном ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при концентрации клеток дрожжей 20 г/л.
На Фиг.6b показан эффект высокой плотности клеток дрожжей RWB218 на продукцию этанола при периодической ферментации с подпиткой в центрифугированном ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при концентрации клеток дрожжей 20 г/л от 0 до 24 часов.
На Фиг.7 показан эффект высокой плотности дрожжей RWB218 на продукцию этанола при периодической ферментации из кукурузной соломы (CS), предварительно обработанной с помощью различных способов предварительной обработки, в ферментном гидролизате предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способам получения продуктов ферментации из содержащего лигноцеллюлозу материала с использованием одного или нескольких ферментирующих организмов.
В соответствии с настоящим изобретением время ферментации можно значительно сократить посредством проведения ферментации при очень высоком количестве клеток во время ферментации. Даже несмотря на то, что скорость ферментации для ферментирующего организма может не быть выше, чем в общепринятых способах ферментации, тот факт, что абсолютное число ферментирующих организмов является высоким во время ферментации, приводит к быстрой продукции (определенной как абсолютное количество продукта ферментации в единицу времени) желаемого продукта ферментации.
Кроме того, согласно изобретению, ферментирующий организм можно выделять и использовать повторно, как описано ниже. Укороченное время ферментации и необязательное повторное использование ферментирующих организмов снижает общую стоимость способов по настоящему изобретению по сравнению с общепринятыми способами.
Следовательно, изобретение относится к способам получения продуктов ферментации из содержащего лигноцеллюлозу материала, где способ включает:
i) предварительную обработку содержащего лигноцеллюлозу материала;
ii) гидролиз предварительно обработанного содержащего лигноцеллюлозу материала;
iii) ферментацию с использованием ферментирующего организма;
где ферментацию начинают и проводят при:
a) количестве клеток ферментирующего организма в диапазоне 10-250×1010 клеток на л среды для ферментации; или
b) концентрации ферментирующего организма в диапазоне 2-90 г массы ферментирующего организма в сухом состоянии на л среды для ферментации.
В предпочтительном варианте осуществления нерастворимые твердые вещества (включая лигнин и непревращенные полисахариды) удаляют перед ферментацией. Например, нерастворимые твердые вещества можно удалять после предварительной обработки содержащего лигноцеллюлозу материала на стадии i). Предварительно обработанный полученный из лигноцеллюлозы материал, с удаленными нерастворимыми твердыми веществами, можно затем подвергать ферментации по изобретению. В другом варианте осуществления нерастворимые твердые вещества можно удалять после гидролиза предварительно обработанного содержащего лигноцеллюлозу материала на стадии ii). Гидролизованный предварительно обработанный полученный из лигноцеллюлозы материал, с удаленными нерастворимыми твердыми веществами, можно затем подвергать ферментации по изобретению.
Полученные из лигноцеллюлозы поддающиеся ферментации сахара, подлежащие ферментации, присутствуют в форме жидкости (например, фильтрата), поступающей со стадий предварительной обработки или гидролиза i) или ii), или с обеих стадий i) и ii). В предпочтительном варианте осуществления гидролиз на стадии ii) и ферментацию на стадии iii) проводят как отдельные стадии гидролиза и ферментации (SHF), как комбинированную стадию гидролиза и ферментации (HHF) или как стадию одновременного гидролиза и ферментации (SSF). Стадии SSF, HHF и SHF хорошо известны в данной области.
В предпочтительном варианте осуществления ферментацию можно проводить при количестве клеток ферментирующего организма в диапазоне 20-250×1010 клеток на л среды для ферментации, более предпочтительно, в диапазоне 50-250×1010 клеток на л среды для ферментации, более предпочтительно, в диапазоне 100-250×1010 клеток на л среды для ферментации, более предпочтительно, в диапазоне 150-250×1010 клеток на л среды для ферментации, например, в диапазоне 200-250×1010 клеток на 1 л среды для ферментации.
В предпочтительном варианте осуществления ферментацию можно проводить при концентрации ферментирующего организма в диапазоне 3-90 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации, 3-50 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации, предпочтительно, в диапазоне 4-50 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации, предпочтительно, в диапазоне 5-50 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации, более предпочтительно, в диапазоне 10-50 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации, более предпочтительно, в диапазоне 10-40 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации; особенно в диапазоне 10-30 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации.
Согласно изобретению ферментирующие организмы можно иммобилизовывать. Например, ферментирующие организмы можно иммобилизовывать на инертных подложках с высокой площадью поверхности, суспендированных в резервуаре/сосуде для ферментации, через который подают гидролизованный и/или предварительно обработанный полученный из лигноцеллюлозы материал, подлежащий ферментации. Любой способ иммобилизации можно использовать по изобретению. Способы иммобилизации ферментирующих организмов хорошо известны в данной области. Примеры пригодных способов иммобилизации можно найти, например, в Kesava et al., 1996, «Ethanol production by immobilized whole cells of Zymomonas mobilis in a continuous flow expanded bed bioreactor and a continuous flow stirred tank bioreactor», Journal of Industrial Microbiology 17:11-14; Gough et al., 1998, «Production of ethanol from molasses at 45 degrees C using Kluyvemmyces marxianus IMB3 immobilized in calcium alginate gels and poly(vinyl alcohol) cryogel», Bioprocess Engineering 19:87-90; Love et al., 1998, «Continuous ethanol fermentation at 45 degrees C using Kluyveromyces marxianus IMB3 immobilized in Calcium alginate and kissiris», Bioprocess Engineering 18:187-189; Abbi et al., 1996, «Bioconversion of pentose sugars to ethanol by free and immobilized cells of Candida shehatae (NCL-3501): Fermentation behaviour» Process Biochemistry 31:555-560; Krishnan et al., 2000, «Ethanol production from glucose and xylose by immobilized Zymomonas mobilis CP4(pZB5)», Applied Biochemistry And Biotechnology 84-6:525-541; Chibata et al., 1981, Ann. Rev. Microphys. Bioeng 10: 197-216; Fukui et al., 1982, Ann. Rev. Microbial 36: 145-172; John F. Kennedy, 1982, Nature, 299: 777-778 (содержание всех ссылок, таким образом, приведено в качестве ссылки).
В одном варианте осуществления ферментирующие организмы можно преимущественно выделять и использовать повторно. Например, ферментирующие организмы можно выделять их отделением от среды для ферментации в резервуаре/сосуде для ферментации. Альтернативно, ферментирующие организмы можно выделять их отделением от среды для ферментации после ферментации. Фракцию среды для ферментации, содержащую продукт ферментации, можно далее перерабатывать или очищать, например, перегонкой. Выделенные ферментирующие организмы можно использовать повторно в том же самом резервуаре/сосуде для ферментации или в одном или нескольких других резервуарах/сосудах для ферментации. Иными словами, ферментирующие организмы можно выделять и возвращать в среду для ферментации и таким образом использовать повторно в одном или нескольких дополнительных циклах ферментации по изобретению. Число циклов ферментации, в которых можно использовать возвращенные ферментирующие организмы, может зависеть от ряда факторов, включая, в качестве неограничивающих примеров, pH, тип ферментирующего организма, концентрацию продукта ферментации, например, концентрацию этанола, или общую концентрацию твердых веществ (TS). Специалисты в данной области могут изменять эти факторы согласно изобретению для оптимизации числа событий повторного использования.
В другом варианте осуществления стадию размножения можно добавлять в способ выделения и повторного использования ферментирующих организмов. Например, выделенный ферментирующий организм можно размножать в течение какого-либо периода времени перед возвращением в цикл или повторным использованием в последующем цикле ферментации.
Любой способ можно использовать для выделения ферментирующих организмов. Пригодные способы хорошо известны в данной области, включая фильтрацию, например, с использованием фильтр-пресса, и центрифугирование.
Согласно предпочтительному варианту осуществления фермент, способный превращать ксилозу в ксилулозу, может присутствовать во время гидролиза и/или ферментации. Такой превращающий ксилозу в ксилулозу фермент может в предпочтительном варианте осуществления представлять собой ксилозо-изомеразу (иногда обозначаемую как глюкозо-изомераза). Примеры пригодных ксилозо-изомераз можно найти в разделе «Ксилозо-изомераза» ниже. Превращение ксилозы в ксилулозу является преимущественным, поскольку оно позволяет некоторым общепринятым C6 ферментирующим организмам, таким как Saccharomyces cerevisiae, превращать ксилулозу в желаемый продукт ферментации, такой как этанол, одновременно с ферментацией C6 сахаров, особенно таких, как глюкоза.
В одном варианте осуществления ферментацию поддающихся ферментации C6 и C5 сахаров проводят одновременно. Одновременную ферментацию C5 и C6 сахаров можно проводить следующим образом:
Стадия ферментации iii) дополнительно включает:
a) одновременную ферментацию C5 и C6 сахаров, полученных на стадии предварительной обработки i) или стадии гидролиза ii);
b) выделение и повторное использование ферментирующих организмов.
Альтернативно, в другом варианте осуществления стадия гидролиза ii) и стадия ферментации iii) дополнительно включают:
1) одновременный гидролиз и одновременную ферментацию C5 и C6 сахаров, полученных на стадии предварительной обработки i).
В другом варианте осуществления стадия гидролиза ii) и стадия ферментации iii) дополнительно включают:
1) одновременный гидролиз и одновременную ферментацию C5 и C6 сахаров, полученных на стадии предварительной обработки i);
2) выделение и повторное использование ферментирующих организмов.
Альтернативно, в другом варианте осуществления, ферментацию поддающихся ферментации C5 сахаров проводят после ферментации поддающихся ферментации C6 сахаров. Последовательную ферментацию C6 и C5 сахаров можно проводить следующим образом:
Стадия ферментации iii) дополнительно включает:
a) ферментацию C6 сахаров, полученных на стадии предварительной обработки i) или стадии гидролиза ii);
b) выделение и повторное использование C6 ферментирующих организмов;
c) ферментацию C5 сахаров;
d) выделение и повторное использование C5 ферментирующих организмов.
Альтернативно, в другом варианте осуществления стадия гидролиза ii) и стадия ферментации iii) дополнительно включает:
1) одновременный гидролиз и ферментацию C6 сахаров, полученных на стадии предварительной обработки i);
2) ферментацию C5 сахаров.
Альтернативно, в другом варианте осуществления стадия гидролиза ii) и стадия ферментации iii) дополнительно включают:
1) одновременный гидролиз и ферментацию C6 сахаров, полученных на стадии предварительной обработки i);
2) удаление нерастворимых твердых веществ;
3) ферментацию C5 сахаров;
4) выделение и повторное использование ферментирующих организмов.
В одном варианте осуществления содержащий лигноцеллюлозу материал можно детоксифицировать. В одном варианте осуществления материал промывают перед гидролизом и/или ферментацией. В другом варианте осуществления содержащий лигноцеллюлозу материал может являться недетоксифицированным, например, непромытым.
Содержащий лигноцеллюлозу материал
«Лигноцеллюлоза» или «содержащий лигноцеллюлозу материал» обозначает материал, первоначально состоящий из целлюлозы, гемицеллюлозы и лигнина. Такой материал часто обозначают как «биомасса».
Биомасса лигноцеллюлозы представляет собой комплексную структуру волокон целлюлозы, обернутых оболочкой из лигнина и гемицеллюлозы. Структура лигноцеллюлозы является такой, что она нечувствительна к ферментативному гидролизу. Чтобы усилить ферментативный гидролиз, лигноцеллюлозу необходимо предварительно обработать, например, кислым гидролизом в адекватных условиях давления и температуры, чтобы разрушить защитный слой лигнина, осахарить и солюбилизировать гемицеллюлозу и разрушить кристаллическую структуру целлюлозы. Затем можно проводить ферментативный гидролиз целлюлозы, например, обработкой целлюлолитическим ферментом для превращения углеводных полимеров в поддающиеся ферментации сахара, которые можно ферментировать до желаемого продукта ферментации, такого как этанол. Обработки гемицеллюлолитическим ферментом можно также применять для гидролиза всей оставшейся гемицеллюлозы в предварительно обработанной биомассе.
Содержащий лигноцеллюлозу материал может представлять собой любой материал, содержащий лигноцеллюлозу. В предпочтительном варианте осуществления содержащий лигноцеллюлозу материал содержит по меньшей мере 30 масс.%, предпочтительно, по меньшей мере 50 масс.%, более предпочтительно, по меньшей мере 70 масс.%, даже более предпочтительно, по меньшей мере 90 масс.%, лигноцеллюлозы. Следует понимать, что содержащий лигноцеллюлозу материал может также содержать другие составляющие, такие как белковый материал, крахмал и сахара, такие как поддающиеся ферментации или не поддающиеся ферментации сахара или их смеси.
Содержащий лигноцеллюлозу материал, как правило, обнаруживают, например, в стеблях, листьях, оболочке семян, листовой обертке и стержнях початков растений или в листьях, ветвях и древесине деревьев. Содержащий лигноцеллюлозу материал включает, но не ограничивается ими, травяной материал, сельскохозяйственные отходы, отходы лесной промышленности, коммунально-бытовые твердые отходы, макулатуру и пульпу и отходы целлюлозно-бумажной промышленности. Следует понимать, что содержащий лигноцеллюлозу материал может присутствовать в форме материала клеточной стенки растений, содержащего лигнин, целлюлозу и гемицеллюлозу в смешанном матриксе.
В предпочтительном варианте осуществления содержащий лигноцеллюлозу материал выбирают из одного или нескольких из кукурузных волокон, рисовой соломы, древесины хвойных пород, древесных стружек, древесины тополя, выжимок и отходов переработки бумаги и пульпы.
Другие примеры пригодного содержащего лигноцеллюлозу материала включают кукурузную солому, стержни кукурузных початков, древесину твердых пород, таких как тополь и береза, древесину мягких пород, солому злаков, такую как пшеничная солома, просо прутьевидное, мискант, рисовую шелуху, коммунально-бытовые твердые отходы (MSW), промышленные органические отходы, конторскую бумагу или их смеси.
В предпочтительном варианте осуществления содержащий лигноцеллюлозу материал представляет собой кукурузную солому или стержни кукурузных початков. В другом предпочтительном варианте осуществления содержащий лигноцеллюлозу материал представляет собой кукурузные волокна. В другом предпочтительном варианте осуществления содержащий лигноцеллюлозу материал представляет собой просо прутьевидное. В другом предпочтительном варианте осуществления содержащий лигноцеллюлозу материал представляет собой выжимки.
Предварительная обработка
Содержащий лигноцеллюлозу материал можно предварительно обрабатывать любым пригодным способом.
Предварительную обработку проводят перед гидролизом или ферментацией. Целью предварительной обработки является отделение или высвобождение целлюлозы, гемицеллюлозы и лигнина, и таким образом улучшение скорости или эффективности гидролиза. Способы предварительной обработки, включая влажное окисление и предварительную обработку щелочью, направлены на высвобождение лигнина, в то время как обработка разбавленной кислотой и автогидролиз направлены на высвобождение гемицеллюлозы. Паровой взрыв является примером предварительной обработки, направленной на высвобождение целлюлозы.
Согласно изобретению стадия предварительной обработки может представлять собой общепринятую стадию предварительной обработки с использованием способов, хорошо известных в данной области. В предпочтительном варианте осуществления предварительная обработка имеет место в водной суспензии. Содержащий лигноцеллюлозу материал может во время предварительной обработки присутствовать в количестве между 10-80 масс.%, предпочтительно, между 20-70 масс.%, особенно, между 30-60 масс.%, например, приблизительно 50 масс.%.
Химическая, механическая и/или биологическая предварительная обработка
Согласно изобретению содержащий лигноцеллюлозу материал можно предварительно обрабатывать химическим, механическим, биологическим способом или любым их сочетанием, до или во время гидролиза.
Предпочтительно, химическую, механическую или биологическую предварительную обработку проводят до гидролиза. Альтернативно, химическую, механическую или биологическую предварительную обработку можно проводить одновременно с гидролизом, например, одновременно с добавлением одного или нескольких целлюлолитических ферментов, или ферментов с другими видами активности, для высвобождения, например, поддающихся ферментации сахаров, таких как глюкоза или мальтоза.
В одном варианте осуществления изобретения предварительно обработанный содержащий лигноцеллюлозу материал можно промывать или детоксифицировать другими способом. Однако промывка или детоксификация не является необходимой. В предпочтительном варианте осуществления предварительно обработанный содержащий лигноцеллюлозу материал не является промытым или детоксифицированным.
Химическая предварительная обработка
Фраза «химическая предварительная обработка» относится к любой химической предварительной обработке, способствующей отделению или высвобождению целлюлозы, гемицеллюлозы или лигнина. Примеры пригодных способов химической предварительной обработки включают обработку, например, разбавленной кислотой, известью, щелочью, органическим растворителем, аммиаком, диоксидом серы или диоксидом углерода. Кроме того, влажное окисление и гидротермолиз с контролируемым pH также считают химической предварительной обработкой.
В предпочтительном варианте осуществления химическая предварительная обработка представляет собой обработку кислотой, более предпочтительно, непрерывную обработку разбавленной кислотой или кислотой умеренной концентрации, например, обработку серной кислотой или другой органической кислотой, такой как уксусная кислота, лимонная кислота, винная кислота, янтарная кислота, хлороводород или их смеси. Можно использовать также другие кислоты. Обработка кислотой умеренной концентрации означает, что pH при обработке находится в диапазоне pH 1-5, предпочтительно, pH 1-3. В конкретном варианте осуществления концентрация кислоты находится в диапазоне от 0,1 до 2,0 масс.% кислоты, и кислота предпочтительно представляет собой серную кислоту. Кислоту можно приводить в контакт с содержащим лигноцеллюлозу материалом, и смесь можно выдерживать при температуре в диапазоне 160-220ºC, например, 165-195ºC, в течение периодов, находящихся в диапазоне от минут до секунд, например, 1-60 минут, например, 2-30 минут или 3-12 минут. Добавление сильных кислот, таких как серная кислота, можно применять для удаления гемицеллюлозы. Такое добавление сильных кислот увеличивает способность целлюлозы к расщеплению.
Другие способы предварительной обработки также предусмотрены в рамках изобретения. Показано, что обработка целлюлозы растворителем превращает приблизительно 90% целлюлозы в глюкозу. Показано также, что ферментативный гидролиз можно значительно усилить, когда структура лигноцеллюлозы нарушена. Щелочной H2O2, озон, органические растворители (с использованием кислот Льюиса, FeCl3, (Al)2SO4 в водных спиртах), глицерин, диоксан, фенол или этиленгликоль присутствуют среди растворителей, известных как разрушающие структуру целлюлозы и способствующие гидролизу (Mosier et al., 2005, Bioresource Technology 96: 673-686).
Щелочная химическая предварительная обработка с помощью основания, например, NaOH, Na2CO3 и аммиака или т.п., также предусмотрена в рамках изобретения. Способы предварительной обработки с использованием аммиака описаны, например, в WO 2006/110891, WO 2006/11899, WO 2006/11900, WO 2006/110901, содержание которых таким образом приведено в качестве ссылки.
Способы влажного окисления включают использование окисляющих агентов, таких как окисляющие агенты на основе сульфитов или т.п. Примеры предварительной обработки растворителем включают обработку DMSO (диметилсульфоксидом) или т.п. Химическую предварительную обработку, как правило, проводят в течение 1-60 минут, например, от 5 до 30 минут, но ее можно проводить в течение более коротких или более длинных периодов времени в зависимости от материала, подлежащего предварительной обработке.
Другие примеры пригодных способов предварительной обработки описаны в Schell et al., 2003, Appl. Biochem and Biotechn. Vol. 105-108, p. 69-85, и Mosier et al., 2005, Bioresource Technology 96: 673-686, и публикации патентной заявки США №2002/0164730, содержание каждого из которых таким образом приведено в качестве ссылки.
Механическая предварительная обработка
Фраза «механическая предварительная обработка» относится к любой механической или физической предварительной обработке, способствующей отделению или высвобождению целлюлозы, гемицеллюлозы или лигнина из содержащего лигноцеллюлозу материала. Например, механическая предварительная обработка включает различные типы измельчения, облучения, обработки паром/парового взрыва и гидротермолиза.
Механическая предварительная обработка включает тонкое измельчение, т.е. механическое уменьшение размера. Тонкое измельчение включает сухое измельчение, влажное измельчение и измельчение на вибрирующей шаровой мельнице. Механическая предварительная обработка может включать высокое давление и/или высокую температуру (паровой взрыв). В одном варианте осуществления изобретения высокое давление означает давление в диапазоне от 300 до 600 psi (от 2068423 до 4136847 Па), предпочтительно, от 400 до 500 psi (от 2757898 до 3447372 Па), например, приблизительно 450 psi (3102635 Па). В одном варианте осуществления изобретения высокая температура означает температуры в диапазоне от приблизительно 100 до 300ºC, предпочтительно, от приблизительно 140 до 235ºC. В предпочтительном варианте осуществления механическая предварительная обработка представляет собой периодический процесс, систему гидролиза с паровой пушкой, где используют высокое давление и высокую температуру, как определено выше. Для этого можно использовать гидролизатор Sunds (доступный из Sunds Defibrator AB (Sweden)).
Комбинированная химическая и механическая предварительная обработка
В предпочтительном варианте осуществления содержащий лигноцеллюлозу материал предварительно обрабатывают как химически, так и механически. Например, стадия предварительной обработки может включать обработку разбавленной кислотой или кислотой умеренной концентрации и обработку высокой температурой и/или давлением. Химическую и механическую предварительные обработки можно проводить последовательно или одновременно, как желательно.
Соответственно, в предпочтительном варианте осуществления содержащий лигноцеллюлозу материал подвергают как химической, так и механической предварительной обработке, чтобы способствовать отделению или высвобождению целлюлозы, гемицеллюлозы или лигнина.
В предпочтительном варианте осуществления предварительную обработку проводят как стадию парового взрыва разбавленной кислоты или кислоты умеренной концентрации. В другом предпочтительном варианте осуществления предварительную обработку проводят как стадию разворачивания волокна аммиаком (или стадию предварительной обработки AFEX).
Биологическая предварительная обработка
Фраза «биологическая предварительная обработка» относится к любой биологической предварительной обработке, способствующей отделению или высвобождению целлюлозы, гемицеллюлозы или лигнина из содержащего лигноцеллюлозу материала. Способы биологической предварительной обработки могут включать применение солюбилизирующих лигнин микроорганизмов. Смотри, например, Hsu, T.-A., 1996, Pretreatment of biomass, in Handbook on Bioethanol: Production and Utilization, Wyman, C.E., ed., Taylor & Francis, Washington, DC, 179-212; Ghosh, P., and Singh, A., 1993, Physicochemical and biological treatments for enzymatic/microbial conversion of lignocellulosic biomass, Adv. Appl. Microbiol. 39: 295-333; McMillan, J.D., 1994, Pretreating lignocellulosic biomass: a review, in Enzymatic Conversion of Biomass for Fuels Production, Himmel, M.E., Baker, J.O., and Overend, R.P., eds., ACS Symposium Series 566, American Chemical Society, Washington, DC, chapter 15; Gong, C.S., Cao, N.J., Du, J., and Tsao, G.T., 1999, Ethanol production from renewable resources, in Advances in Biochemical Engineering/Biotechnology, Scheper, T., ed., Springer-Veriag Berlin Heidelberg, Germany, 65: 207-241; Olsson, L, and Hahn-Hagerdal, B., 1996, Fermentation of lignocellulosic hydrolyzates for ethanol production, Enz. Microb. Tech. 18: 312-331; and Vallander, L., and Eriksson, K.-E. L., 1990, Production of ethanol from lignocellulosic materials: State of the art, Adv. Biochem. Eng./Biotechnol. 42: 63-95.
Гидролиз
Перед ферментацией предварительно обработанного содержащего лигноцеллюлозу материала его можно гидролизовать для разрушения целлюлозы и гемицеллюлозы до поддающихся ферментации сахаров. В предпочтительном варианте осуществления предварительно обработанный материал гидролизуют, предпочтительно, ферментативным способом, перед ферментацией.
Содержание сухих твердых веществ во время гидролиза может находиться в диапазоне 5-50 масс.%, предпочтительно, 10-40 масс.%, предпочтительно, 20-30 масс.%. Гидролиз можно в предпочтительном варианте осуществления проводить как процесс с подпиткой, где предварительно обработанным содержащим лигноцеллюлозу материалом (т.е. субстратом) постепенно подпитывают, например, содержащий фермент раствор для гидролиза.
В предпочтительном варианте осуществления гидролиз проводят ферментативным способом. Согласно изобретению, предварительно обработанный содержащий лигноцеллюлозу материал можно гидролизовать посредством одного или нескольких целлюлолитических ферментов, таких как целлюлазы или гемицеллюлазы, или их сочетания.
В предпочтительном варианте осуществления гидролиз проводят с использованием препарата целлюлолитического фермента, содержащего один или несколько полипептидов, обладающих способностью усиливать целлюлолитическую активность. В предпочтительном варианте осуществления полипептид(ы), обладающий способностью усиливать целлюлолитическую активность, происходит(происходят) из семейства GH61A. Примеры пригодных и предпочтительных препаратов целлюлолитических ферментов и полипептидов, обладающих способностью усиливать целлюлолитическую активность, описаны в разделе «Целлюлолитические ферменты» и в разделе «Полипептиды, усиливающие целлюлолитическое действие» ниже.
Поскольку содержащий лигноцеллюлозу материал может содержать составляющие, отличные от лигнина, целлюлозы и гемицеллюлозы, гидролиз и/или ферментацию на стадиях ii) и iii) можно проводить в присутствии ферментов с дополнительными видами активности, такими как активность протеазы, активность амилазы, активность образующего углеводы фермента и активность эстеразы, такая как активность липазы.
Ферментативный гидролиз предпочтительно проводят в подходящей водной окружающей среде в условиях, которые может легко определить специалист в данной области. В предпочтительном варианте осуществления гидролиз проводят в подходящих, предпочтительно, оптимальных, условиях для рассматриваемого фермента(ферментов).
Пригодные время процесса, температуру и условия pH легко может определить специалист в данной области. Предпочтительно, гидролиз проводят при температуре от 25 до 70ºC, предпочтительно, от 40 до 60ºC, особенно, приблизительно 50ºC. Эту стадию предпочтительно проводят при pH в диапазоне pH 3-8, предпочтительно, pH 4-6, особенно, приблизительно pH 5. Гидролиз, как правило, проводят в течение от 12 до 96 часов, предпочтительно, 16-72 часов, более предпочтительно, от 24 до 48 часов.
Ферментация
Согласно изобретению поддающиеся ферментации сахара из предварительно обработанного и/или гидролизованного содержащего лигноцеллюлозу материала можно ферментировать посредством одного или нескольких ферментирующих организмов, способных ферментировать сахара, такие как глюкоза, ксилоза, манноза и галактоза, напрямую или опосредованно, в желаемый продукт ферментации. Условия ферментации зависят от желаемого продукта ферментации и ферментирующего организма, и их легко может определить обычный специалист в данной области.
Особенно в случае ферментации до этанола, ферментацию можно продолжать в течение 1-48 часов, предпочтительно, 1-24 часов. В одном варианте осуществления ферментацию проводят при температуре от 20 до 40ºC, предпочтительно, от 26 до 34ºC, в частности, приблизительно 32ºC. В одном варианте осуществления pH превышает 5. В другом варианте осуществления pH составляет pH 3-7, предпочтительно, 4-6. Однако некоторые, например, бактериальные ферментирующие организмы обладают более высоким оптимумом температуры ферментации. Таким образом, в одном варианте осуществления ферментацию проводят при температуре между 40-60°С, например 50-60°С. Специалист в данной области может легко определить подходящие условия ферментации.
Ферментацию можно проводить в реакторе периодического действия, в реакторе с подпиткой или реакторе непрерывного действия. Периодическая ферментация с подпиткой может происходить с подпиткой фиксированного объема или меняющегося объема. В одном варианте осуществления применяют периодическую ферментацию с подпиткой. Объем и скорость периодической ферментации с подпиткой зависит, например, от ферментирующего организма, идентичности и концентрации поддающихся, ферментации Сахаров и желаемого продукта ферментации. Такие скорости и объемы ферментации легко может определить обычный специалист в данной области.
SSF, HHF и SHF
В одном варианте осуществления настоящего изобретения гидролиз и ферментацию проводят как стадию одновременного гидролиза и ферментации (SSF). Как правило, это означает, что комбинированные/одновременные гидролиз и ферментацию проводят в условиях (например, при температуре и/или рН), подходящих, предпочтительно, оптимальных, для рассматриваемого ферментирующего организма(организмов).
В другом варианте осуществления стадию гидролиза и стадию ферментации проводят как комбинированную - стадию гидролиза и ферментации (HHF). HHF, как правило, начинается с отдельной стадии частичного гидролиза и заканчивается стадией одновременного гидролиза и ферментации. Отдельная стадия частичного гидролиза представляет собой стадию ферментативного осахаривания целлюлозы, как правило, проводимую в условиях (например, при более высоких температурах), подходящих, предпочтительно, оптимальных, для гидролиза рассматриваемым ферментом(ферментами). Последующую стадию одновременного гидролиза и ферментации, как правило, проводят в условиях, подходящих для ферментирующего организма(организмов) (часто при более низких температурах, чем отдельная стадия гидролиза).
В другом варианте осуществления стадии гидролиза и ферментации можно также проводить как отдельные гидролиз и ферментацию, где гидролиз доводят до завершения до начала ферментации. Это часто обозначают как «SHF».
Выделение
После ферментации продукт ферментации можно, необязательно, отделять от среды для ферментации любым пригодным способом. Например, среду можно подвергать перегонке для экстракции продукта ферментации, или продукт ферментации можно выделять из среды для ферментации способами микрофильтрации или мембранной фильтрации. Альтернативно, продукт ферментации можно выделять отгонкой летучих фракций. Способы выделения хорошо известны в данной области.
Продукты ферментации
Настоящее изобретение можно использовать для получения любого продукта ферментации. Предпочтительные продукты ферментации включают спирты (например, этанол, метанол, бутанол); органические кислоты (например, лимонную кислоту, уксусную кислоту, итаконовую кислоту, молочную кислоту, глюконовую кислоту); кетоны (например, ацетон); аминокислоты (например, глутаминовую кислоту); газы (например, H2 и CO2); антибиотики (например, пенициллин и тетрациклин); ферменты; витамины (например, рибофлавин, B12, бета-каротин); и гормоны.
Другие продукты включают продукты промышленности питьевого спирта, например, пиво и вино; продукты молочной промышленности, например, ферментированные молочные продукты; продукты кожевенной промышленности и продукты табачной промышленности. В предпочтительном варианте осуществления продукт ферментации представляет собой спирт, особенно этанол. Продукт ферментации, такой как этанол, полученный по изобретению, можно, предпочтительно, использовать как топливный спирт/этанол. Однако, в случае этанола, его можно также использовать как питьевой этанол.
Ферментирующий организм
Фраза «ферментирующий организм» относится к любому организму, включая бактериальные и грибковые организмы, пригодные для продукции желаемого продукта ферментации. Ферментирующий организм может представлять собой C6 или C5 ферментирующие организмы, или их сочетание. Как C6, так и C5 ферментирующие организмы хорошо известны в данной области.
Пригодные ферментирующие организмы способны ферментировать, т.е. превращать, поддающиеся ферментации сахара, такие как глюкоза, фруктоза, мальтоза, ксилоза, манноза и/или арабиноза, непосредственно или опосредованно, в желаемый продукт ферментации.
Примеры ферментирующих организмов включают грибковые организмы, такие как дрожжи. Предпочтительные дрожжи включают штаммы рода Saccharomyces, в частности, штаммы Saccharomyces cerevisiae или Saccharomyces uvarum; штамм Pichia, предпочтительно, Pichia stipitis, такие как Pichia stipitis CBS 5773 или Pichia pastoris; штамм рода Candida, в частности, штамм Candida utilis, Candida arabinofermentans, Candida diddensii, Candida sonorensis, Candida shehatae, Candida tropicalis или Candida boidinii. Другие ферментирующие организмы включают штаммы Hansenula, в частности, Hansenula polymorpha или Hansenula anomala; Kluyveromyces, в частности, Kluyveromyces fragilis или Kluyveromyces marxianus; и Schizosaccharomyces, в частности, Schizosaccharomyces pombe.
Предпочтительные бактериальные ферментирующие организмы включают штаммы Escherichia, в частности, Escherichia coli, штаммы Zymomonas, в частности, Zymomonas mobilis, штаммы Zymobacter, в частности, Zymobacter palmae, штаммы Klebsiella, в частности, Klebsiella oxytoca, штаммы Leuconostoc, в частности, Leuconostoc mesenteroides, штаммы Clostridium, в частности, Clostridium butyricum, штаммы Enterobacter, в частности, Enterobacter aerogenes и штаммы Thermoanaerobacter, в частности, Thermoanarobacter BG1L1 (Appl. Microbiol. Biotech. 77: 61-86) и Thermoanarobacter ethanolicus, Thermoanaerobacter thermosaccharolyticum или Thermoanaerobacter mathranii. Предусматривают также штаммы Lactobacillus, как и штаммы Corynebacterium glutamicum R, Bacillus thermoglucosidaisus и Geobacillus thermoglucosidasius.
В одном варианте осуществления ферментирующий организм представляет собой ферментирующий C6 сахар организм, такой как штамм, например, Saccharomyces cerevisiae.
По отношению к ферментации полученных из лигноцеллюлозы материалов, предусматривают ферментирующие C5 сахар организмы. Большинство ферментирующих C5 сахар организмов ферментируют также C6 сахара. Примеры ферментирующих C5 сахар организмы включают штаммы Pichia, такие как вид Pichia stipitis. Известны также ферментирующие C5 сахар бактерии. Некоторые штаммы Saccharomyces cerevisae также ферментируют C5 (и C6) сахара. Примеры представляют собой генетически модифицированные штаммы видов Saccharomyces, способные ферментировать C5 сахара, включая штаммы, описанные, например, в Ho et al., 1998, Applied and Environmental Microbiology, p. 1852-1859 и Karhumaa et al., 2006, Microbial Cell Factories 5:18, и Kuyper et al., 2005, FEMS Yeast Research 5, p. 925-934.
Присутствие ингибиторов в среде для ферментации может ингибировать ферментирующую производительность конкретных ферментирующих организмов и таким образом, снижать объем производства этанола. Известно, что соединения в гидролизатах биомассы и высокие концентрации этанола ингибируют ферментирующую способность конкретных клеток дрожжей. Способы предварительной адаптации или адаптации могут уменьшать этот ингибирующий эффект. Как правило, предварительная адаптация или адаптация клеток дрожжей включает последовательное выращивание клеток дрожжей, до ферментации, для увеличения ферментирующей производительности дрожжей и увеличения продукции этанола. Способы предварительной адаптации и адаптации дрожжей известны в данной области. Такие способы могут включать, например, выращивание клеток дрожжей в присутствии неочищенных гидролизатов биомассы; выращивание клеток дрожжей в присутствии ингибиторов, таких как фенольные соединения, фуральдегиды и органические кислоты; выращивание клеток дрожжей в присутствии не ингибирующих количеств этанола; и дополнение культур дрожжей ацетальдегидом. В одном варианте осуществления ферментирующий организм представляет собой штамм дрожжей, подвергаемый одному или нескольким способам предварительной адаптации или адаптации перед ферментацией.
Конкретным ферментирующим организмам, таким как дрожжи, необходим адекватный источник азота для размножения и ферментации. Можно использовать многие источники азота, и такие источники азота хорошо известны в данной области. В одном варианте осуществления используют источники азота с низкой стоимостью. Такие источники с низкой стоимостью могут является органическими, такими как мочевина, DDG, влажный жмых или кукурузный затор, или неорганическими, такими как аммиак или гидроксид аммония.
Коммерчески доступные дрожжи, пригодные для продукции этанола, включают, например, дрожжи ETHANOL RED™ (доступные из Fermentis/Lesaffre, USA), FALI™ (доступные из Fleischmann's Yeast, USA), свежие дрожжи SUPERSTART и THERMOSACC™ (доступные из Ethanol Technology, WI, USA), BIOFERM AFT и XR (доступные из NABC - North American Bioproducts Corporation, GA, USA), GERT STRAND (доступные из Gert Strand AB, Sweden) и FERMIOL (доступные из DSM Specialties).
Среда для ферментации
Фраза «ферментационная среда» или «среда для ферментации» относится к среде, в которой проводят ферментацию, и которая содержит субстрат для ферментации, то есть, источник углевода, который подвергается метаболизму ферментирующим организмом(организмами), и которая может включать ферментирующий организм(ы).
Среда для ферментации может содержать питательные вещества и стимулятор(ы) роста для ферментирующего организма(организмов). Питательные вещества и стимуляторы роста широко используют в области ферментации, и они включают источники азота, такие как аммиак; витамины и минералы, или их сочетания.
После ферментации ферментационная среда или среда для ферментации могут дополнительно содержать продукт ферментации.
Ферменты
Даже без конкретного упоминания в контексте способа или процесса по изобретению, следует понимать, что фермент(ы), так же как другие соединения, используют в эффективном количестве.
Целлюлолитическая активность
Фразу «целлюлолитическая активность», как применяют в настоящем документе, понимают, как включающую ферменты, обладающие активностью целлобиогидролазы (EC 3.2.1.91), например, целлобиогидролазы I и целлобиогидролазы II, так же как активностью эндоглюканазы (EC 3.2.1.4) и активностью бета-глюкозидазы (EC 3.2.1.21).
По меньшей мере три категории ферментов являются важными для превращения целлюлозы в поддающиеся ферментации сахара: эндоглюканазы (EC 3.2.1.4), которые разрезают цепи целлюлозы случайным образом; целлобиогидролазы (EC 3.2.1.91), которые отрезают звенья целлобиозила с концов цепей целлюлозы и бета-глюкозидазы (EC 3.2.1.21), которые превращают целлобиозу и растворимые целлодекстрины в глюкозу. Среди этих трех категорий ферментов, вовлеченных в биодеградацию целлюлозы, целлобиогидролазы, по-видимому, являются ключевыми ферментами для деградации нативной кристаллической целлюлозы.
Целлюлолитическая активность может, в предпочтительном варианте осуществления, присутствовать в форме препарата ферментов, происходящих из грибов, например, из штамма рода Trichoderma, предпочтительно, штамма Trichoderma reesei; штамма рода Humicola, такого как штамм Humicola insolens; или штамма Chrysosporium, предпочтительно, штамма Chrysosporium lucknowense.
В предпочтительном варианте осуществления препарат целлюлолитического фермента обладает одной или несколькими из следующих видов активности: целлюлазы, гемицеллюлазы, способностью по усилению активности целлюлолитического фермента, активностью бета-глюкозидазы, эндоглюканазы, целлобиогидролазы или ксилозо-изомеразы.
В предпочтительном варианте осуществления целлюлаза может представлять собой композицию, как определено в PCT/US2008/065417, содержание которого, таким образом, приведено в качестве ссылки. Конкретно, в одном варианте осуществления присутствует композиция целлюлазы, используемая в примере 1 (препарат целлюлазы A), описанная ниже. В предпочтительном варианте осуществления препарат целлюлолитического фермента содержит полипептид, обладающий способностью усиливать целлюлолитическую активность, предпочтительно, полипептид семейства GH61A, предпочтительно, полипептид, описанный в WO 2005/074656 (Novozymes). Препарат целлюлолитического фермента может дополнительно включать бета-глюкозидазу, такую как бета-глюкозидаза, полученная из штамма рода Trichoderma, Aspergillus или Penicillium, включая слитый белок, обладающий активностью бета-глюкозидазы, описанный в WO 2008/057637. В предпочтительном варианте осуществления препарат целлюлолитического фермента может также содержать фермент CBH II, предпочтительно, целлобиогидролазу II CEL6A Thielavia terrestris. В другом предпочтительном варианте осуществления препарат целлюлолитического фермента может также содержать целлюлолитические ферменты, предпочтительно, фермент, полученный из Trichoderma reesei или Humicola insolens.
Препарат целлюлолитического фермента может также содержать полипептид, обладающий способностью усиливать целлюлолитическую активность (GH61A), описанный в WO 2005/074656; бета-глюкозидазу (слитый белок, описанный в WO 2008/057637) и целлюлолитические ферменты, полученные из Trichoderma reesei.
В одном варианте осуществления целлюлолитический фермент представляет собой коммерчески доступный продукт CELLUCLAST® 1.5L или CELLUZYME™, доступные из Novozymes A/S, Denmark или ACCELERASE™ 1000 (из Genencor Inc., USA).
Целлюлолитический фермент можно добавлять для гидролиза предварительно обработанного содержащего лигноцеллюлозу материала. Целлюлолитический фермент можно дозировать в диапазоне 0,1-100 FPU на грамм сухого твердого вещества (TS), предпочтительно, 0,5-50 FPU на грамм TS, особенно 1-20 FPU на грамм TS. В другом варианте осуществления по меньшей мере 0,1 мг целлюлолитического фермента на грамм общего твердого вещества (TS), предпочтительно, по меньшей мере 3 мг целлюлолитического фермента на грамм TS, например, от 5 до 10 мг целлюлолитического фермента(ферментов) на грамм TS является(являются) использованными для гидролиза.
Эндоглюканаза (EG)
Термин «эндоглюканаза» обозначает эндо-1,4-(1,3;1,4)-бета-D-глюкан-4-глюканогидролазу (E.C. No. 3.2.1.4), которая катализирует эндо-гидролиз 1,4-бета-D-гликозидных связей в целлюлозе, производных целлюлозы (таких как карбоксиметилцеллюлоза и гидроксиэтилцеллюлоза), лихенине, бета-1,4-связей в смешанных бета-1,3 глюканах, таких как бета-D-глюканы или ксилоглюканы злаковых, и других растительных материалах, содержащих компоненты целлюлозы. Активность эндоглюканазы можно определить с использованием гидролиза карбоксиметилцеллюлозы (CMC) согласно способу Ghose, 1987, Pure and Appl. Chem. 59: 257-268.
В предпочтительном варианте осуществления эндоглюканазы могут являться полученными из штамма рода Trichoderma, предпочтительно, штамма Trichoderma reesei, штамма рода Humicola, такого как штамм Humicola insolens; или штамма Chrysosporium, предпочтительно, штамма Chrysosporium lucknowense.
Целлобиогидролаза (CBH)
Термин «целлобиогидролаза» обозначает 1,4-бета-D-глюкан-целлобиогидролазу (E.C. 3.2.1.91), которая катализирует гидролиз 1,4-бета-D-глюкозидных связей в целлюлозе, целлоолигосахаридах, или любом содержащем бета-1,4-связанную глюкозу полимере, высвобождая целлобиозу из восстанавливающих или невосстанавливающих концов цепи.
Примеры целлобиогидролаз упомянуты выше, включая CBH I и CBH II из Trichoderma reseei; Humicola insolens и целлобиогидролазу CBH II из Thielavia terrestris (CELL6A).
Активность целлобиогидролазы можно определять согласно способам, описанным в Lever et al., 1972, Anal. Biochem. 47: 273-279 и в van Tilbeurgh et al., 1982, FEBS Letters 149: 152-156; van Tilbeurgh and Claeyssens, 1985, FEBS Letters 187: 283-288. Способ Lever et al. подходит для оценки гидролиза целлюлозы в кукурузной соломе, а способ van Tilbeurgh et al. подходит для определения активности целлобиогидролазы для флуоресцентного производного дисахарида.
Бета-глюкозидаза
Одна или несколько бета-глюкозидаз могут присутствовать во время гидролиза. Термин «бета-глюкозидаза» обозначает бета-D-глюкозид-глюкогидролазу (E.C. 3.2.1.21), которая катализирует гидролиз концевых невосстанавливающих остатков бета-D-глюкозы с высвобождением бета-D-глюкозы. Для целей настоящего изобретения, активность бета-глюкозидазы определяют согласно основному способу, описанному в Venturi et al., 2002, J. Basic Microbiol. 42: 55-66, за исключением того, что применяли другие условия, как описано в настоящем описании. Одну единицу активности бета-глюкозидазы определяют как 1,0 мкмоль p-нитрофенола, образуемого в минуту при 50ºC, pH 5 из 4 мМ p-нитрофенил-бета-D-глюкопиранозида в качестве субстрата в 100 мМ цитрате натрия, 0,01% TWEEN® 20.
В предпочтительном варианте осуществления бета-глюкозидаза происходит из грибов, таких как штамм рода Trichoderma, Aspergillus или Penicillium. В предпочтительном варианте осуществления бета-глюкозидаза получена из Trichoderma reesei, например, бета-глюкозидаза, кодируемая геном bgl1 (смотри Фиг.1 из EP 562003). В другом предпочтительном варианте осуществления бета-глюкозидаза получена из Aspergillus oryzae (получена рекомбинантной продукцией в Aspergillus oryzae согласно WO 2002/095014), Aspergillus fumigatus (получена рекомбинантной продукцией в Aspergillus oryzae согласно примеру 22 из WO 2002/095014) или Aspergillus niger (1981, J. Appl. Vol 3, pp 157-163).
Гемицеллюлаза
Гемицеллюлозу можно разрушать посредством гидролиза гемицеллюлазами и/или кислого гидролиза для высвобождения ее компонентов - сахаров с пятью и шестью атомами углерода.
В одном варианте осуществления изобретения полученный из лигноцеллюлозы материал можно обрабатывать с помощью одной или нескольких гемицеллюлаз.
Можно использовать любую гемицеллюлазу, пригодную для использования в гидролизе гемицеллюлозы, предпочтительно, до ксилозы. Предпочтительные гемицеллюлазы включают ксиланазы, арабинофуранозидазы, ацетилксилан-эстеразу, ферулоил-эстеразу, глюкуронидазы, эндо-галактаназу, манназы, эндо- или экзо-арабиназы, экзо-галактаназы, и смеси из двух или более из них. Предпочтительно, гемицеллюлаза для использования по настоящему изобретению представляет собой экзо-действующую гемицеллюлазу, и более предпочтительно, гемицеллюлаза представляет собой экзо-действующую гемицеллюлазу, обладающую способностью гидролизовать гемицеллюлозу в кислых условиях ниже pH 7, предпочтительно, pH 3-7. Пример гемицеллюлазы, пригодной для использования по настоящему изобретению, включает VISCOZYME™ (доступный из Novozymes A/S, Denmark).
В одном варианте осуществления гемицеллюлаза представляет собой ксиланазу. В одном варианте осуществления ксиланаза может предпочтительно происходить из микроорганизмов, например, происходить из грибов (например, Trichoderma, Meripilus, Humicola, Aspergillus, Fusarium) или из бактерии (например, Bacillus). В предпочтительном варианте осуществления ксиланаза получена из мицелиального гриба, предпочтительно, получена из штамма Aspergillus, такого как Aspergillus aculeatus, или штамма Humicola, предпочтительно, Humicola lanuginosa. Ксиланаза может, предпочтительно, представлять собой эндо-1,4-бета-ксиланазу, более предпочтительно, эндо-1,4-бета-ксиланазу из GH10 или GH11. Примеры коммерческих ксиланаз включают SHEARZYME™ и BIOFEED WHEAT™ из Novozymes A/S, Denmark.
Гемицеллюлазу можно добавлять в количестве, эффективном для гидролиза гемицеллюлозы, например, в количествах от приблизительно 0,001 до 0,5 масс.% общих твердых веществ (TS), более предпочтительно, от приблизительно 0,05 до 0,5 масс.% из TS.
Ксиланазы можно добавлять в количествах 0,001-1,0 г/кг DM (сухое вещество) субстрата, предпочтительно, в количествах 0,005-0,5 г/кг DM субстрата, и наиболее предпочтительно, 0,05-0,10 г/кг DM субстрата.
Ксилозо-изомераза
Ксилозо-изомеразы (D-ксилозо-кетоизомераза) (E.C. 5.3.1.5.) представляют собой ферменты, которые катализируют обратимую реакцию изомеризации D-ксилозы до D-ксилулозы. Некоторые ксилозо-изомеразы также осуществляют превращение обратимой изомеризации D-глюкозы до D-фруктозы. Таким образом, ксилозо-изомеразу иногда обозначают как «глюкозо-изомераза».
Ксилозо-изомераза, применяемая в способе или процессе по изобретению, может представлять собой любой фермент, обладающий активностью ксилозо-изомеразы, и может происходить из любых источников, предпочтительно, из бактерий или грибов, таких как мицелиальные грибы или дрожжи. Примеры бактериальных ксилозо-изомераз включают ксилозо-изомеразы, принадлежащие к родам Streptomyces, Actinoplanes, Bacillus и Flavobacterium, и Thermotoga, включая T. neapolitana (Vieille et al., 1995, Appl. Environ. Microbiol. 61 (5), 1867-1875) и T. maritime.
Примеры ксилозо-изомераз грибов представляют собой полученные из вида Basidiomycetes.
Предпочтительная ксилозо-изомераза получена из штамма дрожжей рода Candida, предпочтительно, штамма Candida boidinii, особенно ксилозо-изомераза Candida boidinii, описанная, например, в Vongsuvanlert et al., 1988, Agric. Biol. Chem., 52(7): 1817-1824. Ксилозо-изомеразу можно предпочтительно получать из штамма Candida boidinii (Kloeckera 2201), депонированного как DSM 70034 и ATCC 48180, описанного в Ogata et al., Agric. Biol. Chem, Vol. 33, p. 1519-1520 или Vongsuvanlert et al., 1988, Agric. Biol. Chem, 52(2), p. 1519-1520.
В одном варианте осуществления ксилозо-изомераза получена из штамма Streptomyces, например, получена из штамма Streptomyces murinus (патент США №4687742); S. flavovirens, S. albus, S. achromogenus, S. echinatus, S. wedmorensis, все описаны в патенте США №3616221. Другие ксилозо-изомеразы описаны в патенте США №3622463, патенте США №4351903, патенте США №4137126, патенте США №3625828, патенте HU №12415, патенте DE 2417642, патенте JP №6928473, и WO 2004/044129, содержание каждого из которых приведено в настоящем документе в качестве ссылки.
Ксилозо-изомераза может присутствовать либо в иммобилизованной, либо в жидкой форме. Жидкая форма является предпочтительной.
Примеры коммерчески доступных ксилозо-изомераз включают SWEETZYME™ T из Novozymes A/S, Denmark.
Ксилозо-изомеразу добавляют для обеспечения уровня активности в диапазоне 0,01-100 IGIU на грамм общего твердого вещества.
Активность по усилению целлюлолитической активности
Фразу «активность по усилению целлюлолитической активности» определяют в настоящем документе как биологическую активность, усиливающую гидролиз полученного из лигноцеллюлозы материала белками, обладающими целлюлолитической активностью. Для целей настоящего изобретения, активность по усилению целлюлолитической активности определяют измерением увеличения количества восстанавливающих сахаров или увеличения общего количества целлобиозы и глюкозы в результате гидролиза полученного из лигноцеллюлозы материала, например, предварительно обработанного содержащего лигноцеллюлозу материала, целлюлолитическим белком в следующих условиях: 1-50 мг общего белка/г целлюлозы в PCS (предварительно обработанная кукурузная солома), где общий белок состоит из 80-99,5% масс./масс. целлюлолитического белка/г целлюлозы в PCS и 0,5-20% масс./масс. белка с активностью усиления целлюлолитической активности, в течение 1-7 суток при 50ºC по сравнению с контрольным гидролизом с эквивалентной общей загрузкой белка без активности усиления целлюлолитической активности (1-50 мг целлюлолитического белка/г целлюлозы в PCS).
Полипептиды, обладающие активностью по усилению целлюлолитической активности, усиливают гидролиз полученного из лигноцеллюлозы материала, катализируемый белками, обладающими целлюлолитической активностью, посредством уменьшения количества целлюлолитического фермента, необходимого для достижения той же самой степени гидролиза, предпочтительно, по меньшей мере в 0,1 раза, более чем по меньшей мере в 0,2 раза, более предпочтительно, по меньшей мере в 0,3 раза, более предпочтительно, по меньшей мере в 0,4 раза, более предпочтительно, по меньшей мере в 0,5 раза, более предпочтительно, по меньшей мере в 1 раз, более предпочтительно, по меньшей мере, в 3 раза, более предпочтительно, по меньшей мере в 4 раза, более предпочтительно, по меньшей мере в 5 раз, более предпочтительно, по меньшей мере в 10 раз, более предпочтительно, по меньшей мере в 20 раз, даже более предпочтительно, по меньшей мере в 30 раз, наиболее предпочтительно, по меньшей мере в 50 раз, и даже наиболее предпочтительно, по меньшей мере в 100 раз.
В предпочтительном варианте осуществления гидролиз и/или ферментацию проводят в присутствии целлюлолитического фермента в сочетании с полипептидом, обладающим усиливающей активностью. В предпочтительном варианте осуществления полипептид, обладающий усиливающей активностью, представляет собой полипептид семейства GH61A. В WO 2005/074647 описаны выделенные полипептиды, обладающие активностью по усилению целлюлолитической активности, и их полинуклеотиды из Thielavia terrestris. В WO 2005/074656 описан выделенный полипептид, обладающий активностью усиления целлюлолитической активности, и его полинуклеотид из Thermoascus aurantiacus. В публикации патентной заявки США №2007/0077630 описан выделенный полипептид, обладающий активностью по усилению целлюлолитической активности, и его полинуклеотид из Trichoderma reesei.
Альфа-амилаза
Согласно изобретению можно использовать любую альфа-амилазу. Предпочтительные альфа-амилазы происходят из микроорганизмов, таких как бактерии или грибы. Какая из альфа-амилаз является наиболее подходящей, зависит от условий процесса, но это может легко определить специалист в данной области.
В одном варианте осуществления предпочтительная альфа-амилаза представляет собой кислую альфа-амилазу, например, кислую альфа-амилазу грибов или кислую альфа-амилазу бактерий. Фраза «кислая альфа-амилаза» обозначает альфа-амилазу (E.C. 3.2.1.1), которая при добавлении в эффективном количестве обладает оптимумом активности при pH в диапазоне от 3 до 7, предпочтительно, от 3,5 до 6, или более предпочтительно, 4-5.
Бактериальная альфа-амилаза
В другом предпочтительном варианте осуществления альфа-амилаза происходит из Bacillus. Альфа-амилаза Bacillus может, предпочтительно, происходить из штамма B. licheniformis, B. amyloliquefaciens, B. subtilis или B. stearothermophilus, однако может также происходить из других видов Bacillus. Конкретные примеры предусматриваемых альфа-амилаз включают альфа-амилазу Bacillus licheniformis, показанную на SEQ ID NO:4 в WO 1999/19467, альфа-амилазу Bacillus amyloliquefaciens SEQ ID NO:5 в WO 1999/19467 и альфа-амилазу Bacillus stearothermophilus, показанную на SEQ ID NO:3 в WO 1999/19467 (все последовательности, таким образом, приведены в качестве ссылки). В одном варианте осуществления изобретения альфа-амилаза может представлять собой фермент, обладающий степенью идентичности по меньшей мере 60%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, даже более предпочтительно, по меньшей мере 90%, например, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99%, с любой из последовательностей, показанных на SEQ ID NO:1, 2 или 3, соответственно, в WO 1999/19467.
Альфа-амилаза Bacillus может также представлять собой вариант и/или гибрид, особенно, описанный в любом из WO 1996/23873, WO 1996/23874, WO 1997/41213, WO 1999/19467, WO 2000/60059 и WO 2002/10355 (содержание всех документов таким образом приведено в качестве ссылки). Конкретно предусмотренные варианты альфа-амилазы описаны в патентах США №6093562, 6297038 или 6187576 (таким образом приведенных в качестве ссылки) и включают варианты альфа-амилазы Bacillus stearothermophilus (альфа-амилазы BSG), обладающие делецией одной или двух аминокислот в положениях R179-G182, предпочтительно, двойной делецией, описанной в WO 1996/023873 - смотри, например, страницу 20, строки 1-10 (таким образом, приведенные в качестве ссылки), предпочтительно, соответствующие дельта(181-182) по сравнению с аминокислотной последовательностью альфа-амилазы BSG дикого типа, указанной в SEQ ID NO:3, описанной в WO 1999/19467, или делецией аминокислот R179 и G180 с использованием SEQ ID NO:3 в WO 1999/19467 для нумерации (содержание этой ссылки таким образом приведено в качестве ссылки). Даже более предпочтительными являются альфа-амилазы Bacillus, особенно альфа-амилаза Bacillus stearothermophilus, обладающая двойной делецией, соответствующей дельта(181-182), и дополнительно включающая замену N193F (также обозначаемая I181*+G182*+N193F) по сравнению с аминокислотной последовательностью альфа-амилазы BSG дикого типа, указанной в SEQ ID NO:3, описанной в WO 1999/19467.
Гибридная альфа-амилаза бактерий
Конкретно предусмотренная альфа-амилаза бактерий содержит 445 C-концевых аминокислотных остатков альфа-амилазы Bacillus licheniformis (показанных на SEQ ID NO:4 из WO 1999/19467) и 37 N-концевых аминокислотных остатков альфа-амилазы, полученной из Bacillus amyloliquefaciens (показанной на SEQ ID NO:5 из WO 1999/19467), с одной или несколькими, особенно всеми, из следующих замен:
G48A+T49I+G107A+H156Y+A181T+N190F+I201F+A209V+Q264S (с использованием нумерации Bacillus licheniformis в SEQ ID NO:4 из WO 1999/19467). Также предпочтительными являются варианты, обладающие одной или несколькими из следующих мутаций (или соответствующих мутаций в остовах других альфа-амилаз Bacillus): H154Y, A181T, N190F, A209V и Q264S и/или делецией двух остатков положениями от 176 до 179, предпочтительно, делецией E178 и G179 (с использованием нумерации SEQ ID NO:5 из WO 1999/19467).
Альфа-амилаза грибов
Альфа-амилазы грибов включают альфа-амилазы, происходящие из штамма рода Aspergillus, такие как альфа-амилазы Aspergillus oryzae, Aspergillus niger и Aspergillus kawachii.
Предпочтительной кислой альфа-амилазой грибов является фунгамилоподобная альфа-амилаза, полученная из штамма Aspergillus oryzae. В соответствии с настоящим изобретением, фраза «фунгамилоподобная альфа-амилаза» обозначает альфа-амилазу, обладающую высокой идентичностью, т.е. более 70%, более 75%, более 80%, более 85% более 90%, более 95%, более 96%, более 97%, более 98%, более 99% или даже 100% идентичностью со зрелой частью аминокислотной последовательности, показанной на SEQ ID NO:10 в WO 1996/23874.
Другая предпочтительная альфа-амилаза получена из штамма Aspergillus niger. В предпочтительном варианте осуществления кислая альфа-амилаза грибов представляет собой альфа-амилазу из A. niger, описанную как «AMYA_ASPNG» в базе данных Swiss-prot/TeEMBL под первичным инвентарным №P56271 и описанную в WO 1989/01969 (пример 3). Коммерчески доступная кислая альфа-амилаза грибов, полученная из Aspergillus niger, представляет собой SP288 (доступную из Novozymes A/S, Denmark).
Другие предусматриваемые альфа-амилазы дикого типа включают альфа-амилазы, полученные из штамма родов Rhizomucor и Meripilus, предпочтительно, штамма Rhizomucor pusillus (WO 2004/055178, приведенный в качестве ссылки) или Meripilus giganteus.
В предпочтительном варианте осуществления альфа-амилаза получена из Aspergillus kawachii и описана в Kaneko et al., 1996, J. Ferment. Bioeng. 81:292-298, «Molecular-cloning and determination of the nucleotide-sequence of a gene encoding an acid-stable alpha-amylase from Aspergillus kawachii»; и дополнительно как EMBL:#AB008370.
Альфа-амилаза грибов может также представлять собой фермент дикого типа, содержащий связывающий крахмал домен (SBD) и каталитический домен альфа-амилазы (т.е. не гибридный) или его вариант. В одном варианте осуществления альфа-амилаза дикого типа получена из штамма Aspergillus kawachii.
Гибридная альфа-амилаза грибов
В предпочтительном варианте осуществления кислая альфа-амилаза грибов представляет собой гибридную альфа-амилазу. Предпочтительные примеры гибридных альфа-амилаз грибов включают альфа-амилазы, описанные в WO 2005/003311 или в публикации патентной заявки США №2005/0054071 (Novozymes), или в патентной заявке США №60/638614 (Novozymes), содержание которых таким образом приведено в качестве ссылки. Гибридная альфа-амилаза может содержать каталитический домен (CD) альфа-амилазы и связывающий углевод домен/модуль (CBM), такой как связывающий крахмал домен, и, необязательно, линкер.
Конкретные примеры предусматриваемых гибридных альфа-амилаз включают альфа-амилазы, описанные в таблицах 1-5 из примеров в патентной заявке США №60/638614, включая вариант фунгамила с каталитическим доменом JA118 и SBD Athelia rolfsii (SEQ ID NO:100 в US 60/638614), альфа-амилазу Rhizomucor pusillus с линкером AMG и SBD Athelia rolfsii (SEQ ID NO:101 в патентной заявке США №60/638,614), альфа-амилазу Rhizomucor pusillus с линкером и SBD глюкоамилазы Aspergillus niger (описанную в таблице 5 в виде комбинации аминокислотных последовательностей SEQ ID NO:20, SEQ ID NO:72 и SEQ ID NO:96 в патентной заявке США №11/316535) или в виде V039 в таблице 5 в WO 2006/069290 и альфа-амилазу Meripilus giganteus с линкером и SBD глюкоамилазы Athelia rolfsii (SEQ ID NO:102 в патентной заявке США №60/638614). Другие конкретно предусматриваемые гибридные альфа-амилазы представляют собой любую из альфа-амилаз, перечисленных в таблицах 3, 4, 5 и 6 в примере 4 в патентной заявке США №11/316535 и WO 2006/069290, содержание каждой из которых таким образом приведено в качестве ссылки.
Другие конкретные примеры предусматриваемых гибридных альфа-амилаз включают альфа-амилазы, описанные в публикации патентной заявки США №2005/0054071, включая альфа-амилазы, описанные в таблице 3 на странице 15, такие как альфа-амилаза Aspergillus niger с линкером и связывающим крахмал доменом Aspergillus kawachii.
Предусмотрены также альфа-амилазы, обладающие высокой степенью идентичности с любой из вышеупомянутых альфа-амилаз, т.е. более 70%, более 75%, более 80%, более 85%, более 90%, более 95%, более 96%, более 97%, более 98%, более 99% или даже 100% идентичности с последовательностями зрелого фермента.
Кислые альфа-амилазы согласно изобретению можно добавлять в количестве 0,1-10 AFAU/г DS, предпочтительно, 0,10-5 AFAU/г DS, особенно 0,3-2 AFAU/г DS.
Коммерческие продукты альфа-амилаз
Предпочтительные коммерческие композиции, содержащие альфа-амилазу, включают MYCOLASE из DSM, BAN™, TERMAMYL™ SC, FUNGAMYL™, LIQUOZYME™ X и SAN™ SUPER, SAN™ EXTRA L (Novozymes A/S) и CLARASE™ L-40000, DEX-LO™, SPEZYME™ FRED, SPEZYME™ AA и SPEZYME™ DELTA AA (Genencor Int.), и кислую альфа-амилазу грибов, продаваемую под торговым наименованием SP288 (доступную из Novozymes A/S, Denmark).
Фермент, образующий источник углевода
Фраза «фермент, образующий источник углевода» включает глюкоамилазу (образующую глюкозу), бета-амилазу и мальтогенную амилазу (образующие мальтозу). Фермент, образующий источник углевода, является способным продуцировать углевод, который может использовать в качестве источника энергии рассматриваемый ферментирующий организм(ы), например, при использовании в процессе получения продукта ферментации, такого как этанол. Полученный углевод можно превращать напрямую или опосредованно в желаемый продукт ферментации, предпочтительно, этанол. Согласно изобретению, может присутствовать смесь ферментов, образующих источник углевода. Особенно предусматриваемые смеси представляют собой смеси по меньшей мере глюкоамилазы и альфа-амилазы, особенно кислой амилазы, даже более предпочтительно, кислой альфа-амилазы грибов. Соотношение между активностью кислой альфа-амилазы грибов (AFAU) и активностью глюкоамилазы (AGU) (AFAU на AGU) может, в одном варианте осуществления изобретения, составлять по меньшей мере 0,1, в частности, по меньшей мере 0,16, например, в диапазоне от 0,12 до 0,50 или более.
Глюкоамилаза
Глюкоамилазу, применяемую согласно изобретению, можно получать из любого пригодного источника, например, получать из микроорганизма или растения. Предпочтительные глюкоамилазы являются происходящими из грибов или бактерий, выбранными из группы, состоящей из глюкоамилаз Aspergillus, в частности, глюкоамилазы G1 или G2 A. niger (Boel et al., 1984, EMBO J. 3 (5), p. 1097-1102), и их вариантов, таких как глюкоамилазы, описанные в WO 1992/00381, WO 2000/04136 и WO 2001/04273 (из Novozymes, Denmark); глюкоамилаза A. awamori, описанная в WO 1984/02921, глюкоамилаза A oryzae (Agric. Biol. Chem., 1991, 55 (4), p. 941-949), и их варианты или фрагменты. Другие варианты глюкоамилазы Aspergillus включают варианты с увеличенной термической стабильностью: G137A и G139A (Chen et al., 1996, Prot. Eng. 9, 499-505); D257E и D293E/Q (Chen et al., 1995, Prot. Eng. 8, 575-582); N182 (Chen et al., 1994, Biochem. J. 301, 275-281); с дисульфидными связями, A246C (Fierobe et al., 1996, Biochemistry, 35, 8698-8704; и введением остатков Pro в положении A435 и S436 (Li et al., 1997, Protein Eng. 10, 1199-1204).
Другие глюкоамилазы включают глюкоамилазу Athelia rolfsii (ранее обозначаемого Corticium rolfsii) (смотри патент США №4727026 и (Nagasaka et al., 1998, «Purification and properties of the raw-starch-degrading glucoamylases from Corticium rolfsii, Appl Microbiol Biotechnol 50:323-330), глюкоамилазы Talaromyces, в частности, полученные из Talaromyces emersonii (WO 1999/28448), Talaromyces leycettanus (патент США №Re. 32,153), Talaromyces duponti, Talaromyces thermophilus (патент США №4587215).
Предусматриваемые глюкоамилазы бактерий включают глюкоамилазы из рода Clostridium, в частности, C. thermoamylolyticum (EP 135138) и C. thermohydrosulfuricum (WO 1986/01831) и Trametes cingulata, описанную в WO 2006/069289 (содержание которых таким образом приведено в качестве ссылки).
Гибридные глюкоамилазы также предусматривают согласно изобретению. Примеры гибридных глюкоамилаз описаны в WO 2005/045018. Конкретные примеры включают гибридную глюкоамилазу, описанную в таблицах 1 и 4 из примера 1 из WO 2005/045018, содержание которой таким образом приведено в качестве ссылки до той степени, в которой она описывает гибридные глюкоамилазы.
Предусмотрены также глюкоамилазы, обладающие высокой идентичностью с любой из вышеупомянутых глюкоамилаз, т.е. более 70%, более 75%, более 80%, более 85% более 90%, более 95%, более 96%, более 97%, более 98%, более 99% или даже 100% идентичностью с последовательностями зрелых ферментов.
Коммерчески доступные композиции, содержащие глюкоамилазу, включают AMG 200L; AMG 300 L; SAN™ SUPER, SAN™ EXTRA L, SPIRIZYME™ PLUS, SPIRIZYME™ FUEL, SPIRIZYME™ B4U и AMG™ E (из Novozymes A/S); OPTIDEX™ 300 (из Genencor Int.); AMIGASE™ и AMIGASE™ PLUS (из DSM); G-ZYME™ G900, G-ZYME™ и G990 ZR (из Genencor Int.).
В одном варианте осуществления глюкоамилазы можно добавлять в количестве 0,02-20 AGU/г DS, предпочтительно, 0,1-10 AGU/г DS, особенно 1-5 AGU/г DS, например, 0,5 AGU/г DS.
Бета-амилаза
Термин «бета-амилаза» (E.C 3.2.1.2) представляет собой наименование, традиционно данное экзо-действующим мальтогенным амилазам, которые катализируют гидролиз 1,4-альфа-глюкозидных связей в амилозе, амилопектине и родственных полимерах глюкозы. Звенья мальтозы успешно удаляют с невосстанавливающих концов цепей ступенчатым образом, пока молекула не деградирует, или, в случае амилопектина, до достижения точки ветвления. Высвобождаемая мальтоза обладает бета-аномерной конфигурацией, отсюда наименование бета-амилаза.
Бета-амилазы выделены из различных растений и микроорганизмов (W. M. Fogarty and C.T. Kelly, Progress in Industrial Microbiology, vol. 15, pp. 112-115, 1979). Эти бета-амилазы характеризуются оптимумом температур в диапазоне от 40°C до 65ºC и оптимумом pH в диапазоне от 4,5 до 7. Коммерчески доступной бета-амилазой из ячменя является NOVOZYM™ WBA из Novozymes A/S. Denmark и SPEZYME™ BBA 1500 из Genencor Int., USA.
Мальтогенная амилаза
Амилаза может также представлять собой мальтогенную альфа-амилазу. Мальтогенная альфа-амилаза (глюкан-1,4-альфа-мальтогидролаза, E.C. 3.2.1.133) способна гидролизовать амилозу и амилопектин до мальтозы в альфа-конфигурации. Мальтогенная амилаза из Bacillus stearothermophilus штамма NCIB 11837 является коммерчески доступной из Novozymes A/S. Мальтогенные альфа-амилазы описаны в патентах США №№4598048, 4604355 и 6162628, содержание которых таким образом приведено в качестве ссылки.
Мальтогенную амилазу в предпочтительном варианте осуществления можно добавлять в количестве 0,05-5 мг общего белка/грамм DS или 0,05-5 MANU/г DS.
Протеазы
Протеазу можно добавлять во время гидролиза на стадии ii), ферментации на стадии iii) или одновременного гидролиза и ферментации. Протеазу можно добавлять для дефлоккуляции ферментирующего организма, особенно дрожжей, во время ферментации. Протеаза может представлять собой любую протеазу. В предпочтительном варианте осуществления протеаза представляет собой кислую протеазу, происходящую из микроорганизмов, предпочтительно, из грибов или бактерий. Кислая протеаза грибов является предпочтительной, но можно использовать также другие протеазы.
Пригодные протеазы включают протеазы микроорганизмов, такие как протеазы грибов и бактерий. Предпочтительными протеазами являются кислые протеазы, т.е. протеазы, характеризующиеся способностью гидролизовать белки в кислых условиях ниже pH 7.
Предусматриваемые кислые протеазы грибов включают протеазы грибов, полученные из Aspergillus, Mucor, Rhizopus, Candida, Coriolus, Endothia, Enthomophtra, Irpex, Penicillium, Sclerotium и Torulopsis. В особенности предусматривают протеазы, полученные из Aspergillus niger (смотри, например, Koaze et al., 1964, Agr. Biol. Chem. Japan, 28, 216), Aspergillus saitoi (смотри, например, Yoshida, 1954, J. Agr. Chem. Soc. Japan, 28, 66), Aspergillus awamori (Hayashida et al., 1977, Agric. Biol. Chem., 42(5), 927-933, Aspergillus aculeatus (WO 1995/02044), или Aspergillus oryzae, такие как протеаза pepA; и кислые протеазы из Mucor pusillus или Mucor miehei.
Предусматривают также нейтральные или щелочные протеазы, такие как протеаза, полученная из штамма Bacillus. Конкретная протеаза, предусматриваемая по изобретению, получена из Bacillus amyloliquefaciens и обладает последовательностью, которую можно получить в Swissprot под инвентарным №P06832. Предусматривают также протеазы, обладающие по меньшей мере 90% идентичности с аминокислотной последовательностью, которую можно получить в Swissprot под инвентарным №P06832, например, по меньшей мере 92%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или в особенности, по меньшей мере 99% идентичности.
Кроме того, предусматривают протеазы, обладающие по меньшей мере 90% идентичности с аминокислотной последовательностью, описанной как SEQ ID NO:1 в WO 2003/048353, например, 92%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или в особенности, по меньшей мере 99% идентичности.
Предусматривают также папаиноподобные протеазы, такие как протеазы из состава E.C. 3.4.22.* (цистеиновая протеаза), такие как EC 3.4.22.2 (папаин), EC 3.4.22.6 (химопапаин), EC 3.4.22.7 (асклепаин), EC 3.4.22.14 (актинидаин), EC 3.4.22.15 (катепсин L), EC 3.4.22.25 (глицилэндопептидаза) и EC 3.4.22.30 (карикаин).
В одном варианте осуществления протеаза представляет собой препарат протеазы, полученный из штамма Aspergillus, такого как Aspergillus oryzae. В другом варианте осуществления протеаза получена из штамма Rhizomucor, предпочтительно, Rhizomucor meihei. В другом предусматриваемом варианте осуществления протеаза представляет собой препарат протеазы, предпочтительно, смесь протеолитического препарата, полученного из штамма Aspergillus, такого как Aspergillus oryzae, и протеазы, полученной из штамма Rhizomucor, предпочтительно, Rhizomucor meihei.
Протеазы аспарагиновой кислоты описаны, например, в Handbook of Proteolytic Enzymes, Edited by A.J. Barrett, N D. Rawlings and J.F. Woessner, Academic Press, San Diego, 1998, Chapter 270). Подходящие примеры протеазы аспарагиновой кислоты включают, например, протеазы, описанные в R.M. Berka et al., Gene, 96, 313 (1990)); (R.M. Berka et al., Gene, 125, 195-198 (1993)); и Gomi et al., Biosci. Biotech. Biochem. 57, 1095-1100 (1993), содержание которых таким образом приведено в качестве ссылки.
Коммерчески доступные продукты включают ALCALASE®, ESPERASE™, FLAVOURZYME™, PROMIX™, NEUTRASE®, RENNILASE®, NOVOZYM™ FM 2.0L и NOVOZYM™ 50006 (доступные из Novozymes A/S, Denmark) и GC106™ и SPEZYME™ FAN из Genencor Int., Inc., USA.
Протеаза может присутствовать в количестве 0,0001-1 мг белка фермента на г DS, предпочтительно 0,001-0,1 мг белка фермента на г DS. Альтернативно, протеаза может присутствовать в количестве 0,0001-1 LAPU/г DS, предпочтительно, 0,001-0,1 LAPU/г DS и/или 0,0001-1 mAU-RH/г DS, предпочтительно, 0,001-0,1 mAU-RH/г DS.
Изобретение, описанное и заявленное в пунктах формулы изобретения в настоящем документе, не предназначено для ограничения по объему конкретными вариантами осуществления, описанными в настоящем документе, поскольку эти варианты осуществления предназначены только в качестве иллюстраций некоторых аспектов по изобретению. Любые эквивалентные варианты осуществления предназначены, чтобы входить в объем этого изобретения, так же как все комбинации одного или нескольких из вариантов осуществления. Различные модификации по изобретению в дополнение к модификациям, показанным и описанным в настоящем документе, очевидны специалистам в данной области из приведенного выше описания. Такие модификации также предназначены, чтобы попадать в объем прилагаемых пунктов формулы изобретения.
В настоящем документе процитированы различные ссылки, полные описания которых приведены в качестве ссылки. Настоящее изобретение дополнительно описано посредством следующих примеров, которые не следует истолковывать как ограничивающие объем изобретения.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Препарат целлюлазы A: Целлюлолитическая композиция, содержащая полипептид, обладающий активностью усиления целлюлолитической активности (GH61A), описанный в WO 2005/074656; бета-глюкозидазу (слитый белок, описанный в WO 2008/057637) и препарат целлюлолитических ферментов, полученный из Trichoderma reesei. Препарат целлюлазы A описан в находящейся одновременно на рассмотрении патентной заявке PCT/US2008/065417.
Дрожжи:
RED STAR™, доступные из Red Star/Lesaffre, USA.
RWB218 получали из Royal Nedalco/The Netherlands и как описано в Kuyper et al., 2005, FEMS Yeast Research 5, p. 925-934.
- Непромытая предварительно обработанная кукурузная солома (PCS): После кислого катализа, парового взрыва, полученная из The National Renewable Energy Laboratory, Golden, CO.
Методы
Определение идентичности
Сходство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывают посредством параметра «идентичность».
Степень идентичности между двумя аминокислотными последовательностями можно определить способом Clustal (Higgins, 1989, CABIOS 5: 151-153) с использованием программного обеспечения LASERGENE™ MEGALIGN™ (DNASTAR, Inc., Madison, WI) с помощью таблицы идентичности и следующих параметров множественного выравнивания: Штраф за внесение пропуска 10 и штраф за продолжение пропуска 10. Параметры попарного выравнивания представляют собой Ktuple=1, штраф за внесение пропуска =3, окна=5 и диагонали=5.
Степень идентичности между двумя нуклеотидными последовательностями можно определить способом Wilbur-Lipman (Wilbur and Lipman, 1983, Proceedings of the National Academy of Science USA 80: 726-730) с использованием программного обеспечения LASERGENE™ MEGALIGN™ (DNASTAR, Inc., Madison, WI) с помощью таблицы идентичности и следующих параметров множественного выравнивания: Штраф за внесение пропуска 10 и штраф за продолжение пропуска 10. Параметры попарного выравнивания представляют собой Ktuple=3, штраф за внесение пропуска=3, и окна=20.
Измерение активности целлюлазы с использованием анализа на бумажном фильтре (анализ FPU)
1. Источник метода
1.1 Метод описан в документе, озаглавленном «Measurement of Cellulase Activities» Adney, B. and Baker, J., 1996, Laboratory Analytical Procedure, LAP-006, National Renewable Energy Laboratory (NREL). Он основан на методе IUPAC для измерения активности целлюлазы (Ghose, T.K., Measurement of Cellulse Activities, Pure & Appl. Chem. 59, pp. 257-268, 1987).
2. Процедура
2.1 Метод осуществляли, как описано в Adney and Baker, 1996, выше, за исключением использования 96-луночных планшетов для считывания значений поглощения после развития окраски, как описано ниже.
2.2 Пробирки для анализа фермента:
2.2.1 Свернутую полоску фильтровальной бумаги (#1 Whatman; 1×6 см; 50 мг) помещали на дно пробирки (13×100 мм).
2.2.2 В пробирку добавляют 1,0 мл 0,05 M Na-цитратного буфера (pH 4,80).
2.2.3 Пробирки, содержащие фильтровальную бумагу и буфер, инкубируют в течение 5 мин. при 50ºC (±0,1ºC) в водяной бане с циркуляцией.
2.2.4 После инкубации в пробирку добавляют 0,5 мл разведения фермента в цитратном буфере. Разведения фермента рассчитаны для получения значений немного выше и ниже намеченного значения 2,0 мг глюкозы.
2.2.5 Содержимое пробирки перемешивают осторожным встряхиванием в течение 3 секунд.
2.2.6 После встряхивания пробирки инкубируют в течение 60 мин при 50ºC (+0,1ºC) в водяной бане с циркуляцией.
2.2.7 Немедленно после инкубации в течение 60 мин пробирки убирают из водяной бани, и в каждую пробирку добавляют 3,0 мл реагента DNS для остановки реакции. Пробирки встряхивают в течение 3 секунд для перемешивания.
2.3 Ноль и контроли
2.3.1 Ноль для реагента получают добавлением 1,5 мл цитратного буфера в пробирку.
2.3.2 Контроль для субстрата получают помещением свернутой полоски фильтровальной бумаги на дно пробирки и добавлением 1,5 мл цитратного буфера.
2.3.3 Контроли для фермента получают для каждого разведения фермента смешиванием 1,0 мл цитратного буфера с 0,5 мл соответствующего разведения фермента.
2.3.4 Ноль для реагента, контроль для субстрата и контроли для фермента анализируют таким же способом, как и пробирки для анализа фермента, и вместе с ними.
2.4 Стандарты глюкозы
2.4.1 Получают 100 мл исходного раствора глюкозы (10,0 мг/мл), и аликвоты по 5 мл замораживают. Перед использованием аликвоты оттаивают и встряхивают для перемешивания.
2.4.2 Разведения исходного раствора получают в цитратном буфере следующим образом:
G1=1,0 мл исходного раствора+0,5 мл буфера=6,7 мг/мл=3,3 мг/0,5 мл
G2=0,75 мл исходного раствора+0,75 мл буфера=5,0 мг/мл=2,5 мг/0,5 мл
G3=0,5 мл исходного раствора+1,0 мл буфера=3,3 мг/мл=1,7 мг/0,5 мл
G4=0,2 мл исходного раствора+0,8 мл буфера=2,0 мг/мл=1,0 мг/0,5 мл
2.4.3 Пробирки со стандартами глюкозы получают добавлением 0,5 мл каждого разведения к 1,0 мл цитратного буфера.
2.4.4 Пробирки со стандартами глюкозы анализируют таким же способом, как и пробирки для анализа фермента, и вместе с ними.
2.5 Развитие окраски
2.5.1 После инкубации в течение 60 мин и добавления DNS, все пробирки вместе кипятят в течение 5 мин в водяной бане.
2.5.2 После кипячения их немедленно охлаждают в ледяной/водяной бане.
2.5.3 После охлаждения пробирки кратко встряхивают и позволяют пульпе осесть. Затем для каждой пробирки получают разведение добавлением 50 микролитров из пробирки к 200 микролитрам ddH2O в 96-луночном планшете. Каждую лунку перемешивают, и поглощение считывают при 540 нм.
2.6 Вычисления (примеры приведены в документе NREL)
2.6.1 Получают стандартную кривую для глюкозы нанесением на график концентрации глюкозы (мг/0,5 мл) для четырех стандартов (G1-G4) в зависимости от A540. Кривую наносят по точкам с использованием линейной регрессии (программное обеспечение Prism), и уравнение для кривой используют для определения количества глюкозы, полученного в каждой пробирке для анализа фермента.
2.6.2 Получают график продукции глюкозы (мг/0,5 мл) в зависимости от разведения общего фермента, где Y-ось (разведение фермента) представлена в логарифмической шкале.
2.6.3 Проводят линию между разведением фермента с продукцией непосредственно выше 2,0 мг глюкозы и разведением с продукцией непосредственно ниже этого. По этой линии определяют разведение фермента с продукцией точно 2,0 мг глюкозы.
2.6.4 Количество единиц по фильтровальной бумаге/мл (FPU/мл) вычисляют следующим образом:
FPU/мл=0,37/разведение фермента с продукцией 2,0 мг глюкозы
Активность глюкоамилазы
Активность глюкоамилазы можно измерять в единицах AGI или в единицах глюкоамилазы (AGU).
Активность глюкоамилазы (AGI)
Глюкоамилаза (эквивалент амилоглюкозидазы) превращает крахмал в глюкозу. Количество глюкозы определяют в настоящем документе способом глюкозо-оксидазы для определения активности. Способ описан в разделе 76-11 Starch - Glucoamylase Method with Subsequent Measurement of Glucose with Glucose Oxidase in «Approved methods of the American Association of Cereal Chemists». Vol.1-2 AACC, from American Association of Cereal Chemists, (2000); ISBN: 1-891127-12-8.
Одна единица глюкоамилазы (AGI) представляет собой количество фермента, которое образует 1 микромоль глюкозы в минуту в стандартных условиях метода.
Стандартные условия/условия реакции:
Субстрат: Растворимый крахмал, концентрация приблизительно 16 г сухого вещества/л
Буфер: Ацетат, приблизительно 0,04 M, pH=4,3
pH: 4,3
Температура инкубации: 60ºC
Время реакции: 15 минут
Остановка реакции: NaOH до концентрации приблизительно 0,2 г/л (pH~9)
Концентрация фермента: 0,15-0,55 AAU/мл.
Крахмал должен представлять собой крахмал Линтнера, который представляет собой крахмал жидкой варки, применяемый в лаборатории в качестве колориметрического индикатора. Крахмал Линтнера получают обработкой нативного крахмала разбавленной соляной кислотой, так что он сохраняет способность окрашиваться в синий цвет с помощью иода.
Активность глюкоамилазы (AGU)
Единицу глюкоамилазы Novo (AGU) определяют как количество фермента, которое гидролизует 1 микромоль мальтозы в минуту в стандартных условиях 37ºC, pH 4,3, субстрат: мальтоза 23,2 мМ, буфер: ацетат 0,1M, время реакции 5 минут.
Можно использовать систему с автоанализатором. Мальтозу добавляют к реагенту глюкозо-дегидрогеназе, так что вся присутствующая альфа-D-глюкоза превращается в бета-D-глюкозу. Глюкозо-дегидрогеназа реагирует специфически с бета-D-глюкозой в реакции, упомянутой выше, образуя NADH, который определяют с использованием фотометра при 340 нм в качестве показателя исходной концентрации глюкозы.
Папка (EB-SM-0131.02/01) с более подробным описанием этого аналитического способа является доступной по запросу из Novozymes A/S, Denmark, таким образом, содержание этой папки приведено в качестве ссылки.
Активность альфа-амилазы
Активность альфа-амилазы (KNU)
Активность альфа-амилазы можно определить с использованием кратофельного крахмала в качестве субстрата. Этот способ основан на разрушении модифицированного картофельного крахмала ферментом, и после реакции образцы раствора крахмала/фермента смешивают с раствором иода. Сначала образуется черно-синяя окраска, однако в ходе разрушения крахмала синяя окраска становится слабее и постепенно переходит в красновато-коричневую, которую сравнивают со стандартом цветного стекла.
Одну единицу альфа-амилазы Kilo Novo (KNU) определяют как количество фермента, которое, в стандартных условиях (т.е. при 37ºC+/-0,05; 0,0003 M Ca2+; и pH 5,6) приводит к декстринизации 5260 мг сухого растворимого крахмального вещества Merck Amylum.
Папка EB-SM-0009.02/01 с более подробным описанием этого аналитического способа является доступной по запросу из Novozymes A/S, Denmark, таким образом, содержание этой папки приведено в качестве ссылки.
Активность кислой альфа-амилазы
При использовании в соответствии с настоящим изобретением активность любой кислой альфа-амилазы можно измерять в AFAU (единицы кислой альфа-амилазы грибов). Альтернативно, активность кислой альфа-амилазы можно измерять в AAU (единицы кислой альфа-амилазы).
Единицы кислой альфа-амилазы (AAU)
Активность кислой альфа-амилазы можно измерять в AAU (единицы кислой альфа-амилазы), что представляет собой абсолютный способ. Одна единица кислой амилазы (AAU) представляет собой количество фермента, превращающее 1 г крахмала (100% сухого вещества) в час в стандартизованных условиях в продукт, обладающий прозрачностью при 620 нм после реакции с раствором иода известной концентрации, эквивалентной прозрачности контроля окраски.
Стандартные условия/условия реакции:
Субстрат: Растворимый крахмал. Концентрация приблизительно 20 г DS/л.
Буфер: Цитрат, приблизительно 0,13 M, pH=4,2
Раствор иода: 40,176 г калий иодид+0,088 г иода/л
Водопроводная вода 15º-20ºdH (германский градус жесткости)
pH: 4,2
Температура инкубации: 30ºC
Время реакции: 11 минут
Длина волны: 620 нм
Концентрация фермента: 0,13-0,19 AAU/мл
Рабочий диапазон фермента: 0,13-0,19 AAU/мл
Крахмал должен представлять собой крахмал Линтнера, который представляет собой крахмал жидкой варки, применяемый в лаборатории в качестве колориметрического индикатора. Крахмал Линтнера получают обработкой нативного крахмала разбавленной соляной кислотой, так что он сохраняет способность окрашиваться в синий цвет с помощью иода. Дополнительные подробности можно найти в EP 0140410 B2, описание которого таким образом приведено в качестве ссылки.
Активность кислой альфа-амилазы (AFAU)
Активность кислой альфа-амилазы можно измерять в AFAU (единицы кислой альфа-амилазы грибов), которые определяют относительно стандарта фермента. 1 AFAU определяют как количество фермента, которое деградирует 5,260 мг сухого вещества крахмала в час при упомянутых ниже стандартных условиях.
Кислая альфа-амилаза, эндо-альфа-амилаза (1,4-альфа-D-глюкан-глюканогидролаза, E.C. 3.2.1.1) гидролизует альфа-1,4-глюкозидные связи во внутренних областях молекулы крахмала с образованием декстринов и олигосахаридов с различной длиной цепи. Интенсивность окраски, образованной с помощью иода, является прямо пропорциональной концентрации крахмала. Активность амилазы определяют с использованием обратной колориметрии как уменьшение концентрации крахмала в указанных условиях анализа.

Стандартные условия/условия реакции:
Субстрат: Растворимый крахмал, приблизительно 0,17 г/л
Буфер: Цитрат, приблизительно 0,03 M
Иод (I2): 0,03 г/л
CaCl2: 1,85 мМ
pH: 2,50±0,05
Температура инкубации: 40ºC
Время реакции: 23 секунды
Длина волны: 590 нм
Концентрация фермента: 0,025 AFAU/мл
Рабочий диапазон фермента: 0,01-0,04 AFAU/мл
Папка EB-SM-0259.02/01 с более подробным описанием этого аналитического способа является доступной по запросу из Novozymes A/S, Denmark, таким образом, содержание этой папки приведено в качестве ссылки.
Анализ ксилозо/глюкозо-изомеразы (IGIU)
1 IGIU представляет собой количество фермента, превращающее глюкозу в фруктозу с начальной скоростью 1 микромоль в минуту при тандартных условиях анализа.
Стандартные условия:
Концентрация глюкозы: 45% масс./масс.
pH: 7,5
Температура: 60ºC
Концентрация Mg2+: 99 мг/л (1,0 г/л MgSO4*7H2O)
Концентрация Ca2+: <2 м.д.
Активатор, SO2 концентрация: 100 м.д. (0,18 г/л Na2S2O5)
Буфер, Na2CO3, концентрация: 2 мМ Na2CO3
Активность протеазы
Способ анализа протеазы (LAPU)
1 единица лейцинаминопептидазы (LAPU) представляет собой количество фермента, расщепляющее 1 микромоль субстрата в минуту в следующих условиях: 26 мМ L-лейцин-п-нитроанилид в качестве субстрата, 0,1 M Трис-буфер (pH 8,0), 37ºC, время реакции 10 минут.
LAPU описана в EB-SM-0298.02/01, доступном из Novozymes A/S Denmark по запросу.
Способ анализа протеазы - AU(RH)
Протеолитическую активность можно определять с помощью денатурированного гемоглобина в качестве субстрата. В способе Ансона с использованием гемоглобина для определения протеолитической активности денатурированный гемоглобин расщепляют, и нерасщепленный гемоглобин преципитируют с помощью трихлоруксусной кислоты (TCA). Количество растворимого в TCA продукта определяют с помощью фенольного реагента, придающего синюю окраску с помощью тирозина и триптофана.
Одну единицу по Ансону (AU(RH)) определяют как количество фермента, которое в стандартных условиях (т.е. 25ºC, pH 5,5 и время реакции 10 мин) расщепляет гемоглобин с такой начальной скоростью, что в минуту высвобождается такое количество растворимого в TCA продукта, которое дает такую же окраску с помощью фенольного реагента, как один миллиэквивалент тирозина.
AU(RH) описана в EAL-SM-0350, доступном по запросу из Novozymes A/S Denmark.
Определение активности мальтогенной амилазы (MANU)
Одну MANU (единицу мальтогенной амилазы Novo) можно определить как количество фермента, необходимое для высвобождения одного микромоль мальтозы в минуту при концентрации субстрата мальтотриозы (Sigma M 8378) 10 мг на мл 0,1 M цитратного буфера, pH 5,0 при 37ºC в течение 30 минут.
Измерение массы дрожжей в сухом состоянии
Сухую массу RED STAR™ определяли непосредственным взвешиванием гранул сухих клеток дрожжей. Массу RWB218 в сухом состоянии определяли измерением оптической плотности (OD) клеток посредством спектрофотометра при 600 нм, с использованием предварительно определенной корреляции OD и массы клеток в сухом состоянии. OD 1 соответствует 0,26 г/л сухих клеток.
ПРИМЕРЫ
Пример 1
Продукция этанола при большом количестве клеток
Эффект высокого уровня дрожжей в партии (количества клеток) и повторного использования клеток на продукцию этанола тестировали инокуляцией фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей. Через 24 и 48 часов после начала ферментации клетки использовали повторно посредством центрифугирования, удаления истощенного гидролизата и добавления свежего гидролизата.
Метод:
Непромытую PCS (после кислого катализа и парового взрыва, The National Renewable Energy Laboratory, Golden, CO), гидролизовали в течение 72 часов при 50ºC с использованием исходной концентрации нерастворимых твердых веществ 20% (масс./масс.) и 10 мг препарата целлюлазы A на г целлюлозы. После гидролиза суспензию центрифугировали в течение 10 минут при 3000 об/мин, и супернатант собирали фильтрацией с использованием фильтра Whatman 0,45 микрон.
В лунки 24-луночного культурального планшета (Whatman International Ltd., Florham Park, NJ) добавляли различные количества дрожжей RED STAR™ в диапазоне от 1 г сухих клеток/л до 50 г сухих клеток/л. В каждую лунку добавляли 4 мл ферментного гидролизата PCS, pH 5,0, и клетки ресуспендировали с мягким встряхиванием. Планшет герметично закрывали и инкубировали в инкубаторе с сухим воздухом при 32ºC с покачиванием при 150 об/мин. Образцы собирали через 0, 4, 8 и 24 часов для определения этанола. Анализ с иммобилизованным на микропланшетах для титрования ферментом использовали для количественного определения этанола (реагенты из Diagnostic Chemicals Ltd., Prince Edward Island, Canada). Через 24 часа клетки собирали центрифугированием при 3000 об/мин в течение 12 минут, и супернатанты выбрасывали. Затем в каждую лунку добавляли 4 мл свежего гидролизата PCS, и клетки дрожжей ресуспендировали с помощью стеклянной палочки для перемешивания. Образцы собирали немедленно и затем подвергали второй инкубации в течение 24 часов при 32ºC, после этого времени планшет для ферментации повторно центрифугировали и супернатанты выбрасывали. Четыре мл свежего гидролизата PCS снова добавляли в каждую лунку и ресуспендировали клетки. Образцы собирали немедленно и через 4, 8 и 24 часа во время третьих суток ферментации. Ферментацию заканчивали через 72 часа после начала, и из каждой лунки отбирали образцы для стандартных анализов ВЭЖХ.
Пример 2
Продукция этанола при низком количестве клеток
Тестировали эффект различных количеств растворов сахаров и фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) на продукцию этанола при периодической ферментации в различных штаммах дрожжей. Результаты обобщены на Фигуре 1.
Метод:
В десяти различных средах проводили периодическую ферментацию для продукции этанола дрожжами RED STAR™ и RWB218 (Nedalco). Среды 1-5 представляли собой растворы глюкозы и ксилозы, дополненные 0,5% (масс./об.) дрожжевого экстракта и 1% (масс./об.) пептона. Среды 6-10 представляли собой фильтрованные ферментные гидролизаты предварительно обработанной непромытой кукурузной соломы (fuwPCS) с различными уровнями общих твердых веществ. Уровень сахара сред 5-9 регулировали для получения концентрации ксилозы и глюкозы, эквивалентной концентрации, обнаруженной в 20% общих твердых веществ гидролизата fuwPCS, чтобы протестировать устойчивость штаммов к различным уровням ингибиторов. Все среды стерилизовали фильтрованием.
Среда 1: Только ксилоза при 40 г/л
Среда 2: Только глюкоза при 40 г/л
Среда 3: Ксилоза 20 г/л и глюкоза 20 г/л (низкая доза)
Среда 4: Ксилоза 60 г/л и глюкоза 80 г/л (высокая доза)
Среда 5: 0% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л
Среда 6: 1% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л
Среда 7: 5% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л
Среда 8: 10% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л
Среда 9: 15% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л
Среда 10: 20% TS fuwPCS в ксилозе 40 г/л и глюкозе 75 г/л. Непромытую PCS (после кислого катализа, парового взрыва, The National Renewable Energy Laboratory, Golden, CO) разводили водой и доводили до pH 5,0 с помощью NaOH. Пенициллин, цитратный буфер и среду YP (0,5% (масс./об.) дрожжевого экстракта и 1% (масс./об.) пептона) также добавляли перед гидролизом. Образец гидролизовали в течение 96 часов при 50ºC с препаратом целлюлазы A при концентрации общих твердых веществ 20% (масс./масс.). После гидролиза суспензию центрифугировали в течение 10 минут при 3000 об/мин, и супернатант, pH 5,0, собирали стерильной фильтрацией и использовали для ферментации.
Ферментации проводили в автоклавированных 20 мл минифлаконах при 30ºC в течение 96 час. Оба штамма дрожжей тестировали в десяти средах для ферментации, как перечислено выше. Все тесты проводили в трех повторах. Прекультуру инокулировали в 5 мл среды для ферментации, содержащейся в 20 мл минифлаконе при исходной плотности клеток приблизительно 0,25 г/л. Затем минифлаконы инкубировали в встряхивателе при 150 об/мин в течение четырех суток. В конце ферментации отбирали образцы для измерения уровней этанола, глюкозы, ксилозы, уксусной кислоты и глицерина посредством ВЭЖХ. Подготовка к ВЭЖХ состояла из остановки реакции добавлением 40% H2SO4 (добавлением 1% об./об.), центрифугирования и фильтрации через фильтр 0,20 микрометров. Образцы сохраняли при 4ºC до анализа. Использовали систему ВЭЖХ Agilent™ 1100 в сочетании с детектором RI. Разделительная колонка представляла собой ионоисключающую колонку aminex HPX-87H (300 мм×7,8 мм) от BioRad™.
Пример 3
Продукция этанола при высоком количестве клеток
Эффект высокого уровня (количества клеток) дрожжей RED STAR™ на продукцию этанола при периодической ферментации тестировали посредством инокуляции фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей. Результаты обобщены на Фигуре 2.
Метод:
Непромытую PCS (после кислого катализа, предварительно обработанную кукурузную солому из National Renewable Energy Laboratory, Golden, CO) гидролизовали в течение 120 часов при 50ºC, pH 5,0 с использованием исходной концентрации нерастворимых твердых веществ 20% (масс./масс.) и 50 мг препарата целлюлазы A на г целлюлозы. После гидролиза суспензию центрифугировали в течение 10 минут при 3000 об/мин с использованием настольной центрифуги Beckman-Coulter для отделения твердых веществ. Полученный жидкий гидролизат дополняли питательными веществами: дрожжевым экстрактом и пептоном до уровня 5 г/л каждого и подвергали ферментации с использованием инкубатора с встряхиванием при 150 об/мин в течение 24 час при температуре 32ºC и pH 5,0 в 250 мл бутыли nalgene с рабочим объемом 150 мл при изменении исходной концентрации клеток дрожжей red star от 20 г/л до 90 г/л. Образцы собирали через 3, 7 и 24 час и анализировали по потреблению глюкозы и продукции этанола с использованием ВЭЖХ.
Пример 4
Продукция этанола при большом количестве клеток
Эффект высокого уровня (количества клеток) дрожжей RWB218 на продукцию этанола при периодической ферментации тестировали посредством инокуляции ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей. Результаты обобщены на Фигуре 3.
Метод:
Непромытую PCS (после кислого катализа, парового взрыва, The National Renewable Energy Laboratory, Golden, CO) разводили водой и доводили до pH 5,0 с помощью NaOH. Пенициллин и цитратный буфер также добавляли перед гидролизом. Образец гидролизовали в течение 96 часов при 50ºC с помощью препарата целлюлазы A при общей концентрации твердых веществ 23% (масс./масс.). После гидролиза суспензию центрифугировали в течение 15 минут при 3000 об/мин, и собирали супернатант. Перед ферментацией супернатант дополняли 0,5% дрожжевым экстрактом (масс./об.) и 0,5% (масс./об.) пептоном, и доводили pH до 6,0 с помощью NH4OH. Добавляли определенное количество воды до получения конечной общей концентрации твердых веществ в гидролизате 20% (масс./масс.).
Ферментацию проводили во флаконах 125 мл при 30ºC. Каждый флакон содержал 50 мл вышеуказанного жидкого гидролизата, и его инокулировали с помощью RWB218 при исходной плотности клеток 2, 5, 10, 20, 40 и 60 г клеток на л. Флаконы инкубировали в встряхивателях при 150 об/мин в течение 24 часов. Образцы отбирали через 0, 2, 4, 6, 8, 10, 12, 22 и 24 часа ферментации для измерения уровней этанола, глюкозы, ксилозы, уксусной кислоты и глицерина посредством ВЭЖХ. Подготовка к ВЭЖХ состояла из остановки реакции добавлением 40% H2SO4 (добавлением 1% об./об.), центрифугирования и фильтрации через фильтр 0,20 микрометров. Образцы сохраняли при 4ºC до анализа. Использовали систему ВЭЖХ Agilent™ 1100 в сочетании с детектором RI. Разделительная колонка представляла собой ионоисключающую колонку aminex HPX-87H (300 мм×7,8 мм) от BioRad™.
Пример 5
Продукция этанола при высоком количестве повторно использованных клеток
Эффект высокого уровня (количества клеток) дрожжей RED STAR™ и повторного использования клеток при pH5 на продукцию этанола при периодической ферментации тестировали посредством инокуляции фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при исходной концентрации клеток дрожжей 40 г/л. Через 24 и 48 часов после начала ферментации клетки использовали повторно посредством центрифугирования, удаления истощенного гидролизата и добавления свежего гидролизата. Результаты обобщены на Фигуре 4.
Метод:
Непромытую PCS (после кислого катализа, предварительно обработанную кукурузную солому из National Renewable Energy Laboratory, Golden, CO) гидролизовали в течение 120 часов при 50ºC, pH 5,0 с использованием исходной концентрации твердых веществ 20% (масс./масс.) и 50 мг препарата целлюлазы A на г целлюлозы. После гидролиза суспензию центрифугировали в течение 10 минут при 3000 об/мин с использованием настольной центрифуги Beckman-Coulter для отделения твердых веществ. Полученный жидкий гидролизат дополняли питательными веществами: дрожжевым экстрактом и пептоном до уровня 5 г/л каждого и подвергали ферментации с использованием инкубатора с встряхиванием при 150 об/мин в течение 24 час при температуре 32ºC и pH 5,0 в 250 мл бутыли nalgene с рабочим объемом 150 мл при исходной концентрации клеток дрожжей 40 г/л. Каждые 24 час бутыль nalgene, содержащую жидкий гидролизат и клетки дрожжей, центрифугировали при 3000 об/мин в течение 10 мин с использованием настольной центрифуги Beckman-Coulter. Ферментированный жидкий гидролизат, содержащий этанол, декантировали и добавляли свежий гидролизат, содержащий питательные вещества (объем 150 мл), и клетки дрожжей ресуспендировали в той же самой бутыли nalgene и повторно инкубировали при 32ºC и 150 об/мин в инкубаторе с встряхиванием, как ранее. Образцы собирали через 3, 7 и 23,5 час для каждого цикла ферментации и анализировали по потреблению глюкозы и продукции этанола с использованием ВЭЖХ.
Пример 6
Продукция этанола при высоком количестве повторно использованных клеток
Эффект высокого уровня (количества клеток) дрожжей RED STAR™ и повторного использования клеток при pH6 на продукцию этанола при периодической ферментации тестировали посредством инокуляции фильтрованного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при исходной концентрации клеток дрожжей 40 г/л. Через 12 часов после начала каждого цикла ферментации клетки выделяли центрифугированием, удаляли истощенный гидролизат и добавляли свежий гидролизат. Результаты обобщены на Фигуре 5.
Метод:
Непромытую PCS (после кислого катализа, предварительно обработанную кукурузную солому из National Renewable Energy Laboratory, Golden, CO) гидролизовали в течение 120 часов при 50ºC, pH 5,0 с использованием исходной концентрации твердых веществ 20% (масс./масс.) и 50 мг препарата целлюлазы A на г целлюлозы. После гидролиза суспензию центрифугировали в течение 10 минут при 3000 об/мин с использованием настольной центрифуги Beckman-Coulter. Полученный жидкий гидролизат дополняли питательными веществами: дрожжевым экстрактом и пептоном до уровня 5 г/л каждого и подвергали ферментации с использованием инкубатора с встряхиванием при 150 об/мин в течение 12 час при температуре 32ºC и pH 6,0 в 250 мл бутыли nalgene с рабочим объемом 150 мл при исходной концентрации клеток дрожжей 40 г/л. Раствор гидроксида натрия 10% (масс./масс.) использовали для доведения pH до 6,0. Каждые 12 час бутыль nalgene, содержащую жидкий гидролизат и клетки дрожжей, центрифугировали при 3000 об/мин в течение 10 мин с использованием настольной центрифуги Beckman-Coulter. Ферментированный жидкий гидролизат, содержащий этанол, декантировали и добавляли свежий гидролизат, содержащий питательные вещества (объем 150 мл), и клетки дрожжей ресуспендировали в той же самой бутыли nalgene и повторно инкубировали при 32ºC и 150 об/мин в инкубаторе с встряхиванием, как ранее. Образцы собирали через 3, 7 и 11,5 час после начала каждого цикла ферментации и анализировали по потреблению глюкозы и продукции этанола с использованием ВЭЖХ. Такие же эксперименты проводили при исходной концентрации твердых веществ 15% (масс./масс.) в средах, дополненных приблизительно 20 г/л глюкозы. Клетки использовали повторно восемь (8) раз всего из девяти (9) циклов ферментации. В каждом цикле ферментации получали приблизительно 37 г/л этанола, что указывает на отсутствие потери производительности ферментации повторно использованных дрожжей даже после 9 циклов ферментации. (Данные не представлены).
Пример 7
Продукция этанола при высоком количестве повторно использованных клеток
Эффект высокого уровня (количества клеток) дрожжей RWB218 и повторного использования клеток на продукцию этанола при периодической ферментации с подпиткой тестировали посредством инокуляции центрифугированного ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при исходной концентрации клеток дрожжей 20 г/л. Через 24 часа после начала каждой ферментации клетки использовали повторно посредством центрифугирования, удаления истощенного гидролизата и добавления свежего гидролизата. Результаты для каждого цикла ферментации показаны на Фигуре 6а, и подробности первого цикла ферментации показаны на Фигуре 6b.
Метод:
Непромытую PCS (после кислого катализа, парового взрыва, The National Renewable Energy Laboratory, Golden, CO) разводили водой и доводили до pH 5,0 с помощью NaOH. Пенициллин и цитратный буфер также добавляли перед гидролизом. Образец гидролизовали в течение 96 часов при 50ºC с помощью препарата целлюлазы A при общей концентрации твердых веществ 23% (масс./масс.). После гидролиза суспензию центрифугировали в течение 15 минут при 3000 об/мин, и собирали супернатант. Перед ферментацией супернатант дополняли 0,5% (масс./об.) дрожжевым экстрактом и 0,5% (масс./об.) пептоном или 0,1% (масс./об.) мочевиной и доводили pH до 6,0 с помощью NH4OH. Добавляли воду до получения конечной общей концентрации твердых веществ в гидролизате 20% (масс./масс.).
Ферментацию проводили в 250 мл бутылях Nalgene при 30°C. Одна бутыль содержала 40 мл вышеуказанного жидкого гидролизата, дополненного дрожжевым экстрактом и пептоном, а другая бутыль содержала 40 мл вышеуказанного жидкого гидролизата, дополненного мочевиной. Обе бутыли инокулировали с помощью RWB218 при плотности клеток 20 г клеток на литр (на основании общего рабочего объема 200 мл). Затем бутыли инкубировали в встряхивателе при 150 об/мин. Подпитку одного и того же жидкого гидролизата в виде партий начинали после двух часов ферментации. Общий объем подпитки составлял 160 мл, и общее время подпитки составляло от 22 до 40 час. После завершения подпитки бутыль Nalgene, содержащую ферментированную среду и клетки дрожжей, центрифугировали при 3000 об/мин в течение 15 минут. 160 мл супернатанта, содержащего этанол, декантировали и остальные 40 мл, оставшиеся в бутыли, хорошо перемешивали с клетками дрожжей. Бутыль повторно инкубировали в встряхивателе при 30ºC и 150 об/мин, как ранее, и подпитку начинали снова с наполнением подпитываемой бутыли другими 160 мл такого же жидкого гидролизата, как ранее. Образцы собирали во время каждого цикла ферментации для измерения уровней этанола, глюкозы, ксилозы, уксусной кислоты и глицерина посредством ВЭЖХ. Подготовка к ВЭЖХ состояла из остановки реакции добавлением 40% H2SO4 (1% об./об.), центрифугирования и фильтрации через фильтр 0,20 микрометров. Образцы сохраняли при 4ºC до анализа. Использовали систему ВЭЖХ Agilent™ 1100 в сочетании с детектором RI. Разделительная колонка представляла собой ионоисключающую колонку aminex HPX-87H (300 мм×7,8 мм) от BioRad™.
Пример 8
Продукция этанола при высоком количестве клеток
Эффект высокого уровня (количества клеток) дрожжей RWB218 на продукцию этанола при периодической ферментации из кукурузной соломы (CS), предварительно обработанной различными способами предварительной обработки, тестировали посредством инокуляции ферментного гидролизата предварительно обработанной кукурузной соломы (PCS) при различных исходных концентрациях клеток дрожжей. Результаты обобщены на Фигуре 7.
Метод:
Непромытую кукурузную солому после предварительной автообработки и непромытую предварительно обработанную щелочью кукурузную солому (The National Renewable Energy Laboratory, Golden, CO) разводили водой и доводили до pH 5,0 либо NaOH, либо H2SO4, соответственно. Пенициллин и цитратный буфер также добавляли перед гидролизом. Образцы гидролизовали в течение 48 часов при 50ºC с помощью препарата целлюлазы A и SHEARSYME™ при общей концентрации твердых веществ 20% (масс./об.). После гидролиза суспензию центрифугировали в течение 15 минут при 3000 об/мин, и собирали супернатант. Перед ферментацией супернатант дополняли 0,5% (масс./об.) дрожжевого экстракта и 0,5% (масс./об.) пептона.
Ферментацию проводили во флаконах 125 мл при 30ºC. Каждый флакон содержал 50 мл вышеуказанных жидких гидролизатов, и его инокулировали с помощью RWB218 при исходной плотности клеток 2, 5, 10, 20 и 40 г клеток на литр. Флаконы инкубировали в встряхивателе при 150 об/мин в течение 24 часов. Образцы отбирали через 0, 2, 4, 6, 20 и 24 часов ферментации для измерения уровней этанола, глюкозы, ксилозы, уксусной кислоты и глицерина посредством ВЭЖХ. Подготовка к ВЭЖХ состояла из остановки реакции добавлением 40% H2SO4 (добавлением 1% об./об.), центрифугирования и фильтрации через фильтр 0,20 микрометров. Образцы сохраняли при 4ºC до анализа. Использовали систему ВЭЖХ Agilent™ 1100 в сочетании с детектором RI. Разделительная колонка представляла собой ионоисключающую колонку aminex HPX-87H (300 мм×7,8 мм) от BioRad™.
Реферат
Изобретение относится к области биотехнологии. Предложен способ получения продукта ферментации из содержащего лигноцеллюлозу материала. Содержащий лигноцеллюлозу материал предварительно обрабатывают. Затем проводят гидролиз предварительно обработанного материала. По окончании гидролиза проводят ферментацию с использованием ферментирующего организма. Ферментацию начинают и проводят при концентрации ферментирующего организма в диапазоне 2-90 г массы ферментирующего организма в сухом состоянии на 1 л среды для ферментации. Причем ферментацию проводят как периодическую ферментацию с подпиткой, где С6 и С5 сахара ферментируют одновременно. Предпочтительно продуктом ферментации является этанол. Предложенный способ позволяет повысить выход этанола. 52 з.п. ф-лы, 7 ил., 2 табл., 8 пр.
Формула
i) предварительную обработку содержащего лигноцеллюлозу материала;
ii) гидролиз предварительно обработанного содержащего лигноцеллюлозу материала;
iii) ферментацию с использованием ферментирующего организма;
где стадию гидролиза ii) и стадию ферментации iii) проводят как отдельные гидролиз и ферментацию, и
где ферментацию начинают и проводят при концентрации ферментирующего организма в диапазоне 2-90 г массы ферментирующего организма в сухом состоянии на л среды для ферментации, причем ферментацию проводят как периодическую ферментацию с подпиткой, где С6 и С5 сахара ферментируют одновременно.
Документы, цитированные в отчёте о поиске
Способ производства этанола из целлюлозосодержащих отходов (варианты) и способ получения глюкозы изцеллюлозосодержащих отходов

Комментарии