Твердая дисперсия с улучшенной растворимостью, содержащая производное тетразола в качестве активного ингредиента - RU2662819C2
Код документа: RU2662819C2
Чертежи
Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердой дисперсии с улучшенной растворимостью, содержащей производное тетразола в качестве активного ингредиента, более конкретно, аморфной твердой дисперсии, содержащей производное тетразола формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента, и к фармацевтическому составу, содержащему это соединение.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Следующие ниже производное тетразола формулы (I) и его фармацевтически приемлемая соль известны как ингибитор P-гликопротеина, который обладает видами ингибирующей активности в отношении множественной лекарственной устойчивости в злокачественных клетках (см. патент KR №10-0557093):

где R1-R11, m, n и X являются такими же, как определено ниже.
P-гликопротеины встречаются в эндотелиальных клетках желудочно-кишечного тракта и т.д., и известно, что они ограничивают пероральное всасывание определенных лекарственных средств. Некоторые из основных средств против злокачественной опухоли, таких как паклитаксел, доцетаксел и т.п., не могут преимущественно всасываться организмом вследствие действия P-гликопротеина, если их вводили перорально (Schinkel et al., Cell, 77, 491-502, 1994). Одной из существенных проблем в терапии против злокачественной опухоли является экспрессия устойчивости к средствам против злокачественной опухоли в злокачественных клетках, и среди них наиболее существенные проблемы заключаются в множественной лекарственной устойчивости (MDR), обусловленной сверхэкспрессией P-гликопротеина. В большинстве случаев MDR в злокачественных клетках увеличивается при увеличении использования средства против злокачественной опухоли, и это является причинным фактором, который по существу снижает коэффициенты выживаемости при злокачественной опухоли.
Таким образом, ингибитор P-гликопротеина, содержащий производное тетразола формулы (I), может ингибировать действие P-гликопротеина, таким образом обеспечивая возможность перорального введения определенных лекарственных средства, и, таким образом, ожидают, что он является эффективным против MDR в злокачественных клетках, которая является индуцированной сверхэкспрессией P-гликопротеина.
Однако производное тетразола и его фармацевтически приемлемая соль обладают очень низкими растворимостями, и, таким образом, трудно рассчитывать на хорошую скорость всасывания in vivo. Таким образом, существует необходимость в улучшенной растворимости и скорости всасывания in vivo указанного выше лекарственного средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, целью настоящего изобретения является улучшение растворимости и скорости всасывания in vivo указанного выше производного тетразола и его фармацевтически приемлемой соли.
В соответствии с одной из целей настоящего изобретения предоставлена аморфная твердая дисперсия, содержащая производное тетразола формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента, и фармацевтический состав, содержащий эти соединения:

где
R1 представляет собой хинолин, изохинолин, хиноксалин, пиридин, пиразин, нафталин, фенил, тиофен, фуран, 4-оксо-4H-хромен или циннолин, который является незамещенным или замещенным C1-C5алкилом, гидроксилом, C1-5алкокси, галогеном, трифторметилом, нитро или амино;
R2-R5 и R8-R11 каждый независимо представляет собой H, гидроксил, галоген, нитро, C1-C5алкил или C1-5алкокси; R6 и R7 каждый независимо представляет собой H, гидроксил, галоген, нитро, C1-5алкилен или C1-5алкокси; и R6 и R7 могут являться связанными с образованием 4-8-членного кольца;
m и n каждый независимо представляет собой целое число в диапазоне от 0 до 4, и
X представляет собой CH2, O или S.
Твердая дисперсия по изобретению содержит водорастворимый полимер и/или кислоту для того, чтобы улучшать растворимость своего активного ингредиента, например, производного тетразола формулы (I), таким образом улучшая его скорость всасывания in vivo, и, таким образом, ее можно эффективно использовать для уменьшения MDR в злокачественных клетках.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
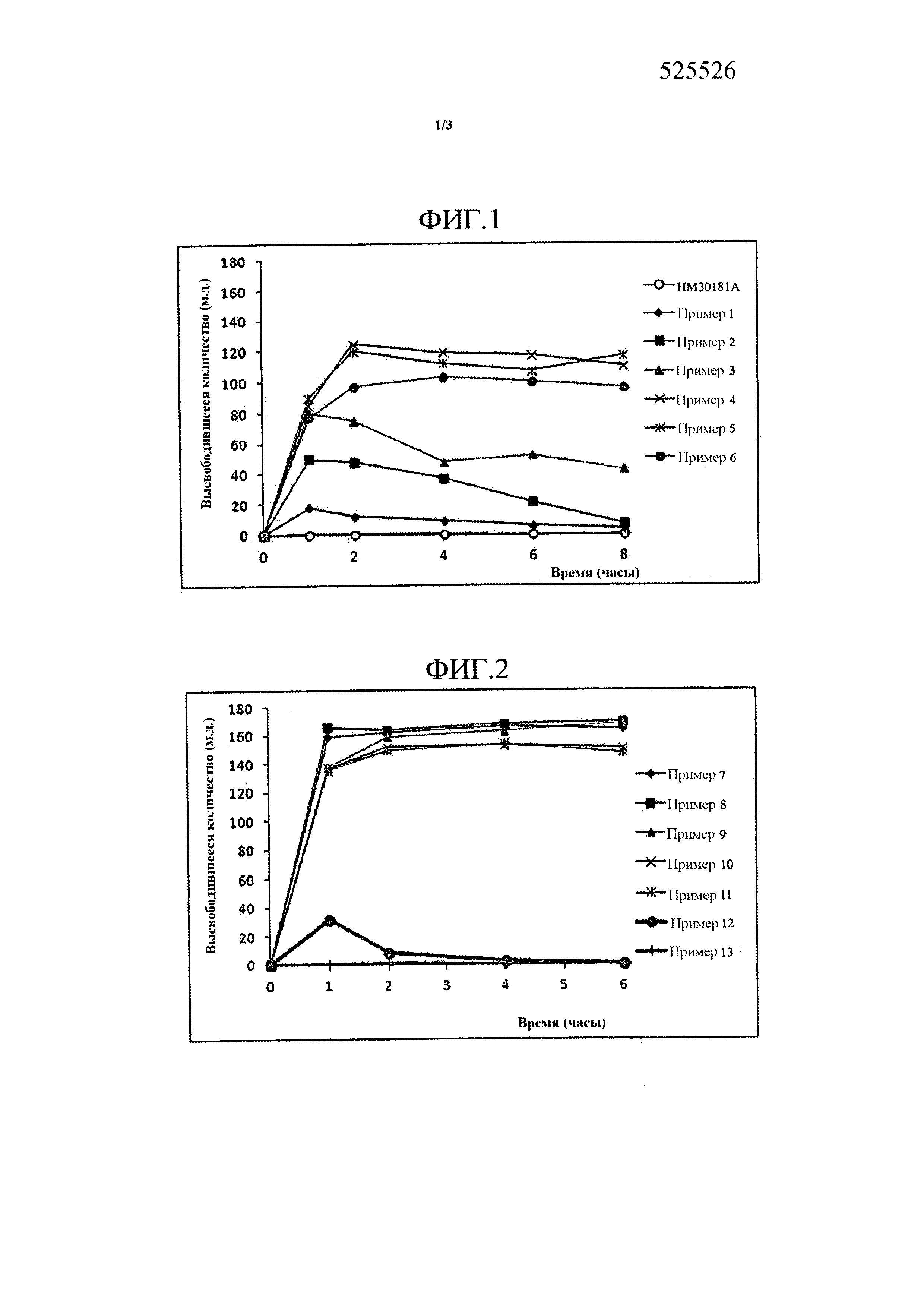
Фиг. 1 представляет собой график, демонстрирующий растворимости HM30181A, производного тетразола формулы (I) и твердых дисперсий, содержащих HM30181A и различные количества водорастворимого полимера (примеры 1-6).
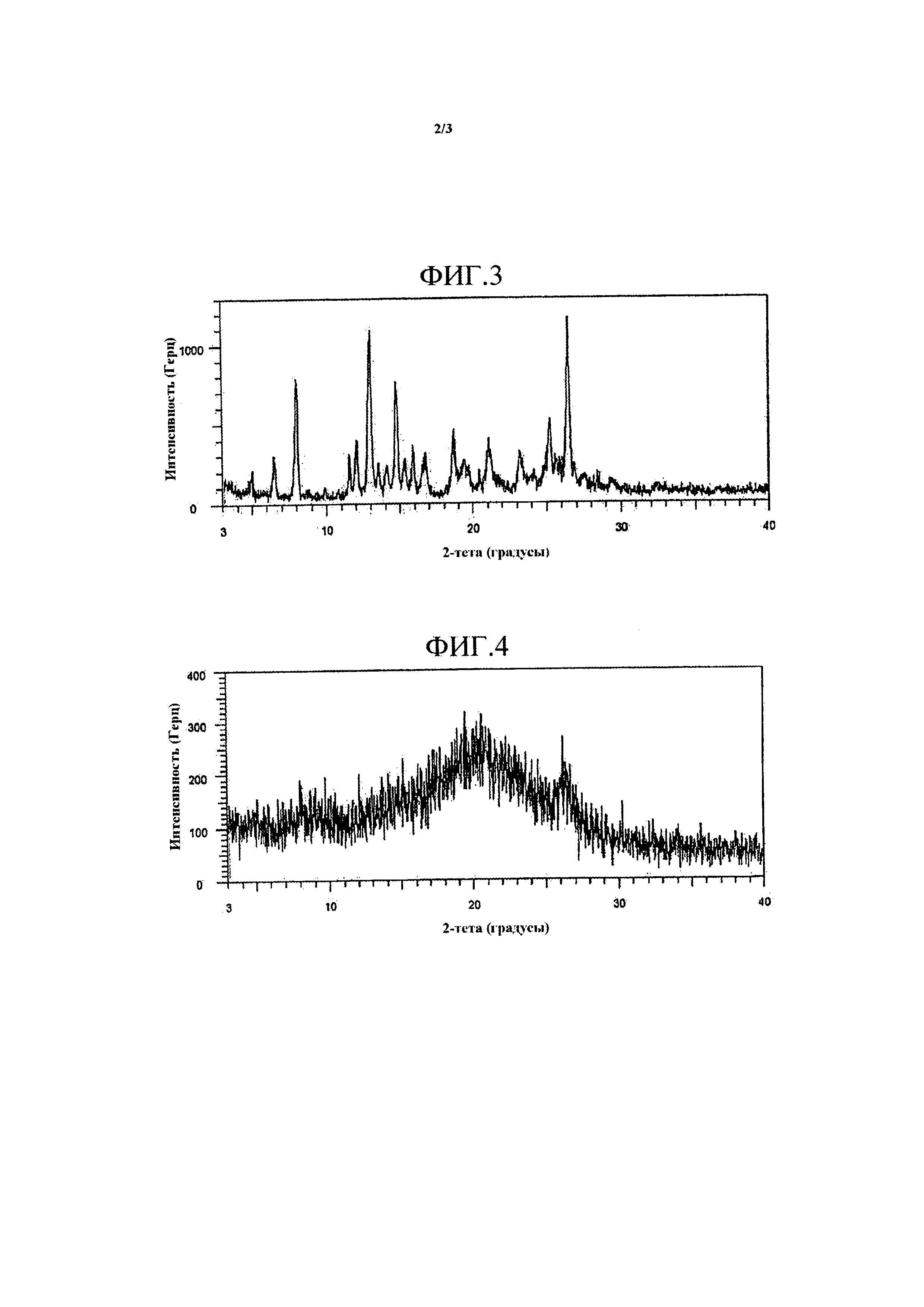
Фиг. 2 представляет собой график, демонстрирующий растворимости твердых дисперсий, содержащих HM30181A и различные виды кислоты (примеры 7-13).
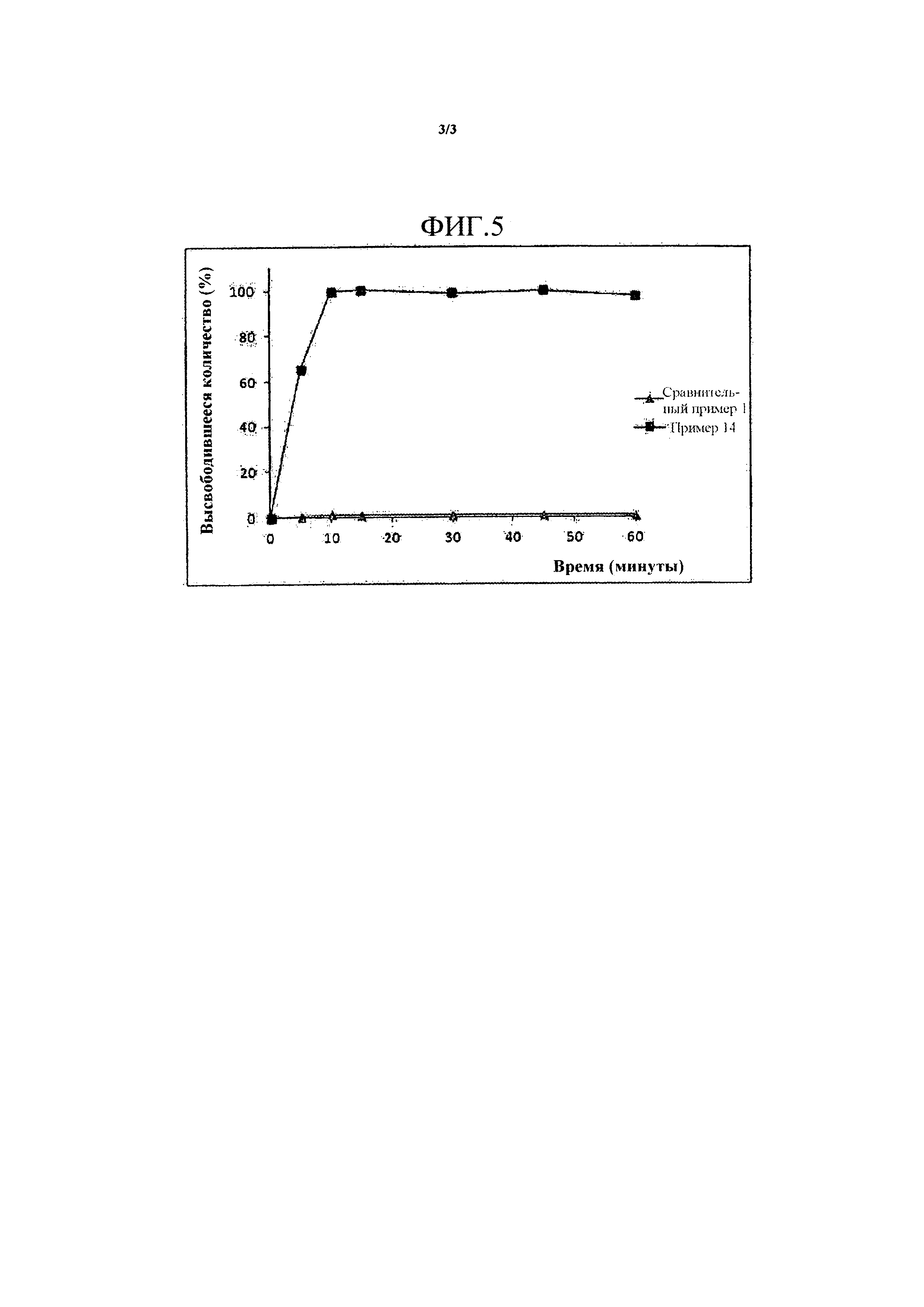
На Фиг. 3 представлены пики в картине дифракции рентгеновских лучей на порошке HM30181A.
На Фиг. 4 представлены пики в картине дифракции рентгеновских лучей на порошке твердой дисперсии примера 8.
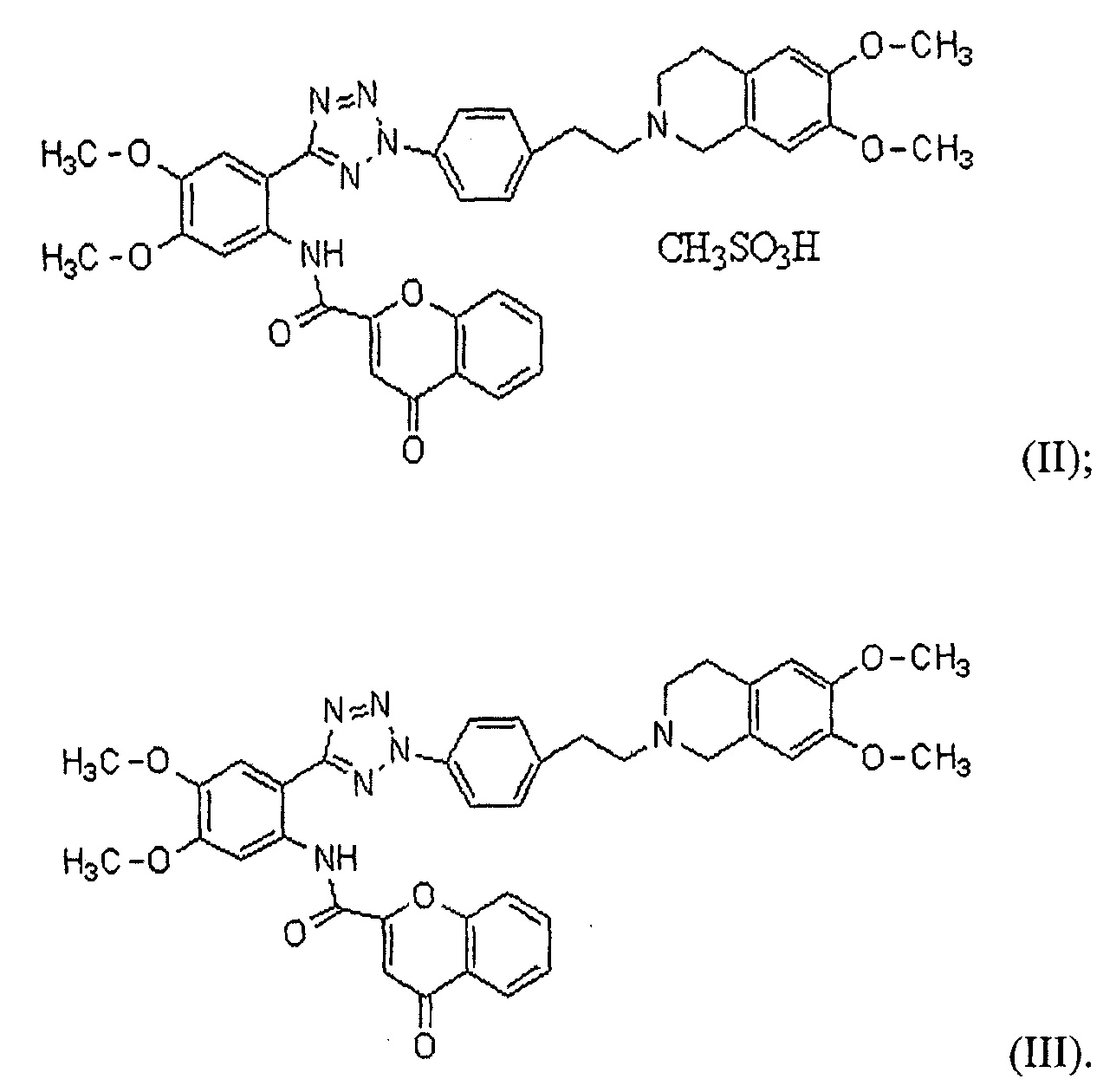
Фиг. 5 представляет собой график, демонстрирующий растворение таблетки примера 14, получаемой с использованием твердой дисперсии по изобретению, и таблетки сравнительного примера 1, получаемой простым смешиванием ингредиентов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее в настоящем описании подробно описано настоящее изобретение.
Настоящее изобретение относится к аморфной твердой дисперсии, содержащей производное тетразола формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента.
Производное тетразола формулы (I) или его фармацевтически приемлемая соль, способ получения и использования этих соединений описаны в патенте KR №10-0557093.
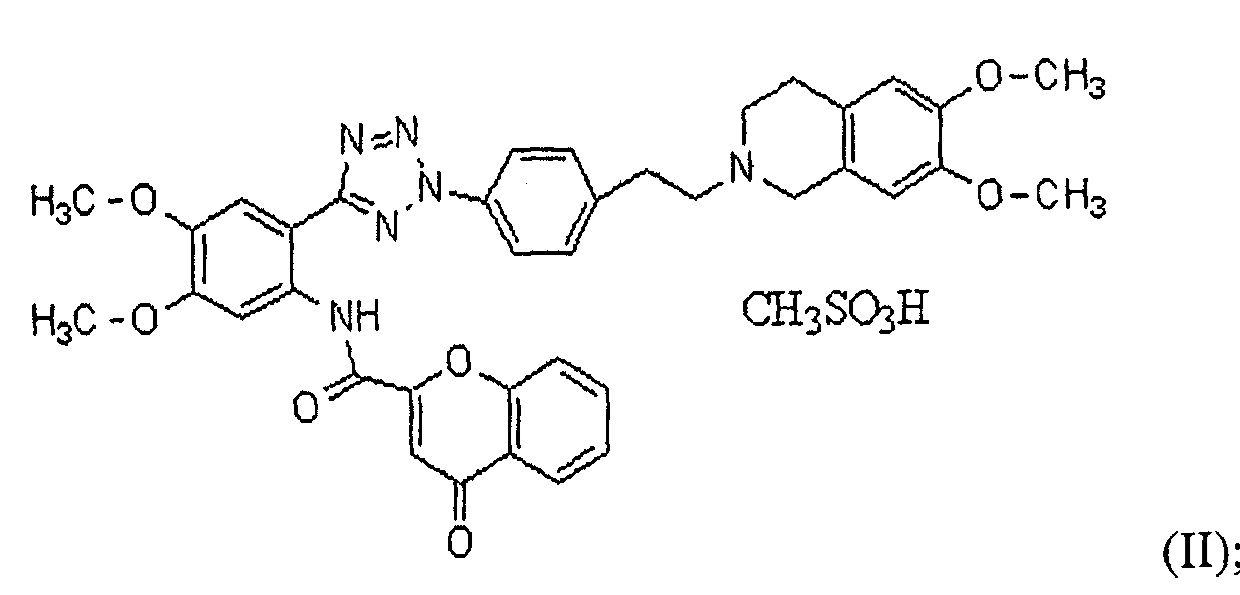
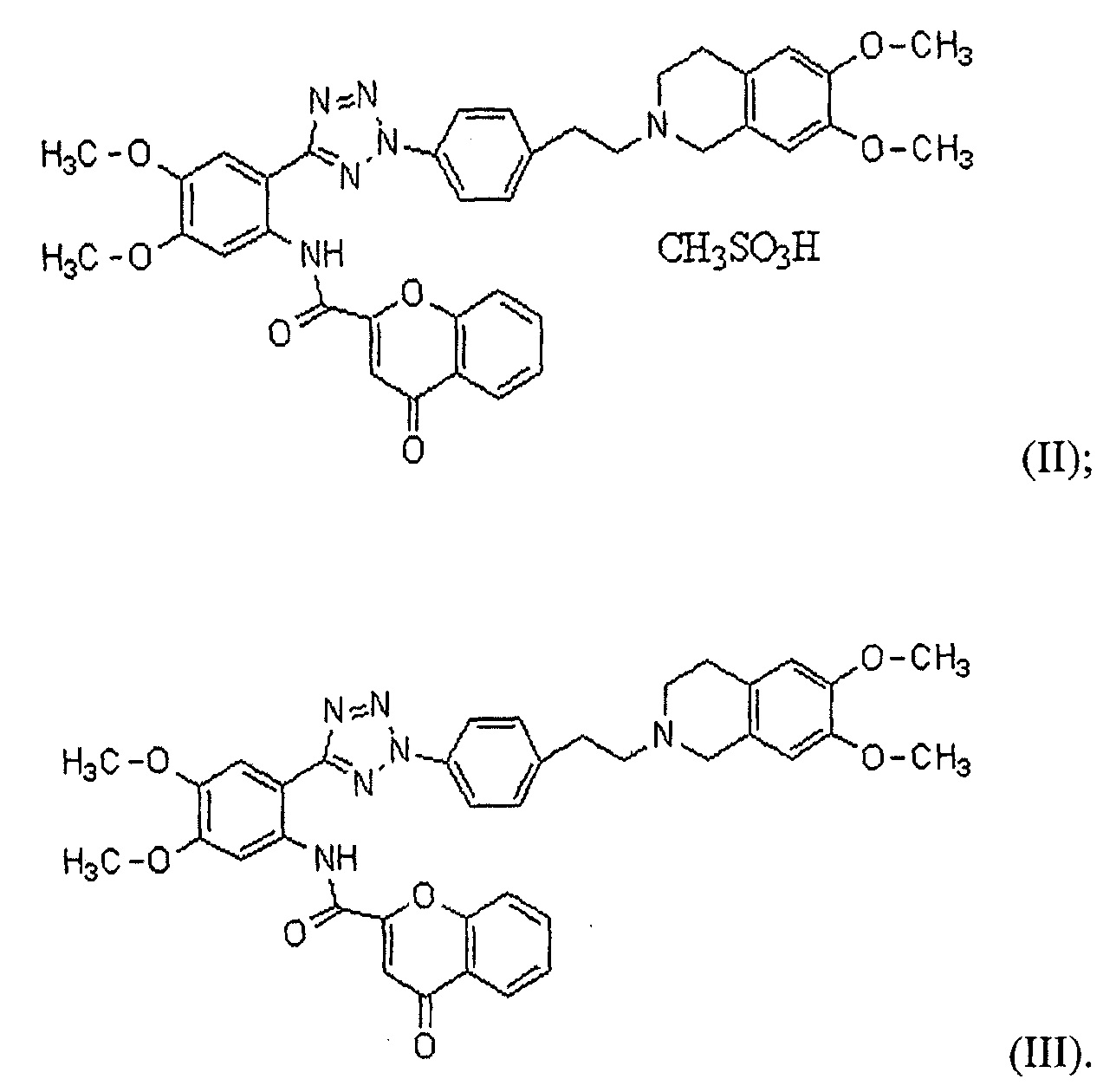
В соответствии с одним конкретным вариантом осуществления настоящего изобретения производное тетразола может представлять собой соединение формулы (II) мезилат [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1H-изохинолин-2-ил)этил]фенил}-2H-тетразол-5-ил)-4,5-диметоксифенил]амина хромон-2-карбоновой кислоты или соединение формулы (III) [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1H-изохинолин-2-ил)этил]фенил}-2H-тетразол-5-ил)-4,5-диметоксифенил]амин хромон-2-карбоновой кислоты:
Твердую дисперсию по настоящему изобретению можно получать растворением производного тетразола формулы (I) или его фармацевтически приемлемой соли в растворителе, предпочтительно органическом растворителе, с получением смешанного раствора, а затем удалением растворителя общепринятым способом, предпочтительно способом сушки распылением.
Твердая дисперсия по настоящему изобретению кроме активного ингредиента может дополнительно содержать водорастворимый полимер для увеличения растворимости производного тетразола формулы (I) или его фармацевтически приемлемой соли.
В случае, когда твердые дисперсии получают из производного тетразола или его фармацевтически приемлемой соли, водорастворимый полимер действует как водорастворимый носитель, который придает активному ингредиенту гидрофильные свойства, таким образом улучшая его растворимость, а также способствует поддержанию твердых дисперсий в аморфном состоянии. Примеры водорастворимых полимеров включают гипромеллозу, гидроксипропилцеллюлозу, поливинилпирролидон, поливинилацеталь, диэтиламиноацетат, полиэтиленгликоль или их смесь, но не ограничены ими. В одном из предпочтительных вариантов осуществления настоящего изобретения, когда твердые дисперсии получают из производного тетразола или его фармацевтически приемлемой соли, используют гипромеллозу.
Водорастворимый полимер может содержаться в количестве от 0,1 до 4 массовых частей в пересчете на 1 массовую часть активного ингредиента. В случае, когда водорастворимый полимер используют в количестве 4 массовых частей или менее в пересчете на 1 массовую часть активного ингредиента, растворимость увеличивается; однако, когда количество превышает 4 массовые части, происходит желатинизация твердых дисперсий, таким образом препятствуя высвобождению активного ингредиента.
Твердая дисперсия по настоящему изобретению кроме активного ингредиента может дополнительно содержать кислоту для увеличения растворимости производного тетразола формулы (I) или его фармацевтически приемлемой соли. Кислота может улучшать растворимость активного ингредиента в результате образования комплексных солей, регулируя значение pH области, окружающей основные ингредиенты, и т.д. Примеры кислоты, которую можно использовать для препарата твердой дисперсии по изобретению, включают неорганические кислоты, такие как фосфорная кислота, соляная кислота, серная кислота, азотная кислота, уксусная кислота, борная кислота и т.п.; и органические кислоты, такие как лимонная кислота, яблочная кислота, винная кислота, молочная кислота, тозилат, янтарная кислота, аскорбиновая кислота, глутаминовая кислота, альгиновая кислота, малеиновая кислота, адипиновая кислота и т.п. Степень улучшения растворимости может изменяться в зависимости от вида используемой кислоты. Конкретные примеры кислоты в настоящем изобретении включают фосфорную кислоту, яблочную кислоту, лимонную кислоту и винную кислоту. Кислота может содержаться в количестве от 0,1 до 3 массовых частей в пересчете на 1 массовую часть активного ингредиента.
В соответствии с одним конкретным вариантом осуществления настоящего изобретения твердая дисперсия, содержащая производное тетразола формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента, может содержать водорастворимый полимер и кислоту.
Твердую дисперсию в соответствии с настоящим изобретением можно получать растворением и диспергированием активного ингредиента в смешанном растворе метиленхлорида, этанола и дистиллированной воды. Отношение смешанного раствора метиленхлорид:этанол:дистиллированная вода предпочтительно составляет от 0,5 до 0,85 массовых частей:от 0,1 до 0,4 массовых частей:от 0,05 до 0,2 массовых частей в пересчете на 1 массовую часть общего смешанного раствора. В соответствии с одним из предпочтительных вариантов осуществления массовое отношение смешанного раствора метиленхлорид:этанол:дистиллированная вода составляет 60~80:20~40:2~10. В соответствии другим предпочтительным вариантом осуществления массовое отношение смешанного раствора метиленхлорид:этанол:дистиллированная вода составляет 65~75:25~35:4~6. Если отношение смешанного раствора выходит за пределы указанного диапазона, могут возникать трудности, такие как отделение слоев, или основные ингредиенты становятся нерастворимы в растворе.
Размер частиц твердой дисперсии по настоящему изобретению является небольшим, и, таким образом, она обладает увеличенной площадью поверхности. Средний диаметр частиц твердой дисперсии по настоящему изобретению составляет менее 150 мкм, предпочтительно менее 100 мкм, более предпочтительно менее 40 мкм.
Для получения аморфной твердой дисперсии производное тетразола по настоящему изобретению добавляют с водорастворимым полимером или кислотой, таким образом улучшая растворимость производного тетразола, и, таким образом, можно существенно улучшать скорость всасывания in vivo указанного лекарственного средства.
Настоящее изобретение относится к фармацевтической композиции, содержащей указанную твердую дисперсию. Фармацевтическая композиция по изобретению является эффективной для уменьшения MDR в злокачественных клетках по сравнению с общепринятыми фармацевтическими композициями, которые просто содержат производное тетразола формулы (I) или его фармацевтически приемлемую соль.
Кроме того, твердая дисперсия, содержащая производное тетразола формулы (I) или его фармацевтически приемлемую соль в соответствии с настоящим изобретением, может увеличивать пероральное всасывание средств против злокачественной опухоли и улучшать активность против злокачественных клеток, и, таким образом, можно использовать совместное введение средства против злокачественной опухоли, предпочтительно средства против злокачественной опухоли, скорость перорального всасывания которого является ограниченной вследствие P-гликопротеина, для увеличения его терапевтических эффектов. Таким образом, твердую дисперсию в соответствии с настоящим изобретением можно совместно вводить со средством против злокачественной опухоли пациентам, которые приобрели хеморезистентность, для устранения MDR и лечения злокачественной опухоли с множественной лекарственной устойчивостью.
Средства против злокачественной опухоли, подходящие для смешивания с твердой дисперсией в соответствии с настоящим изобретением, не являются конкретно ограниченными; однако некоторые из примеров включают средства на основе таксанов, такие как паклитаксел и доцетаксел; средства на основе алкалоидов барвинка, такие как винкристин, винбластин и винорелбин; средства на основе антрациклина, такие как дауномицин и доксорубицин; средства на основе камптотецина, такие как топотекан и иринотекан; актиномицин и этопозид, и т.д.
Фармацевтическую композицию по настоящему изобретению можно формулировать в соответствии с общепринятыми способами и можно получать в форме пероральных составов, таких как таблетки, пилюли, порошки, капсулы, сиропы, эмульсии, микроэмульсии и другие, или состава для парентеральной инъекции, например, внутримышечного, внутривенного или подкожного введения. Фармацевтическая композиция по настоящему изобретению может содержать твердую дисперсию по изобретению и любой возможный носитель и эксципиент. Если фармацевтическую композицию по настоящему изобретению получают в форме перорального состава, примеры носителей или эксципиентов включают целлюлозу, силикат кальция, кукурузный крахмал, лактозу, сахарозу, декстрозу, фосфат кальция, стеариновую кислоту, стеарат магния, стеарат кальция, желатин, тальк, поверхностно-активные вещества, суспендирующие средства, эмульгаторы, разбавители и другие. Также, если фармацевтическую композицию по настоящему изобретению получают в форме инъецируемого состава, примеры носителей включают воду, физиологический раствор, раствор глюкозы, аналоги раствора глюкозы, спирты, гликоли, простой эфир (например, полиэтиленгликоль 400), масла, жирные кислоты, сложные эфиры жирных кислот, глицериды или поверхностно-активные вещества, суспендирующие средства, эмульгаторы и другие.
Фармацевтическую композицию, содержащую твердую дисперсию по изобретению, можно формулировать известным в данной области способом и однократно вводить до или после введения средства против злокачественной опухоли, или вводить совместно с одним или несколькими средствами против злокачественной опухоли. Способ введения можно адаптировать в зависимости от различных факторов, таких как симптомы пациентов, физические свойства средства против злокачественной опухоли и т.п.
Твердую дисперсию по настоящему изобретению можно вводить пероральным или парентеральным способом введения совместно со средством против злокачественной опухоли млекопитающему, включая человека, в диапазоне от 0,1 до 100 мг/кг (массы тела) в пересчете на производное тетразола или его фармацевтически приемлемой соли таким образом, чтобы уменьшать MDR в злокачественных клетках.
Далее в настоящем описании настоящее изобретение более конкретно описано посредством следующих ниже примеров, но они предоставлены исключительно с иллюстративными целями, и настоящее изобретение не является ограниченным ими. Далее в настоящем описании термин "HM30181A", как используют в настоящем описании, относится к соединению формулы (II) мезилат [2-(2-{4-[2-(6,7-диметокси-3,4-дигидро-1H-изохинолин-2-ил)этил]фенил}-2H-тетразол-5-ил)-4,5-диметоксифенил]амина хромон-2-карбоновой кислоты, которое представляет собой пример соединения формулы (I), как описано в патенте KR №10-0557093:
Примеры 1-6: Получение твердой дисперсии с различным количеством водорастворимого полимера
В соответствии с ингредиентами, перечисленными в таблице 1, твердые дисперсии примеров 1-6 получали путем полного растворения и диспергирования HM30181A в качестве активного ингредиента; гипромеллозы P-645 в качестве водорастворимого полимера; и силиката в качестве эксципиента в смешанном растворе метиленхлорида (MC), этанола (EtOH) и дистиллированной воды (DW), а затем сушкой распылением получаемых растворов с использованием компактной распылительной сушилки B-290 (Buchi, Switzerland).
Примеры 7-13: Получение твердой дисперсии с различными видами кислоты
В соответствии с ингредиентами, перечисленными в таблице 2, твердые дисперсии примеров 7-13 получали путем полного растворения и диспергирования HM30181A в качестве активного ингредиента; фосфорной кислоты, DL-яблочной кислоты, лимонной кислоты, L(+)-винной кислоты, фумаровой кислоты или щавелевой кислоты в качестве кислоты; и гипромеллозы P-645 в качестве водорастворимого полимера в смешанном растворе MC, EtOH и DW, а затем сушкой распылением получаемых растворов с использованием распылительной сушилки.
Пример 14: Получение таблетки
В соответствии с ингредиентами, перечисленными в таблице 3, твердую дисперсию получали путем полного растворения и диспергирования HM30181A в качестве активного ингредиента; фосфорной кислоты в качестве кислоты; и гипромеллозы P-645 в качестве водорастворимого полимера в смешанном растворе MC, EtOH и DW, а затем сушкой распылением получаемого раствора с использованием распылительной сушилки.
Затем в соответствии с ингредиентами, перечисленными в таблице 4, получали таблетку примера 14 смешиванием твердой дисперсии с D-маннитом в качестве эксципиента; кросповидона в качестве дезинтегранта; легкой безводной кремниевой кислоты в качестве эксципиента; и стеарилфумарата натрия в качестве смазочного средства, а затем таблетированием получаемой смеси.
Сравнительный пример 1: Получение таблетки
В соответствии с ингредиентами, перечисленными в таблице 5, получали таблетку сравнительного примера 1 смешиванием HM30181A в качестве активного ингредиента; фосфорной кислоты в качестве кислотного солюбилизатора; гипромеллозы P-645 в качестве водорастворимого полимера; D-маннита в качестве эксципиента; кросповидона в качестве дезинтегранта; легкой безводной кремниевой кислоты в качестве эксципиента; и стеарилфумарата натрия в качестве смазочного средства, а затем таблетированием получаемой смеси.
Тестовый пример 1: Растворимости активного ингредиента в различных растворителях
Для установления наиболее подходящего растворителя для твердой дисперсии к растворителю добавляли избыточное количество HM30181A в качестве активного ингредиента, встряхивали в течение 2 часов, а затем получаемую смесь центрифугировали и анализировали ВЭЖХ для измерения растворимости. Используемые для теста на растворимость растворители представляли собой MC, метанол, EtOH, гексан, простой диэтиловый эфир, изопропиловый спирт, ацетон и DW. Результаты представлены в таблице 6.
Как представлено в таблице 6 выше, растворимости производного тетразола HM30181A являлись низкими, когда его растворяли в большинстве растворителей. Результаты указывают на то, что если при получении твердой дисперсии используют только один тип растворителя, то необходимым является значительное количество растворителя для солюбилизации активного ингредиента, что может приводить к сниженной производительности, а также к увлечению производственных затрат.
В тоже время получали комбинации двух растворителей, которые приводили к хорошим растворимостям в указанном выше тесте на растворимость, например, MC и EtOH, и наблюдали характеристики растворения HM30181A. Метанол, который также демонстрировал хорошую растворимость, исключали из теста вследствие его токсичности. Результаты представлены в таблице 7 ниже.
Как представлено в таблице выше, подтверждали, что использование смешанного раствора MC и EtOH, который добавляют совместно с DW, являлось более предпочтительным, чем использование смешанного раствора только MC и EtOH, т.к. добавление DW увеличивало солюбилизацию активного ингредиента в прозрачном растворе. Также можно сделать вывод, что предпочтительное массовое отношение для получения смешанного растворителя для твердой дисперсии составляло MC:EtOH:DW=70:30:5.
Тестовый пример 2: Растворимости твердой дисперсии в зависимости от водорастворимого полимера
Твердые дисперсии, получаемые в примерах 1-6, анализировали на растворение с использованием подходящих количеств каждого образца, которые соответствовали 150 мг HM30181A, а затем сравнивали растворимости.
Условия тестирования
- Среда растворения: дистиллированная вода, 900 мл;
- Система тестирования: вращающийся контейнер для образца, 100 об/мин;
- Температура: 37°C.
Аналитические условия
- Колонка: колонка из нержавеющей стали (внутренний диаметр приблизительно 4,6 мм и длина 15 см), заполненная октадецилсилил силикагелем для LC (диаметр 5 мкм);
- Подвижная фаза: ацетонитрил:буфер pH 2,5 (56:44);
- Температура колонки: 40ºC;
- Скорость потока: 1,0 мл/мин;
- Объем впрыска: 10 мкл;
*буфер pH 2,5: 7,0 г перхлората натрия (NaClO4) и 1,7 г дигидрофосфата калия (KH2PO4) растворяли в 900 мл дистиллированной воды, добавляли фосфорной кислоты для доведения pH до 2,5, а затем добавляли дистиллированной воды, чтобы получать общий объем 1 л.
Растворимости твердых дисперсий, получаемых в примерах 1-6, представлены на Фиг. 1. Как представлено на Фиг. 1, порошок твердых дисперсий преимущественно не растворялся в растворителе, однако, когда к растворителю добавляли гипромеллозу (P-645), например водорастворимый полимер, растворимость твердой дисперсии улучшалась. Также наблюдали, что растворимость твердой дисперсии, как правило, увеличивается при увеличении количества водорастворимого полимера. В частности, растворимость увеличивалась до точки, когда количество водорастворимого полимера являлось в четыре раза больше активного ингредиента, однако количество, превышающее в четыре раза активный ингредиент, вызывало желатинизацию твердых дисперсий, таким образом препятствуя выделению активного ингредиента.
На основании указанных выше результатов можно сделать вывод, что наиболее подходящее количество водорастворимого полимера для твердой дисперсии по настоящему изобретению находится в диапазоне от 0,1 до 4 массовых частей в пересчете на 1 массовую часть активного ингредиента.
Тестовый пример 3: Растворимости твердой дисперсии в зависимости от кислоты
Твердые дисперсии, получаемые в примерах 7-13, анализировали на растворение с использованием подходящих количеств каждого образца, которые соответствуют 150 мг HM30181A, в тех же условиях, как описано в тестовом примере 2. Результаты представлены на Фиг. 2.
Как представлено на Фиг. 2, в случае, когда твердые дисперсии получали с использованием фосфорной кислоты (примеры 7 и 8) и DL-яблочной кислоты (пример 9) в качестве кислоты, твердые дисперсии, которые соответствуют 150 мг HM30181A, полностью растворялись в 900 мл DW, и растворенное состояние сохранялось более 24 часов, что, таким образом, свидетельствует от том, что твердые дисперсии обладают хорошими растворимостями (на Фиг. 2 представлено изменение времени только до 6 часов). Также в случае, когда дисперсии получали с использованием лимонной кислоты (пример 10) и L(+)-винной кислоты (пример 11), твердые дисперсии, которые соответствуют приблизительно 130 мг HM30181A, растворялись в 900 мл DW, что, таким образом, свидетельствует о том, что твердые дисперсии обладают хорошими растворимостями.
Тестовый пример 4: Анализ кристаллической формы активного ингредиента и содержащих его твердых дисперсий
Пики в картине дифракции рентгеновских лучей на порошке активного ингредиента, например, HM30181A, и твердой дисперсии примера 8 определяли с использованием M18XHF-SRA (Macsciences Co., LTD, Japan) в условиях рентгеновского излучения Cu, 40 кВ и 100 мА и скорости сканирования 6°/мин.
Результаты пиков в картине дифракции рентгеновских лучей на порошке HM30181A и твердой дисперсии примера 8 представлены на Фиг. 3 и 4, соответственно. Как представлено на Фиг. 3, активный ингредиент H30181A M имел пики при два-тета (градус) 4,911, 6,474, 7,948, 9,827, 10,712, 11,522, 12,007, 12,936, 13,498, 14,063, 14,744, 15,282, 15,878, 16,686, 18,66, 19,388, 19,698, 21,065, 23,22, 25,222, 26,485, 26,86 и 28,405. Однако, как представлено на Фиг. 4, твердая дисперсия, содержащая активный ингредиент, становилась аморфной в результате процесса сушки.
Тестовый пример 5: Анализ размера частиц твердых дисперсий
Средний размер частиц твердых дисперсий примеров 1-13 измеряли посредством лазерной дифракции с использованием HELOS/BR (Sypatec, Germany) с линзами R1 в условиях 4,5 бар.
Результаты представлены в таблице 8 ниже.
Как представлено в таблице 8 выше, средний размер частиц твердых дисперсий примеров 1-13 составлял 30 мкм или менее.
Тестовый пример 6: Анализ свойств растворения таблеток
Таблетки, получаемые в сравнительном примере 1 и примере 14, анализировали на растворение и сравнивали.
Условия тестирования
- Среда растворения: дистиллированная вода, 900 мл;
- Система тестирования: лопастная мешалка, 100 об/мин;
- Температура: 37ºC.
Аналитические условия
Те же условия, как в тестовом примере 2.
Результаты представлены на Фиг. 5. Как представлено на Фиг. 5, таблетка примера 14, получаемая с использованием твердой дисперсии, полностью растворялась в течение 15 минут; однако, таблетка сравнительного примера 1, которую получали простым смешиванием с ингредиентами, со временем совсем не растворялась. Этот результат свидетельствует о том, что растворимость производного тетразола по настоящему изобретению невозможно улучшать, если таблетку получали простым смешиванием производного тетразола с эксципиентами, наоборот, растворимость можно улучшать с использованием твердой дисперсии.
Реферат
Настоящее изобретение относится к аморфной твердой дисперсии, содержащей производное тетразола формулы (II) или (III) или его фармацевтически приемлемую соль в качестве активного ингредиента и водорастворимый полимер, где водорастворимый полимер представляет собой гипромеллозу, которая содержится в количестве от 0,1 до 4 массовых частей в пересчете на 1 массовую часть активного ингредиента. Изобретение также относится к фармацевтическим композициям для ингибирования Р-гликопротеина, содержащим аморфную твёрдую дисперсию. Технический результат: получена аморфная твердая дисперсия, содержащая производное тетразола формулы (II) или (III), обладающая улучшенной растворимостью и скоростью всасывания, которую можно эффективно использовать для уменьшения множественной лекарственной устойчивости (MDR) в злокачественных клетках. 3 н. и 7 з.п. ф-лы, 5 ил., 8 табл., 21 пр.
Формула
Документы, цитированные в отчёте о поиске
Соединения, способ их получения и фармацевтическая композиция на их основе
Твердый состав с улучшенными растворимостью и стабильностью и способ его получения

Комментарии