Улучшенное выявление коротких гомополимерных повторов - RU2730622C2
Код документа: RU2730622C2
Чертежи


Описание
[001] Настоящая заявка относится к выявлению изменений в числе нуклеотидов в коротких гомополимерных повторах нуклеиновой кислоты, в частности в коротких гомополимерных микросателлитах, например, с целью диагностики микросателлитной нестабильности (MSI) и/или дефекта репарации ошибочно спаренных оснований (MMR) в опухолях. Соответственно, предусмотрены способы выявления изменений в числе нуклеотидов, присутствующих в последовательностях коротких гомополимерных нуклеотидных повторов, а также наборы и картриджи для автоматизированного выявления указанных изменений.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[002] Репарация ошибочно спаренных оснований (MMR) ДНК является эволюционно консервативной многофакторной системой распознавания и репарации неправильных вставок или делеций («вставок/делеций») оснований в геноме, которые могут возникать в ходе репликации или рекомбинации или в ходе репарации некоторых форм повреждения ДНК. В соответствии с вышесказанным имеется основание полагать, что нарушенная MMR коррелирует с геномной нестабильностью и, таким образом, также вовлечена в развитие рака.
[003] Действительно, дефект MMR был описан для нескольких типов рака, в том числе для лейкемии, рака яичников, поджелудочной железы или желудка, и является доказанной причиной синдрома Линча – предрасположенности к раку, который ответственен за 2–5% всех случаев эндометриальных (EM) или колоректальных (CRC) опухолей (Jiricny, 2006). Важно отметить, что в отношении опухолей с дефектной MMR наблюдается различный прогноз и терапевтический эффект при следовании стандартным способам лечения рака (Ng and Schrag, 2010). Например, опухоли с дефектной MMR у пациентов с CRC, по-видимому, не реагируют на химиотерапию, основанную на 5-фторурациле (Fischer et al., 2007), которая является оптимальной химиотерапией для CRC. Кроме того, опухоли с дефектной MMR также, как правило, устойчивы к цисплатину и карбоплатину, которые часто применяются в лечении рака EM (Hewish et al., 2010). Наконец, также наблюдалось, что эти опухоли относительно быстро развивают устойчивость к видам нацеленной терапии, вероятно, из-за своей повышенной частоты мутирования, и, таким образом, также более легко приобретают вторичные мутации, которые потенциально могут влиять на другие механизмы защиты от рака.
[004] Вследствие того, что было показано, что дефект MMR влияет на ответ пациентов на методы лечения рака, его эффективное выявление потенциально может иметь важные последствия в отношении эффективного ведения пациентов и их выживаемости. Из-за сложности мутаций, которые влияют на путь MMR, в клинической практике более общеупотребительно тестировать дефект MMR путем скрининга в отношении ошибок при репликации ДНК, являющихся его прямым следствием, а не выполнять детальный скрининг выбранных мутаций в генах MMR, таких как MLH1, MSH2, MSH6 или PMS2 (Peltomaki, 1997). Эти ошибки при репликации ДНК нагляднее всего проявляются в изменениях варьирования длины последовательностей коротких тандемных повторов, называемых микросателлитами, явление, которое называют микросателлитной нестабильностью или MSI.
[005] Микросателлиты представляют собой участки из обычно повторяющихся 5-50 раз прилегающих (т. е. повторяющихся в тандеме) ДНК-мотивов из одного-пяти нуклеотидов. Они широко распространены по всему геному млекопитающих и наиболее часто расположены в его некодирующих частях. По этой причине многие микросателлиты в биологическом отношении являются молчащими, что позволяет в них накапливаться вредным мутациям на протяжении поколений, что может применяться для ДНК-фингерпринтинга или других идентификационных целей. Тем не менее, клональная утрата (делеция) или приобретение (вставка) одного или более микросателлитных повторяющихся звеньев во множестве микросателлитов в отдельной ткани индивида, но не в окружающей ткани представляют собой отличительный признак дефектной репликации и дают веское основание предполагать о нарушенной MMR и предрасположенности к развитию рака (Pinol et al., 2005).
[006] В настоящее время золотой стандарт анализа MSI предусматривает основанное на ПЦР тестирование в ДНК от пациентов с раком длины по меньшей мере 5 микросателлитных маркеров, в том числе 2 моно- или гомополимеров (BAT25, BAT26) длиной 25 и 26 нуклеотидов и 3 динуклеотидных повторов (D2S123, D5S346, D17S250) (Boland et al, 1998). Панель из этих 5 маркеров MSI впервые была предложена на научном семинаре в Национальном институте рака в г. Бетесда, Мэриленд, и поэтому в настоящее время широко известна как панель Бетесда. Образец, тестируемый с помощью панели Бетесда, определяется как имеющий высокую частоту MSI или фенотип «MSI-H», если 30% или более маркеров (т. е. по меньшей мере 2 из 5 в панели маркеров) были определены как нестабильные. Если один маркер из пяти (или <30% маркеров опухолей) оценивают как MSI-положительный, то образец определяется как имеющий низкую частоту MSI или «MSI-L». Наконец, если не обнаруживают измененных маркеров, то образец считается MSI-стабильным или «MSS» (Boland et al, 1998).
[007] Несмотря на то, что панель Бетесда является существующим стандартом тестирования MSI, она, как правило, демонстрирует низкую чувствительность, особенно в отношении типов рака, отличных от колоректального рака, для которого она первоначально была разработана (Boland et al, 1998). Поэтому широко тестировались альтернативные маркеры, в том числе упомянутые, например, в Murphy et al, 2006 и Garcia-Alfonso 2012, а также WO2013153130.
[008] Другим недостатком известных в настоящее время подходов является их уровень сложности, необходимость в специализированных приборах, выходящих за рамки стандартных лабораторных термоциклеров, а также их ограниченные технические возможности в отношении автоматизации. В существующих в настоящее время методиках выявления MSI применяется один из следующих принципов: (i) применение флуоресцентно-меченых праймеров для выявления маркеров панели Бетесда с последующим капиллярным электрофорезом; (ii) анализ кривой плавления с высоким разрешением 5 маркеров панели Бетесда с использованием dsDNA-интеркалирующего красителя; (iii) масс-спектрометрическое выявление аллелей с различной длиной и (iv) секвенирование нового поколения больших участков ДНК (например, экзома) с последующим подсчетом количества мутаций.
[009] Например, (i) стратегия скрининга по Бетесда, основанная на первоначальной ПЦР, требует интерпретации наблюдателем-специалистом, что препятствует эффективной и непосредственной автоматизации. Далее, (ii) анализ кривой плавления с высоким разрешением с использованием dsDNA-интеркалирующих красителей, применяя также длинные маркеры панели Бетесда, в принципе, хотя и пригодный к адаптации к стандартным ПЦР-термоциклерам, испытывает недостаток в очень ограниченных возможностях мультиплексирования для скрининга нескольких разных маркеров MSI за один цикл, поскольку температура плавления для каждого маркерного ампликона должна в достаточной мере отличаться, чтобы не получать перекрывающиеся сигналы. Кроме того, поскольку эта стратегия основана на образовании гетеродуплексов между аллелями с нормальной и мутантной длиной, она также является менее чувствительной по сравнению с другими альтернативами. Далее, (iii) способ, основанный на масс-спектрометрии (Zhao et al, 2014), в принципе, также поддается автоматизации, но требует специализированного приборного оснащения и высококвалифицированного персонала для интерпретации данных. Наконец, (iv) выявление статуса MSI с помощью секвенирования нового поколения (NGS) и подсчета количества наблюдаемых мутаций, несомненно, имеет преимущество в наблюдении за очень большим количеством положений в геноме или экзоме в отличие от только селективных маркеров с высокой чувствительностью в отношении MSI. Тем не менее, хотя этот способ также, в принципе, по меньшей мере частично автоматизирован, в настоящее время он является очень дорогостоящим, требует специального прибора для NGS и остается времязатратным и сложным из-за получения большого количества данных, которые по-прежнему должен анализировать специалист.
[0010] Таким образом, все из существующих в настоящее время методик определения статуса MSI обладают определенными недостатками, связанными как с ограниченными возможностями выявления, затратами и временем для выполнения, так и с потребностью в дополнительном специализированном оборудовании и интерпретации результатов высококвалифицированным специалистом. Настоящее изобретение решает вышеперечисленные проблемы за счет обеспечения высокочувствительного, подходящего для мультиплексирования и полностью автоматизируемого способа выявления изменений в числе нуклеотидов в коротких гомополимерных микросателлитах, который можно применять с помощью любого стандартного прибора для термоциклирования в рамках количественной ПЦР. Это и другие преимущества настоящего изобретения приводятся в нижеизложенном.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0011] Настоящее изобретение определено в независимых пунктах прилагаемой формулы изобретения. Предпочтительные варианты осуществления определены в зависимых пунктах формулы изобретения. В частности, настоящее изобретение относится к способу выявления изменений в числе нуклеотидов, присутствующих в последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, при этом способ включает стадии:
- получения ампликонов путем амплификации последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов;
- нагревания полученных ампликонов в присутствии по меньшей мере одного генерирующего сигнал олигонуклеотидного зонда, содержащего последовательность, способную гибридизироваться с целевой последовательностью гомополимерных повторов, и выявления изменений в интенсивности сигнала, генерируемого указанным зондом, в зависимости от температуры с получением по меньшей мере одной кривой плавления; и
- установления числа нуклеотидов, присутствующих в целевой последовательности гомополимерных повторов, на основании по меньшей мере одной кривой плавления.
[0012] В предпочтительном варианте осуществления в способе по настоящему изобретению применяются флуоресцентно меченые зонды для выявления вариаций длины участков коротких гомополимерных повторов с помощью стандартного прибора для термоциклирования в рамках количественной ПЦР без необходимости в любом дополнительном оборудовании для анализа после ПЦР. Таким образом, в особенно преимущественном варианте осуществления генерирующий сигнал реагент представляет собой по меньшей мере один меченый (т. е. генерирующий сигнал) олигонуклеотидный зонд, предпочтительно представляющий собой зонд типа «молекулярный маяк», который содержит последовательность, комплементарную последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов, и способную гибридизироваться с указанной целевой последовательностью гомополимерных повторов и ее специфической фланкирующей последовательностью. Более предпочтительно последовательность, способная гибридизироваться с целевой последовательностью гомополимерных повторов, предусматривает последовательность, идентичную или точно комплементарную мутантной форме указанной целевой последовательности гомополимерных повторов, при этом указанная мутантная форма предусматривает делецию по меньшей мере одного гомонуклеотида в указанной целевой последовательности гомополимерных повторов по сравнению с ее формой дикого типа.
[0013] В дополнительном аспекте настоящего изобретения предусмотрен набор, предпочтительно в форме картриджа, для выявления изменений в числе нуклеотидов, присутствующих в целевой последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, при этом указанный набор содержит по меньшей мере один, предпочтительно множество олигонуклеотидных зондов, представляющих собой «молекулярные маяки», при этом каждый содержит последовательность, способную гибридизироваться с последовательностью, содержащей отличающуюся целевую последовательность гомополимерных повторов, длина которой составляет 15 п. о. или меньше; при этом указанный набор также предпочтительно содержит корректирующую полимеразу. Предпочтительно каждый из указанных зондов типа «молекулярный маяк» содержит последовательность, способную гибридизироваться с отличающимися целевыми последовательностями гомополимерных нуклеотидных повторов, и при этом являющуюся идентичной или комплементарной мутантным формам последовательностей с по меньшей мере одной гомонуклеотидной делецией в каждой из указанных отличающихся целевых последовательностей гомополимерных повторов.
[0014] Наконец, в настоящем изобретении также предусмотрены пути применения предусмотренных в данном документе способов, наборов и/или картриджей для выявления микросателлитной нестабильности (MSI), в частности в образце, взятом у пациента с раком.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0015] Для более полного понимания сущности настоящего изобретения делается ссылка на следующее подробное описание, рассматриваемое в сочетании с сопровождающими графическими материалами, на которых:
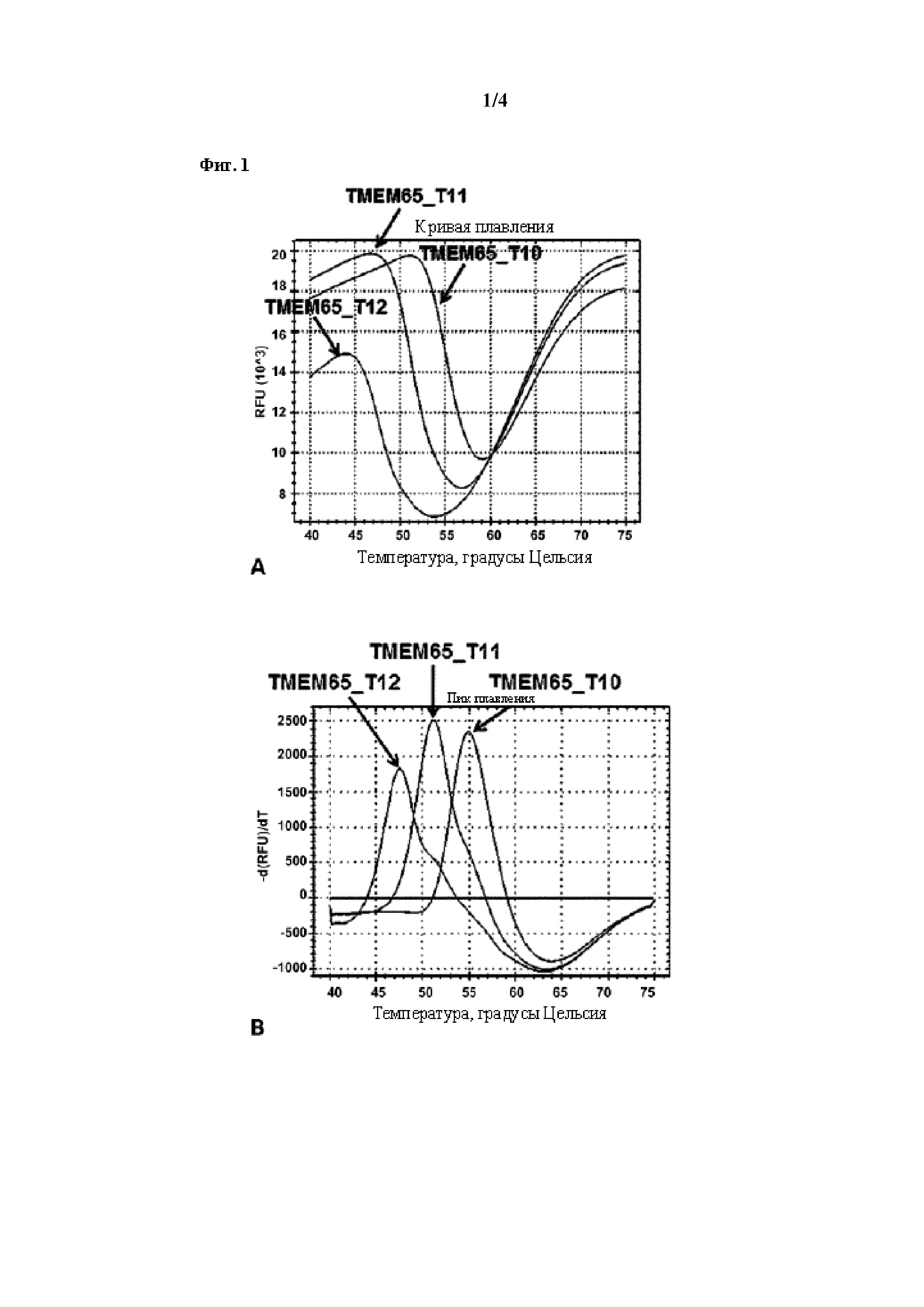
на фигуре 1 показаны кривые плавления (панель A) и пики плавления (панель B), характеризующие кинетику гибридизации в зависимости от температуры для TMEM65-специфического зонда типа «молекулярный маяк», гибридизирующегося с тремя целевыми последовательностями, имеющими разное число гомонуклеотидов в последовательности гомополимерных повторов TMEM65;
на фигуре 2 показаны пики плавления, характеризующие статус микросателлитной стабильности TMEM65 в 10 образцах дикого типа (WT) и образцах с микросателлитной стабильностью (MSS) (черные кривые, длина повтора TMEM65 составляет 11) и в 10 образцах с микросателлитной нестабильностью (MSI-High [MSI-H]) (серые кривые, длина повтора TMEM65 составляет 10);
на фигуре 3 показаны пики плавления зонда TMEM65 для двух случайным образом отобранных образцов MSS, MSS 1 и MSS 2;
на фигуре 4 показаны пики плавления зонда TMEM65 для трех случайным образом отобранных образцов MSI-H (MSI-H 1-3), каждый из которых проявил в отношении зонда TMEM65 пик плавления, полученный для MSI-стабильного образца MSS 1.
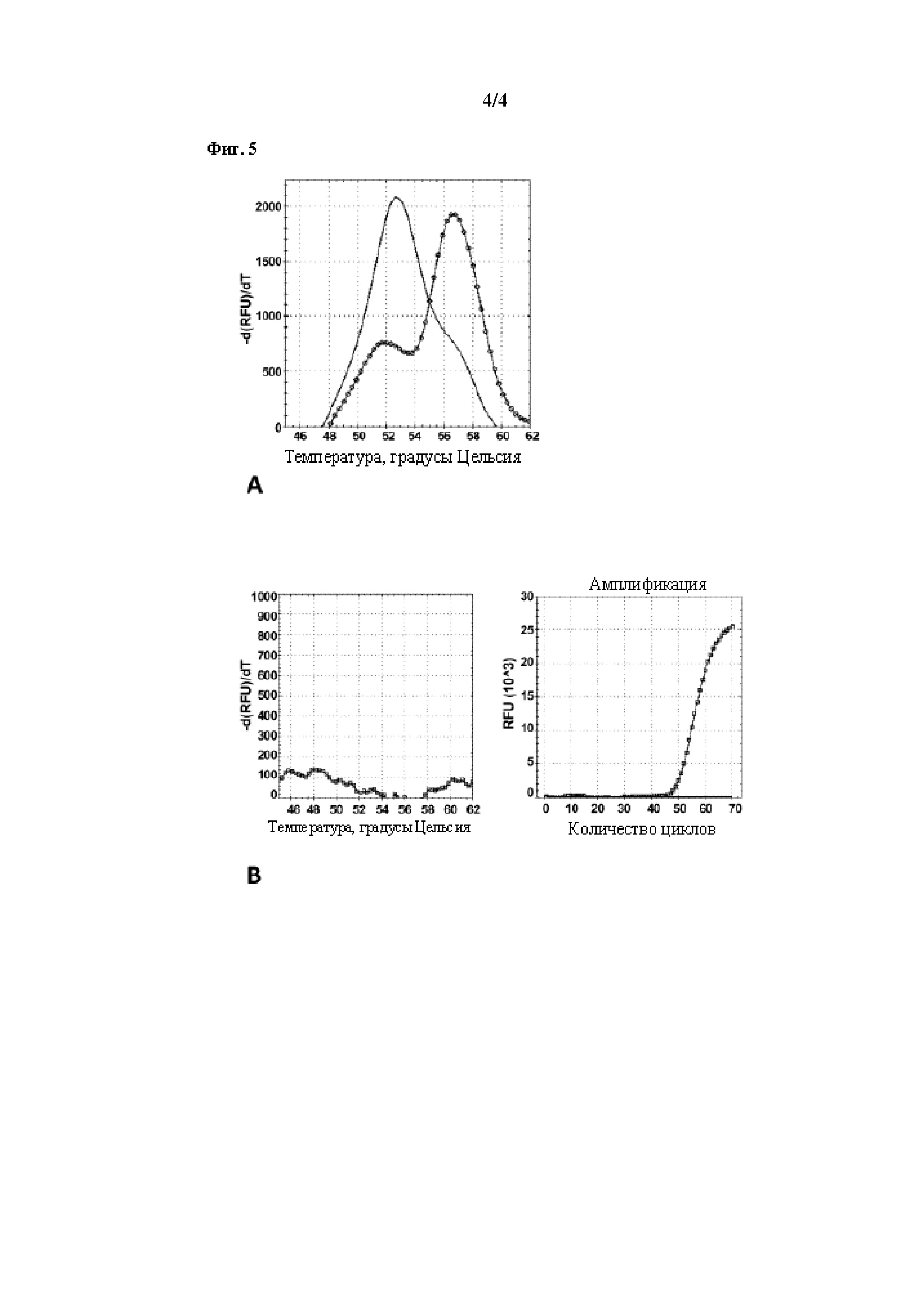
на фигуре 5 показаны пики плавления для специфических в отношении маркера ABAT зондов типа «молекулярный маяк», которые содержат (панель A) «стебель», устойчивый к экзонуклеазной активности полимеразы Q5, либо (панель B) «стебель», который разрушается под действием полимеразы Q5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0016] Настоящее изобретение относится к новым способам, наборам и картриджам, а также путям их применения для выявления даже очень небольших изменений в числе нуклеотидов (например, +/- 1 нук.), присутствующих в коротких, т. е. по меньшей мере на 10 нуклеотидов короче, чем маркер BAT25 панели Бетесда, последовательностях гомополимерных нуклеотидных повторов. Наряду с этим в настоящем изобретении предусмотрены способы, наборы и картриджи, а также пути их применения для выявления нестабильности коротких (<15 п. о., предпочтительно <12 п. о.) гомополимерных микросателлитных маркеров, например, описанных в WO2013153130.
[0017] В частности, настоящее изобретение относится к способу выявления изменений в числе нуклеотидов, присутствующих в последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, предпочтительно 12 п. о., при этом способ включает стадии:
- получения ампликонов путем амплификации последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов;
- нагревания полученных ампликонов в присутствии по меньшей мере одного генерирующего сигнал олигонуклеотидного зонда, содержащего последовательность, способную гибридизироваться с целевой последовательностью гомополимерных повторов, и выявления изменений в интенсивности сигнала, генерируемого указанным зондом, в зависимости от температуры с получением по меньшей мере одной кривой плавления; и
- установления числа нуклеотидов, присутствующих в целевой последовательности гомополимерных повторов, на основании по меньшей мере одной кривой плавления.
[0018] Предусмотренный в данном документе способ обладает преимуществом, заключающимся в пригодности к полной автоматизации и адаптированию к любому стандартному пробору для термоциклирования в рамках количественной ПЦР, что позволяет осуществлять его обычному лабораторному персоналу без необходимости специализированного обучения. В дополнение к вышесказанному, способ является высокочувствительным, подходящим для мультиплексирования, может обеспечивать оценку относительных количеств выявляемых последовательностей гомополимерных нуклеотидных повторов и их вариантов.
[0019] Существующие в настоящее время способы выявления MSI страдают от следующих недостатков:
(a) для определения длины повторов в них требуются дополнительное специализированное оборудование для выполнения анализа после ПЦР и/или этот анализ обычно требует интерпретации высококвалифицированным специалистом; или
(b) в случае анализа кривой плавления с высоким разрешением с использованием dsDNA-интеркалирующих красителей недостаток заключается в очень ограниченной возможности мультиплексирования, чтобы избежать перекрывания сигналов плавления от разных ампликонов, и кроме того, в нем не обеспечивается возможность количественной оценки нестабильных (мутантной формы) последовательностей относительно стабильных (дикого типа) последовательностей.
[0020] В настоящей заявке эти недостатки преодолеваются посредством выполнения анализа кривых плавления с использованием высокочувствительных к мутантным формам флуоресцентно меченых зондов, при котором каждый маркер можно выявлять в различном флуоресцентом канале. В особенно предпочтительном из-за своей чувствительности варианте осуществления последовательность зонда, способная гибридизироваться с целевой последовательностью гомополимерных повторов, предусматривает последовательность, идентичную или комплементарную мутантной форме последовательности с целевой последовательностью гомополимерных повторов, при этом указанная мутантная форма предусматривает делецию по меньшей мере одного гомонуклеотида в указанной целевой последовательности гомополимерных повторов по сравнению с формой дикого типа (т. е. предполагаемой).
[0021] В соответствии с этим в предпочтительном варианте осуществления предусмотрен способ выявления изменений в числе нуклеотидов, присутствующих в последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, при этом способ включает стадии:
- получения ампликонов путем амплификации последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов и ее специфические фланкирующие последовательности;
- выявления сигнала, генерируемого зондом, специфически гибридизирующегося с последовательностью гомополимерных повторов и ее фланкирующими последовательностями; и
- установления числа нуклеотидов, присутствующих в целевой последовательности гомополимерных повторов;
при этом указанный способ характеризуется тем, что зонд содержит последовательность, идентичную или комплементарную мутантной форме последовательности с указанной целевой последовательностью гомополимерных повторов, где указанная мутантная форма последовательности предусматривает делецию по меньшей мере одного гомонуклеотида в указанной целевой последовательности гомополимерных повторов по сравнению с предполагаемой формой дикого типа целевой последовательности гомополимерных повторов.
[0022] Используемый в данном документе термин «нуклеиновая кислота» и его эквивалент «полинуклеотид», как используется в данном документе, обозначает полимер из рибонуклеозидов или дезоксириборибонуклеозидов, содержащий фосфодиэфирные связи между нуклеотидными субъединицами. Нуклеиновые кислоты включают без ограничения ДНК и РНК, в том числе, например, геномную ДНК, митохондриальную или meDNA, cDNA, mRNA, rRNA, tRNA, hnRNA, microRNA, lncRNA и их различные модифицированные варианты. Нуклеиновые кислоты, как правило, можно получить из природных источников, таких как биологические образцы, полученные от различных типов организмов. С другой стороны, нуклеиновые кислоты можно также синтезировать, получать рекомбинированием или другим любым из известных разработанных человеком способом (например, ПЦР).
[0023] Естественно, в предпочтительном варианте осуществления амплификацию предпочтительно выполняют с помощью полимеразной цепной реакции или ПЦР с использованием средства для выполнения ПЦР, такого как термоциклер. Преимущественно в целях лучшей автоматизации ПЦР предпочтительно выполняют с использованием средства для выполнения qPCR, которое обеспечивает простой контроль сигналов, генерируемых реагентом, генерирующим сигнал.
[0024] Термином «количественная ПЦР» или просто «qPCR» в данном документе определяется лабораторная методика, основанная на полимеразной цепной реакции (ПЦР), которую применяют для амплификации и одновременного выявления или количественной оценки целевой молекулы ДНК. В отличие от стандартной ПЦР, где продукт реакции выявляют по ее завершении, т. е. после окончания термоциклирования, ключевым признаком qPCR является то, что ДНК-продукт выявляют в ходе термоциклирования по мере протекания реакции «в реальном времени»; поэтому альтернативным названием qPCR является «ПЦР в реальном времени». В настоящее время существует много разных типов qPCR. Например, если начинать со стадии обратной транскрипции (RT), то qPCR можно применять для количественной оценки числа информационных РНК, и в таком случае ее называют qPCR с обратной транскриптазой или RT-qPCR. Используемые в данном документе термины «количественная ПЦР» или просто «qPCR» будут применяться с предпочтением, нежели термины «ПЦР в реальном времени» или «RT-PCR», во избежание путаницы с «ПЦР с обратной транскрипцией», которую также часто сокращают как RT-PCR. В большинстве анализов qPCR применяют один из двух наиболее распространенных способов выявления продукта амплификации в реальном времени: (a) интеркалирование неспецифических флуоресцентных красителей в любую двухнитевую ДНК или (2) применение специфичных в отношении последовательности ДНК-зондов, состоящих из олигонуклеотидов, которые мечены флуоресцентным репортером, который обеспечивает выявление только после гибридизации зонда с комплементарной ему целевой последовательностью. Флуоресцентные сигналы, генерируемые в ходе термоциклирования, выявляют с помощью соответствующей оптической системы выявления и отслеживают с момента, когда они проходят фоновый пороговый уровень, до тех пор, пока реакция не выходит на плато. Число копий целевых последовательностей можно оценивать с помощью стратегий относительного либо абсолютного количественного определения, обычно путем осуществления анализа формы полученной кривой амплификации (стратегия стандартной кривой) или путем определения момента, когда сигнал превышает некоторое пороговое значение (часто называемое значением Ct, но иногда также значением Cp или значением Cq). При относительном количественном определении уровни целевой нуклеиновой кислоты, оцениваемые в конкретном образце с использованием Ct или анализа стандартной кривой, выражают относительно значений, полученных для той же мишени в другом эталонном образце, например, необработанном контрольном образце. И наоборот, при абсолютном количественном определении сигнал qPCR сопоставляют с исходным числом копий с использованием стандартной кривой, или его также можно вычислять в соответствии с более недавним способом цифровой ПЦР. На сегодняшнее время первая стратегия по-прежнему является более преобладающей и основывается на оценке количества целевой ДНК путем сравнения полученных значений с предварительно построенной стандартной кривой. Эти и другие стратегии количественного определения qPCR широко известны из уровня техники, и характерное для них вычисление может различаться в большей или меньшей степени в зависимости от конкретного применения и системы qPCR.
[0025] Используемый в данном документе термин «средства для выполнения количественной ПЦР» следует понимать как минимальную необходимую совокупность реагентов и элементов для выполнения qPCR. Обычно они включают любые реагенты, обеспечивающие выявляемое при ПЦР в реальном времени термоциклирование матрицы нуклеиновой кислоты, полученной из источника нуклеиновой кислоты. Такие реагенты включают, но в зависимости от типа qPCR, без ограничения предназначенную для ПЦР полимеразу, по меньшей мере один набор праймеров, выявляемый краситель или зонд, dNTP, буфер для ПЦР и т. д. Кроме того, «средства для выполнения количественной ПЦР» обычно также будут включать любую стандартную известную из уровня техники минимальную сборочную единицу из частей, которая обычно без ограничения включает следующее: (1) подходящий отсек (далее называемый «отсеком для термоциклирования в рамках qPCR»), где происходит выявляемое в реальном времени термоциклирование. Такие отсеки могут, например, быть образованы камерой, подходящей для амплификации нуклеиновых кислот, т. е. изготовленной из соответствующего материала, и обеспечения достаточной регуляции внутренней температуры, а также содержащей по меньшей мере одну перегородку, позволяющую выявлять в реальном времени сигналы, генерируемые в ходе такой амплификации, например, перегородку, проницаемую для света. Кроме того, (2) средства для варьирования температуры в этой камере или другом отсеке широко известны из различных существующих установок для термоциклирования. Затем, (3) средства для выявления сигналов, генерируемых в ходе термоциклирования в рамках qPCR, такие как оптический детектор, соединенный с компьютером и т. д. Вкратце, такая минимальная сборочная единица обычно будет включать любую известную из уровня техники систему или системы, способные к инициации и поддержанию реакции термоциклирования в отсеке для термоциклирования в рамках qPCR, настраивая и регулируя температуру для обеспечения стабильных условий термоциклирования в нем, и т. п.; кроме того, она также будет включать любое соответствующее устройство или устройства для выявления, средства для обработки данных (например, компьютер, альтернативно соединенный с базой данных) и системы вывода, позволяющие считывать и контролировать термоциклирование в ходе реакции qPCR в реальном времени (с использованием компьютерного экрана, на котором отображается ход реакции в соответствующем графическом пользовательском интерфейсе); а также любые пакеты программного обеспечения, подходящие для эксплуатации установки и/или отображения, и возможно также для помощи в интерепретации полученных результатов.
[0026] В принципе, в возможных вариантах осуществления любой специфичный в отношении мишени олигонуклеотидный зонд, подходящий для выполнения анализа кривой плавления, можно применять в способе по настоящему изобретению. Предпочтительные известные зонды могут включать пару, состоящую из флуорофора и гасителя, и также могут преимущественно образовывать вторичные структуры, такие как петли или шпильки.
[0027] В предпочтительном варианте осуществления по меньшей мере один меченый олигонуклеотидный зонд представляет собой олигонуклеотидный зонд типа «молекулярный маяк». Зонды типа «молекулярный маяк» или «молекулярные маяки» представляют собой молекулы в форме шпильки с внутренне погашенным флуофором, чья флуоресценция восстанавливается, когда они связываются с целевой последовательностью нуклеиновой кислоты. По этой причине «молекулярные маяки» не разрушаются под действием полимеразы и могут применяться в исследовании их кинетики гибридизации со своей мишенью посредством обращения к кривой плавления. Длина типичного зонда типа «молекулярный маяк» составляет приблизительно 25 нуклеотидов, но он может быть и длиннее. Обычно по меньшей мере 15 средних нуклеотидов комплементарны их мишени в виде нуклеиновой кислоты, в то время как пять нуклеотидов на каждом конце комплементарны друг другу, что позволяет «маяку» собираться в петлевую или шпилечную структуру. «Молекулярный маяк», который не гибридизирован со своей мишенью, можно разделить на 4 структурные части: (1) петлю, представляющую собой участок из 18–30 п. о., который является комплементарным целевой последовательности и гибридизируется с ней; (2) «стебель», который образован 5-7 концевыми нуклеотидами с обоих концов петли, комплементарно связанными друг с другом; (3) флуофор, ковалентно присоединенный к 5'-концу молекулярного маяка; и (4) гаситель, ковалентно присоединенный к 3'-концу «молекулярного маяка». Такая структура обеспечивает то, что когда «маяк» не гибридизирован со своей мишенью и свернут в шпилечную структуру, гаситель гасит испускаемую красителем флуоресценцию таким образом, что сигнал не генерируется. Но когда происходит гибридизация, образуется дуплекс между мишенью в виде нуклеиновой кислоты и петлей «молекулярного маяка», что разрушает шпилечную структуру, удаляет гаситель из красителя, и в конечном итоге приводит к генерированию флуоресцентного сигнала.
[0028] В предпочтительном варианте осуществления вышеуказанного варианта осуществления олигонуклеотидный зонд типа «молекулярный маяк» содержит последовательность, идентичную или комплементарную мутантной форме последовательности гомополимерных повторов, предусматривающей делецию по меньшей мере одного гомонуклеотида в целевой последовательности гомополимерных повторов. Такое строение «молекулярного маяка» позволяет специфически с высокой чувствительностью выявлять выбранные маркеры MSI, где происходят ошибки проскальзывания полимеразы, оставаясь в то же время достаточно чувствительным к формам маркеров дикого типа (т. е. предполагаемым), имеющим повторы по меньшей мере на один гомонуклеотид длиннее. Следует отметить, что под термином «целевая последовательность гомополимерных нуклеотидных повторов» понимают последовательность гомополимерных повторов дикого типа или эталонную последовательность гомополимерных повторов, предполагаемую в условиях отсутствия MSI. Наоборот, под «мутантной формой последовательности гомополимерных нуклеотидных повторов» понимают последовательность гомополимерных нуклеотидных повторов, предусматривающую вставку или делецию по меньшей мере одного гомонуклеотида в последовательности гомополимерных повторов.
[0029] Благодаря приобретенной таким образом специфичности данного зонда типа «молекулярный маяк» в отношении одного маркера гомополимерных повторов и его нестабильных (мутантной формы) вариантов также возможно разработать мультиплексный анализ, при котором по меньшей мере два зонда типа «молекулярный маяк» применяют в одной реакционной пробирке или отсеке.
[0030] Таким образом, в особенно преимущественном варианте осуществления предусмотрен способ, где применяют по меньшей мере второй олигонуклеотидный зонд типа «молекулярный маяк», меченый другим способом, чем первый олигонуклеотидный зонд типа «молекулярный маяк», где указанный второй олигонуклеотидный зонд типа «молекулярный маяк» содержит последовательность, способную гибридизироваться со второй целевой последовательностью гомополимерных нуклеотидных повторов, отличающейся от первой целевой последовательности гомополимерных нуклеотидных повторов.
[0031] Предпочтительно применяют особенно специфические зонды типа «молекулярный маяк». Таким образом, в преимущественном варианте осуществления предусмотрен способ, где вторая целевая последовательность гомополимерных нуклеотидных повторов содержит последовательность, идентичную или комплементарную мутантной последовательности, предусматривающей делецию по меньшей мере одного гомонуклеотида в указанной второй целевой последовательности гомополимерных повторов.
[0032] Известно, что в ходе амплификации участков гомополимерных повторов происходит проскальзывание полимеразы. Это приводит к ошибкам в копировании исходного числа повторяющихся нуклеотидов, что обуславливает накопление искусственных делеций или вставок в амплифицированном ПЦР-продукте. Следовательно, в другом предпочтительном варианте осуществления способа по настоящему изобретению стадию получения ампликонов выполняют с помощью ПЦР, предусматривающей корректирующую полимеразу, т. е. полимеразу, обладающую 3’-5’ экзонуклеазной активностью. Многие такие предназначенные для ПЦР полимеразы известны и доступны на коммерческой основе. Примеры включают без ограничения такие полимеразы, как Q5, Pfx, Pfu, Ex Taq и т. д.
[0033] В дополнительном усовершенствовании вышеуказанного варианта осуществления с целью защиты олигонуклеотидных зондов от потенциальной угрозы, которую может представлять 3’-5’ экзонуклеазная активность корректирующей полимеразы, преимущественной является структурная модификация маяков такими способами, чтобы они не смогли расщепляться. Таким образом, в особенно преимущественном варианте осуществления способа по настоящему изобретению, особенно с точки зрения стабильности анализа, по меньшей мере один генерирующий сигнал меченый олигонуклеотидный зонд имеет структурный признак или модификацию, обеспечивающие защиту указанного зонда от 3’-5’ экзонуклеазной активности полимеразы, при этом указанные структурный признак или модификация предпочтительно выбраны из:
- инвертированного dT на 3’-конце зонда;
- по меньшей мере одной фосфотиоатной связи, расположенной перед любым из последних трех нуклеотидов на 3’-конце зонда.
[0034] Наблюдалось, что в зависимости от корректирующей полимеразы, некоторые корректирующие полимеразы не расщепляют определенные «молекулярные маяки», чей «стебель» состоит из определенных последовательностей. Это неожиданное наблюдение, вероятно, является результатом того, что «стебли» «молекулярных маяков» в зависимости от их последовательностей имеют разные 3D-структуры. Следовательно, можно предположить, что определенные корректирующие полимеразы не способны воздействовать на «молекулярные маяки», чья «стеблевая» структура несовместима с каталитическим центром корректирующей полимеразы. Независимо от механизма авторы настоящего изобретения отметили, что обеспечение некоторых типов «стеблей» «молекулярных маяков» может сделать их полностью неуязвимыми к 3’-5’ экзонуклеазной активности определенных корректирующих полимераз. В соответствии с вышесказанным в альтернативном варианте осуществления предусмотрен способ, где специфический в отношении последовательности зонд представляет собой олигонуклеотидный зонд типа «молекулярный маяк», и где обеспечивающие защиту структурный признак или модификация представляют собой устойчивый к 3’-5’ экзонуклеазной активности «стебель». Такие «стебли» можно легко перенести в «молекулярный маяк», представляющий интерес, с помощью любой методики клонирования или рекомбинации нуклеиновых кислот, известной из уровня техники.
[0035] Одним из основных преимуществ способа по настоящему изобретению является его непосредственная автоматизация и адаптация, особенно к известным стандартным системам qPCR. Следовательно, в особенно предпочтительном варианте осуществления предусмотрен способ по настоящему изобретению, где стадии:
- получения ампликонов путем амплификации последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов;
- нагревания полученных ампликонов в присутствии генерирующего сигнал олигонуклеотидного зонда и выявления изменений в интенсивности указанного сигнала в зависимости от температуры с получением по меньшей мере одной кривой плавления; и
- установления числа нуклеотидов, присутствующих в целевой последовательности гомополимерных повторов, на основании по меньшей мере одной кривой плавления,
выполняют в автоматизированной системе. Особенно подходящей системой для такой автоматизации является платформа Biocartis Idylla, которая дополнительно обеспечивает автоматизацию подготовки образца.
[0036] Преимущественно может быть предусмотрен способ в соответствии с описанным выше вариантом осуществления настоящего изобретения, где указанному способу предшествует любая из следующих стадий:
- обеспечение источника нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, при этом предпочтительно указанный источник представляет собой биологический образец;
- обеспечение высвобождения и/или выделение нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, из источника нуклеиновой кислоты;
- обеспечение указанной высвобожденной и/или очищенной нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, для стадии получения ампликонов;
где по меньшей мере стадии:
- обеспечения высвобождения и/или выделения нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, из источника нуклеиновой кислоты;
- обеспечения указанной высвобожденной и/или очищенной нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, для стадии получения ампликонов;
также выполняют в автоматизированной системе.
[0037] В дополнительном особенно предпочтительном и требующем минимального количества манипуляций и технической подготовки варианте осуществления в соответствии с вышеизложенным вариантом осуществления может быть предусмотрен способ, где по меньшей мере стадии:
- обеспечения высвобождения и/или выделения нуклеиновой кислоты, вероятно содержащей целевую последовательность гомополимерных повторов, из источника нуклеиновой кислоты;
- обеспечения указанной высвобожденной и/или очищенной нуклеиновой кислоты, вероятно содержащий целевую последовательность гомополимерных повторов, для стадии получения ампликонов;
- получения ампликонов путем амплификации последовательности нуклеиновой кислоты, содержащей целевую последовательность гомополимерных повторов; и
- нагревания полученных ампликонов в присутствии генерирующего сигнал олигонуклеотидного зонда и выявления изменений в интенсивности указанного сигнала в зависимости от температуры с получением по меньшей мере одной кривой плавления;
выполняют в картридже, выполненном с возможностью взаимодействия с указанной автоматизированной системой.
[0038] Под используемым в данном документе термином «картридж» следует понимать замкнутую сборочную единицу из камер и/или каналов, которая сформирована в виде единого объекта, который можно переносить или передвигать как таковой, прикрепленный к внутренней или внешней части более крупного прибора, подходящего для приема такого картриджа или соединения с ним. Некоторые части, содержащиеся в картридже, могут быть прочно соединены, в то время как другие могут быть гибко соединены и могут перемещаться относительно других компонентов картриджа. Аналогично, под используемым в данном документе термином «струйный картридж» следует понимать картридж, включающий по меньшей мере одну камеру или канал, подходящий для обработки, подготовки, выпуска или осуществления анализа текучей среды, предпочтительно жидкости. Пример такого картриджа представлен в WO2007004103. Предпочтительно струйный картридж может представлять собой микроструйный картридж. В контексте струйных картриджей термины «выше» и «ниже» могут быть определены как относящиеся к направлению, в котором текучие среды протекают в таком картридже. А именно, отрезок струйного пути в картридже, из которого текучая среда течет во второй отрезок в том же картридже, следует интерпретировать как установленный выше в отношении последнего. Аналогично, отрезок, к которому текучая среда прибывает позже, расположен ниже относительно отрезка, который пройден указанной текучей средой ранее.
[0039] В целом, используемые в данном документе термины «струйный» или иногда «микроструйный» относятся к системам и конструкциям, имеющим отношение к характеру, контролю и манипулированию в отношении текучих сред, которые геометрически ограничены в маленьком, обычно менее миллиметра, масштабе в по меньшей мере одном или двух измерениях (например, ширина и высота или канал). Такие малообъемные текучие среды перемещают, смешивают, разделяют или иным образом подготавливают в микромасштабе, требующем малого размера и низкого потребления энергии. Микроструйные системы включают структуры, такие как микропневматические системы (источники давления, насосы для перекачки жидкостей, микроклапаны и т. д.) и микроструйные структуры для манипуляций в отношении микро-, нано- и пиколитровых объемов (микроструйные каналы и т. д.). Иллюстративные струйные системы были описаны в EP1896180, EP1904234 и EP2419705 и, соответственно, могут применяться в определенных вариантах осуществления представленного в данном документе изобретения.
[0040] В особенно желательном варианте осуществления в соответствии с вышеперечисленными вариантами осуществления для упрощения и облегчения интерпретации результатов способа в соответствии с настоящим изобретением также выполняется анализ кривой плавления автоматизированным способом посредством компьютерного программного обеспечения. Такое программное обеспечение может быть настроено для распознавания характерного положения определенных пиков плавления (или точек перегиба кривой), характеризующих гибридизацию конкретного зонда с конкретной мишенью и полученных посредством нанесения на график отрицательной первой производной кривой плавления, полученной для указанной пары зонда и мишени. Следовательно, в другом предпочтительном варианте осуществления предусмотрен способ по настоящему изобретению, где стадию установления числа нуклеотидов, присутствующих в целевой последовательности гомополимерных повторов, на основании по меньшей мере одной кривой плавления выполняют путем оценки положения или относительного положения по меньшей мере одного пика исходя из первой производной указанной кривой плавления, и наиболее предпочтительно выполняют полностью автоматизированным способом.
[0041] В дополнительном аспекте настоящего изобретения также предусмотрены наборы для выполнения способа в соответствии с настоящим изобретением. В частности, в настоящем изобретении предусмотрен набор для выявления изменений в числе нуклеотидов, присутствующих в целевой последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, при этом указанный набор содержит по меньшей мере один олигонуклеотидный зонд типа «молекулярный маяк», предпочтительно множество олигонуклеотидных зондов типа «молекулярный маяк», при этом каждый молекулярный маяк содержит последовательность, способную гибридизироваться с последовательностью, содержащей отличающуюся целевую последовательность гомополимерных повторов, длина которой составляет 15 п. о. или меньше; и предпочтительно указанный набор также содержит корректирующую полимеразу. Предпочтительно каждый из указанного множества зондов типа «молекулярный маяк» содержит последовательность, способную гибридизироваться с конкретной целевой последовательностью гомополимерных нуклеотидных повторов (предпочтительно отличающейся от последовательности гомополимерных нуклеотидных повторов, на которую нацеливаются другие «молекулярные маяки»), и при этом являющуюся идентичной или комплементарной мутированной форме указанной конкретной целевой последовательности повторов таким образом, что в указанной мутированной форме отсутствует по меньшей мере один гомонуклеотид (т. е. это является делецией) в указанной целевой последовательности гомополимерных повторов по сравнению с формой дикого типа.
[0042] В предпочтительном варианте осуществления предусмотрен набор в форме картриджа. Таким образом, преимущественно в настоящем изобретении предусмотрен набор, где указанные по меньшей мере один, предпочтительно множество олигонуклеотидных зондов типа «молекулярный маяк», и предпочтительно также корректирующая полимераза предусмотрены в картридже, выполненном с возможностью взаимодействия с автоматизированной системой. Как описано выше, подходящий пример картриджа и автоматизированной системы, выполненной с возможностью взаимодействия с ним, представляют собой платформу Biocartis Idylla. Дополнительные детали в отношении этой и аналогично применимых в настоящем изобретении систем можно найти в WO2007004103, EP1896180, EP1904234 и EP2419705. Как можно понять из документов, цитируемых в данном документе, предпочтительные картриджи содержат не только средства для выполнения ПЦР, но также могут быть сконструированы с возможностью непосредственного приема источника нуклеиновой кислоты или образца, высвобождения нуклеиновых кислот из указанного источника нуклеиновой кислоты и предоставления (например, посредством перекачивания) высвобожденной таким образом нуклеиновой кислоты для последующего основанного на ПЦР анализа.
[0043] Под используемым в данном документе термином «источник нуклеиновой кислоты» следует понимать любое вещество, будь то жидкое либо твердое, которое содержит или предположительно содержит нуклеиновую кислоту. Источник нуклеиновой кислоты может представлять собой, например, полученный искусственным способом раствор, содержащий синтетическую или рекомбинантную нуклеиновую кислоту, такой как, среди многих других, раствор, содержащий продукт лигирования, маркер для электрофореза (так называемую «лестницу»), набор праймеров и т. д. Однако чаще всего источник нуклеиновой кислоты будет представлять собой биологический образец, полученный из организма или клеток, образующих его или выделенных из него, предпочтительно клинический образец, полученный от пациента.
[0044] Используемый в данном документе термин «биологический образец» или просто «образец» предназначен для включения ряда биологических источников, которые содержат нуклеиновую кислоту и/или клеточный материал, независимо от того, был ли он свежеполучен из организма (т. е. свежий образец ткани) или законсервирован посредством любого способа, известного из уровня техники (например, образец FFPE). Примеры биологических образцов включают культуры клеток, такие как клетки млекопитающих, а также клетки эукариотических организмов, биологические жидкости, осадки биологических жидкостей, образцы, полученные промыванием, образцы тонкоигольной аспирационной биопсии, образцы биопсий, образцы тканей, раковые клетки, другие типы клеток, полученные от пациента, клетки из тканевой культуры или выращенные in vitro клетки от индивида, подлежащего тестированию в отношении заболевания или инфекции и/или их лечению, или образцы для криминалистического исследования. Неограничивающие примеры образцов биологической жидкости включают цельную кровь, костный мозг, цереброспинальную жидкость (CSF), перитонеальную жидкость, плевральную жидкость, лимфатическую жидкость, сыворотку крови, плазму крови, мочу, хилус, стул, эякулят, мокроту, аспират грудного соска, слюну, образцы мазков, жидкие образцы, полученные смывом или промыванием, и/или образцы, полученные с помощью щетки.
[0045] После помещения биологического образца в системы или в ходе осуществления способов по настоящему изобретению, его обычно приводят в контакт с композицией для получения лизата, в который выделяется нуклеиновая кислота. Используемое в данном документе «приведение в контакт» означает сведение вместе, подвергание воздействию, инкубирование или смешивание образца и композиции. «Выделение» обозначает высвобождение, получение и/или устранение перекрестного связывания. Для высвобождения нуклеиновой кислоты из образца от композиции может требоваться наличие протеазной активности и буферизация pH. Для выделения от композиции может требоваться наличие вероятной осаждающей активности в отношении компонентов, отличных от нуклеиновой кислоты, присутствующих в исследуемом образце, и удаление/растворение фиксатора. Для выделения могут требоваться такие условия, как нагревание или высокоинтенсивный фокусированный ультразвук (HIFU). В одном варианте осуществления в соответствии с сущностью настоящего изобретения биологический образец вводят в картридж, совместимый с автоматизированной системой, такой как диагностический анализатор, где происходят стадии подготовки образца, включающие приведение в контакт с различными растворами и выделение нуклеиновых кислот.
[0046] Кроме того, под термином «средства для высвобождения или очистки нуклеиновой кислоты из биологического образца» следует понимать любое множество химических реагентов и/или физических элементов, известных из уровня техники, которые, как известно, применяются для высвобождения нуклеиновых кислот из клеток или других структур в биологическом образце, и, в случае очистки, достаточного отделения указанных нуклеиновых кислот от нежелательных остатков образца в приемлемо чистой форме (где термин «приемлемо» зависит от дальнейшей цели применения таких очищенных нуклеиновых кислот), обычно в водном растворе. Химические реагенты, подходящие для такой цели, включают, например, любые известные из уровня техники детергенты и/или буферы, содержащие детергенты, хаотропные средства, ингибиторы нуклеазы и т. д., которые используются для разрушения и/или разжижения тканей или клеток, и, таким образом, обеспечивают выделение нуклеиновых кислот, содержащихся в них, в раствор. Аналогично, физические элементы, которые, как известно из уровня техники, применяются в различных способах подготовки образца с целью высвобождения/очистки нуклеиновой кислоты, включают, например, кремнеземные твердые носители, такие как смолы в центрифужных колонках, кремнеземные мембраны, гранулы и т. д.; дополнительные механические устройства для разрушения или установки, генерирующие энергию для разрушения, такие как ультразвуковые аппараты и т. д.
[0047] В соответствии с вышесказанным преимущественно в настоящем изобретении также предусмотрен картридж для автоматизированного выявления изменений в числе нуклеотидов, присутствующих в последовательности гомополимерных нуклеотидных повторов, длина которой составляет 15 п. о. или меньше, при этом картридж содержит:
- отсек для образца для получения биологического образца;
- средства для высвобождения или очистки нуклеиновой кислоты из биологического образца, полученного в отсеке для образца, при этом указанные средства способны сообщаться по текучей среде с указанным отсеком для образца;
- отсек для ПЦР, расположенный ниже отсека для образца и средств для высвобождения или очистки нуклеиновой кислоты и выполненный с возможностью получения по меньшей мере части высвобожденной или очищенной нуклеиновой кислоты или по меньшей мере части библиотеки нуклеиновых кислот, полученной в отсеке для библиотеки, при этом указанный отсек для ПЦР-термоциклирования дополнительно подходит для амплификации нуклеиновых кислот и обеспечивает возможность выявления сигналов, генерируемых в ходе или после такой амплификации;
при этом картридж характеризуется тем, что он дополнительно содержит по меньшей мере один, предпочтительно множество олигонуклеотидных зондов типа «молекулярный маяк», описанных выше, и корректирующую полимеразу, предпочтительно в отсеке для ПЦР.
[0048] В предпочтительном варианте осуществления могут быть предусмотрены олигонуклеотидные зонды типа «молекулярный маяк» и/или корректирующая полимераза в указанном картридже в формате нанесения, что способствует увеличенному сроку хранения такого картриджа в соответствии с настоящим изобретением.
[0049] Наконец, объектом настоящего изобретения также является применение способов, наборов и картриджей в соответствии с настоящим изобретением для выявления микросателлитной нестабильности (MSI), предпочтительно в образце, полученном от пациента, у которого диагностирован рак или который предположительно страдает им.
ПРИМЕРЫ
1. Кривая плавления «молекулярного маяка» в отношении маркера MSI TMEM65
[0050] Способность предпочтительного варианта осуществления представленного в данном документе способа выявлять даже очень небольшие изменения длиной в 1 нуклеотид в последовательности гомополимерных нуклеотидных повторов будет продемонстрирована в данном документе с применением маркера TMEM65 человека, расположенного в хр.8:125325217 и содержащего гомополимерный повтор из 11 остатков аденина (A). Последовательность гомополимерных повторов (выделена жирным шрифтом и подчеркнута) дикого типа (WT) и ее специфическая прилегающая последовательность TMEM65 представлена ниже:
TAAATAAAATTCACTAAATAAGATATAATGAGATTAGGAGTATGAATATGGGGTATTCAGACTTATTCCATTCAGATGAGAAGATGACATCTTTGGAGGGAAAAAAAAAAACCTTACCAAATAATATAAATTGTATCTCATTAATCTTTCAAACATCACTTCAACTTCATCATTTATACCATAAACCTTCTTGACAGTTC
[0051] Для выявления нуклеотидных изменений в последовательности повторов TMEM65 конструировали зонд для выявления типа «молекулярный маяк», содержащий последовательность CGCACGAGGGAAAAAAAAAACCTTACGTGCG, и метили с помощью FAM в качестве молекулы флуоресцентной метки, при этом применяли дабцил в качестве гасителя («стеблевой» участок зонда типа «молекулярный маяк» указан курсивом, участок гибридизации зонда выделен жирным шрифтом, при этом последовательность повторов, идентичная мутированному маркеру TMEM65, содержащему 10 адениновых повторов вместо 11, выделена жирным шрифтом и подчеркнута).
[0052] Для тестирования способности TMEM65-специфического зонда к связыванию и распознаванию как последовательности WT маркера TMEM65, так и ее двух различных мутантных варианта, которые представляют собой делецию либо вставку одного гомонуклеотида, получали 3 синтетические мишени TMEM65, представляющие 3 различных варианта гомополимерных повторов TMEM65. Последовательности трех указанных вариантов приведены ниже в виде ДНК-нитей, которые являются комплементарными TMEM65-специфичному зонду типа «молекулярный маяк» (содержащему поли-A-повтор), который гибридизируется с нитями указанных вариантов. Нити комплементарного варианта TMEM65 (содержащего поли-T-повтор) представляют собой следующее:
TMEM65_T10 (делеция 1 п. о.):
AAATGATGAAGTTGAAGTGATGTTTGAAAGATTAATGAGATACAATTTATATTATTTGGTAAGGTTTTTTTTTTCCCTCCAAAGATGTCATCTTCTCATCTGAATGGAATAAGTCTGAATAC;
TMEM65_T11 (эталон):
AAATGATGAAGTTGAAGTGATGTTTGAAAGATTAATGAGATACAATTTATATTATTTGGTAAGGTTTTTTTTTTTCCCTCCAAAGATGTCATCTTCTCATCTGAATGGAATAAGTCTGAATAC;
TMEM65_T12 (вставка 1 п. о.):
AAATGATGAAGTTGAAGTGATGTTTGAAAGATTAATGAGATACAATTTATATTATTTGGTAAGGTTTTTTTTTTTTCCCTCCAAAGATGTCATCTTCTCATCTGAATGGAATAAGTCTGAATAC.
[0053] TMEM65-специфический зонд типа «молекулярный маяк» в концентрации до 200 нМ добавляли в 3 отдельные ПЦР-пробирки, каждая из которых содержала один из 3 вышеописанных вариантов в концентрации 2500 нМ в стандартном буфере для ПЦР-реакции. Затем смесь подвергали денатурации в приборе Bio-Rad CFX96 в течение 2 мин. при 95°C и затем охлаждали до 45°C в течение 15 мин., предоставляя достаточно времени, чтобы зонд типа «молекулярный маяк» гибридизировался со своей мишенью. Далее выполняли анализ кривой плавления путем нагревания смеси до 75°C с шагом 0,3°C (5 с на цикл) и измеряли флуоресценцию после каждого повышения на 0,3°C.
[0054] Результаты анализа кривой плавления показаны на фигуре 1, где на верхней панели A показаны кривые плавления (в виде зависимости показателя флуоресценции от времени) TMEM65-специфического зонда в отношении трех мишеней, и где на нижней панели B показаны пики плавления или отрицательные значения первых производных кривых плавления, указанных на A. Значения Tm для трех пиков плавления составляли: 54,9°C для TMEM65_T10, 51,3°C для TMEM65_T11 и 47,7°C для TMEM65_T12. Значения дельта Tm пиков плавления составляли:
TMEM65_T10 - TMEM65_T11 = 3,6°C;
TMEM65_T11 - TMEM65_T12 = 3,6°C;
TMEM65_T10 - TMEM65_T12 = 7,2°C.
[0055] На основании этих результатов можно сделать вывод, что делеция или вставка одного нуклеотида по сравнению с эталонной последовательностью (т. е. повторы T10 или T12 в сравнении с эталонным повтором T11) приводят к различию в несколько °C (градусов Цельсия) в Tm пика плавления по сравнению с Tm пика плавления для эталонной последовательности. Следовательно, длину этой последовательности повторов в гене TMEM65 можно определить посредством анализа пиков плавления, полученных в результате гибридизации описанного зонда типа «молекулярный маяк» со своим целевым участком.
2. Оценка статуса маркера MSI TMEM65 в образцах от пациентов с раком
[0056] Образцы FFPE от пациентов с колоректальным раком помещали в струйные картриджи Biocartis Idylla. Картриджи закрывали и загружали в платформу Biocartis Idylla для автоматизированных основанных на ПЦР генетических анализов, после чего начинали автоматизированную подготовку образцов. Сперва ДНК пациентов выделяли из образцов FFPE и затем закачивали в отсеки картриджей, предназначенные для проведения ПЦР. Затем выполняли ассиметричную ПЦР-амплификацию участка, прилегающего к последовательности гомополимерных повторов TMEM65, в каждом картридже с применением следующих праймеров: FWD: 5’-CAGACTTATTCCATTCAGATGAGA-3’ и REV: 5’-GAAGTGATGTTTGAAAGATTAATGAGA-3’. ПЦР-амплификацию выполняли в присутствии вышеописанного TMEM65-специфического зонда типа «молекулярный маяк».
[0057] После проведения ПЦР продукты ПЦР подвергали денатурации в картриджах в течение 2 мин. при 95°C и затем охлаждали до 45°C в течение 15 мин., предоставляя достаточно времени, чтобы TMEM65-специфический зонд типа «молекулярный маяк» гибридизировался со своими мишенями. Затем выполняли анализ кривой плавления все еще в системе Idylla путем нагревания смеси от 40°C до 60°C с шагом 0,3°C (5 с на цикл), и осуществляя в то же время контроль сигналов флуоресценции после каждого повышения на 0,3°C. Пики плавления вычисляли в виде отрицательных значений первых производных полученных кривых плавления.
[0058] На фигуре 2 показаны результаты, полученные от 10 образцов дикого типа (черные кривые, длина повтора TMEM65 составляет 11), которые, как считается, обладают микросателлитной стабильностью (MSS), и 10 мутантных образцов (серые кривые, длина повтора TMEM65 составляет 10), которые, как считается, обладают микросателлитной нестабильностью (MSI-High [MSI-H]). Были отмечены сходные значения высоты пиков пика дикого типа A11 (при ± 49°C) в образцах MSS, при этом в образцах MSI-H как пик дикого типа A11, так и пик мутантной формы A10 (при ± 53°C) характеризовались различным значением высоты. Это отражает варьирующие соотношения аллелей дикого типа и мутантных аллелей, присутствующих в каждом образце.
[0059] На фигурах 3 и 4 показаны репрезентативные примеры образцов FFPE MSS и MSI-H соответственно. На фигуре 4 на каждой из панелей A-C, отображающих три разных образца MSI-H, MSS 1 показан в качестве эталона дикого типа. Образец MSI-H 1 содержит меньше мутантных аллелей, чем аллелей дикого типа, поскольку высота пика мутантной формы A10 (при ± 53°C) ниже, чем высота пика для дикого типа A11 (при ± 49°C). Образец MSI-H 2 содержит сходное количество мутантных аллелей и аллелей дикого типа, поскольку высота пика мутантной формы A10 (при ± 53°C) сходна с высотой пика для дикого типа A11 (при ± 49°C). Образец MSI-H 3 содержит большее количество мутантных аллелей, чем аллелей дикого типа, поскольку высота пика мутантной формы A10 (при ± 53°C) выше, чем высота пика для дикого типа A11 (при ± 49°C).
[0060] Представленные в данном документе результаты демонстрируют, что методика применения зонда типа «молекулярный маяк», описанного в данном документе, позволяет определить число нуклеотидов, присутствующих в последовательности гомополимерных повторов TMEM65, в ДНК из тканевых биоптатов FFPE колоректального рака. Кроме того, этот способ позволяет оценить относительные количества аллелей дикого типа и мутантных аллелей повторов TMEM65, присутствующих в ДНК из биоптата опухоли.
3. Поведение различных зондов типа «молекулярный маяк» в присутствии корректирующей полимеразы
[0061] Для достижения большей чувствительности описанного в данном документе способа предпочтительно применять в смеси для ПЦР-амплификации корректирующую (т. е. исправляющую ошибки) полимеразу, обладающую 3’-5’ экзонуклеазной активностью. Тем не менее, для многих «молекулярных маяков» в смеси наблюдали, что различные тестируемые корректирующие полимеразы могут разрушать разные «маяки», что приводит к частичной или полной потере сигнала и, следовательно, также мешает или препятствует надежной интерпретации данных.
[0062] Пример вышеуказанного представлен на фигуре 5. На верхней панели A показаны пики плавления, полученные с ДНК от 2 клинических образцов FFPE с использованием корректирующей полимеразы Q5 и зонда типа «молекулярный маяк» с последовательностью CGCAGGAAGCTAAAAAAAAAACCCTTCTGCG (имеющего в качестве метки Texas Red и в качестве гасителя Iowa Black FQ), сконструированного для выявления вероятных потерь гомонуклеотидов в маркере MSI ABAT. Пик более темного цвета, отмеченный сплошной линией, соответствует образцу MSS (стабильному), где ABAT относится к дикому типу и содержит 11 адениновых повторов. Линией с кружками показана двойная кривая, полученная с ДНК из образца MSI-H, характеризующегося более высоким пиком делеции в правой части кривой и меньшим пиком WT в левой части. Пик WT обычно наблюдается в образцах опухоли MSI-H, так как почти всегда имеет место загрязнение опухолевой ткани ДНК WT из окружающей опухоль стромы.
[0063] Такие стабильные результаты можно неоднократно получать с другими образцами при использовании корректирующей полимеразы Q5 и вышеописанного ABAT-специфического «молекулярного маяка» без необходимости в дополнительной защите указанного «маяка» посредством каких-либо дополнительных химических модификаций. Была предположено, что это, вероятно, является результатом 3D-структуры «стебля» указанного «маяка», который несовместим для связывания с полимеразой Q5 и разрушения посредством ее экзонуклеазного активного центра.
[0064] Абсолютно отличающийся профиль плавления, показанный в левой части нижней панели B на фигуре 5, получали с использованием полимеразы Q5 для другого «молекулярного маяка», специфичного в отношении ABAT и имеющего последовательность CCGTCCGAAGCTAAAAAAAAAACCCTTGGACGG (с той же меткой и гасителем). Этот зонд эффективно и многократно подвергался разрушению посредством экзонуклеазной активности полимеразы Q5 в ходе ПЦР. Поскольку «маяк» разрушался в ходе ПЦР, нельзя было получить какой-либо сигнал в ходе анализа кривой плавления после ПЦР (график плосковершинный). В правой части панели B показан профиль qPCR для того же зонда, который демонстрирует, что «маяк» является функциональным и генерирует сигнал в ходе ПЦР. Поскольку сигнал больше не присутствует при плавлении после ПЦР, это доказывает, что сигнал, сгенерированный в ходе ПЦР, был вызван разрушением «маяка».
[0065] Было отмечено, что в реакциях ПЦР, выполняемых с использованием полимеразы Q5, но с другими зондами типа «молекулярный маяк», специфичными в отношении различных маркеров MSI, наблюдалась аналогичная тенденция, в зависимости от которой один из стеблей, описанных выше для двух ABAT-специфических зондов, присутствовал в данном «маяке».
Реферат
Группа изобретений относится к области биотехнологии. Предложен способ и набор для выявления изменений в числе нуклеотидов, присутствующих в целевой последовательности гомополимерных нуклеотидных повторов, длина которой составляет 12 п. о. или меньше. Способ включает получение ампликонов, нагревание ампликонов в присутствии генерирующего сигнал олигонуклеотидного зонда и установление присутствующих в целевой последовательности гомополимерных повторов числа нуклеотидов на основании кривой плавления. Набор содержит олигонуклеотидный зонд типа «молекулярный маяк» и обладающую 3’-5’ экзонуклеазной активностью полимеразу. Олигонуклеотидный зонд содержит последовательность, которая способна гибридизироваться с содержащей целевую последовательность гомополимерных повторов последовательностью. Изобретения обеспечивают высокочувствительный и подходящий для мультиплексирования, полностью автоматизируемый способ выявления изменений в числе нуклеотидов в коротких гомополимерных микросателлитах, который можно применять с помощью любого стандартного прибора для термоциклирования в рамках количественной ПЦР. 2 н. и 17 з.п. ф-лы, 5 ил.

Комментарии