Набор из двух праймеров для амплификации нуклеиновой кислоты вируса гепатита а, способ обнаружения вируса гепатита а с его использованием (варианты) и набор для обнаружения вируса гепатита а - RU2406762C2
Код документа: RU2406762C2
Чертежи

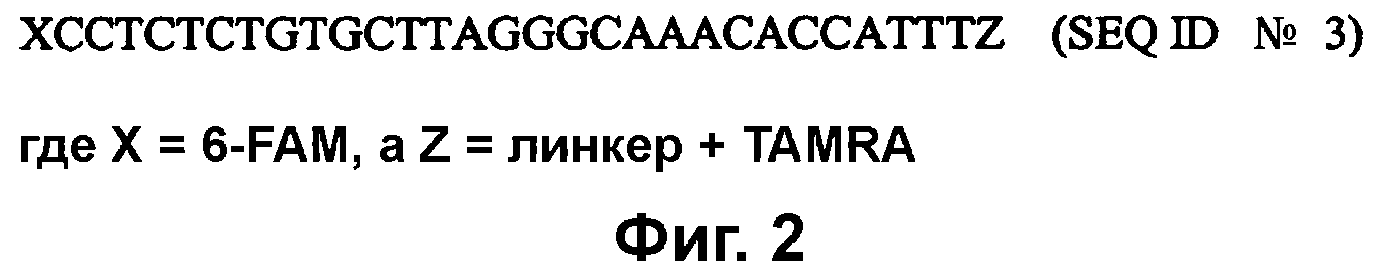



Описание
Область техники
Настоящее изобретение в целом относится к диагностике. Конкретно изобретение относится к основанным на нуклеиновой кислоте анализам для точной диагностики инфекции гепатита A и выявления гепатита A в биологическом образце.
Предпосылки изобретения
Гепатит A представляет собой передающееся кишечным путем заболевание, вызывающее лихорадку, недомогание, потерю аппетита, тошноту, желудочно-кишечный дискомфорт и желтуху. Возбудитель гепатита A, вирус гепатита A, представляет собой маленький безоболочечный сферический вирус, принадлежащий роду Hepatovirus семейства Picornaviridae. Геном HAV состоит из одноцепочечной линейной молекулы РНК длиной 7,5 т.н., кодирующей полибелковый предшественник, перерабатываемый с образованием структурных белков, и белки с ферментативной активностью, необходимые для репликации вируса (Najarian et al., Proc. Natl. Acad. Sci. USA 82: 2627-2632 (1985)). HAV плохо растет в клеточной культуре, не является цитопатическим и дает малые выходы вируса. Хотя РНК HAV, выделенная из вирионов, является инфекционной в клеточной культуре (Locarnini et al., J. Virol. 37: 216-225 (1981) and Siegl et al., J. Gen. Virol. 57: 331-341 (1981)), непосредственное манипулирование вирусным геномом затруднено ввиду того, что он состоит из РНК.
HAV кодирует четыре капсидных белка (A, B, C и D), содержащих большинство антигенных детерминант, распознаваемых антителами инфицированных индивидов. В дополнение к капсидным белкам сообщали об антигенных детерминантах в неструктурных белках, таких как 2A и кодируемой вирусом протеазе. Другая важная антигенная детерминанта HAV описана в соединении между капсидным предшественником P1 и 2A.
Обычно HAV заражаются фекально-оральным путем, или посредством контакта человек-человек, или путем потребления зараженной пищи или воды. Однако существует вероятность переноса HAV посредством объединенных продуктов плазмы. Отсутствие липидной оболочки делает HAV очень устойчивым к физико-химической инактивации, и вирус может выдерживать традиционную тепловую обработку продуктов крови. Таким образом, HAV, а также Parvovirus B19 перенесли введением объединенных производных плазмы. Разработка чувствительных и специфичных диагностических анализов для выявления антигенов и HAV и/или антител у инфицированных индивидов, а также основанных на нуклеиновой кислоте тестов для выявления зараженных вирусом образцов для исключения их из образцов для трансфузии представляет собой важную проблему здравоохранения.
В патенте США № 5290677, выданном Robertson et al., описан захват целых вирусов HAV с применением антител. Выделяют РНК и получают кДНК. Затем кДНК амплифицируют посредством ПЦР с применением праймеров к области капсида генома HAV VP1 и VP3, а амплифицированный продукт выявляют с применением зондов из той же области генома. Выбор праймеров и зондов основан на генотипе HAV, подвергаемого выявлению.
Сущность изобретения
Настоящее изобретение основано на разработке чувствительного, надежного диагностического теста, основанного на нуклеиновой кислоте, для выявления HAV в биологических образцах от потенциально зараженных индивидов. В описанных здесь способах выделенный образец нуклеиновой кислоты применяют в качестве матрицы для амплификации консервативных геномных областей последовательности HAV с применением ПЦР, опосредованной транскрипцией амплификации (TMA), а также в 5'-нуклеазном анализе, таком как способ TaqMan™. Способы позволяют выявление HAV в зараженных вирусом образцах. В определенных осуществлениях в данном изобретении используют праймеры и зонды, полученные из области 5'-UTR генома HAV. Кроме того, способы позволяют анализ в одном контейнере, где нуклеиновые кислоты захваченных образцов можно подвергать амплификации и выявлению в одном и том же контейнере. Применяя способы по изобретению, можно идентифицировать инфицированные образцы и исключить их из образцов для трансфузии, а также из образцов для получения производных крови.
Таким образом, в одном осуществлении данное изобретение относится к способу выявления инфекции HAV в биологическом образце. Способ включает в себя:
(a) приведение твердой подложки в контакт с биологическим образцом при высоких концентрациях хаотропных солей или в гибридизационных условиях, где формируется комплекс между твердой подложкой и нуклеиновыми кислотами-мишенями;
(b) отделение твердой подложки из (a) от образца;
(c) амплификацию нуклеиновых кислот-мишеней, при наличии;
(d) выявление наличия амплифицированных нуклеиновых кислот-мишеней в качестве признака присутствия или отсутствия HAV в образце.
В другом осуществлении данное изобретение относится к способу выявления инфекции HAV в биологическом образце. Способ включает:
(a) приведение твердой подложки в контакт с биологическим образцом при высоких концентрациях хаотропных солей или в гибридизационных условиях, где формируется комплекс между твердой подложкой и нуклеиновыми кислотами-мишенями;
(b) отделение твердой подложки из (a) от образца;
(c) амплификацию цепей-мишеней с применением праймеров, полученных из 5'-UTR генома HAV, таких как праймеры, представленные последовательностями, содержащими SEQ ID №№ 1 и 2. В некоторых осуществлениях способ дополнительно включает стадию применения зонда из 5'-UTR генома HAV, такого как зонд из SEQ ID № 3, для выявления присутствия амплифицированных олигонуклеотидов-мишеней в качестве признака присутствия или отсутствия HAV в образце.
В дополнительном осуществлении изобретение относится к способу выявления инфекции HAV в биологическом образце, где способ включает:
выделение нуклеиновых кислот из биологического образца, в котором предполагают наличие HAV;
амплификацию нуклеиновых кислот с применением, по меньшей мере, двух праймеров, где (a) каждый из праймеров состоит не более чем приблизительно из 60 нуклеотидов в длину и один праймер содержит нуклеотидную последовательность из 10 последовательных нуклеотидов из SEQ ID № 1, а другой праймер содержит нуклеотидную последовательность из 10 последовательных нуклеотидов из SEQ ID № 2, или (b) праймеры обладают 90% идентичности последовательности с нуклеотидной последовательностью (a), где каждый из двух праймеров в достаточной степени комплементарен части соответственно смысловой или антисмысловой цепи выделенной нуклеиновой кислоты, чтобы гибридизоваться с ней; и
выявление наличия амплифицированных нуклеиновых кислот в качестве признака присутствия или отсутствия HAV в образце.
В определенных осуществлениях нуклеиновые кислоты выделяют из биологического образца способом, включающим:
(a) приведение твердой подложки, содержащей связанные с ней захватывающие нуклеиновые кислоты, в контакт с биологическим образцом в гибридизационных условиях, где цепи нуклеиновой кислоты-мишени гибридизуются с захватывающими нуклеиновыми кислотами;
(b) отделение твердой подложки от образца.
В дополнительных осуществлениях выделение, амплификацию и выявление проводят в одном контейнере.
В дополнительном осуществлении захватывающие нуклеиновые кислоты включают в себя один или несколько олигонуклеотидов, где каждый из олигонуклеотидов состоит не более чем приблизительно из 60 нуклеотидов в длину и включает, по меньшей мере, 10 последовательных нуклеотидов из последовательности, выбранной из группы, состоящей из SEQ ID № 4, SEQ ID № 5, SEQ ID № 6, и SEQ ID № 7.
В еще одном дополнительном осуществлении захватывающие нуклеиновые кислоты дополнительно включают гомополимерную цепь приблизительно из 15-25 нуклеотидов в длину, такую как poly(A), poly(T), poly(G), poly(C) или poly(U).
В другом осуществлении амплификация включает в себя ПЦР, опосредованную транскрипцией амплификацию (TMA) или TaqMan.
В дополнительном осуществлении способ дополнительно включает применение меченого олигонуклеотидного зонда для выявления амплифицированного продукта. Зонд представляет собой последовательность длиной не более чем 60 нуклеотидов и состоящую, по меньшей мере, из 10 последовательных нуклеотидов, содержащихся в SEQ ID № 3.
В определенных осуществлениях зонд на 5'-конце и на 3'-конце дополнительно включает в себя детектируемые метки, такие как флуоресцентная метка, выбранная из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В еще одном осуществлении изобретение относится к способу выявления инфекции HAV в биологическом образце, где способ включает:
(a) приведение твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов, где один или несколько олигонуклеотидов включают последовательность, выбранную из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14, в условиях, где захватывающие нуклеиновые кислоты связываются с твердой подложкой,
(b) приведение твердой подложки из (a) в контакт с биологическим образцом в гибридизационных условиях, где цепи нуклеиновой кислоты-мишени из HAV, когда присутствуют, гибридизуются с захватывающими нуклеиновыми кислотами;
(c) отделение твердой подложки из (b) от образца;
(d) амплификацию нуклеиновых кислот с применением смыслового праймера, содержащего SEQ ID № 1, и антисмыслового праймера, содержащего SEQ ID № 2, где смысловой и антисмысловой праймеры в достаточной степени комплементарны частям соответственно смысловой или антисмысловой цепи выделенной нуклеиновой кислоты, чтобы гибридизоваться с ними;
(e) выявление наличия амплифицированных нуклеиновых кислот в качестве признака присутствия или отсутствия HAV в образце.
В определенных осуществлениях указанных выше способов твердая подложка включает в себя гранулы, такие как магнитные гранулы, и выделение, амплификацию и выявление, проводимые в одном контейнере.
В дополнительных осуществлениях изобретение относится к олигонуклеотиду, содержащему нуклеотидную последовательность, состоящую из любой из нуклеотидных последовательностей, приведенных на фиг. 1.
В дополнительных осуществлениях данное изобретение относится к отдельному олигонуклеотиду, состоящему не более чем из 60 нуклеотидов в длину, содержащему:
(a) нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из последовательности, выбранной из группы, состоящей из SEQ ID №№ 1, 2 и 3;
(b) нуклеотидную последовательность с 90% идентичности последовательности с нуклеотидной последовательностью из (a); или
(c) комплементарные (a) и (b) последовательности.
В определенных осуществлениях олигонуклеотид представляет собой нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из SEQ ID №№ 1, 2 или 3.
В дополнительных осуществлениях олигонуклеотид на 5'-конце и на 3'-конце дополнительно содержит детектируемую метку. В определенных осуществлениях детектируемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В еще одном дополнительном осуществлении изобретение относится к набору для диагностического теста, содержащему один или несколько описанных здесь праймеров и инструкции для проведения диагностического теста. В определенных осуществлениях набор для тестирования дополнительно содержит олигонуклеотидный зонд, включающий специфически гибридизующуюся с HAV последовательность из нуклеотидов длиной приблизительно от 10 до приблизительно 50 нуклеотидов, связанную с детектируемой меткой.
В дополнительном осуществлении изобретение относится к набору для выявления HAV в биологическом образце. Набор содержит захватывающие нуклеиновые кислоты, включающие в себя один или несколько олигонуклеотидов, где один или несколько олигонуклеотидов содержат последовательность, выбранную из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14; праймеры, содержащие SEQ ID №№ 1 и 2, и олигонуклеотидный зонд, содержащий SEQ ID № 3. В определенных осуществлениях набор для тестирования дополнительно содержит полимеразу и инструкции для проведения диагностических тестов.
В дополнительном осуществлении изобретение относится к набору для выявления инфекции HAV в биологическом образце, где набор включает
захватывающие нуклеиновые кислоты, включающие один или несколько олигонуклеотидов, где каждый из олигонуклеотидов состоит не более чем из 60 нуклеотидов в длину и содержит нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID № 10, SEQ ID № 11, SEQ ID № 12, SEQ ID № 13 и SEQ ID № 14;
по меньшей мере, два праймера, где (a) каждый из праймеров состоит не более чем приблизительно из 60 нуклеотидов в длину и один праймер содержит нуклеотидную последовательность из, по меньшей мере, 10 последовательных нуклеотидов из SEQ ID № 1, а другой праймер - нуклеотидную последовательность, по меньшей мере, из 10 последовательных нуклеотидов из SEQ ID № 2,
написанные инструкции для выявления инфекции HAV.
В определенных осуществлениях набор дополнительно содержит олигонуклеотидный зонд, состоящий не более чем приблизительно из 60 нуклеотидов в длину и по меньшей мере 10 последовательных нуклеотидов из SEQ ID № 3. На 5'-конце и на 3'-конце зонд дополнительно может содержать детектируемые метки. В некоторых осуществлениях детектируемая метка представляет собой флуоресцентную метку, выбранную из группы, состоящей из 6-карбоксифлуоресцеина (6-FAM), тетраметилродамина (TAMRA) и 2',4',5',7'-тетрахлор-4-7-дихлорфлуоресцеина (TET).
В определенных осуществлениях указанные выше наборы дополнительно включают полимеразу и буферы.
Данный и другие аспекты настоящего осуществления станут очевидны при ссылке на следующее ниже подробное описание и приложенные чертежи. Кроме того, здесь приведены различные ссылки на источники, в которых определенные процедуры и композиции описаны более подробно.
Краткое описание чертежей
На фиг. 1A-1B (SEQ ID №№ 1 и 2) приведены типовые праймеры для применения в амплификации выделенных нуклеиновых кислот HAV.
На фиг. 2 (SEQ ID № 3) приведен зонд для применения в выявлении присутствия амплифицированных олигонуклеотидов-мишеней, указывающих на присутствие HAV, где X представляет собой 6-FAM (флуоресцеин), а Z представляет собой линкер с TAMRA (тетраметилродамин).
На фиг. 3A-3F (SEQ ID №№ 10-15) приведены типовые захватывающие олигонуклеотиды для выделения нуклеиновых кислот HAV из биологического образца.
На фиг. 4A приведена последовательность-мишень HAV дикого типа (SEQ ID № 16).
На фиг. 4B (SEQ ID № 17) приведена типовая внутренняя контрольная последовательность для применения в качестве контроля для захвата и амплификации мишени. Отмеченные полужирным шрифтом основания представляют собой последовательность у дикого типа, замененную на внутреннюю контрольную последовательность.
Подробное описание изобретения
В практической части настоящего изобретения, если не указанно иначе, будут применять традиционные способы химии, биохимии, технологии рекомбинантных ДНК и вирусологии в рамках уровня технологий. Такие технологии полностью описаны в литературе. См., например, Fundamental Virology, 2nd Edition, vol. I & II (B. N. Fields and D. M. Knipe, eds.); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., current addition); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Oligonucleotide Synthesis (N. Gait, ed., 1984); A Practical Guide to Molecular Cloning (1984).
Необходимо отметить, что, как применяют в данной спецификации и приложенной формуле изобретения, единичные формы включают в себя множественные объекты ссылки, если в содержании явно не указано иначе. Таким образом, например, ссылка на олигонуклеотид включает в себя смесь двух или более олигонуклеотидов и т.п.
В тексте применяют следующие сокращения аминокислот:
I. Определения
В описании настоящего изобретения применяют следующие ниже термины и подразумевается, что они определены, как указано ниже.
Термины «полипептид» и «белок» относятся к полимеру из аминокислотных остатков и не ограничены минимальной длиной продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и т.п. включены в пределы определения. И полноразмерные белки, и их фрагменты включены в определение. Термины также включают постэкспрессионные модификации полипептида, например гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения «полипептид» относится к белку, включающему модификации, такие как делеции, добавления или замены (как правило, консервативные по природе) в природной последовательности, при условии, что белок сохраняет желательную активность. Данные модификации могут проводить намеренно так, как при сайт-специфическом мутагенезе, или они могут являться случайными, такими как вследствие мутаций продуцирующих белки хозяев или ошибок вследствие амплификации ПЦР.
При ссылке на белок под «выделенным» подразумевают то, что указанная молекула является изолированной и отдельной от целого организма, в котором данная молекула обнаружена в природе, или находится при существенном отсутствии других биологических макромолекул того же типа. По отношению к полинуклеотиду термин «выделенный» представляет собой молекулу нуклеиновой кислоты целиком или частично освобожденную от последовательностей, обычно связанных с ней в природе; или существующую в природе последовательность, но со связанными с нею гетерологичными последовательностями; или молекулу, отделенную от хромосомы.
Полинуклеотид «полученный из» или «специфичный к» указанной последовательности ссылается на полинуклеотидную последовательность, содержащую непрерывную последовательность, по меньшей мере, приблизительно из 6 нуклеотидов, предпочтительно, по меньшей мере, приблизительно из 8 нуклеотидов, более предпочтительно, по меньшей мере, приблизительно из 10-12 нуклеотидов, и даже более предпочтительно, по меньшей мере, приблизительно из 15-20 нуклеотидов, соответствующих, т.е. идентичных или комплементарных, области указанной нуклеотидной последовательности. Полученный полинуклеотид необязательно получен физически из представляющей интерес нуклеотидной последовательности, но его можно получить любым способом, включающим в качестве неограничивающих примеров химический синтез, репликацию, обратную транскрипцию или транскрипцию, основанную на информации, предоставленной последовательностью оснований в области(ях), из которых получен полинуклеотид. По существу он может представлять или смысловую, или антисмысловую ориентацию исходного полинуклеотида.
«Гомология» относится к проценту сходства между двумя полинуклеотидами или двумя полипептидными молекулами. Две последовательности нуклеиновой кислоты или две полипептидные последовательности являются «по существу гомологичными» друг другу, когда последовательности обнаруживают, по меньшей мере, приблизительно 50%, предпочтительно, по меньшей мере, приблизительно 75%, более предпочтительно, по меньшей мере, приблизительно 80-85%, предпочтительно, по меньшей мере, приблизительно 90% и наиболее предпочтительно, по меньшей мере, приблизительно 95-98% сходства последовательностей на протяжении заданной длины молекул. Как применяют здесь, «по существу гомологичные» также относится к последовательностям, демонстрирующим полную идентичность с конкретной нуклеиновой кислотой или полипептидной последовательностью.
Как правило, «идентичность» относится к точному соответствию нуклеотид-нуклеотид или аминокислота-аминокислота двух полинуклеотидов или полипептидных последовательностей соответственно. Процент идентичности можно определить прямым сравнением информации, заключенной в последовательности, между двумя молекулами посредством выравнивания последовательностей, подсчета точного количества совпадений между двумя выровненными последовательностями, деления на длину более короткой последовательности и умножения результата на 100.
Для помощи в анализе гомологии и идентичности можно применять легкодоступные компьютерные программы, такие как ALIGN, Dayhoff, M.O. in Atlas of Protein Sequence and Structure M.O. Dayhoff ed., 5 Suppl. 3:353-358, National biomedical Research Foundation, Washington, DC, применяющую к анализу пептидов алгоритм локальной гомологии Smith и Waterman Advances in Appl. Math. 2:482-489, 1981. Программы для определения гомологии нуклеотидных последовательностей доступны в Wisconsin Sequence Analysis Package, Version 8 (доступный в Genetics Computer Group, Madison, WI), например, программы BESTFIT, FASTA и GAP, также основанные на алгоритме Smith и Waterman. Данные программы легко применять с параметрами по умолчанию, рекомендованными производителем и описанными в Wisconsin Sequence Analysis Package, указанном выше. Например, процент гомологии конкретной нуклеотидной последовательности и референсной последовательности можно определить с применением алгоритма гомологии Smith и Waterman, с оценочной таблицей по умолчанию и штрафом за пропуск шести нуклеотидных положений.
Другой способ оценки процента гомологии в контексте настоящего изобретения представляет собой применение программного пакета MPSRCH, авторские права на который принадлежат University of Edinburgh, разработанного John F. Collins и Shane S. Sturrok и распространяемого IntelliGenetics, Inc. (Mountain View, CA). Для данного набора пакетов можно использовать алгоритм Smith-Waterman, где для оценочной таблицы применяют параметры по умолчанию (например, штраф за внесение делеции в размере 12, штраф за продолжение делеции в размере 1 и пропуск в размере 6). Из получаемых данных значение «совпадение» отражает «гомологию последовательности». В данной области общеизвестны другие пригодные программы для подсчета процента идентичности или сходства между последовательностями, например, другая программа выравнивания представляет собой BLAST, применяемая с параметрами по умолчанию. Например, BLASTN и BLASTP можно применять с использованием следующих параметров по умолчанию: genetic code = standard; filter = none; strand = both; cutoff = 60; expect = 10; Matrix = BLOSUM62; Descriptions = 50 sequences; sort by = HIGH SCORE; Databases = non-redundant, GenBank + EMBL + DDBJ + PDB + GenBank CDS translations + Swiss protein + Spupdate + PIR. Подробности о данных программах можно найти по следующему интернет-адресу: http://www.ncbi.nlm.gov/cgi-bin/BLAST.
Альтернативно, гомологию можно определять гибридизацией полинуклеотидов в таких условиях, когда формируются стабильные дуплексы между гомологичными областями, с последующим расщеплением специфичной к одноцепочечной нуклеиновой кислоте нуклеазой(ами) и определением размера расщепленных фрагментов. Последовательности нуклеиновых кислот, являющиеся в значительной степени гомологичными, можно идентифицировать в эксперименте гибридизации по Саузерну, например, в строгих условиях, как определено для данной конкретной системы. Определение пригодных условий гибридизации находится в пределах уровня технологий в данной области. Например, см. Sambrook et al., выше; DNA Cloning, выше; Nucleic Acid Hybridization, выше.
Как применяют здесь для описания молекулы нуклеиновой кислоты, «рекомбинантный» означает происходящий из генома, кДНК, вируса, полусинтетический или синтетический полинуклеотид, который в силу его происхождения или манипуляций с ним не связан с целым полинуклеотидом или его частью, с которыми он связан в природе. Термин «рекомбинантный», применяемый в отношении белка или полипептида, означает полипептид, полученный посредством экспрессии рекомбинантного полинуклеотида. Как правило, представляющий интерес ген клонируют, а затем экспрессируют в трансформированных организмах, как описано дополнительно ниже. Организм хозяина экспрессирует чужеродный ген с образованием белка в подходящих для экспрессии условиях.
«Регуляторный элемент» относится к полинуклеотидной последовательности, способствующей транскрипции и/или трансляции полинуклеотидной последовательности, с которой он связан. Термин включает промоторы, последовательности терминации транскрипции, вышерасположенные регуляторные домены, сигналы полиаденилирования, нетранслируемые области, включающие в себя 5'-UTR и 3'-UTR и, когда подходит, лидерные последовательности и энхансеры, которые вместе обеспечивают транскрипцию и трансляцию кодирующей последовательности в клетке-хозяине.
Как применяют здесь, «промотор» представляет собой регуляторную область, способную к связыванию с полимеразой и инициации транскрипции функционально связанной с ней расположенной ниже (в направлении 3') нуклеотидной последовательности. Для целей настоящего изобретения промоторная последовательность включает минимальное количество оснований или элементов, необходимых для инициации транскрипции представляющей интерес последовательности на определяемых выше фона уровнях. В пределах промоторной последовательности находится участок инициации транскрипции, а также домены связывания белков (консенсусные последовательности), ответственные за связывания РНК- или ДНК-полимеразы. Например, промотор может представлять собой последовательность нуклеиновой кислоты, распознающуюся ДНК-зависимой РНК-полимеразой («транскриптазой») в качестве сигнала для связывания с нуклеиновой кислотой и начала транскрипции РНК на конкретном участке. Для связывания таким транскриптазам, как правило, необходима частично двухцепочечная ДНК, содержащая промоторную последовательность и комплементарную ей последовательность; матричная часть (последовательность для транскрипции) не должна являться двухцепочечной. Отдельные ДНК-зависимые РНК-полимеразы распознают множество различных промоторных последовательностей, которые могут заметно отличаться по их эффективности в активации транскрипции. Когда РНК-полимераза связывается с промоторной последовательностью для инициации транскрипции, данная промоторная последовательность не является частью транскрибируемой последовательности. Соответственно, полученные таким образом РНК-транскрипты не включают в себя данную последовательность.
Регуляторная последовательность «направляет транскрипцию» нуклеотидной последовательности, когда РНК- или ДНК-полимераза связывается с промоторной последовательностью и транскрибирует смежную последовательность.
«ДНК-зависимая ДНК-полимерза» представляет собой фермент, синтезирующий комплементарную копию ДНК на матрице ДНК. Примерами являются ДНК-полимераза I E. coli и ДНК-полимераза бактериофага T7. Всем известным ДНК-зависимым ДНК-полимерзам для инициации синтеза необходим комплементарный праймер. В подходящих условиях ДНК-зависимая ДНК-полимерза может синтезировать комплементарную копию ДНК на матрице РНК.
«ДНК-зависимая РНК-полимераза» или «транскриптаза» представляет собой фермент, синтезирующий множество копий РНК на двухцепочечной или частично двухцепочечной молекуле ДНК с (как правило, двухцепочечной) промоторной последовательностью. Молекулы РНК («транскрипты») синтезируются в направлении от 5' к 3', начиная от расположенного ниже в непосредственной близости от промотора определенного положения. Примерами транскриптаз являются ДНК-зависимые РНК-полимеразы E. coli и бактериофагов T7, T3 и SP6.
«РНК-зависимая ДНК-полимераза» или «обратная транскриптаза» представляет собой фермент, синтезирующий комплементарную копию ДНК на матрице РНК. Все известные обратные транскриптазы также обладают способностью создавать комплементарные копии ДНК на матрице ДНК; таким образом, они являются и РНК-, и ДНК-зависимыми ДНК-полимеразами. Для инициации синтеза на матрицах РНК и ДНК необходим праймер.
«РНКаза H» представляет собой фермент, расщепляющий РНК-часть дуплекса РНК:ДНК. Данные ферменты могут являться эндонуклеазами или экзонуклеазами. Большинство обратных транскриптаз, кроме полимеразной активности, как правило, обладает активностью РНКазы H. Однако доступны другие источники РНКазы H, не связанные с полимеразной активностью. Расщепление может приводить к отделению РНК из комплекса РНК:ДНК. Альтернативно, РНКаза H может просто расщеплять РНК в различных участках, таких как участки плавления РНК, или позволять ферментам раскручивать участки РНК.
Термины «полинуклеотид», «олигонуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» здесь применяют для обозначения полимерной формы нуклеотидов любой длины как рибонуклеотидов, так и дезоксирибонуклеотидов. Данный термин относится только к первичной структуре молекулы. Таким образом, термин включает в себя трех-, двух- и одноцепочечную ДНК, а также трех-, двух- и одноцепочечную РНК. Он также включает в себя модификации, такие как метилирование и/или кэпирование, и немодифицированные формы полинуклеотида. Более подробно, термины «полинуклеотид», «олигонуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» включают в себя полидезоксирибонуклеотиды (содержащие 2-дезокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу) и полинуклеотиды другого типа, являющиеся N- или C-гликозидами пуринового или пиримидинового основания, и другие полимеры, содержащие ненуклеотидные основные цепи, например полиамид (например, пептидные нуклеиновые кислоты (PNA)) и полимеры полиморфолино (коммерчески доступные в Anti-Virals, Inc., Corvallis, Oregon, как Neugene) и другие синтетические полимеры нуклеиновой кислоты со специфической последовательностью, при условии, что полимеры содержат нуклеотидные основания в конфигурации, позволяющей спаривание и стэкинг оснований, так как это происходит в ДНК и РНК. Здесь значимого отличия в длине между «полинуклеотидом», «олигонуклеотидом», «нуклеиновой кислотой» и «молекулой нуклеиновой кислоты» нет, и данные термины можно применять взаимозаменяемо. Данные термины относятся только к первичной структуре молекулы. Таким образом, данные термины включают в себя, например, 3'-дезокси-2',5'-ДНК, олигодезоксирибонуклеотид-N3',P5'-фосфорамидаты, 2'-O-алкил-замещенную РНК, двух- и одноцепочечную ДНК, а также двух- и одноцепочечную РНК, гибриды ДНК:РНК и гибриды между PNA и ДНК или РНК, а также включают в себя известные типы модификаций, например, известные в данной области метки, метилирование, «кэпы», замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, например, такие как межнуклеотидные модификации незаряженными связями (например, метилфосфанаты, фосфотриэфиры, фосфорамидаты, карбаматы и т.д.), отрицательно заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.) и положительно заряженными связями (например, аминоалкилфосфороамидаты, аминоалкилфосфоротриэфиры), межнуклеотидные модификации, содержащие боковые группы, такие как, например, белки (включая нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизины и т.д.), межнуклеотидные модификации интеркаляторами (например, акридин, псорален и т.д.), межнуклеотидные модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окисляющиеся металлы и т.д.), межнуклеотидные модификации, содержащие алкилирующие средства, межнуклеотидные модификации с модифицированными связями (например, альфааномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида или олигонуклеотида. В частности, ДНК представляет собой дезоксирибонуклеиновую кислоту.
Как применяют здесь, термин «область нуклеиновой кислоты, являющаяся мишенью» или «нуклеиновая кислота-мишень» означает молекулу нуклеиновой кислоты с «последовательностью-мишенью» для амплификации. Нуклеиновая кислота-мишень может являться или одноцепочечной, или двухцепочечной и может включать в себя кроме последовательности-мишени другие последовательности, которые могут не амплифицироваться. Термин «последовательность-мишень» относится к подлежащей амплификации конкретной нуклеотидной последовательности на нуклеиновой кислоте-мишени. Последовательность-мишень может включать в себя гибридизующуюся с зондом область, содержащуюся в молекуле-мишени, с которой зонд формирует стабильный гибрид в желательных условиях. «Последовательность-мишень» также может включать в себя образующие комплекс последовательности, с которыми олигонуклеотидные праймеры образуют комплексы и удлиняются с использованием последовательности-мишени в качестве матрицы. Там, где нуклеиновая кислота-мишень исходно является одноцепочечной, термин «последовательность-мишень» также относится к последовательности, комплементарной к «последовательности-мишени», существующей в нуклеиновой кислоте-мишени. Если «нуклеиновая кислота-мишень» исходно является двухцепочечной, термин «последовательность-мишень» относится и к плюс(+), и к минус(-) цепям.
Как применяют здесь, термин «праймер» или «олигонуклеотидный праймер» относится к олигонуклеотиду, действующему для инициации синтеза комплементарной цепи нуклеиновой кислоты, когда его помещают в условия, в которых индуцируется синтез продукта удлинения праймера, т.е. в присутствии нуклеотидов и индуцирующего полимеризацию средства, такого как ДНК- или РНК-полимераза, и при подходящей температуре, pH, концентрации металлов и солей. Праймер предпочтительно является одноцепочечным для максимальной эффективности амплификации, но альтернативно может являться двухцепочечным. Если праймер является двухцепочечным, его перед применением для получения продуктов удлинения сначала обрабатывают для разделения цепей. Данную стадию денатурации, как правило, проводят нагреванием, но, альтернативно, можно проводить с применением щелочи и последующей нейтрализации. Таким образом, «праймер» комплементарен матрице и образует комплексы посредством водородных связей или гибридизуется с матрицей с получением комплекса праймер/матрица для инициации синтеза полимеразой, который в процессе синтеза ДНК удлиняется добавлением ковалентно связанных оснований, связанных на 3'-конце комплементарно матрице.
Как применяют здесь, термин «зонд» или «олигонуклеотидный зонд» относится к структуре, содержащей полинуклеотид, такой как определено выше, содержащий последовательность нуклеиновой кислоты, комплементарную последовательности нуклеиновой кислоты, находящейся на анализируемой нуклеиновой кислоте-мишени. Полинуклеотидные области зондов могут состоять из ДНК, и/или РНК, и/или синтетических аналогов нуклеотидов. Когда «олигонуклеотидный зонд» применяют в 5'-нуклеазном анализе, таком как способ TaqMan™, зонд содержит, по меньшей мере, один люминофор и, по меньшей мере, один гаситель, расщепляемый вследствие 5'-эндонуклеазной активности полимеразы, применяемой в реакции для выявления любых амплифицирующихся олигонуклеотидных последовательностей-мишеней. В данном контексте олигонуклеотидный зонд содержит достаточное количество фосфодиэфирных связей, примыкающих к 5'-концу, так что применяемый фермент с 5'→3' экзонуклеазной активностью может эффективно расщеплять связи зонда для разделения люминофоров и гасителей. Когда олигонуклеотидный зонд применяют в способе TMA, его необходимо соответственно метить, как описано ниже.
Необходимо принимать во внимание, что для формирования стабильных гибридов гибридизующимся последовательностям не требуется обладать точной комплементарностью. Во многих случаях стабильные гибриды формируются, когда приблизительно немногим менее чем 10% оснований являются неподходящими, пропуская петли из четырех или более нуклеотидов. Следовательно, как применяют здесь, термин «комплементарный» относится к олигонуклеотиду, формирующему стабильный дуплекс со своим «комплементом» в условиях анализа, как правило, когда гомология составляет 90% или более.
Термины «гибридизовать» и «гибридизация» относятся к формированию комплексов между последовательностями нуклеотидов, достаточно комплементарными, чтобы формировать комплексы посредством образования пар оснований по Уотсону-Крику. Когда праймер «гибридизуется» с мишенью (матрицей), такие комплексы (или гибриды) достаточно стабильны, чтобы выполнять затравочную функцию, например, необходимую ДНК-полимеразе для инициации синтеза ДНК.
Как применяют здесь, термин «связывающаяся пара» относится к первой и второй молекулам, специфически связывающимся друг с другом, таким как комплементарные полинуклеотидные пары, способные к формированию дуплексов нуклеиновой кислоты. «Специфическое связывание» первого участника связывающейся пары со вторым участником связывающейся пары в образце подтверждают связыванием первого участника со вторым или, наоборот, с большей аффинностью и специфичностью, чем с другими компонентами в образце. Связывание между участниками связывающейся пары, как правило, является нековалентным. Если в контексте явно не указано иначе, термины «аффинная молекула» и «анализируемое вещество-мишень» здесь применяют для обозначения первого и второго участников связывающейся пары соответственно.
Термины «специфически связывающаяся молекула» и «аффинная молекула» здесь применяют поочередно, заменяя друг друга, и они относятся к молекуле, селективно связывающейся, химически или физически, с присутствующим в образце детектируемым субстратом. Под «селективным связыванием» подразумевают то, что молекула связывается предпочтительно с представляющей интерес мишенью или связывается с большей активностью с мишенью, чем с другими молекулами. Например, молекула нуклеиновой кислоты связывается с последовательностью, в значительной степени комплементарной ей, а не с не имеющей к ней отношения последовательностями.
«Температура плавления» или «Tm» двухцепочечной молекулы нуклеиновой кислоты определяют как температуру, при которой теряется половина спиральной структуры нуклеиновой кислоты вследствие нагревания или диссоциации водородных связей между парами оснований другим способом, например обработкой кислотой или щелочью или т.п. Tm молекулы нуклеиновой кислоты зависит от ее длины и от состава оснований. Молекулы нуклеиновой кислоты с большим содержанием пар оснований GC обладают большей Tm, чем молекулы нуклеиновой кислоты с избытком пар оснований AT. Разделенные комплементарные цепи нуклеиновых кислот спонтанно соединяются обратно или отжигаются с формированием дуплекса нуклеиновых кислот, когда температура снижается ниже, чем Tm. Наивысшая скорость гибридизации нуклеиновых кислот достигается при температуре приблизительно на 25°C ниже, чем Tm. Tm можно рассчитать, применяя следующее соотношение: Tm=69,3+0,41(GC)% (Marmur et al. (1962) J. Mol. Biol. 5: 109-118).
Как применяют здесь, «биологический образец» относится к образцу ткани или жидкости, полученному у субъекта, который, как правило, включает в себя антитела, продуцируемые субъектом. Типичные образцы включают в себя в качестве неограничивающих примеров кровь, плазму, сыворотку, кал, мочу, костный мозг, желчь, спинальную жидкость, лимфатическую жидкость, образцы кожи, секреты кожи, респираторного, кишечного и мочеполового трактов, слезы, слюну, молоко, клетки крови, органы, образцы биопсии, а также образцы составляющих клеточной культуры in vitro, включающие в себя в качестве неограничивающих примеров кондиционированные среды, образующиеся после роста клеток и тканей в культуральной среде, например рекомбинантные клетки и клеточные компоненты. Предпочтительные биологические образцы представляют собой кровь, плазму и сыворотку.
Как применяют здесь, термины «метка» и «детектируемая метка» относятся к молекуле, которую возможно обнаружить, включающей в качестве неограничивающих примеров радиоактивные изотопы, люминофоры, хемилюминесцентные средства, хромофоры, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, хромофоры, красители, ионы металлов, растворы металлов, лиганды (например, биотин, авидин, стрептавидин или гаптены) и т.п. Термин «люминофор» относится к веществу или его части, способной демонстрировать флуоресценцию в детектируемом диапазоне.
Как применяют здесь, «твердая подложка» относится к твердой поверхности, такой как магнитная гранула, латексная гранула, луночный планшет для микротитрования, стеклянная чашка, нейлон, агароза, акриламид и т.п.
II. Способы осуществления изобретения
Перед подробным описанием настоящего изобретения необходимо понять, что данное изобретение не ограничено конкретными композициями или параметрами процессов, которые, конечно, могут изменяться. Также необходимо понять, что применяемая здесь терминология предназначена только для цели описания конкретных осуществлений изобретения и не предназначена для ограничения.
Хотя в практическом осуществлении настоящего изобретения можно применять ряд композиций и способов, сходных или эквивалентных с описанными здесь композициями и способами, здесь описаны предпочтительные материалы и методы.
Как указано выше, настоящее изобретение основано на открытии новых диагностических способов для точного выявления инфекции вируса гепатита A (HAV) в биологическом образце. Способы зависят от чувствительных основанных на нуклеиновой кислоте способов выявления, позволяющих идентифицировать являющиеся мишенями последовательности нуклеиновой кислоты HAV в образцах, содержащих малое количество вируса. Конкретно, здесь автор заявки обнаружил, что применение последовательностей из 5'-UTR генома HAV обеспечивает быстрое и чувствительное выявление HAV в биологических образцах. Последовательности генома HAV, включающие в себя 5'-UTR, в ряде изолятов HAV известны. См., например, инвентарные номера NCBI K02990; AB020564; AB020565; AB020566; AB020567; AB020568; AB020569; AF268396; M16632; M14707; M20273; NC001489; X83302; Cohen et al. J. Virol. (1987) 61: 50-59. Посредством сравнения последовательностей из различных изолятов HAV легко можно определить данные и другие последовательности из 5'-UTR для применения по данному изобретению. Для удобства различные молекулы нуклеиновой кислоты для применения по настоящему изобретению пронумерованы относительно инвентарного номера NCBI K02990. Последовательность 5'-UTR находится в положениях 1-723 образца с инвентарным номером NCBI K02990.
В стратегии настоящего изобретения нуклеиновые кислоты-мишени отделяют от негомологичной ДНК/РНК. В одном аспекте нуклеиновые кислоты-мишени отделяют посредством формирования комплекса с твердой подложкой. В другом аспекте нуклеиновые кислоты-мишени выделяют применением захватывающих олигонуклеотидов, иммобилизованных на твердой подложке, где захватывающие олигонуклеотиды могут являться специфическими для организма, подлежащего определению. Выделенные нуклеиновые кислоты-мишени затем можно выявлять посредством применения олигонуклеотидных зондов, помеченных репортерными группами, или амплифицировать. Для HAV выделенные нуклеиновые кислоты-мишени предпочтительно амплифицируют с применением праймеров в нетранслируемой области, такой как 5'-UTR. Репрезентативные праймеры для данной области представляют собой праймеры, содержащие последовательности из SEQ ID №№ 1 и 2 (фиг. 1).
В одном аспекте настоящего изобретения биологический образец, потенциально содержащий нуклеиновые кислоты-мишени, приводят в контакт с твердой подложкой, необязательно несущей захватывающие олигонуклеотиды. Захватывающие олигонуклеотиды можно связывать с твердой подложкой, например, посредством ковалентного связывания части зонда с твердой подложкой, посредством аффинного связывания, образования водородных связей или неспецифического связывания.
Захватывающие олигонуклеотиды могут включать в себя приблизительно от 5 до приблизительно 500 нуклеотидов, предпочтительно, приблизительно от 10 до приблизительно 100 нуклеотидов или более предпочтительно, приблизительно от 10 до приблизительно 60 нуклеотидов или любое целое число в данных интервалах, такое как последовательность, включающая в себя 18, 19, 20, 21, 22, 23, 24, 25, 26... 35... 40 и т.д. нуклеотидов из представляющей интерес области. Репрезентативные захватывающие олигонуклеотиды, такие как захватывающие олигонуклеотиды, приведенные здесь на фиг. 3A-3F (SEQ ID №№ 10-15), получают из последовательности 5'-UTR изолята HAV.
Захватывающие олигонуклеотиды можно связывать с твердой подложкой множеством способов. Например, олигонуклеотид можно связывать с твердой подложкой посредством связывания 3'- или 5'-концевого нуклеотида захватывающего олигонуклеотида с твердой подложкой. Более предпочтительно, чтобы захватывающий олигонуклеотид связывался с твердой подложкой посредством линкера, служащего для создания дистанции между зондом и твердой подложкой. Линкер, как правило, составляет, по меньшей мере, 10-50 атомов в длину, более предпочтительно, по меньшей мере, 15-30 атомов в длину. Необходимая длина линкера зависит от конкретной применяемой твердой подложки. Например, когда в качестве твердой подложки применяют сетчатый полистирол, как правило, достаточно линкера длиной шесть атомов.
В данной области известно широкое множество линкеров, которые можно применять для связывания захватывающего олигонуклеотида с твердой подложкой. Линкер можно формировать из любого соединения, значительно не препятствующего гибридизации последовательности-мишени с захватывающим олигонуклеотидом, связанным с твердой подложкой. Линкер можно формировать из гомополимерного олигонуклеотида, который можно легко добавить к линкеру посредством автоматического синтеза. Гомополимерная последовательность может находиться или у 5'-конца или у 3'-конца специфической к вирусу последовательности. В одном аспекте изобретения захватывающие олигонуклеотиды для облегчения связывания с твердой подложкой можно сцепить с гомополимерной цепью, например, такой как poly(A), poly(T), poly(G), poly(C), poly(U), poly(dA), poly(dT), poly(dG), poly(dC) или poly(dU). Гомополимерная цепь может представлять собой приблизительно от 10 до приблизительно 40 нуклеотидов в длину, или, предпочтительно, приблизительно от 12 до приблизительно 25 нуклеотидов в длину, или любое целое число в пределах данных интервалов, такое как, например, 10... 12... 16, 17, 18, 19, 20, 21, 22, 23 или 24 нуклеотидов.
Репрезентативные гомополимерные последовательности включают в себя последовательности poly(T) или poly(A). Альтернативно, в качестве линкера можно применять полимеры, такие как функционализированный полиэтиленгликоль. Такие полимеры значимо не препятствуют гибридизации зонда с олигонуклеотидом-мишенью. Примеры связей включают в себя связи по типу полиэтиленгликоля, карбаматные и амидные связи. Связи между твердой подложкой, линкером и захватывающим олигонуклеотидом предпочтительно не расщепляются в течение удаления защитных групп оснований в основных условиях при высокой температуре.
Захватывающий олигонуклеотид также может являться фосфорилированным на 3'-конце для предотвращения удлинения захватывающего олигонуклеотида.
Твердая подложка может принимать множество форм, например, включающих в себя нитроцеллюлозу, измельченную до сыпучей формы и восстановленную при пропускании содержащей подложку среды с образцом через сито; нитроцеллюлозу или вещества, импрегнированные в магнитные частицы или т.п., позволяющие нитроцеллюлозе перемещаться в пределах среды образца при применении магнитного поля; гранулы или частицы, которые можно фильтровать или которые могут проявлять электромагнетические свойства; полистироловые гранулы, распределяющиеся на поверхности водной среды, и магнитный силикагель. Примеры предпочтительных типов твердых подложек для иммобилизации захватывающих олигонуклеотидов включают в себя стекло с контролируемым размером пор, стеклянные чашки, полистирол, покрытые авидином полистироловые гранулы, целлюлозу, нейлон, акриламидный гель и активированный декстран.
Один аспект настоящего изобретения включает твердую подложку, включающую магнитные силикагель или гранулы, необязательно из магнитного силикагеля, или гранулы, содержащие функциональные группы первичных аминов, облегчающие ковалентное связывание или ассоциацию захватывающих олигонуклеотидов с частицами магнитной подложки. Альтернативно, магнитные силикагель или гранулы несут иммобилизованные на них гомополимеры, такие как последовательности poly(T) или poly(A). Применение твердой подложки с магнитными силикагелем или гранулами позволяет проводить выделение, амплификацию и выявление способом «в одном контейнере», так как твердую подложку можно отделить от биологического образца магнитными силами.
Магнитные гранулы или частицы можно получать с применением стандартных способов или приобретать из коммерческих источников. Как правило, частицы или гранулы могут содержать магнитные частицы, хотя также они могут представлять собой другой магнитный металл или оксиды металлов, или в форме с примесями, или в форме сплава, или в комплексной форме, до тех пор, пока они обладают активной поверхностью и проявляют способность реагировать на магнитное поле. Другие вещества, которые можно применять отдельно или в сочетании с железом, включают в качестве неограничивающих примеров кобальт, никель и кремний. Магнитная гранула, пригодная для применения в настоящем изобретении, включает магнитные гранулы, содержащие группы poly(dT), продаваемые под торговой маркой магнитные гранулы олигонуклеотидов Sera-Mag™ Seradyn, Indianopolis, IN. Магнитный силикагель, пригодный для применения в настоящем изобретении включает магнитный силикагель MagPrep™ Novagen, Madison, WI.
Далее, связывание захватывающих олигонуклеотидов с твердой подложкой инициируют приведением твердой подложки в контакт со средой, содержащей захватывающие олигонуклеотиды. В одном аспекте магнитная гранула, несущая группы poly(dT), гибридизуется с последовательностями-мишенями, содержащими poly(dA), смежные с последовательностью, выбранной из консервативной одноцепочечной области генома HAV. Poly(dA) на захватывающем олигонуклеотиде и poly(dT) на твердой подложке гибридизуются, таким образом, иммобилизуя или связывая захватывающие олигонуклеотиды на твердой подложке. В другом аспекте на поверхности магнитной гранулы иммобилизуют нуклеотидные последовательности длиной приблизительно от 10 до приблизительно 75 нуклеотидов, предпочтительно, приблизительно от 10 до приблизительно 25 нуклеотидов, полученных из нуклеотидных последовательностей, описанных в находящейся на одновременном рассмотрении совместно поданной U.S. Patent Application Serial № 10/267922, поданной 9 октября 2002 года.
Твердую подложку приводят в контакт с биологическим образцом при высоких концентрациях хаотропных солей или в гибридизационных условиях. Захватывающие олигонуклеотиды гибридизуются с цепями-мишенями, присутствующими в биологическом образце. Как правило, гибридизация захватывающих олигонуклеотидов с мишенями может завершиться приблизительно за 15 минут, но может занимать такой длительный интервал времени, как интервал от 3 до 48 часов.
В другом аспекте магнитные частицы силикагеля помещают в среду, содержащую вещество-мишень в условиях, подобранных для обеспечения формирования комплекса. Комплекс наиболее предпочтительно формируется в смеси из магнитных частиц силикагеля, среды и хаотропной соли.
Хаотропные соли представляют собой соли хаотропных ионов, высокорастворимых в водных растворах. Хаотропные ионы, обеспечиваемые такими солями, при достаточно высоких концентрациях в водных растворах белков или нуклеиновых кислот вызывают денатурацию белков, потерю вторичной структуры нуклеиновыми кислотами или, в случае двухцепочечных нуклеиновых кислот, плавление. Полагают, что хаотропные ионы обладают данными эффектами потому, что они разрушают сеть водородных связей, существующую в жидкой воде и, таким образом, делают денатурированные белки и нуклеиновые кислоты термодинамически более стабильными, чем их правильно уложенные или структурированные копии. Репрезентативные хаотропные ионы включают, но не ограничивают, гуанидиний, йодид, перхлорат и трихлорацетат. Предпочтительным в настоящем изобретении является ион гуанидиния. Хаотропные соли включают, но не ограничивают, гуанидингидрохлорид, гуанидинтиоцианат, йодид натрия, перхлорат натрия и трихлорацетат натрия. Предпочтительными являются соли гуанидиния, а особенно предпочтительным является гуанидинтиоцианат.
Концентрация хаотропных ионов для применения в данном практическом осуществлении настоящего способа предпочтительно составляет приблизительно от 0,1 М до 7 М, но более предпочтительно приблизительно от 0,5 М до 5 М. Концентрация хаотропных ионов в смеси должна являться достаточно высокой, чтобы вызывать адгезию биологического материала-мишени к магнитным частицам силикагеля в смеси, но не настолько высокой, чтобы вызывать значительную денатурацию, деградацию или выпадение в осадок материала-мишени в смеси. Белки и крупные молекулы двухцепочечной нуклеиновой кислоты, такие как вирусные нуклеиновые кислоты, стабильны при концентрациях хаотропных солей от 0,5 до 2 М, но известно, что они выпадают в осадок из раствора при концентрации хаотропных солей больше чем приблизительно 2 М.
В одном аспекте настоящего изобретения формируемый, как описано выше, комплекс инкубируют до тех пор, пока, по меньшей мере, какое-либо количество вещества нуклеиновой кислоты не сцепится с магнитной частицей силикагеля для формирования комплекса. Данную стадию инкубации проводят при температуре, по меньшей мере, приблизительно 0°C, предпочтительно, по меньшей мере, приблизительно 4°C, и наиболее предпочтительно, по меньшей мере, приблизительно 20°C, при условии, что температура инкубации составляет не более чем приблизительно 75°C. Таким образом, здесь найдут применение температуры в интервалах от 0°C до 75°C, предпочтительно от 4°C до 50°C, и наиболее предпочтительно приблизительно от 15°C до приблизительно 35°C или температуры, составляющие любое целое число в пределах данных интервалов. Стадию инкубации предпочтительно проводят при температуре ниже температуры, при которой магнитные частицы силикагеля начинают терять свою способность к обратимому связыванию вещества нуклеиновой кислоты, и ее можно проводить приблизительно при комнатной температуре (например, приблизительно при 25°C).
Затем твердую подложку отделяют от биологического образца фильтрованием, пропуская через колонку или посредством магнитных сил. Как будет понятно специалисту в данной области, способ разделения зависит от типа выбранной твердой подложки. Так как мишени гибридизуются с захватывающими олигонуклеотидами, иммобилизованными на твердой подложке, цепи-мишени, таким образом, отделяются от примесей в образце. В некоторых случаях посторонние нуклеиновые кислоты, белки, углеводы, липиды, клеточный дебрис и другие примеси все еще могут оставаться связанными с подложкой, хотя и в значительно более низких концентрациях, чем исходно обнаруживаемые в биологическом образце. Специалисты в данной области должны понимать, что некоторые нежелательные материалы можно удалить промывкой подложки средой для промывания. Отделение твердой подложки от биологического образца предпочтительно удаляет, по меньшей мере, приблизительно 70%, более предпочтительно приблизительно 90% и наиболее предпочтительно, по меньшей мере, приблизительно 95% не являющихся мишенью нуклеиновых кислот, присутствующих в образце.
Способы по настоящему изобретению также могут включать амплификацию захваченных олигонуклеотидов-мишеней для получения амплифицированных нуклеиновых кислот. При амплификации нуклеиновой кислоты-мишени применяют полимеразу нуклеиновых кислот для получения множества копий олигонуклеотида-мишени или его фрагментов. Пригодные способы амплификации, например, такие как связанная с транскрипцией амплификация, полимеразная цепная реакция (ПЦР), опосредованная репликазой амплификация и лигазная цепная реакция (ЛЦР), хорошо известны в данной области.
Праймеры для применения в анализе по изобретению предпочтительно уникальны для организма, присутствие которого определяют. Таким образом, например, для выявления HAV праймеры, такие как приведены на фиг. 1, получают из консервативных областей в нетранслируемой области HAV.
Праймеры и захватывающие олигонуклеотиды для применения в анализах легко синтезировать стандартными способами, например твердофазным синтезом с применением фосфорамидатной химии, как описано в патентах США №№ 4458066 и 4415732; Beaucage et al. (1992) Tetrahedron 48:2223-2311 и Applied Biosystems User Bulletin № 13 (1 April 1987). Другие способы химического синтеза включают, например, фосфотриэфирный способ, описанный Narang et al., Meth. Enzymol. (1979) 68:90 и фосфодиэфирный способ, описанный Brown et al., Meth. Enzymol. (1979) 68:109. С применением тех же способов в зонды можно ввести poly(A), или poly(C), или другие некомплементарные вставки из нуклеотидов. Способами, известными в данной области, с зондами можно связать вставки из гексаэтиленоксида. Cload et al. (1991) J. Am. Chem. Soc. 113:6324-6326; патент США № 4914210, выданный Levenson et al.; Durand et al. (1990) Nucleic Acids Res. 18:6353-6359 и Horn et al. (1986) Tet. Lett. 27:4705-4708. Как правило, праймерные последовательности находятся в диапазоне от 10 до 75 нуклеотидов в длину, например 15-60, 20-40 и т.д., наиболее типично - в диапазоне от 18 до 40 нуклеотидов в длину, и они могут обладать любой длиной в указанных диапазонах. Типичный зонд находится в диапазоне от 10 до 50 нуклеотидов в длину, например 15-40, 18-30 и т.д., и он может обладать любой длиной в указанных диапазонах.
Кроме того, зонды можно связать с детектируемыми метками. Существует несколько известных средств для дериватизации олигонуклеотидов реакционными функциональными группами, позволяющими добавление метки. Например, для биотинилированных зондов доступны несколько подходов для того, чтобы посредством авидина являлось возможным присоединить радиоактивные, флуоресцентные, хемилюминесцентные, ферментативные или электроноплотные метки. См., например, Broken et al., Nucl. Acids Res. (1978) 5:363-384, где описано применение ферритин-авидин-биотиновой метки и Chollet et al. Nucl. Acids Res. (1985) 13:1529-1541, где описана биотинилизация 5'-конца олигонуклеотидов посредством аминоалкилфосфорамидного линкерного спейсера. Также доступно несколько способов для синтеза дериватизированных аминогруппами олигонуклеотидов, которые легко метить флуоресцентным или другими типами соединений, дериватизированных реагирующими с аминогруппами группами, такими как изотиоцианат, N-гидроксисукцинимид или т.п., см., например, Connolly (1987) Nucl. Acids Res. 15:3131-3139, Gibson et al. (1987) Nucl. Acids Res. 15:6455-6467 и патент США № 4605735, выданный Miyoshi et al. Также доступны способы для синтеза дериватизированных сульфгидрильными группами олигонуклеотидов, которые могут вступать в реакцию со специфичными к тиолам метками, см., например, патент США № 4757141, выданный Fung et al., Connolly et al. (1985) Nucl. Acids Res. 13:4485-4502 и Spoat et al. (1987) Nucl. Acids Res. 15:4837-4848. Полный обзор способов для мечения фрагментов нуклеиновой кислоты предоставлен в Matthews et al., Anal. Biochem. (1988) 169:1-25.
Например, зонды можно метить флуоресцентной меткой посредством связывания флуоресцентной молекулы с несвязанным с лигандами концом зонда. Руководство для выбора подходящих флуоресцентных меток можно найти в Smith et al., Meth. Enzymol. (1987) 155:260-301; Karger et al., Nucl. Acids Res. (1991) 19:4955-4962; Haugland (1989) Handbook of Fluorescent Probes and Research Chemicals (Molecular Probes, Inc., Eugene, OR). Предпочтительные флуоресцентные метки включают в себя флуоресцеин и его производные, такие как описаны в патенте США № 4318846 и у Lee et al., Cytometry (1989) 10:151-164 и 6-FAM (флуоресцеин), JOE (2',7'-диметокси-4',5'-дихлорофлуоресцеин), TAMRA (тетраметилродамин), ROX (роданин X), HEX-1, HEX-2, ZOE, TET-1 или NAN-2 и т.п.
Кроме того, зонды можно метить акридиновым эфиром (AE) с применением описанного ниже способа. Современные способы позволяют поместить AE-метку в любом положении в пределах зонда. См., например, Nelson et al. (1995) «Detection of Acridinium Esters by Chemiluminescence» в Nonisotopic Probing, Blotting and Sequencing, Kricka L.J. (ed) Academic Press, San Diego, CA; Nelson et al. (1994) «Application of the Hybridization Protection Assay (HPA) to PCR» в The Polymerase Chain Reaction, Mullis et al. (eds.) Birkhauser, Boston, MA; Weeks et al., Clin. Chem. (1983) 29:1474-1479; Berry et al., Clin. Chem. (1988) 34:2087-2090. Молекулу AE можно непосредственно присоединить к зонду с применением химии не основанного на нуклеотидах линкера, позволяющего размещать метку в любом положении в пределах зонда. См., например, патенты США №№ 5585481 и 5185439.
В определенных осуществлениях добавляют внутренний контроль (IC) или внутренний стандарт для применения в качестве контроля захвата мишени и амплификации. Предпочтительно, IC включает последовательность, отличающуюся от последовательностей-мишеней, способен к гибридизации с зондовыми последовательностями, применяемыми для отделения олигонуклеотидов, специфических для организма образца, и способен к амплификации. Применение внутреннего контроля позволяет контролировать процесс отделения, процесс амплификации и систему выявления и позволяет контролировать выполнение анализа и количественное определение для образца(ов). IC можно ввести в любом подходящем месте, например в буфере для лизиса. В одном осуществлении IC включает РНК, содержащую часть нуклеотидной последовательности HAV и уникальную последовательность, гибридизующуюся с зондом. Таким образом, в определенных осуществлениях IC включает часть генома HAV с модифицированными последовательностями из 5-30 нуклеотидов, например из 6... 9... 12... 15... 20 и т.д. или более оснований, замещенных другими основаниями. Замещающие основания могут располагаться по всей длине последовательности-мишени, так что замещены только 2 или 3 следующие друг за другом последовательности. Репрезентативные IC для HAV приведены на фиг. 4B и содержат 721 п.н., полученных из 5'-UTR генома HAV. Напечатанные полужирным шрифтом в верхнем регистре основания на фиг. 4B представляют собой основания, замещающие основания, находящиеся в последовательности дикого типа (см. фиг. 4A). Анализ может дополнительно включать зонды, специфичные к внутреннему стандарту (зонд IC).
Репрезентативные зонды для последовательности IC подробно описаны в примерах как SEQ ID №№ 18 и 19. Зонд IC можно необязательно связать с детектируемой меткой, отличающейся от детектируемой метки для последовательности-мишени. В тех осуществлениях, где детектируемая метка представляет собой люминофор, IC можно количественно определить спектрофотометрически и исследованиями предела выявления.
Как правило, количество копий IC, не препятствующих выявлению мишени, определяют посредством титрования IC фиксированным IU/копии/PFU мишени, предпочтительно на нижнем пределе, и строят стандартную кривую посредством разведения образца принятого на международном уровне стандарта.
В другом осуществлении, как описано здесь, IC объединяют с РНК, выделенной из образца в соответствии со стандартными способами, известными специалистам в данной области. Затем РНК подвергают обратной транскрипции с применением обратной транскриптазы для получения кДНК. Последовательности кДНК необязательно можно амплифицировать (например, посредством PCR) с применением меченых праймеров. Продукты амплификации разделяют, как правило, посредством электрофореза и определяют количество включенной метки (пропорционально количеству амплифицированного продукта). Затем подсчитывают количество РНК в образце посредством сравнения с сигналом, генерируемым известными стандартами.
Описанные выше праймеры и зонды можно применять в основанных на полимеразной цепной реакции (ПЦР) способах для выявления инфекции HAV в биологических образцах. ПЦР представляет собой способ амплификации желательной являющейся мишенью последовательности нуклеиновой кислоты, содержащейся в молекуле нуклеиновой кислоты или смеси молекул. В ПЦР применяют пару праймеров в избытке, гибридизующихся с комплементарными цепями нуклеиновой кислоты-мишени. Полимераза удлиняет каждый из праймеров, используя нуклеиновую кислоту-мишень в качестве матрицы. Продукты удлинения сами становятся последовательностями-мишенями после диссоциации с исходной цепью-мишенью. Затем гибридизуются новые праймеры, и их удлиняет полимераза, а цикл повторяется, геометрически увеличивая количество молекул последовательности-мишени. Способ ПЦР для амплификации являющихся мишенями последовательностей нуклеиновых кислот в образце хорошо известен в данной области и описан, например, у Innis et al. (eds.) PCR Protocols (Academic Press, NY 1990); Taylor (1991) Polymerase chain reaction: basic principles and automation, in PCR: A Practical Approach, McPherson et al. (eds.) IRL Press, Oxford; Saiki et al. (1986) Nature 324: 163; а также в патентах США №№ 4683195, 4683202 и 4889818.
Конкретно, в ПЦР используют относительно короткие олигонуклеотидные праймеры, фланкирующие нуклеотидную последовательность-мишень, подлежащую амплификации, ориентированные так, чтобы их 3'-концы были обращены друг к другу, каждый праймер удлиняется в направлении другого. Из образца выделяют полинуклеотид и денатурируют, предпочтительно нагреванием, и гибридизируют с первым и вторым праймерами, находящимися в молярном избытке. Полимеризация запускается в присутствии четырех дезоксирибонуклеотидтрифосфатов (dNTP - dATP, dGTP, dCTP и dTTP) с применением зависимого от праймера и матрицы полимеризующего полинуклеотид средства, такого как фермент, способный к образованию продуктов удлинения праймеров, например, ДНК-полимераза I E. coli, фрагмент Кленова ДНК-полимеразы I, ДНК-полимераза T4, термостабильные ДНК-полимеразы, выделяемые из Thermus aquaticus (Taq), доступные из множества источников (например, Perkin Elmer), Thermus thermophilus (United States Biochemicals), Bacillus stereothermophilus (Bio-Rad) или Thermococcus litoralis (полимераза «Vent», New England Biolabs). Это приводит к двум «длинным продуктам», содержащим соответствующие праймеры, на своих 5'-концах ковалентно связанные с вновь синтезированными комплементарными исходным цепями. Затем реакционную смесь возвращают к условиям полимеризации, например, посредством снижения температуры, инактивации денатурирующего средства или добавлением дополнительной полимеразы, и начинают второй цикл. После второго цикла образуются две исходные цепи, два длинных продукта из первого цикла, два новых длинных продукта, реплицировавшихся с исходных цепей и два «коротких продукта», реплицировавшихся с длинных продуктов. Короткие продукты обладают последовательностью последовательности-мишени с праймером на каждом конце. На каждом дополнительном цикле образуются два дополнительных длинных продукта и некоторое количество коротких продуктов, равное количеству длинных и коротких продуктов, существующих в конце предыдущего цикла. Таким образом, количество коротких продуктов, содержащих последовательность-мишень, экспоненциально растет с каждым циклом. Предпочтительно ПЦР проводят в коммерчески доступных термоциклерах, например, Perkin Elmer.
РНК можно амплифицировать посредством обратной транскрипции мРНК в кДНК и последующего проведения ПЦР (ОТ-ПЦР), как описано выше. Альтернативно, для обеих стадий можно применять один фермент, как описано в патенте США № 5322770. мРНК также можно подвергнуть обратной транскрипции в кДНК с последующей лигазной цепной реакцией несимметричных разрывов (RT-AGLCR), как описано у Marshall et al. (1994) PCR Meth. App. 4:80-84.
Флуорогенный 5'-нуклеазный анализ, известный как анализ TaqMan™ (Perkin-Elmer), представляет собой мощную и универсальную основанную на ПЦР систему выявления для нуклеиновых кислот-мишеней. Следовательно, для выявления наличия инфекции в биологическом образце в анализах TaqMan™ можно применять описанные здесь праймеры и зонды, полученные из областей генома HAV. Анализ проводят в сочетании с циклическим изменением температуры посредством слежения за образованием флуоресцентных сигналов. Система анализа обходится без необходимости гель-электрофоретического анализа и обладает способностью получать количественные данные, предоставляя возможность определения количества копий мишени.
Флуорогенный 5'-нуклеазный анализ легко проводить с применением, например, ДНК-полимеразы AmpliTaq Gold, обладающей эндогенной 5'-нуклеазной активностью для расщепления внутреннего олигонуклеотидного зонда, меченного флуоресцентным репортерным красителем и гасителем (см. Holland et al., Proc. Natl. Acad. Sci. USA (1991) 88:7276-7280 и Lee et al., Nucl. Acids Res. (1993) 21:3761-3766). Результаты анализа определяют измерением изменений флуоресценции, происходящих в течение цикла амплификации, так как флуоресцентный зонд расщепляется, разобщая метку-краситель и метку-гаситель и вызывая увеличение флуоресцентного сигнала, пропорционального увеличению количества нуклеиновой кислоты-мишени.
Продукты амплификации можно выявлять в растворе или применяя твердые подложки. В данном способе зонд TaqMan™ разработан так, чтобы гибридизоваться к последовательности-мишени в пределах желательного продукта ПЦР. На 5'-конце зонда TaqMan™ находится флуоресцентный репортерный краситель. 3'-конец зонда блокирован для предотвращения удлинения зонда и содержит краситель, гасящий флуоресценцию люминофора на 5'-конце. В течение последующей амплификации 5'-концевая флуоресцентная метка отщепляется, если в реакционной смеси присутствует полимераза с 5'-экзонуклеазной активностью. Удаление люминофора с 5'-конца приводит к увеличению флуоресценции, которое можно выявить.
Таким образом, в одном аспекте настоящее изобретение относится к способам амплификации являющейся мишенью нуклеотидной последовательности HAV с применением полимеразы нуклеиновой кислоты с 5'→3'-нуклеазной активностью, одного или нескольких праймеров, способных к гибридизации с последовательностью-мишенью HAV и олигонуклеотидного зонда, способного к гибридизации с являющейся мишенью последовательностью HAV ближе к 3'-концу относительно праймера. В течение амплификации полимераза разрушает олигонуклеотидный зонд, когда он гибридизирован с последовательностью-мишенью, таким образом, отделяя репортерную молекулу от молекулы-гасителя. В течение амплификации следят за флуоресценцией репортерной молекулы, соответствующей увеличению количества нуклеиновой кислоты. Репортерная молекула предпочтительно представляет собой флуоресцентный краситель, а молекула-гаситель предпочтительно представляет собой родаминовый краситель.
Хотя длина праймеров и зондов может изменяться, последовательности зондов выбирают так, чтобы они обладали более высокой температурой плавления, чем последовательности праймеров. Предпочтительно, последовательности зондов обладают рассчитанной температурой плавления, которая приблизительно на 10°C выше, чем температура плавления для последовательностей праймеров для амплификации. Следовательно, последовательности праймеров, как правило, короче, чем последовательности зондов. Как правило, последовательности праймеров находятся в диапазоне от 10 до 75 нуклеотидов в длину, более типично - в диапазоне от 20 до 45. Типичный зонд находится в диапазоне от 10 до 50 нуклеотидов в длину, более типично - от 15 до 40 нуклеотидов в длину.
Подробное описание анализа TaqMan™, реагентов и условий для применения в данном изобретении см., например, Holland et al., Proc. Natl. Acad. Sci, U.S.A. (1991) 88:7276-7280; патенты США №№ 5538848, 5723591 и 5876930.
Описанные здесь последовательности HAV также можно применять в качестве основы для анализа опосредованной транскрипцией амплификации (TMA). TMA предоставляет способ идентификации последовательностей нуклеиновых кислот-мишеней, находящихся в образце в очень малых количествах. Такие последовательности может являться трудным или невозможным выявлять с применением способов прямого анализа. Конкретно, TMA представляет собой изотермическую, аутокаталитическую систему амплификации нуклеиновой кислоты-мишени, которая может обеспечить более чем миллиард копий РНК последовательности-мишени. Анализ можно проводить качественно для точного выявления присутствия или отсутствия последовательности-мишени в биологическом образце.
Анализ также предоставляет возможность количественного определения количества последовательности-мишени в диапазоне концентраций, составляющем несколько порядков. TMA предоставляет способ автокаталитического синтеза множества копий являющейся мишенью последовательности нуклеиновой кислоты без повторяющихся манипуляций с условиями реакций, такими как температура, ионная сила и pH.
Обычно TMA включает в себя следующие стадии: (a) выделение нуклеиновой кислоты, включающей в себя РНК, из представляющего интерес биологического образца, предположительно инфицированного HAV; и (b) объединение в реакционной смеси (i) выделенной нуклеиновой кислоты, (ii) первого и второго олигонуклеотидных праймеров, где первый праймер обладает образующей комплекс последовательностью, полностью комплементарной 3'-концевой части последовательности РНК-мишени, чтобы образовать с ней, если она присутствует (например, (+)-цепь), комплекс, а второй праймер обладает образующей комплекс последовательностью, полностью комплементарной 3'-концевой части последовательности, комплементарной мишени (например, (-)-цепи), чтобы образовать с ней комплекс, где первый олигонуклеотид ближе к 5' от комплексообразующей последовательности дополнительно содержит последовательность, включающую в себя промотор, (iii) обратной транскриптазы или РНК- и ДНК-зависимых ДНК-полимераз, (iv) ферментативной активности, избирательно разрушающей РНК-цепь комплекса РНК-ДНК (такой как РНКаза H) и (v) РНК-полимеразы, узнающей промотор.
Компоненты реакционной смеси можно объединять последовательно или одновременно. Реакционную смесь инкубируют в условиях, в которых формируется комплекс олигонуклеотид/последовательность-мишень, включающих в себя условия гибридизации праймеров с нуклеиновой кислотой и условия синтеза нуклеиновой кислоты (включающей в себя рибонуклеозидтрифосфаты и дезоксирибонуклеозидтрифосфаты), в течение периода времени, достаточного для формирования множества копий последовательности-мишени. Реакцию преимущественно проводят в условиях, подходящих для поддержания стабильности реакционных компонентов, таких как входящие в состав ферменты, и без необходимости модификации условий реакции или манипуляции ими в ходе реакции амплификации. Следовательно, реакцию можно проводить в условиях, являющихся по существу изотермическими и включающих в себя, по существу, постоянную ионную силу и pH. Удобно, что реакция не требует стадии денатурации для разделения комплекса РНК-ДНК, образуемого при первой реакции удлинения ДНК.
Пригодные ДНК-полимеразы включают в себя обратные транскриптазы, такие как обратная транскриптаза вируса миелобластоза птиц (AMV) (например, доступная в Seikagaku America, Inc.) и обратная транскриптаза вируса лейкоза мышей Молони (MMLV) (например, доступная в Bethesda Research Laboratories).
Промоторы или промоторные последовательности, пригодные для введения в праймеры, представляют собой последовательности нуклеиновых кислот (или существующие в природе, или полученные синтетически, или являющиеся продуктом расщепления рестриктазами), специфически узнаваемые РНК-полимеразой, узнающей и связывающей данную последовательность и инициирующей процесс транскрипции, вследствие чего образуются транскрипты РНК. Последовательность необязательно может содержать выходящие за пределы реального сайта узнавания РНК-полимеразой нуклеотидные основания, которые могут придавать дополнительную стабильность или чувствительность к процессам деградации или повышенную эффективность транскрипции. Примеры пригодных промоторов включают в себя промоторы, узнаваемые определенными полимеразами бактериофагов, такими как полимеразы бактериофага T3, T7 или SP6, или промотор E. coli. Данные РНК-полимеразы легко доступны в коммерческих источниках, таких как New England Biolabs или Epicentre.
Некоторые обратные транскриптазы, пригодные для применения в описанных здесь способах, такие как обратная транскриптаза AMV, обладают активностью РНКазы H. Однако может являться предпочтительным добавлять экзогенную РНКазу H, такую как РНКаза H E. coli, даже если применяют обратную транскриптазу AMV. РНКаза H легко доступна, например, в Bethesda Research Laboratories.
Полученные данными способами транскрипты РНК могут служить в качестве матриц для получения дополнительных копий последовательности-мишени посредством описанных выше способов. Система является автокаталитической, и амплификация происходит автокаталитически без необходимости повторяющейся модификации или изменения условий реакции, таких как температура, pH, ионная сила или т.п.
Выявление можно осуществлять с применением широкого множества способов, включающих в себя прямое определение последовательности, гибридизацию со специфичными к последовательности олигомерами, гель-электрофорез и масс-спектрометрию. Данные способы можно применять в гетерогенном или гомогенном формате, с применением изотопной или неизотопной метки, а также совсем без метки.
Один из предпочтительных способов выявления представляет собой применение описанных выше олигонуклеотидных зондов, специфичных к последовательностям-мишеням. Зонды можно применять для анализов защиты от гибридизации (HPA). В настоящем осуществлении зонды метят акридиновым эфиром (AE), высокохемилюминесцентной молекулой, что удобно. См., например, Nelson et al. (1995) «Detection of Acridinium Esters by Chemiluminescence» in Nonisotopic Probing, Blotting and Sequencing, Kricka L. J. (ed) Academic Press, San Diego, CA; Nelson et al. (1994) «Application of the Hybridization Protection Assay (HPA) to PCR» in The Polymerase Chain Reaction, Mullis et al. (eds. ) Birkhauser, Boston, MA; Weeks et al., Clin. Chem. (1983) 29:1474-1479; Berry et al., Clin. Chem. (1988) 34:2087-2090. Одну молекулу AE присоединяют непосредственно к зонду с применением химии не основанных на нуклеотидах линкеров, что позволяет вводить метку в любое положение внутри зонда. См., например, патенты США №№ 5585481 и 5185439. Хемилюминесценцию инициируют реакцией с щелочной перекисью водорода, что приводит к возбуждению N-метилакридона, далее распадающегося до основного состояния с испусканием фотона.
Когда молекула AE ковалентно присоединяется к зонду из нуклеиновой кислоты, гидролиз происходит быстро в мягких щелочных условиях. Когда меченный AE зонд полностью комплементарен нуклеиновой кислоте-мишени, скорость гидролиза AE значительно снижена. Таким образом, прогибридизовавшийся и непрогибридизовавшийся меченный AE зонд можно определять непосредственно в растворе без необходимости физического разделения.
Как правило, HPA включает в себя следующие стадии: (a) меченный AE зонд гибридизуют с нуклеиновой кислотой-мишенью в растворе в течение приблизительно от 15 до приблизительно 30 минут. Затем добавляют слабый щелочной раствор, и AE, связанный с непрогибридизовавшимся зондом, гидролизуется. Данная реакция занимает приблизительно от 5 до 10 минут. Оставшийся связанный с прогибридизовавшимся зондом AE определяют в качестве меры количества присутствующей мишени. Данная стадия занимает приблизительно от 2 до 5 секунд. Предпочтительно стадию дифференциального гидролиза проводят при той же температуре, что и стадию гибридизации, как правило, при температуре от 50 до 70°C. Альтернативно, вторую стадию дифференциального гидролиза можно проводить при комнатной температуре. Это позволяет применять повышенные значения pH, например, в диапазоне 10-11, что приводит к большим различиям в скорости гидролиза между прогибридизовавшимся и непрогибридизовавшимся меченным AE зондом. HPA подробно описан, например, в патентах США №№ 6004745; 5948899 и 5283174.
TMA подробно описан, например, в патенте США № 5399491. В одном примере типичного анализа образец выделенной нуклеиновой кислоты, предположительно содержащей являющуюся мишенью последовательность HAV, смешивают с концентратом буфера, содержащим буфер, соли, магний, нуклеотидтрифосфаты, праймеры, дитиотреитол и спермидин. Реакционную смесь необязательно инкубируют приблизительно при 100°C приблизительно 2 минуты для денатурации любой вторичной структуры. После охлаждения до комнатной температуры в реакционную смесь добавляют обратную транскриптазу, РНК-полимеразу и РНКазу H и инкубируют смесь от одного до четырех часов при 37°C. Затем реакционную смесь можно анализировать посредством денатурации продукта, добавления раствора зонда, инкубации 20 минут при 60°C, добавления раствора для избирательного гидролиза непрогибридизовавшегося зонда, инкубации реакционной смеси в течение шести минут при 60°C и измерения оставшейся хемилюминесценции в люминометре.
Как можно легко понять, разработка описанных здесь анализов является объектом большого количества изменений, и в данной области известно много форматов. Указанные выше описания приведены только в качестве руководства, и специалист в данной области может легко модифицировать описанные протоколы с применением хорошо известных в данной области способов.
Описанные выше реагенты для анализа, включающие в себя праймеры, зонды, твердые подложки со связанными зондами, а также другие реагенты для определения, можно предоставлять в наборах с подходящими инструкциями и другими необходимыми реагентами для того, чтобы проводить анализы, как описано выше. Набор, как правило, в отдельных контейнерах содержит сочетание праймеров и зондов (или уже связанных с твердой матрицей, или отдельно с реагентами для связывания их с матрицей), контрольные композиции (положительные и/или отрицательные), меченые реагенты, когда формат анализа требует каких-либо из них, и образующие сигнал реагенты (например, субстрат для фермента), если метка не генерирует сигнал непосредственно. Обычно в набор включают инструкции (например, письменные, кассету, VCR, CD-ROM и т.д.) для проведения анализа. В зависимости от конкретного применяемого анализа набор может содержать также другие упакованные реагенты и вещества (например, буферы для промывки и т.п.). С применением данных наборов можно проводить стандартные анализы, такие как описаны выше.
III. Экспериментальная часть
Ниже приведены примеры конкретных осуществлений выполнения настоящего изобретения. Примеры представлены только с целями иллюстрации и не предназначены для ограничения области настоящего изобретения каким-либо способом.
Предприняты усилия, чтобы убедиться в точности по отношению к применяемым цифрам (например, количества, температуры и т.д.), однако, несомненно, допускаются некоторые экспериментальные ошибки и отклонения.
В приведенных ниже примерах ферменты приобретали в коммерческих источниках и применяли согласно рекомендациям производителей. Нитроцеллюлозные фильтры и т.п. также приобретали в коммерческих источниках.
При выделении фрагментов РНК и ДНК, за исключением того, где указано, все манипуляции с РНК и ДНК проводили стандартными способами. См. Sambrook et al., выше. Рестрикционные ферменты, ДНК-лигазу T4, E. сoli, ДНК-полимеразу I, фрагмент Кленова и другие биологические реагенты можно приобретать у коммерческих поставщиков и применять согласно руководствам производителей. Двухцепочечные фрагменты нуклеиновых кислот разделяли в агарозных гелях.
Пример 1
Выделение РНК HAV из биологического образца
Сыворотку, содержащую нуклеиновую кислоту HAV, приобретали в BioClinical Partners (Berkeley, CA). Для выделения нуклеиновой кислоты из образца применяли два подхода. Конкретно, РНК выделяли (a) связыванием с силикагелем; и (b) отжигом со специфичными к мишени олигонуклеотидами.
(a) Выделение нуклеиновой кислоты связыванием
с силикагелем
РНК выделяли связыванием с силикагелем с применением способа, описанного Boom, R. et al. (1990) «Rapid and simple method for purification of nucleic acids» J. Clin. Microbiol. 28, 495-503. В присутствии высоких концентраций хаотропной соли, такой как гуанидинизотиоцианат, нуклеиновые кислоты связываются с силикагелем. Нуклеиновые кислоты малого размера связываются с силикагелем более эффективно в условиях кислого pH. Связанные нуклеиновые кислоты эффективно элюируют при низкой концентрации соли в буфере со щелочным pH при высоких температурах. Замена обычного силикагеля намагниченным силикагелем значительно облегчает стадии промывки и элюции при выделении нуклеиновой кислоты. Для захвата частиц силикагеля со связанной нуклеиновой кислотой применяют магнитную основу, таким образом, исключая центрифугирование, необходимое для осаждения частиц обычного силикагеля.
Применяли буфер для лизиса из Organon-Teknika (Durham, NC). Данный буфер для лизиса содержит гуанидинизотиоцианат для растворения белков и инактивации РНКаз и ДНКаз. Детергент Triton X-100 дополнительно облегчает процесс растворения и разрушения клеточной структуры и ядерных белков, таким образом, высвобождая нуклеиновую кислоту. Реагент для лизиса подкисляли для усиления связывания нуклеиновой кислоты и для элюции связанной нуклеиновой кислоты применяли 50 мкл щелочного буфера для элюции. Для выделения нуклеиновой кислоты из 2,0 мл содержащей IgM к HAV плазмы применяли предварительно разделенный по 9 мл реагент для лизиса. Для захвата частиц силикагеля, связанных с нуклеиновой кислотой, применяли намагниченный силикагель (MagPrep particles из Novagen, Madison, WI), таким образом исключая стадии центрифугирования, необходимые для осаждения обычных частиц силикагеля. Связанные нуклеиновые кислоты элюировали в 50 мкл 10 мМ Tris pH 9.0, содержащего 1 мМ ЭДТА. После выделения нуклеиновых кислот присутствие HAV определяли посредством ПЦР TaqMan™, как описано ниже.
(b) Выделение нуклеиновой кислоты отжигом со специфичными к мишени олигонуклеотидами
Хотя применение намагниченного силикагеля сильно способствует быстрой и простой обработке в течение стадий промывки и элюции, выделение нуклеиновой кислоты по-прежнему остается трудоемким и занимающим много времени. Поэтому применяли одностадийный захват специфической нуклеиновой кислоты-мишени из плазмы или сыворотки с применением магнитных гранул. Чтобы сделать данный способ применимым для широкого ряда тестов захвата вирусной нуклеиновой кислоты, применяли универсальные магнитные гранулы, связанные с олиго-dT. Применяли магнитные гранулы с олиго-dT Sera-Mag (Seradyn, Indianapolis, IN) с олиго-dT длиной приблизительно 14 п.н. в сочетании с захватывающими олигонуклеотидами, содержащими poly(А)-хвост на 3'-конце, прилегающий к последовательности, специфичной к HAV (обозначенной на конце указанной ниже последовательности).
Магнитные гранулы суспендировали в 0,4 мл не содержащего праймеров буфера для лизиса TMA (GenProbe, San Diego, CA) и тестировали захватывающие праймеры по отдельности или в сочетании. После захвата гранулы промывали три раза буфером для промывки 10 мМ Hepes (pH 7,5), 0,5% NP-40, содержащим 0,3 M NaCl. Гранулы с захваченной нуклеиновой кислотой суспендировали в 100 мкл одностадийного реагента TaqMan™ для ОТ-ПЦР и переносили в микропланшет TaqMan™ для ОТ-ПЦР для выявления посредством ПЦР TaqMan™, как описано ниже. Как выявлено посредством анализа TaqMan™, эффективными для захвата HAV оказались несколько сочетаний олигонуклеотидов.
Применяемые захватывающие олигонуклеотиды приведены ниже (нумерация, указанная в конце последовательности, соответствует положению в геноме HAV относительно инвентарного номера NCBI K02990). Захватывающие последовательности представляют собой последовательности, обратно комплементарные указанным положениям, так как HAV является РНК-вирусом с положительной цепью:
CGGCGTTGAATGGTTTTTGTCAAAAAAAAAAAAAAAAAAAAAAp
(нуклеотиды 483-503 и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 4)
TCACCAATATCCGCCGCTGTTACCAAAAAAAAAAAAAAAAAAAAAAp
(нуклеотиды 451-474, и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 5)
AATTTAGACTCCTACAGCTCCATGCTAATAAAAAAAAAAAAAAAAAAAAAAp
(нуклеотиды 291-319 и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 6)
TTGACCCCGCCGGGCGCAAAAAAAAAAAAAAAAAAAAAAp
(264-280, и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 7)
GAGCCTAGGGCAAGGGGAGAGCCAAAAAAAAAAAAAAAAAAAAAAp
(233-255, и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 8)
AGCCTATAGCCTAGGCAAACGGCAAAAAAAAAAAAAAAAAAAAAAp
(73-95, и 22 п.н. poly(A)-хвоста, p=фосфорилированный) (SEQ ID №: 9)
Пример 2
Выявление РНК HAV посредством TaqMan™
Для амплификации захваченной РНК-мишени применяли способ TaqMan™. Для этого олигонуклеотиды для амплификации состояли из праймеров, специфичных для HAV. Праймеры являлись такими, как указано ниже.
Праймеры для амплификации и зонды для выявления в 5'-нетранслируемой области:
VHAV1-GGATTGATTGTCAGGGCTGTC (Смысловой праймер - нуклеотиды 538-558) (SEQ ID №: 1)
VHAV2-CCCTCTCACAGGATCCCATTT (Антисмысловой праймер - нуклеотиды 612-632, обратно комплементарный) (SEQ ID №: 2)
VHAV3-XCCTCTCTGTGCTTAGGGCAAACACCATTTZ (Зонд - нуклеотиды 576-605) (SEQ ID №: 3), где X=6-FAM (флуоресцеин), а Z = линкер + TAMRA (тетраметилродамин).
Нуклеиновую кислоту из примера 1 разводили для получения приблизительно 100 IU/20 мкл. Реагенты для анализа TaqMan™ приобретали в Applied Biosystems, Foster City, CA. Реакционная смесь для TaqMan™ в конечном объеме 50 мл содержала: 25 мл одностадийной смеси для ОТ-ПЦР TaqMan™, 0,5 пмоль каждого из праймеров для амплификации и 0,2 пмоль зонда. Условия реакции включали 30 мин при 48°C для прохождения ОТ, 10 мин при 96°C для активации фермента с последующими 45 циклами по 30 секунд при 95°C, сменяющимися 30 секундами при 60°C в ABI 7900 Sequence Detector. Для амплификации ПЦР применяли смысловой праймер VHAV1, антисмысловой праймер VHAV2 и зонд VHAV3.
Получали транскрипт внутреннего контроля длиной 721 нуклеотид, фиг. 4B (SEQ ID №: 17), который можно захватить и амплифицировать, но с измененной последовательностью связывания зонда. Буквы с полужирным шрифтом в последовательности, изображенной на фиг. 4B, представляют последовательность в IC, заменяющую последовательность в мишени (Фиг. 4A, SEQ ID №: 16). Иллюстративные последовательности зондов для IC представляют собой xCAGTGACATGCAGGTCTAGCTz (SEQ ID №: 18) или xCCCAGTGACATGCAGGTCTAGCTz (SEQ ID №: 19), где x = TET, а z = линкер + TAMRA.
Пример 3
Тестирование эффективности амплификации и сочетаний захватывающих олигонуклеотидов
На основе последовательности с инвентарным номером NCBI K02990 синтетически конструировали последовательность нуклеотидов 5'-UTR HAV. Последовательность клонировали в плазмиды M13 для получения одноцепочечной ДНК и выделяли ДНК.
(a) Эффективность амплификации
Концентрацию клонированной и выделенной ДНК определяли спектрофотометрически, а разведения ДНК, соответствующие от 10000 до 0,5 копий на реакцию, амплифицировали в анализе TaqMan™ и выявляли с применением способов, праймеров и зондов, описанных выше. Как правило, положительными считали сигналы образцов, полученные при <45 циклах при пороговом значении >0,2. Результаты приведены в таблице.
(b) Сочетание захватывающих олигонуклеотидов
Эффективность сочетаний захватывающих олигонуклеотидов/праймеров тестировали с применением 25 копия/реакция оцДНК. Наиболее эффективным являлось сочетание захватывающих олигонуклеотидов, включающее последовательности SEQ ID №№: 4, 5, 6, 7, 8 и 9.
Таким образом, описаны новые последовательности HAV и анализы для выявления с применением данных последовательностей. Из указанного выше необходимо принять во внимание, что хотя здесь описано специфическое осуществление изобретения, в целях иллюстрации можно вносить различные модификации без отклонения от его сущности и объема.
Реферат
Изобретение относится к области биотехнологии, в частности к набору из двух праймеров для амплификации нуклеиновой кислоты вируса гепатита А, к способу обнаружения вируса гепатита А в биологическом образце, а также к набору для обнаружения вируса гепатита А в биологическом образце. Способ обнаружения вируса гепатита A (HAV) в биологическом образце, содержащем антитела, продуцируемые индивидуумом, осуществляют путем приведения твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов. После чего проводят приведение твердой подложки в контакт с биологическим образцом в условиях гибридизации. Затем осуществляют отделение твердой подложки от образца. Далее проводят амплификацию выделенных нуклеиновых кислот с применением набора из двух праймеров. После чего осуществляют определение наличия амплифицированных нуклеиновых кислот в качестве признака наличия или отсутствия HAV в образце. Способ может также включать определение наличия амплифицированной внутренней контрольной последовательности. Предложенное изобретение позволяет разработать чувствительный, надежный диагностический тест для обнаружения вируса гепатита А (HAV) в биологических образцах от потенциально зараженных индивидов. 9 н. и 34 з.п. ф-лы, 5 ил., 1 табл.
Формула
выделение нуклеиновых кислот из биологического образца, в котором предполагают наличие HAV;
амплификацию выделенных нуклеиновых кислот с применением набора из двух праймеров по п.1 и
определение наличия амплифицированных нуклеиновых кислот в качестве признака наличия или отсутствия HAV в образце.
(a) приведение твердой подложки, содержащей связанные с ней захватывающие нуклеиновые кислоты, в контакт с биологическим образцом в условиях гибридизации, при которых цепи нуклеиновой кислоты-мишени гибридизуются с захватывающими нуклеиновыми кислотами; и
(b) отделение твердой подложки от образца.
выделение нуклеиновых кислот из биологического образца, в котором предполагают наличие HAV;
амплификацию выделенных нуклеиновых кислот с применением набора из двух праймеров по п.1 и
определение наличия амплифицированных нуклеиновых кислот в качестве признака наличия или отсутствия HAV в образце;
причем амплификация включает ПЦР, опосредованную транскрипцией амплификацию (ТМА) или TaqMan; и
обнаружение включает использование олигонуклеотидного зонда HAV, содержащего детектируемую метку, и олигонуклеотидный зонд HAV состоит по меньшей мере из 10 последовательных нуклеотидов последовательности SEQ ID NO:3.
(a) приведение твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов, где один или несколько олигонуклеотидов содержат последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14, в условиях, при которых захватывающие нуклеиновые кислоты связываются с твердой подложкой,
(b) приведение твердой подложки из (а) в контакт с биологическим образцом в условиях гибридизации, при которых цепи нуклеиновой кислоты-мишени HAV, если они присутствуют, гибридизуются с захватывающими нуклеиновыми кислотами; и
(c) отделение твердой подложки (b) от образца;
(d) амплификацию нуклеиновых кислот с помощью набора из двух праймеров по п.1, где праймеры комплементарны части смысловой или антисмысловой цепи соответственно выделенной нуклеиновой кислоты и способны гибридизироваться с ней; и
(е) определение наличия амплифицированных нуклеиновых кислот в качестве признака наличия или отсутствия HAV в образце.
захватывающие нуклеиновые кислоты, содержащие один или несколько олигонуклеотидов, где длина каждого олигонуклеотида составляет от 10 до 60 нуклеотидов и каждый содержит нуклеотидную последовательность по меньшей мере из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14;
два праймера из набора по п.1 и
письменные инструкции для идентификации инфекции HAV.
захватывающие нуклеиновые кислоты, содержащие один или несколько олигонуклеотидов, где длина каждого олигонуклеотида составляет от 10 до 60 нуклеотидов и каждый содержит нуклеотидную последовательность по меньшей мере из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14;
два праймера из набора по п.1;
олигонуклеотидный зонд HAV, содержащий по меньшей мере 10 последовательных нуклеотидов последовательности SEQ ID NO: 3; и
письменные инструкции для идентификации инфекции HAV.
(а) приведение твердой подложки в контакт с захватывающими нуклеиновыми кислотами, содержащими один или несколько олигонуклеотидов, где длина каждого олигонуклеотида составляет от 10 до 60 нуклеотидов и каждый олигонуклеотид содержит нуклеотидную последовательность по меньшей мере из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14, в условиях, при которых захватывающие нуклеиновые кислоты связываются с твердой подложкой,
(b) приведение твердой подложки из (а) в контакт с биологическим образцом и внутренней контрольной последовательностью SEQ ID NO: 17 в условиях гибридизации, при которых цепи нуклеиновой кислоты-мишени HAV, если они присутствуют, гибридизуются с захватывающими нуклеиновыми кислотами, причем внутренняя контрольная последовательность служит для контроля захвата и амплификации мишени и содержит последовательность, которая отличается от последовательностей HAV;
(c) отделение твердой подложки (b) от образца;
(d) амплификацию нуклеиновых кислот, гибридизовавшихся с захватывающими нуклеиновыми последовательностями, используя набор из двух праймеров по п.1;
(e) определение наличия амплифицированных нуклеиновых кислот HAV в качестве признака наличия или отсутствия HAV в образце и
(f) определение наличия амплифицированной внутренней контрольной последовательности SEQ ID NO: 17, используя внутренний контрольный зонд SEQ ID NO: 18 или SEQ ID NO: 19, который является специфичным для последовательности, которая отличается от последовательностей HAV.
10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14.
захватывающие нуклеиновые кислоты, содержащие один или несколько олигонуклеотидов, где длина каждого олигонуклеотида составляет от 10 до 60 нуклеотидов и каждый содержит последовательность по меньшей мере из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14;
два праймера из набора по п.1;
олигонуклеотидный зонд HAV, содержащий по меньшей мере 10 последовательных нуклеотидов последовательности SEQ ID NO: 3;
внутреннюю контрольную последовательность SEQ ID NO: 17, которая служит для контроля связывания и амплификации мишени и содержит последовательность, отличающуюся от последовательностей HAV; и
письменные инструкции для идентификации инфекции HAV.
захватывающие нуклеиновые кислоты, содержащие один или несколько олигонуклеотидов, где длина каждого олигонуклеотида составляет от 10 до 60 нуклеотидов и каждый олигонуклеотид содержит последовательность по меньшей мере из 10 последовательных нуклеотидов последовательности, выбранной из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14;
два праймера из набора по п.1;
олигонуклеотидный зонд HAV, содержащий по меньшей мере 10 последовательных нуклеотидов последовательности SEQ ID NO: 3;
внутреннюю контрольную последовательность SEQ ID NO: 17, которая служит для контроля связывания и амплификации мишени и содержит последовательность, отличающуюся от последовательностей HAV; и
внутренний контрольный зонд SEQ ID NO: 18 или SEQ ID NO: 19, который является специфичным для последовательности, которая отличается от последовательности HAV; и
письменные инструкции для идентификации инфекции HAV.

Комментарии