Способы переноса молекулярных веществ в клетки растений - RU2495935C2
Код документа: RU2495935C2
Чертежи























Описание
ЗАЯВЛЕНИЕ О ПРИОРИТЕТЕ
По настоящей заявке испрашивается приоритет по дате подачи предварительной заявки на патент США с порядковым номером 60/978059, поданной 5 октября 2007 года, в отношении СПОСОБОВ ПЕРЕНОСА МОЛЕКУЛЯРНЫХ ВЕЩЕСТВ В КЛЕТКИ РАСТЕНИЙ.
УРОВЕНЬ ТЕХНИКИ
Наночастицы имеют уникальные свойства, которые использовались для применения в доставке ДНК в клетки. Среди всех исследованных наночастиц наночастицы золота (Au) имеют тенденцию быть превосходными кандидатами для доставки вследствие их низкой цитотоксичности и легкости функционализации различными лигандами биологической важности. Обычно используемый синтез наночастиц Au дает отрицательно заряженную (например, в случае цитратного покрытия) поверхность. Плазмидная ДНК, которая может быть достаточно гибкой для частичного раскручивания ее оснований, может быть доступна наночастицам золота ("GNP"). При этих частично раскрученных условиях, отрицательный заряд на ДНК-скелете может быть достаточно удаленным, так что ван-дер-ваальсовы силы притяжения между этими основаниями и частицей золота являются достаточными для вызывания прикрепления плазмидной ДНК к поверхности частицы золота.
Кроме наночастиц металлов, полупроводниковые наночастицы (например, квантовые точки (quantum dots)) ("QD") в диапазоне размеров 3-5 нм также использовали в качестве носителей для доставки молекул в клетки. ДНК и белки могут быть связаны с лигандом, прикрепленным к поверхности QD (см., например, Patolsky, F. et al., J. Am. Chem. Soc. 125, 13918 (2003)). Покрытые карбоновой кислотой или амином QD могут быть сшиты с молекулами, содержащими тиоловую группу (см., например, Dubertret B. et al., Science 298, 1759 (2002); Akerman, M. E., W. C. W. Chan, P. Laakkonen, S. N. Bhatia, E. Ruoslahti, Proc. Natl. Acad. Sci. U.S.A. 99, 12617 (2002); Mitchell, G. P., C. A. Mirkin, R. L. Letsinger, J. Am. Chem. Soc. 121, 8122 (1999)), или N-гидроксисукцинимил(NHS)эфирной группой с использованием стандартных протоколов биоконъюгации (см., например, Pinaud, F., D. King, H.-P. Moore, S. Weiss, J. Am. Chem. Soc. 126, 6115 (2004); Brachez, M., M. Moronne, P. Gin, S. Weiss, A. P. Alivisatos, Science 281, 2013 (1998)). Одним альтернативным способом является конъюгация покрытых стрептавидином QD с биотинилированными белками, олиго или антителами (см., например, Dahan M. et al., Science 302, 442 (2003); Pinaud, F., D. King, H.-P. Moore, S. Weiss, J. Am. Chem. Soc. 126, 6115 (2004); Dahan M. et al., Science 302, 442 (2003); Wu X. Y., et al., Nature Biotechnol. 21, 41 (2003); Jaiswal, J. K., H. Mattoussi, J. M. Mauro, S. M. Simon, Nature Biotechnol. 21, 47 (2003); и Mansson, A., et al., Biochem. Biophys. Res. Commun. 314, 529 (2004).
Наночастицы использовали для доставки плазмидной ДНК в различные клетки животных. Было обнаружено, что при инкубировании покрытых ДНК наночастиц с клетками, не имеющими клеточной стенки, эти клетки поглощают эти наночастицы и начинают экспрессировать любые гены, кодируемые этой ДНК. Когда желательна доставка наночастиц в клетки, имеющие в норме клеточную стенку, эту клеточную стенку удаляют перед добавлением этих частиц к протопластам растения (см. Torney, F. et al., Nature Nanotechnol. 2, (2007). В клетках растений эта клеточная стенка является барьером для доставки подаваемых экзогенно молекул. Использовали многочисленные инвазивные способы, такие как генный пистолет (баллистика), микроинъекция, электропорация и Agrobacterium, для достижения доставки генов и малых молекул в клетки с клеточной стенкой растений, но доставка белков достигалась только посредством микроинъекции. Доставка малых молекул и белков в присутствии клеточной стенки растительной клетки остается неисследованной и была бы полезной для развития технологий, пригодных для развертывания в интактных клетке/ткани или органе растения для манипуляций in vitro и in vivo.
Данное изобретение относится к способам применения наночастиц для неинвазивной доставки молекулярных веществ в клетки, имеющие клеточную стенку.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие варианты осуществления описаны вместе с системами, инструментами и способами, которые, как предполагается, являются примерными и иллюстративными и не ограничивающими объем изобретения.
Настоящим изобретением представлены способы введения представляющей интерес молекулы в клетку растения, которая имеет клеточную стенку, предусматривающие приведение клетки растения, имеющей клеточную стенку, в контакт с наночастицей и представляющей интерес молекулой и позволение поглощения этой наночастицы и представляющей интерес молекулы в эту клетку.
Далее, представлены способы введения представляющей интерес молекулы в клетку растения, имеющую клеточную стенку, предусматривающие приведение клетки растения, имеющей клеточную стенку, в контакт с наночастицей и молекулой, способной лечить заболевание, и позволение поглощения этой наночастицы и молекулы, способной лечить заболевание, в эту клетку.
Кроме примерных аспектов и вариантов осуществления, описанных выше, дополнительные аспекты и варианты станут очевидными ввиду следующих описаний.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1 изображает фотографии отдельных клеток BY2, наблюдаемых с использованием дифференциального интерференционного контрастного микроскопа, подсоединенного к конфокальной системе визуализации (Панель А). Панель В показывает поле зрения светового микроскопа единственной клетки из варианта BY2, которая окрашена I2KI для более ясного выделения пластиды (амилопласта).
Фиг.2, Панель А, изображает фотоавтотрофные клетки табака (NT1), поддерживаемые в минимальной среде и 5% диоксиде углерода, видимые в световом микроскопе, где видны заметные хлоропласты. Фиг.2, Панель В, показывает сходные клетки NT1, наблюдаемые под флуоресцентным микроскопом, с активными хлоропластами, автофлуоресцирующими красным светом.
Фиг.3 показывает агрегаты суспензии BY2, обработанные только SAMSA-флуоресцеином, и покрытые SAMSA-флуоресцеином GNP. Фиг.3, Панель А, показывает изображение DIC клеток, обработанных только SAMSA-флуоресцеином, в то время как фиг.3, Панель В, показывает флуоресцентное изображение тех же самых клеток. Фиг.3, Панель С, показывает изображение DIC клеток, обработанных покрытыми SAMSA-флуоресцеином GNP, в то время как фиг.3, Панель D, показывает флуоресцентное изображение обработанных покрытыми SAMSA-флуоресцеином GNP. Указаны положения ядра (Nu) и клеточной стенки (CW).
Фиг.4 показывает обработанные покрытыми SAMSA-флуоресцеином GNP отдельные клетки при высоком увеличении. Панель В показывает присутствие большого количества GNP в ядрышке. Панель А показывает вид в ярком поле зрения того же самого ядрышка, показанного в Панели В, при другой плоскости фокусирования.
Фиг.5 показывает фотоавтотрофные клетки, обработанные покрытыми SAMSA-флуоресцеином GNP. Панель А показывает гиалиновые (прозрачные) клетки в 3-4 кластерах с большими хлоропластами, выстилающими внутреннюю сторону клеточной стенки. Панель В показывает накопление наночастиц в хлоропласте. Панели С и D показывают более высокое увеличение единственного хлоропласта с использованием флуоресцентного микроскопа. Наночастицы являются видимыми в мембранных ламеллах хлоропласта и рассеяны среди автофлуоресцирующих хлорофилльных пигментов.
Фиг.6 показывает отражательное и флуоресцентное микроскопические изображения клеток, содержащих наночастицы. Панель А фиг.6 показывает отражательное изображение, где видны преимущественно GNP. Панель В показывает флуоресцирующие частицы в фоне красного автофлуоресцирующего хлоропласта. Объединенное (слитое) отражательное и флуоресцентное изображение показано в Панели С, в которой желтые флуоресцирующие частицы находятся внутри границы хлоропласта.
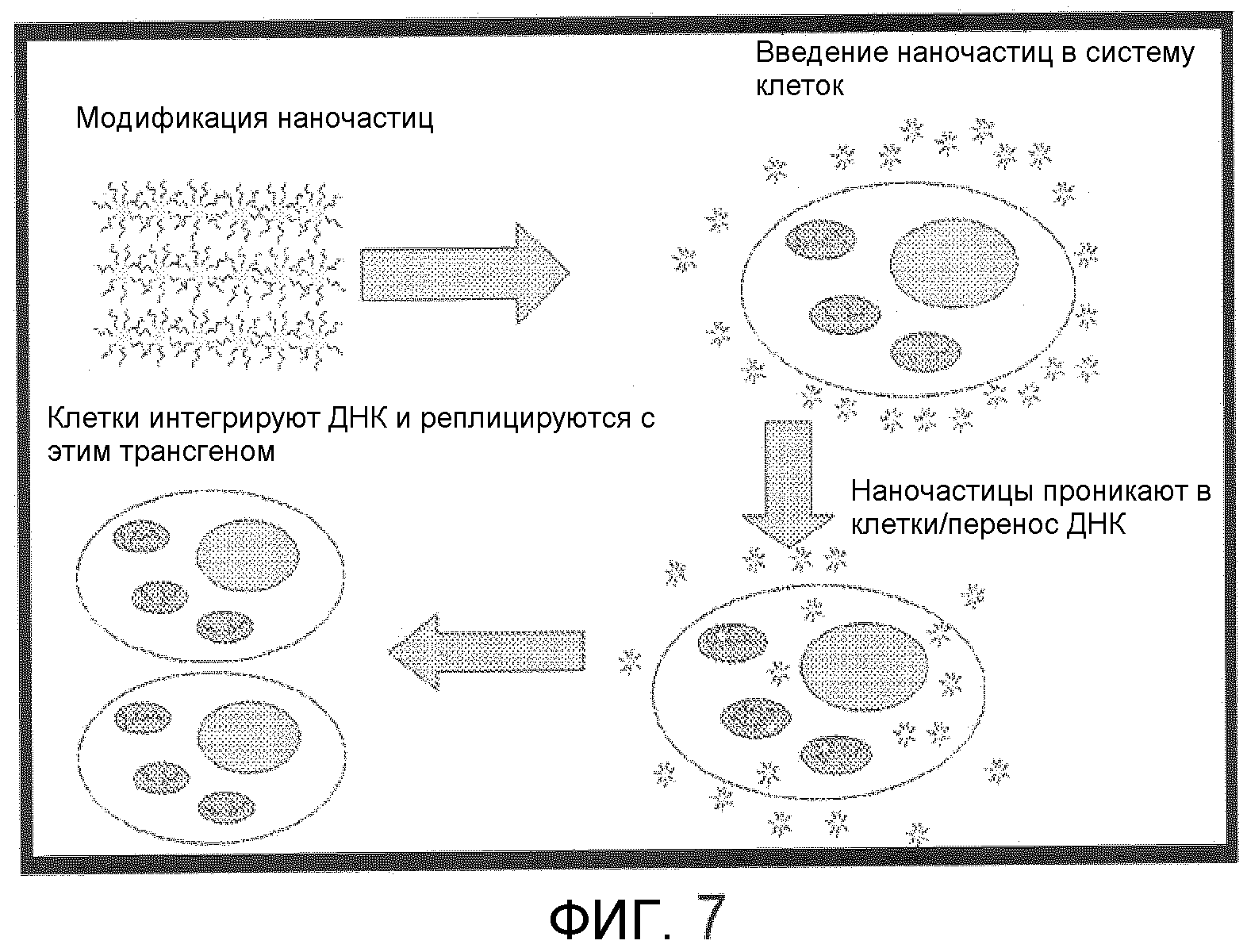
Фиг.7 показывает графическое представление одной возможной схемы трансформации в соответствии с одним вариантом осуществления данного изобретения.
Фиг.8 показывает клеточную интернализацию GFP, визуализированную посредством отражательной микроскопии после двух часов обработки. Панели А и А1 показывают необработанные контрольные клетки под DIC-микроскопом (Панель A), обработанные GFP-связанными Au-NP клетки, видимые под DIC-микроскопом (Панель А1); Панели В и В1 показывают контрольные клетки под отражательным микроскопом (Панель В) и обработанные GFP-связанными Au-NP клетки, видимые под отражательным микроскопом (Панель B1), показывающие интернализацию частиц из отраженных Au-NP; Панели С и С1 показывают контрольные клетки, на которые наложены изображения DIC-микроскопа и отражательного микроскопа (Панель С1); Панели D и D1 показывают обращенное изображение отражательной способности контрольных клеток для доказательства отсутствия частиц в фоне (Панель D) и обращенное изображение отражательной способности обработанных клеток для очень явного доказательства интернализации частиц (Панель D1).
Фиг.9 показывает интернализацию покрытых красителем SAMSA GNP в отдельных клетках. Панель А показывает окрашенные флуоресцеином клетки, причем клеточная стенка и среда обнаруживают флуоресценцию, но не интернализацию красителя; Панель В показывает отдельные клетки под DIC-микроскопом; Панель С показывает фазово-контрастное изображение для доказательства интернализации наночастиц (GNP 150 нм) в цитозоль и ядро, причем флуоресцеин интернализовался только с частицей и плазмолизованными клетками при пролонгированной экспозиции до 1 часа в УФ-свете.
Фиг.10 показывает конъюгат Au-GFP с флуоресцирующими молекулами GFP, перед смешиванием отдельных клеток. Панель А (FITC), B (яркое поле зрения), C (отражение), D (Панели A+B+C): GFP-флуоресцирующие Au-GNP, наблюдаемые посредством флуоресцентной микроскопии, спустя 2 часа после инкубирования, но перед смешиванием клеток. Сходные флуоресцирующие частицы можно было наблюдать на частице, обнаруживающей отражательную способность в ядре (см. фиг.8).
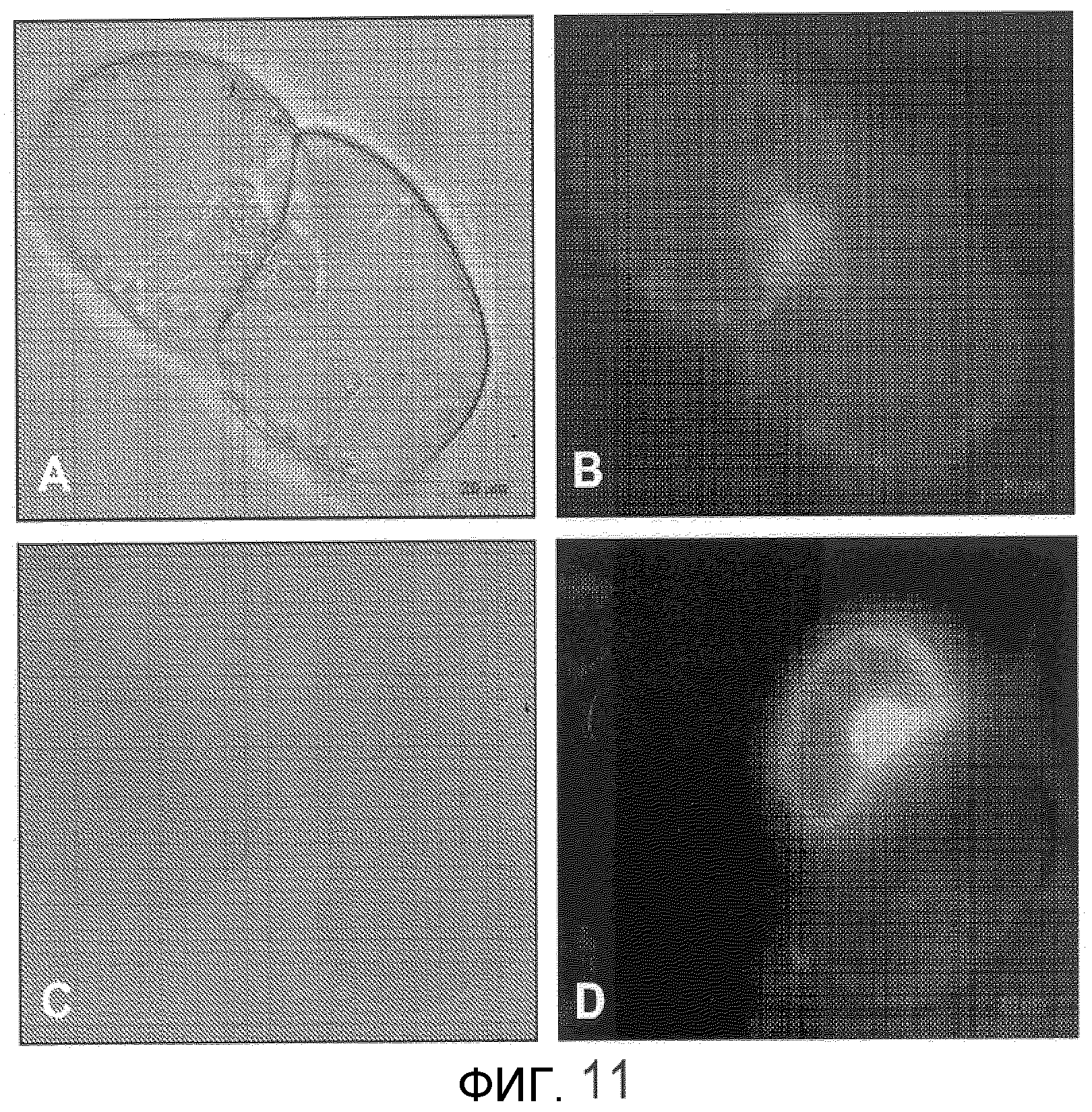
Фиг.11 показывает опосредованную наночастицей (GNP 90 нм) клеточную интернализацию GFP в клеточные линии BY2-E. Панель А показывает делящиеся контрольные клетки с активными цитоплазматическими тяжами (фазово-контрастное изображение); Панель В показывает те же самые клетки, что и в Панели А, при исследовании с использованием FITC, где автофлуоресценция из незеленых пластид в цитоплазме образует периферию, а также из пластид, ассоциированных с делящимся ядром; и где эти цитоплазматические тяжи и цитоплазма вблизи периферии этих клеток не обнаруживают автофлуоресценции; Панель С показывает контрольные клетки BY2, обработанные GFP, которые не присоединены к GNP (FITC), где эти клетки не обнаруживают поглощения GFP, но GFP окружают эти клетки, но не интернализуются; Панель D показывает опосредованную GNP интернализацию GFP, наблюдаемую через FITC-фильтр, причем периферическая цитоплазма, цитоплазматические тяжи и ядро обнаруживают интернализацию GFP, в сравнении с контролем в Панели В.
Фиг.12 показывает линии отдельных клеток BY2-E, обнаруживающие опосредованную GNP интернализацию YFP спустя 2 часа после инкубации клеток. Панель A (FITC), B (Родамин), C (DIC), D (Панели A+B), E (Панели A+B+C): F (обращенное отражательное изображение): интернализация YFP, наблюдаемая с использованием флуоресцентной микроскопии. Стрелки желтого цвета показывают интернализацию в живой отдельной клетке YFP в цитозоле (диффузную или концентрированную в ядре). Стрелки оранжевого цвета показывают интернализацию в плазмолизованных клетках, где масса сморщенных протопластов в клетке показывает интенсивную флуоресценцию, указывающую на интернализацию в этой клетке. Эта клетка обнаружена в той же самой плоскости фокусирования, что и живая клетка, которая расположена рядом, но ниже других живых клеток. Клетки, которые накапливают высокий уровень частицы и имеют флуоресценцию YFP, обнаруживают смерть клеток при пролонгированном исследовании под флуоресцентным микроскопом.
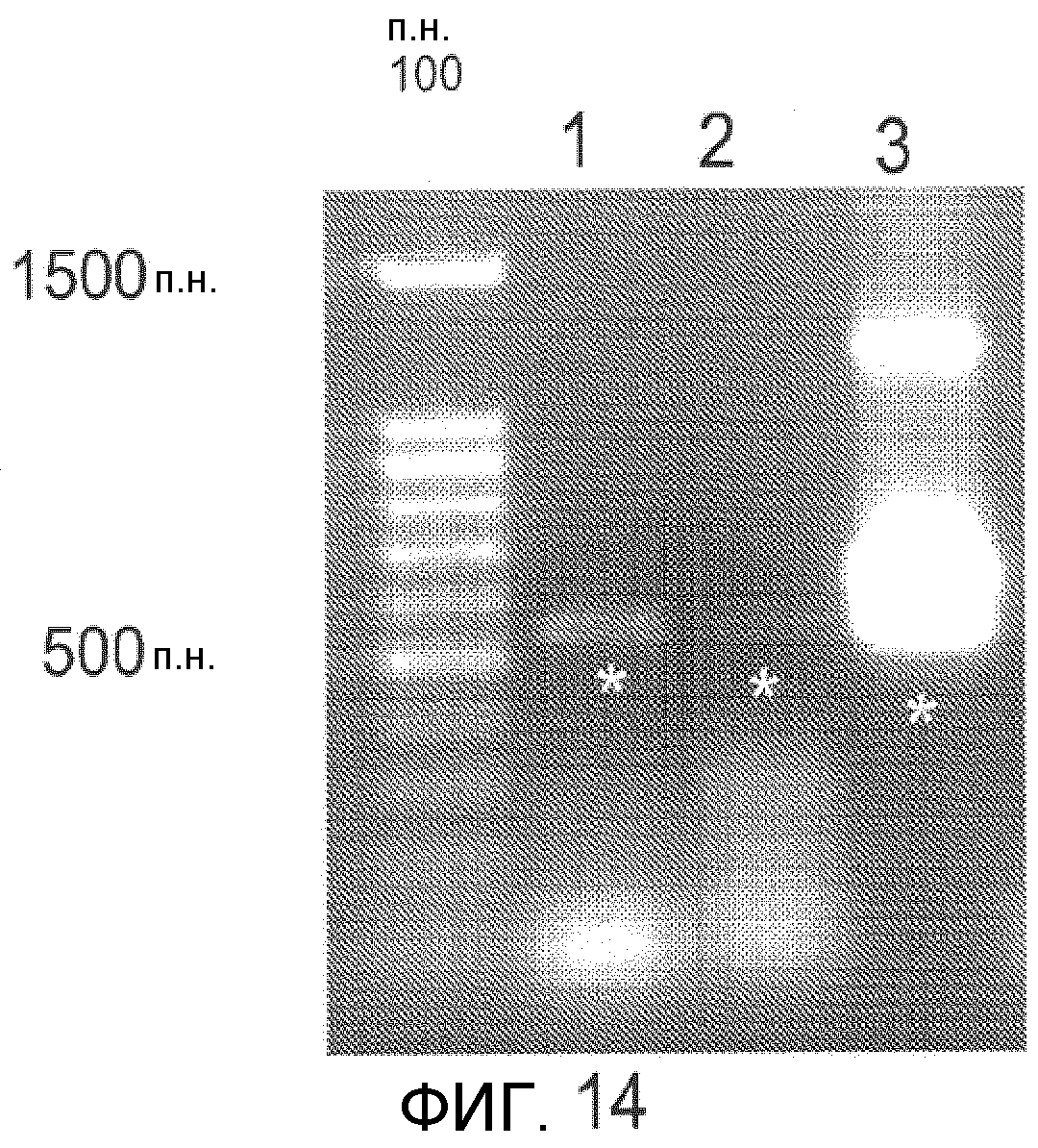
Фиг.13 и 14 показывают изображения в гелях амплифицированных генных продуктов PAT и YFP, которые были амплифицированы.
Фиг.15 показывает гель-электрофорез, осуществленный с использованием конъюгатов QD-пептид для подтверждения присоединения пептидов к QD.
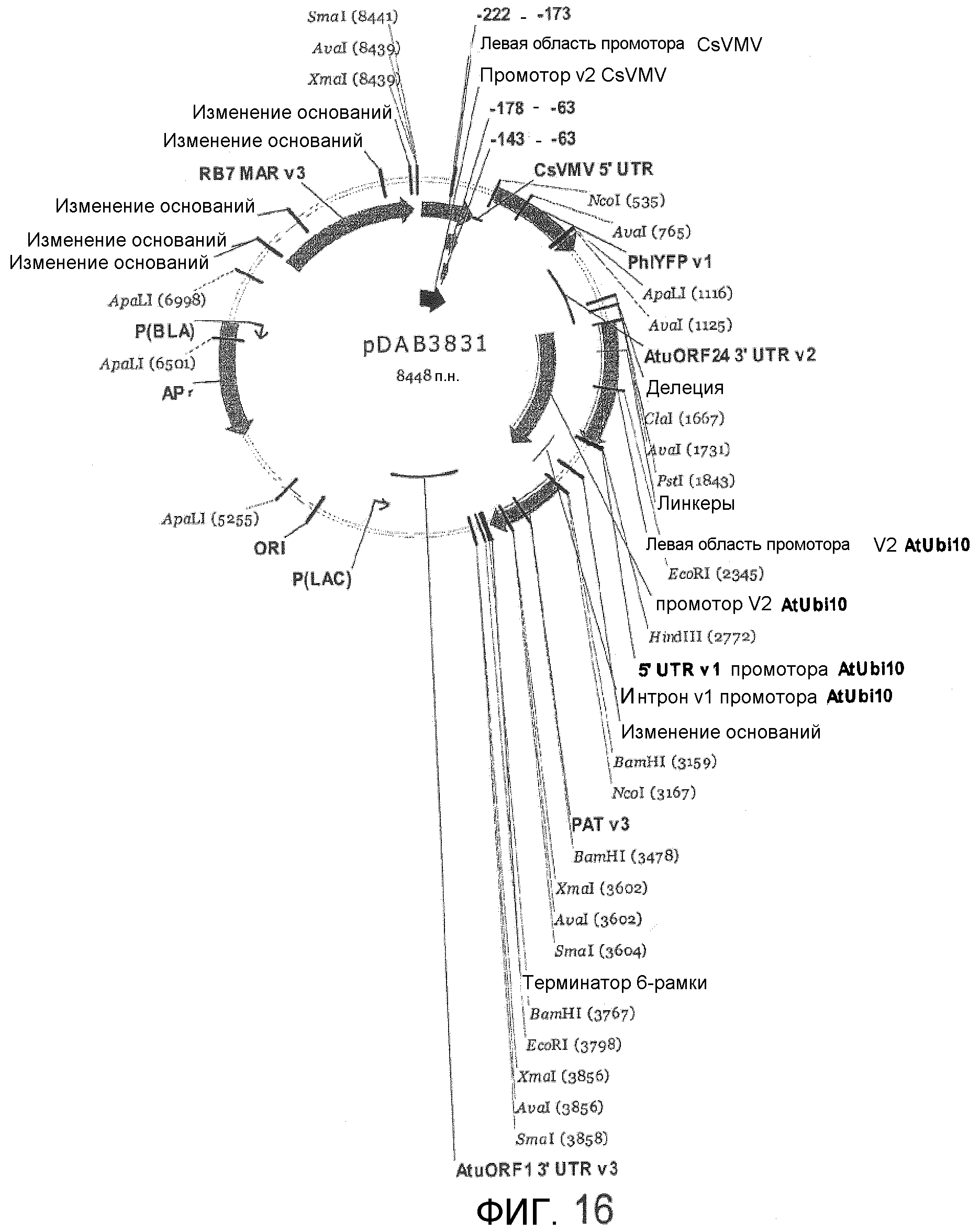
Фиг.16 показывает плазмиду pDAB3831.
НАИЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В этом описании и следующих далее таблицах используется ряд терминов. Для обеспечения ясного и однообразного понимания этого описания и формулы изобретения, в том числе рамок, которые должны придаваться таким терминам, обеспечены следующие определения.
Обратное скрещивание. Обратное скрещивание может быть процессом, в котором селекционер повторяемым образом скрещивает гибридное потомство с одним из родителей, например, гибрид первой генерации F1 с одним из родительских генотипов этого F1-гибрида.
Зародыш (эмбрион). Зародыш может быть маленьким растением, содержащимся в зрелом семени.
Наночастица. Микроскопическая частица по меньшей мере с одним нанометровым размером, обычно меньшим, чем 100 нм. Наночастицы, подходящие для применения в данном изобретении, могут иметь размер 1 нм - 0,4 мкм. Квантовая точка может иметь средний диаметр 1 нм - 10 нм, предпочтительно 2-4 нм. Наночастица может быть выбрана из покрытых золотом наночастиц, пористых наночастиц, мезопористых наночастиц, наночастиц диоксида кремния, полимерных наночастиц, вольфрамовых наночастиц, желатиновых наночастиц, нанооболочек, наносердцевин (нанокоров), наносфер, наностержней, магнитных наночастиц и их комбинаций.
Квантовая точка. Квантовая точка является полупроводниковой наноструктурой, которая ограничивает движение электронов зоны проводимости и дырок валентной зоны, или экситонов (связанных пар электронов зоны проводимости и дырок валентной зоны) во всех трех пространственных направлениях. Это ограничение может быть обусловлено электростатическими потенциалами (генерируемыми наружными электродами, легированием полупроводника, деформацией, примесями), присутствием границы раздела между различными полупроводниковыми материалами (например, в нанокристаллических системах оболочка-сердечник), присутствием поверхности полупроводника (например, полупроводникового нанокристалла) или их комбинациями. Квантовая точка может иметь дискретный квантованный энергетический спектр. Соответствующие волновые функции пространственно локализованы в квантовой точке, но простираются на протяжении многих периодов кристаллической решетки. Квантовая точка содержит малое конечное число (порядка 1-100) электронов зоны проводимости, дырок зоны валентности или экситонов (т.е. конечное число элементарных электрических зарядов).
Устойчивые к глифосату. Устойчивость к дозе глифосата относится к способности растения выживать (т.е. растение не может быть уничтожено) при данной дозе глифосата. В некоторых случаях устойчивые (толерантные) растения могут быть временно желтыми или иным образом проявлять некоторое индуцированное глифосатом повреждение (например, избыточное побегообразование и/или ингибирование роста), но выживают.
Стабилизированные. Термин «стабилизированные» относится к характеристикам растения, которые воспроизводимо передаются от одной генерации к следующей генерации инбредных растений одного и того же сорта.
Поглощение. Поглощение относится к транслокации (передвижению) частицы, такой как наночастица, например, золота или квантовых точек, через клеточную стенку или клеточную мембрану, где эта транслокация происходит не только как результат количества движения, сообщенного этой частице чем-то иным, чем клетка, в которую поглощается эта частица. Неограничивающие примеры устройств или способов, которые вызывают транслокацию частицы через клеточную стенку или клеточную мембрану только в результате количества движения, сообщаемого этой частице, являются биолистическими технологиями, генным пистолетом, технологиями микроинъекции и/или прокалывания.
В соответствии с вариантами осуществления этого изобретения, может быть предложен способ введения представляющей интерес молекулы в клетку растения, содержащую клеточную стенку, предусматривающий приведение наночастицы, содержащей представляющую интерес молекулу, в контакт с этой клеткой и позволение поглощения этой наночастицы через клеточную стенку растения. В конкретных аспектах изобретения эта наночастица может быть любой наночастицей и может обратимо или необратимо содержать представляющую интерес молекулу, быть покрыта представляющей интерес молекулой или быть иным образом связана с представляющей интерес молекулой и/или нести представляющую интерес молекулу. В некоторых вариантах осуществления представляющая интерес молекула может быть введена в эти наночастицы перед контактом с клеткой растения, имеющей клеточную стенку, или совместно с введением этой наночастицы в клетку растения, имеющую клеточную стенку. Примеры наночастиц, которые могут быть использованы в вариантах осуществления данного изобретения, включают, но не ограничиваются ими, золото, квантовые точки, покрытые золотом наночастицы, пористые наночастицы, мезопористые наночастицы, наночастицы диоксида кремния, полимерные наночастицы, вольфрамовые наночастицы, желатиновые наночастицы, нанооболочки, наносердцевины (нанокоры), наносферы, наностержни, магнитные наночастицы и/или их комбинации.
Согласно вариантам осуществления данного изобретения, клетка растения, имеющая клеточную стенку, может быть любой клеткой растения, содержащей интактную и целую клеточную стенку. Примеры клеток, имеющих клеточную стенку, включают, но не ограничиваются ими, водоросли, табак, морковь, кукурузу, канолу, рапс, хлопчатник, пальму, арахис, сою, сахарный тростник, Oryza sp., Arabidopsis sp. и Ricinus sp., предпочтительно табак, морковь, кукурузу, хлопчатник, канолу, сою и сахарный тростник; более предпочтительно табак и морковь. Варианты этого изобретения могут включать клетки, содержащие клеточную стенку, из любой ткани или где бы они ни были обнаружены, в том числе, но не только, в зародышах, меристематических клетках, каллусе, пыльце, листьях, пыльниках, корнях, кончиках корней, цветках, семенах, стручках, стеблях и культуре ткани.
В вариантах осуществления этого изобретения представляющей интерес молекулой может быть любая молекула, которая может доставляться в клетку растения в соответствии с данным изобретением. Представляющие интерес молекулы или компоненты представляющих интерес молекул могут включать, но не ограничиваются ими, молекулы нуклеиновых кислот, ДНК, РНК, RNAi, гены, плазмиды, космиды, YAC, BAC, полипептиды, ферменты, гормоны, гликопептиды, сахара, жиры, сигнальные пептиды, антитела, витамины, мессенджеры, вторичные мессенджеры, аминокислоты, цАМФ, лекарственные средства, гербициды, фунгициды, антибиотики и/или их комбинации.
Варианты осуществления этого изобретения включают способы профилактики или лечения заболевания. Неограничивающие примеры этих вариантов осуществления включают доставку фунгицидов, антибиотиков и/или других лекарственных средств в клетки, нуждающиеся в этом, с использованием способов данного изобретения.
В конкретных вариантах осуществления данного изобретения поверхность наночастицы может быть функционализована, что может, например, допускать нацеленное поглощение или допустить обратимое или необратимое связывание других веществ с поверхностью этой наночастицы. В качестве неограничивающего примера, поверхность наночастицы (например, золотой наночастицы или квантовой точки) может быть функционализована самособирающимся монослоем, например, алкантиолатов, которые могут быть дополнительно функционализованы или дериватизованы. В следующем неограничивающем примере поверхность наночастицы может быть дериватизована линкерами, которые сами могут быть дополнительно функционализованы или дериватизованы. В одном варианте осуществления эта наночастица может быть ПЭГилирована. Другими словами, эта наночастица может содержать или может быть мультифункционализована одним или несколькими корами (активными или неактивными), стерическим (пространственным) покрытием (активным или инертным), расщепляемой связью и/или нацеливающими молекулой или лигандом.
В аспектах этого изобретения наночастица может поглощаться в различные части клеток. Примеры местоположений, в которые может поглощаться наночастица, включают, но не ограничиваются ими, цитозоль, ядро, тонопласты, пластиды, этиопласты, хромопласты, лейкопласты, элайопласты, протеинопласты, амилопласты, хлоропласты и просвет двойной мембраны. В других вариантах осуществления этого изобретения поглощение наночастицы в клетку, содержащую клеточную стенку, может происходить посредством симпластного или апопластного пути.
Дополнительные варианты этого изобретения включают генетически модифицированные клетки растений и способы генерирования их, где эти клетки растений имеют одну или несколько нуклеиновых кислот, введенных в них способами по данному изобретению. В одном примере одного варианта плазмида, содержащая представляющий интерес ген и селектируемый маркер, может быть введена в клетку растения, имеющую клеточную стенку, посредством наночастицы в соответствии с данным изобретением. В дополнительных вариантах осуществления могут быть отобраны стабильные трансформанты, которые стабильно интегрировали представляющий интерес ген и/или селектируемый маркер. В альтернативных вариантах осуществления клетка растения, содержащая представляющий интерес ген, может быть размножена для получения других клеток, содержащих представляющую интерес молекулу. В других вариантах осуществления клетки растений, содержащие представляющую интерес молекулу, могут быть регенерируемой клеткой, которая может быть использована для регенерации целого растения, включающего эту представляющую интерес молекулу.
В другом аспекте, данное изобретение обеспечивает способы создания регенерируемых клеток растений, содержащих представляющую интерес молекулу, для применения в культуре ткани. Эта культура ткани будет предпочтительно способна регенерировать растения, имеющие по существу тот же самый генотип, что и регенерируемые клетки. Регенерируемые клетки в таких культурах ткани могут быть зародышами, протопластами, меристематическими клетками, каллусом, пыльцой, листьями, пыльниками, корнями, кончиками корней, цветками, семенами, стручками или стеблями. Кроме того, один вариант этого изобретения обеспечивает растения, регенерированные из культур ткани этого изобретения.
Альтернативно, данное изобретение обеспечивает способ введения желаемого признака в клетку растения, имеющую клеточную стенку, предусматривающий приведение наночастицы и представляющей интерес молекулы, способной обеспечивать желаемый признак клетке растения, в контакт с этой клеткой и позволение поглощения этой наночастицы через клеточную стенку. Примеры желаемых признаков включают, но не ограничиваются ими, признаки, выбранные из мужской стерильности, устойчивости к гербицидам, устойчивости к насекомым и устойчивости к бактериальному заболеванию, грибковому заболеванию и/или вирусному заболеванию.
Другие аспекты этого изобретения обеспечивают способы генерирования стабилизированных линий растений, содержащих желаемый признак или представляющую интерес молекулу, в которых желаемый признак или желаемая представляющая интерес молекула могут сначала вводиться поглощением наночастицы через клеточную стенку растения. Способы генерирования стабилизированных клеточных линий хорошо известны специалисту с обычной квалификацией в данной области и могут включать, но не ограничиваются ими, такие способы, как самоопыление, обратное скрещивание, получение гибридов, скрещивания с популяциями и т.п. Все растения и клетки растений, содержащие желаемые признак или представляющую интерес молекулу, первыми введенные в клетку растения (или ее предшественники) поглощением наночастиц через клеточную стенку, входят в объем настоящего изобретения. Предпочтительно, клетки растения, содержащие желаемые признак или представляющую интерес молекулу, первыми введенные в это растение или в клетку (или ее предшественники) поглощением наночастиц через клеточную стенку, могут быть использованы в скрещиваниях с другими, отличающимися, клетками растений для получения гибридных клеток первой генерации (F1), семян и/или растений с улучшенными характеристиками.
В вариантах осуществления, в которых представляющая интерес молекула содержит один или несколько генов, эти гены могут быть доминантным или рецессивным аллелем. В качестве примера, ген (гены) будут сообщать такие признаки, как устойчивость к гербицидам, устойчивость к насекомым, устойчивость к бактериям, грибную устойчивость, устойчивость к вирусным заболеваниям, мужскую фертильность, мужскую стерильность, улучшенное пищевое качество и промышленную применимость.
С появлением молекулярно-биологических способов, которые позволили выделять и характеризовать гены, которые кодируют конкретные белковые продукты или РНК-продукты (например, RNAi), исследователи в области биологии растений проявляли большой интерес к получению генной инженерией генома клеток, который содержит и экспрессирует чужеродные гены или дополнительные или модифицированные версии нативных или эндогенных генов (возможно, запускаемых отличающимися промоторами) для изменения этих признаков клетки специфическим образом. Такие чужеродные дополнительные и/или модифицированные гены называют здесь в совокупности "трансгенами". На протяжении последних пятнадцати-двадцати лет были разработаны несколько способов получения трансгенных клеток и, в конкретных вариантах, данное изобретение относится к трансформированным версиям клеток и способам их получения посредством введения в клетку, имеющую клеточную стенку, трансгена через поглощение наночастицы через клеточную стенку. В вариантах этого изобретения этот трансген может содержаться в экспрессирующем векторе.
Трансформация клеток может включать конструирование экспрессирующего вектора, который будет функционировать в конкретной клетке. Такой вектор может содержать ДНК, которая включает ген под контролем регуляторного элемента, или ген, функционально связанный с регуляторным элементом (например, промотором). Этот экспрессирующий вектор может содержать одну или несколько таких комбинаций функционально связанных генов/регуляторных элементов. Этот вектор (векторы) могут быть в форме плазмиды и могут быть использованы отдельно или в комбинации с другими плазмидами для обеспечения трансформированных клеток с использованием способов трансформации, описанных здесь, для включения трансгена (трансгенов) в генетический материал клетки растения, имеющий клеточную стенку.
Экспрессирующие векторы для поглощения посредством наночастицы: Маркерные гены
Экспрессирующие векторы могут включать один генетический маркер, функционально связанный с регуляторным элементом (например, промотором), который позволяет трансформированным клеткам, содержащим этот маркер, либо извлекаться отрицательным отбором (т.е ингибированием роста клеток, которые не содержат ген этого селектируемого маркера) либо положительным отбором (т.е. скринингом на продукт, кодируемый этим генетическим маркером). Многие гены селектируемых маркеров для трансформации хорошо известны в областях трансформации и включают, например, гены, которые кодируют ферменты, которые метаболически детоксифицируют селективный химический агент, который может быть антибиотиком или гербицидом, или гены, которые кодируют измененную мишень, которая может быть нечувствительной к этому ингибитору. Несколько способов положительного отбора также известны в данной области.
Один обычно используемый ген селектируемого маркера, подходящий для трансформации растений, может включать ген неомицинфосфотрансферазы II (nptII) под контролем регуляторных сигналов растения, который придает устойчивость к канамицину. См., например, e.g., Fraley et al., Proc. Natl. Acad. Sci. U.S.A., 80:4803 (1983). Другим обычно используемым геном селектируемого маркера может быть ген гигромицинтрансферазы, который придает устойчивость к антибиотику гигромицину. См., например, Vanden Elzen et al., Plant Mol. Biol., 5:299 (1985). Дополнительные гены селектируемых маркеров бактериального происхождения, которые придают устойчивость к антибиотикам, включают гентамицинацетилтрансферазу, стрептомицинфосфотрансферазу, аминогликозид-3'-аденилтрансферазу и детерминанту устойчивости к блеомицину. См. Hayford et al., Plant Physiol. 86:1216 (1988), Jones et al., Mol. Gen. Genet, 210:86 (1987), Svab et al., Plant Mol. Biol. 14:197 (1990), Hille et al., Plant Mol. Biol. 7:171 (1986). Другие гены селектируемых маркеров придают устойчивость к гербицидам, таким как глифосат, глюфосинат или бромоксинил. См. Comai et al., Nature 317:741-744 (1985), Gordon-Kamm et al., Plant Cell 2:603-618 (1990) и Stalker et al., Science 242:419-423 (1988).
Другие гены селектируемых маркеров, подходящие для трансформации растений, являются генами небактериального происхождения. Эти гены включают, например, дигидрофолатредуктазу мыши, 5-енолпирувилшикимат-3-фосфатсинтазу растений и ацетолактатсинтазу растений. См. Eichholtz et al., Somatic Cell Mol. Genet. 13:67 (1987), Shah et al., Science 233:478 (1986), Charest et al., Plant Cell Rep. 8:643 (1990).
Другой класс генов маркеров, подходящих для трансформации растений, требует скрининга предположительно трансформированных клеток растений, а не прямого генетического отбора трансформированных клеток на устойчивость к токсичному веществу, такому как антибиотик. Эти гены особенно применимы для количественного определения или визуализации пространственного характера экспрессии гена в конкретных тканях, и их часто называют репортерными генами, так как они могут быть слиты с геном или регуляторной генной последовательностью для исследования экспрессии гена. Обычно используемые гены для скрининга трансформированных клеток включают β-глюкуронидазу (GUS), β-галактозидазу, люциферазу и хлорамфениколацетилтрансферазу. См. Jefferson, R. A., Plant Mol. Biol. Rep. 5:387 (1987), Teeri et al., EMBO J. 8:343 (1989), Koncz et al., Proc. Natl. Acad. Sci. U.S.A. 84:131 (1987), DeBlock et al., EMBO J. 3:1681 (1984).
Недавно были сделаны доступными in vivo способы для визуализации активности GUS, которые не требуют разрушения ткани растения. Molecular Probes publication 2908, Imagene Green.TM., p. 1-4(1993) и Naleway et al., J. Cell Biol. 115:151a (1991). Однако, эти in vivo способы для визуализации активности GUS оказались неприменимыми для извлечения трансформированных клеток вследствие низкой чувствительности, высоких флуоресцентных фонов и недостатков, ассоциированных с применением генов люциферазы в качестве селектируемых маркеров.
Совсем недавно гены, кодирующие флуоресцентные белки (например, GFP, EGFP, EBFP, ECFP и YFP), были использованы в качестве маркеров для экспрессии генов в прокариотических и эукариотических клетках. См. Chalfie et al., Science 263:802 (1994). Флуоресцентные белки и мутации флуоресцентных белков могут быть использованы в качестве поддающихся скринингу маркеров.
Экспрессирующие векторы для поглощения посредством наночастицы: Промоторы
Гены, включенные в экспрессирующие векторы, должны запускаться нуклеотидной последовательностью, содержащей регуляторный элемент, например, промотор. В настоящее время несколько типов промоторов известны хорошо в областях трансформации, как и другие элементы, которые могут использоваться отдельно или в комбинации с промоторами.
В данном контексте, "промотор" включает ссылку на область ДНК, которая может находиться слева (апстрим) от старта транскрипции и которая может участвовать в узнавании и связывании РНК-полимеразы и других белков для инициации транскрипции. "Промотором растений" может быть промотор, способный инициировать транскрипцию в клетках растений. Примеры промоторов под относящимся к развитию контролем включают промоторы, которые преимущественно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, волокна, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы называют “тканепредпочтительными”. Промоторы, которые инициируют транскрипцию только в определенных тканях, называют "тканеспецифическими". Специфический в отношении "типа клетки" промотор запускает экспрессию в определенных типах клеток в одном или нескольких органах, например, клетках сосудов в корнях или листьях. "Индуцируемый" промотор может быть промотором, который может находиться под относящимся к окружающей среде контролем. Примеры относящихся к окружающей среде условий, которые могут влиять на транскрипцию посредством индуцируемых промоторов, включают анаэробные условия или присутствие света. Тканеспецифические, тканепредпочтительные, специфические в отношении типа клеток и индуцируемые промоторы составляют класс "неконститутивных промоторов". "Конститутивный промотор" может быть промотором, который может быть активным при большинстве условий окружающей среды.
A. Индуцируемые промоторы
Индуцируемый промотор может быть функционально связан с геном для экспрессии в клетке. Необязательно, индуцируемый промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном для экспрессии в клетке. С индуцируемым промотором скорость транскрипции увеличивается в ответ на индуцирующий агент.
Любой индуцируемый промотор может быть использован для данного изобретения. См. Ward et al., Plant Mol. Biol. 22:361-366 (1993). Примеры индуцируемых промоторов включают, но не ограничиваются ими, промоторы из системы ACEI, которая отвечает на медь (Mett et al., PNAS 90:4567-4571 (1993)); ген In2 из кукурузы, который отвечает на бензолсульфамидные гербицидные предохраняющие агенты (Hershey et al., Mol. Gen Genetics 227:229-237 (1991) и Gatz et al., Mol. Gen. Genetics 243:32-38 (1994)); и Tet репрессор из Tn1O (Gatz et al., Mol. Gen. Genetics 227:229-237 (1991)). Одним особенно применимым индуцируемым промотором может быть промотор, который отвечает на индуцирующий агент, на который растения обычно не отвечают. Примером индуцируемого промотора может быть индуцируемый промотор из гена стероидного гормона, транскрипционная активность которого может быть индуцирована глюкокортикостероидным гормоном. Schena et al., Proc. Natl. Acad. Sci. U.S.A. 88:0421 (1991).
B. Конститутивные промоторы
Конститутивный промотор может быть функционально связан с геном для экспрессии в клетке, или конститутивный промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть связана с геном, для экспрессии в клетке.
Различные конститутивные промоторы могут быть использованы в данном изобретении. Примеры конститутивных промоторов включают, но не ограничиваются ими, промоторы из вирусов растений, такие как промотор 35S из CaMV (Odell et al., Nature 313:810-812 (1985)); промоторы генов актина риса (McElroy et al., Plant Cell 2:163-171 (1990)); убиквитина (Christensen et al., Plant Mol. Biol. 12:619-632 (1989) и Christensen et al., Plant Mol. Biol. 18:675-689 (1992)); pEMU (Last et al., Theor. Appl. Genet. 81:581-588 (1991)); MAS (Velten et al., EMBO J. 3:2723-2730 (1984)); и гистона Н3 из кукурузы (Lepetit et al., Mol. Gen. Genetics 231:276-285 (1992) и Atanassova et al., Plant Journal 2 (3): 291-300 (1992)). Промотор ALS, XbaI/NcoI-фрагмент 5' (слева) от структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, сходная с указанным XbaI/NcoI-фрагментом), представляет особенно применимый конститутивный промотор. См. заявку PCT WO 96/30530.
C. Тканеспецифические или тканепредпочтительные промоторы
Тканеспецифический промотор может быть функционально связан с геном для экспрессии в клетке. Необязательно, этот тканеспецифический промотор может быть функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая может быть функционально связана с геном, для экспрессии в клетке. Растения, трансформированные представляющим интерес геном, функционально связанным с тканеспецифическим промотором, могут продуцировать белковый продукт этого трансгена исключительно или преимущественно в конкретной ткани.
Любой тканеспецифический или тканепредпочтительный промотор может быть использован в данном изобретении. Примеры тканеспецифических или тканепредпочтительных промоторов включают, но не ограничиваются ими, корнепредпочтительный промотор - такой как промотор гена фазеолина (Murai et al., Science 23:476-482 (1983) и Sengupta-Gopalan et al., Proc. Natl. Acad. Sci. U.S.A. 82:3320-3324 (1985)); листоспецифический и индуцируемый светом промотор, такой как промотор cab или rubisco (рубиско) (Simpson et al., EMBO J. 4(11):2723-2729 (1985) и Timko et al., Nature 318:579-582 (1985)); специфический для пыльников промотор, например, из LAT52 (Twell et al., Mol. Gen. Genetics 217:240-245 (1989)); специфический для пыльцы промотор, например, из ZM13 (Guerrero et al., Mol. Gen. Genetics 244:161-168 (1993)), или микроспоропредпочтительный промотор, например, из apg (Twell et al., Sex. Plant Reprod. 6:217-224 (1993)).
Транспорт белка, продуцируемого трансгенами, в субклеточный компартмент, такой как хлоропласт, вакуоль, пероксисома, глиоксисома, клеточная стенка или митохондрия, или для секреции в апопласт, может выполняться посредством функционального связывания нуклеотидной последовательности, кодирующей сигнальную последовательность 5'- и/или 3'-области гена, кодирующего представляющий интерес белок. Нацеливающие последовательности на 5'- и/или 3'-конце структурного гена могут определять, во время синтеза и процессинга белка, где может быть в конечном счете компартментализован кодируемый белок. Альтернативно, такие нацеливающие на субклеточный компартмент белки могут быть непосредственно связаны с наночастицей для направления наночастицы, покрытой представляющей интерес молекулой, в желаемый субклеточный компартмент.
Присутствие сигнальной последовательности направляет полипептид либо во внутриклеточную органеллу, либо в субклеточный компартмент, или для секреции в апопласт. В данной области известны многие сигнальные последовательности. См., например, Becker et al., Plant Mol. Biol. 20:49 (1992), Close, P. S., Master's Thesis, Iowa State University (1993), Knox, C, et al., "Structure and Organization of Two Divergent Alpha- Amylase Genes from Barley", Plant Mol. Biol. 9:3-17 (1987), Lerner et al., Plant Physiol. 91:124-129 (1989), Fontes et al., Plant Cell 3:483-496 (1991), Matsuoka et al., Proc. Natl. Acad. Sci. 88:834 (1991), Gould et al., J. Cell. Biol. 108:1657 (1989), Creissen et al., Plant J. 2:129 (1991), Kalderon, et al., A short amino acid sequence able to specify nuclear location, Cell 39:499-509 (1984), Steifel, et al., Expression of a maize cell wall hydroxyproline-rich glycoprotein gene in early leaf and root vascular differentiation, Plant Cell 2:785-793 (1990).
Гены чужеродных белков и агрономические гены
С использованием трансгенных растений в соответствии с данным изобретением чужеродный белок может продуцироваться в коммерческих количествах. Таким образом, способы отбора и размножения трансформированных растений, которые хорошо известны в данной области, дают множество трансгенных растений, которые собирают общепринятым способом и затем чужеродный белок экстрагируют из представляющей интерес ткани или из общей биомассы. Экстракция белка из биомассы растений может выполняться известными способами, которые обсуждаются, например, Heney and Orr, Anal. Biochem. 114:92-6 (1981).
В аспектах этого изобретения трансгенное растение, обеспеченное для коммерческого получения чужеродного белка, может быть клеткой или растением. Для относительно малого количества трансгенных растений, которые обнаруживают более высокие уровни экспрессии, может быть генерирована генетическая карта, сначала посредством общепринятых анализов RFLP, PCR и SSR, которая идентифицирует приближенное хромосомное местоположение интегрированной ДНК-молекулы. В отношении примеров методологий в этой связи, см. Glick and Thompson, Methods in Plant Molecular Biology and Biotechnology CRC Press, Boca Raton 269:284 (1993). Информация карты, касающаяся хромосомного местоположения, может быть применима для патентованной защиты рассматриваемого трансгенного растения. Если может быть предпринято неправомерное размножение и произведены скрещивания с другой зародышевой плазмой, эта карта области интеграции может быть сравнена с подобными картами подозреваемых растений для определения, имеет ли последняя общее происхождение с рассматриваемым растением. Сравнения карт могут включать гибридизации, RFLP, PCR, SSR и секвенирование, все из которых являются общепринятыми способами.
Подобным образом, агрономические гены могут быть экспрессированы в трансформированных клетках или их потомстве. Более конкретно, растения могут быть генетически сконструированы с использованием способов этого изобретения для экспрессии различных представляющих агрономический интерес фенотипов. Примеры генов, которые могут быть использованы в этом отношении, включают, но не ограничиваются ими, гены, представленные в виде отдельных категорий ниже.
1. Гены, которые придают устойчивость к вредителям или заболеваниям и которые кодируют
A) Гены устойчивости к заболеваниям растений. Защитные силы растений часто активируются специфическим взаимодействием между продуктом гена устойчивости к заболеванию (R) в растении и продуктом соответствующего гена авирулентности (Avr) в патогене. Разнообразные растения могут быть трансформированы клонированными генами устойчивости для конструирования растений, которые являются устойчивыми к конкретным штаммам патогенов. См., например, Jones et al., Science 266:789 (1994) (cloning of the tomato Cf-9 gene for resistance to Cladosporium fulvum); Martin et al., Science 262:1432 (1993) (tomato Pto gene for resistance to Pseudomonas syringae pv. tomato encodes a protein kinase); Mindrinos et al., Cell 78:1089 (1994) (Arabidopsmay be RSP2 gene for resistance to Pseudomonas syringae).
B) Ген, придающий устойчивость к вредителю, такому как соевая нематода. См., например, заявку РСТ WO 96/30517; заявку PCT WO 93/19181.
C) Белок Bacillus thuringiensis, его производное или смоделированный на нем синтетический полипептид. См., например, статью Geiser et al., Gene 48:109 (1986), которая описывает клонирование и нуклеотидную последовательность гена Bt δ-эндотоксина. Кроме того, ДНК-молекулы, кодирующие гены δ-эндотоксина, могут быть приобретены из American Type Culture Collection, Manassas, Va., например, под номерами доступа АТСС 40098, 67136, 31995 и 31998.
D) Лектин. См., например, описание Van Damme et al., Plant Molec. Biol. 24:25 (1994), которые раскрывают нуклеотидные последовательности нескольких генов связывающего маннозу лектина Clivia miniata.
E) Витаминсвязывающий белок, такой как авидин. См. публикацию РСТ US93/06487. Эта заявка описывает применение авидина и гомологов авидина в качестве ларвицидов против насекомых-вредителей.
F) Ингибитор фермента, например, ингибитор протеазы или протеиназы или ингибитор амилазы. См., например, Abe et al., J. Biol. Chem. 262:16793 (1987) (нуклеотидная последовательность ингибитора цистеинпротеиназы), Huub et al., Plant Molec. Biol. 21:985 (1993) (нуклеотидная последовательность кДНК, кодирующая ингибитор I протеиназы табака), Sumitani et al., Biosci. Biotech. Biochem. 57:1243 (1993) (нуклеотидная последовательность ингибитора альфа-амилазы Streptomyces nitrosporeus) и патент U.S. № 5494813 (Hepher and Atkinson, выданный Feb. 27, 1996).
G) Специфический в отношении насекомых гормон или феромон, такой как экдистероидный или ювенильный гормон, его вариант, миметик на его основе или его антагонист или агонист. См., например, описание Hammock et al., Nature 344:458 (1990) экспрессии бакуловирусом клонированной эстеразы ювенильного гормона, инактиватора ювенильного гормона.
H) Специфический для насекомых пептид или нейропептид, который после экспрессии нарушает физиологию пораженного вредителя. Например, см. описания Regan, J. Biol. Chem. 269:9 (1994) (экспрессионное клонирование дает ДНК, кодирующую рецептор диуретического гормона насекомого), и Pratt et al., Biochem. Biophys. Res. Comm. 163:1243 (1989) (аллостатин может быть идентифицирован в Diploptera puntata). См. также патент США, Tomalski et al., который описывает гены, кодирующие специфические в отношении насекомых, паралитические нейротоксины.
I) Специфический в отношении насекомых яд, продуцируемый в природе змеей, осой или каким-либо другим организмом. Например, см. Pang et al., Gene 116: 165 (1992), в отношении раскрытия гетерологичной экспрессии в растениях гена, кодирующего токсичный для скорпиона насекомотоксичный пептид.
J) Фермент, ответственный за повышенное накопление монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, производного фенилпропаноида или другой небелковой молекулы с инсектицидной активностью.
K) Фермент, участвующий в модификации, в том числе посттрансляционной модификации, биологически активной молекулы; например, гликолитический фермент, протеолитический фермент, липолитический фермент, нуклеаза, циклаза, трансаминаза, эстераза, гидролаза, фосфатаза, киназа, фосфорилаза, полимераза, эластаза, хитиназа и глюканаза, независимо от того, являются ли они природными или синтетическими. См. заявку РСТ WO 93/02197, от имени Scott et al., которая описывает нуклеотидную последовательность гена каллазы. ДНК-молекулы, которые содержат кодирующие хитиназу последовательности, могут быть получены, например, из АТСС под номерами доступа 39637 и 67152. См. также Kramer et al., Insect Biochem. Molec. Biol. 23:691 (1993), которые описывают нуклеотидную последовательность кДНК, кодирующей хитиназу бражника табачного, и Kawalleck et al., Plant Molec. Biol. 21:673 (1993), которые обеспечивают нуклеотидную последовательность гена полиубиквитина уби-4-2 петрушки.
L) Молекула, которая стимулирует трансдукцию сигнала. Например, см. описание Botella et al., Plant Molec. Biol. 24:757 (1994) нуклеотидных последовательностей для кДНК-клонов кальмодулина фасоли золотистой (фасоли маш) и Griess et al., Plant Physiol. 104:1467 (1994), которые обеспечивают нуклеотидную последовательность кДНК-клона кальмодулина кукурузы.
M) Гибрид с гидрофобным моментом. См. заявку PCT WO 95/16776 (описание пептидных производных тахиплезина, которые ингибируют грибные патогены растений) и заявку РСТ WO 95/18855 (описывает синтетические антимикробные пептиды, которые придают устойчивость к заболеваниям).
N) Мембранная пермеаза, образователь каналов или блокатор каналов. Например, см. описание Jaynes et al., Plant Sci 89:43 (1993), гетерологичной экспрессии аналога цекропин-β-литического пептида для придания трансгенным растениям табака устойчивости к Pseudomonas solanacearum.
O) Вирус-инвазивный белок или произведенный из него комплекс. Например, накапливание вирусных белков оболочки в трансформированных клетках растений придает устойчивость к вирусной инфекции и/или развитию заболевания, вызываемого вирусом, из которого может быть получен ген белка оболочки, а также родственными вирусами. См. Beachy et al., Ann. rev. Phytopathol. 28:451 (1990). Опосредованная белком оболочки устойчивость была придана после трансформации растений против вируса мозаичной болезни люцерны, вируса мозаичной болезни огурца, вируса полосатости табака, вируса Х картофеля, вируса Y картофеля, вируса гравировки табака, вируса rattle табака и вируса мозаичной болезни табака. Id.
P) Специфическое для насекомых антитело или произведенный из него иммунотоксин. Таким образом, антитело, нацеленное на критическую метаболическую функцию в кишке насекомого, могло бы инактивировать пораженный фермент, убивая это насекомое. Ср. Taylor et al., Abstract #497, Seventh Int'l Symposium on Molecular Plant-Microbe Interactions (Edinburgh, Scotland) (1994) (ферментативная инактивация в трансгенном табаке посредством получения одноцепочечных фрагментов).
Q) Вирус-специфическое антитело. См., например, Tavladoraki et al., Nature 366:469 (1993), которые показали, что трансгенные растения, экспрессирующие гены рекомбинантного антитела, защищены от вирусной атаки.
R) Задерживающий развитие белок, продуцируемый в природе патогеном или паразитом. Например, грибные эндо-1,4-D-полигалактуроназы облегчают грибную колонизацию и высвобождение нутриентов растений солюбилизирующей клеточные стенки растения гомо-α-1,4-D-галактуроназой. См. Lamb et al., Bio/Technology 10:1436 (1992). Клонирование и характеристика гена, который кодирует ингибирующий эндополигалактуроназу белок, была описана Toubart et al., Plant J. 2:367 (1992).
S) Задерживающий развитие белок, продуцируемый в природе растением. Например, Logemann et al., Bio/Technology 10:305 (1992), показали, что трансгенные растения, экспрессирующие ген, инактивирующий рибосомы ячменя, имеют увеличенную устойчивость к грибным заболеваниям.
2. Гены, которые придают устойчивость к гербициду:
A) Гербицид, который ингибирует точку роста или меристему, такой как имидазолинон или сульфонилмочевина. Примеры генов в этой категории кодируют мутантный белок ALS и AHAS, как описано, например, Lee et al., EMBO J. 7:1241 (1988), и Miki et al., Theor. Appl. Genet. 80:449 (1990), соответственно.
B) Глифосат (устойчивость, придаваемая, например, мутантными генами 5-енолпирувилшикимат-3-фосфатсинтазы (EPSP) (через введение рекомбинантных нуклеиновых кислот и/или различных форм мутагенеза in vivo нативных генов EPSP), генами aroA и генами глифосатацетилтрансферазы (GAT), соответственно), другие фосфоносоединения, такие как глюфосинат (гены фосфинотрицинацетилтрансферазы (РАТ) из Streptomyces species, включающих Streptomyces hygroscopicus и Streptomycesviridichromogenes), и пиридинокси- или феноксипропионовые кислоты и циклогексоны (кодирующие ингибитор ACC-азы гены). См., например, патент США № 4940835, выданный Shah, et al. и патент США 6248876, выданный Barry et al., которые описывают нуклеотидные последовательности форм EPSP, которые могут придавать устойчивость к глифосату растению. ДНК-молекула, кодирующая мутантный ген aroA, может быть получена под номером доступа АТСС 39256, и нуклеотидная последовательность этого мутантного гена может быть найдена в патенте США № 4769061, выданном Comai. Европейская заявка на патент № 0333033, поданная Kumada et al., и патент США № 4975374, выданный Goodman et al., раскрывают нуклеотидные последовательности генов глутаминсинтетазы, которые придают устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидная последовательность гена PAT может быть найдена в европейской заявке № 0242246, поданной Leemans et al., DeGreef et al., Bio/Technology 7:61 (1989), которые описывают получение трансгенных растений, которые экспрессируют химерные гены bar, кодирующие активность РАТ. Примеры генов, придающих устойчивость к феноксипропионовым кислотам и циклогексонам, таким как сетоксидим и галоксифоп, включают гены Acc1-S1, Acc1-S2 и Acc1-S3, описанные Marshall et al., Theor. Appl. Genet. 83:435 (1992). Гены GAT, способные придавать устойчивость к глифосату, описаны в WO 2005012515, выданном Castle et. al. Гены, придающие устойчивость к 2,4-D, fop и пиридилоксиауксиновым гербицидам, описаны в WO 2005107437, переуступленном Dow AgroSciences LLC.
C) Гербицид, который ингибирует фотосинтез, такой как триазин (гены psbA и гены gs+) или бензонитрил (ген нитрилазы). Przibila et al., Plant Cell 3:169 (1991), описывают трансформацию Chlamydomonas плазмидами, которые кодируют мутантные гены psbA. Нуклеотидные последовательности для генов нитрилазы описаны в патенте США № 4810648, выданном Stalker, а DNA-молекулы, содержащие эти гены, доступны под номерами доступа АТСС 53435, 67441 и 67442. Клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу, могут быть найдены в работе Hayes et al., Biochem. J. 285: 173 (1992).
3. Гены, которые придают признак, названный признаком добавленной ценности, или вносят вклад в этот признак, такой как:
A) Модифицированный метаболизм жирных кислот, например, трансформацией растения антисмысловым геном стеарил-ACP-десатуразы для увеличения содержания стеариновой кислоты этого растения. См. Knultzon et al., Proc. Natl. Acad. Sci. U.S.A. 89:2624 (1992).
B) Уменьшенное содержание фитата - 1) Введение кодирующего фитазу гена могло бы усиливать разрушение фитата добавлением дополнительного свободного фосфата трансформированному растению. Например, см. Van Hartingsveldt et al., Gene 127:87 (1993), в отношении раскрытия нуклеотидной последовательности гена фитазы Aspergillus niger. 2) Мог бы вводиться ген, который уменьшает содержание фитата. Например, в кукурузе это могло бы выполняться клонированием и затем повторным введением ДНК, ассоциированной с единственным аллелем, который может быть ответственным за мутанты кукурузы, характеризующиеся низкими уровнями фитиновой кислоты. См. Raboy et al., Maydica 35:383 (1990).
C) Модифицированный состав углеводов, производимый, например, трансформацией растений геном, кодирующим фермент, который изменяет характер ветвления крахмала. См. Shiroza et al., J. Bacteol. 170:810 (1988) (нуклеотидная последовательность гена фруктозилтрансферазы мутантов Streptococcus), Steinmetz et al., Mol. Gen. Genet. 20:220 (1985) (нуклеотидная последовательность Bacillus subtilis, которая может быть геном левансахаразы), Pen et al., Bio/Technology 10:292 (1992) (получение трансгенных растений, которые экспрессируют фермент Bacillus licheniformis, который может быть α-амилазой), Elliot et al., Plant Molec. Biol. 21:515 (1993) (нуклеотидные последовательности генов инвертазы томата), Sogaard et al., J. Biol. Chem. 268:22480 (1993) (сайт-направленный мутагенез гена, который может быть геном β-амилазы ячменя) и Fisher et al., Plant Physiol. 102:1045 (1993) (ветвящий фермент II крахмала эндосперма кукурузы).
ПРИМЕРЫ
Данное изобретение описано далее в следующих примерах, которые предоставлены для иллюстрации и не предназначены для ограничения каким-либо образом этого изобретения.
Пример 1
Получение материала растений в виде отдельных клеток
Использовали как клетки BY2, так и клетки NT1. Клетки BY2 являются линией не зеленых, быстро растущих клеток табака. Клетки NT1 являются фотоавтотрофными клетками, выделенными из табака. За три-четыре дня перед трансформацией однонедельную суспензионную культуру субкультивировали в свежую среду перенесением 2 мл культуры NT1 или BY2 в 40 мл сред NT1B или LSBY2, содержащих 50 нМ DAS-PMTI-1 (ингибитор микротрубочек) и 0,5-0,1% (об./об.) ДМСО в колбе на 250 мл. Отдельные клетки собирали либо при четырех днях, либо при семи днях после обработки ингибитором микротрубочек. Используемые отдельные клетки BY2 проводили через проточный цитометр Бекмана для счета жизнеспособных клеток. Получали 658250 жизнеспособных клеток/мл со средним диаметром 10,43 мкм и объемом 593,8 мкм3. Как видно на фиг.1, все эти клетки были отдельными клетками (одна пара на фиг.1 имеет перекрывающиеся края). Эти клетки исследовали с использованием Дифференциального Интерференционного Контрастного (DIC) микроскопа, подсоединенного к системе конфокальной визуализации (Панель А). Панель В показывает вид в световом микроскопе отдельных клеток из клеток BY2 (культуры, обитаемые и поддерживаемые средой EP12%), которые окрашивали I2KI для более ясной визуализации пластиды (амилопласта). Как видно здесь, отдельные клетки BY2 содержат большие количества пластид (амилопластов), распределенных по всей цитоплазме клетки.
Фиг.2, Панель А, изображает световую микроскопию фотоавтотрофных клеток табака (NT1), имеющих заметные хлоропласты, которые поддерживали в минимальной среде и 5% диоксиде углерода. Эти клетки субкультивировали один раз каждые 14 дней перенесением 1 мл суспензии при OD600 3,0. Фиг.2, Панель В, показывает сходные клетки NT1, видимые под флуоресцентным микроскопом, в которых активные хлоропласты можно было наблюдать в виде автофлуоресцирующих красным светом пластид.
Типы клеток, описанные выше, использовали в качестве клеток-мишеней для трансформации. Зеленые клетки (клетки NT1) являются оптимальным типом клеток для миграции наночастицы в хлоропласт, так как они имеют мало клеток в конкретном кластере и являются гиалиновыми (прозрачными). Кроме того, эти клетки имеют очень явно выраженные хлоропласты, которые проявляют красную автофлуоресценцию (как видно на фиг.2, Панели В).
Пример 2
Приготовление наночастиц и обработка клеток
Для определения, поглощают ли клетки флуоресцентный краситель в культуре, использовали отдельные клетки и многоклеточную стандартную агрегатную суспензионную культуру клеток BY2. Эти суспензионные культуры клеток подвергали действию SAMSA-флуоресцеина (5-((2-(и -3)-S-(ацетилмеркапто)сукциноил)аминофлуоресцеина) из Molecular Probes в отсутствие наночастиц в течение 20 минут и затем промывали в течение короткого времени перед наблюдением под флуоресцентным микроскопом.
Золотые наночастицы (GNP) покрывали SAMSA-флуоресцеином в соответствии с техническим руководством (доступным в Интернете в probes.invitrogen.com/media/pis/mp00685.pdf). Конъюгат золото-флуоресцеин готовили с использованием описанного здесь далее способа. 1 мг SAMSA-флуоресцеина растворяли в 100 мкл 0,1 М NaOH и перемешивали на вортексе в течение 15 минут для удаления ацетильной группы, защищающей тиол. Затем этот активированный SAMSA смешивали с 100 мкл частиц золота с диаметром 150 нм (~109 частиц/мл). Затем полученный раствор инкубировали в течение 1 часа для гарантии завершения реакции. Затем добавляли 50 мкл 1 М HCl для нейтрализации этого раствора. Раствор центрифугировали при 3000 об/мин в течение 30 минут и супернатант удаляли. Полученный желтый осадок ресуспендировали в 200 мкл 0,1 М ЗФР с получением раствора оранжевого цвета. Эту стадию очистки повторяли 2 раза, чтобы гарантировать удаление свободного SAMSA-флуоресцеина. Способом прикрепления SAMSA к золоту является в основном образование тиоловой связи. Вследствие существенного электростатического отталкивания (SAMSA является дианионным при рН>7), предполагается, что SAMSA расположен перпендикулярно коллоидной поверхности золота. Эти частицы показали ясную флуоресценцию без какого-либо фона при наблюдении под DIC-микроскопом и мультифотонным конфокальным микроскопом. 20 и 40 мкл покрытых наночастиц золота переносили в 500 мкл суспензий табака BY2/NT1 или фотоавтотрофных клеток табака и инкубировали в течение 20 минут в темноте.
После инкубирования аликвоты 50 мкл суспензий клеток монтировали в виде препарата на микроскопических перфузионных предметных стеклах и наблюдали под микроскопом для прослеживания этих частиц. Кроме того, готовили аликвоты проб для наблюдения под микроскопом после 20-минутной инкубации.
Пример 3
Доставка покрытых флуоресцеином наночастиц и накопление в агрегатах клеток BY2/NT1 и в ядре и пластидах отдельных фотоавтотрофных клеток табака
Суспензионные агрегаты BY2/NT1, обработанные только SAMSA-флуоресцеином и покрытыми SAMSA-флуоресцеином GNP, исследовали при низком и высоком увеличении с использованием DIC-микроскопа, микроскопа с ярким полем и флуоресцентного микроскопа. Фиг.3, Панель А, показывает изображение DIC клеток, обработанных только SAMSA-флуоресцеином, тогда как фиг.3, Панель В, показывает флуоресцентное изображение тех же самых клеток. Фиг.3, Панель С, показывает изображение DIC клеток, обработанных покрытыми SAMSA-флуоресцеином GNP, тогда как фиг.3, Панель D, показывает флуоресцентное изображение обработанных покрытыми SAMSA-флуоресцеином GNP клеток. Как ясно видно на фиг.3, Панели В, только клеточные стенки клеток, обработанных одним SAMSA-флуоресцеином, окрашивались флуоресцеином, и наблюдали очень низкую другую фоновую флуоресценцию. Это свидетельствует о том, что эти клетки не поглощали SAMSA-флуоресцеин в отсутствие наночастиц.
В противоположность этому, покрытые SAMSA-флуоресцеином GNP направлялись в клетки и ядро (Nu), как видно на фиг.3, Панели D. Из DIC-наблюдений ясно, что покрытые SAMSA-флуоресцеином GNP обнаруживались во всех компартментах клеток, за исключением вакуолей. Цитоплазматические тяжи, выстилающие вакуоли, также имели покрытые SAMSA-флуоресцеином GNP, наряду с ядерным компартментом. Эти наночастицы, по-видимому, не имели препятствий при их транспорте через клеточные стенки. Таким образом, накопление покрытых SAMSA-флуоресцеином GNP, по-видимому, находится в симпластной, в противоположность апопластной, непрерывности. Дополнительное исследование обработанных покрытыми SAMSA-флуоресцеином GNP клеток под высокими увеличениями показало присутствие большого количества GNP в ядрышке, и, по-видимому, GNP преимущественно накапливаются в этих органеллах (фиг.4: Панель В). Панель А фиг.4 показывает изображение яркого поля того же ядра, что и в Панели В, при отличающейся плоскости фокусирования.
Фиг.5 показывает фотоавтотрофные клетки, обработанные покрытыми SAMSA-флуоресцеином GNP. Панель А показывает очень гиалиновые (прозрачные) клетки в 3-4-клеточных кластерах с большими хлоропластами, выстилающими внутреннюю стенку клеточной стенки. Панель В показывает накопление наночастиц в хлоропласте. Панели С и D показывают более высокое увеличение отдельного хлоропласта под флуоресцентным микроскопом. Наночастицы видимы в мембранных ламеллах хлоропласта и рассеяны среди красных автофлуоресцирующих хлорофилльных пигментов.
Таким образом, прослеживание живой фотоавтотрофной клетки с использованием микроскопа с ярким полем и флуоресцентного микроскопа в реальном времени продемонстрировало, что наночастицы накапливались как в мембране, так и в матриксе хлоропласта. Эти частицы могли быть также отслежены в просвете двойной мембраны хлоропласта.
Хотя эти эксперименты, выполненные для отслеживания частиц в хлоропласте, обнаружили, что эти частицы, по-видимому, накапливаются в пластидах, было трудно визуально идентифицировать присутствие частиц в оболочке хлоропласта с использованием световых микроскопов вследствие недостаточного разрешения. Таким образом, эти частицы дополнительно прослеживали с использованием отражательного и флуоресцентного микроскопов, и изображения объединяли (сливали) для ясного определения местоположения частицы, как видно на фиг.6. Панель А фиг.6 показывает отражательное изображение, где преимущественно видны GNP. Эта картина не только показывает присутствие наночастиц в хлоропласте, но также показывает большое накопление этих наночастиц в хлоропласте, что указывает на активное поглощение. Панель В показывает флуоресцирующие частицы в фоне красного автофлуоресцирующего хлоропласта. Объединенное (слитое) отражательное и флуоресцентное изображение показано в Панели С, где желтые флуоресцирующие частицы находятся в пределах границы хлоропласта, подтверждая присутствие этой частицы в пластидах.
Пример 4
Доставка присоединенной к ДНК GNP для трансформации ядер
Покрытые ДНК GNP синтезировали при помощи 2 путей, т.е. неспецифического взаимодействия и специфического взаимодействия (с использованием ПЭГ в качестве платформы), и инкубировали с клетками BY2/NT1. Для неспецифического взаимодействия 9 мл 3% маннита добавляли к 1 мл суспензии клеток и затем центрифугировали в течение 5 минут при 1000 об/мин. Затем супернатант декантировали и клетки ресуспендировали в 300 мкл 3% маннита. 50 мкл наночастиц золота с диаметром 150 нм (доступных из BBI International (EM. GC150)) и 50 мкг плазмидной ДНК (pDAB3831) (фиг.16) (SEQ ID NO:1 и 2), кодирующей YFP, добавляли к ресуспендированным клеткам и этой смеси давали инкубироваться в течение 20 минут. После инкубирования 20 мл 3% маннита добавляли к этому раствору и полученную смесь центрифугировали в течение 5 минут при 1000 об/мин. Затем супернатант декантировали и эти клетки ресуспендировали в 3 мл среды для выращивания. Затем ресуспендированные клетки переносили в микролунки по меньшей мере на 48 часов перед перенесением на чашки для отбора. Для специфического взаимодействия (ПЭГ-пути) использовали большой избыток в эквивалентах тиолового лиганда: 100 монослоев на частицу, с приближенной оценкой посредством предположения, что площадь поверхности, занимаемая единственной молекулой тиола, равна приблизительно 0,20 нм. С использованием этого расчета добавляли 2 мг SH-PEG(3)-OCH3 в цитратный раствор GNP. Эту смесь перемешивали при комнатной температуре в течение 20 ч, во время которых цвет этого раствора становился слегка более темным. Затем к реакционной смеси добавляли 3 объема ТГФ и полученный раствор центрифугировали при 13 К об/мин при 4°С в течение 30 минут. Супернатант удаляли, осадок перерастворяли в 10 мл ультрачистой воды (18 МОм·см), добавляли 30 мл ТГФ и проводили второе центрифугирование в тех же самых условиях. Затем осадок растворяли в ультрачистой воде (18 МОм·см) и хранили при комнатной температуре. Для нанесения покрытия плазмидной ДНК на H3CO-PEG-SH-GNP для экспериментов по трансформации 1 мг очищенной плазмидной ДНК инкубировали с 10 мг частиц золота в 50 мл воды в течение 2 часов при 23°С (см., например, Torney, F. et al., Nature Nanotechnol. 2, (2007)).
Одно графическое представление возможной схемы трансформации изображено на фиг.7. Для трансформации использовали плазмидную ДНК, pDAB3831, содержащую репортерный ген YFP. Клетки BY2 обрабатывали, как описано supra, и суспензии инкубировали в течение 48 часов - 72 часов с медленным перемешиванием в микротитрационных луночных планшетах. Аликвоту 50 мкл суспензии брали из общей смеси 0,5-1 мл и исследовали под флуоресцентным микроскопом для наблюдения какой-либо экспрессии репортерного гена. Клетки BY2, трансформированные плазмидой, содержащей репортерный ген YFP, обнаруживали транзиторную экспрессию YFP.
Пример 5
Доставка присоединенной к ДНК ПЭГилированной квантовой точки для ядерной трансформации
ПЭГ-функционализация QD для оценивающих исследований проникновения в клетку: этот протокол заимствовали из Dubertret B. et al., Science 298, 1759 (2002)). 2 мг покрытых TOPO (триоктилфосфиноксидом) CdSe/ZnS QD (квантовых точек) (Ocean nanotechnology, Cat. # QSO0630-0010) суспендировали с 0,015 г (5,5 мкмоль) PEG-PE (1,2-диацил-sn-глицеро-3-фосфоэтаноламин-N-[метокси-полиэтиленгликоль)]) (Avanti lipids, Cat. # 880160) в хлороформе с последующими выпариванием растворителя и солюбилизацией водой. PEG-конъюгирование выполняли для уверенности в том, что имеется полная защита от цитотоксичности.
QD-конъюгация с плазмидной ДНК: 2 мг покрытых TOPO (триоктилфосфиноксидом) QD (квантовых точек) (Ocean nanotechnology, Cat. # QSO0630-0010) суспендировали с 4 мг HS-PEG-OCH3 (Prochimia, Cat. #TH 014-01) в течение ночи при -60-70°C. Растворитель удаляли в вакуумном сушильном шкафу. Затем остаток суспендировали в 1 мл воды (18 M). Эта последняя стадия сопровождалась изменением красного остатка в оранжевый, оптически чистый, прозрачный раствор. Для нанесения покрытия плазмидной ДНК на H3CO-PEG-SH-QD для экспериментов трансформации, 0,02 мг очищенной плазмидной ДНК (pDAB 3831) инкубировали с полученным конъюгатом QD в 2 мл воды в течение 2 часов при 23°С в темноте (Torney, F. et al., Nature Nanotechnol. 2, (2007)).
Инкубация QD с интактными клетками табака: эксперименты с клеточными линиями выполняли с использованием линий отдельных клеток табака Bright Yellow (BY2) (Яркого Желтого), поддерживаемых при 25°C в среде LSBY2. Эти линии отдельных клеток получали при помощи методологии, описанной в IDM# 64901. Концентрацию 1-3 мкл/мл добавляли к 500 мкл клеток в 24-луночном микротитрационном планшете и осторожно вращали на шейкере в течение 20 минут перед анализом этих клеток.
Пример 6
Опосредованная наночастицами трансдукция и клеточная интернализация флуоресцентных белков в интактные клетки растений и потенциальные применения
Материалы для тестирования опосредованной наночастицами трансдукции и клеточной интернализации белков в клетки растений включают коллоиды золота с диаметром 150 нм (BBI International, GC150), 5-((2-(и-3)-S-(ацетилмеркапто)сукциноил)амино)флуоресцеин (SAMSA-флуоресцеин: Invitrogen, A-685), наночастицы с размером 80 и 90 нм покрытых карбоновой кислотой коллоидов золота (TedPella, 32019), Сульфо-NHS (N-гидроксисульфосукцинимид), EDC гидрохлорид (1-этил-3-[3-диметиламинопропил]карбодиимида), (Pierce Biotechnology, 24510, 22980,), MES (2-[N-морфолино]этансульфоновую кислоту) (Fisher Scientific, AC32776-1000), пакеты забуференного фосфатом солевого раствора (Sigma, P5368-10PAK), меченный гистидином GFP (Evrogen, максимум возбуждения - 482 нм, максимум испускания (эмиссии) - 502 нм, FP611), turbo YFP (Evrogen, максимум возбуждения - 525 нм, максимум эмиссии - 538 нм, FP611) и иодид пропидия (Sigma-P4864), диацетат флуоресцеина (Sigma, F7378).
Культуры клеток (отдельных клеток табака BY2-E): использовали как клетки BY2, так и клетки NT1. Клетки BY2/NT1 являются линией не зеленых, быстро растущих клеток табака. За три-четыре дня перед этим экспериментом, однонедельную суспензионную культуру субкультивировали в свежую среду перенесением 2 мл культуры NT1 или BY2 в 40 мл сред NT1B или LSBY2, содержащих 50 нМ DAS-патентованный MTI-1 (PMTI-1) (ингибитор микротрубочек), 1-3% глицерин и 0,05-0,1% (об./об.) ДМСО в колбе на 250 мл. Отдельные клетки собирали либо при 3,5 днях, либо при 7 днях после обработки ингибитором микротрубочек. Используемые отдельные клетки BY2 проводили через проточный цитометр Бекмана для счета жизнеспособных клеток. Получали 658250 жизнеспособных клеток/мл со средним диаметром 10,43 мкм (объемом 593,8 мкм3) - 50,42 мкм (объемом 67079,05 мкм3). Живые клетки в этих культурах после обработки PMTI-1, все, были отдельными клетками. Эти клетки испытывали с использованием Дифференциального Интерференционного Контрастного (DIC) микроскопа, подсоединенного к системе конфокальной визуализации.
Конъюгаты наночастиц: синтезировали конъюгат золото-флуоресцеин, конъюгат золото-меченный гистидином GFP и конъюгат золото-YFP.
Синтез конъюгата золото-флуоресцеин: конъюгат золото-флуоресцеин готовили с использованием способа, описанного ранее (Cannone, F., G. Chirico, et al. (2006), Quenching and Blinking of Fluorescence of a Single Dye Molecule Bound to Gold Nanoparticles. J. Phys. Chem. B 110(33): 16491-16498.). 1 мг SAMSA-флуоресцеина растворяли в 100 мкл 0,1 М NaOH и перемешивали на вортексе в течение 15 минут для удаления ацетильной группы, защищающей тиол. Затем этот активированный SAMSA смешивали с 100 мкл частиц золота с диаметром 150 нм (~109 частиц/мл). Затем полученный раствор инкубировали в течение 1 часа для гарантии завершения реакции. Затем добавляли 50 мкл 1 М HCl для нейтрализации этого раствора. Раствор центрифугировали при 3000 об/мин в течение 30 минут и супернатант удаляли. Полученный желтый осадок ресуспендировали в 200 мкл 0,1 М ЗФР с получением раствора оранжевого цвета. Эту стадию очистки повторяли 2 раза для гарантии удаления свободного SAMSA-флуоресцеина. Способом прикрепления SAMSA к золоту является в основном образование тиоловой связи. Вследствие существенного электростатического отталкивания (SAMSA является дианионным при рН>7), предполагается, что SAMSA расположен перпендикулярно коллоидной поверхности золота (Cannon et al., 2006).
Синтез конъюгата золото-меченный гистидином GFP и конъюгата золото-YFP: Конъюгаты золото-белок синтезировали с использованием небольшой модификации протокола, описанного Grabarek (Grabarek, Z. and J. Gergely (1990), Zero-length cross linking procedure with the use of active esters. Analytical Biochemistry 185(1): 131-135)), который иллюстрировал последовательное связывание двух белков. 0,25 мл коллоидного раствора покрытого 90 нм карбоновой кислотой золота (~109 частиц/мл) центрифугировали при 3000 об/мин в течение 10 минут. После выбрасывания супернатанта красный осадок суспендировали в 1 мл активирующего буфера (0,1 M MES, 0,5 M NaCl, pH 6,0). К этому раствору добавляли 0,4 мг EDC и 1,1 мг сульфо-NHS и перемешивали на вортексе в течение 15 минут при комнатной температуре. Затем добавляли 9 мкл белка (меченного гистидином GFP или turbo YFP) и полученный раствор инкубировали в течение 2 часов в темноте при комнатной температуре для полного завершения реакции этого белка и золота. Отношение коллоидов золота и белка, использованное в этой реакции, определяли нахождением количества карбоновых кислот, присутствующих на частицах золота. Сначала количество карбоксильных групп, присутствующих на одном коллоиде золота, рассчитывали делением площади поверхности 1 частицы золота (предположительно сферической) на поверхность, занимаемую одной карбоксильной группой (0,20 нм2 Kimura, K.; Takashima, S.; Ohshima, H. Journal of Physical Chemistry B 2002, 106, 7260-7266). Этот результат умножали на общее количество коллоидов золота, присутствующих во всем коллоидном растворе золота. Этот результат был равен количеству аминогрупп, присутствующих в данном количестве белка. Эти коллоиды золота присоединяются к белку через образование амидной связи между карбоновой кислотой, присутствующей на золоте, и аминогруппой, присутствующей на белке (Grabarek, Z. and J. Gergely (1990). Zero-length cross linking procedure with the use of active esters. Analytical Biochemistry 185(1): 131-135). Имеются приблизительно 127285 молекул белка, связанных с одной наночастицей золота.
Обработки клеток - Три отдельные пробы готовили для тестирования следующим образом:
Временной ход поглощения золота и жизнеспособность клеток - Готовили следующие пробы в 24-луночных стерильных планшетах:
i) 500 мкл отдельных клеток BY2-E (контроль);
ii) 500 мкл отдельных клеток BY2-E + 20 мкл GNP + 25 мкл флуоресцеиндиацетата (FDA) + 25 мкл иодида пропидия; и
(iii) другие обработки включают 40, 60, 80 мкл GNP с этими клетками и красителями на жизнеспособность клеток, упоминаемыми выше. Обработанные пробы (Ref) исследовали под флуоресцентным микроскопом при 5, 20, 120 минутах и, наконец, после 18-20 часов.
Обработки золотом-SAMSA-флуоресцеином - Готовили следующие пробы в 24-луночных стерильных планшетах:
i) 500 мкл отдельных клеток BY2-E (контроль);
ii) 500 мкл отдельных клеток BY2-E + 20 мкл SAMSA-флуоресцеина (контроль); и
iii) 500 мкл отдельных клеток BY2-E + 20 мкл Au-SAMSA-флуоресцеин.
Эти обработанные клетки инкубировали в течение 20 минут в темноте при комнатной температуре перед проведением микроскопических исследований.
Обработки золотом-меченным гистидиномGFP - Готовили следующие пробы в 24-луночных стерильных планшетах:
i) 500 мкл отдельных клеток BY2-E (контроль);
ii) 500 мкл отдельных клеток BY2-E + 10 мкл меченного гистидином GFP (контроль); и
iii) 500 мкл отдельных клеток BY2-E + 20 мкл Au-меченный гистидином GFP.
Эти обработанные клетки инкубировали в течение 2 часов в темноте при комнатной температуре перед проведением микроскопических исследований.
Микроскопия: Фазово-контрастную и флуоресцентную микроскопию экспериментов с отдельными клетками с конъюгатами Au-SAMSA флуоресцеин и Au-меченный гистидином GFP проводили с использованием инвертационного флуоресцентного микроскопа Leica (DAS). Все эксперименты проводили при увеличении 20Х. Для обработок отдельных клеток SAMSA-флуоресцеином и GFP использовали, соответственно, фильтр FITC (флуоресцеинизотиоцианат) и GFP-фильтр.
Дифференциальная интерференционная контрастная (DIC), конфокальная и отражательная микроскопия: Эти исследования проводили в Центре микроскопии UIUC (University of Illinois at Urbana Champaign) на инвертационном микроскопе Zeiss. Для всех этих способов увеличение сохраняли при 63Х. Для конфокальной микроскопии фильтры FITC, GFP и YFP использовали для различных обработок клеток. Для отражательных исследований дихроичное зеркало заменяли прозрачным предметным стеклом и эмиссионный фильтр удаляли.
Получение изображений: Культивированные в суспензии клетки табака визуализировали с использованием микроскопа Zeiss Axiovert M 200, снабженного микротомной системой изготовления апотомных оптических срезов, связанной с системой освещения X-Cite 120 (Carl Zeiss microimaging, Obercohen, Germany). Частицы золота визуализировали при помощи установки отражательной визуализации с использованием ртутных ламп с применением фильтра возбуждения 635/20 и визуализировали с использованием поляризующего фильтрующего устройства IGS (доступного из 33001, Chroma Technology Corp., Rockingham, VT), состоящего из GG420 glass для блокирования UV, KG5 (блокатора IR), расщепителя луча 50/50 и параллельных поляризаторов возбуждения и испускания. Одновременно получали DIC/просвечивающие световые изображения с использованием стандартной DIC-оптики, и получали GFP в покрытых GFP-ДНК частицах золота (псевдоокрашенные зеленые) с полосой пропускания FITC-фильтра (фильтр возбуждения HQ480/40, дихроичное зеркало Q505LP и испускание HQ535/50). Аликвоты клеток помещали в установку с покровным стеклом, имеющим толщину 500 микрон (Grace Bio-labs, Bend, OR) для визуализации высокого разрешения. Большинство изображений требовали объектива 63x 1.4 NA Planapochromat или объектива 40x 1.4 NA Planapochromat, в зависимости от размера клетки (доступных из Carl Zeiss Microimaging, Obercohen, Germany). Время экспозиции устанавливали для каждого канала (т.е. DIC, отражательный и/или FITC) и экспонировали последовательно с использованием программы Axiovision 4.6 с монохромной камерой Axiocam MRm высокого разрешения (доступной из Carl Zeiss, Obercohen, Germany) с размером 1388×1034 пикселей. При необходимости, разрешение устанавливали при 1024×1024 и последовательности промежутков времени изображений, получаемых при наивысшей возможной скорости для различения динамики частиц, на протяжении периода 2-5 минут, составляющих 150-250 кадров. Эти изображения получали либо в Axiovision 4.6 gallery module, либо Adobe Photoshop (Adobe Systems, San Jose, CA).
Исследования временного хода и интернализации GNP: Для оценивания влияния поглощения частиц и концентрации GNP на целостность и жизнеспособность клеток, эксперименты по исследованию временного хода выполняли на линиях отдельных клеток BY2-E, инкубируемых с функционализованными цитратом GNP (с диаметром 90 нм). В этом эксперименте использовали различные концентрации GNP (20, 40, 60, 80 мкл). Частицы интернализовались в пределах 5 минут после смешивания с клетками, в то время как накопление частиц происходило до 2 часов для обнаружения увеличенных уровней в цитозоле и ядре этих клеток. Среди тестируемых концентраций более высокий уровень жизнеспособности клеток и мощность клеток наблюдали с обработкой 20 мкл, при исследовании при помощи протокола FDA и PI (окрашивание живых/мертвых клеток). Во всех обработанных пробах средняя жизнеспособность этих клеток была близка к 98%, но при наивысшей тестируемой концентрации, в обработке 80 мкл не наблюдали окрашенного FDA ядра. Однако эти неокрашенные ядра не отвечали на PI, что указывало на смерть клеток. Этот результат указывает на то, что наивысшая концентрация частиц могла приводить к внутренним нарушениям до такой степени, что эта клетка может быть в стадии покоя, но все еще живой после 20 часов обработки.
______________________________________________________________________________________________
Исследование слежения отражательной микроскопией: Отражательные исследования на отдельных клетках табака BY2/NT1, обработанных конъюгатами золото-белок (GFP/YFP), показывают присутствие наночастиц золота внутри этих клеток. Это присутствие сравнивали с необработанными контрольными отдельными клетками BY2, которые, по-видимому, являются темными при тех же условиях, как показано на фиг.8. Наблюдали отдельные наночастицы золота, испускающие яркое отражение, как показано на фиг.8. Это является ясным указанием на поглощение наночастиц золота этими имеющими стенки клетками BY2.
Эксперименты с конъюгатом золото-SAMSA-флуоресцеин: Фазово-контрастные эксперименты, проведенные при DAS, выявили ярко-желтое окрашивание внутриклеточного пространства и ядра для обработанных клеток в сравнении с серебряным контрастом, наблюдаемым для контрольных отдельных клеток. Кроме того, во многих клетках, в условиях плазмолиза, плазматическая мембрана сама отрывается от клеточной стенки, оставляя пространство между ними, указывающее на частичный или полный плазмолиз этой клетки, как показано на фиг.9. Такие клетки, при наблюдении в экспериментах конфокальной флуоресценции отдельных клеток, обработанных только SAMSA-флуоресцеином, показывали флуоресценцию в цитоплазме и ядре, в то время как они, по-видимому, являются черными в необработанных контрольных клетках. Кроме того, клетки, обработанные только SAMSA-флуоресцеиновым красителем, обнаруживали некоторую флуоресценцию стенок, но не внутри клеток. Это означает, что SAMSA-флуоресцеин не интернализуется клетками самостоятельно и что наночастица золота действует в качестве носителя для его поглощения.
Эксперименты с конъюгатом золото-меченный гистидином GFP: Для установления доставки белка в интактные клетки через GNP, авторы подтвердили присоединение GFP к GNP с использованием флуоресцентной микроскопии, как показано на фиг.10. Флуоресцентные изображения клеток BY2, обработанных меченным гистидином GFP, показывают внеклеточную флуоресценцию с темными клетками без флуоресценции в центре. Это показывает, что в контрольных обработках, где меченный гистидином GFP добавляют к клеткам без частиц Au, они не интернализуют эти частицы. Данные, которые поддерживают поглощение белка внутрь клеток, включают следующее: i) увеличенную интенсивность флуоресценции в обработанных клетках внутри, ii) флуоресцирующие цитоплазматические тяжи в обработанных клетках в сравнении с темными тяжами в контрольных клетках (см. фиг.11). Сходные наблюдения были сделаны со связанными с YFP наночастицами (GNP), что указывало на явную интернализацию этого флуоресцентного белка в клетки растений интактными клетками (см. фиг.12).
Имеется определенный уровень фоновой отражательной способности и автофлуоресценции в отдельных клетках, которые присущи плазмолизу/умиранию или клеткам, обнаруживающим (PCD)-подобные цитологические характеристики программы смерти клеток. Для ограждения клеток, которые интернализовали белок, от таких фоновых проблем и недвусмысленного доказательства прямыми данными интернализацию белка, проводили обширное исследование пределов отражательной способности для фокусировки и прослеживания уровней индивидуальных частиц или агрегатов частиц. Результаты этого изобретения ясно показали интернализацию частиц с белком вовнутрь клеток и ядра. Однако, клетки, которые накапливали увеличенное количество частиц с флуоресцентным белком, имели тенденцию подвергаться плазмолизу при наблюдении под этим микроскопом. Вероятно, увеличенная концентрация белка вследствие накопления высоких уровней GNP, связанных либо с GFP, либо с YFP, достигает токсичных уровней или продолжительное наблюдение под микроскопом индуцирует ROS, которая, в свою очередь, оказывает вредное действие в таких клетках.
Пример 7
Молекулярный анализ и доказательство геномной интеграции трансгенов в T1-потомстве сорта Columbia Arabidopsis thaliana
Геномную ДНК из трансгенных растений Arabidopsis экстрагировали из общего вещества 6-недельного листа с использованием мининабора DNeasy Plant в соответствии с инструкциями изготовителя (Qiagen Inc). Следующие ПЦР-праймеры YFP и PAT использовали в ПЦР-реакциях, использующих матричную геномную ДНК из Т1-проростков, которые переносят 4-5Х опрыскивание полевого уровня гербицида Finale.
YFP
Прямой праймер: 5'-TGTTCCACGGCAAGATCCCCTACG-5' (SEQ ID NO:3) Обратный праймер: 5'-TATTCATCTGGGTGTGATCGGCCA-3' (SEQ ID NO:4)
PAT
Прямой праймер: 5'-GGAGAGGAGACCAGTTGAGATTAG-3' (SEQ ID NO:5)
Обратный праймер: 5'-AGATCTGGGTAACTGGCCTAACTG-3' (SEQ ID NO:6)
ПЦР для продуктов генов PAT and YFP (желтая флуоресцентная метка, Evrogen) амплифицировали в общем объеме реакции 50 мкл смеси, содержащей 100 нг геномной матричной ДНК, 1х реакционный буфер ExTaq (TaKaRa Bio), 0,2 мМ dNTP, 10 пмоль каждого праймера и 0,025 единиц/мкл ExTaq. Использовали следующие условия ПЦР: 1 цикл при 96°C в течение 5 минут и 31 цикл следующей ПЦР-программы: 94°C, 15 с; 65°C, 30 с; 72°C, 1 мин, и конечное удлинение проводили при 72°C в течение 7 мин для завершения синтеза продукта. Изображения в геле получали с использованием системы визуализации Bio Rad Gel (фиг.13 и 14). Амплифицированные фрагменты гель-очищали с использованием набора для очистки в геле (Qiagen Inc.) в соответствии с инструкциями изготовителя.
ПЦР-фрагменты секвенировали с использованием прямого праймера PAT и обратного праймера YFP при помощи усовершенствованной технологии секвенирования Sanger (MWG Biotechnologies, Inc) и эту последовательность анализировали при помощи программы (программного обеспечения) Sequencher.
Эти результаты показывают, что последовательности PAT и YFP доставлялись посредством опосредованной наночастицами и квантовыми точками доставки ДНК, обеспечивая тем самым ясное доказательство стабильной геномной интеграции трансгенов в геномной ДНК Т1-растений.
Пример 8
Облегченная доставка QD через стенку отдельной клетки табака JTNT1
Несколько пептидов поверхностно функционализовали на основе процедуры, обсуждаемой в примере 7, для тестирования неинвазивной доставки QD через клеточную стенку. Определение прикрепления проникающего в клетку пептида (СРР)/единицы трансдукции белка (PTD) проводили посредством гель-электрофореза, как описано ниже.
Гель-электрофорез проводили на конъюгатах QD-пептид для подтверждения присоединения пептидов к QD. Использованными пробами были QD-амин (контроль), QD-амин-R9, QD-амин-зеин, QD-амин-Pep1 и QD-амин-MPG. R9, зеин, Pep1 и MPG являются пептидами. 2% (масса/объем) агарозный гель использовали для проведения электрофореза при 120 В в TBE-буфере (1X, pH 8) в течение 1 часа. QD-амин-пептиды мигрировали в направлении отрицательного конца электрода, показывая присоединение очень положительного характера пептидов, присоединенных к QD, в то время как QD-амин оставался статическим, показывая слабый положительный заряд этой аминогруппы вследствие эффекта нейтрализации буфера геля при основном рН, как показано на фиг.15 (дорожка 1: QD-амин; 2: QD-амин-R9; 3: QD-амин-Т-зеин; 4: QD-амин-Pep1; 5: QD-амин-MPG).
Эти пептиды тестировали на интернализацию в клетки и испускание QD внутри клетки использовали как меру прослеживания уровня интернализации этих частиц внутри клетки и компартментов. Отдельные клетки JTNT1 с интактными стенками использовали в качестве клеток-мишеней в этих экспериментах. Таблица 1 показывает обработки проб. Эти клетки прослеживали под микроскопом.
Микроскопию проводили в пределах 1 минуты после приготовления пробы на конфокальном микроскопе с вращающимся диском (Andor Technology Revolution System). Фильтр возбуждения был установлен при 488 нм, тогда как фильтр испускания был установлен за 650 нм.
Как показано в таблице 1, контрольные протопласты и JTNTl не обнаруживали автофлуоресценции при длине волны испускания, используемой для QD. Наблюдали существенные остатки (части разрушенных клеток) в каждой из этих проб. Пробы 4, 5, 6 и 7 не обнаруживали интернализации QD внутри отдельных клеток или протопластов. Пробы 8 и 9 показывали ясное присутствие QD, окружавших ядро, как в отдельных клетках со стенками, так и протопластах. Это было обусловлено присутствием проникающего в клетки пептида на QD, который имеет сигнал ядерной локализации (NLS). Однако, проба № 6 и проба № 7, имевшие γ-зеин, связанные с QD, не обнаруживали интернализации QD внутри клетки. Это свидетельствует о том, что QD поглощались в эти клетки вследствие проникающего в клетку пептида (CPP) или единицы трансдукции белков (PTD), а γ-зеин в виде QD, которая была функционализована только аминогруппой, но не CPP/PTD, не становился интернализованным.
Этот результат демонстрирует доказательство клеточной интернализации квантовых точек, соединенных с CPP/PTD, с сигналом ядерной локализации (NLS), проносящим эти QD через клеточную стенку интактной функционализованной клетки, посредством конфокального микроскопа с вращающимся диском (Andor Technology Revolution System). Эта ядерная локализация QD возможна через клеточную стенку в пробе 9 и в отсутствие клеточной стенки, как видно при клеточной интернализации на основе протопластов, которая удаляет клеточную стенку обработкой ферментами. Таким образом, само присутствие клеточной стенки не мешает интернализации квантовых точек, о чем свидетельствует то, что проникновение частиц демонстрируется неинвазивно с CPP/PTD в клетках растений с интактной клеточной стенкой.
Хотя это изобретение было описано в некоторых вариантах осуществления, данное изобретение может быть дополнительно модифицировано в пределах идеи и объема этого описания. Таким образом, предполагается, что эта заявка охватывает любые вариации, применения или адаптации этого изобретения, использующие его общие принципы. Кроме того, предполагается, что эта заявка охватывает такие отклонения от данного описания, которые находятся в пределах известной или общепринятой практики в области, к которой относится это изобретение, и которые входят в пределы пунктов прилагаемой формулы изобретения и их эквивалентов.
Реферат
Изобретение относится к области биохимии, в частности к способам введения представляющей интерес молекулы в клетку растения, имеющую клеточную стенку. Способы включают в себя: субкультивирование однонедельной суспензионной культуры растения, содержащей клетку растения, имеющую клеточную стенку, в свежей культуральной среде, содержащей эффективное количество ингибитора микротрубочек, в течение 4-7 дней; покрытие наночастицы, имеющей диаметр 150 нм или менее, интерес молекулой; приведение субкультуры растения и имеющей покрытие наночастицы в контакт друг с другом; совместное инкубирование субкультуры растения и имеющей покрытие наночастицы в течение по меньшей мере 20 минут для того, чтобы обеспечить поглощение наночастицы и представляющей интерес молекулы в клетку растения, содержащую клеточную стенку; где поглощение не осуществляется посредством метода биолистики, генной пушки, микроинъекции или импалефекции. Изобретение позволяет эффективно вводить представляющую интерес молекулу в клетку растения, имеющую клеточную стенку. 3 н. и 7 з.п. ф-лы, 16 ил., 1 табл., 8 пр.
Формула
(i) субкультивирование однонедельной суспензионной культуры растения, содержащей клетку растения, имеющую клеточную стенку, в свежей культуральной среде, содержащей эффективное количество ингибитора микротрубочек, в течение 4-7 дней, продуцируя посредством этого субкультуру растения, содержащую клетку растения, имеющую клеточную стенку;
(ii) покрытие наночастицы, имеющей диаметр 150 нм или менее, представляющей интерес молекулой;
(iii) приведение субкультуры растения и имеющей покрытие наночастицы в контакт друг с другом; и
(iv) совместное инкубирование субкультуры растения и имеющей покрытие наночастицы в течение по меньшей мере 20 минут для того, чтобы обеспечить поглощение наночастицы и представляющей интерес молекулы в клетку растения, содержащую клеточную стенку;
где поглощение не осуществляют посредством метода биолистики, генной пушки, микроинъекции или импалефекции.
(i) субкультивирование однонедельной суспензионной культуры растения, содержащей клетку растения, имеющую клеточную стенку, в свежей культуральной среде, содержащей эффективное количество ингибитора микротрубочек, в течение 4-7 дней, продуцируя посредством этого субкультуру растения, содержащую клетку растения, имеющую клеточную стенку;
(ii) покрытие наночастицы, функционализированной проникающим в клетку пептидом или единицей трансдукции белка и имеющей диаметр 100 нм или менее, представляющей интерес молекулой;
(iii) приведение субкультуры растения и имеющей покрытие наночастицы в контакт друг с другом; и
(iv) совместное инкубирование субкультуры растения и имеющей покрытие наночастицы в течение по меньшей мере 20 минут для того, чтобы обеспечить поглощение наночастицы и представляющей интерес молекулы в клетку растения, содержащую клеточную стенку;
где поглощение не осуществляют посредством метода биолистики, генной пушки, микроинъекции или импалефекции.
(i) субкультивирование однонедельной суспензионной культуры растения, содержащей клетку растения, имеющую клеточную стенку, в свежей культуральной среде, содержащей эффективное количество ингибитора микротрубочек, в течение 4-7 дней, продуцируя посредством этого субкультуру растения, содержащую клетку растения, имеющую клеточную стенку;
(ii) покрытие золотой наночастицы, имеющей диаметр 150 нм, представляющей интерес молекулой;
(iii) приведение субкультуры растения и имеющей покрытие наночастицы в контакт друг с другом; и
(iv) совместное инкубирование субкультуры растения и имеющей покрытие наночастицы в течение по меньшей мере 20 минут для того, чтобы обеспечить поглощение наночастицы и представляющей интерес молекулы в клетку растения, содержащую клеточную стенку;
где поглощение не осуществляют посредством метода биолистики, генной пушки, микроинъекции или импалефекции; и
где представляющая интерес молекула представляет собой нуклеиновую кислоту или флуоресцеин.
Документы, цитированные в отчёте о поиске
Трансформация хлоропластов ряски

Комментарии