Биологически активное соединение, содержащее кодирующий олигонуклеотид, и библиотека соединений - RU2592673C2
Код документа: RU2592673C2
Чертежи

























































































































































































Описание
Область техники, к которой относится изобретение
Данное изобретение относится к области биологической химии, а именно к новому способу синтеза библиотек молекул, содержащих олигонуклеотидную метку. Данные библиотеки могут быть использованы для определения соединений, связывающихся с определенной биологической мишенью.
Уровень техники
Поиск более эффективных способов идентификации соединений, характеризующихся ценными биологическими свойствами, привел к развитию методов скриннинга огромного числа различных соединений, собранных в коллекциях, которые называются комбинаторными библиотеками. Такие библиотеки включают 105 или более различных соединений. Существует множество способов создания комбинаторных библиотек, а также описан комбинаторный синтез пептидов, пептидомиметиков и низкомолекулярных органических молекул.
Две основные проблемы при использовании комбинаторного подхода в создании лекарственных средств заключаются в синтезе библиотек достаточной сложности и в идентификации молекул, обладающих активностью, определенной различными методами анализа. Общеизвестно, что чем выше степень сложности библиотеки, т.е. число различных структур, включенных в библиотеку, тем выше вероятность наличия в библиотеке молекул, обладающих требуемой активностью. Следовательно, методы химического синтеза для создания библиотеки должны обеспечивать получение огромного числа соединений в пределах разумного промежутка времени. Однако с учетом данной "формальной" или общей концентрации, при увеличении числа различных членов в библиотеке снижается концентрация конкретного члена в библиотеке, что осложняет идентификацию активных молекул в библиотеках высокой сложности.
Один из подходов к преодолению таких недостатков заключается в создании кодированных библиотек, и, прежде всего, библиотек, в которых каждое соединение включает амплифицируемую метку. Такие библиотеки включают ДНК-кодированные библиотеки, в которых меченый фрагмент ДНК, идентифицирующий член библиотеки, можно амплифицировать с использованием методов молекулярной биологии, таких как полимеразная цепная реакция. Однако использование таких способов для получения библиотек, включающих огромное множество соединений, еще находится на стадии разработки, и очевидно, что для реализации такого подхода при создании лекарственных средств существует необходимость в развитии усовершенствованных методов создания таких библиотек.
Раскрытие изобретения
В настоящем изобретении предлагается способ синтеза библиотек молекул, которые содержат кодирующую олигонуклеотидную метку. В данном способе используется стратегия "разделения и объединения", которая заключается в том, что раствор, содержащий инициатор, первый структурный элемент, связанный с кодирующим олигонуклеотидом, разделяют на множество фракций ("разделение"). В каждой фракции инициатор взаимодействует со вторым, уникальным, структурным элементом и вторым уникальным олигонуклеотидом, который идентифицирует второй структурный элемент. Эти реакции проводят одновременно или последовательно, и в случае последовательных реакций, каждая реакция предшествует другой реакции. Димерные молекулы, образующиеся в каждой фракции, объединяют ("объединение") и затем снова разделяют на множество фракций. Каждая из таких фракций взаимодействует с третьим уникальным (специфичным для данной фракции) структурным элементом и третьим уникальным олигонуклеотидом, который кодирует структурный элемент. Число специфичных молекул, присутствующих в полученной библиотеке, зависит (1) от числа различных структурных элементов, использованных на каждой стадии синтеза, и (2) от числа стадий разделения и объединения фракций.
В одном варианте воплощения настоящего изобретения предлагается способ синтеза молекулы, содержащей или представляющей собой функциональный фрагмент, эффективно связанный с кодирующим олигонуклеотидом. Такой способ включает следующие стадии: (1) выбор соединения-инициатора, состоящего из функционального фрагмента, содержащего n структурных элементов (где n равно целому числу 1 или более), причем функциональный фрагмент содержит по меньшей мере одну реакционноспособную группу, и эффективно связана с исходным олигонуклеотидом; (2) взаимодействие соединения-инициатора со структурным элементом, содержащим по меньшей мере одну комплементарную реакционноспособную группу, которая является комплементарной в отношении реакционноспособной группы, описанной на стадии (1), в условиях, пригодных для взаимодействия реакционноспособной группы и комплементарной реакционноспособной группы с образованием ковалентной связи; (3) взаимодействие исходного олигонуклеотида с новым олигонуклеотидом, который идентифицирует структурный элемент, описанном на стадии (b) в присутствии фермента, который катализирует лигирование исходного олигонуклеотида и нового олигонуклеотида в условиях, пригодных для лигирования исходного олигонуклеотида и нового олигонуклеотида, с образованием молекулы, содержащей или представляющей собой функциональный фрагмент, включающий n+1 структурных элементов, которые эффективно связаны с кодирующим олигонуклеотидом. Если функциональная группа, описанная на стадии (3) содержит реакционноспособную группу, то стадии 1-3 при необходимости повторяют один или более раз, при этом проводят циклы 1-i (где i равно целому числу 2 или более) с использованием продукта, полученного на стадии (3) цикла s (где s равно целому числу i-1 или менее), выполняющего функции соединения-инициатора в цикле s+1.
В одном варианте воплощения настоящего изобретения предлагается способ синтеза библиотеки соединений, в которой соединения содержат функциональный фрагмент, содержащий 2 или более структурных элементов, эффективно связанных с олигонуклеотидом, который идентифицирует структуру функционального фрагмента. Способ включает следующие стадии: (1) обеспечение раствора, включающего m соединений-инициаторов (где m равно целому числу 1 или более), причем соединения-инициаторы состоят из функционального фрагмента, содержащего n структурных элементов (где n равно целому числу 1 или более), которые эффективно связаны с исходным олигонуклеотидом, идентифицирующим n структурных элементов; (2) разделение раствора, полученного на стадии (2), на r фракций (где r равно целому числу 2 или более); (3) взаимодействие соединений-инициаторов в составе каждой фракции с одним из r структурных элементов с образованием r фракций, содержащих соединения, состоящие из функционального фрагмента, содержащего n+1 структурных элементов, который эффективно связан с исходным олигонуклеотидом; (4) взаимодействие исходного олигонуклеотида в составе каждой фракции с одним из набора r различных новых олигонуклеотидов в присутствии фермента, который катализирует лигирование нового и исходного олигонуклеотидов в условиях, пригодных для ферментативного лигирования нового и исходного олигонуклеотидов, с получением r аликвотных фракций, состоящих из функционального фрагмента, содержащего n+1 структурных элементов, эффективно связанной с удлиненным олигонуклеотидом, который кодирует n+1 структурных элементов. Способ необязательно включает стадию (5) рекомбинирования r фракций, полученных на стадии (4), с получением раствора, содержащего соединения, состоящие из функциональной группы, содержащей n+1 структурных элементов, и эффективно связанной с удлиненным олигонуклеотидом. Стадии (1)-(5) при необходимости повторяют один или более раз, при этом проводят циклы 1-i (где i равно целому числу 2 или более). В цикле s+1 (где s равно целому числу i-1 или менее), раствор, включающий m соединений-инициаторов, описанных на стадии (1), является раствором, описанным на стадии (5) цикла s. Аналогичным образом, соединения-инициаторы, описанные на стадии (1) цикла s+1, являются соединениями-инициаторами, описанными на стадии (5) цикла s.
В предпочтительном варианте, для конденсации структурных элементов на каждой стадии используют стандартные химические реакции. Структурные элементы конденсируют с образованием линейных или разветвленных полимеров или олигомеров, таких как пептиды, пептидомиметики или пептоиды или неолигомерные молекулы, такие как молекулы, включающие структуру-каркас, к которой присоединяют один или более дополнительных химических компонентов. Например, если структурные элементы представляют собой аминокислотные остатки, то их конденсируют с использованием стандартных методов пептидного синтеза, таких как синтез в растворе или твердофазный синтез, с использованием известных пригодных способов введения/удаления защитных групп. Предпочтительным способом для конденсирования структурных элементов является синтез в растворе. В качестве кодирующих олигонуклеотидов используют одноцепочечные или двухцепочечные олигонуклеотиды, предпочтительно двухцепочечные олигонуклеотиды. Кодирующие олигонуклеотиды предпочтительно включают от 4 до 12 оснований или пар оснований на один структурный элемент; кодирующие олигонуклеотиды конденсируют с использованием стандартных методов синтеза олигонуклеотидов в растворе или твердофазного синтеза, но предпочтительно конденсируют с использованием ферментативного синтеза в растворе. Например, олигонуклеотиды конденсируют с использованием топоизомеразы, лигазы или ДНК-полимеразы, если последовательность кодирующих олигонуклеотидов включает инициирующую последовательность для лигирования с одним из таких ферментов. Ферментативная конденсация кодирующих олигонуклеотидов характеризуется следующими преимуществами: (1) высокая точность присоединения по сравнению со стандартной (неферментативной) конденсацией и (2) использование более простого способа введения/удаления защитных групп.
В другом варианте в настоящем изобретении предлагаются соединения формулы I:
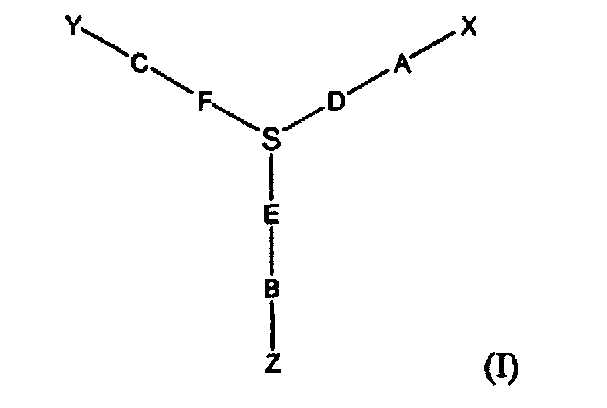
где X означает функциональный фрагмент, содержащий один или более структурных элементов; Z означает олигонуклеотид, присоединенный через 3′-концевой участок к B; Y означает олигонуклеотид, который присоединен через 5′-концевой участок к C; A означает функциональную группу, ковалентно связанную с X; B означает функциональную группу, связанную с 3′-концевым участком фрагмента Z; C означает функциональную группу, связанную с 5′-концевым участком фрагмента Y; D, F и E каждый независимо означает бифункциональную связующую группу, а S означает атом или молекулярный каркас. Такие соединения могут быть в синтезированы в том числе с использованием способов по настоящему изобретению.
Настоящее изобретение относится также к библиотеке соединений, содержащей соединения, содержащие функциональный фрагмент, содержащий два или более структурных элементов, и эффективно связанную с олигонуклеотидом, кодирующим структуру функционального фрагмента. Такие библиотеки включают от приблизительно 102 до приблизительно 1012 или более различных членов, например, 102, 103, 104, 105, 106, 107, 108, 109, 1010, 1011, 1012 или более различных членов, т.е. различных молекулярных структур. В одном варианте воплощения настоящего изобретения библиотека соединений содержит соединения, каждое из которых независимо означает соединение формулы I:

где X означает функциональный фрагмент, содержащий один или более структурных элементов; Z означает олигонуклеотид, присоединенный через 3′-концевой участок к B; Y означает олигонуклеотид, присоединенный через 5′-концевой участок C; A означает функциональную группу, ковалентно связанную с X; B означает функциональную группу, связанную с 3′-концевым участком фрагмента Z; C означает функциональную группу, связанную с 5′-концевым участком фрагмента Y; D, F и E каждый независимо означает бифункциональную связующую группу, а S означает атом или молекулярный каркас. Такие библиотеки могут быть синтезированы в том числе с использованием способов по настоящему изобретению.
В другом аспекте настоящего изобретения предлагается способ поиска (идентификации) соединения, которое связывается с биологической мишенью, при этом указанный способ включает следующие стадии: (1) контактирование биологической мишени с библиотекой соединений по настоящему изобретению, включающей соединения, которые содержат функциональный фрагмент, содержащий два или более структурных элемента и эффективно связанный с олигонуклеотидом, кодирующим структуру функционального фрагмента. Данную стадию проводят в условиях, пригодных для связывания по крайней мере одного члена библиотеки соединений с мишенью; (2) удаление членов библиотеки, которые не связаны с мишенью; (3) амплификация кодирующих олигонуклеотидов по меньшей мере одного члена библиотеки соединений, который связывается с мишенью; (4) секвенирование кодирующих олигонуклеотидов, описанных на стадии (3) и использование последовательностей, определенных на стадии (4), для определения структуры функциональных фрагментов членов библиотеки соединений, которые связываются с биологической мишенью.
Настоящее изобретение демонстрирует несколько преимуществ идентификации молекул, обладающих требуемыми свойствами. Например, способы по настоящему изобретению обеспечивают использование ряда химических реакций для конструирования молекул в присутствии олигонуклеотидной метки. Способы по настоящему изобретению позволяют вводить с высокой точностью олигонуклеотидные метки в образующиеся таким образом химические структуры. Более того, указанные способы позволяют проводить синтез библиотек, содержащих множество копий каждого члена, что в свою очередь позволяет проводить множество циклов селекции в отношении биологической мишени и при этом остается достаточное число молекул, которые подвергаются конечному циклу амплификации и секвенирования олигонуклеотидной метки.
Краткое описание чертежей
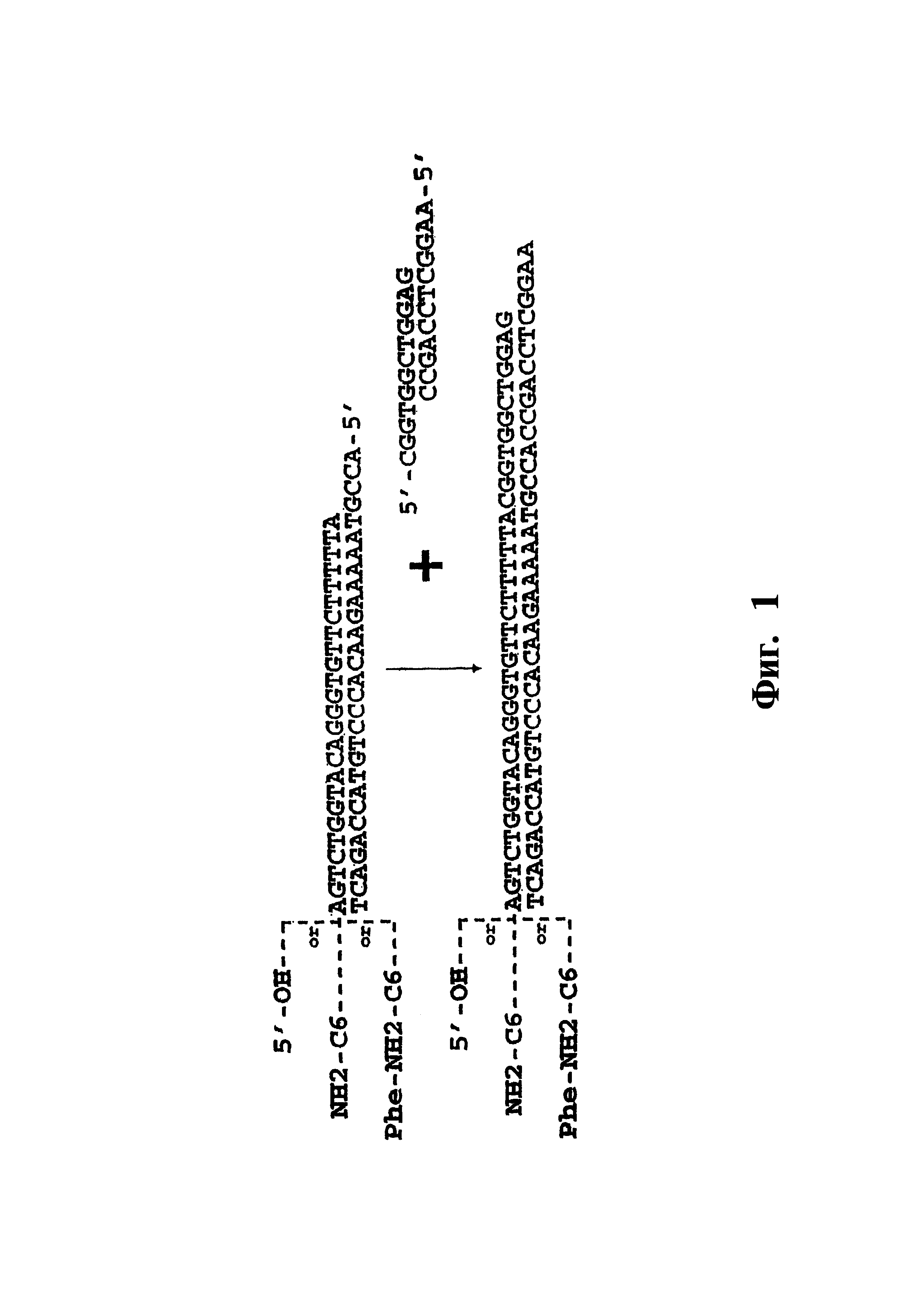
На фиг. 1 показана схема лигирования двухцепочечных нуклеотидов, причем исходный нуклеотид содержит выступающий участок, комплементарный выступающему участку нового олигонуклеотида. Исходная цепочка изображена в виде свободной, конъюгированной с аминогексильным линкером или конъюгированной с остатком фенилаланина через аминогексильный линкер.
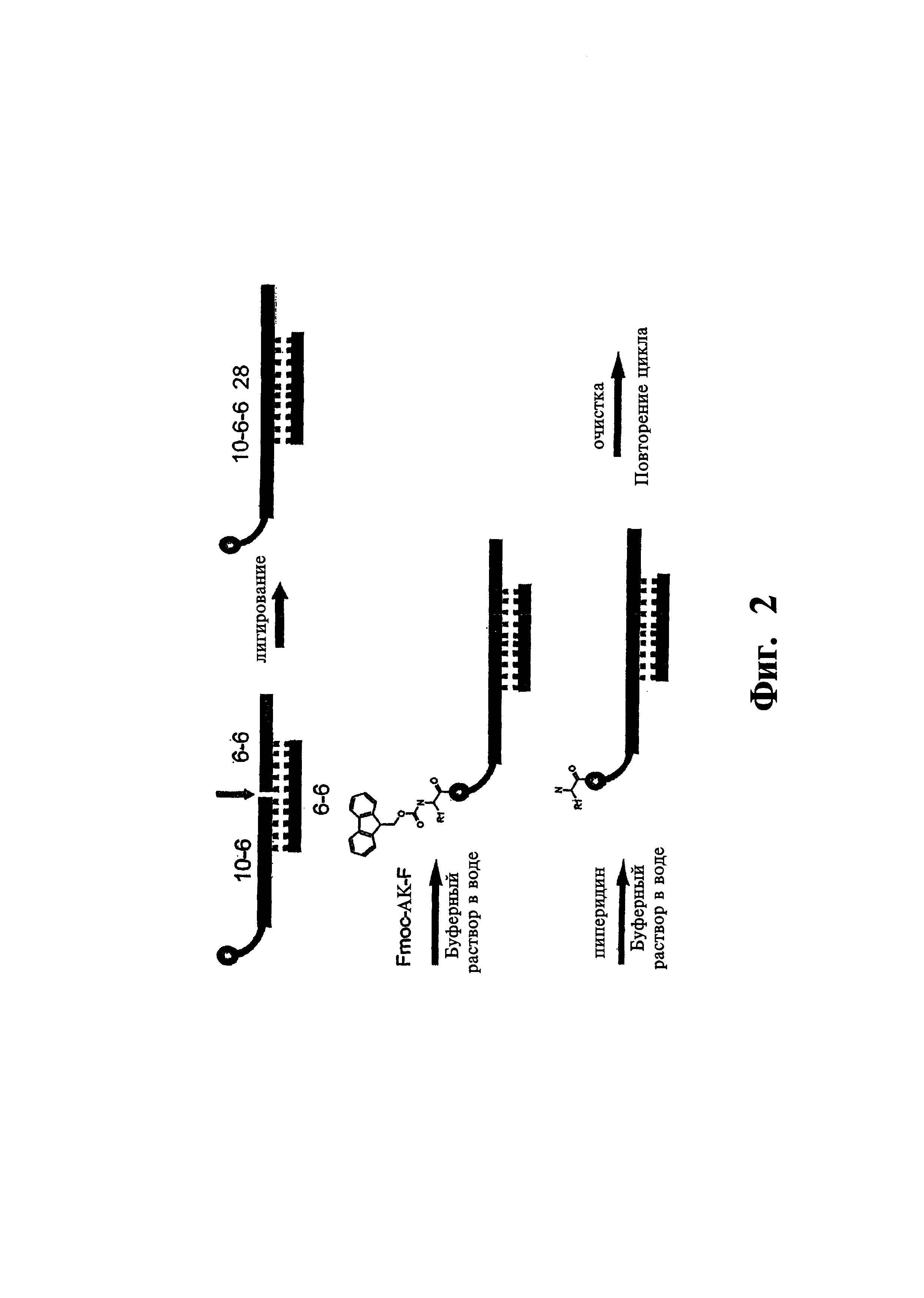
На фиг. 2 показана схема лигирования олигонуклеотидов с использованием фиксирующей цепочки. В данном варианте, фиксирующей цепочкой является 12-членный олигонуклеотид с последовательностями, комплементарными одноцепочечному исходному олигонуклеотиду и одноцепочечному новому олигонуклеотиду.
На фиг. 3 показана схема лигирования исходного и нового олигонуклеотидов, причем исходный олигонуклеотид содержит две ковалентно связанные цепочки, а новый олигонуклеотид является двухцепочечным.
На фиг. 4 показана схема наращивания олигонуклеотидной цепочки с использованием полимеразы. Исходная цепочка изображена в виде свободной, конъюгированной с аминогексильным линкером или конъюгированной с остатком фенилаланина через аминогексильный линкер.
На фиг. 5 показана схема синтетического цикла по одному из вариантов воплощения настоящего изобретения.
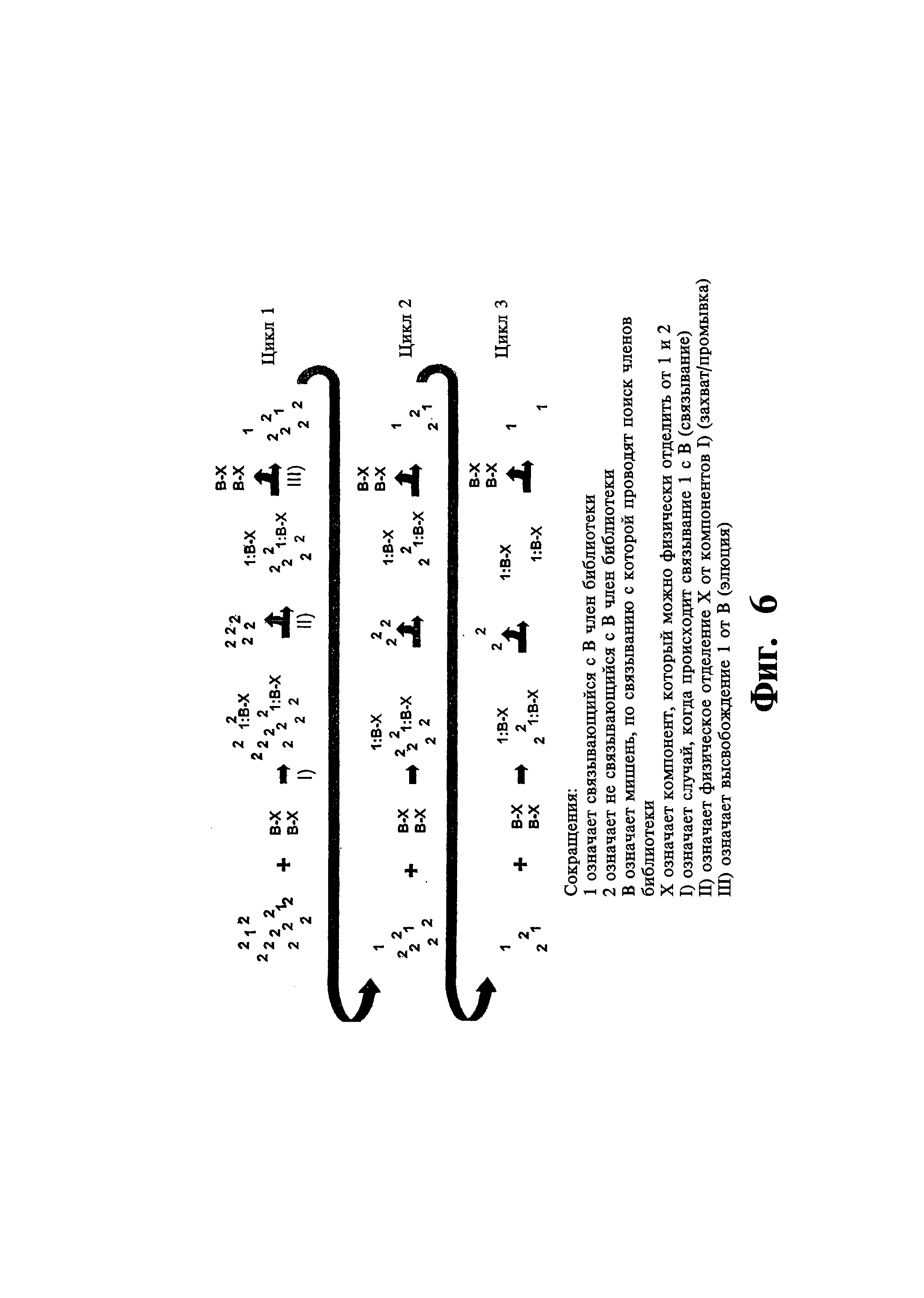
На фиг. 6 показана схема многостадийного процесса идентификации с использованием библиотек по настоящему изобретению.
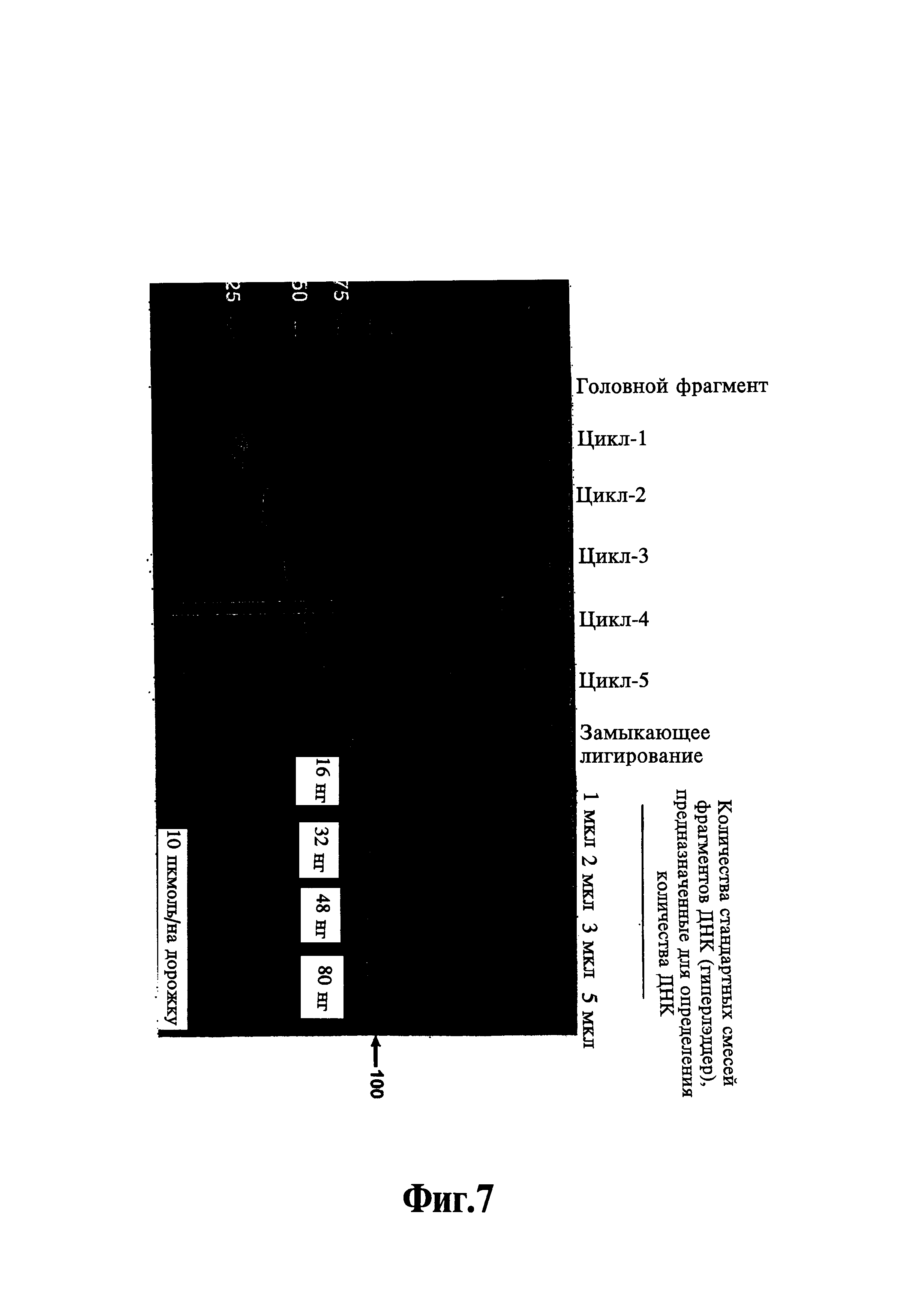
На фиг. 7 показан результат гелевого электрофореза продуктов, полученных в каждом из циклов 1-5, описанных в примере 1, и последующего лигирования замыкающего праймера. Олигонуклеотиды со стандартной молекулярной массой указаны на дорожке 1, и указанные параметры гиперлэддера, для определения количества ДНК, показаны на дорожках 9-12.
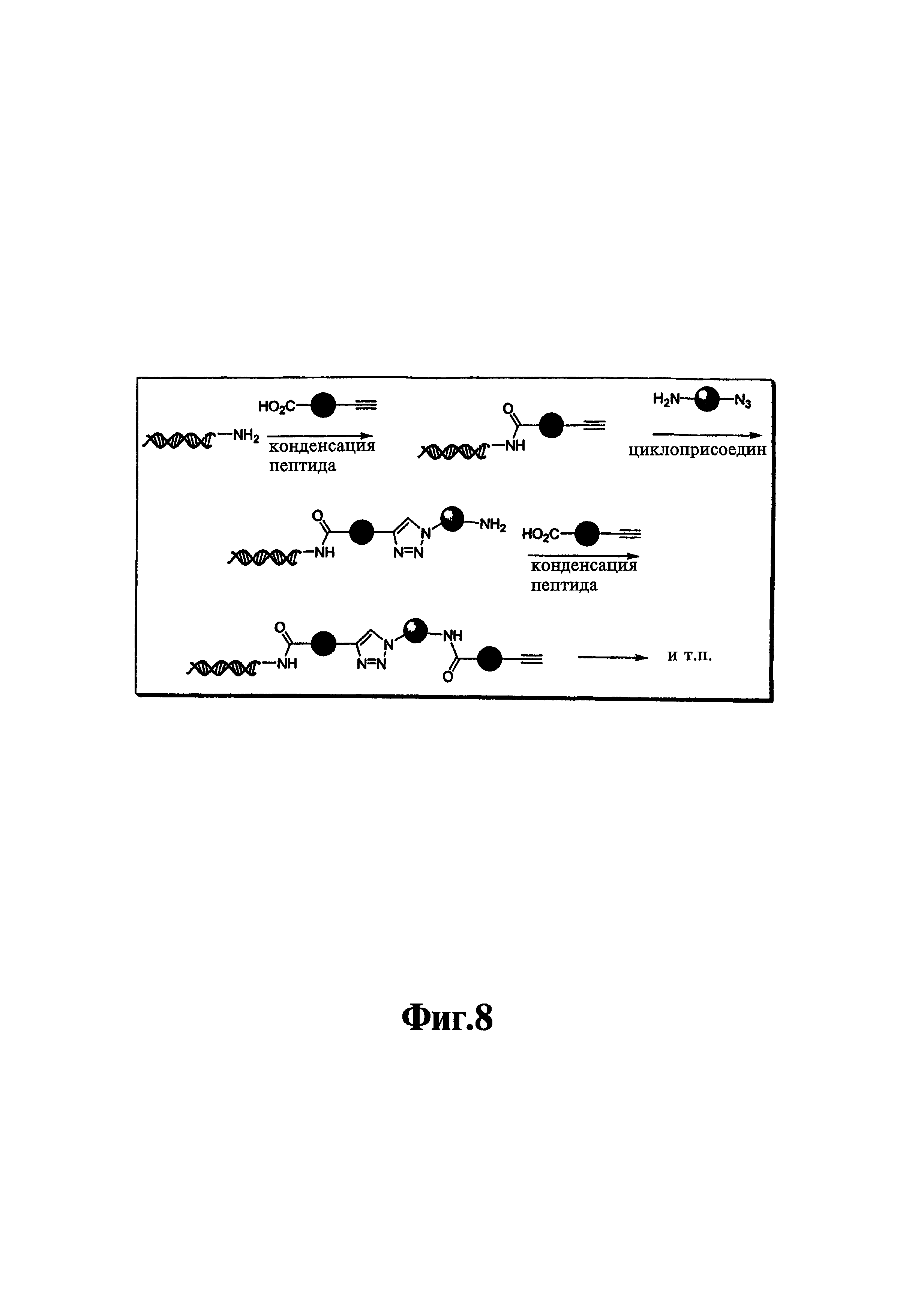
На фиг. 8 показана схема конденсации структурных элементов с использованием азид-алкин-циклоприсоединения.
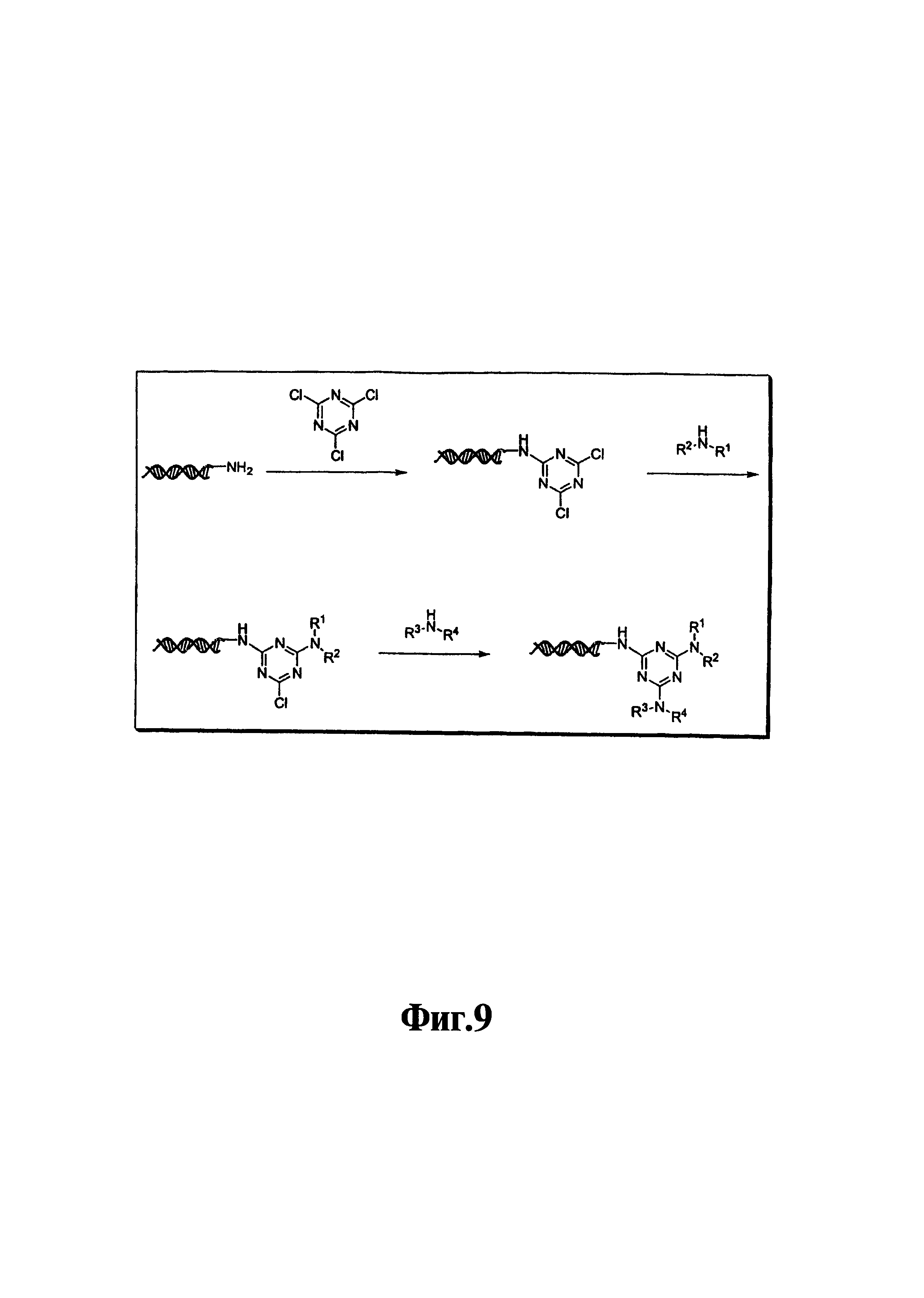
На фиг. 9 и 10 показана конденсация структурных элементов с использованием нуклеофильного ароматического замещения хлорированного триазина.
На фиг. 11 показаны хлорированные гетероароматические структуры, пригодные для синтеза функциональных фрагментов.
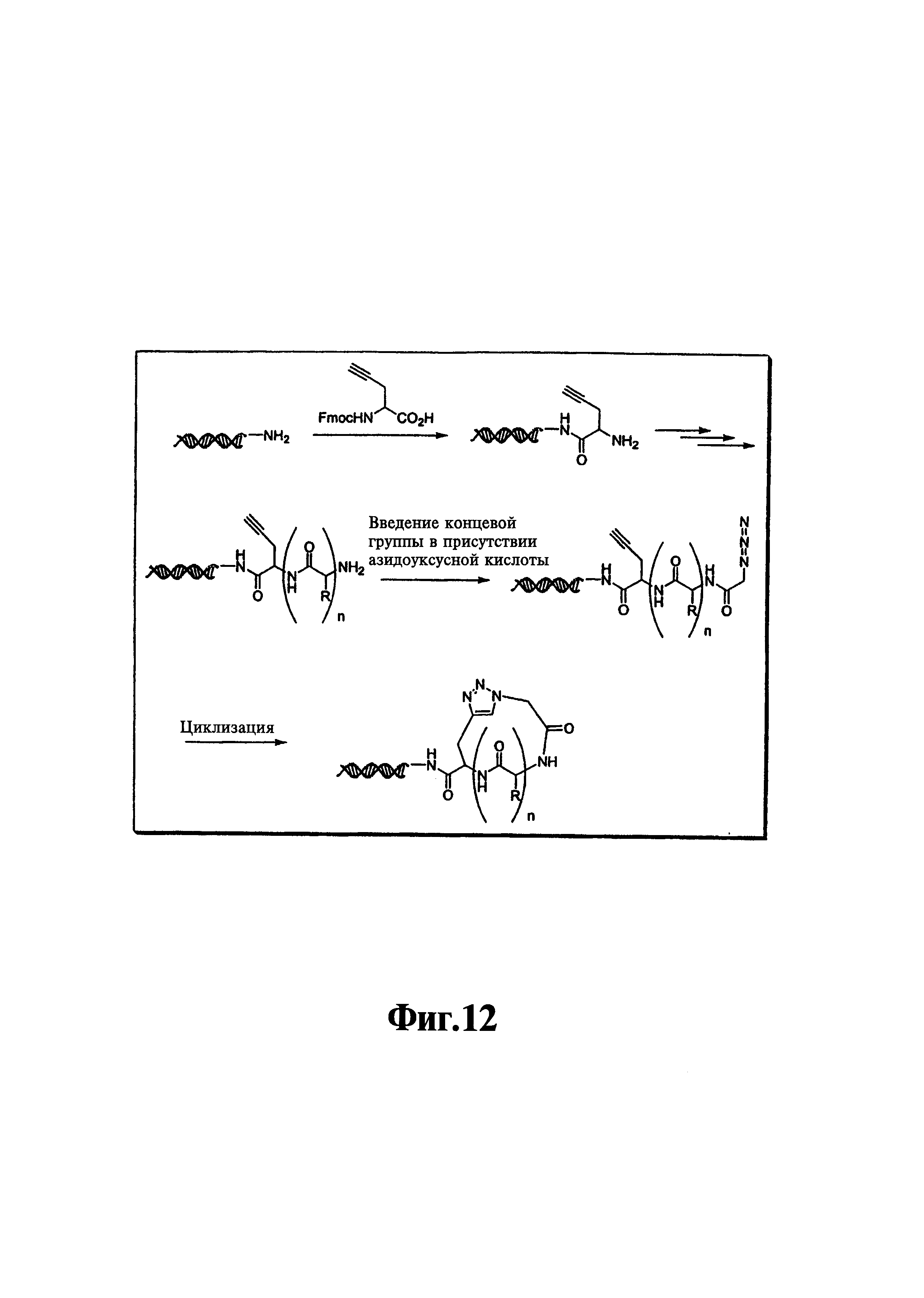
На фиг. 12 показана циклизация линейного пептида с использованием реакции азид-алкин-циклоприсоединения.
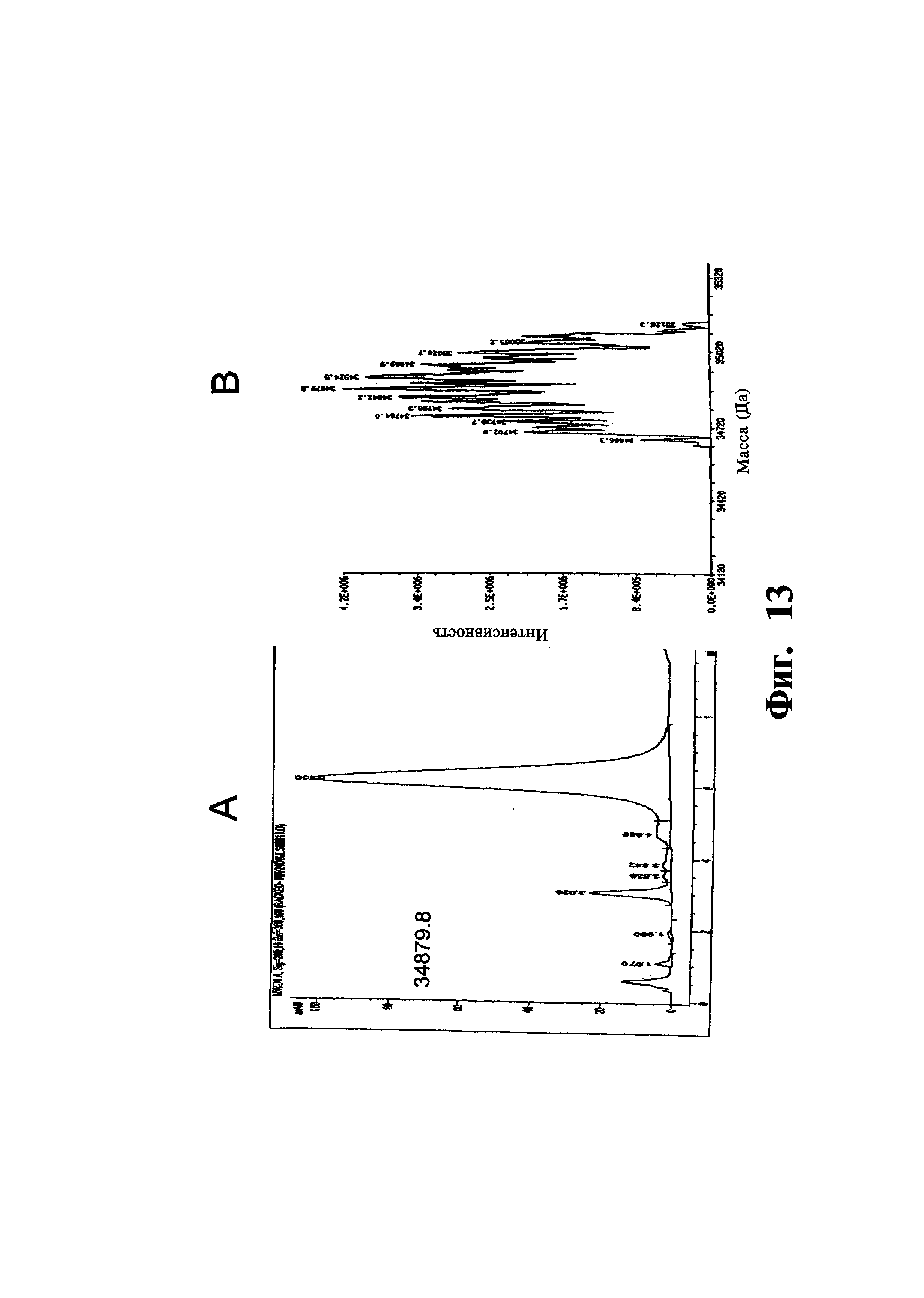
На фиг. 13A показана хроматограмма библиотеки, полученной, как описано в примере 2, в результате цикла 4.
На фиг. 13B показан масс-спектр библиотеки, полученной, как описано в примере 2, в результате цикла 4.
Осуществление изобретения
Настоящее изобретение относится к способам получения соединений комбинаторных библиотек соединений, к соединениям и библиотекам, которые получают с использованием способов по настоящему изобретению, и к способам использования библиотек для идентификации соединений, обладающих требуемыми свойствами, такими как требуемая биологическая активность. Настоящее изобретение относится также к соединениям, которые идентифицируют с использованием таких способов.
Для получения и анализа комбинаторных химических библиотек используют множество подходов. Примеры включают способы, в которых отдельные члены библиотеки физически отделены друг от друга, например, если синтез отдельного соединения проводят в одном из множества отдельных сосудов. Однако обычно в таких библиотеках анализируют единовременно только одно соединение, или в лучшем случае, несколько соединений, и, следовательно, такой способ не является наиболее эффективным методом скриннинга. Согласно другим способам, соединения синтезируют на твердой фазе. Такие твердые носители включают чипы, в которых специфичные соединения занимают особые участки чипа или мембраны ("адресуемое положение"). Согласно другим способам, соединения синтезируют на гранулах, при этом каждая гранула несет отдельную химическую структуру.
При анализе больших библиотек возникают две проблемы: (1) множество отдельных соединений, которые подвергаются анализу и (2) идентификация соединений, проявляющих активность при данном при данном методе анализа. Согласно одному способу, соединения, проявляющие активность при данном методе анализа, идентифицируют разделением исходной библиотеки на меньшие фракции и подфракции, в каждом случае отбирая фракцию или подфракцию, содержащую активные соединения, и затем снова разделяют на фракции до получения активной подфракции, которая содержит набор соединений, который достаточно мал, чтобы все его компоненты можно было синтезировать каждый в отдельности и получить соединения с требуемой активностью. Такой способ является слишком трудоемким и длительным процессом.
Другой способ обратного анализа комбинаторной библиотеки заключается в использовании библиотек, в которых члены библиотеки содержат индивидуальные метки, т.е. каждая метка, присутствующая в библиотеке, связана с конкретной структурой соединения, присутствующего в библиотеке, таким образом, что идентификация метки определяет структуру меченой молекулы. Один из подходов получения меченых библиотек заключается в использовании олигонуклеотидных меток, как описано, например, в патентах США №5573905, 5708153, 5723598, 6060596, в опубликованных заявках на выдачу патентов PCT WO 93/06121, WO 93/20242, WO 94/13623, WO 00/23458, WO 02/074929 и WO 02/103008, а также в работах Brenner and Lenner (Proc.Natl.Acad.Sci.USA, 89, 5381-5383 (1992); Nielsen and Janda (Methods: A Companion to Methods in Enzymology, 6, 361-371 (1994) и Nielesen, Brenner and Janda (J.Amer.Chem.Soc., 115, 9812-9813 (1993)), каждая из которых полностью включена в настоящее описание в качестве ссылки. Такие метки амплифицируют с использованием, например, полимеразной цепной реакции, для получения большого числа копий меченого фрагмента и идентификации его при секвенировании. Секвенирование меченого фрагмента позволяет идентифицировать структуру связывающей молекулы, которая может быть синтезирована в чистой форме и протестирована. К настоящему времени данные по использованию методологии, описанной в статье Lerner et al., для получения больших библиотек, отсутствуют. В настоящем изобретении предлагается усовершенствование способов получения ДНК-кодированных библиотек, а также первые примеры больших (105 членов и более) библиотек ДНК-кодированных молекул, в которых функциональный фрагмент получают с использованием синтеза в растворе. В настоящем изобретении предлагаются способы простого синтеза комбинаторных библиотек, кодированных олигонуклеотидами, причем указанные способы позволяют с высокой точностью вводить олигонуклеотидную метку в каждый член многочисленного набора молекул.
Способы по настоящему изобретению включают способы синтеза бифункциональных молекул, которые включают первый компонент ("функциональный фрагмент"), которая состоит из структурных элементов, и второй компонент, эффективно связанный с первым компонентом, содержащим олигонуклеотидную метку, которая определяет структуру первого компонента, т.е. олигонуклеотидная метка указывает, какие структурные элементы были использованы при конструировании первого компонента, и в каком порядке они связаны. В основном, информации, содержащейся в олигонуклеотидной метке, оказывается достаточно для определения структурных элементов, использованных для конструирования активного компонента. В определенных вариантах, последовательность олигонуклеотидной метки является достаточной для определения расположения структурных элементов в функциональном фрагменте, например, для пептидных групп достаточно аминокислотной последовательности.
Термин "функциональный фрагмент", использованный в данном контексте, означает химический компонент, содержащий один или более структурных элементов. Предпочтительно, структурные элементы в функциональных фрагментах не означают нуклеиновые кислоты. Функциональным фрагментом является линейный, разветвленный или циклический полимер или олигомер или низкомолекулярная органическая молекула.
Термин "структурный элемент", использованный в данном контексте, означает химическое структурное звено, которое соединено с другими химическими структурными звеньями или присоединено к другим таким звеньям. Если функциональный фрагмент является полимерным или олигомерным, то структурные элементы являются мономерными звеньями полимера или олигомера. Структурные элементы включают также структуру-каркас ("каркасный структурный элемент"), к которому присоединена или может быть присоединена одна или более дополнительных структур ("периферические структурные элементы").
Следует понимать, что термин "структурный элемент", использованный в данном контексте, означает химическое структурное звено, которое входит в состав функционального фрагмента, а также находится в реакционноспособной форме, используемой для синтеза функционального фрагмента. Структурный элемент полностью включен в состав функционального фрагмента, и ни одна из частей структурного элемента не высвобождается при синтезе функционального фрагмента. Например, если в реакциях, идущих с образованием связи, высвобождается небольшая молекула (см. ниже), то в состав функционального фрагмента входит "остаток структурного элемента", т.е. остаток, который образуется в процессе синтеза при высвобождении из структурного элемента атомов, которые присоединяются к высвобожденной молекуле.
В качестве структурных элементов используют любые химические соединения, которые являются комплементарными, т.е. эти структурные элементы способны взаимодействовать друг с другом с образованием структуры, содержащей два или более таких структурных элементов. Обычно, все используемые структурные элементы содержат по крайней мере 2 реакционноспособные группы, хотя некоторые структурные элементы (например, последний структурный элемент олигомерного функционального фрагмента) могут содержать только по одной реакционноспособной группе. Реакционноспособные группы двух различных структурных элементов должны быть комплементарными, т.е. способны взаимодействовать друг с другом с образованием ковалентной связи, необязательно с сопутствующим высвобождением небольшой молекулы, такой как вода, HCl, HF и т.п.
Согласно настоящему изобретению, две реакционноспособных группы являются комплементарными, если они способны взаимодействовать с образованием ковалентной связи. В предпочтительном варианте, реакции с образованием связи протекают быстро в условиях окружающей среды в основном без образования побочных продуктов. Предпочтительно, одна реакционноспособная группа взаимодействует с другой комплементарной реакционноспособной группой только один раз. В одном варианте, комплементарные реакционноспособные группы двух структурных элементов взаимодействуют, например, по механизму нуклеофильного замещения с образованием ковалентной связи. В другом варианте один член пары комплементарных реакционноспособных групп является электрофильной группой, а другой член пары - нуклеофильной группой.
Комплементарные электрофильные и нуклеофильные группы включают любые две группы, которые взаимодействуют по механизму нуклеофильного замещения в пригодных условиях с образованием ковалентной связи. В данной области техники известно множество образующих связь реакций. См., например, March, Advanced Organic Chemistry, 4th ed., New York: John Wiley and Sons (1992), гл. 10-16; Carey and Sundberg, Advanced Organic Chemistry, Part B, Plenum (1990), гл. 1-11; Collman et al., Principles and Applications of Organotransition Metal Chemistry, University Science Books, Mill Valley, Calif. (1987), гл. 13-20, каждая из которых полностью включена в настоящее описание в виде ссылки. Примеры пригодных электрофильных групп включают реакционноспособные карбонильные группы, такие как хлорангидридные группы, сложноэфирные группы, включая карбонилпентафторфенильные эфирные группы и сукцинимидные эфирные группы, кето- и альдегидные группы, реакционноспособные сульфонильные группы, такие как сульфонилхлоридные группы и реакционноспособные фосфонильные группы. Другие электрофильные группы включают концевые эпоксидные группы, изоцианатные группы и галогеналкил группы. Пригодные нуклеофильные группы включают первичные и вторичные аминогруппы, гидроксильные группы и карбоксильные группы.
Пригодные комплементарные реакционноспособные группы перечислены ниже. Специалистам в данной области техники известны другие пары реакционноспособных групп, которые можно использовать в настоящем изобретении, а приведенные ниже примеры не ограничивают объем настоящего изобретения.
В первом варианте комплементарные реакционноспособные группы включают активированные карбоксильные группы, реакционноспособные сульфонильные группы или реакционноспособные фосфонильные группы, или комбинацию указанных выше групп, и первичные или вторичные аминогруппы. В данном варианте комплементарные реакционноспособные группы взаимодействуют в пригодных условиях с образованием амидной, сульфонамидной или фосфонамидатной связи.
Во втором варианте воплощения настоящего изобретения, комплементарные реакционноспособные группы включают эпоксидные группы и первичные или вторичные аминогруппы. Эпоксид-содержащий структурный элемент взаимодействует с аминосодержащим структурным элементом в пригодных условиях с образованием связи углерод-азот, т.е. с образованием β-аминоспирта.
В другом варианте, комплементарные реакционноспособные группы включают азиридиновые группы и первичные или вторичные аминогруппы. В пригодных условиях азиридин-содержащий структурный элемент взаимодействует с аминосодержащим структурным элементом с образованием связи углерод-азот, т.е. с образованием 1,2-диамина. В третьем варианте комплементарные реакционноспособные группы включают изоцианатные группы и первичные или вторичные аминогруппы. Изоцианат-содержащий структурный элемент взаимодействует с амино-содержащим структурным элементом в пригодных условиях с образованием связи углерод-азот, т.е. с образованием остатка мочевины.
В четвертом варианте комплементарные реакционноспособные группы включают изоцианатные группы и гидроксильные группы. Изоцианат-содержащий структурный элемент взаимодействует с гидроксил-содержащим структурным элементом в пригодных условиях с образованием связи углерод-кислород, т.е. с образованием карбаматной группы.
В пятом варианте комплементарные реакционноспособные группы включают амино-группы и карбонил-содержащие группы, такие, как альдегиды или кето-группы. Амины взаимодействуют с такими группами по реакции восстановительного аминирования с образованием новой связи углерод-азот.
В шестом варианте комплементарные реакционноспособные группы включают фосфор-илидные группы и альдегиды или кето-группы. Фосфор-илид-содержащий структурный элемент взаимодействует с альдегид- или кето-содержащим структурным элементом в пригодных условиях с образованием углерод-углеродной двойной связи, т.е. с образованием алкена.
В седьмом варианте комплементарные реакционноспособные группы взаимодействуют по механизму циклоприсоединения с образованием циклической структуры. Один пример таких комплементарных реакционноспособных групп включает алкины и органические азиды, которые в пригодных условиях взаимодействуют с образованием триазольной кольцевой структуры. Пример использования такой реакции для связывания двух структурных элементов показан на фиг. 8. Пригодные условия для проведения таких реакций известны в данной области техники и включают условия, описанные в заявке WO 03/101972, содержание которой полностью включено в настоящее описание в качестве ссылки.
В восьмом варианте комплементарные реакционноспособные группы включают алкилгалогениды и нуклеофилы, такие как аминогруппа, гидроксигруппа или карбоксильная группа. Такие группы взаимодействуют в пригодных условиях с образованием связи углерод-азот (алкилгалогенид + амин) или связи углерод-кислородной (алкилгалогенид + гидроксильная или карбоксильная группа).
В девятом варианте комплементарные реакционноспособные группы включают галогенированную гетероароматическую группу и нуклеофил, и структурные элементы связываются в пригодных условиях по реакции ароматического нуклеофильного замещения. Пригодные галогенированные гетероароматические группы включают хлорированные пиримидины, триазины и пурины, которые взаимодействуют с нуклеофилами, такими как амины, в мягких условиях в водном растворе. Примеры реакции олигонуклеотидов, содержащих трихлортриазиновые группы с аминами показаны на фиг. 9 и 10. Примеры пригодных хлорированных гетероароматических групп показаны на фиг. 11.
Следует понимать, что синтез функционального фрагмента можно проводить с использованием одного конкретного типа реакций конденсации, таких как, без ограничения перечисленным, одна из описанных выше реакций, или с использованием комбинации двух или более реакций конденсации, например, двух или более описанных выше реакций. Например, в одном варианте, структурные элементы соединяют путем сочетания образования амидной связи (комплементарные амино- и карбоксильные группы) и восстановительного аминирования (комплементарные амино- и альдегидные или кетогруппы). Можно использовать любые реакции конденсации при условии, что они совместимы с присутствием олигонуклеотида. Двухцепочечные (дуплексные) олигонуклеотидные метки, использованные в определенных вариантах воплощения настоящего изобретения, являются химически более стабильными по сравнению с одноцепочечными метками, и, следовательно, устойчивы в более широком интервале условий реакции и участвуют в реакциях с образованием связи, что невозможно с использованием одноцепочечных меток.
Структурный элемент кроме реакционноспособной группы или групп, образующих функциональный фрагмент, может включать одну или более функциональных групп. Одну или более из таких дополнительных функциональных групп защищают для предотвращения их вступления в нежелательные реакции. Пригодные защитные группы известны в данной области техники для множества функциональных групп (см. книгу Greene and Wuts, Protective Groups in Organic Synthesys, second edition, New York: John Wiley and Sons (1991), включенную в данный контекст в качестве ссылки). Прежде всего используемые защитные группы включают трет-бутиловые простые и сложные эфиры, ацетали, тритильные эфиры и амины, ацетиловые эфиры, триметилсилиловые эфиры, трихлорэтиловые простые и сложные эфиры и карбаматы.
В одном варианте каждый структурный элемент включает две реакционноспособные группы, которые могут быть одинаковыми или отличаться друг от друга. Например, каждый структурный элемент, добавляемый в цикле s, может включать две одинаковые реакционноспособные группы, но при этом обе группы являются комплементарными с реакционноспособными группами структурных элементов, добавляемых на стадиях s-1 и s+1. В другом варианте, каждый структурный элемент включает две реакционноспособные группы, которые комплементарны друг с другом. Например, библиотеку, содержащую полиамидные молекулы, получают по реакциям между структурными элементами, содержащими две первичные аминогруппы, и структурными элементами, содержащими две активированные карбоксильные группы. В полученных соединениях отсутствуют N- или C-концевые фрагменты, т.к. альтернативные амидные группы имеют противоположное направление. В другом варианте, полиамидную библиотеку получают с использованием структурных элементов, каждый из которых включает аминогруппу и активированную карбоксильную группу. В таком варианте, структурные элементы, добавляемые на стадии n-го цикла, содержат свободную реакционноспособную группу, которая комплементарна с доступной реакционноспособной группой в составе структурного элемента n-1, в то время как, предпочтительно, другая реакционноспособная группа в составе структурного элемента n защищена. Например, если члены библиотеки синтезируют в направлении от C-концевого участка к N-концевому участку, то добавляемые структурные элементы содержат активированную карбоксильную группу и защищенную аминогруппу.
Функциональные фрагменты являются полимерными или олигомерными компонентами, такими как пептиды, пептидомиметики, пептидонуклеиновые кислоты или пептоиды, или они являются низкомолекулярными соединениями, например, молекулами со структурой, включающей центральный каркас, и структурами, расположенными по периферии каркаса. Линейные полимерные или олигомерные библиотеки получают с использованием структурных элементов с двумя реакционноспособными группами, в то время как разветвленные полимерные или олигомерные библиотеки получают с использованием структурных элементов с тремя или более реакционноспособными группами, необязательно в комбинации со структурными элементами, содержащими только две реакционноспособные группы. Такие молекулы можно представить общей формулой X1X2…Xn, где каждый X означает мономерное звено полимера, включающего n мономерных звеньев, где n равно целому числу более 1. В случае олигомерных или полимерных соединений нет необходимости в наличии двух функциональных групп на концевых структурных элементов. Например, в случае полиамидной библиотеки, C-концевой структурный элемент содержит аминогруппу, а присутствие карбоксильной группы необязательно. Аналогичным образом, N-концевой структурный элемент содержит карбоксильную группу, но не содержит аминогруппу.
Разветвленные олигомерные или полимерные соединения синтезируют также при условии, что по крайней мере один структурный элемент включает три функциональные группы, которые взаимодействуют с другими структурными элементами. Библиотека по настоящему изобретению включает линейные молекулы, разветвленные молекулы или их комбинацию.
Библиотеки получают также с использованием, например, каркасных структурных элементов с одной или двумя реакционноспособными группами, в комбинации с другими структурными элементами, содержащими только одну доступную реакционноспособную группу, например, в которых любые другие реакционноспособные группы защищены или нереакционноспособны в отношении других реакционноспособных групп в составе каркасного структурного элемента. В одном варианте, например, полученные молекулы могут быть представлены общей формулой X(Y)n, где X означает каркасный структурный элемент, каждый Y означает структурный элемент, связанный с X, а и равно целому числу, равному по крайней мере 2, и предпочтительно от 2 до приблизительно 6. В одном предпочтительном варианте, исходный структурный элемент в цикле 1 означает каркасный структурный элемент. В молекулах формулы X(Y)n каждый Y является одинаковым или различным, но в большинстве членов типичной библиотеки каждый Y является различным.
В одном варианте, библиотеки по настоящему изобретению содержат полиамидные соединения. Полиамидные соединения состоят из структурных элементов, содержащих любые аминокислоты, включая 20 природных α-аминокислот, таких как аланин (Ala, А), глицин (Gly, G), аспарагин (Asn, N), аспартамовая кислота (Asp, D), глутаминовая кислота (Glu, Е), гистидин (His, Н), лейцин (Leu, L), лизин (Lys, K), фенилаланин (Phe, F), тирозин (Tyr, Y), треонин (Thr, T), серин (Ser, S), аргинин (Arg, R), валин (Val, V), глутамин (Gin, Q), изолейцин (Ile, I), цистеин (Cys, С), метионин (Met, M), пролин (Pro, P) и триптофан (Trp, W), в скобках приведены трехбуквенный и однобуквенный коды обозначения аминокислот. В природной форме все из описанных аминокислот существуют в L-конфигурации, если не указано иное. Однако в настоящем изобретении можно использовать D-конфигурацию указанных аминокислот. Такие D-аминокислоты обозначены в настоящем описании в трех- и однобуквенном коде прописными буквами: ala (a), gly (g), leu (1), gln (g), thr (t), ser (s) и т.п. Структурные элементы могут содержать другие α-аминокислоты, включая, без ограничения перечисленным, 3-арилаланины, такие как нафтилаланин, фенилзамещенные фенилаланины, включая 4-фтор-, 4-хлор-, 4-бром- и 4-метилфенилаланин, 3-гетероарилаланины, такие как 3-пиридилаланин, 3-тиенилаланин, 3-хинолилаланин и 3-имидазолилаланин; орнитин, цитрулин, гомоцитрулин, саркозин, гомопролин, гомоцистеин; замещенные пролины, такие как гидроксипролин и фторпролин; дегидропролин, норлейцин, O-метилтирозин, O-метилсерин, O-метилтреонин и 3-циклогексилаланин. Каждую из перечисленных выше аминокислот используют в D- или L-конфигурации.
Структурные элементы могут включать также аминокислоты, не являющиеся α-аминокислотами, такие как α-азаминокислоты, β, γ, δ, ε-аминокислоты, и N-замещенные аминокислоты, такие как N-замещенный глицин, в котором заместитель у атома азота означает, например, замещенный или незамещенный алкил, арил, гетероарил, арилалкил или гетероарилалкил. В одном варианте, заместитель у атома азота означает боковую цепь природных или не природных α-аминокислот.
Структурный элемент может также представлять собой структуру пептидомиметика, такого как дипептидный, трипептидный, тетрапептидный или пентапептидный миметик. Такие пептидомиметиковые структурные элементы предпочтительно включают производные аминоацильных соединений, например, полученных при добавлении таких структурных элементов к наращиваемой поли(аминоацильной) группе по одной и той же или аналогичной реакции, использованной для получения других структурных элементов. В качестве структурных элементов можно использовать также молекулы, которые образуют связи, изостеричные пептидной связи, с образованием функциональных фрагментов пептидомиметиков, включающих модифицированную пептидную цепь, такую как ψ[CH2S], ψ[CH2NH], ψ[CSNH2], ψ[NHCO], ψ[СОСН2] и ψ[(E) или (Z) CH=CH]. В использованной выше номенклатуре ψ означает отсутствие амидной связи. Структура, заменяющая амидную группу, расположена в скобках.
В одном варианте настоящего изобретения предлагается способ синтеза соединения, содержащего или представляющего собой функциональный фрагмент, который эффективно присоединен к кодирующему олигонуклеотиду. Способ включает следующие стадии: (1) получение соединения-инициатора, состоящего из исходного функционального фрагмента, содержащего n структурных элементов (где n равно целому числу 1 или более), по крайней мере одну реакционноспособную группу, и эффективно связанного с исходным олигонуклеотидом, который кодирует n структурных элементов; (2) взаимодействие соединения-инициатора со структурным элементом, содержащим по крайней мере одну комплементарную реакционноспособную группу, являющуюся комплементарной с реакционноспособной группой, полученной на стадии (1), в условиях, пригодных для взаимодействия реакционноспособной группы и комплементарной реакционноспособной группы с образованием ковалентной связи; (3) взаимодействие исходного олигонуклеотида с новым олигонуклеотидом в присутствии фермента, который катализирует лигирование исходного олигонуклеотида и нового олигонуклеотида в пригодных для этого условиях, с получением молекулы, содержащей или представляющей собой функциональный фрагмент, содержащий n+1 структурных элементов, и эффективно связанный с кодирующим олигонуклеотидом. Если функциональный фрагмент, полученный на стадии (3), включает реакционноспособную группу, то стадии 1-3 при необходимости повторяют один или более раз, при этом проводят циклы 1-i (i равно целому числу 2 или более), с участием продукта, полученного на стадии (3) в цикле s-1 (где s равно целому числу i или менее), с образованием соединения-инициатора, описанного на стадии (1) в цикле s. В каждом цикле к наращиваемому функциональному фрагменту добавляют один структурный элемент, а к наращиваемому кодирующему олигонуклеотиду добавляют одну олигонуклеотидную последовательность, которая кодирует новый структурный элемент.
В предпочтительном варианте, каждый конкретный структурный элемент связан с отдельным олигонуклеотидом таким образом, что последовательность нуклеотидов в составе олигонуклеотида, добавленного в данном цикле, идентифицирует функциональный фрагмент, добавленный в том же цикле.
Конденсация структурных элементов и лигирование олигонуклеотидов обычно происходят при одинаковых концентрациях исходных веществ и реагентов. Например, для эффективного связывания структурных элементов предпочтительными являются концентрации порядка от микромолярной или миллимолярной, например, от приблизительно 10 мкм до приблизительно 10 Мм.
В некоторых вариантах, способ также включает стадию, которая включает удаление всех непрореагировавших исходных функциональных фрагментов после проведения стадии (2). Удаление всех непрореагировавших исходных функциональных фрагментов в конкретном цикле позволяет исключить взаимодействие исходного функционального фрагмента в цикле со структурными элементами, добавленными в следующем цикле. Такие реакции могут привести к образованию функциональных фрагментов, не содержащих один или более структурных элементов, и к возможности образования нескольких структур функционального фрагмента, соответствующих конкретной последовательности олигонуклеотида. Такое удаление проводят при взаимодействии любого остаточного функционального фрагмента с соединением, которое взаимодействует с реакционноспособной группой, описанной на стадии (2). Предпочтительно, соединение, используемое для удаления, быстро взаимодействует с реакционноспособной группой, описанной на стадии (2) и не содержит дополнительных реакционноспособных групп, которые могут взаимодействовать со структурными элементами, добавляемыми в следующих циклах. Например, при синтезе соединения, в котором реакционноспособной группой на стадии (2) является аминогруппа, пригодным соединением для удаления является сложный эфир N-гидроксисукцинимида, такой как N-гидроксисукцинимидный эфир уксусной кислоты.
В другом варианте воплощения настоящего изобретения предлагается способ получения библиотек соединений, в которых каждое соединение содержит функциональный фрагмент, содержащий два или более структурных элементов, и который эффективно присоединен к олигонуклеотиду. В предпочтительном варианте, олигонуклеотид присутствует в каждой молекуле и позволяет определить структурные элементы в составе молекулы и, необязательно, порядок добавления этих структурных элементов. В данном варианте, способ по настоящему изобретению включает способ синтеза библиотеки соединений, в которой соединения содержат функциональный фрагмент, содержащий два или более структурных элемента, и который эффективно связан с олигонуклеотидом, который определяет структуру функционального фрагмента. Способ включает следующие стадии: (1) получение раствора, содержащего m соединений-инициаторов (где m равно целому числу 1 или более), состоящих из функционального фрагмента, содержащего n структурных элементов (где n равно целому числу 1 или более), который эффективно связан с исходным олигонуклеотидом, определяющим n структурных компонентов; (2) разделение раствора, полученного на стадии (1), по крайней мере на r фракций (где r равно целому числу 2 или более); (3) взаимодействие каждой фракции с одним из r структурных элементов с образованием r фракций, содержащих соединения, состоящие из функционального фрагмента, содержащего n+1 структурных элементов, и эффективно связанного с исходным олигонуклеотидом; (4) взаимодействие каждой из r фракций, полученных на стадии (3), с одним из набора r новых различных олигонуклеотидов в условиях, пригодных для ферментативного лигирования нового и исходного олигонуклеотидов, при этом получают r фракций, содержащих молекулы, состоящие из функционального фрагмента, содержащего n+1 структурных элементов, и эффективно связанного с удлиненным олигонуклеотидом, который кодирует n+1 структурных элементов. Способ необязательно включает стадию (5) объединения r фракций, полученных на стадии (4), при этом получают раствор, содержащий молекулы, состоящие из функционального фрагмента, содержащего n+1 структурных элементов, и эффективно связанного с удлиненным олигонуклеотидом, который кодирует n+1 структурных элементов. Стадии (1)-(5) повторяют один или более раз, при этом проводят циклы 1-i (где i равно целому числу 2 или более). В цикле s+1, где s равно целому числу i-1 или менее, раствор, содержащий m соединений-инициаторов, полученных на стадии (1), является раствором, полученным на стадии (5) в цикле s. Аналогичным образом, соединения-инициаторы, полученные на стадии (1) в цикле s+1 являются продуктами, полученными на стадии (4) в цикле s.
Раствор, полученный на стадии (2), предпочтительно разделяют на r фракций в каждом цикле синтеза библиотеки. В данном варианте, каждая фракция взаимодействует с отдельным структурным элементом.
Согласно способу по настоящему изобретению порядок добавления структурных элементов и новых олигонуклеотидов не имеет значения, при этом стадии (2) и (3) синтеза молекулы, и стадии (3) и (4) синтеза библиотеки можно проводить в обратном порядке, т.е. новый олигонуклеотид можно лигировать с исходным олигонуклеотидом перед добавлением нового структурного элемента. В некоторых вариантах, эти две стадии можно проводить одновременно.
В некоторых вариантах, способ также включает стадию удаления всех непрореагировавших исходных функциональных фрагментов после проведения стадии (2). Удаление всех непрореагировавших исходных функциональных фрагментов в каждом цикле позволяет исключить взаимодействие исходного функционального фрагмента в цикле со структурными элементами, добавленными в следующем цикле. Такие реакции могут привести к образованию функциональных фрагментов, не содержащих один или более структурных элементов, и к возможности образования нескольких структур функционального фрагмента, которые соответствуют конкретной последовательности олигонуклеотида. Такое удаление проводят при взаимодействии любого остаточного функционального фрагмента с соединением, которое взаимодействует с реакционноспособной группой, описанной на стадии (2). Предпочтительно, соединение, используемое для удаления, быстро взаимодействует с реакционноспособной группой, описанной на стадии (2) и не содержит дополнительных реакционноспособных групп, которые могут взаимодействовать со структурными элементами, добавляемыми в следующих циклах. Например, при синтезе соединения, в котором реакционноспособной группой на стадии (2) является аминогруппа, пригодным соединением для удаления является сложный эфир N-гидроксисукцинимида, такой как N-гидроксисукцинимидный эфир уксусной кислоты.
В одном варианте, структурные элементы, используемые при синтезе библиотеки, выбирают из набора возможных, оценивая способность возможных структурных элементов взаимодействовать с соответствующими комплементарными функциональными группами в условиях, используемых для синтеза библиотеки. Структурные элементы, которые оказались реакционноспособными в таких условиях, отбирают для включения в библиотеку. Продукты каждого отдельного цикла необязательно очищают. Если цикл является промежуточным циклом, т.е. любым циклом, предшествующим конечному циклу, то продукты, полученные в таких циклах, являются промежуточными соединениями и их очищают перед началом следующего цикла. Если цикл является конечным, то полученные продукты являются конечными продуктами и их очищают перед использованием соединений. На такой стадии очистки, например, удаляют непрореагировавшие реагенты или их избыток, а также фермент, использованный для лигирования олигонуклеотида. Используют любые способы, которые пригодны для отделения продуктов от других соединений, присутствующих в растворе, включая жидкостную хроматографию, такую как высокоэффективную жидкостную хроматографию (ВЭЖХ), и осаждение пригодным со-растворителем, таким как этанол. Выбор пригодных способов очистки зависит от природы продуктов и системы растворителей, используемой для синтеза.
Реакции предпочтительно проводят в водном растворе, таком как буферный водный раствор, но также могут быть проведены в смешанной водно-органической среде, совместимой с растворимостью структурных элементов, олигонуклеотидов, промежуточных и конечных продуктов, а также фермента, использованного для катализа лигирования олигонуклеотида.
Следует понимать, что теоретическое число соединений, полученных в данном цикле согласно способу по настоящему изобретению, равно произведению числа различных соединений-инициаторов, m, использованных в данном цикле, на число отдельных структурных элементов r, добавленных в цикле. Реальное число отдельных соединений, полученных в цикле, может быть больше произведения r на m (r×m), но может быть и меньше с учетом различий в реакционной способности некоторых структурных элементов с некоторыми другими элементами. Например, кинетика присоединения определенного структурного элемента к определенному соединению-инициатору определяет выход продукта в ходе данного цикла синтеза и в зависимости от указанной кинетики выход продукта составляет незначительную величину или продукт совсем не образуется.
В одном варианте, стандартный структурный элемент добавляют перед началом цикла 1, после завершения последнего цикла или между двумя любыми циклами. Например, если функциональным фрагментом является полиамид, то стандартный структурный элемент с защищенной N-концевой группой добавляют после завершения последнего цикла. Стандартный структурный элемент вводят между любыми двумя циклами, например, для включения функциональной группы, такой как алкиновая или азидная группу, которую можно использовать для модификации функциональных фрагментов, например, путем циклизации после завершения синтеза библиотеки.
Термин "эффективно связанный", использованный в данном контексте, означает, что две химические структуры связаны вместе таким образом, что связь между ними устойчива в различных условиях, в которых предполагается обрабатывать данную структуру. Обычно функциональный фрагмент и кодирующий олигонуклеотид связаны ковалентно через соответствующую связующую (мостиковую) группу. Связующая группа означает двухвалентный остаток, содержащий связь для присоединения олигонуклеотида и связь для присоединения функционального фрагмента. Например, если функциональным фрагментом является полиамидное соединение, то полиамид присоединен к связующей группе по N-концевому атому, C-концевому атому или через функциональную группу в одной из боковых цепей. Длина связующей группы, достаточной, чтобы разделить полиамидное соединение и олигонуклеотид, составляет по крайней мере один атом, и предпочтительно, более одного атома, например, по крайней мере два, по крайней мере три, по крайней мере четыре, по крайней мере пять или по крайней мере шесть атомов. Предпочтительно, связующая группа является достаточно гибкой для обеспечения связывания полиамидного соединения с молекулами-мишенями независимо от олигонуклеотида.
В одном варианте, связующая группа присоединена к N-концевому атому полиамидного соединения и к 5′-фосфатной группе олигонуклеотида. Например, связующую группу можно получить из соответствующего предшественника, содержащего активированную карбоксильную группу на одном концевом участке и активированную сложноэфирную группу на другом концевом участке. Реакция предшественника связующей группы с N-концевым атомом азота приводит к образованию амидной связи, соединяющей связующую группу с полиамидным соединением или N-концевым структурным элементом, в то время как реакция предшественника связующей группы с 5-гидроксильной группой олигонуклеотида приводит к присоединению олигонуклеотида к связующей группе через сложноэфирную связь. Связующая группа включает, например, полиметиленовую цепь, такую как -(CH2)n-, или поли(этиленгликолевую) цепь, такую как -(CH2CH2O)n, где в обоих случаях n равно целому числу от 1 до приблизительно 20. Предпочтительно, n равно от 2 до приблизительно 12, более предпочтительно от приблизительно 4 до приблизительно 10. В одном варианте, связующая группа включает гексаметиленовую группу (-(CH2)6-).
Если структурные элементы означают аминокислотные остатки, то конечный функциональный фрагмент означает полиамид. Аминокислоты конденсируют с использованием любых пригодных методик с образованием амидных связей. Предпочтительно, конденсацию аминокислотных структурных элементов проводят в условиях, совместимых с ферментативным лигированием олигонуклеотидов, например, при нейтральных или близких к нейтральным pH и в водном растворе. В одном варианте, полиамидное соединение синтезируют в направлении от С-концевого атома к N-концевому. В данном варианте, первый, или C-концевой структурный элемент конденсируют по карбоксильной группе с олигонуклеотидом через пригодную связующую группу. Первый функциональный фрагмент взаимодействует со вторым функциональным фрагментом, который предпочтительно содержит активированную карбоксильную группу и защищенную аминогруппу. Используют любые методики активирования/введения защитных групп, пригодные для образования амидной связи в растворе. Например, пригодные активированные карбоксильные соединения включают ацилфториды (патент США №5360928, полностью включенный в данное описание в качестве ссылки), симметричные ангидриды и N-гидроксисукцинимидные сложные эфиры. Ацильные группы также активируют in situ, как известно в данной области техники, по реакции с пригодным активирующим соединением. Пригодные активирующие соединения включают дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC), 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), гидрохлорид 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC), ангидрид н-пропанфосфоновой кислоты (РРА), N,N-бис(2-оксо-3-оксазолидинил)имидофосфорилхлорид (ВОР-Cl), гексафторфосфат бром-трис-пирролидинофосфония (PyBrop), дифенилфосфорилазид (DPPA), реагент Кастро (ВОР, РуВОР), соли O-бензотриазолил-N,N,N′,N′-тетраметилурония (HBTU), диэтилфосфорилцианид (DEPCN), диоксид 2,5-дифенил-2,3-дигидро-3-оксо-4-гидрокситиофена (HOTDO, реагент Стеглиха), 1,1′-карбонилдиимидазол (CDI) и хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (DMT-MM). Конденсирующие агенты используют в отдельности или в комбинации с добавками, такими как N,N-диметил-4-аминопиридин (DMAP), N-гидроксибензотриазол (HOBt), N-гидроксибензотриазин (HOOBt), N-гидроксисукцинимид (HOSu), N-гидроксиазабензотриазол (HOAt), соли азабензотриазолилтетраметилурония (HATU, HAPyU) или 2-гидроксипиридин. В некоторых вариантах, для синтеза библиотек необходимо использование двух или более методик активации, что необходимо для использования отличающихся в структурном отношении наборов структурных элементов. Для каждого структурного элемента специалист в данной области техники может определить соответствующую методику активации.
В качестве N-концевой защитной группы используют любые защитные группы, совместимые с условиями проведения процесса, а также защитные группы, пригодные в условиях синтеза в растворе. Предпочтительной защитной группой является флуоренилметоксикарбонильная ("Fmoc") группа. Необходимо также вводить защитные группы во все потенциально реакционноспособные функциональные группы в боковой цепи аминоацильного структурного элемента. Предпочтительно защитная группа боковой цепи расположена ортогонально к N-концевой защитной группе, и таким образом защитную группу боковой цепи удаляют в условиях, отличающихся от условий, необходимых для удаления N-концевой защитной группы. Пригодные защитные группы боковой цепи включают нитровератрильную группу, которую можно использовать как для защиты карбоксильных групп в составе боковой цепи, так и аминогрупп в составе боковой цепи. Другие пригодные защитные группы аминогрупп в боковой цепи включают N-пент-4-еноильную группу.
Структурные элементы можно модифицировать после введения их в функциональный фрагмент, например, путем пригодной реакции, вводящей функциональную группу в один или более структурных элементов. Модификация структурных элементов может быть проведена после присоединения конечного структурного элемента или на любой промежуточной стадии синтеза функционального фрагмента, например, после любого цикла синтеза. После синтеза библиотеки бифункциональных молекул по настоящему изобретению модификацию структурных элементов проводят в составе всей библиотеки или в части библиотеки, при этом возрастает степень сложности библиотеки. Пригодные реакции модификации структурных элементов включают такие реакции, которые можно проводить в условиях, совместимых с функциональным фрагментом и кодирующим олигонуклеотидом. Примеры таких реакций включают ацилирование и сульфирование аминогрупп или гидроксильных групп, алкилирование аминогрупп, этерификацию или тиоэтерификацию карбоксильных групп, амидирование карбоксильных групп, эпоксидирование алкенов и другие реакции, известные в данной области техники. Если функциональный фрагмент включает структурный элемент, содержащий алкиновую или азидную функциональную группу, то реакцию циклоприсоединения азида/алкина используют для модификации структурного элемента. Например, структурный элемент, включающий алкин, взаимодействует с органическим азидом, или функциональный блок, включающий азид, взаимодействует с алкином, при этом в любом случае образуется триазол. Реакции модификации структурных элементов проводят после присоединения конечного структурного элемента или на любой промежуточной стадии синтеза и используют для включения в функциональный фрагмент большого числа химических структур, включая углеводы, металлсвязывающие компоненты и структуры, специфичные к определенным биомишеням или тканям.
В одном варианте, функциональный фрагмент содержит линейную серию структурных элементов, которую подвергают циклизации с использованием пригодной реакции. Например, если по крайней мере 2 структурных элемента в линейном наборе включают сульфгидрильные группы, то сульфгидрильные группы окисляют с образованием дисульфидной связи, при этом происходит циклизация линейной серии структурных элементов. Например, функциональными фрагментами являются олигопептиды, которые включают два или более остатков L- или D-цистеина и/или L-или D-гомоцистеина. Структурные элементы могут также включать и другие функциональные группы, способные взаимодействовать друг с другом, такие как карбоксильные группы и амино или гидроксильные группы; при этом происходит циклизация линейной серии.
В предпочтительном варианте, один из структурных элементов в линейном наборе включает алкиновую группу, а другой структурный элемент в линейном наборе включает азидную группу. Азидная и алкиновая группа могут взаимодействовать по механизму циклоприсоединения с образованием макроциклической структуры. Как показано на фиг. 9, функциональным фрагментом является полипептид, содержащий пропаргилглициновый структурный элемент в C-концевом участке и азидоацетильную группу в N-концевом участке. Реакция алкиновой и азидной групп в пригодных условиях приводит к образованию циклического соединения, которое включает триазольную структуру в составе макроцикла. В одном варианте каждый член библиотеки включает алкин- и азид-содержащие структурные элементы, и, следовательно, их можно циклизовать. Во втором варианте, все члены библиотеки включают алкин- и азид-содержащие структурные элементы, но только часть библиотеки циклизуется. В третьем варианте, только некоторые функциональные фрагменты включают алкин- и азид-содержащие структурные элементы, и только такие молекулы циклизуются. В описанных выше втором и третьем вариантах, после реакции циклоприсоединения библиотека будет включать как циклические, так и линейные функциональные фрагменты.
Олигонуклеотиды лигируют с использованием ферментативных методов. В одном варианте исходный структурный элемент эффективно связан с исходным олигонуклеотидом. Перед или после присоединения второго структурного элемента к исходному структурному элементу, вторую олигонуклеотидную последовательность, которая определяет второй структурный элемент, лигируют с исходным олигонуклеотидом. Способы лигирования исходной олигонуклеотидной последовательности и новой олигонуклеотидной последовательности показаны на фиг. 1 и 2. Как показано на фиг. 1, исходный олигонуклеотид является двухцепочечным, причем одна цепочка содержит дополнительную последовательность, комплементарную одному концевому участку второго олигонуклеотида, и способствует контактированию второго и исходного олигонуклеотидов. Предпочтительно, дополнительная последовательность в исходном олигонуклеотиде и комплементарная последовательность во втором олигонуклеотиде обе составляют по крайней мере 4 основания, более предпочтительно обе последовательности имеют одинаковую длину. Исходный и второй олигонуклеотиды лигируют с использованием пригодного фермента. Если исходный олигонуклеотид присоединен к первому структурному элементу в 5′-концевом участке одной из цепей ("верхняя цепь"), то цепь, комплементарная верхней цепи ("нижняя цепь") будет включать дополнительную последовательность в 5′-концевом участке, а второй олигонуклеотид будет включать комплементарную последовательность в 5′-концевом участке. После лигирования второго олигонуклеотида добавляют цепь, комплементарную последовательности второго олигонуклеотида, который присоединен к 3′ участку дополнительной комплементарной последовательности, и который включает еще одну дополнительную последовательность.
В одном варианте, олигонуклеотид наращивают, как показано на фиг. 2. Олигонуклеотид, связанный с наращиваемым функциональным фрагментом, и новый олигонуклеотид предназначены для лигирования с использованием фиксирующей последовательности, которая включает участок, комплементарный 3′-концевому участку в исходном олигонуклеотиде, и участок, комплементарный 5′-концевому участку в новом олигонуклеотиде. Фиксирующая цепь способствует сближению 5′-концевого участка олигонуклеотида с 3′-концевым участком в новом олигонуклеотиде, и лигирование проводят с использованием ферментов. На примере, показанном на фиг. 2, исходный олигонуклеотид состоит из 16 оснований, а фиксирующая цепь является комплементарной 6 основаниям, расположенным в 3′-концевом участке. Новый олигонуклеотид включает 12 оснований, а фиксирующая цепь является комплементарной 6 основаниям в 5′-концевом участке. Длина фиксирующей цепи и длина комплементарных участков не являются определяющими. Однако, комплементарные участки должны быть достаточно длинными для образования устойчивого димера в условиях лигирования, и одновременно достаточно короткими, чтобы исключить образование конечных молекул, содержащих слишком длинный кодирующий нуклеотид. Предпочтительно, длина комплементарных участков составляет от приблизительно 4 оснований до приблизительно 12 оснований, более предпочтительно от приблизительно 5 оснований до приблизительно 10 оснований, и наиболее предпочтительно от приблизительно 5 оснований до приблизительно 8 оснований.
В одном варианте, исходный олигонуклеотид является двухцепочечным и две цепи соединены ковалентной связью. Один из способов ковалентного связывания двух цепей показан на фиг. 3, причем для связывания двух цепей и функционального фрагмента используют связующий фрагмент. В качестве связующего фрагмента используют любую химическую структуру, которая включает первую функциональную группу, способную взаимодействовать со структурным элементом, вторую функциональную группу, способную взаимодействовать с 3′-концевым участком олигонуклеотида, и третью функциональную группу, способную взаимодействовать с 5′-концевым участком олигонуклеотида. Предпочтительно, вторая и третья функциональные группы расположены таким образом, чтобы две олигонуклеотидные цепи находились в относительной ориентации, обеспечивающей гибридизацию двух цепей. Например, связующий фрагмент характеризуется общей структурой (I):

где A означает функциональную группу, которая образует ковалентную связь со структурным элементом, B означает функциональную группу, которая образует связь с 5′-концевым участком олигонуклеотида, а C означает функциональную группу, которая образует связь с 3′-концевым участком олигонуклеотида. D, F и Е означают химические группы, которые связывают функциональные группы А, С и В с атомом S, который является центральным атомом или атомами каркаса. Предпочтительно, D, Е и F каждый независимо означает цепь, такую как алкиленовая цепь или олиго(этиленгликольная) цепь, и D, Е и F могут быть одинаковыми или различными, и предпочтительно их наличие обеспечивает гибридизацию двух олигонуклеотидов и синтез функционального фрагмента. В одном варианте, трехвалентный линкер (связующий фрагмент) характеризуется структурой

В этом варианте, группа NH доступна для присоединения к структурному элементу, в то время как концевые фосфатные группы доступны для присоединения к олигонуклеотиду.
В вариантах, в которых исходных нуклеотид является двухцепочечным, новый олигонуклеотид также является двухцепочечным. Как показано на фиг. 3, одна цепь исходного нуклеотида может быть длиннее другой, и таким образом включает дополнительную последовательность. В таком варианте, новый олигонуклеотид включает дополнительную последовательность, которая является комплементарной с дополнительной последовательностью исходного олигонуклеотида. Гибридизация двух комплементарных дополнительных последовательностей обеспечивает расположение нового олигонуклеотида, пригодное для лигирования с исходным олигонуклеотидом. Такое лигирование проводят ферментативным методом в присутствии ДНК- или РНК-лигаз. Дополнительная последовательность нового олигонуклеотида и исходного нуклеотида предпочтительно характеризуются одинаковой длиной и состоят из 2 или более нуклеотидов, предпочтительно от 2 до приблизительно 10 нуклеотидов, более предпочтительно от 2 до приблизительно 6 нуклеотидов. В одном предпочтительном варианте, новый олигонуклеотид является двухцепочечным, содержащим дополнительную последовательность в каждом концевом участке. Дополнительная последовательность в одном концевом участке является комплементарной дополнительной последовательности исходного олигонуклеотида, в то время как после лигирования нового и исходного олигонуклеотидов, дополнительная последовательность в другом концевом участке превращается в дополнительную последовательность исходного олигонуклеотида в следующем цикле. В одном варианте, три дополнительные последовательности все содержат от 2 до 6 нуклеотидов, а кодирующая последовательность нового олигонуклеотида содержит от 3 до 10 нуклеотидов, предпочтительно от 3 до 6 нуклеотидов. В предпочтительном варианте, все дополнительные последовательности содержат по 2 нуклеотида, а кодирующие последовательности содержат 5 нуклеотидов.
В варианте, показанном на фиг. 4, новая цепь содержит участок в 3′-концевом фрагменте, который является комплементарным с 3′-концевым участком исходного олигонуклеотида, при этом в обеих цепях содержатся дополнительные последовательности в 5′-концевых участках. 5′-концевые последовательности могут быть заполнены путем использования, например, ДНК-полимеразы, такой как vent-полимера за, при этом образуется двухцепочечным олигонуклеотид. Нижнюю цепь такого олигонуклеотида удаляют, а еще одну дополнительную последовательность присоединяют к 3′-концевому участку верхней цепи с использованием аналогичного метода.
Кодирующую олигонуклеотидную метку получают в результате последующего присоединения олигонуклеотидов, которые определяют каждый последующий компонент. В одном варианте способа по настоящему изобретению последующие олигонуклеотидные метки конденсируют методом ферментативного лигирования с образованием кодирующего олигонуклеотида.
Катализируемое ферментом лигирование олигонуклеотидов проводят с использованием любого фермента, который обеспечивает лигирование структурных элементов нуклеиновых кислот. Примеры ферментов включают лигазы, полимеразы и топоизомеразы. В предпочтительном варианте воплощения настоящего изобретения для лигирования олигонуклеотидов используют ДНК лигазу (EC 6.5.1.1), ДНК полимеразу (EC 2.7.7.7), РНК полимеразу (EC 2.7.7.6) или топоизомеразу (EC 5.99.1.2). Описание ферментов каждого класса EC приведено в статье Bairoch, Nucleic Acids Research, 28, 304-4 (2000).
В предпочтительном варианте, используемые олигонуклеотиды по настоящему изобретению являются олигодезоксинуклеотидами, а в качестве ферментов для катализа лигирования олигонуклеотидов используют ДНК-лигазу. Чтобы лигирование происходило в присутствии лигазы, т.е. чтобы образовалась фосфодиэфирная связь между двумя олигонуклеотидами, один олигонуклеотид должен содержать свободную 5′-фосфатную группу, и другой олигонуклеотид должен содержать свободную 3′-гидроксильную группу. Примеры ДНК-лигаз по настоящему изобретению включают Т4 ДНК-лигазу, Taq ДНК-лигазу, Т4 РНК-лигазу, ДНК лигазу (E.coli) (все лигазы выпускаются, например, фирмой New England Biolabs, MA).
Специалистам в данной области техники известно, что каждый фермент для лигирования, характеризуется оптимальной активностью в особых условиях, например, при определенных температуре, концентрации буферного раствора, pH и за определенный период времени. С целью обеспечения оптимального лигирования олигонуклеотидных меток все перечисленные выше условия можно изменять, например, согласно инструкциям фирмы-производителя.
Длина нового олигонуклеотида может быть любой, однако предпочтительно она составляет по крайней мере 3 нуклеотида. Более предпочтительно, новый олигонуклеотид включает 4 или более нуклеотидов. В одном варианте, новый олигонуклеотид включает от 3 до приблизительно 12 нуклеотидов.
Олигонуклеотиды в составе молекул в библиотеке по настоящему изобретению предпочтительно включают общую концевую последовательность, которая можно использовать в качестве праймера для ПЦР, как известно в данной области техники. Такую общую концевую последовательность можно включать в виде концевой последовательности в новом олигонуклеотиде, который присоединяют в конечном цикле синтеза библиотеки, или ее включают после завершения синтеза библиотеки, например, с использованием методов ферментативного лигирования. Описанных в данном контексте.
Предпочтительный вариант способа по настоящему изобретению показан на фиг. 5. Процесс начинают с использования синтетической последовательности ДНК, которая присоединена через 5′-концевой участок к линкеру, который содержит концевую аминогруппу. На стадии 1 такую исходную последовательность ДНК лигируют с новой последовательностью ДНК в присутствии фиксирующей цепи ДНК, ДНК-лигазы и дитиотреита в Трис-буферном растворе. При этом получают меченую последовательность ДНК, которую затем непосредственно используют на следующей стадии без дополнительной очистки или очищают перед следующей стадией, например, с использованием ВЭЖХ или осаждения этанолом. На стадии 2 меченая ДНК взаимодействует с защищенной активированной аминокислотой, в данном примере, с фторидом Fmoc-защищенной аминокислоты, при этом получают конъюгат защищенной аминокислоты и ДНК. На стадии 3, в полученном конъюгате аминокислоты и ДНК удаляют защитную группу, например, в присутствии пиперидина, и полученный конъюгат с удаленной защитной группой необязательно очищают, например, ВЭЖХ или осаждением этанолом. Конъюгат с удаленной защитной группой является продуктом первого цикла синтеза, который превращается в исходный материал во втором цикле, в котором присоединяют второй аминокислотный остаток к свободной аминогруппе конъюгата с удаленной защитной группой.
В вариантах, в которых ПЦР используют для амплификации кодирующих олигонуклеотидов отдельных молекул, кодирующие олигонуклеотиды предпочтительно включают последовательности праймеров для ПЦР. Например, последовательность праймера для ПЦР может быть включена в исходный олигонуклеотид перед первым циклом синтеза, или вместе с введением первого нового олигонуклеотида. Кодирующий олигонуклеотид может также включать завершающую последовательность праймера для ПЦР, которая следует за кодирующими последовательностями. Завершающая последовательность может быть лигирована с кодирующим олигонуклеотидом после конечного цикла синтеза библиотеки или включена в новый олигонуклеотид, вводимый в конечном цикле. Если последовательности праймеров для ПЦР включают в новый олигонуклеотид, такие новые олигонуклеотиды предпочтительно являются более длинными по сравнению с новыми олигонуклеотидами, которые присоединяют в других циклах, поскольку они включают кодирующую последовательность и последовательность праймера для ПЦР.
Если завершающую последовательность добавляют после присоединения конечного структурного элемента и конечного нового олигонуклеотида, то синтез библиотеки, описанный в данном контексте, включает стадию лигирования завершающей последовательности с кодирующим олигонуклеотидом, при этом олигонуклеотидная часть практически всех членов библиотеки имеет в качестве концевого фрагмента последовательность, включающую последовательность праймера для ПЦР. Последовательности праймеров для ПЦР, пригодные для использования в библиотеках по настоящему изобретению, известны в данной области техники, пригодные праймеры и способы описаны, например, в книге Innis et al., eds., PCR Protocols: A Guide to Methods and Applications, San Diego: Academic Press (1990), содержание которой полностью включено в настоящее описание в качестве ссылки. Предпочтительно, заключительную последовательность присоединяют путем лигирования с объединенными фракциями, которые являются продуктами конечного цикла синтеза. Заключительную последовательность присоединяют с использованием ферментов, которые используют при получении библиотеки.
Как указано выше, нуклеотидную последовательность меченого олигонуклеотида как часть способа по настоящему изобретению можно определять с использованием полимеразной цепной реакции (ПЦР).
Меченый олигонуклеотид включает полинуклеотиды, которые определяют структурные элементы, входящие в состав функционального фрагмента, как описано выше. Последовательность нуклеиновой кислоты меченного олигонуклеотида определяют с помощью реакции ПЦР олигонуклеотидной метки следующим образом. Соответствующий образец смешивают с парой праймеров ПЦР, причем каждый член пары характеризуется предварительно выбранной последовательностью нуклеотидов. Пара праймеров ПЦР инициирует реакцию наращивания цепи праймера при гибридизации с участком связывания праймера в кодирующем меченном олигонуклеотиде. Участок связывания праймера ПЦР предпочтительно включен в кодирующий меченный олигонуклеотид. Например, участок связывания праймера ПЦР включен в исходный меченный олигонуклеотид, а участок связывания второго праймера ПЦР включен в конечный меченный олигонуклеотид. В другом варианте, участок связывания второго праймера ПЦР включен в заключительную последовательность, как описано в данном контексте. В предпочтительных вариантах, участок связывания праймера ПЦР составляет по крайней мере приблизительно 5, 7, 10, 13, 15, 17, 20, 22 или 25 нуклеотидов.
Реакцию ПЦР проводят при смешении пары праймеров ПЦР, предпочтительно в предварительно определенном количестве, с нуклеиновыми кислотами кодирующего олигонуклеотида, предпочтительно в предварительно определенном количестве, в буферном растворе ПЦР с образованием реакционной смеси ПЦР. Смесь помещают в термический циклизатор и проводят ряд циклов, число которых обычно предварительно определяют, при этом образуется продукт реакции ПЦР. Количество продукта должно быть достаточным, чтобы выделить его в достаточном количестве для определения последовательности ДНК.
ПЦР обычно проводят в термическом циклизаторе, т.е. при повторном увеличении и снижении температуры реакционной смеси ПЦР в пределах температурного интервала, нижняя граница которого составляет от приблизительно 30°C до приблизительно 55°C, а верхняя граница составляет от приблизительно 90°C до приблизительно 100°C. Повышение и снижение температуры можно проводить в непрерывном режиме, но предпочтительно циклы проводят через определенные периоды времени при определенной температуре, при которой обеспечиваются оптимальные условия синтеза полинуклеотидов, денатурации и гибридизации.
Реакцию ПЦР проводят с использованием любого пригодного способа. В основном ее проводят в буферном водном растворе, т.е., в буферном растворе ПЦР, предпочтительно при pH от 7 до 9, предпочтительно в присутствии молярного избытка праймера. Значительный молярный избыток праймера необходим для повышения эффективности процесса.
Буферный раствор ПЦР содержит также термостабильные трифосфаты дезоксирибонуклеотидов (субстраты синтеза полинуклеотидов) dАТФ, dЦТФ, dГТФ и dТТФ и полимеразу, все компоненты в соответствующих количествах, пригодных для реакции наращивания цепи праймера (синтез полинуклеотидов). Полученный раствор (смесь для ПЦР) нагревают при приблизительно 90-100°C в течение от приблизительно 1 до 10 мин, предпочтительно в течение от 1 до 4 мин. После нагревания раствор охлаждают до 54°C, которая является предпочтительной для гибридизации праймера. Реакцию синтеза проводят при температуре от комнатной температуры до температуры, выше которой снижается эффективность действия полимеразы (индуцирующего агента). Таким образом, например, если используют ДНК-полимеразу, то температура обычно не превышает приблизительно 40°C. Циклы в термическом циклизаторе повторяют до образования требуемого количества продукта ПЦР. Пример буферного раствора ПЦР включает следующие реагенты: 50 Мм KCl, 10 Мм трис-HCl, pH 8,3, 1,5 Мм MgCl2, 0,001 мас./об.% желатины, 20 мкм dATФ, 200 мкм dTTФ, 200 мкм dЦТФ, 200 мкм dГТФ и 2,5 ед. полимеразы ДНК I (Thermus aquaticus (Taq)) на 100 мкл буферного раствора.
Пригодные ферменты для наращивания последовательностей праймеров включают, например, ДНК полимеразу I E.coli, ДНК полимеразу Taq, фрагмент Кленова ДНК полимеразы I E.coli, Т4 ДНК-полимеразу, другие доступные ДНК-полимеразы, обратную транскриптазу и другие ферменты, включая термоустойчивые ферменты, которые способствуют расположению нуклеотидов соответствующим образом с образованием продуктов наращивания цепи праймеров, комплементарных каждой цепи нуклеиновой кислоты. В основном, синтез инициируют в 3′-концевом участке каждого праймера и наращивание цепи происходит в 5′-направлении вдоль цепи матрицы до завершения синтеза с образованием молекул различной длины.
Синтезированная цепь ДНК и комплементарная ей цепь образуют двухцепочечную молекулу, которую используют на следующих стадиях анализа.
Способы амплификации ПЦР подробно описаны в патентах США №4683192, 4683202, 4800159 и 4965188, а также в книгах PCR Technology: Principles and Applications for DNA Amplifications, H. Erich, ed., Stockton Press, New York (1989) и Innis et al., eds., PCR Protocols: A Guide to Methods and Applications, Academic Press, San Diego, Calif. (1990). Содержание всех документов полностью включено в настоящее описание в качестве ссылок.
Термин "полинуклеотид", использованный в данном контексте по отношению к праймерам, зондам и фрагментам или сегментам нуклеиновых кислот, которые синтезируются путем наращивания праймера, означает молекулу, включающую два или более дезоксирибонуклеотидов, предпочтительно более трех.
Термин "праймер", использованный в данном контексте, означает полинуклеотид, полученный путем очистки рестрикционного гидролизата нуклеиновой кислоты или путем синтеза, который действует в качестве точки инициации синтеза нуклеиновой кислоты в условиях, в которых индуцируется синтез продукта наращивания праймера, комплементарного цепи нуклеиновой кислоты, т.е. в присутствии нуклеотидов и агента полимеризации, такого как ДНК-полимераза, обратная транскриптаза и т.п., при пригодной температуре и величине pH. Для достижения максимальной эффективности праймер предпочтительно является одноцепочечным, однако в другом варианте является двухцепочечным. В случае двухцепочечного праймера его перед использованием для получения продуктов наращивания сначала обрабатывают для отделения от комплементарной цепи. Предпочтительно праймер предпочтительно является полидезоксирибонуклеотидом. Праймер может быть достаточно длинным, чтобы обеспечивать запуск синтеза продуктов наращивания в присутствии агентов полимеризации. Точная длина праймеров зависит от многих факторов, включая температуру и источник праймера.
Праймеры, используемые в способе по настоящему изобретению, должны быть в "значительной" степени комплементарными другим цепям каждой специфической последовательности, предназначенной для амплификации. Это означает, что праймер должен быть в значительной степени комплементарным, чтобы обеспечивать точную гибридизацию только с соответствующей цепью матрицы. Следовательно, последовательность праймера может отражать или не отражать точную последовательность матрицы.
Полинуклеотидные праймеры получают с использованием любого пригодного способа, такого как, например, фосфотриэфирный или фосфодиэфирный способы, описанные в статье Narang et al., Meth. Enzymol., 68, 90 (1979), патентах США №4356270, 4458066, 4416988 и 4293652, а также в статье Brown et al., Meth. Ezymol., 68, 109 (1979). Содержание всех указанных документов полностью включено в объем настоящего изобретения в качестве ссылок.
После амплификации кодирующего меченого олигонуклеотида его последовательность и однозначный состав выбранной молекулы определяют с использованием анализа последовательностей нуклеиновых кислот, известной методики секвенирования последовательностей нуклеотидов. Анализ последовательностей нуклеиновых кислот проводят при комбинации (а) физико-химических методов, основанных на гибридизации или денатурации цепи зонда плюс цепи комплементарной ему мишени, и (б) ферментативных реакций с участием полимеразы.
Настоящее изобретение относится также к соединениям, которые получают согласно способам по настоящему изобретению, и к наборам таких соединений, как в виде отдельных соединений, так и в виде объединения соединений, которые образуют библиотеку химических структур. Соединения по настоящему изобретению включают соединения формулы

где X означает функциональный фрагмент, содержащий один или более структурных элементов; Z означает олигонуклеотид, присоединенный по 3′-концевому участку к B, а Y означает олигонуклеотид, который присоединен по 5′-концевому участку к C. А означает функциональную группу, образующую ковалентную связь с X; B означает функциональную группу, образующую 3′-связь с Z, а C означает функциональную группу, образующую 5′-связь с Y. D, F и Е означают химические группы, которые связывают функциональные группы А, С и В с S, который означает атом или молекулярный каркас. Предпочтительно, D, Е и F каждый независимо означает цепь атомов, таких как алкиленовая цепь или олиго(этиленгликольная) цепь. D, Е и F могут быть одинаковыми или различными, и предпочтительно их наличие обеспечивает гибридизацию двух олигонуклеотидов и синтез функционального фрагмента.
Предпочтительно, Y и Z в значительной степени являются комплементарными друг к другу и расположены в соединении таким образом, чтобы способствовать образованию пар Уотсона-Крика и образованию дуплекса в пригодных условиях. Длина Y и Z является одинаковой или различной. Предпочтительно, длина Y и Z является одинаковой, или один из Y и Z длиннее другого на 1-10 оснований. В предпочтительном варианте, длина каждого Y и Z составляет 10 или более оснований, и эти фрагменты содержат комплементарные участки, включающие от 10 и более оснований. Более предпочтительно, Y и Z в значительной степени комплементарны друг другу на протяжении всей длины, т.е. они содержат не более одного ошибочного несовпадения оснований на каждые 10 пар оснований. Более предпочтительно, Y и Z комплементарны на протяжении всей длины, т.е. за исключением дополнительного участка в Y или Z, цепи гибридизуются с образованием пар Уотсона-Крика и не содержат ошибочных несовпадений на протяжении всей длины.
S означает отдельный атом или молекулярный каркас. Например, S означает атом углерода, атом бора, атом азота или атом фосфора, или многоатомный каркас, такой как фосфатная группа или циклическая группа, такая как циклоалкил, циклоалкенил, гетероциклоалкил, гетероциклоалкенил, арил или гетероарил. В одном варианте, линкер означает группу структуры
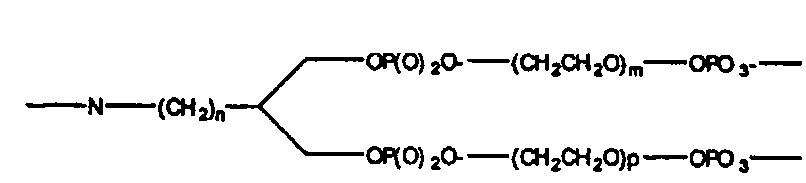
где каждый n, m и p независимо равен целому числу от 1 до приблизительно 20, предпочтительно от 2 до 8 и более предпочтительно от 3 до 6. В другом варианте, линкер (связующий фрагмент) имеет следующую структуру:

В одном варианте, библиотеки по настоящему изобретению включают молекулы, содержащие функциональный фрагмент, содержащий структурные элементы, причем каждый функциональный фрагмент эффективно связан с кодирующим олигонуклеотидом. Последовательность нуклеотидов в кодирующем олигонуклеотиде определяет структурные элементы, присутствующие в функциональном фрагменте, а в некоторых вариантах, определяет порядок их присоединения или расположение. Способ по настоящему изобретению характеризуется преимуществом, которое заключается в том, что метод конструирования функционального фрагмента и олигонуклеотида можно проводить в одной и той же реакционной среде, предпочтительно в водной среде, что таким образом упрощает способ получения библиотеки по сравнению со способами, известными из предшествующего уровня техники. В некоторых вариантах, в которых стадии лигирования олигонуклеотида и стадии присоединения структурных элементов проводят в водной среде, причем для каждой реакции существуют различное оптимальное значение pH. В таких вариантах, реакцию присоединения структурных элементов проводят при пригодных pH и температуре в пригодном водном буфером растворе. Затем буферный раствор можно заменить на водный буферный раствор, характеризующийся пригодным pH для лигирования олигонуклеотида.
Одно из преимуществ способов по настоящему изобретению заключается в том, что их можно использовать для получения библиотеки, включающей огромное число соединений. Способность амплифицировать последовательности кодирующих олигонуклеотидов с использованием известных способов, таких как полимеразная цепная реакция (ПЦР), означает, что выбранные молекулы можно идентифицировать с использованием лишь относительно малого числа копий. Это позволяет использовать чрезвычайно многочисленные библиотеки, которые вследствие их высокой степени сложности включают либо относительно малое количество копий каждого члена библиотеки, либо требуют использования чрезвычайно больших объемов. Например, библиотека, включающая 108 отдельных структур, в которых каждая структура содержится в виде 1×1012 копий (приблизительно 1 пмоль), требует приблизительно 100 л раствора с эффективной концентрацией 1 мкм. Для той же библиотеки, если каждый член представлен 1000000 копиями, то требуется объем 100 мкл с эффективной концентрацией 1 мкм.
В предпочтительном варианте, библиотека включает от приблизительно 103 до приблизительно 1015 копий каждого члена библиотеки. Вследствие различий в эффективности синтеза различных членов библиотеки в любой данной библиотеке члены могут быть представлены различных числом копий. Следовательно, хотя число копий каждого члена, теоретически присутствующего в библиотеке, может быть одинаковым, реальное число копий любого члена данной библиотеки не зависит от числа копий любого другого члена. Более предпочтительно, библиотеки соединений по настоящему изобретению включают по крайней мере приблизительно 105, 106 или 107 копий каждого члена библиотеки, или практически всех членов библиотеки. Термин "практически все" члены библиотеки означает по крайней мере приблизительно 85% членов библиотеки, предпочтительно по крайней мере приблизительно 90% или более предпочтительно по крайней мере приблизительно 95% членов библиотеки.
Библиотека предпочтительно включает достаточное число копий каждого члена, чтобы обеспечить выполнение множества экспериментов (т.е. 2 или более) по отбору соединений в отношении биологической мишени, при этом после завершения конечного числа экспериментов по отбору остается достаточное количество связанных молекул после последнего круга выбора для проведения амплификации олигонуклеотидной метки в остальных молекулах и, следовательно, для идентификации функциональных фрагментов связывающих молекул. Схема такого процесса отбора показана на фиг. 6, где 1 и 2 означают членов библиотеки, B означает молекулу-мишень, а X означает остаток, эффективно связанный с B, что позволяет удалить B из среды для отбора. В данном примере, соединение 1 связано с B, в то время как соединение 2 не связано с B. Процесс отбора, как показано в эксперименте 1, включает (I) контактирование библиотеки, включающей соединения 1 и 2, с B-X в условиях, пригодных для связывания соединения 1 с B, (II) удаление несвязанного соединения 2, (III) диссоциацию соединения 1 от B и удаление BX из реакционной среды. Результатом эксперимента 1 является отбор молекул, обогащенных соединением 1 по сравнению с соединением 2. Следующие эксперименты, включающие стадии I-III, приводят к дальнейшему обогащению соединением 1 по сравнению с соединением 2. Хотя на фиг. 6 показаны 3 эксперимента, на практике можно выполнить любое число экспериментов, например, от 1 до 10 экспериментов, при этом достигается требуемая степень обогащения связывающимися молекулами по сравнению с несвязывающимися.
В варианте, показанном на фиг. 6, амплификацию (синтез большего числа копий) соединений, оставшихся после любого из экспериментов отбора, не проводят. Такая амплификация приводит к образованию смеси соединений, не совместимой с относительными количествами соединений, оставшихся после отбора. Такая несовместимость возникает вследствие того, что синтез некоторых соединений проходит с более высоким выходом по сравнению с другими соединениями, и, следовательно, амплификация будет проходить не пропорционально их присутствию после отбора. Например, если соединение 2 синтезируется с большим выходом, чем соединение 2, то амплификация молекул, оставшихся после эксперимента 2, приведет к непропорциональной амплификации соединения 2 по сравнению с соединением 1, и к образованию смеси соединений с значительно меньшим (или с отсутствием) обогащением соединения 1 по сравнению с соединением 2.
В одном варианте, мишень иммобилизуют на твердом носителе с использованием любой известной методики иммобилизации. В качестве твердого носителя используют, например, водонерастворимую матрицу, расположенную внутри хроматографической колонки или мембраны. Кодирующую библиотеку наносят на водонерастворимую матрицу, расположенную внутри хроматографической колонки. Затем колонку промывают для удаления неспецифически связанных веществ. Соединения, связанные с мишенью, диссоциируют изменением pH, концентрации соли, концентрации органического растворителя или с использованием других методов, таких как конкурентное связывание известного лиганда с мишенью.
В другом варианте, мишень находится в растворе в свободном виде, ее инкубируют в присутствии кодирующей библиотеки. Соединения, связанные с мишенью (называемые в данном контексте "лигандами"), выделяют методом разделения по размерам, таким как гельфильтрация или ультрафильтрация. В одном варианте, смесь кодированных соединений и биомолекулу-мишень пропускают через молекулярно-ситовую хроматографическую колонку (гель-фильтрация), на которой происходит разделение любых комплексов лиганд-мишень от несвязанных соединений. Комплексы лиганд-мишень переносят на обращенно-фазовую хроматографическую колонку, на которой происходит диссоциация лигандов от мишени. Затем диссоциированные лиганды анализируют ПЦР амплификацией и секвенированием кодирующего олигонуклеотида. Такой подход является прежде всего преимущественным в случаях, когда иммобилизация мишени приводит к потере ее активности.
Хотя отдельные лиганды идентифицируют по описанным выше методикам, можно использовать различные уровни анализа для исследования взаимосвязи структуры с активностью и для дальнейшей оптимизации аффинности, специфичности и биоактивности лиганда. Для лигандов, полученных из одного каркаса, используют трехмерное молекулярное моделирование для определения важных структурных характеристик, общих для лигандов, получая таким образом семейства низкомолекулярных лигандов, которые предположительно связываются с одним участком биомолекулы-мишени.
Используют ряд подходов к анализу, позволяющих получить лиганды с высоким сродством к одной мишени, но значительно более слабым сродством к другой близкой по строению мишени. Один подход к анализу заключается в идентификации лигандов для обеих биомолекул в параллельных экспериментах и в последовательном удалении общих лигандов при перекрестном сравнении. По данной методике, лиганды для каждой биомолекулы идентифицируют отдельно, как описано выше. Такой метод можно использовать как в присутствии иммобилизованных биомолекул-мишеней, так и в присутствии биомолекул-мишеней в растворе.
Для иммобилизованных биомолекул-мишеней другая стратегия заключается во включении дополнительной стадии перед отбором, на которой удаляются из библиотеки все лиганды, которые не связываются с биомолекулой-немишенью из библиотеки. Например, первая биомолекула контактирует с кодирующей библиотекой, как описано выше. Затем соединения, которые не связываются с первой биомолекулой, отделяют от всех образующихся комплексов "первая биомолекула-лиганд". Затем вторая биомолекула контактирует с соединениями, которые не связываются с первой биомолекулой. Соединения, которые связываются со второй биомолекулой, могут быть идентифицированы, как описано выше, и характеризуются более сильным сродством ко второй биомолекуле по сравнению с первой.
Лиганд для биомолекулы с неизвестной функцией, который идентифицируют по методике, описанному выше, можно использовать для определения биологической функции биомолекулы, что является преимуществом, поскольку, хотя все еще существует необходимость в выявлении последовательности новых генов, функции белков, закодированных в этой последовательности, и ценность таких белков в качестве мишеней для поиска и разработки новых лекарственных средств с трудом поддаются определению и, возможно, представляют основной недостаток при применении генетической информации для лечения заболеваний. Мишень-специфичные лиганды, полученные способом по настоящему изобретению, можно эффективно использовать для биологических анализов на основе цельных клеток или на соответствующих моделях животных, т.е. для исследования функции белка-мишени и ценности белка-мишени для применения в медицине. Данный подход подтверждает также тот факт, что мишень прежде всего пригодна для поиска низкомолекулярных лекарственных средств.
В одном варианте, одно или более соединений в составе библиотеки по настоящему изобретению являются лигандами для определенной биомолекулы. Способность таких соединений связываться с биомолекулами оценивают методом анализа in vitro. Предпочтительно, функциональные фрагменты связывающихся соединений синтезируют без олигонуклеотидной метки или линкерного (связующего) фрагмента, и оценивают способность таких функциональных фрагментов связываться с биомолекулой.
Влияние связывания функциональных фрагментов с биомолекулой на функцию биомолекулы оценивают также с методом анализа in vitro в отсутствии или в присутствии клеток. В случае биомолекулы с известной функцией анализ включает сравнение активности биомолекулы в присутствии и отсутствии лиганда, например, прямым измерением активности, такой как ферментативная активность, или косвенным анализом, таким как оценка влияния биомолекулы на клеточную функцию. В случае биомолекулы с неизвестной функцией, клетку, которая экспрессирует биомолекулу, вводят в контакт с лигандом и оценивают влияние лиганда на жизнеспособность, функцию, фенотип и/или экспрессию гена клеткой. Анализ in vitro включает, например, оценку апоптоза клеток, клеточной пролиферации или репликации вируса. Например, если биомолекулой является белок, экспрессируемый вирусом, то клетку, инфицированную вирусом, вводят в контакт с лигандом для белка. Затем оценивают влияние связывания лиганда с белком на жизнеспособность вируса.
Лиганд, идентифицированный способом по настоящему изобретению, оценивают также на модели in vivo или при испытании на пациентах. Например, действие лиганда оценивают при испытании на животных или в организме, в котором образуется эта биомолекула. При этом определяют любые изменения состояния здоровья (например, развитие болезни) у животного или в организме пациента.
В случае биомолекулы, такой как белок или нуклеиновая кислота, с неизвестной функцией, влияние лиганда, который связывается с биомолекулой, на клетки или организм, в которых образуется биомолекула, позволяет получить информацию о биологической функции биомолекулы. Например, ингибирование конкретного клеточного процесса в присутствии лиганда свидетельствует о том, что процесс зависит, по крайней мере частично, от функции биомолекулы.
Лиганды, идентифицированные с использованием способов по настоящему изобретению, используют также в качестве аффинных реагентов для биомолекулы, с которой они связываются. В одном варианте, такие лиганды используют для аффинной очистки биомолекулы, например, при аффинной хроматографии раствора, включающего биомолекулу, с использованием твердой фазы, на которой иммобилизованы один или более таких лигандов.
Настоящее изобретение иллюстрируется следующими примерами, которые не ограничивают его объем. Содержание всех ссылок, патентов и опубликованных заявок на выдачу патента, которые цитируются в описании настоящего изобретения, а также фигуры и перечень последовательностей, включены в объем настоящего изобретения в качестве ссылок.
Примеры
Пример 1. Синтез и характеристика библиотеки, содержащей 105 членов
Синтез библиотеки, включающей порядка 105 отдельных членов, проводят с использованием следующих реагентов:
Соединение 1:
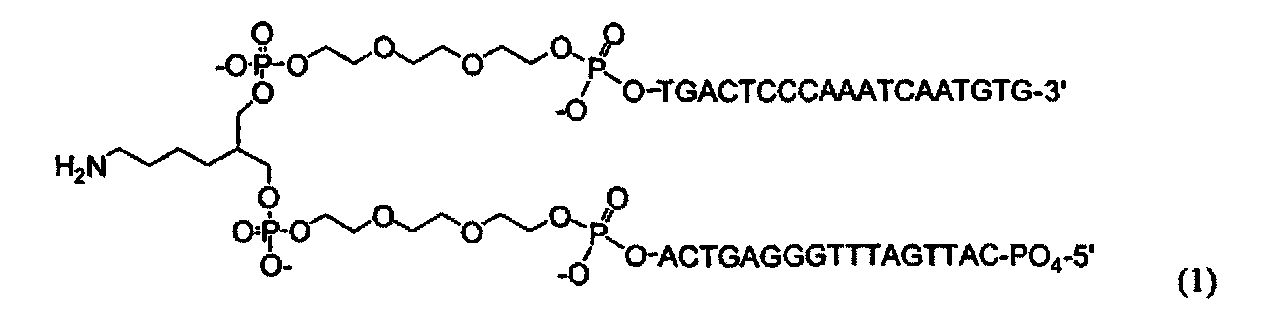
Однобуквенный код структуры дезоксирибонуклеотидов:
A означает аденозин
C означает цитидин
O означает гуанозин
T означает тимидин
Предшественники структурных элементов:






Буферный раствор 1X для лигазы: 50 мМ Трис, pH 7,5, 10 мМ дитиотрейтол, 10 мМ MgCl2, 2,5 мМ АТР, 50 мМ NaCl.
Буферный раствор 10Х для лигазы: 500 мМ Трис, pH 7,5, 100 мМ дитиотрейтол, 100 мМ MgCl2, 25 мМ АТР, 500 мМ NaCl.
Цикл 1
В каждую из 12 пробирок для ПЦР добавляют по 50 мкл 1 мМ раствора соединения 1 в воде, 75 мкл 0,80 мМ раствора одного из нуклеотидов 1.1-1.12, 15 мкл буферного раствора 10Х для лигазы и 10 мкл деионизированной воды. Пробирки нагревают при 95°C в течение 1 мин и затем охлаждают до 16°C в течение 10 мин. В каждую пробирку добавляют по 5000 единиц Т4 ДНК лигазы (2,5 мкл раствора 2000000 ед/мл, фирмы New England Biolabs, номер по каталогу М0202) в 50 мкл буферного раствора 1X для лигазы и полученный раствор инкубируют в течение 16 ч при 16°C.
После лигирования образцы переносят в пробирки Эппендорфа объемом 1,5 мл и обрабатывают 20 мкл 5M водного раствора NaCl и 500 мкл охлажденного (-20°C) этанола, выдерживают при -20°C в течение 1 ч. После центрифугирования супернатант удаляют и осадок промывают 70% водным раствором этанола при -20°C. Каждую порцию осадка растворяют в 150 мкл 150 мМ буферного раствора, содержащего борат натрия, pH 9,4.
Концентрированные растворы, содержащие по одному из предшественников структурных элементов BB1-BB12, N,N-диизопропилэтаноламин и гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония, причем концентрация каждого компонента составляет 0,25 М, готовят в ДМФА и перемешивают при комнатной температуре в течение 20 мин. Растворы предшественников структурных элементов добавляют в каждый надосадочный раствор, описанный выше, и при этом получают 10-кратный избыток структурного элемента по отношению к линкеру (связующему фрагменту). Полученные растворы перемешивают. Через 20 мин в реакционную смесь добавляют еще 10 экв. предшественника структурного элемента и через 40 мин еще 10 экв. Конечная концентрация ДМФА в реакционной смеси составляет 22%. Реакционные смеси перемешивают в течение ночи при 4°C. Ход реакции контролируют методом ОФ-ВЭЖХ (элюент: 50 мМ водный раствор ацетата тетраэтиламмония (pH=7,5) и ацетонитрил, градиент от 2 до 46% ацетонитрила в течение 14 мин). Реакцию останавливают при ацилировании приблизительно 95% исходного материала (линкера). После ацилирования реакционные смеси объединяют и лиофилизируют досуха. Лиофилизованный материал очищают ВЭЖХ и фракции, соответствующие библиотеке (ацилированный продукт), объединяют и лиофилизуют. Библиотеку растворяют в 2,5 мл 0,01 М буферного раствора, содержащего фосфат натрия (pH=8,2), и добавляют 0,1 мл пиперидина (4 об.%). Добавление пиперидина приводит к образованию осадка (опалесцирующий раствор), который не растворяется при перемешивании. Реакционные смеси перемешивают при комнатной температуре в течение 50 мин, и затем опалесцирующий раствор центрифугируют (14000 об/мин), супернатант удаляют с использованием дозатора на 200 мл и осадок ресуспендируют в 0,1 мл воды. Водный слой объединяют с супернатантом и осадок отбрасывают. Библиотеку с удаленными защитными группами осаждают из раствора при добавлении избытка этанола, охлажденного на льду, при этом конечная концентрация этанола в реакционной смеси составляет 70 об.%. После центрифугирования водно-этанольной смеси получают белый осадок, содержащий библиотеку. Осадок промывают один раз охлажденным 70% водным этанолом. После удаления растворителя осадок сушат на воздухе (приблизительно 5 мин) для удаления следов этанола и затем используют в цикле 2. Олигонуклеотиды и соответствующие предшественники структурных элементов, использованные в эксперименте 1, приведены в таблице 1 ниже.
Таблица 1
Циклы 2-5
Для каждого из этих циклов объединенный раствор, полученный в предыдущем цикле, разделяют на 12 равных аликвотных частей по 50 мкл каждая и помещают в пробирки для ПЦР. В каждую пробирку добавляют раствор, содержащий олигонуклеотидную метку, и проводят лигирование, очистку и ацилирование, как описано в цикле 1, за исключением того, что в циклах 3-5 не проводят стадию очистки ВЭЖХ, описанную для цикла 1. Соответствие между олигонуклеотидной меткой и предшественниками структурных элементов, использованных в циклах 2-5, представлено в таблице 2. Продукты, полученные в цикле 5, лигируют с замыкающим праймером, показанным ниже, с использованием метода, описанного выше для лигирования олигонуклеотидных меток.

Таблица 2
Результаты
Методика синтеза, описанная выше, предназначена для получения библиотеки, включающей 125 (приблизительно 249000) различных структур. Результаты синтеза контролируют с использованием гель-электрофореза продукта, полученного в каждом цикле. Результаты каждого из 5 циклов и лигирование конечной библиотеки с заключительным праймером показано на фиг. 7. Соединение, обозначенное "головной фрагмент" означает соединение 1. На фигуре показано, что каждый цикл приводит к ожидаемому повышению молекулярной массы и что продукты в каждом цикле характеризуются высокой гомогенностью по молекулярной массе.
Пример 2. Синтез и характеристика библиотеки, содержащей 108 членов
Синтез библиотеки, включающей порядка 108 отдельных членов, проводят с использованием следующих реагентов:
Соединение 2:

Однобуквенный код структуры дезоксирибонуклеотидов:
A означает аденозин
C означает цитидин
G означает гуанозин
T означает тимидин
Предшественники структурных элементов:






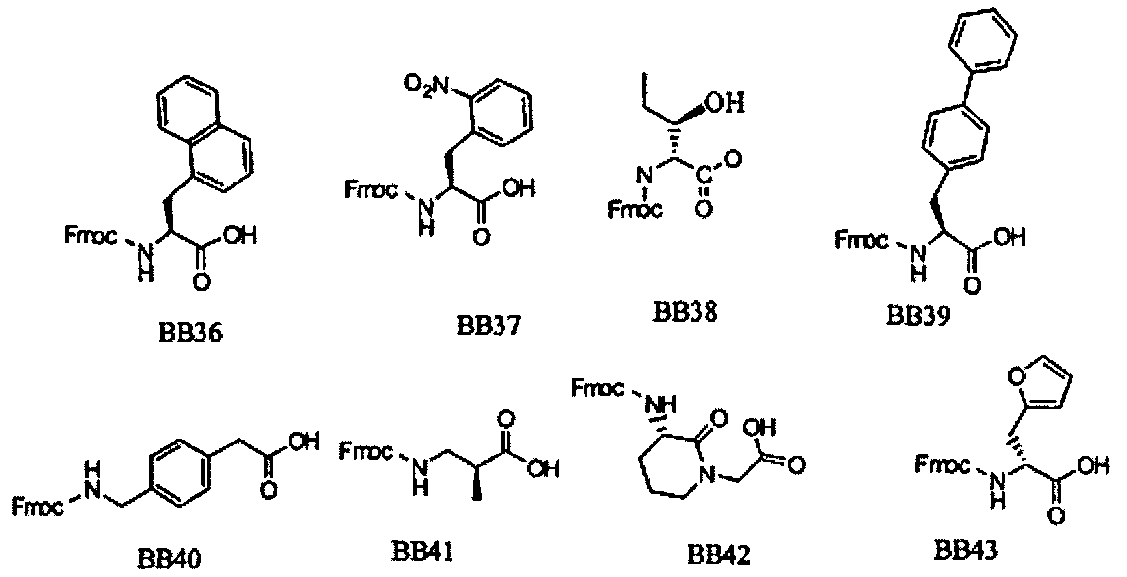







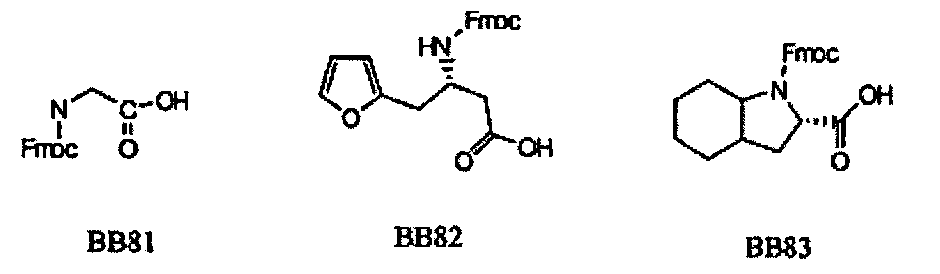

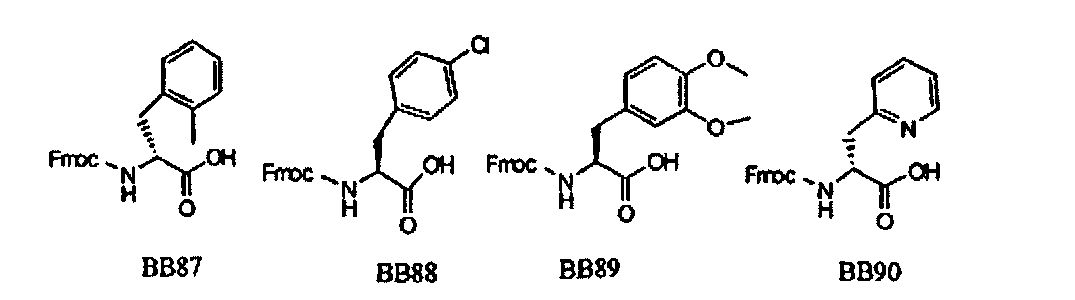
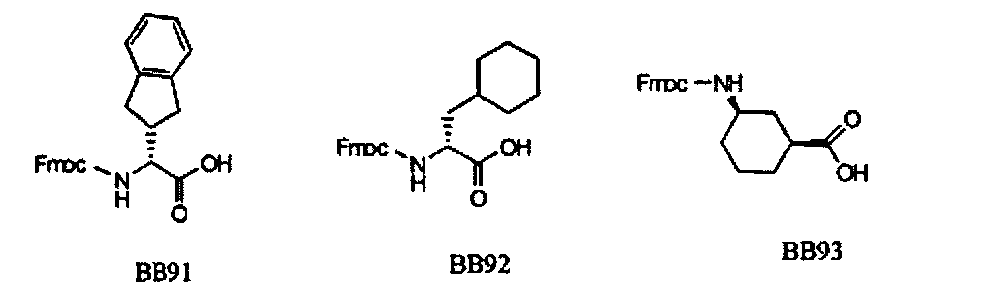
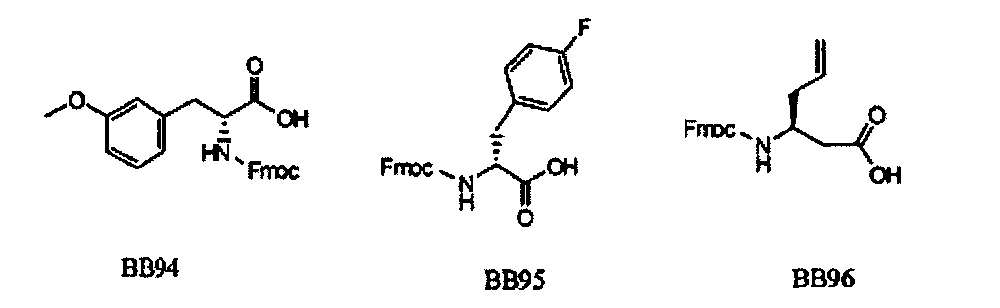

















1X буферный раствор для лигазы: 50 мМ Трис, pH 7,5, 10 мМ дитиотриит, 10 мМ MgCl2, 50 мМ NaCl.
10Х буферный раствор для лигазы: 500 мМ Трис, pH 7,5, 100 мМ дитиотриит, 100 мМ MgCl2, 20 мМ АТР, 500 мМ NaCl.
Присоединение водорастворимого спейсера к соединению 2
В раствор соединения 2 (60 мл, 1 мМ) в буферном растворе, содержащем борат натрия (150 мМ, pH 9,4), охлажденном до 4°C, добавляют 40 экв. N-Fmoc-15-амино-4,7,10,13-тетраоксаоктадекановой кислоты (S-Ado) в N,N-диметилформамиде (ДМФА, 16 мл, 0,15 М) и 40 экв. гидрата хлорида 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния (DMTMM) в воде (9,6 мл, 0,25 М). Смесь осторожно встряхивают в течение 2 ч при 4°C, затем добавляют еще 40 экв. S-Ado и DMTMM, смесь встряхивают в течение 16 ч при 4°C.
После ацилирования добавляют 0,1Х объемов 5 М водного раствора NaCl и 2,5Х объемов охлажденного (-20°C) этанола и смесь выдерживают при -20°C в течение по крайней мере в течение 1 ч. Затем смесь центрифугируют в течение 15 мин при 14000 об/мин при 4°C, при этом получают осадок белого цвета, который промывают охлажденным EtOH и затем подвергают лиофильной сушке при комнатной температуре в течение 30 мин. Твердое вещество растворяют в 40 мл воды и очищают обращенно-фазовой ВЭЖХ на колонке Waters Xterra RP18 (элюент: градиент двухфазной подвижной фазы - 50 мМ водный буферный раствор, содержащий ацетат триэтиламмония, при pH 7,5 и раствор 99% ацетонитрил/1% вода. Очищенный материал концентрируют лиофильно и полученный остаток растворяют в 5 мл воды. К раствору добавляют ОДХ объем пиперидина и смесь осторожно встряхивают в течение 45 мин при комнатной температуре. Продукт очищают осаждением из этанола, как описано выше, и выделяют центрифугированием. Полученный осадок дважды промывают охлажденным EtOH и подвергают лиофильной сушке, и в результате получают очищенное соединение 3.
Цикл 1
В каждую лунку 96-луночного планшета добавляют по 12,5 мкл 4 мМ раствора соединения 3 в воде, 100 мкл 1 мМ раствора одного из олигонуклеотидов 1.1-1.96, как показано в таблице 3 (молярное соотношение соединения 3 к олигонуклеотиду составляет 1:2). Планшеты нагревают при 95°C в течение 1 мин и затем охлаждают до 16°C в течение 10 мин. В каждую лунку добавляют 10 мкл буферного раствора 10Х для лигазы, 30 единиц ДНК Т4 лигазы (1 мкл раствора 30 ед/мкл раствор, фирмы FermentasLife Science, номер по каталогу EL0013), 76,5 мкл воды, и полученный раствор инкубируют в течение 16 ч при 16°C.
После реакции лигирования в каждую лунку добавляют 20 мкл 5 M водного раствора NaCl, 500 мкл охлажденного (-20°C) этанола, и выдерживают при -20°C в течение 1 ч. Планшеты центрифугируют в течение 1 ч при 3200 g на центрифуге устройства Beckman Coulter Allegra 6R с использованием Beckman Microplus Carriers. Супернатант осторожно удаляют при переворачивании планшета и осадок промывают 70% водным раствором этанола при -20°C. Каждую порцию осадка растворяют в буферном растворе, содержащем борат натрия (50 мкл, 150 мМ, pH 9,4), при этом получают раствор с концентрацией 1 мМ, который охлаждают до 4°C.
В каждый раствор добавляют по 40 экв. одного из 96 предшественников структурных элементов в ДМФА (13 мкл, 0,15 мМ), 40 экв. DMTMM в воде (8 мкл, 0,25 М) и раствор осторожно встряхивают при 4°C. Через 2 ч добавляют еще 40 экв. одного из предшественников структурных элементов и DMTMM, полученные растворы осторожно встряхивают в течение 16 ч при 4°C. После ацилирования в каждый раствор добавляют 10 экв. N-гидроксисукцинимидного эфира уксусной кислоты в ДМФА (2 мкл, 0,25 М) и смесь осторожно встряхивают в течение 10 мин.
После ацилирования 96 реакционных смесей объединяют и добавляют 0,1 объем 5 M водного раствора NaCl и 2,5 объемов охлажденного абсолютизированного этанола, смесь выдерживают при -20°C в течение по крайней мере 1 ч. Затем смесь центрифугируют. После центрифугирования удаляют максимально возможное количество супернатанта с использованием микродозатора, при этом получают осадок, который промывают охлажденным этанолом и снова центрифугируют. Супернатант удаляют с использованием дозатора объемом 200 мкл. В пробирку добавляют 70% охлажденный этанол и полученную смесь центрифугируют в течение 5 мин при 4°C. Супернатант удаляют и оставшийся этанол удаляют лиофильно при комнатной температуре в течение 10 мин. Затем осадок растворяют в 2 мл воды и очищают обращенно-фазовой ВЭЖХ на колонке Waters Xterra RP18 (элюент: градиент двухфазной подвижной фазы - 50 мМ водный буферный раствор, содержащий ацетат триэтиламмония, при pH 7,5 и раствор 99% ацетонитрил/1% вода. Фракции, содержащие библиотеку, собирают, объединяют и лиофилизируют. Полученный остаток растворяют в 2,5 мл воды и добавляют 250 мкл пиперидина. Раствор осторожно встряхивают в течение 45 мин и затем осаждают этанолом, как описано выше. Полученный осадок подвергают лиофильной сушке и затем растворяют в буферном растворе, содержащем борат натрия (4,8 мл, 150 мМ, pH 9,4), при этом получают раствор при концентрации 1 мМ.
Раствор охлаждают до 4°C и добавляют по 40 экв. N-Fmoc-пропаргилглицина в ДМФА (1,2 мл, 0,15 М) и DMT-MM в воде (7,7 мл, 0,25 М). Смесь осторожно встряхивают в течение 2 ч при 4°C и затем добавляют еще по 40 экв. N-Fmoc-пропаргилглицина и DMT-MM, раствор встряхивают в течение еще 16 ч. Затем смесь очищают осаждением из EtOH и обращено-фазовой ВЭЖХ, как описано выше, и группу N-Fmoc удаляют обработкой пиперидином, как описано выше. После окончательной очистки осаждением из EtOH полученный осадок подвергают лиофильной сушке и используют на следующей стадии.
Циклы 2-4
Для каждого из таких циклов сухой осадок, полученный в предыдущем цикле, растворяют в воде и концентрацию библиотеки определяют спектрофотометрически с использованием коэффициента экстинкции компонента ДНК, входящего в состав библиотеки, при этом исходный коэффициент экстинкции соединения 2 составляет 131500 л/(моль·см). Концентрацию библиотеки доводят водой таким образом, чтобы конечная концентрация в реакционной среде для лигирования составляла 0,25 мМ. Затем библиотеку делят на 96 равных аликвотных частей в 96-луночном планшете. В каждую лунку добавляют раствор, включающий различные олигонуклеотиды (молярное соотношение компонента библиотеки к олигонуклеотиду составляет 1:2), и проводят лигирование, как описано в цикле 1. Олигонуклеотиды, использованные в циклах 2, 3 и 4, описаны в таблицах 4, 5 и 6, соответственно. Соответствие между олигонуклеотидными метками и предшественниками структурных элементов для циклов 1-4 показано в таблице 7. Библиотеку осаждают при добавлении этанола, как описано выше в цикле 1, и растворяют в буферном растворе, содержащем борат натрия (150 мМ, pH 9,4), при этом получают раствор с концентрацией 1 мМ. Последующие ацилирование и очистку проводят, как описано в цикле 1, за исключением очистки ВЭЖХ, исключенной из цикла 3.
Продукты, полученные в цикле 4, лигируют завершающим праймером, показанным ниже, с использованием метода, описанного выше для лигирования олигонуклеотидов.

Результаты
В результате синтеза, описанного выше, получают библиотеку, включающую 964 (приблизительно 108) различных структур. Ход синтеза библиотеки контролируют методами гель-электрофореза и ЖХ/МС продукта, полученного в каждом цикле. После завершения синтеза библиотеку анализируют с использованием различных методов. На фиг. 13A показана хроматограмма библиотеки, полученная после цикла 4, но перед лигированием заключительным праймером, на фиг. 13B показан масс-спектр библиотеки на той же стадии синтеза. Среднюю молекулярную массу определяют методом ЖХ/МС (отрицательные ионы). Ионные сигналы обрабатывают с использованием программного обеспечения ProMass. Полученный результат соответствует предсказанной величине средней массы библиотеки. Компонент ДНК в составе библиотеки анализируют методом электрофореза в агарозе, который свидетельствует о том, что основная часть материала библиотеки соответствует лигированому продукту соответствующего размера. Анализ последовательности молекулярных клонов ДНК, продуктов ПЦР, полученных с использованием образцов библиотеки, показывает, что лигирование ДНК проходит с высокой точностью и практически полностью завершено.
Циклизация библиотеки
После завершения цикла 4 в части библиотеки N-концевой остаток блокируют с использованием азидоуксусной кислоты в стандартных условиях ацилирования. После очистки осаждением из EtOH продукт растворяют в буферном растворе, содержащем фосфат натрия (150 мМ, pH 8), при этом получают концентрацию 1 мМ, и в полученный раствор добавляют 4 экв. CuSO4 в воде (200 мМ), аскорбиновой кислоты в воде (200 мМ) и раствор соединения, показанного ниже, в ДМФА (200 мМ). Реакционную смесь осторожно встряхивают в течение 2 ч при комнатной температуре.

Для оценки степени циклизации 5 мкл аликвотной части реакционной смеси, полученной после циклизации библиотеки, удаляют и обрабатывают флуоресцентно-меченным азидом или алкином (1 мкл 100 мМ раствора в ДМФА), полученного, как описано в примере 4. Через 16 ч по данным ВЭЖХ при 500 нм показано, что ни азидная, ни алкиновая метки не включаются в состав библиотеки, что свидетельствует о том, что библиотека уже не содержит азидных или алкиновых групп, способных к циклоприсоединению, и следовательно члены библиотеки будут взаимодействовать друг с другом за счет реакций циклизации или межмолекулярных реакций. Циклизованную библиотеку очищают обращенно-фазовой ВЭЖХ, как описано выше. Контрольные эксперименты с использованием нециклизованной библиотеки показывают полное включение флуоресцентных меток, упомянутых выше.
Пример 4. Получение флуоресцентных меток для анализа методом циклизации
В отдельных пробирках пропаргилглицин или 2-амино-3-фенилпропилазид (по 8 мкмоль каждого) смешивают с FAM-OSu (Molecular Probes Inc., 1,2 экв.) в боратном буферном растворе при pH 9,4 (250 мкл). Реакционную смесь выдерживают при комнатной температуре в течение 3 ч и затем лиофилизируют в течение ночи. После очистки на ВЭЖХ получают требуемый флуоресцентный алкин или азид с количественным выходом.
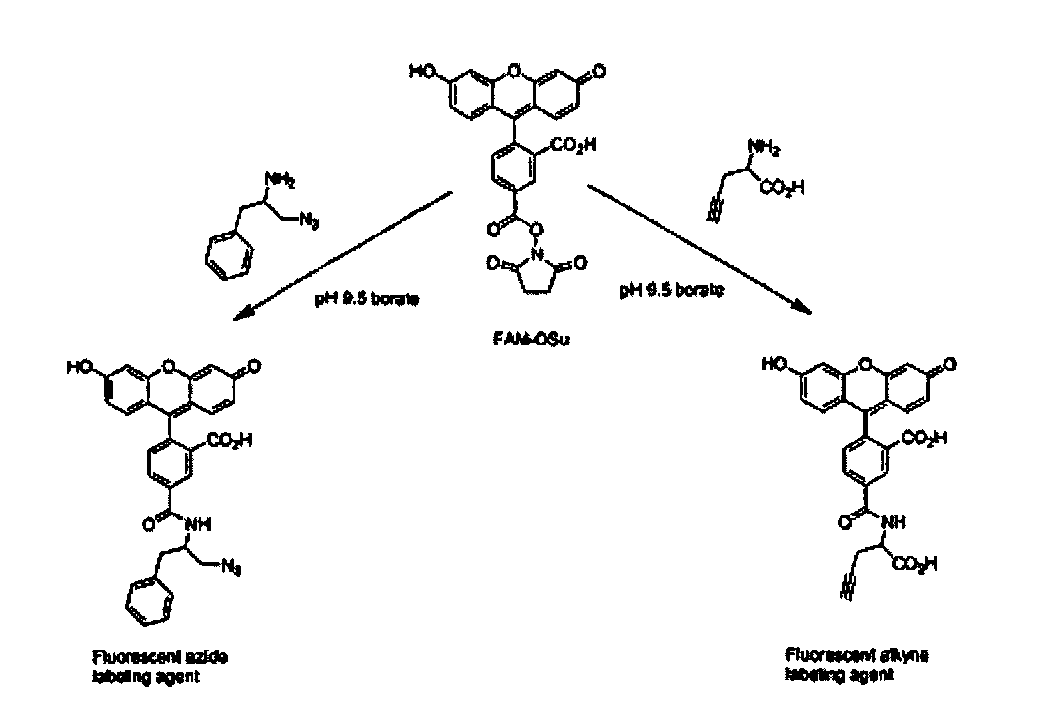
Пример 5. Циклизация индивидуальных соединений с использованием реакции циклоприсоединения азид/алкин
Получение азидоацетил-Gly-Pro-Phe-Pra-NH2:
Указанную последовательность синтезируют с использованием 0,3 ммоль амидной смолы Rink в стандартных условиях твердофазного синтеза с использованием Fmoc-защищенных аминокислот и HATU в качестве активирующего агента (Pra означает C-пропаргилглицин). Азидоуксусную кислоту используют для введения защитной группы в тетрапептид. Пептид отщепляют от смолы при обработке 20% ТФУ/ДХМ в течение 4 ч. После очистки ОФ-ВЭЖХ получают продукт в виде твердого вещества белого цвета (75 мг, 515).1Н (ДМСО-d6, 400 МГц): 8,4-7,8 (m, 3H), 7,4-7,1 (m, 7H), 4,6-4,4 (m, 1H), 4,4-4,2 (m, 2H), 4,0-3,9 (m, 2H), 3,74 (dd, 1H, J=6 Гц, 17 Гц), 3,5-3,3 (m, 2H), 3,07 (dt, 1H, J=5 Гц, 14 Гц), 2,92 (dd, 1H, J=5 Гц, 16 Гц), 2,86 (t, 1H, J=2 Гц), 2,85-2,75 (m, 1H), 2,6-2,4 (m, 2H), 2,2-1,6 (m, 4H). ИК (mull) 2900, 2100, 1450, 1300 см-1. МС (ESI): 497,4 ([M+H], 100%), 993,4 ([2M+H], 50%). МС (ESI): (источник ионной фрагментации): 519,3 ([M+Na], 100%), 491,3 (100%), 480,1 ([M-NH2], 90%), 452,2 ([M-NH2-CO], 20%), 424,2 (20%), 385,1 ([M-Pra], 50%), 357,1 ([M-Pra-CO], 40%), 238,0 ([M-Pra-Phe], 100%).
Циклизация азидоацетил-Gly-Pro-Phe-Pra-NH2:

Азидоацилпептид (31 мг, 0,62 ммоль) растворяют в MeCN (30 мл). Затем добавляют диизопропилэтиламин (DIEA, 1 мл) и Cu(MeCN)4PF6 (1 мг). После перемешивания в течение 1,5 ч раствор упаривают и полученный остаток обрабатывают 20% MeCN/H2O. После центрифугирования для удаления нерастворимых солей раствор очищают обращенно-фазовой ВЭЖХ. Требуемый циклический пептид выделяют в виде твердого вещества белого цвета (10 мг, 32%).1Н (ДМСО-d6, 400 МГц): 8,28 (t, 1H, J=5 Гц), 7,77 (s, 1H), 7,2-6,9 (m, 9H), 4,98 (m, 2H), 4,48 (m, 1H), 4,28 (m, 1H), 4,1-3,9 (m, 2H), 3,63 (dd, 1H, J=5 Гц, 16 Гц), 3,33 (m, 2H), 3,0 (m, 3H), 2,48 (dd, 1H, J=11 Гц, 14 Гц), 1,75 (m, 1H), 1,55 (m, 1H), 1,32 (m, 1H), 1,05 (m, 1H). ИК (mull) 2900, 1475, 1400 см-1. МС (ESI): 497,2 ([М+Н], 100%), 993,2 ([2М+Н], 30%), 1015,2 ([2M+Na], 15%). МС (ESI) (источник ионной фрагментации): 535,2 (70%), 519,3 ([M+Na], 100%), 497,2 ([М+Н], 80%), 480,1 ([M-NH2], 30%), 452,2 ([M-NH2-CO], 40%), 208,1 (60%).
Получение азидоацетил-Gly-Pro-Phe-Pra-Gly-OH:
С использованием 0,3 ммоль смолы Glycine-Wang указанную последовательность синтезируют в стандартных условиях твердофазного синтеза с использованием Fmoc-защищенных аминокислот и HATU в качестве активирующего агента. Азидоуксусную кислоту используют на последней стадии конденсации в качестве защитной группы для пентапептида. Пептид отщепляют от смолы при обработке 50% ТФУ/ДХМ в течение 2 ч. После очистки ОФ-ВЭЖХ получают продукт в виде твердого вещества белого цвета (83 мг, 50%).1Н ЯМР (ДМСО-d6, 400 МГц): 8,4-7,9 (m, 4Н), 7,2 (m, 5H), 4,7-4,2 (m, 3H), 4,0-3,7 (m, 4H), 3,5-3,3 (m, 2H), 3,1 (m, 1H), 2,91 (dd, 1H, J=4 Гц, 16 Гц), 2,84 (t, 1H, J=2,5 Гц), 2,78 (m, 1H), 2,6-2,4 (m, 2H), 2,2-1,6 (m, 4H). ИК (mull) 2900, 2100, 1450, 1300 см-1. МС (ESI): 555,3 ([М+Н], 100%). МС (ESI) (источник ионной фрагментации): 577,1 ([M+Na], 90%), 555,3 (80%), 480,1 ([M-Gly], 100%), 385,1 ([M-Gly-Pra], 70%), 357,1 ([M-Gly-Pra-CO], 40%), 238,0 ([M-Gly-Pra-Phe], 80%).
Циклизация азидоацетил-Gly-Pro-Phe-Pra-Gly-OH:
Пептид (32 мг, 0,058 ммоль) растворяют в MeCN (60 мл). Затем добавляют диизопропилэтиламин (1 мл) и Cu(MeCN)4PF6 (1 мг) и раствор перемешивают в течение 2 ч. Растворитель упаривают и полученный неочищенный продукт очищают ОФ-ВЭЖХ для удаления димеров и тримеров. Циклический мономер выделяют в виде бесцветного стеклообразного вещества (6 мг, 20%). МС (ES1): 555,6 ([М+Н], 100%), 1109,3 ([2М+Н], 20%), 1131,2 ([2M+Na], 15%). МС (ESI) (источник ионной фрагментации) 555,3 ([М+Н], 100%), 480,4 ([M-Gly], 30%), 452,2 ([M-Gly-CO], 25%), 424,5 ([M-Gly-CO], 10%, наблюдается только в циклической структуре).
Конъюгация линейного пептида с ДНК:
Соединение 2 (20 нмоль) растворяют в 45 мкл боратного буферного раствора (pH 9,4, 150 мМ). При 4°C добавляют линейный пептид (18 мкл 100 мМ исходного раствора в ДМФА, 180 нмоль, 40 экв.), DMT-MM (3,6 мкл 500 мМ исходного раствора в воде, 180 нмоль, 40 экв.). После встряхивания в течение 2 ч по данным МСЖХ реакция завершена и продукт выделяют осаждением из этанола. МС (ESI): 1823,0 ([M-3H]/3, 20%), 1367,2 ([M-4H]/4, 20%), 1093,7 ([M-5H]/5, 40%), 911,4 ([M-6H)/6, 100%).
Конъюгация циклического пептида с ДНК:
Соединение 2 (20 нмоль) растворяют в 20 мкл боратного буферного раствора (pH 9,4, 150 мМ). При 4°C добавляют линейный пептид (8 мкл 100 мМ исходного раствора в ДМФА, 80 нмоль, 40 экв.), DMT-MM (1,6 мкл 500 мМ исходного раствора в воде, 80 ммоль, 40 экв.). После встряхивания в течение 2 ч по данным МС-ЖХ реакция завершена и продукт выделяют осаждением из этанола. МС (ESI) 1823,0 ([M-3H]/3, 20%), 1367,2 ([M-4H]/4, 20%), 1093,7 ([M-5H]/5, 40%), 911,4 ([M-6H)/6, 100%).
Циклизация пептида, связанного с ДНК:
Конъюгат линейный пептид-ДНК (10 нмоль) растворяют в натрий-фосфатном буферном растворе, pH 8 (10 мкл, 150 ммоль). При комнатной температуре добавляют по 4 экв. CuSO4, аскорбиновой кислоты и лиганда Sharpless (по 0,2 мкл 200 мМ исходных растворов). Реакционную смесь выдерживают в течение ночи. По данным ОФ-ВЭЖХ линейный пептид-ДНК в смеси отсутствует, и продукт элюируется одновременно с контрольным циклическим пептидом-ДНК. Присутствие следовых количеств димеров или других олигомеров не наблюдается.
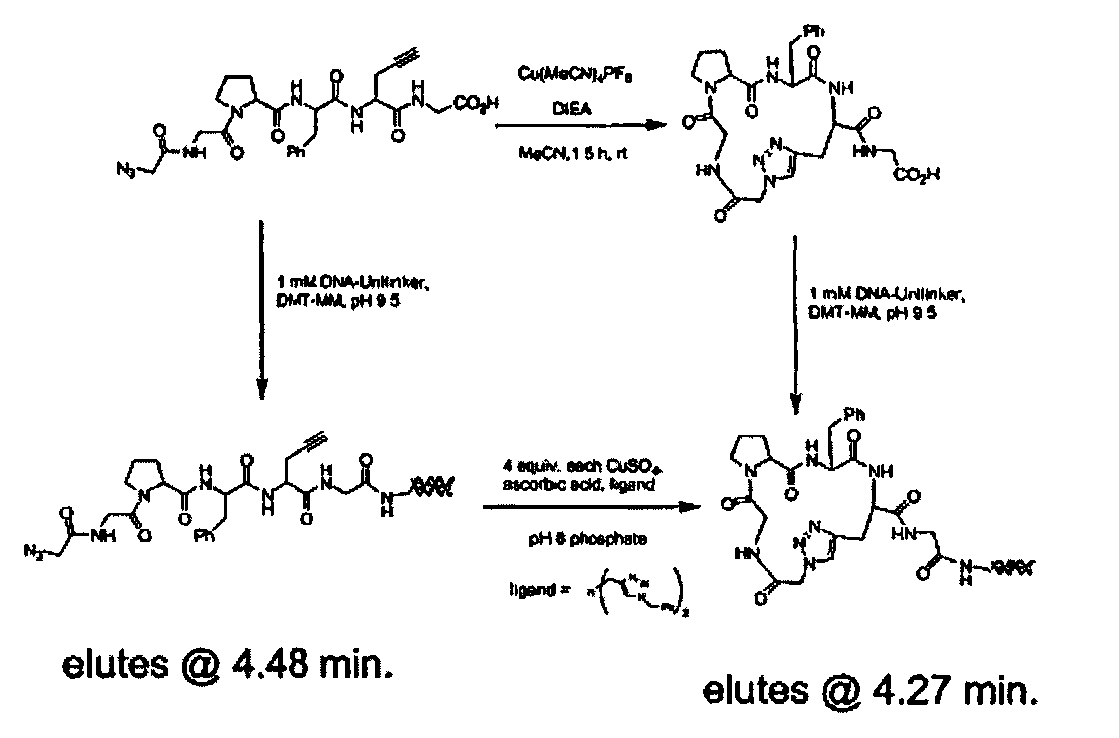
Условия проведения ЖХ: колонка Targa C18, 2,1÷40 мм, 10-40%
MeCN в 40 мМ водном растворе ТЕАА в течение 8 мин.
Пример 6. Применение реакции ароматического нуклеофильного замещения для синтеза функционального фрагмента
Общая методика арилирования соединения 3 цианурхлоридом: Соединение 2 растворяют в боратном буферном растворе, pH 9,4, при этом получают раствор при концентрации 1 мМ. Раствор охлаждают до 4°C и затем добавляют 20 экв. цианурхлорида в виде 500 мМ раствора в MeCN. Через 2 ч по данным МС-ЖХ реакция завершена и полученный конъюгат дихлортриазин-ДНК выделяют осаждением этанолом.
Методика аминозамещения конъюгата дихлортриазин-ДНК:
Конъюгат дихлортриазин-ДНК растворяют в боратном буфере, pH 9,5, при этом получают раствор при концентрации 1 мМ. Затем при комнатной температуре добавляют 40 экв. алифатического амина в виде раствора в ДМФА. Ход реакции контролируют методом МС-ЖХ и через 2 ч реакция завершена. Полученный конъюгат алкиламиномонохлортриазин-ДНК выделяют осаждением этанолом.
Методика аминозамещения конъюгата монохлортриазин-ДНК:
Конъюгат алкиламиномонохлортриазин-ДНК растворяют в боратном буферном растворе, pH 9,5, при этом получают раствор при концентрации 1 мМ. Затем при 42°С добавляют 40 экв. второго алифатического амина в виде раствора в ДМФА. Ход реакции контролируют методом МС-ЖХ и через 2 ч реакция завершена. Полученный конъюгат диаминотриазин-ДНК выделяют осаждением этанолом.
Пример 7. Применение реакции восстановительного аминирования для синтеза функционального фрагмента
Общая методика восстановительного аминирования ДНК-линкера (ДНК-связующего фрагмента), содержащего вторичный амин, с использованием альдегидного структурного элемента:
Соединение 2 конденсируют с N-концевым остатком пролина остатком. Полученное соединение растворяют в боратном буферном растворе (50 мкл, 150 мМ, pH 9,5), при этом получают раствор с концентрацией 1 мМ. К полученному раствору добавляют по 40 экв. альдегидного структурного элемента в ДМФА (8 мкл, 0,25 M) и цианоборгидрида натрия в ДМФА (8 мкл, 0,25 M), раствор нагревают при 80°C в течение 2 ч. После алкилирования раствор очищают осаждением этанолом. Общая методика восстановительного аминирования комплекса ДНК-линкера, содержащего альдегид, с использованием аминоструктурных элементов:
Соединение 2, конденсированное со структурным элементом, содержащим альдегидную группу, растворяют в боратном буферном растворе (50 мкл, 250 мМ, pH 5,5), при этом получают раствор при концентрации 1 мМ. К полученному раствору добавляют по 40 экв. аминоструктурного элемента в ДМФА (8 мкл, 0,25 M) и цианоборгидрида натрия в ДМФА (8 мкл, 0,25 M), раствор нагревают при 80°C в течение 2 ч. После алкилирования раствор очищают осаждением этанолом.
Пример 8. Применение синтеза пептоидных структурных элементов для получения функционального фрагмента
Общая методика синтеза пептоида с использованием комплекса ДНК-линкера:

Соединение 2 растворяют в боратном буферном растворе (50 мкл, 150 мМ, pH 9,4), при этом получают раствор при концентрации 1 мМ, который охлаждают до 4°C. К полученному раствору добавляют 40 экв. N-гидроксисукцинимидилбромацетата в ДМФА (13 мкл, 0,15 М) и раствор осторожно встряхивают при 4°C в течение 2 ч. После ацилирования ДНК-линкер очищают осаждением этанолом и повторно растворяют в боратном буферном растворе (50 мкл, 150 мМ, pH 9,4), при этом получают раствор при концентрации 1 мМ, который охлаждают до 4°C. К полученному раствору добавляют 40 экв. аминоструктурного элемента в ДМФА (13 мкл, 0,15 M) и раствор осторожно встряхивают при 4°C в течение 16 ч. После алкилирования остаток ДНК-линкер очищают осаждением этанолом и повторно растворяют в боратном буферном растворе (50 мкл, 150 мМ, pH 9,4), при этом получают раствор при концентрации 1 мМ, который охлаждают до 4°C. Синтез пептоида продолжают постадийно при добавлении N-гидроксисукцинимидил-бромацетата с последующим добавлением аминоструктурного элемента.
Пример 9. Применение реакции циклоприсоединения азид-алкин для синтеза функционального фрагмента
Общая методика
Алкин-содержащий конъюгат ДНК растворяют в боратном буферном растворе, pH 8,0, при этом получают раствор при концентрации приблизительно 1 мМ. К полученной смеси добавляют 10 экв. органического азида и по 5 экв. сульфата меди(II), аскорбиновой кислоты и лиганда (трис-((1-бензилтриазол-4-ил)метил)амин) при комнатной температуре. Ход реакции контролируют методом ЖХ-МС и через 1-2 ч реакция завершена. Полученный конъюгат триазол-ДНК выделяют осаждением этанолом.
Пример 10. Идентификация лиганда киназы Abl в составе кодирующей библиотеки
Возможность повышать содержание требуемых молекул в ДНК-кодированной библиотеке по сравнению с нежелательными членами библиотеки является первостепенной при идентификации отдельных соединений с определенными свойствами в отношении исследуемых терапевтических мишеней. Для демонстрации такой возможности обогащения синтезируют известную молекулу (как описано в статье Shah et al., Science 305, 399-401 (2004), включенной в настоящее описание в качестве ссылки), способную связываться с киназой rhAbl (GenBank U07563). Данное соединение присоединяют к двухцепочечному олигонуклеотиду через линкер (связующий фрагмент), как описано в предыдущих примерах, с использованием стандартных методик, при этом получают молекулу (функциональный фрагмент, соединенный с олигонуклеотидом), аналогичную соединениям, которые получают по методике, описанной в примерах 1 и 2. Библиотека, которую в основном получают, как описано в примере 2, и соединенный с ДНК участок связывания с киназой Abl сконструированы из уникальных последовательностей ДНК, которые позволяют провести количественный ПЦР анализ для обоих образцов. Соединенный с ДНК участок связывания с киназой Abl смешивают с библиотекой в соотношении 1:1000. Полученную смесь уравновешивают в присутствии киназы rhAble, и фермент сорбируют на твердой фазе, промывают для удаления несвязанных членов библиотеки и элюируют связывающимися молекулами. Соотношение молекул библиотеки и связанного с ДНК ингибитора киназы Abl в элюате составляет 1:1, что означает обогащение по соединенному с ДНК связывающегося с киназой Abl участка в более 500 раз и в 1000-кратном избытке по отношению к молекулам библиотеки.
Эквиваленты. Специалисты в данной области техники могут выявить с использованием стандартных методик множество эквивалентов специфических вариантов воплощения настоящего изобретения, описанных в данном контексте. Такие эквиваленты определены в следующих пунктах формулы настоящего изобретения.
Реферат
Группа изобретений относится к области биохимии. Предложены соединение и варианты библиотеки соединений для идентификации обладающих требуемыми свойствами соединений. Соединение имеет формулугде каждый из n, m и р независимо имеет значение от 1 до 20; X представляет собой функциональный фрагмент, содержащий один или более структурных элементов; Z представляет собой олигонуклеотид, присоединенный по своему 3'-концу к фосфатной группе; Y представляет собой олигонуклеотид, присоединенный по своему 5'-концу к фосфатной группе. Также предложена библиотека для идентификации обладающих требуемыми свойствами соединений, содержащая множество соединений указанной формулы. В другом варианте библиотека содержит по меньшей мере 10отличающихся указанных соединений, которые содержат функционально связанный с олигонуклеотидом функциональный фрагмент, состоящий из двух или более структурных элементов. 3 н. и 10 з.п. ф-лы, 13 ил., 7 табл., 10 пр.
Формула

содержащее связующий фрагмент формулы:
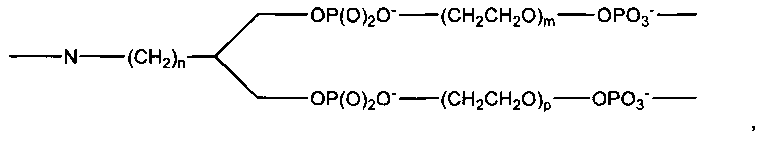
где каждый из n, m и р независимо представляет собой целое число от 1 до примерно 20, где:
X представляет собой функциональный фрагмент, содержащий один или более структурных элементов;
Z представляет собой олигонуклеотид, присоединенный по своему 3'-концу к фосфатной группе;
Y представляет собой олигонуклеотид, присоединенный по своему 5'-концу к фосфатной группе.

содержат связующий фрагмент формулы

где каждый из n, m и р независимо представляет собой целое число от 1 до примерно 20, где:
X представляет собой функциональный фрагмент, содержащий один или более структурных элементов;
Z представляет собой олигонуклеотид, присоединенный по своему 3'-концу к фосфатной группе;
Y представляет собой олигонуклеотид, присоединенный по своему 5'-концу к фосфатной группе.


Комментарии