Противоопухолевая композиция на основе гиалуроновой кислоты и неорганических наночастиц, способ ее получения и ее применение - RU2686679C2
Код документа: RU2686679C2
Чертежи























Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к композиции на основе гиалуроновой кислоты, которая может быть использована для лечения опухолевых заболеваний. Композиция включает в себя полимерные наномицеллы, содержащие гидрофобизированное производное гиалуроновой кислоты или ее фармацевтически приемлемой соли и наночастицы, стабилизированные с помощью олеиновой кислоты, предпочтительно суперпарамагнитные наночастицы железа, наночастицы цинка или апконвертирующие (способные к преобразованию энергии с повышением частоты) наночастицы.
Уровень техники
При лечении опухолевых заболеваний наиболее часто используется химиотерапия, когда пациенту вводят внутривенно или перорально лекарственные вещества, которые распределяются с кровотоком по всему организму. Противоопухолевые вещества, однако, обладают высокой токсичностью не только по отношению к опухолевым клеткам, но также и по отношению к здоровым клеткам. Следствием системного (с общим кровотоком) распределения является токсическое воздействие противоопухолевых терапевтических средств не только в областях с опухолевым заболеванием, но и в областях здоровых тканей и клеток. Кроме того, неселективное распределение препарата уменьшает количество лекарственного вещества, которое, в конечном итоге, достигает опухолевых клеток, таким образом уменьшая эффективность терапии.
Из-за вышеупомянутых фактов, существует огромный интерес к поиску подходящей стратегии, которая позволила бы повысить химиотерапевтическую эффективность, направленную против опухолевых клеток, и в то же время подавлять нежелательную системную токсичность терапевтических средств. Выяснилось, что нежелательные побочные эффекты лекарственных веществ подавляются в большей степени, иногда даже полностью устраняются, если лекарственный препарат вводится в матрикс систем-носителей. Поэтому задачей исследования часто является нацеливание (таргетинг) таких систем-носителей на опухолевые клетки.
В настоящее время существуют две наиболее распространенные стратегии, используемые для нацеливания. Одна из них основана на так называемом пассивном нацеливании, когда используется характерные для опухолевых тканей повышенная проницаемость и способность к удерживанию (так называемый EPR-эффект (enhanced permeability and retention)) (Maeda, 2001). В отличие от здоровых тканей, опухолевые ткани характеризуются перфорированными капиллярами с повышенной проницаемостью, благодаря чему молекулы нанометрового размера могут попадать из крови в опухоль. Однако, пассивное нацеливание, помимо других факторов, лимитируется малоэффективным и неспецифическим захватом опухолевыми клетками систем-носителей с лекарственным веществом (Duncan & Gaspar, 2011; El-Dakdouki, Pure & Huang, 2013). Тем не менее, если система-носитель имеет размер, подходящий для пассивного нацеливания, такой способ нацеливания может обеспечивать повышенный противоопухолевый эффект данного терапевтического средства по отношению к опухолевым клеткам за счет других свойств носителя. Например, в патентной заявке WO 2008/130121 заявлен селективный по отношению к опухолевым клеткам и биологически разлагаемый конъюгат циклофосфазена-платины (II), который образует полимерные мицеллы в водных растворах и, по сравнению с аналогичными конъюгатами US 2001/6333422, проявляет повышенную селективность в пассивном нацеливании на опухолевые ткани. Повышенная селективность по отношению к опухолевым клеткам при пассивном нацеливании также упоминается в заявке на патент WO 2013/188727, которая раскрывает биоразлагаемые пегилированные наночастицы, содержащие конъюгат лекарственного вещества (SN-38, PI-103, этопозид, фенретинид) с ретиноатом или его изомером, связанный через быстро расщепляемую сложноэфирную связь с фенольной группой. В обоих случаях повышенная селективность была обнаружена на основе анализа экспериментальных данных в сравнении с аналогичными системами.
Другой способ усиления эффективности нацеливания и, следовательно, селективности действия лекарственного препарата связан с возможностью модификации терапевтических средств лигандами, имеющими высокое сродство к рецепторам, локализованным на поверхности опухолевых клеток (Duncan & Gaspar, 2011; Ruoslahti, Bhatia & Sailor, 2010). Такая вторая стратегия, которая известна как активное нацеливание, должна обеспечивать селективное перераспределение терапевтического средства в опухолевые клетки. Примером может служить, например, решение, раскрытое в US 2007/0155807, где заявлены производные карбоновых кислот тиазолидинон-амидов и тиазолидинин-амидов, для которых было обнаружено селективное поведение по отношению к клеткам меланомы, проявляющим повышенную экспрессию LPL-рецепторов. Недостатком данного и подобных решений является то, что LPL-рецепторы также экспрессируются в здоровых клетках, например, в кардиомиоцитах, что может привести к их селективному взаимодействию также и в здоровой ткани. Еще одним недостатком данного и других аналогичных решений (например, WO 2012/173677, US 2013/02742200) является тот факт, что экспрессия рецепторов опухолевых клеток варьируется как только во времени, так и при сравнении различных больных (Duncan & Gaspar, 2011). Селективный лиганд связывания, предназначенный для активного нацеливания, может тогда оказывать воздействие только на клетки в определенной стадии опухолевого заболевания или только у некоторых из пациентов.
Другая возможность активного нацеливания заключается в нацеливании систем-носителей с помощью внешнего магнитного поля, в тех случаях, когда такие системы включают в себя либо ковалентно, либо нековалентно связанные магнитные наночастицы. В упомянутом случае предпочтительно могут быть использованы суперпарамагнитные наночастицы (superparamagnetic nanoparticles (SPION)). Чаще всего, они представляют собой наночастицы Fе3O4, которые считаются инертным контрастным веществом для магнитно-резонансной томографии (МРТ) без какой-либо им предназначенной фармакологической функции (Huang et al., 2013). До сих пор для наночастиц SPION не сообщалось о краткосрочной или долгосрочной токсичности после их интернализации в клетке (Huang et al., 2013). Помимо контрастного вещества для МРТ и магнитного нацеливания, SPION могут быть использованы в качестве носителей в сочетании с цитостатиками или другими лекарственными веществами. Другим предпочтительным применением является магнитожидкостная гипертермия, когда SPION поглощают энергию переменного магнитного поля и превращают ее в тепло. Таким образом, можно избирательно увеличивать температуру в зоне, где локализованы SPION. Если SPION локализуются в области опухоли, можно уничтожать раковые клетки с помощью повышенной температуры, так как они более чувствительны к температуре, чем здоровые клетки (Laurent, Dutz, Hafeli & Mahmoudi, 2011).
В сочетании с пассивным или активным нацеливанием, несколько отличительных свойств опухолевых клеток, по сравнению со здоровыми клетками, используются для того, чтобы повысить селективность терапевтического средства (Fleige, Quadir & Haag, 2012). Данные свойства включают в себя, например, более кислое значение pH или повышенный уровень активных форм кислорода (reactive forms of oxygen (ROS)). Патентная заявка US 2013/0230542 раскрывает терапевтические компоненты (производные фенола), которые активируются в среде, где присутствуют ROS, и, следовательно, они должны действовать избирательно в опухолевых клетках, имеющих повышенный уровень ROS. Недостатком упомянутого решения является тот факт, что повышенный уровень ROS наблюдается также в некоторых здоровых клетках. Примерами являются макрофаги, где высокий уровень ROS позволяет устранять патогенные микроорганизмы в фагосомах. Повышенный уровень ROS служит также в других клетках в качестве естественного механизма защиты против гипоксии, а также в качестве сигнальных молекул, влияющих на ряд физиологических функций.
Из литературных данных известны также противоопухолевые композиции, которые перспективны тем, что in vitro они оказывают противоопухолевое действие на некоторые виды опухолевых клеток. Примером может служить композиция, раскрытая в US 2005/0255173, содержащая от одного до трех компонентов, выбранных из следующей группы: лимонная кислота, цинк и альбумин. Упомянутая композиция была более цитотоксичной in vitro против человеческих клеточных линий, полученных из аденокарциномы NIH: OV-CAR-3 и SKOV-3, по сравнению с контрольными клетками WI38 (нормальные фибробласты легкого человека). Недостатком упомянутой композиции является тот факт, что ее противоопухолевое действие зависит от уровня концентрации отдельных компонентов (US 2005/0255173). Поскольку компоненты являются природными для организма, на эффект заявленной композиции может повлиять локальная концентрация отдельных веществ в данном месте введения (например, высокая концентрация альбумина в крови).
Приведенные литературные данные показывают, что исследования противоопухолевых терапевтических средств ведутся во всем мире. Тем не менее, успех клинического применения предлагаемых решений по-прежнему является проблематичным, особенно в связи с тем, что большинство решений включают органические полимеры, которые не являются биологически деградируемыми и не имеют достаточной селективности по отношению к опухолевым клеткам. Поэтому, по-прежнему, существует заинтересованность в поиске новых композиций, обладающих избирательными воздействиями на опухолевые клетки.
Объект изобретения
Объектом настоящего изобретения являются гиалуронановые наномицеллы в сочетании с неорганическими наночастицами в качестве селективных противоопухолевых терапевтических средств. Более конкретно, настоящее изобретение относится к композиции на основе гидрофобизированной гиалуроновой кислоты и неорганических наночастиц, которая действует селективно по отношению к клеткам, происходящим из колоректальной карциномы или аденокарциномы, карциномы легкого, гепатоцеллюлярной карциномы и карциномы молочной железы. Данная композиция также может быть использована в качестве in vivo контрастной среды. Кроме того, настоящее изобретение относится к способу приготовления упомянутой композиции.
Композиция основана на загрузке неорганических наночастиц, стабилизированных олеиновой кислотой, в наномицеллы из гидрофобизированного гиалуронана. Загрузка может быть выполнена путем обработки ультразвуком растворов наночастиц в органическом растворителе с раствором гидрофобизированного гиалуронана в воде. Полученные наномицеллы, содержащие неорганические наночастицы, затем подвергаются центрифугированию и отделяются, таким образом, от свободных неорганических наночастиц и могут быть использованы для селективного воздействия на опухолевые клетки. Основным и уникальным преимуществом композиции по настоящему изобретению является ее селективная активность in vitro по отношению к опухолевым клеткам, даже в том случае, когда обрабатывают смесь опухолевых и контрольных клеток. Композиция содержит неорганические наночастицы, стабилизированные олеиновой кислотой, причем первоначальное назначение неорганических наночастиц состояло в том, чтобы позволить in vivo детектирование композиции после ее введения в организм. Однако, было неожиданно обнаружено, что, в сочетании с гидрофобизированной гиалуроновой кислотой, особенно с олеиловым производным гиалуроновой кислоты, упомянутая композиция является селективно цитотоксической по отношению к опухолевым клеткам in vitro, даже без какого-либо цитостатического или другого терапевтического вещества. Данный неожиданный и необъяснимый до сих пор эффект наблюдался для наночастиц SPION, наночастиц из оксида цинка и апконвертирующих наночастиц при условии, что они были стабилизированы олеиновой кислотой. Неожиданный эффект не может быть однозначно объяснен как рецептор-опосредованный эффект, опосредованный CD44-рецепторами, которые являются специфическими для гиалуронана, и наблюдаемая селективность не может быть, согласно данным, собранным до настоящего времени, связана с влиянием повышенного образования ROS. Тем не менее, такая селективность может быть вызвана другим механизмом внутриклеточного высвобождения ионов в виде наночастиц. Избирательное воздействие на опухолевые клетки тем более удивительно, что SPION, включенные в носители на основе полисахарида или другой полимерной матрицы, обычно считаются нецитотоксические (El-Dakdouki et al., 2012; Li, Kim, Tian, Yu, Jon & Moon, 2012).
Другие преимущества упомянутой композиции включают совместимость с физиологическими растворами, возможность внутривенного введения in vivo и стабильность наномицелл во времени при физиологическом значении pH. Еще одним преимуществом данной композиции является применение гиалуронана в качестве полимера-носителя, образующего оболочку вокруг наномицеллярной системы, посредством чего обеспечивается совместимость композиции для введения in vivo. Предпочтительно, гиалуроновая кислота может также поддерживать связывание упомянутой композиции с опухолевыми клетками, характеризующимися повышенной экспрессией рецептора CD44. Присутствие наночастиц SPION в композиции может быть предпочтительно использовано для нацеливания носителей в нужное место в организме с помощью магнитного поля. Переменное магнитное поле может служить для индуцирования гипертермии, ведущей к разрушению ткани опухоли. Еще одно преимущество заключается в том, что данная композиция может быть объединена с другими активными веществами, такими как цитостатики. Подобно наночастицам SPION и наночастицам оксида цинка, присутствие апконвертирующих наночастиц может быть предпочтительно использовано для in vivo детектирования композиции в ткани. Кроме того, апконвертирующие наночастицы, имеющие определенный состав, могут быть использованы для фотодинамической терапии или для контролируемого высвобождения активных веществ лекарственного средства из композиции. Присутствие наночастиц оксида цинка может быть предпочтительно использовано в опухолевых тканях, имеющих более кислое значение pH, где наночастицы ZnO могут растворяться с высвобождением ионов Zn2+, которые, в то же время, являются локально цитотоксическими в более высоких концентрациях.
Таким образом, настоящее изобретение относится к противоопухолевой композиции на основе ацилированного гиалуронана и неорганических наночастиц, стабилизированных олеиновой кислотой и выбранных из группы, включающей суперпарамагнитные наночастицы, апконвертирующие наночастицы или наночастицы оксида цинка, особенно суперпарамагнитные наночастицы. Ацилированный гиалуронан может представлять собой C6-C18-ацилированное производное гиалуроновой кислоты, имеющее насыщенные и ненасыщенные связи, особенно C18:1 ацилированное производное гиалуроновой кислоты, и упомянутый ацилированный гиалуронан служит носителем неорганических наночастиц. В том случае, если композиция по настоящему изобретению содержит суперпарамагнитные наночастицы, они представляют собой предпочтительно наночастицы на основе оксидов железа, где количество железа в композиции составляет от 0,3 до 3% по массе, предпочтительно 1,0% по массе. Размер суперпарамагнитных наночастиц составляет от 5 до 20 нм, предпочтительно от 5 до 7 нм, более предпочтительно 5 нм. В том случае, если противоопухолевая композиция содержит наночастицы оксида цинка, они присутствуют в ней предпочтительно в количестве от 0,3 до 3% по массе Zn. В том случае, если противоопухолевая композиция содержит апконвертирующие наночастицы, они предпочтительно присутствуют в таком количестве, что общее количество редкоземельных элементов в композиции составляет от 0,3 до 3% hm. Апконвертирующие наночастицы могут содержать, например, Er, Yb и Y. Преимущество композиции в соответствии с композицией по настоящему изобретению заключается также в том факте, что ее можно стерилизовать в окончательной упаковке с помощью автоклавирования.
Противоопухолевая композиция по настоящему изобретению может быть использована в особенности для ингибирования роста как адгезивных, так и суспензионных человеческих опухолевых клеточных линий, полученных из колоректальной карциномы и аденокарциномы, карциномы легкого, гепатоцеллюлярной карциномы, карциномы молочной железы, предпочтительно колоректальной карциномы и аденокарциномы. Кроме того, противоопухолевая композиция, содержащая суперпарамагнитные наночастицы, может быть использована в качестве in vivo контрастного вещества, то есть для детектирования накопления композиции в организме, особенно в печени и в патологических образованиях, например, в опухолях. Выяснилось, что композиция по настоящему изобретению обладает возможностью иным образом высвобождать ионы металлов, in vitro в опухолевых и неопухолевых клетках, особенно в клетках, происходящих из колоректальной аденокарциномы человека (= опухоль) и дермальных фибробластов человека (= не опухоль).
Противоопухолевая композиция по настоящему изобретению может применяться в составе для парентерального или местного введения, например, внутривенно. Она может дополнительно включать и другие добавки, используемые в фармацевтических композициях, предпочтительно хлорид натрия, декстрозу или буферные соли.
Композиция по настоящему изобретению может быть приготовлена следующим образом: готовят водный раствор ацилированного производного гиалуроновой кислоты, затем добавляют неорганические частицы, диспергированные в галогенидном растворителе, например, хлороформе, причем данные неорганические частицы стабилизированы олеиновой кислотой и выбраны из группы, включающей суперпарамагнитные наночастицы, апконвертирующие наночастицы или наночастицы оксида цинка, и полученную суспензию обрабатывают ультразвуком до образования гомогенной смеси, а затем свободные неорганические наночастицы отделяют от неорганических наночастиц, загруженных в наномицеллы, путем центрифугирования и последующей фильтрацией. Затем, фильтрат можно лиофилизовать или стерилизовать автоклавированием с целью долговременного хранения. Лиофилизат можно затем растворить в водном растворе и стерилизовать автоклавированием.
Для цели настоящего изобретения могут быть использованы коммерчески доступные наночастицы SPION, стабилизированные олеиновой кислотой.
Literature
Duncan, R., & Gaspar, R. (2011). Nanomedicine(s) under the Microscope. Molecular Pharmaceutics, 5 (6), 2101-2141.
El-Dakdouki, M.H., Pure, E., & Huang, X. (2013). Development of drug loaded nanoparticles for tumor targeting. Part 1: synthesis, characterization, and biological evaluation in 2D cell cultures. Nanoscale, 5 (9), 3895-3903.
El-Dakdouki, M.H., Zhu, D.C., El-Boubbou, K., Kamat, M., Chen, J., Li, W., & Huang, X. (2012). Development of Multifunctional Hyaluronan-Coated Nanoparticles for Imaging and Drug Delivery to Cancer Cells. Biomacromolecules, 13 (4), 1144-1151.
Fleige, E., Quadir, M.A., & Haag, R. (2012). Stimuli-responsive polymeric nanocarriers for the controlled transport of active compounds: Concepts and applications. Advanced Drug Delivery Reviews, 64 (9), 866-884.
Huang, G., Chen, H., Dong, Y., Luo, X., Yu, H., Moore, Z., Bey, E.A., Boothman, D.A., & Gao, J. (2013). Superparamagnetic iron oxide nanoparticles: amplifying ROS stress to improve anticancer drug efficacy. Theranostics, 3 (2), 116-126.
Laurent, S., Dutz, S., Hafeli, U.O., & Mahmoudi, M. (2011). Magnetic fluid hyperthermia: focus on superparamagnetic iron oxide nanoparticles. Advances in Colloid and Interface Science, 166 (1-2), 8-23.
Li, M., Kim, H.S., Tian, L., Yu, M.K., Jon, S., & Moon, W.K. (2012). Comparison of Two Ultrasmall Superparamagnetic Iron Oxides on Cytotoxicity and MR Imaging of Tumors. Theranostics, 2 (1), 76-85.
Maeda, H. (2001). The enhanced permeability and retention (EPR) effect in tumor vasculature: the key role of tumor-selective macromolecular drug targeting. Advances in Enzyme Regulation, 41 (1), 189-207.
Ruoslahti, E., Bhatia, S.N., & Sailor, M.J. (2010). Targeting of drugs and nanoparticles to tumors. The Journal of Cell Biology, 188 (6), 759-768.
Краткое описание чертежей
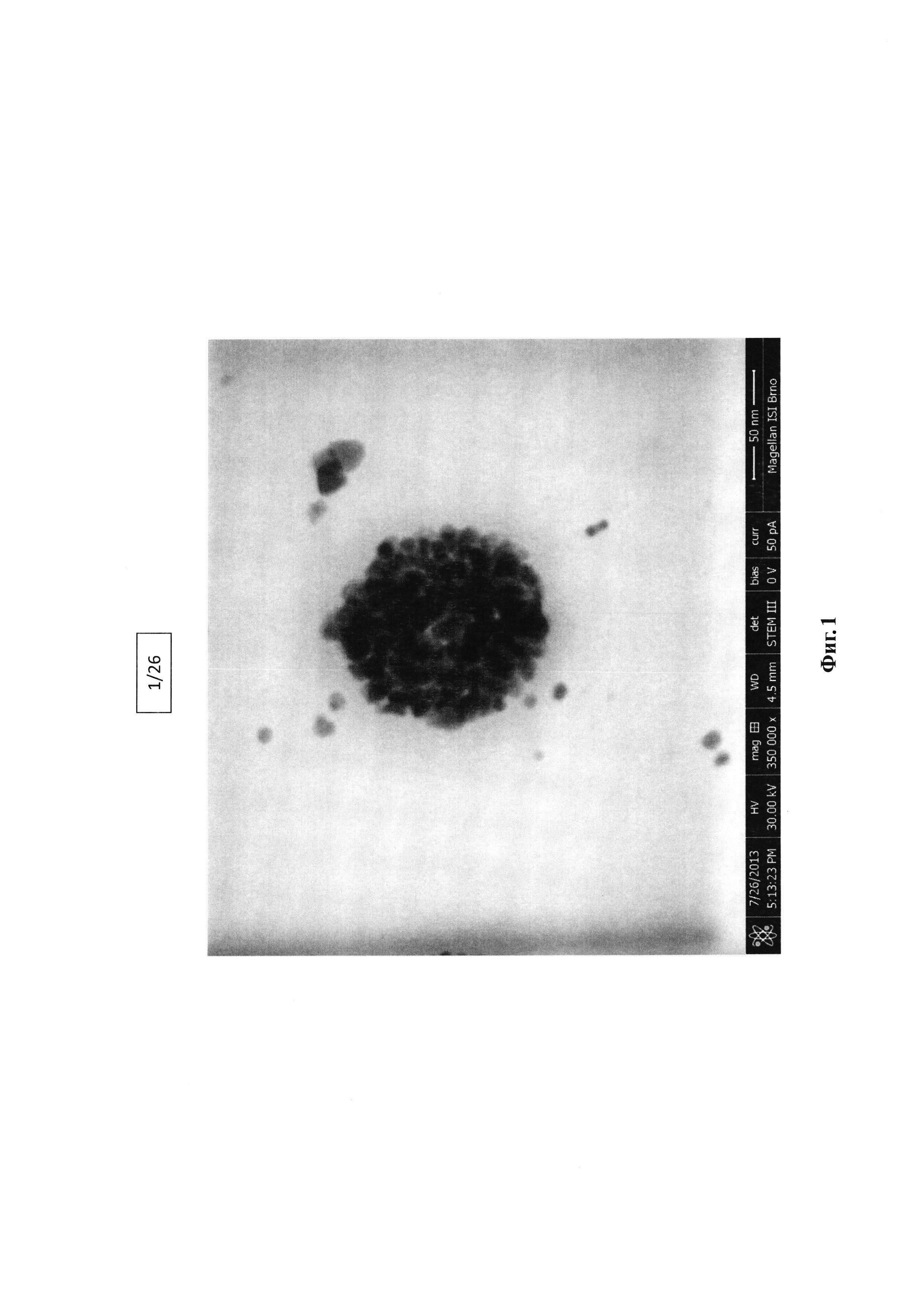
Фигура 1. Полученное с помощью ПЭМ (просвечивающей электронной микроскопии) изображение наночастиц (SPION), инкапсулированных в гидрофобизированный гиалуронан.
Фигура 2А, 2В, 2С. Ингибирование жизнеспособности опухолевой клеточной линии НТ-29 композицией ацилированного гиалуронана с наночастицами SPION по сравнению с положительным/нейтральным эффектом в контрольных фибробластах NHDF и мышиной неопухолевой клеточной линии 3Т3.
Фигура 3. Влияние композиции ацилированного гиалуронана с наночастицами SPION на ингибирование жизнеспособности различных линий опухолевых клеток по сравнению с положительным эффектом в контрольных фибробластах NHDF и мышиной неопухолевой клеточной линии 3T3.
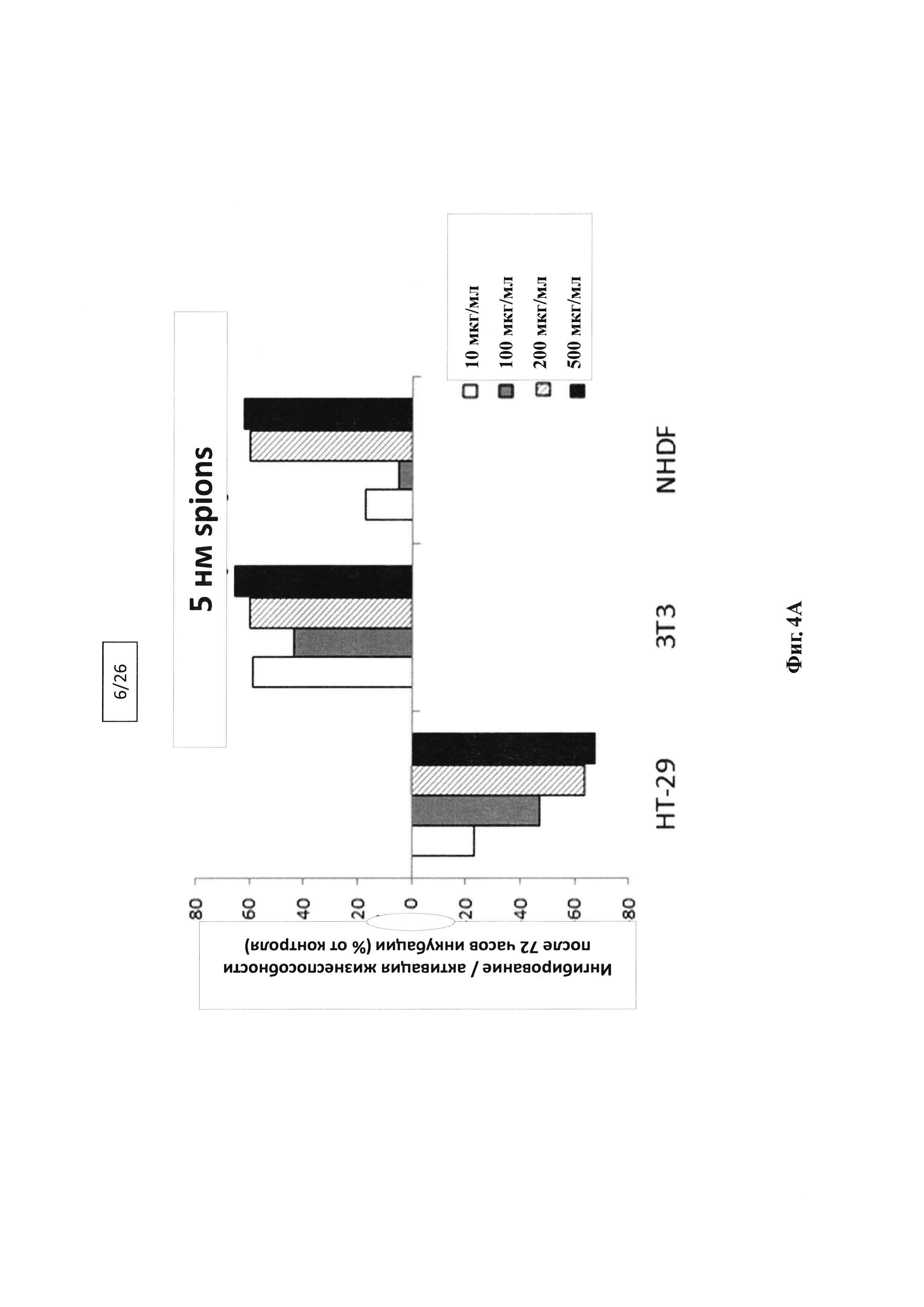
Фигура 4А, 4В, 4С. Сравнение влияния композиций ацилированного гиалуронана с инкапсулированными наночастицами SPION размером 5 нм, 10 нм и 20 нм на жизнеспособность опухолевых клеток НТ-29 и здоровых клеток NHDF и 3Т3.
Фигура 5А, 5В, 5С. Ингибирование жизнеспособности с помощью композиции ацилированного гиалуронана с наночастицами цинка в опухолевой линии НТ-29 по сравнению с положительным/нейтральным эффектом в контрольных фибробластах NHDF и мышиной неопухолевой клеточной линии 3T3.
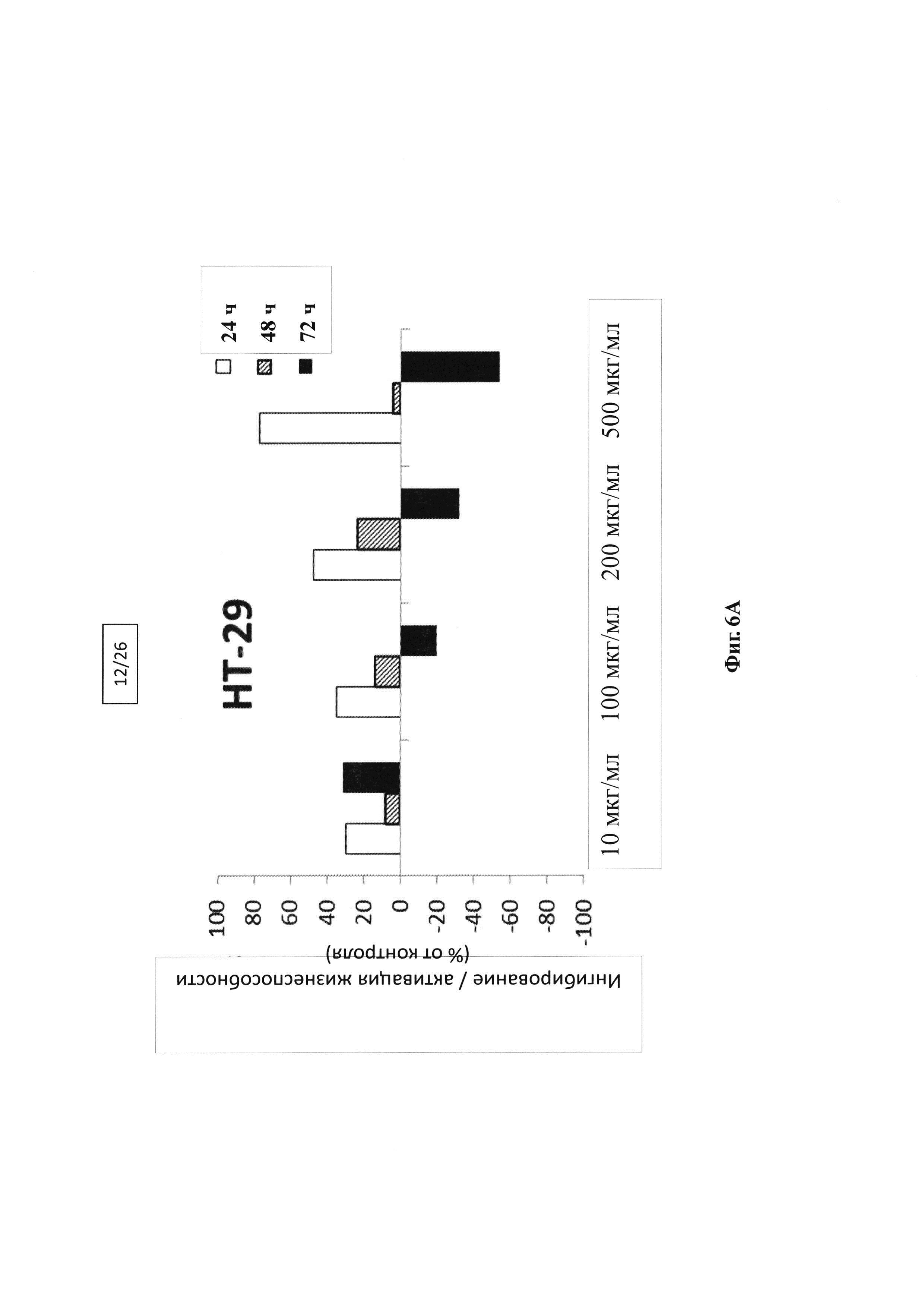
Фигура 6А, 6В, 6С. Ингибирование жизнеспособности с помощью композиции ацилированного гиалуронана с апконвертирующими наночастицами в опухолевой линии НТ-29 по сравнению с положительным/нейтральным эффектом в контрольных фибробластах NHDF и мышиной неопухолевой клеточной линии 3Т3.
Фигура 7. Совместное культивирование здоровых фибробластов NHDF и контрольных клеток НТ-29 с композицией ацилированного гиалуронана с наночастицами SPION.
Фигура 8. Экспрессия рецептора CD44 на поверхности клеток NHDF, MCF-7 и MDA-MB-231, определяемая с помощью проточной цитометрии.
Фигура 9. Индукция образования ROS с помощью композиции ацилированного гиалуронана с наночастицами SPION в NHDF и НТ-29.
Фигура 10. Внутриклеточное окрашивание на Fe в опухолевых клетках НТ-29 и контрольных клетках NHDF после инкубации с композицией ацилированного гиалуронана с наночастицами SPION (масштаб: 10 мкм)
Фигура 11. Детектирование с помощью МРТ накопления во времени наночастиц SPION, загруженных в ацилированный гиалуронан, после внутривенного введения в опухоль (опухоль глиобластомы, 1,1 мг Fe/кг).
Фигура 12. МРТ печени с контрастом после внутривенного введения композиции наночастиц SPION, загруженной в ацилированный гиалуронан (1,1 мг Fe/кг).
Фигура 13. Детектирование Fe в гистологических срезах опухоли (через 2 и 24 часа после введения композиции наночастиц SPION) после их окрашивания берлинской лазурью.
Фигура 14. Детектирование Fe в гистологических срезах печени (через 2 и 24 часов после введения композиции наночастиц SPION) после их окрашивания берлинской лазурью.
Фигура 15. Полученное с помощью ПЭМ изображение наночастиц (SPION), инкапсулированных в гидрофобизированный гиалуронан после стерилизации.
Фигура 16. Селективная цитотоксичность композиции наночастиц SPION до и после стерилизации автоклавированием.
Фигура 17А, 17В, 17С. Индукция апоптоза с помощью композиции наночастиц SPION в опухолевых клетках линии мышиной лимфомы EL4.
Примеры
SS = степень замещения = 100% * молярное количество связанного заместителя/молярное количество всех полисахаридных димеров
Термин эквивалент (экв), используемый в данном описании, относится к димеру гиалуроновой кислоты, если не указано иное. Проценты являются массовыми процентами, если не указано иное.
Молекулярную массу гиалуроновой кислоты (источник: Contipro Pharma, a.s.,


Термин неорганические наночастицы означает неорганические наночастицы, имеющие диагностическую функцию, где данная диагностическая функция представляет собой существенное общее свойство неорганических наночастиц, используемых в композиции в соответствии с изобретением. Диагностическая функция означает возможность детектирования упомянутых частиц способами, доступными в медицине. Наночастицы SPION могут быть обнаружены с помощью магнитного резонанса, в то время как ZnO-наночастицы и апконвертирующие наночастицы могут быть обнаружены посредством люминесцентной визуализации, и все такие частицы специально оптимизированы для детектирования, и именно поэтому они используются. Таким образом, из множества неорганических наночастиц были выбраны те наночастицы, которые делают возможным детектирование (мицелл) in vivo или in vitro.
Термин апконвертирующие наночастицы означает апконвертирующие лантаноидные наночастицы, т.е. наночастицы, содержащие элементы из группы редкоземельных элементов, поскольку никакие другие неорганические наночастицы, способные к эффективному преобразованию энергии с повышением частоты, не известны.
Пример 1. Получение гидрофобизированной гиалуроновой кислоты, более конкретно, олеилового производного (С18:1) гиалуроновой кислоты с помощью смешанного ангидрида бензойной кислоты и олеиновой кислоты.
100 г гиалуронана натрия (250 ммоль, 15 кДа) растворяли в 2000 мл деминерализованной воды. Затем постепенно добавляли 1000 мл изопропанола. После этого к раствору добавляли TEA (70 мл, 3 экв.) и DMAP (1,52 г, 0,05 экв.). В то же время, олеиновую кислоту (35,3 г, 0,5 экв) растворяли в 1000 мл изопропанола, затем к раствору добавляли TEA (70 мл, 3 экв.) и бензоилхлорид (14,4 мл, 0,5 экв.). После активации кислоты осадок отфильтровывали в приготовленный раствор НА. Реакцию проводили в течение 3 часов при комнатной температуре. Затем реакционную смесь разбавляли с 1000 мл деминерализованной воды с добавлением 95 г NaCl. Ацилированное производное выделяли из реакционной смеси осаждением с использованием четырехкратного объема абсолютного изопропанола. После декантации осадок повторно промывали водным раствором изопропилового спирта (85% об.).
SS 13% (определено по ЯМР).
1Н-ЯМР (D2O): δ 0,88 (т, 3Н, -CH-CH3), δ 1,22-1,35 (м, 20Н, (-CH2-)10),
δ 1,60 (м, 2Н, -CH2-CH2-СО-), δ 2,0 (4Н, (-CH2-)), δ 2,41 (т, 2Н, -CH2-СО-), δ 5,41 (д, 2Н, СН=СН)
В данном примере описан общий способ синтеза гидрофобизированного производного гиалуроновой кислоты. Тем не менее, данная процедура не ограничивается только олеиловым производным. Подробное описание синтеза гидрофобизированных производных упоминается в заявке на патент №CZ PV2012-842.
Пример 2. Получение наночастиц SPION со средним размером 5 нм
1,80 г олеата трехвалентного железа, 0,35 мл олеиновой кислоты и 13,35 мл 1-октадецена добавляли в трехгорлую колбу, имеющую объем 50 мл. Смесь медленно нагревали в вакууме до 100°C, где выдерживали в течение 30 минут для удаления летучих компонентов. Затем смесь нагревали при слабом токе аргона до 280°C и выдерживали при данной температуре в течение 60 минут. Смесь продували аргоном во время проведения реакции при 280°C. После охлаждения до комнатной температуры добавляли ацетон к реакционной смеси, и наночастицы разделяли центрифугированием. Осажденные наночастицы SPION затем 4 раза промывали смесью гексан/ацетон (соотношение последовательно от 1:4 до 1:1) и, в заключение, их диспергировали в толуоле и хранили при температуре 4°C в темноте.
Выход: 78%
Размер наночастиц: 5,2±0,8 нм (согласно фотографии, полученной с помощью электронного микроскопа)
Пример 3. Получение наночастиц SPION со средним размером 10 нм
1,80 г олеата трехвалентного железа, 0,35 мл олеиновой кислоты и 13,35 мл 1-октадецена добавляли в трехгорлую колбу, имеющую объем 50 мл. Смесь медленно нагревали в вакууме до 100°C, где выдерживали в течение 30 минут для удаления летучих компонентов. Затем смесь нагревали при слабом токе аргона до температуры кипения (~317°C) и выдерживали при данной температуре в течение 60 минут. После охлаждения до комнатной температуры наночастицы SPION разделяли таким же образом, как в примере 2.
Выход: 74%
Размер наночастиц: 9,8±0,5 нм (согласно фотографии, полученной с помощью электронного микроскопа)
Пример 4. Получение наночастиц SPION со средним размером 20 нм
1,80 г олеата трехвалентного железа, 0,35 мл олеиновой кислоты и 5,34 мл 1-октадецена и 6 г н-докозана добавляли в трехгорлую колбу, имеющую объем 50 мл. Смесь медленно нагревали в вакууме до 100°C, где выдерживали в течение 30 минут для удаления летучих компонентов. Затем смесь нагревали при слабом токе аргона до 315°C и выдерживали при данной температуре в течение 60 минут. После охлаждения до комнатной температуры наночастицы SPION разделяли таким же образом, как в примере 2.
Выход: 56%
Размер наночастиц: 21,1±3,1 нм (согласно фотографии, полученной с помощью электронного микроскопа)
Пример 5. Получение наночастиц ZnO
Дигидрат ацетата цинка (1185,30 мг; 5,4 ммоль) вносили в трехгорлую колбу, имеющую объем 250 мл, и растворяли в метаноле (90 мл) при комнатной температуре. В то же время, в двухгорлой колбе готовили раствор гидроксида тетраметиламмония (1622,91 мг; 8,96 ммоль) в метаноле (22,39 мл). Оба вышеупомянутых раствора дегазировали в ультразвуковой ванне, продувая аргоном в течение 15 минут (температура водной бани 50°C, выход 120 Вт). Раствор ацетата цинка в метаноле нагревали с обратным холодильником в масляной бане (температура бани 60°C). После добавления олеиновой кислоты (310 мкл, 0,99 ммоль) полученную смесь доводили до температуры кипения (температура бани 85°C). Раствор гидроксида тетраметиламмония в метаноле нагревали с обратным холодильником (температура бани 75°C) и быстро добавляли в трехгорлую колбу, содержащую ацетат цинка и олеиновую кислоту. Реакционную смесь нагревали с обратным холодильником при непрерывном перемешивании (600 оборотов в минуту) и продували аргоном в течение 2 минут (температура бани 85°C). Затем смесь разбавляли метанолом (90 мл) и охлаждали в течение 15 мин на бане со льдом. Охлажденную смесь центрифугировали в течение 15 мин (4000×g, 4°C). Частицы промывали этанолом (3×25 мл), за каждой стадией промывки следовало центрифугирование в течение 10 минут (4000×g, 25°C). Частицы диспергировали в хлороформе (45 мл) и хранили при температуре 4°C в темноте.
Квантовый выход флуоресценции: 34% (определено относительным способом, стандарт = norharman)
Размер наночастиц: 3,4±0,3 нм (согласно фотографии, полученной с помощью электронного микроскопа)
Пример 6. Получение апконвертирующих наночастиц
Молярные количества, соответствующие 1,60 ммоль ацетата иттрия (III), 0,36 ммоль ацетата иттербия (III) и 0,04 ммоль ацетата эрбия (III), вносили в трехгорлую колбу, имеющую объем 100 мл, и добавляли октадец-1-ен (34 мл) и олеиновую кислоту (12,0 мл). Смесь вакуумировали при сильном перемешивании (600 оборотов в минуту) и медленно нагревали на масляной бане до 80°C. При данной температуре смесь перемешивали в вакууме до полного осветления и с данного момента в течение еще 90 минут. Колбу со смесью заполняли аргоном и после охлаждения до комнатной температуры в атмосфере аргона добавляли раствор NaOH (200 мг) и NH4F (296,3 мг) в метаноле (20 мл), после чего смесь сразу становилась мутной. Смесь перемешивали при комнатной температуре в течение ночи, а затем медленно испаряли метанол при 65°C (масляная баня). Затем колбу со смесью переносили в нагревательный кожух, управляемый ПИД- (пропорционально-интегрально-дифференцирующим) регулятором. Смесь постепенно вводили в вакуум, в вакууме ее медленно нагревали до 112°C и при данной температуре ее дегазировали в течение 30 минут. Затем колбу, содержащую смесь, заполняли аргоном, и в атмосфере воздуха с обратным холодильником смесь нагревали до 305°C в слабом потоке аргона при скорости 2°C/мин. При 305°C смесь оставляли в течение 110 минут, после снятия с нагрева охлаждали естественным образом до комнатной температуры.
Апконвертирующие наночастицы осаждали из реакционной смеси с помощью этанола (двойной объем от объема реакционной смеси), а затем выделяли центрифугированием (RCF 3000×g, 10 минут). Наночастицы (осадок) диспергировали в гексане (5 мл), осаждали этанолом (10 мл) и отделяли центрифугированием (RCF 3000×g, 7 минут). Наночастицы очищали таким образом три раза с помощью системы гексан/этанол и три раза с помощью системы гексан/ацетон. В заключение, наночастицы диспергировали в хлороформе (10 мл) и хранили при комнатной температуре.
Композиция наночастиц (ICP-OES): NaYF4: …Yb/Er (80% мол Y, 18% мол Yb, 2% мол Er
Органическая составляющая часть (TGA): 7%
Размер наночастиц (электронный микроскоп): 34±2 нм
Пример 7. Получение композиции капронилового производного гиалуроновой кислоты (НАС6) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС6, DS=60%, Mw=38 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеющий форму розетки сосуд для обработки ультразвуком (rosette sonication vessel) (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,1% (маc.)
Пример 8. Получение композиции капронилового производного гиалуроновой кислоты (НАС8) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС8, DS=22%, Mw=20 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили имеющий форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,1% (маc.)
Пример 9. Получение композиции капронилового производного гиалуроновой кислоты (НАС10) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС10, DS=15%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеющий форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%), цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,2% (маc.)
Пример 10. Получение композиции пальмитоильного производного гиалуроновой кислоты (НАС16) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС16, DS=9%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,2% (маc.)
Пример 11. Приготовление состава стеарильного производного гиалуроновой кислоты (НАС18) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС18:0, DS=9%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,0% (маc.)
Пример 12. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,0% (маc.)
Морфология кластеризованных наночастиц в полимерной мицелле показана на фиг. 1.
Пример 13. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами SPION
120 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,8% (маc.)
Пример 15. Получение композиции линоленильного производного гиалуроновой кислоты (НАС18:3) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС18:3, DS=3%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,0% (маc.)
Пример 16. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 0,4% (маc.)
Пример 17. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами SPION
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из среды толуола в хлороформную среду.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг наночастиц SPION, диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 с и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,7% (маc.)
Пример 18. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами SPION и паклитакселом
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке. Наночастицы SPION (стабилизированные олеиновой кислотой, размер наночастиц: 5 нм), полученные в соответствии с примером 2, переносили из толуола в хлороформ. Наночастицы, полученные таким образом, смешивали с 6 мг паклитаксела, растворенного в 3 мл хлороформа.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг SPION и 6 мг паклитаксела в CHCl3 постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 сек и волновод S2). Свободные наночастицы и паклитаксела отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин) и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами и паклитакселом отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Fe (определение ICP): 1,5% (маc.)
Количество загруженного РТХ (определение ВЭЖХ): 0,3% (маc.)
Пример 19. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с наночастицами ZnO
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг оксида цинка (из примера 5), диспергированного в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и волновод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 сек и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин), и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного (определение ICP) Zn: 1,6% (маc.)
Пример 20. Получение композиции олеилового производного гиалуроновой кислоты (НАС18:1) с апконвертирующими наночастицами
150 мг ацилированного гиалуронана (НАС18:1, DS=12%, Mw=15 кДа), полученного согласно примеру 1, растворяли в течение 2 часов в 15 мл деминерализованной воды при постоянном перемешивании на магнитной мешалке.
Раствор ацилированного гиалуронана переносили в имеюший форму розетки сосуд для обработки ультразвуком (RZ 1, объем: 25 мл), погруженный в баню со льдом. Сначала раствор обрабатывали ультразвуком в течение 60 секунд (параметры обработки ультразвуком: 200 Вт, амплитуда 65%, цикла 0,5 с и волновод S2). Далее, 5 мг апконвертирующих наночастиц (из примера 6), диспергированных в 3 мл CHCl3, постепенно добавляли к упомянутому раствору (параметры обработки ультразвуком: 200 Вт, амплитуда 85%, цикл 0,8 с и сонотрод S2). Гомогенизированную суспензию дополнительно обрабатывали ультразвуком в течение 15 мин (параметры обработки ультразвуком: амплитуда 65%, цикл 0,5 сек и волновод S2). Свободные наночастицы отделяли с помощью повторного центрифугирования (3×4500 оборотов в минуту, 10 мин), и полученный супернатант, содержащий наномицеллы гиалуронана с загруженными наночастицами, отбирали, фильтровали через стеклянный фильтр 1,0 мкм и лиофилизировали.
Количество загруженного Er; Y; Yb (определение ICP): 0,02; 0,50; 0,19% (маc.)
Пример 21. In vitro цитотоксичность композиции ацилированного гиалуронана с наночастицами SPION
Первичные клетки и неопухолевые и опухолевые линии (таблица 1) высевали в 96-луночные панели и культивировали в течение 24 часов при 37°C/5% CO2. Затем клетки обрабатывали растворами композиций ацилированного гиалуронана с наночастицами SPION из примеров 7-12, 14 и 15 в концентрациях 10, 100, 200 и 500 мкг/мл (концентрация полимерных мицелл в культуральной среде). Одновременно измеряли влияние на жизнеспособность только одного ацилированного гиалуронана и только одних наночастиц SPION (в соответствующих концентрациях). Жизнеспособность клеток контролировали в моменты времени 0, 24, 48 и 72 ч с помощью способа МТТ; результирующие значения указывали на ингибирование или активацию жизнеспособности клеток в данный момент времени. Контролировали ингибирование клеточной жизнеспособности клеток, обработанных композициями различных ацилированных производных НА с наночастицами SPION (фигуры 2А-С), и влияние состава НАС18:1 + SPION (из примера 12) на различные опухолевые линии (фигура 3). Фигуры 4А-С показывают сравнение цитотоксического действия композиции (в соответствии с примером 12, 16, 17) с 5, 10 и 20 нм SPION. Клеточные линии описаны в таблице 1.

Результаты на фигурах 2А-С показывают, что, в отличие от контрольных линий (NHDF и 3T3), в случае опухолевой линии НТ29 наблюдается значительное ингибирование роста клеток. Самые высокие уровни ингибирования были зарегистрированы для композиции на основе С18- и С18:1-ацилированных производных. Композиция на основе С18:1-производных с наночастицами SPION даже способствовала улучшению жизнеспособности клеток NHDF и 3Т3. Ацилированный гиалуронан и наночастицы SPION порознь не оказывали влияния на жизнеспособность любых из тестируемых клеток (данные не приведены).
Композицию НАС 18:1 с наночастицами SPION дополнительно применяли для обработки других опухолевых линий (фигура 3). Экспериментальные данные показали замедление роста опухолевых линий А549, НСТ116,

Фигуры 4А-С подтверждают селективную противоопухолевую активность композиции с наночастицами SPION размером 5 нм. Данный эффект не наблюдается в той же степени для композиций с наночастицами SPION размером 10 и 20 нм.
Пример 22. In vitro цитотоксичность композиции ацилированного гиалуронана с наночастицами оксида цинка
Первичные человеческие фибробласты (NHDF), клетки НТ-29 опухоли кишечника и линию 3T3 фибробластов мышей высевали на 96-луночные панели и культивировали в течение 24 часов при 37°C/5% CO2. Затем клетки обрабатывали растворами композиций ацилированного гиалуронана с наночастицами оксида цинка из примера 19 в концентрациях 10, 100, 200 и 500 мкг/мл (концентрация полимерных мицелл). Жизнеспособность клеток контролировали в моменты времени 0, 24, 48 и 72 ч с помощью способа МТТ, и результирующие значения указывали на ингибирование или активацию жизнеспособности клеток в данной временной точке (фигуры 5А-С).
Результаты, представленные на фигурах 5А-С, показывают, что, в отличие от контрольных линий (NHDF и 3T3), с увеличением времени инкубации и, кроме того, при более высоких концентрациях полимерных мицелл, происходит ингибирование роста опухолевых клеток. Однако, в данном случае также наблюдалось ингибирование роста при концентрации 500 мкг/мл в клетках 3T3. При более низких концентрациях композиции, а также в контрольной клеточной линии NHDF, не наблюдалось никакого ингибирования.
Пример 23. In vitro цитотоксичность композиции ацилированного гиалуронана с апконвертирующими наночастицами
Первичные человеческие фибробласты (NHDF), клетки НТ-29 опухоли кишечника и линию 3T3 фибробластов мышей высевали на 96-луночные панели и культивировали в течение 24 часов при 37°C/5% СО2. Затем клетки обрабатывали растворами композиций ацилированного гиалуронана с наночастицами оксида цинка из примера 19 в концентрациях 10, 100, 200 и 500 мкг/мл (концентрация полимерных мицелл). Жизнеспособность клеток контролировали в моменты времени 0, 24, 48 и 72 ч с помощью способа МТТ, и результирующие значения указывали на ингибирование или активацию жизнеспособности клеток в данной временной точке (фигуры 6А-С).
Результаты, представленные на фигурах 6А-С, показывают, что в отличие от контрольных линий NHDF, где жизнеспособность сильно увеличивается, с увеличением времени инкубации происходит ингибирование роста опухолевых клеток. Однако, небольшое ингибирование наблюдается также в неопухолевой 3T3 линии.
Пример 24. In vitro селективная цитотоксичность композиции ацилированного гиалуронана с наночастицами SPION
Первичные человеческие фибробласты, помеченные DiO (зеленый), и клетки НТ-29 опухоли, помеченные DiI (красный), которые были в соотношении 3:1 и с общей концентрацией 50000 клеток/лунку, высевали в лунки 24-луночной панели в 1 мл среды RPMI 1640 (Roswell Park Memorial Institut). По достижении по меньшей мере 80% слияния клеточного монослоя, клетки обрабатывали 200 мкг/мл раствором композиции с наночастицами SPION из примера 12. После 72 часов инкубации получали изобрежение клеток с помощью флуоресцентного микроскопа Nikon Ti-Eclipse (фигура 7).
Для объяснения возможного механизма различной активности по отношению к контрольным клеткам и опухолевым клеткам, экспрессию рецептора CD44 для гиалуронана анализировали с помощью проточной цитометрии на клетках NHDF, MCF-7 и MDA-MB-231. После достижения 80% слияния клетки промывали PBS, инкубировали в течение 15 мин/RT с анти-CD44-FITC-антителом, после инкубации их снова 2х промывали PBS и анализировали на проточном цитометре MACSQuant Analyzer (Miltenyi Biotec). Результаты представлены в виде интенсивности флуоресценции (RFU) (фигура 8).
Кроме того, окислительный стресс для клеток NHDF и НТ-29 определяли после обработки композицией ацилированного гиалуронана с наночастицами SPION из примера 12. Клетки культивировали на 6-луночньгх панелях, и после достижения 80% слияния их обрабатывали 200 мкг/мл раствором композиции с наночастицами SPION в течение 24 часов. Что же касается рассматриваемых контрольных клеток, в их случае только среду заменяли на более свежую, не содержащую испытываемой композиции. После инкубации клетки промывали и обрабатывали DCF-DA (нефлуоресцентное вещество, которое окисляется внутриклеточными ROS до флуоресцентного DCF, конечная концентрация: 1 мкМ) в течение 20 мин/37°C/в темноте. После последующего промывания PBS, клетки анализировали на проточном цитометре MACSQuant Analyzer (Miltenyi Biotec). Результаты показаны в виде относительной интенсивности флуоресценции (% от необработанного контроля) DCF внутри клеток (фигура 9).
Результаты, представленные на фигуре 7, подтверждают селективное ингибирование роста в опухолевой линии НТ-29, в то время как контрольные фибробласты NHDF не подвергались негативному влиянию и достигали слияния. Данный эффект не был вызван различной индукцией образования ROS, упомянутая индукция возрастает в обоих типах клеток, но она возрастает до одинакового уровня (фигура 9). Объяснением может служить различная степень ответа на упомянутое увеличение продукции ROS в клетках NHDF и НТ-29.
Различие в активности по отношению к контрольным клеткам и к опухолевым клеткам не зависит от экспрессии основного поверхностного рецептора для гиалуронана, CD44. Фигура 8 подтверждает высокий уровень экспрессии CD44 в контрольных фибробластах NHDF, жизнеспособность которых увеличивалась композицией, и низкий уровень экспрессии в опухолевых клеточных линиях MCF-7 и MDA-MB-231, в которых наблюдалось значительное ингибирование жизнеспособности (фигура 3).
После окрашивания клеток (детектирование присутствия Fe с помощью берлинской лазури), инкубированных с композицией ацилированного гиалуронана с наночастицами SPION из примера 12, наблюдается другое распределение ионов Fe - в то время как растворенный Fe был обнаружен в опухолевых клетках, агрегаты железа были обнаружены в контрольных клетках (фигура 10). Данное явление может служить причиной селективной активности композиции в опухолевых клетках.
Пример 25. Приготовление композиции для внутривенного введения
650 мкл стерильного 0,9% NaCl добавляют к от 20 до 30 мг ацилированного гиалуронана с наночастицами SPION из примера 12, приготовленным стерильным способом, раствор перемешивают время от времени до полного растворения лиофилизата. Раствор готов для инъекций in vivo без проблем.
Раствор, полученный таким образом, является стабильным, насколько об этом можно судить по гидродинамическому размеру частиц, по меньшей мере в течение 2 дней.
Пример 26. Приготовление композиции для внутривенного введения
650 мкл стерильного 5% раствора декстрозы добавляют к от 20 до 30 мг ацилированного гиалуронана с наночастицами SPION из примера 12, приготовленным стерильным способом, раствор перемешивают время от времени до полного растворения лиофилизата. Раствор готов для инъекций in vivo без проблем.
Раствор, полученный таким образом, является стабильным, насколько об этом можно судить по гидродинамическому размеру частиц, по меньшей мере в течение 2 дней.
Пример 27. In vivo детектирование композиции ацилированного гиалуронана с наночастицами SPION
Крысы Lewis Brown Norway с опухолью глиобластомы были использованы для тестирования in vivo. Опухоли прививали путем инъекции суспензии 3×106 клеток глиобластомы в мышцу на ноге, и через 9 дней после этого крысам вводили внутривенно состав ацилированного гиалуронана (НАС18:1) с наночастицами SPION (750 мкл раствора в 0,9% NaCl, с содержанием Fe, составляющим 1,1 мг/кг). Затем крыс анализировали с помощью Bruker BioSpec (4,7 Т).
Накопление наночастиц SPION в опухоли после внутривенного введения композиции было подтверждено на фигуре 11, где было обнаружено особенно потемнение краев опухоли. Заметное накопление наночастиц SPION было обнаружено также в печени (фигура 12), причем упомянутая композиция, следовательно, может быть использована в качестве контрастного агента для печени.
Накопление наночастиц SPION было дополнительно подтверждено после умерщвления животных на гистологических срезах опухоли (фигура 13) и печени (фигура 14), где присутствие Fe был обнаружено по окраске берлинской лазурью (синие пятна на фигурах). Синий краситель не был обнаружен ни в одном из контрольных образцов.
Пример 28. Стерилизация композиции ацилированного гиалуронана с наночастицами SPION автоклавированием
Стерилизацию композиции, полученной в соответствии с примером 12 (концентрация: 30 мг/мл в 0,9% NaCl), проводили в автоклаве при температуре 121°C в течение 15 минут.
Раствор был стабилен после стерилизации, наночастицы SPION оставались кластеризованными в наномицеллах гиалуронана (фигура 15), селективные цитотоксические эффекты по отношению к опухолевым клеткам сохранялись.
Цитотоксичность определяли на опухолевой линии НТ-29 и в контрольных первичных фибробластах NHDF в соответствии с процедурой, описанной в примере 21. На фигуре 16 приведено сравнение композиции из примера 12 до и после стерилизации автоклавированием, селективная цитотоксичность по отношению к опухолевым клеткам сохранялась даже после стерилизации автоклавированием.
Пример 29. Индукция апоптоза в суспензии опухолевых клеток линии EL4 мышиной лимфомы
Клеточную линию EL4 мышиной лимфомы (используется для индукции опухолей в мышиных экспериментальных моделях канцерогенеза) культивировали в среде RPMI 1640 (Roswell Park Memorial Institut). В экспоненциальной фазе роста приготавливали аликвоты из культуры клеток с концентрацией 5×105 клеток/мл питательной среды RPMI, которые обрабатывали 100, 200 и 500 мкг/мл раствора композиции с наночастицами SPION из примера 9. Через 72 ч инкубации клетки отмывали и специфически окрашивали с помощью флуоресцентных маркеров клеточной смерти (пропидий иодид, AnnexinV-FITC), которые впоследствии детектировали на проточном цитометре MACSQuant (Miltenyi Biotec).
На фигурах 17А-С имеется явная индукция апоптоза (клеточная популяция в правом нижнем квадранте, фиг. 17В) и незначительное увеличение индукции некроза (левый/правый верхний квадрант, фиг. 17В) после обработки с 100 мкг/мл раствора композиции с наночастицами SPION из примера 12. Представление живых, апоптотических и некротических клеток после обработки композицией в отдельных концентрациях приведено на графике (фиг. 17С).
Реферат
Группа изобретений относится к химико-фармацевтической промышленности и представляет собой противоопухолевую композицию на основе С-ацилированного производного гиалуроновой кислоты в соответствии с общей формулой (I), где R представляет собой Нили Na, и где Rпредставляет собой Н или -C(=O)CHили -C(=O)CH=CH-het, где у обозначает целое число в диапазоне от 29 до 35, и СНпредставляет собой линейную или разветвленную, насыщенную или ненасыщенную С-цепь, и het представляет собой гетероциклический или гетероароматический остаток, содержащий N, S или О-атомы, причем по меньшей мере в одном повторяющемся звене один или более Rпредставляет собой -C(=O)CH, и где n находится в диапазоне от 12 до 4000, отличающуюся тем, что дополнительно содержит суперпарамагнитные наночастицы со стабилизирующей олеиновой кислотой и не содержит цитостатик. Изобретения также включают способ получения указанной выше композиции. Упомянутая композиция является селективно цитотоксической как в отношении суспензионных, так и адгезивных клеточных опухолевых линий, особенно в отношении опухолевых клеточных линий колоректальной карциномы и аденокарциномы, карциномы легкого, гепатоцеллюлярной карциномы и аденокарциномы молочной железы. 2 н. и 17 з.п. ф-лы, 17 ил., 1 табл., 29 пр.
Формула


Комментарии