Способы ферментативной переэтерификации/этерификации, в которых использованы липазы, иммобилизованные на гидрофобных смолах, в присутствии водных растворов - RU2573929C9
Код документа: RU2573929C9
Чертежи





















Описание
Область техники, к которой относится изобретение
Раскрыт ферментативный способ получения сложных алкилэфиров жирных кислот для применения в областях производства биотоплива, продуктов питания и детергентов. В этом способе источник жирных кислот и спирт или донор спирта вводят в реакцию в присутствии ферментов, иммобилизированных на гидрофобной смоле, в присутствии щелочного водного буфера или воды. Раскрытый способ можно осуществлять как порционно, так и непрерывно, применяя поточные колоночные реакторы с мешалкой или уплотненным слоем.
Предшествующий уровень техники
Иммобилизация ферментов была описана в огромном количестве методик, в основном направленных на уменьшение доли затрат, связанных с ферментами, в общем ферментативном способе; облегчение выделения ферментов из продуктов и обеспечение непрерывного режима способа.
Методики иммобилизации в основном подразделяются в соответствии со следующим:
1) физическая адсорбция ферментов на твердые подложки, такие как диоксид кремния или нерастворимые полимеры;
2) адсорбция на ионообменных смолах;
3) ковалентное взаимодействие ферментов с материалом твердых подложек, таких как неорганические или полимерные эпоксидные подложки;
4) захват ферментов в растущем полимере;
5) локализация ферментов в мембранном реакторе или в полупроницаемом геле;
6) ферментные кристаллы (CLECS) или агрегаты (CLEAS), образованные при помощи поперечных межмолекулярных связей.
Все вышеупомянутые методики иммобилизации ферментов состоят из следующих этапов:
1) растворение фермента в подходящей буферной системе, что касается рН, температуры, типа буферных солей и ионной силы;
2) добавление твердой подложки в ферментный раствор и перемешивание в течение некоторого времени до тех пор, пока молекулы фермента не иммобилизируются на твердой подложке;
3) отфильтровывание с твердой подложки, которая содержит иммобилизированный фермент;
4) промывка подложки подходящим буфером для удаления слабосвязанных молекул фермента и затем высушивание твердой подложки.
Поверхностные ферменты, в основном липазы, были иммобилизированы посредством вышеупомянутых методов. Эти предложенные препараты иммобилизированных ферментов обладают низкой синтетической активностью и коротким периодом полураспада при эксплуатации. В попытке повысить синтетическую активность и стабильность иммобилизированных липаз и других поверхностных ферментов были применены различные способы. Эти способы включают:
1) связывание поверхностных функциональных групп ферментов с гидрофобными остатками, такими как жирные кислоты или полиэтиленгликоль;
2) покрытие поверхности ферментов поверхностно-активными веществами, такими как сложные полиолэфиры жирных кислот;
3) приведение ферментов в контакт с гидрофобными подложками, обычно полипропиленовыми, которые были предварительно обработаны гидрофильными растворителями, такими как этанол или изопропанол.
Ни один из вышеуказанных способов не давал удовлетворительных результатов в отношении стабилизации и экономической эффективности иммобилизированных поверхностных ферментов для того, чтобы осуществить обратное ферментативное превращение в промышленных масштабах. Также сообщалось, что большинство ферментов, иммобилизированных в соответствии с вышеупомянутыми процедурами, либо теряют значительную часть синтетической активности, либо не проявляют своей полной активности вследствие определенных ограничений, связанных с процедурой иммобилизации, или вследствие присутствия определенных ингибиторов ферментов в реакционной среде.
Еще одним значительным недостатком липаз и фосфолипаз является их низкая устойчивость к гидрофильным субстратам, в частности, к спиртам с короткими цепочками и жирным кислотам с короткими цепочками (до С4). Во многих научных исследованиях было обнаружено, что спирты с короткими цепочками и жирные кислоты с короткими цепочками, как, например, метанол и уксусная кислота, соответственно, ответственны за отщепление присущих им молекул воды от четвертичной структуры этих ферментов, что приводит к их денатурации и последующей утрате их каталитической активности. Этот недостаток препятствовал применению липаз для получения промышленных количеств сложных метилэфиров жирных кислот «биодизель» с применением триглицеридов масел и метанола в качестве субстратов.
Дополнительным недостатком применения иммобилизированных липаз для переэтерификации/этерификации источника жирных кислот со свободным спиртом является накопление образовавшихся побочных продуктов глицерина и воды на биокатализаторе и, вследствие этого, препятствие свободному доступу субстратов к активному центру иммобилизированного фермента. Такие биокатализаторы в основном утрачивают свои каталитические свойства после нескольких циклов при применении одинаковой порции биокатализатора.
Современные изобретатели разработали особые препараты иммобилизированных ферментов, обладающие хорошей стабильностью на протяжении многих производственных циклов с сохранением активности. Примеры таких ферментных препаратов раскрываются в том числе в WO/2008/084470, WO/2008/139455 и WO 2009/069116.
Условия, при которых осуществляется каталитическая реакция, могут отрицательно влиять на стабильность и эффективность препаратов иммобилизированных ферментов. Важно иметь ферментные препараты, которые сохраняют стабильность и активность в реакционных условиях.
Эти и другие объекты настоящего изобретения станут очевидными из следующего далее описания.
Сущность изобретения
В одном варианте осуществления настоящее изобретение относится к способу переэтерификации/этерификации источника жирных кислот со спиртом с образованием сложных алкилэфиров жирных кислот, который включает введение в реакцию источника жирных кислот и спирта или донора спирта в присутствии препарата иммобилизированной липазы, где препарат иммобилизированной липазы включает в себя по меньшей мере одну липазу, иммобилизированную на гидрофобной пористой подложке, и реакционная среда содержит водный щелочной буферный раствор.
Во всех аспектах данного варианта, указанный водный щелочной буферный раствор может быть водным слабощелочным буферным раствором. Указанный водный щелочной буферный раствор может содержаться в реакционной среде в количестве до 99 вес.% источника жирных кислот, например, до 90, 80, 70, 60, 50, 40, 30, 25, 20, 15, 12, 10, 8, 5, 4, 3, 2% и 1%. В ином случае, указанный водный щелочной буферный раствор может содержаться в реакционной смеси в количестве больше чем 1 вес. % источника жирных кислот, больше чем 2, 3, 4, 5, 6, 8, 10, 12, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90%, вплоть до 99%. Водный щелочной буферный раствор может иметь рН от 7 до приблизительно 11, например любой из: 7-8,5, 7-9, 7-9,5, 7-10 и 7-11. В способе изобретения рКа добавленного слабощелочного реагента, входящего в состав буферного раствора, может быть выше чем или равно рКа свободных кислот, присутствующих в источнике жирных кислот.
В другом варианте осуществления настоящее изобретение относится к способу переэтерификации/этерификации источника жирных кислот со спиртом с образованием сложных алкилэфиров жирных кислот, который включает введение в реакцию источника жирных кислот и спирта в присутствии препарата иммобилизированной липазы, где препарат иммобилизированной липазы содержит по меньшей мере одну липазу, иммобилизированную на гидрофобной пористой положке, а реакционная среда содержит воду. Вода находится в форме дистиллированной воды или воды, содержащей различные растворенные соли, с рН от 3 до 11. Во всех аспектах данного варианта, реакционная среда может содержать воду или водный раствор в количестве до 99 вес. % источника жирных кислот, например, до 90, 80, 70, 60, 50, 40, 30, 25, 20, 15, 12,10, 8, 5, 4, 3, 2% и 1%. В ином случае, указанный водный щелочной буферный раствор может содержаться в реакционной смеси в количестве больше чем 1 вес. % источника жирных кислот, больше чем 2, 3, 4, 5, 6, 8, 10, 12, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90%, вплоть до 99%.
Во всех вариантах осуществления и аспектах настоящего изобретения спирт может быть спиртом с короткой цепью, например C1-С6 алкиловым спиртом, точнее говоря, С1-С4 алкиловым спиртом, в частности, метанолом или этанолом. Если указанным спиртом является метанол, то указанными полученными сложными эфирами жирных кислот являются сложные метилэфиры жирных кислот (FAME - биодизель). Спирт также может быть жирным спиртом с цепью средней длины (С6-С10) или жирными спиртами с длинными цепями (С12-С22). Донор спирта может быть сложным моноалкилэфиром или диалкилкарбонатом, таким как диметилкарбонат или диэтилкарбонат.
Во всех вариантах осуществления и аспектах настоящего изобретения указанная иммобилизированная липаза способна катализировать этерификацию свободных жирных кислот, с образованием сложных алкилэфиров жирных кислот и воды в качестве побочного продукта, и переэтерификацию триглицеридов, частичных глицеридов, восковых эфиров и фосфолипидов с образованием сложных алкилэфиров жирных кислот и глицерина, длинноцепочечных жирных спиртов и глицерофосфолипидов в качестве побочных продуктов, соответственно.
Во всех вариантах осуществления и аспектах настоящего изобретения, связанных с применением щелочного буфера или щелочного раствора, количество указанного щелочного буфера или раствора в реакционной среде составляет больше чем 0,001 вес. % источника жирных кислот.
Во всех вариантах осуществления и аспектах настоящего изобретения указанная по меньшей мере одна липаза может быть липазой, полученной из любого из Rhizomucor miehei, Pseudomonas sp., Rhizopus niveus, Mucor javanicus, Rhizopus oryzae, Aspergillus niger, Penicillium camembertii, Alcaligenes sp., Acromobacter sp., Burkholderia sp., Thermomyces lanuginosus, Chromobacterium viscosum, Candida antarctica B, Candida rugosa, Candida antarctica А, семян папайи и панкреатина. Препарат липазы может включать по меньшей мере две липазы, которые могут быть каждая отдельно иммобилизированная на гидрофобной подложке или совместно иммобилизированными на одной и той же гидрофобной подложке. Указанные липазы способны одновременно или последовательно катализировать этерификацию свободных жирных кислот, с образованием сложных алкилэфиров жирных кислот и воды в качестве побочного продукта, и переэтерификацию триглицеридов и частичных глицеридов, с образованием сложных алкилэфиров жирных кислот и глицерина в качестве побочного продукта, и/или переэтерификацию фосфолипидов с образованием алкилэфиров жирных кислот, лизофосфолипидов и глицерофосфолипидов в качестве побочных продуктов.
Во всех вариантах осуществления и аспектах настоящего изобретения указанной подложкой может быть любая из подложки на основе гидрофобного алифатического полимера и подложки на основе гидрофобного ароматического полимера. Указанная гидрофобная полимерная подложка может состоять их линейных или разветвленных органических цепей. Указанная подложка может включать макросетчатые органические полимерные или сополимерные цепи. Указанная подложка может быть пористой или непористой неорганической подложкой, которая может быть гидрофобной или покрытой гидрофобным органическим материалом. Указанный органический материал может быть линейной, разветвленной или функционализированной гидрофобной органической цепью.
Во всех вариантах осуществления и аспектах настоящего изобретения, если применяют щелочной буферный раствор, то указанный водный щелочной буферный раствор может быть раствором неорганической щелочной соли или органического основания. Указанный щелочной буферный раствор может быть раствором любого из гидроксида, карбоната, бикарбоната, фосфата, сульфата, ацетата и цитрата щелочных металлов, солей жирных кислот, первичного, вторичного и третичного амина, и любых их смесей. В особых вариантах осуществления указанный щелочной буферный раствор может быть раствором слабого основания, выбранного из бикарбонатов и карбонатов натрия или калия. В некоторых особых вариантах осуществления способа настоящего изобретения указанный щелочной буферный раствор может быть добавлен к указанному источнику жирных кислот на стадии, предшествующей смешиванию, или непосредственно в реакционную среду.
Во всех вариантах осуществления и аспектах настоящего изобретения, если применяют щелочной буферный раствор, содержание указанного щелочного буферного раствора в переэтерификационной/этерификационной реакционной среде может быть в количестве больше чем 0,001 вес. %, от масляного сырья, например, 1-30 вес. %, 1-20 вес. %, 1-10 вес. %, 1-5 вес. %, или 1-2 вес. % от масляного сырья, например, больше чем 6, 7, 8, 10, 12, 15, 20, 30, 40% и 50 вес.% от масляного сырья.
В некоторых вариантах осуществления настоящего изобретения сначала источник жирных кислот можно смешать с щелочным буферным раствором или с водой или водным раствором, и затем смесь можно обработать указанным препаратом иммобилизированной липазы с последующим добавлением указанного спирта и обеспечения протекания реакции в подходящих условиях до тех пор, пока источник жирных кислот не превратится в сложные эфиры жирных кислот.
Во всех вариантах осуществления и аспектах настоящего изобретения указанным источником жирных кислот может быть любое из растительного масла, животного жира, масла водорослей, рыбьего жира, отработанного масла и любых их смесей. Указанный источник жирных кислот может включать свободные жирные кислоты, моно-, ди- или триглицериды, их смеси в любых соотношениях, в присутствии или отсутствии других минорных производных жирных кислот, таких как фосфолипиды, восковые эфиры и сложные эфиры стеринов. Источник жирных кислот может быть неочищенным, очищенным, обесцвеченным, дезодорированным или любым из их комбинаций.
Во всех вариантах осуществления и аспектах настоящего изобретения реакцию можно осуществлять при температуре от 10 до 100°С, в особенности при 25-30°С.
Во всех вариантах осуществления и аспектах настоящего изобретения указанный источник жирных кислот может быть предварительно смешан с указанным спиртом или донором спирта и с указанной водой или буферным раствором в предреакционном сосуде для приготовления с образованием эмульсии, которая может быть затем подана совместно с указанным препаратом иммобилизированной липазы в реакционный сосуд для переэтерификации/этерификации.
Во всех вариантах осуществления и аспектах настоящего изобретения указанную иммобилизированную липазу можно применять в колоночных реакторах с уплотненным слоем, работающих в порционном или непрерывном режиме.
В соответствии с другим аспектом настоящего изобретения обеспечивается система для переэтерификации/этерификации жирных кислот со спиртом с образованием сложных алкилэфиров жирных кислот, включающая:
реакционный сосуд, сконфигурированный для прохождения реакции в реакционной среде, содержащей жирную кислоту и по меньшей мере один из спирта и донора спирта, в присутствии препарата иммобилизированной липазы, где препарат иммобилизированной липазы включает по меньшей мере одну липазу, иммобилизированную на гидрофобной пористой подложке, и реакционная среда содержит по меньшей мере одно из водного щелочного буферного раствора и воды.
Система может включать один или несколько из следующих признаков в любой желаемой комбинации или перестановке.
A. Реакционный сосуд может включать препарат иммобилизированной липазы, по меньшей мере во время работы указанной системы для получения указанных сложных алкилэфиров жирных кислот.
B. Дополнительно или в качестве альтернативы признаку А реакционный сосуд может содержать жирную кислоту и по меньшей мере один из спирта и донора спирта, по меньшей мере во время работы указанной системы для получения указанных сложных алкилэфиров жирных кислот.
C. Дополнительно или в качестве альтернативы признакам А или В указанная реакционная среда включает смесь, причем указанная система дополнительно включает предреакционный сосуд в избирательном жидкостном взаимодействии с указанным реакционным сосудом, причем указанный предреакционный сосуд сконфигурирован для предварительного смешивания по меньшей мере жирной кислоты и по меньшей мере одного из спирта и донора спирта с образованием указанной смеси, и для избирательной подачи указанной смеси в указанный реакционный сосуд по меньшей мере во время работы указанной системы для получения указанных сложных алкилэфиров жирных кислот. Система может факультативно дополнительно включать источник жирной кислоты в избирательном жидкостном взаимодействии с указанным предреакционным сосудом и сконфигурирована для избирательной подачи жирной кислоты в указанный предреакционный сосуд по меньшей мере во время указанной работы указанной системы, и источник спирта в избирательном жидкостном взаимодействии с указанным предреакционным сосудом и сконфигурирована для избирательной подачи по меньшей мере одного из спирта и донора спирта в указанный предреакционный сосуд по меньшей мере во время указанной работы указанной системы. Система может факультативно дополнительно включать источник буфера в избирательном жидкостном взаимодействии с указанным предреакционным сосудом и сконфигурирована для избирательной подачи по меньшей мере одного из водного щелочного буферного раствора и воды в указанный предреакционный сосуд с включением в указанную смесь по меньшей мере во время указанной работы указанной системы.
D. Дополнительно или в качестве альтернативы признакам А-С система может быть сконфигурирована для избирательной подачи одного или нескольких из жирной кислоты, и/или по меньшей мере одного из спирта и донора спирта, и/или по меньшей мере одного из водного щелочного буферного раствора и воды в указанный предреакционный сосуд, каждый непрерывным образом или отдельными порциями, по меньшей мере во время указанной работы указанной системы.
E. Дополнительно или в качестве альтернативы признакам A-D предреакционный сосуд может быть сконфигурирован для избирательной подачи указанной смеси в указанный реакционный сосуд непрерывным образом или отдельными порциями, по меньшей мере во время указанной работы указанной системы.
F. Дополнительно или в качестве альтернативы признакам А-Е система может быть сконфигурирована для избирательной и непосредственной подачи в указанный реакционный сосуд по меньшей мере одной из жирной кислоты; по меньшей мере одного из спирта и донора спирта; и по меньшей мере одного из водного щелочного буферного раствора и воды.
G. Дополнительно или в качестве альтернативы признакам A-F реакционный сосуд может включать систему терморегулирования, сконфигурированную для поддержания реакционной среды в указанном реакционном сосуде в выбранном диапазоне температур.
H. Дополнительно или в качестве альтернативы признакам A-G система может факультативно включать удерживающее устройство, сконфигурированное для удержания препарата иммобилизированной липазы внутри указанного реакционного сосуда по меньшей мере во время работы указанной системы.
I. Дополнительно или в качестве альтернативы признакам А-Н система дополнительно включает сосуд для отделения продуктов в избирательном жидкостном взаимодействии с указанным реакционным сосудом, причем указанная система сконфигурирована для избирательной подачи реакционной смеси, включающей продукты реакции, из указанного реакционного сосуда в указанный сосуд для отделения продуктов, и где указанный сосуд для отделения продуктов сконфигурирован для избирательного отделения выхода сложных алкилэфиров жирных кислот из поступающей в него реакционной смеси. Например, сосуд для отделения продуктов может быть сосудом из системы центрифужного и гравитационного отделения.
J. Дополнительно или в качестве альтернативы признакам A-I реакционный сосуд сконфигурирован для избирательной подачи указанной реакционной смеси в указанный сосуд для отделения продуктов непрерывным образом и/или отдельными порциями во время указанной работы указанной системы.
К. Дополнительно или в качестве альтернативы признакам I-J система сконфигурирована для избирательной подачи указанного выхода сложных алкилэфиров жирных кислот из указанного сосуда для отделения продуктов. Например, система сконфигурирована для избирательной подачи указанного выхода сложных алкилэфиров жирных кислот из указанного сосуда для отделения продуктов непрерывным образом и/или отдельными порциями.
L. Дополнительно или в качестве альтернативы признакам А-К система сконфигурирована для повышения указанного выхода сложных алкилэфиров жирных кислот из реакционной смеси, подаваемой в указанный сосуд для отделения продуктов. В одной конфигурации системы, имеющей данный признак, система сконфигурирована для избирательного перенаправления указанного выхода сложных алкилэфиров жирных кислот в указанный реакционный сосуд для дополнительного повышения указанного выхода сложных алкилэфиров жирных кислот из реакционной смеси, впоследствии подаваемой в указанный сосуд для отделения продуктов. В другой конфигурации системы, имеющей данный признак, система сконфигурирована для избирательного перенаправления указанного выхода сложных алкилэфиров жирных кислот во вспомогательный реакторный модуль, где указанный вспомогательный реакторный модуль включает вспомогательный реакторный сосуд и вспомогательный сосуд для отделения продуктов, где указанный дополнительно повышенный выход сложных алкилэфиров жирных кислот позже избирательно подают через указанный вспомогательный сосуд для отделения продуктов.
Краткое описание чертежей
Для того чтобы понять настоящее изобретение и увидеть, как оно может быть осуществлено на практике, далее будут описаны варианты осуществления посредством неограничивающих примеров со ссылкой на сопроводительные графические материалы, в которых:
Фигура 1. Переэтерификационная активность липазы Thermomyces lanuginosus (TL), иммобилизированной на Amberlite XAD 1600 (Amb. XAD 1600) в качестве гидрофобной смолы и на Duolite D568 (Duo D568) в качестве гидрофильной смолы, и липазы Pseudomonas sp. (PS), иммобилизированной на Sepabeads SP70 (SB SP70) в качестве гидрофобной смолы на пористом диоксиде кремния (Sil.) в качестве гидрофильной смолы.
Сокращения: Conv. - превращение, Сус. - цикл.
Фигура 2. Превращение соевого масла в биодизель и глицерин через 6 часов реакции при различных уровнях 0,1 М раствора бикарбоната натрия с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Thermomyces lanuginosus, иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 3. Превращение соевого масла в биодизель и глицерин через 6 часов реакции при различных уровнях 0,1 М раствора бикарбоната натрия при применении одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Pseudomonas sp., иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 4. Превращение соевого масла в биодизель и глицерин через 6 часов реакции без воды и при различных уровнях воды с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Thermomyces lanuginosus, иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Conv. - превращение; Сус. - цикл; DW - дистиллированная вода.
Фигура 5. Превращение соевого масла в биодизель и глицерин через 6 часов реакции при различных уровнях воды с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Pseudomonas sp., иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Conv. - превращение; Сус. - цикл; DW - дистиллированная вода.
Фигура 6. Превращение смеси FFA (свободных жирных кислот) и соевого масла в биодизель и глицерин и побочные водные продукты после 4 часов этерификации/переэтерификации при различных уровнях 0,1 М раствора бикарбоната натрия с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Pseudomonas sp., иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Conv. - превращение; Сус. - цикл; DW - дистиллированная вода.
Фигура 7. Этерификация гидролизата соевого масла в биодизель и воду через 4 часа реакции в присутствии 2% ОД М раствора бикарбоната натрия с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализатором была липаза, полученная из Pseudomonas sp., иммобилизированная на гидрофобной и пористой смоле на основе полистирола и дивинилбензола.
Сокращения: Ac. Val. - кислотное число; Сус. - цикл.
Фигура 8. Переэтерификация рыбьего жира с этанолом через 6 часов реакции в присутствии 1 вес. % 0,1 М раствора бикарбоната натрия с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализаторами были липазы, полученные из Thermomyces lanuginosus (TL Lip.) и Pseudomonas sp.(PS Lip.), иммобилизированные на Amberlite XAD 1600.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 9. Переэтерификация животного жира с этанолом через 6 часов реакции в присутствии 2 вес. % 0,1 М раствора бикарбоната натрия с применением одинаковой порции биокатализатора в многократных периодических экспериментах. Биокатализаторами были липазы Thermomyces lanuginosus, Pseudomonas sp.(PS Lip.; TL Lip.), иммобилизированные на Amberlite XAD 1600.
Сокращения: Conv. - превращение; Сус. - цикл.
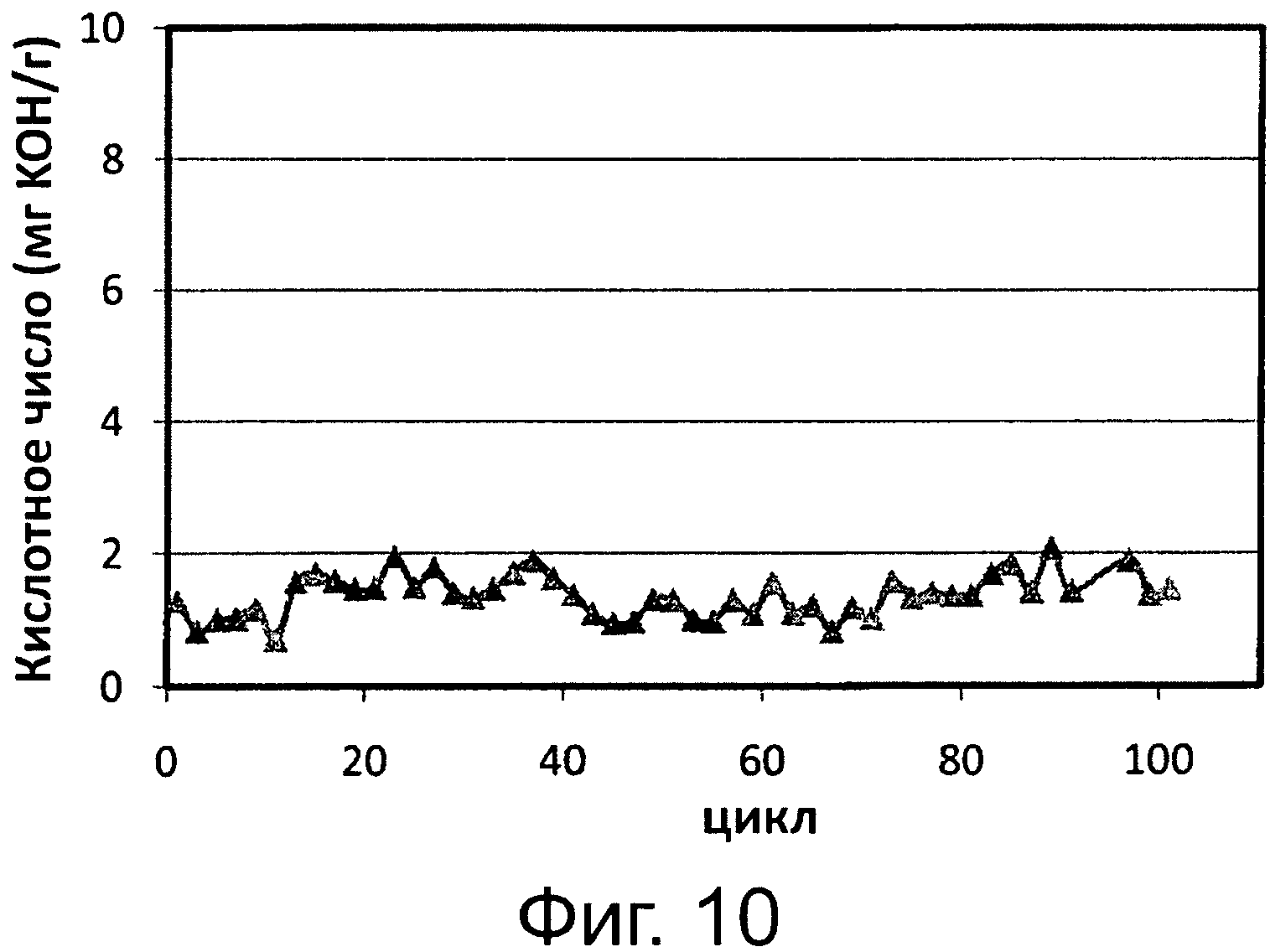
Фигура 10. Обработка реакционной среды переэтерификации/этерификации, полученной после 4 часов и имеющей кислотное число FFA 7 мг КОН/1 г, с применением Pseudomonas sp. или Thermomyces lanuginosus, иммобилизированных на гидрофобных пористых смолах, с Candida antarctica, иммобилизированной на гидрофобной пористой смоле.
Сокращения: Ac. Val. - кислотное число; Сус. - цикл.
Фигура 11. Активность переэтерификации липазы, полученной из Alcaligenes sp. (AL), иммобилизованной на дивинилбензоле/полистироле (DVB-PS) в качестве гидрофобной смолы, на слабой анионообменной гидрофильной смоле (Res.), и на пористом гранулированном силикагеле (Sil) в качестве гидрофобной смолы.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 12. Активность переэтерификации липазы Thermomyces lanuginosus (TL), иммобилизованной на дивинилбензоле/полистироле (DVB-PS) в качестве гидрофобной смолы, на слабой анионообменной гидрофильной смоле (Res.), и на пористом гранулированном силикагеле (Sil) в качестве гидрофобной смолы.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 13. Активность переэтерификации липазы Pseudomonas sp. (PS), иммобилизованной на дивинилбензоле/полистироле (DVB-PS) в качестве гидрофобной смолы, на слабой анионообменной гидрофильной смоле (Res.), и на пористом гранулированном силикагеле (Sil) в качестве гидрофобной смолы.
Сокращения: Conv. - превращение; Сус. - цикл.
Фигура 14. Преобразование соевого масла в метиловые эфиры жирных кислот и глицерин через 6 часов реакции, с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных уровнях 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу 1:3.
Сокращения: Conv. - превращение; Сус. - цикл; Sol. - раствор.
Фигура 15. Преобразование соевого масла в биодизель и глицерин после 6-часовой реакции, с использованием той же партии биокатализатора (Pseudomonas sp. (SP), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных уровнях 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу 1:3.
Сокращения: Conv. - превращение; Сус. - цикл; Sol. - раствор.
Фигура 16. Преобразование соевого масла в биодизель и глицерин после 6-часовой реакции, с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных уровнях 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу 1:3.
Сокращения: Conv. - превращение; Сус. - цикл; Wat. - вода.
Фигура 17. Преобразование олеиновой кислоты в биодизель и воду после 6-часовой реакции, с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных уровнях 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу.
Сокращения: Conv. - превращение; Сус. - цикл; Sol. - раствор.
Фигура 18. Преобразование различных смесей олеиновой кислоты и триглицеридов соевого масла в биодизель, глицерин и воду после 6-часовой реакции с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах в присутствии 8 вес. % 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу.
Сокращения: Conv. - превращение; Сус. - цикл; OA. - Олеиновая кислота.
Фигура 19. Преобразование неочищенных масел, содержащих фосфолипиды, в биодизель и глицерин после 6-часовой реакции с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах в присутствии 8 вес. % 0,1 М раствора бикарбоната натрия. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу.
Сокращения: Conv. - превращение; Сус. - цикл; RSBO - очищенное соевое масло; CSBO - неочищенное соевое масло; PL - фосфолипиды; О. - масло.
Фигура 20. Преобразование соевого масла в биодизель и глицерин после 6-часовой реакции, с использованием той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных значениях рН для 0,1 М раствора бикарбоната натрия. Концентрация буфера в реакционной смеси составляла 8 вес. % масла. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу.
Сокращения: Conv. - превращение; Сус. - цикл.
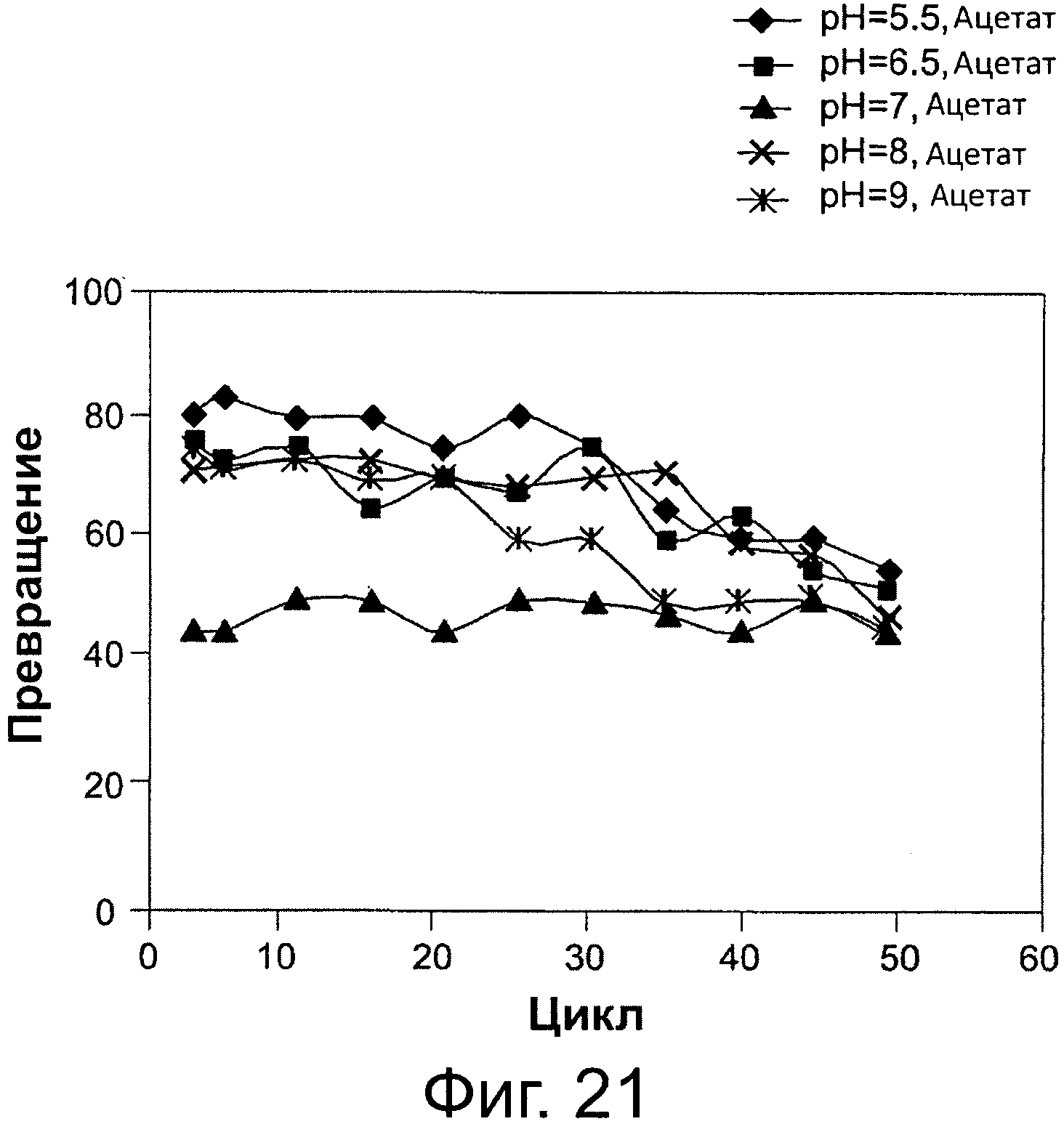
Фигура 21. Преобразование соевого масла в биодизель и глицерин после 6-часовой реакции, с использованием той же партии биокатализатор (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах, при различных значениях рН для 0,1 М раствора бикарбоната натрия. Концентрация буфера в реакционной смеси составляла 8 вес. % масла. Метанол добавляли в реакционную смесь в одну стадию на основе молярного соотношения масла к метанолу.
Сокращения: Conv. - превращение; Сус. - цикл; Acet. - ацетат.
Фигура 22. Схематически иллюстрирует первый вариант осуществления системы для получения сложных алкилэфиров жирных кислот в соответствии с аспектом настоящего изобретения.
Фигура 23. Схематически иллюстрирует второй вариант осуществления системы для получения сложных алкилэфиров жирных кислот в соответствии с аспектом настоящего изобретения.
Осуществление изобретения
В исследованиях по улучшению ферментативно катализируемых производственных процессов, в частности, способов переэтерификации/этерификации источника жирных кислот со спиртом в присутствии иммобилизированной (иммобилизированных) липазы (липаз), современные изобретатели разработали особые условия, при которых стабильность иммобилизированной (иммобилизированных) липазы (липаз) сохраняется на протяжении многих циклов производства.
В варианте осуществления настоящего изобретения настоящее изобретение относится к способу получения сложных алкилэфиров жирных кислот, а именно сложных алкилэфиров жирных кислот с короткими цепочками, таких как сложные метиловые и этиловые эфиры жирных кислот (биодизель), в щелочной микроводной системе без растворителей. В особых вариантах осуществления, щелочная микроводная система является слабощелочной микроводной системой. Способ включает обеспечение источника жирных кислот и введение его в реакцию со свободным спиртом или донором спирта в присутствии препарата иммобилизированной липазы в указанных щелочных или слабощелочных условиях. Не ограничиваясь теорией, предварительная обработка источника жирных кислот щелочным буферным раствором приведет к нейтрализации кислот, что может иметь ингибирующий эффект на фермент. Количество спирта, необходимое для завершения реакции до 100% превращения, может быть добавлено поэтапно или за одну порцию. Дополнительно, спирт может быть спиртом с короткой цепочкой, например метанолом или этанолом. Можно применять другие доноры спирта в реакции с источником жирных кислот в присутствии гидролазы, и позволяя реакции протекать в подходящих условиях до тех пор, пока указанный источник жирных кислот не превратится в сложные алкилэфиры жирных кислот, а именно в сложные метиловые эфиры жирных кислот (FAME) или сложные этиловые эфиры жирных кислот, где указанный препарат гидролазы содержит одну или несколько липаз, раздельно или совместно иммобилизированных на подходящей подложке на основе пористого макросетчатого гидрофобного полимера.
В дополнительном варианте осуществления реакция переэтерификации/этерификации между источником жирной кислоты и спиртом или донором спирта осуществляют в водной микросреде с добавлением воды в реакционную смесь. В особых вариантах осуществления вода может быть добавлена в количестве больше чем 0,0001 вес. % (на основе источника жирных кислот). Под водой, используемой здесь, подразумевается чистая или дистиллированная вода, а также «водные растворы» (также называемые водосодержащими растворами), которые могут быть, но без ограничений, водопроводной водой, морской водой или водой из любого другого естественного водного источника или резервуара, опресненной водой, химически или ферментативно очищенной или обработанной водой и любыми иными водными растворами, например, растворами растворенных солей. рН реакционной системы или водного раствора может варьировать и может быть, например, приблизительно 3-11, например 4-10, 5-10, 5-9, 6-10, 6-9 или 7-9.
Способ настоящего изобретения можно осуществлять до тех пор, пока из реакционной смеси постоянно удаляется образующийся глицерин и любая излишняя вода. Превращение ацильных групп жирных кислот или свободных жирных кислот, содержащихся в указанном источнике жирных кислот, в сложные алкилэфиры, а именно сложные метилэфиры, жирных кислот может быть проконтролировано в различные моменты времени в течение реакции. Реакционную среду можно удалить при помощи подходящих средств в любой желаемый момент времени в течение реакции, таким образом останавливая реакцию, и из реакционной среды выделяют образовавшиеся сложные метилэфиры жирных кислот и, факультативно, образовавшийся глицерин. Реакция, в частности, может быть остановлена, когда превращение ацильных групп жирных кислот или свободных жирных кислот, содержащихся в указанном источнике жирных кислот, в сложные метилэфиры жирных кислот достигнет по меньшей мере 70%, например, по меньшей мере 85% или по меньшей мере 90%.
Реакционная система может быть аналогичной описанной в одновременно находящемся на рассмотрении документе WO 2009/069116. Например, в производственной системе можно применять реактор с мешалкой с фильтром из спеченного стекла или нержавеющей стали в нижней части, который удерживает биокатализатор в реакторе, однако позволяет реакционной среде проходить сквозь реактор. Такая конфигурация реактора позволяет побочным продуктам, конкретно глицерину и воде, которые самодесорбируются из иммобилизированного фермента, оседать на дно реактора и проходить сквозь фильтр. Результатом является непрерывное удаление десорбированного образованного глицерина, а также избытка воды из реакционной среды, что приводит к сдвигу реакции в направлении к синтезу, тем самым достигая превращений выше 98%. Биокатализатор, применяемый в этом реакторе, может быть составлен из одного или многих типов липаз, принимая во внимание их позиционную специфику, а также их происхождение, как описано в данном документе. В другом случае можно применять два последовательных реактора с мешалками с фильтром в нижней части. Между двумя реакторами можно применять отстойный резервуар или центрифугу. Первый реактор может содержать иммобилизированный биокатализатор, состоящий из одного или многих типов липаз. Роль отстойного резервуара или центрифуги между обоими реакторами заключается в удалении образованного глицерина и избытка воды из реакционной среды, что приводит к повышению превращения сырья в его соответствующие сложные алкилэфиры жирных кислот до более 98% во втором реакторе за приемлемое время реакции. Некоторые конкретные системы и способы реакции описаны ниже.
Выражения «реакционная смесь», «реакционная система» и «реакционная среда» могут применяться в данном документе как синонимы.
Применение липаз, иммобилизированных на гидрофобных смолах, в присутствии щелочного буферного раствора или воды, как в вариантах осуществления способа настоящего изобретения, обеспечивает высокую стабильность фермента, а также избежание накопления гидрофильных веществ, как например вода и образованный как побочный продукт глицерин, на биокатализаторе. Во всех аспектах и вариантах осуществления способа настоящего изобретения, в которых используется щелочной или слабощелочной буфер, возможно использование раствора щелочного или слабощелочного буфера больше чем 0,001%, например, 0,01-5, 0,05-5, 0,1-5, 0,5-5, 0,01-50, 0,05-50, 0,1-50, 0,5-50, 1-50, 1-45, 1-40, 1-35, 1-30, 1-25, 1-20, 1-15, 1-10, 1-8%, как например, без ограничения, более чем 0,001, 0,01, 0,05, 0,1, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 3,5, 4%, 4,5% или 5, 6, 7, 8, 10, 12, 15, 20, 25, 30, 35, 40, 45, 50, 60%, или 70%. Уровни раствора щелочного или слабощелочного буфера могут составлять вплоть до 99 вес. %. Во всех аспектах и вариантах осуществления способа настоящего изобретения, где применяют воду или водный раствор, воду или водный раствор применяют на уровнях, без ограничения, более чем 0,0001%, например, 0,0001-50, 0,001-50, 0,1-50, 0,0001-30, 0,001-30, 0,1-30, 0,0001-20, 0,001-20, 0,1-20%, например, без ограничения, 0,001-5, 0,01-5, 0,05-5, 0,1-5, 0,5-5%, например более чем 0,0001, 0,001, 0,01, 0,05, 0,1, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 10, 12, 15, 20, 25, 30, 35, 40, 45, 50%, или 70%. Уровни воды или водного раствора в реакционной смеси могут составлять вплоть до 99 вес. %. Как упоминалось, если применяют щелочной раствор, он может нейтрализовать кислоты, как правило, присутствующие в источнике жирных кислот или производятся в результате побочных реакций. Непрерывное активное удаление этих побочных продуктов может дополнительно повысить эффективность данного способа. Выделенный глицерин можно применять в промышленности.
Источник жирных кислот, применяемый в способе изобретения, может включать по меньшей мере одно из соевого масла, канолового масла, масла водорослей, рапсового масла, оливкового масла, касторового масла, пальмового масла, подсолнечного масла, арахисового масла, хлопкового масла, ятрофного масла, нерафинированного кукурузного масла, рыбьего жира, жира животных, отработанного кулинарного жира, темного жира, масляных триглицеридов, полученных из несъедобных растительных источников, неполных глицеридов и свободных жирных кислот, полученных из этих жиров, или любой смеси по меньшей мере двух указанных веществ в любой желаемой пропорции.
Пример использования неочищенного масла в качестве источника жирных кислот представлен на рис. 19, где было использовано неочищенное соевое масло. На этой же фигуре показано применение содержащихся в масле фосфолипидов, в различных концентрациях, в качестве источника жирных кислот. Применение смеси свободных жирных кислот с маслом показано, в качестве примера, на фиг. 18, где смесь олеиновой кислоты с маслом, в различных концентрациях, а также олеиновой кислоты самой по себе (100%) служат в качестве источника жирных кислот.
Во всех способах изобретения сложные алкилэфиры жирных кислот с короткой цепью, образованные реакцией, представляют собой, в особенности, сложные метиловые, этиловые, изопропиловые или бутиловые эфиры жирных кислот (биодизель). Другие жирные спирты со средней цепью (С6-С10) и жирные спирты с длинной цепью (С12-С22) также можно применять в способе получения по данному изобретению. Эти более длинные спирты могут быть в особенности подходящими при получении различных видов воска, например, для косметических изделий.
Липазы могут быть липазами, полученными из Thermomyces lanuginosus, Rhizomucor miehei, Mucor miehei, Pseudomonas sp., Rhizopus sp., Mucor javanicus, Penicillium roqueforti, Aspergillus niger, Chromobacterium viscosum, Acromobacter sp., Burkholderia sp., Candida antarctica A, Candida antarctica B, Candida rugosa, Alcaligenes sp., Penicillium camembertii, семян папайи и панкреатина, но не ограничиваются этим.
Липазы могут быть совместно иммобилизированными на подходящей подложке, в особенности подложке на основе гидрофобного алифатического полимера или подложке на основе гидрофобного ароматического полимера. Каждая из указанных липаз может быть иммобилизирована на подходящей подложке, где подложки, на которых иммобилизированы указанные липазы, являются идентичными или различными. Используемые липазы могут быть региоспецифичными для их подложки или случайными. При применении более одной липазы, липазы можно иммобилизировать на одной или на различных гидрофобных подложках. Липазы, совместно иммобилизируемые на одной подложке, могут демонстрировать идентичные или различные субстратные избирательности или региоспецифичности для их подложек.
Липазы могут быть региоспецифичными (или сайт-специфичными), каждая применяемая отдельно или в комбинации с липазами одной или другой сайт-специфичности. Обращаясь к положениям sn-1, sn-2- или sn-3, это положения на глицериновом скелете различных глицеридов. Таким образом, липазы, применяемые в способе настоящего изобретения, могут обладать избирательностью к положению sn-2 больше, чем избирательность случайных липаз, т.е. они способствуют катализу реакции между спиртом или донором спирта с жирной ацильной группой положения sn-2, тогда как случайная липаза демонстрирует ту же переэтерификационную активность в отношении жирных ацильных групп во всех трех положениях на глицериновом скелете. Некоторые липазы единственно демонстрируют позиционную активность на положение sn-2, особенно при конкретных условиях, определяемых субстратами, продуктами и т.п. Другие липазы, применяемые в способе настоящего изобретения, являются специфичными к положению sn-1,3. Их можно применять отдельно или вместе со случайной липазой, в особенности липазой, которая обладает сродством к неполным глицеридам, и необязательно с третьей липазой с высоким сродством к положению sn-2.
Подложка является, в частности, пористой и макросетчатой гидрофобной подложкой, которая может быть органической или неорганической. Примерами подложек являются пористые неорганические подложки, такие как, без ограничения, гидрофобизированные подложки на основе кремния или окиси алюминия, и гидрофобные органические подложки, такие как, без ограничения, полимерные или основанные на полимере подложки. Подложки необязательно могут содержать активные функциональные группы, выбранные из эпоксидных или и альдегидных групп, или ионных групп.
Нерастворимая подложка, применяемая в способе настоящего изобретения, в частности, является пористой и сетчатой гидрофобной подложкой на основе алифатического или ароматического полимера, такой как AmberliteR XAD 1600 и SepabeadsR SP70, которые обе состоят из пористой микросетчатой смолы, приготовленной из дивинилбензола или из смеси дивинилбензола и полистирола, AmberliteR XAD 7НР, состоящей из микросетчатого алифатического полиакрилата, и пористого алифатического полимера, такого как пористый полипропилен (AccurelR).
Подложка может быть сетчатым гидрофобным полимером, состоящим из дивинилбензола или смеси дивинилбензола и стирола, и сетчатым гидрофобным алифатическим полимером, состоящим из алифатических полиакрилатов или полиалкена, такого как полипропилен. Конкретные подложки являются пористыми матрицами с размером пор в диапазоне 25-1000 А и, более конкретно, в диапазоне 80-200 А. Подложка также может быть порошкообразным или гранулированным пористым гидрофобным диоксидом кремния или другими неорганическими оксидами. Подложка также может быть порошкообразным или гранулированным пористым гидрофобизированным диоксидом кремния или другими неорганическими оксидами. В конкретных вариантах осуществления площадь поверхности смол подложек превышает 100 м2/г.
Количество щелочного или слабощелочного водного раствора, которое должно подаваться в катализируемую липазой реакцию переэтерификации/этерификации между источником жирных кислот и спиртом, обычно корректируется в соответствии с другими условиями реакции, исходными материалами, биокатализатором и т.п. Это количество может варьировать, как изложено и проиллюстрировано примерами в данном описании. Этот щелочной раствор приготавливают, например, из неорганического щелочного основания или соли или из органического основания. Неорганические основания и соли - это, например, гидроксиды, карбонаты, бикарбонаты, фосфаты, сульфаты, ацетаты и цитраты щелочных металлов. Органические основания могут быть, например, первичными, вторичными или третичными аминами. Также рассматриваются смеси этих щелочных агентов. В способе согласно настоящему изобретению рН микросреды иммобилизированного фермента поддерживают на щелочном или слабощелочном уровнях. Добавление дистиллированной воды в реакционную систему улучшает производительность липаз, иммобилизированных на гидрофобных подложках (смолах), как показано на фиг. 4 и 5. Как проиллюстрировано на фиг. 16, вода может быть добавлена даже в еще больших количествах, при этом стабильность биокатализатора (иммобилизованного фермента) сохраняется и, например, при содержании воды 30 вес. %., та же самая партия биокатализатора демонстрировала 60% активность преобразования после не менее чем 50 циклов. Добавление разных щелочных буферов, с различными значениями рН в зависимости от типа используемого основания, также привело к стабилизации липаз, иммобилизированных на гидрофобных подложках (смолах), как показано, например, на фиг. 2 и 3, а также на фиг. 14, 15 и 17, высокие уровни водных щелочных растворов не наносят вред активности биокатализатора, например, со скоростями превращения около 60% в одной и той же партии биокатализатора, при 30 вес. % 0,1 М раствора бикарбоната натрия в реакционной системе, после не менее чем 50 циклов реакции. Не будучи связанными какой-либо теорией, хотим отметить, что высокие концентрации воды необходимы, поскольку фермент предпочтительно сначала может гидролизовать эфирные связи в формах глицеридов и последовательно этерифицировать образованные свободные жирные кислоты добавленным спиртом. Добавленная вода также может подавлять выделение молекул воды, необходимых для поддержания благоприятной каталитической конфигурацию фермента. Карбонатные и бикарбонатные буферы являются примерами слабых оснований, которые эффективны в повышении стабильности липаз, иммобилизированных на гидрофобных подложках. В данном документе другие подходящие основания описываются. Применяемый в данном документе слабощелочной раствор обычно представляет собой раствор с рН от 7 до приблизительно 11, например, 7-8, 5, 7-9, 7-9, 5, 7-10 или 7-11. В целом, количество применяемого щелочного или слабощелочного водного раствора выражено весовыми процентами (вес. %) на основании количества масла, применяемого в реакции.
Применение липаз, иммобилизированных на пористых гидрофобных подложках на основе полимеров (смолах), в присутствии щелочного или слабощелочного раствора, а также наличие воды или водных растворов, определенных в данном документе, в количествах, изложенных выше, а также приведенных в качестве примера, приводит к стабилизации активности биокатализаторов в реакциях переэтерификации/этерификации между источником жирных кислот и спиртом. Это показано в следующих примерах.
Источник жирных кислот является по меньшей мере одним из триглицеридов, неполных глицеридов, свободных жирных кислот, фосфолипидов, сложных эфиров и амидов жирных кислот или смесью, состоящей из по меньшей мере двух указанных источников.
Получение сложных алкилэфиров жирных кислот осуществляют путем переэтерификации или этерификации, одновременно или последовательно. При такой реакционной системе активность биокатализатора поддерживается без значительных потерь активности при многочисленных применениях, а также избегает накопления побочных продуктов глицерина и воды или других гидрофильных соединений на биокатализаторе.
Данное изобретение обеспечивает способы, задействующие конкретные иммобилизированные поверхностные ферменты, которые сохраняют высокую активность и стабильность в течение многих производственных циклов. Конкретно, применяют препараты липазы и фосфолипазы в реакциях переэтерификации/этерификации. Эти реакции можно задействовать в получении пищевых изделий, косметики и биотоплива («биодизеля»). Особый интерес представляет то, что эти ферменты можно применять для синтеза сложных алкилэфиров жирных кислот с короткой цепью для применения в качестве «биодизеля».
Настоящее изобретение задействовало стабильные иммобилизированные поверхностные ферменты с высокой стойкостью к спиртам с короткой цепью, таким как метанол, этанол и глицерин, а также жирным кислотам с короткой цепью, таким как уксусная кислота. Применение этих препаратов ферментов также предотвращает накопление на иммобилизированном биокатализаторе гидрофильных веществ, в частности, глицерина и воды.
В одном варианте осуществления настоящего изобретения приводится способ одновременных или последовательных реакций переэтерификации/этерификации источника жирных кислот со спиртом с применением одного или нескольких типов липаз, иммобилизированных на гидрофобной подложке (смоле), в присутствии щелочного или слабощелочного водного раствора для получения желаемого продукта, а именно сложных алкилэфиров жирных кислот, при почти полных превращениях в течение приемлемого времени реакции, как правило, менее 5 часов. Слабощелочной раствор, например 0,001М, 0,1М, 0,5М или 1М раствор бикарбоната натрия, может присутствовать в реакционной системе в количестве примерно 4 вес. % или примерно 5 вес. %, или больше чем 5 вес. % от количества масла, применяемого в реакции, например, 6, 8, 10, 12, 15, 20, 25, 30, 40% или 50 вес. %.
Как показано в следующих примерах, эксплуатационный срок службы липаз также может быть продлен путем применения гидрофобной подложки из смолы для иммобилизации липазы в сочетании с применением щелочного или слабощелочного буферного раствора, на различных уровнях и диапазонах и поддиапазонах концентраций, изложенных и приведенных в качестве примера в данном документе, в реакционной среде переэтерификации/этерификации. Как дополнительно показано в следующих примерах, содержание воды реакционной смеси может быть увеличено независимо от значения рН. Таким образом, в другом варианте осуществления стабильность биокатализатора возрастает с возрастанием содержания воды реакционной системы путем добавления воды, при различных уровнях, диапазонах и поддиапазонах концентраций изложенных и приведенных в качестве примера в данном документе. Результаты демонстрируют, что добавление щелочного раствора (фиг. 2 и 3, 14, 15, 17) или воды (фиг. 4, 5, 16) приводит к поддержанию активности фермента и стабильности в течение многих циклов реакции.
Спирт или донор спирта, используемые в способах настоящего изобретения, могут быть алкиловым спиртом с короткой цепью, конкретно C1-С6алкиловым спиртом, более конкретно - С1-С4 алкиловым спиртом и, в частности, метанолом или этанолом, или донор спирта может быть сложным моноалкилэфиром или диалкилкарбонатом, таким как диметилкарбонат. Донор спирта, как например диалкилкарбонат, может также служить в качестве источника для щелочных или слабощелочных свойств реакционной системы.
В соответствии с другим аспектом настоящего изобретения предоставляется система для получения сложных алкилэфиров жирных кислот. Обращаясь к фиг. 22, первый вариант осуществления такой системы, в целом обозначенный численным обозначением 100, включает реакторный сосуд 120, предреакционный подготовительный сосуд 140 и сосуд 160 для отделения продуктов.
Предреакционный подготовительный сосуд 140 сконфигурирован для получения сырьевых материалов и буфера (и/или воды), для образования из них подходящей эмульсии и для подачи приготовленной эмульсии РЕ (также называемой здесь как эмульгированное сырье) в реакторный сосуд 120. В частности, такие материалы обратной связи могут включать жирную кислоту FA (например, отработанный кулинарный жир) из источника 182 жирных кислот, и спирт AL (например, метанол) из источника 184 спирта, и буфер (и/или воду) BU из источника 186 буфера/воды, подаваемые через подходящие линии подачи 152, 154, 156, соответственно, в жидкостном взаимодействии с указанным предреакционным подготовительным сосудом 140 через входы 172, 174, 176 сосуда, соответственно, и подходящие вентили (не показаны).
Предреакционный подготовительный сосуд 140 определяет внутренний объем V1, в котором реакционная смесь, включающая сырьевые материалы и буфер/воду, подаваемые туда посредством входов 172, 174, 176 сосуда, смешиваются вместе при помощи подходящей смешивающей системы 142, приводимой в действие источником питания (не показан), для образования эмульсии РЕ. Предреакционный подготовительный сосуд 140 включает внешний кожух 149, через который подходящая рабочая жидкость может циркулировать для поддержания объема V1 в желаемом устойчивом температурном состоянии. Например, рабочая жидкость может быть маслом или водой, нагретыми или охлажденными в другом сосуде (не показан) и прокачиваемыми через кожух 149 через подходящие входные и выходные отверстия (не показаны). В альтернативных вариациях данного варианта осуществления предреакционный подготовительный сосуд 140 может включать систему элементов нагрева и/или охлаждения, например электрических элементов нагрева и/или охлаждения, вместо или в придачу к кожуху 149.
Реакторный сосуд 120 сконфигурирован для получения подготовленной эмульсии РЕ из предреакционного подготовительного сосуда 140 для введения там в реакцию сырьевых материалов в присутствии подходящего биокатализатора ВС с получением продуктов RP реакции и для подачи продуктов RP реакции из реакционной смеси в сосуд 160 для отделения продуктов. Отводная линия 148 обеспечивает избирательное жидкостное взаимодействие между предреакционным подготовительным сосудом 140 и реакторным сосудом 120 посредством подходящих вентилей (не показаны) и позволяет подготовленной эмульсии РЕ, подготовленной при помощи предреакционного подготовительного сосуда 140, подаваться в реакторный сосуд 120, по желанию.
Реакционный сосуд 120 определяет внутренний объем V2, в котором подготовленную эмульсию РЕ в реакционной смеси, подаваемую туда через вход 122 сосуда, вводят в реакцию, и реакционная смесь может перемешиваться с помощью подходящей перемешивающей системы 124, приводимой в действие источником питания (не показан), для образования продукты RP реакции. Биокатализатор ВС может включать подходящий фермент и обеспечиваться в форме гранул с иммобилизированным ферментом, которые остаются в реакторном сосуде 120 до тех пор, пока они не станут неэффективными или недостаточно эффективными, после чего их можно удалить и заменить новым биокатализатором ВС. Например, биокатализатор ВС может включать липазу, полученную из Thermomyces lanuginosus, иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола.
Реакторный сосуд 120 включает систему терморегуляции в форме внешнего кожуха 129, через который может циркулировать подходящая рабочая жидкость для поддержания объема V2 в желаемом устойчивом температурном состоянии. Например, рабочая жидкость может быть маслом или водой, нагретыми или охлажденными в другом сосуде (не показан) и прокачиваемыми через кожух 129 через подходящие входные и выходные отверстия 123. В альтернативных вариациях данного варианта осуществления система терморегуляции включает систему элементов нагрева и/или охлаждения, например электрических элементов нагрева и/или охлаждения, вместо или в придачу к кожуху 129.
Нижняя часть реакторного сосуда 120 включает выход 127, и выше по течению от выхода 127 обеспечено подходящее удерживающее устройство в форме фильтра 125, сконфигурированное для фильтрации реакционной, смеси, в частности, продуктов RP реакции перед удалением из реакторного сосуда 120, и для предотвращения удаления биокатализатора ВС с продуктами RP реакции.
Сосуд 160 для отделения продуктов сконфигурирован для отделения из продуктов RP реакции желаемого продукта Р (сложного алкилэфира жирных кислот) от побочных продуктов, включая избыточную воду и глицерин G. Отводная линия 147 обеспечивает избирательное жидкостное взаимодействие между сосудом 160 для отделения продуктов и реакторным сосудом 120 посредством подходящих вентилей (не показаны) и позволяет подавать продукты RP реакции в сосуд 160 для отделения продуктов из реакторного сосуда 120, по желанию. В данном варианте осуществления сосуд 160 для отделения продуктов включает систему центрифужного или гравитационного отделения для осуществления вышеуказанного отделения и включает первый выход 162 для вывода продукта Р и второй выход 164 для сбора избыточной воды и глицерина G. Продукт Р можно собирать посредством отвода 163.
Систему, таким образом, можно эксплуатировать в непрерывном режиме производства, при котором подготовленную эмульсию РЕ подают в реакторный сосуд 120 и желаемый продукт Р собирают непрерывным образом посредством отвода 163. Эмульсия РЕ может подготавливаться и доставляться непрерывным образом в реакторный сосуд 120 для пополнения в нем объема реагента с той же скоростью, с которой продукты RP реакции удаляются из выхода 127. В другом случае эмульсия РЕ может подготавливаться и доставляться порциями в реакторный сосуд 120 для пополнения объема реагента в реакционной смеси с дискретными интервалами, каждый раз когда уровень реагентов в реакторном сосуде 120 падает до конкретного минимального уровня после непрерывного удаления продуктов RP реакции через выход 127. Разумеется, также возможно эксплуатировать систему 100 так, чтобы обеспечивать желаемый продукт Р порциями, а не непрерывно.
В другом случае систему 100 можно эксплуатировать в режиме повышенного выхода, в котором продукт Р, вместо того, чтобы сразу же собирать через отвод 163, перенаправляют в реакторный сосуд 120 через необязательную систему перенаправления, включающую линию 165, вход 121 сосуда и вентиль 166, где вентиль 166 можно выборочно эксплуатировать для отведения продукта Р от отвода 163. При перенаправлении к реакторному сосуду 120 продукт Р можно дополнительно ввести там в реакцию со спиртом AL, подаваемым через отдельную линию (не показана) из источника 184, из другого источника спирта (не показан) или из источника 184 через предреакционный подготовительный сосуд 140 для получения более высокого выхода продукта Р, который снова может быть отделен от побочных продуктов с помощью сосуда 160 для отделения продуктов. При подаче спирта через подготовительный сосуд 140 последний сначала опустошают от подготовленной эмульсии РЕ, а соответствующие вентили препятствуют подаче жирных кислот FA и необязательно буфера/воды соответствующими источниками 182 и 186. Можно обеспечить соответствующие насосы или гравитационные подачи и регулируемые вентили для выборочного перемещения соответствующих материалов через соответствующие линии 152, 154, 156, 148, 147, 165, а соответствующий контроллер (не показан) отслеживает и контролирует работу системы.
В по крайней мере некоторых альтернативных вариациях первого варианта осуществления предреакционный подготовительный сосуд 140 может быть одним целым с реакторным сосудом 120. Например, соответствующие внутренние объемы V1 и V2 могут быть разделены стенкой, имеющей открывающее устройство, соответствующее линии 148. В другом случае соответствующие внутренние объемы V1 и V2 могут быть смежными, но внутренний объем V1 в значительной мере отделен от биокатализатора ВС для обеспечения достаточного времени для формирования эмульсии РЕ до достижения биокатализатора ВС.
В альтернативных вариациях первого варианта осуществления одно, два или все из жирной кислоты FA, спирта AL и буфера/воды BU можно подавать непосредственно в реакторный сосуд 120, обходя предреакционный подготовительный сосуд 140. Например, один или несколько из источника 182 жирной кислоты, источника 184 спирта и источника 186 буфера/воды может находиться в избирательном жидкостном взаимодействии непосредственно с реакторным сосудом 120 посредством соответствующих питающих линий (не показаны), обходящих предреакционный подготовительный сосуд 140.
Понятно, что все компоненты системы 100 в соответствии с первым вариантом осуществления, или их альтернативные варианты, имеют подходящую форму и изготовлены из подходящих материалов, как известно в данной области техники, так чтобы позволять каждому компоненту выполнять соответствующие функции при соответствующих условиях, включающих температуру, давление, рН и т.п.
Обращаясь к фиг. 23, второй вариант осуществления системы, обозначенный численным обозначением 200, включает все элементы и признаки первого варианта осуществления, включая его альтернативные вариации, включая все аналогично пронумерованные компоненты, как на фиг. 22, с учетом необходимых изменений, с некоторыми отличиями. Например система 200 также включает: реакторный сосуд 120, предреакционный подготовительный сосуд 140, сосуд 160 для отделения продуктов, источник 182 жирных кислот, источник 184 спиртов, источник 186 буфера/воды, питающие линии 152, 154, 156, входы 172, 174, 176 сосуда, перемешивающую систему 142, внешний кожух 149, выходную линию 148, вход 122 в сосуд, перемешивающую систему 124, внешний кожух 129, биокатализатор ВС, входные и выходные отверстия 123, выход 127, фильтр 125, выходную линию 147 первый выход 162 второй выход 164; как описано для первого варианта осуществления, с учетом необходимых изменений.
Однако во втором варианте осуществления линия 165, отвод 163 и вентиль 166 первого варианта осуществления опущены, и вместо этого вспомогательный реакционный модуль 300 функционально соединен с первым выходом 162 сосуда 160 для отделения продуктов.
Вспомогательный реакторный модуль 300 включает вспомогательный реакторный сосуд 220 и вспомогательный сосуд 260 для отделения продуктов, которые в данном варианте осуществления соответственно в значительной мере аналогичны реакторному сосуду 120 и сосуду 160 для отделения продуктов, с учетом необходимых изменений. При эксплуатации желаемый продукт Р из сосуда 160 для отделения продуктов направляется во вспомогательный реакторный сосуд 220 через линию 266, вентиль 267 и вход 221 в сосуд. При направлении во вспомогательный реакторный сосуд 220 продукт Р может быть дополнительно введен там в реакцию со спиртом AL, подаваемым по отдельной линии (не показана) из источника 184 или из другого источника спирта (не показан), с получением дополнительно прореагировавших продуктов FRP. Линия 249 позволяет дополнительно прореагировавшие продукты FRP перемещать во вспомогательный сосуд 260 для отделения продуктов, который затем функционирует с отделением более высокого выхода продукта Р′ от побочных продуктов.
Система 200 можно эксплуатировать аналогично системе 100, с учетом необходимых изменений.
Из раскрытия и описания следует понимать, что данное изобретение не ограничивается конкретными примерами, этапами способа и материалами, раскрытыми в данном документе, поскольку такие этапы способа и материалы могут в некоторой степени изменяться. Также нужно понимать, что терминология, применяемая в данном документе, применяется только с целью описания конкретных вариантов осуществления и не предназначена быть ограничивающей, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения и ее эквивалентами.
Необходимо отметить, что применяемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают объекты и во множественном числе, если только содержимое прямо не диктует обратного.
По ходу данного описания и формулы изобретения, которая следует за ним, если только контекст не требует иного, слово «включать» и такие вариации как «включает» и «включающий» надо понимать как означающие включение указанного целого числа, или этапа, или группы целых чисел, или этапов, но не исключение любого другого целого числа, или этапа, или группы целых чисел или этапов.
Следующие примеры являются иллюстрациями методик, использованных изобретателями при осуществлении аспектов настоящего изобретения. Следует понимать, что хотя данные методики являются примерами предпочтительных вариантов осуществления для практической реализации настоящего изобретения, специалисты в данной области техники в свете настоящего раскрытия поймут, что многочисленные модификации могут быть осуществлены без отхода от намеченного объема настоящего изобретения.
Примеры
Общие замечания
Все эксперименты проводили или в стеклянных пробирках объемом 30 мл с центрированным стеклянным фильтром на дне, или в механически перемешиваемых реакторах объемом 500 мл с фильтром из спеченного стекла на дне пористостью 150-250 мкм. Обычная реакционная среда содержала источник жирных кислот, спирт, как правило, метанол или этанол в молярном базисе 1:1 в отношении к жирной кислоте независимо свободной или связанной на главной цепи глицерина (для свободных жирных кислот и моноглицеридов 1:1, для диглицеридов 1:2 и для триглицеридов 1:3 в пользу спирта). Источник жирных кислот был предварительно смешан с различными количествами щелочного буфера, в конкретных вариантах осуществления бикарбонатом натрия. Реакции инициировали добавлением липазы, иммобилизированной на гидрофобной смоле (10-15 вес. %), и реакционную среду или перемешивали механически, или взбалтывали при 30°С. Количество спирта добавляли равно в три этапа, каждый спустя час, если только не указано иное. После реакционных превращений забирали образцы из реакционной среды в разные интервалы времени и проводили анализ жирнокислотных компонентов. Превращение в биодизель рассчитывали как: 100 ∗ площадь пика сложных алкилэфиров жирных кислот/сумма всех площадей пиков.
Иммобилизация липазы. Липазы иммобилизировали, следуя стандартным процедурам, где липазу, полученную из определенного микроорганизма, растворяют в буферном растворе 0,1 М при определенном значении рН, например 7,5. Органическую или неорганическую полимерную смолу вводят в раствор липазы. Смесь взбалтывали при комнатной температуре в течение 8 часов. Холодный ацетон необязательно добавляли в смесь с тем, чтобы увеличить осаждение белкового фермента на смоле. Смесь фильтровали и гранулы фермента сушили для уменьшения содержания воды до менее 5%.
Применяли различные смолы, включая гидрофобные полимерные смолы, основанные на полистироле/дивинилбензоле, парафине или любых их комбинаций, для получения смол с гидрофобными характеристиками. Типичные применяемые гидрофобные смолы включали AmberliteR XAD 1600 (Rohm & Haas, США) и SepabeadsR SP70 (Resindion, Италия). Типичные применяемые гидрофильные смолы включали DuoliteR D568 (Rohm & Haas) и пористый силикагель. Липазы можно иммобилизировать отдельно на смоле или разные липазы совместно иммобилизируют на одной и той же смоле.
Пример 1
Переэтерификационная активность липазы, полученной из Thermomyces lanuginosus, иммобилизированной на AmberliteR XAD 1600 в качестве гидрофобной смолы и на DuoliteR D568 в качестве гидрофильной смолы, и липазы, полученной из Pseudomonas sp., иммобилизированной на SepabeadsR SP70 в качестве гидрофобной смолы и на пористой двуокиси кремния в качестве гидрофильной смолы.
Условия реакции. Рафинированное и отбеленное соевое масло (20 г), содержащее 1 вес. % 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Реакционную среду, содержащую 10 вес. % препарата липазы, взболтали при 300 об/мин и 30°С. Результаты показаны на фиг. 1.
Результаты, представленные на фиг. 1, показывают, что липазы как Thermomyces lanuginosus, так и Pseudomonas sp., иммобилизированные на различных смолах, в присутствии 1 вес. % раствора бикарбоната натрия показывали высокую переэтерификационную активность в течение первых 5 циклов с применением одной и той же порции фермента. Наблюдали, что после 5-й порции, при применении той же порции фермента, фильтрация реакционной среды из системы стала трудной по причине образования гелеподобных отложений вокруг гранул обеих липаз, иммобилизированных на гидрофильных смолах, а именно DuoliteR D568 и пористом диоксиде кремния. Переэтерификационная активность обеих липаз, иммобилизированных на гидрофильных смолах, резко уменьшалась в следующих последовательных порциях, и они стали неактивными после 10-го цикла. Напротив, липаза Pseudomonas sp., иммобилизированная на гидрофобной смоле SepabeadsR SP70, сохраняла более 80% своей начальной активности после 70 циклов, тогда как липаза Thermomyces lanuginosus, иммобилизированная на гидрофобной смоле AmberliteR XAD 1600, сохранила более 20% своей начальной активности после более 70 циклов.
Пример 2
A. Превращение соевого масла в биодизель и глицерин через 6 часов реакции с применением той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Рафинированное и отбеленное соевое масло (20 г), содержащее различные концентрации 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Применяли липазу, полученную из Thermomyces lanuginosus, иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (10 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 2.
B. Превращение соевого масла в биодизель и глицерин через 6 часов реакции с применением той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Рафинированное и отбеленное соевое масло (20 г), содержащее различные концентрации 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Применяли липазу, полученную из Pseudomonas sp., иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (10 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 3.
Фиг. 2 и 3 демонстрируют, что количество карбоната натрия в реакционной среде играет главную роль в эксплуатационной долговечности липаз Thermomyces lanuginosus и Pseudomonas sp., иммобилизированных на гидрофобных смолах. На фиг. 2 и 3 можно видеть, что в отсутствии щелочного раствора обе иммобилизированные липазы существенно теряют свою активность после нескольких циклов, тогда как те же иммобилизированные липазы сохраняют свою переэтерификационную активность в ходе многократных применений в присутствии раствора бикарбоната натрия как основания в реакционной системе. Результаты для обоих иммобилизированных ферментов показывают, что увеличение количества раствора бикарбоната натрия в реакционной среде в диапазоне 0-4 вес. % приводит к уменьшению потери ферментной активности при многократных применениях той же порции иммобилизированного фермента.
Пример 3
A. Превращение соевого масла в биодизель и глицерин через 6 часов реакции с применением той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Рафинированное и отбеленное соевое масло (20 г), содержащее различные концентрации дистиллированной воды. Метанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Применяли липазу, полученную из Thermomyces lanuginosus, иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (10 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 4.
B. Превращение соевого масла в биодизель и глицерин через 6 часов реакции с применением той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Рафинированное и отбеленное соевое масло (20 г), содержащее различные концентрации дистиллированной воды. Метанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Применяли липазу, полученную из Pseudomonas sp., иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (10 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 5.
Фиг. 4 и 5 демонстрируют, что переэтерификационная активность с применением одной и той же порции липаз Thermomyces lanuginosus и Pseudomonas sp., иммобилизированных на гидрофобных смолах, во множестве экспериментов также подвержена влиянию количества воды в реакционной системе. Можно увидеть, что увеличение количества воды от отсутствия (нуля) до 4 вес. % приводило к сохранению более высокой остаточной переэтерификационной активности биокатализатора при применении в последовательных циклах. Результаты, представленные на фиг. 2-5, ясно показывают, что применение слабого основания, такого как раствор бикарбоната натрия, в реакциях переэтерификации является благоприятным для поддержания активности липаз, иммобилизированных на гидрофобных смолах, при применении в последовательных циклах.
Пример 4
Превращение смеси свободных жирных кислот (FFA) и соевого масла в биодизель и побочные продукты глицерин и воду через 4 часа этерификации/переэтерификации с применением одной и той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Смесь соевого гидролизата свободных жирных кислот (50 вес.%) и соевого масла (50 вес. %) с начальным значением FFA 72 мг КОН/1 г, содержащая различное количество 0,1 М раствора бикарбоната натрия. Метанол (4,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Применяли липазу, полученную из Pseudomonas sp., иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (20 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 6.
Фиг. 6 демонстрирует, что различное количество основного раствора оказывает значительное влияние на реакцию одновременной этерификации FFA, присутствующих в реакционной смеси, состоящей из эквивалентных пропорций гидролизата соевого масла и триглицеридов соевого масла. Можно видеть, что липаза Pseudomonas sp., иммобилизированная на гидрофобной смоле, теряла свою этерификационную активность, если щелочной раствор не добавляли в реакционную систему этерификации/переэтерификации, тогда как тот же биокатализатор сохранял свою активность в последовательных циклах при добавлении 1 и 2 вес. % растворов 0,1 М бикарбоната натрия отдельно в реакционные системы. Результаты, представленные на фиг. 6, показывают, что применение липазы Pseudomonas sp., иммобилизированной на гидрофобной смоле, уменьшило содержание FFA в присутствии 1 и 2 вес. % раствора 0,1 М бикарбоната натрия от начального значения 72 мг КОН/1 г до 8 и 6 мг КОН/1 г в среднем, соответственно, и сохраняло эту активность в 22 последующих циклах.
Пример 5
Этерификация гидролизата соевого масла в биодизель и воду через 4 часа реакции с применением одной и той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Соевый гидролизат свободных жирных кислот (20 г) со значением FFA в 150 мг КОН/1 г, содержащий 1 вес. % 0,1 М раствора бикарбоната натрия. Метанол (2 мл) добавили в реакционную среду одной порцией. Применяли липазу, полученную из Pseudomonas sp., иммобилизированную на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (10 вес. %). Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 7.
Фиг. 7 демонстрирует, что липаза Pseudomonas sp., иммобилизированная на гидрофобной смоле, также способна катализировать этерификацию свободных жирных кислот с образованием сложных метиловых эфиров жирных кислот и воды в качестве побочного продукта. Результаты демонстрируют, что препарат липазы сохранял свою этерификационную/переэтерификационную активность в среде, содержащей 1% ОД М раствора бикарбоната натрия, в течение более 25 циклов с применением одной и той же порции биокатализатора без наблюдения какой-либо существенной потери активности.
Пример 6
Переэтерификация рыбьего жира с этанолом через 6 часов реакции с применением одной и той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Рафинированный рыбий жир (20 г), содержащий 1% 0,1 М раствора бикарбоната натрия. Этанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. По отдельности применяли (10 вес. %) липазы, полученные из Thermomyces lanuginosus и Pseudomonas sp., иммобилизированные на AmberliteR XAD 1600. Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 8.
Фиг. 8 демонстрирует, что обе липазы, полученные из Thermomyces lanuginosus и Pseudomonas sp., иммобилизированные на гидрофобных смолах, также способны катализировать переэтерификацию триглицеридов рыбьего жира с образованием сложных этиловых эфиров жирных кислот и глицерина в качестве побочного продукта. Результаты также демонстрируют, что оба препарата биокатализатора сохраняли свою переэтерификационную активность в присутствии 1% раствора бикарбоната натрия без существенных потерь активности на протяжении более 20 циклов с применением одной и той же порции биокатализатора.
Пример 7
Переэтерификация животного жира с этанолом через 6 часов реакции с применением одной и той же порции биокатализатора в многократных периодических экспериментах.
Условия реакции. Животный жир (16 г), содержащий сложный этиловый эфир жирных кислот (4 г) и 1% 1 М раствора карбоната натрия. Этанол (2,5 мл) постепенно добавили тремя равными порциями с интервалом в один час каждая. Липазы, полученные из Thermomyces lanuginosus, Pseudomonas sp., иммобилизированные на AmberliteR XAD 1600 (10 вес. %), применяли по отдельности или в комбинации в эквивалентном соотношении. Реакционную среду взбалтывали при 300 об/мин и 37°С. Результаты показаны на фиг. 9.
Фиг. 9 демонстрирует, что обе липазы, полученные из Thermomyces lanuginosus и Pseudomonas sp., по отдельности или в комбинации иммобилизированные на гидрофобных смолах, также способны катализировать переэтерификацию триглицеридов животного жира с этанолом с образованием сложных этиловых эфиров жирных кислот и глицерина в качестве побочного продукта. Исходный материал реакционной среды состоял из животного жира (80%) и сложных этиловых эфиров жирных кислот, полученных из животного жира, с тем, чтобы понизить точку плавления реакционной среды. Результаты, представленные на фиг. 9, показывают, что все биокатализаторы сохранили более 80% от своей начальной активности в присутствии слабощелочного раствора, такого как 1 М карбонат натрия, при применении одной и той же порции биокатализаторов в 100 последовательных циклах.
Пример 8
Обработка переэтерификационной/этерификационной реакционной среды, полученной через 4 часа, содержащей значение FFA 7 мг КОН/1 г, с применением липазы Pseudomonas sp. или липазы Thermomyces lanuginosus, иммобилизированной на гидрофобных пористых смолах, с липазой Candida Antarctica В, иммобилизированной на гидрофобной пористой смоле, и метанола (соотношение 1:10 на молярном базисе между FFA и метанолом, соответственно), с применением одной и той же порции биокатализатора (10 вес. %) в многократных периодических экспериментах. Реакционную среду взбалтывали при 300 об/мин и 30°С. Результаты показаны на фиг. 10.
Фиг. 10 демонстрирует, что переэтерификационную реакционную среду, полученную после обработки или липазой Thermomyces lanuginosus, или липазой Pseudomonas sp., как описано выше, которая как правило содержит значения FFA 3-7 мг КОН/1 г, можно обрабатывать липазой Candida Antarctica В, иммобилизированной либо на гидрофильной, либо на гидрофобной, подложке, что приводит к уменьшению значения FFA до менее 2 мг КОН/1 г. Иммобилизированная липаза может сохранять свою активность на протяжении более 100 циклов.
Пример 9
Активность переэтерификации/этерификации липаз, полученных из Alcaligenes sp. (AL), Pseudomonas sp. (PS) и Thermomyces lanuginosus (TL), иммобилизованных на DVB-PS в качестве гидрофобной смолы и на DuoliteR D568 в качестве гидрофильной ионообменной смолы, и гранулированном пористом силикагеле в качестве гидрофильного ферментного адсорбента.
Условия реакции. Очищенное и осветленное соевое масло (20 г), содержащее 20 вес. % 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли постепенно в трех эквивалентных партиях каждая через час после другой, а если не указано, то в противном случае добавляли в одну стадию. Реакционную, среду, содержащую 10 вес. % препарата липазы, встряхивали при 300 об/мин и 30°С. Результаты показаны на фиг. 10-13.
Результаты, представленные на фиг. 10-13 демонстрируют, что если липазы Alcaligenes sp., Pseudomonas sp. и Thermomyces lanuginosus иммобилизованы на гидрофобные смолы, то в ходе первых нескольких циклов получали высокие уровни превращения, однако ферментная активность резко падала, достигая низких уровней превращения, после 10 циклов с использованием одной и той же партии биокатализатора. Также после пятой партии наблюдали, если использовали одну и ту же партию фермента, что фильтрация реакционной среды из системы затруднялась из-за образования гелеподобного депозита вокруг микроносителей обеих липаз, иммобилизованных на гидрофобных смолах, а именно слабой ионообменной смоле и пористом силикагеле.
Напротив, липазы Alcaligenes sp., Pseudomonas sp. и Thermomyces lanuginosus, иммобилизованные на гидрофобных смолах DVB-PS, сохранили более чем 80% от их изначальной активности после 50 циклов. На фиг. 10-13 показано, что все липазы продемонстрировали высокую активность в первой партии и немного пониженную после второй партии, наиболее вероятно из-за вымывания слабосвязанного фермента со смолы.
Пример 10
А. Превращение соевого масла в биодизельное топливо и глицерин после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции. Очищенное и осветленное соевое масло (20 г), содержащее различные концентрации 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 14.
В. Превращение соевого масла в биодизельное топливо и глицерин после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции: Очищенное и осветленное соевое масло (20 г), содержащее различные концентрации 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Pseudomonas sp., иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 15.
На фиг. 14 и 15 показано, что количество бикарбоната натрия в реакционной среде играет важную роль в долговечности липаз Thermomyces lanuginosus и Pseudomonas sp., иммобилизованных на гидрофобных смолах. Из фиг. 4 и 5 видно, что в отсутствии слабощелочного раствора обе иммобилизованные липазы резко утратили свою активность после нескольких циклов, хотя те же самые иммобилизованные липазы сохраняли свою активность переэтерификации после многократного использования в присутствии раствора бикарбоната натрия в качестве основания в реакционной системе. Результаты для обоих иммобилизованных ферментов говорят о том, что увеличение количества раствора бикарбоната натрия в реакционной среде в диапазоне 0-30 вес. % дает повышенную ферментативную активность переэтерификации при многократных применениях одной и той же партии иммобилизованного фермента. Превышение количества раствора бикарбоната натрия больше чем 30 вес. % приводит к снижению ферментативной активности. Без привязки к теории, можно сказать, что это снижение может быть связано с вымыванием фермента со смолы.
Пример 11
Превращение соевого масла в биодизельное топливо и глицерин после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции. Очищенное и осветленное соевое масло (20 г), содержащее различные концентрации дистиллированной воды. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 16.
На фиг. 16 показано, что количество воды в реакционной среде также играет важную роль в долговечности липазы Thermomyces lanuginosus, иммобилизованной на гидрофобных смолах. Из фиг. 16 видно, что в отсутствии воды обе иммобилизованные липазы резко утратили свою активность после нескольких циклов, хотя те же самые иммобилизованные липазы сохраняли свою активность переэтерификации после многократного использования в присутствии воды в реакционной системе. Результаты для иммобилизованного фермента демонстрируют, что увеличение количества воды в реакционной среде в диапазоне 0-30 вес. % дает повышенную ферментативную активность переэтерификации при многократных применениях одной и той же партии иммобилизованного фермента, хотя превышение количества воды выше 30 вес. % приводит к снижению ферментативной активности.
Пример 12
Превращение олеиновой кислоты в биодизельное топливо и воду после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции. Олеиновая кислота (20 г), содержащая различные концентрации 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 17.
На фиг. 17 показано, что количество раствора бикарбоната натрия в реакционной среде также играет важную роль в определении активности этерификации Thermomyces lanuginosus, иммобилизованной на гидрофобных смолах. Из фиг. 17 видно, что в отсутствии воды в реакционной системе липаза, иммобилизованная на гидрофобной смоле, резко утратила свою активность, при использовании в многократных периодических экспериментах. Увеличение концентрации раствора бикарбоната натрия в диапазоне 0-20 вес. % приводит к увеличению активности этерификации биокатализатора при многократном использовании. Увеличение количества водной фазы выше 30 вес. % приводит к потере ферментативной активности при многократном использовании, наиболее вероятно из-за вымывания фермента со смолы.
Пример 13
Превращение смесей олеиновой кислоты и триглицеридов соевого масла в биодизель, глицерин и воду после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции. Очищенное и осветленное соевое масло, содержащее различные концентрации олеиновой кислоты (20 г), дополняли 8 вес. % 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 18.
На фиг. 18 показано, что липаза Thermomyces lanuginosus, иммобилизованная на гидрофобной и пористой смоле в присутствии буферного раствора способна этерифицировать и переэтерифицировать свободные жирные кислоты и глицериды с образованием биодизеля и побочных продуктов, глицерина и воды. Результаты также говорят о том, что иммобилизованные липазы сохраняют свою каталитическую активность без значимых потерь активности при многократных применениях одной и той же партии биокатализатора в течение 50 циклов.
Пример 14
Превращение неочищенных масел, содержащих фосфолипиды, в биодизельное топливо и глицерин после 6-часовой реакции с использованием одной и той же партии биокатализатора в многократных периодических экспериментах.
Условия реакции. Неочищенное соевое масло, содержащее различные концентрации фосфолипидов (20 г) дополняли 8 вес. % 0,1 М раствора бикарбоната натрия. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 19.
На фиг. 19 показана активность переэтерификации липазы Thermomyces lanuginosus, иммобилизованной на гидрофобной и пористой смоле дивинилбензола-полистирола. Результаты анализа показывают, что в отличие от данных, ранее представленных в литературе, липазы, иммобилизованные на гидрофобных смолах в присутствии раствора бикарбоната натрия способны переэтерифицировать глицериды, включая фосфолипиды с получением биодизеля, и побочных продуктов глицерина и глицерофосфолипидов. Также, результаты демонстрируют, что липазы сохраняют свою переэтерифицирующую каталитическую активность, когда одна и та же партия иммобилизованного фермента используется многократно.
Пример 15
A. Превращение соевого масла в биодизель и глицерин с помощью одной и той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах при различных значениях рН 0,1 М раствора бикарбоната натрия.
Условия реакции. Очищенное и осветленное соевое масло (20 г), содержащее 8 вес. % 0,1 М раствора бикарбоната натрия при различных значениях рН. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 20.
B. Превращение соевого масла в биодизель и глицерин с использованием одной и той же партии биокатализатора (Thermomyces lanuginosus (TL), иммобилизованного на подложке DVB-PS) в многократных периодических экспериментах при различных значениях рН 0,1 М раствора ацетата натрия.
Реакционные условия. Очищенное и осветленное соевое масло (20 г), содержащее 8 вес. % 0,1 М раствора ацетата натрия при различных значениях рН. Метанол (2,5 мл) добавляли в одну стадию. Использовали липазы (10 вес. %), полученные из Thermomyces lanuginosus, иммобилизованные на гидрофобной и пористой смоле на основе полистирола-дивинилбензола. Реакционную среду встряхивали при 300 об/мин и 30°С. Результаты представлены на фиг. 21.
Результаты, представленные на фиг. 20, демонстрируют, что при значениях рН выше 5,5 биокатализатор сохраняет более 60% от изначальной активности переэтерификации после 50 циклов при использовании одной и той же партии фермента. Результаты ясно демонстрируют, что существует линейное снижение активности фермента при значении рН 5,5 и активность падает ниже 20% от изначальной активности фермента.
Схожую тенденцию наблюдали при использовании ацетатного буфера при значениях рН выше 6,5, когда фермент сохранял более чем 50% от его исходной активности после 50 повторных применений (фиг. 21). Результаты, представленные на фиг. 21, демонстрируют также, что при использовании раствора ацетата натрия с рН,5,5 ферментативная активность была низкой, однако оставалась постоянной после 50 повторных применений.
Пример 16
Переэтерификация/этерификация отработанного кулинарного жира, содержащего 10% FFA, с метанолом с получением биодизеля, воды и глицерина, с помощью первого варианта осуществления системы, проиллюстрированной на фиг. 22.
Условия реакции, отработанный кулинарный жир (1100 г), содержащий 2% 0,1 М раствора бикарбоната натрия и метанол (140 г), сначала предварительно смешали в предреакционном подготовительном сосуде 140 для образования эмульсии, которую затем ввели в реакторный сосуд 120, имеющий внутренний объем V2 приблизительно 2 литра. Реакционную смесь смешивали в реакторном сосуде 120 с липазой, полученной из Thermomyces lanuginosus, иммобилизированной на гидрофобной и пористой смоле на основе полистирола-дивинилбензола (30 вес. % от жира), в течение 6 часов при 30°С. Реакционную смесь отфильтровали через фильтр 125 и подали в сосуд 160 для отделения продуктов. Глицерин и избыточную воду удалили из реакционной смеси в сосуде 160 для отделения продуктов. Верхнюю фазу, содержащую сложные метиловые эфиры жирных кислот и непрореагировавшие глицериды, повторно ввели в реакторный сосуд 120 через линию 165 перенаправления и возобновили взбалтывание в реакторном сосуде 120 после добавления метанола (110 г) в реакционную среду в реакторном сосуде 120. Превращение в сложный метиловый эфир через 2 часа составило 98%. Эмульгированную реакционную среду (подготовленную эмульсию), содержащую отработанный кулинарный жир (83 вес. %), метанол (15%) и 0,1 М (2%) раствор бикарбоната натрия, непрерывно подавали в реакторный сосуд 120 со скоростью потока приблизительно 30 мл/мин. Превращение в сложные метиловые эфиры жирных кислот сохранялось до более 3 месяцев без значительных потерь активности при применении той же партии биокатализатора, полученного из липазы Thermomyces lanuginosus, иммобилизированной на макропористой гидрофобной смоле.
Реферат
Группа изобретений относится к ферментативному способу получения сложных алкилэфиров жирных кислот для применения в областях производства биотоплива, продуктов питания и детергентов и системе для осуществления такого способа. В способе используют ферменты, иммобилизированные на гидрофобной смоле, смешанной с источником жирных кислот и спиртом или донором спирта, в присутствии щелочного или слабощелочного водного буфера или в присутствии воды или водного раствора. Способ получения сложных эфиров жирных кислот осуществляют путем переэтерификации или этерификации одновременно или последовательно. Биокаталитическая активность сохраняется без значительных потерь активности при многократных применениях и также без накопления глицерина и водных побочных продуктов или других гидрофильных компонентов на биокатализаторе. Предложенная система включает оборудование и реактивы для осуществления способа с высокой эффективностью. 2 н. и 14 з.п. ф-лы, 23 ил., 16 пр.
Формула
Документы, цитированные в отчёте о поиске
Рафинирование масляных композиций

Комментарии