Рафинирование масляных композиций - RU2151788C1
Код документа: RU2151788C1
Чертежи
















Описание
Изобретение относится к новому способу обработки масляной композиции, содержащей насыщенные и ненасыщенные жирные кислоты в форме глицеридов, с целью получения рафинированного продукта с более высоким содержанием полиненасыщенных жирных кислот. В наиболее предпочтительных вариантах осуществления настоящего изобретения приводится способ повышения концентрации эйкозапентаеновой кислоты (ЕРА) и докозагексаеновой кислоты (DНА) в композиции рыбьего жира.
В настоящем описании полиненасыщенные кислоты идентифицируют в соответствии с системой, в которой омега- или n-число обозначает положение первой двойной связи, если считать от концевой метильной группы, например, в омега-3 или n-3 жирной кислоте первая двойная связь находится у третьей углерод-углеродной связи от концевой метильной группы кислоты. Далее, если жирную кислоту идентифицируют, например, как C18:3, то это означает, что жирная кислота содержит 18 атомов углерода и имеет три двойные связи.
Полиненасыщенными жирными кислотами, которые имеют важное промышленное значение, являются EPA
(эйкозапентаеновая
кислота, C20:5), DHA
(докозагексаеновая кислота, C22:6) и AA (арахидоновая кислота, C20:4). Полное номенклатурное название указанных кислот по системе Международного Союза чистой
и прикладной
химии:
EPA
цис-5,8,11,14,17-эйкозапентаеновая кислота
DHA
цис-4,7,10,13,16,19-докозагексаеновая кислота
AA
цис-5,8,11,
14-эйкозатетраеновая
кислота
Как известно, EPA и
DHA находят все большее применение, в частности, в фармацевтической и пищевой промышленности. Эти кислоты в довольно большом количестве
содержатся в некоторых
маслах, выделяемых из морских продуктов,
однако для многих применений необходимо рафинировать выделяемые из морских продуктов масла с целью увеличения содержания EPA и/или DHA
до приемлемых значений
или даже удаления некоторых других веществ,
которые содержатся в исходном природном сырье. Для фармацевтических целей и для использования в пищу, например, необходимо
практически полностью удалить
все остатки пестицидов, которые встречаются в
маслах, выделяемых из морских продуктов, даже полученных из рыбы, пойманной в морских акваториях, весьма удаленных от
интенсивно культивируемых районов
суши.
Если EPA и DHA должны проявлять биологическую активность и не быть токсичными, то они должны иметь полностью цис-конфигурацию (Z-Z), которая соответствует их встречающему в природе состоянию. Однако указанные кислоты являются чрезвычайно неустойчивыми по отношению к нагреванию и очень легко вступают в быстро протекающие реакции олигомеризации и изомеризации, легко образуют пероксиды. Таким образом, чрезвычайно сложно рафинировать композиции масел, выделяемые из морских продуктов и содержащие EPA и DHA, не рискуя потерять при этом указанные целевые кислоты в их полезной форме.
EPA и DHA содержатся в маслах, выделяемых из морских продуктов, в основном в виде их триглицеридов. До настоящего времени большинство применяемых способов рафинирования начинается либо с этерификации масла с помощью низкомолекулярных спиртов (обычно этанола), либо с гидролиза масла с образованием свободных кислот или их солей, после чего для выделения целевого продукта проводят фракционирование масла.
Однако вследствие сложного состава сырья, выделяемого из морских продуктов, производные полиненасыщенных кислот в достаточно чистом виде непросто получить, применяя методы с одним лишь фракционированием. Обычно используют сочетание разных методов, при этом конкретная выбранная их комбинация зависит от состава исходного сырья, концентрации и других критериев выделения целевого продукта. Одна из методик фракционирования, которая обычно используется в способах выделения больших количеств EPA и/или DHA, предусматривает использование мочевины.
Мочевина обладает полезным свойством образовывать твердые комплексы с органическими соединениями с длинной углеродной цепочкой. Когда композицию масла, выделяемую из морских продуктов и содержащую жирные кислоты или сложные эфиры, добавляют к раствору мочевины, то образуется кристаллический комплекс с более насыщенной фракцией кислот. Кристаллы можно отделить и получить рафинат, состоящий из более ненасыщенных жирных кислот или сложных эфиров жирных кислот.
Образование комплекса с мочевиной используют как для свободных жирных кислот, так и для метиловых или этиловых эфиров жирных кислот. Процесс можно проводить непрерывно, используя теплообменники, снабженные скребками, в качестве реакторов для проведения процессов поглощения с помощью мочевины. При фракционировании сложных эфиров обычно масло вначале взаимодействует со спиртом и/или смесью спирт-вода и затем перед осуществлением комплексообразования с помощью мочевины отделяют сложные эфиры от свободных кислот. Однако можно провести комбинированную in situ этерификацию и фракционирование с помощью мочевины, как это описано в Европейской патентной заявке EP-A-0 255824.
Если указанный способ применяют в сочетании, например, с двумя или большим количеством стадий молекулярной дистилляции, то из исходного масла, выделяемого из морских продуктов, можно получить очищенный продукт, содержащий 85 мас.% или более n-3 полиненасыщенных жирных кислот, в основном EPA и DHA. Однако общий выход рафинированного продукта является слишком низким. При проведении обычной процедуры в промышленности с использованием указанного стандартного способа фракционирования можно извлечь 60 - 80 т 85%-ного концентрата n-3 жирных кислот из 1000 т рыбьего жира, т.е. степень извлечения составляет лишь 6-8%. Столь маленький выход продукта означает, что указанные способы не только являются очень дорогими, но и требуют объемного сложного оборудования.
Липофильный характер многих загрязняющих окружающую среду веществ (например, пестицидов и полихлорированных бифенилов) приводит к накоплению указанных соединений в липидах, содержащихся в морских продуктах. К сожалению, мочевина не образует комплексы со многими указанными загрязняющими окружающую среду веществами, и в итоге концентрат после осуществления комплексообразования с помощью мочевины содержит по сравнению с исходным маслом, выделяемым из морских продуктов, повышенное, а для многих целей неприемлемо высокое количество пестицидов и других загрязняющих окружающую среду продуктов. Таким образом, существующие способы очистки на основе комплексообразования с помощью мочевины с целью получения рафинированного рыбьего жира для использования человеком должны включать сложные и дорогие методы очистки, позволяющие снизить уровни содержаний загрязняющих окружающую среду веществ до приемлемых значений.
Целью настоящего изобретения является улучшенный способ повышения содержания полиненасыщенных жирных кислот в масляной композиции, выделяемой из морских продуктов, в частности промышленный способ, пригодный для осуществления процесса выделения EPA и/или DHA с повышенным выходом из рыбьего жира.
Как известно, липазы хорошо подходят в качестве катализаторов для процессов, в которых применяют очень неустойчивые n-3 полиненасыщенные жирные кислоты, такие как EPA и DHA, встречающиеся в маслах, выделяемых из морских продуктов. Это объясняется их способностью реагировать при низких температурах, нейтральности их pH и мягкого действия, которые помогают предотвратить протекание нежелательных побочных реакций, таких, как цис-транс изомеризация, миграция двойных связей, полимеризация, окисление и т.п. Так, использование липаз для гидролиза жирных кислот, содержащихся в маслах, выделяемых из морских продуктов, достаточно полно описано в литературе.
Например, в публикации Lie and Lambertsen, Comp. Biochem. Physiol. 80B (N. 3), pp. 47-450 (1985), сообщается, что кишечная липаза, выделенная из трески, преимущественно гидролизует полиненасыщенные жирные кислоты 18:4, 20:5 и 22:6, которые присутствуют в виде триглицеридов в масле мойвы. Авторы сообщают, что указанная специфичность особенно ярко выражена для кислоты 20: 5, т.е. EPA.
С другой стороны. Lie and Lambertsen также показали, что C14 -C18 насыщенные и мононенасыщенные жирные кислоты предпочтительно гидролизуются в виде триглицеридов из масла мойвы под действием липазы Candida cylindracea, в то время как длинноцепочечные моноены, C10:1 и C22:1 и, в частности, полиненасыщенные кислоты C18:4, и в меньшей степени EPA и DHA, более устойчивы к гидролизу (Lie and Lambertsen, Fette, Seifen, Anstrichmittel, Bd. 88, S. 365, 1986).
В патентной заявке Японии 59-14793 (Noguchi et al.) описывается способ получения концентратов высокополиненасыщенных жирных кислот на основе аналогичной избирательности липазы по отношению к насыщенным и ненасыщенным кислотам. Этиловые эфиры из различных масел, выделяемых из морских продуктов, таких как масло сардины и скумбрии, гидролизуют различными липазами (Candida cylidracea, Aspergillus rhizopus и Mucor miehei). Селективный гидролиз позволяет получить после отделения гидролизованных жирных кислот концентраты этиловых эфиров с содержанием до 25% EPA и до 17% DHA.
В другом патенте Японии 172691 ("Nippon Oil Fats", 1990) описывается способ, основанный на гидролизе масел, выделяемых из морских продуктов, с помощью липазы Candida sp. EPA или ее сложный эфир получают из компонентов свободной кислоты, а DHA или ее сложный эфир - из остаточного глицеридного компонента. Дальнейший процесс предусматривает разделение компонентов жирной кислоты и глицерида, этерифицирование низшим алкилом, концентрирование полиненасыщенных жирных кислот с использованием комплекса с мочевиной и дальнейшую очистку методом молекулярной дистилляции, жидкостной экстракции суперкритическим диоксидом углерода или жидкостной хроматографии. Takagi (Am. Oil Chem. Soc., vol. 66, p. 488, 1988) описывает способ на основе обратного процесса разделения EPA и DHA с использованием иммобилизованной липазы Mucor miehei.
Концентраты полиненасыщенных кислот, получаемые из масла японской сардины по методу образования аддукта с мочевиной, этерифицируют метанолом в н-гексане при комнатной температуре. Липаза выбирает между EPA и DHA, и селективная этерификация позволяет получить обогащенный метиловым эфиром EPA концентрат, содержащий 51% EPA и 6% DHA, а также обогащенный DHA концентрат свободной жирной кислоты, содержащий 52% DHA и 12% EPA в соотношении соответственно 59 к 41.
Совсем недавно Yamane с сотрудниками применили несколько липаз для селективного гидролиза масла печени трески и рафинирования масла сардин (Agric. Biol. Chem., vol. 54, p. 1459, 1990). Наилучшие результаты получены для нерегиоспецифической липазы Candida cylindracea и 1,3-специфической липазы Aspegillus niger, однако ни одна из липаз не оказалась в состоянии значительно увеличить содержание EPA в глицеридных продуктах.
Из предшествующих исследований по использованию липаз для гидролиза сложных эфиров жирных кислот из масла, выделяемого из морских продуктов, вытекает, что различные липазы ведут себя совершенно по-разному и что липазы часто проявляют ярко выраженную селективность по отношению к одной из двух жирных кислот или по отношению к одному из типов жирных кислот.
Проявляемую некоторыми липазами селективность по отношению к субстрату использовали Zuyi and Ward, которые описывают катализируемый липазой алкоголиз масла из печени трески при получении фракции, обогащенной n-3 полиненасыщенной жирной кислотой (Zuyi and Ward, "Lipase-catalyzed alcoholysis to concentrate the n-3 polyunsaturated fatty acid of cod liver oil". Enzyme Microb. Technol. , 1993, vol. 5, July, 601-606). Авторы изучили девять липаз и обнаружили, что липаза Pseudomonas sp. (CES от компании "Amano International Enzyme Co") осуществляет алкоголиз рыбьего жира с большей скоростью, чем другие липазы, и приводит к получению моноглицеридов с повышенным содержанием EPA и DHA. В этом известном способе спирт (использовали этанол и изопропанол) играет роль как реагента, так и растворителя для проведения реакции.
Zuyi and Ward изучили влияние концентрации воды, содержащейся в реакционной среде, и обнаружили, что алкоголиз (в изопропаноле) под действием липазы CES ускоряется при содержании воды в интервале 0-7,5 об.% Полученные данные свидетельствуют, что оптимальным является содержание воды 5 об.% и что даже при содержании воды 2,5 об.% более 40% исходных триглицеридов, содержащихся в масле, не вступили в реакцию даже по прошествии 12 ч (следует понимать, что это количество воды относится к воде, добавленной в реакционную систему, и не учитывает то небольшое количество воды, которое неизбежно содержится в рыбьем жире и "сухом" ферменте). Таким образом, наблюдается значительный гидролиз триглицеридов до свободных жирных кислот (обычно более 30%), например, при содержании воды 5 об.% гидролиз протекает на 18,9% (по сравнению всего лишь 15,5% для алкоголиза).
Хотя способ Zuyi and Ward представляет научный интерес, он, к сожалению, не является улучшенным способом промышленного получения очищенных композиций EPA/DHA. В частности, неизбежное присутствие в продукте при катализе липазой значительных количеств свободной жирной кислоты осложняет последующую очистку целевых n-3 полиненасыщенных жирных кислот. Так, вследствие низкой летучести свободные жирные кислоты не могут быть отделены от глицеридов обычным методом молекулярной дистилляции. Более того, поскольку сложные эфиры и свободные кислоты существенно отличаются по своей полярности, в то время как моно- и диглицериды занимают промежуточное положение, их нельзя отделить от глицеридов с помощью экстракции. Как показано далее, в настоящем изобретении, напротив, можно использовать методы молекулярной дистилляции не только для отделения глицеридов полиненасыщенных жирных кислот от сложных эфиров насыщенных и мононенасыщенных жирных кислот, но и осуществить удаление из фракции глицеридов целевых полиненасыщенных кислот загрязняющих окружающую среду веществ, таких как пестициды и полихлорированные бифенилы.
Неожиданно обнаружено, что в соответствии с настоящим изобретением некоторые специфические липазы, в том числе липаза Pseudomonas sp., которую применили Zuyi and Ward, могут использоваться для селективной переэтерификации сложноэфирных фрагментов насыщенных и мононенасыщенных жирных кислот в триглицеридах из масла, выделяемого из морских продуктов, в условиях практически безводной реакции. Было обнаружено, что указанная переэтерификация приводит при отсутствии заметного сопутствующего гидролиза к получению смеси моноэфиров более чувствительных к действию фермента жирных кислот, а оставшиеся n-3 полиненасыщенные длинноцепочечные жирные кислоты остаются связанными с фрагментом глицерина в виде сложных эфиров, в основном в виде моно- и диглицеридов, но также и в виде триглицеридов в зависимости от степени конверсии.
В настоящем изобретении, в частности, заявляется способ обработки масляной композиции, содержащей
насыщенные и ненасыщенные жирные
кислоты в форме
триглицеридов, с целью получения очищенного продукта с повышенным содержанием полиненасыщенных жирных кислот, который включает;
(a)
проведение реакции переэтерификации
масляной композиции с
помощью (C1-C6) спирта практически в безводных условиях и в присутствии липазы, которая предпочтительно катализирует переэтерификацию
насыщенных и мононенасыщенных жирных кислот,
при этом количество
указанного (C1-C6)спирта, применяемого в реакции, составляет не более 15 молярных эквивалентов по отношению к количеству
триглицеридов; и последующее
(b) отделение
оставшейся фракции,
обогащенной глицеридами полиненасыщенных жирных кислот, от фракции, содержащей сложные эфиры насыщенных и мононенасыщенных
жирных кислот, полученных в результате указанной реакции
переэтерификации,
катализируемой липазой.
Как указано, в способе по настоящему изобретению используют липазу, которая проявляет активность, выражающуюся в предпочтительной переэтерификации насыщенных и мононенасыщенных жирных кислот, содержащихся в масле, выделяемом из морских продуктов. Показано, что многие липазы обладают очень слабой активностью или вовсе ею не обладают в реакции переэтерификации по настоящему изобретению или проявляют низкую селективность как по отношению к насыщенным и мононенасыщенным жирным кислотам, с одной стороны, так и полиненасыщенным жирным кислотам, с другой стороны. Это относится, например, к Geotrichum candidum (GCL; Amano GC), Aspergillus niger (ANL; Amano A), Candida rugosa (CRL; Amano AY), Chromobacterium viscosum (CVL; Sigma), Humicula lanuginosa (HLL; Amano CE), Rhizopus delemar (RDL; Amano D), Rhizopus oryzae (ROL; Amano F), Penicillium camembertii (PCL; Amano G), Cendida lipolytica (CLL; Amano L), Mucor javanicus (MJL; Amano M) и Rhizopus niveus (RNL; Amano N). Было обнаружено, что Candida antarctica (CAL; Novo SP435) высоко активна в реакции переэтерификации, но, к сожалению, проявляет низкую селективность или вовсе не обладает селективностью по отношению к различным классам жирных кислот, а потому непригодна для использования по настоящему изобретению.
Примерами липаз, которые, как оказалось, работоспособны в способе по настоящему изобретению, являются липаза Mucor miehei (MML; Novo Lipozym), которая проявляет хорошую активность при переэтерификации и обладает разумной селективностью как по отношению к полиненасыщенным жирным кислотам, так и по отношению к насыщенным и мононенасыщенным жирным кислотам; липазы Candida cylindracea (CCL; Sigma) и Penicillum roquefortii (PRL; Amano R), обе из которых проявляют удовлетворительную селективность, хотя их активность ниже, чем некоторых других липаз; липазы Pseudomonas fluorescens (PFL; Amano PS) и Pseudomonas sp. (PSL; Amano AK), обе из которых обладают хорошей активностью и проявляют хорошую селективность, а потому часто предпочтительны для использования по настоящему изобретению.
Иммобилизация липазы на носитель может обеспечить несколько преимуществ. Например, иммобилизация придает липазам большую стабильность, так что они могут служить дольше. Она позволяет проще провести выделение и осуществить их повторное использование, что значительно снижает стоимость. Кроме того, реакции этерификации легче проводятся в том случае, когда применяют иммобилизованный фермент, и липаза становится доступной для проведения непрерывных процессов, что может также оказаться важным для промышленного осуществления способов с применением фермента. В некоторых случаях иммобилизация приводит к увеличению работоспособности фермента. Наконец, дисперсия липазы на поверхности носителя должна обеспечивать лучший контакт липазы с субстратом, что приводит к значительному увеличению активности фермента на единицу веса и значительному снижению дозы фермента и, таким образом, затрат.
Если необходимо получить композицию очищенного рыбьего жира, обогащенную как по EPA, так и по DHA, то предпочтительно использовать липазу, которая проявляет значительную активность по отношению к обеим указанным n-3 полиненасыщенным жирным кислотам, т.е. липазу, которая не обладает яркой выраженной избирательностью по отношению к EPA и DHA. В этом случае преимущественно используют липазы Pseudomonas fluorescens и Pseudomonas sp., при этом последняя является наиболее предпочтительной. Указанные липазы поставляются компанией "Amano International Enzyme Co of Nagoya" (Япония).
Важной особенностью настоящего изобретения является то, что катализируемая липазами переэтерификация должна проводиться в практически безводных условиях. Общее количество воды в реакционной системе из всех источников, включая масло, выделяемое из морских продуктов, и липазы, должно составлять менее 1 мас.%, предпочтительно менее 0,5 мас.% и наиболее предпочтительно в интервале от 0,01 - 0,25 мас.% (В типичном случае исходное масло, выделяемое из морских продуктов, содержит 0,1-0,2 мас.% воды; абсолютный спирт, применяемый в качестве реагента, содержит 0,2- 0,5 мас.% воды и препарат липазы содержит 2 - 2,5 мас.% воды).
Однако использовать полностью безводные условия реакции не представляется возможным, так как небольшие количества воды, обычно около 1 - 2 мас.% от веса липазы, всегда необходимы в ферментативной системе для появления активности, однако это количество в значительной степени зависит от изучаемого фермента (например, липаза Candida cylindrica требует для проявления своей активности по настоящему способу добавления приблизительно 10 мас.% воды). Как показано далее в примерах, эти очень небольшие количества воды не приводят к какому-либо значительному гидролизу, так что становится возможным сохранять концентрацию свободной жирной кислоты в полученном в результате переэтерификации продукте на уровне ниже 3 мас.%, что приблизительно соответствует лишь 10% от уровня гидролиза, о котором сообщают Zuyi and Ward (см. выше).
Другая важная особенность настоящего изобретения заключается в том, что количество присутствующего спирта не должно превышать 15 молярных эквивалентов, преимущественно не более 9 молярных эквивалентов, по отношению к количеству имеющихся триглицеридов (стехиометрическое количество составляет 3 молярных эквивалента). Таким образом, спирт является в основном реагентом, а не растворителем. Удивительно, что катализируемая липазой селективная переэтерификация триглицеридов масла, выделяемого из морских продуктов, протекает столь успешно в такой практически свободной от растворителя системе. Преимущественно используют практически стехиометрическое количество спирта, т. е. от 2 до 5 молярных эквивалентов по отношению к количеству имеющихся триглицеридов, поскольку количество спирта, значительно превышающее стехиометрическое, приводит к снижению выхода целевых полиненасыщенных жирных кислот.
Хотя можно использовать любой (C1-C6)спирт, применение абсолютного спирта (обычное содержание воды составляет от 0, 1 до 0,5 мас.%) является предпочтительным из соображений доступности и стоимости, при этом следует учитывать и требование обеспечения практически безводных условий реакции.
Температура, при которой проводится реакция переэтерификации, не является критической. Однако было показано, что селективность реакции уменьшается с увеличением температуры, хотя скорость реакции возрастает. В общем случае предпочтительно проводить реакцию, в зависимости от используемой липазы, при температуре не более 50 - 60oC, более предпочтительно при комнатной температуре (около 20oC).
Переэтерификацию можно проводить, используя в качестве реакционной среды суперкритические жидкости, в частности суперкритический диоксид углерода. Например, этанолиз рыбьего жира проводят в суперкритическом диоксиде углерода при температуре 40oC под давлением 250 бар. Суперкритический жидкий диоксид углерода может использоваться не только в качестве реакционной среды, но также и для разделения сложных эфиров и свободных жирных кислот от оставшихся глицеридов.
Катализируемую липазой переэтерификацию триглицеридов масла,
выделяемого из морских продуктов, в соответствии с настоящим изобретением можно схематично представить в виде следующего упрощенного
уравнения реакции, используя этанол в качестве примера (C1-C6)
спирта:
Стадия (a)
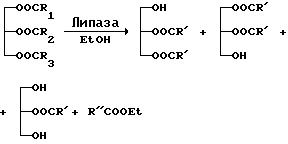
где R1, R2, R3 обозначают смешанные жирные кислоты (насыщенные, мононенасыщенные и полиненасыщенные), которые присутствуют в качестве триглицеридов в исходной композиции;
R' обозначает n-3 полиненасыщенные жирные кислоты; и
R'' обозначает насыщенные и мононенасыщенные жирные кислоты
(для простоты в правой части уравнения показаны лишь 1,2- и 2,3-диглицериды и 2-моноглицериды).
Отделение фракции этиловых эфиров от фракции глицеридов удобно проводить по методу молекулярной дистилляции, при этом относительно летучие этиловые эфиры могут быть сравнительно легко отделены от менее летучей остающейся смеси триглицеридов. Поскольку продукт реакции переэтерификаии содержит небольшие количества свободных кислот, как следствие применения практически безводных условий реакции, то после молекулярной дистилляции можно получить остаточную фракцию, которая практически не содержит нежелательных насыщенных и мононенасыщенных жирных кислот. Даже если в итоге проведения стадии молекулярной дистилляции в дистилляте может быть получена небольшая часть наиболее летучих моноглицеридов, они предпочтительно представляют собой моноглицериды жирных эфиров с относительно короткими цепочками (т.е. в дистиллят попадает небольшое количество EPA и DHA или не попадает вовсе). Аналогично небольшая часть сложноэфирной фракции с низкой летучестью может сохраниться в оставшейся смеси глицеридов, т.е. сложных эфиров преимущественно длинноцепочечных жирных кислот, таких как EPA и DHA. Таким образом, часть относительно небольшого количества целевых полиненасыщенных жирных кислот, которые участвуют в переэтерификации, тем не менее сохраняется в оставшейся фракции после дистилляции. Таким образом, несмотря на то, что молекулярная дистилляция обычно не считается пригодной для проведения сложных разделений, в нашем способе она неожиданно предоставляет преимущества.
Поскольку вещества, загрязняющие окружающую среду, такие, как пестициды и полихлорированные бифенилы более летучи, чем глицериды длинноцепочечных жирных кислот, то молекулярная дистилляция приводит к удалению этих соединений из глицеридной фракции, при этом они концентрируются в дистилляте (сложноэфирной фракции). Это еще одно преимущество, которое предоставляет молекулярная дистилляция в настоящем изобретении.
В самом деле,
специфическим аспектом настоящего изобретения является способ удаления веществ, загрязняющих окружающую среду, из композиции масла, содержащей насыщенные и
ненасыщенные жирные кислоты в форме
триглицеридов, при этом способ включает стадии:
(a) проведения реакции переэтерификации композиции масла с помощью (C1-C6) спирта практически в безводных
условиях и в присутствии липазы,
которая предпочтительно катализирует переэтерификацию насыщенных и мононенасыщенных жирных кислот, при этом количество указанного (C1-C6) спирта, участвующего в
реакции, составляет не более 15
молярных эквивалентов по отношению к количеству триглицеридов; и последующее
(b) проведение для продукта, полученного на стадии (a), одной или большего
количества молекулярных дистилляций,
с целью выделения фракции, обогащенной глицеридами полиненасыщенных жирных кислот, из которой преимущественно удалены вещества, загрязняющие окружающую среду.
Способ по настоящему
изобретению особенно пригоден для получения композиций, содержащих высокие концентрации, более 40 мас.%, преимущественно более 70 мас.%, EPA и DHA, полученных из
морских продуктов. Поскольку продукт
катализируемой липазой переэтерификации содержит нежелательные ненасыщенные или мононенасыщенные жирные кислоты предпочтительно в форме их этиловых эфиров (если
применяют этиловый спирт), а не в
виде свободных кислот (полиненасыщенные жирные кислоты остаются в виде глицеридов), то фракцию насыщенных жирных кислот можно отделить с помощью молекулярной
дистилляции в относительно мягких
условиях, при этом потеря компонентов целевых полиненасыщенных жирных кислот сравнительно низка. В то же время относительно более летучие вещества, загрязняющие
окружающую среду, такие как пестициды
и полихлорированные бифенилы удаляются вместе с фракцией этиловых эфиров, как это указано ранее. Таким образом, по сравнению с обычными способами получения
концентратов EPA/DHA, настоящее
изобретение, в частности, предпочтительные варианты осуществления настоящего изобретения, предоставляет значительные преимущества, среди которых можно упомянуть:
(i) отсутствие какого-либо
растворителя приводит к значительному уменьшению объемов реагентов, при этом указанное действие усиливается за счет возможности использовать лишь стехиометрические
концентрации спирта,
(ii)
реакцию переэтерификации можно проводить в мягких условиях, в частности при комнатной температуре, сокращая до минимума побочные реакции, при этом не требуются
затраты большого количества энергии,
(iii) степень извлечения EPA и DHA очень велика и выделенный продукт практически не содержит веществ, загрязняющих окружающую среду, и
(iv)
использование практически безводных
условий реакции означает, что наблюдается минимальный гидролиз, при этом молекулярная дистилляция глицеридной фракции после реакции переэтерификации приводит к
надежному отделению целевых
полиненасыщенных жирных кислот от нежелательных насыщенных и мононенасыщенных жирных кислот.
Таким образом, процесс алкоголиза по настоящему изобретению
может быть первоначальной
стадией интегрированного промышленного способа получения концентрата EPA + DHA. В этом интегрированном процессе после проведения молекулярной дистилляции или очистки по
другому методу, с целью
отделения фракции этиловых эфиров насыщенных жирных кислот от фракции глицеридов полиненасыщенных жирных кислот, последнюю фракцию, которая содержит целевые полиненасыщенные
жирные кислоты, можно
далее подвергнуть обработке для увеличения концентрации конкретных присутствующих кислот. Например, если необходимо получить концентрат
композиции этиловых эфиров EPA и DHA, то
фракцию глицеридов,
полученную после молекулярной дистилляции, можно, например, этерифицировать путем химической переэтерификации абсолютным этанолом в присутствии каталитического количества,
например,
этоксида натрия
или этоксида калия. Этот процесс можно схематично представить следующим уравнением реакции
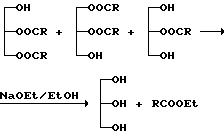
(для простоты показаны лишь 1,2- и 2,3-диглицериды и 2-моноглицериды).
Образовавшийся глицерин можно затем удалить известными способами. Обычно эта процедура позволяет повысить содержания EPA + DHA приблизительно до 45-50 мас.%, т.е. достичь очень высокой степени извлечения полиненасыщенных кислот по сравнению с обычным способом.
В частности,
предпочтительный интегрированный способ получения композиции с высоким содержанием EPA + DHA в соответствии со способом по настоящему изобретению включает далее следующие
стадии:
(c)
переэтерификация глицеридной фракции низшим спиртом, в частности этанолом, с использованием химического катализа, в частности, в щелочной среде, содержащей основание, такое как
этоксид натрия или
калия, в количестве, необходимом лишь для катализа переэтерификации, или с использованием ферментативного катализа, в частности, с помощью липазы Candida antarctica практически в
безводных условиях;
(d) нагревание полученного алкилового эфира с избытком мочевины в алканоле до температуры в интервале от 55 до 99oC;
(e) охлаждение продукта,
полученного на стадии (d),
в
частности, до температуры приблизительно 0-25oC, с целью осаждения аддукта алкилового эфира жирной кислоты с мочевиной, а затем отделение указанного аддукта,
при этом остается раствор,
который в основном содержит эфиры n-3 жирных кислот;
(f) выделение алкиловых эфиров n-3 жирных кислот из раствора, оставшегося на стадии (e); и
(g)
удаление любого растворителя из
смеси, полученной на стадии (f).
В наиболее предпочтительном варианте осуществления указанного интегрированного способа концентрат, полученный на стадии (g), далее концентрируют с помощью одной или более, например девяти, стадий молекулярной дистилляции с целью увеличить содержание EPA + DHA в нем до 85 мас.% или более.
На фиг. 1 схематично показан этот интегрированный способ в соответствии с настоящим изобретением для получения концентрата, содержащего 85 мас.% этиловых эфиров EPA + DHA.
В качестве альтернативы химической переэтерификации глицеридной фракции, например, этанолом в присутствии каталитического количества этоксида натрия или калия, можно провести переэтерификацию ферментативно, в частности, с использованием липазы Candida antarctica. Эта липаза очень активна по отношению к n-3 полиненасыщенным жирным кислотам, а также к другим жирным кислотам и может использоваться для осуществления с высокой эффективностью переэтерификации глицеридной фракции в мягких условиях и без растворителя, что приводит к дальнейшему уменьшению объема используемых реагентов.
В некоторых случаях может оказаться необходимым выделить практически чистую индивидуальную кислоту из исходной композиции масла, выделенной из морских продуктов. Указанный способ получения отдельно практически 100%-ной EPA и отдельно практически 100%-ной DHA схематично показан на фиг. 2. В этом способе осуществления настоящего изобретения для первичного разделения насыщенных и ненасыщенных жирных кислот в соответствии с описанием настоящего изобретения используют не только липазу Pseudomonas (PSL), но на следующей стадии и липазу Mucor miehei (MML), которая селективно способствует переэтерификации EPA, а не DHA, что позволяет провести хорошее разделение этих двух кислот, и липазу Candida antarctica (CAL), чтобы осуществить этанолиз полученной таким образом смеси глицеридов, обогащенной DHA.
В частности, предпочтительный интегрированный способ по настоящему изобретению для получения практически чистой EPA и практически чистой DHA включает следующие
стадии:
(i)
переэтерификация исходного масла, выделяемого из морских продуктов, этанолом с использованием PSL, при этом реакция проводится практически в безводной среде, как это описано
ранее;
(ii)
молекулярная дистилляция продукта, полученного после катализируемой липазой переэтерификации, с целью выделения фракции глицеридов, содержащей 40-50% EPA плюс DHA;
(iii)
переэтерификация
фракции глицеридов, полученной на стадии (ii), этанолом с использованием липазы Mucor miehei (MML) в аналогичных условиях проведения реакции переэтерификации, что и при первичной
переэтерификации
(т.е. практически в отсутствие как растворителя, так и воды, и использование практически стехиометрических количеств этанола);
(iv) разделение полученной EPA-обогащенной
фракции этиловых
эфиров и оставшейся DHA-обогащенной смеси глицеридов методом молекулярной дистилляции аналогично стадии (ii);
(v) переработка EPA-фракции этиловых эфиров, например, с
использованием
молекулярной дистилляции в сочетании с осаждением мочевиной, хроматографией и т.п., с целью концентрировать фракцию EPA до практически 100%-ной чистоты;
(vi) переэтерификация
DHA-обогащенной
смеси глицеридов, полученной на стадии (iii) после катализируемой действием MML реакции, этанолом с использованием липазы Candida antarctica (CAL); и
(vii) выделение
полученного концентрата
этилового эфира DHA с использованием методик, аналогичных применяемым на стадии (v), с целью выделения практически 100%-но чистой DHA.
Хотя важным преимуществом настоящего изобретения является то, что оно хорошо приспособлено для использования в интегрированных процессах получения композиций с высоким содержанием EPA и/или DHA, следует отметить, что те же общие методы могут использоваться для изолирования других ненасыщенных жирных кислот из компонентов масла, выделяемого из морских продуктов, в частности, жирных кислот 18:4 n-3, 20:4 n-3, 21:5 n-3 и 22:5 n-3. Способ по настоящему изобретению применим для масляных продуктов, содержащих полиненасыщенные жирные кислоты из других источников, в частности, продуктов ферментации и масел, выделяемых из овощей, и растительных масел. Для растительных масел и масел, выделяемых из овощей, характерны n-6 полиненасыщенные жирные кислоты. Из n-6 жирных кислот интерес представляют арахидоновая кислота (AA, 20:4 n-6), бисгомо-γ-линоленовая кислота (+BHGLA, 20:3 n-6) и -γ-линоленовая кислота (GLA, 18:3 n-6). Масляные продукты, содержащие арахидоновую кислоту, также промышленно получают путем ферментации с использованием Mortierella.
Было обнаружено, что по способу настоящего изобретения легко можно получить композиции, содержащие, по меньшей мере, 40 мас.% арахидоновой кислоты из растительного масла или масла, выделяемого из овощей. Предпочтительными липазами для использования в данном способе являются липаза Pseudomonas sp. и липаза Pseudomonas fluorescens. Фракцию арахидоновой кислоты можно далее концентрировать практически до 100%-ой чистоты.
Предпочтительный способ получения согласно изобретению
композиции с
содержанием по меньшей мере 40
мас.% арахидоновой кислоты включает в себя следующие дальнейшие стадии:
(с) переэтерификацию глицеридной фракции низшим спиртом в щелочной среде
с
использованием химического катализа или
ферментативного катализа в присутствии липазы;
(d) охлаждение продукта, полученного на стадии (d), для осаждения аддукта алкилового эфира жирной
кислоты с мочевиной с последующим отделением
указанного аддукта от раствора, в основном содержащего эфиры n-6 жирных кислот;
(f) выделение алкиловых эфиров n-6 жирных кислот из раствора,
оставшегося на стадии (e);
(g) удаление
любого растворителя из смеси, полученной на стадии (f).
В общем случае композиция масла, выделяемая из морских продуктов, которая служит исходным веществом в способе согласно изобретению, может быть любым сырым или подвергнутым частичной обработке маслом рыб или других морских продуктов, которое содержит иные кислоты, в том числе полиненасыщенные жирные кислоты, в форме триглицеридов. Как правило, каждая молекула триглицерида в таком масле, выделяемом из морских продуктов, содержит более или менее в случайном сочетании фрагменты сложных эфиров различных жирных кислот, насыщенных, мононенасыщенных или полиненасыщенных с длинными или короткими цепочками.
Настоящее изобретение поясняется следующими примерами.
ПРИМЕР 1
Цель
этого эксперимента - изучение использования нескольких липаз в способе по отделению полиненасыщенных жирных кислот, в частности EPA и DHA, от
насыщенных и мононенасыщенных жирных кислот, содержащихся
в композиции рыбьего жира.
Испытывают липазы, представленные в таблице в примере 1.
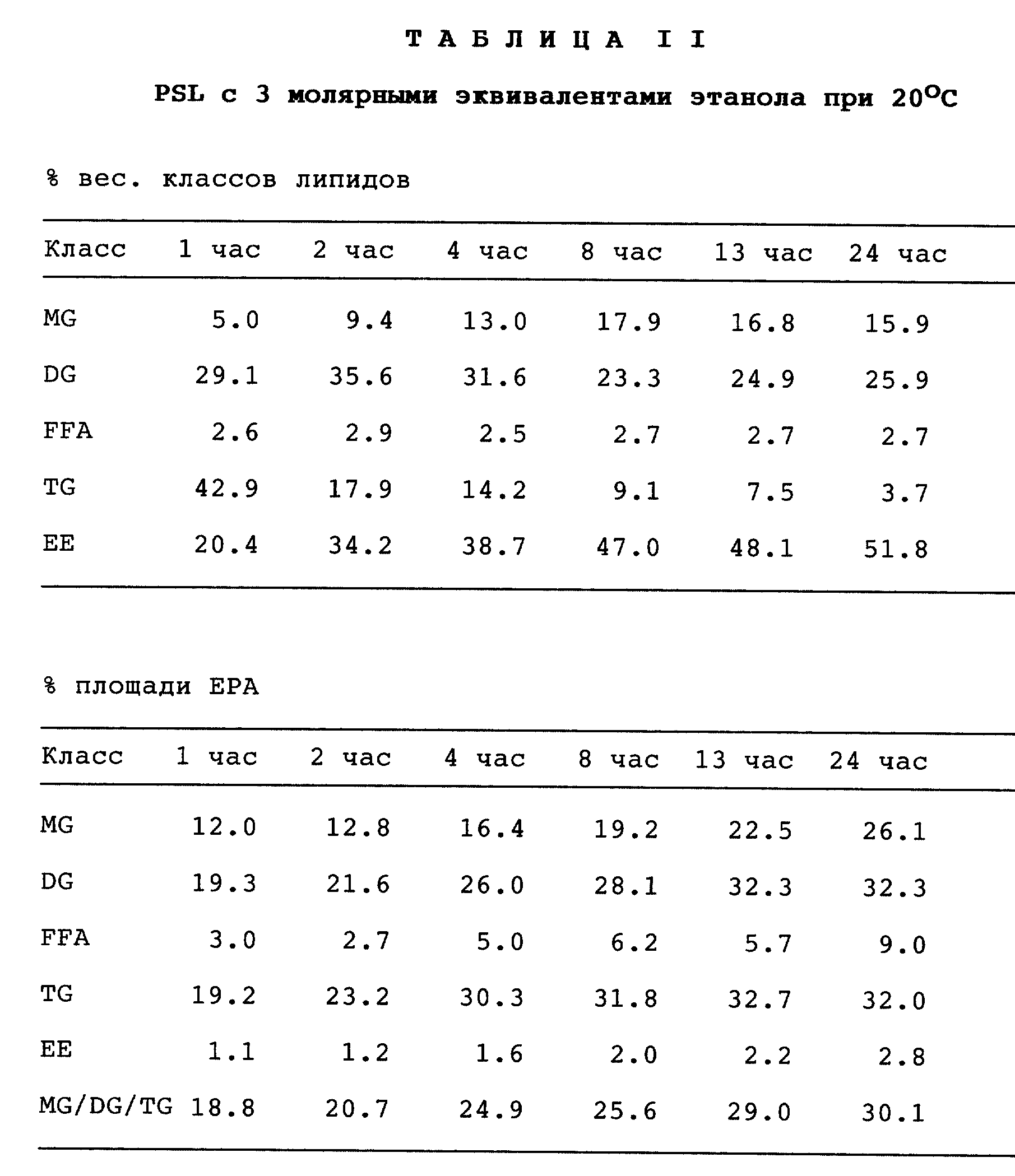
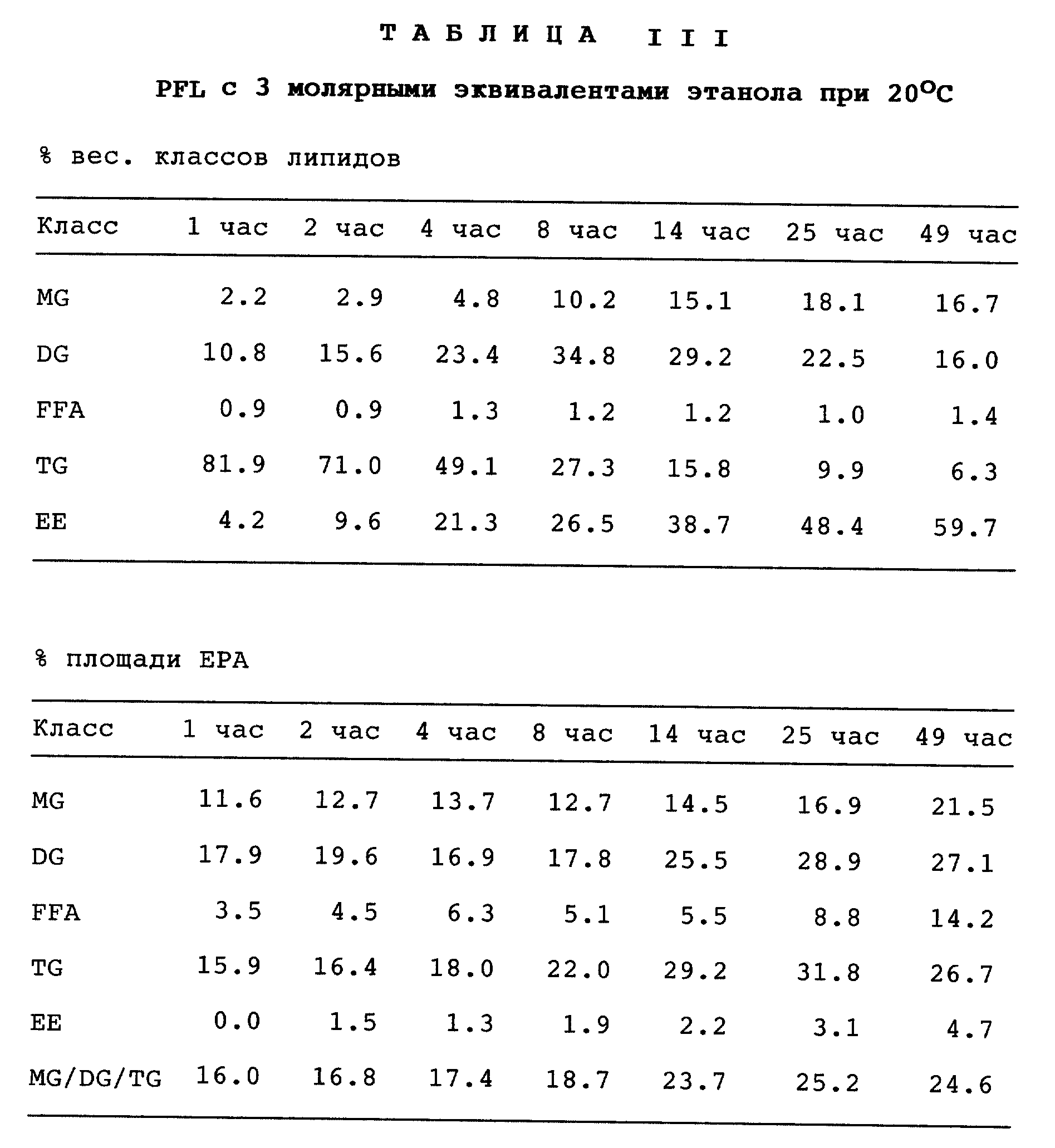
В одном из тестов вышеуказанные липазы испытывают при температуре 37oC; полученные результаты приведены в табл. I. В другом эксперименте две липазы Pseudomonas, PFL и PSL испытывают при температуре 20oC; полученные результаты приведены в табл. II и III.
При проведении испытаний применяют следующие методики.
Триглицериды рыбьего жира поставляются компанией "Pronova Biocare a.s." (Норвегия) и содержат 14.9% EPA и 9.8% DHA. Их используют в том виде, в каком они приходят от поставщика, без дальнейшей обработки. Все растворители соответствуют качеству "чистый для анализа" и поставляются фирмой "Merck AG" (Германия). Если специально не оговаривается, используют стехиометрическое количество этанола (абсолютного), т.е. 3 молярных эквивалента по отношению к триглицеридам. За исключением того случая, когда используют липазу Candida cylindracea, в реакционную систему не добавляют воду. По оценке количество воды, содержащееся в исходных триглицеридах рыбьего жира и липазе, составляет порядка 0.3-0.4 мас.%. В случае липазы Candida cylindracea добавляют воду в количестве 10 мас.% по отношению к весу липазы, что приводит к общему содержанию воды в реакционной системе приблизительно 0.8 мас.%, т.е. даже в этом случае применяют практически безводные условия проведения реакции.
Анализ жирных кислот проводят по их метиловым эфирам на газовом хроматографе Perkin-Elmer 8140 на капиллярной колонке DB- 225 30N длиной 30 м и диаметром 0,25 мм, используя в качестве газа-носителя водород, в соответствии с ранее описанной методикой (G.G. Haraldsson and О. Almarsson, Acta Chemica Scandinavica, 1991, vol. 45, 723-730). Для получения подробных данных исследований для PSL и PFL, приведенных соответственно, в табл. II и III, для отделения липидных фракций от реакционной смеси через определенные промежутки времени, с целью контролировать ход протекания реакций, применяют тонкослойную хроматографию. Используют пластины с силикагелем от компании "Merck" (Арт. 5721) после промывки их смесью хлороформ - метанол (50:50) и сушки при температуре 110oC в течение 30 мин. Элюирование осуществляют смесью петролейный эфир - диэтиловый эфир - уксусная кислота (80:20:1). Rhodamine 6G ("Merck") используют для визуализации полос, которые затем соскабливают, жир метилируют и анализируют, как указано выше. В качестве внутренних стандартов в образцы перед инжекцией добавляют метиловые эфиры C19:0 или C21:0, которые поставляются компанией "Sigma".
В экспериментах, результаты которых приведены в табл. 1, разделение этиловых эфиров и глицеридов проводят на приборе Waters PrepL System 500A. Колонку PrePak 500/Silica Cartridge от компании "Millipore" элюируют 10%-ным раствором этилового эфира в петролейном эфире со скоростью подачи раствора 250 м/мин. После каждого эксперимента получают, как показывает детектор по показателю преломления, два пика, при этом первый появляется по прошествии приблизительного одного объема колонки и представляет собой чистые этиловые эфиры, а второй элюируется приблизительно по прошествии двух объемов колонки и содержит (по данным тонкослойной хроматографии) чистые триглицериды. Оставшиеся моно- и ди- глицериды вымывают из колонки метанолом.
В соответствии с обычной методикой липазу (0.5 г) добавляют к смеси рыбьего жира (5.0 г, приблизительно 5.67 ммол; мол. вес. приблизительно 882 г/мол) и абсолютного этанола (0,80 г, 17,4 ммол). Полученную суспензию фермента осторожно перемешивают при комнатной температуре (37oC в случае экспериментов, приведенных в табл. I) в атмосфере азота. По прошествии соответствующего количества времени реакцию прекращают, добавляя хлороформ, и фермент отделяют фильтрованием. Органический растворитель удаляют в вакууме (ротационным испарителем и вакуумным насосом), получая сырой продукт в виде смеси с количественным выходом. Продукт растворяют в равном объеме хлороформа и инжектируют в жидкостной хроматограф высокого давления, как описано ранее. Каждую фракцию отделяют и растворитель упаривают в вакууме, остаток взвешивают и наконец анализируют методом газовой хроматографии.
Если вместо препаративной хроматографии высокого давления применяют препаративную тонкослойную хроматографию, то из реакционной среды через определенное время с помощью пипетки Пастера отбирают небольшие пробы (100 - 200 мг). Частицы фермента отделяют фильтрованием через ватный тампон, размещенный внутри второй пипетки Пастера. Затем каждый образец разбавляют хлороформом (250 мг/мл) и наносят на тонкослойную пластинку.
Полученные результаты приведены в конце описания в табл. I-III.
В табл. I суммированы результаты экспериментов, которые проводят при температуре 37oC (при использовании 3 молярных эквивалентов этанола) со всеми испытуемыми липазами.
Результаты для Candida cylindracea (CCL) получены при добавлении 10% воды по отношению к весу липазы, поскольку указанная липаза неактивна в отсутствие воды. Следует отметить плохую селективность липазы Candida antarctica (CAL) по отношению к EPA и DHA, а потому эта липаза не применяется по настоящему изобретению. Напротив, все другие испытуемые липазы обладают удовлетворительной активностью и селективностью, а два образца Pseudomonas выделяются от остальных.
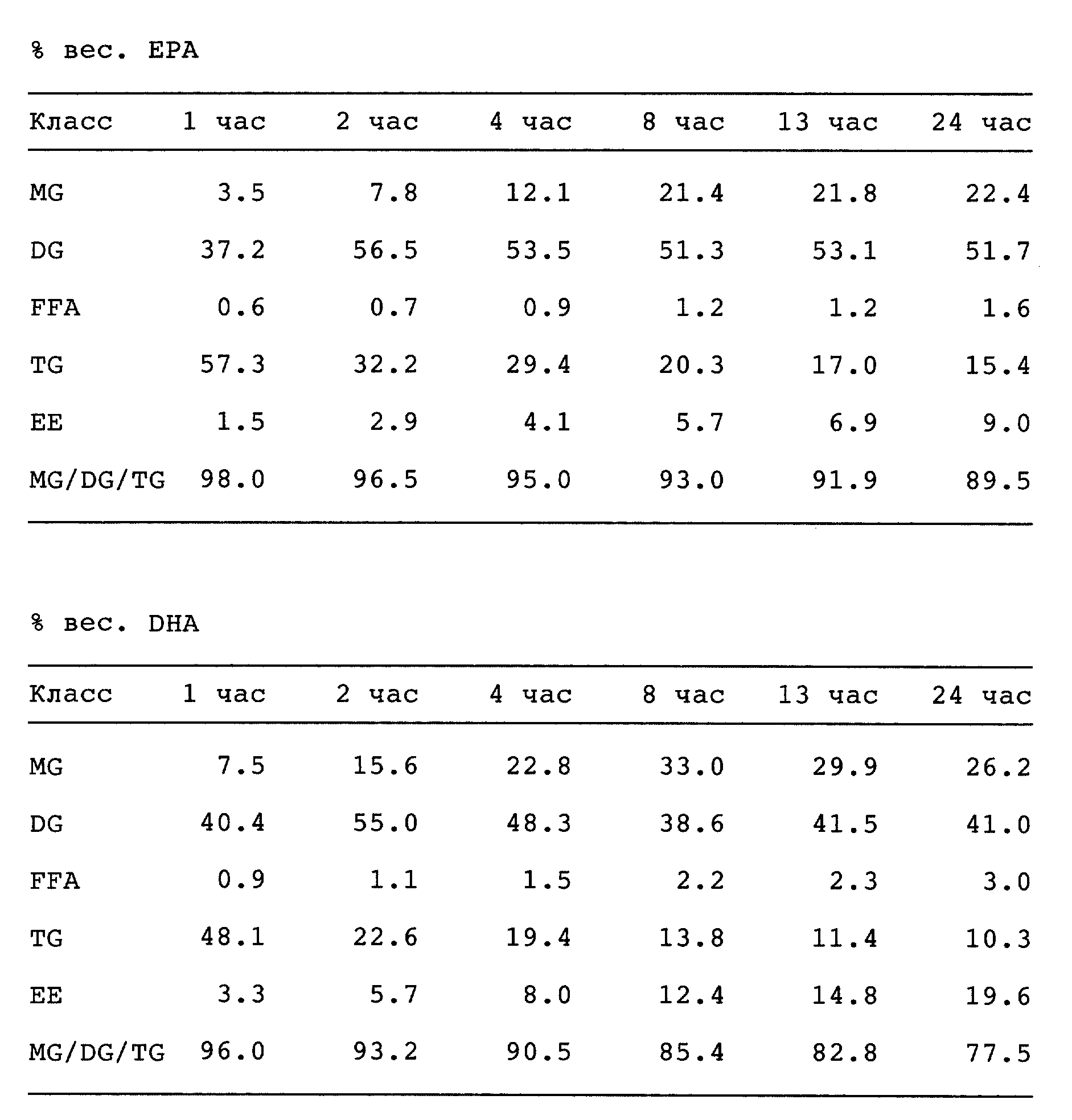
Приведенная табл. II показывает, что превосходные результаты в реакции переэтерификации получены для липазы Pseudomonas sp. Так, степень конверсии 48% достигается через 13 ч и приводит к содержанию EPA + DHA в глицеридах, равному 44,9%, что соответствует степени извлечения 91,9% для EPA и 82,8% для DHA. Через 24 ч протекания реакции степень конверсии составляет 52% и приводит к содержанию EPA + DHA в глицеридах, равному 45,8%, что соответствует степени извлечения 89,5% и 77,5% для EPA и DHA соответственно, указывая на то, что на практике удобнее останавливать реакцию на более ранней стадии. Степень побочной реакции гидролиза остается низкой и неизменной в течение всей реакции и составляет 2,5 - 2,9%.
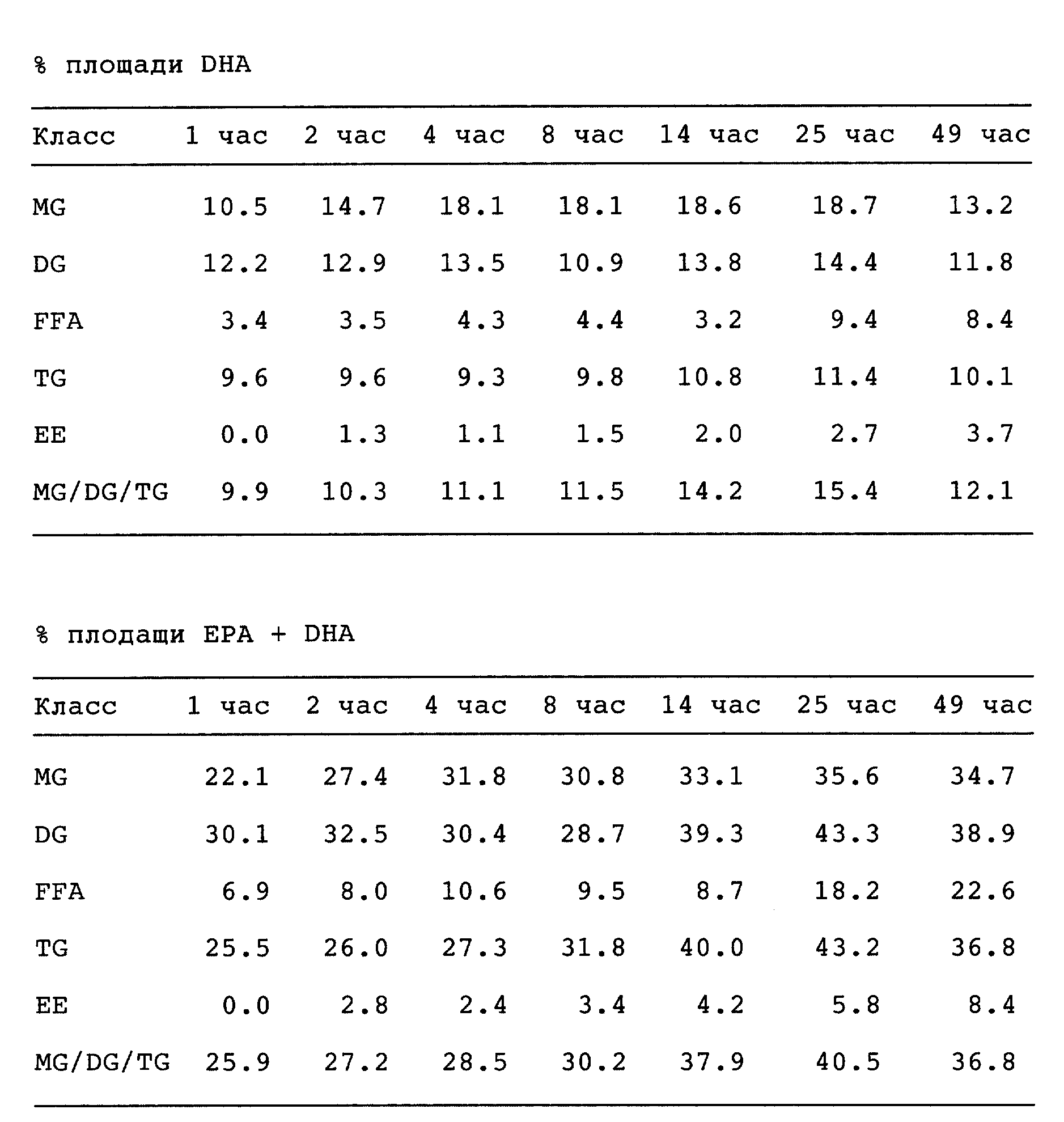
Табл. III показывает, что хорошие результаты переэтерификации получают также и для липазы Pseudomonas fluorescens, хотя скорость конверсии меньше, чем для PSL. Так, через 25 ч степень конверсии составляет 48%, и она возрастает до 60% через 49 ч. С другой стороны, степень гидролиза несколько ниже. Действие этой липазы также предпочтительно по сравнению с Pseudomonas sp. с точки зрения извлечения EPA и DHA (88,6% и 84,1%, соответственно) и количества EPA + DHA (40,5%) по прошествии 25 ч.
В табл. I
- III приняты следующие сокращения:
MG моноглицерид
DG диглицерид
TG триглицерид
FFA свободная жирная кислота
EE
этиловый эфир
% площади EPA
% площади DHA
% площади
EPA + DHA
% Площади определяют интегрированием соответствующих секторов газовой хроматографии
Указанные
сокращения используют во всех
остальных примерах.
Из приведенных данных следует, что обе липазы Pseudomonas проявляют уникально низкую активность по отношению к EPA и DHA, но очень высокую активность по отношению к исходным триглицеридам.
Следует также отметить, что две липазы Pseudomonas в некоторой степени благоприятствуют переэтерификации DHA, а не EPA. Это поведение является очень необычным, поскольку все остальные липазы, принимавшие участие в проведении испытаний, проявляют обратную тенденцию.
Из данных табл. II и III можно также сделать вывод, что по прошествии определенного времени отношение MG/DG/TG начинает отходить от оптимального. Таким образом, желательно завершить реакцию переэтерификации до того, как она полностью закончится.
ПРИМЕР 2
Цель этого
эксперимента - испытать две липазы Pseudomonas, PSL и PFL, при более крупных загрузках.
ПРИМЕР 2a - PSL
Липазу
Pseudomonas sp. (100 г,
25200 активных единиц на грамм)
добавляют к смеси рыбьего жира (1000 г, приблизительно 1,13 мол) и абсолютного спирта (170 г, 3,70 мол). Полученную суспензию фермента осторожно
перемешивают на
магнитной мешалке при комнатной
температуре в атмосфере азота. Расчетное содержание воды в реакционной смеси составляет приблизительно 0,3 - 0,4 мас. %.
Через 25 ч берут пробу в соответствии с методикой, приведенной в примере 1, и анализируют. Дают реакции протекать еще в течение 24 ч. Для выделения липазы из реакционной смеси применяют центрифугирование (5000 об/мин в течение 10 мин).
Когда реакцию прекращают через 50 ч, продукт имеет состав, представленный в табл. IV.
Часть продукта (902.4 г) подвергают дегазированию в вакууме при температуре 80oC, с целью удаления летучих компонентов. Летучие компоненты собирают в ловушке, охлаждаемой жидким азотом. После дегазирования получают 844.1 г смеси глицериды/этиловые эфиры. 756.3 г этой смеси подвергают перегонке в колонке для проведения молекулярной дистилляции при температуре 125oC и давлении 0.005 мбар. Получают 358,6 г (47,4%) дистилята и остаток, вес которого составляет 388,3 г (51, 3%). Фракции имеют состав, представленный в табл. V.
Табл. V показывает, что остаток содержит 47,3% EPA + DHA, т.е. более высокое содержание целевых n-3 полиненасыщенных кислот, чем до проведения молекулярной дистилляции (см. табл. IV). Это означает, что для дальнейшего концентрирования идеальным является использование известных методик, т.е. фракционирование с помощью мочевины с последующей молекулярной дистилляцией.
Следует отметить, что дистиллят содержит значительные количества моноглицеридов (10, 6%), в то время как остаток содержит 2,3% этиловых эфиров. Как указано ранее, это преимущественно моноглицериды жирных кислот с относительно короткими цепочками и этиловые эфиры жирных кислот с длинными цепочками соответственно.
ПРИМЕР 2b
1 кг того же самого рыбьего жира, что и в примере 2а, подвергают переэтерификации этанолом, используя фермент PFL.
Реакцию прерывают через 48 ч. Состав промежуточного продукта приведен в табл. VI.
Промежуточный продукт дегазируют и подвергают молекулярной дистилляции в тех же условиях, что и в примере 2а. Полученные результаты приведены ниже в табл. VIa.
ПРИМЕР 3
Продукты, полученные после трех опытов на пилотной линии, аналогичных опытам по примеру 2, анализируют с
целью
определить содержание веществ, загрязняющих окружающую
среду. Полученные результаты приведены ниже в табл. VII.
Приведенные выше результаты показывают, что вещества, загрязняющие окружающую среду, концентрируются во фракции этиловых эфиров. Для некоторых пестицидов уровни содержания в исходном веществе очевидно были ниже предела обнаружения применяемого метода анализа. По этой причине эти пестициды обнаружены во фракции этиловых эфиров, но не в исходном рыбьем жире. Странно то, что уровень содержания DDT по-видимому не возрастает во фракции этиловых эфиров по сравнению с исходным маслом. Перед разделением этиловых эфиров и глицеридов (методом молекулярной дистилляции) мы провели стадию мягкой молекулярной дистилляции с целью отделить непрореагировавший этанол от реакционной смеси. Вероятно эта стадия отделения этанола была достаточна для удаления части DDT. Анализ выделенного этанола (пример с PSL) показал общее содержание DDT, равное 0,03 мг/кг, но ни один из других пестицидов не обнаружен.
ПРИМЕР
4
Цель этого эксперимента - сравнение различных методов иммобилизации липаз и исследование эффекта от использования
липаз в
иммобилизованной форме в способе по настоящему изобретению.
A. Методика иммобилизации
(i) Мобилизация PSL и PFL на дуолите
Duolite A 562 ("Duolite
International"; 10,
0 г) промывают 3 - 4 раза 30 мМ раствором едкого натра (каждый
раз по 250 мл) в воронке Бюхнера и помещают в химический стакан емкостью 150 мл, добавляют воду (40 мл) и размещают
якорь магнитной
мешалки. pH полученного раствора доводят до 8 с помощью бюретки для
автоматического титрования (1,00 М NaOH). Если первоначальная величина pH меньше 5,0, то для достижения
равновесного значения pH = 8
может потребоваться значительное время. Если, напротив, значение
pH больше 8,0, то оно не уменьшится до тех пор, пока не добавляют раствор липазы. Липазу (2,0 г,
PSL/PFL), растворенную в воде (20 мл),
добавляют к раствору дуолита из пипетки Пастера. С помощью
бюретки для автоматического титрования значение pH в процессе добавления раствора поддерживают в
интервале 8.0 - 8,4 и перемешивают раствор
на магнитной мешалке в течение 1 ч. По прошествии
указанного времени 95 - 99% липазы иммобилизуется на дуолите. После перемешивания препарат липазы
промывают буферным раствором (Tris-HCl; pH 8.0).
Наконец, препарат иммобилизованной липазы сушат в
вакууме (0.1 - 0.01 мм рт. ст.) в течение 0.5-1 ч. Для ускорения процесса сушки можно использовать
паровую баню (40oC). Препарат
иммобилизованной липазы хранят в холодильнике (4o
C).
(ii) Иммобилизация PSL на амберлите
Смолу Amberlite XAD-7 (50 г;
"Rohm and Haas"; содержание воды 70%)
тщательно промывают 0.1 М буферным раствором фосфата натрия с pH
7.0 (дважды по 125 мл). Порошок PSL (Amano AK; 1.5 г; 20 000 единиц липазы, определяемых как
мкмол свободной кислоты, получаемой в
течение одной минуты при гидролизе трибутирина; 17 г единиц липазы
на грамм) растворяют в 0.1М буферном растворе фосфата натрия с pH 7,0 (200 мл). Если значение
pH падает, то его доводят до величины 7,
0. Затем раствор липазы добавляют к смоле и полученную суспензию
перемешивают до тех пор, пока иммобилизация не пройдет по крайней мере на 95% (приблизительно
1 ч), что определяют по измерению
активности в жидкости над осадком по методу гидролиза бутирина.
(iii) Определение активности препаратов иммобилизованной липазы
Иммобилизованную смолу (приблизительно 40 мг)
аккуратно взвешивают и добавляют н-бутиловый эфир пальмитиновой
кислоты (310 - 315 мг). К полученной смеси добавляют 95%-ный этанол (120 мкл) и смесь
хорошо перемешивают в течение 90 минут. Берут
образец и анализируют методом газожидкостной хроматографии.
Количество алкогольных единиц липазы определяют как количество этилового эфира пальмитиновой
кислоты (мкмол), которое образуется за одну
минуту.
B. Эксперименты по определению
производительности при использовании иммобилизованной PSL
Эксперименты на
производительность при этаноле рыбьего жира для PSL,
иммобилизованной как на дуолите, так и амберлите проводят по
следующей методике.
(i) Эксперименты по определению
производительности при использовании иммобилизованной PSL
Смешивают рыбий жир (100 г), абсолютный спирт (20 мл) и воду (1
мл) и полученную смесь энергично перемешивают до образования тонкой
дисперсии. К дисперсии добавляют безводную иммобилизованную липазу
(10 г) и энергично перемешивают по тех пор, пока не образуется
прозрачный раствор. Затем смесь осторожно перемешивают пока степень
превращения не составит приблизительно 50% (24 ч). Липазу отделяют
фильтрованием и используют при последующих экспериментах, а жир
анализируют, как указано ранее.
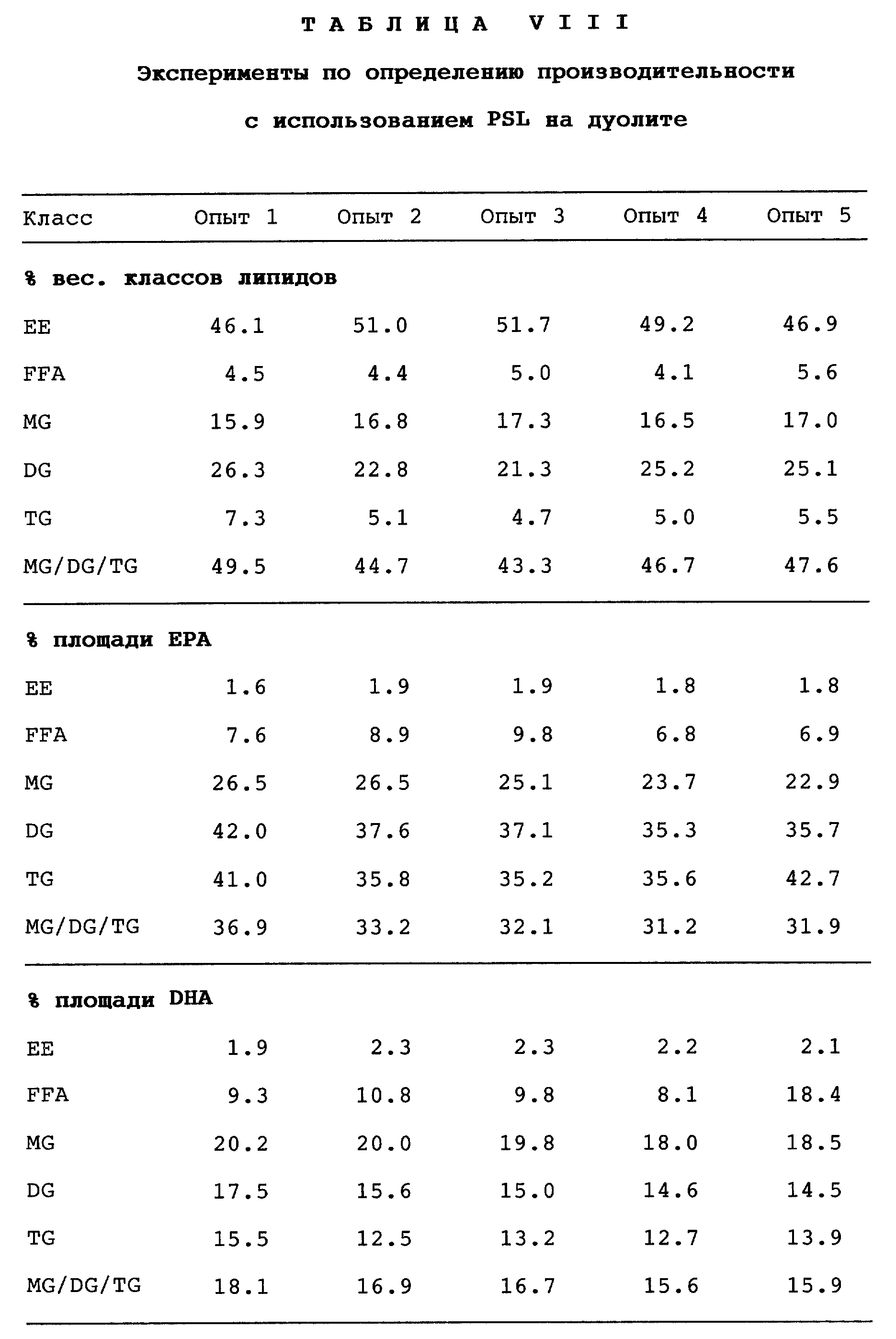
Результаты, полученные в экспериментах по определению производительности при использовании PSL, иммобилизованной на дуолите, приведены в табл. VIII.
Таблица VIII показывает, что в десяти последовательных экспериментах достигается сравнительно высокая степень конверсии (46 - 55%), что свидетельствует о продуктивности иммобилизованной липазы. Степень извлечения EPA и DHA устойчиво оказывается такой же или лучше, если судить по данным, приведенным в табл. II для порошка липазы, даже при том условии, что используют лишь одну пятую от указанного количества липазы. Таким образом, содержание EPA плюс DHA в получаемой смеси глицеридов остается очень высоким и составляет 44 - 55%. Степень побочной реакции гидролиза несколько выше, чем в табл. II, вероятно, вследствие большего количества воды, которое необходимо для иммобилизованной липазы, хотя содержание воды в реакционной смеси остается ниже обусловленного предела, составляющего 1%.
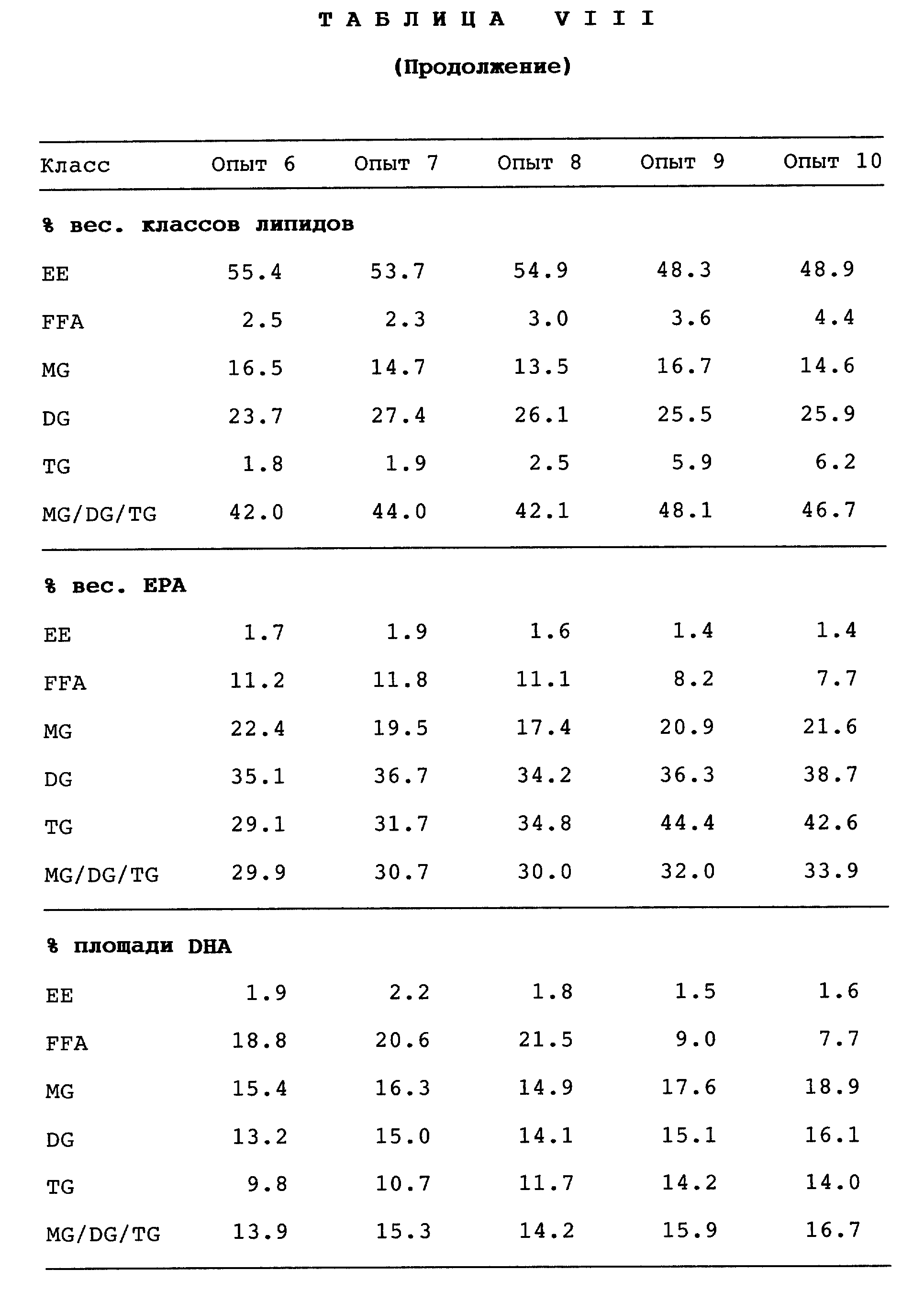
Результаты, полученные в экспериментах по определению производительности при использовании PSL, иммобилизованной на амберлите, которые проводят в тех же условиях, что и для дуолита, приведены в табл. IX.
Из табл. IX следует, что иммобилизация на амберлите даже более успешна, чем иммобилизация на дуолите. Количество иммобилизованной липазы составляет лишь половину от количества, необходимого при иммобилизации на дуолите (одна десятая от исходного количества порошка липазы), чтобы получить аналогичные результаты. Так, значительная степень конверсии (48 - 50%) достигается в восьми последовательных экспериментах по прошествии 24 ч, при этом содержание EPA + DHA в получаемой смеси глицеридов устойчиво составляет от 45 до 47%. Степень извлечения EPA и DHA остается схожей так же, как и степень протекания побочной реакции гидролиза (содержание воды ниже обусловленного предела в 1%, однако результаты гидролиза не включены в таблицу), если сравнивать с препаратами на дуолите.
ПРИМЕР 5
Цель этого эксперимента - изучение активности липазы
Candida antarctica (CAL) и липазы Mucor miehei (MML) при
этанолизе смеси глицеридов, полученной
переэтерификацией рыбьего жира в присутствии PSL, как это описано ранее.
(a) Этанолиз
глицеридов в присутствии CAL
Иммобилизованную CAL
(Novo-Nordisk, SP 435; содержание
воды 1 - 2%; 0.5 г) добавляют к смеси глицеридов (2.5 г; приблизительно 8.5 ммол эфирных эквивалентов;
первичная композиция: 25,0% EPA и 15,1% DHA; получают
катализируемой PSL переэтерификацией
рыбьего жира) и абсолютного этанола (0,80 г, 17,4 ммол). Полученную суспензию фермента осторожно перемешивают
при комнатной температуре в атмосфере азота. Через
определенные промежутки времени
отбирают пробы и анализируют, как описано ранее. Реакцию прерывают через 22 ч, отфильтровывая фермент.
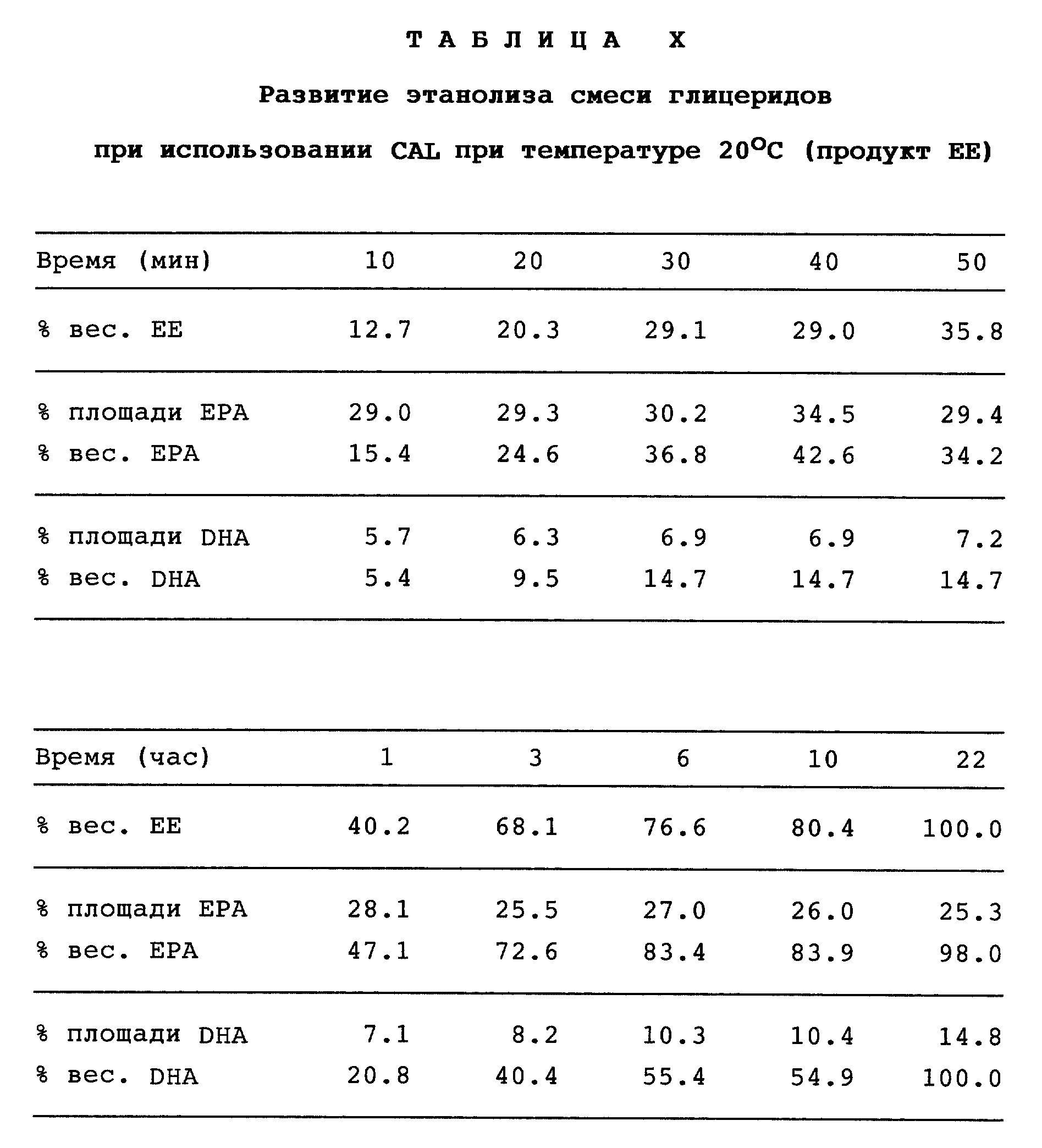
Полученные результаты приведены в табл. X.
Таблица X показывает, как протекает этанолиз смеси глицеридов в присутствии CAL при температуре 20oC. Берут приблизительно двоекратный избыток этанола по отношению к мольным эквивалентам сложноэфирных групп, присутствующих в первичной смеси глицеридов. В таблице приведен лишь состав сложноэфирного продукта. Как видно из таблицы, реакция протекает до конца через 22 ч. Кроме того, хотя липаза проявляет высокую активность по отношению как к EPA и DHA, видно, что она проявляет значительно большую активность по отношению к первой кислоте, т.е. EPA.
(b)
Этанолиз глицеридов в
присутствии MML
Условия реакции идентичны условиям реакции этанолиза с использованием CAL, как это описано выше в (a).
Иммобилизованную MML ("Novo-Nordisk", Liposyme,
содержание воды 10%; 0,
5 г) добавляют к смеси глицеридов (2,5 г; приблизительно 8,5 ммол сложноэфирных эквивалентов; первичная композиция: 25,0% EPA и
15,1% DHA; получают катализируемой PSL
переэтерификацией рыбьего жира)
и абсолютного этанола (0,80 г, 17,4 ммол). Полученную суспензию фермента осторожно перемешивают при комнатной температуре в
атмосфере азота. Через определенные
промежутки времени отбирают пробы и
анализируют, как описано ранее. Реакцию прерывают через 27 ч, отфильтровывая фермент.
Развитие процесса этанолиза в присутствии MML при температуре 20oC того же самого образца глицерида, что и использованный в реакции с CAL, показано далее в табл. XI.
Из табл. XI следует, что MML проявляет высокую избирательность по отношению к EPA и DHA в реакции этанолиза глицеридов, обогащенных EPA/DHA. При степени конверсии 50% через 27 ч протекания реакции приблизительно 80% первоначального количества DHA сохраняется в остаточной смеси глицеридов. Распределение EPA не столь благоприятно, при этом 55% находится в виде этиловых эфиров, а 45% все еще остается в глицеридном остатке. Ситуацию можно улучшить за счет проведения второй реакции этанолиза глицеридного остатка в тех же самых условиях. Следует также отметить, что активность MML обеспечивает возможность использовать в соответствии с этой методологией EPA-обогащенный рыбий жир для получения EPA, а DHA - обогащенный рыбий жир (в частности, тунцовый жир) для получения DHA.
ПРИМЕР 6
Цель этого эксперимента
- продемонстрировать применимость способа по
настоящему изобретению для растительных масел и масел, выделяемых из овощей.
PSL-катализируемый этанолиз
экстракта арахидоновой кислоты
(AA)
Экстракт арахидоновой кислоты
(AA, 20:4 n-6), поставляемый компанией "Pronova Biocare", содержащий 31,1% AA, подвергают обработке в соответствии с
методикой, приведенной в примере 1 для
рыбьего жира, т.е. используют 10% PSL в
виде порошка при температуре 20oC, степень конверсии 50%, 24 ч.
Полученные результаты приведены в табл. XII.
Табл. ХII показывает очень высокую степень извлечения АА из смеси глицеридов, составляющую 87% при степени конверсии 50%, т.е. выше, чем для DHA, но ниже, чем для EPA в соответствующих реакциях с рыбьим жиром. Степень протекания побочной реакции гидролиза сравнима с результатами экспериментов с рыбьим жиром и составляет 2%. Содержание AA в полученной смеси глицеридов составляет 54,2 %. Удивительно, что оно наибольшее во фракции TG и наименьшее во фракции MG.
Реферат
Использование: для обработки масляных композиций, содержащих насыщенные и ненасыщенные жирные кислоты в форме глицеридов. Для получения очищенного продукта с высоким содержанием полиненасыщенных жирных кислот масляную композицию подвергают обработке в присутствии липазы практически безводным спиртом в количестве не более 15 молярных эквивалентов по отношению к количеству триглицеридов. Липаза предпочтительно катализирует переэтерификацию насыщенных и мононенасыщенных жирных кислот. Затем проводят отделение оставшейся фракции, обогащенной глицеридами полиненасыщенных жирных кислот. В предпочтительных вариантах получают композиции с повышенной концентрацией эйкозапентаеновой кислоты и докозагексаеновой кислоты из рыбьего жира. Технический результат - повышение выхода полиненасыщенных жирных кислот. 2 c. и 24 з. п. ф-лы, 12 табл., 2 ил.


Комментарии