Способ получения гетерологичных белков - RU2487168C2
Код документа: RU2487168C2
Чертежи


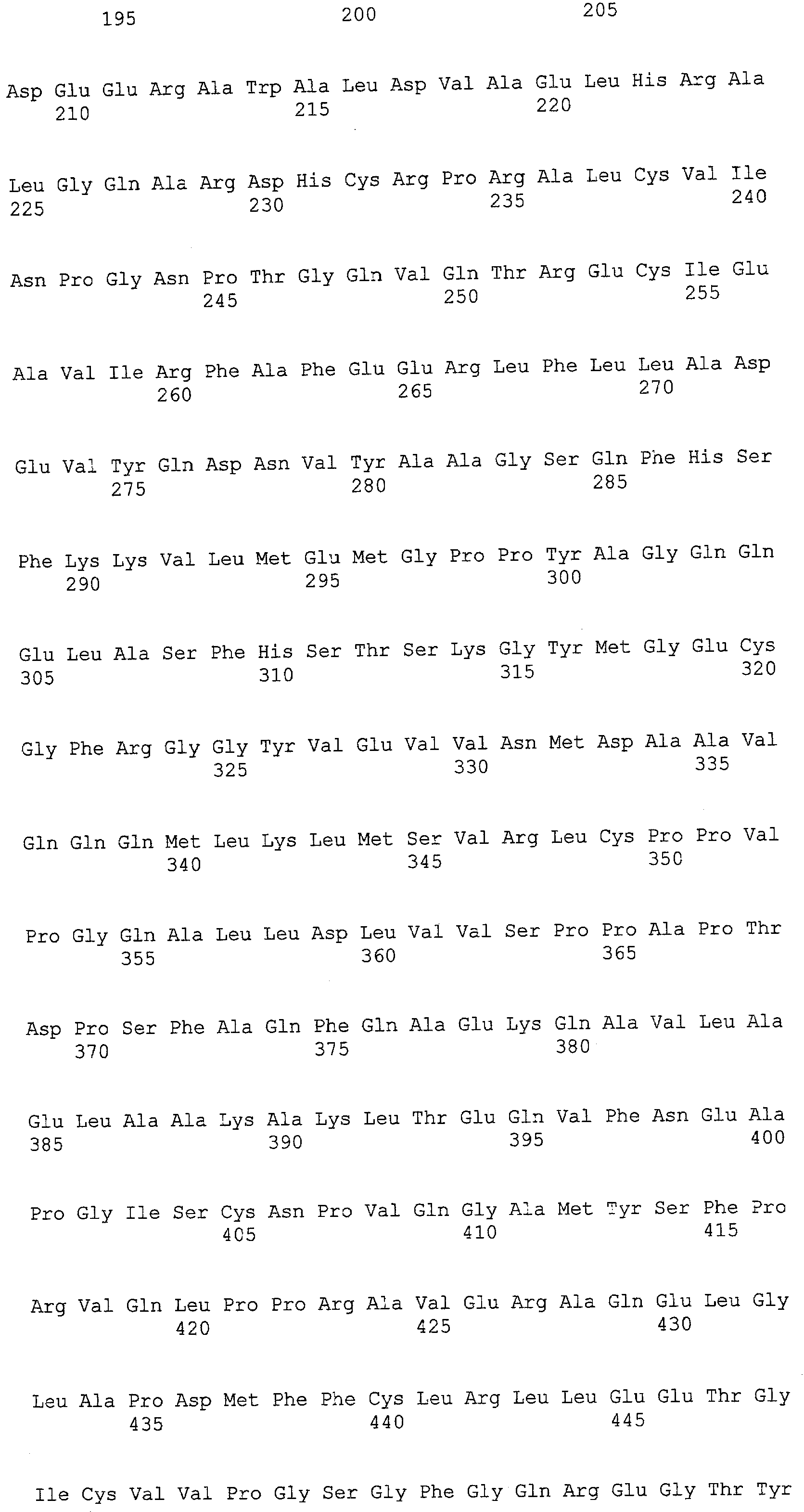




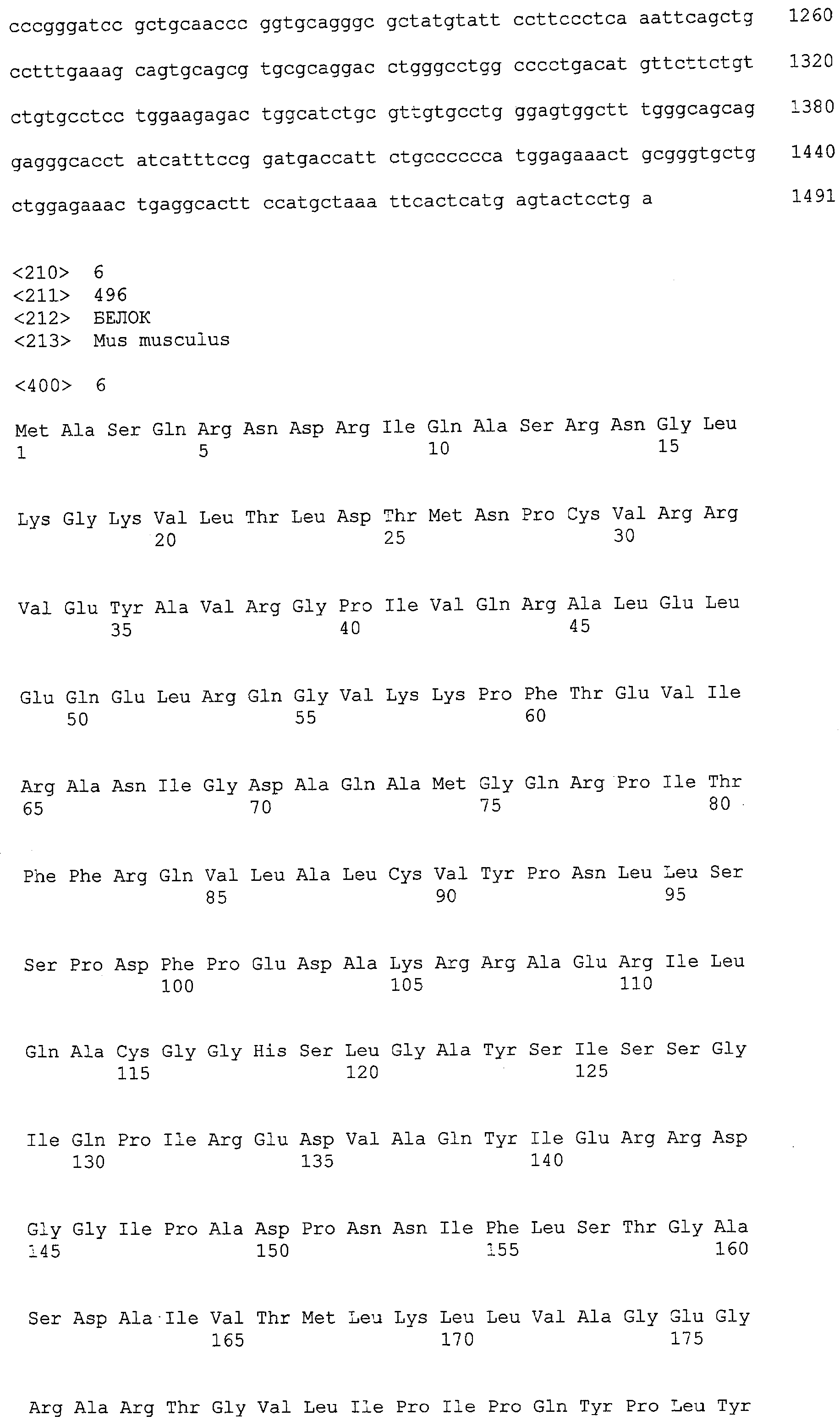



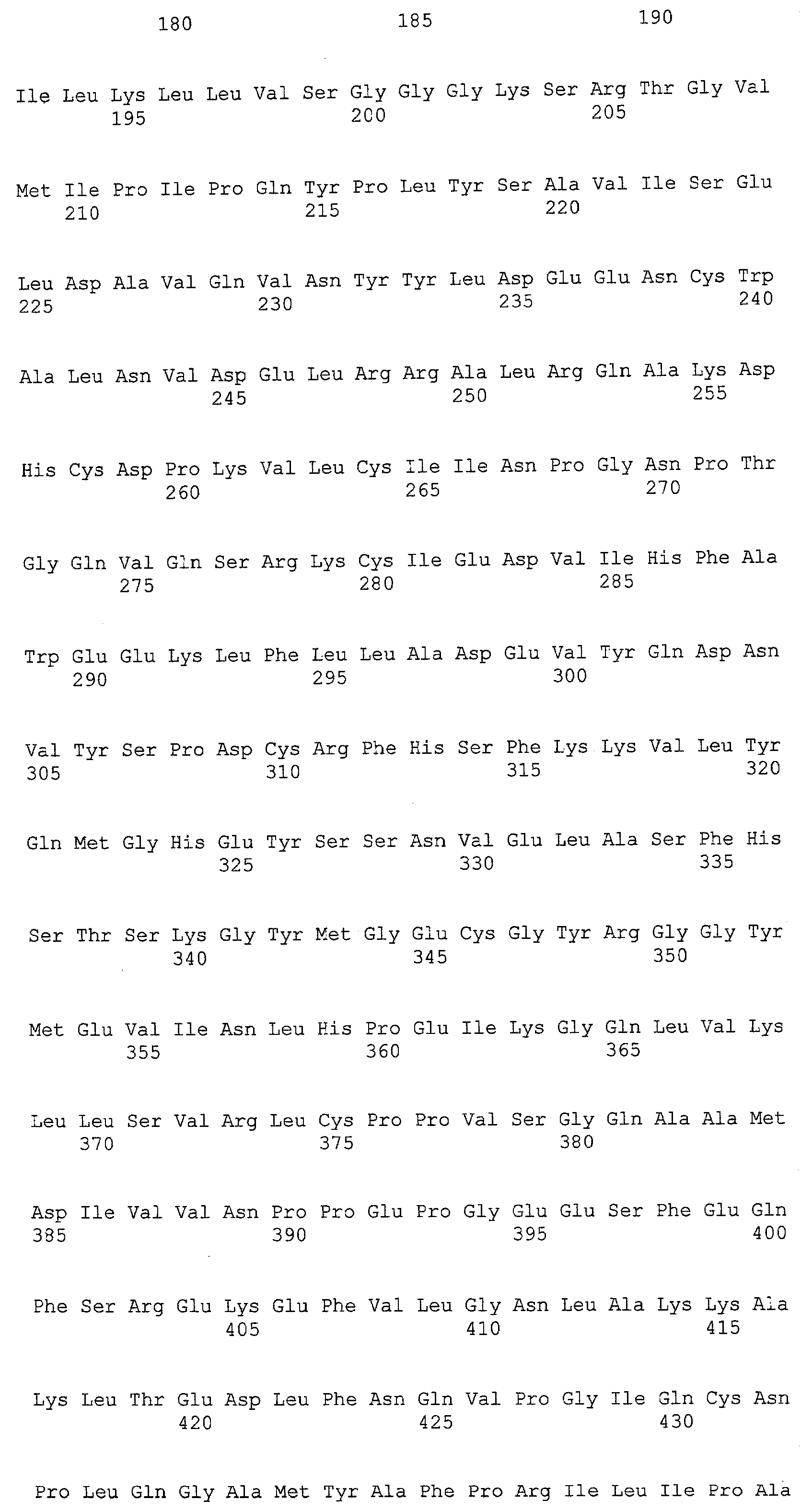


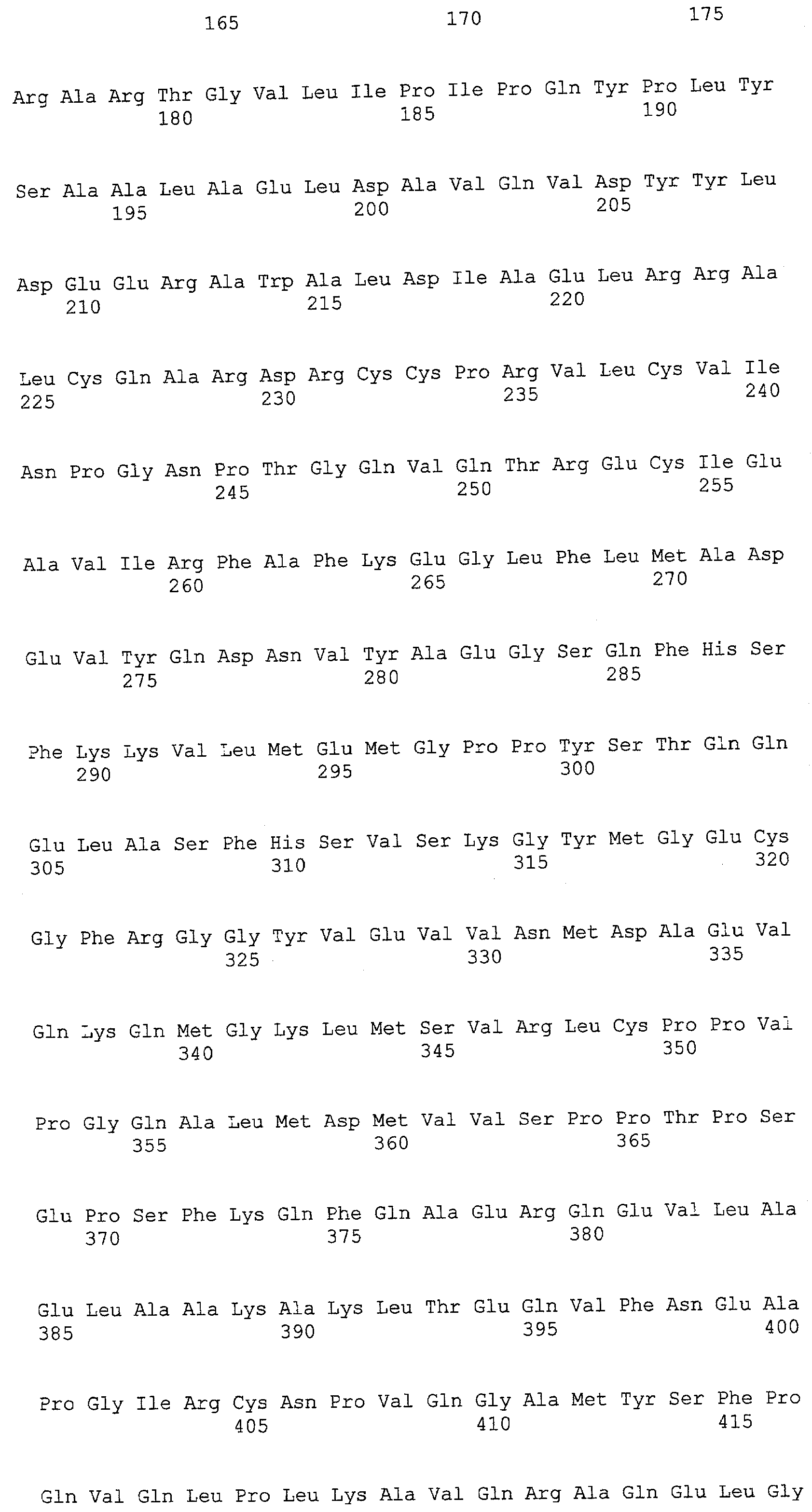

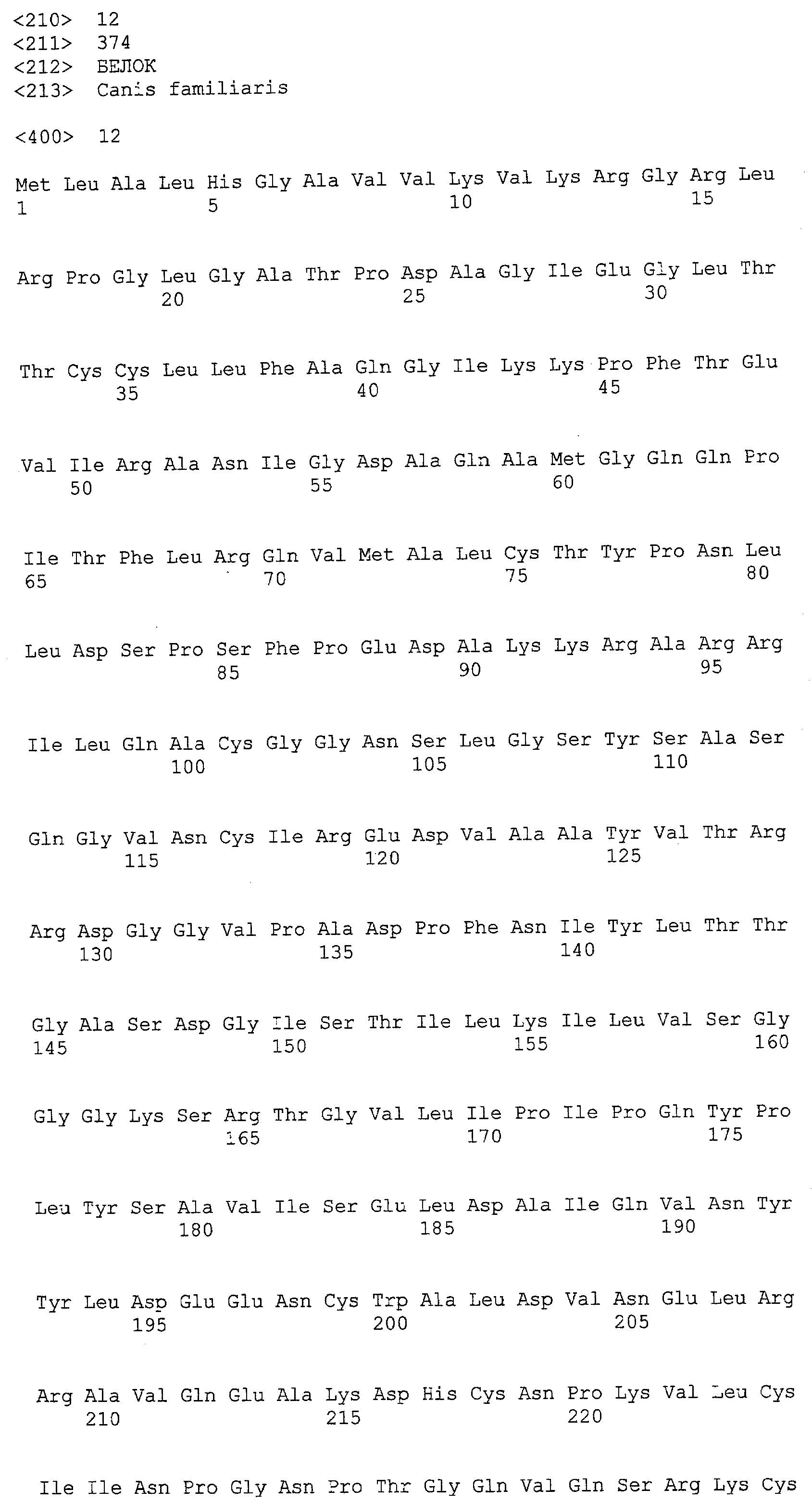


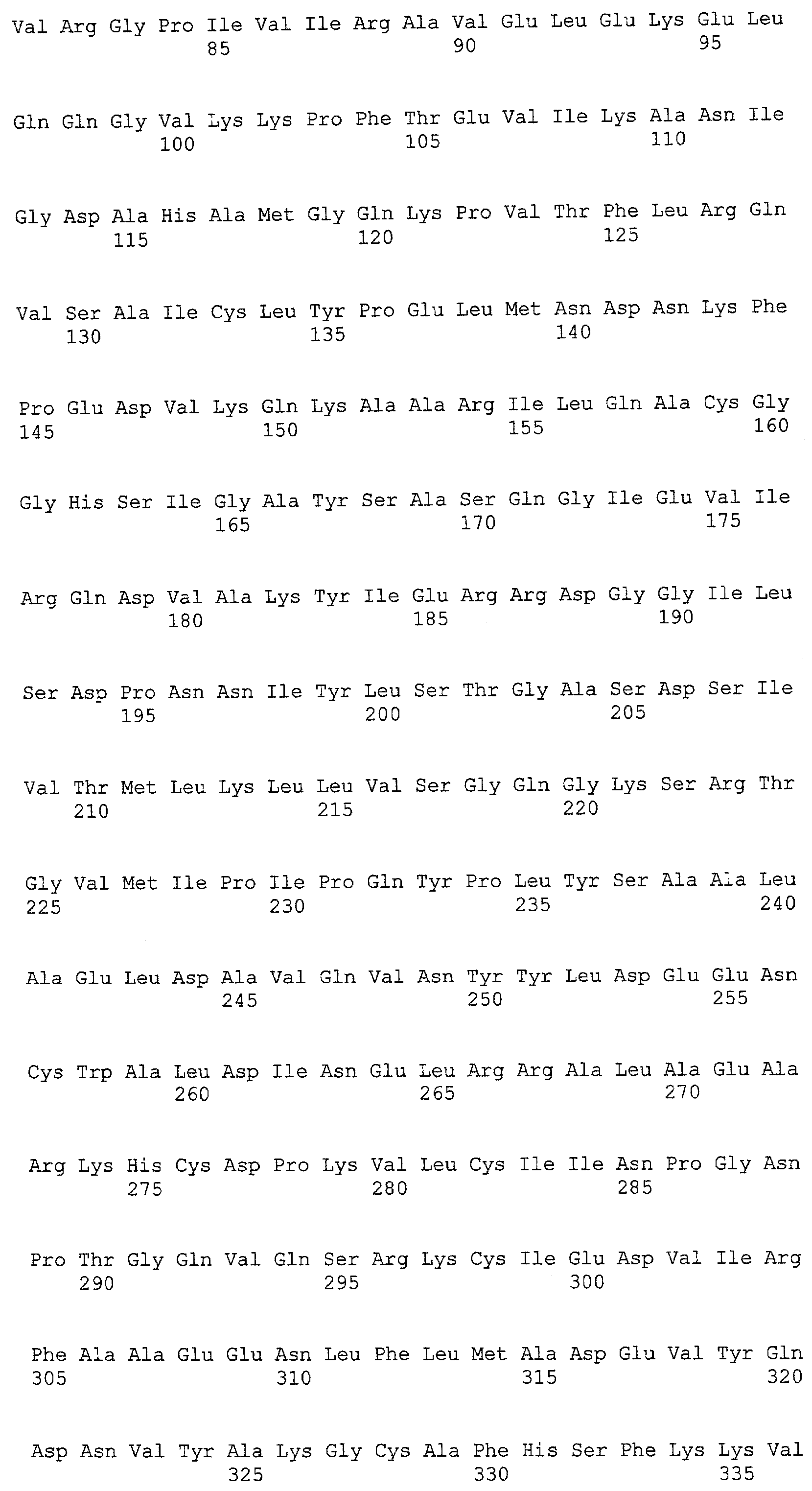
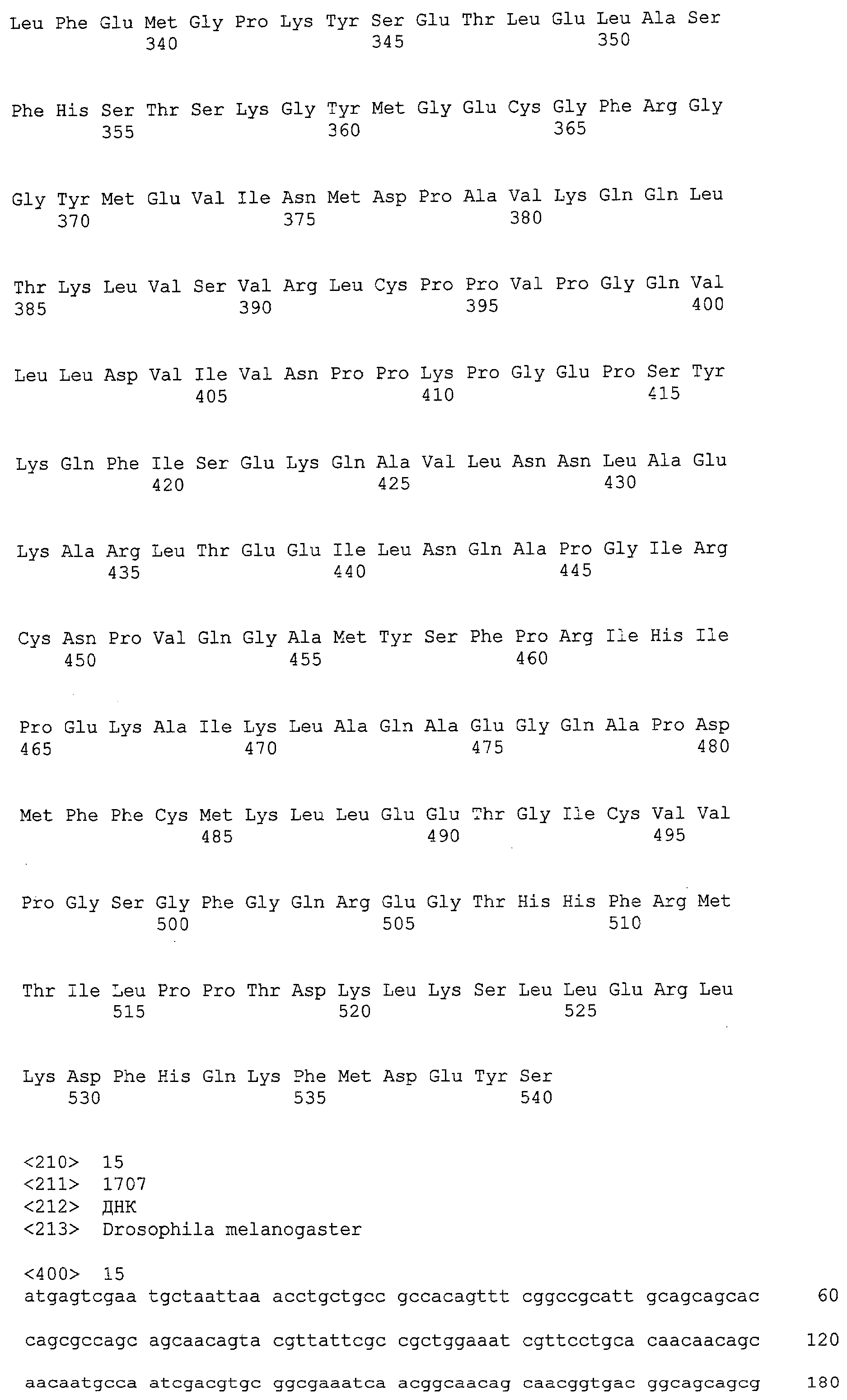







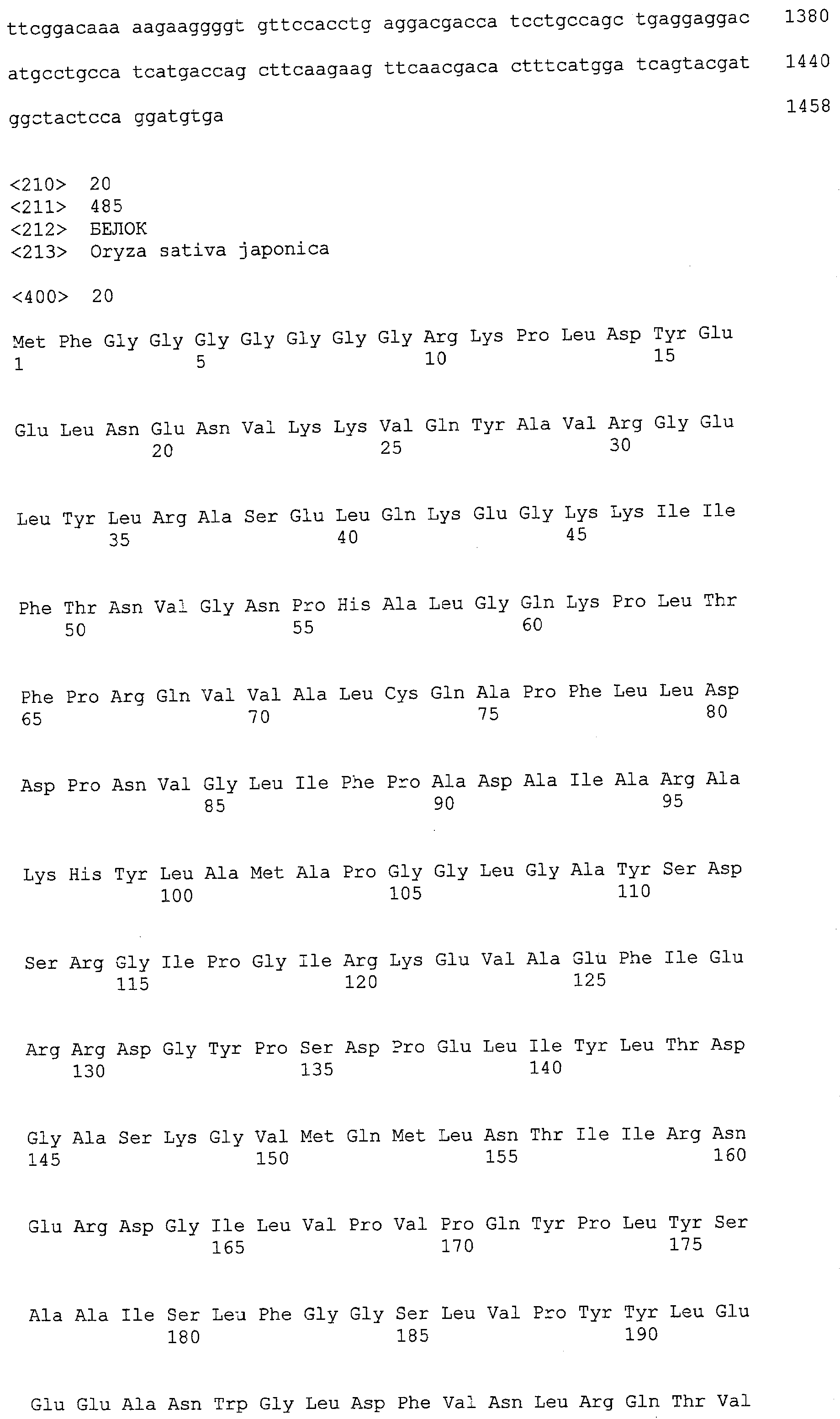
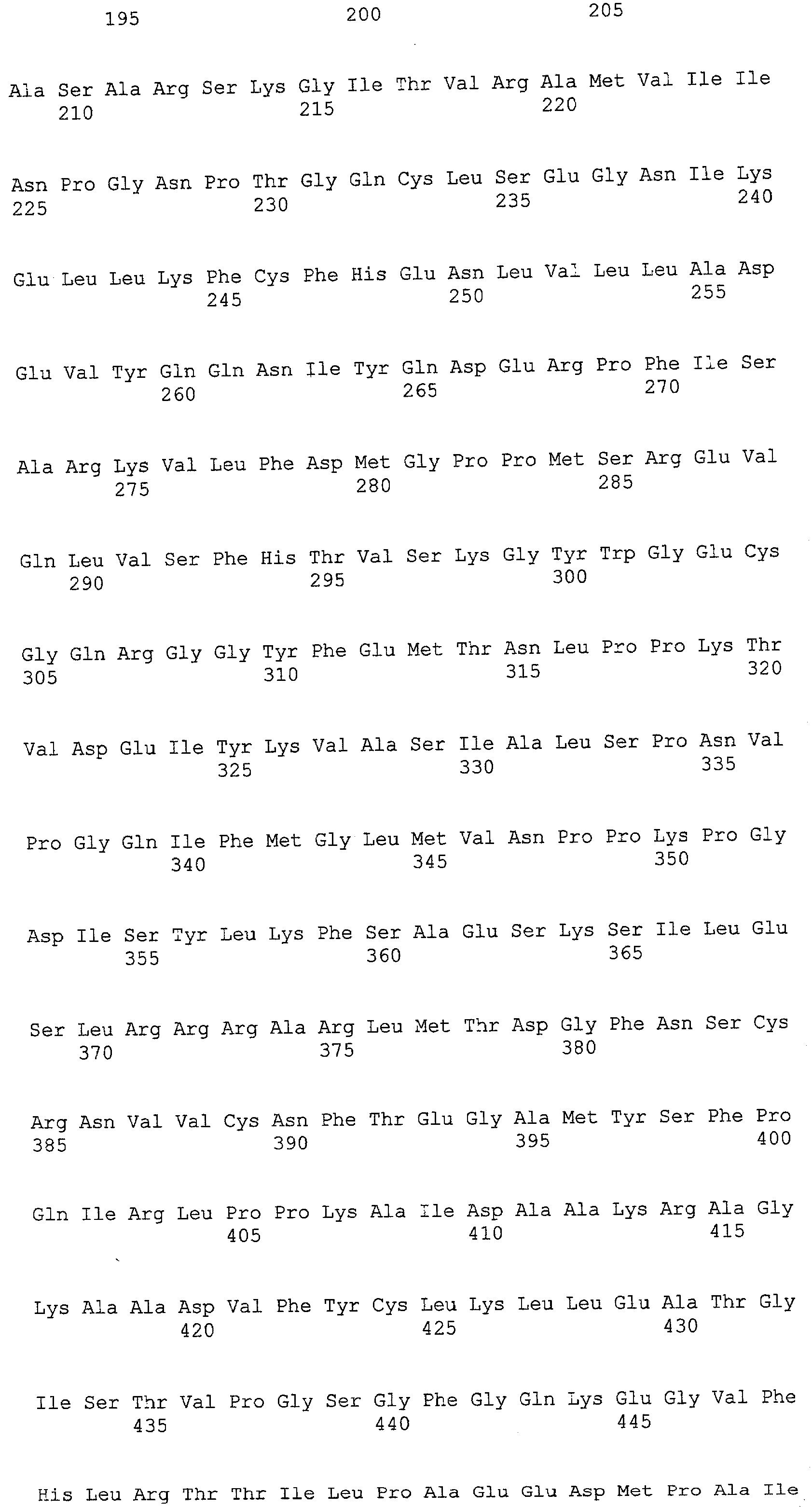

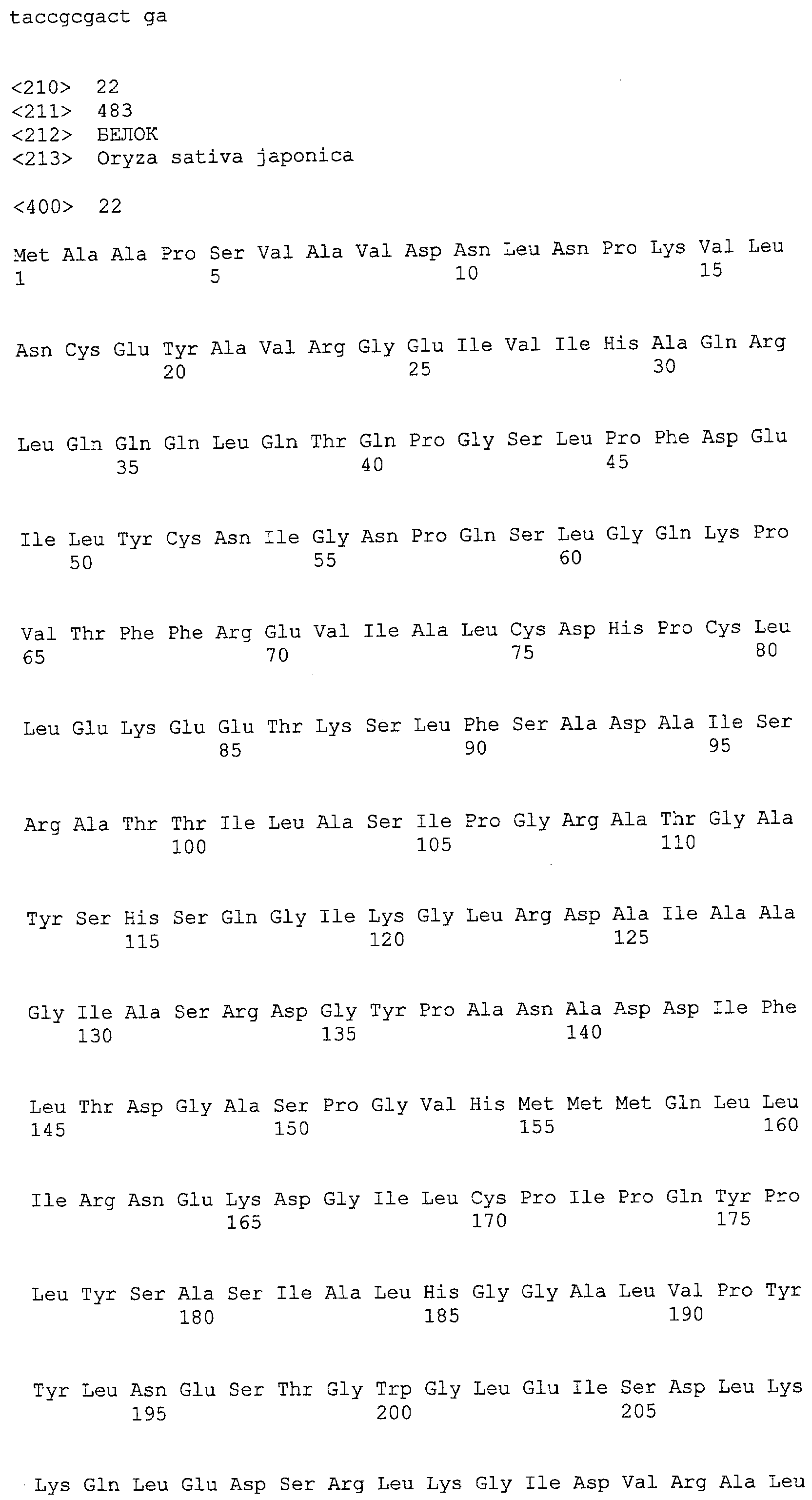
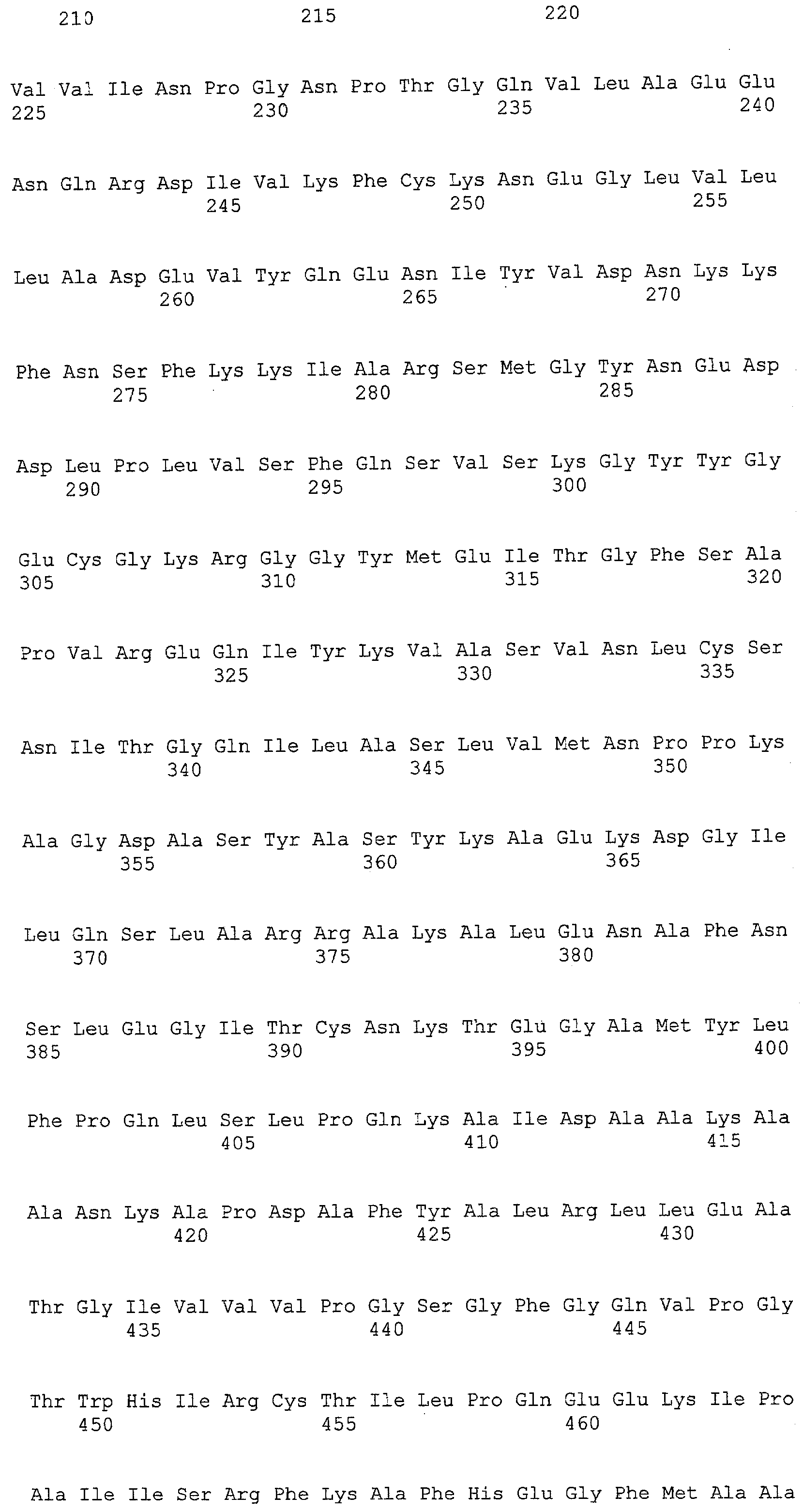


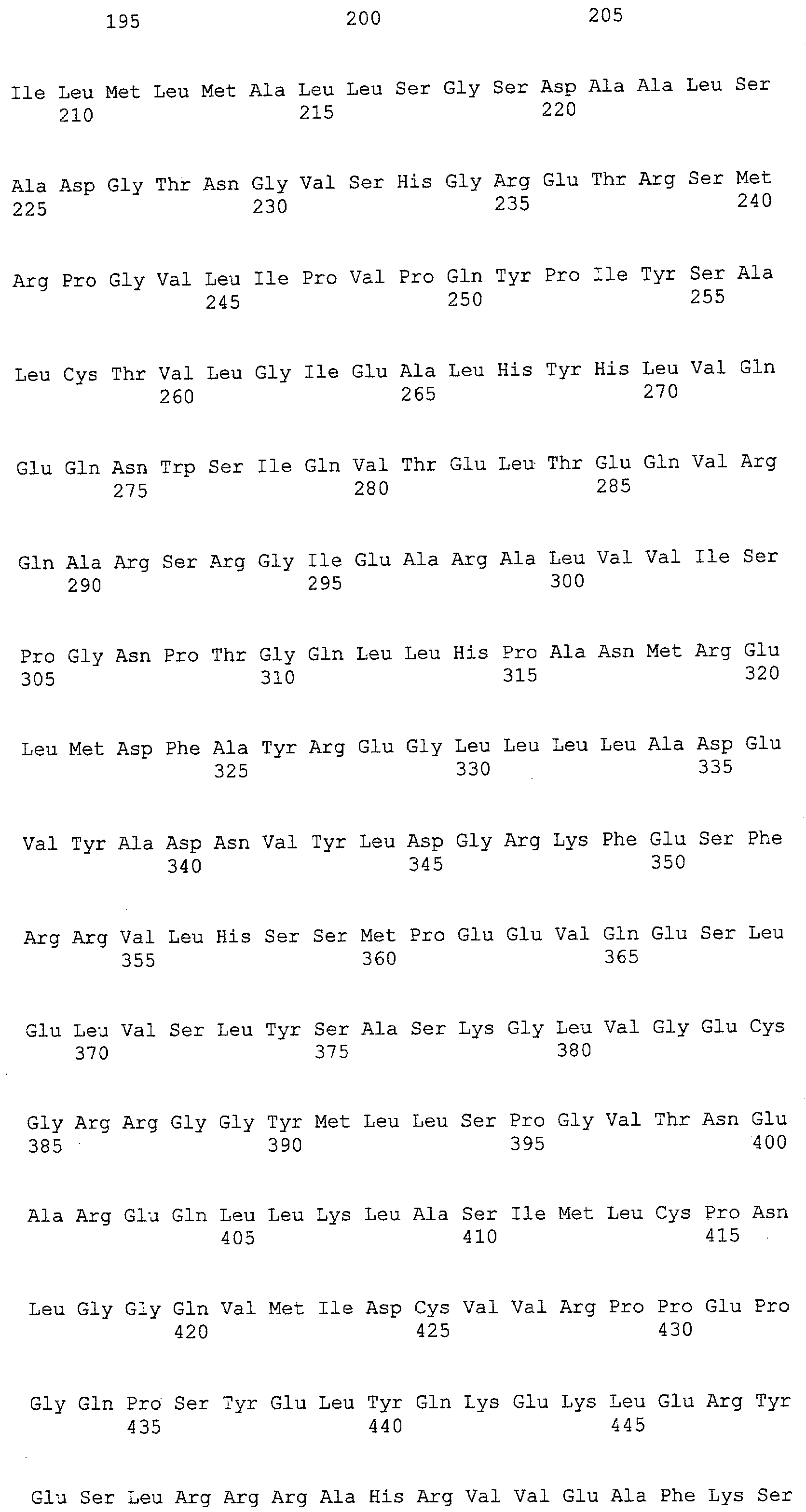


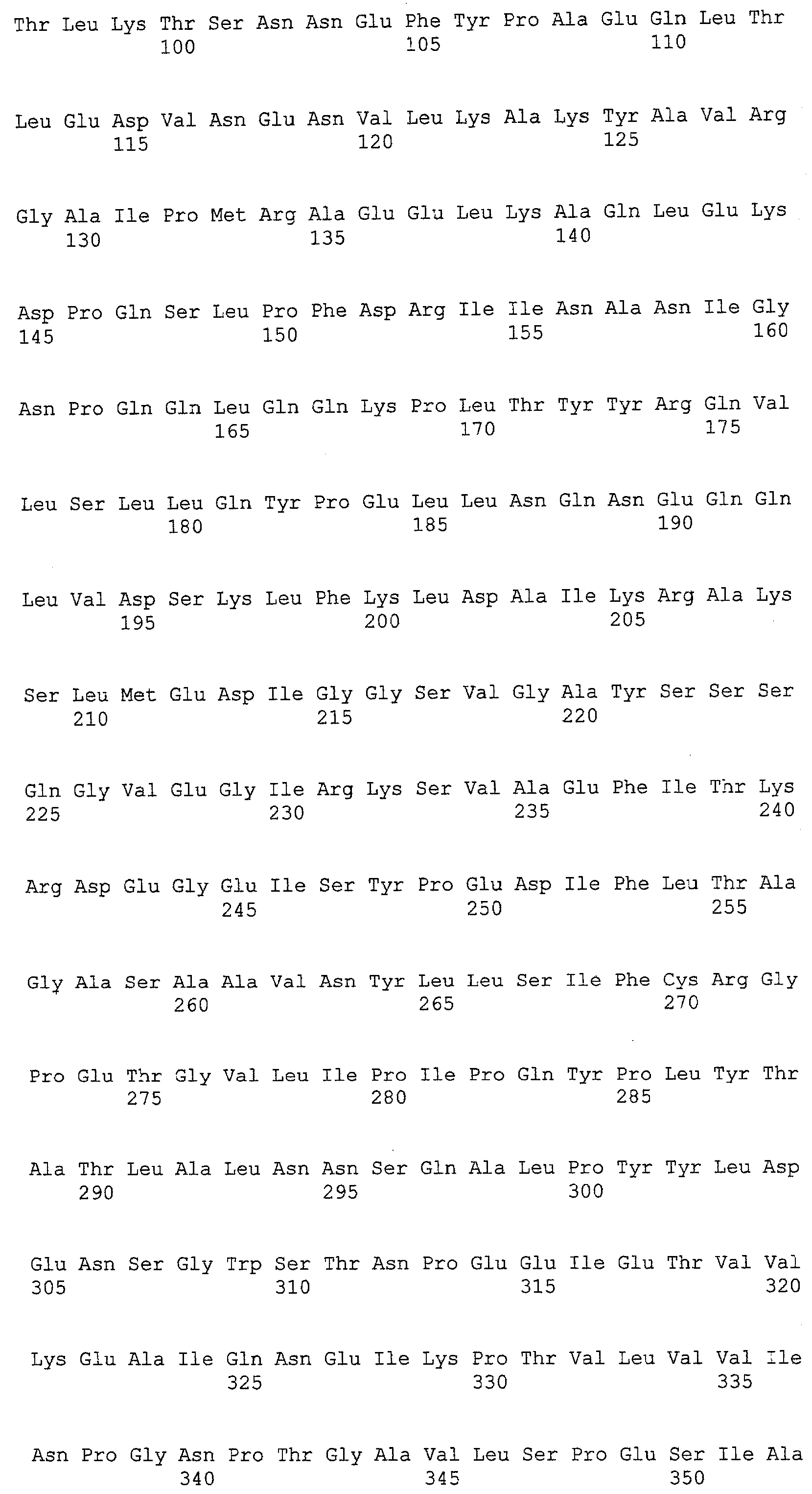






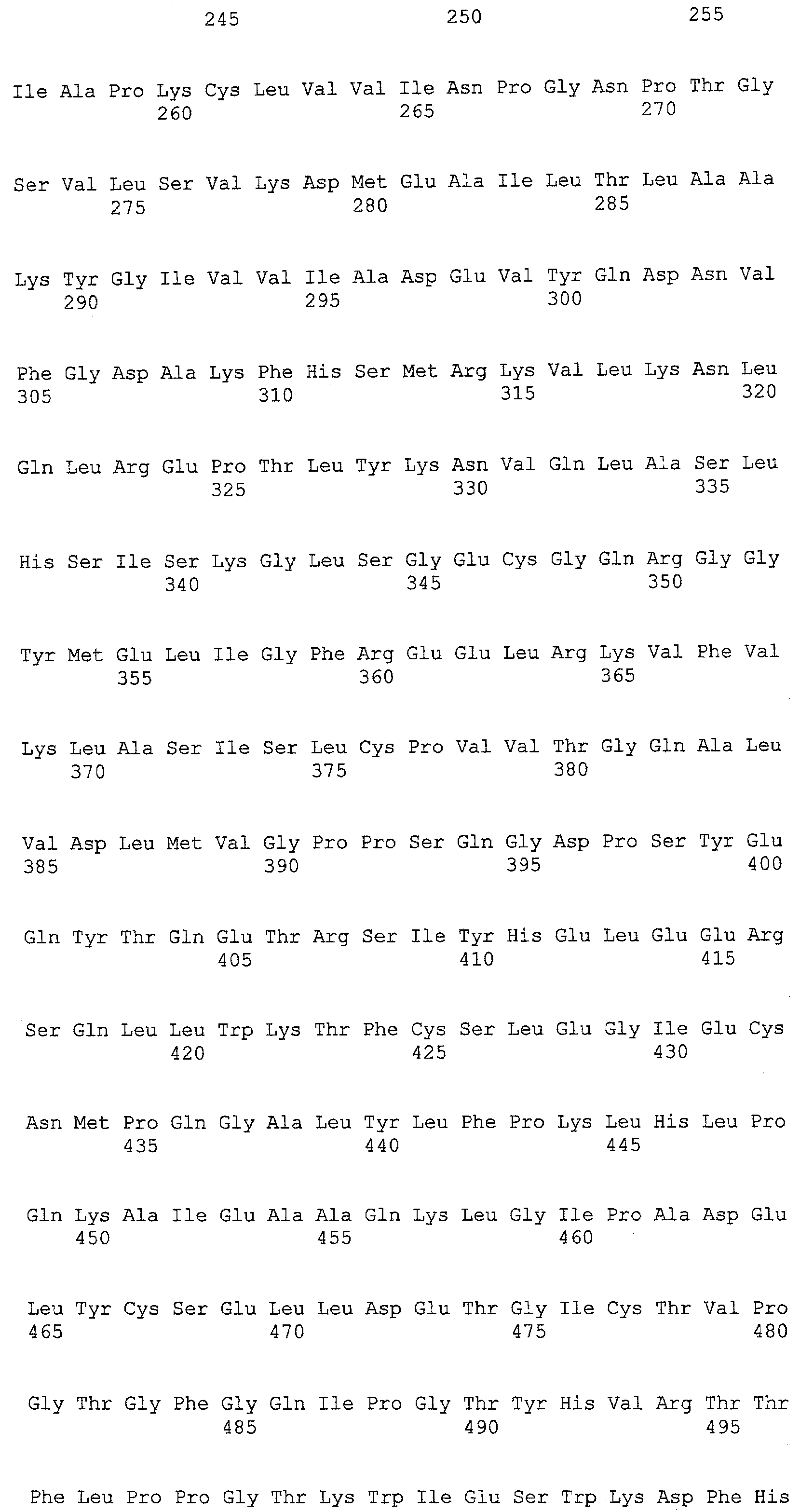

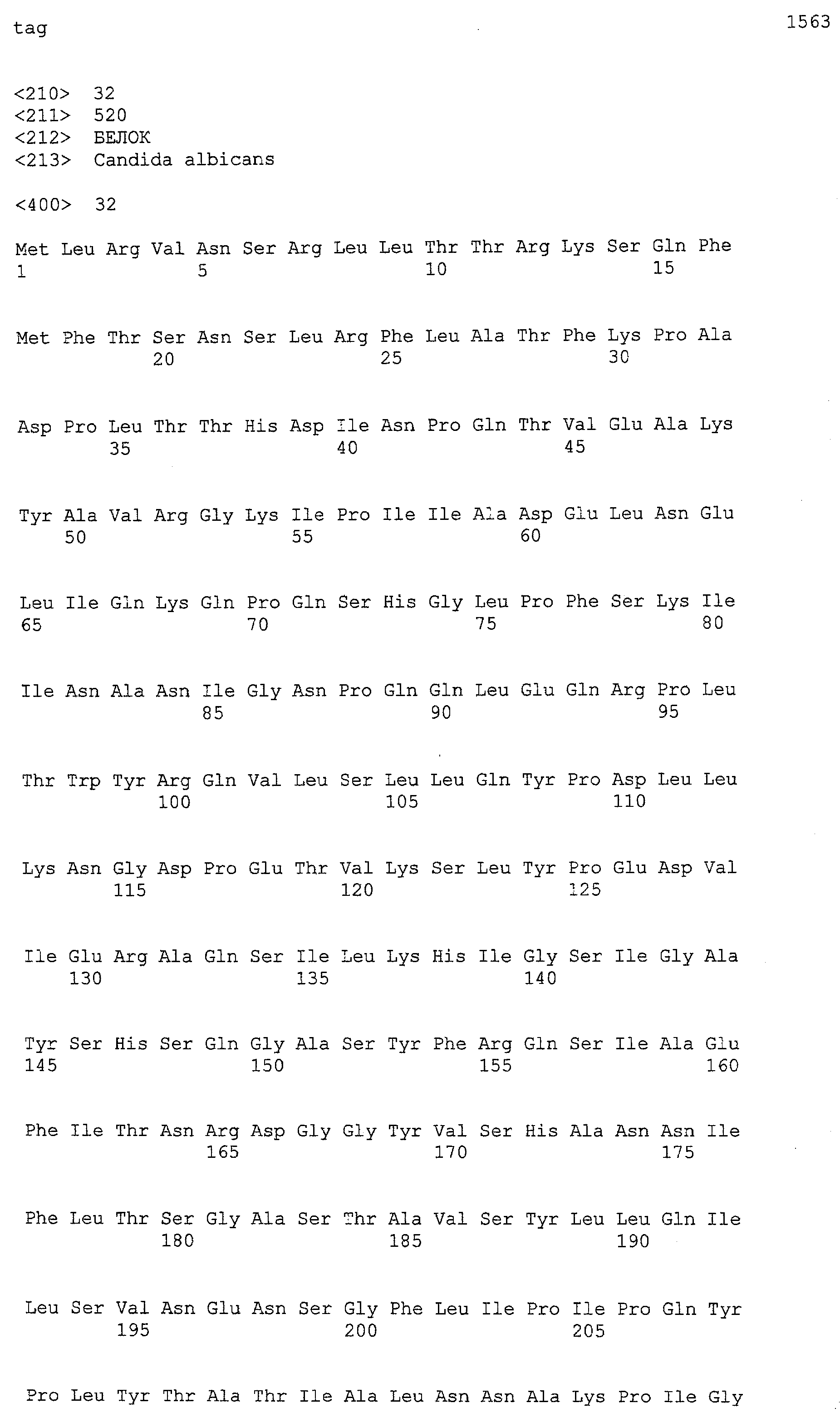



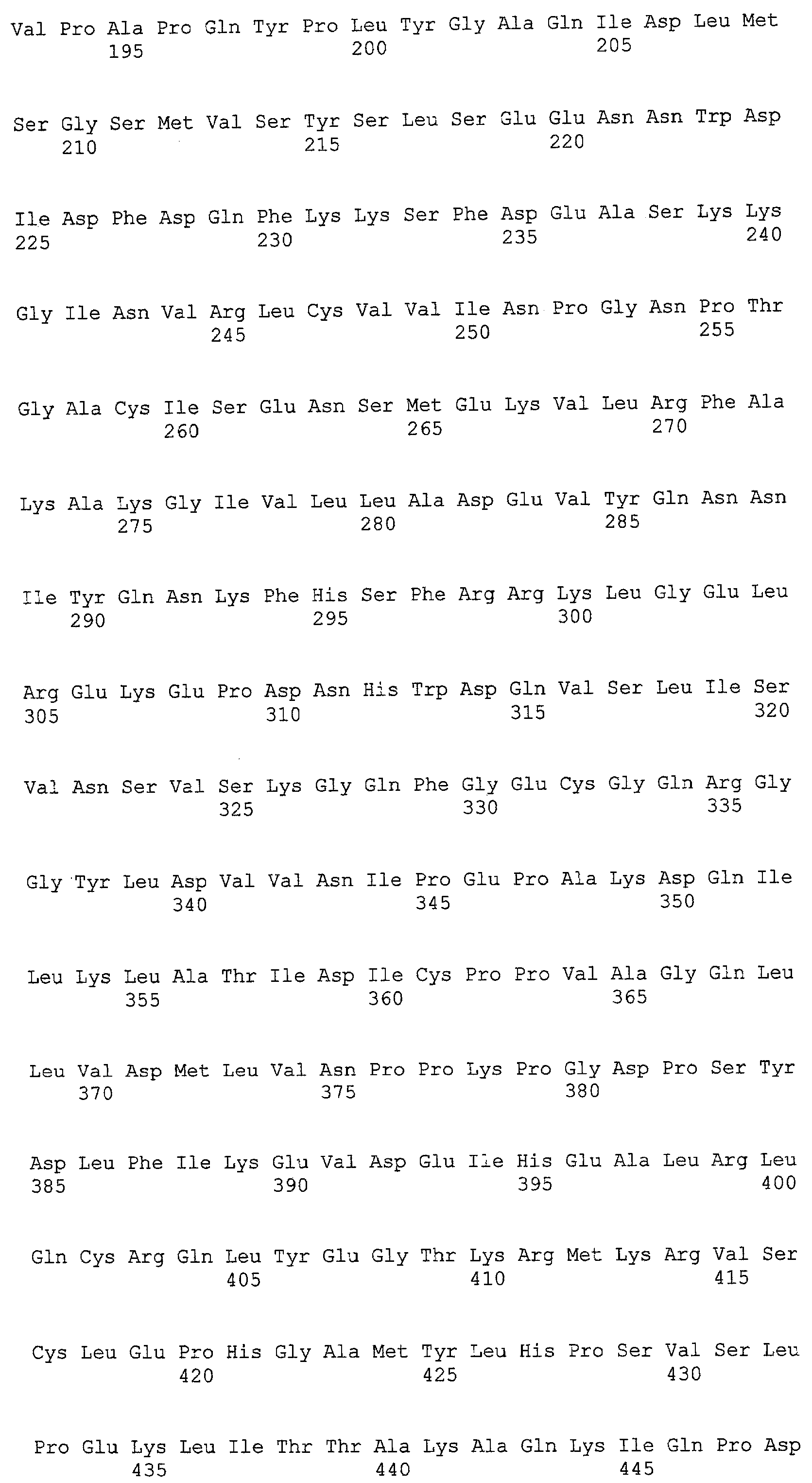





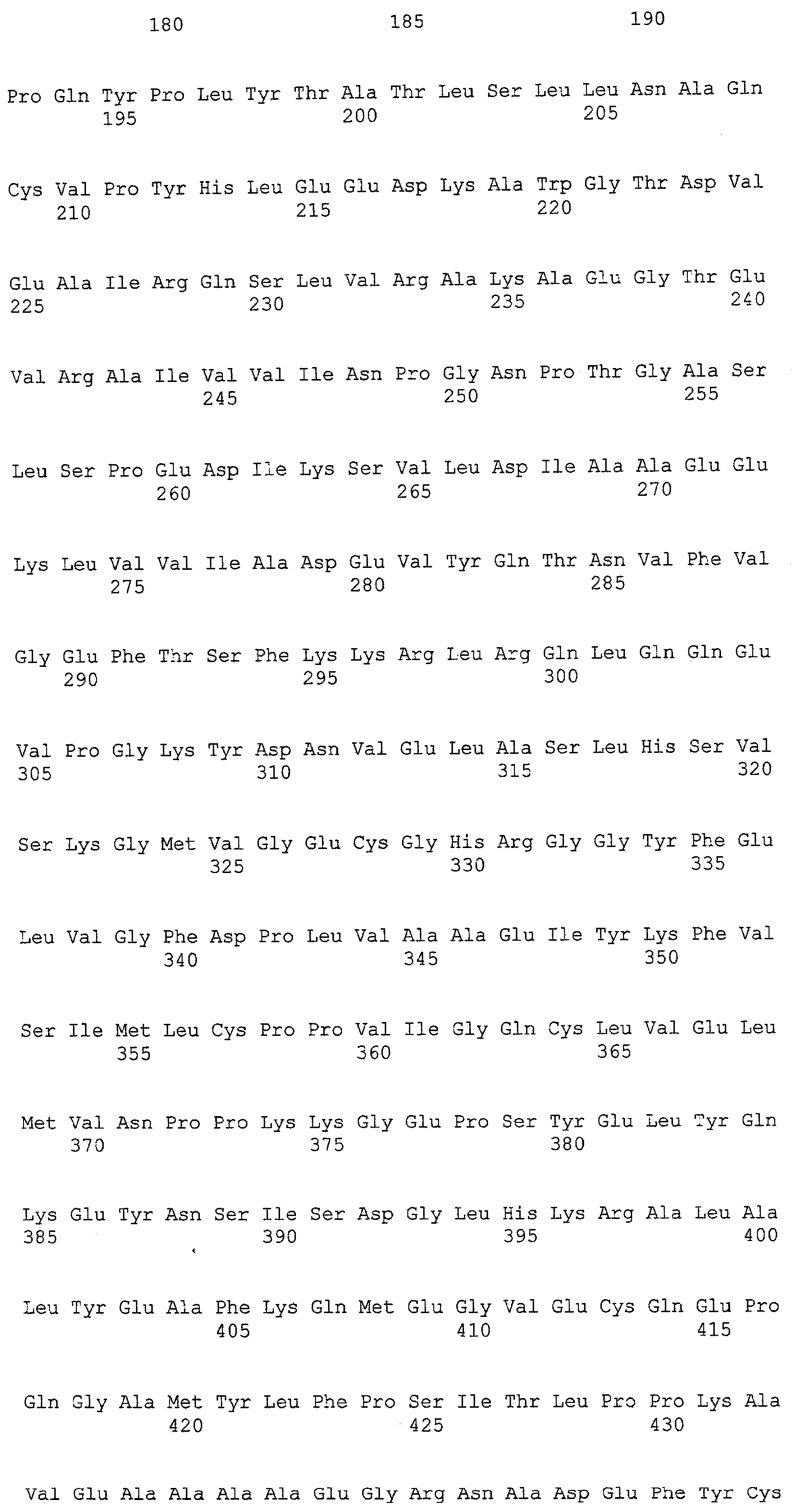




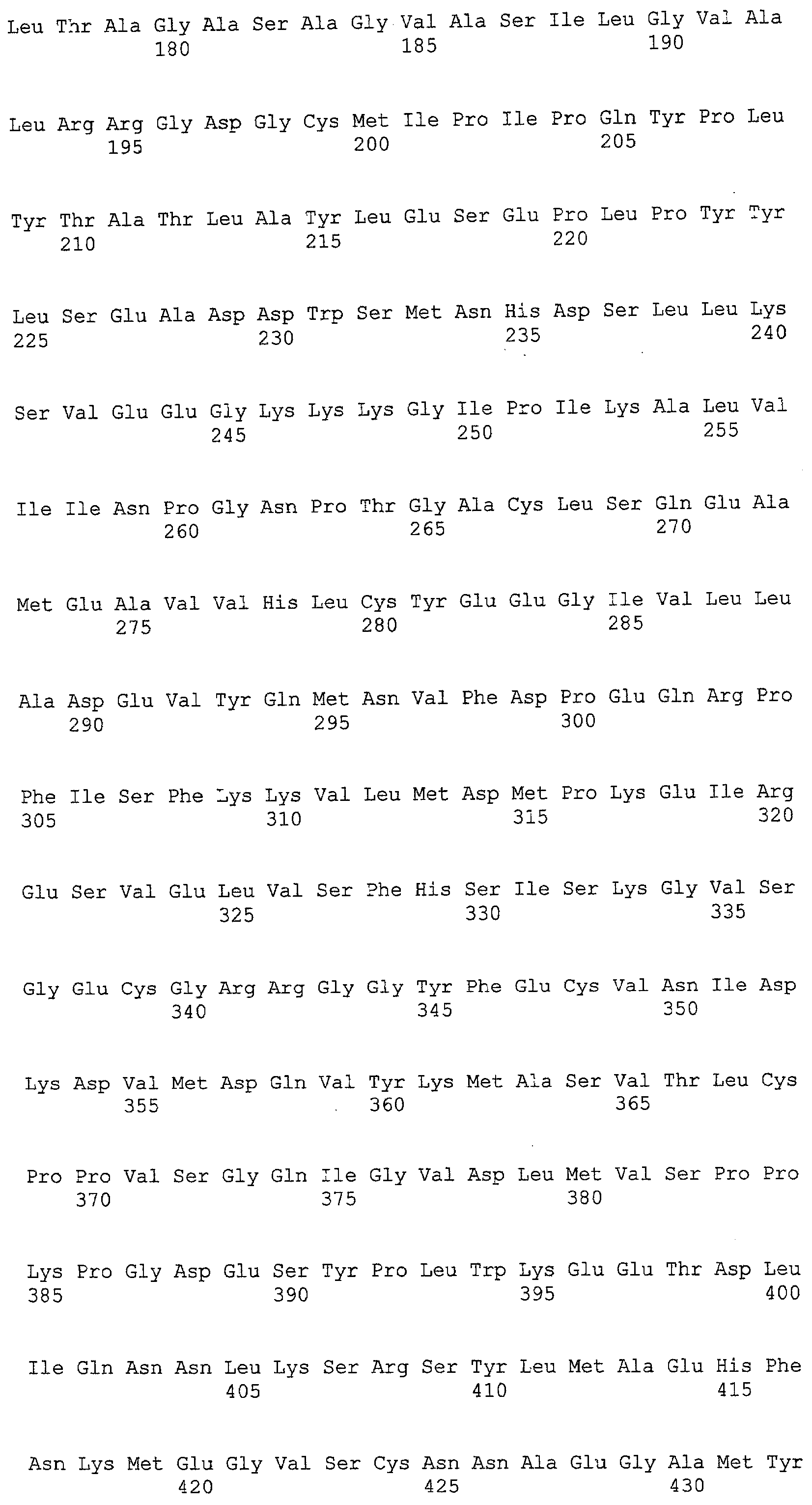









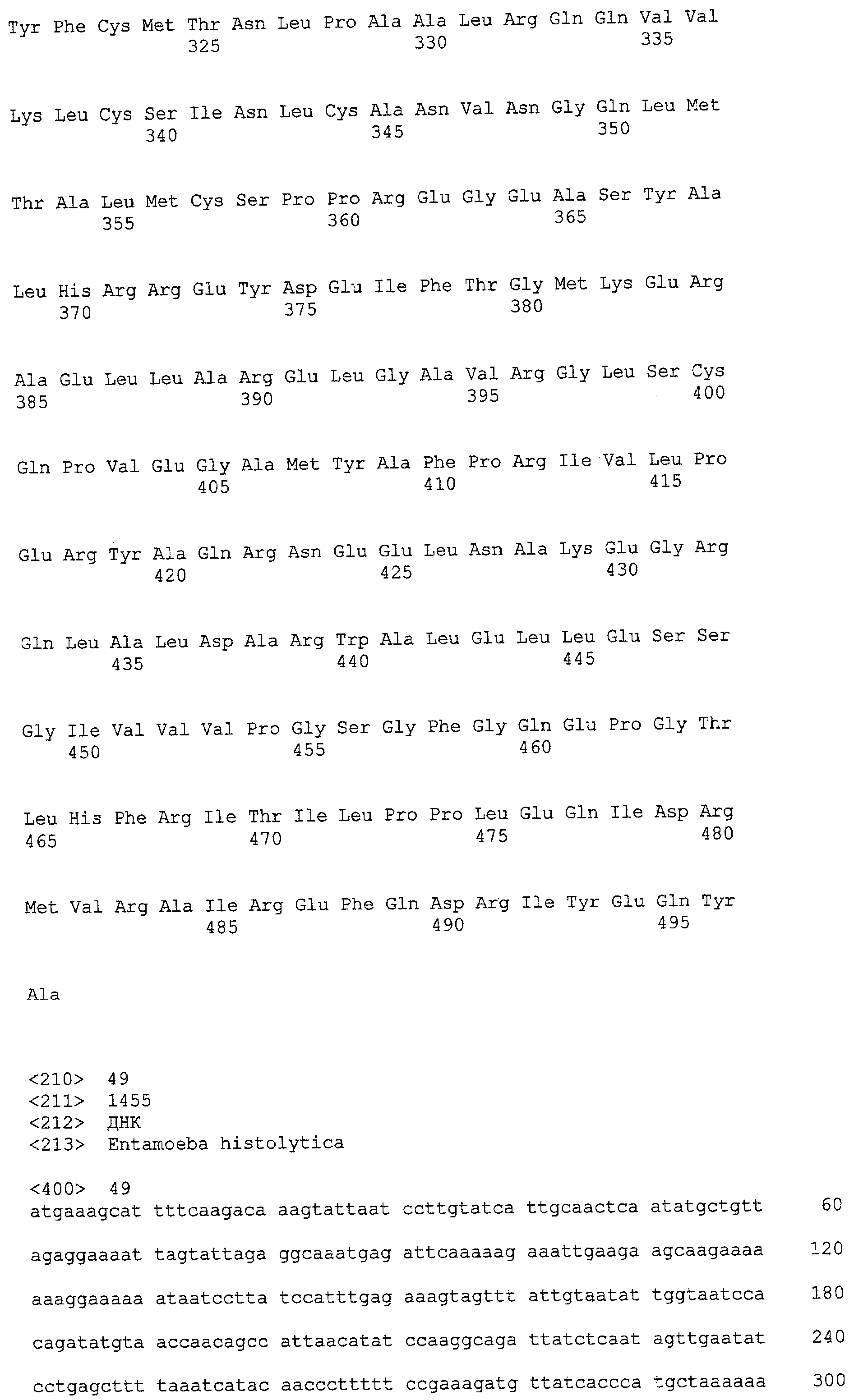




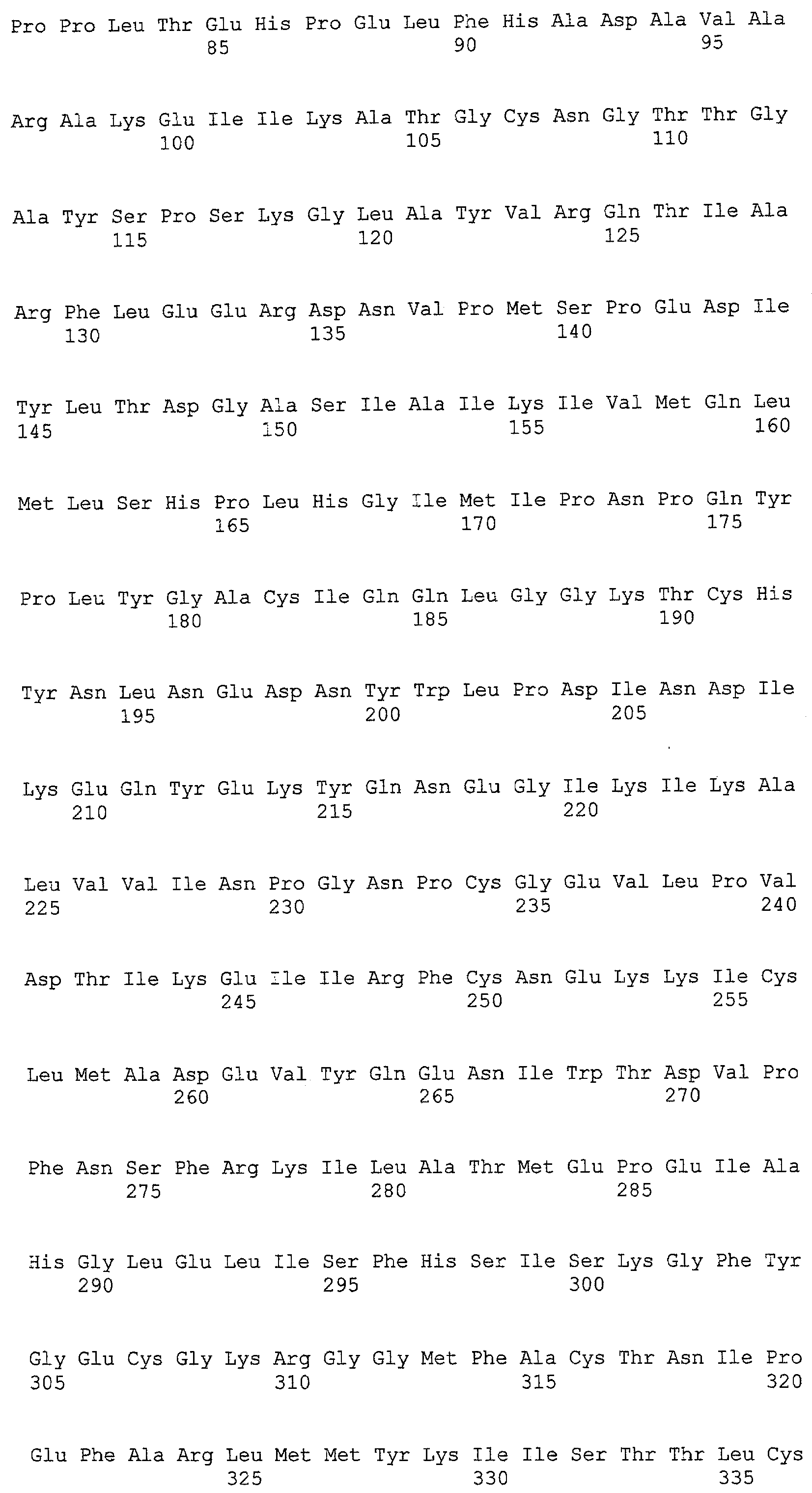


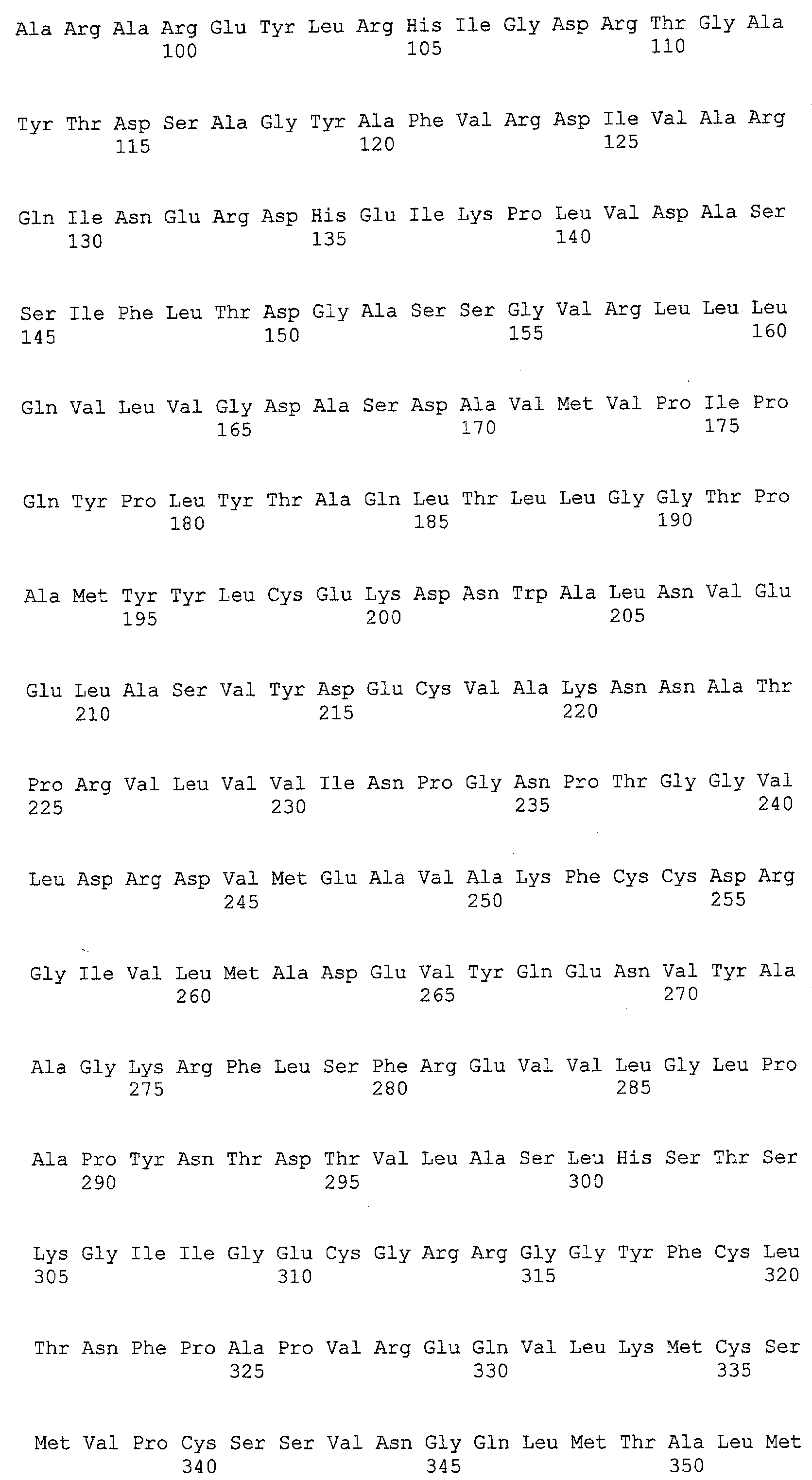








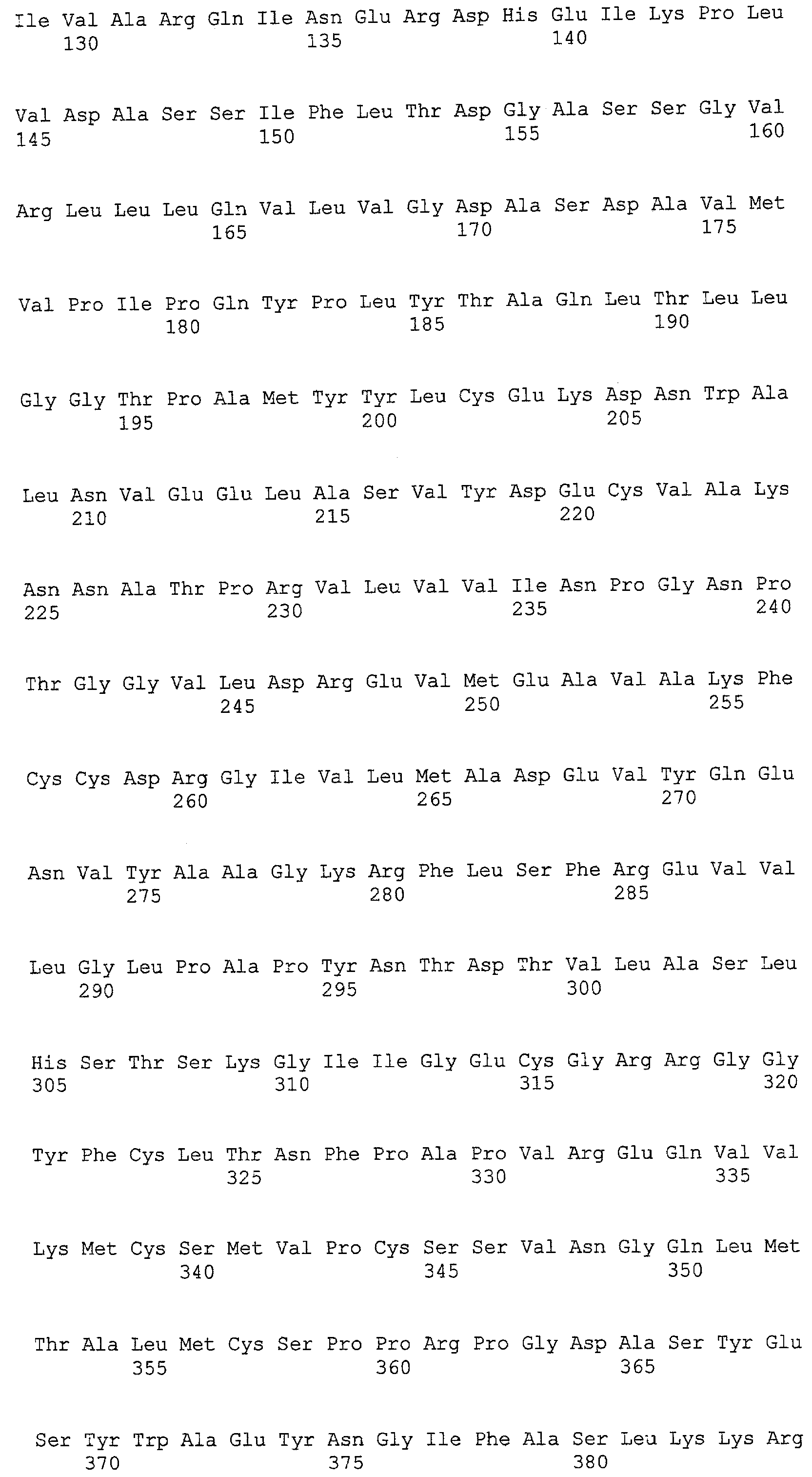






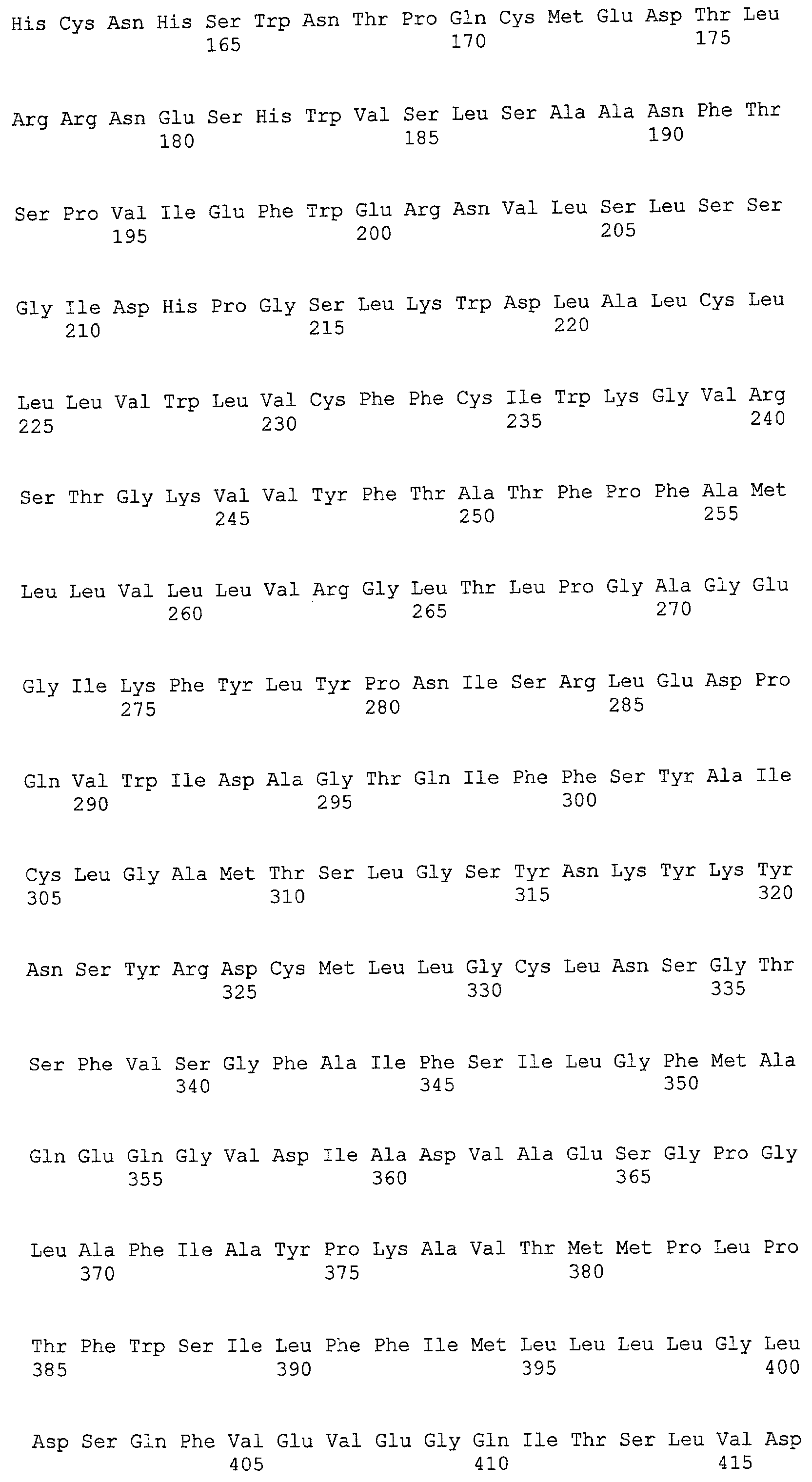


















Описание
ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Настоящее изобретение относится к способу продукции гетерогенного белка, более конкретно, к способу продукции полипептида с использованием клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу.
УРОВЕНЬ ТЕХНИКИ
Когда белки, полезные в фармацевтике, получают способами рекомбинантных ДНК, применение клеток животных обеспечивает сложную посттрансляционную модификацию и сворачивание, которые прокариотические клетки не могут осуществлять. Таким образом, для продукции рекомбинантных белков часто в качестве клеток-хозяев используют клетки животных.
В последнее время было разработано большое количествО биофармацевтических средств, таких как антитела и физиологически активные белки. Способы, которые позволяют эффективную продукцию рекомбинантных белков клетками животных, обеспечивают снижение расходов на биофармацевтические средства и перспективу стабильного снабжения ими пациентов.
В этих обстоятельствах, является желательным способ продукции белков с более высокой эффективностью продукции.
Аланин представляет собой одну из протеиногенных аминокислот, и он является заменимой аминокислотой. В живом организме его биосинтез осуществляется путем переноса аминогруппы с глутамата на пируват, а его деградация осуществляется путем обратной реакции.
В качестве фермента деградации аланина известна аланинаминотрансфераза (EC 2.6.1.2.) (непатентный документ 1). Этот фермент переносит аминогруппу с аланина на 2-оксоглутарат, синтезируя глутамат. Аланинаминотрансферазу также называют глутамат-пируват трансаминазой, которую сокращенно обозначают как GPT (непатентный документ 2). GPT и GOP (аспартатаминотрансфераза) представляют собой ферменты, находящиеся в печени. Поскольку GPT и GOP высвобождаются в кровь при разрушении печеночных клеток, когда выявляют аномально высокие уровни GPT и GOT, то диагностируют в печени нарушение какого-либо типа.
Как показано выше, аланинаминотрансферазу используют в качестве маркера функции печени. Однако, неизвестно поведение клеток-хозяев, таких как клетки CHO, если в них на высоком уровне экспрессируется аланинаминотрансфераза.
[Непатентный документ 1]
Sanjay B. J., et. al., Hepatology (2004) 39(5), 1297-1302
[Непатентный документ 2]
Melanie M. S., et. al., Genomics (1997) 40, 247-252
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление способа, посредством которого можно продуцировать природный или рекомбинантный белок с высоким выходом.
СРЕДСТВА РЕШЕНИЯ ПРОЛЕМЫ
В результате обширных и тщательных исследований для решения указанной выше проблемы авторы настоящего изобретения выявили, что можно повысить выход требуемого полипептида с использованием клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу (в дальнейшем в настоящем документе иногда обозначаемую как “ALT”). Таким образом, было осуществлено настоящее изобретение. Более того, требуемый полипептид можно получить даже в более высоком количестве с использованием клеток, способных коэкспрессировать ALT и переносчик таурина. Поскольку аланин продуцируется в большом количестве с течением времени в клеточной культуре, аланин, накапливаемый в клетках, секретируется в среду. Если бы реакцию биосинтеза пирувата и глутамата из аланина можно было обеспечить экспрессией ALT на высоком уровне, продукты бы использовались в метаболизме в ходе цикла TCA и продукции глюкозы посредством гликогенеза. Это может улучшить поведение клеток в культуре, и, таким образом, ожидается продукция с высоким выходом требуемого полипептида.
Настоящее изобретение можно обобщить следующим образом.
(1) Способ продукции полипептида, включающий культивирование клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид и, тем самым, обеспечение возможности клетке продуцировать указанный полипептид.
(2) Способ по (1), выше, где клетка, которая на высоком уровне экспрессирует аланинаминотрансферазу, представляет собой клетку, в которую перенесена ДНК, кодирующая аланинаминотрансферазу.
(3) Способ продукции по (1) или (2), выше, где клетки, которые на высоком уровне экспрессируют аланинаминотрансферазу, далее на высоком уровне экспрессируют переносчик таурина.
(4) Способ продукции по (3), выше, где клетки, которые на высоком уровне экспрессируют переносчик таурина, представляют собой клетки, в которые перенесена ДНК, кодирующая переносчик таурина.
(5) Способ по (2) или (4), выше, где клетка представляет собой клетки яичника китайского хомяка.
(6) Способ по любому из (1)-(5), выше, где требуемым полипептидом является антитело.
(7) Способ по любому из (2)-(6), выше, где ДНК, кодирующая аланинаминотрансферазу, представляет собой любую из следующих с (a) по (e):
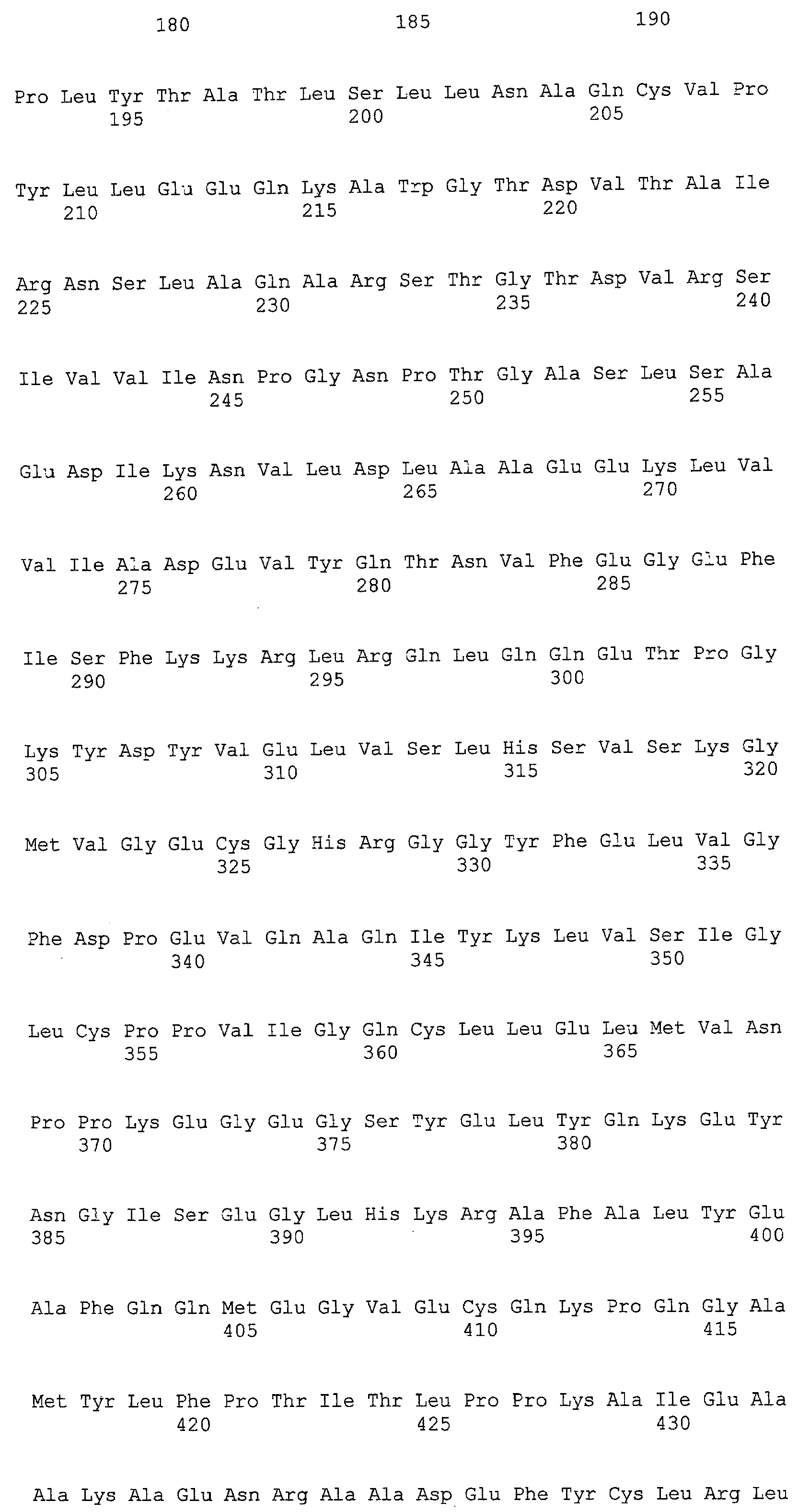
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60;
(b) ДНК, кодирующая полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы;
(c) ДНК, кодирующая полипептид, имеющий 70% или более гомологию аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, и, кроме того, обладает активностью аланинаминотрансферазы;
(d) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59;
(e) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
(8) Способ получения фармацевтического препарата, содержащего полипептид, полученный способом по любому из (1)-(7), выше.
(9) Клетка, которая обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей требуемый полипептид.
(10) Клетка согласно (9), выше, которая далее обладает перенесенной в нее ДНК, кодирующей переносчик таурина.
(11) Клетка, которая обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей переносчик таурина.
(12) Способ продукции полипептида, включающий культивирование в содержащей α-кетоглутарат среде клетки, которая на высоком уровне экспрессирует аланинаминотрансферазу и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид, что, тем самым, дает клетке возможность продуцировать указанный полипептид.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением, становится возможным повышать выход требуемого полипептида.
Настоящее описание охватывает содержание, описанное в описании и/или фигурах патентной заявки Японии № 2007-205158, на основе которой по настоящей патентной заявке испрашивается приоритет.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На фиг.1 представлена плазмида для селекции пуромицином, которую использовали для экспрессии ALT1 человека (496 аминокислот).
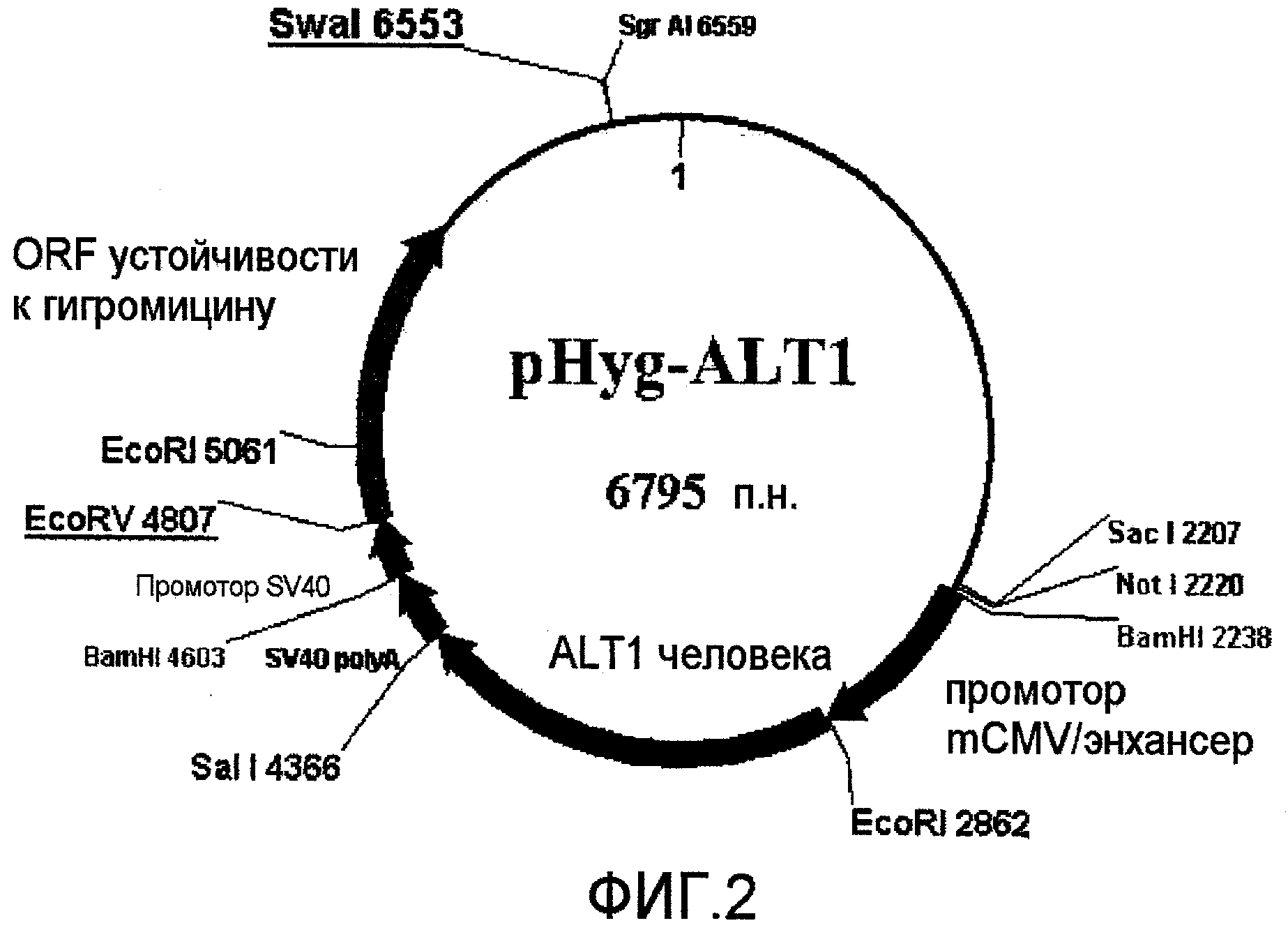
На фиг.2 представлена плазмида для селекции гигромицином, которую использовали для экспрессии ALT1 человека (496 аминокислот).
На фиг.3 представлены графики выхода антитела против глипикана-3 на 17 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетке, в которую была перенесена pPur-ALT1 (n=4), был выше выхода в клетке, в которую была перенесена pPur (n=3) (P<0,01).
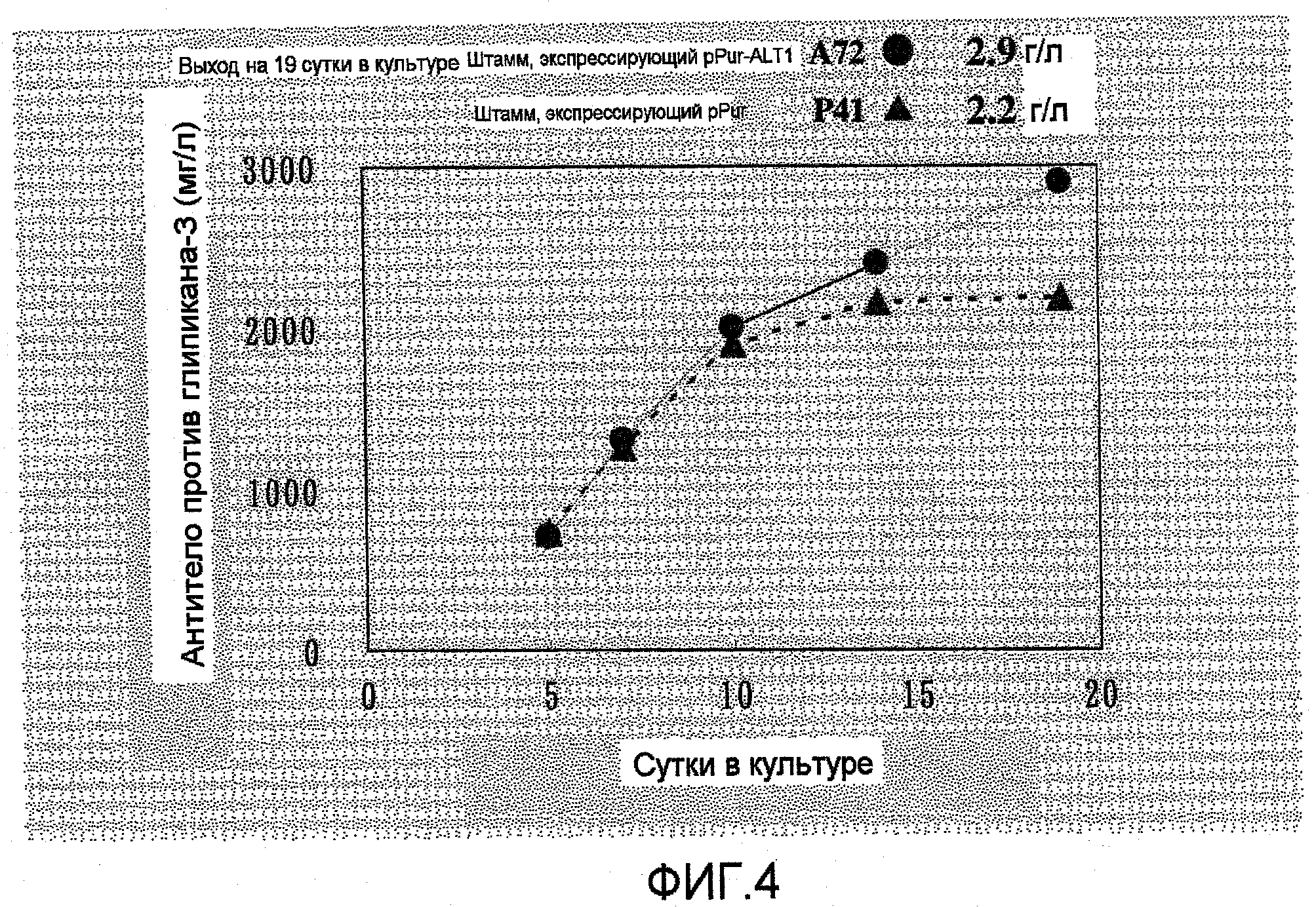
На фиг.4 представлен график, на котором показаны выходы антитела в A72, который представляет собой штамм, экспрессирующий ALT1, и в P41 в качестве контрольного штамма, в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 в A72 составлял 2,9 г/л на 19 сутки в культуре, что превышало выход в P41.
На фиг.5 представлен график, на котором показаны уровни выживаемости A72, который представляет собой штамм, экспрессирующий ALT1, и P41 в качестве контрольного штамма. Уровень выживаемости A72 на поздней стадии культивирования превышал уровень выживаемости P41.
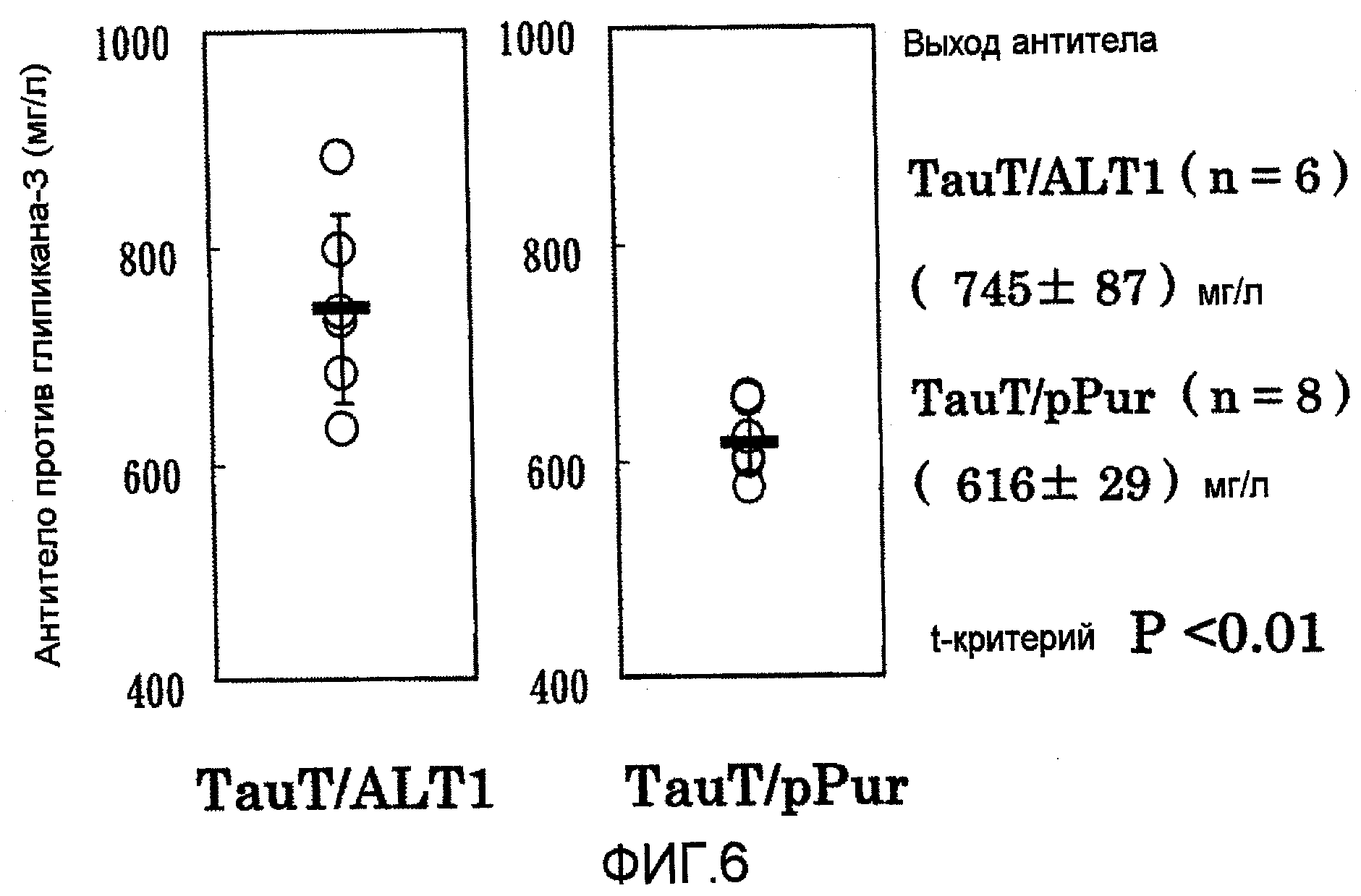
На фиг.6 показаны графики выхода антитела против глипикана-3 на 4 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетке, котрансфицированной pHyg-TauT/pPur-ALT1 (n=6), превышал выход в клетке, котрансфицированной pHyg-TauT/pPur (n=8) (P<0,01).
На фиг.7 представлен график, на котором показан выход антител в TA41, который представляет собой штамм, коэкспрессирующий TauT/ALT1, в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 составил 5,3 г/л на 21 сутки культивирования.
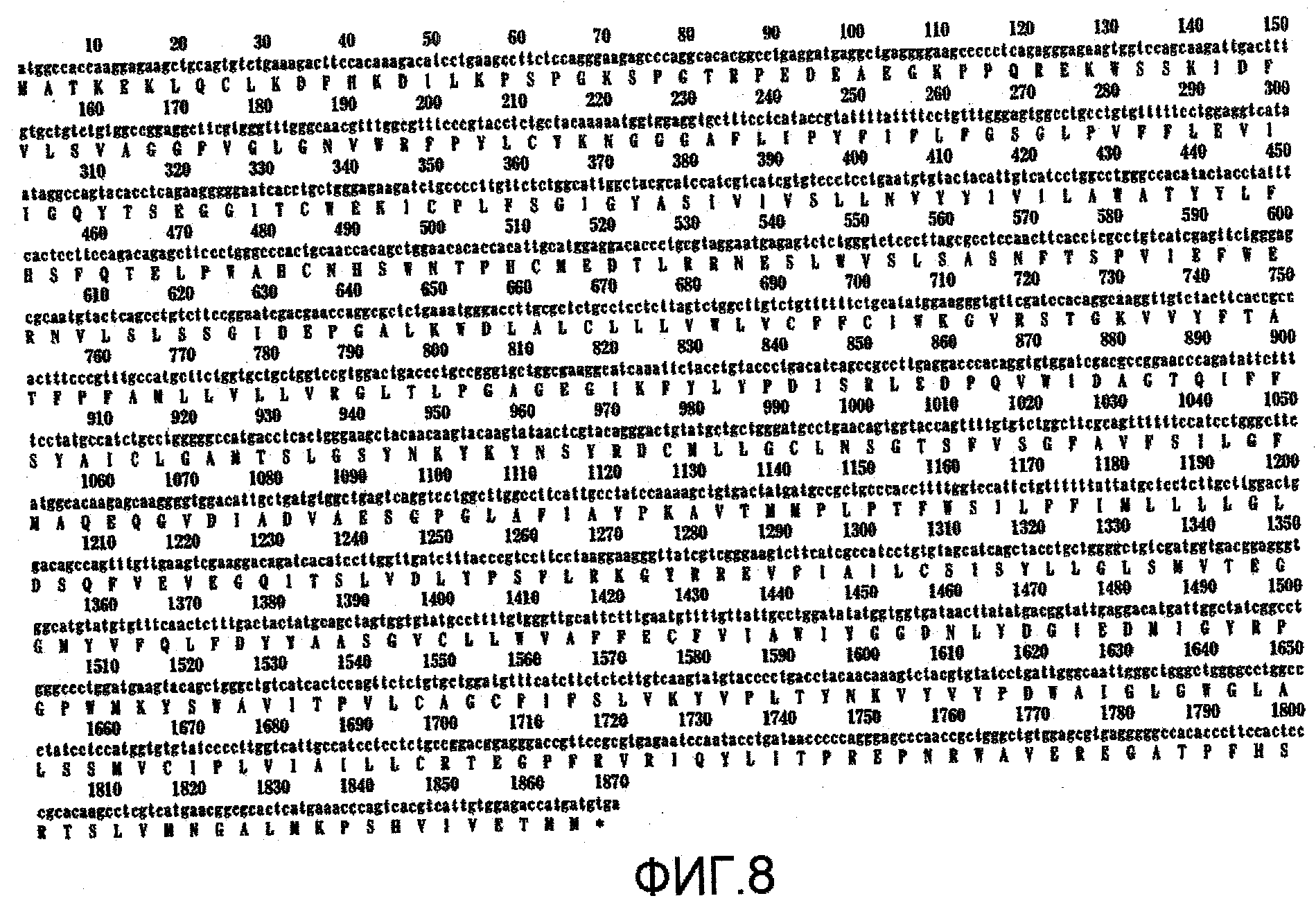
На фиг.8 представлена нуклеотидная последовательность вновь клонированного гена переносчика таурина хомяка из клеток CHO и установленная на ее основе аминокислотная последовательность.
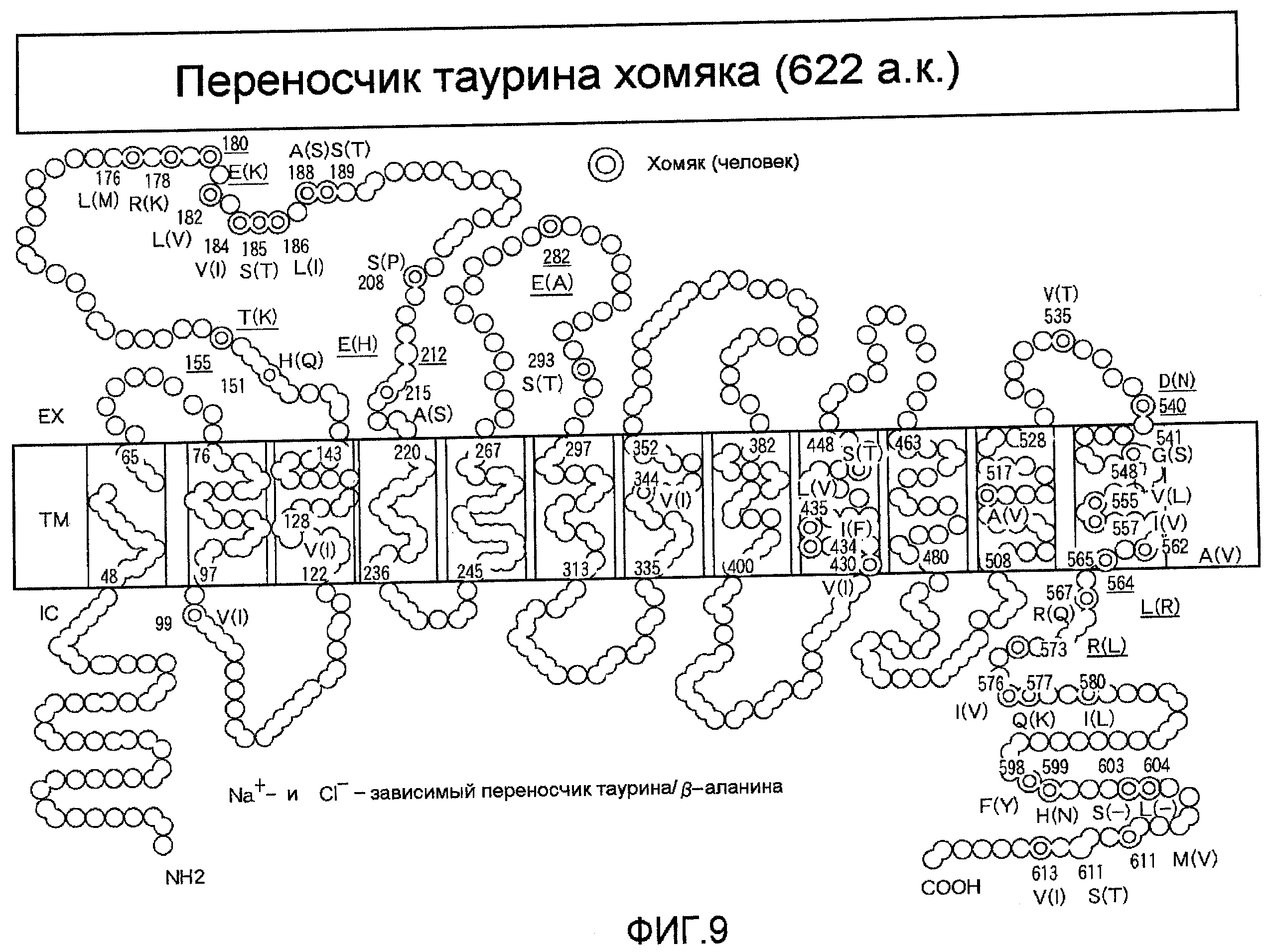
На фиг.9 представлена топология на мембране вновь клонированного переносчика таурина TauT из CHO.
На фиг.10 представлена плазмида, которую использовали для экспрессии TauT хомяка (622 аминокислоты).
На фиг.11 представлены графики плотности жизнеспособных клеток на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Плотность жизнеспособных клеток в клетках, в которые была перенесена pHyg/TauT, была выше плотности жизнеспособных клеток в клетках, в которые была перенесена pHyg.
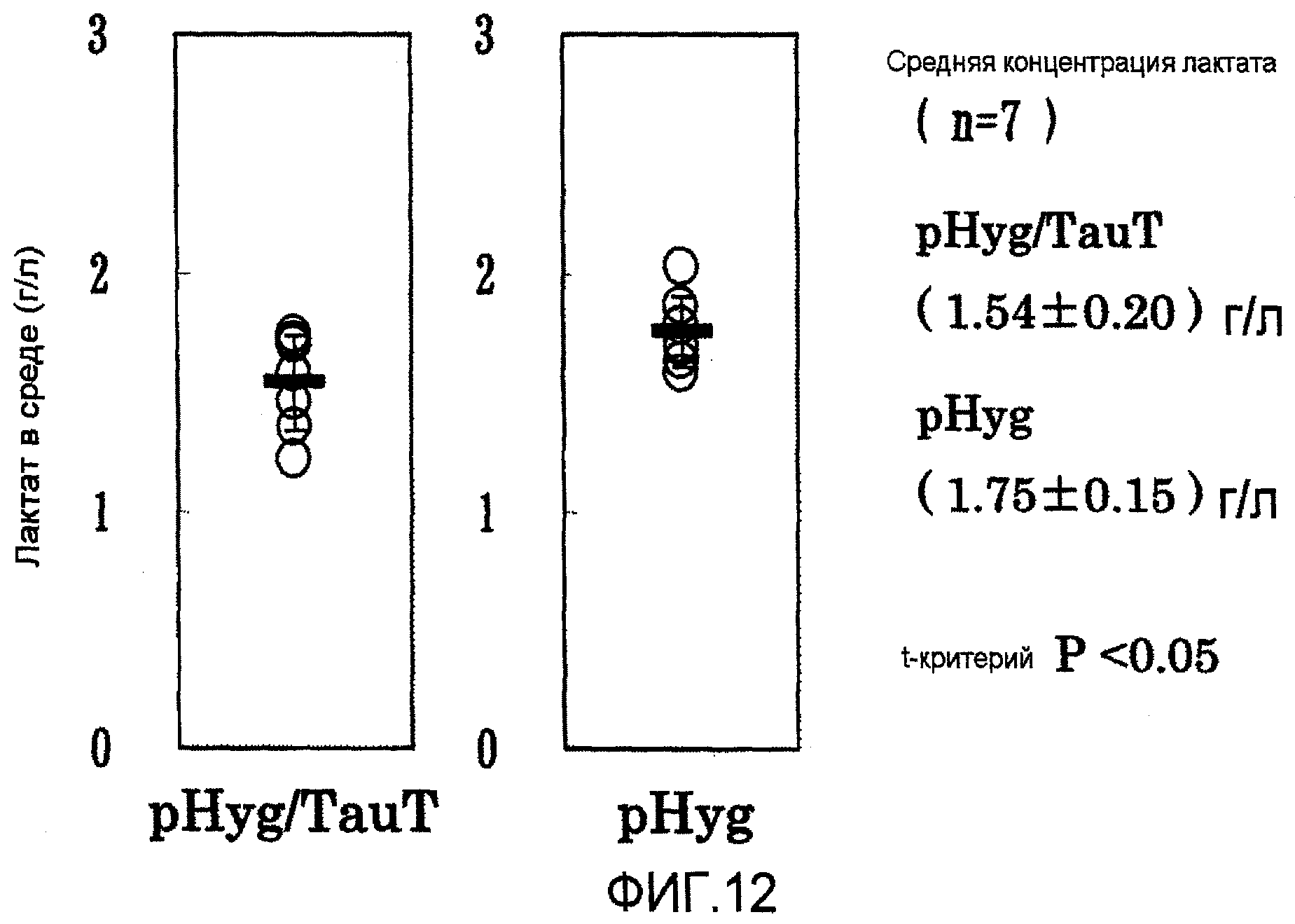
На фиг.12 представлены графики выхода лактата на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Клетка, в которую была перенесена pHyg/TauT, продуцировала меньшее количество лактата, и она была лучше клетки, в которую была перенесена pHyg.
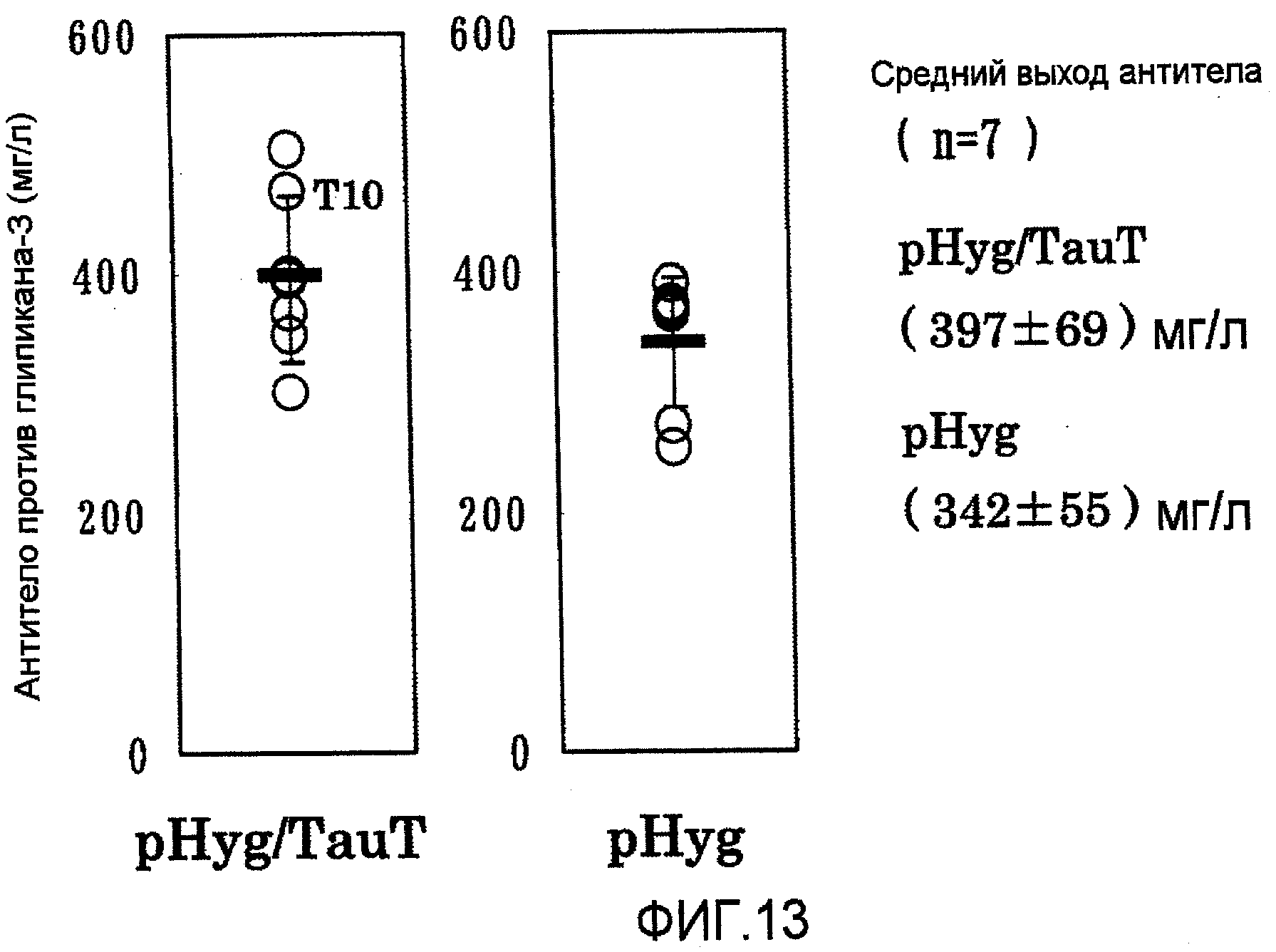
На фиг.13 представлены графики выхода антитела против глипикана-3 на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Четыре из 7 штаммов клеток, в которые была перенесена pHyg/TauT, показали выходы антитела, превышающие наиболее высокий выход в клетках, в которые была перенесена pHyg.
На фиг.14 представлены графики выхода антитела против глипикана-3 на 7 сутки в культуре с подпиткой в перемешиваемом флаконе объемом 50 мл. Выход антитела в клетках, в которые была перенесена pHyg/TauT, превышал выход антитела в клетках, в которые была перенесена pHyg.
На фиг.15 представлен график, на котором показан уровень выживаемости клеток T10, в которые была перенесена pHyg/TauT, (которые показали высокую способность к росту) в культуре с подпиткой в емкости 1 л. Уровень выживаемости T10 составил 80% или более даже на 32 сутки в культуре.
На фиг.16 представлен график, на котором показан выход антител в клетках T10, в которые была перенесена pHyg/TauT, (которые показали высокую способность к росту в процессе размножения в стационарной культуре) в культуре с подпиткой в емкости 1 л. Выход антитела против глипикана-3 в T10 составил 2,9 г/л на 35 сутки в культуре.
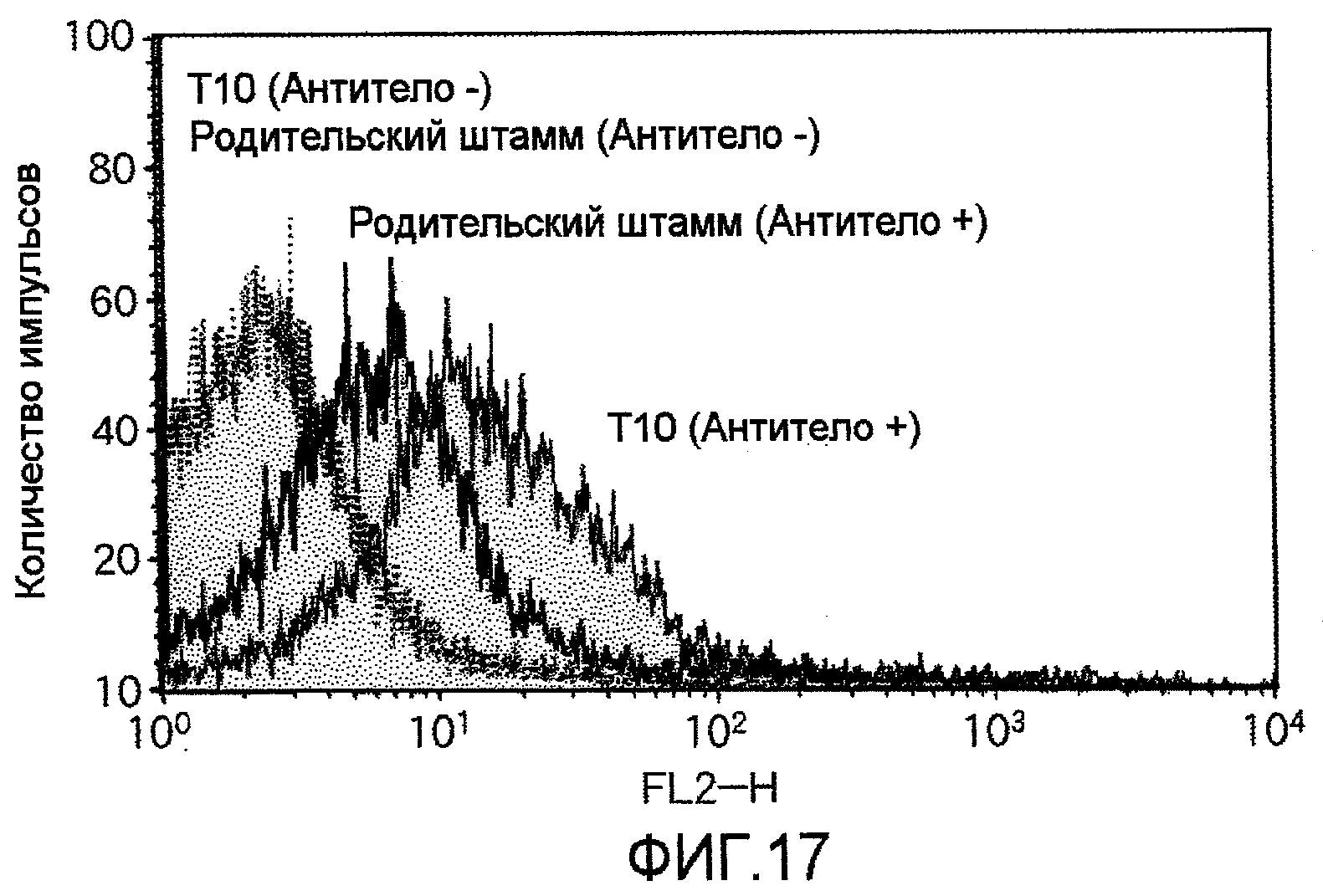
На фиг.17 представлены результаты анализа проточной цитометрией, указывающие на то, что клетки T10, в которые был перенесен TauT, экспрессируют молекулы TauT на их клеточных мембранах.
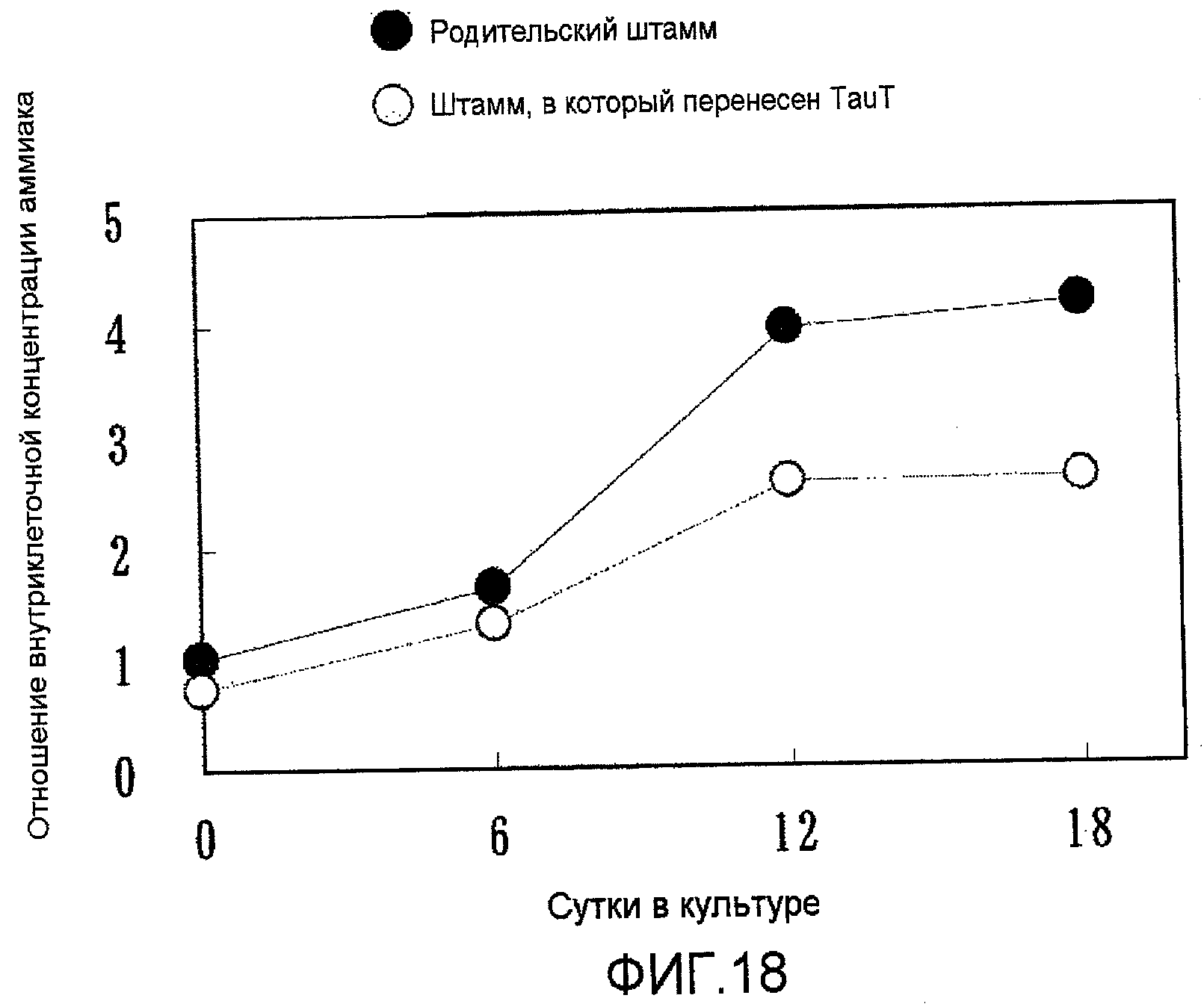
На фиг.18 представлен график, на котором показано внутриклеточное содержание аммиака (уровни концентраций) в культуре с подпиткой в емкости 1 л. Ингибирование аммиака в штаммах, в которые была перенесена pHyg/TauT, было значительным по сравнению с родительским штаммом.
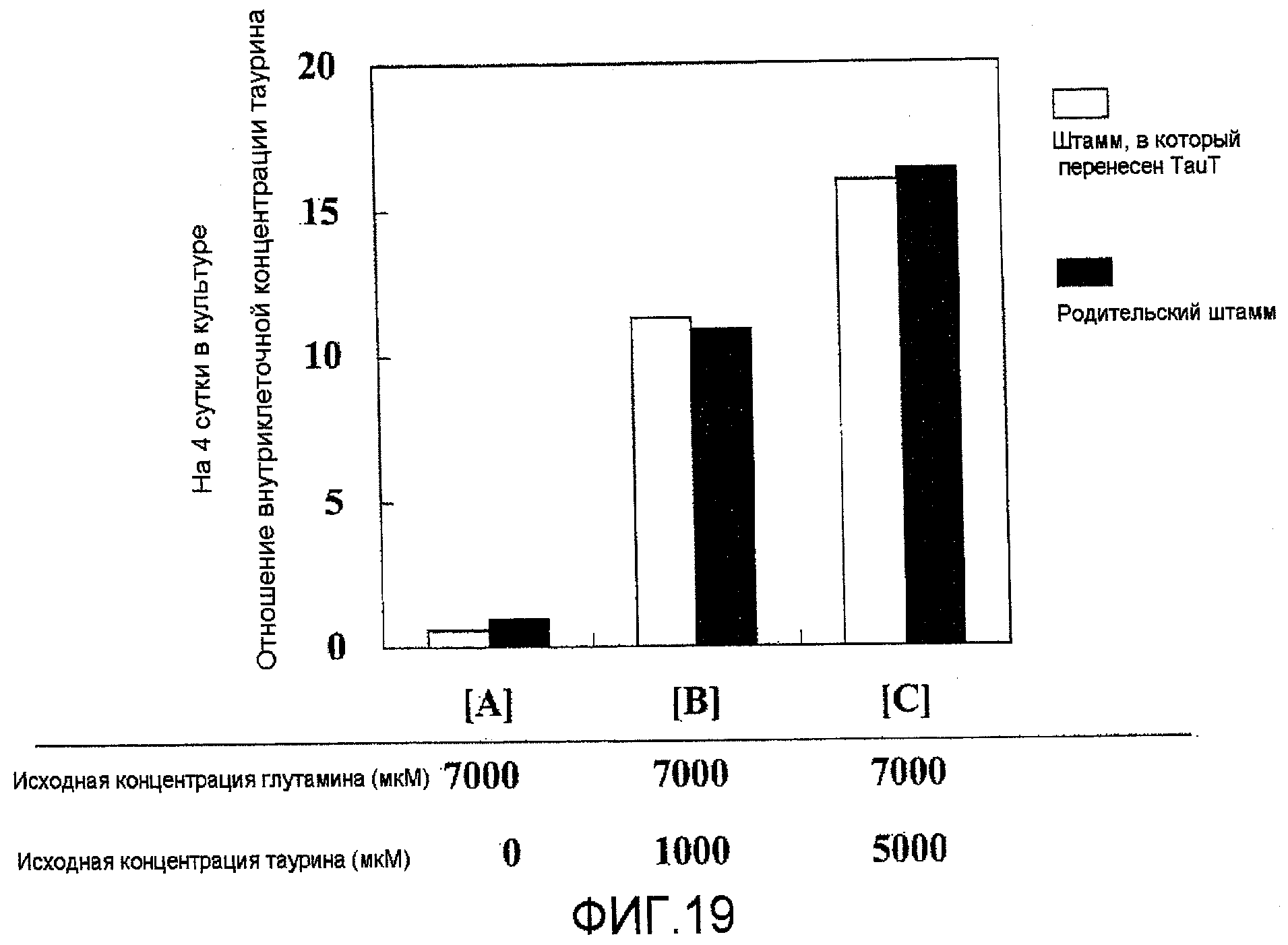
На фиг.19 представлен график, на котором показано, что таурин захватывается клетками в зависимости от концентрации таурина в среде. Не было выявлено отличий в захвате таурина между штаммами, в которые была перенесена pHyg/TauT, и родительскими штаммами.
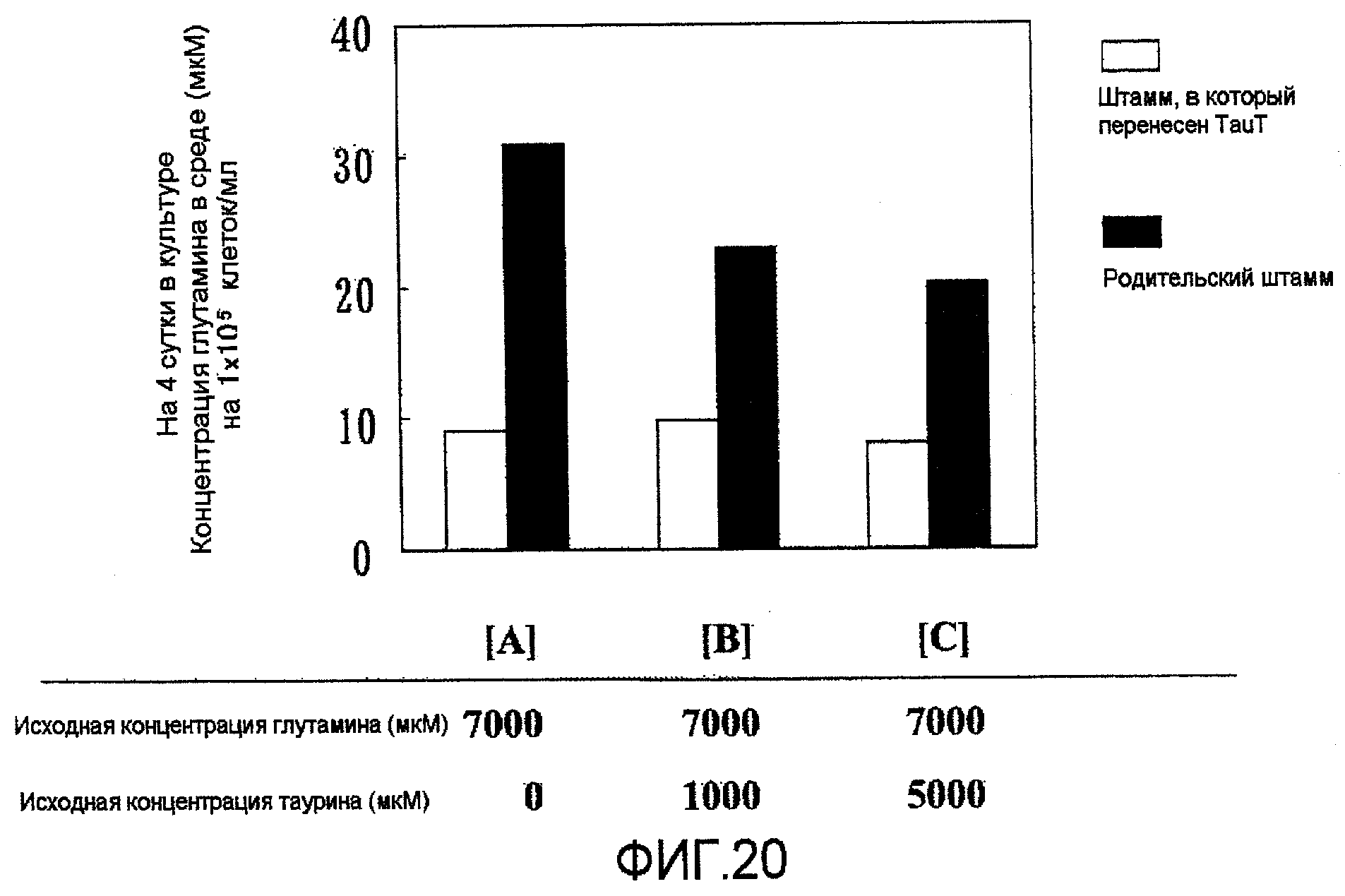
На фиг.20 представлен график, на котором показано потребление глутамина в среде. По сравнению с родительским штаммом, штаммы, в которые была перенесена pHyg/TauT, показали в значительной степени высокое потребление глутамина/клетка, независимо от концентрации таурина в среде.
На фиг.21 представлен график, на котором показано, что выходы антитела против глипикана-3 в штаммах, в которые была перенесена pHyg/TauT, являются практически равными, независимо от исходной концентрации таурина в среде.
На фиг.22 показан выход антитела против глипикана-3 в штамме TA41, коэкспрессирующем TauT/ALT, на 14 сутки в культуре с подпиткой в устройстве для перемешивания. Выход антитела повышался при добавлении α-кетоглутарата.
НАИЛУЧШИЕ СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже, варианты осуществления настоящего изобретения описаны более подробно.
Настоящее изобретение относится к способу продукции полипептида, включающему культивирование клетки, которая на высоком уровне экспрессирует ALT и обладает перенесенной в нее ДНК, кодирующей требуемый полипептид, что, тем самым, дает клетке возможность продуцировать полипептид.
В способе по настоящему изобретению, клетка может быть либо природной клеткой, способной продуцировать требуемый полипептид, либо трансформированной клеткой, в которую перенесена ДНК, кодирующая требуемый полипептид. Предпочтительно, используют трансформированную клетку, в которую перенесена ДНК, кодирующая требуемый полипептид.
В способе по настоящему изобретению требуемый полипептид конкретно не ограничен. Полипептид может представлять собой любой полипептид, такой как антитело (например, антитело против рецептора IL-6, антитело против IL-6, антитело против глипикана-3, антитело против CD3, антитело против CD20, антитело против GPIIb/IIIa, антитело против TNF, антитело против CD25, антитело против EGFR, антитело против Her2/neu, антитело против RSV, антитело против CD33, антитело против CD52, антитело против IgE, антитело против CD11a, антитело против VEGF, антитело против VLA4 и т.п.) или физиологически активный белок (например, гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин, интерферон, интерлейкин, такой как IL-1 или IL-6, t-PA, урокиназа, сывороточный альбумин, фактор свертывания крови, PTH и т.п.). Антитело, в частности, является предпочтительным и оно может представлять собой любое антитело, такое как природное антитело, антитело низкомолекулярного размера (например, Fab, scFv, sc(Fv)2), химерное антитело, гуманизированное антитело, и т.д.
С использованием экспрессирующих на высоком уровне ALT клеток количество полипептида, продуцируемого клетками, можно повышать.
ALT, главным образом, известна как фермент, который образует глутамат переносом аминогруппы с аланина на 2-оксоглутарат. Авторы настоящего изобретения посчитали, что если реакцию биосинтеза пирувата и глутамата из аланина можно было бы обеспечить посредством экспрессии на высоком уровне ALT в клетках-хозяевах, таких как клетки CHO, продукты могут использоваться в метаболизме в ходе цикла TCA и продукции глюкозы путем гликогенеза, и это может улучшить поведение клеток в культуре, приводя к продукции с высоким выходом требуемого полипептида.
Клетки, на высоком уровне экспрессирующие ALT, в частности, не ограничены, при условии, что они способны экспрессировать ALT на более высоких уровнях, чем природные клетки. Природные клетки включают, но не ограничиваются конкретно ими, клетки, которые используют в качестве хозяев при продукции рекомбинантных белков и они могут быть проиллюстрированы клетками CHO.
Клетка, которая на высоком уровне экспрессирует ALT, конкретно не ограничена, при условии, что клетка обладает повышенным уровнем экспрессии ALT по сравнению с соответствующей природной клеткой. Природная клетка конкретно не ограничена. Можно использовать клетку, которую используют в качестве хозяина для продукции рекомбинантного белка (например, клетки CHO).
В качестве клетки, которая на высоком уровне экспрессирует ALT, может быть приведена клетка, в которую искусственно перенесен ген ALT. Клетку, в которую искусственно перенесен ген ALT, можно получать способами, известными специалистам в данной области. Например, такую клетку можно получать включением гена ALT в вектор и трансформацией вектором клетки. Более того, понятие "клетки, в которые искусственно перенесен ген ALT," охватывает в настоящем документе клетки, в которых эндогенный ген ALT активирован способами активации генов (см., например, международную публикацию WO94/12650), так чтобы ALT экспрессировалась на высоком уровне.
В качестве ALT, подлежащей экспрессии на высоком уровне в клетке, можно использовать ALT из любого организма. Конкретно, известны и можно использовать ALT из человека, мыши, крысы, собаки, африканской шпорцевой лягушки, плодовой мушки, нематод, японского риса, Cyanidioschyzon merolae, Saccharomyces cerevisiae, Ashbya gossypii, Candida albicans, Schizosaccharomyces pombe, Aspergillus nidulans, Aspergillus fumigatus, Aspergillus oryzae, Cryptococcus neoformans, Dictyostelium discoideum, Trypanosoma brucei, Leishmania major, Entamoeba histolytica и Trypanosoma cruzi. Предпочтительно, можно использовать ALT из человека, грызуна или того же вида, что и клетка-хозяин. Например, когда клетка, которой позволяют на высоком уровне экспрессировать ALT, представляет собой клетки яичника китайского хомяка (клетки CHO), источником ALT предпочтительно является человек или хомяк. Для ALT человека, мыши и дрожжей существуют варианты (ALT1 и ALT2). ALT2 обладает 80% или более гомологией с ALT1 на уровне аминокислот. Вынужденную экспрессию ALT1 проводили в примерах, описанных ниже.
Кроме того, в качестве гена ALT, подлежащего экспрессии на высоком уровне в клетке, можно использовать любую из следующих ДНК с (a) по (e), кодирующих ALT.
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60;
(b) ДНК, кодирующая полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы;
(c) ДНК, кодирующая полипептид, имеющий 70% или более гомологию аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, и, кроме того, обладает активностью аланинаминотрансферазы;
(d) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59;
(e) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
Клетка, которая на высоком уровне экспрессирует ALT, может представлять собой любую клетку, например, эукариотическую клетку, такую как клетки животных, растений и дрожжей, прокариотическую клетку, такую как E. coli и B. subtilis, и т.д. Предпочтительно, используют клетки животных, такие как клетки CHO и COS, особенно предпочтительными являются клетки CHO. Для получения требуемого полипептида, предпочтительными являются клетки, пригодные для переноса гена, кодирующего требуемый полипептид, такие как клетки CHO-dhfr.
Предпочтительно, клетка по настоящему изобретению, которая на высоком уровне экспрессирует ALT, кроме того, на высоком уровне экспрессирует переносчик таурина для получения требуемого полипептида. Посредством переноса гена, кодирующего требуемый полипептид, в клетку и культивирования полученной клетки в среде можно получать требуемый полипептид в более высоком количестве.
Когда требуемый полипептид продуцируют с использованием клетки, в которую искусственно перенесен ген ALT, порядок переноса гена ALT и переноса гена, кодирующего требуемый полипептид, конкретно не ограничен. Ген, кодирующий требуемый полипептид, может быть перенесен после переноса гена ALT. Альтернативно ген ALT может быть перенесен после переноса гена, кодирующего требуемый полипептид. Также можно переносить ген ALT и ген, кодирующий требуемый полипептид, одновременно.
Ген ALT и ген, кодирующий требуемый полипептид, можно переносить одновременно в одном векторе. Альтернативно их можно переносить по отдельности с использованием множества векторов.
С использованием клетки, которая на высоком уровне экспрессирует ALT и переносчик таурина, можно снижать внутриклеточную концентрацию аммиака.
Известно, что переносчик таурина представляет собой мембранный белок, обладающий осморегуляторной функцией захвата аминокислот (таких как таурин и β-аланин) в клетки.
Клетка, которая на высоком уровне экспрессирует переносчик таурина, конкретно не ограничена, при условии, что клетка обладает повышенным уровнем экспрессии переносчика таурина по сравнению с соответствующей природой клеткой. Природная клетка конкретно не ограничена. Можно использовать клетку, которую используют в качестве хозяина для продукции рекомбинантного белка (например, клетки CHO).
В качестве клетки, которая на высоком уровне экспрессирует переносчик таурина, может быть приведена клетка, в которую искусственно перенесен ген переносчика таурина. Клетку, в которую искусственно перенесен ген переносчика таурина, можно получать способами, известными специалистам в данной области. Например, такую клетку можно получать включением гена переносчика таурина в вектор и трансформации вектора в клетку.
В качестве переносчика таурина, подлежащего экспрессии на высоком уровне в клетке, можно использовать переносчик таурина из любого организма. Конкретно, можно использовать переносчик таурина из человека или грызуна (такого как мышь, крыса или хомяк). Предпочтительно, можно использовать переносчик таурина из человека, грызуна или того же вида, что и клетка-хозяин. Например, когда клетка, которой позволяют на высоком уровне экспрессировать переносчик таурина, представляет собой клетки яичника китайского хомяка (клетки CHO), источником переносчика таурина предпочтительно является человек или хомяк.
Кроме того, в качестве гена переносчика таурина, подлежащего экспрессии на высоком уровне в клетке, можно использовать любую из следующих ДНК с (a1) по (e1), кодирующих переносчик таурина.
(a1) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 62, 64, 66 или 68;
(b1) ДНК, кодирующая полипептид, которая обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 62, 64, 66 или 68, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью переносчика таурина;
(c1) ДНК, кодирующая полипептид, обладающий 70% или более гомологией аминокислотной последовательности с аминокислотной последовательностью, как показано в SEQ ID NO: 62, 64, 66 или 68, и кроме того, имеющий активность переносчика таурина;
(d1) ДНК, обладающая нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67;
(e1) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью переносчика таурина.
Продукцию требуемого полипептида можно проводить переносом гена, кодирующего требуемый полипептид, в клетку, которая на высоком уровне экспрессирует ген переносчика таурина и ген ALT, и культивированием полученной клетки в среде. Более того, требуемый полипептид можно получать с использованием клетки, в которой эндогенный ген активирован способами активации генов (см., например, международную публикацию WO94/12650), так чтобы продуцировался требуемый полипептид.
Когда требуемый полипептид продуцируют с использованием клетки, в которую искусственно перенесен ген переносчика таурина и ген ALT, порядок переноса гена переносчика таурина, переноса гена ALT и переноса гена, кодирующего требуемый полипептид, конкретно не ограничен. Ген, кодирующий требуемый полипептид, можно переносить после переноса гена переносчика таурина и гена ALT. Альтернативно ген переносчика таурина и ген ALT можно переносить после переноса гена, кодирующего требуемый полипептид. Также можно переносить ген переносчика таурина, ген ALT и ген, кодирующий требуемый полипептид, одновременно.
Ген переносчика таурина, ген ALT и ген, кодирующий требуемый полипептид, могут быть перенесены одновременно в одном векторе. Альтернативно они могут быть перенесены по отдельности с использованием нескольких векторов.
Для культивирования клетки, которая на высоком уровне экспрессирует ALT (и которая на высоком уровне экспрессирует переносчик таурина), можно использовать среды, используемые в общепринятых клеточных культурах (предпочтительно, культурах клеток животных). Эти среды обычно содержат аминокислоты, витамины, липидные факторы, источники энергии, регуляторы осмотического давления, источники железа и регуляторы pH. Содержание этих компонентов обычно является следующим: аминокислоты 0,05-1500 мг/л, витамины 0,001-10 мг/л, липидные факторы 0-200 мг/л, источники энергии 1-20 г/л, регуляторы осмотического давления 0,1-10000 мг/л, источники железа 0,1-500 мг/л, регуляторы pH 1-10000 мг/л, микроэлементы металлов 0,00001-200 мг/л, поверхностно-активные вещества 0-5000 мг/л, кофакторы роста 0,05-10000 мкг/л и нуклеозиды 0,001-50 мг/л. Однако содержание не ограничивается этими диапазонами и его можно соответствующим образом выбирать, в зависимости от типа клетки, подлежащей культивированию, типа требуемого полипептида и т.д.
В дополнение к этим компонентам, можно добавлять микроэлементы металлов, поверхностно-активные вещества, кофакторы роста, нуклеозиды и т.п.
Конкретные примеры таких компонентов включают аминокислоты, такие как L-аланин, L-аргинин, L-аспарагин, L-аспарагиновая кислота, L-цистеин, L-цистин, L-глутамин, L-глутаминовая кислота, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-орнитин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин, предпочтительно L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистин, L-глутамин, L-глутаминовую кислоту, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин; витамины, такие как изо-инозитол, биотин, фолиевая кислота, липоевая кислота, никотинамид, никотиновая кислота, п-аминобензойная кислота, пантотенат кальция, пиридоксаль гидрохлорид, гидрохлорид пиридоксина, рибофлавин, гидрохлорид тиамина, витамин B12 и аскорбиновая кислота, предпочтительно, биотин, фолиевую кислоту, липоевую кислоту, никотинамид, пантотенат кальция, пиридоксаль гидрохлорид, рибофлавин, гидрохлорид тиамина, витамин B12 и аскорбиновую кислоту; липидные факторы, такие как хлорид холина, тартрат холина, линолеиновая кислота, олеиновая кислота и холестерин, предпочтительно, хлорид холина; источники энергии, такие как глюкоза, галактоза, манноза и фруктоза, предпочтительно, глюкозу; регуляторы осмотического давления, такие как хлорид натрия, хлорид калия и нитрат калия, предпочтительно, хлорид натрия; источники железа, такие как железо-ЭДТА, цитрат трехвалентного железа, хлорид двухвалентного железа, хлорид трехвалетного железа, сульфат двухвалентного железа, сульфат трехвалентного железа и нитрат трехвалентного железа, предпочтительно, хлорид трехвалентного железа, железо-ЭДТА и цитрат трехвалентного железа; и регуляторы pH, такие как гидрокарбонат натрия, хлорид кальция, дигидрофосфат натрия, HEPES и MOPS, предпочтительно, гидрокарбонат натрия. В качестве примеров могут быть приведены культуральные среды, содержащие любые из этих компонентов.
Помимо указанных выше компонентов, можно добавлять микроэлементы металлов, такие как сульфат меди, сульфат марганца, сульфат цинка, сульфат магния, хлорид никеля, хлорид олова, хлорид магния и субсиликат натрия, предпочтительно, сульфат меди, сульфат цинка и сульфат магния; поверхностно-активные вещества, такие как Tween 80 и Pluronic F68; кофакторы роста, такие как рекомбинантный инсулин, рекомбинантный IGF-1, рекомбинантный EGF, рекомбинантный FGF, рекомбинантный PDGF, рекомбинантный TGF-α, гидрохлорид этаноламина, селенит натрия, ретиноевая кислота и дигидрохлорид путресцина, предпочтительно, селенит натрия, гидрохлорид этаноламина, рекомбинантный IGF-1 и дигидрохлорид путресцина; и нуклеозиды, такие как дезоксиаденозин, дезоксицитидин, дезоксигуанозин, аденозин, цитидин, гуанозин и уридин. В предпочтительных примерах, указанные выше среды могут содержать антибиотики, такие как стрептомицин, пенициллин-G калий и гентамицин, и индикаторы pH, такие как феноловый красный.
Кроме того, в среду можно добавлять α-кетоглутарат, служащий субстратом для ALT. Выход требуемого полипептида (например, антитела) можно повышать путем добавления α-кетоглутарата. В этом случае, количество α-кетоглутарата, подлежащее добавлению, обычно находится в диапазоне от 0,01 до 1000 мМ, предпочтительно от 0,1 до 100 мМ, и более предпочтительно от 1 до 10 мМ.
pH среды варьирует в зависимости от клетки, подлежащей культивированию. Как правило, подходящим является pH 6,8-7,6. Во многих случаях подходящим является pH 7,0-7,4.
Также можно использовать коммерческую среду для культивирования клеток животных, например, D-MEM (модифицированная способом Игла среда Дульбекко), смесь 1:1 D-MEM/F-12 (модифицированная способом Игла среда Дульбекко: смесь питательных веществ F-12), RPMI1640, CHO-S-SFMII (Invitrogen), CHO-SF (Sigma-Aldrich), EX-CELL 301 (JRH Biosciences), CD-CHO (Invitrogen), IS CHO-V (Irvine Scientific), PF-ACF-CHO (Sigma-Aldrich) или сходные с ними.
Альтернативно среда может представлять собой бессывороточную среду, такую как CD-CHO (Invitrogen).
Когда клетка, которая на высоком уровне экспрессирует ALT (и которая на высоком уровне экспрессирует переносчик таурина) представляет собой клетки CHO, клетки CHO можно культивировать способами, известными специалистам в данной области. Например, клетки CHO обычно можно культивировать в атмосфере с концентрацией CO2 в газообразной фазе от 0 до 40%, предпочтительно от 2 до 10%, при 30-39°C, предпочтительно при приблизительно 37°C.
Более того, в случае, когда требуемый полипептид, такой как антитело, продуцируется клеточной культурой, клетки становятся высоко конфлюэнтными на поздней стадии культивирования (приблизительно 1 × 107 клеток/мл), и эффект продуктов их жизнедеятельности, таких как лактат, становится крайне высоким. Если требуемый полипептид продуцируется клетками, на высоком уровне экспрессирующими ALT, поддерживается высокий уровень выживаемости даже на поздней стадии культивирования, и также можно ожидать повышения выхода требуемого полипептида.
Надлежащий период культивирования для получения требуемого полипептида с использованием клетки, которая на высоком уровне экспрессирует ALT, как правило, составляет от 1 суток до 3 месяцев, предпочтительно от 1 суток до 2 месяцев, более предпочтительно от 1 суток до 1 месяца.
В отношении различных устройств для культивирования клеток животных можно использовать устройство для культивирования в виде емкости ферментера, устройство для культивирования с перемешиванием струей воздуха, устройство для культивирования в виде культурального флакона, устройство для культивирования в виде вращающегося флакона, устройство для культивирования в виде микроносителя, устройство для культивирования в псевдоожиженном слое, устройство для культивирования в виде полых волокон, устройство для культивирования в виде вращающегося флакона, устройство для культивирования в фильтрующем слое или сходные с ними.
Культивирование можно проводить любым способом культивирования, таким как периодическая культура, культура с подпиткой или непрерывная культура. Предпочтительно, используют культуру с подпиткой или непрерывную культуру. Более предпочтительной является культура с подпиткой.
Когда культивируют клетку, которая на высоком уровне экспрессирует ALT (и которая может на высоком уровне экспрессировать переносчик таурина), в среду можно добавлять таурин для обеспечения захвата таурина в клетки. Концентрация таурина, подлежащая добавлению в среду, конкретно не ограничена, однако обычно она находится в диапазоне от 0 г/л до 100 г/л, предпочтительно от 0 г/л до 20 г/л, и более предпочтительно от 0 г/л до 10 г/л.
Когда полипептид, продуцируемый способом по настоящему изобретению, обладает биологической активностью, полезной в качестве фармацевтического средства, можно продуцировать фармацевтическое средство смешиванием этого полипептида с фармацевтически приемлемым носителями или добавками и изготовления из них препарата.
Конкретные примеры фармацевтически приемлемых носителей и добавок включают воду, органические растворители, которые являются фармацевтически приемлемыми, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, карбоксиметилцеллюлозу натрия, полиакрилат натрия, альгинат натрия, растворимый в воде декстран, карбоксиметилкрахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую смолу, гуммиарабик, казеин, агар-агар, полиэтиленгликоль, диглицерин, глицерин, пропиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, сывороточный альбумин человека (HSA), маннит, сорбит, лактозу и поверхностно-активные вещества, которые являются приемлемыми в качестве фармацевтических добавок.
В действительности, добавки можно выбирать из указанных выше добавок по отдельности или в сочетании в соответствии с дозированной формой лекарственного средства по настоящему изобретению, но они не ограничиваются добавками, приведенными выше. Например, когда полипептид используют в качестве инъецируемого состава, очищенный полипептид можно растворять в растворителе, таком как физиологический раствор, буфер или раствор глюкозы, а затем в раствор можно добавлять ингибитор адсорбции, такой как Tween 80, Tween 20, желатин или сывороточный альбумин человека. Альтернативно, можно использовать лиофилизированное средство для получения дозированной формы, которую растворяют и разбавляют перед применением. Примеры эксципиента, пригодного для лиофилзации, включают спирты сахаров и сахариды, такие как маннит и глюкоза.
Эффективные дозы полипептида можно надлежащим образом выбирать, в зависимости от типа полипептида, тапа заболевания, подлежащего лечению или профилактике, возраста пациента, тяжести заболевания, и т.д. Например, когда полипептид представляет собой антитело против глипикана, эффективную дозу антитела против глипикана выбирают из диапазона от 0,001 мг до 1000 мг на кг массы тела на введение. Альтернативно можно выбирать дозу 0,01-100000 мг/на организм пациента. Однако эффективная доза не ограничивается этими диапазонами.
Полипептид можно вводить либо перорально, либо парентерально, однако предпочтительным является парентеральное введение. Конкретно, могут быть приведены инъекция (например, системное или местное введение путем внутривенной инъекции, внутримышечная инъекция, внутрибрюшинная инъекция, подкожная инъекция и т.д.), введение через нос, введение через легкие, чрескожное введение и сходные с ними.
В настоящем изобретении в качестве гена, кодирующего ALT, можно использовать ДНК, кодирующую полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60. Альтернативно можно использовать ДНК, кодирующую полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков и, кроме того, обладает активностью аланинаминотрансферазы.
Полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков, и, кроме того, обладает активностью аланинаминотрансферазы, является функционально эквивалентным ALT из человека, мыши, крысы, собаки, африканской шпорцевой лягушки, плодовой мушки, нематод, японского риса, Cyanidioschyzon merolae, Saccharomyces cerevisiae, Ashbya gossypii, Candida albicans, Schizosaccharomyces pombe, Aspergillus nidulans, Aspergillus fumigatus, Aspergillus oryzae, Cryptococcus neoformans, Dictyostelium discoideum, Trypanosoma brucei, Leishmania major, Entamoeba histolytica и Trypanosoma cruzi (в дальнейшем в настоящем документе иногда обозначаемой “ALT из человека или сходных с ним”). Такой полипептид охватывает, например, мутанты ALT из человека или сходных с ним. В примере, описанном ниже, использовали мутант, в котором были заменены четыре из 496 аминокислот (R53S, Q72R, F286S и M332K).
В качестве хорошо известных специалистам в данной области способов получения полипептидов, функционально эквивалентных конкретному полипептиду, могут быть приведены способы внесения мутаций в полипептиды. Например, специалисты в данной области могут получить полипептиды, функционально эквивалентные ALT из человека или сходных с ним, путем соответствующего внесения мутаций в аминокислоты ALT из человека или сходных с ним посредством сайт-направленного мутагенеза (Hashimoto-Gotoh, T. et al. (1995) Gene 152, 271-275; Zoller, MJ, and Smith, M. (1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, TA (1985) Proc Natl Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). Мутации аминокислоты также могут происходить естественным образом.
Конкретные примеры полипептидов, функционально эквивалентных ALT из человека или сходных с ним, включают, но не ограничиваются ими, полипептид, имеющий аминокислотную последовательность, образованную из аминокислотной последовательности (например, SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60) ALT из человека или сходных с ним путем делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; полипептид, имеющий аминокислотную последовательность, образованную из аминокислотной последовательности ALT из человека или сходных с ним, путем делеции одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот; и полипептид, обладающий аминокислотной последовательностью, образованной из аминокислотной последовательности ALT из человека или сходных с ним, путем замены одной или нескольких аминокислот, предпочтительно 1-30 аминокислот, более предпочтительно 1-10 аминокислот, другими аминокислотами.
Аминокислотные остатки, подлежащие мутации, в частности, не ограничены. Предпочтительно, происходят мутации аминокислотных остатков на другие аминокислоты, которые сохраняют свойства боковой цепи исходной аминокислоты. Конкретные примеры свойств боковых цепей аминокислот включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с содержащей гидроксильную группу боковой цепью (S, T и Y), аминокислоты с содержащей атом серы боковой цепью (C и M), аминокислоты с содержащей карбоновую кислоту и амид боковой цепью (D, N, E и Q), аминокислоты с содержащей основание боковой цепью (R, K и H) и аминокислоты с содержащей ароматическую группу боковой цепью (H, F, Y и W) (В скобках указаны однобуквенные коды аминокислот).
Описано, что полипептид, обладающий аминокислотной последовательностью, образованной из исходной аминокислотной последовательности путем модификации (такой как делеция, вставка и/или замена одной или нескольких аминокислот), сохраняет биологическую активность исходного полипептида (Mark, D. F. et al., Proc. Natl. Acad. Sci. USA (1984) 81, 5662-5666; Zoller, M. J. & Smith, M. Nucleic Acids Research (1982) 10, 6487-6500; Wang, A. et al., Science 224, 1431-1433; Dalbadie-McFarland, G. et al., Proc. Natl. Acad. Sci. USA (1982) 79, 6409-6413).
В качестве одного из примеров полипептида, в котором один или несколько аминокислотных остатков добавлено к ALT из человека или сходных с ним, может быть приведен слитый полипептид, содержащий ALT из человека или сходных с ним. Такой слитый полипептид состоит из ALT из человека или сходных с ним и другого полипептида, слитого с ним. Такой слитый полипептид можно получать связыванием гена, кодирующего ALT из человека или сходных с ним, в рамке считывания с геном, кодирующим другой полипептид, переносом полученной ДНК в экспрессирующий вектор и экспрессией ДНК в клетке-хозяине. Можно использовать способы, известные специалистам в данной области. Отсутствуют ограничения для полипептида, подлежащего слиянию с ALT из человека или сходных с ним.
Примеры полипептидов, подлежащих слиянию с ALT из человека или сходных с ним, включают, но не ограничиваются ими, FLAG (Hopp, T. P. et al., BioTechnology (1988) 6, 1204-1210), 6xHis, содержащий шесть остатков гистидина (His), 10xHis, гемагглютинин вируса гриппа (HA), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, T7-метку, HSV-метку, E-метку, фрагмент антигена SV40T, lck-метку, фрагмент α-тубулина, B-метку, фрагмент белка C, глутатион-S-трансферазу (GST), гемагглютинин вируса гриппа (HA), константный участок иммуноглобулина, β-галактозидазу и связывающий мальтозу белок (MBP).
Коммерчески доступный ген, кодирующий такой полипептид, подвергают слиянию с геном, кодирующим ALT из человека или сходных с ним. Полученный таким образом слитый ген экспрессируется с образованием слитого полипептида.
Альтернативный известный специалистам в данной области способ получения полипептидов, функционально эквивалентных конкретному полипептиду, представляет собой способ с использованием технологии гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9,47-9,58, Cold Spring Harbor Lab. Press, 1989). Специалисты в данной области могут общепринятым способом выделять ДНК, высоко гомологичную последовательности ДНК (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59) ALT из человека или сходных с ним, на основе этой последовательности ДНК или ее части, и выделять полипептиды, функционально эквивалентные ALT из человека или сходных с ним, с помощью этой ДНК.
Условия гибридизации для выделения ДНК, кодирующей полипептид, функционально эквивалентный ALT из человека или сходных с ним, могут соответствующим образом выбирать специалисты в данной области. Например, могут быть приведены условия гибридизации низкой строгости. Условия гибридизации низкой строгости представляют собой, например, 42°C, 2 × SSC и 0,1% SDS, предпочтительно 50°C, 2 × SSC и 0,1% SDS. Более предпочтительно, могут быть приведены условия гибридизации высокой строгости. Например, высоко строгие условия представляют собой 65°C, 2 × SSC и 0,1% SDS. В этих условиях, при снижении температуры гибридизации, получают не только ДНК с высокой гомологией, но также ДНК только с низкой гомологией. Напротив, ожидается, что при повышении температуры гибридизации получают только ДНК с высокой гомологией. Однако на строгость гибридизации влияет не только температура, но также множество других факторов (таких как концентрации солей). Специалисты в данной области могут надлежащим образом выбирать эти факторы для достижения сходной строгости.
Полипептид, кодируемый ДНК, выделенный этими способами гибридизации, может обладать 70% гомологией или более и, как правило, он обладает высокой гомологией аминокислотной последовательности с ALT из человека или сходных с ним. Термин “высокая гомология” относится, как правило, к 97% или более гомологии, предпочтительно 98% или более гомологии, более предпочтительно 99% или более гомологии. Для определения гомологии полипептидов можно следовать алгоритму, описанному Wilbur, W. J. and Lipman, D. J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Полипептид может варьировать по аминокислотной последовательности, молекулярной массе, изоэлектрической точке, наличию или отсутствию цепей сахаров, морфологии, и т.д., в зависимости от клетки или хозяина, которые продуцируют полипептид, или от способов очистки, которые описаны ниже. Однако при условии, что полученный полипептид обладает функциями, эквивалентными функциям ALT из человека или сходных с ним, ДНК, кодирующую полипептид, можно использовать в настоящем изобретении. Например, когда полипептид по настоящему изобретению экспрессируется в прокариотах (например, Escherichia coli), на N-конец исходной аминокислотной последовательности полипептида добавляется остаток метионина. Когда полипептид экспрессируется в эукариотах (например, в клетках млекопитающих), удаляется N-концевая сигнальная последовательность. Эти полипептиды можно использовать в настоящем изобретении.
Полипептид можно получать в виде рекомбинантного полипептида или природного полипептида способами, известными специалистам в данной области. Рекомбинантный полипептид можно получать путем включения ДНК, кодирующей полипептид, в соответствующий экспрессирующий вектор, введения вектора в соответствующую клетку-хозяина, сбора полученного трансформанта, экстракции неочищенного полипептида, а затем очистки полипептида хроматографией (такой как ионообменная, обращено-фазовая хроматография или гель-фильтрация, или аффинная хроматография, в которой в колонке фиксируют антитело к полипептиду, полученному способом по настоящему изобретению) или сочетанием этих хроматографических способов.
Когда полипептид экспрессируется в клетке-хозяине (например, в клетке животного или E. coli) в качестве полипептида, слитого с полипептидом глутатион-S-трансферазы, или в качестве рекомбинантного полипептида с добавленными к нему остатками гистидина, экспрессированный полипептид можно очищать колонкой с глутатионом или колонкой с никелем.
После очистки слитого полипептида области, не относящиеся к представляющему интерес полипептиду, могут быть отщеплены тромбином или фактором Xa и удалены из слитого полипептида.
Когда полипептид представляет собой природный полипептид, полипептид можно выделять способами очистки, известными специалистам в данной области. Например, экстракт из тканей или клеток, экспрессирующих полипептид, функционально эквивалентный ALT из человека или сходных с ним, можно наносить на аффинную колонку, с которой связано антитело к ALT из человека или сходных с ним. Антитело может представлять собой либо поликлональное антитело, либо моноклональное антитело.
В настоящем изобретении в качестве ДНК, кодирующей ALT, можно использовать ДНК, обладающую нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59. Альтернативно можно использовать ДНК, которая гибридизуется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
ДНК, кодирующую ALT, можно использовать при продукции in vivo или in vitro требуемого полипептида, как описано выше. Кроме того, ДНК, кодирующую ALT, можно использовать для создания клетки, которая на высоком уровне экспрессирует ALT. ДНК, кодирующая ALT, может иметь любую форму при условии, что она способна кодировать ALT. Таким образом, ДНК может представлять собой, например, кДНК, синтезированную с мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что при условии, что ДНК способна кодировать ALT, ДНК может обладать любой нуклеотидной последовательностью, исходя из вырожденности генетических кодов.
ДНК, кодирующую ALT, можно получать способами, известными специалистам в данной области. Например, ДНК можно получать путем получения библиотеки кДНК из клетки, экспрессирующей ALT, и проведения гибридизации с использованием части последовательности ДНК для ALT (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59) в качестве зонда. Библиотеку кДНК можно получать, например, способом, описанным в Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно можно использовать коммерческую библиотеку кДНК. Также можно получать ДНК, кодирующую ALT, путем получения РНК из клетки, экспрессирующей ALT, синтеза олигонуклеотидных молекул ДНК на основе последовательности ДНК для ALT (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59), и проведения ПЦР с использованием олигонуклеотидных молекул ДНК в качестве праймеров, чтобы, тем самым, амплифицировать кДНК, кодирующую ALT.
Кроме того, посредством определения нуклеотидной последовательности полученной кДНК можно определить область трансляции, кодирующую ALT, и получить аминокислотную последовательность ALT. Кроме того, посредством скрининга геномной библиотеки с использованием полученной кДНК в качестве зонда можно выделять геномную ДНК.
Конкретно, можно использовать следующий способ. Во-первых, выделяют мРНК из клеток, тканей или сходных с ними, экспрессирующих ALT. Для выделения мРНК получают тотальную РНК известными способами, например, способом ультрацентрифугирования с помощью гуанидина (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), способом AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) или сходными с ними, а затем мРНК очищают из тотальной РНК с использованием набора для очистки мРНК (Pharmacia), и т.д. Альтернативно мРНК можно получать прямо с использованием набора для очистки мРНК QuickPrep (Pharmacia).
На основе полученной мРНК синтезируют кДНК с использованием обратной транскриптазы. Альтернативно кДНК можно синтезировать с использованием набора, такого как набор для синтеза первой цепи кДНК с помощью обратной транскриптазы AMV (SEIKAGAKU CORPORATION). Также можно синтезировать и амплифицировать кДНК согласно способу 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора 5'-Ampli FINDER RACE Kit (Clontech) и полимеразной цепной реакции (ПЦР) с праймерами.
Представляющий интерес фрагмент ДНК получают из полученного продукта ПЦР и лигируют с ДНК вектора с получением, тем самым, рекомбинантного вектора. Вектор вводят в хозяина (например, E. coli), с последующей селекцией полученных колоний с получением, тем самым, требуемого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК можно подтверждать известным способом, таким как способ терминации цепи дидезоксинуклеотидами.
Кроме того, можно конструировать нуклеотидную последовательность с более высокой эффективностью экспрессии для ДНК, кодирующей ALT, путем рассмотрения частоты использования кодонов в хозяине, подлежащем применению для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p. 43-74). Кроме того, ДНК, кодирующую ALT, можно модифицировать с использованием коммерчески доступных наборов или известных способов. Примеры таких модификаций включают, но не ограничиваются ими, расщепление ферментами рестрикции, встраивание синтетических олигонуклеотидов или соответствующих фрагментов ДНК, добавление линкеров, и встраивание кодона инициации (ATG) и/или кодона терминации (TAA, TGA или TAG).
ДНК, кодирующая ALT, также включает ДНК, которая гибридизуется с ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и кодирует полипептид, функционально эквивалентный ALT.
Строгие условия могут быть соответствующим образом выбраны специалистами в данной области, включая, например, условия низкой строгости. Условия низкой строгости относятся, например, к 42°C, 2 × SSC и 0,1% SDS, предпочтительно 50°C, 2 × SSC и 0,1% SDS. Более предпочтительно, можно выбирать условия высокой строгости. Условия высокой строгости относятся, например, к 65°C, 2 × SSC и 0,1% SDS. В этих условиях, при повышении температуры гибридизации, можно получать ДНК с более высокой гомологией. Описанная выше ДНК, которая гибридизуется, предпочтительно представляет собой ДНК, полученную из природного источника, например, кДНК или хромосомную ДНК.
Эти ДНК, выделенные способами гибридизации, обычно обладают высокой идентичностью нуклеотидной последовательности с ДНК, кодирующей ALT из человека или сходных с ним. ДНК, кодирующая ALT, также включает ДНК, которая кодирует полипептид, функционально эквивалентный ALT из человека или сходных с ним, и обладает высокой идентичностью с ДНК, кодирующей ALT из человека или сходных с ним. Термин “высокая идентичность” относится обычно к гомологии 96% или более, предпочтительно к гомологии 98% или более, более предпочтительно к идентичности 99% или более. Идентичность нуклеотидных последовательностей можно определять с помощью алгоритма BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны программы, такие как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). Когда нуклеотидные последовательности анализируют посредством BLASTN на основе BLAST, параметры могут быть установлены, например, как количество баллов = 100 и длина слова = 12. Конкретные методики этих способов анализа известны (http://www.ncbi.nlm.nih.gov.).
ДНК, кодирующую ALT, можно встраивать в вектор.
Когда клетка-хозяин, подлежащая применению, представляет собой E. coli, предпочтительно, чтобы вектор обладал ориджином репликации (“ori”), так чтобы вектор в большой степени амплифицировался в E. coli (например, JM109, DH5α, HB101 и XL1-Blue) и его получали в большом количестве, и также генами для селекции трансформированных E. coli (например, генов устойчивости к лекарственному средству, которые обеспечивают отличие трансформанта с помощью некоторых лекарственных средств, таких как ампициллин, тетрациклин, канамицин или хлорамфеникол). Примеры предпочтительных векторов включают, но не ограничиваются ими, векторы M13, векторы pUC, pBR322, pBluescript и pCR-Script. В дополнение к этим векторам могут быть перечислены pGEM-T, pDIRECT, pT7 и т.д., когда вектор используют для целей субклонирования кДНК и вырезания субклонированной кДНК. Когда вектор используют для целей продукции полипептида по настоящему изобретению, особенно пригодным является экспрессирующий вектор. Когда предполагается экспрессия в E. coli, экспрессирующий вектор предпочтительно обладает описанными выше признаками, так что вектор амплифицируется в E. coli, а также он предпочтительно обладает промотором, который позволяет эффективную экспрессию в E. coli, таких как JM109, DH5α, HB101 или XL1-Blue, например, промотор lacZ (Ward et al, Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), промотор araB (Better et al, Science (1988) 240, 1041-1043) или промотор T7. Конкретные примеры такого вектора включают, в дополнение к векторам, приведенным выше, pGEX-5X-1 (Pharmacia), систему QIAexpress (Qiagen), pEGFP, или pET (в качестве их хозяина, предпочтительными являются BL21, экспрессирующие РНК полимеразу T7).
Вектор может содержать сигнальные последовательности для секреции полипептида. Когда полипептид подлежит продукции в периплазме E. coli, в качестве сигнальной последовательности для секреции полипептида можно использовать сигнальную последовательность pelB (Lei, S. P. et al., J. Bacteriol. (1987) 169, 4379). Введение вектора в хозяина можно проводить, например, способом с хлоридом кальция или электропорацией.
В случаях, когда используют клетку-хозяина, отличную от E. coli, векторы, пригодные для продукции требуемого полипептида, включают, но не ограничиваются ими, экспрессирующие векторы, полученные из млекопитающих [например, pкDNA3 от Invitrogen; pEGF-BOS (Nucleic Acids Res. 1990, 18(17), p. 5322); pEF, pCDM8], экспрессирующие векторы, полученные из клеток насекомых (например, бакуловирусная экспрессирующая система Bac-to-BAC от GIBCO BRL; pBacPAK8), экспрессирующие векторы, полученные из растений (например, pMH1, pMH2), экспрессирующие векторы, полученные из вирусов животных (например, pHSV, pMV, pAdexLcw), экспрессирующие векторы, полученные из ретровирусов (например, pZIpneo), экспрессирующие векторы, полученные из дрожжей (например, Pichia Expression Kit от Invitrogen; pNV11; SP-Q01), и экспрессирующие векторы, полученные из Bacillus subtilis (например, pPL608, pKTH50).
Когда предполагается экспрессия полипептида в клетках животных (таких как клетки CHO, клетки COS, клетки NIH3T3 и т.д.), вектор предпочтительно обладает промотором, необходимым для экспрессии полипептида в этих клетках. Примеры такого промотора включают, но не ограничиваются ими, промотор SV40 (Mulligan et al, Nature (1979) 277, 108), промотор MMLV-LTR, промотор EF1α (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322) и промотор CMV. Более предпочтительно, вектор также обладает генами для селекции трансформированных клеток (например, генами устойчивости к лекарственным средствам, которые позволяют различение с помощью лекарственных средств, таких как неомицин или G418). Примеры векторов, имеющих такие свойства, включают, но не ограничиваются ими, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Кроме того, когда предполагается стабильная экспрессия представляющего интерес гена и внутриклеточная амплификация количества копий гена, можно использовать следующий способ. В кратком изложении, в клетки CHO, лишенные каскада синтеза нуклеиновых кислот, вводят вектор, обладающий геном DHFR, который комплементирует отсутствие (например, pCHOI), с последующей амплификацией с метотрексатом (MTX). С другой стороны, когда предполагается временная экспрессия представляющего интерес гена, можно использовать способ, в котором клетки COS, обладающие геном, экспрессирующим антиген SV40T на хромосоме, трансформируют вектором, имеющим ориджин репликации SV40 (например, pcD). В качестве ориджина репликации, также можно использовать ориджин репликации из полиомавируса, аденовируса или папилломавируса крупного рогатого скота (BPV). Кроме того, экспрессирующий вектор может содержать селективные маркеры для амплификации копий гена в системе клетки-хозяина. Примеры таких селективных маркеров включают, но не ограничиваются ими, ген аминогликозидфосфотрансферазы (APH), ген тимидинкиназы (TK), ген ксантин-гуанин-фосфорибозилтрансферазы (Ecogpt) и ген дигидрофолатредуктазы (dhfr) E. coli.
Клетка-хозяин, в которую переносят ДНК, кодирующую ALT (которую можно включать в вектор), конкретно не ограничена. Например, можно использовать E. coli или различные клетки животных. Если ДНК, кодирующую требуемый полипептид, переносят в клетку-хозяина, в которую перенесена ДНК, кодирующая ALT, эта клетка-хозяин может экспрессировать ALT на высоком уровне, что приводит к повышенной продукции требуемого полипептида. Кроме того, в клетку-хозяина, в которую перенесена ДНК, кодирующая ALT, можно переносить ДНК, кодирующую переносчик таурина (которая может быть включена в вектор). При переносе ДНК, кодирующей требуемый полипептид, и ДНК, кодирующей переносчик таурина, в клетку-хозяина, в которую перенесена ДНК, кодирующая ALT, выход требуемого полипептида может повышаться. Для продукции полипептида существуют системы продукции in vivo и in vitro. Примеры систем продукции in vitro включают системы с использованием эукариот и системы с использованием прокариот.
В настоящем изобретении в качестве ДНК, кодирующей переносчик таурина, можно использовать ДНК, кодирующую полипептид, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 62, 64, 66 или 68. Альтернативно можно использовать ДНК, кодирующую полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 62, 64, 66 или 68, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков, и, кроме того, обладает активностью переносчика таурина.
Полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, как показано в SEQ ID NO: 62, 64, 66 или 68, путем замены, делеции, вставки и/или инсерции одного или нескольких аминокислотных остатков, и, кроме того, обладает активностью переносчика таурина, является функционально эквивалентным переносчику таурина из хомяка, крысы, мыши или человека (в дальнейшем в настоящем документе иногда называемому “переносчиком таурина из хомяка или сходных с ним”). Такой полипептид охватывает, например, мутанты переносчика таурина из хомяка или сходных с ним.
В качестве хорошо известных специалистам в данной области способов получения полипептидов, функционально эквивалентных конкретному полипептиду, могут быть приведены способы внесения мутаций в полипептиды. Например, специалисты в данной области могут получить полипептиды, функционально эквивалентные переносчику таурина хомяка путем соответствующего внесения мутаций в аминокислоты переносчика таурина хомяка посредством сайт-направленного мутагенеза (Hashimoto-Gotoh, T. et al. (1995) Gene 152, 271-275; Zoller, MJ, and Smith, M.(1983) Methods Enzymol. 100, 468-500; Kramer, W. et al. (1984) Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Methods. Enzymol. 154, 350-367; Kunkel, TA (1985) Proc Natl Acad Sci USA. 82, 488-492; Kunkel (1988) Methods Enzymol. 85, 2763-2766). Мутации аминокислоты также могут происходить естественным образом.
Конкретные примеры полипептидов, функционально эквивалентных переносчику таурина из хомяка или сходных с ним, включают, но не ограничиваются ими, полипептид, обладающий аминокислотной последовательностью, образованной из аминокислотной последовательности переносчика таурина из хомяка или сходных с ним путем делеции одной или нескольких аминокислот, предпочтительно 2-30 аминокислот, более предпочтительно 2-10 аминокислот; полипептид, обладающий аминокислотной последовательностью, образованной из аминокислотной последовательности переносчика таурина из хомяка или сходных с ним путем вставки одной или нескольких аминокислот, предпочтительно 2-30 аминокислот, более предпочтительно 2-10 аминокислот; и полипептид, обладающий аминокислотной последовательностью, образованной из аминокислотной последовательности переносчика таурина из хомяка или сходных с ним путем замены одной или нескольких аминокислот, предпочтительно 2-30 аминокислот, более предпочтительно 2-10 аминокислот, другими аминокислотами.
Аминокислотные остатки, подлежащие мутации, в частности, не ограничены. Предпочтительно, происходят мутации аминокислотных остатков на другие аминокислоты, которые сохраняют свойства боковой цепи исходной аминокислоты. Конкретные примеры свойств боковых цепей аминокислот включают гидрофобные аминокислоты (A, I, L, M, F, P, W, Y и V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S и T), аминокислоты с алифатической боковой цепью (G, A, V, L, I и P), аминокислоты с содержащей гидроксильную группу боковой цепью (S, T и Y), аминокислоты с содержащей атом серы боковой цепью (C и M), аминокислоты с содержащей карбоновую кислоту и амид боковой цепью (D, N, E и Q), аминокислоты с содержащей основание боковой цепью (R, K и H) и аминокислоты с содержащей ароматическую группу боковой цепью (H, F, Y и W) (В скобках указаны однобуквенные коды аминокислот).
В качестве одного примера полипептида, в котором один или несколько аминокислотных остатков добавлено в переносчик таурина из хомяка или сходных с ним, может быть приведен слитый полипептид, содержащий переносчик таурина из хомяка или сходных с ним. Такой слитый полипептид состоит из переносчика таурина из хомяка или сходных с ним и другого полипептида, слитого с ним. Такой слитый полипептид относится к настоящему изобретению. Такой слитый полипептид можно получать связыванием гена, кодирующего переносчик таурина из хомяка или сходных с ним в рамке считывания с геном, кодирующим другой полипептид, переносом полученной ДНК в экспрессирующий вектор и экспрессией ДНК в клетке-хозяине. Можно использовать способы, известные специалистам в данной области. Отсутствуют ограничения для полипептида, подлежащего слиянию с переносчиком таурина из хомяка или сходных с ним.
Примеры полипептидов, подлежащих слиянию с переносчиком таурина из хомяка или сходных с ним, включают, но не ограничиваются ими, FLAG (Hopp, T. P. et al., BioTechnology (1988) 6, 1204-1210), 6xHis, содержащий шесть остатков гистидина (His), 10xHis, гемагглютинин вируса гриппа (HA), фрагмент c-myc человека, фрагмент VSV-GP, фрагмент p18HIV, T7-метку, HSV-метку, E-метку, фрагмент антигена SV40T, lck-метку, фрагмент α-тубулина, B-метку, фрагмент белка C, глутатион-S-трансферазу (GST), гемагглютинин вируса гриппа (HA), константный участок иммуноглобулина, β-галактозидазу и связывающий мальтозу белок (MBP).
Коммерчески доступный ген, кодирующий такой полипептид, подвергают слиянию с геном, кодирующим переносчик таурина из хомяка или сходных с ним. Полученный таким образом слитый ген экспрессируется с образованием слитого полипептида.
Альтернативный известный специалистам в данной области способ получения полипептидов, функционально эквивалентных конкретному полипептиду, представляет собой способ с использованием технологии гибридизации (Sambrook, J et al., Molecular Cloning 2nd ed., 9,47-9,58, Cold Spring Harbor Lab. Press, 1989). Специалисты в данной области могут обычным образом выделять ДНК, высоко гомологичную последовательности ДНК переносчика таурина из хомяка или сходных с ним, на основе этой последовательности ДНК или ее части, и выделять полипептиды, функционально эквивалентные переносчику таурина из хомяка или сходных с ним, с помощью этой ДНК.
Условия гибридизации для выделения ДНК, кодирующей полипептид, функционально эквивалентный переносчику таурина из хомяка или сходных с ним, могут соответствующим образом выбирать специалисты в данной области. Например, могут быть приведены условия гибридизации низкой строгости. Условия гибридизации низкой строгости представляют собой, например, 42°C, 2 × SSC и 0,1% SDS, предпочтительно 50°C, 2 × SSC и 0,1% SDS. Более предпочтительно, могут быть приведены условия гибридизации высокой строгости. Например, высоко строгие условия представляют собой 65°C, 2 × SSC и 0,1% SDS. В этих условиях, при снижении температуры гибридизации получают не только ДНК с высокой гомологией, но также ДНК только с низкой гомологией. Напротив, ожидается, что при повышении температуры гибридизации получают только ДНК с высокой гомологией. Однако на строгость гибридизации влияет не только температура, но также множество других факторов (таких как концентрации солей). Специалисты в данной области могут надлежащим образом выбирать эти факторы для достижения сходной строгости.
Полипептид, кодируемый ДНК, выделенный этими способами гибридизации, может обладать 70% гомологией или более и, как правило, он обладает высокой гомологией аминокислотной последовательности с переносчиком таурина из хомяка или сходных с ним. Полипептид также включает полипептиды, которые функционально эквивалентны переносчику таурина из хомяка или сходных с ним и обладают высокой гомологией с аминокислотной последовательностью переносчика таурина из хомяка или сходных с ним. Термин “высокая гомология” относится, как правило, к 97% или более гомологии, предпочтительно 98% или более гомологии, более предпочтительно 99% или более гомологии. Для определения гомологии полипептидов можно следовать алгоритму, описанному Wilbur, W. J. and Lipman, D. J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730.
Полипептид может варьировать по аминокислотной последовательности, молекулярной массе, изоэлектрической точке, наличию или отсутствию цепей сахаров, морфологии, и т.д., в зависимости от клетки или хозяина, которые продуцируют полипептид, или от способов очистки, которые описаны ниже. Однако, при условии, что полученный полипептид обладает функциями, эквивалентными функциям переносчика таурина из хомяка или сходных с ним, ДНК, кодирующую полипептид, можно использовать в настоящем изобретении. Например, когда полипептид по настоящему изобретению экспрессируется в прокариотах (например, Escherichia coli), на N-конец исходной аминокислотной последовательности полипептида добавляется остаток метионина. Когда полипептид экспрессируется в эукариотах (например, в клетках млекопитающих), удаляется N-концевая сигнальная последовательность. Эти полипептиды можно использовать в настоящем изобретении.
Полипептид можно получать в виде рекомбинантного полипептида или природного полипептида способами, известными специалистам в данной области. Рекомбинантный полипептид можно получать путем включения ДНК, кодирующей полипептид, в соответствующий экспрессирующий вектор, введения вектора в соответствующую клетку-хозяина, сбора полученного трансформанта, экстракции неочищенного полипептида, а затем очистки полипептида хроматографией (такой как ионообменная, обращено-фазовая хроматография или гель-фильтрация, или аффинная хроматография, в которой в колонке фиксируют антитело к полипептиду, полученному способом по настоящему изобретению) или сочетанием этих хроматографических способов.
Когда полипептид экспрессируется в клетке-хозяине (например, в клетке животного или E. coli) в качестве полипептида, слитого с полипептидом глутатион-S-трансферазы, или в качестве рекомбинантного полипептида с добавленными к нему остатками гистидина, экспрессированный полипептид можно очищать колонкой с глутатионом или колонкой с никелем.
После очистки слитого полипептида области, не относящиеся к представляющему интерес полипептиду, могут быть отщеплены тромбином или фактором Xa и удалены из слитого полипептида.
Когда полипептид представляет собой природный полипептид, полипептид можно выделять способами очистки, известными специалистам в данной области. Например, экстракт из тканей или клеток, экспрессирующих полипептид, функционально эквивалентный переносчику таурина из хомяка или сходных с ним, можно наносить на аффинную колонку, с которой связано антитело к переносчику таурина из хомяка или сходных с ним, описанное ниже. Антитело может представлять собой либо поликлональное антитело, либо моноклональное антитело.
В настоящем изобретении в качестве ДНК, кодирующей переносчик таурина, можно использовать ДНК, обладающую нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67. Альтернативно можно использовать ДНК, которая гибридизуется с ДНК, комплементарной ДНК, имеющей нуклеотидную последовательность, как показано в SEQ ID NO: 61, 63, 65 или 67, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью переносчика таурина.
ДНК, кодирующую переносчик таурина, можно использовать при продукции in vivo или in vitro требуемого полипептида, как описано выше. Кроме того, ДНК, кодирующую переносчик таурина, можно использовать для создания клетки, которая на высоком уровне экспрессирует переносчик таурина. ДНК, кодирующая переносчик таурина, может иметь любую форму при условии, что она способна кодировать переносчик таурина. Таким образом, ДНК может представлять собой, например, кДНК, синтезированную с мРНК, геномную ДНК или химически синтезированную ДНК. Следует отметить, что при условии, что ДНК способна кодировать переносчик таурина, ДНК может обладать любой нуклеотидной последовательностью, исходя из вырожденности генетических кодов.
ДНК, кодирующую переносчик таурина, можно получать способами, известными специалистам в данной области. Например, ДНК можно получать путем получения библиотеки кДНК из клетки, экспрессирующей переносчик таурина, и проведения гибридизации с использованием части последовательности ДНК для переносчика таурина (например, SEQ ID NO: 61, 63, 65 или 67) в качестве зонда. Библиотеку кДНК можно получать, например, способом, описанным в Sambrook, J. et al., Molecular Cloning, Cold Spring Harbor Laboratory Press (1989). Альтернативно можно использовать коммерческую библиотеку кДНК. Также можно получать ДНК, кодирующую переносчик таурина, путем получения РНК из клетки, экспрессирующей переносчик таурина, синтеза олигонуклеотидных молекул ДНК на основе последовательности ДНК для переносчика таурина (например, SEQ ID NO: 61, 63, 65 или 67), и проведения ПЦР с использованием олигонуклеотидных молекул ДНК в качестве праймеров, чтобы, тем самым, амплифицировать кДНК, кодирующую переносчик таурина.
Кроме того, посредством определения нуклеотидной последовательности полученной кДНК можно определить область трансляции, кодирующую переносчик таурина, и получить аминокислотную последовательность переносчика таурина. Кроме того, посредством скрининга геномной библиотеки с использованием полученной кДНК в качестве зонда можно выделять геномную ДНК.
Конкретно, можно использовать следующий способ. Во-первых, выделяют мРНК из клеток, тканей или сходных с ними, экспрессирующих переносчик таурина. Для выделения мРНК получают тотальную РНК известными способами, например, способом ультрацентрифугирования с помощью гуанидина (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), способом AGPC (Chomczynski, P. and Sacchi, N., Anal. Biochem. (1987) 162, 156-159) или сходными с ними, а затем мРНК очищают из тотальной РНК с использованием набора для очистки мРНК (Pharmacia), и т.д. Альтернативно мРНК можно получать прямо с использованием набора для очистки мРНК QuickPrep (Pharmacia).
На основе полученной мРНК синтезируют кДНК с использованием обратной транскриптазы. Альтернативно, кДНК можно синтезировать с использованием набора, такого как набор для синтеза первой цепи кДНК с помощью обратной транскриптазы AMV (SEIKAGAKU CORPORATION). Также можно синтезировать и амплифицировать кДНК согласно способу 5'-RACE (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002; Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932) с использованием набора 5'-Ampli FINDER RACE Kit (Clontech) и полимеразной цепной реакции (ПЦР) с праймерами.
Представляющий интерес фрагмент ДНК получают из полученного продукта ПЦР и лигируют с ДНК вектора с получением, тем самым, рекомбинантного вектора. Вектор вводят в хозяина (например, E. coli), с последующей селекцией полученных колоний с получением, тем самым, требуемого рекомбинантного вектора. Нуклеотидную последовательность представляющей интерес ДНК можно подтверждать известным способом, таким как способ терминации цепи дидезоксинуклеотидами.
Кроме того, можно конструировать нуклеотидную последовательность с более высокой эффективностью экспрессии для ДНК, кодирующей переносчик таурина, путем рассмотрения частоты использования кодонов в хозяине, подлежащем применению для экспрессии (Grantham, R. et al., Nucleic Acids Research (1981) 9, p. 43-74). Кроме того, ДНК, кодирующую переносчик таурина, можно модифицировать с использованием коммерчески доступных наборов или известных способов. Примеры таких модификаций включают, но не ограничиваются ими, расщепление ферментами рестрикции, встраивание синтетических олигонуклеотидов или соответствующих фрагментов ДНК, добавление линкеров и встраивание кодона инициации (ATG) и/или кодона терминации (TAA, TGA или TAG).
ДНК, кодирующая переносчик таурина, также включает ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, как показано в SEQ ID NO: 61, 63, 65 или 67, в строгих условиях и кодирует полипептид, функционально эквивалентный переносчику таурина.
Строгие условия могут быть соответствующим образом выбраны специалистами в данной области, включая, например, условия низкой строгости. Условия низкой строгости относятся, например, к 42°C, 2 × SSC и 0,1% SDS, предпочтительно 50°C, 2 × SSC и 0,1% SDS. Более предпочтительно, можно выбирать условия высокой строгости. Условия высокой строгости относятся, например, к 65°C, 2 × SSC и 0,1% SDS. В этих условиях, при повышении температуры гибридизации, можно получать ДНК с более высокой гомологией. Описанная выше ДНК, которая гибридизуется, предпочтительно представляет собой ДНК, полученную из природного источника, например, кДНК или хромосомную ДНК.
Эти ДНК, выделенные способами гибридизации, обычно обладают высокой идентичностью нуклеотидной последовательности с ДНК, кодирующей переносчик таурина из человека или сходных с ним. ДНК, кодирующая переносчик таурина, также включает ДНК, которая кодирует полипептид, функционально эквивалентный переносчику таурина из хомяка и т.п., и обладает высокой идентичностью с ДНК, кодирующей переносчик таурина из хомяка и т.п. Термин “высокая идентичность” относится обычно к гомологии 96% или более, предпочтительно к гомологии 98% или более, более предпочтительно к идентичности 99% или более. Идентичность нуклеотидных последовательностей можно определять с помощью алгоритма BLAST (Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5877, 1993). На основе этого алгоритма были разработаны программы, такие как BLASTN и BLASTX (Altschul et al. J. Mol. Biol. 215:403-410, 1990). Когда нуклеотидные последовательности анализируют посредством BLASTN на основе BLAST, параметры могут быть установлены, например, как количество баллов = 100 и длина слова = 12. Конкретные методики этих способов анализа известны (http://www.ncbi.nlm.nih.gov.).
ДНК, кодирующую переносчик таурина, можно встраивать в вектор.
Когда клетка-хозяин, подлежащая применению, представляет собой E. coli, предпочтительно, чтобы вектор обладал ориджином репликации (“ori”), так чтобы вектор в большой степени амплифицировался в E. coli (например, JM109, DH5α, HB101 и XL1-Blue) и его получали в большом количестве, и также генами для селекции трансформированных E. coli (например, генов устойчивости к лекарственному средству, которые обеспечивают отличие трансформанта с помощью некоторых лекарственных средств, таких как ампициллин, тетрациклин, канамицин или хлорамфеникол). Примеры предпочтительных векторов включают, но не ограничиваются ими, векторы M13, векторы pUC, pBR322, pBluescript и pCR-Script. В дополнение к этим векторам могут быть перечислены pGEM-T, pDIRECT, pT7 и т.д., когда вектор используют для целей субклонирования кДНК и вырезания субклонированной кДНК. Когда вектор используют для целей продукции полипептида по настоящему изобретению, особенно пригодным является экспрессирующий вектор. Когда предполагается экспрессия в E. coli, экспрессирующий вектор предпочтительно обладает описанными выше признаками, так что вектор амплифицируется в E. coli, а также он предпочтительно обладает промотором, который позволяет эффективную экспрессию в E. coli, таким как JM109, DH5α, HB101 или XL1-Blue, например, промотор lacZ (Ward et al, Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), промотор araB (Better et al, Science (1988) 240, 1041-1043) или промотор T7. Конкретные примеры такого вектора включают, в дополнение к векторам, приведенным выше, pGEX-5X-1 (Pharmacia), систему QIAexpress (Qiagen), pEGFP, или pET (в качестве их хозяина, предпочтительными являются BL21, экспрессирующие РНК полимеразу T7).
Вектор может содержать сигнальные последовательности для секреции полипептида. Когда полипептид подлежит продукции в периплазме E. coli, в качестве сигнальной последовательности для секреции полипептида можно использовать сигнальную последовательность pelB (Lei, S. P. et al., J. Bacteriol. (1987) 169, 4379). Введение вектора в хозяина можно проводить, например, способом с хлоридом кальция или электропорацией.
В случаях, когда используют клетку-хозяина, отличную от E. coli, векторы, пригодные для продукции требуемого полипептида, включают, но не ограничиваются ими, экспрессирующие векторы, полученные из млекопитающих [например, pкDNA3 от Invitrogen; pEGF-BOS (Nucleic Acids Res. 1990, 18(17), p. 5322); pEF, pCDM8], экспрессирующие векторы, полученные из клеток насекомых (например, бакуловирусная экспрессирующая система Bac-to-BAC от GIBCO BRL; pBacPAK8), экспрессирующие векторы, полученные из растений (например, pMH1, pMH2), экспрессирующие векторы, полученные из вирусов животных (например, pHSV, pMV, pAdexLcw), экспрессирующие векторы, полученные из ретровирусов (например, pZIpneo), экспрессирующие векторы, полученные из дрожжей (например, Pichia Expression Kit от Invitrogen; pNV11; SP-Q01), и экспрессирующие векторы, полученные из Bacillus subtilis (например, pPL608, pKTH50).
Когда предполагается экспрессия полипептида в клетках животных (таких как клетки CHO, клетки COS, клетки NIH3T3 и т.д.), вектор предпочтительно обладает промотором, необходимым для экспрессии полипептида в этих клетках. Примеры такого промотора включают, но не ограничиваются ими, промотор SV40 (Mulligan et al, Nature (1979) 277, 108), промотор MMLV-LTR, промотор EF1α (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322) и промотор CMV. Более предпочтительно, вектор также обладает генами для селекции трансформированных клеток (например, генами устойчивости к лекарственным средствам, которые позволяют различение с помощью лекарственных средств, таких как неомицин или G418). Примеры векторов, имеющих такие свойства, включают, но не ограничиваются ими, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Кроме того, когда предполагается стабильная экспрессия представляющего интерес гена и внутриклеточная амплификация количества копий гена, можно использовать следующий способ. В кратком изложении, в клетки CHO, лишенные каскада синтеза нуклеиновых кислот, вводят вектор, обладающий геном DHFR, который комплементирует отсутствие (например, pCHOI), с последующей амплификацией с метотрексатом (MTX). С другой стороны, когда предполагается временная экспрессия представляющего интерес гена, можно использовать способ, в котором клетки COS, обладающие геном, экспрессирующим антиген SV40T на хромосоме, трансформируют вектором, имеющим ориджин репликации SV40 (например, pcD). В качестве ориджина репликации также можно использовать ориджин репликации из полиомавируса, аденовируса или папилломавируса крупного рогатого скота (BPV). Кроме того, экспрессирующий вектор может содержать селективные маркеры для амплификации копий гена в системе клетки-хозяина. Примеры таких селективных маркеров включают, но не ограничиваются ими, ген аминогликозидфосфотрансферазы (APH), ген тимидинкиназы (TK), ген ксантин-гуанин-фосфорибозилтрансферазы (Ecogpt) и ген дигидрофолатредуктазы (dhfr) E. coli.
Настоящее изобретение относится к клетке, которая обладает перенесенной в нее ДНК, кодирующей ALT, и перенесенной в нее ДНК, кодирующей переносчик таурина, оба или каждый из которых могут быть включены в вектор.
Когда используют эукариот, в качестве хозяина можно использовать клетки животных, клетки растений, клетки грибов и т.д. Конкретные примеры клеток животных включают клетки млекопитающих, такие как клетки CHO (J. Exp. Med. (1995) 108, 945), клетки COS, клетки 3T3, клетки миеломы, клетки BHK (почек детенышей хомяка), клетки HeLa и клетки Vero; клетки земноводных, такие как ооциты Xenopus laevis (Valle, et al., Nature (1981) 291, 358-340); или клетки насекомых, такие как клетки sf9, sf21 и Tn5. Среди клеток CHO, особенно предпочтительно используют dhfr-CHO, лишенные гена DHFR (Proc. Natl. Acad. Sci. USA (1980) 77, 4216-4420) и CHO K-1 (Proc. Natl. Acad. Sci. USA (1968) 60, 1275). Когда предполагается высокая экспрессия в клетках животных, клетки CHO являются особенно предпочтительными. Введение ДНК, которая может быть включена в вектор, в клетку-хозяина можно проводить такими способами, как способ с фосфатом кальция, способ с DEAE-декстраном, способ с использованием катионного рибосомного DOTAP (Boehringer-Mannheim), электропорация, липофекция и т.д.
В качестве растительных клеток для продукции полипептида можно использовать клетки из Nicotiana tabacum в качестве системы для продукции полипептидов, и их можно подвергать каллюсной культуре. В качестве клеток грибов для продукции полипептида, конкретные примеры включают дрожжи, относящиеся к роду Saccharomyces, например, Saccharomyces cerevisiae, и нитчатые грибы, относящиеся к роду Aspergillus, например, Aspergillus niger.
Когда используют прокариот, известны системы продукции с использованием бактериальных клеток. Конкретные примеры таких бактериальных клеток включают E. coli (такие как JM109, DH5α, HB101) и Bacillus subtilis.
Полипептид, кодируемый представляющим интерес геном, можно получать трансформацией этих клеток представляющим интерес геном и культивированием трансформированных клеток in vitro. Культивирование можно проводить известными способами. Например, в качестве культурального бульона для клеток животных можно использовать среду, такую как DMEM, MEM, RPMI1640 или IMDM. Вместе с ними можно использовать дополнение сывороткой, такой как эмбриональная телячья сыворотка (FCS). Альтернативно, можно проводить бессывороточное культивирование. pH в процессе культивирования предпочтительно составляет приблизительно 6-8. Культивирование обычно проводят при приблизительно 30-40°C в течение приблизительно 15-200 часов. Если необходимо, проводят замену среды, вентилирование и перемешивание.
С другой стороны, системы продукции in vivo включают системы с использованием животных или растений. Представляющий интерес ген переносят в эти животные и растения для продукции полипептида в организмах животных или организмах растений. Затем полипептид собирают. Термин “хозяин”, как используют в настоящем документе, включает такие животные или растения.
Когда используют животных, доступные системы продукции включают системы с использованием млекопитающих или насекомых. В качестве млекопитающих можно использовать коз, свиней, овец, мышей или крупный рогатый скот (Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). Когда используют млекопитающих, можно использовать трансгенных животных.
Во-первых, представляющий интерес ген подвергают слиянию с геном, кодирующим полипептид, продуцируемый естественным образом в молоке (такой как β-казеин козы) с получением, тем самым, слитого гена. Фрагмент ДНК, содержащий этот слитый ген, инъецируют в эмбрион козы, который затем имплантируют в матку самки козы. Представляющий интерес полипептид можно получать из молока, продуцированного трансгенными козами, рожденными от козы, в которую инъецировали эмбрион, или потомками трансгенных коз. Для повышения выхода молока, содержащего полипептид, продуцируемый трансгенными козами, трансгенным козам можно соответствующим образом вводить гормоны (Ebert, K. M. et al., Bio/Technology (1994) 12, 699-702).
Примеры насекомых, которые можно использовать, включают тутового шелкопряда. В этом случае, тутового шелкопряда инфицируют бакуловирусом, содержащим перенесенный ген, кодирующий представляющий интерес полипептид. Представляющий интерес полипептид можно получать из жидкости организма тутового шелкопряда (Susumu, M. et al., Nature (1985) 315, 592-594).
Более того, когда используют растения, как правило, можно использовать табак. Когда используют табак, ген, кодирующий представляющий интерес полипептид, встраивают в экспрессирующий вектор растения (например, pMON 530), который затем переносят в бактерию, такую как Agrobacterium tumefaciens. Полученной бактерией инфицируют растение табака (например, Nicotiana tabacum). Представляющий интерес полипептид можно получать из листьев этого растения (Julian, K.-C. Ma et al., Eur. J. Immunol. (1994) 24, 131-138).
Полученный таким образом полипептид можно выделять из клетки-хозяина или из окружения клетки-хозяина (например, среды) и очищать до по существу чистого и гомогенного полипептида. Выделение и очистку полипептидов можно проводить с использованием общепринятых способов выделения и очистки полипептидов, и они ничем не ограничиваются. Например, полипептиды можно выделять и очищать путем надлежащего выбора и комбинирования различных инструментов и способов, таких как хроматографические колонки, фильтры, ультрафильтрация, высаливание, осаждение растворителем, экстракция растворителем, дистилляция, иммунопреципитация, электрофорез в SDS-полиакриламидном геле, изоэлектрическое фокусирование, диализ, перекристаллизация и т.д.
Примеры хроматографии включают аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, обращено-фазовую хроматографию, адсорбционную хроматографию, и т.д. (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed. Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996). Эти хроматографические способы можно проводить с использованием жидкостной хроматографии, например, ВЭЖХ, FPLC и т.д. Также настоящее изобретение включает полипептиды, высоко очищенные с использованием этих способов очистки.
До или после очистки также можно проводить необязательные модификации полипептида или удалять из них пептидные части путем реакции полипептида с соответствующим модифицирующим полипептид ферментом. Примеры такого фермента включают, но не ограничиваются ими, трипсин, химотрипсин, лизилэндопептидазу, протеинкиназу и глюкозидазу.
В настоящем изобретении понятие "клетки, в которые перенесена ДНК," охватывает не только клетки, в которые включена экзогенная ДНК с помощью технологии генетической рекомбинации; но также клетки, в которых эндогенная ДНК активирована технологией активации генов (см., например, международную публикацию WO94/12650), так чтобы инициировалась или повышалась экспрессия белка, соответствующего эндогенной ДНК, или транскрипция ДНК.
ПРИМЕРЫ
Ниже в настоящем документе настоящее изобретение описано более подробно с помощью следующих примеров. Следует отметить, что эти примеры предоставлены только для иллюстрации настоящего изобретения, но не для ограничения объема настоящего изобретения.
[ПРИМЕР 1] Клонирование гена аланинаминотрансферазы клеток печени человека
С использованием коммерческой кДНК печени человека QUICK-Clone (Clontech Laboratories, Inc.) в качестве матрицы получали ген аланинаминотрансферазы (ALT1) печени человека способом ПЦР. Ген, клонированный таким образом, секвенировали и подтверждали, что он кодирует ALT1 на основе его гомологии с опубликованной ALT1 человека. Полученный таким образом ген ALT1 имел мутации в пяти участках последовательности из 1488 оснований (c157a, a215g, c765t, t857c, t995a) и кодировал 496 аминокислот, включая четыре отличающихся аминокислоты (R53S, Q72R, F286S, M332K), однако его использовали в качестве клона ПЦР для ALT1 печени человека в целях модулирования клеток.
[ПРИМЕР 2] Повышение выхода антител посредством переноса аланинаминотрансферазы человека
Посредством добавления последовательности Kozak в ALT1 человека, полученную клонированием по примеру 1 (которая в дальнейшем в настоящем документе обозначается как ALT1), конструировали pPur-ALT1 (фиг.1) и pHyg-ALT1 (фиг.2), которые представляли собой экспрессирующие плазмиды с промотором CMV. Экспрессирующие плазмиды pPur-ALT1 или pPur, которые не содержат ген ALT1, вводили в клетки CHO, продуцирующие антитело против глипикана-3, в качестве родительских штаммов (см. международную публикацию WO 2006/006693) путем электропорации, и отбирали клеточные штаммы, которые проявляли высокую пролиферацию в стационарной культуре в присутствии пуромицина (6 мкг/мл) (pPur-ALT1: семь штаммов, pPur: три штамма). После размножения получали тотальную РНК из клеточных штаммов pPur-ALT1 и отбирали шесть штаммов, экспрессирующих ALT1 человека на высоких уровнях способом TaqMan. Кроме того, проводили сравнение по выходу антитела между клетками, в которые была перенесена pPur, в качестве контроля (три штамма) и четырьмя штаммами клеток, в которые была перенесена ALT1 человека, которые пролиферировали на уровне, эквивалентном уровню, наблюдаемому для клеток, в которые была перенесена pPur в ходе культивирования при перемешивании. В ходе культуры с подпиткой в перемешиваемом флаконе объемом 50 мл с исходной плотностью клеток 2 × 105клеток/мл, выход антитела против глипикана-3 в клетках, в которые была перенесена pPur-ALT1 (четыре штамма), на 17 сутки на поздней стадии культивирования в устройстве для перемешивания значимо превышал выход в клетках, в которые была перенесена pPur (три штамма) (t-критерий: p<0,01, фиг.3). Было выявлено, что каждый из штамма A72, экспрессирующего pPur-ALT1, и штамма P41, экспрессирующего pPur, продуцировал наибольшее количество антитела в исследовании с использованием культуры с подпиткой в устройстве для перемешивания, и их подвергали культивированию с подпиткой в емкостях объемом 1 л (исходная плотность клеток 10 × 105 клеток/мл). В результате, выход антитела в A72 составил 2,9 г/л на 19 сутки культивирования, что превышало выход антитела в P41 (2,2 г/л) (фиг.4). Поскольку не наблюдали повышения выхода антитела в P41 на 14 сутки или в последующие сутки после начала культивирования, продукцию с высоким выходом антитела в A72 считали связанной с эффектом поддержания уровня выживаемости (фиг.5). Кроме того, клетки, в которые была перенесена pHyg/ALT (три штамма), которые подвергали селекции лекарственным средством в присутствии гигромицина (200 мкг/мл) способом, сходным со способом, описанным выше, подвергали культивированию с подпиткой вместе с родительским штаммом, в пробирках объемом 15 мл (исходная плотность клеток 1 × 105клеток/мл). В результате, выход антитела против глипикана-3 в клетках, в которые была перенесена pHyg-ALT, на 10 сутки на поздней стадии культивирования в пробирке составлял 471 мг/л, 544 мг/л и 588 мг/л, демонстрируя, что выход антитела в любых из них превышал выход в родительском штамме (400 мг/л) (данные не представлены).
Затем, pPur-ALT1 или pPur котрансфицировали в T10, которая представляла собой клетки, в которые была перенсена pHyg-TauT, используемые в качестве родительского штамма (см. справочный пример 2, описанный ниже). Клетки, коэкспрессирующие TauT/ALT1, которые проявляли высокую пролиферацию и экспрессировали ALT1 человека на высоком уровне (шесть штаммов), и клетки, коэкспрессирующие TauT/pPur, которые проявляли высокую пролиферацию (восемь штаммов), отбирали и подвергали культивированию с подпиткой в перемешиваемых флаконах объемом 50 мл (исходная плотность клеток 10 × 105 клеток/мл). Выход антитела против глипикана-3 в клетках, коэкспрессирующих TauT/ALT1, которые представляли собой клетки, экспрессирующие ALT, на 4 сутки культивирования с перемешиванием значимо превышал выход в клетках TauT/pPur (t-критерий: p<0,01, фиг.6).
TA41, который представлял собой штамм, коэкспрессирующий TauT/ALT1, который продуцировал наибольшее количество антитела (881 мг/л/4 суток) и экспрессировал мРНК ALT1 на наиболее высоком уровне в исследовании с использованием подпитываемой культуры с перемешиванием, повергали культивированию с подпиткой в емкости 1 л (исходная плотность клеток 10 × 105 клеток/мл). Выходы антитела составляли до 1,3 г/л на 7 сутки культивирования, 3,0 г/л на 10 сутки культивирования, 3,5 г/л на 12 сутки культивирования, 4,6 г/л на 17 сутки культивирования и 5,3 г/л на 21 сутки культивирования (фиг.7), и они очевидно превышали значения для TP08 (656 мг/л/4 сутки), который представлял собой контрольный штамм, который продуцировал наибольшее количество антитела среди штаммов, коэкспрессирующих TauT/pPur (2,4 г/л на 10 сутки культивирования).
Выход антитела против глипикана-3 в штамме TA41, коэкспрессирующем TauT/ALT1, на 14 сутки культивирования с подпиткой в перемешиваемом флаконе объемом 50 мл повышался при добавлении α-кетоглутарата, который, подобно аланину, служил в качестве субстрата для ALT (фиг.22). Выход антитела против глипикана-3 на 14 сутки культивирования составил 1452 мг/л в присутствии 2,5 мМ α-кетоглутарата, и 1239 мг/л в отсутствие α-кетоглутарата.
Представленные выше результаты указывают на то, что клетки, способные к продукции антитела с высоким выходом в культуре на поздней стадии, можно получать путем искусственной экспрессии ALT1.
Настоящее изобретение применимо для любой продуцирующей антитело клетки.
[СПРАВОЧНЫЙ ПРИМЕР 1] Клонирование гена переносчика таурина хомяка из CHO
Выделяли тотальную РНК из клеток, продуцирующих антитело против рецептора IL-6 (клеточная линия CHO DXB11, в которую был перенесен ген антитела против рецептора IL-6) (нерассмотренная публикация патента Японии № Hei 8-99902), а затем на ее основе синтезировали кДНК зависимым от поли(A) образом. Ген переносчика таурина хомяка (TauT) получали посредством ПЦР с использованием в качестве матрицы кДНК, фрагментированной тремя ферментами рестрикции, SalI, XhoI и EcoRI. В качестве праймеров для ПЦР были сконструированы праймеры, содержащие 5'-концевую и 3'-концевую последовательность, консервативную для TauT крысы и мыши. Определяли нуклеотидную последовательность клонированного гена. Исходя из гомологии с другими генами TauT известных видов, подтверждали, что клонированный ген кодировал TauT хомяка (фиг.8). Аминокислотная последовательность TauT хомяка обладает высокой гомологией с TauT мыши (96% идентичность), TauT крысы (96% идентичность) и TauT человека (93% идентичность); было предсказано, что TauT представляет собой переносчик с 12 трансмембранными участками (фиг.9).
[СПРАВОЧНЫЙ ПРИМЕР 2] Повышение плотности жизнеспособных клеток, ингибирование продукции лактата и повышение выхода антитела, вызываемые переносом переносчика таурина хомяка
Экспрессирующую pHyg/TauT плазмиду с промотором CMV (фиг.10) конструировали добавлением последовательности Kozak к гену TauT хомяка (в дальнейшем в настоящем документе, TauT), полученной клонированием согласно справочному примеру 1. Контрольную плазмиду pHyg без pHyg/TauT или гена TauT вводили электропорацией в родительский штамм клеток CHO, продуцирующих антитело против глипикана-3 (см. WO 2006/006693). После селекции клеток, в которые была перенесена экспресирующая плазмида, в присутствии гигромицина (400 мкг/мл), все стабильно растущие штаммы клеток размножали (pHyg/TauT: 8 штаммов; pHyg: 7 штаммов). Получали мРНК TauT. Затем было подтверждено, что 7 штаммов экспрессируют TauT на более высоком уровне, чем родительский штамм, способом TaqMan; их отбирали в качестве клеток, в которые была перенесена pHyg/TauT. Средний уровень экспрессии мРНК этих генов с перенесенной плазмидой (7 штаммов) приблизительно в 40 раз превышал уровень в контроле (7 штаммов). Клетки всего 14 штаммов подвергали периодическому культивированию и культивированию с подпиткой в перемешиваемых флаконах объемом 50 мл с исходной плотностью клеток 2 × 105 клеток/мл. На 7 сутки в культуре (поздняя стадия) сравнивали плотности жизнеспособных клеток, выход лактата и выход антитела против глипикана-3. В периодической культуре, по мере роста клеток в культуральном бульоне накапливаются вещества, ингибирующие рост, такие как лактат, и рост этих клеток ингибируется. Однако плотности жизнеспособных клеток (фиг.11) и выход лактата (фиг.12) в клетках, в которые была перенесена pHyg/TauT, превышал плотности жизнеспособных клеток и выход лактата в клетках, в которые была перенесена pHyg (t-критерий; p<0,05). В отношении выхода антитела против глипикана-3, 4 из 7 штаммов клеток, в которые была перенесена pHyg/TauT, показали выход антитела, превышающий наиболее высокий выход в клетке, в которую была трансформирована pHyg (фиг.13). Кроме того, поскольку превосходство клеток, в которые была перенесена pHyg/TauT, в отношении выхода антитела против глипикана-3 стало более очевидным (t-критерий; P<0,01; фиг.14) в культуре с подпиткой, штамм T10, в который была перенесена pHyg/TauT (который показал наиболее высокую способность к росту среди указанных выше 4 штаммов), и родительский штамм подвергали культивированию с подпиткой в емкости 1 л. В результате, доля жизнеспособных клеток T10 сохранялась на уровне 80% или более даже на 32 сутки в культуре (фиг.15), с ингибированной продукцией лактата. Таким образом, выход в них антитела против глипикана-3 достигал 2,9 г/л на 35 сутки в культуре (фиг.16). Анализом проточной цитометрией было подтверждено, что клетка T10, в которую была перенесена TauT, экспрессировала молекулы TauT на клеточной мембране (фиг.17). Эти результаты указывают на то, что путем искусственной экспрессии Taut хомяка можно усиливать потенциал продуцирующих антитела клеток и создавать штаммы, способные усиливать продукцию антитела.
[СПРАВОЧНЫЙ ПРИМЕР 3] Ингибирование продукции аммиака, захвата таурина, повышение потребления глутамина и независимый от таурина выход антитела в штаммах, в которые перенесен TauT
Родительский штамм и штамм, в который была перенесена pHyg/TauT, подвергали культивированию с подпиткой в емкости объемом 1 л с исходной плотностью клеток 2 × 105 клеток/мл. Часть культурального бульона, содержащего 450 × 105 клеток, отбирали из емкости в соответствующие моменты времени. После разделения культурального супернатанта центрифугированием к клеточному осадку добавляли 1 мл охлажденной стерильной воды, содержащей ингибитор протеазы (Complete Mini; Roche Diagnostics; таблетки коктейля ингибиторов протеаз). Затем клетки полностью разрушали на льду в устройстве для облучения ультразвуком (MISONIX ASTRASON MODEL XL2020) с параметрами из включенного импульса в течение 5 секунд и выключенного импульса в течение 5 секунд, повторяющихся 12 раз. Конечный объем обработанных таким образом клеток наносили на центрифужный фильтрующий элемент с получением, тем самым, фильтрата с молекулярной массой 5000 или менее. Этот фильтрат использовали в качестве образца для определения внутриклеточных аминокислот. Каждый образец подвергали детекции и сравнению поглощения при 570 нм с использованием набора нингидриновых реагентов L-8500 (Wako Pure Chemical Industries) и усовершенствованной модели автоматического анализатора аминокислот Hitachi (L-8500). Таким образом, определяли концентрации различных аминокислот в образцах. Поскольку концентрации аминокислот и аммиака в культуральном бульоне представляли собой прямо измеренные значения, проводили сравнения концентраций на уровне мкм. С другой стороны, поскольку внутриклеточные концентрации получали после добавления 1 мл охлажденной стерильной воды к клеточному осадку и облучения его, измеренные концентрации различных аминокислот и аммиака преобразовывали в значения на клетку, с последующим сравнением преобразованных значений. Для определения отношений концентраций аммиака, представленных на фиг.18, выявленное значение аммиака на 450 × 105 клеток в родительском штамме в начале культивирования с подпиткой в емкости объемом 1 л принимали за 1 и сравнивали с выявленными значениями в начале культивирования и на 6, 12 и 18 сутки для культуры штамма, с перенесенной плазмидой. Величины для таурина на фиг.19 и величины для глутамина на фиг.20 также определяли путем описанного выше анализа аминокислот.
В результате, концентрация внутриклеточного аммиака в штамме, в который была перенесена pHyg/TauT, сохранялась на низком уровне на поздней стадии культивирования; полагают, что это приводит к высокому выходу антитела (фиг.18).
Отношения внутриклеточных концентраций таурина определяли аналогичным образом, как описано выше для концентраций аммиака (фиг.19), за исключением того, что за 1 принимали выявленную величину аммиака на 200 × 105 клеток родительского штамма на 4 сутки в культуре с перемешиванием объемом 50 мл.
В результате было выявлено, что штамм, в который была перенесена pHyg/TauT, захватывал таурин в зависимости от количества добавленного таурина, и что его захват был практически равен захвату родительским штаммом. Однако, как показано на фиг.20, потребление глутамина в штамме, в который была перенесена pHyg/TauT, значительно превышало потребление глутамина в родительском штамме и не зависело от начальной концентрации таурина. Было описано, что глутамин повышает рост клеток, уровень выживаемости и способность продуцировать антитело в гибридомах, повышая тем самым выход в них антител (Enzyme and Microbial Technology 17:47-55, 1995). Таким образом, эффект усиления продукции антител в штамме, в который была перенесена pHyg/TauT, может быть вызван опосредуемым переносчиком таурина захватом аминокислот, отличных от таурина (например, глутамина). Концентрации глутамина получали преобразованием значений, определенных аминокислотным анализом культурального бульона на 4 сутки в культуре, как показано на фиг.19, в значения на 1 × 105 клеток.
В действительности, выход антитела против глипикана-3 не зависел от исходной концентрации таурина (0-500 мМ (62,575 г/л)) в начале культивирования при перемешивании с подпиткой объемом 50 мл (фиг.21). Не наблюдали значимых отличий в эффекте исходной концентрации таурина на выход антитела в исходных штаммах.
Результаты, описанные выше, указывают на то, что штаммы, на высоком уровне экспрессирующие TauT, обладают способностью к высокой продукции антитела, даже если среда не содержит таурина в начале культивирования и что существует возможность, что такие штаммы также обеспечивают захват аминокислот, отличных от таурина.
Настоящее изобретение применимо для любой продуцирующей антитело клетки.
Все публикации, патенты и патентные заявки, цитированные в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение применимо для продукции полипептидов.
ТЕКСТОВОЕ ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу человека (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875).
SEQ ID NO: 2 показывает аминокислотную последовательность аланинаминотрансферазы человека (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 2875).
SEQ ID NO: 3 показывает нуклеотидную последовательность гена, кодирующего мутант аланинаминотрансферазы человека (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706).
SEQ ID NO: 4 показывает аминокислотную последовательность мутанта аланинаминотрансферазы человека (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Homo sapiens (человек): 84706).
SEQ ID NO: 5 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу мыши (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282).
SEQ ID NO: 6 показывает аминокислотную последовательность аланинаминотрансферазы мыши (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 76282).
SEQ ID NO: 7 показывает нуклеотидную последовательность гена, кодирующего мутант аланинаминотрансферазы мыши (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682).
SEQ ID NO: 8 показывает аминокислотную последовательность мутанта аланинаминотрансферазы мыши (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Mus musculus (мышь): 108682).
SEQ ID NO: 9 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу крысы (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670).
SEQ ID NO: 10 показывает аминокислотную последовательность аланинаминотрансферазы крысы (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Rattus norvegicus (крыса): 81670).
SEQ ID NO: 11 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу собаки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510).
SEQ ID NO: 12 показывает аминокислотную последовательность аланинаминотрансферазы собаки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Canis familiaris (собака): 609510).
SEQ ID NO: 13 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу африканской шпорцевой лягушки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533).
SEQ ID NO: 14 показывает аминокислотную последовательность аланинаминотрансферазы африканской шпорцевой лягушки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Xenopus laevis (африканская шпорцевая лягушка): 444533).
SEQ ID NO: 15 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу плодовой мушки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (плодовая мушка): Dmel_CG1640).
SEQ ID NO: 16 показывает аминокислотную последовательность аланинаминотрансферазы плодовой мушки (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Drosophila melanogaster (плодовая мушка): Dmel_CG1640).
SEQ ID NO: 17 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу нематод (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематоды): C32F10.8).
SEQ ID NO: 18 показывает аминокислотную последовательность аланинаминотрансферазы нематод (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Caenorhabditis elegans (нематоды): C32F10.8).
SEQ ID NO: 19 показывает нуклеотидную последовательность гена, кодирующего один из двух типов аланинаминотрансфераз японского риса (KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativajaponica (японский рис): 4342210).
SEQ ID NO: 20 показывает аминокислотную последовательность одного из двух типов аланинаминотрансфераз японского риса (KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4342210).
SEQ ID NO: 21 показывает нуклеотидную последовательность гена, кодирующего один из двух типов аланинаминотрансфераз японского риса (KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524).
SEQ ID NO: 22 показывает аминокислотную последовательность одного из двух типов аланинаминотрансфераз японского риса (KEGG/ФЕРМЕНТ: 2.6.1.2/Oryza sativa japonica (японский рис): 4348524).
SEQ ID NO: 23 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Cyanidioschyzon merolae (KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C).
SEQ ID NO: 24 показывает аминокислотную последовательность аланинаминотрансферазы Cyanidioschyzon merolae (KEGG/ФЕРМЕНТ: 2.6.1.2/Cyanidioschyzon merolae: CMM066C).
SEQ ID NO: 25 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Saccharomyces cerevisiae (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C).
SEQ ID NO: 26 показывает аминокислотную последовательность аланинаминотрансферазы Saccharomyces cerevisiae (ALT1) (KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YLR089C).
SEQ ID NO: 27 показывает нуклеотидную последовательность гена, кодирующего мутант аланинаминотрансферазы Saccharomyces cerevisiae (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C).
SEQ ID NO: 28 показывает аминокислотную последовательность мутанта аланинаминотрансферазы Saccharomyces cerevisiae (ALT2) (KEGG/ФЕРМЕНТ: 2.6.1.2/Saccharomyces cerevisiae: YDR111C).
SEQ ID NO: 29 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Ashbya gossypii (KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W).
SEQ ID NO: 30 показывает аминокислотную последовательность аланинаминотрансферазы Ashbya gossypii (KEGG/ФЕРМЕНТ: 2.6.1.2/Ashbya gossypii (Eremothecium gossypii): AGOS_AGR085W).
SEQ ID NO: 31 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Candida albicans (KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: CaO19_346).
SEQ ID NO: 32 показывает аминокислотную последовательность аланинаминотрансферазы Candida albicans (KEGG/ФЕРМЕНТ: 2.6.1.2/Candida albicans: CaO19_346).
SEQ ID NO: 33 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Schizosaccharomyces pombe (KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08).
SEQ ID NO: 34 показывает аминокислотную последовательность аланинаминотрансферазы Schizosaccharomyces pombe (KEGG/ФЕРМЕНТ: 2.6.1.2/Schizosaccharomyces pombe: SPBC582.08).
SEQ ID NO: 35 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Aspergillus nidulans (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2).
SEQ ID NO: 36 показывает аминокислотную последовательность аланинаминотрансферазы Aspergillus nidulans (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus nidulans: AN1923.2).
SEQ ID NO: 37 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Aspergillus fumigatus (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770).
SEQ ID NO: 38 показывает аминокислотную последовательность аланинаминотрансферазы Aspergillus fumigatus (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus fumigatus: AFUA_6G07770).
SEQ ID NO: 39 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Aspergillus oryzae (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO090003000164).
SEQ ID NO: 40 показывает аминокислотную последовательность аланинаминотрансферазы Aspergillus oryzae (KEGG/ФЕРМЕНТ: 2.6.1.2/Aspergillus oryzae: AO090003000164).
SEQ ID NO: 41 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Cryptococcus neoformans (KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490).
SEQ ID NO: 42 показывает аминокислотную последовательность аланинаминотрансферазы Cryptococcus neoformans (KEGG/ФЕРМЕНТ: 2.6.1.2/Cryptococcus neoformans JEC21: CNG01490).
SEQ ID NO: 43 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Dictyostelium discoideum (KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139).
SEQ ID NO: 44 показывает аминокислотную последовательность аланинаминотрансферазы Dictyostelium discoideum (KEGG/ФЕРМЕНТ: 2.6.1.2/Dictyostelium discoideum: DDB_0232139).
SEQ ID NO: 45 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Trypanosoma brucei (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950).
SEQ ID NO: 46 показывает аминокислотную последовательность аланинаминотрансферазы Trypanosoma brucei (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma brucei: Tb927.1.3950).
SEQ ID NO: 47 показывает нуклеотидную последовательность гена, кодирующего аланинаминотрансферазу Leishmania major (KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630).
SEQ ID NO: 48 показывает аминокислотную последовательность аланинаминотрансферазы Leishmania major (KEGG/ФЕРМЕНТ: 2.6.1.2/Leishmania major: LmjF12.0630).
SEQ ID NO: 49 показывает нуклеотидную последовательность гена, кодирующего один из двух типов аланинаминотрансфераз Entamoeba histolytica (KEGG/ФЕРМЕНТ: 2.6.1.2 /Entamoeba histolytica: 233.t00009).
SEQ ID NO: 50 показывает аминокислотную последовательность одного из двух типов аланинаминотрансфераз Entamoeba histolytica (KEGG/ФЕРМЕНТ: 2.6.1.2 /Entamoeba histolytica: 233.t00009).
SEQ ID NO: 51 показывает нуклеотидную последовательность гена, кодирующего один из двух типов аланинаминотрансфераз Entamoeba histolytica (KEGG/ФЕРМЕНТ: 2.6.1.2 /Entamoeba histolytica: 24.t00016).
SEQ ID NO: 52 показывает аминокислотную последовательность одного из двух типов аланинаминотрансфераз Entamoeba histolytica (KEGG/ФЕРМЕНТ: 2.6.1.2 /Entamoeba histolytica: 24.t00016).
SEQ ID NO: 53 показывает нуклеотидную последовательность гена, кодирующего один из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420).
SEQ ID NO: 54 показывает аминокислотную последовательность одного из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.420).
SEQ ID NO: 55 показывает нуклеотидную последовательность гена, кодирующего один из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430).
SEQ ID NO: 56 показывает аминокислотную последовательность одного из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 506529.430).
SEQ ID NO: 57 показывает нуклеотидную последовательность гена, кодирующего один из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120).
SEQ ID NO: 58 показывает аминокислотную последовательность одного из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.120).
SEQ ID NO: 59 показывает нуклеотидную последовательность гена, кодирующего один из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140).
SEQ ID NO: 60 показывает аминокислотную последовательность одного из четырех типов аланинаминотрансфераз Trypanosoma cruzi (KEGG/ФЕРМЕНТ: 2.6.1.2/Trypanosoma cruzi: 510889.140).
SEQ ID NO: 61 показывает нуклеотидную последовательность гена, кодирующего переносчик таурина хомяка.
SEQ ID NO: 62 показывает аминокислотную последовательность переносчика таурина хомяка.
SEQ ID NO: 63 показывает нуклеотидную последовательность гена, кодирующего переносчик таурина крысы (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=8394317).
SEQ ID NO: 64 показывает аминокислотную последовательность переносчика таурина крысы (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=8394317).
SEQ ID NO: 65 показывает нуклеотидную последовательность гена, кодирующего переносчик таурина мыши (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=34328477).
SEQ ID NO: 66 показывает аминокислотную последовательность переносчика таурина мыши (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=34328477).
SEQ ID NO: 67 показывает нуклеотидную последовательность гена, кодирующего переносчик таурина человека (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=110082729).
SEQ ID NO: 68 показывает аминокислотную последовательность переносчика таурина человека (GenBank http://www.ncbi.nlm.nih.gov/entrez/viewer.fcgi?db=nuccore&val=110082729).
Реферат
Изобретение относится к области биотехнологии, а именно к способу продукции требуемого полипептида (варианты), способу получения фармацевтической композиции, клетке СНО для получения требуемого белка, клетке СНО-реципиенту ДНК, кодирующей требуемый полипептид, способу продукции требуемого полипептида. Способ продукции требуемого полипептида включает культивирование клетки СНО, которая является трансформированной ДНК, кодирующей аланинаминотрансферазу, и ДНК, кодирующей требуемый полипептид. В частном случае клетки СНО культивируют в содержащей α-кетоглутарат среде. Способ получения фармацевтической композиции включает получение требуемого полипептида указанным выше способом. Смешивают полипептид с фармацевтически приемлемыми носителями или добавками. Готовят препарат. Клетка СНО для получения требуемого белка обладает перенесенной в нее ДНК, кодирующей аланинаминотрансферазу, и перенесенной в нее ДНК, кодирующей требуемый полипептид. Предложенное изобретение позволяет получать требуемый полипептид с высоким выходом. 5 н. и 5 з.п. ф-лы, 22 ил., 3 пр.
Формула
(a) ДНК, кодирующая полипептид, имеющий аминокислотную последовательность, приведенную в SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60;
(b) ДНК, кодирующая полипептид, который обладает аминокислотной последовательностью, образованной из аминокислотной последовательности, приведенной в SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, путем замены, делеции, добавления и/или инсерции 1-30 аминокислотных остатков, и, кроме того, обладает активностью аланинаминотрансферазы;
(c) ДНК, кодирующая полипептид, имеющий 97% или более гомологию аминокислотной последовательности с аминокислотной последовательностью, приведенной в SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 или 60, и, кроме того, обладает активностью аланинаминотрансферазы;
(d) ДНК, обладающая нуклеотидной последовательностью, приведенной в SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59;
(e) ДНК, которая гибридизуется с ДНК, комплементарной ДНК, обладающей нуклеотидной последовательностью, приведенной в SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 или 59, в строгих условиях, и, кроме того, кодирует полипептид, обладающий активностью аланинаминотрансферазы.
i) получение требуемого полипептида способом по п.1,
ii) смешивание полипептида с фармацевтически приемлемыми носителями или добавками, и
iii) приготовление препарата.

Комментарии