Моноклональное антитело, продуцируемое штаммом гибридных культивируемых клеток мыши mus musculus l. есасс n 90110707, f(ab)-фрагмент моноклонального антитела, продуцируемого штаммом гибридных культивируемых клеток мыши mus musculus l. есасс n 90110707, f - RU2073722C1
Код документа: RU2073722C1
Чертежи


Описание
Это изобретение относится к биотехнологии, в частности к моноклональному антителу, которое имеет высокую нейтрализующую активность против фактора альфа некроза человеческой опухоли (α-ФНО), а также нейтрализующую активность против фактора бета человеческого фактора некроза опухоли (β-ФНО), гибридной клеточной линии, которая продуцирует это антитело и использованию моноклонального антитела.
α-ФНО представляет собой полипептид с молекулярным весом 17500, у которого выявлены первичная и третичная структура (1-2). α-ФНО является биологически активным в виде тримера. Основным источником α-ФНО являются поколения моноцит/макрофаговых клеток, но после соответствующей стимуляции он также хорошо продуцируется другими типами клеток (например Т-лимфоцитами).
β-ФНО является полипептидом, весьма родственным к α-ФНО. Обе молекулы демонстрируют 28% гомологии на аминокислотном уровне (3). Основным источником β-ФНО являются Т-лимфоциты.
α-ФНО был первоначально описан как молекула, которая вызывает кровоизлиятельный некроз опухолей в мышах. Однако после того, как стали доступны большие количества гомогенного α-ФНО посредством клонирования его к ДНК, вскоре стало ясно, что α-ФНО обладает большим множеством биологических активностей (4).
β-ФНО обладает множеством аналогичных биологических активностей, однако были описаны количественные различия относительно дозировок α-ФНО и β-ФНО, необходимых для их биологической активности.
При воспалительной реакции α-ФНО играет центральную роль в защите клетки-хозяина от вторжения в организм вредных агентов. Однако при некоторых обстоятельствах, таких как хроническое или острое, системное или локализованное перепроизводство в сочетании с другими медиаторами воспалительной реакции α-ФНО приводит к большому числу патологических состояний. Наиболее известными примерами являются истощение и септический шок (4-5). Вероятно α-ФНО, как предполагают, играет патогенную роль при заболевании СПИД (6), при противопоказаниям к прививке (7), при церебральной малярии (8), при ревматоидном артрите (9) и некоторых других болезненных состояниях.
Гораздо менее известно об эффектах β-ФНО в живом организме. Однако при наличии факта, что он обладает вне организма биологическими активностями, аналогичными таковым для α-ФНО, можно утверждать, что в случае сверхпроизводства β-ФНО также может вносить свой вклад в патогенез некоторых болезненных состояний.
Эти результаты позволяют предположить, что антитела против α-ФНО, а также возможно антитела против β-ФНО могут быть терапевтически полезными при тех болезненных состояниях, в которых эти полипептиды проявляют патогенный эффект.
Для того, чтобы антитела против α-ФНО были терапевтически эффективны, они должна обладать способностью нейтрализовать токсические эффекты
α-ФНО в живом организме. Поликлональные антитела легко могут быть получены из сыворотки гипериммунизованных животных. Однако эти препараты поликлональных антител не являются оптимальными для
использования в живом организме, вследствие того что
они являются смесью антител, содержащей антитела, которые не нейтрализуют α-ФНО,
они являются смесью антител, содержащей
различные антитела, имеющие различающиеся степени сродства для одинаковых эпитопов,
и они трудно стандаpтизуются в смысле потенциала, из-за изменений от случая к случаю.
Выбранным средством для устранения этих проблем является технология моноклональных антител. Она позволяет продуцировать вне организма при контролируемых условиях и в неограниченных количествах
моноклональные антитела с воспроизводимой специфичностью и степенью средства против α-ФНО, как и против любой иммуногенной молекулы. Ясно, что против отдельного антигена можно получить много
различных моноклональных антител. Они могут различаться друг от друга в терминах:
класса и подкласса антитела,
эпитопной специфичности,
cвязывающего сродства и
нейтрализующей активности вне и внутри организма.
Для терапевтического использования желательно использовать моноклональное антитело против α-ФНО, как и против любого другого антигена, который обладает высокой нейтрализующей активностью. Это может дать возможность назначения меньших дозировок моноклонального антитела для достижения терапевтически эффективных уровней в живом организме, таким образом смягчаются возможные, нежелательные побочные эффекты, вызванные моноклональным антителом.
Однако настоящее изобретение предоставляет новое моноклональное антитело или его связывающий фрагмент, который способен нейтрализовать человеческий α-ФНО. Антитело в соответствии с настоящим изобретением обладает высокой активностью в нейтрализации α -ФНО как вне, так и внутри организма. Таким образом, вне организма человеческий α-ФНО проявляет полумаксимальную биологическую активность при концентрации около 0,15 нг/мл (3,3 • 10-12 моль/л, принимая, что α-ФНО является тримером). В присутствии 1 мкг/мл (6,25 • 10-9 моль/л) указанного антитела человеческий α-ФНО проявляет полумаксимальную биологическую активность примерно при 229 нг/мл (4,6•10-9 моль/л, отношение полумаксимальной биологической активности в присутствии 1 мкг/мл указанного антитела к активности в его отсутствие составляет около 1527). В присутствии 100 нг/л (6,5 • 10-10 моль/л) указанного антитела человеческий α-ФНО проявляет полумаксимальную биологическую активность примерно при 26 нг/мл (5,2•10-10 моль/л). В присутствии 10 нг/мл (6,25 • 10-11 моль/л) указанного антитела человеческий α-ФНО проявляет полумаксимальную активность (биологическую) примерно при 1,9 нг/мл (3,8 • 10-11 моль/л). Таким образом, моноклональное антитело, представленное настоящим изобретением, характеризуется тем фактом, что оно нейтрализует человеческий α-ФНО вне организма при отношении ниже, чем 2:1, в частности при отношении примерно 1,3:1 в молярном исчислении. Кроме того, упомянутое моноклональное антитело нейтрализует и поэтому также распознает структурно родственный полипептидный человеческий β-ФНО.
Так, вне организма человеческий β-ФНО проявляет полумаксимальную биологическую активность примерно при 4 нг/мл (8•10-11 моль/л, принимая, что β-ФНО является тримером). В присутствии 1 мкг/мл (6,25•10-9 моль/л) упомянутого антитела человеческий β-ФНО проявляет полумаксимальную биологическую активность примерно при 25,6 нг/мл (5•10-10 моль/л; отношение полумаксимальной биологической активности в присутствии 1 мкг/мл указанного антитела к активности в его отсутствие составляет около 6,3).
В качестве второго аспекта настоящее изобретение демонстрирует, что упомянутое моноклональное антитело способно осаждать человеческий α-ФНО., что определяется посредством двойной диффузии в двух измерениях (метод Оучтерлони). В качестве третьего аспекта настоящее изобретение демонстрирует, что наименьший комплекс антиген-антитело, образующийся при инкубации указанного моноклонального антитела с человеческим α-ФНО, является высокомолекулярным комплексом антиген-антитело, содержащим практически не менее двух молекул указанного моноклонального антитела и по меньшей мере одну молекулу человеческого α-ФНО. Обычно три молекулы моноклонального антитела связывают вместе две молекулы человеческого α-ФНО.
Термин "высокомолекулярный комплекс антиген-антитело" используется для обозначения антиген-антительных комплексов с молекулярным весом не менее 400 тыс. ед. Дальтона (еД), обычно примерно от 570 до 600 тыс. еД.
Более того, указанное антитело представляет полную защиту мышей от летательной (в ином случае) дозы человеческого α-ФНО при дозировках ниже, чем примерно 1 мкг/мышь, обычно примерно от 0,4 до 0,8 мкг/мышь. Необходимо отметить, что 0,4 мкг/мышь соответствует примерно 20 мкг/кг веса тела.
Кроме того, получена стабильная клеточная линия гибридомы и ее потомство, которое продуцирует такие моноклональные антитела.
Дополнительно в заявке описан способ получения такого моноклонального антитела и фармацевтическая композиция, включающая такое моноклональное антитело, которое способно нейтрализовать как человеческий α-ФНО, так и человеческий β-ФНО и фармацевтически приемлемый носитель и/или разбавитель.
С помощью описанных антител возможно детектирование содержимого человеческого α-ФНО в
жидкостях организма и получение антиидиотипических антител, которые распознают рецепторы человеческих α-ФНО и β-ФНО
Моноклональные антитела по настоящему изобретению могут
принадлежать к любому из классов иммуноглобулинов, таких как IgM, IgD, IgE, IgA или подклассы IgG. Моноклональное антитело может использоваться интактно или в качестве связывающих фрагментов, таких
как Fv, Fab, F(ab')2.
В заявке описано получение моноклонального антитела или его связывающего фрагмента, причем этот способ включает культивирование клеточной линии гибридомы или ее потомства по настоящему изобретению и выделение моноклонального антитела, полученного таким образом.
Моноклональные антитела по настоящему изобретению или их фрагменты могут быть приготовлены путем иммортализации лимфоцитов ряда поколений В-клеток. Иммортализация может быть осуществлена путем трансформации онкогенным вирусом или посредством слияния с уже иммортальной клеточной линией (например, миеломная или лимфобластоидная клеточная линия). Последний подход, который первоначально был описан Келером и Мильштейном (10), привел к созданию иммортальных гибридных клеточных линий, способных к неограниченному росту и продуцированию антитела. Полученные таким образом клеточные линии могут клонироваться и отбираться таким образом, чтобы детектировать антитела против заданного антигена в надклеточной жидкости. Было описано большое количество методик отбора в литературе, которая известна специалистам в этой области биохимии. Эти методики однозначно дают возможность выделить моноклональные антитела против желаемого антигена (антигенов). Однако, если оператор желает выделить моноклональное антитело, обладающее особыми свойствами (например, имеющее высокую или малую степень сродства к антигену, будучи нейтрализованным или не нейтрализованным), то методики отбора должны устанавливаться таким образом, чтобы давать им возможность изолировать моноклональные антитела, имеющие желаемые свойства. Способ установления таких анализов зависит от искомого свойства антигена, против которого оператор желает получить антитела, и говоря вообще, он непредсказуем и должен изучаться в каждом отдельном случае. Однако эта стадия имеет решающее значение, если оператор желает выделить моноклональные антитела с высокой активностью.
По желанию, когда клеточные линии, продуцирующие моноклональные антитела с заданными свойствами против человеческого α-ФНО, выделены в соответствии с настоящим изобретением, они могут использоваться в качестве источника генов, кодирующих моноклональные антитела.
Эти гены могут быть выделены путем приготовления сначала библиотек кДНК из МРНК. Затем выделяется отдельный клон кДНК, кодирующий иммуноглобулин, который может быть обработан дополнительно. Конечной целью этих обработок обычно является, но не обязательно, генерирование антител с пониженной иммуногенной активностью при назначении внутрь организма хозяина, который отличается от того организма, из которого были произведены первоначальные антитела. Это может быть достигнуто посредством сшивки нуклеотидов, соответствующих переменным областям генов с нуклеотидами, соответствующими постоянным областям тех генов, в которые должны быть введены антитела. Альтернативно, нуклеотиды, кодирующие области первоначального моноклонального антитела, определяющие комплементарность, могут быть заменены соответствующими нуклеотидами переменных областей генов антитела, в которые должны быть введены антитела. Окончательно, исходный или модифицированный клон к ДНК затем может быть выделен и помещен в подходящие прокариотические или эукариотические векторы экспрессии и в последующем трансфектирован в хозяина для окончательного продуцирования массы.
На рис. 1 показана специфичность для человеческого α-ФНО моноклонального антитела, которая определена методом ELISA, при котором измеряется остаточное связывание к α-ФНО 100 нг/мл антитела при инкубировании с различными дозами человеческого α-ФНО. или с различными дозами неродственных антигенов.
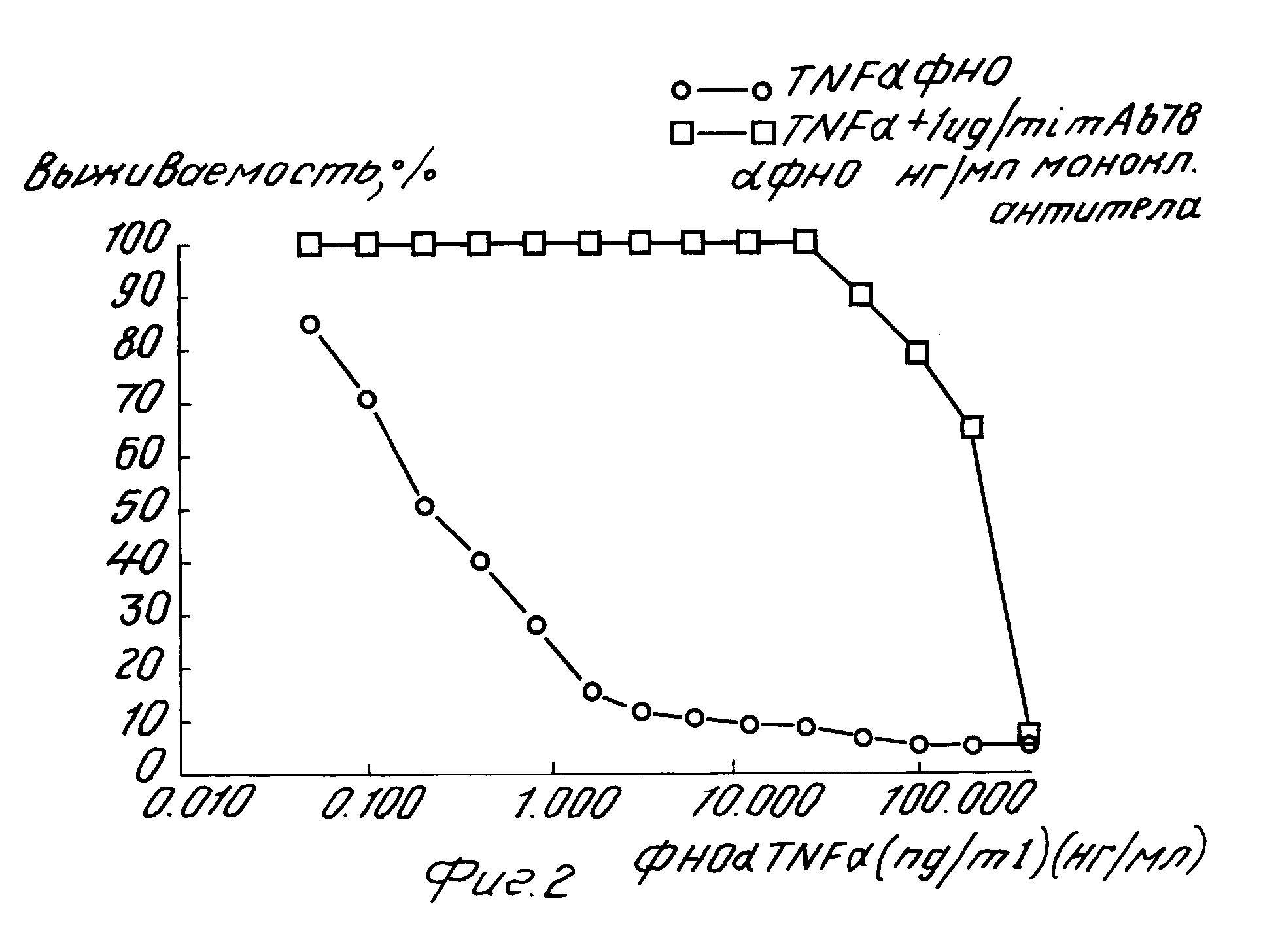
На рис. 2 представлена нейтрализующая активность 1 мкг/мл (6,25 • 10-9 моль/л) моноклональных антител при различных дозах человеческого α-ФНО.
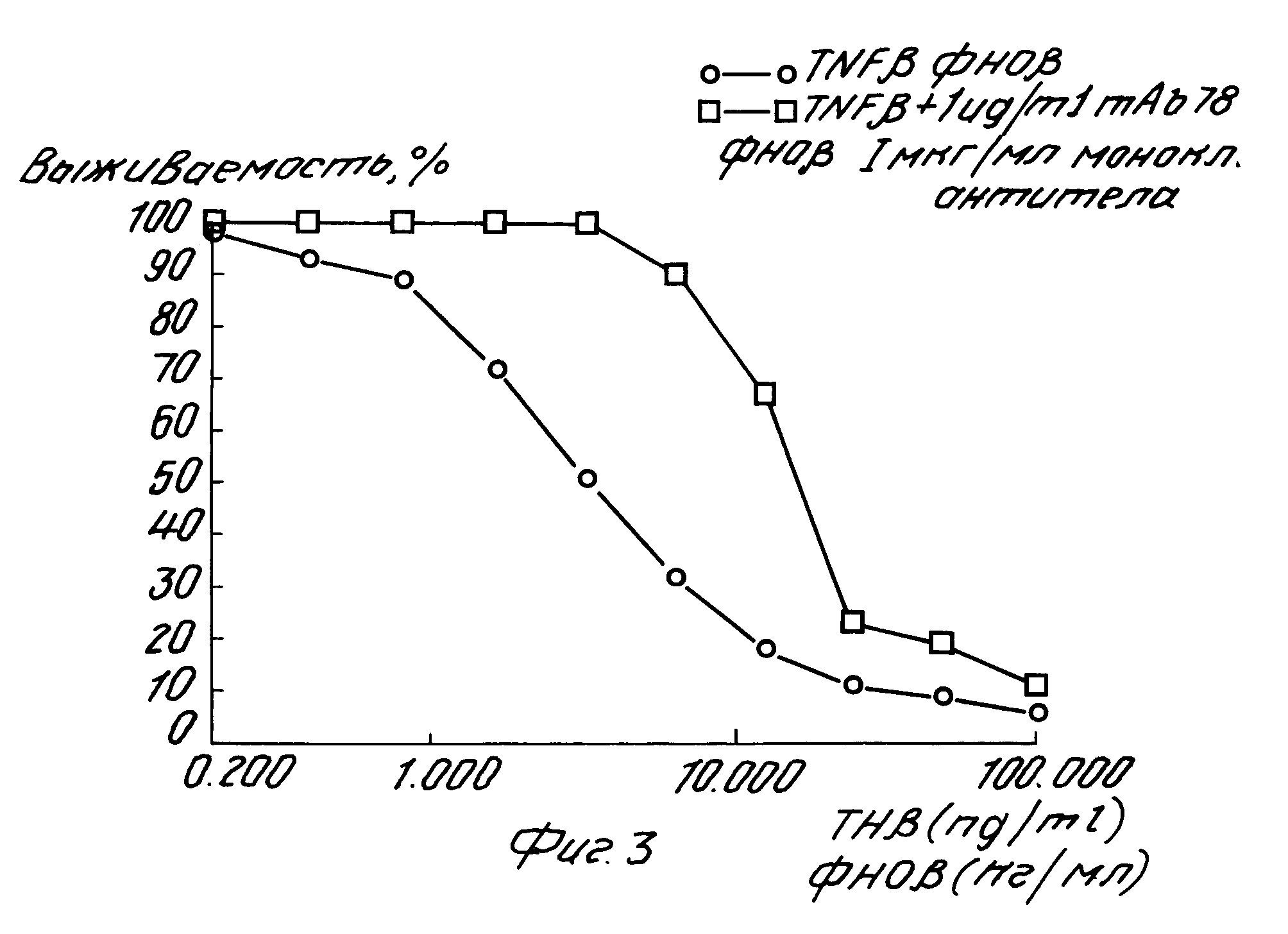
На рис. 3 показана нейтрализующая активность 1 мкг/мл моноклональных антител при различных дозах человеческого β-ФНО.
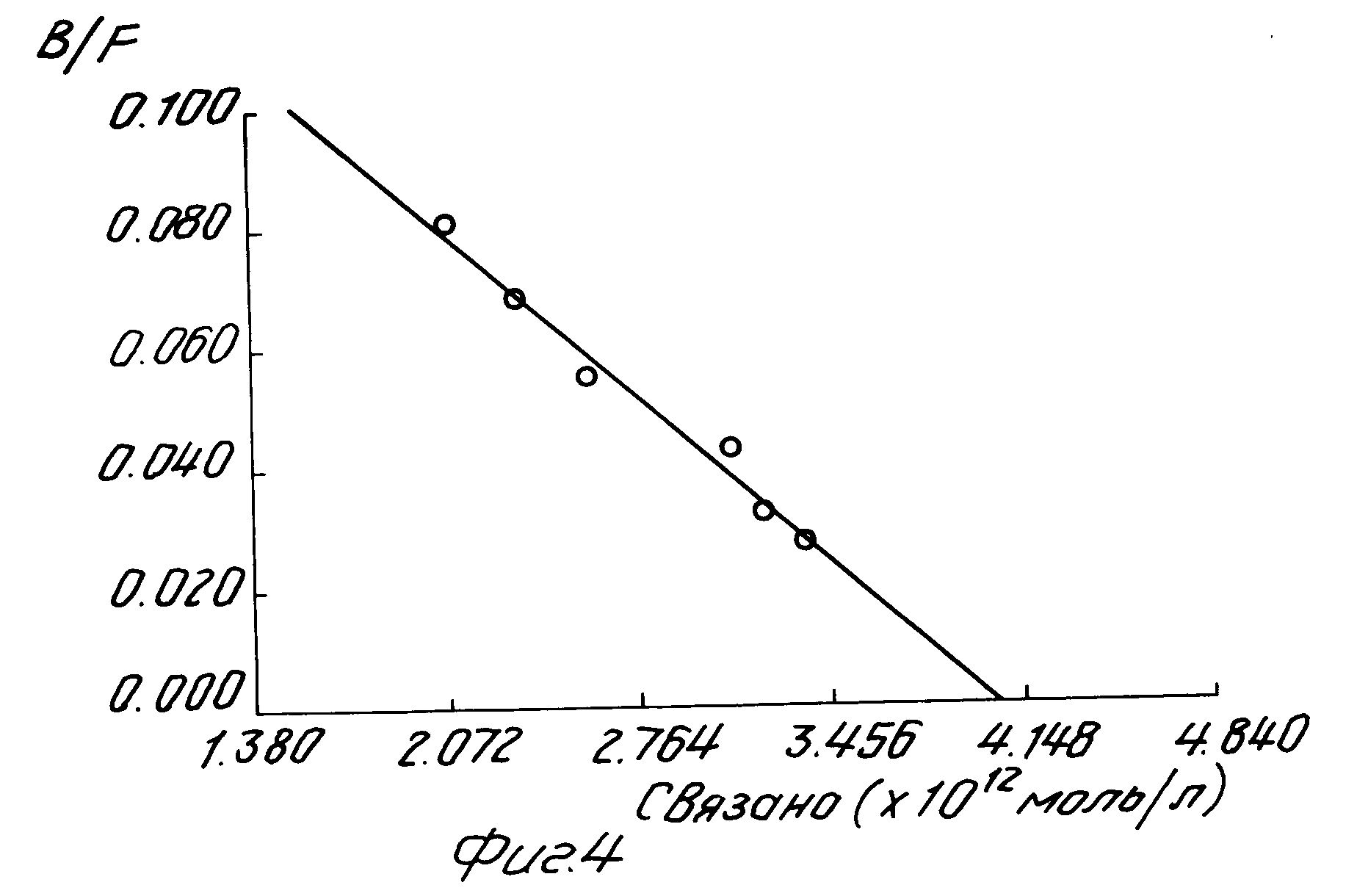
На рис. 4 представлен график Скатчарда для связывания человеческого α-ФНО с упомянутым моноклональным антителом.
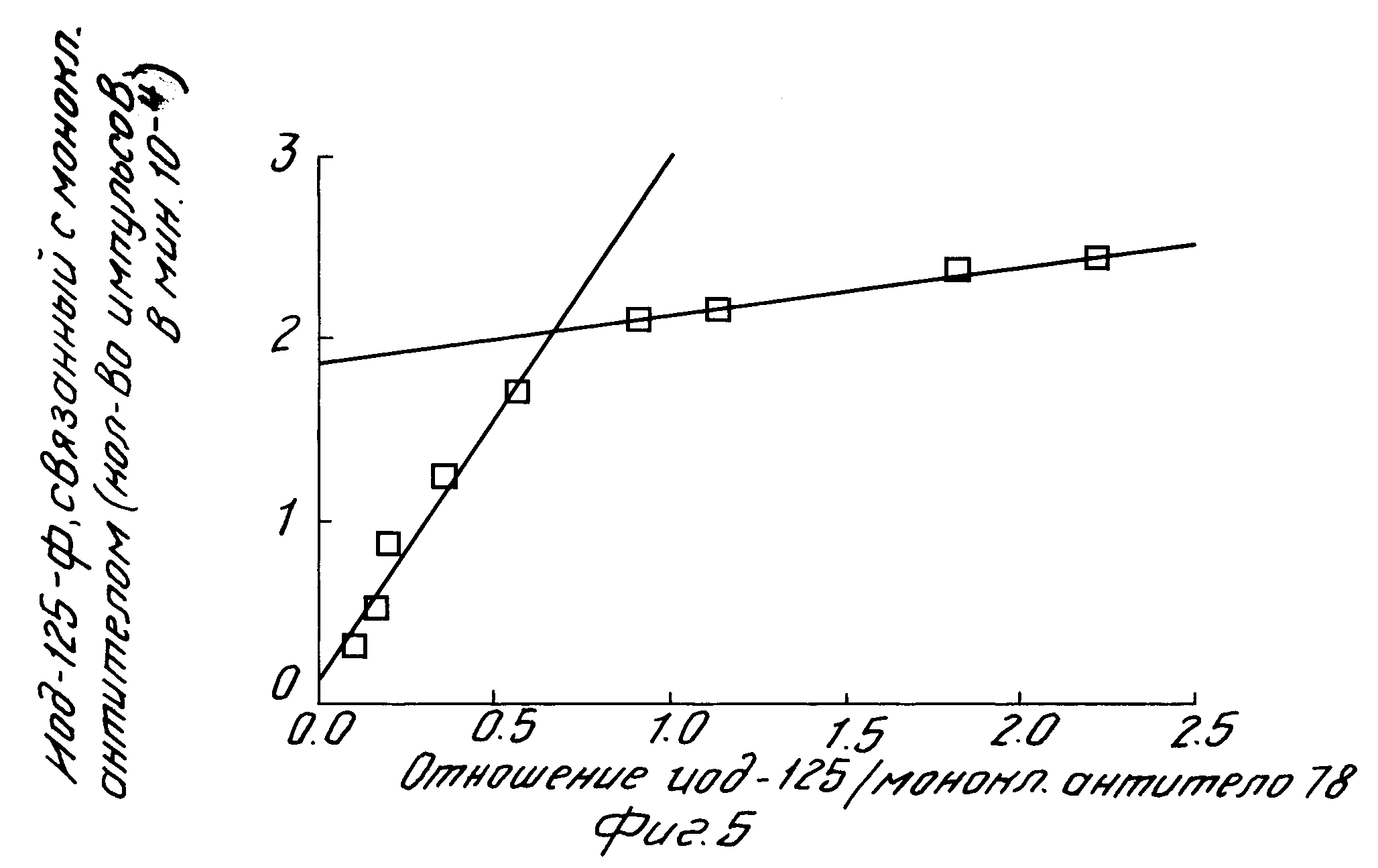
На рис. 5 показана диссоциация человеческого α-ФНО от моноклонального антитела настоящего изобретения.
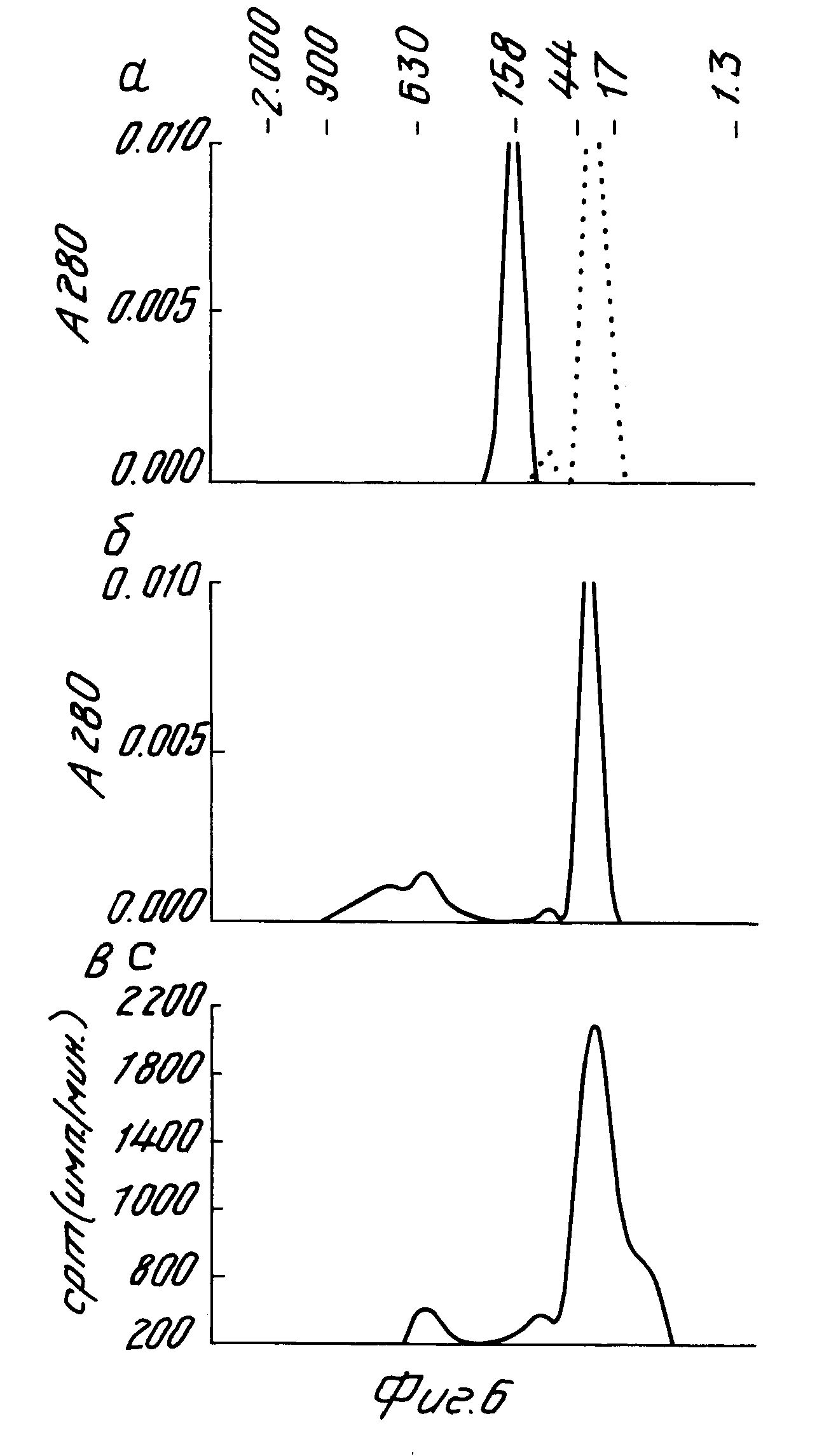
На рис. 6 показаны профили исключения размера жидкостной хроматографии быстрого давления для только 2•10-6 моль/л человеческого α-ФНО (- - - панель A), только 6,25•10-6 моль/л указанного моноклонального антитела (___ панель A), смеси 2•10-6 моль/л человеческого α-ФНО и 2•10-7 моль/л моноклонального антитела (панель В) и смеси 10-10 моль/л иодированного человеческого α-ФНО и 1,25•10-11 моль/л моноклонального антитела (панель С).
В материалах заявки даны таблицы 1, 2, 3, 4 и 5, которые описаны в тексте. Кроме того, табл. 6 демонстрирует параметры связывания человеческого α-ФНО с моноклональным антителом настоящего изобретения.
Таблица 7 показывает концентрации человеческого α-ФНО, при которых достигается полумаксимальная биологическая активность в отсутствии или в присутствии различных концентраций упомянутого моноклонального антитела.
В табл. 8 показано действие на выжимаемость мышей введения им различных доз человеческого α-ФНО.
В табл. 9 показано защищающее действие моноклонального антитела настоящего изобретения для мышей, которым введены две летальные дозы α-ФНО.
В таблице 10 показано защищающее действие инъекции моноклонального антитела настоящего изобретения мышам, введенной в различные моменты до и после их обработки двумя летальными дозами α-ФНО..
Что касается характеристик заявленной гибридной клеточной линии, то термины "постоянный" и "стабильный" означают жизнеспособный в течение продолжительного периода, обычно примерно не менее 6 месяцев. Изобретение раскрывает стабильную, постоянную клеточную линию гибридомы, которая обладает способностью производить специфическое моноклональное антитело в течение по меньшей мере 25 циклов.
Термин "моноклональное антитело" относится к антителу, выбранному из антител, популяция которых является существенно однородной, то есть особи популяции антител являются идентичными, за исключением мутаций естественного происхождения.
Термин "антитело" также означает включение интактных молекул, а также их фрагментов, таких как Fv; Fab и F(ab')2, которые способны связывать антиген. Фрагментам Fv, Fab и F(a,b')2 недостает фрагмента Fc антитела, и они могут обладать меньшим, неспецифическим связыванием ткани, чем интактное антитело. Можно будет признать, что фрагменты Fv, Fab и F(ab')2, и другие фрагменты моноклонального антитела настоящего изобретения могут использоваться также, как интактное антитело для тех же целей, например детектирования α-ФНО и лечения тех болезненных состояний, в которых, как было показано, α-ФНО играет вредную роль.
Термин "нейтрализующий" используется для обозначения способности растворов, содержащих антитело, блокировать биологическую активность α-ФНО и β-ФHO вне и/или внутри организма.
Термин "усиленная или высокая нейтрализующая α-ФНО активность вне организма" используется для обозначения способности раствора, содержащего антитело, нейтрализовать человеческий α-ФНО при весовом отношении 6:1 и при молярном отношении меньше, чем 2:1, при дозах моноклонального антитела не более 10 нг/мл.
Термин "усиленная или высокая нейтрализующая α-ФНО активность в организме" используется для обозначения способности раствора, содержащего антитело, блокировать, при дозах не более 20 мкг/кг веса тела, способность α-ФНО играть вредную роль в живом организме.
Моноклональное антитело, описанное в данной заявке, разумеется, способно осуществлять полную защиту мышей от других летальных доз α-ФНО при дозировках, меньше чем 1 мкг/мышь, типично примерно от 0,4 до 0,8 мкг/мышь. Следует подчеркнуть, что 0,4 мкг/мышь соответствует примерно 20 мкг/кг веса тела.
В предпочтительном варианте осуществления настоящего изобретения такое моноклональное антитело секретируется гибридомной клеточной линией, которая была получена с использованием клеток, способных к неограниченному росту, и клеток, произведенных из мышей, которые были иммунизированы человеческим рекомбинантным α-ФНО.
Клеточная линия, способная к неограниченному росту, представляет собой клеточную линию, которая в практических целях может непрерывно поддерживаться в клеточной культуре. Иными словами, она является стабильной и постоянной, и при слиянии с клетками, которые не проявляют такие свойства, способна присваивать эти свойства продукту слияния.
Может использоваться любая подходящая клеточная линия, способная к неограниченному росту. Типично может быть использована плазмацитома (миелома), происходящая из млекопитающих. Предпочтительным типом клеточной линии является мышиная плазмацитома, лишенная гипоксантин-фосфорибозил-трансферазы (ГФРТ). Однако такая клеточная линия является особенно предпочтительной. Это клеточная линия NSO, хорошо известная, лишенная ГФРТ, плазмацитома происхождения ВАLВ/с, которая сама по себе не продуцирует или не секретирует какого-либо иммуноглобулина, или тяжелой, или легкой цепочки (11).
Клетки, способные к неограниченному росту, сливаются с клетками, из которых по меньшей мене некоторые продуцируют антитела, специфически связывающиеся с человеческим α-ФНО..
Клетки, продуцирующие антитела, обычно получают из мышей, которые иммунизированы человеческим α -ФНО.. Для этой цели может быть использован промышленно доступный человеческий α-ФНО. После слияния продукты слияния подвергают скринингу, отбирая те, которые секретируют целевые моноклональные антитела.
Вне организма сначала они испытываются методом EL ISA, который детектируют антитела против α-ФНО. Затем они испытываются на способность нейтрализовать циклотоксическую активность человеческого α-ФНО на мышиных клетках LM.
Потомство клонов, продуцирующих целевые моноклональные антитела, затем может быть выращено вне организма в подходящей культуральной среде в колбах с культурой ткани или в крупномасштабном устройстве для культивирования (например, Акуцист, фирма Эндотроникс, г. Куун Рэпидз, шт. Миннесота) или в организме как асцитная опухоль в лабораторных животных (например, мышах или крысах).
По желанию, антитело может быть выделено из культуральной среды или жидкости организма; примером могут служить такие
методики как осаждение сульфатом аммония, ионообменная хроматография, жидкостная хроматография высокого разрешения или другие методики, известные среднему специалисту в этой области биохимии. В заявке
описано получение моноклональных антител с высокой нейтрализующей активностью против α-ФНО, а также нейтрализующей активностью против α-ФНО, которые отличаются тем, что
а) их
популяция существенно однородна,
б) они продуцируются клетками, способными к неограниченному росту, которые представляют собой гибриды между клеточной линией, способной к неограниченному
росту, и клеткой, продуцирующей антитела,
в) они проявляют повышенную нейтрализующую активность α-ФНО вне и внутри организма,
г) они способны нейтрализовать и тем самым
распознавать человеческий β-ФНО,
д) они осаждают человеческий α-ФНО,
е) они образуют в растворе комплексы с человеческим α-ФНО, из которых наименьший содержит
практически не менее двух молекул моноклонального антитела и имеют высокий молекулярный вес, обычно не менее 400 тысяч единиц Дальтона.
Благодаря их α-ФНО и β-ФНО нейтрализующей активности моноклональные антитела настоящего изобретения могут быть применены по отношению к млекопитающим, включая людей, для профилактического и/или терапевтического воздействия при болезнях, для которых известно, что α-ФНО и/или β-ФНО оказывают патогенное действие. Как отмечалось ранее, обычно такими болезненными состояниями являются истощение, септический шок, СПИД, церебральная маляция, ревматоидный артрит, хронические и острые воспалительные заболевания, ишемия миокарда, противопоказания к прививкам и другие, для которых уже известно или как полагают α-ФНО и/или β-ФНО играют отрицательную роль.
Уровни дозирования, пригодные для отдельного или систематического назначения взрослым людям, моноклональных антител в соответствии с настоящим изобретением, например, полученных с использованием гибридомного клона 78, могут иметь диапазон 20 мкг 1 мг антитела на 1 кг веса тела. Однократные или многократные назначения этих композиций могут выполняться на уровнях дозирования и по системе, выбранной лечащим врачом. В любом случае, фармацевтическая композиция должна обеспечить достаточное количество антитела для эффективного лечения или профилактики болезни пациента.
Моноклональное антитело этого изобретения может быть применено одно или совместно с другими фармацевтическими активными агентами в фармацевтических композициях, содержащих соответствующие количества моноклонального антитела совместно с фармацевтически приемлемым носителем и/или растворителем.
Ниже приведены типичные примеры рецептур.
А. FCE 27477 лиофилизированная рецептура (композиция предварительно лиофилизированного раствора), содержащая:
Активное лекарство 0,05 0,5% м/о
Наполнитель, например лактоза или маннитол 2,5 5,0% м/о
Поверхностно-активное вещество, например полисорбаты или полоксамер - 0,0025 0,025% м/о
рН регулирующий агент, например
NaOH 0,01N или HCl 0,01N До рН 6,5 7
В. РСЕ 27477 "готовая к применению" рецептура, содержащая:
Активное лекарство 0,05 0,5% м/о
Поверхностно-активное вещество, например
полисорбаты или полоксамер - 0,0025-0,025% м/о
рН регулирующий агент, например NaOH 0,01N или HCl 0,01N До рН 6,5 7
Вода для инъекций Остальное
Для того, чтобы приготовить
изотонический водный раствор, может быть добавлен внешний агент (например, хлорид натрия, сорбитол или декстроза) на его изотоническом уровне.
Моноклональное антитело настоящего изобретения может назначаться при комбинированном методе лечения с другим фармацевтически активным агентом, фармацевтически активные агенты, которые могут быть применены с моноклональными антителами настоящего изобретения или могут назначаться альтернативно в комбинированном методе лечения, могут быть, например, антителами, в особенности моноклональными антителами, против других антигенов, таким образом обеспечивая "коктейль", содержащий моноклональное антитело настоящего изобретения и одно или более (моноклональных) антител против других антигенов, вовлеченных в патогенез соответствующего расстройства.
Дополнительные активные агенты, которые могут быть составлены в рецептуре с моноклональными антителами настоящего изобретения или альтернативно могут быть введены комбинированным методом лечения, особенно для того, чтобы произвести терапевтически полезный эффект, зависят от состояния болезни, подлежащей лечению, и, например, являются промышленно доступным гамма-глобулином и иммуно-глобулиновыми продуктами, антибиотиками, антимикробными продуктами, антибактериальными и противоопухолевыми агентами или смесью из двух или более таких агентов.
Сверх того, моноклональные антитела настоящего изобретения могут быть использованы одни или в комбинированном методе лечения с антибактериальным и, в особенности, с антинеопластичными агентами, с тем, чтобы предотвратить или улучшить возникающие при этом побочные эффекты. Типичными побочными эффектами, которые могут быть устранены, являются, например, кахексия, тошнота, рвота, потеря аппетита, алопеция, понос и нейтропания.
Типично, антимикробные агенты могут включать пенициллин в сочетании с аминогликозидом (например, гентамицин, тобрамицин). Однако могут быть использованы некоторые хорошо известные дополнительные агенты, например цефалоспорины.
Термин "антинеопластичный агент" означает включение как одного противоопухолевого медикамента, так и "коктейлей", то есть смеси таких медикаментов, в соответствии с клинической практикой.
Противоопухолевые агенты, которые могут быть составлены в рецептуре с веществом изобретения или альтернативно, могут быть введены комбинированным методом лечения, представляет собой например, доксорубицин, дауномицин, эпирубицин, идарубицин, этопозид, фторурацил, мефалан, циклофосфамид, блеомицин, винбластин и митомицин или смесь двух или более таких агентов.
Термин "комбинированный метод лечения" означает включение отдельного, а также практически одновременное назначение фармацевтической композиции, содержащей моноклональное антитело настоящего изобретения, фармацевтической композиции, содержащей другой фармацевтически активный агент.
Соответственно, предпочтительной целью настоящего изобретения является комбинированный метод лечения рака у млекопитающих, включая людей, при необходимости такого лечения,
причем этот метод включает назначение
1) моноклонального антитела настоящего изобретения или его связывающего фрагмента, и
2) противоопухолевого агента в таких количествах и в
непосредственной близости по времени, которые достаточны для обеспечения терапевтически полезного эффекта.
Продукты, содержащие моноклональное антитело настоящего изобретения или его связывающий фрагмент и противоопухолевый агент в виде комбинированного препарата, могут быть использованы для одновременного, раздельного или последовательного применения в противораковой терапии.
Поэтому моноклональное антитело настоящего изобретения или его связывающий фрагмент могут использоваться для улучшения лечения рака. Они могут назначаться пациентам, страдающим от рака и обрабатываемым противоопухолевым агентом, например антрациклиновым гликозидом, таким как доксорубицин, даунорубицин, эпирубицин или идарубицин, которые упомянуты выше. Антитело настоящего изобретения и противоопухолевый агент, такой как антрациклиновый гликозид, могут назначаться для улучшения состояния пациента, имеющего лейкомию, такую как миелобластическая лейкомия, лимфома, саркома, нейробластома, опухоль Вилмса или злокачественная неоплазма мочевого пузыря, груди, легких или щитовидной железы.
Кроме того, высокая нейтрализующая активность антитела настоящего изобретения, как показано, например, на рис. 2, позволяет предположить, что упомянутое антитело распознает эпитоп, находящийся близко или внутри центра, связывающего рецептор человеческого α -ФНО. Были охарактеризованы два рецептора α-ФНО (12-13).
Оба рецептора связывают человеческий α-ФНО и β-ФHO с почти одинаковой степенью сродства или экспрессии на целых клетках. Однако растворимые формы этих двух рецепторов связывают человеческий β-ФНО с гораздо меньшей степенью сродства, чем человеческий α-ФНО (14-15). Этот результат позволяет предположить, что солюбилизация внеклеточного домена рецепторов вызывает изменение в относительной степени сродства для человеческого α-ФНО. Если моноклональное антитело настоящего изобретения распознает эпитоп внутри центра человеческого α-ФНО, связывающего рецептор, тогда оно должно функционально вести себя подобно рецептору α-ФНО, то есть оно должно распознавать как человеческий α-ФНО, так и человеческий β-ФНО. Так как упомянутое моноклональное антитело является растворимой молекулой, оно должно функционально вести себя подобно растворимому рецептору α-ФНО, то есть оно должно связывать человеческий α-ФНО с гораздо большей степенью сродства, чем человеческий β-ФНО. Рис. 3 демонстрирует, что, разумеется, это так. Для человеческого β-ФНО отношение полумаксимальной биологической активности в присутствии или в отсутствии 1 мкг/мл упомянутого антитела равно 6,3. Это позволяло предположить, что упомянутое моноклональное антитело связывается с человеческим α-ФНО и человеческим β-ФНО подобно растворимому рецептору α-ФНО.
Следовательно, оно идеально подходит для использования в качестве иммуногена, для того, чтобы получить в соответствии со стандартными методиками, хорошо известными для специалистов в этой области биохимии (16), антиидиотипические антитела, которые связываются с моноклональным антителом настоящего изобретения, подобно человеческому α-ФНО.. Следовательно, эти моноклональные антиидиотипические антитела, которые способны связываться с рецепторами α-ФНО, подобно α-ФНО, и, следовательно, подражательные биологические активности α-ФНО могут быть терапевтически полезными при тех заболеваниях, при которых введение α-ФНО вероятно играет полезную роль. Этими болезненными состояниями являются, например, рак, при котором антиидиотипические антитела изобретения аналогично α-ФНО могут быть введены или как таковые, или предпочтительно как часть комбинированного метода лечения (17), и некоторые автоиммунные заболевания (18).
Моноклональные антитела и фармацевтические композиции, содержащие моноклональные антитела, описанные в заявке, могут назначаться парэнтерально посредством подкожного, внутримышечного, внутриартериального или внутривенного введения.
Фармацевтические композиции, содержащие моноклональные антитела настоящего изобретения, обычно готовятся следующими традиционными методами.
Вообще говоря, носители и/или разбавители согласно фармацевтической композиции настоящего изобретения включают спиртово-водные растворы, эмульсии или суспензии, включая солевые или буферные среды. Парэнтеральные носители включают раствор хлористого натрия, декстрозу Ринджера, декстрозу и хлорид натрия, лактат Ринджера или нелетучие масла. Внутривенные носители включают жидкость и питательные наполнители, электролитные наполнители, такие как на основе декстрозы Ринджера и т.п. Также могут присутствовать предохранители и другие добавки, такие как, например, антимикробные агенты, антиокислители, хелатирующие агенты, инертные газы и т.п. (19).
Обычно в болезненных состояниях, при которых α-ФНО проявляет патогенное действие, содержание α-ФНО в жидкостях организма возрастает по сравнению с тем уровнем, который обнаруживается в тех же самых жидкостях организма здоровых людей. Следовательно, определение уровня α-ФНО в этих жидкостях организма может иметь значение для диагноза и прогнозирования.
Поэтому в заявке описаны иммунологические испытания, в которых биологические свойства моноклональных антител настоящего изобретения являются особенно выгодными. Для цели настоящего изобретения человеческий α-ФНО, который детектируется моноклональными антителами настоящего изобретения, может присутствовать в биологических жидкостях или тканях. Может использоваться любой образец, полученный от пациента и содержащий неизвестное количество человеческого α-ФНО. Обычно образец является жидким, таким как, например, кровь, сыворотка, плазма и т.п.
Моноклональные антитела настоящего изобретения особенно пригодны для использования в иммунологических испытаниях, в которых они могут быть применены в жидкой фазе или связанными с твердой фазой носителя. Кроме того, моноклональное антитело настоящего изобретения в этих иммунологических испытаниях может быть различным образом помечено для детектирования.
Существует много носителей, с которыми моноклональное антитело настоящего изобретения может быть связано и которые могут быть использованы для детектирования наличия человеческого α-ФНО. Хорошо известные носители включают стекло, полистирол, полипропилен, полиэтилен, декстран, найлон, амилазы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Носитель по природе может быть либо растворимым в некоторой степени, либо нерастворимым для целей настоящего изобретения. Специалисты в этой области могут отметить много других подходящих носителей для связывания моноклональных антител или смогут установить это с использованием обычного экспериментирования.
Существует много различных меток и методов введения метки, которые известны среднему специалисту в этой области. Примеры типов меток, которые могут быть использованы в настоящем изобретении, включают, но не ограничиваются ими, ферменты, радиоизотопы, флуоресцирующие вещества, хемилюминесцентные соединения, биолюминесцентные соединения и хелаты металлов. Специалисты в этой области знают другие подходящие метки для связывания с моноклональным антителом или смогут установить это с использованием обычного экспериментирования. Кроме того, связывание этих меток с моноклональным антителом может осуществляться с использованием стандартных методик, обычно известных специалистам в этой области.
Одним из способов, которым моноклональное антитело настоящего изобретения может быть помечено, является связывание его с ферментом. В свою очередь, этот фермент при последующем контакте с субстратом будет взаимодействовать с субстратом таким образом, чтобы образовалась химическая функциональная группа, которая может детектироваться, например, спектрофотометрическими или флуорометрическими средствами. Примеры ферментов, которые могут использоваться для введения детектируемой метки в моноклональные антитела настоящего изобретения, включают малат-дегидрогеназу, стафилококковую нуклеазу, дельта-V-стероидную изомеразу, дрожжевую алкоголь-дегидрогеназу, альфа-глицерофосфат-дегидрогеназу, триозофосфат-изомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагиназу, глюкозоксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-V1-фосфат-дегидрогеназу, глюкоамилазу и ацетилхолинэстеразу.
Моноклональное антитело настоящего изобретения также может быть помечено радиоактивным изотопом, который затем может быть определен такими средствами, как счетчик гамма-частиц или счетчик сцинтилляций. Изотопами, которые особенно пригодны для цели настоящего изобретения, являются: тритий, иод-125, иод-131, фосфор-32, сера-35, углерод-14, хром-51, хлор-36, кобальт-57, кобальт-58, железо-59 и селен-75.
Также можно пометить моноклональное антитело флуоресцентным веществом. Если помеченное флуоресцентно моноклональное антитело подвергнуть действию света с соответствующей длиной волны, то затем его наличие можно обнаружить благодаря флуоресценции красителя. Среди наиболее часто используемых соединений флуоресцентных меток находятся: изотиоцианат флуоресцеина, родамин, фикоэритрин, фикоцианин, аллофикоцианин, офтальдегид и флуорескамин.
Моноклональное антитело настоящего изобретения также может быть помечено с использованием металлов с флуоресцентной эмиссией, таких как европий-152 или других из ряда лантанидов. Эти металлы могут быть присоединены к молекуле антитела с использованием таких хелатных групп для металлов, как диэтилентриаминпентауксусная кислота (ДТПУК) или этилендиаминтетрауксусная кислота (ЭДТУК).
Моноклональное антитело настоящего изобретения может быть помечено для детектирования путем сочетания его с хемилюминесцентным соединением. Наличие моноклонального антитела, печеного хемилюминесцентно, затем определяется путем детектирования наличия люминесценции, которая возникает в ходе химической реакции. Примерами особенно полезных меток хемилюминесцентных веществ являются люминол, изолюминол, сложный терароматический эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты.
Аналогично для метки моноклональных антител настоящего изобретения может быть использовано биолюминесцентное вещество. Биолюминесценция представляет собой тип хемилюминесценции, обнаруженный в биологических системах, в которых каталитический белок увеличивает эффективность хемилюминесцентной реакции. Присутствие биолюминесцентного моноклонального антитела определяется детектированием наличия люминесценции. Важными для целей введения метки являются биолюминесцентные вещества люциферин, люцифераза и аэкворин.
Другая методика, которая также может привести к повышенной чувствительности при использовании в сочетании с настоящим изобретением, состоит в спаривании моноклональных антител настоящего изобретения с низкомолекулярными гаптенами. Затем эти гаптены могут специфически детектироваться с помощью второй реакции. Например, обычным является использование в этой связи таких гаптенов, как биотин (реагирующий с авидином) или динитрофенил, пиридоксаль и флуорескамин (реагирующий со специфическими антигаптеновыми антителами).
Моноклональное антитело настоящего изобретения идеально подходит для приготовления набора. Такой набор может включать носитель, который разделен на отделы, чтобы получить одну или несколько емкостей, таких как ампулы, трубки и т.п. в непосредственной близости друг к другу, причем каждая такая емкость включает отдельные элементы иммунного испытания, которое будет использоваться. Может быть приготовлен аналогичный набор, включающий разделенный на отделы носитель, который имеет одну или несколько емкостей, включающих отдельные элементы, пригодные для терапевтического использования согласно настоящему изобретению.
Имеется множество типов иммунных испытаний, которые могут быть использованы или введены в виде набора. Типичные примеры некоторых иммунных испытаний, в которых могут использоваться антитела изобретения, представляют собой конкурентные испытания и иммунометрические или сэндвичевые испытания.
Термин "иммунометрические испытания" или "сэндвичевые испытания" означает включение одновременного сэндвичевого, заблаговременного сэндвичевого и обратного сэндвичевого иммунных испытаний. Эти термины хорошо понятны специалистам в этой области биохимии. Специалисты в этой области также смогут признать, что моноклональное антитело настоящего изобретения может быть полезным в других вариациях и формах иммунных испытаний, которые известны в настоящее время или будут разработаны в будущем.
В заблаговременном сэндвичевом иммунном испытании образец сначала выдерживают с твердофазным иммуносорбентом, содержащим моноклональное антитело против человеческого α-ФНО. Выдерживание продолжается в течение периода времени, достаточного, чтобы дать возможность антигену в образце связаться с иммобилизованным антителом на твердой фазе. После первого выдерживания твердофазный иммуносорбент выделяют из инкубационной смеси и промывают, чтобы удалить избыток антигена и другие мешающие примеси, такие как неспецифически связанные белки, которые также могут присутствовать в образце. Твердофазный иммуносорбент, содержащий человеческий α-ФНО вместе с иммобилизованным антителом, в последующем выдерживается вторично с растворимым меченым антителом или антителами. После второго выдерживания проводится вторая промывка, чтобы удалить несвязанные меченые антитела из твердофазного иммуносорбента и неспецифически связанные меченые антитела. Затем меченые антитела, связанные с твердофаным иммуносорбентом, детектируются, причем найденное количество меченого антитела служит непосредственной мерой количества антигена, присутствующего в исходном образце. Альтернативно также могут детектироваться меченые антитела, которые не ассоциированы с иммуносорбентом в комплексе, в этом случае мерой является обратное отношение к количеству антигена, присутствующего в образце. Заблаговременные сэндвичевые испытания описаны, например, в патентах США N 3867517, N 4012294 и N 4376110.
При проведении заблаговременного иммунометрического испытания более подробно
процесс включает
а) во-первых, образование смеси образца с антителом, связанным с твердой фазой, и выдерживание смеси в таких условиях и в течение такого времени, которые достаточны, чтобы
дать возможность антигену в образце связаться с антителом, присоединенным к твердой фазе;
б) после упомянутого выдерживания на стадии а) добавляют к смеси антитела, помеченного для
детектирования, (или антител) и выдерживают полученную вновь смесь в течение периода времени и в таких условиях, которые достаточны, чтобы дать возможность меченому антителу связаться с твердофазным
иммуносорбентом;
в) выделяют твердофазный иммуносорбент из смеси после выдерживания на стадии б), и
г) детектируют или меченое антитело, или антитела, связанные с твердофазным
иммуносорбентом, или детектируют антитело, с ним не ассоциированное.
В обратном сэндвичевом испытании образец первоначально выдерживают с меченым антителом, после чего туда же добавляют твердофазный иммуносорбент, содержащий множество иммобилизованных антител, и проводят второе выдерживание. Первоначальная стадия промывки, как в заблаговременном сэндвичевом испытании, здесь не требуется, хотя после второго выдерживания осуществляют промывку. Обратные сэндвичевые испытания были описаны, например, в патентах США N 4098876 и N 4376110.
При проведении
обратного иммунометрического испытания более подробно процесс включает
а) сначала образование смеси образца с растворимым антителом, помеченным для детектирования, в течение периода времени и
в условиях, которые достаточны для того, чтобы дать возможность антигену в образце связаться с меченым антителом;
после стадии выдерживания а) добавляют к смеси антитела, связанные с твердой
фазой, и выдерживают вновь полученную смесь в течение времени и в условиях, которые достаточны для того, чтобы дать возможность антигену, связанному с меченым антителом, присоединиться к твердофазным
антителам;
в) выделяют твердофазный иммуносорбент из выдержанной смеси после стадии выдерживания б), и
г) детектируют или меченое антитело, связанное с твердофазным иммуносорбентом,
или детектируют не связанное с ним меченое антитело.
В одновременном сэндвичевом анализе на одной стадии одновременно выдерживаются: образец, иммуносорбент, имеющий множество иммобилизованных антител, и меченое, растворимое антитело или антитела. При одновременном испытании требуется только единственная инкубация, причем стадии промывки отсутствуют. Использование одновременного испытания, несомненно, является предпочтительным методом. Этот тип испытания приводит к легкости оперирования, гомогенности, воспроизводимости, линейности испытаний и высокой точности. Образец, содержащий антиген, твердофазный иммуносорбент с иммобилизованными антителами и меченым растворимым антителом или антителами, выдерживается в течение периода времени и в условиях, которые достаточны для того, чтобы дать возможность антигену связаться с иммобилизованными антителами и с растворимым антителом. В общем, желательно предоставление условий инкубации, которые достаточны для связывания как можно большего количества антигена, так как это доводит до максимума связывание меченого антитела с твердой фазой, тем самым увеличивается сигнал. Типичными условиями по времени и температуре являются два часа, примерно при 45oC или 12 часов примерно при 37oC.
Обычно антиген связывается с меченым антителом более быстро, чем с иммобилизованным антителом, так как первый находится в растворе, тогда как второй связан с твердой фазой носителя. Вследствие этого меченое антитело может использоваться в уменьшенных концентрациях, чем иммобилизованное антитело, и также предпочтительно использовать высокую удельную активность для меченого антитела. Например, меченое антитело по этому изобретению может быть использовано при концентрации примерно 1 50 нг/на 1 испытание, тогда как иммобилизованное антитело может иметь концентрацию 10 500 нг/на 1 испытание, на 1 антитело. Когда антитело имеет радиометку, оно может иметь удельную активность, например, с одним атомом радиоиода в молекуле, или два или более радиоиода в молекуле антитела.
При проведении одновременного иммунометрического испытания на
образце, содержащем многовалентный антиген, более подробно процесс включает
а) одновременное образование смеси, включающей образец, вместе с антителом, связанным с твердой фазой, и
растворимым меченым антителом или антителами;
б) выдерживание смеси, образовавшейся на стадии а) в течение времени и в условиях, которые достаточны для того, чтобы дать возможность антигену в
образце связаться с иммобилизованными, а также с мечеными антителами;
в) выделение твердофазного иммуносорбента из инкубационной смеси после выдерживания, и
г) детектирование или
меченого антитела, связанного с твердофазным иммуносорбентом, или детектирование меченого антитела, с ним не ассоциированного.
Конечно, конкретные концентрации меченых и иммобилизованных антител, температура и время выдерживания, а также другие условия испытания могут изменяться в зависимости от различных факторов, включая концентрацию антигена в образце, природу образца и т.п. Специалисты в этой области смогут определить рабочие и оптимальные условия испытаний для каждого определения с использованием обычного экспериментирования.
После выдерживания твердофазный иммуносорбент удаляется из инкубационной смеси. Это может осуществляться с помощью любой из известных методик разделения, такой как седиментация или центрифугирование. Детектирование может быть осуществлено с помощью счетчика сцинтилляций, например, если метка испускает радиоактивные гамма-кванты, или с помощью флуориметpа, например, если метка представляет собой флуоресцентный материал. В случае ферментной метки детектирование может осуществляться колориметрическими методами, при которых используется субстрат для фермента.
В испытания могут, конечно, добавляться другие стадии, такие как промывка, перемешивание, встряхивание, фильтрация и т.п. по традиции или по необходимости для любой конкретной ситуации.
Существует много твердофазных иммуносорбентов, которые были использованы и которые могут быть использованы в настоящем изобретении. Хорошо известные иммуносорбенты включают шарики, полученные из стекла, полистирола, полипропилена, декстрана, нейлона и других материалов, и труб, сформованных или покрытых указанными выше материалами и т.п. Иммобилизованные антитела могут быть связаны с твердофазным иммуносорбентом или ковалентно, или физически, с помощью методик, таких как ковалентное связывание через образование амидной или сложно-эфирной связи, или посредством абсорбции.
Специалисты в этой области знают многие другие подходящие твердофазные иммуносорбенты и способы для иммобилизации на них антител или смогут установить это, используя не более чем рутинное экспериментирование.
Изобретение иллюстрируется следующими примерами.
Пример 1.
1. Иммунизация мыши человеческим α-ФНО.
Человеческий α-ФНО (фирма Эсквайр Хми Эй-Джи, г. Цюрих, Швейцария), разбавленный в фосфатно-буферном физиологическом растворе (ФБР), в который добавлен полный вспомогательный агент Фрейда (ПАФ, ф. Дифко, Детройт, шт. Мичиган) в количестве 500 мкл на 500 мкл ФБР, вводят в заднюю часть лапок 5 мышей ВАLB/c в дозе 30 мкг/мышь.
Спустя 14 суток после первой иммунизации человеческий α-ФНО, разбавленный в ФБР с добавкой ПАФ, как указано выше, вводится подкожно тем же самым мышам в дозе 30 мкг/мышь.
Спустя 14 суток после второй иммунизации тем же мышам вводят внутрибрюшинно человеческий α-ФНО, разбавленный ФБР, в дозе 30 мкг/мышь.
Спустя 14 суток после третьей иммунизации тем же мышам вводят человеческий α-ФНО при той же дозировке и условиях, как при третьей иммунизации.
Спустя 3 суток умерщвляли мышь, которая имела наивысший титр антител анти-α-ФНО в сыворотке, что определялось методом ELISA.
2. Получение клеток мышиной селезенки, производящих антитела анти-α-ФНО, способных к неограниченному росту.
В антисептических условиях удаляют селезенку, гомогенизируют ее и центрифугируют полученную суспензию клеток. Одновременно также центрифугируют клетки миеломы NSO (более 99% жизнеспособных клеток). Полученные при центрифугировании 2 лепешки вновь суспендируют в полной среде RPMI. Эта среда является фирменным продуктом RPM1 1640 (ф. Флоу, Опера, Италия), с добавками 1 ммоль/л пирувата натрия (фг. Гибко, Пайслей, Шотландия), несущественных аминокислот (фг. Гибко), 100 мкг/мл стрептомицина, 1,5 мкг/мл амфотерицина В и еще 2 ммоль/г глутамина. Обе суспензии клеток объединяют в соотношение клетки селезенки: клетки миеломы 10:1. Полученную смесь клеток центрифугируют в течение 10 мин при ускорении 400 же. Среду сливают и осторожно добавляют по каплям 1 мл полиэтиленгликоля (ПЭГ 1600, ф. Серва, г. Гейдельберг, Германия, 40 вес. /объем в полной среде RPMI) в течение 1 минуты, для того чтобы произошло слияние. Затем добавляют 5 мл полной среды RPMI в течение 5 минут, затем 10 мл в течение 5 минут и окончательно 15 мл в течение 5 минут. Конечную суспензию центрифугируют в течение 10 минут при 400 же, причем лепешки повторно суспендируют в полной среде RPMI, снабженной 20% плодной сыворотки теленка (ПСТ, ф. Флоу, термически инактивирована при 56oC в течение 30 минут), с тем, чтобы получить окончательную плотность клеток 5 х 105 клеток/мл (клетки селезенки + клетки NSO) 200 мкл этой суспензии засеивают в каждую пробирку из 96-пробирочной панели с тканевыми культурами (фалкон N 3072, ф. Бектон Дикинсон Милан, Италия), которые были предварительно засеяны облученными клетками брюшины мыши. (300 рад, 2,5 х 104 клеток/пробирка).
Затем панели, содержащие продукты слияния, выдерживают 24 часа при 37oC в атмосфере 5% углекислого газа. Затем добавляют 50 мкл полной среды RPMI с добавкой 20% ПСТ и гипоксантина, аминоптерина и тимидина (ГАТ, соответственно окончательные концентрации в панели, моль/л равны 10-4, 4 х 10-7 и 1,6 х 10-5. В этой культуральной среде может выжить только гибридома, так как клетки N 50 погибают в присутствии аминоптерина, а неслитые клетки селезенки обладают ограниченной продолжительностью жизни.
Затем панели выдерживают дополнительно при 37oC и 5% СО2. Культуры подпитывают каждые двое суток свежей средой.
Растущие гибриды становятся видимыми на 4-е сутки. Спустя 3 недели из среды удаляют аминоптерин, и начиная с 5-й недели, используется полная среда RPMI с добавкой 20% ПСТ.
Спустя 10 14 суток, культуры испытываются на продуцирование антител, связывающихся с человеческим α-ФНО в ферментно-связанном иммуносорбентном анализе (ELISA), и антител, нейтрализующих одну из нескольких биологических активностей человеческого α-ФНО. Обычно вследствие легкости испытываются всплывшые культуры на их способность нейтрализовать цитотоксическую активность человеческого α-ФНО на мышиных клетках 1М (ниже смотри подробное описание испытаний). Гибридные клетки, продуцирующие антитела с наибольшей нейтрализующей активностью, клонируются ограниченным разбавлением на входе до 0,5 клеток/ пробирка в 96-пробирочных панелях (фалкон), которые предварительно засеивались облученными клетками брюшины мыши (300 рад. 2,5 х 104 клеток в пробирке). Спустя 2 недели пробирки с положительным ростом испытывают на продуцирование специфических антител α-ФНО с помощью упомянутых выше двух испытаний.
Отбирается один клон, продуцирующий антитела с наибольшей нейтрализующей активностью, и размножается дополнительно. Всплывающие частицы этого клона испытываются для того, чтобы количественно оценить его нейтрализующую активность внутри и вне организма. С этой целью сначала определяется иммуноглобулиновое содержание этих частиц количественным методом ELISA (подробное описание испытания смотри ниже). Для количественного определения их нейтрализующей активности вне организма совместно выдерживают 1 мкг/мл, 100 нг/мл или 10 нг/мл (6,25 х 10-10 или 6,25 х 10-11 моль/л) моноклонального антитела с возрастающими дозами человеческого α -ФНО. Спустя 2 часа определяется остаточная цитотоксическая активность человеческого α-ФНО для мышиных клеток LM. Для того, чтобы понять, имеется ли перекрестная реакция моноклонального антитела с близко родственным полипептидом β-ФНО, 1 мкг/мл моноклонального антитела выдерживают совместно с возрастающими дозами человеческого β-ФНО и спустя 2 часа определяют цитотоксичную активность человеческого β-ФНО на клетки LM.
Для того, чтобы количественно определить нейтрализующую активность моноклонального антитела в организме, затем испытывают его различные дозы на их способность защищать мышей от синдрома летального шока, вызванного α-ФНО, введенным совместно с Д-галактозамином (детальное описание испытания смотри ниже).
Клетки гибридомного клона снова клонируются, как описано выше, для того, чтобы гарантировать стабильность и однородность клеточной популяции. Один клон (клон 78) был выбран и размножен для дальнейшей характеристики. Было установлено, что моноклональное антитело, продуцируемое этим клоном, имеет тяжелые цепочки подкласса ИгГ1 и легкие цепочки класса к.
3. Проверка специфичности человеческого α-ФНО специфичного моноклонального антитела.
На рис. 1 показано, что связанное с человеческим α-ФНО моноклональное антитело, произведенное гибридомой 78, замещается только после предварительного выдерживания с человеческим α-ФНО, но не с рядом неродственных антигенов. Этими неродственными антигенами были фактор эпидермического роста (EGF), соматостатин, интеглейкин 6 (1L 6), трансферрин, фактор гормона щитовидной железы (ТНF), инсулин, антитела крысиного иммуноглобулина G.
4. Нейтрализующая активность моноклонального антитела с усиленной нейтрализующей активностью α-ФНО и β-ФHO вне организма.
На рис. 2 показана нейтрализующая активность 1 мкг/мл (6,25 х 10-9 моль/л) моноклонального антитела, произведенного гибридомным клоном 78, на возрастающие дозы человеческого α-ФНО. Как можно видеть, один человеческий α-ФНО проявляет 50% цитотоксичности при дозе 0,15 нг/мл (3,3 х 10-12 моль/л). В присутствии 1 мкг/мл указанного моноклонального антитела человеческий α-ФНО проявляет 50% цитотоксичности примерно при дозе 229 нг/мл (4,6 х 10-9 моль/л). Это показывает, что 1 мкг/л указанного моноклонального антитела полностью нейтрализует примерно 228 нг/мл человеческого α-ФНО. Отношение полумаксимальной биологической активности в присутствии и с отсутствии 1 мкг/мл упомянутого антитела составляет, следовательно, около 1527.
Допуская, что человеческий α-ФНО присутствует в растворе в виде примера, отсюда можно вывести, что моноклональное антитело нейтрализует человеческий α-ФНО в соотношении примерно 1,3 1 моль на моль.
На рис. 3 показано, что для человеческого β-ФНО отношение полумаксимальной биологической активности в присутствии и в отсутствии 1 мкг/мл указанного антитела по этому изобретению составляет около 6,3. В таблице 7 представлены дозы человеческого α-ФНО, дающие 50% цитотоксической активности на клетках LM в отсутствии и в присутствии 6,25 х 10-9, 6,25 х 10-10 или 6,25 х 10-11 моль/л указанного антитела. Как можно видеть, это антитело нейтрализует при всех испытанных дозах человеческий α-ФНО при молярном отношении меньше 2.
5. Сродство моноклонального антитела с повышенной нейтрализующей активностью α-ФНО..
Сродство моноклонального антитела по настоящему изобретению определяется с помощью анализа Скатчарда. С этой целью 1 нг/мл (6,25 х 10-12 моль/л) упомянутого моноклонального антитела выдерживают с различными дозами иодированного человеческого α-ФНО и после этого определяют количество связанного с человеческим α-ФНО антитела.
Как можно видеть из рис. 4, в координатах графика Скатчарда данные по связыванию дают прямую линию. В табл. 6 показаны параметры человеческого α-ФНО, связывающегося с указанным моноклональным антителом. Как можно видеть, наблюдаемая константа сродства (Кнаб.) равна 3,16 х 1010 л/моль, а наибольшее количество кодированного человеческого α-ФНО, способного связывать 6,25 х 10-12 моль/л указанного моноклонального антитела, равно 4,34 х 10-12 моль/л.
6. Диссоциация человеческого α-ФНО от моноклонального антитела с повышенной нейтрализующей активностью α-ФНО.
Диссоциацию человеческого α-ФНО от указанного антитела определяют посредством предварительной выдержки иодированного человеческого α-ФНО (2,5 нг/мл, 5 х 10-11 моль/л) с моноклональным антителом (2 нг/мл, 1,25 х 10-11 моль/л) c последующим измерением диссоциации путем добавления избытка немеченного человеческого α-ФНО с целью предотвращения реассоциации иодированного человеческого α-ФНО. На рис. 5 показан результат такого эксперимента. Как можно видеть, диссоциация иодированного человеческого α-ФНО подчиняется кинетическому уравнению для реакции первого порядка, давая линейный график. Найденная из этого графика величина константы скорости диссоциации k-1 равна 1,37 х 10-5 с-1 (полупериод равен 14 часам).
7. Двойная иммунодиффузия Оучтерлони в агаре.
Моноклональное антитело по настоящему изобретению способно к иммуноосаждению человеческого α-ФНО.. Полосы преципитина образуются, когда 20 мкг указанного моноклонального антитела (центральный лоток) имеют возможность взаимодействовать с 10 мкг (верхний левый лоток), 5 мкг (верхний правый) и 2,5 мкг (нижний правый) человеческого α -ФНО.
При 1,25 мкг (нижний левый лоток) человеческого α-ФНО полоса преципитина становится невидимой. Известно, что для того, чтобы антиген мог быть осажден моноспецифическим антителом, подобным тому, которое описано в настоящем изобретении, оно должно быть многовалентным и экспрессировать минимум 3 идентичных эпитопа на той же молекуле (20). Человеческий α-ФНО был описан как тример в растворе, но имеются также сообщения о том, что в растворе человеческий α-ФНО существует в виде димера. С помощью моноклонального антитела настоящего изобретения можно однозначно определить α-ФНО как тример.
8. Профили исключения размера жидкостной хроматографии быстрого давления смесей человеческого α-ФНО и моноклонального антитела с повышенной нейтрализующей активностью α-ФНО.
На рис. 6 показаны ЖХБД профили исключения размера 100 мкг/мл (2 х 10-6 моль/л) одного человеческого α-ФHO (- - - панель А), 100 мкг/мл (6,25 х 10-6 моль/л) одного упомянутого моноклонального антитела (----, панель А), смеси 100 мкг/мл (2 х 10-6 моль/л) человеческого α-ФНО и 30 мкг/мл (2 х 10-6 моль/л) моноклонального антитела (панель В) и смеси 5 нг/мл (10-10 моль/л) иодированного человеческого α-ФНО и 2 нг/мл (1,3 х 10-11 моль/л) моноклонального антитела (панель С). Как можно видеть, один человеческий α-ФНО элюируется при объеме, соответствующем молекулярному весу до 40 тыс. ед. Дальтона. Такое хроматографическое поведение человеческого α-ФНО находится в соответствии с другими исследованиями, в которых, как было сообщено, олигомерный α-ФНО обладает кажущимся молекулярным весом 34 40 тыс. ед. Д при гель-фильтрации (22). С другой стороны, смеси человеческого α-ФНО и моноклонального антитела возникают при концентрациях реагента либо в большом избытке, либо близких к рассчитанным величинам Кнаб., обеспечивающим образование комплекса, который элюируется при объемах, соответствующих молекулярному весу по меньшей мере 400 тыс.ед. Д, обычно 570 600 тыс. Д (панели В и С).
9. Вывод, сделанный из экспериментов вне организма, осуществленных с моноклональным антителом с повышенной нейтрализующей активностью α-ФНО..
Рассматривая молекулярный вес комплексов (570 600 тыс. Д), образующихся при взаимодействии человеческого α-ФНО с упомянутым моноклональным антителом с точки зрения факта, что наибольшее количество человеческого α-ФНО, способного связываться и нейтрализоваться моноклональным антителом, равно примерно 0,7 моль α-ФНО моль антитела, можно прийти к выводу, что каждый указанный комплекс является высокомолекулярным комплексом, содержащим фактически по меньшей мере 2 молекулы моноклонального антитела и 1 молекулу человеческого α-ФНО, обычно 3 молекулы моноклонального антитела (6 связывающих функций) связываются вместе с двумя молекулами человеческого α-ФНО (6 эпитопов).
Можно ожидать, что такие комплексы будут элюироваться при гель-фильтрации, при объемах, соответствующих 560 580 тыс. ед. Д, что близко к наблюдаемому в эксперименте. Поскольку результаты по стехиометрии связывания были получены из экспериментов, осуществленных в избытке антигена, мы исключаем возможность того, что комплексы человеческий α-ФНО / моноклональное антитело содержат альтернативные молекулы моноклональное антитело/человеческий α-ФНО в конфигурации открытой цепочки. Вместо этого мы полагаем, что молекулы человеческий α-ФНО /моноклональное антитело сочетаются с образованием структур, аналогичных кольцу. Энергетическое преимущество, а следовательно, и высокая стабильность кольчатых комплексов антиген/антитело обсуждались и тщательно изучались в системах двухвалентный гаптен-антитело (23-26). На самом деле, исследование диссоциации (рис. 5) показывает, что, разумеется, комплексы человеческий α-ФНО /моноклональное антитело являются очень стабильными (k-1 1,37 x 10-5 с-1). Эти величины имеют тот же порядок величины, который сообщался для моноклональных антител, связывающихся с клеточной поверхностью антигенов согласно моногамно двухвалентному характеру связывания (27), другой тип взаимодействия антиген-антитело приводит к образованию аналогично стабильных комплексов. Более того, если в результате образования таких циклических комплексов имеется возможность придавать человеческому α-ФНО и моноклональному антителу состояние наибольшей стабильности, тогда это объясняет кажущийся парадоксальным результат, что в избытке антигена наименьший образующийся комплекс антиген-антитело имеет избыток антитела.
С точки зрения такой модели, однако, возникает вопрос, каким образом человеческий α-ФНО и упомянутое моноклональное антитело могут подвергаться осаждению. При условии, что в описанных комплексах нет эпитопов человеческого α-ФНО, остающихся свободными для взаимодействия с указанными молекулами моноклонального антитела, мы исключаем возможность осаждения в результате образования поперечных сшивок таких комплексов. Скорее можно предпочесть, что возможности образования осаждения и циклических комплексов являются двумя принципиально различающимися явлениями, которые конкурируют между собой. При избытке антигена и низших концентрациях реагента (близких к значению Кнаб.) будет преобладать образование циклических комплексов, при равенстве / избытке антитела и высоких концентрациях реагента образование комплексов сформирует меняющиеся молекулы антитело-антиген в соответствии с классической теорией решетки.
Окончательно, моноклональные антитела, связывающиеся с человеческим α-ФНО подобно тому, как описано в настоящем изобретении, могут иметь преимущество с точки зрения возможных терапевтических приложений в случае болезненных состояний, связанных с человеческим α-ФНО..
Фактически комплексы, содержащие по меньшей мере две типичные молекулы моноклонального антитела, могут рассматриваться как микроагрегаты. Клетки ряда поколений моноцит-макрофаг должны предпочтительно исключать их циркуляции, тем самым предотвращая их выделения в критических органах (например в почках), и таким образом, в этих областях устраняются воспалительные реакции, передаваемые иммунным комплексом.
10. Нейтрализующая активность (в организме) моноклонального антитела с повышенной нейтрализующей α-ФНО активностью.
Для того, чтобы оценить в организме нейтрализующую активность, использовалась модельная система, в которой мышам с помощью инъекции внутрибрюшинно вводили 36 мг Д-галактозамина (ф. Флюка Эй-Джи, Бухс, Швейцария) и человеческого α-ФНО.
Д-Галактозамин приводит животных в чрезвычайно чувствительное состояние в отношении летального эффекта человеческим α-ФНО. Как можно видеть из таблиц 7 9, столь малая доза α-ФНО как 0,1 мкг/мышь уничтожает большинство животных. На самом деле введение такого количества α-ФНО мышам может поднять уровень α-ФНО в крови до уровня, близкого к тому, который обнаруживается у больных людей, в состоянии которых, как предполагается, вредную роль играет α-ФНО (28). Поэтому эта модельная система пригодна для определения тех доз анти α-ФНО моноклонального антитела, которые будут нейтрализовать α-ФНО при болезненном состоянии людей, в котором α-ФНО проявляет патогенный эффект.
В таблицах 8 и 9 приведены результаты исследований защиты в организме, которые были проведены с моноклональным антителом по настоящему изобретению, продуцированному гибридомным клоном 78.
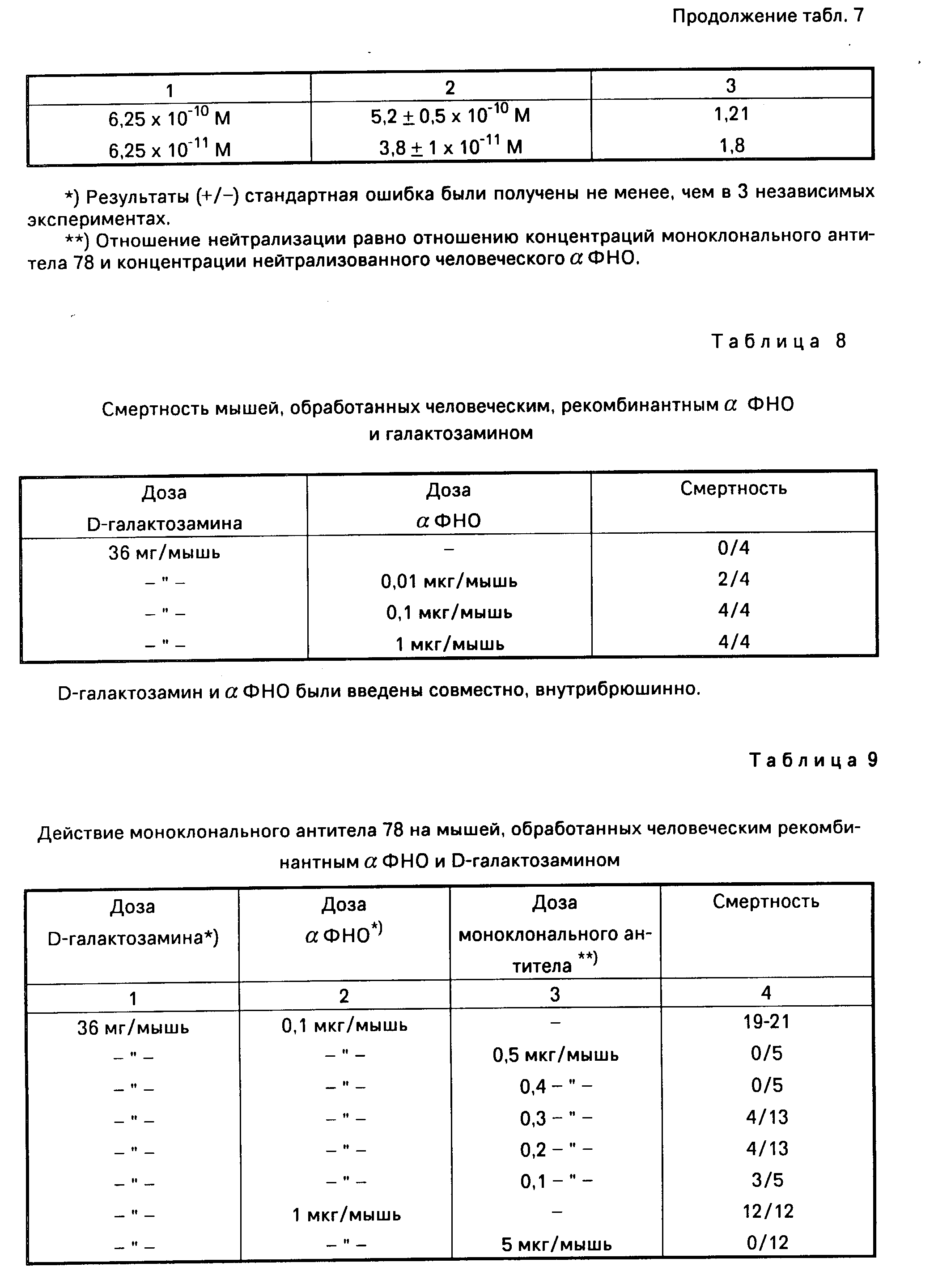
В частности, табл. 8 показывает, что добавка моноклонального антитела в количестве 0,4 мкг/мышь способна полностью защитить мышей от летального эффекта (0,1 мкг/мышь) человеческого α-ФНО, добавленного совместно с 36 мг Д-галактозамина. При использовании сверхлетальной дозы человеческого α-ФНО (1 мкг/мышь) добавка моноклонального антитела (4 мкг/мышь) полностью защищает мышей.
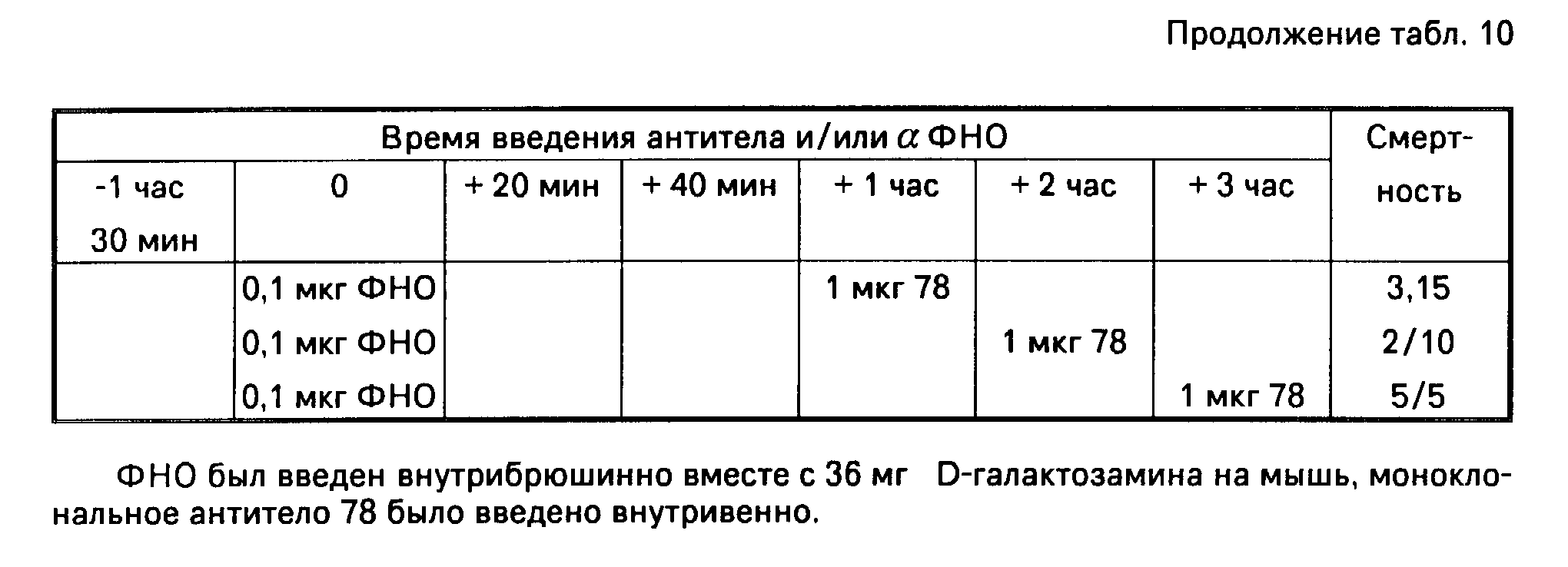
В табл. 9 показаны результаты кинетических исследований. Как можно видеть, 10 мкг/мышь моноклонального антитела способны полностью защитить мышей от летального эффекта α-ФНО (1 мкг/мышь), введенного за 1,5 часа до/или одновременно с α-ФНО. При введении через 20 минут после α-ФНО все еще наблюдается частичная защита. С другой стороны 1 мкг/мышь моноклонального антитела полностью защищает мышей, если оно вводится не позже, чем через 40 минут после α-ФНО, 0,1 мкг/мышь. Если оно вводится через 2 часа после α-ФНО, еще наблюдается частичная защита. Клетки гибридомного клона 78 были депонированы под временным ЕСАСС номером в каталоге 90110707, 7 ноября 1990 г.
Пример 2.
Характеристика гибридомной клеточной линии 78.
Родительские клетки:
а) клетки селезенки мышей BALB/c четырехкратно иммунизированные рекомбинантным человеческим α-ФНО.
б) миеломные клетки NSO (29).
Обе клеточные суспензии комбинировались в соотношении клеток селезенки к миеломным 10:1.
Связывающий агент.
Полиэтиленгликоль (ПЭГ 1500, Серва-Гейдельберг, Западная Германия) 40% w/v в среде RPMI 1640.
Слияние.
Клетки селезенки от мышей, иммунизированных α-ФНО, сливали с миеломными клетками NSO в присутствии ПЭГ в соответствии со стандартной процедурой получения моноклональных антител (см. ссылку выше).
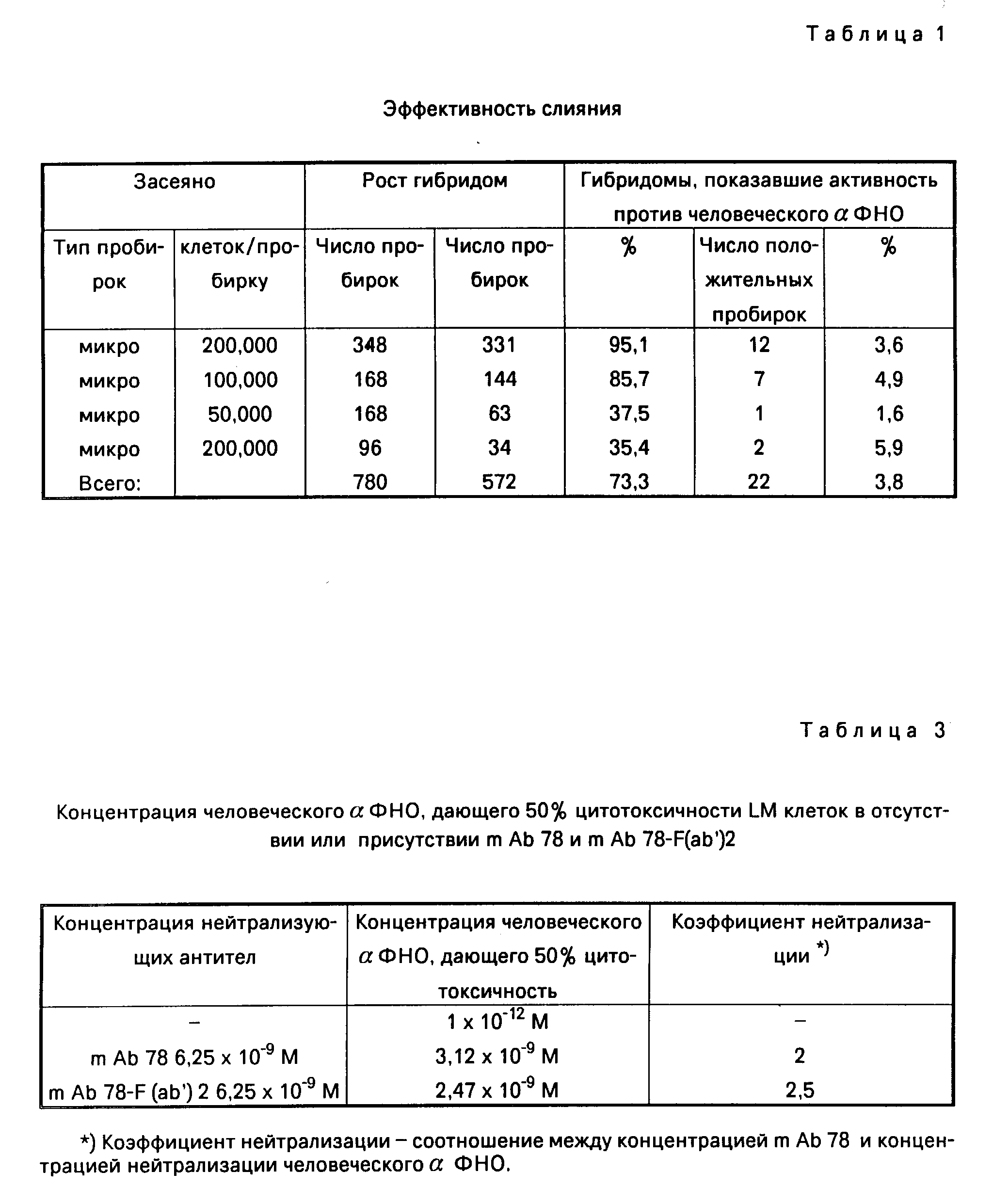
Всего было засеяно слитыми клетками 780 пробирок (684 микро + 96 макропробирок). Рост гибридом наблюдался в 572 пробирках. Мы обнаружили 22 гибридомы, обладавшие свойством специфической связывающей и нейтрализующей активности (см. Селекция гибридных клонов).
Эффективность слияния показана в табл. 1.
Селекция гибридных клонов.
Проведен скрининг растущих гибридом на продукцию моноклональных антител, специфических к человеческому α-ФНО в двух
различных пробах:
1) Первая специфическая к α-ФНО ELISA.
2) Вторая биологическая проба по нейтрализации человеческого α-ФНО "in vitro".
Отобранные с помощью этих проб анти-α-ФНО специфические антитела были тестированы на их способность нейтрализовать цитотоксическую активность человеческого α-ФНО на мышиные LM-клетки.
Клетки из пробирок, имевших супернатант с максимальной анти α-ФНО нейтрализующей активностью, были клонированы дважды методом лимитирующих разведений.
Гибридома 78, продуцирующая IgGkmAb, была выбрана из второго клонирования.
Стандартные условия клеточной культуры.
Среда
RPMI 1640 с добавлением 10% эмбриональной
телячьей сыворотки (ЭТС), 2 мМ глютамина, 1 мМ пирувата Na 1% неосновных аминокислот.
Процесс культивирования.
Гибридные клетки росли в виде суспензии в полной среде RPMI 1640 при 37oC в атмосфере 5% СО2. Оптимальная концентрация гибридом в исходной культуре составляла 100000 клеток/мл среды.
Максимальная концентрация в культуре не превышала 1 х 106 клет/мл.
Число клеток удваивалось за 24 ч так, что они разделялись каждые 2 3 дня.
Продукция антител в супернатанте составляла около 50 100 мкг/мл.
Выращивание гибридом "in vivo".
Гибридомные клетки могли расти в асцитной жидкости мышей. Мыши BALB/c 8
10-недельного
возраста обрабатывались внутрибрюшинной инъекцией 0,5 мл пристана (2,6,10,14-тетраметилпентадекан, Адрих). Спустя 7 10 сут им вводили внутрибрюшинно 1-2 х 106 гибридомных клеток. Асцитная
жидкость извлекалась через 7 10 суток после инокуляции. Концентрация антител в асцитной жидкости составляла около 2 3 мг/мл.
Метод криоконсервации.
Клетки центрифугировались и ресуспендировались до концентрации 5 10 х 106 клеток/мл в 70% среде RPMI + 20% ЭТС + 10% По 1,5 мл этой суспензии затем прицетировалось в криофлаконы и постоянно замораживалось до -80oC в полистироловом боксе по крайней мере в течение 12 ч. Криофлаконы затем переносились в жидкий азот для хранения.
Процедуры контроля контаминации микоплазмами и бактериями.
Мы использовали 3 различных пробы для определения возможной контаминации микоплазмами.
1) Инкубация меченых3H-TdR интактных клеток мышиной селезенки с супернатантом клеточных линий с последующим тестированием.
2) Прямой метод культивирования микоплазм (см. описание метода).
3) Иммуноферментный метод: "Набор для определения микоплазм".
Boehringer Mannheim (см. инструкцию).
Для определения контаминации бактериями мы использовали культуральную пробу: Antibiotic Medium N 1 Penassay (Дифко) + 10% лошадиной сыворотки. 1 мл супернатанта исследуемой клеточной линии добавляли к 5 мл этой среды и инкубировали 24 48 ч при 37oC в аэробных условиях.
Прямой метод культивирования микоплазм.
Этот метод позволяет определять следующие виды микоплазм: M. arginini, M. orale и культурабильный штамм M. hyorinins.
Материал и метод.
1. "Brain Heart Infusion agar" 0418-01 Дифко. Растворяется 5,2 г в 100 мл дистиллированной воды.
2. "Brain Heart Infusion Broth" 0037-01 Дифко. Растворяется 3,7 г в 100 мл дистиллированной воды.
3. Экстракт дрожжей 0127-01-7 Дифко. Растворяется 25 г в 100 мл дистиллированной воды.
4. Лошадиная сыворотка Wittaker Bioproducts-PBI. Инактивирована при 56oC в течение 1 ч.
5. L-аргинин 1М А3909 Сигма.
100 х раствор: 10,5 г в 50 мл 0,9% NaCl.
6. L-глутамин 200 мМ 16-004-49 Fleow.
7. Витамин (100 х раствор) 16-004-49 Fleow.
1,2,3 реагенты автоклавируются 20 мин при 120oC.
Растворы 5,6,7 фильтруются через 0,1 ммк фильтр и сохраняются при -20oC.
Приготовление агара и бульона.
Растворить 100 мл агара
PPLO в микроволновой печи и оставить охлаждаться при комнатной температуре (до тех пор, пока флаконы охладятся и агар станет жидким) и затем добавить:
10% экстракта дрожжей (15,5 мл)
20% лошадиной сыворотки (31 мл)
10 M L-аргинина (1,55 мл)
10 мМ L-глутамина (7,8 мл)
1% витамина (1,55 мл)
Разлить по 10 мл агаровой среды в диски Петри (диаметр
100 мМ), оставить его затвердеть и полностью высушить 30 мин в термостате при 37oC.
Приготовление бульона осуществляется теми же процедурами. В каждую пробирку (30 х 90 мм) разливается по 10 мл среды.
Агар и бульон должны готовиться в стерильных условиях.
Оборудование.
Оборудование поставляется РBI.
1. Поликарбонат jar тип 130.
2. Экс-генераторы, тип BR 38 (Н2 + CO2). Герметически закрыты в баллонах. После разрезания вдоль обозначенной линии наливается 10 мл дистиллированной воды. В присутствии воды находящиеся внутри вещества (соли бромгидрида Na, тартаровая кислота и сода) образуют 1800 мл Н2 и 350 мл СО2, которые необходимы для создания в емкости анаэробных условий.
3. Ана-индикаторы, тип BRSS. Герметически закрыты в баллонах. В присутствии воздуха индикатор приобретает ярко розовый оттенок. Его помещают в емкость генератора и закрывают там. Спустя несколько минут, индикатор становится белым. Это означает, что внутри генератора созданы анаэробные условия и таким образом он работает нормально. Если индикатор не приобретает белого цвета, то генератор не работает.
4. PALL-катализаторы, тип BR 42.
Будучи однократно введены в емкость генератора, катализаторы создают комнатную температуру, необходимую для реакции, описанной в п. 2.
Посев.
Собирается 1 мл клеточной культуральной среды, содержащей около 500000 клеток из хорошо растущей клеточной линии (3 7 сут) без антибиотиков. Инокулируется около 300 мкл суспензии клеток в пробирку с бульоном. Помещается около 300 мкл суспензии клеток на агар, после насечек на поверхности в месте инокуляции изучение облегчается. Бульон и агар инкубируются 7 сут. при 37oC в генераторе при анаэробных условиях или в 5% атмосфере СО2.
Первая проверка результатов осуществляется спустя 7 сут. в стереомикроскопе.
После 7, 14 и 21 сут. инкубации агаровые пластины были исследованы микроскопически на присутствие колоний. Если образцы отрицательны, 300 мкл 7-дневной бульонной культуры помещается на агар, и инкубация пластин и бульона осуществляется, как описано выше.
Вторая проверка проводится через 7 сут.
При отрицательном результате тот же процесс высева 300 мкл повторяется с 14-дневной культурой с последующей инкубацией.
Третья проверка проводится через 7 сут.
"Проверка пластин".
Пластины считаются контаминированными, если содержат одну или более колоний микоплазм. Колонии должны проявляться в своей типичной форме яйца с темной точкой в середине светлого круга.
Пример 3.
Получение фрагментов mAв 78.
F (ав')2 фрагменты mAв 78 были получены путем расщепления пепсином, пользуясь преимуществами коммерчески доступного набора (Lumunopure TMF (a)2 preparation Kif Pieree). Расщепление проводили в течение 16 ч при 37oС и постоянном перемешивании в 20 мМ ацетатного буферного раствора, рН 4.
Все другие операции, включая очистку F (ав')2 фрагментов афинной хроматографией выполняли, следуя рекомендациям производителя.
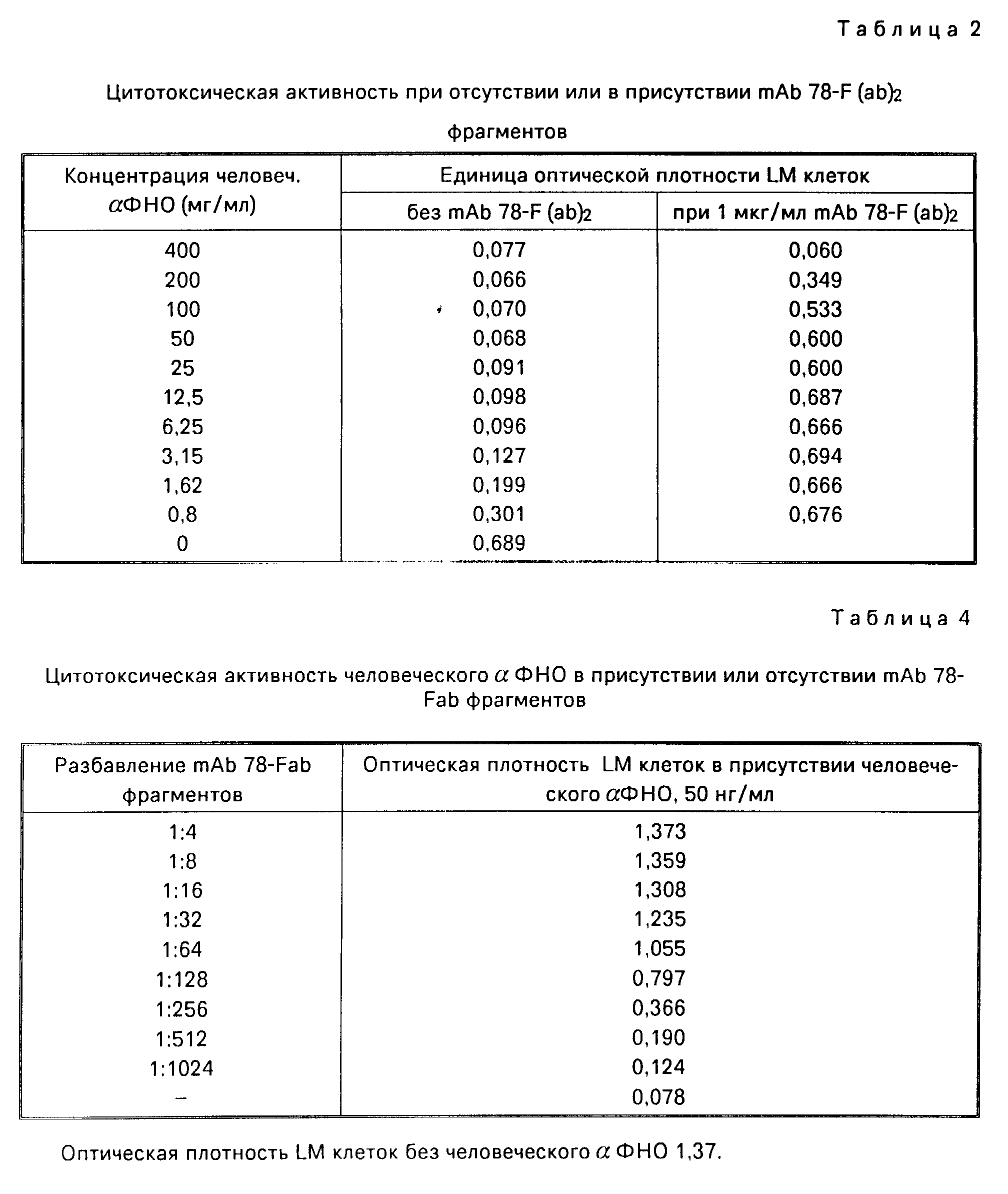
Для того, чтобы выяснить являются ли биологически активными F (ав')2 фрагменты, полученные из mAв 78, была определена концентрация человеческой α-ФНО, оказывающая 50% цитотоксическое действие на LM клетки мышей в отсутствии или при наличии 1 мг/мл mAв 78-F (ав')2 фрагментов. Как можно видеть из таблицы Б, в отсутствии указанных фрагментов человеческий α-ФНО оказызывает 50% цитоксическое действие при концентрации < 0,8 мг/мл, в то время как в присутствии mAв 78-F (ав')2 фрагментов подобный эффект был обнаружен при концентрации 200 нг/мл человеческий α-ФНО.
Результаты.
F (ав')2 фрагменты mAb78 были проанализированы в 12,5% SDS-PAGE для определения молекулярного веса и степени чистоты.
Мы обнаружили единственную полосу около 105000 дальтон, которая была способна связывать человеческий125I-α-ФНО после блоттинга на нитроцеллюлозе. Биологическая активность F (ав')2 была определена с помощью пробы нейтрализации человеческого α-ФНО "in vitro" (cм. стр. 46 48).
Таблица 3 показывает нейтрализующую активность фиксированной дозы mAb 78 и mAb 78-F (ав')2 с возрастающими дозами человеческого α-ФНО на LM-клетки.
Как свидетельствуют результаты, один человеческий α-ФНО проявляет 50% цитотоксичность в концентрации 1 х 10-12 M. В присутствии 6,25 х 10-9 М mAb 78 50% цитотоксичность проявляется при концентрации α-ФНО 3,12 х 10-9 М, тогда как в присутствии 6,25 х 10-9 М mAb78 F (ав')2 для 50% цитотоксичности требовалась концентрация α-ФНО 2,47 х 10-9 М.
Получение Fab фрагментов mAb 78.
Fab фрагменты mAb 78 были получены при использовании преимуществ коммерчески доступного твердофазного связанного папаина (Pieree). Обработку проводили в течение 16 ч при 37oC и постоянном перемешивании в 20 мМ фосфатного буферного раствора, 10 мМ ЕДТА, 20 мМ Д-L Cysteine HCl рН 7. Для того, чтобы выяснить, являются ли биологически активными Fab фрагменты, полученные из mAb 78, было определено, способны ли mAb 78 Fab фрагменты нейтрализовать цитотоксическую активность человеческого α-ФНО по отношению к LM клеткам мышей. В таблице 4 показано, что это на самом деле имеет место. Как можно видеть, mAb-78-Fab фрагменты предохраняют клетки от цитотоксической активности человеческого α -ФHO.
Получение Faв' фрагментов mAв 78.
Faв' фрагменты были получены с использованием имеющего преимущества коммерчески доступного твердо-фазного связанного фицина (набор препаратов иммуноочищенных IgG1Faв' и F (ав')2 Нидерланды).
Стандартный протокол переваривания.
Состав набора:
Иммобилизованный фицин, 2 мл
заполненная колонка, активность геля ≃ 1,2 мг/мл в сравнении со свободным ферментом.
Цистеин HCl
Иммобилизованный белок А, 2,5 мл заполненная колонка.
Емкость ; 6 8 мг мышиных IgG/мл геля.
Иммуноочищенный переваривающий буфер (10х).
Иммуноочищенный связывающий буфер.
Иммуноочищенный мягко элюированный буфер IgG1.
Приготовленный для хранения буфер с иммобилизованным фицином.
Метод.
0,5 мл mAв78 (4 мг/мл) были добавлены к 0,5 мл иммуноочищенного буфера IgG мягкого элюирования.
Для приготовления стандартного переваривающего буфера 40 мг цистеина - HCl были добавлены к 2 мл иммуноочищенного переваривающего IgG буфера. Для приготовления работающего переваривающего буфера 1,5 мл стандартного переваривающего буфера были смешаны с 15 мл иммуноочищенного буфера IgG мягкого элюирования.
Колонка с иммобилизованным фицином была уравновешена с 15 мл работающего переваривающего буфера. 100 мкл стандартного переваривающего буфера были добавлены к 1 мл приготовленного ранее раствора mAb78.
Образец был помещен в колонку с иммобилизованным фицином и пропущен внутрь геля до его основания, после чего было добавлено 200 мкл работающего переваривающего буфера. Нижняя и верхняя части колонки были последовательно перемещены и колонка была инкубирована 21 ч при 37oC.
По окончании времени инкубации переваренные mAb 78 были элюированы с 4 мл связывающего буфера. Элюент содержал F (ав'), Fc-фрагменты и непереваренные IgG F (ав') фрагменты были очищены на колонке, содержащей иммуноочищенный белок А, следующим образом: белок А был уравновешен с 12 мл иммуноочищенного связывающего буфера, 4 мл переваренных mAb 78 были применены, собран 1 мл фракций. F (ав')-фрагменты содержались в свободном объеме (flow through), поскольку белок А способен связывать непереваренные IgG и Fc-фрагменты.
Результаты.
После очистки, проверки и определения молекулярного веса mAb 78-F(ab')-фрагменты были проанализированы с помощью нередуцированной 12% SDS-PAGE. Мы обнаружили единственную полость 50000 дальтон, способную связывать человеческий125I-α-ФНО после блоттинга на нитроцеллюлозе.
Биологическая активность F(ab') была определена с помощью пробы нейтрализации человеческого α-ФНО "in vitro".
Таблица 5 показывает нейтрализующую активность фиксированной дозы mAb 78 и mAb 78-F(ab') с возрастающими дозами человеческого α-ФНО на LM клетки. Как свидетельствуют результаты, один человеческий α-ФНО проявляет 50% цитотоксичность в концентрации 0,8 х 10-12М.
В присутствии 6,25 х 10-9 М mAb 78 50% цитотоксичность проявляется при концентрации α-ФНО 2,8 х 10-9 М, тогда как в присутствии 6,25 х 10-9 М mAb 78-Fab' для 50% цитотоксичности требовалась концентрация α-ФHO 0,34 х 10-9 М.
Предпочтительные моноклональные антитела по настоящему изобретению принадлежат к классу MIg. Особенно предпочтительными моноклональными антителами по настоящему изобретению являются те, что продуцируются гибридомным клоном 78, описанным здесь, который принадлежит к κ изотипу IgG1.
Пример 4.
Анализ свойств полученных моноклональных антител и их фрагментов (методы).
Характеристика свойств полученных моноклональных антител уже была описана в примере один. Однако в этом разделе более подробно раскрыты методы, используемые при этом анализе.
1. ELISA определения специфических антител a-ФНО. Плоскодонные микротитрованные пластины (Ф. Фалкон N 3912) покрывают при 100 мкл/пробирка человеческим α-ФНО (1 мкг/мл), разбавленным в 0,1 моль/л бикарбонатного буфера, рН 9,6. После выдерживания при 4oC в течение ночи остаток α-ФНО сливают и в каждую пробирку добавляют ФБР с добавкой 1% альбумина бычьей сыворотки (АБС, ф. Армоур, Канкаки, шт. Иллинойс).
Эти пластины дополнительно выдерживают в течение 3 часов при комнатной температуре. После этого пластины промывают буфером, который представляет собой ФБР с добавками 0,1% Твина 20 (ф. Мерк, Шухардт, Хозенбрунн, Германия) и 0,01% мертиолата (Би-Ди-Эйч, Пулл, Великобритания). Всплывшие клетки гибридомы, 50 мкл, разбавленные 1:5 в ФБР c добавкой 1% АБС, добавляют в каждую пробирку. Пластину выдерживают 60 минут при 37oC и промывают, как указано выше. Затем в каждую пробирку добавляют 100 мкл пероксидаз-конъюгированный козлиный антимышиный иммуноглобулин G (HRPaIgG, ф. Биорад, Ричмонд, шт. Калифорния), разбавленный 1:3000 в промывочном буфере, пластины выдерживают 45 минут при 37oC и промывают, как указано выше. Затем в каждую пробирку добавляют 100 мкл пероксидазного субстрата (ОРД2, Хемикон, SCI, Рим, Италия, 1 таблетка, растворенная в 5 мл цитратного буфера, ОРД4, Хемикон). Дают 2 минуты при комнатной температуре на протекание реакции, после чего прекращают реакцию посредством добавления 100 мкл 4 молярной серной кислоты в пробирку. Интенсивность окрашивания считывается с пластины ELISA при 492 нм. Всплывшие клетки, имеющие оптическую плотность (ОД) более 0,5, считаются удовлетворительными для наличия антител анти-α-ФНО..
2. Конкурентный метод ELISA для проверки специфичности антител, специфичных к человеческому α-ФНО.
100 нг/мл гибридомных всплывших клеток выдерживают совместно с различными концентрациями человеческого α-ФНО, или с различными концентрациями неродственных антигенов, или с одним разбавителем (ФБР с добавкой 1% АБС) в течение 2 часов при 37oC. В конце периода инкубации измеряют связывание остаточного α-ФНО, в предварительно описанном методе ELSA который позволяет детектировать специфические антитела человеческого α-ФНО.
3. ЕLISA для количественного определения мышиных IgG-антител.
Плоскодонные микротитрованные пластины покрывают при 100 мкл/пробирка козлиным анти-мышиным Иг (ф. Органом Текника, г. Турнхоут, Бельгия, окончательная концентрация 1 мкг/в пробирке), разбавленным в 40 ммоль/л фосфатного буфера (рН 7,4). После выдерживания в течение ночи при 4oC непоглощенные антитела выливают и в каждую пробирку добавляют ФБР с добавкой 1% АБС, чтобы насытить незанятые центры пластика.
Эти пластины дополнительно выдерживают 3 часа при комнатной температуре и после этого промывают 3 раза буфером для промывки. В течение этого периода инкубации проводят последовательные двухкратные разбавления стандартных препаратов мышиного игГ (ф. Пел-Фрииц, Роджера, шт. Арканзас), обычно от 5 до 0,25 мкг ИгГ/мл. Параллельно проводятся последовательные двухкратные разбавления всплывших клеток, содержащих неизвестное количество ИгГ, обычно от 1:100 до 1:12800. Все разбавления осуществляются в ФБР с добавкой 1% АБС. В пробирку добавляют 50 мкл каждого разбавления, пластины выдерживают 60 минут при 37oC и затем промывают, как указано выше. Добавление пероксидазного субстрата и определение цвета проводили, как указано в (1).
Концентрации IgG во всплывших клетках, содержащих неизвестное количество IgG, рассчитывают, обрабатывая данные по программе ELISA 50FT для персонального компьютера (ф. Перкин-Элмер, Норуолк, Коннектикут).
4. ЕLISA для типирования тяжелых и легких цепочек моноклональных антител.
Для этой цели использовался набор Гибридома Суб Изотипинг (фг. Калбиохем, Ла Джолла, Калифорния), в соответствии с инструкциями изготовителя. Типирование осуществлялось на супернатантах гибридомы, разбавленных 1:5 в ФБР с добавкой 1% АБС. Пробирки, для которых значения оптической плотности были больше 0,4, считались удовлетворительными для наличия моноклонального антитела заданного Иг класса, подкласса и легкой цепочки.
5. Определение нейтрализующей активности вне организма анти-α-ФНО моноклональных антител и их F (ав')2 и Faв фрагментов.
В день 0 логарифмически растущие мышиные клетки LM (30) трипсинизуют, центрифугируют и повторно суспендируют при окончательной концентрации 3 х 105 клеток/мл минимальной существенной среды Игла с добавкой 5% ПСТ и 1% глутамина (полный МЕМ).
Добавляют 100 мкл этой суспензии в пробирки плоскодонной микротитрованной пластины (фалкон 3072). Затем проводят разбавление человеческим α-ФНО или β-ФНО (Омниа Рес, Циниселло Бальзамо, Италия) в полном МЕМ с тем, чтобы иметь окончательные концентрации, после добавления в пробирки от 1 мкл/мл до 25 пиког/мл.
Жидкости над осадком или растворы, содержащие антитела, разбавляют в полном МЕМ с тем, чтобы получить окончательную концентрацию, после добавления в пробирки, равную 1 мкг/мл, 100 нг/мл или 10 нг/мл моноклонального антитела.
Для F (ав')2 фрагментов конечная концентрация составляет 0,666 мкг/мл. Для фрагментов Fab конечная концентрация 0,333 мкг/мл.
50 мкл каждого разбавления α-ФНО и β-ФНО совместно выдерживают с 50 мкл моноклонального антитела или с 50 мкл полного МЕМ в течение 2 часов при 37oC. В течение этого инкубационного периода составляют раствор, содержащий актиномицин Д (Флюка) в полном МЕМ. Окончательная концентрация актиномицина Д после добавления в пробирки составляет 1 мкг/мл. В конце инкубационного периода каждую смесь антитело-α-ФНО или антитело β-ФНО и 50 мкл актиномицина Д добавляют в пробирки микротитрованной пластины. В некоторые пробирки добавляют 100 мкл каждого разбавления, содержащего только α-ФНО или β-ФНО. В некоторые контрольные пробирки добавляют только актиномицин Д плюс полный МЕМ. После этого пластины выдерживают 24 часа при 37oC.
В конце этого инкубационного периода в каждую пробирку добавляют 20 мкл раствора тиозолинового голубого (МТТ, Калбиохем, 5 мг/мл в ФБР). Пластины дополнительно выдерживают 4 часа при 37oC. Затем жидкость над осадком сливают, и в каждую пробирку добавляют 200 мкл диметилсульфоксида (ф. Фармиталия, Карло Эрба), и определяют степень окрашивания с помощью пластинчатого счетчика ELISA при 570 нм.
Полученные величины оптической плотности для каждой смеси антитело-α-ФНО или антитело-β -ФНО сопоставляют с полученными для одного α-ФНО или β-ФНО. Дозы α-ФНО или β-ФНО, дающие в отсутствие или в присутствии моноклонального антитела величины для контрольных пробирок (50% цитотоксичности), были определены. Моноклональные антитела с наивысшей нейтрализующей активностью были определены как те, для которых найдено наибольшее увеличение дозы α-ФНО, необходимое для получения 50%-ной цитотоксичности.
6. Определение сродства анти-α-ФНО моноклональных антител и их F (ав')2-фрагментов.
Для того, чтобы определить сродство анти-α-ФНО моноклональных антител и их F (ав')2-фрагментов был проведен следующий эксперимент. 1 нг/мл (6,25 х 10-12 моль/л) указанного моноклонального антитела или одного разбавителя (ФБР с добавкой 0,5% АБС) выдерживают с различными концентрациями иодированного человеческого α-ФНО (NEN Уилмингтон, ДЕ, обычно концентрации изменялись от 0,5 х 10-11 моль/л до 4 х 10-10 моль/л) в пробирках Эппендорфа в течение 4 часов при комнатной температуре. В конце инкубационного периода в каждую пробирку, содержащую анти-α-ФНО моноклональные антитела, добавляют разбавленные 1: 5 иммуношарики (170 5104, Био-Рад, Сеграт, Италия) и пробирки дополнительно выдерживают 1 час. Для F (ав')2 -фрагментов разбавленный 1:10 белок G сефароза 4 быстрого потока (фармация) добавляют в продукт и инкубируют в течение часа на качалках с вращением. Затем смеси центрифугируют в смеси масел фталат/дибутилфталат (1:1,5 по объему), ф. Флюка Эй-Джи. Связанная иммуношариками радиоактивность считывается в гамме-счетчике. Полученные таким образом данные обрабатываются с помощью программы анализа данных равновесного связывания (ЕВДА, Эльзевир Сайенс Паблишерз, Амстердам, Нидерланды).
7. Определение константы скорости диссоциации человеческого α-ФНО, связанного с моноклональным антителом анти-α-ФНО.
2 нг/мл (1,25 х 10-11 моль/л) моноклонального антитела, продуцированного гибридой 78 или один буфер (ФБР + 0,5% АБС) выдерживают
с 2,5 кг/мл (5 х 10-11 моль/л) иодированного человеческого α-ФНО в течение 4 часов при комнатной температуре. После этого добавляют разбавленные 1:5 иммуношарики в течение 1 часа, и
затем смеси дважды центрифугируют. Образовавшиеся таблетки повторно суспендируют в 250 нг/мл (5 х 10-9 моль/л) "холодного" человеческого α-ФНО, для того, чтобы конкурировать за
повторное связывание с любым иодированным человеческим α-ФНО, который продиссоциировал. Спустя различные времена выдерживания (смотри рис. 5) при комнатной температуре, лепешки центрифугируют
сквозь масляную смесь, описанную в п. 6. Затем определяют остаточный иодированный человеческий α-ФНО, специфически связанный с моноклональным антителом, и результаты представляют в виде графика
"процент связанной радиоактивности против логарифма времени". Из этого графика определяется время 50% диссоциации (Т 1/2), которое используется для расчета величины к-1:
к-1 0,693 /Т (1/2).
8. Двойная иммунодиффузия Оухтерлони в агаре.
Для того, чтобы понять, осаждает ли моноклональное антитело, продуцированное гибридомой 78, человеческий α-ФНО, проводится анализ двойной диффузии. С этой целью используется 1%-ный гель агарозы в 0,9% раствора хлорида натрия. Образцы (человеческий α-ФНО и моноклональное антитело) помещаются в круглые лунки. Конфигурациям дают развиваться в течение минимум 24 часов при 4oC и затем их фотографируют.
9. Определение профилей исключения размера ЖХБД смесей человеческого α-ФНО и моноклонального антитела анти-α-ФНО.
Для этой цели смеси человеческого α-ФНО или иодированного человеческого α-ФНО и очищенного моноклонального антитела анти-α-ФНО в избытке человеческого α-ФНО составляются (например, 100 мкг/мл человеческого α-ФНО и 30 мкг/мл моноклонального антитела, или 5 нг/мл иодированного человеческого α-ФНО и 2 нг/мл моноклонального антитела) в ФБР (для смесей 100 мкг/мл человеческого α-ФНО и 30 мкг/мл моноклонального антитела) или в ФБР + 0,5 АБС (для смесей 5 мгк/мл иодированного человеческого α-ФНО и 2 нг/мл моноклонального антитела). Смесям дают выдерживаться в течение 4 часов при комнатной температуре. После этого смеси, один α-ФНО или одно моноклональное антитело подвергают хроматографированию на колонке 10 х 300 мм с фазой Супероуз 6 FPL C (ф. Фармация Эль-Кей-Би Биотехнология, г. Уппсала, Швеция), чтобы проявить профили поглощения A280.
Колонку предварительно доводят до равновесия и элюируют раствором 50 ммоль/л фосфата натрия, 150 ммоль/л хлорида натрия, буфером с рН 7,2. Стандартами молекулярного веса обычно были синий декстран (МВ 2 млн.), человеческий IgM (МВ 0,9 млн.), бычий тироглобулин (МВ 0,67 млн.), бычий IgG (МВ 0,158 млн.), куриный белок (МВ 44000), лошадиный миоглобин (МВ 17000), витамин В12 (МВ 1350).
10. Определение нейтрализующей активности в организме моноклональных антител анти-α-ФНО..
Для того, чтобы оценить нейтрализующую активность в живом организме моноклональных антител анти-α-ФНО составляется модельная система для летального шока в мышах, индуцированного человеческим α-ФНО. С этой целью мышам вводили внутрибрюшинную инъекцию различных доз человеческого α-ФНО (типично 0,1 мкг или 1 мкг/мышь, разбавлен в 0,25 мл ФБР) и Д-галактозамина (типично 36 мг/мышь, разбавлен в 0,25 мл ФБР). Мыши, которым вводились летальные дозы человеческого α-ФНО, умирали в интервале 24 48 часов.
Нейтрализующую активность в организме моноклонального антитела анти-α -ФНО оценивали, вводя мышам внутривенно различные дозы моноклонального антитела (разбавлены в 0,25 мл ФБР) и спустя 90 минут внутрибрюшинно с летальной дозой человеческого α-ФНО..
В другом ряде опытов оценивалась нейтрализующая активность в организме моноклонального антитела анти-α-ФНО во времени. С этой целью моноклональное антитело вводится в различные времена до и после введения летальной дозы человеческого α-ФНО..
Литература
1. Nature, 1984, v. 312, p. 724.
2. Nature, 1989, v. 338, p. 225.
3. Nature, 1984, v. 312, p. 721.
4. Nature, 1986, v. 320, p. 584.
5. Cell, 1987, v. 50, p. 555.
6. Proc. Natl. Acad. Sci. USA, 1989, v. 86, p. 2365.
7. J. Exp. Med. 1987, c. 166, p. 1280.
8. Science, 1987, v. 237, p. 1210.
9. Lancet ii, 244, 1989.
10. Nature, 1975, v. 256, p. 496.
11. M.R. Clark, C. Milstein, Somatic cell Genet, 1981, v. 7, p. 657.
12. Cell, 1990, v. 61, p. 361.
13. Science, 1990, v. 248, p. 1019.
14. J. Biol. Chem. 1989, v. 264, p. 11966.
15. J. Biol. Chem. 1990, v. 265, p. 1531.
16. Д.С. Лингикума и Н.Р. Фарида. Антиидиотипы, рецепторы и молекулярная мимикрия. Из-во "Шпрингер-Ферлаг, Гейдельберг. 1988.
17. J. Exp. Med. 1990, v. 171, p. 629.
18. Nature, 1989, v. 331, p. 456.
19. Релингтоновские фармацевтические науки, 16-ое изд. ред. Мак, 1980.
20. J. Immunol. 1972, v. 109, p. 1300.
21. J. Immunol. 1989, v. 19, p. 1887.
22. J. Chromat. 1988, v. 443, p. 205.
23. Biochemistry. 1977, v. 16, p. 628.
24. Biochemistry, 1991, v. 30, p. 5357.
25. Biochemistry, 1991, v. 30, p. 2348.
26. Immunochemistru 1978, v. 15, p. 307.
27. Biochem. 1989, v. 187, p. 1.
28. J. Infect Diseases, 1990, т. 161, p. 79.
29. G. Gabfere and Milstein "Methods in Enzimology" 73 1, 1981.
30. Ex. Med. 1985, v. 162, p. 1099.
Реферат
Использование: биотехнология, иммунологическое определение альфа-фактора некроза опухолей (α-ФНО) человека в биологических жидкостях организма. Сущность: получение моноклонального антитела (МКА), взаимодействующего с α-ФНО человека, его фрагментов и штамма гибридных клеток, продуцирующего указанное антитело. Штамм получают при слиянии спленоцитов мышей, иммунизированных α-ФНО человека, с клетками миеломы NSO. Продуцируемое этим штаммом МКА, а также его фрагменты с высоким сродством взаимодействуют с α-ФНО человека и нейтрализуют его действие в условиях in vitro. 5 с. п. ф-лы, 6 ил., 10 табл.
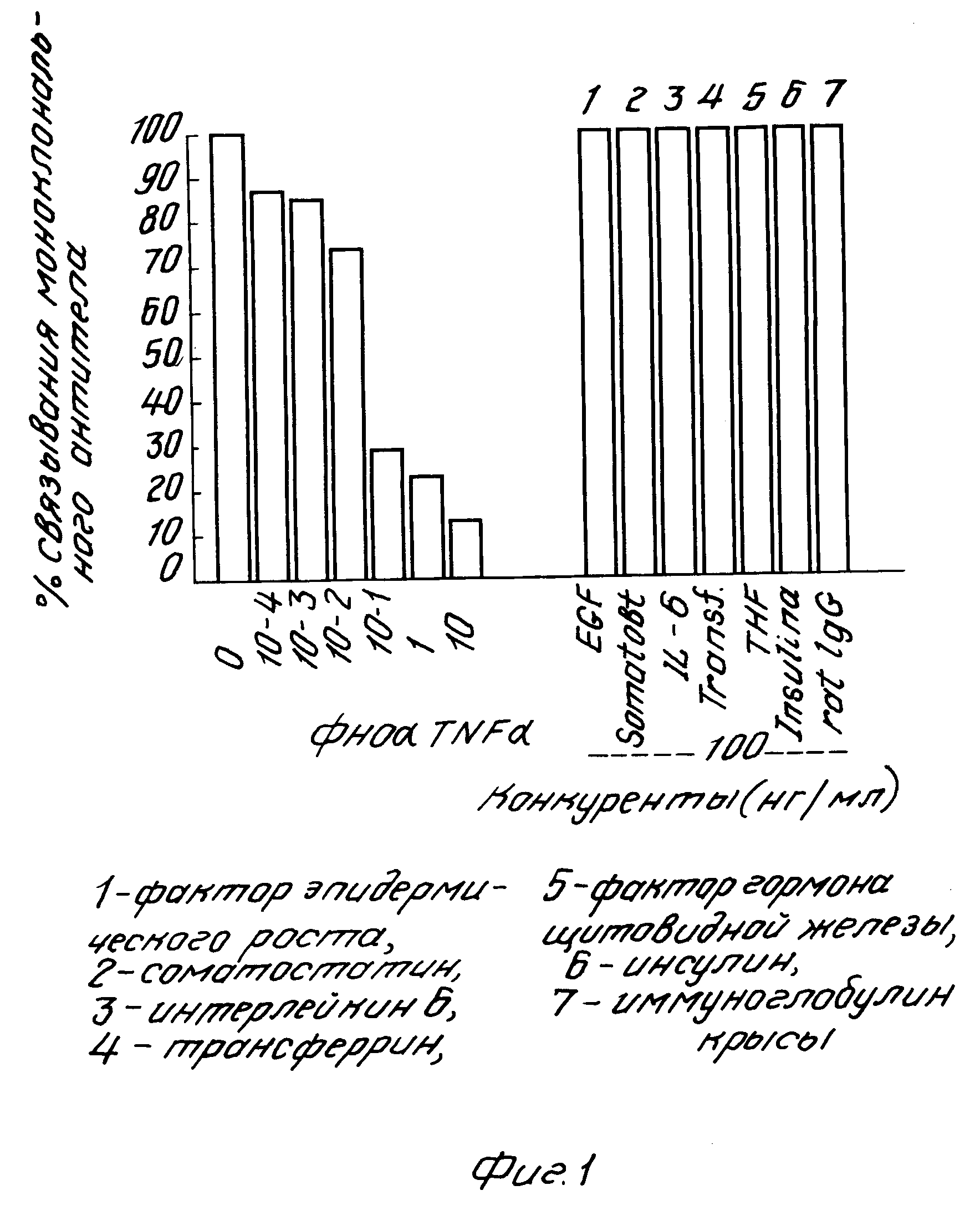

Комментарии