Снижение уровня лактата и увеличение продукции полипептида путем ингибирования экспрессии лактатдегидрогеназы и киназы пируватдегидрогеназы - RU2614125C2
Код документа: RU2614125C2
Чертежи














Описание
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет для предварительной патентной заявки № 61/349727, поданной 28 мая 2010, содержание которой приводится, таким образом, в настоящем документе в качестве ссылки в полном объеме.
Область техники, к которой относится изобретение
Область техники настоящего изобретения относится в целом к способам и композициям для снижения продукции лактата и повышения продукции полипептида в культивируемых клетках.
Уровень техники
Биофармацевтический рынок быстро растет, и предполагается, что данная отрасль производства к 2010 году достигнет 70 биллионов долларов США. См. руководство Genetic Engineering in Livestock: New Applications and Interdisciplinary Perspectives (Engelhard et al., 2009) Springer Berlin Heidelberg. Принимая во внимание повышение спроса на терапевтические белки и повышение конкуренции при разделе рынка среди компаний, существует необходимость улучшения технологий для достижения лучшей выработки терапевтических белков. Для достижения этой цели были рассмотрены различные подходы, такие как создание клеток-хозяев. См. статьи Kuystermans et al., Cytotechnology 53(1-3):3-22 (2007) и O’Callaghan and James, Brief Funct. Genomic Proteomic 7(2):95-110 (2008). Культивируемые клетки, такие как клетки яичника китайского хомячка (СНО), широко используются для продукции терапевтических белков. Например, для продукции рекомбинантных моноклональных антител широко использовали культивирование в рН-контролируемом биореакторе с подпиткой. Langheinrich and Nienow, Biotechnol. Bioeng. 66(3):171-9 (1999). Лактат представляет собой один из основных накапливаемых в процессе культивирования с подпиткой ненужных продуктов, и, как было показано, он ингибирует рост клеток и продукцию белка. См. статьи Glacken et al., Biotechnol. Bioeng. 32:491-506 (1988); и Lao and Toth, Biotechnol. Prog. 13:688-691 (1997). Это, в свою очередь, приводит к увеличению количества щелочи, которую необходимо добавить в культуральную среду для регуляции величины рН. Dietl et al., J. Immunol. 184(3):1200-9 (2010); Langheinrich and Nienow, Biotechnol. Bioeng, 66(3):171-9 (1999). Увеличенное добавление щелочи к среде культивирования клеток для поддержания величины рН может привести к повышению осмолярности, и это повышение может приводить к ингибированию роста клеток и снижению выработки антител. Cruz et al., Enzyme Microb. Technol. 27(1-2):43-52 (2000); Iran et al., Biotechnol. Bioeng, 66:238-246 (1999). Поэтому при разработке полипептида или способа продукции антитела в более высоком титре желательно снижение уровня лактата.
Существует большое число факторов, которые могут влиять на продукцию лактата в культуре клеток, таких как регуляция уровня пирувата. См. статьи Liu et al., J. Biol. Chem., 284(5):2811-22 (2009); и Samuvel et al., J. of Immunol. 182(4):2476-84 (2009). Пируват представляет собой субстрат для ферментов пируватдегидрогеназы (PDH) и лактатдегидрогеназы (LDH).
Комплекс PDH представляет собой мультиферментную единицу, состоящую из трех каталитических ферментов Е1, Е2 и Е3. Patel and Korotchkina, Exp. Mol. Med. 33(4):191-7 (2001). Этот комплекс катализирует реакцию лимитируемого скоростью превращения пирувата в ацетил-КоА, которое представляет собой начальную точку цикла трикарбоновых кислот (ТСА). Активность PDH регулируется ферментами-киназами пируватдегидрогеназы (PDHK) и фосфатазами пируватдегидрогеназы (PDHP). Киназы PDHK фосфорилируют PDH, супрессируя его ферментативную активность, тогда как PDHP дефосфорилируют и, таким образом, активируют PDH. См. статьи Patel and Korotchkina, Exp. Mol. Med. 33(4):191-7 (2001); Roche and Hiromasa, Cell Mol. Life Sci. 64(7-8):830-49 (2007); Holness and Sugden, Biochemical Society Transactions, 31:1143-1151 (2003). В клетках млекопитающих существует четыре изотипа PDHK (PDHK1, PDHK2, PDHK3 и PDHK4) с тканеспецифическим распределением. См. статьи Harris et al., Adv. Enzyme Regul. 42:249-59 (2002); и Bowker-Kinley et al., Biochem. J. 329(1):191-6 (1998).
LDH непосредственно катализирует взаимное превращение пирувата и лактата с одновременным взаимным превращением NADH и NAD+. В клетках млекопитающих LDH существуют в виде либо гомо-, либо гетеротетрамеров, состоящих главным образом из субъединиц А и В (или субъединиц Н и М, соответственно), кодируемых генами LDHa и LDHb, и иногда гомотетрамеров субъединицы С, кодируемой генами LDHc. См. статьи Baumgart et al., J. Biol. Chem. 271(7):3846-55 (1996); Li et al., J. Biol. Chem. 258(11):7029-32 (1983); Skory C.D., Appl. Environ. Microbiol. 66(6):2343-8 (2000); и Read et al., Proteins 43(2):175-185 (2001). Например, в клетках СНО было показано, что изотипы LDH представляют собой промежуточные продукты тетрамера А3В и А2В2. Jeong et al., Biochem. Biophys. Res. Commun. 289(5):1141-9 (2001). Ранее проведенные исследования показали, что снижение LDHa в клетках СНО путем разрушения гена посредством гомологичной рекомбинации (Chen et al., Biotechnol. Bioeng. 72(1):55-61 (2001)), антисмысловой технологии (Jeong et al., Biochem. Biophys. Res. Commun. 289(5):1141-9 (2001)), или малой, или короткой интерферирующей РНК (siRNA) (Kim and Lee, Appl. Microbiol. Biotechnol. 74(1):152-9 (2007)) может снижать уровень лактата, но не достигли существенного улучшения в выработке белка. Например, в случае для siRNA, специфичной для LDHa, по имеющимся данным даже при 45-79% снижении уровня лактата не наблюдалось существенного улучшения специфической выработки (Qp) и титра продукта (антитела), это указывает на то, что в клетках СНО нокдаун одной LDHa недостаточен для улучшения Qp и эффективного выхода продукта. Таким образом, для достижения лучшей продукции терапевтического полипептида требуются более эффективные способы снижения продукции лактата.
Все публикации, патенты и патентные заявки, процитированные в настоящем документе, приводятся, таким образом, в настоящем документе в качестве ссылки в полном объеме для всех целей в той же мере, как если бы конкретно и отдельно указывалось, что каждая отдельная публикация, патент и патентная заявка указанным способом приводятся в качестве ссылки.
Краткая сущность изобретения
Настоящее изобретение относится к способам и композициям для снижения в культивируемых клетках продукции лактата и повышения продукции полипептида. Авторы изобретения обнаружили, что в культивируемых клетках, экспрессирующих полипептиды (например, антитела), одновременное снижение LDH и PDHK посредством siRNA понизило уровень лактата, скорость продукции лактата и осмолярность и повысило специфическую выработку полипептида (например, специфическую выработку) и продукцию полипептида (например, выработку). Кроме того, у этих культивируемых клеток со сниженными LDH и PDHK не наблюдалось негативного влияния на рост клеток, жизнеспособность клеток и качество полученных полипептидов.
В одном из аспектов изобретение относится к способу снижения в культивируемых клетках продукции лактата, причем способ содержит культивирование клеток, экспрессирующих а) малую интерферирующую РНК (siRNA), специфичную для лактатдегидрогеназы (LDH), и b) siRNA, специфичную для киназы пируватдегидрогеназы (PDHK).
В другом аспекте изобретение относится к клеткам в культуре, содержащим а) siRNA, специфичную для LDH, и siRNA, специфичную для PDHK.
В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для второй PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для третьей PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для четвертой PDHK.
В другом аспекте изобретение относится к способу снижения в культивируемых клетках продукции лактата, причем способ содержит культивирование клеток, содержащих последовательность первой гетерологичной нуклеиновой кислоты, кодирующую малую интерферирующую РНК (siRNA), специфичную для лактатдегидрогеназы (LDH), и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для киназы пируватдегидрогеназы (PDHK), где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В другом аспекте изобретение относится к клеткам в культуре, содержащим последовательность первой гетерологичной нуклеиновой кислоты, кодирующую первую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую вторую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В некоторых вариантах осуществления клетки дополнительно содержат последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для второй PDHK, причем последовательность третьей гетерологичной нуклеиновой кислоты функционально связана с третьим промотором. В некоторых вариантах осуществления клетки дополнительно содержат последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для третьей PDHK, причем последовательность четвертой гетерологичной нуклеиновой кислоты функционально связана с четвертым промотором. В некоторых вариантах осуществления клетки дополнительно содержат последовательность пятой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для пятой PDHK, причем последовательность пятой гетерологичной нуклеиновой кислоты функционально связана с пятым промотором.
В некоторых вариантах осуществления LDH представляет собой LDHa, LDHb или LDHc.
В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1 и PDHK2. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1 и PDHK3. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK2 и PDHK3.
В некоторых вариантах осуществления способ снижения продукции лактата в культивируемых клетках содержит культивирование клеток, содержащих последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для лактатдегидрогеназы (LDH), и последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот, кодирующие три различные siRNA, специфичны для первой, второй и третьей PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связаны со вторым, третьим и четвертым промоторами, соответственно. В некоторых вариантах осуществления LDH представляет собой LDHa, в этих вариантах осуществления первая PDHK представляет собой PDHK1, вторая PDHK представляет собой PDHK2 и третья PDHK представляет собой PDHK3.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую первую siRNA, специфичную для LDH, и последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот, кодирующие три различные siRNA, специфичные для первой, второй и третьей PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и где последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связаны со вторым, третьим и четвертым промоторами, соответственно. В некоторых вариантах осуществления LDH представляет собой LDHa, в этих вариантах осуществления первая PDHK представляет собой PDHK1, вторая PDHK представляет собой PDHK2 и третья PDHK представляет собой PDHK3.
В некоторых вариантах осуществления культивируемые клетки продуцируют гетерологичный полипептид. В некоторых вариантах осуществления гетерологичный полипептид представляет собой антитело.
В некоторых вариантах осуществления скорость синтеза лактата культивируемых клеток ниже, чем скорость потребления лактата. В некоторых вариантах осуществления средняя скорость продукции лактата меньше, чем около 0,02 мг/106 клеток/день со знаком минус.
В некоторых вариантах осуществления культивируемые клетки, содержащие siRNA, специфичные для LDH и PDHK, обладают осмолярностью меньше, чем около 300 мОсм.
В некоторых вариантах осуществления культивируемые клетки обладают специфической выработкой (Qp) по меньшей мере на около 75% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH.
В некоторых вариантах осуществления культивируемые клетки обладают специфической выработкой (Qp) по меньшей мере на около 75% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для LDH и PDHK.
В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида (например, выработкой антитела или титром в г/л) на от около 10% до около 800% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около 55% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида по меньшей мере на около 68% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH.
В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на от около 10% до около 800% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около 55% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида по меньшей мере на около 68% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH.
В некоторых вариантах осуществления культивируемые клетки представляют собой клетки млекопитающих. В некоторых вариантах осуществления культивируемые клетки представляют собой клетки, отличные от клеток млекопитающих.
В другом аспекте изобретение относится к способу сайленсинга или снижения транскрипции LDH и PDHK в культивируемых клетках, содержащему: введение в клетку вектора, содержащего последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором, причем siRNA экспрессируются, что приводит к сайленсингу или снижению транскрипции генов LDH и PDHK.
В другом аспекте изобретение относится к способу создания клетки, у которой в культуре наблюдается сниженная продукция лактата, содержащему введение в клетку вектора, содержащего последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В другом аспекте изобретение относится к вектору, содержащему последовательность первой гетерологичной нуклеиновой кислоты, кодирующую малую интерферирующую РНК (siRNA), специфичную для лактатдегидрогеназы (LDH), и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для киназы пируватдегидрогеназы (PDHK), где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и где последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
Краткое описание чертежей
На фиг.1 представлена конструкция siRNA, нацеливающая LDHa/PDHK1, 2, 3. siRNA, нацеливающие LDHa, PDHK1, PDHK2 и PDHK3, клонировали в один вектор pSilencer 3.1, содержащий последовательность гигромицина. Последовательность, нацеленная на LDHa, находилась под контролем промотора U6, тогда как siRNA для PDHK1, 2 и 3 находились под контролем промотора Н1.
На фиг.2 представлены относительные уровни экспрессии мРНК LDHa, PDHK1, 2 и 3 в выбранных 12 клонах siRNA (показано светло-серым цветом). Уровни экспрессии LDHa и PDHK нормализовали к гену домашнего хозяйства b-микроглобулина. Средние уровни экспрессии мРНК 12 модельных клонов показаны темно-серым цветом.
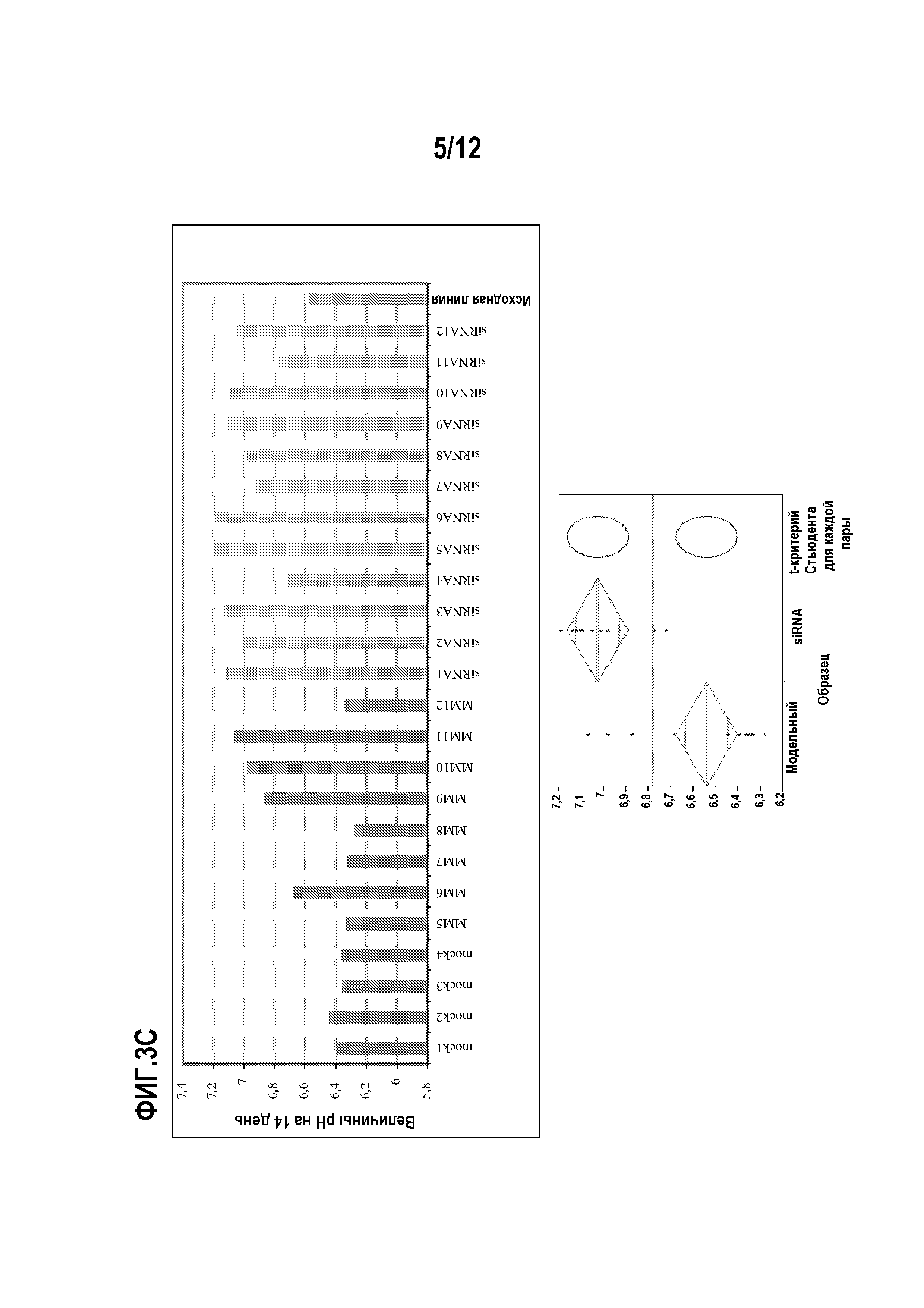
На фиг.3 представлены профили лактата, средние скорости продукции лактата и величины рН на 14 день при оценке во встряхиваемом сосуде с подпиткой. Концентрации лактата измеряли, используя анализатор Nova, в дни 3, 7, 10 и 14 в течение 14-дневной оценки встряхиваемого сосуда. 3А). Профиль лактата модельного клона (темно-серый) и клонов siRNA (светло-серый); 3В). Средняя скорость продукции лактата между 3 и 14 днями (мг/106 клеток/день); и 3С). Величины рН на 14 день. Эксперименты во встряхиваемом сосуде с подпиткой осуществляли 3 раза, и представлены данные эксперимента 1.
На фиг.4 представлены титр, специфическая выработка (Qp) и профили клеточного роста при оценке во встряхиваемой колбе с подпиткой. 4А). титр (выработка) в г/л на 14 день; 4В). Специфическая выработка в пг/клетка/день; и 4С). Измерение клеточного роста путем общего подсчета жизнеспособных клеток (IVCC) в 100 миллионах клеток на день на литр. Модельные клоны темно-серого цвета, а клоны siRNA светло-серые.
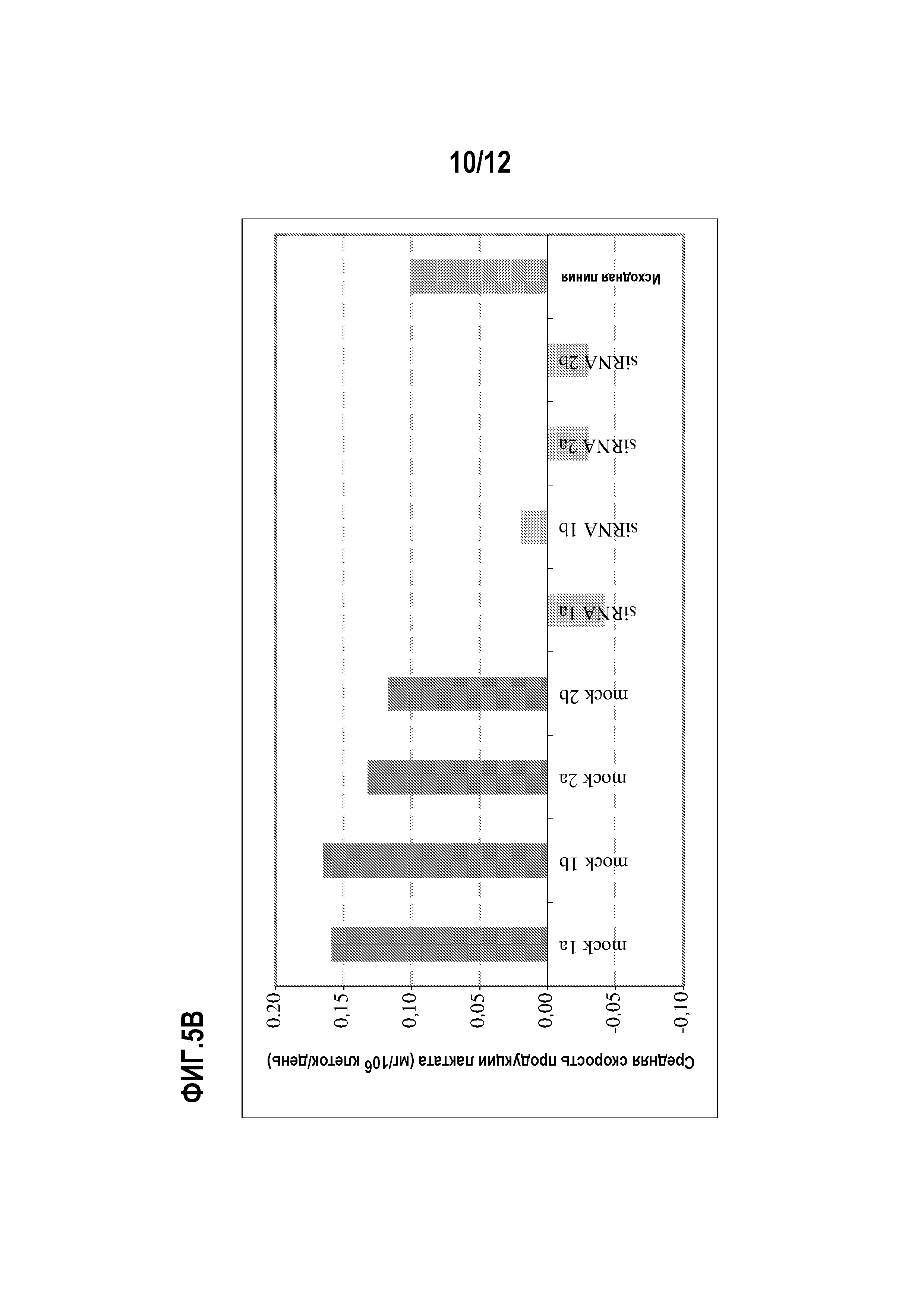
На фиг.5 представлены профиль лактата, средние скорости продукции лактата и профиль осмолярности при оценках в биореакторе объемом 2 л. 5А). Профиль лактата; 5В). Средние скорости продукции лактата; и 5С). Профиль осмолярности.
На фиг.6 представлен профиль выработки культивируемых клеток, содержащих siRNA, модельные или родительские клоны, при оценке в биореакторе объемом 2 л.
Подробное описание изобретения
Настоящее изобретение относится к способам и композициям для снижения продукции лактата и повышения продукции полипептида в культивируемых клетках. Авторы изобретения обнаружили, что совместное снижение LDH и PDHK посредством siRNA способом, известным как РНК-интерференция (RNAi), в культивируемых клетках, экспрессирующих полипептиды (например, антитела), уменьшило уровень лактата, скорость продукции лактата и осмолярность клеток и повысило специфическую выработку полипептида (например, специфическую выработку) и продукцию полипептида (например, выработку). Кроме того, у этих культивируемых клеток со сниженными LDH и PDHK не наблюдалось негативного влияния на рост клеток, жизнеспособность клеток и качество полученных полипептидов. Таким образом, не касаясь теории, уменьшение превращения пируват-лактат путем нокдауна экспрессии LDH и усиление вхождения пирувата в цикл трикарбоновых кислот (ТСА или цикл Кребса) путем нокдауна экспрессии одной или нескольких PDHK может создать синергический эффект в снижении лактата и обеспечении клеток большей энергией и промежуточными продуктами метаболизма. Эти эффекты, в свою очередь, могут привести к повышенной продукции полипептида (например, антитела) в культивируемых клетках.
Соответственно, в одном из аспектов изобретения предлагается способ снижения продукции лактата в культивируемых клетках, содержащий культивирование клеток, экспрессирующих а) siRNA, специфичную для LDH, и b) siRNA, специфичную для PDHK.
В другом аспекте предлагаются клетки в культуре, содержащие а) siRNA, специфичную для LDH, и siRNA, специфичную для PDHK.
В другом аспекте изобретение относится к способу снижения продукции лактата в культивируемых клетках, содержащему культивирование клеток, содержащих последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В еще одном аспекте изобретение относится к клеткам в культуре, содержащим последовательность первой гетерологичной нуклеиновой кислоты, кодирующую первую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую вторую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
При осуществлении настоящего изобретения будут использованы, если не указано другое, принятые техники молекулярной биологии (включая рекомбинантные техники), микробиологии, клеточной биологии, биохимии и иммунологии, которые известны специалистам в данной области. Такие техники полностью объясняются в литературе, такой как руководства (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J.D. Capra, eds., Harwood Academic Publishers, 1995).
Определения
Используемый в настоящем документе термин «клетки в культуре» или «культивируемые клетки» относится к двум или больше клеткам в растворе (например, среде для клеток), который дает возможность осуществления одного или нескольких клеточных делений.
Термин «полинуклеотид» или «нуклеиновая кислота», используемый в настоящем документе взаимозаменяемо, относится к полимерам нуклеотидов любой длины, и к нему относятся ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть встроен в полимер с помощью ДНК- или РНК-полимеразы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификацию в нуклеотидной структуре можно осуществить до или после сборки полимера. Последовательность нуклеотидов может быть прервана компонентами, отличными от нуклеотидов. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с меченым компонентом. К другим типам модификаций относятся, например, «кэпы», замена одного или нескольких природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, межнуклеотидные модификации незаряженными связями (например, метилфосфонатами, фосфотриэфирами, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоатами, фосфородитиоатами и т.д.), модификации, содержащие подвешенные фрагменты, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации интеркаляторами (например, акридином, псораленом и т.д.), модификации, содержащие хелаторы (например, металлы, радиоактивные металлы, бор, металлы-окислители и т.д.), модификации, содержащие алкиляторы, модификации модифицированными связями (например, альфа-аномерными нуклеиновыми кислотами и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующая в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищенными стандартными защитными группами или активированными для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердыми подложками. 5’ и 3’-концевой ОН может быть фосфорилирован или замещен аминами или фрагментами органической кэппирующей группы из 1-20 атомов углерода. Можно также получить производные других гидроксилов со стандартными защитными группами. Полинуклеотиды также могут содержать аналогичные формы сахаров рибоз или дезоксирибоз, которые в основном известны в данной области, к ним относятся, например, 2’-О-метил-, 2’-O-аллил, 2’-фтор- или 2’-азидорибоза, карбоциклические аналоги сахаров, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные формы сахаров, фуранозные формы сахаров, седогептулозы, ациклические аналоги и основные аналоги нуклеозидов, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть замещены альтернативными связующими группами. К этим альтернативным связующим группам относятся, но ими не ограничиваясь, варианты осуществления, в которых фосфат замещают на P(O)S(«тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR’, CO или CH2 («формацеталь»), в которых каждый R или R’ независимо представляет собой Н или замещенный, или незамещенный алкил (1-20 С), необязательно содержащий эфирную (-О-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание применимо ко всем полинуклеотидам, относящимся к настоящему документу, к которым относятся РНК и ДНК.
Термин «РНК-интерференция (RNAi)» относится к способу специфичного для последовательности сайленсинга на уровне транскрипции генов (например, посттранскрипционного сайленсинга генов), опосредованного или инициированного с помощью siRNA. Не касаясь теории, в процессе RNAi при осуществлении способов по изобретению siRNA может индуцировать деградацию мРНК-мишени с последующим специфичным для последовательности ингибированием экспрессии генов LDH и одной или нескольких PDHK.
Термин «гетерологичная нуклеиновая кислота» или «гетерологичный полипептид» относится к нуклеиновой кислоте или полипептиду, последовательность которых не идентична последовательности другой нуклеиновой кислоты или полипептида, обнаруживаемых в той же клетке-хозяине в природе.
Термин «малая интерферирующая РНК», «короткая интерферирующая РНК» или «siRNA» относится к РНК-дуплексу нуклеотидов или в некоторых альтернативных аспектах единичной молекуле РНК, которая нацеливается на интересующую нуклеиновую кислоту, например, LDH или PDHK. siRNA содержит смысловую цепь РНК и комплементарную антисмысловую цепь РНК, отжигаемые вместе за счет взаимодействий стандартного спаривания оснований Уотсона-Крика. siRNA может быть либо непосредственно трансфицирована в культивируемые клетки, либо получена в них иным образом.
В одной из вариаций смысловая цепь РНК и комплементарная антисмысловая цепь РНК связываются спайсером, что приводит к экспрессии структуры типа стебель-петля или шпилька, обозначаемой короткой шпилькой РНК (shRNA). Шпилька затем расщепляется эндонуклеазой (например, Dicer) с образованием siRNA. В другой вариации shRNA представляет собой бифункциональную shRNA, состоящую из двух структур типа стебель-петля, причем одна из структур стебель-петля состоит из полностью совместимой последовательности, направляющей РНК-дуплекс на деградацию мРНК через загрузку в RISC (РНК-индуцированный комплекс сайленсинга), зависящую от расщепления, и вторая структура стебель-петля составлена из ошибочно спаренной цепи, ингибирующей трансляцию мРНК путем секвестрации мРНК через загрузку в RISC независимо от расщепления.
Используемая в настоящем документе siRNA, «специфичная» для LDH или PDHK, относится к siRNA, которая нацеливается на интересующую нуклеиновую кислоту (например, LDH или PDHK) и нуклеотидная последовательность участка дуплекса siRNA которой комплементарна нуклеотидной последовательности нацеленного гена (например, LDH или PDHK).
Используемый в настоящем документе термин «функционально связанный» относится к функциональному взаимодействию между двумя или больше сегментами нуклеиновой кислоты (например, ДНК). Обычно он относится к функциональному взаимодействию последовательности, регулирующей транскрипцию, с транскрибируемой последовательностью. Например, промотор функционально связан с кодирующей последовательностью, такой как нуклеиновая кислота по изобретению, если он стимулирует или модулирует транскрипцию кодирующей последовательности в подходящей клетке-хозяине или другой экспрессирующей системе. Как правило, промоторные последовательности, регулирующие транскрипцию, которые функционально связаны с транскрибируемой последовательностью, физически прилегают к транскрибируемой последовательности, т.е. они действуют в цис-положении. Тем не менее, некоторые последовательности, регулирующие транскрипцию, такие как энхансеры, необязательно физически прилегают или расположены в непосредственной близости от кодирующих последовательностей, транскрипцию которых они усиливают.
К используемому в настоящем документе термину «промотор» относятся все последовательности, способные запускать транскрипцию кодирующей последовательности в культивируемой клетке, например, клетке млекопитающего. Таким образом, промоторы, использованные в конструкциях по изобретению, включают контролирующие транскрипцию элементы, действующие в цис-положении, и регуляторные последовательности, которые вовлечены в регуляцию или модуляцию тайминга и/или скорости транскрипции гена (например, LDH или PDHK). Например, промотор может представлять собой контролирующий транскрипцию элемент, действующий в цис-положении, включающий энхансер, промотор, терминатор транскрипции, точку начала репликации, последовательность интеграции в хромосому, 5’ и 3’ нетранслируемые регионы или интронную последовательность, которые вовлечены в регуляцию транскрипции. Эти последовательности, действующие в цис-положении, обычно взаимодействуют с белками или другими биомолекулами для осуществления (запуска/ остановки, регуляции, модуляции и т.д.) транскрипции. «Конститутивные» промоторы представляют собой промоторы, которые запускают экспрессию постоянно в большинстве условий среды и определяют развитие или дифференциацию клеток. «Индуцибельные» или «регулируемые» промоторы направляют экспрессию нуклеиновой кислоты по изобретению под влиянием условий окружающей среды или условий развития. К примерам условий окружающей среды, которые могут влиять на транскрипцию посредством индуцибельных промоторов, относятся анаэробные условия, повышенная температура, засуха или наличие света.
Используемый в настоящем документе «вектор» означает конструкцию, которая способна доставить и предпочтительно экспрессировать в клетке-хозяине один или несколько интересующих генов или последовательностей (например, LDH или PDHK). К примерам векторов относятся, но ими не ограничиваясь, вирусные векторы, экспрессирующие векторы на основе голой ДНК или РНК, плазмида, космида или фаговые векторы, экспрессирующие векторы на основе ДНК или РНК, ассоциированные с катионными конденсирующими агентами, экспрессирующие векторы на основе ДНК или РНК, инкапсулированные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты. Подходящие векторы представляют собой такие векторы, которые совместимы с используемой клеткой-хозяином. Подходящие векторы могут происходить, например, из бактерии, вируса (такого как бактериофаг Т7 или фаг М-13), космиды, дрожжевого гриба или растения. Протоколы получения и применения таких векторов известны в данной области (см., например, руководство Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, 1989).
Используемую в настоящем документе среднюю скорость продукции лактата рассчитывают как скорость синтеза лактата минус скорость потребления лактата в мг/клетки/день.
Используемая в настоящем документе «специфическая выработка» или «Qp» относится к скорости продукции специфического белка, например, антитела, выраженной в пг/клетка/день. Специфическую выработку рассчитывают как титр белка (пг/клетка/день)/IVCC (рассчитанное общее число жизнеспособных клеток; клетка/день).
Термины «полипептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может быть прерван соединениями, отличными от аминокислот. Термины также охватывают полимер аминокислот, который был модифицирован в природе или путем вмешательства; например, образованием дисульфидной связи, гликозилированием, липидированием, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией, такой как конъюгация с меченым компонентом. Также определение охватывает, например, полипептиды, содержащие один или несколько аналогов аминокислоты (к которым относятся, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области.
Термин «антитело» используется в самом широком смысле и конкретно охватывает моноклональные антитела (к которым относятся полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител.
«Фрагменты антитела» содержат участок полноразмерного антитела, как правило, его антиген-связывающий или вариабельный регион. К примерам фрагментов антител относятся фрагменты Fab, Fab’, F(ab’)2 и Fv; одноцепочечные молекулы антител; диатела; линейные антитела; и мультиспецифические антитела, образованные из фрагментов антител.
Термин «моноклональное антитело», используемый в настоящем документе, относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, идентичны за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высоко специфичны, являясь направленными против одного антигенного сайта. Более того, в противоположность препаратам традиционных (поликлональных) антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Определение «моноклональное» указывает на природу антитела как полученного по существу из гомогенной популяции антител и не должно быть истолковано как требующее продукции антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые по настоящему изобретению, могут быть созданы посредством гибридомного способа, впервые описанного Kohleret et al, Nature 256:495 (1975), или могут быть созданы с помощью способов рекомбинантных ДНК (см., например, пат. США № 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител, используя техники, описанные в статьях Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991), например.
К моноклональным антителам в настоящем документе конкретно относятся «химерные» антитела (иммуноглобулины), в которых участок тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных из конкретного вида или относящихся к определенному классу или подклассу антител, тогда как остальная(ые) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, полученных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что у них наблюдается желаемая биологическая активность (пат. США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
Термин «гипервариабельный регион», используемый в настоящем документе, относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельный регион содержит аминокислотные остатки из «региона, определяющего комплементарность» или «CDR» (т.е. остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или такие остатки из «гипервариабельной петли» (т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). «Каркасные» или «FR» остатки представляют собой остатки вариабельного домена, отличные от остатков гипервариабельного региона, определенных в настоящем документе.
«Гуманизированные» формы антител, отличные от человеческих (например, мышиные), представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из иммуноглобулина, отличного от человеческого. Преимущественно гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки гипервариабельного региона реципиента замещаются остатками гипервариабельного региона вида, отличного от человека (донорское антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающими желаемой специфичностью, аффинностью и способностью. В некоторых примерах остатки каркасного региона (FR) иммуноглобулина человека Fv замещаются соответствующими остатками, отличными от человеческих. Более того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорском антителе. Эти модификации создают для дополнительной очистки антитела. В целом, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют таковым иммуноглобулина, отличного от человеческого, и все или по существу все регионы FR представляют собой регионы FR последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере один участок константного региона (FC) иммуноглобулина, обычно из иммуноглобулина человека. Более подробно см. статьи Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Используемый в настоящем документе термин «иммуноадгезин» означает антителоподобные молекулы, которые объединяют «связывающий домен» гетерологичного белка «адгезина» (например, рецептора, лиганда или фермента) с эффекторными функциями константного домена иммуноглобулина. В структурном отношении иммуноадгезины содержат слияние аминокислотной последовательности адгезина с желательной специфичностью связывания, которая отличается от сайта распознавания и связывания антигена (антиген-объединяющего сайта) антитела (т.е. является «гетерологичной»), и последовательности константного домена иммуноглобулина. Последовательность константного домена иммуноглобулина в иммуноадгезине предпочтительно происходит из тяжелых цепей γ1, γ2 или γ4, поскольку иммуноадгезины, содержащие эти регионы, могут быть очищены посредством хроматографии с использованием белка А (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)).
Термин «лиганд-связывающий домен», используемый в настоящем документе, относится к любому нативному рецептору клеточной поверхности или любому региону, или его производному, сохраняющему по меньшей мере качественное связывание лиганда соответствующего нативного рецептора. В специфическом варианте осуществления рецептор происходит из полипептида клеточной поверхности, имеющего внеклеточный домен, который гомологичен члену семейства супергенов иммуноглобулинов. Другие рецепторы, которые не являются членами семейства супергенов иммуноглобулинов, но тем не менее специфически охватываются этим определением, представляют собой рецепторы цитокинов и, в частности, рецепторы с тирозинкиназной активностью (рецепторные тирозинкиназы), члены суперсемейств рецепторов гематопоэтинов и фактора роста нервов и молекулы клеточной адгезии, например, (Е-, L- и Р-) селектины.
Термин «рецептор-связывающий домен» используется для обозначения любого нативного лиганда рецептора, к которому относятся молекулы клеточной адгезии или любому региону, или производному такого нативного лиганда, сохраняющему по меньшей мере качественную способность связывания рецептора соответствующего нативного лиганда. К этому определению, среди прочих, специфически относятся последовательности связывания лигандов вышеуказанных рецепторов.
«Химера антитело-иммуноадгезин» содержит молекулу, которая объединяет по меньшей мере один домен связывания антитела (определенный в настоящем документе) по меньшей мере с одним иммуноадгезином (определенным в этой заявке). Типичными химерами антитело-иммуноадгезин являются биспецифические химеры CD4-IgG, описанные в статьях Berg et al., PNAS (USA) 88:4723-4727 (1991) и Chamow et al., J. Immunol. 153:4268 (1994).
Термин «осмолярность» относится к числу растворимых частиц, растворенных в 1 литре раствора. Растворы, которые могут быть добавлены в культуральную среду для повышения ее осмолярности, включают белки, пептиды, аминокислоты, неметаболизируемые полимеры, витамины, ионы, соли (например, соли натрия или калия), сахара, метаболиты, органические кислоты, липиды и т.д. Используемая в настоящем документе аббревиатура «мОсм» означает «миллиосмоли/литр Н2О».
К используемому в настоящем документе термину «клетка-хозяин» относятся отдельная клетка, культивируемые клетки или клетка в культуре, которая может стать или стала реципиентом вектора(ов) или siRNA, чтобы встроить вставки полинуклеотидов для продукции полипептида. К клеткам-хозяевам относится потомство одной культивируемой клетки, и потомство может не быть обязательно полностью идентично (по морфологии или комплементу геномной ДНК) исходной родительской клетке вследствие природной, случайной или преднамеренной мутации.
Обозначение «около» для величины или параметра в настоящем документе включает (и описывает) варианты осуществления, которые указывают на эту величину или параметр как таковые. Например, описание, обозначаемое «около Х», включает описание «Х». В числовые диапазоны включены числа, определяемые диапазоном.
Понятно, что во всех случаях варианты осуществления описаны в настоящем документе на языке «содержащий», в других случаях также предлагаются аналогичные варианты осуществления, описанные в терминах «состоящий из» и/или «состоящий по существу из».
При описании аспектов или вариантов осуществления изобретения, с точки зрения группы Маркуша или другой группировки альтернатив, настоящее изобретение охватывает не только всю перечисленную группу как целое, но и каждого члена группы отдельно и все возможные подгруппы основной группы, а также отсутствие в основной группе одного или нескольких членов группы. Настоящее изобретение также предусматривает определенное исключение одного или нескольких каких-либо членов группы в заявленном изобретении.
Способы снижения продукции лактата
К способам в настоящем документе относится культивирование клеток, экспрессирующих siRNA, специфичные для LDH, и по меньшей мере одной или нескольких PDHK, для снижения продукции лактата посредством РНК-интерференции (RNAi). В одном из аспектов способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDH, и b) siRNA, специфичную для PDHK.
В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для второй PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для третьей PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для четвертой PDHK.
В другом аспекте способ содержит последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В другом аспекте предлагается способ сайленсинга или снижения в культивируемой клетке транскрипции LDH и PDHK, содержащий: введение в клетку вектора, содержащего последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором, причем siRNA экспрессируются, благодаря чему происходит сайленсинг или снижение транскрипции генов LDH и PDHK.
В некоторых вариантах осуществления культивируемые клетки дополнительно содержат последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для второй PDHK, причем последовательность третьей гетерологичной нуклеиновой кислоты функционально связана с третьим промотором. В некоторых вариантах осуществления культивируемые клетки дополнительно содержат последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для третьей PDHK, причем последовательность четвертой гетерологичной нуклеиновой кислоты функционально связана с четвертым промотором. В некоторых вариантах осуществления культивируемые клетки дополнительно содержат последовательность пятой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для пятой PDHK, причем последовательность пятой гетерологичной нуклеиновой кислоты функционально связана с пятым промотором.
В некоторых вариантах осуществления LDH представляет собой LDHa, LDHb или LDHc. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK2, PDHK3 и PDHK4. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1, PDHK3 и PDHK4. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1 и PDHK2. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK1 и PDHK3. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK2 и PDHK3. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK2 и PDHK4. В некоторых вариантах осуществления PDHK выбирают из группы, состоящей из PDHK3 и PDHK4.
В некоторых вариантах осуществления способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDHa, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно. В некоторых вариантах осуществления способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDHb, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно. В некоторых вариантах осуществления способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDHc, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно.
В некоторых вариантах осуществления способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDHa, LDHb или LDHc, и b) siRNA, специфичную для двух PDHK, где PDHK выбирают из группы, состоящей из PDHK2, PDHK3 и PDHK4. Например, способ содержит культивирование клеток, экспрессирующих а) siRNA, специфичную для LDHa, и b) siRNA, специфичную для PDHK1 и PDHK2, соответственно.
В некоторых вариантах осуществления в культивируемых клетках, экспрессирующих а) siRNA, специфичную для LDH, и b) siRNA, специфичную для PDHK, уровень экспрессии мРНК LDH снижается по меньшей мере на около 75% и уровень экспрессии мРНК PDHK снижается по меньшей мере на около 25% по сравнению с культивируемыми клетками в отсутствие siRNA, специфичных для LDH и PDHK. В некоторых вариантах осуществления LDH представляет собой LDHa, LDHb или LDHc, и уровень экспрессии мРНК LDH снижается по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90% или по меньшей мере на около 95%. В некоторых вариантах осуществления PDHK представляет собой PDHK1, PDHK2 или PDHK3, и уровень экспрессии мРНК PDHK снижается по меньшей мере на около 25%, по меньшей мере на около 30%, по меньшей мере на около 35%, по меньшей мере на около 40%, по меньшей мере на около 45%, по меньшей мере на около 50%, по меньшей мере на около 55%, по меньшей мере на около 60%, по меньшей мере на около 65%, по меньшей мере на около 70%, по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90% или по меньшей мере на около 95%.
В некоторых вариантах осуществления в культивируемых клетках, экспрессирующих а) siRNA, специфичную для LDHa, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, уровень экспрессии мРНК LDHa снижается на около 90% и уровни экспрессии мРНК PDHK1, PDHK2 и PDHK3 снижаются на около 32%, 83% и 70%, соответственно, по сравнению с культивируемыми клетками в отсутствие siRNA, специфичных для LDHa, PDHK1, PDHK2 и PDHK3.
В некоторых вариантах осуществления способ содержит последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, LDHb или LDHc, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй, третьей и четвертой гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В некоторых вариантах осуществления способ содержит последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, LDHb или LDHc, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, и последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, последовательности второй и третьей гетерологичных нуклеиновых кислот функционально связаны со вторым промотором, и PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4.
В некоторых вариантах осуществления в культивируемых клетках, содержащих последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, уровень экспрессии мРНК LDH снижается по меньшей мере на около 75% и уровень экспрессии мРНК PDHK снижается по меньшей мере на около 25% по сравнению с культивируемыми клетками в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей LDH и PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором. В некоторых вариантах осуществления LDH представляет собой LDHa, LDHb или LDHc и уровень экспрессии мРНК LDH снижается по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90% или по меньшей мере на около 95%. В некоторых вариантах осуществления PDHK представляет собой PDHK1, PDHK2 или PDHK3, и уровень экспрессии мРНК PDHK снижается по меньшей мере на около 25%, по меньшей мере на около 30%, по меньшей мере на около 35%, по меньшей мере на около 40%, по меньшей мере на около 45%, по меньшей мере на около 50%, по меньшей мере на около 55%, по меньшей мере на около 60%, по меньшей мере на около 65%, по меньшей мере на около 70%, по меньшей мере на около 75%, по меньшей мере на около 80%, по меньшей мере на около 85%, по меньшей мере на около 90% или по меньшей мере на около 95%.
В некоторых вариантах осуществления в культивируемых клетках, содержащих последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связана со вторым промотором, уровень экспрессии мРНК LDHa снижается по меньшей мере на около 90% и уровни экспрессии мРНК PDHK1, PDHK2 и PDHK3 снижаются на около 32%, 83% и 70%, соответственно, по сравнению с культивируемыми клетками в отсутствие siRNA, специфичных для LDHa, PDHK1, PDHK2 и PDHK3.
siRNA по изобретению, описанная в настоящем документе, может быть получена или создана из большого числа источников, например, получена in vitro, ex vivo или in vivo, как описано в настоящем документе. В некоторых вариантах осуществления siRNA может содержать от около 1 до около 200 нуклеотидов, от около 5 до около 100 нуклеотидов, от около 10 до около 50 нуклеотидов, от около 15 до около 30 нуклеотидов или от около 19 до около 25 нуклеотидов. В некоторых вариантах осуществления длина siRNA составляет меньше, чем 30 нуклеотидов. В некоторых вариантах осуществления длина siRNA составляет больше, чем 30 нуклеотидов. В некоторых вариантах осуществления siRNA может составлять 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9 или меньше нуклеотидов в длину.
В некоторых вариантах осуществления siRNA может быть получена химическим синтезом, in vitro транскрипцией, используя полимеразу, или путем расщепления эндорибонуклеазой (например, Dicer) длинной двухцепочечной РНК (dsRNA). В некоторых вариантах осуществления siRNA может быть полностью или частично составлена из синтетических нуклеотидов, природных оснований или модифицированных оснований.
В некоторых вариантах осуществления siRNA может быть экспрессирована внутриклеточно. siRNA может кодироваться последовательностью нуклеиновой кислоты, и последовательность нуклеиновой кислоты также может включать один или несколько промоторов. Последовательность нуклеиновой кислоты также может включать сигнал полиаденилирования. В некоторых вариантах осуществления смысловая и антисмысловая цепи РНК-дуплекса могут быть получены от двух независимых промоторов и отжигаться в культивируемой клетке. В некоторых вариантах осуществления смысловая и антисмысловая цепи РНК-дуплекса также могут быть связаны посредством спейсера, составленного из нуклеотидных пар, (например, спейсер из нуклеотидных пар может содержать одну или бóльшее число пар нуклеотидов) или структуры типа стебель-петля с образованием shRNA и экспрессироваться одним промотором. В некоторых вариантах осуществления shRNA может представлять собой бифункциональную shRNA. Шпилька может расщепляться эндорибонуклеазой (например, Dicer) с получением эффективных молекул siRNA. Спайсер или структура типа стебель-петля располагается между смысловой и антисмысловой цепями, которые образуют дуплекс. Стебель-петля может иметь различную длину. В некоторых вариантах осуществления стебель-петля составляет 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 или больше нуклеотидов в длину. Структура-шпилька также может содержать 3’ или 5’ липкие концы. В некоторых вариантах осуществления липкий конец представляет собой 3’ или 5’выступающий участок, имеющий 1, 2, 3, 4 или 5 нуклеотидов в длину. Композиции и способы РНК-опосредованной генной регуляции с помощью siRNA, shRNA или бифункциональной shRNA описаны, например, в заявке США № 20090215860, статьях Rutz and Scheffold, Arthritis Research & Therapy, 6(2):78-85 (2004) и Rao et al., Advanced Drug Delivery Reviews 61:746-759 (2009).
В некоторых вариантах осуществления для получения ответов, специфичных для мишени, siRNA по настоящему изобретению может обладать полной гомологией с последовательностями-мишенями. В некоторых вариантах осуществления siRNA по настоящему изобретению обладает около какой-либо из 99%, 98%, 97%, 96%, 95%, 94%, 92%, 91%, 90%, 88%, 84%, 82%, 80%, 78%, 76%, 74%, 72%, 70%, 65%, 60%, 55%, 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15%, 10% или 5% гомологией с последовательностями-мишенями. В одном из вариантов siRNA по настоящему изобретению может гибридизоваться при физиологических условиях с мишеневой последовательностью нуклеиновой кислоты, например, она может специфически гибридизоваться с последовательностью-мишенью в клетке, например, in vivo. В другом варианте siRNA нацеливает больше, чем одну последовательность-мишень, маркер-мишень или репортерный ген.
Величина идентичности (гомологии) последовательности, необходимая для in vivo нацеливания siRNA на нуклеиновую кислоту-мишень (например, специфическое связывание siRNA с последовательностью-мишенью в клетке в физиологических условиях) может быть протестирована в условиях принятого скрининга, например, в культуре клеток и подобном.
В некоторых вариантах осуществления последовательность-мишень PDHK1 представляет собой GCAGTTCCTGGACTTCGGA (SEQ ID NO:2). В некоторых вариантах осуществления последовательность-мишень PDHK2 представляет собой CATTCAGTACTTCTTGGAC (SEQ ID NO:3). В некоторых вариантах осуществления последовательность-мишень PDHK3 представляет собой TGTAGCTGATGTCGTGAAA (SEQ ID NO:4).
Лактатдегидрогеназа (LDH) превращает пируват в лактат. К номерам доступа типичных полипептидов и нуклеиновых кислот LDH (например, LDHa, LDHb или LDHc) относятся, но ими не ограничиваясь, DQ912661 (LDHa в клетках СНО), ВС067223 (LDHa человека), ВС084698 (LDHa крысы), ВС094428 (LDHa мыши), ВС002362 (LDHb человека), NM_012595 (LDHb крысы), NM_008492 (LDHb мыши), ВС090043 (LDHc человека), NM_017266 (LDHc крысы) и NM_013580 (LDHc мыши). Чтобы определить, обладает ли полипептид LDH активностью LDH путем измерения способности полипептида превращать пируват в лактат in vitro, в клеточном экстракте или in vivo могут быть использованы стандартные способы, известные специалистам в данной области.
Киназа пируватдегидрогеназы (PDHK) ингибирует превращение пирувата в ацетил-КоА. К номерам доступа типичных полипептидов и нуклеиновых кислот PDHK1 относятся, но ими не ограничиваясь, L42450 (человека), ВС089783 (крысы) и NM_172665 (мыши). К номерам доступа типичных полипептидов и нуклеиновых кислот PDHK2 относятся, но ими не ограничиваясь, NM_002611 (человека), NM_030872 (крысы) и NM_133667 (мыши). К номерам доступа типичных полипептидов и нуклеиновых кислот PDHK3 относятся, но ими не ограничиваясь, L42452 (человека), ВС169078 (крысы) и NM_145630 (мыши). К номерам доступа типичных полипептидов и нуклеиновых кислот PDHK4 относятся, но ими не ограничиваясь, NM_002612 (человека), NM_053551 (крысы) и NM_013743 (мыши). Чтобы определить, обладает ли полипептид PDHK активностью PDHK путем измерения способности полипептида ингибировать превращение пирувата в ацтил-КоА in vitro, в клеточном экстракте или in vivo, могут быть использованы стандартные способы, известные специалистам в данной области.
Промоторы хорошо известны в данной области. Любой промотор, который функционирует в клетке-хозяине, может быть использован для экспрессии в клетке-хозяине siRNA, специфичных для LDH и одной или нескольких PDHK. В действительности, любой промотор, способный запускать эти siRNA, подходит по настоящему изобретению, к таковым относятся, но ими не ограничиваясь, U6, H1, CYC1, HIS3, GAL1, GAL4, GAL10, ADH1, PGK, PHO5, GAPDH, T7, CMV, SV40 и EF1a. Например, в некоторых вариантах осуществления способ содержит последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором U6, и последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связаны со вторым промотором Н1. В одном из вариантов последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHb. В другом варианте последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHc.
В другом аспекте предлагается способ создания клетки, в культуре которой наблюдается сниженная продукция лактата, содержащий введение в клетку вектора, содержащего последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
Последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфичную для PDHK, могут быть вставлены в вектор большим числом способов. Например, последовательности siRNA LDH и PDHK лигируют в желаемую позицию в векторе с последующим расщеплением вставки и вектора с помощью подходящих эндонуклеаз-рестриктаз, таких как KasI, BamHI, HindIII или BhIII. В некоторых вариантах осуществления вектор, содержащий последовательности siRNA, специфичные для LDHa и PDHK1, PDHK2 и PDHK3, создают путем вставки последовательности siRNA LDHa в сайт KasI вектора (например, вектора pSilencer 3.1-H1 hygro) с добавлением промотора U6 вблизи от ее 5’ конца, вставки последовательностей siRNA PDHK1 и PDHK2 в сайты BamHI/HindIII и HindIII, соответственно, и вставки последовательности siRNA PDHK3 в BgIII с добавлением промотора Н1 вблизи от 5’ концов PDHK1, PDHK2 и PDHK3. Затем путем трансфекции векторов, содержащих siRNA LDHa и PDHK1, PDHK2 и PDHK3, могут быть получены культивируемые клетки, экспрессирующие сниженное количество лактата.
Композиции
По настоящему изобретению также предлагаются культивируемые клетки, полученные способами, описанными в настоящем документе. Композиции по настоящему изобретению могут быть осуществлены in vivo, ex vivo или in vitro. В одном из аспектов предлагаются клетки в культуре, экспрессирующие а) siRNA, специфичную для LDH, и b) siRNA, специфичную для PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для второй PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для третьей PDHK. В некоторых вариантах осуществления культивируемые клетки дополнительно экспрессируют siRNA, специфичную для четвертой PDHK.
В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHa, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно. В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHb, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно. В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHc, и b) siRNA, специфичную для PDHK1, PDHK2 и PDHK3, соответственно.
В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHa, и b) siRNA, специфичную для двух PDHK, где PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4. В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHb, и b) siRNA, специфичную для двух PDHK, где PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4. В некоторых вариантах осуществления клетки в культуре экспрессируют а) siRNA, специфичную для LDHc, и b) siRNA, специфичную для двух PDHK, где PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4.
В другом аспекте предоставляются клетки в культуре, содержащие последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором. В некоторых вариантах осуществления клетки дополнительно содержат последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для второй PDHK, причем последовательность третьей гетерологичной нуклеиновой кислоты функционально связана с третьим промотором. В некоторых вариантах осуществления клетки дополнительно содержат последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для третьей PDHK, причем последовательность четвертой гетерологичной нуклеиновой кислоты функционально связана с четвертым промотором. В некоторых вариантах осуществления клетки дополнительно содержат последовательность пятой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для пятой PDHK, причем последовательность пятой гетерологичной нуклеиновой кислоты функционально связана с пятым промотором.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), и последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связаны со вторым промотором (например, Н1). В одном из вариантов последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHb. В другом варианте последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHb.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где PDHK выбирают из группы, состоящей из PDHK1, PDHK2, PDHK3 и PDHK4, причем последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), и последовательности второй и третьей гетерологичных нуклеиновых кислот функционально связаны со вторым промотором (например, Н1). В одном из вариантов последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHb. В другом варианте последовательность первой гетерологичной нуклеиновой кислоты, кодирующая siRNA, специфична для LDHc.
В некоторых вариантах осуществления культура клеток включает по меньшей мере около 5, 10, 15, 20, 50, 75, 100, 200, 500, 750, 1000, 5000, 7500, 10000, 15000 или больше клеток.
В другом аспекте предоставляются клетки в культуре, обладающие скоростью синтеза лактата, которая ниже, чем скорость потребления лактата. В некоторых вариантах осуществления клетки в культуре обладают средней скоростью продукции лактата меньше, чем около какой-либо из 0,2 мг/106 клеток/день со знаком минус, 0,1 мг/106 клеток/день со знаком минус, 0,08 мг/106 клеток/день со знаком минус, 0,06 мг/106 клеток/день со знаком минус, 0,04 мг/106 клеток/день со знаком минус, 0,02 мг/106 клеток/день со знаком минус, 0,01 мг/106 клеток/день со знаком минус, 0,008 мг/106 клеток/день со знаком минус, 0,006 мг/106 клеток/день со знаком минус, 0,004 мг/106 клеток/день со знаком минус или 0,002 мг/106 клеток/день со знаком минус.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), последовательности второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связаны со вторым промотором (например, Н1), и клетки в культуре обладают средней скоростью продукции лактата около 0,02 мг/106 клеток/день со знаком минус.
В другом аспекте предоставляются клетки в культуре, содержащие siRNA, специфичную для LDH и PDHK, обладающие сниженной осмолярностью. В некоторых вариантах осуществления клетки в культуре, содержащие siRNA, специфичную для LDH и PDHK, обладают осмолярностью меньше, чем около какой-либо из 500 мОсм, 450 мОсм, 400 мОсм, 350 мОсм, 300 мОсм, 250 мОсм, 200 мОсм или 150 мОсм.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), последовательность второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связана со вторым промотором (например, Н1), и клетки в культуре обладают осмолярностью около 300 мОсм.
В другом аспекте предоставляются клетки в культуре, обладающие повышенной специфической выработкой (Qp). В некоторых вариантах осуществления культивируемые клетки обладают специфической выработкой по меньшей мере на около 60% выше, по меньшей мере на около 65% выше, по меньшей мере на около 70% выше, по меньшей мере на около 75% выше, по меньшей мере на около 80% выше, по меньшей мере на около 85% выше, по меньшей мере на около 90% выше или по меньшей мере на около 95% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают специфической выработкой на около 67% выше, на около 69% выше, на около 71% выше, на около 72% выше, на около 73% выше, на около 74% выше, на около 75% выше, на около 76% выше, на около 77% выше, на около 78% выше, на около 79% выше, на около 81% выше, на около 83% выше, на около 85% выше, на около 87% выше, на около 89% выше, на около 91% выше, на около 93% выше, на около 95% выше, на около 97% выше или на около 99% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), последовательность второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связана со вторым промотором (например, Н1), и клетки в культуре обладают специфической выработкой на около 75% выше.
В другом аспекте предоставляются культивируемые клетки, полученные способом, описанным в настоящем документе, с повышенной выработкой полипептида (например, выработкой антитела или титром в г/л). В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около от 10% до 800% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около 10% выше, на около 15% выше, на около 20% выше, на около 25% выше, на около 30% выше, на около 35% выше, на около 40% выше, на около 45% выше, на около 50% выше, на около 55% выше, на около 58% выше, на около 60% выше, на около 65% выше, на около 70% выше, на около 71% выше, на около 75% выше, на около 80% выше, на около 85% выше, на около 90% выше, на около 95% выше, на около 100% выше, на около 125% выше, на около 150% выше, на около 200% выше, на около 250% выше, на около 300% выше, на около 350% выше, на около 400% выше, на около 450% выше, на около 500% выше, на около 550% выше, на около 600% выше, на около 650% выше, на около 700% выше, на около 750% выше или на около 800% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида по меньшей мере на около 55% выше, по меньшей мере на около 60% выше, по меньшей мере на около 65% выше, по меньшей мере на около 68% выше, по меньшей мере на около 70% выше, по меньшей мере на около 80% выше, по меньшей мере на около 85% выше или по меньшей мере на около 90% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK и LDH.
В некоторых вариантах осуществления клетки в культуре содержат последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDHa, последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK1, последовательность третьей гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK2, и последовательность четвертой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK3, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором (например, U6), последовательность второй, третьей и четвертой гетерологичных нуклеиновых кислот функционально связана со вторым промотором (например, Н1), и культивируемые клетки обладают выработкой антитела (например, в г/л) по меньшей мере на около 68% выше, чем культивируемые клетки в отсутствие последовательности гетерологичной нуклеиновой кислоты, содержащей PDHK1, PDHK2, PDHK3 и LDHa.
В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около от 10% до 800% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH (в некоторых вариантах осуществления выработкой антитела). В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида на около 10% выше, на около 15% выше, на около 20% выше, на около 25% выше, на около 30% выше, на около 35% выше, на около 40% выше, на около 45% выше, на около 50% выше, на около 55% выше, на около 60% выше, на около 65% выше, на около 70% выше, на около 75% выше, на около 80% выше, на около 85% выше, на около 90% выше, на около 95% выше, на около 100% выше, на около 125% выше, на около 150% выше, на около 200% выше, на около 250% выше, на около 300% выше, на около 350% выше, на около 400% выше, на около 450% выше, на около 500% выше, на около 550% выше, на около 600% выше, на около 650% выше, на около 700% выше, на около 750% выше или на около 800% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH. В некоторых вариантах осуществления культивируемые клетки обладают выработкой полипептида по меньшей мере на около 65% выше, по меньшей мере на около 68% выше, по меньшей мере на около 70% выше, по меньшей мере на около 80% выше, по меньшей мере на около 85% выше или по меньшей мере на около 90% выше, чем культивируемые клетки в отсутствие siRNA, специфичных для PDHK и LDH. В некоторых вариантах осуществления выработка антитела составляет по меньшей мере на около 68% выше, чем у культивируемых клеток в отсутствие siRNA, специфичных для PDHK и LDH.
В другом аспекте предоставляется вектор, содержащий последовательность первой гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для LDH, и последовательность второй гетерологичной нуклеиновой кислоты, кодирующую siRNA, специфичную для PDHK, где последовательность первой гетерологичной нуклеиновой кислоты функционально связана с первым промотором, и последовательность второй гетерологичной нуклеиновой кислоты функционально связана со вторым промотором.
В некоторых вариантах осуществления вектор содержит нуклеиновую кислоту под контролем последовательности, контролирующей экспрессию. Под используемой в настоящем документе «последовательностью, контролирующей экспрессию» понимают последовательность нуклеиновой кислоты, которая направляет транскрипцию интересующей нуклеиновой кислоты. Последовательность, контролирующая экспрессию, может представлять собой промотор, такой как конститутивный или индуцибельный промотор или энхансер. «Индуцибельный промотор» представляет собой промотор, который активен под контролем окружающей среды или факторов развития. Последовательность, контролирующая экспрессию, функционально связана с транскрибируемым сегментом нуклеиновой кислоты.
В некоторых вариантах осуществления вектор также включает терминирующую последовательность. Регионы, контролирующие терминацию, также могут быть получены из большого числа генов, нативных для клетки-хозяина. В некоторых вариантах осуществления терминирующую последовательность и последовательность промотора получают из одного и того же источника. В другом варианте осуществления терминирующая последовательность является эндогенной для клетки-хозяина. Необязательно может быть включен сайт терминации. Для эффективной экспрессии полипептидов ДНК, кодирующую полипептид, функционально связывают при участии инициирующих кодонов с выбранными регионами, контролирующими экспрессию, так что экспрессия приводит к образованию подходящей мессенджерной РНК.
В некоторых вариантах осуществления вектор содержит селективный маркер. Термин «селективный маркер» относится к нуклеиновой кислоте, способной экспрессироваться в клетке-хозяине, что позволяет без труда отобрать такие клетки-хозяева, которые содержат встроенную нуклеиновую кислоту или вектор. К примерам селективных маркеров относятся, но ими не ограничиваясь, нуклеиновые кислоты, отвечающие за устойчивость к антибиотикам (например, канамицину, ампициллину, карбенициллину, гентамицину, гигромицину, флеомицину, блеомицину, неомицину или хлорамфениколу) и/или нуклеиновые кислоты, которые дают клетке-хозяину метаболическое преимущество, такое как питательное преимущество. В некоторых вариантах осуществления селективный маркер представляет собой нуклеиновую кислоту гигромицина.
Полипептиды
К полипептиду или белку, получаемому используя способы и культивируемые клетки, описанные в настоящем документе, относятся, но ими не ограничиваясь, антитело или иммуноадгезин. Ниже обсуждаются техники получения таких молекул.
Антитела
К антителам по настоящему изобретению относятся, но ими не ограничиваясь: антитела против CD20, такие как химерные антитела против CD20 «C2B8», описанные в пат. США № 5736137 (РИТУКСАН®); антитела против VEGF, к которым относятся гуманизированные и/или аффинно-зрелые антитела против VEGF, такие как гуманизированное антитело против VEGF huA4.6.1 АВАСТИН® (Kim et al., Growth Factors, 7:53-64 (1992), международная публикация № WO 96/30046 и WO 98/45331, опубликованная 15 октября 1998) и V3L4; антитело против MUC16; антитела против CD4, такие как антитело сМ-7412 (Choy et al. Arthritis Rheum. 39(1):52-56 (1996)) и антитело ибализумаб (TNX355); антитела против МЕТ, такие как одноплечевое антитело против C-Met 5D5; антитела против HER2 трастузумаб (ГЕРЦЕПТИН®) (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285-4289 (1992), пат. США № 5725856) и гуманизированное антитело 2С4 (WO 01/00245, Adams et al.), химерный или гуманизированный вариант антитела 2Н7, описанный в пат. США № 5721108В1 или тозитумомаб (БЕКСАР®); антитела против IL-8 (St John et al., Chest, 103:932 (1993) и международная публикация № WO 95/23865); антитела против антигена стволовых клеток предстательной железы (PSCA) (WO 01/40309); антитела против CD40, к которым относятся S2C6 и его гуманизированные варианты (WO 00/75348); антитела против CD1 (пат. США № 5622700, WO 98/23761, Steppe et al., Transplant Intl. 4:3-7 (1991), и Hourmant et al., Transplantation 58:377-380 (1994)); антитела против CD18 (пат. США № 5622700, опубликованный 22 апреля 1997, или как описано в WO 97/26912, опубликованном 31 июля 1997); антитела против IgE (к которым относятся Е25, Е26 и Е27; пат. США № 5714338, опубликованный 3 февраля 1998, или пат. США № 5091313, опубликованный 25 февраля 1992, WO 93/04173, опубликованный 4 марта 1993, или международная заявка № РСТ/US98/13410, поданная 30 июня 1998, пат. США № 5714338, статья Presta et al., J. Immunol. 151:2623-2632 (1993) и международная публикация № WO 95/19181); антитела против рецептора Аро-2 (WO 98/51793, опубликованный 19 ноября 1998); антитела против TNF-α, к которым относятся сА2 (РЕМИКАД®), CDP571 и МАК-195 (см. пат. США № 5672347, опубликованный 30 сентября 1997, статьи Lorenz et al. J. immunol. 156(4):1646-1653(1996) и Dhainaut et al. Crit. Care Med. 23(9):1461-1469 (1995)); антитела против тканевого фактора (TF) (европейский патент № 0420937 В1, выданный 9 ноября 1994); антитела против интегрина человека α4β7 (WO 98/06248, опубликованный 19 февраля 1998); антитела против рецептора эпидермального фактора роста (EGFR) (например, химерное или гуманизированное антитело 225, описанное в WO 96/40210, опубликованном 19 декабря 1996); антитела против CD3, такие как ОКТ3 (пат. США № 4515893, опубликованный 7 мая 1985); антитела против CD25 или против Тас, такие как CHI-621 (СИМУЛЕКТ® и ЗЕНАПАКС® (см. пат. США № 5693762, опубликованный 2 декабря 1997); антитела против CD52, такие как CAMPATH-1H (Riechmann et al. Nature 332:323-337 (1988)); антитела против рецептора Fc, такие как антитело М22, направленное против Fcy RI, описанное в статье Graziano et al. J. Immunol. 155(10):4996-5002 (1995); антитела против карциноэмбрионального антигена (СЕА), такие как hMN-1 4 (Sharkey et al. Cancer Res. 55(23 Suppl): 5935s-5945s (1995); антитела, направленные против эпителиальных клеток молочных желез, к которым относятся huBrE-3, hu-Mc 3 и CHL6 (Ceriani et al. Cancer Res. 55(23): 5852s-5856s (1995); и Richman et al. Cancer Res. 55(23 Supp): 5916s-5920s (1995)); антитела, которые связываются с клетками карциномы толстого кишечника, такие как С242 (Litton et al. Eur J Immunol. 26(1): 1-9 (1996)); антитела против CD38, например, АТ 13/5 (Ellis et al. J. Immunol. 155(2):925-937 (1995)); антитела против CD33, такие как Hu M195 (Jurcic et al. Cancer Res 55(23 Suppl):5908s-5910s (1995) и СМА-676 или CDP771; антитела против CD22, такие как LL2 или LymphoCide (Juweid et al. Cancer Res 55(23 Suppl):5899s-5907s (1995)); антитела против ЕрСАМ, такие как 17-1А (ПАНОРЕКС®); антитела против GpIIb/IIIa, такие как абциксимаб или с7Е3 Fab (РЕОПРО®); антитела против RSV, такие как MEDI-493 (СИНАГИС®); антитела против CMV, такие как ПРОТОВИР®; антитела против HIV, такие как PRO542; антитела против гепатита, такие как антитело против гепатита B ОСТАВИР®; антитела против СА 125, такие как ОваРекс; антиидиотипическое антитело BEC2 против эпитопа GD3; антитела против ανβ3, к которым относится ВИТАКСИН®; антитело против почечноклеточной карциномы человека, такое как ch-G250; ING-1; антитело против 17-1A человека (3622W94); антитело против колоректальной опухоли человека (А33); антитело против меланомы человека R24, направленное против ганглиозида GD3; антитело против плоскоклеточной карциномы человека (SF-25); и антитела против лейкоцитарного антигена человека (HLA), такие как Smart ID10 и антитело против HLA DR Oncolym (Lym-1).
Помимо антител, конкретно указанных выше, специалист может получить антитела, направленные против интересующего антигена, например, используя техники, описанные ниже.
(i) Выбор и получение антигена
Антитело в настоящем документе направлено против интересующего антигена. Предпочтительно антиген представляет собой биологически важный полипептид, и введение антитела млекопитающему, страдающему заболеванием или расстройством, может привести к терапевтическому эффекту у этого млекопитающего. Тем не менее, также рассматриваются антитела, направленные против антигенов, отличных от полипептидов (таких как опухоль-ассоциированные гликолипидные антигены; см. пат. США № 5091178). Если антиген представляет собой полипептид, он может представлять собой трансмембранную молекулу (например, рецептор) или лиганд, такой как фактор роста. К типичным антигенам относятся белки, описанные в разделе (3) ниже. К типичным молекулярным мишеням антител, охватываемым настоящим изобретением, относятся белки CD, такие как CD3, CD4, CD8, CD19, CD20, CD22 и CD34; члены семейства рецепторов ErbB, такие как рецептор EGFR, HER2, HER3 или HER4; молекулы клеточной адгезии, такие как LFA-1, Mac1, р1 50,95, VLA-4, ICAM-1, VCAM и интегрин αν/β3, включающий либо его α, либо β субъединицы (например, антитела против CD11a, против CD18 или против CD11b); факторы роста, такие как VEGF; IgE; антигены групп крови; рецептор flk2/flk3; рецептор ожирения (ОВ); рецептор mpl; CTLA-4; белок С или любые другие антигены, упомянутые в настоящем документе.
Для получения антител в качестве иммуногенов могут быть использованы растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами. В отношении трансмембранных молекул, таких как рецепторы, в качестве иммуногена могут быть использованы фрагменты таковых (например, внеклеточный домен рецептора). Альтернативно, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Такие клетки могут быть получены из природного источника (например, линий раковых клеток) или могут представлять собой клетки, которые были трансформированы путем рекомбинантных техник для экспрессии трансмембранной молекулы.
Специалисту в данной области будут понятны и другие антигены и их формы, используемые для получения антител.
(ii) Поликлональные антитела
Поликлональные антитела предпочтительно вырабатывают у животных путем большого числа подкожных (sc) или внутрибрюшинных (ip) инъекций соответствующего антигена и наполнителя. Может быть полезным конъюгирование антигена с белком, который является иммуногенным у иммунизируемого вида, например, гемоцианином лимфы улитки, сывороточным альбумином, бычьим тиреоглобулином или соевым ингибитором трипсина, используя бифункциональный или используемый для получения производных агент, например, сложный эфир малеимидобензоилсульфосукцинимида (конъюгация через цистеиновые остатки), N-гидроксисукцинимид (через лизиновые остатки), глютаральдегид, янтарный ангидрид, SOCl2 или R1N=C=NR, где R и R1представляют собой различные алкильные группы.
Животных иммунизируют против антигена, иммуногенных конъюгатов или производных, комбинируя, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и вводя раствор внутридермально в большое число участков. Через один месяц животных повторно иммунизируют с помощью от 1/5 до {фракции (1/10)} от исходного количества антигена или конъюгата в полном адъюванте Фрейнда путем подкожного введения в большое число участков. Через семь - 14 дней у животных берут кровь и сыворотку исследуют на титр антитела. Животных повторно иммунизируют вплоть до выхода титра на плато. Предпочтительно животных повторно иммунизируют конъюгатом того же антигена, но конъюгированным с отличным белком и/или через отличный перекрестно сшивающий реагент. Конъюгаты также могут быть получены в культуре рекомбинантных клеток в виде слияний белков. Кроме того, для усиления иммунного ответа подходящим образом используют агрегирующие агенты, такие как квасцы.
(iii) Моноклональные антитела
Моноклональные антитела могут быть получены, используя способ на основе гибридом, впервые описанный Kohler et al., Nature, 256:495 (1975), или могут быть получены способами на основе рекомбинантных ДНК (пат. США № 4816567).
В способе на основе гибридом мышь или другое подходящее животное-хозяин, такое как хомячок или макака, иммунизируют, как описано в настоящем документе выше, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфично связываться с белком, использованным для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Лимфоциты затем сливают с клетками миеломы, используя подходящий агент для слияния, такой как полиэтиленгликоль, для образования гибридомной клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или жизнеспособность неслитых родительских клеток миеломы. Например, при отсутствии у родительских клеток миеломы фермента гипоксантингуанинфосфорибозилтрансферазы (HGPRT или HPRT) культуральная среда для гибридом обычно будет включать гипоксантин, аминоптерин и тимидин (среда НАТ), эти вещества предотвращают рост дефицитных по HGPRT клеток.
Предпочтительные клетки миеломы представляют собой такие клетки миеломы, которые эффективно сливаются, поддерживают стабильную продукцию на высоком уровне антитела посредством отобранных продуцирующих антитело клеток и чувствительны к среде, такой как среда НАТ. Среди них предпочтительные линии клеток миеломы представляют собой линии миеломы мыши, такие как полученные из опухолей мыши МОРС-21 и МРС-11, доступные из Salk Institute Cell Distribution Center, San Diego, Calif. USA и клетки SP-2 или X63-Ag8-653, доступные из American Type Culture Collection, Rockville, Md. USA. Линии клеток миеломы человека и гетеромиеломы мыши-человека также были описаны на предмет продукции моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, анализируют в отношении продукции моноклональных антител, направленных против антигена. Предпочтительно, специфичность связывания моноклональных антител, выработанных клетками гибридомы, определяют иммунопреципитацией или с помощью анализа связывания in vitro, такого как радиоиммуноанализ (RIA) или ферментный иммуносорбентный анализ (ELISA).
После идентификации клеток гибридомы, которые продуцируют антитела желательной специфичности, аффинности и/или активности, клоны могут быть субклонированы способами предельного разведения и выращены стандартными способами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). К подходящим культуральным средам для этой цели относится, например, среда D-MEM или RPMI-1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей в животном.
Моноклональные антитела, секретированные субклонами, подходящим образом отделяют от культуральной среды, асцитной жидкости или сыворотки принятыми способами очистки иммуноглобулинов, такими как, например, хроматография с использованием белка А-сефарозы, гидроксилапатита, гель-электрофорез, диализ или аффинная хроматография. Предпочтительно используют способ аффинной хроматографии с белком А, используя градиент рН, описанный в настоящем документе.
ДНК, кодирующую моноклональные антитела, без труда выделяют и секвенируют, используя принятые способы (например, используя олигонуклеотидные зонды, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи моноклональных антител). Клетки гибридомы служат в качестве предпочтительного источника такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки павиана COS, клетки яичника китайского хомячка (СНО) или клетки миеломы, которые в ином случае не продуцируют белок иммуноглобулина, чтобы синтезировать моноклональные антитела в рекомбинантных клетках-хозяевах.
ДНК также может быть модифицирована, например, заменой кодирующей последовательностью константных доменов тяжелой и легкой цепей гомологичных последовательностей мыши (пат. США № 4816567; Morrison et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)) или ковалентным соединением с кодирующей последовательностью иммуноглобулина всей или части кодирующей последовательности полипептида, отличного от иммуноглобулина.
Обычно такие отличные от иммуноглобулинов полипептиды замещаются константными доменами антитела или они замещаются вариабельными доменами одного антиген-связывающего сайта антитела для создания химерного бивалентного антитела, содержащего один антиген-связывающий сайт, обладающий специфичностью в отношении антигена, и другой антиген-связывающий сайт, обладающий специфичностью в отношении отличного антигена.
Моноклональные антитела могут быть выделены из фаговых библиотек антител, созданных, используя методики, описанные в статьях McCafferty et al., Nature, 348:552-554 (1990). Авторы Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991) описывают выделение антител мыши и человека, соответственно, используя фаговые библиотеки. В последующих публикациях описана продукция высокоаффинных (диапазон нМ) антител человека путем перетасовки цепей (Marks et al., Bio/Technology, 10:779-783 (1992)), а также комбинаторной инфекции и in vivo рекомбинации в качестве стратегии конструирования очень больших фаговых библиотек (Waterhouse et al., Nuc. Acids. Res., 21:2265-2266 (1993)). Таким образом, эти техники являются приемлемой альтернативой традиционным техникам гибридом для выделения моноклональных антител.
(iv) Гуманизированные антитела и антитела человека
Гуманизированное антитело имеет один или несколько аминокислотных остатков, встроенных в него из источника, отличного от человека. Эти аминокислотные остатки, отличные от человеческих, часто обозначают как «импортные» остатки, которые обычно получают из «импортного» вариабельного домена. Гуманизация может быть по существу осуществлена по способу Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)) путем замещения CDR или последовательностями CDR грызунов соответствующих последовательностей антитела человека. Соответственно, такие «гуманизированные» антитела представляют собой химерные антитела (пат. США № 4816567), в которых значительно меньшая часть, чем интактный вариабельный домен человека, была заменена соответствующей последовательностью вида, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые остатки FR замещают остатками из аналогичных сайтов в антителах грызунов.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепи, используемых в создании гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу «оптимальной подгонки» последовательность вариабельного домена антитела грызуна подвергают скринингу против полной библиотеки известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем берут в качестве FR человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993)). В другом способе используют конкретный каркас, полученный из консенсусной последовательности всех антител человека определенной подгруппы легких или тяжелых цепей. Один и тот же каркас может быть использован для нескольких различных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)).
Также важно, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения этой цели согласно предпочтительному способу гуманизированные антитела получают, проводя анализ исходных последовательностей и большого числа концептуальных гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов общедоступны и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и показывают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулина. Исследование таких изображений позволяет проанализировать вероятную роль остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связываться со своим антигеном. Таким образом, могут быть выбраны и объединены остатки FR из реципиентных и импортируемых последовательностей так, чтобы достичь желательных характеристик антитела, таких как повышенная аффинность по отношению к антигену(ам)-мишени(ям). В общем, остатки CDR непосредственно и в наибольшей степени влияют на связывание антигена.
Альтернативно, в настоящее время возможно получать трансгенных животных (например, мышей), которые способны при иммунизации продуцировать полный список антител человека в отсутствие продукции эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена региона соединения тяжелых цепей антитела (JH) у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенного антитела. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить к продукции антител человека при антигенной стимуляции. См., например, статьи Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993); и Duchosal et al. Nature 355:258 (1992). Антитела человека также могут быть получены из библиотек фаговых дисплеев (Hoogenboom et al., J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Vaughan et al. Nature Biotech 14:309 (1996)).
(v) Фрагменты антител
Было разработано большое число техник для продукции фрагментов антител. Традиционно такие фрагменты получали путем протеолитического расщепления интактных антител (см., например, статьи Morimoto et al. Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако в настоящее время такие фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Например, фрагменты антител могут быть выделены из фаговых библиотек антител, описанных выше. Альтернативно, фрагменты Fab’-SH могут быть непосредственно извлечены из E.coli и химически связаны с образованием F(ab’)2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). Согласно другому подходу F(ab’)2-фрагменты могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Также может быть выделен одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185. Специалисту в данной области будут понятны и другие техники продукции фрагментов антител.
(vi) Мультиспецифические антитела
Мультиспецифические антитела обладают специфичностями связывания, по меньшей мере, к двум различным антигенам. Несмотря на то, что такие молекулы, как правило, будут связываться лишь с двумя антигенами (т.е. биспецифические антитела, BsAbs), антитела с дополнительными специфичностями, такие как триспецифические антитела, охватываются данным выражением при его использовании в настоящем документе.
Способы создания биспецифических антител известны в данной области. Традиционная продукция полноразмерных биспецифических антител основана на коэкспрессии двух пар - тяжелая цепь-легкая цепь иммуноглобулина, при этом две цепи обладают различными специфичностями (Millstein et al., Nature, 305:537-539 (1983)). Вследствие случайного набора тяжелых и легких цепей иммуноглобулина эти гибридомы (квадромы) вырабатывают потенциальную смесь из 10 различных молекул антител, из которых лишь одна обладает правильной биспецифической структурой. Очистка правильной молекулы, которую обычно осуществляют стадиями аффинной хроматографии, является довольно громоздкой, а выходы продукта низкими. Аналогичные способы описаны в WO 93/08829, и в статье Traunecker et al., EMBO J., 10:3655-3659 (1991).
Согласно другому подходу, описанному в WO 96/27011, область контакта между парой молекул антител может быть создана так, чтобы максимизировать процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная область контакта содержит по меньшей мере часть домена СН3 константного домена антитела. В этом способе одну или несколько небольших аминокислотных боковых цепей области контакта первой молекулы антитела замещают более крупными боковыми цепями (например, с тирозином или триптофаном). Создают компенсирующие «полости», имеющие размер, идентичный или подобный размеру большой(их) боковой(ых) цепи(ей), в области контакта второй молекулы антитела путем замещения больших аминокислотных боковых цепей на меньшие (например, с аланином или треонином). Это предоставляет механизм увеличения выхода гетеродимера над другими нежелательными конечными продуктами, такими как гомодимеры.
К биспецифическим антителам относятся перекрестно связанные или «гетероконъюгированные» антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, другое с биотином. Такие антитела были предложены, например, для нацеливания клеток иммунной системы на нежелательные клетки (пат. США № 4676980) и лечения HIV-инфекции (WO 91/00360, WO 92/200373 и ЕР 03089). Гетероконъюгированные антитела могут быть созданы, используя любые принятые способы перекрестного связывания. Подходящие агенты для перекрестного связывания хорошо известны в данной области и описаны в пат. США № 4676980 наряду с большим числом техник перекрестного сшивания.
Техники получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела могут быть получены, используя химическое связывание. Авторы Brennan et al., Science, 229:81 (1985) описали способ, в котором интактные антитела протеолитически расщепляют с образованием F(ab’)2-фрагментов. Эти фрагменты восстанавливают при наличии арсенита натрия агента, образующего комплексы дитиола, для стабилизации соседних дитиолов и предотвращения образования межмолекулярного дисульфида. Полученные Fab’-фрагменты затем превращают в производные тионитробензоата (TNB). Одно из производных Fab’-TNB затем вновь превращают в Fab’-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab’-TNB для образования биспецифического антитела. Полученные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Недавний прогресс облегчил непосредственное извлечение Fab’-SH-фрагментов из E. coli, которые могут быть химически связаны с образованием биспецифических антител. Авторы Shalaby et al., J. Exp. Med., 175:217-225 (1992) описали продукцию полностью гуманизированной молекулы биспецифического антитела на основе F(ab’)2. Каждый Fab’-фрагмент отдельно секретировался из клеток Е. coli и подвергался направленному химическому связыванию in vitro с образованием биспецифического антитела. Образованное таким образом биспецифическое антитело оказалось способно связываться с клетками, сверхэкспрессирующими рецептор ErbB2, и нормальными Т-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека против опухолевых мишеней молочных желез человека.
Также было описано большое число техник создания и выделения фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела были получены, используя лейциновые молнии. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun связывали с Fab’-участками двух различных антител путем слияния генов. Гомодимеры антител восстанавливали в шарнирном регионе для образования мономеров и затем вновь окисляли, чтобы образовать гетеродимеры антител. Этот способ также может быть использован для продукции гомодимеров антител. Технология «диантител», описанная авторами Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993), предложила альтернативный механизм создания фрагментов биспецифических антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) линкером, который слишком короток для спаривания между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VH и VL другого фрагмента, таким образом, формируя два сайта связывания антигена. Также было сообщено о другой стратегии создания фрагментов биспецифических антител, используя димеры одноцепочечного Fv (sFv). См. статью Gruber et al., J. Immunol., 152:5368 (1994). Альтернативно, антитела могут представлять собой «линейные антитела», описанные в статье Zapata et al. Protein Eng. 8(10):1057-1062 (1995). Вкратце, эти антитела содержат пару тандемных сегментов Fd (VH-CH1-VH иVL), которые образуют пару антигенсвязывающих регионов. Линейные антитела могут представлять собой биспецифические или моноспецифические антитела.
Рассматриваются антитела с больше, чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tutt et al. J. Immunol. 147:60 (1991).
Иммуноадгезины
Самая простая и самая понятная конструкция иммуноадгезина объединяет связывающий(е) домен(ы) адгезина (например, внеклеточный домен (ECD) рецептора) с шарнирным и Fc регионами тяжелой цепи иммуноглобулина. Как правило, при получении иммуноадгезинов по настоящему изобретению нуклеиновая кислота, кодирующая связывающий домен адгезина, должна быть слита С-концом с нуклеиновой кислотой, кодирующей N-конец последовательности константного домена иммуноглобулина, тем не менее, также возможны N-концевые слияния.
Обычно в таких слияниях кодируемый химерный полипептид сохранит, по меньшей мере, функционально активными шарнир, домены CH2 и CH3 константного региона тяжелой цепи иммуноглобулина. Также создают слияния с С-концом Fc-участка константного домена или непосредственно N-конца с CH1 тяжелой цепи или соответствующего региона легкой цепи. Точный сайт, по которому создают слияние, не имеет решающего значения; конкретные сайты хорошо известны и могут быть выбраны с целью оптимизации биологической активности, секреции или характеристик связывания иммуноадгезина.
В некоторых вариантах осуществления последовательность адгезина сливают с N-концом Fc-домена иммуноглобулина G1 (IgG1). Существует возможность слияния всего константного региона тяжелой цепи с последовательностью адгезина. Тем не менее, предпочтительно, чтобы в слиянии использовали последовательность, начинающуюся в шарнирном регионе непосредственно выше сайта расщепления папаином, который определяет Fc IgG химически (т.е. с остатка 216, принимая первый остаток константного региона тяжелой цепи за 114) или аналогичные сайты других иммуноглобулинов. В некоторых вариантах осуществления аминокислотную последовательность адгезина сливают с (а) шарнирным регионом и/или CH2 и CH3 или (b) CH1, шарниром, доменами CH2 и CH3 тяжелой цепи IgG.
В отношении биспецифических иммуноадгезинов, иммуноадгезины собирают в виде мультимеров и, в частности, в виде гетеродимеров или гетеротетрамеров. Как правило, такие собранные иммуноглобулины будут иметь известные структуры составляющих их единиц. Основная четырехцепочечная структурная единица представляет собой форму, в которой существуют IgG, IgD и IgE. Четырехцепочечная единица повторяется в высокомолекулярных иммуноглобулинах; IgM в основном существует в виде пентамера четырехосновных единиц, удерживаемых вместе дисульфидными связями. Глобулин IgA и иногда глобулин IgG также могут существовать в сыворотке в мультимерной форме. В случае мультимера каждая из четырех единиц может быть одной и той же или различаться.
Ниже схематически представлено большое число типичных собранных иммуноадгезинов в объеме настоящего документа:
(а) ACL-ACL;
(b) ACH-(ACH, ACL-ACH, ACL-VHCH или VLCL-ACH);
(с) ACL-ACH-(ACL-ACH, ACL-VHCH, VLCL-ACH или VLCL-VHCH);
(d) ACL-VHCH-(ACH или ACL-VHCH или VLCL-ACH);
(e) VLCL-ACH-(ACL-VHCH или VLCL-ACH); и
(f) (A-Y)n-(VLCL-VHCH)2,
где каждый А представляет идентичные или различные аминокислотные последовательности адгезина;
VL представляет собой вариабельный домен легкой цепи иммуноглобулина;
VH представляет собой вариабельный домен тяжелой цепи иммуноглобулина;
CLпредставляет собой константный домен легкой цепи иммуноглобулина;
CHпредставляет собой константный домен тяжелой цепи иммуноглобулина;
n представляет собой целое число больше, чем 1;
Y обозначает остаток ковалентно перекрестно-связывающего агента.
Для краткости у вышеуказанных структур показаны лишь ключевые признаки; они не указывают ни на связывающий (J) или другие домены иммуноглобулинов, ни показывают на дисульфидные связи. Тем не менее, при необходимости таких доменов для связывающей активности они должны быть созданы в типичных участках, которые они занимают в молекулах иммуноглобулинов.
Альтернативно, последовательности адгезина могут быть вставлены между последовательностями тяжелой цепи и легкой цепи иммуноглобулина так, чтобы получить иммуноглобулин, содержащий химерную тяжелую цепь. В этом варианте осуществления последовательности адгезина сливают с 3’ концом тяжелой цепи иммуноглобулина в каждом плече иммуноглобулина либо между шарниром и доменом СН2, либо между доменами СН2 и СН3. О подобных структурах было сообщено авторами Hoogenboom et al., Mol. Immunol. 28:1027-1037 (1991).
Несмотря на то, что в иммуноадгезинах по настоящему изобретению наличие легкой цепи иммуноглобулина не обязательно, легкая цепь иммуноглобулина может присутствовать либо ковалентно ассоциированной со слитым полипептидом адгезин-тяжелая цепь иммуноглобулина, либо непосредственно слитой с адгезином. В первом случае ДНК, кодирующую легкую цепь иммуноглобулина, обычно коэкспрессируют с ДНК, кодирующей слитый белок адгезин-тяжелая цепь иммуноглобулина. При секреции гибридная тяжелая цепь и легкая цепь будут ковалентно ассоциированы с получением иммуноглобулиноподобной структуры, содержащей две связанные дисульфидом части тяжелая цепь-легкая цепь иммуноглобулина. Способы, подходящие для получения таких структур, описаны, например, в пат. США № 4816567, опубликованном 28 марта 1989.
Иммуноадгезины самым принятым образом конструируют путем слияния в рамке считывания последовательности кДНК, кодирующей участок адгезина, с последовательностью кДНК иммуноглобулина. Тем не менее, также может быть использовано слияние с геномными фрагментами иммуноглобулина (см., например, статьи Aruffo et al., Cell 61:1303-1313 (1990); и Stamenkovic et al., Cell 66:1133-1144 (1991)). Для последнего типа слияния требуется наличие регуляторных последовательностей Ig для экспрессии. кДНК, кодирующие константные регионы тяжелых цепей IgG, могут быть выделены на основе опубликованных последовательностей библиотек кДНК, полученных из лимфоцитов селезенки или периферической крови путем методик гибридизации или полимеразной цепной реакции (PCR). кДНК, кодирующие «адгезин» и иммуноглобулиновые участки иммуноадгезина, вставляют в тандеме в плазмидный вектор, который направляет эффективную экспрессию в выбранных клетках-хозяевах.
Экспрессия полипептидов
Полипептид (например, антитело), вырабатываемый, используя способ, описанный в настоящем документе, обычно получают, используя рекомбинантные техники.
Подходящие клетки-хозяева для клонирования или экспрессии siRNA в векторы в настоящем документе представляют собой клетки прокариот, дрожжей или высших эукариот. К подходящим прокариотам для этой цели относятся эубактерии, такие как Грам-отрицательные или Грам-положительные организмы, например, энтеробактерии, такие как Escherichia, например, E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, описанная в DD 266710, опубликованном 12 апреля 1989), Pseudomonas, такие как P. aeruginosa и Streptomyces. Эти примеры являются, скорее, иллюстративными, чем ограничивающими.
Помимо прокариот в качестве клонирующих или экспрессирующих хозяев для векторов, кодирующих полипептиды, подходят эукариотические микробы, такие как мицелиальные грибы или дрожжи. Среди низших эукариотических микроорганизмов-хозяев чаще всего используются Saccharomyces cerevisiae или обыкновенные хлебопекарные дрожжи. Тем не менее, широко доступно и может использоваться в настоящем документе большое число других родов, видов и штаммов, таких как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24178), K.waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и мицелиальные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и хозяева Aspergillus, такие как A. nidulans и A. niger.
Для экспрессии гликозилированного полипептида подходящие культивируемые клетки получают из многоклеточных организмов. К примерам клеток беспозвоночных относятся клетки растений и насекомых. Было идентифицировано большое число бакуловирусных штаммов и вариантов и соответствующих пермиссивных клеток-хозяев насекомых от хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и тутовый шелкопряд Bombyx mori. Большое число вирусных штаммов для трансфекции доступно в печати, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вируса по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. В качестве хозяев также могут быть использованы культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томата и табака.
Однако существовала потребность в клетках позвоночных, и размножение клеток позвоночных в культуре (культуре ткани) стало принятой процедурой. К примерам используемых линий клеток млекопитающих относятся, но ими не ограничиваясь, клетки почки обезьяны CV1, трансформированные вирусом SV40 (COS-7, ATCC CRL 1651); клетки эмбриональной почки человека (клетки 293 или клетки 293, субклонированные для подращивания в суспендированной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки хомячка-младенца (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки Сертоли мыши (TM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы буффало (BRL 3A, ATCC CRL 1442); клетки легкого человека (W138, ATCC CCL 75); клетки печени человека (Hep G2, HB 8065); опухоль молочных желез мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS4; и клетки гепатомы человека (Hep G2).
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами для продукции полипептида и культивируют в принятых питательных средах, модифицированных подходящим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих желательные последовательности.
Клетки-хозяева, использованные для продукции полипептида в способах по настоящему изобретению, могут быть культивированы в большом числе сред. Для культивирования клеток-хозяев подходят коммерчески доступные среды, такие как Ham’s F10 (продукция фирмы Sigma), Minimal Essential Medium (среда МЕМ), (продукция фирмы Sigma), RPMI-1640 (продукция фирмы Sigma) и среда Игла в модификации Дульбекко (DMEM), (продукция фирмы Sigma), или среда Игла в модификации Дульбекко GIBCO®: питательная смесь F-12 (продукция фирмы Invitrogen). Кроме того, в качестве культуральных сред для клеток-хозяев может быть использована любая из сред, описанных в статьях Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США 4767704; 4657866; 4927762; 4560655 или 5122469; WO 90/03430; WO 87/00195 или пат. США Re. 30985. Также могут быть использованы другие определенные или синтетические ростовые среды, и подходящая среда для подращивания конкретного типа клеток-хозяев известна специалисту в области молекулярной и клеточной биологии. Любая из таких сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальций, магний и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как ГЕНТАМИЦИНТМ, гигромицин), микроэлементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или равноценным источником энергии. Также могут быть включены любые другие необходимые добавки в подходящих концентрациях, которые были бы известны специалисту в данной области. Условия культивирования, такие как температура, величина рН и подобное, ранее использовались для клетки-хозяина, выбранной для экспрессии, и будут очевидны специалисту в данной области.
Для культивирования клеток могут быть использованы стандартные условия культивирования клеток. Клетки подращивают и поддерживают при подходящей температуре, газовой смеси и величине рН (таких как от около 20°С до около 37°С, от около 6% до около 84% СО2 и при величине рН между около 5 и около 9). В некоторых вариантах осуществления клетки подращивают на подходящей клеточной среде при 37°С в течение первых 48 часов и изменяют до 33° в течение последующих 12 дней. Реакции могут быть осуществлены в аэробных или анаэробных условиях, исходя из необходимых условий для культивирования клеток-хозяев. В некоторых вариантах осуществления клетки подращивают, используя любой известный способ ферментации, к которому относятся, но ими не ограничиваясь, ферментация, периодическая ферментация с подпиткой или непрерывные процессы.
При использовании рекомбинантных техник полипептид может быть получен внутриклеточно, в периплазматическом пространстве или прямо секретирован в среду. При продукции полипептида внутриклеточно на первой стадии удаляют дебрис в виде частиц, либо клетки-хозяева, либо лизированные клетки (например, получаемые при гомогенизации), например, центрифугированием или ультрафильтрацией. При секреции полипептида в среду обычно сначала концентрируют супернатанты от таких экспрессирующих систем, используя коммерчески доступный фильтр для концентрирования белка, например, устройство ультрафильтрации Amicon или Millipore Pellicon.
Наборы
Настоящее изобретение также предоставляет наборы, содержащие композиции и инструкции для применения, содержащие описание способов по изобретению. Наборы могут содержать культивируемые клетки, siRNA, последовательности-мишени, трансфицирующие агенты, инструкции по осуществлению способов по настоящему изобретению или любое их сочетание.
Следующие примеры предлагаются для иллюстрации, но не ограничения изобретения.
ПРИМЕРЫ
Понятно, что примеры и варианты осуществления, описанные в настоящем документе, предназначены лишь для целей иллюстрации и что большое число модификаций или изменений в свете этого будет понятно специалистам в данной области и должно быть включено в сущность и сферу действия настоящей заявки.
Пример 1: Нокдаун PDHK1, PDHK2, PDHK3 и LDHa снижает продукцию лактата и повышает титр/выработку антитела
Материалы и способы
Создание вектора, нацеливающего LDHa/PDHK1, 2, 3
Последовательность, нацеленную на LDHa, выбирали, как описано ранее авторами Kim and Lee et al, Appl. Microbiol. Biotechnol. 74(1):152-159 (2007), и последовательность siRNA для LDHa представляет собой CTCGATTCCGTTATCTGAT (SEQ ID NO:1). Для создания последовательности siRNA, нацеленной на PDHK, частичные кДНК-последовательности PDHK1, 2 и 3 в клетках СНО клонировали путем полимеразной цепной реакции с обратной транскрипцией (RT-PCR) с праймерами, расположенными в высококонсервативных регионах генов PDHK. Клонированные неполные последовательности использовали для создания последовательности siRNA согласно способу, описанному Elbashier et al. (Methods 26:199-213 (2002)).
Последовательность (siRNA), нацеливающая PDHK1: GCAGTTCCTGGACTTCGGA (SEQ ID NO:2)
Последовательность (siRNA), нацеливающая PDHK2: CATTCAGTACTTCTTGGAC (SEQ ID NO:3)
Последовательность (siRNA), нацеливающая PDHK3: TGTAGCTGATGTCGTGAAA (SEQ ID NO:4)
Единичную конструкцию, содержащую последовательности, нацеленные на LDHa и PDHK, создавали, используя вектор pSilencer 3.1-H1 hygro (Cat#. AM5766, Applied Biosystems/Ambion, Austin, TX). siRNA для LDHa вставляли в сайт KasI вектора pSilencer 3.1 с добавлением промотора U6 из вектора pSilencer 2.1 вблизи от 5’конца siRNA. Последовательности siRNA для siRNA PDHK1 и 2 вставляли в сайты BamHI/HindIII и HindIII, соответственно. Сайт BgIII вставляли с 3’ стороны от siRNA PDHK2 и использовали для вставки siRNA PDHK3. В качестве отрицательного контроля использовали вектор pSilencer 3.1, содержащий закодированную последовательность siRNA.
Культура клеток
Клетки СНО, дефицитные по дигидрофолатредуктазе (DHFR), культивировали в собственной среде на основе DMEM/F12 в колбах со встряхиванием при 37°С и 5% СО2. Клетки пересевали каждые три-четыре дня.
Разработка стабильной линии клеток с siRNA (клон siRNA)
Линию клеток СНО, резистентную к метотрексату (МТХ) в концентрации 25 нМ и экспрессирующую рекомбинантное моноклональное антитело, трансфицировали, используя липофектамин 2000 CD (Cat#12566-014, продукция фирмы Invitrogen, Carlsbad, CA) согласно рекомендации производителя (Invitrogen, Carlsbad, CA). Трансфицированные клетки центрифугировали и засевали в селективную (без глицина, гипоксантина и тимидина) среду на основе DMEM/F-12, содержащую МТХ в концентрации 25 нМ и гигромицин в концентрации 400 мкг/мл (Cat#10687010, продукция фирмы Invitrogen, Carlsbad, CA). Ресуспендированные клетки помещали в 96-луночные планшеты для получения отдельных клонов. Клоны siRNA получали путем трансфекции плазмидой с siRNA, содержащей последовательности, нацеленные на гены LDHa и PDHK, тогда как модельные клоны получали путем трансфекции модельной плазмидой (Cat#. AM5766, Applied Biosystems/Ambion, Austin, TX), содержащей закодированную последовательность, созданную без явной гомологии с известными генами.
Количественный анализ ПЦР в режиме реального времени (qRT-PCR или Taqman)
Суммарную РНК из отдельных клонов выделяли, используя набор RNeasy 96 (Cat#74181, продукция фирмы Qiagen), и обрабатывали путем расщепления ДНКазой (Cat#79254, набор ДНКаз, свободных от РНКаз, продукция фирмы Qiagen) для удаления остаточной ДНК, возможно, присутствующей в образцах выделенной РНК. Taqman осуществляли, используя универсальную смесь для qRT-PCR согласно инструкциям производителя (Cat#4309169, продукция фирмы Applied Biosystems), и уровни экспрессии PDHK и LDHa нормализовали к гену домашнего хозяйства β-микроглобулина.
Последовательности праймеров и зондов, использованные для анализа Taqman, представлены далее:
Прямой праймер PDHK1:
Обратный праймер PDHK1:
Зонд PDHK1:
Прямой праймер PDHK2:
Обратный праймер PDHK2:
Зонд PDHK2:
Прямой праймер PDHK3:
Обратный праймер PDHK3:
Зонд PDHK3:
Прямой праймер LDHa:
Обратный праймер LDHa:
Зонд LDHa:
Прямой праймер β-микроглобулина:
Обратный праймер β-микроглобулина:
Зонд β-микроглобулина:

Оценка клонов, выращенных во встряхиваемых сосудах с подпиткой
Двенадцать клонов siRNA и двенадцать модельных клонов засевали в специальную среду для продукции с величиной рН 7,15, используя 14-дневный способ культивирования с подпиткой с одной болюсной подпиткой на 3 день и сдвигом температуры с 37°С до 33°С на 2 день. Жизнеспособность клеток и подсчет жизнеспособных клеток отслеживали посредством исключения красителя трипанового синего, используя анализатор Vicell (продукция фирмы Beckman Coulter). Концентрации лактата измеряли на день 3, 7, 10 и 14, используя анализатор Nova Bioprofile (продукция фирмы Nova biomedical). Среднюю скорость специфической продукции лактата клетками qs рассчитывают как угол наклона графика интегрированного суммарного числа клеток, и накопленный выработанный лактат [St-So] рассчитывают, исходя из уравнения равновесия массы лактата, составленного на объем всей культуры:
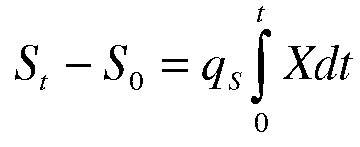
где St представляет собой суммарное количество лактата в культуральном объеме (мг) во время t, S0 представляет собой суммарное количество лактата в культуральном объеме (мг) во время t=0, X представляет собой суммарное число клеток в культуральном объеме в любое данное время, t и qs представляет собой скорость специфической продукции лактата в мг/клетка/день. Поскольку вышеуказанное уравнение составляют для интервала времени между t=0 и t=t, то qs представляет собой среднюю скорость продукции лактата за данный интервал времени. Согласно правилу, использованному в настоящей работе, если лактата вырабатывается больше, чем потребляется клеткой, то величина qs положительна.
Принцип действия биореактора с подпиткой
Эксперименты в биореакторе осуществляли в биореакторах с механическим перемешиванием объемом 2 л (продукция фирмы Applikon, foster City, CA), функционирующих при рабочем объеме 1,5 л. После добавления концентрированных питательных веществ через 72 часа после инокуляции при необходимости добавляли глюкозу в течение 14-дневного культивирования с подпиткой. Растворенный кислород и встряхивание поддерживали в культурах биореактора при заданных значениях 30% насыщения воздуха и 275 об/мин, соответственно. Величину рН культуры контролировали на 7,0 путем добавления газа СО2 или раствора Na2CO3 в концентрации 1М. Температуру культуры поддерживали при 37°С в течение первых 48 часов и затем изменяли до 33°С. Контроль процесса в каждом биореакторе осуществляли, используя цифровую контрольную систему фирмы B. Braun Biotech (Allentown, PA).
Анализы образцов
Титр антитела определяли, используя принятую аффинную хроматографию с белком А, используя UV детекцию. См. статью Fahrner et al., Biotechnol. Appl. Biochem. 30:121-128 (1999). Образцы культуры анализировали в отношении концентрации жизнеспособных клеток и жизнеспособности с помощью счетчика клеток Vi-Cell AS (продукция фирмы Beckman Coulter, Fullerton, CA), величины рН и концентрации лактата с помощью биоанализатора Bioprofile 400 (продукция фирмы Nova Biomedical, Waltham, MA) и осмолярности с помощью осмометра для большого числа образцов (продукция фирмы Advanced Instruments, Norwood, MA).
Статистический анализ
Двусторонний t-критерий Стьюдента рассчитывали, используя программное обеспечение JMP.
Результаты
Создание вектора siRNA, нацеливающего PDHK и LDHa
По сообщению Harris et al. (Adv. Enzyme Regul. 42:249-59 (2002) в клетках млекопитающих существует четыре гена PDHK. Для оценки наличия в клетках СНО всех четырех генов PDHK создавали четыре набора праймеров для ОТ-ПЦР на основе консервативных регионов между последовательностями PDHK человека и мыши. Результаты ПЦР выявили, что даже если в клетках СНО могут быть детектированы мРНК всех четырех PDHK, в дефицитных по DHFR (дефицитных по дигидрофолатредуктазе) клетках СНО уровень мРНК PDHK4 минимален и намного меньше, чем 3 других PDHK. Поэтому нокаутировали экспрессию лишь генов PDHK1, 2 и 3 наряду с геном LDHa. Для LDHa и каждого PDHK создавали и тестировали в клетках СНО три последовательности siRNA, чтобы выбрать последовательность siRNA, у которой наблюдается наилучшее снижение гена-мишени. Лучшую последовательность siRNA для LDHa выбирали, исходя из находок авторов Kim and Lee. Appl. Microbiol. Biotechnol. 74(1):152-9 (2007). Последовательность siRNA для LDHa и генов PDHK создавали в одном векторе, в котором siRNA для LDHa находилась под контролем промотора U6, тогда как siRNA для каждой PDHK запускалась промоторами Н1 (фиг.1).
Получение устойчивых клонов со сниженной экспрессией PDHK1, 2, 3 и LDHa
Конструкцию siRNA, нацеливающую гены PDHK и LDHa, трансфицировали в клетки СНО, экспрессирующие моноклональное антитело для получения отдельных клонов, названных клонами siRNA. Отдельные клоны siRNA анализировали в отношении экспрессии мРНК четырех генов, PDHK1, 2, 3 и LDHa, используя анализ Taqman. Двенадцать клонов siRNA, у которых наблюдалась самая сниженная экспрессия вышеуказанных четырех генов, идентифицировали (фиг.2) для проведения дополнительного анализа. В клетки, экспрессирующие то же самое антитело, также трансфицировали модельный вектор, содержащий закодированную последовательность, для получения отдельных клонов, названных модельными клонами. Двенадцать модельных клонов выбирали случайным образом в качестве контроля, и их уровни экспрессии мРНК генов LDHa и PDHK1, 2 и 3 также анализировали с помощью Taqman. В среднем по сравнению с модельными клонами уровни экспрессии мРНК LDHa, PDHK1, 2 и 3 в выбранных двенадцати клонах siRNA снижались на 90%, 32%, 83% и 70%, соответственно (фиг.2).
Оценка во встряхиваемых сосудах с подпиткой клонов siRNA и модельных клонов (а) Сниженные уровни лактата и повышенные величины рН в культуральных средах, обнаруженные в клонах siRNA
Для оценки влияния siRNA-опосредованного снижения LDHa и PDHK на продукцию лактата оценивали 12 клонов siRNA и 12 модельных клонов во встряхиваемых сосудах в собственной среде, используя 14-дневный процесс с подпиткой и изменением температуры. Эксперимент был повторен три раза, и наблюдались аналогичные результаты. Результаты одного ряда эксперимента представлены на фигурах как репрезентативные. Результаты показали, что в целом по сравнению с модельными клонами у клонов siRNA уровни лактата были снижены (фиг.3). На 14 день у клонов siRNA в среднем наблюдалось на 91% меньше лактата, чем у модельных клонов (р<0,0001) (фиг.3А). В соответствии с меньшим уровнем лактата в клонах siRNA за 14-дневный период продукции средняя скорость продукции лактата клонов siRNA составила 0,02 мг/106 клеток/день со знаком минус, указывая на то, что скорость синтеза лактата меньше, чем скорость потребления. Напротив, у модельных клонов средняя скорость продукции лактата оказалась 0,01 мг/106 клеток/день, указывая на то, что в целом скорость синтеза лактата выше, чем скорость потребления. Это различие в скорости продукции лактата между клонами siRNA и модельными клонами оказалось статистически значимым (р<0,002) (фиг.3В). Поскольку уровень лактата в средах влияет на величину рН, на 14 день средняя величина рН у модельных клонов снизилась до 6,54, тогда как средняя величина рН у клонов siRNA составила 7,04 (фиг.3С). У модельных клонов обнаруженная меньшая средняя величина рН находится в соответствии с большим средним уровнем лактата.
b) Повышенные титр антител и специфическая выработка (Qp), наблюдаемые в клонах siRNA
Для изучения, влияет ли нокдаун экспрессии генов PDHK и LDHa на продукцию антитела, собирали образцы из экспериментов во встряхиваемом сосуде с подпиткой на день 3, 7, 10 и 14 для измерения титров антитела с помощью хроматографии с белком А. Данные показали, что в среднем клоны siRNA продуцировали на 68% больше антитела, чем модельные клоны (фиг.4А, р<0,022), и средняя специфическая для клеток выработка (Qp), измеренная в пг/клетка-день, у клонов siRNA оказалась на 75% выше, чем у модельных клонов (фиг.4В, р<0,006). Для оценки роста клеток из встряхиваемого сосуда на день 3, 7, 10 и 14 собирали образцы для измерения числа жизнеспособных клеток и жизнеспособности, чтобы рассчитать общее число жизнеспособных клеток (IVCC). В противоположность титрам антитела и величинам Qp в росте клеток между двумя группами не наблюдалось заметных различий (фиг.4С). Характерные признаки, связанные с качеством продукта антитела, к которым относятся профиль гликанов, варианты заряда и процент агрегации, оказались сопоставимыми между клонами siRNA и модельными клонами.
Оценка культивирования в биореакторе с подпиткой клонов siRNA и модельных клонов
Поскольку культивирование в рН-контролируемом биореакторе с подпиткой представляет собой стандартную модель в уменьшенном размере широкомасштабного производства, культивирование некоторых клонов siRNA и модельных клонов в биореакторах объемом 2 л изучалось дополнительно. Принимая во внимание ограничение доступности биореактора и сложность эксперимента, не культивировали 12 клонов siRNA и 12 модельных клонов в двух повторах вследствие непрактичности. Для оценки в биореакторе объемом 2л выбирали два типичных клона siRNA и два типичных модельных клона, метаболические профили которых лучше отражали средние характеристики каждой группы для минимизации систематической ошибки отбора, наряду с исходной линией, использованной для трансфекций плазмидой siRNA и модельной плазмидой. Образцы культур клеток собирали ежедневно (за исключением дней 6 и 13) для анализа количества лактата, глюкозы, осмолярности и титра. Концентрации лактата клонов siRNA в основном оставались на одном уровне, тогда как концентрации лактата модельных и исходных клонов продолжали повышаться в течение 14-дневного периода продукции. На 14 день два клона siRNA в средах в среднем имели уровень лактата на 86% ниже, чем модельные клоны или исходный клон (фиг.5А), и обладали меньшей скоростью специфической продукции лактата, чем модельные клоны и исходная линия (фиг.5В). Аналогично, осмолярности клонов siRNA оставались около 300 мОсм, тогда как осмолярности модельных клонов или исходного клона продолжали повышаться в течение 14-дневного периода продукции. На 14 день средние осмолярности 2 клонов siRNA оказались на 60% ниже, чем у модельных и исходных клонов (фиг.5С). Важно, что на 14 день клоны siRNA в среднем вырабатывали антитело на 125% больше, чем модельные клоны (фиг.6). Как обнаружено при оценке во встряхиваемой колбе с подпиткой, в биореакторах объемом 2 л клоны siRNA и модельные клоны обладали сопоставимыми показателями жизнеспособности и клеточного роста.
Обсуждение
Ранее проведенное исследование продемонстрировало, что снижение экспрессии гена LDHa самостоятельно оказалось способно снизить продукцию лактата. Kim and Lee, Appl. Microbiol. Biotechnol. 74(1):152-9 (2007). Тем не менее, в этом исследовании несмотря на 45-79% снижение уровня лактата, не оказалось существенного улучшения величины Qp и титра продукта, это указывает на то, что в клетках СНО нокдаун LDHa самостоятельно недостаточен для улучшения Qp и эффективного выхода продукта. Кроме того, одновременно снижение в клетках СНО PDHK1, 2 и 3 оказалось недостаточным ни для снижения уровня лактата, ни для повышения выработки антитела. Поскольку единственный путь выработки клетками лактата проходит через восстановление пирувата, а пируват не только может быть превращен в лактат с помощью LDH, но также с помощью PDH превращен в ацетил-КоА, входящий в цикл ТСА и окисляющийся, снижение продукции лактата за счет нокдауна экспрессии LDHa и стимуляция вхождения пирувата в цикл ТСА за счет нокдауна генов PDHK могут обладать синергитическим влиянием на снижение уровня лактата и обеспечение клетки большей энергией и, возможно, промежуточными продуктами метаболизма, что приведет к повышенной продукции антитела.
Во всех протестированных клонах экспрессия LDHa, PDHK2 и PDHK3 снижалась существенно, а экспрессия PDHK1 снижалась умеренно. Умеренное снижение экспрессии PDHK1 происходит, вероятно, вследствие неоптимальной последовательности-мишени siRNA, поскольку умеренное снижение наблюдалось с тремя протестированными последовательностями siRNA для PDHK1. В модельных клонах и клонах siRNA наблюдались варианты продукции лактата и продукции антитела, поскольку каждый клон обладал различными уровнями экспрессии LDHa и PDHK. Тем не менее на 14 день при культивировании во встряхиваемом сосуде с подпиткой средний уровень лактата в группе siRNA оказался ниже, чем в модельной группе, что привело к меньшей средней величине рН у модельных клонов по сравнению с величиной рН у клонов siRNA. Гораздо важнее, что, помимо меньшей скорости специфической продукции лактата, повысились средний титр и Qp клонов siRNA на 68% и 75%, соответственно, по сравнению с модельными клонами при отсутствии заметных различий в росте клеток и качестве продукта между клонами siRNA и модельными клонами. Интересно, что между титрами на 14 день и уровнями лактата на 14 день существовала хорошая обратная зависимость среди модельных клонов, но не среди клонов siRNA. Обнаруженные различия в титрах и уровнях лактата среди модельных клонов, вероятно, могут иметь место, поскольку исходный клон является гетерогенным в выработке антитела и клеточном метаболизме, даже если клеточную линию получали из одного клона. В общей сложности оценивали 12 модельных клонов, принимая во внимание клональную вариативность. Данные указывают на то, что в клетках СНО нокдаун гена LDHa и генов PDHK одновременно снижает уровень лактата и улучшает продукцию антитела. Следовательно, эффективным подходом в разработке надежных и продуктивных способов получения антитела является одновременное снижение и LDHa, и PDHK.
Дополнительно изучались характеристики 2 модельных и 2 клонов siRNA в биореакторах объемом 2 л в двух повторах. Эти 4 клона выбирали так, чтобы лучше представить среднюю выработку в каждой группе на основании оценок во встряхиваемом сосуде с подпиткой. Подобно наблюдениям, полученным из эксперимента со встряхиваемым сосудом, при оценке в биореакторе объемом 2 л клоны siRNA обладали меньшими уровнями лактата и более высокими титрами, чем модельные клоны. С учетом регуляции величины рН в биореакторах с подпиткой объемом 2 л у модельных культур наблюдалась повышенная осмолярность по сравнению с культурами siRNA, поскольку для поддержания заданной точки рН более высоким уровням лактата в модельных клонах требовалась добавка большего количества щелочи.
В заключение, данные, полученные во встряхиваемом сосуде с подпиткой, и оценки в биореакторе объемом 2 л показали, что в клетках СНО одновременный нокдаун LDHa, PDHK1, 2 и 3 эффективен в снижении уровня лактата и повышении титра антитела, не влияя на рост клеток и качество продукта.
Реферат
Изобретения относятся к области биотехнологии и касаются способа снижения продукции лактата в клетках млекопитающего, способа сайлесинга или снижения в клетке млекопитающего транскрипции лактатдегидрогеназы (LDH) и киназы пируватдегидрогеназы (PDHK), способа получения клетки млекопитающего, которая проявляет пониженное продуцирование лактата в культуре, вектора, содержащего первую гетерологичную нуклеотидную последовательность, кодирующую малую интерферирующую РНК (миРНК), специфичную для лактатдегидрогеназы, и вторую гетерологичную нуклеотидную последовательность, кодирующую миРНК, специфичную для киназы пируватдегидрогеназы, каждая из которых связана со своим промотором. Представленные изобретения позволяют снизить в культивируемых клетках продукцию лактата и повысить продукцию гетерологичного полипептида. 6 н. и 34 з.п. ф-лы, 6 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ получения гетерологичных белков

Комментарии