Микроорганизм, обладающий способностью продуцировать l-лизин, и способ получения l-лизина с использованием этого микроорганизма - RU2694729C2
Код документа: RU2694729C2
Чертежи












Описание
Область изобретения
Настоящее изобретение относится к микроорганизму, продуцирующему L-лизин, и способу получения L-лизина с использованием этого микроорганизма.
Предшествующий уровень техники
Микроорганизм рода Corynebacterium может использовать органические кислоты, такие как глюконат, ацетат и пируват, а также глюкозу, сахарозу и фруктозу в качестве источника углерода. Среди них ацетат, который представляет собой органическую кислоту, относящуюся к монокарбоновым кислотам, поступает в клетки путем пассивной диффузии или посредством переносчика монокарбоновых кислот (MctC), когда его использует микроорганизм рода Corynebacterium, фосфорилируется ацетаткиназой (аскА) с превращением в ацетилфосфат и включается в ацетил-КоА с помощью фосфотрансацетилазы (pta). Образованный таким образом ацетил-КоА непосредственно включается в цикл трикарбоновых кислот (ЦТК) и глиоксилатный цикл (J. Bacterid. 2009. 191: 940-948), и таким образом образуется оксалоацетат, который является предшественником лизина.
Тем не менее, когда штамм рода Corynebacterium культивируют с использованием ацетата в качестве единственного источника углерода или в составе смешанного источника углерода, существует проблема, которая заключается в том, что может проявляться феномен ингибирования роста в соответствии с его концентрацией. Известно, что применение ацетата имеет ограничения в том, что скорость его метаболизма является низкой по сравнению с сахаридами, такими как глюкоза, а также, поскольку ацетат может ингибировать рост клеток, когда он присутствует в определенной концентрации в клетке, увеличение концентрации ацетата в культуральной среде может увеличивать лаг-фазу, тем самым увеличивая общее время культивирования (Arch. Microbiol. 1991. 155: 505-510). Соответственно, существует потребность в разработке способа для быстрого превращения ацетата в культуральной среде в ацетил-КоА в клетке.
Однако, ацетаткиназа и фосфотрансацетилаза, которые используются в пути активации ацетата, обладают двунаправленностью (обратимым действием), и поэтому существует проблема в том, что ацетил-КоА может быть превращен обратно в ацетат, и также сообщалось, что это может оказывать отрицательное действие на продуцирование L-лизина. Следовательно, разработка способа эффективного использования ацетата все еще актуально.
Описание
Техническая задача
Авторы настоящего изобретения приложили много усилий для создания микроорганизма для эффективного потребления ацетата, который вырабатывается во время культивирования или предоставляется в качестве нового источника углерода, и в результате они подтвердили, что микроорганизм, обладающий усиленной активностью ацетаткиназы пути активации ацетата, может увеличивать способность потреблять ацетат и продуцировать L-лизин, тем самым создав настоящее изобретение.
Техническое решение
Задача настоящего изобретения заключается в том, чтобы предложить микроорганизм рода Corynebacterium, продуцирующий L-лизин, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью.
Другая задача настоящего изобретения заключается в том, чтобы предложить способ продуцирования L-лизина с использованием вышеупомянутого организма.
Полезные эффекты изобретения
Микроорганизм по настоящему изобретению, являясь штаммом, обладающим повышенной способностью потреблять ацетат благодаря усиленному пути активации ацетата, представляет собой микроорганизм, который может продуцировать L-лизин с высоким выходом. Полученный таким образом L-лизин можно использовать в различных продуктах, включая не только корма для животных или добавки к кормам для животных, но также продукты питания и пищевые добавки для людей, лекарственные средства и так далее.
Краткое описание графических материалов
На Фиг. 1а и 1б показаны графики, иллюстрирующие анализ способности КССМ11016Р (контрольный штамм) и модифицированного КССМ11016Р (модифицированный штамм с введенными pta и pta-ackA) потреблять ацетат в среде с ацетатом (Фиг. 1а) и в среде без ацетата (Фиг. 1б).
На Фиг. 2 показана схематическая диаграмма pDZTn-lysCP1-ackA, вектора для сверхэкспрессии ackA с промотора LysCPI, который представляет собой сильный промотор.
На Фиг. 3 показан график, иллюстрирующий анализ способности КССМ11016Р (контрольный штамм) и модифицированного КССМ11016Р (модифицированный штамм с введенными pta, pta-ackA и acs) потреблять ацетат.
Наилучшее воплощение изобретения
В одном аспекте настоящего изобретения предложен микроорганизм рода Corynebacterium, продуцирующий L-лизин, в котором усилена активность ацетаткиназы. Более конкретно, миркоорганизм представляет собой микроорганизм рода Corynebacterium, продуцирующий L-лизин, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью.
Как его используют здесь, термин "L-лизин" относится к типу L-аминокислоты, которая представляет собой основную а-аминокислоту и незаменимую аминокислоту, не синтезируемую in vivo, имеющую химическую формулу NH2(CH2)4CH(NH2)COOH.
Ацетат представляет собой органическую кислоту, относящуюся к монокарбоновым кислотам, которая поступает в клетки путем пассивной диффузии или посредством переносчика монокарбоновых кислот, когда его использует микроорганизм рода Corynebacterium, фосфорилируется ацетаткиназой с превращением в ацетилфосфат и включается в ацетил-КоА с помощью фосфотрансацетилазы. Образованный таким образом ацетил-КоА непосредственно включается в цикл трикарбоновых кислот (ЦТК) и глиоксилатный цикл, и таким образом образуется оксалоацетат, предшественник лизина. Микроорганизм рода Corynebacterium может использовать ацетат в качестве источника углерода. Однако, когда этот микроорганизм культивируют с использованием ацетата в качестве единственного источника углерода или в составе смешанного источника углерода, существует проблема в том, что проявляется феномен ингибирования роста в соответствии с его концентрацией (Arch. Microbiol. 1991. 155: 505-510).
В общих чертах, существуют два пути активации ацетата для превращения ацетата в ацетил-КоА в клетке. Как описано выше, два фермента (то есть ацетаткиназа и фосфотрансацетилаза) действуют последовательно у штамма рода Corynebacterium. Известно, что ген ackA кодирует ацетаткиназу, а ген pta кодирует фосфотрансацетилазу (Microbiol. 1999 145: 503-513). В другом пути у штамма рода Escherichia задействована ацетил-КоА-синтетаза, и известно, что ген acs кодирует ацетил-КоА-синтетазу (Appl Microbiol Biotechnol. 2006. 71: 870-874). Однако, поскольку путь активации в штамме рода Escherichia происходит посредством обратимой реакции, не проводились попытки просто усилить этот путь.
Неожиданно, однако, авторы настоящего изобретения подтвердили не только то, что усиление ацетаткиназы может привести к быстрому превращению ацетата в ацетил-КоА в клетке, но также и то, что отрицательное действие по ингибированию роста, описанное выше, можно преодолеть для увеличения способности продуцирования L-аминокислоты. Следовательно, авторам настоящего изобретения удалось предоставить новый микроорганизм рода Corynebacterium, продуцирующий L-лизин, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью.
В примере воплощения по настоящему изобретению было подтверждено, что микроорганизм, в котором активность гена ackA была усилена, демонстрировал высокую скорость потребления ацетата и также значительное уменьшение лаг-фазы при росте микроорганизма. Напротив, было подтверждено, что когда активность гена pta была усилена, микроорганизм не демонстрировал какого-либо существенного различия в скорости потребления ацетата по сравнению с таковой в контрольной группе (Фиг. 1а и 1б), и таким образом было подтверждено, что белок, важный для увеличения способности потреблять ацетат путем активации ацетата и увеличения способности продуцировать L-лизин без ингибирования роста, представляет собой ацетаткиназу. То есть было подтверждено, что микроорганизм, который может продуцировать L-лизин с высоким выходом и обладает повышенной способностью потреблять ацетат без ингибирования роста, может быть получен путем усиления активности ацетаткиназы с помощью различных способов на основании вышеприведенных результатов.
Микроорганизм рода Corynebacterium по настоящему изобретению, который обладает повышенной способностью потреблять ацетат и повышенной способностью продуцировать L-лизин, может представлять собой микроорганизм рода Corynebacterium, который может продуцировать L-лизин и обладает усиленной активностью ацетаткиназы по сравнению с ее эндогенной активностью.
Дополнительно микроорганизм рода Corynebacterium, который обладает повышенной способностью потреблять ацетат и повышенной способностью продуцировать L-лизин, может представлять собой микроорганизм рода Corynebacterium, обладающий усиленной активностью ацетаткиназы по сравнению с ее эндогенной активностью, в котором дополнительно: (1) активность фосфотрансацетилазы усилена по сравнению с ее эндогенной активностью; (2) активность ацетил-КоА-синтетазы введена или усилена; или (3) активность фосфотрансацетилазы усилена по сравнению с ее эндогенной активностью и активность ацетил-КоА-синтетазы введена или усилена.
Авторы настоящего изобретения подтвердили, что у микроорганизма, обладающего активностью ацетаткиназы, которая является наиболее важной для увеличения способности потреблять ацетат и способности продуцировать L-лизин, усиленной по сравнению с ее эндогенной активностью, когда активность фосфотрансацетилазы дополнительно усилена по сравнению с ее эндогенной активностью и/или активность ацетил-КоА-синтетазы дополнительно введена или усилена, способность потреблять ацетат дополнительно увеличивается, и в данном изобретении авторы настоящего изобретения предложили такой новый микроорганизм. В примере воплощения по настоящему изобретению было подтверждено, что дополнительное введение гена acs, который имеет происхождение от микроорганизма рода Escherichia и кодирует ацетил-КоА, может увеличивать скорость потребления ацетата (Фиг. 3), и результаты подтверждают, что введение или усиление активности ацетил-КоА-синтетазы также может увеличивать скорость потребления ацетата, тем самым увеличивая способность продуцировать L-лизин.
Как его используют здесь, термин "ацетаткиназа (ЕС 2.7.2.1)" относится к ферменту, имеющему функцию продуцирования ацетилфосфата путем фосфорилирования ацетата. Гены, кодирующие ацетаткиназу, можно обобщенно отнести к ackA, и последовательности белка и гена ацетаткиназы можно получить из известной базы данных (например, GenBank от NCBI), но не ограничиваясь этим. Ацетаткиназа может иметь аминокислотную последовательность SEQ ID NO: 12, но любая последовательность белка, обладающая активностью ацетаткиназы, может быть включена без ограничения.
Как его используют здесь, термин "фосфотрансацетилаза (ЕС 2.3.1.8)" относится к ферменту, имеющему функцию превращения ацетилфосфата в ацетил-КоА путем реакции, приведенной ниже.
КоА + ацетилфосфат ↔ ацетил-КоА + фосфат
Как его используют здесь, термин "фосфотрансацетилаза" можно применять взаимозаменяемо в отношении ферментов, таких как фосфат-ацетилтрансфераза и фосфоацилаза. Ген, кодирующий фосфотрансацетилазу, можно обобщенно отнести к pta, и последовательности белка и гена фосфотрансацетилазы можно получить из известной базы данных (например, GenBank от NCBI), но не ограничиваясь этим. Фосфотрансацетилаза может иметь аминокислотную последовательность SEQ ID NO: 13, но может быть включена без ограничения любая последовательность белка, обладающая активностью фосфотрансацетилазы.
Как его используют здесь, термин "ацетил-КоА-синтетаза (ЕС 6.2.1.1)" относится к ферменту, имеющему функцию превращения ацетата в ацетил-КоА путем реакции, приведенной ниже.
ацетат + КоА ↔ ацетил-КоА
Ген, кодирующий ацетил-КоА-синтетазу, можно обобщенно отнести к acs, и последовательности белка и гена ацетил-КоА-синтетазы можно получить из известной базы данных (например, GenBank от NCBI), но не ограничиваясь этим. Ацетил-КоА-синтетаза может иметь аминокислотную последовательность SEQ ID NO: 14, но может быть включена без ограничения любая последовательность белка, обладающая активностью ацетил-КоА-синтетазы.
Каждый из описанных выше белков может включать, без ограничения, в дополнение к аминокислотным последовательностям, представленным в перечне последовательностей с помощью SEQ ID NO, любую аминокислотную последовательность, которая имеет гомологию 80% или больше, в особенности 90% или больше, более конкретно 95% или больше и еще более конкретно 97% или больше с перечисленными выше аминокислотными последовательностями, при условии, что эти аминокислотные последовательности кодируют белки, которые обладают действием по существу таким же или соответствующим каждому из этих белков. Кроме того, очевидно, что любой модифицированный белок, имеющий гомологию, описанную выше, может попадать в объем настоящего изобретения, несмотря на то, что этот белок может иметь аминокислотную последовательность с частичной делецией, модификацией, заменой или вставкой в нее.
Кроме того, гены, кодирующие каждый из белков по настоящему изобретению, также могут включать, без ограничения, дополнительно к полинуклеотидным последовательностям, описанным в перечне последовательностей с помощью SEQ ID NO, любую последовательность гена, кодирующую белки, которая имеет гомологию 80% или больше, в особенности 90% или больше, более конкретно 95% или больше, еще более конкретно 98% или больше и наиболее конкретно 99% или больше с каждой из перечисленных выше полинуклеотидных последовательностей, при условии, что эта последовательность гена кодирует белок, который обладает действием по существу таким же или соответствующим каждому из этих белков. Кроме того, очевидно, что любая полинуклеотидная последовательность, имеющая вышеупомянутые гомологии, может попадать в объем настоящего изобретения, несмотря на то, что эта последовательность может иметь частичную делецию, модификацию, замену или вставку в нее.
Как его используют здесь, термин "гомология" относится к степени идентичности между полипептидными последовательностями или аминокислотными последовательностями, кодирующими белки, и когда присутствует достаточно высокий процент гомологии, продукты экспрессии соответствующих генов могут обладать одинаковыми или сходными активностями.
Как его используют здесь, термин "эндогенная активность" относится к активному состоянию полипептида в микроорганизме в немодифицированном состоянии, то есть в природном состоянии.
Как его используют здесь, термин "усиление активности белка по сравнению с его эндогенной активностью" относится к повышению внутриклеточной активности белка в микроорганизме путем модифицирования белка для улучшения внутриклеточной активности по сравнению с активностью белка, которой он обладал в своем природном состоянии. Дополнительно, как его используют здесь, термин "усиление активности белка" относится не только к усилению активности белка по сравнению с его эндогенной активностью, но также к повышению внутриклеточной активности определенного белка путем модифицирования микроорганизма, который первоначально не обладал активностью этого определенного белка, для придания ему активности этого определенного белка и модифицирования для улучшения его внутриклеточной активности.
"Усиление" включает не только достижение более сильного действия, чем первоначальное действие благодаря повышению активности самого белка, но оно может быть выполнено по меньшей мере одним способом, выбранным из группы, состоящей из способа увеличения числа копий полинуклеотида, кодирующего белок, способа введения модификации в регуляторную последовательность гена, кодирующего белок, способа замены регуляторной последовательности гена, кодирующего белок, в хромосоме последовательностью, имеющую высокую активность, способа замены гена, кодирующего белок, мутированным геном для повышения активности белка и способа введения модификации в ген, кодирующий белок, на хромосоме для усиления активности белка, однако может быть включен, без ограничения, любой известный способ, который может усиливать активность белка по сравнению с его эндогенной активностью или усиливать введенную активность.
Как его используют здесь, термин "введение активности белка" относится к обеспечению активности определенного белка у микроорганизма, который не обладает активностью определенного белка.
"Введение активности белка" может быть выполнено различными способами, известными в данной области техники, например, способом вставки полинуклеотида, включающего полинуклеотидную последовательность, кодирующую белок, в хромосому; способом увеличения числа копий полинуклеотида путем такого способа как введение полинуклеотида в микроорганизм путем введения в векторную систему; способом введения промотора, способного проявлять улучшенную активность, или введения белка с модификацией в промоторе в область, лежащую выше по ходу транскрипции от полинуклеотидной последовательности, кодирующей белок; способом введения модификации в полинуклеотидную последовательность, кодирующую белок, и так далее, однако может быть включен, без ограничения, любой известный способ, которым можно вводить активность белка.
В вышеизложенном, увеличение числа копий полинуклеотида может быть выполнено в форме, в которой полинуклеотид функционально связан с вектором, или путем вставки полинуклеотида в хромосому или клетку-хозяин, хотя способ специально не ограничен этим. В частности, увеличение числа копий полинуклеотида может быть выполнено путем введения вектора, который способен реплицироваться и функционировать независимо от клетки-хозяина, и с которым полинуклеотид, кодирующий белок по настоящему изобретению, функционально связан, или может быть выполнено путем введения в клетку-хозяин вектора, который может вставлять полинуклеотид в хромосому клетки-хозяина и с которым полинуклеотид функционально связан.
Вектор представляет собой ДНК-конструкцию, включающую полинуклеотидную последовательность полинуклеотида, кодирующего белок-мишень, которая функционально связана с подходящей регуляторной последовательностью, обеспечивающей возможность экспрессии белка-мишени в клетке-хозяине. Регуляторная последовательность включает промотор, способный запускать транскрипцию, любую операторную последовательность для регуляции транскрипции, последовательность, кодирующую подходящую мРНК рибосом-связывающего домена, и последовательность, регулирующую терминацию транскрипции и трансляции. Вектор после трансформации им подходящей клетки-хозяина, может реплицироваться или функционировать независимо от генома хозяина или может сам интегрироваться в геном хозяина.
Вектор, используемый в настоящем изобретении, может не быть специально ограничен, при условии, что этот вектор способен реплицироваться в клетке-хозяине, и он может быть сконструирован с использованием любого вектора, известного в данной области техники. Примеры вектора могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве вектора-фага или вектора-космиды можно применять pWE15, М13, λMBL3, λMBL4, λIXII, λASHII, λAPII, λt10, λt11, Charon4A, Charon21A и так далее; и в качестве плазмидного вектора можно применять основанные на pBR, pUC, pBluescriptll, pGEM, pTZ, pCL, pET и так далее. Векторы, которые можно использовать в настоящем изобретении, специально не ограничены, но может быть использован любой известный вектор экспрессии, например вектор pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118, pCCIBAC и так далее.
Дополнительно полинуклеотид, кодирующий эндогенный белок-мишень, может быть заменен модифицированным полинуклеотидом в хромосоме с помощью вектора для вставки хромосомы в клетку-хозяин. Альтернативно, полинуклеотид, кодирующий чужеродный белок-мишень для введения в хромосому, может быть заменен модифицированным полинуклеотидом. Вставка полинуклеотида в хромосому может быть выполнена с использованием любого способа, известного в данной области техники, например, путем гомологичной рекомбинации. Поскольку вектор по настоящему изобретению может быть вставлен в хромосому путем гомологичной рекомбинации, дополнительно может быть включен маркер селекции для подтверждения вставки в хромосому. Маркер селекции применяют для отбора трансформированной клетки, то есть для подтверждения того, что полинуклеотид-мишень был вставлен, и можно использовать маркеры, способные обеспечивать отбираемые фенотипы, такие как устойчивость к лекарственному средству, потребность в питательном веществе, устойчивость к цитотоксическим агентам и экспрессия поверхностных белков. В условиях, где происходит обработка агентами селекции, только клетки, способные экспрессировать маркеры селекции, могут выжить или проявлять другие фенотипические признаки, и таким образом трансформированные клетки могут быть отобраны.
Как его используют здесь, термин "трансформация" относится к процессу введения вектора, включающего полинуклеотид, кодирующий белок-мишень, в клетку-хозяин, тем самым обеспечивая возможность экспрессии полинуклеотида, кодирующего белок, в клетке-хозяине. Для полинуклеотида, которым трансформируют, не имеет значения, вставляется ли он в хромосому клетки-хозяина и локализуется в ней, или он локализуется за пределами хромосомы, при условии, что он может экспрессироваться в клетке-хозяине. Дополнительно, полинуклеотид включает ДНК и РНК, которые кодируют белок-мишень. Полинуклеотид может быть вставлен в любой форме при условии, что он может быть введен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть введен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую все основные элементы, необходимые для самостоятельной экспрессии. Экспрессионная кассета обычно может включать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, домен связывания с рибосомой и сигнал терминации трансляции. Экспрессионная кассета может быть в форме вектора экспрессии, способного к саморепликации. Дополнительно полинуклеотид может быть введен в клетку-хозяина как есть и функционально связан с последовательностью, необходимой для его экспрессии в клетке-хозяине.
Дополнительно, как его используют здесь, термин "функционально связанный" относится к функциональной связи между промоторной последовательностью, которая запускает и опосредует транскрипцию полинуклеотида, кодирующего белок-мишень по настоящему изобретению, и вышеупомянутой последовательностью гена.
Способ трансформации вектором по настоящему изобретению может включать любой способ, которым можно вводить полинуклеотид в клетку, и трансформация может быть выполнена с помощью подходящей методики, известной в данной области техники, выбранной в соответствии с клеткой-хозяином. Например, способ может включать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, способ с полиэтиленгликолем (ПЭГ), способ с ДЭАЭ-декстраном, способ с катионными липосомами и способ с ацетатом лития/ДМСО и так далее, но не ограничиваясь ими.
Лучше, чтобы клетка-хозяин, предназначенная для использования, имела высокую эффективность введения ДНК и высокую эффективность экспрессии введенной ДНК, и для целей настоящего изобретения клетка-хозяин может представлять собой микроорганизм рода Corynebacterium.
Затем может быть выполнено введение модификации в последовательность контроля экспрессии для увеличения экспрессии полинуклеотида, хотя специально не ограничиваясь этим, путем индуцирования модификации в полинуклеотидной последовательности посредством делеции, вставки, консервативной замены или неконсервативной замены или их комбинации с целью дополнительно усилить активность последовательности контроля экспрессии; или путем замены полинуклеотидной последовательности на полинуклеотидную последовательность с усиленной активностью. Последовательность контроля экспрессии, хотя специально не ограничена ими, может включать промотор, операторную последовательность, последовательность, кодирующую домен связывания с рибосомой, последовательность для регуляции терминации транскрипции и трансляции и так далее.
Сильный экзогенный промотор может быть присоединен вместо исходного промотора в области выше по ходу транскрипции от экспрессионной единицы полинуклеотида. Примеры сильных экзогенных промоторов могут включать промотор pcj7, промотор lysCP1, промотор EF-Tu, промотор groEL, промотор асеА, промотор асеВ и так далее, и предпочтительно промотор, имеющий происхождение из Corynebacterium, такой как промотор pcj7 или промотор lysCP1. Последовательность промотора lysCP1 и способ его получения описаны в патенте Кореи No. 10-0930203, и вышеупомянутый патент Кореи включен сюда посредством ссылочного примера во всей своей полноте. В примере воплощения по настоящему изобретению было подтверждено, что присоединение гена ackA к промотору lysCP1, который представляет собой сильный промотор, приводит к улучшенной способности потреблять ацетат по сравнению с таковой у контрольной группы (Фиг. 3), и этот результат подтверждает, что с повышением уровня экспрессии гена ackA увеличивается скорость потребления ацетата.
Кроме того, модификация полинуклеотидной последовательности в хромосоме может быть выполнена путем индуцирования модификации в последовательности контроля экспрессии путем делеции, вставки, неконсервативной или консервативной замены или их комбинации для дополнительного усиления активности полинуклеотидной последовательности или путем замены на улучшенную полинуклеотидную последовательность для обеспечения более сильной активности.
Как правило, введение или усиление активности белка может увеличивать активность или концентрацию соответствующего белка относительно активности или концентрации белка дикого типа или в штамме микроорганизма на начальной стадии от по меньшей мере 10%, 25%, 50%, 75%, 100%, 150%, 200%, 300%, 400% или 500% максимально до 1000% или 2000%, но не ограничиваясь этим.
Как его используют здесь, термин "микроорганизм, продуцирующий L-лизин" относится к штамму микроорганизма, который способен продуцировать L-лизин для целей настоящего изобретения, и он представляет собой штамм, который способен эффективно потреблять ацетат в культуральной среде и накапливать L-ацетат без ингибирования роста. Микроорганизм может включать все микроорганизмы рода Corynebacterium, обладающие усиленной активностью ацетаткиназы по сравнению с ее эндогенной активностью, например, Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium thermoaminogenes, Brevibacterium flavum, Brevibacterium fermentum и так далее, но не ограничиваясь ими. В примере воплощения микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum, и примеры Corynebacterium glutamicum могут включать КССМ11016Р (патент Кореи No. 10-0397322), КССМ10770Р (патент Кореи No. 10-0924065), КССМ11347Р (патент Кореи No. 10-0073610) и CJ3P (Binder et al. Genome Biology 2012, 13: R40), но не ограничиваясь ими.
В примере воплощения по настоящему изобретению было подтверждено, что когда ген ackA сверхэкспрессировался в Corynebacterium glutamicum КССМ11016Р, используемом в качестве родительского штамма репрезентативного микроорганизма рода Corynebacterium, способность потреблять ацетат была повышена, и количество полученного L-лизина было увеличено без ингибирования роста (Примеры 2-6). Более того, сверхэкспрессия гена ackA у различных микроорганизмов рода Corynebacterium (КССМ10770Р, КССМ11347Р или CJ3P) также показала увеличение их способности продуцировать L-лизин (пример 7), и результаты подтверждают, что способность продуцировать L-лизин увеличивается вследствие усиления активности белка у микроорганизма рода Corynebacterium, который использует ацетаткиназу, кодируемую геном ackA, для утилизации ацетата. Дополнительно было подтверждено, что дальнейшее добавление активности фосфотрансацетилазы и/или введение или усиление активности ацетил-КоА, в дополнение к усилению активности ацетаткиназы, кодируемой геном ackA, также может увеличивать способность потреблять ацетат и способность продуцировать L-лизин.
В другом аспекте настоящего изобретения предложен способ получения L-лизина, включающий: (1) культивирование нового микроорганизма рода Corynebacterium, обладающего повышенной способностью продуцировать L-лизин благодаря повышенной способности потреблять ацетат из среды; и (2) выделение L-лизина из культуральной среды или культивируемого микроорганизма.
Микроорганизм рода Corynebacterium, обладающий повышенной способностью продуцировать L-лизин, является таким как описано выше.
Как его используют здесь, термин "культивирование" относится к выращиванию микроорганизма в условиях окружающей среды, контролируемых подходящим образом и искусственно. Согласно настоящему изобретению процесс получения L-лизина путем культивирования микроорганизма рода Corynebacterium может быть выполнен с использованием способов, хорошо известных в данной области техники. В частности, культивирование может проводиться непрерывно в периодическом процессе (процессе с подпиткой или повторяющемся процессе с подпиткой), но не ограничиваясь этим.
Среда, используемая для культивирования, должна подходящим образом соответствовать требованиям для конкретных штаммов. Культуральная среда для штаммов Corynebacterium уже известна (например, Manual of Methods for General Bacteriology. American Society for Bacteriology. Washington D.C., USA, 1981). Примеры источников углерода для использования в этой среде могут включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол, и органические кислоты, такие как глюконовая кислота, уксусная кислота и пировиноградная кислота, но не ограничиваясь этим. Эти источники углерода можно использовать по отдельности или в комбинации. Примеры источников азота для использования в среде могут включать пептон, дрожжевой экстракт, мясной бульон, солодовый экстракт, жидкий кукурузный экстракт, соевую муку и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Эти источники азота также можно использовать по отдельности или в комбинации. Примеры источников фосфора для использования в среде могут включать дигидрофосфат калия, гидроортофосфат калия или соответствующие натрий-содержащие соли. Дополнительно соли металлов, таких как сульфат магния или сульфат железа, необходимые для роста, могут содержаться в среде. Наконец, необходимые вещества для роста, такие как аминокислоты и витамины, также могут содержаться в дополнение к веществам, описанным выше. Дополнительно можно использовать предшественники, подходящие для культуральной среды. Эти источники можно добавлять в культуру подходящим способом во время культивирования путем периодического культивирования или непрерывного культивирования. Эти различные способы раскрыты в ссылках (например, "Biochemical Engineering" by James M. Lee, Prentice-Hall International Editions, 138-176).
Значение pH культуры может быть подведено подходящим образом с использованием такого соединения, как гидроксид натрия, гидроксид калия и аммония, или кислоты, такой как фосфорная кислота и серная кислота. Дополнительно можно применять пеногаситель, такой как полигликолевый сложный эфир жирной кислоты, для предупреждения образования пены. Дополнительно для поддержания аэробного состояния культуры в культуру может быть введен кислород или газ, содержащий кислород (например, воздух). Температура в культуре обычно может составлять от 20°С до 45°С, в частности, от 25°С до 40°С, но может варьировать в зависимости от условий. Дополнительно, культивирование можно продолжать до тех пор, пока не будет получено максимальное количество желаемой L-аминокислоты, которое может быть достигнуто в течение периода от 10 часов до 100 часов. L-лизин может секретироваться в культуральную среду или может оставаться в клетках.
Способ получения L-лизина по настоящему изобретению может включать выделение лизина из культивируемого микроорганизма или из культуральной среды. Способ выделения L-лизина из культивируемого микроорганизма или из культуральной среды может быть выполнен с использованием способа, известного в данной области техники, например, центрифугирования, фильтрования, анионообменной хроматографии, кристаллизации, высокоэффективной хроматографии (ВЭЖХ) и так далее, но способ не ограничивается ими.
Выделение может включать процесс очистки.
Подробное описание изобретения
Здесь и далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры и экспериментальные примеры. Однако, следующие примеры и экспериментальные примеры приведены исключительно для иллюстративных целей и не предназначены никаким образом ограничивать объем настоящего изобретения.
Пример 1: Получение вектора для вставки ackA, pta или pta и ackA в хромосому
Для получения вектора для последующей независимой или одновременной вставки гена ackA и гена pta в хромосому Corynebacterium вектор pDZTN (патент Кореи No. 10-1126041), сконструированный из вектора pDZ, использовали в качестве основного вектора для вставки генов-мишеней в область транспозона. Поскольку эти два гена образуют оперон в форме pta-ackA, для сверхэкспрессии только гена ackA для последующей вставки промоторный участок оперона pta-ackA был функционально связан с расположенной выше по ходу транскрипции открытой рамкой считывания (ОРС) гена ackA. Последовательности праймеров, использованные в Примерах, показаны в Таблице 1 ниже.
Для получения вектора для последующей вставки гена ackA были синтезированы праймеры (SEQ ID NO: 1 и 2) для амплификации гена ackA на основе полинуклеотидных последовательностей, опубликованных ранее, и участок ОРС гена ackA размером примерно 1300 п. н. амплифицировали путем ПЦР с использованием хромосомы Corynebacterium glutamicum АТСС 13032 в качестве матрицы. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 сек, отжига при 56°С в течение 30 сек и полимеризации при 72°С в течение 90 сек и полимеризация при 72°С в течение 7 мин. Подчеркнутые участки полинуклеотидных последовательностей представляют собой сайты рестрикции.

Кроме того, синтезировали праймеры (SEQ ID NO: 3 и 4) для амплификации промоторного участка оперона pta-ackA и промоторный участок размером примерно 350 п. н. амплифицировали путем ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС 13032 в качестве матрицы. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 сек, отжига при 56°С в течение 30 сек и полимеризации при 72°С в течение 90 сек; и полимеризация при 72°С в течение 7 мин. Подчеркнутые участки полинуклеотидных последовательностей представляют собой сайты рестрикции.
Амплифицированные путем ПЦР фрагменты ДНК обрабатывали ферментами рестрикции SpeI и NdeI для получения соответствующих сегментов ДНК. Полученные таким образом сегменты ДНК лигировали в вектор pDZTN, имеющий сайт для SpeI, трансформировали клетки Е. coli DH5α и высевали на твердую среду LB (Лурия-Бертани), содержащую канамицин (25 мг/л). Колонии, трансформированные вектором, в которых произошла вставка гена-мишени, отбирали, плазмиду получали известным традиционным способом выделения празмид, и полученная таким образом плазмида получила название pDZTN-Ppta_ackA.
Для получения вектора для последующей вставки гена pta был синтезирован праймер (SEQ ID NO: 5) к участку ОРС гена pta, и участок гена pta размером примерно 1750 п.н. амплифицировали путем ПЦР с использованием хромосомы Corynebacterium glutamicum АТСС 13032 в качестве матрицы наряду с праймерами (SEQ ID NO: 3 и 5) для амплификации участка, охватывающего область от промотора до конца ОРС гена pta. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации 94°С в течение 30 сек, отжига при 56°С в течение 30 сек и полимеризации при 72°С в течение 90 сек; и полимеризация при 72°С в течение 7 мин.
Амплифицированные путем ПЦР фрагменты ДНК обрабатывали ферментом рестрикции SpeI для получения сегментов DNA. Полученные таким образом сегменты ДНК лигировали в вектор pDZTN, имеющий сайт для SpeI, для получения плазмиды, и плазмида получила название pDZTN-pta.
Для получения вектора для одновременной вставки двух генов в форме оперона участок гена pta-ackA размером примерно 3000 п.н. был получен путем ПЦР с использованием хромосомы Corynebacterium glutamicum АТСС 13032 в качестве матрицы наряду с праймерами (SEQ ID NO: 3 и 2), которые служили для амплификации участка, охватывающего область от предсказанного промоторного участка оперона генов pta-ackA (SEQ ID NO: 10) до конца ОРС гена ackA. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 сек, отжига при 56°С в течение 30 сек и полимеризации при 72°С в течение 3 мин; и полимеризация при 72°С в течение 7 мин. Амплифицированные путем ПЦР фрагменты ДНК обрабатывали ферментом рестрикции SpeI для получения сегментов ДНК. Полученные таким образом сегменты ДНК лигировали в вектор pDZTN, имеющий сайт для SpeI, для получения плазмиды, и плазмида получила название pDZTN-pta-ackA.
Пример 2: Анализ способности потреблять ацетат штамма с вставленным в хромосому геном ackA и/или геном pta
Векторами трех типов, полученными в примере 1, т.е. pDZTN-Ppta_ackA, pDZTN-pta и pDZTN-pta-ackA, трансформировали Corynebacterium glutamicum КССМ11016Р (первоначально микроорганизм был раскрыт как KFCC10881, повторно депонирован в международный орган депонирования в соответствии с Будапештским договором под присвоенным номером доступа No. КССМ11016Р; патенты Кореи No. 10-0159812 и 10-0397322) способом электрического импульса, и штаммы, в которых гены-мишени были вставлены в хромосому путем гомологичной рекомбинации, были селективно выделены путем ПЦР и названы KCCM11016P::Ppta_ackA(Tn), KCCM11016P::pta(Tn) и KCCM11016P::pta-ackA(Tn).
Штаммы трех типов и контрольной группы инокулировали в 250 мл колбу с угловыми перегородками, содержащую 25 мл посевной культуральной среды, и культивировали с встряхиванием при 200 об/мин при 30°С в течение 20 часов. Затем 1 мл раствора посевной культуры инокулировали в 250 мл колбу с угловыми перегородками, содержащую 24 мл продукционной среды, и культивировали с встряхиванием при 200 об/мин при 37°С в течение 96 часов. Культуральную среду собирали каждые 12 часов во время культивирования и анализировали количества глюкозы и ацетата, оставшихся в культуральной среде, и поглощение при 562 нм, и результаты показаны на Фиг. 1а и 1б.
Посевная культуральная среда (рН 7,0)
Глюкоза (20 г), (NH4)2SO4 (10 г), пептон (10 г), дрожжевой экстракт (5 г), мочевина (1,5 г), KH2PO4 (4 г), K2HPO4 (8 г), MgSO4⋅7H2O (0,5 г), биотин (100 мкг), тиамин HCl (1000 мкг), кальций-пантотеновая кислота (2000 мкг) и никотинамид (2000 мкг) (в расчете на 1 л дистиллированной воды).
Продукционная среда (рН 7,0)
Глюкоза (100 г), ацетат аммония (7,1 г) (с добавлением или без), (NH4)2SO4 (40 г), соевый белок (2,5 г), твердый кукурузный экстракт (5 г), мочевина (3 г), KH2PO4 (1 г), MgSO4⋅7H2O (0,5 г), биотин (100 мкг), тиамин HCl (1000 мкг), кальций-пантотеновая кислота (2000 мкг), никотинамид (3000 мкг) и СаСО3 (30 г) (в расчете на 1 л дистиллированной воды).
Как показано на Фиг. 1а, штамм KCCM11016P::Ppta_ackA(Tn) продуцировал ацетат в среду без ацетата, в то же время потребляя глюкозу, и потреблял ацетат после того, как использовал всю глюкозу, в отличие от родительского штамма КССМ11016Р. На основании этих результатов было подтверждено, что ацетаткиназа вовлечена в продуцирование ацетата. Дополнительно, наблюдали, что скорость роста культуры была замедлена при продуцировании ацетата.
Однако, как показано на Фиг. 16, штамм KCCM11016P::Ppta_ackA(Tn) демонстрировал свойство более быстрого потребления ацетата на начальной стадии культивирования при культивировании в среде с ацетатом по сравнению со штаммом КССМ11016Р (контрольная группа), и в результате лаг-фаза роста штамма значительно сокращалась по сравнению с таковой в контрольной группе. Штамм KCCM11016P::pta(Tn) не показал существенной разницы в скорости потребления ацетата по сравнению с таковой контрольной группы. Однако было подтверждено, что штамм KCCM11016P::pta-ackA(Tn), в котором два гена были оба введены в форме оперона, демонстрировал небольшое увеличение скорости потребления ацетата по сравнению с таковой штамма KCCM11016P::Ppta_ackA(Tn), в котором был введен только ген ackA.
Вышеприведенные результаты подтверждают, что ацетаткиназа, которую кодирует ген ackA, представляет собой основной фермент в продуцировании или активации ацетата, и он вовлечен в продуцирование ацетата, когда ацетат не присутствует в среде, тогда как при присутствии ацетата в среде он используется в пути активации ацетата. Дополнительно было подтверждено, что сверхэкспрессия ackA может существенно повышать способность утилизировать ацетат вследствие усиления пути активации, в то же время уменьшая ингибирование роста, тем самым возможно сокращая лаг-фазу.
Пример 3: Получение штамма, сверхэкспрессирующего ген ackA посредством сильного промотора, и подтверждение его эффекта
Для повторного подтверждения способности потреблять ацетат и его действия при сверхэкспрессии гена ackA, была сделана попытка индуцировать экспрессию гена ackA, который был дополнительно вставлен с использованием промотора lysCP1 (патент Кореи No. 10-0930203), который представляет собой сильный промотор, как сообщалось ранее. Праймеры, используемые в Примерах по настоящему изобретению, представлены в Таблице 2 ниже.
Вектор для вставки в хромосому был получен с использованием вектора pDZTn, описанного в Примере 1, в качестве базового вектора. Праймеры (SEQ ID NO: 6 и 7) для амплификации промоторного участка lysCP1 синтезировали на основе полинуклеотидных последовательностей, описанных ранее, и сегмент ДНК размером примерно 450 п. н. был получен путем ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum KCCM11016P-lysCP1 (патент Кореи No. 10-0930203) в качестве матрицы. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 сек, отжига при 56°С в течение 30 сек и полимеризации при 72°С в течение 30 сек; и полимеризация при 72°С в течение 7 мин.

Фрагменты ДНК, амплифицированные путем ПЦР, обрабатывали ферментами рестрикции XhoI и NdeI для получения соответствующих сегментов ДНК. Полученные таким образом участки ДНК лигировали в вектор pDZTN, имеющий сайты для XhoI и SpeI, наряду с фрагментами ДНК вокруг участка ОРС гена ackA, имеющего сайты для NdeI и SpeI, полученный в Примере 1, которым трансформировали Е. coli DH5α, и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Колонии, трансформированные вектором, в который был вставлен ген-мишень, отбирали, плазмиду получали известным традиционным способом выделения плазмид, и полученная таким образом плазмида была названа pDZTN-lysCP1_ackA (Фиг. 2).
Полученным таким образом вектором pDZTN-lysCP1_ackA трансформировали Corynebacterium glutamicum КССМ11016Р, который продуцирует L-лизин, путем гомологичной рекомбинации. Затем колонии, в которых pDZTN-lysCP1_ackA был интегрирован в хромосому путем ПЦР, селективно выделяли, и они получили название KCCM11016P::lysCP1_ackA(Tn).
Штамм KCCM11016P::lysCP1_ackA(Tn), штамм
KCCM11016P::Ppta_ackA(Tn) и штамм КССМ11016Р (контрольная группа) культивировали таким же образом как в Примере 2, и количество оставшегося в культуральной среде ацетата анализировали каждые 12 часов. Результаты показаны на Фиг. 3.
В результате штамм KCCM11016P::Ppta_ackA(Tn) демонстрировал улучшенную способность потреблять ацетат по сравнению с таковой у контрольной группы, как показано в результатах Примера 2. Дополнительно было подтверждено, что штамм KCCM11016P::lysCP1_ackA(Tn) демонстрировал увеличенную скорость потребления ацетата, чем таковая у штамма KCCM11016P::Ppta_ackA(Tn).
Вышеприведенные результаты показывают, что скорость потребления ацетата увеличивается с увеличением экспрессии гена ackA, и результаты повторно подтверждают, что сверхэкспрессия гена ackA является главной причиной повышения способности потреблять ацетат.
Пример 4: Анализ лизин-продуцирующей способности штамма, сверхэкспрессирующего ген ackA
Для подтверждения способности штамма Corynebacterium glutamicum KCCM11016P::lysCP1_ackA(Tn), полученного в Примере 3, продуцировать лизин штамм Corynebacterium glutamicum KCCM11016P::lysCP1_ackA(Tn) культивировали наряду со штаммом КССМ11016Р (контрольная группа) таким же образом, как в Примере 2. После завершения культивирования концентрацию L-лизина анализировали путем ВЭЖХ, и эти результаты показаны в Таблице 3 ниже.
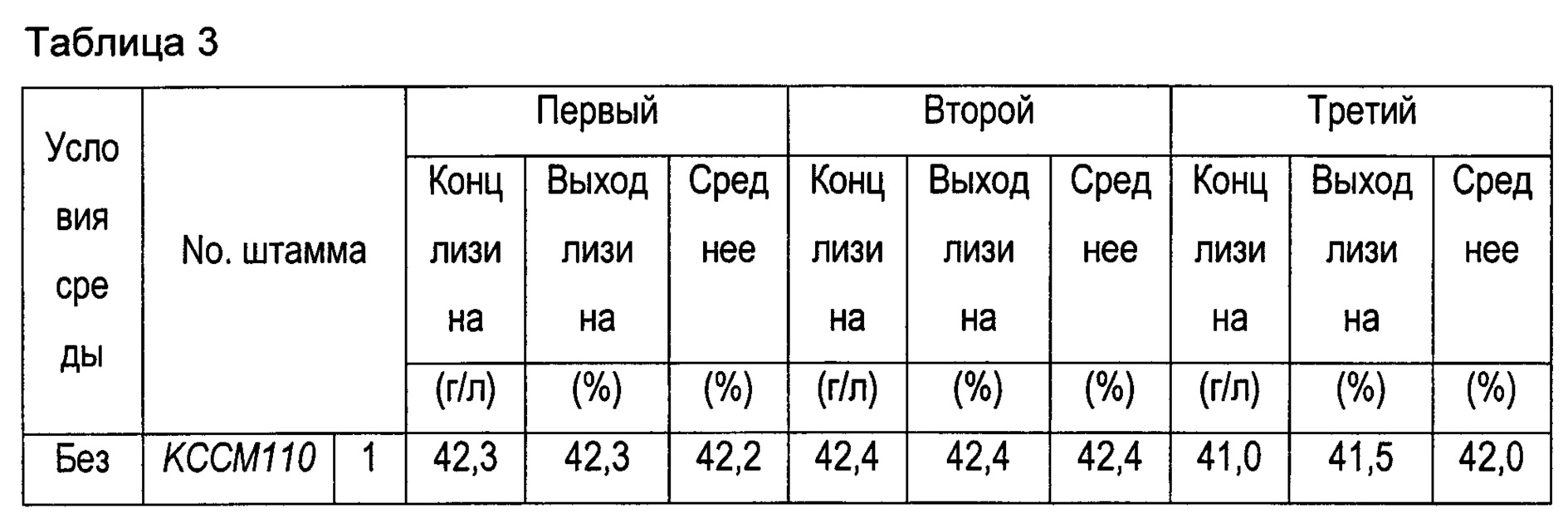

В результате, когда штаммы культивировали с использованием глюкозы в качестве единственного источника углерода без добавления ацетата, штамм КССМ11016Р::lysCP1_аскА(Tn) демонстрировал такой же уровень способности продуцировать лизин, как и у контрольной группы, как показано в Таблице 3. Однако, было подтверждено, что когда штаммы культивировали в среде, содержащей ацетат, штамм KCCM11016P::lysCP1_ackA(Tn) демонстрировал среднее увеличение выхода лизина на 12% (полный выход источника углерода = концентрация лизина/(добавленное количество (глюкоза + ацетат)) по сравнению с таковым контрольной группы.
Вышеприведенные результаты подтверждают, что усиление пути активации ацетата увеличивает не только способность потреблять ацетат, но также способность продуцировать L-лизин. Дополнительно, эти результаты подтверждают, что когда ацетат используют в качестве источника углерода, применение штамма с усиленным геном ackA по настоящему изобретению может приводить к продуцированию лизина с высоким выходом, в то же время уменьшая время культивирования без ингибирования роста клеток.
В этих условиях авторы настоящего изобретения назвали штамм KCCM11016P::lysCP1_ackA(Tn) с увеличенными способностями потреблять ацетат и продуцировать L-лизин Corynebacterium glutamicum "СА01-2278", который депонирован в Корейском центре культивирования микроорганизмов (КССМ) под депозитарным номером КССМ11480Р.
Пример 5: Получение штамма с введенным геном acs и анализ эффекта этого штамма
Для вставки пути активации ацетата, имеющего происхождение из Escherichia, в хромосому Corynebacterium был получен вектор для вставки в хромосому с использованием вектора pDZTn, упомянутого в Примере 1, в качестве базового вектора после получения гена acs (SEQ ID NO: 11), который известен как путь активации ацетата, имеющий происхождение из Escherichia. Экспрессию индуцировали путем функционального связывания промотора гена pta-ackA, полученного из Corynebacterium, в участок, расположенный выше по ходу транскрипции от кодона инициации гена acs. Праймеры, используемые в настоящем изобретении, показаны в Таблице 4 ниже.
Праймеры (SEQ ID NO: 8 и 9) для амплификации участка гена acs синтезировали на основе полинуклеотидных последовательностей, описанных ранее, и участок ОРС гена acs размером примерно 2000 п. н. амплифицировали путем ПЦР с использованием хромосомы штамма Е. coli W (АТСС9637) в качестве матрицы. В частности, ПЦР проводили в следующих условиях: денатурация при 94°С в течение 5 мин; 30 циклов денатурации при 94°С в течение 30 сек, отжига при 56°С в течение 30 сек, и полимеризации при 72°С в течение 2 мин; и полимеризация при 72°С в течение 7 мин.

Фрагменты ДНК, амплифицированные путем ПЦР, обрабатывали ферментами рестрикции SpeI and NdeI, наряду с фрагментами ДНК промотора оперона pta_ackA, который был получен в Примере 5, для получения сегмента ДНК. Полученные таким образом сегменты ДНК лигировали в вектор pDZTN, имеющий сайт для SpeI, которым трансформировали Е. coli DH5α, и высевали на твердую среду LB, содержащую канамицин (25 мг/л). Колонии, трансформированные вектором, в который был вставлен ген-мишень, отбирали, плазмиду получали известным традиционным способом выделения плазмид, и полученная таким образом плазмида была названа pDZTN-Ppta-acs.
Полученным таким образом вектором трансформировали Corynebacterium glutamicum KCCM11016P::Ppta_ackA(Tn), полученный в Примере 2, методом электрического импульса, и отбирали штаммы, в которых ген acs был вставлен в хромосому путем гомологичной рекомбинации. В частности, те колонии, в которых ген acs был вставлен в транспозон, отличный от транспозона, в котором ген Ppta_ackA был вставлен предварительно, селективно выделяли путем ПЦР и называли KCCM11016P::Ppta_ackA(Tn)-Ppta_acs(Tn).
Штамм KCCM11016P::Ppta_ackA(Tn)-Ppta_acs(Tn) и штамм KCCM11016P::Ppta_ackA(Tn) (контрольная группа) культивировали таким же образом, как в Примере 2, и количество ацетата, оставшегося в культуральной среде, анализировали каждые 12 часов.
В результате было подтверждено, что штамм KCCM11016P::Ppta_ackA(Tn)-Ppta_acs(Tn) демонстрировал небольшое увеличение скорости потребления ацетата по сравнению с таковой в контрольной группе (Фиг. 3).
Эти результаты подтверждают, что не только сверхэкспрессия гена ackA, но также введение гена acs, который представляет собой чужеродный ген, имеющий происхождение из Escherichia, в микроорганизм рода Corynebacterium может увеличивать скорость потребления ацетата и способность продуцировать L-лизин.
Пример 7: Сравнение L-лизин-продуцирующей способности штаммов. которые сверхэкспрессируют ген ackA, имеющий происхождение из штамма, продуцирующего L-лизин
Для подтверждения эффекта усиления продукции лизина штаммами, сверхэкспрессирующими ackA, сравнивали способность продуцировать L-лизин различными штаммами, продуцирующими лизин, имеющими происхождение от Corynebacterium.
Ген ackA вводили в три репрезентативных штамма, продуцирующих лизин, Corynebacterium glutamicum КССМ10770Р (патент Кореи No. 10-0924065), КССМ11347Р (первоначально микроорганизм был раскрыт как KFCC10750 и повторно депонирован в международный орган депонирования в соответствии с Будапештским договором под присвоенным номером доступа No. КССМ11347Р; патент Кореи No. 10-0073610) и CJ3P (Binder et al. Genome Biology 2012, 13: R40) и сравнивали их способность продуцировать L-лизин.
Вектором pDZTN-lysCP1_ackA, полученным в Примере 3, трансформировали Corynebacterium glutamicum КССМ10770Р, КССМ11347Р и CJ3P, соответствующим образом, путем встраивания в хромосому посредством гомологичной рекомбинации. Затем колонии селективно выделяли путем ПЦР, и каждый из штаммов получил название KCCM10770P::lysCP1_ackA(Tn), KCCM11347P::lysCP1_ackA(Tn) и CJ3P::lysCP1_ackA(Tn), соответственно.
Для сравнения способности вышеупомянутых штаммов продуцировать лизин штаммы культивировали наряду с каждой из контрольных групп таким же образом, как в Примере 2. По завершении культивирования концентрацию L-лизина анализировали путем ВЭЖХ, и результаты показаны в Таблице 5 ниже.

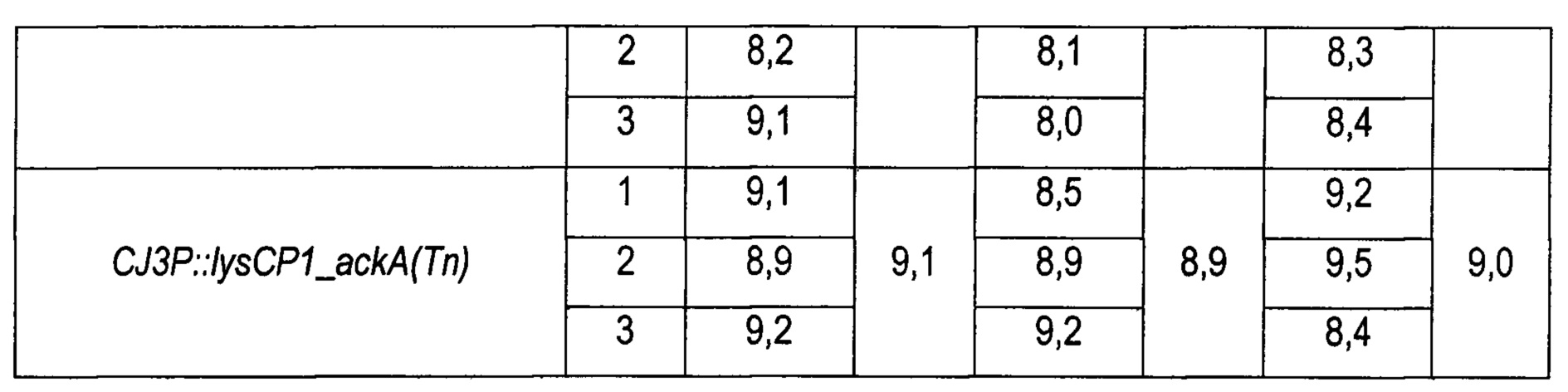
В результате, как показано в Таблице 5, все штаммы, сверхэкспрессирующие ackA, с происхождением из штамма, продуцирующего лизин, демонстрировали повышение способности продуцировать L-лизин. Штамм KCCM10770P::lysCP1_ackA(Tn) демонстрировал повышение концентрации лизина примерно на 11% по сравнению с таковой у штамма КССМ10770Р (контрольная группа). Штамм KCCM11347P::lysCP1_ackA(Tn) демонстрировал повышение концентрации лизина примерно на 10% по сравнению с таковой у штамма КССМ11347Р (контрольная группа). Штамм CJ3P::lysCP1_ackA(Tn) демонстрировал повышение концентрации лизина примерно на 11% по сравнению с таковой у штамма CJ3P (контрольная группа).
Соответственно, вышеприведенные результаты подтверждают, что повышение активности ацетаткиназы у различных типов штаммов, продуцирующих L-лизин, имеющих происхождение от Corynebacterium glutamicum, в результате приводит к повышению способности продуцировать L-лизин.
Из вышеизложенного специалист в области техники, к которой относится данное изобретение, будет способен понять, что настоящее изобретение может быть реализовано в других специфических формах без модификации технических концепций или существенных характеристик настоящего изобретения. В этом отношении примеры воплощений, раскрытые здесь, служат только для иллюстративных целей, и их не следует истолковывать как ограничивающие объем настоящего изобретения. Напротив, настоящее изобретение предназначено охватывать не только примеры воплощений, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в пределах сущности и объема настоящего изобретения, как определено в прилагаемой формуле изобретения.
Реферат
Группа изобретений относится к области биотехнологии. Предложен микроорганизм рода Corynebacterium, обладающий усиленной способностью продуцировать L-лизин по сравнению с немодифицированным микроорганизмом, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью, в котором ацетаткиназа имеет аминокислотную последовательность SEQ ID NO: 12. Предложен способ получения L-лизина с использованием микроорганизма рода Corynebacterium, обладающего усиленной способностью продуцировать L-лизин по сравнению с немодифицированным микроорганизмом, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью. Предложено применение микроорганизма рода Corynebacterium, в котором активность ацетаткиназы усилена по сравнению с ее эндогенной активностью, для усиленного продуцирования L-лизина. Группа изобретений позволяет продуцировать L-лизин с высоким выходом по сравнению с исходным немодифицированным микроорганизмом. 3 н. и 4 з.п. ф-лы, 3 ил., 5 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Бактерия - продуцент l-аминокислоты и способ получения l-аминокислоты (варианты)

Комментарии