Бактерия - продуцент l-аминокислоты и способ получения l-аминокислоты (варианты) - RU2316588C1
Код документа: RU2316588C1
Чертежи








Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения L-аминокислоты методом ферментации с использованием микроорганизма. Настоящее изобретение, в частности, относится к способу получения таких L-аминокислот, как L-лизин, L-аргинин, L-орнитин, L-гистидин, L-изолейцин, L-треонин, L-пролин, L-фенилаланин, L-цистеин и L-глутаминовая кислота. Они представляют собой L-аминокислоты, применяемые в промышленности. В частности, L-лизин, L-треонин, L-изолейцин и L-пролин пригодны для использования в качестве добавок к кормам для животных, в качестве компонентов оздоровительной пищи и для инфузии аминокислот. L-аргинин и L-орнитин пригодны для использования в качестве агентов, улучшающих работу печени, для инфузии аминокислот, и в качестве компонентов комплексных препаратов аминокислот L-гистидин пригоден для использования в качестве средства, улучшающего работу печени и в качестве предшественника гистамина. L-фенилаланин пригоден для использования в качестве предшественника подсластителей.
Уровень техники
L-аминокислоты получают в промышленных масштабах методом ферментации с использованием микроорганизмов, которые относятся к роду Brevibacterium, Corynebacterium, Escherichia и т.п.
Способы получения L-лизина описываются в ЕР 0857784А, JP 11-192088A, WO 00/53726 и WO 96/17930. Способы получения L-аргинина описываются в ЕР 0999267А, ЕР 1170358А и JP 2002-017342А. В указанных описанных способах используют штаммы бактерий-продуцентов основных L-аминокислот, в том числе штаммы, выделенные из природных источников или их искусственно мутированные штаммы, а также рекомбинантные штаммы, которые обладают повышенной активностью фермента биосинтеза основных L-аминокислот.
Кроме того, сообщается (WO 00/61723 и JP 2001-120269А) о способах получения L-аминокислот из метанола, который доступен для проведения ферментации в больших количествах по низкой цене, с использованием мутированных штаммов или генетически модифицированных штаммов микроорганизмов, которые относятся к роду Methylophilus или Methylobacillus.
Известно, что методы модифицирования включения или экспорта L-аминокислот клетками бактерий улучшают способность бактерий продуцировать L-аминокислоты. Методы модифицирования захвата L-аминокислот предусматривают исключение или снижение захвата L-аминокислот клетками, с целью повышения способности продуцировать L-аминокислоты. В частности, указанные методы включают метод удаления оперона gluABCD или его части, с тем, чтобы устранить или ослабить включение L-глутаминовой кислоты (ЕР 1038970А).
Методы модифицирования экспортера включают метод исключения или снижения экспорта промежуточного соединения или субстрата при биосинтезе L-аминокислот и метод усиления экспорта продуцированной L-аминокислоты. В качестве метода исключения или снижения экспорта промежуточного соединения при биосинтезе L-глутаминовой кислоты известен способ мутации или разрушения гена α-кетоглутаратпермеазы, с целью снижения экспорта α-кетоглутаровой кислоты (WO 01/005959).
В качестве метода усиления экспорта L-аминокислот был предложен способ активации lysE (гена-экпортера основных L-аминокислот; J. Mol. Microbiol. Biotechnol., 1999 Nov; 1 (2): 327-36) в штамме бактерии Corynebacterium, которая, как известно, продуцирует L-лизин (WO 97/23597) или L-аргинин (патентная публикация США 2003-0113899). Известен также способ увеличения экспрессии генов rhtA, B, C (JP 2000-189177A) и yfiK, гена yahN (EP 1016710A), которые, как полагают, вовлекаются в экспорт L-аминокислот, в клетках бактерии Escherichia.
В качестве гена для экспорта основных L-аминокислот известен вышеуказанный ген lysE. Однако в том случае, когда ген lysE амплифицируют в ассимилирующих метанол бактериях, таких как бактерия Methylophilus, а полученный штамм используют для получения L-лизина или L-аргинина, то ген lysE дикого типа, выделенный из бактерии Coryneform, является смертельным для бактерии Methylophilus, и поэтому необходимо вводить мутантный ген lysE (ЕР 1266966А), который позволяет расти микроорганизму-хозяину. Таким образом, ген lysE не всегда работоспособен при экспорте L-лизина или L-аргинина в том случае, когда его вводят в гетерогенные микроорганизмы. По этой причине желательно получить ген для экспорта и продуцирования L-аминокислот, который обладает способностью секретировать значительные количества L-аминокислот, в том числе L-лизина или L-аргинина, в различных гетерогенных микроорганизмах-хозяевах.
Ген ybjE расположен в геноме Escherichia coli , и было высказано предположение, что он кодирует предполагаемый белок на мембране (Science, 277 (5331): 1453-74, 1997). Однако о клонировании гена и его анализе посредством экспрессии в бактериальных клетках не сообщается, и, таким образом, его физиологическое действие остается неизвестным.
Сущность изобретения
Целью настоящего изобретения является штамм бактерии, который способен эффективно продуцировать L-аминокислоту. Другой целью настоящего изобретения является предоставление способа эффективного получения L-аминокислоты с использованием указанного штамма.
Для того, чтобы добиться поставленных целей, авторы настоящего изобретения провели тщательное исследование и в результате на основании устойчивости к высоким концентрациям L-лизина получили ген ybjE, новый ген для экспортера L-аминокислот. Кроме того, авторы также обнаружили, что L-аминокислоты, включая основные L-аминокислоты, такие как L-лизин, L-аргинин, L-орнитин и L-гистидин; алифатические L-аминокислоты, такие как L-изолейцин; гидроксилсодержащие L-аминокислоты, такие как L-треонин; циклические L-аминокислоты, такие как L-пролин; ароматические L-аминокислоты, такие как L-фенилаланин; серосодержащие L-аминокислоты, такие как L-цистеин; и кислые L-аминокислоты, такие как L-глутаминовая кислота, можно эффективно получать с использованием микроорганизма, в котором увеличена экспрессия гена ybjE.
Объектом настоящего изобретения является микроорганизм, обладающий способностью продуцировать L-аминокислоты, при этом указанный микроорганизм модифицируют таким образом, что экспрессия гена ybjE увеличивается.
Еще одним из объектов настоящего изобретения является вышеуказанный микроорганизм, в котором экспрессию указанного гена ybjE усиливают путем увеличения копийности указанного гена ybjE или путем модифицирования регуляторной последовательности, которая контролирует экспрессию указанного гена ybjE.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, в котором аминокислотную последовательность белка, кодируемого указанным геном ybjE, выбирают из группы, включающей SEQ ID NO: 2, 9 и 10, и в котором указанный белок обладает способностью экспортировать L-аминокислоту.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, где указанный ген ybjE выбирают из группы, включающей:
(а) ДНК, содержащую нуклеотидную последовательность SEQ ID NO: 1; и
(b) ДНК, способную гибридизоваться в строгих условиях с нуклеотидной последовательностью SEQ ID NO: 1 или зондом, который может быть получен из нуклеотидной последовательности SEQ ID NO: 1, и где указанная ДНК кодирует белок, способный экспортировать L-аминокислоту.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, где указанный ген ybjE выбирают из группы, включающей:
(а) ДНК, содержащую нуклеотидную последовательность, включающую нуклеотиды с номерами с 49 по 948 из SEQ ID NO: 1; и
(b) ДНК, способную гибридизоваться в строгих условиях с нуклеотидной последовательностью, включающую нуклеотиды с номерами с 49 по 948 из SEQ ID NO: 1, или зондом, который может быть получен из нуклеотидной последовательности, включающей нуклеотиды с номерами с 49 по 948 из SEQ ID NO: 1, и где указанная ДНК кодирует белок, способный экспортировать L-аминокислоту.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанная способность указанного микроорганизма экспортировать L-аминокислоту повышается с указанным увеличением экспрессии указанного гена ybjE.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом устойчивость микроорганизма к L-аминокислоте или аналогу L-аминокислоты повышается с указанным увеличением экспрессии указанного гена ybjE.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанную L-аминокислоту выбирают из группы, включающей L-лизин, L-аргинин, L-орнитин, L-гистидин, L-изолейцин, L-треонин, L-пролин, L-фенилаланин, L-цистеин и L-глутаминовую кислоту.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанный микроорганизм относится к семейству энтеробактерий.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанный микроорганизм, относящийся к семейству энтеробактерий, представляет собой микроорганизм, относящийся к роду Escherichia.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанный микроорганизм является бактерией Coryneform.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанный микроорганизм является микроорганизмом, ассимилирующим метанол.
Еще одним объектом настоящего изобретения является вышеуказанный микроорганизм, при этом указанный микроорганизм, ассимилирующий метанол, относится к роду Methylophilus или Methylobacillus.
Еще одним объектом настоящего изобретения является способ получения L-аминокислоты, включающий выращивание вышеуказанного микроорганизма в питательной среде, с целью получения и накопления указанной L-аминокислоты, и выделение указанной L-аминокислоты из питательной среды или микроорганизма.
Еще одним объектом настоящего изобретения является способ получения L-аминокислоты, включающий выращивание вышеуказанного микроорганизма в жидкой питательной среде, содержащей метанол в качестве основного источника углерода, с целью получения и накопления указанной L-аминокислоты, и выделение указанной L-аминокислоты из питательной среды или микроорганизма.
Еще одним объектом настоящего изобретения является вышеуказанный способ, при этом L-аминокислоту выбирают из группы, включающей L-лизин, L-аргинин, L-орнитин, L-гистидин, L-изолейцин, L-треонин, L-пролин, L-фенилаланин, L-цистеин и L-глутаминовую кислоту.
Краткое описание фигур
На Фиг. 1 приведена схема конструкции плазмиды для амплификации гена ybjE в бактериях Escherichia.
На Фиг. 2 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-лизина.
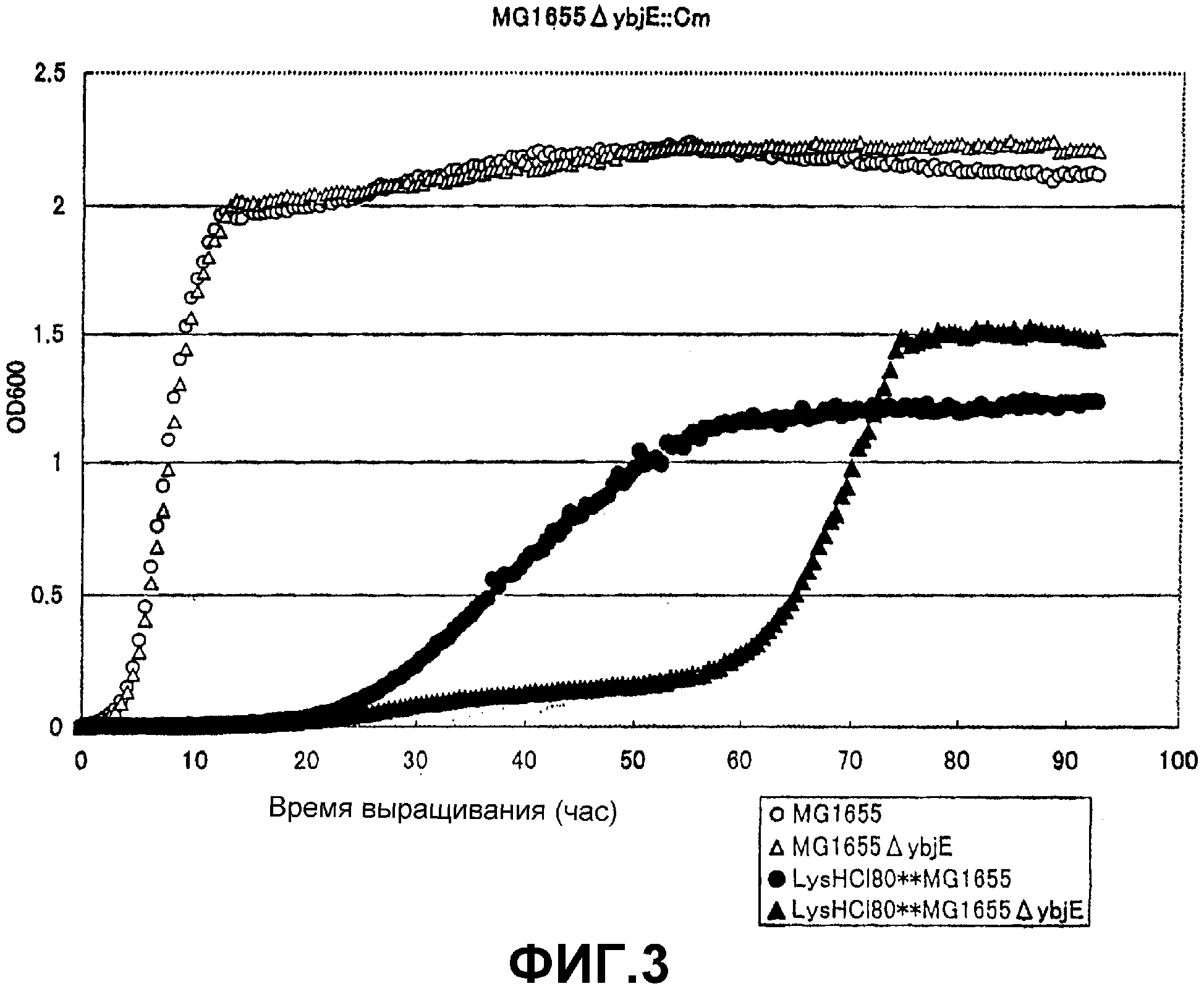
На Фиг. 3 приведены кривые роста для контрольного штамма и штамма Escherichia coli с инактивированным геном ybjE, в присутствии высоких концентраций L-лизина.
На Фиг. 4 приведена схема конструкции плазмиды для амплификации гена ybjE в бактериях, ассимилирующих метанол.
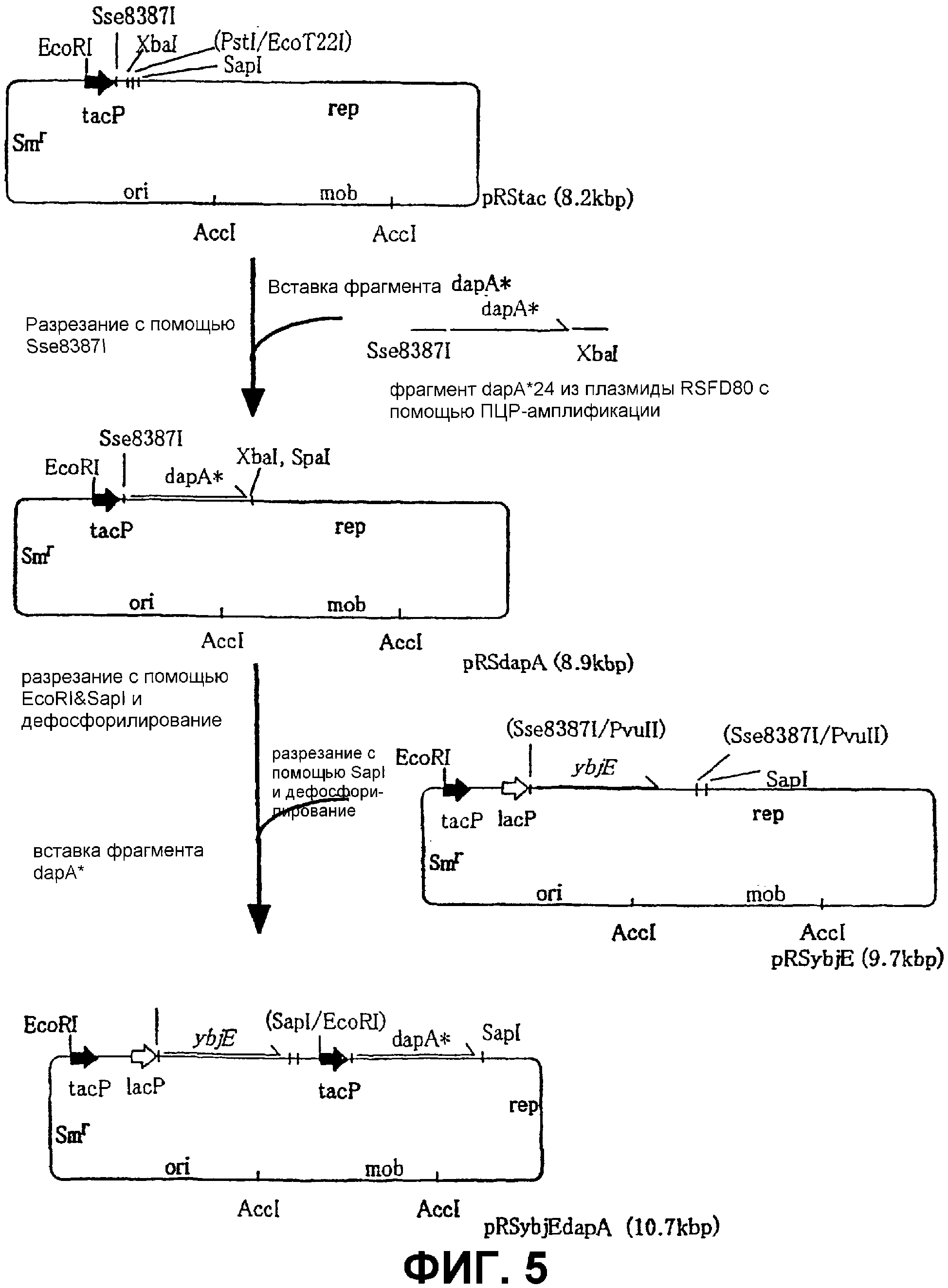
На Фиг. 5 приведена схема конструкции плазмиды для продуцирования L-лизина с использованием бактерий, ассимилирующих метанол.
На Фиг. 6 приведены кривые роста для контрольного штамма и штамма Methylophilus methylotrophus с амплифицированным геном ybjE в присутствии аналога L-лизина.
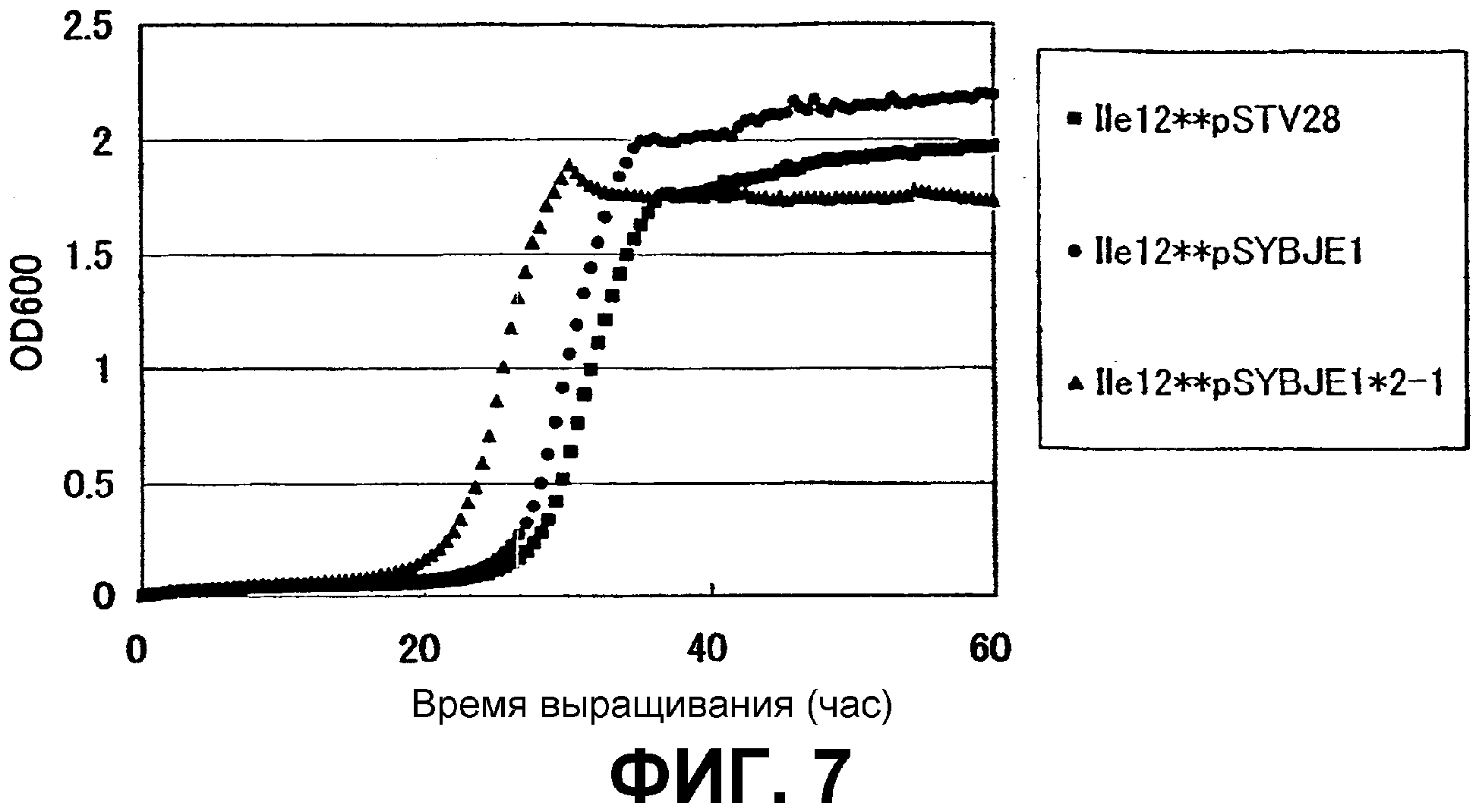
На Фиг. 7 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-изолейцина.
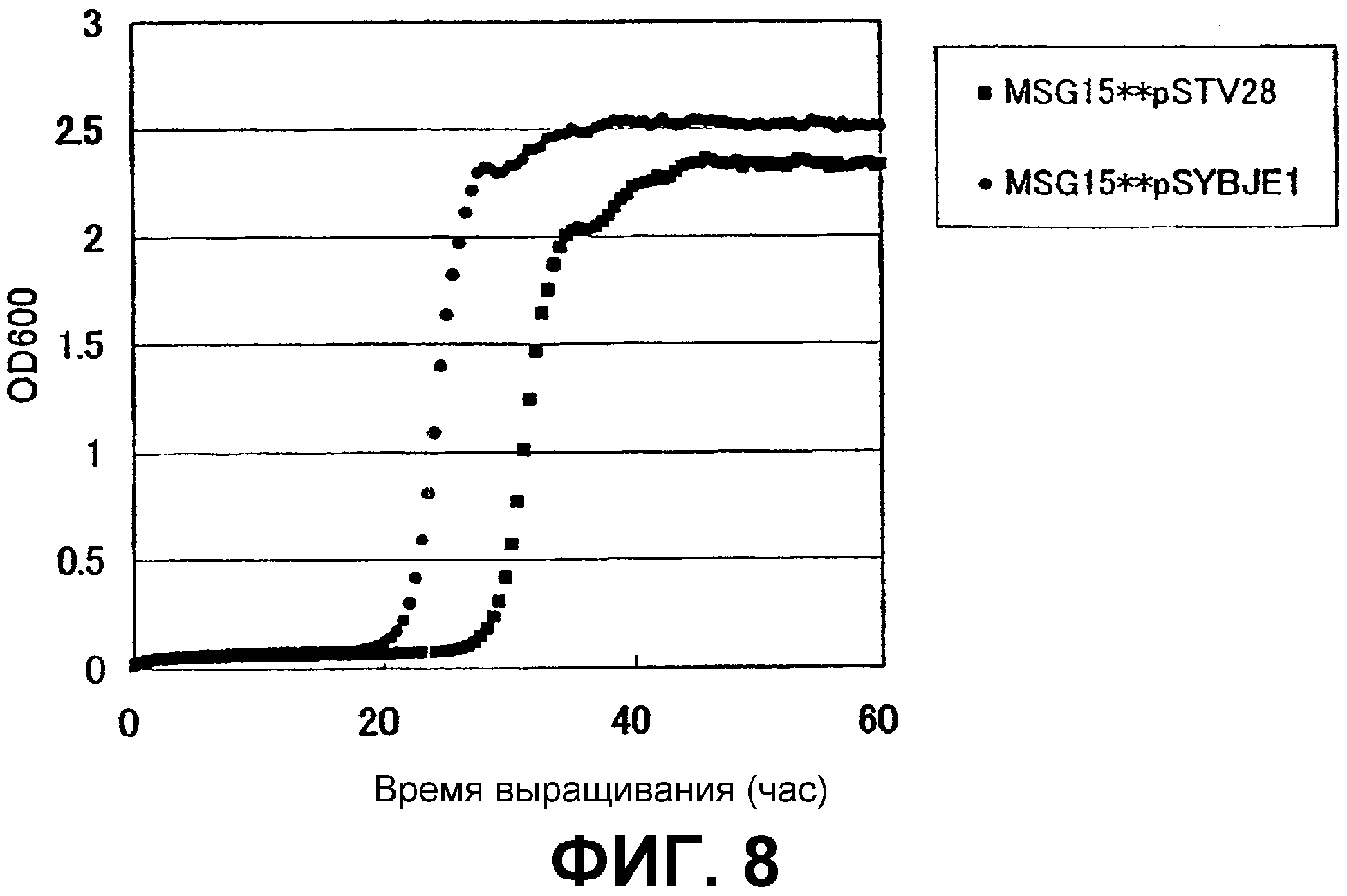
На Фиг. 8 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-глутамата.
На Фиг. 9 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-треонина.
На Фиг. 10 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-гистидина.
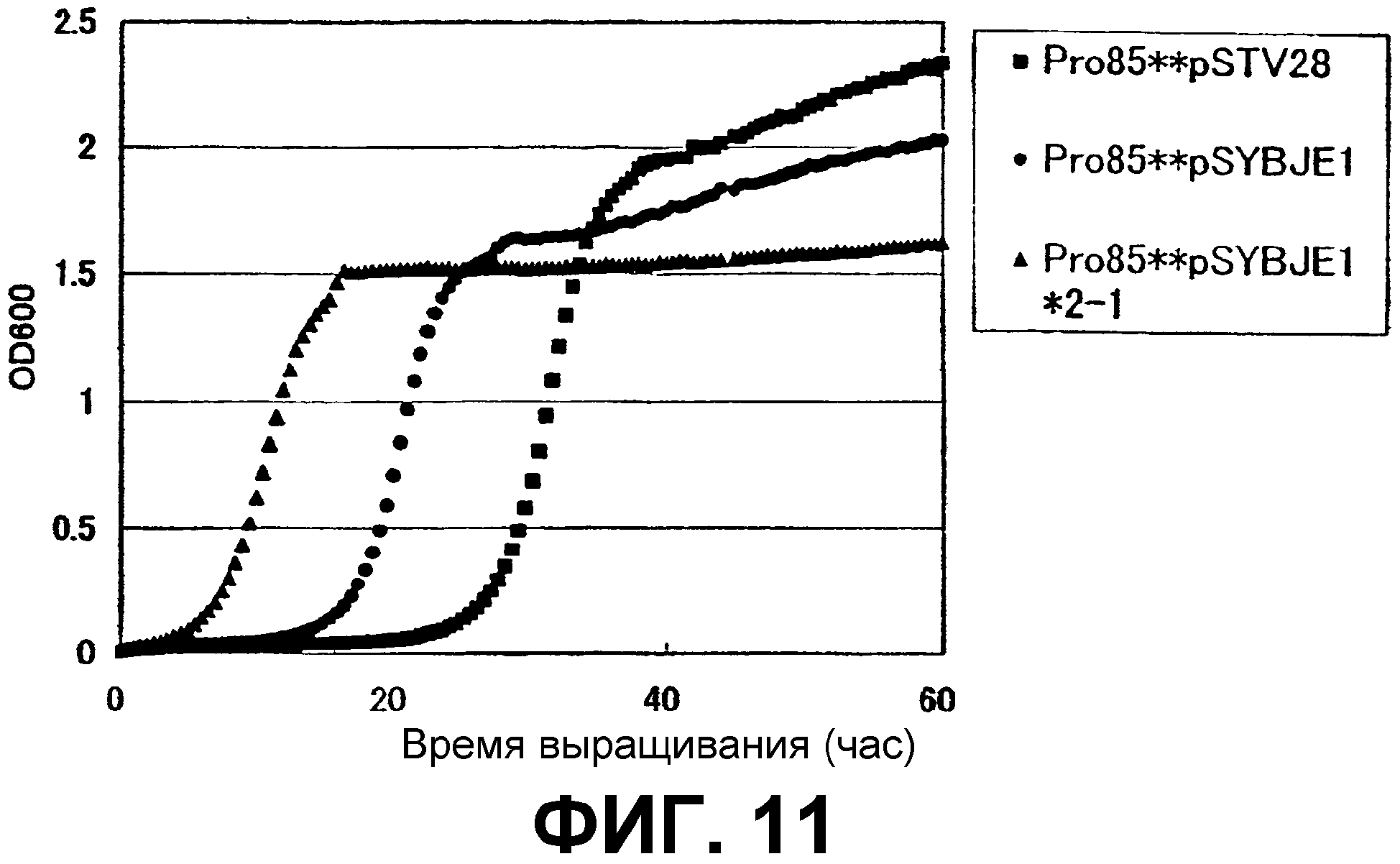
На Фиг. 11 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-пролина.
На Фиг. 12 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-орнитина.
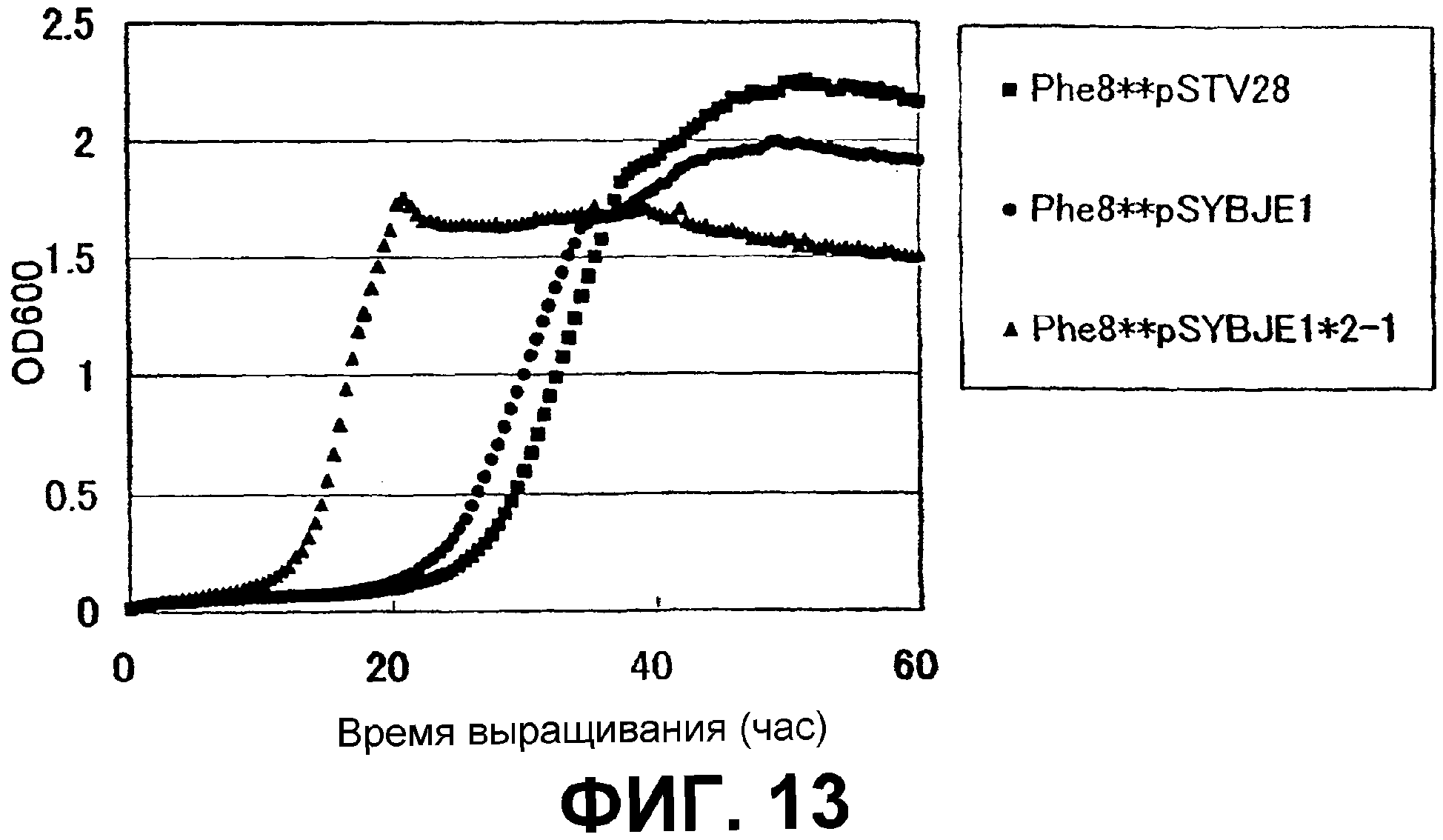
На Фиг. 13 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-фенилаланина.
На Фиг. 14 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-цистеина.
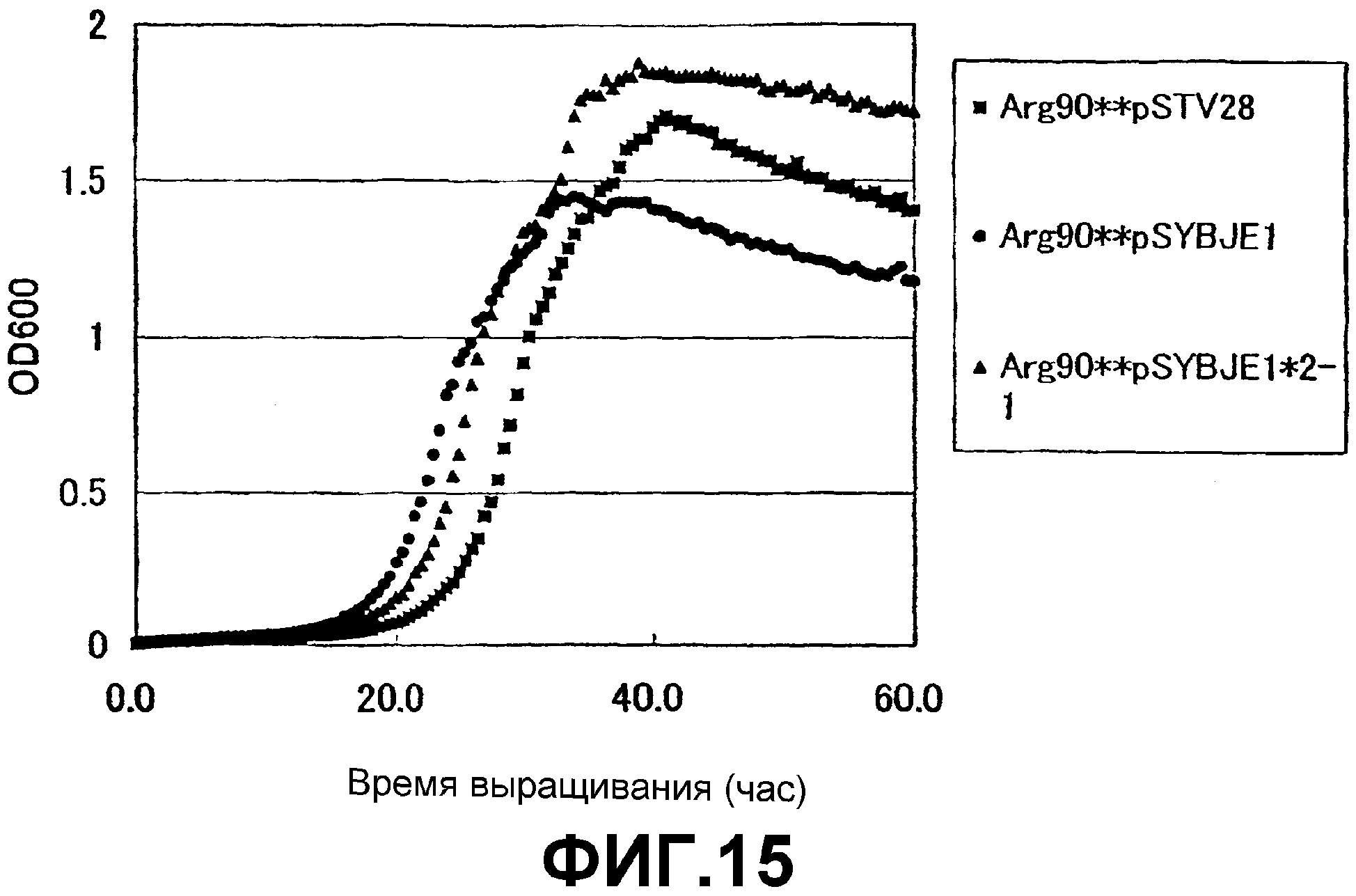
На Фиг. 15 приведены кривые роста для контрольного штамма и штамма Escherichia coli с амплифицированным геном ybjE в присутствии высоких концентраций L-аргинина.
На Фиг. 16 приведены кривые роста для контрольного штамма и штаммов Escherichia coli с амплифицированным геном ybjE (948 пар нуклеотидов или 900 пар нуклеотидов)в присутствии высоких концентраций L-лизина.
Подробное описание предпочтительных вариантов осуществления
Настоящее изобретение детально разъясняется ниже.
1. Микроорганизм по настоящему изобретению
Микроорганизм по настоящему изобретению способен продуцировать L-аминокислоту, и его модифицируют таким образом, что экспрессия гена ybjE увеличивается. Выражение "способность продуцировать L-аминокислоту" по тексту настоящего описания означает способность вызывать накопление L-аминокислоты в питательной среде или в клетках микроорганизма, когда микроорганизм по настоящему изобретению выращивают в питательной среде. Микроорганизм по настоящему изобретению может быть способен продуцировать несколько видов L-аминокислот. Микроорганизм, который способен продуцировать L-аминокислоту, может быть микроорганизмом, который изначально обладает способностью продуцировать L-аминокислоту, или может быть микроорганизмом, который получают модификацией родительского штамма микроорганизма, как указано ниже, с использованием методов мутагенеза или с помощью методов рекомбинантной ДНК таким образом, чтобы микроорганизм приобрел способность продуцировать L-аминокислоту. Микроорганизм по настоящему изобретению может быть также микроорганизмом, который приобрел способность продуцировать L-аминокислоту путем увеличения экспрессии гена ybjE.
L-аминокислоты, которые продуцируют согласно настоящему изобретению, специально не ограничиваются и включают основные L-аминокислоты, такие как L-лизин, L-аргинин, L-орнитин, L-гистидин и L-цитруллин; алифатические L-аминокислоты, такие как L-изолейцин, L-аланин, L-валин, L-лейцин и L-глицин; гидроксилсодержащие L-аминокислоты, такие как L-треонин и L-серин; циклические L-аминокислоты, такие как L-пролин; ароматические L-аминокислоты, такие как L-фенилаланин, L-тирозин и L-триптофан; серосодержащие L-аминокислоты, такие как L-цистеин, L-цистин и L-метионин; и кислые L-аминокислоты и их амиды, такие как L-глутаминовая кислота, L-аспарагиновая кислота, L-глутамин и L-аспарагин. Микроорганизм по настоящему изобретению может обладать способностью продуцировать два или несколько видов указанных L-аминокислот.
Придание способности продуцировать L-аминокислоту
Ниже приведены примеры микроорганизмов, обладающих способностью продуцировать L-аминокислоту, которые используют по настоящему изобретению. Однако микроорганизмы указанными примерами не ограничиваются, а включают любые микроорганизмы, которые обладают способностью продуцировать L-аминокислоту.
В качестве родительского штамма микроорганизма по настоящему изобретению могут применяться микроорганизмы семейства энтеробактерий, такие как бактерии Escherichia, бактерии Pantoea или бактерии Coryneform и т.д. Кроме того, могут применяться ассимилирующие метанол бактерии, такие как бактерии Methylophilus и бактерии Methylobacillus, которые способны продуцировать L-аминокислоты из метанола. Далее, примеры родительских штаммов включают семейство энтеробактерий, которые относятся к γ-протеобактериям, включая бактерии, относящиеся к роду Escherichia, Pantoea, Enterobacter, Klebsiella, Serratia, Erwinia, Salmonella и Morganella, и другие бактерии, в том числе бактерии Alicyclobacillus и бактерии Bacillus, и дрожжи, включая дрожжи, которые относятся к роду Saccharomyces, Candida и т.п. Указанные родительские штаммы могут изначально обладать геном ybjE или могут не обладать прирожденным геном ybjE и показывать улучшенную способность экспортировать L-аминокислоту после введения гена ybjE.
Могут применяться бактерии Escherichia, описанные у Neidhardt et al. (Neidhardt, F.C. et al., Escherichia coli and Salmonella Typhimurum, American Society for Microbiology, Washington D.C., 1208, Table 1), такие как Escherichia coli. Примеры штаммов Escherichia coli дикого типа включают, но этим не ограничиваясь, штамм К12 и его производные, штамм Escherichia coli MG1655 (ATCC No. 47076) и штамм W3110 (ATCC No. 27325). Указанные штаммы могут быть получены из Американской коллекции типовых культур (ATCC, адрес: P.O. Box 1549, Manassas, VA 20108, United States of America).
Примеры бактерий Enterobacter включают Enterobacter agglomerans, Enterobacter aerogenes и т.д. Примеры бактерий Pantoea включают Pantoea ananatis и т.д. Хотя некоторые бактерии, первоначально классифицированные как Enterobacter aerogenes, в настоящее время могут быть классифицированы как Pantoea agglomerans, Pantoea ananatis или Pantoea stewartii на основании анализа 16S рРНК, микроорганизм, относящийся к семейству энтеробактерий, который используют согласно настоящему изобретению, может быть либо бактериями Enterobacter, либо бактериями Pantoea. Конкретные примеры Pantoea ananatis включают Pantoea ananatis AJ13355 (FERM BP-6614), Pantoea ananatis AJ13356 (FERM BP-6615), Pantoea ananatis AJ13601 (FERM BP-7207) и их производные. Указанные штаммы были первоначально идентифицированы и депонированы как Enterobacter agglomerans, а в настоящее время классифицируются как Pantoea ananatis.
Примеры бактерий Methylophilus включают, но этим не ограничиваясь, Methylophilus methylotrophus, а типичные примеры Methylophilus methylotrophus включают штамм AS1 (NCIMB10515) и т.д. Штамм Methylophilus methylotrophus AS1 (NCIMB 10515) доступен из Национальных коллекций промышленных и морских бактерий (адрес: NCIMB Lts., Torry Research Station, 135, Abbey Road, Aberdeen AB9 8DG, United Kingdom).
Примеры бактерий Methylobacillus включают, но этим не ограничиваясь, Methylobacillus glycogenes, Methylobacillus flagellatum и т.д. Примеры Methylobacillus glycogenes включают штамм Т-11 (NCIMB 11375), штамм АТСС 21276, штамм АТСС 21371, штамм ATR80 (Appl. Microbiol. Biotechnol., vol. 42, pp. 67-72 (1994)), штамм А513 (Appl. Microbiol. Biotechnol., vol. 42, pp. 67-72 (1994)) и т.д. Штамм Methylobacillus glycogenes NCIMB 11375 доступен из Национальных коллекций промышленных и морских бактерий (адрес: NCIMB Lts., Torry Research Station, 135, Abbey Road, Aberdeen AB9 8DG, United Kingdom). Примеры Methylobacillus flagellatum включают штамм КТ (Arch. Microbiol., vol. 149, pp. 441-446 (1988)) и т.д.
Бактерии Coryneform представляют собой группу микроорганизмов, которые описаны в Bergey's Manual of Determinative Bacteriology, 8th Ed., p. 599 (1974) и могут применяться согласно настоящему изобретению. Указанные микроорганизмы классифицируют на аэробные, грампозитивные и не кислотостойкие, которые не способны к множественному делению. Бактерии Coryneform включают также такие бактерии, которые ранее относили к роду Brevibacterium, но которые в настоящее объединяют в род Corynebacterium (Int. J. Syst. Bacteriol., 41, 255 (1991)), а также бактерии, которые относятся к роду Brevibacterium или Microbacterium, которые близко связаны с геном Corynebacterium.
Примеры подобных бактерий Coryneform перечислены ниже:
Corynebacterium acetoacidophilum
Corynebacterium acetoglutamicum
Corynebacterium alkanolyticum
Corynebacterium callunae
Corynebacterium glutamicum
Corynebacterium lilium
Corynebacterium melassecola
Corynebacterium thermoaminogenes (Corynebacterium efficiens)
Corynebacterium herculis
Brevibacterium divaricatum
Brevibacterium flavum
Brevibacterium immariophilum
Brevibacterium lactofermentum
Brevibacterium roseum
Brevibacterium saccharolyticum
Brevibacterium thiogenitallis
Corynebacterium ammoniagens
Brevibacterium album
Brevibacterium cerinum
Microbacterium ammoniaphilum
В частности, можно привести примеры следующих штаммов:
Corynebacterium acetoacidophilum ATCC13870
Corynebacterium acetoglutamicum ATCC15806
Corynebacterium alkanolyticum ATCC21511
Corynebacterium callunae ATCC15991
Corynebacterium glutamicum ATCC13020, ATCC13032, ATCC13060
Corynebacterium lilium ATCC15990
Corynebacterium melassecola ATCC17965
Corynebacterium efficiens AJ12340 (FERM BP-1539)
Corynebacterium herculis ATCC13868
Brevibacterium divaricatum ATCC14020
Brevibacterium flavum ATCC13826, ATCC14067, AJ12418 (FERM BP-2205)
Brevibacterium immariophilum ATCC14068
Brevibacterium lactofermentum ATCC13869 (Corynebacterium glutamicum ATCC13869)
Brevibacterium roseum ATCC13825
Brevibacterium saccharolyticum ATCC14066
Brevibacterium thiogenitallis ATCC19240
Corynebacterium ammoniagenes ATCC6871, ATCC6872
Brevibacterium album ATCC15111
Brevibacterium cerinum ATCC15112
Microbacterium ammoniaphilum ATCC15354
Указанные микроорганизмы можно получить, например, из Американской коллекции типовых культур. Каждому штамму присвоен уникальный регистрационный номер, который приведен в каталоге Американской коллекции типовых культур. Штаммы можно заказать в соответствии с этим регистрационным номером. Кроме того, штамм AJ12340 был депонирован 27 октября 1987 в Национальном технологическом институте бионаук и человека, Агентстве прикладной науки и технологии, Министерстве международного труда и промышленности (в настоящее время - независимое исполнительное агентство, Национальный институт передовой прикладной науки и технологии, Международный патентный депозитарий организмов (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, почтовый код: 305-5466)) в качестве международного депозита в соответствии с Будапештским договором и ему присвоен инвентарный номер FERM BP-1539. Штамм AJ12418 был депонирован 5 января 1989 в Национальном институте передовой прикладной науки и технологии, Международном патентном депозитарии организмов в качестве международного депозита в соответствии с Будапештским договором, и ему присвоен инвентарный номер FERM BP-2205.
Далее поясняются способы придания способности родительскому штамму, как указано выше, продуцировать L-аминокислоту.
Для придания способности продуцировать L-аминокислоту могут быть использованы обычные способы, применяемые для выращивания бактерии - продуцента L-аминокислоты, которая относится к роду бактерий Escherichia или Coryneform и т.д. Например, могут применяться способы получения ауксотрофного мутантного штамма, штамма, устойчивого к аналогу аминокислоты, или мутантного штамма с метаболическим регулированием, который обладает способностью продуцировать L-аминокислоту, и способы получения рекомбинантного штамма, обладающего повышенной активностью фермента биосинтеза L-аминокислот ("Amino Acid Fermentation", The Japan Scientific Societies Press [Gakkai Shuppan Center], 1st Edition, May 30, 1986, pp. 77-100). При выращивании бактерий-продуцентов L-аминокислоты с использованием указанных способов можно придать одно или несколько свойств, включая ауксотрофию, стойкость к аналогу аминокислоты и метаболическое регулирование мутации.
При разработке рекомбинантного штамма может быть увеличена активность ферментов биосинтеза одной или нескольких L-аминокислот. Кроме того, способы придания свойств ауксотрофии, придания стойкости к аналогу аминокислоты и метаболическое регулирование мутации могут быть объединены со способами увеличения активности фермента биосинтеза L-аминокислот.
Ауксотрофный мутантный штамм, штамм, устойчивый к аналогу аминокислоты или штамм, мутировавший путем метаболического регулирования, который обладает способностью продуцировать L-аминокислоту, можно получить, подвергая родительский штамм или штамм дикого типа типичной мутагенной обработке, такой как рентгеновское или ультрафиолетовое облучение, обработка мутагеном, таким как N-метил-N'-нитро-N-нитрозогуанидин (NTG). Затем из мутантных штаммов можно выделить ауксотрофный мутантный штамм, штамм, устойчивый к аналогу аминокислоты, или мутантный штамм с метаболическим регулированием, которые обладают способностью продуцировать L-аминокислоту.
Примеры аналогов L-лизина включают оксализин, гидроксамат лизина, S-(2-аминоэтил)-L-цистеин (АЕС), γ-метиллизин, α-хлоркапролактам, норлейцин и т.п. Примеры аналогов L-аргинина включают гидроксамат аргинина, гомоаргинин, D-аргинин, канаванин, гидроксамат аргинина.
Конкретные примеры штаммов, устойчивых к аналогам L-лизина, или штаммов, мутировавших путем метаболического регулирования, которые обладают способностью продуцировать L-лизин, включают штамм Escherichia coli AJ11442 (FERM BP-1543, NRRL B-12185, JP 56-18596A и патент США № 4346170), штамм Escherichia coli VL611 (JP 2000-189180А) и т.п. Кроме того, в качестве штамма Escherichia coli, продуцирующего L-лизин, можно использовать штамм WC196 (WO 96/17930). Штамм WC196 первоначально был выращен путем придания устойчивости штамму W3110, который выделяют из Escherichia coli К-12, к действию АЕС (S-(2-аминоэтил)-L-цистеин). Штамм WC196 был обозначен как штамм Escherichia coli AJ13069 и был депонирован в независимом исполнительном агентстве, Национальном институте передовой прикладной науки и технологии, Международном патентном депозитарии организмов (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, Japan, почтовый код: 305-8566) 6 декабря 1994 и ему присвоен инвентарный номер FERM P-14690. Затем депозит был переведен 29 сентября 1995 в международный депозит в соответствии с Будапештским договором и ему присвоен инвентарный номер FERM BP-5252.
Примеры бактерий Coryneform, которые обладают способностью продуцировать L-лизин, включают мутантные штаммы, устойчивые к S-(2-аминоэтил)-цистеину (далее обозначают как "AEC"), в том числе Brevibacterium lactofermentum AJ11082 (NRRL B-11470) (описан в JP56-1914B, JP56-1915B, JP57-14157B, JP57-14158B, JP57-30474B, JP58-10075B, JP59-4993B, JP61-35840B, JP62-24074B, JP62-36673B, JP5-11958B, JP7-112437B и JP7-112438B), мутантные штаммы, ауксотрофные по аминокислоте, такой как L-гомосерин (JP48-28078B и JP56-6499B), мутантные штаммы, устойчивые к АЕС, и ауксотрофные по аминокислотам, таким как L-лейцин, L-гомосерин, L-пролин, L-серин, L-аргинин, L-аланин и L-валин (патенты США № 3708395 и 3825472), мутантные штаммы-продуценты L-лизина, устойчивые к DL-α-амино-ε-капролактаму, α-аминолауриллактаму, аналогу аспарагиновой кислоты, лекарственному сульфамидному препарату, хиноиду и N-лауроиллейцину, мутантные штаммы-продуценты L-лизина, устойчивые к ингибитору оксалоацетатдекарбоксилазы или ингибитору фермента респираторного тракта (JP50-53588A, JP50-31093A, JP52-102498A, JP53-9394A, JP53-86089A, JP55-9783A, JP55-9759A, JP56-32995A, JP56-39778A, JP53-43591B и JP53-1833B), мутантные штаммы-продуценты L-лизина, ауксотрофные по инозитолу или уксусной кислоте (JP55-9784A и JP56-8692A), мутантные штаммы-продуценты L-лизина, которые чувствительны к действию фторпировиноградной кислоты или температуры 34°С или выше (JP55-9783A и JP53-86090A), мутантные штаммы - продуценты L-лизина бактерий Brevibacterium или Corynebacterium, устойчивые к этиленгликолю (патент США № 4411997) и т.д.
Способность продуцировать L-аминокислоту можно придать также путем увеличения экспрессии гена, кодирующего фермент биосинтеза L-аминокислоты.
Например, способность продуцировать L-лизин можно придать путем увеличения экспрессии гена, кодирующего дигидродипиколинатсинтазу, и гена, кодирующего аспартокиназу. В частности, приготавливают рекомбинантную ДНК лигированием фрагмента гена, кодирующего дигидродипиколинатсинтазу, и фрагмента гена, кодирующего аспартокиназу, в вектор, преимущественно высококопийный вектор, который операбельно можно поместить в микроорганизм-хозяин, используемый для продукции L-лизина. В итоге этой трансформации копийность гена, кодирующего дигидродипиколинатсинтазу, и гена, кодирующего аспартокиназу в клетке-хозяине, возрастает, и, таким образом, активность указанных ферментов усиливается. Далее по тексту настоящего описания дигидродипиколинатсинтазу, аспартокиназу и аспартокиназу III обозначают их аббревиатурами, соответственно, как DDPS, AK и AKIII.
Гены, которые кодируют DDPS и AK, специально не ограничиваются, при условии, что они кодируют белки, обладающие соответственно активностью DDPS и AK. Примеры подобных генов включают гены Escherichia coli, Methylophilus methylotrophus, Corynebacterium glutamicum и т.д. Поскольку нуклеотидные последовательности для гена DDPS (dapA, Richaud, F. et al., J. Bacteriol., 297 (1986) и гена AKIII (lysC, Cassan, M., Parsot, C., Cohen, G.N. and Patte, J.C., J. Biol. Chem., 261, 1052 (1986)), известны, то указанные гены могут быть получены методом ПЦР с использованием праймеров, разработанных на основании их нуклеотидных последовательностей в хромосомной ДНК микроорганизма, такого как штамм E. coli К-12. Далее по тексту настоящего описания ген, кодирующий DDPS, и ген, кодирующий AK, в качестве примеров представлены генами dapA и lysC, полученными из E. coli, однако гены, кодирующие DDPS, и гены, кодирующие AK, не ограничиваются генами dapA и lysC.
Известно, что DDPS дикого типа, полученная из Escherichia coli, чувствительна к ингибированию L-лизином по типу обратной связи, и что AKIII дикого типа, полученная из Escherichia coli, чувствительна к супрессии и ингибированию L-лизином по типу обратной связи. Поэтому в том случае, когда используют dapA и lysC, то предпочтительно применяют мутантные гены, кодирующие DDPS и AK, которые устойчивы к ингибированию L-лизином по типу обратной связи. Далее по тексту настоящего изобретения DDPS, имеющая мутацию, которая выявляется при ингибировании L-лизином по типу обратной связи, может также обозначаться как "мутантная DDPS", а ДНК, кодирующая мутантную DDPS, может также обозначаться как "мутантный dapA" или "dapA*". AKIII, полученная из Escherichia coli, которая имеет мутацию, устраняющую ингибирование L-лизином по типу обратной связи, может также обозначаться как "мутантная AKIII", а ДНК, кодирующая мутантную AKIII, может также обозначаться как "мутантный lysC". DDPS, полученная из бактерий Corynebacterium, обладает изначальной стойкостью к ингибированию L-лизином по типу обратной связи, и поэтому DDPS и AK, которые применяются согласно настоящему изобретению, не обязательно должны подвергаться мутации.
Примеры ДНК, кодирующей мутантную DDPS, которая устойчива к ингибированию L-лизином по типу обратной связи, включают ДНК, кодирующую DDPS, аминокислотная последовательность которой включает замещение 118-го остатка гистидина тирозином. (Патенты США № 5661012 и 6040160). Кроме того, примеры ДНК, кодирующей мутантную AKIII, которая устойчива к ингибированию L-лизином по типу обратной связи, включают ДНК, кодирующую AKIII, аминокислотная последовательность которой включает замещение 352-го остатка треонина изолейцином (Патенты США № 5661012 и 6040160). Мутантную ДНК можно получить с помощью сайтнаправленного мутагенеза по методу ПЦР и т.п.
Плазмида, которую используют для клонирования гена, может быть любой плазмидой при условии, что она может реплицироваться в микроорганизмах, и конкретные примеры плазмид включают pBR322, pTWV228 (Takara Bio), pMW119 (Nippon Gene), pUC19 и т.д.
Вектор, который операбельно можно поместить в микроорганизм-хозяин, используемый для трансформации, представляет собой плазмиду, обладающую способностью автономно реплицироваться в клетках каждого микроорганизма. Конкретные примеры векторов для Escherichia coli включают pSTV29 (Takara Bio), RSF1010 (Gene, Vol. 75 (2), pp. 271-288, 1989), pUC19, pBR322, pMW119 и т.д. Могут также использоваться векторы ДНК фага. Вектор для бактерии Methylophilus, например, представляет собой плазмиду, которая обладает способностью автономно реплицироваться в клетках бактерий Methylophilus. Конкретные примеры векторов для бактерии Methylophilus включают RSF1010 и его производные, такие как pAYC32 (Chistorerdov, A.Y., Tsygankov, Y.D., Plasmid, 16, 161-167 (1986)), pMFY42 (Gene, 44, 53 (1990)), pRP301 и pTB70 (Nature, 287, 396 (1980)). Примеры вектора, который операбельно можно поместить в бактерию Coryneform, включают pAM330 (JP58-67699A), pHM1519 (JP58-77895A) и pSFK6 (JP-2000-262288A). Кроме того, векторы, которые получают удалением фрагмента ДНК, придающего плазмиде способность автономно реплицироваться в бактерии Coryneform, с последующей вставкой фрагмента в векторы для Escherichia coli, могут быть использованы в качестве так называемого челночного вектора, который способен автономно реплицироваться как в Escherichia coli, так и в бактерии Coryneform.
С целью приготовления рекомбинантной ДНК посредством лигирования dapA и lysC с любым из вышеуказанных векторов, можно использовать рестриктазы для расщепления как фрагмента ДНК, содержащего dapA и lysC, так и вектора. Лигирование обычно осуществляют с помощью лигазы, такой как Т4 ДНК-лигаза. dapA и lysC могут быть включены в отдельные векторы или в один вектор. Методы, которые могут применяться для расщепления с помощью рестриктаз, лигирования ДНК, приготовления хромосомной ДНК, проведения ПЦР, приготовления плазмидной ДНК, трансформации, подбора олигонуклеотидов в качестве праймеров и т.д., могут быть обычными методами, хорошо известными специалистам. Подобные методы описываются в Sambrook, J., Fritsch, E.F., and Maniatis, T., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989) и т.п. Для введения в микроорганизм рекомбинантной ДНК, полученной вышеуказанным способом, может применяться любой метод при условии, что обеспечивается достаточная эффективность трансформации. Например, может применяться электропорация (Canadian Journal of Microbiology, 43, 97 (1997)).
В качестве плазмиды, которая содержит мутантный dapA, кодирующий мутантную DDPS, и мутантный lysC, кодирующий мутантную AKIII, может применяться плазмида RSFD80, пригодная для широкого круга хозяев (патент США № 6040160). Штамм Escherichia coli JM109, трансформированный с помощью RSFD80, был обозначен как AJ12396 (патент США № 6040160), и указанный штамм был депонирован 28 октября 1993 в независимом исполнительном агентстве, Национальном институте передовой прикладной науки и технологии, Международном патентном депозитарии организмов и получил инвентарный номер FERM P-13936. Затем депозит был преобразован 1 ноября 1994 в международный депозит в соответствии с Будапештским договором и ему присвоен инвентарный номер FERM BP-4859. RSFD80 можно получить из штамма AJ12396 известным способом.
Экспрессию гена DDPS и гена АК можно также увеличить путем интегрирования множества копий dapA и lysC в хромосомную ДНК микроорганизма. С целью введения множества копий dapA и lysC в хромосомную ДНК микроорганизма, можно провести гомологичную рекомбинацию путем конъюгирования последовательности, которая присутствует во многих копиях в хромосомной ДНК. В качестве последовательности, которая содержится в хромосомной ДНК во множестве копий, может использоваться повторяющаяся ДНК или инвертированный повтор, содержащийся на конце способного к перемещению элемента. Иначе, как описано в JP2-109985А, множество копий dapA и/или lysC может быть введено в хромосомную ДНК с помощью транспозона. В обоих указанных методах активности DDPS и АК усиливаются в результате увеличения копийности dapA и lysC в трансформированных штаммах.
Помимо вышеуказанных способов амплификации гена экспрессию гена DDPS и гена АК можно также увеличить путем замещения регуляторной последовательности, контролирующей экспрессию, такой как промоторы dapA и lysC, более сильными промоторами (JP1-215280А). Примеры подобных сильных промоторов включают lac промотор, trp промотор, trc промотор, tac промотор, PR промотор и PL промотор фага лямбда, tet промотор, amyE промотор, spac промотор и т.д. Вставка указанных промоторов вместо природных промоторов увеличивает экспрессию dapA и lysC, что приводит к увеличению активности DDPS и АК. Усиление регуляторной последовательности, контролирующей экспрессию, можно комбинировать с увеличением копийности dapA и lysC.
Способность продуцировать L-лизин можно придать также путем увеличения экспрессии гена, кодирующего фермент биосинтеза L-лизина, отличный от DDPS и АК. Примеры подобных ферментов включают ферменты диаминопимелатного пути синтеза, такие как дигидродипиколинатредуктаза, диаминопимелатдекарбоксилаза, диаминопимелатдегидрогеназа (WO 96/40934), фосфоенолпируваткарбоксилаза (JP60-87788A), аспартатаминотрансфераза (JP6-102028B), диаминопимелатэпимераза (JP2003-135066A), аспартатсемиальдегиддегидрогеназа (WO 00/61723). Другие примеры подобных ферментов включают ферменты аминоадипатного пути развития, такие как гомоаконитатгидратаза (JP2000-157276A) и т.д. Увеличение экспрессии гена указанных ферментов можно комбинировать с увеличением экспрессии генов DDPS и АК.
Кроме того, микроорганизм, обладающий способностью продуцировать L-лизин, можно получить также путем снижения или исключения внутриклеточной активности фермента, который катализирует реакцию синтеза соединения, отличного от L-лизина, и реакцию, ответвляющуюся от пути биосинтеза L-лизина. Примеры подобных ферментов включают гомосериндегидрогеназу и лизиндекарбоксилазу. Штаммы, в которых активность указанных ферментов снижена или исключена, описываются в WO 95/23864 и WO 96/17930.
Примеры методов снижения или исключения внутриклеточной активности фермента включают мутацию или делецию гена, кодирующего фермент в клетках микроорганизма, таким образом, что внутриклеточная активность снижается или исключается по сравнению с немутированным штаммом. Примеры методов мутации или делеции гена включают модификацию регуляторных последовательностей, контролирующих экспрессию, таких как промоторы и последовательности Шайна-Дальгарно (SD), введение миссенс-мутаций, нонсенс-мутаций или мутаций смещения рамки считывания в открытую рамку считывания и делеция части гена (J. Biol. Chem. 1997, 272 (13): 8611-7). Мутированный ген можно ввести в микроорганизм с помощью метода гомологичной рекомбинации, в которой ген дикого типа в хромосоме заменяется на мутированный ген, или с использованием транспозона или IS-фактора. Методы гомологичной рекомбинации включают методы с использованием линейной ДНК, термочувствительной плазмиды и нереплицируемой плазмиды. Указанные методы описываются в Proc. Natl. Acad. Sci. USA, 2000 Jun 6; 97 (12): 6640-5, патенте США № 6303383, JP05-007491A и т.д.
Способы увеличения и снижения активности фермента биосинтеза L-лизина могут применяться для придания способности продуцировать другую L-аминокислоту. Конкретные примеры Escherichia coli, которые обладают способностью продуцировать L-аргинин, включают мутантные штаммы, устойчивые к α-метилметионину, п-фторфенилаланину, D-аргинину, гидроксамату аргинина, S-(2-аминоэтил)цистеину, α-метилсерину, β-2-тиенилаланину или сульфагуанидину (JP No. 56-106598A) и т.д. Кроме того, можно использовать штамм Escherichia coli 237, представляющий собой бактерию - продуцент L-аргинина, которая содержит мутацию, придающую устойчивость к ингибированию L-аргинином по типу обратной связи, и которая обладает высокой активностью N-ацетилглутаматсинтазы (российская заявка на патент № 2000117677). Указанный штамм 10 апреля 2000 был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ), ВНИИгенетика, под номером VKPM B-7925, а 18 мая 2001 был переведен в международный депозит в соответствии с Будапештским договором. Может также использоваться штамм Escherichia coli 382, который был получен из штамма 237 и который обладает повышенной способностью ассимилировать ацетат (JP2002-017342A). Штамм Escherichia coli 382 был депонирован 10 апреля 2000 во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под номером VKPM B-7926.
Примеры бактерий Coryneform, обладающих способностью продуцировать L-аргинин, включают штаммы бактерии Coryneform, которые не только устойчивы к 2-тиазолаланину, но и ауксотрофны по отношению к L-гистидину, L-пролину, L-треонину, L-изолейцину, L-метионину или L-триптофану (JP54-44096A), штамм бактерии Coryneform, который устойчив к кетомалоновой кислоте, фтормалоновой кислоте или монофторуксусной кислоте (JP57-18989A), штамм бактерии Coryneform, который устойчив к аргининолу (JP62-24075A), штамм бактерии Coryneform, который устойчив к Х-гуанидину (Х обозначает производное жирной кислоты или алифатическую цепочку, JP2-186995A), штамм бактерии Coryneform, который устойчив к гидроксамату аргинина и 6-азаурацилу (JP57-150381A), штамм бактерии Coryneform, дефицитный по ArgR (белок-супрессор ферментов биосинтеза аргинина) (JP2002-51790A) и т.д.
Активности ферментов биосинтеза L-аргинина, L-гистидина, L-орнитина и других L-аминокислот могут быть усилены с помощью методов, аналогичных вышеуказанным методам для ферментов биосинтеза L-лизина.
Примеры ферментов биосинтеза L-аргинина включают один или несколько видов ферментов, выбранных из N-ацетилглутаматсинтазы (argA), N-ацетилглутамилфосфатредуктазы (argC), орнитинацетилтрансферазы (argJ), N-ацетилглутаматкиназы (argB), ацетилорнитинтрансаминазы (argD), ацетилорнитиндеацетилазы (argE), орнитинкарбамоилтрансферазы (argF), аргининосукцинатсинтазы (argG), аргининосукцинатлиазы (argH) и карбамоилфосфатсинтазы (carAB). Названия генов, кодирующих указанные ферменты, приведены соответственно в скобках после названий ферментов. Примеры штаммов, у которых усиливаются активности указанных ферментов, включают, например, штаммы, приведенные в JP2000-287693A, JP2000-197490A, JP07-028749B и т.д.
Способность продуцировать L-аргинин можно также придать путем увеличения экспрессии гена, кодирующего глутаматдегидрогеназу (ЕР 1057893А) или путем увеличения активности глутаматсинтазы (US2005-00142236). Известно, что ферменты биосинтеза L-аргинина супрессируются L-аргинином, и поэтому способность продуцировать L-аргинин можно также эффективно усилить путем удаления ингибитора аргинина или путем введения мутации в N-ацетилглутаминсинтазу (ЕР 1154020А и ЕР 1170361А), которая придает устойчивость к ингибированию по типу обратной связи.
Кроме того, в качестве штаммов-продуцентов L-аргинина, можно также использовать бактерии Bacillus, устойчивые к аналогу гистидина или аналогу триптофана (JP52-114092А), бактерии Bacillus, ауксотрофные, по крайней мере, по одному из L-метионина, L-гистидина, L-треонина, L-пролина, L-изолейцина, L-лизина, аденина, гуанина и урацила (или предшественника урацила) (JP52-99289A), бактерии Bacillus, устойчивые к гидроксамату аргинина (JP51-6754В), Serratia marcescens, ауксотрофную по янтарной кислоте или устойчивую к нуклеотидному аналогу (JP58-9692А), Serratia marcescens, дефицитную по способности преобразовывать аргинин в ходе обмена веществ, устойчивую к антагонисту аргинина и канаванину и ауксотрофную по лизину (JP52-8729A), Saccharomyces cerevisiae, устойчивую к аргинину, гидроксамату аргинина, гомоаргинину, D-аргинину, канаванину, гидроксамату аргинина и 6-азаурацилу (JP53-143288A), Candida tropicalis, устойчивую к канаванину (JP53-3586A) и т.д.
Примеры ферментов биосинтеза L-гистидина включают АТФ-фосфорибозилтрансферазу (hisG), фосфорибозил-АМФ-циклогидролазу (hisI), фосфорибозил-АТФ-пирофосфогидролазу (hisIE), фосфорибозилформимино-5-аминоимидазолкарбоксамидриботидизомеразу (hisA), амидотрансферазу (hisH), гистидинолфосфатаминотрансферазу (hisC), гистидинолфосфатазу ( hisB), гистидинолдегидрогеназу (hisD) и т.п.
Известно, что гены, кодирующие ферменты биосинтеза L-гистидина (hisG, hisBHAFI), ингибируются L-гистидином, а потому способность продуцировать L-гистидин можно также эффективно усилить путем введения мутации, придающей устойчивость к ингибированию по типу обратной связи, в АТФ-фосфорибозилтрансферазу ( hisG) (патенты России №№ 2003677 и 2119536).
Конкретные примеры микроорганизмов, которые обладают способностью продуцировать L-гистидин, включают штаммы E. coli FERM-P5038 и 5048, которые вводили вместе с вектором, содержащим ДНК, которая кодирует фермент биосинтеза L-гистидина (JP56-005099А), штаммы с введенным rht, геном для экспорта аминокислоты (ЕР 1016710А), штамм E. coli 80, которому придают устойчивость к сульфагуанидину, DL-1,2,4-триазол-3-аланину и стрептомицину (VKPM B-7270, патент России 2119536) и т.д.
Биосинтетический путь получения L-орнитина включает несколько ферментов, которые являются общими с биосинтетическим путем получения L-аргинина. Примеры ферментов биосинтеза L-орнитина включают N-ацетилглутаматсинтазу (argA), N-ацетилглутамилфосфатредуктазу (argC), орнитинацетилтрансферазу (argJ), N-ацетилглутаматкиназу (argB), ацетилорнитинтрансаминазу (argD), ацетилорнитиндеацетилазу (argE) и т.д.
Примеры бактерий, обладающих способностью продуцировать L-орнитин, включают бактерии Coryneform и бактерии Arthrobacter, в которые вводят L-цитруллин- или L-аргинин-ауксотрофные мутации (JP02-283290A), штамм AJ11589 бактерии Coryneform, устойчивый к активным веществам, подобным витамину Р (FERM-P5644, JP57-016696A) и т.п.
Примеры микроорганизмов, обладающих способностью продуцировать L-треонин, включают мутант, устойчивый к 6-диметиламинопурину, который способен продуцировать L-треонин (JP5-304969A), штамм, в котором ген фермента биосинтеза треонина, содержащего мутацию для увеличения ферментативной активности, амплифицирован плазмидой (JP1-29559B, JP05-227977A), штамм, в котором оперон треонина амплифицирован плазмидой (JP2-109985A), штамм, в котором амплифицированы ген, кодирующий пируваткарбоксилазу, и ген, кодирующий никотинамиднуклеотидтрансгидрогеназу (JP2002-51787A), и т.д.
Штамм Escherichia coli VKPM B-3996 (патент США № 5175107) также может использоваться в качестве штамма-продуцента L-треонина. VKPM B-3996 был депонирован 19 ноября 1987 во Всероссийской коллекции промышленных микроорганизмов (ВКПМ), ВНИИгенетика под регистрационным номером VKPM B-3996. Штамм VKPM B-3996 включает плазмиду pVIC40 (международная патентная публикация WO 90/04636), которую получают вставкой оперона треонина (thrABC) в плазмиду pAYC32, включающую ген-маркер устойчивости к стрептомицину (Chistorerdov, A.Y., Tsygankov, Y.D., Plasmid, 1986, 16, 161-167). Аспартокиназа-I-гомосериндегидрогеназа I, кодируемая мутантным геном thrA, который содержится в pVIC40, не чувствительна к ингибированию L-треонином по типу обратной связи.
В качестве штамма - продуцента L-треонина может также использоваться штамм Escherichia coli VKPM B-5318 (ЕР 0593792В). VKPM B-5318 был депонирован 3 мая 1990 во Всероссийской коллекции промышленных микроорганизмов (ВКПМ), ВНИИгенетика (адрес ВКПМ, ВНИИгенетика: Дорожный проезд 1, Москва, 113545, Россия) под регистрационным номером VKPM B-5318. Штамм VKPM B-5318 является аутотрофным по L-изолейцину, и оперон треонина, кодирующий фермент биосинтеза треонина, расположен в прямом направлении от термочувствительного репрессора С1, PR-промотора и N-конца белка Cro, полученного из λ-фага, более того, штамм включает плазмидную ДНК, сконструированную таким образом, что экспрессия гена биосинтеза треонина регулируется промотором и репрессором, полученными из λ-фага.
Кроме того, в качестве штамма - продуцента L-треонина, может также использоваться штамм Escherichia coli MG442 (US 4278765). Штамм MG442 был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) как CMIMB-1628.
Бактерии, обладающие способностью продуцировать L-треонин, могут быть получены путем увеличения активности фермента биосинтеза L-треонина. Примеры генов, кодирующих ферменты биосинтеза L-треонина, включают ген аспартокиназы III, ген аспартатсемиальдегиддегидрогеназы и т.п. Можно повысить активность фермента биосинтеза L-треонина в бактерии, в которой ингибирована активность фермента, подавляющего синтез треонина. Примеры бактерии, в которой ингибирована активность фермента, подавляющего синтез треонина, включают штамм TDH6, у которого отмечается недостаточная активность треониндегидрогеназы (JP2001-346578А).
Бактерию, обладающую способностью продуцировать L-глутаминовую кислоту, можно получить также путем увеличения активности фермента биосинтеза L-глутаминовой кислоты. Примеры ферментов биосинтеза L-глутаминовой кислоты включают глутаматдегидрогеназу, глутаминсинтазу, глутаматсинтазу, изоцитратдегидрогеназу, аконитатгидратазу, цитратсинтазу, пируваткарбоксилазу, фосфоенолпируваткарбоксилазу, фосфоенолпируватсинтазу, енолазу, фосфоглицеромутазу, фосфоглицераткиназу, глицеральдегид-3-фосфатдегидрогеназу, триозафосфатизомеразу, фруктозабифосфатальдолазу, фосфофруктокиназу, глюкозафосфатизомеразу и т.д.
В частности, бактерии, в которых наблюдается повышенная активность указанных ферментов биосинтеза L-глутаминовой кислоты, включают штаммы бактерии Coryneform, раскрытые в WO 00/18935 и JP2000-232890А, и штаммы семейства энтеробактерий, раскрытые в JP2001-333769А, JP2000-106869А, JP2000-189169A и JP2000-333769А.
Бактерии, обладающие способностью продуцировать L-глутаминовую кислоту, можно получить также путем ослабления или устранения активности одного или нескольких ферментов, которые катализируют реакцию, приводящую к ответвлению от синтеза L-глутаминовой кислоты и к получению соединения, отличного от L-глутаминовой кислоты. Подобные ферменты включают изоцитратлиазу, α-кетоглутаратдегидрогеназу, фосфатацетилтрансферазу, ацетаткиназу, синтазу ацетогидроксикислот, ацетолактатсинтазу, формиатацетилтрансферазу, лактатдегидрогеназу, глутаматдекарбоксилазу, 1-пирофосфатдегидрогеназу и т.д.
В частности, бактерия, в которой снижена активность α -кетоглутаратдегидрогеназы, включает штамм Brevibacterium lactofermentum Δs, раскрытый в WO 95/34672, штамм Brevibacterium lactofermentum AJ12821 (FERM BP-4172), раскрытый в JP6-237779A, штаммы Escherichia coli, раскрытые в JP5-244970A или JP7-203980A, и штамм Enterobacter agglomerans, раскрытый в JP2001-333769A.
Примеры бактерий, обладающих способностью продуцировать L-цистеин, включают штамм Escherichia coli, в котором снижена активность цистатионин-β-лиазы (JP2003-169668А), и штамм Escherichia coli (JP11-155571А) или бактерии Coryneform (JP2002-233384А), у которых отсутствует ингибирование серинацетилтрансферазы L-цистеином по типу обратной связи.
Примеры бактерий Escherichia, обладающих способностью продуцировать L-пролин, включают штамм Escherichia coli 702 (VKPM B-8011), устойчивый к 3,4-дигидроксипролину и азатидин-2-карбоксилату, и штамм 702ilvA (VKPM B-8012), который получен удалением гена ilvA в штамме 702 (JP2002-300874A).
Примеры бактерий Escherichia, обладающих способностью продуцировать L-фенилаланин, включают штамм Escherichia coli AJ12739 (tyrA::Tn10, TyrR; VKPM B-8197), у которого удалены гены tyrA и tyrR, штамм Escherichia coli HW1089, в который введен мутированный pheA (патент США № 5354672), и штамм Escherichia coli, в котором амплифицированы гены yddG и yedA (WO 03/044192). Примеры бактерий Coryneform, обладающих способностью продуцировать L-фенилаланин, включают штамм, который является ауксотрофным по тирозину и устойчив к действию L-фенилаланил-L-тирозина (JP5-49489А).
Бактерии, обладающие способностью продуцировать L-триптофан, могут быть получены путем увеличения активности ферментов биосинтеза L-триптофана, в том числе фосфоглицератдегидрогеназы и антранилатсинтазы. Указанные ферменты могут быть устойчивы к ингибированию L-триптофаном или L-серином по типу обратной связи. Например, бактерия, содержащая указанные ферменты, устойчивые к ингибированию по типу обратной связи, может быть получена введением плазмиды pGH5, которая включает мутантный ген serA, кодирующий устойчивую к L-триптофану фосфоглицератдегидрогеназу, в штамм Escherichia coli SV164, который включает ген, кодирующий устойчивую к L-серину антранилатсинтазу (WO 94/08031).
Бактерии, обладающие способностью продуцировать L-триптофан, могут быть также получены путем увеличения активности ферментов биосинтеза L-триптофана, которые кодируются опероном триптофана. Подобные ферменты включают оперон L-триптофана триптофансинтазу и антранилатсинтазу. Примеры указанных бактерий включают штамм Escherichia coli, в который введен оперон триптофана, содержащий ген, который кодирует стойкую к L-серину антранилатсинтазу (JP57-71397A, JP62-244382A и патент США № 4371614).
Кроме того, примеры бактерий, обладающих способностью продуцировать L-триптофан, включают штамм Escherichia coli AGX17(pGX44) [NRRL B-12263], являющийся ауксотрофным по L-фенилаланину и L-тирозину, и штамм AGX6 (pGX50)aroP [NRRL B-12264], включающий плазмиду pGX50, которая содержит оперон триптофана (патент США № 4371614).
Примеры бактерий Escherichia, обладающих способностью продуцировать L-изолейцин, включают мутантный штамм, стойкий к 6-диметиламинопурину (JP5-304969А), мутантный штамм, стойкий к L-изолейцингидроксамату, тиаизолейцину, DL-этионину или аргинингидроксамату (JP5-130882А), и рекомбинантный штамм, у которого ген, кодирующий треониндеаминазу и синтазу ацетогидроксикислот, амплифицирован плазмидой (JP2-458A, JP2-42988A и JP8-47397A).
Бактерии, обладающие способностью продуцировать L-валин, могут быть также получены путем увеличения активности ферментов биосинтеза L-валина, включая ферменты, кодируемые опероном ilvGMEDA, в частности путем увеличения активности ацетоксигидроксилатсинтазы, кодируемой геном ilvG (JP02-748418В). Указанные ферменты могут быть устойчивы к ингибированию L-валином по типу обратной связи.
Бактериями, обладающими способностью продуцировать L-валин, могут быть бактерии, у которых снижена экспрессия гена ацетолактатсинтазы III (гена ilvIH).
Бактерии, обладающие способностью продуцировать L-валин, могут быть устойчивы к аналогам аминокислот. Примеры подобных бактерий включают мутантный штамм, который является ауксотрофным по L-изолейцину и L-метионину и устойчив к D-рибозе, пуриновому нуклеозиду или пиримидиновому рибонуклеозиду (FERM P-1841, P-5556; JP53-025034А), и мутантный штамм, устойчивый к поликетоноиду (FERM P-9325; JP04-045314В).
Примеры бактерий, обладающих способностью продуцировать L-аланин, включают штамм бактерии Coryneform, дефицитный по активности Н+-АТФазы (Appl. Microbiol. Biotechnol. 2001 Nov.; 57(4): 534-40), или штамм бактерии Coryneform, у которого амплифицирован ген β-декарбоксилазы аспарагиновой кислоты (JP07-163383А).
Увеличение экспрессии гена ybjE
Микроорганизм по настоящему изобретению может быть получен, как описано выше, модификацией микроорганизма, обладающего способностью продуцировать L-аминокислоту, таким образом, что экспрессия гена ybjE увеличивается. Иначе можно вначале увеличить экспрессию гена ybjE, а затем придать способность продуцировать L-аминокислоту.
Экспрессию гена ybjE можно увеличить либо путем увеличения экспрессии эндогенного гена ybjE за счет модификации регуляторной последовательности, контролирующей экспрессию, такой как промотор, или путем экзогенного введения гена ybjE с помощью плазмиды и т.п. Указанные методы можно комбинировать.
Увеличение экспрессии гена ybjE можно подтвердить измерением количества РНК при экспрессии гена ybjE в бактерии по настоящему изобретению с помощью гибридизации по методу нозерн-блоттинга или по методу RT-PCR (Molecular cloning: Cold Spring Harbor Laboratory Press, Cold Spring Harbor (USA), 2001) и сравнения его с штаммом дикого типа или немодифицированным штаммом. Экспрессия гена ybjE в микроорганизме по настоящему изобретению увеличивается в значительно большей степени, чем в штамме дикого типа или немодифицированном штамме, и предпочтительно увеличивается не менее чем в 1,5 раза, более предпочтительно не менее чем в 2 раза и наиболее предпочтительно не менее чем в 3 раза по сравнению со штаммом дикого типа или немодифицированным штаммом.
Ген ybjE может быть выделен из Escherichia coli или его гомолога. Примеры гена ybjE из Escherichia coli включают ген, кодирующий белок, который имеет аминокислотную последовательность, составленную аминокислотами с номерами с 17 по 315 в SEQ ID NO: 2, предпочтительно ген, имеющий нуклеотидную последовательность, включающую нуклеотиды с номерами с 49 по 948 из SEQ ID NO: 1. Несмотря на то, что кодоном для Val в положении 1 в аминокислотной последовательности SEQ ID NO: 2 является gtg, его можно транслировать как Met, а белок, кодируемый геном ybjE, может быть белком с аминокислотной последовательностью SEQ ID NO: 2 (с 1 по 315). В таком случае предпочтительно использовать ДНК, содержащую нуклеотидную последовательность, составленную нуклеотидами с номерами с 1 по 948 из SEQ ID NO: 1. Тем не менее из Примеров очевидно, что микроорганизм, который можно применять в способе получения по настоящему изобретению, может быть получен путем использования ДНК, содержащей нуклеотидную последовательность SEQ ID NO: 1 (с 49 по 948) независимо от того, остаток какой аминокислоты является кодоном инициирования трансляции.
Гомолог гена ybjE из Escherichia coli относится к гену, который обладает высоким структурным сходством с геном ybjE из Escherichia coli и усиливает способность экспортировать L-аминокислоту или повышает устойчивость к L-аминокислоте, а также усиливает способность микроорганизма-хозяина продуцировать L-аминокислоту. Примеры гомологов гена ybjE включают ген, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. Аминокислотная последовательность SEQ ID NO: 9 представляет собой последовательность, которая сохраняется в белке YbjE из Escherichia coli (SEQ ID NO: 2) и в белке YbjE из штамма Salmonella typhimurium LT2. Аминокислотная последовательность SEQ ID NO: 10 представляет собой последовательность, которая сохраняется в белке YbjE из Escherichia coli и в белке YbjE из штамма Yersinia pestis CO92 YPO1361.
Гомолог гена ybjE может быть геном, кодирующим белок, который на 70% или больше, предпочтительно на 80% или больше, еще более предпочтительно на 90% или больше, еще более предпочтительно на 95% или больше, наиболее предпочтительно на 98% или больше гомологичен общей аминокислотной последовательности SEQ ID NO: 2 или аминокислотной последовательности, составленной аминокислотами с номерами с 17 по 315 в SEQ ID NO: 2, и который обладает способностью экспортировать L-аминокислоту. Примеры гомолога гена ybjE включают также белок, который имеет аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10 и который обладает способностью экспортировать L-аминокислоту. Степень гомологии аминокислотной последовательности и последовательности ДНК может быть определена с помощью алгоритма BLAST (Proc. Natl. Acad. Sci. USA, 90, and 5873 (1993)) и FASTA (Methods Enzymol., 183, and 63 (1990)), разработанных Karlin и Altschul. Программа, получившая название BLASTN и BLASTX, разработана на основе указанного алгоритма BLAST (см. http://www.ncbi.nlm.nih.gov).
Могут также использоваться гены ybjE, полученные из микроорганизма, отличного от E. coli, и они включают ген, полученный из штамма Shigella flexneri 2a str. 2457T, который имеет последовательность, комплементарную нуклеотидам с номерами с 275793 по 276692 или с 275793 по 276740 из последовательности с инвентарным номером АЕ016980 из базы данных GenBank; ген, полученный из штамма Salmonella typhimurium LT 2, который имеет последовательность, комплементарную нуклеотидам с номерами с 97 по 996 из последовательности с инвентарным номером АЕ008740 из базы данных GenBank; и ген, полученный из штамма Yersinia pestis CO92, который имеет последовательность, комплементарную нуклеотидам с номерами с 197812 по 198708 из последовательности с инвентарным номером АJ414147 из базы данных GenBank. Кроме того, ген ybjE может быть клонирован из бактерии Coryneform, такой как Corynebacterium glutamicum и Brevibacterium lactofermentum, из бактерии Pseudomonas, такой как Pseudomonas aeruginosa, из бактерии Mycobacterium, такой как Mycobacterium tuberculosis или подобной бактерии, на основании степени гомологии приведенным выше генам.
Кроме того, ген ybjE по настоящему изобретению не ограничивается геном дикого типа, а может быть мутантным или искусственно модифицированным геном, кодирующим белок, который имеет аминокислотную последовательность SEQ ID NO: 2, аминокислотную последовательность, составленную аминокислотами с номерами с 17 по 315 в SEQ ID NO: 2, или аминокислотную последовательность SEQ ID NO: 9 или 10. Кодируемый белок может включать замены, делеции или вставки одного или нескольких аминокислотных остатков в одной или нескольких позициях, при условии, что сохраняются функции кодируемого белка YbjE, а именно способность экспортировать L-лизин. Хотя количество "нескольких" аминокислотных остатков, которые рассматриваются в настоящем описании, различается в зависимости от позиций в трехмерной структуре или типов аминокислотных остатков, оно может составлять от 2 до 20, предпочтительно от 2 до 10, более предпочтительно от 2 до 5. Замена аминокислот преимущественно представляет собой консервативную замену, включая замену ala на ser или thr, замену arg на gln, his или lys, замену asn на glu, gln, lys, his или asp, замену asp на asn, glu или gln, замену cys на ser или ala, замену gln на asn, glu, lys, his, asp или arg, замену glu на gly, asn, gln, lys или asp, замену gly на pro, замену his на asn, lys, gln, arg или tyr, замену ile на leu, met, val или phe, замену leu на ile, met, val или phe, замену lys на asn, glu, gln, his или arg, замену met на ile, leu, val или phe, замену phe на trp, tyr, met, ile или leu, замену ser на thr или ala, замену thr на ser или ala, замену trp на phe или tyr, замену tyr на his, phe или trp и замену val на met, ile или leu. Замена, делеция или вставка одного или нескольких нуклеотидов, как указано выше, включает также природную мутацию, которая возникает вследствие индивидуальных различий и различий в видах микроорганизмов, которые включают ген ybjE (мутант или вариант).
Подобные гены можно получить путем модифицирования нуклеотидной последовательности, приведенной в SEQ ID NO: 1, или нуклеотидной последовательности, составленной нуклеотидами с номерами с 49 по 948 из SEQ ID NO: 1, например с помощью сайт-направленного мутагенеза, таким образом, что производится одна или несколько замен, делеций или вставок в конкретные участки кодируемого геном белка.
Примеры гена ybjE, который содержит мутацию в последовательности SEQ ID NO: 1, включают ген ybjE, имеющий последовательность SEQ ID NO: 1, в которой нуклеотид (гуанин) в 3-й позиции заменен аденином.
Кроме того, подобные гены могут быть также получены обычными вызывающими мутагенез обработками, которые описаны ниже. Примеры вызывающих мутагенез обработок включают in vitro обработку гена, имеющего нуклеотидную последовательность, приведенную в SEQ ID NO: 1, или нуклеотидную последовательность, составленную нуклеотидами с номерами с 49 по 948 из SEQ ID NO: 1, с помощью гидроксиламина, и обработку накапливающего ген микроорганизма, такого как бактерия Escherichia, ультрафиолетовым облучением или же мутирующим агентом, который используют для обычных вызывающих мутагенез обработок, таким как N-метил-N'-нитро-N-нитрозогуанидин (NTG) или EMS (этилметансульфонат). Кодируют ли эти гены белок, обладающий способностью экспортировать L-аминокислоту, может быть подтверждено, например, экспрессией генов в подходящей клетке и измерением, увеличилось ли количество L-аминокислоты, экспортированной в питательную среду. Придают ли указанные гены устойчивость микроорганизму-хозяину к L-аминокислоте, может быть подтверждено путем введения генов в микроорганизм-хозяин, выращивание хозяина в присутствии высоких концентраций L-аминокислоты и сравнение роста указанного микроорганизма с ростом контрольного штамма.
Ген ybjE включает также ДНК, которая способна в строгих условиях к гибридизации с нуклеотидной последовательностью SEQ ID NO: 1, с нуклеотидной последовательностью, составленной нуклеотидами с номерами с 49 по 948 из SEQ ID NO: 1, или с зондом, приготовленным из указанных последовательностей, и которая кодирует белок, обладающий способностью экспортировать L-аминокислоту. Выражение "строгие условия" в настоящем описании обозначают условия, в которых образуется так называемый специфичный гибрид, а неспецифичный гибрид не образуется. Трудно точно описать эти условия с помощью любых численных значений. Однако примеры строгих условий включают такие условия, при которых молекулы ДНК, обладающие высокой степенью гомологии друг к другу, например молекулы ДНК, обладающие степенью гомологии друг к другу не ниже чем 50%, гибридизуются, а молекулы ДНК, имеющие степень гомологии ниже 50%, - не гибридизуются, и такие условия, при которых молекулы ДНК гибридизуются друг в друга при концентрации соли в процессе промывки, типичной для гибридизации по Саузерну, т.е. в процессе однократной промывки или преимущественно в процессе 2-3 промывок с использованием 1 x SSC, 0,1% SDS при 60°С, предпочтительно, 0,1 x SSC, 0,1% SDS при 60°С, более предпочтительно 0,1 x SSC, 0,1% SDS при 68°С.
Экспрессия гена ybjE может быть увеличена, например, путем увеличения копийности гена ybjE в клетках с помощью методов генетической рекомбинации. Например, рекомбинантная ДНК может быть приготовлена лигированием фрагмента гена, содержащего ген ybjE, с вектором, преимущественно с высококопийным вектором, который способен реплицироваться в микроорганизме-хозяине, и введением полученного вектора в микроорганизм-хозяин.
Если используют ген ybjE из Escherichia coli, то его можно получить, например, методом ПЦР (полимеразной цепной реакцией, см. White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, сконструированных на основе нуклеотидной последовательности SEQ ID NO: 1, например праймеров, каждый из которых содержит последовательность SEQ ID NO: 5 или 6, и с использованием хромосомной ДНК из Escherichia coli в качестве матрицы. Может также использоваться ген ybjE из других микроорганизмов, и его можно получить из их хромосомных ДНК или библиотеки хромосомных ДНК методом ПЦР с использованием олигонуклеотидных праймеров, сконструированных на основе последовательности их гена ybjE, или его гомологичной последовательности, или с использованием белка YbjE из различных видов микроорганизмов, или методом гибридизации с использованием олигонуклеотидного зонда, приготовленного на основе информации об указанной последовательности. Хромосомную ДНК можно выделить из микроорганизма, который служит в качестве донора ДНК, например, по методу Saito и Miura (см. H.Saito и K.Miura, Biochem. Biophys. Acta, 72, 619 (1963), Text for Bioengineering Experiments, Edited by the Society for Bioscience and Bioengineering, Japan, pp. 97-98, Baifukan, 1992).
Затем ген ybjE лигируют с ДНК вектора, который можно операбельно поместить в микроорганизм-хозяин, и получают рекомбинантную ДНК. Преимущественно применяют векторы, способные автономно реплицироваться в микроорганизме-хозяине.
Примеры векторов, способных автономно реплицироваться в Escherichia coli, включают pUC19, pUC18, pHSG299, pHSG399, pHSG398, pACYC184 (pHSG и pACYC поставляются фирмой Takara Bio), RSF1010, pBR322, pMW219 (pMW поставляется фирмой Nippon Gene) и т.п.
Примеры векторов, способных автономно реплицироваться в бактериях Coryneform, включают pAM330 (JP58-67699A), pHM1519 (JP58-77895A), pVK7 (US2003-0175912) и pSFK6 (JP2000-262288A). Кроме того, может использоваться так называемый челночный вектор, способный автономно реплицироваться как в Escherichia coli, так и в бактериях Coryneform.
Примеры векторов, способных автономно реплицироваться в бактериях Methylophilus, включают RSF1010 и его производные, такие как pAYC32 (Chistorerdov, A.Y., Tsygankov, Y.D., Plasmid, 16, pp. 61-167 (1986)), pMFY42 (Gene, 44, р.53 (1990)), pRK301 и pTB70 (Nature, 287, 396 (1980)).
Чтобы приготовить рекомбинантную ДНК лигированием гена ybjE и любого из вышеупомянутых векторов, вектор и фрагмент, содержащий ген ybjE, расщепляют рестриктазами и лигируют, как правило, с помощью лигазы, такой как Т4 ДНК-лигаза.
Для введения в микроорганизм рекомбинантной ДНК, приготовленной, как указано выше, можно применять любой известный в настоящее время способ трансформации. Например, можно применять обработку клетки-реципиента хлоридом кальция таким образом, чтобы увеличить проницаемость ДНК, как описано для Escherichia coli (Mandel, M. и Higa, A., J. Mol. Biol., 53, 159 (1970)), и использовать для введения ДНК компетентные клетки, приготовленные из растущих клеток, как описано для Bacillus subtilis (Duncan, C.H., Wilson, G.A. and Young, F.E., Gene, 1, 153 (1977)). В дополнение к указанным методам можно использовать введение рекомбинантной ДНК в фотобластоподобные или сферопластоподобные клетки-реципиенты, которое, как было показано, может быть применено для Bacillus subtilis, актиномицетов и дрожжей (Chang, S. and Choen, S.N., Molec. Gen. Genet., 168, 111 (1979); Bibb, M.J., Ward, J.M. and Hopwood, O.A., Nature, 274, 398 (1978); Hinnen, A., Hicks, J.B. and Fink, G.R., Proc. Natl. Sci., USA, 75, 1929 (1978)). Кроме того, трансформацию бактерий Coryneform можно осуществить методом электроимпульса (Sugimoto et al., JP2-207791A).
Копийность гена ybjE можно увеличить также интегрированием множества копий гена в хромосомную ДНК микроорганизма. Для того, чтобы интегрировать множество копий гена ybjE в хромосомную ДНК микроорганизма, можно осуществить гомологичную рекомбинацию путем использования целевой последовательности, которая существует во множестве копий в хромосомной ДНК. В качестве последовательности, в которой множество копий содержится в хромосомной ДНК, могут использоваться повторяющаяся ДНК или инвертированные повторы на конце транспозона. Иначе, как описано в JP2-109985А, можно также встроить ген ybjE в транспозон и дать ему возможность перенестись таким образом, что множество копий гена интегрируется в хромосомную ДНК. Интегрирование гена ybjE в хромосому можно подтвердить гибридизацией по Саузерну с помощью зонда, содержащего частичную последовательность гена ybjE.
Увеличения экспрессии гена ybjE можно также добиться либо путем замещения регуляторной последовательности, контролирующей экспрессию, в том числе промотора гена ybjE, в хромосомной ДНК или в плазмиде на более сильную, как описано в WO 00/18935, либо путем амплификации фактора регулирования, который увеличивает экспрессию гена ybjE, либо путем удаления или ослабления фактора регулирования, который уменьшает экспрессию гена ybjE. Например, в качестве сильных промоторов известны lac промотор, trp промотор, trc промотор и т.п. Кроме того, можно также осуществить несколько замен нуклеотидов в область промотора гена ybjE таким образом, чтобы промотор стал более действенным. Метод оценки действенности промотора и примеры действенных промоторов раскрывают Goldstein et al. (Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128). Более того, поскольку известно, что последовательность спейсера между участком связывания рибосомы (RBS) и кодоном инициирования трансляции, в частности несколько нуклеотидов в обратном направлении сразу же от кодона инициирования, оказывает большое влияние на эффективность трансляции, то эту последовательность можно модифицировать. Регуляторную последовательность, контролирующую экспрессию гена ybjE, можно идентифицировать с помощью вектора для идентификации промотора или программного обеспечения для генетического анализа, такого как GENETYX.
Экспрессия гена ybjE усиливается за счет подобного замещения или модификации промотора. Замещение регуляторной последовательности, контролирующей экспрессию, можно также осуществить, например, с помощью термочувствительной плазмиды. Примеры термочувствительной плазмиды для бактерии Coryneform включают р48К и pSFKT2 (JP2000-262288A), pHSC4 (см. выложенную заявку на патент Франции № 2667875, 1992 и JP5-7491А) и т.д. Указанные плазмиды способны автономно реплицироваться в бактерии Coryneform, по крайней мере, при температуре 25°С, но не способны автономно реплицироваться при температуре 37°С. Модификацию регуляторной последовательности, контролирующей экспрессию, можно комбинировать с увеличением копийности гена ybjE .
С целью увеличения активности белка, кодируемого геном ybjE, в ген ybjE можно ввести мутацию, которая повышает способность экспортировать L-аминокислоту. Примеры мутации, которая повышает активность белка, кодируемого геном ybjE (белка YbjE), включают мутацию в последовательности промотора, которая усиливает транскрипцию гена ybjE, и мутацию в участке кодирования гена ybjE, которая усиливает специфическую активность белка YbjE.
Микроорганизм по настоящему изобретению предпочтительно представляет собой такой микроорганизм, способность экспортировать L-аминокислоту в котором повышается благодаря модификации, приводящей к увеличению экспрессии гена ybjE. Выражение "способность экспортировать L-аминокислоту повышается", которое используют по тексту настоящего описания, означает, что при выращивании микроорганизма, который был модифицирован, с целью увеличения экспрессии гена ybjE, количество L-аминокислоты, экспортированной в среду микроорганизмом, превышает количество L-аминокислоты, экспортированной немодифицированным штаммом, таким как родительский штамм или соответствующий штамм дикого типа. Повышение способности экспортировать L-аминокислоту наблюдают путем определения повышения концентрации L-аминокислоты в питательной среде. Кроме того, повышение способности экспортировать L-аминокислоту наблюдают также путем определения снижения внутриклеточной концентрации L-аминокислоты после введения гена ybjE в микроорганизм. Количество L-аминокислоты, экспортированной из микроорганизма по настоящему изобретению, предпочтительно повышается на 10% или больше, более предпочтительно на 30% или больше и наиболее предпочтительно на 50% или больше по сравнению с количеством L-аминокислоты, экспортированной из немодифицированного штамма. Кроме того, увеличение способности экспортировать L-аминокислоту наблюдают также по снижению внутриклеточной концентрации L-аминокислоты после введения гена ybjE в микроорганизм. Например, внутриклеточную концентрацию L-аминокислоты можно измерить следующим образом: соответствующее количество силиконового масла с удельной плотностью 1,07 добавляют к питательной среде, содержащей клетки микробов, и клетки отделяют от питательной среды центрифугированием, преимущественно при скорости вращения 12000 об/мин в течение 2 мин. Затем клетки обрабатывают 22%-ной хлорной кислотой (A.Ishizaki et al., Biotech. Teqniq. (1995), Vol. 9, No. 6, p. 409). С помощью подготовленных подобным образом клеток можно измерить внутриклеточную концентрацию L-аминокислоты. Кроме того, "способность экспортировать L-аминокислоту" можно непосредственно наблюдать путем измерения захвата клетками содержащей радиоактивную метку L-аминокислоты, используя везикулы с вывернутой наружу мембраной (J. Biol. Chem., Vol. 277, Issue 51, 49841-49849). Например, везикулы с вывернутой наружу мембраной приготавливают из клеток, в которые введен ген ybjE. Затем к везикулам добавляют АТФ или другие субстраты, являющиеся источниками энергии, и определяют захват клетками содержащей радиоактивную метку L-аминокислоты. Иначе "способность экспортировать L-аминокислоту" можно наблюдать путем измерения скорости реакции обмена между не содержащей метку L-аминокислотой и содержащей метку L-аминокислотой в активных клетках.
Кроме того, микроорганизм по настоящему изобретению предпочтительно представляет собой такой микроорганизм, который становится более устойчивым к L-аминокислоте или аналогу L-аминокислоты благодаря модификации, которая приводит к увеличению экспрессии гена ybjE. Таким образом, микроорганизм по настоящему изобретению предпочтительно представляет собой микроорганизм, который способен расти в присутствии L-аминокислоты или аналога L-аминокислоты с концентрацией, при которой немодифицированный штамм не может расти. Рост клеток в присутствии L-аминокислоты или аналога L-аминокислоты может быть подтвержден в минимальной питательной среде, содержащей высокие концентрации L-аминокислоты или аналога L-аминокислоты, например 0,3 г/л или выше. Устойчивость штамма с амплифицированным геном ybjE к L-аминокислоте или аналогу L-аминокислоты может быть подтверждена путем измерения роста штамма в минимальной питательной среде, содержащей высокие концентрации L-аминокислоты или аналога L-аминокислоты, и сравнения с ростом родительского штамма или немодифицированного штамма. Метод сравнения роста включает метод сравнения оптической плотности при длине волны 580-660 нм для питательной среды, в которой выращивают каждый из штаммов. Концентрация L-аминокислоты или аналога L-аминокислоты, которую добавляют в среду, специально не ограничивается, при условии, что она подавляет рост немодифицированного штамма, но преимущественно составляет не менее 0,3 г/л. Например, гидрохлорид L-лизина добавляют в количестве 80 г/л, гидрохлорид L-аргинина добавляют в количестве 90 г/л, гидрохлорид L-орнитина добавляют в количестве 45 г/л, гидрохлорид L-гистидина добавляют в количестве 30 г/л, гидрохлорид L-изолейцина добавляют в количестве 12 г/л, гидрохлорид L-треонина добавляют в количестве 40 г/л, однозамещенный L-глутамат натрия добавляют в количестве 15 г/л, L-фенилаланин добавляют в количестве 8 г/л, L-пролин добавляют в количестве 85 г/л и L-цистеин добавляют в количестве 0,3 г/л.
Микроорганизмом по настоящему изобретению может быть микроорганизм, который становится более устойчивым к L-лизину или аналогу L-лизина благодаря модификации, которая приводит к увеличению экспрессии гена ybjE. Примеры аналогов L-лизина включают оксализин, гидроксамат лизина, S-(2-аминоэтил)-L-цистеин (АЕС), γ-метиллизин, α-хлоркапролактам и т.п., но ими не ограничиваются. Устойчивость к L-лизину можно подтвердить таким же образом, как указано выше для подтверждения устойчивости к L-аминокислоте или аналогу L-аминокислоты.
Микроорганизмом по настоящему изобретению может быть микроорганизм, который становится более устойчивым к L-аргинину или аналогу L-аргинина благодаря модификации, которая приводит к увеличению экспрессии гена ybjE. Примеры аналогов L-аргинина включают гидроксамат аргинина, гомоаргинин, D-аргинин, канаванин, гидроксамат аргинина и т.д. Устойчивость к L-аргинину или аналогу L-аргинина можно подтвердить таким же образом, как указано выше для подтверждения устойчивости к L-аминокислоте или аналогу L-аминокислоты.
Способ получения L-аминокислоты
Способ получения по настоящему изобретению включает выращивание микроорганизма по настоящему изобретению в питательной среде, с целью получения и накопления L-аминокислоты в питательной среде или клетках микроорганизма, и выделение указанной L-аминокислоты из питательной среды или клеток.
Питательную среду, которую используют по настоящему изобретению, можно выбрать из хорошо известных питательных сред, обычно применяемых для ферментативного получения L-аминокислот методом ферментации с использованием микроорганизмов. Таким образом, может использоваться обычная питательная среда, которая содержит источник углерода, источник азота, неорганические ионы и, если необходимо, другие органические ингредиенты. В качестве источника углерода могут использоваться сахариды, такие как глюкоза, сахароза, лактоза, галактоза, фруктоза или гидролизат крахмала, спирты, такие как глицерин или сорбит, или органические кислоты, такие как фумаровая кислота, лимонная кислота или янтарная кислота. В качестве источника азота могут использоваться неорганические соли аммония, такие как сульфат аммония, хлорид аммония или фосфат аммония, природные источники азота, такие как гидролизат соевого белка, газообразный аммиак, водный раствор аммиака и т.п. В качестве небольших добавок органических нутриентов в питательную среду в соответствующих количествах желательно добавлять такие вещества, как витамин В1 и L-гомосерин, экстракт дрожжей и т.п. В отличие от вышеприведенных компонентов, если необходимо, в небольших количествах добавляют фосфат калия, сульфат магния, ион железа, ион марганца и т.д. Питательная среда, используемая по настоящему изобретению, может быть натуральной средой или синтетической средой, при условии, что она содержит источник углерода, источник азота, неорганические ионы и, если необходимо, другие органические ингредиенты.
Выращивание преимущественно проводят в аэробных условиях в течение 1-7 дней. Температуру при выращивании преимущественно поддерживают в диапазоне от 24°С до 37°С, а рН при выращивании преимущественно поддерживают в диапазоне от 5 до 9. Для регулирования величины рН могут применяться минеральные или органические, кислые или щелочные вещества, а также газообразный аммиак и т.п. L-аминокислоты обычно можно выделить из питательной среды, в которой проводят ферментацию, с использованием сочетания хорошо известных методов, таких как применение ионообменных смол, осаждение и другие методы. В том случае, когда L-аминокислота накапливается, например, в клетках, то клетки можно разрушить ультразвуковой обработкой, разрушенные клетки можно отделить центрифугированием, а L-аминокислоту можно отделить от надосадочной жидкости с помощью ионообменной смолы или другого аналогичного способа.
Если в качестве основного источника углерода в способе получения по настоящему изобретению применяют метанол, то стоимость осуществления способа снижается, а поэтому предпочтительны такие микроорганизмы, как бактерии Methylophilus или Methylobacillus, которые способны ассимилировать метанол. В этом случае выращивание можно осуществлять в соответствии с методами выращивания, типичными для микроорганизмов, ассимилирующих метанол (см., например, WO 00/61723, JP2001-120269A и т.д.). В том случае, когда выращивание проводят с использованием метанола в качестве основного источника углерода, метанол преимущественно добавляют в среду с концентрацией от 0,001 до 30%. Для выращивания микроорганизмов, ассимилирующих метанол, в среду преимущественно добавляют сульфат аммония и т.п. и используют его в качестве источника азота. Кроме того, предпочтительно в небольших количествах добавляют микрокомпоненты, такие как фосфат калия, фосфат натрия, сульфат магния, сульфат железа (II) и сульфат марганца.
Выращивание микроорганизмов, ассимилирующих метанол, преимущественно осуществляют в аэробных условиях при встряхивании или перемешивании для аэрации, при величине рН от 5 до 9 и при температуре в диапазоне от 20°С до 45°С, обычно в течение от 24 до 120 час. L-аминокислоту можно выделить из культуры с помощью комбинации хорошо известных методов, таких как использование ионообменных смол, осаждение и других методов. Выделение L-аминокислот из клеток можно осуществить аналогично способам, приведенным выше.
ПРИМЕРЫ
Далее настоящее изобретение поясняется более детально со ссылкой на следующие не ограничивающие настоящее изобретение примеры. Реагенты, которые применяют в следующих примерах, получают, если не указано иное, от компании Wako Pure Chemicals или компании Nakarai Tesque. Состав питательной среды, которую используют в каждом примере, приведен ниже. Для регулирования рН всех питательных сред применяют NaOH или HCl.
Питательная среда L
Указанную смесь стерилизуют паром при 120°С в течение 20 мин.
Агаровая среда L:
Указанную смесь стерилизуют паром при 120°С в течение 20 мин.
Минимальная питательная среда (в соответствии с Molecular cloning, Vol. 3)
После того, как доводят объем до 1 л, смесь стерилизуют паром при 115°С в течение 10 мин и в подходящий момент добавляют L-лизин.
Минимальная агаровая питательная среда:
Указанную смесь стерилизуют паром при 115°С в течение 10 мин.
Питательная среда для получения L-лизина для бактерии Escherichia:
Доводят величину рН до 7,0 с помощью гидроксида калия и компоненты стерилизуют паром при 115°С в течение 10 мин, за исключением глюкозы и MgSO4·7Н2О, которые стерилизуют отдельно. В качестве антибиотика добавляют 50 мг/л хлорамфеникола.
Питательная среда для получения L-аргинина для бактерии Escherichia:
Доводят величину рН до 7,2 с помощью гидроксида калия и компоненты стерилизуют паром при 115°С в течение 10 мин, за исключением глюкозы и MgSO4·7Н2О, которые стерилизуют отдельно. В качестве антибиотика добавляют 50 мг/л хлорамфеникола.
Питательная среда для получения L-лизина для бактерии Methylophilus (среда SEII):
Компоненты, кроме метанола, стерилизуют паром при 121°С в течение 15 мин, а метанол добавляют после того, как компоненты достаточно остынут. Эту питательную среду готовят в соответствии со ссылкой Journal of General Microbiology (1989) 125, 135, 3153-3164, Silman N.J., Carver M.A. & Jones C.W. Вместо сульфата аммония используют 1,18 г ацетамида, а хлорид кальция добавляют с концентрацией 72 мг/л.
Компоненты, кроме метанола, стерилизуют паром при 121°С в течение 15 мин, а метанол добавляют после того, как компоненты достаточно остынут.
Питательная среда CM2S для бактерии Coryneform:
Доводят величину рН до 7,2 с помощью гидроксида калия и компоненты стерилизуют паром при 120°С в течение 30 мин. Когда среду используют для выращивания в чашке, то добавляют 20 г/л агара.
Питательная среда для получения L-лизина для бактерии Coryneform:
Доводят величину рН до 7,5 с помощью гидроксида калия и компоненты стерилизуют паром при 115°С в течение 10 мин, за исключением глюкозы и MgSO4·7Н2О, которые стерилизуют отдельно.
Пример 1: Отбор гена-экспортера L-лизина
Поиск гена-экспортера L-лизина проводят следующим образом.
1-1 Конструирование штамма Escherichia coli, в который вводят плазмидную библиотеку.
Хромосомную ДНК выделяют обычным образом из штамма, полученного делецией lysA (гена диаминопимелатдекарбоксилазы) в штамме MG1655 (ATCC 47076). Фрагменты размером от 2 до 4 тысяч пар нуклеотидов (т.п.н.), полученные частичным расщеплением хромосомной ДНК с помощью рестриктазы Sau3AI, вводят в каждый из векторов pTWV229 (Takara Bio), pSTV28 (Takara Bio) и pMW118 (Nippon Gene), каждый из которых предварительно расщепляют с помощью BamHI, и таким образом получают плазмидные библиотеки. Каждую из указанных плазмидных библиотек вводят в штамм MG1655 методом электропорации.
1-2 Отбор гена устойчивости к L-лизину
Штаммы MG1655, в которые введены плазмидные библиотеки, отбирают в среде L по устойчивости к ампицилину для штамма, в который был введен pTWV229, устойчивости к хлорамфениколу для штамма, в который был введен pSTV28, и устойчивости к ампицилину для штамма, в который был введен pMW118. В общей сложности получают около 80000 трансформированных колоний. Эти трансформанты помещают в минимальную питательную среду, содержащую 60 г/л гидрохлорида лизина, в которой штамм MG1655 может образовать очень мало колоний или вовсе не образует колоний.
После выращивания при 37°С в течение 36 час приблизительно 50 колоний, которые появились в питательной среде, содержащей высокую концентрацию лизина, отбирают в качестве кандидатов штаммов, устойчивых к лизину. Для того, чтобы определить последовательности, которые были введены в векторы штаммов-кандидатов, устойчивых к лизину, проводят ПЦР, используя синтетические олигонуклеотиды, имеющие последовательность SEQ ID NO: 3 (прямой праймер М13) и последовательность SEQ ID NO: 4 (обратный праймер М13), которые комплементарны последовательности ДНК, расположенной вокруг участка множественного клонирования плазмиды, и определяют последовательности амплифицированных фрагментов.
В результате определения нуклеотидных последовательностей обнаруживают, что почти все фрагменты содержат ybjE, расположенный под номерами с 913181 по 914128 в штаммах, устойчивых к L-лизину.
Анализируют прогнозируемые аминокислотные последовательности из последовательности гена ybjE. Когда последовательность белка анализируют на наличие гидрофобных свойств, то обнаруживают, что белок является сильно гидрофобным. Поэтому было высказано предположение, что белок, кодируемый геном ybjE, представляет собой мембранный белок и он может вовлекаться в экспорт аминокислот.
Пример 2: Влияние амплификации гена ybjE в Escherichia coli
2-1 Конструирование плазмиды для амплификации ybjE и введение ее в Escherichia coli
Далее, с целью изучения влияния амплификации гена ybjE, конструируют вектор для амплификации ybjE и вводят его в MG1655. Полная нуклеотидная последовательность хромосомы из Escherichia coli (штамм Escherichia coli К-12) описана (Science, 277, 1453-1474 (1997)), поэтому готовят синтетический олигонуклеотид с SEQ ID NO: 5, последовательность которого комплементарна последовательности нуклеотидов с номерами с 4085 по 4104 в последовательности с инвентарным номером АЕ000189 из базы данных GenBank, и синтетический олигонуклеотид с SEQ ID NO: 6, который соответствует последовательности нуклеотидов с номерами с 2689 по 2708 той же самой нуклеотидной последовательности, на основе нуклеотидной последовательности гена ybjE, описанного в приведенной выше литературе, и используют их соответственно в качестве 5'-праймера и 3'-праймера, чтобы осуществить ПЦР. Хромосомную ДНК штамма Escherichia coli MG1655 используют в качестве матрицы.
С целью конструирования плазмиды pSYBJE для амплификации ybjE, полученный продукт ПЦР лигируют с вектором pSTV28, который был расщеплен (Takara Bio) с помощью SmaI. Схема конструкции приведена на Фиг. 1. Плазмиду, в которой ген ybjE лигирован в прямом направлении по отношению к lac промотору, обозначают как pSYBJE1, а плазмиду, в которой он лигирован в обратном направлении, обозначают как pSYBJE2.
Каждую из плазмид для амплификации гена ybjE, pSYBJE1, pSYBJE2 и контрольную плазмиду pSTV28 (Takara Bio) вводят обычным образом в MG1655 (АТСС 47076). Трансформанты отбирают по устойчивости к хлорамфениколу, и штамм, в который введен pSYBJE1, обозначают как MG1655/pSYBJE1, штамм, в который введен pSYBJE2, обозначают как MG1655/pSYBJE2, а штамм, в который введен pSTV28, обозначают как MG1655/pSTV28.
2-2 Влияние амплификации гена ybjE в бактерии Escherichia
Влияние амплификации гена ybjE на устойчивость штамма Escherichia coli MG1655 к различным аминокислотам исследуют с помощью штамма, в который введен pSYBJE1 или pSYBJE2. Штаммы MG1655/pSYBJE1, MG1655/pSYBJE2 и контрольный MG1655/pSTV28, каждый инокулируют в 5 мл среды L, содержащей 50 мкг/мл хлорамфеникола, и выращивают в течение приблизительно 6 час в аппарате для выращивания при встряхивании на качалке. Культуральную среду, в которой клетки пролиферируют до оптической плотности OD600 = приблизительно 1,0, центрифугируют и затем клетки дважды промывают минимальной питательной средой М9. Затем клетки высевают в минимальную питательную среду М9, содержащую 50 мкг/мл хлорамфеникола, и в минимальную питательную среду М9, содержащую 80 г/л гидрохлорида лизина, до оптической плотности OD600 = 0,05 и выращивают в течение приблизительно 70 час.
Результаты приведены на Фиг. 2, которые показывают, что в присутствии высоких концентраций L-лизина увеличение экспрессии гена ybjE улучшает скорость роста на ранней стадии, а также скорость деления клеток в логарифмической фазе роста по сравнению с контрольным штаммом.
Пример 3. Влияние инактивации гена ybjE на устойчивость бактерии Escherichia к аминокислоте
3-1 Конструирование штамма с инактивированным геном ybjE
Делецию в гене ybjE осуществляют с использованием метода, разработанного Datsenko и Wanner и получившего название "интеграция с использованием Red-системы" (Proc. Natl. Acad. Sci. USA, 2000, vol. 97, No. 12, pp. 6640-6645). Согласно этому методу продукт ПЦР получают, используя синтетический олигонуклеотид, который содержит целевой ген на 5'-конце и ген устойчивости к антибиотику на 3'-конце. С помощью указанного метода штамм с инактивированным геном можно сконструировать в одну стадию. Согласно этому методу конструируют праймеры, комплементарные областям, прилегающим к гену ybjE или гену, который придает устойчивость к антибиотику плазмиде, используемой в качестве матрицы, и получают продукт ПЦР эндогенного гена ybjE. Продукт ПЦР можно получить, используя в качестве матрицы плазмиду pACYC184 (NBL Gene Sciences Ltd., U.K, инвентарный номер Х06403 в базе данных GenBank/EMBL) и синтетические олигонуклеотиды с последовательностями SEQ ID NO: 7 или 8 в качестве праймеров.
Амплифицированный продукт ПЦР очищают в агарозном геле и используют для электропорации штамма Escherichia coli MG1655, который включает плазмиду pKD46, содержащую термочувствительный репликон. Плазмида pKD46 (Proc. Acad. Sci. USA, 2000, vol. 97, No. 12, pp. 6640-6645) содержит фрагмент ДНК λ-фага размером 2154 нуклеотидов, состоящий из генов системы гомологичной рекомбинации λ Red (гены λ, β, exo), которые находятся под контролем индуцируемого арабинозой промотора ParaB (инвентарный номер J02459 в базе данных GenBank/EMBL, нуклеотиды с 31088 по 33241). Плазмида pKD46 необходима для интеграции продукта ПЦР в хромосому штамма MG1655.
Электрокомпетентные клетки получают следующим образом. Штамм Escherichia coli MG1655 выращивают в течение ночи при температуре 30°С в питательной среде LB, содержащей 100 мг/л ампицилина, а затем разбавляют в 100 раз с помощью 5 мл питательной среды SOB (Molecular Cloning. A Laboratory Manual, 2nd Edition, Sambrook, J. et al., Cold Spring Harbor Laboratory Press (1989)), содержащей ампициллин и L-арабинозу (1 мМ). Разбавленные клетки выращивают при аэрации при температуре 30°С до достижения оптической плотности OD600 приблизительно 0,6, а затем, чтобы клетки можно было использовать для электропорации, их концентрируют в 100 раз и трижды промывают ледяной деионизованной водой. Электропорацию осуществляют, используя 70 мкл компетентных клеток и приблизительно 100 нг продукта ПЦР. Клетки после электропорации вносят в 1 мл питательной среды SOC (Molecular Cloning. A Laboratory Manual, 2nd Edition, Sambrook, J. et al., Cold Spring Harbor Laboratory Press (1989)), выращивают при 37°С в течение 2,5 час, и после этого высевают в агаровую питательную среду L при 37°С. Указанным образом отбирают Cm(хлорамфеникол)-устойчивые рекомбинантные штаммы. Затем для элиминирования плазмиды pKD46 осуществляют два пассажа при 42°С в агаровой питательной среде, содержащей Cm (хлорамфеникол), и полученные колонии проверяют на устойчивость к ампициллину. Указанным образом получают чувствительные к ампициллину штаммы, у которых элиминирована pKD46.
Инактивацию гена ybjE в мутантном штамме, который можно идентифицировать по устойчивости к хлорамфениколу, подтверждают методом ПЦР. Длина продукта ПЦР, полученного с использованием ДНК из клеток штамма MG1655ΔybjE::cat с инактивированным геном ybjE, больше чем длина продукта ПЦР, полученного для штамма дикого типа. Таким образом, подтверждают, что ген устойчивости к хлорамфениколу был введен в ген ybjE и что ген ybjE был инактивирован. Штамм с инактивированным геном ybjE, содержащий вставку гена устойчивости к хлорамфениколу, обозначают как MG1655ΔybjE::Cm.
3-2 Подтверждение устойчивости к аминокислоте штамма, дефицитного по гену ybjE
Исследуют влияние штамма MG1655ΔybjE::Cm, дефицитного по гену ybjE, на устойчивость к аминокислоте. Центрифугируют культуральные среды (600 OD ≈0), полученные выращиванием MG1655ΔybjE::Cm и контрольного штамма MG1655 в питательной среде L в течение приблизительно 6 час в аппарате для культивирования при встряхивании на качалке. Затем клетки дважды промывают минимальной средой питательной М9 и высевают в минимальную питательную среду М9 или минимальную питательную среду М9, содержащую 80 г/л гидрохлорида лизина, до оптической плотности OD600 = 0,05 и выращивают в течение приблизительно 70 час. После этого анализируют результаты выращивания.
Результаты приведены на Фиг. 3. Как видно из Фиг. 3, делеция гена ybjE ослабляет рост на ранней стадии в присутствии высоких концентраций L-лизина по сравнению с контрольным штаммом. Из этого результата и результатов Примера 2 выявляют, что ген ybjE придает устойчивость к L-лизину.
Пример 4. Влияние амплификации гена ybjE на продукцию L-лизина бактерией Escherichia
В качестве штамма-продуцента L-лизина используют штамм Escherichia coli, штамм WC196 (AJ13069 (FERM BP-5252), WO 96/17930), который устойчив к АЕС (S-(2-аминоэтил)цистеину).
Штамм WC196 трансформируют плазмидой pSYBJE1 для амплификации гена ybjE. Плазмиду pSTV28 (Takara Bio) трансформируют отдельно в качестве контроля (как в Примере 2). Указанным образом получают штаммы, устойчивые к хлорамфениколу. Подтверждают введение плазмиды, и штамм с введенной плазмидой pSYBJE1 обозначают как WC196/ybjE, а штамм с введенной контрольной плазмидой pSTV28 обозначают как WC196/pSTV28.
Каждый из штаммов WC196/ybjE и WC196/pSTV28 выращивают при 37°С в питательной среде L, содержащей 50 мг/л хлорамфеникола, до тех пор пока величина оптической плотности OD600 не достигнет значения приблизительно 0,6. Затем в каждую культуральную среду добавляют равный объем 40%-ного раствора глицерина, перемешивают, а затем делят на части подходящего объема и хранят при минус 80°С. В настоящем описании их обозначают как маточные глицериновые растворы.
Маточные глицериновые растворы указанных штаммов оттаивают и 100 мкл каждого маточного раствора равномерно наносят в чашку с питательной средой L, содержащей 50 мг/л хлорамфеникола, и инкубируют при 37°С в течение 24 час. Приблизительно 1/8 часть собранных с чашки клеток инокулируют в 20 мл среды для ферментации (в минимальной питательной среде М9), содержащей 50 мг/л хлорамфеникола, в колбе Сакагучи емкостью 500 мл и выращивают при 37°С в течение 27 час в аппарате для культивирования при встряхивании на качалке. По окончании выращивания количество лизина, который накоплен в среде, измеряют с помощью анализатора Biotech Analyzer AS210 (Sakura Seiki). Что касается концентрации L-лизина в клетках, то подходящий объем культуральной среды добавляют к силиконовому маслу с удельной плотностью 1,07 и клетки отделяют центрифугированием при скорости вращения 12000 об/мин в течение 2 мин. Затем выделенные клетки разрушают обработкой 22%-ной хлорной кислотой и определяют концентрацию лизина.
Данные о накоплении и выходе L-лизина, а также величина отношения внеклеточной концентрации лизина к внутриклеточной концентрации лизина после 24 час приведены в Таблице 1. Отношение внеклеточной концентрации лизина к внутриклеточной концентрации лизина, обозначенное как *, определяют делением внеклеточной концентрации лизина (мг/г сухого веса бактерий) на внутриклеточную концентрацию лизина (мг/г сухого веса бактерий). Как видно из Таблицы 1, штамм WC196/pSYBJE1 накапливает большее количество лизина по сравнению со штаммом WC196/pSTV28, в который не введен ген ybjE. Кроме того, в штамме WC196/pSYBJE1, в который введен ген ybjE, внеклеточная концентрация L-лизина увеличилась относительно внутриклеточной концентрации L-лизина благодаря заметному снижению внутриклеточной концентрации лизина по сравнению с контрольным штаммом WC196/pSTV28, и, таким образом, предполагают, что ген ybjE является геном-экспортером L-лизина.
Пример 5. Влияние амплификации гена ybjE на продукцию L-аргинина бактерией Escherichia
Обнаружено, что как накопление, так и выход L-лизина повышается в штамме с амплифицированным геном ybjE по сравнению с контрольным штаммом. Изучено также влияние амплификации гена ybjE на продукцию L-аргинина, который, так же как и L-лизин, является известной основной аминокислотой. В качестве L-аргинин-продуцирующей бактерии Escherichia coli используют штамм 237, который ингибируется по типу обратной связи при высвобождении ацетилглутаматсинтазы (VKPM B-7925, Российская патентная заявка 2000117677).
5-1 Получение штамма Escherichia coli 237 с амплифицированным геном ybjE
Используя способ, приведенный в Примере 4, приготавливают штамм 237/pSYBJE1 с амплифицированным геном ybjE и контрольный штамм 237/pSTV28.
5-2 Продукция L-аргинина
Используя питательные среды, способы выращивания и способы анализа, приведенные ниже, изучают влияние амплификации гена ybjE на продукцию L-аргинина. В качестве предкультуры 100 мкл маточного раствора в глицерине инокулируют в агаровую питательную среду L, а затем равномерно наносят в чашку с питательной средой L, содержащей 50 мг/л хлорамфеникола, и инкубируют при 32°С в течение 24 час. Приблизительно 1/8 часть клеток, собранных с чашки, высевают в 20 мл питательной среды для продукции аргинина и выращивают при 32°С в течение 90 час. Выращивание штаммов с введенной плазмидой осуществляют при добавлении хлорамфеникола.
1 мл культуральной питательной среды отбирают в процессе выращивания и измеряют концентрацию глюкозы и накопление L-аргинина в клетках и культуральной среде. С целью определения концентрации глюкозы и концентрации L-аргинина в культуральной среде, культуральную среду центрифугируют со скоростью 15000 об/мин в течение 5 мин и полученную надосадочную жидкость разбавляют соответствующим количеством воды, и концентрацию в разбавленной надосадочной жидкости определяют с помощью анализатора Biotech Analyzer (Sakura Seiki) и аминокислотного анализатора Amino Acid Analyzer L-8500 (Hitachi Instrument Service). С целью определения концентрации L-аргинина в клетках, соответствующий объем культуральной среды добавляют к силиконовому маслу с удельной плотностью 1,07 и центрифугируют со скоростью 12000 об/мин в течение 2 мин, затем выделенные клетки разрушают обработкой 22%-ной хлорной кислотой и измеряют концентрацию L-аргинина. Данные о накоплении и выходе L-аргинина, а также величине отношения внеклеточной концентрации L-аргинина к внутриклеточной концентрации L-аргинина после 90 час приведены в Таблице 2. Отношение внеклеточной концентрации к внутриклеточной концентрации, обозначенное как *, определяют делением внеклеточной концентрации L-аргинина (мг/г сухого веса бактерий) на внутриклеточную концентрацию L-аргинина (мг/г сухого веса бактерий).
Обнаружено, что накопление и выход L-аргинина повышается в штамме с амплифицированным геном ybjE по сравнению с контрольным штаммом. Кроме того, повышается отношение внеклеточной концентрации к внутриклеточной концентрации аргинина. Таким образом, было высказано предположение, что указанный ген вовлекается также в экспорт L-аргинина.
Пример 6. Влияние введения гена ybjE, выделенного из бактерии Escherichia, в бактерию Methylophilus
6-1 Конструирование плазмиды pRSybjE для амплификации ybjE
Чтобы ввести ген ybjE в бактерию Methylophilus, используют известную плазмиду pRS (JP 3-501682A) для конструирования плазмиды pRSybjE, с целью экспрессии ybjE. pRS представляет собой плазмиду, которая содержит векторный сегмент плазмиды pVIC40, который получают (WO 90/04636, JP 3-501682A) делецией участка ДНК, кодирующего оперон треонина. Плазмиду pVIC40 получают из векторной плазмиды pAYC32, пригодной к использованию для широкого круга хозяев (Chistorerdov, A.Y., Tsygankov, Y.D., Plasmid, 1986, 16, 161-167), которая является производной RSF1010.
Вначале плазмиду pRStac, которая содержит tac промотор, конструируют из pRS следующим образом по схеме, приведенной на Фиг. 3. Вектор pRS расщепляют рестриктазами EcoRI и PstI, добавляют фенольно-хлороформенный раствор и перемешивают смесь, с целью прерывания реакции. Затем реакционную смесь центрифугируют, верхний слой отделяют и выделяют молекулы ДНК осаждением этанолом и разделением в 0,8%-ном агарозном геле. С помощью EASY TRAP Ver. 2 (набор для выделения ДНК, Takara Bio) выделяют фрагмент ДНК размером приблизительно 8 т.п.н. Иначе, участок tac промотора амплифицируют методом ПЦР, используя плазмиду pKK223-3 (вектор экспрессии, Pharmacia) в качестве матрицы и праймера, которые имеют последовательности SEQ ID NO: 16 и 17 (цикл, состоящий из денатурации при 94°С в течение 20 сек, отжига при 55°С в течение 30 сек и достраивания цепи при 72°С в течение 60 сек, повторяют 30 циклов). Для проведения ПЦР используют ДНК-полимеразу Pyrobest (Takara Bio). Амплифицированный фрагмент ДНК, содержащий tac промотор, очищают с помощью комплекта PCR prep (Promega) и расщепляют рестриктазами EcoRI и EcoT22I, сайт узнавания которых сконструирован в праймерах. Затем реакционную смесь добавляют в фенольно-хлороформенный раствор и перемешивают смесь, с целью прерывания реакции. После центрифугирования реакционной смеси верхний слой отделяют и выделяют молекулы ДНК осаждением этанолом и разделением в 0,8%-ном агарозном геле. С помощью EASY TRAP Ver. 2 выделяют фрагмент ДНК размером приблизительно 0,15 т.п.н.
Продукт расщепления вектора pRS и фрагмент участка tac промотора, который получают, как указано выше, лигируют с помощью набора DNA Ligation Kit Ver. 2 (Takara Bio). Полученный при проведении лигирования раствор используют для трансформации Escherichia coli (компетентные клетки Escherichia coli JM109, Takara Bio). Клетки помещают в агаровую питательную среду LB, содержащую 20 мг/л стрептомицина, и оставляют инкубироваться на ночь при 37°С. Каждую из колоний, которые появляются в агаровой питательной среде, высевают в питательную среду LB, содержащую 20 мг/л стрептомицина, и выращивают при 37°С в течение 8 час при встряхивании. Плазмидную ДНК выделяют из каждой культуры по методу обработки щелочным SDS и структуру каждой плазмиды подтверждают расщеплением рестриктазами. Выбирают плазмиду, в которой направление транскрипции гена устойчивости к стрептомицину и tac промотора совпадают, и обозначают ее как pRStac.
pRStac, полученную как указано выше, расщепляют с помощью Sse8387I (Takara Bio), и смешивают с фенольно-хлороформенным раствором, с целью прерывания реакции. После центрифугирования смеси верхний слой отделяют и молекулы ДНК выделяют осаждением этанолом с последующим затуплением концов с помощью набора DNA Blunting Kit.
Кроме того, вышеуказанную pSYBJE1 расщепляют рестриктазой PvuII и смешивают с фенольно-хлороформенным раствором, с целью прерывания реакции. После центрифугирования реакционной смеси верхний слой отделяют и выделяют молекулы ДНК осаждением этанолом и разделением в 0,8%-ном агарозном геле. С помощью EASY TRAP Ver. 2 (набор для выделения ДНК, Takara Bio) выделяют фрагмент ДНК размером приблизительно 1,5 т.п.н., содержащий lac промотор и ген ybjE.
Продукт расщепления вектора pRStac и фрагмент участка гена ybjE, полученный, как указано выше, лигируют с помощью набора DNA Ligation Kit Ver. 2 (Takara Bio). Полученный при проведении лигирования раствор используют для трансформации Escherichia coli (компетентные клетки Escherichia coli JM109, Takara Bio). Клетки помещают в агаровую питательную среду LB, содержащую 20 мг/л стрептомицина, и оставляют инкубироваться на ночь при 37°С. Колонии, которые появляются в агаровой питательной среде, высевают в питательную среду LB, содержащую 20 мг/л стрептомицина, и выращивают при 37°С в течение 8 час при встряхивании. Плазмидную ДНК выделяют из каждой культуральной среды по методу обработки щелочным SDS и структуру каждой плазмиды подтверждают расщеплением рестриктазами и секвенированием ДНК, с целью отбора pRSybjE (Фиг. 4). В плазмиде pRSybjE ген ybjE размещен таким образом, что он транскрибируется в том же направлении, что и tac промотор.
6-2 Введение pRSybjE в бактерию Methylophilus
pRSybjE, полученную, как указано выше, вводят в штамм Methylophilus methylotrophus AS1 (NCIMB10515) электропорацией (Canadian Journal of Microbiology, 43, 197 (1997)). Кроме того, pRS также вводят в штамм AS1 в качестве контроля. Трансформанты для pRSybjE и pRS выделяют по их устойчивости к стрептомицину.
Штамм Methylophilus methylotrophus AS1, включающий pRS или pRSybjE (AS1/pRS, AS1/pRSybjE), наносят в чашку с питательной средой SEII, содержащей 20 мг/л стрептомицина, и выращивают в течение ночи при 37°С. Затем соскабливают клетки с приблизительно 0,3 см2 поверхности питательной среды, инокулируют в питательную среду SEII (20 мл), содержащую 20 мг/л стрептомицина, и выращивают при 37°С при встряхивании в течение 34 час. По окончании выращивания клетки удаляют центрифугированием и определяют концентрацию L-лизина в надосадочной жидкости с помощью анализатора аминокислот (Nihon Bunko, высокоэффективная жидкостная хроматография). Полученные результаты приведены в Таблице 3.
Как результат амплификации гена ybjE, накопленные количества L-лизина и L-аргинина значительно увеличиваются по сравнению с контрольным штаммом AS1/pRS. Таким образом, предполагают, что ybjE вовлекается также в экспорт L-аминокислот бактерии Methylophilus methylotrophus.
Пример 7. Оценка Methylophilus methylotrophus, в которую введены ген, кодирующий дигидродипиколинатсинтазу с ослабленным ингибированием по типу обратной связи, и ген ybjE
Поскольку было обнаружено, что введение гена ybjE способствует экспорту L-лизина в штамме Methylophilus methylotrophus AS1, то активность фермента биосинтеза L-лизина усиливается в штамме, в который, с целью дальнейшего улучшения продукции L-лизина, вводят ген ybjE.
7-1 Конструирование плазмиды pRSdapA, содержащей ген, кодирующий дигидродипиколинатсинтазу, которая устойчива к ингибированию L-лизином по типу обратной связи
Плазмиду pRSdapA, содержащую ген, кодирующий дигидродипиколинатсинтазу, которая устойчива к ингибированию L-лизином по типу обратной связи (далее по тексту настоящего описания обозначают как "dapA*"), получают в соответствии со схемой конструкции, приведенной на Фиг. 5.
pRStac, полученный в Примере 6, расщепляют обработкой Sse8387I и XbaI и смешивают с фенольно-хлороформенным раствором, чтобы прервать реакцию. После центрифугирования реакционной смеси верхний слой отделяют и выделяют молекулы ДНК осаждением этанолом и разделением в 0,8%-ном агарозном геле. В итоге выделяют фрагмент ДНК размером приблизительно 8,2 т.п.н.
Фрагмент гена dapA* амплифицируют методом ПЦР, используя в качестве матрицы плазмиду RSFD80 (см. патент США № 6040160), содержащую ген dapA*, и праймеры с последовательностями SEQ ID NO: 14 и 15 (денатурация при 94°С в течение 20 сек, отжиг при 55°С в течение 30 сек, достраивание цепи при 72°С в течение 60 сек). Для проведения ПЦР используют ДНК-полимеразу Pyrobest (Takara Bio). Полученный фрагмент dapA* очищают с помощью комплекта PCR prep (Promega) и затем расщепляют рестриктазами Sse8387I и XbaI. Реакционный раствор смешивают с фенольно-хлороформенным раствором, с целью прерывания реакции. После центрифугирования реакционной смеси верхний слой отделяют и выделяют молекулы ДНК осаждением этанолом и разделением в 0, 8%-ном агарозном геле. В итоге выделяют фрагмент ДНК размером приблизительно 1,0 т.п.н.
Продукт расщепления вектора pRStac и фрагмент гена dapA*, полученный, как указано выше, лигируют друг с другом с помощью DNA Ligation Kit Ver. 2 (Takara Bio). Полученный при проведении лигирования раствор используют для трансформации клеток Escherichia coli (компетентные клетки Escherichia coli JM109). Клетки помещают в чашку с агаровой питательной средой LB, содержащей 20 мг/л стрептомицина, и оставляют инкубироваться на ночь при 37°С. Каждую из колоний, которые возникают в агаровой питательной среде, высевают в жидкую питательным среду LB, содержащую 20 мг/л стрептомицина, и выращивают при 37°С в течение 8 час при встряхивании. Плазмидную ДНК выделяют из каждой культуры по методу обработки щелочным SDS и структуру каждой плазмиды подтверждают расщеплением рестриктазами и секвенированием ДНК, с целью отбора плазмиды pRSdapA. В плазмиде pRSdapA ген dapA* размещен таким образом, что он транскрибируется в том же направлении, что и tac промотор.
Штамм Escherichia coli JM109, трансформированный плазмидой pRSdapA, обозначают как AJ13831, и этот штамм был депонирован 4 июня 2001 в независимом исполнительном агентстве, Национальном институте передовой прикладной науки и технологии, Международном патентном депозитарии организмов под инвентарным номером FERM P-18370. Затем этот депозит был преобразован 13 мая 2002 в международный депозит в соответствии с Будапештским договором и ему присвоен инвентарный номер FERM BP-8041. Таким образом, плазмиду pRSdapA можно также получить из указанного штамма.
7-2 Конструирование плазмиды, содержащей ybjE и dapA*
С целью оценки эффекта от комбинирования ybjE и dapA*, конструируют плазмиду, полученную согласно способу, который показан на Фиг. 5, вставкой гена ybjE в плазмиду pRSdapA. pRSybjE, приготовленную в Примере 6, расщепляют рестриктазой SapI и затупляют концы с помощью набора DNA Blunting Kit (Takara Bio). Кроме того, плазмиду pRSdapA расщепляют рестриктазами EcoRI и SapI, на 0, 8%-ном агарозном геле выделяют фрагмент размером приблизительно 1 т.п.н., содержащий tac промотор и участок dapA*, и выделяют его с помощью EASY TRAP Ver. 2 (Takara Bio). У этого фрагмента затупляют концы по аналогии с тем, как указано выше, и лигируют его с указанным выше продуктом расщепления pRSybjE с помощью DNA Ligation Kit Ver. 2 (Takara Bio).
Полученный при проведении лигирования раствор используют для трансформации клеток Escherichia coli (компетентные клетки Escherichia coli JM109, Takara Bio). Клетки помещают в чашку с агаровой питательной средой LB, содержащей 20 мг/л стрептомицина, и оставляют инкубироваться на ночь при 37°С. Каждую из колоний, которые возникают в агаровой среде, высевают в жидкую питательную среду LB, содержащую 20 мг/л стрептомицина, и выращивают при 37°С в течение 8 час при встряхивании. Плазмидную ДНК выделяют из каждой культуры по методу обработки щелочным SDS и структуру плазмид подтверждают расщеплением рестриктазами и секвенированием ДНК, с целью отбора плазмиды pRSybjEdapA. В указанной плазмиде ген ybjE и ген dapA* размещены таким образом, что они транскрибируются в одном и том же направлении относительно друг друга.
pRSybjEdapA, полученную, как указано выше, а также pRSybjE, pRSdapA и контрольную плазмиду pRS соответственно вводят методом электропорации в штамм Methylophilus methylotrophus AS1 (NCIMB10515).
7-3 Продукция L-лизина бактерией Methylophilus, содержащей ybjE и dapA*
Каждый из штаммов AS1 с введенными pRSybjEdapA, pRSybjE, pRSdapA или pRS, которые получают, как указано выше, наносят в чашку с питательной средой SEII, содержащей 20 мг/л стрептомицина, и выращивают в течение ночи при 37°С. Затем соскабливают клетки с приблизительно 0,3 см2 поверхности питательной среды, инокулируют в питательную среду SEII (20 мл), содержащую 20 мг/л стрептомицина, и выращивают при 37°С при встряхивании в течение 34 час. По окончании выращивания клетки удаляют центрифугированием и определяют концентрацию L-лизина в надосадочной жидкости с помощью анализатора аминокислот (Nihon Bunko, высокоэффективная жидкостная хроматография). Полученные результаты приведены в Таблице 4. Штамм, в который вводят pRSybjEdapA, показывает повышенное накопление L-лизина по сравнению со штаммами, в которые вводили лишь pRSdapA или pRSybjE. Таким образом, обнаруживают, что одновременная стимуляция геном ybjE и геном dapA*, оказывает синергическое действие на продукцию L-лизина.
Пример 8. Влияние амплификации ybjE на устойчивость к аналогу лизина
Далее, исследуют влияние амплификации ybjE на устойчивость к аналогу лизина. Вышеуказанные штаммы Methylophilus methylotrophus AS1, содержащие AS1/pRSybjE или контрольную pRS, раздельно выращивают в течение ночи в питательной среде SEII, содержащей 20 мг/л стрептомицина. Каждую культуру инокулируют в свежую питательную среду SEII (содержащую 20 мг/л стрептомицина) в объеме 10% и выращивают при 37°С при встряхивании до тех пор, пока клетки не достигнут логарифмической фазы роста. Каждую культуру инокулируют в объеме 4% в питательную среду SEII, содержащую 20 мг/л стрептомицина и 0, 3 или 5 г/л S-(2-аминоэтил)цистеина (АЕС), и выращивают при 37°С при встряхивании. В процессе выращивания величину OD при 660 нм измеряют через каждые 30 мин для определения степени устойчивости штаммов к АЕС. Результаты приведены на Фиг. 6. Для определения степени устойчивости используют биофоторекордер TN-1506 (производитель - фирма Advantec), при этом 5 мл культуры помещают в пробирку и проводят анализ. Результаты приведены на Фиг. 6.
В итоге и при добавлении АЕС задержка роста для штамма AS1/pRSybjE не наблюдается, в то время как рост штамма AS1/pRS существенно замедляется. Таким образом, обнаружено, что амплификация гена ybjE придает не только устойчивость к L-лизину, но и устойчивость к аналогу L-лизина.
Пример 9. Влияние амплификации ybjE на продукцию L-треонина
В качестве исходного штамма используют штамм Escherichia coli В-5318 (ЕР 0593792). Штамм В-5318 трансформируют плазмидой pSYBJE1, как описано в Примере 2, или контрольной плазмидой pSTV28 (Takara Bio), с целью получения штамма, устойчивого к хлорамфениколу. После секвенирования может быть выбран штамм В-5318/pSYBJE1 и штамм В-5318/pSTV28.
Указанные штаммы выращивают в среде L, содержащей 50 мг/л хлорамфеникола, при 37°С до тех пор, пока оптическая плотность OD600 не достигнет значения приблизительно 0,6. Культуру смешивают с таким же количеством 40%-ного раствора глицерина, делят на порции подходящего объема и хранят при минус 80°С.
Маточный глицериновый раствор оттаивают и 100 мкл его равномерно наносят на чашку с питательным раствором L, содержащим 50 мг/л хлорамфеникола, и инкубируют при 37°С в течение 24 час. Затем собирают клетки приблизительно с одной восьмой части поверхности питательной среды, инокулируют в питательную среду для продуцирования L-треонина и выращивают при 37°С и при встряхивании в течение 24 час. По окончании выращивания клетки отделяют центрифугированием и с помощью обычного метода определяют концентрацию L-треонина в надосадочной жидкости с культурой. Указанным образом может быть получен штамм, в котором ген ybjE амплифицирован и который обладает повышенной способностью продуцировать L-треонин.
Пример 10. Влияние амплификации гена ybjE в бактерии Coryneform
10-1 Конструирование плазмиды для амплификации гена ybjE
pSYBJE2, описанную в Примере 2, расщепляют обработкой EcoRI и PstI и расщепленный фрагмент лигируют в pVK7 (US 20030175912), который был расщеплен теми же ферментами. Полученную плазмиду обозначают как pVYBJE1.
10-2 Влияние амплификации гена ybjE на продукцию L-лизина бактерией Coryneform
В качестве исходного штамма используют штамм Corynebacterium glutamicum (Brevibacterium lactofermentum) ATCC13861. Штамм ATCC13861 трансформируют плазмидой pVYBJE1 или контрольной плазмидой pVK7, с целью получить штамм, устойчивый к канамицину. После секвенирования отбирают штамм ATCC13861/pVYBJE1 и штамм ATCC13861/pVK7.
Указанные штаммы выращивают в питательной среде M-CM2S, содержащей 25 мг/л канамицина, при 31,5°С до получения значения оптической плотности OD600, равного приблизительно 0,6. Культуру смешивают с равным объемом 40%-ного раствора глицерина, делят на порции подходящего объема и хранят при минус 80°С.
Маточный глицериновый раствор оттаивают и 100 мкл его равномерно наносят на чашку с питательной средой M-CM2S, содержащей 25 мг/л канамицина, и инкубируют при 31,5° С в течение 24 час. Затем собирают клетки приблизительно с одной восьмой части с поверхности питательной среды, инокулируют в 20 мл среды для ферментации, содержащей 25 мг/л канамицина, и выращивают при 31,5°С в течение 42 час при встряхивании на качалке со скоростью 115 об/мин. По окончании выращивания клетки отделяют центрифугированием и концентрацию L-треонина в надосадочной жидкости с культурой определяют с помощью Biotech Analyzer AS210 (Sakura Seiki). Все количество глюкозы в питательной среде полностью потребляется после выращивания в течение 42 час.
Результаты приведены в Таблице 5. ATCC13861/pVYBJE1, в которой ген ybjE амплифицирован, способна вызывать накопление L-лизина в большем количестве по сравнению с контрольным штаммом ATCC13861/pVK7. Обнаружено, что ген ybjE также принимает участие в экспорте L-аминокислот и увеличивает продукцию L-лизина в бактерии Coryneform.
Пример 11. Влияние амплификации гена ybjE на рост при высоких концентрациях L-аминокислот
Штамм Escherichia coli MG1655 (ATCC47076) трансформируют с помощью pSYBJE1, включающей ген ybjE, или контрольной плазмидой pSTV28 (Takara Bio). Кроме того, штамм MG1655 трансформируют с помощью pSYBJE1*2-1, включающей мутантный ген ybjE с последовательностью SEQ ID NO: 1, в которой нуклеотид (гуанин) в 3-й позиции заменен аденином.
Трансформанты, вводимые указанными плазмидами, отбирают на основе их устойчивости к хлорамфениколу и отобранные штаммы обозначают соответственно как MG1655/pSYBJE1, MG1655/pSYBJE1*2-1 и MG1655/pSTV28.
MG1655/pSYBJE1*2-1 конструируют следующим образом. Мутантный ген ybjE амплифицируют с помощью ПЦР, используя праймеры, каждый из которых содержит последовательность SEQ ID NO: 5 или 6 из хромосомной ДНК штамма E. coli NVC578, продуцирующего L-лизин. Амплифицированную ДНК секвенируют и устанавливают, что она имеет последовательность SEQ ID NO: 1, в которой нуклеотид (гуанин) в 3-й позиции заменен аденином. Амплифицированную ДНК лигируют с pSTV28, расщепленной обработкой SmaI, и плазмиду, в которой мутантный ген ybjE размещен таким образом, что он экспрессируется lac промотором, отбирают и обозначают как pSYBJE1*2-1.
Мутантный ген ybjE может быть также получен введением мутации в ген ybjE дикого типа при использовании таких методов, как метод ПЦР с перекрытием и элонгацией (Nucleic Acids Res, 25, 2227-8 (1997), при этом мутантный ген ybjE амплифицируют праймерами, один из которых содержит нуклеотидную замену.
Затем исследуют рост штаммов MG1655/pSYBJE1, MG1655/pSYBJE1*2-1 и MG1655/pSTV28 в присутствии высоких концентраций каждой из L-аминокислот.
Указанные штаммы выращивают в течение приблизительно 6 час при встряхивании в 5 мл питательной среды L, содержащей 50 мг/л хлорамфеникола. После того как оптическая плотность среды с культурой достигнет значения OD600, приблизительно равного 1,0, культуру центрифугируют, клетки дважды промывают минимальной питательной средой М9 и инокулируют с величиной OD600=0,05 в минимальную питательную среду М9, содержащую 50 мг/л хлорамфеникола, и каждую из L-аминокислот (12 г/л изолейцина, 40 г/л треонина, 15 г/л глутамата натрия, 30 г/л гидрохлорида гистидина, 45 г/л гидрохлорида орнитина, 90 г/л гидрохлорида аргинина, 8 г/л фенилаланина, 85 г/л пролина или 0,3 г/л цистеина), и выращивают в течение 70 час. L-изолейцин выбирают в качестве представителя алифатических L-аминокислот, L-треонин выбирают в качестве представителя гидроксилсодержащих L-аминокислот, L-пролин выбирают в качестве представителя циклических L-аминокислот, L-фенилаланин выбирают в качестве представителя ароматических L-аминокислот, L-цистеин выбирают в качестве представителя серосодержащих L-аминокислот, L-глутаминовую кислоту выбирают в качестве представителя кислых L-аминокислот и их амидов. Результаты приведены на Фиг. 7-15. Обнаружено, что амплификация гена ybjE улучшает рост штамма MG1655 в присутствии высоких концентраций L-аминокислот, в частности L-аргинина, L-орнитина, L-изолейцина, L-глутаминовой кислоты, L-треонина, L-гистидина, L-пролина, L-фенилаланина и L-цистеина. Обнаружено также, что мутантный ген ybjE более эффективно придает штамму MG1655 устойчивость к аминокислотам, чем ген ybjE дикого типа.
Пример 12. Влияние гена ybjE, имеющего нуклеотидную последовательность, составленную нуклеотидами с номерами 49-948 из SEQ ID NO: 1
Ген ybjE, имеющий нуклеотидную последовательность, составленную нуклеотидами с номерами 49-948 из SEQ ID NO: 1 (далее по тексту настоящего описания обозначают как ybjE-900), амплифицируют из хромосомной ДНК штамма MG1655 методом ПЦР, используя праймеры, имеющие нуклеотидную последовательность SEQ ID NO: 13 или 12. Кроме того, методом ПЦР, используя праймеры, имеющие нуклеотидную последовательность SEQ ID NO: 11 или 12, амплифицируют ген ybjE, имеющий нуклеотидную последовательность, составленную нуклеотидами с номерами 1-948 из SEQ ID NO: 1, в которой гуанин в позиции 1 заменен аденином (далее по тексту настоящего описания обозначают как ybjE-948).
Продукт ПЦР, полученный из каждой реакционной смеси, очищают и каждый лигируют с вектором pTV28 (Takara Bio), расщепленным обработкой SmaI, и таким образом получают плазмиду для амплификации гена ybjE-900 или гена ybjE-948. Плазмиду, в которой ген ybjE-900 размещен таким образом, чтобы он экспрессировался lac промотором, отбирают и обозначают как pSYBJE900, а плазмиду, в которой ген ybjE-948 размещен таким образом, чтобы он экспрессировался lac промотором, отбирают и обозначают как pSYBJE948.
Штамм Escherichia coli MG1655 (ATCC47076) трансформируют с помощью pSYBJE900, pSYBJE948, pSYBJE1, который используют в Примере 2, или контрольной плазмиды pSTV28. Трансформанты, вводимые указанными плазмидами, отбирают на основе их устойчивости к хлорамфениколу и отобранные штаммы обозначают соответственно как MG1655/pSYBJE900, MG1655/pSYBJE948, MG1655/pSYBJE1 и MG1655/pSTV28.
Затем исследуют рост штаммов MG1655/pSYBJE900, MG1655/pSYBJE948, MG1655/pSYBJE1 и MG1655/pSTV28 в присутствии высоких концентраций L-лизина.
Указанные штаммы выращивают в течение 6 час при встряхивании в 3 мл питательной среды L, содержащей 50 мг/л хлорамфеникола. После того, как оптическая плотность среды OD600 достигает значения, приблизительно равного 1,0, культуру центрифугируют, клетки дважды промывают минимальной питательной средой М9 и инокулируют до величины OD600=0,05 в минимальную питательную среду М9, содержащую 50 мг/л хлорамфеникола и 80 г/л гидрохлорида лизина, и выращивают в течение приблизительно 20 час. Результаты приведены на Фиг. 16. Обнаружено, что амплификация гена ybjE-900 улучшает рост штамма MG1655 в присутствии высоких концентраций L-лизина в ранней фазе роста, а также в логарифмической фазе роста почти также как гены ybjE-948 и ybjE, содержащиеся в pSYBJE1. Полученные данные указывают на то, что последовательность нуклеотидов с номерами 49-948 в последовательности гена ybjE (SEQ ID NO: 1) достаточна для того, чтобы оказать влияние на экспорт L-аминокислот.
Применимость в промышленности
Согласно настоящему изобретению L-аминокислоты, в частности L-лизин, L-треонин, L-изолейцин, L-пролин, L-аргинин, L-орнитин, L-гистидин, L-фенилаланин и L-глутаминовая кислота, могут эффективно продуцироваться ферментацией. L-лизин, L-треонин, L-изолейцин и L-пролин пригодны для использования в качестве добавок к кормам для животных, в качестве компонентов оздоровительной пищи и для инфузии аминокислот. L-аргинин и L-орнитин пригодны для использования в качестве агентов, улучшающих работу печени, для инфузии аминокислот и в качестве компонентов комплексных препаратов аминокислот, L-гистидин пригоден для использования в качестве агента, улучшающего работу печени, и предшественника гистамина. L-фенилаланин пригоден для использования в качестве предшественника подсластителей.









Реферат
Изобретение относится к области биотехнологии. L-аминокислоты получают выращиванием бактерии, например Escherichia coli, модифицированной таким образом, что увеличена экспрессия гена ybjE, которая приводит к накоплению в бактерии и питательной среде L-аминокислот. 5 н. и 15 з.п. ф-лы, 16 ил., 5 табл.


Комментарии