Микрофлюидный чип для создания клеточных моделей органов млекопитающих - RU2584598C1
Код документа: RU2584598C1
Чертежи

Описание
Область техники, к которой относится изобретение
Изобретение относится к устройствам для работы с клетками тканей, человека, животных или растений и (или) культурами вирусов и может быть, в частности, использовано для испытаний лекарственных препаратов, создания клеточных моделей тканей и органов млекопитающих и моделирования межорганных взаимодействий.
Уровень техники
Для доклинических испытаний лекарства в настоящее время используются модели in vitro, а также животные модели. Например, для определения эффективности и токсичности онкологических препаратов, в первую очередь оценивается действие вещества на многочисленные раковые клеточные линии [Paull K.D. et al. Display and analysis of patterns of differential activity of drugs against human tumor cell lines: development of mean graph and COMPARE algorithm. // Journal Of The National Cancer Institute. 1989. Vol. 81, №14. P. 1088-1092.1]; затем на иммортализованные клеточные линии, выведенные из здоровых тканей, на которых тестируется токсичность соединения.
Процесс разработки лекарства обычно начинается с высокопроизводительного скрининга соединений для выделения из них эффективных кандидатов. Традиционные тест-системы, такие как клеточные культуры in vitro, дают первичные представления об эффективности и токсичности вещества, которые требуют дальнейшего тестирования на животных моделях. В идентификации мишеней для лекарственных препаратов задействованы такие научные области, как геномика, протеомика и комбинаторная химия. Рост числа синтезируемых соединений требует более быстрого и эффективного скрининга, чем позволяют традиционные тесты.
Кроме того, традиционные тест-системы, например, основанные на культивировании клеточных моделей в планшетах, не воссоздают реалистичной картины микроокружения, в котором находятся клетки в теле человека, играющего важную роль в процессах адсорбции, распределения, метаболизма и экскреции препарата (принцип ADME [Esch М.В., King T.L., Shuler M.L. The role of body-on-a-chip devices in drug and toxicity studies. // Annual review of biomedical engineering. 2011. Vol. 13. P. 55-72.; Sung J.H., Shuler M.L. A micro cell culture analog (microCCA) with 3-D hydrogel culture of multiple
cell lines to assess metabolism-dependent cytotoxicity of anti-cancer drugs. // Lab on a Chip. 2009. Vol. 9, №10. P. 1385-1394]), моделирование которых является необходимым условием достоверной оценки эффективности и токсичности препарата. Отличия в параметрах механических воздействий на клетки in vivo и in vitro также существенно влияют на воспроизведение в модели отклика организма на воздействие.
Следующей стадией после тестирования лекарства на клетках являются испытания на животных. Однако сравнение предсказанной и реальной эффективности лекарства свидетельствует о том, что оценка действия препарата на человека далеко не всегда возможна с помощью животных моделей [Johnson J.I. et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials // British Journal of Cancer. Nature Publishing Group, 2001. Vol. 84, №10. P. 1424-1431.; Paul S.M. et al. How to improve R&D productivity: the pharmaceutical industry's grand challenge. // Nature reviews. Drug discovery. 2010. Vol. 9, №3. P. 203-214]. Причинами такого несоответствия могут быть межвидовые различия в метаболизме, имплантированный характер опухоли, а также общая практика использования иммуномодифицированных животных. В связи с этим на сегодняшний день даже обширные доклинические испытания не гарантируют клинической эффективности и безопасности использования препарата. В то время, как клеточные культуры могут предоставить информацию о терапевтических эффектах определенного соединения на целевую ткань, но не на весь организм, данные, полученные на животных моделях, не всегда могут быть экстраполированы на человека.
Микробиореакторы, содержащие объединенные микрожидкостными каналами ячейки для одновременного культивирования нескольких клеточных моделей тканей, могут быть использованы для оптимизации процесса разработки лекарственных препаратов. Наиболее актуальной проблемой, приводящей к необходимости разработки таких моделей, на сегодняшний день является тот факт, что в актуальных процедурах скрининга препаратов клетки находятся в условиях, значительно отличающихся от реальных, и не выполняют своих нативных функций. Ток среды, взаимодействие между различными тканями и другие параметры, определяющие физиологический отклик организма, не воспроизводятся обычными моделями тканей. В частности, в макроскопических системах для культивирования клетки находятся на дне камеры и покрыты культуральной жидкостью, объем которой значительно превышает объем физиологических жидкостей, приходящихся на клетки того или иного органа в организме.
Микроскопические аналоги клеточных культур, воспроизводящие реальные соотношения между объемами различных тканей в организме и моделирующие взаимодействия между ними в условиях близкого к физиологическому тока жидкости (т.н. «человек на чипе»), представляют собой замену традиционным методам скрининга с использованием клеточных культур и доклиническим испытаниям на животных.
Вместе с тем на сегодняшний день не существует системы, в достаточной степени воспроизводящей все свойства человеческого организма, валидность тестирования на которой была бы доказана экспериментально. Основной проблемой при разработке аутентичных in vitro моделей остается воссоздание взаимодействия между различными органами в организме, как в физиологических условиях, так и в случае заболеваний. В связи с этим затруднена и оценка воздействия химического препарата на те или иные органы, что приводит к невозможности исследования комплексного результата применения препарата и эффективности лечения.
Наиболее близким заявляемому решению является устройство, представленное в материалах заявки US 2012/0214189 А1, представляющее собой микрофлюидный чип для культивирования клеточных моделей, имеющий сходную геометрию расположения микрожидкостных каналов. Устройство чипа включает четыре ячейки: ячейку «печени» для моделирования органа, ответственного за трансформацию ксенобиотиков, ячейку «легкого», представляющую собой «целевую» ткань, ячейку «жира» для моделирования биоаккумуляции гидрофобных соединений, и ячейки «других тканей», несущие вспомогательную функцию для моделирования циркуляции через неметаболизирующие и неаккумулирующие ткани. При этом ячейка «легкого» подключена ко входу чипа, а ячейки «печени», «жира» и «других тканей» соединены параллельно и подключены между ячейкой «легкого» и выходом чипа.
Недостатком данного устройства является игнорирование в модели анатомии и физиологии органов брюшной полости, что может привести к недостоверным результатам моделирования фармакокинетики ксенобиотиков. В частности при моделирования перорального введения, при котором в большинстве случаев всасывание происходит в кишечнике, ксенобиотик попадает на выход чипа, минуя печень. Тогда как в человеческом организме вся венозная кровь из кишечника фильтруется печенью.
Раскрытие изобретения
Задачей, на решение которой направлено изобретение, является воспроизведение в микрофлюидном чипе с несколькими клеточными моделями органов ключевых физиологических параметров взаимодействия основных органов человека.
Получаемый технический результат может быть выражен в более аутентичном поведении клеточных моделей органов при культивировании в микробиореакторе и, следовательно, приводит к получению более достоверных результатов при тестировании воздействия различных препаратов на жизнеспособность моделей с учетом их метаболического взаимодействия в процессе циркуляции среды по сравнению с микробиореакторами, не учитывающими этих особенностей за счет использования заявляемого дизайна микрофлюидного чипа с подобранной геометрии ячеек и соединяющих их каналов.
Указанный технический результат может быть получен при культивировании клеточных моделей органов человека в микрофлюидном чипе, объединяющем их общим током жидкости, моделирующей систему кровообращения для обеспечения метаболического взаимодействия между клеточными моделями. Для наиболее точного воссоздания физиологических параметров, таких как соотношение объемов органов, скорость тока жидкости, соотношение объема жидкой питательной среды и клеток, концентрации растворенных газов, а также для снижения общего количества необходимых реагентов и биологического материала и повышения производительности исследований, устройство должно обладать гидродинамическими характеристиками ячеек и каналов, соотношение которых рассчитано, исходя из реальных размеров органов и тканей, а также гемодинамики организма человека.
Поставленная задача решается тем, что микрофлюидный чип (микробиореактор) для создания клеточных моделей органов млекопитающих содержит объединенные системой микрожидкостных каналов, по крайней мере, шесть ячеек для одновременного культивирования клеточных моделей тканей и органов млекопитающих в проточном или замкнутом режимах, две из которых, предназначены для моделей кишечника и печени млекопитающего, а оставшиеся, по крайней мере, четыре ячейки - являются типовыми, при этом система каналов включает входной и выходной каналы микрофлюидного чипа, входной и выходной каналы ячейки модели кишечника, последний из которых соединен с входным каналом ячейки модели печени, по крайней мере, четыре распределительных канала, расположенных со стороны входа в типовые ячейки, по крайней мере, четыре смесительных канала, расположенных со стороны выхода из типовых ячеек, и байпасный канал для ячейки модели кишечника, при этом по два из четырех распределительных и смесительных канала обеспечивают парное соединение типовых ячеек с образованием двух замкнутых контуров, которые со стороны входа параллельно подключены к входному каналу через оставшиеся третий и четвертый распределительные каналы, со стороны выхода через оставшиеся третий и четвертый смесительные каналы подключены к выходному каналу, при этом выходной канал ячейки модели печени переходит в четвертый смесительный канал, а четвертый распределительный канал имеет две ветви, первая из которых, предназначенная для соединения с третьим распределительным каналом, имеет общую протяженность l, вторая ветвь - для соединения с входным каналом модели кишечника и байпасным каналом, выполнена с участком увеличения гидродинамического сопротивления подаваемой среды и имеет общую протяженность 15÷16l.
Наилучший результат достигается при выполнении микрофлюидного чипа, в котором центры типовых ячеек размещены на одной оси, при этом первые, вторые и третьи смесительные и распределительные каналы имеют симметричное расположение относительно упомянутой оси. Каналы, как правило, выполнены в слое полимерного оптически прозрачного материала (ПДМС) со стороны его нижней поверхности и загерметизированы предметным стеклом. Каналы выполнены, преимущественно, прямоугольного сечения с высотой, не превышающей 0.1 мм, и шириной не менее 0.4 мм. Участок увеличения гидродинамического сопротивления подаваемой среды может быть выполнен в виде змеевика, содержащего, по крайней мере, восемь U-образных элементов. Байпасный канал также может включать участок, выполненный в виде змеевика, содержащего, по крайней мере, один U-образный элемент. Участки байпасного канала со стороны входа и выхода могут быть выполнены с радиусным изгибом.
В одном из вариантов осуществления изобретения соединения входного канала микрофлюидного чипа с четвертым распределительным, четвертого распределительного с третьим распределительным, третьего распределительного с первым и вторым распределительными каналами, а также соединение выходного канала микрофлюидного чипа с четвертым смесительным, четвертого смесительного с третьим смесительным, третьего смесительного с первым и вторым смесительными каналами, выполнены Т-образными, а соединение байпасного канала с одной стороны с входным каналом модели кишечника и четвертым распределительным каналом, и с другой стороны - с выходным каналом модели кишечника и входным каналом модели печени выполнено Y-образным. При этом Т-образное соединение образовано тремя прямыми отрезками соответствующих каналов, соединенных под углами 90°, 90° и 180° касательными дугами с радиусами 0.4 мм с допустимой величиной отклонения от указанных параметров не более чем на 10%. Y-образное соединение образовано тремя прямыми отрезками соответствующих каналов, соединенных под углами 135°, 135° и 90° касательными дугами с радиусами 0.4 мм, при этом угол 90° составляет между байпасным каналом и входным и выходным каналами ячейки модели кишечника, соответственно, с допустимой величиной отклонения от указанных параметров не более чем на 10%.
В одном из вариантов осуществления изобретения каждая ячейка в проекции на плоскости образована двумя округлыми линиями с диаметром 4.2 мм, соединенными с каналами на входе и выходе из ячейки дугообразными линиями с радиусом кривизны 2.1 мм, с допустимой величиной отклонения от указанных параметров не более чем на 10%, при этом продольная ось каналов проходит через центр ячейки.
Байпасный канал имеет геометрические размеры и форму, обеспечивающие поступление в ячейку модели печени всей жидкости из ячейки модели кишечника и части жидкости, не прошедшей через ячейку модели кишечника, с соотношением 3:1 соответственно. Четвертый распределительный канал имеет геометрические размеры и форму, обеспечивающие получение соотношения объемного расхода жидкости между первой и второй его ветвями 5:1.
Таким образом, в предлагаемом техническом решении выполняется соотношение объемных расходов культуральной жидкости 1:5 между фрагментом, содержащим ячейки модели печени и модели кишечника, и ячейками моделей прочих органов, соответственно, тем самым воспроизводя аналогичное соотношение человеческого организма. Также выполняется соотношение 1:3 между поступающей в ячейку модели печени «свежей» культуральной жидкостью и культуральной жидкостью, поступающей из ячейки модели кишечника, чем моделируются общая печеночная артерия и воротная вена.
Краткое описание чертежей
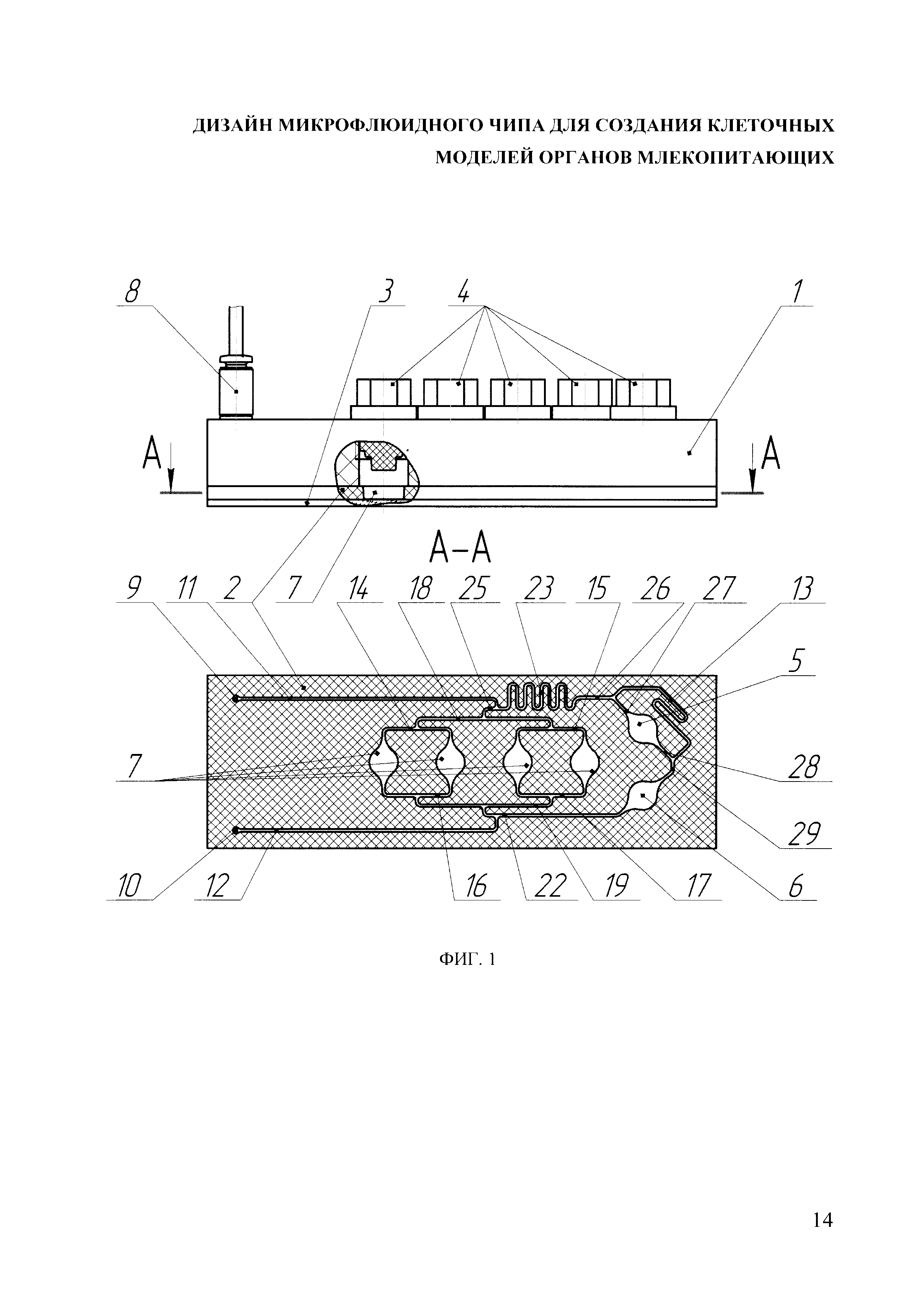
Изобретение поясняется чертежами, где на фиг. 1 представлено схематичное изображение заявляемого устройства - вид сбоку и под ним разрез слоя полидиметилсилоксана, в котором размещена микрофлюидная система.
На фиг. 2 представлены Т-образное и Y-образное соединения, а также U-образный элемент.
Позициями на чертежах обозначены: 1 - пластина из поликарбоната, 2 - слой полидиметилсилоксана, 3 - предметное стекло, 4 - пробка, 5 - ячейка модели кишечника, 6 - ячейка модели печени, 7 - ячейка типовой модели, 8 - фитинг, 9 - входное отверстие в слое полидиметилсилоксана, 10 - выходное отверстие в слое полидиметилсилоксана, 11 - входной канал микрофлюидного чипа, 12 - выходной канал микрофлюидного чипа, 13 - байпасный канал, 14 - первый распределительный канал, 15 - второй распределительный канал, 16 - первый смесительный канал, 17 - второй смесительный канал, 18 - третий распределительный канал, 19 - третий смесительный канал, 20 - Т-образное соединение, 21 - U-образный элемент, 22 - четвертый смесительный канал, 23 - участок увеличения гидравлического сопротивления, 24 - Y-образное соединение, 25 - первая ветвь четвертого распределительного канала, 26 - вторая ветвь четвертого распределительного канала, 27 - входной канал ячейки кишечника, 28 - выходной канал ячейки кишечника, 29 - входной канал ячейки печени.
Осуществление изобретения
Конструкция микрофлюидного чипа (микробиореактора) основана на трехслойной структуре, верхний слой которой образован пластиной (поз.1), выполненной из поликарбоната толщиной 10 мм, на которой отлит слой полидиметилсилоксана (ПДМС) (поз. 2), содержащий систему микрофлюидных каналов прямоугольного сечения (например, с высотой 0.1 мм и шириной 0.4 мм) и ячейки, герметизированные снизу слоем, образованным стандартным предметным стеклом (поз. 3). Применение каналов постоянного сечения позволило обеспечить приемлемую технологичность формы для литья слоя ПДМС.
Микрофлюидный чип содержит в себе объединенные микрофлюидными каналами, по крайней мере, шесть идентичных ячеек, предназначенных для одновременного сокультивирования размещенных в них клеточных моделей органов и тканей человека в проточном или замкнутом режимах. Модели могут быть представлены сфероидами или мембранной вставкой (например Трансвел). Ячейки сверху герметизированы пробками (поз. 4), закрепленными в пластине из поликарбоната с помощью резьбового соединения.
Каждая ячейка в плоскости каналов представляет собой окружность, например, с диаметром 4.2 мм, к которой симметрично относительно центра подключены входной и выходной каналы. С целью устранения неоднородностей и обеспечения более равномерного распределения поля скоростей по площади ячейки, каналы сопряжены с окружностью ячейки дугами, например, с радиусом 2.1 мм.
Две ячейки предназначены для моделей кишечника (поз. 5) и печени (поз. 6), а оставшиеся, по меньшей мере, четыре ячейки - являются типовыми (поз. 7), т.е. предназначены для культивирования других моделей, таких как модель мышечной ткани, модель нейрональной ткани, модель почки и т.п.
Также в пластине из поликарбоната имеются входное и выходное резьбовые отверстия для фитингов (поз. 8), сообщающиеся с соответствующими входным (поз. 9) и выходным (поз. 10) отверстием в слое ПДМС, подключенными к входному (поз. 11) и выходному каналам (поз. 12).
Система каналов включает в себя два фрагмента, первый из которых объединяет четыре типовых ячейки, а второй - соединяет ячейку модели кишечника и подключенную после нее ячейку модели печени.
В первом фрагменте ячейки соединены попарно первыми (поз. 14) и вторыми (поз. 15) распределительными и первыми (поз. 16) и вторыми (поз. 17) смесительными каналами, которые в свою очередь соединены третьим распределительным (поз. 18) и третьим смесительным (поз. 19) каналами соответственно. Соединения сделаны симметричными по горизонтальной и вертикальной осям и образованы Т-соединениями (поз. 20), что обеспечивает одинаковый объемный расход в каждой ячейке (равный четверти объемного расхода в третьем распределительном канале).
Второй фрагмент соединяет ячейки модели кишечника и печени. Жидкость, поступающая по второй ветви четвертого распределительного канала (поз. 26) ко второму фрагменту, делится между ячейкой модели кишечника и ее байпасным каналом, откуда поступает на ячейку модели печени. В частности, входной канал ячейки модели кишечника (поз. 27) соединен с байпасным каналом (поз. 13), который в свою очередь соединен с выходным каналом ячейки модели печени (поз. 28) и входным каналом модели кишечника (поз. 29). Гидродинамическое сопротивление байпасного канала, обусловленное его формой (два U-образных элемента (поз. 21), представляющих собой изгиб канала на 180°, например, с радиусом 0.6 мм) и длиной, подобрано таким образом, что на модель печени поступает вся жидкость из модели кишечника и часть жидкости, не прошедшей через модель кишечника, с соотношением 3 к 1 соответственно.
Первый и второй фрагменты соединены первой и второй ветвями четвертого распределительного канала (поз. 25, 26) и четвертым смесительным каналом (поз. 22), к которым подключены входной и выходной каналы микрофлюидного чипа соответственно. При этом выходной канал ячейки модели печени переходит в четвертый смесительный канал. Гидродинамическое сопротивление четвертого распределительного канала подобрано таким образом, что соотношение объемного расхода между первым и вторым фрагментом составляет 5 к 1 соответственно. Для этого четвертый распределительный канал имеет участок увеличения гидродинамического сопротивления (поз. 23), который представляет собой восемь идентичных U-образных элементов, представляющих собой изгиб канала на 180°, например с радиусом 0.6 мм, соединенных в виде змеевика.
Все соединения выполнены Т-образными, кроме соединений ячейки кишечника и байпасного канала, которые выполнены Y-образными (поз. 24) (с углами 135°, 135° и 90°). Оба варианта соединения обеспечивают равенство гидродинамических сопротивлений на симметричных ветвях и отсутствие неравномерного деления между ветвями частиц, которые могут находиться в культуральной жидкости. Для устранения неоднородности течения каналы в обоих вариантах соединений сопряжены дугами с радиусами, например, 0.4 мм.
Подбор гидродинамического сопротивления в отдельных участках системы микрофлюидных каналов осуществлялся итеративно с помощью численного моделирования и использования эмпирических соотношений для гидродинамического сопротивления каналов прямоугольного сечения.
При культивировании моделей культуральная жидкость подается на вход микрофлюидного устройства и в соответствии с гидродинамическими сопротивлениями различных участков распределяется, обеспечивая заданные соотношения объемных расходов.
Проверка выполнения соотношений объемных расходов производилась экспериментально на макетах с помощью анемометрии по изображениям частиц.
По результатам экспериментального сравнения функциональный статус сокультивируемых в данном микрофлюидном чипе клеточных моделей оказался более выраженным по сравнению со статической моделью. Таким образом, в данной конструкции достигается более аутентичное поведение клеточных моделей органов.
Реферат
Изобретение относится к области биохимии. Предложен микрофлюидный чип для создания клеточных моделей органов млекопитающих. Чип содержит пластину из поликарбоната, на которой отлит слой полидиметилсилоксана с размещенной в нём микрофлюидной системой. Микрофлюидная система включает объединенные микрожидкостными каналами шесть ячеек для одновременного культивирования клеточных моделей тканей и органов млекопитающих. Первая ячейка предназначена для модели кишечника, вторая для модели печени млекопитающего, а оставшиеся ячейки предназначены для типовых моделей. При этом система каналов включает входной и выходной каналы микрофлюидного чипа, входной и выходной каналы ячейки модели кишечника, четыре распределительных канала, четыре смесительных канала и байпасный канал для ячейки модели кишечника. Изобретение обеспечивает более аутентичное поведение клеточных моделей органов при культивировании, вследствие чего получение более достоверных результатов при тестировании воздействия различных препаратов на жизнеспособность моделей. 10 з.п. ф-лы, 2 ил.
Формула
Документы, цитированные в отчёте о поиске
Устройство "орган-на-чипе"

Комментарии