Устройство "орган-на-чипе" - RU2517046C2
Код документа: RU2517046C2
Чертежи

Описание
Настоящее изобретение относится к автономному, предпочтительно, контролируемому датчиками устройству «орган-на-чипе», которое позволяет осуществлять создание или поддержание органов или органоидов, а также ниш стволовых клеток в формате миниатюризированной интегральной схемы, пригодной для наблюдения в режиме прямого доступа путем получения изображений живой клетки и, например, двухфотонной микроскопии, и их применения для, например, тестирования активности, фармакодинамики и фармакокинетики химических соединений или для изучения самосборки, гомеостаза, повреждения, регенерации или взаимодействия органов или органоидов и ниш стволовых клеток, а также явлений созревания, старения, смерти и хронобиологии.
Известный уровень техники
Парадигма строгой корреляции между архитектурой и функциональностью применима ко всем уровням биологической жизни на Земле. Эти уровни увеличивающейся биологической сложности шаг за шагом возникали в ходе многих миллионов лет процесса эволюции. Жизнь, наиболее вероятно, возникла посредством небольших изменений окружения, которые создали возможность для самосборки, формирующей следующий уровень сложности. Считается, что для людей эти уровни представляют молекулы, клетки, органоидные ткани, органы, системы и, наконец, сами индивидуальные организмы. В настоящее время доказано, что почти все органы и системы построены из составных, идентичных, функционально самодостаточных структурных элементов. Эти органоидные элементы имеют чрезвычайно малые размеры - от нескольких клеточных слоев до нескольких миллиметров. Дольки печени, нефроны почки, дерма и эпидермис кожи, слизистая оболочка кишечника, островки Лангерганса поджелудочной железы, серое и белое вещество коры головного мозга и мозжечка, и способствующие состоянию покоя ниши взрослых стволовых клеток представляют собой лишь небольшую выборку примеров таких органоидных структур человека, и все они обладают выраженной функциональностью и высокоизменчивой геометрией конгломерата. По причине характерной функциональности, высокого уровня самодостаточности и множественности указанных микроорганоидов в соответствующем органе, модель их реакционной способности в отношении любых химических веществ представляется репрезентативной для всего органа. Для реализации наиболее значительных функций органов и систем, природа создала чрезвычайно малые, но сложно устроенные биологические структуры. Размножение этих структур в любом данном органе является инструментом природы для управления рисками во избежание полной потери функциональности при частичных повреждениях органа. С другой стороны, в эволюционном аспекте, данная концепция позволила легко приспосабливать размер органа и его форму к нуждам данных видов - например, печень у мышей и человека - по-прежнему используя практически одинаковый генеральный план для построения единичного функционального микроорганоидного элемента. Уникальный и выдающийся шанс тестирования химических веществ, обладающий предсказательной силой в отношении воздействия на человека, заключается в создании эквивалентов микроорганоидов человека in vitro. Первое устройство «орган-на-чипе», называемое «Интегрированная дискретная сложная клеточная культура органа», было описано в 2004 г. Li и et al., Chem. Biol. Interaction. Устройство основывается на статических культурах различных тканей в традиционной 6-луночной плашке, покрытой гелем и соединяющей различные культуры посредством полутвердой среды на основе диффузии. С тех пор прилагались значительные усилия для разработки систем культивирования и биореакторов, более естественно имитирующих архитектуру и in vivo-окружение в условиях in vitro. Всестороннее изложение дано в статье М.А. Swartz и др.: Capturing complex 3D tissue physiology in vitro. Nat. Rev. Mol. Cell Biol., 7, 211-224, 2006. Миниатюризированные перфузионные системы культивирования разрабатывались для ряда различных тканей, например, для почечных канальцев (Minuth et al.: The formation of pores in the basal lamina of regenerated renal tubules. Biomaterials, 29, 2749-2756, 2008) или нейронной ткани (Hillenkamp и et al.: Maintenance of adult porcine retina and retinal pigment epithelium in perfusion culture: Characterization of an organotypic in vitro model. Experimental Eye Research, 86, 661-668, 2008).
Ни одна из существующих трехмерных систем культивирования и биореакторов не конструировалась в соответствии с требованиями в отношении размера, формы и питания различных органоидов в автономного и наблюдаемого в режиме прямого доступа окружения интегральной схемы, не зависящего от внешнего оборудования. Применяя настоящее изобретение, например, для создания органоидов человека, можно предвидеть качественно новый уровень биобезопасности и эффективности тестирования различных химических веществ, таких как химические реактивы, лекарственные вещества, нутрицевтики и космецевтики, перед их воздействием на человеческий организм.
Краткое изложения сути изобретения
Настоящее изобретение относится к автономному устройству «орган-на-чипе» (1), содержащему:
(a) по меньшей мере, один резервуар для подачи среды (2);
(b) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), где резервуар для подачи среды (2) соединяется, по меньшей мере, с одной секцией роста органов (3) посредством микрожидкостного канала подачи (6).
В дополнительном аспекте настоящее изобретение относится к автономному устройству «орган-на-чипе» (1), содержащему:
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
(b) где, по меньшей мере, одна полость для органов (4, 4а, 4b) содержит и/или соединена, по меньшей мере, с одним датчиком (8, 8а, 8b).
В дополнительном аспекте настоящее изобретение относится к автономному устройству «орган-на-чипе» (1), содержащему:
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
(b) где секция роста органов (3) содержит, по меньшей мере, одну полость для стволовых клеток (9).
В дополнительном аспекте настоящее изобретение относится к способу изготовления предлагаемого автономного устройства «орган-на-чипе» (1), включающему этапы связывания слоя среды (12) непроницаемым для жидкостей образом со слоем секций роста (13) или его частями.
В дополнительном аспекте настоящее изобретение относится к блоку питания (17) для поддержания предлагаемого автономного устройства «орган-на-чипе» (1) при функционировании, содержащему: (а) средства крепления (18) для съемного крепления автономного устройства «орган-на-чипе» (1), и (b) электрические соединители (19) для соединения соответствующих соединителей автономного устройства «орган-на-чипе» (1) с блоком питания (17).
Способ создания органа и/или органоида в предлагаемом автономном устройстве «орган-на-чипе» (1), включающий следующие этапы:
(a) загрузки суспензии клеток и/или среза ткани в одну или несколько полостей для органов (4, 4а, 4b); и
(b) герметизации одной или нескольких полостей для органов (4, 4а, 4b) непроницаемым для жидкостей образом.
В дополнительном аспекте настоящее изобретение относится к способу тестирования влияния одного или нескольких тестовых соединений на одну или несколько тканей, органов и/или органоидов, созданных в предлагаемом автономном устройстве «орган-на-чипе» (1), включающему:
(a) обеспечение автономного устройства «орган-на-чипе» (1) согласно настоящему изобретению, содержащего одну или несколько тканей, органов и/или органоидов, или
реализацию способа создания органа и/или органоида в автономном устройстве «орган-на-чипе» (1) согласно настоящему изобретению;
(b) добавление к органу и/или органоиду одного или нескольких тестовых соединений;
(c) микроскопическую оценку органа и/или органоида, и/или
определение одного или нескольких параметров, определяемых одним или несколькими датчиками (8, 8а, 8b).
В дополнительном аспекте настоящее изобретение относится к применению предлагаемого автономного устройства «орган-на-чипе» (1), содержащего одну или несколько тканей, органов и/или органоидов для тестирования влияний одного или нескольких тестовых соединений на ткани, органы и/или органоиды, или исследования функций органа или органоида.
Краткое описание графических материалов
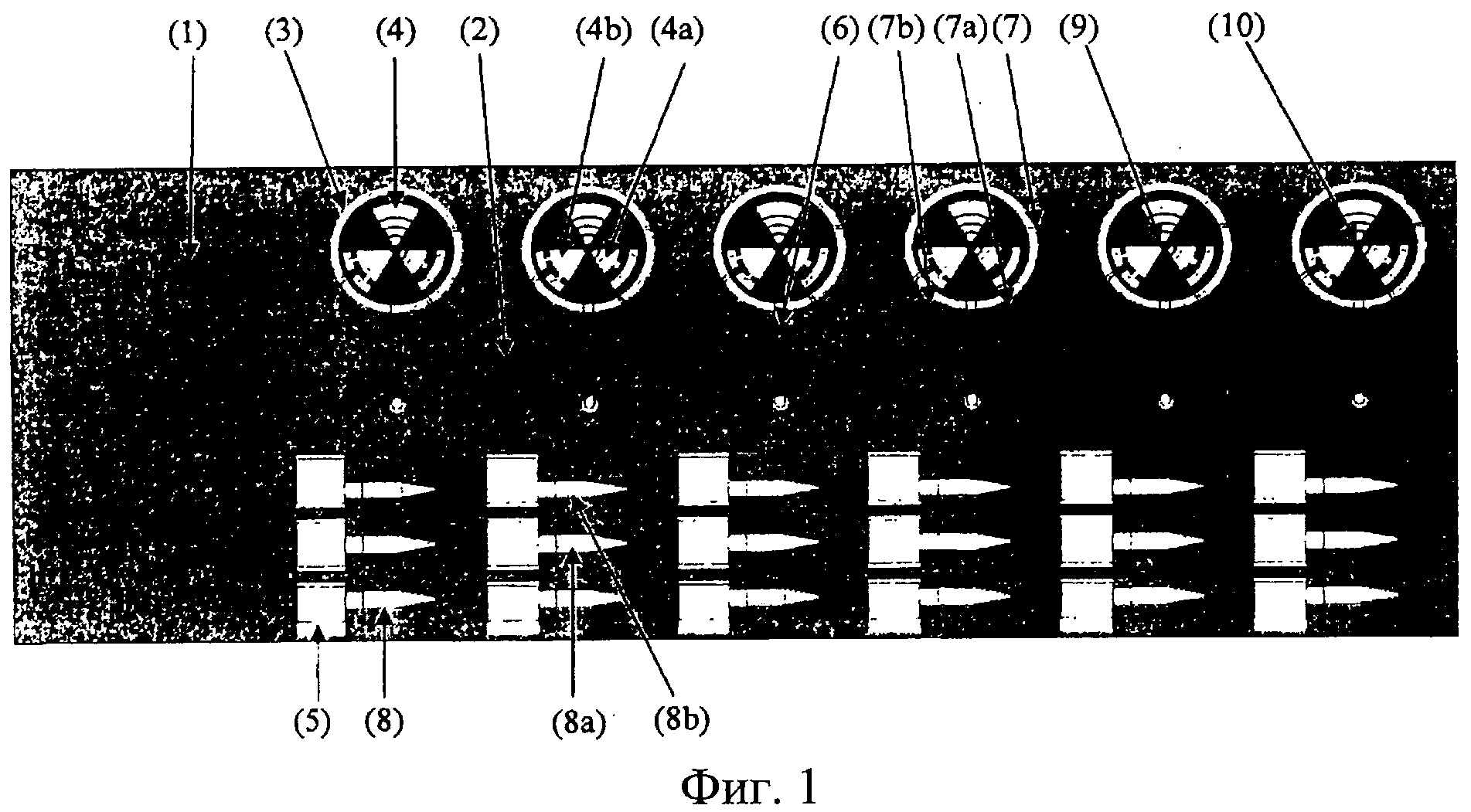
Фиг.1: вид сверху вниз предпочтительного варианта осуществления секции частично собранного автономного устройства «орган-на-чипе» (1), содержащего верхний закрывающий слой (14) и слой полостей для органов (15). Поскольку верхний закрывающий слой (14) и слой полостей для органов (15) находятся один над другим, их нельзя различить на приведенном здесь виде сверху вниз, и, соответственно, верхний закрывающий слой (14) и слой полостей для органов (15) на этой фигуре не отмечены. Эта секция содержит шесть отдельных секций роста органов (3), каждая из которых содержит по три полости для органов (4, 4а, 4b). Для того чтобы показать заключаемые здесь особенности, детали изображены полупрозрачными. Однако в некоторых предпочтительных вариантах осуществления материал, используемый для изготовления верхнего закрывающего слоя (14) и/или слоя полостей для органов (15), является частично или полностью прозрачным. Среда, подаваемая из расположенного выше слоя среды (12) (не показан), течет через микрожидкостный канал подачи (6), предпочтительно, в центр секции роста органов (3), что позволяет осуществлять равномерное распределение среды по одной, двум, трем или большему количеству полостей для органов (4, 4а, 4b), находящихся в одной секции роста органов (3). Среда предпочтительно подается в секцию роста органов через выпуск (10), расположенный напротив полости для стволовых клеток (9), которая располагается в слое полостей для органов (15). Таким образом, стволовые клетки могут течь вместе со свежей средой в соседние полости для органов (4, 4а, 4b) для пополнения/регенерации клеточных популяций, составляющих соответствующий орган и/или органоид. Полости для органов (4, 4а, 4b) из одной секции роста органов (3) предпочтительно заселяются разными клеточными популяциями, образующими разные ткани, органы и/или органоиды, что позволяет, например, одновременно тестировать влияние одного и того же химического соединения на более чем один орган или органоид. Полости для органов (4, 4а, 4b) предпочтительно микроструктурированы таким образом, чтобы поддерживать организацию клеточной популяции в соответствующий требуемый орган и/или органоид. Некоторые ткани, органы и/или органоиды требуют для своего образования и/или поддержания особенного микроокружения, например, изменений давления, вторичного потока среды в полости для органов, специфической дополнительной среды и т.д. Полость для органов (4) имеет структуру, предусматривающую несколько отдельных микрополостей, что обеспечивает создание и/или поддержание, например, нейронов. Полость для органов (4а) имеет структуру, предусматривающую повышенное давление, что обеспечивает создание и/или поддержание, например, костных и/или хрящевых структур. Полость органа (4b) имеет структуру, предусматривающую вторичный поток в полости для органов, что обеспечивает создание и/или поддержание, например, васкуляризированной кожи. Полость для органов (4, 4а, 4b) предпочтительно ограничена сверху верхним закрывающим слоем (14) и снизу - нижним закрывающим слоем (16), в то время как боковые стороны полости сформированы в слое полостей для органов (15). Таким образом, микроструктуры, необходимые для роста и/или поддержания органов, также могут предусматриваться верхним и/или нижним концами полости для органов (4, 4а, 4b). Выпуск, позволяющий среде затекать в микрожидкостный канал сброса (7, 7а, 7b), предпочтительно расположен в положении напротив выпуска (10) микрожидкостного канала подачи (6) так, чтобы любая среда, текущая через впуск (10) в полость для органов (4, 4а, 4b), преимущественно текла через всю полость для органов (4, 4а, 4b) перед вытеканием из полости для органов через впуск каналов сброса (7, 7а, b). Сбрасываемая среда затем течет, предпочтительно, через отдельный канал (7, 7а, 7b) для каждой полости для органов (4, 4а, 4b) в секции роста органов (3) к одному или нескольким датчикам, расположенным в протоке (8, 8а, 8b). Таким образом, ответная реакция на определенное химическое соединение и/или изменение среды может оцениваться индивидуально для каждого органа и/или органоида, расположенного в полости для органов (4, 4а, 4b) секции роста органов (3). Затем среда затекает в резервуар для сброса среды (5). Несмотря на то, что возможен общий резервуар для сброса среды (5), предусматриваемый для сбрасываемой среды из всех полостей для органов (4, 4а, 4b) секции роста органов (3) или даже для всех секций роста органов единичного устройства «орган-на-чипе» (1), предпочтительным является обеспечение одного резервуара для сброса среды (5) для сбрасываемой среды из каждой секции роста органов, или, предпочтительно, для каждой полости для органов (4, 4а, 4b) во избежание смешивания сбрасываемой среды. Также предпочтительно, чтобы все имеющие одинаковые микроструктуры полости для органов внутри каждой секции роста органов (3), или внутри различных секций роста органов (3), соединялись с одной сбрасываемой средой во избежание смешивания сброса из различных органов или органоидов. В предпочтительном варианте осуществления, где каждая полость для органов (4, 4а, 4b) секций роста органов (3) соединена с отдельным резервуаром для сброса (5), возможен отбор образца или всей сбрасываемой среды из отдельных резервуаров для сброса среды (5) и дальнейший анализ по отдельности каждой из сред, сбрасываемых из каждого органа и/или органоида. Полость резервуара для сброса среды (5) предпочтительно располагается в слое среды (12), который не показан. В предпочтительном варианте осуществления, изображенном на этой фигуре, предусматривается соответствующее прямоугольное отверстие в верхнем закрывающем слое (14) и слое полостей для органов (15). Поэтому в данном варианте резервуар для сброса среды (5) проходит почти через все автономное устройство «орган-на-чипе» (1) между нижней частью нижнего закрывающего слоя (16) и верхним краем слоя среды (12), таким образом, обеспечивая максимальное пространство для хранения сбрасываемой среды.
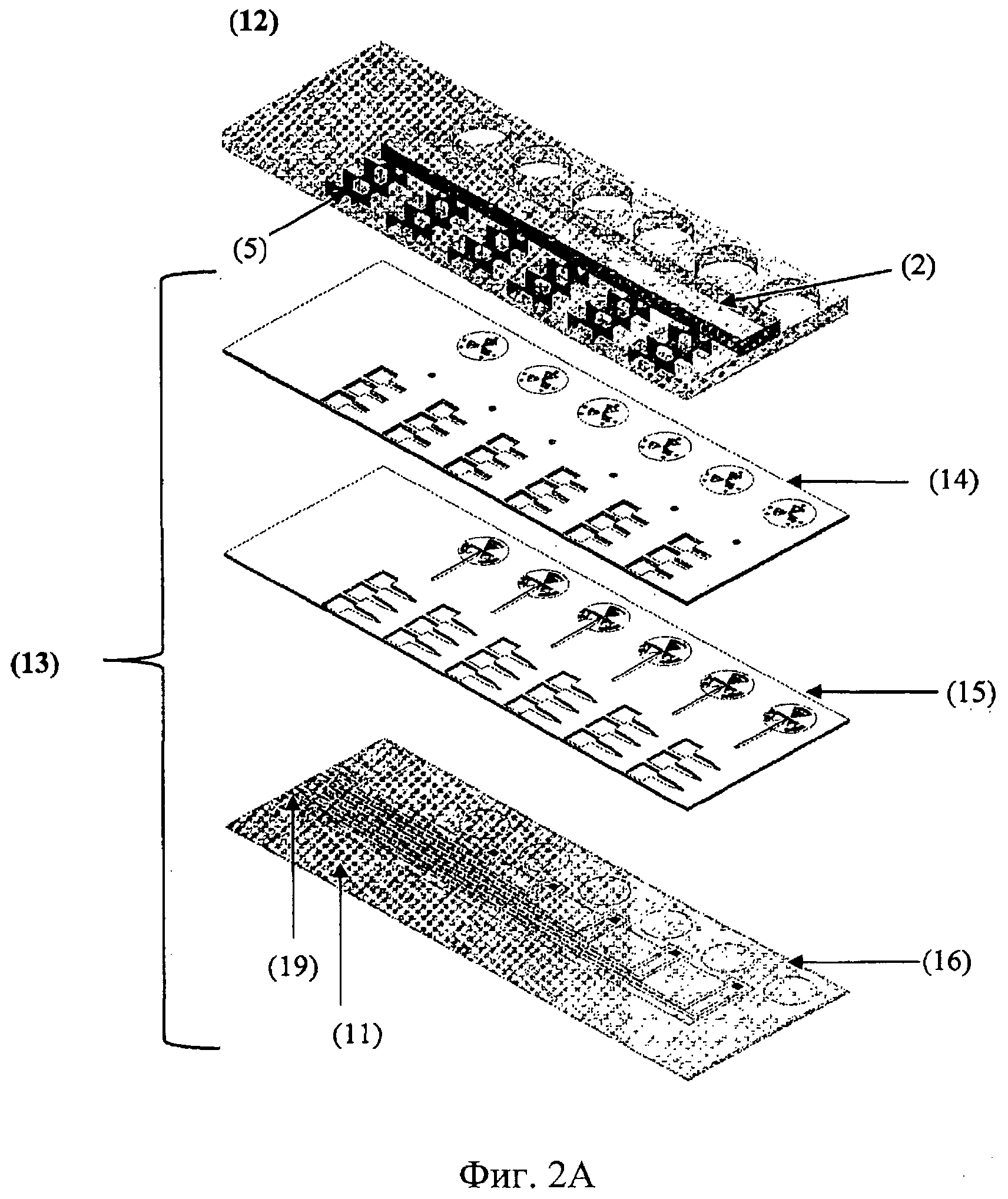
Фиг.2А: Покомпонентное изображение предпочтительного варианта осуществления автономного устройства «орган-на-чипе» (1), содержащего слой среды (12), слой секций роста органов (13), содержащий верхний закрывающий слой (14), слой полостей для органов (15) и нижний закрывающий слой (16). Слой среды (12) включает вырезы, которые позволяют осуществлять доступ к секциям роста органов (3), располагающимся в слое секций роста органов (15) между верхним и нижним закрывающими слоями. Указанные вырезы предпочтительно соответствуют по размеру расположенным ниже вырезам на соответствующей секции роста органов (3) для осуществления доступа к каждой полости для органов (4, 4а, 4b) внутри секции роста органов (3). Предпочтительно, клеточная популяция, предпочтительно, суспензия клеток и/или срез ткани, используемые для создания соответствующего органа или органоида, загружается непосредственно в полость для органов (4, 4а, 4b) через указанные вырезы, которые затем герметизируются во избежание загрязнения загруженных клеточных популяций. Указанное уплотнение предпочтительно является непроницаемым для жидкостей, однако является газопроницаемым. В альтернативном варианте осуществления, вся клеточная популяция генерируется из одной или нескольких стволовых клеток, которые могут вноситься в секцию роста органов через микрожидкостный канал подачи (6) вместе со средой, и/или через дополнительный порт доступа непосредственно в полость для стволовых клеток (9). Кроме того, внутри слоя среды (12) находится резервуар для подачи среды (2). Этот резервуар предпочтительно снабжается портом доступа, позволяющим заполнять резервуар для подачи среды (2) необходимыми средами, или слой среды (12) снабжается предварительно заполненным резервуаром для подачи среды, который может обеспечиваться отверстием, позволяющим воздуху попадать в резервуар для подачи среды. Для гибкости слой среды (12), содержащий заранее заполненный резервуар для подачи среды (2), может соединяться в месте применения со слоем секций роста органов (13) для образования автономного устройства «орган-на-чипе» (1), или полностью собранное автономное устройство «орган-на-чипе» может предусматриваться как с предварительно заполненным резервуаром для подачи среды (2), так и с пустым резервуаром для подачи среды (2), который заполняется в месте применения. Кроме того, слой среды (12) содержит один или несколько резервуаров для сброса среды (5). Они находятся в жидкостном соединении с секцией роста органов (3) и, в частности, с содержащимися в ней полостями для органов (4, 4а, 4b). Предпочтительно, чтобы датчик (8, 8а, 8b) находился в протоке (7, 7а, 7b), соединяющем отдельные полости для органов с резервуаром (резервуарами) для сброса среды (5), предпочтительно расположенным (расположенными) внутри автономного устройства «орган-на-чипе» (1). В предпочтительном варианте, изображенном на этой фигуре, предусматривается вырез одинаковой формы и размерами в верхнем закрывающем слое, слое полостей для органов и слое среды для образования резервуара для сброса среды (5). Нижний закрывающий слой (16) оснащается электрическими соединителями (19), которые обеспечивают (1) подачу электроэнергии к средствам нагрева (11), которые могут располагаться в нижних частях полостей для органов (4, 4а, 4b), в резервуаре для подачи среды (2) или в любой другой части нижнего закрывающего слоя; и/или (ii) для соединения с сенсорными устройствами и/или приводами (средствами повышения давления, насосами, датчиками температуры и т.д.), которые предпочтительно располагаются внутри полостей для органов (4, 4а, 4b) или могут располагаться в любой другой части нижнего закрывающего слоя; и/или (iii) для соединения с датчиками (8, 8а, 8b).
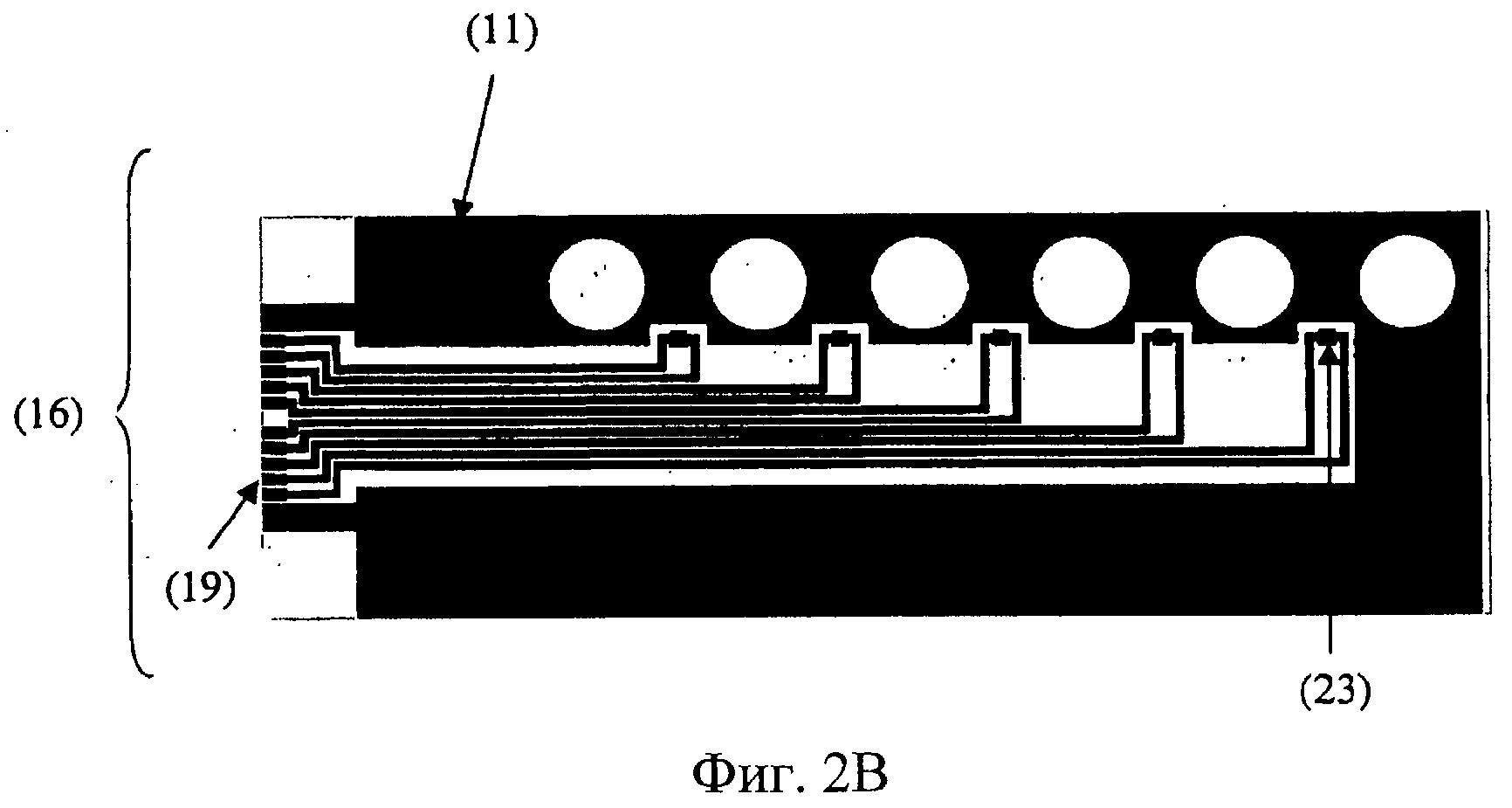
Фиг.2В. Вид сверху вниз верхней стороны нижнего закрывающего слоя (16). Изображены средства нагрева (11), которые предпочтительно изготавливаются из оксида индия и олова (ITO), датчик температуры (23), который предпочтительно представляет собой извилистую конструкцию, изготавливаемую из платины, и электрические соединители (19), которые предпочтительно изготавливаются из золота. Проводящие дорожки также изготавливаются из золота. Нижний закрывающий слой (16) предпочтительно изготавливается из стекла и является прозрачным, по меньшей мере, в областях секций роста органов (3) для осуществления просвечивающейся микроскопии. Нижний закрывающий слой (16) предпочтительно снабжается датчиками температуры для контроля температуры внутри секций роста органов (3).
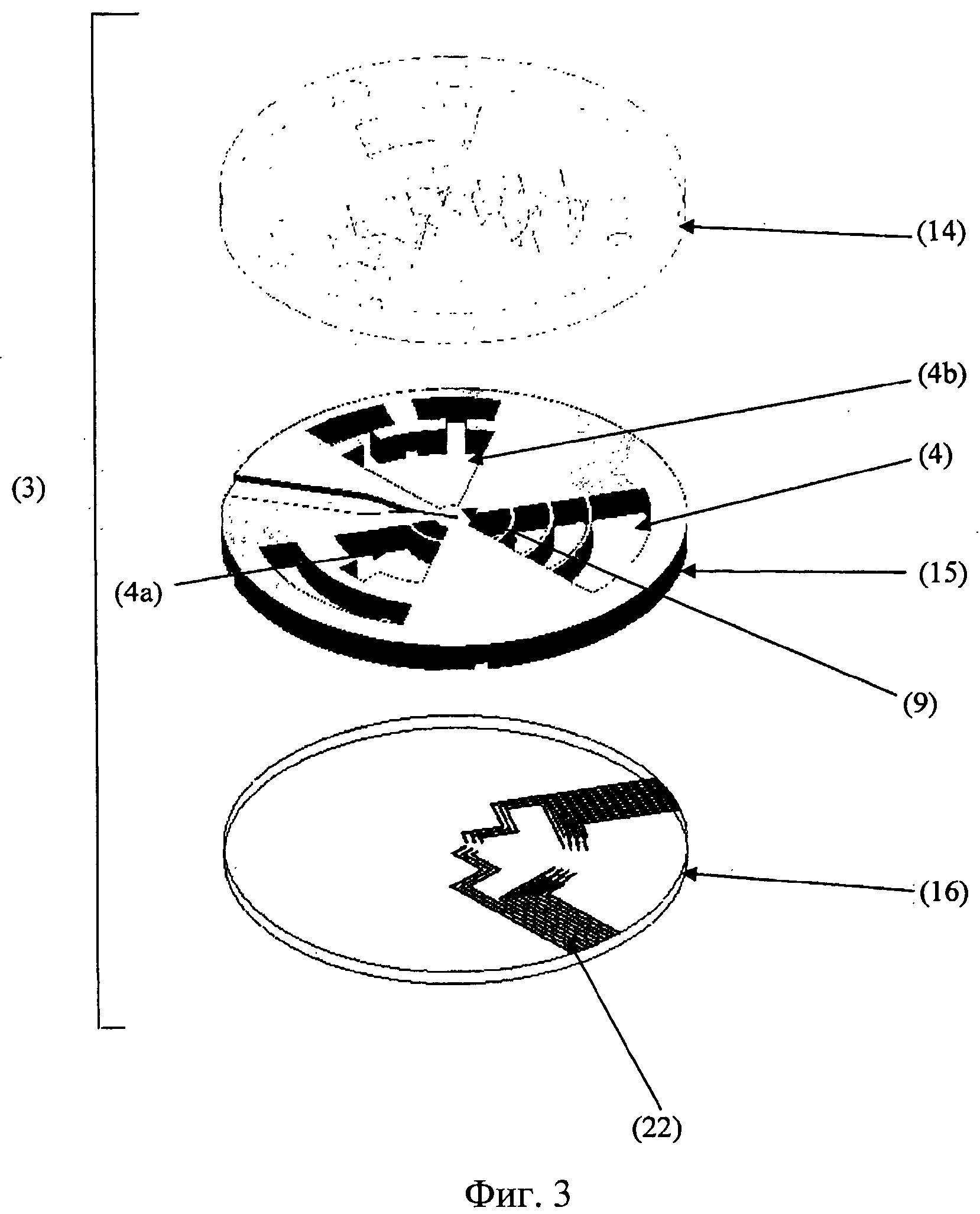
Фиг.3. Покомпонентный вид предпочтительного варианта осуществления секции роста органов (3), содержащей три полости для органов (4, 4а, 4b). В этом предпочтительном варианте каждая из полостей для органов (4, 4а, 4b) закрыта или, по меньшей мере, частично закрыта с верхней стороны верхним закрывающим слоем (14), который включает микроструктуры, слоем полостей для органов (15), который предусматривает большинство необходимых микроструктур, и нижним закрывающим слоем (16), который предусматривает, например, средства измерения полного сопротивления (22), необходимые для оценки полного сопротивления в полости органа, адаптированной для роста нервов.
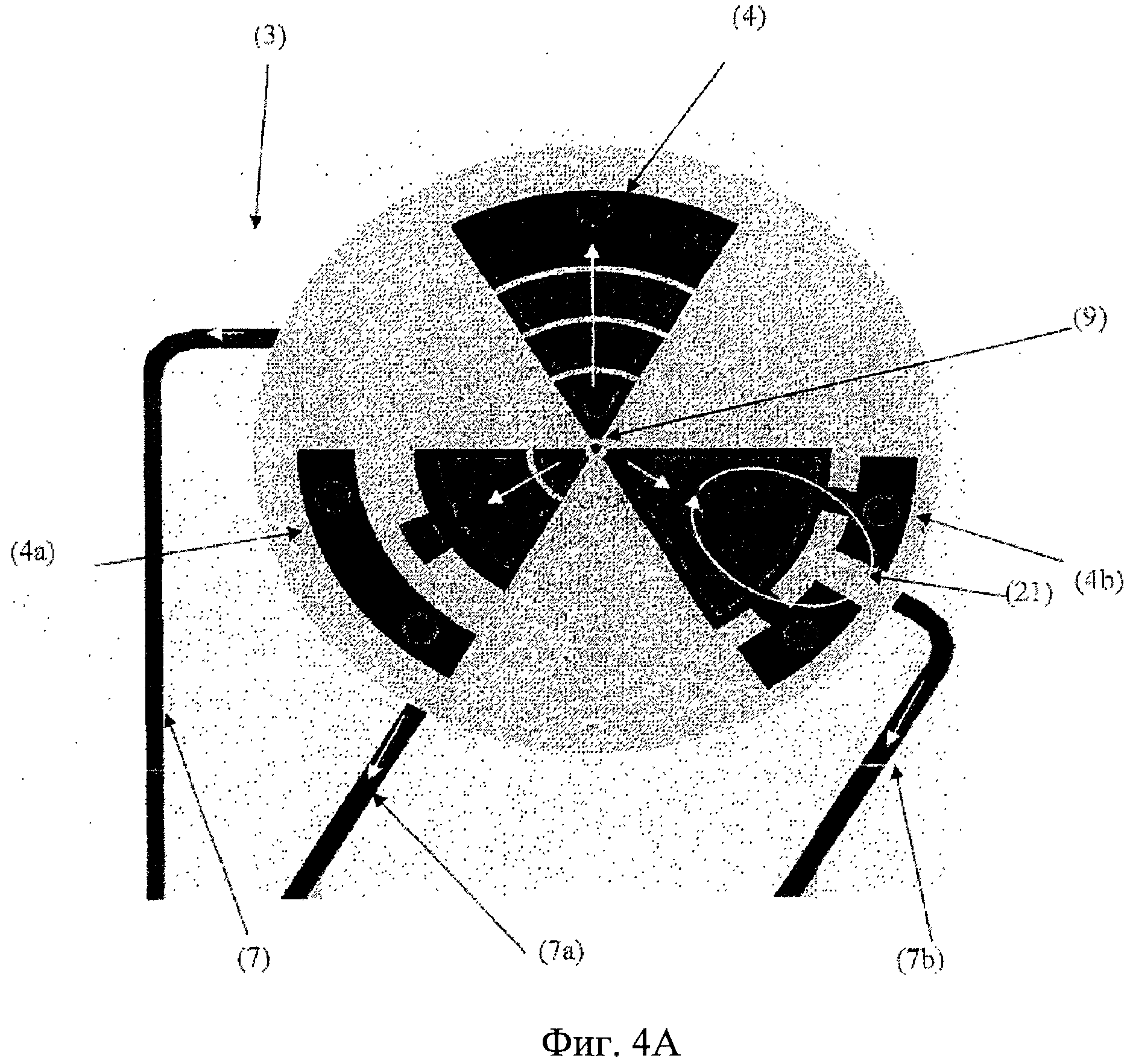
Фиг.4А. Вид сверху вниз на секцию согласно предпочтительному варианту осуществления слоя полостей для органов (15), содержащего секцию роста органов (3), содержащую три полости для органов (4, 4а, 4b) с разной структурой. Течение среды внутри секции роста органов (3) в полости для органов (4, 4а, 4b) начинается от выпуска (10) микрожидкостного канала подачи (не показан, поскольку в данном варианте находится на верхнем закрывающем слое), находящегося рядом с полостью для стволовых клеток (9), в полости для органов (4, 4а, 4b) и наружу через три отдельных микрожидкостных канала сброса (7, 7а, 7b). Направление течения жидкости показано прямыми белыми стрелками. Течение в полостях для органов предпочтительно происходит радиально наружу от выпуска среды в середине секции роста в направлении впусков каналов сброса (7, 7а, 7b) на периферии секции роста. В полости роста (4b), которая обеспечивает среду для создания/поддержания васкуляризированной кожи, под действием средств повышения давления или насосов, расположенных в боковых камерах полости для органа (4b) возникает вторичный поток жидкости (21).
Фиг.4В. Трехмерное изображение части секции роста органов (3), содержащей три полости для органов (4, 4а, 4b), где в предпочтительном варианте осуществления полость для зрелых стволовых клеток (9) располагается в центре трех полостей для органов (4, 4а, 4b).
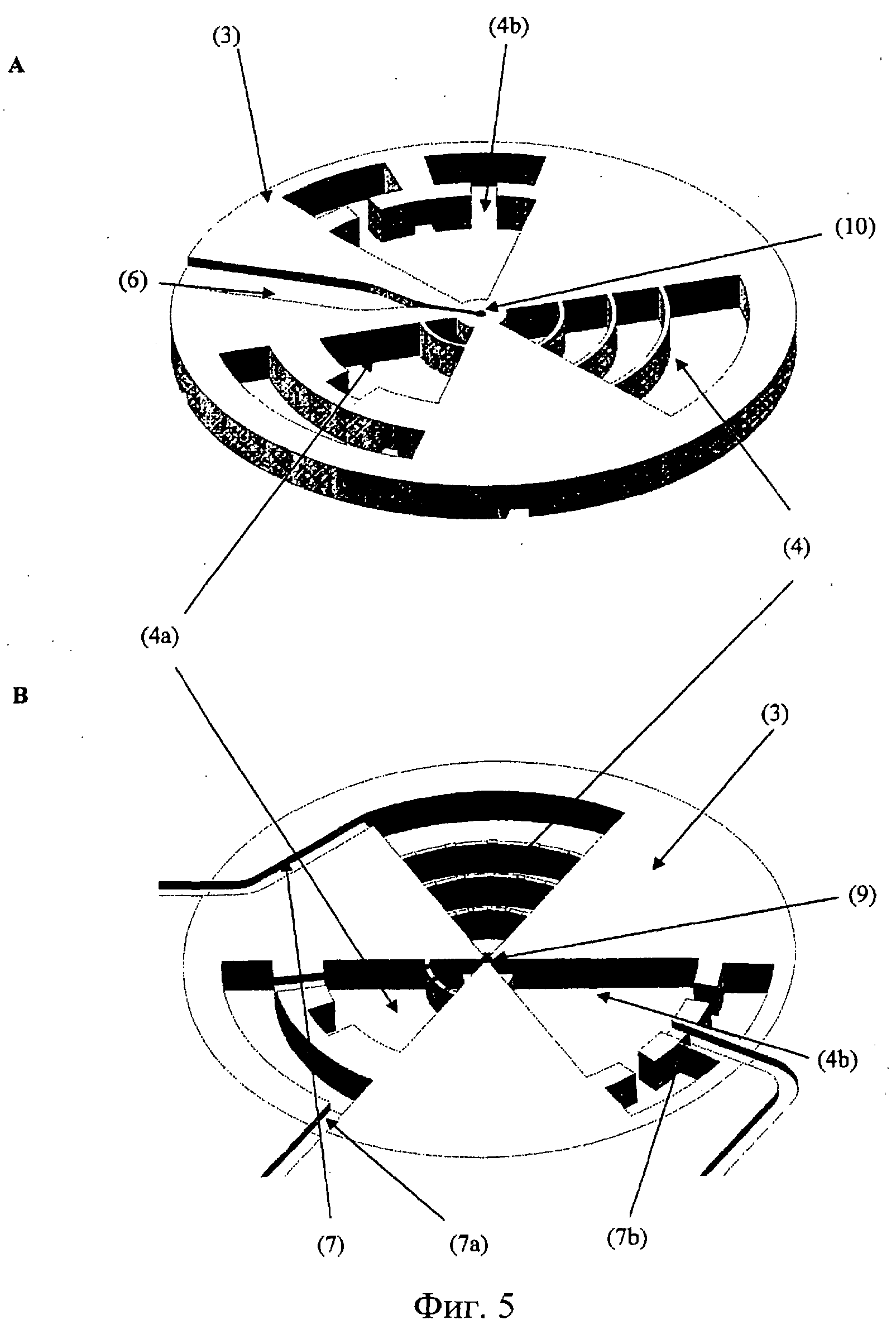
Фиг.5. Вид сверху (А) и снизу (В) секции предпочтительного слоя полостей для органов (15), содержащего средний сегмент секции роста органов (3), содержащей три полости для органов (4, 4а, 4b). Верхнее уплотнение и нижнее уплотнение полостей для органов (4, 4а, 4b), обеспечиваемые соответственно верхним и нижним закрывающими слоями, которые не показаны. Панель А отображает микрожидкостный канал подачи (6), который заканчивается выпуском (10). Панель В отображает полость для стволовых клеток (9), которая расположена напротив выпуска (10).
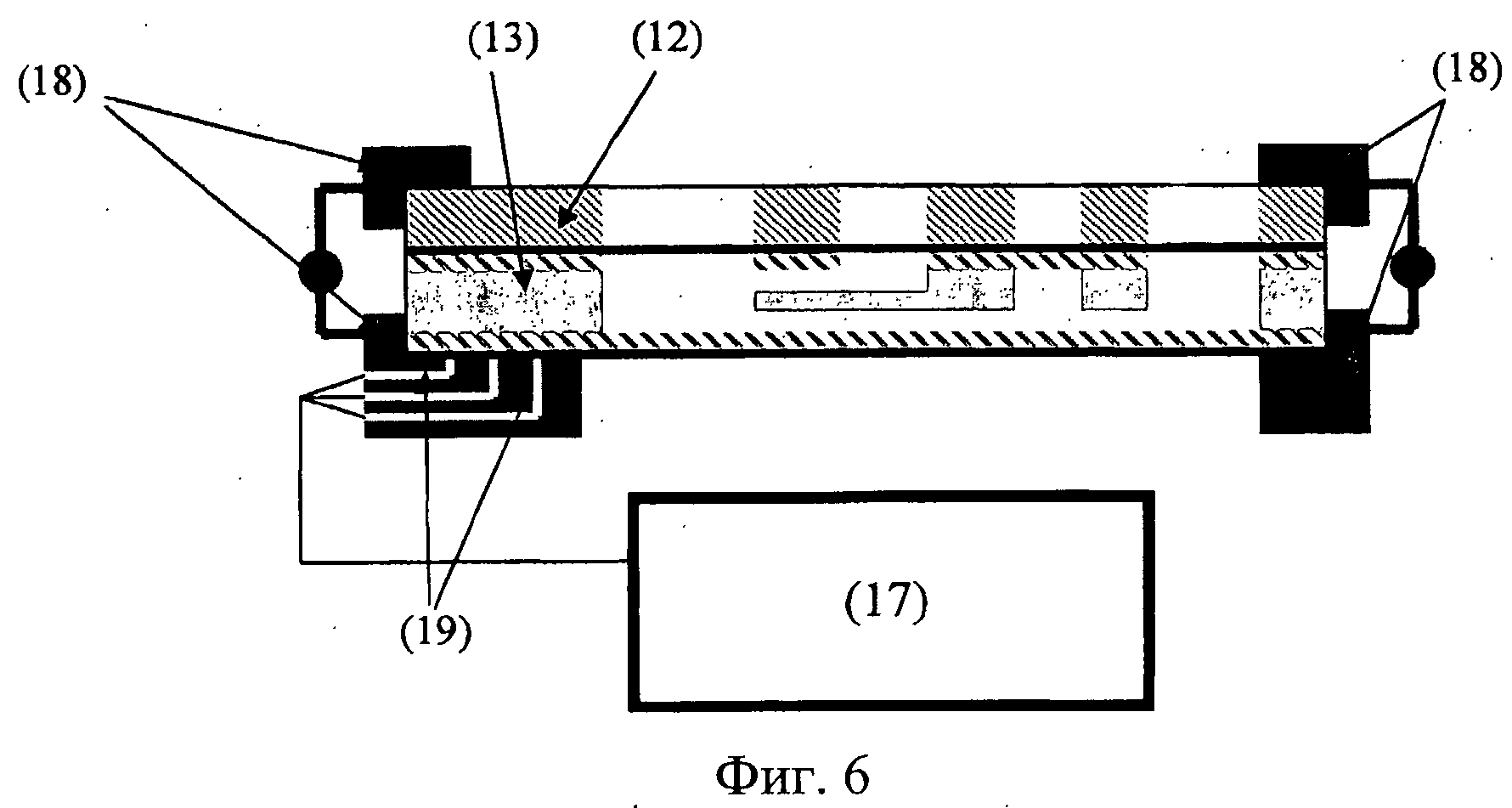
Фиг.6. Вид в разрезе предпочтительного варианта осуществления автономного устройства «орган-на-чипе» (1). Отображен слой среды (12) и слой секций роста органов (13), которые удерживаются на месте средствами крепления (18), которые также предоставляют, по меньшей мере, одну контактную поверхность, содержащую электрические соединители (19), которые съемным образом соединяются с соответствующими соединителями на нижней стороне автономного устройства «орган-на-чипе» (1). Блок питания (17) обеспечивает подачу электроэнергии, например, для нагревания, нагнетания и/или электростимуляции, и предпочтительно содержит блок обработки данных, предназначенный для оценки и/или индикации сигналов от одного или нескольких датчиков.
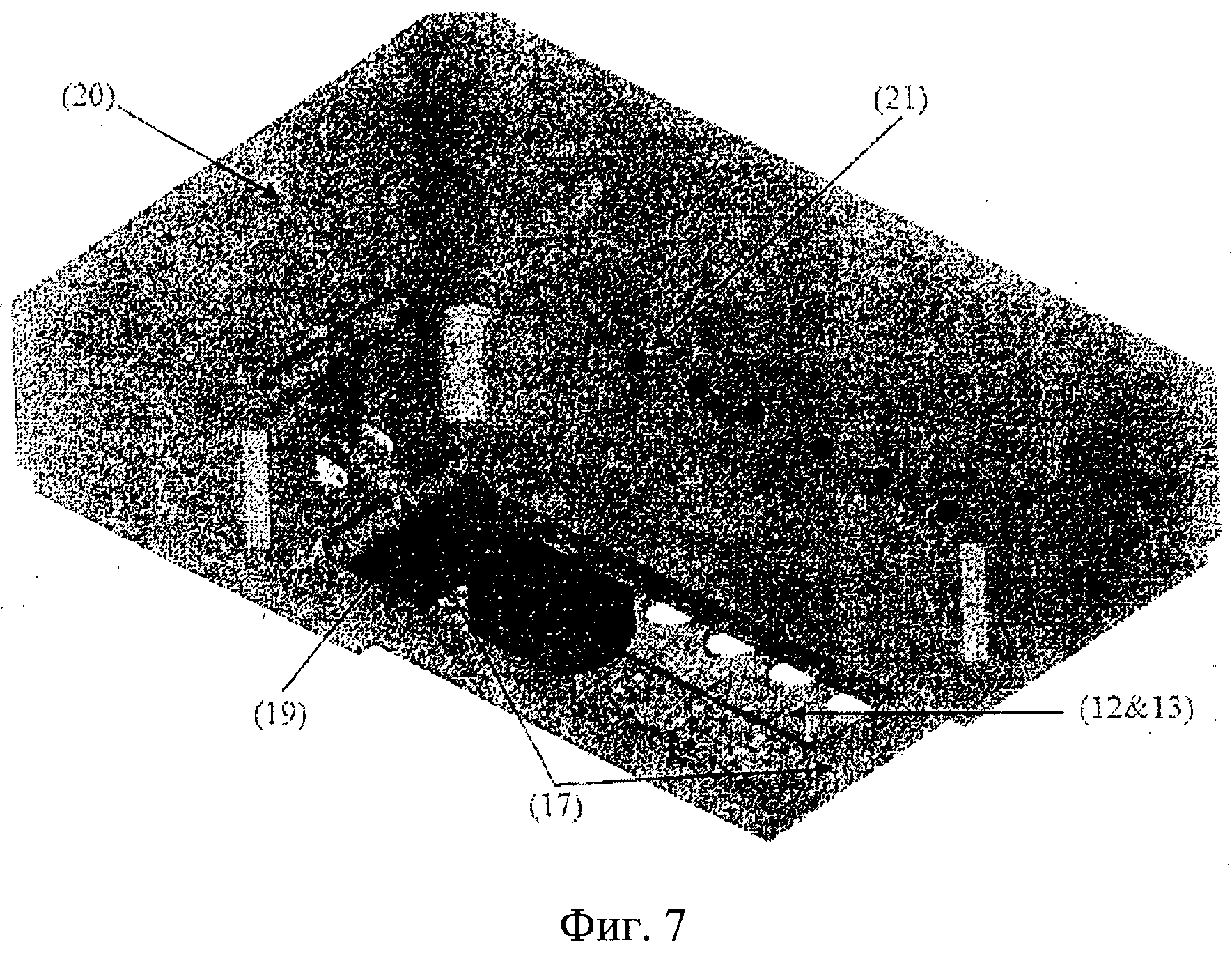
Фиг.7. Трехмерное изображение предпочтительного варианта осуществления интегрированного блока питания (17), содержащего средства крепления (18) на обеих сторонах автономного устройства «орган-на-чипе» (1). Электрические соединители (19) соединяют автономное устройство «орган-на-чипе» (1) с блоком питания (17) и средствами индикации перегрева (20), указывающими на избыточное количество тепла в соответствующих секциях роста органов (3).
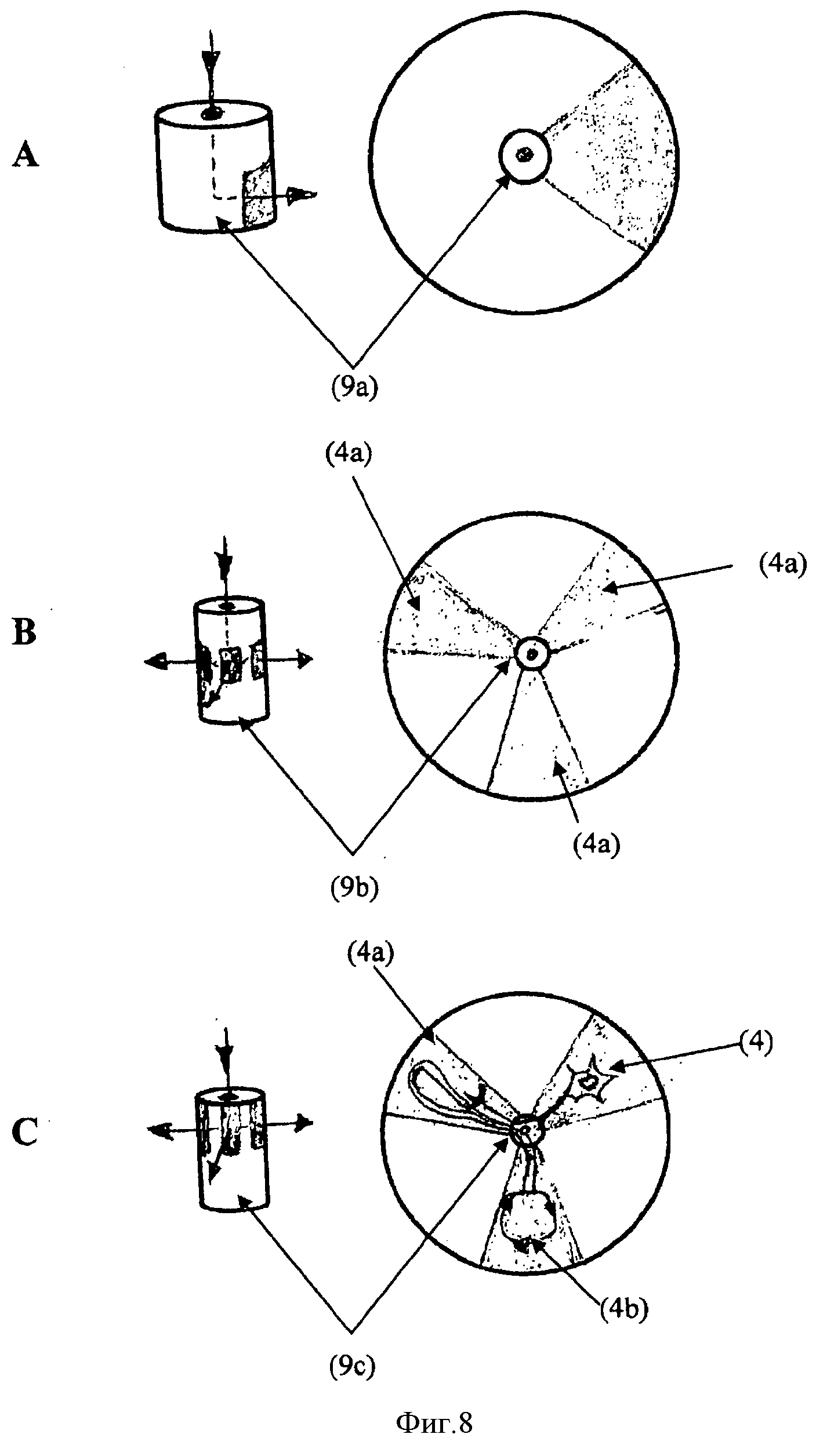
Фиг.8. Каждая из трех панелей А, В и С на Фиг.8 показывает трехмерное изображение и сечение различных полостей для стволовых клеток (9). Панель А показывает иллюстративную полость ниши неонатальных стволовых клеток (9а); Панель В показывает иллюстративную полость ниши пре-/постнатальных стволовых клеток (9b); и панель С показывает иллюстративную полость способствующей состоянию покоя ниши взрослых стволовых клеток (9с).
Подробное описание изобретения
Перед тем как настоящее изобретение ниже будет описано более подробно, следует понять, что данное изобретение не ограничивается конкретными описанными здесь методикой, протоколами или реактивами, поскольку они могут изменяться. Следует также понимать, что используемая в данном описании терминология преследует цель описания лишь конкретных вариантов осуществления изобретения и не предназначена для ограничения объема настоящего изобретения, который ограничивается только приложенной формулой изобретения. Если не определено обратное, все технические и специфические термины, используемые в данном описании, обладают теми же значениями, что и в обычном понимании специалистов в данной области.
Используемые в данном описании термины предпочтительно определены как описано в словаре "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", Leuenberger, H.G.W, Nagel, B. and Kölbl, H. eds. (1995), Helvetica Chimica Acta, CH-4010 Basel, Switzerland).
Везде в данном описании и следующей за ним формуле изобретения, за исключением тех случаев, когда контекст требует обратного, слово «содержать», а также его разновидности, такие как «содержит» и «содержащий», следует понимать как подразумевающее включение определенного целого или этапа, или группы целых или этапов, но не исключение любого другого целого или этапа, или группы целых или этапов. В нижеследующих абзацах различные аспекты изобретения определены более детально. Каждый аспект, определенный таким образом, может комбинироваться с любым другим аспектом или аспектами, если ясно не указывается на обратное. В частности, любая особенность, указанная как предпочтительная или преимущественная, может комбинироваться с любой другой особенностью или особенностями, указанными как предпочтительные или преимущественные.
В тексте настоящего описания цитируется несколько документов. Каждый из процитированных здесь документов (включая патенты, заявки на патенты, научные публикации, технические описания производителей, инструкции и т.д.), как выше, так и ниже, ссылкой полностью включаются в настоящее описание. Ничто здесь не следует истолковывать как допущение того, что данное изобретение не имеет права противопоставлять данное описание более раннему приоритету на основании предшествующих изобретений.
Ниже приводятся некоторые определения терминов, часто используемых в настоящем описании. Эти термины в каждом случае их использования в оставшейся части настоящего описания имеют должным образом определенное значение и предпочтительные значения:
«Аутокринные факторы» - это все те вещества, секретируемые клетками, которые поддерживают и являются посредниками в поддержании, росте и дифференцировке той же клетки, которая секретирует этот фактор.
«Паракринные факторы» - это все вещества, секретируемые клетками, которые поддерживают и являются посредниками в поддержании, росте и дифференцировке другой, но соседней клетки.
Термин «самообучение» описывает все факторы, ведущие к усовершенствованному поведению клеток.
Термин «дифференцировка» означает развитие тканеспецифических функций культивированных клеток.
Термин «поддержание» описывает способность поддерживать все функции данной ткани постоянными в процессе культивирования данной клеточной культуры.
Термин «живой клеточный материал» описывает клетки, клеточные агрегаты, ткани, органоиды и органы.
Термин «клетки» означает клеточные линии или эмбриональные клетки позвоночных или беспозвоночных.
Термин «ткань» означает биопсийный материал или эксплантат, взятый у пациентов или животных.
Термин «органоиды» означает искусственные, вновь генерированные, функциональные клеточные агрегаты клеток различных типов in vitro, которые проявляют, по меньшей мере, одну функцию органа или ткани, а предпочтительно проявляют большинство функций органа или ткани.
Термин «орган» означает искусственные, вновь генерированные, функциональные клеточные агрегаты клеток различных типов in vitro, которые проявляют все функции натурального органа.
Термин «среда» (множественное число: «среды») означает поддерживающую рост жидкость, содержащую питательные и другие вещества для культивирования клеток.
Термин «добавки» описывает вещества, которые необходимо добавить к культуральным средам с целью индукции или модификации клеточной функции, которые могут иметь определенный состав, как, например, очищенные или рекомбинантные цитокины или факторы роста, или неопределенный состав, как, например, сыворотка.
Термин «матрикс» обозначает вещества или смеси веществ, которые усиливают пролиферацию, дифференцировку, функционирование или формирование органа или органоида клеток. Материал матрикса может наноситься на поверхности или обеспечиваться в объемных приложениях для оптимизации прикрепления клеток или образования трехмерных культур. Матрикс, применимый в контексте настоящего изобретения, может принимать множество форм, включая, например, гидрогели, пены, тканые или нетканые материалы. Материал матрикса может включать вещества матрикса, имеющие природное происхождение, такие как белки внеклеточного матрикса, предпочтительно коллагены, ламинины, эластин, витронектин, фибронектин, малые белки клеточного матрикса, малые интегрин-связывающие гликопротеины, факторы роста или протеогликаны, или может включать искусственные вещества матрикса, такие как нерасщепляемые полимеры, например, полиамидные волокна, метилцеллюлоза, агароза или альгинатные гели, или расщепляемые полимеры, такие как полилактид.
Термин «микрожидкостный» относится к поведению, точному управлению и манипуляциям с жидкостями, которые геометрически ограничены малым, как правило, субмиллиметровым, масштабом. Термин «микрожидкостный» означает один или несколько следующих вариантов: (i) малые объемы (мкл, нл, пл или фл), т.е. полости для органов предпочтительно имеют объем 1 мм3 или менее, а микрожидкостные каналы допускают течение 0,1-2 мм3 среды в день под давлением 0,005-2 Бар, т.е. 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 1,0, 1,5, или 2,0 Бар, и (ii) малый размер, т.е. диаметр канала от около 100 нанометров до нескольких сотен микрометров. В контексте настоящего изобретения, микрожидкостный канал предпочтительно имеет диаметр между 100 нм и 1 мм, предпочтительно, 0,5-200 мкм, более предпочтительно, 1-100 мкм, т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 мкм. Если отверстие канала не имеет круглого поперечного сечения, тогда отверстие предпочтительно имеет площадь поверхности, находящуюся в пределах и предпочтительных пределах площадей поверхности для каналов с указанными выше круглыми поперечными сечениями.
Для преодоления трудностей, связанных с известными системами культивирования клеток, настоящее изобретение обеспечивает автономное устройство «орган-на-чипе» (1), содержащее:
(a) по меньшей мере, один резервуар для подачи среды (2),
(b) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
где резервуар для подачи среды (2) соединяется, по меньшей мере, с одной секцией роста органов (3) микрожидкостным каналом подачи (6).
Термин «автономный» относится к тому факту, что среды и добавки, необходимые для дифференцировки и поддержания органов, тканей или органоидов, по меньшей мере, в одной секции роста органов (3), доставляются из устройства «орган-на-чипе» (1), т.е., по меньшей мере, один резервуар для среды (2) содержится в устройстве «орган-на-чипе» (1) и соединяется посредством микрожидкостных каналов (6) внутри устройства «орган-на-чипе» (1) с секцией роста органов (3) и/или с одной или несколькими полостями органов (4, 4а, 4b), которые содержатся внутри одной или нескольких секций роста органов (3). Таким образом, жидкостное соединение, доставляющее жидкость из внешнего резервуара для жидкостей, отсутствует. Соответственно, устройство «орган-на-чипе» (1) может быть подвергнуто манипуляциям и перемещению без возникновения опасности загрязнения среды, а затем и клеток в секциях роста органов (3). Кроме того, предпочтительной является доставка газообразной среды, например О2/СО2, в секцию роста органов пассивным образом, т.е путем диффузии в среду через мембрану или биосовместимую полимерную пленку из окружающей среды. Такая мембрана или полимерная пленка предпочтительно является непроницаемой для жидкостей. Опять таки это является предпочтительным является при выполнении манипуляций с устройством «орган-на-чипе». Мембрана или пленка, по меньшей мере, частично покрывает секцию роста органов (3), таким образом, позволяя О2/СО2 диффундировать в среду, которая течет через полости для органов. В предпочтительном варианте осуществления мембрана формируется или прикрепляется после загрузки клеток в полости для органов, или составляет неотъемлемую часть устройства «орган-на-чипе». Соответственно, в предпочтительном варианте осуществления устройство «орган-на-чипе» не содержит соединителей с внешними источниками газообразной среды, и/или не содержит устройств для активного аэрирования среды. Среда предпочтительно повторно не проходит через секцию роста органов (3), а течет от одного или нескольких резервуаров со средой (2) через секции роста органов (3) в один или несколько резервуаров для сброса среды (5).
Термин «устройство «орган-на-чипе» относится к блоку, который предпочтительно изготовлен из нескольких индивидуально структурированных и микроструктурированных слоев, находящихся в непроницаемом для жидкостей соединении друг с другом, и предпочтительно способен обеспечить непроницаемое для жидкости окружение, и, таким образом, стерильные условия. Устройство предпочтительно имеет размеры для использования в стандартных высокопроизводительных установках систем бесперебойного электропитания, например, имеющих размеры стандартного титрационного микропланшета или полоски. Таким образом, его ширина составляет 2-10 см, предпочтительно, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 см, и/или длина составляет 3-15 см, предпочтительно, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 см, и/или высота составляет 0,2-10 мм, предпочтительно, 1-4 мм, т.е. 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 5,0, 6,0, 7,0. 8,0, 9,0 или 10,0 мм. Для соответствия формату стандартного титрационного микропланшета, отношение ширины к длине предпочтительно составляет 1:3. Особенно предпочтительны размеры: ширина - 2,5 см, длина - 7,5 см, высота - 3 мм.
Предпочтительные материалы включают SiO2, стекло и синтетические полимеры. Предпочтительные синтетические полимеры включают полистирол (PS), поликарбонат (PC), полиамид (РА), полиимид (PI), полиэфирэфиркетон (PEEK), полифениленсульфид (PPSE), эпоксидная смола (ЕР), ненасыщенный полиэфир (UP), феноловая смола (PF), полисилоксан, например, полидиметилисилоксан (PDMS), меламиновая смола (MF), сложный эфир цианата (СА), политетрафторэтилен (PTFE) и их смеси. Особенно предпочтительны синтетические полимеры, которые оптически прозрачны и включают, например, полистирол (PS), поликарбонат (PC) и полисилоксан, полидиметилсилоксан (PDMS).
Секция роста органов (3) представляет собой микроструктурированную область внутри устройства «орган-на-чипе» (1), которая предусматривает все необходимое микроокружение для дифференцировки и/или поддержания органа и/или органоида, и предпочтительно содержит впуск среды, выпуск среды, полость для стволовых клеток (см. ниже), датчики (см. ниже) и полость для органов (4) (см. ниже), которая удерживает большую часть клеток, образующих соответствующий органоид или орган, и/или открытую поверхность, которая может покрываться, в значительной степени, непроницаемым для жидкостей и газопроницаемым образом соответствующими средствами, включающими мембрану, например, мембрану из PTFE, фибриновые пластины, пластины из напыляемого пластыря и/или продуктов коагуляции, после загрузки клеток/тканей в секцию роста органов (3), или эластичными пластинами, которые покрывают отверстие, например, губами, изготовленными из эластичного материала типа полисилоксана, например PDMS. В предпочтительном варианте осуществления указанная эластичная пластина полностью накрывает секцию роста органов и имеет вырезы в каждой из полостей для органов (4, 4а, 4b), при этом вырезы позволяют осуществлять доступ к отдельным полостям для органов (4, 4а, 4b). Эластичные пластины обладают тем преимуществом, что секции роста органов (3) остаются доступными без необходимости повторной герметизации мембраны после осуществления доступа. Покрытая поверхность предпочтительно непроницаема для жидкостей, однако при этом газопроницаема и, таким образом, допускает обмен О2 и СO2 между клетками в секции роста органов и окружающей средой. Секция роста органов предпочтительно имеет практически круглую или круглую форму, что является благоприятным в случае, когда секция роста органов содержит более одной полости для органов. В этом предпочтительном варианте осуществления секция роста органов в значительной степени имеет форму плоского цилиндра, который, однако, не является полностью полым, но содержит структуры и микроструктуры, описываемые в настоящем описании. Отношение диаметра к высоте секции роста органов предпочтительно составляет 2:1-6:1, более предпочтительно, 3:1-5:1. В частности, если секция включает две, три, четыре, пять, шесть, семь, восемь или большее количество полостей для органов (4, 4а, 4b), более предпочтительна круглая структура, поскольку тогда возможна подача среды через микрожидкостный канал подачи (6), имеющий выпуск (10) в центре круга. Затем среда распределяется между полостями для органов (4, 4а, 4b), каждая из которых имеет форму сегмента круга, а в трехмерном изображении имеет форму сегмента цилиндра. Площадь поверхности секции роста предпочтительно составляет 0,1-3 см2, предпочтительно, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0 см2, особенно предпочтительные секции роста имеют площадь поверхности 0,3-0,7 см, предпочтительно, 0,56 см2. Если секция роста имеет круглую форму, предпочтительный ее диаметр составляет 0,1-1 см, предпочтительно, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0, наиболее предпочтительно, 0,6 см. Как правило, устройство «орган-на-чипе» содержит более одной секции роста органов (3). Принимая во внимание указанные предпочтительные размеры каждой секции роста органов (3), становится возможным разместить большее количество отдельных секций роста органов на одном устройстве «орган-на-чипе». Устройство «орган-на-чипе» предпочтительно содержит 3-2000 секций роста органов (3), предпочтительно, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 24, 30, 36, 48, 60, 72, 84, 96, 108, 120, 132, 144, 156, 168, 180, 192, 204, 216, 228, 240 или большее количество секций. В предпочтительном формате титрационного микропланшета в прямоугольной матрице 2:3 устройства «орган-на-чипе» размещается 6, 24, 96, 384 или даже 1536 секций роста органов (3).
Как изложено выше, секция роста органов (3) содержит полость, обозначаемую термином «полость для органов», которая удерживает большую часть клеток, т.е., по меньшей мере, 80%, предпочтительно, 85%, 90%, 95%, 98% или больше количество клеток, заключенных в секции роста органов. Полость для органов (4, 4а, 4b) предпочтительно имеет размер, форму и содержание питательных веществ для каждого конкретного органа и обеспечивает доступ для введения дополнительных необходимых элементов микроархитектуры и микросреды, а также для загрузки, в зависимости от обстоятельств, клеточной суспензии, клеточных кластеров и/или срезов тканей в устройство «орган-на-чипе», и покрыта соответствующими материалами для притяжения/поддержания клеток конкретного типа, как более подробно описано ниже. Кроме того, полость для органов, которая фактически может подразделяться на несколько «подполостей», что может быть необходимо для симуляции корректного окружения для ткани или органа конкретного типа, может оснащаться датчиками, микроприводами и т.д., как более подробно будет разъяснено ниже. Каждая полость для органов внутри каждой секции роста органов предпочтительно обеспечивает соответствующую микросреду для разных органов и/или органоидов, например, для нейронов, сердечной ткани, хрящей, костей и/или васкуляризированной кожи. Таким образом, можно одновременно оценивать влияние одного конкретного соединения на несколько тканей, органоидов и/или органов. В альтернативном варианте, одна секция роста органов может содержать две или большее количество полостей для органов одного типа, которые позволяют измерять влияние данного соединения с большей статистической значимостью путем усреднения результатов, полученных параллельно из двух, трех, четырех или большего количества полостей. Кроме того, одна секция роста органов может содержать одну полость для органов, содержащую клетки, относящиеся к конкретному клеточному типу, которые могут служить в качестве стандарта для каждого измерения. Как правило, полость для органов внутри секции роста органов имеет объем от 1×102 до 0,01 мм3, предпочтительнее, 100, 90, 80, 70, 60, 50, 40, 30, 20, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2, 0,1, 0,09, 0,08, 0,07, 0,06 и 0,05 мм3, предпочтительно, 1 мм3. Каждая полость для органов внутри данной секции роста органов предпочтительно имеет близкий, например±20%, или одинаковый объем. Если секция роста содержит две или более полостей для органов (4, 4а, 4b), они предпочтительно располагаются радиально относительно выпуска (10) микрожидкостного канала подачи (6). В этом предпочтительном варианте полости для органов (4, 4а, 4b) предпочтительно размещаются в форме конических сегментов диска, где диск - это секция роста органов (3).
Предпочтительно, полость для органов дополнительно структурирована путем подразделения на две, три, четыре или большее количество полостей, содержащих или состоящих из главной полости и одной или двух боковых полостей, находящихся друг с другом в жидкостном соединении. Предпочтительно, она содержит структурированную внутреннюю поверхность, снабженную гребнями, каналами, воронками для разграничения окружения, пригодного для поддержания роста и поддержания соответствующего требуемого органоида и/или органа. Так, полости для органов (4, 4а, 4b) внутри секции роста органов (3) предоставляют пространство для самосборки, поддержания и/или повторной сборки мельчайших функционально самодостаточных элементов конкретного органа (например, альвеол легкого, эпидермиса и дермы кожи, слизистой оболочки кишечника, долек печени или нефронов почек) или конкретной системы (например, микроциркуляторной части кровеносной системы, серого вещества нервной системы). Элементарными природными строительными блоками для направленной сборки органа in vivo, которые имитируются в предлагаемом устройстве «орган-на-чипе», являются размеры, форма, характеристики питательных свойств, микроархитектура (например, внеклеточные матриксы и мембраны, а также свойства поверхностей) и локальное микроокружение (например, градиенты морфогенов и хемокинов). Секция органов предпочтительно содержит комбинацию полостей для органов со структурами, поддерживающими рост следующих комбинаций органов: дольки печени и эпидермис и дерма кожи, предпочтительно содержащие волосяной мешочек и, необязательно, содержащие микроциркуляторную часть, соединяющую обе полости для органов.
Предпочтительные полости для органов (4, 4а, 4b) имеют конструкцию, которая обеспечивает соответствующую среду для ткани мозга (4), гибридного органоида кости/хряща (4а) и васкуляризированной кожи (4b), предпочтительно, с волосяным мешочком. Другими предпочтительными тканями являются сегменты печени, почка и слизистая оболочка кишечника.
В предпочтительном варианте осуществления полости для органов (4), сконструированной для культивирования ткани центральной нервной системы, полость для органов оснащается тремя, четырьмя, пятью или шестью отдельными пространствами для поддержания, например, различных слоев серого вещества коры головного мозга или мозжечка (от периферии к центру: слой зернистых клеток, молекулярный клеточный слой, слой клеток Пуркинье и белое вещество, образуемое нервами). Три секции для серого вещества этой полости для органов загружены срезами тканей соответствующих частей мозга или заполнены соответствующими нейронами и смешаны с необходимым количеством глиальных клеток. Стенки между секциями допускают прохождение дендритов и аксонов. Нервы на основе аксонов располагаются в сегменте, непосредственно соединенном с полостью для стволовых клеток (9) (см. ниже), и поэтому могут проникать через верхнюю часть полости для стволовых клеток (9) в другие полости для органов (4). В нижних частях соответствующих сегментов могут предусматриваться средства измерения полного сопротивления, которые могут служить в качестве датчиков для доказательства воссоздания соединения функционального слоя серого вещества.
В предпочтительном варианте осуществления полости для органов (4а), которая сконструирована для культивирования гибридного органоида кости/хряща, присутствующего в суставах, полость для органов подразделяется на центральную область кости и периферическую часть, которая представляет область хряща. В область хряща, которая предпочтительно больше, чем область кости, загружается коллагеновый матрикс, хондробласты и хондроциты и к ней при помощи средств повышения давления, интегрированных в небольшой нише на периферии этого сегмента, прилагается постоянное или периодическое давление. Этот сегмент закрывается сверху, предпочтительно, посредством верхнего закрывающего слоя (14) непроницаемым для жидкостей образом при помощи пленка или эластичной пластины, которая, предпочтительно, непроницаема для кислорода. Поверхность раздела центрального сегмента кости может покрываться факторами роста кости, такими как, например, костный морфогенетический белок (BMP). В сегмент кости могут преимущественно загружаться спикулы костного мозга или кальцинированный коллагеновый матрикс, заполненный остеокластами или остеобластом.
В предпочтительном варианте осуществления полости для органов (4b), которая сконструирована для культивирования эквивалента васкуляризированной кожи, микрососуд, находящийся в жидкостном соединении с двумя периферическими резервуарами и сформированный из биологически разлагаемых или синтетических полимеров, позволяет эндотелиальным клеткам конфлюентно прикрепляться к внутренней стенке и врастать в окружающую ткань. Между резервуарами предусматриваются средства нагнетания для обеспечения циркуляции крови или заменителей крови через сосуд. Полость для органов может быть заполнена внеклеточным кожным матриксом и суспензией кератиноцитов и/или срезами кожной ткани. Кроме того, в сегменте могут сеяться волосяные мешки, таким образом, обеспечивая архитектуру и микроокружение для развития в полости для органов эквивалента васкуляризированной кожи. Необязательно, предусматриваются разрушаемый матрикс или предварительно скомпонованный микроканал, которые засеваются эндотелиальными клетками для формирования капиллярной сети внутри полости для органов или между двумя или большим количеством, или всеми полостями для органов (4, 4а, 4b) внутри секции роста органов (3).
В предпочтительном варианте осуществления полость для органов имеет конструкцию, для поддержания образования сегментов печени путем обеспечения рассредоточенного окружения, которое допускает рост сегментов печени с максимальной длиной 500 мкм, путем обеспечения градиента О2, вдоль всего сегмента печени и обеспечения полярных гепатоцитов «кровяной стороной» и «желчной стороной». Любая желчь, которая может продуцироваться, может дренироваться в отдельный резервуар для сброса через предусмотренный для этого микроканал. Таким образом, сегмент печени будет питаться из центра или сегмента органа, в то время как сброс, включающий необязательные отдельные микроканалы для устранения желчи, будет располагаться на периферии. Предполагается, что для того чтобы позволить прикрепление синусоидальных клеток и образование пространства Диссе, используются пористые коллагеновые матриксы или предварительно структурированные синтетические каркасы. Предполагается, что слои гепатоцитов, для оптимального взаимодействия с эндотелиальными клетками и клетками Купфера, будут внедряться в полость органа в полутвердом или твердом матриксе.
В ходе работы устройства «орган-на-чипе» два, три, четыре, пять или более различных тканей, органоидов или органов, образующихся по отдельности в двух, трех, четырех, пяти или большем количестве полостей для органов (4, 4а, 4b) внутри секции роста органов (3), могут взаимодействовать друг с другом. Взаимодействие может возникать между полостями для органов путем, например, прорастания нервов из (4) и/или микрокапилляров из (4b) в другие полости. Такое взаимодействие может происходить через отдельно предусматриваемые соединительные каналы/отверстия между двумя различными полостями для органов (4, 4а, 4b), которые по необходимости могут быть открыты или закрыты, и/или через расположенную в центре полость для стволовых клеток (9). Как уже отмечалось выше, предусматриваются капилляры, которые предпочтительно позволяют среде течь в полости для органов (4, 4а, 4b) и/или внутри секции роста органов (3). Для этого в секции роста органов могут располагаться предварительно собранные неразрушаемые микроканалы, которые могут заполняться эндотелиальными клетками, или разрушаемые матриксы, например, из Matrigel, соединяющие две или более полостей для органов. Эндотелиальные клетки затем растут, используя направляющее действие матрикса. В альтернативном варианте может предусматриваться не содержащая клеток синтетическая циркуляционная сеть. В случае сигналов о значительном повреждении, происходящих от органоидов и/или органов в полостях для органов (4, 4а, 4b), покоящиеся стволовые клетки в полости для стволовых клеток (9), содержащей нишу кроветворных стволовых клеток, которая может формироваться в нижней части полости для стволовых клеток (9) и обладает ограниченным течением жидкости, сосредоточение из остеобластных питающих клеток и кроветворных стволовых клеток, могут регенерировать указанные повреждения, например, в полости костных и хрящевых органов.
Резервуар для подачи среды (2) содержит среду и/или добавки, необходимые для дифференцировки и/или поддержания клеток в секциях роста органов. Размер резервуара для подачи среды, заключенного в автономном устройстве «орган-на-чипе» согласно настоящему изобретению, ограничен несколькими параметрами, включая (i) необходимый период автономного культивирования и (ii) требуемую скорость замены среды. Как правило, резервуар для подачи среды содержит объем среды, избыточный по отношению к объему полости для органов (4, 4а, 4b) в расчете на один день культивирования, умноженный на количество присоединенных полостей для органов и количество дней культивирования, и добавки, если это необходимо. В предпочтительном варианте период автономного культивирования составляет, по меньшей мере, 10 дней, 15 дней, 20 дней, 25 дней, 30 дней, 35 дней, 40 дней, 45 дней, 50 дней, 60 дней, 70 дней, 80 дней, 90 дней или более. Соответственно, размер резервуара для подачи среды (2), заключенного в предлагаемом устройстве «орган-на-чипе», можно вычислить по следующей формуле: (no·vo·Хm·tc), где nо - количество полостей для органов, vo - объем полостей для органов (предполагается, что объемы всех полостей для органов близки, т.е. ±20%, иначе необходимо вводить в формулу объемы отдельных полостей для органов), Хm - скорость обмена среды в расчете на день, tc - период автономного культивирования. Предпочтительные значения nо лежат в интервале 18-96, vo - в интервале 0,5-2 мм3, Xm - в интервале 0,5-2, tc - в интервале 14-90. Как правило, резервуар для сброса среды имеет объем, по меньшей мере, соответствующий объему резервуара для подачи среды. В типичном варианте осуществления, резервуар для подачи среды (2), заключенный в устройстве «орган-на-чипе», имеет объем 2-5 мл. При данной скорости потока среды, как правило, нет необходимости в оснащении резервуара для подачи среды (2) вентиляционной системой во избежание негативного возрастания давления, поскольку любая необходимая газообразная среда способна диффундировать через газопроницаемую мембрану, покрывающую полости для органов, в полости для органов и обратно в резервуар для подачи среды (2). Отсутствие вентиляционной системы является предпочтительным вариантом, поскольку это минимизирует риск загрязнения резервуара для подачи среды. В зависимости от типа клеток, тканей, органоидов или органов, которые создаются и/или поддерживаются в секции роста органов (3), для поддержки дифференцировки и/или поддержания всех клеток, тканей, органоидов или органов достаточно либо одной среды, либо необходимо доставлять разные среды к разным секциям роста органов (3) и/или разные среды - к разным полостям для органов (4, 4а, 4b) внутри секции роста органов (3). Кроме того, может оказаться необходимой доставка двух или большего количества сред в различные моменты времени, например, соответственно, в ходе дифференцировки и поддержания. Поэтому устройство «орган-на-чипе» (1) в некоторых вариантах его осуществления может содержать 2, 3, 4, 5, 6, 7 или большее количество различных резервуаров для подачи среды (2), которые находятся в жидкостном соединении с секцией роста органов через микрожидкостный канал подачи (6). Поскольку некоторые клетки, ткани, органоиды или органы могут требовать второй среды, один резервуар для подачи среды (2) может находиться в жидкостном соединении только с одной полостью для органа (4, 4а, 4b) внутри данной секции роста органов (3), сконструированной для обеспечения микроокружения для типа клеток, требующего такой второй среды.
Предпочтительно, по меньшей мере, один микрожидкостный канал подачи (6) жидкостно соединяет резервуар для подачи среды (2) с одной или несколькими секциями роста органов (3). Диаметр микрожидкостных каналов подачи предпочтительно составляет от 100 нм до 1 мм, предпочтительно, 0,5-200 мкм, более предпочтительно, 1-100 мкм. Микрожидкостный канал подачи (6) предпочтительно снабжается дополнительным выпуском, который позволяет отдельно вводить добавки и/или тестовые соединения в секции роста органов (3). Указанный выпуск предпочтительно располагается на достаточном расстоянии от выпуска микрожидкостного канала подачи (10) для того, чтобы позволить среде смешиваться с добавками и/или тестовым соединением для надежного равномерного распределения добавок и/или соответствующего тестового соединения между двумя или большим количеством полостей для органов внутри одной секции роста органов.
Для управлением потоком среды и/или добавок к каждой секции роста органов возможно обеспечение средствами управления потока протока от резервуара для подачи среды (2) к секциям роста органов (3). Указанное управление потоком предпочтительно реализуется внешними источниками давления, внешними механическими насосами, интегрированными механическими микронасосами или электрокинетическими механизмами. Возможности мониторинга процессов в системах непрерывного потока достигаются при помощи высокочувствительных микрожидкостных датчиков потока на основе, например, технологии MEMS, которая обеспечивает разрешения вплоть до нанолитрового диапазона. Таким образом, указанные устройства также могут присутствовать в протоке к секции роста органов и/или из секции роста органов.
В предпочтительном варианте осуществления предлагаемое автономное устройство «орган-на-чипе» (1) также содержит, по меньшей мере, одну полость для стволовых клеток (9), предпочтительно, полость для неонатальных, пре-/постнатальных стволовых клеток или взрослых стволовых клеток, - внутри секции роста органов (3). Полость для стволовых клеток представляет собой микроструктурированную область внутри секции роста органов (3), которая обеспечивает окружение, пригодное для поддержания стволовых клеток на разных стадиях дифференцировки. Так, стволовые клетки могут независимо мигрировать в полость для стволовых клеток (9) или вводиться непосредственно в полость для стволовых клеток (9) как совместно, так и независимо от клеток, вводимых в одну или несколько полостей для органов, заключенных внутри секции роста органов (3). Направляющими элементами для образования полостей для стволовых клеток (9) in vivo являются размер, форма, свойства поверхности (например, питающих клеток), характеристики питательной среды и жидкостный профиль. Полость для стволовых клеток предпочтительно жидкостно соединяется с одной или несколькими полостями для органов (4, 4а, 4b), что позволяет стволовым клеткам мигрировать в различные полости для органов (4, 4а, 4b) для регенерации и поддержания соответствующего органоида и/или органа. Полость для стволовых клеток предпочтительно жидкостно соединена, по меньшей мере, с одной полостью для органов (4, 4а, 4b) отверстием, имеющим диаметр не более 80 мкм и не менее 10 мкм. Полость для стволовых клеток (9) предпочтительно имеет диаметр 10-200 мкм, предпочтительно, менее 100 мкм. Для того, чтобы позволить стволовым клеткам, содержащимся в полости для стволовых клеток, сходным образом осуществлять доступ к двум или большему количеству полостей для органов, содержащихся в секции роста органов (3), полость для стволовых клеток (9) предпочтительно равно удалена от полостей для органов (4, 4а, 4b). В предпочтительном варианте осуществления, где секция роста органов (3), содержащая две, три, четыре, пять, шесть или больше полостей для органов (4, 4а, 4b), имеет круглую форму, полость для стволовых клеток (9) предпочтительно располагается в центре секции роста органов (3). Также предпочтительным является размещение полости для стволовых клеток (9) напротив выпуска (10) микрожидкостного канала подачи (6), что позволяет получать предпочтительный доступ стволовых клеток в полости для стволовых клеток к свежей среде. Полость для стволовых клеток предпочтительно облицована базальной пластинкой в качестве матрикса. Эта пластинка может продуцироваться интерфазами эпителиальных клеток и фибробластов и, таким образом, может предусматриваться посредством синтеза de novo на первом этапе создания полости для стволовых клеток или доставляться из подвергнутой децеллюляризации ткани, для которой известно, что она содержит базальную пластинку, а также вводиться в полость для стволовых клеток перед посевом стволовых клеток. Указанная базальная пластинка способна поддерживать прикрепление и поддержание стволовых клеток в полости для стволовых клеток, предпочтительно, в полости для неонатальных, пре-/постнатальных стволовых клеток или взрослых стволовых клеток.
Полость для неонатальных стволовых клеток обеспечивает окружение, пригодное для привлечения/поддержания неонатальных стволовых клеток. Предпочтительный вариант осуществления полости для неонатальных стволовых клеток, способствующий неонатальному развитию, представляет собой полое тело, предпочтительно - полый цилиндр. Это полое тело, например цилиндр, предпочтительно имеет высоту 200-1000 мкм, предпочтительно - 400 мкм, и диаметр 80-300 мкм, предпочтительно - 100 мкм. Предпочтительно, только одна полость для органов (4, 4а, 4b) находится в жидкостном соединении с полостью для стволовых клеток. Выпуск (10) микрожидкостного канала подачи (6) и жидкостное соединение с секцией (секциями) роста органов расположены таким образом, чтобы среда текла через полый цилиндр над стволовыми клетками, которые находятся в полости для стволовых клеток. Если полость находится внутри круглой секции роста органов, она предпочтительно покрывает менее 10%, предпочтительно - менее 2,5%, площади поверхности секции роста органов (3). Предпочтительно жидкостное соединение с полостью для органов (4, 4а, 4b) находится сбоку от полости для стволовых клеток (9) напротив выпуска микрожидкостного канала подачи (6). Предпочтительно, цилиндр соединяется с конической полостью для органов только в нижней части цилиндра относительно выпуска (10) микрожидкостного канала подачи (6). Это отверстие предпочтительно имеет высоту от около 150 мкм до около 450 мкм, предпочтительно, около 300 мкм, от нижней части полости для стволовых клеток, что равно приблизительному диаметру зародышевой гаструлы, претерпевающей асимметричное деление. Полость для неонатальных стволовых клеток предпочтительно не содержит покрытие, матрикс и/или питающий подслой. Образование бластулы и гаструлы в полости стволовых клеток происходит в течение нескольких дней путем симметричного деления стволовых клеток. Для этой цели полость для стволовых клеток может преимущественно заполняться средой желточного мешка. Эта среда может подаваться из резервуара для подачи среды (2) или второго резервуара для подачи среды, если для создания органа и/или органоида используется одна эта среда, или она может вводиться в полость для стволовых клеток при посеве неонатальных стволовых клеток в полость. Если среда желточного мешка доставляется из резервуара для подачи среды (2), развитие ткани в полости для органов (4, 4а, 4b), предпочтительно в полости для единичного органа, будет направляться перфузией одновременно с асимметрическим делением. Полость для органов предпочтительно имеет длину около 3 мм. Секции роста органов (3), содержащие полости для неонатальных стволовых клеток и ткани, органы и органоиды, которые в них развиваются, предпочтительно применимы в фундаментальных исследованиях, предпочтительно, в области биологии развития для всех царств многоклеточных организмов и для тестирования химических веществ на эмбриотоксичность.
Полость для пре- и постнатальных стволовых клеток обеспечивает окружение, пригодное для привлечения/поддержания пре- и постнатальных стволовых клеток, которые способствуют созреванию и быстрому росту органов и тканей в ходе беременности и детства. Предпочтительный вариант осуществления полости для пре- и постнатальных стволовых клеток представляет собой полое тело, предпочтительно, цилиндр, с областью сниженной скорости потока жидкости. Скорость потока жидкости в этой области - которую также можно назвать нишей стволовых клеток - снижена относительно скорости потока жидкости в других частях полости для стволовых клеток (9). Поэтому большая часть среды будет течь в полость для стволовых клеток (9) и из нее в полости для органов (4, 4а, 4b), не попадая в эту конкретную область. Высота полого тела, предпочтительно цилиндра, составляет 200-1000 мкм, предпочтительно 400 мкм. Диаметр предпочтительно составляет 10-300 мкм, предпочтительно составляет 10-200 мкм, например, 20, 30, 40, 50, 60, 70, 80, 90, 100 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 мкм. Предпочтительным является, чтобы несколько, т.е. две, три, четыре, пять или более, предпочтительно идентичных полостей для роста органов (4, 4а, 4b) находились в жидкостном соединении с полостью для пре- и постнатальных стволовых клеток. Жидкостное соединение с одной или несколькими полостями для органов (4, 4а, 4b) предпочтительно располагается в середине полого тела, предпочтительно в середине цилиндра. Это/эти отверстие/отверстия предпочтительно находится/находятся на расстоянии от нижней части полости для стволовых клеток относительно выпуска (10) микрожидкостного канала подачи (6) от около 100 мкм до около 300 мкм, предпочтительно около 200 мкм, таким образом, образуя область возле нижней части полости для стволовых клеток с пониженной скоростью потока среды, что является предпочтительным для поддержания пре- и постнатальных стволовых клеток в полости для стволовых клеток (9). Отверстия предпочтительно являются щелевидными. Таким образом, в предпочтительном варианте среда течет через выпуск (10) микрожидкостного канала подачи (6) в верхнюю часть полости для стволовых клеток (9) и вытекает наружу в полости для органов в средней секции полости для стволовых клеток (9). Область сниженной скорости потока находится в нижней части полого тела, предпочтительно, цилиндра. Для создания в этой области специфических для органов ниш пре- и постнатальных стволовых клеток, они предпочтительно состоят из специфического для ниши стволовых клеток питающего подслоя, прикрепленного к поверхности нижней части полости или к микропористому материалу микроносителя биологического или синтетического происхождения. Соответствующие стволовые клетки переносятся в полость для стволовых клеток, преимущественно, непосредственно к нижней части полости для стволовых клеток и культивируются при постоянных условиях, например, с использованием потока среды из пренатальной сыворотки или сыворотки новорожденных. В нижней части ниши на дне ниши, где скорость потока среды минимальна и подача питательных веществ обеспечивается, главным образом, диффузией, самообновление стволовых клеток обеспечивается симметричными делениями стволовых клеток. При прорастании клеток в кластеры ткани большего размера, в более высоких областях ниши возникают градиенты питательных веществ и турбулентности потока среды, которые поддерживают асимметричное деление и вытекание клеток-предшественников органов в идентичные полости для органов (4, 4a, 4b) с определенными размером, формой, микроокружением и архитектурой. Секции роста органов (3), содержащие полости для пре- и постнатальных стволовых клеток, а также тканей, органов и органоидов, развивающихся в них, предпочтительно используются в фундаментальных исследованиях, предпочтительно в исследованиях созревания органов и функций ниш стволовых клеток в ходе жизни в пред- и постнатальный период. Кроме того, они предпочтительно применяются в токсикологии, фармакодинамике и фармакокинетике веществ с точки зрения их биологической безопасности или образа действия, предпочтительно, в период детства.
Полость для взрослых стволовых клеток обеспечивает окружение, пригодное для привлечения/поддержания взрослых стволовых клеток. Предпочтительный вариант осуществления полости для взрослых стволовых клеток, способствующий образованию способствующих состоянию покоя ниш взрослых стволовых клеток отдельных органов, представляет собой полое тело, преимущественно, цилиндр, с областью пониженной скорости потока жидкости. Скорость потока жидкости в этой области - которую также можно назвать нишей стволовых клеток - снижена относительно скорости потока жидкости в других частях полости для стволовых клеток (9). Поэтому большая часть среды течет в полость для стволовых клеток (9) и вытекает из нее в полости для органов (4, 4a, 4b), не попадая в эту конкретную область. Высота полого тела, предпочтительно - цилиндра, составляет 200-1000 мкм, предпочтительно 400 мкм. Диаметр предпочтительно составляет 10-300 мкм, предпочтительно 10-200 мкм. Предпочтительным является, чтобы несколько, т.е. две, три, четыре, пять или более, предпочтительно, разных полостей для роста органов (4, 4a, 4b) находились в жидкостном соединении с полостью для взрослых стволовых клеток. Жидкостное соединение с одной или несколькими полостями для органов (4, 4a, 4b) предпочтительно располагается в середине полого тела, предпочтительно в середине цилиндра, и проходит к верхней части полости для стволовых клеток, предпочтительно, щелеобразно. Отверстие (отверстия) предпочтительно находится на расстоянии от около 100 мкм до около 400 мкм, предпочтительно на расстоянии около 300 мкм, от нижней части полости для стволовых клеток относительно выпуска (10) микрожидкостного канала подачи (6), таким образом, образуя в нижней части полости для стволовых клеток область с пониженной скоростью потока среды, что является предпочтительным для поддержания взрослых стволовых клеток в полости для стволовых клеток (9). Таким образом, в предпочтительном варианте осуществления среда течет через выпуск (10) микрожидкостного канала подачи (6) в верхнюю часть полости для стволовых клеток (9) и вытекает в полости для органов, не попадая в нижнюю часть полости для стволовых клеток (9). В предпочтительных вариантах в качестве неограничивающих примеров внутри полости для стволовых клеток (9) образуется ниша фолликулярных стволовых клеток кожи, ниша криптовых стволовых клеток тонкого кишечника, ниша бронхоальвеолярных стволовых клеток легкого, ниша кроветворных стволовых клеток для восстановления крови, ниша стволовых клеток подбрюшинной зоны для регенерации нервной ткани или ниша стволовых клеток, предназначенных для поддержания гормональных желез. В зависимости от конкретной комбинации органоидов и систем органов, управление централизованным питанием органов и их регуляция может приводить к образованию вспомогательных структур для органов и органоидов, включая нервы и кровеносные сосуды, которые могут проходить из одной полости для органов (4, 4а, 4b) в другую полость для органов (4, 4а, 4b), предпочтительно, пересекая полость для стволовых клеток (9).
Способствующие состоянию покоя ниши органоспецифичных взрослых стволовых клеток создаются в полости для взрослых стволовых клеток (9) предпочтительно путем введения питающих клеток, матриксов и стволовых клеток в полость для стволовых клеток (9), специфичную для создаваемой ниши для стволовых клеток, предпочтительно, в нижнюю часть полости (9). Обзор компонентов, составляющих физиологические ниши взрослых стволовых клеток для различных органов, приведен в документе D.L. Jones и A.J. Wagers: No place like home: anatomy and function of the stem cell niche. Nature Reviews/ Molecular Cell Biology, V.9, pp.11-21, январь 2008 г., который ссылкой полностью включается в настоящее описание, в частности, что касается его учения о требованиях (например, покрытиях, факторах роста, компонентах внеклеточных матриксов) для создания соответствующей полости для стволовых клеток.
Адгезивные молекулы, которые могут способствовать поддержанию стволовых клеток внутри полости для стволовых клеток (9), могут выбираться из числа интегринов, катенинов, кадгеринов, других клеточных адгезивных белков или их комбинаций. Адгезивные молекулы, пригодные для поддержания стволовых клеток внутри полости для стволовых клеток (9), предпочтительно выбираются из интегрина-α6, интегрина-β1, β-катенина, Е-кадгерина, N-кадгерина или комбинаций двух или большего количества указанных белков, приведенных в качестве неограничивающих примеров. Полость стволовых клеток (9) также может содержать клетки, которые выполняют роль поддерживающих клеток для стволовых клеток. Пригодные поддерживающие клетки могут быть выбраны из следующего списка неограничивающих примеров типов клеток: остеобласты, клетки сосудистого эндотелия, фибробласты крипт, клетки Панета, фибробласты кожи, клетки сосудистого эндотелия, астроциты, клетки Сертоли, интерстициальные клетки, а также комбинации двух или большего количества указанных клеток. Специалисты поймут, что выбор подходящей поддерживающей клетки(поддерживающих клеток) зависит от стволовых клеток, которые необходимо поддерживать в полости для стволовых клеток (9). В частности, остеобласты пригодны в качестве поддерживающих для кроветворных стволовых клеток (HSC), клетки сосудистого эндотелия пригодны в качестве поддерживающих для HSC, стволовых клеток субвентрикулярной зоны (SVZ), стволовых клеток субгранулярной зоны (SGZ) и сперматогониальных стволовых клеток (SSC); фибробласты крипт, а также клетки Панета пригодны в качестве поддерживающих для цилиндрических клеток основания крипт (СВС); фибробласты кожи пригодны в качестве поддерживающих для фолликулярных стволовых клеток; астроциты пригодны в качестве поддерживающих для SVZ- и SGZ-стволовых клеток; и клетки Сертоли, а также интерстициальные клетки пригодны в качестве поддерживающих для SSC. Также учитывается, что на механические свойства полости для стволовых клеток (9) влияет функция стволовых клеток. В частности, относительная эластичность, или жесткость, полости для стволовых клеток (9) может непосредственно модифицировать решения о дифференцировке стволовыми клетками (D.L.Jones и A.J.Wagers (2008), выше). Например, относительно эластичная подложка может применяться в полости для стволовых клеток (9) для содействия невральной дифференцировке мезенхимных стволовых клеток (MSC). Напротив, выбор в полости для стволовых клеток (9) жесткой подложки будет благоприятствовать остеобластной дифференцировке MSC. Наконец, подложка с промежуточной жесткостью будет побуждать дифференцировку в направлении клеток скелетных мышц. Также предполагается добавление в полость для стволовых клеток (9) одного или нескольких факторов, влияющих на поддержание, дифференцировку и/или состояние покоя стволовых клеток. Например, остеопонтин (OPN) подавляет распространение стволовых клеток в нишу HCS (W.P.Daley и др.: Extracellular matrix dynamics in development and regenerative medicine. J. Cell Science (2008), v. 121, pp.255-264) и может добавляться в полость для стволовых клеток (9) для получения аналогичного эффекта. Примерами других применимых факторов являются стальной фактор (SLF), Wnt, Notch, ангиопоэтин-1 (ANG1), костный морфогенетический белок (BMP), sonic hedgehog (Shh) и нейротрофический фактор, получаемый из линии глиальных клеток (GDNF).
Компоненты предпочтительно внедряются в полутвердую среду, предпочтительно, агарозу, метилцеллюлозу или альгинат. В полости для органов предпочтительно загружаются матриксы, покрытия, клеточные суспензии или клеточные кластеры, такие как срезы тканей, которые, соответственно, необходимы для образования требуемого органоида и/или органа. Обеспечивается предпочтительно постоянный поток среды, например, содержащей сыворотку взрослых организмов или синтетическую полную среду. Величина потока такова, что поток не мешает нише стволовых клеток, которая может формироваться в нижней части полости для стволовых клеток (9). Из-за формы и геометрии предпочтительно, чтобы ниша взрослых стволовых клеток снабжалась питательными веществами исключительно путем диффузии. Как только в той или иной полости для органов происходит васкуляризация или рост нервов, нервы и микрокапилляры могут легко проникать в другие полости для органов через верхнюю часть ниши стволовых клеток, таким образом, иннервируя и васкуляризируя другие органоиды в той же секции роста органов. Сразу после достижения системой естественного гомеостаза, возможно применение тестовых веществ. Клетки ниши стволовых клеток преимущественно находятся в состоянии покоя и могут активироваться для регенерации сегментов органов только после получения сигналов о повреждениях из полостей для органов. Секции роста органов (3), содержащие одну или несколько полостей для взрослых стволовых клеток и развивающихся из них тканей, органов и органоидов, предпочтительно используются в фундаментальном исследовании, предпочтительно, в исследовании ниш взрослых стволовых клеток, физиологии органов и гомеостаза. Кроме того, они предпочтительно используются для тестирования химических веществ, важных для здоровья потребителей.
Также предпочтительно, чтобы полость стволовых клеток (9) имела цилиндрическую форму. Такая форма является особенно предпочтительной, если полость для стволовых клеток (9) располагается в центре секции роста органов (3).
Во втором аспекте настоящее изобретение относится к устройству «орган-на-чипе» (1), предпочтительно, к автономному устройству «орган-на-чипе», содержащему:
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
(b) где, по меньшей мере, одна полость для органов (4, 4а, 4b) содержит и/или соединена, по меньшей мере, с одним датчиком (8, 8а, 8b). Предпочтительно автономное устройство «орган-на-чипе» (1) согласно второму аспекту дополнительно содержит, по меньшей мере, один резервуар для подачи среды (2), где резервуар для подачи среды (2) соединяется, по меньшей мере, с одной секцией роста органов (3) через микрожидкостный канал подачи (6) и, по меньшей мере, одной полостью для органов (4, 4а, 4b), заключенной в ней. Все термины, используемые в отношении второго аспекта, например, «автономный», «секция органов (3)», «полость для органов (4, 4а, 4b)» и «резервуар для подачи среды», имеют значение и предпочтительные значения, описанные выше, а термин «датчик» имеет значение, описанное ниже. Также предпочтительно, чтобы секция органов (3) дополнительно содержала, по меньшей мере, одну полость для стволовых клеток (9), предпочтительно, неонатальных, пре-/постнатальных стволовых клеток или взрослых стволовых клеток.
В третьем аспекте настоящее изобретение относится к устройству «орган-на-чипе» (1), предпочтительно, к автономному устройству «орган-на-чипе» (1), содержащему:
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
(b) где секция роста органов (3) содержит полость для стволовых клеток (9).
Термины, используемые в контексте указанного третьего аспекта, например, «секция роста органов», «полость для органов» и «полость для стволовых клеток» имеют значение и предпочтительные значения, указанные для первого аспекта настоящего изобретения. Обеспечение полости для стволовых клеток (9), имеющей описанные выше свойства, внутри секции роста органов (3) предусматривает усовершенствованную систему культивирования тканей, органоидов и органов, поддерживаемых в полостях для органов (4, 4а, 4b), поскольку она моделирует естественную ситуацию, в которой органы и ткани пополняются за счет стволовых клеток, которые поддерживаются в состоянии покоя, однако способны к пролиферации внутри или поблизости от органа и/или ткани.
Устройство «орган-на-чипе» (1) согласно третьему аспекту настоящего изобретения предпочтительно содержит, по меньшей мере, один резервуар для подачи среды (2), где резервуар для подачи среды (2) соединяется, по меньшей мере, с одной секцией роста органов (3) микрожидкостным каналом подачи (6). И снова, в данном контексте термины «резервуар для подачи среды (2)» и «микрожидкостный канал подачи (6)» имеют то же значение, что и предпочтительные значения, описанные выше в отношении первого аспекта изобретения.
Может предусматриваться отдельный резервуар для сброса среды, присоединяемый через соединитель к устройству «орган-на-чипе» (1) согласно любому из аспектов настоящего изобретения, т.е. представляющий собой отдельный объект. В этом случае любая сбрасываемая среда будет удаляться из устройства и может быть удалена в процессе работы устройства. Однако более предпочтительно, чтобы устройство «орган-на-чипе» согласно любому из аспектов настоящего изобретения дополнительно содержало, по меньшей мере, один резервуар для сброса среды (5), где, по меньшей мере, одна полость для органов (4, 4а, 4b) соединена, по меньшей мере, с одним резервуаром для сброса среды (5) микрожидкостным каналом сброса (7). В этом предпочтительном варианте все условия для жидкостей и требования сбросу содержатся внутри устройства «орган-на-чипе» согласно настоящему изобретению, что дополнительно увеличивает гибкость и снижает риск загрязнения. Несмотря на то, что каждая секция роста органов (3), включающая все полости для органов (4, 4а, 4b), заключенные в ней, может соединяться через один микрожидкостный канал сброса (7, 7а, 7b), предпочтительно, чтобы каждая полость для органов отдельно соединялась с резервуаром для сброса среды (5), предусматриваемым конкретно для этой полости для органов (4, 4а, 4b).
Свойства клеток, тканей, органоидов и/или органов, создаваемых и/или поддерживаемых в секции роста органов и полостях для органов, соответственно, могут подвергаться мониторингу в потоке среды, дренируемой из секции роста органов (3) и полостей для органов (4, 4а, 4b), соответственно, или внутри полостей для органов (4, 4а, 4b). Эти свойства могут включать секретируемые или высвобождаемые вещества, модифицированные вещества, изменение полного сопротивления, электрические импульсы, механические силы и т.д. Для детектирования этих свойств в любом из аспектов устройства «орган-на-чипе» (1) согласно настоящему изобретению предпочтительным является размещение, по меньшей мере, одного датчика (8, 8а, 8b) между, по меньшей мере, одной полостью для органов (4, 4а, 4b) и, по меньшей мере, одним резервуаром для сброса среды (5), и/или внутри, по меньшей мере, одной полости для органов. Такие датчики (8, 8а, 8b) известны из уровня техники и предпочтительно выбираются из группы, состоящей из датчика рН, датчика рO2, датчика захвата анализируемого вещества, датчика поверхностных акустических волн (SAW); датчика плазменного резонанса, датчика температуры, датчика СО2, датчика NO, датчика хемотаксиса, датчика цитокинов, датчика ионов, потенциометрического датчика, амперометрического датчика, проточного датчика, датчика проводимости, датчика напряжений, датчика электромагнитного поля и датчика метаболизма. Свойство клеток, тканей, органоидов и/или органов, которое может оцениваться, будет зависеть от соответствующих клеток, тканей, органоидов и/или органов. Так, предполагается, что различные датчики предусматриваются для различных клеток, тканей, органоидов и/или органов, находящихся в отдельных полостях органов внутри одной секции роста органов (3). Для электрически активных клеток, органоидов и органов эффективную технологию представляют мультимикроэлектродные матрицы (A.Robitzki et al.: Cells on a chip - the use of electric properties for highly sensitive monitoring of blood-derived factors involved in angiotensin II type 1 receptor signaling. Cell Physiol. Biochem. 16 (1-3), 51-58 2005). Для электрофизиологически неактивных клеток и органоидов возможно применение импедансной спектроскопии, как описано в статье J. Aguilo et al.: Impedance dispersion width as a parameter to monitoring living tissues. Physiol. Meas. 26 (2), 165-173, 2005. В качестве альтернативы или дополнительно, проток снабжается двумя, тремя, четырьмя или пятью различными датчиками с целью обеспечения дополнительной гибкости системы или для одновременного мониторинга двух или большего количества свойств. Если, например, тестируется способность органоида печени осуществлять метаболизм данного химического вещества, может потребоваться как определение количество метаболита в потоке, так и обнаружение апоптоза или некроза, которые могут возникнуть в органоиде. К любой полости для стволовых клеток или органов в устройстве «орган-на-чипе» (1) может применяться получение изображений живой клетки, органоида или органа в сочетании с двухфотонной микроскопией, проникающей в ткани на глубину более 1 мм. В более предпочтительном варианте осуществления автономное устройство «орган-на-чипе» дополнительно содержит датчик температуры, предназначенный для определения температуры, по меньшей мере, в одном резервуаре для подачи среды (2) и/или, по меньшей мере, одной полости для органов (4, 4а, 4b).
В качестве альтернативы или дополнения, к среде могут добавляться и течь вместе со средой чувствительные вещества, например вещества, чувствительные к рН. Такие чувствительные вещества предпочтительно могут уже содержаться в резервуаре для подачи среды (2), могут содержаться в отдельном резервуаре или могут добавляться непрерывно, через определенные интервалы времени или, если необходимо, производить определенные измерения, могут добавляться через мембрану или эластичную пластинку непосредственно в секцию роста органов (3), предпочтительно, непосредственно в полость для органов (4, 4а, 4b). Как правило, указанные чувствительные вещества изменяют свои физические и/или химические свойства в ответ на изменения в окружении, например, изменения рН, рO2, концентрации солей, температуры, присутствия или отсутствия анализируемого вещества и т.д. Таким изменением физического свойства может являться, например, изменение свойств поглощения или испускания, например, флуоресценции, или изменение окислительно-восстановительного потенциала чувствительного вещества. В некоторых предпочтительных вариантах указанные чувствительные вещества могут иммобилизироваться в полости для органов (4, 4а, 4b) или иммобилизироваться на поверхности, или внутри, микрошариков или наношариков. В аспекте настоящего изобретения термин «микрошарик» относится, предпочтительно, к круглой частице, имеющей диаметр от 20 до 0,5 мкм, а термин «наношарик» относится, предпочтительно, к круглой частице, имеющей диаметр менее 0,5 мкм. В зависимости от своих размеров, указанные шарики могут течь вместе со средой или оставаться в полости для органов. Для управления перемещениями микро- или наношариков внутри полости для органов (4, 4а, 4b), предпочтительно, тех из них, который слишком велики для переноса с потоком среды, предполагается, что шарики снабжаются магнитным, или намагничивающимся, ядром, которое может перемещаться под действием магнитных или электрических полей, генерируемых в устройстве «орган-на-чипе». Также указанные шарики могут добавляться через отверстие в верхней части ростового сегмента, который затем может повторно герметизироваться или может предусматривать указанную повторную герметизацию посредством покрытия эластичной пластинкой отверстия.
Для обеспечения соответствующей среды для органоида или органа, который создается и поддерживается в полости для органов (4), она содержит одну или несколько структур, которые выбираются из четырех типов, а именно: микроструктуры, структуры химических модификаций, средства привода и сенсорные средства, а также из их комбинаций. Как правило, полость для органов содержит тканеспецифические микроструктуры и структуры химической модификации.
Термин «микроструктуры» включает, например, трехмерные, предпочтительно, биологически разлагаемые полимерные каркасы, которые предусматриваются с целью индукции миграции правильного типа клеток, например, из полости для стволовых клеток, в полость для органов или для обеспечения дополнительных поверхностных областей для прикрепления клеток, или микроокружений внутри полости для органов (4, 4а, 4b). Микроструктуры могут являться биологически разлагаемыми, что означает их распад, как химический, так и механический, с течением времени. Когда этот распад происходит, клетки секретируют свой собственный внутриклеточный матрикс, который играет критически важную роль в выживании и функционировании клеток. В нормальной ткани существует активный динамический взаимный обмен между клетками, составляющими ткань, и окружающим внеклеточным матриксом. Последние открытия в этой области собраны в документе W.P. Daley и др.: Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science, 121, 255-264. Внеклеточный матрикс обеспечивает химические сигналы, которые регулируют морфологические свойства и фенотипические признаки клеток, и может индуцировать деление, дифференцировку и даже гибель клеток. Кроме того, клетки также постоянно перестраивают внутриклеточный матрикс. Клетки разрушают и строят заново внеклеточный матрикс, а также секретируют в матрикс химические вещества, которые позднее используются ими же или другими клетками, которые могут мигрировать в данную область. Также наблюдалось, что внеклеточный матрикс является одним из важнейших компонентов эмбрионального развития. Инициирующие клетки секретируют химические сигналы, которые помогают следующим клеткам дифференцироваться в соответствующий конечный фенотип. Например, указанные химические сигналы приводят к дифференцировке клеток нервного валика в аксоны, клетки гладкой мускулатуры или нейроны. Микроструктуры предпочтительно включают микроносители, предпочтительно, микроносители коллагена; кальцинированные зоны, предпочтительно, кальцинированного коллагена; гели синтетических полипептидов, предпочтительно, полиаминокислотные гели, например, глютаминовые гели; капилляры, которые могут проходить через полость для органов и соединяться с дополнительными резервуаром (резервуарами) для подачи среды; и полые тканые или нетканые полимерные волокна, предпочтительно, полиэфирсульфоновые или полилактидные волокна. Указанные микроструктуры предпочтительно вводятся в полость для органов тогда, когда устройство «орган-на-чипе», по меньшей мере, частично или полностью собрано. Поэтому микроструктуры, предпочтительно, отделены от материала, образующего полость для органов, который, как отмечено выше, предусматривает дополнительные подструктуры, такие как гребни, каналы, сосуды и т.д.
Термин «структуры химической модификации» здесь относится к веществам, которые прикрепляются, например, адсорбируются, ковалентно или нековалентно связываются, со всей или частью поверхности полости для органов (4, 4а, 4b), образуя тонкие слои, как правило, мономолекулярные слои.
Предпочтительные примеры включают пептиды, белки, такие как, например, костный морфогенетический белок (BMP), нейронный фактор роста, эритропоэтин, факторы, стимулирующие образование колоний, интерлейкины, интерфероны, интегрины, селектины или рецепторы вышеупомянутых белков и сшитые белки, предпочтительно, пептиды, включающие RGD-мотив, или белки, например, альбумины, трансферрины, инсулины или фибрины. Для сшивания белков может использоваться множество известных в этой области агентов, содержащих глутаровый альдегид. Для локального прикрепления к части полости может применяться фотохимическая сенсибилизация поверхности.
Средства привода предпочтительно предусматриваются в полости для органов (4, 4а, 4b) для более полного моделирования природного микроокружения, которое, в дополнении к химическим раздражителями, также предусматривает физические раздражители, необходимые для создания и поддержания конкретных тканей, органоидов и/или органов. Так, средства привода содержат средства, которые изменяют физическое состояние клеток путем приложения давления к клеточной массе, что требуется, например, для образования костей и хрящей, обеспечивают циркуляции жидкости в полости для органов, имитируя ток крови по капиллярам или поверхность раздела ткани в кишке, подают тепло или обеспечивают электрическую стимуляцию. Указанные средства привода, предпочтительно, содержат: по меньшей мере, средства пульсирующего повышения давления, расположенные в отдельной вспомогательной полости этой полости для органов и предназначенные для создания вторичного потока через полость для органов, один или несколько электродов, силы электромагнитного поля, или микронасосы, включающие пьезоэлементы, эластичные мембраны, который качаются туда и обратно, эластичные полые сферы, засеянные пейсмекерными клетками/кардиомиоцитами, чьи сокращения обозначаются термином «микросердце», двигатели на поверхностных акустических волнах (SAW) или магнитные поршни, которые действуют на мембраны внутри полостей для органов.
В альтернативном варианте единичные клетки или части органов могут перемещаться внутри полости для органов, в полость для органов или из полости для органов с использованием шариков с магнитным или намагничивающимся ядром и лигандов, присоединенных к поверхности, которая преимущественно связывается с определенными типами клеток или группами клеток, и приложения магнитного или электрического поля. Пригодные шарики хорошо известны специалистам как микро- или наношарики. Выбор типа шарика определяется количеством клеток, которые необходимо переместить, прилагая электрическое или магнитное поле, и поэтому могут использоваться как микро-, так и наношарики. Автономное устройство «орган-на-чипе» может собираться с некоторым количеством предварительно загруженных в него указанных шариков, или они могут загружаться, предпочтительно, через отверстие в полостях для органов, по мере необходимости.
Для оценки состояния дифференцировки и здоровья, а также многих других свойств, включая метаболическую активность, количества апоптических клеток, количества пролиферирующих клеток и т.д. развивающихся или развитых органоидов или органов, в полости для органов (4, 4а, 4b) предусматриваются сенсорные средства, позволяющие датчикам получать более прямой доступ к клеткам по сравнению с датчиками, расположенными, например, в протоке к микрожидкостному отсеку для сброса (8, 8а, 8b). Предпочтительные датчики включают датчики температуры, чувствительные химические вещества, которые предпочтительно прикрепляются к поверхности полости для органа или антитела, специфичные для цитокинов, которые прикрепляются к множеству микроповерхностей, изготовленных из золота, расположенных в выпускном канале сброса и наблюдаемых посредством плазменного резонанса, и оптические волокна, которые позволяют доставлять свет с разной длиной волны в полость для органов и детектировать любой свет, который может испускаться, отражаться или поглощаться в полости для органов. Чувствительные вещества представляют собой вещества, которые меняют измеримое физическое или химическое свойство в ответ на данный раздражитель. Как указывалось выше, указанные поверхности также могут быть поверхностью микро- или наношарика, расположенного внутри полости для органа (4, 4а, 4b).
Конкретные комбинации подструктур внутри полости для органов, микроструктур, структур химических модификаций и средств привода обеспечивают окружение для создания и дифференцировки конкретных тканей.
Полости для органов (4, 4а, 4b) внутри секции роста органов (3) обеспечивают пространство для самосборки, поддержания и/или повторной сборки наименьшего функционально самодостаточного структурного элемента конкретного органа (например, альвеолы легкого, эпидермиса и дермы кожи, слизистой оболочки кишечника, дольки печени, нефрона почки) или конкретной системы органов (например, микроциркуляторной части кровеносной системы, серого вещества нервной системы). Элементарными природными строительными блоками для направленной сборки органов in vivo являются размер, форма, характеристики питания, микроархитектура (например, внеклеточный матрикс и мембраны, свойства поверхностей), а также локальное микроокружение (например, градиенты морфогенов и хемокинов). Предпочтительный вариант полостей для органов в иллюстративных целях предусматривается для трех типов органов: (4) - ткань мозга, (4а) - кость/хрящ, и (4b) - васкуляризированная кожа, задавая соответствующий размер, форму и питание для каждого конкретного органа и обеспечивая доступ для введения дополнительных необходимых элементов микроархитектуры и микроокружения, а также для загрузки в устройство «орган-на-чипе» клеточных суспензий или тканей.
В предпочтительном варианте полость для органов (4), например, сконструирована для культивирования ткани центральной нервной системы и обеспечивает четыре раздельных пространства для поддержания, например, различных слоев серого вещества коры головного мозга или мозжечка (от периферии к центру: слой зернистых клеток, молекулярный клеточный слой, слой клеток Пуркинье и слой белого вещества, образуемый нервами). Три секции серого вещества этой полости для органов загружены срезами тканей соответствующих частей мозга или заполнены соответствующими нейронами и смешаны с необходимым количеством глиальных клеток. Стенки между секциями допускают прохождение дендритов и аксонов. Нервы на основе аксонов располагаются в сегменте, непосредственно соединенном с полостью для стволовых клеток, и поэтому могут проникать сквозь верхнюю часть полости стволовых клеток в другие полости для органов. В соответствующих нижних частях сегментов могут предусматриваться средства измерения полного сопротивления, которые могут служить в качестве датчиков для доказательства воссоздания соединения функционального слоя серого вещества.
В предпочтительном варианте осуществления полость для органов (4а) обеспечивает размеры, форму и условия питания для культивирования гибридного органоида кости/хряща. Меньший центральный сегмент представляет собой область кости, а большая периферическая часть представляет собой область хряща. В область хряща загружается коллагеновый матрикс, хондробласты и хондроциты и к ней при помощи средств повышения давления, интегрированных в небольшой нише на периферии этого сегмента, постоянно или периодически прилагается давление. Этот сегмент закрывается сверху, предпочтительно, непроницаемой для жидкостей пленкой, непроницаемой также и для кислорода. Поверхность раздела центрального сегмента кости покрывается костным морфогенетическим белком (BMP). В сегмент кости преимущественно загружаются спикулы костного мозга или кальцинированный коллагеновый матрикс, заполненный остеокластами или остеобластами.
В предпочтительном варианте осуществления полость для органов (4b) содержит микрососуд, находящийся в непроницаемом для жидкостей соединении с двумя периферическими резервуарами и сформированный из биологически разлагаемых или синтетических полимеров, позволяющих эндотелиальным клеткам конфлюентно прикрепляться к внутренней стенке и врастать в окружающую ткань. Между резервуарами предусмотрены насосные средства для обеспечения циркуляции крови или заменителей крови через сосуд. Полость для органов заполнена внеклеточным кожным матриксом и суспензией кератиноцитов и/или срезами кожной ткани. Кроме того, в сегмент могут засеваться волосяные мешки, таким образом, обеспечивая архитектуру и микроокружение для развития в полости для органов эквивалента васкуляризированной кожи.
Наконец, в ходе работы указанного сегмента роста может возникать взаимодействие между полостями для органов путем разрастания нервов из 4 или микрокапилляров из 4b в другие полости. В случае сигналов о значительных повреждениях стволовые клетки, находящиеся в состоянии покоя, например, из ниши кроветворных стволовых клеток, построенной из остеобластных питающих клеток и кроветворных стволовых клеток, могут регенерировать указанные повреждения, например, в полости для органов, содержащей кость и хрящ.
Поскольку, как описано выше, возможна косвенная оценка нескольких свойств клеток, заключенных в полостях для органов (4, 4а, 4b), при помощи датчиков, также предпочтительно, чтобы автономное устройство «орган-на-чипе» (1) согласно настоящему изобретению было пригодным для микроскопического наблюдения. Для этого каждая из частей устройства «орган-на-чипе» может изготавливаться из оптически прозрачного материала. Одна или несколько секций роста органов (3), одна или несколько полостей для органов (4, 4а, 4b) и/или, по меньшей мере, один датчик (8, 8а, 8b) являются пригодными для микроскопического наблюдения. Получение изображений живых клеток с применением двухфотонной микроскопии во всем слое полостей для органов (15) обеспечивает информацию в режиме прямого доступа о сборке и поддержании органов, а также о влиянии веществ на поведение органов. Как установлено выше, устройство «орган-на-чипе» в предпочтительном варианте его осуществления содержит отверстие к окружению для каждой секции органов (3). Это отверстие предпочтительно имеет размер, идентичный размеру самой секции органов (3). В ходе работы оно может покрываться прозрачным, непроницаемым для жидкостей, газопроницаемым материалом, таким как, например, пластина напыляемого лейкопластыря, эластичной пластинкой, изготовленной из, например, PDMS, или пластинкой из фибрина. При таком расположении можно при помощи оптической микроскопии непосредственно наблюдать клетки в полости для органов, например, подавая свет сверху, как в лазерной сканирующей микроскопии. Менее утонченный способ, который также обеспечивает получение изображений с высоким разрешением, использует просвечивающую микроскопию. Использование просвечивающей микроскопии, однако, требует оптической прозрачности материала вдоль всего пути прохождения света через устройство «орган-на-чипе» (1) согласно настоящему изобретению. Как более подробно будет описано ниже, микроструктурированные слои, используемые для сборки устройства «орган-на-чипе» согласно настоящему изобретению, предпочтительно изготавливаются из оптически прозрачных материалов, таких как стекло или SiO2, и поэтому пригодны для обеспечения оптически прозрачного материала вдоль всего пути прохождения света. Если, например, определенные структуры, такие как нагревательные элементы, размещаются на пути прохождения света, они также могут изготавливаться из оптически прозрачных материалов, как, например, нагревательные элементы, изготовленные из оксида индия и олова (ITN). Особенно предпочтительно, чтобы полость для стволовых клеток (9) была пригодной для микроскопического наблюдения с целью установления ее заполненности и состояния клеток в этой полости.
Течение жидкостей через микрожидкостную систему автономного устройства «орган-на-чипе» (1) согласно настоящему изобретению может достигаться посредством, например, силы тяжести или капиллярных сил. Для установления потока среды через систему предпочтительно, однако, чтобы резервуар для сброса среды (5) содержал гидрофильный материал, который при смачивании поглощал бы среду и, таким образом, обеспечивал всасывание, достаточное для обеспечения потока жидкости. В альтернативном варианте, в протоке между резервуаром для подачи среды (2) и резервуаром для сброса среды (5) может устанавливаться микронасос. Последний вариант осуществления предпочтителен тем, что скорость потока жидкости может более легко адаптироваться к условиям роста, количествам клеток и т.д., наблюдаемым в секции роста органов. Так, если увеличивается скорость апоптоза и/или уменьшается скорость пролиферации, скорость потока среды может быть увеличена для обеспечения улучшенного питания клеток.
Как установлено выше, предпочтительно, чтобы все устройства, требуемые для создания и поддержания тканей, органоидов или органов, были интегрированы в автономном устройстве «орган-на-чипе» (1) согласно настоящему изобретению. Преимуществом, обеспечиваемым в этом случае, является независимость автономного устройства «орган-на-чипе» (1) от вторичных узлов обеспечения, источников подачи среды и, предпочтительно, съемных средств. Так, в предпочтительном варианте автономное устройство «орган-на-чипе» (1) дополнительно содержит средства нагрева, расположенные так, чтобы нагревать, по меньшей мере, один резервуар для подачи среды (2), по меньшей мере, одну полость для органов (4, 4а, 4b) или оба эти компонента. Эти секции устройства «орган-на-чипе» предпочтительно нагреваются до температуры, эквивалентной температурам в организме, из которого получены клетки, например, до 37°С. Средства нагрева (11) могут состоять из любого известного материала, который может образовывать относительно тонкие нагревательные элементы, например, нагревательные элементы толщиной 1-100 мкм. Предпочтительные средства нагрева изготавливаются из оксида индия и олова, платины, золота или их смесей. Среди них предпочтительным является оксид индия и олова по причине того, что он оптически прозрачен.
Для обеспечения эффективного изготовления автономного устройства «орган-на-чипе» (1) согласно настоящему изобретению, предпочтительной является сборка двух, трех, четырех, пяти, шести, семи или большего количества отдельно изготовленных слоев в зависимости от необходимой сложности микроструктур. Эти слои могут изготавливаться множеством способов, включая механическую обработку твердых блоков материала путем, например, помола или лазерной абляции; технологий литья или оптической литографии, обычно используемых в полупроводниковых технологиях. Структуры, находящиеся на поверхности одного слоя, могут становиться внутренними закрытыми структурами при соединении непроницаемым для жидкостей образом второго слоя, содержащего соответствующие микроструктуры, с первым слоем. Предпочтительно, чтобы все слои имели одинаковую длину и ширину для того, чтобы гарантировать, что все слои, соединенные друг с другом, образуют бескорпусный прибор, который представляет собой моноблок. Таким образом, в предпочтительном варианте осуществления устройство согласно настоящему изобретению содержит слой среды (12) и слой секций роста органов (13). В предпочтительном варианте оба слоя собираются заранее и доставляются к месту применения как монолитная интегральная схема, которая может необязательно содержать среду в резервуаре для подачи среды (2) и/или добавки. Предполагается, однако, что в некоторых вариантах осуществления слой среды (12) обеспечивается отдельно от слоя секций роста органов (13) и может прикрепляться к слою секции роста органов лишь после того, как в полости для органов (4, 4а, 4b) загружаются клетки и/или фрагменты тканей. Устройство «орган-на-чипе» или его части предпочтительно упаковываются по отдельности в стерильном окружении. В предпочтительном варианте собранное устройство «орган-на-чипе» пригодно для стерилизации в автоклаве и/или путем облучения.
Слой среды (12), как правило, имеет толщину 0,5-20 мм, предпочтительно, 0,5, 1,0, 1,5, 2,0, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 11,0, 12,0, 13,0, 14,0, 15,0, 16,0, 17,0, 18,0, 19,0, 20,0 мм, и содержит относительно простые конструкции, включающие резервуар для подачи среды (2) и/или резервуар для сброса среды (5), которые имеют размеры, пригодные для подачи и/или получения нужного количества среды в ходе работы. Так, предпочтительно, чтобы слой среды изготавливался путем литья, например, из синтетических полимеров, предпочтительно, из PS, PC, PA, PI, PEEK, PPSE, EP, UP, PF, PDMS, MF, CA, PTFE и их смесей, в частности, PS, PC и полисилоксана, предпочтительно, PDMS. Как отмечалось выше, предпочтительно, чтобы автономное устройство «орган-на-чипе» (1) согласно настоящему изобретению содержало одно или несколько отверстий, каждое из которых позволяло бы осуществлять доступ в секцию роста органов (3), предпочтительно, в полость для органов (4) и/или полость для стволовых клеток (9). Эти отверстия используются в предпочтительных вариантах осуществления для загрузки клеток и/или фрагментов ткани в соответствующую полость для органов (4, 4а, 4b). Таким образом, слой среды (12) предпочтительно содержит вырезы, соответствующие по размерам и количеству секциям роста органов (3) в слое секций роста органов (13).
В предпочтительном варианте осуществления резервуары для подачи среды (2) и/или резервуары для сброса среды (5) располагаются в слое среды (12). Эти конструкции предпочтительно размещаются в слое среды так, чтобы они не перекрывали отверстие (отверстия), которое (которые) предусматриваются в предпочтительном варианте осуществления слоя среды для осуществления доступа газовой среды в секцию роста органов (3), и, соответственно, в полости для органов (4, 4а, 4b), которые располагаются под слоем среды в слое секций роста органов (13). Слой секций роста органов (13) предпочтительно содержит все структуры, которые более подробно описаны выше, и обеспечивает необходимое окружение, включая структурные, химические и физические раздражители, для дифференцировки и поддержания тканей, органоидов и органов. Поэтому он содержит микроструктуры для, например, развития кости и хряща, развития васкуляризированной кожи или роста нервов. По причине небольшого размера необходимых структур, часто используются технологии фотолитографии и, соответственно, предпочтительно, чтобы материалы были сходны с материалами, традиционно используемыми в области полупроводниковых технологий, включая SiO2, GaAs, стекло или их комбинации.
В предпочтительном варианте осуществления слой секций роста органов (13) содержит верхний закрывающий слой (14), слой полостей для органов (15) и нижний закрывающего слоя (16). Эти три слоя совместно определяют границы секции роста органов (3), где верхний слой определяет верхний край секции роста органов (3) и, соответственно, полостей для органов (4, 4а, 4b), слой полостей для органов определяет боковые стороны полостей для органов, а нижний закрывающий слой определяет нижний край секции роста органов (3) и, соответственно, полостей для органов (4, 4а, 4b).
Верхний закрывающий слой (14) предпочтительно имеет толщину от 20 мкм до 2 мм, предпочтительно 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170,180, 190, 200, 250, 300, 350, 400, 450, 500, 550, 600, 700, 800, 900, 1000, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900 или 2000 мкм. Он жидкостно отделяет микрожидкостные каналы в слое секций роста органов от слоя среды. Однако он содержит отверстия, допускающие жидкостное соединение с соответствующими отверстиями в слое среды, например, обеспечивающими поток среды из и обратно в слой среды (12). Для осуществления доступа в секцию роста органов (3) могут предусматриваться дополнительные отверстия, предпочтительно, к полостям для органов (4, 4а, 4b), при загрузке клеток в полости для органов (4, 4а, 4b) и/или полость для стволовых клеток (9), которые могут закрываться позднее соответствующими средствами, которые описаны выше. Верхний закрывающий слой (14) также может содержать поверхностные структуры, специфичные для органов, в области секции роста органов (3), которые частично или полностью покрывают секцию роста органов (3) или полости для органов (4, 4а, 4b). Материалом верхнего закрывающего слоя (14) является SiO2 или стекло, наиболее предпочтительно стекло.
Слой полостей для органов (15) содержит одну или несколько полостей для органов (4, 4а, 4b) и/или полости для стволовых клеток (9) и, необязательно, микрожидкостные каналы. Если дано, что слой полостей для органов содержит полости для органов, это подразумевает, что большая часть объема полости для органов (4, 4а, 4b) предусматривается в слое полостей для органов (15), что обеспечивает боковые стороны полости для органов. Слой полостей для органов (15) предпочтительно имеет толщину от 100 мкм до 10 мм, предпочтительно, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 200, 250, 300, 350, 400, 550, 600, 650, 700, 750, 800, 850, 900, 1000 мкм, 1,5, 1,6, 1,7, 1,8, 1,9 или 2,0 мм. Особенно предпочтительная толщина составляет 250-750 мкм для осуществления непрерывного мониторинга клеток в полости для органов и/или полости для стволовых клеток при помощи просвечивающей микроскопии. Толщина слоя полостей для органов (15) выбирается так, чтобы обеспечивался объем, необходимый для полости для органов (4, 4а, 4b). Материалом слоя полостей для органов (15) является SiO2 или стекло, наиболее предпочтительно SiO2.
Нижний закрывающий слой (16) предпочтительно имеет толщину от 20 мкм до 2 мм, предпочтительно, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350, 400, 550 или 600 мкм. Он жидкостно отделяет микрожидкостные каналы и/или отверстия в слое полостей для органов (15) от внешнего окружения, т.е., предпочтительно, он не содержит отверстий. Материалом нижнего закрывающего слоя (15) является SiO2 или стекло, наиболее предпочтительно стекло. Нижний закрывающий слой (16) предпочтительно содержит один или несколько следующего: средства нагрева (11), сенсорные средства, предпочтительно, термочувствительные устройства или электрические соединители для соединения с соответствующими электрическими соединителями (19) средств крепления (18).
Как описано выше, устройство «орган-на-чипе» согласно настоящему изобретению может доставляться к месту применения полностью собранным, а также может содержать все среды и/или добавки, необходимые для роста и дифференцировки соответствующих тканей, органоидов и/или органов. Так, в предпочтительном варианте осуществления резервуар для подачи среды (2) содержит среду для роста клеток.
В дополнительном аспекте настоящее изобретение относится к способу изготовления автономного устройства «орган-на-чипе» (1), включающий этапы связывания непроницаемым для жидкостей образом слоя среды (12) со слоем секций роста органов (13) или его частями. Это связывание может достигаться известными в данной области адгезивами или, в зависимости от соответствующих материалов, путем сварки.
Устройство «орган-на-чипе» также может содержать источник энергии, например, аккумулятор, для обеспечения некоторых функций, например, микронакачивания, функций датчиков, независимости от каких-либо источников энергии, и может присоединяться к устройству «орган-на-чипе» через, например, средства крепления (18), как описано выше. Кроме того, устройство «орган-на-чипе» может содержать сигнальные средства, например, светодиоды и передатчики излучения, для внешнего сообщения состояния устройства «орган-на-чипе». Например, предполагается, что светодиод на устройстве «орган-на-чипе» мигает, если температура выходит за пределы заданного температурного интервала.
Автономное устройство «орган-на-чипе» можно перемещать, поскольку оно предпочтительно содержит все детали для независимого поддержания клеток, тканей, органоидов и/или органов. Однако, в предпочтительном варианте осуществления устройство «орган-на-чипе» помещается в специально адаптированный блок питания (17), поддерживающий автономное устройство «орган-на-чипе» (1) при функционировании. Указанный блок питания (17) содержит:
(a) средства крепления (18) для съемного крепления автономного устройства «орган-на-чипе» (1); и
(b) электрические соединители (19) для соединения соответствующих соединителей автономного устройства «орган-на-чипе» (1) с блоком питания (17).
Блок питания (17), как правило, содержит средства индикации, такие как, например, световые индикаторы или звуковые индикаторы, для оповещения оператора устройств об изменениях параметров устройства, таких как температура, насыщение кислородом, рН и т.д. Поскольку предполагается интеграция схемы, необходимой для настройки и оценки средств привода и датчиков, заключенных в устройстве «орган-на-чипе» (1), эти функции также возможно интегрировать в блок питания. В этих вариантах преимущественно то, что устройство «орган-на-чипе» является одноразовым и выбрасывается по истечении одного периода инкубации. Соответственно, предпочтительно, чтобы блок питания (17) содержал средства регулировки. Как правило, эти средства определяют, например, температуру в устройстве «орган-на-чипе», скорость потока жидкостей в устройстве «орган-на-чипе» или электрическую стимуляцию, которая может быть необходима для некоторых тканей, и приводят эти параметры в соответствие, например, с предварительно заданными параметрами.
В предпочтительном варианте осуществления блок питания (17) содержит средства крепления (18), которые позволяют закреплять, по меньшей мере, два устройства «орган-на-чипе» (1) одно над другим.
В дополнительном аспекте настоящее изобретение относится к способу создания органа и/или органоида в автономном устройстве «орган-на-чипе» (1). Этот способ включает этапы:
(a) загрузки суспензии клеток или среза ткани в одну или несколько полостей для органов (4, 4а, 4b), предпочтительно, в автономное устройство «орган-на-чипе» (1) в соответствии с первым, вторым или третьим вариантами его осуществления, описанным выше;
(b) герметизации одной или нескольких полостей для органов (4, 4а, 4b) непроницаемым для жидкостей образом.
Возможна непосредственная загрузка клеток и среза (срезов) ткани в полость для органов через отверстие, например, в верхнем закрывающем слое (14), при помощи соответствующих средств, таких как, например, микрошприц, или путем затекания вместе со средой через полость для органов клеток, которые затем прикрепляются к структурам и поверхностям, предусматриваемым в этих полостях. Такая загрузка может производиться как вручную, так и полностью автоматически. В последнем случае предпочтительно, чтобы шаговое устройство загружало любую необходимую среду, клетки или вещества через отверстие секции роста органов (3), способное герметизироваться, повторно герметизироваться или автоматически герметизироваться в зависимости от обстоятельств. Тип клеток, вводимых в полости для органов (4, 4а, 4b), зависит от органоида или органа, который создается. Суспензия клеток предпочтительно содержит тотипотентные или плюрипотентные стволовые клетки, коммитированные к направлению дифференцировки клетки, дифференцированные клетки, компоненты внеклеточного матрикса или их смеси. Особенно предпочтительно, чтобы срезы ткани загружались в полости для органов (4, 4а, 4b), поскольку они лишь вынуждены подвергаться повторной сборке в полости для органов без необходимости в правильной дифференцировке, как может происходить в случае, когда органоид или орган создается из стволовых клеток или других более дифференцированных клеток-предшественников.
Для изоляции полости для органов (4, 4а, 4b) от окружающей среды после загрузки клеток в полость для органов могут использоваться герметики, такие как фибриновый клей, напыляемая на повязку биосовместимая полимерная пленка или продукты коагуляции. Герметик предпочтительно обеспечивает непроницаемый для жидкостей, но при этом газопроницаемый слой или мембрану на отверстиях полостей для органов (4, 4а, 4b).
На последующем этапе автономное устройство «орган-на-чипе» (1) инкубируется до образования органа или органоида. Как правило, для завершения образования указанного органа или органоида требуется инкубация в течение, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней.
Признаком устройства «орган-на-чипе» является независимость от внешнего снабжения, в частности, средой и/или удалением сброса, поскольку соответствующие жидкостные соединения и резервуары уже предусмотрены в устройстве «орган-на-чипе». Инкубация предпочтительно производится в отсутствие внешнего контроля температуры и/или без обеспечения определенной атмосферы и/или без обеспечения внешней стерильности.
В дополнительном аспекте настоящее изобретение относится к способу тестирования влияния одного или нескольких тестовых соединений на один или несколько органов и/или органоидов, созданных в автономном устройстве «орган-на-чипе» (1). Этот способ включает следующие этапы:
(a) обеспечение автономного устройства «орган-на-чипе» (1), содержащего один или несколько органов и/или органоидов, или реализацию способа создания органа и/или органоида в автономном устройстве «орган-на-чипе» (1), как описано выше;
(b) добавление одного или нескольких тестовых соединений к органу и/или органоиду;
(c) микроскопическую оценку органа и/или органоида, и/или определение одного или нескольких параметров, определяемых одним или несколькими датчиками.
Датчики, используемые в данном способе, могут представлять собой датчики (8, 8а, 8b), которые осуществляют мониторинг среды, вытекающей из устройства «орган-на-чипе» или могут представлять собой датчики, расположенные внутри полости для органов.
В дополнительном аспекте настоящее изобретение относится к применению автономного устройства «орган-на-чипе» (1), содержащего один или несколько органов и/или органоидов, для тестирования эффектов одного или нескольких тестовых соединений на органы или органоиды, или для изучения функций органов или органоидов. Предпочтительно определяется эффективность, побочные эффекты, биобезопасность или образ действия одного или нескольких тестовых соединений.
Список позиций
(1) автономное устройство «орган-на-чипе»,
(2) резервуар для подачи среды,
(3) секция роста органов,
(4, 4а, 4b) полости для органов,
(5) резервуар для сброса среды,
(6) микрожидкостный канал подачи,
(7, 7а, 7b) микрожидкостные каналы сброса,
(8, 8а, 8b)датчики,
(9) полость для стволовых клеток,
(9а) полость ниши неонатальных стволовых клеток,
(9b) полость ниши пре- и постнатальных стволовых клеток
(9с) полость способствующей состоянию покоя ниши взрослых стволовых клеток,
(10) выпуск микрожидкостного канала подачи (6),
(11) средства нагрева,
(12) слой среды,
(13) слой секций роста органов,
(14) верхний закрывающий слой,
(15) слой полостей для органов,
(16) нижний закрывающий слой,
(17) блок питания,
(18) средства крепления,
(19) электрические соединители,
(20) средства индикации перегрева,
(21) вторичный поток жидкости,
(22) средства измерения полного сопротивления,
(23) датчик температуры.
Реферат
Группа изобретений относится к медицине и биологии и может быть использована для культивирования, исследования и тестирования тестовых соединений на тканях, органоидах и нишах стволовых клеток в формате миниатюризированной интегральной схемы. Для этого предложены автономное устройство, способ его изготовления и применения для тестирования тестовых соединений на популяциях клеток, блок питания, а также способы культивирования клеток и органоидов, способ тестирования химических соединений на данных клетках. Автономное устройство «орган-на-чипе» содержит резервуары для подачи среды; секции роста органов с полостями для органов, в том числе, с полостью для стволовых клеток; резервуары для сброса среды. Полость для органов посредством микрожидкостных каналов соединена с резервуаром для подачи среды и резервуаром для сброса среды и может быть соединена и/или содержать датчики. Посредством заявленного автономного устройства осуществляют культивирование клеток и органоидов, путем загрузки суспензии клеток или среза ткани в полости для органов, герметизации данных полостей, а также тестирование тестовых соединений на клетках и органоидах с последующей их микроскопической оценкой и определением параметров среды указанными датчиками. Такое соединение «полости для органов» с резервуаром для сброса среды, объединенного с контролируемым датчиками устройством, обеспечивает долговременное культивирование клеток, в том числе, в живом организме, и возможность перемещения данного устройства без отсоединения жидкостных каналов от внешнего резервуара для сброса, что обеспечивает автономность функционировани
Формула
(a) по меньшей мере, один резервуар для подачи среды (2); и
(b) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b);
(c) по меньшей мере, один резервуар для сброса среды (5); и
где резервуар для подачи среды (2) соединен, по меньшей мере, с одной секцией роста органов (3) посредством микрожидкостного канала подачи (6) и, по меньшей мере, с одной полостью для органов (4, 4а, 4b) и по меньшей мере, одна полость для органов (4, 4а, 4b) соединена, по меньшей мере, с одним резервуаром для сброса среды (5) посредством микрожидкостного канала сброса (7).
(a) биологически расщепляемых микроносителей;
(b) средств повышения давления;
(c) коллагеновой сети;
(d) зон кальцификации;
(e) капилляров, соединенных с дополнительным резервуаром для подачи среды;
(f) по меньшей мере, двух резервуаров, каждый из которых оснащен средствами пульсирующего повышения давления для обеспечения вторичного потока через полость для органов;
(g) одного или нескольких электродов;
(h) фибриновых гелей;
(i) гелей синтетических полипептидов;
(j) сшитых белков;
(k) тканых и/или нетканых полимерных волокон;
(l) сил электромагнитного поля;
(m) микронасосов;
(n) чувствительных веществ;
(о) датчиков; и
(р) оптических волокон.
(a) датчика рН;
(b) датчика pO2;
(c) датчика захвата анализируемого вещества;
(d) датчика проводимости;
(e) датчика плазменного резонанса;
(f) датчика температуры;
(g) датчика СО2;
(h) датчика NO;
(i) датчика хемотаксиса;
(j) датчика цитокинов;
(k) датчика ионов;
(l) потенциометрического датчика;
(m) амперометрического датчика;
(n) проточного датчика;
(о) датчика наполнения;
(р) датчика полного сопротивления;
(q) датчика проводимости;
(r) датчика электромагнитного поля;
(s) датчика поверхностных акустических волн (SAW); и
(t) датчика метаболизма.
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b); и
(b) по меньшей мере, один резервуар для сброса среды (5); и
где, по меньшей мере, одна полость для органов (4, 4а, 4b) содержит и/или соединена, по меньшей мере, с одним датчиком (8, 8а, 8b), и по меньшей мере, одна полость для органов (4, 4а, 4b) соединена, по меньшей мере, с одним резервуаром для сброса среды (5) посредством микрожидкостного канала сброса (7).
(a) биологически расщепляемых микроносителей;
(b) средств повышения давления;
(с) коллагеновой сети;
(d) зон кальцификации;
(e) капилляров, соединенных с дополнительным резервуаром для подачи среды;
(f) по меньшей мере, двух резервуаров, каждый из которых оснащен средствами пульсирующего повышения давления для обеспечения вторичного потока через полость для органов;
(g) одного или нескольких электродов;
(h) фибриновых гелей;
(i) гелей синтетических полипептидов;
(j) сшитых белков;
(k) тканых и/или нетканых полимерных волокон;
(l) сил электромагнитного поля;
(m) микронасосов;
(n) чувствительных веществ;
(о) датчиков; и
(р) оптических волокон.
(a) датчика рН;
(b) датчика рO2;
(c) датчика захвата анализируемого вещества;
(d) датчика проводимости;
(e) датчика плазмонного резонанса;
(f) датчика температуры;
(g) датчика СО2;
(h) датчика NО;
(i) датчика хемотаксиса;
(j) датчика цитокинов;
(k) датчика ионов;
(l) потенциометрического датчика;
(m) амперометрического датчика;
(n) проточного датчика;
(о) датчика наполнения;
(р) датчика полного сопротивления;
(q) датчика проводимости;
(r) датчика электромагнитного поля;
(s) датчика поверхностных акустических волн (SAW); и
(t) датчика метаболизма.
(a) по меньшей мере, одну секцию роста органов (3), содержащую, по меньшей мере, одну полость для органов (4, 4а, 4b), и
(b) по меньшей мере, один резервуар для сброса среды (5),
где секция роста органов (3) содержит полость для стволовых клеток (9), и по меньшей мере, одна полость для органов (4, 4а, 4b) соединена, по меньшей мере, с одним резервуаром для сброса среды (5) посредством микрожидкостного канала сброса (7).
(a) биологически расщепляемых микроносителей;
(b) средств повышения давления;
(c) коллагеновой сети;
(d) зон кальцификации;
(e) капилляров, соединенных с дополнительным резервуаром для подачи среды;
(f) по меньшей мере, двух резервуаров, каждый из которых оснащен средствами пульсирующего повышения давления для обеспечения вторичного потока через полость для органов;
(g) одного или нескольких электродов;
(h) фибриновых гелей;
(i) гелей синтетических полипептидов;
(j) сшитых белков;
(k) тканых и/или нетканых полимерных волокон;
(l) сил электромагнитного поля;
(m) микронасосов;
(n) чувствительных веществ;
(о) датчиков; и
(р) оптических волокон.
(a) датчика рН;
(b) датчика pO2;
(c) датчика захвата анализируемого вещества;
(d) датчика проводимости;
(e) датчика плазменного резонанса;
(f) датчика температуры;
(g) датчика CO2;
(h) датчика NO;
(i) датчика хемотаксиса;
(j) датчика цитокинов;
(k) датчика ионов;
(l) потенциометрического датчика;
(m) амперометрического датчика;
(n) проточного датчика;
(о) датчика наполнения;
(р) датчика полного сопротивления;
(q) датчика проводимости;
(r) датчика электромагнитного поля;
(s) датчика поверхностных акустических волн (SAW); и
(t) датчика метаболизма.
(а) средства крепления (18) для съемного закрепления автономного устройства «орган-на-чипе» (1), и
(b) электрические соединители (19) для соединения соответствующих соединителей автономного устройства «орган-на-чипе» (1) с блоком питания (17).
(a) загрузки суспензии клеток или среза ткани в одну или несколько полостей для органов (4, 4а, 4b), и
(b) герметизации одной или нескольких полостей для органов (4, 4а, 4b) непроницаемым для жидкостей образом.
(a) обеспечение автономного устройства «орган-на-чипе» (1) по пп.1-82, содержащего один или несколько органов и/или органоидов, или
реализацию способа создания органа и/или органоида по пп.88-92 в автономном устройстве «орган-на-чипе» (1);
(b) добавление к органу и/или органоиду одного или нескольких тестовых соединений;
(c) микроскопическую оценку органа и/или органоида; и/или
определение одного или нескольких параметров, определяемых одним или несколькими датчиками (8, 8а, 8b).

Комментарии