Внутриклеточная доставка - RU2656156C2
Код документа: RU2656156C2
Чертежи



























Описание
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет временной заявки США №61/548013, поданной 17 октября 2011 года, и временной заявки США №61/684301, поданной 17 августа 2012 года, содержание каждой из которых включено в настоящее описание в качестве ссылки.
ЗАЯВЛЕНИЕ О ФЕДЕРАЛЬНО СПОНСИРУЕМОМ ИССЛЕДОВАНИИ
Настоящее изобретение было осуществлено по меньшей мере частично при поддержке правительства по гранту 5 RC1 EB011187-02, выданному National Institute of Health. Правительство имеет определенные права на настоящее изобретение.
УРОВЕНЬ ТЕХНИКИ
Разработка многих фармацевтических препаратов в большой степени сфокусирована на низкомолекулярных лекарственных средствах. Эти лекарственные средства называются так вследствие их относительно небольшого размера, который позволяет им свободно диффундировать в организме, достигая их мишени. Эти молекулы также способны проникать через в ином случае непроницаемую клеточную мембрану по большей части беспрепятственно. Однако лекарственные средства следующего поколения на основе белков, ДНК или РНК не могут беспрепятственно проходить через клеточную мембрану и, таким образом, для облегчения их доставки требуется клеточная модификация. В общепризнанных способах используются химические вещества и электрические импульсы для прохождения через мембрану и доставки материала в цитоплазму. Надлежащая внутриклеточная доставка является критической стадией в этом исследовании, разработке и осуществлении лекарственных средств следующего поколения.
Существующие способы часто трудно разработать и они являются высокоспецифическими в отношении их конкретного применения. Более того, существующие способы не направлены надлежащим образом на многие клинически важные типы клеток, такие как стволовые клетки и иммунные клетки. Таким образом, существует потребность в более надежном и точном способе, способном удовлетворить потребности современных биологических/медицинских исследований.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение основано на неожиданном открытии, что контролируемое повреждение, например, осуществление воздействия на клетку сжатия, быстрого растягивания, быстрого сдавливания или импульса с высоким усилием сдвига приводит к захвату молекул в цитоплазму клетки из окружающей клеточной среды. Таким образом, изобретение относится к безвекторной микрожидкостной платформе для внутриклеточной доставки прямо в цитозоль эукариотической клетки материалов, например, соединения или композиции. Устройство является пригодным в качестве универсального и широко применимого лабораторного инструмента для доставки желаемых молекул в клетки-мишени. Доставка молекул в клетку с использованием способов, описанных в настоящем описании, является пропорциональной, например, линейно или монотонно скорости клеток через область сужения и/или сдавления. Например, 50 мкл суспензии клеток проходит через устройство за несколько секунд. Пропускная способность находится в диапазоне от 1 клетка/секунда на канал (или даже менее) до более чем 1000 клеток/секунда на канал. Типичные скорости клеток через сужение включают от 10 мм/секунда до 500 мм/секунда, хотя скорость клеток может составлять вплоть до 10 м/c (или даже выше). Дополнительные каналы можно помещать параллельно для увеличения общей пропускной способности системы.
Захват молекулы происходит посредством диффузии, а не эндоцитоза, т.е. груз (соединение(я), подлежащее доставке в клетку) находится в цитоплазме, а не в эндосомах после прохождения через устройство. В эндосомах после обработки клеток груз появляется в небольшом количестве или он не появляется. Например, крупные молекулы захватываются медленнее, чем молекулы меньших размеров. Контролируемое растяжение клеток и скорость движения клеток через сужение приводит к более высокой доставке молекул-мишеней при сохранении жизнеспособности и целостности клеток. После обработки жизнеспособность клеток составляет 70-100%, например, типичная жизнеспособность составляет 90% после обработки. При сравнении было показано, что предшествующие способы доставки с использованием высоких уровней сдвига отдельно в течение секунд или миллисекунд приводят к низкой жизнеспособности клеток после обработки. В противоположность предшествующим способам, способы по изобретению подвергают клетки сдвиговому импульсу в диапазоне 100-1000 Па в течение очень короткого периода времени (приблизительно 100 микросекунд) по мере того, как клетка проходит через сужение. Однако настоящие способы существенно отличаются от предшествующих способов. В настоящих способах предпочтительно происходит полная механическая деформация клетки по мере того, как она проходит через сужение, что может обеспечить сдвиговые усилия, отличающиеся от предшествующих способов. В предпочтительных вариантах осуществления клетки не подвергают воздействию электрического тока. В других вариантах осуществления используют комбинированную обработку, например, механическую деформацию с использованием устройства, описанного в настоящем описании, с последующей или предшествующей электропорацией (тип осмотической трансфекции, при которой используют электрический ток для обеспечения временных отверстий в клеточных мембранах, позволяя вхождение нуклеиновых кислот или макромолекул).
Груз представляет собой соединение или композицию, подлежащие доставке в клетку. Например, груз может включать белки, флуоресцентные красители, квантовые точки, углеродные нанотрубки, молекулы РНК, молекулы ДНК, антигены и другие макромолекулы, наночастицы и композиции.
Ширина сужения устройства, длина суженной части, геометрия области входа и глубина трубки устройства влияют на доставку молекул в клетку. Предпочтительно ширина суженной области трубки составляет не менее 4 мкм в диаметре, и длина суженной части трубки предпочтительно составляет 40-50 мкм. Длина суженной части, как правило, не превышает 90 мкм. Диаметр суженной части соответствует типу клетки, подлежащей обработке. Как описано ниже, диаметр является меньшим, чем диаметр клетки (например, 20-99% от диаметра клетки). Многие клетки имеют диаметр 5-15 мкм, например, дендритные клетки имеют диаметр 7-8 мкм. Например, диаметр области сужения составляет 4,5, 5, 5,5, 6 или 6,5 мкм для обработки единичных клеток. В другом примере размер/диаметр области сужения для обработки яйцеклетки человека составляет от 6,2 мкм до 8,4 мкм, хотя возможны сужения большего и меньшего размера (диаметр яйцеклетки человека составляет приблизительно 12 мкм). В другом примере эмбрионы (например, кластеры из 2-3 клеток) обрабатывают с использованием диаметра сужения от 12 мкм до 17 мкм.
Устройство и способы пригодны для разработки и изготовления вакцин с использованием специализированных антигенпредставляющих клеток, таких как дендритные клетки. Например, способ стимуляции представления антигена осуществляют, подвергая дендритную клетку контролируемому повреждению, такому как временное сжатие или импульс с высоким сдвиговым усилием, и контактируя дендритную клетку с раствором, содержащим антиген-мишень. Способ обеспечивает высоко активированные антигенпредставляющие клетки по сравнению с предшествующими способами стимуляции. Изготовление вакцины осуществляют, пропуская дендритные клетки или другие антигенпредставляющие клетки через содержащее сужение устройство (тем самым, подвергая клетки явлению быстрого растяжения), а затем инкубируя клетки в растворе, содержащем груз, например, антиген. Клетки подвергают периодическому культивированию в культуральной среде, содержащей один или несколько антигенов, после быстрой деформации клеток, однако клетки можно контактировать с антигеном до, в процессе и/или после явления/процесса быстрой деформации.
В циркулирующем буфере необязательно используют поверхностно-активные вещества (например, 0,1-10% масс./масс.) (например, полоксамер, сыворотка животного, белок-альбумин). На доставку молекул в клетки не влияет присутствие поверхностно-активных веществ; однако поверхностно-активные вещества необязательно используют для уменьшения закупорки устройства в процессе эксплуатации.
Устройство изготавливают из кремния, металла (например, нержавеющая сталь), пластмассы (например, полистирол), керамики или любого другого материала, пригодного для гравирования рельефа микронного масштаба и включает одну или несколько трубок или каналов, через которые проходят клетки. Кремний является особенно пригодным, поскольку способы формирования микрорельефа являются налаженными для этого материала, таким образом, проще изготовить новые устройства, изменить конструкцию и т.д. Кроме того, жесткость кремния может обеспечить преимущество над более мягкими субстратами, такими как полидиметилсилоксан (PDMS), например, более высокие уровни доставки. Например, устройство включает 2, 10, 20, 25, 45, 50 75, 100 или более каналов. Микрорельеф на устройстве формируют гравированием на кремнии. Клетки продвигают, например, проталкивают, через каналы или трубки с использованием давления. Клеточный привод может обеспечивать давление. Клеточный привод может включать, например, нагнетающий насос, газовый баллон, компрессор, вакуумный насос, шприц, шприцевой насос, перистальтический насос, ручной шприц, пипетку, поршень, капиллярный действующий элемент и гравитацию. В качестве альтернативы каналам клетки можно пропускать через сужение в форме сети или близко помещенных пластин. В любом случае, ширина сужения, через которое проходят клетки, составляет 20-99% от ширины или диаметра клетки, подлежащей обработке, в ее естественном, т.е. не подвергнутом стрессу, состоянии. Температура может влиять на захват композиций и влиять на жизнеспособность. Способы осуществляют при комнатной температуре (например, 20°C), физиологической температуре (например, 39°C), температуре, превышающей физиологическую температуру, или сниженной температуре (например, 4°C), или при температурах между этими иллюстративными температурами.
После контролируемого повреждения клетки посредством сужения, растяжения и/или импульса с высоким усилием сдвига клетки инкубируют в растворе для доставки, который содержит соединение или молекулу, которые желают ввести в клетку. Контролируемое повреждение может характеризоваться как небольшой, например диаметром 200 нм, дефект в клеточной мембране. Для закрытия повреждения, вызванного прохождением через сужение, период восстановления для клеток составляет порядка нескольких минут. Период доставки составляет 1-10 минут или более, например, 15, 20, 30, 60 минут или более, причем 2-5 минут являются оптимальными при работе при комнатной температуре. Более длительные периоды инкубации в растворе для доставки необязательно обеспечивают увеличенный захват. Например, данные показали, что после 5 минут клетки захватывают мало дополнительного материала или не захватывают его.
Таким образом, изобретение относится к решению длительно существовавших проблем в области доставки лекарственного средства к клеткам и устранению недостатков предшествующих способов.
Что касается доставки материала в эукариотическую клетку, клетки можно классифицировать на две основных категории:
1) Простые для доставки (ETD) клетки: Большинство доступных химических и вирусных способов относятся к этой категории. Простые для доставки клетки часто не имеют прямого клинического значения.
2) Трудные для доставки (DTD) клетки: Высокое клиническое значение. Достижения в технологии доставки могут значительно облегчить/ускорить разработку новых способов терапии. Эта категория включает стволовые клетки, первичные клетки и иммунные клетки. Ожидается, что рынок доставки DTD значительно вырастет по мере ускорения разработки новых терапевтических средств на основе РНК, стволовых клеток и белков в последующие годы.
Способы, описанные в настоящем описании, оказались особенно пригодными для областей разработки DTD, хотя некоторые способы можно использовать для клеток ETD. Кроме того, они облегчают доставку материалов (таких как квантовые точки, углеродные нанотрубки и антитела), которые нельзя эффективно доставить никаким другим способом как в клетки ETD, так и в клетки DTD.
Как правило, в одном аспекте вариант осуществления изобретения может относиться к микрожидкостной системе для обеспечения разрывов клеточной мембраны, причем система включает микрожидкостный канал, определяющий просвет и имеющий такую конфигурацию, что клетка, суспендированная в буфере, может проходить через него, где микрожидкостный канал включает сужение, где диаметр сужения является функцией диаметра клетки.
Варианты осуществления изобретения также могут обеспечить один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки, проходящей через него. Поперечное сечение канала выбрано из группы, состоящей из округлого, эллиптического, удлиненного щелевого, квадратного, шестиугольного и треугольного. Сужение включает область входа, центральную точку и область выхода. Область входа определяет угол сужения, где угол сужения оптимизирован для уменьшения закупорки канала. Микрожидкостная система, кроме того, включает множество микрожидкостных каналов, расположенных параллельно, например, 2, 5, 10, 20, 40, 45, 50, 75, 100, 500, 1000 или более.
Как правило, в другом аспекте варианты осуществления изобретения также обеспечивают способ доставки соединения в клетку, причем способ включает предоставление клетки в суспензии или суспендирование клетки и груза в растворе, пропускание раствора через микрожидкостный канал, который включает сужение, изменение размера сужения в зависимости от диаметра клетки, пропускание клетки через сужение так, чтобы к клетке применялось давление, вызывающее разрывы в клетке, достаточно крупные, чтобы груз прошел через них, и инкубацию клетки в растворе в течение заданного периода времени после того, как он пройдет через сужение.
Варианты осуществления изобретения также могут обеспечивать один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки. Поперечное сечение микрожидкостного канала выбрано из группы, состоящей из кругового, эллиптического, удлиненного щелевого, квадратного шестиугольного и треугольного. Прохождение раствора включает прохождение раствора через область вхождения, центральную точку и область выхода из сужения. Кроме того, способ включает уменьшение закупорки микрожидкостного канала путем корректирования угла сужения в области входа. Прохождение раствора включает прохождение раствора через множество микрожидкостных каналов, расположенных параллельно.
Как правило, в другом аспекте варианты осуществления изобретения также могут обеспечить способ доставки соединения в клетку, причем способ включает предоставление клетки в растворе или суспендирование клетки в растворе, прохождение раствора через микрожидкостный канал, который включает сужение, изменение размера сужения в зависимости от диаметра клетки, прохождение клетки через сужение так, чтобы к клетке применялось давление, вызывающее разрывы в клетке, и инкубацию клетки в растворе, содержащем груз, в течение заданного периода времени после того, как он проходит через сужение, где разрывы являются достаточно большими, чтобы груз проходил через них.
Варианты осуществления изобретения также обеспечивают один или несколько из следующих признаков. Диаметр сужения составляет по существу 20-99% от диаметра клетки. Поперечное сечение микрожидкостного канала выбрано из группы, состоящей из кругового, эллиптического, удлиненного щелевого, квадратного шестиугольного и треугольного. Прохождение раствора включает прохождение раствора через область вхождения, центральную точку и область выхода из сужения. Кроме того, способ включает уменьшение закупорки микрожидкостного канала путем корректирования угла сужения в области входа. Прохождение раствора включает прохождение раствора через множество микрожидкостных каналов, расположенных последовательно и параллельно. Инкубация включает инкубацию клетки в течение от 0,0001 секунды до 20 минут (или даже более). Давление представляет собой давление сдвига и сдавления.
Как правило, в другом аспекте, варианты осуществления изобретения также обеспечивают способ доставки соединения в клетку, причем способ включает предоставление клетки в растворе или суспендирование клетки в растворе, деформацию клетки так, чтобы в мембране клетки возникали разрывы, и инкубацию клетки в растворе с грузом после деформации клеток.
Варианты осуществления изобретения также могут обеспечить один или несколько из следующих признаков. Деформация клетки включает деформацию клетки в течение от 1 мкс до 10 мс, например, 10 мкс, 50 мкс, 100 мкс, 500 мкс и 750 мкс. Инкубацию проводят в течение от 0,0001 секунд до 20 минут, например, 1 секунды, 30 секунд, 90 секунд, 270 секунд и 900 секунд.
Различные варианты осуществления изобретения могут обеспечить одну или несколько из следующих возможностей. По сравнению с предшествующими способами можно достигать большей точности и масштабируемости. Доставка материала к клетке может быть автоматизирована. Материал, такой как белки, РНК, миРНК (siRNA), пептиды, ДНК и не проникающий краситель можно вводить в клетку, такую как эмбриональные стволовые клетки или индуцированные плюрипотентные стволовые клетки (iPSC), первичные клетки или иммортализованные клеточные линии. Устройство и способы пригодны для любого типа клеток, и размер области сужения адаптируют к размеру клетки, подлежащей обработке. Устройства и способы могут обеспечить значительные преимущества. Например, экспериментальные искажения в настоящих системах могут быть снижены по сравнению с предшествующими способами. Доставляемые количества материала могут быть постоянными для популяции клеток. Клетки можно индивидуально обрабатывать, а не обрабатывать партией. Изобретение также продемонстрировало довольно уникальную возможность доставлять различные наночастицы и белки в цитозоль. Существующие способы являются недостаточно надежными и недостаточными в отношении выполнения таких функций.
Что касается доставки чувствительных грузов, например, белки (особенно крупные белки, например, более 30, 50, 100, 150, 200, 300, 400, 500 кДа или более), квантовые точки или другие грузы, которые являются чувствительными к электричеству или повреждаются под воздействием электричества, надежно доставляются в клетки при сохранении целостности и активности чувствительного груза. Таким образом, устройство и способы имеют значительные преимущества над существующими способами, такими как электропорация, которая подвергает композиции груза воздействию электричества (тем самым, повреждая груз) и приводят к низкой жизнеспособности (например, 505 или более клеток, как правило, погибают после электропорации). Другим преимуществом способа быстрого растяжения/деформации является то, что стволовые клетки или клетки-предшественники становятся восприимчивыми к захвату груза без изменения состояния дифференцировки или активности обработанной клетки. В дополнение к доставке композиций в цитоплазму клетки для терапевтических целей, например, изготовления вакцин, способ используют для введения молекул, например, больших молекул, содержащих поддающийся обнаружению маркер, для мечения внутриклеточных структур, таких как органеллы, или для мечения внутриклеточных компонентов для целей диагностики или визуализации.
Различные варианты осуществления изобретения также могут обеспечить одну или несколько из следующих возможностей. ДНК можно доставлять в подлежащие доставке дозы клетки, такие как стволовые, первичные, иммунные клетки. Можно проводить доставку очень крупных плазмид (даже целых хромосом). Можно без труда проводить количественную доставку в клетку известного количества генной конструкции для исследования уровня экспрессии представляющего интерес гена и ее чувствительности к концентрации. Можно проводить доставку известных количеств последовательностей ДНК вместе с известным количеством ферментов, которые усиливают рекомбинацию ДНК, для достижения более простой/более эффективной стабильной доставки, гомологичной рекомбинации и сайт-специфического мутагенеза. Способы и устройства, описанные в настоящем описании, также могут быть пригодными для количественной доставки РНК для более эффективных/наглядных исследований РНК. Также можно без труда проводить доставку малой интерферирующей РНК (миРНК) в цитоплазму клетки.
Различные варианты осуществления изобретения также могут обеспечить одну или несколько из следующих возможностей. РНК можно доставлять в клетку для подавления РНК без необходимости в липосомах. Известные количества молекул РНК вместе с известными количествами молекул dicer можно доставлять для обеспечения стандартизованной эффективной РНК в множестве клеточных линий в различных условиях. мРНК можно доставлять в клетки для исследования аспектов регуляции экспрессии генов на посттрансляционном уровне. Могут быть возможными известные количества метки для РНК в целях исследования времени полужизни РНК и клеток. Можно достигать универсальной доставки белка. Известные количества белков-меток можно доставлять для исследований времени полужизни в клетках. Можно осуществлять доставку белков-меток в область расположения исследуемого белка. Известные количества меченых белков можно доставлять для исследования белок-белковых взаимодействий в клеточной среде. Можно осуществлять доставку меченых антител в живые клетки для иммунного окрашивания и вестерн-блоттинга на основе флуоресценции.
Различные варианты осуществления изобретения также могут обеспечивать одну или несколько из следующих клинических или исследовательских возможностей. Можно достигать количественной доставки лекарственных средств в клеточных моделях для улучшения скрининговых исследований и исследований дозировок. Способ можно использовать в качестве высокопроизводительного способа скрининга активности белка в цитозоле, чтобы помочь идентифицировать белковые терапевтические средства или понять механизмы заболевания. Такие применения в настоящее время строго ограничиваются современными способами доставки белков вследствие их неэффективности. Устройства и способы пригодны для внутриклеточной доставки лекарственных средств в конкретную подгруппу циркулирующих клеток крови (например, лимфоциты), высокопроизводительной доставки сахаров в клетки для улучшения криоконсервации клеток, особенно ооцитов, направленной клеточной дифференцировки посредством введения белков, мРНК, ДНК и/или факторов роста, доставки генетического или белкового материала для индукции перепрограммирования клеток для получения клеток iPS, доставки ДНК и/или ферментов рекомбинации в эмбриональные стволовые клетки для разработки линий трансгенных стволовых клеток, доставки ДНК и/или ферментов рекомбинации в зиготы для получения трансгенных организмов, активации DC-клеток, получения iPSC, и дифференцировки стволовых клеток, доставки наночастиц для диагностики и/или механических исследований, а также введения квантовых точек. Также с использованием устройств и способов, описанных в настоящем описании, модифицируют клетки кожи, используемые для пластической хирургии.
Способ стимуляции представления антигена с использованием способа доставки антигена и/или иммуностимулирующих молекул обеспечивает антигенпредставляющие клетки, например, дендритные клетки, с увеличенными уровнями активности по сравнению с традиционными способами стимуляции, тем самым обеспечивая увеличенные уровни опосредуемого T и B-клетками иммунитета в отношении антигена-мишени. Таким образом, такой способ можно использовать в качестве средства активации иммунной системы в ответ на злокачественную опухоль или инфекции.
Для целей скрининга, визуализации или диагностики устройство используют в способе мечения клеток. Способ мечения клеток осуществляют, подвергая клетку контролируемому повреждению и контактируя клетки с раствором, содержащим поддающийся обнаружению маркер, где указанное повреждение включает временное сужение или импульс высокого сдвига. Поддающийся обнаружению маркер включает флуоресцентную молекулу, радионуклид, квантовые точки, золотые наночастицы или магнитные гранулы.
До изобретения манипулирование со стволовыми клетками для введения экзогенных композиций было трудным. Устройство и способы, описанные в настоящем описании, например, для пропускания стволовых клеток или клеток-предшественников, таких как индуцированные плюрипотентные стволовые клетки (iPSC), через канал с сужением, не индуцируют дифференцировку, но надежно индуцируют захват композиции в клетку. Например, в такие клетки вводят факторы дифференцировки. После захвата введенных факторов клетки проходят путь дифференцировки, определяемый введенным фактором, без осложнений, ассоциированных со способом, посредством которого фактор(ы) был введен в клетку.
В дополнение к отдельным клеткам, даже очень крупным клеткам, например яйцеклеткам, диаметром приблизительно 200 мкм, кластеры клеток, например, кластеры из 2-5 клеток, таких как эмбрион, содержащий 2-3 клетки, обрабатывают для захвата заданных композиций. Размер отверстия корректируют соответствующим образом, т.е. так, чтобы ширина сужения была немного ниже размера кластера. Например, ширина канала составляет 20-99% от ширины кластера клеток.
Клетки или кластеры клеток очищают/выделяют или обогащают желаемым типом клеток. Дендритные клетки или другие клетки, например, иммунные клетки, такие как макрофаги, B-клетки, T-клетки или стволовые клетки, такие как эмбриональные стволовые клетки или iPS, используемые в способах, очищают или увеличивают в количестве. Например, клетки выделяют или увеличивают в количестве посредством экспрессии на них маркеров клеточной поверхности или других идентифицирующих характеристик. Дендритные клетки идентифицируют и выделяют благодаря экспрессии ими β-интегрина, CD11c или других идентифицирующих маркеров клеточной поверхности. Что касается клеток, термин "выделенный" означает, что клетка по существу свободна от других типов клеток или клеточного материала, с которыми она встречается в природе. Например, образец клеток конкретного типа тканей или фенотипа является "по существу чистым", когда популяция клеток в нем составляет по меньшей мере 60%. Предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 99% или 100% препарата составляет популяция клеток. Чистоту измеряют подходящим стандартным способом, например, активируемой флуоресценцией сортировкой клеток (FACS).
Композиции груза, такие как полинуклеотиды, полипептиды или другие средства, являются очищенными и/или выделенными. В частности, как используют в рамках изобретения, "выделенная" или "очищенная" молекула нуклеиновой кислоты, полинуклеотид, полипептид или белок, являются по существу свободными от другого клеточного материала или культуральной среды при продуцировании рекомбинантными способами или химических предшественников или других химических веществ, когда они химически синтезированы. Очищенные соединения имеют по меньшей мере 60% по массе (масса сухого вещества) представляющего интерес соединения. Предпочтительно препарат имеет по меньшей мере 75%, более предпочтительно по меньшей мере 90%, и наиболее предпочтительно по меньшей мере 99% по массе представляющего интерес соединения. Например, очищенное соединение представляет собой соединение, которое имеет по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 98%, 99% или 100% (масс./масс.) желаемого соединения по массе. Чистоту измеряют любым подходящим стандартным способом, например, колоночной хроматографией, тонкослойной хроматографией или высокоэффективной жидкостной хроматографией (ВЭЖХ). Очищенный или выделенный полинуклеотид (рибонуклеиновая кислота (РНК) или дезоксирибонуклеиновая кислота (ДНК)) является свободным от генов или последовательностей, которые фланкируют его в его встречающемся в природе состоянии. Примеры выделенной или очищенной молекулы нуклеиновой кислоты включают: (a) ДНК, которая является частью встречающейся в природе молекулы геномной ДНК, но не фланкируется обеими последовательностями нуклеиновой кислоты, которые фланкируют эту часть молекулы в геноме организма, в котором она встречается в природе; (b) нуклеиновую кислоту, встроенную в вектор или в геномную ДНК прокариотического или эукариотического организма так, чтобы полученная молекула не была идентична какому-либо встречающемся в природе вектору или геномной ДНК; (c) отдельную молекулу, такую как кДНК, геномный фрагмент, фрагмент, продуцируемый полимеразной цепной реакцией (ПЦР), или фрагмент рестрикции; и (d) рекомбинантную нуклеотидную последовательность, которая является частью гибридного гена, т.е. гена, кодирующего слитый белок. Выделенные молекулы нуклеиновой кислоты в соответствии с настоящим изобретением дополнительно включают молекулы, продуцируемые синтетически, а также любые нуклеиновые кислоты, которые изменены химически и/или которые имеют модифицированные основные цепи.
Суспензионный раствор представляет собой любой физиологический или совместимый с клеткой буфер или раствор. Например, суспензионный раствор представляет собой клеточную культуральную среду или фосфатно-солевой буфер. Груз представляет собой тот же самый или отличающийся суспензионный раствор, который также содержит композицию, предназначенную для доставки внутрь клетки.
Преимущества устройства включают избегание модификации желаемого груза и отсутствие необходимости в воздействии на груз каких-либо электромагнитных полей или других форм стресса. Что касается электропорации, было показано, что этот способ повреждает белки и является неэффективным в отношении доставки. Этот существенный недостаток не является проблемой в случае способа, описанного в настоящем описании; способ по настоящему изобретению особенно пригоден для доставки чувствительных грузов, например белков, в частности, крупных белков (например, от 40 кДа до 70 кДа, и вплоть до 120, 130, 150, 200 кДа или более), крупных конструкций нуклеиновых кислот (например, плазмиды и другие конструкции, содержащие полимеры нуклеиновой кислоты размером 1 т.п.н., 2 т.п.н., 5 т.п.н. или более и вплоть до целых хромосом), крупных соединений, а также квантовых точек (например, диаметром 12 нм) и других материалов, которые известны тем, что они являются чувствительными и легко повреждаются под воздействием электричества. Например, поверхностные лиганды на наночастице или квантовой точке могут повреждаться или могут становиться заряженными в ответ на электрическое поле, что, таким образом, приводит к агрегации частиц, тем самым ограничивая/устраняя их функциональность. Другим преимуществом способа контролируемого повреждения является время контактирования клеток с композицией для доставки. Особое значение для белков, которые являются чувствительными к протеазам, температурам, а также электричеству, имеет то, что клетки контактируют с раствором груза после обработки и в течение относительно короткого периода времени по сравнению с предшествующими способами. Микрожидкостный характер устройства также требует меньших рабочих объемов, тем самым экономя дорогостоящие исходные материалы и/или клетки. Устройство также может быть сопряжено с существующими способами доставки, такими как электропорация или липосомы, для обеспечения усиленной доставки относительно каждого способа по отдельности.
Функциональная активность доставляемого груза обратно коррелирует со сдвиговой нагрузкой на жидкость, т.е. физическая нагрузка на мембрану клетки, такая как растяжение клеточной мембраны, опосредует захват груза в большей степени, чем усилие сдвига. Общепринятые способы доставки наночастиц могут приводить к большему количеству материала, получающему доступ к внутриклеточной среде клетки; однако эти способы обеспечивают меньшую активность доставляемого материала по сравнению со способами, описанными в настоящем описании, вследствие того факта, что предшествующие способы приводят к изоляции доставляемого материала в эндосомах. Способы, описанные в настоящем описании, обеспечивают прямую доставку в цитозоль соединений/композиций, так чтобы меньшее количество груза, доставляемое в клетку, обеспечивало больший уровень функциональной активности доставляемых молекул вследствие их доступности для других компонентов цитозоля. Например, предшествующие способы доставки наночастиц обеспечили в 2-10 раз большее количество доставляемого материала в клетки, но с небольшой или отсутствием функциональной активности доставляемого материала вследствие изоляции в эндосомах. Устройства и способы по изобретению преодолевают этот недостаток предшествующих способов внутриклеточной доставки вследствие избегания эндосомального компартмента.
Дополнительные преимущества и признаки включают временной масштаб обработки и скорости клеток, которые являются значительно более высокими, чем для предшествующих подходов. Более того, другие способы не сдавливают клетки настолько, насколько настоящие способы, например, как определяют по размеру (диаметру) клетки относительно размера (диаметра) сужения (в качестве % от диаметра клетки). Это быстрое, мощное, но сублетальное, сдавление или деформация обеспечивает лучшие результаты в отношении прямого захвата груза в цитозоль клетками. Деформация клеток является быстрой, т.е. происходит в течение по существу от 1 мкс до 1 мс. Как правило, индуцированный чрезмерной деформацией стресс клетки может быть летальным для клетки, хотя в то же время недостаточный стресс не индуцирует разрывов в клетке. Таким образом, настоящее изобретение относится к способам и системам, которые обеспечивают достаточный стресс для индукции временных разрывов, но не чрезмерный стресс, чтобы разрывы оказались постоянными и летальными для клетки.
Любые из описанных выше способов осуществляют in vitro, ex vivo или in vivo. Для применений in vivo устройство может быть имплантировано в просвет сосуда, например, встроенный стент. Эти и другие возможности изобретения, а также само изобретение, станут более понятными после обзора следующих чертежей, подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1A представлена схематическая диаграмма микрожидкостной системы. Клетки подвергают воздействию доставляемого материала (груза) после пропускания через сужение.
На фиг. 1B представлена схематическая диаграмма микрожидкостной системы. Клетки подвергают воздействию доставляемого материала (груза) на протяжении всего процесса посредством суспендирования клеток в растворе, который включает доставляемый материал (груз) (например, клетки подвергают воздействию доставляемого материала до и после пропускания через сужение).
На фиг. 2A представлена схематическая диаграмма варианта осуществления микрожидкостной системы.
На фиг. 2B представлена иллюстрационная диаграмма микрожидкостной системы, на которой изображены глубина, ширина и длина.
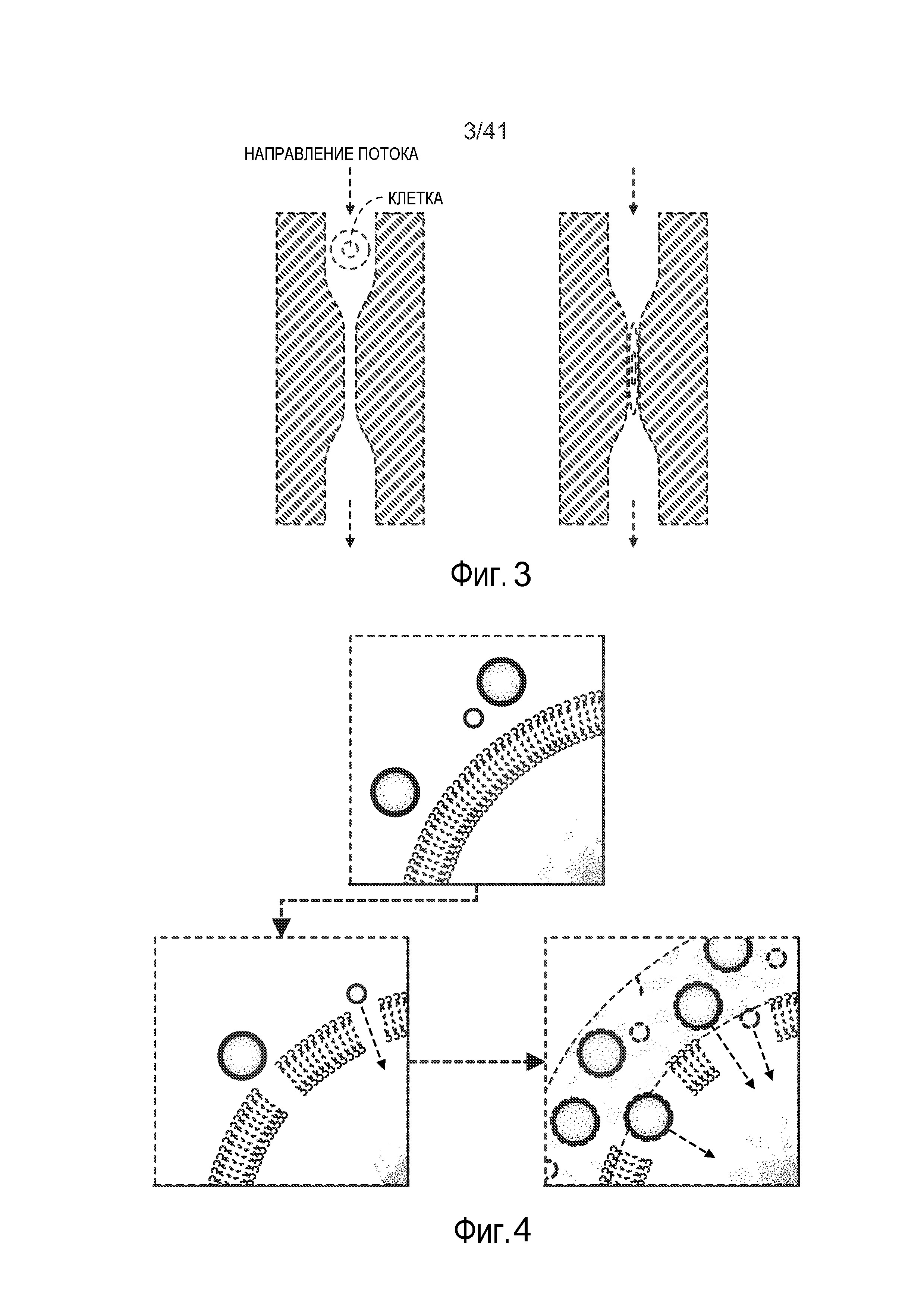
На фиг. 3 представлена схематическая диаграмма микрожидкостной системы.
На фиг. 4 представлена схематическая диаграмма, на которой показаны разрывы клеточной стенки.
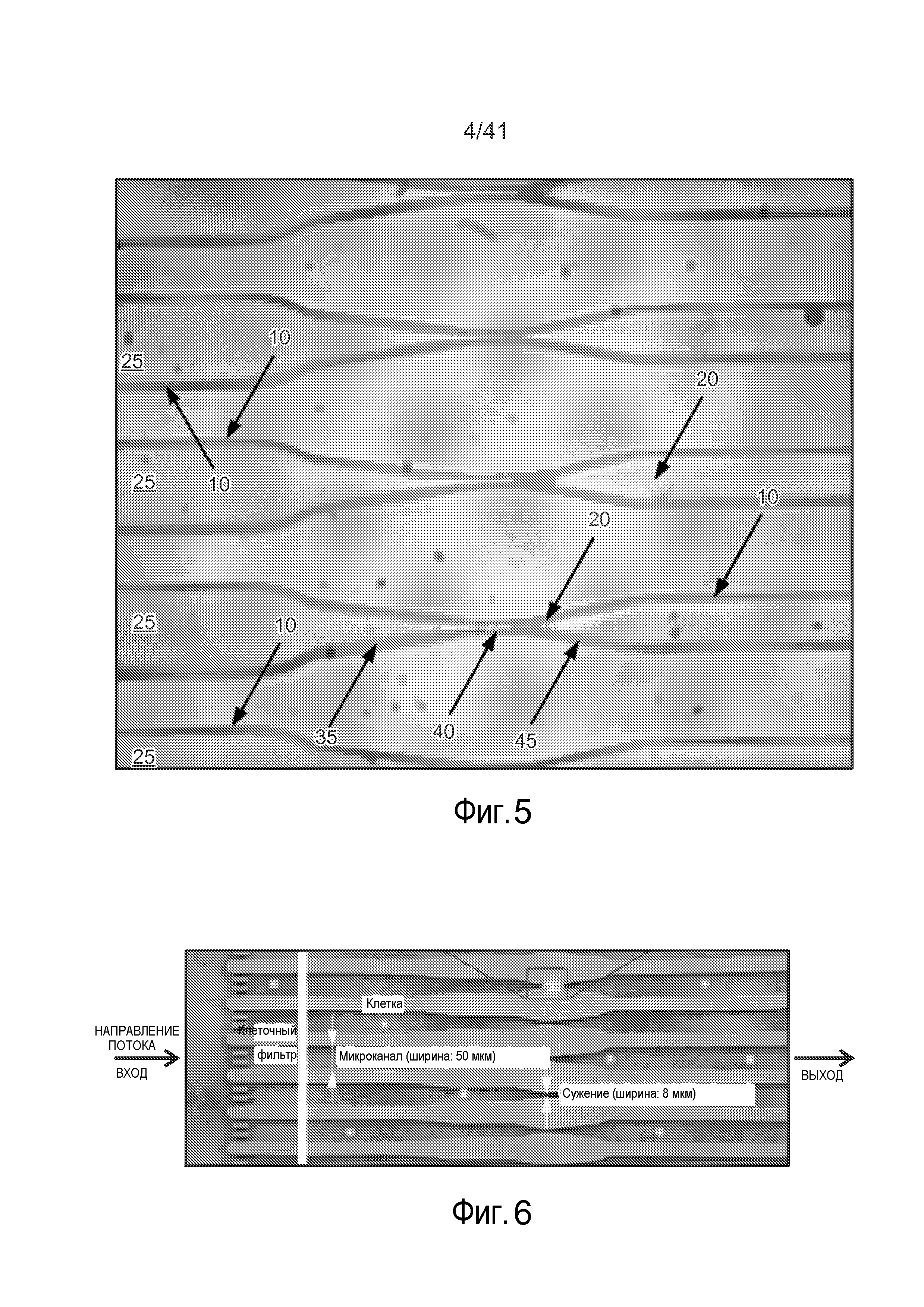
На фиг. 5 представлена фотография микрожидкостной системы.
На фиг. 6 представлена фотография микрожидкостной системы.
На фиг. 7 представлена фотография микрожидкостной системы.
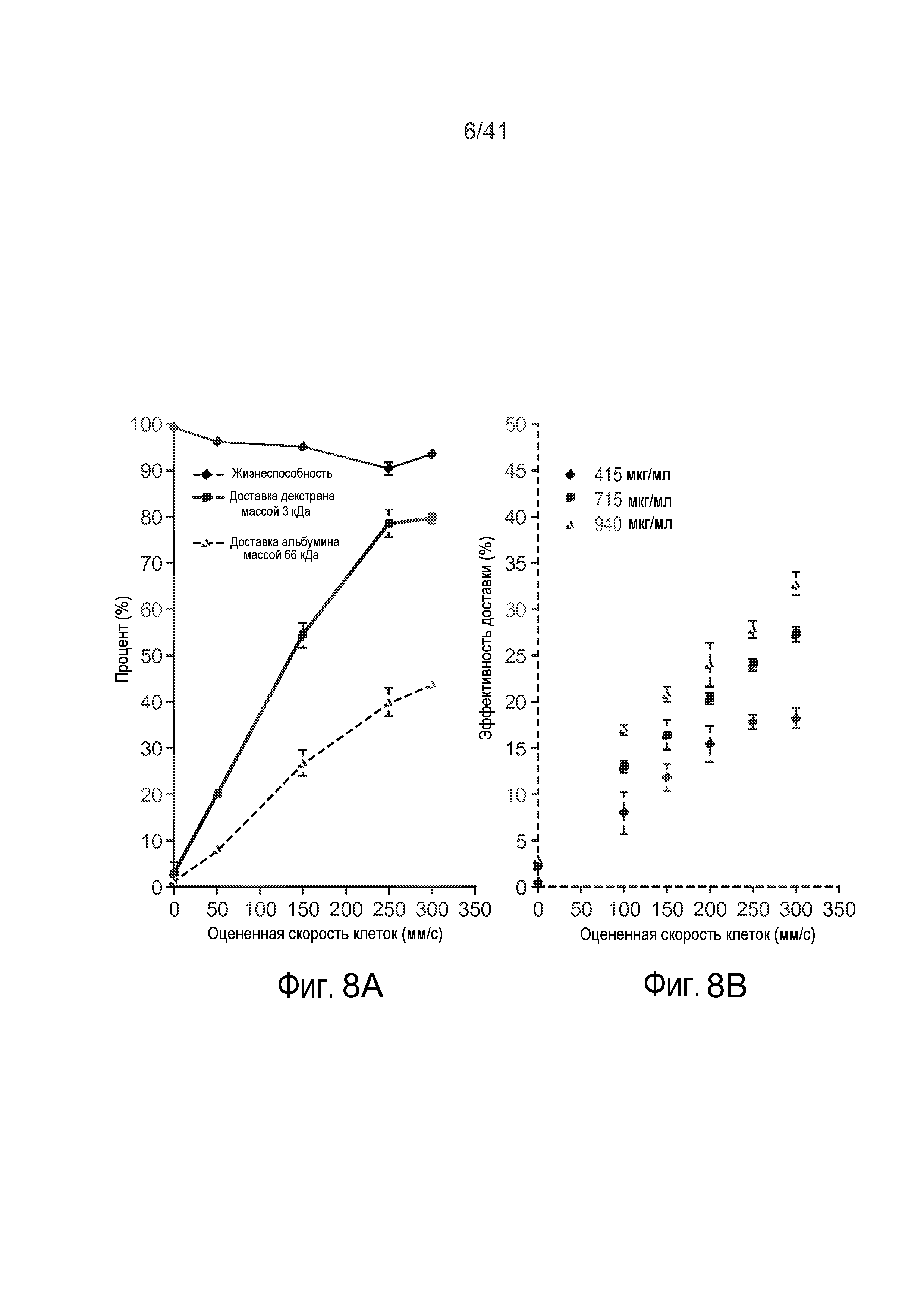
На фиг. 8A-8B представлены графики, на которых показаны иллюстративные результаты, полученные для микрожидкостной системы.
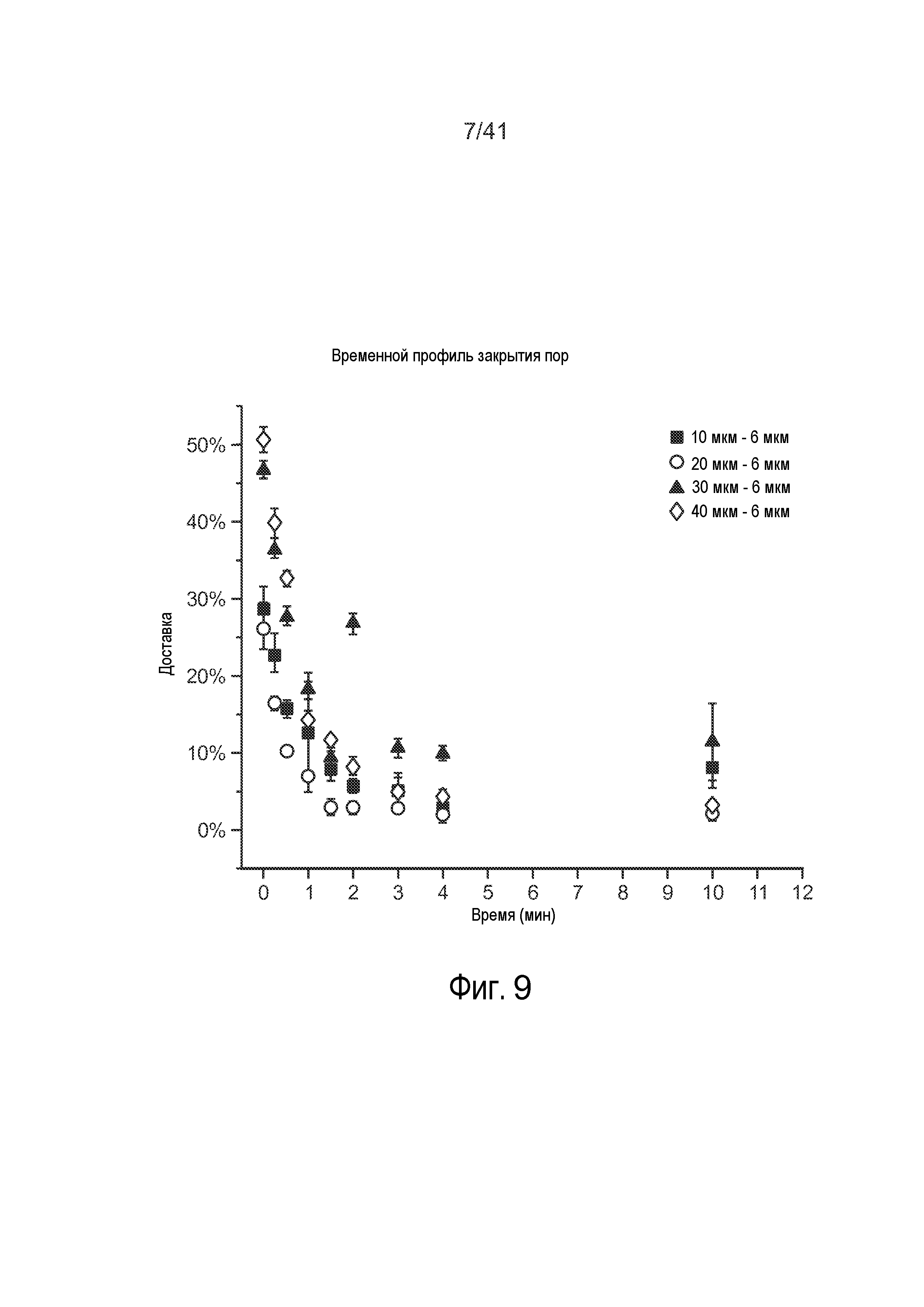
На фиг. 9 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 10 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 11 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 12 представлена схематическая диаграмма микрожидкостной системы.
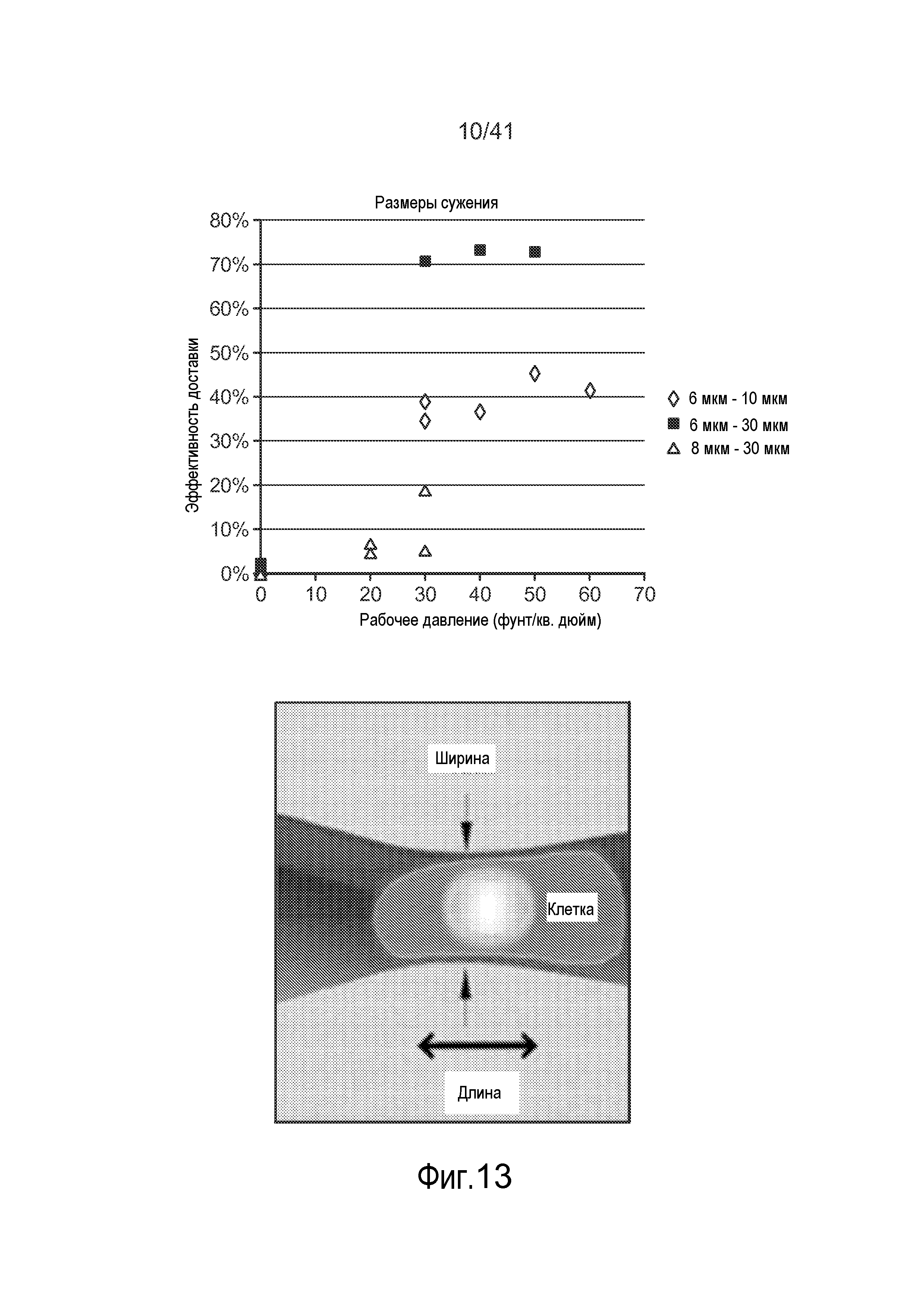
На фиг. 13 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
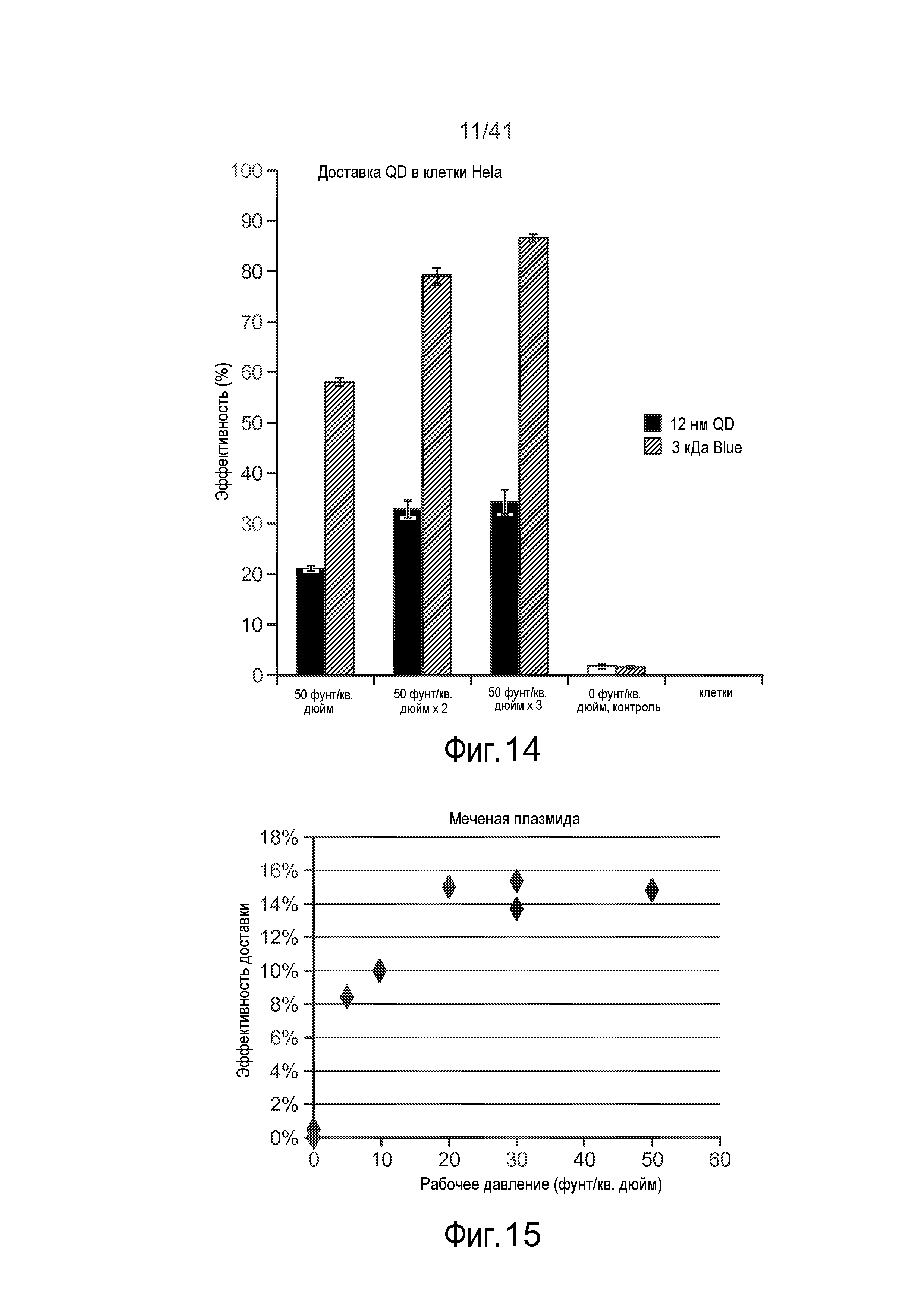
На фиг. 14 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 15 представлен график, на котором показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 16A-16F представлены иллюстративные схематические диаграммы микрожидкостных систем.
На фиг. 17 представлена проточная диаграмма, относящаяся к способу с использованием микрожидкостной системы.
На фиг. 18A-18B представлены графики, на которых показаны иллюстративные результаты, полученные для клеток, которые обрабатывали с использованием микрожидкостной системы.
На фиг. 19 представлено наложение трансмиссионных и конфокальных флуоресцентных изображений, за которыми следуют конфокальные флуоресцентные изображения z-сечения обработанных клеток, доставляемых с помощью квантовых точек (QD) с использованием настоящего изобретения.
На фиг. 20A проиллюстрирована эффективность доставки в цитозоль клеток HeLa при обработке с помощью настоящего изобретения посредством QD, покрытых полиимидазольным лигандом (PIL). Жизнеспособность клеток составляла >80% при измерении посредством проточной цитометрии.
На фиг. 20B иллюстрируется жизнеспособность клеток HeLa при доставке простых QD535 с помощью настоящего изобретения, при измерении по окрашиванию йодидом пропидия и с помощью проточной ицитометрии.
На фиг. 21 иллюстрируется модель конструкции, поглощение и стабильность в различных средах.
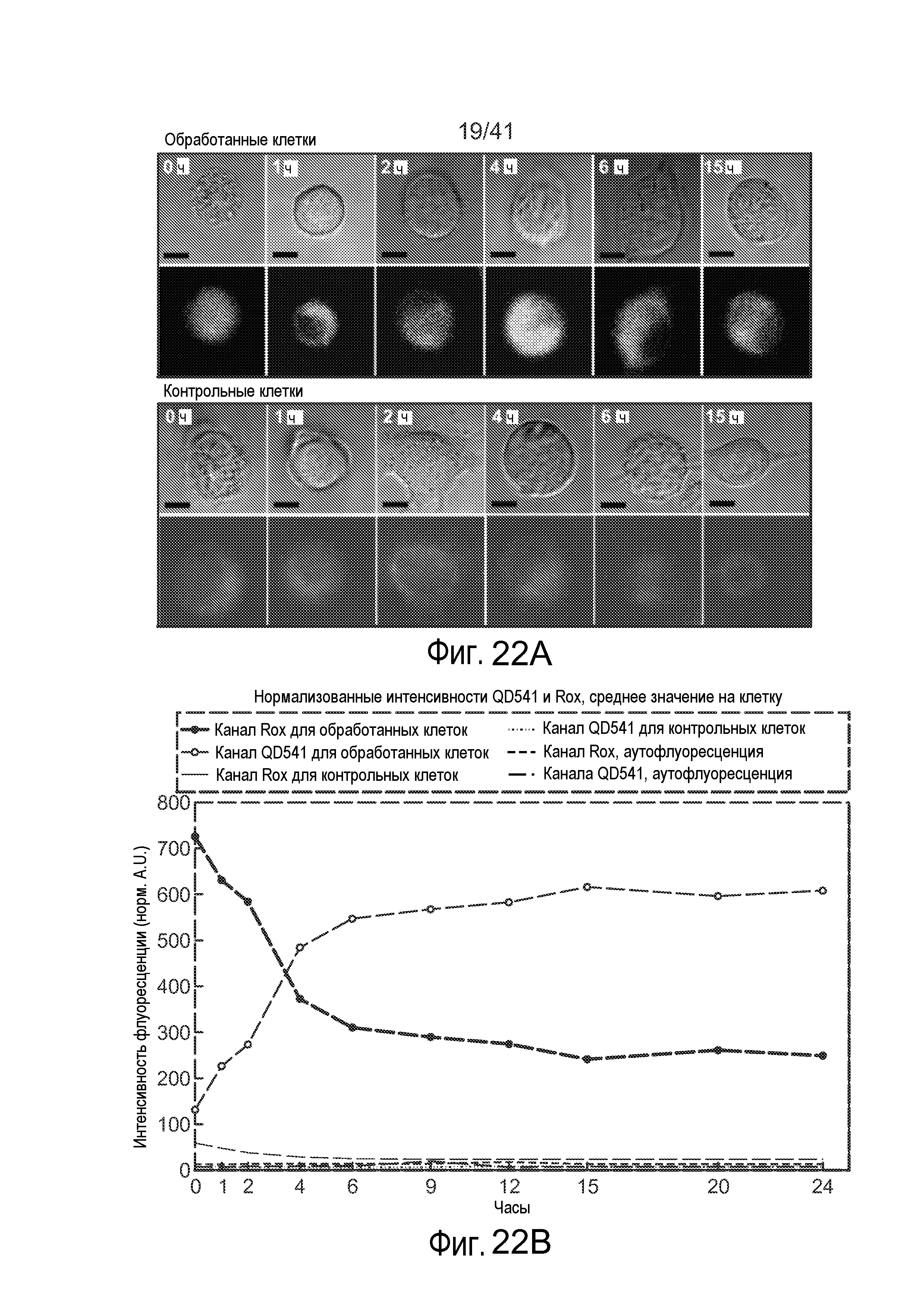
На фиг. 22A иллюстрируются изображения конфокальной микроскопии живых клеток для обработанных и контрольных клеток.
На фиг. 22B иллюстрируется изменение интенсивности обработанных клеток в зависимости от времени в зеленых и красных каналах.
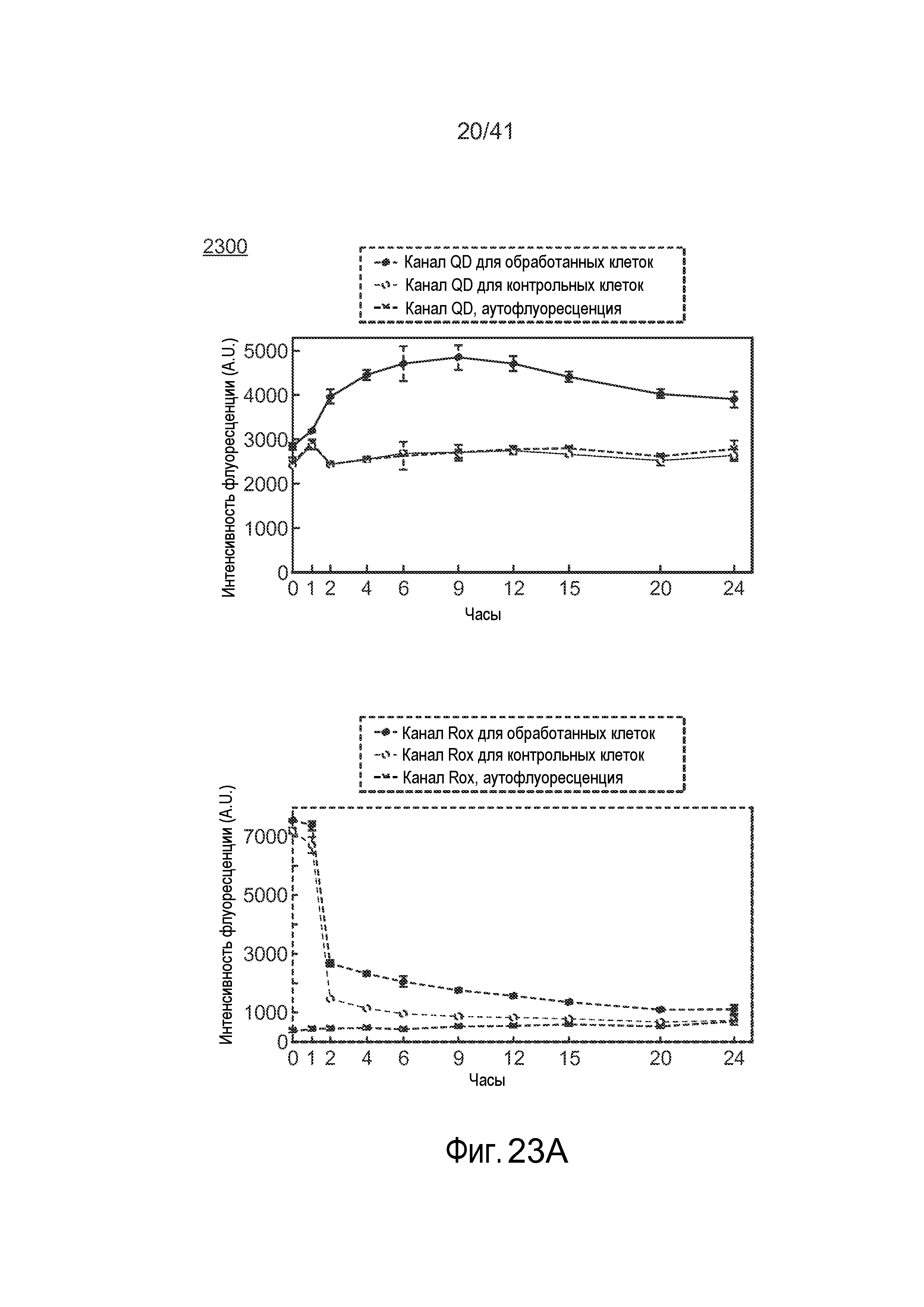
На фиг. 23 иллюстрируется измерение посредством проточной цитометрии средней флуоресценции и жизнеспособности клеток.
На фиг. 24 иллюстрируется эпифлуоресцентная визуализация неагрегированных единичных квантовых точек в цитозоле клеток после обработки с помощью устройства посредством 10 нМ раствора квантовых точек, и мерцающие следы трех квантовых точек с аутофлуоресценцией.
На фиг. 25 иллюстрируются результаты эксперимента, демонстрирующие, что эффективность доставки зависит от скорости клетки и конструкции сужения.
На фиг. 26 проиллюстрированы изображения различных горизонтальных плоскостей клеток HeLa после доставки конъюгированного с pacific blue 3 кДа декстрана, при измерении с помощью конфокальной микроскопии.
На фиг. 27 иллюстрируется упрощенная 2D-модель диффузии, которая имитирует пассивную диффузию материала в клетку через мембрану с порами.
На фиг. 28 иллюстрируются результаты двухуровневой доставки материала.
На фиг. 29 иллюстрируются данные, относящиеся к доставке миРНК, белка и наночастиц.
На фиг. 30 иллюстрируется применимость настоящего изобретения для различных типов клеток.
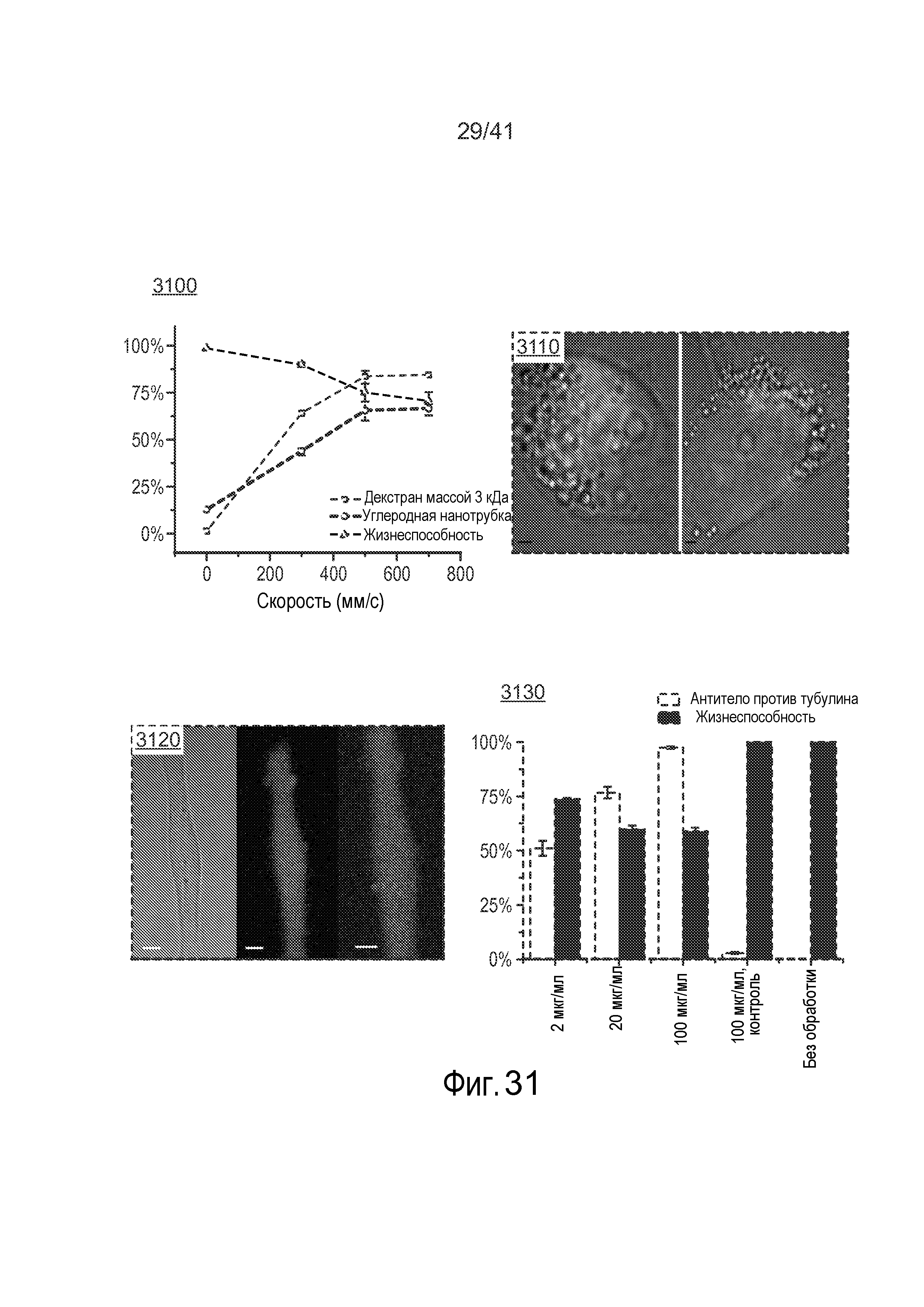
На фиг. 31 иллюстрируются данные доставки наноматериала и антитела.
На фиг. 32 иллюстрируются применения для доставки белка.
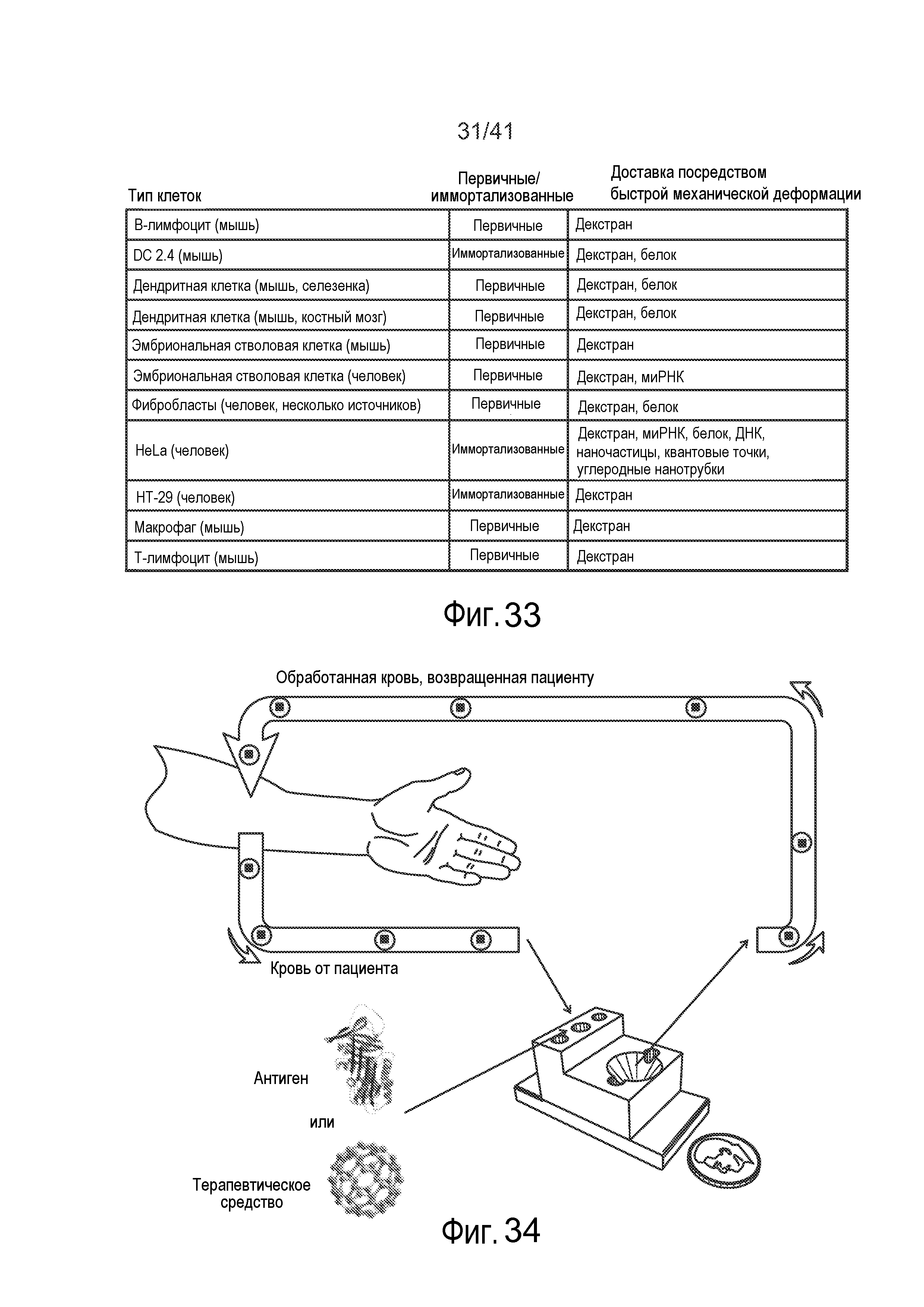
На фиг. 33 представлена таблица иллюстративных типов клеток, в которые был успешно доставлен груз.
На фиг. 34 представлена иллюстрация, на которой изображена система, в которой кровь пациента обрабатывают с помощью микрожидкостного устройства для доставки груза, такого как макромолекулы.
На фиг. 35 иллюстрируется эффективность доставки и жизнеспособность эмбриональных стволовых клеток человека, обработанных с помощью устройства 10 мкм-6 мкм для доставки груза.
На фиг. 36 представлено получение и охарактеризация линий iPSC мыши и человека посредством прямой доставки слитых перепрограммирующих белков с использованием настоящего изобретения.
На фиг. 37 представлены результаты перепрограммирования белков и представлена экспрессия маркера эмбриональных стволовых клеток человека Oct4, SSEA-4, Tra-60, Tra-80, щелочной фосфатазы (AP) в колониях iPSC.
На фиг. 38 представлены микрофотографии, иллюстрирующие устройство, модифицированное посредством встроенных электродов на любую сторону сужения посредством фотолитографического формирования рельефа и нанесения Au для внесения локализованного электрического поля в канал, тем самым комбинируя деформацию клеток с электропорацией.
На фиг. 39 представлен другой вариант осуществления микрожидкостной системы, где область вхождения имеет угол сужения 90 градусов.
На фиг. 40A и 40B представлены графики, на которых показано сравнение жизнеспособности и эффективности доставки между устройством в соответствии с иллюстративным вариантом осуществления, представленным на фиг. 2A, и устройством в соответствии с иллюстративным вариантом осуществления, представленным на фиг. 39.
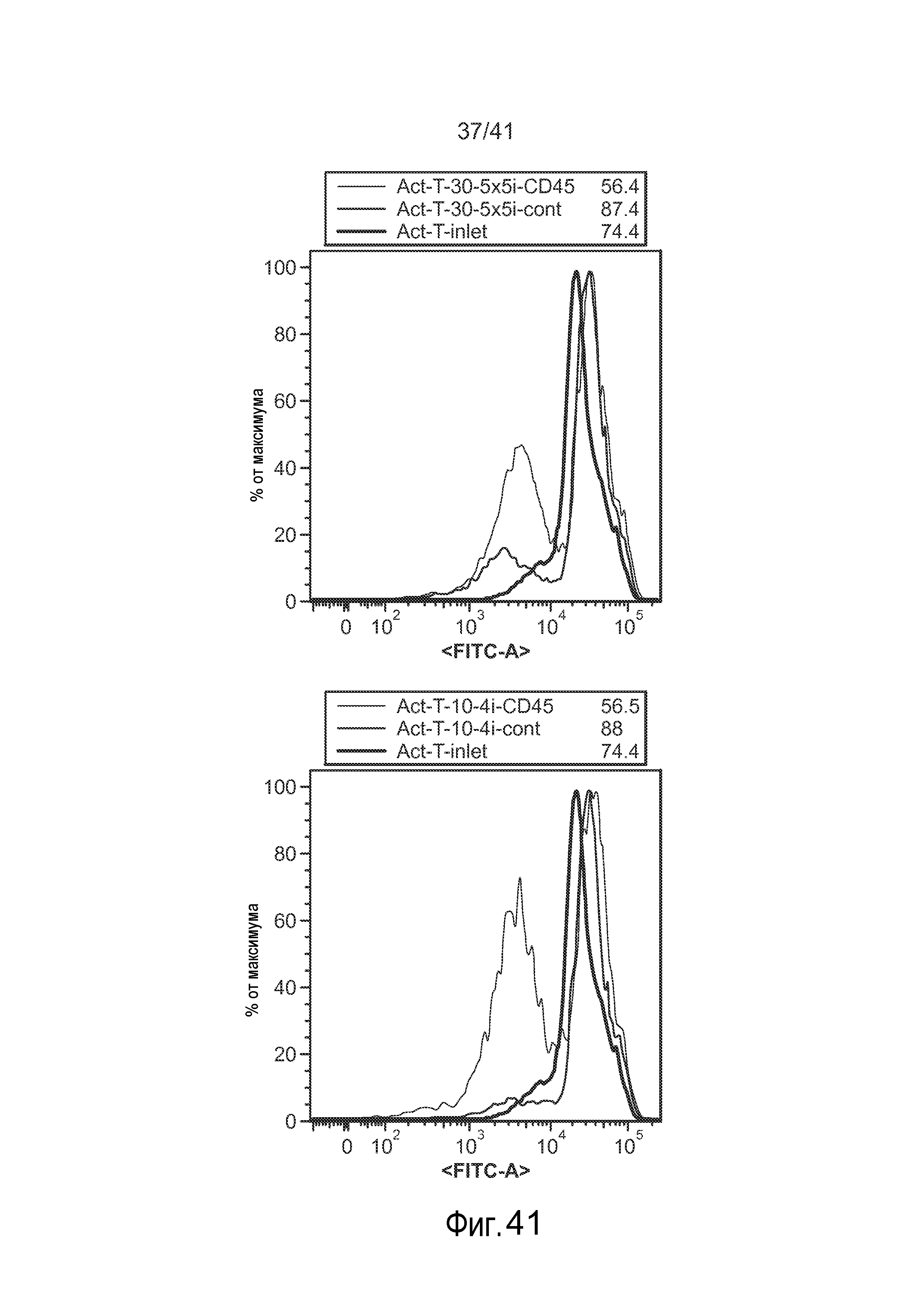
На фиг. 41 представлена гистограмма экспрессии CD45 в активированных T-клетках при измерении с помощью антитела к CD45 с Alexa 488. Клетки, которые обрабатывали с помощью устройства в присутствии РНК для подавления CD45, проявляют более низкий пик интенсивности флуоресценции, тем самым указывая на нокдаун экспрессии гена CD45.
На фиг. 42 представлена иллюстрация, на которой показано несколько иллюстративных областей применения, таких как регенеративная медицина; иммунология; визуализация и сенсорное обнаружение; и вакцины против злокачественной опухоли и исследование злокачественной опухоли.
На фиг. 43A и 43B представлены гистограммы интенсивности проточной цитометрии контрольной популяции, которую подвергли воздействию конъюгированного с cascade blue декстрана массой 3 кДа, и популяции клеток, которую обрабатывали в устройстве 30 мкм-6 мкм, а затем подвергали воздействию декстрана массой 3 кДа.
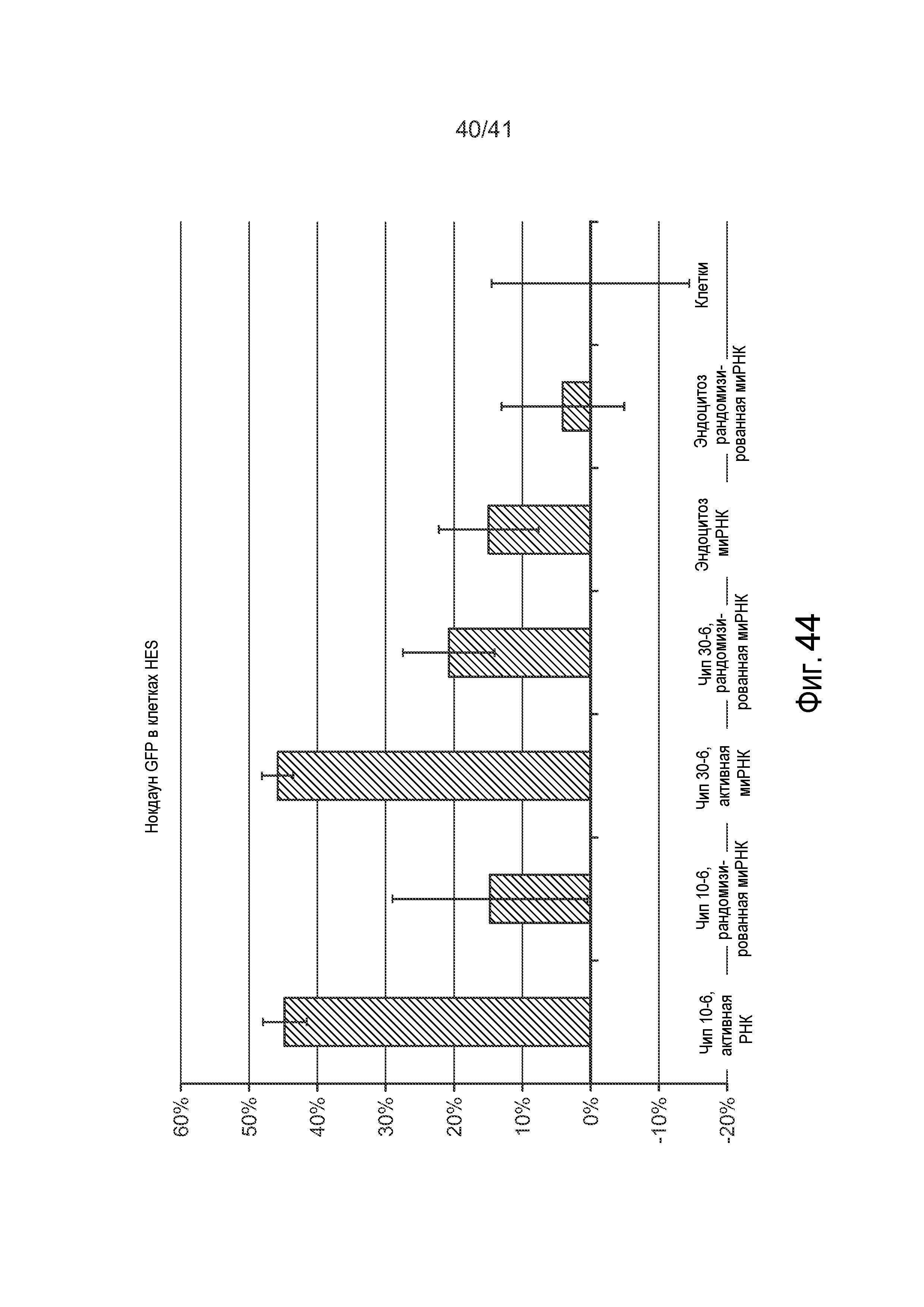
На фиг. 44 представлена столбиковая диаграмма, иллюстрирующая нокдаун GFP в эмбриональных стволовых клетках человека после обработки с использованием микрожидкостного устройства и сходных способов.
ПОДРОБНОЕ ОПИСАНИЕ
Варианты осуществления изобретения относятся к способам осуществления контролируемой деформации клетки в течение заданного количества времени для обеспечения разрывов в клеточной мембране, так чтобы материалы можно было доставлять внутрь клетки. Деформацию можно обеспечивать, например, посредством давления, индуцированного механической нагрузкой и сдвиговыми усилиями. В одном примере микрожидкостная система включает структуру, которая контролирует и/или манипулирует жидкостями посредством геометрического ограничения жидкостей в мелком масштабе (например, субмиллилитровые объемы, такие как микролитры, нанолитры и пиколитры). Микрожидкостная система способна к внутриклеточной доставке практически любого груза в клетку. Система состоит из одного или нескольких микрожидкостных каналов с сужением, через которые проходит клетка. Предпочтительно клетки проходят через микрожидкостный канал, будучи суспендированными в жидкой среде, которая пропускается через систему под давлением. Когда клетка проходит через сужение, ее мембрана нарушается, вызывая временные разрывы мембраны и обеспечивая захват груза, который присутствует в окружающей среде. Размер сужения зависит от размера клетки-мишени, однако предпочтительно он имеет тот же порядок или меньше, чем диаметр клетки. Множество сужений можно располагать параллельно и/или последовательно. Разрыв в клетке представляет собой отверстие в клетке, которое позволяет материалу извне клетки пройти в клетку (например, выемка, трещина, полость, отверстие, пора, щель, брешь, перфорация). Разрывы (например, поры или выемки), создаваемые способами, описанными в настоящем описании, не образуются в результате сборки субъединиц белков с образованием мультимерной структуры поры, такой как пора, создаваемая комплементом или бактериальными гемолизинами. Другие варианты осуществления находятся в пределах объема описанного изобретения.
Ссылаясь на фиг. 1-3, микрожидкостная система 5 включает канал 10, определяющий просвет трубки. Микрожидкостный канал 10 включает сужение 15, которое предпочтительно организовано так, что только одна клетка-мишень 20 может пройти через сужение 15 за один раз. Предпочтительно клетки 20 проходят через канал 10, будучи суспендированными в буферном растворе 25, который также включает доставляемые материалы 30, хотя доставляемые материалы можно доставлять в буферный раствор 25 после того, как клетки 20 пройдут через сужение 15. По мере того, как клетка 20 приближается и проходит через сужение 15, в сужении 15 применяется давление (например, механическое сдавление) на клетку 20, сдавливающее клетку 20 (например, показанную как клетка 201). Давление, примененное к клетке посредством сужения 15, вызывает разрывы (например, выемки, представленные на фиг. 4) в клеточной мембране (например, клетка 202). После прохождения клетки через сужение 15, клетка 20 начинает захватывать материал в буферном растворе 25 через выемки, включая доставляемый материал 30 (например, клетка 203). Клеточная мембрана восстанавливается стечением времени, и по меньшей мере часть доставляемого материала 30 предпочтительно остается захваченным в клетку.
Конфигурацию сужения 15 можно выполнять так, чтобы контролировать сужение клетки 20, тем самым контролируя давление, применяемое к клетке 20. Предпочтительно сужение 15 включает область 35 входа, центральную точку 40 и область 45 выхода. Например, диаметр(ы) сужения 15 можно варьировать для коррекции давления, применяемого к клетке (и как быстро это давление применяется/устраняется), и длину сужения 15 можно варьировать для коррекции количества времени, в течение которого давление применяют к клетке. В определенных конфигурациях физическое сужение клетки не требуется, вместо этого кратковременное воздействие на клетку необычно высокого уровня сдвига и/или уровня сдавления может вызывать желаемые разрывы. Как правило, отсутствует требование, касающееся внешнего диаметра микрожидкостной системы, и соотношение внутреннего диаметра и внешнего диаметра можно варьировать (например, более 5).
Диаметр центральной точки 40 может зависеть от диаметра клетки 20. Предпочтительно центральная точка 40 имеет тот же порядок или меньше, чем диаметр клетки 20 (например, 20-99% от диаметра клетки). Предпочтительно диаметр центральной точки 40 составляет от 60% до 70% от диаметра клетки, хотя оптимальный диаметр центральной точки может варьировать, в зависимости от применения и/или типа клетки. Иллюстративные диаметры центральной точки 40, которые использовали в предшествующих экспериментах, составляет 5-6 мкм и 7-8 мкм. Центральная точка 40 также может превышать диаметр клетки 20, но организована так, чтобы обеспечить импульс давления (например, сдвиг), который применяется к клетке 20. Такое давление можно применять к клетке 20 без прикосновения ее к стенкам канала 10. Сдвиг можно измерять известными способами (например, Journal of Applied Physics 27, 1097 (1956); Murphey et al.).
Угол сужения (например, на фиг. 2A) области 35 входа может варьировать (например, то, как быстро уменьшается диаметр). Угол сужения предпочтительно представляет собой угол, который минимизирует закупорку системы 5 во время прохождения через нее клеток. Угол области 45 выхода также может варьировать. Например, угол области 45 выхода организован так, чтобы снижать вероятность турбулентности/завихрений, которые могут привести к неламинарному потоку (например, диапазон 1-80 градусов). Стенки области 35 входа и/или области 45 выхода предпочтительно являются линейными, хотя возможны другие конфигурации (например, стенки могут быть искривленными).
Поперечное сечение канала 10, области 35 входа, центральной точки 40 и области 45 выхода могут варьировать. Например, различные поперечные сечения могут быть круговыми, эллиптическими, удлиненными щелевыми, квадратными, шестиугольными, треугольным и т.д. Длина центральной точки 40 также может варьировать, и ее можно корректировать так, чтобы варьировать количество времени, когда давление применяют к клетке 20, по мере того, как она походит через сужение 15. При данной скорости потока более длинное сужение 15 (например, более длинная центральная точка 40) будет обеспечивать давление на клетку 20 в течение более длительного периода времени. Глубина канала 10, область 35 входа, центральная точка 40 и область 45 выхода могут варьировать. Например, глубину можно корректировать, чтобы обеспечить большее сужение и тем самым усилить доставку аналогично изменениям ширины сужения. Ширина и длина варьируют среди конструкций устройств и она может быть установлена в процессе изготовления устройства, например, с помощью хромированного фотошаблона, используемого на стадии литографии (когда устройство основано на кремнии). Глубина может быть единообразной на протяжении канала и ее можно устанавливать в процессе изготовления устройства, например, посредством стадии глубокого реактивного ионного травления. Глубина может составлять, например, 15 мкм-20 мкм. Как используют в рамках изобретения, размеры устройства указывают с помощью серии цифр, указывающих длину, ширину и количество сужений (например, 30 мкм-6 мкм-x5 обозначает устройство с длиной 30 мкм, шириной 6 мкм и 5 сужениями).
Скорость, при которой клетки 20 проходят через канал 10, также можно варьировать для контроля доставки доставляемого материала 30 в клетки 20. Например, корректирование скорости клеток 20 через канал 10 может изменять количество времени, в течение которого давление применяют к клеткам, и может изменять быстроту применения давления к клетке (например, медленно или импульсом). Клетки 20 проходят через систему 5 со скоростью по меньшей мере 0,1 мм/с, такой как от 0,1 мм/с до 5 м/с, и предпочтительно от 10 мм/с до 500 мм/с, хотя возможны другие скорости. В некоторых вариантах осуществления клетки 20 могут проходить через систему 5 при скорости, превышающей 5 м/c.
Канал 10 может быть изготовлен из различных материалов, таких как кремний, стекло, керамика, кристаллические субстраты, аморфные субстраты и полимеры (например, поли-метилметакрилат (PMMA), PDMS, сополимер циклических олефинов (COC) и т.д.). Предпочтительно изготовление предпочтительно проводят в чистом помещении и в нем могут использоваться, например, сухая гравировка, влажная гравировка, фотолитография, инжекционное формование, лазерное выжигание, шаблоны SU-8 и т.д. Один иллюстративный канал 10 имеет длину приблизительно 40-50 мкм с диаметром в области без сужения приблизительно 50 мкм и диаметром сужения приблизительно 4-8 мкм. Предпочтительно длину канала 10 оставляют настолько короткой, чтобы избегать закупоривания. Возможны другие размеры.
На фиг. 39 представлен другой вариант осуществления микрожидкостной системы. В этом варианте осуществления канал 10 включает предварительную область 50 входа, которая не сужает клетку 20. Расширенная область 55 канала обеспечивает, чтобы область 35 входа имела угол сужения 90 градусов (например, альфа на фиг. 2A).
На фиг. 40A и 40B представлены два графика, на которых показано сравнение жизнеспособности и эффективности доставки между двумя иллюстративными вариантами осуществления. Обозначение 4000 указывает на изменения, проведенные при использовании варианта осуществления в соответствии с фиг. 2A, в то время как 4010 обозначает измерения, проведенные при использовании варианта осуществления в соответствии с фиг. 39. Показано, что для той же скорости клетки и действующего давления, вариант осуществления на фиг. 39 обеспечивает высокую эффективность доставки и жизнеспособность. Это происходит несмотря на наличие сходных скоростей сдвига, скоростей клеток и времени, затраченного при сдавлении, с вариантом осуществления на фиг. 2A.
Несколько параметров могут влиять на доставку доставляемого материала 30 в клетку 20. Например, размеры сужения 15, действующие скорости потока (например, время прохождение клетки до сужения 15), концентрация доставляемого материала 30 в буферном растворе 25, и количество времени, в течение которого клетка 20 восстанавливается/инкубируется в буферном растворе 25 после сужения, могут влиять на поглощение доставляемого материала 30 клеткой 20. Дополнительные параметры, влияющие на доставку материала 30 в клетку 20, могут включать скорость клетки 20 в сужении 15, скорость сдвига в сужении 20, компонент скорости, который перпендикулярен скорости потока, степень сдавления клетки и время в сужении. Такие параметры можно рассчитывать для контроля доставки доставляемого материала 30. Композиция буферного раствора 25 (например, концентрация соли, содержание сыворотки и т.д.) также могут влиять на доставку доставляемого материала 30. По мере того, как клетка 20 проходит через сужение 15, деформация/стресс, индуцируемые сужением 15, временно вызывают повреждение клетки, которое вызывает пассивную диффузию материала через разрыв. В некоторых вариантах осуществления, клетка 20 деформируется только в течение короткого периода времени, порядка 100 мкс, для минимизации вероятности активации апоптотических каскадов через механизмы передачи сигнала в клетке, хотя возможна другая длительность (например, в диапазоне от наносекунд до часов). Первоначальные наблюдения показали, что поглощение доставляемого материала 30 клеткой 20 происходит в течение времени порядка минут после того, как клетка 20 проходит через сужение 15.
Клетки 20 могут направляться через канал 10 различными способами. Например, можно применять давление с помощью насоса на стороне входа (например, газовый баллон или компрессор), вакуум можно применять с помощью вакуумного насоса на стороне выхода, можно применять капиллярное действие через трубку и/или система 5 может представлять собой систему с подачей самотеком. Также можно использовать проточные системы на основе вытеснения (например, шприцевой насос, перистальтический насос, ручной шприц или пипетка, поршни и т.д.). Иллюстративные скорости потока через один канал 10 составляют порядка 1 мкл за несколько секунд. Кроме того, буферный раствор 25 может включать одно или несколько смазывающих веществ (pluronic или другие поверхностно-активные вещества), которые могут быть предназначены для снижения или устранения закупорки канала 10 и повышения жизнеспособности.
Систему 5 можно контролировать так, чтобы доставка количеств доставляемого материала 30 была стабильной среди популяции клеток. Например, система 5 может включать использование конвекционного механизма доставки после сужения, который направляет доставляемый материал 30 к проницаемой мембране клетки 20. Посредством контроля скорости потока во вторичном потоке, предпочтительно можно контролировать качество доставляемого материала 30, предоставленного клетке. Кроме того, контроль концентрации доставляемого материала 30 в буферном растворе 25 в процессе восстановления мембраны также может увеличить стабильность доставки доставляемого материала 30 к популяции клеток. Предпочтительно система 5 действует в качестве исключительно механической системы без применения каких-либо электрических полей и/или химических агентов, хотя возможны другие конфигурации (например, электрические и/или оптические сенсоры можно использовать для измерения свойств клеток, таких как флуоресценция). Кроме того, система 5 предпочтительно действует независимо от типа доставляемого материала. Например, белки, РНК и ДНК можно доставлять через одну и ту же систему без каких-либо дополнительных модификаций.
В некоторых конфигурациях в случае определенных типов клеток 20, клетки 20 можно инкубировать в одном или нескольких растворах, которые облегчают поглощение доставляемого материала внутрь клетки. Например, клетки 20 можно инкубировать в растворе для деполимеризации, таком как Lantrunculin A (мкг/мл), в течение 1 часа перед доставкой для деполимеризации актинового цитоскелета. В качестве дополнительного примера клетки можно инкубировать в 10 мкМ колхицине (Sigma) в течение 2 часов перед доставкой для деполимеризации сети микротрубочек. Эти способы могут помочь обеспечить экспрессию гена при доставке ДНК.
Ссылаясь на фиг. 5, показана фотография параллельной конфигурации системы 5. Система 5 может включать любое количество параллельных каналов. Предпочтительно по мере добавления дополнительных параллельных каналов к системе 5, может быть увеличена общая пропускная способность системы 5. На фиг. 6 показана фотография параллельной конфигурации системы 5, которая включает фильтры на входе каждого из каналов 10. Кроме того, на фиг. 6 также показана конфигурация сужения 15, которая включает область 35 входа, которая включает множество ступеней. Ссылаясь на фиг. 7, показана дополнительная фотография прототипа системы 5. Как очевидно из фиг. 7, прототип, включая инкубационную лунку, имеет размеры приблизительно 1 дюйм × ¼ дюйма × ¼ дюйма (2,5 см×0,6 см×0,6 см). Другие конфигурации системы 5 также могут включать сортеры, модули для предварительной обработки/пост-обработки, и/или сенсорные модули (например, оптические, электрические и магнитные).
Как более подробно описано ниже в отношении примеров, микрожидкостная система и сходные способы имеют широкий диапазон применений. На фиг. 42 представлена иллюстрация, на которой изображено несколько иллюстративных областей применения. Например, настоящее изобретение можно использовать для регенеративной медицины, например, для обеспечения перепрограммирования клеток и дифференцировки стволовых клеток. Настоящее изобретение можно использовать для иммунологии, например, для представления антигена и усиления/подавления иммунной активности через доставку в дендритные клетки, моноциты, T-клетки, B-клетки и другие лимфоциты. Кроме того, увеличенная доставка квантовых точек, углеродных нанотрубок и антител может быть пригодной для визуализации и сенсорного обнаружения. Кроме того, настоящее изобретение имеет применение в вакцинах против злокачественной опухоли и в исследованиях, таких как выделение циркулирующих опухолевых клеток (CTC) и лечение лимфомы. Способ также обеспечивает надежную платформу для скрининга активной миРНК и низкомолекулярных соединений, способных лечить заболевание, или манипулирования поведением клеток.
Эта идея была успешно продемонстрирована в прототипе, где клетки 20 индуцировали для захвата иным образом не проникающего через мембрану красителя (например, флуоресцентные красители с молекулярной массой от 3 кДа до 2 МДа), ДНК, белка, РНК, нанотрубок или наночастиц, присутствующих в буферном растворе 25. Было показано, что клетки 20 восстанавливаются и пролиферируют после процесса, удерживая доставленный материал в течение более чем 72 часов. С помощью этой системы было исследовано одиннадцать различных типов клеток, включая типы клеток, приведенные на фиг. 33, таким образом, демонстрируя, что система обеспечивает надежную эффективность для различных типов клеток. На фиг. 33 представлена таблица, включающая типы клеток, для которых успешно было применено настоящее изобретение. Средняя пропускная способность для клеток была измерена на уровне порядка 5000-20000 клеток/секунда, средняя эффективность доставки была измерена на уровне 96%, и жизнеспособность клеток была измерена на уровне 95% с использованием одного канала 10. Все испытания проводили при комнатной температуре. Однако в некоторых способах температура может варьировать. Например, способы можно осуществлять при комнатной температуре (например, 20°C), физиологической температуре (например, 39°C), превышающей физиологическую температуру, или сниженной температуре (например, 4°C), или температурах между этими иллюстративными температурами. Выполнение способов при сниженной температуре (т.е. по существу около 4°C, которую можно обеспечивать, например, с использованием охлаждения, ледяной бани или других известных способов), обеспечило неожиданное повышение эффективности доставки и жизнеспособности клеток. Таким образом, температуру можно корректировать для влияния на доставку композиции и жизнеспособность клеток.
Как показано на фиг. 8A-8B, увеличение скорости клетки через сужение 15 может увеличить процент доставки и эффективность доставки доставляемого материала 30. Было обнаружено, что эффективность доставки изменяется линейно в зависимости от скорости клеток, и что существовал зависимый от дозы ответ.
Как показано на фиг. 9, время инкубации клетки в буферном растворе 25 после того, как клетка проходит сужение 15, может оказывать эффект на общий процент доставки доставляемого материала 30 к клетке 20. Однако было отмечено, что после определенного времени инкубации (приблизительно 2-3 минуты), процент доставки по существу не изменялся. Исходя из этих данных, полагают, что разрывы, возникающие в клетке 20 после того, как она проходит через сужение 15, корректируются в пределах порядка пяти минут после прохождения клетки 20 сужения 15. Кроме того, и для сравнения, -1 минута соответствует контрольной группе.
Как показано на фиг. 10, было выявлено, что прохождение клеток 20 через сужение 15 несколько раз может иметь эффект на общий процент доставки, но что оно отрицательно влияет на жизнеспособность клеток 20. Для получения этих данных клетки пропускали через сужение 15, собирали и вновь пропускали через устройство приблизительно в пределах 1 минуты.
Было выявлено, что в то время, когда клетки 20 имеют разрывы (например, после прохождения через сужение 15), материал из клетки может выходить через разрывы. Таким образом, было выявлено, что когда клетки 20 имеют разрывы, материал может входить и выходить из клетки 20. Это свойство означает, что систему 5 можно использовать в качестве способа взятия образца внутриклеточного материала без лизиса клетки. Разрывы в клеточной мембране предпочтительно приводят к утечке макромолекул из цитоплазмы и, таким образом, это можно использовать для исследования состава цитоплазмы.
Как показано на фиг. 11, стабильные клетки HeLa, экспрессирующие зеленый флуоресцентный белок (GFP), обрабатывали в присутствии подавляющей GFP миРНК (Ambion, США) и анализировали посредством FACS (FACS Canto II, BD Biosciences, США) через 48 часов в отношении нокдауна флуоресценции. Результаты на фиг. 11 указывают на >40% нокдаун экспрессии гена - результат, сравнимый с результатом коммерческих реагентов, таких как Lipofectamine 2000 (Invitrogen, U.S.A). Рандомизированные контрольные миРНК, также представленные на фиг. 11, указывают на то, что этот нокдаун не вызван самим процессом деформации.
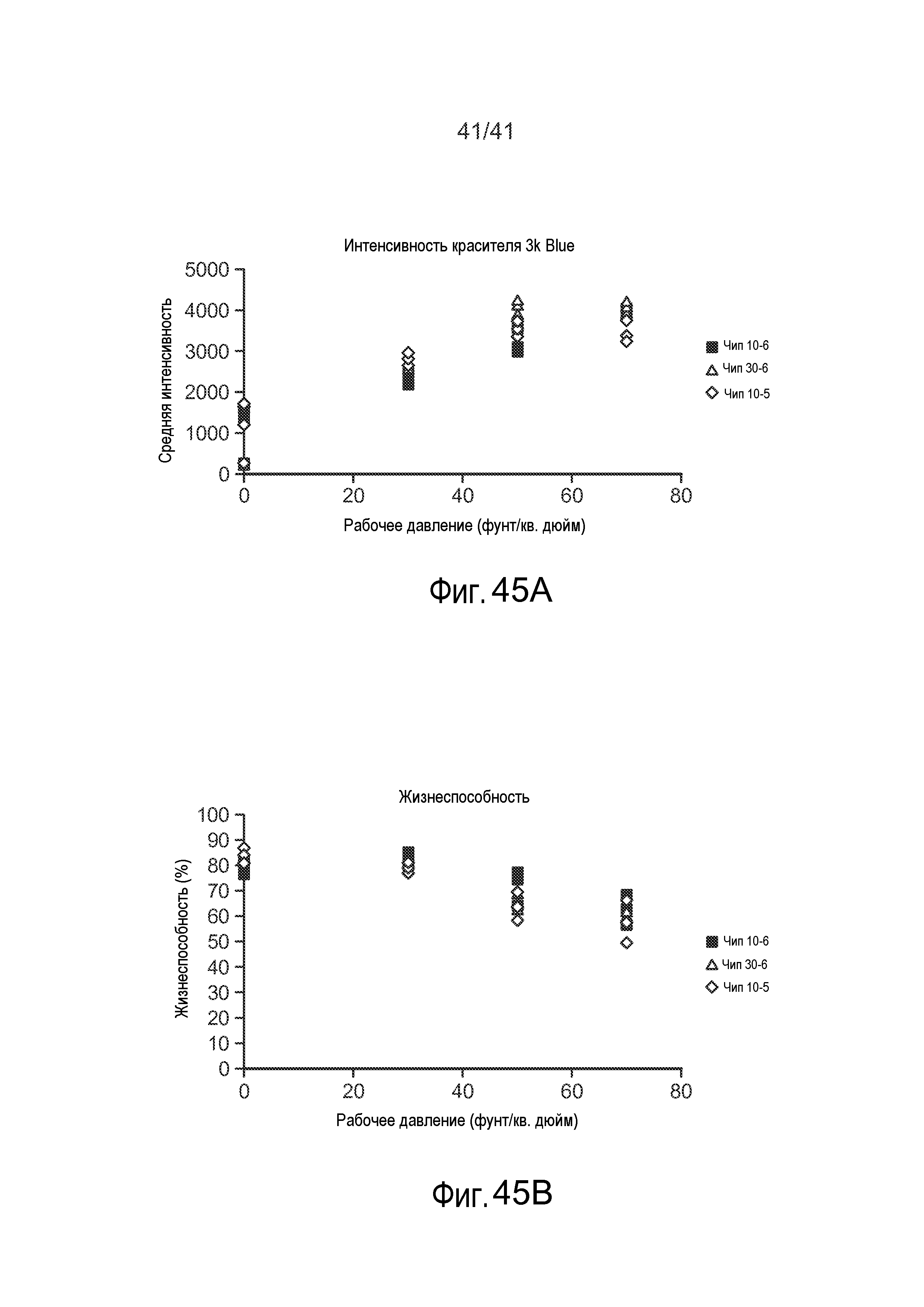
Как показано на фиг. 13-14 размеры сужения могут оказывать эффект на общую эффективностью доставки доставляемого материала 30. Например, на фиг. 13-14 показано, что по мере варьирования рабочего давления (например, посредством варьирования длины и/или ширины сужения 15) общая эффективность доставки в некоторой степени варьирует (фиг. 14 относится к доставке квантовых точек (наночастиц) в различных условиях). Более того, как показано на фиг. 18A-18B, оцененные скорости клеток могут иметь эффект на общую жизнеспособность и эффективность доставки доставляемого материала 30. Например, на фиг. 18A показано, что по мере варьирования рабочей скорости, общая эффективность доставки в некоторой степени варьирует. Кроме того, на фиг. 18B показано, что по мере варьирования рабочей скорости, жизнеспособность клеток может в некоторой степени варьировать. На этих фигурах показано, что изменение длины сужения может усилить доставку при минимальном влиянии на жизнеспособность. Кроме того, более крупные молекулы входят в клетку при более низкой скорости после сужения, чем более мелкие молекулы. Этот способ внутриклеточной доставки, описанный в настоящем описании, является "универсальным", поскольку он работает для многих различных типов материалов и клеток. Кроме того, нарушения мембраны, индуцируемые с помощью этого устройства, обычно могут иметь размеры по меньшей мере ~100 нм, хотя возможны нарушения других размеров.
Ссылаясь на фиг. 12, в одном варианте осуществления градиент концентрации между буферным раствором 25 и цитозолем можно контролировать, чтобы прогнозируемым образом контролировать количество доставляемого материала. Можно использовать способы локализованной доставки, которые осуществляют воздействие на клетки 20 концентрированной взвеси макромолекул после внесения пор в клетки 20 посредством сужения. Однако любой такой способ локализованной доставки должен учитывать оцененное время закрытия разрыва для обеспечения надлежащего функционирования. Это можно осуществлять посредством включения "микронасадки", перпендикулярной каналу, которая доставляет высокую концентрацию груза близко к клеточной мембране (проиллюстрировано на фиг. 6A). Предпочтительно микронасадка может быть расположена в сужении 15 и/или вблизи него. Такой подход может позволить дополнение механизма диффузионной доставки конвекционным механизмом, таким образом, обеспечивая более точную нагрузку клеток более высокими концентрациями. Предпочтительно инжекция происходит, когда клетка 20 находится в области высокой концентрации в сужении 15. Локализованный способ имеет дополнительное преимущество, состоящее в сохранении ценных доставляемых материалов, поскольку в этом случае нет необходимости в поддержании высоких концентраций в буфере.
Ссылаясь на фиг. 16A, для применения давления к клеткам 20, так чтобы обеспечивался разрыв, можно использовать серию микростолбиков 100. В этом варианте осуществления клетки 20 проталкивают через набор сужающих столбиков так, чтобы к клеткам 20 применялось давление.
Ссылаясь на фиг. 16B, сдавливающие пластины 105 можно использовать для применения давления к клеткам 20 так, чтобы возникали разрывы. В этом варианте осуществления сдавливающие пластины 105 можно контролировать так, чтобы давление применялось к клеткам 20 в течение заданного количества времени. Сдавливающие пластины 105 могут быть организованы так, чтобы одна или обе пластины двигались, применяя давление к клеткам 20. Также могут быть предоставлены дополнительные наборы сдавливающих пластин 105, так чтобы клетки 20 были по существу окружены.
Ссылаясь на фиг. 16C, можно использовать добавки 115 в буфер (или наполнители, связывающиеся с поверхностью клеток) для имитации сдавления по мере того, как клетка 20 проходит через сужение 15, диаметр которого превышает диаметр клетки 20. Например, возможно имитируемое сужение вследствие препятствия посредством добавок 115 в буфер. Примеры добавок 115 в буфер включают микро или наночастицы (например, на основе полимеров, на основе липидов, на основе керамики, металлические и т.д.). Эти частицы метят связывающим клетку лигандом, таким как антитело, последовательность ДНК, пептид или низкомолекулярное соединение, хотя это не требуется.
Ссылаясь на фиг. 16D, для сдавления клетки 20 можно использовать гранулы 120. Например, для применения давления к клетке 20 можно использовать магнитные и/или электростатические силы, или, в случае фиг. 16E, для продвижения клетки 20. Предпочтительно сила, применяемая к клетке 20, является достаточной для обеспечения разрыва.
Ссылаясь на фиг. 16F, множество потоков 125 жидкости может быть направлено таким образом, чтобы обеспечить сдавление (или быстрый временный сдвиг) клетки 20. Например, множество потоков 125 жидкости может быть запущено таким образом, чтобы они приближались или сталкивались друг с другом. По мере того, как клетки 20 проходят через множество потоков 125 жидкости, можно применять силу к клеткам 20 так, чтобы возникал разрыв мембраны клетки 20. Альтернативно клетки можно запускать через узкую щелеобразную насадку для облегчения доставки.
Система 5 может представлять собой независимую систему, такую как система, представленная на фиг. 7, хотя возможны другие конфигурации. Например, система 5 может быть имплантирована in vivo пациенту для локальной внутриклеточной доставки, и/или она может быть включена ex vivo в устройство для обработки клеток перед возвращением клеток пациенту.
В дополнение к ее преимуществам доставки, описанным в настоящем описании, микрожидкостной характер системы обеспечивает осуществление точного контроля условий доставки, предварительной обработки и последующей охарактеризации клеток. Например, система может быть выполнена последовательно с модулем для активированной флуоресценцией сортировки клеток (FACS). Это может обеспечить доставку и сортировку желаемых клеток в одной и той же системе в реальном времени. Также можно использовать различные способы анализа до обработки и после сортировки, таким образом, позволяя разработку непрерывных высокопроизводительных анализов для скрининга лекарственных средств и диагностики.
Эффективность доставки груза, доставляемого в клетки-мишени, определяют, подвергая контрольную популяцию клеток-мишеней воздействию груза, также как и популяцию, подвергнутую обработке с помощью микрожидкостного устройства. Контрольный образец подвергают воздействию того же раствора для доставки при той же концентрации в течение по меньшей мере того же количества времени, что и клетки, обработанные с помощью устройства. Для компенсации поверхностного связывания, эндоцитоза и других эффектов, таких как аутофлуоресценция, область доставки определяют так, чтобы только наилучшие 1-5% живых контрольных клеток попали в эту область. Эффективность доставки образца, таким образом, соответствует проценту живых клеток, которые находятся в области доставки. Например, на фиг. 43A представлена гистограмма интенсивности при проточной цитометрии контрольной популяции, которую подвергли воздействию конъюгированного с cascade blue декстрана массой 3 кДа. На фиг. 43B представлена гистограмма интенсивности при проточной цитометрии клеток, подвергнутых воздействию устройства 30 мкм-6 мкм. Определенная область доставки представляет собой незакрашенную область как на фиг. 43A, так и на фиг. 43B.
В процессе работы, ссылаясь на фиг. 17, и далее ссылаясь на фиг. 1-3, способ 1000 проведения внутриклеточной доставки с помощью системы 5 включает представленные стадии. Однако способ 1000 является только иллюстративным и не ограничивающим. Способ 1000 можно изменять, например, добавлением, удалением, изменением или перестановкой стадий.
На стадии 1005 клетки 20 суспендируют в буферном растворе 25 вместе с доставляемыми материалами 30. Типичные концентрации клеток могут находиться в диапазоне от 104 до 109 клеток/мл. Концентрации доставляемого материала могут находиться в диапазоне от 10 мг/мл до 0,1 мкг/мл. Доставляемый материал можно добавлять в клеточный буфер до или сразу после доставки в зависимости от ситуации, учитывая, что повреждения/поры остаются открытыми в течение 1-5 минут. Буферные растворы могут состоять из ряда солей, сахаров, факторов роста, происходящих из животных продуктов или любого другого компонента, необходимого для надлежащей пролиферации клеток, поддержания здоровья клеток или индукции каскадов передачи сигнала. Также в буферный раствор 25 можно добавлять дополнительные материалы. Например, в буферный раствор 25 можно добавлять поверхностно-активные вещества (например, pluronic) и/или наполнители.
На стадии 1010 буферный раствор 25, включающий клетки 20 и доставляемые материалы 30, пропускают через канал 10 системы 5. Буферный раствор 25 можно пропускать через канал 10 с использованием гравитации или это можно осуществлять другими способами. Например, можно применять давление к буферному раствору 25 на стороне входа в канал 10 (например, с использованием газового баллона и/или компрессора), и/или вакуум можно применять с помощью вакуумного насоса на стороне выхода. Кроме того, также можно использовать проточные системы на основе вытеснения.
По мере прохождения индивидуальных клеток 20 через сужение 15, к клетке 20 кратковременно применяется давление вследствие твердой конструкции сужения 15, вызывающее развитие разрывов, таких как выемки, в клеточной мембране, так чтобы доставляемые материалы 30 можно было доставлять внутрь клетки 20. Количество и/или длительность применяемого к клетке 20 давления можно варьировать, корректируя размеры сужения 15, скорость, при которой клетка 20 проходит через сужение 15, и/или корректируя форму сужения 15. В одной конфигурации приблизительно 5000-20000 клеток/секунда проходят через сужение 15, и каждая клетка сдавливается в течение приблизительно 100 мкс.
Система 5 может включать один или несколько каналов 10. Например, система 5 может включать 50-100 каналов 10, которые расположены в параллельной конфигурации. Использование параллельной конфигурации может уменьшить последствия закупорки в одном или нескольких каналах 10, и может увеличивать общую пропускную способность системы 5. Кроме того, система 5 может включать один или несколько каналов последовательно друг за другом.
На стадии 1015 после прохождения клетками 20 сужения 15, клеткам позволяют инкубироваться/восстановиться посредством нахождения в буферном растворе 25. За это время клетки 20 захватят некоторые из доставляемых материалов 30, присутствующие в буферном растворе 25, через разрывы в клеточной мембране. Один из механизмов захвата основан на диффузии, поскольку более крупные молекулы, по-видимому, поглощаются более медленно, чем более мелкие молекулы. Предпочтительно клеткам 20 позволяют инкубироваться/восстановиться в буферном растворе 25 в течение порядка 2-5 минут, хотя возможна другая длительность. За то время, когда клетки 20 инкубируются/восстанавливаются в буферном растворе 25, материал из клеток 20 также может выходить из клетки в буферный раствор 25. В ходе периода инкубации/восстановления, определенные условия можно контролировать для обеспечения того, чтобы доставляемые количества доставляемых материалов 30 являлись стабильными в клеточной популяции. Например, после сужения можно использовать конвекционные механизмы, которые направляют доставляемый материал к инкубирующейся/восстанавливающейся клетке.
Необязательно, на стадии 1020, после инкубации/восстановления клеток, клетки можно промывать для удаления буферного раствора. Предпочтительно промывание происходит после периода времени, требуемого для устранения разрывов, хотя промывание можно проводить в другое время для контроля количества доставляемых материалов 30, поглощенных клетками.
Пример 1 - Доставка функциональных сконструированных наночастиц
Сконструированные наноматериалы имеют огромный потенциал в качестве инструментов для визуализации живых клеток, средств для доставки терапевтических молекул или даже в качестве способов манипуляции живыми клетками с помощью внешних средств, таких как световые или магнитные поля. (Howarth, M., et al. Monovalent, reduced-size quantum dots for imaging receptors on living cells. Nature Methods 5, 397-399 (2008)). Однако большинство из этих потенциальных применений требуют, чтобы наноматериалы доставлялись в цитозоль клеток. Большинство наночастиц, таких как QD необходимо пассивировать с помощью полимера, который обеспечивает растворимость наночастиц в водной среде и который в основном препятствует их пассивной диффузии через клеточную мембрану.
Микроинъекция наночастиц считается непрактичной вследствие необходимости в специализированном оборудовании и низкой пропускной способности, в то время как электропорация вызывает агрегацию QD внутри клетки. Таким образом, большинство попыток доставить QD в цитоплазу клетки основано на эндоцитозе QD клеткой и просачивании из эндосом. До настоящего изобретения было невозможно доставить QD в цитоплазму клеток удовлетворительным и масштабируемым образом. Настоящая система обеспечивает решение этой проблемы доставки предшествующих подходов.
Микрожидкостное устройство комбинируют с новым поколением недавно описанных биологически совместимых QD. (Liu, W., et al. Compact biocompatible quantum dots via RAFT-mediated synthesis of imidasol-based random copolymer ligand. JACS 132, 472-483 (2010)). QD, используемые на протяжении примера 1, покрывали полиимидазольным лигандом, состоящим из множества хелатирующих металл имидазольных групп и множества солюбилизирующих в воде пассивирующих молекул поли(этилен)гликоля (PEG).
Для доставки QD в цитозоль клетки разделяли на аликвоты в раствор PBS, содержащий QD. Раствор с клетками-QD переносили пипеткой в микрожидкостное устройство и раствор пропускали через каналы при постоянном давлении с последующим временем инкубации 5 мин. После этого периода инкубации избыток QD отделяли центрифугированием. Для контрольной популяции раствор с клетками-QD помещали в микрожидкостное устройство и клетки подвергали воздействию раствора QD в течение количества времени, эквивалентного протоколу доставки в цитозоль.
На фиг. 19 представлено наложение трансмиссионных и конфокальных флуоресцентных изображений, за которыми следуют конфокальные флуоресцентные изображения z-сечения обработанных клеток, в которые доставляли QD с использованием настоящего изобретения. На фиг. 19 иллюстрируются (сверху) изображения сразу после обработки (т.е. доставки) и (снизу) после инкубации в течение 48 ч при 37°C и 5% CO2. Профиль диффузного окрашивания ограничен цитоплазмой, и наночастицы, по-видимому, не проникают в ядро (темная область в клетке). Масштабная метка соответствует 10 мкм. Конкретный свободный полиимидазольный лиганд, который покрывал QD, визуализированные на фиг. 19, не обладал функциональностью, отличной от обеспечения биосовместимости через группы PEG. Изображения конфокальной микроскопии показывают, что клетки HeLa, открепленные и округлые после прохождения через микрожидкостное устройство, имеют диффузное цитоплазматическое окрашивание QD в различных z-сечениях клетки (фиг. 19, сверху). Диффузное окрашивание сохраняется даже через 48 часов после инкубации и прикрепления клеток при 37°C в 5% CO2 (фиг. 19, низ). Диффузная флуоресценция QD снижается через 48 ч, вероятно, вследствие деления клеток (фиг. 19). Устройство доставляло QD (гидродинамический диаметр ~13 нм) в ~40% популяции живых клеток при скорости прохождения ~10000 клеток/c. На фиг. 20A иллюстрируется эффективность доставки в цитозоль клеток HeLa при обработке с использованием настоящего изобретения посредством QD, покрытых PIL. Жизнеспособность клеток составляла >80% при измерении посредством проточной цитометрии. На фиг. 20B иллюстрируется жизнеспособность клеток HeLa при доставке простых QD535 с использованием настоящего изобретения, при измерении по окрашиванию йодидом пропидия и измерении с помощью проточной цитометрии. Жизнеспособность обработанных клеток при измерении с помощью проточной цитометрии, диффузное окрашивание на конфокальных изображениях и способность клеток к прикреплению согласуются с доставкой QD в цитоплазму живой клетки.
Для подтверждения того, что флуоресценция действительно является следствием QD, доставляемых в цитозоль, в противоположность QD, изолируемым в эндосомах, наночастицу конструировали так, чтобы она изменяла ее профиль испускания при взаимодействии с восстанавливающей средой цитозоля. Потенциал к восстановлению внутри клеточной цитоплазмы составляет от ~260 до ~220 мВ и в основном определяется поддержанием высоких концентраций (5-10 мМ) трипептида глутатиона.
Таким образом, посредством измерения флуоресценции конструкции QD-краситель, испускание которой изменяется под воздействием цитозольной среды, можно определить локализацию и химическую доступность доставляемых наночастиц. Конструировали QD-краситель, состоящий из QD зеленого свечения (λ-испускание = 541 нм), которые действуют в качестве донора энергии для красителя карбокси-X-родамина (Rox) (λ-испускание = 610 нм), конъюгированного через поддающуюся восстановлению дисульфидную связь.
На фиг. 21 иллюстрируется модель конструкции, поглощение и стабильность в различных средах. На 2100 представлено схематическое изображение PIL перед конъюгацией с красителем и нанесением на QD (слева) и полученной конструкции QD-дисульфид-Rox (справа) (изображение не в масштабе). На 2110 представлен спектр поглощения конструкции красителя QD-дисульфид. Возбуждение при 488 нм и при 405 нм обеспечило исключительное поглощение для QD на протяжении эксперимента. На 2120 представлена стабильность переноса энергии флуоресценции с QD на Rox для этой конструкции в полной культуральной среде при 37°C и 5% CO2, что демонстрирует, что дисульфидная связь не расщепляется во внеклеточной среде. На графике 2130 проиллюстрировано расщепление дисульфидной связи цитозольным восстановителем глутатионом, как показано по восстановлению флуоресценции QD. На 2140 представлено восстановление флуоресценции QD при обработке нетиольным восстановителем трис(2-карбоксиэтил)фосфином, далее подтверждая расщепление дисульфидной связи.
Тиольные группы, которые включали в PIL, образовывали дисульфидные связи с тиолированными красителями Rox. Спектр поглощения очищенной конструкции имеет признаки поглощения как QD, так и Rox (2120) при среднем уровне 13 молекул красителя Rox на QD, что эффективно осуществляло гашение флуоресценции QD (2130). Эта конструкция служит в качестве необратимого сенсора специфической восстанавливающей среды в цитозоле. Когда QD селективно возбуждают лазером при 488 нм (микроскопия) или 405 нм (проточная цитометрия) в то время как дисульфидные мостики остаются неизмененными, конструкция претерпевает резонансный перенос энергии флуоресценции (FRET), так что испускание Rox в красной области преобладает. В анализе в растворе клеточный восстановитель глутатион расщепляет дисульфидные мостики, высвобождая краситель Rox и позволяя флуоресценции QD восстановиться (2140). Восстановитель не на основе тиола трис-(2-карбоксиэтил)фосфин также обеспечивает восстановление флуоресценции QD, указывая на то, что высвобождение Rox с поверхности QD происходит не посредством вытеснения PIL глутатионом (2140). Флуоресценция Rox может не полностью исчезать, поскольку некоторые из дисульфидных мостиков пространственно закрыты длинными группами PEG на PIL, и вследствие небольшого неспецифического взаимодействия между красителем и поверхностью QD.
Изменения профиля флуоресценции конструкции при измерении посредством проточной цитометрии и конфокальной микроскопии, подтверждают доставку конструкций QD-дисульфид-Rox в цитоплазму клетки. Под воздействием восстанавливающей среды цитозоля расщепление дисульфидных связей прерывает процесс FRET от QD до красителя. Таким образом, при исключительном возбуждении QD, флуоресценция канала QD возрастает, в то время как флуоресценция канала Rox снижается с течением времени. Живые клетки HeLa обрабатывали с помощью микрожидкостного устройства в растворе при высокой концентрации QD-дисульфид-Rox, инкубировали в течение 5 минут и промывали для удаления избытка QD перед добавлением среды для культивирования клеток (т.е. обработанных клеток). Контрольные клетки инкубировали с QD-дисульфид-Rox в течение 5 минут вместо обработки с использованием микрожидкостного устройства, и промывали перед помещением в среду для культивирования клеток. Флуоресценцию канала Rox и QD этих обработанных и контрольных клеток наблюдали с помощью как конфокальной микроскопии, так и проточной цитометрии.
На фиг. 22A и 22B иллюстрируются изображения конфокальной микроскопии живых клеток и анализ интенсивности флуоресценции, демонстрирующий цитоплазматическое окрашивание и химическую доступность поверхности QD. На фиг. 22A иллюстрируются изображения обработанных клеток (сверху) и контрольных клеток (снизу). Появление диффузной зеленой флуоресценции присутствует только в обработанных клетках. Масштабная метка соответствует 10 мкм. На фиг. 22B иллюстрируется изменение интенсивности в зависимости от времени в зеленых и красных каналах. Поскольку n<20 в каждый момент времени, колебания общей средней флуоресценции корректировали посредством нормализации к моменту времени 0 ч.
Под конфокальным микроскопом диффузная флуоресценция, которая появляется в цитоплазме обработанных клеток, прогрессирует от выраженной красной до выраженной зеленой (как показано на фиг. 22A). Изображения контрольных клеток демонстрируют некоторое неспецифическое связывание на наружной мембране, на которое указывает флуоресценция в форме кольца, и отсутствует увеличение сигналов в зеленом канале. Эти эффекты согласуются с ожидаемым расщеплением цитозольных дисульфидных связей, которые снижают эффект FRET. На фиг. 22B, на линейных графиках представлена средняя интенсивность каналов QD и Rox на клетку после корректирования в отношении различий от клетки к клетке в отношении доставляемого флуоресцентного материала посредством нормализации к общей флуоресценции, для обработанных и контрольных клеток, и аутофлуоресценции. Для обработанных клеток, на графике показано пересечение на уровне 2-4 часов инкубации, где флуоресценция QD возрастает выше флуоресценции Rox. Интересно, что показано, что сигнал Rox обработанных клеток стабилизирован выше уровней аутофлуоресценции после 9 часов. Это согласуется с результатами анализов в растворе, где некоторый FRET оставался после восстановления. Наблюдаемое диффузное окрашивание, и увеличение сигнала QD и снижение сигнала Rox убедительно подтверждают доставку в цитозоль и последующее расщепление дисульфидных связей. Флуоресценция QD в контрольных клетках после гашения посредством FRET до Rox, оказалась неотличимой от аутофлуоресценции. Контрольные клетки проявляют некоторую флуоресценцию Rox выше аутофлуоресценции в ранние моменты времени, которая затем устойчиво снижается. Это может быть приписано неспецифическим взаимодействиям между QD-S-S-Rox и поверхностью клетки, с последующим повторным растворением конструкций в среде.
На фиг. 23 иллюстрируется измерение с помощью проточной цитометрии средней флуоресценции и жизнеспособности клеток. На 2300 представлена средняя флуоресценция QD (слева) и Rox (справа) на клетку, демонстрирующая увеличение флуоресценции QD только в обработанных клетках. Флуоресценция Rox как в обработанных, так и в контрольных, клетках происходит на уровнях аутофлуоресценции в момент времени 24 ч. На 2310 представлена гистограмма распределения интенсивности флуоресценции среди обработанных и контрольных клеток в выбранные моменты времени в канале QD (слева) и канале Rox (справа). Согласно оценке, доставка QD произошла по меньшей мере в 35% популяции клеток. Серые области предназначены для направления движения глаз на пики гистограмм интенсивности флуоресценции. На 2320 проиллюстрирована жизнеспособность контрольных и обработанных клеток при измерении с помощью йодида пропидия.
Результаты измерений с помощью проточной цитометрии, проиллюстрированные на фиг. 23, подтверждают, что конструкции QD-дисульфид-Rox могут взаимодействовать с цитозольной средой. Результаты измерения проточной цитометрии регистрировали на всех живых клетках, охватывая как доставленные (~35% обработанной популяции клеток), так и недоставленные клетки. На 2100 проиллюстрирована средняя флуоресценция на клетку для обработанных и контрольных популяций клеток. Средняя флуоресценция QD сначала увеличивается для обработанных клеток, достигая пика через ~9 ч, и постепенно снижается после этого, в противоположность флуоресценции QD в популяции контрольных клеток, которая остается сравнимой с уровнями аутофлуоресценции. Это согласуется с восстановлением в цитозоле дисульфидных мостиков между QD и красителем внутри обработанных клеток с последующим разбавлением флуоресцентных конструкций посредством деления клеток. Флуоресценция Rox как для обработанных, так и для контрольных клеток начинается на высоком уровне и падает в течение первых 2 ч. Это падение приписывается к повторному растворению в среде частиц, которые связались с клеточной поверхностью в процессе инкубации. Средняя флуоресценция Rox в обработанной клеточной популяции оказалась сходной с контрольными клетками вследствие присутствия в обработанной популяции клеток, в которые не произошла доставка. Присутствие клеток в которые как произошла доставка, так и не произошла доставка, в обработанной популяции можно отличить на гистограммах интенсивности QD и Rox, представленных на 2310. С увеличением времени гистограммы флуоресценции становятся бимодальными для обработанных клеток, но остаются унимодальными для контрольных клеток. Флуоресценция QD увеличивается с течением времени в подгруппе клеток обработанной клеточной популяции (2100), далее подтверждая прерывание процесса FRET в цитозоле обработанных и подвергнутых доставке клеток. Флуоресценция Rox в общем снижается по мере повторного растворения связанных с мембраной конструкций в среде, однако подгруппа обработанной популяции клеток сохраняет флуоресценцию Rox. Это согласуется с неполным восстановлением связей QD-S-S-Rox, наблюдаемым при конфокальной микроскопии. Жизнеспособность обработанной клеточной популяции при измерении по окрашиванию йодидом пропидия находится в пределах 10% от контрольной популяции во все моменты времени (2130). Жизнеспособность клеток >90% относительно контрольной группы выигрывает в сравнении с альтернативными способами, такими как электропорация и способы на основе полимеров, которые обеспечивают жизнеспособность после обработки только 40-60%.
На фиг. 24 иллюстрируется эпифлуоресцентное изображение неагрегированных единичных QD в цитозоле клеток после обработки в устройстве с 10 нМ раствором QD (сверху), и кривые мерцания для трех QD, обозначенных как 2400, 2410 и 2420, с аутофлуоресценцией. Кривые мерцания для QD, по-видимому, являются небинарными вследствие длительного времени в емкостях для получения данных (500 мс). Масштабные метки представляют собой 10 мкм.
Платформа для доставки QD также позволила визуализацию единичных молекул посредством доставки неагрегированных конструкций QD-дисульфид-Rox, поскольку наблюдаемая периодичность испускания согласуется с единичными QD. Для этого эксперимента конструкции QD-дисульфид-Rox доставляли в цитозоль с последующей инкубацией в течение 10 часов и визуализировали на эпифлуоресцентном микроскопе. Инкубация в течение 10 часов обеспечила восстановление флуоресценции QD внутри цитозоля вследствие восстановления дисульфидной связи; эпифлуоресцентную микроскопию использовали для обеспечения того, чтобы было накоплено достаточно фотонов. Несколько мерцающих QD наблюдали, когда клетки обрабатывали с использованием настоящего изобретения при низких концентрациях QD (фиг. 24). Кривые интенсивности мерцающих QD в цитозоле, представленные на 2400, 2410 и 2420, выглядят небинарными в результате длительного времени в емкостях для получениях данных (500 мс). Движения переходных клеток считали минимальными в ходе временных рамок получения данных (~1 мин). Эти данные демонстрируют возможность наблюдения событий отдельных молекул в цитозоле клеток посредством доставки QD в качестве флуоресцентных меток с использованием настоящего изобретения.
В примере 1 продемонстрирована доставка наночастиц в цитозоль клеток в соответствии с вариантом осуществления настоящего изобретения. Путем наблюдения за расщеплением QD-дисульфид-Rox цитозольными восстановителями было показано, что поверхность наночастиц взаимодействует с цитозольными компонентами. Варианты осуществления настоящего изобретения обеспечивают доставку QD в цитоплазму клеток с высокой пропускной способностью без каких-либо проникающих в клетку или ускользающих от эндосом лигандов при сохранении жизнеспособности клеток и целостности QD. Эффективность доставки 35% можно далее увеличить посредством увеличения количества микрожидкостных сужений, изменения размеров сужений или увеличения количества циклов обработки. В отличие от большинства способов доставки, обусловленных проникающим в клетку пептидом или положительным зарядом, настоящее изобретение не требует двойной конъюгации средства для внутриклеточной доставки и средства, нацеливающего на белок цитозоля, на одной и той же наночастице. Посредством устранения необходимости вышеуказанного, можно достигать уменьшения проблем перекрестной реактивности, неравной реакционной эффективности стратегий конъюгации и стехиометрии конъюгации. Таким образом, достигают значительной приспособляемости модели конструкции QD, позволяющей внутриклеточное мечение и отслеживание белков. Способы пригодны для доставки множества флуоресцентных материалов с помощью комплексных решений, которые осуществляют нацеливание на внутриклеточные белки и органеллы через испытанные стратегии нацеливания на белки, такие как, но не ограничиваясь ими, стрептавидин-биотин, HaloTag-хлоралкан и мечение сортазой.
В примере 1 все химические реагенты приобретали от Sigma Aldrich и использовали в полученном виде, если нет иных указаний. Чувствительные к воздуху материалы содержали в перчаточном боксе Omni-Lab VAC в атмосфере сухого азота с уровнями кислорода <0,2 м.д. Все растворители были спектроскопическими или реагентными. Соединения, содержащие ароматическое кольцо, визуализировали на TLC с использованием ручной УФ-лампы и KMnO4. Содержащие амины соединения визуализировали на TLC с использованием нингидринового красителя. Колоночную флэш-хроматографию проводили на Teledyne Isco Combi Flash Companion. Клетки HeLa приобретали от ATCC и все материалы клеточной среды приобретали от Mediatech, если нет иных указаний.
В примере 1, спектры 1H ЯМР регистрировали на ЯМР-спектрометре Bruker DRX 401. MS-ESI проводили на устройстве Bruker Daltonics APEXIV 4.7 FT-ICR-MS. Спектры поглощения в ультрафиолетовой и видимой области спектра получали с использованием спектрофотометра с диодной матрицей HP 8453. Спектры фотолюминесценции и поглощения регистрировали с помощью устройства для считывания микропланшетов BioTek Synergy 4 Microplate Reader. Молекулярные массы полимеров определяли в растворе DMF на системе ВЭЖХ/GPC серии Agilent 1100 с тремя колонками PLgel (103, 104, 105 A) последовательно против точных полистироловых стандартов. Производные красителей очищали с использованием системы ВЭЖХ Varian ProStar Prep HPLC system. Модифицированный полимер очищали с использованием колонок GE Healthcare's PD-10, заполненных SephadexTM G-25M. QD после обмена лигандов очищали диализом с центрифугированием с помощью центрифужных фильтров с пороговым значением 30K Millipore Amicon Ultra и с помощью GFC на системе хроматографии AKTAprime Plus (Amersham Biosciences), оборудованной предварительно заполненной стеклянной колонкой Superdex 200 10/100. Измерения проточной цитометрией проводили на LSR Fortessa (BD Biosciences).
В примере 1 ядра CdSe с первым пиком поглощения 478 нм синтезировали с использованием ранее описанного способа (1). Обобщая, 0,4 ммоль (54,1 мг) CdO, 0,8 ммоль (0,2232 г) TDPA, 9,6 ммоль (3,72 г) TOPO помещали в 25 мл круглодонную колбу. Раствор дегазировали в течение 1 ч при 160°C и нагревали до 300°C в атмосфере аргона до тех пор, пока CdO не растворялся и не образовывал прозрачный однородный раствор. После этого следовало помещение раствора в вакуум при 160°C для удаления образовавшейся воды. Раствор повторно нагревали до 360°C в атмосфере аргона и быстро добавляли раствор TOP-Se (1,5 мл 1,5 M TOP-Se в 1,5 мл TOP) с получением элементов CdSe с первым признаком поглощения при 478 нм.
Оболочки CdS наносили на ядра CdSe посредством модификации ранее описанных методик (2). Ядра, выделенные посредством повторяющихся преципитаций из гексана с ацетоном, доводили до 180°C в смеси растворителей олеиламина (3 мл) и октадецена (6 мл). Затем непрерывно подавляли первичные растворы Cd и S при скорости 4 мл/ч. Первичный раствор Cd состоял из 0,33 ммоль Cd-олеата и 0,66 ммоль олеиламина в смеси растворителей октадецена (1,5 мл) и TOP (3 мл). Первичный раствор S состоял из 0,3 ммоль гексаметилдисилатиана [(TMS)2S] в 6 мл TOP. Добавление всего 3 монослоев каждого из Cd и S обеспечивало QD с испусканием при 541 нм и квантовым выходом 60% при разбавлении в октане. Коэффициент экстинкции CdSe(CdS) вычисляли с использованием коэффициента экстинкции ядер CdSe из литературы (3) и предполагая, что 95% ядер CdSe сохранялись в ходе стадии покрытия.
В примере 1, кремниевый чип изготавливали с использованием способов фотолитографии и глубокого реактивного ионного травления. Полученную кремниевую пластину с гравировкой очищали (с помощью H2O2 и H2SO4) для удаления дебриса, окисляли для получения стеклянной поверхности и связывали с пластиной Pyrex, а затем разрезали на индивидуально упакованные устройства. Затем каждое устройство исследовали по отдельности в отношении дефектов перед применением.
Пример 2 - Доставка макромолекул
Внутриклеточная доставка макромолекул является важной стадией в терапевтических и исследовательских применениях. Опосредуемая наночастицами доставка ДНК и РНК, например, является пригодной для генной терапии, в то время как доставку белков используют для влияния на функции клеток как в клинических, так и в лабораторных условиях. Другие материалы, такие как низкомолекулярные соединения, квантовые точки или золотые наночастицы, доставляют в цитозоль для целей, варьирующих от терапии злокачественной опухоли до внутриклеточного мечения и отслеживания отдельных молекул.
Чтобы продемонстрировать универсальность способа, модельные молекулы декстрана доставляли в несколько типов клеток: дендритные клетки DC2.4, фибробласты крайней плоти новорожденного человека (NuFF) и эмбриональные стволовые клетки мыши (mESC), которые достигали эффективности доставки вплоть до 55%, 65% и 30%, соответственно. Первоначальные эксперименты также показали успешную доставку в первичные лимфоциты, макрофаги и дендритные клетки, происходящие из мышей. Более того, этот способ не обеспечил избыточной цитотоксичности или не индуцировал дифференцировку стволовых клеток. Действительно все типы клеток были жизнеспособными более чем на 60% даже при более высоких исследованных скоростях. Конструкция устройства и условия функционирования не были предварительно оптимизированы ни для одного из упомянутых выше типов клеток.
На фиг. 25 проиллюстрированы результаты эксперимента, демонстрирующие, что эффективность доставки зависит от скорости клетки и конструкции сужения. Размеры сужения обозначены цифрами (например, 10 мкм-6 мкм-x5), так что первое число соответствует длине сужения, второе число соответствует ширине сужения и третье число (если оно присутствует) соответствует количеству сужений последовательно на канал. На 2500 показана эффективность доставки и на 2510 представлена жизнеспособность клеток через 18 часов после обработки (измеренная с помощью проточной цитометрии) в зависимости от скорости клеток для конструкций устройств 40 мкм-6 мкм (o), 20 мкм-6 мкм (□) и 10 мкм-6 мкм-x5 (Δ). На 2520 показана эффективность доставки и жизнеспособность клеток 2530 (измеренная посредством проточной цитометрии) в зависимости от скорости для первичных фибробластов человека (□), дендритных клеток DC2.4 (o), и эмбриональных стволовых клеток мыши (mESC) (Δ), обработанных с помощью устройства 30 мкм-6 мкм. Фибробласты и дендритные клетки человека анализировали через 18 часов после доставки. MESC анализировали через 1 час после доставки. Все точки данных анализировали в трех экземплярах и планки погрешности соответствуют двум стандартным отклонениям.
На фиг. 26 проиллюстрированы изображения, 2600, различных горизонтальных плоскостей клетки HeLa после доставки конъюгированного с pacific blue декстрана массой 3 кДа, при определении посредством конфокальной микроскопии. Изображения представлены сверху вниз, а затем слева направо, где сверху слева представлено изображение при z=6,98 мкм и снизу справа представлено изображение при z=-6,7 мкм. Масштабная метка соответствует 6 мкм. На 2610 представлена эффективность доставки в живые клетки с помощью устройства 10 мкм-6 мкм (□), 20 мкм-6 мкм (o), 30 мкм-6 мкм (Δ) и 40 мкм-6 мкм (◊). Ось времени указывает на количество времени после первоначальной обработки клеток до того, как они были подвергнуты воздействию намеченного раствора для доставки. Все результаты измеряли с помощью проточной цитометрии через 18 часов после обработки. На 2620 представлена средняя интенсивность для популяции клеток, в которую осуществляли доставку, нормализованная к необработанным клеткам для контроля аутофлуоресценции. Конъюгированный с флуоресцеином декстран массой 70 кДа (горизонтальные линии) и конъюгированный с pacific blue декстран массой 3 кДа (диагональные линии) доставляются в клетки (циклы 1 и 3) и удаляются из клеток (цикл 2) в последовательных циклах обработки. Контроль соответствует клеткам, которые подверглись воздействию только раствора для доставки, но не были обработаны с помощью устройства. Все точки данных исследовали в трех экземплярах и планки погрешностей соответствуют двум стандартным отклонениям.
Поскольку в предшествующих способах доставки на основе наночастиц и проникающего в клетку пептида (CPP) используются каскады эндоцитоза, существуют данные, которые вычеркивают влияние эндоцитоза в механизме доставки с помощью настоящего изобретения. На фиг. 26 на 2600 иллюстрируется, что конфокальная микроскопия клеток, обработанных конъюгированным с pacific blue декстраном массой 3 кДа, демонстрирует диффузное окрашивание цитозоля в противоположность точечной характеристике, которой можно ожидать в случае способов, обусловленных эндоцитозом. Более того, когда эксперименты по доставке проводят при 4°C, что является температурой, при которой эндоцитоз минимизируется, температура в минимальной степени влияет на эффективность доставки для обоих исследуемых материалов грузов: декстрана массой 3 кДа и 70 кДа. Эти данные указывают на то, что маловероятно, что эндоцитоз ответственен за доставку в этой системе.
Охарактеризовывали кинетику доставки с течением времени. Клетки обрабатывали с использованием настоящего изобретения в отсутствие доставляемого материала, а затем подвергали воздействию меченного pacific blue декстрана массой 3 кДа в определенные временные интервалы после обработки. В этом подходе по мере того, как клетки проходили через сужение, их мембраны нарушались; однако не происходило поддающейся измерению доставки до тех пор, пока они не подвергались воздействию меченого декстрана. Таким образом, эффективность доставки в каждый момент времени может отражать соотношение клеток, в которых остались поры в течение этого количества времени после обработки. Этот способ устанавливает кинетику образования/закрытия пор. Результаты указывают на то, что практически 90% доставки происходит в течение первой минуты после обработки, независимо от конструкции устройства (2610). Наблюдаемая временная шкала подтверждает гипотезу образования пор, поскольку в предшествующих работах, касающихся кинетики репарации мембраны, описано, что закрытие мембраны происходит приблизительно через 30 с после индукции повреждения. Напротив рекомендованный временной масштаб для способов, обусловленных эндоцитозом, таких как механизмы опосредуемой наночастицами и CPP доставки, составляет порядка нескольких часов.
Поскольку доставка материала через поры в мембранах является диффузионной, материал может обмениваться между внутренним и внешним содержимым клетки на протяжении времени существования поры. С другой стороны, опосредуемые эндоцитозом или конвекционные механизмы должны быть однонаправленными, т.е. должны обеспечивать только транспорт материала в клетку. Чтобы продемонстрировать двунаправленный транспорт материала через клеточную мембрану, проводили эксперимент, состоящий из 3 циклов доставки. На первом цикле клетки обрабатывали в присутствии декстрана массой 3 кДа и 70 кДа, инкубировали в течение 5 мин в растворе декстрана и промывали два раза посредством PBS. Одну треть образца сохраняли и высевали для наблюдения. На втором цикле оставшиеся промытые клетки вновь обрабатывали с помощью устройства, но в отсутствие какого-либо доставляемого материала, и инкубировали в течение дополнительных 5 мин. Половину этого образца высевали для наблюдения. На третьем цикле оставшиеся клетки после второго цикла пропускали через устройство в тех же условиях, что и на первом цикле (т.е. в присутствии декстрана), инкубировали в течение 5 минут и промывали два раза в PBS. Клетки анализировали посредством проточной цитометрии через 18 часов после эксперимента. Изменения нормализованной интенсивности флуоресценции демонстрируют суммарную диффузию декстрана в клетки в ходе первого цикла, из клеток в ходе второго цикла, и обратно в ходе третьего цикла (2620). Таким образом, эти результаты согласуются с механизмом диффузионной доставки.
На фиг. 27 проиллюстрирована упрощенная диффузионная 2D-модель разработанная в пакете программ, известном как COMSOL Multiphysics, который имитирует пассивную диффузию материала в клетку через мембрану с порами. COMSOL Multiphysics представляет собой пакет программ для анализа методом конечных элементов, алгоритм решения и программное обеспечение моделирования/FEA, разработанный COMSOL для различных физических и инженерных применений, особенно сопряженных явлений или мультифизики. На 2700 показана доставка/утрата материала в зависимости от диффузионной способности мембраны. Результаты моделирования указывают на процент материала, доставленного/утраченного из клетки в зависимости от диффузионной способности мембраны, когда представляющий интерес материал находится в буфере (□) или в клетке (o) в момент образования пор. На 2710 представлено графическое изображение смоделированной системы и градиент концентрации, который образуется на мембране, если материал доставляют из буфера в клетку.
С использованием литературных значений для диффузионной способности частиц внутрь и наружу цитоплазмы клеток, экспериментальные результаты, представленные на фиг. 26 качественно воссоздавали с диффузией в качестве единственного режима переноса массы. Более того, при аппроксимации экспериментальных данных к этой модели, этот способ доставляет 10-40% доставляемого материала буфера в цитозоль клетки. При сравнении было оценено, что способы CPP для доставки белка доставляют только 0,1% материала буфера в цитозоль.
Размер частиц (или гидродинамический радиус) влияет на их диффузионную способность и на их способность проникать через поры в мембране, имеющие размер частиц. Таким образом, этот параметр влияет на эффективность доставки в механизме образования пор/диффузии. В серии экспериментов доставляли исследуемые грузы декстрана размером 3 кДа, 10 кДа, 70 кДа, 500 кДа и 2 МДа, конъюгированные с флуоресцеином или pacific blue. Также доставляли меченные флуоресцеином плазмиды, оцененные на уровне 3,1 МДа. Эти модельные молекулы выбирали на основе сходства их молекулярной массы с представляющими интерес доставляемыми материалами. Декстран размером 3 кДа-10 кДа, например, имеет сходный размер с некоторыми короткими пептидами или миРНК, в то время как диапазон 70 кДа-2 МДа имитирует размер большинства белков и некоторых небольших наночастиц.
На фиг. 28 иллюстрируются результаты двухуровневой доставки материала. На 2800 представлена эффективность доставки живых клеток в зависимости от скорости, для клеток HeLa, обработанных декстраном массой 3 кДа, конъюгированным с Pacific Blue (□), декстраном массой 70 кДа, конъюгированным с флуоресцеином (o) и декстраном массой 2 МДа (Δ). Этот эксперимент проводили на чипе 10 мкм-6 мкм-x5. Все точки данных исследовали в трех экземплярах и планки погрешностей соответствуют двум стандартным отклонениям. На 2810 и 2820 иллюстрируется наложения гистограмм данных проточной цитометрии для клеток HeLa, которые являются необработанными (красный), обработанными при 700 мм/с (зеленый), обработанными при 500 мм/с (оранжевый), обработанными при 300 мм/с (светло-голубой) или только подвергнутыми воздействию доставляемого материала (контроль, темно синий). Доставляемый материал состоял из конъюгированного с pacific blue декстрана массой 3 кДа (2810) и конъюгированного с флуоресцеином декстрана массой 70 кДа (2820).
Эксперименты показали, что молекулы, имеющие размер больше 70 кДа, имеют отличающийся профиль доставки от декстрана массой 3 кДа (2800). Устройство обеспечивало двухуровневую доставку, где устройство 10 мкм-6 мкм-x5, действовавшее при 500 мм/с, например, обеспечивало более 90% живых клеток получением молекул массой 3 кДа, в то время как приблизительно 50% получали более крупные молекулы размером 70 кДа и 2 МДа.
Гистограммы, соответствующие этим данным проточной цитометрии, указывают на то, что доставка декстрана массой 3 кДа обеспечивает два отчетливых пика (2810). В первой субпопуляции клетки проявляют умеренные уровни доставки, как наблюдали по сдвигу пика относительно контролей (контроли учитывают эндоцитоз и поверхностное связывание, как описано ранее для точек данных 0 мм/с) с увеличением в 2-6 раз средней интенсивности флуоресценции. Во второй популяции клетки проявляют увеличенные уровни доставки, соответствующие увеличению в 20-100 раз средней интенсивности флуоресценции относительно контролей. Этот эффект может указывать на то, что последняя из субпопуляций имела больше пор, чем первая, таким образом, обеспечивая увеличение количества входящего материала практически в 10 раз. Действительно, как проиллюстрировано с помощью кривых для 300 мм/с, 500 мм/с и 700 мм/с, увеличение строгости обработки посредством увеличения действующих скоростей, по-видимому, увеличивает долю клеток с увеличенной доставкой. Наблюдаются сходные характеристики доставки более крупных молекул декстрана массой 70 кДа (2820). Однако эффект является менее выраженным, поскольку меньшая диффузионная способность частиц и возможные эффекты исключения по размеру снижают общее доставляемое количество. Популяция с умеренной доставкой (первый пик) демонстрирует увеличение средней интенсивности флуоресценции только в 1,5-2 раза по сравнению с наблюдаемым увеличением в 2-6 раз в случае 3 кДа. Этот эффект может объяснить различие в данных доставки на 2800, как и в случае более крупных молекул, популяцию с мягкой доставкой может быть трудно отличить от контролей на основе представленного определения доставки. В результате для более крупных молекул, таких как декстран массой 70 кДа и 2 МДа, по большей части измеряют вторую популяцию с усиленной доставкой.
Для подтверждения того, что материал, доставляемый посредством быстрой механической деформации, является активным и биологически доступным в цитозоле клеток, проводили серию экспериментов, доставляющих исследуемый груз в виде подавляющей GFP миРНК (Ambion, США) в клетки HeLa, экспрессирующие дестабилизированный GFP. Наблюдали дозозависимый и специфический к последовательности GFP нокдаун (вплоть до 80%) через 18 часов после обработки. Ответ в виде нокдауна генов на скорость клеток и конструкцию устройства согласовывался с экспериментами по доставке декстрана, так что более высокие скорости и конструкции с множественными сужениями обеспечивали больший нокдаун генов. Lipofectamine 2000 использовали в качестве положительного контроля в этих экспериментах. Конструкция устройства и параметры работы не были оптимизированы для доставки миРНК перед проведением этих экспериментов.
На фиг. 29 проиллюстрированы данные, касающиеся доставки миРНК, белка и наночастиц. На 2900 проиллюстрирован нокдаун генов в зависимости от типа устройства и скорости клеток в дестабилизированных экспрессирующих GFP клетках HeLa через 18 часов после доставки миРНК против eGFP с использованием 10 мкм-6 мкм-x5 чипа при концентрации доставки 5 мкМ. lipofectamine 2000 использовали в качестве положительного контроля. На 2910 представлена эффективность доставки меченного флуоресцеином декстрана массой 70 кДа и меченного pacific blue декстрана массой 3 кДа посредством быстрой механической деформации и электропорации. Каждый тип декстрана был в концентрации 0,1 мг/мл в растворе для доставки. На 2920 представлена эффективность доставки меченного флуоресцеином бычьего сывороточного альбумина (o), эффективность доставки конъюгированного с pacific blue декстрана массой 3 кДа (□) и жизнеспособность клеток (Δ) в зависимости от скорости, с использованием устройства 30 мкм-6 мкм. На 2930 представлены флуорсцентные микрофотографии клеток HeLa сразу после доставки антител против тубулина с меткой Alexa Fluor 488. Масштабные метки соответствуют 5 мкм. На 2940 и 2950 представлены изображения микроскопии туннелирующих электронов (TEM) золотых наночастиц (некоторые из них указаны стрелками) в клетках, полученных через ~1 с после обработки с использованием устройства 10 мкм-6 мкм-x5. Масштабные метки соответствуют 500 нм. Все точки данных анализировали в трех экземплярах и планки погрешностей соответствуют двум стандартным отклонениям.
В следующих экспериментах исследовали возможность доставки в цитозоль при ранее затруднительных применениях, таких как доставка белков и наночастиц. Для сравнения эффективности настоящего изобретения с коммерчески доступными способами декстран массой 3 кДа и 70 кДа доставляли в качестве белковой модели в фибробласты человека с использованием настоящего изобретения и системы электропорации Neon (Invitrogen). Результаты указывают на то, что быстрая механическая деформация обеспечивает увеличение доставки в 7 раз или более для таких макромолекул (2910). Для переключения способа на доставку белков, устройство с диаметром канала 30 мкм-6 мкм использовали для доставки меченного флуоресцеином бычьего сывороточного альбумина (BSA) в клетки HeLa с вплоть до 44% эффективностью при сохранении жизнеспособности выше 90% (2920). Также после обработки в клетки HeLa доставляли меченные Alexa Fluor 488 антитела к тубулину (Bio Legend) с помощью устройства 30 мкм-6 мкм с использованием концентрации антитела 0,25 мг/мл (2930). Диффузное окрашивание указывает на то, что материал не захватывается в эндосомы и, таким образом, пригоден для окрашивания антителом клеточных структур цитозоля живых клеток. Также с использованием этого способа успешно доставляли аполипопротеин E.
Для доставки наночастиц, изображения TEM для клеток, фиксированных через ~1 с после деформации (2940 и 2950) демонстрируют доставку покрытых PEG 1000 15-нм золотых наночастиц. Золотые наночастицы, по-видимому, по большей части были неагрегированными и визуально не изолировались в эндосомах. На этих изображениях наблюдали доказательства различных дефектов в цитоплазме клеток, ответственных за доставку. Была продемонстрирована высокоэффективная нетоксичная доставка квантовых точек прямо в цитозоль клеток - цель, которой трудно было достигнуть с помощью предшествующих способов. В этих экспериментах квантовые точки с красителем Rox, связанным с их поверхностью, доставляли посредством быстрой механической деформации и наблюдали с течением времени. Эти данные обеспечили минимальную оцененную эффективность доставки 35% и подтвердили, что доставленные квантовые точки находились в цитозоле и были химически доступными для внутриклеточной среды.
Временные поры образуются посредством быстрой механической деформации клетки по мере того, как она проходит через микрожидкостное сужение. Данные подтверждают этот механизм посредством демонстрации диффузного окрашивания цитозоля (фиг. 26 на 2600), функциональности миРНК (фиг. 29 на 2900) и двунаправленного движения материала через мембрану с порами (фиг. 26 на 2920). Был идентифицирован ряд параметров, таких как размеры сужения, количество последовательных сужений и скорость клеток, которые влияют на эффективность доставки и жизнеспособность (фиг. 25). Таким образом, эти параметры можно использовать для оптимизации конструкции устройства для индивидуальных применений на основе типа клеток и размера доставляемого материала.
В примере 2 этот способ основан на микрожидкостной системе, которая может быть включена в более крупную интегрированную систему, состоящую из множества стадий предварительной обработки перед доставкой и стадий анализа или сортировки после обработки. При средней пропускной скорости 10000 клеток/с, устройство для доставки, например, может быть встроено в одной линии с устройством для проточной цитометрии для сортировки клеток или выполнения других аналитических задач сразу после доставки.
Устройства, системы и способы, описанные в настоящем описании, обеспечивают ряд потенциальных преимуществ над существующими способами. Аналогично электропорации и микроинъекции, эта система представляет собой механизм на основе образования пор и, таким образом, она не основана на экзогенных механизмах, химической модификации грузов или каскадах эндоцитоза. Однако в противоположность электропорации, она не основана на электрических полях, которые имеют ограниченный успех при доставке белков, могут повреждать некоторые грузы или вызывают цитотоксичность. Действительно, текущие результаты продемонстрировали относительно высокую жизнеспособность в большинстве применений и чувствительные грузы, такие как квантовые точки, оказываются неповрежденными. Таким образом, настоящее изобретение относится к значительным преимуществам в областях, таких как мечение и отслеживание материала цитозоля, где повреждение квантовой точки вследствие электропорации может быть проблемой и использование химических способов доставки может ограничить диапазон доступных поверхностных химических групп.
В примере 2 также продемонстрирована способность устройства доставлять белки в цитозоль клеток. Данные и оценки при моделировании указывают на то, что настоящее изобретение может доставлять в 10-100 раз больше материала на клетку относительно предшествующих методик, таких как использование проникающих в клетку пептидов или электропорации. Это увеличение скоростей доставки обеспечивает мощный способ для применения в перепрограммировании клеток с помощью белков, например, где доставка факторов транскрипции в цитозоль клеток является основным препятствием для разработки надежных способов получения iPSC. Также настоящее изобретения можно использовать для исследования механизма заболевания посредством доставки различных представляющих интерес белков/пептидов. Действительно настоящее изобретение можно использовать для высокопроизводительного скрининга пептидных библиотек, поскольку, в отличие от большинства способов на основе CPP или наночастиц, настоящее изобретение является нечувствительным к структуре и химии белков, не основано на каскадах эндоцитоза и не влияет на функциональность белков.
Поскольку настоящее изобретение продемонстрировало потенциал к доставке в первичные клетки, доставку в цитозоль посредством быстрой механической деформации также можно использовать в качестве механизма лечения ex vivo. В этом подходе клетки-мишени пациента, выделенные из крови или другой ткани, обрабатывают с помощью устройства вне организма пациента, а затем повторно вводят в организм. Преимуществом такого подхода является увеличенная эффективность доставки терапевтических средств на основе белков или наночастиц, и она является более безопасной, чем существующие способы, поскольку она устраняет необходимость в потенциально токсичных векторных частицах и смягчает какие-либо потенциальные побочные эффекты, ассоциированные с ретикулоэндотелиальным выведением и нецелевой доставкой.
В примере 2 устройства на основе кремния изготавливали на микротехнологическом оборудовании с использованием способов фотолитографии и глубокого реактивного ионного травления. В этом процессе кремниевые пластины размером 6'' (15 см) толщиной 450 мкм обрабатывали гексаметилдисилазаном (HMDS), покрытым методом центрифугирования фототвердеющим материалом (OCG934, FujiFilm) в течение 60 с при 3000 об./мин., подвергали УФ-излучению (EV1-EVG) через хромированный фотошаблон с конструкцией канала сужения и проявляли в растворе AZ405 (AZ Electronic Materials) в течение 100 с. После обжига в течение 20 мин при 90°C, пластину протравливали посредством глубокого реактивного ионного травления (SPTS Technologies) до желаемый глубины (как правило, в этом примере 15 мкм). Обработку Piranha (H2O2 и H2SO4) использовали для удаления какого-либо оставшегося фототвердеющего материала после завершения процесса травления. Для гравирования отверстий для доступа (т.е. входа и выхода) процесс повторяли на противоположной стороне пластины (т.е. стороне, не содержащей выгравированные каналы) с использованием отличающегося шаблона, который содержит узоры отверстий для доступа, и большей толщины фототвердеющего материала AZ9260 (AZ Electronic Materials).
Кислородную плазму и очистку RCA использовали для удаления каких-либо оставшихся примесей. Влажное окисление использовали для выращивания 100-200 нм оксида кремния, а затем пластину анодным образом связывали с пластиной Pyrex и нарезали на индивидуальные устройства. Каждое устройство перед применением по отдельности исследовали в отношении дефектов.
Перед каждым экспериментом устройства помещали на держатель с резервуарами на входе и на выходе (все индивидуально разработаны и изготовлены Firstcut). Эти резервуары соединены с устройством с использованием уплотнительных колец Buna-N (McMaster-Carr) для обеспечения надлежащей герметизации. Резервуар на входе соединен с системой регулятора давления с использованием тефлоновой трубки для обеспечения необходимой движущей силы для продвижения материала через устройство. В примере 2 можно было использовать давления вплоть до 70 фунт./кв. дюйм (482,6 кПа).
Клеточная культура примера 2 включала HeLa (ATCC), эксрессирующие GFP HeLa и DC2.4 (ATCC), клетки культивировали в модифицированной способом дульбекко питательной среде (DMEM, Mediatech) с высоким содержанием глюкозы, дополненной 10% эмбриональной телячьей сывороткой (FBS) (Atlanta Biologies) и 1% пенициллин-стрептомицином (Mediatech). Первичные фибробластные клетки человека (NuFF) (Globalstem) культивировали в DMEM с высоким содержанием глюкозы, дополненной 15% FBS. Клетки поддерживали в инкубаторе при 37°C и 5% CO2. В соответствующих случаях, прикрепляющиеся клетки суспендировали посредством обработки 0,05% трипсином/EDTA (Mediatech) в течение 5-10 мин.
Эмбриональные стволовые клетки мыши (mESC) выращивали на эмбриональных фибробластах мыши (Chemicon) в среде, состоящей из 85% DMEM для нокаута, 15% эмбриональной телячьей сыворотки, 1 мМ глутамина, 0,1 мМ бета-меркаптоэтанола и 1% неосновных аминокислот, дополненных 1000 единиц/мл LIF (Millipore, США). Клетки пассировали каждые 2-3 суток с использованием 0,25% трипсина/EDTA. При обработке с помощью устройства mESC были способны вновь формировать колонии и сохраняли нормальную морфологию даже через 2 недели после обработки.
Для проведения эксперимента примера 2, клетки сначала суспендировали в желаемом буфере для доставки (среда для роста, фосфатно-солевой буфер (PBS) или PBS, дополненный 3% FBS и 1% F-68 Pluronics (Sigma)), смешанным с желаемым доставляемым материалом и помещали в резервуар устройства на входе. Этот резервуар соединен с линией сжатого воздуха, контролируемой регулятором, и выбранное давление (0-70 фунт./кв. дюйм (0-482,6 кПа)) использовали для направления жидкости через устройство. Затем обработанные клетки собирают из резервуара на выходе. Клетки инкубировали при комнатной температуре растворе для доставки в течение 5-20 мин после обработки для обеспечения закрытия пор перед проведением дальнейшей обработки.
В экспериментах примера 2, сравнивающих доставку молекул декстрана различных размеров или белка против декстрана, представляющие интерес молекулы доставляли совместно, т.е. их использовали в одном и том же эксперименте с одной и той же популяцией клеток, на одно и том же устройстве и различали на основе их флуоресцентных меток. Все экспериментальные условия осуществляли в трех экземплярах и планки погрешности соответствуют двум стандартным отклонениям.
Для доставки флуоресцентно меченных молекул декстрана (Invitrogen) или аполипопротеина E (Invitrogen), эксперименты примера 2 проводили, как описано выше, так чтобы буфер для доставки содержал 0,1-0,3 мг/мл декстрана или 1 мг/мл аполипопротеина E, соответственно.
Для доставки конъюгированного с флуоресцеином BSA (Invitrogen), клетки сначала инкубировали в культуральной среде, содержавшей 5 мг/мл немеченого BSA (Sigma), в течение 2 часов при 37°C, а затем обрабатывали с помощью устройства примера 2 с использованием буфера для доставки, содержащего 1 мг/мл конъюгированного с флуоресцеином BSA. Стадия предварительной инкубации была предназначена для минимизации неспецифического связывания флуоресцентно меченного BSA с клеточной поверхностью.
Нокдаун GFP в примере 2 измеряли в качестве процентного снижения средней интенсивности флуоресценции популяции клеток относительно необработанных контролей. Lipofectamine 2000 + частицы миРНК получали посредством комбинирования 1 мкг миРНК с 1 мкл реагента Lipofectamine 2000 в 100 мкл PBS. После инкубации в течение 20 мин при комнатной температуре, 20 мкл этой смеси добавляли в каждую экспериментальную лунку, содержащую ~20000 клеток и 100 мкл среды. Клеткам позволяли инкубироваться с частицами в течение 18 часов перед анализом.
В примере 2 золотые наночастицы получали посредством конъюгации полиэтиленгликоля (PEG) с концевым тиолом с ММ 1000 с поверхностью наночастицы, затем избыток PEG смывали четыре раза посредством центрифугирования (10000 rcf в течение 30 мин) и полученный материал суспендировали в PBS до конечной концентрации 100 нМ. Для визуализации доставки GNP в клетках HeLa, клетки суспендировали в PBS, дополненном 3% FBS, 1% F-68 Pluronics и 47 нМ GNP; обрабатывали с помощью устройства 10 мкм-6 мкм-x5 и фиксировали в 2,5% (масс./об.) глутаральдегиде, 3% (масс./об.) параформальдегиде и 5,0% (масс./об.) сахарозе в 0,1 M буфере на основе какодилата натрия (pH 7,4). После фиксации в течение ночи клетки подвергали постфиксации в 1% (масс./об.) OsO4 в веронал-ацетатном буфере в течение 1 ч. Затем их целиком окрашивали в течение ночи с помощью 0,5% уранилацетата в веронал-ацетатном буфере (pH 6,0), дегидратировали и заключали в смолу Spurr. Срезы нарезали на Reichert Ultracut E (Leica) при толщине 70 нм с помощью алмазного ножа. Срезы исследовали с помощью электронного микроскопа EM410 (Phillips).
В примере 2, систему электропорации Neon (Invitrogen) использовали для трансфекции клеток NuFF меченным флуоресцеином декстраном массой 70 кДа и меченным pacific blue декстраном массой 3 кДа. При промывании клеток следовали методике изготовителя и их суспендировали в соответствующих буферах. Клетки обрабатывали с использованием 10-мкл наконечника при плотности 10 клеток/мл с концентрацией декстрана 0,1 мг/мл. Три типа использованных условий были следующими: 1) один импульс 1700 В длительностью 20 мс, 2) три импульса 1600 В длительностью 10 мс, 3) два импульса 1400 В длительностью 20 мс. Условия как 1, так и 3, были рекомендованы изготовителем в качестве оптимальных условий для трансфекции фибробластных клеток человека с эффективностью доставки плазмиды eGFP 84% и 82%, соответственно.
На конфокальных изображениях примера 2 образцы центрифугировали при 800 rcf в течение 4 мин и промывали 2-3 раза посредством PBS перед визуализацией. Конфокальные изображения получали на живых клетках с использованием конфокального дополнительного блока C1 на инвертационном микроскопе Nikon TE2000-U с водно-иммерсионными линзами 60x. Возбуждение флуоресцентных образцов осуществляли с помощью лазера при 405 нм и детекцию проводили с использованием стандартного фильтра DAPI (Nikon).
Для флуоресцентной микроскопии примера 2 образцы центрифугировали при 800 rcf в течение 4 мин и промывали 2-3 посредством PBS перед визуализацией. Изображения получали с использованием инертационного микроскопа Axiovert 200 (Zeiss), оборудованного линзами Neofluar (Zeiss). Возбуждение флуоресценции обеспечивали с помощью ртутной лампы X-cite 120Q (Lumen Dynamics). Микроскоп оборудован камерой Hamamatsu C4742-95 (Hamamatsu) и изображения анализировали с помощью ImageJ (NIH).
Для проточной цитометрии примера 2 для анализа клеток после эксперимента по доставке клетки промывали 2-3 раза посредством PBS (>100 мкл на лунку в 96-луночном планшете). Затем их ресуспендировали в PBS, дополненном 3% FBS, 1% F-68 Pluronics и 10 мкг/мл йодида пропидия (Sigma). Клетки анализировали на LSR Fortessa (BD Biosciences) или FACSCanto (BD Biosciences), оборудованных высокопроизводительным роботом для взятия образцов. Лазеры 405 нм и 488нм использовали для возбуждения желаемых флуорофоров.
Сигналы йодида пропидия (краситель живые/погибшие), флуоресцеина и pacific blue выявляли с использованием длинноволнового пропускающего фильтра при 695 нм, фильтров 530/30 и 450/50, соответственно. Анализ данных проводили с использованием программного обеспечения FACS Diva (BD Biosciences) и FlowJo (FlowJo).
Пример 3 - стволовые клетки и иммунные клетки
Белки, наночастицы, миРНК, ДНК и углеродные нанотрубки успешно доставляли в одиннадцать различных типов клеток, включая эмбриональные стволовые клетки и иммунные клетки. Действительно, способность доставлять структурно разнообразные материалы и их применимость к первичным клеткам, которые трудно трансфицировать, указывает на то, что устройство и способы имеют широкую применимость в исследовательских и клинических применениях.
В примере 3 каждое устройство состоит из 45 идентичных параллельных микрожидкостных каналов, содержащих одно или несколько сужений, выгравированных на кремниевом чипе и герметизированных с помощью слоя Pyrex. Ширина и длина каждого сужения (более подробно описанного ниже) находится в диапазоне 4-8 мкм и 10-40 мкм, соответственно. Устройство примера 3, как правило, действовало при пропускной скорости 20000 клеток/с, обеспечивая практически один миллион обработанных клеток на устройство, пока не происходил отказ в работе вследствие закупорки. Конструкция параллельного канала была выбрана для увеличения пропускной способности, одновременно обеспечивая единообразную обработку клеток, поскольку какая-либо закупорка или дефекты в одном канале не могут повлиять на скорость потока в соседних каналах (устройство может действовать при постоянном давлении). Перед применением устройство можно сначала соединить со стальным соединительным устройством, которое соединяет резервуары на входе и на выходе с кремниевым устройством. Затем смесь клеток и желаемого доставляемого материала можно помещать в резервуар на входе и к входу подсоединять тефлоновую трубку. Затем можно использовать регулятор давления для коррекции давления в резервуаре на входе и продвижения клеток через устройство. Обработанные клетки можно собирать с резервуара на выходе.
Параметры, которые влияют на эффективность доставки, которые были идентифицированы (см., например, пример 2 выше), могут включать скорость клеток, размеры сужения и количество сужений (тем самым, изменяя уровни сдвига и сдавления в отношении клеток). Например, эффективность доставки не проходящих через мембрану меченных pacific blue молекул декстрана массой 3 кДа в живые клетки HeLa увеличивается монотонно с увеличением скорости клеток через различные конструкции сужения (например, фиг. 25 на 2500). Размеры сужения также влияют на доставку; увеличение длины сужения от 20 мкм до 40 мкм практически удваивало эффективность доставки при всех рабочих скоростях (например, фиг. 25 на 2500), с минимальным эффектом на жизнеспособность (например, фиг. 25 на 2510). Уменьшение ширины сужения имело сходный эффект. Увеличение количества сужений последовательно также увеличивало эффективность доставки, так что устройство с пятью сужениями длиной 10 мкм последовательно превосходило конструкции с одним сужением длиной 10 мкм, 20 мкм или 40 мкм при всех скоростях клеток (например, фиг. 25 на 2500 и 2510). В этих данных точки данных 0 мм/с соответствуют контрольному случаю, где клетки претерпевают ту же обработку, что и другие образцы, но их не пропускают через устройство, и, таким образом, они отражают любые эффекты эндоцитоза и поверхностного связывания.
Для исследования универсальности способа оценивали его способность доставлять модельные молекулы декстрана в несколько типов клеток, которые традиционно трудно трансфицировать, особенно иммунные клетки и стволовые клетки. Для этих экспериментов использовали флуоресцентно меченный декстран массой 70 кДа и 3 кДа, поскольку эти типы декстрана имеют сходный размер с многими молекулами белков и миРНК, соответственно, их легко обнаруживать посредством проточной цитометрии, и они имеют минимальные эффекты поверхностного связывания, поскольку они отрицательно заряжены.
На фиг. 30 проиллюстрирована применимость настоящего изобретения для различных типов клеток. На 3000 показана эффективность доставки и жизнеспособность клеток NuFF, обработанных с помощью устройства 30 мкм-6 мкм для доставки декстрана массой 3 кДа и 70 кДа. На 3010 представлена эффективность доставки и жизнеспособность выделенных из селезенки дендритных клеток мыши, обработанных с помощью устройства 10 мкм-4 мкм, для доставки декстрана массой 3 кДа и 70 кДа. На 3020 представлена эффективность доставки и жизнеспособность эмбриональных стволовых клеток мыши, обработанных с помощью устройства 10 мкм-6 мкм, для доставки декстрана массой 3 кДа и 70 кДа. На 3030 представлена эффективность доставки декстрана массой 3 кДа и на 3040 представлена эффективность доставки декстрана массой 70 кДа в B-клетки (CD19+), T-клетки (TCR-B+) и макрофаги (CD11b), выделенные из цельной крови мыши посредством центрифугирования и обработанные с помощью устройств 30 мкм-5 мкм и 30 мкм-5 мкм-x5 при 1000 мм/с. Декстран массой 3 кДа и 70 кДа метили посредством pacific blue и флуоресцеина, соответственно. Все точки данных анализировали в трех экземплярах и планки погрешности соответствуют двум стандартным отклонениям.
С использованием различных конструкций устройства молекулы декстрана доставляли в фибробласты крайней плоти новорожденного человека (NuFF) (3000), первичные дендритные клетки мыши (3010) и эмбриональные стволовые клетки (3020). Эти эксперименты обеспечили минимальную утрату (<25%) жизнеспособности клеток (3000, 3010 и 3020) и результаты для эмбриональных стволовых клеток мыши указывают на то, что этот способ не индуцирует дифференцировку. В следующих исследованиях лейкоциты (лейкоцитарная пленка) выделяли из крови мыши центрифугированием и обрабатывали их с помощью устройства. B-клетки, T-клетки и макрофаги, различаемые с помощью окрашивания антителами, показали успешную доставку декстрана массой как 3 кДа, так и 70 (3030 и 3040).
Для иллюстрации потенциала настоящего изобретения в отношении решения имеющихся в настоящее время проблем доставки, проводили ряд экспериментов с возможными применениями в диапазоне от перепрограммирования клеток до сенсорного обнаружения с помощью углеродных нанотрубок. В дополнение к применению конкретных материалов, подробно описанных ниже, настоящее изобретение продемонстрировало успешную доставку различных исследуемых грузов, таких как аполипопротеин E, бычий сывороточный альбумин и GFP-плазмиды.
На фиг. 31 проиллюстрированы данные доставки наноматериалов и антитела. На 3100 представлена эффективность доставки и жизнеспособность клеток HeLa, обработанных с помощью устройства 10 мкм-6 мкм-x5 в отношении доставки меченного pacific blue декстрана массой 3 кДа и меченных Cy5 заключенных в ДНК углеродных нанотрубок. На 3110 представлены светлопольные изображения клеток, на которые наложено рассеяние Рамана в G-полосе (красный) для указания на доставку углеродных нанотрубок в обработанные клетки (слева) против эндоцитоза (справа). Масштабные метки соответствуют 2 мкм. На 3120 представлена флуоресцентная микрофотография клетки HeLa через 18 ч после доставки меченного pacific blue декстрана массой 3 кДа (средняя панель) и антител к тубулину с меткой Alexa Fluor 488 (правая панель). Масштабные метки соответствуют 3 мкм. На 3130 представлена эффективность доставки и жизнеспособность клеток HeLa, обработанных с помощью устройства 10 мкм-6 мкм-x5, при 500 мм/с, для доставки меченных Alexa Fluor 488 антител против тубулина. Эффективность доставки при различных концентрациях антитела сравнивают с контролем с эндоцитозом при 100 мкг/мл и необработанными клетками.
Подтверждение успешной доставки углеродных нанотрубок (инкапсулированных в олигонуклеотид ДНК) осуществляли посредством проточной цитометрии (3100) и спектрокскопии Рамана (3110). Также с использованием этого способа доставляли антитела к тубулину (3120 и 3130), обеспечивая диффузное распределение в клетке, которое согласуется с доставкой в цитозоль. Упомянутые выше материалы в настоящее время трудно доставить в цитозоль клетки и каждый материал часто требует специализированной модификации для облегчения доставки. В примере 3 все четыре материала доставляли в клетки HeLa с использованием одного и того же набора условий в устройстве 10 мкм-6 мкм-x5.
Эффективная доставка белков в первичные клетки может обеспечить несколько терапевтических применений. Проблемой перепрограммирования клеток, например, является неэффективность предшествующих способов доставки на основе CPP. На фиг. 32 проиллюстрированы применения для доставки белков. На 3200 представлен анализ с использованием вестерн-блоттинга доставки c-Myc, Klf-4, Oct-4 и Sox-2 посредством проникающих в клетку пептидов против доставки с помощью устройства 10 мкм-6 мкм в клетки NuFF. Каждый из четырех белков имеет дополнительные 9 групп аргинина (9R) для облегчения захвата. Столбцы лизата (Ly) соответствуют содержанию белка в клетках, которые промывали и лизировали, в то время как столбцы среды соответствуют содержанию белка в среде. На 3210 представлена эффективность доставки и жизнеспособность для выделенных из селезенки дендритных клеток, обработанных с помощью устройства 10 мкм-4 мкм, для доставки меченного pacific blue декстрана массой 3 кДа и меченного Alexa Fluor 488 овальбумина. Все точки данных анализировали в трех экземплярах и планки погрешностей соответствуют двум стандартным отклонениям.
Возможность доставлять четыре иллюстративных фактора транскрипции (Oct4, Sox2, c-Myc и Klf-4) в фибробластные клетки человека исследовали и сравнивали со способом CPP (3200). Результаты показывают, что в дополнение к тому, что доставка посредством быстрой механической деформации не основана на эндоцитозе, который может оставлять большое количество материала в эндосомах, она обеспечивает значительно более высокую эффективность доставки всех 4 белков. Этот результат согласуется с упомянутым выше моделированием, которое показало, что настоящее изобретение может иметь улучшение доставки белка относительно CPP в 10-100 раз.
Представление антигена в дендритных клетках (DC) представляет собой другую область, в которой настоящее изобретение имеет преимущество. Исследователи исследовали способы экспрессии антигенов на рецепторах MHC класса I DC, чтобы индуцировать мощный ответ цитотоксических T-клеток. Настоящее изобретение, которое имеет прямое клиническое значение для получения вакцин против злокачественной опухоли, например, основано на цитозольной доставке антигенных белков, поскольку представление посредством MHC класса I происходит практически исключительно для цитозольных белков. Способствуя прямой цитозольной доставке материала, настоящее изобретение служит в качестве платформы для достижения ответа цитотоксических T-клеток in vivo против конкретного антигена. Для иллюстрации этой способности меченный Alexa 488 овальбумин, модельный антигенный белок, успешно доставляли в дендритные клетки мыши, происходящие из селезенки (3210). Несмотря на более высокий уровень эндоцитоза в этом типе клеток, устройство обеспечивало значительное увеличение скоростей доставки относительно контролей с эндоцитозом (0 мм/с). Более того, доставляемый материал находится в цитоплазме вследствие механизма деформации клеток. Этот признак является особенно важным для доставки антигена, поскольку цитоплазматиическое воздействие является критическим требованием для представления антигенов MHC класса I.
Система примера 3 представляет собой полезный исследовательский инструмент, способный доставлять углеродные нанотрубки, золотые наночастицы и антитела (фиг. 31) - три материала, которые трудно доставлять с помощью современных способов. Настоящее изобретение значительно расширяет возможность исследовать внутриклеточные процессы, облегчая окрашивание антителами и квантовыми точками структур/белков живых клеток и обеспечивая применение углеродных нанотрубок в качестве цитозольного молекулярного зонда или химического сенсора. В качестве надежного способа доставки белков, его можно использовать для высокопроизводительного скрининга библиотек пептидов/белков, поскольку, в отличие от большинства способов на основе CPP или наночастиц, этот способ является нечувствительным к структуре и химии белков, не основан на каскадах эндоцитоза и не влияет на функциональность белков.
Кроме того, настоящее изобретение является пригодным для терапии (фиг. 32). Например, клетки-мишени пациента выделяют из крови или другой ткани, обрабатывают с помощью устройства для доставки желаемого терапевтического средства, и повторно вводят в организм. Такой подход имеет преимущество увеличенной эффективности доставки терапевтических макромолекул и является более безопасным, чем существующие способы, поскольку он устраняет потребность в потенциально токсичных векторных частицах и устраняет какие-либо потенциальные побочные эффекты, ассоциированные с ретикулоэндотелиальным выведением и нецелевой доставкой.
Пример 4 - Персонализированная вакцинация против злокачественной опухоли
Современные проблемы внутриклеточной доставки макромолекул являются существенным препятствием для лучшего понимания механизмов заболевания и внедрения новых терапевтических подходов. Несмотря на последние достижения в технологии доставки, обработка полученных от пациента клеток остается проблемой, и современные способы часто основаны на токсических электрических полях или эндогенных материалах. Микрожидкостная платформа и сходные системы и способы основаны на механической деформации клеток для облегчения доставки. Этот контролируемый физический подход обеспечивает результаты в областях, которые ранее были трудными, таких как перепрограммирование клеток с помощью белков и доставка квантовых точек.
Наиболее эффективным и прямым способом для влияния на поведение клетки является доставка активных веществ в цитоплазму клеток. Таким образом, внутриклеточная доставка макромолекул играет важную роль в исследовании и разработке (R&D), причем применения варьируют от разработки лекарственных средств до исследования биохимических процессов для терапевтических применений. Однако современные способы имеют ограничения. Они часто имеют низкую эффективность в полученных от пациента (первичных) клетках, основаны на токсичных электрических полях или экзогенных материалах, и непригодны для доставки структурно разнообразных материалов, таких как белки.
Надежная платформа для доставки, способная решать эти проблемы, обеспечивает значительные достижения в биологических исследованиях и служит в качестве основы для нового поколения лекарственных средств, таких как персонализированная вакцинация против злокачественной опухоли. Эффективный способ доставки белков в иммунные клетки, например, может служить в качестве платформы для вакцинации против злокачественной опухоли.
Как описано выше, микрожидкостные устройства, сходные системы и способы, описанные в настоящем описании, облегчают внутриклеточную доставку материала посредством быстрой деформации клетки по мере того, как она проходит через сужение. Процесс деформации вызывает временное нарушение клеточной мембраны и тем самым обеспечивает пассивную диффузию материала из окружающего буфера в цитозоль клетки. Посредством устранения потребности в экзогенных материалах и электрических полях, на которых основаны современные способы, этот подход обеспечивает упрощенный надежный подход для доставки со сниженной токсичностью. Таким образом, этот способ может служить в качестве широкой платформы для внутриклеточной доставки макромолекул с преимуществами в некоторых исследовательских и клинических применениях, таких как вакцинация против злокачественной опухоли.
На фиг. 34 представлена иллюстрация, на которой изображена система, в которой кровь пациента обрабатывают с помощью микрожидкостного устройства для доставки макромолекул. Один вариант осуществления настоящего изобретения включает систему, в которой дендритные клетки (DC), выделенные из крови пациента, обрабатывают с помощью устройства ex vivo для активации их против конкретного антигена злокачественной опухоли, а затем вновь вводят в кровоток пациента. Например, доставленный антиген представляет собой часто экспрессируемый белок, о котором известно, что он ассоциирован с конкретным заболеванием, или белок, специфический для пациента, полученный при биопсии. Посредством доставки антигенов злокачественной опухоли прямо в цитоплазму DC можно исследовать каскад представления антигена MHC-I и индуцировать мощный ответ цитотоксических T-лимфоцитов (CTL) у пациента. Затем эти активированные T-клетки находят и уничтожают любые злокачественные клетки, которые экспрессируют антиген-мишень. Универсальность платформы в отношении использования общепризнанных специфических антигенов заболевания или антигенов, происходящих непосредственно из опухоли пациента, позволяют лечить пациентов, которые являются устойчивыми к другим способам терапии. Действительно, это обеспечивает персонализированный направленный ответ против заболевания с минимальными побочными эффектами. Этот вариант осуществления может осуществлять обученный технический специалист в типичной больничной лаборатории (<1 ч на обработку). Вследствие малого размера и относительной простоты также можно использовать управляемую пациентом систему лечения.
Способ для вакцин против злокачественной опухоли был продемонстрирован в модели на мышах. Эту систему использовали для успешной доставки и обработки овальбумина, являющегося модельным антигенам, в дендритные клетки мыши, на которую указывает увеличенное представление антигена, пептида SIINFEKL, на рецепторах MHC класса I. Эти обработанные дендритные клетки стимулируют пролиферативный ответ цитотоксических T-лимфоцитов (CTL) in vitro. Обработанные DC вновь вводят животному для получения ответа CTL in vivo. Устройства являются пригодными для доставки антигенов в DC, выделенные из крови человека.
Данные указывают на то, что устройство способно доставлять материал в чувствительные первичные клетки (включая DC), не вызывая чрезмерной гибели клеток. Таким образом, повреждение клеток не является серьезной проблемой. Иммунный ответ может быть усилен посредством увеличения количества обработанных клеток, увеличения количества и разнообразия доставляемого антигена и/или совместной доставки активирующих факторов, таких как липополисахарид. В случае клеток, обработанных с помощью устройства, наблюдали небольшую токсичность или отсутствие токсичности, что, таким образом, делает способы не только осуществимыми, но также преимущественными для терапевтических применений у человека и ветеринарных применений.
Пример 5 - Лечение злокачественной опухоли крови
Как описано в примере 4, быстрая механическая деформация клеток может обеспечить надежное средство для доставки антигенов в дендритные клетки (DC) и, таким образом, может быть платформой для клеточной терапии. Эта система основана на открытии, что быстрая механическая деформация клеток может обеспечить образование временных пор в мембране, которые обеспечивают диффузионную доставку материала из окружающей среды. В отличие от существующих способов терапии, описанных ранее, этот способ не основан на специализированных механизмах слитых белков, перекрестном представлении антигена, вирусных векторах, наночастицах или механизмах эндоцитоза; таким образом, он обеспечивает значительное увеличение эффективности in vivo при снижении расходов на терапию. Универсальность и простота этого фундаментально отличающегося подхода обеспечивает широкую платформу для активации дендритных клеток, которые могут индуцировать ответ CD8 против различных антигенов злокачественной опухоли. Система может быть нацелена на злокачественные опухоли крови, такие как B-клеточная лимфома, которые являются более восприимчивыми к иммунной терапии, а также несколько дополнительных типов злокачественной опухоли (например, меланома, рак поджелудочной железы, и т.д.) и обеспечивает актуальный персонализированный новых подход для борьбы с заболеванием.
Клеточная терапия злокачественной опухоли является привлекательной возможностью вследствие ее способности активировать иммунную систему пациента и запускать длительный антигенспецифический ответ CD8 T-клеток против заболевания. Эти способы терапии, такие как недавно одобренная Provenge® для рака предстательной железы, имеют минимальные побочные эффекты относительно химиотерапии и лучевой терапии. Однако одним из наибольших препятствий для разработки клеточной терапии является достижение надлежащего представления антигенов посредством доставки антигенов в цитоплазму клеток.
Традиционно, активация эффекторного ответа CD8 отличается от ответа CD4 положением чужеродного белка, входящего в антигенпредставляющую клетку (например, дендритную клетку). Белки, находящиеся в цитоплазме, индуцируют ответ CD8, в то время как внеклеточные белки, уловленные посредством эндоцитоза, индуцируют ответ CD4. Поскольку механизм перекрестного представления в антигенпредставляющих клетках остается неясным, необходимо разработать надежный способ доставки желаемого антигена прямо в цитоплазму клетки для обеспечения терапии с использованием мощного ответа цитотоксических эффекторов CD8. Надежный эффективный способ цитоплазматической доставки в дендритные клетки используют в качестве платформы для индукции иммунных ответов против различных типов злокачественной опухоли.
Эксперименты на клетках HeLa, проиллюстрированные на фиг. 8A и фиг. 11, показали, что быстрая механическая деформация клеток приводит к образованию временных повреждений/пор в клеточной мембране, которые обеспечивают пассивную диффузию материала из окружающего буфера в цитоплазму клеток. Это ранее не описанное явление продуцирует клетки, которые являются жизнеспособными и нормально пролиферируют после лечения. Эксперименты показали, что более крупные молекулы проявляют более низкие уровни доставки, чем меньшие молекулы, тем самым указывая на диффузионный механизм. Успешная доставка миРНК и диффузное окрашивание цитозоля, определяемые с помощью конфокальной микроскопии, также указывают на то, что доставляемые материалы располагаются в цитозоле и находятся в активном/доступном состоянии. Традиционно, способы доставки антигена часто оказываются перспективными в клеточных линиях, но не переносятся на первичные иммунные клетки. Однако способ доставки, описанный в настоящем описании, является независимым от каскадов эндоцитоза или клеточного ответа на экзогенные материалы, которые могут значительно варьировать среди типов клеток, и основан в основном на свойствах бислоя мембраны. Таким образом, благодаря простоте и новому пути, эта технология является более подверженной переходу с доставки в клеточную линию на доставку в первичные иммунные клетки и, таким образом, обеспечивает значительное улучшение представления антигена.
Представление антигенов MHC класса I и созревание дендритных клеток можно анализировать с помощью окрашивания антителом в ответ на доставку белка овальбумина. T-клетки, полученные от трансгенных мышей OT-I и OT-II TCR, также можно использовать для определения пролиферации CD8 и CD4 в ответ на нагрузку антигеном овальбумином и/или SIINFEKL. Систему можно оптимизировать для увеличенной пролиферации CD8 по сравнению с дендритными клетками, стимулированными посредством эндоцитоза отдельно.
Первичные дендритные клетки мыши очищают посредством выделения MACS CD11c+ (Miltenyi Biotec, Германия) из селезенок мышей B6. Можно использовать устройство, которое содержит сужения с шириной канала 6 мкм, способное образовывать 13-мкм поры в мембране клеток HeLa. Вследствие меньшего размера этих дендритных клеток, можно проводить микрообработку и исследование устройства с шириной канала 3-5 мкм. Существующие протоколы фотолитографии и глубокого реактивного ионного травления можно модифицировать для обеспечения эффективного изготовления этих устройств. Флуоресцентно меченные молекулы декстрана можно использовать в качестве модельных молекул для оценки эффективности доставки посредством FACS. Затем белок овальбумин можно доставлять в клетки и оценивать с помощью вестерн-блоттинга для подтверждения захвата белка в первичные клетки.
Созревание дендритных клеток можно исследовать с помощью окрашивания антителами против CD80 и CD86, чтобы показать, что способ быстрой деформации индуцирует созревание клеток. Использование внеклеточных агонистов TLR, таких как липополисахарид (LPS), можно рассматривать, если считается необходимым вручную индуцировать созревание DC после доставки. Белок овальбумин можно доставлять в дендритные клетки и представление антигена можно количественно определять с помощью антител против MHC-I-SIINFEKL. Кроме того, можно оценивать эффективность представления антигена в ответ на доставку специфичных к TCR пептидов, чтобы показать способность системы доставлять/представлять антигенные белки против пептидов. Затем CD8 и CD4 T-клетки можно собирать из трансгенных по TCR мышей OT-I и OT-II, соответственно, окрашивать посредством CFSE, и кокультивировать с обработанными овальбумином дендритными клетками в течение 5 суток. Пролиферацию T-клеток обеих подгрупп можно измерять посредством FACS. Конструкцию устройства можно оптимизировать для получения увеличенных уровней популяций функциональных CD8 T-клеток по сравнению с общепринятыми способами in vitro (например, эндоцитоз).
Универсальная способность индуцировать антигенспецифические ответы CD8 является целью терапии злокачественной опухоли, которая являлась недостижимой до настоящего времени вследствие неэффективного представления антигена и недостаточной приспосабливаемости способа доставки. Существующие способы имеют ряд недостатков, включая их зависимости от повреждающих электрических полей, использования экзогенных материалов, модификации белковой последовательности и/или каскадов эндоцитоза для облегчения доставки антигена. Однако настоящее изобретение обеспечивает фундаментально отличающийся подход цитозольной доставки, который не обладает ни одной из упомянутых выше проблем. Более того, вследствие природы его механизма образования пор-диффузии, этот способ широко применим среди различных типов антигенов и, таким образом, он может быть направлен на ряд злокачественных опухолей-мишеней. Этот механизм можно даже использовать для введения дополнительных молекул передачи сигнала в целях повышения созревания/активации DC для достижения более мощного ответа T-клеток. Такая широкая платформа является более универсальной и надежной, чем любые из существующих механизмов доставки/представления антигена, исследуемых для вакцин против злокачественной опухоли.
Пример 5 может иметь широкое применение. Учитывая огромное социальное бремя злокачественной опухоли в стране (согласно оценкам, 570000 смертей в США в 2011 году); злокачественная опухоль может поразить значительную часть популяции. Для популяции заболевших людей является преимущественной разработка новых клеточных способов терапии, которые приспособят мощь иммунной системы пациента для борьбы с заболеванием. Настоящее изобретение является более эффективной персонализированной платформой для лечения различных типов злокачественных опухолей, таких как злокачественные опухоли крови, например, лейкозы, лимфомы и множественные миеломы, а также миелопролиферативные новообразования и миелодиспластические синдромы. Способы также особенно пригодны для лечения метастатических злокачественных опухолей, например, вследствие их склонности к распространению через кровоток. Например, злокачественные опухоли с неизвестным антигенным эпитопом можно лечить посредством расщепления образца биоптата опухоли, доставки лизата в DC пациента, и повторного введения DC в организм. Это может обеспечить активацию T-клеток хозяина против широкого диапазона антигенов злокачественной опухоли, тем самым обеспечивая эффективное лечение, направленное против множества мишеней. Этот персонализированный аспект может представлять особый интерес для людей, у которых могут развиться редкие формы злокачественной опухоли, часто не излечимые современными способами лечениям, вследствие воздействия неблагоприятных условий внешней среды. Посредством адаптации лечения к индивидуальному заболеванию, этот способ может обеспечить своевременный эффективный уход даже в наиболее агрессивных случаях, таких как злокачественные опухоли с множественной устойчивостью к лекарственным средствам. Эта терапия на основе иммунитета также, в частности, может быть эффективной для профилактики метастазов (ответственных за ~90% смертей, связанных со злокачественной опухолью), поскольку CD8 T-клетки могут без труда находить и уничтожать метастатические клетки, в то время как иммунологическая память, обеспечиваемая этими способами лечения, может предотвратить рецидив в будущем. Кроме того, в качестве исследовательского инструмента этот способ может обеспечить беспрецедентные механистические исследования процессинга антигена для лучшего понимания процессов перекрестного представления антигенов и, таким образом, увеличения эффективности существующих/альтернативных способов активации иммунной системы.
Пример 6 - Перепрограммирование клеток
Стволовые клетки играют важную роль в современных исследованиях в области регенеративной медицины, особенно в быстро расширяющейся области инженерии тканей. iPSC представляют особый интерес вследствие их способности к самообновлению, продемонстрированной способности к дифференцировке в любой тип клеток и аутологичных (специфических для пациента) характеристик. Таким образом, iPSC обеспечивают возможность получать клетки-предшественники множества ростков из общего плюрипотентного источника, которые могут быть объединены в различные, но, тем не менее, взаимодействующие тканевые компартменты. Более того, эти клетки в конечном итоге могут устранить необходимость в эмбриональных стволовых клетках человека (hESC) в клинических применениях, таким образом, позволяя избегать множества моральных и этических споров, которые связаны с этими типами клеток. Более того, происходящие из пациента iPSC устраняют или минимизируют проблемы иммунного отторжения происходящих из hESC клеток. Таким образом, современные исследования в значительной степени сфокусированы на разработке эффективных безвирусных протоколов для получения больших количеств iPSC.
iPSC первоначально были получены посредством перепрограммирования фибробластов взрослых мышей и человека (HF) в плюрипотентное состояние на основе ретровирусной сверхэкспрессии 4 факторов транскрипции Oct 3/4, Sox2, c-Myc и Klf4. Эти iPSC не только в значительной степени идентичны клеткам ES в отношении общей экспрессии генов, метилирования ДНК и модификации гистонов, но также они способны дифференцироваться в типы клеток, соответствующие всем 3 зародышевым слоям. В то время как технология iPSC имеет огромный потенциал для биомедицинского исследования и клеточной терапии, для реализации ее полного потенциала необходимо преодолеть значительные препятствия. Например, большинство линий iPSC происходят из различных соматических клеток вследствие ретровирусного или лентивирусного введения генов, кодирующих факторы перепрограммирования, что приводит к множественным хромосомным нарушениям вследствие встраивания вируса, любое из которых может вызывать генетическую дисфункцию и/или опухоль. Кроме того, перепрограммирующие трансгены (в частности, c-Myc и Klf4) тесно ассоциированы с онкогенезом, повышая вероятность того, что его остаточная экспрессия и/или реактивация могут вызвать образование опухоли. Таким образом, во многих лабораториях недавно исследовали различные подходы без встраивания в геном, такие как аденовирусы, эписомальные векторы, мРНК и микроРНК. Примечательно, что было показано, что iPSC можно получать посредством прямой доставки четырех факторов перепрограммирования (Oct 3/4, Sox2, c-Myc и Klf4), слитых с проникающими в клетку пептидами (CPP). В то время как было описано, что получение iPSC мыши можно осуществлять посредством доставки четырех слитых с CPP факторов, экспрессируемых в E. coli, может быть показано, что iPSC человека можно получать посредством четырех слитых с CPP факторов, экспрессируемых в клетках млекопитающих. Однако в обоих исследованиях сообщалось, что эффективность перепрограммирования в случае перепрограммирования на основе белков является очень низкой (<0,01%). Поскольку перепрограммирование на основе белков не вовлекает никакой тип генетического материала (ДНК или РНК) и векторного носителя (вирус или плазмида), прямая доставка белков обеспечивает одну из наиболее безопасных методик перепрограммирования. Показано, что iPSC человека на основе белков эффективно формировали функциональные дофаминовые нейроны без аномальных свойств, ассоциированных с встраиванием вируса в геном. Поскольку эффективность перепрограммирования на основе белков может быть повышена с помощью настоящего изобретения с использованием технологии платформы для доставки, она открывает широкую возможность для получения клинически ценных клеток iPS. Более того, этот подход обеспечивает линейный уровень контроля над клеточной функцией вследствие избегания стохастических процессов, которые управляют трансляцией и/или транскрипцией при перепрограммировании с помощью мРНК, плазмиды и вируса. Таким образом, прямая доставка белка обеспечивает два фундаментальных преимущества над альтернативными способами: устранение риска мутагенного встраивания и обеспечение более точного контроля высокочувствительных процессов перепрограммирования. Технология доставки, описанная в настоящем описании, продемонстрировала ее способность доставлять белки с высокой эффективностью в HF и стволовые клетки. Эксперименты, сравнивающие способности этого способа к доставке с существующими методологиями с проникающими пептидами показали значительное увеличение доставки с использованием этого подхода (увеличение потенциально в 100 раз на основе моделирования). Более того, его физический механизм образования пор устраняет потребность в химической модификации или использовании экзогенных соединений, которые вовлечены в альтернативные способы доставки белка. Низкомолекулярные соединения, миРНК и другие факторы также можно совместно доставлять в процессе перепрограммирования, поскольку способ является агностическим к типу доставляемого материала. Таким образом, эта система обеспечивает уникальный инструмент для индукции перепрограммирования клеток через прямую доставку белка. Этот простой механизм действия (т.е. диффузия через поры) также позволяет потенциально прогнозировать и контролировать доставляемые количества с высокой точностью, таким образом, облегчая исследования по оптимизации для увеличения понимания динамики перепрограммирования и тем самым значительного увеличения эффективности. Наконец, можно использовать этот микрожидкостный способ в качестве медицинского устройства для получения iPSC для клинической модификации тканей и применений в клеточной терапии.
Более того, применения этой системы не ограничены доставкой белков. Этот способ может быть включен в универсальный способ доставки, способный доставлять ряд макромолекул (ДНК, РНК, белки, сахара и пептиды) практически в любой тип клеток. Это обеспечивает реципиентов для применений, для которых современные технологии являются недостаточными. Современные способы на основе липосом, наночастиц и электропорации, например, часто не могут трансфицировать определенные первичные клетки (такие как иммунные клетки или стволовые клетки) и могут быть неэффективными в отношении доставки белков и наночастиц (таких как квантовые точки). Пептидная доставка для терапевтического скрининга и применений на основе механизма заболевания также может быть осуществлена с помощью этого нового способа, в то время как современные способы часто требуют химической модификации или инкапсулирования. Также можно использовать этот способ для применений в сенсорном обнаружении на основе наночастиц для доставки модифицированных квантовых точек в целях мечения органелл и исследований механизма заболевания.
Внутриклеточная доставка является краеугольным камнем множества биологических научных применений в диапазоне от фундаментальных исследований экспрессии генов до механизмов заболевания и, на что направлена настоящая заявка, получения iPSC. Общепринятые способы доставки, такие как липосомы, полимерные наночастицы и электропорация, часто вовлекают использование экзогенных соединений в качестве носителя для доставки (или электрических полей в случае электропорации) и они являются специфическими для материала и/или клеток. Например, Lipofectamine (Invitrogen) может доставлять молекулы ДНК и РНК (в подгруппы клеточных линий или первичных клеток) но не может образовывать надлежащего комплекса для доставки белков или других макромолекул. Электропорация, с другой стороны, хотя и является перспективной с точки зрения ее способности нацеливаться на различные типы клеток, вызывает повреждения клеток вследствие высоких электрических полей и имеет ограниченный успех в доставке белков. Это делает ее особенно непригодной для множественных трансфекций, требуемых, например, для получения iPSC. Проникающие через мембрану пептиды являются другим способом доставки, которые являются в большой степени специфическими для белков. Эти способы на основе пептидов, однако, обладают непредсказуемыми эффектами на функциональность белка и связаны со значительной деградацией белка в эндосоме. Таким образом, настоящее изобретение, относящееся к универсальному способу, способному доставлять ряд макромолекул (ДНК, РНК, белки, пептиды, низкомолекулярные соединения), при минимальной гибели клеток, обеспечивает беспрецедентный контроль клеточной функции в одной технологической платформе, тем самым позволяя исследовать механизм заболевания, идентифицировать макромолекулярные терапевтические кандидаты, направлять дифференцировку или перепрограммирование стволовых клеток и разрабатывать диагностические способы с репортерными клеточными линиями.
Микрожидкостное устройство, описанное в настоящем описании, может служить в качестве широкой универсальной платформы для доставки. В качестве микрожидкостного устройства оно имеет преимущество точного контроля условий обработки на уровне единичной клетки. Уникальная комбинация контроля на уровне единичной клетки и макромасштабной пропускной способности ставит это устройство в уникальное положение относительно существующих способов доставки. Данные к настоящему времени продемонстрировали способность системы доставлять материал в более чем 11 различных типах клеток, включая злокачественные клеточные линии, эмбриональные стволовые клетки, первичные фибробласты и первичные лимфоциты. Ее механизм механического образования пор также обеспечил доставку прежде проблематичных материалов, таких как углеродные нанотрубки и квантовые точки.
Предшествующая работа с использованием рекомбинантных белков для получения iPSC продемонстрировала чрезмерно низкую эффективность (<0,01%) и тем самым она непригодна для широко распространенного клинического применения. Однако устройство, системы и способы, упомянутые в настоящем описании, продемонстрировали их способность доставлять белки прямо в цитоплазму с высокой эффективностью и минимальной гибелью клеток, таким образом, обеспечивая привлекательную возможность достигнуть существенного увеличения эффективности перепрограммирования посредством более эффективной доставки. Посредством прямого определения количества доступного белка можно осуществлять точный контроль внутриклеточной кинетики. С другой стороны, другие способы перепрограммирования (например, экспрессия с помощью вирусов, плазмид и мРНК) основаны на стохастических эффектах для определения уровня доступности белка и, таким образом, непригодны для исследования кинетики. Низкая эффективность современных методологий перепрограммирования указывает на то, что процесс является в высокой степени чувствительным к стохастическим изменениям и только узкий диапазон уровней экспрессии факторов транскрипции приведет к перепрограммированию. Посредством прямой доставки белков в цитоплазму можно осуществлять беспрецедентный контроль доступности белка и, таким образом, более согласованно применять точные условия, необходимые для перепрограммирования. После идентификации и оптимизации эти условия можно воспроизводить в точности для каждой клетки, подвергающейся обработке, и, таким образом, можно значительно повысить эффективность перепрограммирования.
Этот способ обеспечивает/улучшает различные применения внутриклеточной доставки. Кроме того, строго механическая природа этого способа устраняет какие-либо потенциальные осложнения вследствие применения химических агентов или электрических полей. Данные не показали никаких существенных изменений в поведении клеток в результате обработки. Таким образом, эта система является надежным, высокопроизводительным, высокоэффективным, универсальным механизмом внутриклеточной доставки с конкретной пригодностью в применениях по перепрограммированию.
Данные указывают на то, что быстрая деформация, которая происходит, когда клетка проходит через сужение, индуцирует образование временных пор в клеточной мембране, обеспечивающих диффузию макромолекул из окружающего буфера в цитозоль. Этот способ был продемонстрирован на 11 различных типах клеток, включая злокачественные клеточные линии, первичные фибробласты, первичные лимфоциты и эмбриональные стволовые клетки (не вызывая дифференцировки). Один прототип способен обрабатывать ~20000 клеток/с и действовать при диапазоне концентраций клеток (104-108 клеток/мл). Проблемы, касающиеся закупорки, также были в большой степени устранены посредством усовершенствования экспериментальных протоколов и конструкций чипов, так чтобы каждое устройство было способно обрабатывать ~1 миллион клеток перед закупоркой, с возможностью очистки и повторного использования. Кроме того, многоканальная конструкция обеспечивает значительную избыточность, так что закупорка одного канала не влияет на эффективность других. Обеспечиваемый давлением поток (при контролируемом постоянном давлении) и параллельная конструкция каналов обеспечивает постоянный профиль потока на канал, независимо от процента закупоренных каналов в чипе.
Была продемонстрирована способность устройства доставлять молекулы декстрана в фибробласты и эмбриональные стволовые клетки человека. На фиг. 35 проиллюстрированы потенциальные преимущества перепрограммирования клеток. На 3500 представлена эффективность доставки и жизнеспособность эмбриональных стволовых клеток человека, обработанных с помощью устройства 10 мкм-6 мкм для доставки декстрана массой 3 кДа. На 3510 представлен анализ с использованием вестерн-блоттинга доставки c-Myc, Klf-4, Oct-4 и Sox-2 с помощью проникающих в клетку пептидов против доставки с помощью устройства 10 мкм-6 мкм в клетки NuFF. Столбцы лизата (Ly) соответствуют содержанию белка в клетках, которые промывали и лизировали, в то время как столбцы среды соответствуют содержанию белка в среде. На 3520 представлены изображения конфокальной микроскопии клеток NuFF, фиксированных после доставки перепрограммирующих факторов. Белки мечены с использованием конъюгированного с Alexa 488 антитела против FLAG и ядра окрашены DAPI.
Более того, эффективность доставки с помощью устройств сравнивали с эффективностью доставки способа с 9 остатками аргинина (CPP), в настоящее время используемого для перепрограммирования на основе белков. Результаты (3510) продемонстрировали значительное увеличение количества доставляемых c-Myc, Klf4, Oct4 и Sox2 при измерении с помощью вестерн-блоттинга. Затем с помощью конфокальной микроскопии была подтверждена успешная локализация этих факторов транскрипции в ядре клетки (3520). Была разработана простая 2-D-модель диффузии в COMSOL для моделирования механизма доставки на основе литературных величин диффузионной способности частиц внутрь цитоплазмы клеток и наружу. Посредством аппроксимации этой модели к экспериментальным данным, может быть оценено, что способ доставляет 10-40% доставляемого материала, присутствующего в буфере, в цитозоль клеток. Посредством сравнения оценено, что способы CPP для доставки белка доставляют только 0,1% материала буфера в цитозоль. Таким образом, этот подход обеспечивает надежное увеличение количества доставляемого перепрограммирующего материала (в 10-100 раз). Более того, он обеспечивает более высокую биодоступность доставляемых факторов транскрипции.
На фиг. 36 представлено получение и охарактеризация линий iPSC мыши и человека посредством прямой доставки слитых перепрограммирующих белков. На 3600 представлена исходная культура гепатоцитов мыши (первое изображение); морфология после 6 циклов обработки белком (второе изображение); установившиеся колонии iPS (третье изображение); и окрашивание посредством AP установившихся колоний iPS (четвертое изображение). На 3610 представлено иммунное окрашивание маркеров ESC (Nanog, Oct4 и SSEA1) в p-miPSC. Ядра окрашивали посредством DAPI (синий). На 3620 анализ секвенирования с бисульфитом промотора Oct4 демонстрирует практически полное эпигенетическое перепрограммирование в линиях p-miPSC-1 и p-miPSC-2. Незакрашенные и закрашенные круги указывают на метилированные и метилированные CpG, соответственно. На 3630 потенциал к дифферецнировке in vivo анализировали посредством инъекции p-miPSCs иммунодефицитным мышам и посредством окрашивания с помощью H&E тератом. Полученные тератомы содержали ткани, соответствующие все три зародышевых слоя; клетки ростка эктодермы (невральная трубка или эпидермис), мезодермы (хрящи или мышцы) и эндодермы (дыхательный эпителий или подобный кишечному эпителий). На 3640 химеры, происходящие из p-miPSC-1 (левая панель) и p-miPSC-2 (правая панель), плода на E13.5 демонстрирует высокий уровень GFP из инъецированного p-miPSCs. На 3650-3670, линии iPSC человека, p-hiPSC-01 (3660) и p-hiPSC-02 (3670) получают посредством прямой доставки слитых с CPP четырех перепрограммирующих факторов из полученных биопсией фибробластов взрослого человека (3650).
На фиг. 37 представлены предварительные результаты перепрограммирования с помощью белков. На 3700 представлено прогрессирование морфологических изменений из фибробластов в колонии. Белыми стрелками указаны потенциальные перепрограмированные клетки. Красная стрелка указывает на коалесцирующие iPSC, образующие колонию. На 3710-3760 представлена экспрессия маркеров эмбриональных стволовых клеток человека: Oct4, SSEA-4, Tra-60, Tra-80, щелочная фосфатаза (AP) в колониях iPSC. В соответствующих случаях небольшой прямоугольник соответствует контрастной окраске DAPI. Масштабные метки соответствуют 100 мкм.
Поскольку iPSC человека были получены на основе белков и охарактеризованы, далее получали полностью перепрограммированные iPSC мыши и человека с помощью предшествующего способа доставки слитых с CPP перепрограммирующих факторов, как исследовали с помощью всех критериев, включающих эпигенетический анализ, плюрипотентность in vivo и образование химеры (фиг. 36). Однако, несмотря на применение частично очищенных белков эффективность перепрограммирования все еще была низкой (<0,1%) и отнимала больше времени, чем способы перепрограммирования с помощью вирусов. Таким образом, была предпринята попытка использовать устройство для доставки 4 перепрограммирующих белков: Oct4, Sox2, Klf4 и c-Myc в фибробласты человека при концентрации буфера 80 мкг/мл. Клетки обрабатывали 4 раза с интервалом 48 ч между доставками в каждом случае. После 14-20 суток в культуре появлялись первые перепрограммированные hiPSC-подобные колонии. В это время наблюдали изменение морфологии фибробластов, поскольку они образовывали колонии iPSC и они экспрессировали несколько маркеров hESC (фиг. 37).
Клатрин, кавеолы и макропиноцитоз являются тремя наиболее часто предполагаемыми механизмами интернализации посредством эндоцитоза. Для исследования того, вовлечен ли эндоцитоз в макромолекуляную доставку после быстрой деформации клеток, можно использовать известные химические реагенты для блокирования этих механизмов. В частности, хлорпромазин можно использовать для ингибирования опосредуемого клатрином эндоцитоза; генистеин можно использовать для ингибирования опосредуемого кавеолами эндоцитоза; и 5-(N-этил-N-изопропил)амиролид (EIPA) можно использовать для ингибирования макропиноцитоза (все из них можно приобретать от Sigma Aldrich). Клетки HeLa можно инкубировать с хлорпромазином (10 мкл/мл), генистеином (200 мкМ) и EIPA (25 мкМ) в течение 2 часов перед обработкой. Затем можно доставлять декстран, белки dsRED и dsRED-9R посредством быстрой деформации обработанных клеток. Соответствующая эффективность доставки при измерении посредством FACS может проиллюстрировать влияние ингибирования эндоцитоза на механизмы доставки как с помощью CPP, так и с помощью устройства. Эксперименты по колокализации с маркерами эндосом (Invitrogen) с использованием конфокальной микроскопии также могут помочь определить процент материала, который изолирован в эндосомах.
Является возможным сопряжение системы быстрой деформации клеток с другими общепринятыми способами доставки, такими как электропорация, для устранения механизмов эндоцитоза. Включение электродов вблизи сужения может обеспечить сопряжение деформации и электропорации для достижения эффектов доставки, обеспечивающих усиленную эффективность системы относительно каждого способа отдельно. Кроме того, совместная доставка химических веществ, таких как хлороквин (Sigma), различные полимеры или обеспечивающие просачивание из эндосом пептиды, можно использовать для обеспечения ускользания от эндосом доставляемых материалов в системе быстрой деформации клеток.
По мере прохождения клетки через сужение, она подвергается кратковременному (~10-100 мкс), но быстрому сдвигу или сдавлению. Ранее было оказано, что тангенциальный сдвиг индуцирует образование пор. Однако система также индуцирует механическое сдавление. Для оценки этих параметров, клетки HeLa и HF можно инкубировать в 0,1 мкг/мл лантрункулина A (Invitrogen) в течение 1 часа перед доставкой для деполимеризации актинового цитоскелета. Затем в популяцию обработанных клеток можно доставлять флуоресцентно меченный декстран (Invitrogen) с использованием устройства для быстрой деформации. Эти эксперименты также можно повторять с клетками, которые инкубируют в 10 мкМ колхицине (Sigma) в течение 2 часов перед доставкой для деполимеризации сети микротрубочек. Для измерения эффективности доставки обработанных токсином клеток относительно необработанных клеток можно использовать анализ FACS. Полагают, что образование пор коррелирует со скоростью деформации клетки в ответ на данную геометрию. Роль цитоскелета в ограничении деформации ранее исследовали с использованием устройства, которое исследует способность клетки к деформации, для получения количественных показателей уровней деформации. В этом способе электроды помещают на любую сторону сужения и измеряют изменение емкости между двумя электродами по мере прохождения клетки. Затем изменения емкости в сужении сопоставляют с времени прохождения клетки, т.е. ее состоянием деформации. Эффективность доставки устройством в упомянутых выше экспериментах можно сопоставить с этими предшествующими исследованиями деформации, чтобы получить количественную взаимосвязь между уровнем деформации и эффективностью образования пор.
Аналогично опубликованным исследованиям, характеризующим образование пор под действием ультразвука, можно использовать способы сканирующей электронной микроскопии (SEM) и трансмиссионной электронной микроскопии (TEM) на образцах, фиксированных при определенных временных интервалах после обработки для прямого измерения размера и распределения предполагаемых пор с течением времени. Фиксацию клеток можно проводить при комнатной температуре с использованием 25% раствора гултаральдегида (Sigma). Затем перед визуализацией образцы клеток можно дегидратировать посредством последовательных промываний этанолом. Для прямой визуализации фиксированных образцов можно использовать способы средовой SEM (ESEM). Однако вследствие относительно низкого разрешения (~200 нм), этот способ пригоден для обнаружения морфологических изменений или повреждений масштаба 1-0,5 мкм. Если ESEM не обнаруживает никаких морфологических изменений, клетки можно покрывать слоем золота толщиной 1-10 нм с использованием вакуумного испарителя для усиления разрешения до нанометрового масштаба, необходимого для прямого наблюдения более мелких структур пор с использованием SEM. Также можно использовать TEM в качестве альтернативного способа визуализации, если SEM не даст желаемых результатов. Эти способы позволяют отличить локальное повреждение от единообразного механизма доставки с образованием пор и измерить средний размер и распределение пор. Размер и распределение пор в клетках, которые претерпели быструю деформацию клеток, можно сравнивать с необработанными клетками. Локализованное распределение пор на поверхности мембраны указывает на модель повреждения, в то время как более единообразное распределение подтверждает единообразную модель образования пор.
Микрофизическое программное обеспечение COMSOL можно использовать для конструирования 3D-модели клетки с порами. С использованием опубликованных данных в отношении диффузионной способности цитоплазмы и буфера, в сочетании с соответствующими моделями пор из механистических исследований, можно получить прогнозирующую модель доставки. Модель имитирует пористую мембрану, разделяющую цитоплазму с низкой диффузионной способностью и область буфера с высокой диффузионной способностью. Согласно допущениям в модели поры имеют фиксированный размер в течение фиксированного периода времени перед моментальным закрытием. Динамическое поведение пор, такое как изменения формы и диаметра, может быть включено в комплексные модели посредством сопряжения с MatLab или другим программным обеспечением. Смоделированные прогнозы о доставляемом количестве можно подтверждать с использованием экспериментальных данных на основе FACS и гель-электрофореза (например, вестерн-блоты). Эти сравнения можно использовать для тонкой регуляции модели и, таким образом, они позволяют ей прогнозировать количество доставляемого материала. Прогнозирующие способности этой модели могут имитировать эффекты варьирования размера пор, времени открытия поры и концентраций буфера и, таким образом, их можно использовать в качестве руководства для дальнейших исследований.
Мультифизическое моделирование (например, COMSOL или CFD-ACE) также можно использовать для моделирования прохождения жидкости через устройство. Эти модели можно использовать для того, чтобы точнее предсказать скорости потока и нагрузку сдвига в областях входа, выхода и сужения. Эти данные можно использовать для установления связей между нагрузкой сдвига и скоростью потока в целях эффективной доставки через конструкции сужения. Более того, посредством конструирования широкой модели устройства можно исследовать устойчивость падения давления между различными каналами и корректировать конструкции входа и выхода для обеспечения того, чтобы все каналы действовали в практически идентичных условиях, так чтобы повысилось единообразие обработки популяции клеток.
Процесс доставки можно оптимизировать, главным образом, для увеличения эффективности доставки и жизнеспособности клеток. Единообразие популяции (т.е. доставка сходного количества материала в каждую клетку) можно использовать в качестве вторичного параметра оптимизации. Исходные результаты идентифицировали скорость клеток, длину сужения, ширину сужения и форму области входа в качестве чувствительных параметров. С другой стороны, состав среды оказался не основным фактором. Можно конструировать серию устройств, в которых систематически варьирует длина и ширина сужения между 5-50 мкм и 4-8 мкм, соответственно. Возможны различные углы наклона при уменьшении ширины главного канала с образованием сужения. Экспериментальные данные об эффективности и жизнеспособности для этих устройств при измерении с помощью FACS, можно сопоставлять с упомянутыми выше данными моделирования для лучшего понимания эффектов нагрузки сдвига и размеров сужения. Этот процесс можно повторять для различных линий клеток, которые могут по-разному отвечать на обработку. Эти данные можно использовать для разработки устройств с оптимизированной геометрией и рабочими параметрами для конкретных (или конкретных подгрупп) типов клеток.
На фиг. 38 представлены микрофотографии, иллюстрирующие альтернативные структуры устройств. Представлен микроснимок, полученный при светлопольном освещении, предварительного комбинирования сужения и электродов (масштабная метка 30 мкм). Как проиллюстрировано на фиг. 38, устройство может быть модифицировано посредством сопряжения явления быстрой деформации с электропорацией. Золотые электроды можно встраивать на любую сторону сужения посредством фотолитографического формирования рельефа и наслоения Au для введения локализованного электрического поля в канал. Последующие эксперименты могут идентифицировать действующие величины параметров (сила электрического поля, частота и действующая скорость), которые демонстрируют улучшенную эффективность относительно современных способов. Посредством сопряжения двух независимых механизмов образования пор, можно осуществлять более точный контроль над системой и манипулировать множеством параметров в целях оптимизации эффективности системы для каждого типа клеток. Кроме того, электрические поля можно использовать в качестве движущей силы для доставки более крупных заряженных молекул, таких как ДНК, которые имеют низкие скорости диффузии.
Возможна усовершенствованная одноразовая версия системы, пригодной для применения потенциальными компаньонами. Для осуществления версии устройства на основе полимера можно использовать инжекционное формование или горячее тиснение PMMA и поликарбоната. Вытекающее снижение затрат может обеспечить использование этих устройств в качестве одноразового инструмента, таким образом, увеличивая стерильность и простоту применения. Кроме того, посредством упрощения соединения трубок, системы установки и системы регуляции давления, является осуществимым предоставление удобной для пользования системы.
Является возможным перепрограммирование фибробластов на основе белков в клетки iPS и исследования по оптимизации пространства параметров перепрограммирования. Предшествующие исследования показали, что iPSC можно получать посредством прямой доставки слитых с CPP перепрограммирующих факторов из тканей как человека, так и мыши (фиг. 36) и что эти белок-iPSC могут дифференцироваться в функциональные клетки (например, дофаминовые нейроны) без аномальных фенотипов, ассоциированных с вирусными iPSC. Однако вследствие многих факторов, включающих деградацию белка в культуре, неэффективность доставки и деградацию внутри эндосом клеток, эффективность перепрограммирования посредством прямой доставки белка является слишком низкой (<0,01%) для любого практического применения. Микрожидкостные устройства, описанные в настоящем описании, могут значительно увеличить эффективность перепрограмирования на основе белков, позволяя эффективную доставку белка в цитоплазму, таким образом, избегая вредоносной эндосомальной среды и затруднительного процесса ускользания от эндосом, которые обычно встречаются при способах доставки свободного или инкапсулированного белка.
Получение iPSC человека облегчается посредством микрожидкостной доставки. Устройство используют для доставки одного или нескольких, например, 4 перепрограмирующих белков (c-Myc (белок, номер доступа Genbank NP_002458.2; ДНК, номер доступа Genbank NM_002467.4), Klf4 (белок, номер доступа Genbank AAH30811.1; ДНК, номер доступа Genbank NM_004235.4), Oct4 (белок, номер доступа Genbank ADW77326.1; ДНК, номер доступа Genbank HQ122675.1), и Sox2 (белок, номер доступа Genbank NP_003097.1; ДНК, номер доступа Genbank NM_003106.3)) в эмбриональные фибробласты человека (HF). В дополнение к четырем факторам Yamanaka (MKOS представляет собой c-Myc-Klf4-Oct4-Sox2), было идентифицировано несколько дополнительных факторов (например, Lin28 (белок, номер доступа Genbank AAH28566.1; ДНК, номер доступа Genbank NM_024674.4) и Nanog (белок, номер доступа Genbank AAP49529.1; ДНК, номер доступа Genbank NM_024865.2), Esrrb (белок, номер доступа Genbank AAI31518.1; ДНК, номер доступа Genbank NM_004452.3), Glis1 (белок, номер доступа Genbank NP_671726.2; ДНК, номер доступа Genbank NM_147193.2), и PRDM14 (белок, номер доступа Genbank NP_078780.1; ДНК, номер доступа Genbank NM_024504.3)), усиливающих эффективность перепрограммирования. Была полностью разработана экспрессия у млекопитающих и очистка 6 факторов (MKOS + Lin28 и Nanog; MKOSLN) и установлена биоактивность каждого фактора с использованием репортерных анализов. Эти факторы могут экспрессироваться либо в E.coli, либо в клетках млекопитающих. Поскольку экспрессируемые E.coli белки лишены посттрансляционных модификаций, таких как фосфорилирование, ацетилирование и убиквитинилирование, после экспрессии в клетках млекопитающих можно использовать очищенные белки (HEK293 и CHO). Для сравнения, можно использовать экспрессируемые в E.coli белки (коммерчески доступные от Stemgent, Cambridge, MA). Во-первых, меченные FLAG перепрограммирующие факторы, экспрессируемые в клетках HEK293 посредством трансфекции, можно ресуспендировать в буфере для лизиса клеток NP40, содержащем 50 мМ Tris-HCl, pH 7,4, 250 мМ NaCl, 5 мМ EDTA, 1% NP-40, и ингибиторы протеазы. После центрифугирования, в собранную растворимую фракцию можно добавлять уравновешенный агарозный аффинный гель против FLAG M2. После промывания PBS два раза, оставшиеся меченные FLAG белки можно элюировать посредством добавления 0,1 мг/мл пептида FLAG (Sigma). Раствор с суспендированными фибробластами человека и 4 или 6 очищенными белками можно использовать в устройстве и обработанные клетки можно высевать на покрытые 0,1% желатином чашки с кондиционированной средой hESC за 1, 2 или 3 сток до следующего цикла доставки. После повторения циклов доставки (6-16) с микрожидкостным устройством, обработанные клетки можно высевать на обработанные митомицином C эмбриональные фибробласты мыши (MEF) и выращивать в течение 3-4 недель с регулярной средой hESC. Колонии IPSC могут стать видимыми в пределах 3 недель после посева на MEF. Эффективность получения iPSC можно сравнивать с эффективностью при доставке с помощью белков с использованием оригинальных слитых с CPP рекомбинантных белков авторов изобретения. Эти кандидаты iPSC можно тщательно исследовать в отношении всех критериев аутентичных iPSC, включая молекулярные и клеточные свойства, а также плюрипотентность in vitro и in vivo, как описано ранее. Использование 4 или 6 факторов обеспечит линии iPSC со значительно увеличенной эффективностью. Также возможно далее экспресировать дополнительные факторы, такие как Esrrb, Glis1 и PRDM14, и использовать эти факторы в экспериментах по перепрограммированию.
Перепрограммирующие белки и мРНК и/или микроРНК можно доставлять в комбинации. Микрожидкостное устройство можно использовать для доставки не только белков, но также других макромолекул. Чтобы воспользоваться преимуществом этого уникального свойства для оптимального перепрограммирования без встраивания в геном, возможно комбинировать применение перепрограммирующих факторов и мРНК и/или микроРНК. В частности, значительный интерес представляет то, что линии iPSC можно успешно получать с использованием только микроРНК. Действительно, трансфекция на основе Lipofectamine микроРНК может образовывать iPSC-подобные колонии. Поскольку микроРНК, вероятно, индуцируют перепрограммирование по механизму, отличающемуся от перепрограммирующих факторов, соответствующее комбинирование как перепрограммирующих белков, так и микроРНК с использованием микрожидкостного устройства может далее повысить эффективность перепрограммирования. Комбинированная доставка белков и мРНК может значительно упростить эффективность перепрограммирования. Таким образом, с использованием микрожидкостного устройства можно осуществлять оптимально комбинированную обработку белками, мРНК и/или микроРНК. Хотя микроРНК/мРНК может не обеспечить эквивалентный белкам уровень контроля, возможность исследований высокопроизводительной оптимизации устройства, тем не менее, обеспечивает значительное увеличение эффективности относительно предшествующих подходов.
Уникальные признаки микрожидкостного устройства могут обеспечить доставку различных определенных количеств каждого фактора контролируемым повторяющимся образом. Оптимизация настоящего изобретения облегчает разработку надежного высокоэффективного инструмента для доставки белка в HF. Можно установить оптимальные количества для доставки и долю каждого перепрограммирующего фактора. В отличие от способов на основе мРНК, плазмид или вирусов, эта система не основана на стохастической природе экспрессии и/или трансляции генов для определения эффективной внутриклеточной концентрации факторов транскрипции. Таким образом, способность устройства доставлять белок прямо в цитозоль ставит его в уникальное положение в отношении осуществления точного контроля над внутриклеточной средой. Возможна серия схем доставки, которые варьируют частоту обработки (один раз в 1, 2 или 3 суток) и концентрацию белка каждого из четырех факторов независимо. В частности, на основе нескольких сообщений, указывающих на то, что более высокие уровни Oct4 являются критическими для эффективного перепрограммирования, можно исследовать эффект использования различных концентраций Oct4 при сохранении концентраций других факторов на том же уровне. Различные концентрации c-Myc можно оценивать для данного типа клеток, поскольку было выявлено, что его высокие уровни образуют по большей части трансформированные колонии вместо iPSC в некоторых ситуациях. Более того, можно исследовать эффект более частой обработки c-Myc вследствие его чрезвычайно короткого времени полужизни (~30 мин) при соответствующей концентрации.
Оптимизация временной обработки перепрограммирующими факторами облегчается с использованием описанных способов. Каждый фактор имеет функциональную роль и участвует в процессе перепрограммирования. По меньшей мере один и, в некоторых случаях, комбинации факторов необходимы для достижения желаемого результата перепрограммирования. Например, известно, что c-Myc подавляет экспрессию генов дифференцировки. Кроме того, известно, что Klf4 подавляет микроРНК let-7, которая связана с каскадами дифференцировки и ингибированием плюрипотентности. Таким образом, временно регулируемое перепрограммирование может быть возможным посредством обработки c-Myc и/или Klf4 в течение первоначального периода на основе субоптимальных условий. Кроме того, хотя Nanog не требуется для получения iPSC, известно, что он является критическим для конечного установления и поддержания плюрипотентности. Таким образом, можно исследовать эффект добавления Nanog на более поздней стадии процесса перепрограммирования. Более того, можно исследовать последовательную обработку посредством микроРНК и белков, и можно сравнивать эффективность перепрограммирования с эффективностью перепрограммирования каждой из обработок или одновременной обработкой. Это временно регулируемое перепрограммирование является осуществимым благодаря уникальному признаку микрожидкостного устройства и может быть важным для дальнейшей оптимизации перепрограммирующих белков. Эффективность перепрограммирования можно вычислять посредством деления количества колоний на 28 сутки на количество обработанных клеток HF. После завершения можно использовать регрессионный анализ для установления относительной важности каждого перепрограммирующего фактора, его оптимальной концентрации, оптимальной частоты/времени доставки и, в результате, оптимального протокола для получения iPSC. Возможность контролировать количество и временной режим для белка, доставляемого в каждую клетку, может пролить свет на функциональное значение каждого фактора в процессе перепрограммирования, тем самым далее увеличивая понимание процесса перепрограммирования клеток и установления плюрипотентности. Кроме того, результаты этой работы можно использовать для дальнейшего усовершенствования конструкции устройства так, чтобы она удовлетворяла конкретным потребностям перепрограммирования и обеспечивала в итоге разработку клинически применимых версий.
С использованием оптимизированной методики перепрограммирования белков, как описано выше, протокол можно, в общем, использовать для специфических для пациента взрослых фибробластных клеток человека. Поскольку была исследована эффективная дифференцировка ESC и iPSC в функциональные дофаминовые нейроны и эффекты трансплантации, можно получить iPSC или линии iPSC из фибробластов человека, полученных от пациентов с болезнью Паркинсона. После получения и охарактеризации линий iPSC индуцируют их дифференцировку в дофаминовые нейроны и охарактеризовывают их клеточные, молекулярные, физиологические и электрофизиологические свойства. Дофаминовые нейроны после трансплантации исследуют в отношении функциональности in vivo в модели на животных болезни Паркинсона, таких как генетическая модель PD, мыши с афакией.
Микрожидкостную доставку белков можно использовать для прямого преобразования клеток, например, прямого преобразования фибробластов в другие типы клеток, такие как функциональные нейроны, гепатоциты и клетки крови. В прошлом для манипуляций использовалась вирусная экспрессия ключевых факторов транскрипции, вызывающая значительные хромосомные нарушения и мутации генов, тем самым демонстрируя необходимость в разработке невирусных способов преобразования без встраивания в геном, таких как прямая доставка белка с использованием способов, описанных в настоящем описании. Таким образом, устройство можно использовать для микрожидкостной доставки белков для прямого преобразования клеток. Поскольку экспрессия у млекопитающих определенных факторов транскрипции иногда является затрудненной, может быть более осуществимым исследование преобразования с помощью одного или двух белковых факторов. Однако возможно направлять фибробласты на другую клеточную судьбу с использованием единичного фактора, например, Oct4 или Sox2, для получения предшественников крови или нейрональных предшественников, соответственно. Эти белки являются легкодоступными в очищенной форме для преобразований клеток с использованием микрожидкостной доставки белков.
На фиг. 44 представлена столбиковая диаграмма, иллюстрирующая нокдаун в HESC при измерении по интенсивности GFP через 48 часов после обработки активными последовательностями миРНК и рандомизированными контролями с использованием микрожидкостного устройства и сходных способов. На фиг. 45A и 45B представлены два графика, иллюстрирующих интенсивность красителя и жизнеспособность эмбриональных клеток человека после доставки синего красителя массой 3 кДа.
Другие варианты осуществления находятся в пределах объема и сущности изобретения. Например, вследствие характера программного обеспечения, функции, описанные выше, можно осуществлять с использованием программного обеспечения, технических средств, встроенных программ, фиксированного монтажа или комбинаций любого из них. Элементы, выполняющие функции, также могут находиться в различных положениях, в том числе могут быть распределены, так что части функций осуществляются в других физических положениях.
Отмечается, что одна или несколько ссылок включены в настоящее описание. В случае, когда любой из включенных материалов не согласуется с настоящим описанием, настоящее описание будет решающим. Более того, когда это необходимо, материал, включенный в настоящее описание в качестве ссылки, следует не учитывать, если это необходимо, для сохранения допустимости формулы изобретения.
Кроме того, хотя представленное выше описание относится к изобретению, описание может включать более одного изобретения.
Реферат
Группа изобретений относится к биотехнологии и медицине, а именно к безвекторной микрожидкостной платформе для внутриклеточной доставки в цитозоль эукариотической клетки соединения или композиции. Предложены микрожидкостные системы для обеспечения разрывов в клетке и способы доставки груза в клетку. Микрожидкостные системы включают устройство, в частности микрожидкостный канал, содержащее деформирующее клетку сужение, и компонент, обеспечивающий продвижение клеток. Диаметр сужения составляет 20-99% от диаметра клетки и индуцирует в клетке достаточно крупные разрывы, чтобы груз прошел через них. Способы доставки груза в клетку с использованием указанной системы обеспечивают доставку ДНК, РНК, миРНК или белка в первичные фибробласты и стволовые клетки, антигена или РНК в первичные иммунные клетки, квантовых точек, углеродных нанотрубок или лекарственных средств в клетку-мишень. Изобретения позволяют исключить модификацию желаемого груза, пригодны для доставки чувствительных грузов, а также обеспечивают прямую доставку груза в цитозоль, избегая эндосомального компартмента, не приводят к изменению состояния дифференцировки или активности обработанной клетки. 5 н. и 40 з.п. ф-лы, 45 ил., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Липосомы, используемые для доставки лекарственных средств

Комментарии