Препараты полиалкиленоксид-аспарагиназы и способы их получения и применение - RU2758796C2
Код документа: RU2758796C2
Чертежи









Описание
Перекрестные ссылки на родственные заявки и их включение в качестве ссылки
В этой заявке испрашивается приоритет предварительной заявки на патент США №62/344,249, поданной 1 июня 2016 г.; предварительной заявки на патент США №62/344,252, поданной 1 июня 2016 г., и предварительной заявки на патент США №62/344,256, поданной 1 июня 2016 г., каждая из которых полностью включена в качестве ссылки.
Введение
L-аспарагиназа представляет собой фермент, который гидролизует аминокислоту L-аспарагин путем реакции дезаминирования с получением L-аспартата и аммиака. Е. coli содержит два изофермента аспарагиназы: L-аспарагиназу I и L-аспарагиназу II. L-аспарагиназа I расположена в цитозоле и имеет низкое сродство к аспарагину. Однако, L-аспарагиназа II расположена в периплазме и имеет высокое сродство к L-аспарагину. L-аспарагиназа II Е. coli представляет собой тетрамер идентичных субъединиц. L-аспарагиназа II Е. coli также известна как L-аспарагин амидогидролаза, тип ЕС-2, ЕС 3.5.1.1. Известно, что L-аспарагиназа имеет терапевтическую ценность для лечения лейкоза. L-аспарагиназа представляет собой амидогидролазу, которая катализирует превращение L-аспарагина в L-аспарагиновую кислоту и аммиак. Она играет важную роль в метаболизме L-аспарагина у растений, животных и микроорганизмов. В настоящее время точно установлено, что терапевтическая активность фермента вызывается истощением/удалением циркулирующего L-аспарагина, необходимого питательного вещества для пролиферации и выживания опухолевых (лейкемических) клеток, в которых повреждена способность синтеза L-аспарагина, но не в нормальных клетках. Введение L-аспарагиназы пациентам с лейкозом индуцирует селективную гибель опухолевых клеток путем гидролиза L-аспарагина, что приводит к лечению злокачественных опухолей.
В других случаях, L-аспарагиназа, сама по себе, страдает от типичных недостатков белковых терапевтических средств, таких как высокая скорость клиренса белка, чужеродного пациенту, и возможность индуцирования иммунной ответной реакции у пациента, леченного с применением этого фермента. Для преодоления этих недостатков, можно использовать производное L-аспарагиназы, конъюгированное с полиэтиленгликолем (ПЭГ-аспарагиназа). ПЭГ-аспарагиназа может быть получена, используя L-аспарагиназу II, экстрагированную из Е. coli, и может быть по существу неантигенной и может проявлять уменьшенную скорость клиренса из системы кровообращения пациента.
Жидкий инъекционный препарат ПЭГ-аспарагиназы (Oncaspar®) ранее был разрешен для коммерческого производства Управлением по контролю за продуктами и лекарствами (U.S. Food and Drug Administration). Oncaspar® был разрешен в качестве терапии «первой линии» пациентов с острым лимфобластным лейкозом (ALL) в качестве компонента химиотерапевтической схемы с применением нескольких средств. Дополнительно, Oncaspar® был разрешен для лечения пациентов с ALL и гиперчувствительностью к аспарагиназе (например, нативным формам L-аспарагиназы).
Сущность
Аспекты изобретения включают композиции полиалкиленоксид-аспарагиназы. В некоторых случаях, композиции включают один или несколько буферов и соль. В других аспектах, композиция представляет собой лиофилизированную стабильную при хранении композицию. В других случаях, лиофилизированные композиции включают один или несколько буферов, соль и сахар. Аспекты осуществления изобретения дополнительно включают способы получения композиций. Композиции находят использование для различных применений, например, для лечения опухолевого состояния у субъекта.
Краткое описание фигур
На Фиг. 1 представлена схема технологического процесса для способа получения лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 2 представлен график чистоты (%) относительно времени (недели) при 40°С для лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 3 представлен график эффективности (МЕ/мл) относительно времени (недели) при 40°С для лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 4 представлен график чистоты (%) относительно времени (недели) при 25°С для лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 5 представлен график эффективности (МЕ/мл) относительно времени (недели) при 25°С для лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
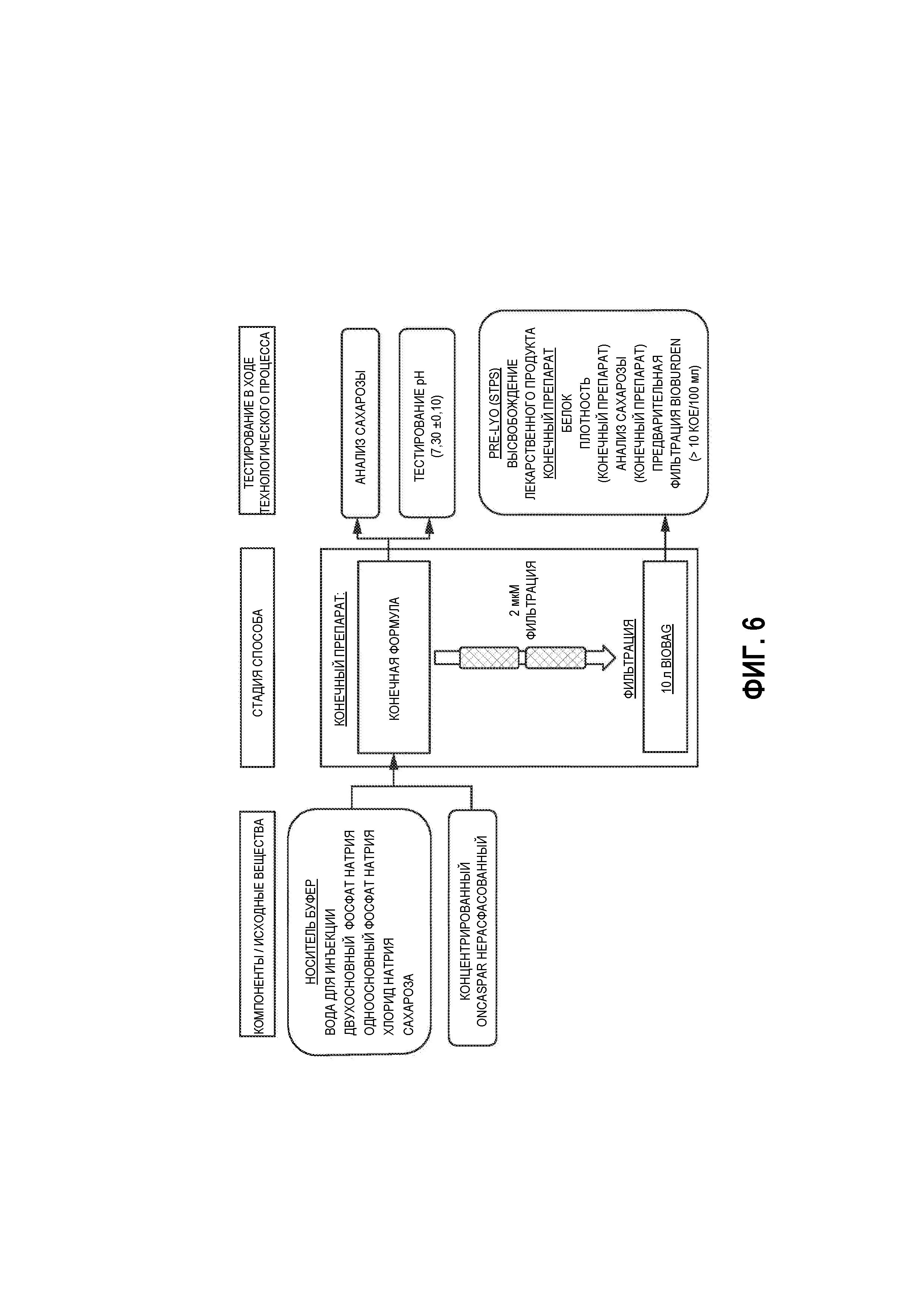
На Фиг. 6 представлена схема технологического процесса способа получения лиофилизированной стабильной при хранении композиции, в соответствии с вариантами осуществления настоящей заявки. Показаны конечный препарат и стадии фильтрации.
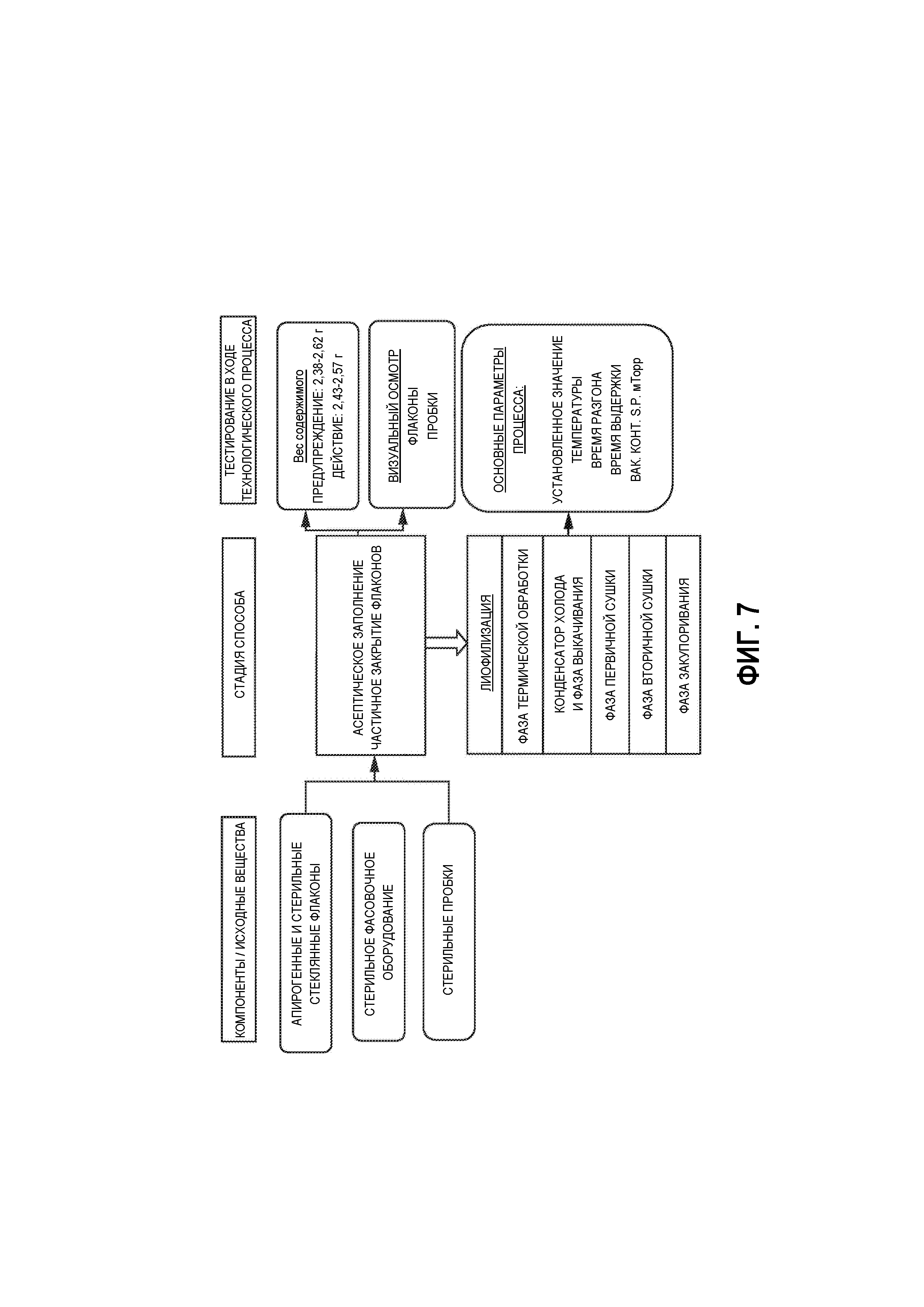
На Фиг. 7 представлена схема технологического процесса способа получения лиофилизированной стабильной при хранении композиции, в соответствии с вариантами осуществления настоящей заявки. Показаны стадии асептического заполнения и лиофилизации.
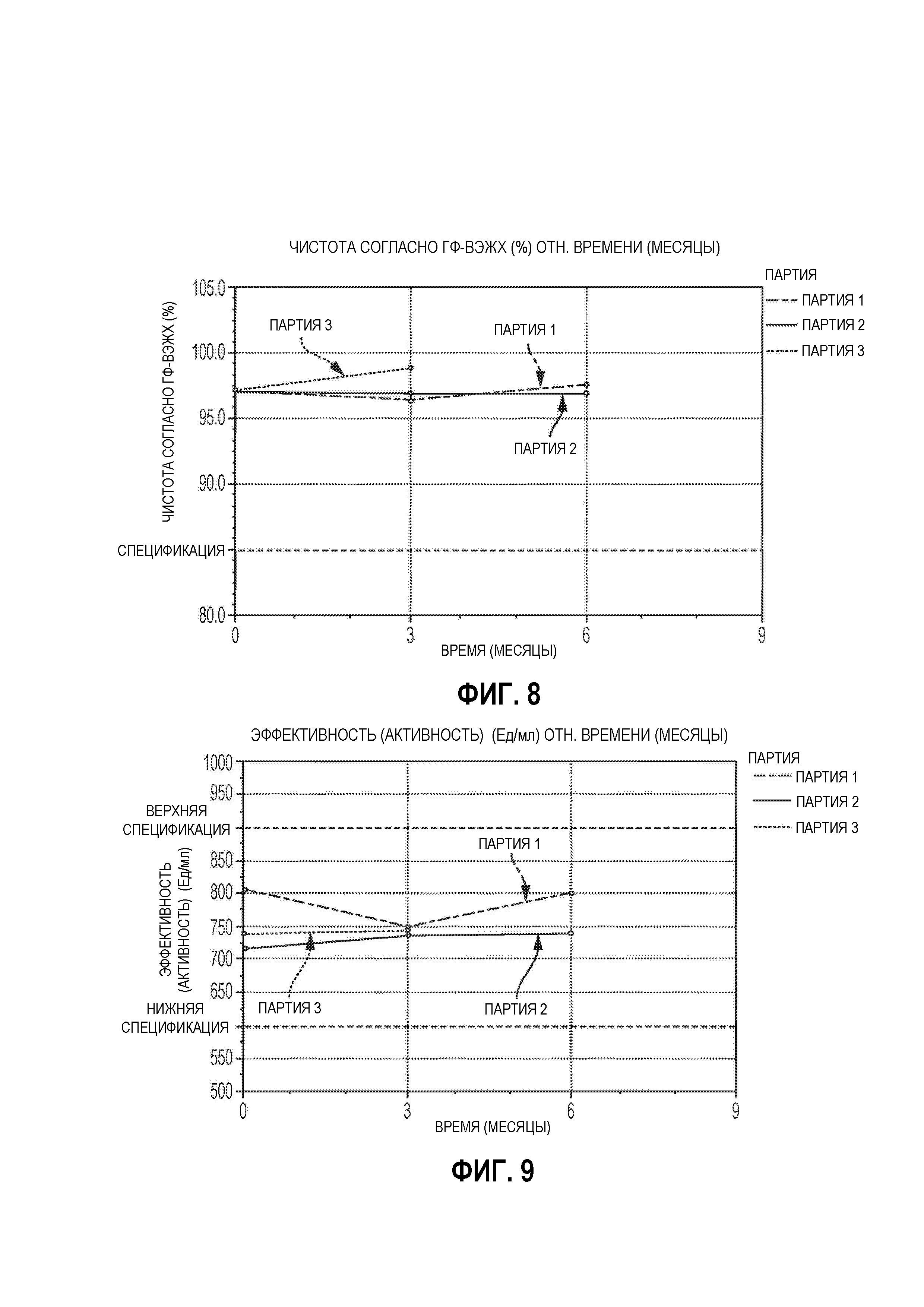
На Фиг. 8 представлен график чистоты согласно ГФ-ВЭЖХ (%) в зависимости от времени (месяцы) для лиофилизированной композиции, которую хранили при 2-8°С (например, 5°С), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 9 представлен график эффективности (активности) (МЕ/мл) относительно времени (месяцы) для лиофилизированной композиции, которую хранили при 2-8°С (например, 5°С), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 10 представлен график суммарных агрегатов согласно ГФ-ВЭЖХ относительно времени (месяцы) для лиофилизированной композиции, которую хранили при 2-8°С (например, 5°С), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 11 представлен график чистоты согласно ГФ-ВЭЖХ (%) в зависимости от времени (месяцев) для лиофилизированной композиции, которую хранили в условиях ускоренной деградации (25±3°С; 60%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 12 представлен график эффективности (активности) (МЕ/мл) относительно времени (месяцы) для лиофилизированной композиции, которую хранили в условиях ускоренной деградации (25±3°С; 60%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
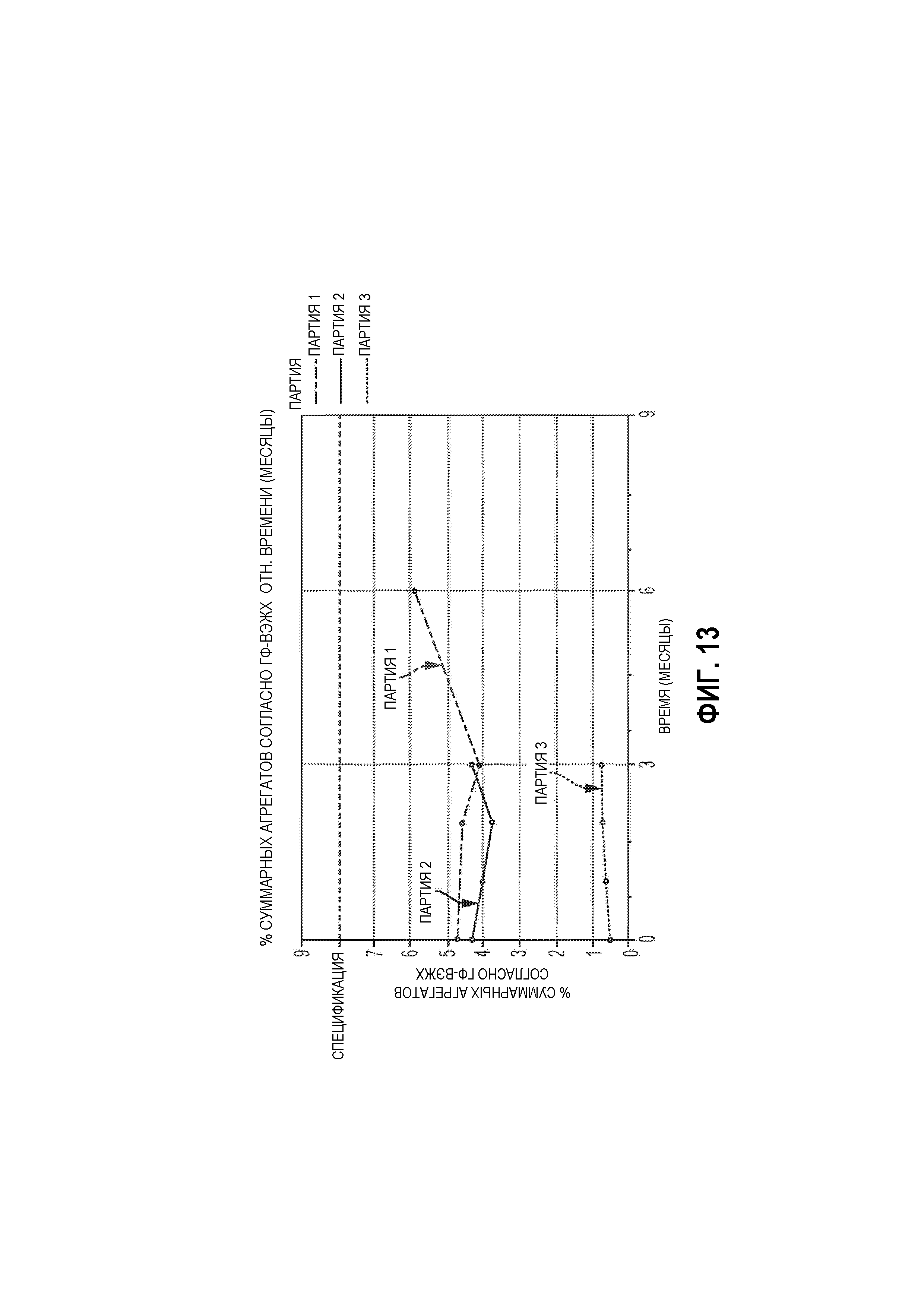
На Фиг. 13 представлен график суммарных агрегатов согласно ГФ-ВЭЖХ относительно времени (месяцы) для лиофилизированной композиции, которую хранили в условиях ускоренной деградации (25±3°С; 60%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 14 представлен график чистоты согласно ГФ-ВЭЖХ (%) в зависимости от времени (месяцев) для лиофилизированной композиции, которую хранили в условиях теплового стресса (40±2°С; 75%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 15 представлен график эффективности (активности) (МЕ/мл) относительно времени (месяцы) для лиофилизированной композиции, которую хранили в условиях теплового стресса (40±2°С; 75%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
На Фиг. 16 представлен график суммарных агрегатов согласно ГФ-ВЭЖХ относительно времени (месяцы) для лиофилизированной композиции, которую хранили в условиях теплового стресса (40±2°С; 75%±5% OB), в соответствии с вариантами осуществления настоящей заявки.
Определения
В описании вариантов осуществления данной заявки, могут применяться следующие термины, и они определяются, как указано ниже.
Под "по существу очищенным" понимают выделение вещества таким образом, что вещество включает большинство образца, в котором оно содержится. Например, образец, который по существу очищенный, содержит 50% или больше вещества, представляющего интерес, например, 60% или больше вещества, представляющего интерес, например, 75% или больше вещества, представляющего интерес, например, 90% или больше вещества, представляющего интерес, например, 95% или больше вещества, представляющего интерес, включая 99% или больше вещества, представляющего интерес. Любой подходящий протокол можно применять для очистки вещества, представляющего интерес, и включая, но не ограничиваясь только ими, фильтрацию (например, диафильтрацию, ультрафильтрацию, и др.), селективное осаждение, кристаллизацию, ионо-обменную хроматографию, аффинную хроматографию и седиментацию согласно плотности.
Под "выделенным" при описании соединения, представляющего интерес, понимают, что оно находится в окружающей среде, отличающейся от той, в котором соединение обычно находится в природе. "Выделенный" обозначает, что охватывает соединения, которые находятся в образцах, по существу обогащенных для соединения, представляющего интерес, и/или в которых соединение, представляющее интерес, частично или по существу очищено.
Термины "пациент" и "субъект" используются взаимозаменяемо и применяются в их общепринятом смысле по отношению к живому организму, страдающему от или предрасположенному к состоянию, которое можно предотвратить или лечить путем введения композиции согласно настоящему изобретению, и включает как людей, так и животных, отличающихся от людей. Примеры субъектов включают, но не ограничиваясь только ими, людей, шимпанзе и другие виды приматов и обезьян; сельскохозяйственные животные, такие как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние млекопитающие, такие как собаки и коты; лабораторные животные, включая грызунов, таких как мыши, крысы и морские свинки; птицы, включая домашние, дикие и пернатая дичь, такие как цыплята, индюки и другие куриные, утки, гуси и др. Термин не включает конкретного возраста. Таким образом, представляют интерес взрослые особи, подростки и новорожденные особи. "Фармацевтически эффективное количество" и "терапевтически эффективное количество" относятся к количеству соединения или композиции, достаточному для лечения указанного нарушения или заболевания или одного или нескольких его симптомов и/или для предотвращения проявления заболевания или нарушения. По отношению к опухолевым состояниям, фармацевтически или терапевтически эффективное количество включает количество, достаточное для, в частности, изменение степени и/или распространения злокачественного новообразования у субъекта на снижение, и/или снижение скорости роста злокачественного новообразования.
Термин "лечить" или "лечение", как используется в настоящей заявке, обозначает лечить или лечение заболевания или медицинского состояния у пациента, такого как млекопитающее (например, человека), которое включает: (а) предотвращение заболевания или медицинского состояния от его проявления, например, профилактическое лечение субъекта; (б) улучшение заболевания или медицинского состояния, такое как, устранение или вызывание регрессии заболевания или медицинского состояния у пациента; (в) подавление заболевания или медицинского состояния, например, путем замедления или остановки развития заболевания или медицинского состояния у пациента; или (г) ослабление симптома заболевания или медицинского состояния у пациента.
Термин "физиологические условия" охватывает те условия, которые совместимы с живыми клетками, например, преимущественно водные условия температуры, pH, содержания соли, и др., которые совместимы с живыми клетками.
Перед тем, как варианты осуществления настоящего изобретения будут описаны более подробно, следует отметить, что варианты осуществления не ограничиваются конкретными вариантами осуществления, описанными в настоящем описании; так как такие варианты осуществления могут изменяться. Также подразумевается, что терминология, используемая в настоящей заявке, предназначена только для описания предпочтительных вариантов осуществления изобретения, и терминология не предназначена для ограничения изобретения. Объем вариантов осуществления настоящего раскрытия будет ограничиваться только пунктами приложенной формулы изобретения. Если специально не указано иначе, то все технические и научные термины, используемые в настоящей заявке, имеют такие же значение, что и обычно понимаются квалифицированным специалистом в данной области техники, к которой относится настоящее изобретение. Если указан диапазон значений, то подразумевается, что каждое промежуточное значение, с точностью до десятой доли единицы нижнего предела, если из контекста очевидно не следует другое, между верхним и нижним пределом указанного диапазона и любое другое указанное или промежуточное значение в этом указанном диапазоне, охватывается вариантами осуществления настоящего раскрытия. Верхние и нижние пределы этих узких диапазонов независимо могут включаться в узкие диапазоны и также охватываются вариантами осуществления настоящего раскрытия, с учетом любого специфически исключенного предела в указанном диапазоне. Если указанный диапазон включает один или оба предела, то диапазоны, исключающие любой из или оба эти включенные пределы также охватываются объемом изобретения. Определенные диапазоны, представленные в настоящем изобретении, с числовыми величинами, с предшествующим термином "приблизительно." Термин "приблизительно", используемый в настоящей заявке, обеспечивает буквальное подтверждение для точного числа, которое следует за ним, а также числа, которые находятся рядом или приближенно к числу, перед которым находится термин. При определении, будет ли число находится рядом или приблизительно к специфически указанному числу, ближайшее или приблизительное непроцитированное число может представлять собой число, которое, в том контексте, в котором оно присутствует, обеспечивает существенный эквивалент специфически указанному числу.
Все публикации, патенты и патентные заявки, процитированные в настоящем описании, включены в него путем ссылки таким же образом, если бы каждая индивидуальная публикация, патент или патентная заявка были специфически и индивидуально указаны, как включенные в качестве ссылки. Кроме того, каждая процитированная публикация, патент или патентная заявка включены в настоящую заявку путем ссылки для раскрытия и описания сущности вопроса, в связи с которым эти публикации процитированы. Цитирование любой публикации относится к ее раскрытию до даты подачи заявки и не должно рассматриваться как допущение, что изобретение, описанное в настоящей заявке, не предоставляет право датировать более ранним числом такую публикацию посредством более раннего изобретения. Кроме того, представленные даты публикации могут отличаться от действительных дат публикаций, что может нуждаться в независимом подтверждении.
Следует отметить, что пункты формулы изобретения могут быть составлены с исключением любого необязательного элемента. Как таковое, эта формулировка предназначена быть в качестве предшествующего основания для применения такой исключительной терминологии, так "исключительно," "только" и др. в связи с перечислением заявленных элементов, или применение "отрицательного" ограничения. Как будет понятным для квалифицированных специалистов в данной области техники при прочтении настоящего раскрытия, что каждый из индивидуальных вариантов осуществления, описанных и проиллюстрированных в настоящей заявке, имеет дискретные компоненты и характерные особенности, которые легко могут быть отделены от или комбинированы с любыми другими несколькими вариантами осуществления без отклонения от объема или сущности вариантов осуществления настоящего изобретения. Любой указанный способ может быть осуществлен в указанном порядке осуществления стадий или в любом другом порядке, который логически возможен. Несмотря на то, что любые способы и материалы, сходные или эквивалентные тем, которые описаны в настоящей заявке, также могут использоваться при практическом осуществлении или тестировании вариантов осуществления настоящей заявки, далее описаны репрезентативные иллюстративные способы и материалы.
Подробное описание
Аспекты изобретения включают композиции полиалкиленоксид-аспарагиназы. В других случаях, композиции включают один или несколько буферов и соль. Аспекты осуществления изобретения дополнительно включают способы получения композиций. Композиции находят использование для различных применений, например, для лечения опухолевого состояния у субъекта.
Аспекты изобретения включают лиофилизированные стабильные композиции при хранении полиалкиленоксид-аспарагиназы. В других случаях, лиофилизированные композиции включают один или несколько буферов, соль и сахар. Аспекты осуществления изобретения дополнительно включают способы получения таких композиций. Композиции находят использование для различных применений, например, для лечения опухолевого состояния (например, острый миелоидный лейкоз (AML)) у субъекта.
Аспекты изобретения включают способ лечения субъекта в отношении AML. Способы включают введение субъекту дозы полиалкиленоксид-аспарагиназы, эффективной для лечения у субъекта AML. Аспекты осуществления изобретения дополнительно включают композиции, содержащие полиалкиленоксид-аспарагиназу, и наборы, которые можно использовать в заявленных способах.
При дальнейшем описании вариантов осуществления настоящей заявки, сначала более подробно описаны композиции (например, жидкая и лиофилизированная). После этого, также описаны способы получения, способы применения и наборы, которые включают заявленную композицию.
КОМПОЗИЦИИ
Аспекты настоящей заявки включают композицию полиалкиленоксид-аспарагиназы, которая включает полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой. Композиция также может включать один или несколько буферов и соль. В определенных вариантах осуществления, композиция представляет собой лиофилизированную стабильную при хранении композицию. Лиофилизированная стабильная при хранении композиция также может включать один или несколько буферов, соль и сахар.
Как описано в настоящей заявке, композиции согласно настоящему раскрытию могут включать полиалкиленоксид-аспарагиназу. Полиалкиленоксид-аспарагиназа включает аспарагиназу, ковалентно связанную с помощью линкера с одной или несколькими полиалкиленоксидными группами. Аспарагиназа представляет собой фермент, который может состоять из четырех идентичных субъединиц с одним активным сайтом на тетрамер. Например, фермент аспарагиназа может представлять собой L-аспарагиназу (например, L-аспарагиназу II), которая гидролизует аминокислоту L-аспарагин (также известная как (S)-2,4-диамино-4-оксобутановая кислота, или аспарагинин, или сокращенно Asn или N) с получением L-аспартата (также известен как (S)-2-аминоянтарная кислота) и аммиак в соответствии со следующей реакцией:

В других случаях, аспарагиназа может гидролизовать аминокислоту L-глутамин (также известен как (S)-2,5-диамино-5-оксопентановая кислота, или сокращенно как Gln или Q) с получением L-глутамата (также известен как (S)-2-аминопентанглутаровая кислота) и аммиака в соответствии со следующей реакцией:

Вышеописанные реакции, которые опосредуются L-аспарагиназой, также могут обозначаться как реакция дезаминирования. В других случаях, L-аспарагиназа в композиции имеет происхождение из прокариотического источника, такого как, включая но не ограничиваясь только ими, бактерии Escherichia coli (E. coli). В этой связи, аспарагиназа в заявленной композиции может представлять собой E. coli аспарагиназу. В других случаях, аспарагиназа экспрессируется E. coli. Аспарагиназа может быть восстановлена и очищена от культуральной среды, содержащей E. coli, которые экспрессируют аспарагиназу. Дополнительно к аспарагиназам дикого типа, аспарагиназа также может представлять не встречающуюся в природе аспарагиназу и/или синтетически полученную аспарагиназу и/или активный фрагмент встречающейся в природе и/или синтетической аспарагиназы. Примеры аспарагиназ, которые можно применять в вариантах осуществления изобретения включают, но не ограничиваясь только ими, те, которые описаны в: 9,322,008; 9,127,266; 9,051,561; 8,617,868; 7,807,436; 6,991,788; 6,537,547; 6,436,396; 6,368,845; 6,274,367; 6,251,388; 6,165,735; 6,140,101; 6,087,151; 6,042,825; 5,854,051; 5,310,670; 4,729,957 и 4,617,271; раскрытие которых включено в настоящую заявку в качестве ссылки.
Как описано выше, аспарагиназа в композиции полиалкиленоксид-аспарагиназы представляет собой аспарагиназу, ковалентно связанную с одной или несколькими полиалкиленоксидными группами. Например, аспарагиназа могут включать одну или несколько полиалкиленоксидных групп, ковалентно связанных с аспарагиназой с помощью способа пост-трансляционной модификации. Полиалкиленоксид-аспарагиназа может включать одну или несколько полиалкиленоксидных групп, ковалентно связаных с аспарагиназой в одном или нескольких положений на аспарагиназе. Например, полиалкиленоксидная группа может быть ковалентно связана с аминокислотным остатком аспарагиназы. В других случаях, полиалкиленоксидная группу ковалентно связана с аминогруппой аминокислотного остатка аспарагиназы. В определенных вариантах осуществления, полиалкиленоксидная группа ковалентно связана с аминокислотной боковой цепью N-концевой аминокислоты в аспарагиназе. В определенных вариантах осуществления, полиалкиленоксидная группа ковалентно связана с эпсилон-аминогруппой лизина (K) в аспарагиназе. В определенных вариантах осуществления, полиалкиленоксидная группа ковалентно связана с аминокислотной боковой цепью N-концевой аминокислоты и эпсилон-аминогруппой лизина (K) в аспарагиназе.
В других случаях, полиалкиленоксид-аспарагиназа по существу неантигенна. Под "неантигенной" или "по существу неантигенной" понимают композицию, которая не вызывает существенной иммунной ответной реакции у субъекта, если композицию вводят субъекту. В других случаях, полиалкиленоксид-аспарагиназа имеет уменьшенную скорость клиренса из кровотока субъекта по сравнению с немодифицированной аспарагиназой. Например, период полуэлиминации полиалкиленоксид-аспарагиназы может составлять 1 день или больше, например, 2 дня или больше, или 3 дня или больше, или 4 дня или больше, или 5 дней или больше, или 6 дней или больше, или 7 дней или больше, или 8 дней или больше, или 9 дней или больше, или 10 дней или больше, или 11 дней или больше, или 12 дней или больше, или 13 дней или больше, или 14 дней или больше, или 15 дней или больше, или 16 дней или больше, или 17 дней или больше, или 18 дней или больше, или 19 дней или больше, или 20 дней или больше. В определенных вариантах осуществления, период полуэлиминации полиалкиленоксид-аспарагиназы составляет 3 дня или больше. В определенных вариантах осуществления, период полуэлиминации полиалкиленоксид-аспарагиназы составляет 5 дней или больше.
Полиалкиленоксидная группа, которая связана с аспарагиназой, может представлять собой любую физиологически совместимую полиалкиленоксидную группу. Поли(алкиленоксиды) (ПАО), которые также известны как полиоксиалкилены (ПОА), получают путем полимеризации алкиленоксидов (например, этиленоксида, пропиленоксида, бутиленоксида). Гомополимер образуется только из одного типа алкиленоксида, в то время как сополимер образуется их двух или более различных алкиленоксидов, известных как сополимеры алкиленоксидов (АОС). Примерами таких соединений являются поли(этиленоксид) (ПЭО), который представляет собой полимер этиленоксида (ЭО), и поли(пропиленоксид) (ППО), который представляет собой полимер пропиленоксида (ПО). Поли(этиленоксид) также обычно известен как полиэтиленгликоль (ПЭГ) или полиоксиэтилен (ПОЭ). Молекулярный вес таких полимеров в целом характеризуется средним из распределения длин (или повторяемых единиц). Дополнительно к стандартным линейным формам, образуются разветвленные или звездообразные формы поли(алкиленоксидов) путем инициации реакции полимеризация с полифункциональным инициатором с множественными гидроксил-, амино-, или тиол-группами, каждая из которых служит в качестве начальной точки для роста полимерной цепи. Например, применение глицерина (три гидроксильные группы) в качестве инициатора приводит к получению трех-плечего разветвленного полимера, в то время как пентаэритрол приводит к четырех-плечему полимеру. Обычно, полимеры такого типа с 3-10 плечами обозначаются "разветвленными", в то время как те, которые имеют больше 10 плеч, обозначаются "звездообразные" полимеры. "Гребнеобразные" сополимеры сходны с разветвленными и звездообразными формами, но инициатором для гребнеобразных сополимеров является полифункциональный полимер с множественными гидроксил-, амино-, или тиол-группами, расположенный вдоль исходного скелета, каждая из которых может служить в качестве начальной точки для роста полимерной цепи. "Привытие" сополимеры получают путем добавления подвешенных полимерных цепей вдоль полимерного каркаса, который имеет ненасыщенные С=С связи или подвешенные функциональные группы (например, гидроксил), из которых могут быть добавлены подвешенные цепи путем применения реакционноспособной монофункциональной полимерной цепи. Все поли(алкиленоксиды) содержат, дополнительно к множественным алкиленоксид-производным повторяемым единицам, единичный остаток, соответствующий молекуле, используемой для инициации синтеза полимера. Для линейных полимеров, это может быть алкиленгликоль, соответствующий алкиленоксиду, используемому для синтеза (например, этиленгликоль и этиленоксид, соответственно) и, таким образом, остаток, имеющий происхождение из инициатора, будет неотличим от других повторяемых остатков в полимерной цепи. Но в качестве инициаторов часто используют небольшие молекулы, отличающиеся от алкиленгликолей, их примеры включают метанол или N-бутанол (для линейных полимеров) и триметилол пропан, глицерин, и пентаэритрол (для разветвленных полимеров) или этилендиамин. Масса инициатора относительно массы конечной полимерной цепи, как правило, очень маленькая и ею можно пренебречь. Таким образом, термин поли(алкиленоксид) используется в настоящей заявке в его общепринятом значении, и включает как поли(алкиленоксиды), инициированные с помощью молекулы алкиленгликоля, так и поли(алкиленоксиды), инициированные с помощью другой небольшой молекулы.
В определенных вариантах осуществления изобретения, физиологически совместимая полиалкиленоксидная группа по существу стабильна в условиях, совместимым с живыми клетками, например, преимущественно водных условиях температуры, рН, содержанию соли, и др., которые совместимы с живыми клетками. В определенных вариантах осуществления изобретения, полиалкиленоксидная группа является водорастворимой. Термин "водорастворимый полимер" относится к полиалкиленоксидной группе, которая по существу растворима в воде, такой как в водных условиях, обнаруженных в организме субъекта. Представляющие интерес полиалкиленоксидные группы включают, но не ограничиваясь только ими, полиалкиленгликоли с неразветвленными цепями. Полиалкиленгликоли с неразветвленными цепями, используемые в определенных вариантах осуществления изобретения, имеют следующую структурную формулу:
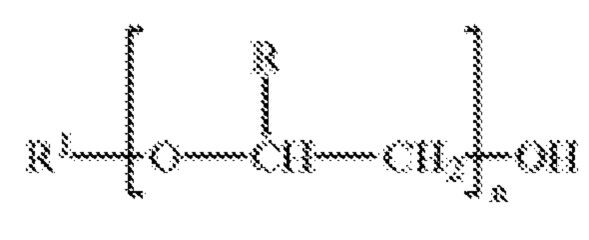
где R выбирают из группы, включающей водород, низший алкил и их смеси, R1 выбирают из группы, включающей водород и низший алкил, и n представляет собой положительное целое число. Под "низшим алкилом" понимают алкильную группу, имеющую от одного до четырех атомов углерода, то есть, метил, этил, пропил, бутил, и изомеры указанных ранее групп. R может быть выбран из группы, включающей водород, метил, и их смеси, R1 может быть выбран из группы, включающей водород и метил, и n может представлять собой положительное целое число, выбранное для обеспечения желательного полимерного размера. В других случаях, поли(алкиленгликоли), применяемые в вариантах осуществления изобретения, представляют собой поли(этиленгликоль), поли(пропиленгликоль), их смеси, и сополимеры поли(этиленгликоля) и поли(пропиленгликоль), где одна из концевых гидроксильных групп полимера может быть замещена низшей алкильной группой.
В определенных вариантах осуществления, полиалкиленоксид представляет собой полиэтиленгликоль (ПЭГ). В определенных вариантах осуществления изобретения, полиэтиленгликоль (ПЭГ) имеет молекулярный вес от 1000 до 20000 Дальтон. В определенных вариантах осуществления изобретения, ПЭГ имеет молекулярный вес от 1000 до 20000 Дальтон, или 1000 до 19000 Дальтон, или 1000 до 18000 Дальтон, или 1000 до 17000 Дальтон, или 1000 до 16000 Дальтон, или 1000 до 15000 Дальтон, или 1000 до 14000 Дальтон, или от 1000 до 13000 Дальтон, или от 1000 до 12000 Дальтон, или от 1000 до 11000, или от 1000 до 10000, или от 1500 до 10000 Дальтон, или от 2000 до 10000 Дальтон, или от 2000 до 9000 Дальтон, или от 2000 до 8000 Дальтон, или от 2000 до 7000 Дальтон, или от 2000 до 6000 Дальтон, или от 3000 до 6000 Дальтон или от 4000 до 6000 Дальтон, или от 4500 до 5500 Дальтон. В определенных вариантах осуществления изобретения, ПЭГ имеет молекулярный вес от 2000 до 10000 Дальтон. В определенных вариантах осуществления изобретения, ПЭГ имеет молекулярный вес от 4000 до 6000 Дальтон. В определенных вариантах осуществления изобретения, ПЭГ имеет молекулярный вес 5000 Дальтон. В других случаях, полиэтиленгликоль представляет собой метоксиполиэтиленгликоль (например, монометоксиполиэтиленгликоль, или "мПЭГ").
Как описано выше, полиалкиленоксидная группа может быть ковалентно присоединена к аспарагиназе. В других случаях, полиалкиленоксидная группа ковалентно связана с помощью линкера с аспарагиназой. В таком случае, полиалкиленоксидная группа может быть ковалентно присоединена к аспарагиназе с помощью линкера. Линкер может представлять собой любую подходящую функциональную группу, которая предоставляет возможность присоединения полиалкиленоксидной группы к аспарагиназе. Например, линкер могут включать реакционноспособную функциональную группу, которая обеспечивает ковалентную связь между полиэтиленоксидной группой и аспарагиназой. В других случаях, линкер включает реакционноспособную функциональную группу, которая обеспечивает ковалентную связь между полиэтиленоксидной группой и аминокислотным остатком аспарагиназы. Например, линкер может включать реакционноспособную функциональную группу, которая обеспечивает ковалентную связь между полиалкиленоксидной группой и аминогруппой аминокислотного остатка аспарагиназы. Примеры таких реакционноспособных функциональных групп включают, но не ограничиваясь только ими, n-нитрофенокси, тиазолидинил тион, N-гидроксисукцинимидил, или другие подходящие реакционноспособные функциональные группы, такие как, но не ограничиваясь только ими, N-гидроксибензотриазолил, галоген, N-гидроксифталимидил, имидазолил, O-ацил мочевины, пентафторфенол или 2,4,6-трихлорфенол, и др. В других случаях, реакционноспособная функциональная группа линкера представляет собой N-гидроксисукцинимидил.
Соответственно, осуществляя ковалентное присоединение полиалкиленоксидной группы к аспарагиназе, линкер может включать функциональные группы, такие как, но не ограничиваясь только ими, уретановый линкер (также известен как карбаматный линкер), сукцинатный линкер, и др.
В определенных вариантах осуществления изобретения, линкер включает уретановый линкер (также известен как карбаматный линкер). Например, реакция присоединения метоксиполиэтиленгликоля (мПЭГ) к аминогруппе аминокислоты полипептида (например, аспарагиназы) с помощью уретанового (карбаматного) линкера показана ниже.

На представленной выше схеме, метоксиполиэтиленгликоль сукцинимидил карбонат (также обозначается как СК-ПЭГ) подвергается реакции с аминогруппой аминокислоты полипептида (например, аспарагиназы) с получением полиэтиленгликоль-аспарагиназы с уретановым (карбаматным) линкером. СК-ПЭГ-аспарагиназа также описана в Angiolillo, AL., и др., "Pharmacokinetic (PK) and pharmacodynamics (PD) properties of SC-PEG E. coli 1-asparaginase (EZN-2285) in the treatment of patients with acute lymphoblastic leukemia (ALL): Results from Children's Oncology Group (COG) study AALL07P4", 2012 American Society of Clinical Oncology (ASCO) Annual Meeting, Poster 9543; и Angiolillo, AL., и др., "Pharmacokinetic and Pharmacodynamic Properties of Calaspargase Pegol Escherichia coli L-Asparaginase in the Treatment of Patients With Acute Lymphoblastic Leukemia: Results From Children's Oncology Group Study AALL07P4", J Clin. Oncology, 32(34), 2014, 3874-3882.
В определенных вариантах осуществления изобретения, линкер включает сукцинатный линкер (также обозначается как сукцинильный линкер). Например, реакция для присоединения метоксиполиэтиленгликоля (мПЭГ) к аминогруппе аминокислоты полпипетида (например, аспарагиназы) с помощью сукцинатного линкера представлена ниже.

На реакционной схеме, представленной выше, метоксиполиэтиленгликоль сукцинимидил сукцинат (также обозначаемый как СС-ПЭГ) подвергается реакции с аминогруппой аминокислоты полипептида (например, аспарагиназы) с получением полиэтиленгликоль-аспарагиназы с сукцинатным линкером. СС-ПЭГ-аспарагиназа также описана в патентах США №№5,122,614; 5,324,844; и 5,612,460, раскрытие каждого из которых включено в настоящую заявку в качестве ссылки.
В определенных вариантах осуществления изобретения, композиция, которая содержит полиалкиленоксид-аспарагиназу, представляет собой дегидратированную композицию. Как используется в настоящей заявке, дегидратированная композиция представляет собой композицию, которая включает воду в небольшом количества, таком как 25% или меньше, или 20% или меньше, или 15% или меньше, или 10% или меньше, или 9% или меньше, или 8% или меньше, или 7% или меньше, или 6% или меньше, или 5% или меньше, или 4% или меньше, или 3% или меньше, или 2% или меньше, или 1% или меньше воды, как определено путем титрования Карла Фишера (КФ). В других случаях, дегидратированная композиция имеет 3% или меньше воды, как определено путем титрования Карла Фишера. В других случаях, дегидратированная композиция имеет 1% или меньше воды, как определено путем титрования Карла Фишера. В других случаях, дегидратированная композиция имеет 0,5% или меньше воды, как определено путем титрования Карла Фишера. Можно использовать любой подходящий протокол для получения дегидратированной композиции, такой как повышение температуры композиции (например, нагревание), уменьшение давление, лиофилизация (также известна как сушка вымораживанием), и др., и их комбинации.
В определенных вариантах осуществления изобретения, лиофилизацию используются для получения дегидратированной композиции, и, следовательно, композиция (например, композиция, которая содержит полиалкиленоксид-аспарагиназу) представляет собой лиофилизированную композицию. В других случаях, лиофилизированная композиция представляет собой композицию, где вода была удалена из композиции путем сублимации, где вода в композиции подвергается фазовому переходу из твердого состояния в газообразное. Например, лиофилизированная композиция может представлять собой композицию, в которой вода была удалена из композиции путем замораживания композиции (например, замораживания воды в композиции) и затем уменьшения давления, окружающего композицию, таким образом, что вода в композиции подвергается сублимации. Как описано выше, лиофилизированная композиция может включать воду в небольшом количестве, таком как 25% или меньше, или 20% или меньше, или 15% или меньше, или 10% или меньше, или 9% или меньше, или 8% или меньше, или 7% или меньше, или 6% или меньше, или 5% или меньше, или 4% или меньше, или 3% или меньше, или 2% или меньше, или 1% или меньше, или 0,5% или меньше, или 0,25% или меньше, или 0,1% или меньше воды, как определено путем титрования Карла Фишера (КФ). В определенных вариантах осуществления изобретения, лиофилизированная композиция может включать воду в небольшом количестве, таком как в диапазоне от приблизительно 0,1% до приблизительно 25%, или от приблизительно 0,25% до приблизительно 20%, или от приблизительно 0,5% до приблизительно 15%, или от приблизительно 1% до приблизительно 10%, или от приблизительно 2% до приблизительно 9%, или от приблизительно 3% до приблизительно 8%, или от приблизительно 4% до приблизительно 7%, или от приблизительно 5% до приблизительно 6%, как определено путем титрования Карла Фишера (КФ). В определенных вариантах осуществления изобретения, лиофилизированная композиция может включать воду в небольшом количестве, таком как в диапазоне от приблизительно 0,1% до приблизительно 5%, или приблизительно 0,25% до приблизительно 4%, или приблизительно 0,5% до от приблизительно 3%, или от приблизительно 1% до приблизительно 2%, как определено путем титрования Карла Фишера (КФ). В других случаях, лиофилизированная композиция имеет 3% или меньше воды, как определено путем титрования Карла Фишера. В других случаях, лиофилизированная композиция имеет 1% или меньше воды, как определено путем титрования Карла Фишера. В других случаях, лиофилизированная композиция имеет 0,5% или меньше воды, как определено путем титрования Карла Фишера.
Вследствие низкого содержания воды в лиофилизированной композиции, как описано выше, лиофилизированная композиция может находится в твердой форме. В других случаях, твердая лиофилизированная композиция представляет собой порошок. В других случаях, лиофилизированная композиция может облегчать хранение композиции в течение длительного периода времени (например, по сравнению с жидким препаратом такой же самой композиции). Например, лиофилизированная композиция может представлять собой стабильную при хранении композицию (например, лиофилизированную стабильную при хранении композицию), где композиция является по существу стабильной в течение длительного периода времени. Под "стабильной" или "стабильной при хранении" или "по существу стабильной" понимают композицию, которая существенно не разлагается и/или не теряет активность в течение длительного периода времени. Например, стабильная при хранении композиция может не иметь существенных примесей вследствие разложения композиции в течение длительного периода времени, таких как 10% или меньше примеси, или 9% или меньше, или 8% или меньше, или 7% или меньше, или 6% или меньше, или 5% или меньше, или 4% или меньше, или 3% или меньше, или 2% или меньше, или 1% или меньше продуктов разложения в течение длительного периода времени. В определенных вариантах осуществления, стабильная при хранении композиция может иметь в диапазоне от приблизительно 1% до приблизительно 10%, или приблизительно 2% до приблизительно 9%, или приблизительно 3% до приблизительно 8%, или приблизительно 4% до приблизительно 7%, или приблизительно 6% до приблизительно 5% меньше продукты разложения в течение длительного периода времени. В определенных случаях, стабильная при хранении композиция имеет 5% или меньше примесей в течение длительного периода времени. В других случаях, стабильная при хранении композиция по существу сохраняет свою активность в течение длительного периода времени, например, сохраняет 100% своей активности, или 99% или больше, или 98% или больше, или 97% или больше, или 96% или больше, или 95% или больше, или 94% или больше, или 93% или больше, или 92% или больше, или 91% или больше, или 90% или больше, или 85% или больше, или 80% или больше, или 75% или больше своей активности в течение длительного периода времени. В определенных вариантах осуществления, стабильная при хранении композиция по существу сохраняет свою активность в течение длительного периода времени, например, в диапазоне от приблизительно 75% до приблизительно 100%, или приблизительно 80% до приблизительно 99%, или приблизительно 85% до приблизительно 98%, или приблизительно 90% до приблизительно 97%, или приблизительно 91% до приблизительно 96%, или приблизительно 92% до приблизительно 95%, или приблизительно 93% до приблизительно 94% больше своей активности в течение длительного периода времени. Например, стабильная при хранении композиция может сохранять 90% или больше своей активности в течение длительного периода времени. В других случаях, стабильная при хранении композиция сохраняет 95% или больше своей активности в течение длительного периода времени. Длительный период времени представляет собой период времени, такой как 1 неделя или больше, или 2 недели или больше, или 3 недели или больше, или 1 месяц или больше, или 2 месяца или больше, или 3 месяца или больше, или 4 месяца или больше, или 6 месяцев или больше, или 9 месяцев или больше, или 1 год или больше, или 1,5 года (например, 18 месяцев) или больше, или 2 года или больше, или 2,5 года (например, 30 месяцев) или больше, или 3 года или больше, или 3,5 года (например, 42 месяцев) или больше, или 4 года или больше, или 4,5 года (например, 54 месяцев) или больше, или 5 лет или больше. Например, длительный период времени может составлять 6 месяцев или больше. В других случаях, длительный период времени составляет 9 месяцев или больше. В других случаях, длительный период времени составляет 1 год (например, 12 месяцев) или больше. В других случаях, длительный период времени составляет 1,5 года (например, 18 месяцев) или больше. В других случаях, длительный период времени составляет 2 года (например, 24 месяцев) или больше. В определенных вариантах осуществления, длительный период времени может находится в диапазоне от приблизительно 1 недели до приблизительно 3 недель, или от приблизительно 1 месяца до приблизительно 6 месяцев, или от приблизительно 6 месяцев до приблизительно 9 месяцев, или от приблизительно 1 год до приблизительно 1,5 года, или от приблизительно 1 год до приблизительно 2 года, или от приблизительно 1 год до приблизительно 3 года, от или приблизительно 1 год до приблизительно 4 года, или от приблизительно 1 год до приблизительно 5 года. В определенных вариантах осуществления, стабильная при хранении композиция по существу стабильна в течение длительного периода времени при температуре окружающей среды, такой как температура от 20 до 40°С, или от 25 до 35°С, или от 25 до 30°С. В других случаях, стабильная при хранении композиция по существу стабильна в течение длительного периода времени при температуре, меньшей за температуру окружающей среды, такой как температура от 0 до 20°С, или от 0 до 15°С, или от 0 до 10°С, или от 2 до 8°С.
В других случаях, композиция включает терапевтически эффективного количества полиалкиленоксид-аспарагиназы. Ферментативная активность полиалкиленоксид-аспарагиназы может быть измерена в международных единицах (ME), которые соответствуют количеству фермента, необходимому для выработки 1 мколь аммиака в минуту при рН 7,3 и температуре 37°С. В некоторых случаях, полиалкиленоксид-аспарагиназа может присутствовать в композиции в количестве (например, полиалкиленоксид-аспарагиназа может иметь эффективность (активность)) в интервале от 100 до 5000 МЕ/г, например, от 500 до 4500 МЕ/г, или от 500 до 4000 МЕ/г, или от 500 до 3500 МЕ/г, или от 500 до 3000 МЕ/г, или от 500 до 2500 МЕ/г, или от 500 до 2000 МЕ/г, или от 500 до 1500 МЕ/г, или от 500 до 1000 МЕ/г, или 600 до 900 МЕ/г, или, или от 700 до 800 МЕ/г. В определенных случаях, полиалкиленоксид-аспарагиназа может присутствовать в композиции в количестве в интервале от 500 до 1000 МЕ/г. Например, полиалкиленоксид-аспарагиназа может иметь эффективность (активность) в интервале от 500 до 1000 МЕ/г. В определенных случаях, полиалкиленоксид-аспарагиназа присутствует в композиции в количестве в интервале от 700 до 800 МЕ/г. Например, полиалкиленоксид-аспарагиназа может иметь эффективность (активность) в интервале от 700 до 800 МЕ/г. В определенных случаях, полиалкиленоксид-аспарагиназа присутствует в композиции в количестве 750 МЕ/г. Например, полиалкиленоксид-аспарагиназа может иметь эффективность (активность) 750 МЕ/г.
В других случаях, полиалкиленоксид-аспарагиназа в композиции присутствует в терапевтически эффективном количестве, где полиалкиленоксид-аспарагиназа имеет удельную активность 50 МЕ/мг белка или больше, например, 55 МЕ/мг белка или больше, или 60 МЕ/мг белка или больше, или 65 МЕ/мг белка или больше, или 70 МЕ/мг белка или больше, или 75 МЕ/мг белка или больше, или 80 МЕ/мг белка или больше, или 85 МЕ/мг белка или больше, или 90 МЕ/мг белка или больше, или 95 МЕ/мг белка или больше, или 100 МЕ/мг белка или больше, или 105 МЕ/мг белка или больше, или 110 МЕ/мг белка или больше, или 115 МЕ/мг белка или больше, или 120 МЕ/мг белка или больше, или 125 МЕ/мг белка или больше, или 130 МЕ/мг белка или больше, или 135 МЕ/мг белка или больше, или 140 МЕ/мг белка или больше, или 145 МЕ/мг белка или больше, или 150 МЕ/мг белка или больше. Например, полиалкиленоксид-аспарагиназа в композиции может иметь удельную активность 85 МЕ/мг белка или больше. В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа в композиции имеет удельную активность в интервале от 50 до 150 МЕ/мг белка, или от 55 до 145 МЕ/мг белка, или от 60 до 140 МЕ/мг белка, или от 65 до 135 МЕ/мг белка, или от 70 до 130 МЕ/мг белка, или от 75 до 125 МЕ/мг белка, или от 80 до 120 МЕ/мг белка, или от 85 до 115 МЕ/мг белка, или от 90 до 110 МЕ/мг белка, или от 95 до 105 МЕ/мг белка. В других случаях, полиалкиленоксид-аспарагиназа в композиции имеет удельную активность в интервале от 50 до 150 МЕ/мг белка, например, 65 до 140 МЕ/мг белка, или от 70 до 135 МЕ/мг белка, или от 75 до 130 МЕ/мг белка, или от 75 до 125 МЕ/мг белка. Например, полиалкиленоксид-аспарагиназа в композиции может иметь удельную активность в интервале от 75 до 125 МЕ/мг белка. В определенных вариантах осуществления изобретения, полиалкиленоксид-аспарагиназа в композиции присутствует в терапевтически эффективном количестве, где полиалкиленоксид-аспарагиназа в композиции присутствует в количестве в интервале от 1 мг/мл до 15 мг/мл, например, от 1,5 мг/мл до 14,5 мг/мл, или от 2 мг/мл до 14 мг/мл, или от 2,5 мг/мл до 13,5 мг/мл, или от 3 мг/мл до 13 мг/мл, или от 3,5 мг/мл до 12,5 мг/мл, или от 4 мг/мл до 12 мг/мл, или от 4,5 мг/мл до 11,5 мг/мл, или от 4,5 мг/мл до 11 мг/мл, или от 4,5 мг/мл до 10,5 мг/мл, или от 4,5 мг/мл до 10 мг/мл, или от 4,5 мг/мл до 9,5 мг/мл, или от 4,5 мг/мл до 9 мг/мл, или от 4,5 мг/мл до 8,5 мг/мл, или от 5 мг/мл до 8 мг/мл. В других случаях, полиалкиленоксид-аспарагиназа в композиции присутствует в количестве в интервале от 4,5 мг/мл до 8,5 мг/мл.
При введении субъекту, композиция может включать, количество полиалкиленоксид-аспарагиназы, достаточное для доставки от 100 до 5000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту, например, от 500 до 5000 МЕ/м2 или от 500 до 4500 МЕ/м2, или от 500 до 4000 МЕ/м2, или от 500 до 3500 МЕ/м2 или от 500 до 3000 МЕ/м2, или от 1000 до 3000 МЕ/м2, или от 1500 до 3000 МЕ/м2, или от 1750 до 3000 МЕ/м2, или от 2000 до 3000 МЕ/м2, или от 2000 до 2750 МЕ/м2 или от 2250 до 2750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. Например, композиция может включать количество полиалкиленоксид-аспарагиназы, достаточное для доставки от 1500 до 3000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных случаях, композиция включает количество полиалкиленоксид-аспарагиназы, достаточное для доставки от 2000 до 2,750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных случаях, композиция включает количество полиалкиленоксид-аспарагиназы, достаточное для доставки от 2,250 до 2,750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. Например, композиция может включать количество полиалкиленоксид-аспарагиназы, достаточное для доставки 2,500 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту.
В определенных вариантах осуществления изобретения, доза, вводимая субъекту, представляет собой жидкую дозированную форму, например, водную дозированную форму. В определенных вариантах осуществления, дополнительно к полиалкиленоксид-аспарагиназе, доза включает буфер и соль.
Композиции согласно настоящему раскрытию, дополнительно к полиалкиленоксид-аспарагиназе, могут включать дополнительные компоненты. Например, композиция может включать буфер. Буферы, подходящие для применения в композициях согласно настоящему раскрытию, включают буферы, которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих буферов включают, но не ограничиваясь только ими, фосфатный буферы (например, фосфатно-солевой буферный раствор (PBS)), Фосфатно-солевой буферный раствор Дульбекко (DPBS), сбалансированный солевой раствор Хэнка (HBSS), сбалансированный солевой раствор Эрла (EBSS), Трис буфер, буферный раствор Рингера с лактатом и др., и их комбинации. Буфер, включенный в композицию, может представлять собой буфер, который поддерживает значение рН композиции при физиологически совместимом рН, например, рН в интервале от 6 от 8, или рН приблизительно 7, например 7,2, 7,3 или 7,4. В других случаях, буфер представляет собой фосфатный буфер. Фосфатный буфер может включать двухосновный фосфат натрия (также известен как динатрийфосфат или гидрофосфат натрия; Na2HPO4) и/или одноосновный фосфат натрия (также известен как монофосфат натрия; NaH2PO4).
В других случаях, количество двухосновного фосфата натрия в композиции находится в диапазоне от 0,05 до 5 мас. %, например, 0,1-4,5 мас. %, или 0,1-4 мас. %, или 0,1-3,5 мас. %, или 0,1-3 мас. %, или 0,1-2,5 мас. %, или 0,1-2 мас. %, или 0,1-1 мас. %, или от 0,1 до 0,9 мас. %, или от 0,1 до 0,8 мас. %, или от 0,1 до 0,7 мас. %, или от 0,1 до 0,6 мас. %, или 0,2 до 0,6 мас. %, или 0,3 до 0,6 мас. %, или 0,4 до 0,6 мас. %, или 0,5 до 0,6 мас. %. Например, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 1,0 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,2 до 0,8 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,3 до 0,6 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,5 до 0,6 мас. %. Например, двухосновный фосфат натрия может присутствовать в композиции в количестве приблизительно 0,6 мас. %, например, 0,56 мас. % (или 0,558 мас. %). В определенных вариантах осуществления изобретения, количество одноосновного фосфата натрия в композиции находится в диапазоне от 0,005 до 2 мас. %, например, 0,01-1,8 мас. %, или 0,01-1,6 мас. %, или 0,01-1,4 мас. %, или 0,01-1,2 мас. %, или 0,01-1,0 мас. %, или от 0,01 до 0,8 мас. %, или от 0,01 до 0,6 мас. %, или от 0,01 до 0,4 мас. %, или от 0,01 до 0,2 мас. %, или 0,02 до 0,18 мас. %, или 0,03 до 0,16 мас. %, или 0,04 до 0,16 мас. %, или 0,045 до 0,15 мас. %, или 0,04 до 0,14 мас. %, или 0,05 до 0,14 мас. %, или от 0,1 до 0,2 мас. %, или от 0,1 до 0,15 мас. %. Например, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,05 до 0,2 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,01 до 0,2 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,09 до 0,15 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 0,2 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 0,15 мас. %. Например, одноосновный фосфат натрия может присутствовать в композиции в количестве 0,12 мас. % (или 0,129 мас. %).
Другой дополнительный компонент, который может быть включен в композиции согласно настоящему раскрытию, представляет собой соль. Соли, подходящие для применения в композициях согласно настоящему раскрытию, включают соли, которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих солей включают, но не ограничиваясь только ими, хлорид натрия, хлорид калия, хлорид кальция, хлорид магния, и др., и их комбинации. В определенных случаях, соль представляет собой хлорид натрия. В других случаях, количество соли (например, хлорида натрия) в композиции находится в диапазоне от 0,05 до 5 мас. %, например, от 0,05 до 4 мас. %, или от 0,05 до 3 мас. %, или от 0,05 до 2 мас. %, или от 0,1 до 5 мас. %, или от 0,1 до 4 мас. %, или от 0,1 до 3 мас. %, или от 0,1 до 2 мас. %, или от 0,1 до 1,5 мас. %, или от 0,1 до 1 мас. %, или от 0,2 до 1 мас. %, или от 0,3 до 1 мас. %, или от 0,4 до 1 мас. %, или от 0,5 до 1 мас. %, или от 0,6 до 1 мас. %, или от 0,7 до 1 мас. %, или от 0,8 до 1 мас. %, или 0,8 до 0,9 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,5 до 1 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,2 до 2 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,7 до 1 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,8 до 0,9 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве 0,85 мас. %.
В определенных вариантах осуществления изобретения, композиция, содержащая полиалкиленоксид-аспарагиназу, представляет собой лиофилизированную композицию. Лиофилизированная композиции согласно настоящему раскрытию, дополнительно к полиалкиленоксид-аспарагиназе, также может включать буфер, соль, и сахар. Например, аспекты настоящей заявки включают лиофилизированную стабильную при хранении композицию полиалкиленоксид-аспарагиназы, которая включает полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой, буфер, соль и сахар.
Буферы, подходящие для применения в лиофилизированных композициях согласно настоящему раскрытию, включают буферы, которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих буферов включают те буферы, которые описаны выше. В других случаях, буфер представляет собой фосфатный буфер. В определенных вариантах осуществления изобретения, фосфатный буфер могут включать двухосновный фосфат натрия и одноосновный фосфат натрия. В других случаях, количество двухосновного фосфата натрия в композиции находится в диапазоне от 0,05 до 1 мас. %, например, от 0,1 до 0,9 мас. %, или от 0,1 до 0,8 мас. %, или от 0,1 до 0,7 мас. %, или от 0,1 до 0,6 мас. %, или от 0,1 до 0,5 мас. %, или от 0,1 до 0,4 мас. %, или 0,2 до 0,4 мас. %, или 0,2 до 0,3 мас. %, или 0,25 до 0,3 мас. %. Например, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 0,5 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,2 до 0,4 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,25 до 0,3 мас. %. Например, двухосновный фосфат натрия может присутствовать в композиции в количестве приблизительно 0,3 мас. %, например, 0,28 мас. % (или 0,279 мас. %). В определенных вариантах осуществления, количество одноосновного фосфата натрия в композиции находится в диапазоне от 0,005 до 1 мас. %, например, от 0,01 до 0,9 мас. %, или от 0,01 до 0,8 мас. %, или от 0,01 до 0,7 мас. %, или 0,01-0,6 мас. %, или от 0,01 до 0,5 мас. %, или от 0,01 до 0,4 мас. %, или от 0,01 до 0,3 мас. %, или от 0,01 до 0,2 мас. %, или от 0,01 до 0,1 мас. %, или 0,02 до 0,09 мас. %, или 0,03 до 0,08 мас. %, или 0,04 до 0,08 мас. %, или 0,045 до 0,075 мас. %, или 0,04 до 0,07 мас. %, или 0,05 до 0,07 мас. %. Например, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,01 до 0,1 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,05 до 0,07 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,045 до 0,075 мас. %. Например, одноосновный фосфат натрия может присутствовать в композиции в количестве 0,06 мас. %.
В определенных аспектах, лиофилизированная композиции согласно настоящему раскрытию включают соль. Соли, подходящие для применения в композициях согласно настоящему раскрытию, включают соли, которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих солей включают те соли, которые описаны выше. В определенных случаях, соль представляет собой хлорид натрия.
В других случаях, количество соли (например, хлорида натрия) в композиции находится в диапазоне от 0,05 до 1 мас. %, например, 0,1 до 0,9 мас. %, или от 0,1 до 0,8 мас. %, или от 0,1 до 0,7 мас. %, или от 0,1 до 0,6 мас. %, или от 0,1 до 0,5 мас. %, или 0,2 до 0,5 мас. %, или 0,3 до 0,5 мас. %, или 0,4 до 0,5 мас. %, или 0,4 до 0,45 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,1 до 1 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,3 до 0,5 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,4 до 0,45 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве приблизительно 0,4 мас. %, например, 0,425 мас. %.
Другим компонентом, который может быть включен в композиции согласно настоящему раскрытию, является сахар. Сахара, подходящие для применения в композициях согласно настоящему раскрытию включают сахара которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих Сахаров включают, но не ограничиваясь только ими, сахарозу, маннит, мальтозу, трегалозу, 2-гидроксипропил-бета-циклодекстрин (β-HPCD), лактозу, глюкозу, фруктозу, галактозу глюкозамин, и др., и их комбинации. В определенных случаях, сахар представляет собой дисахарид. Например, дисахарид может представлять собой сахарозу.
В других случаях, количество сахара (например, сахарозы) в композиции находится в диапазоне от 0,1 до 25 мас. %, например, от 0,5 до 20 мас. %, или от 1 до 15 мас. %, или от 1 до 10 мас. %, или от 1 до 9 мас. %, или от 1 до 8 мас. %, или от 2 до 7 мас. %, или от 2 до 6 мас. %, или от 3 до 5 мас. %, или от 4 до 5 мас. %. Например, сахар (например, сахароза) может присутствовать в композиции в количестве в интервале от 1 до 10 мас. %. В определенных случаях, сахар (например, сахароза) может присутствовать в композиции в количестве в интервале от 3 до 5 мас. %. В определенных случаях, сахар (например, сахароза) может присутствовать в композиции в количестве в интервале от 4 до 5 мас. %. Например, сахар (например, сахароза) может присутствовать в композиции в количестве 4,5 мас. %.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 500 до 1000 МЕ/г, двухосновного фосфата натрия в количестве в интервале от 0,1 до 1,0 мас. %, одноосновного фосфата натрия в количестве в интервале от 0,01 до 0,2 мас. %, соль (например, хлорида натрия) в количестве в интервале от 0,2 до 2 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 700 до 800 МЕ/г, двухосновного фосфата натрия в количестве в интервале от 0,2 до 0,8 мас. %, одноосновного фосфата натрия в количестве в интервале от 0,1 до 0,14 мас. %, соли (например, хлорида натрия) в количестве в интервале от 0,6 до 1,0 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 700 до 800 МЕ/г, двухосновный фосфат натрия в количестве в интервале от 0,5 до 0,6 мас. %, одноосновный натрия фосфат в количестве в интервале от 0,09 до 0,15 мас. %, соль (например, хлорид натрия) в количестве в интервале от 0,8 до 0,9 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) 750 МЕ/г, двухосновного фосфата натрия в количестве приблизительно 0,6 мас. %, одноосновного фосфата натрия в количестве приблизительно 0,1 мас. %, соли (например, хлорида натрия) в количестве приблизительно 0,9 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) 750 МЕ/г, двухосновного фосфата натрия в количестве 0,56 мас. % (или 0,558 мас. %), одноосновного фосфата натрия в количестве 0,13 мас. % (или 0,129 мас. %), соли (например, хлорида натрия) в количестве 0,85 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, двухосновного фосфата натрия, одноосновного фосфата натрия, соли (например, хлорида натрия), и воды. В других вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, двухосновного фосфата натрия, одноосновного фосфата натрия, соли (например, хлорида натрия), сахара (например, сахарозы), и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 500 до 1000 МЕ/г, двухосновного фосфата натрия в количестве в интервале от 0,1 до 0,5 мас. %, одноосновного фосфата натрия в количестве в интервале от 0,01 до 0,1 мас. %, соли (например, хлорида натрия) в количестве в интервале от 0,1 до 1 мас. %, сахара (например, сахарозы) в количестве в интервале от 1 до 10 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 700 до 800 МЕ/г, двухосновного фосфата натрия в количестве в интервале от 0,2 до 0,4 мас. %, одноосновного фосфата натрия в количестве в интервале от 0,05 до 0,07 мас. %, соли (например, хлорида натрия) в количестве в интервале от 0,3 до 0,5 мас. %, сахара (например, сахарозы) в количестве в интервале от 3 до 5 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) в интервале от 700 до 800 МЕ/г, двухосновного фосфата натрия в количестве в интервале от 0,25 до 0,3 мас. %, одноосновного фосфата натрия в количестве в интервале от 0,045 до 0,075 мас. %, соли (например, хлорида натрия) в количестве в интервале от 0,4 до 0,45 мас. %, сахара (например, сахарозы) в количестве в интервале от 4 до 5 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) 750 МЕ/г, двухосновного фосфата натрия в количестве приблизительно 0,3 мас. %, одноосновного фосфата натрия в количестве приблизительно 0,06 мас. %, соли (например, хлорида натрия) в количестве приблизительно 0,4 мас. %, сахара (например, сахарозы) в количестве приблизительно 4,5 мас. %, и воды.
В определенных вариантах осуществления, композиция содержит, по существу состоит из, или состоит из полиалкиленоксид-аспарагиназы, имеющей эффективность (активность) 750 МЕ/г, двухосновного фосфата натрия в количестве 0,28 мас. % (или 0,279 мас. %), одноосновного фосфата натрия в количестве 0,06 мас. %, соли (например, хлорида натрия) в количестве 0,43 мас. % (или 0,425 мас. %), сахара (например, сахарозы) в количестве 4,5 мас. %, и воды.
В определенных случаях, композиция (например, жидкая или лиофилизированная композиция) представляет собой стерильную композицию. Под "стерильной" подразумевается, что по существу отсутствуют иммуногенные компоненты в композиции, такие как, например, по существу отсутствуют микроорганизмы (например, грибы, бактерии, вирусы, споровые формы, и др.). В других случаях, композиция находится в контейнере. Обеспечение композиции в контейнере может облегчать поддержание композиции виде стерильной композиции. Например, контейнер может быть сконфигурирован таким образом, что содержать композицию закрытой в контейнере в стерильной окружающей среде. В таком случае, контейнер может представлять собой запечатанный контейнер, например, контейнер могут включать уплотнение, такой как водонепроницаемое и/или воздухонепроницаемое уплотнение. Уплотнение может удаляться с контейнера, предоставляя пользователю доступ к содержимому контейнера. В других случаях, уплотнение может представлять собой разрушаемое уплотнение, или в других случаях, уплотнение может сконфигурировано с возможностью вставки иглы, канюли или шприца вовнутрь контейнера без удаления уплотнения с контейнера. В других случаях, уплотнение, сконфигурировано для предоставления возможности доступа вовнутрь контейнера без удаления уплотнения с контейнера, может облегчать поддержание содержимого контейнера (например, композиции в контейнере) в стерильной окружающей среде перед введением композиции субъекту. Подходящие материалы для уплотнения включают, например, резиновые или полимерные уплотнения, такие как, но не ограничиваясь только ими, силиконовый каучук, природный каучук, стирольный бутадиеновый каучук, сополимеры этилен-пропилена, полихлоропрен, полиакрилат, полибутадиен, полиуретан, стирол бутадиен, и др., и их комбинации. Например, в определенных вариантах осуществления изобретения, уплотнение представляет собой мембрану, прокалываемую иглой, шприцом или канюлей. Уплотнение также может обеспечивать подходящий доступ к образцу в контейнере, а также является защитным бартером, который перекрывает раскрытие контейнера. В других случаях, уплотнение представляет собой удаляемое уплотнение, такое как резьбовой или нажимной колпачок или другой подходящий запечатывающий элемент, который может применяться для открытия контейнера. Например, резьбовой колпачок может быть навинчен на отверстие перед или после добавления образца в контейнер.
В других случаях, контейнер представляет собой контейнер с единичной дозой. Контейнер с единичной дозой относится к контейнеру, который содержит одну или больше единичных доз для введения субъекту. В определенных вариантах осуществления, контейнер с единичной дозой включает заранее определенное количество заявленной композиции, рассчитанное в количестве, достаточном для получения желательного эффекта у субъекта. Определенные варианты осуществления композиций могут быть обеспечены в контейнере с единичной дозой, подходящим для индивидуального введения точных дозировок. Количество активной композиции, вводимое субъекту, может зависеть от субъекта, подвергаемого лечению, тяжести поражения и способа введения. Например, контейнер с единичной дозой может содержать вводимое количество композиции, как описано в настоящей заявке, в количестве, эффективном для достижения желательного эффекта у субъекта, подвергаемого лечению. В определенных случаях, контейнер с единичной дозой включает композицию, имеющую полиалкиленоксид-аспарагин в терапевтически эффективном количестве. Терапевтически эффективные количества полиалкиленоксид-аспарагин описаны выше. В определенных вариантах осуществления изобретения, контейнер с единичной дозой представляет собой флакон. В других случаях, флакон представляет собой запечатанный флакон (например, как описано выше по отношению к запечатанному контейнеру).
Контейнер может состоять из любого подходящего материала, который совместим с полиалкиленоксид-аспарагиназой и другими компонентами композиции. Например, контейнер может представлять собой совместимый с твердыми веществами контейнер, сконфигурированный таким образом, чтобы содержать твердое вещество (например, лиофилизированную композицию). В других случаях, контейнер представляет собой совместимый с жидкостью контейнер, сконфигурированный таким образом, чтобы содержать жидкость. Контейнеры также могут быть совместимыми с твердым веществом и жидкостью, где контейнер сконфигурирован таким образом, чтобы содержать твердые вещества и жидкости. В других случаях, жидкость в контейнере может представлять собой водную жидкость, и в этих случаях, контейнер может быть совместим с водными композициями. Под "совместимым" понимают, что контейнер является по существу инертным (например, существенно не реагирует с) жидкостью и/или композициями или другими компонентами, контактирующими с контейнером. Примеры подходящих материалов для контейнера включают, но не ограничиваясь только ими, стекло и пластик. Например, контейнер может состоять из стекла, такого как, но не ограничиваясь только ими, силикатное стекло, боросиликатное стекло, натрийборосиликатное стекло (например, PYREX™), плавленое кварцевое стекло, плавленое кремниевое стекло и др. Другие примеры подходящих материалов для контейнера включают пластмассы, такие как, но не ограничиваясь только ими, полипропилен, полиметилпентен, политетрафторэтилен (PTFE), перфторэтиловые эфиры (PFE), фторированный этилен пропилен (FEP), перфторалкоксиалканы (PFA), полиэтилен терефталат (PET), полиэтилен (РЕ), полиэфирэфиркетон (PEEK), полистирол, и др. В определенных случаях, как описано выше, контейнер представляет собой флакон, и, в таком случае, может представлять собой стеклянный флакон. Как описано выше, контейнер может представлять собой запечатанный контейнер, и, в таком случае, может представлять собой запечатанный стеклянный флакон.
Как описано более подробно ниже, жидкие или восстановленные композиции согласно настоящему раскрытию могут вводиться субъекту, например, путем инъекции или внутривенно. В определенных вариантах осуществления изобретения, перед введением восстановленной композиции субъекту, твердая композиция, например, как описано выше, может комбинироваться с жидкостью для обеспечения жидкой композиции, подходящие для введения, например, путем инъекции или внутривенно. В других случаях, перед введением композиции субъекту, твердая композиция может комбинироваться с водой (например, водой для инъекций, ВДИ) для обеспечения водной композиции, подходящей для введения, например, путем инъекции или внутривенно. Например, лиофилизированная композиция может быть восстановлена водой (например, водой для инъекций, ВДИ) с получением восстановленной дозированной единицы пригодны для введения субъекту, например, путем инъекции или внутривенно.
Как указано в настоящей заявке, аспекты настоящей заявки включают композицию, которая включает: полиалкиленоксид-аспарагиназу, которая включает полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой; буфер и соль. В определенных вариантах осуществления изобретения, как описано выше, полиалкиленоксид представляет собой полиэтиленгликоль. В определенных вариантах осуществления изобретения, как описано выше, линкер представляет собой уретановый (карбаматный) линкер. В определенных вариантах осуществления изобретения, как описано выше, аспарагиназа представляет собой Е. coli аспарагиназу. В определенных вариантах осуществления изобретения, как описано выше, буфер представляет собой фосфатный буфер. В определенных вариантах осуществления изобретения, как описано выше, соль представляет собой хлорид натрия. Соответственно, определенные варианты осуществления композиции включают полиэтиленгликоль-аспарагиназу, которая включает полиэтиленгликолевую группу, ковалентно связанную с помощью уретанового линкера с Е. coli аспарагиназой; фосфатный буфер и соль. Каждый из компонентов этих композиций (например, молекулярный вес полиэтиленгликоля, количество полиэтиленгликоль-аспарагиназы, количество и тип фосфатного буфера, количество и тип соли) являются такими, как подробно описано выше.
Как указано в настоящей заявке, аспекты настоящей заявки включают лиофилизированную стабильную при хранении композицию, которая включает: полиалкиленоксид-аспарагиназу, которая включает полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой; буфер, соль и сахар. В определенных вариантах осуществления изобретения, как описано выше, полиалкиленоксид представляет собой полиэтиленгликоль. В определенных вариантах осуществления изобретения, как описано выше, линкер представляет собой уретановый (карбаматный) линкер. В определенных вариантах осуществления изобретения, как описано выше, аспарагиназа представляет собой Е. coli аспарагиназу. В определенных вариантах осуществления изобретения, как описано выше, буфер представляет собой фосфатный буфер. В определенных вариантах осуществления изобретения, как описано выше, соль представляет собой хлорид натрия. В определенных вариантах осуществления изобретения, как описано выше, сахар представляет собой дисахарид (например, сахароза). Таким образом, определенные варианты осуществления лиофилизированной стабильной при хранении композиции включают полиэтиленгликоль-аспарагиназу, которая включает полиэтиленгликолевую группу, ковалентно связанную с помощью уретанового линкера с Е. coli аспарагиназой; фосфатный буфер, соль и дисахарид. Каждый из компонентов этих композиций (например, молекулярный вес полиэтиленгликоля, количество полиэтиленгликоль-аспарагиназы, количество и тип фосфатного буфера, количество и тип соли, количество и тип дисахарида, и др.) являются такими, как подробно описано выше.
Композиции согласно настоящему раскрытию также может включать другие компоненты, такие как дополнительные фармацевтически приемлемые наполнители или наполнитель для доставки дозы в виде части композиции. Наполнители могут включать, но не ограничиваясь только ими, углеводы, неорганические соли, органические соли, противомикробные средства, антиоксиданты, поверхностно-активные вещества, воду (например, воду для инъекций (ВДИ)), спирты, полиолы, глицерин, растительные масла, фосфолипиды, буферы, кислоты, основания, и любые их комбинации. Также может применяться углевод, такой как сахар, дериватизированный сахар, такой как альдит, альдоновая кислота, эстерифицированный сахар, и/или сахарный полимер. Некоторые представляющие интерес углеводные наполнители включают, например, моносахариды, такие как фруктоза, мальтоза, галактоза, глюкоза, D-манноза, сорбоза, и др; дисахариды, такие как лактоза, сахароза, трегалоза, целлобиоза, и др; полисахариды, такие как раффиноза, мелицитоза, мальтодекстрины, декстраны, крахмалы и др; и альдиты, такие как маннит, ксилит, мальтит, лактит, ксилит, сорбит (глюцит), пиранозил сорбит, миоинозит, и др. Неорганические и органические соли могут включать, но не ограничиваясь только ими лимонную кислоту, хлорид натрия, хлорид калия, сульфат натрия, нитрат калия, одноосновный фосфат натрия, двухосновный фосфат натрия, и любые их комбинации.
В определенных вариантах осуществления изобретения, композиции согласно настоящему раскрытию также может включать противомикробное средство для предотвращения или остановки роста микроорганизмов, такое как, например бензалкония хлорид, бензетония хлорид, бензиловый спирт, цетилпиридиний хлорид, хлорбутанол, фенол, фенилэтиловый спирт, нитрат фенилртути, тимерсол, и любые их комбинации.
Один или больше антиоксидантов также могут быть включены в композицию. Антиоксиданты, которые могут уменьшать или предотвращать окисление и, следовательно, ухудшение характеристик композиции, могут включать, например, аскорбил пальмитат, бутилоксианизол, бутилокситолуол, фосфорноватистую кислоту, монотиоглицерин, пропилгаллат, бисульфит натрия, формальдегид-сульфоксилат натрия, метабисульфит натрия и любые их комбинации.
Одно или больше поверхностно-активных веществ также могут быть включены в композиции согласно настоящему раскрытию. Например, подходящие поверхностно-активные вещества могут включать, но не ограничиваясь только ими Полисорбаты, такие как "Твин 20" и "Твин 80," и плюронисик, такие как F68 и F88 (BASF, Mount Olive, New Jersey); сложный эфир сорбитана; липиды, такие как фосфолипиды, такие как лецитин и другие фосфатидилхолины, фосфатидилэтаноламины, жирные кислоты и сложные эфиры жирных кислоты; стероиды, такие как холестерин; хелатирующие агенты, такие как EDTA; и цинк и другие катионы.
Кислоты или основания также могут присутствовать в композициях согласно настоящему раскрытию. Например, кислоты могут включать, но не ограничиваясь только ими, соляную кислоту, уксусную кислоту, фосфорную кислоту, лимонную кислоту, яблочную кислоту, молочную кислоту, муравьиную кислоту, трихлоруксусную кислоту, азотную кислоту, перхлорную кислоту, фосфорную кислоту, серную кислоту, фумаровую кислоту и любые их комбинации. Примеры оснований включают, но не ограничиваясь только ими гидроксид натрия, ацетат натрия, гидроксид аммония, гидроксид калия, ацетат аммония, ацетат калия, фосфат натрия, фосфат калия, цитрат натрия, формиат натрия, сульфат натрия, сульфат калия, фумерат калия и любые их комбинации.
Количество каждого индивидуального наполнителя в композиции может изменяться в зависимости от природы и функции наполнителя, наполнителя для доставки дозировки и конкретных потребностей композиции. В других случаях, оптимальное количество любого индивидуального наполнителя определяют с помощью общепринятых экспериментов, то есть, путем приготовления композиций, содержащих различных количества наполнителя (в интервале от низких до высоких), исследуя стабильность и другие параметры, и затем определяя интервал, при котором достигаются оптимальные характеристики без существенных побочных эффектов. Тем не менее, наполнитель (и) в целом будут присутствовать в композиции в количестве от 1% до 99% по весу, например, от 5% до 98% по весу, например, от 15% до 95% по весу наполнителя, включая 30% или меньше по весу, или 20% или меньше по весу, или 10% или меньше по весу. Фармацевтические наполнители, в частности с другими наполнителями, которые могут применяться в композициях, описаны в "Remington: The Science & Practice of Pharmacy", 22-oe изд., Williams & Williams, (2012), "Physician's Desk Reference", 70-oe изд., PDR Network, Montvale, NJ (2015), и Rowe, RC., Handbook of Pharmaceutical Excipients, 7-ое изд., Pharmaceutical Press, New York, NY, (2012), раскрытие каждого из которых включено в настоящую заявку в качестве ссылки.
Способы применения
Аспекты согласно настоящему раскрытию также включают способы применения композиции (например, жидкой и лиофилизированной), описанные в настоящей заявке. В определенных вариантах осуществления изобретения, способ применения представляет собой способ дезаминирования аспарагина у субъекта. Как описано выше, фермент аспарагиназа может опосредовать реакцию дезаминирования, где аминокислота аспарагин гидролизируется с образования аспартата и аммиака, например, в соответствии со следующей реакцией:

В других случаях, активность аспарагиназы уменьшает концентрацию аспарагина у субъекта, а именно уменьшается концентрация аспарагина в плазме у субъекта. Истощение аспарагина у субъекта может отрицательно влиять на клетки в субъекта, которые зависят от присутствия аспарагина для синтеза белка. Например, на синтез белка в клетках, в которых отсутствует способность синтезировать свой собственный аспарагин (например, клетки, в которых отсутствует фермент аспарагин-синтетаза) может оказывать отрицательно влияние отсутствие экзогенного аспарагина, что, в свою очередь, может приводить к апоптозу клеток. В других случаях, клетки в субъекта, которые зависят от присутствия аспарагина для синтеза белка, могут быть связаны с опухолевым состоянием, таким как злокачественное новообразование. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от опухолевого состояния, такие как способы лечения субъекта от злокачественного новообразования. Следовательно, композиции согласно настоящему раскрытию, которые включают полиалкиленоксид-аспарагиназу могут быть терапевтически эффективными для лечения опухолевых состояний, таких как злокачественное новообразование. В определенных вариантах осуществления изобретения, на неопухолевые клетки у субъекта не оказывают существенного влияния композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию. Например, неопухолевые клетки у субъекта могут иметь фермент аспарагин-синтетазу, и, следовательно, сохранять способность синтезировать аспарагин.
В определенных вариантах осуществления изобретения, опухолевое состояние, подвергаемое лечению у субъекта, включает опухолевые состояния, которые поддаются лечению с помощью введения полиалкиленоксид-аспарагиназы субъекту, например, опухолевые состояния, которые зависят от экзогенного аспарагина. Например, опухолевые состояния, которые можно лечить путем введения полиалкиленоксид-аспарагиназы субъекту, включают злокачественные новообразования, такие как солидные опухоли или опухоли жидких тканей.
В определенных случаях, опухолевое состояние характеризуется присутствием
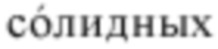
Другие
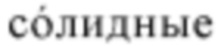
В определенных случаях, опухолевое состояние характеризуется присутствием опухоли жидких тканей. Например, опухоль жидких тканей может включать метастатические раковые клетки (например, циркулирующие опухолевые клетки (СТС)), злокачественные заболевания крови, и др., и их комбинации. Примеры злокачественных заболеваний крови включают, но не ограничиваясь только ими, лейкоз, лимфому и миелому. В других случаях, злокачественное новообразование представляет собой лейкоз. Таким образом, в определенных вариантах осуществления, способ представляет собой способ лечения субъекта от лейкоза, используя полиалкиленоксид-аспарагиназу (например, жидкую или восстановленную лиофилизированную композицию полиалкиленоксид-аспарагиназы согласно настоящему раскрытию).
Различные типы лейкозов могут поддаваться лечению с применением заявленных способов. Например, лейкоз может представлять собой острый лейкоз. Острый лейкоз может характеризоваться быстрым повышением незрелых клеточных элементов крови. Быстрое повышение незрелых клеточных элементов крови может приводить к сгущению, что, в свою очередь, может обуславливать продукцию костным мозгом существенно меньшего количества здоровых клеточные элементы крови. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от острого лейкоза, например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидко или восстановленной лиофилизированной композиций полиалкиленоксид-аспарагиназы согласно настоящему раскрытию), эффективной для лечения у субъекта острого лейкоза.
В других вариантах, лейкоз представляет собой хронический лейкоз. В других случаях, хронический лейкоз может характеризоваться повышением количества относительно зрелых, но атипичных, лейкоцитов. Хронический лейкоз может развиваться в течение длительного периода времени (например, месяцы или годы), где атипичные лейкоциты продуцируются в значительно более высокой степени, чем нормальные. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от хронического лейкоза, например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию), эффективной для лечения у субъекта хронического лейкоза.
В определенных вариантах осуществления изобретения, лейкоз представляет собой лимфобластный лейкоз (также обозначается как лимфоцитарный лейкоз). Лимфобластный лейкоз может характеризоваться типом клеточных элементов крови, пораженных лейкозом. При лимфобластном лейкозе аномальное изменение в клеточных элементах крови происходит в клетках костного мозга, которые нормально развиваются в лимфоциты. Например, лимфобластный лейкоз может представлять собой В-клеточный лейкоз. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от лимфобластного лейкоза (лимфоцитарного лейкоза), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию) эффективной для лечения у субъекта лимфобластного лейкоза (лимфоцитарного лейкоза). Например, специфический тип лимфобластного лейкоза, который можно лечить, используя заявленные способы, включает острый лимфобластный лейкоз (ALL). В этих вариантах осуществления, способы согласно настоящему раскрытию включают способы лечения субъекта от острого лимфобластного лейкоза (ALL), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию) эффективной для лечения у субъекта ALL. Другие типы лимфобластного лейкоза, который можно лечить, используя заявленные способы, включают, но не ограничиваясь только ими, хронический лимфоцитарный лейкоз (CLL). В этих вариантах осуществления, способы согласно настоящему раскрытию включают способы лечения субъекта от хронического лимфоцитарного лейкоза (CLL), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидкая или восстановленная лиофилизированная композиция полиалкиленоксид-аспарагиназы согласно настоящему раскрытию) эффективной для лечения у субъекта CLL.
В других вариантах осуществления, лейкоз представляет собой миелоидный лейкоз (также обозначается как миелогенный лейкоз). Миелоидный лейкоз может характеризоваться типом клеточных элементов крови, пораженных лейкозом. При миелоидном лейкозе аномальное изменение в клеточных элементах крови происходит в клетках костного мозга, которые нормально развиваются в эритроциты и/или тромбоциты. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от миелоидного лейкоза (миелогенного лейкоза), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию), эффективной для лечения у субъекта миелоидного лейкоза (миелогенного лейкоза). Например, специфический тип миелоидного лейкоза, который можно лечить, используя заявленные способы, включает острый миелоидный лейкоз (AML). В этих вариантах осуществления, способы согласно настоящему раскрытию включают способы лечения субъекта от острого миелоидного лейкоза (AML), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию), эффективной для лечения у субъекта AML.
Примеры AML включают, но не ограничиваясь только ими, AML с повторяющимися цитогенетическими транслокациями, AML с мультилинейной дисплазией, и другие AML. Например, AML с повторяющимися цитогенетическими транслокациями включают, в частности, AML с t(8; 21)(q22; q22), AMLI(CBF-альфа)/ETO, острый промиелоцитарный лейкоз (AML с t(15; 17)(q22; q11-12) и варианты, PML/RAR-альфа), AML с атипичными эозинофилами костного мозга (inv(16)(p13q22) или t(16; 16)(p13; q11), CBFb/MYH1 IX), и AML с 1 lq23 (MLL) аномалиями. Примеры AML с мультилинейной дисплазией могут включать те, которые связаны с или без предшествующего миелодиспластического синдрома. Другие типы острого миелоидного лейкоза включают, например, AML минимально дифференциированный, AML без созревания, AML с созреванием, острый мономиелоцитарный лейкоз, острый моноцитарный лейкоз, острый эритроидный лейкоз, острый мегакариоцитный лейкоз, острый базофильный лейкоз и острый панмиелоз с миелофиброзом.
Другие типы миелоидного лейкоза, которые можно лечить, используя заявленные способы, включают, но не ограничиваясь только ими, хронический миелолейкоз (CML). В этих вариантах осуществления, способы согласно настоящему раскрытию включают способы лечения субъекта от хронического миелолейкоза (CML), например, путем введения субъекту дозы полиалкиленоксид-аспарагиназы, (например, жидкой или восстановленной лиофилизированной композиции полиалкиленоксид-аспарагиназы согласно настоящему раскрытию) эффективной для лечения у субъекта CML.
В определенных случаях, аспарагиназа может опосредовать дезаминирование глутамина, где аминокислота глутамин гидролизируется с образованием глутамата и аммиака, например, в соответствии со следующей реакцией:

В других случаях, активность аспарагиназы уменьшает концентрацию глутамина у субъекта, а именно уменьшает концентрацию глутамина в плазме у субъекта. Аналогично к обсуждаемому выше, истощение глутамина у субъекта может оказывать отрицательное влияние на клетки у субъекта, которые зависят от присутствия глутамина для синтеза белка. Например, на синтез белка в клетках, в которых отсутствует способность синтезировать свой собственный глутамин (например, клетки, в которых отсутствует фермент глутамин синтетаза) может оказывать отрицательное влияние отсутствие экзогенного глутамина, что, в свою очередь, может приводить к апоптозу клеток. В других случаях, клетки в субъекта, которые зависят от присутствия глутамина для синтеза белка, могут быть связаны с опухолевым состоянием, таким как злокачественное новообразование. Таким образом, способы согласно настоящему раскрытию включают способы лечения субъекта от опухолевого состояния, такие как способы лечения субъекта от злокачественного новообразования, где опухолевое состояние могут зависеть от экзогенного глутамина. Например, варианты осуществления заявленных способов включают способы дезаминирования глутамина у субъекта. В определенных вариантах осуществления изобретения, не неопухолевые клетки у субъекта не оказывает существенное влияние полиалкиленоксид-аспарагиназа, вводимая субъекту. Например, неопухолевые клетки у субъекта могут иметь фермент глутамин-синтетаза, и, следовательно, сохранять способность синтезировать глутамин.
Как описано выше, композиции согласно настоящему раскрытию включают лиофилизированные стабильные при хранении композиции. Перед введением композиции субъекту, лиофилизированная композиция может комбинироваться с жидкостью для обеспечения жидкой композиции, подходящей для введения, например, путем инъекции или внутривенно. В других случаях, перед введением композиции субъекту, лиофилизированная композиция комбинируется с водой (например, водой для инъекций, ВДИ) для обеспечения водной композиции, подходящей для введения, например, путем инъекции или внутривенно. Например, способы согласно настоящему раскрытию могут включать восстановление лиофилизированной композиции (например, лиофилизированной стабильной при хранении композиции) согласно настоящему раскрытию. Восстановление лиофилизированной композиции может обеспечивать получение восстановленной дозированной единицы. В других случаях, восстановленная дозированная единица пригодна для введения субъекту, например путем инъекции или внутривенно. В определенных вариантах осуществления изобретения, восстановление лиофилизированной композиции включает комбинирование лиофилизированной композиции (например, лиофилизированной стабильной при хранении композиции) с водой (например, воду для инъекций, ВДИ).
Жидкая или восстановленная дозированная единица может включать заранее определенное количество композиции согласно настоящему раскрытию, рассчитанное в количестве, достаточном для получения желательного терапевтического эффекта у субъекта. Количество композиции в дозированной единице (например, жидкой или восстановленной), которое вводят субъекту, может зависеть от субъекта, подвергаемого лечению, тяжести поражения и способа введения. Например, дозированная единица может включать количество композиции для введения, как описано в настоящей заявке, в терапевтически эффективном количестве.
Определенные варианты осуществления дозированной единицы могут включать количество полиалкиленоксид-аспарагиназы в интервале от 100 до 5000 МЕ/мл, например, от 500 до 4500 МЕ/мл, или от 500 до 4000 МЕ/мл, или от 500 до 3500 МЕ/мл, или от 500 до 3000 МЕ/мл, или от 500 до 2500 МЕ/мл, или от 500 до 2000 МЕ/мл, или от 500 до 1500 МЕ/мл, или от 500 до 1000 МЕ/мл, или 600 до 900 МЕ/мл, или, или от 700 до 800 МЕ/мл. В определенных случаях, дозированная единица включает количество полиалкиленоксид-аспарагиназы в интервале от 500 до 1000 МЕ/мл. В определенных случаях, дозированная единица включает количество полиалкиленоксид-аспарагиназы в интервале от 700 до 800 МЕ/мл. Например, дозированная единица может включать 750 МЕ/мл полиалкиленоксид-аспарагиназы.
В определенных вариантах осуществления изобретения, дозированная единица включает терапевтически эффективное количество (например, удельную активность) полиалкиленоксид-аспарагиназы, такое как 50 МЕ/мг белка или больше, например, 55 МЕ/мг белка или больше, или 60 МЕ/мг белка или больше, или 65 МЕ/мг белка или больше, или 70 МЕ/мг белка или больше, или 75 МЕ/мг белка или больше, или 80 МЕ/мг белка или больше, или 85 МЕ/мг белка или больше, или 90 МЕ/мг белка или больше, или 95 МЕ/мг белка или больше, или 100 МЕ/мг белка или больше, или 105 МЕ/мг белка или больше, или 110 МЕ/мг белка или больше, или 115 МЕ/мг белка или больше, или 120 МЕ/мг белка или больше, или 125 МЕ/мг белка или больше, или 130 МЕ/мг белка или больше, или 135 МЕ/мг белка или больше, или 140 МЕ/мг белка или больше, или 145 МЕ/мг белка или больше, или 150 МЕ/мг белка или больше. Например, дозированная единица может иметь удельную активность 85 МЕ/мг белка или больше. В определенных вариантах осуществления, дозированная единица имеет удельную активность в интервале от 50 до 150 МЕ/мг белка, или от 55 до 145 МЕ/мг белка, или от 60 до 140 МЕ/мг белка, или от 65 до 135 МЕ/мг белка, или от 70 до 130 МЕ/мг белка, или от 75 до 125 МЕ/мг белка, или от 80 до 120 МЕ/мг белка, или от 85 до 115 МЕ/мг белка, или от 90 до 110 МЕ/мг белка, или от 95 до 105 МЕ/мг белка. В других случаях, дозированная единица имеет удельную активность в интервале от 50 до 150 МЕ/мг белка, например, от 65 до 140 МЕ/мг белка, или от 70 до 135 МЕ/мг белка, или от 75 до 130 МЕ/мг белка, или от 75 до 125 МЕ/мг белка. Например, дозированная единица может иметь удельную активность в интервале от 75 до 125 МЕ/мг белка.
В определенных вариантах осуществления изобретения, дозированная единица включает терапевтически эффективное количество (например, концентрацию белка) полиалкиленоксид-аспарагиназы в количестве в интервале от 1 мг/мл до 15 мг/мл, например, от 1,5 мг/мл до 14,5 мг/мл, или от 2 мг/мл до 14 мг/мл, или от 2,5 мг/мл до 13,5 мг/мл, или от 3 мг/мл до 13 мг/мл, или от 3,5 мг/мл до 12,5 мг/мл, или от 4 мг/мл до 12 мг/мл, или от 4,5 мг/мл до 11,5 мг/мл, или от 4,5 мг/мл до 11 мг/мл, или от 4,5 мг/мл до 10,5 мг/мл, или от 4,5 мг/мл до 10 мг/мл, или от 4,5 мг/мл до 9,5 мг/мл, или от 4,5 мг/мл до 9 мг/мл, или от 4,5 мг/мл до 8,5 мг/мл, или от 5 мг/мл до 8 мг/мл. В других случаях, дозированная единица включает полиалкиленоксид-аспарагиназа в количестве в интервале от 4,5 мг/мл до 8,5 мг/мл.
При введении субъекту, дозированная единица может включать терапевтически эффективное количество полиалкиленоксид-аспарагиназы, так, что дозированная единица доставляет от 100 до 5000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту, например, от 500 до 5000 МЕ/м2, или от 500 до 4500 МЕ/м2, или от 500 до 4000 МЕ/м2 или от 500 до 3500 МЕ/м2, или от 500 до 3000 МЕ/м2, или 1000 до 3,000 МЕ/м2, или от 1500 до 3000 МЕ/м2, или от 1750 до 3000 МЕ/м2, или от 2000 до 3000 МЕ/м2 или от 2000 до 2,750 МЕ/м2, или от 2250 до 2750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. Например, дозированная единица может доставлять от 1500 до 3000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных случаях, дозированная единица доставляет от 2000 до 2750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных случаях, дозированная единица доставляет от 2,250 дл 2,750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. Например, дозированная единица может доставлять 2,500 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту.
В определенных вариантах осуществления изобретения, дозированная единица включает буфер, такой как буфер, описанный подробно выше. Например, дозированная единица может включать фосфатный буфер, и так такой буфер может включать двухосновный фосфат натрия и одноосновный фосфат натрия.
В других случаях, дозированная единица включает фосфатный буфер, и как такой буфер может включать двухосновный фосфат натрия и одноосновный фосфат натрия. В определенных случаях, дозированная единица включает двухосновный фосфат натрия в количестве в интервале 0,5-10 мг/г, например, 1-9 мг/г, или 1-8 мг/г, или 1-7 мг/г, или 2-7 мг/г, или 3-6 мг/г, или 4-6 мг/г, или 5-6 мг/г. Например, дозированная единица может включать двухосновный фосфат натрия в количестве в интервале от 4 до 6 мг/г. В определенных случаях, дозированная единица включает двухосновный фосфат натрия в количестве в диапазоне 5-6 мг/г. Например, дозированная единица может включать двухосновный фосфат натрия в количестве приблизительно 5,5 мг/г, например, 5,6 мг/г (или 5,58 мг/г). В определенных вариантах осуществления изобретения, дозированная единица включает одноосновный фосфат натрия в количестве в интервале от 0,05 до 5 мг/г, например, 0,1-4,5 мг/г, или 0,1-4 мг/г, или 0,1-3,5 мг/г, или 0,1-3 мг/г, или 0,1-2,5 мг/г, или 0,1-2 мг/г, или 0,5-2 мг/г, или 1-2 мг/г, или 1-1,5 мг/г. Например, дозированная единица может включать одноосновный фосфат натрия в количестве в интервале от 1 до 2 мг/г. В определенных случаях, дозированная единица включает одноосновный фосфат натрия в количестве в интервале от 1 до 1,5 мг/г. Например, дозированная единица может включать одноосновный фосфат натрия в количестве 1,2 мг/г (или 1,29 мг/г).
В определенных вариантах осуществления изобретения, дозированная единица включает соль. Соли, подходящие для применения в дозированной единице включают соли, которые совместимы с полиалкиленоксид-аспарагиназой и пригодны для введения субъекту, например, путем инъекции или внутривенного введения. Примеры подходящих солей включают, но не ограничиваясь только ими, хлорид натрия, хлорид калия, хлорид кальция, хлорид магния, и др., и их комбинации.
В определенных случаях, дозированная единица включает соль, такую как хлорид натрия. В других случаях, дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 1 до 20 мг/г, например, 1-19 мг/г, или 1-18 мг/г, или 1-17 мг/г, или 1-16 мг/г, или 1-15 мг/г, или 2-15 мг/г, или 3-15 мг/г, или 4-15 мг/г, или 5-14 мг/г, или 5-13 мг/г, или 5-12 мг/г, или 5-11 мг/г, или 5-10 мг/г, или 5-9 мг/г, или 6-9 мг/г, или 7-9 мг/г, или 8-9 мг/г. Например, дозированная единица может включать соль (например, хлорид натрия) в количестве в интервале от 1 до 10 мг/г. В определенных случаях, дозированная единица включает соль (например, хлорид натрия) в количестве в диапазоне 5-10 мг/г. В определенных случаях, дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 6 до 9 мг/г. В определенных случаях, дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 8 до 9 мг/г. Например, дозированная единица может включать соль (например, хлорид натрия) в количестве 8,5 мг/г.
В других случаях, препарат, который вводят субъекту, представляет собой ПЭГ-аспарагиназу жидкий препарат для инъекций, коммерчески известный как Oncaspar®, который разрешен для коммерческого применения Управлением по контролю за продуктами и лекарствами США. Oncaspar® (пэгаспаргаза) представляет собой L-аспарагиназу (L-аспарагин амидогидролазу), которая ковалентно конъюгирована к монометоксиполиэтиленгликолю (мПЭГ), которая представлена в прозрачном, бесцветном, не содержащем консервантов изотоническом стерильном растворе в фосфатно-солевом буфере, рН 7,3. Каждый миллилитр содержит 750±150 Международных единиц пэгаспаргазы, двухосновный фосфат натрия, USP (5,58 мг), одноосновный фосфат натрия, USP (1,20 мг) и хлорид натрия, USP (9,5 мг) в вода для инъекций, USP.
В определенных вариантах осуществления изобретения, дозированная единица, вводимая субъекту, представляет собой дозированную единицу, приготовленную из лиофилизированной композиции, например, лиофилизированной стабильной при хранении композиции, как описано в настоящей заявке. Дозированная единица, приготовленная из лиофилизированной композиции, может представлять собой жидкую дозу. Дополнительно к полиалкиленоксид-аспарагиназе, варианты осуществления дозированной единицы (например, дозы, восстановленной из лиофилизированной композиции) могут включать буфер, соль и сахар.
В определенных вариантах осуществления изобретения, восстановленная дозированная единица включает буфер, такой как буфер, описанный более подробно выше. В других случаях, восстановленная дозированная единица включает двухосновный фосфат натрия в количестве в интервале от 0,5-10 мг/г, например, 1-9 мг/г, или 1-8 мг/г, или 1-7 мг/г, или 1-6 мг/г, или 1 до 5 мг/г, или 1-4 мг/г, или 2-4 мг/г, или 2-3 мг/г, или 2,5-3 мг/г. Например, восстановленная дозированная единица может включать двухосновный фосфат натрия в количестве в интервале от 1 до 5 мг/г. В определенных случаях, восстановленная дозированная единица может включать двухосновный фосфат натрия в количестве в интервале от 2 до 4 мг/г. В определенных случаях, восстановленная дозированная единица может включать двухосновный фосфат натрия в количестве в интервале от 2,5 до 3 мг/г. Например, восстановленная дозированная единица может включать двухосновный фосфат натрия в количестве приблизительно 3 мг/г, например, 2,8 мг/г (или 2,79 мг/г). В определенных вариантах осуществления изобретения, восстановленная дозированная единица включает одноосновный фосфат натрия в количестве в интервале от 0,05 до 1 мг/г, например, 0,1 до 0,9 мг/г, или от 0,1 до 0,8 мг/г, или 0,2 до 0,8 мг/г, или 0,3 до 0,8 мг/г, или 0,4 до 0,8 мг/г, или 0,45 до 0,75 мг/г, или 0,5 до 0,7 мг/г. Например, восстановленная дозированная единица может включать одноосновный фосфат натрия в количестве в интервале от 0,45 до 0,75 мг/г. В определенных случаях, восстановленная дозированная единица включает одноосновный фосфат натрия в количестве в интервале от 0,5 до 0,7 мг/г. Например, восстановленная дозированная единица может включать одноосновный фосфат натрия в количестве 0,6 мг/г.
В определенных вариантах осуществления изобретения, восстановленная дозированная единица включает соль, такую как соль, описанную подробно выше. В определенных случаях, восстановленная дозированная единица включает соль, такую как хлорид натрия. В других случаях, восстановленная дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 0,5-10 мг/г, например, 1-9 мг/г, или 1-8 мг/г, или 1-7 мг/г, или 1-6 мг/г, или 1-5 мг/г, или 2-5 мг/г, или 3-5 мг/г, или 4-5 мг/г, или 4-4,5 мг/г. Например, восстановленная дозированная единица может включать соль (например, хлорид натрия) в количестве в интервале от 1 до 10 мг/г. В определенных случаях, восстановленная дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 3 до 5 мг/г. В определенных случаях, восстановленная дозированная единица включает соль (например, хлорид натрия) в количестве в интервале от 4 до 4,55 мг/г. Например, восстановленная дозированная единица может включать соль (например, хлорид натрия) в количестве приблизительно 4 мг/г, например, 4,25 мг/г.
В определенных вариантах осуществления изобретения, восстановленная дозированная единица включает сахар, такой как сахар, описанный более подробно выше. В определенных случаях, восстановленная дозированная единица включает сахар, такой как дисахарид. В других случаях, восстановленная дозированная единица включает сахар, такой как сахароза. В других случаях, восстановленная дозированная единица включает количество сахара (например, сахарозы) в интервале 1-250 мг/г, например, 5-200 мг/г, или 10-150 мг/г, или 10-100 мг/г, или 10-90 мг/г, или 10-80 мг/г, или 20-70 мг/г, или 20-60 мг/г, или 30-50 мг/г, или 40-50 мг/г. Например, восстановленная дозированная единица может включать сахар (например, сахароза) в количестве в интервале от 10 до 100 мг/г. В определенных случаях, восстановленная дозированная единица может включать сахар (например, сахароза) в количестве в интервале от 30 до 50 мг/г. В определенных случаях, восстановленная дозированная единица может включать сахар (например, сахароза) в количестве в интервале от 40 до 50 мг/г. Например, восстановленная дозированная единица может включать сахар (например, сахароза) в количестве 45 мг/г. В определенных вариантах осуществления изобретения, дозированная единица (например, жидкая или восстановленная) имеет значение рН, совместимые с физиологическими условиями. В других случаях, рН дозированной единицы находится в диапазоне от 6 до 8. В других случаях, рН дозированной единицы находится в диапазоне от 7 до 8. Например, рН дозированной единицы может находиться в диапазоне от 7 до 7,5. В других случаях, значение рН дозированной единицы составляет 7,2. В других случаях, значение рН дозированной единицы составляет 7,3. В других случаях, значение рН дозированной единицы составляет 7,4.
В определенных вариантах осуществления изобретения, способ может включать введение дозированной единицы субъекту для дезаминирования аспарагинов у субъекта. Путь введения может быть выбран в соответствии с различными факторами, включая, но не ограничиваясь только ими, состояние, подвергаемое лечению, тип используемой композиции и/или устройства, пациента, подвергаемого лечению, и др. Пути введения, пригодные в описанных способах, включают, но не ограничиваясь только ими, пероральный и парентеральный пути, такие как внутривенный (вв), внутрибрюшинный (вб), внутримышечный (вм), ректальный, местный, глазной, назальный и трансдермальный. Например, композиции, подходящие для инъекции, могут вводиться с помощью внутривенного, внутримышечного, внутрикожного, подкожного, подъязычного, внутрикостного или другого пути введения.
В других случаях, введение дозированной единицы субъекту включает внутривенно введение дозированной единицы субъекту. В других случаях, введение дозированной единицы субъекту включает внутримышечно введение дозированной единицы субъекту. В других случаях, введение восстановленной дозированной единицы субъекту включает внутривенно введение восстановленной дозированной единицы субъекту. В других случаях, введение восстановленной дозированной единицы субъекту включает внутримышечно введение восстановленной дозированной единицы субъекту. В определенных вариантах осуществления изобретения, способ включает введение дозированной единицы субъекту в соответствии со схемой лечения. Например, в других случаях, субъекту, подвергаемому лечению, схема лечения может быть назначена лечащим врачом. В других случаях, схема лечения включает, но не обязательно ограничиваясь только ими, введение пять раз в сутки, четыре раза в сутки, три раза в сутки, два раза в сутки, один раз в сутки, три раза в неделю, дважды в неделю, один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз в месяц, один раз каждые 5 недель, один раз каждые 6 недель, один раз каждые у 7 недель, один раз в два месяца и любая их комбинация.
В определенных вариантах осуществления, схема лечения включает введение одной или больше доз в течение длительного периода времени. В определенных случаях, субъекту вводят единичную дозу (например, единичную дозированную единицу), и после начальной дозы можно затем вводить субъекту одну или больше доз в последующее время. В других случаях, более одной дозы (например, более одной дозированной единицы) вводят субъекту, и после начальной дозы можно затем вводить субъекту одну или больше доз в последующее время. Например, единичную дозу (например, единичную дозированную единицу) можно вводить субъекту, и после единичной дозы можно вводить субъекту единичную дозу в последующее время. Дополнительные единичные дозы можно вводить в последующие моменты времени. В других случаях, субъекту можно вводить единичную дозу (например, единичную дозированную единицу), и после единичной дозы можно субъекту вводить две дозы в последующее время. Дополнительные единичные или множественные дозы можно вводить в последующие моменты времени.
В определенных случаях, схема лечения включает множественные фазы. Схема лечения может включать множественные фазы, где схема дозирования отличается в каждой фазе схемы лечения. В других случаях, субъекту назначают схему лечения с двумя фазами; фазой индукции и фазой консолидации. В определенных случаях, субъекту назначают схему лечения с двумя фазами, где схема дозирования первой фазы отличается от схемы дозирования во второй фазе. Например, субъекту может быть назначена схема лечения с двумя фазами, включая фазу индукции и фазу консолидации, где схема дозирования фазы индукции отличается от схемы дозирования фазы консолидации. В других вариантах осуществления, субъекту может быть назначена схема лечения с тремя фазами; фаза индукции, фаза консолидации, и фаза поддержания. В других случаях, субъекту назначают схему лечения с тремя фазами, включая фазу индукции, фазу консолидации, и фазу поддержания, где схема дозирования каждой фазы отличается от других фаз. Например, субъекту может быть назначена схема лечения с тремя фазами, включая фазу индукции, фазу консолидации, и фазу поддержания, где схемы дозирования фазы индукции, фазы консолидации, и фазы поддержания каждая отличается друг от друга.
В определенных вариантах осуществления изобретения, продолжительность времени лечения во время каждой фазы схемы лечения является одинаковой, или в других случаях может быть различной. Например, продолжительность времени во время фазы индукции может составлять 1 неделю или больше, например, 2 недели или больше, или 3 недели или больше, или 4 недели или больше, или 5 недель или больше, или 6 недель или больше, или 7 недель или больше, или 8 недель или больше. В других случаях, продолжительность времени во время фазы индукции составляет 4 недели. В других случаях, продолжительность времени во время фазы индукции составляет 5 недель.
В определенных вариантах осуществления изобретения, продолжительность времени во время фазы консолидации составляет 1 неделю или больше, например, 2 недели или больше, или 3 недели или больше, или 4 недели или больше, или 5 недель или больше, или 6 недель или больше, или 7 недель или больше, или 8 недель или больше, или 9 недель или больше, или 10 недель или больше, или 11 недель или больше, или 12 недель или больше, или 13 недель или больше, или 14 недель или больше, или 15 недель или больше, или 16 недель или больше, или 17 недель или больше, или 18 недель или больше, или 19 недель или больше, или 20 недель или больше, или 21 недель или больше, или 22 недель или больше, или 23 недель или больше, или 24 недель или больше, или 25 недель или больше, или 26 недель или больше, или 27 недель или больше, или 28 недель или больше, или 29 недель или больше, или 30 недель или больше, или 31 недель или больше, или 32 недель или больше. В других случаях, продолжительность времени во время фазы консолидации составляет 8 недель. В других случаях, продолжительность времени во время фазы консолидации составляет 27 недель. В других случаях, продолжительность времени во время фазы консолидации составляет 30 недель.
В определенных вариантах осуществления изобретения, продолжительность времени во время фазы поддержания составляет 1 неделю или больше, например, 2 недели или больше, или 3 недели или больше, или 4 недели или больше, или 5 недель или больше, или 6 недель или больше, или 7 недель или больше, или 8 недель или больше, или 9 недель или больше, или 10 недель или больше, или 12 недель или больше, или 16 недель или больше, или 20 недель или больше, или 24 недели или больше, или 28 недель или больше, или 32 недели или больше, или 36 недель или больше, или 40 недель или больше, или 44 недели или больше, или 48 недель или больше, или 52 недели или больше, или 56 недель или больше, или 60 недель или больше, или 64 недели или больше, или 68 недель или больше, или 72 недели или больше, или 76 недель или больше, или 80 недель или больше, или 84 недели или больше, или 88 недель или больше, или 92 недели или больше, или 96 недель или больше, или 100 недель или больше, или 104 недели или больше, или 108 недель или больше, или 112 недель или больше, или 116 недель или больше, или 120 недель или больше, или 124 недели или больше, или 128 недель или больше, или 132 недели или больше, или 136 недель или больше, или 140 недель или больше, или 144 недели или больше, или 148 недель или больше, или 152 недели или больше, или 156 недель или больше, или 160 недель или больше, или 164 недели или больше, или 168 недель или больше, или 172 недели или больше, или 176 недель или больше, или 180 недель или больше. В других случаях, продолжительность времени во время фазы поддержания составляет 8 недель. В других случаях, продолжительность времени во время фазы поддержания составляет 88 недель. В других случаях, продолжительность времени во время фазы поддержания составляет 104 недели. В других случаях, продолжительность времени во время фазы консолидации составляет 140 недель. В других случаях, продолжительность времени во время фазы поддержания составляет 156 недель. В других случаях, продолжительность времени во время фазы поддержания находится в диапазоне от 88 до 104 недель. В других случаях, продолжительность времени во время фазы поддержания находится в диапазоне от 88 до 140 недель. В других случаях, продолжительность времени во время фазы поддержания находится в диапазоне от 88 до 156 недель.
Примеры схем лечения, которые могут вводиться субъекту включают, но не ограничиваясь только ими, те, которые описаны в настоящей заявке. В определенных вариантах осуществления изобретения, схема лечения включает введение единичной дозированной единицы субъекту в фазу индукции и множественные дозированные единицы во время фазы поддержания. В определенных вариантах осуществления изобретения, схема лечения включает введение единичной дозированной единицы субъекту в фазу индукции и множественные дозированные единицы во время фазы консолидации. Например, множественные дозированные единицы могут вводиться субъекту путем введения дозированной единицы субъекту каждые 3 недели (например, во время фазы консолидации). В других случаях, единичную дозированную единицу вводят субъекту один раз каждые 3 недели. Как описано выше, фаза консолидации может составлять 30 недель, и, таким образом, суммарно 10 дозированных единиц могут вводиться субъекту (например, единичная дозированная единица может вводиться субъекту один раз каждые 3 недели в течение 30 недель). Дополнительные (или меньше) дозированные единицы могут вводиться субъекту в период между фазой индукции и фазой консолидации, или после фазы консолидации, как является желательно или как назначено лечащим врачом.
В других примерах, схема лечения может включать введение единичной дозированной единицы субъекту в фазу индукции и множественные дозированные единицы во время фазы консолидации, где множественные дозированные единицы могут вводиться субъекту путем введения дозированной единицы субъекту каждые 2 недели. В других случаях, единичную дозированную единицу вводят субъекту один раз каждые 2 недели. Как описано выше, фаза консолидации может составлять 30 недель, и, таким образом, суммарно 15 дозированных единиц могут вводиться субъекту (например, единичная дозированная единица может вводиться субъекту один раз каждые 2 недели в течение 30 недель). Дополнительные (или меньше) дозированные единицы могут вводиться субъекту в период между фазой индукции и фазой консолидации, или после фазы консолидации, как является желательно или как назначено лечащим врачом.
В других вариантах осуществления, схема лечения включает введение единичной дозированной единицы субъекту в фазу индукции, множественные дозированные единицы во время фазы консолидации, и множественные дозированные единицы во время фазы поддержания. Например, множественные дозированные единицы во время фазы консолидации могут вводиться субъекту в определенные дни вслед за инициацией фазы консолидации. В других случаях, множественные дозированные единицы во время фазы консолидации могут вводиться субъекту путем введения больше, чем одной дозированной единицы субъекту в одно и то же время. Например, множественные дозированные единицы во время фазы консолидации могут вводиться субъекту путем введения больше, чем одной дозированной единицы субъекту в определенный день вслед за инициацией фазы консолидации и больше, чем одной дозированной единицы субъекту в последующий день во время фазы консолидации. Пример этого типа схемы лечения может включать введение 2 дозированных единиц субъекту в день 15 вслед за инициацией фазы консолидации и 2 дозированных единиц в день 43 вслед за инициацией фазы консолидации. Дополнительные (или меньше) дозированные единицы могут вводиться субъекту в период между фазой индукции и фазой консолидации, или после фазы консолидации, но перед фазой поддержания, как является желательно или как назначено лечащим врачом.
В определенных вариантах осуществления изобретения, множественные дозированные единицы во время фазы поддержания могут вводиться субъекту в определенные дни вслед за инициацией фазы поддержания. В других случаях, множественные дозированные единицы во время фазы поддержания могут вводиться субъекту путем введения больше, чем одной дозированной единицы субъекту в одно и то же время. Например, множественные единицы во время фазы поддержания могут вводиться субъекту путем введения больше, чем одной дозированной единицы субъекту в определенный день вслед за инициацией фазы поддержания и больше, чем одной дозированной единицы субъекту в последующий день во время фазы поддержания. Пример этого типа схемы лечения может включать введение 2 дозированных единиц субъекту в день 2 вслед за инициацией фазы поддержания и 2 дозированных единиц в день 22 вслед за инициацией фазы поддержания. Другой пример схемы лечения во время фазы поддержания может включать введение 2 дозированных единиц субъекту в день 4 вслед за инициацией фазы поддержания и 2 дозированных единиц в день 43 вслед за инициацией фазы поддержания. В других случаях, схема лечения может включать множественные фазы поддержания. В определенных случаях, схема дозирования во время каждой фазы поддержания может быть одинаковой, или в других вариантах, схема дозирования во время каждой фазы поддержания может быть различной. Дополнительные (или меньше) дозированные единицы могут вводиться субъекту в период между фаза консолидации и фаза поддержания, или после фазы поддержания, или в период между различными фазами поддержаниями, как является желательно или как назначено лечащим врачом.
В определенных вариантах осуществления изобретения, дозированные единицы согласно настоящему раскрытию могут вводиться перед, одновременно с или после других активных агентов для лечения связанных или несвязанных состояний, например, в комбинированной терапии. Примеры таких дополнительных терапий включают лучевые терапии, хирургические терапии и химиотерапевтические терапии. Если обеспечиваются в одно и то же время в качестве других активных агентов, то дозированные единицы согласно настоящему раскрытию могут обеспечиваться в одном и том же или в различных препаратах. Например, одновременная терапия может достигаться путем введения дозированной единицы и фармацевтической композиции, имеющей по меньшей мере один другой активный агент, такой как химиотерапевтическое средство, которые в комбинации обеспечивают терапевтически эффективную дозу, в соответствии с конкретной схемой лечения. Введение отдельных фармацевтических композиций может осуществляться одновременно или в разное время (например, последовательно, в любом порядке, в тот же самый день или в разные дни), до тех пор пока, у субъекта, подвергающегося терапии, вызывается терапевтически эффективный эффект комбинации этих веществ.
Таким образом, аспекты согласно настоящему раскрытию дополнительно включают комбинированные терапии. В определенных вариантах осуществления изобретения, заявленный способ включает введение терапевтически эффективного количества одного или больше дополнительных активных агентов. Под комбинированной терапией подразумевается, что полиалкиленоксид-аспарагиназу (например, как описано в настоящей заявке) можно использовать в комбинации с другим терапевтическим средством для лечение единичного заболевания или состояния. В определенных вариантах осуществления изобретения, соединение согласно настоящему раскрытию вводят одновременно с введением другого терапевтического средства, которое может вводиться в качестве компонента композиции, включающей соединение согласно настоящему раскрытию или в качестве компонента другой композиции. В определенных вариантах осуществления, композицию, включающую соединение согласно настоящему раскрытию, вводят перед или после введения другого терапевтического средства.
Заявленные соединения можно использовать совместно с любым агентом, пригодным для лечения опухолевого состояния, таким как противораковые средства и противоопухолевые средства. Один класс представляющих интерес противораковых средств включает химиотерапевтические средства. "Химиотерапия" обозначает введение одного или больше химиотерапевтических лекарственных средств и/или других агентов пациенту со злокачественным новообразованием с помощью различных методов, включая внутривенное, пероральное, внутримышечное, внутрибрюшинное, внутрипузырное, подкожное, трансдермальное, буккальное введение или ингаляцию. Представляющие интерес агенты, которые можно применять совместно с заявленными соединениями, включают, но не ограничиваясь только ими, противораковые химиотерапевтические средства, агенты, которые действуют путем уменьшения клеточной пролиферации, антиметаболитные агенты, средства, поражающие микротрубочки, модуляторы гормонов и стероиды, природные продукты и Модификаторы биологических ответных реакций, например, как описано более подробно ниже.
Противораковые химиотерапевтические средства включают не-пептидные (то есть, не-белковоподобные) соединения, которые уменьшают пролиферацию злокачественных клеток, и охватывают цитотоксические средства и цитостатические средства. Неограничивающие примеры химиотерапевтических средств включают алкилирующие средства, нитрозомочевины, антиметаболиты, противоопухолевые антибиотики, растительные (барвинка) алкалоиды, и стероидные гормоны. Также можно использовать пептидные соединения. Подходящие противораковые химиотерапевтические средства включают доластатин и его активные аналоги и производные; и ауристатин и его активные аналоги и производные (например, Монометил ауристатин D (MMAD), монометил ауристатин Е (ММАЕ), монометил ауристатин F (MMAF), и др). См., например, WO 96/33212, WO 96/14856, и U.S. 6,323,315. Например, доластатин 10 или ауристатин РЕ может быть включен в конъюгат антитело-лекарственное средство согласно настоящему раскрытию. Подходящие противораковые химиотерапевтические средства также включают майтанзиноиды и их активные аналоги и производные (см., например, ЕР 1391213; и Liu и др. (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623); дуокармицины и их активные аналоги и производные (например, включая синтетические аналоги, KW-2189 и СВ 1-ТМ1); и бензодиазепины и их активные аналоги и производные (например, пирролобензодиазепин (PBD).
Агенты, которые действуют путем уменьшения клеточной пролиферации известны в данной области техники и широко используются. Такие агенты включают алкилирующие средства, такие как азотистые иприты, нитрозомочевины, производные этиленимина, алкилсульфонаты, и триазены, включая, но не ограничиваясь только ими, мехлорэтамин, циклофосфамид (Цитоксан™), мельфалан (L-сарколизин), кармустин (BCNU), ломустин (CCNU), семустин (метил-CCNU), стрептозоцин, хлорзотоцин, урациловый иприт, хлорметин, изосфамид, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, дакарбазин и темозоломид.
Антиметаболитные агенты включают аналоги фолиевой кислоты, пиримидиновые аналоги, пуриновые аналоги, и ингибиторы аденозиндезаминазы, включая, но не ограничиваясь только ими, цитарабин (CYTOSAR-U), цитозин арабинозид, фторурацил (5-FU), флоксуридин (FudR), 6-тиогуанин, 6-меркаптопурин (6-МР), пентостатин, 5-фторурацил (5-FU), метотрексат, 10-пропаргил-5,8-дидеазафолат (PDDF, СВ3717), 5,8-дидеазатетрагидрофолиевую кислоту (DDATHF), лейковорин, флударабин фосфат, пентостатин и гемцитабин.
Подходящие природные продукты и их производные, (например, алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины, и эпиподофиллотоксины), включают, но не ограничиваясь только ими, Ara-С, паклитаксел (Таксол®), доцетаксел (Таксотер®), дезоксикоформицин, митомицин-С, азатиоприн; бреквинар; алкалоиды, например, винкристин, винбластин, винорелбин, виндезин, и др.; подофиллотоксины, например, этопозид, тенипозид, и др.; антибиотики, например, антрациклин, даунорубицин гидрохлорид (дауномицин, рубидомицин, церубидин), идарубицин, доксорубицин, эпирубицин и морфолино производные, и др.; феноксизон бисциклопептиды, например, дактиномицин; основные гликопептиды, например, блеомицин; гликозиды антрахинона, например, пликамицин (митрамицин); антрацендионы, например, митоксантрон; азиринопирроло индолдионы, например, митомицин; макроциклические иммуносупрессанты, например, циклоспорин, FK-506 (такролимус, програф), рапамицин, и др.; и др.
Другие антипролиферативные цитотоксические средства представляют собой навельбен, СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифосамид и дролоксафине. Средства, поражающие микротрубочки, которые имеют антипролиферативную активность, также являются подходящими для применения и включают, но не ограничиваясь только ими, аллоколхицин (NSC 406042), Галихондрин В (NSC 609395), колхицин (NSC 757), производные колхицин (например, NSC 33410), долстатин (NSC 376128), майтансин (NSC 153858), ризоксин (NSC 332598), паклитаксел (Таксол®), производные Таксол®, доцетаксел (Таксотер®), тиоколхицин (NSC 361792), тритил цистерин, винбластин сульфат, винкристин сульфат, природные и синтетические эпотилоны, включая но не ограничиваясь только ими, эпотилон А, эпотилон В, дискодермолид; эстрамустин, нокодазол и др.
Модуляторы гормонов и стероиды (включая синтетические аналоги), которые являются подходящими для применения включают, но не ограничиваясь только ими, адренокортикостероиды, например, преднизон, дексаметазон, и др.; эстрогены и прегестины, например, гидроксипрогестерон капроат, медроксипрогестерон ацетат, мегестрол ацетат, эстрадиол, кломифен, тамоксифен; и др.; и препараты для подавления коры надпочечников, например, аминоглутетимид; 17α-этинилэстрадиол; диэтилстильбестрол, тестостерон, флуоксиместерон, дромостанолон пропионат, тестолактон, метилпреднизолон, метил-тестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон, аминоглутетимид, эстрамустин, медроксипрогестерон ацетат, лейпролид, флутамид (Дрогенил), Торемифен (Фарестон), и Золадекс®. Эстрогены стимулируют пролиферацию и дифференциацию; следовательно, соединения, которые связываются с рецептором эстрогена, используются для блокировки этой активности. Кортикостероиды могут ингибировать пролиферацию Т-клеток.
Другие подходящие химиотерапевтические средства включают комплексы металлов например, цисплатин (цис-DDP), карбоплатин, и др.; мочевины, например, гидроксимочевину; и гидразины, например, N-метилгидразин; эпидофиллотоксин; ингибитор топоизомеразы; прокарбазин; митоксантрон; лейковорин; тегафур; и др. Другие представляющие интерес антипролиферативные агенты включают иммуносупрессанты, например, микофеноловую кислоту, талидомид, дезоксиспергуалин, азаспорин, лефлуномид, мизорибин, азаспиран (SKF 105685); Iressa® (ZD 1839, 4-(3-хлор-4-фторфениламино)-7-метокси-6-(3-(4-морфолинил)пропокси)хиназолин); и др.
Таксаны являются подходящими для применения. "Таксаны" включают паклитаксел, а также любое активное производное таксана или пролекарство. "Паклитаксел" (который следует понимать в настоящей заявке как охватывающий аналоги, препараты и производные, такие как, например, доцетаксел, ТАКСОЛ™, ТАКСОТЕР™ (препарат доцетаксела), 10-дезацетильные аналоги паклитаксела и 3'N-дезбензоил-3'N-трет-бутоксикарбонильные аналоги паклитаксела) легко могут быть получены, используя методики, хорошо известные квалифицированным специалистам в данной области техники (см. также WO 94/07882, WO 94/07881, WO 94/07880, WO 94/07876, WO 93/23555, WO 93/10076; патент US №№5,294,637; 5,283,253; 5,279,949; 5,274,137; 5,202,448; 5,200,534; 5,229,529; и ЕР 590,267), или получены из различных коммерческих источников, включая например, Sigma Chemical Co., St. Louis, Mo. (T7402 из Taxus brevifolia; или T-1912 из Taxus yannanensis). Паклитаксел следует понимать как относящийся не только к общепринятой химически доступной форме паклитаксела, но также и к аналогам и производным (например, Таксотер™ доцетаксел, как указано выше) и конъюгатам паклитаксел (например, паклитаксел-ПЭГ, паклитаксел-декстран, или паклитаксел-ксилоза). Также термином "таксан" охватываются различные известные производные, включая как гидрофильные, так и гидрофобные производные. Производные таксана включают, но не ограничиваясь только ими, галактозные и маннозные производные, описанные в международной патентной заявке № WO 99/18113; пиперазиновые и другие производные, описанные в WO 99/14209; производные таксана, описанные в WO 99/09021, WO 98/22451, и патент US №5,869,680; 6-тио производные, описанные в WO 98/28288; сульфонамидные производные, описанные в патенте US № 5,821,263; и производное таксола, описанное в патенте US №5,415,869. Он в дальнейшем включает пролекарства паклитаксела, включая, но не ограничиваясь только ими, те соединения, которые описаны в WO 98/58927; WO 98/13059; и патент US №5,824,701.
Модификаторы биологических ответных реакций подходящие для применения включают, но не ограничиваясь только ими, (1) ингибиторы активностьи тирозинкиназа (RTK); (2) ингибиторы активности серии / треонин киназы; (3) антагонисты опухолеспецифических антигенов, такие как антитела, которые связываются специфически с опухолевым антигеном; (4) агонисты рецептора апоптоза; (5) интерлейкин-2; (6) ИФН-α; (7) ИФН-γ; (8) колониестимулирующие факторы; и (9) ингибиторы ангиогенеза.
Субъекты, которые могут подвергаться лечению с использованием способов и композиций согласно настоящему раскрытию, включают субъектов любого возраста. В других случаях, субъект может быть взрослым. Например, взрослый субъект, который является человеком, может иметь 18 лет или старше. Субъекты, которые могут подвергаться лечению с использованием способов и композиций согласно настоящему раскрытию, также включают субъектов-подростков. Например, субъект, предоставляющий собой подроста-человека, может иметь возраст меньше 18 лет. В других случаях, субъекты находятся в возрастном диапазоне от 1 месяца до 18 лет, например, от 1 года до 18 лет, включая от 2 лет до 18 лет, например, от 5 лет до 16 лет.
В других случаях, способы включают диагностирование субъекта как имеющего AML. Субъект может подвергаться диагностике для выявления наличия AML, используя любой подходящий протокол. В других случаях, французская, американская и британская (FAB) система классификации применяется для диагностики и классификации острого миелоидного лейкоза. Для постановки диагноза острого миелоидного лейкоза необходимо, что миелобласты составляли 30% (или 20% на основании недавней системы классификации Всемирной организации здравоохранении (ВОЗ) или больше клеток костного мозга или циркулирующих лейкоцитов. Гематологические свойства заболевания определяют различные подтипы, описанные ниже. FAB номенклатура (M1-М7) классифицирует подтипы острого миелоидного лейкоза в соответствии с нормальными элементами костного мозга, которые наиболее сходны с бластами. В других случаях, способы включают определения пригодности субъекта, диагностированного как имеющего AML, для лечения с использованием композиции полиалкиленоксид-аспарагиназы, например, как описано в настоящей заявке. В других случаях, способы включают мониторинг эффективности лечения. За эффективностью лечения можно наблюдать, используя любой подходящий протокол.
СПОСОБЫ ПОЛУЧЕНИЯ
Аспекты настоящей заявки включают способы получения композиций полиалкиленоксид-аспарагиназы, описанных в настоящей заявке. В определенных случаях, способ представляет собой способ получения жидкой композиции полиалкиленоксид-аспарагиназы, как описано в настоящей заявке. Способ может включать получение водной композиции, которая включает полиалкиленоксид-аспарагиназу, имеющую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой, буфер, и соль.
Варианты осуществления способов получения композиция полиалкиленоксид-аспарагиназы могут включать получение водного концентрата композиции. Например, способ получения водного концентрата композиции может включать одну или несколько стадий: приготовление раствора аспарагиназы (например, L-аспарагиназы); присоединение полиалкиленоксида (например, полиэтиленгликоля) к аспарагиназе; осветление полиалкиленоксид-аспарагиназы; фильтрование и концентрирование раствора полиалкиленоксид-аспарагиназы; разведение раствора полиалкиленоксид-аспарагиназы; фильтрование раствора полиалкиленоксид-аспарагиназы и заполнение раствора полиалкиленоксид-аспарагиназы в стерильный контейнер; и хранение раствора полиалкиленоксид-аспарагиназы.
В способ получения водного концентрата композиции, может быть приготовлен раствор аспарагиназы (например, L-аспарагиназы). Аспарагиназа может быть смешана с раствором, таким как водный раствор (например, буферный водный раствор). Примеры подходящих буферов включают, но не ограничиваясь только ими, фосфатный буфер, фосфатно-солевой буферный раствор (PBS), фосфатно-солевой буферный раствор Дульбекко (DPBS), сбалансированный солевой раствор Хэнка (HBSS), сбалансированный солевой раствор Эрла (EBSS), Трис буфер, буферный раствор Рингера с лактатом, боратный буфер, и др., и их комбинации. В других случаях, аспарагиназа смешана с фосфатным буфером.
Фосфатный буфер может включать двухосновный фосфат натрия и одноосновный фосфат натрия. В других случаях, количество двухосновного фосфата натрия в водном концентрате композиции находится в диапазоне от 0,05 до 5 мас. %, например, 0,1-4,5 мас. %, или 0,1-4 мас. %, или 0,1-3,5 мас. %, или 0,1-3 мас. %, или 0,1-2,5 мас. %, или 0,1-2 мас. %, или 0,1-1 мас. %, или 0,1-0,9 мас. %, или 0,1-0,8 мас. %, или 0,1-0,7 мас. %, или 0,1-0,6 мас. %, или 0,2-0,6 мас. %, или 0,3-0,6 мас. %, или 0,4-0,6 мас. %, или 0,5-0,6 мас. %. Например, двухосновный фосфат натрия может присутствовать в водном концентрате композиции в количестве в интервале от 0,1 до 1 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,2 до 0,8 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,3 до 0,6 мас. %. В определенных случаях, двухосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,5 до 0,6 мас. %. Например, двухосновный фосфат натрия может присутствовать в композиции в количестве приблизительно 0,6 мас. %, например, 0,56 мас. % (или 0,558 мас. %). В определенных вариантах осуществления изобретения, количество одноосновного фосфата натрия в водном концентрате композиции в диапазоне 0,005-2 мас. %, например, 0,01-1,8 мас. %, или 0,01-1,6 мас. %, или 0,01-1,4 мас. %, или 0,01-1,2 мас. %, или 0,01-1,0 мас. %, или 0,01-0,8 мас. %, или 0,01-0,6 мас. %, или от 0,01 до 0,4 мас. %, или 0,01-0,2 мас. %, или 0,02-0,18 мас. %, или 0,03-0,16 мас. %, или 0,04-0,16 мас. %, или 0,045-0,15 мас. %, или 0,04-0,14 мас. %, или 0,05-0,14 мас. %, или 0,1-0,2 мас. %, или от 0,1-0,15 мас. %. Например, одноосновный фосфат натрия может присутствовать в водном концентрате композиции в количестве в интервале от 0,05 до 0,2 мас. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,01 до 0,2 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,09 до 0,15 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 0,2 мас. %. В определенных случаях, одноосновный фосфат натрия может присутствовать в композиции в количестве в интервале от 0,1 до 0,15 мас. %. Например, одноосновный фосфат натрия может присутствовать в композиции в количестве 0,12 мас. % (или 0,129 мас. %).
Дополнительные компоненты, которые могут быть включены в водный концентрат композиции, включают соль. Примеры подходящих солей включают, но не ограничиваясь только ими, хлорид натрия, хлорид калия, хлорид кальция, хлорид магния, и др., и их комбинации. В определенных случаях, соль представляет собой хлорид натрия.
В других случаях, количество соли (например, хлорида натрия) в водном концентрате композиции находится в диапазоне от 0,05 до 5 мас. %, например, от 0,05 до 4 мас. %, или от 0,05 до 3 мас. %, или от 0,05 до 2 мас. %, или от 0,1 до 5 мас. %, или 0,1-4 мас. %, или 0,1-3 мас. %, или 0,1-2 мас. %, или 0,1-1,5 мас. %, или 0,1-1 мас. %, или от 0,2 до 1 мас. %, или от 0,3 до 1 мас. %, или от 0,4 до 1 мас. %, или от 0,5 до 1 мас. %, или от 0,6 до 1 мас. %, или от 0,7 до 1 мас. %, или от 0,8 до 1 мас. %, или 0,8 до 0,9 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,5 до 1 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,2 до 2 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,7 до 1 мас. %. В определенных случаях, соль (например, хлорид натрия) может присутствовать в композиции в количестве в интервале от 0,8 до 0,9 мас. %. Например, соль (например, хлорид натрия) может присутствовать в композиции в количестве 0,85 мас. %.
Другие аспекты настоящей заявки включают способы получения лиофилизированных стабильных при хранении композиций, описанных в настоящей заявке. В определенных случаях, способ представляет собой способ приготовления лиофилизированной композиции полиалкиленоксид-аспарагиназы, как описано в настоящей заявке. Способ может включать лиофилизацию водной композиции, которая включает полиалкиленоксид-аспарагиназу, имеющую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой, буфер, соль, и сахар образом, достаточным для получения лиофилизированной стабильной при хранении композиция полиалкиленоксид-аспарагиназы.
В определенных вариантах осуществления изобретения, лиофилизацию используют для дегидратирования водного концентрата композиции. В других случаях, лиофилизация включает удаления воды из водного концентрата композиции. Вода может быть удалена путем сублимации воды в композиции. Например, вода в композиции может подвергаться фазовому переходу из твердого состояния в газообразное. В определенных случаях, лиофилизация включает замораживание композиции (например, замораживание воды в композиции) и затем уменьшение давления, окружающего к композицию, таким образом, что вода в композиции подвергается сублимации. Во время лиофилизации, температура композиции может быть уменьшена, например, до температуры ниже точки замерзания воды в композиции. Например, температура композиции может быть уменьшена до 0°С или меньше, или -5°С или меньше, или -10°С или меньше, или -15°С или меньше, или -20°С или меньше, или -25°С или меньше, или -30°С или меньше, или -35°С или меньше, или -40°С или меньше, или -45°С или меньше, или -50°С или меньше, или -55°С или меньше, или -60°С или меньше, или -65°С или меньше, или -75°С или меньше. В других случаях, температуру композиции уменьшают до -45°С. В других случаях, температуру композиции уменьшают до -30°с.
В определенных вариантах осуществления изобретения, давление, окружающее композицию, уменьшено ниже стандартного атмосферного давления. Например, давление, окружающее композицию, может быть уменьшено до 500 Т или меньше, например, 250 Т или меньше, или 100 Т или меньше, или 50 Т или меньше, или 10 Т или меньше, или 1 Т или меньше, или 500 мТорр или меньше, или 400 мТорр или меньше, или 300 мТорр или меньше, или 200 мТорр или меньше, или 100 мТорр или меньше, или 90 мТорр или меньше, или 80 мТорр или меньше, или 70 мТорр или меньше, или 60 мТорр или меньше, или 50 мТорр или меньше, или 40 мТорр или меньше, или 30 мТорр или меньше, или 20 мТорр или меньше, или 10 мТорр или меньше. В других случаях, давление, окружающее композицию, уменьшают до 60 мТорр или меньше, например, 50 мТорр.
В определенных вариантах осуществления, лиофилизация также может включать повышение температуры композиции в то время как давление, окружающее композицию, уменьшают. Например, температура композиции может быть повышена от минимальной температуру, как описано выше, до температуры, большей за минимальную температуру. В других случаях, температуру повышают для облегчения сублимации воды в композиции при уменьшенном окружающем давлении.
Варианты осуществления способа получения лиофилизированной композиции полиалкиленоксид-аспарагиназы также могут включать получение водного концентрата композиции, который впоследствии лиофилизируют. Схема технологического процесса способа получения водного концентрата композиции представлена на Фиг. 1. Как показано на Фиг. 1, способ получения водного концентрата композиции могут включать одну или несколько стадий: приготовление раствора аспарагиназы (например, L-аспарагиназы) (10); присоединение полиалкиленоксида (например, полиэтиленгликоля) к аспарагиназе (20); осветление полиалкиленоксид-аспарагиназа (30); фильтрование и концентрирование раствора полиалкиленоксид-аспарагиназы (40); разведение раствора полиалкиленоксид-аспарагиназы (50); фильтрование раствора полиалкиленоксид-аспарагиназы и заполнение раствора полиалкиленоксид-аспарагиназы в стерильный контейнер (60); и хранение раствора полиалкиленоксид-аспарагиназы (70).
В способе получения водного концентрата композиции, может быть приготовлен раствор аспарагиназы (например, L-аспарагиназы). Аспарагиназа может быть смешана с раствором, таким как водный раствор (например, буферный водный раствор). Примеры подходящих буферов включают, но не ограничиваясь только ими, фосфатный буфер, фосфатно-солевой буферный раствор (PBS), фосфатно-солевой буферный раствор Дульбекко (DPBS), сбалансированный солевой раствор Хэнка (HBSS), сбалансированный солевой раствор Эрла (EBSS), Трис буфер, буферный раствор Рингера с лактатом, боратный буфер, и др., и их комбинации. В других случаях, аспарагиназа смешана с фосфатным буфером.
В определенных вариантах осуществления, фосфатный буфер может включать двухосновный фосфат натрия и одноосновный фосфат натрия. В других случаях, количество двухосновного фосфата натрия в водном концентрате композиции находится в диапазоне от 0,05 до 1 мас. %, например, 0,1 до 0,9 мас. %, или от 0,1 до 0,8 мас. %, или от 0,1 до 0,7 мас. %, или от 0,1 до 0,6 мас. %, или от 0,1 до 0,5 мас. %, или от 0,1 до 0,4 мас. %, или 0,2 до 0,4 мас. %, или 0,2 до 0,3 мас. %, или 0,25 до 0,3 мас. %. Например, двухосновный натрия фосфат может присутствовать в водном концентрате композиции в количестве в интервале от 0,1 до 0,5 мас. %. В определенных вариантах осуществления изобретения, количество одноосновного фосфата натрия в водном концентрате композиции находится в диапазоне от 0,005 до 1 мас. %, например, от 0,01 до 0,9 мас. %, или от 0,01 до 0,8 мас. %, или от 0,01 до 0,7 мас. %, или от 0,01 до 0,6 мас. %, или от 0,01 до 0,5 мас. %, или от 0,01 до 0,4 мас. %, или от 0,01 до 0,3 мас. %, или от 0,01 до 0,2 мас. %, или от 0,01 до 0,1 мас. %, или 0,02 до 0,09 мас. %, или 0,03 до 0,08 мас. %, или 0,04 до 0,08 мас. %, или 0,045 до 0,075 мас. %, или 0,04 до 0,07 мас. %, или 0,05 до 0,07 мас. %. Например, одноосновный фосфат натрия может присутствовать в водном концентрате композиции в количестве в интервале от 0,01 до 0,1 мас.
Дополнительные компоненты, которые могут быть включены в водный концентрат композиции, включают соль. Примеры подходящих солей включают, но не ограничиваясь только ими, хлорид натрия, хлорид калия, хлорид кальция, хлорид магния, и др., и их комбинации. В определенных случаях, соль представляет собой хлорид натрия.
В других случаях, количество соли (например, хлорида натрия) в водном концентрате композиции находится в диапазоне от 0,05 до 1 мас. %, например, 0,1 до 0,9 мас. %, или от 0,1 до 0,8 мас. %, или от 0,1 до 0,7 мас. %, или от 0,1 до 0,6 мас. %, или от 0,1 до 0,5 мас. %, или 0,2 до 0,5 мас. %, или 0,3 до 0,5 мас. %, или 0,4 до 0,5 мас. %, или 0,4 до 0,45 мас. %. Например, соль (например, хлорид натрия) может присутствовать в водном концентрате композиции в количестве в интервале от 0,1 до 1 мас. %.
Другой компонент, который может быть включен в водный концентрат композиции, представляет собой сахар. Примеры подходящих сахаров включают, но не ограничиваясь только ими, сахарозу, маннит, мальтозу, трегалозу, 2-гидроксипропил-бета-циклодекстрин (β-HPCD), лактозу, глюкозу, фруктозу, галактозу, глюкозамин, и др., и их комбинации. В определенных случаях, сахар представляет собой дисахарид. Например, дисахарид может представлять собой сахарозу.
В других случаях, количество сахара (например, сахарозы) в водном концентрате композиции находится в диапазоне 0,1-25 мас. %, например, 0,5-20 мас. %, или 1-15 мас. %, или 1-10 мас. %, или 1-9 мас. %, или 1-8 мас. %, или 2-7 мас. %, или 2-6 мас. %, или 3-5 мас. %, или 4-5 мас. %. Например, сахар (например, сахароза) может присутствовать в водном концентрате композиции в количестве в интервале от 1 до 10 мас. %.
После приготовления раствора аспарагиназы, аспарагиназа может быть присоединена к полиалкиленоксиду (например, полиэтиленгликолю), таким образом, что полиалкиленоксид ковалентно связывается с аспарагиназой с получением конъюгата полиалкиленоксид-аспарагиназа. После приготовления полиалкиленоксид-аспарагиназы, раствор может подвергаться осветлению. В некоторых случаях, осветление включает фильтрование раствора через фильтр для удаления взвешенных частиц из раствора. При осуществлении стадии фильтрации можно получать по существу очищенный полиалкиленоксид-аспарагиназу.
В других случаях, отфильтрованный раствор полиалкиленоксид-аспарагиназы впоследствии подвергают стадии диафильтрации и концентрации. Раствор полиалкиленоксид-аспарагиназы может быть диафильтрован, используя ультрафильтрационную мембрану и может быть получен образованный концентрат полиалкиленоксид-аспарагиназы. Концентрат со стадии диафильтрации затем может быть разведен таким образом, что раствор содержит желательную концентрацию полиалкиленоксид-аспарагиназы. Подходящие буферы, пригодные для стадии разведения, включают те, которые описаны выше. В других случаях, фосфатный буфер используют для разведения раствора полиалкиленоксид-аспарагиназы, таким образом получая водный концентрат композиции. Например, концентрат со стадии диафильтрации может быть разведен таким образом, что полученный водный концентрат композиции включает количество полиалкиленоксид-аспарагиназы, имеющей эффективность (активность)) в интервале от 100 до 5000 МЕ/мл, например, от 500 до 4500 МЕ/мл, или от 500 до 4000 МЕ/мл, или от 500 до 3500 МЕ/мл, или от 500 до 3000 МЕ/мл, или 1000 до 3,000 МЕ/мл, или от 1500 до 3000 МЕ/мл. В определенных случаях, водный концентрат композиции включает полиалкиленоксид-аспарагиназа в количестве в интервале от 1500 до 3000 МЕ/мл. В других случаях, количество полиалкиленоксид-аспарагиназы в водном концентрате композиции больше, чем количество полиалкиленоксид-аспарагиназы в восстановленной лиофилизированной композиции, описанной в настоящей заявке. В других случаях, при диафильтрации получают по существу очищенную полиалкиленоксид-аспарагиназу.
Затем водный концентрат композиции может быть профильтрован и заполнен в стерильный контейнер. Примеры подходящих контейнерных материалов для контейнера включают полимеры, такие как, но не ограничиваясь только ими, полипропилен, полиметилпентен, политетрафторэтилен (PTFE), перфтор этиловые эфиры (PFE), фторированный этилен пропилен (FEP), перфторалкокси алканы (PFA), полиэтилен терефталат (PET), полиэтилен (РЕ), полиэфирэфиркетон (PEEK), полистирол, и др. Например, контейнер может представлять собой стерильную полимерную сумку. Водный концентрат композиции можно хранить в контейнере в течение периода времени, и можно переработать в лиофилизированную стабильную при хранении композицию согласно настоящему раскрытию.
Варианты осуществления способа могут дополнительно включают отгрузку водного концентрата композиции в удаленное местоположение. "Удаленное местоположение," представляет собой местоположение, отличающееся от местоположения, в котором получают водный концентрат композиции. Например, удаленное местоположение может представлять собой другое местоположение (например, офис, лабораторию и др.) в том же самом городе, другое местоположение в другом городе, другое местоположение в другом штате, другое местоположение в другой стране, и др. В связи с этим, если указано, что одно изделие "удалено" от другого, то это обозначает, что два изделия могут находиться в одной и той же комнате, но раздельно, или по меньшей мере в различных комнатах или различных строениях, и могут быть на расстоянии друг от друга по меньшей мере одна миля, десять миль или сто миль или больше.
В определенных вариантах осуществления изобретения, как описано выше, способ включает лиофилизацию водного концентрата композиции образом, достаточным для получения лиофилизированной стабильной при хранении композиция полиалкиленоксид-аспарагиназы. В других случаях, лиофилизация может осуществляться в контейнере с единичной дозой. Лиофилизация водного концентрата композиции с получением лиофилизированной стабильной при хранении композицит полиалкиленоксид-аспарагиназы в контейнере с единичной дозой может облегчать получение лиофилизированной композиции в контейнере с единичной дозой, например, путем элиминации необходимости лиофилизации водного концентрата композиции в отдельном контейнере и затем переноса лиофилизированной композиции из отдельного контейнера в контейнер с единичной дозой. В связи с этим, в определенных вариантах осуществления, способ включает введение водного концентрата композиции в контейнер с единичной дозой и лиофилизацию водного концентрата композиции в контейнере с единичной дозой. Как описано выше, контейнер с единичной дозой может представлять собой флакон, такой как стеклянный флакон.
После лиофилизация, способ дополнительно может включать запечатывание лиофилизированной композиции в контейнере с единичной дозой. Например, можно применять уплотнение или крышку к открытому контейнеру с единичной дозой, таим образом запечатывая контейнер с единичной дозой. Запечатанные контейнеры могут храниться в течение длительного периода времени, такого как 1 неделя или больше, или 2 недели или больше, или 3 недели или больше, или 1 месяц или больше, или 2 месяца или больше, или 3 месяца или больше, или 4 месяца или больше, или 6 месяцев или больше, или 9 месяцев или больше, или 1 год или больше, или 1,5 года (например, 18 месяцев) или больше, или 2 года или больше, или 2,5 года (например, 30 месяцев) или больше, или 3 года или больше, или 3,5 года (например, 42 месяцев) или больше, или 4 года или больше, или 4,5 года (например, 54 месяцев) или больше, или 5 года или больше. Например, длительный период времени может составлять 6 месяцев или больше. В других случаях, запечатанные контейнеры могут храниться в течение 9 месяцев или больше. В других случаях, запечатанные контейнеры могут храниться в течение 1 годв (например, 12 месяцев) или больше. В других случаях, запечатанные контейнеры могут храниться в течение 1,5 года (например, 18 месяцев) или больше. В других случаях, запечатанные контейнеры могут храниться в течение 2 лет (например, 24 месяцев) или больше.
НАБОРЫ
Также обеспечиваются наборы для применения при практическом осуществлении заявленных способов, где наборы могут включать одну или больше из вышеописанных жидких и/или лиофилизированных композиций. Например, набор может включать контейнер с единичной дозой, который содержит жидкую композицию, как описано в настоящей заявке. Или, например, набор может включать контейнер с единичной дозой, который содержит лиофилизированную композицию, как описано в настоящей заявке. В других случаях, набор включает два или больше контейнеров с единичными дозами, каждый содержащий жидкую композицию, как описано в настоящей заявке. В других случаях, набор включает два или больше контейнера с единичными дозами, каждый содержащий лиофилизированную композицию, как описано в настоящей заявке. В некоторых случаях, набор включает два или больше контейнеров с единичными дозами, где один или больше контейнеров с единичными дозами содержит жидкую композицию, как описано в настоящей заявке и один или больше контейнеров с единичными дозами содержит лиофилизированная композиция, как описано в настоящей заявке. В определенных вариантах осуществления изобретения, набор включает упаковку, сконфигурированную так, что содержать контейнер(ы) с единичной дозой. Упаковка может представлять собой герметизирующую упаковку, такую как стерильную герметизирующую упаковку. Стерильная упаковка может быт сконфигурирована таким образом, чтобы герметично закрывать от внешней среды, так, чтобы внутри упаковки по существу не было микроорганизмов (таких как грибы, бактерии, вирусы, споровые формы и др.). В других случаях, упаковку герметично запечатывают, например, упаковку, устойчивую к водяному пару, необязательно под водонепроницаемым уплотнением и/или вакуумным уплотнением.
В определенных вариантах осуществления изобретения, набор включает буфер. Например, набор может включать жидкость для разбавления, например, буфер для разбавления, который может быть пригодным для введения субъекту, и др. Набор может дополнительно включать другие компоненты, например, устройства для применения лекарственного средства, жидкие источники и др., которые могут найти применение при практическом осуществлении заявленных способов. Различные компоненты в наборах могут быть упакованы, если это является желательным, например, совместно или раздельно. Компоненты заявленных наборов могут присутствовать в отдельных контейнерах, или несколько компонентов могут присутствовать в одном контейнере, где контейнеры и/или упаковки (или их часть) набора могут быть стерильными, если это является желательным.
Дополнительно к вышеописанным компонентам, заявленные наборы могут также включать инструкции по применению компонентов набора для практического осуществления заявленных способов. Инструкции по практическом применению заявленных способов обычно записывают на подходящий носитель информации. Например, инструкции могут быть напечатаны, например, на бумаге или пластике и др. В связи с этим, инструкции могут присутствовать в наборах в виде листка-вкладыша, при нанесении этикеток на контейнера набора или его компоненты (то есть, ассоциированы у упаковкой или субупаковкой) и др. В других вариантах осуществления, инструкции представлены в виде электронного файла хранения данных, представленном на подходящем считываемым компьютером носителе информации, например, портативном флэш-накопителе, CD-ROM, DVD-ROM, Blu-ray, и др. В еще других вариантах осуществления, действующие инструкции не находятся в наборе, но обеспечиваются указания для получения инструкций из удаленного источника, например, через интернет. Примером такого варианта осуществления является набор, который включает веб-адрес, инструкции можно просмотреть и/или с которого инструкции можно скачать. Как и в случае с инструкциями, этот вариант для получения инструкций записан на подходящем носителе.
Полезность
Заявленные композиции (например, жидкие или лиофилизированные стабильные при хранении композиции) и способы находят применения при показаниях, при которых существует потребность лечить субъекта от заболевания или состояния, которые поддаются лечению путем введения полиалкиленоксид-аспарагиназы. Например, заявленные композиции (например, жидкие или лиофилизированные стабильные при хранении композиции) и способы находят применения для лечения опухолевого состояния у субъекта. В других случаях, заявленные композиции (например, жидкие или лиофилизированные стабильные при хранении композиции) и способы находят применения для лечения злокачественного новообразования у субъекта. Примеры типов злокачественных новообразований, которые поддаются лечению с применением заявленных композиций (например, жидких или лиофилизированных стабильных при хранении композиции) и способов, включают, но не ограничиваясь только ими, лейкоз, такой как острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), и др. Таким образом, заявленные лиофилизированные стабильные при хранении композиции и способы находят применения для обеспечения терапевтически эффективного лечения опухолевых состояний, таких как злокачественное новообразование, включая, но не ограничиваясь только ими, лейкоз, такой как острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), и др.
Лиофилизированные стабильные при хранении композиции и способы согласно настоящему раскрытию находят применения для лечения субъектов любого возраста. В других случаях, заявленные композиции (например, жидкие или лиофилизированные стабильные при хранении композиции) и способы находят применения для лечения взрослого. Например, взрослый субъект-человек может иметь возраст 18 лет или старше. В других случаях, композиции (например, жидкие или лиофилизированные стабильные при хранении композиции) и способы находят применения для лечения подростка. Например, подросток субъект-человек может иметь возраст меньше 18 лет.
Композиции и способы согласно настоящему раскрытию находят применения для показаний, где является желательной стабильная при хранении композиция. Например, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной (например, существенно не разлагается и/или сохраняет по существу всю свою активность) в течение длительного периода времени. Например, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной в течение длительного периода времени, например, 1 неделя или больше, или 2 недели или больше, или 3 недели или больше, или 1 месяц или больше, или 2 месяца или больше, или 3 месяца или больше, или 4 месяца или больше, или 6 месяцев или больше, или 9 месяцев или больше, или 1 год или больше, или 1,5 года (например, 18 месяцев) или больше, или 2 года или больше, или 2,5 года (например, 30 месяцев) или больше, или 3 года или больше, или 3,5 года (например, 42 месяцев) или больше, или 4 года или больше, или 4,5 лет (например, 54 месяцев) или больше, или 5 лет или больше. В других случаях, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной в течение 9 месяцев или больше. В других случаях, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной в течение 1 год (например, 12 месяцев) или больше. В других случаях, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной в течение 1,5 лет (например, 18 месяцев) или больше. В других случаях, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, которая является стабильной в течение 2 лет (например, 24 месяцев) или больше. В определенных вариантах осуществления изобретения, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, что повышает срок хранения композиции вплоть до 1 недели, или 2 недель, или 3 недель, или 1 месяца, или 2 месяцев, или 3 месяцев, или 4 месяцев, или 6 месяцев, или 9 месяцев, или 1 года, или 1,5 лет (например, 18 месяцев), или 2 лет, или 2,5 лет (например, 30 месяцев), или 3 лет, или 3,5 лет (например, 42 месяцев), или 4 лет или больше, или 4,5 лет (например, 54 месяцев), или 5 лет. В определенных вариантах осуществления изобретения, композиции и способы согласно настоящему раскрытию находят применения для обеспечения стабильной при хранении композиции, что повышает срок хранения композиции на срок от 1 месяца до 5 лет, или от 6 месяцев до 4 лет, или от 9 месяцев до 3 лет, или от 1 года до 2 лет.
В определенных вариантах осуществления изобретения, дозы согласно настоящему раскрытию могут вводиться перед, одновременно с или после другой одной или нескольких терапий другого опухолевого состояния для лечения связанных или несвязанных состояний. Если обеспечиваются в одно и то же время в качестве терапий другого опухолевого состояния, то дозы согласно настоящему раскрытию могут обеспечиваться в одном и том же или в другом препарате. Например, одновременную терапию можно осуществлять путем введения дозы и фармацевтической композиции, имеющей по меньшей мере одно другое активной средство, такое как химиотерапевтическое средство, что в комбинации обеспечивает терапевтически эффективную дозу, в соответствии с конкретной схемой лечения. Введение отдельных фармацевтических композиций или лечений можно осуществлять одновременно или в различное время (например, последовательно, в любом порядке, в тот же день, или в другие дни), до тех пор, пока комбинация этих веществ вызывает у субъекта, подвергаемого терапии, терапевтически эффективный эффект. Таким образом, способы и композиции согласно настоящему раскрытию находят применения для лечения субъекта с применением комбинированной терапии, которая включает введение полиалкиленоксид-аспарагиназы согласно настоящему раскрытию в комбинации с одним или несколькими дополнительными активными агентами и/или терапиями (например, облучением, химиотерапией, иммунотерапией и др.).
Как можно оценить из раскрытия, представленного выше, варианты осуществления настоящего раскрытия имеют большее разнообразие применений. Таким образом, примеры, представленные в настоящей заявке, предназначены для иллюстрации и не предназначены для толкования в качестве ограничения вариантов осуществления настоящего раскрытия каким бы то ни было образом. Квалифицированный специалист в данной области техники легко определит разнообразные некритические параметры, которые могут быть изменены или модифицированы для получения по существу сходных результатов. Таким образом, следующие примеры предложены таким образом, чтобы обеспечить квалифицированному специалисту в данной области техники с полным раскрытием и описанием, как осуществить и применить варианты осуществления настоящего раскрытия, и не предназначены как для ограничения объема, которые изобретатели рассматривают как их изобретение, и также они не предназначены для того, чтобы представлять, что эксперименты, представленные ниже, представляют собой все или только осуществленные эксперименты. Могут быть осуществлены действия для обеспечения точности по отношению к используемым числовым величинам (например, количествам, температурам, и др.), но следует принимать во внимание некоторые экспериментальные погрешности и отклонения. Если специально не указано иначе, части представляют собой весовые части, молекулярный вес представляет собой средневесовой молекулярный вес, температура представлена в градусах Цельсия, и давления представляет собой атмосферное давление или близкое к атмосферному давлению.
Следующие примеры предназначены только для иллюстрации, и не предназначены никоим образом для ограничения объема вариантов осуществления настоящего раскрытия. Могут быть осуществлены действия для обеспечения точности по отношению к используемым числовым величинам (например, количествам, температурам, и др.), но, несомненно, следует принимать во внимание некоторые экспериментальные погрешности и отклонения.
Примеры
Пример 1
Концентрированную нерасфасованную композицию, которая включала полиэтиленгликоль-аспарагиназу, имеющий СС-ПЭГ линкер, получали в соответствии со следующим протоколом. После получения концентрированной нерасфасованной композиции, получали лиофилизированную композицию из концентрированной нерасфасованной композиции в соответствии с протоколом, описанным ниже. На Фиг. 1 представлена схема технологического процесса для способа получения лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки.
Приготовление раствора L-Аспарагиназы
Рассчитывали количество L-аспарагиназы, необходимое для обработки, взвешивали в лабораторном стакане из нержавеющей стали объемом 6 л, и смешивали в течение 5-10 минут. Рассчитывали количество фосфатного буфера, необходимое для разведения L-аспарагиназы для получения целевой концентрация 5 мг/мл, и взвешивали. После этого L-аспарагиназу добавляли к фосфатному буферу и смешивали в сосуде высокого давления из нержавеющей стали объемом 7 галлонов в течение 10-15 минут. Образцы отбирали и подвергали тестированию для определения концентрации белка и удельной активности.
ПЭГилирование
Рассчитывали количество СС-ПЭГ, необходимое для этой стадии, и взвешивали. Сосуд высокого давления из нержавеющей стали объемом 7 галлонов, содержащий разведенный раствор L-аспарагиназы, нагревали до 29-31°С при легком перемешивании. Как только раствор L-аспарагиназы достигал подходящего температурного диапазона, скорость мешалки повышали, и запускали титровальный насос. Как только значение рН доводили до 7,7-7,9 с помощью 0,5 н. NaOH, то добавляли СС-ПЭГ в сосуд высокого давления из нержавеющей стали объемом 7 галлонов. Через 30 минут, титрационный насос останавливали и температурную рубашку отсоединяли.
Осветление
После этого обработанный материал фильтровали через фильтр 0,45 мкм (Millipore, Billerica, Massachusetts) в другой сосуд высокого давления из нержавеющей стали объемом 7 галлонов, используя диафильтрационный пульсирующий насос. После осветления, добавляли фосфатный буфер в исходный сосуд высокого давления из нержавеющей стали объемом 7 галлонов и прокачивали через фильтр 0,45 мкм в сосуд высокого давления из нержавеющей стали объемом 7 галлонов в качестве ополаскивания.
Диафильтрация/Концентрация
Рассчитывали количество PBS, необходимое для 15Х диафильтрации, и приготавливали диафильтрационную систему. Сосуд высокого давления из нержавеющей стали объемом 7 галлонов помещали на весы. Диафильтрационную систему Millipore Pellicon®-2 оборудовали мембранами с номинальными пределами молекулярного веса 100000 Да, которую предварительно обрабатывали, используя диафильтрационный пульсирующий насос и 5 л PBS. После этого устанавливали систему регулирования уровня, включая буфер пульсирующий насос, и сосуд высокого давления из нержавеющей стали объемом 7 галлонов помещали на верх весов. Систему Pellicon®-2 заполняли полиэтиленгликоль-аспарагиназой для кондиционирования и рециркулировали в течение 5 минут.
После кондиционирования, открывали пермеатную спускную трубу и начинали диафильтрацию. Через 15 и 30 минут, образец получали из пермеатной спускной трубы во флакон и подвергали тестированию для определения активности и содержания белка. Материал, предназначенный для лиофилизации, диафильтировали, затем концентрировали до 18,0 мг/мл или больше и активности 1850 МЕ/мл или больше. После завершения диафильтрации, доводили объем материала, находящегося в процессе обработки в сосуде высокого давления из нержавеющей стали объемом 7 галлонов, до целевой концентрации (18,0 мг/мл или больше для приготовления лиофилизированного препарата) путем удаления подходящего количества пермеата. Затем через систему прокачивали PBS в сосуд высокого давления из нержавеющей стали объемом 7 галлонов в качестве ополаскивания.
Осуществляли исследования контроля качества продукта после диафильтрации, включая определение состава примесей продукта. Пермеатную фермент-ферментативную активность (ЕЕА) измеряли через 15 минут и 30 минут, чтобы убедиться в том, что продукт удерживание на диафильтрационной мембране. Свободный ПЭГ и N-Гидроксисукцинимид (NHS) были компонентами состава примесей, связанных с обработкой, измеренных в конечном продукте. Формальные контроли в ходе технологического процесса для типовой операции диафильтрации представлены в Таблице 1 ниже.
Данные NHS и свободного ПЭГ, полученные для этих трех композиций лекарственного вещества (например, концентрированных нерасфасованных композиций лекарственного вещества), предназначенных для лиофилизации, представлены в Таблице 2 ниже. Полученные данные свидетельствуют о том, небольшие изменения процесса диафильтрации/концентрации не оказывают влияния на качество продукта.


* значения вычитали от тестирования образцов после диафильтрации /предварительного разведения
Разведение
Материал, находящийся в процессе обработки, смешивали в сосуде высокого давления из нержавеющей стали объемом 7 галлонов, перед отбиранием образцов для тестирования активности и содержания белка. После этого объем материала, находящегося в процессе обработки, разводили PBS для доведения концентрации белка до целевого значения ≥18,0 мг/мл (цель 20,0 мг/мл), (≥1850 МЕ/мл активности) для лекарственного вещества, предназначенного для лиофилизированной композиции. После этого разведенный материал, находящийся в процессе обработки, смешивали перед отбиранием образцов для тестирования контроля качества (см. Таблицу 1).
Стерильная фильтрация
Концентрированный раствор для лиофилизации фильтровали через 0,2 мкм в однократные стерильные мешки объемом 20 для хранения до осуществления лиофилизации. Образец собирали и проводили тест на стерильность. Ннерасфасованную композицию лекарственного вещества, которая включает полиэтиленгликоль-аспарагиназу для лиофилизации, можно выдерживать в мешках объемом 20 л при 2-8°С вплоть до 2 месяцев перед лиофилизацией.
Закрытие контейнера
Нерасфасованную композицию лекарственного вещества, которая включала полиэтиленгликоль-аспарагиназу для лиофилизации, перерабатывали в лиофилизированную композицию после стадии фильтрации 0,2 мкм и расфасовки в одноразовые предварительно простерилизованные биопроцессируемые мешки объемом 20 л. Материал конструкции мешка включал слои полиэтилена низкой плотности (LDPE), линейного полиэтилена низкой плотности (LLDPE), нейлона и этиленвиниловго спирта (EVOH). Поверхностью для прямого контакта с продуктом (внутренний слой) являлся LDPE. Каждый мешок имел два отверстия с присоединенными трубками, которые фиксировались к мешку и обжимали плотно заклепками до тех, пока не была готовность к приему нерасфасованной композиции лекарственного вещества, которая включала полиэтиленгликоль-аспарагиназу для лиофилизации. Мешки облучали и высвобождали после экспозиции 25-40 кГр, и подвергали тестированию эндотоксина лизата амебоцитов мечехвоста (LAL), 100% визуальной герметичности и просачивания воздуха, а также 100% визуального контроля после сборки. Результаты квалификационных тестирований показали, что внутренний слой мешка проходит тесты биологической реакционной способности, включая тестирование USP <88> класс IV пластмассы, USP <87> тестирование цитотоксичности, и USP <661> тестирование физико-химических качеств. Дополнительно, мешки соответствуют USP <788> относительно взвешенных частиц в препаратах для инъекций и все тестирования экстрагируемых веществ согласуются с требованиями производителя.
Время удержания стабильности лекарственного вещества
За концентрированным нерасфасованным материалом лекарственного вещества наблюдали через 0, 2, 4, 6, 8, и 1225 недель при 2-8°С. Образцы стабильности поддерживали в мешках для образцов объемом 250 мл с поверхностью контакта с продуктом из полиэтилена. Данные плана проведения тестирований представлены в Таблице 3 для Партии 1, Таблице 4 для Партии 2, и Таблице 5 для Партии 3.
Данные стабильности для концентрированного нерасфасованного лекарственного вещества, предназначенного для лиофилизированных композиций, соответствуют критериям приемлемости в течение 12 недель плана проведения тестирований и указывают на то, что приемлемым является время удержания 2 месяца между получением концентрированного нерасфасованного лекарственного вещества и получением лиофилизированной композиции.

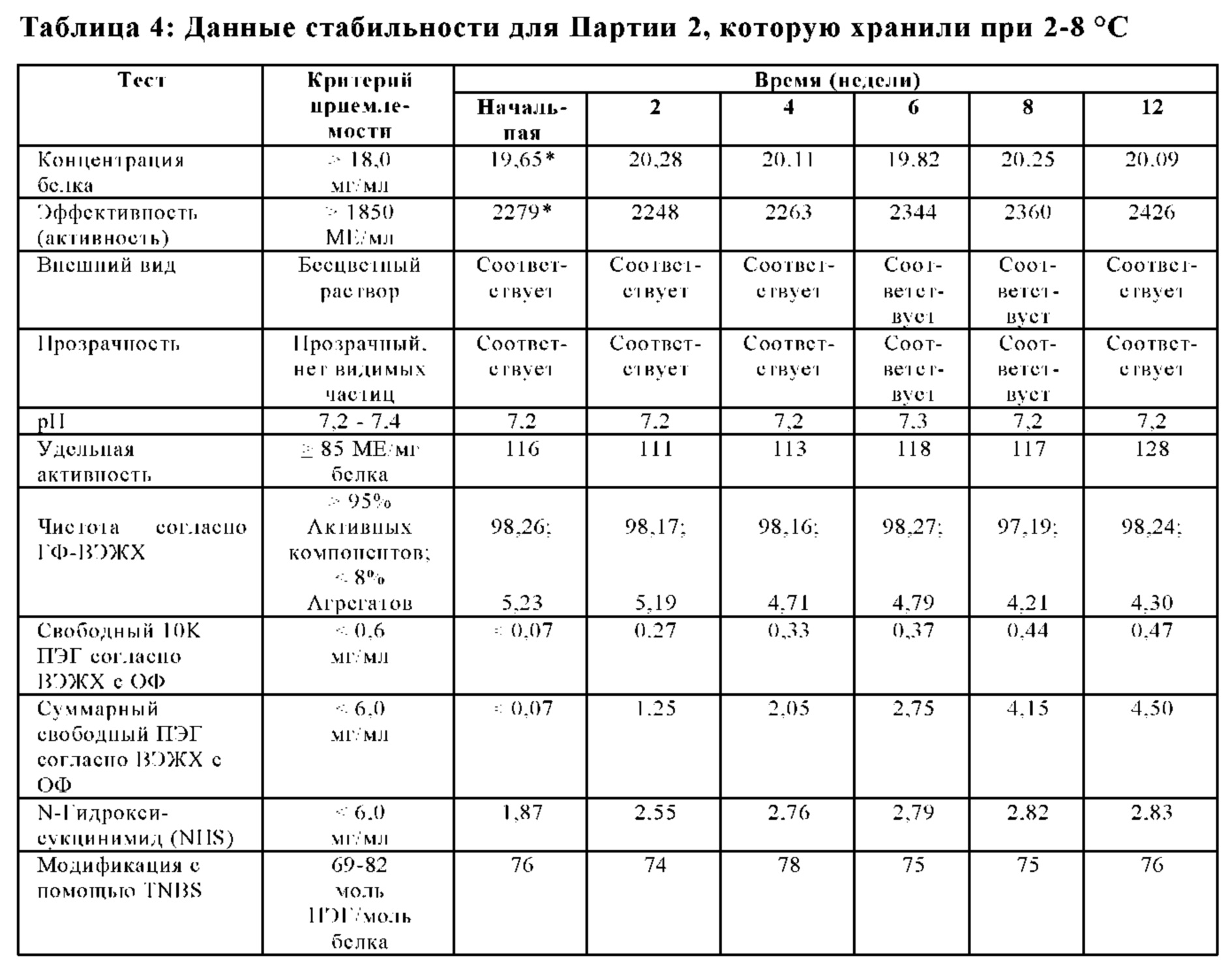
* значения вычитали от тестирования образцов после диафильтрации /предварительного разведения

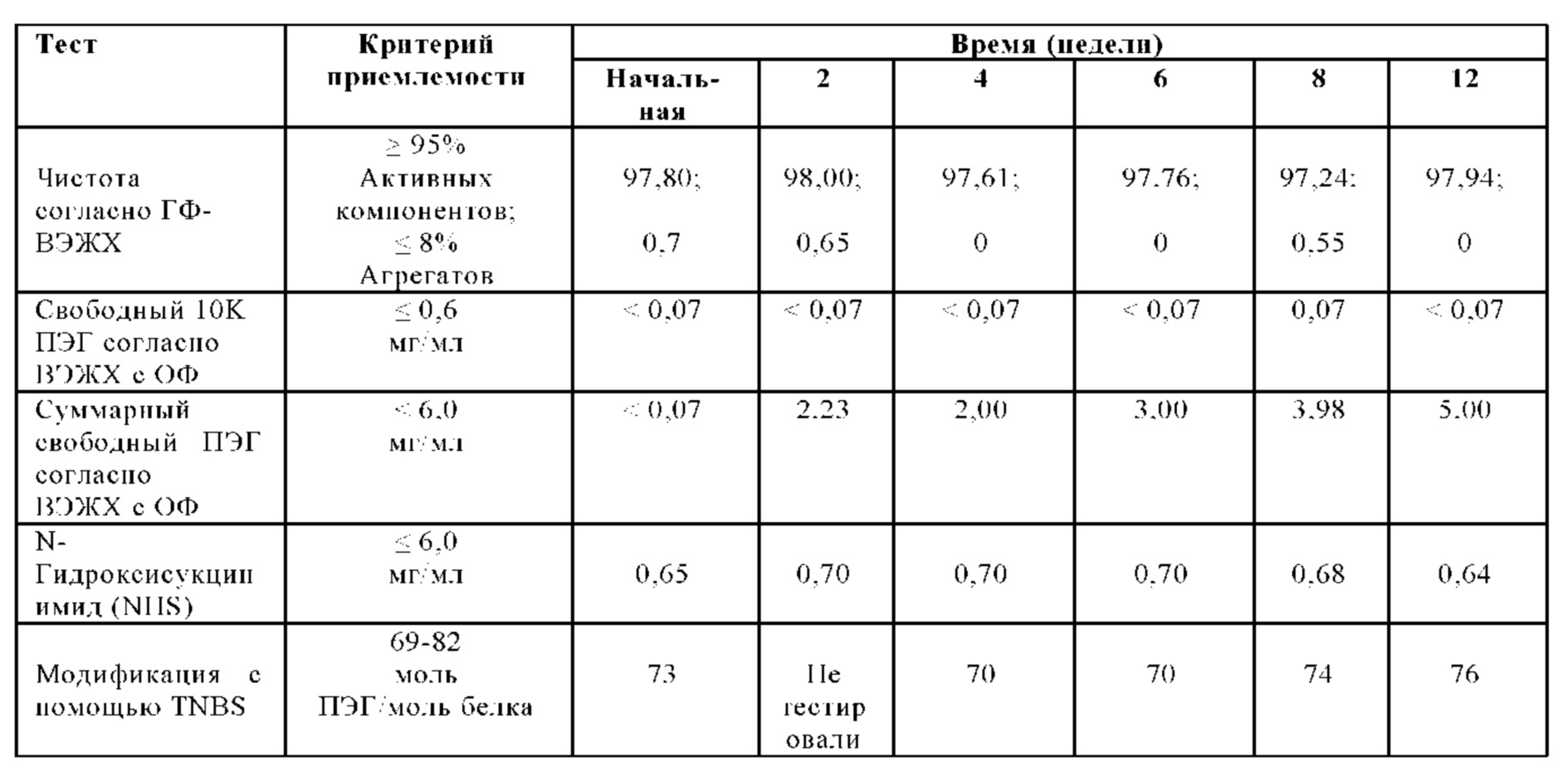
Лиофилизированная композиция
Порошок лиофилизированной композиции для инъекций получали во флаконе для одноразового применения, содержащем 3,750 ME активной ПЭГилированной L-аспарагиназы (750 МЕ/мл после восстановления с 5,2 мл ВДИ). Компоненты лиофилизированной композиции включали 4,5% сахарозу, двухосновный фосфат натрия, одноосновный фосфат натрия, и хлорид натрия после восстановления. Состав лиофилизированной композиции представлен в Таблице 6. Дополнительно, лиофилизированная композиция обеспечивалась в обработанных стеклянных флаконах-контейнерах (Nipro тип 1), имеющих алюминиевый предохранительный колпачок 20 мм.

* значения представлены после восстановления с ВДИ
Разработка препарата лиофилизированной полиэтиленгликоль-аспарагиназы
Задачей разработки лиофилизированного препарата полиэтиленгликоль-аспарагиназы было достижение стабильной лиофилизированной композиции, которая является подходящей для хранения при 2-8°С или 25°С в течение по меньшей мере 18 месяцев.
Осуществляли начальные эксперименты для оценки целесообразности лиофилизированной композиции полиэтиленгликоля-аспарагиназы. Исследовали пять вариантов лиофилизированных композиций. Каждый препарат содержал ~5 мг/мл полиэтиленгликоля-аспарагиназы в 50 мМ фосфатном буфере, рН 6,5 и 5% мас./об. одного из пяти различных криопротекторов (маннит, мальтоза, сахароза, трегалоза, и/или β-HPCD). Дополнительно, полиэтиленгликоль-аспарагиназу без криопротектора также подвергали лиофилизации. Эти шесть лиофилизированных композиций сравнивали с партией полиэтиленгликоль-аспарагиназы в жидком препарате (Oncaspar®), который использовали для приготовления этих различных препаратов. Способ определения чистоты гель-проникающей хроматографии (ГФ-ВЭЖХ) использовали для оценки качества композиции полиэтиленгликоль-аспарагиназы. Результаты исследования представлены в Таблице 7. Как можно увидеть из Таблицы 7, было обнаружено, что сахароза является наиболее эффективной для сохранения чистота полиэтиленгликоль-аспарагиназы при лиофилизации. Чистота (83,0%) лиофилизированной композиции с 5% сахарозой была сопоставима с чистотой (83,8%) жидкого препарата полиэтиленгликоль-аспарагиназы, который использовали для приготовления шести препаратов для последующей лиофилизации.

1 Все препараты также содержали ~5 мл Oncaspar в 5 мМ фосфатном буфере, рН 6,5
2 предполагаемое время удерживания Oncaspar
Несколько различных наполнителей (например, сахароза, трегалоза, маннит, Полисорбат 80) оценивали в качестве потенциальных стабилизирующих агентов для включения в лиофилизированную композицию. Осуществляли четыре эксперимента, каждый включал четыре различные композиции. Приготавливали небольшие опытные лабораторные лиофилизированной полиэтиленгликоль-аспарагиназы с различными наполнителями и оценивали их стабильность. Перечень препаратов, которые тестировали, представлен в Таблице 8.

Все партии, описанные в Таблица 8, оценивали в тестах стабильности при 5°С, 25°С и 40°С, и оценивали с помощью панели тестов (Активность, Удельная активность, Белок, рН, Чистота (ГФ-ВЭЖХ), Агрегаты (ГФ-ВЭЖХ), и Взвешенные частицы), в которых определяли характеристики первичного качества полиэтиленгликоль-аспарагиназы при высвобождении и относительно стабильности. На основании этих анализов данных стабильности, собранных от 16 различных препаратов, описанных в Таблица 8, сахароза была идентифицирована как подходящий криопротектор (например, стабилизирующий агент).
Различные концентрации сахарозы тестировали для оценки концентрации, подходящей как наиболее надежная (то есть, менее влияющая на протокол лиофилизации) и более стабильна в продукте. Приготавливали дополнительные опытные партии, содержащие различные концентрации сахарозы, как обобщено в Таблице 9. Концентрации сахарозы и ПЭГ-аспарагиназы, представленные в Таблице 9, указывают количества, присутствующие в концентрированном нерасфасованном лекарственном веществе. Во время процесса лиофилизации, флаконы заполняли на 2,5 мл перед инициацией лиофилизации. Эти лиофилизированные флаконы восстанавливали с помощью 5,0 мл, что приводило к получению конечных концентраций сахарозы и ПЭГ-аспарагиназы, которые составляют приблизительно половину от тех концентраций, которые представлены в таблице. В этом исследовании было показано, что повышение содержание сахара предоставляет возможность более высоких температур лиофилизации, что является менее стрессовым для лиофилизированного продукта, а также уменьшает суммарное время цикла лиофилизации и приводит к обезвоженному (более стабильному) лиофилизированному продукту.
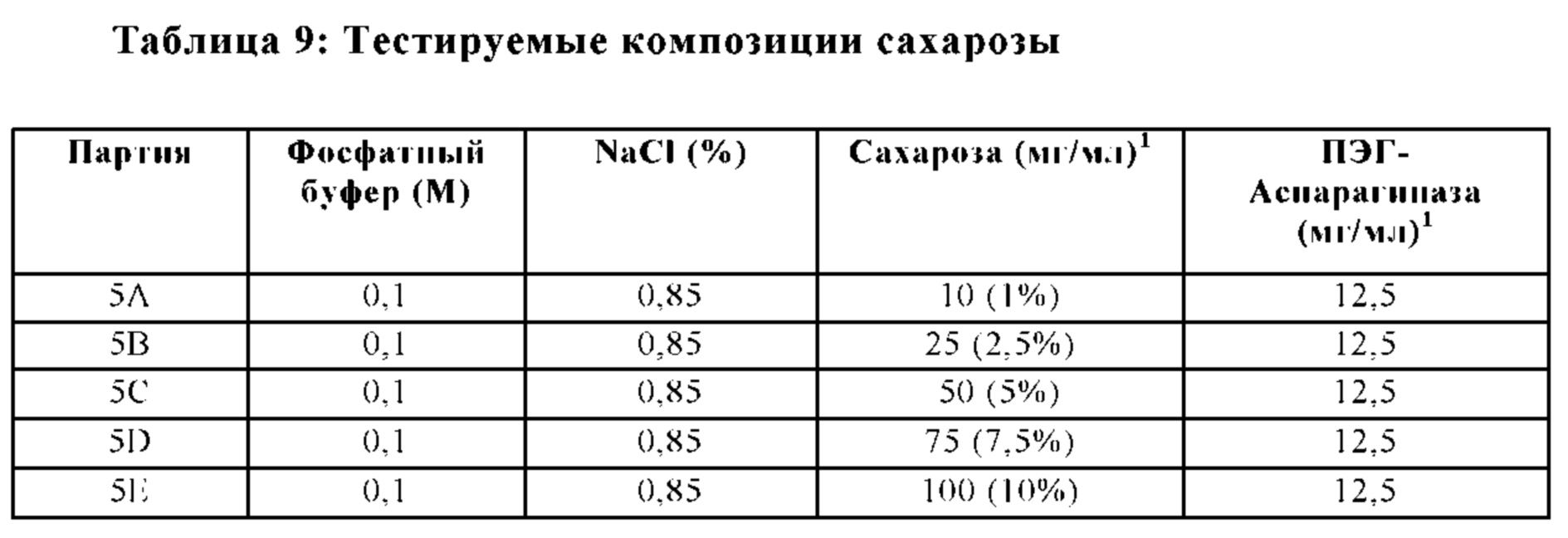
1 Концентрация во время лиофилизации в 2,5 мл/флакон. Концентрацию снижали на половину после восстановления конечного продукта с 5 мл/флакон ВДИ.
Пять партий, описанных в Таблица 9, также оценивали в тестах стабильности при 5°С, 25°С и 40°С. Анализировали качественные характеристики, такие как активность, удельная активность, белок, рН, чистота (ГФ-ВЭЖХ), агрегаты (ГФ-ВЭЖХ), и взвешенные частицы во время этого исследования стабильности. Результаты исследования чистоты и активности при исследовании «ускоренного старения» (25°С) и стресса (40°С) для этих партий представлены на фигурах 2-5. Эти данные стабильности указывают на то, что препарат, содержащий 10% сахарозу (5% сахароза после восстановления конечного продукта с 5 мл/флакон ВДИ), обеспечивает продукт с наилучшей стабильностью по отношению к чистоте и активности. На другие качественные характеристики различные препараты оказывали меньшей влияние, а также были стабильными в партии с 10% сахарозой. На Фиг. 2 представлен график чистоты (%) относительно времени (недели) при 40°С для лиофилизированных композиций ПЭГ-аспарагиназы из партий 5А, 5В, 5С, 5D, 5Е и 1А. На Фиг. 3 представлен график эффективности (МЕ/мл) относительно времени (недели) при 40°С для лиофилизированных композиций ПЭГ-аспарагиназа из партий 5С, 5D, 5Е и 1А. На Фиг. 4 представлен график чистоты (%) относительно времени (недели) при 25°С для лиофилизированных композиций ПЭГ-аспарагиназы из партий 5А, 5В, 5С, 5D, 5Е и 1А На Фиг. 5 представлен график эффективности (МЕ/мл) относительно времени (недели) при 25°С для лиофилизированных композиций ПЭГ-аспарагиназы из партий 5С, 5D, 5Е и 1А
Лиофилизация
Приготавливали буфер, который включает воду для инъекций (ВДИ), двухосновный фосфат натрия, одноосновный фосфат натрия, хлорид натрия, и сахароза. Буфер использовали для разведения концентрированного нерасфасованного лекарственного вещества.
ВДИ добавляли в химический стакан при 90% целевого веса, необходимого для получения буферного раствора. Затем индивидуально взвешивали фосфат натрия одноосновный, фосфат натрия двухосновный, и хлорид натрия и добавляли к ВДИ и смешивали до растворения. Взвешивали необходимое количество сахарозы и добавляли к смеси буферного раствора и смешивали до растворения. После этого измеряли значение рН раствора и доводили до 7,3±0,1 путем медленного добавления NaOH. ВДИ добавляли к буферному раствору при необходимости, и плотность концентрированного нерасфасованного раствора использовали для взвешивания требуемого объема концентрированного нерасфасованного раствора, необходимого для размера партии. Образец буфера отбирали для исследования сахарозы. Концентрированный нерасфасованный раствор добавляли к буферному раствору и конечный раствор смешивали в течение не менее (NLT) 10 минут. После завершения смешивания, получали подтверждающие измерения рН (7,3±0,1) сверху, посередине и с дна сосуда, и образцы отбирали для испытания в процесс производства белка, плотности, сахарозы, и пре-фильтрационной бионагрузки.
После приготовления раствора конечного препарата его подвергали стерильной фильтрации. Предварительно простерилизованные фильтрационные трубопроводы помещали во флакон с приготовленным нерасфасованным препаратом и затем нерасфасованный препарат фильтровали через два фильтра 0,22 мкм, расположенным на фильтровальные трубопроводах в предварительно простерилизованный биопроцессируемый мешок объемом 10 л для подготовки к заполнению. После того, как весь продукт был перенесен в биопроцессируемый мешок объемом 10 л, фильтрационные трубопроводы отсоединяли от биопроцессируемого мешка и фильтры тестировали относительно их целостности. Один 20 мл образец перед лиофилизацией отбирали перед фильтром (нефильтрованный) и тестировали для определения конечной спецификации лекарственного продукта.
Потоковая диаграмма, иллюстрирующая конечный препарат и стадию способа стерильной фильтрации, представлена на Фиг. 6.
Асептическое заполнение и лиофилизация
После завершения стерильной фильтрации, биомешок объемом 10 л, содержащий нерасфасованный API раствор, присоединяли к заполняющему трубопроводу и затем флаконы с продуктом заполняли при целевом весе наполнения 2,5 г/флакон и частично закрывали, используя Flexicon FMB210 уплотнитель. За весами наполнения наблюдали путем осуществления минимум одной проверки веса (1 флакон) для каждого заполняемого поддона (производственный предел: 2,43-2,57 г, предел предупреждения: 2,38-2,62 г) во время операции заполнения. После завершения операции заполнения, тестировали 20 флаконов перед лиофилизацией и все оставшиеся заполненные флаконы переносили в поддоны для лиофилизации из нержавеющей стали и затем загружали в предварительно охлажденную систему для сушки вымораживанием (5°С) 270 фут2 Hull для лиофилизации. Процесс лиофилизации включает фазы, представленные в Таблице 10.

После завершения цикла лиофилизации, откачивающую камеру снова заполняли газообразным азотом и флаконы полностью закрывали. Потоковая диаграмма, иллюстрирующая стадии процесса асептического заполнения и лиофилизации, представлена на Фиг. 7. После этого полностью закрытие флаконы упаковывали в картон (90 флаконов/картон) и затем хранили и/или отгружали.
Спецификации лиофилизированной композиции
Спецификации продуктов для лиофилизированной композиции представлены в Таблице 11.

Анализ партий
Анализ партий для партий продукта лиофилизированной композиции представлены в Таблице 12 ниже. Результаты для всех трех партий представлены в пределах спецификаций высвобождения.

Исследования стабильности
Партии 1, 2, и 3 лиофилизированного лекарственного продукта помещали в для поведения тестов долгосрочной стабильности (2-8°С) и ускоренного старения (25±3°С; 60%±5% ОВ). Эти партии также помещали в тест стабильности при тепловом стрессе (40±2°С; 75%±5% ОВ) для оценки профиля разложения продукта, индуцированного нагреванием.
Долгосрочная стабильность (2-8°С)
Данные стабильности, полученные для партий лиофилизированного лекарственного продукта, которые хранили в длительных условиях (2-8°С), представлены в Таблицах 13-16. Данные долгосрочной стабильности указывают на то, что лиофилизированный лекарственный продукт, который хранили при 5±3°С, сохраняется хорошо в пределах критерия приемлемости для всех временных точек стабильности. Данные содержания воды (КФ) находятся в диапазоне 0,96%-1,35% (спецификация = NMT 3,0%) при условиях хранения при 2-8°С в течение 12 недель. В отличие от коммерчески доступного жидкого лекарственного продукта, который демонстрирует повышение активности и снижение чистоты в динамике, этой тенденции не наблюдается для лиофилизированных композиций. Графики стабильности для чистоты (Фиг. 8) и активности (Фиг. 9), а также агрегатов (Фиг. 10), при 2-8°С, представлены на сопровождающих фигурах.
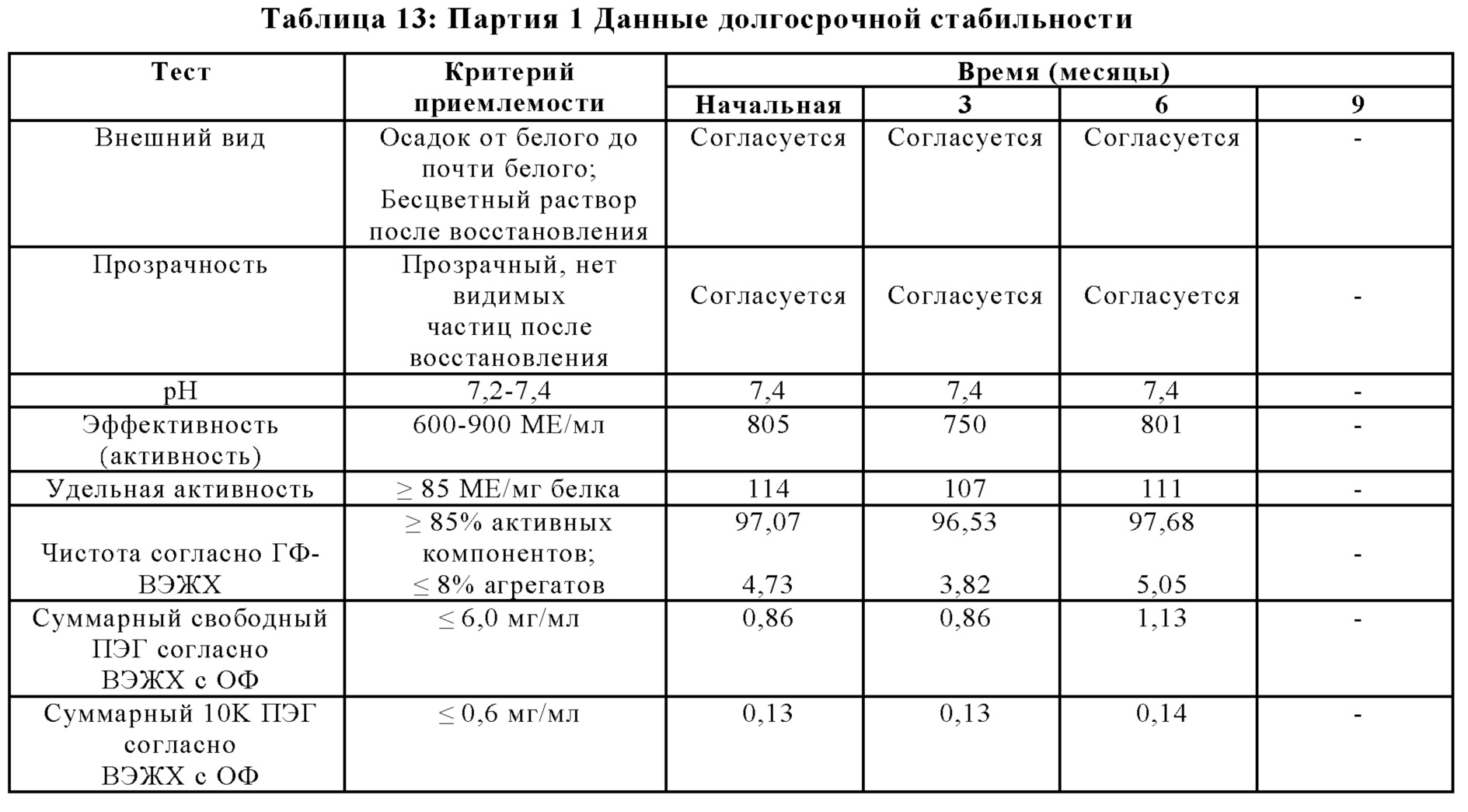
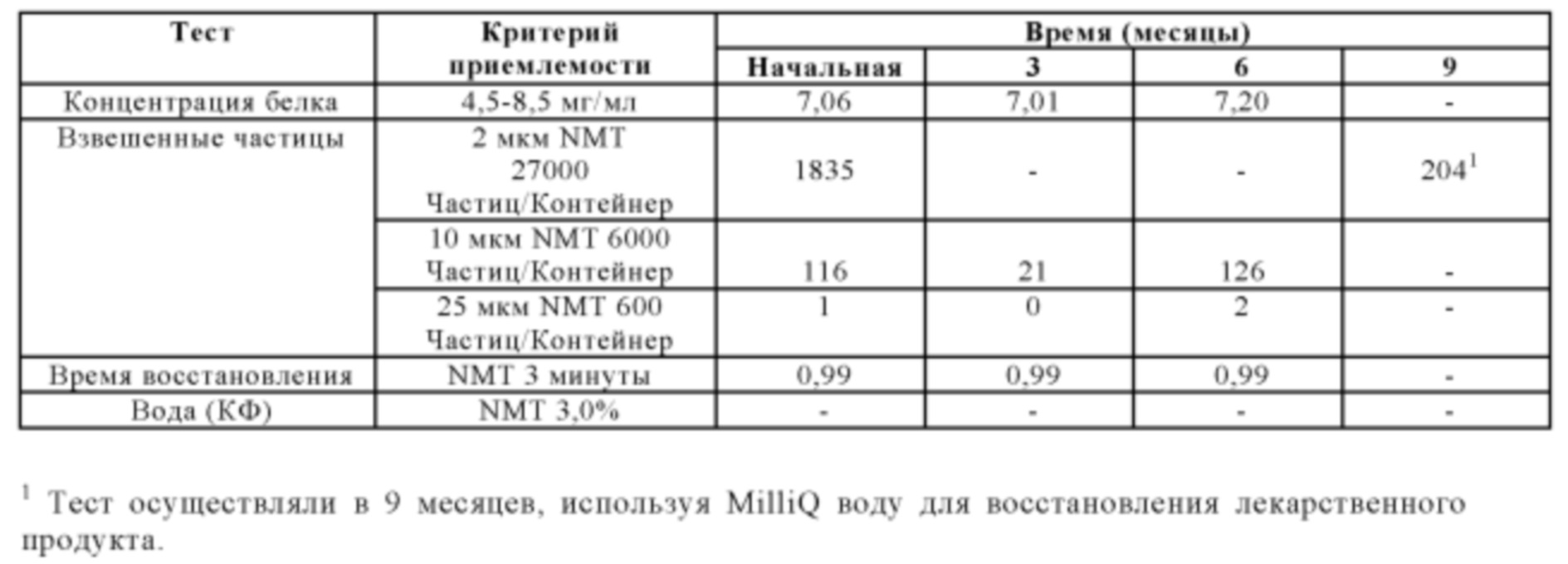
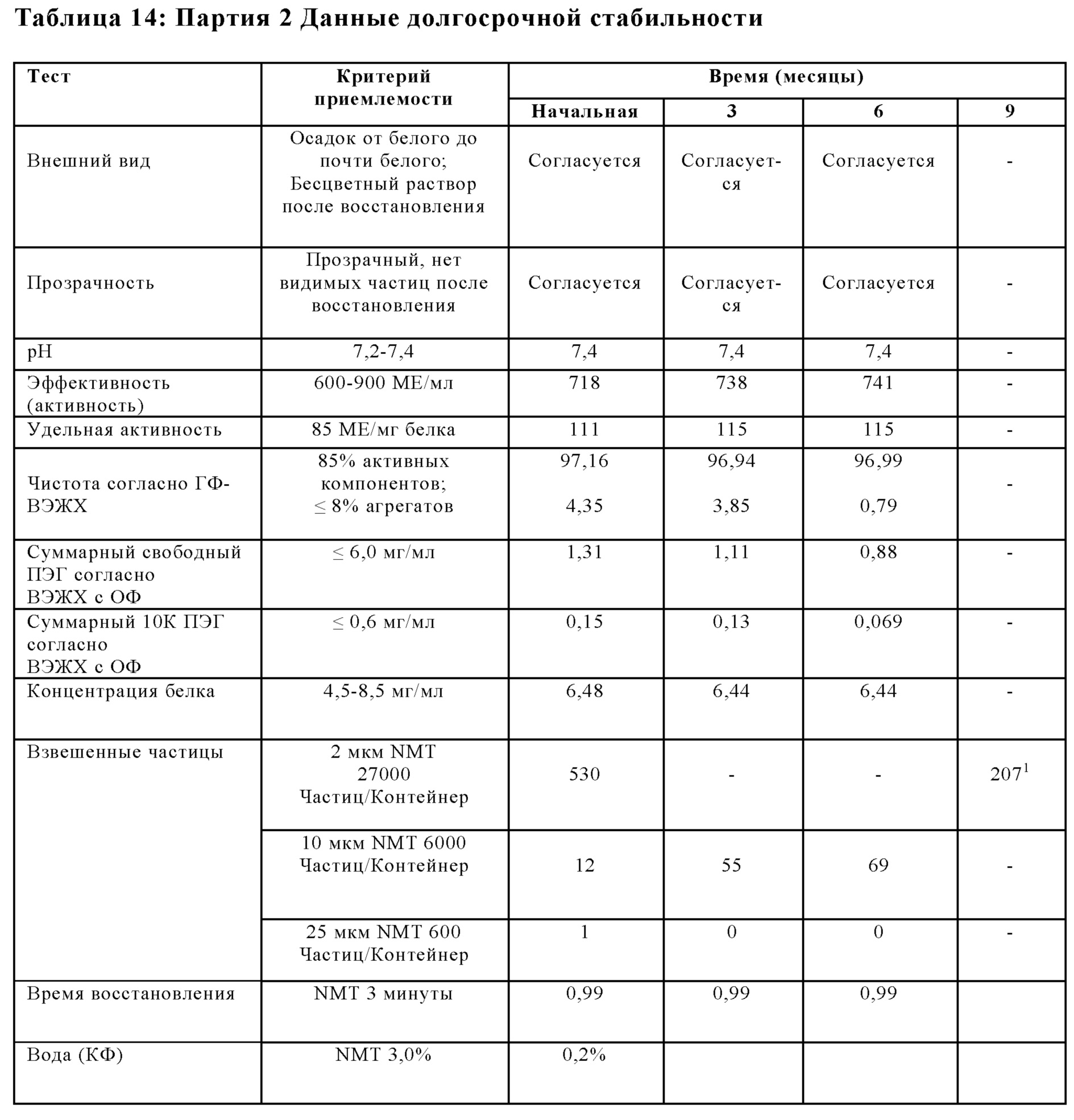



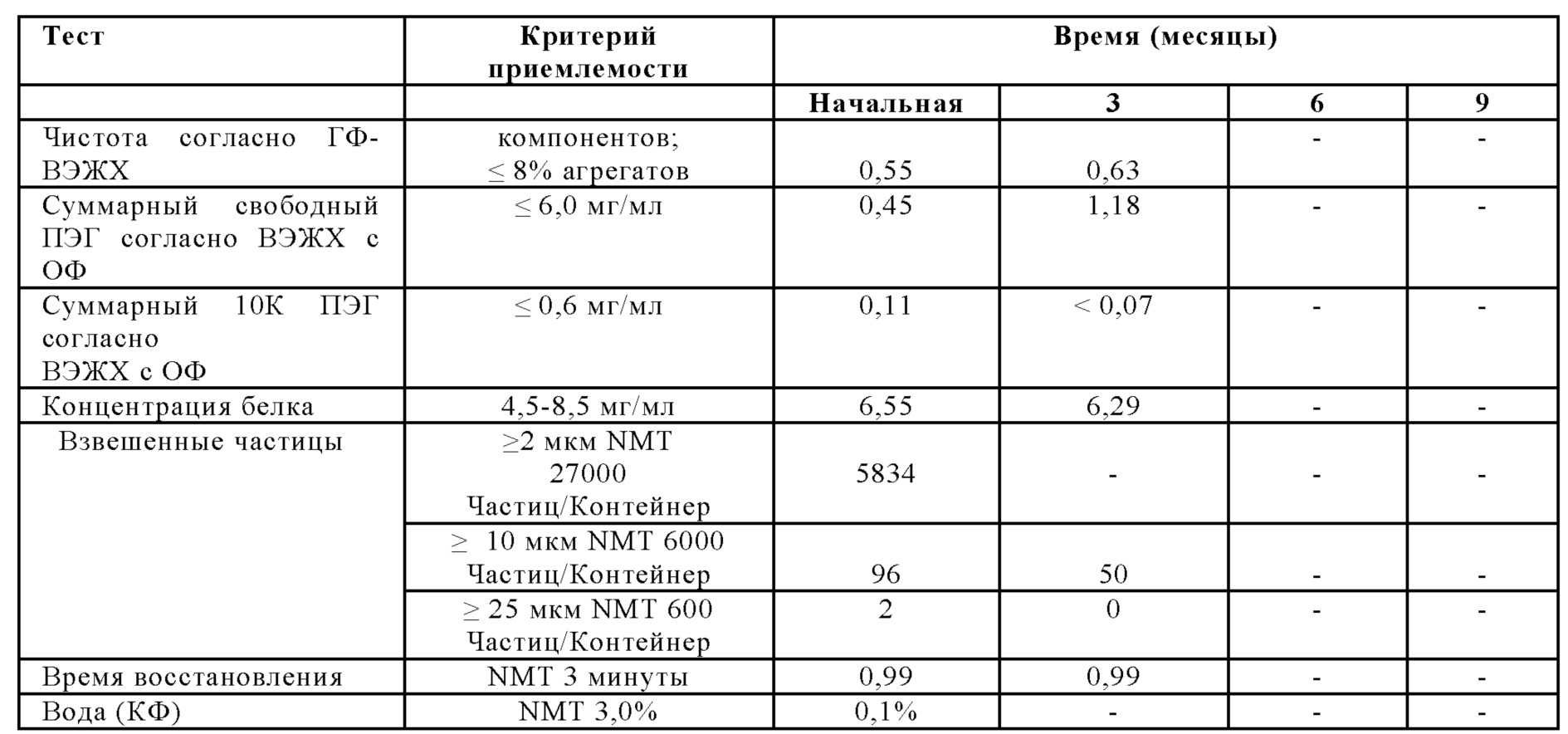
Ускоренное старение (25±3°С; 60%±5% ОВ)
Данные стабильности для партий лиофилизированного лекарственного продукта, которые хранили в условиях ускоренного старения (25±3°С; 60%±5% ОВ), представлены в Таблицах 17-20. Данные стабильности указывают на то, что лиофилизированный лекарственный продукт, который хранили в условиях «ускоренного старения, сохраняется хорошо в пределах критерия приемлемости для всех временных точек стабильности. Содержание воды (КФ) находится в диапазоне 1,12%-1,23% (спецификация = NMT 3,0%) при условиях хранения при 25°С в течение 4 недель. Графики стабильности для качественных характеристик чистоты (Фиг. 11) и активности (Фиг. 12), а также агрегатов (Фиг. 13), при 25±3°С представлены на сопровождающих фигурах.

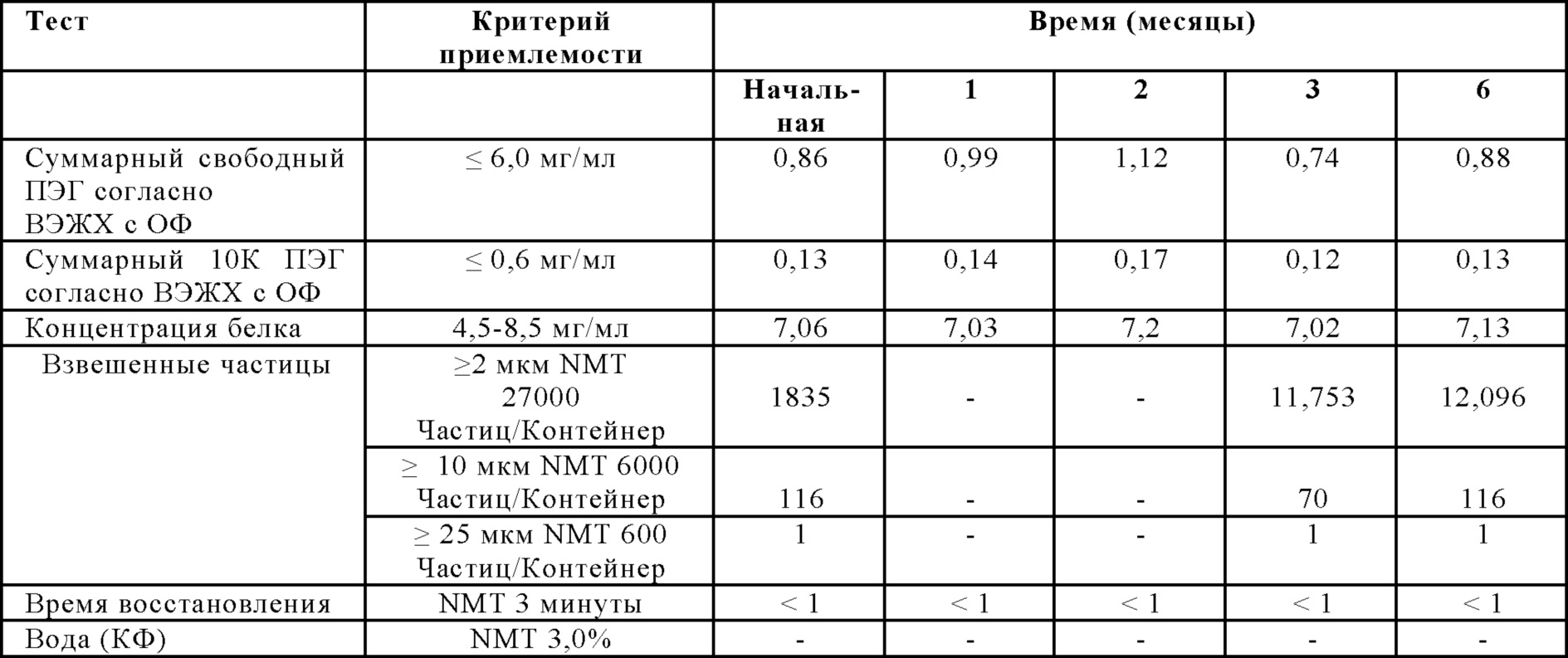

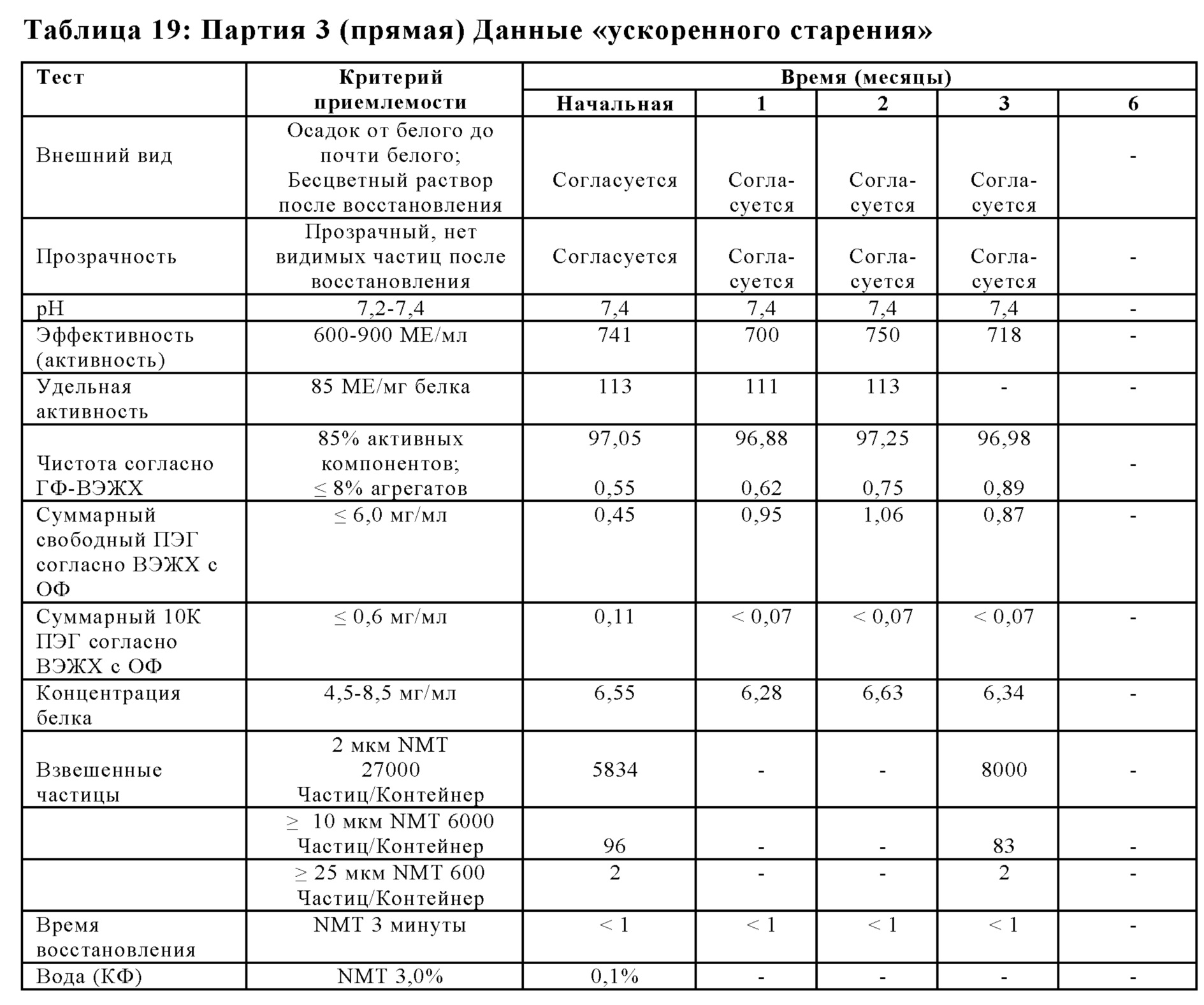

Стабильность при тепловом стрессе (40±2°С; 75%±5% ОВ) Данные стабильности для партий лиофилизированного лекарственного продукта, которые хранили в стрессовых условиях (40±2°С; 75%±5% ОВ), представлены в Таблицах 21-24. Данные стабильности указывают на то, что лиофилизированный лекарственный продукт, который хранили в стрессовых условиях, сохраняется хорошо в пределах критерия приемлемости для всей продолжительности исследования. Содержание воды (КФ) находится в диапазоне 1,16%-1,45% (спецификация = NMT 3,0%) при хранении в условиях 40°С в течение 4 недель. Графики стабильности для активности (Фиг. 14) и чистоты (Фиг. 15), а также агрегатов (Фиг. 16), при 40±2°С представлены на сопровождающих фигурах.


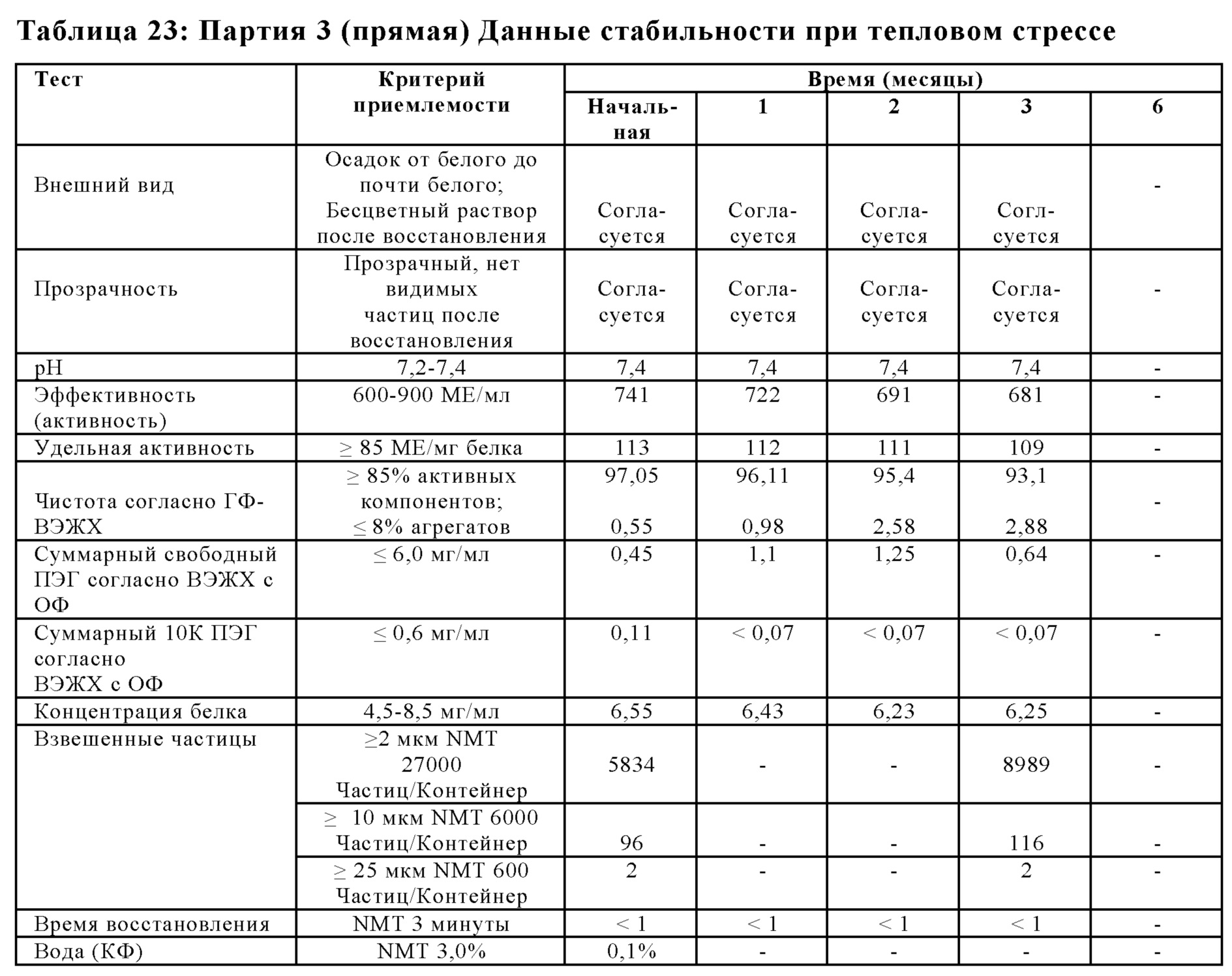
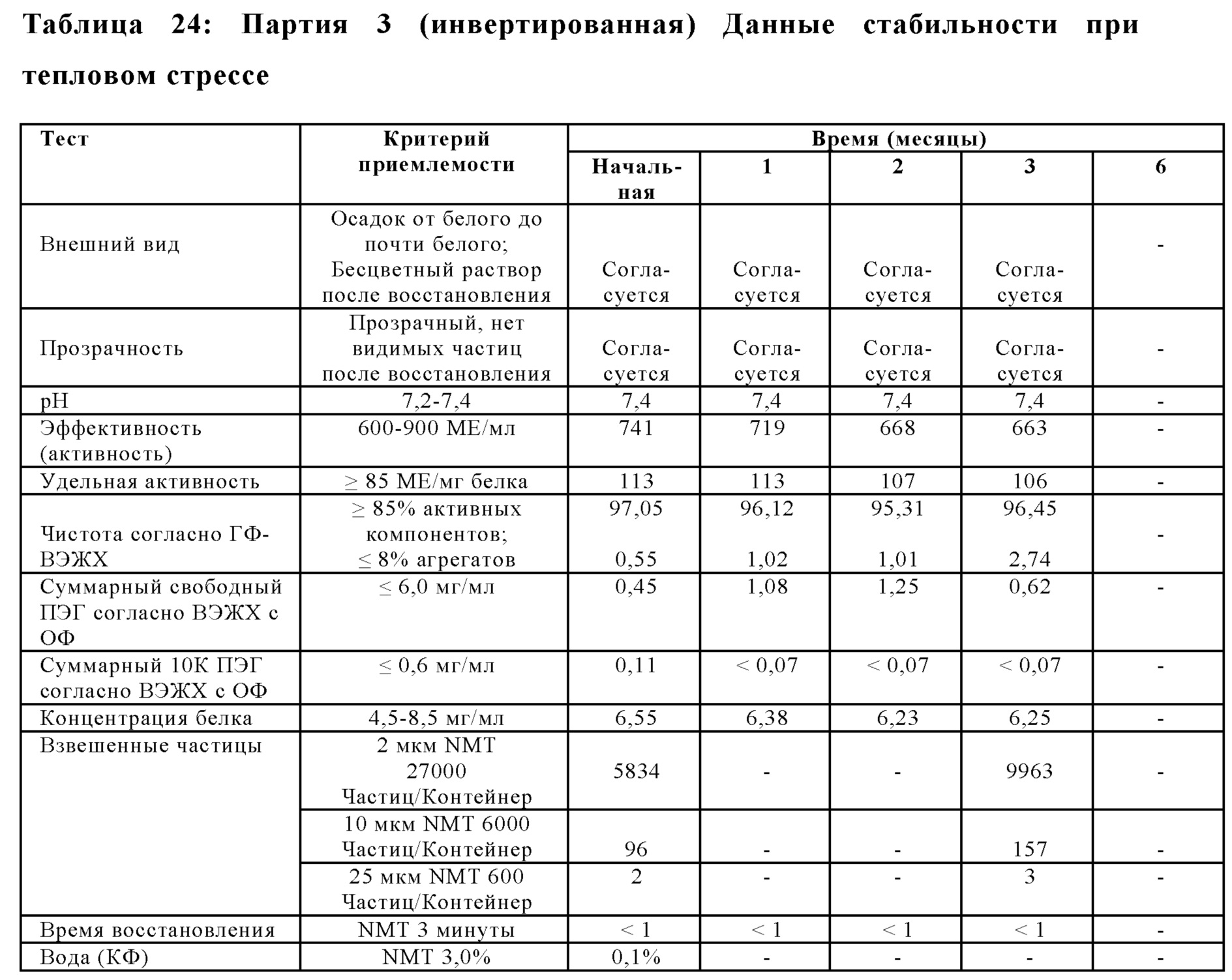
Пример 2
Получали композицию, которая включала полиэтиленгликоль-аспарагиназу, имеющую СК-ПЭГ линкер (то есть, сукцинимидил-карбонатный линкер) - каласпаргаза пэгол (сукцинимидил карбонат-полиэтиленгликоль [СК-ПЭГ] E.coli L-аспарагиназа). Состав композиции представлен в Таблице 25.

Пример 3
После получения концентрированной нерасфасованной композиции, может быть получена лиофилизированная композиция каласпаргазы пэгол из концентрированной нерасфасованной композиции. На Фиг. 1 представлен пример схемы технологического процесса, который можно использовать для получения лиофилизированной стабильной при хранении композиции в соответствии с вариантами осуществления настоящей заявки. Порошок лиофилизированной композиции для инъекции можно получать в одноразовом флаконе, содержащем 3,750 ME активной каласпаргазы пэгол (750 МЕ/мл после восстановления с 5,2 мл ВДИ). Компоненты лиофилизированной композиции могут включать 4,5% сахарозу, двухосновный фосфат натрия, одноосновный фосфат натрия, и хлорид натрия после восстановления. Состав лиофилизированной композиции представлен в Таблице 26.

Пример 4
Задачей этого исследования являлось обеспечение сравнительной фармакокинетической (РК), фармакодинамической (PD) и иммуногенной информации для жидкой пэгаспаргазы (ПЭГ-L-аспарагиназы; Oncaspar®) и лиофилизированная пэгаспаргазы, при введении внутривенно, путем медленной болюсной инъекции, собакам породы бигль один раз (День 1) или один раз еженедельно в течение 4 недель (Дни 1, 15, 22, 29 и 36). Поскольку восстановленная лиофилизированная пэгаспаргаза будет вводиться внутривенно людям, то такой же путь введения использовали в этом исследовании. Исследования единичной дозы и повторной дозы PK/PD необходимы для определения и сравнения фармакокинетики и фармакодинамики жидкой и восстановленной лиофилизированной версий при эквивалентной дозе.
Собакам породы бигль (номинально 5/пол/группу) вводили 500 МЕ/кг жидкой пэгаспаргазы или восстановленной лиофилизированной пэгаспаргазы путем внутривенной инъекции в дозируемом объеме 0,667 мл/кг (см. Таблицу 27). Собаки породы бигль имели возраст приблизительно 6 месяцев с весом для мужского пола от 7,2 кг до 10,7 кг и женского пола от 5,6 кг до 8,2 кг.
Жидкую пэгаспаргазу (5 мл PBS буфер с 50 мМ фосфата и 0,85% физиологического раствора при рН 7,2-7,4) использовали в полученном от производителя виде и не было необходимости в приготовлении препарата. Лиофилизированную пэгаспаргазу (см. пример 1) приготавливали для введения путем (используя шприц с калибром 21) восстановления содержимого флакона с помощью 5,2 мл воды для инъекций (ВДИ), используя асептические методики для получения 750 МЕ/мл концентрации. Содержимое флакона осторожно встряхивали до полного растворения. Смесь визуально контролировали относительно наличия взвешенные частицы, мутности или обесцвечивания перед введением. Свежие препараты приготавливали для каждого дня введения дозы, выдерживая при комнатной температуры и используя в течение 2 часов после приготовления.

Животные в Группах 1 и 3 получали единичную дозу жидкой пэгаспаргазы или лиофилизированной пэгаспаргазы, соответственно в день 1. Животные в Группах 2 и 4 получали повторные дозы жидкой пэгаспаргазы или лиофилизированной пэгаспаргазы, соответственно. Вводили медленную болюсную (в течение приблизительно 2 минут) внутривенную инъекцию в течение 2 часов от приготовления тестируемого препарата. Использовали балонный катетер (а не катетер-бабочку), с последующим промыванием физиологическим раствором для очищения с крышки катетера любого оставшегося дозированного объема. Прямую иглу вставляли в крышечку катетера для гарантирования того, что положение иглы будет оставаться правильным в течение 2 минут.
Образцы крови отбирали у всех животных в дни 1 и 36 для фармакокинетических и фармакодинамических анализов. Приблизительно 1,0 мл цельной крови получали в каждую временную точку. Животные не анестезировали и они не были голодными перед забором крови. Кровь собирали в пробирки, содержащие антикоагулянт натрий гепарин и помещали на жидкий лед в вертикальном положении. Образцы крови центрифугировали в течение 5 минут (приблизительно при 3000 об./мин, приблизительно при 4°С) для получения плазмы, начиная в течение 5 минут от забора образца крови.
PD: Одну аликвоту 125 мкл плазмы пипетировали в криопробирку, предварительно заполненную 125 мкл SeraPrep для определения аспарагина. Пробирку инвертированная 3 раза для смешивания SeraPrep и сразу быстро замораживали в жидком азоте или метаноле/сухом льде в течение 15 минут от забора образца крови. Все аликвоты, содержащие SeraPrep, анализировали для определения аспарагина с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с масс-спектрометрическим обнаружением (ЖХ- МС/МС).
PK: Оставшуюся плазму разделяли на две криопробирки для определения активность аспарагиназы и быстро замораживали в течение 30 минут от забора образца крови. Все аликвоты, не содержащие SeraPrep, анализировали для определения активности аспарагиназы путем колориметрической смешанной ферментативной реакции.
Результаты
Анализы, осуществленные во время периода лечения для лиофилизированной пэгаспаргазы, подтвердили, что вводили дозированные препараты в подходящей концентрации (предполагаемая концентрация белка 6,6 мг/мл и активность 741 МЕ/мл, на анализируемую партию) (Таблица 28).

Объединенные средние групповые значения концентрации в плазме (Cmax) аспарагиназы и объединенные средние групповые значения площади под кривыми концентрации аспарагиназы в плазме в динамике, оцениваемые вплоть до 552 часов после введения дозы (AUC0-552) в день 1 и после повторного дозирования в день 36, обобщены для каждой группы (объединенные полы) в Таблице 29.
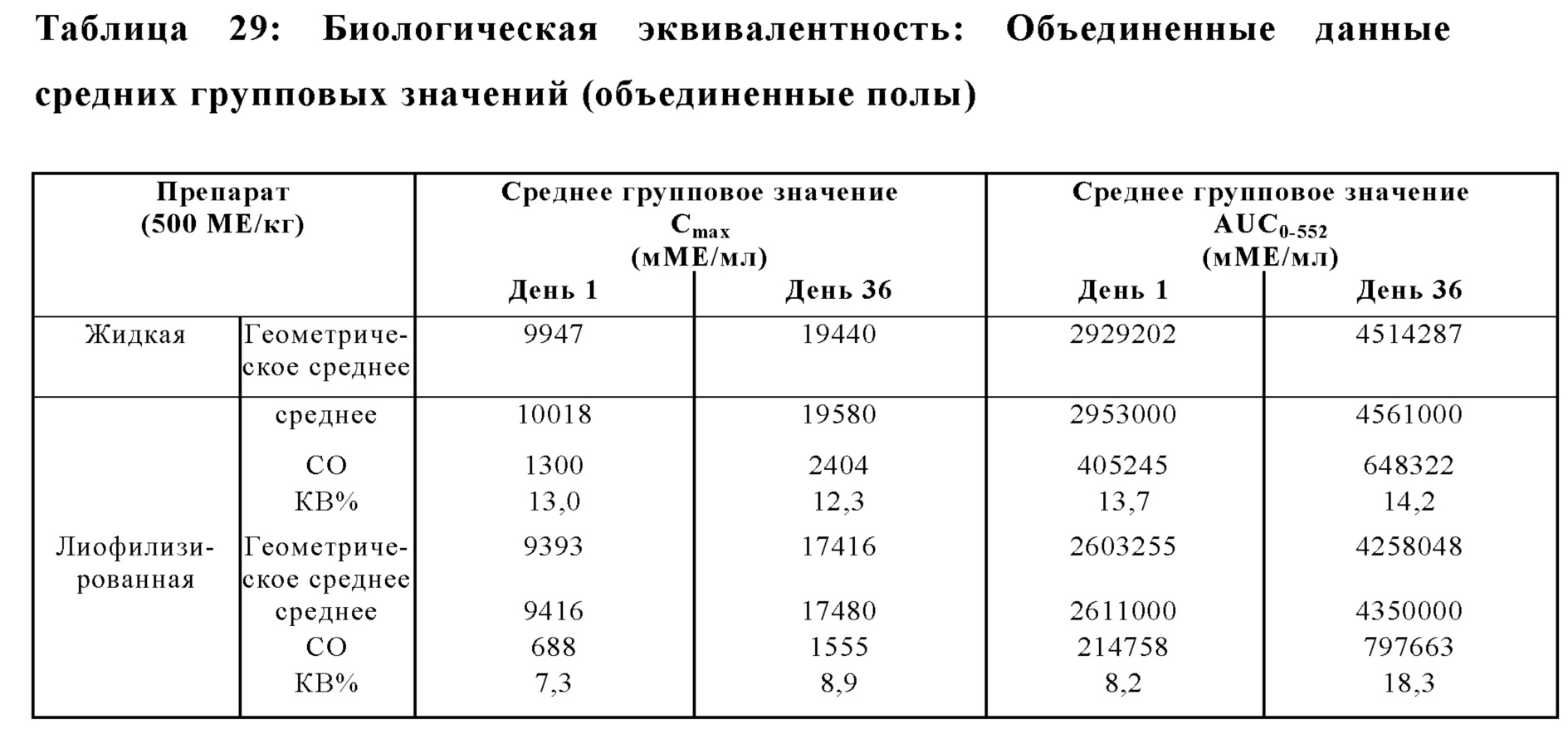
Исследование создавали в виде схемы с параллельными группами и данные анализировали статистически, используя методики дисперсионного анализа. Анализировали данные Cmax и AUC0-552 для обоих дней, используя ANOVA модель относительно таких факторов как состав, время, пол и их взаимодействия.
Анализировали два препарата пэгаспаргазы по отношению к Cmax и AUC0-552 и соответствующие двусторонние 90% доверительные интервалы для соотношения геометрических средних обобщены в Таблице 30.

Для Cmax были доказательства биологической эквивалентности, так как доверительный интервал (0,867 до 0,970) в содержался в критической области. Для AUC0-552 были доказательства биологической эквивалентности, так как доверительный интервал (0,841 до 0,996) содержался в критической области.
Средняя максимальная концентрация в плазме (Cmax) пэгаспаргазы и средние площади под кривыми концентрация пэгаспаргазы в плазме в зависимости от времени, оцениваемые вплоть до 552 часов после введения дозы (AUC0,552) в день 1 и после повторного дозирования в день 36, обобщены ниже (в зависимости от пола) со среднеквадратическими отклонениями в круглых скобках в Таблице 31.

Взаимоотношения между средней максимальной концентрацией в плазме (Cmax) аспарагиназы, средними площадями под кривыми концентрации аспарагиназы в плазме в динамике во времени (AUC0-552) и уровнем дозирования для лиофилизированного препарата выражены в виде соотношения по сравнению с жидким препаратом и представлены в Таблице 32.
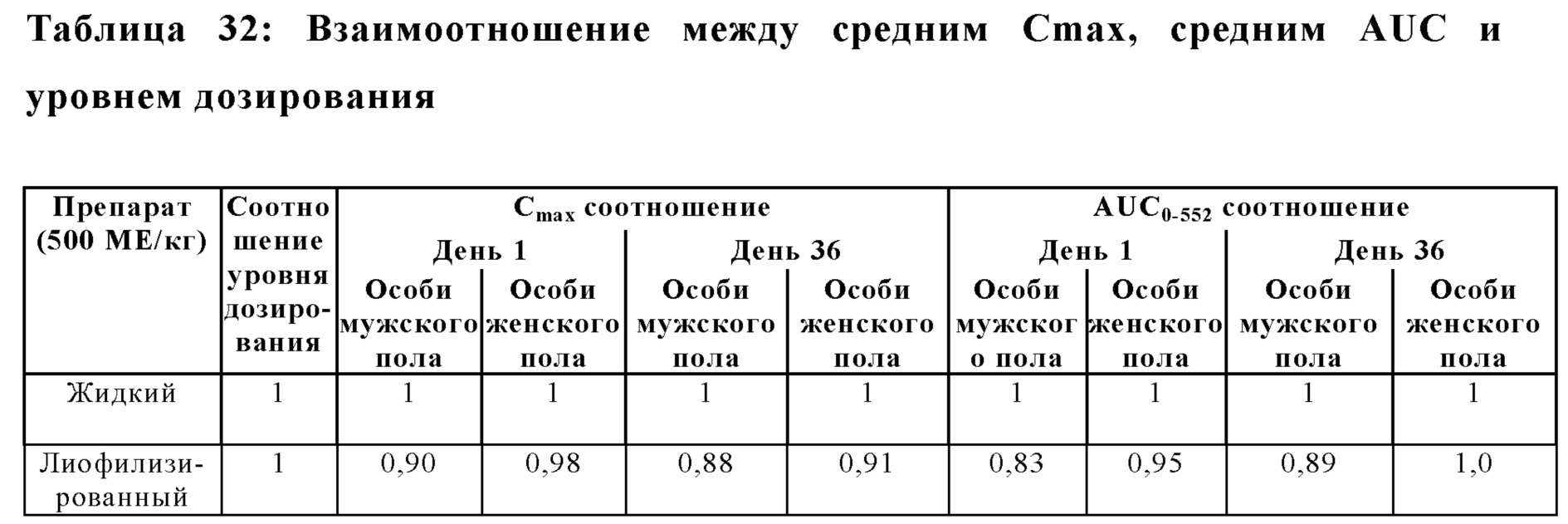
Значения Cmax и AUC0-552 при системно воздействии на собак аспарагиназы было сходным после введения восстановленной лиофилизированной пэгаспаргазы, по сравнению с жидким препаратом, в день 1 и после повторных введений в день 36. Отсутствуют доказательства существенного отличия между препаратами для AUC0-552, но получены некоторые доказательства различия между значениями Cmax различных препаратов, где Cmax после введения лиофилизированного продукта немного ниже (8%), чем при дозировании в виде жидкого препарата.
Значения Cmax и AUC0-552 при системно воздействии на собак женского пола аспарагиназы в целом были сходны с такими, которые индуцированы воздействием у собак мужского пола и отсутствуют доказательства каких-либо статистически достоверных различий, связанных с половым признаком, при системном воздействии для Cmax или AUC0-552.
Другими параметрами, которые оценивались во время проведения исследования, была: жизнеспособность, клинические наблюдения, масса тела, потребление пищи, число дыханий в минуту, температура тела, гематология, свертываемость и биохимия крови; для этих параметров не наблюдали побочных эффектов, связанных с введением тестируемого препарата.
После повторных внутривенных доз (День 36) значения Cmax и степень (AUC0-552) системного воздействия на собак аспарагиназы были выше, чем такие значения после единичной дозы (День 1 и эти различия были статистически достоверными (р<0,001). Средние скорости накопления, рассчитанные на основании значений AUC0-552 (следует отметить, что различные животные обеспечивали данные каждый день), были больше одного, указывая на то, что накопление аспарагиназы происходит после повторного внутривенного введения жидкой пэгаспаргазы. В целом, два препарата пэгаспаргазы показали, что они являются эквивалентными, что касается Cmax и AUC0-552, так как соответствующие двусторонние 90% доверительные интервалы для соотношения геометрического среднего полностью подпадает в общепринятые пределы биологической эквивалентности в интервале от 0,8 от 1,25. Отсутствует достоверное отличие между двумя препаратами, что касается AUC0-552. Системное воздействие аспарагиназы было сходным для двух продуктов и некоторые накопление происходило у обоих полов при повторном дозировании. Аспарагин полностью подавлялся вплоть до 336 часов у всех животных и вплоть до 552 часов у большинства из них.
В заключение, отсутствуют заметные отличия между дозами 500 МЕ/кг либо жидкой пэгаспаргазы или восстановленной лиофилизированной пэгаспаргазы и они имеют сопоставимые фармакокинетические, фармакодинамические и иммуногенные профили.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
В одном варианте осуществления, настоящее раскрытие обеспечивает лиофилизированную стабильную при хранении композицию, которая включает полиалкиленоксид-аспарагиназу, имеющую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой. Лиофилизированная стабильная при хранении композиция также включает буфер, соль и сахар.
В определенных вариантах осуществления, полиалкиленоксидная группа включает полиэтиленгликолевую группу. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес в интервале от 2000 до 10000 Дальтон. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон. В определенных вариантах осуществления, аспарагиназа представляет собой Е. coli аспарагиназу.
В определенных вариантах осуществления, линкер представляет собой уретановый линкер. В определенных вариантах осуществления, линкер представляет собой сукцинатный линкер.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве в интервале от 500 до 1000 МЕ/г. В определенных вариантах осуществления, буфер включает фосфатный буфер. В определенных вариантах осуществления, фосфатный буфер включает двухосновный фосфат натрия и одноосновный фосфат натрия. В определенных вариантах осуществления, двухосновный фосфат натрия присутствует в количестве в интервале от 0,1 до 0,5 мас. %. В определенных вариантах осуществления, одноосновный фосфат натрия присутствует в количестве в интервале от 0,01 до 0,1 мас. %. В определенных вариантах осуществления, соль представляет собой хлорид натрия. В определенных вариантах осуществления, хлорид натрия присутствует в количестве в интервале от 0,1 до 1 мас. %.
В определенных вариантах осуществления, сахар включает дисахарид. В определенных вариантах осуществления, дисахарид включает сахарозу. В определенных вариантах осуществления, сахар включает сахароза в количестве в интервале от 1 до 10 мас. %. В определенных вариантах осуществления, композиция находится в контейнере с единичной дозой. В определенных вариантах осуществления, контейнер с единичной дозой представляет собой флакон. В определенных вариантах осуществления, флакон представляет собой запечатанный стеклянный флакон.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %).
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве 0,279 мас. % и одноосновный фосфат натрия в количестве 0,06 мас. %, соль представляет собой хлорид натрия в количестве 0,425 мас. %, и сахар представляет собой сахарозу в количестве 4,5 мас. %. В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве 0,279 мас. % и одноосновный фосфат натрия в количестве 0,06 мас. %, соль представляет собой хлорид натрия в количестве 0,425 мас. %, и сахар представляет собой сахарозу в количестве 4,5 мас. %).
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве 0,558 мас. % и одноосновный фосфат натрия в количестве 0,129 мас. %, и соль представляет собой хлорид натрия в количестве 0,85 мас. %
В другом варианте осуществления, настоящее раскрытие обеспечивает лиофилизированную стабильную при хранении композицию, которая включает полиэтиленгликоль-аспарагиназу, имеющую полиэтиленгликолевую группу, ковалентно связанную с помощью сукцинатного линкера с Е. coli аспарагиназой. В другом варианте осуществления, настоящее раскрытие обеспечивает лиофилизированную стабильную при хранении композицию, которая включает полиэтиленгликоль-аспарагиназу, имеющую полиэтиленгликолевую группу, ковалентно связанную с помощью уретанового линкера с Е. coli аспарагинаой.
Лиофилизированная стабильная при хранении композиция также включает фосфатный буфер, соль, и необязательно дисахарид, как изложено в вариантах осуществления выше. В другом варианте осуществления, настоящее раскрытие обеспечивает способ дезаминирования аспарагина у субъекта путем введения композиции, как описано в настоящей заявке.
В определенных вариантах осуществления, способ включает восстановление лиофилизированной стабильной при хранении композиции в соответствии с настоящим раскрытием с получением восстановленной дозированной единицы, и введение восстановленной дозированной единицы субъекту для дезаминирования аспарагина у субъекта. В определенных вариантах осуществления, восстановление включает комбинирование лиофилизированной стабильной при хранении композиции с водой для инъекций (ВДИ).
В определенных вариантах осуществления, дозированная единица включает от 700 до 800 МЕ/мл полиалкиленоксид-аспарагиназы.
В определенных вариантах осуществления, дозированная единица включает 2,5-6 мг/г двухосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает 2,5-3 мг/г двухосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает от 5 до 6 мг/г двухосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает от 5,25 до 5,75 мг/г двухосновного фосфата натрия.
В определенных вариантах осуществления, дозированная единица включает от 0,45 до 1,5 мг/г одноосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает 0,45 до 0,75 мг/г одноосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает 1-2 мг/г одноосновного фосфата натрия. В определенных вариантах осуществления, дозированная единица включает 1-1,5 мг/г одноосновного фосфата натрия.
В определенных вариантах осуществления, дозированная единица включает 4-9 мг/г хлорида натрия. В определенных вариантах осуществления, дозированная единица включает 4-4,5 мг/г хлорида натрия. В определенных вариантах осуществления, дозированная единица включает 8-9 мг/г хлорида натрия.
В определенных вариантах осуществления, дозированная единица включает сахароза. В определенных вариантах осуществления, сахароза присутствует в количестве в интервале от 40 до 50 мг/г.
В определенных вариантах осуществления, восстановленная дозированная единица доставляет от 1500 до 3000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных вариантах осуществления, восстановленная дозированная единица доставляет от 2000 до 2750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных вариантах осуществления, способ представляет собой способ лечения субъекта от опухолевого состояния. В определенных вариантах осуществления, опухолевое состояние представляет собой злокачественное новообразование. В определенных вариантах осуществления, злокачественное новообразование представляет собой лейкоз. В определенных вариантах осуществления, лейкоз представляет собой острый лимфобластный лейкоз (ALL). В определенных вариантах осуществления, лейкоз представляет собой острый миелоидный лейкоз (AML). В определенных вариантах осуществления, субъекту назначена схема лечения, которая включает фазу индукции, фазу консолидации и фазу поддержания. В определенных вариантах осуществления, способ включает введение единичной восстановленной дозированной единицы субъекту в фазу индукции и множественных восстановленных дозированных единиц во время фазы поддержания. В определенных вариантах осуществления, множественные восстановленные дозированные единицы вводят субъекту путем введения восстановленной дозированной единицы субъекту каждые 3 недели. В определенных вариантах осуществления, множественные восстановленные дозированные единицы вводят субъекту путем введения восстановленной дозированной единицы субъекту каждые 2 недели.
В определенных вариантах осуществления, субъект представляет собой подростка. В определенных вариантах осуществления, субъект представляет собой взрослого. В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/мл, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 2,5 до 3 мг/г и одноосновный фосфат натрия в количестве в интервале от 0,5 до 0,7 мг/г, соль представляет собой хлорид натрия в количестве в интервале от 4 до 4,5 мг/г, и сахар представляет собой сахарозу в количестве в интервале от 40 до 50 мг/г.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/мл, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве 2,79 мг/г и одноосновный фосфат натрия в количестве 0,6 мг/г, соль представляет собой хлорид натрия в количестве 4,25 мг/г, и сахар представляет собой сахарозу в количестве 45 мг/г.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/мл, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 2,5-3 мг/г и одноосновный фосфат натрия в количестве в интервале от 0,5 до 0,7 мг/г, соль представляет собой хлорид натрия в количестве в интервале от 4 до 4,5 мг/г, и сахар представляет собой сахарозу в количестве в интервале от 40 до 50 мг/г.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/мл, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве 2,79 мг/г и одноосновный фосфат натрия в количестве 0,6 мг/г, соль представляет собой хлорид натрия в количестве 4,25 мг/г, и сахар представляет собой сахарозу в количестве 45 мг/г. В другом варианте осуществления, настоящее раскрытие обеспечивает способ приготовления лиофилизированной композиции полиалкиленоксид-аспарагиназы путем лиофилизации водного концентрата композиции образом, достаточным для получения лиофилизированной стабильной при хранении композиции полиалкиленоксид-аспарагиназу. Водный концентрат композиции включает полиалкиленоксид-аспарагиназу, имеющую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой, буфер, соль и сахар.
В определенных вариантах осуществления, водный концентрат композиции включает от 1500 до 3000 МЕ/мл полиалкиленоксид-аспарагиназы.
В определенных вариантах осуществления, водный концентрат композиции включает 0,1 до 0,5 мас. % двухосновного фосфата натрия. В определенных вариантах осуществления, водный концентрат композиции включает 0,01 до 0,1 мас. % одноосновного фосфата натрия.
В определенных вариантах осуществления, водный концентрат композиции включает 0,1-1 мас. % хлорида натрия.
В определенных вариантах осуществления, водный концентрат композиции включает сахароза. В определенных вариантах осуществления, сахароза присутствует в количестве в интервале от 1 до 10 мас. %. В определенных вариантах осуществления, способ также включает получение водного концентрата композиции.
В определенных вариантах осуществления, способ также включает введение водного концентрата композиции в контейнер с единичной дозой и лиофилизацию водного концентрата композиции в контейнере с единичной дозой. В определенных вариантах осуществления, контейнер с единичной дозой представляет собой флакон. В некоторых вариантах осуществления, флакон представляет собой стеклянный флакон. В определенных вариантах осуществления, способ также включает запечатывание лиофилизированной композиции в контейнере с единичной дозой. В определенных вариантах осуществления, полиалкиленоксидная группа включает полиэтиленгликолевую группу. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес в интервале от 2000 до 10000 Дальтон. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон. В определенных вариантах осуществления, аспарагиназа представляет собой Е. coli аспарагиназа.
В определенных вариантах осуществления, линкер представляет собой уретановый линкер. В определенных вариантах осуществления, линкер представляет собой сукцинатный линкер.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой E. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %. В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %).
В других вариантах осуществления, настоящее раскрытие обеспечивает набор, который включает еще два контейнера с единичными дозами, каждый содержащий лиофилизированную стабильную при хранении композицию. Лиофилизированная стабильная при хранении композиция включает полиалкиленоксид-аспарагиназу, имеющую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой, буфер, соль и сахар.
В определенных вариантах осуществления, полиалкиленоксидная группа включает полиэтиленгликолевую группу. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес в интервале от 2000 до 10000 Дальтон. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон. В определенных вариантах осуществления, аспарагиназа представляет собой Е. coli аспарагиназа. В определенных вариантах осуществления, линкер представляет собой уретановый линкер. В определенных вариантах осуществления, линкер представляет собой сукцинатный линкер.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве в интервале от 500 до 1000 МЕ/г. В определенных вариантах осуществления, буфер включает фосфатный буфер. В определенных вариантах осуществления, фосфатный буфер включает двухосновный фосфат натрия и одноосновный фосфат натрия. В определенных вариантах осуществления, двухосновный фосфат натрия присутствует в количестве в интервале от 0,1 до 0,5 мас. %. В определенных вариантах осуществления, одноосновный фосфат натрия присутствует в количестве в интервале от 0,01 до 0,1 мас. %. В определенных вариантах осуществления, соль представляет собой хлорид натрия. В определенных вариантах осуществления, хлорид натрия присутствует в количестве в интервале от 0,1 до 1 мас. %.
В определенных вариантах осуществления, сахар включает дисахарид. В определенных вариантах осуществления, дисахарид включает сахарозу. В определенных вариантах осуществления, сахар включает сахароза в количестве в интервале от 1 до 10 мас. %. В определенных вариантах осуществления, контейнер с единичными дозами представляют собой флаконы. В определенных вариантах осуществления, флаконы представляют собой стеклянные флаконы. В определенных вариантах осуществления, контейнер с единичными дозами запечатаны.
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %).
В определенных вариантах осуществления, полиалкиленоксид-аспарагиназа присутствует в количестве 750 МЕ/г, полиалкиленоксидная группа включает полиэтиленгликолевую группу с молекулярным весом 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер включая двухосновный фосфат натрия в количестве в интервале от 0,25 до 0,3 мас. % и одноосновный фосфат натрия в количестве в интервале от 0,05 до 0,07 мас. %, соль представляет собой хлорид натрия в количестве в интервале от 0,4 до 0,45 мас. %, и сахар представляет собой сахарозу в количестве в интервале от 4 до 5 мас. %. В другом варианте осуществления, настоящее раскрытие обеспечивает способ лечения субъекта от острого миелоидного лейкоза (AML). Способ включает введение субъекту дозы полиалкиленоксид-аспарагиназы, эффективной для лечения у субъекта AML, где полиалкиленоксид-аспарагиназа имеет полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой.
В определенных вариантах осуществления, полиалкиленоксидная группа включает полиэтиленгликолевую группу. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес в интервале от 2000 до 10000 Дальтон. В определенных вариантах осуществления, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон. В определенных вариантах осуществления, аспарагиназа представляет собой Е. coli аспарагиназу.
В определенных вариантах осуществления, линкер представляет собой уретановый линкер. В определенных вариантах осуществления, линкер представляет собой сукцинатный линкер.
В определенных вариантах осуществления, доза включает от 700 до 800 МЕ/мл полиалкиленоксид-аспарагиназы. В определенных вариантах осуществления, доза включает буфер и соль. В определенных вариантах осуществления, буфер включает фосфатный буфер. В определенных вариантах осуществления, фосфатный буфер включает двухосновный фосфат натрия и одноосновный фосфат натрия. В определенных вариантах осуществления, доза включает 5,25-5,75 мг/г двухосновного фосфата натрия. В определенных вариантах осуществления, доза включает 1,0-1,5 мг/г одноосновного фосфата натрия. В определенных вариантах осуществления, соль представляет собой хлорид натрия. В определенных вариантах осуществления, доза включает 8-9 мг/г хлорида натрия.
В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер, который включает 5,25-5,75 мг/г двухосновного фосфата натрия и 1-1,5 мг/г одноосновного фосфата натрия, и соль включает 8-9 мг/г хлорида натрия.
В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер, который включает 5,58 мг/г двухосновного фосфата натрия и 1,29 мг/г одноосновного фосфата натрия, и соль включает 8,5 мг/г хлорида натрия. В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер, который включает 5,25-5,75 мг/г двухосновного фосфата натрия и 1-1,5 мг/г одноосновного фосфата натрия, и соль включает 8-9 мг/г хлорида натрия.
В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер, который включает 5,58 мг/г двухосновного фосфата натрия и 1,29 мг/г одноосновного фосфата натрия, и соль включает 8,5 мг/г хлорида натрия.
В определенных вариантах осуществления, доза включает буфер, соль и сахар. В определенных вариантах осуществления, буфер включает фосфатный буфер. В определенных вариантах осуществления, фосфатный буфер включает двухосновный фосфат натрия и одноосновный фосфат натрия. В определенных вариантах осуществления, доза включает 2,5-3 мг/г двухосновного фосфата натрия. В определенных вариантах осуществления, доза включает 0,45-0,75 мг/г одноосновного фосфата натрия. В определенных вариантах осуществления, соль представляет собой хлорид натрия. В определенных вариантах осуществления, доза включает 4-4,5 мг/г хлорида натрия. В определенных вариантах осуществления, сахар включает дисахарид. В определенных вариантах осуществления, дисахарид включает сахарозу. В определенных вариантах осуществления, сахароза присутствует в количестве в интервале от 40 до 50 мг/г. В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер, который включает 2,5-3 мг/г двухосновного фосфата натрия и 0,5 до 0,7 мг/г одноосновного фосфата натрия, соль включает 4-4,5 мг/г хлорида натрия, и сахар включает 40-50 мг/г сахарозы.
В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой уретановый линкер, буфер представляет собой фосфатный буфер, который включает 2,79 мг/г двухосновного фосфата натрия и 0,6 мг/г одноосновного фосфата натрия, соль включает 4,25 мг/г хлорида натрия, и сахар включает 45 мг/г сахарозы. В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер, который включает 2,5-3 мг/г двухосновного фосфата натрия и 0,5-0,7 мг/г одноосновного фосфата натрия, соль включает 4-4,5 мг/г хлорида натрия, и сахар включает 40-50 мг/г сахарозы.
В определенных вариантах осуществления, доза включает 750 МЕ/мл полиалкиленоксид-аспарагиназы, полиэтиленгликолевая группа имеет молекулярный вес 5000 Дальтон, аспарагиназа представляет собой Е. coli аспарагиназу, линкер представляет собой сукцинатный линкер, буфер представляет собой фосфатный буфер, который включает 2,79 мг/г двухосновного фосфата натрия и 0,6 мг/г одноосновного фосфата натрия, соль включает 4,25 мг/г хлорида натрия, и сахар включает 45 мг/г сахарозы.
В определенных вариантах осуществления, способ также включает получение дозировки путем восстановления лиофилизированной стабильной при хранении композиции.
В определенных вариантах осуществления, дозировка доставляет от 1500 до 3000 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту. В определенных вариантах осуществления, дозировка доставляет от 2000 до 2750 МЕ/м2 полиалкиленоксид-аспарагиназы субъекту.
В определенных вариантах осуществления, субъекту назначена схема лечения, которая включает фазу индукции, фазу консолидации и фазу поддержания. В определенных вариантах осуществления, способ включает введение субъекту единичной дозы в фазу индукции и многократных доз во время фазы поддержания. В определенных вариантах осуществления, многократные дозы вводят субъекту путем введения дозы субъекту каждые 3 недели. В определенных вариантах осуществления, многократные дозы вводят субъекту путем введения дозы субъекту каждые 2 недели.
В определенных вариантах осуществления, субъект представляет собой подростка.
В определенных вариантах осуществления, субъект представляет собой взрослого.
Несмотря на то, что изложенные выше варианты осуществлены изобретения были описаны более подобно путем иллюстрации и примеров для облегчения понимания, для квалифицированного специалиста в данной области техники будет легко понятным в свете сведений, представленных в настоящем раскрытии, что могут быть осуществлены определенные изменения и модификации без отклонения от сущности или объема пунктов приложенной формулы изобретения. Таким образом, предшествующее только иллюстрирует основы вариантов осуществления настоящего раскрытия. Следует принять во внимание, что квалифицированные специалисты в данной области техники смогут разработать различные компоновки, которые, несмотря на то, что конкретно не описаны или не представлены в настоящей заявке, охватываются принципами вариантов осуществления настоящего раскрытия и включены в его сущность и объем. Кроме того, все примеры и условные обозначения, процитированные в настоящей заявке, принципиально предназначены для помощи специалисту в понимании принципов вариантов осуществления настоящего раскрытия и концепции, которыми изобретатели вносят вклад в развитие уровня техники, и должны рассматриваться как не ограничивающее такими специфически указанными примерами и условиями. Кроме того, все указания в настоящей заявке, изложенные принципы, аспекты и варианты осуществления настоящего раскрытия, а также их специфические примеры, предназначены для охвата как их структурных, так и функциональных эквивалентов. Дополнительно, подразумевается, что такие эквиваленты включают как известные в настоящее время эквиваленты, так и эквиваленты, разработанные в будущем, то есть любые разработанные элементы, которые осуществляют такую же самую функцию, независимо от структуры. Таким образом, объем вариантов осуществления настоящего раскрытия не предназначен для ограничения вариантами осуществления, представленными и описанными в настоящей заявке. Наоборот, объем и сущность вариантов осуществления настоящего раскрытия реализуются пунктами приложенной формулы изобретения.
Реферат
Изобретение относится к медицине и может быть использовано для лечения опухолевого состояния у субъекта. Заявлена восстановленная лиофилизированная композиция для дезаминирования аспарагина, которая содержит полиалкиленоксид-аспарагиназу в концентрации от 100 до 5000 МЕ/мл указанной композиции, двухосновный фосфат натрия в концентрации от 0,1 до 0,8 мас. %, одноосновный фосфат натрия в концентрации от 0,01 до 0,5 мас. %, соль в концентрации от 0,05 до 1 мас. % и сахар в концентрации от 0,1 до 25 мас. %, где полиалкиленоксид-аспарагиназа содержит аспарагиназу, ковалентно связанную с полиалкиленоксидной группой. Лиофилизированная стабильная при хранении композиция для дезаминирования аспарагина стабильна при хранении и способна к образованию восстановленной лиофилизированной стабильной при хранении композиции при восстановлении водой для инъекций (ВДИ). Способ приготовления лиофилизированной композиции полиалкиленоксид-аспарагиназы включает лиофилизацию водного концентрата композиции, содержащей: (I) полиалкиленоксид-аспарагиназу, содержащую полиалкиленоксидную группу, ковалентно связанную с помощью линкера с аспарагиназой; (II) буфер, который содержит двухосновный фосфат натрия и одноосновный фосфат натрия; (III) соль и (III) сахар. Набор для дезаминирования аспарагина содержит один или более контейнеров с единичными дозами, каждая содержит лиофилизированную стабильную при хранении композицию. Композиции находят использование для различных применений, например для лечения опухолевого состояния у субъекта. 4 н. и 14 з.п. ф-лы, 32 табл.,16 ил., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Фармацевтические композиции с фактором роста нерва
Стабильная изотоническая лиофилизированная протеиновая композиция

Комментарии