Фармацевтические композиции с фактором роста нерва - RU2126265C1
Код документа: RU2126265C1
Чертежи



Описание
Область техники, к которой
относится изобретение
Настоящее изобретение относится к фармацевтическим композициям с фактором роста нервов. Изобретение также относится к композициям с фактором роста нервов, пригодным для
лиофилизации.
Предпосылки создания изобретения
Многочисленные полипептиды и протеины регулируют рост или выживание клеток, такие молекулы называют "факторами роста". Примеры
факторов роста включают эпидермальный фактор роста (EGF - epidermal growth factor), кислотный и щелочной факторы роста фибробласта (аEGF и bEGF - acidiuc и basic Fibroblast growth factor),
тромбоцитарный фактор роста (PDGF - plateled derived growth factor), цилиарный нейротропный фактор (CNTF - ciliary neutrophic factor) и фактор роста нервов (NGF - nerve growth factor). Среди них NGF
был первым, который был идентифицирован и охарактеризован (Levi-Montalcini R. и др., J. Exp. Zool. , 116 : 321, 1951). NGF стимулирует выживание и активность определенных типов нервных клеток. Кроме
того, NGF стимулирует дифференциацию не созревших нервных клеток в пост-митотические развившиеся нейроны.
Результатом очистки NGF из подчелюстной железы мыши явилась идентификация комплекса, включающего три субъединицы: α, β и γ.
Предполагается, что вся нейротропная активность NGF свойственна субъединице β, т.е. протеину, состоящему из 118 аминокислот и имеющему молекулярный вес около 13000 Да (Varon S. И др., Proc.Natl.Acad.Sci.USA, 57 : 1782 - 1789, 1967; Green, L.A., и др., Neurobiol., 1 : 37 - 48. 1971). В растворе субъединицы β образуют димеры с молекулярным весом около 26500 Да.
Предполагают, что NGF эффективен для лечения определенных дегенеративных заболеваний как периферической, так и центральной нервной системы. Предполагают, что введение NGF может быть полезным при лечении болезней, при которых недостаток NGF, аномалии его рецептора или изменения в его транспортировке или внутриклеточных процессах приводят к снижению функций нейронов, атрофии или даже гибели клетки. Такие болезни включают наследственные сенсорные и моторные заболевания нервной системы, наследственную и спорадически проявляющуюся дегенерацию системы, аминотропные латеральные склерозы, болезнь Паркинсона и болезнь Альцгеймера (Goedert M. Т др., Mol. Brain Rec., 1 : 85 - 92, 1986; Mobley W.C. и др., Soc. Neurosci. Abstr., 13 : 186, 1987; Mobley W. C. и др., Soc. Neurosci. Abstr., 4 : 302, 1988; Hefti F. и др., Ann.Neurol., 20 : 275 - 281, 1986). Предполагают, что NGF также уменьшает смертность нервных клеток после воздействия некоторых ядов, таких как 6-гидроксидопамин (Aloe L. , Arch. Ital. Biol., 113 : 326 - 353, 1975), винбластин и колхицин (Menesini-Chen M.G. и др., Proc. Natl. Acad. Sci. USA, 74 : 5559 - 5563, 1977; Johnson E. M. , Brain Res.,141 : 105 - 118, 1978) и капсайцин (Otten U., Nature, 301 : 515 - 577, 1983).
Высокий уровень экспрессии мРНК NGF в гиппокампе, области, связанной с памятью и обучаемостью, позволяет предположить, что клиническое введение NGF может быть эффективным для лечения слабоумия (Kaisho Y. и др., Biochem Biophys. Res. Com., 174 : 379-385, 1991). В публикациях сообщалось, что интравентрикулярное введение NGF препятствует гибели базальных холинергических нейронов переднего мозга после аксотомии, что позволяет предположить, что NGF может быть эффективным для стимуляции выживания клеток после повреждения (Hefti F. , J. Neurosci., 6 : 2155 - 2162, 1986; Williams-L. и др., Proc. Natl. Acad. Sci. USA, 83 : 9231 - 9235, 1986; Kromer L., Science, 235 : 214 - 216, 1987).
Использование NGF для лечения сопряжено со значительными проблемами. Эти проблемы связаны с 1) сохранением биоактивности NGF, которая может изменяться в процессе получения, очистки или хранения; и 2) введением NGF, относительно крупной гидрофильной молекулы, таким образом, чтобы он достиг места действия в количестве, достаточном для его эффективности. Биоактивность NGF, подобно другим протеинам, зависит от его вторичной и третичной структуры. Субъединица β NGF имеет три внутренние дисульфидные связи, которые, как полагают, важны для биоактивности (Kanaya E. и др., Gene, 83 : 65 - 74, 1989; Iwane M. и др., Biochem. Biophys. Res. Comm., 171 : 116 - 122, 1990: Hu G. -L. и Neet K.E., Gene, 70 : 57 - 65, 1988). Кроме того, эффективное количество биологически активного NGF уменьшается в той степени, в какой денатурируется любой протеин. Целостность протеина, следовательно, должна поддерживаться как во время получения и хранения, так и во время введения. Протеины особенно склонны к разложению при повышенных температурах.
Низкие температуры обычно уменьшают разложение протеина. Однако более экономично хранить протеин при комнатной температуре, т.е. при приблизительно 25oC, а не при пониженных температурах около 4oC. Следовательно, желательно, чтобы композиции были стабильными при хранении как при комнатной температуре, так и при охлаждении до приблизительно 4oC.
Кроме проблем, связанных со стабильностью, NGF, подобно многим другим протеинам, неспецифически связывается с поверхностями. Такое неспецифическое связывание может происходит по отношению к различным материалам, включая стекло и пластмассы, например полиэтилен и полипропилен. Из этих материалов могут быть изготовлены ампулы, тубы, шприцы, имплантируемые приспособления для вливания или любая поверхность, которая может контактировать с NGF во время его получения, хранения или введения.
Другими трудностями при введении протеинов, таких как NGF, в виде лечебных препаратов являются плохая абсорбция организмом и разложение желудочными кислотами. Следовательно, оральный способ введения обычно непригоден. Для преодоления таких абсорбционных барьеров для таких протеинов могут быть необходимы инъекции или вливания.
Инъекция приемлема в том случае, когда место лечения легко доступно. Однако, если это место относительно недоступно, как в случае ЦНС, более практичным может быть непрерывное вливание для долговременного введения. Такое введение может оказаться неосуществимым вследствие различных сложностей. Например, непрерывное вливание может достигаться путем вживления NGF-насоса в мозг, однако долговременное выдерживание протеина при температуре тела часто приводит к разложению протеина. Также могут возникнуть дополнительные потери вследствие адсорбции протеина камерой насоса по истечении некоторого времени.
В дополнение к проблемам, связанным с введением NGF, существуют также проблемы, связанные с его долговременным хранением с момента получения до введения. Лиофилизация является одним из способов, предназначенных для долговременного хранения биологических протеинов, предотвращающих разложение, агрегацию и/или неспецифическую адсорбцию. Однако процесс лиофилизации сам по себе сопряжен с трудностями. Поскольку объем жидкости уменьшается во время процесса замораживания, эффективная концентрация соли резко возрастает, что может привести к денатурации протеина, снижению эффективной терапевтической активности при восстановлении. Кроме того, образование кристаллов льда во время процесса замораживания может быть причиной денатурации и также снижать эффективное количество имеющегося в распоряжении биоактивного NGF. Следовательно, композиция должна быть такой, чтобы предотвращать флуктуации концентрации соли и минимизировать образование кристаллов льда.
Одним предметом настоящего изобретения является получение водных композиций с NGF, сохраняющих биоактивность в течение по крайней мере одного месяца в диапазоне температур от приблизительно 4oC до приблизительно 40o C.
Еще одним предметом настоящего изобретения является получение композиций с NGF, в которых биоактивность сохраняется после лиофилизации и восстановления.
И еще одним предметом изобретения является создание способов хранения биологически активного NGF в растворе.
Краткое описание изобретения
В настоящем изобретении представлены стабильные
композиции с фактором роста нервов, способные храниться при температурах ниже температуры окружающей среды, при температуре окружающей среды и повышенных температурах без существенных потерь
количества или активности протеина. Композиции представляют собой водные растворы, включающие:
(а) фактор роста нервов;
(б) необязательно биологически приемлемый, водорастворимый
носитель;
(в) достаточное количество биологически приемлемой соли для поддержания изотоничности;
(г) буфер для поддержания рН композиции на уровне от приблизительно 4,5 до
приблизительно 6,0; и
(д) воду.
Другим предметом изобретения являются фармацевтические композиции с NGF, пригодные для лиофилизации.
Фармацевтические
композиции по изобретению, пригодные для лиофилизации, представляют собой водные растворы, включающие:
(а) фактор роста нервов;
(б) биологически приемлемый наполнитель;
(в)
буфер для поддержания рН композиции на уровне от приблизительно 5,5 до приблизительно 6,5;
(д) необязательно биологически приемлемый, водорастворимый носитель; и
(д) воду.
Другими примерами выполнения изобретения являются лиофилизированные композиции, из которых в значительной степени удалена вода. После восстановления с помощью восстанавливающего наполнителя, необязательно включающего биологически приемлемый носитель, лиофилизированные композиции по изобретению пригодны для введения пациентам в случае необходимости терапевтического вмешательства.
Настоящее изобретение также включает способ хранения NGF в водных композициях по изобретению при температурах от приблизительно 4oC до приблизительно 40oC .
Другим примером выполнения изобретения является способ лечения нейронной дисфункции человека, включающий введение терапевтически эффективного количества композиции с NGF по изобретению.
Подробное описание изобретения
Разработка стабильных дозируемых форм для парентерального введения NGF требует оценки множества факторов, включающих путь поступления вещества в
организм, адсорбционные взаимодействия и совместимость с применяемым оборудованием и возможными приспособлениями для доставки. Далее, должны быть рассмотрены стабильность NGF в водных композициях при
температурах ниже температуры окружающей среды, при температуре окружающей среды и повышенных температурах. Одним из примеров выполнения настоящего изобретения является композиция с NGF в водном
растворе, обладающая стабильностью в некотором диапазоне температур и особенно при повышенных (по крайней мере, около 40oC) температурах. Эта композиция включает водный раствор NGF, соль и
буфер, имеющий рН от приблизительно 4,5 до приблизительно 6,0. Композиция, кроме того, необязательно может содержать носитель, это сочетание ингредиентов неожиданно придает исключительно хорошие
характеристики данному раствору, прежде всего в отношении стабильности при повышенных температурах. Также предлагается композиция с NGF, пригодная для лиофилизации. В настоящем изобретении также
предложен способ хранения NGF.
При использовании в описании термин "биологически приемлемый" относится к материалам, характеризующимся отсутствием неблагоприятных биологических эффектов in vivo. "Комнатная температура" соответствует температуре от приблизительно 22oC до приблизительно 25oC. "Температура тела" соответствует температуре от приблизительно 36oC до приблизительно 40oC. "Лиофилизируемая композиция" относится к водной композиции с NGF, которая может быть высушена путем замораживания так, что содержание влаги становится ниже приблизительно 2%, и которая сохраняет по меньшей мере около 70% начальной биоактивности NGF при восстановлении. "Изотоничный" относится к раствору, имеющему приблизительно такое же осмотическое давление, как и сыворотка крови, т.е. приблизительно 300 миллимоль на литр. "Носитель" обозначает любой биологически приемлемый эмульгирующий, диспергирующий агент, поверхностно-активное вещество или протеин, который уменьшает адсорбцию NGF поверхностью.
"NGF" обозначает любую форму фактора роста нервов, предпочтительно субъединицу β фактора роста нервов, которая проявляет биологическую активность и связывается с NGF-рецептором. Термин NGF также включает гибридизированные и модифицированные формы NGF, которые связываются с NGF-рецептором и сохраняют биоактивность NGF. Модифицированные формы NGF могут включать слившиеся протеины, такие как описанные у Iwai S. и др., Chem.Pharm. Bull., 34 : 4724 - 4730, 1986 и у Kanaya E. и др., Gene, 83 : 65 - 74, 1989, и фрагменты NGF, и гибриды, в которых определенные аминокислоты удалены или замещены так, что при этом сохраняется достаточная биоактивность NGF и связывание с рецептором для обеспечения терапевтической активности.
Предпочтительной формой NGF является NGF человека (hNGF - human NGF). Наиболее предпочтительной формой hNGF является рекомибинантный hNGF (rhNGF - recombinant hNGF). Способы получения NGF, пригодного для использования в композициях по изобретению, хорошо известны специалистам в данной области техники. Например, пригодный rhNGF может быть получен с помощью системы экспрессии бакуловируса (Barnett J. и др., Exp.Neurol., 110 : 11 - 24, 1990; ЕРО 370171), системы экспрессии дрожжей (Kanaya E. и др., Gene 83 : 65 - 74, 1989), системы экспрессии клеток млекопитающих (СНО) (Iwane M. и др., . Biochem. Biophys. Res.Comm., 171 : 116 - 122, 1990) или COS-системы экспрессии (Bruce G. и др., Neurobiol. Aging. 10 : 89 - 94, 1989). NGF должен иметь чистоту по крайней мере 65%, предпочтительно по крайней мере 85%, более предпочтительно по крайней мере 95% и наиболее предпочтительно по крайней мере 98%. Чистота выделенного NGF для использования в композициях может быть определена с помощью электрофореза в полиакриламидном геле с додецилсульфатом натрия с окрашиванием серебром или другими способами, известными специалистам в данной области техники.
В водных композиция с NGF по изобретению NGF присутствует в терапевтически эффективных количествах. Предпочтительно концентрация NGF составляет от приблизительно 0,0001 до приблизительно 0,125 вес.% водной композиции, что соответствует диапазону приблизительно от 1 до приблизительно 1250 мкг/мл. Более предпочтительно NGF присутствует в концентрации от приблизительно 0,001 до приблизительно 0,10 вес.% (от 10 до 1000 мкг/мл) водной композиции. Еще более предпочтительно NGF присутствует в концентрации от приблизительно 0,01 до приблизительно 0,10 вес.% (от 100 до 1000 мкг/мл) водной композиции. Наиболее предпочтительно NGF присутствует в концентрации от приблизительно 0,01 до до приблизительно 0,05 вес.% (от 100 до 500 мкг/мл) водной композиции.
Водные композиции с NGF необязательно включают носители. Присутствие носителя в композиции уменьшает или предотвращает адсорбцию NGF различными поверхностями. Потребность в носителе зависит от концентрации NGF в водной композиции. При достаточно высоких ( выше, чем приблизительно 500 мкг/мл) концентрациях NGF достаточное количество NGF сохраняется в растворе, компенсируя потери, происходящие вследствие поверхностной адсорбции. Пригодные носители включают, но не ограничиваются ими, полисорбаты, такие как сывороточный альбумин. Предпочтительным носителем является протеин. Сывороточный альбумин человека (HSA - human serum albumin) является наиболее предпочтительным. Весовое отношение NGF к носителю составляет от приблизительно 0,0001 : 1 до приблизительно 1 : 1. Более предпочтительное весовое отношение составляет от приблизительно 0,01 : 1 до приблизительно 1 : 1. Наиболее предпочтительное весовое отношение NGF к носителю составляет от приблизительно 0,01 : 1 до приблизительно 0,5 : 1. Следовательно, когда в качестве носителя используют HSA, предпочтительная концентрация HSA составляет от приблизительно 0,1 до приблизительно 1,25 вес.% водной композиции (т.е от 1 до 12,5 мг/мл). Предпочтительная композиция включает приблизительно от 0,3 до 0,7 вес. % HSA по отношению к водной композиции, более предпочтительно приблизительно от 0,4 до 0,6 вес.% HSA по отношению к водной композиции. Наиболее предпочтительно композиция включает приблизительно 0,5 вес.% (т.е 5 мг/мл) HSA по отношению к водной композиции.
Композиция с NGF также содержит такое количество биологически приемлемой соли, которое достаточно для поддержания тоничности жидкости. Соль также способствует сохранению NGF в растворе. Предпочтительно композиции с NGF содержат такое количество соли, которое в пределах физиологической пригодности достаточно для изотоничности с человеческой кровью или спинномозговой жидкостью. Предпочтительной солью является хлорид натрия ( NaCl), однако могут быть использованы и другие биологически приемлемые соли, такие как хлорид калия (KCI), хлорид кальция (CaCl)2 и хлорид магния (MgCl)2. Соль может являться одной солью или комбинацией солей. Предпочтительная композиция включает приблизительно от 0,5 до 1,0 вес.% (т.е. от 5 до 10 мг/мл) соли по отношению к водной композиции. Более предпочтительная композиция включает приблизительно от 0,6 до 0,9 вес.% соли по отношению к композиции. Более предпочтительно композиция включает приблизительно от 0,7 до 0,9 вес.% соли по отношению к водной композиции. Наиболее предпочтительная композиция включает приблизительно 0,87 вес.% (т.е. 8,7 мг/мл) соли по отношению к водной композиции.
Далее, композиция с NGF содержит биологически приемлемый буфер для поддержания рН в течение срока хранения. Было установлено, что NGF более стабилен при низких значениях рН. Предпочтительная стабильная композиция с NGF забуферена физиологически приемлемым буфером до рН приблизительно от 4,5 до приблизительно 6,0, а наиболее предпочтительно от приблизительно 5,0 до приблизительно 5,4. Наиболее предпочтительное значение рН композиции равно приблизительно 5,2. Предпочтительным буфером является лимонная кислота, однако можно использовать и другие буферы, способные поддерживать рН в желаемых пределах. Другие пригодные буферы включают уксусную кислоту/ацетат и малеиновую кислоту/малеат. Предпочтительное количество буфера изменяется в зависимости от типа используемого буфера и буферной емкости. Буфер должен присутствовать в композиции в количестве, достаточном для поддержания конечного значения рН композиции в предпочтительном диапазоне значений рН. Предпочтительная концентрация буфера для стабильных композиций с NGF составляет приблизительно от 0,1 до приблизительно 0,3 вес.% водной композиции (от 0,1 до 3,0 мг/мл), более предпочтительная концентрация буфера составляет приблизительно от 0,1 до приблизительно 0,25 вес.% водной композиции (от 1,0 до 2,5 мг/мл) и наиболее предпочтительная концентрация буфера 0,2 вес.% водной композиции (2,0 мг/мл).
Композиция включает воду в количестве, достаточном для достижения соответствующей концентрации компонентов композиции.
Предпочтительные стабильные водные композиции с NGF включает приблизительно от 1 до 1250 мкг/мл NGF, от 1 до 12,5 мг/мл HSA, от 5 до 10 мг/мл NaCl, от 0,2 до 3,0 мг/мл лимонной кислоты и воду, причем значение рН композиции устанавливается на уровне от приблизительно 4,5 до приблизительно 6,0, более предпочтительно приблизительно от 5,0 до приблизительно 5,4. Наиболее предпочтительные стабильные композиции с NGF включают от 10 до 500 мкг/мл NGF, 5 мг/мл HSA, 8,7 мг/мл NaCl, 2,1 мг/мл лимонной кислоты и воду, причем значение рН композиции устанавливается на уровне приблизительно 5,2.
Лиофилизированные композиции по изобретению особенно пригодны для обеспечения долговременно хранения NGF, прежде всего при повышенных температурах. Лиофилизируемые композиции данного изобретения включают NGF, биологически приемлемый наполнитель, буфер для поддержания рН композиции на уровне приблизительно от 5,5 до приблизительно 6,5, необязательно биологически приемлемую соль, необязательно биологически приемлемый водорастворимый носитель и воду.
NGF присутствует в лиофилизируемых композициях приблизительно в том же диапазоне концентраций, как и в водных композициях. Наполнитель обычно обеспечивает механическую опору, позволяющую основе сохранять свою форму в течение и после процесса сушки с замораживанием. В качестве наполнителя могут быть использованы один или более сахаров. Сахара, используемые в настоящем изобретении, включают, но не ограничены ими, моносахариды, олигосахариды и полисахариды. Примеры пригодных сахаров включают, но не ограничены ими, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу и декстран. Сахар также включает спирты из ряда сахаров, такие как маннит, сорбит, инозит, дульцит, ксилит и арабит. В соответствии с настоящим изобретением могут быть использованы также смеси сахаров.
Предпочтительный наполнитель включает комбинацию сахаров. Предпочтительный наполнитель представляет собой комбинацию сахарозы и маннита. Не основываясь на какой-либо теории, можно предположить, что сахароза при охлаждении и последующей лиофилизации образует аморфное стекло, позволяя увеличить потенциальную стабильность протеина (т.е. создает препятствие для агрегации) путем образования молекулярной дисперсии NGF в жестком стекле. Стабильность также может быть увеличена за счет свойства сахара выступать в роли заместителя воды, теряемой при лиофилизации. Молекулы сахара скорее, чем молекулы воды, становятся связанными с протеином через водородные связи. Маннит, будучи смешанным в соотношении 1 : 1 по массе с сахарозой (у которой температура стеклования составляет -36oC), повышает температуру стеклования композиции на 5oC, до - 31oC. Это существенно укорачивает первичное время сушки композиции во время лиофилизации, позволяя при этом образоваться аморфной стекловидной основе, и это считается преимуществом при организации крупномасштабного производства. Другие наполнители, обладающие такими же характеристиками, могут быть использованы для замены одного или обоих указанных сахаров.
Композиции по изобретению, которые должны быть лиофилизированы, предпочтительно имеют более высокое значение рН, чем композиции, которые не лиофилизируют или которые восстанавливают. Наполнители (сахара), которые присутствуют в лиофилизируемых композициях по изобретению, обычно более стабильны при более высоком рН. Предпочтительно значения рН композиции до лиофилизации находятся между приблизительно 5,5 и приблизительно 6,5. Наиболее предпочтительно рН лиофилизируемой композиции с NGF находится между приблизительно 5,8 и приблизительно 6,2. Значение рН наиболее предпочтительной лиофилизируемой композиции NGF составляет приблизительно 6,0. Когда в качестве наполнителя используется сахароза, предпочтительное значение рН лиофилизируемой композиции составляет приблизительно 6,0, так как при более кислом рН сахароза, нередуцирующий дисахарид, гидролизируется до редуцирующих сахаров D-фруктозы и D-глюкозы. Цитратный буфер является наиболее предпочтительным буфером для лиофилизируемых композиций с NGF, но могут быть использованы и другие биологически приемлемые буферы, например малеатный. Предпочтительны буферы, отличные от ацетатного, из-за свойства уксусной кислоты испаряться во время лиофилизации. Необходимо понимать, что может быть необходима регулировка конечного значения рН с помощью кислоты или основания. Любое снижение долговременной стабильности водного NGF вследствие увеличения рН выше приблизительно 6,0, вероятно, может быть преодолено путем увеличения стабильности при лиофилизации NGF.
В идеальном варианте при выборе буфера нужно принимать во внимание возможные сдвиги рН во время лиофилизации, вызванные последовательной кристаллизацией компонентов буфера. Например, при использовании фосфатных буферов щелочной компонент имеет более высокую точку эвтектики, чем кислотный компонент, поэтому он выкристаллизовывается первым и рН падает. Цитратный буфер является предпочтительным, поскольку, вероятно, оба компонента буфера имеют приблизительно одинаковую точку эвтектики, что приводит к очень незначительным флуктуациям рН при снижении температуры. Другие пригодные буферы должны иметь компоненты с одинаковыми или близкими точками эвтектики.
Лиофилизируемые композиции также необязательно включают биологически приемлемую соль. Соль, которая может быть выбрана из тех же солей, применяемых в водных композициях, присутствует в лиофилизируемой композиции в такой же или более низких концентрациях по сравнению с водными композициями. Поскольку концентрация соли может возрастать во время лиофилизации, может оказаться целесообразным снизить концентрацию соли, присутствующей в лиофилизируемых композициях, для предотвращения денатурации протеина, снижение концентрации соли в лиофилизируемой композиции может быть компенсировано во время восстановления таким образом, чтобы придать конечной композиции достаточную изотоничность, пригодную для введения пациенту.
Необязательные лиофилизируемые композиции включают биологически приемлемый водорастворимый носитель. Носители и концентрация носителей, которые могут быть использованы в лиофилизируемых композициях по изобретению, такие же, как и те, которые пригодны для использования в водных композициях по изобретению.
Предпочтительные лиофилизируемые композиции включают приблизительно от 1 до 1250 мкг/мл NGF, от 15 до 45 мг/мл сахарозы, от 15 до 45 мг/мл маннита, необязательно от 7 до 9 мг/мл NaCl и от 0,1 до 0,7 мг/мл лимонной кислоты при значениях рН от приблизительно 5,5 до приблизительно 6,5. Наиболее предпочтительные лиофилизируемые композиции с NGF включают от 100 до 1250 мкг/мл NGF, 30 мг/мл сахарозы, 30 мг/мл маннита, 5 мг/мл сывороточного альбумина человека, необязательно 8,7 мг/мл NaCl и 0,3 мг/мл лимонной кислоты. Наиболее предпочтительное значение рН лиофилизируемой композиции равно приблизительно 6,0.
Лиофилизируемые композиции по изобретению лиофилизируют до содержания остаточной влаги менее, чем приблизительно 2%, однако также рассматриваются композиции, которые сохраняют биологическую активность NGF как при более, так и при менее высоком содержании влаги.
Предпочтительная лиофилизируемая композиция включает от 0,001 до 1,25 частей фактора роста нервов, от 30 до 90 частей сахара и менее приблизительно 1 части воды.
Лиофилизируемую композицию с NGF восстанавливают с помощью растворителя, содержащего буфер, такой как лимонная кислота, и соль, например хлорид натрия, с тем, чтобы образовавшаяся восстановленная композиция оказалась подобной жидкой водной композиции, т.е. включающей приблизительно от 1 до 1250 мкг/мл NGF, от 1 до 12,5 мг/мл HSA, от 5 до 10 мг/мл NaCl, от 0,2 до 3,0 мг/мл лимонной кислоты, от 1,5 до 30 мг/мл сахарозы и от 1,5 до 30 мг/мл маннита при рН 5,2.
Лиофилизированная композиция с NGF по изобретению также пригодна в качестве компонента набора, обеспечивающего удобный и экономный путь получения стабильного лиофилизированного NGF в форме, которую можно быстро и легко восстановить в подходящем носителе для введения пациенту в случае необходимости лечения. Кроме лиофилизированной композиции с NGF такие наборы по изобретению также включают восстанавливающий носитель. Восстанавливающий носитель включает стерильную воду и достаточное количество соли для того, чтобы сделать конечную композицию практически изотоничной. Восстанавливающий носитель, кроме того, может включать дополнительный буфер, общий объем восстанавливающего носителя, присутствующего в наборе, должен быть достаточным для получения конечной концентрации NGF, пригодной для введения пациенту в случае необходимости лечения. В предпочтительном примере выполнения настоящего изобретения предложен набор, включающий две ампулы. Одна ампула содержит стерильную лиофилизированную композицию с NGF по изобретению, в вторая ампула содержит стерильный восстанавливающий носитель. При использовании набора соответствующее количество восстанавливающего носителя добавляют в ампулу, содержащую лиофилизированную композицию с NGF. После разбавления лиофилизированной композиции восстановленная композиция может быть немедленно введена пациенту.
Благодаря долговременной стабильности восстановленной композиции по изобретению также возможно приготовить достаточное количество восстановленной композиции для обеспечения множества доз.
Композиции по изобретению пригодны для лечения пациентов с состоянием, чувствительным к NGF-терапии. Обычно такие композиции стерильны и пригодны для внутривенного, внутримышечного, парентерального и интрацеребровентрикулярного введения. Такая терапия может быть полезна при лечении нейронных дисфункций, включающих повреждение нейронов или дегенерацию чувствительных к NGF нейронов. NGF может быть особенно пригодным для лечения болезни, связанной с потерей центральных холинергических нейронов, такой как болезнь Альцгеймера. NGF как лекарство при болезни Альцгеймера и других форм слабоумия описан в ЕР 0370171.
Композиции по изобретению для слабоумия могут быть введены любым из многочисленных путей в зависимости от конкретной конечной цели. Наиболее пригодный путь введения будет зависеть от цели и конкретного субъекта.
Для устранения трудностей, связанных с преодолением гематоэнцефалического барьера, NGF может быть введен в ЦНС путем прямых интравентрикулярных инъекций или через импрегнированные лекарством имплантаты или насосы. Другим путем введения является непрерывное вливание через интрацеребровентрикулярное устройство с канюлей. В другом варианте для проникновения через гематоэнцефалический барьер может быть необходима конъюгация NGF с молекулами носителя, такого как трансферрин.
Полагают, что терапевтически эффективное количество NGF должно составлять от приблизительно 0,001 до приблизительно 0,5 мг в день, предпочтительно от приблизительно 0,01 до 0,1 мг в день, наиболее предпочтительно от приблизительно 0,02 до приблизительно 0,06 мг в день. Точная доза и схема введения будут зависеть от многих факторов, таких как путь введения и степень поражения пациента, подлежащего лечению.
Процедуры анализа
Идентификация и количественная оценка NGF с использованием жидкостной хроматографии высокого разрешения (ЖХВР) с
обращенной фазой
NGF идентифицировали и подвергали количественной оценке, анализируя образцы объемом 100 мкм с помощью ЖХВР с обращенной фазой (жидкостной хроматограф Hewlett Packard HP 1090),
оснащенный аналитической колонкой с обращенной фазой 300

Идентификацию NGF проводили путем сравнения времени удерживания в образце с соответствующим временем удерживания свежеприготовленного калиброванного стандартного раствора NGF, приготовленного из NGF, взятого из этой же серии. Количество NGF в образцах подсчитывали путем сравнения со стандартной кривой, полученной серийными разбавлениями известных концентраций.
Определение концентрации NGF (мкг/мл) с помощью твердофазного
иммуноферментного анализа (ELISA)
Концентрации NGF также определяли с помощью ELISA. Как стандарты, так и образцы анализировали в трех повторностях. Каждый планшет содержал полную стандартную
кривую NGF и соответствующих контролей без NGF.
После того, как в каждую лунку 96-луночного планшета добавляли 100 мкл покрывающих антител (мышиных моноклональных 24Cl, индуцированных rhNGF), планшеты заворачивали в обертку Saran с влажным бумажным полотенцем и инкубировали в течение ночи в холодильнике при 2 - 8oC. Лунки опорожняли, промывали трижды с использованием самонаполняющегося набора шприцев Wheaton, вводя 250 мкл/на лунку промывочного буфера (содержащего 500 мМ Триса, 2М хлорида натрия, забуференного до рН 7) и высушивали до лепешки. Далее, в каждую лунку добавляли 200 мкл блокирующего буфера (1%-ный раствор бычьего сывороточного альбумина) для блокирования неспецифических сайтов, в каждую лунку добавляли 50 мкл образца и планшеты инкубировали в течение минимум 1 часа при комнатной температуре, перемешивая на планшетном шейкере. Затем лунки снова опорожняли и высушивали до лепешки досуха, после чего добавляли по 50 мкл раствора стандарта и образца. Затем планшеты покрывали и инкубировали в течение 2 часов при комнатной температуре. Лунки планшета вновь опорожняли, промывали четырежды промывочным буфером и высушивали до лепешки. В каждую лунку добавляли пятьдесят (50) мкл биотинилированных антител (мышиных моноклональных 8Cl, индуцированных rhNGF), планшеты покрывали и инкубировали в течение двух часов. Лунки планшетов опорожняли, промывали и высушивали, как указано выше, и в каждую лунку добавляли 50 мкл стрептавидинового конъюгата пероксидазы из хрена. Планшеты покрывали и инкубировали в течение 20 минут при комнатной температуре, перемешивая на планшетном шейкере. Планшеты промывали пятикратно промывочным буфером. Затем в каждую лунку добавляли 50 мкл орто-фенилендиаминного (ОФД) субстратного буфера, планшеты покрывали и инкубировали в темноте в течение 1 часа.
Для определения абсорбции в каждой лунке использовали микропланшетный ридер для определения кинетики максимальной скорости реакции (Vmax) (Molecular Devices, Mountain View). Для определения чистой величины абсорбции каждой лунки из пика абсорбции при 450 нм вычитали фоновую абсорбцию при 650 нм. Концентрацию NGF в образцах определяли путем сравнения со стандартной кривой NGF.
Определение активности NGF
Биоактивность NGF определяли с помощью биоанализа РС-12. Биоанализ РС-12 основан на
увеличении метаболической активности феохромоцитомных клеток РС-12 (Green, Trends Neurosci. 7 : 91, 1986) при экспозиции NGF. Метаболическую активность клеток РС-12 измеряли на основе клеточного
поглощения 3-[4,5-диметилтиазол-2-ил] -2,5-дифенилтетразолийбромида (C18H16N5Br) (МТТ), который превращается с помощью клеточной дегидрогеназы в нерастворимые
внутриклеточные голубые кристаллы.
Каждая лунка 96-луночного планшета содержала приблизительно 30000 клеток РС-12 в 50 мкл среды RPMI-1640 (фирма Sigma). Готовили серийные разбавления каждого образца и стандартов для того, чтобы получить растворы, содержащие от 0,006 до 400 нг rhNGF на 1 мл RPMI-1640 c 0,2%-ным бычьим сывороточным альбумином (БСА). Затем в каждую лунку добавляли пятьдесят микролитров каждого раствора для получения концентраций от 0,003 до 200 нг NGF на 1 мл, и каждую концентрацию анализировали трижды. После выдерживания планшетов в течение двух дней в 5% СО2 при 37oC в каждую лунку добавляли 10 мкг МТТ и планшеты инкубировали еще в течение 4 часов. Затем добавляли один объем 20% додецилсульфата натрия в 50% диметилформамида (ДМФ), рН 4,7, и планшеты обертывали целлофаном, запечатывали внутри пластиковых пакетов и инкубировали в течение ночи при 37oC. На следующий день планшеты считывали с использованием планшетного ридера, Vmax, настроенного на 575 нм. Отношение опытной кривой ED50 к стандартной кривой ED50 NGF позволяло определить относительную эффективность двух препаратов.
ПРИМЕР 1
Композиция с NGF
Готовили водные композиции, содержащие 1, 10, 100 и 1000 мкг/мл rhNGF, 5 мг/мл HSA, 8,7 мг/мл хлорида натрия и 2,1 мг/мл лимонной кислоты и
соответствующее количество воды для получения 10 мл композиции, забуференные до рН 5,2. После растворения лимонной кислоты и соли в приблизительно 70% общего объема рН регулировали с помощью NaOH/HCl,
и добавляли, осторожно перемешивая вместе с водой, HSA и NGF до получения требуемого объема, и композицию фильтровали через фильтр Millipore Millex-GV с размером пор 0,2 микрона.
Используемый для получения композиции rhNGF экспрессировали в клетках насекомых с помощью бакуловирусного экспрессирующего вектора и очищали с помощью ионообменной хроматографии и хроматографии с обращенной фазой, как описано у Barnett J. и др., Exp. Neurol., 110 : 11 - 24, 1990.
ПРИМЕР 2
Стабильность композиций с NGF при 5oC и 25oC
250
мкл аликвотных проб композиции по примеру 1 с концентрацией NGF 100 мкг/мл хранили при 5oC и 25oC (комнатная температура) в полиэтиленовых ампулах с капельницей в течение 6
месяцев. Анализы этих образцов, проведенные с помощью ЖХВР с обращенной фазой, ELISA и биоанализов (описанных выше), показали отсутствие потерь протеина в течение 6 месяцев (таблица 1).
(Результаты, полученные с помощью ЖХВР с обращенной фазой, представляют собой средние значения ± стандартные отклонения по 2 - 4 повторностям. Результаты анализа биологической активности представляют собой средние значения ± 95% доверительные уровни по 3 определениям).
ПРИМЕР 3
Стабильность различных композиций с NGF, хранившихся в полиэтиленовых
катетерах при 37oC
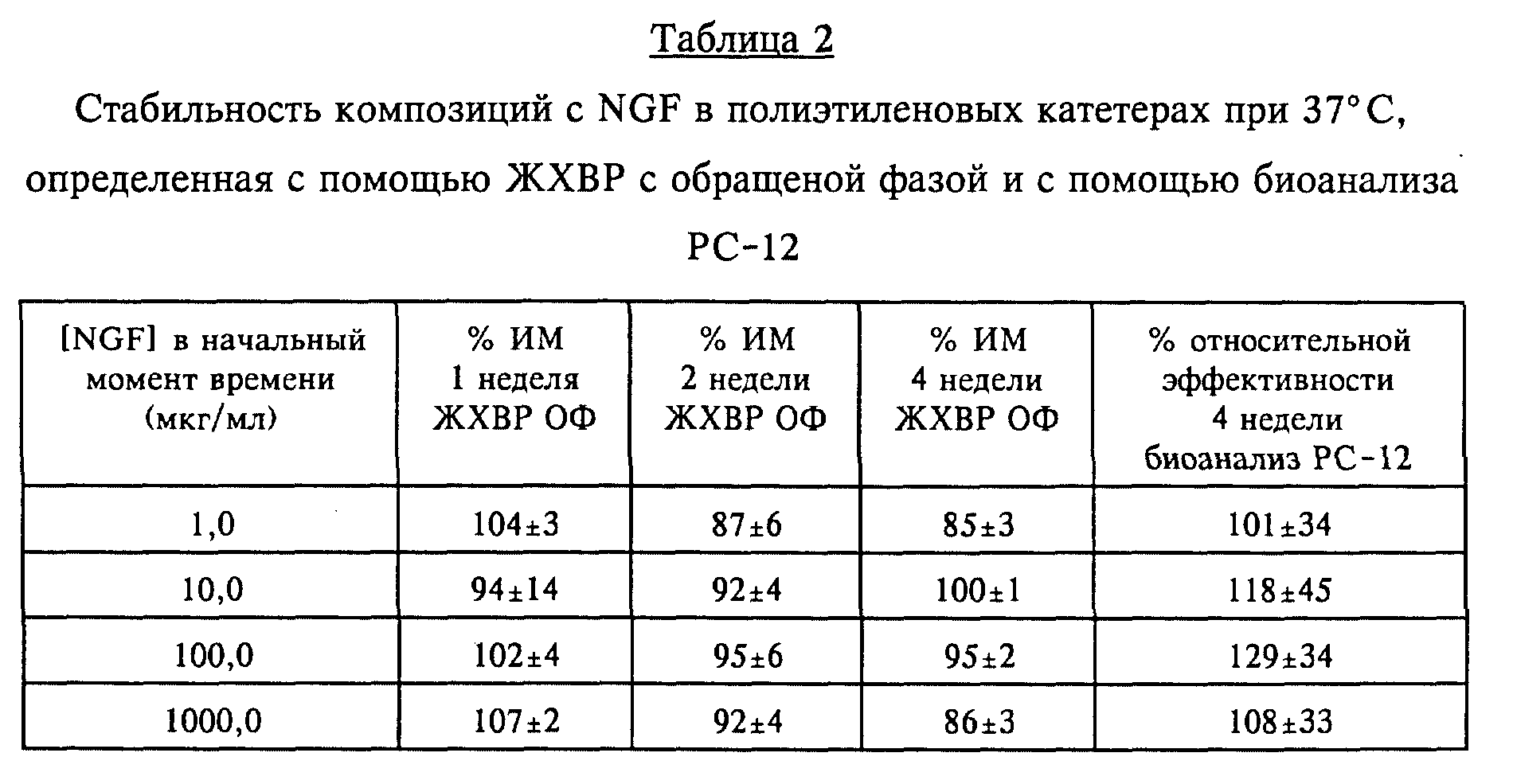
250 мкл аликвотных проб композиций с NGF, содержащих от 1 до 1000 мкг/мл rhNGF, полученных, как описано в примере 1, хранили в не пропускающих излучение
полиэтиленовых катетерах (внутренний диаметр 0,030 дюймов и наружный диаметр 0,048 дюймов) при 37oC в течение до 4 недель.
Результаты, приведенные в таблице 2, свидетельствуют об отсутствии существенного снижения содержания протеина (при измерении ЖХВР с обращенной фазой) или активности NGF (при использовании биоанализа РС-12).
(Результаты, полученные с помощью ЖХВР с обращенной фазой, представляют собой средние значения ± стандартные отклонения по 2 - 4 повторностям. Результаты анализа биологической активности представляют собой средние значения ± 95oC доверительные уровни по 3 определениям).
ПРИМЕР 4
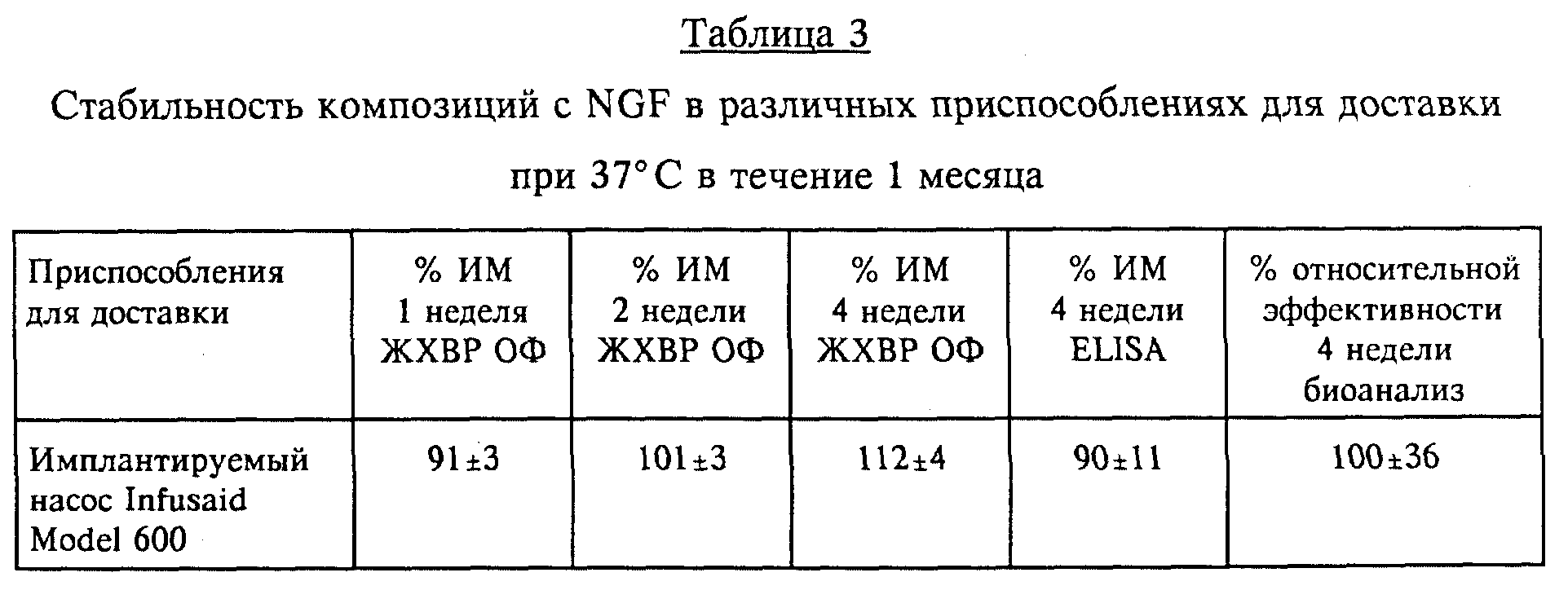
Стабильность композиции с NGF в различных приспособлениях для доставки
Аликвотными пробами композиции по примеру 1 с концентрацией NGF 100 мкг/мл наполняли либо имплантируемый инфузионный насос Infusaid Model 600 (Shiley-Infusaid Inc. , Norwood, MA), либо имплантируемый
инфузионный насос Medtronics Synchromed (Medronics Inc., Minneapolis, NN), либо миниосмотический инфузионный насос Alzet Model 2ML4 (Alza Corp., Palo Alto, CA). Насосы помещали в водяную баню с
температурой 37oC и инициировали выход композиции из насоса. В течение 4-недельного периода времени еженедельно собирали образцы, и анализировали на содержание протеина, и определяли
активность с помощью ЖХВР с обращенной фазой, ELISA и биоанализа РС-12.
Данные, приведенные в таблице 3, показывают, что не обнаружено существенного снижения концентрации или активности NGF.
(Результаты, полученные с помощью ЖХВР с обращенной фазой, представляют собой средние значения ± стандартные отклонения по 2 - 4 повторностям. Результаты анализа биологической активности представляют собой средние значения ± 95% доверительные уровни по 3 определениям, н.о. = не определено).
ПРИМЕР 5
Изучение стабильности
композиций с NGF при рН от 4 до 10
Готовили водные композиции, содержащие 100 мкг/мл NGF, 1 мг/мл HSA и 9 мг/мл хлорида натрия, забуференные до рН 4 - 10, и фильтровали в стерильных условиях
через фильтр с размером пор 0,2 мкм (Millex-GV; Millipore Corp.) по способу, описанному в примере 1. Композиции с рН 4 - 5 забуферивали с помощью ацетата, а композицию с рН 10 забуферивали с помощью
Триса. Аликвотные пробы объемом 1 мл переносили в полипропиленовые ампулы с капельницей, которые затем инкубировали либо при комнатной температуре (от 23oC до 25oC) или при
37oC. Образцы извлекали через различные интервалы времени и анализировали с помощью ЖХВР с обращенной фазой. Константы скорости реакции первого порядка, характеризующие потери NGF из
раствора, представляли в виде графика зависимости от рН. Было установлено, что скорости разложения NGF в растворе возрастают при значениях рН, меньших чем приблизительно 4,5 и при больших чем
приблизительно 6,0. Наиболее высокую стабильность наблюдали при рН 5,2.
ПРИМЕР 6
Стабильность композиций с NGF в зависимости от концентрации носителя
Исследовали
влияние типа и количества носителя на стабильность NGF.
Готовили водные композиции, содержащие 100 мкг/мл, описанные в примере 1, и водные композиции, включающие другие носители, перечисленные в таблице 4. Каждую композицию фильтровали в стерильных условиях через фильтр Millipore Millex-GV c размером пор 0,2 мкм. Стабильность NGF в различных композициях определяли путем инкубирования композиций с NGF в полипропиленовых ампулах с капельницей при 37oC. Спустя 2 недели образцы удаляли и анализировали содержание протеина с помощью ЖХВР с обращенной фазой.
ПРИМЕР 7
Композиция с NGF для лиофилизации
При комнатной температуре готовили водную композицию с NGF, содержащую 100 мкг/мл NGF, 30 мг/мл сахарозы, 30 мг/мл маннита, 5
мг/мл HSA и 0,3 мг/мл лимонной кислоты, получая с помощью NaOH pH 6,0. После растворения лимонной кислоты и сахаров приблизительно в 70% общего объема устанавливали значение рН и добавляли HSA NGF,
осторожно перемешивая вместе с достаточным количеством воды до получения требуемого объема.
ПРИМЕР 8
Лиофилизация композиции с NGF
Изучали стабильность при
лиофилизации водной композиции с NGF по примеру 7. Аликвотные пробы композиций с NGF объемом 1 мл, приготовленные в соответствии с примером 7, помещали в 5 мл стеклянные ампулы типа I, закрытые
лиофилизирующими пробками. Ампулы, содержащие композицию, загружали в сушильную морозильную камеру (FTS Systems Inc.), которую перед началом замораживания устанавливали на 5oC. Затем
температуру камеры снижали до -40oC. После 2-часового выдерживания при -40oC камеру вакуумировали и давление сохраняли на уровне от 80 до 100 мл с постоянным потоком азота.
Температуру постепенно повышали на 4oC в час до тех пор, пока не была достигнута конечная температура сушки 25oC. Приблизительно в течение 30-часового цикла получали конечное
содержание влаги в продукте от 1 до 2%.
Высушенный путем замораживания порошок хранили при 5oC и спустя 3 дня восстанавливали при комнатной температуре с помощью 1 мл растворителя, состоящего из 8,7 мг/мл хлорида натрия и 1,1 мг/мл лимонной кислоты, забуференного до рН. Концентрацию NGF в образцах анализировали с помощью ЖХВР с обращенной фазой. Потерь протеина вследствие лиофилизации обнаружено не было.
ПРИМЕР 9
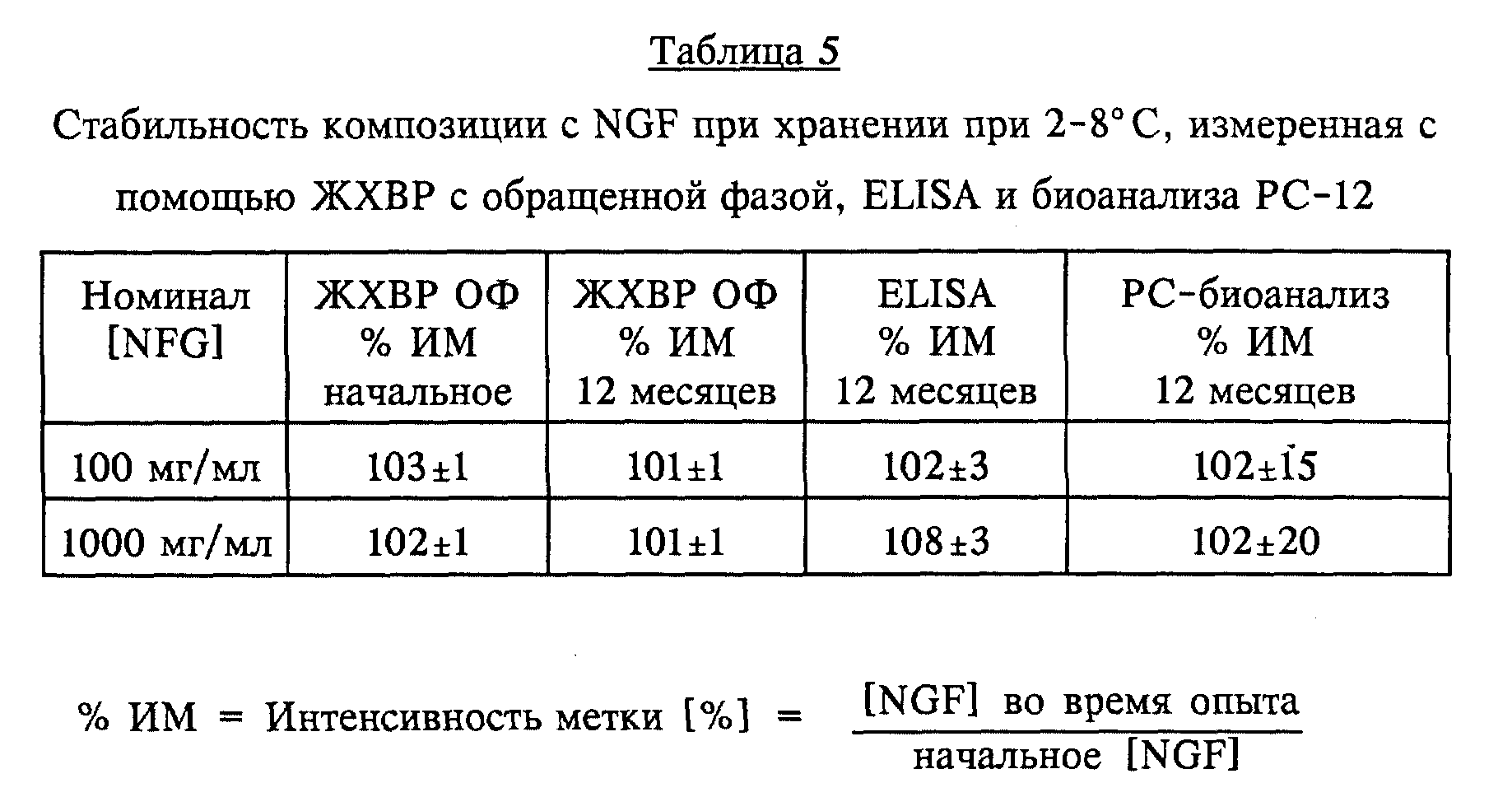
Исследование стабильности композиции с NGF при хранении в стеклянных ампулах при 2 - 8oC
Готовили
водные композиции, содержащие 100 или 1000 мкг/мл rhNGF, в соответствии с процедурой примера 1, за исключением того, что размер порции увеличивали до 1,5 л. Аликвотные пробы объемом 4,2 мл помещали в
ампулы типа I из оптического стекла с покрытыми тефлоном пробками из синтетического бутилкаучука и хранили при 2 - 8oC. Результаты, приведенные ниже в таблице 5, показывают отсутствие
существенного снижения содержания протеина (при измерении с помощью ЖХВР с обращенной фазой и ELISA) или активности NGF (при измерении с помощью биоанализа РС-12).
Идентификация и
количественная оценка NGF с помощью ЖХВР с обращенной фазой
В данном примере 9 использовали следующую процедуру: NGF идентифицировали и количественно оценивали, анализируя образцы объемом 100
мкл с помощью ЖХВР с обращенной фазой (жидкостной хроматограф Hewlett Packard HP 1090), с использованием широкопористого бутила (С4) Bakerbond размером 4 - 6 мм х 250 мм с размером пор 300
После этого использовали процедуру ЖХВР, описанную выше в разделе "Процедуры анализа".
Реферат
Изобретение относится к медицине. Предложены стабильные, водные фармацевтические композиции с фактором роста нервов (NGF) человека в водных изотонических растворах, забуференных для поддержания рН от приблизительно 4,5 до приблизительно 6,0, и необязательно включающие носитель, такой как сывороточный альбумин человека. Также предложены водные композиции с NGF, пригодные для лиофилизации и последующего восстановления, в которых rhNGF смешан с сахарами, необязательно с сывороточным альбумином человека и буфером. Композиции пригодны для применения при лечении болезни Альцгеймера и других нейронных расстройств. Предложенные составы более стабильны. Водные композиции сохраняют биоактивность более длительное время. 3 с. и 11 з.п. ф-лы, 5 табл.

Комментарии