Выбрасываемая жидкость, устройство для выбрасывания, картридж для выбрасывания и способ получения капель жидкости - RU2342947C1
Код документа: RU2342947C1
Чертежи




Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к жидкой композиции, подходящей для получения капель жидкости, содержащей, по меньшей мере, один ингредиент из белков и пептидов, а также к способу получения таких капель и устройству для выбрасывания, в котором применяется такой способ получения капель жидкости.
Предшествующий уровень техники
К настоящему времени предпринято множество попыток использования белкового раствора для получения капель жидкости. Например, при осуществлении способа доставки лекарственных средств в организм, сочли необходимым вводить капли жидкости через слизистую оболочку, например, ввиду преимуществ, заключавшихся в том, что при изготовлении биочипа или биодатчика может потребоваться лишь малый объем белка, вследствие чего белок может легко усваиваться. Кроме того, было уделено внимание способу использования малой капли жидкого белка для управления кристаллизацией белка, а также для рентгеноскопии физиологически активного вещества (см., например, выложенную японскую патентную заявку №2002-355025, Allain LR et al., "Fresenius J. Anal. Chem.", vol. 371, p.146-150, Hodwari Ei and Cachau RE, "Biotechniques", vol. 33, p.1302-1306, 2002).
За последние годы стало возможным массовое производство белков, таких, как ферменты и вещества, обладающие физиологической активностью, по любой технологии, например по технологии генетической рекомбинации. Потому процесс получения белка в виде капель жидкости может оказаться эффективным средством в области исследования, использования и аппликации нового белкового лекарства. Более конкретно, существуют нарастающие и значительные потребности в средствах для снабжения пациентов многими фармацевтическими веществами в виде микрокапель. Микрокапли стали важными при введении белков, пептидов и других биологических материалов через легкие. Иными словами, легкие стали значимым маршрутом введения вместо впрыскивания лекарственного средства на основе макромолекулярных пептидов, примером которого является инсулин, потому что легкие имеют альвеолы, обладающие большими площадями поверхностей порядка 50-140 м2, а эпителий, являющийся барьером поглощения, тонок, имея толщину 0,1 мкм, хотя ферментативные активности легких меньше, чем ферментативные активности желудочно-кишечного тракта.
Вообще говоря, известно, что осаждение микрокапель лекарственного средства в легких зависит в значительной степени от усредненных по массе аэродинамических диаметров этих капель. В частности, доставка микрокапель в альвеолы легких в глубоких участках легких, по существу, требует разработки стабильного фармацевтического препарата, который можно получать с высокой воспроизводимостью при узком распределении размеров частиц капель в диапазоне 1-5 мкм, а также требует разработки формы для введения.
Применительно к способу получения одинаковых капель с узким распределением размеров частиц, в публикациях известного уровня техники (см., например, патент США №5894841 и выложенную японскую патентную публикацию №2002-248171) сообщается об использовании подходящего генератора капель, позаимствованного из генераторов капель, применяемых при струйной печати для получения исключительно мелких капель и аппликации этих капель. В данном случае конкретный способ струйной печати, о котором идет речь, предусматривает направление выбрасываемой жидкости в малую камеру, где на эту жидкость воздействует давление выбрасывания, обеспечивая тем самым выбрасывание капель жидкости из отверстий. Способ выпуска может быть любым из тех, которые известны в данной области техники, например, таким, который предусматривает формирование пузырьков воздуха, выбрасывающих капли через отверстия, выполненные на камере, посредством тепловых измерительных преобразователей, таких, как тонкопленочные резисторы (т.е. способом струйной термопечати), и таким, который предусматривает выбрасывание жидкости прямо из отверстий, выполненных на камере, посредством пьезоэлектрических измерительных преобразователей (т.е. способом пьезоэлектрической струйной печати). Камера и отверстия входят в состав элемента печатающей головки, а этот элемент в таком случае соединен и с источником подачи жидкости и с контроллером для управления выбрасыванием капель жидкости.
Чтобы обеспечить поглощение лекарственного средства легкими, следует обеспечить управление дозой лекарственного средства. Поэтому получение капель жидкости методом струйной печати, предусматривающим возможность регулирования объема выброса этой жидкости, обуславливает весьма предпочтительную конфигурацию. Однако, с другой стороны, выбрасывание раствора в этом случае должно осуществляться наверняка. Но выбрасывание белкового раствора нестабильно, когда управление белковым раствором производится применительно лишь к его поверхностному натяжению и коэффициенту вязкости. Поэтому часто возникают трудности с получением количественно точного выбрасывания.
Проблемы, связанные с процессом получения капель белка или пептида, предусматривающим использование способа струйной печати, возникают из-за того, что третичная структура белка является хрупкой. Так, агрегирование или разложение белка может происходить, когда разрушается его конфигурация. Когда способ получения капель осуществляют с использованием способа струйной печати, структуры многих белков могут становиться нестабильными из-за физического напряжения, такого, как давление или напряжение при сдвиге, либо из-за большой поверхностной энергии, присущей микрокаплям (если применяется способ струйной термопечати, то помимо вышеупомянутого напряжения прикладывается еще и тепло). В частности, в случае способа струйной печати эти физические воздействия намного больше, чем сила сдвига и тепловая энергия, прикладываемые посредством обычного перемешивания или термообработки (например, в случае способа струйной термопечати моментально создаются условия, соответствующие температуре 300°С и давлению 90 атм). Кроме того, некоторые физические напряжения оказываются действующими одновременно, так что стабильность белка может претерпевать значительное снижение по сравнению со случаем обычных манипуляций с белком. С учетом этого обычная технология стабилизации белка может оказаться неудовлетворительной при использовании технологии струйной печати. Если такая проблема существует, то оказывается возможным агрегирование белка в момент получения капель, вследствие чего могут засоряться сопла, а это затрудняет выброс капель.
Кроме того, капли, имеющие диаметры от 1 до 5 мкм, которые подходят для вдыхания в легкие, намного меньше, чем капли, имеющие диаметры 16 мкм и используемые в любом принтере, выпускаемом промышленностью в настоящее время. Следовательно, большее значение поверхностной энергии или напряжения сдвига может быть выражено в первых каплях, а не последних, которые и используются в принтере. Поэтому выбрасывание микрокапель, подходящих для вдыхания белка в легкие, оказывается гораздо труднее.
С учетом вышеописанных диаметров капель, способ струйной термопечати, предусматривающий наличие очень плотно расположенных сопел и малые технологические затраты, предпочтителен для использования в качестве способа выпуска белкового раствора.
В аннотации международной публикации WO 02/094342 раскрыто соединение для регулирования поверхностного натяжения и способ добавления увлажнителя для жидкой композиции с целью легочного поглощения капли, полученной способом струйной термопечати. При этом для увеличения стабильности белка в растворе, поставляемом в виде капель за счет поверхностного натяжения, вязкости или увлажняющего действия раствора, добавляют поверхностно-активное вещество или водорастворимый полимер, например, полиэтиленгликоль.
Однако в упомянутом описании ничего не сказано о стабильности выпуска, и, кроме того, добавление поверхностно-активного вещества или водорастворимого полимера вызывает неудовлетворительные эффекты, когда концентрация белка или пептида увеличивается. В результате, сама добавка часто препятствует достижению стабильности выпуска. Помимо этого существуют многие поверхностно-активные вещества, признанные вовсе не оказывающими влияние, по сравнению с теми, которые какое-то влияние оказывают. Дополнительно стабильность определяется не только поверхностным натяжением и вязкостью. Вследствие этого способ, раскрытый в упомянутом документе, не нашел широкого применения для стабилизации выбрасывания. Поэтому для практического применения в контексте выбрасывания становится существенной любая жидкость, которая обеспечивает возможность стабильного выбрасывания белка или пептида.
Помимо этого в каждом из таких документов, как выложенная японская патентная заявка №2003-144655 и японский патент №03610231, раскрыт способ получения белкового чипа или аналогичного средства как способ использования белка или пептида таким образом, что он выбрасывается посредством способа струйной термопечати. Вместе с тем, по существу, отсутствует описание стабильного выбрасывания белка и пептида.
Как описано выше, способ струйной печати известен в технике как один из способов выбрасывания образца жидкости после получения из нее мелких капель. Этот способ струйной печати имеет характеристический признак демонстрации высокой управляемости объемом выбрасываемой жидкости после ее обеспечения в виде капель даже в случае, если упомянутый объем чрезвычайно мал. Способы выпуска микрокапель, основанные на способе струйной печати, включают в себя вибрационный способ с использованием пьезоэлектрического элемента или аналогичного средства и способ струйной термопечати с использованием микронагревательного элемента. В случае вибрационного способа с использованием пьезоэлектрического элемента или аналогичного средства, уменьшение размера используемого пьезоэлектрического элемента ограничено, да и количество отверстий для выбрасывания, формируемых на единицу площади, также ограничено. Кроме того, с увеличением количества отверстий для выбрасывания на единицу площади растут издержки производства. В противоположность этому, в случае способа струйной термопечати можно сравнительно легко сделать размер микронагревательного элемента меньше, а количество отверстий для выбрасывания на единицу площади можно сделать больше, чем размер микронагревательного элемента и количество отверстий для выбрасывания, соответственно, характерные для вибрационного способа с использованием пьезоэлектрического элемента или аналогичного способа, при этом также можно значительно уменьшить технологические затраты способа.
Когда применяют способ струйной термопечати, существует потребность в координации физических свойств выбрасываемой жидкости для управления состоянием подходящего аэрозоля микрокапель жидкости, выбрасываемой из соответствующих отверстий, а также объемом жидкости. Иными словами, состав жидкости, включая вид и композицию растворителя, и концентрацию растворенного вещества, а также содержание растворителя и растворенного вещества в растворе, следует сделать регулируемыми для получения желаемого объема микрокапли. Помимо этого были также разработаны различные механизмы выпуска капель на основе принципа способа струйной термопечати. В частности, в случае обычной головки для струйной печати, устанавливаемой на принтере, объем каждой капли выбрасываемой жидкости составляет порядка нескольких пиколитров. При этом нужно отметить, что разработаны технологии механизма выбрасывания и способа выбрасывания, обеспечивающие формирование капель имеющими исключительно малые размеры, соответствующие объемам порядка нескольких субпиколитров или фемтолитров (см. аннотацию международной публикации WO 02/092813). Например, когда в качестве цели, покрываемой лекарственным средством, предполагаются соматические клетки размером несколько микрометров, предполагается, что может потребоваться использование исключительно мелких отдельных выбрасываемых капель.
В качестве способа стабилизации белка известен способ, включающий в себя добавление любого из водорастворимых полимеров, такого, как поверхностно-активные вещества, глицерины, углеводороды различных видов и полиэтиленгликоли, а также альбумина. Кроме того, в качестве способов хранения белкового препарата в течение длительного периода известны несколько способов (японский патент №03618633, международная публикация №WO 02/017957 и национальная публикация №2003-510368 переведенной версии заявки РСТ), предусматривающих добавление аминокислот в эритромицин, гранулоцитарный колониестимулирующий фактор (G-CSF) и интерферон. Однако в соответствии с исследованием, проведенным авторами настоящего изобретения на основе вида и концентрации белка или пептида или концентрации добавки, эти способы могут оказаться неудовлетворительными для обеспечения стабильности выбрасывания при осуществлении способа струйной термопечати.
Во многих случаях, по существу, не оказывается влияния на улучшение рабочих параметров выбрасывания, при выбрасывании белка или пептида даже после получения композиции с такими полиолами, как этиленгликоль и глицерин, и таким увлажнителем, как мочевина, которые являются подходящими добавками для чернил, используемых при струйной печати. Поэтому было принято решение разработать выбрасываемую жидкость для стабильного выбрасывания белкового раствора или пептида на основе принципа способа струйной печати с использованием тепловой энергии.
Краткое изложение существа изобретения
Настоящее изобретение направлено на разработку: жидкой композиции в качестве жидкости, предусматриваемой для стабильного выпуска капель и содержащей, по меньшей мере, один ингредиент из белков и пептидов, посредством способа струйной печати на основе принципа способа струйной печати с использованием тепловой энергии; а также способа выбрасывания и устройства для выбрасывания, подходящих для использования при выбрасывании капель белка.
Выбрасываемая жидкость, согласно настоящему изобретению, является жидкостью, которую выбрасывают из отверстия с использованием тепловой энергии и которая содержит: соединение, выбранное из группы гуанидина, и жидкое вещество.
Картридж для выбрасываемой жидкости, согласно настоящему изобретению, содержит: емкость, в которой хранится выбрасываемая жидкость; и головку для струйной термопечати.
Жидкостной ингалятор, согласно настоящему изобретению, содержит вышеописанный картридж и отверстие для выбрасывания, предназначенное для введения выбрасываемой жидкости из части головки, выбрасывающей жидкость для струйной термопечати картриджа в ингаляционную часть тела пользователя.
Способ получения капель жидкости, согласно настоящему изобретению, включает в себя приложение тепловой энергии к жидкости, содержащей, по меньшей мере, один ингредиент из белков и пептидов, для обеспечения жидкости в виде капель, и отличается тем, что эта жидкость содержит соединение, имеющее группу гуанидина.
В соответствии с настоящим изобретением, соединение, содержащее группу гуанидина, добавляют в раствор, содержащий, по меньшей мере, один ингредиент из белков и пептидов, так что при осуществлении способа получения капель жидкости путем приложения к ней тепловой энергии происходит стабильное выбрасывание выбрасываемой жидкости. Кроме того, добавление поверхностно-активного вещества в выбрасываемую жидкость может вызвать синергический эффект применительно к стабильности выбрасывания, тем самым обеспечивая выбрасывание белкового раствора с большей концентрацией. Когда, по меньшей мере, один ингредиент из белков и пептидов является терапевтическим компонентом, выбрасываемой жидкости можно придать вид капель путем выпуска из портативного устройства для выбрасывания таким образом, что можно вдыхать через легкие, по меньшей мере, один ингредиент из белков и пептидов, предусматриваемых в качестве терапевтического компонента, эффективный, когда его вдыхают через легкие. Кроме того, можно использовать выбрасываемую жидкость, когда ее выбрасывают на подложку, для изготовления биочипа и биодатчика, а также рентгеноскопии биологического вещества.
Краткое описание чертежей
На фиг.1 представлена условная схема, иллюстрирующая способ нанесения белка на подложку.
На фиг.2 представлена иллюстрация одного рисунка для расположения белка на подложке.
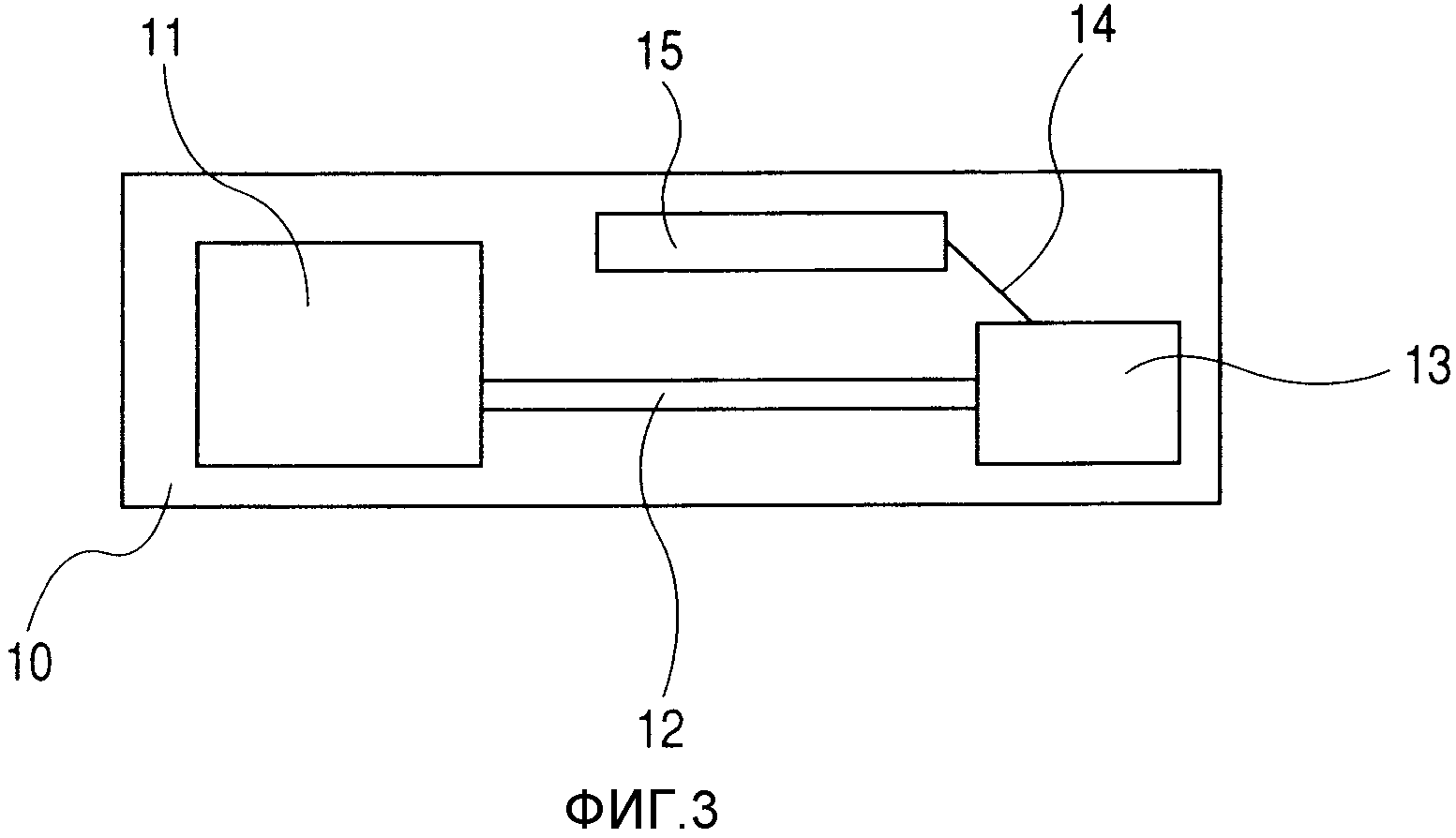
На фиг.3 представлена условная схема, иллюстрирующая блок картриджа ингаляционной головки.
На фиг.4 представлено перспективное изображение ингалятора.
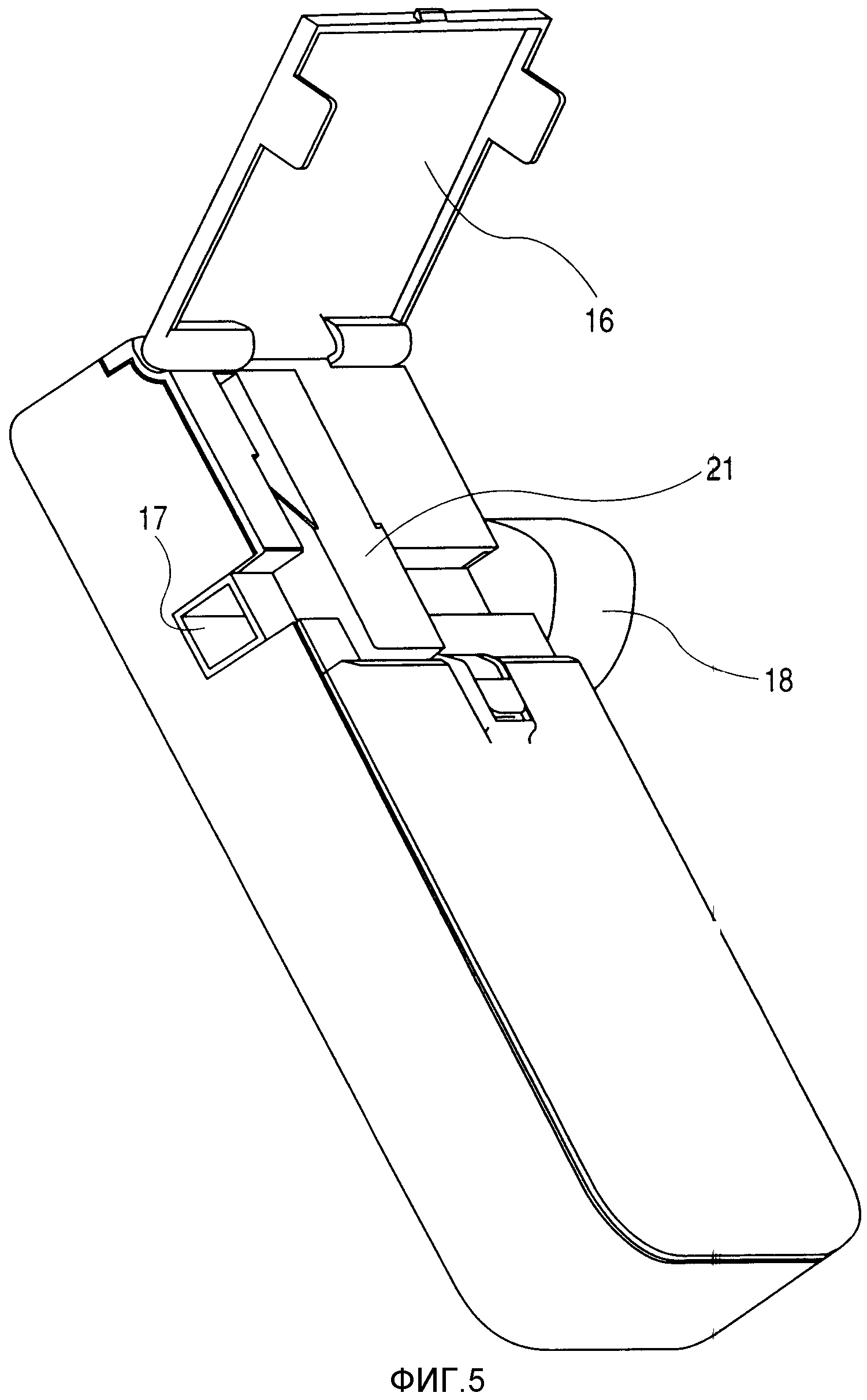
На фиг.5 представлено перспективное изображение состояния, в котором крышка, обеспечивающая доступ и показанная на фиг.4, открыта.
На фиг.6 приведено графическое представление объема выброса раствора альбумина, когда его выбрасывают с использованием способа струйной печати.
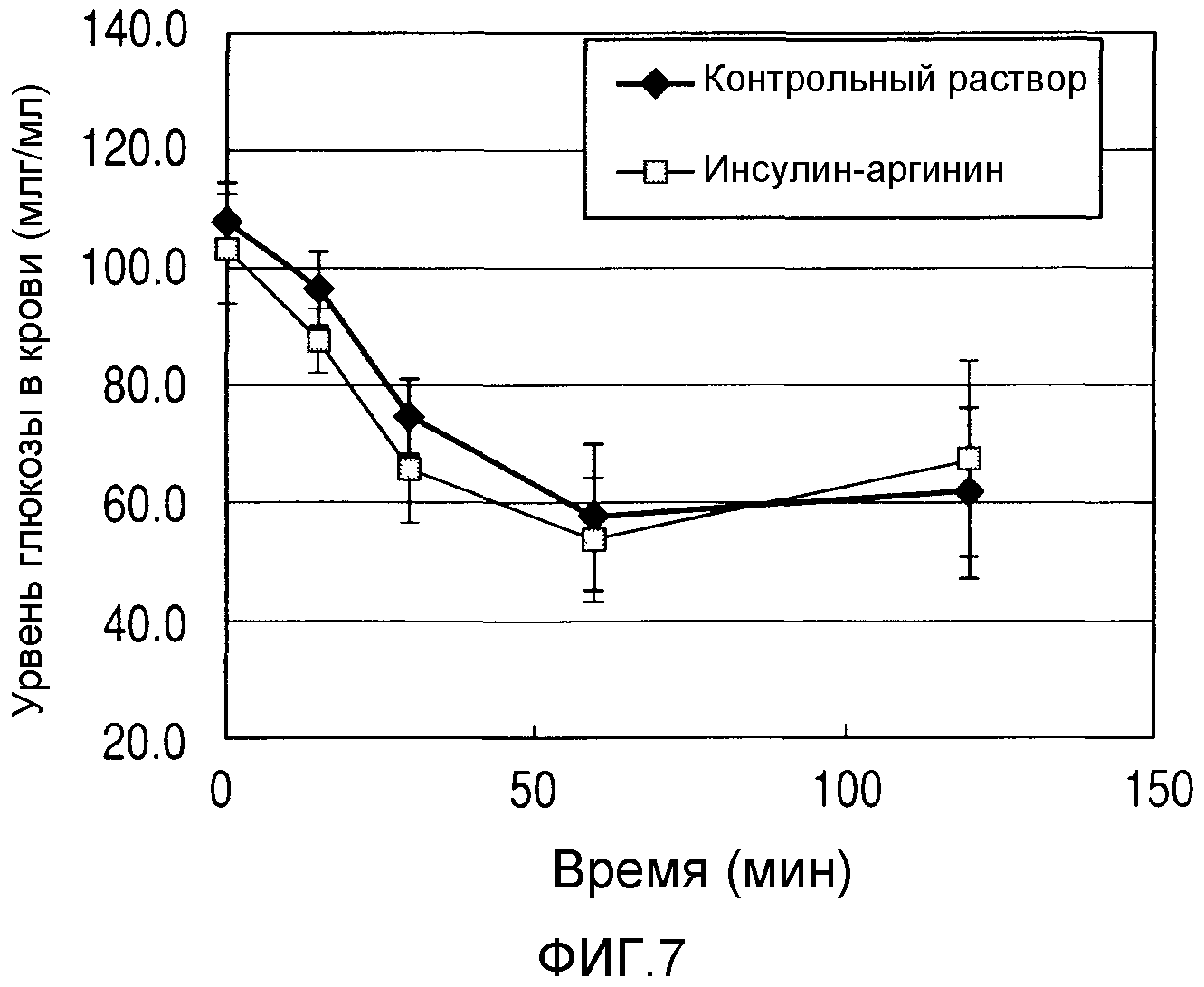
На фиг.7 приведено графическое представление уровней глюкозы в крови крыс в зависимости от времени в случае введения инсулина.
На фиг.8 приведено графическое представление объема раствора инсулина, когда его выбрасывают с использованием способа струйной печати.
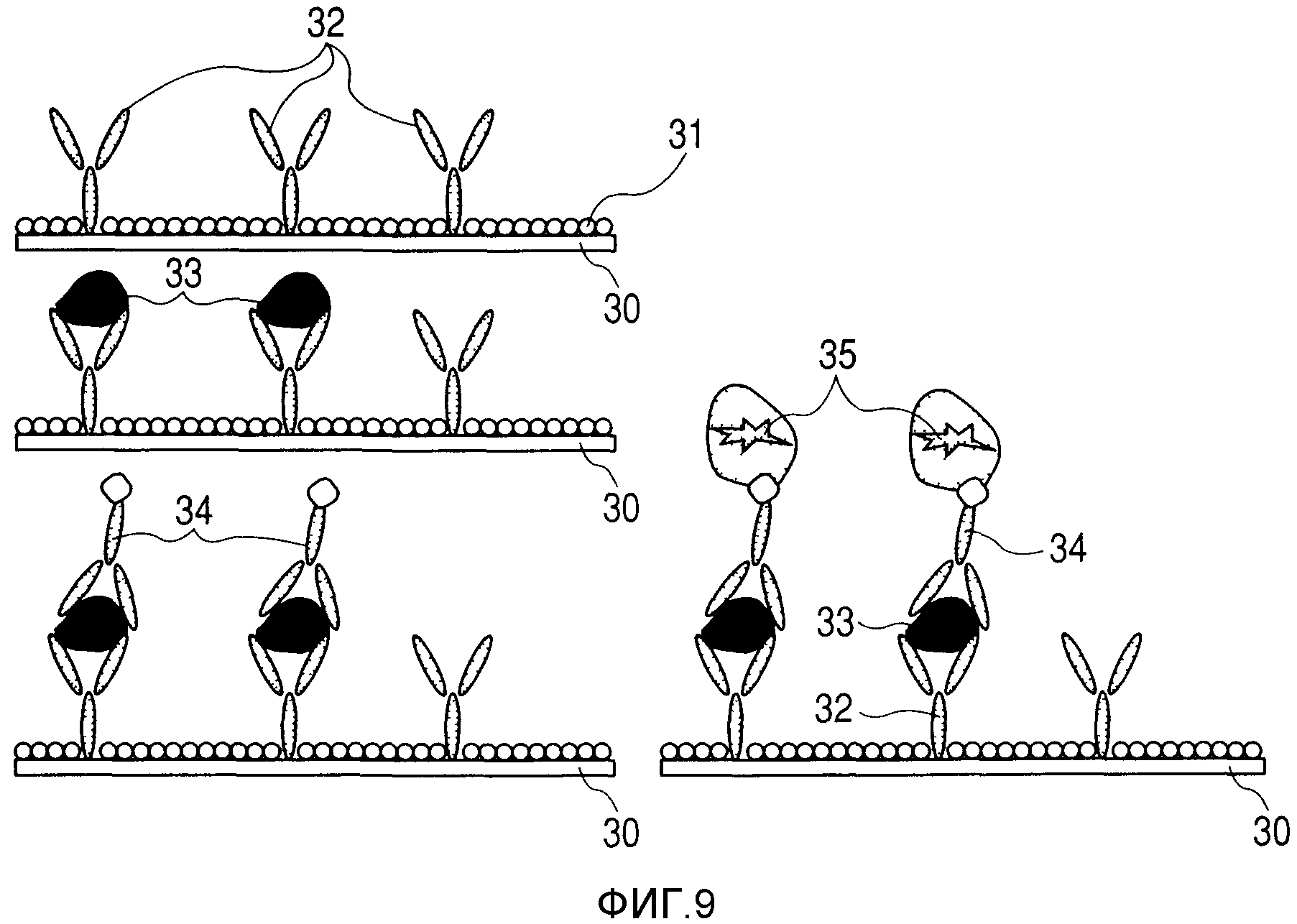
На фиг.9 представлена диаграмма модели экспериментального способа согласно примеру.
Лучший вариант осуществления изобретения
В том смысле, в каком он употребляется в настоящем изобретении, термин "белок (белки)" относится к любому полипептиду, в котором некоторое количество аминокислот связано друг с другом пептидными связями и который растворен или диспергирован в водном растворе. Кроме того, в том смысле, в каком он употребляется в настоящем изобретении, термин "пептид (пептиды)" относится к пептиду, в котором от двух или более до 50-ти или менее аминокислот связаны друг с другом пептидными связями. Эти белки и пептиды могут быть химически синтезированными или полученными путем очистки тех, которые существуют в природе. Как правило, они могут быть рекомбинантами натуральных белков и пептидов. Вообще говоря, белки и пептиды можно химически модифицировать путем ковалентного связывания остатков аминокислот с молекулами белка и пептида таким образом, что становится возможным продление их терапевтических эффектов с достижением интенсификации их эффектов. При воплощении настоящего изобретения можно использовать различные виды белков и пептидов, капли которых желательно получить. В той степени, в какой они способны оказывать физиологическое воздействие на живые организмы, на белки и пептиды, которые можно использовать в настоящем изобретении, ограничения, по существу, не накладываются. В наиболее типичном случае получение капель белков и пептидов, согласно настоящему изобретению, служит для доставки белков и пептидов, которые полезны в качестве средств лечения легких. Их примеры включают в себя: кальцитонины; факторы свертывания крови; различные гемопоэтические факторы, такие, как гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-микрофаго-коллониестимулирующий фактор (GM-CSF), колониестимулирующий фактор (CSF), эозинофилпероксидаза (EPO), гранулоцитарно-микрофаго-мегакариоцитостимулирующий фактор (GM-MSF), а также CSF-1; интерлейкины, такие, как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11 и IL-12; инсулиноподобные факторы роста (IGFs); цитокины, такие, как микрофаго- колониестимулирующий фактор (M-CSF), тимозин, фактор некроза опухоли (TNF) и фактор торможения лейкемии (LIF). Белки, обладающие другими терапевтическими эффектами, включают в себя вазоактивные пептиды, интерфероны (альфа-, бета-, гамма- и обычный интерферон), факторы и гормоны роста, такие, как гормоны роста человека и другие гормоны роста животных, например гормоны роста крупного рогатого скота, свиней и птиц, инсулин, окситоцин, ангиотензин, метионинэнкефалин, вещество Р, ЕТ-1, фибробластный фактор роста (FGF), кератоцитарный фактор роста (KGF), эпидермальный фактор роста (KGF), инсулиноподобный фактор роста (IGF), тробмоцитарный фактор роста (PDGF), люлиберин (рилизинг-фактор лютеинизирующего гормона (лютропина)) (LHRH), рилизинг-фактор гормона роста (GHRH), фолликулостимулирующий гормон (FSH), десмопрессинацетат (синтетический аналог гипофизарного гормона 8-аргинин-вазопрессина) (DDAVP), паращитовидный гормон (PTH), вазопрессин, глюкагон и соматостатин. Можно также использовать ингибиторы протеазы, включая лейпептин, пепстатин, и такие ингибиторы металлопротеиназы, как ингибиторы металлопротеиназы в тканях (TIMP-1 и TIMP-2). Можно также использовать факторы роста нервов, такие, как мозговой невротический фактор (BDNF) и NT3. Кроме того, можно также использовать такие активаторы плазминогенов, как активатор плазминогенов в тканях (tPA), урокиназа и стрептокиназа. Можно также использовать любую часть пептида, которая содержит всю основную структуру белка-предшественника или ее часть и сохраняет, по меньшей мере, часть биологических характеристик белка-предшественника. Можно также использовать любое из вышеуказанных веществ, модифицированных аналогами, такими, как замещенные или дефектные аналоги, модифицированными аминокислотами, такими, как пептидные аналоги, и водорастворимыми полимерами, такими, как полиэтиленгликоль (PEG) и поливинилацетат (PVA).
Кроме того, для производства биочипа или биодатчика и использования при рентгеноскопии белков и пептидов, помимо вышеописанных белков и пептидов, можно также использовать вышеописанные вещества, модифицированные любым из различных ферментов, таких, как оксидаза, редуктаза, трансфераза, гидраза, лиаза, изомераза, синтетаза, эпимераза, мутаза и разеаза, различные антитела, такие, как иммуноглобулин G (IgG) и иммуноглобулин Е (IgE) и их антигены, а также белки и пептиды для диагностического применения, такие, как аллерген, шаперонин, авидин и биотин, и иммобилизующие вещества.
Любой белок или пептид в выбрасываемой жидкости может быть имеющим молекулярную массу от 0,3 килодальтона (кДа) до 150 кДа. Содержание, по меньшей мере, одного ингредиента, выбранного из белков и пептидов, который выбран в зависимости от назначения, предпочтительно находится в диапазоне от 1 мкг/л до 200 мг/л, а более предпочтительно - от 0,1 мг/л до 60 мг/л.
Вообще говоря известно, что выбрасывание чернил способом струйной печати можно улучшить за счет добавления поверхностно-активного вещества или растворителя, такого, как полиэтиленгликоль. Вместе с тем, авторы изобретения обнаружили, что когда выбрасывается белковый или пептидный раствор, нельзя признать, что улучшение выбрасываемости достигается лишь за счет этого добавления, и может потребоваться дополнительная добавка.
В нижеследующем описании настоящее изобретение будет охарактеризовано, главным образом, применительно к конфигурации, предусматривающей использование способа струйной термопечати, потому что способ струйной термопечати демонстрирует наиболее значимое улучшение выбрасываемости. Когда начали применять способ струйной термопечати, понадобилось малогабаритное устройство, способное привлечь малыми затратами на его производство и увеличенным количеством более плотно расположенных выбрасывающих сопел, а также обуславливающее необходимость частой замены головки новой головкой. При таких обстоятельствах, как описано выше, в которых часто используется настоящее изобретение, использование способа струйной термопечати может оказаться предпочтительным. В результате интенсивных исследований, авторы настоящего изобретения обнаружили, что белковый или пептидный раствор, добавленный в соединение, имеющее группу гуанидина, пригоден для стабильного получения капель способом струйной печати.
Соединение, имеющее группу гуанидина, может вносить вклад в стабильность выбрасывания. Причина этого до сих пор не выявлена, но считается, что возможно следующее объяснение.
Группа гуанидина имеет плоскую структуру, на которой часть аминогруппы действует как донор водорода, образуя водородную связь, а верхняя и нижняя поверхности плоскости молекулы несут π-электроны, сохраняя гидрофобность. Кроме того, пептидные связи между белками или пептидами могут и не иметь существенных различий между собой даже в случае водородной связи с группой гуанидина или водородной связи в качестве связующего звена между водой и пептидом. Помимо этого, поскольку группа гуанидина имеет гидрофобную часть, эта гидрофобная часть группы гуанидина и гидрофобная часть белка или пептида могут взаимодействовать друг с другом, а часть аминогруппы при этом образует водородную связь с водой, тем самым, обуславливая повышение растворимости денатурированного белка или пептида в воде и препятствуя взаимодействию между белками и пептидами. Такое действие может предотвратить денатурацию и агрегирование белка или пептида, обуславливаемые энергией, генерируемой во время выпуска способом струйной термопечати, что приводит к стабилизации выбрасывания.
Исследования, проведенные авторами настоящего изобретения, подтвердили, что когда способ струйной термопечати обеспечивает выбрасываемый белок или пептид в концентрации, достаточной для демонстрации эффективной биоактивности, выбрасывание почти не наблюдается, если молекулярная масса белка или пептида составляет 3000 или более при частоте выбрасывания, составляющей 20 кГц, хотя это явление и зависит от типа или концентрации белка или пептида.
При осуществлении настоящего изобретения, возбуждение головки для струйной термопечати обычно проводят на низкой частоте возбуждения. Причина разных стабильностей выбрасывания в зависимости от частот возбуждения заключается в том, что выбрасываемая жидкость может нагреваться нагревателями в головке для струйной термопечати, вследствие чего часть белка или пептида может становиться нерастворимой в воде, предотвращая перенос энергии из нагревателя в раствор. Когда частота возбуждения является низкой, даже если и окажется возможным временное создание нерастворимых веществ, они снова растворятся за период времени, проходящий до последующего возбуждения. С другой стороны, когда частота возбуждения является высокой, восстановление растворимости может оказаться неудовлетворительным, в результате чего может уменьшиться стабильность выбрасывания. Однако для того, чтобы обеспечить выбрасывание большого количества раствора, выбрасывание следует проводить с высокой частотой, находящейся на некотором уровне или превышающей его. Поэтому в настоящем изобретении частота возбуждения предпочтительно находится в диапазоне от 1 кГц до 100 кГц, а более предпочтительно - в диапазоне от 1 кГц до 30 кГц.
Соединение, имеющее группу гуанидина и используемое в настоящем изобретении, предпочтительно является одним из тех, каждое из которых представляется нижеследующей общей формулой (1).

В формуле (1), на каждый из радикалов R1-R4 конкретные ограничения не накладываются, поскольку он представляет собой любую комбинацию групп, которая дает структуру, способную обеспечить сохранение соединением своей растворимости в воде, и каждый из радикалов R1-R4 предпочтительно является независимо от других атомом водорода, полярной функциональной группой, углеводородной группой, или ацильной группой. Примеры подходящих полярных функциональных групп включают в себя аминогруппу, гидроксильную группу, карбоксильную группу, сульфогруппу, альдегидную группу и нитрогруппу. На количество атомов углерода в углеводородной группе конкретные ограничения не накладываются, поскольку оно не меньше 1, а предпочтительно составляет от 1 до 18. Примеры подходящих углеводородных групп включают в себя метиловую, этиловую, пропиловую, изопропиловую, н-бутиловую, изобутиловую, трет-бутиловую, н-пентиловую, неопентиловую, н-гексиловую, изогексиловую, н-гептиловую, н-октиловую, н-нониловую, н-ундециловую, н-додециловую, н-тридециловую, н-тетрадециловую, н-гексадециловую, н-гептадециловую, н-октадециловую, виниловую, аллиловую, циклопентиловую, циклогексиловую, олеиловую, линоиловую, линолениловую и фенильную группы. Каждая из углеводородных групп может быть замещена, по меньшей мере, одним заместителем из атома галогена, ацильной группы и полярной функциональной группы, или может включать в себя ненасыщенную связь. Кроме того, каждая из углеводородных групп может включать в себя, по меньшей мере, одну из простоэфирной связи, сложноэфирной связи и амидной связи. Помимо этого можно использовать полимер, в котором каждое из упомянутых соединений может быть предусмотрено в виде одиночного элементарного звена, и можно использовать поверхностно-активное вещество, содержащее в своей структуре любое из упомянутых соединений. Соединение, имеющее группу гуанидина, предпочтительно имеет молекулярную массу 59-1000, а более предпочтительно - 59-300. Это соединение предпочтительно является соединением, обладающим растворимостью в воде более 0,01 мас.% в нейтральной области (рН=5,5-8,5).
Из соединений, каждое из которых имеет группу гуанидина, предпочтительные соединения включают в себя производные аргинина, каждое из которых представлено общей формулой (2), описываемой ниже. Аргинин полезен в качестве добавки потому, что он является одной из аминокислот, а его производное оказывает малое влияние на живой организм.

В той степени, в какой возможно сохранение их растворимости в воде, радикалы R5-R9 могут образовывать любую комбинацию. Радикал R5 представляет собой натуральный углеводород, имеющий 1-6 атомов углерода, причем этот углеводород может быть насыщенным или ненасыщенным.
Каждый из радикалов R6-R9 независимо от других является атомом водорода, углеводородной группой или ацильной группой. Каждый из этих радикалов может включать в себя простую эфирную связь, сложноэфирную связь или амидную связь. На количество атомов углерода в углеводородной группе конкретные ограничения не накладываются, поскольку оно не меньше 1, а предпочтительно составляет от 1 до 18. Примеры подходящих углеводородных групп включают в себя метиловую, этиловую, пропиловую, изопропиловую, н-бутиловую, изобутиловую, трет-бутиловую, н-пентиловую, неопентиловую, н-гексиловую, изогексиловую, н-гептиловую, н-октиловую, н-нониловую, н-ундециловую, н-додециловую, н-тридециловую, н-тетрадециловую, н-гексадециловую, н-гептадециловую, н-октадециловую, виниловую, аллиловую, циклопентиловую, циклогексиловую, олеиловую, линоиловую, линолениловую и фенильную группы.
На количество атомов углерода в углеводородной цепи ацильной группы конкретные ограничения не накладываются, поскольку оно не меньше 1, а предпочтительно составляет от 1 до 18. Примеры подходящих ацильных групп включают в себя формиловую, ацетиловую, пропиониловую, бутириловую, валериловую, оксалиловую, малониловую, сукциниловую, безноиловую, акрилоиловую, метакрилоиловую, кротониловую, капроиловую, каприлоиловую, лауроиловую, миристоиловую, пальмитоиловую, стеароиловую и олеоиловую группы.
Кроме того, каждая из этих углеводородных групп R5-R9 может быть замещена, по меньшей мере, одной функциональной группой, выбранной из атома галогена, ацильной группы, гидроксильной группы, карбоксильной группы, сульфогруппы, альдегидной группы, амидной группы, аминогруппы и нитрогруппы, или может включать в себя, по меньшей мере, одну из простоэфирной связи, сложноэфирной связи и амидной связи.
Атом галогена может быть одним из атомов фтора, хлора, брома и йода. Часть атомов водорода или все атомы водорода, входящие в состав гидроксильной группы, карбоксильной группы, амидной группы и аминогруппы, могут быть замещены углеводородными группами.
Помимо этого можно использовать соли соединений, каждое из которых представлено формулой (2). Кроме того, можно использовать полимер, в котором каждое из упомянутых соединений может быть предусмотрено в виде одиночного элементарного звена, и можно использовать поверхностно-активное вещество, содержащее в своей структуре любое из упомянутых соединений.
Из производных аргинина, более предпочтительные соединения включают в себя аргинин, сложный метиловый эфир аргинина, сложный этиловый эфир, Nα-ациларгинин и их соли, а наиболее предпочтительные соединения включают в себя аргинин, Nα-ациларгинин и их соли.
Концентрация соединения, имеющего группу гуанидина, при добавлении предпочтительно составляет 0,01-30 мас.%, более предпочтительно - 1-20 мас.%, хотя она зависит от типа и концентрации белка или пептида.
В настоящем изобретении обнаружено, что стабильное выбрасывание можно сохранить посредством совместного добавления соединения, имеющего группу гуанидина, и поверхностно-активного вещества, даже если концентрация добавок существенно уменьшена. Добавляемый объем соединения, имеющего группу гуанидина, можно сделать составляющим от половины до десятой доли раствора, имеющего ту же концентрацию белка, добавляя 0,2-1 массовую часть поверхностно-активного вещества на одну массовую часть соединения, имеющего группу гуанидина. Воздействия поверхностно-активного вещества отличаются от воздействий соединения, имеющего группу гуанидина, и могут включать в себя действие предотвращения денатурации белка и действие повторного растворения агрегированного белка для стабилизации выбрасывания. Комбинация этих двух разных воздействий может привести к синергическому эффекту, который дает существенное повышение стабильности выбрасывания. Отдельно взятое поверхностно-активное вещество может не гарантировать стабильность выбрасывания, так как оно может оказаться не в состоянии предотвратить агрегирование белка ввиду недостаточности упомянутых действий.
В том смысле, в каком термин "поверхностно-активное вещество" употребляется в настоящем изобретении, он обозначает соединение, имеющее и полярную часть, и неполярную часть в одной молекуле, а также обладающее характеристическим признаком, заключающимся в том, что эти части находятся в своих соответствующих разных локальных областях в молекуле, вследствие чего поверхностно-активное вещество уменьшает два поверхностных натяжения в несмешиваемой корреляции посредством молекулярной компоновки на поверхности раздела, и поэтому становится возможным образование мицеллы.
В частности, типичные примеры используемых поверхностно-активных веществ включают в себя - но не в ограничительном смысле - следующие: сорбитановый сложный эфир жирной кислоты, такой, как сорбитанмонокаприлат, сорбитанмонолаурат или сорбитанмонопальминат; N-ациламинокислоту поверхностно-активного вещества, имеющего аминокислоту в гидрофильной группе, такую, как глицин жирной N-кислоты кокосового масла, жирная N-глутаминовая кислота кокосового масла или N-лауроиловая глутаминовая кислота; соль жирной кислоты аминокислоты; глицериновый сложный эфир жирной кислоты, такой, как глицеринмонокаприлат, глицеринмономиристат или глицеринмоностеарат; полиглицериновый сложный эфир жирной кислоты, такой, как декаглицеринмоностеарат, декаглицериндистеарат или декаглицеринмонолинолат; полиоксиэтиленсорбитановый сложный эфир жирной кислоты, такой, как полиоксиэтиленсорбитанмонолаурат, полиоксиэтиленсорбитанмоностеарат, полиоксиэтиленсорбитанмонопальмитат, полиоксиэтиленсорбитантриолеат или полиоксиэтиленсорбитантристеарат; полиоксиэтиленсорбитный сложный эфир жирной кислоты, такой, как полиоксиэтиленсорбиттетрастеарат или полиоксиэтиленсорбиттетраолеат; полиоксиэтиленглицериновый сложный эфир жирной кислоты, такой, как полиоксиэтиленглицеринмоностеарат; полиэтиленгликолевый сложный эфир жирной кислоты, такой, как полиэтиленгликольдистеарат; полиоксиэтиленалкиловый простой эфир, такой, как полиоксиэтиленлауриловый простой эфир; полиоксиэтиленполиоксипропиленалкиловый простой эфир, такой, как полиоксиэтиленполиоксипропиленгликолевый простой эфир, полиоксиэтиленполиоксипропиленпропиловый простой эфир или полиоксиэтиленполиоксипропиленцетиловый простой эфир; полиоксиэтиленалкилфенильный простой эфир, такой, как полиоксиэтиленнонилфенильный простой эфир; отвержденное в полиоксиэтилене касторовое масло, такое, как полиоксиэтиленовое касторовое масло, отвержденное в полиоксиэтилене касторовое масло (гидрированное в полиоксиэтилене касторовое масло); полиоксиэтиленовое производное пчелиного воска, такое, как полиоксиэтиленсорбитный пчелиный воск; производное полиоксиэтиленланолина, такое, как полиоксиэтиленланолин; поверхностно-активное вещество, имеющее гидрофильно-липофильный баланс (ГЛБ) 6-18, такое, как полиоксиэтиленамид жирной кислоты (например, полиоксиэтиленстеарамид); аниооногенное поверхностно-активное вещество, такое, как алкилсульфат, имеющий 8-18 атомов углерода (например, цетилсульфат натрия, лаурилсульфат натрия или олеилсульфат натрия); сульфат полиоксиэтиленалкилового простого эфира, имеющий среднее число дополнительных молей этиленоксида от 2 до 4 и 8-18 атомов углерода в алкильной группе (например, полиоксиэтиленлаурилсульфат натрия); алкилбензолсульфонат, имеющий 8-18 атомов углерода, такой, как лаурилбензолсульфонат натрия; алкилсульфосукцинат, имеющий 8-18 атомов углерода в алкильной группе, такой, как лаурилсульфосукцинат натрия; природное поверхностно-активное вещество, такое, как лецитин или глицерофосфолипид; сфингофосфолипид, такой, как сфингомелин, и сложный эфир сахарозы и жирной кислоты сложного эфира жирной кислоты, имеющий 8-18 атомов углерода. Эти поверхностно-активные вещества добавляют по отдельности или в комбинации из двух или более типов в выбрасываемую жидкость (жидкие композиции) согласно настоящему изобретению.
Предпочтительные поверхностно-активные вещества включают в себя полиоксиэтиленсорбитановый сложный эфир жирной кислоты, N-ациламинокислоту и соли жирных кислот аминокислот, а конкретно предпочтительные поверхностно-активные вещества включают в себя полиоксиэтилен-20-сорбитанмонолаурат, полиоксиэтилен-(4)-сорбитанмоноолеат, глицин жирной N-кислоты кокосового масла, жирную глутаминовую кислоту жирной N-кислоты кокосового масла, N-лауроилсаркозин и соль аргинина/жирной кислоты кокосового масла. Из них, наиболее предпочтительные поверхностно-активные вещества включают в себя полиоксиэтилен-20-сорбитанмонолаурат, полиоксиэтилен-20-сорбитанмоноолеат и соль аргинина/жирной кислоты кокосового масла. Кроме того, предпочтительными для ингаляции легких являются полиоксиэтилен-20-сорбитанмонолаурат и полиоксиэтилен-20-сорбитанмоноолеат.
Поверхностно-активное вещество можно добавлять, например, в концентрации от 0,001 мас.% до 20 мас.% в случае инсулина, хотя эта концентрация зависит от сосуществующего белка или аналогичного средства. Кроме того, поверхностно-активное вещество предпочтительно добавляют в концентрации от 0,1 до 1,0 массовой части на одну массовую часть соединения, имеющего группу гуанидина.
В настоящем изобретении возможно смешивание белка с аминокислотами, а поверхностно-активное вещество можно примешивать заранее или непосредственно перед выбрасыванием. Предпочтительным является получение их однородной смеси перед выбрасыванием.
В вариантах осуществления настоящего изобретения, для устранения микробных воздействий можно добавлять антимикробный агент, гермицидный агент и антисептический агент. Примеры этих агентов включают в себя: фенольные производные, такие, как фенол, крезол и анизол; четвертичные соли аммония, такие, как бензалконийхлорид и бензатонийхлорид; бензойные кислоты, такие, как сложный эфир бензойной кислоты и параоксибензойной кислоты; и сорбиновую кислоту.
В некоторых вариантах осуществления настоящего изобретения, для повышения физической стабильности при консервации можно добавлять любое из таких веществ, как масло, глицерин, этанол, мочевина, целлюлоза, полиэтиленгликоль и альгинат. Кроме того, для оценки химической стабильности можно добавлять аскорбиновую кислоту, лимонную кислоту, циклодекстрин, токоферол или любой другой антиокислительный агент.
Для регулирования рН выбрасываемой жидкости можно добавлять любой буфер. Примеры буфера, который можно использовать, включают в себя аскорбиновую кислоту, лимонную кислоту, разбавленную соляную кислоту и разбавленный едкий натр, а также включают в себя другие буферы, такие, как кислый фосфат натрия, дигидрогенфосфат натрия, дигидрогенфосфат калия, сополимер стирола и бутадиена (PBS), 2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту (HEPES) и трис(гидроксиметил)аминометан (Tris).
В качестве изотонизирующего агента можно добавлять аминоэтилсульфоновую кислоту, хлорид калия, хлорид натрия, глицерин или бикарбонат натрия.
В качестве ароматизирующего агента можно добавлять любое из веществ, являющихся полисахаридами, такими, как глюкоза и сорбит, подслащивающими веществами, такими, как аспартам, ментол и различные душистые вещества.
Когда вышеописанную выбрасывающую жидкость используют для производства биочипа или биодатчика или для рентгеноскопии белка, можно воспользоваться системой, почти такой же, как выпускаемый в настоящее время промышленностью струйный принтер.
Подробности будут описаны со ссылками на фиг.1. Посредством емкости 1, выбрасываемая жидкость заполняет сопло головки 3 для струйной печати. Выбрасываемая жидкость 4 выбрасывается за счет возбуждения головки для струйной печати под управлением контроллера 6 возбуждения, при этом расстояние между подложкой и поверхностью сопла головки для струйной печати поддерживается постоянным. Позиция 2 обозначает путь потока жидкости. За счет выпуска с получением рисунка изображения, на подложке можно формировать рисунок. Однако в альтернативном варианте предпочтительным оказывается формирование рисунка из пятен, не связанных друг с другом, как показано на фиг.1.
Кроме того, раствор, содержащий контрольное вещество, выбрасывается с получением того же рисунка на подложке для инициирования эффективной реакции между подложкой и контрольным веществом, или этот раствор можно выбрасывать с изменениями в концентрации за счет изменения выбрасываемого объема контрольного образца.
Когда вышеописанную выбрасывающую жидкость используют для вдыхания легкими, обязательным является устройство, выполненное с возможностью выпуска состава дозы, согласно настоящему изобретению, в форме капель, имеющих малое распределение размеров частиц от 1 до 5 мкм. Часть головки, предназначенная для выпуска капель, представляет собой отсоединяемый блок картриджа. Блок картриджа включает в себя следующие части. Он будет описан со ссылками на фиг.3. Картридж 10 имеет емкость 11, которая заполнена лекарственным средством, проточный канал 12 жидкости для подачи лекарственного средства в точку испарения, расположенную рядом с отверстием (отверстием для выброса), часть 13 головки (выпускающую жидкость часть) для выпуска выпускаемой жидкости и проводку 14, включающую в себя электрическую соединительную часть 15, с контроллером. Подробности части 13 головки соответствуют головке для выбрасывания жидкости, описанной в выложенной японской патентной заявке №2003-154665.
Ингалятор, рассматриваемый в качестве контроллера выбрасывания, предоставляет пользователю возможность носить его и владеть им, а также выполнен с возможностью выпуска постоянного объема лекарственного средства в форме капель, имеющих одинаковый размер частиц, и поэтому предоставляет пользователю возможность вдыхать лекарственное средство.
Теперь, со ссылками на фиг.4 и 5, будет описана условная конфигурация ингалятора, используемого в настоящем изобретении.
На фиг.4 представлено перспективное изображение, иллюстрирующее внешний вид ингалятора, при этом позиция 20 обозначает тело ингалятора, позиция 16 обозначает крышку, обеспечивающую доступ, а тело и крышка образуют корпус. Позиция 19 обозначает источник электропитания. На фиг.5 крышка, обеспечивающая доступ, показана открытой. Когда крышка, обеспечивающая доступ, открыта, можно увидеть блок 21 картриджа головки и мундштук 18. Когда пользователь осуществляет вдох, воздух может попадать в мундштук через воздухозаборник 17, а затем - смешиваться с лекарственным средством, выбрасываемым из отверстия для выбрасывания, выполненного в части головки блока 21 картриджа головки, после чего воздух движется вперед к выходному отверстию мундштука в форме, обеспечивающей распыление его человеком. Пользователь вставляет наконечник мундштука в рот, а потом удерживает его зубами, после чего следует всасывание на вдохе. Таким образом, можно достичь эффективного вдыхания раствора лекарственного средства, который выбрасывается в форме капель из выбрасывающей жидкость части блока головки картриджа.
Кроме того, можно выполнить блок 21 картриджа головки закрепляемым с возможностью открепления на ингаляторе, если это необходимо.
При наличии конфигурации, показанной на фиг.4 и 5, сформировавшиеся микрокапли могут естественным путем достигать горла и попадать внутрь трахеи пациента, которому они вводятся, с вдыхаемым воздухом. Следовательно, можно управлять объемом распыляемой жидкости (дозой активного ингредиента) независимо от объема вдыхаемого воздуха.
Примеры
Чтобы можно было лучше понять трудности, возникающие при выбрасывании белкового раствора, перед приведением примера представлены объемы выброса, когда способом струйной термопечати выбрасывается только белок. Используемый белковый раствор представлял собой альбумин, растворенный в сополимере стирола и бутадиена (PSB), а выбрасывание при каждой концентрации осуществляли с помощью струйного принтера для термопечати (торговая марка PIXUS-950i, производится фирмой Canon Inc.), представлявшего собой изделие, модернизированное для сбора раствора. В отличие от этого объемы выброса соответствующих растворов альбумина представлены относительно объема одновременно выбрасываемого PSB-буфера, который по определению составляет 100%. Результаты показаны на фиг. 6.
Стабильность оказывается не полной даже тогда, когда концентрация альбумина составляет всего 1 мкг/мл. Выбрасывание постепенно затрудняется по мере роста концентрации белка. При осуществлении настоящего изобретения, выбрасываемые капли должны иметь меньшие размеры, так что выбрасывание белкового раствора может оказаться трудным.
Далее будет приведено более подробное описание настоящего изобретения со ссылками на примеры. Эти примеры являются конкретными примерами, приводимыми для достижения углубленного понимания, так что настоящее изобретение вовсе не ограничивается этими конкретными примерами. В нижеследующем тексте символ "%" обозначает "мас.%".
Примеры 1-8 и сравнительные примеры 1-30
Получение капель белкового раствора способом струйной термопечати
Процедуру приготовления выбрасываемой жидкости проводили таким образом, что сначала альбумин растворяли в PBS-буфере при подходящей концентрации, а затем перемешивали, добавляя при этом соединение, содержащее группу гуанидина, после чего регулировали концентрации соответствующих веществ до достижения предварительно определенных постоянных уровней с помощью PBS-буфера.
Перед этим картридж головки, имеющий диаметр сопел, равный 3 мкм, и используемый для эксперимента, заполняли 30-процентным водным раствором этанола. Затем измерительное устройство лазерного дифракционного типа, предназначенное для установления распределения размеров частиц (SprayTech, производится фирмой Malvern Co., Ltd.), использовали для измерения размеров частиц и установления распределения размеров частиц с целью обнаружения капель, имеющих распределение размеров частиц с резким пиком на 3 мкм.
Вышеописанный картридж головки, имеющий диаметр сопел, равный 3 мкм, заполняли выбрасываемой жидкостью заранее, а потом соединяли с котроллером выбрасывания, после чего осуществляли выбрасывание в течение 1 секунды на частоте 20 кГц при напряжении 2В с интервалом 3 секунды до последующего выбрасывания. Эту процедуру повторяли 50 раз, после чего визуально контролировали, произошло ли выбрасывание. В случае, когда выбрасывание происходило 50 раз или более, оценивали, обозначая значком о, случай, когда выбрасывание происходило менее 50 раз, оценивали, обозначая значком Δ, а случай, когда выбрасывание происходило менее 15 раз, оценивали, обозначая значком x. Кроме того, на выбрасываемой жидкости перед ее выбрасыванием и после него проводили анализ методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (условия анализа: устройство - колонка от JASCO Corp.модели YMC-Pack Diol-200,500×8 мм (внутренний диаметр); растворитель для элюирования - 0,1-молярный KH2PO4-K2HPO4 (pH 7,0), содержащий 0,2-молярный NaCl; расход - 0,7 мл/мин; температура - 25°С; обнаружение - в ультрафиолетовом излучении при длине волны 215 нм) для наблюдения за изменением композиции выбрасываемой жидкости.
В качестве сравнительных примеров, приготавливали выбрасываемые жидкости с использованием чистой воды, растворов различных белков и веществ, отличающихся от тех, которые применяются для настоящего изобретения, а затем провели эксперимент так, что соответствующие жидкости выбрасывались таким же образом, как жидкости согласно примерам. При этом составы, исследованные в качестве примеров и сравнительных примеров, а также результаты этих исследований, перечислены в нижеследующей таблице 1.
Выбрасывание чистой воды согласно сравнительному примеру 1 происходило без прерываний ввиду отсутствия белка в чистой воде. Однако в каждом из сравнительных примеров 2-23 и 25-30, которые предусматривали наличие белка, выбрасывание не происходило вовсе или было незначительным независимо от вида белка и присутствия или отсутствия добавок. Когда добавляли поверхностно-активное вещество Tween 80, как показано в сравнительном примере 14, наблюдалась некоторая степень выбрасывания, но стабильность его оказалась неудовлетворительной. Кроме того, когда концентрацию добавляемого Tween 80 увеличивали, в отличие от предыдущей ситуации выбрасывание не наблюдалось вовсе. С другой стороны, в каждом из сравнительных примеров 1-8 выбрасывание осуществлялось нормально и было стабильным. В результате анализа методом ЖХВР, в каждом из примеров 1-8 не были выявлены изменения в положении пика и области пика перед выбрасыванием и после него, а также не было выявлено изменение в композиции жидкости.
Примеры 9-31
Эффекты различных белков и концентраций добавок
Затем выбрали аргинин в качестве соединения, имеющего группу гуанидина, а потом добавляли его в определенных концентрациях в различные белки. Эти выбрасываемые жидкости оценивали так же, как выбрасываемую жидкость согласно примеру 1 в тех же условиях эксперимента по выбрасыванию. При этом составы, исследованные в упомянутых примерах, а также полученные результаты перечислены в нижеследующей таблице 2.
Благодаря упомянутым концентрациям и типам белков добавление аргинина дало возможность нормального выбрасывания соответствующих белков способом струйной термопечати, несмотря на различие в требуемых концентрациях при добавлении. Поэтому подтвердился тот факт, что аргинин может влиять на широкое множество белков. Кроме того, в примерах, где наблюдалось нормальное выбрасывание, был проведен анализ методом ВЭЖХ. В результате выяснилось, что на графике пика не было изменений перед выбрасыванием и после него, а затем подтвердилось отсутствие изменений в композиции жидкости.
Пример 32
Подтверждение фармакологической активности
В композиции, показанной в примере 10, исследовали фармакологическую активность композиции перед выбрасыванием и после него. В качестве эксперимента, самцам крыс Wistar в возрасте 8-ми недель, имевших вес тела около 250 г, не давали есть в течение одних суток, а затем анестезировали нембуталом, после чего брали у них кровь из хвостовой вены. Это состояние считалось базисным. После этого осуществляли выбрасывание раствора, имевшего композицию согласно фиг.10, способом струйной термопечати и собирали упомянутую композицию, а потом делали подкожную инъекцию дозой 1,6 ед./кг, после чего брали кровь из хвостовой вены животного через 15, 30, 60 и 120 минут после введения. Собранную кровь центрифугировали, а полученную сыворотку затем подвергали измерению содержания глюкозы в крови (по 6 животных в группе). Раствор инсулина при отсутствии какой-либо добавки, который не подвергался выбрасыванию способом струйной термопечати, тестировали аналогичным образом, а потом использовали в качестве контрольного. Образцы введенного раствора согласно примеру 10, выбрасывание которых осуществляли способом струйной термопечати, исследовали, чтобы определить наличие или отсутствие фармакологических изменений из-за изменений уровней глюкозы в крови. Результаты показаны на фиг.7.
В результате эксперимента, уровни глюкозы в крови крыс, которым вводили инсулин, сразу же уменьшались. Следовательно, наблюдения подтвердили, что инсулин вызывает эффект снижения уровней глюкозы в крови. В отличие от этого, при осуществлении наблюдений в соответствии с контрактом выяснилось, что состав согласно фиг.10, выбрасывание которого осуществляли способом струйной термопечати, также продемонстрировал аналогичный эффект снижения уровней глюкозы в крови. Что касается эффекта снижения уровней глюкозы в крови, то в каждой точке наблюдения не было обнаружено значимых различий со сравнительным примером. Подтвердилось, что даже после выпуска подобного струе чернил состава согласно примеру 10 его активность сохранилась.
Пример 33
Эффективность выбрасывания
Осуществляли выбрасывание раствора, содержащего инсулин в концентрации 1,0 мг/мл, способом струйной термопечати, а затем оценивали объем выброса на предмет наличия или отсутствия добавки, чтобы подтвердить воспроизводимость выбрасывания.
Выбрасываемыми растворами были: раствор (аргинин/инсулин), приготовленный путем добавления аргинина концентрации 1,0 мг/мл в раствор инсулина; раствор (Tween 80/инсулин), приготовленный путем добавления Tween 80 концентрации 1,0 мг/мл в раствор инсулина; и раствор, содержащий только инсулин концентрации 1,0 мг/мл. Выбрасывание этих растворов осуществляли с помощью струйного принтера (торговая марка PIXUS-950i, производится фирмой Canon Inc.), представлявшего собой изделие, модернизированное для сбора раствора. Объем выброса одновременно выбрасывавшейся чистой воды по определению составлял 100%. На фиг.8 показан график объема выброса каждого раствора. Эксперимент проводили на каждом растворе 5 раз. Показаны средние значения и стандартные отклонения.
Объем добавляемого раствора с инсулином был малым или вообще нулевым, а эффективность выбрасывания была очень низкой. Объем добавляемого раствора с инсулином в Tween 80 составлял около 40% по отношению к объему чистой воды. Однако в этом случае не было воспроизводимости из-за изменений в объемах выброса. С другой стороны, добавляемый раствор с инсулином в аргинине демонстрировал почти такой же объем выброса, как в случае выбрасываемой чистой воды, а также демонстрировал высокую воспроизводимость. При одновременном выбрасывании, объем выброса добавляемого раствора с инсулином в аргинине в 100 раз или более превышал объем выброса добавляемого раствора только с инсулином. Кроме того, он примерно в 2,5 раза превышал объем выброса добавляемого раствора с инсулином в Tween 80. Следовательно, подтвердился тот факт, что эффективность выбрасывания весьма значительно возросла.
Примеры 34-52
Синергический эффект соединения, имеющего группу гуанидина, с поверхностно-активным веществом
Приготавливали выбрасываемые жидкости таким образом, что поверхностно-активное вещество добавляли в добавляемый раствор с соединением, имеющим группу гуанидина в белке. Полученные выбрасываемые жидкости оценивали посредством такого же эксперимента по выбрасыванию, как эксперимент в примере 1. При этом составы, исследованные в качестве примеров, и полученные результаты, перечислены в нижеследующей таблице 3.
Когда аргинин и Twine 80 добавляли одновременно, оказалось возможным выбрасывание белкового раствора при предельно меньшей концентрации, чем концентрация добавляемого раствора только с аргинином. Кроме того, выбрасывание осуществляли с концентрацией, при которой выбрасывание добавляемого раствора только с аргинином было невозможно. Помимо этого объемы добавок были значительно уменьшены в целом. Кроме того, стало возможным выбрасывание высококонцентрированного белкового раствора с синергическим эффектом. В результате осуществления анализа методом ЖХВР в каждом из примеров 19 - 24 выяснилось, что на графике пика не было изменений перед выбрасыванием и после него, и не было обнаружено изменений в композиции жидкости.
Пример 53
Изготовление биочипа с использованием впрыскивающего принтера и измерения
На фиг.9 показана модель этого примера. На фиг.9, позиция 30 обозначает подложку, позиция 31 обозначает маскирующее вещество, а позиция 32 обозначает вещество (такое, как белок или пептид), которое должно особым образом реагировать с контрольным веществом, позиция 33 обозначает контрольное вещество, позиция 34 обозначает вещество, специфичное для контрольного вещества, а позиция 35 обозначает метку, причем все обозначенные позициями вещества представлены условно.
Приготавливали каждое из человеческого моноклонального антитела IL2, человеческого моноклонального антитела IL4 и человеческого моноклонального антитела IL6 в концентрации 0,1-500 мкг/мл в PBS. При этом для приготовления выбрасываемой жидкости добавляли L-аргинин до 1% (в весовом отношении). Получаемым раствором наполняли головку принтера (торговая марка PIXUS-950i, производится фирмой Canon Inc.), а затем выбрасывали на скользящее стекло, покрытое поли-L-лизином.
Стекло после выбрасывания инкубировали при 4°С, а затем маскировали инкубированное стекло 1%-ным N,O-бис(триметилсилил)ацетамидом (BSA). После маскирования, стекло очень тщательно промывали, а затем обеспечивали его использование в качестве подложки с антителом для чипа.
Вещества для чипов и контроля - рекомбинанты IL2, IL4 и IL6 в концентрации 1 мкг/мл каждый - приготавливали в PBS с 1,0%-ным (в весовом отношении) L-аргинином, 0,5%-ным (в весовом отношении) Tween 20 и 0,1%-ным (в весовом отношении) BSA, соответственно. Раствором наполняли головку струйного принтера (торговая марка PIXUS-950i, производится фирмой Canon Inc.), а затем выбрасывали на вышеописанную подложку с теми же рисунками. После выпуска, на подложку устанавливали покрывающее стекло и давали прореагировать при 4°С.Продукт реакции очень тщательно промывали, а потом сушили.
После этого подложку подвергали реакции с веществом, которое специально наносили на образец, а потом метили это вещество. Каждый из растворов антител, которые были помечены биотином в качестве веществ, специально наносимых на образец (бионинилированные человеческое моноклональное антитело IL2, человеческое моноклональное антитело IL4 и человеческое моноклональное антитело IL6) приготавливали в PBS так, чтобы их окончательная концентрация достигала 1 мкг/мл вместе с 1,0%-ным (в весовом отношении) L-аргинином, 0,5%-ным (в весовом отношении) Tween 20 и 0,1%-ным (в весовом отношении) BSA, после чего этим раствором наполняли головку струйного принтера (торговая марка PIXUS-950i, производится фирмой Canon Inc.), а затем выбрасывали на вышеописанную подложку с теми же рисунками. После выпуска, на подложку устанавливали покрывающее стекло и давали прореагировать при 4°С. Продукт реакции очень тщательно промывали, а потом сушили.
Для маркировки, стрептавидин, меченый Cy3, приготавливали в PBS в окончательной концентрации 10 мкг/мл с 1,0%-ным (в весовом отношении) L-аргинином, 0,5%-ным (в весовом отношении) Tween 20 и 0,1%-ным (в весовом отношении) BSA, после чего этим раствором наполняли головку струйного принтера (торговая марка PIXUS-950i, производится фирмой Canon Inc.), а затем выбрасывали на вышеописанную подложку с теми же рисунками. После выпуска, на подложку устанавливали покрывающее стекло и давали прореагировать при 4°С. Продукт реакции очень тщательно промывали, а потом сушили.
После этого, направляли возбуждающий свет на подложку после реакции, а затем измеряли уровень сигнала флуоресценции по отношению к эмиссии Су3 с использованием сканера флуоресценции, на котором был расположен фильтр, имевший длину волны пропускания, составлявшую 532 нм. Затем проводили обнаружение сигналов флуоресценции, зависящих от типов и концентраций образцов.
В этой заявке выдвигаются притязания на приоритет японских патентных заявок №2004-279864, поданной 27 сентября 2004 г., и 2005-252154, поданной 31 августа 2005 г., причем обе они упоминаются здесь для справок.
Реферат
Изобретение относится к области медицины и направлено на обеспечение стабильности регулируемого выбрасывания белкового раствора или пептида с получением желаемого объема микрокапли. Этот результат обеспечивается за счет того, что, согласно изобретению, предложена выбрасываемая жидкость, которую можно стабильно выбрасывать способом струйной термопечати с использованием тепловой энергии даже в случае наличия, по меньшей мере, одного ингредиента из белков и пептидов, а также предложены способ и устройство, обеспечивающие выпуск жидкости, содержащей, по меньшей мере, один ингредиент из белков и пептидов, и предусматривающие использование упомянутой выбрасываемой жидкости. По меньшей мере, одно соединение, имеющее группу гуанидина, добавляют в водный раствор, по меньшей мере, одного ингредиента из белков и пептидов для улучшения его качеств на случай выбрасывания способом струйной термопечати с использованием тепловой энергии. 4 н. и 5 з.п. ф-лы, 9 ил., 3 табл.

Формула
Документы, цитированные в отчёте о поиске
Аэрозольные препараты пептидов и белков
Баллон для доставки фармацевтического состава, дозирующий ингалятор

Комментарии