Деаморфизация высушенных распылением составов посредством смешивания распылением - RU2698331C2
Код документа: RU2698331C2
Чертежи

Описание
Область техники, к которой относится изобретение
[001] Это изобретение относится к способам изготовления и композициям высушенных распылением частиц, приготовленных из водного сырьевого материала, содержащего суспензию одного или более активных фармацевтических ингредиентов. Изобретение дополнительно относится к органическим соединениям и их применению в качестве фармацевтических средств, более конкретно, к физически и химически стабильным и по существу однородным сухим порошковым составам, которые содержат один, два, три или более активных ингредиентов. Полученные в результате порошковые составы пригодны для лечения множества заболеваний и состояний.
Уровень техники, предшествующий изобретению
[002] Активные фармацевтические ингредиенты (АФИ), которые пригодны для лечения респираторных заболеваний, обычно составлены для введения ингаляцией посредством портативных ингаляторов. Классы портативных ингаляторов включают дозирующие ингаляторы под давлением (ДИД) и сухие порошковые ингаляторы (СПИ).
[003] В фармацевтической разработке имеет место однозначное предпочтение в отношении кристаллических АФИ. Большинство рыночных респираторных лекарственных продуктов, включая все терапевтические средства от астмы/ХОБЛ, основаны на кристаллических твердых частицах. Кристаллические АФИ имеют склонность к высокому уровню чистоты и стабильности, особенно, если большая часть термодинамически стабильного полиморфа была идентифицирована.
[004] Доставка респираторного лекарственного средства накладывает дополнительные ограничения на кристаллический АФИ. Во-первых, АФИ часто должен обладать возможностью быть микронизированным для достижения частиц лекарственного средства в пригодном для вдыхания диапазоне размеров от приблизительно 1 мкм до 5 мкм. Процесс измельчения может привести к частичной потере кристалличности с образованием аморфного или неупорядоченного материала. Небольшие количества такого кристаллографически дефектного материала в кристаллическом АФИ могут иметь вредоносное влияние на составленный лекарственный продукт с точки зрения как химической, так и физической стабильности. Большая часть проблем с физической нестабильностью, наблюдаемых в фармацевтических твердых частицах, происходит преимущественно в неупорядоченных некристаллических областях. В результате, АФИ наиболее часто подвергается дополнительному процессу деаморфизации для увеличения или сохранения кристалличности. Для лактозных смесей, в частности, может требоваться этап деаморфизации для ограничения аморфного содержания в порошковых частицах.
[005] В настоящее время большинство рыночных ингаляционных продуктов сочетают микронизированный АФИ с крупным моногидратом лактозы с образованием смеси, которая вдыхается пациентом. Высушивание распылением представляет собой альтернативный производственный процесс для приготовления порошков для ингаляции.
[006] Высушивание распылением является способом продуцирования сухого порошка из жидкого раствора или диспергированных частиц в жидкости высушиванием с горячим газом. Полученные в результате сухие порошки могут быть введены или с СПИ, или в суспензии с пригодным вытеснителем с ДИД. Высушивание распылением позволяет контроль композиции поверхности и морфологии частиц, факторов критичных для достижения хорошей порошковой флюидизации и дисперсности. Это, в свою очередь, ведет к значительным улучшениям в нацеливании к легким и в однородности дозы по сравнению с составами, основанными на смесях микронизированного АФИ и грубого моногидрата лактозы.
[007] Преимущество высушивания распылением заключается в том, что оно позволяет контроль физической формы АФИ. АФИ может быть сконструирован в процессе высушивания распылением так, чтобы он был кристаллическим или аморфным в зависимости от композиции сырьевого материала и условий высушивания распылением. Физическая форма АФИ в лекарственном продукте оказывает влияние на химическую стабильность при хранении. Некоторые АФИ являются более стабильными в виде аморфных твердых частиц, тогда как другие являются более стабильными в кристаллическом виде. Для маленьких молекул, в особенности терапевтических средств для лечения астмы и хронической обструктивной болезни легких (ХОБЛ), часто является предпочтительным сохранение АФИ в кристаллическом виде.
[008] Способ приготовления высушенных распылением частиц, содержащих кристаллический АФИ, заключается в высушивании распылением суспензии микронизированного АФИ в не растворяющей жидкой непрерывной фазе. Для кристаллических АФИ с плохой растворимостью в воде способ заключается в высушивании распылением суспензии АФИ, диспергированного в эмульсии типа масло в воде (основанный на суспензии процесс PULMOSPHERE™).
[009] АФИ для лечения пациентов, страдающих от астмы и хронической обструктивной болезни легких, являются высокоэффективными с номинальными дозами в диапазоне от около 5 микрограмм (мкг) до 500 мкг. Минимальная масса наполнения, которая может быть достигнута в блистерных емкостях для использования в сухом порошковом ингаляторе (СПИ), составляет около 500 мкг с массами наполнения в диапазоне от около 1 миллиграмм (мг) до 2 мг, что более практично на высокоскоростной линии наполнения. Для СПИ на основе капсул минимальная масса наполнения, вероятно, является даже более высокой, такой как от 2 мг до 6 мг. Высокая эффективность терапевтических средств от астмы/ХОБЛ и минимальная масса наполнения накладывает ограничения на нагрузки целевого лекарственного средства в высушенных распылением составах. В целом, нагрузка лекарственного средства составляет менее 10% мас./мас., более часто порядка от 0,1% мас./мас. до 5% мас./мас.
[0010] Высокая эффективность (низкие нагрузки лекарственного средства) для высушенных распылением составов терапевтических средств от астмы/ХОБЛ накладывает ограничения на стратегии конструирования частиц для этих сильнодействующих АФИ. Например, в основанных на суспензии сырьевых материалах, где АФИ диспергирован в виде тонко микронизированных кристаллов в жидкости, низкая нагрузка лекарственного средства может привести к возрастаниям доли плохо растворимого кристаллического лекарственного средства, которое может раствориться в жидкости. Из-за быстрой кинетики высушивания в процессе высушивания распылением (миллисекундная шкала времени) растворенный АФИ обычно будет преобразован в аморфную фазу в высушенном распылением лекарственном продукте. Для многих АФИ метастабильная аморфная фаза увеличивала скорости химического разрушения по сравнению с кристаллическим лекарственным средством.
Краткая сущность изобретения
[0011] Варианты осуществления данного изобретения предоставляют композиции, которые достигают целевого содержания АФИ в высушенных распылением частицах, при этом сохраняя кристалличность АФИ в процессе высушивания распылением, даже когда АФИ имеет ограниченную растворимость в жидкой непрерывной фазе суспензии, которая должна быть высушена распылением. Это обеспечивает деаморфизацию для ограничения аморфного содержания в порошковых частицах.
[0012] Варианты осуществления данного изобретения предоставляют высушенные распылением составы кристаллического АФИ со сниженным аморфным содержанием, что приводит в результате к улучшениям химической и/или физической стабильности АФИ при хранении.
[0013] Варианты осуществления данного изобретения предоставляют композиции и способы, которые минимизируют растворенную фракцию АФИ, приводя в результате к соответствующей минимизации потенциально нестабильного аморфного АФИ в конечном продукте.
[0014] Варианты осуществления данного изобретения предоставляют частицы, приготовленные высушиванием распылением суспензий АФИ, где доза и растворимость АФИ выбраны и/или контролируются для ограничения растворения АФИ в жидкой фазе сырьевого материала.
[0015] В одном аспекте данного изобретения предоставлен способ снижения растворенной фракции активного фармацевтического ингредиента (АФИ) в основанном на суспензии процессе высушивания распылением, при этом способ включает высушивание распылением сырьевого материала, содержащего вспомогательные вещества и АФИ с более высоким содержанием лекарственного средства, чем требуется в конечном лекарственном продукте, которое приводит к частицам, имеющим высокое содержание лекарственного средства. Такие частицы затем смешивают с высушенными распылением частицами несущей среды (отсутствует АФИ). Полученная в результате смесь приводит в результате к сниженному образованию аморфного АФИ и, в результате этого, к улучшенной химической стабильности при хранении.
[0016] В другом аспекте частицы несущей среды могут быть дополнительно или альтернативно замещены высушенными распылением частицами, содержащими второй АФИ и вспомогательные вещества, для формирования комбинации с фиксированной дозой, из двух более активных веществ, где растворенная фракция первого АФИ снижена в комбинации с фиксированной дозой.
[0017] В первом аспекте данное изобретение относится к сконструированному порошковому составу для ингаляции, который содержит по существу однородную смесь первого сконструированного порошка и второго сконструированного порошка, при этом указанный первый сконструированный порошок содержит высушенные распылением частицы, которые содержат кристаллический терапевтически активный ингредиент, диспергированный в фармацевтически приемлемом гидрофобном вспомогательном веществе, при этом указанный второй сконструированный порошок содержит высушенные распылением частицы, образованные из фармацевтически приемлемого гидрофобного вспомогательного вещества, которое по существу является не содержащим какой-либо терапевтически активный ингредиент, и при этом нагрузка активного ингредиента в указанном первом высушенном распылением порошке является достаточно высокой для ограничения растворения активного ингредиента в сырьевом материале, который должен быть высушен распылением.
[0018] Сухой порошковый состав по данному изобретению может содержать один, два, три или более активных ингредиентов. Дополнительные активные ингредиенты могут быть составлены вместе в первом и/или втором сконструированном порошке, и/или могут быть составлены в третьем или более сконструированном порошке или порошках. Дополнительные активные ингредиенты могут быть представлены в кристаллической или аморфной форме.
[0019] Растворенный процент для кристаллического активного ингредиента в первом жидком сырьевом материале составляет менее 10% мас./мас., предпочтительно менее 5% мас./мас. или 1% мас./мас.
[0020] В некоторых вариантах осуществления первый сконструированный порошок и второй сконструированный порошок имеют одну или более физико-химических характеристик (например, морфология частиц, поверхностная композиция, насыпная плотность и распределение первичных частиц по размерам), которые по существу являются сходными. Эти свойства оптимизированы для предоставления сконструированных порошковых смесей, которые флюидизируются и диспергируются с малым количеством прилагаемой энергии, имеют превосходные легочные эффективности доставки и маленькую склонность к сегрегации при транспортировке или хранении.
[0021] Активные ингредиенты могут быть любыми активными фармацевтическими ингредиентами, которые пригодны для лечения обструктивного или воспалительного заболевания дыхательных путей, в частности астмы и ХОБЛ. Пригодные активные ингредиенты включают β2-агонисты длительного действия, такие как салметерол, формотерол, индакатерол и их соли, мускариновые антагонисты, такие как тиотропий и гликопирроний и их соли, и кортикостероиды, включая будесонид, циклезонид, флутиказон и мометазон и их соли. Пригодные иллюстративные комбинации включают (индакатерола малеат и гликопиррония бромид), (индакатерола ацетат и гликопиррония бромид), (индакатерола ксинафоат и гликопиррония бромид), (индакатерола малеат и мометазона фуроат), (формотерола фумарат и будесонид), (салметерола ксинафоат и флутиказона пропионат), (салметерола ксинафоат и тиотропия бромид), (формотерола фумарат и тиотропия бромид), (индакатерола малеат, мометазона фуроат и гликопиррония бромид), (индакатерола ацетат, мометазона фуроат и гликопиррония бромид), (индакатерола ксинафоат, мометазона фуроат и гликопиррония бромид) и (формотерола фумарат, флутиказона пропионат и тиотропия бромид).
[0022] Во втором аспекте настоящее изобретение относится к способу получения ингалируемого сухого порошкового состава высушенных распылением частиц, при этом способ включает этапы:
(a) приготовление первого сырьевого материала, содержащего кристаллический активный ингредиент, диспергированный в жидкой фазе, и гидрофобное вспомогательное вещество, растворенное или диспергированное в жидкой фазе, и высушивание распылением указанного первого сырьевого материала для предоставления первого сконструированного сухого порошка, где нагрузка лекарственного средства кристаллического активного агента является достаточно высокой для ограничения растворения в растворителе фазы сырьевого материала;
(b) приготовление второго сырьевого материала, содержащего гидрофобное вспомогательное вещество, растворенное или диспергированное в жидкой фазе, при этом указанный второй сырьевой материал по существу не содержит активный ингредиент, и высушивание распылением указанного второго сырьевого материала для предоставления второго сконструированного сухого порошка, по существу не содержащего активный ингредиент, и;
(c) смешивание активных сухих порошковых частиц и неактивных сухих порошковых частиц для предоставления ингалируемого сухого порошкового состава, где доля неактивных сухих порошковых частиц из второго сырьевого материала отрегулирована для доставки целевой дозы активного ингредиента в первом сырьевом материале.
[0023] В дополнительных вариантах осуществления может быть составлена комбинация с фиксированными дозами из двух или более активных ингредиентов, где дополнительные активные ингредиенты растворены или диспергированы или в первом, или во втором исходном сырье, или альтернативно в дополнительном третьем или более сырьевом материале.
[0024] В третьем аспекте данное изобретение относится к способу лечения заболевания или состояния, который включает введение объекту, нуждающемуся в этом, эффективного количества сухого порошкового состава в соответствии с вариантами осуществления данного документа.
[0025] В четвертом аспекте данное изобретение относится к применению сухого порошкового состава в соответствии с вариантами осуществления данного изобретения в производстве лекарственного препарата для лечения заболевания или состояния.
[0026] В пятом аспекте данное изобретение относится к сухому порошковому составу в соответствии с вариантами осуществления данного изобретения для применения в лечении заболевания или состояния. Заболевание или состояние может являться системным, легочным или и тем и другим.
[0027] В шестом аспекте данное изобретение относится к способу лечения обструктивного или воспалительного заболевания дыхательных путей, который включает введение объекту, нуждающемуся в этом, эффективного количества сухого порошкового состава в соответствии с вариантами осуществления данного документа. Обструктивное или воспалительное заболевание дыхательных путей может включать астму или ХОБЛ, или и то и другое.
[0028] В седьмом аспекте данное изобретение относится к применению сухого порошкового состава в соответствии с вариантами осуществления данного изобретения в производстве лекарственного препарата для лечения обструктивного или воспалительного заболевания дыхательных путей. Обструктивное или воспалительное заболевание дыхательных путей может включать астму или ХОБЛ, или и то и другое.
[0029] В восьмом аспекте данное изобретение относится к сухому порошковому составу в соответствии с вариантами осуществления данного изобретения для применения в лечении обструктивного или воспалительного заболевания дыхательных путей. Обструктивное или воспалительное заболевание дыхательных путей может включать астму или ХОБЛ, или и то и другое.
[0030] В девятом аспекте данное изобретение относится к системе доставки, которая включает ингалятор, который содержит сухой порошковый состав в соответствии с вариантами осуществления данного документа.
[0031] Десятый аспект данного изобретения включает любые два или более вышеприведенных аспектов, вариантов осуществления или признаков.
Термины
[0032] Термины, применяемые в описании, имеют следующие значения:
[0033] “Активный ингредиент”, “терапевтически активный ингредиент”, “активный агент”, “лекарственное средство” или “лекарственное вещество”, как применено в данном документе, означает активный ингредиент фармацевтического средства, также известный как активный фармацевтический ингредиент (АФИ).
[0034] “Комбинация с фиксированной дозой”, как применено в данном документе, относится к фармацевтическому продукту, который содержит два или более активных ингредиентов, которые составлены вместе в единичной форме дозирования, доступной в некоторых фиксированных дозах.
[0035] “Аморфный”, как применено в данном документе, относится к состоянию, в котором у материала отсутствует дальний порядок на молекулярном уровне и который, в зависимости от температуры, может проявлять физические свойства твердого тела или жидкости. Как правило, такие материалы не демонстрируют отличительной дифракционной рентгенограммы и, несмотря на то, что проявляют свойства твердого вещества, более формально их описывают как жидкости. При нагревании происходит изменение свойств с твердых на жидкие, что характеризуется изменением состояния, как правило, второго порядка (“стеклование”).
[0036] “Кристаллический”, как применено в данном документе, относится к твердой фазе, в которой материал имеет внутреннюю структуру с регулярным порядком на молекулярном уровне и демонстрирует отличительную дифракционную рентгенограмму с определенными пиками. Такие материалы при достаточном нагревании также будут проявлять свойства жидкости, но изменение с твердого состояния на жидкое характеризуется фазовым изменением, как правило, первого порядка (“точка плавления”). В контексте данного изобретения кристаллический активный ингредиент означает активный ингредиент с кристалличностью больше чем 85%. В некоторых вариантах осуществления кристалличность соответственно составляет больше чем 90%. В других вариантах осуществления кристалличность соответственно составляет больше чем 95%.
[0037] “Концентрация твердых частиц” относится к концентрации активного(ых) ингредиента(ов) и вспомогательных веществ, растворенных или диспергированных в жидком растворе или дисперсии, которая должна быть высушена распылением.
[0038] “Загрузка лекарственного средства” относится к проценту активного(ых) ингредиента(ов) по массе в общей массе состава.
[0039] “Растворенный %” относится к проценту кристаллического активного ингредиента, который растворяется в жидком сырьевом материале, который должен быть высушен распылением.
[0040] “Средний массовый диаметр” или “СМД” или “x50”, как применено в данном документе, означает средний диаметр множества частиц, как правило, в совокупности полидисперсных частиц, т.е. состоящий из диапазона размеров частиц. Значения СМД, сообщаемые в данном документе, определены лазерной дифракцией (Sympatec Helos, Clausthal-Zellerfeld, Germany), если контекст не указывает на иное.
[0041] “Шероховатый”, как применено в данном документе, означает имеющий многочисленные морщины или складки, т.е. являющийся рельефным или морщинистым.
[0042] “Шероховатость”, как применено в данном документе, является мерой поверхностной шероховатости сконструированной частицы. Для целей этого изобретения шероховатость рассчитывается из специфической поверхностной площади, полученной из измерений БЭТ, истинной плотности, полученной из гелиевой пикнометрии, и соотношения поверхности к объему, полученному лазерной дифракцией (Sympatec), а именно:
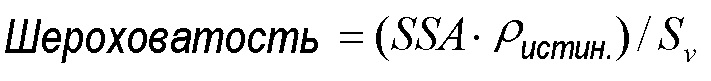
[0043] где Sv=6/D32, где D32 является средним диаметром, основанным на единичной площади поверхности. Возрастания поверхностной шероховатости, как ожидается, снизят межчастичные когезионные силы и улучшат нацеливание аэрозоля в легкие. Улучшенное легочное нацеливание, как ожидается, снизит варьируемость между пациентами и уровни лекарственного средства в мезофаринксе и общей системе циркуляции. В одном или более вариантов осуществления шероховатость Sv составляет от 3 до 20, например, от 5 до 10.
[0044] “Испускаемая доза” или “ИД”, как применено в данном документе, относится к указанию доставки сухого порошка из ингаляторного устройства после приведения в действие или явления диспергирования из порошкового блока. ИД определяют как соотношение доз, доставленных ингаляторным устройством, к номинальной или отмеренной дозе. ИД является экспериментально определенным параметром, и может быть определенным с применением устройства in vitro, которое имитирует дозирование пациента. Она иногда также называется доставленной дозой (ДД). ИД определена с применением специфичного к лекарственному средству способа, такого как жидкостная хроматография высокого давления.
[0045] “Испускаемая порошковая масса” или “ИПМ”, как применено в данном документе, относится к массе порошка, которая доставлена из ингаляторного устройства после приведения в действие или явления диспергирования из порошкового блока. ИПМ измеряют гравиметрически.
[0046] “Масс-медианный аэродинамический диаметр” или “ММАД”, как применено в данном документе, относится к медианному аэродинамическому размеру множества частиц, как правило, в полидисперсной совокупности. “Аэродинамический диаметр” является диаметром сферы с единичной плотностью, имеющей ту же скорость осаждения, обычно в воздухе, как порошок, и вследствие этого является пригодным путем для характеризации аэрозолированного порошка или другой диспергированной частицы или состава частицы с точки зрения его поведения при осаждении. Аэродинамическое распределение частиц по размерам (АРЧР) и ММАД определены в данном документе методом каскадного импактора, с применением NEXT GENERATION IMPACTOR™. В целом, если частицы аэродинамически являются слишком большими, то меньшее количество частиц глубоко проникнет в легкие. Если частицы являются слишком маленькими, то больший процент частиц может быть выдохнут.
[0047] “Мелкоразмерная фракция частиц” или “МФЧ”, как применено в данном документе, означает массу активного ингредиента ниже заданного минимального аэродинамического размера по сравнению с номинальной дозой. Например, МФЧ<3,3мкмотносится к проценту номинальной дозы, который имеет аэродинамический размер частиц менее 3,3 мкм. Значения МФЧ определены с применением метода каскадного импактора на каскадном импакторе ANDERSEN™ или на каскадном импакторе NEXT GENERATION IMPACTOR™.
[0048] “Легочная доза” относится к проценту активного(ых) ингредиента(ов), который проходит идеализированную ротоглотку Алберта. Данные могут быть выражены как процент номинальной дозы или испускаемой дозы.
[0049] Во всем описании и в последующей формуле изобретения, если по контексту не требуется иное, слово “содержат” или вариации, такие как “содержит” или “содержащий”, должны быть поняты как подразумевающие включение указанного целого числа или этапа, или группы целых чисел или этапов, но не исключение любого другого целого числа или этапа, или группы целых чисел или этапов.
[0050] Полное раскрытие каждого патента США и международной патентной заявки, упомянутых в этом описании патента, полностью включено в данный документ посредством ссылки.
Описание чертежей
[0051] Сухой порошковый состав по данному изобретению может быть описан со ссылкой на прилагаемые чертежи. В этих чертежах:
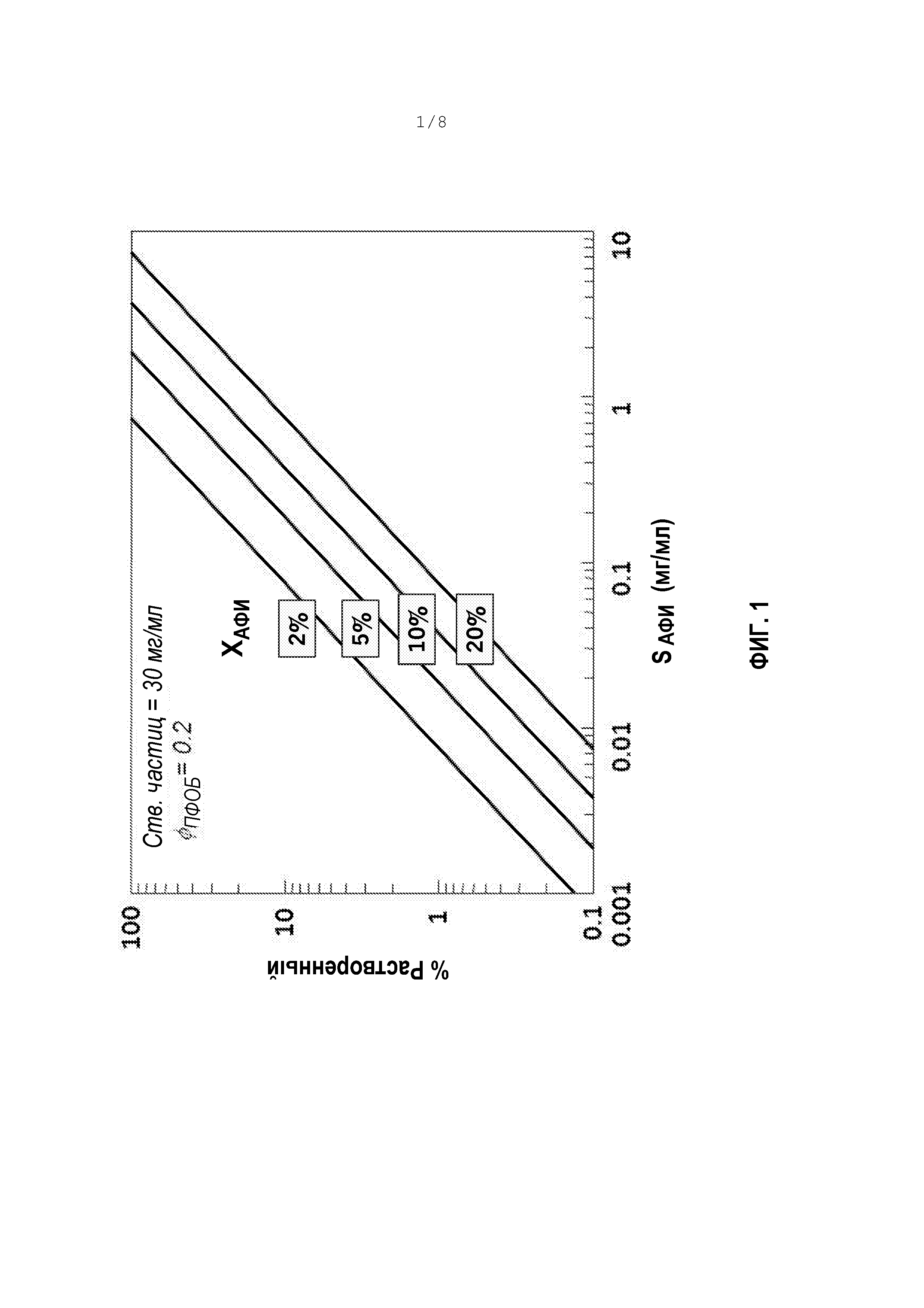
[0052] Фигура 1 является графиком, показывающим долю АФИ, растворенного в жидком сырьевом материале в виде функции SАФИ.
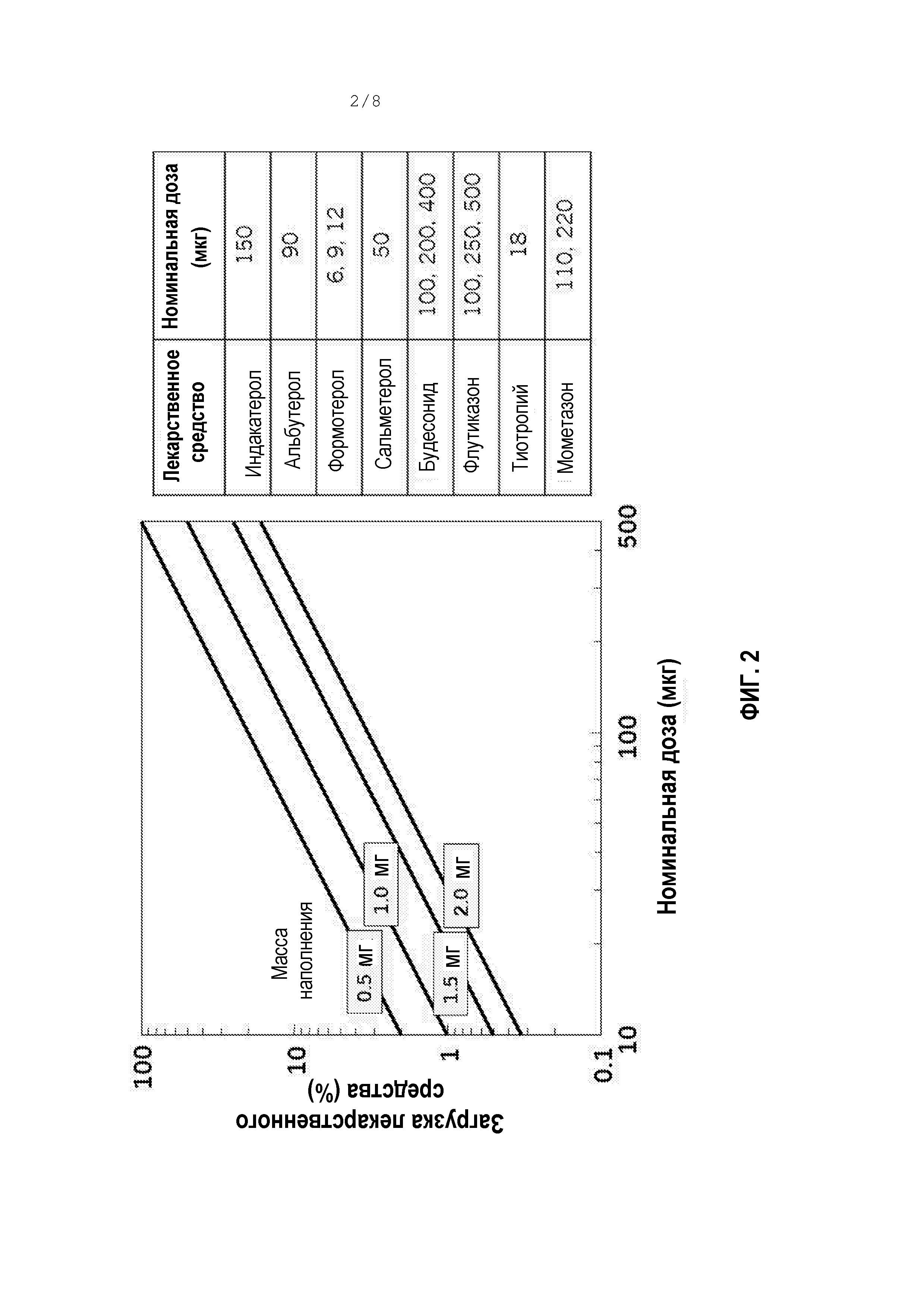
[0053] Фигура 2 является графиком нагрузки лекарственного средства по сравнению с номинальной дозой для четырех различных масс наполнения АФИ и иллюстрирует влияние эффективности на нагрузку лекарственного средства в высушенных распылением составах.
[0054] Фигура 3A является изображением в разобранном виде соплового узла, и фигура 3B является схематическим изображением составного сырьевого агрегата для сопла распылителя, известного под товарным знаком HYDRA™.
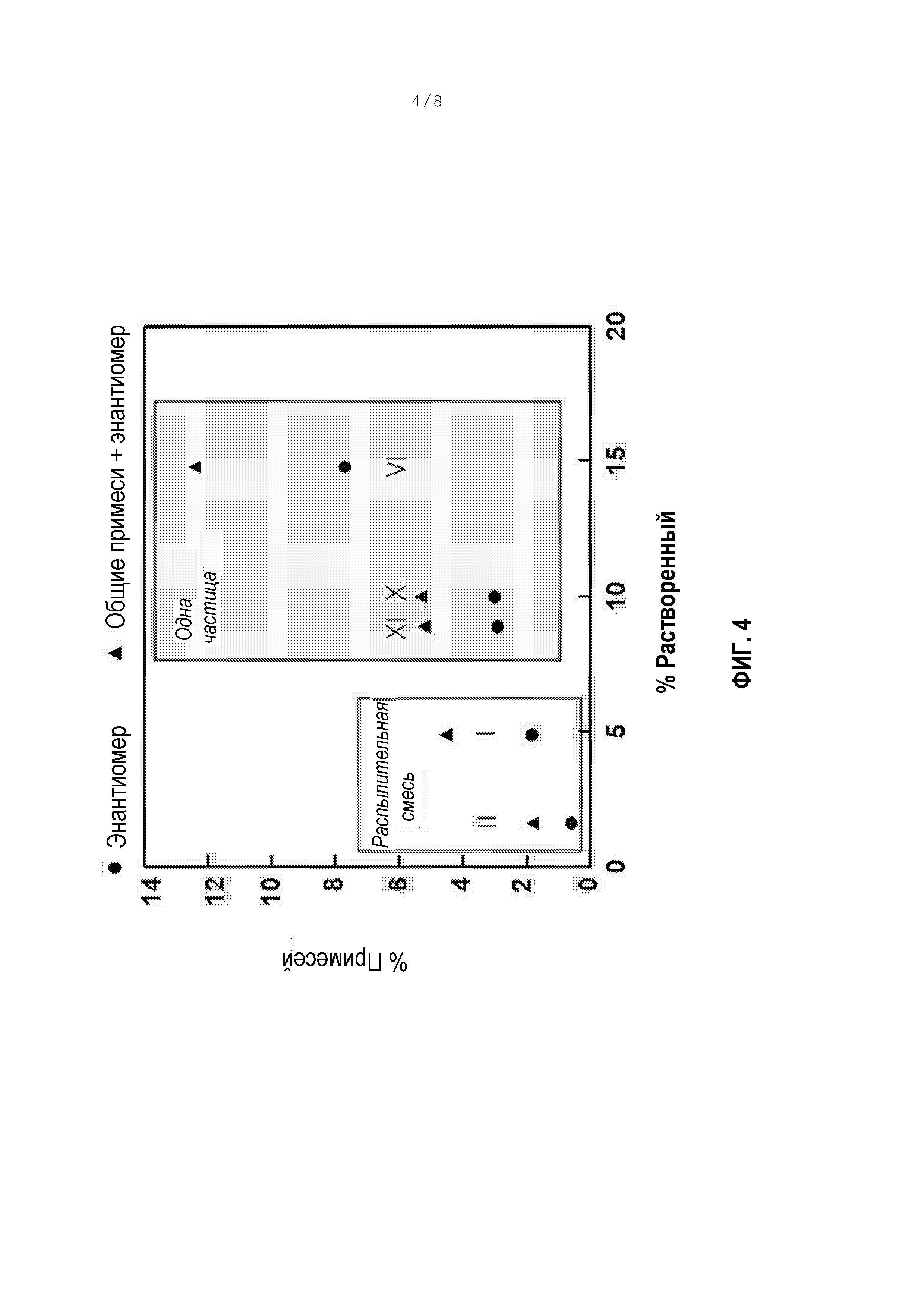
[0055] Фигура 4 является графиком некоторых из результатов примера 9, а именно, вычисленного процента растворенного индакатерола в сравнении с общим содержанием примесей (S-энантиомер плюс общее содержание примесей, полученное посредством ВЭЖХ) для составов, содержащих индакатерол. Она показывает, что смешанные распылением сухие порошки по данному изобретению являются более химически стабильными, чем сухие порошки, приготовленные общепринятым способом высушивания распылением одиночной частицы (одинарное сопло). Римские цифры относятся к номерам партий в примере 9.
[0056] Фигура 5 является графиком “легочной дозы” индакатерола после введения аэрозоля рыночного лекарственного продукта Onbrez (стандартная смесь) с Breathhaler (номинальная доза 150 мкг). Также представлены соответствующие “легочные дозы”, полученные для смешанного распылением состава индакатерола, доставленного с Breathhaler с номинальными дозами 40 мкг, 75 мкг и 150 мкг. “Легочная доза” относится к in-vitro измерению массы порошка, которая доставлена через идеализированную модель ротоглотки Алберта.
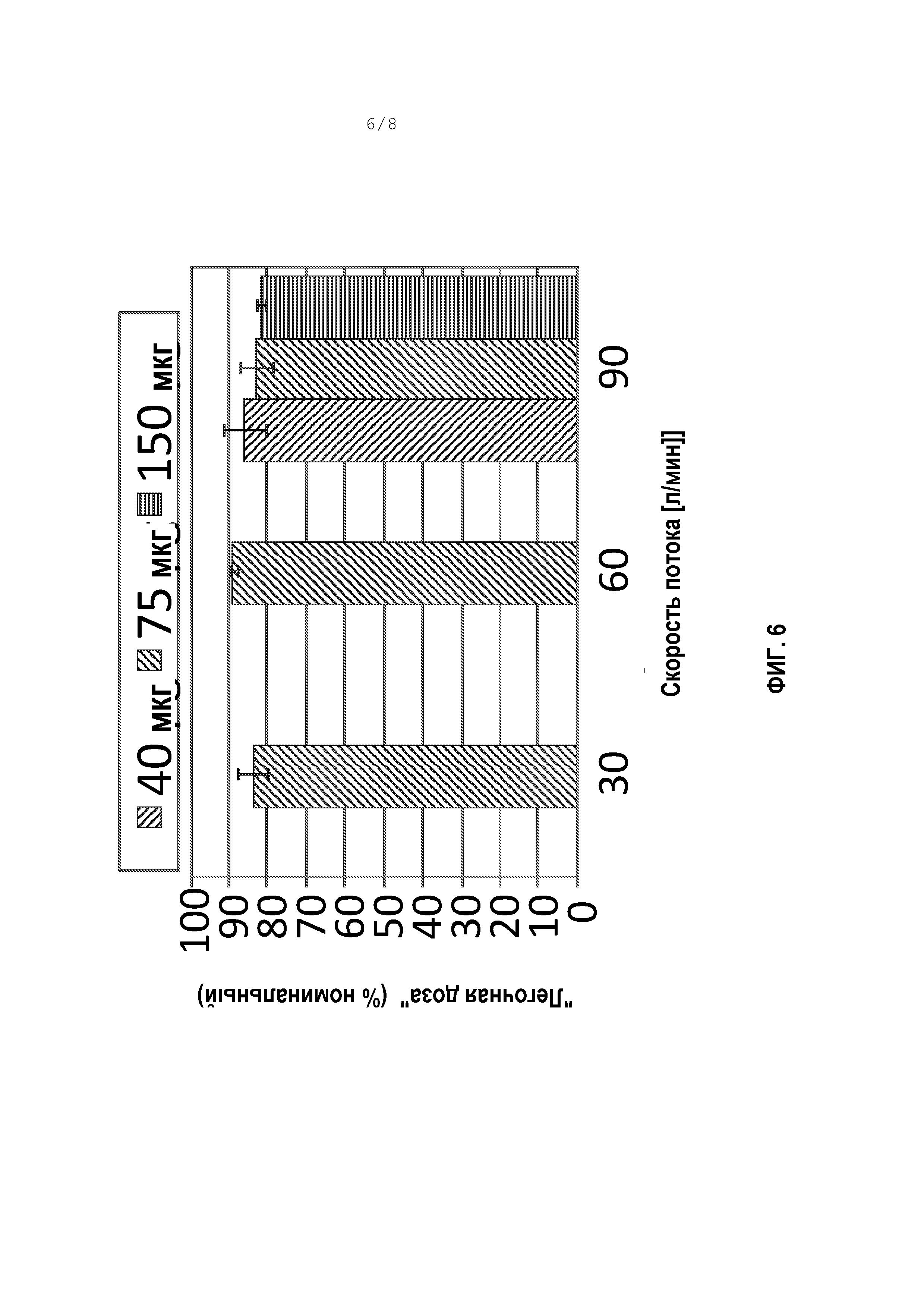
[0057] Фигура 6 является графиком “легочной дозы” индакатерола после введения аэрозоля смешанного распылением состава индакатерола, доставленного с Breathhaler с различными скоростями расхода. “Легочная доза” относится к in-vitro измерению массы порошка, которая доставлена через идеализированную модель ротоглотки Алберта.
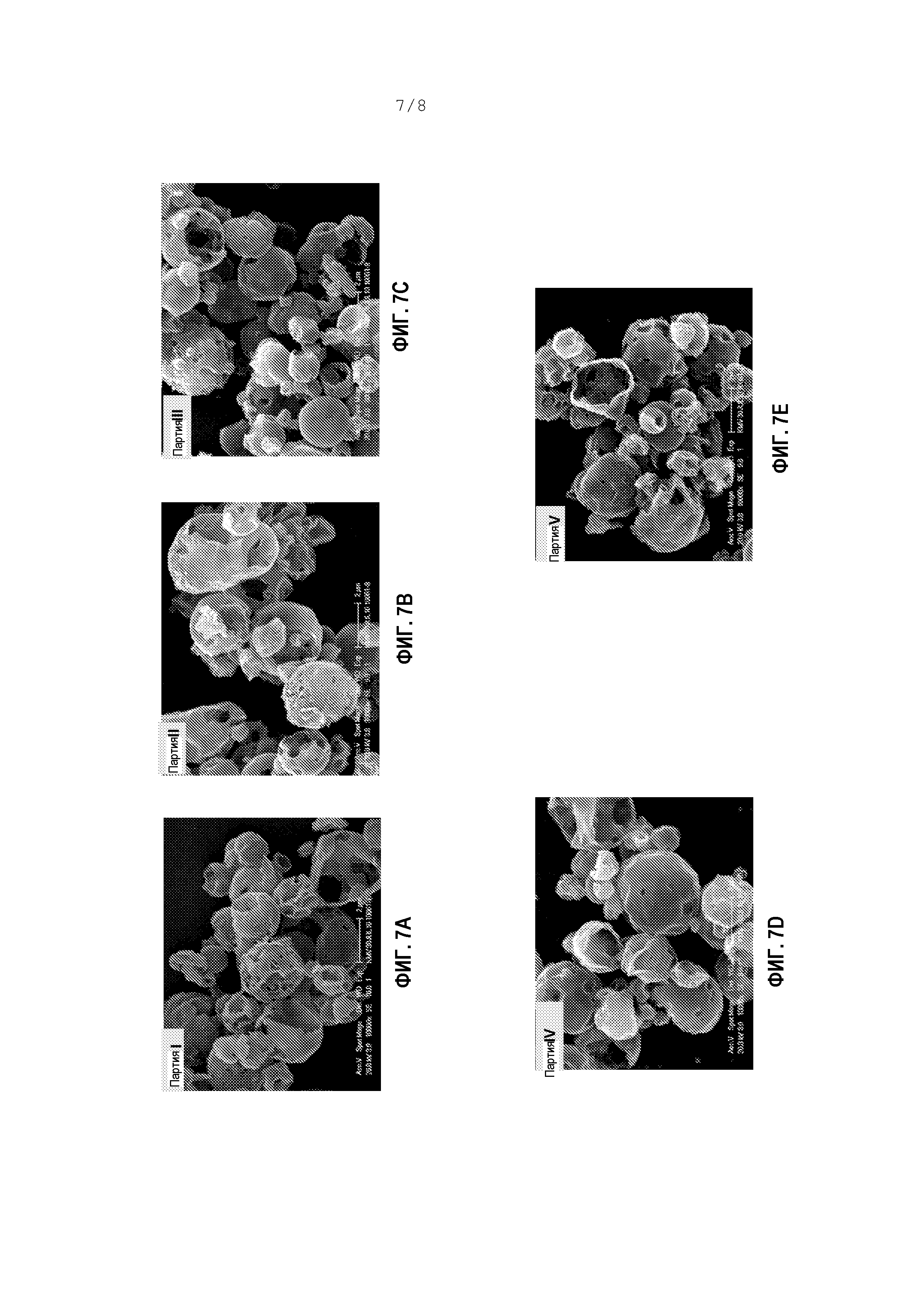
[0058] Фигуры 7A-7E являются микрофотографиями, показывающими частицы, изготовленные в соответствии с вариантами осуществления изобретения.
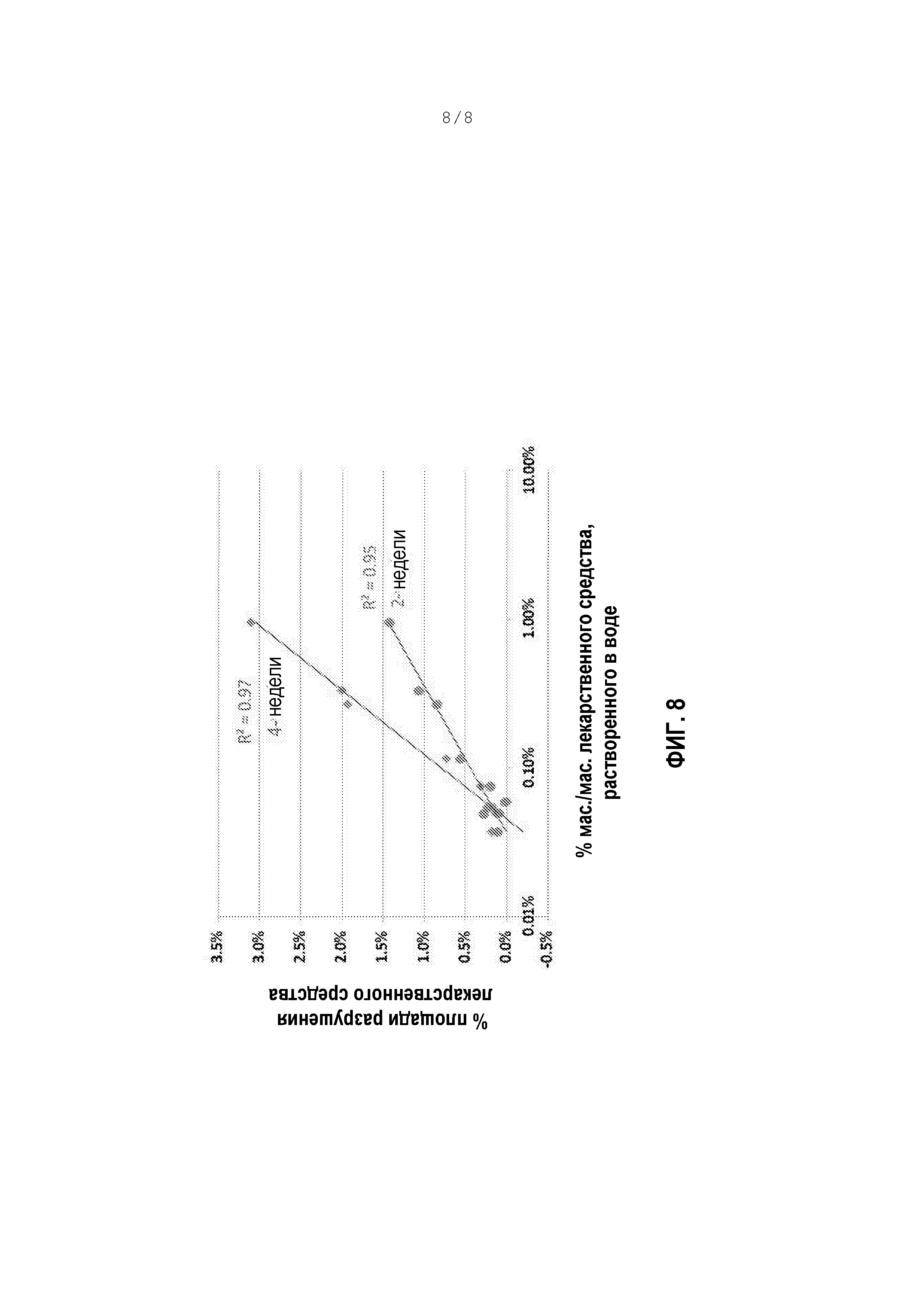
[0059] Фигура 8 является графиком, показывающим разрушение соединения аналога простациклина состава PULMOSPHERE™ в виде функции от процента растворенного АФИ в исходном сырье на водной основе, которое должно быть высушено распылением.
Подробное описание
[0060] Варианты осуществления данного изобретения направлены на состав и способ для улучшения химической стабильности сильнодействующих АФИ в основанном на суспензии способе высушивания распылением путем снижения растворенной фракции АФИ в суспензионной среде, такой как жидкость. Когда растворенный АФИ преобразован в аморфный АФИ во время высушивания распылением и когда аморфные фазы часто имеют сниженную химическую стабильность по сравнению с кристаллическим лекарственным средством, варианты осуществления изобретения формируют по существу кристаллические лекарственные средства за счет ограничения количества лекарственного средства, которое растворено в жидкости во время высушивания распылением.
[0061] Высокая эффективность (низкие нагрузки лекарственного средства) для высушенных распылением составов терапевтических средств от астмы/ХОБЛ могут ограничить стратегии конструирования частиц для этих сильнодействующих АФИ. Например, в основанных на суспензии сырьевых материалах, где АФИ диспергирован в виде тонко микронизированных кристаллов в жидкости, низкая нагрузка лекарственного средства может привести к возрастанию доли плохо растворимого кристаллического лекарственного средства, которое может растворяться в жидкости. Процент АФИ, растворенный в жидком сырьевом материале, выражен посредством:
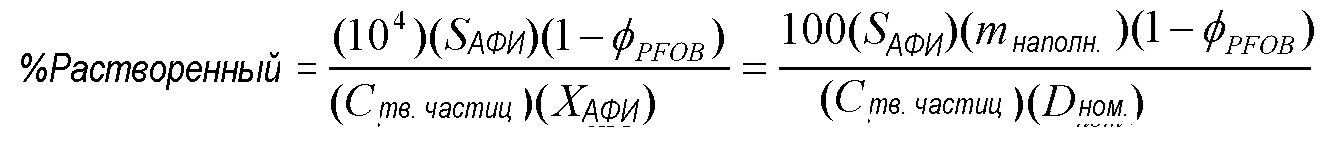
где SАФИ является растворимостью АФИ (мг/мл), φPFOB является объемной фракцией порообразующего агента, если он представлен в составе (об./об.), Cтв. частицявляется концентрацией твердых частиц в сырьевом материале (мг/мл), и XАФИ является нагрузкой лекарственного средства АФИ в высушенном распылением лекарственном продукте (% мас./мас.). Нагрузка лекарственного средства просто связана с соотношением номинальной дозы Dном к массе наполнения mнаполн.
[0062] Для массы наполнения 3 мг и реальных параметров высушивания распылением φPFOB=0,2 и Cтв. частиц=30 мг/мл), %Растворенный сокращается до простого соотношения растворимости к номинальной дозе, а именно:
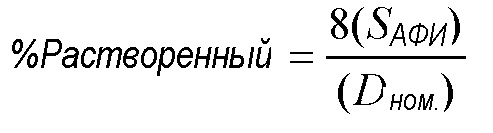
[0063] Снижения %растворенного могут быть достигнуты посредством снижения SАФИ, или возрастания Cтв. частиц,или XАФИ. Доля АФИ, растворенного в жидком сырьевом материале, в виде функции SАФИ, графически отображена на фигуре 1. Различные линии на фигуре 1 представляют различные значения XАФИ. Конкретно для этого графика предположено, что Cтв. частиц=30 мг/мл и φPFOB=0,2. Для XАФИ=2%-5%, которое является типичным для сильнодействующих терапевтических средств от астмы/ХОБЛ, как продемонстрировано на фигуре 2, %растворенный составляет 1-10%, даже для растворимости АФИ только лишь 0,1 мг/мл. Для номинальной дозы 100 мкг любой АФИ с растворимостью >0,16 мг/мл приведет в результате к >10% аморфному содержанию. Поэтому, сильнодействующие АФИ с растворимостью между 0,1 и 1,0 мг/мл имеют риск наличия значительного аморфного содержания после высушивания распылением из сырьевого материала на водной основе. Таблица 1 ниже дополнительно иллюстрирует эффекты активности посредством демонстрирования номинальной дозы, связанной с различными АФИ от астмы/ХОБЛ.
[0064] Из-за быстрой кинетики высушивания в процессе высушивания распылением (миллисекундная шкала времени) растворенный АФИ обычно будет преобразован в аморфную фазу в высушенном распылением лекарственном продукте. Для многих АФИ метастабильная аморфная фаза увеличивала скорости химического разрушения по сравнению с кристаллическим лекарственным средством.
[0065] Варианты осуществления способа по данному изобретению приводят к сухим порошковым составам для ингаляции, содержащим смесь сконструированных частиц, в которых частицы приготовлены высушиванием распылением водного сырьевого материала, содержащего суспензию одного или более АФИ, где доза и растворимость АФИ приводит в результате к растворению в водной фазе.
[0066] Варианты осуществления способа по данному изобретению приводят к сухим порошковым составам для ингаляции, содержащим смесь сконструированных частиц, при этом смесь содержит по меньшей мере один активный ингредиент, который пригоден для лечения заболевания и состояния.
[0067] Варианты осуществления способа по данному изобретению приводят к сухим порошковым составам для ингаляции, содержащим смесь сконструированных частиц, при этом смесь пригодна для лечения обструктивного или воспалительного заболевания дыхательных путей, такого как астма и/или ХОБЛ.
[0068] В одном варианте осуществления сухой порошковый состав по изобретению содержит по существу однородную смесь первого сконструированного порошка и второго сконструированного порошка.
[0069] Первый сконструированный порошок содержит высушенные распылением частицы, которые содержат по существу кристаллический терапевтически активный ингредиент, диспергированный в фармацевтически приемлемом гидрофобном вспомогательном веществе.
[0070] Нагрузка лекарственного средства кристаллического терапевтически активного ингредиента в первом сконструированном порошке является достаточно высокой для ограничения растворения активного ингредиента в жидком сырьевом материале, который должен быть высушен распылением. Процент растворенного активного ингредиента в сырьевом материале должен составлять менее 10% мас./мас., предпочтительно менее 5% мас./мас., более предпочтительно менее 1% мас./мас. Растворенный процент может быть измерен экспериментально специфичным к лекарственному средству аналитическим способом, или вычислен на основании измеренной растворимости и композиции сырьевого материала с применением уравнения 1.
[0071] Второй сконструированный порошок содержит высушенные распылением частицы, которые образованы из фармацевтически приемлемого гидрофобного вспомогательного вещества и являются по существу не содержащими какой-либо терапевтически активный ингредиент. В некоторых вариантах осуществления гидрофобное вспомогательное вещество первого высушенного распылением порошка является таким же, что и гидрофобное вспомогательное вещество второго высушенного распылением порошка, для того чтобы максимизировать однородность и активность смеси. В некоторых вариантах осуществления вторые частицы содержат второе лекарственное средство, так же как и дополнительное гидрофобное вспомогательное вещество для разбавления лекарственного средства, например, концентрации. Второе и третье лекарственные средства могут быть представлены или в кристаллической, или в аморфной форме и могут быть представлены в том же исходном сырье или другом сырьевом материале. Содержание второго и третьего АФИ в комбинации с фиксированной дозой будет обусловлено требуемой номинальной дозой, массой наполнения и смесью композиции, как указано выше для первого АФИ. Цель для всех АФИ заключается в поддержании АФИ в полностью кристаллическом или в полностью аморфном виде в лекарственном продукте.
[0072] В некоторых вариантах осуществления, таких как варианты осуществления комбинаций с фиксированной дозой, содержащей индакатерол, как описано в данном документе, вторые частицы содержат второе лекарственное средство, а также дополнительное гидрофобное вспомогательное вещество для разбавления общей концентрации лекарственного средства.
[0073] Сухой порошковый состав по данному изобретению может содержать один, два, три или более активных ингредиентов. Дополнительные активные ингредиенты могут быть составлены вместе в первом или втором сконструированном порошке, или могут быть составлены в третий сконструированный порошок. Дополнительные активные ингредиенты могут быть представлены или в кристаллической, или в аморфной форме.
[0074] Смесь из двух или более высушенных распылением порошков может быть приготовлена посредством физического смешивания двух или более порошков с применением смесителя, такого как TURBULA®. В предпочтительном варианте осуществления образование частиц и смешивание двух порошков происходит в одноэтапном процессе, обозначаемом смешивание распылением. В этом процессе два сырьевых материала пульверизируются в распылительную сушилку одновременно с пульверизатором, содержащим множественные сопла с двумя текучими средами. При таком сценарии смешивание частиц происходит в реальном времени по мере того, как генерируются частицы, приводя к превосходной однородности в смеси. Иллюстративный процесс смешивания распылением описан в патенте США 8524279. В частности, публикация патента раскрывает процесс высушивания распылением, который был сконструирован для приготовления меньших частиц (например, 0,5-50 мкм), которые пригодны для использования в фармацевтических продуктах, которые введены посредством ингаляции. Способ включает приготовление сырьевого материала, содержащего активный агент в жидкости несущей среды, пульверизацию сырьевого материала с применением жидкого пульверизатора для получения капельного спрея и протекание капельного спрея в нагретом газовом потоке для испарения жидкой несущей среды с получением сухих частиц, которые содержат активный агент. Патент США 8524279 раскрывает в общих чертах то, что если пульверизатор предоставлен с множеством сырьевых материалов, то два различных типа частиц могут быть образованы и смешаны в одном этапе, т.е. смешиванием распылением. Способы и композиции вариантов осуществления настоящего изобретения обеспечивают физическую смесь частиц с одинаковыми или подобными физико-химическими свойствами, содержащими распределения по размерам первичных частиц, насыпные плотности, морфологию и поверхностную композицию. Другими словами, цель заключается в создании смеси частиц, которые по существу являются идентичными с точки зрения межчастичных когезионных сил и их результирующих физических свойств. Такая смесь преимущественно имеет минимальную склонность к сегрегации при транспортировке или хранении, и межчастичные когезионные силы будут эквивалентными для различных лекарственных средств в комбинации с фиксированной дозой, приводя к эквивалентным характеристикам аэрозоля для моносоставов и их комбинаций с фиксированными дозами. Иллюстративные различия между лактозными смесями предшествующего уровня техники и вариантов осуществления распыляемых смесей данного изобретения подробно раскрыты в таблице 2. В случае лактозных смесей считается желательным образование агломерата между лекарственным средством и носителем, так что свойства не расфасованного порошка лекарственного продукта улучшены. В вариантах осуществления данного изобретения, в отличие от этого, композиция сконструирована для минимизации степени агломерации порошка и для создания частиц, которые легко деагломерируют с малым количеством затраченной энергии. Поэтому в вариантах осуществления данного изобретения требуемые свойства порошка основаны на самих сконструированных частицах.
[0075] В традиционной смеси для ингаляции микронизированные частицы лекарственного средства (1-5 мкм) смешаны с крупными частицами инертного носителя (50-200 мкм) для образования упорядоченной смеси, в которой частицы лекарственного средства связываются с частицами носителя.
[0076] Некоторые варианты осуществления данного изобретения включают способ и композицию, содержащую частицы, которые являются по существу идентичными с точки зрения поверхностной композиции и морфологии. В некоторых вариантах осуществления сырьевой материал и/или процесс высушивания распылением отрегулированы для продуцирования частиц со структурой оболочка/ядро. В таких вариантах осуществления оболочка частиц по существу составлена из гидрофобного вспомогательного вещества. Ядро частиц содержит активный(ые) ингредиент(ы) и дополнительные вспомогательные вещества для повышения химической стабильности от активного(ых) ингредиента(ов). Морфология частиц и поверхностная композиция может быть “структурирована” или “сконструирована” регулированием композиции сырьевого материала и условий высушивания распылением.
[0077] Испарение летучих жидких компонентов в пульверизированной капле во время высушивания распылением может быть описано как комбинированная проблема тепло- и массопереноса. Различие между давлением пара жидкостей и их парциальным давлением в газовой фазе является движущей силой процесса высушивания. Два характерных времени являются критичными, при этом определяя морфологию высушенных распылением частиц и распределение твердых материалов в высушенных частицах. Первое является временем, необходимым для того, чтобы капля была высушена, ιd, и второе является временем, необходимым материалам в пульверизированной капле для диффундирования от края капли к ее центру, R2/D. Здесь R является радиусом пульверизированной капли и D является коэффициентом диффузии растворенного вещества или эмульсией капли, представленной в сырьевом материале. Соотношение этих двух характерных времен определяет число Пекле,
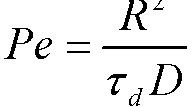
[0078] Различные компоненты в комплексном эмульсионном сырьевом материале имеют различные Pe (например, капли эмульсии в сравнении с растворенными веществами), и это обуславливает развитие концентрационных градиентов в частице.
[0079] Из-за довольно крупного размера эмульсионные капли диффундируют очень медленно и накапливаются на поверхности удаляющейся капли. По мере того как процесс высушивания продолжается, испаряющийся фронт становится обогащенным оболочкой или коркой в каплях эмульсии, окружающей остающийся раствор. В конечном счете, остающаяся водная фаза и более высококипящая масляная фаза выпаривается через корку, оставляя позади поры в месте исходных жидких капель. Поверхность частиц является обогащенной в компонентах, создавая медленно диффундирующие эмульсионные капли.
[0080] В случае основанных на суспензии сырьевых материалов, описанных в данном документе, нагрузки лекарственного средства являются низкими и кристаллические частицы лекарственного средства составляют небольшой процент лекарственного продукта. Кристаллы лекарственного средства покрыты пористым слоем гидрофобного вспомогательного вещества в соответствии с обсуждаемыми выше Пекле. Частицы несущей среды без лекарственного средства проявляют поверхностную композицию, подобную содержащим лекарственное средство частицам.
[0081] В целом, сконструированные порошки вариантов осуществления данного изобретения сконструированы для снижения межчастичных когезионных сил посредством включения пор или неровностей в поверхность частиц, и посредством обогащения гидрофобным вспомогательным веществом на поверхности раздела частиц. Как таковые, частицы сконструированы для флюидизирования и диспергирования с малым количеством приложенной энергии, несмотря на то, что они не смешаны с крупными частицами носителя. Предусмотрено, чтобы легочные эффективности доставки составляли более чем 40% доставленной дозы. Литературные данные демонстрируют, что средняя варьируемость между пациентами при таких условиях будет снижаться до 10-20%. Степень депонирования в горле может объяснить варьируемость легочного депонирования ингалируемых лекарственных средств. Кроме того, считается, что доставка сконструированных частиц из пассивного сухого порошкового ингалятора будет в значительной степени независима от пиковой скорости инспираторного расхода (PIF) пациента. Считается, что снижение орофарингеальной фильтрации и независимости скорости расхода приведет в результате к более единообразной доставке лекарственного средства для сконструированных порошков по данному изобретению, чем продаваемые в настоящее время терапевтические средства от астмы/ХОБЛ.
[0082] Сконструированные порошки по данному изобретению обеспечат превосходную однородность испускаемой дозы или испускаемой порошковой массы от измерения к измерению. В некоторых вариантах осуществления варьируемость находится в пределах требований руководства FDA, которое устанавливает, что 90% измерений должно быть в пределах 20% отклонения от заявленного значения, не выходя за переделы 25% отклонения. В некоторых вариантах осуществления 90% измерений находятся в пределах 15% отклонения от заявленного значения или в пределах 10% отклонения заявленного значения или средней испускаемой дозы.
[0083] Варианты осуществления данного изобретения приводят к частицам, проявляющим хорошую корреляцию в аэродинамическом распределении частиц по размерам между двумя различными активными ингредиентами в смешанной распылением комбинации с фиксированной дозой. Это оценивают прямым сравнением специфических стадий группирования в каскадном импакторе NEXT GENERATION IMPACTOR™ (NGI™). Варианты осуществления данного изобретения приводят к тому, что варьируемость дозы больших частиц (от стадии 0 до стадии 2) должна быть в пределах 25%, предпочтительно в пределах 15% или 10%. В некоторых вариантах осуществления вариация дозы мелкоразмерных частиц (от стадии 3 до фильтра) составляет в пределах 15%, предпочтительно в пределах 10% или 5%. Дополнительно или альтернативно, в некоторых вариантах осуществления вариация фракции очень мелкоразмерных частиц (от стадии 4 до фильтра) составляет в пределах 15%, предпочтительно в пределах 10% или 5%.
[0084] Варианты осуществления данного изобретения включают сконструированные частицы, где группирование стадий от стадии 3 до фильтра обеспечивает по меньшей мере 40% номинальной дозы, предпочтительно более чем 50% или 60% номинальной дозы.
[0085] Варианты осуществления данного изобретения включают частицы, которые сконструированы с применением технологии производства сухогопорошка на основе эмульсии PULMOSPHERE™. Конструктивные решения, сопутствующие этой технологии, описаны подробно в патентах США 6565885, 7871598 и 7442388, раскрытия которых полностью включены в данный документ. В частности, способ приготовления перфорированных микроструктур для фармацевтических применений включает высушивание распылением сырьевого материала, содержащего биоактивный агент, поверхностно-активное вещество (например, фосфолипид) и газообразующее вещество. Полученные в результате перфорированные микроструктуры содержат биоактивный агент и поверхностно-активное вещество и известны как частицы PULMOSPHERE™.
[0086] Варианты осуществления данного изобретения включают смешанные распылением составы, характеризуемые высокооднородными характеристиками аэрозоля. Это может быть обосновано хорошей корреляцией между гравиметрическими и специфичными к лекарственному средству анализами на испускаемую порошковую массу и испускаемую дозу. В предпочтительных вариантах осуществления расхождение между двумя измерениями должно составлять в пределах 15%, предпочтительно в пределах 10% или 5%. Согласованность между гравиметрическим и специфичным к лекарственному средству распределением по размерам обеспечивает меру однородности смешивания между двумя типами частиц в смеси.
[0087] Наличие аморфных доменов лекарственного средства в кристаллических микронизированных лекарственных средствах для ингаляции обычно считается нежелательным. Аморфные домены являются термодинамически нестабильными и могут со временем превращаться в стабильный кристаллический полиморф. Процесс рекристаллизации часто приводит в результате к огрублению микронизированных частиц лекарственного средства и сниженным характеристикам аэрозоля. Аморфные домены с более высокой энергией могут также проявлять большую растворимость, более быстрое растворение и сниженную химическую стабильность по сравнению с кристаллическим лекарственным средством. В результате этого, общепринятой практикой является попытка снижения аморфного содержания микронизированных частиц лекарственного средства, и компании придерживаются больших длин для порошков “с состоянием” для снижения аморфного содержания. Способ по данному изобретению минимизирует образование аморфных доменов в активном ингредиенте во время высушивания распылением, посредством снижения %растворенного активного ингредиента в жидком сырьевом материале, который должен быть высушен распылением.
Активный ингредиент
[0088] Данное изобретение направлено на составы, содержащие кристаллический активный ингредиент с ограниченной растворимостью в жидком сырьевом материале, который должен быть высушен распылением. Варианты осуществления данного изобретения являются особенно пригодными для конструирования частиц, содержащих сильнодействующие активные ингредиенты с номинальной дозой менее 500 мкг. Варианты осуществления данного изобретения пригодны для конструирования частиц, содержащих высушенные распылением составы, содержащие терапевтические средства от астмы и/или ХОБЛ.
[0089] Варианты осуществления данного изобретения пригодны для конструирования высушенных распылением частиц, содержащих один или более сильнодействующих активных ингредиентов, в которых один или более активных агентов характеризуются ограниченной растворимостью в сырьевом материале, который должен быть высушен распылением, и в которых способ и состав сохраняет кристалличность активного вещества в результирующем высушенном распылением лекарственном продукте.
[0090] Варианты осуществления данного изобретения пригодны для конструирования высушенных распылением частиц, содержащих один или более сильнодействующих активных ингредиентов, в которых один или более активных агентов характеризуется растворенной фракцией, как определено по уравнению 1, и в которых способ и состав сохраняет кристалличность активного вещества в результирующем высушенном распылением продукте.
[0091] Активный(ые) ингредиент(ы) сухого порошка по данному изобретению могут быть любым активным фармацевтическим ингредиентом, который пригоден для лечения заболевания или состояния, в особенности подвергающегося лечению легочным введением. Подвергающееся лечению заболевание или состояние может быть системным, легочным или и тем и другим.
[0092] Во многих вариантах осуществления активный фармацевтический ингредиент является ингредиентом, который пригоден для лечения обструктивного или воспалительного заболевания дыхательных путей, в частности, астмы и/или ХОБЛ. Активный(ые) ингредиент(ы) могут быть выбраны, например, из бронходилататоров, противовоспалительных средств и их смесей, в частности, β2-агонистов длительного действия (LABA), мускариновых антагонистов длительного действия (LAMA), ингалируемых кортикостероидов (ICS), бифункциональных β2-агонист-мускариновых антагонистов (MABA), PDE4 ингибиторов, A2A агонистов, кальциевых блокаторов и их смесей.
[0093] Пригодные активные ингредиенты включают β2-агонисты. Пригодные β2-агонисты включают в себя арформотерол (например, тартрат), альбутерол/сальбутамол (например, рацемат или индивидуальный энантиомер, такой как R-энантиомер, или его соль, в частности сульфат), AZD3199, бамбутерол, BI-171800, битолтерол (например, мезилат), кармотерол, кленбутерол, этантерол, фенотерол (например, рацемат или индивидуальный энантиомер, такой как R-энантиомер, или его соль, в частности гидробромид), флербутерол, формотерол (например, рацемат или индивидуальный диастереомер, такой как R,R-диастереомер, или его соль, в частности, фумарат или фумарата дигидрат), GSK-159802, GSK-597901, GSK-678007, индакатерол (например, рацемат или индивидуальный энантиомер, такой как R-энантиомер, или его соль, в частности малеат, ацетат или ксинафоат), абедитерол, метапротеренол, милветерол (например, гидрохлорид), наминтерол, олодатерол (например, рацемат или индивидуальный энантиомер, такой как R-энантиомер, или его соль, в частности гидрохлорид), пирбутерол (например, ацетат), прокатерол, репротерол, салмефамол, салметерол (например, рацемат или индивидуальный энантиомер, такой как R-энантиомер, или его соль, в частности ксинафоат), тербуталин (например, сульфат) и вилантерол (или его соль, в частности трифенатат). В некоторых предпочтительных вариантах осуществления β2-агонист является β2-агонистом ультрадлительного действия, таким как индакатерол, или возможно абедитерол, милветерол, олодатерол или вилантерол.
[0094] В некоторых вариантах осуществления один из активных ингредиентов представляет собой индакатерол (т.е. (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он) или его соль. Он является агонистом β2-адренорецептора, который, в частности, имеет длительную продолжительность действия (т.е. более 24 часов) и кратковременное начало действия (т.е. около 10 минут). Это соединение получено посредством способов, описанных в международных заявках на патент WO 2000/75114 и WO 2005/123684. Оно способно к образованию солей присоединения кислоты, в частности, фармацевтически приемлемых солей присоединения кислоты. Фармацевтически приемлемые соли присоединения кислоты соединения формулы I включают соли неорганических кислот, например, фтористоводородной кислоты, хлористоводородной кислоты, бромистоводородной кислоты или йодистоводородной кислоты, азотной кислоты, серной кислоты, ортофосфорной кислоты; и органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, бензойная кислота, о-гидроксибензойная кислота, п-гидроксибензойная кислота, п-хлорбензойная кислота, дифенилуксусная кислота, трифенилуксусная кислота, 1-гидроксинафталин-2-карбоновая кислота, 3-гидроксинафталин-2-карбоновая кислота, алифатические гидроксикислоты, такие как молочная кислота, лимонная кислота, винная кислота или яблочная кислота, дикарбоновые кислоты, такие как фумаровая кислота, малеиновая кислота или янтарная кислота, и сульфоновые кислоты, такие как метансульфоновая кислота или бензолсульфоновая кислота. Эти соли могут быть получены из соединения известными процедурами образования солей. Предпочтительной солью (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она является малеатная соль. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ацетат. Другой предпочтительной солью является (R)-5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-она ксинафоат. Другие пригодные соли включают гидросукцинат, фумарат, гиппурат, мезилат, гидросульфат, гидротартрат, гидрохлорид, гидробромид, формиат, эзилат, тозилат, гликолят и гидромалонат, которые, как и ацетат и ксинафоат, раскрыты в международной патентной заявке WO 2008/000839 вместе со способами их соответствующего получения.
[0095] Пригодные активные ингредиенты включают мускариновые антагонисты или противомускариновые средства. Пригодные мускариновые антагонисты включают аклидиний (например, бромид), BEA-2180 (например, бромид), CHF-5407, дарифенацин (например, бромид), даротропий (например, бромид), гликопирролат (например, рацемат или отдельный энантиомер, или его соль, в частности бромид), декспирроний (например, бромид), iGSK-202405, умеклидиний, GSK-656398, ипратропий (например, бромид), LAS35201, отилоний (например, бромид), окситропий (например, бромид), оксибутинин, PF-3715455, пирензепин, реватропат (например, гидробромид), солифенацин (например, сукцинат), TD-4208, теродилин, тиотропий (например, бромид), толтеродин (например, тартрат) и троспий (например, хлорид). В некоторых предпочтительных вариантах осуществления мускариновые антагонисты являются мускариновым антагонистом длительного действия, таким как бромид даротропия, умеклидиний, гликопирролат или тиотропия бромид.
[0096] В некоторых вариантах осуществления один из активных ингредиентов является солью гликопиррония. Соли гликопиррония включают гликопиррония бромид, также известный как гликопирролат, про который известно, что он является эффективным противомускариновым агентом. Более конкретно, он ингибирует ацетилхолин, связывающийся с M3 мускариновыми рецепторами, посредством этого ингибируя бронхоконстрикцию. Гликопирролат является четверичной солью аммония. Пригодные противоионы являются фармацевтически приемлемыми противоионами, включая, например, фторид, хлорид, бромид, йодид, нитрат, сульфат, фосфат, формиат, ацетат, трифторацетат, пропионат, бутират, лактат, цитрат, тартрат, малат, малеат, сукцинат, бензоат, п-хлорбензоат, дифенилацетат или трифенилацетат, о-гидроксибензоат, п-гидроксибензоат, 1-гидроксинафталин-2-карбоксилат, 3-гидроксинафталин-2-карбоксилат, метансульфонат и бензолсульфонат. Гликопирролат может быть получен с применением процедур, описанных в патенте Соединенных Штатов Америки 2956062. Он имеет два стереогенных центра и поэтому существует в четырех изомерных формах, а именно, (3R,2’R)-, (3S,2’R)-, (3R,2’S)- и (3S,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния бромид, как описано в описаниях патентов Соединенных Штатов Америки 6307060 и 6613795. Когда лекарственным веществом сухого порошкового состава является гликопирролат, он может представлять собой одну или более этих изомерных форм, в частности, 3S,2’R изомер, 3R,2’R изомер или 2S,3’R изомер, таким образом включая отдельные энантиомеры, смеси диастереомеров или рацематы, в частности, (3S,2’R/3R,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния бромид. R,R-гликопирролат также известен как декспирроний.
[0097] Пригодные активные ингредиенты включают бифункциональные активные ингредиенты, такие как двойственные β2-агонисты-мускариновые антагонисты. Пригодные двойственные β2-агонисты-мускариновые антагонисты включают в себя GSK-961081 (например, сукцинат).
[0098] В некоторых вариантах осуществления активный(ые) ингредиент(ы) сухих порошков по данному изобретению может(гут) быть любым активным фармацевтическим ингредиентом, который пригоден для лечения легочной артериальной гипертензии и/или родственных заболеваний. Пригодные активные ингредиенты включают в себя любые ингредиенты, обладающие эффективностью против такого(их) заболевания(ий), такие как сигнальные молекулы, ингибиторы агрегации тромбоцитов и сосудорасширители. В некоторых вариантах осуществления активное средство содержит аналог простациклина.
[0099] Пригодные активные ингредиенты включают стероиды, например кортикостероиды. Пригодные стероиды включают будесонид, бекламетазон (например, дипропионат), бутиксокорт (например, пропионат), CHF5188, циклезонид, дексаметазон, флунизолид, флутиказон (например, пропионат или фуроат), GSK-685698, GSK-870086, LAS40369, метилпреднизолон, мометазон (например, фуроат), преднизолон, рофлепонид и триамцинолон (например, ацетонид). В некоторых предпочтительных вариантах осуществления стероид представляет собой кортикостероиды длительного действия, такие как будесонид, циклезонид, флутиказон или мометазон.
[00100] В одном варианте осуществления один из активных ингредиентов представляет собой мометазон (т.е. (11β,16α)-9,21-дихлор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метилпрегна-1,4-диен-3,20-дион, альтернативно обозначаемый 9α,21-дихлор-16α-метил-1,4-прегнадиен-11β,17α-диол-3,20-дион 17-(2’-фуроат)) или его соль, например, мометазона фуроат и моногидрат мометазона фуроата. Мометазона фуроат и его получение описаны в патенте США 4472393. Его применение в лечении астмы описано в патенте США 5889015. Его применение в лечении других респираторных заболеваний описано в патентах США 5889015, 6057307, 6057581, 6677322, 6677323 и 6365581.
[00101] Предусмотрены фармацевтически приемлемые сложные эфиры, ацетали и соли вышеупомянутых терапевтических средств. Определение подходящих сложных эфиров, ацеталей или солевых форм обуславливается продолжительностью действия и данными о переносимости/безопасности. Также выбор АФИ может быть важным с точки зрения выбора терапевтических средств с подходящими физическими свойствами (например, растворимостью) для выполнения вариантов осуществления данного изобретения.
Комбинации
[00102] Сухой порошковый состав по данному изобретению может содержать два, три, четыре или более терапевтически активных ингредиента, которые пригодны для лечения заболеваний и состояний.
[00103] В некоторых вариантах осуществления заболевания или состояния включают обструктивное или воспалительное заболевание дыхательных путей, в частности астму и ХОБЛ. В частности, предпочтительная комбинация с фиксированными дозами включает комбинации АФИ из следующих семейств: LABA/ICS, LABA/LAMA, LABA/LAMA/ICS и MABA/ICS.
[00104] Пригодные комбинации включают те, которые содержат β2-агонист и кортикостероид. Иллюстративные варианты осуществления комбинаций показаны заключенными в скобки: (кармотерол и будесонид), (формотерол и беклометазон), (формотерола фумарат и будесонид), (формотерола фумарата дигидрат и мометазона фуроат), (формотерола фумарат и циклезонид), (индакатерола малеат и мометазона фуроат), (индакатерола ацетат и мометазона фуроат), (индакатерола ксинафоат и мометазона фуроат), (милветерола гидрохлорид и флутиказон), (олодатерола гидрохлорид и флутиказона фуроат), (олодатерола гидрохлорид и мометазона фуроат), (салметерола ксинафоат и флутиказона пропионат), (вилантерола трифенатат и флутиказона фуроат) и (вилантерола трифенатат и мометазона фуроат); β2-агонист и мускариновый антагонист, например, (формотерол и аклидиния бромид), (индакатерол и даротропий), (индакатерола малеат и гликопирролат); (индакатерола ацетат и гликопирролат); (индакатерола ксинафоат и гликопирролат); (индакатерола малеат и умеклидиний), (милветерола гидрохлорид и гликопирролат), (милветерола гидрохлорид и тиотропия бромид), олодатерола гидрохлорид и гликопирролат), (олодатерола гидрохлорид и тиотропия бромид), (салметерола ксинафоат и тиотропия бромид), (вилантерола трифенатат и даротропий), (вилантерола трифенатат и гликопирролат), (вилантерола трифенатат и умеклидиний) и (вилантерола трифенатат и тиотропия бромид); и мускариновый антагонист и кортикостероид, например, (гликопирролат и мометазона фуроат) и (гликопирролат и циклезонид); или двойственный β2-агонист-мускариновый антагонист и кортикостероид, например, (GSK-961081 сукцинат и мометазона фуроат), (GSK-961081 сукцинат и мометазона фуроата моногидрат) и (GSK-961081 сукцинат и циклезонид). Необходимо отметить, что фактически возможны любые комбинации, включая комбинации между активными веществами, описанными в круглых скобках, и с другими.
[00105] Некоторые варианты осуществления данного изобретения включают высушенные распылением частицы, содержащие два активных ингредиента. Некоторые варианты осуществления данного изобретения включают высушенные распылением частицы, содержащие три активных ингредиента.
[00106] Пригодные тройные комбинации включают те, которые содержат β2-агонист, мускариновый антагонист и кортикостероид, например, (салметерола ксинафоат, флутиказона пропионат и тиотропия бромид), (индакатерола малеат, мометазона фуроат и гликопирролат), (индакатерола ацетат, мометазона фуроат и гликопирролат) и (индакатерола ксинафоат, мометазона фуроат и гликопирролат).
[00107] Некоторые варианты осуществления данного изобретения включают высушенные распылением частицы, содержащие более трех активных ингредиентов.
Вспомогательные вещества
[00108] Минимальная масса наполнения мелкоразмерного порошка, которая обоснованно может быть наполнена в коммерческом масштабе на высокоскоростной линии наполнения с относительным стандартным отклонением менее 3%, составляет около 0,5 мг. Напротив, необходимая легочная доза активных ингредиентов может составлять только 0,01 мг, и обычно составляет около 0,2 мг или менее. Поэтому, обычно требуются значительные количества вспомогательных веществ.
[00109] В некоторых вариантах осуществления сухой порошковый состав по данному изобретению содержит фармацевтически приемлемое гидрофобное вспомогательное вещество.
[00110] Гидрофобное вспомогательное вещество может принимать различные формы, которые будут зависеть, по меньшей мере до некоторой степени, от композиции и предполагаемого применения сухого порошкового состава. Пригодные фармацевтически приемлемые гидрофобные вспомогательные вещества в целом могут быть выбраны из группы, состоящей из длинноцепочечных фосфолипидов, гидрофобных аминокислот и пептидов и длинноцепочечных жирнокислотных мыл.
[00111] В некоторых вариантах осуществления составы данного изобретения содержат первый и второй сконструированный порошок. В таких вариантах осуществления первый сконструированный порошок сухого порошкового состава содержит высушенные распылением частицы, которые содержат терапевтически активный ингредиент, диспергированный в фармацевтически приемлемом гидрофобном вспомогательном веществе. Второй сконструированный порошок сухого порошкового состава содержит высушенные распылением частицы, которые образованы из фармацевтически приемлемого гидрофобного вспомогательного вещества (и не содержат какой-либо терапевтически активный ингредиент).
[00112] В некоторых вариантах осуществления гидрофобное вспомогательное вещество первого высушенного распылением порошка является таким же, что и гидрофобное вспомогательное вещество второго высушенного распылением порошка, для того чтобы максимизировать однородность и характеристики смеси. В некоторых вариантах осуществления вспомогательное вещество первого высушенного распылением порошка является отличным от вспомогательного вещества второго высушенного распылением порошка.
[00113] Содержание гидрофобного вспомогательного вещества в составе может быть определено из номинальной дозы АФИ и массы наполнения:
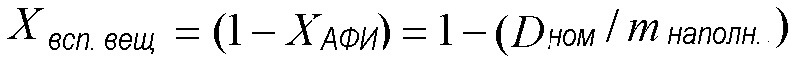
[00114] Посредством контроля состава и процесса, возможно, чтобы поверхность первых высушенных распылением частиц была первоначально составлена из гидрофобного вспомогательного вещества. Поверхностные концентрации могут составлять более чем 70%, такие как более 75% или 80% или 85%. В некоторых вариантах осуществления поверхность составлена из более чем 90% гидрофобного вспомогательного вещества, или более чем 95%, или 98%, или 99% гидрофобного вспомогательного вещества. Для сильнодействующих АФИ не является необычным, чтобы поверхность была составлена из более чем 95% гидрофобного вспомогательного вещества.
[00115] В некоторых вариантах осуществления гидрофобное вспомогательное вещество облегчает развитие шероховатой морфологии частиц. Это означает, что морфология частиц является пористой, морщинистой и складчатой в большей степени, чем гладкой. Это означает, что внутренняя и/или внешняя поверхность частиц ингалируемого лекарственного препарата, по меньшей мере частично, является шероховатой. Эта шероховатость пригодна для обеспечения однородности дозы и нацеливания лекарственного средства путем улучшения порошковой флюидизации и дисперсности. Возрастания шероховатости частиц приводят к снижению межчастичных когезионных сил как результату неспособности частиц сближаться в пределах контакта Ван-дер-Ваальса. Снижения когезионных сил достаточно для значительного улучшения порошковой флюидизации и диспергирования во множестве шероховатых частиц.
[00116] Шероховатость частиц может быть увеличена посредством применения порообразующего агента, такого как перфлуброн, во время их производства или посредством контроля состава и/или процесса продуцирования шероховатых частиц.
[00117] Фосфолипиды как из природных, так и из синтетических источников могут быть использованы в варьирующихся количествах. Когда фосфолипиды представлены, их количества, как правило, достаточно для обеспечения пористой покрывающей матрицы из фосфолипидов. При наличии, фосфолипидное содержание обычно варьируется от около 40 до 99% мас./мас. лекарственного препарата, например, от 70% до 90% мас./мас. лекарственного препарата. Высокий процент вспомогательного вещества также обуславливается высокой эффективностью и вследствие этого, как правило, небольшими дозами активных ингредиентов. Учитывая, что в высушенных распылением частицах не присутствуют частицы носителя, вспомогательные вещества также служат в качестве объемообразующих агентов в составе, позволяя эффективную доставку терапевтических средств с низкой дозой. В некоторых вариантах осуществления также желательно поддерживать нагрузку лекарственного средства низкой для обеспечения того, чтобы свойства частицы контролировались посредством поверхностной композиции и морфологии частиц. Это обеспечивает достижение сопоставимых физической стабильности и характеристик аэрозоля между моно и комбинированными частицами, даже для смеси сконструированных частиц с сопоставимой поверхностной композицией и морфологией частиц.
[00118] Обычно единообразные фосфолипиды содержат фосфолипиды, имеющие фазовый переход от геля к жидкому кристаллу выше, чем около 40°C, такой как выше, чем 60°C, или выше, чем около 80°C. Включенные фосфолипиды могут быть относительно длинноцепочечными (например, C16-C22) насыщенными фосфолипидами. Иллюстративные фосфолипиды, пригодные в раскрытых стабилизированных препаратах, включают, но не ограничены ими, фосфатидилхолины, такие как дипальмитоилфосфатидилхолин (ДПФХ), дистеароилфосфатидилхолин (ДСФХ) и гидрогенизированный фосфатидилхолин яйца или соевый фосфатидилхолин (например, E-100-3, S-100-3, доступный у Lipoid KG, Ludwigshafen, Germany). Природные фосфолипиды предпочтительно являются гидрогенизированными c низким йодным числом (<10).
[00119] Фосфолипиды необязательно могут быть комбинированы с холестеролом для модифицирования текучести ацильных цепей фосфолипида.
[00120] Длинноцепочечные фосфолипиды могут необязательно быть комбинированы с ионом двухвалентного металла (например, кальция, магния). Такой ион двухвалентного металла оказывает воздействие на снижение гидратации головной группы, тем самым увеличивая фазовый переход фосфолипида от геля к жидкому кристаллу, и смачиваемость порошков на выстилающей легкие жидкости. Молярное отношение поливалентного катиона к фосфолипиду может составлять по меньшей мере около 0,05:1, такое как около 0,05:1 до 0,5:1. В одном или более вариантов осуществления молярное соотношение поливалентный катион:фосфолипид составляет 0,5:1. Не подразумевая связывание теорией, считается, что ион двухвалентного металла связывается с фосфатными группами в головных группах цвиттерионного фосфатидилхолина, при этом вытесняя молекулы воды в процессе. Молярные отношения металлического иона к фосфолипиду выше 0,5 могут приводить в результате к свободному металлическому иону, не связанному с фосфатными группами. Это может значительно увеличить гигроскопичность полученного в результате сухого порошка и не является предпочтительным. Когда поливалентный металлический ион представляет собой кальций, он может быть в форме хлорида кальция. Хотя металлические ионы, такие как кальций, часто включены в состав фосфолипидов, никакой из них не является обязательным, и их применение может быть проблематичным, когда другие ионы представлены в составе (например, фосфат, который может осаждать ионы кальция в виде фосфата кальция). Когда имеют место проблемы единообразности, они могут быть преодолены применением солей Mg++, так как они, как правило, имеют значения Ksp, величина которых является на три-четыре порядка более высокой, чем для солей Ca++.
[00121] Гидрофобное вспомогательное вещество может также содержать длинноцепочечные жирнокислотные мыла. Длина алкильной цепи обычно составляет 14-22 атомов углерода в длину, предпочтительны насыщенные алкильные цепи. В жирнокислотных мылах могут быть использованы моновалентные (например, Na+, K+) или дивалентные противоионы (например, Ca++, Mg++). Особенно предпочтительными жирнокислотными мылами являются стеарат натрия и стеарат магния. Растворимость жирнокислотных мыл может быть увеличена выше точки Крафта. Соли калия жирных кислот обычно имеют самые низкие точки температуры Крафта и большую водную растворимость при заданной температуре. Предполагается, что соли кальция имеют наиболее низкую растворимость. Гидрофобные жирнокислотные мыла обеспечивают подобное воску покрытие частиц. Предлагаемые нагрузки в высушенных распылением частицах подобны фосфолипидам, подробно описанным ранее.
[00122] Гидрофобное вспомогательное вещество может также содержать гидрофобные аминокислоты, пептиды или белки. В частности, предпочтительными являются аминокислота лейцин и ее олигомеры - дилейцин и трилейцин. Также предусмотрены белки, такие как человеческий сывороточный альбумин. Трилейцин является особенно предпочтительным, так как его профиль растворимости и другие физико-химические свойства (например, поверхностная активность, log P) облегчают образование частиц со структурой ядро/оболочка, где трилейцин контролирует поверхностные свойства и морфологию полученных в результате частиц.
[00123] Другие предусмотренные вспомогательные вещества включают соли, буферы и стеклообразующие агенты. Особое значение для состава распылительных смесей для предотвращения растворения АФИ в сырьевом материале заключается в добавлении сопряженного основания кислоты, использованной для формирования соли АФИ. Например, для индакатерола малеата сопряженным основанием является натрия малеат. Когда индакатерола малеат помещен в воду, устанавливается равновесие между индакатерола малеатом, свободным основанием индакатерола и малеатом натрия. Добавление малеата натрия сдвигает равновесие в сторону солевой формы, тем самым понижая растворимость соли и снижая аморфное содержание в высушенном распылением порошке. Это часто называют общим ионным эффектом. Общий ион может также служить в качестве буфера и стеклообразующего вспомогательного вещества в составе.
[00124] Традиционные стеклообразующие агенты (например, углеводы, аминокислоты, буферы) также предусмотрены. В частности, предпочтительными являются сахароза, трегалоза, маннит и натрия цитрат).
Состав
[00125] Варианты осуществления данного изобретения предоставляют сухой порошковый состав, который содержит химически стабильную и по существу однородную смесь высушенных распылением частиц.
[00126] Варианты осуществления данного изобретения включают сконструированные частицы, содержащие пористую или шероховатую поверхность. Такие частицы проявляют сниженные межчастичные когезионные силы по сравнению с микронизированными кристаллами лекарственного средства с сопоставимым размером первичных частиц. Это приводит к улучшениям флюидизации и дисперсности порошка по сравнению с упорядоченными смесями микронизированного лекарственного средства и крупной лактозы.
[00127] Варианты осуществления сухих порошковых составов по данному изобретению могут включать от 0,1 до 50% мас./мас. активных ингредиентов, или от 0,1 до 40% мас./мас. активных ингредиентов, или от 0,1% до 30% мас./мас. активного(ых) ингредиента(ов), такое как от 0,5% до 10% мас./мас. или от 2% до 5% мас./мас.
[00128] В некоторых вариантах осуществления кристаллические активные ингредиенты являются микронизированными. СМД (x50) микронизированных активных ингредиентов должен составлять менее 3,0 мкм, предпочтительно менее 2,0 мкм или 1,0 мкм. x90 должен составлять менее 7 мкм, предпочтительно менее 5 мкм или 3 мкм.
[00129] Сухой порошковый состав по данному изобретению может содержать одно или более вспомогательных веществ в добавление к вышеупомянутому гидрофобному вспомогательному веществу. Такие дополнительные вспомогательные вещества иногда называются в данном документе “добавки”.
[00130] В одном или более вариантов осуществления сухого порошкового состава по данному изобретению состав может дополнительно включать добавки для дополнительного усиления стабильности или биоединообразности состава. Например, предусмотрены различные соли, буферы, хелаторы, объемообразующие агенты, общие ионы, стеклообразующие вспомогательные вещества и маскирующие вкус агенты. Другие добавки, пригодные для использования в композиции в соответствии с изобретением, перечислены в “Remington: The Science & Practice of Pharmacy,” 19th Ed., Williams & Williams, (1995), и в “Physician’s Desk Reference,” 52nd Ed., Medical Economics, Montvale, N.J. (1998), оба из которых полностью включены в данный документ посредством ссылки.
[00131] В некоторых вариантах осуществления, в частности содержащих активный агент и фосфолипид, гидрофобное вспомогательное вещество составляет баланс состава. Это означает, что оно служит как в качестве поверхностного модификатора, так и в качестве объемообразующего агента в составе. В таких вариантах осуществления содержание гидрофобного вспомогательного вещества в сухом порошковом составе по данному изобретению составляет более чем 70% мас./мас. композиции, часто более чем 90% мас./мас. или 95% мас./мас., или 99% мас./мас. композиции данной частицы. Нагрузка гидрофобного вспомогательного вещества может составлять такое высокое значение, как 99,9% мас./мас.
[00132] Использование гидрофобного вспомогательного вещества, такого как трилейцин, может быть ограничено его растворимостью в жидком сырьевом материале. Как правило, содержание трилейцина в сконструированном порошке составляет менее 30% мас./мас., более часто порядка от 10% мас./мас. до 20% мас./мас. Из-за его ограниченной растворимости в воде и его поверхностной активности трилейцин является превосходным формирователем оболочки. В результате этого трилейцин обычно смешивают с объемообразующим агентом, который представлен в ядре частицы с кристаллическим активным ингредиентом. Лейцин может также быть применен в качестве формирующего оболочку вспомогательного вещества, и варианты осуществления изобретения могут включать частицы с достижением концентраций лейцина вплоть до около 50%. Жирнокислотные мыла могут проявлять себя подобно лейцину и трилейцину и, таким образом, являются пригодными модификаторами поверхности.
[00133] Объемообразующие агенты могут быть стеклообразующими вспомогательными веществами c высокой температурой перехода в стеклообразное состояние (>80°C). Варианты осуществления данного изобретения могут включать стеклообразующие агенты, такие как сахароза, трегалоза, лактоза, маннит и цитрат натрия. Эти объемообразующие агенты могут дополнительно или альтернативно содействовать стабилизированию любого аморфного активного ингредиента, представленного в составе.
[00134] В некоторых предпочтительных вариантах осуществления гидрофобное вспомогательное вещество содержит более чем 70% поверхности раздела частиц, как измерено посредством электронной спектроскопии для химического анализа (ESCA, также известной как рентгеновская фотоэлектронная спектроскопия или XPS), предпочтительно более чем 90% или 95%.
[00135] В некоторых вариантах осуществления частицы сухого порошкового состава данного изобретения соответственно имеют среднемассовый диаметр (СМД) между 1 и 5 микрон, например, между 1,5 и 4 микрон.
[00136] В некоторых вариантах осуществления частицы сухого порошкового состава по изобретению соответственно имеют среднемассовый аэродинамический диаметр (ММАД) между 1 и 5 микрон, например, между 1 и 3 микрон.
[00137] В некоторых вариантах осуществления частицы сухого порошкового состава по изобретению соответственно имеют шероховатость более чем 1,5, например, от 1,5 до 20, от 3 до 15 или от 5 до 10.
[00138] В некоторых вариантах осуществления, для того чтобы минимизировать между пациентами варьируемость легочного депонирования, частицы сухого порошкового состава по изобретению соответственно имеют фракцию мелкоразмерных частиц, выраженную в виде процента номинальной дозы <3,3мкм (МФЧ<3,3мкм) более чем 40%, предпочтительно более чем 50%, но особенно предпочтительно более чем 60%. Предусмотрено легочное депонирование, составляющее такое высокое значение, как 50-60% от номинальной дозы (60-80% доставленной дозы).
[00139] В некоторых вариантах осуществления доза мелкоразмерных частиц среди частиц сухого порошкового состава по изобретению, имеющих диаметр менее 4,7 мкм (т.е. МФЧ<4,7 мкм), соответственно составляет более чем 50%, например, между 40% и 90%, в частности, между 50% и 80%. Это минимизирует варьируемость между пациентами, связанную с орофарингеальной фильтрацией.
[00140] Когда состав по данному изобретению содержит два активных ингредиента, различия МФЧ<3,3мкмдля двух активных ингредиентов составляют соответственно менее 15%, предпочтительно менее 5%.
[00141] В некоторых вариантах осуществления “легочная доза”, как измерено с применением идеализированной глотки-рта Альберта, составляет более чем 50% испускаемой дозы, например, между 50% и 90%, в частности, между 50% и 80% испускаемой дозы.
Способ
[00142] Данное изобретение предоставляет способ получения сухих порошковых составов для ингаляции, содержащих смесь высушенных распылением частиц, при этом смесь содержит по меньшей мере один активный ингредиент. Варианты осуществления данного изобретения предоставляют способ получения сухих порошковых составов для ингаляции, содержащих смесь высушенных распылением частиц, при этом смесь содержит по меньшей мере один активный ингредиент, который пригоден для лечения обструктивного или воспалительного заболевания дыхательных путей, в частности астмы и/или ХОБЛ.
[00143] Высушивание распылением обеспечивает преимущества в продуцировании сконструированных частиц для ингаляции, такие как возможность быстро продуцировать сухой порошок и контролировать свойства частиц, включая размер, морфологию, плотность и поверхностную композицию. Процесс высушивания является очень быстрым (порядка миллисекунд). В результате этого большинство активных ингредиентов, которые растворены в жидкой фазе, осаждаются в виде аморфных твердых частиц, так как они не имеют достаточного времени для кристаллизации.
[00144] Высушивание распылением включает четыре элементарных операции: приготовление сырьевого материала, пульверизацию сырьевого материала для продуцирования капель микронного размера, высушивание капель в горячем газе и сбор высушенных частиц пылеуловительной камерой или циклонным сепаратором.
[00145] Варианты осуществления способа данного изобретения включают три этапа, однако в некоторых вариантах осуществления два или даже все три этих этапа могут быть осуществлены по существу одновременно, так на практике способ может в действительности считаться одноэтапным процессом. Исключительно в целях описания способа по данному изобретению три этапа будут описаны отдельно, но такое описание не должно рассматриваться как ограничение трехэтапным способом.
[00146] В вариантах осуществления первого этапа способа по изобретению активные сухие порошковые частицы получены посредством приготовления первого сырьевого материала и высушивания распылением сырьевого материала для предоставления активных сухих порошковых частиц.
[00147] Первый сырьевой материал содержит по меньшей мере один активный ингредиент и фармацевтически приемлемое гидрофобное вспомогательное вещество, диспергированное в жидком исходном сырье или несущей среде. Первый сырьевой материал предоставлен с нагрузкой активного ингредиента, которая является достаточно высокой для снижения доли активного ингредиента, который растворяется в жидком сырьевом материале, который должен быть высушен распылением.
[00148] Выбор жидкого сырьевого материала (или несущей среды) зависит от физико-химических свойств активных ингредиентов. Пригодные жидкости, из которых осуществляют выбор, включают воду, этанол, этанол/воду, ацетон, дихлорметан, диметилсульфоксид и другие растворители класса 3, как определено в ICH Q3C Guidelines, например, ICH Topic Q3C (R4) Impurities: Guideline for Residual Solvents (European Medicines Agency reference CPMP/ICH/283/95 of February 2009).
[00149] В некоторых вариантах осуществления активный ингредиент плохо растворим в воде, так что предпочтительной жидкостью является вода. Когда активный ингредиент содержит индакатерол или его соль, жидкость соответственно является водой.
[00150] Растворимость активного ингредиента в сырьевом материале, который должен быть высушен распылением, может быть снижена посредством снижения температуры сырьевого материала. В соответствии с эмпирическим правилом, растворимость снижается в два раза с каждыми 10°C снижения температуры. Поэтому от комнатной температуры до охлажденного состояния ожидается снижение растворимости приблизительно в 4 раза.
[00151] В некоторых случаях добавление соли, которая “высаливает” активный ингредиент, может быть использовано для дополнительного расширения диапазона нерастворимых активных ингредиентов, которые могут быть получены в контексте изобретения. Также может быть возможно модифицировать pH или добавлять общие ионы к активным ингредиентам с ионизируемыми группами для ограничения растворимости в соответствии с принципом Ле Шателье. Природа соли может быть использована для модифицирования физико-химических свойств, в частности, растворимости активного ингредиента.
[00152] Когда растворимость кристаллического активного ингредиента известна, необходимая нагрузка лекарственного средства для достижения целевого %растворенного в сырьевом материале может быть вычислена с применением уравнения 1.
[00153] В некоторых вариантах осуществления %растворенного кристаллического активного ингредиента составляет менее 10% мас./мас., предпочтительно менее 5% мас./мас. или 1% мас./мас.
[00154] Распределение частиц по размерам нерастворимого кристаллического активного ингредиента имеет важное значение в достижении однородности в пульверизированных каплях во время высушивания распылением. Варианты осуществления данного изобретения обеспечивают то, что x50 (срединный диаметр) должен составлять менее 3,0 мкм, предпочтительно менее 2,0 мкм или даже 1,0 мкм. В некоторых вариантах осуществления кристаллические нерастворимые частицы могут быть наноразмерными, т.е. x50<1000 нм или 200 нм. x90 должен составлять менее 7 мкм, предпочтительно менее 5 мкм, предпочтительно менее 4 мкм или даже 3 мкм. Для наночастиц x90 должен составлять менее чем около 1000 нм.
[00155] В вариантах осуществления, где сухие порошки будут содержать два или более активных ингредиентов, которые являются по существу нерастворимыми в воде, часто является предпочтительным то, чтобы они имели подобное распределение по размерам первичных частиц такое, что аэродинамическое распределение частиц по размерам и модель легочного депонирования являются подобными для активных ингредиентов в моносоставах.
[00156] В вариантах осуществления, включающих сырьевые материалы, содержащие эмульсии типа масло в воде, диспергированная масляная фаза служит в качестве порообразующего агента для увеличения пористости частиц и шероховатости высушенного распылением лекарственного продукта. Пригодные порообразующие агенты включают в себя различные фторированные масла, включая перфтороктилбромид (перфлуброн), перфтордекалин и перфтороктилэтан. Капли эмульсии могут быть стабилизированы посредством монослоя длинноцепочечного фосфолипида, который служит в качестве гидрофобного вспомогательного вещества в высушенных распылением частицах.
[00157] В вариантах осуществления изобретения эмульсия может быть приготовлена посредством первого диспергирующего гидрофобного вспомогательного вещества в горячей дистиллированной воде (например, 70°C) с применением пригодного механического смесителя с большими сдвиговыми усилиями (например, смеситель ULTRA-TURRAX T-25) при 8000 об./мин. в течение от 2 до 5 минут. Если гидрофобное вспомогательное вещество является фосфолипидом, дивалентный металл, например, хлорид кальция, может быть добавлен для снижения гидратации головной группы. Затем при перемешивании по каплям добавляют фторуглерод. Полученная в результате эмульсия фторуглерода в воде затем может быть обработана с применением гомогенизатора с высоким давлением для снижения размера частиц. Как правило, эмульсию обрабатывают в двух-пяти раздельных пропусканий при давлении от 55,16 МПа до 137,90 МПа (8000-20000 фунт/кв. дюйм) для продуцирования капель со средним диаметром менее 600 нм. Активный ингредиент добавляют в непрерывную фазу эмульсии и смешивают и/или гомогенизируют, пока он не становится диспергированным и не образуется суспензия. Дополнительные вспомогательные вещества/добавки растворяют в непрерывной фазе эмульсии.
[00158] В некоторых вариантах осуществления сырьевой материал имеет водную основу, однако ингалируемые сухие порошковые составы данного изобретения могут также быть приготовлены с применением органических растворителей или двухрастворительных систем. Системы этанол/вода особенно пригодны в качестве средства для контроля растворимости одного или более из материалов, содержащих частицу. Системы на основе растворителя особенно пригодны для составов, содержащих гидрофобные вспомогательные вещества, например, трилейцин и/или лейцин, которые являются растворенными в жидком сырьевом материале.
[00159] Важно контролировать влагосодержание лекарственного продукта. Для лекарственных средств, которые не являются гидратами, влагосодержание в порошке предпочтительно составляет менее 5%, более типично менее 3% или даже 2% мас./мас. Влагосодержание должно быть достаточно высоким, однако для обеспечения того, чтобы порошок не проявлял значительные силы электростатического притяжения. Влагосодержание в высушенных распылением порошках может быть определено титрованием по методу Карла Фишера.
[00160] В некоторых вариантах осуществления сырьевой материал распыляют в поток теплого отфильтрованного воздуха, который выпаривает растворитель и переносит высушенный продукт в коллектор. Затем отработанный воздух откачивают с растворителем. Условия функционирования распылительного осушителя, такие как входная и выходная температура, скорость подачи, пульверизационное давление, скорость расхода высушивающего воздуха и конфигурация сопла, могут быть отрегулированы для того, чтобы продуцировать необходимый размер частиц, влагосодержание и выход продуцирования полученных в результате сухих частиц. Выбор подходящего аппарата и производственных условий находится в пределах компетенции опытного специалиста в свете идей данного документа и может быть выполнен без избыточного экспериментирования. Иллюстративные установки для масштабного осушителя NIRO® PSD-1® являются следующими: температура воздуха на входе от около 80°C до около 200°C, такая как от 110°C до 17°C; воздуха на выходе около 40°C до около 120°C, такая как около 60°C до 100°C; скорость подачи жидкоcти от около 30 г/мин до около 120 г/мин, такая как около 50 г/мин до 100 г/мин; общий расход воздуха от около 238 л/мин до около 391 л/мин (140-230 станд. куб. футов/мин), такой как от около 272 до 357 л/мин (160-210 станд. куб. футов/мин); и скорость расхода пульверизированного воздуха от около 51 до 153 л/мин (30-90 станд. куб. футов/мин), такая как от около 68 до 136 л/мин (40-80 станд. куб./мин). Содержание твердых частиц в высушенном распылением сырьевом материале, как правило, будет в диапазоне от 0,5 % мас./об. (5 мг/мл) до 10% мас./об. (100 мг/мл), таким как от 1,0% мас./об. до 5,0% мас./об. Установки, естественно, будут варьироваться в зависимости от масштаба и типа используемого оборудования и природы применяемой системы растворителей. В любом случае, применение этих и подобных способов обеспечивает образование частиц с диаметрами, подходящими для аэрозольного депонирования в легкие.
[00161] При высушивании формируется пленка из гидрофобного фосфолипида на поверхности частиц. Водорастворимое лекарственное средство и вспомогательные вещества диффундируют через пульверизированные капли. В конечном счете, масляная фаза выпаривается, оставляя поры в высушенных распылением частицах и шероховатую морфологию частиц. Природа поверхности и морфологии частицы будет контролироваться посредством контроля растворимости и диффузивности компонентов в сырьевом материале. Поверхностно-активные гидрофобные вспомогательные вещества (например, трилейцин, фосфолипиды, жирнокислотные мыла) могут быть сконцентрированы на поверхности раздела, при этом улучшая флюидизацию и дисперсность порошка, при этом также обуславливая увеличенную поверхностную шероховатость для частиц.
[00162] В вариантах осуществления, включающих сырьевые материалы, в которых все вспомогательные вещества растворены в сырьевом материале, покрытия со структурой ядро/оболочка на диспергированном(ых) активном(ых) ингредиенте(ах) обуславливаются различиями в физических свойствах растворенных веществ.
[00163] Порообразующий агент может быть добавлен для того, чтобы увеличить поверхностную шероховатость частиц. Это улучшает характеристики флюидизации и дисперсности частиц.
[00164] В вариантах осуществления второго этапа способа по изобретению неактивные сухие порошковые частицы получены из второго сырьевого материала, и этот сырьевой материал высушивают распылением для предоставления неактивных сухих порошковых частиц. Второй сырьевой материал содержит фармацевтически приемлемое гидрофобное вспомогательное вещество и предпочтительно по существу не содержит активный ингредиент.
[00165] Частицы необязательно могут содержать дополнительную добавку для увеличения объема композиции. Несмотря на то, что она может не быть необходима, когда использованы сырьевые материалы на основе эмульсии, дополнительные объемообразующие агенты необходимы для вспомогательных веществ, подобных трилейцину, который имеет ограниченную растворимость в водном или этанольном сырьевом материале. Предпочтительными объемообразующими агентами являются углеводы, такие как сахароза, трегалоза, сахарные спирты, подобные манниту, или соли или буферы.
[00166] Отношение содержащих неактивное средство порошковых частиц к содержащим активное средство частицам будет определено нагрузкой лекарственного средства, необходимой для содержащих активное средство сухих порошковых частиц для ограничения растворения кристаллического лекарственного средства в жидком сырьевом материале, который должен быть высушен распылением. В некоторых вариантах осуществления неактивные частицы в сущности имеют роль “фильтра” для достижения требуемой нагрузки лекарственного средства, необходимой для доставки терапевтической дозы АФИ с приемлемой массой наполнения в порошковой емкости.
[00167] Гидрофобное вспомогательное вещество, используемое для приготовления второго сырьевого материала, может быть тем же гидрофобным вспомогательным веществом, что используемое для приготовления первого сырьевого материала, или может быть другим гидрофобным вспомогательным веществом. В вариантах осуществления, где одинаковое гидрофобное вспомогательное вещество используется как для активных сухих порошковых частиц, образованных в первом этапе, так и для неактивных сухих порошковых частиц, образованных во втором этапе, полученный в результате сухой порошковый состав по изобретению часто характеризуется по существу идентичными физико-химическими свойствами, что приводит к требуемой однородности смеси.
[00168] Выбор жидкости зависит от физико-химических свойств активных ингредиентов. Пригодные жидкости, из которых можно выбирать, включают воду, этанол, этанол/вода, ацетон, дихлорметан, диметилсульфоксид и другие растворители класса 3, как определено в ICH Q3C Guidelines, например, ICH Topic Q3C (R4) Impurities: Guideline for Residual Solvents (European Medicines Agency reference CPMP/ICH/283/95 of February 2009).
[00169] Любой этап высушивания распылением и/или все этапы высушивания распылением могут быть осуществлены с применением традиционного оборудования, используемого для приготовления высушенных распылением частиц для использования в фармацевтических средствах, которые вводят ингаляцией. Коммерчески доступные распылительные осушители включают осушители, производимые Büchi Ltd. и Niro Corp.
[00170] Как было рассмотрено ранее для частиц, содержащих кристаллический активный ингредиент, природа поверхности и морфология частицы будет контролироваться посредством контроля растворимости и диффузивности компонентов в сырьевом материале. Поверхностно-активные гидрофобные вспомогательные вещества (например, трилейцин, фосфолипиды, жирнокислотные мыла) могут быть сконцентрированы на поверхности раздела, при этом улучшая порошковую флюидизацию и дисперсность, при этом также обуславливая увеличенную поверхностную шероховатость для частиц.
[00171] Для вариантов осуществления, включающих комбинации с фиксированными дозами, содержащими два или более активных ингредиентов, активные ингредиенты могут быть растворены или диспергированы или в первом, или во втором сырьевом материале, или дополнительно или альтернативно, в третьем сырьевом материале. Дополнительные активные ингредиенты могут быть составлены или в кристаллической, или аморфной форме.
[00172] В вариантах осуществления третьего этапа способа по изобретению активные сухие порошковые частицы и неактивные сухие порошковые частицы перемешаны или смешаны для предоставления ингалируемого сухого порошкового состава по изобретению.
[00173] Активные сухие порошковые частицы, приготовленные в первом этапе, могут быть перемешаны с неактивными сухими порошковыми частицами, приготовленными во втором этапе с применением традиционного оборудования для смешивания.
[00174] В некоторых вариантах осуществления первый, второй и третий этапы удобным образом проводят в одноэтапном способе образования и смешивания частиц, “смешивании распылением”. В этом процессе активные сухие порошковые частицы эжектируются из одного или более сопл распылительного осушителя и перемешиваются с неактивными сухими порошковыми частицами, которые эжектируются из одного или более других сопл распылительного осушителя, расположенных в непосредственной близости. Это может быть легко достигнуто с применением многоголовочного пульверизатора, наполненного индивидуальными сырьевыми материалами. Такой многоголовочный пульверизатор раскрыт в патенте США 8524279, Snyder et al.
[00175] По сравнению с широко применяемыми операциями механического смешивания, смешивание распылением исключает потребность в промежуточном хранении, снижает риск контаминации продукта и/или потери продукта и снижает капитальные затраты на оборудование, тем самым снижая время производства и затраты. Кроме того, процесс распылительного смешивания снижает возможность трибоэлектрического заряда, который может представлять проблему при традиционных операциях смешивания.
[00176] Однородность смеси может быть проанализирована с применением активного(ых) ингредиента(о) в смешанных распылением составах после наполнения в блистер из фольги с двух сторон. В этой связи, значения содержания должны как минимум удовлетворять существующим нормативным рекомендациям на однородность содержания, которые устанавливают, что относительное стандартное отклонение (ОСО) должно быть меньше или равно 6%. В некоторых вариантах осуществления в данном документе ОСО однородности содержания должно составлять менее 5%, или менее 4%, или менее 3%, или менее 2% по меньшей мере одного, или двух, или каждого из начала, середины и конца группы. В некоторых вариантах осуществления способа и состава по данному изобретению однородность значений содержания поддерживается во время транспортировки и при хранении лекарственного продукта в течение периода по меньшей мере двух лет.
Применение в терапии
[00177] Варианты осуществления данного изобретения предоставляют способ для лечения обструктивного или воспалительного заболевания дыхательных путей, в частности, астмы и хронического обструктивного легочного заболевания, при этом способ включает введение объекту, нуждающемуся в этом, эффективного количества вышеупомянутого сухого порошкового состава.
[00178] В одном или более вариантов осуществления способ лечения включает введение объекту сухого порошкового состава, содержащего три активных вещества (“тромбо”), содержащего около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. мометазона фуроата, около 0,5-3% мас./мас. гликопиррония бромида, около 89-98% ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера).
[00179] В одном или более вариантов осуществления способ лечения включат введение объекту сухого порошкового состава, содержащего два активных вещества (“комбо”), содержащего около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. мометазона фуроата, около 93-99% мас./мас. ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера).
[00180] В одном или более вариантов осуществления способ лечения включает введение объекту сухого порошкового состава, содержащего два активных вещества (“комбо”): содержащего около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. гликопиррония бромида, около 93-99% ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера).
[00181] Данное изобретение также относится к применению вышеупомянутого сухого порошкового состава в производстве лекарственного препарата для лечения обструктивного или воспалительного заболевания дыхательных путей, в частности, астмы и хронического обструктивного легочного заболевания.
[00182] Данное изобретение также предоставляет вышеупомянутый сухой порошковый состав для применения в лечении обструктивного или воспалительного заболевания дыхательных путей, в частности, астмы и хронического обструктивного легочного заболевания.
[00183] Лечение заболевания или состояния в соответствии с изобретением может быть симптоматичным или профилактическим лечением, или и тем и другим.
[00184] Иллюстративные обструктивные или воспалительные заболевания дыхательных путей, к которым применимо данное изобретение, включают астму любого типа или генеза, включая как наследственную (неаллергическую) астму, так и приобретенную (аллергическую) астму. Лечение астмы также должно подразумеваться как обширное лечение объектов, например, возрастом менее 4 или 5 лет, проявляющих симптомы одышки и диагностированных или диагностируемых как “одышливые дети дошкольного возраста”, установленная категория пациентов имеет большую медицинскую важность, и в настоящее время они часто идентифицируются как ранние или астматики в ранней фазе. (Для удобства это конкретное астматическое состояние называется “синдром одышливых детей дошкольного возраста”.)
[00185] О профилактической эффективности в лечении астмы будет свидетельствовать снижение частоты или тяжести симптоматичного приступа, например, острого астматического или бронхоконстрикторного приступа, улучшение легочной функции или улучшенная гиперреактивность дыхательных путей. Это может быть дополнительно обосновано сниженной потребностью в другой симптоматичной терапии, т.е. терапии от или предназначенной для ограничения или устранения симптоматичного приступа, когда он происходит, например провоспалительной (например, кортикостероид) или бронхорасширяющей. Профилактическое преимущество для астмы может, в частности, быть очевидно для объектов, склонных к “утреннему погружению”. “Утреннее погружение” представляет собой общепризнанный астматический синдром, распространенный у существенного процента астматиков и характеризуемый приступом астмы, например, между часами около 4 до 6 утра, т.е. обычно в момент времени, существенно отдаленный от любой ранее введенной симптоматичной терапии астмы.
[00186] Другие обструктивные или воспалительные заболевания и состояния дыхательных путей, к которым применимо данное изобретение, включают острый/взрослый респираторный дистресс-синдром (ОРДС), хроническое обструктивное легочное или заболевание дыхательных путей (ХОБЛ или ХОЗДП), включая хронический бронхит, или диспноэ, связанное с этим, эмфизему, так же как и обострение гиперреактивности дыхательных путей после терапии с другим лекарственным средством, в частности, терапии с другим ингалируемым лекарственным средством. Изобретение также применимо для лечения бронхита любого типа или генеза, включая, например, острый, арахиновый, катаральный, крупозный, хронический или гнойный туберкулезный бронхит. Дополнительно обструктивное или воспалительное заболевание дыхательных путей, к которому применимо данное изобретение, включает пневмокониоз (воспалительное, обычно трудовое, заболевание легких, часто сопровождаемое обструкцией дыхательных путей, или хронической или острой, и вызванное повторяющимся вдыханием пыли), любого типа или генеза, включая, например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз. Также предусмотрена бронхоэктазия, связанная с кистозным фиброзом и не КФ бронхоэктазией.
[00187] Варианты осуществления сухого порошкового состава по данному изобретению, в частности, пригодны для лечения астмы, ХОБЛ или и того, и другого.
[00188] Иллюстративные системные заболевания и состояния, к которым применимо данное изобретение, включают без ограничения легочную артериальную гипертензию.
Единичная форма дозирования
[00189] Данное изобретение также предоставляет единичную форму дозирования, включающую контейнер, содержащий сухой порошковый состав по данному изобретению.
[00190] В одном варианте осуществления данное изобретение направлено на единичную форму дозирования, включающую контейнер, содержащий сухой порошковый состав из трех активных веществ (“тромбо”): содержащий около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. мометазона фуроата, около 0,5-3% мас./мас. гликопиррония бромида, около 89-98% ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера). В вариантах осуществления изобретения единичная форма дозирования содержит массу наполнения от 0,5 мг до 10 мг.
[00191] В одном варианте осуществления данное изобретение направлено на единичную форму дозирования, включающую контейнер, содержащий сухой порошковый состав из двух активных веществ (“комбо”): содержащий около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. мометазона фуроата, около 93-99% мас./мас. ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера). В вариантах осуществления изобретения единичная форма дозирования содержит массу наполнения от 0,5 мг до 10 мг.
[00192] В одном варианте осуществления данное изобретение направлено на единичную форму дозирования, включающую контейнер, содержащий сухой порошковый состав из двух активных веществ (“комбо”), содержащий около 0,5-3% мас./мас. индакатерола малеата, около 0,5-3% мас./мас. гликопиррония бромида, около 93-99% ДСФХ плюс CaCl2 и около 0,1-1% мас./мас. малеиновой кислоты (в качестве буфера). В вариантах осуществления изобретения единичная форма дозирования содержит массу наполнения от 0,5 мг до 10 мг.
[00193] Примеры контейнеров включают, но не ограничены ими, капсулы, блистеры или контейнерно-укупорочные системы, изготовленные из металла, полимера (например, пластика, эластомера), стекла или подобного.
[00194] Контейнер может быть вставлен в устройство для производства аэрозолей. Контейнер может иметь пригодную форму, размер и материал для содержания сухого порошкового состава и для предоставления сухого порошкового состава в состоянии, пригодном для применения. Например, капсула или блистер может включать стенку, которая содержит материал, который не реагирует неблагоприятно с сухим порошковым составом. В добавление, стенка может содержать материал, который позволяет капсуле быть открытой для обеспечения того, чтобы сухой порошковый состав был аэрозолирован. В одной или более версий стенка содержит одно или более из желатина, гидроксипропилметилцеллюлозы (ГПМЦ), включающей полиэтиленгликоль ГПМЦ, гидроксипропилцеллюлозы, агара, алюминиевой фольги или подобного. Для продаваемых в настоящее время терапевтических средств от астмы/ХОБЛ масса наполнения в контейнер составляет в диапазоне от 0,5 мг до 10 мг, предпочтительно в диапазоне от 1 мг до 4 мг.
[00195] Использование блистеров из фольги с двух сторон также предусмотрено. Выбор подходящих видов фольги для блистера находится в рамках компетенции специалиста в данной области в свете идей данного документа. Природа используемых видов фольги будет обуславливаться влагопроницаемостью склеивания и возможностью материала быть сформированным в блистер с подходящим размером и формой. В одном варианте осуществления порошок нагружают в блистеры из фольги с двух сторон с массой наполнения от 0,5 до 10 мг, предпочтительно от 1,0 мг до 4,0 мг.
Система доставки
[00196] Данное изобретение также обеспечивает систему доставки, содержащую ингалятор и сухой порошковый состав по изобретению.
[00197] В одном варианте осуществления данное изобретение направлено на систему доставки, включающую сухой порошковый ингалятор и сухой порошковый состав для ингаляции, который содержит по существу однородную смесь первого сконструированного порошка и второго сконструированного порошка, при этом указанный первый сконструированный порошок содержит высушенные распылением частицы, которые содержат терапевтически активный ингредиент, диспергированный в фармацевтически приемлемом гидрофобном вспомогательном веществе, при этом указанный второй сконструированный порошок содержит высушенные распылением частицы, которые образованы из фармацевтически приемлемого гидрофобного вспомогательного вещества и являются по существу не содержащими какой-либо терапевтически активный ингредиент, и при этом нагрузка активного ингредиента в указанном первом высушенном распылением порошке является достаточно высокой для ограничения растворения активного ингредиента в сырьевом материале, который должен быть высушен распылением.
Ингаляторы
[00198] Пригодные ингаляторы включают сухой порошковый ингалятор (СПИ). Некоторые такие ингаляторы включают ингаляторы однократной дозы, где сухой порошок хранится в капсуле или блистере, и пациент загружает одну или более капсул или блистеров в устройство перед использованием. Другие многодозовые сухие порошковые ингаляторы включают ингаляторы, в которых доза предварительно упакована в блистеры из фольги с двух сторон, например, в картридж, полоску или колесо.
[00199] Предпочтительные сухие порошковые ингаляторы включают многодозовые сухие порошковые ингаляторы, такие как ингаляторы DISKUS™ (GSK, описанный в патенте США 6536427), DISKHALER™ (GSK, описанный в WO 97/25086), GEMINI™ (GSK, описанный в WO 05/14089), GYROHALER™ (Vectura, описанный в WO 05/37353), PROHALER™ (Valois, описанный в WO 03/77979) и TWISTHALER™ (Merck, описанный в WO 93/00123, WO 94/14492 и WO 97/30743).
[00200] Предпочтительные однодозовые сухие порошковые ингаляторы включают AEROLIZER™ (Novartis, описанный в патенте США 3991761) и BREATHHALER™ (Novartis, описанный в публикации патентной заявки США 2007/0295332 (Ziegler et al.). Другие пригодные однодозовые ингаляторы включают ингаляторы, описанные в патентах США 8069851 и 7559325.
[00201] Предпочтительные блистерные ингаляторы однократной дозы, которые некоторые пациенты считают более простыми и более удобными для лекарственных препаратов, для которых требуется введение раз в сутки, включают ингалятор, описанный в публикации патентной заявки США 2010/0108058 Glusker et al.
[00202] Особенно предпочтительными ингаляторами являются многодозовые сухие порошковые ингаляторы, в которых энергию для флюидизирования и диспергирования порошка предоставляет пациент (т.е. “пассивные” МД-СПИ). Порошки по данному изобретению флюидизируются и диспергируются эффективно при низких пиковых скоростях вдоха (ПСВ). В результате этого небольшие изменения в диспергировании порошка с наблюдаемыми ПСВ эффективно уравновешивают возрастания инерциальных столкновений, которые происходят с возрастанием ПСВ, приводя к независимому от скорости расхода легочному депонированию. Отсутствие зависимости от скорости расхода, наблюдаемое для порошков по данному изобретению, приводит к снижениям общей варьируемости между пациентами. Пригодные пассивные многодозовые ингаляторы на основе блистера включают в себя устройства DISKUS™ (GSK), GYROHALER™ (Vectura), DISKHALER™ (GSK), GEMINI™ (GSK) и PROHALER™ (Valois).
[00203] Некоторые пациенты могут предпочитать использование “активного” многодозового сухого порошкового ингалятора, в котором энергия для флюидизирования и диспергирования порошка предоставляется ингалятором. Такие пригодные ингаляторы включают сухие порошковые ингаляторы под давлением, как раскрыто, например в WO 96/09085, WO 00/072904, WO 00/021594 и WO 01/043530 и ингаляторы ASPIRAIR™ (Vectura). Другие активные устройства могут включать устройства, доступные у MicroDose Technologies Inc., такие как устройство, описанное в публикации патента Соединенных Штатов Америки 2005/0183724. Предпочтительными устройствами будут являться те, которые не только диспергируют порошки однородно с активным компонентом устройства (например, сжатым воздухом, импеллером), но также стандартизируют дыхательный профиль так, чтобы не создавать обратную зависимость от скорости расхода (т.е., возрастания легочного депонирования со снижением ПСВ), что является обычным для активных СПИ.
Капсулы
[00204] Дополнительные варианты осуществления и свойства частично раскрыты в последующем описании и частично будут очевидны специалисту в данной области при рассмотрении описания, или могут быть поняты при воплощении изобретения на практике.
[00205] Это изобретение дополнительно проиллюстрировано следующими примерами, которые не должны считаться ограничивающими.
Раскрытие аббревиатур, использованных в примерах
[00206] В примерах использованы следующие аббревиатуры:
ПРИМЕРЫ
Пример 1 - Приготовление смешанных распылением сухих порошковых составов индакатерола малеата и индакатерола малеата + мометазона фуроат
[00211] В этом примере сухие порошковые составы по изобретению, содержащие индакатерола малеат, приготавливали процессом смешивания распылением. Это включает состав, содержащий комбинацию с фиксированной дозой индакатерола малеата и мометазона фуроата.
[00212] Пять смешанных распылением составов (см. таблицы 3 и 4) приготавливали и высушивали распылением на масштабном распылительном осушителе Niro PS-1, оборудованном многоголовочным пульверизатором HYDRA™. Пульверизатор HYDRA™ (фигура 3) содержит пять сопл для двух текучих сред (см. фигуру 3A), каждое из которых контролируется независимой жидкой питающей линией, как показано схематически на фигуре 3B. Применяли обыкновенную газовую линию для подачи пульверизационного газа (сжатый воздух) во все сопла. Сопла направляли для минимизации воздействия выбросов распылений во время высушивания. Для пяти партий, подробно описанных ниже, использовали только три из пяти распылительных сопл (линии подачи A, B, C). Композиция высушенных распылением сырьевых материалов, и скорости расхода жидкости подробно раскрыты в таблице 3. Также продемонстрированы композиции индакатерола малеата (ИМ) и мометазона фуроата (МФ) в не расфасованном порошке для распылительной смеси.
[00213] Для партии I линия подачи A содержала 6% мас./мас. ИМ (на основе свободного основания). Остаток линии подачи A был составлен из соотношения 2:1 моль:моль ДСФХ:CaCl2. Сырьевой материал для линий подачи B и C представлял собой 100% соотношения 2:1 моль:моль ДСФХ:CaCl2. Общая нагрузка твердых частиц составляла 30 мг/мл для всех из смешанных распылением партий, и использовали 10:1 мас./мас. ПФОБ:вспомогательное вещество (ДСФХ, CaCl2, трегалоза, натрия малеат). Конечное содержание ИМ в смешанном распылением составе составляло 1,44%. Следовательно, нагрузка лекарственного средства в линии подачи A была увеличена более чем в 4 раза.
[00214] В партии II концентрация индакатерола в линии подачи A составляла 18% мас./мас. и концентрация в смешанном распылением нефасованном порошке составляла только 4,1% мас./мас., так как остающиеся высушенные распылением частицы из линий подачи B и C не содержали АФИ. Если предположить, что индакатерола малеат имеет растворимость в воде 0,2 мг/мл, то процесс смешивания распылением, используемый в партии II, снижает растворенный индакатерол в сырьевом материале на величину от около 8,0% до 1,6% (уравнение 1).
[00215] Партию III составляли подобно партии II за исключением того, что 5% мас./мас. трегалозы добавляли в линию подачи A. Трегалоза является вспомогательным веществом, используемым для стабилизации аморфного ИМ, который должен образовываться во время процесса.
[00216] Партия IV составлена подобно партии II за исключением того, что 20 мМ малеата натрия (pH 5,5) добавляли в линию подачи A. Малеат натрия добавляли для снижения растворимости индакатерола в воде до примерно 0,01 мг/мл (общий ионный эффект). В этом случае смешивание распылением снижало растворенный индакатерол в сырьевом материале на величину от около 8,0% до 0,1%. Предполагая, что весь %растворенный был преобразован в аморфное твердое вещество в высушенных распылением порошках, фракции аморфного лекарственного средства, вводимого во время процесса высушивания распылением со смешиванием распылением и с общим ионным эффектом, вероятно, являются сопоставимыми или составляют меньше, чем количество, введенное во время стандартных процессов микронизации с ассоциированным этапом деаморфизации.
[00217] Партия V содержит комбинацию с фиксированной дозой ИМ и МФ. МФ составляли в линиях подачи B и C.
[00218] Композиции смешанных распылением составов подробно раскрыты в таблице 4. Стоит отметить, что составы изготовлены из первоначального соотношения 2:1 моль:моль ДСФХ:CaCl2 (>90% мас./мас.). Фосфолипид служит в качестве гидрофобного вспомогательного вещества, контролирует композицию поверхности и морфологию частиц. Он также служит в качестве объемообразующего агента в составе.
Пример 2 - Приготовление смешанных распылением сухих порошковых составов индакатерола малеата и индакатерола малеата + мометазона фуроат из основанного на эмульсии сырьевого материала
[00219] В этом примере более подробно представлено приготовление сырьевых материалов, используемых в примере 1. Приготавливали сухие порошковые составы по изобретению, содержащие индакатерола малеат, и приготавливали сухие порошковые составы по изобретению, содержащие индакатерола малеат и мометазона фуроат из основанного на эмульсии сырьевого материала, который приготавливали в соответствии со способом, описанным в патенте Соединенных Штатов Америки 6565885. В этом способе кристаллический микронизированный индакатерола малеат диспергировали в непрерывной фазе эмульсии типа масло в воде. Способ привел в результате к кристаллическим частицам индакатерола, покрытым пористым слоем гидрофобного вспомогательного вещества. Морфологию частиц подтверждали посредством сканирующей электронной микроскопии (данные не приведены).
[00220] Соответственно, дистеароилфосфатидилхолин (ДСФХ) и CaCl2 диспергировали и растворяли соответственно в нагретой воде (~70°C) со смесителем с высоким сдвиговым усилием ULTRA TURRAX™ T-25™ для формирования многослойных липосом. Масляной фазой был перфтороктилбромид, ПФОБ (Atofina, Paris, France). ПФОБ добавляли по каплям к дисперсии ДСФХ при перемешивании для создания крупной (микронного размера) эмульсии типа масло в воде. Капли эмульсии стабилизировали монослоем ДСФХ. Крупную эмульсию затем гомогенизировали при высоком давлении с гомогенизатором AVESTIN C-50®, в трех раздельных этапах, при давлении установки 69,55 МПа, 68,95 МПа и 138,1 МПа (10 и 20 фунт/кв.дюйм изб. давления). Это продуцирует мелкоразмерные (субмикронные) капли эмульсии. Средний диаметр капель эмульсии, обычно находится в диапазоне от 0,1 мкм до 1,0, более часто от 0,3 мкм до 0,6 мкм.
[00221] Суспензию с дополненным индакатерола малеатом также приготавливали со смесителем с высоким сдвиговым усилием. ДСФХ включали в дисперсию в качестве смачивающего агента для облегчения суспендирования индакатерола в воде. Дисперсию ДСФХ приготавливали добавлением ДСФХ к нагретой воде (~70°C) и затем перемешиванием с применением смесителя с высоким сдвиговым усилием. Дисперсию ДСФХ затем быстро охлаждали до 2-8°C перед добавлением ИМ. Для партии IV буферизующий раствор малеата натрия приготавливали добавлением предварительно определенного количества малеиновой кислоты и NaOH для достижения раствора с pH 5,5, который затем быстро охлаждали до 2-8°C. Дополнительные вспомогательные вещества для партий III и IV добавляли к дисперсии ДСФХ перед добавлением индакатерола. Индакатерол затем добавляли к быстро охлажденной дополненной ДСФХ дисперсии с применением смесителя с высоким сдвиговым усилием. Все дополненные суспензии АФИ приготавливали при холодных условиях производства для поддержания лекарственного средства при 2-8°C (для дополнительного минимизирования растворения IM).
[00222] Для партии V дополненную мометазона фуроатом (МФ) суспензию приготавливали с применением смесителя с высоким сдвиговым усилием (ULTRA TURRAX™ T-25™) для диспергирования микронизированного МФ в воде. Сырьевые материалы приготавливали добавлением соответственных дополнений к мелкоразмерной эмульсии, которую хранили при 2-8°C. Полученные в результате сырьевые материалы хранили при 2-8°C в открытых сосудах из нержавеющей стали и перемешивали с надземным LIGHTNIN® лабораторным смесителем. Несущую среду сырьевого материала, применяемую для линий подачи B и C, приготавливали разбавлением мелкоразмерной эмульсии до целевой концентрации твердых частиц 5% мас./об. или 50 мг/мл.
[00223] Конфигурация пульверизатора, применяемого для этого протокола, позволяла то, чтобы три независимых потока сырьевого материала были поданы в распылительный осушитель. Три потока сырьевого материала были разделены следующим образом:
- Один поток сырьевого материала (линия подачи A) использовали для высушивания распылением индакатерол-содержащего сырьевого материала.
- Два остающихся потока (линии подачи B и C) имели одинаковый сырьевой материал (для разделения расхода поровну использовали Y-образный фитинг), который являлся или несущей средой (партии I, II, III и IV), или содержащим мометазон исходным сырьем (партия V).
[00224] Для сохранения соотношений сырьевых материалов с фиксированным значением использовали многоголовочный перистальтический насос, управляемый одним стержнем. Одиночный измеритель расхода использовали для наблюдения за общей скоростью расхода линий подачи B+C. Так как был доступен только одиночный измеритель расхода, скорость расхода линии подачи A определяли гравиметрически, определяя массу сырьевого материала A, доставленного в течение фиксированного периода времени. Условия высушивания распылением и целевые соотношения линии подачи выбирали после оценки производительностей оборудования (пульверизатор и многоголовочный насос для сырьевого материала). Целевое соотношение волюметрических скоростей подачи для композиций, показанных в таблице 3, составляло приблизительно 3:1 (линия подачи B+C):(линия подачи A). Целевые условия высушивания распылением показаны в таблице 5.
Пример 3 - Измерение физических свойств смешанных распылением сухих порошковых составов индакатерола малеата и индакатерола малеата + мометазона фуроат
[00225] В этом примере измеряли некоторые физико-химические свойства смешанных распылением сухих порошковых составов в примере 1, а именно, размер первичных частиц, насыпную плотность и содержание воды.
[00226] Фигуры 7A-7E являются микрофотографиями смешанных распылением порошков вариантов осуществления данного изобретения, при этом порошки содержат индакатерол. Порошки составляли в соответствии с таблицей 3, и фигуры 7A-E по порядку соответствуют от партии I до партии V. Порошки проявляют полостную, пористую морфологию, характерную для процесса высушивания распылением на основе эмульсии. Не имело место свидетельств различных типов частиц в смешанных распылением составах фигур 7A-E.
[00227] Таблица 6 представляет физические свойства, измеренные для таких составов.
[00228] Распределения по размерам первичных частиц высушенных распылением порошков определяли посредством лазерной дифракции (Sympatec GmbH, Clausthal-Zellerfeld, Germany). Анализатор размеров частиц SYMPATEC HELOS™ был оборудован микродозовым дозатором ASPIROS™ и диспергирующим сухой порошок блоком RODOS™. Массу образца приблизительно 10 мг вводили в ASPIROS. Использовали инициирующую концентрацию (Cопт) приблизительно 1% и рабочее давление 4 бар. Данные собирали в течение измерения продолжительностью 10 секунд. Распределения частиц по размерам вычисляли посредством инструментального программного обеспечения с применением модели Фраунгофера. Перед измерением образцовоценивали пригодность системы посредством измерения распределения по размерам первичных частиц карбидокремниевого стандартного образца, предоставляемого Sympatec GmbH. Данные представлены относительно среднего диаметра (x50) и ГСО (x84,13/x50). ГСО или геометрическое стандартное отклонение является мерой полидисперсности логарифмически нормального распределения частиц по размерам.
[00229] Насыпные плотности определяли измерением массы порошка, необходимой для наполнения цилиндрической полости (одноосное компактирование (UC ячейка)) известного объема с применением микрошпателя. Держатель образца осторожно постукивали по рабочей поверхности. Больше порошка добавляли в ячейку по мере того, как объем образца снижался. Этапы постукивания и добавления порошка повторяли, пока полость не была заполнена и слой порошка больше не уплотнялся при дополнительном постукивании. Приведенные результаты представляют среднее из пяти повторений.
[00230] Содержание воды или влаги в порошке относится к количеству воды, содержащейся в веществе на основе % мас./мас. Содержание воды в каждом из смешанных распылением сухих порошковых составов примера 1 определяли титрованием по методу Карла Фишера.
[00231] Результаты показывают, что распределения по размерам первичных частиц были исключительно единообразными между порошками, несмотря на тот факт, что композиции порошков были весьма различными. Это демонстрирует, что распределение по размерам первичных частиц контролируется, в первую очередь, условиями высушивания распылением, а не различиями композиции.
[00232] Физические свойства смешанных распылением порошков из партий II и IV были исключительно совпадающими, несмотря на то, что сухие порошки партии II являлись составом моно индакатерола малеата, и сухие порошковые партии IV являлись составом комбинации с фиксированной дозой индакатерола малеата и мометазона фуроата. Небольшие различия в насыпных плотностях, отмеченные для партии III, вероятно, являются результатом добавления трегалозы в состав. Трегалоза взаимодействует с липидом, тем самым немного изменяя поверхностные свойства и приводя к более высокой плотности частиц. Моносоставы и комбинации с фиксированными дозами, содержащие фосфолипид и добавленную трегалозу, также, как ожидается, будут проявлять эквивалентные физические свойства с сопоставимыми насыпными плотностями. Это было продемонстрировано для не распылительно смешанных составов.
[00233] Результаты показывают, что цель достижения высушенных распылением частиц с физическими свойствами, независимыми от композиции активных веществ и вспомогательных веществ в частицах, была достигнута для смешанных распылением сухих порошковых составов примера 1.
Пример 4 - Однородность содержания смешанного распылением сухого порошка, содержащего индакатерола малеат
[00234] В этом примере измеряли однородность содержания смешанного распылением сухого порошка, приготовленного в партии II примера 1. Партия II содержит кристаллический индакатерола малеат в качестве единственного активного ингредиента.
[00235] Нефасованный порошок, содержащий смешанный распылением индакатерол из партии II, наполняли в однодозовые блистеры из фольги с двух сторон, с массой наполнения 1,5 мг, с применением наполнителя на барабанной основе, описанного в описании патента Соединенных Штатов Америки 2004/0060265. Однородность содержания наполненных блистеров оценивали способом специфичной к лекарственному средству обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ). Лекарственное содержание и продукты разрушения определяли с ВЭЖХ системой Waters Alliance 2695/2795 с двухпоточным детектором длины волны Waters 2487, детектором Water PDA 996 и программным обеспечением Waters Empower Build 1154. Для анализа содержания и сопутствующих веществ использовали колонку YMC Pack ODS AQ; для энантиомера использовали колонку Daicel Chiral OJ-RH. Анализировали два повторения для каждого образца. Результаты содержаний представлены в таблице 7 ниже.
[00236] Относительное стандартное отклонение (ОСО) измерения содержания индакатерола для десяти повторений составило только 1,5%. Однородность содержания наполненных блистеров, которая была достигнута, подтверждала эффективность процесса смешивания распылением по изобретению в достижении однородной смеси частиц индакатерола и частиц несущей среды в одноэтапном процессе высушивания/смешивания. Данные также демонстрируют возможность достижения целевой лекарственной нагрузки индакатерола в распыленной смеси.
Пример 5 - Однородность содержания смешанного распылением сухого порошка, содержащего индакатерола малеат и мометазона фуроат
[00237] В этом примере измеряли однородность содержания смешанного распылением сухого порошка, приготовленного в партии V примера 1. Он содержит индакатерола малеат и мометазона фуроат в качестве активных ингредиентов в отдельных смешанных распылением частицах.
[00238] Смешанный распылением сухой порошок из партии V, который содержит частицы, которые содержат индакатерола малеат и мометазона фуроат, наполняли в блистеры из фольги с двух сторон с массой наполнения 1,5 мг. Однородность содержания наполненных блистеров оценивали обращенно-фазовой высокоэффективной жидкостной хроматографией (ОФ-ВЭЖХ), как описано в примере 4. Результаты представлены в таблице 8 ниже.
[00239] Однородность измеренного содержания значения была превосходной для обоих активных ингредиентов, о чем свидетельствовали значения ОСО для 10 повторений, составившие 1,44% и 1,61% для индакатерола и мометазона, соответственно. Это подтверждает эффективность процесса смешивания распылением по изобретению в достижении однородной смеси в одноэтапном процессе высушивания/смешивания.
Пример 6 - Сравнение испускаемой порошковой массы и испускаемых доз посредством ОФ-ВЭЖХ для смешанного распылением сухого порошкового состава индакатерола малеата
[00240] В этом примере измеряли аэрозольные характеристики смешанного распылением сухого порошка, приготовленного в партии II примера 1. Более конкретно, определяли и сравнивали испускаемую порошковую массу и испускаемую дозу порошка, доставляемого патентованным однодозовым пассивным сухим порошковым ингалятором на основе блистера. Порошок содержал индакатерола малеат в качестве единственного активного ингредиента.
[00241] Сухой порошковый ингалятор представлял собой ингалятор, описанный в международной патентной заявке WO 08/51621. Масса наполнения в блистер составляла 1,5 мг. Аэрозольные характеристики оценивали при падении давления 4 кПа, соответствующем скорости расхода 35 л/мин.
[00242] Измеряли испускаемую порошковую массу (ИПМ) и испускаемую дозу (ИД) порошка, и результаты представлены в таблице 9 ниже.
[00243] Гравиметрические определения ИПМ предоставляют меру общей массы порошка (высушенных распылением частиц, содержащих индакатерол, и высушенных распылением частицы несущей среды), которая испускается из устройства и улавливается на фильтре. Данные выражены в виде процента номинальной массы наполнения.
[00244] ИД определена специфичным к лекарственному средству способом ВЭЖХ, описанным в примере 4. ИД обеспечивает меру массы индакатерола, выходящего из ингалятора, выраженную в виде процента заявленного (номинального) содержания индакатерола в блистере.
[00245] Результаты показывают, что измерения ИПМ и ИД являются по существу эквивалентными. Это предполагает, что содержащие лекарственное средство частицы и вспомогательное вещество/частицы несущей среды были хорошо перемешаны во время процесса смешивания распылением. Кроме того, результаты демонстрируют, что не происходит сегрегации двух типов частиц во время процесса барабанного заполнения.
Пример 7 - Сравнение испускаемой порошковой массы и испускаемых доз посредством ОФ-ВЭЖХ для смешанного распылением сухого порошкового состава индакатерола малеата и мометазона фуроата
[00246] В этом примере измеряли аэрозольные характеристики смешанного распылением сухого порошка, приготовленного в партии V примера 1. Более конкретно, определяли и сравнивали испускаемую порошковую массу и испускаемую дозу порошка, доставленного патентованным пассивным сухим порошковым ингалятором однократной дозы на основе блистера. Порошок содержал индакатерола малеат и мометазона фуроат в качестве активных ингредиентов.
[00247] Сухой порошковый ингалятор представлял собой ингалятор, описанный в международной патентной заявке WO 08/51621. Масса наполнения в блистер составляла 1,5 мг. Аэрозольные характеристики оценивали при падении давления 4 кПа, соответствующем скорости расхода 35 л/мин.
[00248] Измеряли испускаемую порошковую массу (ИПМ) и испускаемую дозу (ИД) порошка, и результаты представлены в таблице 10 ниже.
[00249] Результаты показывают, что гравиметрические ИПМ и специфичные к лекарственному средству ИД определения точно соответствуют. Это предполагает, что частицы с обогащенным содержанием индакатерола были хорошо перемешаны с частицами, содержащими мометазон во время процесса смешивания распылением. Кроме того, результаты демонстрируют, что не происходит сегрегации двух типов частиц во время процесса барабанного наполнения.
Пример 8 - Аэродинамическое распределение частиц по размерам смешанного распылением сухого порошкового состава индакатерола малеата и мометазона фуроата
[00250] В этом примере аэрозольные характеристики смешанного распылением сухого порошка, приготовленного в партии V примера 1 и доставленного патентованным однодозовым пассивным сухим порошковым ингалятором на основе блистера, определяли измерением его аэродинамического распределения частиц по размерам (АРЧР).
[00251] Сухой порошковый ингалятор представлял собой ингалятор, описанный в международной патентной заявке WO 08/51621. Экспериментально определенные номинальные дозы составляли 70±1 мкг для двух лекарственных средств. Масса наполнения в блистер составляла 1,5 мг. Скорость расхода составляла 35 л/мин, что соответствует падению давления 4 кПа.
[00252] АРЧР измеряли с помощью NEXT GENERATION IMPACTOR™. Для порошка оценивали постадийные порошковые массы индакатерола и мометазона. Статистические данные (среднее, стандартное отклонение) основаны на пяти повторных измерениях.
[00253] Результаты измерений АРЧР представлены в таблице 11 ниже.
[00254] Аэродинамическое распределение частиц по размерам подразделяли на различные стадийные группирования. “LPD0-2”означаетфракцию больших частиц, представленную на стадиях 0-2 (массовая основа). “FPD3-F”относится к дозе мелкоразмерных частиц на стадиях от 3 до фильтра, и “VFPD4-F” представляет дозу очень мелкоразмерных частиц на стадиях от 4 до фильтра. Массу индакатерола и мометазона на различных стадиях в NGI определяли специфичным к лекарственному средству способом ВЭЖХ.
[00255] Результаты показывают, что АРЧР для индакатерола и мометазона соответствуют очень точно на постадийной основе. Небольшие различия в LPD, FPD и VFPD для двух активных ингредиентов указывают на то, что порошок имеет превосходную однородность смеси. Кроме того, превосходная согласованность АРЧР для смешанных распылением порошков указывает на то, что различия в свойствах частиц являются пренебрежимо малыми между двумя порошками. Это было, несомненно, обосновано конструированием, в соответствии с которым частицы были сконструированы так, чтобы они имели структуру ядро/оболочка, где поверхностная композиция и морфология контролируются гидрофобным вспомогательным веществом (ДСФХ), с отличающимися АФИ, представленными в ядре частиц.
[00256] Общее депонирование двух активных ингредиентов на стадии 3 до фильтра представляет 66%-68% измеренной номинальной дозы. На основании предыдущих гамма сцинтиграфических исследований на здоровых добровольцах можно было предположить, что легочная доставка in-vivo будет составлять ~50-60% от номинальной дозы с варьируемостью между пациентами только 10-20%.
Пример 9 - Химическая стабильность смешанного распылением сухого порошка, содержащего индакатерола малеат
[00257] В этом примере оценивали химическую стабильность всех из смешанных распылением сухих порошков, приготовленных в примере 1, и шести других смешанных распылением сухих порошков, содержащих индакатерола малеат, с применением ОФ-ВЭЖХ, как описано в примере 4.
[00258] Нефасованные порошки оценивали в условиях ускоренных испытаний (T=60°C) в течение периода семи дней. Результаты представлены в таблице 12 ниже. Они показывают возрастания продуктов разрушения, т.е. содержание энантиомеров и общие разрушенные продукты.
[00259] Химическую стабильность определяли количественно с точки зрения процента превращения в S-энантиомер индакатерола и общего содержания примесей, наблюдаемого посредством ВЭЖХ.
[00260] Расчетный %растворенный вычисляли на основании композиций сырьевого материала в соответствии с уравнением 1. Растворимость индакатерола в воде составляла 0,2 мг/мл и 0,01 мг/мл в 20 мМ малеатном буфере. Сниженная растворимость в малеатном буфере является результатом сдвига равновесия в направлении осаждения индакатерола малеата, которое происходит в результате добавления общего иона. Влияние смешивания распылением на растворенную фракцию ясно видно посредством сравнения партий I и VI. В смешанной распылением партии I общая нагрузка лекарственного средства составляет 1,4%, при этом растворенная фракция составляет только 4,9%. Напротив, для единственного сырьевого материала партии VI лекарственное содержание в действительности является более высоким (2%), при этом растворенная фракция составляет почти 15%. Более высокое содержание растворенной фракции приводит в результате к значительно более высоким уровням энантиомера (7,7% в сравнении с 1,8%) и более высоким уровням общего содержания примесей (4,7% в сравнении с 2,7%). Партия V, использующая как общий ионный эффект, так и смешивание распылением, показывает наиболее низкую растворенную фракцию и наилучшую химическую стабильность из тестируемых партий.
[00261] Результаты, показанные в таблице 12, показывают сильную корреляцию между растворенной фракцией индакатерола в высушенном распылением сырьевом материале и полученными в результате измерениями химической стабильности индакатерола при хранении. Результаты отображены графически на фигуре 4.
[00262] Фигура 4 показывает % растворенного индакатерола для партий I-XI, отображенный графически в зависимости от энантиомера и энантиомера с общими примесями. Значительные улучшения химической стабильности отмечены со снижением растворенного содержания индакатерола. Добавление общего иона (малеата) сдвигает равновесие в направлении соли, значительно снижая его растворимость (общий ионный эффект). Это также является средством для снижения растворенной фракции индакатерола. Когда растворенной фракции мало, добавление стеклообразующего агента (например, трегалозы) обеспечивает небольшое добавочное преимущество, если аморфное содержание порошка является низким.
[00263] Все вместе результаты, представленные в таблице 12 и на фигуре 4, показывают значительную корреляцию между долей индакатерола, который растворен в сырьевом материале, который должен быть высушен распылением, и полученной в результате химической стабильностью при хранении. Предполагается, что сниженная химическая стабильность происходит в результате возрастания доли аморфного индакатерола в порошке. Из-за быстрых промежутков времени высушивания, связанных с высушиванием распылением (миллисекундная шкала времени), предположено, что любой индакатерол, который растворяется в сырьевом материале, будет преобразован в аморфный материал в высушенном распылением лекарственном продукте. К сожалению, невозможно определить количественно аморфное содержание в высушенных распылением порошках из-за низких нагрузок лекарственного средства и низкой чувствительности существующих в настоящее время аналитических способов. Тем не менее, вероятность того, что растворенный индакатерол превратится в аморфное лекарственное средство в высушенных распылением порошках является высокой, и корреляция между растворенной фракцией индакатерола и полученными в результате различиями стабильности, наблюдаемыми при хранении, обеспечивает дополнительное обоснование связи между растворенной фракцией/аморфным содержанием/химической стабильностью.
Пример 10 - Оценки легочной доставки высушенных распылением сконструированных порошков индакатерола малеата в сухом порошковом ингаляторе Breathhaler®
[00264] Пример 10 обеспечивает оценки предполагаемого среднего легочного депонирования in-vivo из измерений массы активного ингредиента, которая депонируется на фильтре после идеализированной ротоглотки Алберта. Идеализированная модель ротоглотки Алберта была сконструирована на основании расчетов анатомий ротоглотки, полученных из визуализирующих исследований. Модель была сконструирована для предоставления среднего депонирования в ротоглотке. “Легочная доза” представляет массу активного ингредиента, которая не депонируется в ротоглотке.
[00265] “Легочная доза” in-vitro для высушенного распылением состава ИМ (партия VIII) представлена на фигуре 5. Сконструированный порошок доставлен с сухим порошковым ингалятором Breathhaler®. Breathhaler® является портативным сухим порошковым ингалятором на основе капсул с низким сопротивлением устройства. Результаты сравнивали с результатами рыночного продукта ИМ (ингаляционный порошок OnBrez®, Novartis, Basel, Switzerland), который составлен с применением стандартной технологии смешивания, и в котором использован такой же сухой порошковый ингалятор. Легочная доза in-vitro для сконструированного порошка составляет около двух доз стандартной смеси. 37% легочного депонирования, предсказанные для торгового лекарственного продукта OnBrez, хорошо согласуются с предыдущими фармакокинетическими результатами для этого лекарственного продукта у пациентов с ХОБЛ. Следовательно, эти результаты предполагают, что легочное депонирование для сконструированных порошков должно составлять около 70% от номинальной дозы. Кроме того, сконструированные порошки показывают линейный дозозависимый эффект.
[00266] Сконструированный порошковый состав (партия VIII) также показывает минимальную зависимость от скорости расхода. Фигура 6 показывает график легочной дозы in-vitro в виде функции от скорости расхода через сухой порошковый ингалятор Breathhaler®. Скорость расхода варьируется от 30 л/мин до 60 л/мин до 90 л/мин. Ингалятор Breathhaler® представляет собой устройство низкого сопротивления, и большинство пациентов могут добиться скоростей расхода свыше 90 л/мин. Следовательно, скорость расхода 30 л/мин представляет условия очень строгого теста. Легочная доза in-vitro остается выше 80% для всех тестируемых скоростей расхода.
Пример 11 - Аэродинамические распределения частиц по размерам в смешанных распылением составах индакатерола малеата и мометазона фуроата, доставленных из сухого порошкового ингалятора Breathhaler®
[00267] Аэродинамическое распределение частиц по размерам комбинации с фиксированной дозой ИМ и МФ (партия V) из сухого порошкового ингалятора Breathhaler® сравнивали с результатами из моносостава ИМ (партия II). Результаты представлены относительно ММАД и массы на стадии группирования из S3-F (таблица 13), полученной на импакторе Next GENERATION. Ингалятор Breathhaler® функционировал со скоростью расхода 60 л/мин. Массу наполнения регулировали для доставки номинальной дозы около 150 мкг.
[00268] ММАД и МФЧS3-F являются единообразными для ИМ в моно и комбо составах. Кроме того, доставки ИМ и МФ являются единообразными в комбинационном продукте. Общее отклонение МФЧS3-F для ИМ и МФ в комбо продукте составляет менее 5% от доставки лекарственного средства, полученной для моносостава.
Пример 12 - Композиции индакатерола малеата, мометазона фуроата и гликопиррония бромида, приготовленные смешиванием распылением
[00269] Производили шесть дополнительных партий смешанных распылением порошков на масштабном распылительном осушителе Niro PS-1, оборудованном многоголовочным пульверизатором Hydra. Все из партий составляли с применением соотношения 2:1 моль:моль дистеароилфосфатидилхолин (ДСФХ):CaCl2 и массового соотношения 10:1 ПФОБ:вспомогательное вещество (ДСФХ и CaCl2). Сырьевой материал плацебо содержал ДСФХ и CaCl2с общей концентрацией твердых частиц 4,04% мас./мас. и с массовым соотношением ПФОБ к воде 0,68 мас./мас. Лекарственный сырьевой материал содержал индакатерола малеат (ИМ), гликопиррония бромид (ГБ) и мометазона фуроат (МФ), ДСФХ и CaCl2с общей концентрацией твердых частиц 4,19% мас./мас. и массовым соотношением ПФОБ к воде 0,52 мас./мас. для всех партий. Композиции плацебо и лекарственного сырьевого материала шести партий подробно раскрыты в таблице 14. Сырьевые материалы плацебо и лекарственного средства высушивали распылением при соотношении подачи приблизительно 3:1 соответствующим образом. Два сырьевых материала смешивали распылением на Niro PSD-1, где сырьевой материал плацебо нагнетали со скоростью, варьирующейся от 63,7 до 75,1 г/мин, и лекарственное вещество нагнетали со скоростями, варьирующимися от 22,5 до 24,9 г/мин. Целевые композиции для 6 смешанных распылением партий приведены в таблице 15. Частицы, содержащие лекарственное средство, являются обогащенными более чем в 5 раз лекарственным средством по сравнению с не расфасованной композицией, посредством этого снижая растворенную фракцию для плохо растворимых лекарственных средств (например, индакатерола малеата) в сырьевом материале. Кроме того, добавление малеата натрия в качестве общего иона снижает растворимость индакатерола малеата от 0,2 мг/мл до 0,01 мг/мл. В общем, %растворенный для индакатерола малеата в шести партиях составлял ≈0,17% (вычислено с применением уравнения 1).
[00270] Смешанные распылением составы частиц высушены распылением из основанного на эмульсии сырьевого материала с использованием многоголовочного пульверизатора Hydra. Микронизированный индакатерола малеат и мометазона фуроат диспергировали в непрерывной фазе эмульсии типа масло в воде сырьевого материала лекарственного вещества; тогда как гликопиррония бромид, малеиновую кислоту, лимонную кислоту и гидроксид натрия растворяли в непрерывной фазе. Малеиновую кислоту добавляли для подавления растворимости индакатерола малеата посредством общего ионного эффекта и буферизации состава. Лимонную кислоту добавляли в качестве буфера к партии 6-3 для контроля pH при 4,5, так как малеиновая кислота имеет небольшую или не обладает буферной емкостью при требуемом pH. Все pH сырьевого материала лекарственного вещества регулировали с применением гидроксида натрия. Сырьевые материалы лекарственного вещества совместно высушивали распылением с сырьевым материалом плацебо с применением пульверизатора Hydra, оборудованного четырьмя соплами с соотношением подачи приблизительно 1:3, соответственно. Целевые композиции сырьевых материалов описаны в примере 12 (таблица 14). Производственный процесс приводит в результате к частицам, содержащим аморфный ГБ, кристаллический ИМ и МФ, покрытый пористым слоем гидрофобных вспомогательных веществ.
[00271] Сырьевой материал плацебо приготавливали диспергированием дистеароилфосфатидилхолина (ДСФХ) в нагретой воде (~70°C), содержащей растворенный CaCl2, со смесителем с высоким сдвиговым усилием (Ultra-Turrax T-50, IKA-Werke GmbH, Staufen Germany) для формирования многослойных липосом. Перфтороктилбромид (ПФОБ) добавляли к дисперсии ДСФХ при перешивании для создания крупной (микронного размера) эмульсии типа масло в воде. Дополнительную воду добавляли к крупной эмульсии для получения необходимой массы эмульсии для подсчета потерь от испарения. Крупную эмульсию затем гомогенизировали (M110 Microfluidizer, Microfluidics Corp., Newton, MA) в двух отдельных этапах при давлении установки 138,1±20,7 МПа (20±3 фунт/кв.дюйм изб. давления) для создания субмикронной эмульсии.
[00272] Сырьевые материалы лекарственного вещества приготавливали диспергированием ИМ и/или МФ кристаллов лекарственного вещества в эмульсию типа масло в воде, содержащую натрия малеат, ДСФХ, хлорид кальция и ПФОБ, с применением смесителя с высоким сдвиговым усилием (Ultra-Turrax T-25, IKA-Werke GmbH, Staufen Germany). Все сырьевые материалы лекарственного вещества поддерживали при температуре от 2 до 8°C. При необходимости добавляли ГБ и растворяли в непрерывной фазе эмульсии типа масло в воде. Для группы 6-3 приготавливали цитратный буфер и добавляли к эмульсии типа масло в воде, наряду с малеиновой кислотой, перед добавлением лекарственных веществ ИМ и МФ.
[00273] Эмульсию типа масло в воде для сырьевых материалов лекарственного вещества приготавливали с применением таких же процедур и оборудования, как описано выше для сырьевого материала плацебо. Эмульсию типа масло в воде затем быстро охлаждали до 2-8°C. Для каждой группы, за исключением 6-3, приготавливали буферизующие растворы малеата натрия добавлением предварительно определенного количества кислоты и NaOH для достижения раствора с pH 3, который затем быстро охлаждали до 2-8°C. Для партии 6-3 приготавливали буферизующий раствор добавлением предварительно определенного количества лимонной кислоты и малеиновой кислоты и NaOH для достижения pH 4,5, который затем быстро охлаждали до 2-8°C.
[00274] Конфигурация пульверизатора, используемая для этого протокола, давала возможность подачи четырех независимых линий сырьевого материала в распылительный осушитель. Четыре потока сырьевого материала распределяли следующим образом:
- сырьевые материалы лекарственного вещества подавали в один из потоков пульверизатора (низкий расход).
- сырьевые материалы плацебо подавали в три оставшихся потока пульверизатора, оборудованного каскадными Y-образными фиттингами для разделения расхода (высокий расход).
[00275] Для подержания соотношения, при котором сырьевые материалы нагнетались, использовали два независимо контролируемых перистальтических насоса. Наблюдали за скоростями расхода каждого сырьевого материала. Целевые условия высушивания распылением показаны в таблице 16.
Пример 13 - Аэрозольные характеристики смешанных распылением комбинаций
[00276] Аэрозольные характеристики для индакатерола малеата в выбранных смешанных распылением партиях представлены в таблице 17. Порошки доставляли с портативным пассивным сухим порошковым ингалятором (T-326), со скоростью расхода 60 л/мин. Составы содержали моно ИМ состав, его комбинацию с фиксированными дозами с МФ и ГБ и тройную комбинацию ИМ/ГБ/МФ. Аэрозольные характеристики были единообразными между моносоставом и комбинацией с фиксированными дозами с вариацией во фракции мелкоразмерных частиц (МФЧS3-F) для комбинации с фиксированными дозами по сравнению с моносоставом из 10% или менее.
Пример 14 - Химическая стабильность смешанных распылением составов, содержащих ИМ, МФ и ГБ
[00277] Химическая стабильность смешанных распылением составов ИМ и его комбинации с фиксированными дозами с МФ и ГБ представлены в таблице 18. Представленные данные отображают главные продукты разрушения для каждого из трех лекарственных веществ, как определено посредством ОФ-ВЭЖХ. Смешивание распылением сохраняло кристаллическую природу индакатерола (%растворенный = 0,17%), приводя в результате к минимальному химическому разрушению при хранении. Единственным продуктом разрушения, который появлялся при уровнях значительно выше LOQ, являлся пик 529 для индакатерола. Это представляет собой энантиомерную форму лекарственного средства. Энантиомер был определен в доклинических исследованиях с гораздо более высокими уровнями, и эта степень разрушения не представляет проблем.
Пример 15 Влияние растворения соединения X в воде на химическую стабильность высушенного распылением лекарственного продукта
Этот пример иллюстрирует, что способы и композиции смешивания распылением по данному изобретения могут быть применены к любому основанному на суспензии процессу высушивания распылением, где АФИ имеет ограниченную растворимость в водном сырьевом материале, который должен быть высушен распылением. В этом примере новый аналог простациклина (соединение X) для лечения легочной артериальной гипертензии был высушен распылением. Форма свободного основания соединения X имеет растворимость в воде 0,01 мг/мл. Так как доза АФИ снижена до диапазона 100 мкг, нагрузка лекарственного средства состава также должна быть сниженной. Это в результате приводит к растворению АФИ в сырьевом материале, который должен быть высушен распылением. Даже небольшие количества растворенного соединения X (около 1% мас./мас.) могут оказывать значительное влияние на химическую стабильность высушенного распылением лекарственного продукта. Фигура 8 показывает график разрушения АФИ, наблюдаемый для соединения X, как функцию от процента растворенного в течение двухнедельного и четырехнедельного периодов времени. На фигуре 8 можно увидеть, что небольшие величины растворения АФИ имеют большое влияние на химическую стабильность высушенного распылением лекарственного продукта. Растворенный процент варьируется с изменениями содержания лекарственного средства и содержания твердых частиц в сырьевом материале (см. таблицу 19 ниже). Баланс состава составляет молярное соотношение 2:1 ДСФХ:CaCl2. Все составы высушивали распылением на изготовленной на заказ лабораторной масштабной распылительной сушилке, разработанной научными работниками Novartis. Высушенные распылением порошки хранили при 40°C/75% ОВ в течение этих периодов времени. Значительные возрастания разрушения наблюдались для %растворенного, превышающего 0,1%. Поэтому, в некоторых вариантах осуществления способа и композиции по данному изобретению, %растворенного активного средства составляет менее чем около 0,1%, такой как менее чем около 0,09%, или 0,08%, или 0,07%, или 0,06%, или 0,05%. В некоторых вариантах осуществления способа и композиции по данному изобретению процент разрушения лекарственного средства после 4 недель составлял менее чем около 1,5%, такой как менее чем около 1% или 0,9%, или 0,8%, или 0,7%, или 0,6%, или 0,5%, или 0,4%, или 0,3%, или 0,2%, или 0,1%.
Пример 16: Смешивание распылением составов соединения X для подержания химической стабильности высушенного распылением лекарственного продукта
Для того чтобы сохранить стабильность соединения X, разрабатывали процесс смешивания распылением, в котором частицы, содержащие соединение X, при нагрузке лекарственного средства 20% и 40% мас./мас. для ограничения растворения АФИ перемешивали с плацебо частицами PULMOSPHERE™, содержащими молярное соотношение 2:1 ДСФХ:CaCl2. Смешанные распылением составы имели содержание АФИ только лишь 2,5% мас./мас. Таблица 20 предоставляет композиции тестированных смешанных распылением составов. Все составы приготавливали на масштабной распылительной сушилке Niro PSD-1, оборудованной изготовленными на заказ аппаратными средствами для пульверизации и сбора. Пульверизатор Hydra использовали для смешивания распылением вплоть до пяти независимых жидких питающих и пульверизационных газовых потоков.
После хранения в течение 4 недель при 40°C/75% ОВ общее разрушение составляло менее 0,35% для всех из тестированных распыленных смесей. Для составов, где сопло, содержащее соединение X, поддерживалось при концентрации 40% мас./мас., общее разрушение составляло менее 0,20%. Поэтому, процесс смешивания распылением был эффективен для минимизации растворения АФИ в сырьевом материале и поддержания химической стабильности высушенного распылением лекарственного продукта.
[00278] Различные признаки и варианты осуществления данного изобретения, на которые имеются ссылки в индивидуальных разделах выше, применимы соответствующим образом к другим разделам при внесении необходимых изменений. Следовательно, признаки, заданные в одном разделе, могут быть комбинированы с признаками, заданными в других разделах, соответствующим образом.
[00279] Специалист в данной области признает или будет способен установить с применением не более чем рутинных экспериментов многие эквиваленты специфических вариантов осуществления изобретения, описанных в данном документе. Подразумевается, что такие эквиваленты охватываются последующей формулой изобретения.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к порошковому составу для ингаляции для лечения обструктивного или воспалительного заболевания дыхательных путей. Предложен порошковый состав для ингаляции для лечения обструктивного или воспалительного заболевания дыхательных путей, содержащий смесь первого сконструированного порошка и второго сконструированного порошка, при этом указанный первый сконструированный порошок содержит первые высушенные распылением частицы, содержащие один или более кристаллических терапевтически активных ингредиентов, диспергированных в фармацевтически приемлемом гидрофобном вспомогательном веществе, где один или более активных ингредиентов выбраны из группы, состоящей из β-агониста длительного действия, мускаринового антагониста и кортикостероида; при этом указанный второй сконструированный порошок содержит вторые высушенные распылением частицы фармацевтически приемлемого гидрофобного вспомогательного вещества, где вторые высушенные распылением частицы не содержат какой-либо терапевтически активный ингредиент; и где первый высушенный распылением порошок и второй высушенный распылением порошок содержат одинаковое гидрофобное вспомогательное вещество, которое представляет собой фосфолипид. Предложен также способ получения ингалируемого сухого порошкового состава высушенных распылением частиц, при этом способ включает этапы:приготовление первого сырьевого материала, приготовление второго сырьевого материала, смешивание активных сухих порошковых частиц и неактивных сухих порошковых частиц для предоставления ингалируемого сухого порошкового состава. Вышеописанный порошковый состав способен сохранять свою стабильность при хранении. 2 н. и 16 з.п. ф-лы, 8 ил., 20 табл., 16 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ улучшения фармацевтических свойств микрочастиц, содержащих дикетопиперазин и активный агент

Комментарии