Фармацевтические композиции - RU2568882C2
Код документа: RU2568882C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим продуктам и составам, содержащим R(+)будесонид. В частности, настоящее изобретение относится к фармацевтическим продуктам и составам, содержащим R(+)будесонид, которые являются пригодными для лечения и/или профилактики респираторного, воспалительного или обструктивного заболевания дыхательных путей. Настоящее изобретение также относится к способу получения состава в соответствии с настоящим изобретением, его терапевтическому использованию и способам лечения с его применением.
Уровень техники
Бронхиальная астма и хроническая обструктивная болезнь легких (ХОБЛ) представляют собой наиболее распространенные состояния, которые влияют на большинство людей. Обструкция дыхательных путей представляет собой главную характерную особенность в каждом из этих заболеваний дыхательных путей, и лекарственные средства, используемые при лечении, являются также часто подобными.
Патофизиология бронхиальной астмы и связанных нарушений включает в себя различные симптомы, включая бронхоконстрикцию, воспаление дыхательных путей и увеличенный слизистый секрет, что приводит к свистящему дыханию, кашлю и одышке. Постоянный или рецидивирующий кашель может усугубить проблему, вызывая дальнейшее раздражение и воспаление дыхательных путей. Бронхоконстрикция возникает вследствие спазма гладкой мускулатуры бронхов и воспаления дыхательных путей с отеком слизистой оболочки.
ХОБЛ представляет собой тяжелое респираторное состояние, которое увеличивает свое распространение по всему миру. В Индии, по оценкам, распространенность составляет приблизительно 12,36 миллионов. В настоящее время она является четвертой по значимости причиной смерти в Великобритании и США и по прогнозам займет третье место среди заболеваний в мировом значении к 2020 году.
ХОБЛ представляет собой контролируемое и поддающееся лечению состояние заболевания, характеризующееся ограничением воздушного потока, который не полностью обращается. Обструкция дыхательных путей обычно является прогрессирующей и связана с патологическим воспалительным ответом легких на вредные частицы или газы, в первую очередь, вызвана курением сигарет. Хотя ХОБЛ поражает легкие, она также производит значительные системные последствия. ХОБЛ связана с повышенной секрецией слизи, эмфиземой и бронхиолитом.
Терапия для лечения или профилактики ХОБЛ и бронхиальной астмы в настоящее время включает в себя использование бронходилататоров, таких как бета2-агонисты, антихолинергические средства и стероиды.
Ингаляционные бронходилататоры представляют собой основу фармакотерапии в отношении ХОБЛ вследствие их потенциала для облегчения симптомов, снижения обострений заболевания и улучшения качества жизни. Эти лекарственные средства также улучшают ограничение воздушного потока и чрезмерное расширение, таким образом повышая выносливость к физической нагрузке. Кроме того бронходилататоры могут уменьшить усталость дыхательных мышц (неоднозначно) и улучшить мукоцилиарный клиренс.
Бета2-агонисты пролонгированного действия улучшают функцию легких, сокращают симптомы и защищают от одышки, вызванной физической нагрузкой, пациентов с бронхиальной астмой и ХОБЛ. Бета2-агонисты пролонгированного действия индуцируют бронходилатацию, вызывая длительное расслабление гладких мышц дыхательных путей. В дополнение к длительной бронходилатации бета2-агонисты пролонгированного действия (LABA) оказывают другие эффекты, такие как ингибирование пролиферации гладкомышечных клеток дыхательных путей и высвобождение медиаторов воспаления, также как не гладкомышечные эффекты, такие как стимуляция мукоцилиарного транспорта, цитопротекция слизистой оболочки дыхательных путей и ослабление воспроизводства и активации нейтрофилов.
Бета2-агонисты пролонгированного действия уменьшают симптомы, которые происходят в ночное время или рано утром, которые обычно влияют на характер сна и снижают общее качество жизни пациента.
Кроме того, использование бета2-агонистов пролонгированного действия снижает частоту введения лекарственного средства.
Антихолинергические средства также являются наиболее предпочтительным вариантом для симптоматического лечения пациентов с ХОБЛ.
Антихолинергические средства ингибируют мускариновое действие ацетилхолина на структуры, иннервированные постганглионарными холинергическими нервами. Эти средства обычно ингибируют бронхоконстрикцию, расслабляя гладкие мышцы и вызывая значительную бронходилатацию.
Хотя также известно, что бета2-агонисты и антихолинергические средства обеспечивают облегчение симптомов при бронхоконстрикции, другой компонент бронхиальной астмы, который представляет собой воспаление, требует отдельного лечения, такого как с помощью стероида. Большинство из этих ингаляционных кортикостероидов необходимо вводить в несколько режимом дозирования.
Полагают, что лечение с помощью кортикостероидов/глюкокортикоидов является одним из наиболее мощных и эффективных методов лечения, доступных в настоящее время в отношении персистирующей бронхиальной астмы. Кортикостероиды оказывают ингибирующие эффекты на клетки воспаления и медиаторы воспаления, участвующие в патогенезе респираторных нарушений.
Кортикостероиды используют в нескольких формах для лечения многих различных состояний. Поскольку они уменьшают кожный зуд, отек, покраснение и аллергические реакции, они часто используются при лечении кожных заболеваний, тяжелых степеней аллергии, бронхиальной астмы и артрита.
В настоящее время доступные кортикостероиды включают беклометазон, будесонид, флутиказон, мометазон и триамцинолон.
Комбинированная терапия бета2-агониста пролонгированного действия, антихолинергического средства и ингаляционного кортикостероида улучшает легочную эффективность, уменьшает воспалительную реакцию и обеспечивает облегчение симптомов по сравнению с более высокими дозами ингаляционных кортикостероидов отдельно у пациентов, страдающих от респираторных нарушений, таких как бронхиальная астма и ХОБЛ. Однако выбор определенного бета2-агониста пролонгированного действия, определенного антихолинергического средства и определенного ингаляционного кортикостероида играет очень важную роль в формировании комбинации фиксированных доз.
Комбинированная терапия также упрощает лечение респираторных нарушений, снижает стоимость лечения и обеспечивает контроль респираторных нарушений. Снижение частоты дозы до минимальной является основным шагом в упрощении контролирования ХОБЛ и бронхиальной астмы для улучшения соблюдения пациентом предписанного режима терапии.
В US 2009088408 раскрывают фармацевтические композиции антихолинергических средств, кортикостероидов и бетамиметиков и их использование при лечении заболеваний дыхательных путей.
В US 20050042174 раскрывают комбинированные дозы лекарственных средств для бронхиальной астмы, такие как комбинация доз бета2-агониста, антихолинергического средства и противовоспалительного стероида.
В WO 2006105401 раскрывают комбинацию антихолинергического средства, кортикостероида и бета2-агониста пролонгированного действия для одновременного и последовательного введения при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
В WO 2004028545 раскрывают комбинацию бета2-агониста пролонгированного действия и глюкокортикостероида при лечении фиброзных заболеваний.
Тем не менее использование кортикостероидов особенно у детей было ограничено вследствие возможных побочных эффектов. У детей и подростков эти лекарственные средства могут остановить или замедлить рост и оказать влияние на функции надпочечников (небольшие железы, расположенные над каждой почкой, которые секретируют природные кортикостероиды). Другой возможной проблемой для детей является то, что кортикостероиды могут спровоцировать инфекции, такие как ветряная оспа и более серьезное корь.
Другие побочные эффекты, которые связаны с кортикостероидами, включают супрессию гипоталамо-гипофизарно-надпочечниковой (ГГН) оси, влияние на рост костей у детей и на плотность костной ткани у пожилых людей, глазные осложнения (образование катаракты и глаукома) и атрофию кожи. У людей старшего возраста кортикостероиды могут увеличить риск высокого кровяного давления и заболевания костей. Проблемы с костями вследствие приема кортикостероидов наиболее вероятны у пожилых женщин.
Преимущества и риски приема кортикостероидов для детей и подростков должны быть тщательно обсуждены с лечащим врачом. Регулируя дозы и формы, в которых принимают кортикостероиды, лечащий врач может снизить вероятность нежелательных побочных эффектов.
Некоторые кортикостероиды существуют в виде энантиомеров и проявляют хиральность. Энантиомеры представляют собой структурно идентичные соединения, которые отличаются только тем, что один изомер является зеркальным отражением другого и зеркальные изображения не могут быть наложены друг на друга. Это явление известно как хиральность. Несмотря на структурную идентичность энантиомеры могут обладать совершенно различными эффектами в биологических системах; один энантиомер может иметь определенную биологическую активность, тогда как другой энантиомер может не иметь биологической активности вообще или может иметь полностью отличную форму биологической активности.
Будесонид, кортикостероид, широко использовался при лечении хронического и астматического бронхита вследствие его сильного противовоспалительного действия, высокой селективности и меньшего количества побочных эффектов. Форма, в которой будесонид в настоящее время используется, представляет собой рацемическую смесь. То есть, она представляет собой смесь оптических изомеров, называемых энантиомерами R(+) и S(-), которые характеризуются различной эффективностью и фармакокинетическими свойствами.
Будесонид представляет собой химическую смесь двух эпимеров 22R(+) и 22S(-), имеющих различную конфигурацию в ацетале атома 22-углерода. R(+)будесонид, который состоит в основном из эпимера 22R, оказывается клинически превосходящим по сравнению с препаратами, состоящими из 1:1 смеси эпимеров.
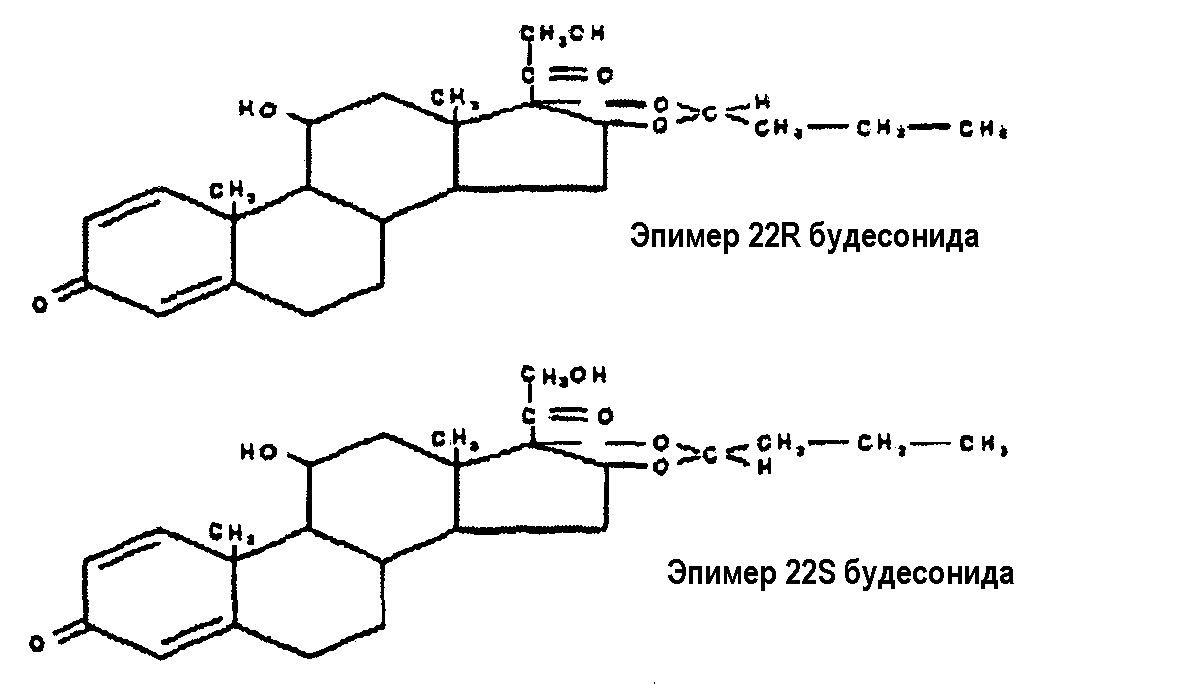
Противовоспалительные свойства R(+)изомера почти в три раза сильнее по сравнению с S(-)изомером. R(+)будесонид также имеет больший объем распределения и плазменный клиренс. R(+)будесонид очень хорошо переносится и не вызывает серьезных побочных эффектов. Однако поскольку R(+)будесонид подвергается биотрансформации быстрее, чем S(-)-изомер, системное действие R(+)будесонида слабее по сравнению с S(-)будесонидом.
Будесонид представляет собой основу при лечении респираторных и воспалительных или обструктивных заболеваний дыхательных путей. Однако большинство составов, содержащих будесонид, доступных в данной области техники, содержат рацемическую смесь будесонида.
Следовательно, еще остается необходимость в разработке фармацевтических композиций, содержащих R(+)будесонид для ингаляций, имеющих уменьшенные побочные эффекты, и в разработке фармацевтических композиций, содержащих R(+)будесонид в комбинации с одним или более бронходилататорами для ингаляций, имеющих уменьшенные побочные эффекты.
Цель изобретения
Целью настоящего изобретения является создание новых фармацевтических композиций для ингаляции, содержащих R(+)будесонид и один или более бронходилататоров, для введения при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Другой целью настоящего изобретения является создание новых фармацевтических композиций для ингаляции, содержащих R(+)будесонид и один или более бронходилататоров для ингаляции, имеющих уменьшенные побочные эффекты при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Композиции в соответствии с изобретением могут, конечно, включать в себя один или более фармацевтически приемлемых эксципиентов.
Еще одной целью настоящего изобретения является способ получения новых фармацевтических композиций, содержащих R(+)будесонид и один или более бронходилататоров, для введения при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Дополнительной целью настоящего изобретения является создание фармацевтических композиций, содержащих R(+)будесонид и один или более бронходилататоров, для использования при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Сущность изобретения
В соответствии с первым аспектом настоящего изобретения обеспечивают фармацевтическую композицию, содержащую R(+)будесонид и один или более бронходилататоров.
В соответствии со вторым аспектом настоящего изобретения обеспечивают способ получения фармацевтической композиции, содержащей R(+)будесонид и один или более бронходилататоров.
В соответствии с третьим аспектом настоящего изобретения обеспечивают фармацевтическую композицию, содержащую R(+)будесонид и один или более бронходилататоров, для использования при лечении нарушений или состояний, которые реагируют, или предотвращаются, или облегчаются, или устраняются при введении R(+)будесонида и одного или более бронходилататоров.
Подробное описание изобретения
Было установлено, что R(+)энантиомер будесонида обеспечивает освобождение от бронхиальных нарушений, тогда как одновременно снижая нежелательные побочные эффекты, обычно встречающиеся при использовании кортикостероидов. Кроме того, поскольку используют активный энантиомер, необходимая доза также снижается по сравнению с рацемическим будесонидом, уменьшенная доза также способствует сокращению нежелательных побочных эффектов.
Таким образом, настоящее изобретение обеспечивает новые фармацевтические композиции для ингаляции, содержащие R(+)будесонид и один или более бронходилататоров, для введения при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей при одновременном снижении нежелательных побочных эффектов, обычно встречающихся при использовании кортикостероидов.
В соответствии с настоящим изобретением оптически чистый R(+)изомер будесонида могут вводить отдельно или в комбинации с одним или более бронходилататорами или другим лекарственным средством(ами) для лечения и/или профилактики респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Другие лекарственные средства могут быть выбраны из различных классов лекарственных средств, обычно используемых при респираторных заболеваниях, например, бронходилататоры.
Настоящее изобретение относится к фармацевтической композиции, содержащей R(+)будесонид и один или более бронходилататоров.
Бронходилататоры, используемые в соответствии с настоящим изобретением, могут быть бета2-агонистами и/или антихолинергическими средствами. Как уже обсуждалось, выбор определенного бета2-агониста пролонгированного действия, антихолинергического средства и ингаляционного кортикостероида играет очень важную роль в формировании комбинации фиксированных доз.
Термины «агент бета2-агонист» или «бета2-агонист» или «антихолинергическое средство» или «кортикостероиды» используются в широком смысле и включают в себя не только бета2-агонист или антихолинергическое средство как таковые, но также их фармацевтически приемлемые соли, фармацевтически приемлемые сольваты, фармацевтически приемлемые гидраты, фармацевтически приемлемые энантиомеры, фармацевтически приемлемые производные, фармацевтически приемлемые энантиомеры, фармацевтически приемлемые полиморфные модификации, фармацевтически приемлемые пролекарства и подобное.
Настоящее изобретение также относится к фармацевтической композиции, содержащей R(+)будесонид и один или более бета2-агонистов.
В соответствии с настоящим изобретением бета2-агонисты могут содержать один или более бета2-агонистов короткого действия, бета2-агонистов пролонгированного действия или бета2-агонистов ультра-пролонгированного действия.
Бета2-агонисты, которые могут быть использованы в соответствии с настоящим изобретением, включают альбутерол, левоальбутерол, тербуталин, пирбутерол, прокатерол, метапротеренол, фенотерол, битолтерола мезилат, ритодрин, салметерол, формотерол, арформотерол, кармотерол, бамбутерол, кленбутерол, индакатерол, милветерол, вилантерол, олодатерол.
В соответствии с одним из вариантов осуществления настоящего изобретения фармацевтическая композиция может содержать R(+)будесонид и формотерол с одним или более фармацевтически приемлемыми эксципиентами, R(+)будесонид и арформотерол с одним или более фармацевтически приемлемыми эксципиентами, R(+)будесонид и салметерол с одним или более фармацевтически приемлемыми эксципиентами.
В соответствии с другим вариантом осуществления настоящего изобретения фармацевтическая композиция может содержать R(+)будесонид и кармотерол с одним или более фармацевтически приемлемыми эксципиентами.
В соответствии с еще одним вариантом осуществления настоящего изобретения фармацевтическая композиция может содержать R(+)будесонид и индакатерол с одним или более фармацевтически приемлемыми эксципиентами.
Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую R(+)будесонид и один или более антихолинергических средств.
Подходящие антихолинергические средства включают тиотропий, ипратропий и окситропий.
В соответствии с одним из вариантов осуществления настоящего изобретения фармацевтическая композиция может содержать R(+)будесонид и тиотропий с одним или более фармацевтически приемлемыми эксципиентами, или R(+)будесонид и ипратропий с одним или более фармацевтически приемлемыми эксципиентами, или R(+)будесонид и окситропий с одним или более фармацевтически приемлемыми эксципиентами.
Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую R(+)будесонид и один или более бета-агонистов и один или более антихолинергических средств.
В соответствии с вариантом осуществления настоящего изобретения фармацевтическая композиция может содержать R(+)будесонид, арформотерол и тиотропий с одним или более фармацевтически приемлемыми эксципиентами, или R(+)будесонид, арформотерол и тиотропий с одним или более фармацевтически приемлемыми эксципиентами или R(+)будесонид, тиотропий и кармотерол с одним или более фармацевтически приемлемыми эксципиентами, или R(+)будесонид, тиотропий и индакатерол с одним или более фармацевтически приемлемыми эксципиентами.
Предпочтительный бета2-агонист для использования в настоящем изобретении представляет собой кармотерол.
Кармотерол, химически известный как 8-гидрокси-5-(1-гидрокси-2-(N-(2-(4-метоксифенил)-1-метилэтил)амино)этил)-2(1Н)-хинолинона гидрохлорид представляет собой бета2-агонист пролонгированного действия, охарактеризованный с помощью быстрого начала действия, длительной продолжительности действия, а также высокой селективности по отношению к бета2адренорецепторам. Кроме того, кармотерол является более эффективным, чем другие бета2-агонисты пролонгированного действия.
Другой предпочтительный бета2-агонист для использования в настоящем изобретении представляет собой индакатерол.
Индакатерол, химически известный как (R)-5-[2-[(5,6-диэтил-2,3-дигидро-1Н-инден-2-ил)амино]-1-гидроксиэтил]-8-гидрокси-хинолин-2(1Н)-он представляет собой бета2-агонист ультра-пролонгированного действия. Кроме того, индакатерол обладает более длительной продолжительностью действия, а также имеет больший кардиоваскулярный предел безопасности.
Предпочтительное антихолинергическое средство для использования в настоящем изобретении представляет собой тиотропий.
Тиотропий является химически известным как (1α, 2β, 4β, 5α, 7β)-7-[(гидрокси ди-2-тиенилацетил)окси]-9,9-ди-метил-3-окса-9-азониатрицикло[3.3.1.02,4]нонана бромида моногидрат. Тиотропий имеет продолжительность действия до 32 часов. Также тиотропий приводит к улучшению при диспноэ и снижению потребности в неотложной терапии.
Тиотропий в комбинации с легочной реабилитацией (ЛР) связан с увеличением времени физических упражнений на выносливость и производит клинически значимые улучшения при диспноэ и состояния здоровья по сравнению с ЛР отдельно у пациентов с ХОБЛ.
Кроме того, тиотропий является более эффективным, чем ипратропий при лечении пациентов с ХОБЛ на основании эффекта функции легких, диспноэ, скоростей обострения и состояния здоровья.
Термины «кармотерол», «индакатерол» и «тиотропий» используются в широком смысле и включают в себя не только «кармотерол», «индакатерол» и «тиотропий» как таковые, но также их фармацевтически приемлемые соли, фармацевтически приемлемые сольваты, фармацевтически приемлемые гидраты, фармацевтически приемлемые сложные эфиры, фармацевтически приемлемые энантиомеры, фармацевтически приемлемые производные, фармацевтически приемлемые полиморфные модификации, фармацевтически приемлемые пролекарства и подобное.
Термин «R(+)будесонид» используется в широком смысле и включает в себя не только «R(+)будесонид» как таковой, но также его фармацевтически приемлемые соли, фармацевтически приемлемые сольваты, фармацевтически приемлемые гидраты, фармацевтически приемлемые сложные эфиры, фармацевтически приемлемые производные, фармацевтически приемлемые полиморфные модификации, фармацевтически приемлемые пролекарства и подобное.
В соответствии с настоящим изобретением предпочтительные бета2-агонисты представляют собой: кармотерол, индакатерол, формотерол, арформотерол, салметерол.
В соответствии с настоящим изобретением предпочтительные антихолинергические средства представляют собой: тиотропий, окситропий, ипратропий.
Наиболее предпочтительные композиции в соответствии с изобретением представляют собой фармацевтические композиции, в которых бета2-агонист содержит или состоит из кармотерола, индакатерола, формотерола, аформотерола, салметерола и антихолинергическое средство содержит или состоит из тиотропия.
Наиболее предпочтительные композиции содержат:
R(+)будесонид, бета2-агонист, содержащий кармотерол, антихолинергическое средство, содержащее тиотропий, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, состоящий из кармотерола, антихолинергическое средство, состоящее из тиотропия, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, содержащий индакатерол, антихолинергическое средство, содержащее тиотропий, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, состоящий из индакатерола, антихолинергическое средство, состоящее из тиотропия, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, содержащий формотерол, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, состоящий из формотерола, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, содержащий арформотерол, и необязательно один или более фармацевтически приемлемых эксципиентов.
R(+)будесонид, бета2-агонист, состоящий из арформотерола, и необязательно один или более фармацевтически приемлемых эксципиентов.
В соответствии с настоящим изобретением R(+)будесонид может присутствовать в композиции в количестве от приблизительно 80 мкг до приблизительно 640 мкг.
В соответствии с настоящим изобретением кармотерол может присутствовать в композиции в количестве от приблизительно 1 мкг до приблизительно 4 мкг.
В соответствии с настоящим изобретением индакатерол может присутствовать в композиции в количестве от приблизительно 50 мкг до приблизительно 800 мкг.
В соответствии с настоящим изобретением тиотропий может присутствовать в композиции в количестве от приблизительно 9 мкг до приблизительно 18 мкг.
Авторы изобретения обнаружили, что комбинированная терапия R(+)будесонида, тиотропия и кармотерола и комбинированная терапия R(+)будесонида, тиотропия и индакатерола обеспечивают эффективные методы лечения воспалительных и/или обструктивных заболеваний дыхательных путей, в частности ХОБЛ или бронхиальной астмы.
Кроме того, комбинация R(+)будесонида, тиотропия и кармотерола и комбинация R(+)будесонида, тиотропия и индакатерола обеспечивает быстрое начало действия и улучшенный контроль обструктивных или воспалительных заболеваний дыхательных путей или уменьшение обострений заболеваний.
Другое преимущество комбинаций заключается в том, что они облегчают лечение обструктивных и воспалительных заболеваний дыхательных путей с единичным лекарственным средством.
Авторы изобретения дополнительно обнаружили, что комбинация R(+)будесонида, тиотропия и кармотерола и комбинация R(+)будесонида, тиотропия и индакатерола каждая может вводиться один раз в день в терапевтически эффективных количествах.
Дополнительно эта комбинированная терапия обеспечивает введение комбинации с использованием единичного ингалятора для пациентов с тяжелой степенью ХОБЛ, которым в настоящее время приходится пользоваться несколькими ингаляторами. Это особенно важно, поскольку ХОБЛ является заболеванием пожилых людей, которые могут запутаться между ингаляторами и которые также страдают от нескольких комбинированных состояний, таких как заболевание сердца, артрит и подобные и получают другие лекарственные средства.
Фармацевтические композиции настоящего изобретения могут вводить любым подходящим способом, используемым для доставки лекарственных средств в дыхательные пути. Композицию настоящего изобретения таким образом могут вводить, используя дозированные ингаляторы (MDI), порошковые ингаляторы (DPI), небулайзеры, назальные спреи, назальные капли, порошки для вдувания, спреи и пластыри со спреем.
Предпочтительные варианты осуществления изобретения включают фармацевтические композиции, содержащие R(+)будесонид и один или более бронходилататоров, которые используются в виде небулайзеров, порошковых ингаляторов (DPI), назальных спреев, назальных капель, порошков для вдувания, спреев и пластырей со спреем, в наиболее предпочтительном варианте осуществления композиции используются в виде дозированных ингаляторов (MDI).
Различные формы дозировки в соответствии с настоящим изобретением могут содержать носители/эксципиенты, подходящие для их получения.
Составы дозированных ингаляций в соответствии с настоящим изобретением могут содержать один или более фармацевтически приемлемых эксципиентов, таких как ГФУ/ГФА пропелленты, сорастворители, наполнители, нелетучий компонент, буферы/агенты, регулирующие рН, поверхностно-активные вещества, консерванты, комплексообразующие агенты, скользящие вещества, антиоксиданты или их комбинации.
В контексте настоящего изобретения пропелленты представляют собой такие вещества, которые при смешивании с сорастворителем(ями) образуют гомогенную систему пропеллентов, в которой может быть растворено терапевтически эффективное количество лекарственного средства. ГФУ/ГФА пропеллент должен быть токсикологически безопасным и должен иметь давление паров, которое является подходящим для введения лекарственного средства с помощью находящегося под давлением MDI.
В соответствии с настоящим изобретением ГФУ/ГФА пропелленты могут содержать один или более из 1,1,1,2-тетрафторэтана (ГФА-134(а)), 1,1,1,2,3,3,3-гептафторпропана (ГФА-227), ГФУ-32 (дифторметана), ГФУ-143(а) (1,1,1-трифторэтана), ГФУ-134 (1,1,2,2-тетрафторэтана), ГФУ-152a (1,1-дифторэтана) и других пропеллентов, которые могут быть известны специалисту в данной области техники.
В контексте настоящего изобретения сорастворитель представляет собой любой растворитель, который смешивается в составе в желательном количестве и который при добавлении обеспечивает состав, в котором может быть растворено лекарственное средство. Функция сорастворителя представляет собой увеличение растворимости лекарственного средства и эксципиентов в составе.
В соответствии с настоящим изобретением сорастворитель может содержать один или более С2-С6алифатических спиртов, таких как, но не ограничиваясь ими, этиловый спирт и изопропиловый спирт; гликолей, таких как, но не ограничиваясь ими, пропиленгликоль, полиэтиленгликоли, полипропиленгликоли, эфиры гликолей и блок-сополимеры оксиэтилена и оксипропилена; и других веществ, таких как, но не ограничиваясь ими, глицерин, полиоксиэтиленовые спирты и полиоксиэтиленовые эфиры жирных кислот; углеводородов, таких как, но не ограничиваясь ими, н-пропан, н-бутан, изобутан, н-пентан, изопентан, нео-пентан и н-гексан; и эфиров, таких как, но не ограничиваясь ими, диэтиловый эфир.
Подходящие поверхностно-активные вещества могут использовать в составе аэрозольного раствора настоящего изобретения, которые могут служить для стабилизации состава раствора и улучшения производительности системы клапанов в дозированном ингаляторе.
В соответствии с настоящим изобретением поверхностно-активное вещество может содержать одно или более ионных и/или неионных поверхностно-активных веществ, но не ограничиваясь ими, олеиновую кислоту, сорбитан триолеат, лецитин, изопропилмиристат, тилоксапол, поливинилпирролидон, полисорбаты, такие как полисорбат 80, витамин E-TPGS и макрогол гидроксистеараты, такие как макрогол-15-гидроксистеарат.
В контексте настоящего изобретения нелетучий компонент представляет собой все суспендированные или растворенные компоненты, которые останутся после испарения растворителя.
В соответствии с настоящим изобретением нелетучий компонент может содержать один или более моносахаридов, таких как, но не ограничиваясь ими, глюкоза, арабиноза; дисахаридов, таких как лактоза, мальтоза; олигосахаридов и полисахаридов, таких как, но не ограничиваясь ими, декстраны; полиспиртов, таких как, но не ограничиваясь ими, глицерин, сорбит, маннит, ксилит; солей, таких как, но не ограничиваясь ими, хлорид калия, хлорид магния, сульфат магния, хлорид натрия, цитрат натрия, фосфат натрия, гидрофосфат натрия, гидрокарбонат натрия, цитрат калия, фосфат калия, гидрофосфат калия, гидрокарбонат калия, карбонат кальция и хлорид кальция.
Подходящие наполнители могут использовать в составах дозированных ингаляций настоящего изобретения.
В соответствии с настоящим изобретением наполнитель может содержать один или более сахаридов, включая моносахариды, дисахариды, полисахариды и сахарные спирты, такие как арабиноза, глюкоза, фруктоза, рибоза, манноза, сахароза, трегалоза, лактоза, мальтоза, крахмалы, декстран или маннит.
Подходящие буферы или агенты, регулирующие рН, могут использовать в составах дозированных ингаляций настоящего изобретения.
В соответствии с настоящим изобретением буфер или агент, регулирующий рН, может содержать одну или более органических или неорганических кислот, таких как, но не ограничиваясь ими, лимонная кислота, аскорбиновая кислота, хлористоводородная кислота, серная кислота, азотная кислота или фосфорная кислота.
Подходящие консерванты могут использовать в составах аэрозольных растворов настоящего изобретения для защиты таких составов от контаминации патогенными бактериями.
В соответствии с настоящим изобретением консервант может содержать один или более из бензалкония хлорида, бензойной кислоты, бензоатов, таких как бензоат натрия и других консервантов, которые могут быть известны специалисту в данной области техники.
Подходящие комплексообразующие агенты могут использовать в составах аэрозольных растворов настоящего изобретения, которые способны образовывать сложные связи.
В соответствии с настоящим изобретением комплексообразующий агент может содержать один или более, но не ограничиваясь ими, натрия ЭДТА или динатрия ЭДТА.
Дополнительным предпочтительным вариантом осуществления настоящего изобретения может быть вариант осуществления, в котором композиция представлена в виде порошка для вдувания. R(+)будесонид в комбинации с одним или более бронходилататорами может быть смешан с веществами инертного носителя или составлен с веществами инертного носителя для получения порошков для вдувания.
Композицию сухого порошка для вдувания в соответствии с настоящим изобретением могут вводить с помощью инсуффлятора, который может производить мелкодисперсное облако сухого порошка. Инсуффлятор предпочтительно снабжен средствами для обеспечения введения, по существу, предварительно определенного количества состава или продукта, как предусмотрено настоящим изобретением. Порошок может быть использован непосредственно с помощью инсуффлятора, который снабжен бутылкой или контейнером для порошка, или порошок может быть заполнен в капсулу или картридж, такие как желатиновые капсулы или другие устройства единичной дозы, приспособленные для введения. Инсуффлятор предпочтительно имеет средства для открытия капсулы или другие устройства с дозой.
Дополнительным предпочтительным вариантом осуществления настоящего изобретения может быть вариант осуществления, в котором композиция представлена в виде ингалятора сухого порошка (DPI). R(+)будесонид в комбинации с одним или более бронходилататорами может быть смешан с веществами инертного носителя или составлен с веществами инертного носителя для получения составов сухого порошка для ингаляций.
Вещества носителя, пригодные для получения порошков для вдувания или составов сухого порошка для ингаляций настоящего изобретения, включают, но не ограничиваются ими, сахара/сахарные спирты, такие как глюкоза, сахароза, лактоза и фруктоза, крахмалы или производные крахмала, олигосахариды, такие как декстрины, циклодекстрины и их производные, поливинилпирролидон, альгиновую кислоту, тилозу, кремниевую кислоту, целлюлозу, производные целлюлозы (например, эфир целлюлозы), сахарные спирты, такие как маннит или сорбит, карбонат кальция, фосфат кальция, лактозу, лактит, декстраты, декстрозу, мальтодекстрин, сахариды, включая моносахариды, дисахариды, полисахариды; сахарные спирты, такие как арабиноза, рибоза, манноза, сахароза, трегалоза, мальтоза и декстран.
В другом варианте осуществления настоящего изобретения композиция может быть в виде состава небулайзера.
Терапия распыления имеет преимущество перед другой ингаляционной терапией, так как она проста в использовании и не требует координации или больших усилий. Она также работает гораздо быстрее, чем лекарственные средства, принимаемые внутрь.
Для небулайзеров композиция в соответствии с настоящим изобретением может содержать подходящие эксципиенты, такие как осмотические агенты, регуляторы рН буферный агент, смачивающий агент и комплексообразующие агенты в подходящем наполнителе.
Осмотические агенты, которые могут использовать в составах небулайзера в соответствии с настоящим изобретением, включают хлорид натрия, хлорид калия, хлорид цинка, хлорид кальция и их смеси. Другие подходящие осмотические агенты включают, но не ограничиваются ими, маннит, глицерин, декстрозу и их смеси.
рН состава небулайзера может быть установлен с помощью добавления фармакологически приемлемых кислот. Фармакологически приемлемые неорганические кислоты или органические кислоты могут использовать для этой цели. Примеры предпочтительных неорганических кислот выбраны из группы, состоящей из хлористоводородной кислоты, бромистоводородной кислоты, азотной кислоты, серной кислоты и фосфорной кислоты и их смесей. Примеры наиболее подходящих органических кислот выбраны из группы, состоящей из аскорбиновой кислоты, лимонной кислоты, яблочной кислоты, винной кислоты, малеиновой кислоты, янтарной кислоты, фумаровой кислоты, уксусной кислоты, муравьиной кислоты и пропионовой кислоты и их смесей.
Комплексообразующие агенты, которые могут использовать в составах небулайзера в соответствии с настоящим изобретением, включают этилендиаминтетрауксусную кислоту (ЭДТА) или одну из ее известных солей, например, натрия ЭДТА или динатрия ЭДТА дигидрат (эдетат натрия).
Смачивающие агенты, которые могут использовать в составах небулайзера в соответствии с настоящим изобретением, включают диоктилсульфосукцинат натрия; полисорбаты, такие как полисорбат 20, полисорбат 40, полисорбат 60, полисорбат 80, полисорбат 65, полисорбат 85; эфиры сорбита и жирной кислоты, такие как Спэн 20, Спэн 40, Спэн 60 Спэн 80, Спэн 120; лаурилсульфат натрия; полиэтоксилированное касторовое масло; полиэтоксилированное гидрогенизированное касторовое масло и их смеси.
Антимикробный консервант также могут добавить в упаковки для многократного использования.
Состав в соответствии с настоящим изобретением может быть помещен в соответствующие контейнеры, снабженные средствами, позволяющими применять содержащийся состав в дыхательные пути.
Составы сухого порошка для ингаляций настоящего изобретения могут быть заключены или в капсулы из желатина или ГПМЦ, или в блистеры. Альтернативно, составы сухого порошка для ингаляций могут содержаться в резервуаре или в виде единичной дозы, или устройства многократных доз сухого порошка для ингаляций.
Альтернативно, составы сухого порошка для ингаляций могут быть суспендированы в подходящем жидком наполнителе и упакованы в аэрозольный контейнер вместе с подходящими пропеллентами или их смесями.
Дополнительно, составы сухого порошка для ингаляций также могут быть диспергированы в подходящем потоке газа с образованием аэрозольной композиции.
Составы дозированных ингаляций настоящего изобретения могут быть упакованы в простые алюминиевые контейнеры или SS (из нержавеющей стали) контейнеры. Некоторые аэрозольные лекарственные средства, как правило, прилипают к внутренним поверхностям, т.е. стенкам контейнеров и клапанов. Это может привести к получению пациентом значительно меньшего количества, чем заданное количество активного агента при каждой активации дозированных ингаляторов. Покрытие внутренней поверхности контейнера подходящим полимером может уменьшить эту проблему прилипания. Подходящие покрытия включают фторуглеродные сополимеры, такие как ФЭП-ПЭС (фторированный этилен-пропилен и полиэфирсульфон) и ПФА-ПЭС (перфторалкоксиалкан и полиэфирсульфон), эпокси и этилен. Альтернативно, внутренние поверхности контейнеров могут быть анодированы, обработаны плазмой или покрыты плазмой.
Специалисту в данной области техники будет очевидно, что фармацевтическая композиция в соответствии с настоящим изобретением может дополнительно содержать (т.е. в дополнение к бронходилататору, т.е. бета2-агонисту и/или антихолинергическому средству) одно или более активных веществ, выбранных из антигистаминных средств, противоаллергических средств или антагониста лейкотриенов или их фармацевтически приемлемых солей, сольватов, таутомеров, производных, энантиомеров, изомеров, гидратов, пролекарств или их полиморфных модификаций.
Настоящее изобретение также обеспечивает способ получения композиций в соответствии с настоящим изобретением.
Таким образом, настоящее изобретение обеспечивает способ получения состава дозированных ингаляций, который включает смешивание одного или более фармацевтически приемлемых носителей и/или эксципиентов с активными веществами (например, R(+)будесонид и один или более бронходилататоров) и пропеллентом и необязательно помещение состава в предварительно подготовленные контейнеры.
Настоящее изобретение также обеспечивает способ получения состава сухого порошка для ингаляции, который включает смешивание одного или более фармацевтически приемлемых носителей и/или эксципиентов с активными веществами (например, R(+)будесонид и один или более бронходилататоров) и получение состава в виде ингалятора сухого порошка.
Настоящее изобретение также обеспечивает способ получения раствора для ингаляций, который включает растворение лекарственных средств, необязательно хелатирующих агентов, осмотических агентов и любых других подходящих ингредиентов в наполнителе и установление рН с использованием подходящего агента, регулирующего рН.
Настоящее изобретение дополнительно обеспечивает способ лечения млекопитающих, таких как человек, для лечения респираторного, воспалительного или обструктивного заболевания дыхательных путей, такого как ХОБЛ и бронхиальная астма, который включает введение терапевтически эффективного количества фармацевтической композиции в соответствии с настоящим изобретением. Способ лечения может быть охарактеризован в том, что R(+)будесонид и один или более бронходилататоров вводят один раз в день в терапевтически эффективных количествах, например, R(+)будесонид, тиотропий и кармотерол или R(+)будесонид, тиотропий и индакатерол вводят один раз в день в терапевтически эффективных количествах.
Кроме того, настоящее изобретение обеспечивает фармацевтические композиции, содержащие R(+)будесонид и один или более бронходилататоров для использования при профилактике или лечении респираторного, воспалительного или обструктивного заболевания дыхательных путей.
Следующие примеры служат только для иллюстрации изобретения и не предназначены никаким образом ограничивать объем настоящего изобретения.
Пример 1
Способ:
(1) R(+)Будесонид и Арформотерола тартрат диспергировали с пропеллентом.
(2) Суспензию, полученную в стадии (1), заполняли в предварительно подготовленные контейнеры.
Пример 2
Способ:
(1) Лецитин диспергировали в этаноле.
(2) R(+)Будесонид и Арформотерола тартрат диспергировали в смеси, полученной в стадии (1).
(3) Суспензию лекарственных средств смешивали с пропеллентом ГФА277.
(4) Суспензию, полученную в стадии (3), заполняли в предварительно подготовленные контейнеры.
Пример 3
Способ:
(1) R(+)Будесонид и Арформотерола тартрат диспергировали с пропеллентом.
(2) Суспензию, полученную в стадии (1), заполняли в предварительно подготовленные контейнеры.
Пример 4
Способ:
(1) ПВП диспергировали в ПЭГ.
(2) R(+)Будесонид и Арформотерола тартрат диспергировали в смеси, полученной в стадии (1).
(3) Суспензию лекарственных средств смешивали с пропеллентом ГФА277.
(4) Суспензию, полученную в стадии (3), заполняли в предварительно подготовленные контейнеры.
Пример 5
Способ:
(1) R(+)Будесонид и Формотерола фумарат диспергировали с пропеллентом.
(2) Суспензию, полученную в стадии (1), заполняли в предварительно подготовленные контейнеры.
Пример 6
Способ:
(1) Лецитин диспергировали в этаноле.
(2) R(+)Будесонид и Формотерола фумарат диспергировали в смеси, полученной в стадии (1).
(3) Суспензию лекарственных средств смешивали с пропеллентом ГФА277.
(4) Суспензию, полученную в стадии (3), заполняли в предварительно подготовленные контейнеры.
Пример 7
Способ:
(1) R(+)Будесонид и Формотерола фумарат диспергировали с пропеллентом.
(2) Суспензию, полученную в стадии (1), заполняли в предварительно подготовленные контейнеры.
Пример 8
Способ:
(1) ПВП диспергировали в ПЭГ.
(2) R(+)будесонид и Формотерола фумарат диспергировали в смеси, полученной в стадии (1).
(3) Суспензию лекарственных средств смешивали с пропеллентом ГФА277.
(4) Суспензию, полученную в стадии (3), заполняли в предварительно подготовленные контейнеры.
Пример 9
Способ:
(1) R(+)Будесонид, Тиотропий и Кармотерол гомогенизировали с частью количества ГФА.
(2) Суспензию, полученную в стадии (1), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(3) Результирующую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 10
Способ:
(1) R(+)Будесонид, Тиотропий и Кармотерол гомогенизировали с лактозой и частью количества ГФА.
(2) Суспензию, полученную в стадии (1), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(3) Результирующую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 11
Способ:
(1) ПВП растворяли в ПЭГ и части количества ГФА.
(2) Раствор, полученный в стадии (1), переносили в сосуд для смешивания.
(3) R(+)Будесонид, Тиотропий и Кармотерол гомогенизировали с частью количества ГФА.
(4) Суспензию, полученную в стадии (3), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(5) Результирующую общую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 12
Способ:
(1) Глицерин растворяли в этаноле и добавляли необходимое количество HCl.
(2) R(+)Будесонид, Тиотропий и Кармотерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 13
Способ:
(1) Необходимое количество HCl добавляли в этанол.
(2) R(+)Будесонид, Тиотропий и Кармотерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 14
Способ:
(1) Необходимое количество лимонной кислоты и глицерина добавляли в этанол.
(2) R(+)Будесонид, Тиотропий и Кармотерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 15
Способ:
(1) Необходимое количество лимонной кислоты добавляли в этанол.
(2) R(+)Будесонид, Тиотропий и Кармотерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 16
Способ:
(1) Необходимое количество лецитина добавляли в этанол.
(2) Тиотропий и Кармотерол гомогенизировали с частью количества ГФА и переносили в сосуд для смешивания.
(3) R(+)Будесонид гомогенизировали с раствором, полученным в стадии (1), и частью количества ГФА.
(4) Суспензию, полученную в стадии (4), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(5) Результирующую суспензию затем перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 17
Способ:
(1) Необходимое количество олеиновой кислоты добавляли в этанол.
(2) Тиотропий и Кармотерол гомогенизировали с частью количества ГФА и переносили в сосуд для смешивания.
(3) R(+)Будесонид гомогенизировали с раствором, полученным в стадии (1), и частью количества ГФА.
(4) Суспензию, полученную в стадии (4), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(5) Результирующую суспензию затем перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 18
Способ:
(1) R(+)Будесонид, Кармотерол, Тиотропия бромид моногидрат просеивали с частью количества лактозы.
(2) Совместно просеянные вещества стадии (1) затем просеивали с оставшимся количеством лактозы и перемешивали.
(3) Смесь стадии (2) затем заполняли в капсулы.
Пример 19
Способ:
(1) R(+)Будесонид, Кармотерол, Тиотропия бромид моногидрат просеивали с частью количества лактозы.
(2) Совместно просеянные вещества стадии (1) затем просеивали с оставшимся количеством лактозы и перемешивали.
(3) Смесь стадии (2) затем заполняли в капсулы.
Пример 20
Способ:
(1) R(+)Будесонид, Тиотропий и Индакатерол гомогенизировали с частью количества ГФА.
(2) Суспензию, полученную в стадии 1, переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(3) Результирующую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 21
Способ:
(1) R(+)Будесонид, Тиотропий и Индакатерол гомогенизировали с лактозой и частью количества ГФА.
(2) Суспензию, полученную в стадии 1, переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(3) Результирующую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 22
Способ:
(1) ПВП растворяли в ПЭГ и части количества ГФА.
(2) Раствор, полученный в стадии 1, переносили в сосуд для смешивания.
(3) R(+)Будесонид, Тиотропий и Индакатерол гомогенизировали с частью количества ГФА.
(4) Суспензию, полученную в стадии 3, переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
(5) Результирующую общую суспензию перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 23
Способ:
(1) Глицерин растворяли в этаноле и добавляли необходимое количество HCl.
(2) R(+)Будесонид, Тиотропий и Индакатерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 24
Способ:
(1) Необходимое количество HCl добавляли в этанол.
(2) R(+)Будесонид, Тиотропий и Индакатерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 25
Способ:
(1) Необходимое количество лимонной кислоты и глицерина добавляли в этанол.
(2) R(+)Будесонид, Тиотропий и Индакатерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 26
Способ:
1) Необходимое количество лимонной кислоты добавляли в этанол.
2) R(+)Будесонид, Тиотропий и Индакатерол растворяли в растворе, полученном в стадии (1).
(3) Результирующий раствор переносили в сосуд для смешивания, в который добавляли ГФА.
(4) Результирующий раствор перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 27
Способ:
1) Необходимое количество лецитина добавляли в этанол.
2) Тиотропий и Индакатерол гомогенизировали с частью количества ГФА и переносили в сосуд для смешивания.
3) R(+)Будесонид гомогенизировали с раствором, полученным в стадии (1), и частью количества ГФА.
4) Суспензию, полученную в стадии (4), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
5) Результирующую суспензию затем перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 28
Способ:
1) Необходимое количество олеиновой кислоты добавляли в этанол.
2) Тиотропий и Индакатерол гомогенизировали с частью количества ГФА и переносили в сосуд для смешивания.
3) R(+)Будесонид гомогенизировали с раствором, полученным в стадии (1), и частью количества ГФА.
4) Суспензию, полученную в стадии (4), переносили в сосуд для смешивания, в который добавляли оставшееся количество ГФА.
5) Результирующую суспензию затем перемешивали, рециркулировали и заполняли в предварительно подготовленные алюминиевые контейнеры.
Пример 29
Способ:
(1) R(+)Будесонид, Индакатерола малеат, Тиотропия бромид моногидрат просеивали с частью количества лактозы.
(2) Совместно просеянные вещества стадии (1) затем просеивали с оставшимся количеством лактозы и перемешивали.
(3) Смесь стадии (2) затем заполняли в капсулы.
Пример 30
Способ:
(1) R(+)Будесонид, Индакатерола малеат, Тиотропия бромид моногидрат просеивали с частью количества лактозы.
(2) Совместно просеянные вещества стадии 1 затем просеивали с оставшимся количеством лактозы и перемешивали.
(3) Смесь стадии 2 затем заполняли в капсулы.
Специалисту в данной области техники будет очевидно, что различные замещения и модификации могут быть сделаны в изобретении, раскрытом в настоящем описании, не отходя от сущности изобретения. Таким образом, следует понимать, что хотя настоящее изобретение было определенно раскрыто с помощью предпочтительных вариантов осуществления и дополнительных материалов, специалист в данной области техники может прибегнуть к модификациям и изменениям концепции, раскрытым в настоящем описании, и полагают, что такие модификации и изменения находятся в объеме настоящего изобретения.
Следует понимать, что фразеология и терминология, используемые в настоящей заявке, предназначены с целью описания и не должны рассматриваться как ограничение изобретения. Использование «включающий», «содержащий» или «имеющий» и их вариаций в настоящем описании означает включение пунктов, перечисленных в дальнейшем, и их эквивалентов, а также дополнительных пунктов.
Следует отметить, что используемые в данной спецификации и прилагаемой формуле изобретения формы единственного числа «а», «an» и «the» включают множественные ссылки, если контекст явно не диктует иное. Так, например, ссылка на «эксципиент» включает один эксципиент, а также два или более различных эксципиентов и подобное.
Реферат
Изобретение относится к фармацевтической промышленности и представляет собой фармацевтическую композицию для лечения респираторного, воспалительного или обструктивного заболевания дыхательных путей, содержащая R(+) будесонид и один или более бета-агонистов, выбранных из альбутерола, левоальбутерола, тербуталина, пирбутерола, прокатерола, метапротеренола, фенотерола, битолтерола мезилата, ритодрина, арформотерола, кармотерола, бамбутерола, кленбутерола, индакатерола, милветерола, вилантерола или олодатерола, и необязательно один или более фармацевтически приемлемых эксципиентов. Изобретение обеспечивает введение заявленной комбинации один раз в день и уменьшение побочных эффектов при лечении респираторных, воспалительных или обструктивных заболеваний дыхательных путей. 4 н. и 35 з.п. ф-лы, 30 пр.
Формула
Документы, цитированные в отчёте о поиске
Применение композиции, содержащей формотерол и будесонид, для лечения острого состояния астмы

Комментарии