Способы лечения кохлеарной синаптопатии - RU2757276C2
Код документа: RU2757276C2
Чертежи


























Описание
Предпосылки создания изобретения
Потеря слуха
[0001] Более 5% мирового населения страдает некоторой формой приводящего к нетрудоспособности нарушения слуха (WHO Fact Sheet No. 300 ʺDeafness and Hearing Lossʺ, updated March 2015). Большинство таких случаев происходят из-за сенсорно-невральной потери слуха (SNHL), которая относится к нарушению в результате повреждения или потери функции улитки внутреннего уха -и/или- слухового нерва. В большинстве случаев SNHL имеет место постепенное ухудшение слухового порога, происходящее в течение от нескольких лет до нескольких десятилетий. Это может сопровождаться другими симптомами, такими как звон в ушах (тиннитус), головокружение или дурнота (вертиго). SNHL может быть наследственной или приобретенной (например, шум-индуцированной). Она может быть врожденной или развиваться позже в течение жизни. Наиболее распространенным типом сенсорно-невральной потери слуха является возрастная (пресбиакузис), за ней следует шум-индуцированная потеря слуха (NIHL).
[0002] Во многих случаях SNHL происходит в результате непосредственного повреждения волосковых сенсорных клеток в улитке внутреннего уха. В этом случае звуковые волны, которые проходят через заполненную жидкостью полость улитки внутреннего уха, вызывают вибрацию волосковых сенсорных клеток внутреннего уха. Если вибрация достаточно сильная, волосковые сенсорные клетки могут повреждаться и умирать. Это необратимый процесс у млекопитающих, и его можно легко идентифицировать по сдвигу порога слухового ответа ствола мозга (ABR) и снижению отоакустических эмиссий продуктов искажения (DPOAE).
[0003] Недавняя работа, касающаяся возрастной и шум-индуцированной потери слуха, показывает, что синапсы, а не волосковые сенсорные клетки, могут быть наиболее уязвимыми компонентами внутреннего уха, приводящими к дефициту слуха (Kujawa SG and Liberman MC, J Neurosci. 2009, 29(45): 14077-14085). Эти специализированные синапсы образуют мост между клетками спирального ганглия слухового нерва и волосковыми сенсорными клетками внутреннего уха (Safieddine S, et al., Annu Rev Neurosci. 2012, 35: 509-528). Каждый нейрон спирального ганглия (SGN) направляет один периферический аксон к Кортиеву органу, где он контактирует с одной внутренней волосковой клеткой (IHC) через один немиелинизированный концевой дендрит в Кортиевом органе (Liberman MC, Hear Res. 1980, 3(1): 45-63). Потеря или повреждение этих синапсов (называемая кохлеарной синаптопатией или слуховой синаптопатией) может привести к сильным эффектам на слух и представляет собой важную форму сенсорно-невральной потери слуха. Кохлеарная синаптопатия является вероятным фактором, влияющим на многие различные слуховые перцептивные отклонения, типичные при старении и после шумового воздействия, включая затруднения с восприятием речи на фоне шума (Bharadwaj HM, et al., Front Syst Neurosci. 2014, 8(26)), тиннитус и гиперакузию (Gu JW, et al., J Neurophysiol. 2010, 104(6): 3361-70; Schaette R and McAlpine M., J Neurosci. 2011, 31(38): 13452-57). В отличие от повреждения внешних волосковых сенсорных клеток, субъекты с потерей или повреждением синапса могут демонстрировать нормальные ABR пороги и нормальные DPOAE, но устойчивые дефициты амплитуды волны I в слуховом отделе ствола мозга (ABR) (Kujawa SG and Liberman MC, J Neurosci. 2009, 29(45): 14077-14085; Lin HW, et al., JARO 2011, 12: 605-616). Субъекты с кохлеарной синаптопатией демонстрируют нормальные аудиограммы (обладают способностью распознавать звук при нормальных порогах), но у них отсутствует способность анализировать сверхпороговые звуки, т.е. звуки в большом динамическом диапазоне звуковых частот и интенсивностей. Такая обработка звука является важной для распознавания речи или другого звукового коннтента выше конкурирующего фонового шума. Этот тип потери слуха назвали ʺскрытой потерей слухаʺ (см., например, Wan G and Corfas G., Hear Res. 2015, 329: 1-10; Moser T and Starr A, Nature Reviews Neurology, 2016, 135-149), поскольку меньше чем существенные синаптические и нейронные потеряи не выявляются стандартными методами оценки на основе порога.
[0004] В настоящее время нет одобренных фармакологических или биологических методов лечения для людей с кохлеарной синаптопатией; хотя современные слуховые аппараты могут помочь справиться с этим типом нарушения слуха, многие пациенты плохо реагируют на слуховые аппараты. Поскольку синаптические связи не восстанавливаются самопроизвольно, необходимы новые фармакологические методы лечения, направленные на восстановление синаптических связей. В недавнем исследовании у мышей, подвергшихся воздействию шума, которые получали доставку нейротрофина-3 (NT-3) в нишу окна улитки, восстанавливались синапсы внутренних волосковых клеток и было соответствующее улучшение амплитуды волны 1 ABR (Suzuki J, et al., Scientific Reports 2016. Doi: 10.1038/srep24907). Это неудивительно, поскольку NT3 является фактором роста, который связывается с рецепторами TrkC и хорошо известен благодаря его эффектам на выживание нейронов и синаптогенез. Применение агонистов Trk для лечения кохлеарной синаптопатии раскрыто в WO2017120465, опубликованной 13 июля 2017 года.
Ухо и слух
[0005] Ухо делится на три основные части: наружное ухо, среднее ухо и внутреннее ухо. Наружное ухо состоит из ушной раковины, наружного слухового прохода и обращенной наружу части барабанной мембраны, также известной как барабанная перепонка. Функция наружного уха, в частности, состоит в том, чтобы собирать и направлять звуковые волны в направлении барабанной перепонки и среднего уха.
[0006] За барабанной перепонкой лежит среднее ухо, заполненная воздухом полость, содержащая три кости, называемые косточками: молоточек, наковальня и стремечко. Слуховые косточки соединены между собой крошечными связками, образуя мостик через пространство полости, при этом молоточек прикреплен к барабанной перепонке на одном конце, а на другом конце стремечко прикреплено к овальному окну улитки во внутренней части уха. Звуковые волны от наружного уха сначала вызывают вибрацию барабанной перепонки. Вибрация передается через слуховые косточки и овальное окно в улитку, передавая движение жидкостям во внутреннем ухе.
[0007] Заполненное жидкостью внутреннее ухо состоит из двух основных компонентов: улитки и вестибулярного аппарата. Вестибулярный аппарат является органом равновесия, тогда как улитка является частью, связанной со слухом. Улитка представляет собой трубчатую структуру, которая свернута в форму, напоминающую улитку. Внутренняя часть улитки разделена на три области, определяемые положением вестибулярной мембраны и базилярной мембраны. Часть над вестибулярной мембраной представляет собой вестибулярную лестницу, которая проходит от овального окна до верхушки улитки и содержит жидкость-перилимфу, водную жидкость с низким содержанием калия и высоким содержанием натрия. Базилярная мембрана определяет область барабанной лестницы, которая проходит от верхушки улитки до круглого окна и также содержит перилимфу. Между вестибулярной лестницей и барабанной лестницей находится канал улитки, который заканчивается как закрытый мешочек на верхушке улитки и содержит эндолимфу, в которой основным ионом является калий.
[0008] Улитка также тонотопически организована, что означает, что различные частоты звуковых волн взаимодействуют с различными точками на структуре. Такая настройка частоты во внутреннем ухе отчасти объясняется геометрией базилярной мембраны, которая является более широкой и более гибкой на апикальном конце, а также уже и жестче на базальном конце. Точки, отвечающие на высокие частоты, находятся у основания базилярной мембраны, а точки, отвечающие на низкие частоты, находятся на верхушке, что приводит к топографическому картированию частоты (то есть к тонотопии).
[0009] Орган Корти, чувствительный орган слуха, который позволяет преобразовывать звуковые колебания в нервные сигналы, расположен на базилярной мембране и содержит слуховые сенсорные клетки, известные как волосковые клетки. Два типа волосковых клеток, внутренние волосковые клетки (IHC) и наружные волосковые клетки (OHC), расположены с образованием одного ряда IHC и трех рядов OHC внутри органа Корти. Звуковая волна, передаваемая во внутреннее ухо, создает волну давления для прохождения в жидкости улитки (бегущая волна), заставляя базилярную мембрану (а вместе с ней и орган Корти) вибрировать вверх и вниз. Шаблон вибрации зависит от интенсивности и частоты поступающего звука. Вибрация базилярной мембраны усиливается OHC, что позволяет воспринимать даже очень тихие звуки. OHC также тонко настраивают разрешение по частоте базилярной мембраны. ОНС также издают звуки, которые можно обнаружить во наружном слуховом проходе при помощи чувствительных микрофонов. Эти внутренне генерируемые звуки, называемые отоакустическими эмиссиями, в настоящее время используются для скрининга новорожденных для выявления потери слуха. ОНС очень чувствительны к повреждениям, и их повреждение приводит к наиболее распространенному типу потери слуха - умеренной нейросенсорной тугоухости, когда тихие звуки ниже разговорной речи не слышны, но громкие звуки воспринимаются как громкие.
[0010] IHC представляют собой первичные слуховые сенсорные клетки, которые передают информацию, кодируемую вибрационным шаблоном в улитке, слуховому нерву путем преобразования механического сигнала в электрический нейронный сигнал. IHC иннервируются афферентными нейронами, которые являются субпопуляцией (тип I) нейронов спирального ганглия (SGN). ʺАфферентные синапсы внутренних волосковых клетокʺ относятся к синаптическим связям между IHC и афферентными нервными волокнами SGN типа I; каждый IHC может образовывать до 20 синаптических связей с SGN типа I, тогда как каждый SGN типа I образует связь только с одним IHC. В то время как потеря синапсов происходит в нормальном стареющем ухе, воздействие шума также вызывает такие потери, которые в конечном итоге приводят к потере SGN с задержкой во времени и к постоянной потере слуха.
[0011] Хотя недавние исследования на животных позволяют предположить, что местная доставка нейтрофина-3 (NT-3) может быть потенциальным лечением кохлеарной синаптопатии, в настоящее время не существует никакого приемлемого лечения кохлеарной синаптопатии. Сохраняется необходимость в новых фармакологических методах лечения для восстановления синаптических связей в улитке.
Сущность изобретения
[0012] Настоящая заявка направлена, частью, на удивительное и неожиданное открытие, что ингибиторы гамма-секретазы (GSI) и модуляторы гамма-секретазы (GSM) (совместно указанные как GSI/Ms) могут регенерировать IHC синапсы у животных, подвергшихся воздействию патогенных уровней шума. Это говорит о том, что GSI/Ms могут быть эффективны для лечения состояний, ассоциированных с потерей IHC синапсов, включая, но не ограничиваясь этим, состояния, описанные как скрытая потеря слуха. Настоящая заявка также направлена, частью, на удивительное и неожиданное открытие, что GSI/Ms вызывают рост нейритов в анализах культур in vitro, содержащих клетки спирального ганглия. Соответственно, некоторые варианты осуществления настоящей заявки относятся к лечению и/или облегчению одного или нескольких состояний, ассоциированных с потерей синапсов, в частности, с потерей кохлеарных синапсов.
[0013] Некоторые варианты осуществления обеспечивают способ лечения кохлеарной синаптопати у пациента, нуждающегося в этом, который включает введение указанному пациенту терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных. В некоторых вариантах осуществления указанная кохлеарная синаптопатия представляет собой скрытую потерю слуха. В некоторых вариантах осуществления указанная кохлеарная синаптопатия представляет собой тиннитус.
[0014] Некоторые варианты осуществления обеспечивают способы лечения потери слуха в результате потери афферентных синапсов внутренних волосковых клеток у пациента, нуждающегося в этом, которые включают введение указанному пациенту терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных.
[0015] Некоторые варианты осуществления обеспечивают способы лечения тиннитуса в результате потери афферентных синапсов внутренних волосковых клеток у пациента, нуждающегося в этом, которые включают введение указанному пациенту терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных.
[0016] Некоторые варианты осуществления обеспечивают способы лечения потери слуха у пациента, нуждающегося в этом, который демонстрирует нормальный ABR порог и/или нормальную DPOAE, включающие введение указанному пациенту терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных, где указанный пациент не показывает никакого явного дефицита ABR порога и DPOAE.
[0017] В некоторых вариантах осуществления указанный пациент демонстрирует уменьшенную амплитуду потенциала волны I ABR по сравнению с пациентами с нормальным слухом. В некоторых вариантах осуществления указанный пациент демонстрирует сдвиги латентности V волны ABR при усилении фонового шума. В некоторых вариантах осуществления указанный пациент демонстрирует повышенное SP/AP отношение (отношение суммационного потенциала к потенциалу действия), определенное методом электрокохлеографии, по сравнению с пациентами с нормальным слухом. В некоторых вариантах осуществления указанные пациенты показывают значительно более худшие результаты в функциональных испытаниях на распознавание слов по сравнению с пациентами с нормальным слухом.
[0018] Некоторые варианты осуществления включают введение ингибитора гамма-секретазы или его фармацевтически приемлемой соли.
[0019] Некоторые варианты осуществления включают введение модулятора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0020] Некоторые варианты осуществления включают введение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты и (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида или фармацевтически приемлемой соли любого из вышеуказанных.
[0021] В некоторых вариантах осуществления указанные ингибитор гамма-секретазы, модулятор гамма-секретазы или фармацевтически приемлемую соль любого из вышеуказанных вводят в область или вблизи круглого окна улитки внутреннего уха.
[0022] В некоторых вариантах осуществления указанные ингибитор гамма-секретазы, модулятор гамма-секретазы или фармацевтически приемлемую соль любого из вышеуказанных вводят пероральным путем.
[0023] В некоторых вариантах осуществления указанные ингибитор гамма-секретазы, модулятор гамма-секретазы или фармацевтически приемлемую соль любого из вышеуказанных вводят интратимпанальным путем.
[0024] Некоторые варианты осуществления включают введение модулятора гамма-секретазы.
[0025] В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0026] Некоторые варианты осуществления включают введение ингибитора гамма-секретазы. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0027] Некоторые варианты осуществления включают введение модулятора гамма-секретазы. В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0028] Некоторые варианты осуществления включают введение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0029] Некоторые варианты осуществления включают введение модулятора гамма-секретазы. В некоторых вариантах осуществления указанный модулятор гамма-секретазы выбран из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0030] Некоторые варианты осуществления включают введение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы выбран из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0031] В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемую соль вводят в фармацевтической композиции, включающей фармацевтически приемлемый водный раствор, включающий:
где указанный ингибитор гамма-секретазы присутствует в количестве приблизительно 0,01% до приблизительно 20% мас./об. указанного водного раствора.
[0032] В некоторых вариантах осуществления указанный ингибитор гамма-секретазы выбран из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0033] В некоторых вариантах осуществления указанный фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407.
[0034] В некоторых вариантах осуществления указанный фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407, и где указанный ингибитор гамма-секретазы присутствует в количестве приблизительно 0,1%-5% мас./об. и выбран из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0035] Некоторые варианты осуществления обеспечивают применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения кохлеарной синаптопатии. В некоторых вариантах осуществления указанная кохлеарная синаптопатия представляет собой скрытую потерю слуха. В некоторых вариантах осуществления указанная кохлеарная синаптопатия представляет собой тиннитус.
[0036] Некоторые варианты осуществления обеспечивают применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения потери слуха в результате потери афферентных синапсов внутренних волосковых клеток.
[0037] Некоторые варианты осуществления обеспечивают применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения тиннитуса, являющегося результатом потери афферентных синапсов внутренних волосковых клеток.
[0038] Некоторые варианты осуществления обеспечивают применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения потери слуха, где указанная потеря слуха характеризуется нормальным ABR порогом и/или нормальной DPOAE. В некоторых вариантах осуществления указанная потеря слуха характеризуется устойчивыми дефицитами амплитуды волны 1 ABR.
[0039] Некоторые варианты осуществления включают применение ингибитора гамма-секретазы или его фармацевтически приемлемой соли.
[0040] Некоторые варианты осуществления включают применение модулятора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0041] Некоторые варианты осуществления включают применение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты и (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида или фармацевтически приемлемой соли любого из вышеуказанных.
[0042] В некоторых вариантах осуществления указанное применение включает введение указанного ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных в область или вблизи круглого окна улитки внутреннего уха.
[0043] В некоторых вариантах осуществления указанное применение включает введение указанного ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных пероральным путем.
[0044] В некоторых вариантах осуществления указанное применение включает введение указанного ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных интратимпанальным путем.
[0045] Некоторые варианты осуществления включают применение модулятора гамма-секретазы. В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0046] Некоторые варианты осуществления включают применение ингибитора гамма-секретазы. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0047] Некоторые варианты осуществления включают применение модулятора гамма-секретазы. В некоторых вариантах осуществления указанный модулятор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0048] Некоторые варианты осуществления включают применение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль выбраны из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0049] Некоторые варианты осуществления включают применение модулятора гамма-секретазы. В некоторых вариантах осуществления указанный модулятор гамма-секретазы выбран из группы, состоящей из:

и фармацевтически приемлемых солей любого из указанных выше.
[0050] Некоторые варианты осуществления включают применение ингибитора гамма-секретазы или его фармацевтически приемлемой соли. В некоторых вариантах осуществления указанный ингибитор гамма-секретазы выбран из группы, состоящей из: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0051] В некоторых вариантах осуществления указанный ингибитор гамма-секретазы или его фармацевтически приемлемая соль сформулированы в виде фармацевтической композиции, включающей фармацевтически приемлемый водный раствор, включающий:
где указанный ингибитор гамма-секретазы присутствует в количестве приблизительно 0,01% до приблизительно 20% мас./об. указанного водного раствора.
[0052] В некоторых вариантах осуществления указанный ингибитор гамма-секретазы выбран из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
[0053] В некоторых вариантах осуществления указанный фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407.
[0054] В некоторых вариантах осуществления указанный фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407, и где указанный ингибитор гамма-секретазы присутствует в количестве приблизительно 0,1%-5% мас./об. и выбран из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида и фармацевтически приемлемых солей любого из указанных выше.
Краткое описание чертежей
[0055] Фиг. 1A, 1B, 1C и 1D показывают анатомию уха, поперечный разрез улитки внутреннего уха, Кортиева органа и афферентные синапсы внутренних волосковых клеток, соответственно.
[0056] Фиг. 2A и 2B показывают повышения уровней α-фрагмента DCC в GSM- и GSI-обработанном спинном мозге и улитке внутреннего уха по сравнению с образцами, обработанными носителем, соответственно.
[0057] Фиг. 3 показывает повышение уровней α-фрагмента DCC после применения GSI у мышей in vivo.
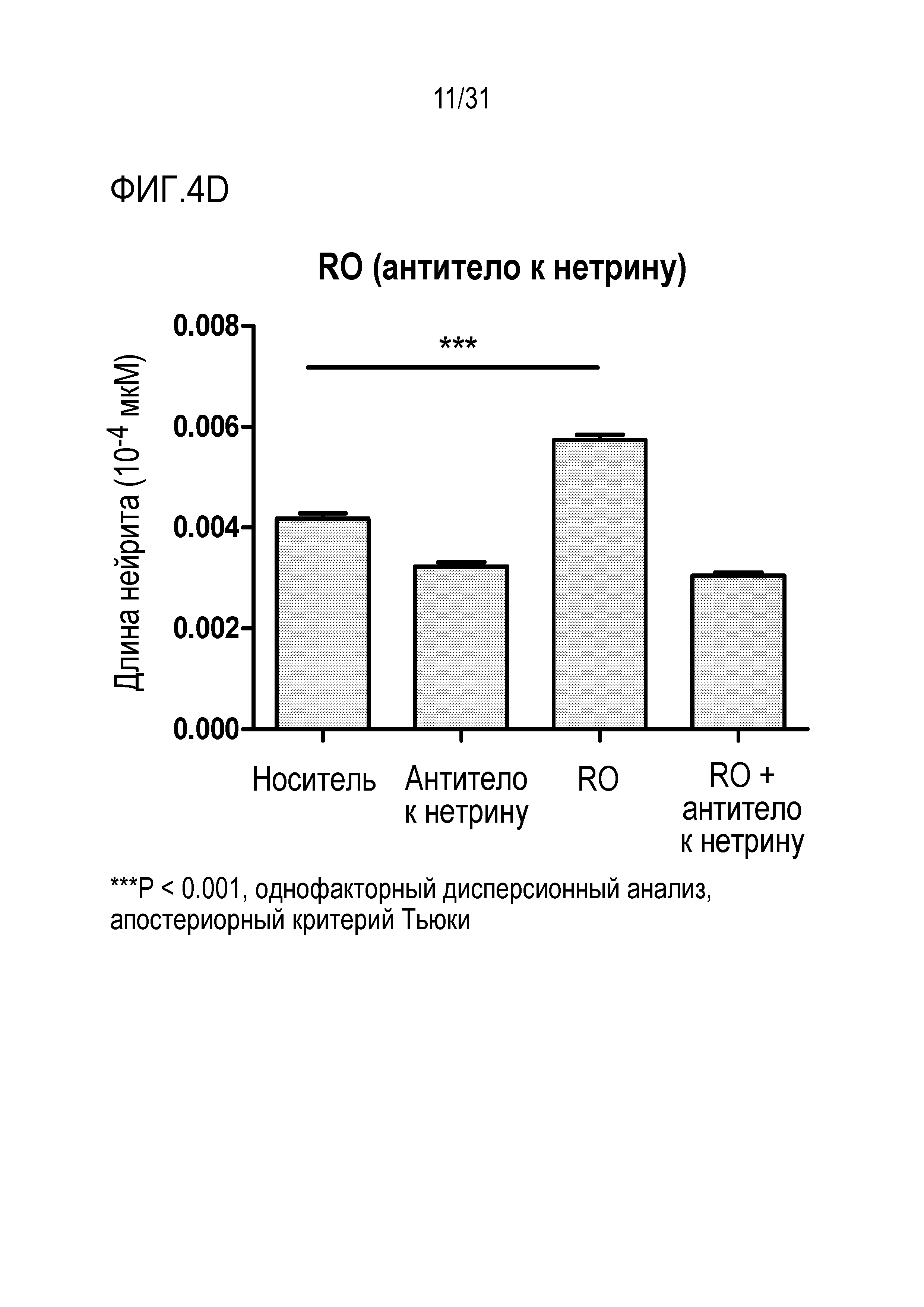
[0058] Фиг. 4A - 4C показывают дозозависимые увеличения длины нейритов SGN I типа после обработки при помощи GSMs RO, NGP555 и PF-06648671, соответственно. Фиг. 4D показывает, что добавление антитела против нетрина блокировало эффект GSM, вызывающий удлинение нейритов.
[0059] Фиг. 5 показывает повышение синаптической плотности после перорального введения RO и NGP555 в мышиной модели шум-индуцированной кохлеарной синаптопатии.
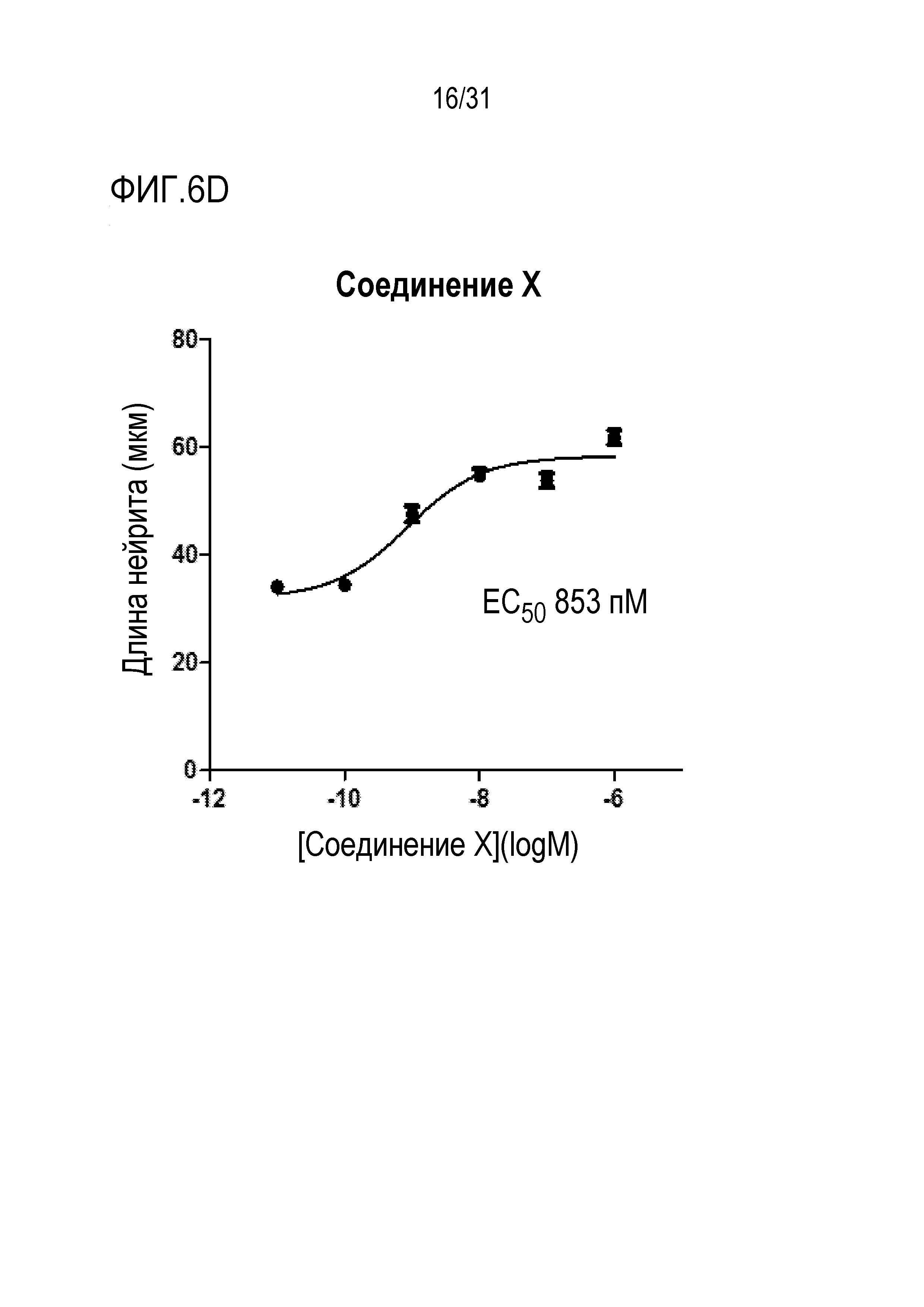
[0060] Фиг. 6A показывает увеличение длины нейритов SGN I типа после обработки при помощи GSI. Фиг. 6B показывает дозозависимое увеличение длины нейритов SGN I типа после обработки ингибиторами гамма-секретазы, Соединением I и Соединением II. Фиг. 6C показывает, что длина нейритов SGN I типа увеличивается после обработки Notch-сберегающим ингибитором гамма-секретазы, BMS-708163 (авагацестат). Фиг. 6D показывает дозозависимое увеличение длины нейритов SGN I типа после обработки ингибитором гамма-секретазы - Соединением X.
[0061] Фиг. 7A показывает повышение синаптической плотности после GSI-обработки в мышиной модели шум-индуцированный кохлеарной синаптопатии. Фиг. 7B показывает почти полное восстановление синапсов в средней области 1 (охватывающей диапазон 16-24 кГц) после обработки Соединением I при обеих дозах 0,2% и 2% в мышиной модели шум-индуцированный кохлеарной синаптопатии. Фиг. 7C показывает почти полное восстановление синапсов в средней области 2 (охватывающей диапазон 24-32 кГц) после обработки Соединением I при обеих дозах 0,2% и 2% в мышиной модели шум-индуцированный кохлеарной синаптопатии.
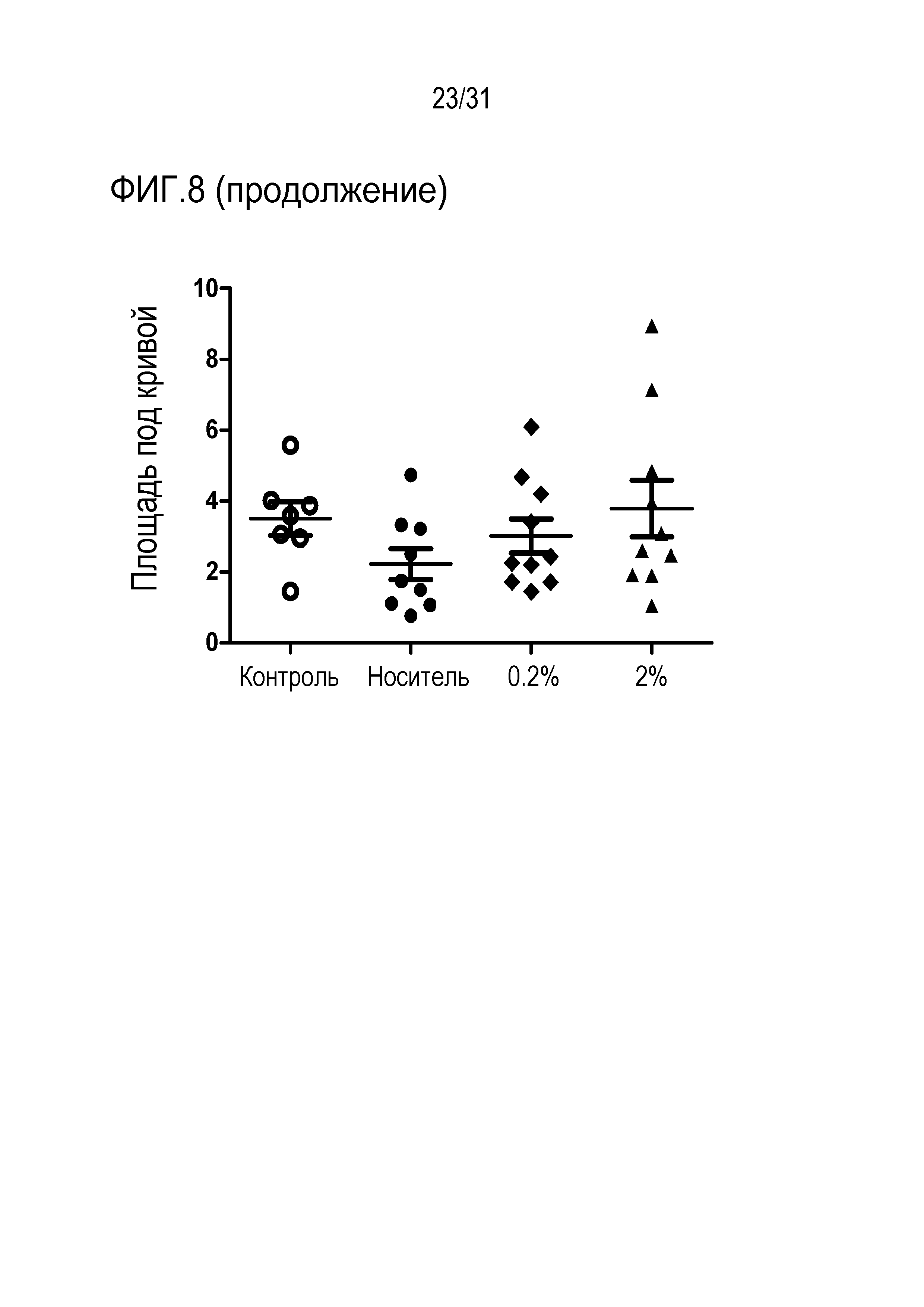
[0062] Фиг. 8 показывает улучшение амплитуд волны I после локального введения Соединения I у мышей с шум-индуцированной синаптопатией.
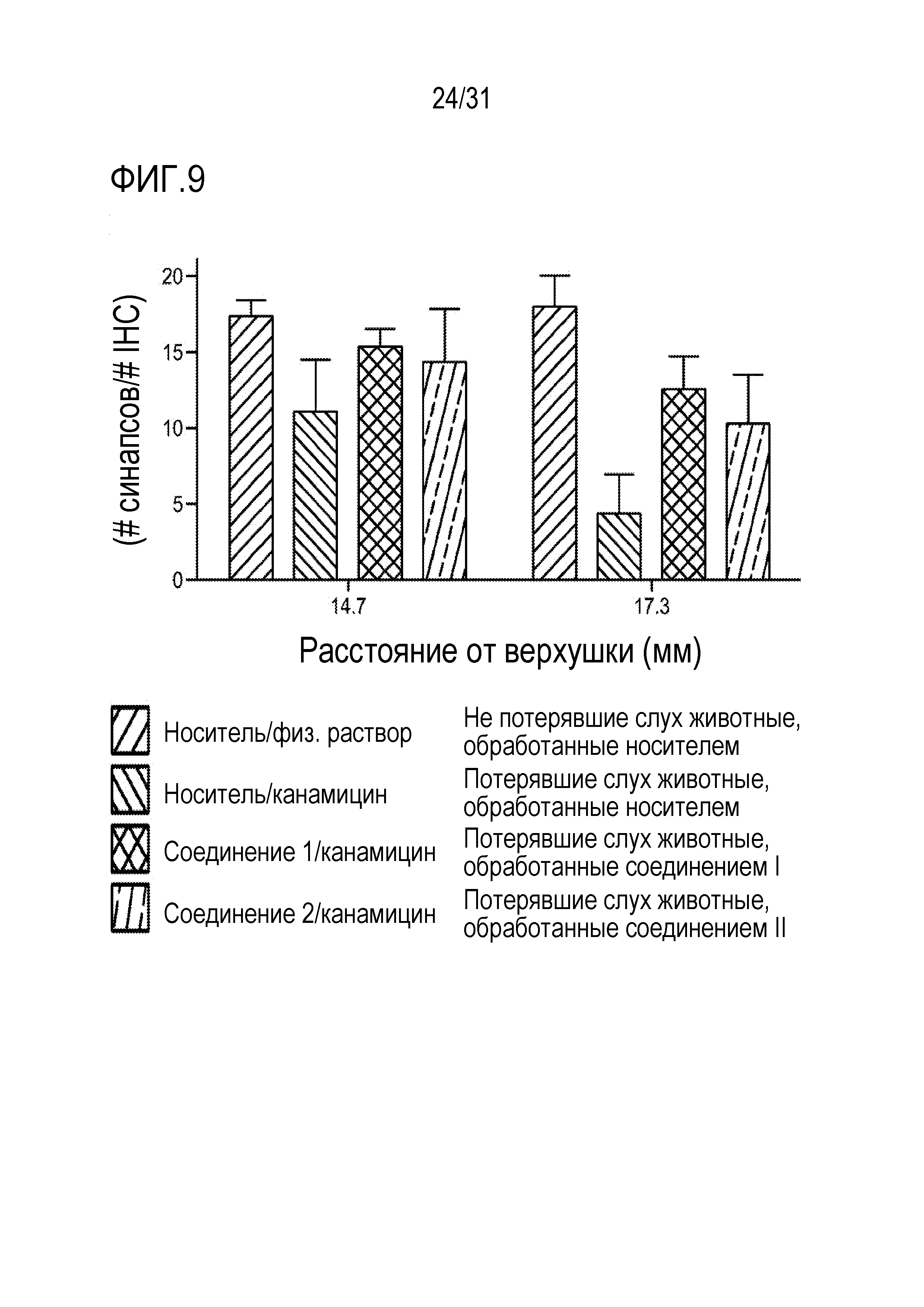
[0063] Фиг. 9 показывает повышение синаптической плотности после GSI-обработки в модели канамицин-индуцированной кохлеарной синаптопатии у морских свинок.
[0064] Фиг. 10 показывает структуры испытываемых соединений-ингибиторов гамма-секретазы(GSI) и дополнительные примеры GSI.
[0065] Фиг. 11 показывает структуры примеров GSM, включая NGP555 и PF-06648671.
Подробное описание
[0066] ʺКохлеарная (или слуховая) синаптопатияʺ относится к потере синапсов между внутренними волосковыми сенсорными клетками и кохлеарными афферентными нервными волокнами, и может проявляться в виде различных нарушений слуха, включая например:
- сенсорно-невральную потерю слуха, такую как возрастная потеря слуха (также известная как пресбиакузис), шум-индуцированная потеря слуха (включая воздействие неожиданного громкого шума и продолжительное или повторяющееся воздействие неожиданного громкого шума), ототоксин-индуцированная потеря слуха (ототоксины включают аминогликозидные антибиотики, такие как гентамицин, канамицин, амикацин, и химиотерапевтические средства на основе платины, такие как цисплатин), и потеря слухового восприятия речи на фоне шума (скрытая потеря слуха; затруднения в понимании речи при повышенном уровне шума);
- тиннитус (ощущение фантомного звука в отсутствие внешнего звука или звон в ушах);
- гиперакузию (нарушенная толерантность к нормальному звуку окружающей среды); и
- болезнь Меньера (расстройство внутреннего уха, характеризующееся колебаниями пороговых сдвигов, головокружением и шумом в ушах).
[0067] Пациентов, страдающих кохлеарной синаптопатией, обычно невозможно диагностировать с использованием аудиометрических тестов для определения порога слуха, и они могут демонстрировать нормальный слуховой ответ ствола мозга (ABR) (слуховой вызванный потенциал, зарегистрированный электродами, размещенными на черепе). Это потому, что шум-индуцированное повреждение слухового нерва может присутствовать даже после восстановления ABR порога (Furman et al. Journal of Neurophysiology 2013 110(3):577-586), и, более типично, оценки порога, такие как аудиограммы (проверки остроты слуха), полезны для определения повреждения внешних волосковых клеток, а не повреждения слухового нерва и синапсов (Kujawa et al. 2009). Пациенты с кохлеарной синаптопатией могут демонстрировать пониженные амплитуды потенциала волны I ABR по сравнению с пациентами, не страдающими кохлеарной синаптопатией. (Schaette et al.,2011). Некоторые пациенты с кохлеарной синаптопатией могут демонстрировать уменьшенную амплитуду волны I ABR на их аудиограммах по сравнению с пациентами, не страдающими кохлеарной синаптопатией. Последнее исследование также говорит о том, что SP/AP отношение (суммационный потенциал/потенциал действия), полученное методом электрокохлеографии, может быть полезным инструментом детекции/диагностики, где повышенное SP/AP отношение по сравнению с эталонным отношением указывает на кохлеарную синаптопатию (Liberman MC, et al., PloS ONE, 2016, 11(9):e0162726; и WO2017127619). Высокочастотная аудиометрия, измеряющая высокочастотные пороги более 8 кГц или в диапазоне от 8 до 16 кГц, была предложена в качестве способа выявления кохлеарной синапопатии (Liberman et al. 2016).
[0068] Латентность волны-V ABR при шуме также можно использовать в качестве диагностического маркера, поскольку было продемонстрировано, что она отражает потерю слухового нерва (Mehraei G, et al., J. Neurosci. 2016, 36 (13): 3755 - 64). Кохлеарную синаптопатию также можно обнаружить или диагностировать методом распознавания слов при шуме или временного сжатия и реверберации. Проверку слуха при шуме и проверку распознавания речи при шуме можно использовать для выявления пациентов с кохлеарной синаптопатией. Примеры функционального испытания распознавания слов включают Аудиторский тест № 6 Северо-Западного университета (NU-6), тест W-22 Центрального института глухих (CID), тест восприятия речи у детей Северо-Западного университета (NU-CHIPS), тест с бессмысленными слогами Университета Нью-Йорка, тест с бессмысленными слогами, проверку слуха при шуме (HINT), QuickSIN, тест идентификации синтетического предложения (SSI), тест восприятия речи и шума (SPIN) и тест распознавания связной речи. Таким образом, кохлеарную синаптопатию, такую как скрытая потеря слуха, можно выявить и/или диагностировать с использованием одного или комбинации вышеуказанных инструментов.
[0069] Ингибиторы гамма-секретазы и модуляторы гамма-секретазы долгое время исследовали в качестве потенциальных терапевтических средств для лечения болезни Альцгеймера и рака, и было описано большое количество таких соединений, особенно в патентной литературе.
Ингибиторы гамма-секретазы (GSI)
[0070] WO 2014/039781, озаглавленный ʺTreating Hearing Lossʺ, раскрывает способ лечения потери слуха, связанного с потерей волосковых клеток улитки, с использованием ингибиторов Notch, например ингибиторов гамма-секретазы. Как правило, ингибирование гамма-секретазы приводит к ингибированию передачи сигналов Notch в ядро, что приводит к де-репрессии энхансерного элемента Atoh1 и последующей индукции ATOH1, ключевого регулятора дифференцировки волосковых клеток. Хотя было показано, что передача сигналов Notch вовлечена в генерирование новых сенсорных волосковых клеток внутреннего уха, такая же связь не была установлена в отношении образования синапсов. Авторы настоящего изобретения оценили ингибиторы гамма-секретазы, которые ингибируют передачу сигналов Notch, а также те, которые не ингибируют передачу сигналов Notch, так называемые Notch-сберегающие ингибиторы гамма-секретазы, в регенерации афферентных синапсов IHC. Полученные результаты показывают, что оба типа GSI одинаково эффективны, и это предполагает, что ингибирование гамма-секретазы, но не ингибирование Notch, является вероятным механизмом регенерации синапсов во внутреннем ухе.
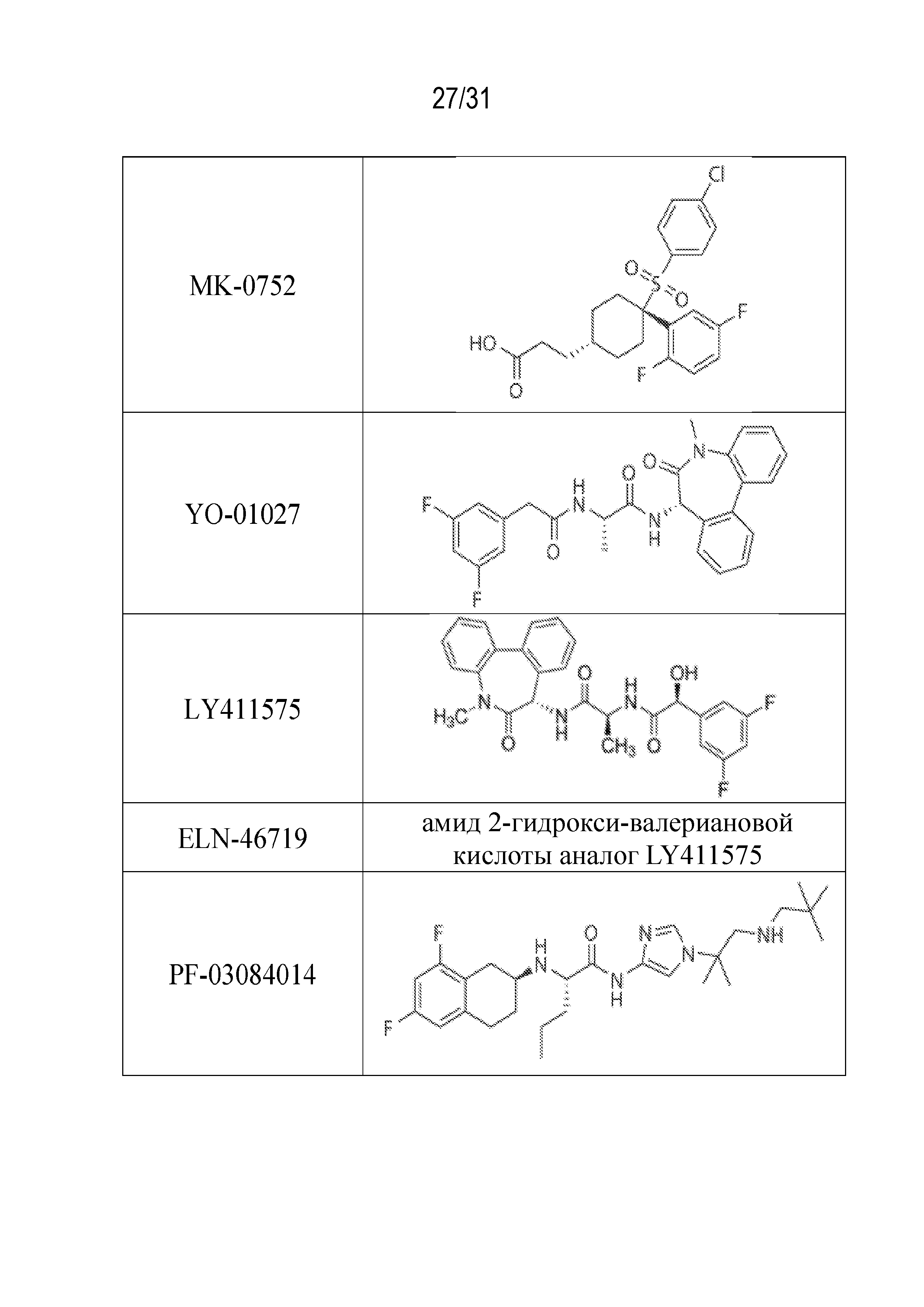
[0071] Примеры подходящих ингибиторов гамма-секретазы для применения в любом из способов по настоящему изобретению раскрыты, например, в публикациях патентных заявок США №№ 2004/0029862, 2004/0049038, 2004/0186147, 2005/0215602, 2005/0182111, 2005/0182109, 2005/0143369, 2005/0119293, 2008/008316, и 2011/0020232; патентах США №№ 6756511; 6890956; 6984626; 7049296; 7101895; 7138400; 7144910; 7160875; 7166587; 7183303; 7253158; 8188069; 8084477; международных публикациях №№ WO 1998/28268; WO 2001/70677, WO 2002/049038, WO 2004/186147, WO 2003/093253, WO 2003/093251, WO 2003/093252, WO 2003/093264, WO 2005/030731, WO 2005/014553, WO 2004/039800, WO 2004/039370 и WO2017/007702; и EP2244713, раскрытие каждого из этих документов включено в настоящую заявку посредством ссылки во всей полноте. Некоторые конкретные ингибиторы гамма-секретазы, которые могут быть указаны, включают: (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этиловый эфир (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты (указанный как ʺСоединение Iʺ); (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид (указанный как ʺСоединение IIʺ); 4,4,4-трифтор-N-((2S)-1-((9-метокси-3,3-диметил-5-оксо-2,3,5,6-тетрагидро-1H-бензо[f]пирроло-[1,2-a]азепин-6-ил)амино)-1-оксопропан-2-ил)бутанамид (указанный как ʺСоединение Xʺ); DAPT; L-685458; авагацестат; BMS-299897; MK-0752; YO-01027; LY411575; ELN-46719; PF-03084014; семагацестат; бегацестат; MRK-003; MRK-560; RO-4929097; JLK 6; ALX-260-127.
[0072] В некоторых вариантах осуществления ингибитор гамма-секретазы для применения в любом из способов по настоящему изобретению представляет собой (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этиловый эфир (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты или (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид.
Модуляторы гамма-секретазы (GSM)
[0073] Модуляторы гамма-секретазы (GSM) представляют собой низкомолекулярные соединения, которые селективно уменьшают образование патогенного амилоидного бета-42 пептида (A42), не влияя на общее количество продукции AB (Weggen S, et al., Nature. 2001, 414, 212-214), и они оказались перспективными терапевтическими средствами для лечения болезни Альцгеймера. Этот класс малых молекул является значительным отходом от ингибиторов гамма-секретазы (GSI), которые действуют как ингибиторы протеаз, снижая активность гамма-секретазы, что приводит к снижению общей продукции AB. Было обнаружено, что GSI обладают токсичностью, связанной с механизмом, непосредственно связанным с ингибированием процессирования NOTCH. Совсем недавно были описаны NOTCH-сберегающие GSI (Fraering PC, et al., J. Biol. Chem., 2005, 280 (51): 41987-96); однако, остается невыясненным обладают ли они достаточной селективностью по отношению к передаче сигналов NOTCH, чтобы избежать токсичности. В отличие от этого, GSM обычно предлагают значительно более высокую селективность в отношении снижения уровня AB42 по сравнению с ингибированием NOTCH и, таким образом, могут потенциально избежать токсичности, ассоциированной с GSI на терапевтических уровнях. GSM могут быть идентифицированы с использованием методов скрининга, известных в данной области техники, таких как методы, описанные в Chen et al., Bioorg. Med. Chem. Lett., 2013, 23:6447-6454, и Jung, et al., FASEB J. 2013, 27(9):3775-3785. Хотя GSM были описаны для лечения болезни Альцгеймера, об их применении для лечения потери слуха не сообщалось. Кроме того, их применение для лечения потери слуха вообще нельзя было ожидать или предсказать на основании данных, известных в настоящее время из литературы.
[0074] Примеры подходящих модуляторов гамма-секретазы для применения в любом из способов по настоящему изобретению раскрыты, например, в Bursavich et al., J. Med. Chem., 2016, 59:7389-7409; Crump et al., Biochem., 2013, 52(19): 3197-216; а также в цитируемых в них ссылочных документах. Модуляторы гамма-секретазы раскрыты в других публикациях, например, US7244739, WO201507058, WO2016201168, WO2014045156, WO2012116965, US20150274721, каждая из которых включена в настоящую заявку посредством ссылки во всей полноте. Некоторые модуляторы гамма-секретазы, которые можно указать, представлены на Фиг. 11.
[0075] В некоторых вариантах осуществления модулятор гамма-секретазы для применения в любом из способов по настоящему изобретению выбран из:


и фармацевтически приемлемых солей любого из указанных выше.
[0076] В некоторых вариантах осуществления модулятор гамма-секретазы для применения в любом из способов по настоящему изобретению представляет собой:

и его фармацевтически приемлемые соли.
[0077] GSI/Ms могут быть оценены для применения по настоящему изобретению с использованием in vitro и/или in vivo анализов, известных в данной области техники, таких как анализы, описанные в Примерах; а именно, in vitro анализ для измерения роста нейритов SGN после воздействия GSI/Ms; in vivo анализы для оценки восстановления синаптических плотностей после обработки при помощи GSI/Ms в модели шум-индуцированный и ототоксин-индуцированной синаптопатии у мышей и у морских свинок, соответственно.
Фармацевтические композиции
[0078] Фармацевтические композиции типично включают фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" относится к носителю или адъюванту, который можно вводить пациенту вместе с соединением по настоящему изобретению или его фармацевтически приемлемой солью и который не разрушает его фармакологическую активность и является нетоксичным при введении в дозах, достаточных для доставки терапевтического количества соединения.
[0079] Термин "композиция" в контексте настоящей заявки предназначен для охвата продукта, включающего указанные ингредиенты, а также любого продукта, который прямо или косвенно является результатом комбинации указанных ингредиентов. Такой термин в отношении фармацевтической композиции предназначен для охвата продукта, включающего активный ингредиент(ингредиенты), и инертного ингредиента(ингредиентов), составляющего носитель, а также любого продукта, который прямо или косвенно является результатом комбинации, комплексообразования или агрегации любых двух или более ингредиентов, или диссоциации одного или нескольких ингредиентов, или других типов реакций или взаимодействий одного или нескольких ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную путем смешивания соединения по настоящему изобретению или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя. Под "фармацевтически приемлемым" подразумевается, что носитель, разбавитель или эксципиент должны быть совместимы с другими ингредиентами композиции и не причинять вреда реципиенту.
[0080] Фармацевтические композиции можно сформулировать для системного введения, например, перорального, парентерального (например, подкожного, внутрикожного, внутривенного, внутримышечного, внутрисуставного, внутриартериального, интрасиновиального, интрастернального, интратекального, внутриочагового и путем интракраниальной инъекции или инфузии), через имплантируемый резервуар или путем инъекции. Фармацевтические композиции могут быть сформулированы для местного введения для оптимизации местного воздействия лекарственного средства при ограничении системного воздействия.
[0081] В некоторых вариантах осуществления активные ингредиенты по настоящему изобретению вводят при около 0,01 мг - 1,000 мг, около 2 мг - 900 мг, около 3 мг - 800 мг, около 4 мг - 700 мг, около 5 мг - 600 мг, около 10 мг - 500 мг, около 50 мг - 400 мг, около 100 мг - 300 мг, около 150 мг - 250 мг или при любом промежуточном значении. В некоторых вариантах осуществления общую суточную дозу можно разделить и вводить частями в течение суток, например, один раз в день, два раза в день, три раза в день или четыре раза в день. В некоторых вариантах осуществления общую дозу можно вводить один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю, пять раз в неделю или шесть раз в неделю; частоту введения можно уменьшить, например, до одного раза в две недели, одного раза в месяц, одного раза в квартал и т.д., когда используют композиции замедленного высвобождения.
[0082] В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению для инъекций включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные инъекционные растворы или дисперсии непосредственно перед применением. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла (такие как оливковое масло) и органические сложные эфиры для инъекций, такие как этилолеат. Надлежащую текучесть можно поддерживать, например, путем использования покрывающих агентов, таких как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ.
[0083] В некоторых вариантах осуществления фармацевтические композиции могут также содержать адъюванты, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие агенты. Предотвращение действия микроорганизмов можно обеспечить путем включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т.п. Также может быть желательно включить изотонические агенты, такие как сахара, хлорид натрия и т.п. Пролонгированная абсорбция инъецируемой фармацевтической формы может достигаться путем включения веществ, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин. При желании и для более эффективной дистрибуции соединения можно включить в системы медленного высвобождения или направленной доставки, такие как полимерные матрицы, липосомы и микросферы.
[0084] В некоторых вариантах осуществления фармацевтические композиции, которые представляют собой композиции для инъекций, могут быть стерилизованы, например, путем фильтрования через удерживающий бактерии фильтр или путем включения стерилизующих агентов в форме стерильных твердых фармацевтических композиций, которые можно растворить или диспергировать в стерильной воде или другой стерильной инъекционной среде непосредственно перед использованием.
[0085] В некоторых вариантах осуществления обеспечиваются твердые лекарственные формы быстрорастворимых фармацевтических композиций для перорального введения. В некоторых вариантах осуществления пероральные лекарственные формы включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано по меньшей мере с одним инертным фармацевтически приемлемым эксципиентом или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнителями или объемообразующими веществами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, c) увлажнителями, такими как глицерин, d) разрыхлителями, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, е) замедляющими растворение веществами, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими веществами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолиновая и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и их смесями. В случае капсул, таблеток и пилюль лекарственная форма также может включать буферные агенты.
[0086] Твердые фармацевтические композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах с использованием таких эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
[0087] Твердые лекарственные формы быстрорастворимых фармацевтических композиций, такие как таблетки, драже, капсулы, пилюли и гранулы, могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических препаратов. Они могут, необязательно, содержать вещества, делающие композицию непрозрачной, а также могут иметь такую композицию, чтобы они высвобождали активный ингредиент(ингредиенты) только или предпочтительно в определенной части кишечного тракта, необязательно замедленным образом. Примеры фармацевтических композиций для погружения в них лекарственного средства, которые можно использовать, включают полимерные вещества и воски.
[0088] Активные соединения также могут быть в микроинкапсулированной форме, если это необходимо, с одним или несколькими из вышеуказанных эксципиентов.
[0089] Некоторые варианты осуществления обеспечивают жидкие лекарственные формы быстрорастворимых фармацевтических композиций для перорального введения. В некоторых вариантах осуществления жидкие лекарственные формы включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси.
[0090] Помимо инертных разбавителей, фармацевтические композиции для перорального введения также могут включать адъюванты, такие как смачивающие вещества, эмульгаторы и суспендирующие агенты, подсластители, отдушки и ароматизаторы.
[0091] Суспензии соединений по изобретению, помимо активных соединений, могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтиленсорбита и сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
[0092] В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению сформулированы для доставки во внутреннее ухо. Доставка лекарственных средств во внутреннее ухо рассматривается в следующих документах, содержание которых включено в настоящую заявку посредством ссылки:
1. Salt AN and Plontke SKR, Local Inner-Ear Drug Delivery and Pharmacokinetics. Drug Discovery Today, 2005, 10(19):1299-1306.
2. Liu et al., Current Strategies for Drug Delivery to the Inner Ear. Acta Pharmaceutica Sinica B, 2013, 3(2):86-96.
3. Leary Swan EE et al., Inner Ear Drug Delivery for Auditory Applications. Adv Drug Deliv Rev, 2008, 60(15):1583-1599.
[0093] В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению сформулированы для интратимпанального введения, например, жидкая или гелевая композиция для доставки в область или вблизи мембраны круглого окна улитки внутреннего уха. В некоторых вариантах осуществления фармацевтические композиции для интратимпанального введения обеспечивают замедленное высвобождение активного средства в среднем ухе. Композиции замедленного высвобождения типично включают полимер; подходящие полимеры для настоящего изобретения, которые можно указать, включают, но не ограничиваются этим, желатин, гиалуроновую кислоту/гиалуронаты, хитозан и полиоксиэтилен-полиоксипропиленовые триблок-сополимеры [см., например, Liu et al., Acta Pharmaceutica Sinica B, 2013, 13(2): 86-96, и Swan et al., Adv. Drug Deliv. Rev., 2008, 60(15):1583-1599].
[0094] В некоторых вариантах осуществления фармацевтические композиции по изобретению могут доставляться в среднее ухо в виде жидкости с низкой вязкостью при температуре окружающей среды, которая образует in situ гель, имеющий более высокую вязкость. Преимущества такой композиции включают (1) удобство обращения с жидкостью во время введения и (2) после гелеобразования in situ пролонгированное время высвобождения лекарственного средства в месте отложения. Увеличение времени высвобождения приводит к увеличению продолжительности терапевтической эффективности и потенциально к снижению дозы препарата. Такие композиции преимущественно включают термообратимый гель, который обладает таким свойством, что он представляет собой жидкость при температуре окружающей среды и гель при температуре тела млекопитающего.
[0095] Термообратимые гели, подходящие для фармацевтического применения, могут быть получены с использованием полимеров, включая поли(молочную кислоту)-поли(этиленгликоль) (PLA-PEG) или триблок-сополимеры PEG-PLGA-PEG. Раствор хитозан-глицерофосфата способен образовывать обратимый термоотверждаемый гель. Добавление фосфатов на основе сахаров превращает хитозан в термообратимую гелевую систему доставки лекарственного средства. Обычная группа термообратимых гелей включает полимеры на основе полиоксиалкилена, такие как полиоксиэтилен-полиоксипропиленовые триблок-сополимеры, общеизвестные как полоксамеры. Полоксамеры в водных растворах проявляют термообратимые свойства, которые выгодны для настоящего изобретения. Таким образом, водные растворы полоксамера могут переходить из жидкого состояния в гелевое состояние при повышении температуры. Температуру перехода жидкость-гель можно регулировать путем изменения концентрации полоксамера, а также путем добавления других эксципиентов, таких как модификаторы вязкости; таким образом, можно получить растворы полоксамера, которые находятся в жидком состоянии при комнатной температуре или ниже, и переходят в гелевое состояние при температуре тела. В некоторых вариантах осуществления композиции по изобретению термообратимый гель представляет собой полоксамер 407 (например, Pluronic® F127, продаваемый BASF, Florham Park, NJ). Полоксамер может присутствовать при концентрации от около 15 до около 25% масс. или при любом промежуточном значении. В некоторых вариантах осуществления концентрация полоксамера 407 составляет от около 15 до около 18% масс. или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация полоксамера 407 составляет от около 16 до около 17% масс. или имеет любое промежуточное значение. В некоторых вариантах осуществления полоксамер присутствует при приблизительно 15 или 16 или 17 или 18% масс. или при любом промежуточном значении. В некоторых вариантах осуществления фармацевтические композиции по настоящему изобретению, включающие полоксамер 407, необязательно могут включать гидроксипропилметилцеллюлозу (HPMC), имеющую номинальную вязкость 40-120 сантипуаз (сП) или вязкость, имеющую любое промежуточное значение, и в количестве приблизительно 0,5%-4% масс. или при любом промежуточном значении.
[0096] В некоторых вариантах осуществления композиция по настоящему изобретению представляет собой водную фармацевтическую композицию для интратимпанального введения, включающую активное средство и фармацевтически приемлемый носитель, включающий (a) приблизительно 0,5%-8% масс. гиалуроновой кислоты; или (b) (i) приблизительно 0,5%-4% масс. гиалуроновой кислоты, и (ii) приблизительно 5%-20% по объему полиэтиленгликоля 400 (PEG400).
[0097] В водных фармацевтических композициях для интратимпанального введения концентрация активного вещества, как правило, составляет от около 0,01% мас./об. до 20% мас./об.. Этот диапазон включает под-диапазон от около 0,05 мас./об. до около 15 мас./об., от около 0,1 мас./об. до около 10 мас./об., от около 0,1% мас./об. до около 5% мас./об. или любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет от около 0,5% мас./об. до около 5% мас./об. или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет от около 0,5 до около 4% мас./об. или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет от около 1 до около 5% мас./об. или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет от около 1 до около до около 4% или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет около 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 или 5% мас./об. или имеет любое промежуточное значение. В некоторых вариантах осуществления концентрация активного вещества составляет около 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1% мас./об. или имеет любое промежуточное значение.
[0098] Композиция, раскрытая в настоящей заявке, может содержать любые обычные нетоксичные фармацевтически приемлемые эксципиенты. В некоторых вариантах осуществления pH композиции составляет от около 6 до 8, или от около 6 до 7, или от около 7 до 8, или имеет любое промежуточное значение. В некоторых вариантах осуществления композиция может включать буфер, такой как мононатрийфосфат или динатрийфосфат или их комбинация, и может включать фосфатно-солевой буферный раствор (PBS) или буфер, такой как трис(гидроксиметил)аминометан (TRIS). Количество буфера может составлять от около 0,1 до около 0,5%, или это может быть любое промежуточное количество, в расчете на массу.
[0099] В некоторых вариантах осуществления водная фармацевтическая композиция по настоящему изобретению может включать модификатор вязкости, такой как Carbopol® 974P (Lubrizol Advanced Materials, Cleveland, OH). В некоторых вариантах осуществления водная фармацевтическая композиция для интратимпанального введения включает активное средство и фармацевтически приемлемый носитель, включающий полоксамер 407, и модификатор вязкости, такой как Carbopol® 974P. В некоторых вариантах осуществления полоксамер 407 присутствует в количестве около 10% - 20% масс., а Carbopol® 974P присутствует в количестве от около 0,1% до около 0,3% масс. Другие обычные эксципиенты могут включать консерванты, такие как метилпарабен, а также хлорид натрия для обеспечения изотоничности. Композиции формулируют таким образом, что они обеспечивали замедленное высвобождение активного агента в течение периода, достаточного для осуществления модуляции гамма-секретазы. Замедленная модуляция гамма-секретазы минимизирует частоту введения до одного раза в неделю, раз в две недели, раз в месяц, раз в два месяца, раз в квартал, раз в полгода, раз в год и т.д. В некоторых вариантах осуществления частота введения составляет один раз в две недели, или два раза в месяц, или раз в месяц, или раз в два месяца, или раз в квартал.
[0100] Водную фармацевтическую композицию, раскрытую в настоящей заявке, включающую активное средство и носитель, можно получить с использованием обычных способов, и она может быть упакована для применения в виде однократной дозы, например в шприце, или в виде многократных доз, например в флаконе. Альтернативно, компонент, представляющий собой активное средство, и компонент, представляющий собой водный раствор, могут быть упакованы отдельно, в отдельных отделениях или в отдельных контейнерах, и смешаны перед введением.
[0101] В некоторых вариантах осуществления любые из водных фармацевтических композиций, раскрытых в настоящей заявке, дополнительно включают NT-3.
[0102] Иллюстративные примеры композиций, подходящих для местного введения во внутреннее ухо ингибиторов гамма-секретазы и модуляторов гамма-секретазы, приведены в WO2017075264, которая включена в настоящую заявку посредством ссылки. Некоторые примеры включают фармацевтическую композицию, включающую фармацевтически приемлемый водный раствор, включающий:
где указанный GSI или GSM присутствует при приблизительно 0,01% до приблизительно 20% мас./об. указанного водного раствора. В некоторых вариантах осуществления ингибитор гамма-секретазы выбран из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты и кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида. В некоторых вариантах осуществления модулятор гамма-секретазы выбран из NGP 555 и PF06648671. В некоторых вариантах осуществления фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407. В некоторых вариантах осуществления фармацевтически приемлемый водный раствор включает приблизительно 15%-25% масс. (масс/масс) полоксамера 407, и указанный GSI или GSM присутствует при приблизительно 0,1%-5% мас./об. и выбран из группы, состоящей из кристаллического (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, кристаллического (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида, NGP 555 и PF06648671.
Применения и способы лечения
[0103] Некоторые варианты осуществления обеспечивают способы для лечения кохлеарной синаптопатии, включающие введение терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных пациенту, нуждающемуся в этом. Некоторые варианты осуществления обеспечивают применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения кохлеарной синаптопатии. Термин ʺкохлеарная синаптопатияʺ, как правило, относится к состояниям, возникающим вследствие потери синапсов между внутренними волосковыми сенсорными клетками и кохлеарными афферентными нервными волокнами, независимо от причины такой потери, и включает, но не ограничивается этим, сенсорно-невральную потерю слуха, тиннитус, гиперакузию и болезнь Меньера. Соответственно, в некоторых вариантах осуществления настоящее изобретение направлено на способы лечения потери слуха (включая скрытую потерю слуха) или тиннитуса в результате потери афферентных синапсов внутренних волосковых клеток, которые включают введение пациенту, нуждающемуся в этом, терапевтически эффективного количества ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных. Подобным образом, в некоторых вариантах осуществления настоящее изобретение направлено на применение ингибитора гамма-секретазы, модулятора гамма-секретазы или фармацевтически приемлемой соли любого из вышеуказанных для лечения потери слуха (включая скрытую потерю слуха) или тиннитус в результате потери афферентных синапсов внутренних волосковых клеток. В контексте настоящей заявки, потеря слуха или тиннитус ʺв результате потери афферентных синапсов внутренних волосковых клетокʺ включают потерю слуха или тиннитус, которые можно, по меньшей мере частично, отнести за счет потери синапсов.
[0104] Сенсорно-невральная потеря слуха (SNHL) происходит из-за повреждения улитки внутреннего уха или нейронного проводящего пути от улитки внутреннего уха к головному мозгу и включает возрастную потерю слуха, шум-индуцированную потерю слуха, потерю слуха, вызванную ототоксичными химическими веществами, и потерю слухового восприятия речи на фоне шума (скрытая потеря слуха; затруднения в понимании речи при повышенном уровне шума).
[0105] Возрастная потеря слуха, или пресбикус, представляет собой прогрессирующую потерю слуха, возникающую в результате старения, и она обычно больше при более высоких частотах. Индуцированная шумом потеря слуха вызвана воздействием хронических и повторяющихся громких шумов, таких как громкая музыка, тяжелое оборудование или механизмы, или коротким звуком высокой интенсивности, таким как выстрел или взрыв. Потеря слуха также может быть вызвана ототоксичными химическими веществами, такими как ототоксичные препараты; известные ототоксичные лекарственные средства включают аминогликозидные антибиотики, такие как гентамицин, канамицин, амикацин; петлевые диуретики, такие как фуросемид; химиотерапевтические средства, такие как цисплатин, карбоплатин, блеомицин и винкристин. Потеря слухового восприятия речи на фоне шума, также известная как скрытая потеря слуха, поскольку такая потеря слуха не может быть измерена аудиограммой, относится к трудностям в понимании речи в шумной обстановке.
[0106] Тиннитус относится к расстройству, характеризующемуся восприятием звука в отсутствие каких-либо внешних раздражителей. В некоторых случаях тиннитус возникает в одном или обоих ушах непрерывно или спорадически и чаще всего описывается как звенящий звук. Гиперакузия относится к труднопереносимым нормальным звукам окружающей среды; пациенты могут считать такие звуки невыносимыми и болезненно громкими. Болезнь Меньера представляет собой идиопатическое состояние, характеризующееся внезапными приступами головокружения, тошноты и рвоты, которые могут длиться от 3 до 24 часов и могут постепенно стихать; прогрессирующая потеря слуха, шум в ушах и ощущение давления в ушах являются сопутствующими симтомами этой болезнь с течением времени.
[0107] В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой возрастную потерю слуха. В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой шум-индуцированную потерю слуха. В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой потерю слухового восприятия речи на фоне шума. В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой тиннитус. В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой гиперакузию. В некоторых вариантах осуществления кохлеарная синаптопатия представляет собой болезнь Меньера. В некоторых вариантах осуществления пациенты, принимающие лечение, не показывают никакого явного дефицита уровней ABR порога и DPOAE, но демонстрируют устойчивый дефицит амплитуды волны 1 и/или латентности волны V ABR. В некоторых вариантах осуществления пациенты, принимающие лечение, показывают повышенное отношение SP/AP по сравнению с эталонным отношением SP/AP. В контексте настоящей заявки термин ʺлечениеʺ или ʺтерапияʺ или ʺлечащийʺ и т.п. включает контроль, облегчение, реверсию или замедление прогрессирования состояния, подлежащего лечению; например, уменьшение или остановку дальнейшей потери слуха из-за указанных выше или других факторов; и восстановление слуха после частичной или полной потери слуха из-за указанных выше или других факторов. Лечение также включает профилактику (например, замедление начала развития или снижение риска развития) потери слуха, а также профилактическое применение, например до, в процессе или после приема ототоксичных химических веществ, таких как аминогликозидный антибиотик, такой как гентамицин, или химиотерапевтические средства на основе платины, такие как цисплатин.
[0108] В контексте настоящей заявки термин ʺтерапевтически эффективное количествоʺ относится к количеству активного вещества, достаточному для того, чтобы вызвать желаемый или полезный эффект при заболевании или расстройстве, которое лечат; что касается профилактики, оно относится к количеству активного вещества, достаточному для предотвращения возникновения или ослабления эффекта заболевания или расстройства. Используемое количество зависит от выбранного активного вещества, серьезности заболевания или расстройства, подвергаемого лечению, пути введения и характеристик пациента, таких как возраст.
[0109] В некоторых вариантах осуществления настоящего изобретения активное средство вводят перорально. В некоторых вариантах осуществления модулятор гамма-секретазы вводят в пероральной фармацевтической композиции. В некоторых вариантах осуществления ингибитор гамма-секретазы вводят в пероральной фармацевтической композиции.
[0110] В некоторых вариантах осуществления настоящего изобретения активное средство вводят в ухо посредством интратимпанальной инъекции в среднее ухо, внутреннее ухо или улитку или их комбинации. Интратимпанальный также называют транстимпанальным, и оба термина используются взаимозаменяемо в настоящей заявке. Интратимпанальная инъекция представляет собой метод введения терапевтического средства через барабанную перепонку в среднее ухо, где терапевтическиое средство может диффундировать через мембрану круглого окна, чтобы достичь внутреннего уха. Он используется в клинической практике в течение многих лет и является относительно незначительным вмешательством, которое можно осуществить в кабинете врача. Для повторных инъекций в барабанную перепонку может быть вставлена вентиляционная трубка среднего уха, через которую лекарственное средство может вводиться в пространство среднего уха за барабанной перепонкой в среднее и/или внутреннее ухо. В одном варианте осуществления активное средство вводят внутримышечно в область или вблизи мембраны круглого окна.
[0111] В некоторых вариантах осуществления способа по настоящему изобретению активное средство вводят в водной фармацевтической композиции, включающей термообратимый гель; такие композиции являются жидкими при комнатной температуре (для простоты введения) и превращаются в гель при температуре тела, таким образом, фармацевтическая композиция не быстро просачивается через евстахиеву трубу. В некоторых вариантах осуществления в способе по настоящему изобретению используют фармацевтические композиции, описанные в настоящей заявке.
[0112] Дозы для местного введения в среднее/внутреннее ухо модулятора гамма-секретазы, ингибитора гамма-секретазы и фармацевтически приемлемых солей любого из вышеуказанных будут зависеть от конкретного используемого соединения, пути введения, тяжести состояния, подлежащего лечению, и характеристик пациента. Дозы включают около 0,06 мг - около 100 мг. Этот диапазон включает поддиапазоны около 0,1 мг - около 90 мг, 0,25 мг - около 80 мг, 0,4 мг - 70 мг, 0,6 мг - 60 мг, 0,80 мг - 50 мг, 1,0 мг - 40 мг, 2 мг - 30 мг и 3 мг - 20 мг. Дозы можно вводить в виде водной фармацевтической композиции, включающей водный раствор, где объем водного раствора, предназначенный для введения, включает диапазон от около 100 мкл до около 500 мкл по объему. Этот диапазон объемов включает поддиапазоны около 100 мкл - 150 мкл, 100 мкл - 200 мкл, 100 мкл - 250 мкл, 100 мкл - 300 мкл, 100 мкл - 350 мкл, 100 мкл - 400 мкл, 100 мкл - 450 мкл и 100 мкл - 500 мкл. Этот диапазон объемов также включает поддиапазоны около 200 мкл - 250 мкл, 200 мкл - 300 мкл, 200 мкл - 350 мкл, 200 мкл - 400 мкл, 200 мкл - 450 мкл и 200 мкл - 500 мкл. Этот диапазон объемов также включает поддиапазоны около 300 мкл - 350 мкл, 300 мкл - 400 мкл, 300 мкл - 450 мкл и 300 мкл - 500 мкл. Этот диапазон объемов также включает поддиапазоны около 400 мкл - 450 мкл и 400 мкл - 500 мкл. Из-за физических ограничений содержание активного средства в водной фармацевтической композиции предположительно составляет 20% масс или меньше. В некоторых вариантах осуществления ингибитор гамма-секретазы вводят в среднее/внутреннее ухо. В некоторых вариантах осуществления модулятор гамма-секретазы вводят в среднее/внутреннее ухо.
[0113] В одном аспекте соединения, раскрытые в настоящей заявке, можно вводить совместно с одним или несколькими дополнительными средствами, такими как стероид; например, дексаметазон. В некоторых вариантах осуществления дополнительное средство представляет собой NT-3. В некоторых вариантах осуществления дополнительные средства можно вводить отдельно от GSI или GSM (например, последовательно, например, в перекрывающемся режиме). В других вариантах осуществления эти средства могут быть частью одной лекарственной формы, смешанными вместе с GSI или GSM в одной композиции. В еще одном варианте осуществления эти средства можно вводить в виде отдельной дозы, которую вводят примерно в то же время, когда вводят GSI или GSM. Когда композиции, раскрытые в настоящей заявке, включают комбинацию GSI или GSM и одного или нескольких дополнительных терапевтических или профилактических средств, и GSI и GSM и дополнительное средство могут присутствовать в дозах около 1-100%, и более предпочтительно около 5-95% от дозы, вводимой в режиме монотерапии.
[0114] Настоящее раскрытие дополнительно иллюстрируется следующими примерами, которые никоим образом не предназначены для ограничения объема формулы изобретения.
Пример 1. Исследования DCC (отсутствующий при колоректальной карциноме) с GSM и GSI in vitro
[0115] Предыдущие сообщения показали, что DCC (отсутствующий при колоректальной карциноме) является субстратом γ-секретазы. DCC представляет собой рецептор для наводящей молекулы, нетрина, и его активация приводит к росту аксонов нервных клеток, повороту аксонов и образованию синапсов. В обработанном эмбриональном спинном мозге мышей с нокаутом гена пресенелина наблюдается стабильная экспрессия α-фрагмента DCC; эти фрагменты могут усиливать нетрин-DCC-опосредованные события, включая рост аксонов в культивированных двигательных нейронах (Taniguchi et al., 2003, J. Biol. Chem., 278:30425-30428, и Bai et al., 2011, Cell, 144(1): 106-18). Следующие исследования осуществляли с использованием GSM, ʺROʺ, а также GSI - Соединения I. RO имеет структуру:

[0116] RO можно получить в соответствии со способами, раскрытыми в WO2012116965 (например, с использованием процедуры, аналогичной той, которая описана в Примере 6 этой заявки, с использованием в качестве исходного вещества соединения Примера 5, стадии a).
Эмбриональный мышиный спинной мозг ex vivo
[0117] Спинной мозг 15-дневных эмбрионов мышей CD-1 собирали и разрезали на 1-2-мм сегменты и переносили в бессывороточную питательную среду (DMEM-F12, N2 и B27 сывороточные добавки, пенициллин/стрептомицин) с 1мкМ RO или 1 мкМ Соединения I. Сегменты культивировали в течение 24 часов (37°C, 5% CO2) затем обрабатывали для Вестерн-блота. Мембраны зондировали антителом к DCC, распознающим внутриклеточный домен, и полоски нормализовали к актину. Повышение уровня α-фрагмента наблюдали в обеих группах обработки GSM и GSI по сравнению с группой обработки носителем (Фиг. 2a).
Улитки внутреннего уха мыши ex vivo
[0118] Улитки внутреннего уха получали от CD-1 мышей через 21 день после рождения. Делали отверстие в кости у верхушки улитки уха для обеспечения возможности протекания жидкости. Улитки внутреннего уха инкубировали в бессывороточной питательной среде (DMEM-F12, N2 и B27 сывороточные добавки, пенициллин/стрептомицин) с 1мкМ RO или 1 мкМ Соединения I. Через 24 часа спиральный ганглий выделяли и обрабатывали для Вестерн-блота. Мембраны зондировали антителом к DCC, распознающим внутриклеточный домен, и полоски нормализовали к актину. Повышение уровня α-фрагмента наблюдали в обеих группах обработки GSM и GSI по сравнению с группой обработки носителем (Фиг. 2b).
Пример 2. GSI повышает уровни α-фрагмента DCC
Вестерн-блот для a-фрагмента DCC
[0119] Соединение I (2% в носителе, 2мкл) или носитель (2мкл) доставляли билатерально в круглое окно CBA/J мышей. Через неделю улитки внутреннего уха собирали и обрабатывали для Вестерн-блота. Обе улитки внутреннего уха от двух животных использовали для установления каждой точки измерения. Улитку гомогенизировали в 50 мкл буфера для анализа радиоиммунопреципитации, затем оставляли для дальнейшего лизиса при 4°С в течение 1 часа. Кость отделяли центрифугированием и добавляли 4х буфер для загрузки образца. Образцы обрабатывали на 4-15% TGX градиентном геле (BioRad, Hercules, CA) и переносили на нитроцеллюлозную мембрану и блокировали при помощи блокирующего буфера Odyssey (LI-COR, NE). Блоты зондировали мышиными антителами к DCC (BD Biosciences, San Jose, CA) в соотношении 1:500 и кроличьими антителами к актину (контроль нагрузки) (Li-Cor, NE) в блокирующем буфере, содержащем 0,1% Tween-20. Мембраны промывали PBS/0,1% Tween, затем инкубировали во вторичном антителе (козлиное анти-мышиное IRDye 680LT и козлиное анти-кроличье IRDye 800LT, оба от LI-COR, NE), разведенном 1:10000 в блокирующем буфере, содержащем 0,1% Tween-20 и 0,01% SDS. Мембраны промывали в PBS, затем визуализировали на сканере LiCor Odyssey Classic и α-фрагмент DCC определяли количественно с использованием ImageJ. Животные, обработанные соединением I, показали примерно двукратное увеличение α-фрагмента DCC по сравнению с животными, обработанными только носителем (Фиг. 3).
Пример 3. GSM повышают рост нейритов нервных клеток спирального ганглия I типа
[0120] Культивировали нейроны спирального ганглия (SGN), полученные от CD-1 мышей через 5 дней после рождения, с использованием способов, описанных в Whitlon DS, et al., Scientific Reports, 2015, 5, 15960, doi:10,1038/srep15960. Нейроны диссоциировали и высевали в покрытые коллагеном 96-луночные планшеты в питательную среду (DMEM/F12, N2 и B27 сывороточные добавки и пенициллин/стрептомицин). После культивирования в течение 18 часов нейроны обрабатывали различными концентрациями RO или NGP-555 в течение 24 часов. Нейроны фиксировали и окрашивали кроличьим антителом к b-тубулину (сомато-аксональный маркер), а затем ослиным-антикроличьим вторичным антителом, конъюгированным с Alexa 568, и подвергали контрастирующему окрашиванию синим флуоресцентным красителем Hoechst для окрашивания ДНК. Осуществляли визуализацию нейронов на InCell 2000. Длину нейритов измеряли с использованием ImageJ. Подсчитывали только β-тубулин+ клетки, демонстрирующие биполярную морфологию (свидетельствующие о SGNs I типа). Как с RO, так и с NGP555 наблюдали дозозависимое увеличение роста нейритов (EC50 24нМ для RO, EC50 527пМ для NGP555, Фиг. 4A и 4B, соответственно). PF-06648671 оценивали аналогичным образом, и он показал EC50 303пМ, Фиг. 4C).
[0121] Для определения вовлечен или нет нетрин-DCC путь в GSM-индуцированный рост нейритов, блокирующее функцию нетрина антитело добавляли к среде за 1 час до добавления 1мкМ испытываемого соединения. Через 24 часа нейроны окрашивали β-тубулином и анализировали только нейриты из нейронов I типа. Совместное применение антитела к нетрину с испытываемым соединением приводит к значительному уменьшению роста нейритов (Фиг. 4D).
Пример 4. Шум-индуцированная кохлеарная синаптопатия у мышей
[0122] Самок мышей CBA/J подвергали воздействию 98 дБ 8-16 кГц фильтрованного шума в течение 2 часов. Через три недели вводили через желудочный зонд носитель (0,5% метилцеллюлоза, два раза в день), NGP-555 (50 мг/кг, два раза в день) или RO (10 мг/кг, один раз в день). Четырнадцать дней спустя мышей умерщвляли, удаляли улитку, затем ткани фиксировали перфузией 4% параформальдегида. Улитку промывали не содержащим кальция/магния PBS, затем декальцифицировали в 12,5 мМ EDTA в течение 3 дней. Улитку разделяли пополам, разрезая стержень улитки посередине через овальное окно до верхушки. Затем отдельные повороты разделяли и окрашивали антителами против Myo6 и CtBP2. Определяли количество синапсов на внутреннюю волосковую клетку на повороте, содержащем область 32 кГц. В соответствии с литературой, уменьшение синаптической плотности (но не уменьшение количества внутренних или наружных волосковых клеток) наблюдалось после 98 дБ поражения. Лечение пероральным NGP-555 значительно увеличило количество синапсов на внутренних волосковых клетках (Фиг. 5), демонстрируя эффективность GSM для лечения синаптопатии.
Пример 5. Ингибиторы гамма-секретазы увеличивают рост нейритов нервных клеток спирального ганглия I типа
[0123] Нейроны мышиных спиральных ганглиев (SGN) собирали от мышей CD-1 (постнатальный период день 3-5), диссоциировали и культивировали на коллагене I в бессывороточной среде. Клетки обрабатывали в течение 24-48 часов испытываемым соединением в 0,1% DMSO, затем иммуноокрашивали маркером нейритов Tuj1 и визуализировали. Длину нейритов определяли количественно с использованием программы ImageJ (разработанной NIH и общедоступной). Определяли только количество Tuj1+ клеток с четкой биполярной морфологией, характерной для SGN типа I. Испытываемые соединения представляли собой Соединение I, Соединение II и RO4929097, а также Notch-сберегающий GSI, BMS-708163; NT-3 был включен в качестве положительного контроля. Результаты показаны на Фиг. 6А, 6В и 6С. Испытываемые соединения демонстрируют значительное дозозависимое увеличение длины нейритов SGN I типа (Фиг. 6А и Фиг. 6В). Кроме того, BMS-708163 - Notch-сберегающий GSI и Соединение I - Notch-ингибирующий GSI оба увеличивали рост нейритов SGN I типа (Фиг. 6C). Еще один GSI, такой как Соединение X (см. WO2017007702, Соединение 1, раскрытое в этом документе), оценивали в этом анализе, и он также показывает дозозависимое увеличение длины нейритов SGN типа I (Фиг. 6D).
Пример 6. Шум-индуцированная кохлеарная синаптопатия у мышей
[0124] Осуществляли два отдельных эксперимента с использованием этого протокола: в эксперименте 1 (Фиг. 7А) обработку соединением I сравнивали с NT3, в эксперименте 2 (Фиг. 7В, 7С и Фиг.8) оценивали два уровня дозы соединения I. Для обоих экспериментов самок CBA/J мышей возраста 6 недель (The Jackson Laboratory, Bar Harbor, ME), находящихся в состоянии бодрствования и необездвиженных, подвергали воздействию отфильтрованного шума в октавном диапазоне частот (8-16 кГц) в течение 2 часов при уровне звукового давления 98 дБ в реверберационной камере звукового воздействия. Мышей помещали в специально изготовленную проволочную клетку, находящуюся поверх 4-дюймовой пены высокой плотности, с проволочным полом на 1 дюйм выше пены. Сигнал шума генерировался и фильтровался предварительным усилителем TDT RZ6 (Tucker Davis Technologies, Alachua, FL), усиливался усилителем мощности Crown XLS1000 и доставлялся компрессионным драйвером JBL 2426H, соединенным с рупором JBL 2730A. Уровни звука проверяли в центре клетки с использованием 1/4-дюймового конденсаторного микрофона (PCB Piezotronics, Depew, NY) перед каждым воздействием. ABR собирали через 1 и 14 дней после воздействия шума в целях обеспечения временного смещения порога без постоянного смещения порога. Через семнадцать дней после воздействия шума мышам вводили билатерально кристаллическое соединение I (2% в PF10 *) или NT3 (2 мкл 150 нг/мкл) (эксперимент 1); кристаллическое соединение I (2% и 0,2% в PF10) (эксперимент 2); и ABR собирали через 14 дней после введения. Животные из контрольной группы введения носителя получали билатеральные инъекции PF10. Также использовали соответствующих по возрасту контрольных животных, которые ранее не подвергались обработке.
[0125] Анализ волны I ABR: Форма волны слухового ответа ствола головного мозга (ABR) включает набор волн (помеченных как I-V). Мышей анестезировали кетамином и ксилазином. ABR сигналы собирали с использованием слухового процессора RZ6 Tucker-Davis Technologies. Используемые стимулы представляли собой 5 мсек звук (2 мсек cos2 нарастание-падение) на частотах 4, 8, 16, 24 и 32 кГц, передаваемый с чередующейся полярностью со скоростью 21/сек. Электрические ответы собирали с использованием игольчатых электродов на верхнем и на нижнем крае ушной раковины с опорным заземлением в центре черепа, усиливали в 20 раз с полосой пропускания 3-100 Гц и усредняли по 512 ответам при каждом SPL. Ответы собирали для уровней стимула с шагом 10 дБ от SPL 90 дБ до SPL 10 дБ. ABR порог определяли как самый низкий уровень звука, при котором можно наблюдать воспроизводимую форму волны. Если при SPL 90 дБ не могли обнаружить никакого ответа, порог определяли как SPL 100 дБ. Функциональное измерение синаптопатии через амплитуды волны I выражали в вольтах. Пиковые амплитуды волны I определяли путем выведения средних значений потенциала необработанного сигнала и определения окна или латентности, при которой появляется пик волны I. Измерения от пика до минимального уровня использовали для расчета амплитуды волны I. Амплитуды волны I после обработки (на выбранных частотах) для каждого уровня децибелов нормализовали к значению дня 14 для оценки амплитуды волны 1.
[0126] Иммуногистохимия. Животных умерщвляли сразу после последнего ABR путем декапитации и осуществляли иммуногистохимический анализ. Вкратце, улитки удаляли и фиксировали путем интраскалярной перфузии 4% параформальдегидом (PFA). Улитки фиксировали в течение ночи, затем PFA обменивали на раствор 125 мМ EDTA для декальцификации (по меньшей мере 72 часа). Кость удаляли и орган Корти разделяли на апикальный (~начало - 16 кГц), средний 1 (~16-24 кГц), средний 2 (~24-32 кГц) и базальный (~32 кГц - конец) повороты и переносили в 96-луночный планшет, содержащий DBPS для иммуноокрашивания. Кохлеарную ткань блокировали 5% раствором лошадиной сыворотки в DPBS и 0,3% Triton X-100 в течение 1 часа при комнатной температуре с последующей инкубацией в течение ночи при 37°C со следующими первичными антителами: мышиное(IgG1) анти-CtBP2 (C-концевой связывающийся белок) при 1:200 (BD Biosciences), кроличий миозин 6 при 1:250 (Proteus Biosciences, Ramona, CA), для очерчивания волосковых клеток. Кохлеарные фрагменты промывали и затем инкубировали в течение 60 мин при комнатной температуре в подходящих для вида вторичных антителах: CF647 козлиное антимышиное IgG1 (Biotium) при 1:500, Alexa Fluor 568-конъюгированное ослиное антикроличье (Thermo Fisher) при 1:500. Hoechst 33342 (Thermo Fisher) использовали в качестве нуклеарного контр-окрашивания. Окрашенные кохлеарные фрагменты закрепляли на предметных стеклах и получали изображения с использованием конфокального микроскопа Nikon C2, используя программу NIS Elements (версия 4.20, Melville, NY).
[0127] Анализ: изображения получали с использованием 40х масляного объектива с шагом 0,5 мкм по оси z. Количество CtBP2+ синапсов на внутреннюю волосковую клетку подсчитывали вручную. Внутренние и внешние волосковые клетки охарактеризовывали по иммунореактивности миозина 6 и местоположению, и их количество подсчитывали вручную.
[0128] Статистический анализ: Данные анализировали с использованием программы GraphPad Prism (La Jolla, CA) и статистическую значимость определяли с использованием двустороннего t-критерия Стьюдента или однофакторного дисперсионного анализа, при необходимости с последующим апостериорным анализом.
Пример 7. Модель морских свинок с использованием канамицина
[0129] Начиная с дня 0, самцов морских свинок Hartley (450-500 г) делали глухими путем внутрибрюшинного введения канамицина (400 мг/кг), вводимого один раз в день в течение 10 последовательных дней. Было показано, что эти состояния приводят к прогрессирующей потере наружных волосковых клеток и соответствующему ухудшению порогов ABR, что происходит в градиенте от основания к вершине. Потеря плотности синапсов в этой модели ранее не описывалась. В день 15 животные получали билатеральные транстимпанальные инъекции носителя (30 мкл), кристаллического соединения I (30 мкл 2% в носителе) или кристаллического соединения II (30 мкл 2% в носителе). Через три месяца после введения испытываемого вещества животных подвергали эвтаназии, улитки внутреннего уха собирали и окрашивали фаллоидином и антителами против CtBP2 и NF-200. Количество CtBP2+/NF-200+ синапсов определяли и нормализовали к количеству внутренних волосковых клеток для получения плотности синапсов. Плотность синапсов снижалась при обработке канамицином на расстоянии 14,7 и 17,3 мм от верхушки улитки, которая в улитке морской свинки коррелирует с частотой 16 и 32 кГц соответственно, в соответствии с картой частот Гринвуда. Плотность синапсов увеличивалась при обработке гамма-секретазой, как показано на Фиг. 9. Эти данные являются первым доказательством восстановления плотности синапсов при помощи ингибитора гамма-секретазы, и они предполагают, что эта парадигма лечения может быть полезной для лечения синаптопатии.
[0130] Носитель (PF10) и GSI в носителе, используемые в примерах 6 и 7, получали следующим образом: к 129 мл стерильной воды добавляли 0,96 г хлорида натрия, 0,59 г двухосновного фосфата натрия и 0,14 г одноосновного фосфата натрия. Раствор перемешивали при температуре окружающей среды и добавляли 25,6 г полоксамера 407 и перемешивали в течение ночи с получением прозрачного раствора. Раствор стерильно фильтровали и 1 мл раствора, описанного выше, добавляли к 20 мг кристаллического соединения I или 20 мг кристаллического соединения II, и суспензию встряхивали в течение 60 минут с получением гомогенной суспензии. Кристаллическое соединение I, кристаллическое соединение II и их получение описаны в предварительной заявке США № 62/248625, поданной 30 октября 2015 г., и в заявке PCT № PCT/US16/59194, поданной 27 октября 2016 г., в настоящее время WO2017075264, опубликованной 4 мая 2017 г., каждая из которых включена в настоящую заявку посредством ссылки.
[0131] В другом варианте осуществления любой из вышеописанных вариантов осуществления может использоваться отдельно или в комбинации с любым одним или несколькими из вышеописанных вариантов осуществления.
[0132] Хотя вышеизложенное было описано довольно подробно при помощи иллюстраций и примеров в целях ясности и понимания, специалистам в данной области техники будет понятно, что возможны многочисленные и различные модификации без отступления от сути настоящего изобретения. Поэтому следует четко понимать, что формы, раскрытые в настоящей заявке, являются только иллюстративными и предназначены не для ограничения объема настоящего раскрытия, а скорее для охвата всех модификаций и альтернатив вместе с действительным объемом и сущностью изобретения.
Реферат
Изобретение относится к способу лечения кохлеарной синаптопатии, способу лечения потери слуха в результате потери афферентных синапсов внутренних волосковых клеток, способу лечения тиннитуса в результате потери афферентных синапсов внутренних волосковых клеток и способу лечения потери слуха у пациента, который демонстрирует нормальный ABR порог и/или нормальную DPOAE, которые включают введение пациенту терапевтически эффективного количества соединения, выбранного из группы, состоящей из (S)-1-((S)-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-илкарбамоил)этилового эфира (2,2,3,3,3-пентафторпропил)-карбаминовой кислоты, (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида,,, и, или фармацевтически приемлемой соли любого из вышеуказанных соединений. 4 н. и 20 з.п. ф-лы, 23 ил., 7 пр.
Формула















Документы, цитированные в отчёте о поиске
Производные земещенного дибензоазепина и бензодиазепина, полезные в качестве ингибиторов секретазы

Комментарии