Фармацевтическая композиция для трансназального введения - RU2470666C2
Код документа: RU2470666C2
Чертежи









Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции для обеспечения прохождения гидрофильного биологически активного вещества от полости носа в кровь при сохранении его активности.
Уровень техники
В дополнение к низкомолекулярным гидрофобным лекарственным средствам, в основном применяемым до настоящего времени, гидрофильные биологически активные вещества, такие как пептиды и нуклеиновые кислоты, недавно появились в клинических учреждениях. Их применяют в качестве лекарственных средств, и они показали заметные терапевтические эффекты. Однако вплоть до настоящего времени, в большинстве случаев, способы их введения ограничены использованием растворов для инъекции. Это происходит потому, что гидрофильные вещества неспособны проходить через слой эпителиальных клеток слизистой оболочки, в отличие от известных лекарственных средств. Поскольку клетки в слое эпителиальных клеток тесно связаны друг с другом для предотвращения проникновения чужеродных веществ в живой организм, вещества, обладающие гидрофильностью, с трудом могут проходить через данный слой, так что пероральное введение, которое является общепринятым способом введения лекарственных средств, не способно дать возможность веществам действовать внутри организма.
Поскольку введение лекарственного средства посредством инъекции является тяжелой нагрузкой для пациента и врача, особенно в случаях, когда терапия является частой и продолжается долгое время, были исследованы различные способы, позволяющие введение такого гидрофильного биологически активного вещества способом, отличным от инъекции.
При пероральном введении, которое широко используют в качестве обычного способа введения лекарственного средства, существует ряд попыток для способов, дающих возможность абсорбции гидрофильного биологически активного вещества. В частности, для улучшения проницаемости слоя эпителиальных клеток желудочно-кишечного тракта, который является главной областью абсорбции при проведении перорального введения, предприняты попытки с использованием поверхностно-активных веществ, адгезивных для эпителиальных клеток веществ, проникающих в клетку пептидов и т.п.
«Проникающий в клетку пептид» является общим термином для пептидов, обладающих свойством проходить из внешнего окружения клетки внутрь клетки без разрушения мембраны клетки. Хорошо известные примеры пептидов включают различные типы пептидов, такие как олигоаргинин, имеющий участок аргинина; Tat, пептид вируса HIV-1 (патентный литературный источник 1); и пенетратин, имеющий такую же аминокислотную последовательность, как показано на SEQ ID NO:1 по настоящему изобретению (патентные литературные источники 2 и 3). В данное описание включены различные пептиды, и их примеры включают пептиды, характеризующиеся просто основностью; пептиды, обладающие гидрофобным доменом; пептиды, характеризующиеся амфифильностью первичной структуры или вторичной структуры пептидов, и пептиды с неизвестным механизмом. С использованием таких пептидов проводили обширные исследования по их способности прохождения в клетку, и их применению в качестве носителей для доставки генов, связанных с ними, в клетку.
Кроме того, проводили исследования с целью способствовать проникновению через слой эпителиальных клеток и способствовать абсорбции при пероральном введении с использованием такого свойства (патентные литературные источники 4 и 5). Однако, поскольку эффекты усиления абсорбции проникающих в клетку пептидов, используемых в этих исследованиях, основаны на оценке с помощью смывов из желудочно-кишечного тракта и т.п., действительные эффекты при пероральном введении являются неясными. Кроме того, трудно реализовать стабильную абсорбцию из-за пищеварительной деградации в желудке и изменений во внешнем окружении в желудочно-кишечном тракте при проглатывании, так что практическое применение перорального введения гидрофильного биологически активного вещества не было достигнуто.
В качестве способа, отличного от перорального введения для реализации абсорбции, был разработан способ введения с использованием слоя слизистой оболочки носа. Между слизистой оболочкой носа и слизистой оболочкой желудочно-кишечного тракта существуют различия в типах клеток, составляющих слой слизистой оболочки, и различия в свойствах отдельных клеток, и для деструктивных ферментов, существующих в просветах, показаны разнообразные различия, такие как различия в их типах и количествах, так что способы, отличные от способов усиления абсорбции в желудочно-кишечном тракте, необходимы для усиления трансназальной абсорбции.
Введение можно легко осуществлять через слизистую оболочку носа, и слизистая оболочка носа обладает свойствами, подходящими для абсорбции лекарственных средств, из-за развития под ней кровеносных сосудов и лимфатических сосудов. Кроме того, считают, что, поскольку лекарственное средство, абсорбированное из полости носа, напрямую проходит в системный кровоток после абсорбции, можно избежать эффекта первого прохождения через печень, таким образом, полость носа считается эффективной в качестве участка введения лекарственных средств, подверженных метаболизму в желудочно-кишечном тракте и/или печени. Однако, поскольку, как и в других участках абсорбции, слизистая оболочка носа обладает низкой проницаемостью для гидрофильных биологически активных веществ, и поскольку площадь участка абсорбции является небольшой, усиливающий абсорбцию способ является необходимым для реализации абсорбции гидрофильных биологически активных веществ из полости носа.
К настоящему времени существуют примеры клинических тестов с помощью трансназальных составов с использованием поверхностно-активных веществ в качестве усиливающих абсорбцию средств от множества изготовителей лекарственных средств, однако отказались от всех таких тестов из-за сильного раздражения слизистой оболочки носа. Кроме того, в качестве способа, в котором не применяют поверхностно-активное вещество, предприняты попытки усиления абсорбции с использованием пептида на стадии исследования, и попытка усиления трансназальной абсорбции посредством непосредственного присоединения пептида к лекарственному средству описана в патентном литературном источнике 6. Однако, поскольку по такому способу необходима химическая модификация лекарственного средства, он неизбежно имеет множество проблем, подлежащих решению, таких как уменьшение фармакологической активности лекарственного средства, изменения в фармакокинетике, увеличение стоимости производства и антигенности вводимого лекарственного средства.
Возможности усиления трансназальной абсорбции посредством пенетратина или его модифицированного продукта приведены в патентных литературных источниках 2 и 3, однако, поскольку для них необходима ковалентная связь между лекарственным средством, дающим возможность проникновения через слизистую оболочку, и модифицированным продуктом пенетратина, они представляют собой способы, отличные от настоящего изобретения, где гидрофильное биологически активное вещество и пенетратин или его модифицированный продукт не являются ковалентно связанными друг с другом. Известно, что эффективное возникновение десорбции из клетки, в дополнение к прохождению из внешнего окружения клетки внутрь клетки, является необходимым для реализации назальной абсорбции с использованием проникающего в клетку пептида, и на способность к абсорбции при абсорбции через слизистую оболочку носа влияют различные факторы, отличные от проницаемости клетки, такие как возможность деградации пептида различными деструктивными ферментами, существующими в ткани слизистой оболочки носа. Таким образом, необходимость экспериментального подтверждения с использованием модели животного или т.п., обладает ли проникающий в клетку пептид способностью проникать через слизистую оболочку носа, является общераспространенным техническим знанием для специалистов в данной области. Однако, поскольку в патентных литературных источниках 2 и 3 не описано экспериментальное подтверждение способности проникновения через слизистую оболочку носа пенетратина и его модифицированного продукта, для специалистов в данной области непросто заключить из патентных литературных источников 2 и 3, что пенетратин и его модифицированный продукт способны к проникновению через слизистую оболочку носа.
Предпринята также попытка введения олигоаргинина, который не является ковалентно связанным с лекарственным средством, в качестве усиливающего назальную абсорбцию вещества вместе с лекарственным средством (патентный литературный источник 7), но для этого необходима высокая концентрация олигоаргинина, и его эффект показан только с помощью одной модели лекарственного средства, флуоресцентно-меченного декстрана, так что способность проникновения для пептидного гидрофильного биологически активного вещества является неизвестной.
Таким образом, высоко практическая технология для обеспечения высокой эффективности назальной абсорбции гидрофильных биологически активных веществ еще не разработана.
[Патентный литературный источник 1] JP 10-33186 A
[Патентный литературный источник 2] Опубликованная переведенная патентная заявка Японии PCT No. 2002-530059
[Патентный литературный источник 3] Опубликованная переведенная Патентная заявка Японии РСТ No. 2002-519392
[Патентный литературный источник 4] JP 2006-257074 А
[Патентный литературный источник 5] JP 2008-7448 А
[Патентный литературный источник 6] WO 2004/037859
[Патентный литературный источник 7] JP 10-95738 А
Описание изобретения
Проблемы, подлежащие решению посредством изобретения
Целью настоящего изобретения является предоставление фармацевтической композиции, чтобы дать возможность прохождения назально введенного гидрофильного биологически активного вещества в кровь.
Средства для решения проблем
Для преодоления вышеописанных проблем авторы настоящего изобретения исследовали способ улучшения эффективности абсорбции гидрофильного биологически активного вещества, обладающего низкой проницаемостью через слизистую оболочку в кровь в нормальных условиях, и обнаружили, что фармацевтическая композиция, содержащая гидрофильное биологически активное вещество и: (а) пептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO:1, при условии, что амидированный на С-конце пептид исключен; (b) пептид, имеющий такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько аминокислот исключены, замещены и/или добавлены, где пептид обладает проницаемостью через слизистую оболочку носа, при условии, что амидированный на С-конце пептид исключен, или (с) пептид, имеющий аминокислотную последовательность, представленную последовательностью, обратной (а) или (b), где пептид обладает проницаемостью через слизистую оболочку носа, при условии, что амидированный на С-конце пептид исключен, является эффективной и может реализовывать высокоэффективное прохождение гидрофильного биологически активного вещества в кровь при назальном введении. То есть настоящее изобретение состоит из следующего.
(1) Фармацевтическая композиция для назального введения, содержащая гидрофильное биологически активное вещество и любое из (а)-(с) ниже, при условии, что амидированный на С-конце пептид исключен:
(a) пептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO:1;
(b) пептид, имеющий такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько аминокислот исключены, замещены и/или добавлены, где пептид обладает проницаемостью через слизистую оболочку носа, и
(c) пептид имеющий аминокислотную последовательность, представленную последовательностью, обратной (а) или (b), где пептид обладает проницаемостью через слизистую оболочку носа, при условии.
(2) Фармацевтическая композиция для назального введения согласно (1), где пептид из (b) имеет такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько основных аминокислот замещены другой(ими) основной(ыми) аминокислотой(ами) или добавлены, где пептид обладает проницаемостью через слизистую оболочку носа.
(3) Фармацевтическая композиция для назального введения согласно (1), где пептид из (b) имеет аминокислотную последовательность, показанную в любой из SEQ ID NO:3-6.
(4) Фармацевтическая композиция для назального введения согласно любому из (1)-(3), где пептид из (с) имеет аминокислотную последовательность, показанную в SEQ ID NO:2.
(5) Фармацевтическая композиция для назального введения согласно любому из (1)-(4), содержащая любой из пептидов из (а)-(с) в концентрации 0,2-2,0 мМ.
(6) Фармацевтическая композиция для назального введения согласно любому из (1)-(5), где гидрофильным биологически активным веществом является пептид.
(7) Фармацевтическая композиция для назального введения согласно любому из (1)-(6), где гидрофильным биологически активным веществом является инсулин или интерферон β.
Эффект изобретения
По настоящему изобретению возможно прохождение введенного назально гидрофильного биологически активного вещества в кровь, и возможна более простая и более ориентированная на пациента фармакотерапия по сравнению с общепринятым способом введения посредством инъекции.
Краткое описание чертежей
На Фиг.1 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептида SEQ ID NO:1 или SEQ ID NO:7: уровень в крови.
На Фиг.2 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептида SEQ ID NO:1 или SEQ ID NO:7: уровень глюкозы в крови.
На Фиг.3 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептида SEQ ID NO:1 или SEQ ID NO:7: биодоступность.
На Фиг.4 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептида SEQ ID NO:1: зависимость от концентрации.
На Фиг.5 показан эффект усиления абсорбции для вводимого назально флуоресцентно-меченного декстрана, полученный с использованием пептида SEQ ID NO:1.
На Фиг.6 показан эффект усиления абсорбции для вводимого назально интерферона β, полученный с использованием пептида SEQ ID NO:1.
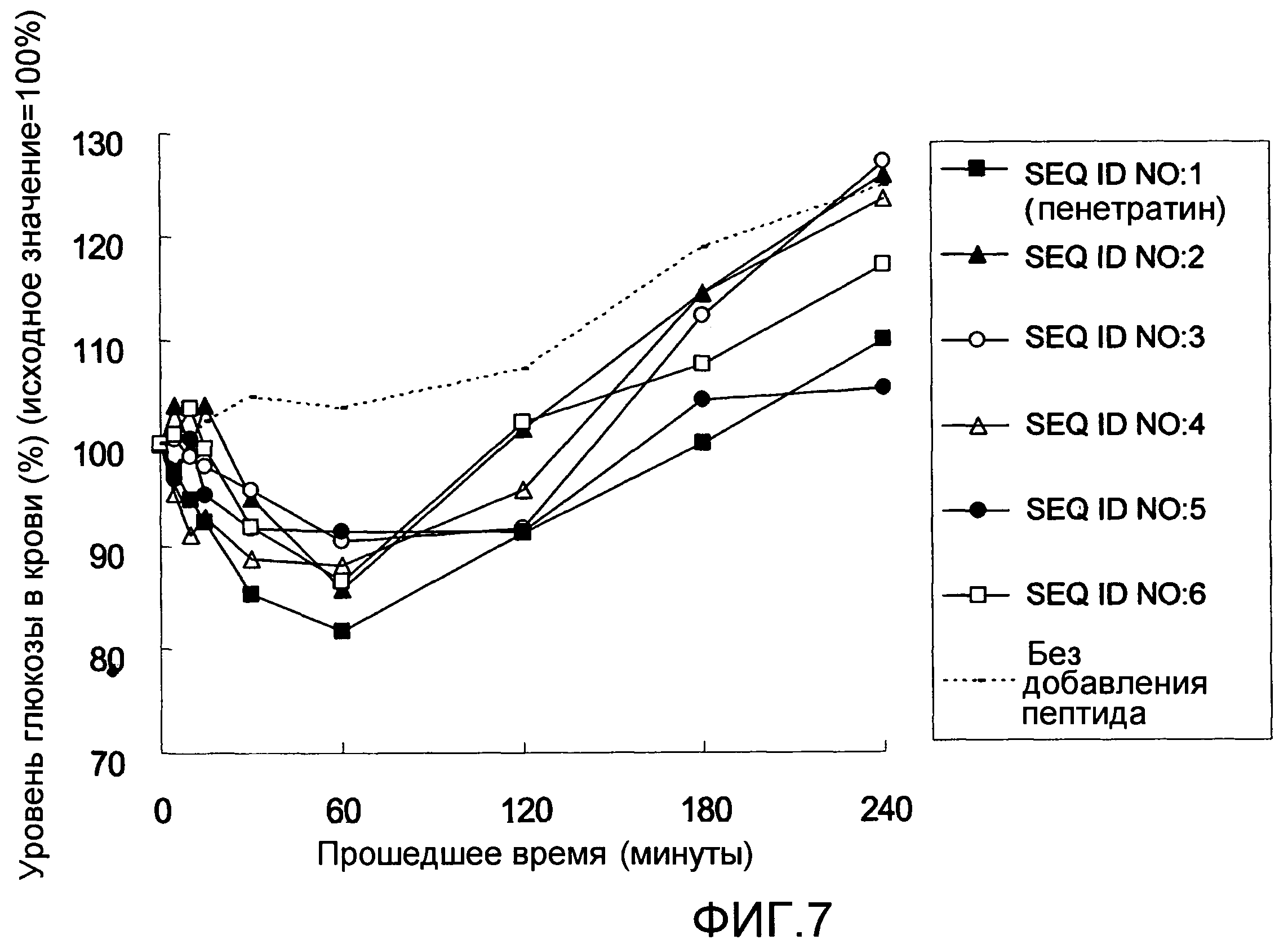
На Фиг.7 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептидов SEQ ID NO:1-6: уровень глюкозы в крови.
На Фиг.8 показан эффект усиления абсорбции для вводимого назально инсулина, полученный с использованием пептидов SEQ ID NO:1-6: уровень в крови.
Наилучший способ осуществления изобретения
Настоящее изобретение относится к фармацевтической композиции для назального введения, чтобы дать возможность прохождения гидрофильного биологически активного вещества из полости носа в кровь, где фармацевтическая композиция содержит гидрофильное биологически активное вещество в качестве фармакологически активного компонента и специфический пептид, обладающий проницаемостью через слизистую оболочку носа, которые смешаны независимо и не ковалентно связаны друг с другом. В данном описании «гидрофильное биологически активное вещество» по настоящему изобретению означает физиологически активное вещество, которое является типично гидрофильным. «Гидрофильный» в данном описании означает высокую растворимость в воде, и вещество, которое растворяется в воде в количестве 1 мкг или более на 1 мл воды, определено как гидрофильное. «Физиологически активное вещество» означает вещества, которые, как правило, действуют в живом организме и вызывают изменения в живом организме, и примеры которых включают белки, которые связываются с рецепторами на конкретных клетках, и ферменты, обладающие аффинностью в отношении веществ в живом организме. Кроме того, оно может представлять собой вещество, которое не вступает в прямую реакцию с веществом в живом организме, и включает вещества, которые можно вводить в живой организм для медицинского применения, такие как декстран, который используют в качестве альтернативы плазме крови для увеличения объема крови.
«Пептид» по настоящему изобретению представляет собой вещество, имеющее структуру, в которой аминокислоты связаны друг с другом посредством пептидных связей. Среди пептидов такие, которые обладают высокой молекулярной массой, как правило, называют белками, однако в настоящем описании такие белки также называют пептидами без ограничений по их молекулярным массам. Кроме того, гликопротеины, имеющие сахарную цепь, присоединенную к белку, и производные, имеющие химическую модификацию, такую как полиэтиленгликолирование (ПЕГилирование), также включены в пептиды по настоящему изобретению.
Фармацевтическая композиция для назального введения по настоящему изобретению будет подробно описана ниже.
В настоящем изобретении пептид, содержащийся вместе с гидрофильным биологически активным веществом и имеющий аминокислотную последовательность, показанную в SEQ ID NO:1, представляет собой пептид, как правило, называемый пенетратином. Пенетратин представляет собой пептид, обладающий клеточной проницаемостью, обнаруженный в ДНК-связывающем участке пептида из Drosophila, называемого Antennapedia. Авторы настоящего изобретения впервые обнаружили, что назальное введение пенетратина, при условии, что амидированный на С-конце пептид исключен, вместе с гидрофильным биологически активным веществом дает возможность прохождения гидрофильного биологически активного вещества в кровь в живом организме с высоким соотношением благодаря отличной проницаемости слизистой оболочки носа для пенетратина, завершив, таким образом, настоящее изобретение.
Для пептида, имеющего аминокислотную последовательность SEQ ID NO:1, используемого в настоящем изобретении, делеция, замещение и/или добавление одной или нескольких аминокислот являются приемлемыми, пока различие(ия) лежит(ат) в диапазоне, где сохраняется проницаемость через слизистую оболочку носа, необходимая по настоящему изобретению как у целого пептида, при условии, что амидированный на С-конце пептид исключен. Например, случаи, где основная аминокислота(ты) в пептиде замещена(ны) другой или несколькими другими основными аминокислотами, случаи, где гидрофильная аминокислота(ты) замещена(ны) другой или другими из множества гидрофильных аминокислот, и случаи, где гидрофобная аминокислота(ты) замещена(ны) другой или другими из множества гидрофобных аминокислот в пептиде, не изменяют свойств целого пептида, и таким образом их принимают без проблем. В частности, случаи, где одна или несколько основных аминокислот замещена(ны) или добавлены в аминокислотной последовательности, показанной SEQ ID NO:1, принимают предпочтительно. Число делеции(ий), замещения(ий) и/или добавления(ий) описанных выше аминокислот предпочтительно является небольшим, и предпочтительно в него вовлечены 1-5 аминокислот, более предпочтительно 1-3 аминокислоты, еще более предпочтительно 1 аминокислота. В данном случае в настоящем изобретении «гидрофобная аминокислота» означает аминокислоту, выбранную из группы, состоящей из лейцина, изолейцина, триптофана, фенилаланина, валина и аланина, и «гидрофильная аминокислота» означает аминокислоту, выбранную из группы, состоящей из серина, треонина, аспарагиновой кислоты, глутаминовой кислоты, лизина, аргинина и гистидина. «Основная аминокислота» означает аминокислоту, выбранную из группы, состоящей из лизина, аргинина и гистидина. Предпочтительные примеры пептида, имеющего такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько аминокислот исключены, замещены и/или добавлены, где пептид обладает проницаемостью через слизистую оболочку носа, включают пептид, имеющий аминокислотные последовательности, показанные в любой из SEQ ID NO:3-6.
В настоящем изобретении, даже если пептид, содержащийся вместе с гидрофильным биологически активным веществом, представляет собой пептид, представленный обратной последовательностью, или пептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO:1, обладающий эффективной проницаемостью через слизистую оболочку носа, или пептид, имеющий такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что часть аминокислот исключены, замещены и/или добавлены, он является приемлемым, пока различие лежит в диапазоне, где проницаемость через слизистую оболочку носа, необходимая по настоящему изобретению, сохраняется как в целом пептиде, при условии, что амидированный на С-конце пептид исключен. В данном описании пептид, представленный обратной последовательностью, означает, что последовательность аминокислот, составляющих пептид, обращена. Например, когда последовательность аминокислот в пептиде от N-конца до С-конца представляет собой аргинин, глутамин, изолейцин и лизин, обратный ему пептид имеет аминокислотную последовательность от N-конца до С-конца, лизин, изолейцин, глутамин и аргинин. Предпочтительные примеры этого включают пептид, представленный обратной последовательностью пептида, имеющего аминокислотную последовательность, показанную в SEQ ID NO:1 (SEQ ID NO:2).
Согласно настоящему изобретению можно использовать в качестве аминокислот, составляющих пептид, содержащийся вместе с гидрофильным биологически активным веществом, природные L-аминокислоты, а также неприродные аминокислоты, такие как производное, полученное модификацией части природной аминокислоты. Например, поскольку D-аминокислоты с трудом поддаются деградации протеазами, их можно эффективно использовать, и таким образом аминокислотная последовательность пептида может являться частично или полностью состоящей из D-аминокислот и соответствующим образом выбранной в зависимости от гидрофильного биологически активного вещества, вводимого вместе с пептидом. В случаях, где гидрофильное биологически активное вещество в целом обладает отрицательными зарядами, общая аминокислотная последовательность предпочтительно состоит из L-аминокислот. Например, когда гидрофильным биологически активным веществом является инсулин, общая аминокислотная последовательность предпочтительно состоит из L-аминокислот. В случаях, где гидрофильное биологически активное вещество не обладает зарядами, или в случаях, где оно обладает положительными зарядами, общая аминокислотная последовательность предпочтительно состоит из D-аминокислот. Например, в случае интерферона β, обладающего положительными зарядами, общая аминокислотная последовательность предпочтительно состоит из D-аминокислот.
В настоящем изобретении пептид, содержащийся вместе с гидрофильным биологически активным веществом, можно получать общепринятым способом синтеза пептидов, и можно также получать, например, путем введения гена, кодирующего аминокислотную последовательность пептида, в микроорганизм, такой как E. coli, клетки животных, клетки насекомых или т.п., и путем обеспечения экспрессии гена. Кроме того, пептид можно получать также деградацией белка, имеющего аминокислотную последовательность пептида, встречающегося в природе. Например, пептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO:1, частично имеет такую же последовательность, как белок Antennapedia в Drosophila, и его можно также получить обработкой протеазой белка, встречающегося в природе.
Согласно настоящему изобретению, либо отдельный тип, либо множество типов пептида(пептидов) могут содержаться вместе с гидрофильным биологически активным веществом, и отдельный тип пептида является предпочтительным. Его концентрация не является ограниченной, и как показано в примерах, она составляет предпочтительно 0,2-2 мМ. Концентрация 0,5-2 мМ является более предпочтительной, поскольку с ее помощью наблюдали заметное назальное проникновение гидрофильного биологически активного вещества. Концентрация пептида по настоящему изобретению означает концентрацию пептида при его введении в полость носа, и в случаях, где фармацевтическая композиция по настоящему изобретению представляет собой раствор, она означает концентрацию в растворе, и в случае твердого вещества она означает концентрацию, полученную, когда дозу композиции для введения разводят до 40 мкл раствора, что представляет собой стандартный объем для однократного назального введения.
Конкретные примеры гидрофильного биологически активного вещества, используемого в настоящем изобретении, включают пептиды, цепи сахаров и нуклеиновые кислоты, и оно предпочтительно представляет собой пептид. Конкретные примеры пептида включают антитела, пептидные гормоны и цитокины, и он предпочтительно представляет собой пептидный гормон или цитокин. Примеры пептидного гормона включают инсулин, кальцитонин, паратиреоидный гормон, гормон роста, GLP-1 и эксендин-4; и примеры цитокина включают интерфероны, интерлейкины и G-CSF; и он предпочтительно представляет собой инсулин или интерферон β. Каждое из этих гидрофильных биологически активных веществ может представлять собой либо встречающееся в природе вещество, либо производное, полученное модификацией части структуры его последовательности. Кроме того, оно может представлять собой производное, полученное химической модификацией, такой как полиэтиленгликолирование (ПЕГилирование).
Назальная абсорбция гидрофильного биологически активного вещества по настоящему изобретению означает прохождение гидрофильного биологически активного вещества, введенного в полость носа, от полости носа в кровь. Ее результат можно подтвердить наблюдением увеличения уровня в крови гидрофильного биологически активного вещества или проявления его фармакологической активности. Уровень в крови гидрофильного биологически активного вещества можно измерять способом общепринятым у специалистов в данной области, таким как иммуноанализ. Фармакологическую активность можно измерить с использованием в качестве показателя, в случае фермента, его ферментативной активности; и в случае вещества, действующего на рецептор на клетке, его способности изменять функцию клетки-мишени или уровня продукции маркерного вещества. Например, фармакологическую активность инсулина можно измерить с использованием в качестве показателя уровня глюкозы в крови животного, которому вводили инсулин.
Усиливается или нет абсорбция, можно подтвердить сравнением между: соотношением величины прохождения лекарственного средства в кровь по отношению к количеству введенного лекарственного средства, наблюдаемым, когда гидрофильное биологически активное вещество, являющееся фармакологически активным компонентом, вводят отдельно в полость носа; и соотношением величины прохождения лекарственного средства в кровь по отношению к количеству введенного лекарственного средства, наблюдаемым, когда вводят также фармацевтическую композицию по настоящему изобретению. Если последнее соотношение выше, можно подтвердить усиление абсорбции. Чтобы дать возможность проявления достаточного функционирования в качестве действительного фармацевтического средства, значение биодоступности фармацевтической композиции, показывающее процентное соотношение значения AUC (площадь под кривой концентрация в крови в зависимости от времени) по отношению к AUC при введении того же самого количества гидрофильного биологически активного вещества посредством инъекции, предпочтительно составляет не менее 10%, более предпочтительно не менее 20%.
Фармацевтическая композиция для назального введения по настоящему изобретению может содержать также фармацевтически приемлемый носитель и/или добавку. Примеры таких носителей и добавок включают воду, фармацевтически приемлемые органические растворители, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловые полимеры, карбоксиметилцеллюлозу натрия, полиакрилат натрия, альгинат натрия, водорастворимый декстран, карбоксиметилкрахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую смолу, гуммиарабик, казеин, желатин, агар, диглицерин, пропиленгликоль, полиэтиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, человеческий сывороточный альбумин (HSA), маннит, сорбит, лактозу и поверхностно-активные вещества, приемлемые в качестве фармацевтических добавок.
Фармацевтическую композицию для назального введения по настоящему изобретению можно использовать в различных формах, таких как раствор, твердое вещество или порошок, но, принимая во внимание стабильность и удобство в обращении, форма твердого вещества или порошка, полученного таким способом, как лиофилизация, является предпочтительной.
Способ введения фармацевтической композиции для назального введения по настоящему изобретению животным (включая человека) не является ограниченным в отношении ее конкретной формы. Например, композицию в сухом состоянии или в форме раствора можно вводить как таковую; композицией можно заполнять капсулу вместе с носителем и затем вводить; или композицию в сухом состоянии можно однократно растворять или диспергировать в воде и затем вводить.
Дозу и число доз при введении фармацевтической композиции для назального введения по настоящему изобретению в живой организм соответствующим образом выбирают в зависимости от дозированной формы, возраста и массы тела пациента, и тяжести симптомов, и композицию в норме можно вводить в дозе в пределах диапазона 0,0001-50 мг, предпочтительно в пределах диапазона 0,001-20 мг для взрослого в сутки на массу содержащегося гидрофильного биологически активного вещества.
Примеры
Пример 1: Назальное введение инсулина
<Метод>
Предписанное количество порошка инсулина (Wako Pure Chemicals) отмеряли и помещали в пробирку 1,5 мл (Eppendorf), с последующим растворением в 0,1 н. HCl и затем добавлением такого же количества 0,1 н. NaOH, с получением раствора инсулина.
Пенетратин (SEQ ID NO:1; его синтез поручен Sigma Genosys) или олигоаргинин (SEQ ID NO:7; его синтез поручен Sigma Genosys), имеющие аминокислотную последовательность, состоящую полностью из L-аминокислот или D-аминокислот, растворяли в PBS и объединяли с полученным выше раствором инсулина, с получением, для каждого эксперимента введения, 40 мкл смешанного раствора, содержащего инсулин (10 МЕ/кг) и 0,5 мМ каждого пептида.
Самцов крыс SD, имеющих массу тела приблизительно 200 г, подвергали голоданию в течение 24 часов и анестезировали внутрибрюшинной инъекцией 50 мг/кг пентобарбитала, с последующим разрезом в шейной части трахеи для освобождения трахеи. Полиэтиленовую трубку (INTRAMEDIC PE205, Clay Adams) вставляли в трахею, пищевод частично надрезали и трубку, имеющую такой же диаметр, осторожно вставляли от надрезанной части пищевода до хоанов без повреждения тканей. Наконечник трубки, предназначенной для вставки в хоаны, предварительно плотно запечатывали гигроскопической ватой и клеем. Для предотвращения подтекания раствора лекарственного средства, носонебный канал в челюсти, открытый в полость рта, закрывали синтетическим клеем (Арон Альфа A; изготовлен в Daiichi Sankyo Company, Limited). Из яремной вены отбирали 0,25 мл крови до и через 5, 10, 15, 30, 60, 120, 180 и 240 минут после введения полученного смешанного раствора инсулина и пептида или только инсулина, с последующим центрифугированием для отделения плазмы крови и измерением концентрации инсулина в плазме с помощью набора EIA (Levis). Биодоступность рассчитывали путем сравнения с данными, полученными при подкожном введении инсулина.
<Результаты>
Изменения уровня инсулина в крови с течением времени показаны на фиг.1, и изменения уровня глюкозы в крови показаны на фиг.2. Для крыс, которым назально вводили только инсулин, почти не показали увеличения уровня инсулина в крови, в то время как для крыс, которым вводили пенетратин или олигоаргинин вместе с инсулином, прохождение инсулина в кровь наблюдали сразу после введения. Наибольший максимальный уровень в крови достигали с помощью L-пенетратина, и затем по порядку следовали D-пенетратин, D-олигоаргинин и L-олигоаргинин (фиг.1). Наблюдали уменьшение уровня глюкозы в крови, которое представляет собой фармакологическую активность, вызванную прохождением инсулина в кровь, и подтверждали уменьшение уровня глюкозы в крови, отражающее уровень инсулина в крови (фиг.2).
Биодоступность составляла 0,8% для крыс, которым водили только инсулин, в то время как в случаях одновременного введения инсулина и L- или D-олигоаргинина биодоступность (BA) составляла 1,1% для L-олигоаргинина и 2,0% для D-олигоаргинина, и в случаях одновременного введения инсулина и пенетратина BA составляла 3,4% для D-пенетратина и 7,1% для L-пенетратина (фиг.3), что показывает, что пенетратин оказывает более сильный эффект усиления абсорбции инсулина по сравнению с олигоаргинином.
Пример 2: Назальное введение инсулина и его зависимость от концентрации пептида
<Метод>
L-пенетратин (SEQ ID NO:1), для которого показали наибольшую эффективность по эффекту усиления абсорбции в примере 1, аналогично оценивали по аналогичной методике примера 1, за исключением того, что его концентрацию в растворе, подлежащем введению, изменяли до 0,2 мМ, 0,5 мМ, 1 мМ или 2 мМ.
<Результаты>
В то время как биодоступность в случае введения только инсулина составляла 1,7%, биодоступность в случаях введения 0,2 мМ, 0,5 мМ, 1 мМ и 2 мМ L-пенетратина составляла 15,1%, 17,9%, 28,4% и 50,7%, соответственно. Таким образом, эффективность абсорбции инсулина улучшалась в зависимости от концентрации пенетратина (фиг.4).
Пример 3: Назальное введение флуоресцентно-меченного декстрана
<Метод>
Флуоресцентно-меченный декстран FD-4 (Molecular probes, Inc.) разводили в PBS, с получением раствора 4 мг/мл. С использованием 40 мкл полученного раствора проводили оценку по аналогичной методике примера 1. Концентрацию FD в крови количественно оценивали флуорометрией. Биодоступность рассчитывали путем сравнения со случаем, где такое же количество FD-4 вводили внутривенно.
<Результаты>
Биодоступность составляла 4,9% для крыс, которым водили только FD-4, 17% в случае использования L-пенетратина, и 36% в случае использования D-пенетратина. Биодоступность для крыс, которым вводили L-олигоаргинин и D-олигоаргинин, составляла 12,4% и 12,4%, соответственно. Таким образом, для пенетратина показан более сильный эффект усиления абсорбции по сравнению с олигоаргинином (фиг.5).
Пример 4: Назальное введение интерферона β
<Метод>
При охлаждении во льду, 1 мл PBS, дополненного Tween 20, добавляли к человеческому интерферону β дикого типа («Ферон», изготовленный в Toray Industries, Inc.), с получением раствора 6000000 МЕ/мл, и отбирали аликвоты по 100 мкл полученного раствора. К полученной аликвоте добавляли 566 мкл PBS, дополненного Tween 20, с получением раствора 900000 МЕ/мл. Отмеряли каждый из D-пенетратина и L-пенетратина (SEQ ID NO:1), и к полученному добавляли 40 мкл раствора интерферона β, так что достигали конечной концентрации 0,5 мМ или 2 мМ, с получением смешанного раствора интерферона β и пенетратина, который затем оценивали по аналогичной методике примера 1. Концентрацию интерферона β измеряли посредством «Набора для ELISA интерферона β человека», изготовленного в Kamakura Techno-Science Inc., и биодоступность рассчитывали путем сравнения его концентрации в плазме с его концентрацией в случае, где такое же количество интерферона β вводили внутривенно.
<Результаты>
При добавлении пенетратина вместе с интерфероном β наблюдали прохождение интерферона β в кровь. Биодоступность составляла 6,1% для 0,5 мМ L-пенетратина, 11,0% для 0,5 мМ D-пенетратина и 22,0% для 2 мМ D-пенетратина (фиг.6).
Пример 5: Назальное введение инсулина
<Метод>
Предписанное количество порошка инсулина (Wako Pure Chemicals) отмеряли и помещали в пробирку 1,5 мл (Eppendorf), с последующим растворением в 0,1 н. HCl и затем добавлением такого же количества 0,1 н. NaOH, с получением раствора инсулина.
Каждый из пептидов, имеющих аминокислотную последовательность, состоящую полностью из L-аминокислот (SEQ ID NO:1-6; их синтез поручен Sigma Genosys), растворяли в PBS и объединяли с полученным выше раствором инсулина, с получением, для каждого эксперимента введения, 40 мкл смешанного раствора, содержащего инсулин (1 МЕ/кг) и 0,5 мМ каждого пептида. Полученные растворы подвергали оценке по аналогичной методике примера 1.
<Результаты>
Изменения уровня глюкозы в крови с течением времени показаны на фиг.7; изменения уровня инсулина в крови с течением времени показаны на фиг.8; и различные параметры, полученные по результатам оценки, показаны в таблице 1. Увеличение уровня инсулина в крови почти невозможно было наблюдать для крыс, которым назально вводили только инсулин, в то время как одновременное введение каждого из пептидов SEQ ID NO:1-6 с инсулином вызывало прохождение инсулина в кровь сразу после введения, приводя к уменьшению уровня глюкозы в крови. Биодоступность (BA), рассчитанная на основании изменений уровня инсулина в крови, составляла 2,3% для крыс, которым вводили только инсулин, в то время как она составляла 4,4-20,1% в случаях с пептидами SEQ ID NO:1-6. Фармацевтическая доступность (PA), рассчитанная на основании изменений уровня глюкозы в крови, составляла 4,7% в случае введения только инсулина, но составляла 15,7%-37,5% в случаях с пептидами SEQ ID NO:1-6.
Промышленная применимость
Согласно настоящему изобретению, гидрофильные биологически активные вещества, которые до настоящего времени вводили в форме растворов для инъекции, можно вводить назально и, таким образом, можно предоставлять лекарственные средства, сильно уменьшающие болевые ощущения и неудобство у пациентов. Уменьшение болевых ощущений и неудобства посещения медицинских учреждений для пациентов, вызываемых такими растворами для инъекций, может не только реализовывать ориентированное на пациента здравоохранение в клинических учреждениях, но также коренным образом изменять общепринятую концепцию составов, приводя к созданию современных составов.
Реферат
Изобретение относится к медицине, в частности к фармацевтической композиции для назального введения, содержащей гидрофильное биологически активное вещество и пептид, (а) имеющий аминокислотную последовательность SEQ ID NO:1; (b) пептид, имеющий такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько аминокислот исключены, замещены и/или добавлены, где пептид обладает проницаемостью через слизистую оболочку носа; (с) пептид, имеющий аминокислотную последовательность, представленную последовательностью, обратной (а) или (b), где пептид обладает проницаемостью через слизистую оболочку носа, любое из (а)-(с), при условии, что амидированный на С-конце пептид исключен. Гидрофильное биологически активное вещество, обладающее низкой способностью к абсорбции через слизистую оболочку, которое общепринятым образом можно вводить только посредством инъекции, можно вводить назально с помощью заявленного пептида, в частности инсулин или интерферон-бета. Изобретение обеспечивает уменьшение у пациентов болевых ощущений и неудобств, вызванных введением посредством инъекции, за счет назального введения композиции. 6 з.п. ф-лы, 1 табл., 8 ил., 5 пр.
Формула
(a) пептид, имеющий аминокислотную последовательность, показанную в SEQ ID NO:1;
(b) пептид, имеющий такую же аминокислотную последовательность, как показано в SEQ ID NO:1, за исключением того, что одна или несколько аминокислот исключены, замещены и/или добавлены, где указанный пептид обладает проницаемостью через слизистую оболочку носа; и
(c) пептид, имеющий аминокислотную последовательность, представленную последовательностью, обратной (а) или (b), где указанный пептид обладает проницаемостью через слизистую оболочку носа.
Документы, цитированные в отчёте о поиске
Векторы и усилители трансцитоза для доставки лекарственных веществ
Усилители абсорбции для фармацевтических композиций местного применения

Комментарии