Усилители абсорбции для фармацевтических композиций местного применения - RU2165265C2
Код документа: RU2165265C2
Чертежи
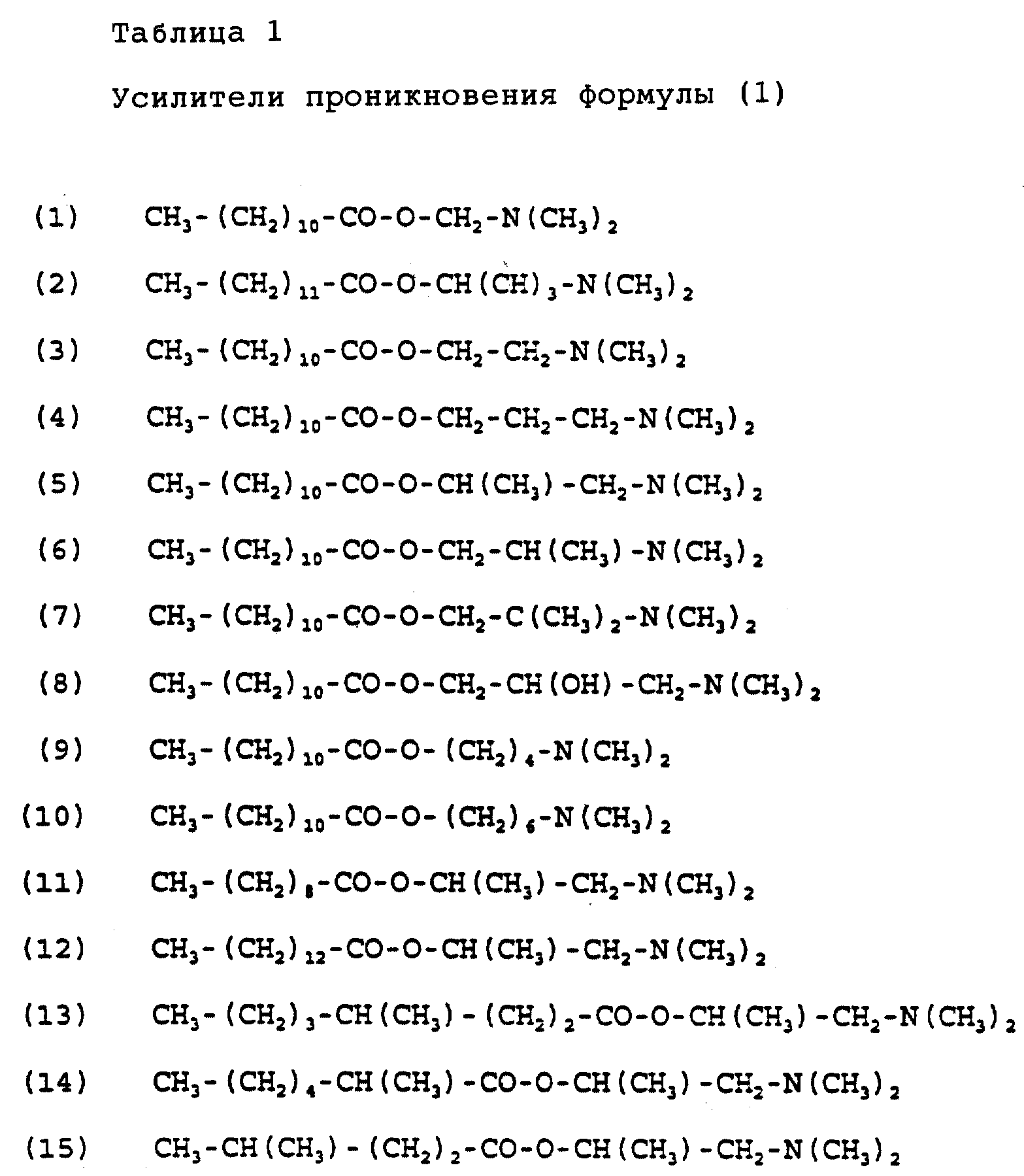



Описание
Изобретение является частичным продолжением заявки на патент США N 08/133454, поданной 7 октября 1993 года.
Изобретение относится к разработке безопасных и эффективных средств, которые увеличивают скорость доставки физиологически активных агентов через кожу или слизистую оболочку рта. В частности, настоящее изобретение относится к улучшенным усилителям проникновения реагентов для использования при доставке местных или системных физиологически активных агентов в организм млекопитающего.
Кожные лекарственные составы являются примером старейших лекарственных форм в истории человечества. Весьма вероятно, что уже древние люди использовали смолы и животные жиры для лечения повреждений кожи, вызываемых ранениями и ожогами. Использование подобных кожных составов для местного применения в значительной степени осталось неизменным вплоть до середины нашего столетия. Концепция назначения лекарств через кожу для достижения местного или системного воздействия впервые серьезно выдвинута в начале 1970-х. С тех пор в этой области проводятся интенсивные исследования.
Чрескожный путь доставки лекарств предоставляет ряд преимуществ перед традиционными путями доставки лекарственных средств. Например, лекарство может быть доставлено к нужным тканям через прилегающие области кожи. Чрескожный путь доставки лекарственных средств позволяет также осуществить медленное контролируемое выделение лекарства в системное обращение. Поскольку многие лекарства плохо поглощаются или плохо поддаются доставке традиционными путями назначения, чрескожный путь является эффективным способом достижения лучшей биологической доступности указанных лекарств. Чрескожный путь введения лекарственных средств имеет и то преимущество, что чрескожное назначение лекарств можно легко приостановить, если в процессе терапии возникают нежелательные побочные эффекты.
Несмотря на отмеченные выше преимущества, количество чрескожных композиций ограничено. Их нельзя использовать с большинством полярных лекарственных средств, поскольку они слишком медленно проникают через кожу. Это свойство имеет решающее значение, так как большинство лекарственных средств являются полярными соединениями. Кроме того, многие лекарства вызывают реакцию и/или раздражение на коже в месте их применения.
Известны два способа увеличения скорости проникновения полярных лекарств сквозь кожу. Первый из них заключается в приготовлении улучшенной композиции, содержащей лекарственное средство, с целью увеличения его термодинамической активности. Термодинамическая активность лекарственного средства в кожной композиции зависит от концентрации лекарственного средства и выбора носителя. Второй способ включает "применение физических методов, в частности лекарственного электрофореза, или использование химических соединений, в частности усилителей проникновения реагентов, с целью увеличения проницаемости разделяющей мембраны. Последний способ в общем случае является более практичным, поскольку он удобнее и эффективнее.
Поэтому в последние два десятилетия изучено большое количество соединений с точки зрения их эффективности для увеличения скорости проникновения лекарств сквозь кожу. Классическими примерами признанных активных усилителей являются протоноакцепторные растворители, в частности диметилсульфоксид (ДМСО) и диметилацетамид (ДМАМ). Недавно в качестве эффективных усилителей описаны 2-пирролидон, N, N-диэтил-м-толуамид (ДЭТА), 1-додецилазациклогептан-2-он (Azone, зарегистрированный товарный знак фирмы "Nelson Research"), N,N-диметилформамид, N-метил-2-пирролидон и тиогликолят кальция.
В предыдущей работе одного из заявителей настоящего изобретения, а именно в патенте США 4980378, выданном 25 декабря 1990, и в патенте США 5082866, выданном 21 января 1992, приводится группа биоразлагаемых усилителей абсорбции, которые представляют собой N,N-дизамещенные аминоацетаты.
Биоразлагаемые усилители абсорбции, описываемые в вышеуказанных патентах, решают несколько проблем, которые возникали со многими известными ранее из области техники усилителями проникновения через кожу. Одной из этих проблем является невозможность использовать известные усилители с наиболее полярными лекарственными средствами, поскольку они слишком медленно проникают через кожу. Кроме того, многие из ранее известных из области техники усилителей проникновения через кожу вызывают реакцию и/или раздражение на коже в месте их применения. Таким образом, ранее указанные патенты, которые используются в этих целях, позволяют решить некоторые проблемы.
Нами обнаружено, что соединения, которые представляют собой N, N-дизамещенные производные сложных эфиров аминоалканолов с некоторыми алифатическими кислотами, неожиданно оказались хорошими усилителями проникновения реагентов. Например, отдельным представителем этого класса соединения является производные и-алкановой кислоты и аминоалканола, додеканоат 1-(N,N-диметиламино)-2-пропанола, которое можно получить взаимодействием соответствующего аминоалканола с лауроилхдоридом в присутствии триэтиламина. Указанные соединения легко получаются в больших количествах.
Таким образом, одной из целей настоящего изобретения являются дополнительные биоразлагаемые усилители абсорбции, которые значительно увеличивают термодинамическую активность фармакологически активных средств и повышают проницаемость разделительных мембран, таких как кожа и слизистые оболочки.
Еще одной целью настоящего изобретения является улучшение чрескожной доставки лекарства с помощью дополнительных новых соединений, которые усиливают поглощение активных соединений кожей и слизистыми оболочками, такими как десны. Указанные лекарственные средства обладают меньшей токсичностью и меньшей стоимостью при изготовлении по сравнению с соединениями, которые ранее использовали в этих целях.
Способ достижения поставленных и других целей настоящего изобретения станет очевиден из подробного описания изобретения, которое приводится далее.
Разработана и синтезирована новая группа сложных эфиров длинноцепочечных алифатических кислот с N,N-дизамещенными аминоспиртами. Фрагмент длинноцепочечной кислоты может представлять собой остаток либо насыщенной карбоновой кислоты, либо ненасыщенной карбововой кислоты с длинной цепью, такой как олеиновая или линолевая кислота. Указанные соединения как насыщенные (I), так и ненасыщенные (II) представляют собой класс биоразлагаемых (или "мягких") усилителей проникновения реагентов, которые благодаря своей структуре оказывают меньшее вредное или токсическое воздействие и тем не менее являются превосходными усилителями абсорбции через кожу или слизистые оболочки рта (особенно через десны).
В настоящем изобретении заявляется способ введения физиологически активных средств через поверхности тела, такие как кожа и слизистые оболочки, а также композиции для использования в указанном способе. В частности, изобретение относится к способу усиления проникновения физиологически активного средства сквозь хожу млекопитающего путем наружного применения физиологически активного средства в количестве, достаточном для достижения требуемого местного или системного воздействия, в сочетании с вышеописанным биоразлагаемым (или "мягким") усилителем проникновения реагента в количестве, достаточном для усиления проникновения физиологически активного средства. В изобретении заявляется также фармацевтическая композиция, включающая одно или несколько указанных соединений вместе с фармацевтически приемлемым носителем.
Краткое описание чертежей
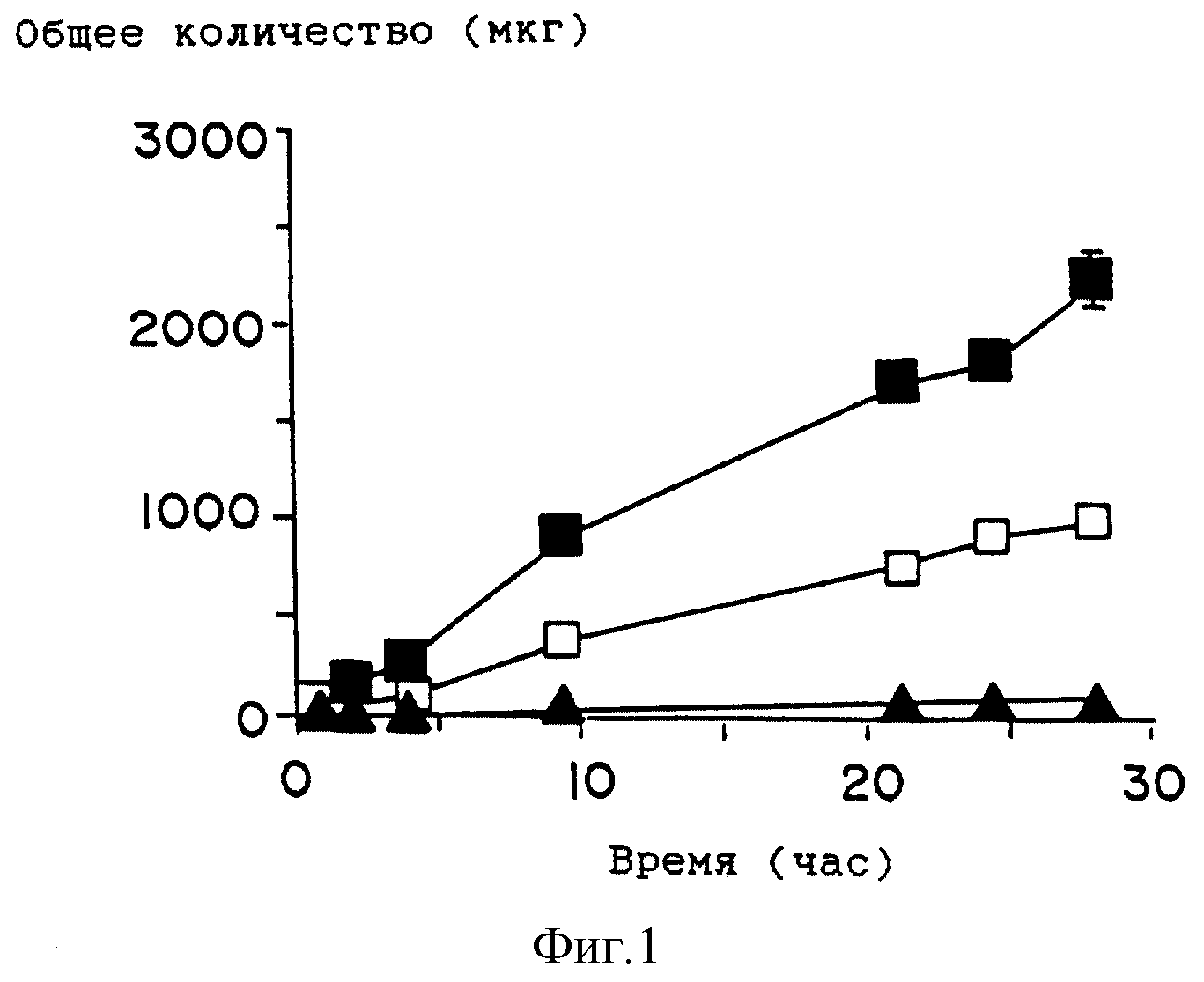
На фиг. 1 приведен график профиля проникновения лекарства (зависимость общего количества лекарства, обнаруженного в приемной ячейке диффузионного устройства с
вертикальными ячейками, от времени) для растворов, содержащих клонидин в присутствии усилителя по настоящему изобретению, додеканоата 1-(N, N-диметиламиио)-2-пропанола [DAIPD ■ )], известного
из области техники усилителя Azone ( □ ), и контрольных растворов, не содержащих усилитель (

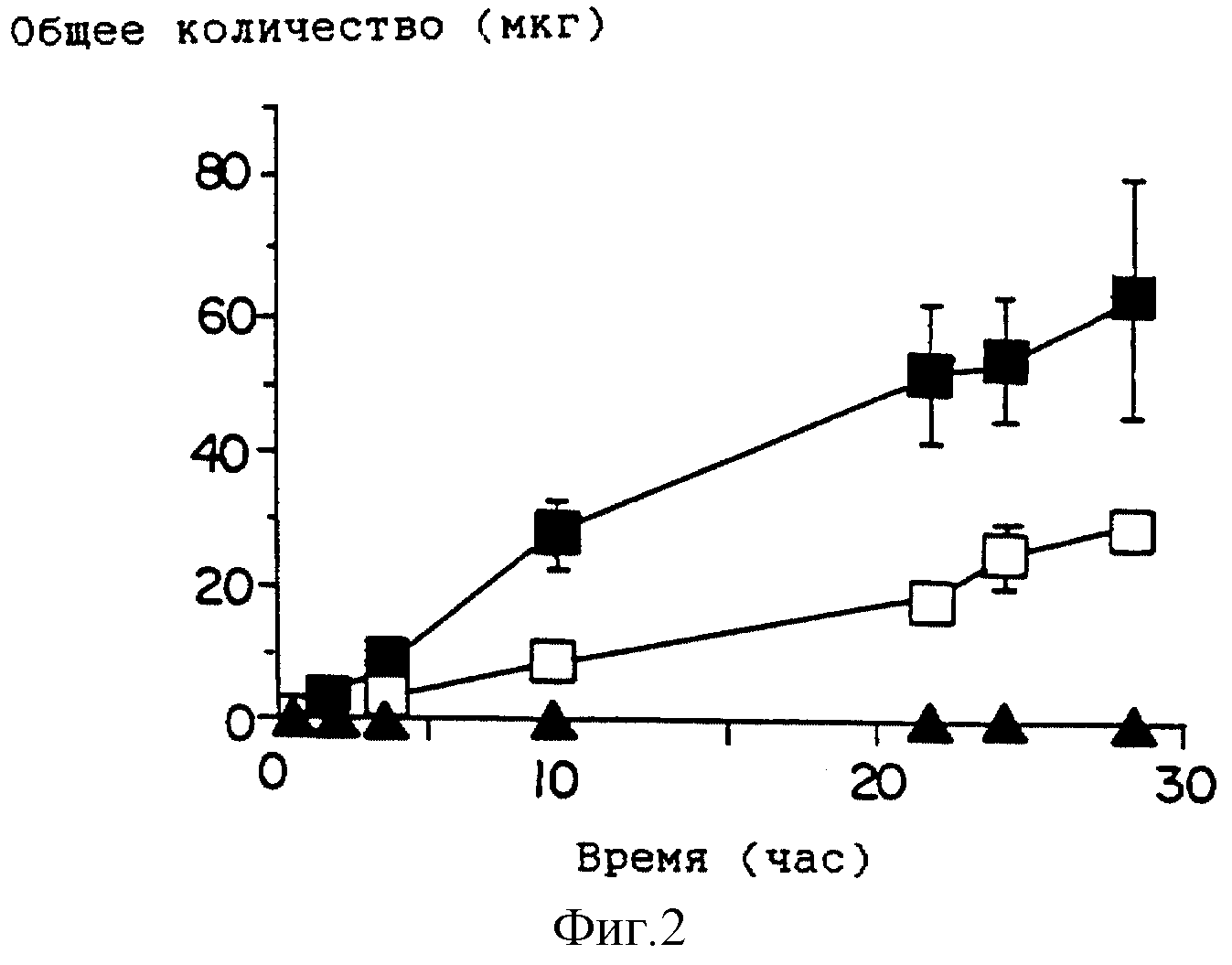
На фиг. 2 приведен график профиля проникновения лекарства для растворов, содержащих гидрокортизон в присутствии DAIPD ( ■ ), Azone ( □ ), и контрольных растворов (

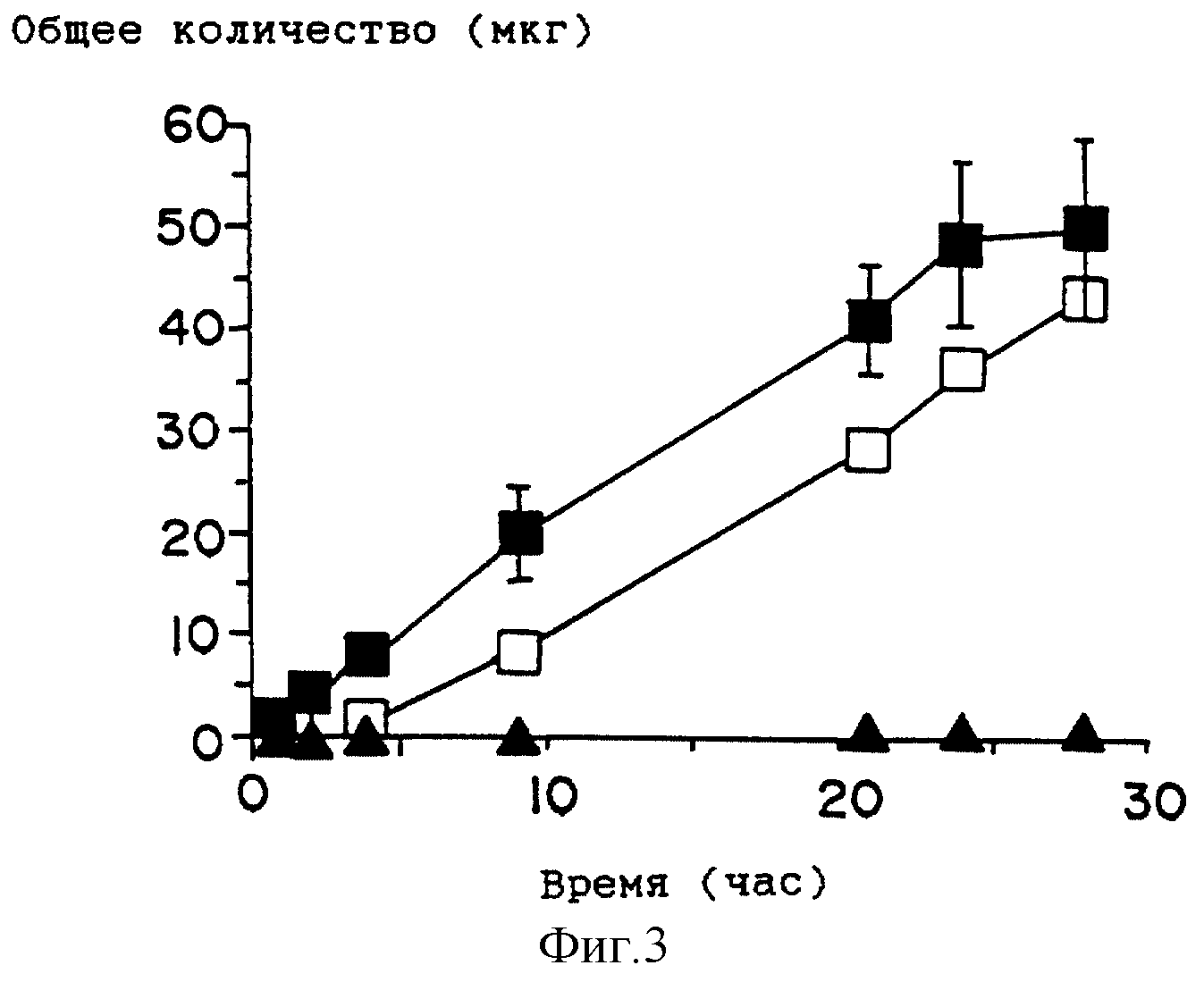
На фиг. 3 приведен график профиля проникновения лекарства для растворов, содержащих индометацин в присутствии DAIPD ( ■ ), Azone ( □ ), и контрольных растворов (

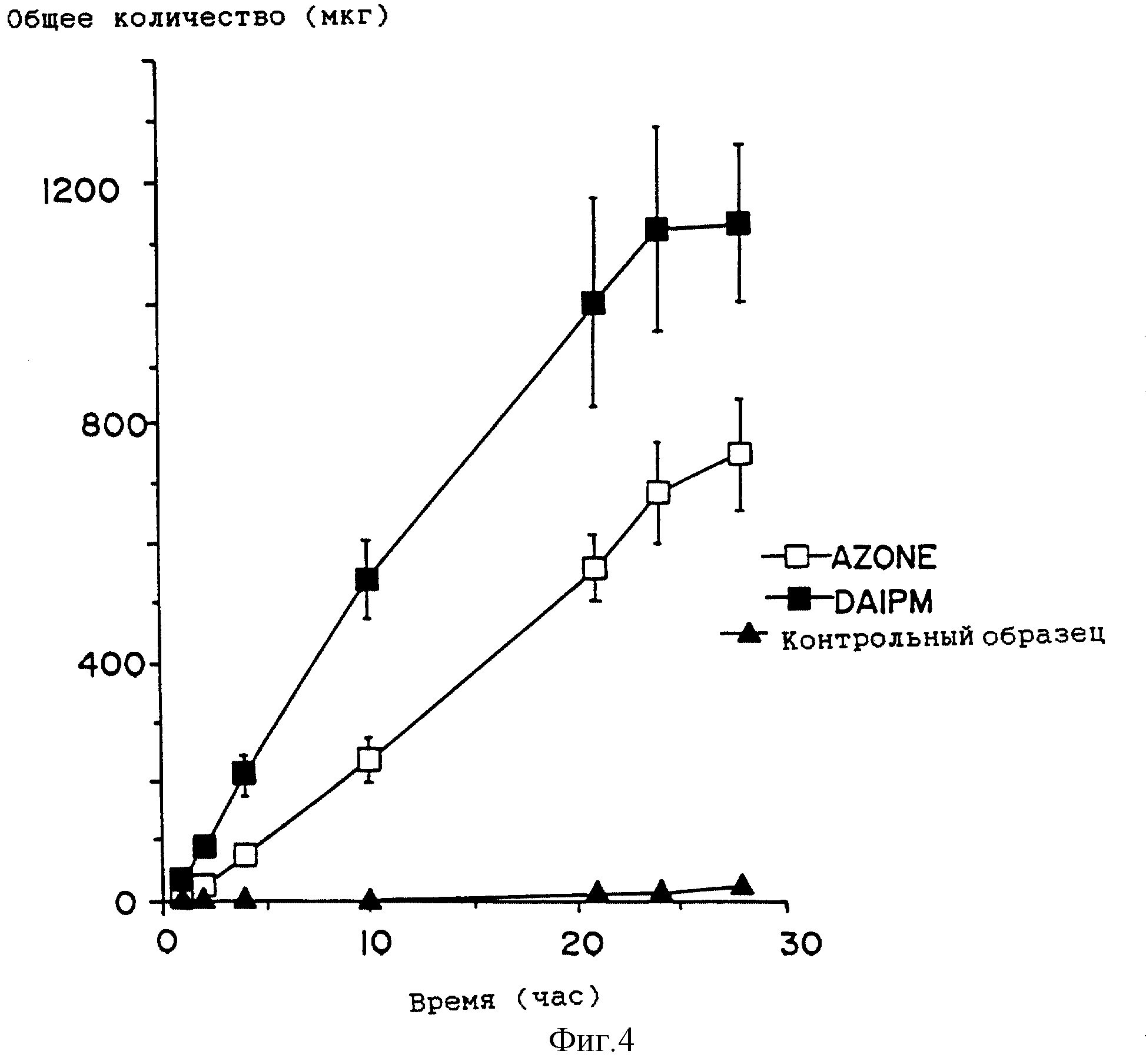
На фиг. 4 приведен график профиля проникновения лекарства для растворов, содержащих клонидин в присутствии другого усилителя по настоящему изобретению, миристата 1-(N,N-диметиламино)-2-пропанола (DAIPM ( ■ ), Azone ( □ ), и контрольных растворов (

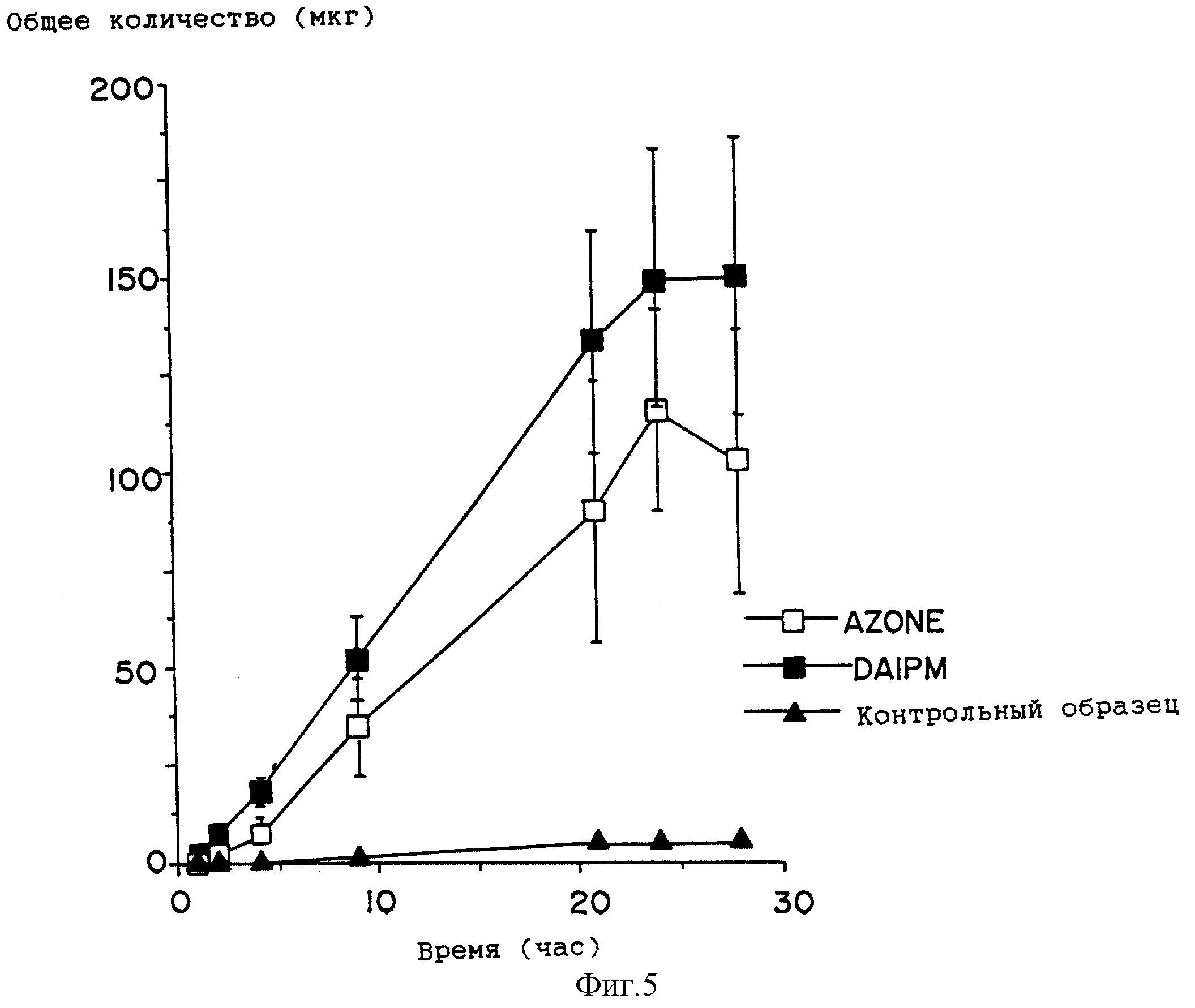
На фиг. 5 приведен график профиля проникновения лекарства для растворов, содержащих гидрокортизон в присутствии DAIPM ( ■ ), Azone ( □ ), и контрольных растворов (

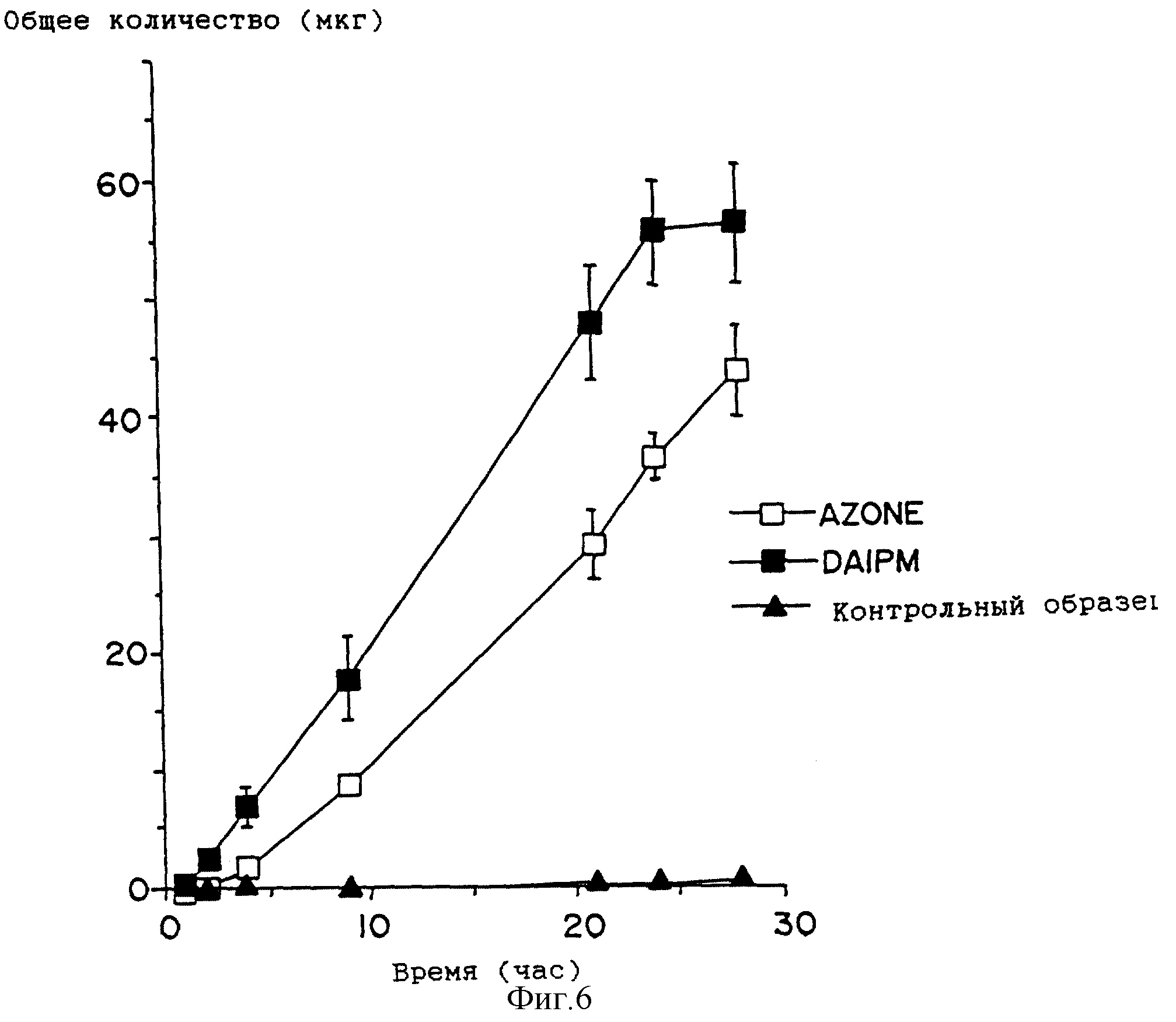
На фиг. 6 приведен график профиля проникновения лекарства для растворов, содержащих индометацин в присутствии DAIPM ( ■ ), Azone ( □ ), и контрольных растворов (

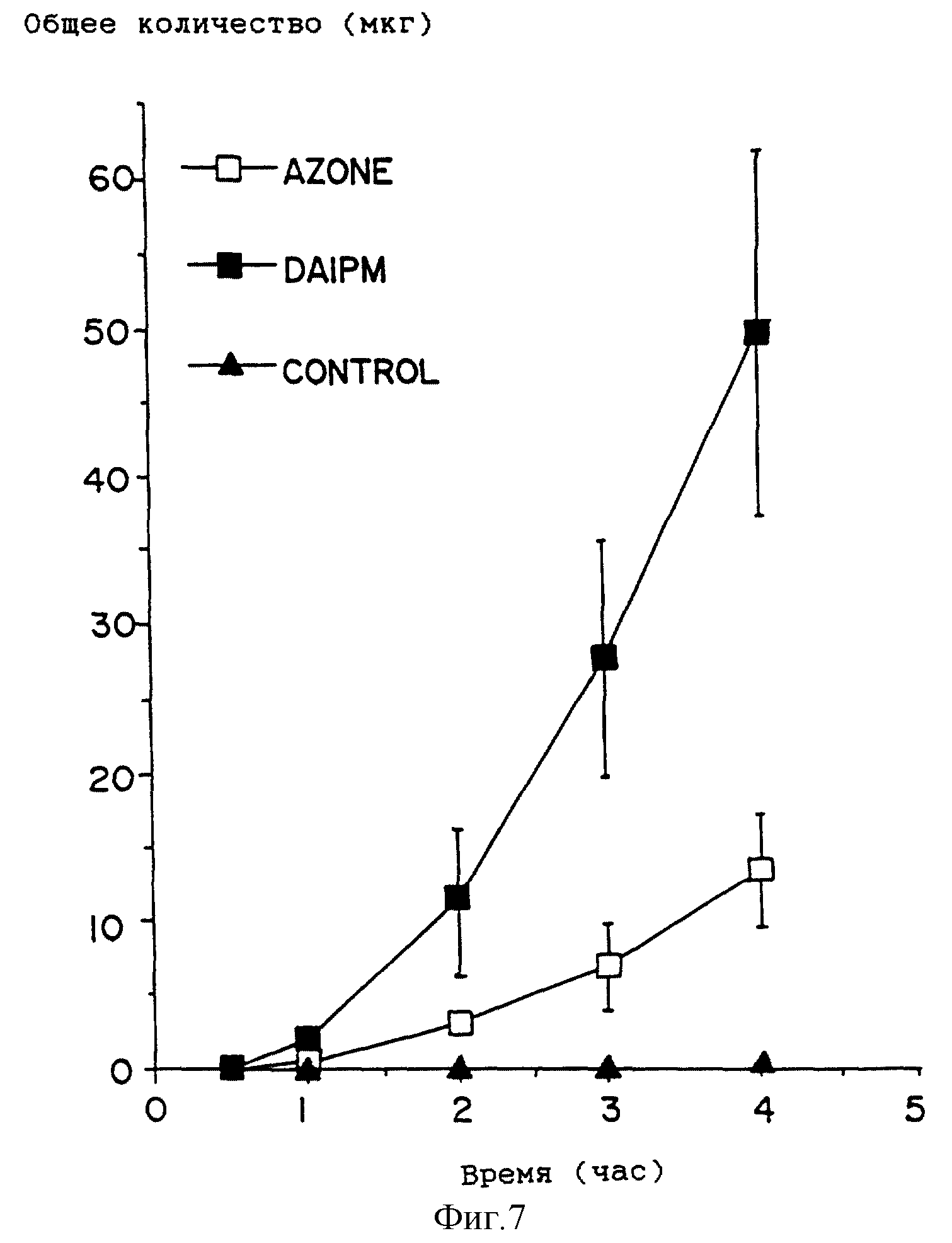
На фиг. 7 приведен график профиля проникновения лекарства для растворов, содержащих простагландин E в присутствии DAIPM ( ■ ), Azone ( □ ), и контрольных растворов (

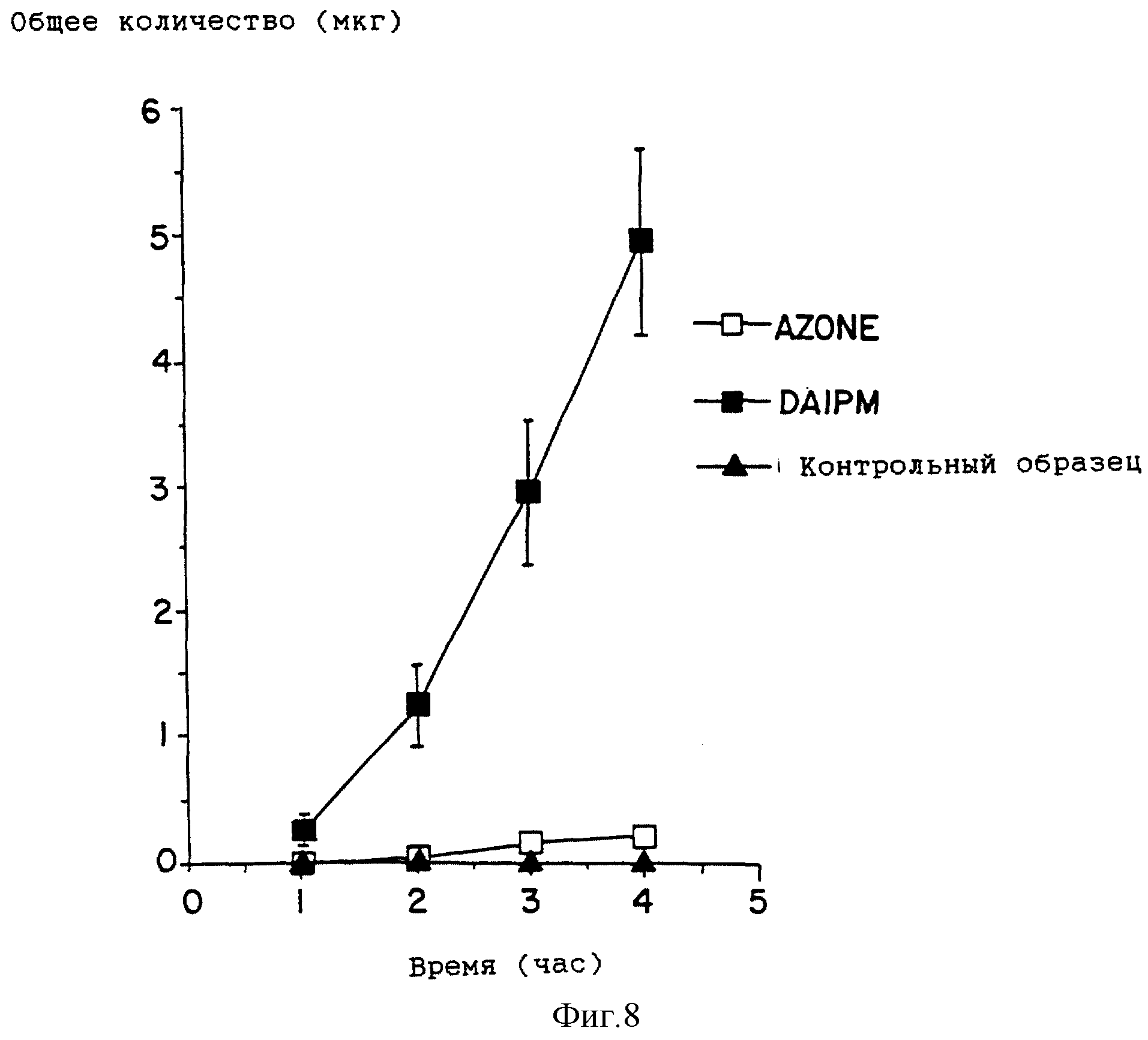
На фиг. 8 приведен график профиля проникновения лекарства для 45%-ных этанольных растворов, содержащих празозин после предварительной обработки DAIPM ( ■ ), Azone ( □ ), и контрольных растворов (

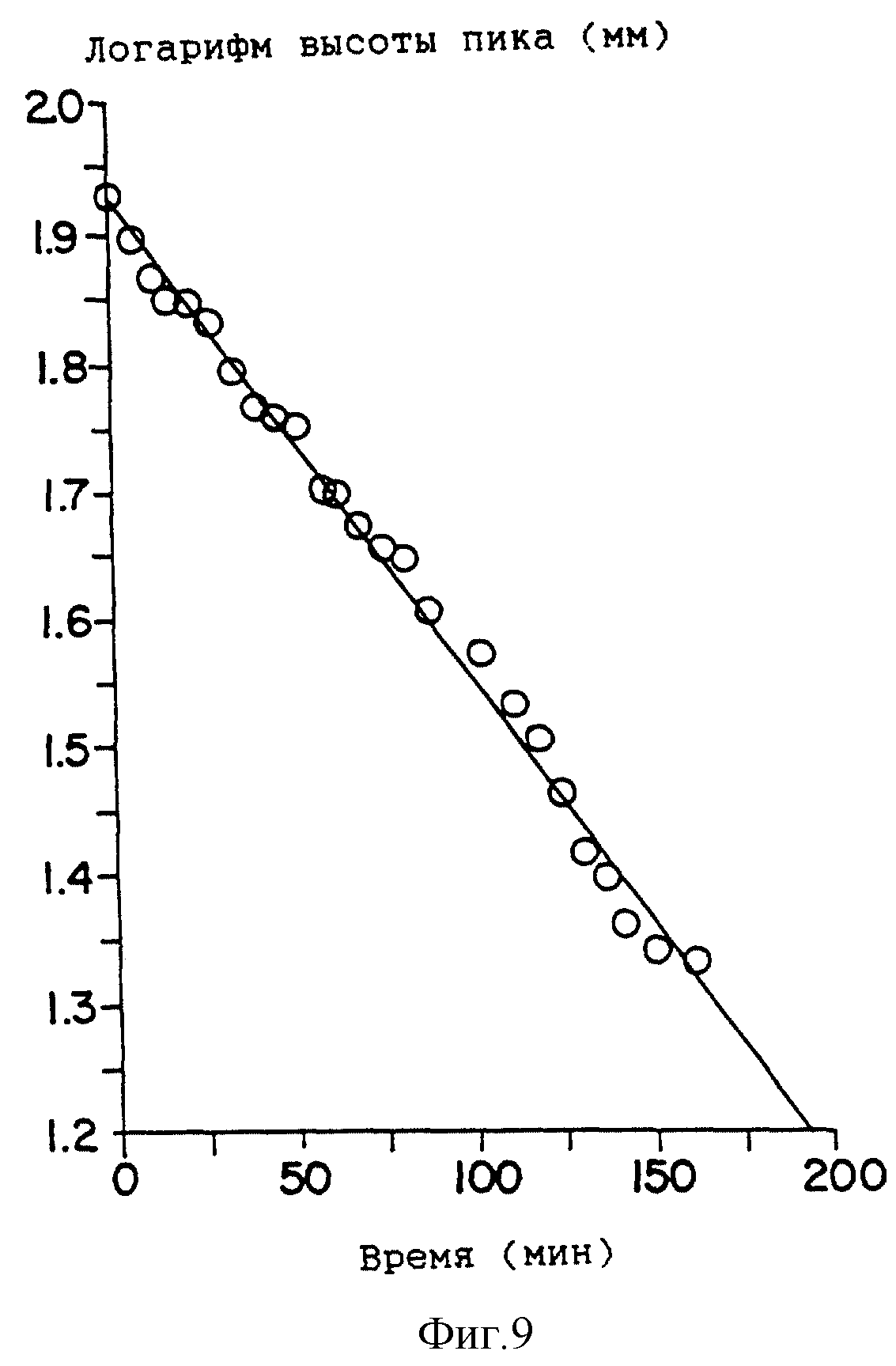
На фиг. 9 показана биоразлагаемость DAIPD в присутс твии свиной эстеразы при 32oC и pH 7,0.
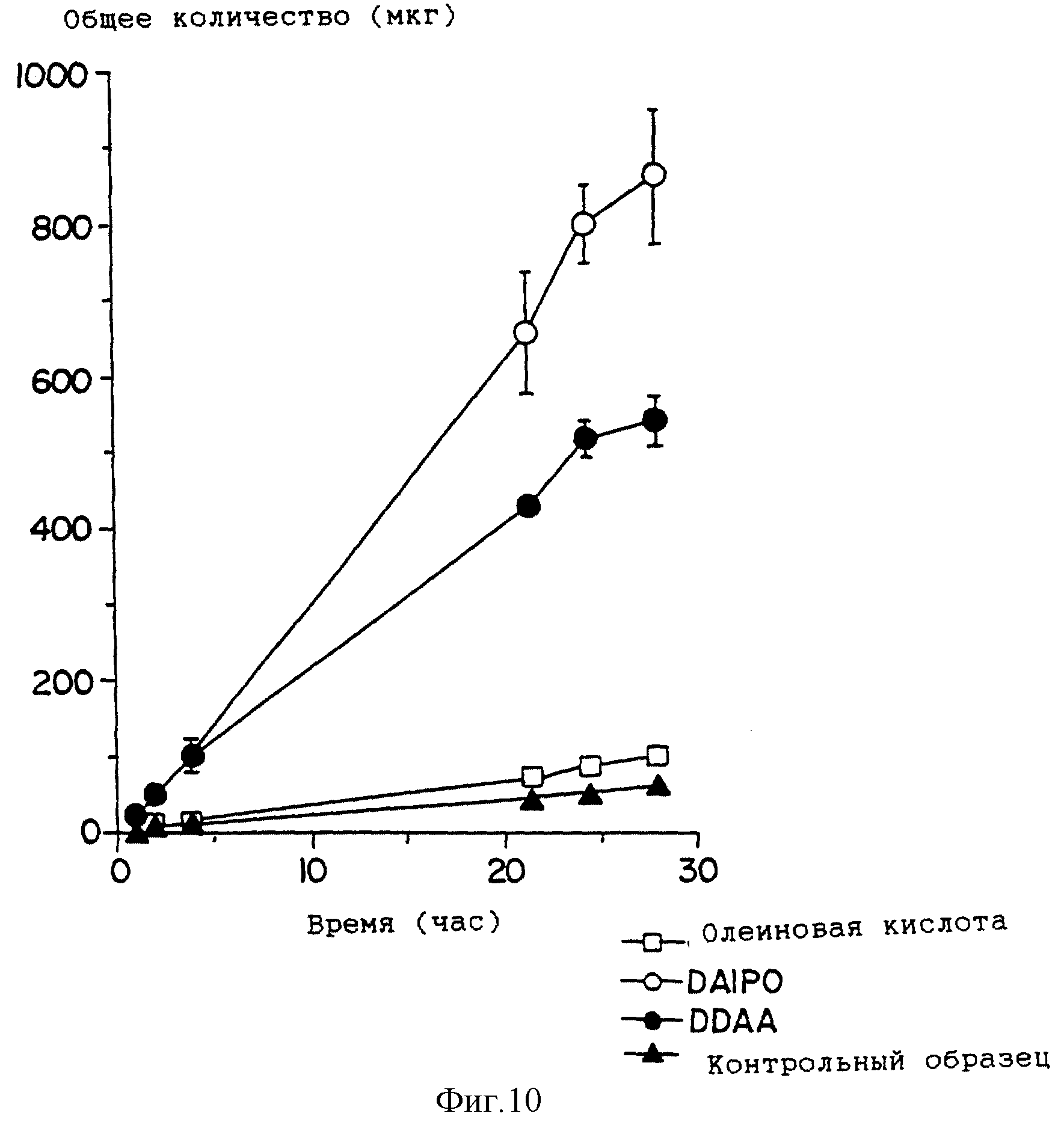
На фиг. 10 приведен график профиля проникновения лекарства для растворов, содержащих хлонидин в присутствии ненасыщенного эфира по настоящему изобретению, DAIPO ( · ) додецилового эфира N,N-диметиламиноацетата [DDAA ( □ )] олеиновой кислоты, и контрольных растворов (

Как ранее упоминалось, соединения по настоящему изобретению представляют собой сложные эфиры
длинноцепочечных кислот, которые могут быть насыщенными (формула I) или ненасыщенными (формула II), с аминоспиртами. В том случае, если длинноцепочечный фрагмент является насыщенным, соединения имеют
формулу:
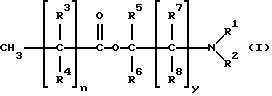
где n = 5-18 целое число; y = 0-5, целое число; R1 - R7, одинаковые или различные являются членами группы, включающей водород и (C1-C8)алкил, a R8 является членом группы, включающей водород, гидроксил и (C1-C8)алкил.
Примеры подходящих соединений формулы (I) по настоящему изобретению приведены в табл. 1.
R1 и R2 предпочтительно выбирают из группы, включающей водород, метил и этил, а еще более предпочтительно R1 и R2 обозначают метил. Если соединения формулы (I) имеет насыщенный длинноцепочечный фрагмент, то предпочтительным усилителем является додеканоат 1-(N, N-диметиламино)-2-пропанола [DAIPD, табл. 1 (5)] . Другим предпочтительным усилителем формулы (I) является миристат 1-(N,N-диметил амино)-2-пропанола [DAIPM, табл. 1 (12)].
Хотя алкильные радикалы могут быть с прямой или разветвленной цепью, в частности, метилом, этилом, пропилом, бутилом, пентилом, гексилом, гептилом или октилом, предпочтительно они являются радикалами с прямой цепью, поскольку, видимо, обеспечивают большее усиление.
Если соединения готовят из неочищенных длинноцепочечных
кислот, то они имеют формулу:
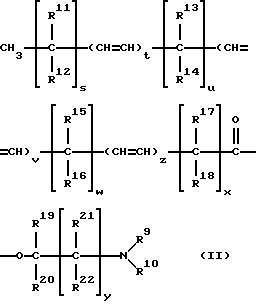
где t, v и z каждый обозначают целое число 0 до 1 включительно, s, u, w, и x каждый обозначают целое число от 0 до 12 включительно, при этом (s+ u + w + x) представляет собой целое число от 4 до 18 включительно, y = 0-5 целое число, a R9-R22 могут быть одинаковыми или отличаться друг от друга и являются членами группы, включающей водород к (C1- C8)алкил.
Для соединений формулы (II) R9 и R10 предпочтительно являются членами группы, включающей водород, метил этил, а более предпочтительно R9 и R10 обозначают метил. Наиболее предпочтительным соединением формулы (II) является олеат 1-(N,N-диметиламино)-2-пропанола (DAIPO), т.е. соединение формулы (I), у которого S и x = 7, t = 1, u, v, w, y и z = нулю, a R9, R10, R19 и R20 - метил.
Соединения формулы (I) или формулы (II) легко получают в одну стадию путем взаимодействия соответствующего аминоалканола с алканоил- или алкеноилгалогенидом, преимущественно хлоридом, в присутствии триэтиламина обычно в подходящем растворителе, таком как хлороформ. Реакцию можно проводить в присутствии растворителя без растворителя, поскольку использование растворителя не является обязательным.
Количество усилителя проникновения формулы (I), которое может использоваться по настоящему изобретению, представляет собой нетоксичное количество, эффективное для усиления абсорбции через кожу слизистые оболочки. В общем случае это количество составляет приблизительно от 0,4% до приблизительно 95% от общего количества композици. Предпочтительно используют приблизительно от 0,5 до приблизительно 40% от общего количества композиции.
Приведенные в настоящем описании соединения полезны для улучшения сквозьпокровной абсорбции или абсорбции через слизистые оболочки физиологически активных средств. Термин "схвозьпокровный" в контексте настоящего изобретения обозначает чрескожный или чрезпокровный, он означает проникновение веществ сквозь неповрежденную кожу. Хотя термин "абсорбция через слизистые оболочки" в общем случае относится к любым слизистым оболочкам тела, особый интерес представляет абсорбция сквозь слизистые оболочки ротовой полости. Так, в настоящем изобретении главным образом рассматривается щечная, подъязычная, десневая и небная абсорбция. В предпочтительном варианте осуществления настоящего изобретения данные усилители проникновения реагентов используют для улучшения абсорбции через те ткани рта, которые в наибольшей степени напоминают по своей клеточной структуре хожу, т.е. через десны и небо. Термин "физиологически активное средство" используется в настоящем описании для обозначения широкого класса полезных химических и терапевтических средств, включая физиологически активные стероиды, антибиотики, антигрибковые средства, антибактериальные средства, противоопухолевые средства, болеутоляющие средства и сочетания болеутоляющих средств, средства, снижающие аппетит, противоглистные средства, противоартритные средства, антиастические средства, противосудорожные средства, антидепрессанты, противодиабетическне средства, средства против поноса, антигистаминные препараты, противовоспалительные средства, средства от мигрени, средства для усиления двигательных функций, противорвотные средства, лекарства против болезни Паркинсона, противозудные средства, антипсихотические средства, жаропонижающие средства, спазмолитические средства, в том числе для желудочно-кишечного и мочеиспускательного тракта, антихолинергические средства, симпатомиметические средства, производные ксантина, сердечно-сосудистые препараты, в том числе блокеры кальциевого канала, бетаблокеры, средства против аритмии, средства, снижающие артериальное давление, мочегонные средства, сосудорасширяющие средства, в том числе общие, коронарные, периферические и церебральные, стимуляторы центральной нервной системы, препараты от кашля и простуды, противоотечные средства, гормоны, снотворные средства, иммунодепрессанты, миорелаксанты, парасимпатолические средства, парасимпатомиметические средства, психостимуляторы, седативные средства, транквилизаторы, аллергены, антигистаминные средства, антивоспалительные средства, физиологически активные пептиды и белки, средства защиты от ультрафиолетовых лучей, парфюмерные препараты, средства для отпугивания насекомых, средства для крашения волос и т.п. Термин "физиологически активный", который используется для характеристики рассматриваемых в настоящем описании средств, имеет широкое значение и охватывает не только средства, которые оказывают прямое фармакологическое воздействие на реципиента, но и средства, которые оказывают косвенное или наблюдаемое воздействие и полезны в области медицины, в частности красители или пигменты для тканей, применяемые в диагностических целях, средства защиты тканей от ультрафиолетовых лучей и т.п.
Например, типичными фунгицидными средствами и средствами, задерживающими рост грибков, являются тиабендазол, хлороксин, амфотерицин, кандицидин, фунгимицин, нистатин, хлордантоин, клотримазол, этонам нитрат, миконазол нитрат, пирролнитрин, салициловая кислота, фезатион, тиклатон, толнафтат, триацетин, цинк, пиритион и натриевая соль пиритиона.
Стероиды включают кортизон, кортодоксон, фторацетонид, флудрокортизон, дифторзон диацетат, флурандренодон ацетонид, медризон, амцинафел, амцинафид, бетаметазон и его сложные эфиры, хлоропреднизон, клоркортелон, дессинолон, дезонид, дексаметазон, дихлоризон, дифлупреднат, флуклоронид, флуметазон, флунизолид, флуоционид, флутортолон, фторметалон, флуперолон, флупреднизолон, мепреднизон, метилмепреднизон, параметазон, преднизолон и преднизон.
Антибактериальные средства включают сульфонамиды, пенициллины, цефалоспорины, пенициллиназу, эритромицины, линомицины, ванкомицины, тетрациклины, хлорамфениколы, стрептомицины и т.п. Специфическими примерами антибактериальных средств являются эритромицин, этилкарбонат эритромицина, эритромицин эстолат, эритромицин глюценат, эритромицин этилсукцинат, эритромицин лактобионат, линкомицин, клиндамицин, тетрациклин, хлортетрациклин, демеклоциклин, доксициклин, метациклин, окситетрациклин, миноциклин и т.п.
Пептиды и белки включают, в частности, пептиды от малого до среднего размера, в частности инсулин, вазопрессин, окситоцин и гормон роста человека.
Другие средства включают иододеоксиуридин, подофиллин, теофиллин, изопротеренол, триамицинолон ацетонид, гидрокортизон, индометацин, фенилбутазон, п-аминобензойная кислота, аминопропионитрил и пеницилламин.
Приведенный выше список ни в коей мере не является исчерпывающим, и в способе по настоящему изобретению может использоваться любое физиологически активное средство.
Важным преимуществом настоящего изобретения является то, что улучшается абсорбция и полярных и неполярных лекарств. Полярные биологически активные средства включают различные терапевтические средства, такие как ксантины, триамтерен и теофиллин, противоопухолевые средства, 5-фторуридиндеоксирибозид, 6-меркаптопуриндеоксирибозид, видарабин, наркотические аналгетики, гидроморфон, циклазин, пентазоцин, бупоморфин, соединения с органическими анионами, гепарин, простагландины и простагландиноподобные соединения, натриевая соль кломоина, камбеноксолон, полигидроксильные соединения, допамин, добутамин, L-допа, а-метилдопа, полипептиды, антагонисты ангиотензина, брадикинин, инсулин, адренокортикотропный гормон, энкефалины, эндорфины, соматостатин, секретин и различные соединения, такие как тетрациклины, бромокриптин, лижокаин, циметидин или родственные соединения. Количество указанных полярных биологически активных средств, необходимое для приготовления лекарственной формы, может варьироваться в широком диапазоне, однако обычно определяется количеством, необходимым для получения терапевтически эффективной лекарственной формы.
Средства, которые обычно применяются в виде глазных капель, капель в уши или капель в нос, или в виде препаратов для введения через ротовую полость, более эффективны, если они применяются вместе с усилителями проникновения реагентов по настоящему изобретению.
Как указано выше, средства, которые используются в диагностике, могут быть более эффективными, если их растворяют в одном из носителей по настоящему изобретению. Тест по пятнам для диагностики аллергии можно быстро провести, не царапая хожу и не покрывая поверхность, которую подвергают действию аллергена, если аллергены применяют совместно с усилителями по настоящему изобретению.
Настоящее изобретение также полезно при местном применении косметических и эстетических средств. Например, такие соединения как меланоцитстимулирующий гормон или дигидроксиацетон и т.п., более эффективны при нанесении на хожу для стимулировании загара, если они используются совместно с усилителями по настоящему изобретению. Средство наносится на кожу быстрее и в большем количестве, если его применяют в соответствии с настоящим изобретением. Красители для волос также проникают полнее и эффективнее, если их растворяют в носителях по настоящему изобретению.
Хотя выше в описании рассматривается название физиологически активного средства совместно с усилителем проникновения реагентов, усилитель проникновения может, если необходимо, наноситься перед или после применения физиологически активного средства.
Подразумевается, что физиологически активные средства, которые используют в соответствии с настоящим изобретением, применяют как для системного, так и для местного применения.
Лекарственные формы для местного применения на кожу или слизистые оболочки человека и животных включают кремы, лосьоны, гели, мази, суппозитории, распыляемые вещества, например распыляемые вещества для носа, аэрозоли, трансбукальные и подъязычные таблетки, десенные и щечные бляшки или одно из разнообразных чрескожных медицинских средств для применения при продолжительном назначении системно активных лекарств путем абсорбции через кожу, слизистые оболочки рта или другие мембраны. См., например, один или несколько патентов США с номерами 3598122, 3598123, 3731683, 3742951, 3814097, 3921636, 3971376, 3993072, 3993073, 3996934, 4031894, 4060084, 4069307, 4201211, 4230105, 4292299, 4292303 и 4077407. В указанных патентах приводятся и разнообразные конкретные системно активные средства, которые также могут быть полезны при чрескожной доставке лекарств, и описания этих патентов приводятся здесь для справок.
В указанные композиции для получения лекарственной формы, соответствующей конкретному способу ее назначения, могут включаться обычные фармацевтические составные средства, разбавители или носители. Количество и типы разбавителя или носителя должны, конечно, определяться с учетом совместимости с соединением по настоящему изобретению. Например, для поддержания нужной концентрации реагента в растворе суспензии может потребоваться сорастворитель или поверхностно-активное вещество.
Для составов, распыляемых через нос и другие слизистые оболочки разбавителем предпочтительно служит солевой физиологический раствор, В указанных дозировочных формах может в различных концентрациях, например, приблизительно от 2% до приблизительно 75% вес. или более, присутствовать усилитель по настоящему изобретению.
Лосьоны и гели, мази или кремы могут содержать обычные ингредиенты, составляющие основу композиции, например цетиловый спирт, или эмульгатор, такой как лаурилсульфат, и воду. Другой тип основы получают, смешивая равные количества стеариновой кислоты, цетилового спирта, триэтаноламина и моностеарата глицерина с водой. В других типах основ могут использоваться полиэтиленгликоли, имеющие разную вязкость в зависимости от требуемой консистенции.
Суппозитории можно приготовить из полиэтиленгликоля 4000 с большой вязкостью, воды и усилителя проникновения реагента.
Типичными инертными соединениями, которые могут включаться в вышеуказанные дозировочные формы, являются обычные образующие композицию вещества, такие как, например, ацетон, изо-пропиловый спирт, галогенсодержащие углеводороды (фреоны), этиловый спирт, поливинилпирролидон, пропиленгликоль, отдушки, гелеобразующие соединения, такие как "Carbopol", минеральные масла, стеариловый спирт, стеариновая кислота, спермацеты, моноолеат сорбита, "Polysorbates","Tweens", сорбит, метилцелюлоза и т.п. Композиции по настоящему изобретению смешивают с любыми нетоксичными фармацевтически приемлемыми инертными носителями. Подобные носители хорошо известны специалистам в области приготовления фармацевтических композиций. Неспециалистов отсылаем к справочнику "Remington's Pharmaceutical Sciences", 18 th Edition, 1990 (Ed. Alfonso R.Jenaro), Mack Publiscing Company, Easton, Pa.
Любой тип систем для чрескожной доставки лекарств пригоден для осуществления настоящего изобретения, например такие системы как чрескожный пластырь, трансбуккальная таблетка и т.п. Разнообразные системы чрескожной доставки лекарств описываются в патенте США 4624655, который приводится здесь для справок.
Количество композиции и, таким образом, количество содержащегося в ней назначаемого физиологически активного средства представляет собой эффективное количество, необходимое для получения результата, ожидаемого от применения этой композиции. Оно, конечно, определяется практикующим врачом на основании собственного опыта. Благодаря достигаемой повышенной активности дозировку физиологически активного средства можно зачастую уменьшить по сравнению с обычно применяемой дозировкой. В соответствии с обычной практикой при составлении композиции вначале устанавливают дозировку, близкую к нижней границе полезного диапазона доз конкретного средства, а затем дозировку увеличивают в зависимости от наблюдаемой ответной реакции, и это является обычной процедурой, которую используют врачи.
Концентрация физиологически активного средства в различных дозировочных формах, конечно, соответствует обычно применяемой концентрации для конкретного средства в обычных составах для получения ожидаемого результата для данного способа назначения лекарства. Желаемый результат оказывает влияние как на количество физиологически активного средства, так и на количество усилителя проникновения лекарственного средства. Если необходимо добиться более локализованного воздействия как, например, при лечении поверхностных инфекций с помощью антибактериальных средств, то можно использовать меньшие количества физиологически активных средств и меньшие концентрации усилителя проникновения лекарственного средства. В том случае, если необходимо более глубокое проникновение лекарства, как в случае местной анестезии, для обеспечения соответствующего проникновения может оказаться желательным применить большие концентрации усилителя. Если для местного нанесения необходимы общие системные концентрации реагента, то обычно требуются еще большие концентрации усилителя, а количество лекарственного средства, например, стероида, включаемого в композицию, может быть достаточным для того, чтобы обеспечить нужный уровень содержания средства в крови.
Описание вариантов осуществления
изобретения
С целью дальнейшего пояснения настоящего изобретения и предоставляемых им преимуществ, приводятся следующие конкретные примеры, при этом следует понимать, что эти примеры
предназначены лишь для иллюстрации и ни в коем случае не ограничивают настоящее изобретение.
Пример 1
Способность додеканоата 1-(N, N-диметилaминo)-2 пропанола (DAIPD)
усиливать проникновение лекарств
Способность DAIPD усиливать проникновение лекарственного средства сравнивают с аналогичной способностью Azone, который берут в качестве типичного усилителя,
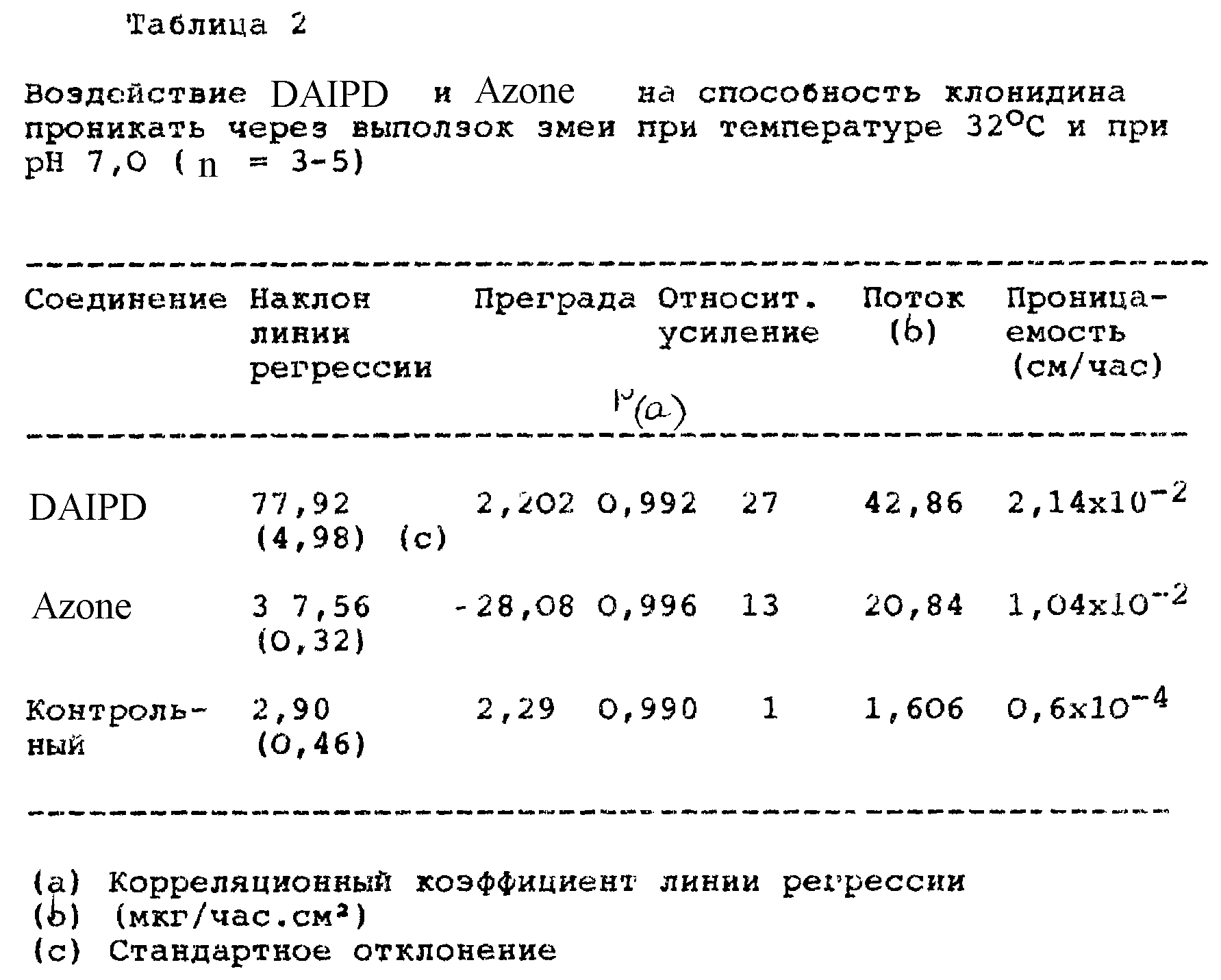
повышать проникновение лекарственного средства, при этом в качестве модельной мембраны используют сброшенную змеиную кожу (выползок змеи). Профили проникновения клонидина, гидрокортизона и
индометацина в буферном растворе с pH 7,0 и в присутствии DAIPD и Azone при 32oC приведены на фиг. 1 - фиг. 3 и в табл. 2 - табл. 4. Проникающие вещества подобраны таким образом, чтобы
получились примеры лекарств основного типа (клонидин), лекарств нейтрального типа (гидрокортизон) и лекарств кислого типа (индометацин).
К 20,6 г (0,2 М),1-(N, N-диметиламино)-2-пропанола в 250 мл хлороформа в присутствии триэтиламина (30 мл), добавляют порциями 43,2 г (0,2 М) лауроилхлорида и перемешивают при комнатной температуре в течение 24 ч. Остаток отфильтровывают, реакционную смесь трижды промывают водой (каждый раз по 250 мл) и органическую фазу сушат над безводным сульфатом магния. Растворитель упаривают в вакууме и маслянистый остаток растворяют в атилацетате и очищают колоночной хроматографией, используя тот же растворитель. За ходом реакции следят с помощью тонкослойной хроматографии. В качестве растворителя для тонкослойной хроматографии используют атилацетат. Визуализацию проводят с помощью паров иода. Выход составляет 95%. Значения Rf составляют 0,21 (этилацетат) и 0,74 (хлороформ; метанол, 1:1). Регистрируют также ИК-спектр, ЯМР-спектр и масс-спектр (электронная ионизация) ИК-спектр): γ 2920, 2840 (C-H), 1730 (C= O), 1040 (C-O-C) см-1.1H ЯМР (хлороформ-d): δ 0,88 (3H, триплет, CH3), 1,21-1,23 (3H, дублет,
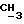
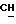
Липофильность, выражаемую величиной Rm, определяют в соответствии с методикой приведенной в публикации J.K.Seydel and K.J.Schaper, "Chemische Struktur und biologische Aktivitaet von Wirkstoffen", Verlag Chemie, Weinheim New-York, 1979, стр. 257-259. Пластинки пропитывают 5%-ным раствором парафина в диэтиловым эфире. В качестве проявителя используют смесь ацетона и фосфатного буфера (0,01 М, pH 7,0) (4:1). Величину Rm вычисляют по следующему уравнению Rm =log[(1/Rf )-1].
Видимые значения рКа определяют титрованием 0,25 мМ раствора усилителя с помощью водного 0,1 N раствора соляной кислоты в 50 мл смеси ацетонитрила и воды (1: 1). Их рассчитывают в соответствии с методикой, опубликованной A. Albert and E.P.Sergeant, "The Determination of Ionization Constants", Chapman and Hall, London, 1971, pp. 39-40.
Выползок змеи подготавливают, как описано ранее (в публикации S.Buyuktimkin, N. Buyuktimkin and J.H.Rytting. "Synthesis and enhancing effect of dodecyl 2-(N, N-dimethylamino) propionate on the transepidermal delivery of indomethacin, clonidine and hydrocortisone", Pharm. Res., 10 1632-1637, 1993, и в патентах США N 4980378 и N 5082866, которые приводятся в качестве ссылок. Выползок змеи хранят при температуре минус 20oC. Перед проведением эксперимента змеиной коже дают нагреться до комнатной температуры по крайней мере за 12 ч до использования. С целью уменьшения разброса полученных результатов, для каждой серии экспериментов используют кусочки, отрезанные от одного целого куска змеинoй кожи.
Индометацин, клонидин и гидрокортизон анализируют методом жидкостной хроматографии высокого давления, как это описано ранее (см. ранее Buyuktimkin et al., 1993).
Кусочки выползка змеи (приблизительно 3 х 3 см) предварительно за два часа до эксперимента обрабатывают 15 мкл усилителя (разделяют на три порции по 5 мкл). После размещения кожи в верхней части приемной ячейки Франца, заполненной фосфатным буферным раствором с pH 7,0 (0,1 поверх приемной ячейки размещают подающую ячейку. В подающую ячейку помещают аликвоту в количестве 0,5 мл суспензии гидрокортизона индометацина, полученную суспендированием, соответственно, 50 мг или 25 мг лекарства в 25 мл того же самого буфера, и перемешиванием при 32oC в течение 24 ч, или раствора клонидина (2%) в том же самом буфере. Раствор в приемном отделении перемешивают с помощью магнитной мешалки. Через определенные промежутки времени из приемной ячейки берут пробы и анализируют их методом жидкостной хроматографии высокого давления. Площадь поверхности змеиной кожи составляет 1,8 см2, а объем приемной ячейки составляет 8-10 мл.
Наиболее заметный эффект усиления проникновения лекарств по сравнению с Azone наблюдается для клонидина и гидрокортизона и приблизительно соответствует улучшению проницаемости в два раза. По сравнению с контрольными образцами наибольшее усиление наблюдается для DAIPD в случае гидрокортизона. В системе н-октанол/буфер с pH 7,0 коэффициенты распределения лекарства, выраженные в виде log P, составляет 0,4, 0,8 и 1,2 для клонидина, гидрокортизона и индометацина, соответственно. Индометацин, который является наиболее липофильным из трех рассмотренных лекарств, показывает усиление, приблизительно равное усилению, которое оказывает Azone. Ожидалось, что для индометацина, как более липофильного соединения, эффект проникновения через кожу будет выражен ярче. Однако ожидаемый порядок не наблюдается в настоящем исследовании. Эти наблюдения заставляют предположить, что помимо липофильности определенную роль могут играть другие факторы, такие как взаимодействия лекарство/усилитель и лекарство/кожа.
Профиль проникновения изученных в настоящем изобретении проникающих лекарственных средств показывает время задержки с последующим линейным непрерывным потоком. Времена задержки рассчитывают по известным методикам, полученные значения приведены в табл. 5.
Изучение одного лишь времени задержки не позволяет найти причину относительно низкого усиления для индометацина. Время задержки для клонидина в присутствии DAIPD не обнаружено. Для гидрокортизона время задержки возрастает до 45 мин, в то время как для индометацина оно составляет приблизительно 24 мин. Предварительная обработка с помощью Azone также показывает аналогичную тенденцию, подтверждая тот факт, что помимо лопофильности на поток указанных лекарств оказывают влияние и другие механизмы.
Анализ данных, представленных на фиг. 1 - фиг. 3 и в табл. 2-5, показывает, что соединения по настоящему изобретению представляют собой эффективные усилители проникновения местного действия и они полезны для улучшения чрескожной доставки лекарств, при этом они более эффективны, чем обычные усилители, известные из области техники.
Пример 2
Способность миристата 1-(N,N-диметиламино)-2-пропанола (DAIPM) усиливать проникновение лекарств.
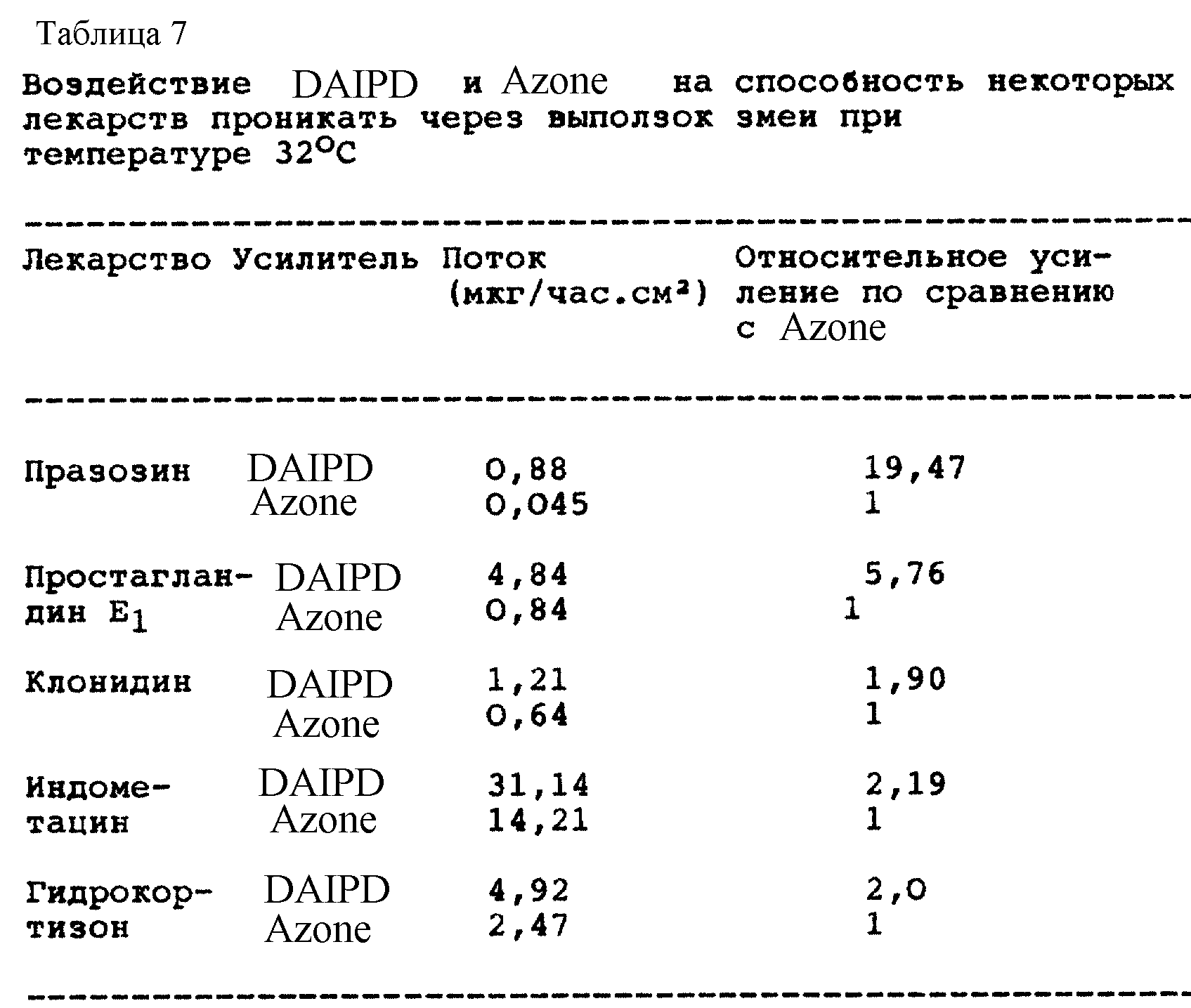
Способность миристата 1-(N,N-диметиламино)-2-пропанола (DAIPM) усиливать проникновение лекарственного средства изучат, проводя серии экспериментов, аналогичные описанным в примере 1. Результаты представлены на фиг. 4 - фиг. 8 и в табл. 7.
Как и DAIPD, DAIPM приблизительно вдвое увеличивает поток, по сравнению с Azone, для клонидина (фиг. 4, сравните табл. 2 и табл. 7) и гидрокортизона (фиг. 5, сравните табл. 3 и табл. 7). Однако DAIPM показывает лучшие свойства, по сравнению с DAIPD, и приблизительно вдвое, по сравнению с Azone, улучшает проникающую способность индометацина (фиг. 6, сравните табл. 4 и табл. 7).
DAIPM приводит к еще большему улучшению по сравнению с Azone в экспериментах с двумя другими лекарствами. DAIPM усиливает проникновение простагландина E1 (фиг. 7) почти в четыре раза по сравнению с Azone (табл. 7). Почти 20-кратное улучшение достигнуто в экспериментах с празозином (фиг. 8, табл. 7).
Пример 3
Биоразлагаемость додеканоата 1-(N,N-иметиламино)-2-пропанола (DAIPD).
Аликвоту 0,1 мл эстеразы свиньи (235 единиц на мг белка) разбавляют до объема 100 мл с помощью фосфатного буфера с pH 7,0. Раствор усилителя готовят, растворяя приблизительно 12 мг (приблизительно 0,045 ммоль) усилителя в 10 мл ацетонитрила. Аликвоту 100 мкл полученного раствора переносят в 10 мл колбу для титрования. Добавляют 9,8 мл буферного раствора с pH 7,0 и 100 мкл разбавленного раствора эстеразы. Смесь перемешивают при 32oC на водяной бане. Исчезновение пика усилителя контролируют методом жидкостной хроматографии высокого давления. Исчезает полоса поглощения на длине волны 204 нм. Система растворителя представляет собой смесь ацетонитрила и 0,02 М водного раствора гексансульфоната натрия (7: 4) со скоростью подачи раствора 0,9 мл/мин. Время удерживания DAIPD составляет 3,95 мин. Кинетические исследования проводят в три серии экспериментов. Полученные результаты приведены на фиг. 9.
Как сообщается (B. T.Nghien and T.Higuchi, "Esterase activity in snake skin", Int. J. Pharm. 44: 125-130, 1988) активность эстеразы обнаружена в выползке змеи. Для того, чтобы подтвердить биоразлагаемость DAIPD изучают его фрагментацию в присутствии эстеразы свиньи. Зависимость логарифма высоты пика от времени показывает, что кинетика деградации соответствует псевдопервому порядку, при этом Kнабл. = 0,0087 мин-1 t1/2 = 79,5 мин (фиг. 9). Таким образом, подтверждается катализируемая эстеразой биораэлагаемость усилителя. Hirvoven et al. (см. ниже) показали, что чрескожная доставка пропанолола после предварительной обработки додецил-N,N-диметиламиноацетатом (DDAA), биоразлагаемым усилителем, который описан в патентах США N 4980378 и N 5082866, больше не усиливается уже через четыре дня, в то время как усиление под действием А.о.е все еще существует по прошествии недели. (J.Hirvonen, P. Paronen and A.Urtti, "Reversible enhancement of transdermal propanolol by dodecyl N,N-dimethylamino acetate", 18 th International Symposium on Coontrolled Release of Bioactive Materials, July 8-11, 1991, Amsterdam, p. 31. ). Таким образом, если они существуют, то токсические и раздражающие воздействия биоразлагаемых соединений могут быть значительно снижены, а период активности может быть ограничен.
Таким образом, результаты показывают, что DAIPD является биоразлагаемым усилителем, который является более эффективным, чем Azone. DAIPD потенциально может быть полезен при усилении проникновения нескольких различных классов лекарств.
Пример 4
Синтез олеата 1-(N,N-диметиламино)-2-пропанола (DAIPO)
Олеат-(N, N-диметиламино)-2-пропанола (DAIPO) является примером
соединения формулы (II).
К 10,3 г (0,1 моль 1-(N,N- диметиламино)-2-пропанола в 250 мл хлороформа, содержащего триэтиламин (15 мл), порциями добавляют 50 г (0,1 моль) олеилхлорида (60%) и перемешивают при комнатной температуре в течение 24 ч.
Остаток отфильтровывают, реакционную смесь трижды промывают водой (каждый раз по 250 мл) и органическую фазу сушат над безводным сульфатом магния. Растворитель упаривают в вакууме и маслянистый остаток растворяют в этилацетате и очищают колоночной хроматографией на силикагале, используя тот же растворитель. Процедуру проводят в темноте, а соединения хранят под азотом. За ходом реакции следят с помощью тонкослойной хроматографии. В качестве растворителя для тонкослойной хроматографии используют этилацетат. Визуализацию проводят с помощью паров иода. Выход составляет 60%. Значения Rf составляют 0,24 (этилацетат). ИК (спектр) (CHCl3) γ 2925, 2845 (C-H),1730 (C= O), 1090 (C-O-C) см-1,1H ЯМР (хлороформ-d): δ 0,88 (3H, триплет, CH3), 1,21-1,23 (3H, дублет,
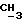
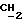
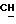
На фиг. 10 приведены данные по усилению в виде профилей проникновения клонидина с ненасыщенным эфиром формулы (II), DAIPO, в сравнении с олеиновой кислотой, с DDAA и с контрольным образцом, полученные для методик проникновения через кожу в модели, рассмотренной в примере 1. Эти данные показывают, что указанные соединения в общем случае потенциально являются более сильными усилителями абсорбции. молекул с основными свойствами, чем соединения, приведенные в патентах США N 4980378 и N 5082866, и они эффективны при усилении проникновения нейтральных и кислых реагентов.
Таким образом, в изобретении достигнуты все ранее поставленные цели.
Приведенное описание и примеры даны для иллюстрации и не ограничивают настоящее изобретение. Возможны и другие варианты, соответствующие сущности и объему притязаний по настоящему изобретению, и они вполне очевидны для специалистов в данной области техники.
Реферат
Способ усиления проникновения фармакологически активного средства включает местное нанесение на кожу или слизистую оболочку фармакологически активного средства и соединения для усиления его проникновения. Усилители проникновения являются биоразлагаемыми веществами и представляют собой новую группу сложных эфиров длинноцепочечных алифатических кислот с N,N-дизамещенными аминоспиртами. Наиболее предпочтительными усилителями проникновения являются додеканоат 1-(N,N-диметиламино)-2-пропанола, миристат 1-(N, N-диметиламино)-2-пропанола и олеат 1-(N,N-диметиламино)-2-пропанола. Новые усилители проникновения повышают проницаемость разделительных мембран и увеличивают поглощение фармакологически активных соединений кожей и слизистыми оболочками. 4 с. и 18 з.п.ф-лы, 10 ил., 7 табл.
Формула
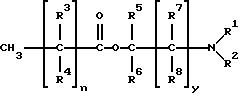
где n = 5 - 12, целое число;
y = 0 - 5, целое число; R1 - R7 одинаковые или различные, выбраны из группы, включающей водород и (C1 - C8) алкил;
R8 выбран из группы, включающей водород, гидроксил и (C1 - C8)алкил.
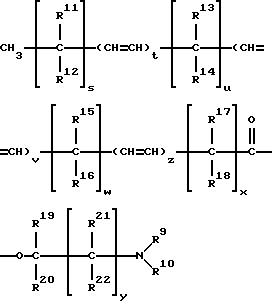
где t, v и z каждый равен 0 или 1; s, u, w, и x каждый обозначает целое число от 0 до 12 включительно, при этом (s + u + w + x) представляет собой целое число от 4 до 18 включительно;
y = 0 - 5, целое число;
R9 - R22, одинаковые или различные, выбраны из группы, включающей водород и (C1 - C8)алкил.
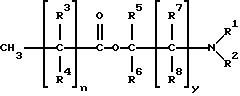
где n = 5 - 18, целое число; y = 0 - 5, целое число;
R1 - R7, одинаковые или различные, выбраны из группы, включающей водород и (C1 - C8)алкил;
R8 выбран из группы, включающей водород, гидроксил и (C1 - C8)алкил.
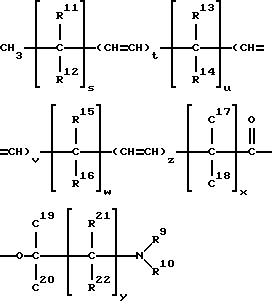
где, t, v и z каждый равен 0 или 1;
s, u, w и x каждый обозначает целое число от 0 до 12 включительно, при этом (s + u + w + x) представляет собой целое число от 4 до 18 включительно;
y = 0 - 5, целое число;
R9 - R22, одинаковые или различные, выбраны из группы, включающей водород и (C1 - C8)алкил.

Комментарии