Составы с контролируемым высвобождением и способы их использования - RU2627429C2
Код документа: RU2627429C2
Чертежи
















Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к составам с контролируемым высвобождением и способу их использования и предпочтительно, но не исключительно, к составам низкой вязкости с контролируемым высвобождением для лечения мастита у лактирующих животных.
УРОВЕНЬ ТЕХНИКИ
Для того чтобы лечить лактирующих животных с маститом или другой микробной инфекцией наиболее часто используются лекарственные препараты с содержанием антибиотиков. Существует целый ряд имеющихся в продаже лекарственных препаратов с содержанием антибиотиков, которые используются для интрамаммарного лечения мастита на протяжении периода лактации.
Тем не менее, одной из главных проблем, с которой сталкиваются при проведении лечения антибиотиками, является плохо контролируемое высвобождение действующего вещества на протяжении периода лечения. Это может привести к проблемам с поддерживанием концентраций действующего вещества выше минимальной ингибирующей концентрации, при которой 90% микробов погибают (обозначается MIC 90). Например, если антибиотик высвобождается слишком быстро, антибиотик может выйти при первой дойке после введения. Впоследствии концентрация антибиотика может быть слишком низкой для оставшегося периода до получения следующим введением, часто это происходит 12 часов спустя. Это может привести к потери эффективности лечения инфекции, более длительным периодам лечения, и/или в конечном счете закончится повышением устойчивости к антибиотикам.
Для противодействия этим проблемам такие лекарственные препараты, как NitroClox™ (длительного действия) LA и Orbenin™ LA зачастую созданы с более высокой вязкостью, что представляет собой известный технический прием для того, чтобы замедлить скорость высвобождения из состава действующего вещества. Действительно, такой примененный подход к терапии мастита у лактирующей и недойной коровы известен как лекарственные формы препаратов пролонгированного действия, в которых действующее вещество медленно высвобождается из, как правило, густой пасты в течение продолжительного периода времени. Например, если антибиотик вводится в период лактации через каждые 48 часов, то антибиотик медленно высвобождается с концентрацией выше MIC 90 в течение приблизительно 36 часов после применения. Впоследствии концентрация антибиотика является слишком низкой для оставшегося периода перед следующим введением дозы, часто это происходит 12 часов спустя. Опять же, это приводит к потере эффективности лечения инфекции.
Дополнительной причиной разработки химиками составов высокой вязкости является то, что высокая вязкость повышает физическую стабильность состава.
Тем не менее, при лечении многих заболеваний, и таких как мастит в период лактации, высокая вязкость приводит к другим проблемам. Например, высокая вязкость приводит к пролонгированию содержания низких уровней антибиотиков в молоке и такое молоко должно быть изъято из продажи. Долгий период ожидания (WHP) приводит к потере доходов.
Кроме того, более высокая вязкость состава требует больших усилий для инфузии или парентерального введения лекарственного препарата. Это может привести к проблемам, связанным с повышенной трудностью при инфузии (в дальнейшем именуемой способностью препарата проходить при введении через иглу) с помощью шприца в вымя.
При лечении мастита повышенная вязкость состава также приводит к более худшему распределению препарата в вымени.
Необходимость применения загустителей или других вспомогательных веществ для того, чтобы увеличить вязкость состава также делают производственный процесс более трудоемким и дорогостоящим. Кроме того, это как правило понимают в промышленности, что чем выше вязкость состава, тем труднее придется обращаться с ним в процессе производства.
Еще одной дополнительной проблемой, с которой сталкиваются при использовании большинства суспензий для изготовления лекарственных препаратов для лечения мастита является образование осадка суспензии при хранении. Конечно, более высокая вязкость состава помогает стабилизировать суспензию физически, но при этом более высокая вязкость обычно не может предотвратить образование осадка, она только замедляет осаждение. В связи с этим, даже вязкие суспензии образуют в конечном итоге осадок, а осадок затем становится слежавшимся, в результате чего часто оказывается трудным повторно его диспергировать перед введением. Высокая вязкость состава препятствует повторной диспергируемости осадков.
По этой причине, в промышленности существует давно испытываемая потребность для разработки улучшенного состава для лечения таких заболеваний, как мастит в течение периода лактации животного. В случае лечения мастита, желаемые характерные особенности такой состава включают в себя:
- профиль контролируемого высвобождения действующего вещества;
- короткий период ожидания (WHP) - например, для лечения таких заболеваний, как мастит в течение периода лактации животного;
- хорошую повторную диспергируемость после хранения или перед введением;
- способность препарата свободно проходить при введении через иглу или другом способе введения;
- хорошее распределение состава в области применения;
- основу состава, которая адаптирована для использования с различными действующим веществами для лечения или профилактики любого заболевания или патологического состояния, но вдобавок к тому же имеет контролируемое и/или замедленное высвобождение действующего вещества;
- основу состава, которая адаптирована к различным режимам применения (то есть к различным профилям контролируемого высвобождения); и/или
- простоту в изготовлении и использовании фармацевтически приемлемых вспомогательных веществ.
Это является целью настоящего изобретения для того, чтобы разрешить вопросы, связанные с указанными выше проблемами или по меньшей мере предоставить неограниченному кругу лиц полезный выбор.
Все ссылки, включая любые патенты или патентные заявки, которые указаны в этом подробном описании включены в данное описание путем ссылки. Не допускается признание того, что любая ссылка составляет предшествующий уровень техники. Рассмотрение ссылок констатирует, что их авторы заявляют свои права, а заявители оставляют за собой право оспорить точность и применимость цитируемых документов. Следует четко понимать, что, несмотря на то, что ряд предыдущих публикаций приведены в настоящем документе, эта ссылка не является признанием того, что любой из этих документов образует часть общедоступного известного уровня техники в данной области, в Новой Зеландии или в любой другой стране.
В данном описании повсюду слово "содержать" или его вариации, такие как "содержит" или "содержащий", следует понимать как предполагающее включение указанного элемента, в целом или частично, или группы элементов целого или частей, но не исключение любого другого элемента, в целом или частично, или группы элементов целого или частей.
Дополнительные аспекты и преимущества настоящего изобретения станут очевидными из последующего описания, которое приведено в только в качестве примера.
ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом настоящего изобретения предлагается состав, содержащий терапевтически эффективное количество действующего вещества или действующих веществ, и
основу, содержащую
количестве коллоидного диоксида кремния,
по меньшей мере одно масло; и
по меньшей мере одно поверхностно-активное вещество,
отличающийся тем, что вязкость состава составляет менее 1000 мПа⋅с при скорости сдвига 100 1/с и при температуре 20°C.
При исследовании было неожиданно обнаружено, что состав был особенно эффективным в случае лечения мастита, в связи с тем, что он помогает обеспечить:
- профиль контролируемого высвобождения действующего вещества, например, которое может быть использовано для поддержания концентраций действующего вещества выше MIC 90 в течение периода лечения;
- низкую вязкость для того, чтобы обеспечить способность препарата проходить при введении через иглу, повторную диспергируемость и/или хорошее распределение в вымени, и/или
- короткий WHP по сравнению с другими доступными в настоящее время лекарственными препаратами для лечения мастита.
Как будет описано дополнительно, была признана особая важность данного изобретения для лечения мастита антибиотиками. Тем не менее, было бы разумно ожидаемым каким либо специалистом в данной области, что та же изобретательская идея раскрытого состава будет применяться к профилю контролируемого высвобождения по существу, любого действующего вещества или соединения, которому это необходимо для лечения других патологических состояний.
Без желания быть ограниченным механизмом действия, считается, что это контролируемое высвобождение возникло вследствие того, что поверхностно-активное вещество взаимодействует с коллоидным диоксидом кремния, в результате чего происходит изменение профиля высвобождения из состава действующего вещества.
Важно отметить, что этот профиль контролируемого высвобождения действующего вещества достигается без чрезмерного изменения вязкости состава и, в частности без существенного увеличения вязкости состава.
Согласно примеру на Фигуре 2, исследования in vitro показали, что оказалось возможным уменьшение выведения лекарственного вещества (приравнивая к снижению профиля высвобождения в естественных условиях) в среде растворения приблизительно от 50% до 5% в процентах по массе в течение периода времени продолжительностью 180 минут. Этот положительный эффект был достигнут несмотря на то, что вязкость состава увеличилась только минимально от 90 мПа⋅с до 118 мПа⋅с (при скорости сдвига 100 1/с при температуре 20°C). Как иллюстрировано на Фигуре 2, эта скорость выведения 5% в процентах по массе была такой же, как и полученная у конкурирующего продукта, Orbenin™ LA. Тем не менее, Orbenin™ LA имеет вязкость 1080 мПа⋅с и приблизительно 10 точек перегиба, которые иллюстрированы в этом примере согласно настоящему изобретению.
Очевидно, что если возникает необходимость в более высокой вязкости состава, это может быть достигнуто с помощью загустителей, которые хорошо известны в данной области.
Например, при лечении мастита в период лактации может быть достигнута более низкая вязкость состава, которая помогает обеспечить многочисленные преимущественные характерные особенности, такие как легкая повторная диспергируемость, способность препарата проходить при введении через иглу, изготовление и/или короткий WHP. Такие характерные особенности могут быть обеспечены в то время как изменяется профиль высвобождения действующего вещества состава для того, чтобы удовлетворять желаемым требованиям. При лечении мастита, например, это контролируемое высвобождение используется для того, чтобы обеспечить содержание действующего вещества в концентрации выше MIC 90 в течение всего периода лечения.
Были проведены предварительные исследования в соответствии с примерами, приведенными в настоящем документе, которые иллюстрируют значительные преимущества.
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ СОСТАВА
Действующее вещество
Предпочтительно, действующее вещество представляет собой антибиотик, комбинацию антибиотиков или антибиотик в комбинации с действующим веществом, которое не является антибиотиком. Было получено подтверждение, что предпочтительным антибиотиком является клоксациллин благодаря своей эффективности при лечении мастита.
Предпочтительно, клоксациллин представлен как клоксациллин натрия. Конечно, также могут быть использованы другие формы клоксациллина, такие как клоксациллин бензатин.
Другие предпочтительные действующие вещества содержат бета-лактамы, пенициллины, цефалоспорины, аминогликозиды, хинолоны, фосфомицин, сульфонамиды, тетрациклины и макролидные антибиотики.
Предпочтительные комбинации действующих веществ состоят из амоксициллина и клавулановой кислоты; действующего вещества пенициллина и аминогликозида; клоксациллина и тилозина; и антибиотика с нестероидным противовоспалительным лекарственным веществом.
Тем не менее, по существу любой антибиотик, действующее вещество, которое не является антибиотиком, или их функциональные производные могут быть использованы в настоящем изобретении.
Например, было установлено в соответствии с примерами, приведенными в настоящем изобретении, что изобретение также работает подобным образом, когда действующее вещество представляет собой вещество на основе тилозина, цефапирин натрий или антибиотик цефапирин бензатин.
Кроме того, было также удивительно обнаружить, что скорость высвобождения зависит от типа используемого действующего вещества. Если тип / количество диоксида кремния и поверхностно-активного вещества остается постоянным, то смена действующего вещества от цефапирина до клоксациллина (при поддерживании концентрации обоих приблизительно 4,5% в процентах по массе) привела к очень разной скорости высвобождения. Цефапирин высвобождался намного медленнее, чем клоксациллин. Это иллюстрирует то, что путем регулирования типа и возможно концентрации действующего вещества (и при соответствии диоксид кремния и поверхностно - активного вещества), может быть достигнуто желаемое высвобождение практически любого действующего вещества.
Предпочтительно действующее вещество микронизируют. Термин микронизированный следует воспринимать как означающий частицу со средней величиной диаметра d 50 от 1 до 20 мкм. Микронизация помогает уменьшить скорость образования осадка. Более того, более крупные частицы могут образовывать мостики в передней части наконечника шприца, которые могут повлиять на возможность введения с помощью шприца.
В данном описании, термин "способность препарата проходить при введении через иглу" или "возможность введения с помощью шприца" следует воспринимать в значении легкость введения лекарственного средства животному с помощью шприца. Это чаще всего зависит от вязкости, а также от размера частиц лекарственных препаратов или состава вспомогательных веществ, которые могут иногда частично или полностью блокировать наконечник шприца во время введения лекарственного средства.
Коллоидный диоксид кремния
Повсюду в данном описании термин коллоидный диоксид кремния следует воспринимать как означающий частицы аморфной коллоидальной двуокиси кремния с наибольшим диаметром отдельной частицы диоксида кремния от приблизительно 1 нм до 1000 нм (1 мкм).
Дополнительное описание известных характерных особенностей и использования коллоидного диоксида кремния представлено далее в этом подробном описании. Это помогает проиллюстрировать, что рассматриваемое использование коллоидного диоксида кремния очень отличается от ранее известных видов использования таких в качестве загустителя и/или вещества, которое предотвращает слипание.
Предпочтительно, коллоидный диоксид кремния представляет собой коллоидный аморфный диоксид кремния.
В настоящее время доступны много различных видов коллоидного аморфного диоксида кремния Специалистам в данной области техники должно быть понятно, что все имеющиеся в настоящее время и будущие виды коллоидного аморфного диоксида кремния будут обеспечивать такие же преимущества, как описано в настоящем документе. В соответствии с примерами, приведенными в данном подробном описании, было обнаружено, что аморфный коллоидный диоксид кремния является особенно эффективным.
Предпочтительно, аморфный коллоидный диоксид кремния обладает гидрофобными свойствами.
Было определено, что гидрофобный коллоидный диоксид кремния является значительно более эффективным, чем гидрофильный коллоидный диоксид кремния при изменении профиля высвобождения действующего вещества, в то время как вязкость сохранялась относительно низкой и/или по существу неизменной.
Это было неожиданным результатом, что составы с использованием гидрофобного коллоидного диоксида кремния имеют более низкую вязкость, чем те, в которых использован его гидрофильный аналог. Гидрофильный коллоидный диоксид кремния, как известно, используется в качестве загустителя, который обеспечивает более медленный профиль высвобождения в результате сгущения состава.
Вместо этого, когда в данном исследовании использовали гидрофильный диоксид кремния, включение поверхностно - активного вещества имело тенденцию увеличивать вязкость состава более, чем при использовании гидрофобного диоксида кремния. Это был особенно удивительный результат, так как использование гидрофобного диоксида кремния вместо гидрофильного диоксида кремния в настоящем изобретении, как правило, обеспечивает больший контроль высвобождения действующего вещества.
Предпочтительным имеющимся в продаже гидрофобным коллоидным диоксидом кремния является Aerosil® R 972 (поставляется Aerosil).
Предпочтительно, концентрация коллоидного диоксида кремния составляет от 0,1 до 5% в процентах по массе. Было обнаружено, что это количество является особенно эффективным в использовании при лечении мастита в период лактации в соответствии с предпочтительными режимами рекомендованной дозировки, которые описаны в настоящем документе.
Более предпочтительно, концентрация коллоидного диоксида кремния составляет от 1 до 3% в процентах по массе. Особенно предпочтительное количество коллоидного диоксида кремния составляло 1,75% в процентах по массе. Например, это было обнаружено для того, чтобы обеспечить возможность приемлемого высвобождения действующего вещества в течение всего периода лечения (обычно 24 часа), а также чтобы поддерживать концентрацию клоксациллина выше MIC 90, но одновременно при условии более прибыльного короткого WHP по сравнению с конкурирующими продуктами. Это всего лишь один пример того, как механизм контролируемого высвобождения согласно настоящему изобретению может быть эффективно использован.
Как описывалось выше, количество используемого коллоидного диоксида кремния частично регулируется в зависимости от типа используемого действующего вещества и желаемой скорости высвобождения. Например, цефапирин показывает значительно более медленное высвобождение от основания состава, чем клоксациллин.
По этой причине, можно решить снизить количество коллоидного диоксида кремния для достижения аналогичной скорости высвобождения, которая обеспечивается при использовании клоксациллина, если это так желательно.
Протоколы испытаний в естественных условиях хорошо известны в этой отрасли и представляют простой тест для того, чтобы определить полученную концентрацию действующего вещества данной состава в молоке. Согласно таким исследованиям, специалисты в данной области смогут легко регулировать количество коллоидного диоксида кремния (или в этом отношении действующего вещества или количество / тип поверхностно-активного вещества) для того, чтобы достичь желаемой скорости высвобождения, по существу, любого состава.
В целом, было установлено, что чем выше концентрация коллоидного диоксида кремния в основании состава, тем медленнее скорость высвобождения действующего вещества. Важно, что это замедление скорости высвобождения достигнуто без чрезмерного влияния на вязкость составов. В конкурирующих лекарственных препаратах, таких как NitroClox™ LA или Orbenin™ LA, аналогичная скорость высвобождения может быть достигнута только за счет использования гораздо более высокой вязкости, которая имеет многочисленные недостатки, как описано выше.
Поверхностно-активное вещество
Повсюду в данном подробном описании термин поверхностно-активное вещество должно рассматриваться как означающее любое соединение, которое снижает поверхностное натяжение жидкости, а также любое соединение, которое снижает поверхностное натяжение на границе раздела между двумя жидкостями или любое соединение, которое снижает поверхностное натяжение на границе раздела между жидкостью и твердым телом. Поверхностно-активные вещества могут также действовать в качестве эмульгаторов, моющих средств, смачивающих агентов и так далее.
Предпочтительно, поверхностно-активное вещество представляет собой неионное поверхностно-активное вещество.
Тем не менее, согласно настоящему изобретению считается, что амфотерные, анионные или катионные поверхностно-активные вещества должны работать также хорошо.
Предпочтительно, неионное поверхностно-активное вещество имеет гидрофильно-липофильный баланс (HLB) в диапазоне от 0,5 до 30.
Более предпочтительно, неионное поверхностно-активное вещество имеет гидрофильно-липофильный баланс HLB в диапазоне от 4 до 16.
Более предпочтительно, поверхностно-активное вещество выбирают из группы, выделенной из сложных эфиров сорбитана, сложных эфиров полиоксиэтиленсорбитана и жирных кислот, полиоксиэтиленовых производных касторового масла, полиоксиэтиленовых эфиров стеариновой кислоты, полиэтиленоксид моноолеата и их комбинаций.
Неожиданно было обнаружено, что некоторые поверхностно-активные вещества проявили более лучшую работу, чем другие при контролировании скорости высвобождения выбранного действующего вещества.
Например, 0,1% в процентах по массе PEG12-олеат обладал большим эффектом на замедление скорости высвобождения клоксациллина, чем 0,1% в процентах по массе Span80, в то время как все остальные переменные оставались постоянными.
Предпочтительно, концентрация поверхностно-активного вещества составляет от 0,01 до 10% в процентах по массе.
В целом, было установлено, что чем выше концентрация поверхностно-активного вещества в основании состава, тем медленнее скорость высвобождения действующего вещества.
По этой причине, количество / тип поверхностно-активного вещества и/или соотношение поверхностно-активного вещества к коллоидному диоксиду кремния служат средствами контроля скорости высвобождения действующего вещества.
Предпочтительно, соотношение коллоидного диоксида кремния к поверхностно-активному веществу составляет от 1:100 до 500:1.
Более предпочтительно, соотношение коллоидного диоксида кремния к поверхностно-активному веществу составляет от 1:5 до 6:1.
Необязательно, основа состава может содержать более чем один тип поверхностно - активного вещества. Было бы разумно ожидать, что профиль высвобождения полученного в результате состава (и другие характеристики, такие как WHP) могут быть более тонко контролированными с помощью использования комбинации поверхностно-активных веществ в одном составе, и/или в разных составах, которые вводятся в течение курса лечения.
Масло
Во многих составах масла необходимы в качестве среды для изготовления лекарственных препаратов. Например, лекарственные препараты с содержанием антибиотика, в том числе таких действующих веществ как клоксациллин или цефапирин, изготовлены, как правило, на основе масляной среды. Например, это помогает введению лекарственного препарата в виде инфузии или инъекции через канал соска, и/или достижению достаточной химической стабильности на протяжении срока годности.
Предпочтительно, масло имеет низкую вязкость.
Использование масла с низкой вязкостью помогает обеспечить сохранение низкой вязкости полученного в результате состава. Это помогает обеспечить для состава хорошее распределение внутри вымени, легкое повторное диспергирование после хранения и легкое введение с помощью шприца.
Предпочтительно, вязкость масла составляет от 1 до 100 мПа⋅с при 20°C.
Более предпочтительно, вязкость масла составляет менее чем 40 мПа⋅с при 20°C.
Более предпочтительно, масло выбрано из группы, состоящей из триглицеридов средней цепи (например, Miglyol 812 или Miglyol 840), этилолеата, легкого вазелинового масла, кунжутного масла и арахисового масла. Тем не менее, следует понимать, что в настоящем изобретении могут быть использованы другие аналогичные масла с низкой вязкостью.
Предпочтительно, масло имеет низкую плотность от 0,80 до 0,99 г/см3.
Как проиллюстрировано на Фигуре 6, было обнаружено, что различные используемые масла изменяют скорость высвобождения действующего вещества. Эффект не был резко выраженным по сравнению с изменениями в типе / количестве используемого поверхностно-активного вещества, коллоидного диоксида кремния или действующего вещества. По этой причине, представляется возможным, что такие изменения могут быть обусловлены просто вязкостью масла, а не полученной в результате составом. Вследствие этого, в предпочтительном варианте осуществления изобретения для поддержания более низкой вязкости состава используется масло с более низкой вязкостью.
Более того, также считается, что масло взаимодействует с одним или более компонентом в основе состава для воздействия на скорость высвобождения действующего вещества отдельным образом, а именно контролируемым высвобождением, которое зависит от вязкости.
Вязкость конечного состава
Очевидно, что вязкость состава может быть специально приведена в соответствие к конкретным необходимым требованиям. Для некоторых составов используется относительно высокая вязкость. Для других составов низкая вязкость может поддерживаться без добавления дополнительных вспомогательных веществ, таких как загустители или масла высокой вязкости. Такие модификаторы вязкости также способствуют воздействию, в случае необходимости, на профиль высвобождения действующего вещества.
Предпочтительные диапазоны значений вязкости и числовые значения, обсуждаемые ниже, являются такими, которые были обнаружены как особенно эффективные для интрамаммарного лечения мастита в период лактации.
Если не указано иное, вязкость состава, указанного в данном описании, основана на измерениях с использованием метода коаксиальных цилиндров при скорости сдвига 100 1/с и при температуре 20°C. Вязкость составов согласно настоящему изобретению составляет ниже чем 1000 мПа⋅с при измерении в указанных условиях.
Более предпочтительно, конечный состав имеет вязкость ниже 300 мПа⋅с.
Более предпочтительно, состав имеет вязкость ниже 150 мПа⋅с.
NitroClox™LA и Orbenin™ LA имеют вязкость выше 1000 мПа⋅с при скорости сдвига 100 1/с и температуре 20°C. Аналогичным образом, составы для лечения мастита у коров в сухостойный период или другие составы, которые содержат коллоидный диоксид кремния, обычно имеют вязкость значительно выше верхнего предела.
В ходе исследования было определено, что состав для лечения мастита на протяжении периода лактации предпочтительно имеет вязкость менее 1000 мПа⋅с (и более предпочтительно ниже 300 мПа⋅с) и при этом обеспечивает лучшие характеристики в отношении возможности легкого введения с помощью шприца, повторной диспергируемости, распределения состава в вымени и/или короткого WHP по сравнению с конкурирующими лекарственными препаратами, такими как NitroClox™ LA и Orbenin™ LA. Эти полезные характерные особенности сохраняются, в то время как обеспечение профиля высвобождения действующего вещества соответствующим образом контролируется для того, чтобы обеспечить возможность поддерживать концентрацию действующего вещества значительно выше MIC 90 в течение всего периода лечения.
Предпочтительный способ применения
Предпочтительно, состав, описанный в данном документе используется для лечения мастита посредством интрамаммарной инфузии в течение периода лактации.
В случае возникновения мастита в период лактации, состав может быть использован для крупного рогатого скота, овец и других животных, которые, как правило, используются для коммерческого производства молока.
Это помогает дифференцировать предпочтительное использование согласно настоящему изобретению от применения при мастите в сухостойный период (т.е. применения вне периода лактации).
Тем не менее, понятно, что настоящее изобретение может использоваться для того, чтобы лечить, по существу, любое патологическое состояние или заболевание, в зависимости от выбранного действующего вещества. Основная концепция изобретения состава не должна быть ограничена составами для интрамаммарного лечения мастита.
В соответствии с дополнительным аспектом настоящего изобретения предложен способ лечения микробной инфекции у животного, нуждающегося в этой составе как, по существу, описано в настоящем документе, при этом способ включает в себя стадию введения состава посредством интрамаммарной инфузии.
Способ введения состава как правило осуществляется с помощью инфузии через канал соска.
Предпочтительно, способ включает в себя режим рекомендованной дозировки от 1 до 12 доз 1-10 г лекарственного препарата с лечебной схемой введения каждые 12, 24 или 48 часов.
Более предпочтительно, способ включает в себя режим рекомендованной дозировки от 3 до 6 доз 5 г лекарственного препарата с лечебной схемой введения каждые 24 часа на протяжении периода применения от 48 часов (3 дозы) до 120 часов (6 доз).
Этот режим рекомендованной дозировки является достаточным для успешного лечения животного с доклиническим или клиническим маститом на протяжении периода лактации.
После окончания расчетного WHP нормальный производственный процесс доения можно возобновлять снова. Опять же, в ходе исследования было обнаружено, что WHP согласно настоящему изобретению является существенно ниже, чем при применении других доступных в настоящее время лекарственных препаратов, таких как NitroClox™ LA, когда были сопоставлены одинаковые периоды применения.
Фигура 14 иллюстрирует в качестве примера один состав в соответствии с настоящим изобретением, который имеет WHP 72 часа по сравнению с NitroClox™ LA, имеющим WHP 108 часов (лечебная схема три дозы с интервалами в 24 часа). На основе предположений, изложенных в следующем пункте, это приравнивается к увеличению прибыли в размере $ 24 на одну корову, которая образовалась в результате более короткого на 36 часов WHP. Когда это умножается на большую молочную ферму, или действительно на целую страну, легко увидеть важность этого изобретения.
Что представляет собой увеличение прибыли в размере $24 на одну корову понимается в молочной промышленности Новой Зеландии так, как изложено кратко ниже. Каждое доение, как правило, приносит около 10 л молока (что приравнивается к 1 кг сухого молока), а фермер продает 1 кг сухого молока за $8 такой компании, как Fonterra. Более того, каждую корову, как правило, доят через каждые 12 часов.
Особенно преимущественное использование настоящего изобретения представляет собой комбинацию способов применения различных составов, которые имеют различные профили высвобождения в течение периода лечения.
Чтобы проиллюстрировать это, лечение мастита включает в себя начальное использование состава с относительно медленным высвобождением действующего вещества в первой части периода лечения, однако более позднее применение (я) использует состав с быстрым высвобождением действующего вещества.
Это помогает в том смысле, что в начале периода лечения требуется меньшее количество применений состава. Это также помогает обеспечить поддержание концентрации действующего вещества выше MIC 90. К концу периода лечения состав с быстрым высвобождением используется в основном для поддержания уровней содержания действующего вещества. Тем не менее, поскольку действующее вещество высвобождается более быстро, период WHP по прежнему остается коротким.
Предпочтительный способ изготовления
В соответствии с дополнительным аспектом настоящего изобретения предлагается способ изготовления состава, по существу описанного выше, включающий в себя этапы:
a) смешивание масла и поверхностно-активного вещества в контейнере до образования гомогенной масляной смеси;
b) диспергирование действующего вещества в масляной смеси; и
c) последующее добавление коллоидного диоксида кремния в масляную смесь.
Необязательно по меньшей мере один консервант смешивают с маслом и поверхностно-активным веществом на этапе а). Например, в качестве консервантов могут быть использованы метилпарабен и пропилпарабен.
Предпочтительно, масляную смесь, которая получена на этапе а) подвергают термической стерилизации. Например, используют три часа инкубации при 140°C, а затем впоследствии дают смеси остыть.
Предпочтительно, на этапе b) и этапе с) использовать оборудование с высоким усилием сдвига диспергирования.
Предпочтительно, коллоидный диоксид кремния на этапе с) также подвергают термической стерилизации перед добавлением к масляной смеси.
Предпочтительно, масляную смесь, которая получена на этапе с) гомогенно смешивают.
Было установлено, что предпочтительная низкая вязкость состава также помогает при производственном процессе. В отличие от других составов, отсутствует дополнительный этап, который требуется для смешивания с загустителем (например hydroxystearin).
Кроме того, низкая вязкость помогает, когда шприцы должны быть заполнены после изготовлении состава перед применением.
Предпочтительное использование микронизированных действующих веществ также помогает предотвратить быстрое осаждение состава. Дополнительно, считается возможным, что высвобождение микронизированного действующего вещества легче контролировать, чем немикронизированных эквивалентов, потенциально, так как распределение размера частиц, является, вероятно, более однородным. Кроме того, вполне возможно, что любое взаимодействие с другими компонентами в составе может быть увеличено с большей площадью поверхности более мелких микронизированных частиц.
Дополнительная исходная информация о коллоидном диоксиде кремния
Аморфный коллоидный диоксид кремния, такой как коллоидный диоксид кремния, обычно используется в качестве модификатора вязкости, а более конкретно, загустителя в жидких лекарственных формах препаратов. Некоторые примеры того, как был использован коллоидный диоксид кремния. В соответствии с тем, что широко известно в данной области, было установлено, что коллоидный диоксид кремния помогает в изменении высвобождения действующих веществ из состава, но только в качестве загустителя. Как описано ранее, как правило, чем состав становится более густой, тем медленнее становится профиль высвобождения действующего вещества, и наоборот. Это совершенно разные понятия настоящего изобретения.
NZ 523128 описывает ветеринарное лекарственное средство в жидкой лекарственной форме для перорального введения, содержащее действующее вещество, которое растворяют в растворителе, затем адсорбируют на сорбирующей среде, такой как Aerosil R972 аморфный диоксид кремния, и затем диспергируют растворитель в другой жидкости, которая содержит другое действующее вещество, растворенное или суспендированное в ней.
WO 03070155 описывает лекарственный препарат для перорального введения, содержащий действующее вещество, суспендированное в масляной матрице, с поверхностно - активным веществом и коллоидным диоксидом кремния. Состав выполнен в виде вязкого раствора с добавлением гидрогенизированного растительного масла, в том числе желтого пчелиного воска в качестве суспендирующего агента и лецитина. Диоксид кремния используется в качестве вспомогательного диспергирующего вещества для гидрохлорида псевдоэфедрина, а также входит в состав оболочки желатиновых капсул.
WO 0160409 описывает лекарственную форму препарата в виде пасты, которая содержит действующее вещество, аморфный диоксид кремния, модификатор вязкости, абсорбент, краситель и носитель. Модификатор вязкости содержит PEG 200-600, моноэтиламин, глицерин и пропиленгликоль.
WO 9824436 описывает лекарственную форму препарата в виде геля, который содержит коллоидный диоксид кремния и триацетин.
JP 3153623 (на основе английского перевода реферата) описывает полутвердый фармацевтический состав для перорального введения. Состав содержит лекарственное средство, физиологически допустимую жидкость, пищевое масло, коллоидный диоксид кремния, стеарат алюминия или полиэтиленгликоль с высокой молекулярной массой.
US 4980175 описывает жидкие составы для перорального введения, которые содержат антацидное вещество (гидроксид алюминия и т.д.) и коллоидный диоксид кремния, суспендированный в триглицеридах средней цепи. Эмульгатор (гексаглицерин моноолеат) включен для того, чтобы уменьшить привкус масла.
US 4781920 описывает антигельминтную пасту, которая содержит минеральное масло, поверхностно-активное вещество полисорбат 20, аморфный диоксид кремния и тетрамизола резинат.
Эти документы не описывают, что сочетание компонентов (в частности, поверхностно - активного вещества и коллоидного диоксида кремния) взаимодействует для того, чтобы обеспечить механизм контролируемого высвобождения действующего вещества. Более того, те составы, которые содержат как поверхностно-активное вещество, так и коллоидный диоксид кремния, описаны как вязкие жидкие составы или пасты, которые не входят в объем настоящего изобретения (состав с вязкостью ниже 1000 мПа⋅с). Коллоидный диоксид кремния, который применяется в таких составах, обычно используется в качестве модификатора вязкости (загустителя) для того, чтобы напрямую воздействовать на контролируемое высвобождение.
В других примерах аморфный коллоидный диоксид кремния используется для изготовления лекарственных форм препарата в виде таблеток или порошков в качестве вещества, которое препятствует слеживанию и комкованию. AEROSIL рассматривает другие типичные направления практического применения коллоидного диоксида кремния в качестве вещества, препятствующего слеживанию или в качестве стабилизатора на своем сайте (www.aerosil.com).
Аморфный коллоидный диоксид кремния существует в виде частиц (называемые первичные, вторичные или третичные частицы в зависимости от их уровня агрегации и/или агломерации).
При механическом воздействии диоксид кремния третичной структуры разбивается на первичные или вторичные агрегаты, система становится более жидкой, а вязкость падает. После прекращения механического воздействия, третичная структура агломерированных частиц диоксида кремния образуется снова, и вязкость возвращается к исходному значению.
Как указано в технической информации 1279, группа Aerosil, Degussa, гидрофобный AEROSIL® ("R") был обработан в процессе производства для получения гидрофобной поверхности. Во время этого процесса силанольные группы вступали в реакцию. Представляет интерес, что гидрофобные виды AEROSIL® часто демонстрируют низкую эффективность загущения по сравнению с гидрофильными видами.
По этой причине для жидких лекарственных форм гидрофильный аморфный диоксид кремния рекомендуется для контроля вязкости и, вследствие этого, более медленного высвобождения действующего вещества, а гидрофобный аморфный диоксид кремния рекомендуется для стабилизации, чтобы предотвратить образование твердых осадков (т.е. слеживание), в частности, во время хранения (www.aerosil.com).
В химической технологии изготовления лекарственного средства используют общий принцип: повышение концентрации загустителя в лекарственной форме препарата, чем больше вязкость, тем медленнее действующее вещество высвобождается из полученного лекарственного препарата.
По этой причине неожиданно было обнаружено, что изменение компонентов настоящего состава существенно влияет на профиль высвобождения действующего вещества без избыточного влияния на вязкость. Это четко проиллюстрировано в качестве примеров, приведенных в данном подробном описании.
Как иллюстрировано на Фигуре 10, высвобождение клоксациллина из предпочтительного состава точно контролируется и замедляется при концентрациях в молоке выше MIC 90=0,5 мг / л (для клоксациллина в Новой Зеландии, число взято из Salomon и др., 1998 J Dairy Sci 81:570-578) в течение более чем 48 часов после применения (пример 17). Это не может быть достигнуто с существующими на рынке продуктами с лечебной схемой 48 часов, такими как NitroClox™ LA (Фигура 13) и Orbenin™ LA (Фигура 15), даже несмотря на то, что при сравнении вязкость является значительно более высокой.
Коллоидный диоксид кремния был использован в лекарственном препарате Orbenin™ LA производства компании Pfizer, но только в общепринятом направлении использования в качестве загустителя и/или вещества, которое препятствует слеживанию. Дополнительный загуститель hydroxystearin добавляют с коллоидным диоксидом кремния для увеличения вязкости лекарственной формы препарата, которая используется для достижения медленного высвобождение действующего вещества. В отличие от настоящего изобретения в лекарственной форме препарата Orbenin™ LA нет включения в состав поверхностно-активного вещества.
В результате загуститель, который используется в лекарственном препарате Orbenin™ LA, имеет намного более высокую вязкость, чем та, которая достигнута по настоящему изобретению (как приведено в примерах). Как уже рассматривалось ранее, это приводит к проблемам со способностью препарата проходить при введении через иглу. По этой причине авторы настоящего изобретения считают, что настоящее изобретение, которое способно достичь более низкой вязкости, и при этом обладает возможностью эффективно контролировать высвобождение действующего вещества, имеет значительные преимущества перед Orbenin™ LA.
WO 87/03876 также описывает лекарственную форму препарата для лечения / профилактики мастита во время периода сухостоя. WO 87/03876 рассматривает использование коллоидного диоксида кремния вместе с добавлением дополнительных загустителей для того, чтобы обеспечить вязкость лекарственной формы препарата. Опять же, результат создания этой очень вязкой лекарственной формы препарата заключается в обеспечении контролируемого высвобождения действующего вещества в течение длительного периода лечения (на протяжении периода сухостоя в противоположность периоду лактации). Это отличается от использования коллоидного диоксида кремния в настоящем изобретении.
WO 03/063877 также описывает использование коллоидного диоксида кремния для лечения мастита во время периода сухостоя. Опять же, цель состоит в том, чтобы обеспечить высокую вязкость лекарственной формы препарата при использовании коллоидного диоксида кремния в качестве загустителя для медленного высвобождения антибиотика.
US 4401674 описывает интрамаммарную лекарственную форму препарата, которая содержит пенициллин и молекулярное сито. Коллоидный диоксид кремния отличается от молекулярных сит. Молекулярные сита, составляют, как правило, несколько микрон (мкм) в диаметре, что делает их значительно большими, чем коллоидные частицы диоксида кремния. В отличие от коллоидного диоксида кремния молекулярные сита не имеют загущающих свойств и, таким образом, обычно не используются в качестве загустителей.
Раздел 1, строки с 54 по 58 из US 4401674, рассматривается, что, если лекарственная форма препарата должна быть использована для лактирующих коров, то эмульгатор (или, альтернативно, кокосовое масло) добавляется в состав для "ускорения смешивания состава с выделяемой водянистой жидкостью в вымени". Это полностью отличается от концепции настоящего изобретения, где поверхностно-активное вещество является химически взаимодействующим со структурой диоксида кремния для вызывания изменения в скорости высвобождения. Например, скорость высвобождения действующего вещества замедляется с увеличением концентрации поверхностно-активного вещества. В зависимости от типа / количества поверхностно-активного вещества, диоксида кремния и/или действующего вещества, скорость высвобождения действующего вещества из состава меняется, и, что является важным, без избыточного влияния на вязкость.
Кроме того, US 4401674 не описывает или не представляет, что эмульгирующий агент будет изменять скорость высвобождения действующего вещества. Это просто предусмотрено для ускорения смешивания состава.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Дополнительные аспекты настоящего изобретения станут очевидными из последующего описания, которое приведено только в качестве примера со ссылкой на прилагаемые чертежи, на которых:
Фигура 1 иллюстрирует сравнение динамических вязкостей между составами для лечения мастита (применение в период лактации).
Фигура 2 иллюстрирует влияние поверхностно-активного вещества на скорость высвобождения действующего вещества (in vitro).
Фигура 3 иллюстрирует влияние поверхностно-активного вещества на скорость высвобождения действующего вещества (in vitro).
Фигура 4 иллюстрирует влияние концентрации коллоидного диоксида кремния на скорость высвобождения действующего вещества (in vitro).
Фигура 5 иллюстрирует влияние вида коллоидного диоксида кремния (гидрофобного против гидрофильного) на скорость высвобождения действующего вещества (in vitro).
Фигура 6 иллюстрирует влияние масла на скорость высвобождения действующего вещества (in vitro).
Фигура 7 представляет иллюстративный пример биодоступности клоксациллина в тканях через 2 часа после применения (в естественных условиях).
Фигура 8 иллюстрирует влияние вида действующего вещества на концентрацию действующего вещества в молоке (в естественных условиях).
Фигура 9 иллюстрирует влияние вида действующего вещества на концентрацию действующего вещества в молоке (в естественных условиях).
Фигура 10 иллюстрирует влияние характерных особенностей состава на WHP (в естественных условиях).
Фигура 11 иллюстрирует влияние количества применений состава по примеру 1 на WHP (в естественных условиях).
Фигура 12 иллюстрирует определение WHP по примеру 1 состава на основе нормативных документов ACVM (в естественных условиях).
Фигура 13 иллюстрирует сравнение применения состава по примеру 1 и NitroClox™ LA (в естественных условиях).
Фигура 14 иллюстрирует сравнение WHP состава по примеру 1 и NitroClox™ LA (в естественных условиях).
Фигура 15 иллюстрирует сравнение применения состава по примеру 1 и Orbenin™ LA (в естественных условиях).
Фигура 16 иллюстрирует сравнение WHP состава по примеру 1 и Orbenin™ LA (в естественных условиях).
ЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
ЧАСТЬ 1: пример составов

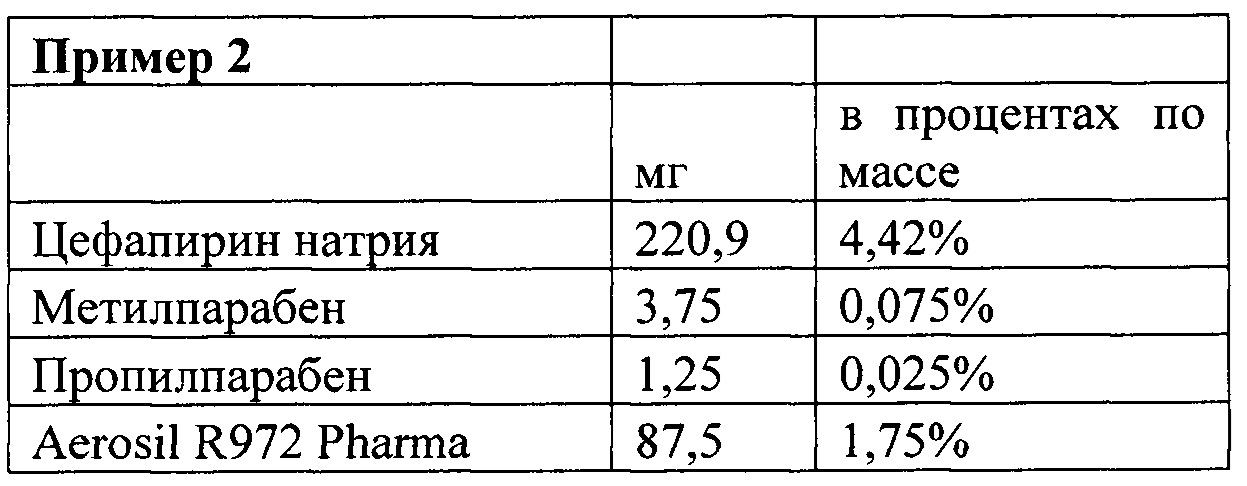

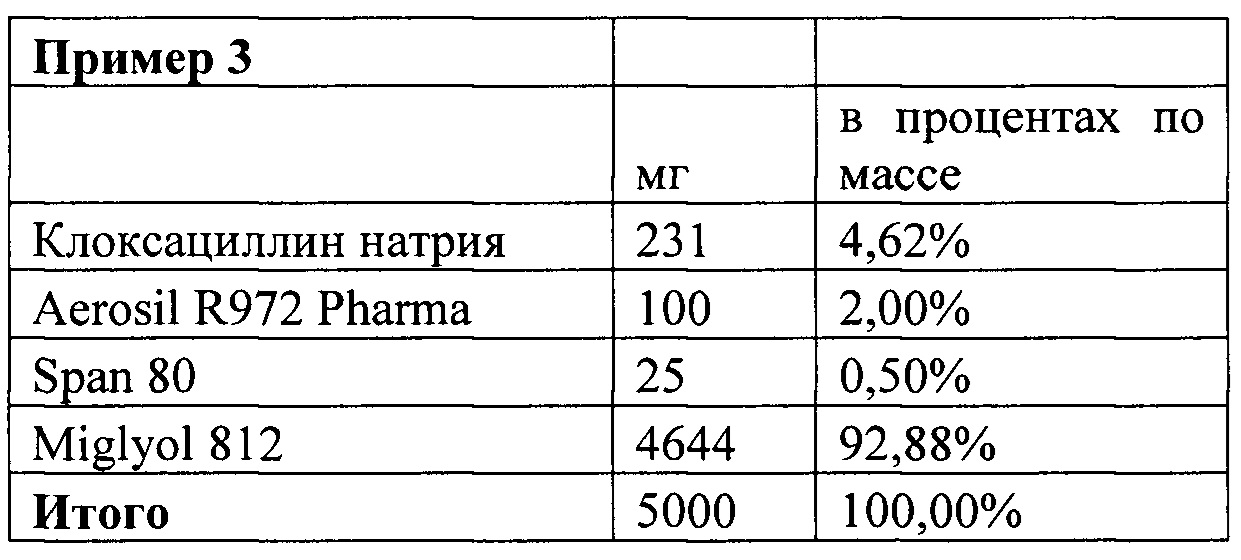


















Следует отметить, что Клоксациллин натрия, используемый в примерах 1-17 (а также в примере 18, показанном ниже) находится в микронизированной форме.
ЧАСТЬ 2: иллюстративный пример скорости контролируемого высвобождения действующего вещества
Фигура 1 иллюстрирует сравнительно низкую вязкость предпочтительного состава в соответствии с настоящим изобретением по сравнению с референтными препаратами, существующими в настоящее время на рынке. Скорость высвобождения в среде растворения (показанная на Фигурах 2-6) рассмотрена изобретателями для того, чтобы иллюстрировать скорость высвобождения в естественных условиях.
Фигура 2 наглядно иллюстрирует одно из главных преимуществ настоящего изобретения. По сравнению с Orbenin™ LA два тестовых состава на Фигуре 2 имеют очень низкую вязкость (90-150 мПа⋅с против 1080 мПа⋅с). Orbenin™ LA способен поддерживать относительно медленное высвобождение клоксациллина (приблизительно 5%) с помощью использования загустителя (hydroxystearin). Эта вязкость Orbenin™ LA по сравнению с существующими составами визуализирована на Фигуре 1.
Два тестовых состава, которые иллюстрированы на Фигуре 2, не содержат загуститель для того, чтобы вызвать медленный профиль высвобождения. Вместо этого, тщательный выбор поверхностно - активного вещества (Span80 против РЕG12-олеат) используется для того, чтобы значительно изменить профиль высвобождения клоксациллина без значительного повышения вязкости. Тестовый состав, который содержит РЕG12-олеат имеет профиль высвобождения по существу идентичный (если не медленнее), чем Orbenin™ LA, но вязкость при этом выгодно остается относительно низкой (180 мПа⋅с).
Фигура 3 иллюстрирует, что скорость высвобождения действующего вещества зависит не только от выбора типа поверхностно-активного вещества, но также и от его концентрации. Примером этого служит увеличение концентрации Span80 (HLB=4,3) от 0,05% до 1% (примеры от 8 до 11). Наблюдается только небольшое повышение вязкости, зато представлено непропорциональное уменьшение высвобождения действующего вещества.
Аналогичным образом, иллюстрировано изменение концентрации PEG12-олеат (HLB=13,7) (примеры 6 и 7) с соответствующими изменениями в профиле высвобождения. Таким образом, это иллюстрирует, что могут быть использованы различные виды и концентрации поверхностно-активных веществ для контроля профиля высвобождения составов в естественных условиях.
Фигура 4 иллюстрирует, что концентрация коллоидного диоксида кремния также влияет на скорость высвобождения действующего вещества. Было обнаружено, что как только концентрация коллоидного диоксида кремния (в данном случае Aerosil R972) увеличилась с 1,75% до 3% в процентах по массе, скорость высвобождения была снижена.
Опять же, несмотря на то, что профиль высвобождения резко замедлился в связи с тем, что концентрация диоксида кремния увеличилась с 1,75 до 3%, вязкость увеличилась только незначительно с 90 мПа⋅с до 127 мПа⋅с.
Фигура 5 иллюстрирует, что тип коллоидного диоксида кремния также влияет на скорость высвобождения действующего вещества. В рамках настоящего документа показано, что гидрофобный коллоидный диоксид кремния (Aerosil R972) существенно снижает скорость высвобождения по сравнению с гидрофильным коллоидным диоксидом кремния (Aerosil 200). Вопреки всему, гидрофобный диоксид кремния придает состава более низкую вязкость по сравнению с такой же составом, которая использует гидрофильный диоксид кремния. Это противоречит привычному пониманию в данной области.
Фигура 6 иллюстрирует, что тип используемого масла также влияет на скорость высвобождения действующего вещества.
Фигура 7 иллюстрирует распределение клоксациллина в различных тканях через два часа после его применения. В этом случае ткань определена как сохранившееся вымя непосредственно после доения, которое содержит внеклеточную жидкость, кровеносные сосуды, и, возможно, некоторое оставшееся молоко, которое осталось не выдоенным.
Фигуры 8 и 9 иллюстрируют каким образом различные действующие вещества также имеют влияние на профиль высвобождения действующего вещества, при всех прочих равных, по существу, условиях. На Фигуре 8 иллюстрировано, что когда клоксациллин в примере 1 состава заменяется на цефапирин (как показано в примере состава 2), профиль высвобождения, по существу, замедляется. На Фигуре 9 различия также были замечены между клоксациллином и тилозином. Это было действительно неожиданным результатом и свидетельствует о том, что высвобождение действующего вещества зависит от взаимодействия с возможной структурной сетью, образованной с некоторыми или со всеми вспомогательными веществами основы состава.
Фигуры 10-14 иллюстрируют, как WHP состава зависит от характерных особенностей состава.
Фигура 10 иллюстрирует, как увеличение количества коллоидного диоксида кремния от 1,75% до 3,00% в процентах по массе значительно изменяет WHP.
Фигура 11 иллюстрирует, что количество применений состава не оказывает влияния на WHP. WHP является приблизительно равным независимо от того, было животное обработано 6 раз через каждые 24 часа, или 3 раза через каждые 24 часа.
Фигура 12 иллюстрирует расчетный WHP в примере 1 состава в соответствии с нормативными документами ACVM (Сельскохозяйственные соединения и ветеринарные препараты).
Фигура 13 иллюстрирует сравнение эффективности состава в примере 1 и NitroClox™ LA. Особый интерес заключается в том, что после каждого применения количество действующего вещества является более высоким при введении состава согласно примеру 1, чем при введении NitroClox™ LA, что указывает на более высокую биодоступность примера 1 состава через 24 часа после применения. Аналогично NitroClox™ LA, концентрация состава примера 1 не снижается ниже MIC 90 (сплошная линия) через 24 часа после применения, но более быстро удаляется из молока после последнего применения в 0 часов.
Фигура 14 отражает результаты, которые иллюстрированы на Фигуре 13. Пример 1 состава рассчитывает иметь WHP, который составляет всего 72 часа по сравнению со 108 часами для NitroClox™ LA.
Фигура 15 сравнивает пример 1 состава с Orbenin™ LA, хотя и с разной лечебной схемой (6 применений через каждые 24 часа против 3-х применений через каждые 48 часов, соответственно). Видно, что несмотря на то, что лечебная схема с использованием состава примера 1 обеспечивает более продолжительный и постоянный уровень действующего вещества в молоке по сравнению с лечебной схемой с использованием Orbenin™ LA, действующее вещество высвобождается из молока гораздо быстрее после последнего применения. Как можно видеть, последнее применение Orbenin™ LA происходит через 96 часов, в то время как последнее применение состава примера 1 происходит через 120 часов; при этом обеспечивается более длительный период лечения. Фигура 16 иллюстрирует, что вычисленный WHP составляет 12 часов и на 24 часа короче при лечебной схеме 6 введений через 24 часа примера 1 состава по сравнению с лечебными схемами Orbenin 3 введения через 48 час и 5 введений через 24 часа, соответственно.
ЧАСТЬ 3: способ изготовления
a) Смешивают Miglyol 812, метилпарабен, пропилпарабен и Span80 так, чтобы образовать гомогенную масляную смесь.
b) Стерилизуют смесь при 140°C в течение 3 часов и затем охлаждают до комнатной температуры.
c) В отдельный контейнер загружают необходимое количество Aerosil R972 Pharma.
d) Стерилизуют при 140°C в течение 3 часов и затем охлаждают до комнатной температуры.
e) Диспергируют и гомогенизируют клоксациллин натрия в простерилизованной масляной смеси.
f) Диспергируют стерилизованный Aerosil R972 Pharma в простерилизованной масляной суспензии.
g) Гомогенизируют смесь.
ЧАСТЬ 3: исследование на животных
Часть исследования было начата в ноябре 2011 года, была исследована эффективность лекарственной формы препарата по примеру 18, как подробно описано ниже, при лечении мастита крупного рогатого скота.

Животные, используемые в исследовании, являлись молочными коровами с диагнозом клинического мастита. В день 0 были получены образцы молока для бактериологического анализа и животных обрабатывали путем интрамаммарной инфузии по примеру 18 три раза через каждые 24 часа. Доза для каждого применения составляла 200 мг клоксациллина в виде натриевой соли.
На 28-й и 35-й дни были получены дополнительные пробы молока для бактериологического анализа, чтобы определить показатель эффективности лечения. Для успешного бактериологического излечения требуется клиническое излечение животного от мастита и отсутствие в анализах на 28-й день и 35-й день возбудителя, который был идентифицирован в день 0.
Промежуточные результаты были получены по состоянию на 1 ноября 2012 года, при этом представлено бактериологическое излечение 69,6% из 100 коров, отобранных для исследования с клиническим маститом, которых лечили по примеру 18, и у которых на момент отбора были идентифицированы грамположительные бактерии.
О сопоставимом исследовании сообщает MD Wraight, New Zealand Veterinary Journal 51(1), 26-32, 2003 "A comparative efficacy trial between cefuroxime and cloxacillin as intramammary treatments for clinical mastitis in lactating cows on commercial dairy farms". В этом исследовании 200 мг клоксациллина в лекарственной форме пролонгированного действия препарата вводили интрамаммарно каждые 48 часов в течение трех раз, что привело к бактериологическому излечению в 64,3% случаев.
Промежуточные результаты исследования по примеру 18 демонстрируют высокую эффективность составов согласно настоящему изобретению даже по сравнению с более интенсивными применениями препарата пролонгированного действия с использованием того же самого действующего вещества. Это указывает на то, что достигнут преимущественный более короткий период ожидания посредством использования состава согласно настоящему изобретению без уменьшения или снижения эффективности лечения.
ЧАСТЬ 4: стабильность лекарственной формы препарата
Исследование стабильности проводили на трех партиях препарата по примеру 18. Эти партии были упакованы в полиэтиленовые шприцы емкостью 5 мл и хранились при специально созданных температурах хранения и условиях влажности, при 25°C/60% относительной влажности, 30°C/65% относительной влажности и 40°C/75% относительной влажности. Физические и химические характеристики партий были запротоколированы через равные промежутки времени в соответствии с рекомендациями ACVM. На основе данных по стабильности при температуре хранения 25°C ожидаемый срок годности составляет не менее 18 месяцев.
Аспекты настоящего изобретения были описаны только в качестве примера и следует понимать, что модификации и дополнения могут быть сделаны в нем без отступления от объема изобретения, как определено в прилагаемой формуле изобретения.
Реферат
Настоящее изобретение относится к составу для лечения или профилактики мастита в течение периода лактации домашнего животного. Состав содержит терапевтически эффективное количество по меньшей мере одного действующего вещества и основу, содержащую коллоидный диоксид кремния в концентрации от 0,1 до 5% мас., по меньшей мере одно масло и по меньшей мере одно поверхностно-активное вещество в концентрации от 0,01 до 10% мас. Действующее вещество выбрано из группы антибиотиков, состоящей из бета-лактамов, пенициллинов, цефалоспоринов, аминогликозидов, хинолонов, сульфонамидов, тетрациклинов, макролидов и их комбинаций. Масло выбрано из группы, состоящей из триглицеридов, легкого вазелинового масла, этилолеата, кунжутного масла и арахисового масла. В составе по изобретению коллоидный диоксид кремния диспергирован в масле. Вязкость состава составляет менее 1000 мПа⋅с при скорости сдвига 100 1/с и при температуре 20°C. Также описан способ изготовления состава и применение состава для лечения или профилактики мастита у нуждающегося в этом животного. Состав по изобретению обеспечивает контролируемое высвобождение действующего вещества из композиции с низкой вязкостью. 4 н. и 20 з.п. ф-лы, 16 ил., 18 пр.
Формула
Документы, цитированные в отчёте о поиске
Диспергируемые фармацевтические композиции

Комментарии