Модифицированная рнк, кодирующая полипептиды vegf-a, составы, содержащие ее, и пути их применения - RU2756313C2
Код документа: RU2756313C2
Чертежи

















































Описание
1. ОБЛАСТЬ ТЕХНИКИ
[001] Настоящее изобретение относится к модифицированным молекулам РНК, кодирующим полипептиды VEGF-A, и к составам, содержащим модифицированную РНК. Кроме того, аспекты настоящего изобретения относятся к способам получения и путям применения составов, содержащих модифицированную РНК, в лечении субъектов, страдающих от заболеваний, реагирующих на терапию с помощью VEGF-A.
2. ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[002] Пути с участием фактора роста эндотелия сосудов A (VEGF-A) играют центральную роль в контроле сердечно-сосудистой физиологической функции в целом и в артериогенезе, в частности. Функции VEGF-A предусматривают роль в активации передачи сигнала с участием оксида азота (NO), сосудистой проницаемости, опухолевом ангиогенезе, артериогенезе, эндотелиальной репликации и переключении клеточной дифференцировки у мультипотентных сердечно-сосудистых предшественников. Несмотря на то, что ингибирование путей с участием VEGF-A за счет как малых молекул, так и антител уже стало стандартом лечения выбранных форм рака и дегенерации желтого пятна, все еще сохраняются сложности в раскрытии потенциала усиления путей с участием VEGF-A для обеспечения потенциальных терапевтических эффектов, которые включают расслабление гладкой мускулатуры, стимуляцию образования новых сосудов и потенциально реверсию патологий в сосудистом ответе, связанных с сосудистыми осложнениями диабета.
[003] В связи с этим, было перепробовано множество различных способов, обеспечивающих возможность клинически приемлемых подходов к контролю пространственной и временной экспрессии VEGF-A в тканях-мишенях. Однако каждый из подходов имеет значительные недостатки: системные подходы на основе белка VEGF-A могут приводить к значительной гипотензии, a VEGF-A быстро разрушается; VEGF-A, инкапсулированый в вирус, и "голые" ДНК-плазмиды с ним имеют ограниченный временный контроль экспрессии белка, а эффективность in vivo экспрессии может сильно варьировать и не зависит от дозы; аденовирусные векторы могут активировать иммунную систему; и "голая" РНК является лабильной, характеризуются низкими уровнями трансфекции и также может запускать иммунную активацию. Вследствие этого такие недостатки ограничивают применимость VEGF-A в качестве терапевтической платформы.
[004] В некоторых предыдущих исследованиях in vivo применение терапевтических РНК, например siRNA, зависело от использования липидных наночастиц (LNP) для защиты мРНК от разложения, а также для эффективной трансфекции. Кроме того, попытки достичь терапевтических уровней терапевтического средства на основе RNAi в органах, отличных от печени, приводили к реакциям гиперчувствительности, связанным с инфузией, а также к гепатотоксичности, что, тем самым, ограничивало их применение для терапии заболеваний в других системах органов (Rudin С.М. et al., Clin. Cancer Res., (2004) 10, 7244-7251). Кроме того, в выбранных случаях для терапевтических путей применения в клинических условиях использовали другие варианты этих LNP, но они могли вызывать дозозависимое повреждение тканей (Coelho Т. et al., N Engl J Med, (2013) 369, 819-829). Примеры таких дозозависимых эффектов токсичности, обусловленных некоторыми липидосодержащими фармацевтическими составами нуклеиновых кислот, включают реакции, связанные с инфузией, такие как одышка, гипоксия, дрожь, боль в спине, гипотензия и поражение печени. Более того, хотя катионные липиды, как правило, включают в липидные составы терапевтических средств на основе РНК, например siRNA, для улучшения инкапсуляции и стабильности РНК, некоторые такие липиды могут проявлять такие типы дозозависимой токсичности, как нарушение целостности структуры мембран, лизис и некроз клеток и/или изменение экспрессии множественных генов нежелательным образом (Xue H.Y., Curr Pharm Des., (2015) 21(22):3140-7). Также документальными доказательствами были подтверждены типы дозозависимой системной токсичности липоплексов на уровне доклинических и клинических исследований. Захват липоплексов клетками Купфера в печени может запускать воспалительные реакции, которые могут наносить повреждения печени и приводить к повышению уровней основных функциональных показателей печени. Также могут наблюдаться лейкопения и тромбоцитопения (Zhang J., Adv Drug Deliv Rev., (2005) 57(5):689-698). Более того, липофектамин вызывает иммунную/воспалительную реакцию и гибель клеток.
[005] Соответственно, чтобы избежать потенциальной иммуногенности РНК и типов дозозависимой токсичности, связанных с некоторыми LNP, необходимы альтернативные, менее токсичные составы модифицированных РНК, кодирующих полипептиды VEGF-A, для доставки модифицированных РНК на терапевтически приемлемых уровнях при лечении субъектов, страдающих от заболеваний, реагирующих на терапию с помощью VEGF-A.
3. КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[006] Настоящее изобретение относится к модифицированным молекулам РНК, кодирующим полипептиды VEGF-A, и к составам, содержащим модифицированную РНК. Также раскрыты следующие преимущества VEGF-A-кодирующей модифицированной РНК в этих составах с точки зрения экспрессии белка, получения терапевтических средств с меньшей токсичностью и обеспечения инструментов, применимых в лечение субъектов, страдающих от заболеваний, реагирующих на терапию с помощью VEGF-A.
[007] Определенные варианты осуществления настоящего изобретения кратко описаны ниже. Данный перечень является только иллюстративным и не исчерпывает все варианты осуществления, представленные в настоящем изобретении.
[008] Вариант осуществления 1. Композиция, содержащая модифицированную РНК, предпочтительно модифицированную РНК под SEQ ID NO: 1, кодирующую полипептид VEGF-A под SEQ ID NO: 2, и буфер, предпочтительно цитратно-солевой буфер, забуференный фосфатом солевой (PBS) буфер или трометаминовый (ТНАМ) буфер, где буфер практически не содержит двухвалентных катионов.
[009] Вариант осуществления 2. Состав, содержащий фармацевтически приемлемое количество модифицированной РНК, предпочтительно модифицированной РНК под SEQ ID NO: 1, кодирующей полипептид VEGF-A под SEQ ID NO: 2, и буфер, предпочтительно цитратно-солевой буфер, забуференный фосфатом солевой (PBS) буфер или трометаминовый (ТНАМ) буфер, где буфер практически не содержит двухвалентных катионов.
[010] Вариант осуществления 3. Состав по варианту осуществления 2, где указанный буфер, практически не содержащий двухвалентные катионы, представляет собой цитратно-солевой буфер.
[011] Вариант осуществления 4. Состав по варианту осуществления 3, где цитратно-солевой буфер практически не содержит кальций и магний.
[012] Вариант осуществления 5. Состав по варианту осуществления 3, где цитратно-солевой буфер не содержит кальций или магний.
[013] Вариант осуществления 6. Состав по варианту осуществления 2, дополнительно содержащий фармацевтически приемлемое вспомогательное вещество.
[014] Вариант осуществления 7. Состав по варианту осуществления 6, где фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей.
[015] Вариант осуществления 8. Способ лечения субъекта, страдающего от заболевания, реагирующего на терапию с помощью VEGF-A, предусматривающий введение субъекту композиции согласно варианту осуществления 1, и/или состава согласно любому из вариантов осуществления 2-7.
[016] Вариант осуществления 9. Способ по варианту осуществления 8, где буфер, который практически не содержит двухвалентных катионов, в указанных композиции или составе представляет собой цитратно-солевой буфер.
[017] Вариант осуществления 10. Способ по варианту осуществления 9, где цитратно-солевой буфер практически не содержит кальций и магний.
[018] Вариант осуществления 11. Способ по варианту осуществления 9, где цитратно-солевой буфер не содержит кальций или магний.
[019] Вариант осуществления 12. Способ по варианту осуществления 8, где состав дополнительно содержит фармацевтически приемлемое вспомогательное вещество.
[020] Вариант осуществления 13. Способ по варианту осуществления 12, где фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей.
[021] Вариант осуществления 14. Способ по варианту осуществления 8, где заболевание выбрано из сердечной недостаточности со сниженной или сохраненной фракцией выброса, заболевания почек, заболевания, связанного с пересадкой кожи и пересадкой ткани, сердечной дисфункции после MI, ишемической болезни сердца, повреждения сосудов в результате травмы или хирургического вмешательства, кожной язвы, в том числе диабетической язвы, критической ишемии конечностей, легочной гипертензии и болезни периферических артерий.
[022] Вариант осуществления 15. Способ по варианту осуществления 8, где заболевание представляет собой сердечную недостаточность со сниженной или сохраненной фракцией выброса.
[023] Вариант осуществления 16. Способ по варианту осуществления 8, где заболевание представляет собой сердечную дисфункцию после MI.
[024] Вариант осуществления 17. Способ по варианту осуществления 8, где заболевание представляет собой ишемическую болезнь сердца.
[025] Вариант осуществления 18. Способ по варианту осуществления 8, где заболевание представляет собой повреждение сосудов в результате травмы или хирургического вмешательства.
[026] Вариант осуществления 19. Способ по варианту осуществления 8, где заболевание представляет собой кожную язву, в том числе диабетическую язву.
[027] Вариант осуществления 20. Способ варианта осуществления 8, где заболевание представляет собой критическую ишемию конечностей.
[028] Вариант осуществления 21. Способ по варианту осуществления 8, где заболевание представляет собой легочную гипертензию.
[029] Вариант осуществления 22. Способ по варианту осуществления 8, где заболевание представляет собой болезнь периферических артерий.
[030] Вариант осуществления 23. Способ по варианту осуществления 8, где композицию или состав вводят субъекту с помощью внутримышечного, внутрикожного, подкожного, интракардиального или эпикардиального пути введения, через катетер воротной вены, через катетер коронарного синуса и/или путем непосредственного введения в область, подлежащую лечению.
[031] Вариант осуществления 24. Способ по варианту осуществления 8, где композицию или состав вводят субъекту внутримышечно.
[032] Вариант осуществления 25. Способ по варианту осуществления 8, где композицию или состав вводят субъекту внутрикожно.
[033] Вариант осуществления 26. Способ по варианту осуществления 8, где композицию или состав вводят субъекту подкожно.
[034] Вариант осуществления 27. Способ по варианту осуществления 8, где композицию или состав вводят субъекту интракардиально или эпикардиально, предпочтительно при фиксированной дозе в виде нескольких введений.
[035] Вариант осуществления 28. Способ по варианту осуществления 8, где композицию или состав вводят субъекту через катетер воротной вены, предпочтительно при фиксированной дозе в виде нескольких введений.
[036] Вариант осуществления 29. Способ по варианту осуществления 8, где композицию или состав вводят субъекту через катетер коронарного синуса, предпочтительно при фиксированной дозе в виде нескольких введений.
[037] Вариант осуществления 30. Способ по варианту осуществления 8, где композицию или состав вводят субъекту путем непосредственного введения в область, подлежащую лечению, предпочтительно при фиксированной дозе в виде нескольких введений.
[038] Вариант осуществления 31. Способ по варианту осуществления 8, где композиция или состав содержат модифицированную РНК при концентрации от 0,1 до 1 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[039] Вариант осуществления 32. Способ по варианту осуществления 8, где композиция или состав содержат модифицированную РНК при концентрации от 1 до 10 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[040] Вариант осуществления 33. Способ по варианту осуществления 8, где композиция или состав содержат модифицированную РНК при концентрации от 10 до 50 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[041] Вариант осуществления 34. Способ по варианту осуществления 9, где композиция или состав с цитратно-солевым буфером являются менее токсичными для субъекта, чем липидосодержащие композиция или состав.
[042] Вариант осуществления 35. Способ модуляции физиологического процесса в клетке млекопитающего, его ткани или субъекте-млекопитающем, предусматривающий приведение указанных клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[043] Вариант осуществления 36. Способ по варианту осуществления 35, где модуляция выбрана из индуцирования ангиогенеза, стимуляции пролиферации васкулярных клеток, усиления пролиферации и/или изменения развития клеток-предшественников эпикардиального происхождения, активации эндотелизации, индуцирования сердечной регенерации, усиления реваскуляризации тканевых лоскутов для заживления раны, улучшения сосудистой функции, усиления тканевой перфузии и образования новых сосудов, уменьшения рубцовой ткани и улучшения сердечной функции.
[044] Вариант осуществления 37. Способ по варианту осуществления 35, где модуляция предусматривает индуцирование ангиогенеза.
[045] Вариант осуществления 38. Способ по варианту осуществления 35, где модуляция предусматривает стимуляцию пролиферации васкулярных клеток.
[046] Вариант осуществления 39. Способ по варианту осуществления 35, где модуляция предусматривает усиление пролиферации и/или изменение развития клеток-предшественников эпикардиального происхождения.
[047] Вариант осуществления 40. Способ по варианту осуществления 35, где модуляция предусматривает активацию эндотелизации.
[048] Вариант осуществления 41. Способ по варианту осуществления 35, где модуляция предусматривает индуцирование сердечной регенерации.
[049] Вариант осуществления 42. Способ по варианту осуществления 35, где модуляция предусматривает усиление реваскуляризации тканевых лоскутов для заживления раны.
[050] Вариант осуществления 43. Способ по варианту осуществления 35, где модуляция предусматривает улучшение сосудистой функции.
[051] Вариант осуществления 44. Способ по варианту осуществления 35, где модуляция предусматривает усиление тканевой перфузии и образование новых сосудов.
[052] Вариант осуществления 45. Способ по варианту осуществления 35, где модуляция предусматривает уменьшение рубцовой ткани.
[053] Вариант осуществления 46. Способ по варианту осуществления 35, где модуляция предусматривает улучшение сердечной функции.
[054] Вариант осуществления 47. Способ по варианту осуществления 35, где буфер, который практически не содержит двухвалентных катионов, в указанных композиции или составе представляет собой цитратно-солевой буфер.
[055] Вариант осуществления 48. Способ по варианту осуществления 47, где цитратно-солевой буфер практически не содержит кальций и магний.
[056] Вариант осуществления 49. Способ по варианту осуществления 47, где цитратно-солевой буфер не содержит кальций или магний.
[057] Вариант осуществления 50. Способ по варианту осуществления 35, где композиция или состав содержат модифицированную РНК при концентрации от 0,1 до 1 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[058] Вариант осуществления 51. Способ по варианту осуществления 35, где композиция или состав содержат модифицированную РНК при концентрации от 1 до 10 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[059] Вариант осуществления 52. Способ по варианту осуществления 35, где композиция или состав содержат модифицированную РНК при концентрации от 10 до 50 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[060] Вариант осуществления 53. Способ экспрессии VEGF-A в клетке млекопитающего или его ткани, предусматривающий приведение указанных клетки млекопитающего или его ткани в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[061] Вариант осуществления 54. Способ по варианту осуществления 53, где буфер, который практически не содержит двухвалентных катионов, в указанных композиции или составе представляет собой цитратно-солевой буфер.
[062] Вариант осуществления 55. Способ по варианту осуществления 54, где цитратно-солевой буфер практически не содержит кальций и магний.
[063] Вариант осуществления 56. Способ по варианту осуществления 54, где цитратно-солевой буфер не содержит кальций или магний.
[064] Вариант осуществления 57. Способ по варианту осуществления 53, где композиция или состав содержат модифицированную РНК при концентрации от 0,1 до 1 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[065] Вариант осуществления 58. Способ по варианту осуществления 53, где композиция или состав содержат модифицированную РНК при концентрации от 1 до 10 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[066] Вариант осуществления 59. Способ по варианту осуществления 53, где композиция или состав содержат модифицированную РНК при концентрации от 10 до 50 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[067] Вариант осуществления 60. Способ получения VEGF-A у субъекта, предусматривающий введение указанному субъекту композиции согласно варианту осуществления 1 и/или состава согласно любому из вариантов осуществления 2-7.
[068] Вариант осуществления 61. Способ по варианту осуществления 60, где буфер, который практически не содержит двухвалентных катионов, в указанных композиции или составе представляет собой цитратно-солевой буфер.
[069] Вариант осуществления 62. Способ по варианту осуществления 61, где цитратно-солевой буфер практически не содержит кальций и магний.
[070] Вариант осуществления 63. Способ по варианту осуществления 61, где цитратно-солевой буфер не содержит кальций или магний.
[071] Вариант осуществления 64. Способ по варианту осуществления 60, где состав дополнительно содержит фармацевтически приемлемое вспомогательное вещество.
[072] Вариант осуществления 65. Способ по варианту осуществления 64, где фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей.
[073] Вариант осуществления 66. Способ по варианту осуществления 60, где субъект страдает от заболевания, реагирующего на терапию с помощью VEGF-А.
[074] Вариант осуществления 67. Способ по варианту осуществления 66, где заболевание выбрано из сердечной недостаточности со сниженной или сохраненной фракцией выброса, заболевания почек, заболевания, связанного с пересадкой кожи и пересадкой ткани, сердечной дисфункции после MI, ишемической болезни сердца, повреждения сосудов в результате травмы или хирургического вмешательства, кожной язвы, в том числе диабетической язвы, критической ишемии конечностей, легочной гипертензии и болезни периферических артерий.
[075] Вариант осуществления 68. Способ по варианту осуществления 66, где заболевание представляет собой сердечную недостаточность со сниженной или сохраненной фракцией выброса.
[076] Вариант осуществления 69. Способ по варианту осуществления 66, где заболевание представляет собой сердечную дисфункцию после MI.
[077] Вариант осуществления 70. Способ по варианту осуществления 66, где заболевание представляет собой ишемическую болезнь сердца.
[078] Вариант осуществления 71. Способ по варианту осуществления 66, где заболевание представляет собой повреждение сосудов в результате травмы или хирургического вмешательства.
[079] Вариант осуществления 72. Способ по варианту осуществления 66, где заболевание представляет собой кожную язву, в том числе диабетическую язву.
[080] Вариант осуществления 73. Способ варианта осуществления 66, где заболевание представляет собой критическую ишемию конечностей.
[081] Вариант осуществления 74. Способ по варианту осуществления 66, где заболевание представляет собой легочную гипертензию.
[082] Вариант осуществления 75. Способ по варианту осуществления 66, где заболевание представляет собой болезнь периферических артерий.
[083] Вариант осуществления 76. Способ по варианту осуществления 60, где композицию или состав вводят субъекту с помощью внутримышечного, внутрикожного, подкожного, интракардиального или эпикардиального пути введения, через катетер воротной вены, через катетер коронарного синуса и/или путем непосредственного введения в область, подлежащую лечению.
[084] Вариант осуществления 77. Способ по варианту осуществления 60, где композицию или состав вводят субъекту внутримышечно.
[085] Вариант осуществления 78. Способ по варианту осуществления 60, где композицию или состав вводят субъекту внутрикожно.
[086] Вариант осуществления 79. Способ по варианту осуществления 60, где композицию или состав вводят субъекту подкожно.
[087] Вариант осуществления 80. Способ по варианту осуществления 60, где композицию или состав вводят субъекту интракардиально или эпикардиально, предпочтительно при фиксированной дозе в виде нескольких введений.
[088] Вариант осуществления 81. Способ по варианту осуществления 60, где композицию или состав вводят субъекту через катетер воротной вены, предпочтительно при фиксированной дозе в виде нескольких введений.
[089] Вариант осуществления 82. Способ по варианту осуществления 60, где композицию или состав вводят субъекту через катетер коронарного синуса, предпочтительно при фиксированной дозе в виде нескольких введений.
[090] Вариант осуществления 83. Способ по варианту осуществления 60, где композицию или состав вводят субъекту путем непосредственного введения в область, подлежащую лечению, предпочтительно при фиксированной дозе в виде нескольких введений.
[091] Вариант осуществления 84. Способ по варианту осуществления 60, где композиция или состав содержат модифицированную РНК при концентрации от 0,1 до 1 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[092] Вариант осуществления 85. Способ по варианту осуществления 60, где композиция или состав содержат модифицированную РНК при концентрации от 1 до 10 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[093] Вариант осуществления 86. Способ по варианту осуществления 60, где композиция или состав содержат модифицированную РНК при концентрации от 10 до 50 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[094] Вариант осуществления 87. Способ получения композиции или состава, предусматривающий объединение модифицированной РНК, предпочтительно модифицированной РНК под SEQ ID NO: 1, кодирующей полипептид VEGF-A под SEQ ID NO: 2, с буфером, предпочтительно цитратно-солевым буфером, забуференным фосфатом солевым (PBS) буфером или трометаминовым (ТНАМ) буфером, в композицию или состав, где буфер практически не содержит двухвалентных катионов, и где композиция или состав являются эффективными для лечения субъекта, страдающего от заболевания, реагирующего на терапию с помощью VEGF-A.
[095] Вариант осуществления 88. Способ по варианту осуществления 87, где цитратно-солевой буфер практически не содержит кальций и магний.
[096] Вариант осуществления 89. Способ по варианту осуществления 87, где цитратно-солевой буфер не содержит кальций или магний.
[097] Вариант осуществления 90. Способ по варианту осуществления 87, где композиция или состав содержат модифицированную РНК при концентрации от 0,1 до 1 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[098] Вариант осуществления 91. Способ по варианту осуществления 87, где композиция или состав содержат модифицированную РНК при концентрации от 1 до 10 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[099] Вариант осуществления 92. Способ по варианту осуществления 87, где композиция или состав содержат модифицированную РНК при концентрации от 10 до 50 мкг/мкл, предпочтительно составленную в цитратно-солевом буфере.
[0100] Вариант осуществления 93. Способ по варианту осуществления 87, где композиция или состав с цитратно-солевым буфером являются менее токсичными для субъекта, чем липидосодержащие композиция или состав.
[0101] Вариант осуществления 94. Способ снижения токсичности при лечении с помощью VEGF-A у субъекта, предусматривающий составление модифицированной РНК, предпочтительно модифицированной РНК под SEQ ID NO: 1, кодирующей полипептид VEGF-A под SEQ ID NO: 2, с буфером, предпочтительно цитратно-солевым буфером, забуференным фосфатом солевым (PBS) буфером или трометаминовым (ТНАМ) буфером, в композицию или состав, где буфер практически не содержит двухвалентных катионов.
[0102] Вариант осуществления 95. Способ по варианту осуществления 94, где цитратно-солевой буфер практически не содержит кальций и магний.
[0103] Вариант осуществления 96. Способ по варианту осуществления 94, где цитратно-солевой буфер не содержит кальций или магний.
[0104] Вариант осуществления 97. Последовательность нуклеиновой кислоты, содержащая матрицу in vitro транскрипции для получения модифицированной РНК, предпочтительно модифицированной РНК под SEQ ID NO: 1, кодирующей полипептид VEGF-A под SEQ ID NO: 2.
[0105] Вариант осуществления 98. Способ усиления заживления раны в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0106] Вариант осуществления 99. Способ индуцирования неоваскуляризации в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0107] Вариант осуществления 100. Способ индуцирования ангиогенеза в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0108] Вариант осуществления 101. Способ индуцирования расширения кровеносных сосудов в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0109] Вариант осуществления 102. Способ индуцирования активации тока крови в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0110] Вариант осуществления 103. Способ увеличения плотности капилляров и/или артериол в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
[0111] Вариант осуществления 104. Способ уменьшения фиброза в ткани млекопитающего или у субъекта, предусматривающий приведение указанных ткани млекопитающего или субъекта в контакт с композицией согласно варианту осуществления 1 и/или составом согласно любому из вариантов осуществления 2-7.
4. ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0112] Специалистам в данной области будет понятно, что графические материалы, описанные ниже, приведены исключительно с иллюстративной целью. Графические материалы не предназначены для ограничения объема идей настоящего изобретения каким-либо образом.
[0113] ФИГ. 1A и 1B. Структура (ФИГ. 1А) и последовательность (SEQ ID NO: 1, ФИГ. 1B) модифицированной РНК VEGF-A, используемая в примерах.
[0114] ФИГ. 2А, 2В и 2С. Трансфекция более высокой дозы модифицированной РНК привела к продукции большего количества белка VEGF-A в клетках гладкой мускулатуры аорты человека (ФИГ. 2А). Временная динамика продукции белка VEGF-A после трансфекции модифицированной РНК в клетках гладкой мускулатуры аорты человека (ФИГ. 2В). Продукция белка VEGF-A в фибробластах сердца мыши (ФИГ. 2С, левая панель) и эндотелиальных клетках свиньи (ФИГ. 2С, правая панель) после трансфекции модифицированной РНК.
[0115] ФИГ. 3А, 3В и 3С. Белок VEGF-A, продуцированный за счет модифицированной РНК VEGF-A, индуцировал фосфорилирование VEGFR2 в эндотелиальных клетках человека (ФИГ. 3А) и активацию нисходящих сигнальных путей eNOS в эндотелиальных клетках человека (ФИГ. 3В) и Akt в фибробластах сердца мыши (ФИГ. 3С).
[0116] ФИГ. 4А, 4В и 4С. Белок VEGF-A, продуцированный за счет модифицированной РНК VEGF-A, воздействует на некоторые важные стадии в процессе ангиогенеза. Белок VEGF-A, продуцируемый с помощью модифицированной РНК VEGF-A, усиливал пролиферацию (ФИГ. 4А) и миграцию (ФИГ. 4В) культивируемых эндотелиальных клеток человека. Белок VEGF-A, продуцируемый с помощью модифицированной РНК VEGF-A, усиливал прорастание кровеносных сосудов в 3D культуре с гранулами, покрытыми эндотелиальными клетками (ФИГ. 4С).
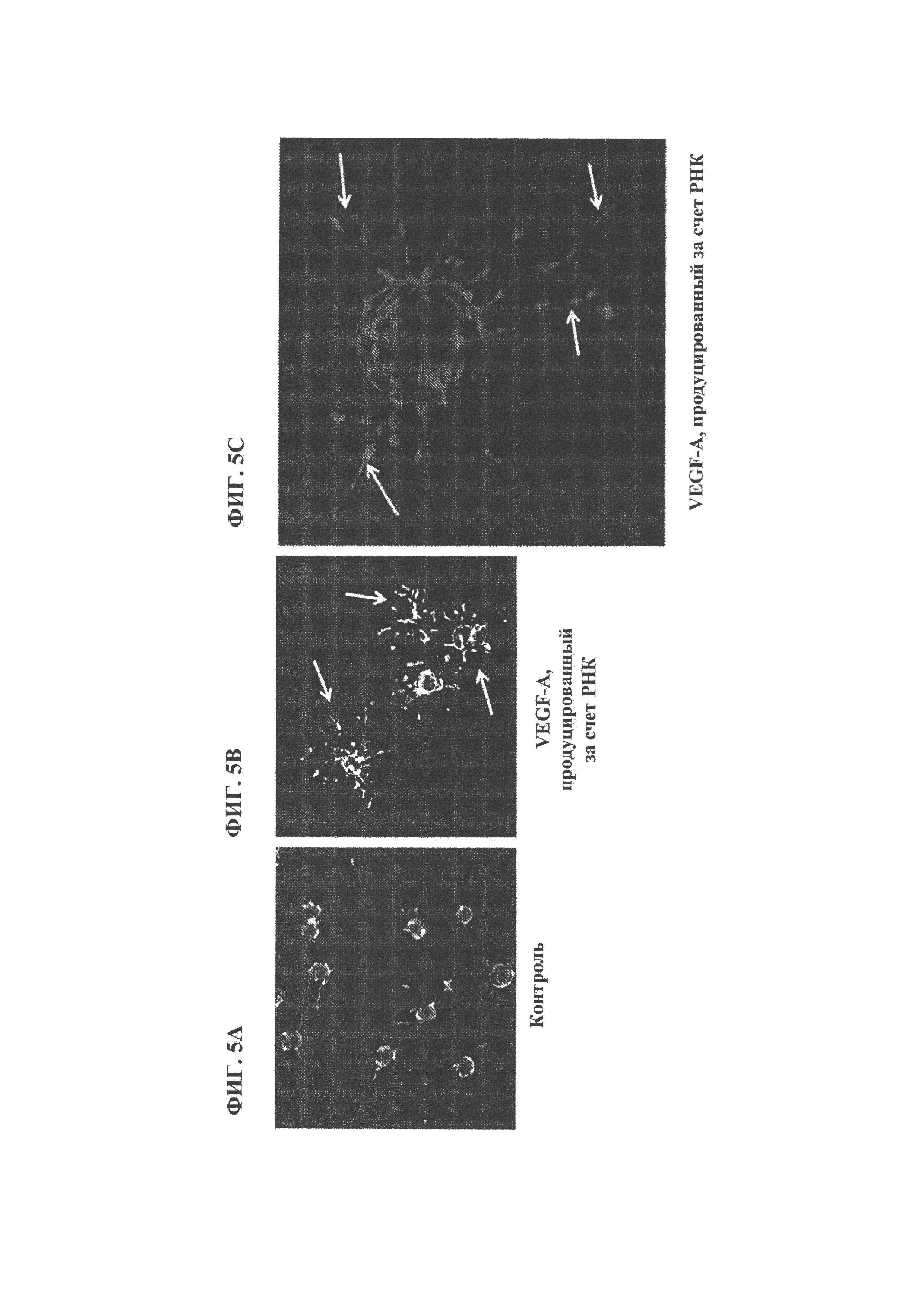
[0117] ФИГ. 5A, 5B и 5С. Изображения прорастания кровеносных сосудов из гранул, покрытых эндотелиальными клетками и обработанных контрольной средой (ФИГ. 5А) или кондиционированной средой с VEGF-A, продуцированным за счет модифицированной РНК (ФИГ. 5В). Увеличенный вид прорастания кровеносных сосудов из гранул, покрытых эндотелиальными клетками и обработанных VEGF-A, продуцированным за счет модифицированной РНК (ФИГ. 5С).
[0118] ФИГ. 6А, 6В и 6С. Сравнение окрашивания с помощью X-gal, являющегося показателем фермента β-галактозидазы, продуцируемого в сердце мышей после интракардиальной инъекции 50 мкл цитратного солевого раствора (ФИГ. 6А), модифицированной РНК LacZ, составленной в липофектамине (100 мкг, ФИГ. 6В) или в цитратно-солевом буфере (150 мкг, ФИГ. 6С).
[0119] ФИГ. 7. Оценка белка люциферазы, продуцируемого в сердце мышей после интракардиальной инъекции модифицированной РНК люциферазы светляка, составленной в забуференном фосфатом солевом растворе (PBS, n=3), цитратном солевом растворе (C/S, n=6) или трометамине, также известном как 2-амино-2-(гидроксиметил)-1,3-пропандиол (ТНАМ, n=3). Буферы PBS, C/S и ТНАМ (n=2/группа) использовали в качестве отрицательного контроля.
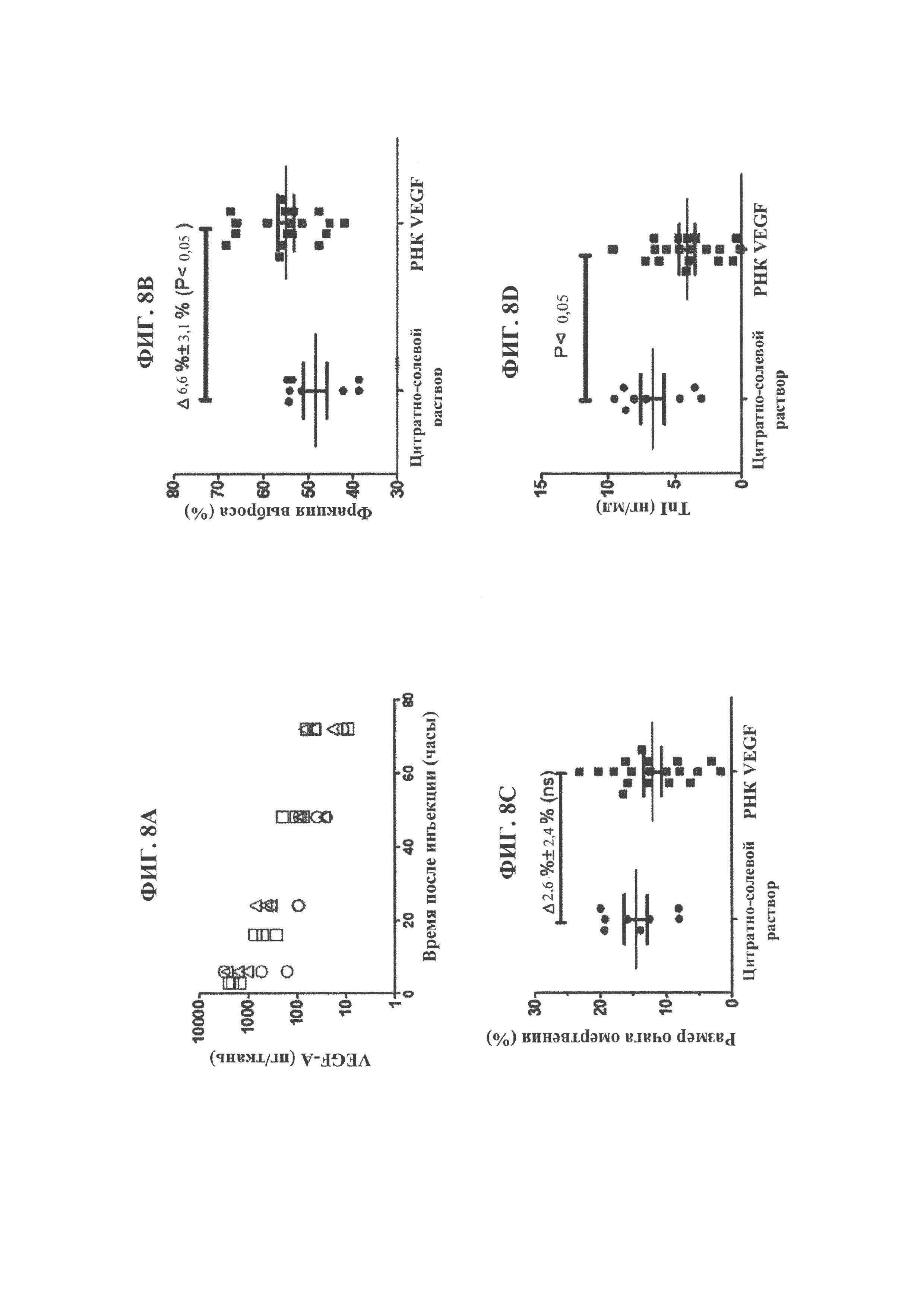
[0120] ФИГ. 8А, 8В, 8С и 8D. Уровни белка VEGF-A в сердце не подвергавшихся воздействию крыс в разные моменты времени после интракардиальной инъекции 15 мкг (кружки), 150 мкг (квадраты) или 1800 мкг (треугольники) модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе (ФИГ. 8А). Сравнение фракции выброса левого желудочка и размера очага омертвения (в виде % массы левого желудочка) у крыс, у которых вызывали инфаркт миокарда и которым вводили интракардиальную инъекцию цитратно-солевого раствора или модифицированной РНК VEGF-A (150 или 1800 мкг, составленной в цитратно-солевом растворе). Фракцию выброса (ФИГ. 8В) и размер очага омертвения (ФИГ. 8С) оценивали с помощью магнитно-резонансной визуализации сердца через 8 дней после индуцирования инфаркта и инъекции. Уровни кардиального тропонина I (TnI) в венозной крови, взятой от крыс через один день после индуцирования инфаркта миокарда и интракардиальной инъекции цитратно-солевого раствора или модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе (ФИГ. 8D).
[0121] ФИГ. 9А и 9В. Типичные образцы, собранные из свободной стенки левого желудочка у карликовых свиней Геттинген, которым вводили эпикардиальную инъекцию, содержащую модифицированную РНК LacZ (по 100 мкг в 3 отдельные участка инъекции). Ткань собирали через 6 часов после инъекции и окрашивали с помощью X-gal в течение 18 часов. На левом образце показано окрашивание в ткани, в которую инъецировали модифицированную РНК LacZ, составленную в липофектамине (ФИГ. 9А), а на правом образце - в ткани, в которую инъецировали модифицированную РНК LacZ, составленную в цитратно-солевом растворе (ФИГ. 9В), соответственно.
[0122] ФИГ. 10. Белок VEGF-A человека в образцах ткани левого желудочка свиньи через 6 часов после эпикардиальной инъекции варьирующих доз модифицированной РНК VEGF-A у карликовых свиней Геттинген.
[0123] ФИГ. 11A, 11B, 11С, 11D, 11E, 11F и 11G. Трансфекция модифицированной РНК LacZ и люциферазы, находящейся в цитратно-солевом буфере, и ее трансляция в сердце. 75 мкг модифицированной РНК LacZ, находящейся в цитратно-солевом буфере, инъецировали в сердце мыши. Продукция β-галактозидазы наблюдалась в приблизительно 10% левых желудочков сердца (типичные изображения на ФИГ. 11А, ФИГ. 11С и ФИГ. 11D). На увеличенном виде окрашивания с помощью X-gal показана продукция β-галактозидазы в сердце после инъекции модифицированной РНК LacZ (ФИГ. 11В). Модифицированную РНК люциферазы инъецировали в сердце. Посредством РНК-гибридизации in situ с применением люциферазного зонда выявили присутствие модифицированной РНК люциферазы в участке инъекции в миокарде (ФИГ. 11Е). Увеличенный вид РНК-гибридизации in situ с применением люциферазного зонда, на котором показано присутствие модифицированной РНК люциферазы (ФИГ. 11F). Посредством иммуногистохимии выявила экспрессию белка люциферазы в участке инъекции в миокарде после инъекции модифицированной РНК люциферазы (ФИГ. 11G).
[0124] ФИГ. 12А, 12В и 12С. Экспрессия белка VEGF-A после инъекции в сердце модифицированной РНК, находящейся в цитратно-солевом буфере, является насыщаемой и характеризуется аналогичными фармакокинетическими показателями у нескольких видов. Фармакокинетические показатели белка VEGF-А после однократных инъекций в сердце модифицированной РНК VEGF-A, составленной в цитратно-солевом буфере (NTB) по сравнению с липофектамином (LNP), у мыши на протяжении 72 часов (ФИГ. 12А). Межвидовое сравнение уровней белка VEGF-A после введения возрастающих доз модифицированной РНК VEGF-A в цитратном солевом растворе (ФИГ. 12В). Фармакокинетические показатели для белка VEGF-A, продуцируемого за счет возрастающих доз модифицированной РНК VEGF-A, у крысы. Измерения площади под кривой (AUC) для белка VEGF-A, продуцируемого через 72 часа (ФИГ. 12С).
[0125] ФИГ. 13А и 13В. Оценка продукции белка VEGF-A человека после интракардиальной инъекции модифицированной РНК VEGF-A человека у мыши, крысы и свиньи. Величина и временные профили (0-72 часа на ФИГ. 13А и 0-192 часа на ФИГ. 13В) уровня белка VEGF-A, продуцируемого в сердце мыши (закрашенные квадраты), крысы (закрашенные звездочки) и свиньи (закрашенные кружочки) после интракардиальной инъекции 100 мкг модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе. Показаны значения геометрического среднего ± SD.
[0126] ФИГ. 14. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на фракцию выброса (EF) левого желудочка у карликовых свиней, у которых вызвали инфаркт миокарда. Серийные оценки EF выполняли перед (BF) и после (AF) постоянной окклюзии левой передней нисходящей коронарной артерии. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Последующую оценку EF выполняли затем во время инъекции исследуемого лекарственного средства через 7 дней после окклюзии (7D AF) и еще раз через 2 месяца (2 МО AF). В момент 7D AF свиней рандомизировали для получения 20 эпикардиальных инъекций (по 100 мкл каждая), содержащих либо цитратно-солевой раствор (закрашенные квадраты, n=8), либо модифицированную РНК VEGF-A при общей дозе 1 мг (закрашенные кружки, n=8) или 10 мг (закрашенные треугольники, n=8), или рекомбинантный белок VEGF-A человека, составленный в самособирающихся нановолокнах (закрашенные ромбы, n=5), соответственно. *; Р<0,05 в сравнении с контрольной группой, обработанной цитратно-солевым раствором, в момент 2 МО AF, **; Р<0,01 в сравнении с контрольной группой, обработанной цитратно-солевым раствором, в момент 2 МО AF,



[0127] ФИГ. 15. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на развитие максимального давления в левом желудочке в динамике по времени (dP/dt max) у карликовых свиней, у которых вызвали инфаркт миокарда. Карликовых свиней подвергли постоянной окклюзии левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Через семь дней подвергшихся инфаркту свиней рандомизировали в группы "слепой" эпикардиальной инъекции, содержащей среду-носитель, представляющий собой цитратно-солевой раствор (2 мл, закрашенные квадраты), 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантный белок VEGF-A человека (200 нг), составленный в самособирающихся нановолокнах (закрашенные ромбы). Указанную дозу/объем вводили в виде 20 отдельных инъекций (по 100 мкл каждая) в периинфарктную область. Функцию левого желудочка измеряли инвазивным путем через 2 месяца после инъекции. Показаны индивидуальные данные и средние значения ± SEM.
[0128] ФИГ. 16. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на развитие минимального давления в левом желудочке в динамике по времени (dP/dt min) у карликовых свиней, у которых вызвали инфаркт миокарда. Карликовых свиней подвергли постоянной окклюзии левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Через семь дней подвергшихся инфаркту свиней рандомизировали в группы "слепой" эпикардиальной инъекции, содержащей среду-носитель, представляющий собой цитратно-солевой раствор (2 мл, закрашенные квадраты), 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантный белок VEGF-A человека (200 нг), составленный в самособирающихся нановолокнах (закрашенные ромбы). Указанную дозу/объем вводили в виде 20 отдельных инъекций (по 100 мкл каждая) в периинфарктную область. Функцию левого желудочка измеряли инвазивным путем через 2 месяца после инъекции. Показаны индивидуальные данные и средние значения ± SEM.
[0129] ФИГ. 17. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на систолическую функцию (сократимость, ESPVR) у карликовых свиней, у которых вызвали инфаркт миокарда. Карликовых свиней подвергли постоянной окклюзии левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Через семь дней подвергшихся инфаркту свиней рандомизировали в группы "слепой" эпикардиальной инъекции, содержащей среду-носитель, представляющий собой цитратно-солевой раствор (2 мл, закрашенные квадраты), 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантный белок VEGF-A человека (200 нг), составленный в самособирающихся нановолокнах (закрашенные ромбы). Указанную дозу/объем вводили в виде 20 отдельных инъекций (по 100 мкл каждая) в периинфарктную область. Функцию левого желудочка измеряли инвазивным путем через 2 месяца после инъекции. Показаны индивидуальные данные и средние значения ± SEM.
[0130] ФИГ. 18. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на диастолическую функцию (растяжимость, EDPVR) у карликовых свиней, у которых вызвали инфаркт миокарда. Карликовых свиней подвергли постоянной окклюзии левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Через семь дней подвергшихся инфаркту свиней рандомизировали в группы "слепой" эпикардиальной инъекции, содержащей среду-носитель, представляющий собой цитратно-солевой раствор (2 мл, закрашенные квадраты), 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантный белок VEGF-A человека (200 нг), составленный в самособирающихся нановолокнах (закрашенные ромбы). Указанную дозу/объем вводили в виде 20 отдельных инъекций (по 100 мкл каждая) в периинфарктную область. Функцию левого желудочка измеряли инвазивным путем через 2 месяца после инъекции. Показаны индивидуальные данные и средние значения ± SEM.
[0131] ФИГ. 19. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на отношение задействованной систолической работы и преднагрузки (PRSW), у карликовых свиней, у которых вызвали инфаркт миокарда. Карликовых свиней подвергли постоянной окклюзии левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. У отдельной группы свиней проводили процедуру ложной операции без окклюзии коронарной артерии (незакрашенные кружки, n=5). Через семь дней подвергшихся инфаркту свиней рандомизировали в группы "слепой" эпикардиальной инъекции, содержащей среду-носитель, представляющий собой цитратно-солевой раствор (2 мл, закрашенные квадраты), 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантный белок VEGF-A человека (200 нг), составленный в самособирающихся нановолокнах (закрашенные ромбы). Указанную дозу/объем вводили в виде 20 отдельных инъекций (по 100 мкл каждая) в периинфарктную область. Функцию левого желудочка измеряли инвазивным путем через 2 месяца после инъекции. Показаны индивидуальные данные и средние значения ± SEM.
[0132] ФИГ. 20А, 20В и 20С. Эффекты модифицированной РНК VEGF-A человека и рекомбинантного VEGF-A человека на размер очага омертвения у карликовых свиней, у которых вызвали инфаркт миокарда. Размер очага омертвения представлен как общий размер очага омертвения в левом желудочке (срезы 2, 3, 4 и 5, ФИГ. 20А), размер очага омертвения в средней части левого желудочка (срезы 3 и 4, ФИГ. 20В) и размер очага омертвения в центральной части левого желудочка (срез 4, панель на ФИГ. 20С) у карликовых свиней, которым вводили эпикардиальную инъекцию, содержащую цитратно-солевой раствор (закрашенные квадраты) или 1 мг (закрашенные кружки) или 10 мг (закрашенные треугольники) модифицированной РНК VEGF-A или рекомбинантного белка VEGF-A человека (200 нг), составленного в самособирающихся нановолокнах (закрашенные ромбы). Введение инъекции осуществляли через 7 дней после индуцирования инфаркта миокарда путем постоянной окклюзии левой передней нисходящей коронарной артерии. Размер очага омертвения измеряли через 2 месяца после введения инъекции. Показаны средние значения ± SEM.
[0133] ФИГ. 21. Значения массы тела мышей в ходе испытания 1 из примера 14. Массу тела каждой мыши регистрировали в момент времени получения каждой фотографии. Данные представлены как средние значения ± SEM, черный столбик; однократная инъекция среды-носителя, заштрихованный столбик; двукратная инъекция среды-носителя, серый столбик; однократная инъекция модифицированной РНК VEGF-A, столбик в горизонтальную полоску; двукратная инъекция модифицированной РНК VEGF-A, *; р<0,05 для двукратной инъекции среды носителя в сравнении с однократной инъекцией среды-носителя.
[0134] ФИГ. 22. Измерения уровня глюкозы в крови натощак и после приема пищи у мышей в испытании 1 из примера 14. В день 0 уровень глюкозы в крови измеряли после четырехчасового периода голодания. В день 18 измеряли уровень глюкозы в крови после приема пищи. Данные представлены как средние значения ± SEM, черный столбик; однократная инъекция среды-носителя, заштрихованный столбик; двукратная инъекция среды-носителя, серый столбик; однократная инъекция модифицированной РНК VEGF-A, столбик в горизонтальную полоску; двукратная инъекция модифицированной РНК VEGF-A, *; р<0,05 для однократной инъекции модифицированной РНК VEGF-A в сравнении с однократной инъекцией среды-носителя.
[0135] ФИГ. 23. Кривая заживления раны для испытания 1 из примера 14. Среднюю нормализованную площадь открытой раны на основе медианных значений, полученных от трех наблюдателей, наносили на график в зависимости от дней после хирургического вмешательства. Данные представлены как средние значения ± SEM, *р<0,05 для двукратной инъекции модифицированной РНК VEGF-A (незакрашенный квадрат) в сравнении с однократной (закрашенный кружок) и двукратной (незакрашенный кружок) инъекцией среды-носителя соответственно в день 6, а также двукратной инъекции модифицированной РНК VEGF-A в сравнении с двукратной инъекцией среды-носителя в день 10 соответственно. Закрашенный квадрат; однократная инъекция модифицированной РНК VEGF-A.
[0136] ФИГ. 24. Интерполяция кубическими сплайнами кривой заживления раны на основании испытания 1 из примера 14. Интерполяцию кубическими сплайнами создавали, чтобы аппроксимировать к времени закрытия на 25%, 50% и 75%, как показано горизонтальными пунктирными серыми линиями. Данные представлены как средние значения нормализованной площади открытой раны на основе медианных значений, полученных от трех наблюдателей.

[0137] ФИГ. 25. Процент заживления раны в промежутках между моментами времени в испытании 1 из примера 14. Средний процент закрытия раны рассчитывали в промежутке между каждым моментом времени с применением нормализованных данных площади раны. Данные представлены как средние значения ± SEM; *р<0,05 для более высокого среднего процента закрытия раны в случае двукратной инъекции модифицированной РНК VEGF-A (столбик в горизонтальную полоску) в сравнении с двукратной (заштрихованный столбик) и однократной (черный столбик) инъекцией среды-носителя соответственно для дня 3-6, а также для более низкого среднего процента закрытия раны в случае однократной инъекции модифицированной РНК VEGF-A (серый столбик) в сравнении с однократной и двукратной инъекцией среды-носителя для дня 10-13 соответственно.
[0138] ФИГ. 26. Типичные изображения срезов ран, окрашенных гематоксилином и эозином, в испытании 1 из примера 14. А; однократная инъекция среды-носителя, В; двукратная инъекция среды-носителя, С; однократная инъекция модифицированной РНК VEGF-A, D; двукратная инъекция модифицированной РНК VEGF-A.
[0139] ФИГ. 27. Типичные изображения срезов ран, окрашенных с помощью CD31, в испытании 1 из примера 14. Указатели-стрелки показывают на области сильного окрашивания CD31. А) однократное введение среды-носителя, В) двукратное введение среды-носителя, С) однократное введение модифицированной РНК VEGF-A, D) двукратное введение модифицированной РНК VEGF-A.
[0140] ФИГ. 28. Количественная оценка окрашивания CD31 в испытании 1 из примера 14. На панелях A-D представлены типичные полученные изображения, а на панелях Е-Н представлены типичные изображения, подвергнутые пороговому отсечению положительного окрашивания CD31 (коричневый канал). А и Е; однократное введение среды-носителя, В и F; двукратное введение среды-носителя, С и G; однократное введение модифицированной РНК VEGF-A, D и Н; двукратное введение модифицированной РНК VEGF-A, I; количественная оценка процента площади окрашивания CD31 (площади, покрытой черными элементами изображения). Черный столбик; однократная инъекция среды-носителя, заштрихованный столбик; двукратная инъекция среды-носителя, серый столбик; однократная инъекция модифицированной РНК VEGF-A, столбик в горизонтальную полоску; двукратная инъекция модифицированной РНК VEGF-A.
[0141] ФИГ. 29. Анализ нисходящей передачи сигнала VEGF с помощью вестерн-блоттинга (испытание 1) из примера 14. Верхняя панель; блоты pAKT и AKT для образцов дня 18 от мышей, получающих однократную дозу среды-носителя в день 0, двукратную дозу среды-носителя в дни 0 и 3, однократную дозу модифицированной РНК VEGF-A в день 0 и двукратную дозу модифицированной РНК VEGF-A в дни 0 и 3. Нижняя панель; для количественного отношения pAKT/AKT показано отсутствие статистического различия между группами обработки. Левый столбик; однократная инъекция среды-носителя, левый средний столбик; двукратная инъекция среды-носителя, правый средний столбик; однократная инъекция модифицированной РНК VEGF-A, правый столбик; двукратная инъекция модифицированной РНК VEGF-A.
[0142] ФИГ. 30. Вестерн-блоттинг-анализ pVEGFR2, VEGFR2 и VEGF-A в ранах мышей, собранных в день 18, на основании испытания 1 из примера 14. Верхняя панель; блоты pVEGFR2, VEGFR2 и VEGFA для образцов дня 18 от мышей, получающих однократную дозу среды-носителя в день 0, двукратную дозу среды-носителя в дни 0 и 3, однократную дозу модифицированной РНК VEGF-A в день 0 и двукратную дозу модифицированной РНК VEGF-A в дни 0 и 3. Нижняя панель; для количественного отношения pVEGFR2/VEGFR2 показано отсутствие статистического различия между группами обработки. Левый столбик; однократная инъекция среды-носителя, левый средний столбик; двукратная инъекция среды-носителя, правый средний столбик; однократная инъекция модифицированной РНК VEGF-A, правый столбик; двукратная инъекция модифицированной РНК VEGF-A.
[0143] ФИГ. 31. Значения массы тела мышей в ходе испытания 2 из примера 14. Массу тела каждой мыши регистрировали в момент времени получения каждой фотографии. Данные представлены как средние значения ± SEM. Левый столбик: двукратная инъекция среды-носителя, правый столбик: двукратная инъекция модифицированной РНК VEGF-A.
[0144] ФИГ. 32. Уровень глюкозы в крови натощак и после приема пищи у мышей в испытании 2 из примера 14. В день 0 уровень глюкозы в крови измеряли после четырехчасового периода голодания. В день 18 измеряли уровень глюкозы в крови после приема пищи. Данные представлены как средние значения ± SEM. Левый столбик: двукратная инъекция среды-носителя, правый столбик: двукратная инъекция модифицированной РНК VEGF-A.
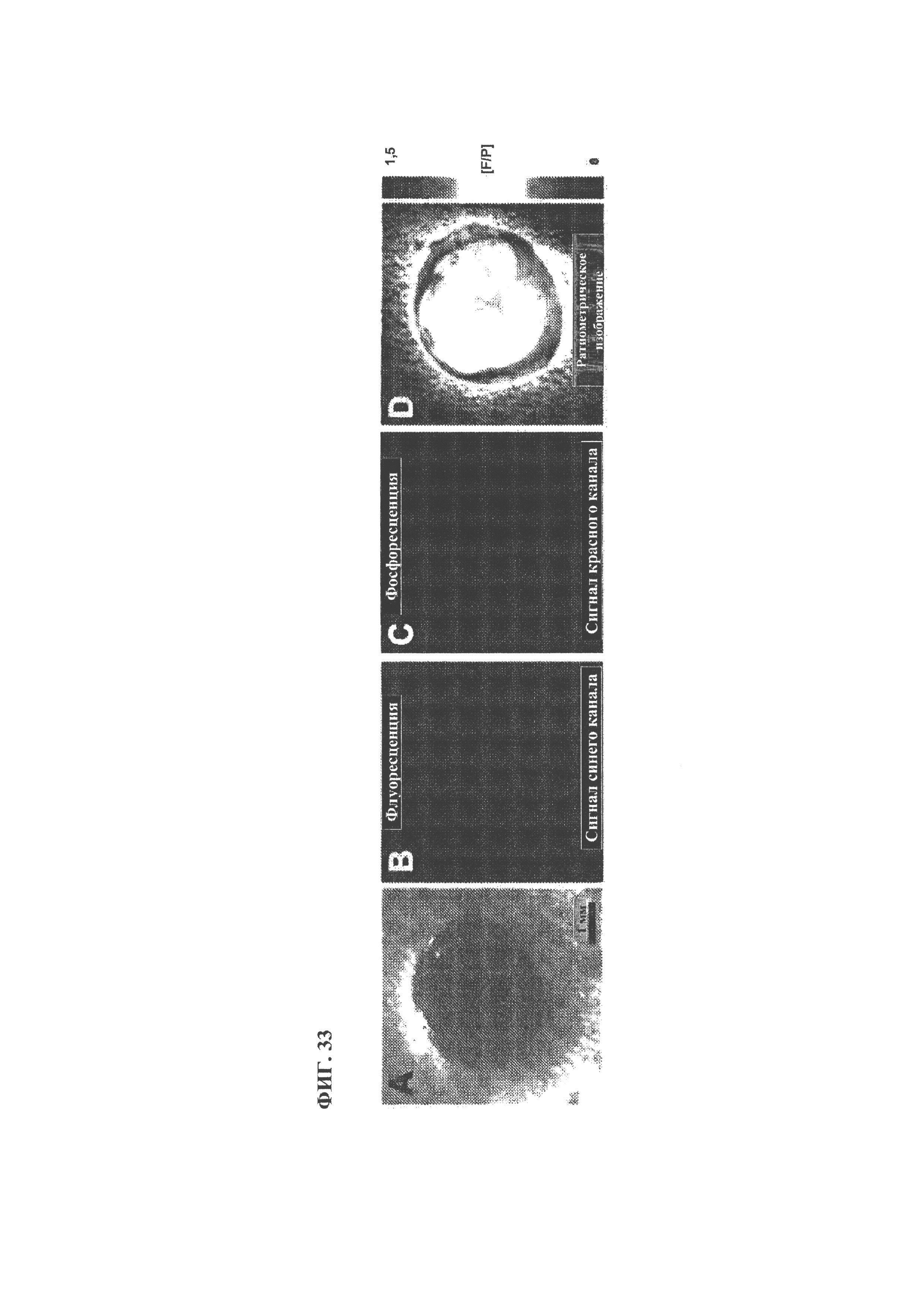
[0145] ФИГ. 33. Схематическое изображение in vivo нанесения чувствительных к кислороду наночастиц. А) Нанесение наночастиц на рану во всю толщину кожи. При возбуждении наночастицы испускают сильную флуоресценцию при комнатной температуре (В) и сильную кислородозависимую фосфоресценцию (С). Ратиометрическое изображение получали на основе соотношения флуоресценции и фосфоресценции, чтобы охарактеризовать относительный уровень кислорода в раневом ложе (D).
[0146] ФИГ. 34. Ратиометрические изображения уровней относительного насыщения кислородом в пределах раневых лож в испытании 2 из примера 14. Типичные светлопольные и ратиометрические изображения ран, обработанных с помощью двукратного введения среды-носителя (верхняя половина) и двукратного введения модифицированной РНК VEGF-A (нижняя половина), для каждого момента времени. Граница раны обведена черным.
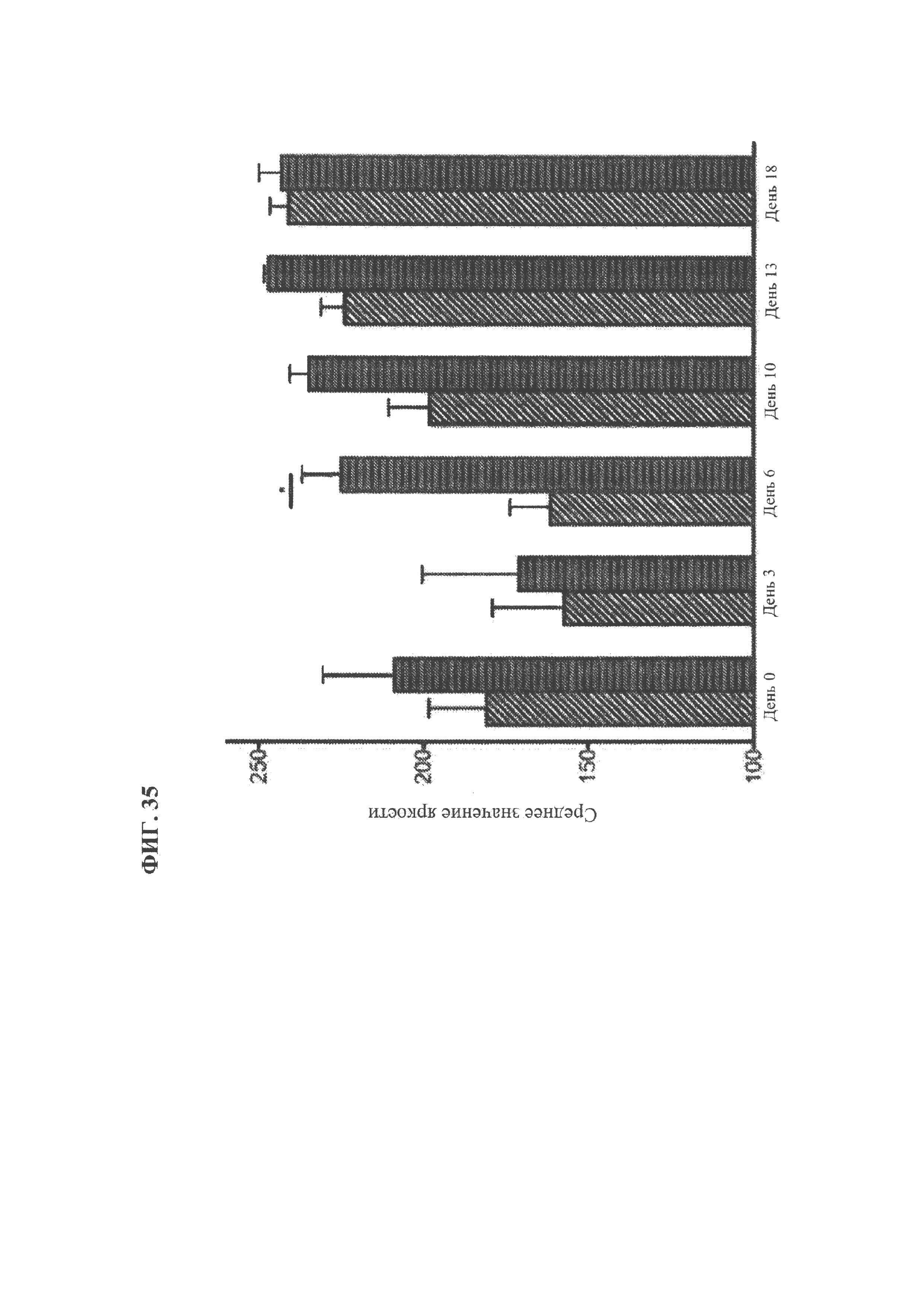
[0147] ФИГ. 35. Количественная оценка насыщения кислородом посредством анализа изображений флуоресценции и фосфоресценции, испускаемых чувствительными к кислороду наночастицами в раневом ложе. Для раневого ложа рассчитывали средний уровень отношения яркости для каждого необработанного изображения флуоресценции и фосфоресценции. Данные представлены в виде средних значений ± SEM, *р<0,05 для среднего уровня отношения яркости в случае двукратной инъекции модифицированной РНК VEGF-А (правый столбик) в сравнении с двукратной инъекцией среды-носителя (левый столбик).
[0148] ФИГ. 36. Кривая заживления раны для испытания 2 из примера 14. Среднюю нормализованную площадь открытой раны на основе медианных значений, полученных от трех независимых наблюдателей, наносили на график в зависимости от дней после хирургического вмешательства. Данные представлены в виде средних значений ± SEM, *р<0,05 для меньшей площади открытой раны в случае двукратной инъекции модифицированной РНК VEGF-A (незакрашенный квадрат) в сравнении с двукратной инъекцией среды-носителя (незакрашенный кружок), соответственно в день 6. В случае двукратной инъекции среды-носителя площадь под кривой составляла 641,31, а в случае двукратной инъекции модифицированной РНК VEGF-A - 604,35 соответственно.
[0149] ФИГ. 37. Интерполяция кубическими сплайнами кривой заживления раны на основании испытания 2 из примера 14. Интерполяцию кубическими сплайнами создавали, чтобы аппроксимировать для времени закрытия на 25%, 50% и 75%, как показано серыми пунктирными линиями. Данные представлены в виде средних значений нормализованной площади открытой раны на основе медианных значений, полученных от трех наблюдателей. #; р<0,05 для двукратной инъекции модифицированной РНК VEGF-A (незакрашенный квадрат) в сравнении с двукратной инъекцией среды-носителя (незакрашенный кружок).
[0150] ФИГ. 38. Процент заживления раны в промежутках между моментами времени в испытании 2 из примера 14. Средний процент закрытия раны рассчитывали в промежутке между каждым моментом времени с применением нормализованных данных площади раны. Данные представлены в виде средних значений ± SEM; *р<0,05 для более высокого среднего процента закрытия раны в случае двукратной инъекции модифицированной РНК VEGF-A (правый столбик) в сравнении с двукратной инъекцией среды-носителя (левый столбик) для дня 3-6.
[0151] ФИГ. 39. Фотоакустическая микроскопия сосудистых ответов на высокую дозу модифицированной РНК VEGF-A в ухе мыши. Первый ряд; сосудистая структура; второй ряд; sO2 (%); третий ряд; скорость тока крови (мм/с). Пунктирный кружок; участок инъекции. Стрелки в ряду 3; сосуды со значительной активацией тока крови. Пометки вверху над первым рядом указывают время после внутрикожной инъекции модифицированной РНК VEGF-A (100 мкг).
[0152] ФИГ. 40. Образование новых сосудов и ангиогенез в ухе мыши, которой ввели внутрикожную инъекцию, содержащую высокую дозу модифицированной РНК VEGF-A. Увеличенные изображения новых сосудов (отмеченных стрелками, второй ряд) и ангиогенеза в ухе мыши, которой ввели внутрикожную инъекцию, содержащую 100 мкг модифицированной РНК VEGF-A. Увеличенный участок обозначен пунктирным квадратом в первом ряду. Пометки вверху над первым рядом указывают время после внутрикожной инъекции модифицированной РНК VEGF-A (100 мкг).
[0153] ФИГ. 41. Фотоакустическая микроскопия сосудистых ответов на низкую дозу модифицированной РНК VEGF-A в ухе мыши. Первый ряд; сосудистая структура; второй ряд; sO2 (%); третий ряд; скорость тока крови (мм/с). Пунктирный кружок; участок инъекции. Пометки вверху над первым рядом указывают время после внутрикожной инъекции модифицированной РНК VEGF-A (10 мкг).
[0154] ФИГ. 42. Фотоакустическая микроскопия сосудистых ответов на рекомбинантный белок VEGF-A человека в ухе мыши. Первый ряд; сосудистая структура; второй ряд; sO2 (%); третий ряд; скорость тока крови (мм/с). Пунктирный кружок; участок инъекции. Пометки вверху над первым рядом указывают время после внутрикожной инъекции рекомбинантного белка VEGF-A человека (1 мкг). Сосуды с явной активацией тока указаны стрелками в третьем ряду.
[0155] ФИГ. 43. Фотоакустическая микроскопия сосудистых ответов на цитратно-солевой раствор в ухе мыши. Первый ряд; сосудистая структура; второй ряд; sO2 (%); третий ряд; скорость тока крови (мм/с). Пунктирный кружок; участок инъекции. Пометки вверху над первым рядом указывают время после внутрикожной инъекции цитратно-солевого раствора (10 мкл).
[0156] ФИГ. 44. Эффекты модифицированной РНК VEGF-A, рекомбинантного белка VEGF-A человека и цитратно-солевого раствора на сосудистые ответы в ухе мыши. Количественный анализ острых и долговременных сосудистых ответов (диаметр сосудов, левая панель, и объемная скорость тока крови, правая панель), индуцированных за счет внутрикожной инъекции модифицированной РНК VEGF-A (100 мкг, закрашенные квадраты), рекомбинантного белка VEGF-A человека (1 мкг, закрашенные треугольники) или цитратно-солевого раствора (10 мкл, закрашенные кружки) в ухе мыши. Показанные значения представляют собой средние значения ± SD, n=3/группа.
[0157] ФИГ. 45. Воздействие на микрососудистый ток и насыщение кислородом после инъекции модифицированной РНК VEGF-A в ухе мыши. Модифицированную РНК VEGF-A (100 мкг) водили с помощью внутрикожной инъекции в ухо мыши. Микрососудистый ток (панель А) и насыщение кислородом (панель В) оценивали перед инъекцией (исходный уровень) и через 7 дней.
[0158] ФИГ. 46. Воздействие на микрососудистый ток и насыщение кислородом после инъекции рекомбинантного белка VEGF-A человека в ухе мыши. Рекомбинантный белок VEGF-A человека (1 мкг) водили с помощью внутрикожной инъекции в ухо мыши. Микрососудистый ток (панель А) и насыщение кислородом (панель В) оценивали перед инъекцией (исходный уровень) и через 7 дней.
[0159] ФИГ. 47. Воздействие на микрососудистый ток и насыщение кислородом после инъекции среды-носителя, представляющей собой цитратно-солевой раствор, в ухе мыши. Среду-носитель, представляющую собой цитратно-солевой раствор (10 мкл), водили с помощью внутрикожной инъекции в ухо мыши. Микрососудистый ток (панель А) и насыщение кислородом (панель В) оценивали перед инъекцией (исходный уровень) и через 7 дней.
[0160] ФИГ. 48А и ФИГ. 48В. Схема эксперимента для примера 16 показана на ФИГ. 48А. Размещение инъекций модифицированной РНК VEGF-A для примера 16 проиллюстрировано на ФИГ. 48В.
[0161] ФИГ. 49. Концентрацию VEGF-A человека в микродиализных элюатах от кроликов, которым вводили внутрикожную инъекцию, содержащую модифицированную РНК VEGF-A. Концентрации VEGF-A человека в элюатах из зонда для микродиализа с отсечением по размеру 100 кДа, внутрикожно вставленного в заднюю ногу кролика. Значения представлены как среднее значение ± SEM. Микродиализ начинали в t=0 ч., а четыре id инъекции модифицированной РНК VEGF-A (по 50 мкг каждая) вводили в t=1 ч. Пунктирная линия указывает на нижний предел количественной оценки (LLOQ, 33,4 пг/мл). Каждому кролику вставляли по два катетера, n=4 кролика.
[0162] ФИГ. 50А, ФИГ. 50В и ФИГ. 50C. Эффекты в отношении плотности капилляров (ФИГ. 50А), плотности артериол (ФИГ. 50В) и фиброза (ФИГ. 50С) после интракардиальной инъекции модифицированной РНК VEGF-A человека у свиней, у которых вызывали инфаркт миокарда in vivo. Карликовых свиней подвергли постоянному лигированию левой передней нисходящей коронарной артерии и через 7 дней ввели эпикардиальную инъекцию, содержащую модифицированную РНК VEGF-A (1 мг, закрашенный серый столбик (n=8), или 10 мг, заштрихованный столбик (n=8)). или цитратно-солевой раствор (закрашенный черный столбик, n=8). Отдельную группу животных подвергали процедуре ложной операции (коронарную артерию не лигировали и эпикардиальные инъекции не вводили (незакрашенный столбик, n=5)). Через два месяца после лигирования животных умерщвляли и сердечную ткань собирали для оценки плотности капилляров (ФИГ. 50А) в периинфарктной (пограничной) зоне. Показаны средние значения ± SEM. *; Р<0,05 и ***; Р<0,001 в сравнении с животными, обработанными цитратно-солевым раствором (однофакторный ANOVA и апостериорный критерий Даннетта). В рамках ФИГ. 50В, через два месяца после лигирования животных умерщвляли и сердечную ткань собирали для оценки плотности артериол в периинфарктной (пограничной) зоне. Показаны средние значения ± SEM. **; Р<0,0 в сравнении с животными, обработанными цитратно-солевым раствором (однофакторный ANOVA и апостериорный критерий Даннетта). В рамках ФИГ. 50С, через два месяца после лигирования животных умерщвляли и сердечную ткань собрали для оценки фиброза (отложения коллагена) в отдалении от подвергшейся инфаркту области. Показаны средние значения ± SEM. *; Р<0,05 и **; Р<0,01 в сравнении с животными, обработанными цитратно-солевым раствором (однофакторный ANOVA и апостериорный критерий Даннетта).
[0163] ФИГ. 51. Временной профиль продукции белка VEGF-A человека после трансфекции модифицированной РНК VEGF-A в клетки гладкой мускулатуры аорты человека (hAoSMC, незакрашенные кружочки) и в кардиомиоциты человека, происходящие из индуцированных плюрипотентных клеток (hiPS-CM, закрашенные треугольники). Данные показаны как средние значения ± SEM.
[0164] ФИГ. 52А и ФИГ. 52В. На ФИГ. 52А проиллюстрировано иммуногистохимическое исследование в отношении транскрипционного фактора опухоли Вильмса 1 (Wt-1), как маркера клеток эпикардиального происхождения (EPDC), в нормальном не подвергавшемся инфаркту сердце мыши (контроль) и в сердцах, которые подвергали постоянной окклюзии левой передней нисходящей коронарной артерии в течение 3, 7 или 14 дней перед сбором ткани. Стрелки указывают на экспрессию Wt-1. На ФИГ. 52 В проиллюстрирована балльная оценка наличия Wt-1+ клеток в нормальном не подвергавшемся инфаркту сердце мыши (контроль) и в сердцах, которые подвергали постоянной окклюзии левой передней нисходящей коронарной артерии в течение 3, 7 или 14 дней перед сбором ткани. M1; инфаркт миокарда. *; Р<0,05, ***; Р<0,001 в сравнении с контролем, n=3-5 в каждой группе исследования.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0165] Все упоминаемые источники включены в данный документ посредством ссылки во всей своей полноте.
[0166] Специалисту в области, к которой относится настоящее изобретение, получившему преимущество в отношении принципов, представленных в вышеприведенных описаниях и связанных с ними графических материалах, придут на ум множество модификаций и других вариантов осуществления настоящего изобретения, изложенного в данном документе. Поэтому следует понимать, что настоящее раскрытие не должно ограничиваться специальными раскрытыми вариантами осуществления, и предусмотрено, что модификации и другие варианты осуществления включены в объем прилагаемой формулы изобретения. Хотя в данном документе используются специальные термины, они применяются исключительно в общем и информативном смысле, а не для целей ограничения.
[0167] Единицы измерения, префиксы и символы могут обозначаться в своей форме, принятой в СИ. Если не указано иное, нуклеиновые кислотызаписываются слева направо в 5'-3' ориентации; аминокислотные последовательности записываются слева направо в ориентации от аминогруппы до карбоксигруппы соответственно. Числовые диапазоны включают числа, определяющие диапазон. Аминокислоты могут обозначаться в данном документе с помощью их общеизвестных трехбуквенных символов или с помощью однобуквенных символов, рекомендованных комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично, нуклеотиды могут обозначаться с помощью их общепринятых однобуквенных кодов. Термины, определяемые ниже, более полно определены посредством ссылки на настоящее описание во всей его полноте.
5.1. Определения
[0168] Если специально не указано иное, то все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понятно среднему специалисту в области техники, к которой принадлежит настоящее изобретение. Если не упомянуто иное, методики, используемые или предусматриваемые в данном документе, представляют собой стандартные методы, хорошо известные рядовому специалисту в данной области. При осуществлении настоящего изобретения на практике, если не указано иное, будут использоваться традиционные методики микробиологии, культивирования тканей, молекулярной биологии, химии, биохимии и технологии рекомбинантной ДНК, которые находятся в пределах компетентности специалиста в данной области. Материалы, способы и примеры являются исключительно иллюстративными, а не ограничивающими. Следующее представлено в иллюстративных целях и не предназначено для ограничения объема настоящего изобретения.
[0169] В некоторых вариантах осуществления числовые параметры, изложенные в настоящем описании (в которое включена формула изобретения во всей своей полноте), представляют собой приблизительные величины, которые могут варьироваться в зависимости от требуемых свойств, которые должны быть получены в конкретном варианте осуществления. В некоторых вариантах осуществления числовые параметры должны толковаться с учетом количества сообщаемых значащих разрядов и путем применения обычных методик округления. Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем некоторых вариантов осуществления настоящего изобретения, представляют собой приблизительные величины, числовые значения, указанные в специальных примерах, сообщаются с наибольшей возможной точностью. Числовые значения, представленные в некоторых вариантах осуществления настоящего изобретения, могут содержать определенные ошибки, обязательно возникающие вследствие стандартного отклонения, обнаруживаемого в их соответствующих результатах измерений при тестировании. Предусматривается, что приведение диапазонов значений в данном документе служит исключительно в качестве метода сокращения индивидуального указания каждого отдельного значения, входящего в данный диапазон. Если в данном документе не указано иное, каждое индивидуальное значение включено в настоящее описание, как если бы оно было индивидуально упомянуто в данном документе.
[0170] Для удобства здесь собраны определенные термины, используемые во всей настоящей заявке (включая описание, примеры и прилагаемую формулу изобретения). Если не определено иное, то все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понятно среднему специалисту в области техники, к которой принадлежит настоящее изобретение.
[0171] Используемый в данном документе термин "введение" относится к помещению фармацевтической композиции или фармацевтического состава, содержащих по меньшей мере одну модифицированную РНК, в субъекта способом или путем, который приводит по меньшей мере к частичной локализации фармацевтической композиции или фармацевтического состава, в желаемом участке или ткани. В некоторых вариантах осуществления фармацевтическая композиция или фармацевтический состав, содержащие модифицированную РНК, могут вводить с помощью любого подходящего пути введения, который приводит к эффективному лечению субъекта, т.е. введение приводит к доставке в требуемое местоположение или ткань у субъекта, при этом по меньшей мере часть белка, экспрессируемого за счет модифицированной РНК, расположена в требуемых ткани-мишени или местоположении клетки-мишени.
[0172] Введение может быть внутримышечным, трансартериальным, внутрибрюшинным, внутривенным, внутриартериальным, подкожным, внутрижелудочковым, внутрикожным, интракардиальным, эпикардиальным, через катетер воротной вены, через катетер коронарного синуса и/или прямым введением в область, подлежащую лечению. Фармацевтические композиции специально составляют для каждого пути введения, что приводит к фармацевтическим составам, специфическим в отношении введения.
[0173] Общеизвестно, что используемый в данном документе термин "композиция" означает комбинацию по меньшей мере двух частей или элементов, которые составляю что-либо. Например, используемая в данном документе композиция обычно содержит по меньшей мере полинуклеотид, первичную конструкцию или модифицированную РНК согласно настоящему изобретению и подходящий носитель или вспомогательное вещество.
[0174] Термины "предусматривать", "иметь" и "включать" являются неограничивающими глаголами-связками. Любые формы или времена одного или нескольких из этих глаголов, такие как "предусматривает", "предусматривающий", "имеет", "имеющий", "включает" и "включающий", также являются неограничивающими. Например, любой способ, который "предусматривает", "имеет" или "включает" одну или несколько стадий, не ограничивается наличием только таких одной или нескольких стадий и также может охватывать другие не перечисленные стадии. Аналогичным образом, любая композиция, которая "предусматривает", "имеет" или "включает" один или несколько признаков, не ограничивается наличием только данных одного или нескольких признаков и может охватывать другие не перечисленные признаки. Все способы, описанные в данном документе, могут выполняться в любом подходящем порядке, если в данном документе не указано иное или иное явно не противоречит контексту. Применение любых видов примеров или иллюстративных фраз (например, "такой как"), предусматриваемых в отношении определенных вариантов осуществления в данном документе, предназначено исключительно для лучшего освещения настоящего изобретения, а не для формулирования ограничения объема настоящего изобретения, заявленного иным образом. Никакая фраза в настоящем описании не должна толковаться как указание, что какой-либо незаявленный элемент является существенным для осуществления настоящего изобретения на практике.
[0175] Термин "состоящий фактически из" ограничивает объем пункта формулы до указанных материалов или стадий "и того, что не влияет существенно на основную и новую характеристику(и)" заявленного изобретения. In re Herz, 537 F.2d 549, 551-52, 190 USPQ 461, 463 (CCPA 1976) (выделение автора) (Известная из уровня техники гидравлическая жидкость, для которой требуется диспергатор, обсуждаемый аппелянтами, была исключена из пунктов формулы изобретения, ограниченных функциональной жидкостью, "состоящей фактически из" определенных компонентов.
[0176] Термин "состоящий из" относится к композициям, способам и их соответствующим компонентам, описываемым в данном документе, которые исключают любой элемент, не упомянутый в таком описании варианта осуществления.
[0177] Термины "заболевание" или "нарушение" используются в данном документе взаимозаменяемо и относятся к любому изменению состояния организма или некоторых органов, приостанавливающему или нарушающему выполнение функций и/или вызывающему такие симптомы, как дискомфорт, дисфункция, дистресс или даже смерть пораженного индивидуума или находящихся в контакте с индивидуумом. К заболеванию или нарушению также может относиться подавленное состояние, недомогание, болезненное состояние, расстройство, дурнота, болезнь, страдание, немощность или поражение.
[0178] Используемый в данном документе термин "заболевание, реагирующее на терапию с помощью VEGF-A" относится к нарушению, которое демонстрирует улучшение одного или нескольких симптомов или клинических маркеров после введения фармацевтической композиции или фармацевтического состава, содержащих белок VEGF-A или средство, способное продуцировать белок VEGF-A, такое как модифицированная РНК, раскрытая в данном документе. В качестве альтернативы заболевание является "реагирующим" на терапию с помощью VEGF-A, если прогрессирование заболевания снижается или останавливается в случае введения фармацевтической композиции или фармацевтического состава, содержащих белок VEGF-A или средство, способное продуцировать белок VEGF-A. Благоприятные или требуемые клинические результаты включают без ограничения облегчение одного или нескольких симптомов, уменьшение степени заболевания, стабилизированное (т.е. не ухудшающееся) состояние заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (неважно частичную или полную).
[0179] Используемый в данном документе термин "двухвалентный катион" относится к ионной частице с положительной валентностью 2. Например, ион магния, Mg2+, и ион кальция, Са2+, являются двухвалентными катионами.
[0180] "Лекарственная форма" представляет собой физическую форму, в виде которой лекарственное средство (например, модифицированную РНК) получают и распределяют, такую как таблетка (покрытая, замедленного высвобождения, диспергируемая и т.п.), капсула, мазь или инъецируемый препарат (порошок, раствор).
[0181] Фраза "лекарственный продукт" означает готовую лекарственную форму, например, таблетку, капсулу, раствор и т.п., которая содержит активный лекарственный ингредиент (например, модифицированную РНК), обычно, но не обязательно, в ассоциации с неактивными ингредиентами.
[0182] Используемый в данном документе термин "эффективное количество" относится к количеству терапевтического средства (например, модифицированной РНК), фармацевтической композиции или фармацевтического состава, достаточному для уменьшения по меньшей мере одного или нескольких симптомов заболевания или нарушения или для обеспечения требуемого эффекта. Например, это может быть количество, которое вызывает терапевтически или профилактически значимое снижение симптома или клинического маркера, ассоциированного с сердечной дисфункцией или другим нарушением, при введении типичному субъекту, который имеет сердечно-сосудистое состояние или другое заболевание или нарушение.
[0183] Используемый в данном документе термин "экспрессия" последовательности нуклеиновой кислоты относится к одному или нескольким из следующих событий: (1) образованию РНК-матрицы за счет последовательности ДНК (например, посредством транскрипции); (2) процессингу РНК-транскрипта (например, посредством сплайсинга, редактирования, образования 5'-кэпа и/или процессинга 3'-конца); (3) трансляции РНК в полипептид или белок и (4) посттрансляционной модификации полипептида или белка.
[0184] Используемый в данном документе термин "состав" или "фармацевтический состав" относится к типу композиции, которая содержит фармацевтическую смесь или раствор, содержащие активный фармацевтический ингредиент (например, модифицированную РНК), вместе с фармацевтически приемлемыми носителями/разбавителями/вспомогательными веществами, подходящими для введения млекопитающему (например, человеку, нуждающемуся в этом) с помощью конкретного пути введения. Например, используемый в данном документе "состав" может специально составляться с включением подходящих средств доставки и/или других фармацевтически приемлемых носителей для введения с помощью одного или нескольких из целого ряда путей введения, таких как внутримышечный, внутрикожный, подкожный или интракардиальный путь введения, через катетер воротной вены, через катетер коронарного синуса и/или путем непосредственного введения в область, подлежащую лечению. Таким образом, понятно, что "состав" представляет собой композицию, специально составленную для конкретного пути введения. Составы могут представлять собой композиции, представленные в виде конкретной лекарственной формы.
[0185] Используемый в данном документе термин "модифицированная РНК" относится к молекулам РНК, содержащим одну, две или более двух нуклеозидных модификаций по сравнению с аденозином (A) ((2R,3R,4S,5R)-2-(6-амино-9H-пурин-9-ил)-5-(гидроксиметил)оксолан-3,4-диол), гуанозином (G) (2-амино-9-[3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]-3H-пурин-6-он), цитидином (С) (4-амино-1-[3,4-дигидрокси-5-(гидроксиметил)тетрагидрофуран-2-ил]пиримидин-2-он) и уридином (U) (1-[(3R,4S,5R)-3,4-дигидрокси-5-(гидроксиметил)оксолан-2-ил]пиримидин-2,4-дион) или по сравнению с AMP, GMP, CMP и UMP в молекулах РНК, или их части. Неограничивающие примеры нуклеозидных модификаций представлены в другом разделе настоящего описания. Когда нуклеотидная последовательность конкретной заявленной РНК во всем остальном идентична последовательности встречающейся в природе молекулы РНК, подразумевается, что модифицированная РНК представляет собой молекулу РНК с по меньшей мере одной модификацией, отличной от существующих у природного аналога. Отличие может заключаться либо в химическом изменении нуклеозида/нуклеотида, либо в положении данного изменения в пределах последовательности. В одном варианте осуществления модифицированная РНК представляет собой модифицированную матричную РНК (или "модифицированную мРНК").
[0186] Используемый в данном документе термин "модуляция физиологического процесса" относится к регуляции различных функций живых организмов и их частей, таких как клетки или ткани, а также физических или химических процессов, протекающих в них. Например, для физиологических процессов, в которых центральная роль принадлежит VEGF-A, модуляция может включать индуцирование ангиогенеза, стимуляцию пролиферации васкулярных клеток, усиление пролиферации и/или изменение развития клеток-предшественников эпикардиального происхождения, активацию эндотелизации, индуцирование сердечной регенерации, усиление реваскуляризации тканевых лоскутов для заживления раны, улучшение сосудистой функции, усиление тканевой перфузии и образование новых сосудов, уменьшение рубцовой ткани, повышение отношения задействованной систолической работы и преднагрузки (PRSW), усиление развития максимального давления, усиление инотропной функции, увеличение фракции выброса левого желудочка (LVEF), снижение уровней биомаркеров, ассоциированных с сердечной дисфункцией (например, NT-proBNP, BNP, hsTnT и hsTnI), уменьшение размера очага омертвения, уменьшение фиброза сердечной ткани и/или улучшение сердечной функции.
[0187] Используемый в данном документе термин "нуклеиновая кислота" в своем самом широком смысле включает любое соединение и/или вещество, которое составляет полимер из нуклеотидов, связанных с помощью фосфодиэфирной связи. Такие полимеры часто называют олигонуклеотидами или полинуклеотидами в зависимости от размера. Термины "полинуклеотидная последовательность" и "нуклеотидная последовательность" используются в данном документе взаимозаменяемо.
[0188] Фраза "фармацевтически приемлемый" используется в данном документе для обозначения тех соединений, материалов, композиций и/или лекарственных форм, которые по результатам тщательной медицинской оценки являются подходящими для применения в контакте с тканями людей и животных, не вызывая чрезмерную токсичность, раздражение, аллергическую реакцию или другие проблемы или осложнения, соизмеримые с обоснованным соотношением польза/риск. Разрешительные органы регистрации лекарственных средств (например, EMA, US-FDA) предоставляют руководство и одобряют фармацевтически приемлемые соединения, материалы, композиции и/или лекарственные формы. Примеры могут быть перечислены в Фармакопеях.
[0189] Фраза "фармацевтически приемлемое вспомогательное вещество" используется в данном документе для обозначения фармацевтически приемлемого материала, выбранного из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель.
[0190] Используемый в данном документе "полипептид" означает полимер из аминокислотных остатков (природных или неприродных), связанных вместе, чаще всего, пептидными связями. Термин, используемый в данном документе, относится к белкам, полипептидам и пептидам любого размера, структуры или функции. Полипептид может представлять собой одиночную молекулу или может представлять собой мультимолекулярный комплекс, такой как димер, тример или тетрамер. Они также могут предусматривать полипептиды с одиночной цепью или многоцепочечные полипептиды, такие как антитела или инсулин, и могут быть ассоциированными или связанными. Дисульфидные связи чаще всего находятся в многоцепочечных полипептидах. Термин "полипептид" также может применяться в отношении полимеров из аминокислот, в которых один или несколько аминокислотных остатков представляют собой искусственные химические аналоги соответствующих встречающихся в природе аминокислот.
[0191] Используемый в данном документе "белок" представляет собой полимер, состоящий фактически из любой из 20 аминокислот. Хотя термин "полипептид" зачастую используется при ссылке на относительно большие полипептиды, а термин "пептид" зачастую используется при ссылке на небольшие полипептиды, использование этих терминов в уровне техники перекрывается и варьирует. Термины "пептид(ы)", "белок(белки)" и "полипептид(ы)" иногда используются в данном документе взаимозаменяемо.
[0192] Используемый в данном документе термин "рекомбинантный" означает, что белок получен за счет прокариотической или эукариотической системы экспрессии посредством применения нуклеиновой кислоты, с которой провели генетическую манипуляцию путем введения "гетерологичной нуклеиновой кислоты" или изменения нативной нуклеиновой кислоты.
[0193] Термин "статистически значимый" или "достоверно" относится к статистической значимости. Данный термин относится к статистическому доказательству того, что имеется отличие. Его можно определить как вероятность принятия решения об отвергании нулевой гипотезы в том случае, когда нулевая гипотеза в действительности является истинной. Решение зачастую принимается с применением р-значения. Можно использовать любой другой показатель достоверной значимости, который общеизвестен из уровня техники.
[0194] Термины "субъект" и "индивидуум" используются в данном документе взаимозаменяемо и относятся к животному, например человеку, который получает лечение, включая профилактическое лечение, с помощью способов и композиций, описанных в данном документе. В случае лечения состояний или болезненных состояний, специфических для конкретного животного, такого как субъект-человек, термин "субъект" относится к такому конкретному животному.
[0195] Термин "практически не содержит" относится к состоянию, при котором композиция или состав не содержат существенных количеств конкретных элементов. Например, композиция или состав, "практически не содержащие" двухвалентных катионов, содержат небольшое количество двухвалентных катионов или не содержат их вообще.
[0196] Как используется в данном документе, субъект или индивидуум, "страдающие от" заболевания, нарушения и/или состояния, являются таковыми, у которых были диагностированы или проявляются один или несколько симптомов заболевания, нарушения и/или состояния. В некоторых вариантах осуществления субъект может подвергаться риску возникновения заболевания, нарушения и/или состояния.
[0197] Термин "ткань" относится к группе или слою подобных специализированных клеток, которые совместно выполняют определенные специальные функции. Термин "тканеспецифический" относится к источнику или определяющей характеристике клеток из определенной ткани.
[0198] Используемые в данном документе термины "лечить", или "лечение", или "осуществление лечения" относятся к терапевтическому лечению, при котором целью является предотвращение или замедление развития заболевания, такое как замедление развития нарушения сердечной деятельности или уменьшение по меньшей мере одного неблагоприятного эффекта или симптома сосудистого состояния, заболевания или нарушения, такого как любое нарушения, характеризующееся недостаточной или нежелательной сердечной функцией.
[0199] Следует учитывать, что настоящее изобретение не ограничивается конкретными методами, протоколами, реагентами и т.п., описываемыми в данном документе, и соответственно их можно варьировать. Терминология, используемая в данном документе, приведена исключительно с целью описания конкретных вариантов осуществления, и не предназначена для ограничения объема настоящего изобретения, который определяется исключительно формулой изобретения.
5.2. Модифицированная РНК, кодирующая полипептиды VEGF-A
[0200] В области терапевтических средств, диагностических средств, реагентов и биологических анализов большой интерес представляет возможность доставки нуклеиновой кислоты, например рибонуклеиновой кислоты (РНК), внутрь клетки, будь то in vitro, in vivo, in situ или ex vivo, таким образом, чтобы обеспечить внутриклеточную трансляцию нуклеиновой кислоты и продукцию закодированного представляющего интерес полипептида.
[0201] РНК, встречающиеся в природе, синтезированы из четырех основных рибонуклеотидов: ATP, СТР, UTP и GTP, но могут содержать нуклеотиды, подвергнутые посттранскрипционной модификации. Кроме того, в РНК было идентифицировано приблизительно сто разных нуклеозидных модификаций (Rozenski, J, Crain, Р, and McCloskey, J., The RNA Modification Database: 1999 update, Nucl Acids Res, (1999) 27: 196-197).
[0202] Согласно настоящему изобретению такие РНК предпочтительно модифицированы, чтобы избежать недостатков других молекул РНК из уровня техники (например, активации врожденного иммунного ответа и быстрого разложения при введении). Следовательно, такие полинуклеотиды называются модифицированная РНК. В некоторых вариантах осуществления модифицированная РНК после введения субъекту уклоняется от врожденного иммунного ответа. В некоторых вариантах осуществления время полужизни модифицированной РНК по сравнению с немодифицированной РНК удлинено.
[0203] В предпочтительном варианте осуществления молекула РНК представляет собой матричную РНК (мРНК). Используемый в данном документе термин "матричная РНК" (мРНК) относится к любому полинуклеотиду, который кодирует представляющий интерес полипептид и который может быть транслирован с продуцированием закодированного представляющего интерес полипептида in vitro, in vivo, in situ или ex vivo.
[0204] Как показано на ФИГ. 1А, основные компоненты молекулы мРНК обычно включают по меньшей мере кодирующий участок, 5'-нетранслируемый участок (UTR), 3'-нетранслируемый участок(UTR), 5'-кэп и поли-(А) хвост. Отталкиваясь от этой модульной структуры дикого типа, настоящее изобретение расширяет объем функциональных возможностей традиционных молекул мРНК за счет обеспечения полинуклеотидов или конструкций первичной РНК, которые сохраняют модульную организацию, но которые содержат одну или несколько структурных и/или химических модификаций или изменений, которые придают полинуклеотиду полезные свойства, включая, в некоторых вариантах осуществления, отсутствие значительного индуцирования врожденного иммунного ответа клетки, в которую введен данный полинуклеотид.
[0205] Модифицированные РНК могут включать любую пригодную модификацию относительно стандартной нуклеотидной цепи РНК, такую как модификация сахара, нуклеотидного основания (например, одна или несколько модификаций нуклеотидного основания, такие как замена или замещение атома в пиримидиновом нуклеотидном основании на необязательно замещенную аминогруппу, необязательно замещенный тиол, необязательно замещенный алкил (например, метил или этил) или галоген (например, хлор или фтор), или межнуклеозидной связи (например, одну или несколько модификаций в фосфодиэфирном остове). Модифицированные РНК необязательно могут включать другие средства (например, RNAi-индуцирующие средства, средства для RNAi, siRNA, shRNA, miRNA, антисмысловую РНК, рибозимы, каталитическую ДНК, tRNA, РНК, которая индуцирует образование тройной спирали, аптамеры, векторы и т.п.).
[0206] В публикации заявки на патент США №2014/0073687 раскрыты иллюстративные модифицированные РНК с некоторыми применимыми модификациями, например, по меньшей мере с одним или несколькими модифицированными нуклеозидами, выбранными из 5-метилцитидина (5mC), N6-метиладенозина (m6A), 3,2'-O-диметилуридина (m4U), 2-тиоуридина (s2U), 2'-фторуридина, псевдоуридина, 2'-O-метилуридина (Um), 2'-дезоксиуридина (2'dU), 4-тиоуридина (s4U), 5-метилуридина (m5U), 2'-O-метиладенозина (m6A), N6,2'-O-диметиладенозина (m6Am), N6,N6,2'-O-триметиладенозина (m62Am), 2-O-метилцитидина (Cm), 7-метилгуанозина (m7G), 2'-O-метилгуанозина (Gm), N2,7-диметилгуанозина (m-2,7G), N2,N2,7-триметилгуанозина (m-2,2,7G).
Дополнительные модификации описаны в публикации заявки на патент США №2015/0051268, поданной 7 октября 2014 года, и патенте США №9061059, поданном 3 февраля 2014 года. Следовательно, все такие модификации включены в данный документ посредством ссылки во всей своей полноте. Дополнительные модификации описаны в данном документе.
[0207] В качестве неограничивающих примеров, в некоторых вариантах осуществления модифицированная РНК может включать, например, по меньшей мере один уридинмонофосфат (UMP), который модифицирован с образованием N1-метил-псевдо-UMP. В некоторых вариантах осуществления N1-метил-псевдо-UMP присутствует вместо UMP, при этом процентное содержание UMP в последовательности составляет 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все UMP были заменены на N1-метил-псевдо-UMP.
[0208] В некоторых вариантах осуществления модифицированная РНК (дополнительно) может включать, например, по меньшей мере один цитидинмонофосфат (CMP), который модифицирован с образованием метил-СМР. В некоторых вариантах осуществления метил-СМР присутствует вместо СМР, при этом процентное содержание СМР в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все CMP были заменены на 5-метил-СМР.
[0209] В некоторых вариантах осуществления модифицированная РНК (дополнительно) может включать, например, по меньшей мере один аденозинмонофосфат (AMP), который модифицирован с образованием N6-метил-АМР. В некоторых вариантах осуществления N6-метил-АМР присутствует вместо AMP, при этом процентное содержание AMP в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все AMP были заменены на N6-метил-АМР.
[0210] В некоторых вариантах осуществления модифицированная РНК (дополнительно) может включать, например, по меньшей мере один гуанозинмонофосфат (GMP), который модифицирован с образованием 7-метил-GMP. В некоторых вариантах осуществления 7-метил-GMP присутствует вместо GMP, при этом процентное содержание GMP в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все GMP были заменены на 7-метил-GMP.
[0211] В некоторых вариантах осуществления модифицированная РНК (дополнительно) может включать, например, по меньшей мере один или несколько модифицированных нуклеозидов, выбранных из 5-метилцитидина (5mC), N6-метиладенозина (m6A), 3,2'-O-диметилуридина (m4U), 2-тиоуридина (s2U), 2'-фторуридина, псевдоуридина, 2'-O-метилуридина (Um), 2'-дезоксиуридина (2'dU), 4-тиоуридина (s4U), 5-метилуридина (m5U), 2'-O-метиладенозина (m6A), N6,2'-O-диметиладенозина (m6Am), N6,N6,2'-O-триметиладенозина (m62Am), 2'-O-метилцитидина (Cm), 7-метилгуанозина (m7G), 2'-O-метилгуанозина (Gm), N2,7-диметилгуанозина (m-2,7G), N2,N2,7-триметилгуанозина (m-2,2,7G) и N1-метил-псведоуридина, или любую их комбинацию. Каждая возможность и комбинация представляет отдельный вариант осуществления настоящего изобретения.
[0212] В некоторых вариантах осуществления модифицированные РНК содержат модификацию в 5'-кэпе, такую как 5'-дигуанозиновый кэп. В некоторых вариантах осуществления модифицированные РНК содержат модификацию в кодирующем участке. В некоторых вариантах осуществления модифицированные РНК содержат модификацию в 5'-UTR. В некоторых вариантах осуществления модифицированные РНК содержат модификацию в 3'-UTR. В некоторых вариантах осуществления модифицированные РНК содержат модификацию в поли-(А) хвосте. В некоторых вариантах осуществления модифицированные РНК содержат любую комбинацию модификаций в кодирующем участке, 5'-кэпе, 5'-UTR, 3'-UTR или поли-(А) хвосте. В некоторых вариантах осуществления модифицированная РНК необязательно может быть обработана щелочной фосфатазой.
[0213] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид фактора роста эндотелия сосудов (VEGF), любой из большого семейства белков VEGF, которые играют центральную роль в контроле сердечно-сосудистой физиологической функции в целом и артериогенеза в частности (Holmes D.I. et al., Genome Biol., (2005)6(2):209). Функции VEGF-A также предусматривают роль в активации передачи сигнала с участием оксида азота (NO), сосудистой проницаемости, ангиогенезе во время эмбрионального развития и постнатальном ангиогенезе, опухолевом ангиогенезе, артериогенезе, эндотелиальной репликации, и он служит в качестве переключателя клеточной дифференцировки у мультипотентных сердечно-сосудистых предшественников.
[0214] Специалистам в данной области будет понятно, что для любого конкретного гена VEGF может существовать один или несколько вариантов или изоформ. Неограничивающие примеры полипептидов VEGF-A согласно настоящему изобретению перечислены в таблице 1. Специалистам в данной области будет понятно, что последовательности, раскрытые в таблице 1, содержат потенциальные фланкирующие участки. Они закодированы в каждой нуклеотидной последовательности либо в направлении 5' (против хода транскрипции), либо в направлении 3' (по ходу транскрипции) от открытой рамки считывания. Открытая рамка считывания определенно и специально раскрыта путем заявления нуклеотидной эталонной последовательности. Также можно дополнительно охарактеризовать 5'- и 3'-фланкирующие участки, используя одну или несколько доступных баз данных или алгоритмов. В базах данных аннотированы признаки, свойственные фланкирующим участкам последовательностей в NCBI, и они доступны из уровня техники.



[0215] Специалистам в данной области будет понятно, что молекулы РНК, кодирующие полипептид VEGF-A, например, полипептид VEGF-A человека, могут быть разработаны согласно изоформам VEGF-А, перечисленным в таблице 1. Рядовому специалисту в данной области обычно известны многочисленные изоформы остальных представителей семейства VEGF.
[0216] В одном варианте осуществления настоящего изобретения представлена модифицированная РНК, кодирующая полипептид VEGF-A (например, SEQ ID NO: 2). В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF-A, где модифицированная РНК содержит SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК дополнительно содержит 5'-кэп, 5'-UTR, 3'-UTR, поли(А) хвост или любую их комбинацию. В некоторых вариантах осуществления 5'-кэп, 5'-UTR, 3'-UTR, поли(А) хвост или любая их комбинация могут включать один или несколько модифицированных нуклеотидов.
[0217] В некоторых вариантах осуществления модифицированная РНК, кодирующая полипептид VEGF-A, может иметь структуру, изображенную на ФИГ. 1В, которая представляет собой SEQ ID NO: 1.
[0218] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF, где модифицированная РНК содержит один или несколько модифицированных нуклеотидов UMP в последовательности нуклеиновой кислоты под SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК, кодирующая полипептид VEGF-A, может включать, например, по меньшей мере один UMP, модифицированный с образованием N1-метил-псевдо-UMP. В некоторых вариантах осуществления N1-метил-псевдо-UMP присутствует вместо UMP, при этом процентное содержание UMP в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все UMP были заменены на N1-метил-псевдо-UMP.
[0219] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF, где модифицированная РНК (дополнительно) содержит один или несколько модифицированных нуклеотидов СМР в последовательности нуклеиновой кислоты под SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК, кодирующая полипептид VEGF-A, может включать, например, по меньшей мере один СМР, модифицированный с образованием метил-СМР. В некоторых вариантах осуществления метил-СМР присутствует вместо СМР, при этом процентное содержание СМР в последовательности выбрано из 0,1%, 2%, 3%, 4%, 1%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все СМР были заменены на 5-метил-CMP.
[0220] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF, где модифицированная РНК (дополнительно) содержит один или несколько модифицированных нуклеотидов AMP в последовательности нуклеиновой кислоты под SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК, кодирующая полипептид VEGF-A, может включать, например, по меньшей мере один AMP, модифицированный с образованием N6-метил-AMP. В некоторых вариантах осуществления N6-метил-AMP присутствует вместо AMP, при этом процентное содержание AMP в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все AMP были заменены на N6-метил-АМР.
[0221] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF, где модифицированная РНК (дополнительно) содержит один или несколько модифицированных нуклеотидов GMP в последовательности нуклеиновой кислоты под SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК может включать, например, по меньшей мере один GMP, модифицированный с образованием 7-метил-GMP. В некоторых вариантах осуществления 7-метил-CMP присутствует вместо GMP, при этом процентное содержание GMP в последовательности выбрано из 0,1%, 1%, 2%, 3%, 4%, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99,9% и 100%. В некоторых вариантах осуществления все GMP были заменены на 7-метил-GMP.
[0222] В некоторых вариантах осуществления модифицированная РНК кодирует полипептид VEGF, где модифицированная РНК (дополнительно) содержит один или несколько модифицированных нуклеотидов в пределах последовательности нуклеиновой кислоты под SEQ ID NO: 1. В некоторых вариантах осуществления модифицированная РНК, кодирующая полипептид VEGF-A, может включать, например, по меньшей мере один или несколько модифицированных нуклеозидов, выбранных из 5-метилцитидина (5mC), N6-метиладенозина (m6A), 3,2'-O-диметилуридина (m4U), 2-тиоуридина (s2U), 2'-фторуридина, псевдоуридина, 2'-O-метилуридина (Um), 2'-дезоксиуридина (2'dU), 4-тиоуридина (s4U), 5-метилуридина (m5U), 2'-O-метиладенозина (m6A), N6,2'-O-диметиладенозина (m6Am), N6,N6,2'-O-триметиладенозина (m62Am), 2'-O-метилцитидина (Cm), 7-метилгуанозина (m7G), 2'-O-метилгуанозина (Gm), N2,7-диметилгуанозина (m-2,7G), N2,N2,7-триметилгуанозина (m-2,2,7G) и N1-метил-псведоуридина, или любую их комбинацию. Каждая возможность и комбинация представляет отдельный вариант осуществления настоящего изобретения.
5.3. Композиции, содержащие модифицированную РНК
[0223] Некоторые варианты осуществления относятся к композициям, включая специфические составы, содержащие раскрытые модифицированные РНК. В некоторых вариантах осуществления состав содержит фармацевтически эффективное количество одной или нескольких модифицированных РНК.
[0224] В некоторых вариантах осуществления фармацевтическая композиция может содержать по меньшей мере одну или несколько модифицированных РНК в липидосодержащем комплексе, таком как липосомы, липоплексы и липидные наночастицы. В целом, липосомы, липоплексы или липидные наночастицы могут применяться для улучшения эффективности продукции белка, управляемой полинуклеотидом, первичной конструкцией или модифицированной РНК, поскольку такие составы могут быть способны увеличивать уровень трансфекции клеток полинуклеотидом, первичной конструкцией или модифицированной РНК и/или увеличивать уровень трансляции кодируемого белка. Один такой пример предусматривает применение липидной инкапсуляции для обеспечения возможности эффективной системной доставки полиплексной плазмидной ДНК (Heyes et al., Mol Ther. (2007) 15:713-720; которая включена в данный документ посредством ссылки во всей своей полноте). Липосомы, липоплексы или липидные наночастицы также можно использовать для увеличения стабильности полинуклеотида, первичной конструкции или модифицированной РНК.
[0225] Следовательно, в некоторых вариантах осуществления фармацевтические композиции модифицированных РНК включают липосомы. Липосомы представляют собой везикулы, полученные искусственным путем, которые могут состоять преимущественно из липидного бислоя и могут использоваться в качестве средства доставки для введения питательных веществ и фармацевтических составов. Липосомы могут иметь различные размеры, например, без ограничения, диаметр многослойной везикулы (MLV) может составлять сотни нанометров, и она может содержать серию концентрических бислоев, разделенных узкими водными компартментами, диаметр небольшой однослойной везикулы (SUV) может составлять менее 50 нм, а диаметр большой однослойной везикулы (LUV) может составлять от 50 до 500 нм. В структуру липосомы можно включать без ограничения опсонины или лиганды, чтобы улучшить прикрепление липосом к пораженной ткани или активировать процессы, такие как без ограничения эндоцитоз. Липосомы могут характеризоваться низким или высоким рН для улучшения доставки фармацевтических композиций.
[0226] В некоторых вариантах осуществления фармацевтические композиции модифицированной РНК включают липоплекс, такой как без ограничения система AtuPLEXTM, система DACC, система DBTC и другие технологии липоплексов с siRNA от Silence Therapeutics (Лондон, Великобритания), STEMFECT™ от STEMGENT® (Кембридж, Массачусетс) и система для нацеленной и ненацеленной доставки нуклеиновых кислот на основе полиэтиленимина (PEI) или протамина (Aleku et al. Cancer Res. 2008 68:9788-9798; Strumberg et al. Int J Clin Pharmacol Ther 2012 50:76-78; Santel et al., Gene Ther 2006 13:1222-1234; Santel et al., Gene Ther 2006 13:1360-1370; Gutbier et al., Pulm Pharmacol. Ther., (2010) 23:334-344; Kaufmann et al. Microvasc Res, (2010) 80:286-293; Weide et al. J Immuno Ther., (2009) 32:498-507; Weide et al. J Immunother., (2008) 31:180-188; Pascolo Expert Opin. Biol. Ther. 4:1285-1294; Fotin-Mleczek et al., J. Immunother, (2011) 34:1-15; Song et al., Nature Biotechnol., (2005) 23:709-717; Peer et al., Proc Natl Acad Sci USA., (2007) 6; 104:4095-4100; deFougerolles Hum Gene Ther., (2008) 19:125-132; все из которых включены в данный документ посредством ссылки во всей своей полноте).
[0227] В некоторых вариантах осуществления фармацевтические композиции модифицированной РНК включают твердую липидную наночастицу. Твердая липидная наночастица (SLN) может быть сферической со средним диаметром от 10 до 1000 нм. SLN обладает твердой липидной сердцевинной матрицей, которая может солюбилизировать липофильные молекулы и может быть стабилизирована поверхностно-активными веществами и/или эмульгаторами. В следующем варианте осуществления липидная наночастица может представлять собой самособирающуюся липидную полимерную наночастицу (см. Zhang et al., ACS Nano, (2008), 2 (8), pp 1696-1702; включенную в настоящий документ посредством ссылки во всей своей полноте).
[0228] Дополнительные липидосодержащие композиции обсуждаются в публикации заявки на патент США №2015/0051268; включенной в данный документ посредством ссылки во всей своей полноте. Следовательно, в некоторых вариантах осуществления фармацевтические составы модифицированной РНК согласно настоящему изобретению составляют в виде липидосодержащих составов, обсуждаемых в публикации заявки на патент США №2015/0051268.
[0229] В некоторых вариантах осуществления настоящего изобретения фармацевтические составы модифицированной РНК не включают никакого липидосодержащего комплекса (такого как липосомы, липоплексы или липидные наночастицы) и в данном документе называются составами с "голой" РНК. В WO 2012/103985 было высказано предположение, что "голая" РНК может проникать в клетки только тогда, когда она составлена в присутствии двухвалентных катионов, предпочтительно кальция. Более того, в других исследованиях было высказано предположение и показано, что кальций необходим для направления молекул "голых" РНК в животные ткани in vivo (Wolff J. A. et al., Science, (1999), 247, 1465-1468). Аналогичным образом, Probst et al. показали, что инъекция "голой" РНК in vivo сильно зависит от присутствия кальция в инъекционном растворе (Probst J. et al., Gene Ther, (2007) 14, 1175-1180). Следовательно, в таких исследованиях, касающихся доставки "голой" РНК в клетки и ткани, было высказано убедительное предположение о необходимости кальция в составе.
[0230] Тем не менее, в некоторых вариантах осуществления настоящего изобретения "голую" модифицированную РНК составляют с забуференным фосфатом солевым (PBS) буфером. Например, модифицированная РНК может быть составлена с буфером PBS, рН 7,4, который практически не содержит двухвалентных катионов. В некоторых вариантах осуществления модифицированная РНК может быть составлена с буфером PBS, рН 7,4, который практически не содержит кальций или магний. В некоторых вариантах осуществления модифицированная РНК может быть составлена с буфером PBS, рН 7,4, не содержащим кальций или магний.
[0231] В некоторых вариантах осуществления "голую" модифицированную РНК составляют с цитратно-солевым буфером. Например, модифицированная РНК может быть составлена с цитратно-солевым буфером, рН 7,0, который практически не содержит двухвалентных катионов. В некоторых вариантах осуществления модифицированная РНК может быть составлена с цитратно-солевым буфером, рН 7,0, который практически не содержит кальций или магний. В некоторых вариантах осуществления модифицированная РНК может быть составлена с цитратно-солевым буфером, рН 7,0, не содержащим кальций или магний. Например, модифицированная РНК может быть составлена с цитратно-солевым буфером, рН 7,0, содержащим 10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде HyClone, где цитратно-солевой буфер не содержит кальций или магний.
[0232] В некоторых вариантах осуществления "голую" модифицированную РНК составляют с трометаминовым (THAM) буфером. Например, модифицированная РНК может быть составлена с буфером ТНАМ, рН 8,0, который практически не содержит двухвалентных катионов. В некоторых вариантах осуществления модифицированная РНК может быть составлена с буфером ТНАМ, который практически не содержит кальций или магний. В некоторых вариантах осуществления модифицированная РНК может быть составлена с буфером ТНАМ, рН 8,0, не содержащим кальций или магний. Например, модифицированная РНК может быть составлена с буфером ТНАМ (трометамин, также известный как 2-амино-2-(гидроксиметил)-1,3-пропандиол, 300 ммоль/л Tris-HCl), рН 8,0, где буфер ТНАМ не содержит кальций или магний.
[0233] В некоторых вариантах осуществления фармацевтические составы "голой" РНК могут дополнительно содержать фармацевтически приемлемое вспомогательное вещество, которое, как используется в данном документе, включает без ограничения любые виды растворителей, дисперсионных сред, разбавителей или других жидких сред-носителей, добавок для образования дисперсии или суспензии, поверхностно-активных средств, средств, регулирующих изотоничность, загустителей или эмульгаторов, консервантов и т.п., подходящих для конкретной требуемой лекарственной формы. Вспомогательные вещества также могут включать без ограничения полимеры, наночастицы типа сердцевина/оболочка, пептиды, белки, клетки, гиалуронидазу, имитаторы наночастиц и их комбинации. Различные вспомогательные вещества для составления фармацевтических композиций и методики получения композиции известны из уровня техники (см. Remington: The Science and Practice of Pharmacy, 22nd Edition, Edited by Allen, Loyd V., Jr, Pharmaceutical Press; который включен в данный документ посредством ссылки во всей своей полноте). В пределах объема настоящего изобретения может предусматриваться применение традиционной среды-вспомогательного вещества, за исключением случаев, когда какая-либо традиционная среда-вспомогательное вещество может быть несовместима с веществом или его производными, например, осуществляет какой-либо нежелательный биологический эффект или иным образом взаимодействует вредным образом с любым другим компонентом(ами) фармацевтической композиции.
[0234] В некоторых вариантах осуществления состав "голой" РНК содержит фармацевтически эффективное количество одной или нескольких модифицированных РНК, где состав содержит забуференный фосфатом солевой буфер и дополнительно содержит фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель. В некоторых вариантах осуществления растворитель представляет собой неводный растворитель.
[0235] В некоторых вариантах осуществления состав "голой" РНК содержит фармацевтически эффективное количество одной или нескольких модифицированных РНК, где состав содержит буфер ТНАМ и дополнительно содержит фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель.
[0236] В некоторых вариантах осуществления состав "голой" РНК содержит фармацевтически эффективное количество одной или нескольких модифицированных РНК, где состав содержит цитратно-солевой буфер и дополнительно содержит фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель.
[0237] В определенных вариантах осуществления составы, содержащие модифицированную РНК согласно настоящему изобретению, находятся в липидосодержащем комплексе (таком как липосомы, липоплексы и липидные наночастицы), забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления составы, содержащие модифицированную РНК согласно настоящему изобретению, составлены в липидосодержащем комплексе (таком как липосомы, липоплексы и липидные наночастицы), забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления составы, содержащие модифицированную РНК согласно настоящему изобретению, составлены в липидосодержащем комплексе (таком как липосомы, липоплексы и липидные наночастицы), забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0238] В предпочтительных вариантах осуществления составы "голой" РНК, содержащие модифицированную РНК согласно настоящему изобретению, содержат цитратно-солевой буфер. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0239] В некоторых вариантах осуществления состав "голой" РНК, содержащий модифицированную РНК, кодирующую полипептид VEGF-A, которая составлена в цитратно-солевом буфере, является менее токсичным для субъекта, чем липидосодержащий состав.
5.4. Лечение субъектов, страдающих от заболеваний, реагирующих на терапию с помощью VEGF-A
[0240] Субъекты с недостаточной экспрессией VEGF-A могут страдать от многих сосудистых заболеваний, в том числе без ограничения сердечной недостаточности со сниженной или сохраненной фракцией выброса, заболевания почек, заболевания, связанного с пересадкой кожи и пересадкой ткани, сердечной дисфункции после MI, ишемической болезни сердца, повреждения сосудов в результате травмы или хирургического вмешательства, кожной язвы, в том числе диабетической язвы, критической ишемии конечностей, легочной гипертензии и болезни периферических артерий. Цель настоящего изобретения заключается в лечении субъектов, страдающих от заболеваний, реагирующих на терапию с помощью VEGF-A, путем непосредственного введения одной или нескольких молекул модифицированной РНК, кодирующей полипептиды VEGF-A. В некоторых вариантах осуществления "голую" РНК VEGF-A вводят субъекту в цитратно-солевом буфере без липидов и кальция.
[0241] Как правило, экзогенные нуклеиновые кислоты, введенные в клетки, индуцируют врожденный иммунный ответ, что приводит к продукции интерферона (IFN) и гибели клетки. Однако модифицированные РНК преодолевают по меньшей мере некоторые из этих проблем и представляют большой интерес для области терапевтических средств, диагностических средств, реагентов и биологических анализов с точки зрения доставки нуклеиновой кислоты, например рибонуклеиновой кислоты (РНК), внутрь клетки, как in vivo, так и ex vivo, таким образом, чтобы обеспечить внутриклеточную трансляцию нуклеиновой кислоты и продукцию закодированного белка.
[0242] Модифицированные РНК и белки, транслированные за счет модифицированных РНК, описываемых в данном документе, могут применяться в качестве терапевтических средств. Например, модифицированную РНК, описываемую в данном документе, можно вводить субъекту, где модифицированная РНК транслируется с продуцированием терапевтического белка любого представителя семейства VEGF или его фрагмента у субъекта. Представлены способы лечения заболевания или состояний у человека и других млекопитающих. Все составы, описываемые в данном документе для VEGF-A, можно соответствующим образом использовать в случае любого другого представителя семейства VEGF.
[0243] В некоторых вариантах осуществления композиции и конкретные составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения заболевания, такого как сердечная недостаточности со сниженной или сохраненной фракцией выброса, заболевание почек, заболевание, связанное с пересадкой кожи и пересадкой ткани, сердечная дисфункция после MI, ишемическая болезнь сердца, повреждение сосудов в результате травмы или хирургического вмешательства, кожная язва, в том числе диабетическая язвя, для заживления ран, таких как рваные раны, при критической ишемии конечностей, легочной гипертензии и болезни периферических артерий.
[0244] В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения сердечной недостаточности со сниженной или сохраненной фракцией выброса. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения сердечной дисфункции после MI. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения ишемической болезни сердца. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения повреждения сосудов в результате травмы или хирургического вмешательства. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения кожной язвы, в том числе диабетической язвы. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять в заживлении раны, например, в заживлении рваных ран. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять при критической ишемии конечностей. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения легочной гипертензии. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения болезни периферических артерий. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения заболевания почек. В некоторых вариантах осуществления составы, содержащие одну или несколько модифицированных РНК, кодирующих полипептиды VEGF-A, можно применять для лечения заболевания, связанного с пересадкой кожи и пересадкой ткани.
[0245] Другие аспекты настоящего изобретения относятся к введению составов, содержащих модифицированные РНК, субъектам, нуждающимся в этом. Введение состава может быть внутримышечным, трансартериальным, внутрибрюшинным, внутривенным, внутриартериальным, подкожным, внутрижелудочковым, внутрикожным, интракардиальным, эпикардиальным, через катетер воротной вены, через катетер коронарного синуса и/или прямым введением в область, подлежащую лечению.
[0246] Однако настоящее изобретение также охватывает доставку молекул "голой" модифицированной РНК или комплексов модифицированной РНК и/или их фармацевтических, профилактических или диагностических составов с помощью любого подходящего пути введения с учетом вероятного прогресса в отраслях доставки лекарственных средств.
[0247] В качестве неограничивающих примеров в некоторых вариантах осуществления составы согласно настоящему изобретению вводят субъекту внутримышечным, внутрикожным, подкожным, интракардиальным или эпикардиальным путем, через катетер воротной вены, через катетер коронарного синуса и/или путем непосредственного введения в область, подлежащую лечению. В некоторых вариантах осуществления состав вводят субъекту внутримышечно. В некоторых вариантах осуществления состав вводят субъекту внутрикожно. В некоторых вариантах осуществления состав вводят субъекту подкожно.
[0248] В некоторых вариантах осуществления состав вводят субъекту интракардиально, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления состав вводят субъекту через катетер воротной вены, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления состав вводят субъекту через катетер коронарного синуса, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления состав вводят субъекту путем непосредственного введения в область, подлежащую лечению, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. Например, состав вводят субъекту с помощью прямой инъекции в пораженную область во время хирургической операции на открытом сердце, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления состав вводят субъекту эпикардиально, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. Например, в случае пациентов, у которых выполняют шунтирование коронарной артерии (CABG), состав вводят пациенту с наружной стороны сердца, предпочтительно при фиксированной дозе в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В каждом из вариантов осуществления по данному абзацу "несколько введений" могут быть отделены друг от друга короткими (1-5 минут), средними (6-30 минут) или длительными (более 30 минут, часов или даже дней) промежутками времени.
[0249] Состав можно вводить субъекту с применением любого числа введений, эффективного для лечения заболевания, нарушения и/или состояния. Точное необходимое количество будет варьировать от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, тяжести заболевания, конкретного состава, его способа введения, его способа активности и т.п. Однако будет понятно, что общее суточное применение составов может определять лечащий врач в рамках тщательной медицинской оценки. Конкретный фармацевтически эффективный уровень дозы для любого конкретного пациента будет зависеть от целого ряда факторов, в том числе от заболевания, подлежащего лечению, и тяжести заболевания; активности конкретного используемого соединения; конкретного используемого состава; возраста, массы тела, общего состояния здоровья, пола и диеты пациента; времени введения, пути введения и скорости выделения конкретного используемого соединения; продолжительности лечения; лекарственных средств (например, модифицированной РНК), применяемых в комбинации или одновременно с конкретным используемым соединением; и подобных факторов, хорошо известных в области медицины.
[0250] В определенных вариантах осуществления составы согласно настоящему изобретению вводят субъекту, где составы предусматривают липидосодержащий комплекс (такой как липосомы, липоплексы и липидные наночастицы). В других вариантах осуществления "голую" модифицированную РНК вводят в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В других вариантах осуществления "голую" модифицированную РНК вводят при отсутствии двухвалентных катионов, в том числе кальция. В предпочтительных вариантах осуществления составы для интракардиального или внутрикожного введения, содержащие модифицированную РНК, составляют в цитратно-солевом буфере, не содержащем кальций или магний. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0251] В определенных вариантах осуществления составы согласно настоящему изобретению можно вводить при уровнях дозы, достаточных для доставки от приблизительно 0,0001 мг/кг до приблизительно 100 мг/кг, от приблизительно 0,001 мг/кг до приблизительно 0,05 мг/кг, от приблизительно 0,005 мг/кг до приблизительно 0,05 мг/кг, от приблизительно 0,001 мг/кг до приблизительно 0,005 мг/кг, от приблизительно 0,05 мг/кг до приблизительно 0,5 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 50 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 40 мг/кг, от приблизительно 0,5 мг/кг до приблизительно 30 мг/кг, от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг или от приблизительно 1 мг/кг до приблизительно 25 мг/кг модифицированной РНК в расчете на массу тела субъекта в сутки, один или несколько раз в сутки, для получения требуемого терапевтического или профилактического эффекта. Требуемую дозу можно доставлять три раза в сутки, два раза в сутки, один раз в сутки, через сутки, раз в трое суток, раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или один раз в виде однократной дозы, либо в виде болюсной дозы, либо в виде нескольких введений в течение секунды, минут или часов за 24-часовой период времени. В определенных вариантах осуществления требуемую дозу можно доставлять с применением нескольких введений (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше введений).
[0252] В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы. Например, составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 0,1 мг до приблизительно 1 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 1 мг до приблизительно 10 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 10 мг до приблизительно 25 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 25 мг до приблизительно 50 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 50 мг до приблизительно 100 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированных уровнях дозы от приблизительно 0,1 до приблизительно 25 мг, в пересчете либо на введение, либо на общую дозу. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. Например, в некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 0,1 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 1 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 10 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 25 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 50 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений. В некоторых вариантах осуществления составы согласно настоящему изобретению можно вводить при фиксированной дозе 100 мг, в пересчете либо на введение, либо на общую дозу, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений.
[0253] В некоторых вариантах осуществления составы согласно настоящему изобретению вводят субъекту, где состав, содержащий "голую" модифицированную РНК, кодирующую полипептид VEGF-A, которая составлена в цитратно-солевом буфере, является менее токсичным для субъекта, чем липидосодержащий состав. Оценки токсичности, обусловленной доставкой РНК в составах согласно настоящему изобретению, можно осуществлять с помощью способов, хорошо известных из уровня техники. Например, для улучшения инкапсуляции и стабильности РНК в липидные составы терапевтических средств на основе РНК как правило, включают катионные липиды. Однако некоторые катионные липиды могут дозозависимым образом нарушать целостность структуры мембраны, вызывать лизис и некроз клеток и/или изменять экспрессию нескольких генов нежелательным образом (Xue H.Y., Curr Pharm Des., (2015) 21(22):3140-7; включен в данный документ посредством ссылки во всей своей полноте). Следовательно, примеры токсичности можно оценивать путем измерения степени лизиса и некроза клеток и/или изменения экспрессии нескольких генов, обусловленных доставкой РНК в составах согласно настоящему изобретению. Документальными доказательствами были подтверждены типы дозозависимой системной токсичности некоторых липоплексов на уровне доклинических и клинических исследований. Захват некоторых липоплексов клетками Купфера в печени может запускать воспалительные реакции, которые могут наносить повреждения печени и приводить к повышению уровней основных функциональных показателей печени. Также может наблюдаться лейкопения и тромбоцитопения (Zhang J., Adv Drug Deliv Rev., (2005) 57(5):689-698; включен в данный документ посредством ссылки во всей своей полноте). Следовательно, примеры токсичности можно оценивать путем измерения воспалительных реакций, обусловленных доставкой РНК в составах согласно настоящему изобретению. Кроме того, примеры токсичности можно оценивать путем измерения реакций, связанных с инфузией, таких как одышка, гипоксия, дрожь, боль в спине, гипотензия и поражение печени.
[0254] Субъект, страдающий от сосудистого заболевания, является "реагирующим" на лечение, если уменьшается один или несколько симптомов или клинических маркеров. В качестве альтернативы лечение является работающим, если прогрессирование заболевания снижается или прекращается. Например, сердечная недостаточность (HF) возникает, когда сердце ослаблено и не заполняется или не может прокачать достаточное количество крови для удовлетворения потребностей организма в крови и кислороде. Аналогичным образом, пациент с ишемической болезнью сердца (IHD) имеет проблемы с сердцем, вызванные сужением сердечных артерий. Когда артерии сужены, меньше крови и кислорода достигает сердечной мышцы. Вследствие микрососудистой дисфункции, потери функциональных сосудов и/или потери сердечной ткани у пациента обычно развивается сердечная дисфункция после MI. Кроме того, сосудистые структуры чаще всего повреждаются при проникающей травме или хирургическом вмешательстве. Диабет отрицательно влияет на многочисленные компоненты, служащие для заживления раны, и пациент с заживлением диабетической раны обычно характеризуется измененным током крови из-за сосудистой дисфункции. Следовательно, у пациента с кожной язвой, в том числе с диабетическими язвами, заживление раны обычно снижено или замедлено. Критическая ишемия конечностей (CLI) представляет собой тяжелую обструкцию артерий, которая заметно снижает ток крови в конечностях (ладонях, стопах и ногах) и прогрессирует до такой степени, что вызывает сильную боль и даже кожные язвы, открытые поражения кожи или гангрену. Легочная гипертензия (РН или PHTN) представляет собой повышение кровяного давления в легочной артерии, легочной вене или легочных капиллярах, совместно известных как сосудистая система легких, что приводит к одышке, головокружению, обморокам, отекам ног и другим симптомам. Болезнь периферических артерий (PAD) представляет собой сужение периферических артерий в ногах, желудке, руках и голове, чаще всего в артериях ног. Эти условия обычно диагностируют клинически на основе различных физических обследований с подтверждением с помощью эхокардиографии, анализов крови, электрокардиографии с магнитно-резонансной визуализацией (MRI) и других подходящих тестов. Например, диагноз значительного повреждения сосудов основывается на внимательном физикальном осмотре и тестах визуализации. Следовательно, лечение любого из этих состояний является работающим, если пациент демонстрирует менее тяжелые симптомы при физикальных осмотрах и/или улучшения результатов тестирования с помощью эхокардиографии, анализов крови, MRI, электрокардиографии или любых других подходящих и/или традиционных тестов.
[0255] В некоторых вариантах осуществления субъект, страдающий от сосудистого заболевания, переносит инфаркт миокарда. В некоторых вариантах осуществления субъекта перенес инфаркт миокарда не позднее приблизительно одного месяца до осуществления лечения с помощью составов, раскрытых в данном документе.
[0256] В некоторых вариантах осуществления инфаркт миокарда запускает активацию клеток эпикардиального происхождения (EPDC) с течением времени. В некоторых вариантах осуществления субъекта, переносящего инфаркт миокарда, лечат с помощью составов, раскрытых в данном документе, через несколько дней после инфаркта миокарда, предпочтительно во время достижения пика активации EPDC. В некоторых вариантах осуществления субъекта, переносящего инфаркт миокарда, лечат с помощью составов, раскрытых в данном документе, через приблизительно 7 дней после инфаркта миокарда. В некоторых вариантах осуществления субъекта, переносящего инфаркт миокарда, лечат с помощью составов, раскрытых в данном документе, через приблизительно 10 дней после инфаркта миокарда, 2 недели после инфаркта миокарда, 3 недели после инфаркта миокарда или 6 недель после инфаркта миокарда.
[0257] В некоторых вариантах осуществления терапия с помощью композиций или составов, описываемых в данном документе, предусматривает лечение инфаркта миокарда со сниженной фракцией выброса. В других вариантах осуществления терапия предусматривает лечение сердечной недостаточности с сохраненной фракцией выброса. В некоторых вариантах осуществления композицию или состав вводят инъекцией в пограничную зону между здоровой и подвергшейся инфаркту тканью.
[0258] В некоторых вариантах осуществления субъект, страдающий от сосудистого заболевания, также страдает от заболевания коронарной артерии, высокого кровяного давления, диабета, мерцательной аритмии, порока клапанов сердца, кардиомиопатии или инфекции.
[0259] В некоторых вариантах осуществления субъект, страдающий от сосудистого заболевания, страдает от дисфункции левого желудочка. В некоторых вариантах осуществления субъект характеризуется фракцией выброса левого желудочка (LVEF), составляющей менее приблизительно 40%. В некоторых вариантах осуществления субъект характеризуется LVEF, составляющей менее приблизительно 45%.
[0260] В некоторых вариантах осуществления субъект страдает от сердечной недостаточности со сниженной или сохраненной фракцией выброса. В некоторых вариантах осуществления субъекта с сердечной недостаточностью со сниженной или сохраненной фракцией выброса классифицируют как находящегося на II-IV стадии согласно руководству Функциональная классификация Нью-Йоркской ассоциации кардиологов (NYHAFC).
[0261] В некоторых вариантах осуществления субъект характеризуется повышенными уровнями одного или нескольких биомаркеров, являющихся показателем сердечной недостаточности со сниженной или сохраненной фракцией выброса (например, NT-proBNP, BNP, hsTnT или hsTnI). В некоторых вариантах осуществления субъект характеризуется повышенным уровнем BNP (натрийуретического пептида типа В). В некоторых вариантах осуществления субъект характеризуется уровнями BNP, составляющими приблизительно 100 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями BNP, составляющими приблизительно 100-300 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями BNP, составляющими приблизительно 300-600 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями BNP, составляющими приблизительно 600 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями BNP, составляющими приблизительно 600-900 пг/мл. В некоторых вариантах осуществления субъект характеризуется повышенными уровнями NT-proBNP (N-терминального предшественника натрийуретического пептида типа В). В некоторых вариантах осуществления субъект характеризуется уровнями NT-proBNP, составляющими приблизительно 450 пг/мл. В некоторых вариантах осуществления возраст субъекта составляет менее 50 лет, и он характеризуется уровнями NT-proBNP, составляющими приблизительно 450 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями NT-proBNP, составляющими приблизительно 900 пг/мл. В некоторых вариантах осуществления возраст субъекта составляет приблизительно 50-75 лет, и он характеризуется уровнями NT-proBNP, составляющими приблизительно 900 пг/мл. В некоторых вариантах осуществления субъект характеризуется уровнями NT-proBNP, составляющими по меньшей мере 1800 пг/мл. В некоторых вариантах осуществления возраст субъекта составляет приблизительно 75 лет, и он характеризуется уровнями NT-proBNP, составляющими приблизительно 1800 пг/мл. В некоторых вариантах осуществления субъект характеризуется повышенными уровнями hsTnT (высокочувствительного тропонина Т). В некоторых вариантах осуществления субъект характеризуется повышенными уровнями hsTnI (высокочувствительного тропонина I).
[0262] В некоторых вариантах осуществления субъект перенес инфаркт миокарда не позднее приблизительно одного месяца до осуществления лечения с помощью составов, раскрытых в данном документе, при этом он характеризуется LVEF, составляющей менее приблизительно 45%.
[0263] В некоторых вариантах осуществления субъект страдает от хронической ишемической сердечной недостаточности со сниженной или сохраненной фракцией выброса, при этом характеризуется LVEF, составляющей менее приблизительно 40%, уровнем NT-proBNP, составляющим по меньшей мере приблизительно 600 пг/мл, и классифицирован как находящийся на II-IV стадии согласно руководству NYHAFC.
[0264] Кроме того, для оценки улучшений общей патофизиологии можно применять молекулярные измерения сосудистых функций. Примеры таких измерений включают повышенную доступность оксида азота (NO), повышенный ангиогенез/артериогенез и рекрутинг стволовых клеток в сердечную ткань. Следовательно, пациент, страдающий от сосудистого заболевания, является "реагирующим" на лечение, если у пациента демонстрируется улучшение молекулярных функций при этих измерениях.
5.5. Модуляция физиологического процесса в клетке млекопитающего, его ткани или субъекте-млекопитающем
[0265] Другой аспект настоящего изобретения относится к введению композиции или конкретного состава, содержащих модифицированную РНК, кодирующую полипептид VEGF-A, для модуляции физиологического процесса в клетке млекопитающего, его ткани или субъекте-млекопитающем. В некоторых вариантах осуществления способ модуляции физиологического процесса в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В качестве неограничивающих примеров, модуляция физиологического процесса может включать индуцирование ангиогенеза, стимуляцию пролиферации васкулярных клеток, усиление пролиферации и/или изменение развития клеток-предшественников эпикардиального происхождения, активацию эндотелизации, индуцирование сердечной регенерации, усиление реваскуляризации тканевых лоскутов для заживления раны, улучшение сосудистой функции, усиление тканевой перфузии и образование новых сосудов, уменьшение рубцовой ткани, повышение отношения задействованной систолической работы и преднагрузки, усиление развития максимального давления, усиление инотропной функции, увеличение фракции выброса левого желудочка (например, на приблизительно 5-10%), снижение уровней биомаркеров, ассоциированных с сердечной дисфункцией (например, NT-proBNP, BNP, hsTnT и hsTnI), уменьшение размера очага омертвения, уменьшение фиброза сердечной ткани и/или улучшение сердечной функции.
[0266] Термин "приведение в контакт" или "контакт", используемый в данном документе в отношении приведения клетки, ткани или субъекта в контакт с модифицированной РНК, раскрываемой в данном документе, включает приведение модифицированной РНК в прикосновение или предельно непосредственную близость с клеткой, тканью или субъектом. Следовательно, в некоторых вариантах осуществления фраза "приведение в контакт" относится к способу воздействия, которое может быть прямым или опосредованным. В одном способе такой контакт предусматривает прямую инъекцию композиции в клетку, ткань или субъекта с помощью любых средств, хорошо известных из уровня техники. В другом варианте осуществления приведение в контакт также охватывает такое опосредованное приведение в контакт, как через наружную среду, которая окружает ткань, или любым путем, известным из уровня техники. Каждая возможность представляет отдельный вариант осуществления настоящего изобретения.
[0267] В некоторых вариантах осуществления способ индуцирования ангиогенеза у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК на индуцирование ангиогенеза можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Lopez J J. et al., Cardiovasc Res, (1998) 40, 272-281; Galiano R.D. et al., Am J Pathol., (2004) 164, 1935-1947; Lin Y.D. et al., Sci Transl Med., (2012) 4(146): 146ra 109; Zangi L. et al., Nat Biotechnol., (2013) 10, 898-907; все из которых включены в данный документ посредством ссылки).
[0268] В некоторых вариантах осуществления способ стимуляции пролиферации васкулярныых клеток у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении стимуляции пролиферации васкулярных клеток можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Galiano R.D. et al., Am J Pathol, (2004) 164, 1935-1947; включенную в данный документ посредством ссылки во всей своей полноте).
[0269] В некоторых вариантах осуществления способ усиления пролиферации и/или изменения развития клеток-предшественников эпикардиального происхождения у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении усиления пролиферации и/или изменения развития клеток-предшественников эпикардиального происхождения можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Zangi L. et al., Nat Biotechnol., (2013) 10, 898-907; включенную в данный документ посредством ссылки во всей своей полноте).
[0270] В некоторых вариантах осуществления способ активации эндотелизации у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении активации эндотелизации можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Galiano R.D. et al., Am J Pathol, (2004) 164, 1935-1947; включенную в данный документ посредством ссылки во всей своей полноте).
[0271] В некоторых вариантах осуществления способ индуцирования сердечной регенерации в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении индуцирования сердечной регенерации можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Zangi L. et al., Nat Biotechnol., (2013) 10, 898-907; Lin Y.D. et al., Sci Transl Med., (2012) 4(146): 146ra109; обе из которых включены в данный документ посредством ссылки).
[0272] В некоторых вариантах осуществления способ усиления реваскуляризации тканевых лоскутов для заживления раны в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении усиления реваскуляризации тканевых лоскутов для заживления раны можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Tohyama Н. et al., Chang Gung Med J, (2009) 32, 133-139; Chen J. et al., Exp Ther Med, (2012) 4, 430-434; обе из которых включены в данный документ посредством ссылки).
[0273] В некоторых вариантах осуществления способ улучшения сосудистой функции в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении улучшения сосудистой функции можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Lopez J.J. et al., Cardiovasc Res, (1998) 40, 272-281; Tio R.A. et al., Hum Gene Ther., (1999) 10, 2953-2960; Sato K. et al., J Am Coll Cardiol., (2001) 37, 616-23; все из которых включены в данный документ посредством ссылки).
[0274] В некоторых вариантах осуществления способ усиления тканевой перфузии и образования новых сосудов в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении усиления тканевой перфузии и образования новых сосудов можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Chiappini С, et al., Nat Mater., (2015) 14, 532-539; Lin Y.D. et al„ Sci Transl Med., (2012) 4(146): 146ra109; Zangi L. et al„ Nat Biotechnol., (2013) 10, 898-907; все из которых включены в данный документ посредством ссылки).
[0275] В некоторых вариантах осуществления способ уменьшения рубцовой ткани в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении уменьшения рубцовой ткани можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Rosano J.M. et al., Cardiovasc Eng Technol., (2012) 3, 237-247; Galiano R.D. et al, Am J Pathol, (2004) 164, 1935-1947; Lin Y.D. et al., Sci Transl Med., (2012) 4(146): 146ra109; Zangi L. et al., Nat Biotechnol. (2013) 10, 898-907; все из которых включены в данный документ посредством ссылки).
[0276] В некоторых вариантах осуществления способ улучшения сердечной функции у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении улучшения сердечной функции можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Rosano J.M. et al., Cardiovasc Eng Technol., (2012) 3, 237-247; Lin Y.D. et al„ Sci Transl Med., (2012) 4(146):146ra109; Zangi L. et al„ Nat Biotechnol., (2013) 10, 898-907; все из которых включены в данный документ посредством ссылки).
[0277] В некоторых вариантах осуществления способ повышения отношения задействованной систолической работы и преднагрузки (PRSW) у клетки млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении повышения отношения задействованной систолической работы и преднагрузки можно оценивать с помощью способов, хорошо известных из уровня техники (см., например, Fenely et al., JACC, (1992), 19(7): 1522-30).
[0278] В некоторых вариантах осуществления способ усиления развития максимального давления в клетке млекопитающего, его ткани или субъекта-млекопитающего предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении усиления развития максимального давления можно оценивать с помощью способов, хорошо известных из уровня техники, таких как левая вентрикулография, коронарная ангиография, эхокардиография, MRI-сканирование, СТ-сканирование, синхронизированное SPEC-сканирование миокарда или синхронизированное РЕТ-сканирование миокарда.
[0279] В некоторых вариантах осуществления способ усиления инотропной функции в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении инотропной функции можно оценивать с помощью способов, хорошо известных из уровня техники, таких как левая вентрикулография, коронарная ангиография, эхокардиография, MRI-сканирование, СТ-сканирование, синхронизированное SPEC-сканирование миокарда или синхронизированное РЕТ-сканирование миокарда.
[0280] В некоторых вариантах осуществления способ увеличения фракции выброса левого желудочка (LVEF) в клетке сердца млекопитающего, или его сердечной ткани, или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. Эффекты модифицированной РНК в отношении увеличения фракции выброса левого желудочка можно оценивать с помощью способов, хорошо известных из уровня техники, таких как левая вентрикулография, коронарная ангиография, эхокардиография, MRI-сканирование, СТ-сканирование, синхронизированное SPEC-сканирование миокарда или синхронизированное РЕТ-сканирование миокарда. В некоторых вариантах осуществления LVEF увеличивается на приблизительно 4%-10%. В некоторых вариантах осуществления LVEF увеличивается на приблизительно 5%-8%.
[0281] В некоторых вариантах осуществления способ снижения уровня одного или нескольких биомаркеров, ассоциированных с сердечной дисфункцией (например, NT-proBNP, BNP, hsTnT и hsTnI), в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний.
[0282] В некоторых вариантах осуществления способ уменьшения размера очага омертвения в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. В некоторых вариантах осуществления размер очага омертвения снижается. В некоторых вариантах осуществления очаг омертвения исчезает. Эффекты модифицированной РНК в отношении размера очага омертвения можно оценивать с помощью способов, хорошо известных из уровня техники, таких как левая вентрикулография, коронарная ангиография, эхокардиография, MRI-сканирование, СТ-сканирование, синхронизированное SPEC-сканирование миокарда или синхронизированное РЕТ-сканирование миокарда.
[0283] В некоторых вариантах осуществления способ снижения фиброза в клетке млекопитающего, его ткани или субъекте-млекопитающем предусматривает приведение клетки млекопитающего, его ткани или субъекта-млекопитающего в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний. В некоторых вариантах осуществления фиброз снижается. В некоторых вариантах осуществления фиброз исчезает. Эффекты модифицированной РНК в отношении фиброза можно оценивать с помощью способов, хорошо известных из уровня техники, таких как левая вентрикулография, коронарная ангиография, эхокардиография, MRI-сканирование, СТ-сканирование, синхронизированное SPEC-сканирование миокарда или синхронизированное РЕТ-сканирование миокарда.
5.6. Экспрессия VEGF-A в клетке млекопитающего или его ткани
[0284] Другой аспект настоящего изобретения относится к введению композиции или конкретного состава, содержащих модифицированную РНК, кодирующую полипептид VEGF-A, для in vivo, in vitro, in situ или ex vivo экспрессии белка в клетке млекопитающего или его ткани.
[0285] Некоторые варианты осуществления относятся к способу экспрессии VEGF-A в клетке млекопитающего или его ткани, предусматривающему приведение клетки млекопитающего или его ткани in vivo, in vitro или ex vivo в контакт с композицией, содержащей модифицированную РНК.
[0286] В некоторых вариантах осуществления способ экспрессии VEGF-A в клетке млекопитающего или его ткани предусматривает приведение клетки млекопитающего или его ткани в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению.
[0287] В некоторых вариантах осуществления способ экспрессии VEGF-A в клетке млекопитающего или его ткани предусматривает приведение клетки млекопитающего или его ткани в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению, где композицию составляют в забуференном фосфатом солевом буфере, буфере ТНАМ или цитратно-солевом буфере. В предпочтительных вариантах осуществления композиции, содержащие модифицированную РНК, содержат цитратно-солевой буфер. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний.
[0288] В некоторых вариантах осуществления способ экспрессии VEGF-A в клетке млекопитающего или его ткани предусматривает приведение клетки млекопитающего или его ткани в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению, где композиция содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления композиция содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления композиция содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0289] В некоторых вариантах осуществления способ экспрессии VEGF-A в клетке млекопитающего или его ткани предусматривает приведение клетки млекопитающего или его ткани в контакт с композицией, содержащей модифицированную РНК согласно настоящему изобретению, где композиция составлена в липидосодержащем комплексе (таком как липосомы, липоплексы и липидные наночастицы).
[0290] В некоторых вариантах осуществления способ экспрессии VEGF-A в клетке млекопитающего или его ткани предусматривает приведение клетки млекопитающего или его ткани в контакт с композицией, содержащей модифицированную РНК, составленную в цитратно-солевом буфере, где композиция является менее токсичной для субъекта, чем липидосодержащий состав.
5.7. Способ получения VEGF-A у субъекта
[0291] Некоторые варианты осуществления относятся к способу получения VEGF-A у субъекта, предусматривающему введение субъекту композиции или конкретного состава, содержащих модифицированную РНК согласно настоящему изобретению.
[0292] В качестве неограничивающих примеров в некоторых вариантах осуществления способ получения VEGF-A у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению. В некоторых вариантах осуществления составы составлены в цитратно-солевом буфере. В некоторых вариантах осуществления состав дополнительно содержит фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления состав дополнительно содержит фармацевтически приемлемое вспомогательное вещество, выбранное из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель.
[0293] В некоторых вариантах осуществления состав дополнительно содержит фармацевтически приемлемое вспомогательное вещество, выбранное из липида, липидоида, липосомы, липидной наночастицы, липоплекса и их смесей.
[0294] В некоторых вариантах осуществления способ получения VEGF-A у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению, где субъект страдает от заболевания, реагирующего на терапию с помощью VEGF-A. В некоторых вариантах осуществления субъект страдает от заболевания, выбранного из сердечной недостаточности со сниженной или сохраненной фракцией выброса, заболевания почек, заболевания, связанного с пересадкой кожи и пересадкой ткани, сердечной дисфункции после MI, ишемической болезни сердца, повреждения сосудов в результате травмы или хирургического вмешательства, кожной язвы, в том числе диабетической язвы, критической ишемии конечностей, легочной гипертензии и болезни периферических артерий. В некоторых вариантах осуществления заболевание представляет собой сердечную недостаточность со сниженной или сохраненной фракцией выброса. В некоторых вариантах осуществления заболевание представляет собой сердечную дисфункцию после MI. В некоторых вариантах осуществления заболевание представляет собой ишемическую болезнь сердца. В некоторых вариантах осуществления заболевание представляет собой повреждение сосудов в результате травмы или хирургического вмешательства. В некоторых вариантах осуществления заболевание представляет собой кожную язву, в том числе диабетическую язву. В некоторых вариантах осуществления заболевание представляет собой критическую ишемию конечностей. В некоторых вариантах осуществления заболевание представляет собой легочную гипертензию. В некоторых вариантах осуществления заболевание представляет собой болезнь периферических артерий. В некоторых вариантах осуществления заболевание представляет собой заболевание почек. В некоторых вариантах осуществления заболевание представляет собой заболевание, связанное с пересадкой кожи и пересадкой ткани.
[0295] В некоторых вариантах осуществления способ получения VEGF-A у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению, где состав вводят субъекту посредством внутримышечного, внутрикожного, подкожного или интракардиального пути введения, через катетер воротной вены, через катетер коронарного синуса и/или путем непосредственного введения в область, подлежащую лечению. В некоторых вариантах осуществления состав вводят субъекту внутримышечно. В некоторых вариантах осуществления состав вводят субъекту внутрикожно. В некоторых вариантах осуществления состав вводят субъекту подкожно. В некоторых вариантах осуществления состав вводят субъекту интракардиально, предпочтительно в виде нескольких (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, шестнадцати, семнадцати, восемнадцати, девятнадцати, двадцати или больше) введений при фиксированной дозе. В некоторых вариантах осуществления состав вводят субъекту через катетер воротной вены. В некоторых вариантах осуществления состав вводят субъекту через катетер коронарного синуса. В некоторых вариантах осуществления состав вводят субъекту путем непосредственного введения в область, подлежащую лечению.
[0296] В некоторых вариантах осуществления способ получения VEGF-А у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению, где состав содержит липидосодержащий комплекс (такой как липосомы, липоплексы и липидные наночастицы), забуференный фосфатом солевой буфер, буфер ТНАМ или цитратно-солевой буфер. В предпочтительных вариантах осуществления составы, содержащие модифицированную РНК, составлены в цитратно-солевом буфере. В некоторых вариантах осуществления цитратно-солевой буфер практически не содержит кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний.
[0297] В некоторых вариантах осуществления способ получения VEGF-A у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению, где состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0298] В некоторых вариантах осуществления способ получения VEGF-A у субъекта предусматривает введение субъекту состава, содержащего модифицированную РНК согласно настоящему изобретению, где состав содержит цитратно-солевой буфер и является менее токсичным для субъекта, чем липидосодержащий состав.
5.8. Способ получения состава
[0299] Некоторые варианты осуществления относятся к способу получения состава, предусматривающему объединение модифицированной РНК согласно настоящему изобретению с липидосодержащий комплексом (таким как липосомы, липоплексы и липидные наночастицы), забуференным фосфатом солевым буфером, буфером ТНАМ или цитратно-солевым буфером.
[0300] Некоторые варианты осуществления относятся к способу получения состава, предусматривающему объединение модифицированной РНК с цитратно-солевым буфером, где состав является эффективным для лечения субъекта, страдающего от заболевания, реагирующего на терапию с помощью VEGF-A, модуляции физиологического процесса в клетке млекопитающего, его ткани или субъекте-млекопитающего, экспрессии VEGF-A в клетке млекопитающего или его ткани и/или продуцирования VEGF-A у субъекта.
[0301] В некоторых вариантах осуществления способ получения состава предусматривает объединение модифицированной РНК согласно настоящему изобретению с цитратно-солевым буфером, где состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 0,1 до 1 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 1 до 10 мкг/мкл. В некоторых вариантах осуществления состав содержит модифицированную РНК, составленную в цитратно-солевом буфере при концентрации от 10 до 50 мкг/мкл.
[0302] В некоторых вариантах осуществления способ получения состава предусматривает объединение модифицированной РНК с цитратно-солевым буфером согласно настоящему изобретению, где состав содержит цитратно-солевой буфер и является менее токсичным для субъекта, чем липидосодержащий состав.
[0303] В некоторых вариантах осуществления способ получения состава предусматривает объединение модифицированной РНК с цитратно-солевым буфером согласно настоящему изобретению, где цитратно-солевой буфер практически не содержит двухвалентных катионов, в том числе кальций и магний. В некоторых вариантах осуществления цитратно-солевой буфер не содержит кальций или магний.
[0304] В некоторых вариантах осуществления способ получения состава предусматривает объединение модифицированной РНК с цитратно-солевым буфером согласно настоящему изобретению, где состав содержит цитратно-солевой буфер и дополнительно содержит фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель.
[0305] Составы можно вводить субъекту с помощью целого ряда путей введения согласно настоящему изобретению. Специальные составы, подходящие для внутрикожных, интракардиальных, подкожных и внутримышечных инъекций, известны из уровня техники. Например, чтобы пролонгировать эффект активного ингредиента, зачастую желательно замедлить всасывание активного ингредиента после внутримышечной инъекции. Отсроченное всасывание формы лекарственного средства, которую ввели внутримышечно, достигается путем растворения или суспендирования лекарственного средства (например, модифицированной РНК) в масляной среде-носителе. Инъекционные депо-формы получают путем формирования микроинкапсулированных матриц лекарственного средства (например, модифицированной РНК) в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера и природы конкретного используемого полимера, скорость высвобождения лекарственного средства можно контролировать. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). В случае внутрикожных и подкожных инъекций составы предпочтительно составляют таким образом, чтобы они не индуцировали иммунный ответ при доставке во внутрикожный компартмент. Добавки, которые можно использовать в составах для внутрикожных инъекций, включают, например, увлажняющие средства, эмульгаторы или средства для поддержания рН. Составы для внутрикожных инъекций также могут содержать одно или несколько других вспомогательных веществ, таких как сахариды и многоатомные спирты. В случае интракардиальных инъекций составы предпочтительно составляют таким образом, чтобы они не вызывали дополнительных повреждений сердечной мышцы и коронарных артерий после применения инъекционной иглы. Подходящие составы для интракардиальной инъекции представлены в данном документе.
5.9. Способ снижения токсичности композиций модифицированной РНК
[0306] Некоторые варианты осуществления относятся к способу снижения токсичности лечения с помощью модифицированной РНК у субъекта, предусматривающему составление модифицированной РНК с цитратно-соллевым буфером. В некоторых вариантах осуществления состав модифицированной РНК с цитратно-солевым буфером является менее токсичным для субъекта, чем липидосодержащий состав. В некоторых вариантах осуществления токсичность липидосодержащего состава представляет собой дозозависимую токсичность. В некоторых вариантах осуществления токсичность липидосодержащего состава представляет собой дозолимитирующую токсичность.
[0307] В некоторых вариантах осуществления способ снижения токсичности лечения у субъекта предусматривает составление модифицированной РНК согласно настоящему изобретению с цитратно-солевым буфером и дополнительно предусматривает фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах осуществления фармацевтически приемлемое вспомогательное вещество выбрано из растворителя, дисперсионной среды, разбавителя, добавки для образования дисперсии, суспензии, поверхностно-активного средства, средства, регулирующего изотоничность, загустителя или эмульгатора, консерванта, наночастиц типа сердцевина/оболочка, полимера, пептида, белка, клетки, гиалуронидазы и их смесей. В некоторых вариантах осуществления растворитель представляет собой водный растворитель. В некоторых вариантах осуществления растворитель представляет собой неводный растворитель.
[0308] В некоторых вариантах осуществления способ снижения токсичности лечения у субъекта предусматривает составление модифицированной РНК согласно настоящему изобретению с цитратно-солевым буфером, где субъект страдает от заболевания, реагирующего на терапию с помощью VEGF-A. В некоторых вариантах осуществления субъект страдает от заболевания, выбранного из сердечной недостаточности со сниженной или сохраненной фракцией выброса, заболевания почек, заболевания, связанного с пересадкой кожи и пересадкой ткани, сердечной дисфункции после MI, ишемической болезни сердца, повреждения сосудов в результате травмы или хирургического вмешательства, кожной язвы, в том числе диабетической язвы, критической ишемии конечностей, легочной гипертензии и болезни периферических артерий. В некоторых вариантах осуществления заболевание представляет собой сердечную недостаточность со сниженной или сохраненной фракцией выброса. В некоторых вариантах осуществления заболевание представляет собой сердечную дисфункцию после MI. В некоторых вариантах осуществления заболевание представляет собой ишемическую болезнь сердца. В некоторых вариантах осуществления заболевание представляет собой повреждение сосудов в результате травмы или хирургического вмешательства. В некоторых вариантах осуществления заболевание представляет собой кожную язву, в том числе диабетическую язву. В некоторых вариантах осуществления заболевание представляет собой критическую ишемию конечностей. В некоторых вариантах осуществления заболевание представляет собой легочную гипертензию. В некоторых вариантах осуществления заболевание представляет собой болезнь периферических артерий. В некоторых вариантах осуществления заболевание представляет собой болезнь периферических артерий. В некоторых вариантах осуществления заболевание представляет собой заболевание почек. В некоторых вариантах осуществления заболевание представляет собой заболевание, связанное с пересадкой кожи и пересадкой ткани.
5.10. Последовательности нуклеиновой кислоты.
[0309] Некоторые варианты осуществления относятся к последовательности нуклеиновой кислоты, содержащей матрицу in vitro транскрипции для получения модифицированной РНК. В некоторых вариантах осуществления последовательность нуклеиновой кислоты содержит матрицу in vitro транскрипции для получения модифицированной РНК согласно настоящему изобретению.
[0310] После того как становится доступной матрица транскрипции для получения модифицированной РНК, модифицированные РНК согласно настоящему изобретению можно получать согласно любой доступной методике, хорошо известной из уровня техники, с применением коммерчески доступных исходных материалов (см., например, публикацию заявки на патент США №2015/0051268; патент США №8710200; публикацию заявки на патент США №2013/0259923; все из которых включены посредством ссылки).
[0311] Все пункты в формуле изобретения в данном документе включены посредством ссылки в описание во всей своей полноте как дополнительные варианты осуществления.
6. ПРИМЕРЫ
6.1. ПРИМЕР 1
Трансфекция модифицированной РНК VEGF-A и продукция белка VEGF-A
[0312] Для исследования трансфекционного потенциала модифицированной РНК VEGF-A 10000 клеток высевали в 96-луночные планшеты в обычную среду для культивирования. Для получения кондиционированных сред, содержащих VEGF-A, продуцированный за счет модифицированной РНК, 250000 эндотелиальных клеток пупочной вены человека (HUVEC) (Lonza, Базель, Швейцария) высевали в шестилуночные планшеты в среду, среда для выращивания эндотелиальных клеток (EGM) (Lonza). На следующий день проводили трансфекцию в бессывороточной среде, базовая среда для эндотелиальных клеток (ЕВМ) (Lonza). Модифицированную РНК VEGF А (указанные количества) смешивали с Lipofectamine 2000 (Invitrogen, Карлсбад, Калифорния, США) согласно инструкциям производителя и добавляли к клеткам. В качестве контроля трансфекции применяли Lipofectamine 2000, смешанный с водой. Через 4 часа среду для трансфекции удаляли и заменяли свежей бессывороточной средой ЕВМ и среды собирали в указанные моменты времени. Кондиционированную среду собирали через 24 часа и хранили при -80°C. Концентрацию VEGF А человека измеряли с помощью ELISA, как описано ниже.
[0313] Количество VEGF-A человека в культуральной среде клеток после трансфекции измеряли с помощью набора ELISA для VEGF-A человека (Novex, Invitrogen) согласно инструкциям производителя. Поглощение считывали при 450 нм на устройстве для считывания SpectraMax и рассчитывали концентрацию VEGF А в образцах.
[0314] Для всех трансфекций модифицированной РНК VEGF-A в клетки in vitro требовался Lipofectamine 2000. Модифицированная РНК VEGF-A могла трансфицироваться в множество типов клеток сердца человека. Более высокая доза модифицированной РНК приводила к продукции большего количества белка VEGF-A (ФИГ. 2А). Продукция белка за счет модифицированной РНК достигала пикового значения через приблизительно 8 часов после трансфекций, а затем снижалась (ФИГ. 2В). Кроме того, трансфекция модифицированной РНК и продукция белка были эффективными у разных видов, и как фибробласты сердца мыши, так и эндотелиальные клетки свиньи можно было трансфицировать, что приводило к трансляции белка VEGF-A (ФИГ. 2С).
6.2. ПРИМЕР 2
Активация передачи сигнала рецептором 2 VEGF под действием рекомбинантного и продуцированного за счет модифицированной РНК VEGF-А
[0315] Сто тысяч HUVEC высевали в 12-луночные планшеты в среду EGM. На следующий день клетки подвергали истощению в течение 24 часов в ЕВМ, а затем воздействовали на них с помощью 100 нг/мл VEGF-A, либо рекомбинантного (R&D Systems, Миннеаполис, Миннесота, США), либо продуцированного за счет модифицированной РНК (добавленного в виде кондиционированных сред), или сред без VEGF-A. Стимуляцию прекращали через 2, 10 и 20 минут и среду удаляли. Общий белок получали из культивируемых клеток с помощью буфера для лизиса, содержащего ингибиторы протеаз и фосфатаз (Mesoscale Discovery, Роквилл, Мэриленд, США). Концентрацию белка измеряли с применением набора для анализа белков ВСА (Pierce, Рокфорд, Иллинойс, США) согласно протоколу производителя.
[0316] Пятнадцать микрограммов белка загружали на гель с 4-12% градиентом Bis-Tris и выполняли электрофорез с применением подвижного буфера MES SDS (Invitrogen). Подвергнутый фракционированию белок разделяли с помощью электрофореза на мембране из поливинилдифторида (PVDF) (Invitrogen). Мембраны блокировали с помощью 5% BSA в TBS Tween (0,1%), а затем инкубировали с первичными антителами при 4°C на протяжении ночи. В качестве первичных антител применяли антитела к рецептору 2 VEGF (VEGFR2), фосфорилированному VEGFR2 (p-VEGFR2), Akt, фосфорилированному Akt (p-Akt), eNOS (все от компании CellSignaling, Дэнверс, Массачусетс, США) и фосфорилированному eNOS (p-eNOS, BD Biosciences, Франклин-Лейке, Нью-Джерси, США). Мембраны инкубировали с меченным пероксидазой хрена вторичным антителом (Dako, Глоструп, Дания) и иммунные реакции выявляли с применением субстрата для ECL вестерн-блоттинга (Pierce). Хемилюминесцентные сигналы визуализировали с применением системы визуализации ChemiDoc Touch (BioRad, Геркулес, Калифорния, США).
[0317] Для подтверждения того, что белок VEGF-A, продуцированный за счет модифицированной РНК, был активным, кондиционированную среду от клеток, трансфицированных модифицированной РНК VEGF-A, добавляли к культивируемым клеткам. Это приводило к фосфорилированию основного рецептора VEGF-A, рецептор 2 VEGF, в эндотелиальных клетках человека (ФИГ. 3А). Кроме того, кондиционированная среда также индуцировала фосфорилирование нисходящих путей передачи сигнала eNOS в эндотелиальных клетках человека (ФИГ. 3В) и Akt в фибробластах сердца мыши (ФИГ. 3С) соответственно.
6.3. ПРИМЕР 3
Белок VEGF-A, продуцированный за счет модифицированной РНК, является активным белком, стимулировавшим некоторые важные стадии в процессе ангиогенеза
[0318] HUVEC высевали в 96-луночные планшеты при плотности 3000 клеток на лунку в среду EGM (Lonza). На следующий день среду меняли на базовую среду ЕВМ, дополненную 2% эмбриональной телячьей сыворотки (FBS) и рекомбинантным VEGF-A (R&D Systems), или на кондиционированную среду, содержащую VEGF-A, продуцированный за счет модифицированной РНК, дополненную 2% FBS. Концентрация VEGF составляла 10 нг/мл, 50 нг/мл и 100 нг/мл, соответственно. Среду без VEGF-A использовали в качестве контроля. Планшеты выдерживали при 37°C в 5% СО2 и через два дня фиксировали в забуференном 4% формальдегиде (Histolab, Готенбург, Швеция), а ядра окрашивали с помощью Hoechst (Invitrogen) в течение 10 минут. Число ядер определяли в системе для высокопродуктивного анализа Image Express.
[0319] HUVEC окрашивали с помощью Cell Tracker Red (Molecular Probes, Юджин, Орегон, США) согласно инструкции производителя и высевали в среде ЕВМ, дополненной 2% сыворотки, на вкладыши Transwell с мембраной FloroBlok, имеющей размер пор 8 мкм, в 24-луночном планшете (Corning, Нью-Йорк, США). В нижнюю камеру добавляли ЕВМ с 2% сыворотки, содержащую рекомбинантный VEGF-A человека (R&D Systems), или кондиционированную среду, содержащую VEGF-A, продуцированный за счет модифицированной РНК, с 2% сыворотки. VEGF-A в качестве хемоаттрактанта исследовали при концентрациях 10 нг/мл и 100 нг/мл соответственно. Среду без VEGF-А использовали в качестве контроля. Через 24 часа клетки, которые мигрировали на нижнюю сторону мембраны, подсчитывали с помощью системы для высокопродуктивного анализа Image Express.
[0320] HUVEC смешивали с гранулами микроносителя Cytodex 3 (GE Healthcare, Литл-Чалфонт, Великобритания) в ЕВМ и пробирки выдерживали при 37°C и регулярно встряхивали для обеспечения равномерного покрытия. Через 4 часа гранулы, покрытые эндотелиальными клетками, высевали в колбы и выдерживали при 37°C и 5% СО2 на протяжении ночи. Гранулы суспендировали из расчета 500 гранул/мл в растворе фибриногена (2 мг/мл, Sigma Aldrich, Сент-Луис, Миссури, США), содержащем апротинин (0,15 единиц/мл, Sigma Aldrich), а затем добавляли в лунки, содержащие тромбин (0,625 единиц/мл, Sigma Aldrich), в 96-луночных планшетах. Через 15 минут из фибринового геля образовывался сгусток, и добавляли среду EGM с рекомбинантным VEGF-A или кондиционированную среду, содержащую VEGF-A, продуцированный за счет модифицированной РНК. В качестве контроля использовали среду без VEGF-A. Планшеты выдерживали при 37°C и 5% СО2 в течение 2 дней, после чего оценивали прорастание кровеносных сосудов. Клетки окрашивали кальцеином в течение 30 минут, планшеты считывали на системе для высокопродуктивного анализа Image Express и определяли прорастание.
[0321] Как показано, белок VEGF-A, продуцированный за счет модифицированной РНК, воздействовал на несколько важных стадий в процессе ангиогенеза. VEGF-A усиливал пролиферацию (ФИГ. 4А) и миграцию (ФИГ. 4В) культивируемых эндотелиальных клеток человека. Кроме того, прорастание кровеносных сосудов в 3D культуре с гранулами, покрытыми эндотелиальными клетками, усиливалось под действием VEGF-A, продуцированного за счет модифицированной РНК (ФИГ. 4С и ФИГ. 5). Важно отметить, что в эндотелиальных клетках белок VEGF-A, продуцированный за счет модифицированной РНК, индуцировал ответы, аналогичные таковым под действием рекомбинантного белка VEGF-A, что показывает, что VEGF-A, продуцированный за счет модифицированной РНК, сохраняет свои свойства и способность воздействовать на ангиогенез.
6.4. ПРИМЕР 4
Оценка уровня белка β-галактозидазы после однократной интракардиальной инъекции модифицированной РНК LacZ у мыши
[0322] Самцов мышей C57B1/6 (возрастом 10-12 недель) анестезировали изофлураном. Область грудной клетки слева брили и дезинфицировали, а после проведения интубации сердце обнажали посредством левосторонней торакотомии. Модифицированную РНК LacZ, составленную в цитратно-солевом растворе (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия) или Lipofectamine® (реагент для трансфекции RNAiMAX, Thermo Fisher Scientific Inc., Нью-Йорк, США), вводили инъекцией (50 мкл) в свободную стенку левого желудочка в направлении от вершины к основанию сердца. После проведения инъекции грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. Затем, когда налаживалось нормальное дыхание, мышь отсоединяли от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку. В предварительно заданные моменты времени после инъекции в сердце мышь анестезировали и грудную клетку вскрывали во второй раз. Сердце иссекали и эффективность трансфекции и присутствие репортерного фермента β-галактозидазы изучали с помощью окрашивания 5-бром-4-хлор-3-индолил-β-D-галактопиранозидом (X-gal). X-gal гидролизуется под действием фермента, образуя интенсивно синий нерастворимый продукт, являющийся признаком присутствия активной β-галактозидазы. Вкратце, орган или ткань промывали в фосфатном буфере и фиксировали в 4% параформальдегиде в течение 15 минут и промывали 3 раза (20-30 минут) с помощью 0,1 ммоль/л фосфатного буфера для промывания (рН 7,3), содержащего 2 ммоль/л MgCl2, 0,01% дезоксихолата натрия и 0,02% Nonidet Р40. Затем свежеприготовленный раствор X-gal (фосфатный буфер для промывания, содержащий 5 ммоль/л K4Fe(CN)6, 5 ммоль/л K3Fe/CN)6 и 1 мг/мл X-gal) добавляли в образец, который затем оборачивали фольгой и инкубировали при 37°C на протяжении ночи. Затем образец 3 раза промывали фосфатным буфером для промывания и фотографировали.
[0323] После проведения левосторонней торакотомии анестезированным мышам вводили однократную интракардиальную инъекцию цитратно-солевого раствора или модифицированной РНК LacZ. Через приблизительно 24 часа мышей умерщвляли и сердца иссекали. Затем сердца подвергали окрашиванию с помощью X-gal на протяжении ночи. На ФИГ. 6В и 6С проиллюстрированы эффективные и качественно аналогичные трансфекция и продукция фермента β-галактозидазы в верхушечной области, в которую вводили инъекцию модифицированной РНК, составленной в липофектамине (ФИГ. 6В) или цитратно-солевом буфере (ФИГ. 6С). Никакого окрашивания не наблюдали в сердцах, в которые инъецировали только цитратно-солевой раствор (ФИГ. 6А).
6.5. ПРИМЕР 5
Оценка экспрессии белка люциферазы после интракардиальной инъекции модифицированной РНК люциферазы у не подвергавшихся обработке мышей
[0324] Самцов мышей С57В1/6 (возрастом 10-12 недель) анестезировали смесью кетамина (10 мг/кг) и ксилазина (3,5-4 мг/кг), вводимой путем внутрибрюшинной инъекции. Область грудной клетки слева брили и дезинфицировали, а после проведения интубации сердце обнажали посредством левосторонней торакотомии.
[0325] Модифицированную РНК люциферазы светляка составляли со следующими буферами:
1. Буфер PBS (1x PBS, без кальция, без магния, рН 7,4);
2. Цитратно-солевой буфер (C/S, 10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН 7,0);
3. Буфер ТНАМ (трометамин, также известный как 2-амино-2-(гидроксиметил)-1,3-пропандиол), 300 ммоль/л Tris-HCl, рН 8,0).
[0326] В общей сложности 25 мкг модифицированной РНК люциферазы вводили инъекцией (50 мкл) в свободную стенку левого желудочка в направлении от вершины к основанию сердца. После проведения инъекции грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. После проведения хирургического вмешательства мышь получала внутрибрюшинную инъекцию атипамезола гидрохлорида (1 мг/кг) и подкожную инъекцию бупренорфина гидрохлорида (0,02 мг/кг). Затем, когда налаживалось нормальное дыхание, мышь отсоединяли от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку.
[0327] После проведения левосторонней торакотомии анестезированным мышам вводили однократную интракардиальную инъекцию только буфера (контроли PBS, C/S или ТНАМ) или модифицированной РНК люциферазы светляка, составленной в буфере PBS, C/S или ТНАМ. Сердца иссекали для оценки экспрессии белка люциферазы с помощью визуализации биолюминесценции IVIS. Результаты, представленные ниже, являются комбинацией двух разделенных во времени исследований на мыши. В таблице 2 приведены индивидуальные необработанные значения биолюминесцентного потока IVIS, а на ФИГ. 7 проиллюстрированы в виде графика средние значения для всех групп обработки соответственно.

[0328] Как изображено на ФИГ. 7, экспрессию белка люциферазы выявляли во всех сердцах, в которые инъецировали модифицированную РНК люциферазы, тогда как для отрицательных контролей (PBS, C/S и ТНАМ) показан незначительный сигнал - отсутствие сигнала. Исходный сигнал биолюминесценции IVIS для этих контролей колеблется от ~4 до 7,5+Е03 единиц биолюминесцентного потока, выраженного как фотоны/секунда. Во всех сердцах, инъецированных модифицированной РНК люциферазы, наблюдали возрастание интенсивности сигнала люциферазы на 3-4 порядка. Статистическое различие между разными буферами не выявлено.
6.6. ПРИМЕР 6
Оценка продукции белка VEGF-A человека после интракардиальной инъекции модифицированной РНК VEGF-A человека у крысы
[0329] Самцов крыс Sprague Dawley (масса тела 250-300 г) анестезировали изофлураном и им вводили подкожную инъекцию маркаина (25 мг/кг) и бупренорфина (0,05 мг/кг) для обезболивания. Область грудной клетки слева брили и дезинфицировали, а после проведения интубации сердце обнажали посредством левосторонней торакотомии в пятом межреберном промежутке.
Модифицированную РНК VEGF-A человека (1800, 150 или 15 мкг), составленную в цитратно-солевом растворе (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия), вводили инъекцией в виде шести отдельных инъекций (по 15 мкл каждая, общий объем 90 мкл), расположенных в линию на свободной стенке левого желудочка. После проведения инъекции грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. Затем, когда налаживалось нормальное дыхание, крысу отсоединяли от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку. В предварительно заданные моменты времени после инъекции в сердце крысу анестезировали и грудную клетку вскрывали во второй раз для получения образца ткани сердца. Сердце иссекали и отрезали правый желудочек, а также левое и правое предсердия. Поперечный срез, включающий участки инъекции, вырезали, разделяли на две части, которые подвергали быстрому замораживанию в жидком азоте и хранили при -80°C до анализа на белок VEGF-A. Отдельный образец ткани брали с верхушки, отдаленной от участка инъекций, в качестве отрицательного контроля.
[0330] Анестезированным крысам вводили интракардиальную инъекцию 3 разных доз (15, 150 или 1800 мкг) модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе. Каждую дозу вводили в виде шести отдельных инъекций вдоль свободной стенки левого желудочка в один момент времени. Животных умерщвляли в разные моменты времени после проведения инъекций, сердца иссекали и ткань желудочков собирали для анализа на содержание белка VEGF-A. На ФИГ. 8А обобщены временные профили и порядок величины содержания продуцированного белка VEGF-A для каждой из трех инъецированных доз. Как можно видеть, продукция белка не находилась в линейной зависимости от дозы, и 10-кратное повышение дозы от 15 до 150 мкг обеспечивало только 1,6-кратное увеличение площади под кривой (AUC), и аналогичную AUC наблюдали для групп, получавших дозу 150 и 1800 мкг (отличие в 1,1 раза).
6.7. ПРИМЕР 7
Эффекты в отношении функции левого желудочка и размера очага омертвения после интракардиальной инъекции модифицированной РНК VEGF-A человека у крыс, у которых вызвали инфаркт миокарда
[0331] Самцов крыс Sprague Dawley (масса тела 250-300 г) анестезировали, предварительно обрабатывали и подвергали торакотомии, как описано выше. Животных затем подвергали постоянному лигированию левой передней нисходящей коронарной артерии для индуцирования инфаркта миокарда. После лигирования осуществляли 90 мкл интракардиальную инъекцию, содержащую либо цитратно-солевой раствор (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия), либо 150 или 1800 мкг модифицированной РНК VEGF-A человека, составленной в цитратно-солевом растворе. Весь объем доставляли в виде шести отдельных эпикардиальных инъекций вдоль пограничной зоны очага омертвения. После проведения инъекций грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. Затем, когда налаживалось нормальное дыхание, крысу отсоединяли от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку.
[0332] Через один и восемь дней после процедуры животных передавали в лабораторию, осуществляющую диагностическую визуализацию, для оценки функции левого желудочка и размера очага омертвения с помощью магнитно-резонансной визуализации (MRI). Кроме того, через день после процедуры из хвостовой вены отбирали образец крови для анализа на сердечный тропонин I (диагностический тест на сердечный тропонин I i-STAT®, Abbott Point of Care Inc., Эббот-Парк, Иллинойс 60064, США) в качестве биомаркера повреждения сердца. MRI-сканирование осуществляли с применением системы MRI, специально предусмотренной для мелких животных, при силе поля 4,7 Т. Изображения получали в ориентации короткой оси, и были получены комплекты изображений, охватывающие левый желудочек. Электрокардиографию использовали для запуска визуализации на определенных фазах сердечного цикла. Сердечную функцию оценивали по серии изображений, демонстрирующей движение стенки левого желудочка в течение одного сердечного сокращения. Визуализирующая последовательность, используемая при получении серии изображений, представляла собой последовательность градиентное эхо с временем повторения сечения 10 мс и углом поворота 25. Объем левого желудочка оценивал с помощью ручной обрисовки в разные моменты времени опытный специалист по считыванию с применением специально предусмотренного программного обеспечения для анализа изображений. Конечно-систолический (ESV) и конечно-диастолический (EDV) объемы идентифицировали как наименьший и наибольший объемы левого желудочка. Фракцию выброса (EF), отражающую сердечную функцию, оценивали с помощью формулы EF=(EDV-ESV)/EDV. Изображения, демонстрирующие распространенность очага омертвения сердца получали после введения гадодиамида, контрастного средства, содержащего гадолиний. За десять минут до получения изображения 0,3 ммоль/кг гадодиамида вводили инъекцией через катетер хвостовой вены. Визуализацию выполняли с применением последовательности градиентное эхо, при этом контрастный препарат предусматривал применение инверсного импульса. Время повторения составляло минимум 900 мс, а угол поворота составлял 90. Объемы стенки левого желудочка (LVV) и очага омертвения (IV) оценивал опытный специалист по считыванию с помощью ручной обрисовки с применением специально предусмотренного программного обеспечения для анализа изображений. Размер очага омертвения (IS), выраженный как подвергшаяся инфаркту часть стенки левого желудочка, определяли с помощью формулы IS=IV/LVV.
[0333] Двадцать семь крыс подвергали постоянному лигированию левой передней нисходящей коронарной артерии и вводили интракардиальные инъекции, содержащие цитратно-солевой раствор (n=8), или низкую (150 мкг, n=9), или высокую (1800 мкг, n=10) дозу модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе. Животных наблюдали в течение 8 дней и эффекты в отношении фракции выброса левого желудочка и размера очага омертвения оценивали с помощью MRI в день 1 и день 8 после индуцирования инфаркта. Сердечный TnI измеряли в венозной крови в день 1 в качестве биомаркера повреждения кардиомиоцитов. Поскольку две дозы модифицированной РНК VEGF-A приводили к аналогичным количествам продуцированного VEGF-A, в анализе эффективности данные от обеих групп объединяли. По сравнению с крысами, обработанными цитратно-солевым раствором, животные, которым вводили модифицированную РНК VEGF-A, характеризовались значительно более высокой фракцией выброса левого желудочка в день 8 (ФИГ. 8В) и более низкими уровнями сердечного TnI в день 1 (ФИГ. 8D). Кроме того, крысы с активной обработкой демонстрировали тенденцию к уменьшению размера очага омертвения в сравнении с крысами, обработанными средой-носителем (ФИГ. 8С).
6.8. ПРИМЕР 8
Оценка β-галактозидазы и белка VEGF-A человека после интракардиальной инъекции модифицированной РНК LacZ или модифицированной РНК VEGF-A человека у карликовых свиней Геттинген
[0334] Самок карликовых свиней Геттинген (масса тела ~25 кг), которых не кормили на протяжении ночи, седатировали с помощью внутримышечной инъекции мидазолама и кетамина. После проведения седации внутривенный катетер помещали в аурикулярную краевую вену для индуцирования анестезии с помощью пропофола и свинье проводили эндотрахеальную интубацию. Затем свинью переносили в лабораторию и присоединяли к аппарату искусственной вентиляции легких. Общую анестезию поддерживали с помощью изофлурана, доставляемого через прецизионный аэрозольный аппарат и циркуляционный дыхательный контур с адсорбером при периодическом мониторинге газа в артериальной крови. Показатели жизнедеятельности (частота сердечных сокращений, кровяное давление, частота дыхания, пульсовая оксиметрия О2, ЭКГ и температура тела) постоянно контролировали на протяжении всего эксперимента. Внутривенную инфузионную терапию проводили на протяжении всей процедуры со скоростью, регулируемой с целью замены потери крови или в случае низкого системного кровяного давления. Для обнажения сердца выполняли левостороннюю торакотомию и модифицированную РНК LacZ или модифицированную РНК VEGF-A (при варьирующих объемах и дозах) вводили инъекцией в свободную стенку левого желудочка на глубину приблизительно 5 мм от эпикардиальной поверхности. Участок инъекции помечали небольшим швом и спустя 6 часов сердце иссекали. Блоки из трансмуральной ткани собирали в участках инъекции и окрашивали с помощью X-gal в отношении β-галактозидазы, как описано выше. Для анализа на белок VEGF-A каждый блок ткани разделяли на 6 отдельных образцов от эпикарда до эндокарда. Эти образцы быстро замораживали в жидком азоте и хранили при -80°C до проведения анализа на VEGF-A, как описано ниже.
[0335] Модифицированную РНК LacZ или VEGF-A вводили эпикардиальной инъекцией в свободную стенку левого желудочка и через 6 часов собирали образцы ткани для окрашивания с помощью X-gal или для анализа на белок VEGF-A. У свиней, которым вводили модифицированную РНК LacZ, продукция β-галактозидазы была качественно аналогичной при применении в качестве среды трансфекций липофектамина (ФИГ. 9А) и при применении цитратно-солевого раствора (ФИГ. 9В).
6.9. ПРИМЕР 9
Количественная оценка белка VEGF-A человека в сердечной ткани
[0336] Буфер Tris для лизиса, содержащий ингибиторы I и II фосфатазы и ингибитор протеазы (Meso Scale Discovery (MSD), Роквилл, Мэриленд, США) добавляли к замороженным биоптатам ткани и замораживали при приблизительно -20°C перед гомогенизацией. Затем добавляли керамические гранулы (3 мм) и образцы гомогенизировали с применением устройства для гомогенизации Precellys. Гомогенаты центрифугировали и надосадочные жидкости хранили при -80°C до проведения анализа.
[0337] Концентрацию VEGF-А определяли с применением иммунологического сэндвич-анализа с выявлением электрохимической люминесценции. Наборы панели 1 для обнаружения цитокинов VEGF-A (человека) MSD V-PLEX применяли для измерения концентрации VEGF-A в гомогенатах ткани. Анализ выполняли согласно инструкциям в наборе. Стандарты серийно разводили 1 к 2 с помощью разбавителя из набора и дополнительные контроли включали в каждую партию для отслеживания выполнения анализа. Образцы разводили минимум 1 к 10 с помощью разбавителя из набора перед анализом и планшеты считывали на устройстве MSD Sector 600.
[0338] На ФИГ. 10 обобщена дозозависимая продукция VEGF-A через 6 часов после эпикардиальных инъекций варьирующих доз (50-2000 мкг на инъекцию) модифицированной РНК VEGF-A, составленной в цитратно-солевом растворе. Уровни продуцированного белка указывают на насыщение при низких дозах инъецированной модифицированной РНК VEGF-A, что соответствует результатам для крысы (ФИГ. 8А).
6.10. ПРИМЕР 10
Трансфекция модифицированной РНК LacZ и люциферазы, находящейся в цитратно-солевом буфере, и ее трансляция в сердце
[0339] Как показано, при введении с помощью инъекций в сердце 75 мкг модифицированной РНК, кодирующей LacZ, она трансфицировалась и транслировалась в приблизительно 10% левого желудочка (ФИГ. 11А, 11B, 11С и 11D). РНК-гибридизация in situ модифицированной РНК люциферазы выявила экспрессию по окрашиванию миокарда в участке инъекции (ФИГ. 11Е и 11F), а коррелирующая экспрессия белка люциферазы показана с помощью иммуногистохимического анализа на серийных срезах (ФИГ. 11G).
6.11. ПРИМЕР 11
Экспрессия белка VEGF-A после инъекции в сердце модифицированной РНК, находящейся в цитратно-солевом буфере, является насыщаемой и характеризуется аналогичными фармакокинетическими показателями у нескольких видов
[0340] Для сравнения продукции белка VEGF-A 150 мкг модифицированной РНК VEGF-A в цитратно-солевом буфере и 100 мкг модифицированной РНК VEGF-A с применением RNAiMax (липидосодержащий состав) в качестве носителя доставки вводили инъекцией в сердце крысы. Через 24 часа уровни белка VEGF-A у крыс, которым вводили цитратно-солевой буфер (NTB), были сравнимыми с уровнями у крыс, которым инъецировали RNAiMax, а также были подобными фармакокинетические профили (ФИГ. 12А). Экспрессия белка была дозолимитированой и насыщаемой, что было заметно по видам (ФИГ. 12В). При десятикратном увеличении дозы наблюдали только 1,6-кратное увеличение площади под кривой (ФИГ. 12С).
6.12. ПРИМЕР 12
Оценка продукции белка VEGF-A человека после интракардиальной инъекции модифицированной РНК VEGF-A человека у мыши, крысы и свиньи
[0341] Для сравнения продукции белка VEGF-A 150 мкг модифицированной РНК VEGF-A в цитратно-солевом буфере и 100 мкг модифицированной РНК VEGF-A с применением RNAiMax (липидосодержащий состав) в качестве носителя доставки вводили инъекцией в сердце крысы. Через 24 часа уровни белка VEGF-A у крыс. Самцов мышей C57B1/6 (возраст 10-12 недель) анестезировали изофлураном. Область грудной клетки слева брили и дезинфицировали, а после проведения интубации сердце обнажали посредством левосторонней торакотомии. Сто мкг модифицированной РНК VEGF-A (кодирующей белок VEGF-A человека (VEGF-A)), составленной в цитратно-солевом растворе (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия), вводили инъекцией (50 мкл) в свободную стенку левого желудочка в направлении от вершины к основанию сердца. После проведения инъекции грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. Затем, когда налаживалось нормальное дыхание, мышь убирали от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку. В предварительно заданные моменты времени после инъекции в сердце мышь анестезировали и грудную клетку вскрывали во второй раз для получения образца ткани сердца. Сердце иссекали и отрезали правый желудочек, а также левое и правое предсердия. Остальную сердечную ткань (т.е. свободную стенку левого желудочка и внутрижелудочковую перегородку) быстро замораживали в жидком азоте и хранили при -80°C до проведения анализа на белок VEGF-A, как описано ниже.
[0342] Самцов крыс Sprague Dawley (масса тела 250-300 г) анестезировали изофлураном и им вводили подкожную инъекцию маркаина (25 мг/кг) и бупренорфина (0,05 мг/кг) для обезболивания. Область грудной клетки слева брили и дезинфицировали, а после проведения интубации сердце обнажали посредством левосторонней торакотомии в пятом межреберном промежутке. Модифицированную РНК VEGF-A человека (100 мкг), составленную в цитратно-солевом растворе (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия), вводили инъекцией в виде трех отдельных инъекций (по 20 мкл каждая, общий объем 60 мкл), расположенных в линию на свободной стенке левого желудочка. После проведения инъекции грудную клетку и кожу закрывали путем сшивания, а избыток воздуха из грудной полости удаляли осторожным надавливанием на грудь. Затем, когда налаживалось нормальное дыхание, крысу отсоединяли от аппарата искусственной вентиляции легких и возвращали в ее домашнюю клетку. В предварительно заданные моменты времени после инъекции в сердце крысу анестезировали и грудную клетку вскрывали во второй раз для получения образца ткани сердца. Сердце иссекали и отрезали правый желудочек, а также левое и правое предсердия. Поперечный срез, включающий участки инъекции, вырезали, разделяли на две части, которые подвергали быстрому замораживанию в жидком азоте и хранили при -80°C до анализа на белок VEGF-A, как описано ниже.
[0343] Самок карликовых свиней Геттинген (масса тела ~25 кг), которых не кормили на протяжении ночи, седатировали с помощью внутримышечной инъекции мидазолама и кетамина. После проведения седации внутривенный катетер помещали в аурикулярную краевую вену для индуцирования анестезии с помощью пропофола и свинье проводили эндотрахеальную интубацию. Затем свинью переносили в лабораторию и присоединяли к аппарату искусственной вентиляции легких. Общую анестезию поддерживали с помощью изофлурана, доставляемого через прецизионный аэрозольный аппарат и циркуляционный дыхательный контур с адсорбером при периодическом мониторинге газа в артериальной крови. Показатели жизнедеятельности (частота сердечных сокращений, кровяное давление, частота дыхания, пульсовая оксиметрия О2, ЭКГ и температура тела) постоянно контролировали на протяжении всего эксперимента. Внутривенную инфузионную терапию проводили на протяжении всей процедуры со скоростью, регулируемой с целью замены потери крови или в случае низкого системного кровяного давления. Для обнажения сердца выполняли левостороннюю торакотомию и модифицированную РНК VEGF-A (100 мкг, составлена в цитратно-солевом растворе (10 ммоль/л цитрата, 130 ммоль/л хлорида натрия в воде Hyclone, рН доводили до приблизительно 7,5 с помощью гидроксида натрия) вводили инъекцией в свободную стенку левого желудочка на глубину приблизительно 5 мм от эпикардиальной поверхности. Участок инъекции помечали небольшим швом и спустя 6 часов сердце иссекали. Собирали блоки трансмуральной ткани. Для анализа на белок VEGF-A каждый блок ткани разделяли на 6 отдельных образцов от эпикарда до эндокарда. Эти образцы быстро замораживали в жидком азоте и хранили при -80°C до проведения анализа на VEGF-A, как описано ниже.
[0344] Как проиллюстрировано на ФИГ. 13А и 13В, количество продуцированного белка достигало пикового значения через приблизительно 6-12 часов после инъекции, и величина и временные профили продуцированного белка VEGF А были подобны у разных видов. Белок VEGF-A человека все еще наблюдали в сердечной ткани через 192 часа после инъекции у крысы (ФИГ. 13В).
6.13. ПРИМЕР 13
Эффекты в отношении функции левого желудочка и размера очага омертвения после интракардиальной инъекции модифицированной РНК VEGF-A человека у свиней, у которых вызвали инфаркт миокарда
[0345] Тридцать четыре половозрелых карликовых свиньи Lanyu (возраст ~5 месяцев) обоих полов не кормили на протяжении ночи и анестезировали, проводили эндотрахеальную интубацию и искусственную вентиляцию легких через респиратор со смесью кислорода, воздуха и изофлурана. Показатели жизнедеятельности (частота сердечных сокращений, кровяное давление, частота дыхания, пульсовая оксиметрия О2, ЭКГ и температура тела) постоянно контролировали на протяжении всего эксперимента. Внутривенную инфузионную терапию проводили на протяжении всей процедуры со скоростью, регулируемой с целью замены потери крови или в случае низкого системного кровяного давления. Для обнажения сердца выполняли левостороннюю торакотомию и осуществляли постоянную окклюзии средней части левой передней нисходящей коронарной артерии у всех свиней, за исключением 5, у которых артерию не окклюдировали (группа ложной операции). Затем грудную клетку закрывали и свинью переносили в отделение интенсивной терапии на приблизительно 2 часа, после чего ее возвращали в ее загон. Перед хирургическим вмешательством и после него вводили анальгетики и антибиотики для купирования боли и предупреждения инфекции.
[0346] Через семь дней после первого хирургического вмешательства свиней готовили ко второму хирургическому вмешательству, как описано выше, и опять переносили в операционную. После подготовки подвернутых инфаркту свиней рандомизировали в группы обработки в "слепом" режиме цитратно-солевым раствором (n=8), низкой дозой модифицированной РНК VEGF-A (1 мг, n=8), высокой дозой модифицированной РНК VEGF-A (10 мг, n=8) или рекомбинантным белком VEGF-A человека, составленным в самособирающихся нановолокнах (n=5). Нановолоконную конструкцию, хотя она и не одобрена для клинического применения, включали в качестве терапии положительного контроля (Lin Y.D. et al., Science Transl Med, (2012) 4:146ral09; включена в данный документ посредством ссылки во всей своей полноте). После проведения левосторонней торакотомии исследуемые лекарственные средства вводили в виде 20 эпикардиальных инъекций, распределенных по зоне вокруг очага омертвения/очагу омертвения, при этом объем каждой инъекции составлял 100 мкл. После проведения процедуры свиней обрабатывали, как описано выше, и оставляли восстанавливаться в течение 2 месяцев перед выполнением конечных экспериментов.
[0347] На протяжении исследования с помощью эхокардиографии проводили серийные измерения функции левого желудочка. Соответственно, измерения выполняли под анестезией у свиней с закрытой грудной клеткой непосредственно перед и после индуцирования инфаркта миокарда, непосредственно перед интракардиальной инъекцией исследуемых лекарственных средств и в день умерщвления. Сердечную функцию оценивали с помощью 2D эхокардиография с применением Vivid Q с зондом 3,5 МГц (GE Healthcare, Хортен, Норвегия). Свиней помещали в положение лежа на левом боку. Левую парастернальную позицию по длинной оси левого желудочка получали с помощью режима М, чтобы измерить объем левого желудочка для получения фракции выброса левого желудочка. В конце исследования (т.е. через 2 месяца после введения исследуемых лекарственных средств) свиней анестезировали, как описано выше, и подключали к приборам для инвазивной гемодинамической оценки с помощью катетера для записи петли давление-объем (Millar Instruments, Хьюстон, Техас, США), размещенного в полости левого желудочка посредством катетеризации правой сонной артерии. Данные гемодинамики анализировали с помощью коммерческого программного обеспечения (AD Instruments). После гемодинамической оценки свинью умерщвляли и сердце собирали. Сердце трижды промывали и обрабатывали с получением пяти срезов от верхушки до уровня сосочковой мышцы. Получали изображения каждого среза, а размеры очага омертвения оценивали с применением коммерческого программного обеспечения (ImageJ). Размер очага омертвения рассчитывали как процент площади желудочка целиком минус площадь внутреннего пространства.
[0348] Серийные оценки фракции выброса левого желудочка (EF) выполняли в ходе исследования. Как можно видеть на ФИГ. 14, постоянная окклюзия левой передней нисходящей коронарной артерии была ассоциирована с немедленным уменьшением EF от приблизительно 65% до ниже 45%, причем такое снижение сохранялось через 7 дней после окклюзии, когда выполняли инъекцию исследуемых лекарственных средств. У свиней, подвергнутых процедуре ложной операции, такого уменьшения не наблюдалось. Через два месяца после выполнения инъекций обнаружили, что свиньи, которым вводили модифицированную РНК VEGF-A или рекомбинантный белок VEGF-A, составленный в самособирающихся нановолокнах, характеризовались улучшением EF в сравнении со свиньями, которым инъецировали цитратно-солевой раствор. При сравнении изменений в EF от дня инъекции до конца исследования статистически значимое улучшение наблюдали как в группе обработки модифицированной РНК VEGF-A, так и в группе обработки белком VEGF-A, но не у группы обработки цитратно-солевым раствором. Инвазивная гемодинамическая оценка функции левого желудочка, выполняемая в конце исследования, показала аналогичное улучшение, о чем свидетельствуют различия в развитии максимального давления в левом желудочке в динамике по времени (dP/dt max, ФИГ. 15), развитии минимального давления в динамике по времени (dP/dt min, ФИГ. 16), отношении конечно-систолического давления к объему (ESPVR, ФИГ. 17), отношении конечно-диастолического давления к объему (EDPVR, ФИГ. 18) и отношении задействованной систолической работы и преднагрузки (PRSW, ФИГ. 19) соответственно.
[0349] Размер очага омертвения измеряли после сбора образцов ткани в конце исследования и определяли количественно как общий размер очага омертвения в левом желудочке (срезы 2, 3, 4 и 5, ФИГ. 20А), размер очага омертвения в средней части левого желудочка (срезы 3 и 4, ФИГ. 20В) и размер очага омертвения в центральной части левого желудочка (срез 4, панель на ФИГ. 20С). Как можно видеть на ФИГ. 20А, 20В и 20С, обработка модифицированной РНК VEGF-A, а также белком VEGF-A/нановолокном была ассоциирована с дозозависимым уменьшением размера очага омертвения в сравнении со свиньями, обработанными цитратно-солевым раствором.
6.14. ПРИМЕР 14
In vivo эффект модифицированной РНК VEGF-A человека на модели заживления раны у мышей с диабетом
[0350] Цель данного эксперимента заключалась в определении того, проявляет ли модифицированная РНК VEGF-A человека биоактивность при замедленном заживлении кожных ран у мышиной модели диабета. Выполняли два испытания с применением мыши db/db, которая характеризовалась недостаточностью экспрессии лептинового рецептора вследствие точковой мутации и у которой наблюдалось замедленное заживление кожных ран по сравнению со здоровыми контрольными мышами. Мышь db/db широко использовалась в опубликованных литературных источниках для тестирования терапевтической эффективности различных видов лечения, направленных на ускорение заживления ран. В первое испытание, испытание 1, включали 32 самцов мышей db/db, и оно было разработано для: 1) оценки эффекта модифицированной РНК VEGF-A человека на скорость заживления ран, 2) определения того, вызывает ли лечение нарушения в образовании грануляционной ткани, и 3) определения эффекта модифицированной РНК VEGF-A человека на васкуляризацию грануляционной ткани. Во второе испытание, испытание 2, включали 7 самцов мышей db/db, и оно было разработано для оценки насыщения кислородом раны в динамике по времени с применением ратиометрической визуализации новой чувствительной к кислороду наночастицы на основе бора. Вкратце, в первый день испытания (день 0) раны диаметром 1 см во всю толщину кожи наносили хирургическим путем на спине каждой мыши и сразу же вводили внутрикожной инъекцией модифицированную РНК VEGF-A человека или контроль в виде среды-носителя (n=8 мышей на группу) по периметру раны. Подгруппе мышей (n=8 мышей на группу) также вводили либо модифицированную РНК VEGF-A человека, либо контроль в виде среды-носителя в день 3. Раны перевязывали с применением Tegaderm и мышей размещали по отдельности в клетках. В последующие моменты времени получали серийные фотографии раны, а в конечный момент времени (день 18) собирали ткани раны и обрабатывали для проведения иммуногистохимического анализа (CD31+ окрашивание для выявления эндотелиальных клеток и окрашивание гематоксилином и эозином (Н&Е)). В испытании 2 серийные изображения флуоресценции и фосфоресценции получали после местного введения чувствительных к кислороду наночастиц в раневое ложе после проведения экспериментальной процедуры, аналогичной испытанию 1, за исключением того, что введение дозы выполняли только в день 0 и 3. Результаты испытания 1 показали, что последовательное введение дозы модифицированной РНК VEGF-A человека (100 мкг в день 0 и 100 мкг в день 3) значимо (Р<0,05) уменьшало площадь открытой раны в день 6 и день 10 по сравнению с последовательным введением дозы контроля в виде среды-носителя, тогда как этого не происходило при однократном введении дозы либо модифицированной РНК VEGF-A человека, либо контроля в виде среды-носителя. Средний процент закрытия раны в промежутке между ранними моментами времени (дни 3-6) достоверно повышался по сравнению с контролем в виде среды-носителя. Уровень CD31+ окрашивания грануляционной ткани также повышался у мышей с последовательным введением дозы модифицированной РНК VEGF-A человека. В испытании 2 уровни кислорода в ранах в день 6 также были значимо (Р<0,05) повышены у мышей с 2 последовательными дозами по 100 мкг модифицированной РНК VEGF-A человека по сравнению с группой, которой вводили двукратную инъекцию среды-носителя. Данный эксперимент подтверждает, что обработка кожных ран на спине мышей с диабетом с помощью последовательного введения дозы модифицированной РНК VEGF-A человека значимо ускоряет заживление раны во время ранней более клинически значимой фазы заживления раны. Ускоренное заживление сопровождается увеличением васкуляризации грануляционной ткани и увеличением насыщения кислородом раневого ложа в ранние моменты времени.
[0351] Тестируемые соединение и состав


[0352] Тест-система

[0353] Схема исследования



[0354] Экспериментальные процедуры
[0355] Эксперименты делили на два испытания, испытание 1 и испытание 2. Испытание 1 фокусировалось исключительно на оценке биоактивности модифицированной РНК VEGF-A человека в контексте заживления диабетической раны. В испытании 2 тоже тестировали биоактивность модифицированной РНК VEGF-A человека на той же модели заживления раны, но также использовали применение чувствительных к кислороду наночастиц для определения насыщения кислородом раневого ложа. Процедуры, приведенные ниже, являются общими для обоих испытаний, если не указано иное.
[0356] Рана во всю толщину кожи (день 0). Мышей анестезировали 2% ингалируемой смесью изофлурана/кислорода, а затем удаляли волосы и дезинфицировали перед проведением хирургического вмешательства. На спине мыши отмечали кружок диаметром 1 см с применением трафарета. Кожу (включая дерму и эпидермис) осторожно иссекали из обведенной зоны с образованием раны во всю толщину кожи. Модифицированную РНК VEGF-A человека или среду-носитель вводили внутрикожной инъекцией. Анальгетик (бупренорфин, 0,1 мг/кг) вводили после хирургического вмешательства и раны покрывали повязкой Tegaderm и самоклеящимся пластырем.
[0357] Внутрикожные инъекции (дни 0 и 3). Десять мкл × 4 модифицированной РНК VEGF-A человека или среды-носителя (приведенного выше) вводили инъекцией непосредственно после иссечения кожи. В день 0 (день нанесения раны) модифицированную РНК VEGF-A человека или среду-носитель вводили инъекцией в дермальный слой кожи в положения 0, 90, 180 и 270 градусов вокруг периметра ран. В день 3 модифицированную РНК VEGF-A человека или среду-носитель вводили внутрикожной инъекцией в положения 45, 135, 225 и 315 градусов вокруг периметра раны, чтобы не допустить инъекции в одно и то же положение дважды.
[0358] Процедура визуализации (дни 0, 3, 6, 10, 13 и 18). Самоклеящийся пластырь и повязки Tegaderm удаляли перед проведением визуализации ран. В каждый день перед проведением визуализации (день 0, 3, 6, 10, 13 и 18) регистрировали массу тела. Изображения получали на фиксированном расстоянии над раной с помощью двенадцати-мегапиксельной камерой, в то время как мышей анестезировали 2% ингалируемой смесью изофлурана/кислорода. После проведения визуализации раны покрывали новой повязкой Tegaderm и оборачивали имеющимся самоклеящимся пластырем (если не предусматривалась визуализация наночастиц).
[0359] Процедура визуализации с чувствительными к кислороду наночастицами (день 0, 3, 6, 10, 13 и 18). Визуализацию в отношении уровней кислорода выполняли только в испытании 2. После проведения визуализации, как описано выше, у мышей поддерживали анестезию и их помещали на предметный столик микроскопа с контролируемой температурой со специально разработанной платформой для визуализации. Для каждой раны при УФ-освещении получали изображения М-JPEG, состоящие из 1) 10 кадров (получены при скорости 3 кадра/секунда) раны перед нанесением наночастиц на основе бора (BNP) и 2) 60 кадров (получены при скорости 3 кадра/секунда) после выливания 50 мкл раствора наночастиц в раневое ложе. После проведения визуализации раны покрывали новой повязкой Tegaderm и оборачивали имеющимся самоклеящимся пластырем.
[0360] Анализ изображения насыщения раны кислородом. Визуализацию в отношении уровней кислорода выполняли только в испытании 2. Изображения раны при УФ-освещении (получено, как описано выше) анализировали с применением специально написанных программ MATLAB. Чтобы учесть фоновый сигнал, выбранные точки в пределах раневого ложа анализировали в отношении интенсивности красного и синего каналов перед добавлением наночастиц. Эти значения фоновой интенсивности вычитали из значений интенсивности красного и синего каналов после добавления наночастиц. Для каждого пикселя вычисляли отношение интенсивности синего канала к интенсивности красного канала для представления отношения флуоресценции (постоянная в присутствии BNP) к фосфоресценции (гасится в присутствии кислорода). Затем ратиометрические изображения отображали качественно с применением 256-значной цветовой карты, приведенной в соответствие с отношением, ограниченным отношениям флуоресценции к фосфоресценции с пространственно-временным разрешением. Для количественной оценки уровня кислорода в раневом ложе необработанные значения интенсивности красного и синего каналов использовали для построения изображения в оттенках серого (низкое содержание кислорода; черные пиксели, высокое содержание кислорода; белые пиксели). Раневое ложе выбирали как рассматриваемую область и проводили количественную оценку среднее уровня яркости пикселей с применением программного обеспечения ImageJ.
[0361] Сбор ткани, получение гистологических срезов и окрашивание (день 18). Мышей умерщвляли путем асфиксии с помощью CO2 и получали конечное изображение раны. Область 1,5 см × 1,5 см вокруг центра раны иссекали и делили на продольные трети для трех отдельных анализов. Одну треть ткани быстро замораживали в жидком азоте и отправляли на оценку белков нисходящей передачи сигнала VEGF. Среднюю треть ткани фиксировали в 10% формалине в течение 1 недели и обрабатывали для заливки в парафин. Нарезали срезы толщиной пять мкм и окрашивали гематоксилином и эозином (Н&Е), а также в отношении CD31 (Santa Cruz Biotechnology, sc-1506, PECAM-1 (M-20)).
[0362] Измерения уровня глюкозы в крови (день 0 и день 18). Перед началом нанесения раны в день 0 всех мышей не кормили в течение четырех часов, при этом их держали в клетках с бумажной подстилкой без корма. Перед нанесением раны осуществляли начальные измерения уровня глюкозы натощак. Во время сбора крови в день 18 проводили измерения уровня глюкозы не натощак и отбирали небольшой образец крови.
[0363] Анализ данных
[0364] Количественная оценка площади раны: момент времени для испытаний 1 и 2. Применяя Image J, наблюдатели очерчивали рану по периметру и ImageJ вычислял площадь открытой раны. Чтобы учесть отличия в суждениях разных наблюдателей, для каждой раны сообщалось среднее значение трех областей раны. Площадь ран в каждый момент времени нормализовали до начальной площади раны (день 0), чтобы учесть незначительные отличия в начальных размерах ран. Данные анализировали статистически с применением двухфакторного ANOVA для повторных измерений, при этом значимость задавали на уровне Р<0,05. Для этих данных выполняли интерполяцию кубическими сплайнами, чтобы вычислить ожидаемое время для 25%, 50% и 75% закрытия раны соответственно. Средний процент заживления в промежутках между моментами времени рассчитывали путем вычитания процента площади оставшейся раны от предыдущего процента площади оставшейся раны. Данные анализировали с применением двухфакторного ANOVA для повторных измерений, при этом значимость задавали на уровне Р<0,05.
[0365] Анализ окрашивания CD31 (испытание 1). Гистологические поперечные срезы ткани раны подвергали иммунологическому окрашиванию в отношении CD31 и визуализировали с применением микроскопии в проходящем свете с помощью объектива 40х. Коричневый канал (положительное мечение CD31) ограничивали до белого и черного для удаления фона и неспецифического мечения. Процент ограниченной области положительного окрашивания CD31 рассчитывали для каждой из групп обработки с n=3.
[0366] Анализ окрашивания гематоксилином и эозином (испытание 1). Парафиновые срезы от каждой раны окрашивали с помощью Н&Е и визуализировали с применением микроскопии в проходящем свете с применением объектива 4х. Грануляционную ткань проверяли визуально с качественной оценкой толщины и целостности эпидермиса, площади поперечного сечения грануляционной ткани (ширины и толщины) и присутствия или отсутствия любых аномальных тканевых структур, таких как гемангиомы.
[0367] Анализ нисходящей передачи сигнала VEGF (вестерн-блоттинг) (испытание 1). Образцы ткани кожи гомогенизировали с буфером RIPA для лизиса (sc-24948, Santa Cruz Biotechnology, Санта-Круз, Калифорния) и центрифугировали, концентрации белков в надосадочной жидкости определяли с помощью анализа на белок Bradford (№5000112, Bio-Red, Геркулес, Калифорния). 30 мкг общего белка загружали на полиакриламидный гель (№3450124, Bio-Red, Геркулес, Калифорния) и переносили на мембрану (№1620232, Bio-Red, Геркулес, Калифорния). Мембрану исследовали с помощью следующих антител: антитело к pAKT (S473, №4060, Cell Signaling, Дэнверс, Массачусетс) и антитело к AKT (№4691, Cell Signaling Technology, Дэнверс, Массачусетс), вторичное антитело к IgG кролика (IRDye 800CW, LI-COR Biosciences, Линкольн, Небраска). Количественную оценку полосок pAKT и AKT выполняли с применением программы 29 Image J.
[0368] Анализ массы тела и уровня глюкозы в крови. Массу тела и уровни глюкозы в крови анализировали статистически с применением двухфакторного ANOVA для повторных измерений, при этом значимость задавали на уровне Р<0,05.
[0369] Анализ с количественной оценкой содержания кислорода (испытание 2). Средние уровни яркости необработанных изображений наночастиц анализировали статистически с применением двухфакторного ANOVA для повторных измерений, при этом значимость задавали на уровне Р<0,05.
[0370] Результаты
Результаты измерений площади раны (испытание 1)
[0371] Масса тела мышей db/db во всех группах, включенных в испытание 1, показана на ФИГ. 21. Массы тела были аналогичными у всех групп во все моменты времени, за исключением группы, которой вводили однократную инъекцию среды-носителя, и группы, которой вводили однократную инъекцию модифицированной РНК VEGF-A, для которых наблюдалось значимое (Р<0,05) отличие в день 13. Считается, что данное отличие не влияет на результаты исследования.
[0372] Уровни глюкозы натощак и после приема пищи у мышей db/db для всех групп в день 0 и в день 18 показаны на ФИГ. 22. Все группы имели аналогичные значения, за исключением группы, которой вводили однократную инъекцию среды-носителя, и группы, которой вводили однократную инъекцию модифицированной РНК VEGF-A, для которых наблюдалось значимое (Р<0,05) различие, составлявшее 85 мг/дл в день 0. Считается, что данное отличие не влияет на результаты исследования.
[0373] Результаты измерений площади раны в течение 18-дневного периода наблюдения показаны на ФИГ. 23-25. С точки зрения закрытия площади открытой раны для группы, которой вводили однократную инъекцию дозы модифицированной РНК VEGF-A в день 0, не показан какой-либо значительный эффект по сравнению с группой, которой вводили однократную инъекцию эквивалента среды-носителя, в течение 18-дневного периода наблюдения. С другой стороны, для группы, которой вводили двукратную инъекцию модифицированной РНК VEGF-A в день 0 и 3, действительно показано значимо (Р<0,05) более быстрое закрытие в день 6 при 55% площади открытой раны и в день 10 при 27% площади открытой раны по сравнению с группой, которой вводили двукратную инъекцию среды-носителя, при площади открытой раны 71% в день 6 и площади открытой раны 49% в день 10 соответственно (ФИГ. 23). Площадь под кривой для однократной инъекции среды-носителя составляла 962,83, двукратной инъекции среды-носителя - 998,21, однократной инъекции модифицированной РНК VEGF-A - 895,12, двукратной инъекции модифицированной РНК VEGF-A - 792,79 соответственно. Время до 25% закрытия в случае введения однократной инъекции среды-носителя составляло 6,2 дня, введения двукратной инъекции среды-носителя - 5,4 дня, введения однократной инъекции модифицированной РНК VEGF-A - 5,1 дня и введения двукратной инъекции модифицированной РНК VEGF-A - 4,2 дня соответственно (ФИГ. 24). Время до 50% закрытия в случае введения однократной инъекции среды-носителя составляло 8,9 дня, введения двукратной инъекции среды-носителя - 9,8 дня, введения однократной инъекции модифицированной РНК VEGF-A - 7,8 дня и введения двукратной инъекции модифицированной РНК VEGF-A - 6,3 дня соответственно (ФИГ. 24). Время до 75% закрытия в случае введения однократной инъекции среды-носителя составляло 12,3 дня, введения двукратной инъекции среды-носителя - 13,7 дня, введения однократной инъекции модифицированной РНК VEGF-A - 12,5 дня и введения двукратной инъекции модифицированной РНК VEGF-A - 10,4 дня соответственно (ФИГ. 24). По сравнению со средним процентом закрытия раны в промежутки между моментами времени для группы, которой вводили двукратную инъекцию модифицированной РНК VEGF-A, показано значимое (Р<0,05) отличие при 40% изменении между днями 3-6 по сравнению с группой, которой вводили двукратную инъекцию среды-носителя, при 20% изменении, в то же время группа, которой вводили однократную инъекцию модифицированной РНК VEGF-A, не демонстрировала значимости по сравнению с группой, которой вводили однократную инъекцию среды-носителя (ФИГ. 25).
Результаты гистологической оценки (испытание 1)
[0374] Типичные результаты окрашенных Н&Е срезов площади раны в день 18 показаны на ФИГ. 26. Данное окрашивание показало нормальные грануляционные ткани без каких-либо признаков аномальных тканевых структур. На ФИГ. 27 показаны типичные CD31 -положительные окрашивания для срезов площади раны после введения однократной и двукратной инъекций среды-носителя и модифицированной РНК VEGF-A соответственно. Количественная оценка сосудов на основе эндотелиальных клеток в площади раны, показанной на ФИГ. 28, отражала повышенный процент ограниченной площади CD31-положительного окрашивания в случае введения как однократной (4,3±4,0, среднее значение±SD), так и двукратной (8,4±4,4) инъекции модифицированной РНК VEGF-A по сравнению с введением однократной (3,2±0,6) и двукратной (3,2±0,6) инъекции среды-носителя соответственно.
Анализ нисходящей передачи сигнала VEGF с помощью вестерн-блоттинга (испытание 1)
[0375] Результаты анализа нисходящей передачи сигнала VEGF в день 18, включая АКТ и VEGFR2, показаны на ФИГ. 29 и ФИГ. 30. Данные результаты не показали никакой продолжающейся нисходящей передачи сигнала в день 18 (конец исследования).
Результаты измерений с чувствительными к кислороду наночастицами (испытание 2)
[0376] Масса тела мышей db/db, включенных в две группы, т.е. с введением двукратной инъекции среды-носителя и модифицированной РНК VEGF-А, в испытании 2, показана в зависимости от времени на ФИГ. 31. Масса тела была аналогичной у всех групп во все моменты времени. Уровни глюкозы в крови натощак и после приема пищи в день 0 и день 18 соответственно для мышей db/db, которым вводили двукратную инъекцию среды-носителя и модифицированной РНК VEGF-A в испытании 2, показаны на ФИГ. 32. Уровни глюкозы в крови натощак и после приема пищи были аналогичными в обеих группах.
[0377] В испытании 2 чувствительные к кислороду наночастицы помещали в раны для оценки насыщения кислородом. На ФИГ. 33 показано схематическое изображение технологии количественного определения чувствительных к кислороду наночастиц. При комнатной температуре и после возбуждение наночастицы испускают флуоресценцию, захватываемую как сигнала синего канала, и кислородозависимую фосфоресценцию, захватываемую как сигнала красного канала. Когда эти сигналы совмещали, то в результате получали изображение относительного насыщения кислородом раны. На ФИГ. 34 показаны типичные изображения для мыши, которой вводили двукратную инъекцию среды-носителя, и мыши, которой вводили двукратную инъекцию модифицированной РНК VEGF-A, в зависимости от времени. Уже в день 3 желтый и красный цвет были более выражены в площади раны у мыши, которой вводили двукратную инъекцию модифицированной РНК VEGF-A, по сравнению с мышью, которой вводили двукратную инъекцию среды-носителя. В день 6 наблюдали значимое (Р<0,05) повышение насыщения кислородом для группы, которой вводили двукратную инъекцию модифицированной РНК VEGF-A, по сравнению с группой, которой вводили двукратную инъекцию среды-носителя (ФИГ. 35).
[0378] Результаты измерений площади раны в течение 18-дневного периода наблюдения показаны на ФИГ. 36-38. Для группы, которой вводили двукратную инъекцию модифицированной РНК VEGF-A в день 0 и 3, действительно показано значимо (Р<0,05) более быстрое закрытие в день 6 при 45% площади открытой раны по сравнению с группой, которой вводили двукратную инъекцию среды-носителя, при площади открытой раны 62% соответственно. Время до 25% закрытия в случае введения двукратной инъекции среды-носителя составляло 3,4 дня, а в случае введения двукратной инъекции модифицированной РНК VEGF-A - 3,8 дня соответственно. Время до 50% закрытия в случае введения двукратной инъекции среды-носителя составляло 7,1 дня, а в случае введения двукратной инъекции модифицированной РНК VEGF-A - 5,6 дня соответственно. Время до 75% закрытия в случае введения двукратной инъекции среды-носителя составляло 8,9 дня, а в случае введения двукратной инъекции модифицированной РНК VEGF-A - 7,8 дня соответственно. При сравнении среднего процента закрытия раны в промежутках между моментами времен для группы, которой вводили двукратную инъекцию модифицированной РНК VEGF-A, не показано значимого (Р<0,05) отличия при 40% изменении между днями 3-6 по сравнению с группой, которой вводили двукратную инъекцию среды-носителя, при 14% изменении соответственно.
[0379] Выводы
[0380] Внутрикожное введение 100 мкг модифицированной РНК VEGF-A, разделенное на 4 участка инъекции вблизи параметра раны, как в день 0, так и в день 3 после повреждения значимо снижало площадь открытой раны у мышей db/db в день 6 и день 10 по сравнению с контролем в виде среды-носителя.
[0381] Внутрикожное введение 100 мкг модифицированной РНК VEGF-A, разделенное на 4 участка инъекции вблизи периметра раны, как в день 0, так и в день 3 после повреждения значимо повышало средний процент закрытия раны между ранними моментами времени (дни 3-6) по сравнению с контролем в виде среды-носителя.
[0382] Внутрикожное введение 100 мкг модифицированной РНК VEGF-A, разделенное на 4 участка инъекции вблизи периметра раны как в день 0, так и в день 3 после повреждения увеличивало площадь CD31 + иммунного окрашивания на гистологических поперечных срезах грануляционной ткани в день 18 по сравнению с контролем в виде среды-носителя и по сравнению с введением дозы модифицированной РНК VEGF-A только в начальной момент времени (день 0).
[0383] Внутрикожное введение 100 мкг модифицированной РНК VEGF-A, разделенное на 4 участка инъекции вблизи параметра раны, как в день 0, так и в день 3 после повреждения значимо повышало количество кислорода в ране в день 6 по сравнению с контролем в виде среды-носителя.
6.15. ПРИМЕР 15
Фотоакустическая микроскопия эффектов модифицированной РНК VEGF-A человека на гемодинамические показатели и неоваскуляризацию в ухе мыши in vivo
[0384] В данном эксперименте острые и хронические сосудистые ответы на модифицированную РНК VEGF-A человека (модифицированная РНК VEGF-A) отслеживали в ухе здоровой мыши in vivo. Методику мультипараметрической фотоакустической микроскопии (РАМ) применяли, чтобы охарактеризовать в динамике эффект модифицированной РНК VEGF-A на диаметр сосудов, насыщение кислородом гемоглобина (sO2), ток крови и неоваскуляризацию. Выполняли параллельные и количественные сравнения ответов на модифицированную РНК VEGF-A, рекомбинантный белок VEGF-A человека и цитратно-солевой раствор/среду-носитель. Кроме того, исследовали дозовую зависимость ответов путем сравнения последствий, индуцированных высокой дозой (100 мкг/ухо) и низкой дозой (10 мкг/ухо) модифицированной РНК VEGF-A. Исследования показали, что модифицированная РНК VEGF-A индуцировала заметную активацию локального тока крови вблизи участка инъекции в течение небольшого промежутка времени после введения инъекции (от 30 минут до 6 часов). Кроме того, значительный капиллярный ангиогенез и неоваскуляризацию отмечали через 7-14 дней после инъекции высокой дозы модифицированной РНК VEGF-A, в отличие от ушей, в которые вводили инъекцию, содержащую низкую дозу модифицированной РНК VEGF-A, белок VEGF-A или цитратно-солевой раствор. Кроме того, модифицированная РНК VEGF-A индуцировала выраженную и пространственно ограниченную активацию микрососудистого тока крови ниже участка инъекции, что явно отличалась от ответа на рекомбинантный белок VEGF-А человека при высокой концентрации.
[0385] Цель настоящего исследования заключалась в том, чтобы охарактеризовать в динамике эффект модифицированной РНК VEGF-A на диаметр сосудов, насыщение кислородом гемоглобина (sO2), ток крови и неоваскуляризацию с помощью методики мультипараметрической фотоакустической микроскопии (РАМ) в ухе здоровой мыши in vivo.
[0386] Соединение и состав


Контрольное/эталонное соединение представляет собой рекомбинантный белок VEGF-A165 человека от R&D Systems Inc, 614 McKinley Place NE, Миннеаполис, Миннесота 55413, США.
[0387] Тест-система

[0388] Схема исследования


[0389] Экспериментальные процедуры
[0390] В случае визуализации уха мыши, при этом данная процедура была совершенно неинвазивной, одну и ту же мышь можно было подвергать повторной визуализации для периодического мониторинга эффектов разных лекарственных средств на диаметр сосудов, sO2, ток крови, ангиогенез и неоваскуляризацию. Изображение уха мыши на исходном уровне получали перед введением внутрикожной инъекции исследуемых лекарственных средств. Затем обработанное лекарственным средством ухо отслеживали в течение 6 часов для фиксации острых сосудистых ответов и повторно визуализировали в день 7 для регистрации хронических гемодинамических ответов и возможной неоваскуляризации. Для проверки стойкости ремоделирования сосудов, индуцированного модифицированной РНК VEGF-A, мышей, которых обрабатывали высокой дозой модифицированной РНК VEGF-A, дополнительно подвергали визуализации в дни 14, 21 и 28 соответственно.
[0391] Подробный протокол визуализации РАМ заключался в следующем. Мышь анестезировали в небольшой камере, заполненной ингаляционным газом с 3% изофлурана (типичная скорость потока 1-1,5 л/минута, в зависимости от массы тела). Анестезию поддерживали из расчета 1,5% изофлурана на протяжении эксперимента. В качестве ингаляционного газа применяли воздух медицинской степени чистоты, чтобы поддерживать мышь в нормальном физиологическом состоянии. Чистый кислород не подходит, поскольку он повышает насыщение кислородом венозной крови до уровня, превышающего нормальный физиологический уровень, и искажает измерение РАМ. Затем мышь переносили из анестезионной камеры на расположенный рядом стереотаксический стол. Температуру тела мыши поддерживали при 37°С с применением грелки-подушки. После размещения на стереотаксическом столе на поверхность уха, подлежащего визуализации, наносили слой геля для ультразвуковых исследований. Действовали осторожно, чтобы избежать попадания пузырьков воздуха в гель. Затем ухо помещали ниже резервуара, заполненного деионизированной водой, и медленно поднимали до тех пор, пока гель для ультразвуковых исследований мягко не соприкасался с дном резервуара, которое было покрыто тонкой мембраной из полиэтилена. На глаза наносили мазь, чтобы предупредить высыхание и случайное повреждение лазером. Визуализирующую головку затем опускали до тех пор, пока акустическая линза не погружалась в резервуар с водой. Удаляли любые пузырьки воздуха, захваченные под линзой. Таким образом, по вертикали сверху вниз установка включала акустическую линзу, резервуар с водой, гель для ультразвуковых исследований и ухо мыши. Затем проверяли плотность лазерного излучения, чтобы убедиться, что он работает в пределах норм лазерной безопасности Американского национального института стандартов (т.е. 20 мДж/см2) После получения изображения ухо мыши очищали с помощью деионизированной воды, и мышь возвращали обратно в ее домашнюю клетку.
[0392] С помощью мультипараметрической РАМ одновременно получали три параметра (Ning et al., Simultaneous photoacoustic microscopy of microvascular anatomy, oxygen saturation, and blood flow. Opt Lett, 2015, 40:910-913). Анатомию сосудов получали напрямую за счет преобразования Гильберта необработанных фотоакустических сигналов, полученных с помощью РАМ, в каждом положении получения образца. Значения сосудистого sO2 получали с помощью возбуждения при двух длинах волн, чтобы отличать окси- и дезоксигемоглобин по спектрам их оптического поглощения. Скорость кровотока оценивали количественно путем корреляции 100 последовательных А-линий, полученных при 532 нм. Временное окно для анализа корреляций было установлено на 10 мс. Временная динамика вычисленного коэффициента корреляции соответствует экспоненциальному распаду второго порядка, и константу распада, которая линейно пропорциональна скорости тока крови, рассчитывали для количественной оценки потока. Кроме того, рассчитывали средний диаметр, sO2 и ток крови отдельных сосудов с использованием документально зафиксированного алгоритма сегментации сосудов (Soetikno et al., Vessel segmentation analysis of ischemic stroke images acquired with photoacoustic microscopy. Proc. SPIE, 2012, 8223:822345). Результаты измерения разных животных в пределах каждой группы объединяли для статистического анализа.
[0393] Анализ данных
[0394] Результаты показаны как средние значения±SD. Чтобы исследовать количественные отличия между мышами, которых обрабатывали цитратно-солевым раствором, модифицированной РНК VEGF-A и рекомбинантным белком VEGF-A человека, для выполнения статистического анализа использовали смешанную модель для повторных измерений. Модель индивидуального отрезка с авторегрессионной структурой ковариационной матрицы подгоняли под отличие диаметра сосуда или скорости объемного тока исходного уровня. Кроме того, диаметр сосудов или скорость объемного тока на исходном уровне использовали в качестве ковариаты для введения поправки на любые отличия.
[0395] Результаты
[0396] Высокую дозу модифицированной РНК VEGF-A вводили внутрикожной инъекцией в ухо трем здоровым мышам. На ФИГ. 39 показаны типичные периодические изображения РАМ сосудистой структуры, sO2 и тока крови. В течение небольшого промежутка времени (т.е. до 6 часов) после инъекции наблюдали значительную активацию сосудистых sO2 и тока крови на периферии от участка инъекции у всех трех мышей. Изображения РАМ, повторно полученные в дни 7, 14, 21 и 28, показывали, что ранее активированный sO2 постепенно регрессировал обратно, в то время как ток крови оставался выше исходного уровня. Помимо устойчивой активации тока крови выраженный ангиогенез и неоваскуляризацию наблюдали у двух из трех ушей, в которые вводили инъекцию, содержащую высокую дозу модифицированной РНК VEGF-A (ФИГ. 40). Сильный контраст этих новых сосудов на изображениях РАМ означает, что они были сильно перфузированы эритроцитами. В частности, как показано на ФИГ. 40, новые сосуды появились через 14 дней после инъекции, регрессировали в день 21 и "исчезли" в день 28. Аналогичным образом, у 2-ой мыши, которую обработали высокой дозой, новые сосуды показались в день 7 и "исчезли" через 14 дней после инъекции. "Регрессия/исчезновение" новых сосудов, вероятно, была обусловлена утратой перфузии крови.
[0397] Чтобы исследовать, могла ли сниженная доза модифицированной РНК VEGF-A вызывать активацию тока крови и неоваскуляризацию, оценивали сосудистые ответы на более низкие дозы модифицированной РНК VEGF-A (30 мкг и 10 мкг). У одной мыши, которой вводили инъекцию, содержащую 30 мкг модифицированной РНК VEGF-A, индуцировалась менее устойчивая активация sO2 и тока крови, которые возвращались обратно к исходному уровню в день 14. Хотя имелась способность обеспечивать капиллярный ангиогенез вокруг участка инъекции, выраженной неоваскуляризации не наблюдали. Снижение дозы модифицированной РНК VEGF-A еще ниже (до 10 мкг) у двух мышей привело к дальнейшему нарушению сосудистого ответа (ФИГ. 41). В частности, острая активация сосудистых sO2 и тока крови была немного слабее и менее устойчивой (возвращалась обратно к исходному уровню в день 7), и не наблюдали заметной неоваскуляризации или ангиогенеза. Эти результаты дополнительно подтверждают зависимость от дозы сосудистых ответов на модифицированную РНК VEGF-A.
[0398] В качестве сравнения на трех мышах исследовали сосудистые ответы на рекомбинантный белок VEGF-A человека (ФИГ. 42). Аналогично высокой и средней дозе модифицированной РНК VEGF-A белок VEGF-A индуцировал устойчивую активацию локальных sO2 и тока крови на всем протяжении 7-дневного периода наблюдения. Однако, только у двух из трех мышей наблюдали очень умеренный капиллярный ангиогенез в день 7, и во всех случаях не наблюдали новых сосудов.
[0399] Наконец, проводили три контрольных эксперимента для изучения сосудистых ответов на цитратно-солевой раствор. Как показано на ФИГ. 43, локальные sO2 и ток крови были слегка активированы в течение небольшого промежутка времени после инъекции, вероятно, вследствие увеличения давления интерстициальной жидкости, и возвращались к исходным уровням ко дню 7. Ангиогенез, неоваскуляризацию или воспалительный ответ не наблюдали.
[0400] Дополнительное количественное сравнение сосудистых ответов на высокую дозу модифицированной РНК VEGF-A, рекомбинантного белка VEGF-A человека и цитратно-солевого раствора проводили с применением сегментации сосудов, и его результаты показаны на ФИГ. 44. Острые и выраженные расширение кровеносных сосудов и активацию тока наблюдали в течение небольшого промежутка времени после инъекции модифицированной РНК VEGF-A и белка VEGF-A. Умеренные ответы в отношении диаметра сосудов и тока крови также наблюдали в ответ на инъекцию цитратно-солевого раствора, что, вероятно, было следствием повышенного давления интерстициальной жидкости. В связи с этим изменение диаметра сосудов (среднее для 4 сосудов) от исходного уровня (до инъекции) сравнивали в динамике по времени между обработками, а цитратно-солевой раствор принимали в качестве контроля. Взаимосвязь между обработкой и временем была статистически значимой (Р<0,0001). Все обработки статистически отличались друг от друга через 7 дней (р=0,0009), а модифицированная РНК VEGF-A и рекомбинантный белок VEGF-A человека отличались от солевого раствора через 6 часов (р=0,004). Аналогичный анализ проводили в отношении изменения скорости объемного тока от исходного уровня (среднее для 4 сосудов). Изменение скорости объемного тока сравнивали в динамике по времени между обработками, а цитратно-солевой раствор принимали в качестве контроля. Взаимосвязь между обработкой и временем была статистически значимой (р=0,02). В день 7 модифицированная РНК VEGF-A и рекомбинантный белок VEGF-A человека отличались от цитратно-солевого раствора (р=0,0015). Через семь дней после инъекции диаметр сосудов и ток крови в группе обработки цитратно-солевым раствором возвращались обратно к исходному уровню, что сильно контрастировало с устойчивым расширением кровеносных сосудов и активацией тока в группах обработки модифицированной РНК VEGF-A и рекомбинантным белком VEGF-A человека.
[0401] Дополнительно исследовали пространственную зависимость микрососудистых ответов на локализованную инъекцию. С этой целью все крупные сосуды диаметром более 50 мкм удаляли с применением сегментации сосудов, а затем оставшиеся микрососуды делили на микросегменты. Затем микрососудистые sO2 и ток крови расширяли до уровня ткани путем наложения значений отдельных микросегментов. Весовой коэффициент в наложении определяли как обратную функцию расстояния между центром масс микросегмента и местоположением ткани, представляющей интерес. Вычитание карт тока и sO2 на уровне ткани, полученных перед инъекцией модифицированной РНК VEGF-A (т.е. на исходном уровне), из таковых, полученных в день 7, показывало выраженную (т.е. ~4-кратную) и пространственно ограниченную активацию микрососудистого тока крови ниже участка инъекции (ФИГ. 45), тогда как изменение микрососудистого sO2 было умеренным (ФИГ. 45). Напротив, индуцированная белком VEGF-A активация микрососудистого тока была менее выраженной и более концентрированной вокруг участка инъекции (ФИГ. 46), но увеличение микрососудистого sO2 было более значительным. Как и ожидалось, микрососудистые ответы на инъекцию солевого раствора прекращались в день 7 (ФИГ. 47).
[0402] Выводы
[0403] С применением мультипараметрической фотоакустической микроскопии и сегментации сосудов отслеживали и сравнивали пространственно-временные сосудистые ответы на внутрикожную инъекцию модифицированной РНК VEGF-A, рекомбинантного белка VEGF-A человека и цитратно-солевого раствора. Было показано, что модифицированная РНК VEGF-A может индуцировать дозозависимые, выраженные и устойчивые расширение кровеносных сосудов, активацию тока, капиллярный ангиогенез и неоваскуляризацию in vivo. Кроме того, модифицированная РНК VEGF-A индуцировала выраженную и пространственно ограниченную активацию микрососудистого тока крови ниже участка инъекции, что явно отличалась от ответа на рекомбинантный белок VEGF-А человека при высокой концентрации.
6.16. ПРИМЕР 16
Экспрессия и выявление белка VEGF-A человека после внутрикожной инъекции модифицированной РНК VEGF-A у кролика in vivo
[0404] В данном эксперименте продукцию белка VEGF-A в коже кролика после внутрикожных (id) инъекций модифицированной РНК VEGF-A человека (модифицированная РНК VEGF-A), составленной в цитратно-солевом растворе, исследовали с помощью методики микродиализа.
[0405] Два зонда для микродиализа вставляли id в левую заднюю ногу каждому из 4 анестезированных кроликов. В t=0 часов (ч.) начиналось время восстановления для обоих зондов для микродиализа. Через один час осуществляли 4 инъекции модифицированной РНК VEGF-A (по 50 мкл и 50 мкг каждая) вблизи каждого зонда для микродиализа. Белоксодержащий элюат собирали на льду через каждый час, начиная с t=2 ч. вплоть до t=6 ч. После последнего сбора элюата область, окружающую участки инъекции, иссекали.
[0406] Через три часа после инъекций модифицированной РНК VEGF-A детектируемые уровни (218±155, среднее значение±SEM) VEGF-A человека выявляли в элюатах, полученных в 3 из 8 зондов. Соответственно, через 4 и 5 часов после инъекции белок VEGF-A выявляли в элюате, полученном в 5 из 8 и в 5 из 8 зондов соответственно. Несмотря на большую вариацию наблюдаемых концентраций; уровни белка демонстрировали тенденцию к выходу на плато в эти моменты времени (369±217 и 360±203 пг/мл соответственно).
[0407] Был сделан вывод, что белок VEGF-A человека можно выявлять с помощью методики микродиализа в коже кролика через три - пять часов после id инъекции модифицированной РНК VEGF-A.
[0408] Соединение и состав

[0409] Тест-система


[0410] Схема исследования

[0411] Экспериментальные процедуры
[0412] Анестезия и поддержание гомеостаза. Самцов кроликов новозеландские белые (NZW) анестезировали кетамином (5 мг/кг, Ketalar®, Pfizer АВ, Соллентуна, Швеция) и медетомидином (0,15 мг/кг, Domitor®, Orion Pharma, Эспоо, Финляндия), которые вводили в виде внутривенной болюсной инъекции с последующей поддерживающей инфузией (11 и 0,33 мг/кг*ч.) соответственно. Кроликам проводили интубацию и искусственную вентиляцию смесью комнатного воздуха и 10% О2 с помощью аппарата искусственной вентиляции легких Servo (900D, Siemens Elema, Солна, Швеция). Интенсивность дыхания поддерживали на постоянном уровне 30 циклов/минута. Перед экспериментом и во время него в артериальной крови измеряли содержание газов крови и рН с помощью анализатора газов крови (ABL800 Flex, Radiometer, Копенгаген, Дания), и, при необходимости, регулировали их в пределах нормальных физиологических диапазонов для кроликов путем регуляции дыхательного объема. Ректальную температуру 38-39,5°С поддерживали с помощью накрывания животных и внешнего нагревания.
[0413] Подготовка животных. Чрескожный полиэтиленовый катетер (Venflon 0,8 мм, Viggo, Хельсингборг, Швеция) для введения анестетиков вставляли в краевую вену левого уха. Полиэтиленовый катетер (Intramedic РЕ-90 Clay Adams, Becton Dickinson, Спаркс, Мэриленд, США) вставляли в правую сонную артерию для регистрации артериального кровяного давления (с помощью датчика давления, Peter von Berg Medizintechnik Gmbh, Кирхзеон/Енглхартинг, Германия) и для забора образцов крови, соответственно. Сигналы измерений кровяного давления регистрировали и записывали с применением компьютера и программного обеспечения (PharmLab V6.6, AstraZeneca R&D, Мельндаль, Швеция). Мех на левой задней ноге удаляли с помощью электрической бритвы.
[0414] Микродиализ. Два линейных зонда для микродиализа с отсечением по размеру 100 кДа, под названием А и В в каждом эксперименте, (66 линейных катетеров и 66 линейных катетеров с высоким пределом отсечения, М Dialysis АВ, Hammarby, Стокгольм, Швеция) вставляли id в верхнюю часть левой задней ноги кролика в соответствии с инструкциями, предоставленными поставщиком. Зонды для микродиализа перфузировали физиологическим раствором (9 мг/мл, Fresenius Kabi AG, Бад-Хомбург, Германия) со скоростью 0,5 мкл/минута и образцы элюатов собирали на льду в предварительно взвешенные 0,5-мл пробирки (Protein LoBind, Eppendorf AG, Гамбург, Германия). Мертвое пространство между диализной мембраной и выходным отверстием трубки для сбора составляло приблизительно 1,5 мкл. Определяли объем каждого элюата, и добавляли 2% альбумин бычьей сыворотки (BSA, А7979, Sigma-Aldrich, Сент-Луис, Миссури, США) в забуференном фосфатом солевом растворе (PBS, рН 7,4, Gibco® от Life Technologies™, Пейсли, Великобритания) до состояния 1:1. Образцы хранили при -80°С до выполнения анализа.
[0415] Протокол эксперимента. Схема эксперимента проиллюстрирована на ФИГ. 48А. В t=0 ч. начинался период восстановления для обоих зондов для микродиализа. Через один час (т.е. t=1 ч.) собирали восстановленный элюат, а затем осуществляли 4 инъекции в участках установки зонда для микродиализа, как показано на ФИГ. 48В. Белоксодержащий элюат собирали через каждый час от t=2 ч. вплоть до t=6 ч. и обрабатывали, как описано выше. В конце исследования животных умерщвляли летальной iv дозой пентобарбитала натрия (Allfatal vet, Omnidea АВ, Стокгольм, Швеция).
[0416] Оценка белка VEGF-A человека в микродиализных элюатах. Для определения концентраций экспрессированного VEGF-A человека в образцах микродиализных элюатов использовали платформу Gyrolab. В Gyrolab применяется аффинный проточный формат с микроструктурными лунками (Gyros, Уппсала, Швеция). Применяли Gyrolab Bioaffy 1000 CD, состоящий из 96 микроструктурных лунок, содержащих колонку для аффинного захвата с материалом, покрытым стрептавидином (Gyros). Сначала, биотинилированное поликлональное антитело захвата к VEGF А человека (AF-293-NA, R&D Systems, Абингтон, Великобритания) иммобилизовали на покрытой стрептавидином колонке, в которой образцы протекали за счет гравитации под действием вращения, и аналит захватывался на антителах. Затем через колонку пропускали меченое Alexa антитело выявления к VEGF-A человека (R&D Systems) и интенсивность флуоресценции использовали для количественной оценки лиганда. Стандартную кривую строили с применением линейной аппроксимации по пяти параметрам и концентрацию образцов рассчитывали по стандартной кривой согласно их поглощению. Разведения для построения стандартной кривой в диапазоне от 16,7 пг/мл до 12170 пг/мл готовили с помощью VEGF-A165 человека (293-VE-010, R&D Systems) в разбавителе 9 от MSD (Meso Scale Discovery, Роквилл, Мэриленд, США). Контроли качества готовили на основании стандарта WHO VEGF-А 165 человека (Национальный институт биологических стандартов и контроля, Хертфоршир, Великобритания) в разбавителе 9 от MSD. Перед анализом все из стандарта, QC и образцов смешивали с Rexxip HN-max (Gyros) из расчета 1:1.
[0417] Анализ данных. Результаты представлены как среднее значение±SEM.
[0418] Результаты
[0419] Индивидуальные уровни белка VEGF-A человека для четырех кроликов (каждый с двумя вставленными зондами, А и В) представлены как среднее значение±SEM на ФИГ. 49. Через три часа после инъекций модифицированной РНК VEGF-A детектируемые уровни (218±155, среднее значение±SEM) VEGF-A человека выявляли в элюатах, полученных в 3 из 8 зондов. Соответственно, через 4 и 5 часов после инъекции белок VEGF-A выявляли в элюате, полученном в 5 из 8 и в 5 из 8 зондов соответственно. Несмотря на большую вариацию наблюдаемых концентраций; уровни белка демонстрировали тенденцию к выходу на плато в эти моменты времени (369±217 и 360±203 пг/мл соответственно).
[0420] Вывод
[0421] Белок VEGF-A человека, выявляемый с помощью методики микродиализа, экспрессируется в коже кролика через 3-5 часов после внутрикожной инъекции модифицированной РНК VEGF-A.
6.17. ПРИМЕР 17
Эффекты в отношении плотности капилляров и артериол, а также фиброза после интракардиальной инъекции модифицированной РНК VEGF-A человека у свиней, у которых вызывали инфаркт миокарда in vivo.
[0422] Оценки эффектов модифицированной РНК VEGF-A (1 или 10 мг), цитратно-солевого раствора (2 мл) или процедуры ложной операции в отношении плотности капилляров и артериол, а также фиброза выполняли на карликовых свиньях Lanyu.
[0423] Анализ плотности капилляров и артериол. После окончания исследования образцы ткани из периинфарктной области фиксировали в 4% параформальдегиде при 4°С в течение по меньшей мере 24 часов, а затем заливали в парафин. После получения срезов, депарафинирования и регидратации выполняли демаскирование антигена путем кипячения в буфере цитрата натрия (рН 6) с концентрацией 10 ммоль/л в течение 10 минут. Затем срезы инкубировали с антителом к сердечному тропонину I (1:200, DSHB, Айова, Айова, США), антителом к изолектину (1:100, Invitrogen, Карлсбад, Калифорния, США) и SM-22α (1:200, Abcam, Кембридж, Великобритания) на протяжении ночи. После трехкратного промывания срезы инкубировали с соответствующими антителами, меченными Alexa Fluor 488 или 568 (Invitrogen). Ядра окрашивали с помощью 4',6-диамидино-2-фенилиндола (DAPI, Sigma-Aldrich, Сент-Луис, Миссури, США). После заключения среза плотность капилляров и артериол рассчитывали путем ручного подсчета и усреднения на основании изображений (увеличение 200х), взятых в трех случайно выбранных областях на протяжении периинфарктной области.
[0424] Измерение фиброза. Образцы, взятые в отдалении от инфарктной/периинфарктной областей обрабатывали, как описано выше для образцов периинфарктной области. Фиброз, как функцию отложения коллагена, определяли с применением трехцветной окраски по Массону. Изображения из трех случайно выбранных областей получали с применением светлопольной микроскопии (увеличение 200х) для каждого среза, а затем количественно оценивали (AxioVision, Zeiss, Мюнхен, Германия) и усредняли.
[0425] Результаты
[0426] На ФИГ. 50А и ФИГ. 50В проиллюстрированы эффекты процедуры ложной операции или инъекции модифицированной РНК VEGF-A (1 или 10 мг) или цитратно-солевого раствора (2 мл) на плотность капилляров и артериол в периинфарктной (пограничной) области, оцененные через два месяца после индуцирования инфаркта миокарда. Как видно, инъекция модифицированной РНК VEGF-A была ассоциирована с дозозависимым и статистически значимым увеличением плотности капилляров и артериол по сравнению с инъекцией цитратно-солевого раствора.
[0427] Было продемонстрировано, что инъекция модифицированной РНК VEGF-A в сравнении с цитратно-солевым раствором статистически значимо уменьшает содержание коллагена (т.е. фиброз) в образцах тканей, собранных в отдалении от подвергшейся инфаркту области (ФИГ. 50С).
6.18. ПРИМЕР 18
Временная динамика продукции белка VEGF-A после трансфекции модифицированной РНК VEGF-A человека in vitro
[0428] Для исследования временного профиля продукции белка VEGF-A человека после трансфекции модифицированной РНК VEGF-A 10000 клеток гладкой мускулатуры аорты человека (hAoSMC, (Lonza, Базель, Швейцария) или 20000 кардиомиоцитов человека, происходящих из индуцированных плюрипотентных клеток (hiPS-CM, Cellular Dynamics, Мадисон, Висконсин, США), высевали в 96-луночные планшеты в базовую среду для клеток гладкой мускулатуры, дополненную факторами роста (SmGM-2, Lonza), или полностью дополненную среду для поддержания кардиомиоцитов (Cellular Dynamics) соответственно. Трансфекцию осуществляли на следующий день в бессывороточной среде, и при этом 250 нг модифицированной РНК VEGF-A смешивали с Lipofectamine 2000 (Invitrogen, Карлсбад, Калифорния, США) согласно инструкциям производителя и добавляли к клеткам. Lipofectamine 2000, смешанный с водой, использовали в качестве контроля трансфекции. Среду заменяли на свежую среду через каждые 8 часов и содержание белка VEGF-A человека измеряли в надосадочной жидкости с помощью ELISA в разные моменты времени.
[0429] Величина содержания белка VEGF-А человека, продуцированного за счет модифицированной РНК VEGF-A, достигала пика через приблизительно 8 часов после трансфекции как в клетках гладкой мускулатуры аорты человека, так и в кардиомиоцитах человека, а затем снижалась до низких уровней (ФИГ. 51). Через 32 часа после трансфекции белок не выявлялся или выявлялись очень низкие уровни белка.
6.19. ПРИМЕР 19
Временная динамика размножения клеток эпикардиального происхождения после инфаркта миокарда у мыши
[0430] Самцов мышей C57BL/6 анестезировали изофлураном, проводили интубацию, подсоединяли к аппаратам искусственной вентиляции легких и искусственно вентилировали с помощью 2,5-3% изофлурана, дополненного воздухом и кислородом (80/20%). Ректальную температуру поддерживали на уровне 37,5°С с помощью нагретого операционного стола и нагревательной лампы. Затем грудную клетку выбривали и игольчатые электроды для ECG вставляли в лапы для оценки частоты сердечных сокращений и ЭКГ. На коже делали разрез, мышцы грудной клетки аккуратно отделяли и обнажали четвертый межреберный промежуток для введения расширителя грудной клетки. Перикард осторожно рассекали и для создания постоянной окклюзии шелковую лигатуру 7-0 помещали вокруг левой передней нисходящей коронарной артерии сразу под левым предсердием. Ишемию подтверждали визуальным осмотром (бледность левого желудочка в отдалении от нитки) и повышением ST-сегмента на ЭКГ. Контрольных животных не подвергали окклюзии артерии. Затем ребра и кожу закрывали с помощью рассасывающихся нитей 6-0. Анальгетик (бупренорфин, 0,05 мг/кг, 10 мл/кг) вводили подкожно, и мышам давали возможность восстановиться в своей клетке на электрической грелке-подушке. Мышей умерщвляли в день 3, день 7 и день 14 после инфаркта миокарда (MI). Сердца иссекали, а затем промывали солевым раствором перед фиксацией в формалине. Активацию клеток эпикардиального происхождения (EPDC) оценивали по экспрессии белка опухоли Вильмса 1 (Wt-1) с помощью иммуногистохимического анализа.
[0431] Фиксированные в формалине сердца нарезали в поперечном направлении на срезы толщиной 1 мм от верхушки до основания. Срезы сердца дегидратировали в этаноле и ксилоле, заливали в парафин и под конец нарезали на срезы толщиной 4 мкм. Иммуногистохимический анализ в отношении Wt-1 в качестве маркера EPDC выполняли на автоматизированном устройстве для окрашивания препаратов Ventana Discovery XT с применением поликлональных антител кролика к Wt-1 (разведение 1:200, Calbiochem, Сан-Диего, Калифорния, США). Все реагенты представляли собой продукты от Ventana (Roche, Базель, Швейцария). Wt-1-положительные (Wt-1+) клетки оценивали слепым методом и с помощью ручной системы присвоения балла. Баллы определяли следующим образом, 0; отсутствие Wt-1+ клеток, 1; очень небольшое число Wt-1+положительных клеток, 2; небольшое число Wt-1+ положительных клеток в одном слое, расположенном на определенном уровне в сердце, 3; умеренное число Wt-1+ положительных клеток, расположенных на нескольких уровнях в сердце; и 4; большое число Wt-1+ положительных клеток в толстом слое, расположенном на нескольких уровнях в сердце.
[0432] Небольшое число Wt-1+ EPDC обнаруживали в эпикарде контрольных, не подвергавшихся инфаркту сердцах (ФИГ. 52А). После индуцирования MI Wt-1+ EPDC активировались и размножались, достигая пикового значения через 7 дней после MI (ФИГ. 52В).
7. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
7.1. SEQ ID NO: 1: Модифицированная РНК кодирующая VEGF-A, используемая в примерах

где
А, С, G и U=AMP, CMP, GMP и N1-метил-псевдо-UMP соответственно Me = метил
p = неорганический фосфат
7.1. SEQ ID NO: 2: Аминокислотная последовательность изоформы VEGF-165 VEGF-A человека

7.3. Конструкция мРНК люциферазы
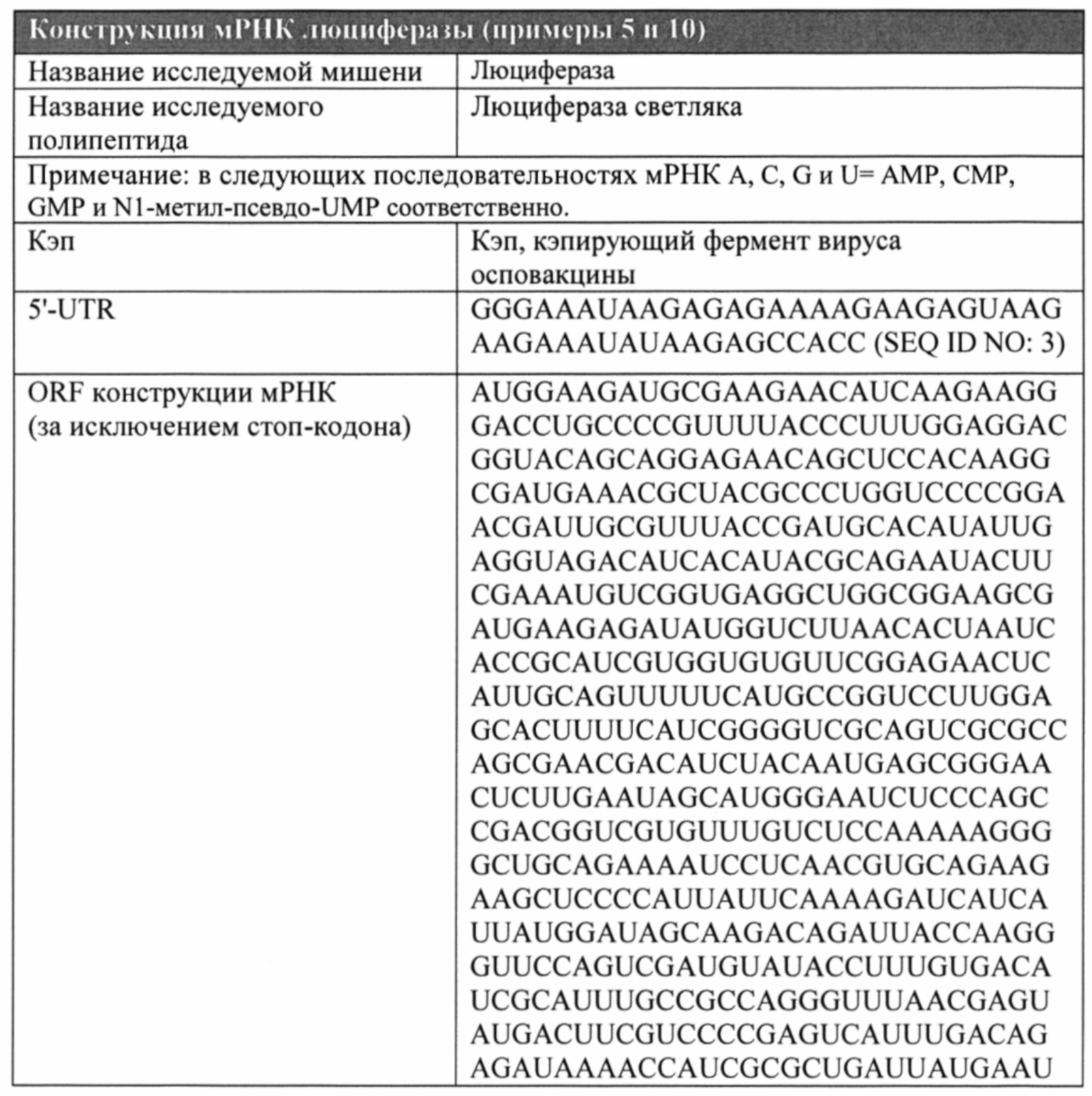


7.4. Конструкция мРНК LacZ
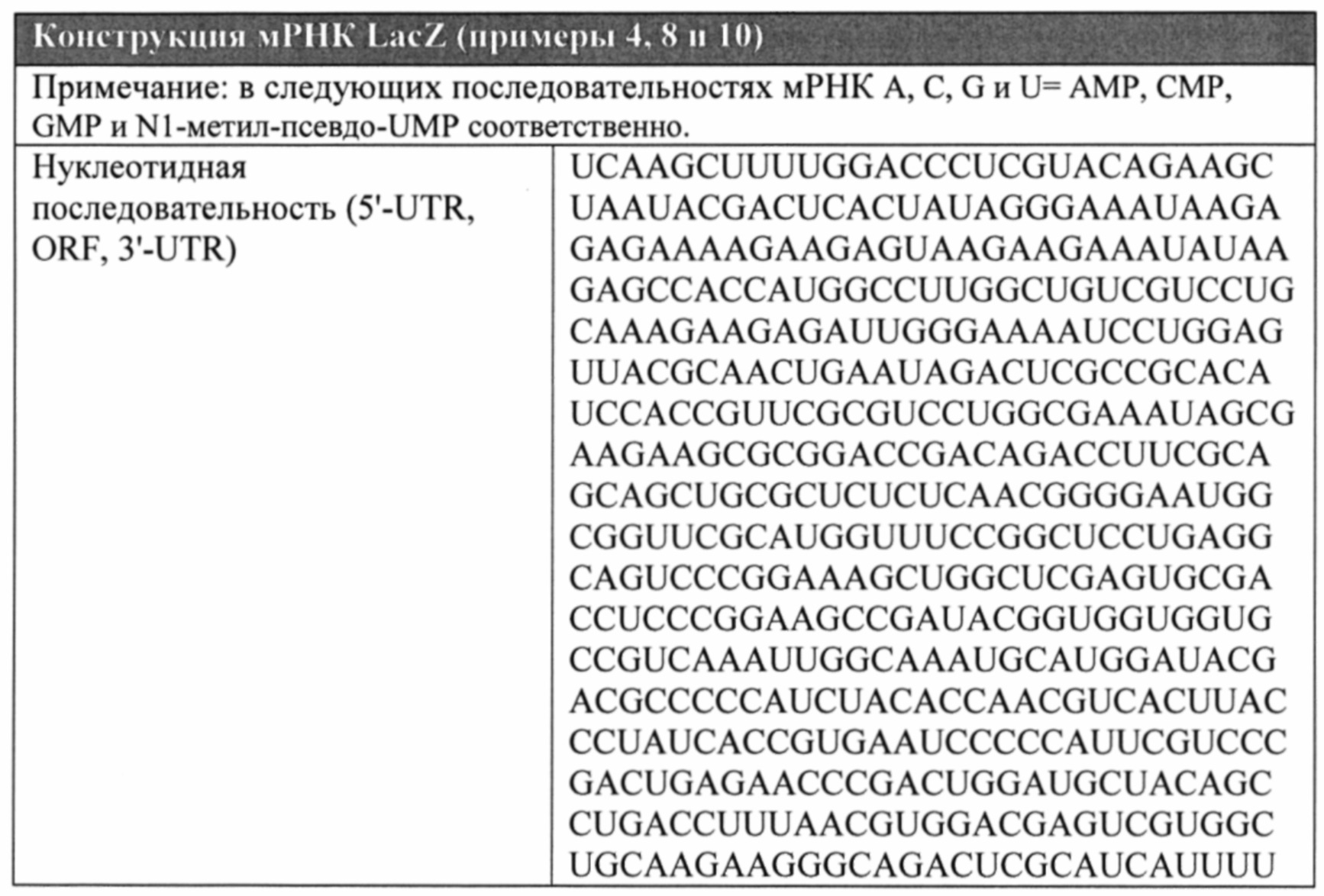





--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ModernaTX, Inc.
<120> мРНК, кодирующая VEGF, и способы ее применения
<130> 200369-WO-PCT
<150> US 62/346,979
<151> 2016-06-07
<150> US 62/411,091
<151> 2016-10-21
<150> US 62/432,005
<151> 2016-12-09
<160> 9
<170> PatentIn версия 3.5
<210> 1
<211> 845
<212> РНК
<213> Искусственная последовательность
<220>
<223> Модифицированная РНК, кодирующая VEGF-A
<220>
<221> модифицированное_основание
<222> (1)..(1)
<223> 5' 7MeGppp, где Me = метил, а p = неорганический фосфат
<220>
<221> другой_признак
<222> (1)..(845)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<220>
<221> модифицированное_основание
<222> (2)..(2)
<223> G2'OMe, где Me представляет собой метил
<220>
<221> модифицированное_основание
<222> (845)..(845)
<223> 3' GOH
<400> 1
ggggaaauaa gagagaaaag aagaguaaga agaaauauaa gagccaccau gaacuuucug 60
cugucuuggg ugcauuggag ccuugccuug cugcucuacc uccaccaugc caaguggucc 120
caggcugcac ccauggcaga aggaggaggg cagaaucauc acgaaguggu gaaguucaug 180
gaugucuauc agcgcagcua cugccaucca aucgagaccc ugguggacau cuuccaggag 240
uacccugaug agaucgagua caucuucaag ccauccugug ugccccugau gcgaugcggg 300
ggcugcugca augacgaggg ccuggagugu gugcccacug aggaguccaa caucaccaug 360
cagauuaugc ggaucaaacc ucaccaaggc cagcacauag gagagaugag cuuccuacag 420
cacaacaaau gugaaugcag accaaagaaa gauagagcaa gacaagaaaa ucccuguggg 480
ccuugcucag agcggagaaa gcauuuguuu guacaagauc cgcagacgug uaaauguucc 540
ugcaaaaaca cagacucgcg uugcaaggcg aggcagcuug aguuaaacga acguacuugc 600
agaugugaca agccgaggcg gugauaauag gcuggagccu cgguggccau gcuucuugcc 660
ccuugggccu ccccccagcc ccuccucccc uuccugcacc cguacccccg uggucuuuga 720
auaaagucug agugggcggc aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
ucuag 845
<210> 2
<211> 191
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Asn Phe Leu Leu Ser Trp Val His Trp Ser Leu Ala Leu Leu Leu
1 5 10 15
Tyr Leu His His Ala Lys Trp Ser Gln Ala Ala Pro Met Ala Glu Gly
20 25 30
Gly Gly Gln Asn His His Glu Val Val Lys Phe Met Asp Val Tyr Gln
35 40 45
Arg Ser Tyr Cys His Pro Ile Glu Thr Leu Val Asp Ile Phe Gln Glu
50 55 60
Tyr Pro Asp Glu Ile Glu Tyr Ile Phe Lys Pro Ser Cys Val Pro Leu
65 70 75 80
Met Arg Cys Gly Gly Cys Cys Asn Asp Glu Gly Leu Glu Cys Val Pro
85 90 95
Thr Glu Glu Ser Asn Ile Thr Met Gln Ile Met Arg Ile Lys Pro His
100 105 110
Gln Gly Gln His Ile Gly Glu Met Ser Phe Leu Gln His Asn Lys Cys
115 120 125
Glu Cys Arg Pro Lys Lys Asp Arg Ala Arg Gln Glu Asn Pro Cys Gly
130 135 140
Pro Cys Ser Glu Arg Arg Lys His Leu Phe Val Gln Asp Pro Gln Thr
145 150 155 160
Cys Lys Cys Ser Cys Lys Asn Thr Asp Ser Arg Cys Lys Ala Arg Gln
165 170 175
Leu Glu Leu Asn Glu Arg Thr Cys Arg Cys Asp Lys Pro Arg Arg
180 185 190
<210> 3
<211> 47
<212> РНК
<213> Искусственная последовательность
<220>
<223> 5'-UTR люциферазы светляка
<220>
<221> другой_признак
<222> (1)..(47)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<400> 3
gggaaauaag agagaaaaga agaguaagaa gaaauauaag agccacc 47
<210> 4
<211> 1650
<212> РНК
<213> Искусственная последовательность
<220>
<223> ORF люциферазы светляка из конструкции мРНК (за исключением стоп-кодона)
<220>
<221> другой_признак
<222> (1)..(1650)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<400> 4
auggaagaug cgaagaacau caagaaggga ccugccccgu uuuacccuuu ggaggacggu 60
acagcaggag aacagcucca caaggcgaug aaacgcuacg cccugguccc cggaacgauu 120
gcguuuaccg augcacauau ugagguagac aucacauacg cagaauacuu cgaaaugucg 180
gugaggcugg cggaagcgau gaagagauau ggucuuaaca cuaaucaccg caucguggug 240
uguucggaga acucauugca guuuuucaug ccgguccuug gagcacuuuu caucgggguc 300
gcagucgcgc cagcgaacga caucuacaau gagcgggaac ucuugaauag caugggaauc 360
ucccagccga cggucguguu ugucuccaaa aaggggcugc agaaaauccu caacgugcag 420
aagaagcucc ccauuauuca aaagaucauc auuauggaua gcaagacaga uuaccaaggg 480
uuccagucga uguauaccuu ugugacaucg cauuugccgc caggguuuaa cgaguaugac 540
uucguccccg agucauuuga cagagauaaa accaucgcgc ugauuaugaa uuccucgggu 600
agcaccgguu ugccaaaggg gguggcguug ccccaccgca cugcuugugu gcgguucucg 660
cacgcuaggg auccuaucuu ugguaaucag aucauucccg acacagcaau ccuguccgug 720
guaccuuuuc aucacgguuu uggcauguuc acgacucucg gcuauuugau uugcgguuuc 780
agggucguac uuauguaucg guucgaggaa gaacuguuuu ugagauccuu gcaagauuac 840
aagauccagu cggcccuccu ugugccaacg cuuuucucau ucuuugcgaa aucgacacuu 900
auugauaagu augaccuuuc caaucugcau gagauugccu cagggggagc gccgcuuagc 960
aaggaagucg gggaggcagu ggccaagcgc uuccaccuuc ccggaauucg gcagggauac 1020
gggcucacgg agacaacauc cgcgauccuu aucacgcccg agggugacga uaagccggga 1080
gccgucggaa aagugguccc cuucuuugaa gccaaggucg uagaccucga cacgggaaaa 1140
acccucggag ugaaccagag gggcgagcuc ugcgugagag ggccgaugau caugucaggu 1200
uacgugaaua acccugaagc gacgaaugcg cugaucgaca aggaugggug guugcauucg 1260
ggagacauug ccuauuggga ugaggaugag cacuucuuua ucguagaucg acuuaagagc 1320
uugaucaaau acaaaggcua ucagguagcg ccugccgagc ucgagucaau ccugcuccag 1380
caccccaaca uuuucgacgc cggaguggcc ggguugcccg augacgacgc gggugagcug 1440
ccagcggccg ugguaguccu cgaacauggg aaaacaauga ccgaaaagga gaucguggac 1500
uacguagcau cacaagugac gacugcgaag aaacugaggg gagggguagu cuuuguggac 1560
gaggucccga aaggcuugac ugggaagcuu gacgcucgca aaauccggga aauccugauu 1620
aaggcaaaga aaggcgggaa aaucgcuguc 1650
<210> 5
<211> 119
<212> РНК
<213> Искусственная последовательность
<220>
<223> 3'-UTR люциферазы светляка
<220>
<221> другой_признак
<222> (1)..(119)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<400> 5
ugauaauagg cuggagccuc gguggccaug cuucuugccc cuugggccuc cccccagccc 60
cuccuccccu uccugcaccc guacccccgu ggucuuugaa uaaagucuga gugggcggc 119
<210> 6
<211> 550
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Люцифераза светляка
<400> 6
Met Glu Asp Ala Lys Asn Ile Lys Lys Gly Pro Ala Pro Phe Tyr Pro
1 5 10 15
Leu Glu Asp Gly Thr Ala Gly Glu Gln Leu His Lys Ala Met Lys Arg
20 25 30
Tyr Ala Leu Val Pro Gly Thr Ile Ala Phe Thr Asp Ala His Ile Glu
35 40 45
Val Asp Ile Thr Tyr Ala Glu Tyr Phe Glu Met Ser Val Arg Leu Ala
50 55 60
Glu Ala Met Lys Arg Tyr Gly Leu Asn Thr Asn His Arg Ile Val Val
65 70 75 80
Cys Ser Glu Asn Ser Leu Gln Phe Phe Met Pro Val Leu Gly Ala Leu
85 90 95
Phe Ile Gly Val Ala Val Ala Pro Ala Asn Asp Ile Tyr Asn Glu Arg
100 105 110
Glu Leu Leu Asn Ser Met Gly Ile Ser Gln Pro Thr Val Val Phe Val
115 120 125
Ser Lys Lys Gly Leu Gln Lys Ile Leu Asn Val Gln Lys Lys Leu Pro
130 135 140
Ile Ile Gln Lys Ile Ile Ile Met Asp Ser Lys Thr Asp Tyr Gln Gly
145 150 155 160
Phe Gln Ser Met Tyr Thr Phe Val Thr Ser His Leu Pro Pro Gly Phe
165 170 175
Asn Glu Tyr Asp Phe Val Pro Glu Ser Phe Asp Arg Asp Lys Thr Ile
180 185 190
Ala Leu Ile Met Asn Ser Ser Gly Ser Thr Gly Leu Pro Lys Gly Val
195 200 205
Ala Leu Pro His Arg Thr Ala Cys Val Arg Phe Ser His Ala Arg Asp
210 215 220
Pro Ile Phe Gly Asn Gln Ile Ile Pro Asp Thr Ala Ile Leu Ser Val
225 230 235 240
Val Pro Phe His His Gly Phe Gly Met Phe Thr Thr Leu Gly Tyr Leu
245 250 255
Ile Cys Gly Phe Arg Val Val Leu Met Tyr Arg Phe Glu Glu Glu Leu
260 265 270
Phe Leu Arg Ser Leu Gln Asp Tyr Lys Ile Gln Ser Ala Leu Leu Val
275 280 285
Pro Thr Leu Phe Ser Phe Phe Ala Lys Ser Thr Leu Ile Asp Lys Tyr
290 295 300
Asp Leu Ser Asn Leu His Glu Ile Ala Ser Gly Gly Ala Pro Leu Ser
305 310 315 320
Lys Glu Val Gly Glu Ala Val Ala Lys Arg Phe His Leu Pro Gly Ile
325 330 335
Arg Gln Gly Tyr Gly Leu Thr Glu Thr Thr Ser Ala Ile Leu Ile Thr
340 345 350
Pro Glu Gly Asp Asp Lys Pro Gly Ala Val Gly Lys Val Val Pro Phe
355 360 365
Phe Glu Ala Lys Val Val Asp Leu Asp Thr Gly Lys Thr Leu Gly Val
370 375 380
Asn Gln Arg Gly Glu Leu Cys Val Arg Gly Pro Met Ile Met Ser Gly
385 390 395 400
Tyr Val Asn Asn Pro Glu Ala Thr Asn Ala Leu Ile Asp Lys Asp Gly
405 410 415
Trp Leu His Ser Gly Asp Ile Ala Tyr Trp Asp Glu Asp Glu His Phe
420 425 430
Phe Ile Val Asp Arg Leu Lys Ser Leu Ile Lys Tyr Lys Gly Tyr Gln
435 440 445
Val Ala Pro Ala Glu Leu Glu Ser Ile Leu Leu Gln His Pro Asn Ile
450 455 460
Phe Asp Ala Gly Val Ala Gly Leu Pro Asp Asp Asp Ala Gly Glu Leu
465 470 475 480
Pro Ala Ala Val Val Val Leu Glu His Gly Lys Thr Met Thr Glu Lys
485 490 495
Glu Ile Val Asp Tyr Val Ala Ser Gln Val Thr Thr Ala Lys Lys Leu
500 505 510
Arg Gly Gly Val Val Phe Val Asp Glu Val Pro Lys Gly Leu Thr Gly
515 520 525
Lys Leu Asp Ala Arg Lys Ile Arg Glu Ile Leu Ile Lys Ala Lys Lys
530 535 540
Gly Gly Lys Ile Ala Val
545 550
<210> 7
<211> 3274
<212> РНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность LacZ (5'-UTR, ORF, 3'-UTR)
<220>
<221> другой_признак
<222> (1)..(3274)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<400> 7
ucaagcuuuu ggacccucgu acagaagcua auacgacuca cuauagggaa auaagagaga 60
aaagaagagu aagaagaaau auaagagcca ccauggccuu ggcugucguc cugcaaagaa 120
gagauuggga aaauccugga guuacgcaac ugaauagacu cgccgcacau ccaccguucg 180
cguccuggcg aaauagcgaa gaagcgcgga ccgacagacc uucgcagcag cugcgcucuc 240
ucaacgggga auggcgguuc gcaugguuuc cggcuccuga ggcagucccg gaaagcuggc 300
ucgagugcga ccucccggaa gccgauacgg ugguggugcc gucaaauugg caaaugcaug 360
gauacgacgc ccccaucuac accaacguca cuuacccuau caccgugaau cccccauucg 420
ucccgacuga gaacccgacu ggaugcuaca gccugaccuu uaacguggac gagucguggc 480
ugcaagaagg gcagacucgc aucauuuucg acggagucaa cuccgcguuc caucuuuggu 540
guaacggacg guggguggga uacgggcagg acuccaggcu gccgagcgaa uucgacuugu 600
cagccuuccu gcgcgccggc gaaaaccgcc uggcugucau gguccuuaga uggucggaug 660
gcucguaccu ggaggaucag gacaugugga ggaugucagg gaucuuccgg gaugucucgc 720
ugcuccacaa gccaacuacc cagaucuccg acuuucaugu ggccacccgc uucaacgaug 780
acuucagcag ggcgguucug gaagccgagg ugcaaaugug cggagaacug agggacuacc 840
uccgcgugac ugucucgcuc uggcagggug aaacccaagu ggcuucaggc acugcaccgu 900
ucggaggaga aaucaucgac gaacggggag gauacgccga ucgcgucacc cugcgccuca 960
auguggaaaa uccgaaacug uggucggcag aaaucccuaa uuuguaccgg gccguggugg 1020
agcugcacac cgccgacgga acucugaucg aggccgaggc augcgaugug ggauuccgcg 1080
agguccgcau cgaaaaugga cugcuucugc uuaauggcaa accgcugcuc auccgcggag 1140
ugaacagaca cgagcaucac ccgcugcacg gucaggucau ggaugaacag acuauggugc 1200
aagacauccu gcugaugaaa caaaacaacu ucaacgccgu ucggugcucc cauuacccua 1260
aucacccguu gugguauacc cuuugcgauc gguacggccu cuacguggug gacgaagcga 1320
acaucgagac ucacggaaug gucccuauga accgccucac ugacgacccg agguggcucc 1380
cggcaauguc ggaacgagug acucggaugg ugcagaggga ccgcaaccau ccgucgguga 1440
uaaucugguc gcuggggaac gaaucuggcc acggagcuaa ccacgaugcg cuguaccgcu 1500
ggauuaaguc cguggaccca agccggcccg uccaguacga aggagguggu gcugauacca 1560
cugcaaccga caucaucugc ccaauguaug cgcgggugga ugaggaccaa ccuuucccgg 1620
cggugccaaa gugguccauc aagaaauggc ucucgcugcc cggagaaacg cgcccgcuga 1680
uccugugcga auaugcgcac gcuaugggaa auucacuggg gggauuugcg aaguacuggc 1740
aggcuuuucg acaguacccg agacuccagg guggcuucgu gugggacugg guugaccaga 1800
gccucaucaa auacgaugaa aacggcaacc caugguccgc guacggcgga gacuuuggag 1860
acaccccuaa cgaucgccag uucugcauga acggccuggu guucgccgac agaacuccgc 1920
auccagcccu uacugaggcu aagcaccaac aacaguucuu ccaguucaga cugucggggc 1980
aaacgaucga agugacuucc gaauaccucu uccggcauuc ggacaacgag uugcugcacu 2040
ggauggucgc ccuggaugga aagccccucg ccuccggaga agugccgcuc gacguggcgc 2100
cgcagggaaa gcaguugauc gaguugccgg aacugccaca gcccgaguca gcaggacagc 2160
ucuggcuuac cgucagaguc gugcagccaa augccaccgc cuggucggag gcaggacaua 2220
uuucagccug gcagcagugg cgccucgccg agaaucugag cgugaccuug ccagcagccu 2280
cacacgccau uccgcaucug accacguccg aaauggacuu uuguaucgaa cuggggaaua 2340
agcgcuggca guucaaucgg caaucaggcu uccuguccca gauguggauu ggugacaaga 2400
agcagcuccu gaccccgcug cgcgaucagu ucacucgcgc cccacuugac aacgacauug 2460
gcgugagcga ggccacgcgu aucgauccaa acgcuugggu ggagcgcugg aaggcggcug 2520
gccacuauca ggcggaggcc gcgcuccugc aguguaccgc ggauacccuc gcagacgccg 2580
uucugauuac cacggcgcau gccuggcaac accagggaaa gacccuguuu aucagccgca 2640
aaacuuaccg gaucgauggc agcggccaaa uggcgaucac uguggacguc gagguggcau 2700
cagacacucc acacccagca cggaucggac ucaauugcca acuggcucaa guggcugaga 2760
gagucaauug gcugggccuc ggcccccaag agaacuaccc ugaucggcuu acugccgcau 2820
gcuuugaccg gugggaucug ccucugucgg auauguacac ccccuacgug uucccauccg 2880
agaacggucu gagaugcggu acuagggagu ugaacuacgg accgcaccaa uggagggggg 2940
acuuucaguu caacaucuca agauacagcc agcagcaauu gauggaaacc ucgcaccggc 3000
aucucuugca ugcagaggaa gggaccuggc ugaacaucga uggauuccac augggaauug 3060
guggggauga cuccuggucc ccuagcgugu ccgcggaacu ucagcugucc gccggccggu 3120
accacuacca gcucgugugg ugucaaaagu gauaauaggc uggagccucg guggccaugc 3180
uucuugcccc uugggccucc ccccagcccc uccuccccuu ccugcacccg uacccccgug 3240
gucuuugaau aaagucugag ugggcggcuc uaga 3274
<210> 8
<211> 1019
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> LacZ
<400> 8
Met Ala Leu Ala Val Val Leu Gln Arg Arg Asp Trp Glu Asn Pro Gly
1 5 10 15
Val Thr Gln Leu Asn Arg Leu Ala Ala His Pro Pro Phe Ala Ser Trp
20 25 30
Arg Asn Ser Glu Glu Ala Arg Thr Asp Arg Pro Ser Gln Gln Leu Arg
35 40 45
Ser Leu Asn Gly Glu Trp Arg Phe Ala Trp Phe Pro Ala Pro Glu Ala
50 55 60
Val Pro Glu Ser Trp Leu Glu Cys Asp Leu Pro Glu Ala Asp Thr Val
65 70 75 80
Val Val Pro Ser Asn Trp Gln Met His Gly Tyr Asp Ala Pro Ile Tyr
85 90 95
Thr Asn Val Thr Tyr Pro Ile Thr Val Asn Pro Pro Phe Val Pro Thr
100 105 110
Glu Asn Pro Thr Gly Cys Tyr Ser Leu Thr Phe Asn Val Asp Glu Ser
115 120 125
Trp Leu Gln Glu Gly Gln Thr Arg Ile Ile Phe Asp Gly Val Asn Ser
130 135 140
Ala Phe His Leu Trp Cys Asn Gly Arg Trp Val Gly Tyr Gly Gln Asp
145 150 155 160
Ser Arg Leu Pro Ser Glu Phe Asp Leu Ser Ala Phe Leu Arg Ala Gly
165 170 175
Glu Asn Arg Leu Ala Val Met Val Leu Arg Trp Ser Asp Gly Ser Tyr
180 185 190
Leu Glu Asp Gln Asp Met Trp Arg Met Ser Gly Ile Phe Arg Asp Val
195 200 205
Ser Leu Leu His Lys Pro Thr Thr Gln Ile Ser Asp Phe His Val Ala
210 215 220
Thr Arg Phe Asn Asp Asp Phe Ser Arg Ala Val Leu Glu Ala Glu Val
225 230 235 240
Gln Met Cys Gly Glu Leu Arg Asp Tyr Leu Arg Val Thr Val Ser Leu
245 250 255
Trp Gln Gly Glu Thr Gln Val Ala Ser Gly Thr Ala Pro Phe Gly Gly
260 265 270
Glu Ile Ile Asp Glu Arg Gly Gly Tyr Ala Asp Arg Val Thr Leu Arg
275 280 285
Leu Asn Val Glu Asn Pro Lys Leu Trp Ser Ala Glu Ile Pro Asn Leu
290 295 300
Tyr Arg Ala Val Val Glu Leu His Thr Ala Asp Gly Thr Leu Ile Glu
305 310 315 320
Ala Glu Ala Cys Asp Val Gly Phe Arg Glu Val Arg Ile Glu Asn Gly
325 330 335
Leu Leu Leu Leu Asn Gly Lys Pro Leu Leu Ile Arg Gly Val Asn Arg
340 345 350
His Glu His His Pro Leu His Gly Gln Val Met Asp Glu Gln Thr Met
355 360 365
Val Gln Asp Ile Leu Leu Met Lys Gln Asn Asn Phe Asn Ala Val Arg
370 375 380
Cys Ser His Tyr Pro Asn His Pro Leu Trp Tyr Thr Leu Cys Asp Arg
385 390 395 400
Tyr Gly Leu Tyr Val Val Asp Glu Ala Asn Ile Glu Thr His Gly Met
405 410 415
Val Pro Met Asn Arg Leu Thr Asp Asp Pro Arg Trp Leu Pro Ala Met
420 425 430
Ser Glu Arg Val Thr Arg Met Val Gln Arg Asp Arg Asn His Pro Ser
435 440 445
Val Ile Ile Trp Ser Leu Gly Asn Glu Ser Gly His Gly Ala Asn His
450 455 460
Asp Ala Leu Tyr Arg Trp Ile Lys Ser Val Asp Pro Ser Arg Pro Val
465 470 475 480
Gln Tyr Glu Gly Gly Gly Ala Asp Thr Thr Ala Thr Asp Ile Ile Cys
485 490 495
Pro Met Tyr Ala Arg Val Asp Glu Asp Gln Pro Phe Pro Ala Val Pro
500 505 510
Lys Trp Ser Ile Lys Lys Trp Leu Ser Leu Pro Gly Glu Thr Arg Pro
515 520 525
Leu Ile Leu Cys Glu Tyr Ala His Ala Met Gly Asn Ser Leu Gly Gly
530 535 540
Phe Ala Lys Tyr Trp Gln Ala Phe Arg Gln Tyr Pro Arg Leu Gln Gly
545 550 555 560
Gly Phe Val Trp Asp Trp Val Asp Gln Ser Leu Ile Lys Tyr Asp Glu
565 570 575
Asn Gly Asn Pro Trp Ser Ala Tyr Gly Gly Asp Phe Gly Asp Thr Pro
580 585 590
Asn Asp Arg Gln Phe Cys Met Asn Gly Leu Val Phe Ala Asp Arg Thr
595 600 605
Pro His Pro Ala Leu Thr Glu Ala Lys His Gln Gln Gln Phe Phe Gln
610 615 620
Phe Arg Leu Ser Gly Gln Thr Ile Glu Val Thr Ser Glu Tyr Leu Phe
625 630 635 640
Arg His Ser Asp Asn Glu Leu Leu His Trp Met Val Ala Leu Asp Gly
645 650 655
Lys Pro Leu Ala Ser Gly Glu Val Pro Leu Asp Val Ala Pro Gln Gly
660 665 670
Lys Gln Leu Ile Glu Leu Pro Glu Leu Pro Gln Pro Glu Ser Ala Gly
675 680 685
Gln Leu Trp Leu Thr Val Arg Val Val Gln Pro Asn Ala Thr Ala Trp
690 695 700
Ser Glu Ala Gly His Ile Ser Ala Trp Gln Gln Trp Arg Leu Ala Glu
705 710 715 720
Asn Leu Ser Val Thr Leu Pro Ala Ala Ser His Ala Ile Pro His Leu
725 730 735
Thr Thr Ser Glu Met Asp Phe Cys Ile Glu Leu Gly Asn Lys Arg Trp
740 745 750
Gln Phe Asn Arg Gln Ser Gly Phe Leu Ser Gln Met Trp Ile Gly Asp
755 760 765
Lys Lys Gln Leu Leu Thr Pro Leu Arg Asp Gln Phe Thr Arg Ala Pro
770 775 780
Leu Asp Asn Asp Ile Gly Val Ser Glu Ala Thr Arg Ile Asp Pro Asn
785 790 795 800
Ala Trp Val Glu Arg Trp Lys Ala Ala Gly His Tyr Gln Ala Glu Ala
805 810 815
Ala Leu Leu Gln Cys Thr Ala Asp Thr Leu Ala Asp Ala Val Leu Ile
820 825 830
Thr Thr Ala His Ala Trp Gln His Gln Gly Lys Thr Leu Phe Ile Ser
835 840 845
Arg Lys Thr Tyr Arg Ile Asp Gly Ser Gly Gln Met Ala Ile Thr Val
850 855 860
Asp Val Glu Val Ala Ser Asp Thr Pro His Pro Ala Arg Ile Gly Leu
865 870 875 880
Asn Cys Gln Leu Ala Gln Val Ala Glu Arg Val Asn Trp Leu Gly Leu
885 890 895
Gly Pro Gln Glu Asn Tyr Pro Asp Arg Leu Thr Ala Ala Cys Phe Asp
900 905 910
Arg Trp Asp Leu Pro Leu Ser Asp Met Tyr Thr Pro Tyr Val Phe Pro
915 920 925
Ser Glu Asn Gly Leu Arg Cys Gly Thr Arg Glu Leu Asn Tyr Gly Pro
930 935 940
His Gln Trp Arg Gly Asp Phe Gln Phe Asn Ile Ser Arg Tyr Ser Gln
945 950 955 960
Gln Gln Leu Met Glu Thr Ser His Arg His Leu Leu His Ala Glu Glu
965 970 975
Gly Thr Trp Leu Asn Ile Asp Gly Phe His Met Gly Ile Gly Gly Asp
980 985 990
Asp Ser Trp Ser Pro Ser Val Ser Ala Glu Leu Gln Leu Ser Ala Gly
995 1000 1005
Arg Tyr His Tyr Gln Leu Val Trp Cys Gln Lys
1010 1015
<210> 9
<211> 3057
<212> РНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность ORF LacZ
<220>
<221> другой_признак
<222> (1)..(3057)
<223> A = AMP, C = CMP, G = GMP, U = N1-метил-псевдо-UMP
<400> 9
auggccuugg cugucguccu gcaaagaaga gauugggaaa auccuggagu uacgcaacug 60
aauagacucg ccgcacaucc accguucgcg uccuggcgaa auagcgaaga agcgcggacc 120
gacagaccuu cgcagcagcu gcgcucucuc aacggggaau ggcgguucgc augguuuccg 180
gcuccugagg cagucccgga aagcuggcuc gagugcgacc ucccggaagc cgauacggug 240
guggugccgu caaauuggca aaugcaugga uacgacgccc ccaucuacac caacgucacu 300
uacccuauca ccgugaaucc cccauucguc ccgacugaga acccgacugg augcuacagc 360
cugaccuuua acguggacga gucguggcug caagaagggc agacucgcau cauuuucgac 420
ggagucaacu ccgcguucca ucuuuggugu aacggacggu gggugggaua cgggcaggac 480
uccaggcugc cgagcgaauu cgacuuguca gccuuccugc gcgccggcga aaaccgccug 540
gcugucaugg uccuuagaug gucggauggc ucguaccugg aggaucagga cauguggagg 600
augucaggga ucuuccggga ugucucgcug cuccacaagc caacuaccca gaucuccgac 660
uuucaugugg ccacccgcuu caacgaugac uucagcaggg cgguucugga agccgaggug 720
caaaugugcg gagaacugag ggacuaccuc cgcgugacug ucucgcucug gcagggugaa 780
acccaagugg cuucaggcac ugcaccguuc ggaggagaaa ucaucgacga acggggagga 840
uacgccgauc gcgucacccu gcgccucaau guggaaaauc cgaaacugug gucggcagaa 900
aucccuaauu uguaccgggc cgugguggag cugcacaccg ccgacggaac ucugaucgag 960
gccgaggcau gcgauguggg auuccgcgag guccgcaucg aaaauggacu gcuucugcuu 1020
aauggcaaac cgcugcucau ccgcggagug aacagacacg agcaucaccc gcugcacggu 1080
caggucaugg augaacagac uauggugcaa gacauccugc ugaugaaaca aaacaacuuc 1140
aacgccguuc ggugcuccca uuacccuaau cacccguugu gguauacccu uugcgaucgg 1200
uacggccucu acguggugga cgaagcgaac aucgagacuc acggaauggu cccuaugaac 1260
cgccucacug acgacccgag guggcucccg gcaaugucgg aacgagugac ucggauggug 1320
cagagggacc gcaaccaucc gucggugaua aucuggucgc uggggaacga aucuggccac 1380
ggagcuaacc acgaugcgcu guaccgcugg auuaaguccg uggacccaag ccggcccguc 1440
caguacgaag gagguggugc ugauaccacu gcaaccgaca ucaucugccc aauguaugcg 1500
cggguggaug aggaccaacc uuucccggcg gugccaaagu gguccaucaa gaaauggcuc 1560
ucgcugcccg gagaaacgcg cccgcugauc cugugcgaau augcgcacgc uaugggaaau 1620
ucacuggggg gauuugcgaa guacuggcag gcuuuucgac aguacccgag acuccagggu 1680
ggcuucgugu gggacugggu ugaccagagc cucaucaaau acgaugaaaa cggcaaccca 1740
ugguccgcgu acggcggaga cuuuggagac accccuaacg aucgccaguu cugcaugaac 1800
ggccuggugu ucgccgacag aacuccgcau ccagcccuua cugaggcuaa gcaccaacaa 1860
caguucuucc aguucagacu gucggggcaa acgaucgaag ugacuuccga auaccucuuc 1920
cggcauucgg acaacgaguu gcugcacugg auggucgccc uggauggaaa gccccucgcc 1980
uccggagaag ugccgcucga cguggcgccg cagggaaagc aguugaucga guugccggaa 2040
cugccacagc ccgagucagc aggacagcuc uggcuuaccg ucagagucgu gcagccaaau 2100
gccaccgccu ggucggaggc aggacauauu ucagccuggc agcaguggcg ccucgccgag 2160
aaucugagcg ugaccuugcc agcagccuca cacgccauuc cgcaucugac cacguccgaa 2220
auggacuuuu guaucgaacu ggggaauaag cgcuggcagu ucaaucggca aucaggcuuc 2280
cugucccaga uguggauugg ugacaagaag cagcuccuga ccccgcugcg cgaucaguuc 2340
acucgcgccc cacuugacaa cgacauuggc gugagcgagg ccacgcguau cgauccaaac 2400
gcuugggugg agcgcuggaa ggcggcuggc cacuaucagg cggaggccgc gcuccugcag 2460
uguaccgcgg auacccucgc agacgccguu cugauuacca cggcgcaugc cuggcaacac 2520
cagggaaaga cccuguuuau cagccgcaaa acuuaccgga ucgauggcag cggccaaaug 2580
gcgaucacug uggacgucga gguggcauca gacacuccac acccagcacg gaucggacuc 2640
aauugccaac uggcucaagu ggcugagaga gucaauuggc ugggccucgg cccccaagag 2700
aacuacccug aucggcuuac ugccgcaugc uuugaccggu gggaucugcc ucugucggau 2760
auguacaccc ccuacguguu cccauccgag aacggucuga gaugcgguac uagggaguug 2820
aacuacggac cgcaccaaug gaggggggac uuucaguuca acaucucaag auacagccag 2880
cagcaauuga uggaaaccuc gcaccggcau cucuugcaug cagaggaagg gaccuggcug 2940
aacaucgaug gauuccacau gggaauuggu ggggaugacu ccuggucccc uagcgugucc 3000
gcggaacuuc agcuguccgc cggccgguac cacuaccagc ucguguggug ucaaaag 3057
<---
Реферат
Изобретение относится к области биотехнологии, конкретно к фармацевтическим композициям модифицированных молекул РНК, кодирующих VEGF-A, и может быть использовано в медицине для VEGF-A терапии. Предложена композиция для доставки модифицированной мРНК, кодирующей полипептид VEGF-A, in vivo при терапии с помощью VEGF-A, содержащая эффективное количество мРНК, кодирующей полипептид VEGF-A, и цитратно-солевой буфер, где цитратно-солевой буфер практически не содержит двухвалентных катионов. Композицию применяют в способе лечения заболевания, которое демонстрирует улучшение одного или нескольких симптомов или клинических маркеров после терапии с помощью VEGF-A, например, заболевания, выбранного из сердечной недостаточности со сниженной или сохраненной фракцией выброса, сердечной дисфункции после MI, ишемической болезни сердца и кожной язвы, в том числе диабетической язвы. Изобретение обеспечивает снижение токсичности композиции для доставки модифицированной мРНК, кодирующей VEGF-A, in vivo. 3 н. и 10 з.п. ф-лы, 52 ил., 2 табл., 19 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиции, улучшающие перфузию в области инфаркта, и способы восстановления сосудистого повреждения

Комментарии