Белки, вызывающие измененную иммуногенную реакцию, и способы их получения и использования - RU2311458C2
Код документа: RU2311458C2
Чертежи


















Описание
Предпосылки изобретения
Белки, используемые в промышленных, фармацевтических и коммерческих применениях, приобретают все большее распространение. Индивидуумы, подвергаемые действию белков, могут становиться сенсибилизированными ими, после чего последующее их воздействие может вызывать аллергические реакции. Например, некоторые протеазы могут вызывать реакции гиперчувствительности у некоторых индивидуумов. В результате, несмотря на полезность протеаз в промышленности, например, в детергентах, применяемых для стирки, в косметике, обработке текстильных изделий и т.д., и интенсивную исследовательскую работу, выполняемую в данной области, для получения улучшенных протеаз, которые, например, более эффективно удаляют пятна в условиях моющего действия, применение протеаз в промышленности было проблематичным.
Большая работа была проведена для снижения этих проблем. Среди стратегий, исследованных для снижения иммуногенного потенциала протеаз, использовали усовершенствованные промышленные способы, которые уменьшают потенциальный контакт посредством контроля и минимизации концентраций на рабочем месте частиц пыли или аэрозоля, несущих находящуюся в воздухе протеазу, улучшенные способы грануляции, которые снижают количество пыли или аэрозоля, фактически продуцируемого из протеазного продукта, и улучшенные способы извлечения для уменьшения уровня потенциально аллергенных загрязнителей в конечном продукте. Однако попытки уменьшения аллергенности протеазы, per se, были относительно неуспешными. Альтернативно, прилагались усилия к тому, чтобы замаскировать эпитопы в протеазе, которые распознаются иммуноглобулином Е (IgE) у гиперчувствительных индивидуумов (PCT публикация No. WO 92/10755), или для увеличения или изменения природы антигенных детерминант присоединением полимеров или пептидов/белков к неблагоприятной протеазе.
Когда имеет место адаптивная иммунная реакция в преувеличенной или неадекватной форме, говорят, что индивидуум, подверженный этой реакции, является гиперчувствительным. Реакции гиперчувствительности являются результатом обычно благоприятных иммунных реакций, действующих неадекватно и иногда вызывающих воспалительные реакции и повреждение тканей. Они могут быть спровоцированы многими аллергенами; и причина реакции гиперчувствительности будет варьироваться от одного индивидуума к другому. Гиперчувствительность обычно не проявляется при первом контакте с аллергеном, но обычно появляется при последующем контакте. Одна форма гиперчувствительности имеет место, когда IgE-ответная реакция направлена против безвредных антигенов окружающей среды, таких как пыльца, клещи домашней мыши или перхоть животных. Происходящее при этом высвобождение фармакологических медиаторов IgE-сенсибилизированными тучными клетками вызывает острую воспалительную реакцию с такими симптомами, как астма или ринит.
Тем не менее, стратегия, предусматривающая модификацию сайтов IgE, обычно не будет успешной в профилактике причины начальной реакции сенсибилизации. Таким образом, подобные стратегии, хотя, возможно, и нейтрализующие или уменьшающие тяжесть последующей реакции гиперчувствительности, не будут уменьшать число индивидуумов или лиц, фактически сенсибилизированных. Например, когда известно, что определенное лицо является гиперчувствительным к определенному антигену, общим способом контроля такой ситуации является изоляция гиперчувствительного лица от данного антигена, насколько это возможно. Действительно, любой другой способ действия мог бы быть угрожающим для здоровья гиперчувствительного индивидуума. Таким образом, хотя уменьшение угрозы специфического белка для гиперчувствительного индивидуума является важным, для промышленных целей было бы гораздо более полезным в первую очередь уменьшение или устранение способности данного белка инициировать реакцию гиперчувствительности.
Т-лимфоциты (Т-клетки) являются ключевыми участниками в индукции и регуляции иммунных реакций и в выполнении функций иммунологических эффекторов. Известно, что специфический иммунитет против инфекционных агентов и опухолей зависит от таких клеток, и считается, что они способствуют заживлению ран. С другой стороны, неспособность контролировать такие реакции может приводить к аутоагрессии. Обычно, антиген презентируется Т-клеткам в форме антигенпрезентирующих клеток, которые через различные поверхностно-клеточные механизмы захватывают и представляют антиген или частичный антиген таким образом, что он распознается Т-клеткой. При распознавании специфического эпитопа рецепторами на поверхности Т-клеток (Т-клеточными рецепторами) Т-клетки начинают серию комплексных взаимодействий, в том числе пролиферацию, которая приводит к продуцированию антитела В-клетками. Хотя как Т-клетки, так и В-клетки активируются антигенными эпитопами, которые существуют в конкретном белке или пептиде, фактические эпитопы, распознаваемые этими мононуклеарными клетками, обычно не являются идентичными. Действительно, эпитоп, который активирует Т-клетку для инициации создания иммунологического разнообразия, очень часто не находится на том же самом эпитопе, который позднее распознается В-клетками в ходе иммунологической реакции. Таким образом, что касается гиперчувствительности, хотя специфическое антигенное взаимодействие между Т-клеткой и антигеном является критическим элементом в инициации иммунной реакции в отношении экспонирования антигена, специфика этого взаимодействия, т.е. распознаваемый эпитоп, часто не имеет отношения к последующему развитию резко выраженной аллергической реакции, опосредованной IgE-антителом.
В PCT публикации No. WO 96/40791 описан способ получения конъюгатов полиалкиленоксид-протеазы с уменьшенной аллергенностью с использованием полиалкиленоксида в качестве исходного вещества.
В PCT публикации No. WO 97/30148 описан конъюгат полипептида с уменьшенной аллергенностью, который содержит одну полимерную молекулу-носитель, имеющую две или более полипептидных молекул, связанных ковалентно друг с другом.
В PCT публикации No. WO 96/17929 описан способ получения полипептидов с уменьшенной аллергенностью, включающий стадию конъюгации 1-30 полимолекул с исходным полипептидом.
В PCT публикации No. WO 92/10755 описан способ получения вариантов белков, индуцирующих уменьшенную иммуногенную реакцию у животных. В этой заявке представляющие интерес белки, ряд протеаз и их вариантов использовали для иммунизации крыс. Сыворотки от данных крыс использовали затем для измерения реактивности поликлональных антител, уже продуцированных и присутствующих в иммунизированных сыворотках, к представляющему интерес белку и его вариантам. Из этих результатов можно было определить, были ли антитела в препарате сравнительно более или менее реактивными с белком и его вариантами, что делало возможным анализ того, какие изменения в белке, вероятно, должны нейтрализовать или уменьшать способность Ig к связыванию. Из испытаний на крысах был сделан вывод, что изменение любого из 309 остатков субтилизина, соответствующих положениям 127, 128, 129, 130, 131, 136, 151, 152, 153, 154, 161, 162, 163, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 186, 193, 194, 195, 196, 197, 247, 251, 261, будет приводить к изменению иммунологического потенциала.
В PCT публикации No. WO 94/10191 описаны низкоаллергенные белки, содержащие олигомерные формы исходного мономерного белка, где данный олигомер по существу сохранял его активность.
В PCT публикации No. WO 99/49056 описано множество вариантов субтилизина, имеющих аминокислотные замены в определенном участке эпитопа. Однако из-за большого числа описанных вариантов специалист в данной области поставлен перед проблемой идентификации оптимального протеазного продукта для личной гигиены или других применений у людей, который имеет пониженное иммуногенное действие.
В PCT публикации No. WO 01/07578 описано множество вариантов субтилизина, имеющих аминокислотные замены в определенных участках эпитопа. Однако из-за большого числа описанных вариантов специалист в данной области поставлен перед проблемой идентификации оптимального протеазного продукта для личной гигиены или других применений у людей, который имеет пониженное иммуногенное действие.
Хотя некоторые исследования обеспечили способы уменьшения аллергенности некоторых белков и идентификации эпитопов, которые вызывают аллергические реакции у некоторых индивидуумов, анализы, используемые для идентификации таких эпитопов, обычно включают измерение антител IgE и IgG в сыворотках крови, перед воздействием антигена. Однако инициирование Ig-реакции свидетельствует о произошедшей сенсибилизации. Поэтому существует необходимость идентификации белков, которые вызывают усиленную иммунологическую реакцию, и необходимость получения белков, которые вызывают уменьшенную иммунологическую реакцию. Данное изобретение удовлетворяет эти и другие потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Способы и композиции, представленные в данном изобретении, могут быть использованы для получения гипоаллергенных композиций. Как используется в данном описании, "гипоаллергенная" означает, что композиция вызывает меньшую иммуногенную реакцию, чем та же самая композиция, с предшественниками белков данного изобретения. Как используется в данном описании, "гипераллергенная" означает, что композиция вызывает более сильную иммуногенную реакцию, чем та же самая композиция, с предшественниками белков данного изобретения.
Композиции данного изобретения могут быть воплощены, например, в очищающих композициях, продуктах гидролиза пептидов, косметических формах, композициях для ухода за кожей, волосами и полостью рта, фармацевтических продуктах, таких как продукты для удаления сгустков крови, продуктов для исследований, таких как ферменты и терапевтические агенты, в том числе вакцины.
В одном аспекте данного изобретения отобрана и представлена представляющая интерес протеаза. Представляющая интерес протеаза предпочтительно является протеазой, имеющей Т-клеточный эпитоп, и затем варьируется, как описано ниже. Однако представляющая интерес протеаза может быть также выбрана на основе природных свойств и быть неизмененной.
В одном аспекте данного изобретения представлен вариант представляющей интерес протеазы, содержащий Т-клеточный эпитоп. Данный вариант отличается от представляющей интерес протеазы тем, что он имеет измененный Т-клеточный эпитоп, так что указанный вариант и указанная представляющая интерес протеаза вызывают различные (например, увеличенную, уменьшенную или устраненную) иммуногенные реакции у человека.
Протеазой может быть любая представляющая интерес протеаза. В одном аспекте протеаза является протеазой субтилизина. В предпочтительных вариантах представляющая интерес протеаза и вариант указанной представляющей интерес протеазы обладают, по меньшей мере, частью той же самой активности. Например, если представлен вариант протеазы, указанный вариант будет вызывать измененную иммуногенную реакцию, но будет сохранять детектируемую и предпочтительно сравнимую активность и стабильность протеазы.
Если представлен вариант представляющей интерес протеазы, Т-клеточный эпитоп может быть изменен рядом путей, в том числе аминокислотными заменами, делециями, добавлениями и их комбинациями. Предпочтительно, Т-клеточный эпитоп изменен таким образом, что он содержит аминокислотные замены. В одном описываемом в данном описании варианте аминокислотные замены произведены в отношении соответствующих аминокислот гомолога представляющей интерес протеазы, где гомолог не содержит тот же самый Т-клеточный эпитоп в соответствующем положении, что и представляющая интерес протеаза. В одном аспекте концевая часть представляющей интерес протеазы, содержащая, по меньшей мере, один Т-клеточный эпитоп, заменена соответствующей концевой частью гомолога представляющей интерес протеазы, где данная замена вызывает указанную отличающуюся иммуногенную реакцию.
В другом варианте осуществления представлены нуклеиновые кислоты, кодирующие протеазы, вызывающие желательную иммуногенную реакцию. Кроме того, изобретение включает экспрессирующие векторы и клетки-хозяева, содержащие представленные в данном описании нуклеиновые кислоты. После идентификации протеаз настоящего изобретения и их вариантов могут быть идентифицированы и представлены в данном описании по существу гомологичные последовательности данных протеаз и их вариантов или последовательности, которые гибридизуются с данными протеазами и вариантами. Термин "гомологичные" определяется дополнительно ниже и может относиться к сходству или идентичности, причем термин идентичность является предпочтительным. Предпочтительно, гомологичные последовательности являются аминокислотными последовательностями или нуклеиновыми кислотами, кодирующими пептиды, обладающие активностью представленных в данном описании протеаз и их вариантов.
Еще в одном аспекте данного изобретения представлена протеаза, имеющая измененную иммуногенную реакцию. В одном варианте представляющая интерес протеаза или ее вариант содержит эпитоп, определяемый способом данного изобретения, который включает (а) получение из единственного источника крови раствора дендритных клеток и раствора "наивных" CD4+ и/или CD8+ Т-клеток; (b) стимуляцию дифференцировки в указанном растворе дендритных клеток; (с) объединение указанного раствора дифференцированных дендритных клеток и указанных "наивных" CD4+ и/или CD8+ Т-клеток с указанным белком; и (d) измерение пролиферации Т-клеток в указанной стадии (с).
Было обнаружено, что сериновые протеазы, обычно известные как субтилизины, в том числе субтилизин BPN', имеют выступающие участки эпитопов в положении аминокислот 70-84, первом участке эпитопа, и 109-123, втором участке эпитопа, соответствующем BPN'. Такой субтилизин был генетически переконструирован для изменения, например, для ослабления иммунологических свойств, приписываемых этим участкам эпитопов. Таким образом, были обнаружены субтилизины, которые индуцируют уменьшенную иммунологическую реакцию при сохранении их активности эффективных протеаз. Кроме того, были обнаружены субтилизины, которые индуцируют такую уменьшенную иммунологическую реакцию и являются термо- и рН-стабильными. Таким образом, данные протеазы пригодны для применения в нескольких типах композиций, включающих, но не ограничивающихся ими, фармацевтические композиции, моющие композиции для стирки, композиции для мытья посуды, твердой поверхности, для ухода за кожей, ухода за волосами, косметического ухода, ухода за полостью рта и композиции для контактных линз.
Было обнаружено, что сериновые протеазы, обычно известные как субтилизины, в том числе субтилизин BPN', имеют выступающие участки эпитопов в положении аминокислот 70-84, первом участке эпитопа, и 109-123, втором участке эпитопа, соответствующем BPN'. Такой субтилизин был генетически переконструирован для изменения, например, для ослабления иммунологических свойств, определяемых данными участками эпитопов. Таким образом, были обнаружены субтилизины, которые индуцируют уменьшенную иммунологическую реакцию при сохранении их активности эффективных протеаз. Кроме того, были обнаружены субтилизины, которые индуцируют такую иммунологическую реакцию и являются термо- и рН-стабильными. Таким образом, данные протеазы пригодны для применения в нескольких типах композиций, включающих, но не ограничивающихся ими, фармацевтические композиции, моющие композиции для стирки, композиции для мытья посуды, твердой поверхности, для ухода за кожей, ухода за волосами, косметического ухода, ухода за полостью рта и композиции для контактных линз.
В одном варианте осуществления были обнаружены варианты представляющей интерес протеазы, причем указанный вариант отличается от представляющей интерес протеазы тем, что он имеет измененный Т-клеточный эпитоп, так что данный вариант и представляющая интерес протеаза вызывают различные иммуногенные реакции у человека. Представляющий интерес Т-клеточный эпитоп включает замену положений аминокислотных остатков, выбранных из положений, состоящих из остатков, соответствующих остаткам 76, 79 и 122 субтилизина Bacillus amyloliquefaciens. В другом варианте представляющая интерес Т-клетка включает положение аминокислотного остатка, выбранное из группы, состоящей из положений 76 и 122. В другом варианте представляющая интерес Т-клетка включает замену положения аминокислотного остатка в положении 122 и в одном или обоих положениях 76 и 79. Иммуногенная реакция, вызываемая данным вариантом, в одном варианте осуществления изобретения, является меньшей, чем иммуногенная реакция, вызываемая представляющей интерес протеазой. В другом варианте изобретения иммуногенная реакция, вызываемая данным вариантом, является более высокой, чем иммуногенная реакция, вызываемая представляющей интерес протеазой. Могут быть также включены дополнительные замены в одном или более из положений 3, 31, 40, 41, 111, 147, 218, 206 и/или 217. Могут быть также включены дополнительные замены в одном или более из положений 216, 181, 101, 215, 216, 217, 247, 46, 154, 128, 182, 107, 250, 254, 258, 50, 47, 48, 182, 183, 185, 248 и/или 262. Были также обнаружены специфические наборы замен, включающие различные пермутации указанных выше остатков.
В другом варианте разработан способ уменьшения иммуногенной реакции протеазы, включающий получение протеазы-предшественника; и получение варианта указанной протеазы-предшественника, причем данный вариант имеет, по меньшей мере, один Т-клеточный эпитоп протеазы-предшественника, где данный вариант проявляет измененную иммуногенную реакцию, которая отличается от иммуногенной реакции протеазы-предшественника.
В другом варианте выделена нуклеиновая кислота, кодирующая заявляемые вариантные протеазы, экспрессирующие векторы, клетки-хозяева, трансформированные экспрессирующими векторами, очищающие композиции, композиции для очистки полости рта, фармацевтические композиции и композиции для ухода за кожей (включающие косметически приемлемые носители, активные ингредиенты для ухода за кожей, влагоудерживающие агенты, смягчающие агенты, эмульгаторы, полимерные загущающие агенты и силиконовые масла).
Другие аспекты данного изобретения будут понятными специалисту в данной области из следующего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1А, 1B-1, 1В-2 иллюстрируют последовательность ДНК (SEQ ID:NO 1) и последовательность аминокислот (SEQ ID:NO 2) для субтилизина Bacillus amyloliquefaciens (BPN') и частичную рестрикционную карту этого гена.
Фиг.2 иллюстрирует консервативные аминокислотные остатки субтилизинов Bacillus amyloliquefaciens (SEQ ID:NO 3) и Bacilluslentus (дикого типа) (SEQ ID:NO 4).
Фиг.3А и 3В иллюстрируют сопоставление аминокислотной последовательности протеаз типа субтилизина Bacillusamyloliquefaciens (BPN'), Bacillussubtilis, Bacilluslicheniformis (SEQ ID:NO 5) и Bacillus lentus. Символ * обозначает отсутствие конкретных аминокислотных остатков в сравнении с субтилизином BPN'.
Фиг.4А иллюстрирует аминокислотную последовательность протеазы-предшественника Р1.
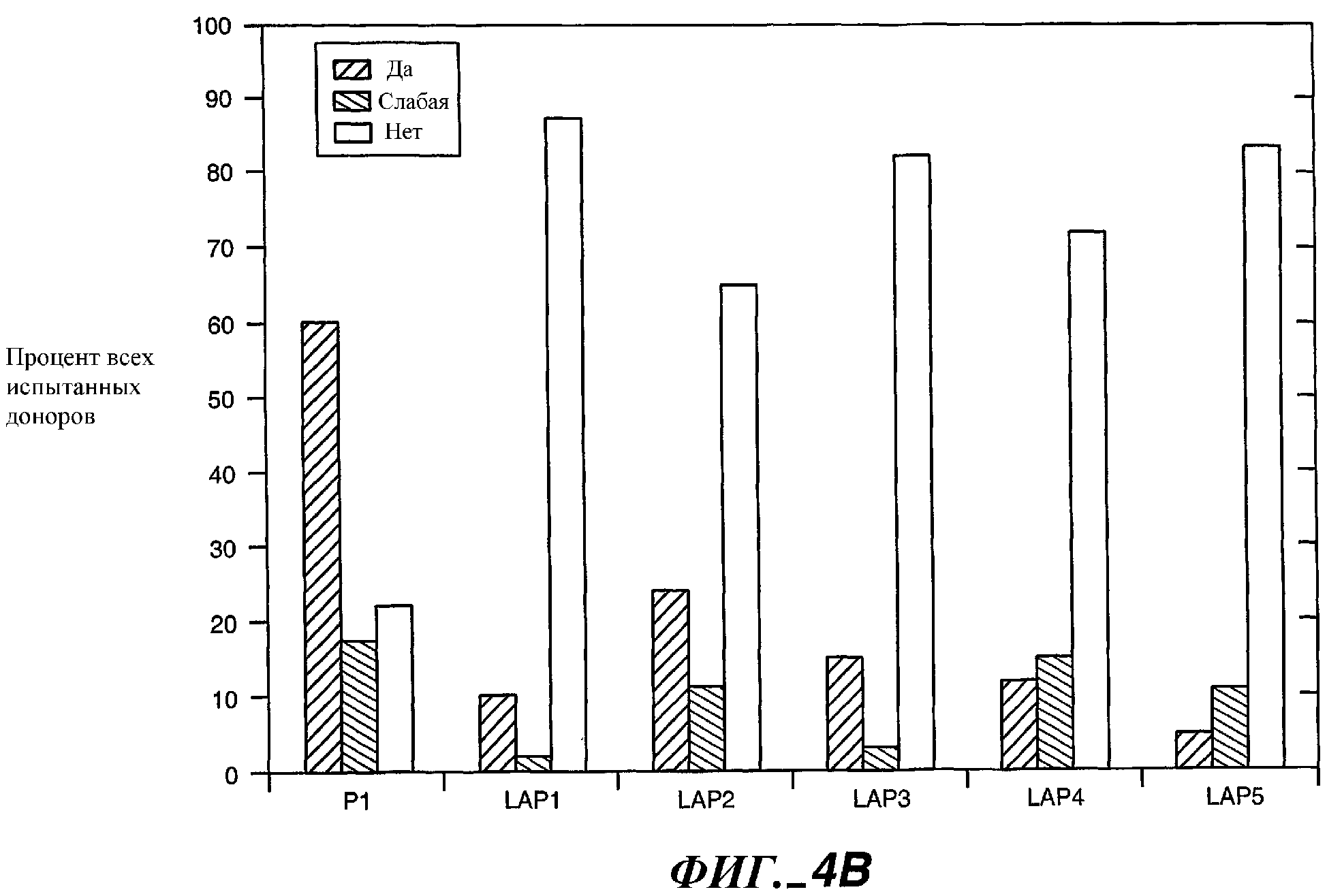
Фиг.4B иллюстрирует ответную реакцию in vitro на белковый вариант Р1 субтилизина (BPN'-Y217L) в сравнении с вариантами LAP2 (BPN'-Y217L/I79A/I122A), LAP3 (BPN'-Y217L/N76D/I122A) и LAP4 (BPN'-Y217L/N76D/I79A/I122A).
Фиг.4B иллюстрирует процент респондеров на пептид 70-84 BPN' и различные варианты (n = 20).
Фиг.5 иллюстрирует индекс стимуляции (SI) респондеров на сайт остатков 109-123 Р1 (BPN'-Y217L).
Фиг.6 иллюстрирует 13 пептидных последовательностей, имеющих различные замены аланином в эпитопе, простирающемся от остатка 109 до остатка 123, используемых для определения измененной иммуногенной реакции субъектов-людей на рассматриваемые пептиды.
Фиг.7 иллюстрирует индекс стимуляции (SI) пяти субъектов-людей, подвергнутых действию синтезированных содержащих аланиновые замены пептидов фиг. 6.
Фиг.7А иллюстрирует SI нескольких субъектов-людей, подвергнутых действию пептидных последовательностей фиг. 6.
Фиг.7B иллюстрирует реакции иммунизированных Р1 в квасцах самок мышей HLA-DR3/DQ2 на Р1.
Фиг.7С иллюстрирует реакции иммунизированных Р1 в квасцах самцов мышей HLA-DR3/DQ2 на Р1.
Фиг.8 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 5,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -◇-; -

Фиг.9 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 6,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -◇-; -

Фиг.10 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 7,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -◇-; -

Фиг.11 иллюстрирует гидролиз раствора 5 мг/мл субстрата диметилказеина при рН 8,5, показанный изменением оптической плотности субстрата, различными концентрациями вариантов субтилизина (Р1 -◇-; -

Фиг.12 иллюстрирует гидролиз раствора 5 мг/мл субстрата бычьего коллагена при различных рН (5,5-8, 5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -◇-; -

Фиг.13 иллюстрирует гидролиз раствора 5 мг/мл субстрата эластина при различных рН (5,5-8,5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -◇-; -

Фиг.14 иллюстрирует гидролиз раствора 5 мг/мл субстрата бычьего кератина при различных рН (5,5-8,5), показанный изменением оптической плотности субстрата, различными вариантами субтилизина (Р1 -◇-; -

Фиг.15 иллюстрирует изменение периода полужизни фермента на протяжении диапазона температур 42-56°С как меры термостабильности различных вариантов протеазы в 50 мМ PIPES (рН 6,5) (Р1 -◇-; -

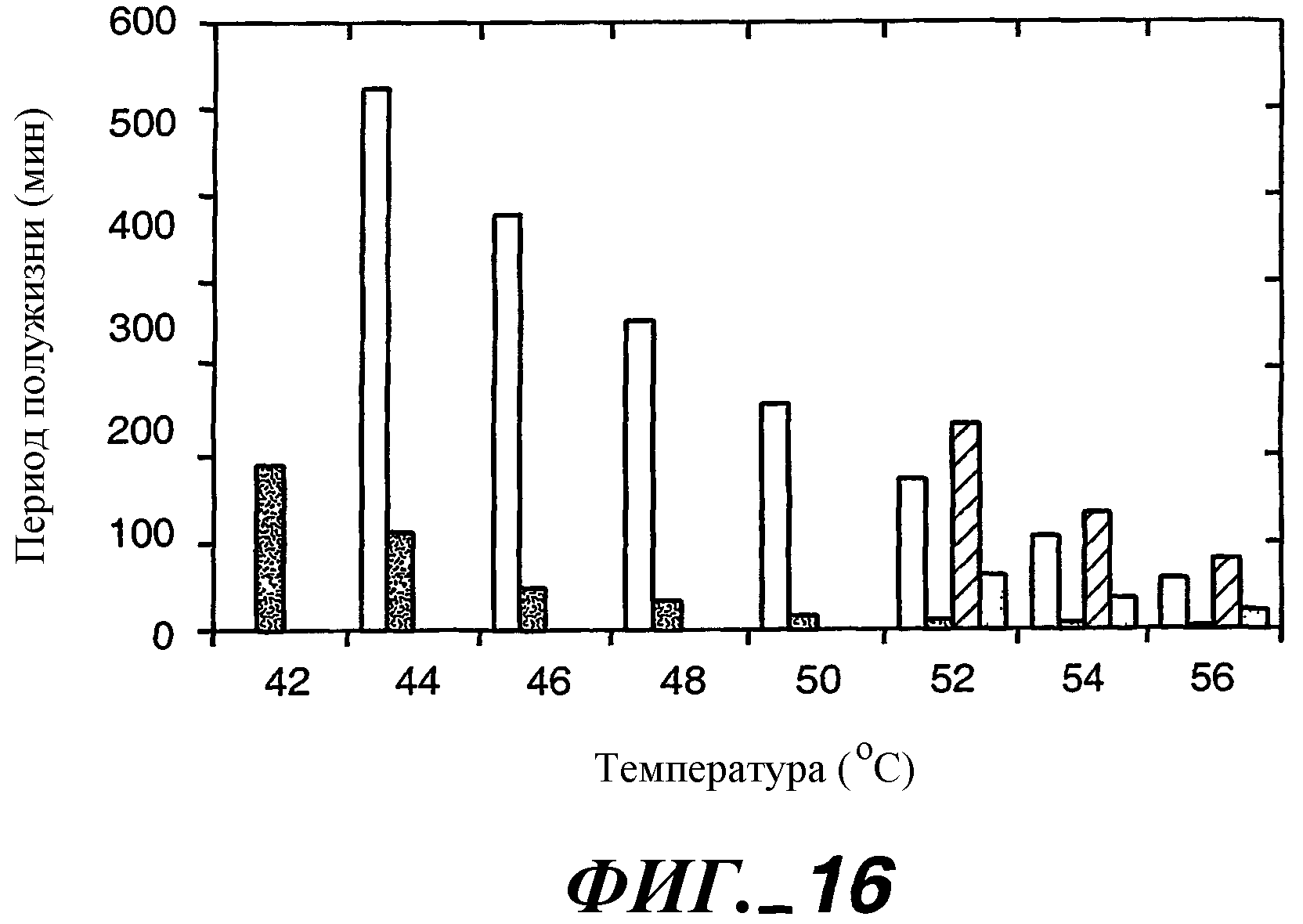
Фиг.16 иллюстрирует изменение периода полужизни фермента на протяжении диапазона температур 42-56°С как меры термостабильности различных вариантов протеазы в 50 мМ TES (рН 7,5) (Р1 -◇-; -

ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте данного изобретения целью является представление варианта протеазы с измененной иммуногенной реакцией и аллергенным потенциалом в сравнении с протеазой-предшественником или представляющей интерес протеазой, так как уменьшение такого потенциала делает возможным более безопасное применение фермента. Хотя данное изобретение применимо для изменения потенциала иммуногенной реакции, описываемые мутации могут быть использованы в комбинации с мутациями, известными в данной области для получения измененной термостабильности и/или измененной субстратной специфичности, модифицированной активности, увеличенной удельной активности, измененной устойчивости к щелочи или измененного В-клеточного эпитопа, в сравнении с предшественником.
Согласно данному изобретению представлен вариант протеазы с измененной иммуногенной реакцией, причем данный вариант содержит Т-клеточный эпитоп, где вариант представляющего интерес пептида отличается от пептида-предшественника или представляющего интерес пептида тем, что он имеет измененный Т-клеточный эпитоп, так что представляющий интерес вариант пептида вызывает отличные иммуногенные реакции у человека. Было предположено, что измененная иммуногенная реакция включает измененную аллергенность, включающую как увеличенную, так и уменьшенную иммуногенную реакцию. Т-клеточный эпитоп может включать замену аминокислоты, выбранной из остатков в идентифицированном эпитопе. Вариант протеазы данного изобретения, включающий такие замены с уменьшением иммуногенной реакции, может характеризоваться активностью, сравнимой с активностью протеазы-предшественника, сайт-направленных мутационных вариантов, которые не вызывают иммуногенной реакции, или гибридных вариантов протеазы.
Таким образом, данное изобретение включает также способ изменения, например, увеличения или уменьшения иммуногенной реакции протеазы, включающий: получение протеазы-предшественника и модификацию протеазы-предшественника для получения варианта или производного указанной протеазы-предшественника, причем данный вариант имеет, по меньшей мере, один измененный Т-клеточный эпитоп протеазы-предшественника. Кроме того, данный вариант отличается проявлением измененной иммуногенной реакции, которая отличается от иммуногенной реакции протеазы-предшественника. Как описано в другом месте данной заявки, имеются, по меньшей мере, два Т-клеточных эпитопа в субтилизиновых протеазах, первый эпитоп, соответствующий остаткам 70-84 Bacillusamyloliquefaciens, и второй эпитоп, соответствующий остаткам 109-123 Bacillus amyloliquefaciens. Способ может дополнительно включать определение остатков, которые увеличивают или уменьшают такую иммуногенную реакцию. Такие остатки могут быть определены способами скрининга пептидов, описанными в другом месте данной заявки. В одном варианте данный вариант протеазы содержит аминокислотную замену в группе положений, соответствующих положениям аминокислот 76, 79 и 122 Bacillus amyloliquefaciens, причем указанные замены находятся, по меньшей мере, в одном из указанных эпитопов. Полученный вариант проявляет измененную иммуногенную реакцию в сравнении с иммуногенной реакцией протеазы-предшественника.
Понятно, что термины белок, полипептид и пептид используются в данном описании иногда взаимозаменяемо. Специалист в данной области сможет понять, когда пептид является частью белка, по контексту, в котором используется данный термин.
В одном варианте пептид, имеющий измененную иммуногенную реакцию, например, увеличенную или уменьшенную иммуногенную реакцию, получают из представляющей интерес протеазы. Представляющая интерес протеаза может быть протеазой дикого типа, мутированным вариантом, конъюгированным вариантом, гибридным вариантом, имеющим делеции, замены или добавления аминокислот в представляющем интерес эпитопе, который может вызывать сенсибилизацию у индивидуума или в выборке индивидуумов. Эпитоп может быть идентифицирован при помощи анализа, который идентифицирует эпитопы и не-эпитопы, следующим образом: дифференцированные дендритные клетки объединяют с "наивными" CD4+ и/или CD8+ Т-клетками и с представляющим интерес пептидом. Более конкретно, может быть представлен представляющий интерес пептид с уменьшенной иммуногенной реакцией, в котором Т-клеточный эпитоп распознается с использованием способа, включающего стадии: (а) получения из единственного источника крови раствора дендритных клеток и раствора "наивных" CD4+ и/или CD8+ Т-клеток; (b) стимуляции дифференцировки в указанном растворе дендритных клеток; (с) объединения указанного раствора дифференцированных дендритных клеток и указанных "наивных" CD4+ и/или CD8+ Т-клеток с представляющим интерес пептидом; и (d) измерения пролиферации Т-клеток в указанной стадии (с).
В варианте данного изобретения получают ряд пептидных олигомеров, которые соответствуют всей представляющей интерес протеазе или ее части. Например, получают пептидную библиотеку, охватывающую соответствующую часть белка или весь белок. В одном варианте способ получения пептидов заключается во введении перекрывания в пептидную библиотеку, например, с получением первого пептида, соответствующего аминокислотной последовательности 1-10 рассматриваемого белка, второго пептида, соответствующего аминокислотной последовательности 4-14 рассматриваемого белка, третьего пептида, соответствующего аминокислотной последовательности 7-17 рассматриваемого белка, четвертого пептида, соответствующего аминокислотной последовательности 10-20 рассматриваемого белка, и т.д., пока не будут созданы репрезентативные пептиды, соответствующие всей молекуле. Анализом каждого из данных пептидов индивидуально в представленном в данном описании анализе можно точно идентифицировать местоположение эпитопов, распознаваемых Т-клетками. В приведенном выше примере более высокая реакция одного конкретного пептида, чем реакция его соседних пептидов, будет облегчать идентификацию якорного участка эпитопа до трех аминокислот. После определения местоположения эпитопов можно изменять аминокислоты в каждом эпитопе, пока данный пептид не станет вызывать отличающуюся Т-клеточную реакцию в сравнении с исходным белком. Кроме того, могут быть идентифицированы белки, которые имеют желательную низкую силу Т-клеточного эпитопа, которые могут быть использованы в их природных формах.
"Антигенпрезентирующая клетка", как используется в данном описании, является клеткой иммунной системы, которая презентирует антиген на ее поверхности, который распознается рецепторами на поверхности Т-клеток. Примерами антигенпрезентирующих клеток являются дендритные клетки, смыкающиеся клетки (клетки с дендритной морфологией, находящейся в тимусзависимой области лимфатических узлов), активированные В-клетки и макрофаги.
"Т-клеточная пролиферация", как используется в данном описании, означает число Т-клеток, продуцируемых во время инкубирования Т-клеток с антигенпрезентирующими клетками, с антигеном или без антигена.
"Т-клеточная фоновая пролиферация", как используется в данном описании, означает Т-клеточную пролиферацию, которая обычно наблюдается у индивидуума в ответ на воздействие антигенпрезентирующих клеток в отсутствие пептидного или белкового антигена. Для преследуемых в данном изобретении целей уровень фоновой Т-клеточной пролиферации определяли в расчете на пробу для каждого индивидуума в виде пролиферации Т-клеток в ответ на антигенпрезентирующие клетки в отсутствие антигена.
"Т-клеточный эпитоп" означает признак пептида или белка, который распознается рецептором Т-клеток в инициации иммунологической реакции на пептид, содержащий антиген. Считается, что распознавание Т-клеточного эпитопа Т-клеткой происходит посредством механизма, в котором Т-клетки распознают пептидные фрагменты антигенов, которые связаны с молекулами главного комплекса гистосовместимости (МНС) класса I или класса II, экспрессируемыми на антигенпрезентирующих клетках (см., например, Moeller, G. ed., "Antigenic Requirements for Activation of MHC-Restricted Responses", ImmunologicalReview, Vol. 98, p. 187 (Copenhagen; Munksgaard) (1987)).
"Проба" в данном контексте обозначает мононуклеарные клетки, которые являются "наивными", т.е. несенсибилизированными к рассматриваемому антигену.
"Гомолог", как используется в данном описании, означает белок или фермент, который имеет сходные каталитическое действие, структуру и/или использование с представляющим интерес белком. Для целей данного изобретения гомолог и представляющий интерес белок не являются обязательно эволюционно родственными, например, одним и тем же функциональным белком из различных видов. Желательно найти гомолог, который имеет третичную и/или первичную структуру, сходную с представляющим интерес белком, так как замена эпитопа в представляющем интерес белке аналогичным сегментом из данного гомолога будет уменьшать разрушаемость такого изменения. Таким образом, близко гомологичные ферменты будут обеспечивать наиболее желательный источник эпитопных замен. Альтернативно, если это возможно, предпочтительно рассматривать человеческие аналоги для конкретного белка. Например, замена специфического эпитопа в бактериальном субтилизине последовательностью из человеческого аналога субтилизина (например, субтилизина человека) должна приводить к уменьшенной иммуногенной реакции в бактериальном белке.
"Аналогичная" последовательность может быть определена обеспечением того, что аминокислоты замены обнаруживают сходные функцию, третичную структуру и/или консервативные остатки относительно аминокислот в представляющем интерес белке в эпитопе или вблизи от эпитопа. Таким образом, где эпитоп содержит, например, альфа-спираль или структуру бета-складки, аминокислоты замены должны сохранять эту специфическую структуру.
Затем определенные или идентифицированные эпитопы могут быть модифицированы для изменения, например увеличения или уменьшения, иммунологического потенциала представляющего интерес белка. В одном варианте эпитоп, подлежащий модификации, вызывает более чем трехкратный уровень фоновой пролиферации Т-клеток в пробе. После модификации этот эпитоп вызывает меньшую, чем трехкратная фоновая, пролиферацию, предпочтительно меньшую, чем двукратная фоновая, пролиферацию, и наиболее предпочтительно, меньшую, чем фоновая, пролиферацию или пролиферацию, равную фоновой пролиферации. В другом варианте подлежащий модификации эпитоп вызывает уровень пролиферации Т-клеток, в три раза меньший, чем фоновая пролиферация Т-клеток в пробе. После модификации этот эпитоп вызывает большую, чем трехкратная фоновая, пролиферацию, предпочтительно большую, чем двукратная фоновая, пролиферацию, и наиболее предпочтительно пролиферацию, большую, чем фоновая пролиферация, или равную фоновой пролиферации.
Эпитоп может быть модифицирован различными путями, например: (а) аминокислотная последовательность эпитопа может быть заменена аналогичной последовательностью человеческого гомолога представляющего интерес белка; (b) аминокислотная последовательность эпитопа может быть заменена аналогичной последовательностью не-человеческого гомолога представляющего интерес белка, которая вызывает меньшую иммуногенную, например аллергенную, реакцию вследствие распознавания Т-клеточного эпитопа, чем последовательность представляющего интерес белка; (с) аминокислотная последовательность эпитопа может быть заменена последовательностью, которая по существу имитирует признаки основной третичной структуры эпитопа, но которая вызывает меньшую иммуногенную, например аллергенную, реакцию вследствие узнавания Т-клеточного эпитопа, чем последовательность представляющего интерес белка.
Специалисту в данной области должно быть понятно, что эпитопы могут быть модифицированы и другими путями в зависимости от желаемого результата. Например, если желательным является аутоиммунная реакция против аутологичного антигена, предполагается, что аминокислотная последовательность эпитопа будет заменяться аминокислотами, которые уменьшают или вызывают смещение в воспалительной или другой иммунной реакции.
Данное изобретение охватывает все белки, иммуногенную реакцию против которых желательно модулировать. Специалисту в данной области будет понятно, что белки и пептиды данного изобретения не должны быть обязательно природными белками и пептидами. Действительно, в одном варианте данного изобретения рассматриваются подвергнутые перетасовке гены, обладающие измененной иммунологической реакцией. В отношении описания перетасовки генов и экспрессии таких генов см. Stemmer, Proc. Natl. Acad. Sci. USA 91:10747 (1994); Patten, et al., Current Opinion in Biotechnol. 8:724 (1997); Kuchner & Arnold, Trends Biotechnol. 15:523 (1997; Moore, et al., J. Mol. Biol. 272:336 (1997); Zhao, et al., Nature Biotechnol. 16:258 (1998); Giver, et al., Proc. Natl. Acad. Sci. USA 95:12809 (1998); Harayama, Trends Biotechnol. 16:76 (1998); Lin, et al., Biotechnol., Prog. 15:467 (1999) and Sun, J. Comput. Biol. 6:77 (1999). Белки могут быть изменены для модуляции иммунологической реакции на этот белок.
Предпочтительно, протеазы данного изобретения выделяют или очищают. Под очисткой или выделением подразумевается, что протеазу изменяют из ее природного состояния путем отделения протеазы от некоторых или всех природных компонентов, с которыми она связана в природе. Это может выполняться известными в данной области способами разделения, такими как ионообменная хроматография, аффинная хроматография, гидрофобная хроматография, диализ, обработка протеазами, осаждение сульфатом аммония или другое солевое осаждение белков, центрифугирование, гель-фильтрационная хроматография, фильтрация, микрофильтрация, гель-электрофорез или разделение на градиенте для удаления целых клеток, клеточных остатков (дебриса), примесей, посторонних белков или ферментов, нежелательных в конечной композиции. Кроме того, можно затем добавлять к содержащей протеазу композиции компоненты, которые обеспечивают дополнительные полезные качества, например активирующие агенты, агенты против ингибирования, желательные ионы, соединения для регуляции рН или другие ферменты, такие как целлюлаза.
Кроме указанных выше белков и пептидов, данное изобретение включает белки или представляет варианты белков, которые проявляют измененную иммуногенную реакцию, например увеличенную или уменьшенную иммуногенную реакцию. Белки, например протеазы, проявляют увеличенную иммуногенную реакцию, когда Т-клеточная реакция, которую они вызывают, является большей, чем реакция, вызываемая исходным белком (предшественником). Чистым результатом этой более высокой реакции является увеличение количества антител, направленных против варианта белка. Белки проявляют уменьшенную иммуногенную реакцию, когда Т-клеточная реакция, которую они вызывают, является меньшей, чем реакция, вызываемая исходным белком. Чистым результатом этой более низкой реакции является отсутствие антител, направленных против варианта белка.
Примеры анализов, применимых в определении измененной иммуногенной реакции варианта белка, включают, но не ограничиваются ими, анализы in vivo (Т-клеточные реакции мышей HLA-DR3/DQ2 и анализы in vitro реакции (мононуклеарных клеток периферической крови человека (PBMC)) на Протеазу 1 (Р1 является протеазой BPN'-Y217L) и ее вариантов. Анализы in vivo, применимые в определении уменьшенной иммуногенной реакции, включают, но не ограничиваются ими, использование трансгенных мышей, например крыс (Taurog et al., Immunol. Rev., 169:209-223 (1999)), кроликов или свиней. Предпочтительной моделью трансгенных мышей для испытания представляющих интерес модифицированных белков и вариантов in vivo, определяющей уменьшенную иммуногенную реакцию, является модель мышей HLA-DR3/DQ2. Такая мышиная модель экспрессирует гаплотип, в общем обычный для популяции человека. Она экспрессирует HLA-DR3 на В-клетках и макрофагах во вторичных иммунных органах. Она может положительно регулировать экспрессию HLA-DR на активированных Т-клетках аналогичным образом в сравнении с Т-клетками человека. Она экспрессирует HLA-DQ2 при более низких уровнях, чем HLA-DR, что также согласуется с распределением экспрессии для молекул HLA у людей. Показано, что представляющие интерес эпитопы протеазы связываются с HLA-DQ2, при помощи анализов связывания с клеточной поверхностью.
Известны различия между данной мышиной моделью и моделями трансгенных мышей HLA, описанными в литературе. Мыши HLA, используемые в данном изобретении, экспрессируют HLA-DR и -DQ аналогично тому, что наблюдают у людей, то есть экспрессия HLA-DQ является очень низкой и не может положительно регулироваться LPS-опосредованной активацией В-клеток. Это находится в сильном противоречии с ситуацией у других трансгенных животных, которые были выбраны для экспрессии высоких уровней отдельных трансгенов HLA. Такую мышь скрестили с мышью, дефектной по мышиному I-Ab, что подавляет экспрессию эндогенного гетеродимера I-Aab, см. Grusby et al., Proc. Natl. Acad. Sci., 90:3913-3917 (1993), который соответствует DQ человека. Эти мыши продолжают экспрессировать бета-цепь I-E мышиного МНС класса II. Данная молекула может образовывать пару с альфа-цепью HLA-DR с образованием смешанного димера, который, вероятно, экспрессируется при высоких уровнях на антигенпрезентирующих клетках. Известны другие трансгенные мыши HLA, и они могли бы использоваться подобным образом для оценки потенциальных иммунных реакций на гаплотипы класса II, например, см. Herman et al., J. Immunol. 163:6275-6282; Sonderstrup et al., Immunological Reviews 172:335-343 (1999); Taneja and David, Immunological Reviews 169:67-79 (1999).
Кроме изменения, например, увеличивающего или уменьшающего иммуногенную реакцию животного, такого как человек, природных аминокислотных последовательностей, данное изобретение включает снижение иммуногенной реакции мутированного белка, например, белка или протеазы, которая была изменена для изменения функциональной активности белка. Во многих случаях мутация белков, например, для увеличения активности, увеличения термостабильности, увеличения устойчивости к щелочи и/или окислительной стабильности, приводит к включению новых Т-клеточных эпитопов в мутированный белок. Данное изобретение определило присутствие новых Т-клеточных эпитопов и определило аминокислоты-замены, которые будут изменять иммуногенную реакцию мутированного белка.
Хотя данное изобретение включает указанные выше белки и многие другие белки, для простоты далее будут описаны особенно предпочтительные варианты данного изобретения, которые включают модификацию протеазы. Протеазы являются карбонилгидролазами, которые обычно действуют, расщепляя пептидные связи белков или пептидов. Как используется в данном описании, "протеаза" обозначает природную протеазу или рекомбинантную протеазу. Природные протеазы включают, например, α-аминоацилпептидгидролазу, гидролазу пептидиламинокислоты, ациламиногидролазу, серинкарбоксипептидазу, металлокарбоксипептидазу, тиолпротеиназу, карбоксилпротеиназу и металлопротеиназу. Включены серин-, металло-, тиол- и кислые протеазы, а также эндо- и экзопротеазы.
Субтилизины являются бактериальными или грибковыми протеазами, которые обычно действуют, расщепляя пептидные связи белков и пептидов. Как используется в данном описании, "субтилизин" обозначает природный субтилизин или рекомбинантный субтилизин. Известно, что серия природных субтилизинов продуцируется и часто секретируется различными видами микробов. Аминокислотные последовательности членов этой серии являются не полностью гомологичными. Однако субтилизины в данной серии проявляют такой же или схожий тип протеолитической активности. Данный класс сериновых протеаз имеет общую аминокислотную последовательность, определяющую каталитическую триаду, которая отличает их от родственных химотрипсину классу сериновых протеаз. Субтилизины и родственные химотрипсину сериновые протеазы имеют каталитическую триаду, содержащую аспартат, гистидин и серин. В родственных субтилизину протеазах относительный порядок данных аминокислот, при считывании от амино- к карбоксиконцу, является следующим: аспартат-гистидин-серин. Однако, в родственных химотрипсину протеазах относительный порядок является следующим: гистидин-аспартат-серин. Таким образом, субтилизин в данном описании относится к сериновой протеазе, имеющей каталитическую триаду родственных субтилизину протеаз. Примеры включают, но не ограничиваются ими, субтилизины, идентифицированные на Фиг.3 данного описания. Обычно и для целей данного изобретения нумерация аминокислот в протеазах соответствует номерам, характеризующим последовательность зрелого субтилизина Bacillus amyloliquefaciens, приведенную на фиг.1.
Термины "рекомбинантный", "рекомбинантный субтилизин" или "рекомбинантная протеаза" относятся к субтилизину или протеазе, в которых ДНК-последовательность, кодирующая субтилизин или протеазу, модифицирована с получением вариантной (или мутантной) ДНК-последовательности, которая кодирует замену, делецию или инсерцию одной или более аминокислот в природной аминокислотной последовательности. Подходящие способы получения такой модификации, которые могут комбинироваться со способами, раскрытыми в данном описании, включают способы, раскрытые в патенте США 4760025 (US RE 34606), патенте США 5204015 и патенте США 5185258.
"Не-человеческие субтилизины" и кодирующие их ДНК могут быть получены из многих прокариотических и эукариотических организмов. Подходящие примеры прокариотических организмов включают грамотрицательные организмы, такие как E. coli или Pseudomonas, и грамположительные бактерии, такие как Micrococcus или Bacillus. Примеры эукариотических организмов, из которых могут быть получены субтилизины и их гены, включают дрожжи, такие как Saccharomycescerevisiae, грибки, такие как Aspergillus sp.
"Субтилизин человека" означает белки человеческого происхождения, которые обладают каталитической активностью субтилизинового типа, например семейство кексина полученных от человека протеаз. Кроме того, производные или гомологи представленных в данном описании белков, в том числе белков из иных, чем человек, источников, таких как мышь или кролик, которые сохраняют существенную активность пептида, такую как способность гидролизовать пептидные связи и проявлять измененную иммуногенную реакцию, как описано в другом месте данной заявки, и т.д., обладают, по меньшей мере 50%, по меньшей мере 65% и предпочтительно по меньшей мере 80%, более предпочтительно, по меньшей мере 90% и иногда даже 95%, 97% или даже 99% гомологией относительно представляющей интерес протеазы. Существенная активность гомолога включает способность вызывать отличающиеся иммуногенные реакции у человека. В одном варианте представляющая интерес протеаза показана на фиг.4А.
Номера положений аминокислот, используемые в данном описании, относятся к номерам, характеризующим зрелую последовательность субтилизина Bacillus amyloliquefaciens, представленную на фиг.1. Однако изобретение не ограничивается мутацией этого конкретного субтилизина, но распространяется на протеазы-предшественники, содержащие аминокислотные остатки в положениях, которые "эквивалентны" конкретным идентифицированным остаткам в субтилизине Bacillus amyloliquefaciens. Например, если протеазой-предшественником является субтилизин Bacillus lentus, могут быть произведены замены, делеции и/или инсерции в эквивалентном аминокислотном остатке в B. lentus, соответствующем остаткам, перечисленным выше.
Остаток (аминокислота) протеазы-предшественника является эквивалентным остатку субтилизина Bacillus amyloliquefaciens, если он является либо гомологичным (т.е. соответствующим в положении либо первичной, либо вторичной структуры), либо аналогичным специфическому остатку или части этого остатка в субтилизине Bacillus amyloliquefaciens (т.е. имеющим ту же самую или сходную функциональную способность объединяться, реагировать или взаимодействовать химически). "Соответствующий", как используется в данном описании, обычно относится к аналогичному положению в пептиде.
Для установления гомологии относительно первичной структуры, аминокислотную последовательность протеазы-предшественника непосредственно сравнивают с первичной последовательностью субтилизина Bacillus amyloliquefaciens и, конкретно, с серией остатков, о которых известно, что они являются инвариантными в субтилизинах, для которых данная последовательность известна. Например, на фиг.2 показаны консервативные остатки для субтилизина Bacillus amyloliquefaciens и субтилизина B. lentus. После сопоставления консервативных остатков с допущением необходимых инсерций и делеций для поддержания сопоставления (т.е. избегая удаления консервативных остатков посредством произвольной делеции и инсерции) определяют остатки, эквивалентные конкретным аминокислотам в первичной последовательности субтилизина Bacillus amyloliquefaciens. Сопоставление консервативных остатков предпочтительно должно сохранять 100% таких остатков. Однако сопоставление более чем 75% или всего лишь 50% консервативных остатков также является адекватным для определения эквивалентных остатков. Инвариантность каталитической триады, Asp32/His64/Ser221 должна быть сохранена.
Например, аминокислотная последовательность субтилизина Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus licheniformis (carlsbergensis) и Bacillus lentus может быть сопоставлена для обеспечения максимальной величины гомологии между аминокислотными последовательностями. Сравнение этих последовательностей показывает, что имеется ряд консервативных остатков, содержащихся в каждой последовательности. Консервативные остатки, например, между BPN' и B. lentus, идентифицированы на фиг.2.
Таким образом, консервативные остатки могут быть использованы для определения соответствующих эквивалентных аминокислотных остатков субтилизина Bacillus amyloliquefaciens в других субтилизинах, таких как субтилизин Bacillus lentus (РСТ публикация № WO89/06279, опубликованная 13 июля 1989 года), предпочтительный фермент-предшественник протеазы данного изобретения, или субтилизин, называемый РВ92 (ЕР 0328299), который является высоко гомологичным предпочтительному субтилизину Bacilluslentus. Аминокислотные последовательности некоторых из этих субтилизинов сопоставлены на фиг. 3А и 3В с последовательностью субтилизина Bacillus amyloliquefaciens для получения максимальной гомологии консервативных остатков. Как можно видеть, имеется ряд делеций в последовательности Bacillus lentus в сравнении с субтилизином Bacillus amyloliquefaciens. Так, например, эквивалентной аминокислотой для Val165 в субтилизине Bacillus amyloliquefaciens в других субтилизинах является изолейцин для B. lentus и B. licheniformis.
Так, например, аминокислота в положении +170 является лизином (К) в обоих субтилизинах Bacillus amyloliquefaciens и B. licheniformis и аргинином (R) в савиназе. Однако в одном варианте осуществления вариантов протеазы данного изобретения аминокислота, эквивалентная положению +170 субтилизина Bacillus amyloliquefaciens, заменена аспарагиновой кислотой (D). Сокращения и однобуквенные коды для всех аминокислот в данном изобретении соответствуют руководству Patentin User Manual (GenBank, Mountain View, CA) 1990, p.101.
Гомологичные последовательности могут быть также определены с использованием "алгоритма сравнения последовательностей". Оптимальное сопоставление последовательностей для сравнения может быть проведено, например, алгоритмом локальной гомологии Смита-Уотермана, Adv. Appl. Math. 2:482 (1981), алгоритмом сопоставления гомологии Нидлемана-Вунша, J. Mol. Biol. 48:443 (1970), способом поиска сходства Пирсона-Липмана, Proc. Natl. Acad. Sci. USA 85:2444 (1988), компьютеризованными воплощениями этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI) или визуальным обследованием.
Примером алгоритма, который пригоден для определения сходства последовательностей, является алгоритм BLAST, который описан в Altschul, et al., J. Mol. Biol. 215:403-410 (1990). Программное обеспечение для выполнения анализов BLAST является общедоступным через Национальный Центр Информации по Биотехнологии (http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает сначала идентификацию высокобалльных пар последовательностей (HSP) идентификацией коротких слов длины W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительно оцениваемому пороговому баллу Т при сопоставлении со словом той же самой длины в последовательности базы данных. Эти первоначальные хиты (совпадения) соседних слов действуют в качестве стартовых точек для нахождения более длинных HSP, содержащих их. Хиты слов распространяются в обоих направлениях вдоль каждой из двух сравниваемых последовательностей до тех пор, пока может увеличиваться кумулятивный балл сопоставления. Распространение хитов слов останавливают, когда: кумулятивный балл сопоставления падает в Х раз от максимальной достигнутой величины; кумулятивный балл идет к нулю или ниже; или достигается конец любой последовательности. Параметры W, T и Х алгоритма BLAST определяют чувствительность и скорость сопоставления. Программа BLAST использует по умолчанию длину слова (W) 11, сопоставления матрицы оценки BLOSUM62 (см. Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 (1989)) (В) 50, ожидание (Е) 10, M'5, N'-4 и сравнение обеих цепей.
Затем алгоритм BLAST выполняет статистический анализ сходства между двумя последовательностями (см., например, Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787 (1993)). Одной мерой сходства, обеспечиваемой алгоритмом BLAST, является наименьшая вероятность суммы (Р(N)), которая обеспечивает указание вероятности, с которой будет происходить случайным образом совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, аминокислотная последовательность считается сходной с белком, таким как протеаза, если наименьшая вероятность суммы в сравнении тестируемой аминокислотной последовательности с белком, таким как аминокислотная последовательность протеазы, является менее чем приблизительно 0,1, более предпочтительно менее чем приблизительно 0,01 и наиболее предпочтительно менее чем приблизительно 0,001.
"Эквивалентные остатки" могут быть также определены определением гомологии на уровне третичной структуры в отношении белка-предшественника, третичная структура которого была определена рентгеновской кристаллографией. Эквивалентные остатки определяются как остатки, для которых атомные координаты двух или более атомов основной цепи конкретного аминокислотного остатка белка-предшественника, такого как протеаза и субтилизин Bacillus amyloliquefaciens (N на N, СА на СА, С на С и О на О), находятся в пределах 0,13 нм и предпочтительно 0,1 нм после сопоставления. Сопоставление достигается после того, как наилучшая модель ориентирована и помещена для образования максимального перекрывания атомных координат не-водородных атомов белка, такого как рассматриваемая протеаза, с субтилизином Bacillus amyloliquefaciens. Наилучшей моделью является кристаллографическая модель, дающая наименьший фактор R для экспериментальных данных дифракции при наивысшем доступном разрешении.
Эквивалентные остатки, которые являются функционально аналогичными специфическому остатку субтилизина Bacillus amyloliquefaciens, определяются как те аминокислоты белка-предшественника, такого как протеаза, которые могут принимать такую конформацию, что они будут либо изменять, модифицировать, либо вносить вклад в структуру белка, связывание субстрата или катализ таким же образом, который определен и характеризует специфический остаток субтилизина Bacillus amyloliquefaciens. Далее, они являются остатками белка-предшественника, например, протеазы (для которой третичная структура получена рентгеновской хроматографией), которые занимают аналогичное положение до такой степени, что, хотя атомы основной цепи конкретного остатка могут не удовлетворять критериям эквивалентности на основе занятия гомологичного положения, атомные координаты по меньшей мере двух из атомов боковой цепи данного остатка лежат с 0,13 нм соответствующих атомов боковой цепи субтилизина Bacillus amyloliquefaciens. Координаты трехмерной структуры субтилизина Bacillus amyloliquefaciens представлены в публикации ЕРО № 0251446 (эквивалент патента США 5182204, описание которого включено в данное описание в качестве ссылки), и могут быть использованы, как описано в общем виде выше, для определения эквивалентных остатков на уровне третичной структуры.
"Производное" обозначает белок, который получен из белка-предшественника (например, природного белка) добавлением одной или более аминокислот либо к С-концевой, либо к N-концевой стороне, заменой одной или более аминокислот в одном или в ряде различных сайтов в данной аминокислотной последовательности, делецией одной или более аминокислот на одной или обеих сторонах белка или в одном или более сайтах в аминокислотной последовательности, или инсерцией одной или более аминокислот в одном или более сайтах в аминокислотной последовательности. Получение производного протеазы достигается предпочтительно модификацией ДНК-последовательности, которая кодирует природный белок, трансформацией этой ДНК-последовательности в подходящий хозяин и экспрессией модифицированной ДНК-последовательности с образованием производного протеазы.
Производное протеазы данного изобретения включает пептиды, содержащие измененные аминокислотные последовательности в сравнении с аминокислотной последовательностью-предшественником (например, протеазы дикого типа или протеазы в природном состоянии), которые сохраняют характерную протеазную природу протеазы-предшественника, но которые имеют измененные свойства в некотором специфическом аспекте. Например, производное протеазы может иметь увеличенный оптимум рН или увеличенную температурную или окислительную стабильность, но будут сохранять его характерную субстратную активность. Подобным образом, производные в соответствии с данным изобретением включают домен связывания кальция, который был либо добавлен, либо удален или модифицирован таким образом, что это существенно ухудшает или усиливает его способность связывать кальций. Подобным образом, каталитический протеолитический домен может быть либо добавлен, либо удален, либо модифицирован для функционирования в сочетании с протеазой. Предполагается, что производные в соответствии с данным изобретением могут быть получены из ДНК-фрагмента, кодирующего производное протеазы, где функциональная активность экспрессируемого производного протеазы сохраняется. Подходящие способы такой модификации ДНК-последовательности-предшественника включают раскрытые в данном описании способы, а также способы, известные специалистам в данной области (см., например, ЕР0328299, WO89/06279 и патенты и заявки США, на которые ссылаются в данном описании). Некоторые из остатков, идентифицированных для замены, инсерции или делеции, являются консервативными остатками, тогда как другие не являются консервативными остатками.
Такая модификация предпочтительно имеет место в "ДНК-последовательности-предшественниках", которая кодирует аминокислотную последовательность фермента-предшественника, но может быть следствием манипуляции с белком-предшественником. Примеры ДНК-последовательности-предшественника включают, но не ограничиваются ими, BPN' и BPN'-Y217L. В случае остатков, которые не являются консервативными, замена одной или более аминокислот ограничена заменами, которые обусловливают получение варианта, имеющего аминокислотную последовательность, которая не соответствует последовательности, обнаруженной в природе. В случае консервативных остатков такие замены не должны приводить к природной последовательности. Производное дополнительно включает химическую модификацию для изменения характеристик протеазы.
Выражение "по существу идентичные" в контексте двух нуклеиновых кислот или полипептидов обычно означает, что полинуклеотид или полипептид содержит последовательность, которая обладает, по меньшей мере 60% идентичностью последовательности, предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 90%, еще более предпочтительно 95% и иногда даже 97% идентичностью, в сравнении со ссылочной последовательностью при использовании описанных выше программ (например, BLAST, ALIGN, CLUSTAL) с использованием стандартных параметров. Одним указанием на то, что два полипептида являются по существу идентичными, является то, что первый полипептид является иммунологически перекрестно-реактивным со вторым полипептидом. Обычно, полипептиды, которые отличаются консервативными аминокислотными заменами, являются иммунологически перекрестно-реактивными. Таким образом, полипептид является по существу идентичным второму полипептиду, например, когда два данных пептида отличаются только консервативной заменой. Другим указанием на то, что две последовательности нуклеиновых кислот являются по существу идентичными, является то, что две молекулы гибридизуются друг с другом в жестких условиях (например, в диапазоне среды для высокой жесткости).
"Гибридизация" включает любой процесс, при помощи которого цепь нуклеиновой кислоты соединяется с комплементарной цепью нуклеиновой кислоты посредством спаривания оснований. Таким образом, строго говоря, данный термин относится к способности комплемента последовательности-мишени связываться с тест-последовательностью, или наоборот.
"Условия гибридизации" обычно классифицируют по степени "жесткости" условий, в которых измеряют гибридизацию. Степень жесткости может быть основана, например, на температуре плавления (Tm) связывающего нуклеиновую кислоту комплекса или зонда. Например, "максимальная жесткость" обычно имеет место при приблизительно Tm-5°С (на 5°С ниже Tm данного зонда); "высокая жесткость" при приблизительно 5-10°С ниже данной Tm; "промежуточная жесткость" при приблизительно 10-20°С ниже Tm зонда; и "низкая жесткость" при приблизительно 20-25°С ниже Tm. Альтернативно, или наряду с этим, условия гибридизации могут быть основаны на условиях соли или ионной силы гибридизации и/или одной или более жесткостях промывок. Например, 6х SSC = очень низкая жесткость; 3х SSC = низкая-средняя жесткость; 1х SSC = средняя жесткость и 0,5х SSC = высокая жесткость. Функционально, условия максимальной жесткости могут быть использованы для идентификации последовательностей нуклеиновых кислот, имеющих жесткую идентичность или почти жесткую идентичность с гибридизационным зондом; в то время как условия высокой жесткости используют для идентификации последовательностей нуклеиновых кислот, обладающих приблизительно 80% или большей идентичностью последовательности с зондом.
Вариант протеазы, имеющий измененный эпитоп, может быть использован для получения олигонуклеотидных последовательностей, или праймеры длиной приблизительно 10-30 нуклеотидов могут быть сконструированы из полинуклеотидной последовательности, например праймеры, описанные на фиг.6, и использованы в ПЦР-технологии для выделения природной последовательности или вариантов геномных последовательностей.
Другая общая стратегия для "клонирования" фрагментов геномной ДНК Bacillus subtilis для секвенирования использует обратную ПЦР. Известный участок сканируют на набор подходящих сайтов расщепления рестриктазами и обратную ПЦР выполняют с набором определенных ДНК-праймеров от самой крайней ДНК-последовательности. ДНК-фрагменты из обратной ПЦР непосредственно используют в качестве матрицы в реакции секвенирования. Новообразованные последовательности могут быть использованы для конструирования новых олигонуклеотидов. Новые олигонуклеотиды используют для амплификации ДНК-фрагментов с геномной ДНК в качестве матрицы. Определение последовательности на обеих цепях участка ДНК заканчивают применением стратегии прогулки праймера на геномных ДНК-фрагментах. Преимущество множественных стартовых точек в прогулке праймера происходит из применения серии обратных ПЦР-фрагментов с различными размерами новых "клонированных" кусков ДНК. Новый раунд обратной ПЦР начинается от самой наружной ДНК-последовательности. Полная стратегия обратной ПЦР основана на последовательном применении общепринятой полимеразы taq и применении обратной ПЦР длинного диапазона в тех случаях, в которых полимераза taq не может амплифицировать ДНК-фрагменты. Секвенирование нуклеиновых кислот осуществляют с помощью стандартной технологии. Один способ секвенирования нуклеиновых кислот включает применение ДНК-секвенатора Perkin-Elmer Applied Biosystems 373 (Perkin-Elmer, Foster City, California) в соответствии с инструкциями изготовителя.
Последовательности нуклеиновых кислот, полученные из геномной ДНК, могут содержать регуляторные участки, помимо кодирующих участков. Независимо от источника, выделенный ген МР должен быть молекулярно клонирован в подходящий вектор для размножения гена.
В молекулярном клонировании гена из геномной ДНК получают ДНК-фрагменты, некоторые из которых будут кодировать желательный ген. ДНК может быть расщеплена в специфических сайтах с использованием различных рестриктаз. Альтернативно, можно использовать ДНКазу в присутствии марганца для фрагментирования ДНК, или ДНК может быть физически разрезана, например, с использованием обработки ультразвуком. Затем линейные ДНК-фрагменты могут быть разделены в соответствии с размером стандартными способами, включающими, но не ограничивающимися ими, электрофорез в агарозном или полиакриламидном геле и колоночную хроматографию.
После генерирования ДНК-фрагментов идентификация специфического ДНК-фрагмента, содержащего измененную эпитопную последовательность, может быть выполнена различными путями. Например, олигомер измененного эпитопа гена Bacillus subtilis данного изобретения или его специфической РНК, или его фрагмента, такого как зонд или праймер, может быть выделен и помечен и затем использован в гибридизационных анализах для детектирования эпитопной последовательности с измененной иммуногенной реакцией (Benton, W. and Davis, R., 1977, Science 196:180; Grunstein, M. and Hogness, D., 1975, Proc. Natl. Acad. Sci. USA 72:3961). ДНК-фрагменты, имеющие существенное сходство с зондом, будут гибридизоваться в жестких условиях.
Таким образом, данное изобретение обеспечивает способ детектирования измененных иммуногенных полинуклеотидных гомологов, включающий гибридизацию части или всей последовательности нуклеиновой кислоты эпитопа Bacillus subtilis либо геномного происхождения, либо происходящей из кДНК.
Способ амплификации, проводимый в технологиях полимеразной цепной реакции (ПЦР), описан в Dieffenbach, CW and GS Dveksler, (PCR Primer, a Laboratory Manual, Cold Spring Harbor Press, Plainview, NY, 1995). Последовательность нуклеиновой кислоты, по меньшей мере, из приблизительно 10 нуклеотидов и приблизительно 60 нуклеотидов из МР B. subtilis, предпочтительно приблизительно 12-30 нуклеотидов и более предпочтительно приблизительно 20-25 нуклеотидов, может быть использована в качестве зонда или ПЦР-праймера.
Для применений, требующих высокой селективности, обычно может быть желательным применение относительно жестких условий для образования гибридов, например, могут быть выбраны относительно низкосолевые и/или высокотемпературные условия. Условия гибридизации, в том числе умеренной жесткости и высокой жесткости, описаны в руководстве Sambrook et al., включенном в данное описание в качестве ссылки.
Данное изобретение включает протеазы, имеющие измененную иммуногенность, которые эквивалентны протеазам, которые получены из специфического указанного микробного штамма. Являются "эквивалентными", в данном контексте, означает, что протеазы кодируются полинуклеотидом, способным гибридизоваться с полинуклеотидом, имеющим последовательность, показанную в виде любой последовательности фигур 1А-1С, в условиях средней-высокой жесткости, и все еще сохраняющим измененную иммуногенную реакцию на Т-клетки человека. "Является эквивалентной" означает, что данная протеаза обладает, по меньшей мере 55%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 99% идентичностью с последовательностями эпитопа и вариантами протеазы, имеющими такие эпитопы, например, имеющими аминокислотную последовательность, описанную на фиг.4А, модифицированную, как описано в другом месте данной заявки.
"Гибридные протеазы" или "слитые протеазы" являются белками, сконструированными из, по меньшей мере, двух различных или "исходных" белков, которые являются предпочтительно гомологами друг друга. Например, предпочтительные гибридная протеаза или слитый белок могут иметь N-конец белка и С-конец гомолога белка. В предпочтительном варианте две концевые стороны могут быть объединены, чтобы соответствовать полноразмерному активному белку. В предпочтительном варианте гомологи имеют существенное сходство, но не имеют идентичных Т-клеточных эпитопов. Таким образом, в одном варианте, например, представляющая интерес протеаза, имеющая один или более Т-клеточных эпитопов на С-конце, может иметь С-конец, замененный С-концом гомолога, имеющим менее сильный Т-клеточный эпитоп на С-конце, меньше Т-клеточных эпитопов или может не иметь Т-клеточного эпитопа на С-конце. Таким образом, специалист в данной области поймет, что на основании идентификации Т-клеточных эпитопов среди гомологов можно получить множество вариантов, вызывающих различные иммуногенные реакции. Более того, понятно, что внутренние части и более чем один гомолог, могут быть использованы для получения вариантов данного изобретения.
Пример рассматриваемого данным изобретением гибрида, включал гибрид протеазы, сконструированный с использованием установленных способов конструирования белков. Гибрид конструировали таким образом, что высокоаллергенную аминокислотную последовательность белка заменяли соответствующей последовательностью из менее аллергенного гомолога. В этом случае, первые 122 аминокислоты происходили из GG36, а остальная аминокислотная последовательность происходила из BPN'.
Варианты данного изобретения включают зрелые формы белковых вариантов, а также про- и препроформы таких белковых вариантов. Препроформы являются предпочтительной конструкцией, так как это облегчает экспрессию, секрецию и созревание белковых вариантов.
"Пропоследовательностью" называют последовательность аминокислот, связанную с N-концевой частью зрелой формы белка, которая при удалении приводит к появлению "зрелой" формы белка. Многие протеолитические ферменты обнаружены в природе в виде трансляционных проферментных продуктов и, в отсутствие посттрансляционного процессинга, экспрессируются в таком виде. Предпочтительной пропоследовательностью для продуцирования вариантов белков, таких как варианты протеазы, является предполагаемая пропоследовательность субтилизина Bacillus amyloliquefaciens, хотя могут быть использованы другие пропоследовательности.
"Сигнальной последовательностью" или "препоследовательностью" называют любую последовательность аминокислот, связанную с N-концевой частью белка или с N-концевой частью пробелка, которая может участвовать в секреции зрелой формы или проформы белка. Это определение сигнальной последовательности является функциональным определением, имеющим в виду включение всех аминокислотных последовательностей, кодируемых N-концевой частью гена белка, которые участвуют в выполнении секреции белка в природных условиях. Данное изобретение использует такие последовательности для осуществления секреции вариантов белков, определенных в данном описании. Одна возможная сигнальная последовательность содержит первые семь аминокислотных остатков сигнальной последовательности субтилизина Bacillus subtilis, слитые с остатками сигнальной последовательности субтилизина Bacillus lentus (АТСС 21536).
"Препро"-форма варианта белка состоит из зрелой формы белка, имеющей пропоследовательность, функционально связанную с аминоконцом белка, и "пре" или "сигнальную" последовательность, функционально связанную с аминоконцом пропоследовательности.
"Экспрессирующий вектор" относится к ДНК-конструкции, содержащей ДНК-последовательность, которая функционально связана с подходящей регуляторной последовательностью, способной осуществлять экспрессию указанной ДНК в подходящем хозяине. Такие регуляторные последовательности включают промотор для осуществления транскрипции, необязательную операторную последовательность для регуляции такой транскрипции, последовательность, кодирующую подходящие сайты связывания рибосомы мРНК, и последовательности, которые регулируют терминацию транскрипции и трансляции. Вектор может быть плазмидой, фаговой частицей или просто потенциальной геномной вставкой. После трансформации в подходящий хозяин вектор может реплицироваться и функционировать независимо от генома хозяина или может, в некоторых случаях, интегрироваться в сам геном. В данном описании "плазмида" и "вектор" иногда используются взаимозаменяемо, так как в настоящее время плазмида является наиболее часто используемой формой вектора. Однако предполагается, что данное изобретение включает такие другие формы экспрессирующих векторов, которые выполняют эквивалентные функции и которые являются или становятся известными в данной области.
"Клетки-хозяева" в контексте данного изобретения являются обычно прокариотическими и эукариотическими хозяевами, которые предпочтительно были подвергнуты манипуляциям с использованием способов, описанных в патенте США 4760025 (RE 34606), для придания им неспособности секреции ферментативно активной эндопротеазы. Предпочтительной клеткой-хозяином для экспрессии белка является штамм Bacillus BG2036, который является дефектным по ферментативно активному нейтральному белку и щелочной протеазе (субтилизину). Конструирование штамма BG2036 описано подробно в патенте США 5264366. Другие клетки-хозяева для экспрессии белка включают Bacillus subtilis I168 (также описанный в патенте США 4760026 (RE 34606) и патенте США 5264366, описание которых включено в данное описание в качестве ссылки), а также любой подходящий штамм Bacillus, такой как B. licheniformis, B. lentus и т.д.
Клетки-хозяева трансформируют или трансфецируют векторами, сконструированными с использованием способов рекомбинантных ДНК. Такие способы могут быть найдены в любом руководстве по практике молекулярной биологии, например, Sambrook et al., Molecular Cloning - A Laboratory Manual, (2nd ed.) Vol. 1-3, Cold Spring Harbor Publishing (1989) ("Sambrook") и Current Protocols in Molecular Biology, Ausubel et al., (eds.), Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley and Sons, Inc., (1997 Supplement) ("Ausubel"). Такие трансформированные клетки способны либо реплицировать векторы, кодирующие белковые варианты, либо экспрессировать желательный белковый вариант. В случае векторов, которые кодируют пре- или препро-форму белкового варианта, такие варианты, при экспрессии, обычно секретируются из клетки-хозяина в среду клетки-хозяина.
Термин "функционально связаны", при описании связи между двумя участками ДНК, просто означает, что они являются функционально связанными друг с другом. Например, препоследовательность функционально связана с пептидом, если она функционирует в качестве сигнальной последовательности, участвуя в секреции зрелой формы белка, наиболее вероятно, отщепляя сигнальную последовательность. Промотор функционально связан с кодирующей последовательностью, если он регулирует транскрипцию последовательности; сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен таким образом, чтобы осуществить трансляцию.
Гены, кодирующие природный белок-предшественник, могут быть получены в соответствии с общими способами, известными специалистами в данной области. Данные способы обычно включают синтез меченых зондов, имеющих предположительные последовательности, кодирующие участки представляющего интерес белка, получение геномных библиотек из организмов, экспрессирующих белок, и скрининг библиотек на представляющий интерес ген гибридизацией с зондами. Затем положительно гибридизующиеся клоны картируют и секвенируют.
Ген белка лигируют в подходящую экспрессионную плазмиду. Затем клонированный ген белка используют для трансформации или трансфекции клетки-хозяина для экспрессии гена белка. Данная плазмида может реплицироваться в хозяевах, в том случае, если она содержит хорошо известные элементы, необходимые для репликации плазмиды, или плазмида может быть сконструирована для интеграции в хромосому хозяина. Для эффективной экспрессии гена должны использоваться необходимые элементы, например промотор, функционально связанный с рассматриваемым геном (который может быть представлен в виде собственного гомологичного промотора гена, если он является приемлемым, т.е. транскрибируемым данным хозяином), терминатор транскрипции (участок полиаденилирования для эукариотических клеток-хозяев), который является экзогенным или обеспечивается эндогенным участком терминатора гена белка, и, желательно, селективный ген, такой как ген устойчивости к антибиотику, который позволяет непрерывное поддержание инфицированных плазмидой клеток-хозяев посредством роста в содержащих антибиотик средах.
В одном варианте ген может быть природным геном, таким как ген Bacillus lentus или Bacillus amyloliquefaciens. Альтернативно, может быть получен синтетический ген, кодирующий природный или мутантный белок-предшественник. При таком подходе определяют последовательность ДНК и/или аминокислотную последовательность белка-предшественника. После этого синтезируют множественные, перекрывающиеся синтетические одноцепочечные ДНК-фрагменты, которые при гибридизации и лигировании дают синтетическую ДНК, кодирующую белок-предшественник. Пример конструирования синтетического гена представлен в примере 3 патента США 5204015, описание которого включено в данное описание в качестве ссылки.
После клонирования природного или синтетического гена белка-предшественника предпринимают ряд модификаций для увеличения возможности применения данного гена за пределами синтеза природного белка-предшественника. Такие модификации включают получение рекомбинантных белков, как описано в патенте США 4760025 (RE 34606) и Публикации ЕРО № 0251446, и получение вариантов белков, описанных в данном описании.
Варианты белков могут быть получены большим разнообразием различных способов мутагенеза, хорошо известных специалистам в данной области. Такие способы могут быть найдены в любом лабораторном руководстве по молекулярной биологии, например, Sambrook et al., Molecular Cloning - A Laboratory Manual (2nd ed.), Cold Spring Harbor или Current Protocols in Molecular Biology, Ausubel et al., Greene Publishing Associates, Inc. and John Wiley and Sons. Наборы для мутагенеза также доступны у многих коммерческих поставщиков молекулярной биологии. Известны также способы получения специфических замен в определенных аминокислотах (сайт-направленных), специфических или случайных мутаций в определенном участке гена (участко-специфических) или неспецифического (случайного) мутагенеза по всей длине гена (насыщающего мутагенеза). Сайт-направленный мутагенез одноцепочечной или двухцепочечной ДНК с использованием ПЦР, кассетного мутагенеза, синтеза генов, подверженной ошибкам ПЦР и химического мутагенеза насыщения являются способами, которые можно использовать для получения желаемых вариантов белков. После получения таких вариантов их можно подвергнуть скринингу на желательное свойство (измененное, например, высокое или увеличенное; или низкую или уменьшенную иммуногенную реакцию, увеличенную термостабильность или устойчивость к щелочи и т.д.).
В одном аспекте данного изобретения целью является обеспечение варианта белка, имеющего измененный потенциал иммуногенной реакции в сравнении с белком-предшественником. Хотя данное изобретение применимо для понижения иммуногенной реакции, описанные в данном описании мутации могут быть использованы в комбинации с мутациями, известными в данной области, для получения измененной термостабильности и/или измененной субстратной специфичности, модифицированной активности, улучшенной удельной активности или измененной устойчивости к щелочи в сравнении с предшественником.
Таким образом, данное изобретение относится к изменению способности Т-клеточного эпитопа, который включает положения остатков 109-123 в Bacillus amyloliquefaciens, индуцировать пролиферацию Т-клеток. Кроме того, данное изобретение относится к изменению способности Т-клеточного эпитопа, который включает положения остатков 70-84 в Bacillus amyloliquefaciens, индуцировать пролиферацию Т-клеток. Один предпочтительный вариант данного изобретения предусматривает получение модификации в одном или обоих положениях 79 и 122. Другой вариант изобретения предусматривает получение модификаций в одном или обоих положениях 76 и 122. Еще один вариант содержит модификации в положениях 76, 79 и 122. В комбинации с описанными в настоящее время мутацией (мутациями) в участке, соответствующем аминокислотным остаткам 109-123 и/или 70-84, данное изобретение дополнительно охватывает мутацию (например, замену) в положении 76, необязательно в комбинации с одной или более мутациями, выбранными из группы, состоящей из положений, соответствующих 3, 31, 40, 41, 111, 147, 218, 206 и/или 217.
Варианты данного изобретения охватывают специфические комбинации замененных остатков, соответствующих положениям; 79-122-217, 76-122-217 и 76-79-122-217, необязательно в комбинации с одной или более заменами в представляющей интерес протеазе, эквивалентными заменам, выбранным из группы, состоящей из положений, соответствующих 3, 76, 31, 40, 41, 111, 147, 218, 206 и/или 217 субтилизина Bacillus amyloliquefaciens. Другие варианты включают другие дополнительные замены в одном или более положениях в указанной представляющей интерес протеазе, эквивалентные заменам, выбранным из группы, состоящей из 216, 181, 101, 215, 216, 217, 247, 46, 154, 128, 182, 101, 104, 107, 250, 254, 258, 50, 47, 48, 182, 183, 185, 248 и 262 Bacillusamyloliquefaciens. Такие мутации могут быть использованы, кроме уменьшения аллергенного потенциала варианта белка данного изобретения, для модуляции общей стабильности и/или протеолитической активности фермента.
Более конкретно, эти специфические замены включают N76D, I79T, I79A, I122A и их консервативные замены. Другие варианты данного изобретения рассматривают специфические комбинации замененных остатков, соответствующих положениям: I79A-I122A-Y217L, N76D-I122A-Y217L и N76D-I79A-I122A-Y217L, необязательно вместе с одной или более из следующих замен: S3T; N76D; I31L; P40Q; D41A; I111V; V147P,I; N218S; Q206L и/или L217M. Необязательно, дополнительная замена может быть при одном или более положениях, соответствующих группе положений, состоящей из A216K, D181G, S101V, G215A, A216E, Y217S, R247Y, R247S, R247Q, G46S, S101Q, S154G, G128S, S182T, S101R, Y104W, I107V, L250G, T254G, T254A, G258S, M50A, G47S, A48G, S182R, S183R, Q185A, S101R, S248G и Y262F.
Серии комбинаций, обсуждаемые в данной заявке, включают, но не ограничиваются ими, BPN'-Y217L/I79A; BPN'-Y217L/I79A/I122A; BPN'-Y217L/N76D/I122A; BPN'-Y217L/N76D/I79A/I122A и BPN'-Y217L/N76D. Дополнительные серии комбинаций, обсуждаемых в данной заявке, включают, но не ограничиваются ими, N76D/I79A/I122A/N218S; N76D/I79A/I122A/Q206L;
N76D/I79A/I122A/Q206L/N218S; I79A/I122A/Q206L; I79A/I122A/N218S;
I79A/I122A/P40Q; I79A/I122A/D41A и I79A/I122A/H238Y.
В одном варианте последние серии комбинаций произведены в представляющей интерес протеазе BPN'-Y217L. В другом варианте были сконструированы дополнительные серии комбинаций
Р1-N76D/I79A/I122A/A216K; P1-N76D/I79A/I122A/D181G;
P1-N76D/I79A/I122A/S101V; P1-N76D/I79A/I122A/G215A;
P1-N76D/I79A/I122A/A216E; P1-N76D/I79A/I122A/L217S;
P1-N76D/I79A/I122A/R247Y; P1-N76D/I79A/I122A/R247S;
P1-N76D/I79A/I122A/R247Q; P1-N76D/I79A/I122A/G46S;
P1-N76D/I79A/I122A/S101Q/S154G; P1-N76D/I79A/I122A/G128S;
P1-N76D/I79A/I122A/S182T; P1-N76D/I79A/I122A/S101R;
P1-N76D/I79A/I122A/Y104W/I107V; P1-N76D/I79A/I122A/L250G;
P1-N76D/I79A/I122A/T254G; P1-N76D/I79A/I122A/T254A;
P1-N76D/I79A/I122A/G258S; P1-N76D/I79A/I122A/M50A;
P1-N76D/I79A/I122A/G47S; P1-N76D/I79A/I122A/A48G;
P1-N76D/I79A/I122A/S182R; P1-N76D/I79A/I122A/S183R;
P1-N76D/I79A/I122A/Q185A; P1-N76D/I79A/I122A/S101R/I107V;
P1-N76D/I79A/I122A/S248G и P1-N76D/I79A/I122A/Y262F,
где Р1 является BPN'-Y217L.
Наиболее предпочтительные варианты изобретения включают следующие специфические комбинации замененных остатков, соответствующих положениям N76D-I122A-Y217L субтилизина Bacillusamyloliquefaciens. Такие замены предпочтительно производят в (рекомбинантном или природном) субтилизине Bacillus amyloliquefaciens, хотя замены могут быть произведены в белке любого Bacillus.
На основании результатов скрининга, полученных с вариантами белков, мутации, указанные выше в субтилизине Bacillus amyloliquefaciens, являются важными для протеолитической активности, эффективности и/или стабильности этих ферментов и эффективности очистки или промывки, а также других применений таких вариантов ферментов.
Кроме описанных выше точечных мутаций, слияние двух гомологичных белков может также исключать Т-клеточные эпитопы. Как поясняется в примерах ниже, участок белка, в котором находится Т-клеточный эпитоп, может быть заменен тем же самым участком в гомологичном белке, который не имеет Т-клеточного эпитопа. В примерах ниже, слитый белок создают с протеазой Bacillus lentus и ее гомологом Bacillus amyloliquefaciens, так что полученный белок не имеет Т-клеточного эпитопа, присутствующего в исходной протеазе Bacillus lentus. Любая длина может быть слита в исходный белок, от единственного эпитопа до большой части данного белка, при сохранении желаемой активности. Однако необязательно должен сохраняться исходный уровень активности. Вследствие пониженной аллергенности белка можно использовать больше гибридного белка, чем исходного белка, для достижения тех же самых уровней активности.
Активность варианта протеазы может быть определена и сравнена с представляющей интерес протеазой испытанием взаимодействия протеазы с различными коммерческими субстратами, включающими, но не ограничивающимися ими, казеин, кератин, эластин, коллаген. Протеазная активность может быть определена анализами, известными в данной области. Примеры анализов для определения протеазной активности включают, но не ограничиваются ими, анализ с сукцинил-Ala-Ala-Pro-Phe-пара-нитроанилидом (SAAPFpNA) (Delmar, E.G., et al., Anal. Biochem. 94 (1979) 316-320; Achtstetter, Arch. Biochem. Biophys. 207:445-54 (1981)); и анализ с натриевой солью 2,4,6-тринитробензолсульфоната (TNBS). В анализе SAAPFpNA протеазы расщепляют связь между пептидом и п-нитроанилином с образованием видимой желтой окраски с поглощением при 405 нм. В TNBS-способе с окрашиванием измеряют ферментативный гидролиз субстрата до полипептидов, содержащих свободные аминогруппы. Такие аминогруппы реагируют с TNBS с образованием окрашенного в желтый цвет комплекса. Таким образом, чем более глубоко окрашена реакционная смесь, тем большая активность измеряется. Желтый цвет может быть определен различными анализаторами или спектрофотометрами, известными в данной области.
Другие характеристики вариантов протеаз могут быть определены способами, известными специалистам в данной области. Примеры характеристик включают, но не ограничиваются ими, термостабильность, устойчивость к щелочи и стабильность конкретной протеазы в различных субстратных или буферных растворах или композициях продуктов.
При комбинировании с описанной в данном описании методикой анализа стабильности фермента были идентифицированы мутанты, полученные неспецифическим (случайным) мутагенезом, которые демонстрировали либо увеличенную, либо уменьшенную устойчивость к щелочи или термостабильность при сохранении ферментативной активности.
Устойчивость к щелочи измеряют либо по известным методикам, либо описанными в данном описании способами. Существенное изменение устойчивости к щелочи доказывается, по меньшей мере, приблизительно 5% или большим увеличением или уменьшением (предпочтительно увеличением) периода полужизни ферментативной активности мутанта в сравнении с карбонилгидролазой-предшественником. В случае субтилизинов устойчивость к щелочи может измеряться как функция ферментативной активности субтилизина при варьирующемся рН.
Термостабильность измеряют либо по известным методикам, либо описанными в данном описании способами. Существенное изменение термостабильности доказывается, по меньшей мере, приблизительно 5% или большим увеличением или уменьшением (предпочтительно увеличением) периода полужизни каталитической активности мутанта при воздействии относительно высокой температуры и нейтрального рН, в сравнении с карбонилгидролазой-предшественником. В случае субтилизинов термостабильность измеряют аутопротеолитической деградацией субтилизина при повышенных температурах и различных рН. См. фиг. 14 и 15.
Многие из вариантов белков данного изобретения применимы в приготовлении различных детергентных композиций. Ряд известных соединений являются подходящими поверхностно-активными веществами, применимыми в композициях, содержащих мутанты белков данного изобретения. Они включают неионные, анионные, катионные или цвиттерионные детергенты, описанные в патенте США 4404128, выданном Barry J. Anderson, и патенте США 4261868, выданном Jiri Flora, et al. Подходящей детергентной формой является форма, описанная в примере 7 патента США 5204015 (ранее включенного в качестве ссылки). В данной области известны различные формы, которые могут быть использованы в качестве очищающих композиций. Должно быть понятно, что, кроме обычных очищающих композиций, варианты белков данного изобретения могут быть использованы для любой цели, для которой используются природные белки или белки дикого типа. Таким образом, эти варианты могут быть использованы, например, для приготовления кускового или жидкого мыла, композиций для ухода за посудой, для очистки поверхностей, очищающих растворов или продуктов для контактных линз, гидролиза пептидов, обработки отходов, текстильных применений, в качестве ферментов расщепления слитых белков в производстве белков и т.д. Варианты данного изобретения могут проявлять, кроме уменьшенной аллергенности, увеличенную эффективность в детергентной композиции (в сравнении с предшественником). В данном контексте, увеличенная эффективность детергента определяется как увеличение очистки чувствительных к определенному ферменту пятен, таких как пятна от травы или пятна крови, при определении посредством общепринятой оценки после стандартного моющего цикла.
Белки, в частности протеазы данного изобретения, могут быть приготовлены в виде известных порошкообразных и жидких моющих средств, имеющих рН между 6,5 и 12,0, при уровнях приблизительно 0,01-5% (предпочтительно 0,1%-5%) по массе. Очищающие композиции детергентов могут также включать другие ферменты, например, известные протеазы, амилазы, целлюлазы, липазы или эндогликозидазы, а также модифицирующие добавки и стабилизаторы.
Добавление белков, в частности, протеаз данного изобретения, к общепринятым очищающим композициям не создает никакого особого ограничения применения. Другими словами, любые температура и рН, пригодные для детергента, пригодны также для данных композиций, пока рН находится в указанном выше диапазоне и температура ниже описанной температуры денатурации белка. Кроме того, белки данного изобретения могут быть использованы в очищающей композиции без детергентов, либо отдельно, либо в комбинации с модифицирующими добавками и стабилизаторами.
Одним аспектом данного изобретения является композиция для обработки текстиля, которая включает варианты белков данного изобретения. Композиция может быть использована для обработки, например, шелка или шерсти, как описано в таких публикациях, как RD 216034; ЕР 134267; US 4533359 и ЕР 344259.
Варианты могут быть подвергнуты скринингу на протеолитическую активность в соответствии со способами, хорошо известными в данной области. Предпочтительные варианты протеазы содержат множественные замены в положениях, соответствующих положениям 76, 79, 122 субтилизина Bacillus amyloliquefaciens.
Протеазы данного изобретения проявляют модифицированную иммуногенность в сравнении с их белками-предшественниками. В предпочтительных вариантах белки проявляют уменьшенную аллергенность. Специалисту в данной области будет понятно, что применения протеаз данного изобретения будут определяться, в значительной части, иммунологическими свойствами белков. Например, протеазы, которые проявляют уменьшенную аллергенность, могут быть использованы в очищающих композициях. "Очищающие композиции" являются композициями, которые могут быть использованы для удаления нежелательных соединений из субстратов, таких как ткань, посуда, контактные линзы, другие твердые субстраты, волосы (шампуни), кожа (мыла и кремы), зубы (полоскания для полости рта, зубные пасты) и т.д. Эффективное количество одного или более вариантов протеазы, описанных в данном описании, может быть включено в композиции, применимые для очистки различных поверхностей, нуждающихся в удалении белковых пятен. Такие очищающие композиции включают детергентные композиции для очистки твердых поверхностей, не ограниченные по форме (например, жидкие и гранулярные); детергентные композиции для чистки тканей, не ограниченные по форме (например, гранулярные, жидкие и кусковые формы); композиции для мойки посуды (не ограниченные по форме); композиции для очистки полости рта, не ограниченные по форме (например, формы зубного порошка, зубной пасты и зубного эликсира); и композиции для очистки зубных протезов, не ограниченные по форме (например, жидкость, таблетки). В данном контексте, "эффективное количество" относится к количеству вариантов протеазы, необходимому для достижения ферментативной активности, требующейся в специфической очищающей композиции. Такие эффективные количества могут быть легко определены специалистом в данной области, и они основаны на многих факторах, таких как конкретный используемый вариант фермента, применение очистки, конкретный состав очищающей композиции, и на том, требуется ли жидкая или сухая (например, гранулярная, кусковая) композиция, и т.п.
Эффективное количество одного или более вариантов протеазы, описанной в данном описании, может быть включено в композиции, применяемые к содержащим кератин веществам, таким как ногти и волосы, включающих, но не ограничивающихся ими, в композиции, применимые в качестве спреев для волос, шампуней и/или кондиционирующих композиций, композиции, применяемые с целью регуляции роста волос, и композиции, наносимые на волосы и кожу головы для лечения себореи, дерматита и/или перхоти.
Эффективное количество одного или более вариантов протеазы, описанных в данном описании, может быть включено в композиции, пригодные для местного нанесения на кожу или волосы. Эти композиции могут быть в форме кремов, лосьонов, гелей и т.п. и могут быть приготовлены в виде водных композиций или могут быть приготовлены в виде эмульсий одной или более фаз в водной непрерывной фазе.
Например, композиции для ухода за кожей включают вариант представляющей интерес протеазы, описанный выше, содержащий Т-клеточный эпитоп, где указанный вариант отличается от указанной представляющей интерес протеазы тем, что он имеет измененный Т-клеточный эпитоп, так что указанный вариант и указанная представляющая интерес протеаза вызывают различные иммуногенные реакции у человека. Вариант представляющей интерес протеазы может содержать аминокислотную замену, выбранную из группы, состоящей из остатков, соответствующих положениям 76, 79 и 122 субтилизина Bacillus amyloliquefaciens; влагоудерживающих агентов; активных ингредиентов для ухода за кожей; поверхностно-активных веществ; смягчающих агентов; полимерных загущающих агентов и силикона.
Активные ингредиенты для ухода за кожей
Описываемые в данном описании композиции могут содержать активный ингредиент для ухода за кожей на уровне от приблизительно 0,1% до приблизительно 20%, предпочтительно от приблизительно 1% до приблизительно 10%, более предпочтительно от приблизительно 2% до приблизительно 8%, по массе. Неограничивающие примеры подходящих активных ингредиентов для ухода за кожей включают компонент витамина В3, пантенол, витамин Е, ацетат витамина Е, ретинол, ретинилпропионат, ретинилпальмитат, ретиноевую кислоту, витамин С, теобромин, α-гидроксикислоту, фарнезол, фитантриол, салициловую кислоту, пальмитилпептапептид-3 и их смеси.
Соединение В3
Как используется в данном описании, "соединение витамина В3" означает соединение, имеющее формулу:

где R обозначает -CONH2 (т.е. ниацинамид), -СООН (т.е. никотиновую кислоту) или -СН2ОН (т.е. никотиниловый спирт); его производные и соли любого из указанных выше соединений. Примеры производных указанных выше соединений витамина В3 включают сложные эфиры никотиновой кислоты, в том числе не расширяющие сосуды эфиры никотиновой кислоты, никотиниламинокислоты, эфиры никотинилового спирта и карбоновых кислот, N-оксид никотиновой кислоты и N-оксид ниацинамида.
Подходящие эфиры никотиновой кислоты включают сложные эфиры никотиновой кислоты и С1-С22, предпочтительно С1-С16, предпочтительно С1-С6спиртов. Спирты имеют подходящую прямую цепь или разветвленную цепь, являются циклическими или ациклическими, насыщенными или ненасыщенными (в том числе ароматическими) и замещенными или незамещенными. Сложные эфиры предпочтительно являются не-сосудорасширяющими. В данном контексте термин "не-сосудорасширяющие" означает, что эфир обычно не дает видимой реакции покраснения после нанесения на кожу в рассматриваемой композиции (большая часть общей популяции не будет испытывать видимой реакции покраснения, хотя такие соединения могут вызывать расширение сосудов, не обнаруживаемое невооруженным глазом). Не-сосудорасширяющие эфиры никотиновой кислоты включают никотинат токоферола и гексаникотинат инозита; предпочтительным является никотинат токоферола. Более полное описание соединений витамина В3 приведено в WO 98/22085. Предпочтительными соединениями витамина В3 являются ниацинамид и никотинат токоферола.
Ретиноиды
Другим подходящим активным ингредиентом для ухода за кожей является ретиноид. В данном контексте "ретиноид" включает все природные и/или синтетические аналоги витамина А или ретинолподобных соединений, которые обладают биологической активностью витамина А в коже, а также геометрические изомеры и стереоизомеры данных соединений. При включении ретиноида в описываемые в данном описании композиции он обычно составляет от или приблизительно 0,005% до или приблизительно 2%, более предпочтительно 0,01%-приблизительно 2% ретиноида. Ретинол предпочтительно используют в количестве от или приблизительно 0,01% до или приблизительно 0,15%; сложные эфиры ретинола предпочтительно используют в количестве от приблизительно 0,01% до приблизительно 2% (например, около 1%).
Ретиноидом предпочтительно является ретинол, сложные эфиры ретинола (например, С2-С22алкиловые эфиры ретинола, в том числе ретинилпальмитат, ретинилацетат, ретинилпропионат), ретинол и/или ретиноевая кислота (в том числе полностью транс-ретиноевая кислота и/или 13-цис-ретиноевая кислота), более предпочтительно ретиноиды, отличные от ретиноевой кислоты. Эти соединения хорошо известны в данной области и являются коммерчески доступными из ряда источников, например, Sigma Chemical Company (St. Louis, MO) и Boehringer Mannheim (Indianapolis, IN). Предпочтительными ретиноидами являются ретинол, ретинилпальмитат, ретинилацетат, ретинилпропионат, ретиналь, ретиноевая кислота и их комбинации. Более предпочтительными являются ретинол, ретинилпропионат, ретиноевая кислота и ретинилпальмитат. Ретиноид может быть включен в виде по существу чистого вещества или в виде экстракта, полученного подходящим физическим и/или химическим выделением из природных (например, растительных) источников.
Носитель
Описываемые в данном описании композиции могут содержать безопасное и эффективное количество дерматологически приемлемого носителя, пригодного для местного нанесения на кожу или волосы, в который включены необходимые вещества и необязательные другие вещества таким образом, чтобы обеспечить доставку необходимых веществ и необязательных компонентов к коже или волосам в подходящей концентрации. Таким образом, носитель может действовать как разбавитель, диспергирующий агент, растворитель или т.п. для необходимых компонентов, который гарантирует, что они могут быть нанесены и однородно распределены на выбранной мишени при подходящей концентрации.
Тип носителя, используемый в данном изобретении, зависит от типа формы продукта, желательной для данной композиции. Носитель может быть твердым, полутвердым или жидким. Подходящие носители являются жидкими или полутвердыми, такими как кремы, лосьоны, гели, стержни, мази, пасты и муссы. Предпочтительно носитель находится в форме лосьона, крема или геля, более предпочтительно такого, который имеет достаточную густоту или предел текучести для предотвращения седиментации частиц. Носитель может быть сам инертным или может обладать дерматологически полезным действием сам по себе. Носитель может быть нанесен непосредственно на кожу и/или волосы или может быт нанесен с использованием тканой или нетканой салфетки или куска ткани. Он может быть также в форме пластыря, маски или повязки. Он может быть нанесен на кожу и/или волосы в виде аэрозоля или распылен другим образом. Носитель должен также быть физически и химически совместимым с необходимыми компонентами, описанными в данном описании, и не должен чрезмерно нарушать стабильность, эффективность или другие полезные свойства, связанные с композициями данного изобретения.
Предпочтительные носители содержат дерматологически приемлемый, гидрофильный разбавитель. Подходящие гидрофильные носители включают воду, органические гидрофильные разбавители, такие как С1-С4 одноатомные спирты и низкомолекулярные гликоли и полиолы, включающие пропиленгликоль, полиэтиленгликоль (например, с MW 200-600), пропиленгликоль (например, с MW 425-2025), глицерин, бутиленгликоль, 1,2,4-бутантриол, сложные эфиры сорбита, 1,2,6-гексантриол, этанол, изопропанол, этоксилированные простые эфиры, пропоксилированные простые эфиры и их комбинации. Разбавителем является предпочтительно жидкость. Вода является предпочтительным разбавителем. Композиция предпочтительно содержит, по меньшей мере, приблизительно 20% гидрофильного разбавителя.
Подходящие носители могут также содержать эмульсию, содержащую гидрофильную фазу, в частности, водную фазу, и гидрофобную фазу, например, липид, масло или маслянистый материал. Как хорошо известно специалисту в данной области, гидрофильная фаза будет диспергироваться в гидрофобной фазе или наоборот, с образованием, соответственно, гидрофильной или гидрофобной диспергированной и непрерывной фаз, в зависимости от ингредиентов композиции. В технологии приготовления эмульсий термин "диспергированная фаза" является хорошо известным для специалиста в данной области, который означает, что данная фаза существует в виде малых частиц или капель, которые суспендированы в непрерывной фазе и окружены непрерывной фазой. Диспергированная фаза известна также под названием внутренняя или прерывистая фаза. Эмульсия может быть или содержать (например, в трехфазной или другой многофазной эмульсии) эмульсию типа масло-в-воде или эмульсию типа вода-в-масле, например, эмульсию вода-в-силиконе. Эмульсии типа масло-в-воде обычно содержат от приблизительно 1% до приблизительно 60% (предпочтительно приблизительно 1%-30%) диспергированной гидрофобной фазы и от приблизительно 1% до приблизительно 99% (предпочтительно от приблизительно 40% до приблизительно 90%) непрерывной гидрофильной фазы; эмульсии типа вода-в-масле обычно содержат от приблизительно 1% до приблизительно 98% (предпочтительно от приблизительно 40% до приблизительно 90%) диспергированной гидрофильной фазы и от приблизительно 1% до приблизительно 50% (предпочтительно приблизительно 1%-30%) непрерывной гидрофобной фазы.
Влагоудерживающие агенты
Композиции данного изобретения могут содержать влагоудерживающие агенты, которые предпочтительно присутствуют на уровне от приблизительно 0,01% до приблизительно 20%, более предпочтительно от приблизительно 0,1% до приблизительно 15% и, в частности, от приблизительно 0,5% до приблизительно 10%. Предпочтительные влагоудерживающие агенты включают, но не ограничиваются ими, соединения, выбранные из многоатомных спиртов, мочевины, D- или DL-пантенола, пантотената кальция, желе-рояля (маточного молочка пчел), пантетина, пантотеина, пантенилэтилового простого эфира, пангамовой кислоты, пиридоксина, комплекса пантоиллактоза-витамин В, гексан-1,2,6-триола, гуанидина или его производных и их смесей.
Подходящие многоатомные спирты для применения в данном изобретении включают полиалкиленгликоли и более предпочтительно алкиленполиолы и их производные, в том числе пропиленгликоль, дипропиленгликоль, полипропиленгликоль, полиэтиленгликоль и их производные, сорбит, гидроксипропилсорбит, эритрит, треитол, пентаэритрит, ксилит, глюцит, маннит, гексиленгликоль, бутиленгликоль (например, 1,3-бутиленгликоль), гексантриол (например, 1,2,6-гексантриол), триметилолпропан, неопентилгликоль, глицерин, этоксилированный глицерин, пропан-1,3-диол, пропоксилированный глицерин и их смеси. Для применения в данном изобретении пригодны также алкоксилированные производные любого из приведенных выше многоатомных спиртов. Предпочтительные многоатомные спирты данного изобретения выбраны из глицерина, бутиленгликоля, пропиленгликоля, дипропиленгликоля, полиэтиленгликоля, гексантриола, этоксилированного глицерина и пропоксилированного глицерина и их смесей.
Подходящими влагоудерживающими агентами, применимыми в данном изобретении, являются натрий-2-пирролидон-5-карбоксилат (NaPCA), гуанидин; гликолевая кислота и гликолятные соли (например, аммония и четвертичного алкиламмония); молочная кислота и лактатные соли (например, аммония и четвертичного алкиламмония); алоэ (aloe vera) в любой из его различных форм (например, гель aloe vera); гиалуроновая кислота и ее производные (например, производные в виде солей, такие как гиалуронат натрия); лактамид моноэтаноламина; ацетамид моноэтаноламина; мочевина; пантенол и его производные и их смеси.
По меньшей мере часть (до приблизительно 5% по массе композиции) влагоудерживающего агента может быть включена в форме смеси с состоящим из частиц сшитым гидрофобным сополимером акрилата или метакрилата, присутствующего предпочтительно в количестве от приблизительно 0,1% до приблизительно 10%, который может быть добавлен либо к водной, либо к дисперсной фазе. Данный сополимер является особенно ценным для уменьшения блеска и контроля масла, способствует обеспечению эффективных преимуществ увлажнения и описан более подробно в WO96/03964, включенном в данное описание в качестве ссылки.
Смягчающие агенты
Варианты эмульсии типа масло-в-воде данного изобретения могут содержать от приблизительно 1% до приблизительно 20%, предпочтительно от приблизительно 1,5% до приблизительно 15%, более предпочтительно от приблизительно 0,1% до приблизительно 8%, более предпочтительно от приблизительно 0,5% до приблизительно 5% дерматологически приемлемого смягчающего агента. Смягчающие агенты склонны смягчать кожу, увеличивать гладкость и мягкость кожи, предотвращать или уменьшать сухость кожи и/или защищать кожу. Смягчающие агенты обычно являются несмешивающимися с водой, маслянистыми или воскообразными веществами, и смягчающие агенты с высокими молекулярными массами могут придавать свойства липкости композиции для местного нанесения. Известно большое разнообразие подходящих смягчающих агентов, и они могут использоваться в данном изобретении. Ссылка Sagarin, Cosmetics, Science and Technology, 2nd Edition, Vol. 1, pp. 32-43 (1972), содержит многочисленные примеры веществ, пригодных в качестве смягчающего агента. Все смягчающие агенты, обсуждаемые в WO 00/24372, должны рассматриваться как пригодные для применения в данном изобретении, хотя предпочтительные примеры описаны более подробно ниже:
i) Углеводороды с прямой и разветвленной цепью, имеющие от приблизительно 7 до приблизительно 40 атомов углерода, такие как додекан, сквалан, холестерин, гидрогенированный полиизобутилен, изогексадекан, изоэйкозан, изооктагексаконтан, изогексапентаконтагектан и С7-С40изопарафины, которые являются разветвленными С7-С40углеводородами. Подходящие углеводороды с разветвленной цепью для применения в данном изобретении выбраны из изопентаконтаоктана, петролатума (вазелина) и их смесей. Подходящими для применения в данном изобретении являются алифатические углеводороды с разветвленной цепью, продаваемые под торговой маркой Перметил (RTM) и коммерчески доступные от Presperse Inc., P.O. Box 735, South Plainfield, N.J. 07080, U.S.A.
ii) Сложные эфиры С1-С30спирта и С1-С30карбоновых кислот, С12-15алкилбензоаты и С2-С30дикарбоновые кислоты, например, изононилизононаноат, изостеарилнеопентаноат, изодецилоктаноат, изодецилизононаноат, тридецилизононаноат, миристилоктаноат, октилпеларгонат, октилизононаноат, миристилмиристат, миристилнеопентаноат, миристилоктаноат, изопропилмиристат, миристилпропионат, изопропилстеарат, изопропилизостеарат, метилизостеарат, бегенилбегенат, диоктилмалеат, диизопропиладипат и диизопропилдилинолеат и их смеси.
iii) Сложные С1-С30моно- и полиэфиры сахаров и родственные вещества. Такие сложные эфиры получают из сахарной или полиольной части молекулы и одной или более частей карбоновых кислот. В зависимости от составляющих кислоты и сахара сложные эфиры могут быть либо в жидкой, либо в твердой форме при комнатной температуре. Примеры включают: тетраолеат глюкозы, тетраэфиры галактозы и олеиновой кислоты, тетраолеат сорбита, тетраолеат сахарозы, пентаолеат сахарозы, гексаолеат сахарозы, гептаолеат сахарозы, октаолеат сахарозы, гексаэфир сорбита, в котором этерифицирующими частями карбоновой кислоты являются пальмитолеат и арахидат в молярном соотношении 1:2, и октаэфир сахарозы, где этерифицирующими частями карбоновых кислот являются лаурат, линолеат и бегенат в молярном соотношении 1:3:4. Другие вещества включают сложные эфиры сахарозы и жирной кислоты хлопкового или соевого масла. Другие примеры таких веществ описаны в WO 96/16636, включенном в данное описание в качестве ссылки. Особенно предпочтительное вещество известно по INCI под названием поликоттонсидированная сахароза (polycottonseedate sucrose).
iv) Растительные масла и гидрогенизированные растительные масла. Примеры растительных масел и гидрогенизированных растительных масел включают сафлоровое масло, кокосовое масло, хлопковое масло, менхэденовое масло, пальмовое масло, арахисовое масло, соевое масло, рапсовое масло, льняное масло, рисовое масло, хвойное масло, кунжутное масло, подсолнечное масло, частично или полностью гидрогенизированные масла из указанных выше масел и их смеси.
v) Растворимые или коллоидально-растворимые увлажняющие агенты. Примеры включают гиалуроновую кислоту и привитые на крахмал полиакрилаты натрия, такие как Sanwet (RTM) IM-1000, IM-1500 и IM-2500, доступные от Celanese Superabsorbent Materials, Portsmith, VA, USA и описанные в USA-A-4076663.
Предпочтительными смягчающими агентами для применения в данном изобретении являются изогексадекан, изооктаконтан, петролатум (вазелин), изононилизононаноат, изодецилоктаноат, изодецилизононаноат, тридецилизононаноат, миристилоктаноат, октилизононаноат, миристилмиристат, метилизостеарат, изопропилизостеарат, С12-15 алкилбензоаты и их смеси. Особенно предпочтительными смягчающими агентами для применения в данном изобретении являются изогексадекан, изононилизононаноат, метилизостеарат, изопропилизостеарат, петролатум (вазелин) или их смеси.
Эмульгаторы/поверхностно-активные вещества
Описываемые в данном описании композиции могут содержать эмульгатор и/или поверхностно-активное вещество, обычно для облегчения диспергирования и суспендирования дисперсной фазы в непрерывной водной фазе. Поверхностно-активное вещество может быть также полезным, если продукт предназначен для очистки кожи. Для удобства далее эмульгаторы будут называться термином "поверхностно-активные вещества", следовательно, термины "поверхностно-активное вещество" (поверхностно-активные вещества) будут использоваться для ссылки на поверхностно-активные агенты, будут ли они использоваться в качестве эмульгаторов или для других выполняемых поверхностно-активными веществами целей, таких как очистка кожи. Известные или общепринятые поверхностно-активные вещества могут быть использованы в композиции, при условии, что выбранный агент является химически и физически совместимым с основными компонентами композиции и обеспечивает желательные свойства. Подходящие поверхностно-активные вещества включают не-силиконовые вещества и их смеси. Все поверхностно-активные вещества, обсуждаемые в заявке WO 00/24372, должны рассматриваться как пригодные для применения в данном изобретении.
Композиции данного изобретения могут содержать от приблизительно 0,05% до приблизительно 15% поверхностно-активного вещества или смеси поверхностно-активных веществ. Конкретный поверхностно-активный агент или конкретная смесь поверхностно-активных агентов будет зависеть от рН композиции и от других присутствующих компонентов.
Среди неионных поверхностно-активных веществ, которые применимы в данном изобретении, находятся поверхностно-активные вещества, которые могут быть в широком смысле определены как продукты конденсации спиртов с длинной цепью, например С8-30спиртов, с полимерами сахара или крахмала, т.е. гликозидами. Другие применимые неионные поверхностно-активные вещества включают продукты конденсации алкиленоксидов с жирными кислотами (т.е. алкиленоксидные эфиры жирных кислот). Такие вещества имеют общую формулу RCO(X)nOH, где R обозначает С10-30алкильную группу, Х обозначает -ОСН2СН2- (т.е. получен из этиленгликоля или оксида) или -ОСН2СНСН3- (т.е. получен из пропиленгликоля или оксида), и n равно целому числу от приблизительно 6 до приблизительно 200. Другие неионные поверхностно-активные вещества являются продуктами конденсации алкиленоксидов с 2 молями жирных кислот (т.е. алкиленоксидные диэфиры жирных кислот). Такие вещества имеют общую формулу RCO(X)nOOCR, где R обозначает С10-С30алкильную группу, Х обозначает -ОСН2СН2- (т.е. получен из этиленгликоля или оксида) или -ОСН2СНСН3 - (т.е. получен из пропиленгликоля или оксида), и n равно целому числу от приблизительно 6 до приблизительно 100. Эмульгатором для применения в данном изобретении является наиболее предпочтительно смесь эфира жирной кислоты на основе смеси эфира сорбитана и жирной кислоты и эфира сахарозы и жирной кислоты, особенно смесь стеарата сорбитана и кокоата (эфира кислоты кокосового масла) сахарозы. Такая смесь коммерчески доступна от ICI под торговой маркой Arlatone 2121. Еще более подходящие примеры включают смесь цетеариловых спиртов, цетеариловых глюкозидов, таких как доступные под торговой маркой Montanov 68 от Seppic и доступные под торговой маркой Emulgade PL68/50 от Henkel.
Гидрофильные поверхностно-активные вещества, применимые в данном изобретении, могут альтернативно или дополнительно включать любые из большого разнообразия катионных, анионных, цвиттерионных и амфотерных поверхностно-активных веществ, известных в данной области. См., например, McCutcheon's, Detergents and Emulsifiers, North American Edition (1986), published by Allured Publishing Corporation; U.S. патент США № 5011681, выданный Clotti et al. 30 апреля 1991 года; патент США № 4421769, выданный Dixon et al. 20 декабря 1983 года, и патент США № 3755560, выданный Dickert et al. 28 августа 1973 года. Большое разнообразие анионных поверхностно-активных веществ также применимо в данном изобретении. См., например, патент США № 3929678, выданный Laughlin et al. 30 декабря 1975 года.
Большое разнообразие анионных поверхностно-активных веществ также применимо в данном изобретении. См., например, патент США № 3929678, выданный Laughlin et al. 30 декабря 1975 года. Примеры анионных поверхностно-активных веществ включают алкоилизетионаты (например, С12-С30), алкилсульфаты и алкоксисульфаты и их соли, алкилфосфаты и алкоксифосфаты и их соли, алкилметилтаураты (например, С12-С30) и мыла (например, соли щелочных металлов, например, натриевые или калиевые соли жирных кислот).
Амфотерные и цвиттерионные поверхностно-активные вещества также применимы в данном изобретении. Примерами амфотерных и цвиттерионных поверхностно-активных веществ, которые могут быть использованы в композициях данного изобретения, являются такие поверхностно-активные вещества, которые в широком смысле описываются как производные алифатических вторичных и третичных аминов, в которых алифатический радикал может быть с прямой или разветвленной цепью и в которых один из алифатических заместителей содержит от приблизительно 8 до приблизительно 22 атомов углерода (предпочтительно С8-С18), а другой содержит анионную водорастворимую группу, например, карбокси, сульфонат, сульфат, фосфат или фосфонат. Примерами являются алкилиминоацетаты и иминодиалканоаты и аминоалканоаты, производные имидазолиния и аммония. Другими подходящими амфотерными и цвиттерионными поверхностно-активными веществами являются поверхностно-активные вещества, выбранные из группы, состоящей из бетаинов, сультаинов, гидроксисультаинов и разветвленных и неразветвленных алканоилсаркозинатов и их смесей.
Некоторые эмульсии данного изобретения могут включать силиконсодержащие эмульгатор или поверхностно-активное вещество. В данном изобретении применимо большое разнообразие силиконовых эмульгаторов. Такие силиконовые эмульгаторы являются обычно органически модифицированными полиорганосилоксанами, также известными специалистам в данной области. Применимые силиконовые эмульгаторы включают сополиолы диметикона. Данные вещества являются полидиметилсилоксанами, которые были модифицированы для включения простых полиэфирных боковых цепей, таких как полиэтиленоксидные цепи, полипропиленоксидные цепи, их смеси и простые полиэфирные цепи, содержащие части, происходящие как из этиленоксида, так и пропиленоксида. Другие примеры включают алкилмодифицированные сополиолы диметикона, т.е. соединения, которые содержат подвешенные С2-С30 боковые цепи. Другие применимые сополиолы диметикона включают вещества, имеющие различные катионные, анионные, амфотерные и цвиттерионные боковые части.
Полимерные загущающие агенты
Композиции данного изобретения могут содержать, по меньшей мере, один полимерный загущающий агент. Полимерные загущающие агенты, применимые в данном изобретении, предпочтительно имеют среднечисловую молекулярную массу более чем 20000, более предпочтительно, более чем 50000, и особенно предпочтительно, более чем 100000. Композиции данного изобретения могут содержать от приблизительно 0,01% до приблизительно 10%, предпочтительно от приблизительно 0,1% до приблизительно 8% и наиболее предпочтительно от приблизительно 0,5% до приблизительно 5%, по массе композиции, полимерного загущающего агента или смесей загущающих агентов.
Предпочтительные полимерные загущающие агенты для применения в данном изобретении включают неионные загущающие агенты и анионные загущающие агенты или их смеси. Подходящие неионные загущающие агенты включают полиакриламидные полимеры, сшитые поли(N-винилпирролидоны), полисахариды, природные или синтетические камеди, поливинилпирролидон и поливиниловый спирт. Подходящие анионные загущающие агенты включают сополимеры акриловой кислоты и этилакрилата, карбоксивиниловые полимеры и сшитые сополимеры простых алкилвиниловых эфиров и малеинового ангидрида. Особенно предпочтительными загущающими агентами для применения в данном изобретении являются неионные полиакриламидные полимеры, такие как полиакриламид, и изопарафин и лаурет-7, доступный под торговой маркой Sepigel 305 от Seppic Corporation, и сополимеры акриловой кислоты и этилакрилата и карбоксивиниловые полимеры, доступные от B.F. Goodrich Company под торговой маркой Carbopol resins, или их смеси. Подходящие Carbopol resins могут быть гидрофобно модифицированы, а другие пригодные смолы описаны в WO98/22085, или их смеси.
Силиконовое масло
Композиции данного изобретения могут содержать, по меньшей мере, одну фазу силиконового масла. Фаза (фазы) силиконового масла обычно составляет от приблизительно 0,1% до приблизительно 20%, предпочтительно от приблизительно 0,5% до приблизительно 10%, более предпочтительно от приблизительно 0,5% до приблизительно 5% композиции. Фаза силиконового масла или каждая фаза силиконового масла предпочтительно содержит один или более силиконовых компонентов.
Силиконовые компоненты могут быть жидкостями, включающими прямую цепь, разветвленные и циклические силиконы. Подходящие силиконовые жидкости, применимые в данном изобретении, включают силиконы, включающие полиалкилсилоксановые жидкости, полиарилсилоксановые жидкости, циклические и линейные полиалкилсилоксаны, полиалкоксилированные силиконы, модифицированные амино и четвертичным аммонием силиконы, полиалкиларилсилоксаны или сополимер простого полиэфира и силоксана и их смеси. Силиконовые жидкости могут быть летучими и нелетучими. Силиконовые жидкости обычно имеют средневесовую молекулярную массу менее приблизительно 200000. Подходящие силиконовые жидкости имеют молекулярную массу приблизительно 100000 или менее, предпочтительно приблизительно 50000 или менее, наиболее предпочтительно приблизительно 10000 или менее. Предпочтительно, силиконовая жидкость выбрана из силиконовых жидкостей, имеющих средневесовую молекулярную массу в диапазоне от приблизительно 100 до приблизительно 50000 и предпочтительно от приблизительно 200 до приблизительно 40000. Обычно силиконовые жидкости имеют вязкость в диапазоне от приблизительно 0,65 до приблизительно 600000 мм2·с-1, предпочтительно от приблизительно 0,65 до приблизительно 10000 мм2·с-1 при 25°С. Вязкость может быть измерена с использованием стеклянного капиллярного вискозиметра, описанного в Dow Corning Corporate Test Method CTM0004, July 29, 1970. Подходящие полидиметилсилоксаны, которые могут быть использованы в данном изобретении, включают полидиметилсилоксаны, доступные, например, от General Electric Company в виде серий SF и Viscasil (RTM) и от Dow Corning в виде серий Dow Corning 200. Применимы также по существу нелетучие полиалкиларилсилоксаны, например, полиметилфенилсилоксаны, имеющие вязкости приблизительно 0,65-30000 мм2·с-1 при 25°С. Такие силоксаны доступны, например, от General Electric Company в виде метилфениловой жидкости SF 1075 или от Dow Corning в виде жидкости косметического сорта 556. Циклическими полидиметилсилоксанами, подходящими для применения в данном изобретении, являются соединения, имеющие кольцевую структуру, включающую от приблизительно 3 до приблизительно 7 (CH3)2SiO-частей молекулы.
В данном изобретении могут быть также использованы силиконовые каучуки. Под термином "силиконовый каучук" в данном описании имеются в виду высокомолекулярные силиконы, имеющие средневесовую молекулярную массу более или приблизительно 200000 и предпочтительно от приблизительно 200000 до приблизительно 4000000. Сюда включены нелетучие полиалкил- и полиарилсилоксановые каучуки. В предпочтительных вариантах силиконовая масляная фаза содержит силиконовый каучук или смесь силиконов, включающую силиконовый каучук. Обычно силиконовые каучуки имеют вязкость при 25°С более или приблизительно 1000000 мм2·с-1. Силиконовые каучуки включают диметиконы, описанные Petrarch и другими, в том числе в патенте США US-А-4152416, выданном 1 мая 1979 года Spitzer et al., и Noll, Walter, Chemistry and Technology of Silicones, New York: Academic Press 1968. Силиконовые каучуки описаны в General Electric Silicone Rubber Product Data Sheets SE 30, SE 33, SE 54 и SE 76. Характерные примеры силиконовых каучуков включают полидиметилсилоксан, сополимер (полидиметилсилоксан)(метилвинилсилоксан), сополимер поли(диметилсилоксан)(дифенил)(метилвинилсилоксан) и их смеси. Предпочтительными силиконовыми каучуками для применения в данном изобретении являются силиконовые каучуки, имеющие молекулярную массу от приблизительно 200000 до приблизительно 4000000, выбранные из диметиконола, сополиола диметикона, диметикона и их смесей.
Силиконовая фаза, применяемая в данном изобретении, предпочтительно содержит силиконовый каучук, включенный в композицию в виде части смеси силиконовый каучук-жидкость. При включении силиконового каучука в виде части смеси силиконовый каучук-жидкость, силиконовый каучук предпочтительно составляет от приблизительно 5% до приблизительно 40%, в частности, от приблизительно 10% до 20% по массе смеси силиконовый каучук-жидкость. Подходящими смесями силиконовый каучук-жидкость в данном изобретении являются смеси, состоящие по существу из:
(i) силикона, имеющего молекулярную массу от приблизительно 200000 до приблизительно 4000000, выбранного из диметиконола, фторсиликона и диметикона и их смесей, и
(ii) носителя, который является силиконовой жидкостью, имеющей вязкость от приблизительно 0,65 мм2 ·с-1 до приблизительно 100 мм2·с-1,
где отношение i) к ii) равно от приблизительно 10:90 до приблизительно 20:80 и где указанный компонент на основе силиконового каучука имеет конечную вязкость от приблизительно 100 мм2·с-1 до приблизительно 100000 мм2·с-1, предпочтительно от приблизительно 500 мм2·с-1 до приблизительно 10000 мм2·с-1.
Другими силиконовыми компонентами, пригодными для применения в фазе силиконового масла в данном изобретении, являются сшитые полиорганосилоксановые полимеры, необязательно диспергированные в жидком носителе. Обычно, когда они присутствуют, сшитые полиорганосилоксановые полимеры, вместе с их носителем (если он присутствует), составляют 0,1%-приблизительно 20%, предпочтительно от приблизительно 0,5% до приблизительно 10%, более предпочтительно от приблизительно 0,5% до приблизительно 5% композиции. Такие полимеры содержат полиорганосилоксановые полимеры, сшитые сшивающим агентом. Подходящие сшивающие агенты описаны в WO98/22085. Примеры подходящих полиорганосилоксановых полимеров для применения в данном изобретении включают метилвинилдиметикон, метилвинилдифенилдиметикон и метилвинилфенилметилдифенилдиметикон.
Другой класс силиконовых компонентов, пригодных для применения в силиконовой масляной фазе в данном изобретении, включает сополимеры полидиорганосилоксана и полиоксиалкилена, содержащие, по меньшей мере, один полидиорганосилоксановый сегмент и, по меньшей мере, один полиоксиалкиленовый сегмент. Подходящие полидиорганосилоксановые сегменты и их сополимеры описаны в WO 98/22085. Подходящие сополимеры полидиорганосилоксана и полиалкилена коммерчески доступны под торговыми марками Belsil (RTM) от Wacker-Chemie GmbH, Geschlftsbereich S, Postfach D-8000 Munich 22 и Abil (RTM) от Th. Goldschmidt Ltd., Tego House, Victoria Road, Ruislip, Middlesex, HA4 0YL, например, Belsil (RTM) 6031 и Abil (RTM) В88183. Особенно предпочтительная жидкая смесь сополимеров для применения в данном изобретении включает Dow Corning DC3225C, который имеет название CTFA Диметикон/Полиол диметикона.
Солнцезащитные фильтры
Композиции данного изобретения могут содержать органический солнцезащитный фильтр. Подходящие солнцезащитные фильтры могут иметь поглощающие УФА свойства, поглощающие УФВ свойства или их смесь. Точное количество активного ингредиента солнцезащитного фильтра будет варьироваться в зависимости от желательного солнцезащитного фактора, т.е. "SPF" композиции, а также от желаемого уровня защиты от УФ. Композиции данного изобретения предпочтительно имеют SPF, по меньшей мере, 10, предпочтительно, по меньшей мере, 15. SPF является обычно используемой мерой фотозащитного (светозащитного) действия солнцезащитного фильтра против эритемы. SPF определяется как отношение энергии ультрафиолета, требующейся для образования минимальной эритемы на защищенной коже, к энергии ультрафиолета, требующейся для образования той же самой минимальной эритемы на незащищенной коже у того же самого индивидуума. (См. Federal Register, 43, No 166, pp. 38206-38269, August 25, 1978). Используемые количества солнцезащитного фильтра обычно составляют от приблизительно 2% до приблизительно 20%, более часто от приблизительно 4% до приблизительно 14%. Подходящие солнцезащитные фильтры включают, но не ограничиваются ими, солнцезащитные фильтры, описанные в CTFA International Cosmetic Ingredient Dictionary and Handbook, 7th edition, volume 2, pp. 1672, edited by Wenninger and McEwen (The Cosmetic, Toiletry, and Fragrance Association, Inc., Washington, D.C., 1997).
Композиции данного изобретения могут содержать поглощающие УФА активные ингредиенты солнцезащитного фильтра, которые поглощают УФ-излучение, имеющее длину волны от приблизительно 320 нм до приблизительно 400 нм. Подходящие поглощающие УФА ингредиенты солнцезащитного фильтра выбраны из производных дибензоилметана, производных антранилата, таких как метилантранилат и гомометил-1-N-ацетилантранилат, и их смесей. Примеры дибензоилметановых активных ингредиентов солнцезащитных фильтров описаны в патента США № 4387089, выданном Depolo, и в Sunscreens: Development, Evaluation and Regulatory Aspects, edited by N.J. Lowe and N.A. Shaath, Marcel Dekker, Inc. (1990). УФА-поглощающий активный ингредиент солнцезащитного фильтра предпочтительно присутствует в количестве, достаточном для обеспечения защиты от УФА широкого спектра, либо независимо, либо в комбинации с другими защищающими от УФ-активными ингредиентами, которые могут присутствовать в композиции.
Подходящими активными ингредиентами солнцезащитных УФА-фильтров являются дибензоилметановые активные ингредиенты солнцезащитного фильтра и их производные. Они включают, например, но не ограничиваются ими, ингредиенты, выбранные из
2-метилдибензоилметана, 4-метилдибензоилметана,
4-изопропилдибензоилметана, 4-трет-бутилдибензоилметана,
2,4-диметилдибензоилметана, 2,5-диметилдибензоилметана,
4,4'-диизопропилбензоилметана,
4-(1, 1-диметилэтил)-4'-метоксидибензоилметана,
2-метил-5-изопропил-4'-метоксидибензоилметана,
2-метил-5-трет-бутил-4'-метоксидибензоилметана,
2, 4-диметил-4'-метоксидибензоилметана,
2,6-диметил-4'-трет-бутил-4'-метоксидибензоилметана и их смесей. Предпочтительные активные ингредиенты дибензоилсодержащих солнцезащитных фильтров включают ингредиенты, выбранные из 4-(1,1-диметилэтил)-4'-метоксидибензоилметана, 4-изопропилдибензоилметана и их смесей. Предпочтительным активным ингредиентом солнцезащитного фильтра является 4-(1, 1-диметилэтил)-4'-метоксидибензоилметан.
Активный ингредиент солнцезащитного фильтра 4-(1,1-диметилэтил)-4'-метоксидибензоилметан, который известен также как бутилметоксидибензоилметан или авобензон (Avobenzone), коммерчески доступен под названиями Parsol® 1789 от Givaudan Roure (International) S.A. (Basel, Switzerland) и Eusolex® 9020 от Merck & Co., Inc (Whitehouse Station, NJ). Солнцезащитный фильтр 4-изопропилдибензоилметан, который известен также как изопропилдибензоилметан, коммерчески доступен от Merck под названием Eusolex® 8020.
Композиции данного изобретения могут дополнительно содержать активный ингредиент УФВ-солнцезащитного фильтра, который поглощает УФ-излучение, имеющее длину волны от приблизительно 290 нм до приблизительно 320 нм. Данные композиции содержат количество активного ингредиента УФВ-солнцезащитного фильтра, которое является безопасным и эффективным для обеспечения УФВ-защиты, либо независимо, либо в комбинации с другими активными ингредиентами УФ-солнцезащитного фильтра, которые могут присутствовать в композиции. Композиции могут содержать от приблизительно 0,1% до приблизительно 16%, более предпочтительно от приблизительно 0,1% до приблизительно 12% и наиболее предпочтительно от приблизительно 0,5% до приблизительно 8% по массе УФВ-поглощающего органического солнцезащитного фильтра.
Различные активные ингредиенты УФВ-солнцезащитного фильтра являются пригодными для применения в данном изобретении. Неограничивающие примеры таких активных ингредиентов солнцезащитных фильтров описаны в патенте США № 5087372, выданном 11 февраля 1992 Haffey et al., и патентах США с номерами 5073371 и 5073372, выданных 17 декабря 1991 года Tumer et al., и Segarin, et al., at Chapter VIII, pages 189 et seq., of Cosmetics Science and Technology. Дополнительными полезными солнцезащитными средствами являются средства, описанные в патенте США № 4937370, выданном 26 июня 1990 года Sabatelli, и патенте США № 4999186, выданном 12 марта 1991 года Sabatelli et al. Предпочтительные активные ингредиенты УФВ-солнцезащитных фильтров выбраны из
2-этилгексил-2-циано-3,2-этилгексил-N,N-диметил-п-аминобензоата,
п-аминобензойной кислоты, оксибензона, гомоментилсалицилата,
октилсалицилата, 4, 4'-метокси-трет-бутилдибензоилметана,
4-изопропилдибензоилметана, 3-бензилиденкамфоры,
3-(4-метилбензилиден)камфоры,
3-дифенилакрилата (называемого октокриленом),
2-фенилбензимидазол-5-сульфоновой кислоты (PBSA),
циннаматов и их производных, таких как 2-этилгексил-п-метоксициннамат и октил-п-метоксициннамат, ТЕА салицилата, октилдиметил РАВА, производных камфоры и их производных, и их смесей. Предпочтительными органическими солнцезащитными средствами являются 2-этилгексил-2-циано-3,3-дифенилакрилат (называемый октокриленом), 2-фенилбензимидазол-5-сульфоновая кислота (PBSA), октил-п-метоксициннамат и их смеси. В данном изобретении применимы также формы солей и нейтрализованные формы кислых солнцезащитных фильтров.
К любой из композиций, применимых в данном изобретении, может быть добавлен агент для стабилизации УФА-солнцезащитного фильтра для предотвращения его разложению светом при воздействии УФ-излучения и, следовательно, для поддержания его УФА-солнцезащитной эффективности. Можно процитировать большой диапазон соединений, которые могут обеспечивать такие стабилизирующие свойства и должны быть выбраны для улучшения как УФА-солнцезащитного фильтра, так и композиции в целом. Подходящие стабилизирующие агенты включают, но не ограничиваются ими, агенты, описанные в патентах США с номерами 5972316, 5968485, 5935556, 5827508 и патенте WO00/06110. Предпочтительные примеры стабилизирующих агентов для применения в данном изобретении включают 2-этилгексил-2-циано-3,3-дифенилакрилат (называемый октокриленом), этил-2-циано-3,3-дифенилакрилат, 2-этилгексил-3,3-дифенилакрилат, этил-3,3-бис(4-метоксифенил)акрилат и их смеси. Наиболее предпочтительным является 2-этилгексил-2-циано-3,3-дифенилакрилат.
К любой из композиций, применимых в данном изобретении, может быть добавлен агент для улучшения свойств кожи в данных композициях, в частности для увеличения их сопротивления смыванию водой или стиранию. Предпочтительным агентом, который будет обеспечивать это качество, является сополимер этилена и акриловой кислоты. Композиции, содержащие такой сополимер, описаны в патенте США 4663157, выданном 5 мая 1987 года Brock.
Кроме органических солнцезащитных средств, композиции данного изобретения могут дополнительно содержать неорганические физические солнцезащитные косметические средства. Неограничивающие примеры подходящих солнцезащитных косметических средств описаны в CTFA International Cosmetic Ingredient Dictionary, 6th Edition, 1995, pp. 1026-28 and 1103, Sayre, R.M. et al., "Physical Sunscreens", J. Soc. Cosmet. Chem., vol. 41, No 2, pp. 103-109 (1990). Предпочтительными неорганическими физическими солнцезащитными косметическими средствами являются оксид цинка и диоксид титана и их смеси.
При применении физические косметические солнцезащитные средства присутствуют в таком количестве, что данные композиции являются прозрачными на коже (т.е. не осветляющими), предпочтительно в количестве, меньшем или равном приблизительно 5%. При применении диоксида титана он может иметь анатазную, рутильную или аморфную структуру (модификации диоксида титана). Частицы физического солнцезащитного косметического средства, например диоксида титана или оксида цинка, могут быть непокрытыми или могут иметь покрытие из различных веществ, включающих, но не ограничивающихся ими, аминокислоты, соединения алюминия, такие как оксид алюминия, стеарат алюминия, лаурат алюминия и т.п.; карбоновые кислоты и их соли, например, стеариновая кислота и ее соли; фосфолипиды, такие как лецитин; органические силиконовые соединения; неорганические силиконовые соединения, такие как диоксид кремния и силикаты; и их смеси. Предпочтительный диоксид титана коммерчески доступен от Tayca (Japan) и распространяется Tri-K Industries (Emerson, NJ) под названием тонкоизмельченной серии МТ (например, МТ 100SAS). Композиции данного изобретения могут содержать от приблизительно 0,1% до приблизительно 10%, более предпочтительно от приблизительно 0,1% до приблизительно 4% и наиболее предпочтительно от приблизительно 0,5% до приблизительно 2,5%, по массе, неорганического солнцезащитного средства.
Антимикробные и противогрибковые активные ингредиенты
Описываемые в данном описании композиции могут также содержать антимикробные и противогрибковые активные ингредиенты. Неограничивающие примеры антимикробных и противогрибковых активных ингредиентов включают β-лактамные лекарственные средства, хинолоновые лекарственные средства, ципрофлоксацин, норфлоксацин, тетрациклин, эритромицин, амикацин, 2,4,4'-трихлор-2'-гидроксидифениловый эфир, 3,4,4'-тихлорбанилид, феноксиэтанол, феноксипропанол, феноксиизопропанол, доксициклин, капреомицин, хлоргексидин, хлортетрациклин, окситетрациклин, клиндамицин, этамбутол, изетионат гексамидина, метронидазол, пентамидин, гентамидин, канамицин, линеомицин, метациклин, метенамин, миноциклин, неомицин, нетилмицин, паромомицин, стрептомицин, тобрамицин, миконазол, гидрохлорид тетрациклина, эритромицин, цинк-эритромицин, эстолат эритромицина, стеарат эритромицина, сульфат амикацина, гидрохлорид доксициклина, сульфат капреомицина, глюконат хлоргексидина, гидрохлорид хлоргексидина, гидрохлорид хлортетрациклина, гидрохлорид окситетрациклина, гидрохлорид клиндамицина, гидрохлорид этамбутола, гидрохлорид метронидазола, гидрохлорид пентамидина, сульфат гентамицина, сульфат канамицина, гидрохлорид линеомицина, гидрохлорид метациклина, гиппурат метенамина, манделат метенамина, гидрохлорид миноциклина, сульфат неомицина, сульфат нетилмицина, сульфат паромомицина, сульфат стрептомицина, сульфат тобрамицина, гидрохлорид миконазола, гидрохлорид аманфадина, сульфат аманфадина, октопирокс, парахлорметаксиленол, нистатин, толнафтат, клотримазол, цетилпиридинийхлорид (СРС), пироктоноламин, селенийсульфид, кетоконазол, триклокарбон, триклозан, цинк-пиритион, итраконазол, азиатскую кислоту, хинокитиол, мипироцин и лекарственные средства, описанные в ЕРА 0680745 (включенном в данное описание в качестве ссылки), гидрохлорид клинацина, пероксид бензоила, пероксид бензила, миноциклин, феноксиизопропанол и их смеси.
Другие необязательные ингредиенты
В описываемые в данном описании композиции могут быть также добавлены разнообразные необязательные ингредиенты, такие как нейтрализующие агенты, отдушки и красящие агенты. Предпочтительно, чтобы любой дополнительный ингредиент усиливал такие преимущества действия продукта, как мягкость/гладкость кожи. Кроме того, предпочтительно, чтобы любой из таких ингредиентов не действовал отрицательным образом на эстетические свойства продукта. Поэтому высокие уровни белков, таких как коллаген и эластин, не являются предпочтительными в композициях, применимых в данном изобретении.
Композиции данного изобретения могут также содержать от приблизительно 0,01% до приблизительно 10%, предпочтительно от приблизительно 0,1% до приблизительно 5% содержащего пантенол увлажняющего агента. Пантеноловый увлажняющий агент может быть выбран из D-пантенола ([R]-2,4-дигидрокси-N-[3-гидроксипропил)]-3, 3-диметилбутамида), DL-пантенола, пантотената кальция, желе-рояля, пантетина, пантотеина, пантенилового простого эфира, пангамовой кислоты, пиридоксина и пантоиллактозы.
Нейтрализующие агенты, пригодные для применения в нейтрализации содержащих кислотную группу гидрофильных гелеобразующих агентов, используемые в данном изобретении, включают гидроксид натрия, гидроксид калия, гидроксид аммония, моноэтаноламин, диэтаноламин, аминометилпропанол, трис-буфер и триэтаноламин.
Другие необязательные вещества включают кератолитические агенты; водорастворимые или солюбилизируемые консерванты, предпочтительно на уровне от приблизительно 0,1% до приблизительно 5%, такие как Germall 115, метиловый, этиловый, пропиловый и бутиловый эфиры гидроксибензойной кислоты, бензиловый спирт, DMDM гидантоиниодпропанилбутилкарбонат, доступный под торговой маркой Glydant Plus от Lonza, ЭДТА, Euxyl (RTM) K400, Bromopol (2-бром-2-нитропропан-1,3-диол) и феноксипропанол; антибактериальные средства, такие как Иргазан (RTM) и феноксиэтанол (предпочтительно на уровнях от приблизительно 0,1% до приблизительно 5%); растворимые или коллоидально-растворимые увлажняющие агенты, такие как гиалуроновая кислота и крахмал-сшитые полиакрилаты натрия, такие как Sanwet (RTM) IM-1000, IM-1500 и IM-2500, доступные от Celanese Superabsorbent Materials, Portsmith, VA, USA и описанные в USA-A-4076663; витамины, такие как витамин А, витамин С, витамин Е и их производные и их элементы структуры, такие как фитантриол, и витамин К и его компоненты, такие как жирный спирт додекатриенол; альфа- и бета-гидроксикислоты; алоэ (aloe vera); сфингозины и фитосфингозины, холестерин; отбеливающие кожу агенты; N-ацетилцистеин; красящие агенты; антибактериальные агенты, такие как ТСС/TSC, также известные как триклозан и трихлоруглерод; отдушки и солюбилизаторы отдушек. Примеры альфа-гидроксикислот включают гликолевую кислоту, молочную кислоту, яблочную кислоту, лимонную кислоту, гликолевую кислоту вместе с гликолятом аммония, альфа-гидроксиэтановую кислоту, альфа-гидроксиоктановую кислоту, альфа-гидроксикаприловую кислоту, гидроксикаприловую кислоту, смешанную фруктовую кислоту, три-альфа-гидроксифруктовые кислоты, тройную фруктовую кислоту, экстракт сахарного тростника, альфа-гидроксикислоту и ботанический (растительный) материал, содержащий 1-альфа-гидроксикислоту и гликомер в сшитом, содержащем жирные кислоты питательном альфа-продукте. Предпочтительными примерами альфа-гидроксикислот являются гликолевая кислота и молочная кислота. Предпочтительно альфа-гидроксикислоты используют в пределах до 10%.
Безопасное и эффективное количество противовоспалительного агента может быть добавлено к композициям данного изобретения, предпочтительно от приблизительно 0,1% до приблизительно 5%, более предпочтительно от приблизительно 0,1% до приблизительно 2%, композиции. Противовоспалительный агент усиливает благоприятные действия данного изобретения на внешний вид кожи, например, подобные агенты способствуют более однородному и приемлемому оттенку или цвету кожи. Точное количество противовоспалительного агента, используемого в композициях, будет зависеть от конкретного используемого противовоспалительного агента, так как такие агенты сильно отличаются по их действенности.
Композиции данного изобретения могут дополнительно включать антиоксидант/акцептор радикалов. Антиоксидант/акцептор радикалов особенно применим для обеспечения защиты от УФ-излучения, которое может вызывать увеличенное образование шероховатости (чешуек) или изменения текстуры в роговом слое кожи, и от других агентов окружающей среды, которые могут вызывать повреждение кожи. Подходящие количества составляют от приблизительно 0,1% до приблизительно 10%, более предпочтительно от приблизительно 1% до приблизительно 5% композиции. Используются такие антиоксиданты/акцепторы радикалов, как аскорбиновая кислота (витамин С) и ее соли.
Включение хелатообразующего агента особенно полезно для обеспечения защиты от УФ-излучения, которое может способствовать образованию избыточной шероховатости или изменениям текстуры кожи, и от других агентов окружающей среды, которые могут вызывать повреждение кожи. Подходящие количества составляют от приблизительно 0,01% до приблизительно 1%, более предпочтительно от приблизительно 0,05% до приблизительно 0,5%, композиции. Примеры хелатообразующих агентов, которые применимы в данном изобретении, описаны в патенте США № 5487884, включенном в данное описание в качестве ссылки. Предпочтительными хелатообразующими агентами, применимыми в композициях данного изобретения, являются этилендиаминтетрауксусная кислота (ЭДТА), фурилдиоксим и его производные.
Композиции данного изобретения могут также содержать отбеливающий кожу агент. При его использовании композиции предпочтительно содержат от приблизительно 0,1% до приблизительно 10%, более предпочтительно от приблизительно 0,2% до приблизительно 5%, также предпочтительно от приблизительно 0,5% до приблизительно 2% отбеливающего кожу агента. Подходящие отбеливающие кожу агенты включают известные в данной области агенты, в том числе койевую кислоту, арбутин, аскорбиновую кислоту и ее производные, например, аскорбилфосфат магния. Дополнительные отбеливающие кожу агенты, пригодные для применения в данном изобретении, включают также агенты, описанные в WO 95/34280 и WO 95/23780, включенные в данное описание в качестве ссылки.
Другие необязательные вещества включают водорастворимые или солюбилизируемые консерванты, предпочтительно на уровне от приблизительно 0,1% до приблизительно 5%, такие как Germall 115, метиловый, этиловый, пропиловый и бутиловый эфиры гидроксибензойной кислоты, бензиловый спирт, DMDM гидантоиниодпропанилбутилкарбанат, доступный под торговой маркой Glydant Plus от Lonza, ЭДТА, Euxyl (RTM) K400, Bromopol (2-бром-2-нитропропан-1,3-диол) и феноксипропанол; антибактериальные средства, такие как Иргазан (RTM) и феноксиэтанол (предпочтительно в пределах от приблизительно 0,1% до приблизительно 5%). Антибактериальные агенты, такие как ТСС/TCS, также известные как триклозан и трихлоркарбон, также применимы в композициях данного изобретения.
Другие необязательные вещества, применимые в данном изобретении, включают пигменты, которые, если они являются нерастворимыми в воде, вносят вклад и включаются в общий уровень ингредиентов масляной фазы. Пигменты, пригодные для применения в композициях данного изобретения, могут быть органическими и/или неорганическими. В термин "пигменты" включены также вещества, имеющие неяркую окраску или приглушенный блеск, такие как агенты матового завершающего штриха (завершающей отделки), а также светорассеивающие агенты. Предпочтительно композиции данного изобретения содержат состоящие из частиц вещества, имеющие показатель преломления света от приблизительно 1,3 до приблизительно 1,7, причем состоящие из частиц вещества диспергированы в композиции и имеют средний размер частиц от приблизительно 2 до приблизительно 30 мкм. Предпочтительно состоящие из частиц вещества, применимые в данном изобретении, имеют относительно узкое распределение частиц, что подразумевает, что более 50% этих частиц попадают в границы 3 мкм с каждой стороны от соответствующей средней величины. Предпочтительно также, чтобы более 50%, предпочтительно также, чтобы более 50%, предпочтительно более 60%, более предпочтительно более 70% частиц попадало в диапазон размеров, предписанный для соответствующих средних величин. Подходящие состоящие из частиц вещества являются органическими или органосиликоновыми и предпочтительно органосиликоновыми полимерами. Предпочтительные частицы являются свободно-текучими, твердыми веществами. Под термином "твердый" имеется в виду, что частицы не являются полыми. Пустота в центре полых частиц может оказывать неблагоприятное влияние на показатель преломления и, следовательно, на визуальные эффекты частиц либо на коже, либо на композиции. Подходящие органические состоящие из частиц вещества включают вещества, полученные из полиметилсилсесквиоксана, цитируемого выше, полиамида, политена, полиакрилонитрила, полиакриловой кислоты, полиметакриловой кислоты, полистирола, политетрафторэтилена (PTFE) и поли(винилиденхлорида). Могут быть также использованы сополимеры, полученные из мономеров названных выше веществ. Неорганические вещества включают диоксид кремния и нитрид бора. Репрезентативными коммерчески доступными примерами используемых состоящих из частиц веществ являются Tospearl® 145, который имеет средний размер частиц приблизительно 4,5 мкм, и ЕА-209® от Kobo, который является сополимером этилена и акриловой кислоты, имеющим средний размер частиц приблизительно 10 мкм, Nylon-12, доступный под торговой маркой Orgasol 2002 от Elf Atochem, France, или их смеси.
Дополнительными примерами подходящих пигментов являются диоксид титана, предварительно диспергированный диоксид титана от Kobo, например, Kobo GWL75CAP, оксиды железа, ацилглутамат-оксиды железа, ультрамариновый синий, красители D&С, кармин и их смеси. В зависимости от типа композиции обычно будет использоваться смесь пигментов. Предпочтительными пигментами для применения в данном изобретении с точки зрения ощущения увлажненности кожи, внешнего вида кожи и эмульсионной совместимости являются обработанные пигменты. Пигменты могут быть обработаны такими соединениями, как аминокислоты, силиконы, лецитин и эфирные масла.
Значение рН описываемой в данном описании композиции должно находиться в диапазоне от приблизительно 6,1 до приблизительно 10,0, где рН конечной композиции доводят добавлением кислых, основных или буферных солей, по мере необходимости.
Получение композиций
Композиции данного изобретения получают стандартными способами, хорошо известными специалистам в данной области. Обычно водная фаза и/или масляная фаза должна быть приготовлена отдельно, причем вещества подобного распределения фаз добавляют в любом порядке. Если конечный продукт является эмульсией, две фазы затем объединяют при интенсивном перемешивании. Любые ингредиенты в форме с высокой летучестью или вещества, чувствительные к гидролизу при высоких температурах, могут добавляться при осторожном перемешивании к концу процесса, после эмульгирования, если это возможно.
Протеазы с уменьшенной аллергенностью могут также использоваться при обработке текстильных изделий. Термин "обработка текстильных изделий" включает процесс, в котором текстильные изделия, отдельные пряжи или волокна, которые могут быть сотканы, сваляны или связаны в ткани или одежды, обрабатывают для достижения желательной характеристики. Примерами таких желательных характеристик являются "окраска одежды из грубой ткани", депиллинг, удаление волос, расшлихтовка, размягчение и другие обработки текстиля, хорошо известные специалистам в данной области.
В одном варианте данного изобретения идентифицированные в данном изобретении эпитопы могут быть использованы для индуцирования иммунной реакции, например, если желательно индуцировать антитела против протеазы, включающей один или оба из таких эпитопов. Такие антитела могут быть использованы, например, для скрининга других протеаз, которые включают один или оба из этих участков или участков, высоко гомологичных им. Таким образом, данное изобретение обеспечивает протеазу, включающую одну или обе из следующих последовательностей: (i) остатки 70-84 и/или (ii) остатки 109-123 субтилизина Bacillus amyloliquefaciens. Данное изобретение может быть осуществлено в иммуноанализах, использующих выделенный природный эпитоп, рекомбинантный белок или синтетический пептид, представляющие специфические участки эпитопов, для оценки лиц на сенсибилизацию к белкам, включающим эти или высоко гомологичные участки.
В другом варианте фрагменты эпитопов, описанные в данном описании, могут быть использованы в детектировании антигенпрезентирующих клеток, имеющих молекулы МНС, способные связывать и представлять такие фрагменты. Например, фрагменты эпитопов могут включать детектируемую метку (например, радиоактивную метку). Меченые фрагменты могут быть затем инкубированы с представляющими интерес клетками, и затем могут быть детектированы клетки, которые связывают (или представляют) меченые фрагменты.
Должно быть понятно, что данное изобретение относится ко всем белкам, против которых желательно модулировать иммуногенную реакцию, например, пептидам, которые должны быть использованы в качестве Т-клеточных вакцин, или пептидам или белкам для использования в качестве терапевтических агентов, например, против рака, инфекционных заболеваний и аутоиммунных заболеваний.
Вакцины и/или терапевтические агенты могут быть использованы в сочетании с фармацевтически приемлемыми носителями. В применении в данном изобретении, "фармацевтически приемлемым" компонентом является компонент, который пригоден для использования на людях и/или животных без нежелательных побочных эффектов (таких как токсичность, раздражение и аллергическая реакция), соизмеримых с разумным соотношением польза/риск. В данном контексте "фармацевтический носитель" является фармацевтически применимым растворителем, суспендирующим агентом или носителем для доставки протеазы, имеющей уменьшенную аллергенность, животному или человеку. Носитель может быть жидким или твердым и его выбирают в соответствии с планируемым способом введения. Примеры жидких носителей включают стерильный солевой раствор, воду, буферы, органические растворители и их комбинации.
Дозовое количество будет широко варьироваться в зависимости от вида теплокровного животного или человека и подлежащего обработке вируса. Вводимая доза будет, конечно варьироваться в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и способ и путь введения; возраст, здоровье и/или вес реципиента; природа и степень симптомов; метаболические характеристики данного лекарственного средства и пациента; тип сопутствующей обработки; частота обработки или желаемый эффект.
Обычно такая малая доза, как приблизительно 1 миллиграмм (мг) на килограмм (кг) массы тела является подходящей, но предпочтительно может быть использована доза 10 мг/кг и до 10000 мг/кг. Предпочтительно используют дозу от приблизительно 10 мг/кг до приблизительно 5000 мг/кг. Наиболее предпочтительно, дозы находятся между 250 мг/кг и приблизительно 5000 мг/кг. Дозы, применимые для местного уменьшения иммуногенной реакции, равны 250 мг/кг, 500 мг/кг, 2500 мг/кг, 3500 мг/кг, 4000 мг/кг, 5000 мг/кг и 6000 мг/кг. Может быть использован любой диапазон доз. Обычно измененную иммуногенную протеазу можно вводить ежедневно один или более раз в день, или протеазы с уменьшенной иммуногенностью могут предоставляться один-четыре раза в неделю либо в виде единственной дозы, либо в виде разделенных доз в течение дня. Дозировка два раза в неделю на протяжении периода, по меньшей мере, нескольких недель является предпочтительной, и часто дозировка продолжается на протяжении продолжительных периодов времени и, возможно, в течение всей жизни пациента. Однако доза и схема приема дозы будут варьироваться в зависимости от способности пациента поддерживать желаемые и эффективные уровни противовирусных агентов в плазме крови.
При внутривенном введении наиболее предпочтительные дозы могут быть в диапазоне от приблизительно 1 до приблизительно 10 мг/кг/мин во время инфузии с постоянной скоростью.
Доза для людей является обычно меньшей, чем используемая для мышей, и равна обычно приблизительно 1/12 дозы, которая эффективна для мышей. Таким образом, если доза 500 мг/кг была эффективной для мышей, доза 42 мг/кг может использоваться для людей. Для человека с весом 60 кг доза будет составлять 2520 мг.
Соединения данного изобретения могут быть введены любым подходящим способом, включающим, но не ограничивающимся ими, например, пероральный, ректальный, назальный, местное (в том числе трансдермальное, аэрозольное, буккальное и сублингвальное), вагинальный, парентеральный (в том числе подкожный, внутримышечный, внутривенный и интрадермальный), внутрипузырный или инъекцию в зону вируса или около вируса.
Дозовые количества основаны на эффективных ингибиторных концентрациях, наблюдаемых в противовирусных исследованиях. Предпочтительный путь введения будет варьироваться в зависимости от (1) состояния и возраста реципиента, (2) подлежащего обработке вируса, (3) природы инфекции и (4) желательных уровней в крови. Считается, что парентеральное лечение внутривенным, подкожным или внутримышечным введением соединений данного изобретения, приготовленных с подходящим носителем, другими противовирусными агентами или соединениями или разбавителями для облегчения введения, будет предпочтительным способом введения данных соединений теплокровным животным.
Все публикации и патенты, цитируемые в данном описании, включены тем самым в качестве ссылки во всей своей полноте. Следующее описание представлено в качестве примера и не должно пониматься как ограничение объема прилагаемой формулы изобретения.
ПРИМЕРЫ
Пример 1
Продукты для ухода за кожей
"Минорные" вещества включают: модифицирующие рН агенты, консерванты, модифицирующие вязкость агенты и отдушки. Количества представляют масс. процент, если нет иного указания, и не указывают значащих цифр.
Пример 2
Анализ для идентификации Т-клеточных пептидных эпитопов с использованием "наивных" Т-клеток человека
Свежие клетки периферической крови человека брали у "наивных" людей, т.е. лиц, о которых неизвестно, что они были подвергнуты действию протеазы Bacillus lentus или сенсибилизированы к протеазе Bacillus lentus, для определения антигенных эпитопов в протеазе Bacillus lentus и субтилизине человека. Под "наивными" людьми имеют в виду то, что о данном индивидууме нет сведений о том, что он подвергался действию протеазы или развивал реакцию на протеазу в прошлом. Периферические мононуклеарные клетки крови (хранящиеся при комнатной температуре, не более 24 часов) готовили для использования следующим образом. Приблизительно 30 мл раствора препарата лейкоцитной пленки из одной единицы цельной крови доводили до 50 мл забуференным фосфатом раствором Дульбекко (ДЗФР) и разделяли на две пробирки. Под пробы наслаивали 12,5 мл находящейся при комнатной температуре плотной среды для разделения лимфопрепарата (lymphoprep) (Nycomed, плотность 1,077 г/мл). Пробирки центрифугировали в течение тридцати минут при 600 g. Межфазную границу двух фаз собирали, объединяли и промывали в ДЗФР. Плотность клеток полученного раствора измеряли при помощи гемоцитометра. Жизнеспособность измеряли исключением трипанового синего.
Из полученного раствора получали культуру дифференцированных дендритных клеток из пробы мононуклеарных клеток периферической крови, имеющую плотность 108 клеток на колбу 75 мл, для культивирования в растворе следующим образом:
(1) 50 мл бессывороточной среды AIM V (Gibco) дополняли разведением 1:100 бета-меркаптоэтанола (Gibco). Колбы оставляли стоять в течение двух часов при 37°С в 5% СО2, чтобы дать моноцитам прикрепиться к стенке колбы.
(2) Дифференцировку клеток-моноцитов в дендритные клетки проводили следующим образом: неприкрепленные клетки удаляли и полученные прикрепленные клетки (моноциты) объединяли с 30 мл среды AIM V, 800 единиц GM-CSF (Endogen) и 500 единиц/мл IL-4 (Endogen); полученную смесь культивировали в течение 5 дней в условиях 37°С в 5% СО2. Спустя пять дней добавляли цитокин TNFα (Endogen) до 0,2 единиц/мл, добавляли цитокин IL-1α (Endogen) до конечной концентрации 50 единиц/мл и смесь инкубировали при 37°С в 5% СО2 в течение еще двух дней.
(3) На седьмой день добавляли митомицин С до концентрации 50 мкг/мл для остановки роста культуры теперь дифференцированных дендритных клеток. Раствор инкубировали в течение 60 минут при 37°С в 5% СО2. Дендритные клетки собирали осторожным соскабливанием прикрепленных клеток со дна колбы клеточным скребком. Затем прикрепленные и неприкрепленные клетки центрифугировали при 600 g в течение 5 минут, промывали ДЗФР и считали.
(4) Полученные дендритные клетки помещали в 96-луночную круглодонную матрицу-планшет при 2х104 клеток на лунку в общем объеме 100 микролитров среды AIM V.
CD4+ Т-клетки получали из замороженных аликвот проб клеток периферической крови, используемых для получения дендритных клеток, с применением набора для отбора CD4+ (Biotex) в соответствии с инструкциями изготовителей со следующими модификациями: аликвоты оттаивали и промывали таким образом, чтобы на колонку Cellect было нанесено 108 клеток; клетки ресуспендировали в 4 мл ДЗФР и 1 мл Cell-реагента из набора для отбора, раствор выдерживали при комнатной температуре в течение 20 минут. Полученный раствор центрифугировали в течение пяти минут при 600 g при комнатной температуре, осадок ресуспендировали в 2 мл ДЗФР и наносили на колонки Cellect. Эффлюент из колонок собирали в 2% сыворотке человека в ДЗФР. Полученный раствор CD4+ клеток центрифугировали, ресуспендировали в среде AIM V и определяли плотность клеток.
Суспензию CD4+ Т-клеток ресуспендировали до числа клеток 2х106/мл в среде AIM V для облегчения эффективного манипулирования с 96-луночным планшетом.
Пептидный антиген получают из 1 М исходного раствора в ДМСО разведением в среде AIM V при соотношении 1:10. 10 микролитров исходного раствора помещают в каждую лунку 96-луночного планшета, содержащую дифференцированные дендритные клетки. 100 мкл разведенного раствора CD4+ Т-клеток, приготовленного, как описано выше, дополнительно добавляют в каждую лунку. Используемые контроли включают разведенные слепые контроли ДМСО и положительные контроли столбнячного токсоида.
Конечные концентрации в каждой лунке, при общем объеме 210 мкл, являются следующими:
2 х 104 CD4+
2 х 105 дендритных клеток (R:S 10:1)
5 мМ пептид
Пример 3
Тестирование на уменьшенную аллергенность в вариантах протеазы определением целого фермента на клетку человека в анализе пролиферации in vitro
Обоснование:
Данный анализ предназначен для тестирования реакций пролиферации in vitro мононуклеарных клеток периферической крови человека (PBMC) на представляющий интерес пептид (Р1, BPN'-Y217L) и его варианты. Р1 и варианты фермента инактивировали обработкой фенилметилсульфонилфторидом ("PMSF"). PBMC человека культивировали с увеличивающимися дозами инактивированного Р1 и всех подлежащих тестированию вариантов. Тестируемыми вариантами в данных экспериментах являлись:
LAP 1:BPN'-Y217L; I79A
LAP 2:BPN'-Y217L; I79A; I122A
LAP 3:BPN'-Y217L; N76D; I122A
LAP 4:BPN'-Y217L; N76D; I79А; I122A
LAP 5:BPN'-Y217L; N76D
Пролиферация в ответ на Р1 показала, что целая молекула процессировалась и представлялась Т-клеткам антигенпрезентирующими клетками в популяции PBMC. Отсутствие пролиферации в ответ на данные варианты могло указывать, где модификации аминокислот успешно ингибировали процессинг, представление и/или распознавание Т-клетками эпитопов Р1.
Способы:
Образцы светлого слоя кровяного сгустка человека получали от Stanford University Blood Center (Palo Alto, CA). PBMC выделяли зависимым от плотности разделением, промывали в забуференном фосфатом солевом растворе Дульбекко (ДЗФР) и считали.
Протеазу Р1 и ее варианты инактивировали PMSF: 100 мМ PMSF в 100% этаноле добавляли к раствору 2 мг/мл ферментов при разведении 1:50. Смесь встряхивали на вортексе и давали ей стоять при комнатной температуре в течение 5 минут. Снова добавляли PMSF при разведении 1:50 и давали стоять в течение еще 5 минут. PMSF добавляли в третий раз, давали стоять еще 5 минут и оставшуюся активность фермента оценивали в колориметрическом анализе с субстратом сукцинил-Ala-Ala-Pro-Phe-пара-нитроанилидом (Delmar, EG, et al., (1979)).
PBMC ресуспендировали в концентрации 2 х 106 клеток/мл в 5% АВ-сыворотке человека, RPMI 1640 (пенициллин/стрептомицин/глутамин). Клетки высевали при 2 мл на лунку в 24-луночные планшеты и добавляли ферменты. Каждого донора испытывали с Р1 и с таким количеством вариантов, какое могло быть тестировано (ограничения числом клеток). Используемые концентрации фермента в большинстве исследований были 1, 5, 10 и 20 мкг/мл. Последние девять экспериментов выполняли с увеличенным диапазоном доз 5, 10, 20 и 40 мкг/мл фермента. Однако для согласованности собранные в данном описании результаты основаны на высшей дозе 20 мкг/мл. Культуры инкубировали при 37°С, 5% СО2 в течение 5 дней. На 5 день культуры ресуспендировали пипетированием и 100 мкл повторности из каждой лунки переносили в 96-луночные планшеты. В лунки добавляли кратковременно (пульс-мечение) тритированный тимидин (0,5 мкКи на лунку) и инкубирование продолжали в течение 6 часов при 37°С. Затем материал планшетов собирали и определяли включение.
Результаты:
30-40 индивидуумов испытывали на их реакции на протеазу Р1 и варианты на основе Р1 (например, LAP1-LAP5). Фермент LAP5 добавляли к протоколу позднее и с этим вариантом испытывали только 18 индивидуумов. Результаты для всех индивидуумов собирали, и они представлены в таблице и на графике ниже. Результат называли положительным ("да"), если индекс стимуляции (S.I.) был больше или равен 2,0 при более высоких дозах. Реакцию называли слабой, если она обнаруживала S.I. меньше 2,0, но выше фона (фиг. 4).
Шестьдесят процентов всех испытанных доноров увеличивали пролиферативную реакцию на Р1 с S.I. 2,0 или более. Реакции на все 6 ферментов были собраны и представлены в таблице ниже:
Многие индивидуумы, которые имеют положительные реакции на данные варианты, имели гораздо более низкие реакции, чем на исходную молекулу протеазы Р1.
Выводы:
Все испытанные варианты индуцируют более низкий процент респондеров. Все варианты включают аминокислотные замены в участке 70-84, либо замену N76D, либо замену I79A. Небольшое число доноров отвечали на каждый из вариантов, что предполагает, что данные варианты могли быть процессированными и представленными антигенпрезентирующими клетками в культурах. Однако ответные реакции на варианты всегда были более низкими, чем на исходную молекулу Р1. Только у одного индивидуума из 40 испытанных (Т78186) имелась ответная реакция на вариант в отсутствие реакции на исходный фермент. Этот донор отвечал на LAP1 и LAP2, но не на LAP3, LAP4 или LAP5.
Пример 4
Определение специфического остатка измененной аллергенности в эпитопе
Пептидные варианты на основе последовательности 70-84 Р1 испытывали в анализе картирования Sticker, et al., с пробами крови 20 доноров одной местности. Набор пептидов конструировали с помощью Mimostopes (San Diego, CA). Для каждого из данных пептидных вариантов конструировали содержащие замены трех аминокислот 15-меры для охвата всего участка предполагаемого изменения. Это делали для гарантии того, чтобы не был создан новый Т-клеточный эпитоп в другой "рамке считывания" 3-мера, когда данный вариант включают в протеазу с низкой аллергенностью. Исходные пептиды в данном наборе анализировали масс-спектрометрией и было обнаружено, что они являются приблизительно на 70% интактными 15-мерами.
Последовательности пептидов были следующими:
Тримерные "потомки" в каждом участке не показаны для ясности.
Двадцать проб крови использовали для тестирования всех пептидных вариантов. Пептиды использовали при 5 мкМ. У данной группы людей было обнаружено, что 50% доноров отвечали на участок 70-84 фиг.4B. Все из вариантов 70-84 индуцировали значимо более низкие реакции. Следует обратить внимание на то, что только один индивидуум отвечал на пептид I79A и никто из других не отвечал на пептид N76D, что иллюстрировало уменьшение иммуногенной реакции данного варианта после указанной модификации пептида.
Пример 5
Определение специфического остатка измененной аллергенности во втором эпитопе
Ряд пептидов с заменами аланином, описывающих участок 109-123 Р1, испытывали по стандартной методике анализа праймирования (Stickler, MM, et al., J. Immunother. 23(6):654-660 (2000). Последовательность по 109-123 была: NGIEWAIANNMDVIN. Пептиды с аланиновыми заменами изображены на фиг.6. Не-репондеры изображены на фиг.4С.
Использовали всего двадцать доноров. Два индивидуума достигали индекса стимуляции ["SI"] 3 или более (фиг.5), что согласовалось с низким процентом "наивных" респондеров на данный участок. Величина индекса стимуляции "1,0" равна уровням фона. Например, величина индекса стимуляции 2 обозначает, что реакция была в два раза выше уровня фона. Для получения более надежной оценки якорных остатков собирали также данные для всех индивидуумов, SI-реакция которых на контрольный пептид была равна 2 или большей (фиг.7). На основании этих данных замену в положении 13 можно было считать наилучшей для уменьшения иммуногенности, так как ни один из не-респондеров не увеличивал реакцию на такое изменение (фиг.7), и все респондеры с SI, равным 2 или более, относительно контрольного пептида обнаруживали уменьшенную пролиферацию в ответ на измененный пептид. Аминокислотная замена в пептиде № 13 обозначена I122A и представляет собой последовательность: NGIEWAIANNMDVAN.
Кроме того, на основании этих данных замену в положении 11 можно было считать наилучшей для увеличения иммуногенной реакции, так как три из пяти респондеров с SI, равным 2 или более, относительно контрольного пептида обнаруживали увеличенную пролиферацию в ответ на измененный пептид. Аминокислотная замена в пептиде № 11 обозначена D120A и представляет собой последовательность: NGIEWAIANNMAVIN.
Пример 6
Уменьшение аллергенности in vivo Т-клеточных реакций на Р1 мыши HLA-DR3/DQ2
Способы:
Трансген HLA-DR3/DQ2 размножали на фоне нокаута (С2D) МНС класса II для создания мышей, используемых в этом исследовании (Cosgrove D, et al., Cell 66:1051-66 (1991)). В данных исследованиях использовали как самцов, так и самок мышей. Возраст животных был в диапазоне от одного года до 6-8 недель. Все животные разводились и содержались в Aviron Animal Facility (Mountain View, CA), AALAC аккредитованном предприятии. Животных оценивали проточной цитометрией и было обнаружено, что они экспрессируют высокие уровни HLA-DR и низкие уровни HLA-DQ, с использованием двух различных реагентов, содержащих антитела против HLA-DQ. Самки экспрессируют в целом более высокие уровни молекул HLA, чем самцы. Животных иммунизировали несколькими способами, в том числе иммунизациями в подушечку лапки в полном адъюванте Фрейнда (CFA), внутрибрюшинной иммунизацией в CFA и внутрибрюшинной иммунизацией протеазой Р1, осажденной на квасцах.
Результаты :
Для подтверждения того, что мыши HLA-DR3/DQ2 процессируют и представляют эпитопы 70-84 и/или 109-123 из интактного фермента Р1, реакции спленоцитов (селезеночных макрофагов) подвергали картированию эпитопов в Р1-иммунизированных мышах. Самок и самцов мышей иммунизировали три раза 10 мкг Р1 в квасцах в дни 1, 3 и 10. Селезенки удаляли в день 15. Спленоциты самок мышей помещали in vitro при 106 клеток на лунку с 50 мкг/мл Р1-пептидов. Спленоциты 5 самцов мышей объединяли и устанавливали культуры в двух повторностях, как описано для спленоцитов самок мышей. Культуры пульс-метили (кратковременно метили) 0,5 мкКи тритированного тимидина на 24 час и собирали на 48 час. Импульсы для повторностей культур усредняли и вычитали фон. Импульсы фона для каждой культуры были 2486±218 имп/мин для Р1 в квасцах самок HLA-DR3/DQ2 (фиг.7А) и 5314±529 имп/мин для Р1 в квасцах самцов HLA-DR3/DQ2 (фиг.7В). Самки мышей отвечали на 20 мкг/мл инактивированного PMSF Р1 в культуре с индексом стимуляции 2,2, спленоциты самцов с SI 1,7. Реакции на 10 мкг/мл РНА были сильными, причем самки показали SI 18, а самцы SI 10.
Обе группы мышей (самцы и самки, описанные выше) обнаружили заметную реакцию на пептид 109-123. Реакция на пептид 70-84 отсутствовала у самок мышей, иммунизированных данным способом. Однако самцы мышей проявляли реакцию на этот пептид.
Пример 7
Конструирование низкоаллергенных стабильных вариантов протеазы
После определения местоположения Т-клеточного эпитопа конструировали варианты протеазы с использованием установленных способов конструирования белков. Варианты конструировали таким образом, что высокоаллергенную аминокислотную последовательность белка заменяли соответствующей последовательностью из менее аллергенного гомолога. В этом случае заменяли различные остатки в мутантном субтилизине (Р1) Bacillus amyloliquefaciens. Получение протеазы Р1 описано в переопубликованном патенте США RE 34606, Европейском патенте 130756 и патенте США 5441882. Ген варианта Р1 и маркерный ген хлорамфеникола фланкировали повторяемой последовательностью, соответствующей последовательности 5' относительно локусов apre E, для амплификации числа копий с использованием отбора на основе хлорамфеникола.
Конструировали три мутанта протеазы.
LAP2
Вариант протеазы LAP2 вводили в Р1 (BPN'-Y217L) превращением I79 в аланин и I122 в аланин сайт-направленным мутагенезом в векторе на основе pBluescript.
В полученной плазмиде LAP2 последовательность 5' относительно локуса aprE повторяли после гена хлорамфеникола для амплификации числа копий гена с использованием увеличивающихся концентраций хлорамфеникола. Плазмиду LAP2 трансформировали в продукционный штамм Bacillus при помощи стандартной процедуры трансформации. Трансформанты отбирали на LA-чашках, содержащих 5 мкг/мл хлорамфеникола. Трансформанты выращивали и субкультивировали в среде LB с увеличивающимися уровнями хлорамфеникола для амплификации числа копий гена LAP2 на хромосомах. После амплификации штаммов LAP2 до 25 мкг/мл хлорамфеникола трансформанты LAP2 высевали на LA+25 мкг/мл хлорамфеникола, содержащем 1% обезжиренное молоко, и анализировали на присутствие зон подавления, которые указывали на протеазную активность. Амплифицированные штаммы LAP2 образовывали зоны подавления в анализе с чашками с обезжиренным молоком.
LAP3
Вариант протеазы LAP3 вводили в Р1 заменой N76 остатком аспарагиновой кислоты и заменой I122 аланином сайт-направленным мутагенезом в векторе на основе pBluescript с образованием LAP3. LAP3 трансформировали в штамм-продуцент Bacillus и амплифицировали, как описано выше, и высевали на чашки с обезжиренным молоком. Трансформанты LAP3 образовывали зоны подавления в анализах с чашками с обезжиренным молоком.
LAP4
Вариант протеазы LAP3 вводили в Р1 заменой N76 остатком аспарагиновой кислоты и заменой I79 остатком аланина и I122 аланином сайт-направленным мутагенезом в векторе на основе pBluescript с образованием LAP4. LAP4 трансформировали в штамм-продуцент Bacillus и амплифицировали, как описано выше, и высевали на чашки с обезжиренным молоком. Трансформанты LAP4 образовывали зоны подавления в анализах с чашками с обезжиренным молоком.
Пример 8
Мутации, стабилизирующие протеазу более низкой аллергенности (N76D, I79A, I122A, N218S, Q206L, P40Q, D41A, H238Y)
Ниже перечислены варианты, полученные для увеличения стабильности при помощи сайт-направленных мутаций:
Р1-N76D/I79A/I122A/N218S;
P1-N76D/I79A/I122A/Q206L;
P1-N76D/I79A/I122A/Q206L/N218S;
P1-I79A/I122A/Q206L;
P1-I79A/I122A/N218S;
P1-I79A/I122A/P40Q;
P1-I79A/I122A/D41A и
P1-I79A/I122A/H238Y.
Каждый вариант протеазы вводили в Р1 заменой соответствующих остатков, как желательно (например, N76 остатком аспарагиновой кислоты, I79 остатком аланина, I122 остатком аланина, Q206 остатком лизина, N218 остатком серина, Р40 остатком глутамина, D41 остатком аланина и Н238 остатком тирозина) сайт-направленным мутагенезом в векторе на основе pBluescript для создания соответственного стабилизированного варианта LAP. Каждый стабилизированный вариант LAP трансформировали в штамм-продуцент Bacillus и амплифицировали, как описано выше, и высевали на чашки с обезжиренным молоком. Трансформанты LAP образовывали зоны подавления в анализах с чашками с обезжиренным молоком.
Пример 9
Мутации, стабилизирующие протеазу более низкой аллергенности (A216K, D181G, S101V, G215A, A216E, L217S, R247Y, R247S, R247Q, G48S, S101Q/S154G, G128S, S182T, S101R, Y104W/I107V, L250G, T254G, T254A, G258S, M50A, G47S, A48G, S182R, S183R, Q185A, S101R/I107V, S248G, Y262F)
Ниже перечислены варианты, полученные для увеличения стабильности при помощи сайт-направленных мутаций:
Р1-N76D/I79A/I122A/A216K;
Р1-N76D/I79A/I122A/D181G;
Р1-N76D/I79A/I122A/S101V;
Р1-N76D/I79A/I122A/G215A;
Р1-N76D/I79A/I122A/A216E;
Р1-N76D/I79A/I122A/L217S;
Р1-N76D/I79A/I122A/R247Y;
Р1-N76D/I79A/I122A/R247S;
Р1-N76D/I79A/I122A/R247Q;
Р1-N76D/I79A/I122A/G46S;
Р1-N76D/I79A/I122A/S101Q/S154G;
Р1-N76D/I79A/I122A/G128S;
Р1-N76D/I79A/I122A/S182T;
Р1-N76D/I79A/I122A/S101R;
Р1-N76D/I79A/I122A/Y104W/I107V;
Р1-N76D/I79A/I122A/L250G;
Р1-N76D/I79A/I122A/T254G;
Р1-N76D/I79A/I122A/T254A;
Р1-N76D/I79A/I122A/G258S;
Р1-N76D/I79A/I122A/M50A;
Р1-N76D/I79A/I122A/G47S;
Р1-N76D/I79A/I122A/A48G;
Р1-N76D/I79A/I122A/S182R;
Р1-N76D/I79A/I122A/S183R;
Р1-N76D/I79A/I122A/Q185A;
Р1-N76D/I79A/I122A/S101R/I107V;
Р1-N76D/I79A/I122A/S248G и
Р1-N76D/I79A/I122A/Y262F.
Каждый вариант протеазы вводили в Р1 заменой соответствующих остатков, как желательно (например, N76 остатком аспарагиновой кислоты, I79 остатком аланина, I122 остатком аланина, А216 остатком лизина, D181 остатком глицина, S101 остатком валина, G215 остатком аланина и т.д.) сайт-направленным мутагенезом в векторе на основе pBluescript для создания соответственного стабилизированного варианта LAP. Каждый стабилизированный вариант LAP трансформировали в штамм-продуцент Bacillus и амплифицировали, как описано выше, и высевали на чашки с обезжиренным молоком. Трансформанты LAP образовывали зоны подавления в анализах с чашками с обезжиренным молоком.
Пример 10
Гидролиз диметилказеина ("DMC") мутантным вариантом субтилизина
Мутантный вариант субтилизина (Р1, LAP2, LAP3 и LAP4), выделенный и очищенный описанными в данном описании способами, анализировали на его способность гидролизовать коммерческий синтетический субстрат диметилказеин (Sigma C-9801). Раствор DMC-субстрата 5 мг/мл готовили в подходящем буфере (5 мг/мл DMC, 0,005% (масс/масс) Твин 80® (полиоксиэтиленсорбитанмоноолеат, Sigma P-1754)). Подходящими для DMC-субстрата буферами были следующие буферы: 50 мМ ацетат натрия для рН 5,5; 50 мМ N-трис(гидроксиметил)метил-2-аминоэтансульфоновая кислота ("TES") для рН 6,5; 50 мМ пиперазин-N-N'-бис-2-этансульфоновая кислота ("PIPES") для рН 7,5; и 50 мМ Трис для рН 8,5. 200 мкл желательного рН-субстрата переносили в 96-луночный микротитрационный планшет и предварительно инкубировали при 37°С в течение двадцати минут перед добавлением фермента. Цветную реакцию способа с 2,4, 6-тринитробензолсульфонатной солью ("TNBS") определяли на спектрофотометре SpectraMax 250. Этот анализ измеряет ферментативный гидролиз DMC до пептидов, содержащих свободные аминогруппы. Аминогруппы реагируют с 2,4,6-тринитробензолсульфоновой кислотой с образованием окрашенного в желтый цвет комплекса.
Таким образом, чем более глубоко окрашена реакционная смесь, тем больше измеряемая активность. Анализ детектирования TNBS выполняли на супернатанте после двух часов инкубации при 37°С. Раствор 1 мг/мл TNBS готовили в реагенте (2,4 г NaOH, 45,4 г Na2B4)7 х 10Н2О, растворенного нагреванием в 1000 мл). Аликвоты по 60 мкл помещали в 96-луночный микротитрационный планшет. В каждую лунку добавляли 10 мкл инкубированного раствора фермента, описанного выше, и перемешивали в течение 20 минут при комнатной температуре. 20 мкл раствора NaH2PO4 (70,4 г NaH2PO4×Н2 О и 1,2 г Na2SO3 в 2000 мл) смешивали в течение 1 минуты в лунках для остановки реакции и определяли оптическую плотность при 405 нм в спектрофотометре SpectraMax 250. Также готовили контроль (тот же самый раствор TNBS без фермента). Гидролиз измеряли по следующей формуле:
Оптическая плотность405 (раствор фермента)-Оптическая плотность405 (без фермента)
при варьирующих концентрациях фермента (0, 2,5, 5, 7,5 и 10 ч.млн.). Данные на фиг.8-10 показывают сравнительную способность мутантных вариантов гидролизовать такой субстрат по отношению к протеазам известного мутантного варианта (Р1).
Как можно видеть на данных фигурах, все три фермента показали значительный гидролиз DMC-субстратов при различных рН и различных концентрациях фермента.
Пример 11
Гидролиз коллагена, эластина и кератина вариантами протеаз
Мутантный вариант субтилизина (Р1, LAP2, LAP3 и LAP4), выделенный и очищенный описанными в данном описании способами, анализировали на его способность гидролизовать коммерческие субстраты, бычий коллаген (Sigma C-9879), бычий эластин (Sigma Е-1625) и бычий кератин (ICN Biomedical 902111). Готовили раствор субстрата 5 мг/мл (0,005% Твин 80®). Каждый субстрат готовили при подходящем рН, как описано (например, рН 5,5, 6,5, 7,5 и 8,5). 1,5 мл каждого субстрата переносили в 24-луночный планшет Costar при 37°С. Планшеты предварительно инкубировали при 37°С в течение двадцати минут перед добавлением фермента. Способ детектирования с TNBS, описанный выше, выполняли на супернатанте после двух часов инкубирования при 37°С.
Данные на фиг.11-13 показывают сравнительную способность мутантных вариантов гидролизовать такие субстраты по отношению к протеазам известного мутантного варианта (Р1).
Как можно видеть на данных фигурах, все три фермента показали значительный гидролиз субстратов коллагена, эластина и кератина при различных рН и различных концентрациях фермента.
Пример 12
Термостабильность вариантов протеазы в буфере, содержащем пиперазин-N-N'-бис-2-этансульфоновую кислоту ("PIPES")
Параметры: Определения проводили в ПЦР-термоциклере типа Stratagene Robocycler с использованием 5,0 ч.млн. фермента (применяли один из Р1, LAP2, LAP3, LAP4) в пяти временных точках (5, 10, 20, 40 и 60 минут) при рН 6,5 при каждой температуре (в диапазоне от 42 до 56°С с интервалами два градуса в описанном выше ПЦР-термоциклере), стабильность измеряли при каждом втором градусе Цельсия от 42 до 56°С.
Готовили 50 мМ PIPES-буфер (50 мМ PIPES, 0,005% Твин 80®). рН доводили до 6,5.
Пробы анализировали с использованием стандартного анализа с сукцинил-ala-ala-pro-phe-пара-нитроанилидом ("SAAPFpNA") (Delmar, E.G., et al., Anal. Biochem. 94 (1979) 316-320; Achtstetter, Arch. Biochem. Biophys 207:445-54 (1981)) (рН 6,5, 25°С). Пробы разбавляли до приблизительно 300 миллиOD/мин. Термостабильность выражали в виде периода полужизни (H.L.) фермента (мин), определяемого следующим образом:
H.L. = In2/наклон, где наклон обозначает наклон кривой скорости по времени для каждой температуры.
Как можно видеть на фиг.14, мутантный вариант LAP4 имел наилучшую стабильность, которая была лучше, чем стабильность контрольного Р1 при температуре более 52°С.
Пример 13
Термостабильность вариантов протеазы в N-трис(гидроксиметил)метил-2-аминоэтансульфоновой кислоте ("TES")
Параметры: Определения проводили с использованием 5,0 ч.млн. фермента (Р1, LAP2, LAP3, LAP4) в пяти временных точках (5, 10, 20, 40 и 60 минут) при рН 6,5 при каждой температуре (в диапазоне от 42 до 56°С с интервалами два градуса с использованием приведенного выше температурного градиента ПЦР-термоциклера), стабильность измеряли при каждом втором градусе Цельсия от 42 до 56°С.
Готовили TES-буфер смешиванием 50 мМ TES (Sigma Т 1375), 0,005 Твин 80®. рН доводили до 6,5.
Термостабильность вариантов определяли в виде остаточной активности варианта, измеренной с использованием сукцинил-ala-ala-pro-phe-пара-нитроанилида ("SAAPFpNA") (Sigma no. S-7388, Mol. Wt. 624,6 г/моль) (E.G. Delmar et al., Anal. Biochem. 94 (1979) 316-320; Achtstetter, Arch. Biochem. Biophys 207:445-454 (1981)) (рН 6,5, 25°С). Образовавшийся (желтый) п-нитроанилид (pNA) измеряли спектрофотометрически при 410 нм: εм = 8,480 М-1·см-1, с использованием спектрофотометра SpectraMax 250, причем пробы разбавляли до приблизительно 300 мOD/мин. Термостабильность выражали в виде периода полужизни (мин), как описано выше.
Как можно видеть на фиг.15, мутантный вариант LAP4 имел наилучшую стабильность, которая была лучше, чем стабильность контрольного Р1 при температуре более 50°С.
Пример 14
Гидролиз диметилказеина ("DMC") и кератина мутантным вариантом субтилизина
Ферментативную активность вариантов, приготовленных, как описано в примере 9, сравнивали с ферментативной активностью LAP2 с использованием субстратов DMC и кератина, как описано в способах, представленных в примерах 10 и 11. Результаты суммированы в таблице 2.
Пример 15
Стабильность вариантов протеазы в растворе для мытья тела
С использованием клонированных ферментов (как описано в примере 1) стабильность различных вариантов протеазы измеряли с применением следующего протокола. Результаты суммированы в таблице ниже.
Способ измерения стабильности раствора для мытья тела
Параметры: (Р1, LAP2, LAP3, LAP4), 30 минут при 45°С в одном исследовании и 30 минут при 50°С во втором исследовании.
50/50 (м/м) раствор для мытья тела готовили смешиванием твердого вещества для мытья тела под торговой маркой ZEST® (Procter & Gamble, Cincinnati, Ohio) с деионизованной водой. рН буферной смеси был около 6,8.
Подлежащие тестированию ферменты разбавляли таким образом, чтобы их конечная концентрация фермента в 50 м/м % растворе средство для мытья тела:деионизованная вода давала изменение OD405 0,5-1,0 при анализе 10 мкл раствора фермент/средство для мытья тела с использованием способа конечной точки SAAPFpNA-анализа (Delmar, et al., 1979). После установления величины разбавления 200 мкл разбавленной смеси помещали в лунки 96-луночного микротитрационного планшета. Планшет герметизировали и помещали на водяную баню при 40°С в одном исследовании и при 50°С в другом исследовании. Планшеты удаляли из водяной бани спустя 45 минут и пробы по 10 мкл анализировали по способу конечной точки. Остаточный % активности рассчитывали как 100 х конечная активность:начальная активность.
Как можно видеть из таблицы 3, варианты, включающие N76D, имели увеличенную величину остаточной ферментативной активности и, следовательно, более широкий диапазон термостабильности, чем Р1. Например, при 50°С соединения с N76D имели 71%, 29%, 64%, 58% и 84% остаточной активности, в то время как Р1, без вариантов со стабилизирующими остатками, имел только 11% остаточную активность. Кроме того, в то время как Q206L, N218S, P40Q, D41A и H238Y имели 76%, 85%, 72%, 77% и 73% остаточную активность, LAP2 имел 56% остаточную активность. Все ферменты имели увеличенную стабильность в присутствии средства для мытья тела при 50°С, но Р1-N76D, N79A, I122A, Q206L, N218S имели наилучшую стабильность.
После описания предпочтительных вариантов данного изобретения специалисту в данной области будет очевидно, что могут быть произведены различные модификации в отношении описанных вариантов и что такие модификации, как подразумевается, входят в объем данного изобретения.
Реферат
Изобретение относится к биотехнологии и касается варианта белка субтилизина Bacillus amyloliguefaciens с заменой Y217L, содержащий Т-клеточный эпитоп, при этом указанный Т-клеточный эпитоп указанного варианта включает одну или несколько аминокислотных замен, выбранных из группы, состоящей из остатков, соответствующих положениям 76, 79 и 122, где указанный вариант субтилизина необязательно имеет замену в одном или нескольких из положений 3, 31, 40, 41, 46, 47, 48, 50, 76, 101, 104, 107, 111, 128, 147, 154, 181, 182, 183, 185, 206, 215, 216, 218, 238, 247, 248, 250, 254, 258, 262. Изобретение относится также к молекулам ДНК, которые кодируют варианты субтилизина, клеткам-хозяевам, содержащим данную ДНК, а также к композициям для ухода за кожей, содержащим указанный вариант субтилизина. Изобретение позволяет получить варианты субтилизина, которые проявляют уменьшенную иммуногенную реакцию у человека по сравнению с исходным субтилизином. 8 н. и 23 з.п. ф-лы, 16 ил., 3 табл.
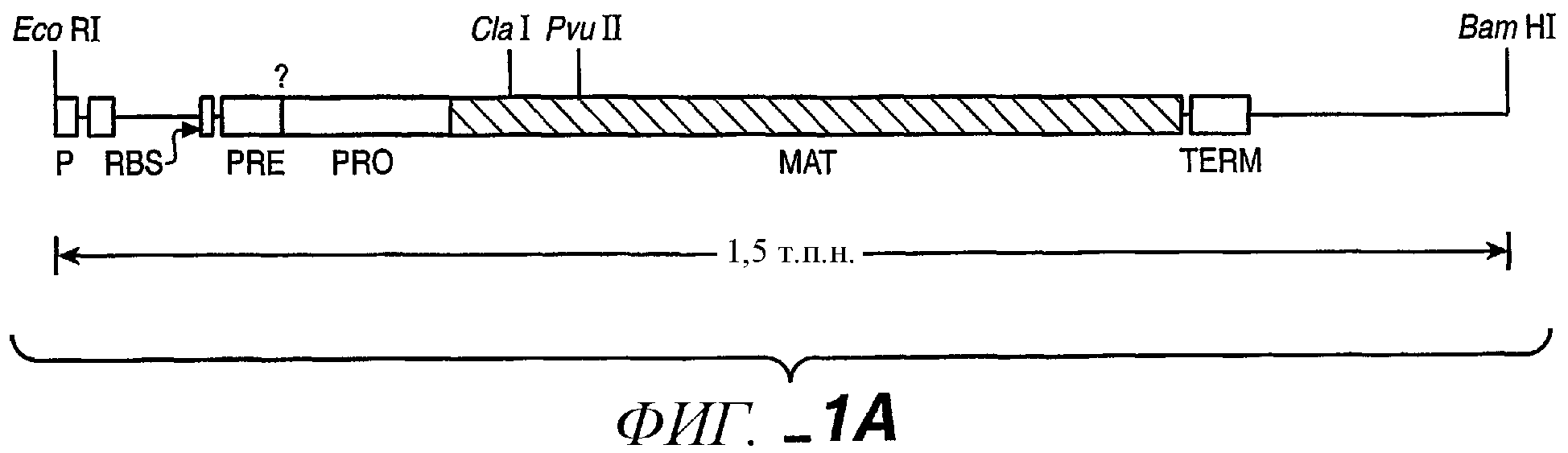
Формула
Документы, цитированные в отчёте о поиске
Модифицированный субтилизин, днк, кодирующая модифицированный субтилизин, вектор экспрессии, кодирующий днк, и штамм культуры клетки хозяина

Комментарии