Модифицированный субтилизин, днк, кодирующая модифицированный субтилизин, вектор экспрессии, кодирующий днк, и штамм культуры клетки хозяина - RU2136756C1
Код документа: RU2136756C1
Чертежи

































Описание
Настоящее изобретение относится к новым вариантам карбонилгидролазы с аминокислотными последовательностями, в которых многочисленные аминокислотные остатки предшественника карбонилгидролазы, особенно в положении, соответствующем или эквивалентном +760, в сочетании с одним или более аминокислотным остатком, выбранным из группы, включающей положения +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204,- +206, +210, +216, +217, +218, +222, +260, +265 и/или +274 в последовательности субтилизина Bacillus amyloliquefaciens замещены другими аминокислотами. Такие мутанты/варианты карбонилгидролазы в основном получают путем модификации in vitro последовательности ДНК, кодирующей предшественник природной или рекомбинантной карбонилгидролазы, так что в соответствующей аминокислотной последовательности предшественника карбонилгидролазы происходят замещения многочисленных аминокислотных остатков сами по себе или в сочетании с другими замещениями в других положениях, а также с другими инсерциями и делециями.
Предпосылки создания изобретения.
Сериновые протеиназы относятся к подгруппе карбонилгидролаз. Они составляют отдельный класс ферментов, обладающих широкой специфичностью и многочисленными биологическими функциями (см. Stroud.R. Sci.Amer., 131:74-88). Несмотря на функциональную разнородность, механизм каталитического расщепления сериновых протеиназ свойственен по крайней мере двум генетически различным семействам ферментов: субтилизинам и химотрипсину млекопитающих, родственным и гомологичным бактериальным сериновым протеиназам (например, трипсину и трипсину S. gresius). Эти два семейства сериновых протеиназ обнаруживают значительное сходство механизмов катализа (Kraut.J. (1977), Ann.Rev.Biochem. , 46: 331-358. Более того, несмотря на различие первичной структуры, третичную структуру ферментов этих двух семейств объединяет наличие каталитическиактивной триады аминокислот, состоящей из серина, гистидина и аспартата.
Субтилизин представляет собой сериновую эндопротеиназу (м.масса 27,500), которая в больших количествах секретируется многими видами Bacillus и другими
микроорганизмами. Белковая последовательность субтилизина определена по крайней мере у четырех различных видов Bacillus. (Markland.F.S., et al., Honne-Seyler's Z. Physiol. Chem., 364:1537-1540).
Опубликована и трехмерная кристаллографическая структура субтилизина Bacillus amyloliquefaciens при разрешении 2,5 A. (Wright, C.S., et al., (1969), Nature, 221:235- 242: Drenth. J., et al.,(1972),
Eur.J.Biochem., 26:177-181. Эти исследования показывают, что несмотря на отсутствие генетического родства субтилизина с сериновыми протеиназами млекопитающих, указанные ферменты имеют сходное строение
активного центра. Кристаллические структуры субтилизина (полученные при использовании рентгеновских лучей), содержащие ковалентно-связанные пептидные ингибиторы (Robertus. J.D., et al., (1972),
Biochemistry, 11:2439-2449) или комплексы продукта (Robertus. J. D. , et al., (1976), J.Biol. Chem., 251: 1097-1103) также позволяют судить об активном центре и предполагаемой субстратсвязывающей
"щели" субтилизина. Кроме того, опубликовано множество исследований, посвященных кинетической активности и химическим модификациям пневмолизина (Philipp, М., et а1. (1983), Mol.Cell.Biochem., 51:5-32;
Svendsen, В. (1976), Carlsberg Res.Comm., 41;237-291; Markland, F.S., Id.). По крайней мере в одной работе описан субтилизин, у которого боковая цепь метионина в положении 222 под действием перекиси
водорода превращена в метионинсульфоксид (Stauffer, D.C., et al., (1965), J.Biol.Chem., 244: 5333-5338), а боковая цепь серина в положении 221 путем химической модификации преобразована в цистеин
(Polgar, et al., (1981), Biochimica et Biophysica Acta, 667:351-354.)
В патенте США N 4,760,025 (RE 34,606) описывается субтилизин, содержащий модифицированные аминокислотные остатки,
соответствующие следующим аминокислотам субтилизина Bacillus amyloliquefaciens: тирозин -1, аспартат +32, аспарагин +155, тирозин +104, метионин +222, глицин +166, гистидин +64, глицин +169,
фенилаланин +189, серин +33, серин +221, тирозин +217, глутамат +156 и аланин +152. В патенте США N 5,182,204 описан пневмолизин, содержащий модифицированный аминокислотный остаток в положении +224
субтилизина Bacillus amyloliquefaciens и других субтилизинов, причем модификацию осуществляют путем замещения, инсерции или делеции, и она может быть скомбинирована с модификациями аминокислотных
остатков, указанных в патенте США 4,760,025 (RE 34,606), что приводит к получению полезных мутантных форм или вариантов субтилизина. В патенте США N 5,155,033 описываются сходные мутантные формы
субтилизина, имеющие модифицированный аминокислотный остаток в положении +225 В. amyloliquefaciens. В патентах США N 5,185,258 и 5,204,015 описываются мутантные формы субтилизинов, имеющие
модифицированные аминокислотные остатки в положениях+123 и/или +274. Указанные документы приведены здесь в качестве ссылок, так же как и заявка на патент США SN 07/898,382, в которой охарактеризован
субтилизин, имеющий модифицированные аминокислотные остатки в положениях +99, +101, +103, +107, +126, +128, +135, +197 и +204. Все указанные патенты и заявки легко доступны. В патенте США N 4,914, 031
описываются некоторые аналоги субтилизина, включая субтилизин с модифицированным аминокислотным остатком в положении +76. Данный патент также приведен здесь в качестве ссылки. Однако аминокислотные
остатки, модифицированные согласно настоящему изобретению, и/или особые их комбинации, заявленные в формуле, в указанных выше источниках информации не раскрыты.
В соответствии с вышесказанным, один из заявленных объектов относится к вариантам карбонилгидролазы (предпочтительно субтилизину Bacillus amyloliquefaciens), содержащим многочисленные замены аминокислотных остатков в предшественнике карбонилгидролазы, в том числе +76 в сочетании с одной или более заменами, выбранными из группы, включающей положения + 99, +4101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210,+216, +217, +218, +222, +260, +265 4 и/или +274. Такие варианты в целом имеют по крайней мере одно свойство, отличное от аналогичного свойства предшественника карбонилгидролазы, из аминокислотной последовательности которого получена аминокислотная последовательность данного варианта.
Другими объектами изобретения являются последовательности ДНК, кодирующие варианты карбонилгидролазы, а также векторы экспрессии, содержащие указанные ДНК-последовательности.
Еще одним объектом изобретения являются клетки-хозяева, трансформированные указанными векторами, так же как и клетки-хозяева, способные экспрессировать соответствующие ДНК с образованием вариантов карбонилгидролазы как внутриклеточно, так и внеклеточно.
Указанные выше ссылки приведены здесь исключительно для описания уровня техники, известного на дату подачи заявки, и ничто не может поставить под сомнение право изобретателей использовать с этой целью информацию, основанную на ранее поданных заявках.
Краткое описание изобретения.
Изобретение относится к неприродным вариантам карбонилгидролаз, имеющим измененные протеолитическую активность, стабильность, субстратную специфичность, pH-профиль и/или физико-химические свойства по сравнению с предшественником карбонилгидролазы, из аминокислотной последовательности которого получают аминокислотную последовательность того или иного варианта. Предшественник карбонилгидролазы может быть природной или рекомбинантной карбонилгидролазой. Указанные варианты карбонилгидролазы имеют аминокислотную последовательность, которая не обнаруживается в природе, и образована в результате замещений многочисленных аминокислотных остатков в предшественнике- карбонилгидролазы другими аминокислотами. Эти многочисленные аминокислотные остатки в ферменте-предшественнике соответствуют положению +76 в сочетании с одним или более следующими положениями: +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, +222, +260, +265 и/или +274, причем данная нумерация соответствует порядку аминокислот в природном субтилизине Bacillus amyloliquefaciens или эквивалентным аминокислотным остаткам в других карбонилгидролазах или субтилизинах, например в субтилизине Bacillus lentus. Варианты карбонилгидролазы, заявленные в настоящем изобретении, содержат замещение аминокислотного остатка в положении +76 в сочетании с одной или более другими модификациями. Предпочтительные варианты ферментов, заявленные в настоящем изобретении, содержат замещения, делеции или инсерции аминокислотных остатков в следующих комбинациях: 76/99; 76/101; 76/103; 76/104; 76/107; 76/123; 76/99/101; 76/99/103; 76/99/104; 76/101/103; 76/101/104; 76/103/104; 76/104/107; 76/104/123; 76/107/123; 76/99/101/103; 76/99/101/104; 76/99/103/104; 76/101/103/104; 76/103/104/123; 76/104/107/123; 76/99/101/103/104; 76/99/103/104/123; 76/99/101/103/104/123; 76/103/104/128; 76/103/104/260; 76/103/104/265; 76/103/104/197; 76/103/104/105; 76/103/104/135; 76/103/104/126; 76/103/104/107; 76/103/104/210; 76/103/104/126/265 и/или 76/103/104/222. Наиболее предпочтительные варианты ферментов, заявленные в настоящем изобретении, содержат замещения, делеции или инсерции аминокислотных остатков в субтилизине В. amyloliquefaciens в следующих комбинациях: 76/99; 76/104; 76/99/104; 76/103/104; 76/104/107; 76/101/103/104; 76/99/101/103/104 и 76/101/104.
Изобретение также относится к вариантам ДНК-последовательностей, кодирующим указанные варианты карбонилгидролаз или субтилизина. Такие варианты ДНК-последовательностей происходят из ДНК-последовательности предшественника, которая кодирует природный или рекомбинантный фермент.
Для получения вариантов ДНК-последовательностей последовательность предшественника модифицируют так, что новая последовательность кодирует замещения одного или более специфических аминокислотных остатков, соответствующих положениям: 76, 99, 101, 103, 104, 107, 123,27, 105, 109, 126, 128, 135, 156, 166, 195, 197, 204, 206, 210, 216, 217, 218, 222, 260, 265 и/или 274 или их комбинациям в субтилизине Bacillus amyloliquefaciens. Несмотря на то, что аминокислотные остатки, подлежащие модификации, соответствуют таковым В. amyloliquefaciens (нумерация остатков подходит и для всех других субтилизинов), предпочтительной ДНК-последовательностью предшественника, используемой для осуществления настоящего изобретения, является ДНК-последовательность субтилизина Bacillus lentus, приведенная на фиг.6 (SEQ ID N 11).
Варианты ДНК-последовательностей, заявленные в настоящем изобретении, кодируют инсерции или замещения аминокислот в положении +76 в сочетании с одной или более другими модификациями. Предпочтительные варианты ДНК-последовательностей кодируют замещения или инсерции аминокислотных остатков в следующих сочетаниях: 76/99; 76/101; 76/103; 76/104; 76/107; 76/123; 76/99/101; 76/99/103; 76/99/104; 76/101/103; 76/101/104; 76/103/104; 76/104/107; 76/104/123; 76/107/123; 76/99/101/103; 76/99/101/104; 76/99/103/104; 76/101/103/104; 76/103/104/123; 76/104/107/123; 76/99/101/103/104; 76/99/103/104/123; 76/99/101/103/104/123; 76/103/104/128; 76/103/104/260; 76/103/104/265; 76/103/104/197; 76/103/104/105; 76/103/104/135; 76/103/104/126; 76/103/104/107; 76/103/104/210; 76/103/104/126/265 и/или 76/103/104/222. Наиболее предпочтительные варианты ДНК- последовательностей кодируют следующие модифицированные комбинации аминокислотных остатков: 76/99; 76/104; 76/103/104; 76/104/107; 76/101/103/104; 76/99/101/103/104 и 76/101/104. Указанные рекомбинантные ДНК-последовательности кодируют варианты карбонилгидролазы, имеющие новые последовательности аминокислот и, в целом, по крайней мере одно свойство, существенно отличающееся от аналогичного свойства предшественника карбонилгидролазы. К таким свойствам относятся протеолитическая активность, субстратная специфичность, стабильность, измененный pH-профиль и/или другие физико-химические признаки.
Настоящее изобретение относится к замещениям любой из 19 природных L-аминокислот в установленных положениях аминокислотной последовательности. Такие замещения могут осуществляться в любом предшественнике субтилизина (прокариотическом, эукариотическом, субтилизине млекопитающих и т.д.). Предпочтительно замещения осуществляют в каждом из идентифицированных положений аминокислотных остатков, которые не ограничиваются указанными: замещения в положении 76 включают D, H, E, G, F, K, P и N; замещения в положении 99 включают D, Т, N, Q, G, и S; замещения в положении 101 включают G, D, К, L, A, E, S и R; замещения в положении 103 включают Q, Т, D, E, Y, К, G, R, S и A; замещения в положении 104 включают все девятнадцать природных аминокислот; замещения в положении 107 включают V, L, М, Y, G, E, F, Т, S, A, N и I; замещения в положении 123 включают N, Т, I, G, A, C и S; замещения в положении 27 включают К, N, С, V и Т; замещения в положении 105 включают A, D, G, R и N: замещения в положении 107 включают A, L, V, Y, G, F, Т, S, и A; замещения в положении 109 включают S, К, R, A, N и D; замещения в положении 126 включают A, F, I, V и G: замещения в положении 128 включают G, L и А; замещения в положении 135 включают A, F, I, S и V; замещения в положении 156 включают D, E, A, G, Q, и K; замещения в положении 166 включают все девятнадцать природных аминокислот; замещения в положении 195 включают E; замещения в положении 197 включают E; замещения в положении 204 включают A, G, C, S и D; замещения в положении 206 включают L, Y, N, D и E; замещения в положении 210 включают L, I, S, С и F; замещения в положении 216 включают V, E, Т и К; замещения в положении 217 включают все девятнадцать природных аминокислот; замещения в положении 218 включают S, A, G, Т и V; замещения в положении 222 включают все девятнадцать природных аминокислот; замещения в положении 260 включают P, N, G, A, S, С, К и D; замещения в положении 265 включают N, G, A, S, С, К, Y и H; и замещения в положении 274 включают A и S. Особенно предпочтительные аминокислотные остатки, которые подлежат замещению в каждом из указанных положений, приведены в табл. 1. (см.в конце описания). Несмотря на это, следует понимать, что в каждом положении можно произвести замену на любую аминокислоту.
Кроме того, в настоящее изобретение включены векторы экспрессии, содержащие указанные варианты ДНК-последовательностей карбонилгидролазы, а также клетки-хозяева, трансформированные такими векторами и способные продуцировать указанные варианты. Изобретение относится также к детергентным композициям, в состав которых входят заявленные в настоящем изобретении варианты карбонилгидролазы.
Краткое описание рисунков.
На фиг. 1A-С приведены последовательности аминокислот и ДНК для субтилизина Bacillus amyloliquefaciens и частичная рестрикционная карта гена (SEQ ID N 6).
На фиг. 2 приведены консервативные аминокислотные остатки субтилизинов Bacillus amyloliquefaciens (BPN') и Bacillus lentis (дикий тип).
На фиг. 3A и 3B приведены аминокислотные последовательности четырех субтилизинов. Верхняя строка соответствует аминокислотной последовательности субтилизина Bacillus amyloliquefaciens (иногда обозначаемого как субтилизин BPN') (SEQ ID N 7). Вторая строка соответствует аминокислотной последовательности субтилизина Bacillus subtilis (SEQ ID N 8). Третья строка соответствует аминокислотной последовательности субтилизина B.licheniformis (SEQ ID N9). Четвертая строка соответствует аминокислотной последовательности субтилизина Bacillus lentis (также обозначаемого как субтилизин 309 в заявке PCT W089/06276) (SEQ ID N 10). Звездочка означает отсутствие специфических аминокислотных остатков в сравнении с субтилизином BPN'.
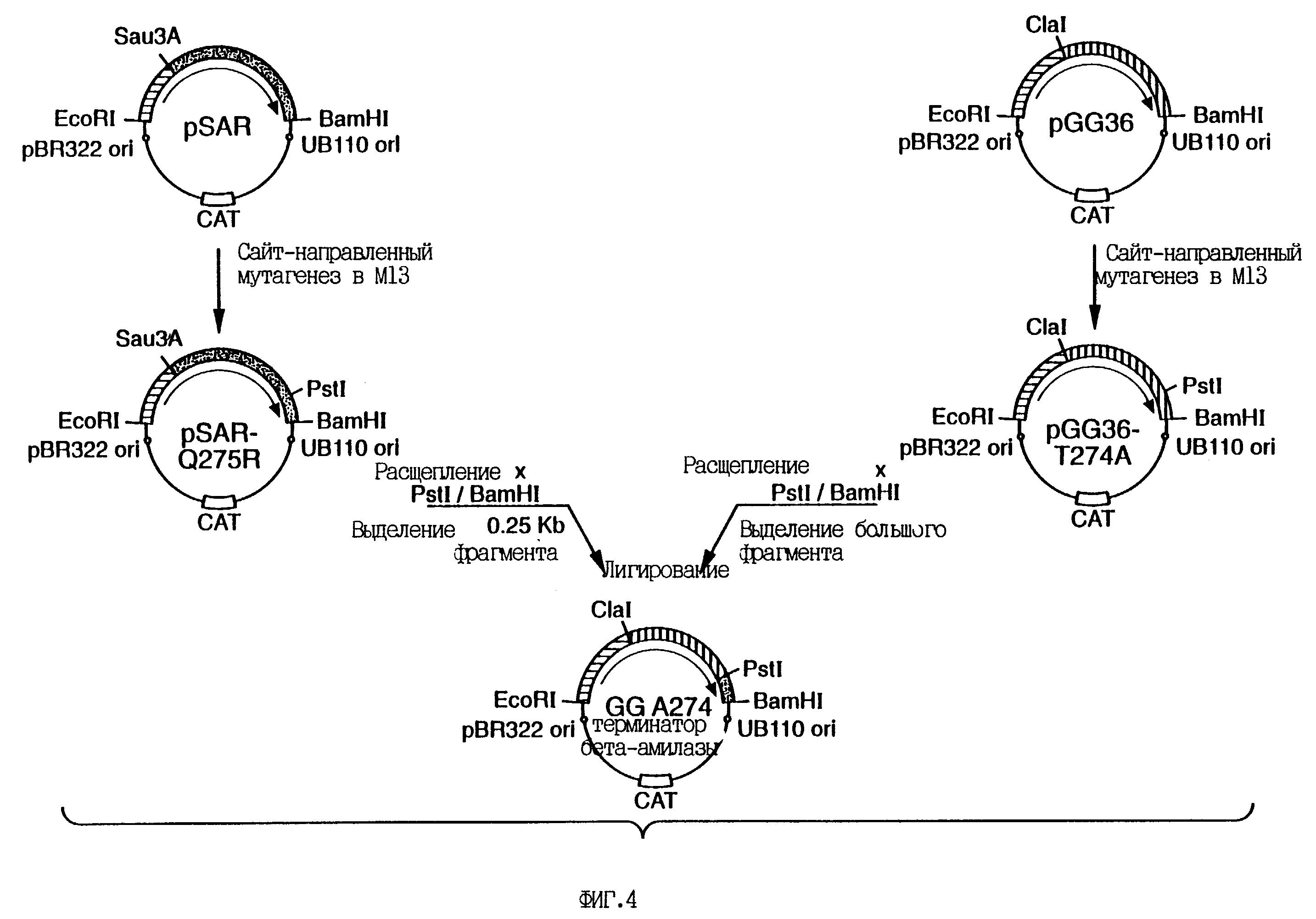
На фиг.4 приведена схема конструирования плазмиды GGA274.
На фиг. 5 приведена схема конструирования плазмиды GGT274, которая является промежуточной плазмидой по отношению к некоторым плазмидам экспрессии, используемым при осуществлении изобретения.
На фиг. 6A и 6B приведена аминокислотная последовательность субтилизина Bacillus lentis (SEQ ID N 11). Зрелый белок субтилизина кодируется последовательностью, начинающейся с кодона GCG (334-336), соответствующего аминокислоте аланину.
На фиг.7A и 7B приведены последовательности аминокислот и ДНК для субтилизина в случае предпочтительного варианта осуществления изобретения (N76D/S103A/V104I) (SEQ ID N 12). ДНК была модифицирована описанными способами, чтобы в положении 76 был закодирован аспартат, в положении 103 -аланин и в положении 104 - изолейцин. Вариант зрелого белка субтилизина кодируется последовательностью, начинающейся с кодона GCG (334-336), соответствующему аминокислоте аланину.
На фиг.8 приведена схема конструирования вектора pBCDAICAT.
На фиг.9 приведена схема конструирования вектора pUCCATFNA.
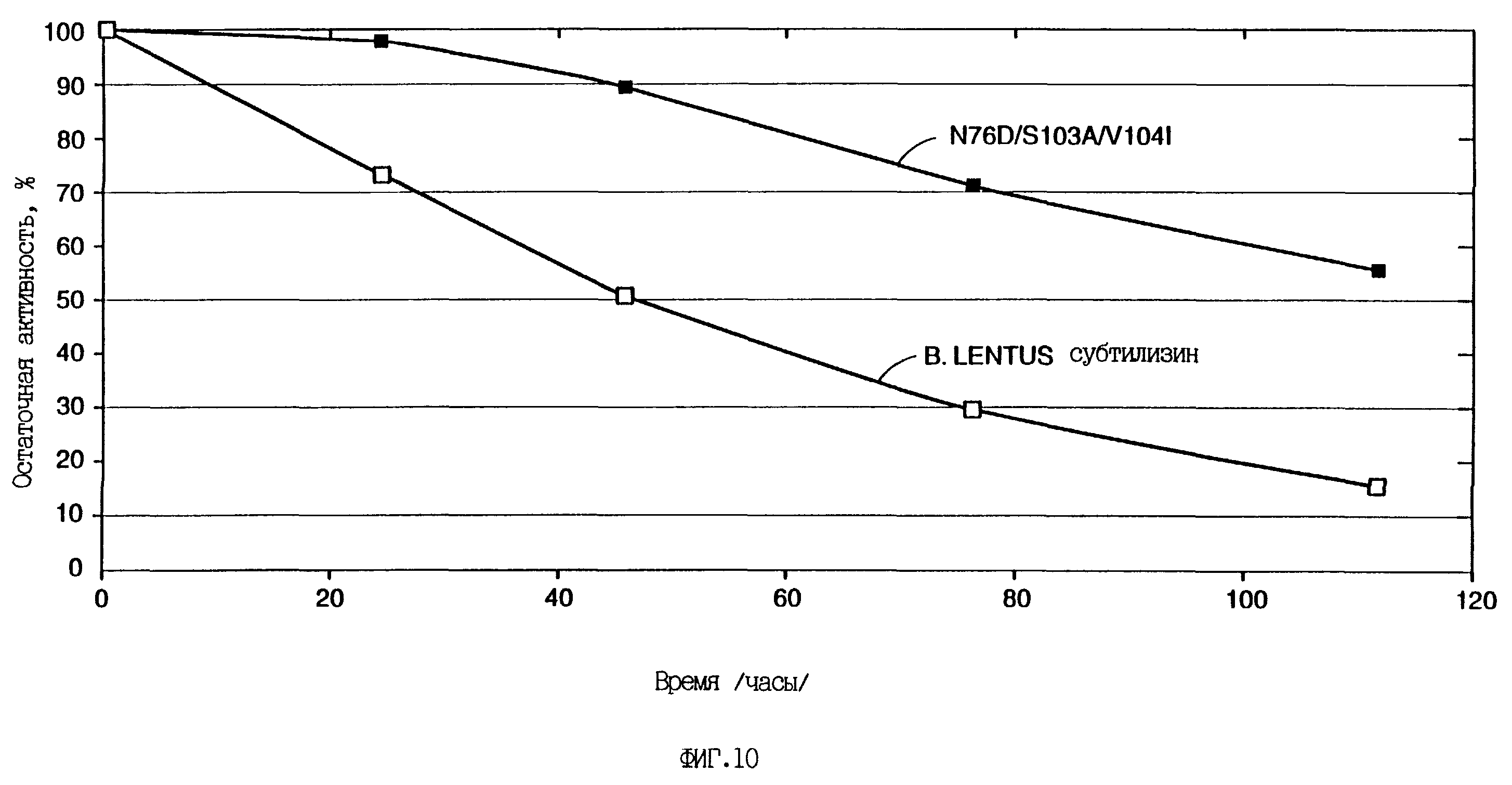
Фиг.10 иллюстрирует стабильность предпочтительной мутантной формы фермента по сравнению с формой дикого типа в жидкой среде с детергентом.
Подробное описание изобретения.
Обнаружено, что полученные in vitro мутации в субтилизине B.lentus, затрагивающие аминокислотный остаток, эквивалентный таковому в положении +76 субтилизина Bacillus amyloliquefaciens, обеспечивают образование вариантов субтилизина, проявляющих измененную стабильность (например, измененную стабильность к аутопротеолизу) по сравнению с предшественником субтилизина. (cм. табл.IV и VI в конце описания).
Кроме того, обнаружено, что полученные in vitro мутации в аминокислотных остатках в положениях +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, +222, +260, +265 и/или +274 аминокислотной последовательности субтилизина Bacillus amyloliquefaciens как по отдельности, так и в комбинации друг с другом и в любом сочетании с мутациями в положении +76 приводят к образованию вариантов субтилизина с измененной протеолитической активностью, термостабильностью, субстратной специфичностью, а также с измененными профилем pH и физико-химическими свойствами.
Карбонилгидролазы относятся к ферментам, которые гидролизуют соединения, содержащие
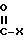
связи, в которых X представляет собой кислород или азот. Известны карбонилгидролазы природного происхождения и рекомбинантные. К природным карбонилгидролазам относятся собственно гидролазы, например пептидные гидролазы, такие как субтилизины или металлопротеиназы. Пептидные гидролазы включают альфа-аминоацилпептидную гидролазу, пептидиламинокислотную гидролазу, ациламиногидролазу, сериновую карбоксипептидазу, металлокарбоксипептидазу, тиоловую протеиназу, карбоксилпротеиназу и металлопротеиназу. К сериновым, тиоловым, аминокислотным и металлопротеиназам относятся как эндо-, так и экзопротеиназы.
К рекомбинантной карбонилгидролазе относится карбонилгидролаза с модифицированной последовательностью ДНК, для получения которой в ДНК природной карбонилгидролазы генерируют мутации, определяющие замену, инсерцию или делецию одного или более аминокислотных остатков в аминокислотной последовательности природной карбонилгидролазы. Соответствующие способы модификации описаны в настоящей заявке, а также в патентах США N 4,760,025 (RE 34,606), N 5,204,015 и 5,185,258, которые приведены здесь в качестве ссылок.
Субтилизины представляют собой бактериальные или грибные карбонилгидролазы, которые в основном расщепляют пептидные связи в белках и пептидах. Используемое здесь понятие "субтилизин" относится как к природному, так и к рекомбинантному субтилизину. Известно, что различные виды микроорганизмов продуцируют и во многих случаях секретируют определенные природные субтилизины. Их аминокислотные последовательности не полностью гомологичны. Однако указанные субтилизины обнаруживают сходный тип протеолитической активности. Этот класс сериновых протеиназ имеет общий аминокислотный участок, а именно каталитическую триаду аминокислот, которая отлична от таковой у родственного химотрипсину класса сериновых протеиназ. Субтилизины и родственные химотрипсину сериновые протеиназы имеют каталитическую триаду аминокислот, включающую аспартат, гистидин и серин. В родственных субтилизину протеиназах относительный порядок указанных аминокислот в направлении от аминотерминального к карбокситерминальному концу следующий: аспартат, гистидин, серин. В родственных химотрипсину протеиназах аминокислоты расположены в следующем порядке: гистидин, аспартат, серин. Таким образом, описываемый здесь субтилизин относится к сериновым протеиназам, имеющим каталитическую триаду родственных субтилизину протеиназ. Примеры относятся к субтилизинам, приведенным на фиг.3, но не ограничиваются указанными ферментами.
К "рекомбинантному субтилизину" относится субтилизин с модифицированной последовательностью ДНК (вариант ДНК-последовательности или мутантная ДНК-последовательность), которая включает замещение, делецию или инсерцию одной или более аминокислот по сравнению с аминокислотной последовательностью природного субтилизина. Подходящие способы получения таких модификаций раскрыты в настоящем описании и в патентах США N 4,760,025 (RE 34,606), N 5,204,015 и 5,185,258.
"Карбонилгидролазы не человеческого происхождения" и кодирующие их последовательности ДНК могут быть получены из многих прокариотических и эукариотических организмов. Примерами соответствующих прокариотических организмов служат грамотрицательные бактерии, такие как E.coli или Pseudomonas, и грамположительные бактерии, такие как Micrococcus или Bacillus. Примерами эукариотических организмов, из которых могут быть получены карбонилгидролазы и кодирующие их гены, являются дрожжи, например Saccharomyces cerevisiae, грибы, например Aspergillus sp. и млекопитающие, например бык (получение гена, кодирующего карбонилгидролазу химозин). Так же, как и в случае субтилизинов, определенные карбонилгидролазы могут быть получены из различных родственных видов, причем аминокислотные последовательности таких карбонилгидролаз не полностью гомологичны, но ферменты обнаруживают одинаковый или сходный вид биологической активности. Таким образом, описываемые здесь карбонилгидролазы не человеческого происхождения имеют функциональную активность карбонилгидролаз, которая непосредственно или опосредованным образом ассоциируется с активностью карбонилгидролаз из прокариотических и эукариотических источников.
"Вариант карбонилгидролазы" имеет аминокислотную последовательность, которая получена на основе аминокислотной последовательности "предшественника карбонилгидролазы". Предшественник карбонилгидролаз (например субтилизин) включает как природные карбонилгидролазы (субтилизин), так и рекомбинантные карбонилгидролазы (субтилизин). Аминокислотная последовательность варианта карбонилгидролазы "происходит" из аминокислотной последовательности предшественника гидролазы в результате замещения, делеции или инсерции одной или более аминокислот в последовательности предшественника. Такие модификации затрагивают последовательность ДНК предшественника, кодирующую соответствующую аминокислотную последовательность (субтилизина) в противовес манипуляциям карбонилгидролазным предшественником (субтилизином) per se (т.е. на уровне белка). Подходящие способы модификаций последовательности ДНК предшественника описаны здесь, а также известны специалистам в данной области исследований (см., например, ЕР 0328299, WO 89/06279 и патенты и заявки США, указанные ранее).
Мутациям подвергаются специфические аминокислотные остатки субтилизина Bacillus amyloliquefaciens, соответствующие положению +76 в сочетании с одним или более аминокислотными остатками в следующих положениях: +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, +222, +260, +265 и/или +274. Предпочтительными комбинациями модифицированных остатков являются следующие: 76/99; 76/101; 76/103; 76/104; 76/107; 76/123; 76/99/101; 76/99/103; 76/99/104; 76/101/103; 76/101/104; 76/103/104; 76/104/107; 76/104/123; 76/107/123; 76/99/101/103; 76/99/101/104; 76/99/103/104; 76/101/103/104; 76/103/104/123; 76/104/107/123; 76/99/101/103/104; 76/99/103/104/123; 76/99/101/103/104/123; 76/103/104/128; 76/103/104/260; 76/103/104/265; 76/103/104/197; 76/103/104/105; 76/103/104/135; 76/103/104/126; 76/103/104/107; 76/103/104/210; 76/103/104/126/265 и/или 76/103/104/222; наиболее предпочтительными являются сочетания 76/99; 76/104; 76/99/104; 76/103/104; 76/104/107; 76/101/103/104; 76/99/101/103/104 и 76/101/ 104. Указанные аминокислотные остатки пронумерованы в соответствии с их положением в молекуле зрелого субтилизина Bacillus amyloliquefaciens, чья аминокислотная последовательность приведена на фиг.1. Однако данное изобретение не ограничивается получением только этого мутантного субтилизина, но относится и к предшественнику карбонилгидролазы, содержащему мутантные аминокислотные остатки в положениях, которые эквивалентны положению специфических аминокислотных остатков в субтилизине Bacillus amyloliquefaciens. В предпочтительном варианте осуществления изобретения предшественником субтилизина является субтилизин Bacillus lentus, и замещения, делеции или инсерции осуществляются по отношению к аминокислотным остаткам В.lentus, эквивалентным указанным выше.
Аминокислотный остаток (аминокислота) в предшественнике карбонилгидролазы считается эквивалентным остатку субтилизина Bacillus amyloliquefaciens, если он гомологичен (т.е. соответствует по положению в первичной или третичной структуре) или аналогичен специфическому остатку или его части в субтилизине Bacillus amyloliquefaciens (т.е. имеет ту же самую или сходную функциональную способность к химическому комбинированию, реагированию или взаимодействию).
Для установления гомологии по первичной структуре аминокислотную последовательность предшественника карбонилгидролазы непосредственным образом сравнивают с первичной аминокислотной последовательностью субтилизина Bacillus amyloliquefaciens и в особенности с набором аминокислотных остатков, про которые известно, что они инвариантны в установленных последовательностях субтилизинов. На фиг.2 показаны консервативные аминокислотные остатки в субтилизинах В.amyloliquefaciens и В.lentus. После установления порядка расположения консервативных последовательностей, что необходимо для поддержания определенного характера инсерций и делеций (т.е. для исключения элиминации консервативных аминокислотных остатков в результате случайной делеций или инсерций), выявляют остатки, эквивалентные специфическим аминокислотам в первичной последовательности субтилизина Bacillus amyloliquefaciens. При сопоставлении аминокислотных остатков предпочтительным считается совпадение консервативных остатков на 100%. Однако совпадение более чем на 75% и даже на 50% является адекватным для идентификации эквивалентных аминокислотных остатков. При этом следует поддерживать консервативность каталитической триады Asp32/His64/Ser221.
В качестве примера на фиг.3 приведен порядок расположения аминокислотных остатков в молекуле субтилизинов Bacillus amyloliquefaciens, Bacillus subtilis, Bacillus licheniformis (carlsbergensis) и Bacillus lentus для выявления гомологии между аминокислотными последовательностями. Сравнение их показывает, что в каждой последовательности имеются многочисленные консервативные аминокислотные остатки. Эти остатки (в сравнении BPN' с субтилизином В.lentus) приведены на фиг.2.
Указанные консервативные аминокислотные остатки, таким образом, могут служить для выявления эквивалентных остатков субтилизина Bacillus amyloliquefaciens в других карбонилгидролазах, таких как субтилизин Bacillus lentus (заявка PCT N WO/06279, опубликованная 13.07.89), предпочтительном предшественнике описываемого здесь субтилизина, или же в субтилизине, называемом PB 92 (EP 0328299), который обладает высокой гомологией с предпочтительным субтилизином Bacillus lentus. Аминокислотные последовательности некоторых из указанных субтилизинов приведены на фиг.3A и 3B в сравнении с последовательностью субтилизина Bacillus amyloliquefaciens для выявления максимальной гомологии консервативных аминокислотных остатков. Как можно видеть из рисунков, имеется определенное число делеций в последовательности субтилизина Bacillus lentus в сравнении с субтилизином Bacillus amyloliquefaciens. Так, например эквивалентная аминокислота для Val165 в субтилизине Bacillus aplyloliquefaciens в субтилизинах B.lentus и B.licheniformis является изолейцином.
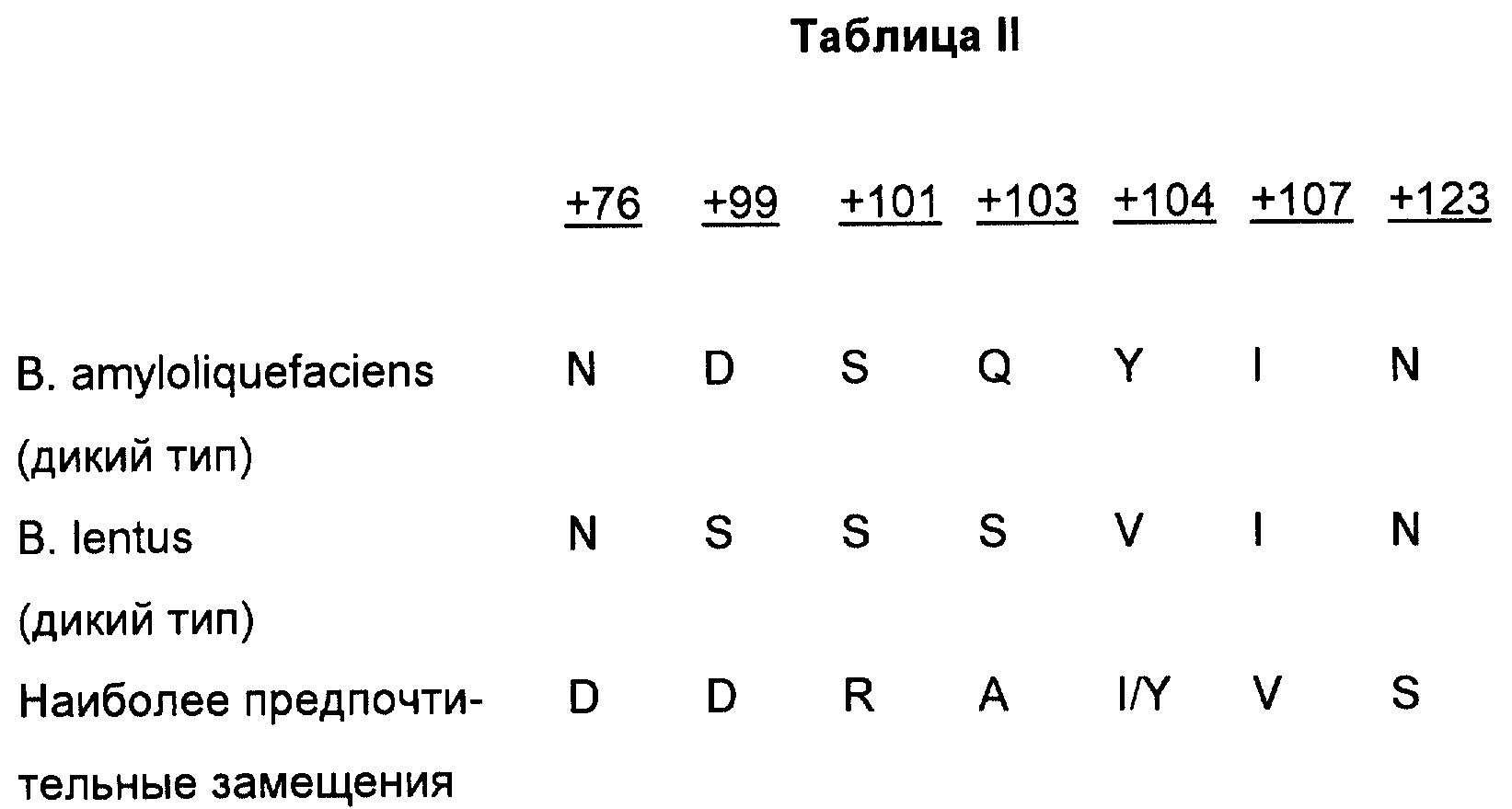
Таким образом, например, в положении +76 субтилизинов B.amyloliquefaciens и B.lentus находится аминокислота аспарагин (N). Однако в предпочтительном варианте осуществления изобретения аминокислоту, эквивалентную находящейся в положении +76 субтилизина Bacillus amyloliquefaciens, замещают на аспартат (D). Сравнение некоторых аминокислотных остатков, подлежащих замещению, в противоположность наиболее предпочтительным заменам для каждого положения приведены в табл. II в иллюстративных целях (см.в конце описания).
Эквивалентные аминокислотные остатки могут быть также выявлены путем установления гомологии на уровне третичной структуры предшественника карбонилгидролазы, определенной с помощью рентгеновской кристаллографии. Эквивалентными остатками считаются такие, для которых два или более атома в основной цепи специфического аминокислотного остатка в предшественнике карбонилгидролазы и субтилизина Bacillus amyloliquefaciens располагаются в пределах 0,13 нм и предпочтительно 0,1 нм после сопоставления. Сопоставление проводят вслед за определением ориентации и расположения наилучшей модели третичной структуры с целью достижения максимального перекрывания неводородных атомов белка карбонилгидролазы в сравнении с субтилизином Bacillus amyloliquefaciens. Наилучшая модель - это такая кристаллографическая модель, при которой обеспечивается наименьшее значение R-фактора для экспериментальных данных по дифракции при наивысшем возможном разрешении.

Эквивалентные аминокислотные остатки в предшественнике карбонилгидролазы считаются функционально аналогичными специфическому остатку в субтилизине Bacillus amyloliquefaciens, если они влияют на конформацию таким образом, что изменяют, модифицируют или поддерживают структуру белка, а также связывание с субстратом или каталитические свойства так же, как и специфический аминокислотный остаток в субтилизине Bacillus amyloliquefaciens. Более того, к ним относятся такие остатки в предшественнике карбонилгидролазы (для которого путем рентгеновской кристаллографии установлена третичная структура), которые занимают аналогичное положение в заданных пределах так, что, несмотря на то, что атомы основной цепи данного остатка могут и не соответствовать критерию эквивалентности в смысле занимания гомологичной позиции, по крайней мере два атома боковой цепи остатка расположены в пределах 0,13 нм в соответствии с атомами боковой цепи в субтилизине Bacillus amyloliquefaciens. Параметры трехмерной структуры субтилизина Bacillus amyloliquefaciens раскрыты в опубликованной заявке на Европейский патент N 0251446 (эквивалентной заявке на патент США SN 08/212,291 и приведенной здесь в качестве ссылки) и могут быть использованы, как описано выше, для выявления эквивалентных остатков на уровне третичной структуры.
Некоторые аминокислотные остатки, подлежащие замещению, инсерции или делеции, являются консервативными, в то время как другие - нет. В случае неконсервативных остатков замещения одной или более аминокислот ограничиваются теми, которые приводят к образованию варианта с аминокислотной последовательностью, не встречающейся в природе. В случае консервативных остатков такие замещения также не приводят к получению природных последовательностей. Варианты карбонилгидролазы, описанные в настоящей заявке, включают как зрелые формы вариантов карбонилгидролазы, так и их про- и пре-про-формы. Пре-про-формы являются предпочтительными, поскольку в этом случае облегчаются экспрессия, секреция и созревание вариантов карбонилгидролазы.
"Про-последовательность" означает последовательность аминокислот, связанную с N-терминальным участком зрелой формы карбонилгидролазы, удаление которой приводит к образованию свободной зрелой формы карбонилгидролазы. Многие протеолитические ферменты обнаруживаются в природе в виде проферментных продуктов трансляции и в отсутствие посттрансляционного процессинга, экспрессируются именно в такой форме. Предпочтительная последовательность для получения вариантов карбонилгидролазы, в особенности вариантов субтилизина, представляет собой генетическую про-последовательность субтилизина Bacillus amyloliquefaciens, хотя могут быть использованы и другие пропоследовательности субтилизина. В примерах 1 и 2 используется гипотетическая про-последовательность субтилизина Bacillus lentus (ATCC 21536).
"Сигнальная последовательность" или "пре-последовательность" означает какую-либо последовательность аминокислот, связанную с N-терминальным участком карбонилгидролазы или с N-терминальным участком прогидролазы, которая принимает участие в секреции зрелой формы или проформы гидролазы. Такое определение сигнальной последовательности является функциональным и относится ко всем аминокислотным последовательностям, кодируемым N-терминальным участком гена субтилизина или других секретируемых карбонилгидролаз, которые обеспечивают эффективную секрецию субтилизина или других карбонилгидролаз в нативных условиях. В настоящем изобретении такие последовательности используются для обеспечения секреции вариантов карбонилгидролазы. Предпочтительная сигнальная последовательность, используемая в примере 1, содержит первые семь аминокислотных остатков сигнальной последовательности субтилизина Bacillus subtilis, слитых с оставшейся частью сигнальной последовательности субтилизина Bacillus lentus (ATCC 21 536).
"Пре-про-форма" карбонилгидролазы представляет собой зрелую гидролазу, имеющую про-последовательность, функционально соединенную с аминотерминальным участком гидролазы, и "пре" или "сигнальную" последовательность, функционально связанную с аминотерминальным участком про-последовательности. "Вектор экспрессии" представляет собой ДНК-конструкт, содержащий последовательность ДНК, функционально связанную с соответствующей контролирующей последовательностью, способной обеспечивать экспрессию указанной ДНК в соответствующем хозяине. Такие контролирующие последовательности включают промотор, обеспечивающий эффективную транскрипцию, факультативную операторную последовательность для контроля транскрипции, последовательность, кодирующую сайт связывания с рибосомой в молекуле мРНК, и последовательности, контролирующие терминацию транскрипции и трансляции. Вектор может быть плазмидой, фаговой частицей или просто потенциальной геномной вставкой. Введенный путем трансформации в подходящую хозяйскую клетку, вектор может реплицироваться и функционировать независимо от генома хозяина, а может, в некоторых случаях, интегрировать в его геном. В настоящем описании термины "плазмида" и "вектор" иногда используются взаимозаменяемо, поскольку плазмида является наиболее часто используемой формой вектора. Однако для осуществления изобретения могут использоваться и другие формы векторов экспрессии, выполняющие эквивалентные функции и известные специалистам в данной области исследований.
"Клетки-хозяева", используемые в настоящем изобретении, являются прокариотическими или эукариотическими клетками, которые с помощью методов, описанных в патенте США N 4,760,025 (RE 34,606) изменяют таким образом, что они теряют способность к секреции энзиматически активных эндопептидаз.
Предпочтительными клетками-хозяевами для экспрессии субтилизина являются клетки штамма бактерий Bacillus BG2036, дефектного по энзиматически активной нейтральной протеиназе и алкалинпротеиназе (субтилизину). Получение штамма BG2036 подробно описано в патенте США N 5,264,366. Другими клетками-хозяевами для экспрессии субтилизина являются клетки штамма Bacillus subtilis I168 (также описанного в патенте США N 4,760,025 (RE 34,606) и в патенте США N 5,264,366, которые приводятся здесь в качестве ссылки), а также клетки любого другого подходящего штамма Bacillus, например B. licheniformis, B. lentus и т.д.
Клетки-хозяева трансформируют или трансфицируют векторами, полученными с помощью технологии рекомбинантных ДНК. Такие трансформированные клетки-хозяева способны к репликации векторов, кодирующих варианты карбонилгидролазы, и к экспрессии необходимого варианта. При использовании векторов, кодирующих пре- или пре-проформу варианта карбонилгидролазы, такие варианты после экспрессии обычно секретируются из клетки-хозяина в культуральную среду.
Понятие "функционально-связанный" при описании взаимодействий между двумя участками ДНК просто означает, что они имеют функциональное отношение друг к другу. Например, пре-последовательность функционально связана с пептидом, если ее функции как сигнальной последовательности, принимающей участие в секреции зрелой формы белка, с наибольшей вероятностью включают и отщепление сигнальной последовательности. Промотор функционально связан с кодирующей последовательностью, если он контролирует транскрипцию последовательности: сайт связывания с рибосомой функционально связан с кодирующей последовательностью, если его расположение обеспечивает трансляцию.
Гены, кодирующие природный предшественник карбонилгидролазы, могут быть получены в соответствии с основными методами, известными специалистам в данной области исследований. Такие методы обычно включают синтезирование меченых проб, имеющих предполагаемые последовательности кодирующих участков гена соответствующей гидролазы, получение геномных библиотек из организмов, экспрессирующих гидролазу, и скрининг библиотек для выделения нужного гена путем гибридизации с пробами. Клоны, положительные по результатам гибридизации, затем картируют и секвенируют. Ген В. lentus, используемый в примерах, был клонирован, как описано в примере 1 патента США N 5,185,258, который приводится здесь в качестве ссылки. Ген BPN', используемый в примере 5, был клонирован, как описано в примере 1 заявки США N 34,606, который также приводится здесь в качестве ссылки.
Клонированный ген карбонилгидролазы затем используют для трансформации клеток-хозяев с целью экспрессии гидролазы. Ген гидролазы встраивают в высококопийную плазмиду. Эта плазмида реплицируется в клетках-хозяевах и содержит хорошо известные элементы, необходимые для репликации плазмиды: промотор, функционально-связанный с нужным геном (который может быть собственным гомологичным промотором данного гена, если он распознается, т. е. транскрибируется клеткой-хозяином), терминатор транскрипции и участок полиаденилирования (необходимый для обеспечения стабильности мРНК, транскрибируемой с гена гидролазы в некоторых эукариотических клетках-хозяевах), который может быть экзогенным или же входить в комплекс с эндогенным терминаторным участком гена гидролазы, и, желательно, маркерный ген селекции, например ген устойчивости к антибиотику, который определяет длительное культивирование "инфицированных" плазмидой клеток-хозяев в среде, содержащей антибиотик. Высококопийные плазмиды также содержат ориджин репликации, который обеспечивает их размножение в больших количествах в цитоплазме клетки-хозяина вне зависимости от хромосомы. Однако в объеме настоящего изобретения решается задача интегрирования многочисленных копий гена гидролазы в геном клетки-хозяина. Для этого используют прокариотические и эукариотические организмы, которые в особенности способны к гомологичной рекомбинации. Гены, используемые в излагаемых здесь примерах, являются природными генами В.lentus и B. amyloliquefaciens. Альтернативно могут быть использованы синтетические гены, кодирующие природные или мутантные формы предшественника карбонилгидролазы (субтилизина). Для этого определяют последовательность ДНК или аминокислотную последовательность предшественника гидролазы (субтилизина). Затем синтезируют многочисленные перекрывающиеся одноцепочечные фрагменты ДНК, с помощью которых в результате гибридизации и лигирования получают синтетическую ДНК, кодирующую предшественник гидролазы. Одна из синтетических генных конструкций приведена в примере 3 патента США N 5,204,015, который указывается здесь в качестве ссылки.
После клонирования природного или синтетического гена предшественника карбонилгидролазы для расширения возможностей использования данного гена (помимо обеспечения синтеза природного предшественника карбонилгидролазы) осуществляют многочисленные его модификации. Такие модификации обеспечивают получение рекомбинантных карбонилгидролаз, как описывается в патенте США N 4,760,025 (RE 34,606) и опубликованной заявке на Европейский патент N 0251446, и вариантов карбонилгидролаз, раскрытых в настоящем изобретении.
Излагаемый ниже метод кассетного мутагенеза может быть использован для конструирования и идентификации вариантов карбонилгидролазы, заявленных в настоящем изобретении, однако могут быть применены и другие методы, например сайт-направленный мутагенез. В первую очередь получают природный ген, кодирующий гидролазу, и секвенируют его полностью или частично. Затем последовательность сканируют, чтобы определить точку, в которой желательно осуществить мутацию (делецию, инсерцию или замещение) одной или более аминокислот. Последовательности, фланкирующие эту точку, исследуют на наличие сайтов рестрикции для замещения короткого генного сегмента олигонуклеотидами, при экспрессии которых образуются различные мутантные формы. Такие сайты рестрикции преимущественно являются уникальными сайтами гена гидролазы и обеспечивают замену генного сегмента. Однако может быть использован любой подходящий сайт рестрикции, не часто встречающийся в гене гидролазы, так что генные фрагменты, полученные в результате рестрикционного расщепления, способны собираться в нужную последовательность. Если сайты рестрикции не обнаруживаются на подходящем расстоянии от выбранной точки (10-15 нуклеотидов), такие сайты могут быть созданы путем замещения нуклеотидов в гене таким образом, что ни рамка считывания, ни кодирующие аминокислоты в конечной конструкции не изменяются. Мутации гена, изменяющие его структуру с целью получения желаемой последовательности, осуществляют при использовании праймера М13 в соответствии с хорошо известными методами. Задача выявления локализации подходящих фланкирующих участков и оценки необходимых изменений в двух соответствующих рестрикционных сайтах решается без особых проблем с учетом вырожденности генетического кода, рестрикционной карты гена и с помощью многочисленных рестрикционных ферментов. Следует иметь в виду, что при доступности подходящего фланкирующего сайта рестрикции, указанный выше подход используют всегда принимая во внимание и наличие фланкирующего участка, не содержащего сайта рестрикции.
После клонирования природной или синтетической ДНК, рестрикционные сайты, фланкирующие участки, в которых будут генерированы мутации, расщепляют соответствующими рестриктазами, и в ген встраивают многочисленные олигонуклеотидные кассеты, комплементарные концевым терминальным последовательностям. При этом процесс мутагенеза упрощается, поскольку могут быть синтезированы все олигонуклеотиды, имеющие те же самые рестрикционные сайты, и отпадает необходимость в создании рестрикционных сайтов с помощью синтетических линкеров.
Под протеолитической активностью при описании настоящего изобретения понимается скорость гидролиза пептидных связей в расчете на 1 мг активного фермента. Для определения протеолитической активности используются различные хорошо известные методы (см., например, K.M.Kalisz, "Микробные протеиназы", Достижения биохимической инженерии/биотехнологии, под ред.А.Fichter, 1988.) Помимо модифицированной протеолитической активности, варианты ферментов, заявленных в настоящем изобретении, могут иметь другие модифицированные свойства, такие как Км, Ккат, отношение Ккат/Км, и/или измененную субстратную специфичность и/или модифицированный профиль pH-активности. Указанные ферменты могут соответствовать определенному субстрату, который, например, может присутствовать в препарате пептидов. Они могут успешно использоваться для гидролиза пептидов и входить в состав стиральных средств.
Один аспект настоящего изобретения заключается в получении варианта карбонилгидролазы, имеющей измененную протеолитическую активность в сравнении с предшественником карбонилгидролазы, поскольку существенное увеличение такой активности обеспечивает большую эффективность взаимодействия фермента с субстратом. Кроме того, желательно получение вариантов ферментов, имеющих измененную термостабильность и/или измененную субстратную специфичность по сравнению с предшественником. Предпочтительная карбонилгидролаза, в которой следует генерировать мутации, представляет собой субтилизин. Специфические аминокислоты, обеспечивающие получение заданного результата по отношению к карбонилгидролазам типа субтилизина, эквивалентны следующим приведенным в примерах аминокислотным остаткам или их любым комбинациям в субтилизине Bacillus amyloliquefaciens: +76, +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, +22, +260 и/или +274. В некоторых случаях желательно получить более низкую протеолитическую активность. Например, уменьшение протеолитической активности может быть полезно при использовании синтетической активности карбонилгидролаз (в частности, при синтезе пептидов). Протеолитическая активность способна "разрушить" продукт такого синтеза. В других случаях, наоборот, желательно увеличение протеолитической активности варианта фермента в сравнении с предшественником. Кроме того, иногда необходимо изменение стабильности варианта фермента, например устойчивости к щелочи или температурным воздействиям. Увеличение или уменьшение Ккат, Км или Ккат/Км зависит от субстрата, используемого для определения этих кинетических параметров.
Другой аспект настоящего изобретения заключается в установлении того факта, что аминокислотные остатки, эквивалентные остаткам в положении +76 в сочетании с другими модификациями в молекуле субтилизина, имеют важное значение для генерации сверхвысокой стабильности и/или протеолитической активности фермента. Так (см. примеры), в случае предпочтительного варианта осуществления изобретения, для получения повышенной стабильности и/или активности целевой мутантной формы фермента аспарагин (N), эквивалентный остатку в положении +76 в молекуле субтилизина Bacillus lentus, может быть замещен на аспартат (D) в сочетании с модификацией одной или более следующих аминокислот: +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, +222, +260 и/или +274.
Наиболее предпочтительные варианты осуществления изобретения изложены в примерах. При этом используются следующие специфические комбинации замещаемых аминокислотных остатков: N76D/S99D; N76D/V104l; N76D/ S99D/V104I; N76D/S103A/V104I; N76D/V104I/I107V; N76D/V104Y/I107V и N76D/S101R/S103A/V104I. Кроме того, в примерах описаны все комбинации мутантных форм, заявленные в формуле настоящего изобретения. Указанные замещения предпочтительно осуществляют в молекуле субтилизина Bacillus lentus (рекомбинантного или природного), однако могут быть произведены и в молекуле любого субтилизина бактерий рода Bacillus. Из результатов, полученных с указанным и другими вариантами субтилизина, с очевидностью следует, что для обеспечения протеолитической активности, стабильности и/или других существенных свойств ферментов, например отмывающей способности, важное значение имеют аминокислотные остатки в карбонилгидролазах (предпочтительно в субтилизине), эквивалентные следующим положениям аминокислот в субтилизине Bacillus amyloliquefaciens: +76, +99, +101, +103, +104, +107, +123, +27, +105, +109, +126, +128, +135, +156, +166, +195, +197, +204, +206, +210, +216, +217, +218, + 222, +260 и/или +274.
Многие варианты карбонилгидролазы, заявленные в настоящем изобретении, в особенности субтилизин, могут быть полезны для приготовления различных детергентных композиций. Известные ранее соединения являются подходящими сурфактантами, используемыми в композициях, содержащих мутантные формы заявленной карбонилгидролазы. К ним относятся неионные, анионные, катионные или цвиттерионные детергенты, описанные в патенте США N 44,404,128 Barry J. Anderson и в патенте США N 4,261,868 Jiri Flora, et al. Подходящая детергентная композиция описана в примере 7 патента США N 5,204,015 и упоминается здесь в качестве ссылки. Указанные композиции могут быть использованы как моющие средства. Помимо обычных моющих композиций, варианты субтилизина, полученные согласно настоящему изобретению, могут быть применены для любых целей, так же как и нативные субтилизины и субтилизины дикого типа. Так, данные варианты могут быть использованы, например, для получения твердого или жидкого мыла, средств для мытья посуды, увлажнителей, растворов для протирания контактных линз, стиральных порошков, а также в качестве ферментов пептидного гидролиза, ферментов слияния/расщепления при синтезе пептидов и т. д. Заявленные варианты карбонилгидролаз могут усиливать детергентные свойства композиций по сравнению с предшественниками фермента. Как описано здесь, такое усиление определяется повышенной способностью некоторых ферментов к взаимодействию с такими загрязнителями, как трава или кровь, что подтверждается обычными измерениями, которые проводят после цикла "отмывания".
Полученные согласно настоящему изобретению субтилизины могут входить в состав известных жидких или порошкообразных детергентов, имеющих pH в интервале 6,5 и 12,0, в весовом количестве 0,01%- 5% (предпочтительно 0,1%-0,5%). Указанные моющие детергентные композиции могут включать и другие ферменты, например известные протеиназы, амилазы, целлюлазы, липазы или эндогликозидазы, так же как и основные компоненты и стабилизаторы. Добавление заявленных субтилизинов к обычным моющим композициям не создает каких-либо ограничений. Иными словами, температура и pH, подходящие для детергента, также подходят и для приготавливаемой композиции, при том что значение pH находится в пределах указанного выше интервала, а температура - ниже описанной температуры денатурации субтилизина. Кроме того, заявленные субтилизины могут быть применены и в моющих композициях, не содержащих детергентов, как сами по себе, так и в сочетании с основными компонентами и стабилизаторами.
Приведенные ниже примеры не следует считать ограничивающими объем изобретения, изложенный в формуле.
Пример 1. Получение плазмиды для экспрессии гена GG36 в Bacillus subtilis.
Клонирование и конструирование гена из В.subtilis для экспрессии субтилизина осуществляют так же,
как описано в патенте США N 5,185,258. Плазмиду GGA274 (см. фиг. 5) модифицируют как показано на этом же рисунке. Pstl-сайт, введенный в процессе конструирования в плазмиду GGA274, удаляют путем
олигонуклеотид-направленного мутагенеза (см. пример 2) с помощью олигонуклеотида, имеющего следующую последовательность:
5'-GAAGCTGCA
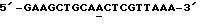
Подчеркнутый нуклеотид "А" элиминирует последовательность, распознаваемую ферментом рестрикции Pstl, и изменяет соответствующий аминокислотный остаток в положении 274 с аланина на треонин. Треонин в положении 274 представляет собой остаток дикого типа, первоначально обнаруженный в клонированной генной последовательности B.lentus. ДНК-фрагмент, кодирующий субтилизин, вырезают из плазмиды GGA274 или ее производных (например, GGT274, показанной на фиг. 5) с помощью рестриктаз EcoRI и BamHI. Затем ДНК фрагмент субклонируют в векторе на основе бактериофага М13 для осуществления мутагенеза. После мутагенеза и клонирования мутантный ген субтилизина вырезают при помощи рестриктаз EcoRI и Hind III и переносят его в плазмиду экспрессии, подобную GGA274, для обеспечения продуцирования и выделения мутантных белков субтилизина.
Пример 2. Олигонуклеотид-направленный мутагенез.
Олигонуклеотид-направленный мутагенез осуществляют, как описано в работе Joller, М. et al., (1983), Methods Enzymol. 100: 468-500. Например, для изменения аминокислотного остатка в положении 76 с аспарагина (N) на аспартат (D) (N76D) используют синтетический олигонуклеотид



Для осуществления мутагенеза в
положениях 99, 101, 103 и 104 используют различные олигонуклеотиды в зависимости от сочетаний желаемых мутаций. Например, для одновременного введения изменений S99D, S101R, S103A и Vl 041 в одну
молекулу субтилизина использовали следующий олигонуклеотид:

Сходным образом, для генерации изменений I107V и N123S использовались соответственно следующие олигонуклеотиды:

Опять же подчеркнутые нуклеотиды определяют изменения аминокислотных остатков или введение необходимых сайтов распознавания ферментами рестрикции в сравнении с последовательностями дикого типа.
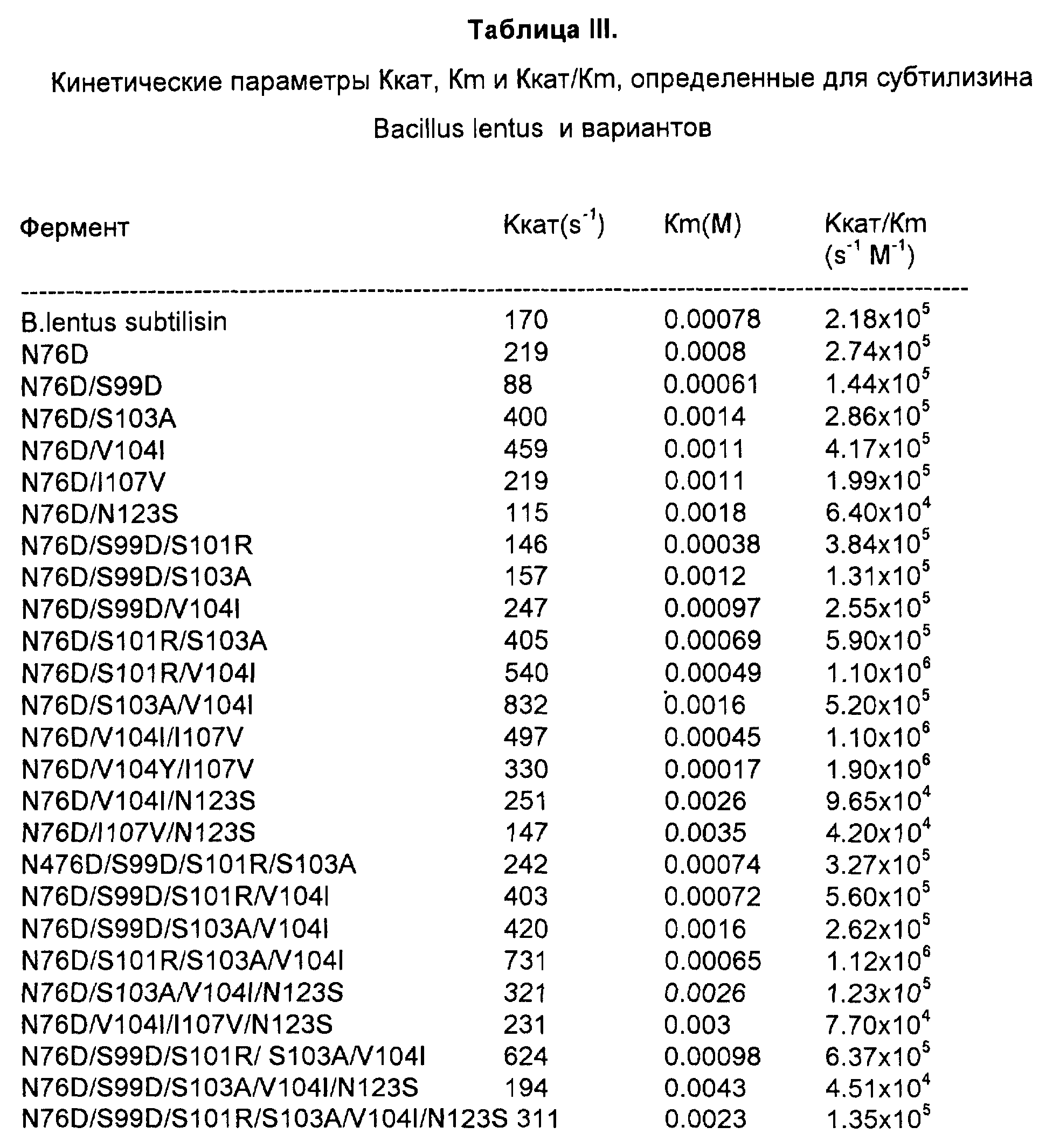
Пример 3. Протеолитическая активность вариантов субтилизина.
В соответствии с методами, описанными в примере 2, получают варианты субтилизина, которые перечислены в таблице III. Протеолитическая активность с каждого варианта субтилизина показана в таблице III. Кинетические параметры Ккат, Кm и Ккат/Кm определяли на основании гидролиза синтетического пептидного субстрата сукцинил-L-Ala-L-Ala-L-Pro- L-Phe-p-нитроанилида с помощью метода, описанного в работе P.Bonneau, et al., (1991), J.Am.Chem.Soc., Vol. 113, N 3, p.1030. Небольшую аликвоту исходного раствора варианта субтилизина добавляли в 1-см кювету, содержащую субстрат, растворенный в 0,1 М трис-HCl-буфере, pH 8,6, и помещали кювету в термостат при 425oC. Течение реакции регистрировали спектрофотометрически, измеряя поглощение продукта реакции p-нитроанилина при 410 нм. Кинетические параметры вычисляли, используя нелинейный алгоритм регрессии, соответствующий скорости реакции и концентрации продукта для каждой отдельной реакции в соответствии с уравнением Михаэлиса-Ментен.
Результаты, приведенные в табл. III, свидетельствуют о том, что все тестированные варианты субтилизина обладают протеолитической активностью. Более того, детальный анализ приведенных данных выявляет значительное изменение протеолитической активности вариантов субтилизина Bacillus lentus, имеющих замещения аминокислотных остатков, эквивалентных остаткам, находящимся в положениях 76,99, 101, 103, 104, 107 и 123 субтилизина Bacillus amyloliquefaciens.
Пример 4. Термоустойчивость вариантов субтилизина.
Сравнение термостабильности субтилизина Bacillus lentus и вариантов, полученных согласно настоящему изобретению, как описано в примере 2, приведено в табл. IV. Аликвоты очищенных ферментов (15 мкг/мл в 0,1 М глицине и 0,01%-ном Твине-80, pH 10,0, с добавлением или без 50 мМ CaCl2) помещают в небольшие пробирки и инкубируют при 10oC в течение 5 мин, затем при 10oC-60oC в течение 1 мин и при 60oC в течение 20 мин.
Далее пробирки на 10 мин помещают в лед. Аликвоты из пробирок исследуют на энзиматическую активность, перенося их из пробирок в 1-см кюветы, содержащие 1,2 мМ синтетического пептидного субстрата сукцинил-L-Ala-L-Ala-Pro-L-Phe-p-нитроанилида, растворенного в 0,1 М Трис-HCl буфере, pH 8,6. Кюветы помещают в термостат при 25oC. Первоначальную линейную скорость реакции как функцию времени оценивают спектрофотометрически, измеряя поглощение продукта реакции р-нитроанилина при 410 нм. Данные выражают в процентах активности в сравнении с активностью, предшествующей нагреванию фермента. Результаты исследований, приведенные в табл. IV, показывают, что значительная часть вариантов субтилизина (24 из 26) проявляет термоустойчивость, сравнимую с термоустойчивостью субтилизина Bacillus lentus при осуществлении теста с добавлением 50 мМ CaCl2. Однако в отсутствие CaCl2 существенная доля вариантов субтилизина (19 из 26) оказывается значительно более стабильной, чем субтилизин Bacillus lentus.
Более того, варианты N76D/S99D, N76D/V1041, N76D/S99D/V1041, N76D/S103A/V1041, N76D/V104I/I107V, N76D/V104Y/I107V и N76D/S101R/S103A/V104I обладают гораздо большей устойчивостью, чем вариант с одним замещением в положении +76 (N76D), при осуществлении теста с добавлением 50 мМ CaCl2.
Пример 5. Олигонуклеотид-направленный мутагенез с одноцепочечной ДНК-матрицей, полученной из фагемиды.
A. Получение вариантов B.lentus
Мутагенез осуществляют так же, как описано выше в примере 2. Одноцепочечную ДНК-матрицу получают при
использовании фагемиды. С этой целью для конструирования фагемидного вектора в первую очередь конструируют вектор pBCDAICAT. Схема конструирования вектора приведена на фиг.8. Сначала
Clal-Clal-фрагмент, кодирующий ген CAT, из плазмиды pC194 (Horinouchi.S. and WeisbIum. B. , J.Bacteriol., 150:8-15, 1982) клонируют в Accl-сайт полилинкерного участка плазмиды pUC19 (New England
Biolabs, Beverly, MA) с получением плазмиды pUCCHL, a EcoRI-Dral-фрагмент (0,6 кб) с 5'-конца кодирующей ДНК GG36DAI клонируют в EcoRI и EcoRV сайты плазмиды pBSKS (Stratagene Inc., San Diego, CA) с
получением плазмиды pBC2SK5. Один EcoRI-сайт плазмиды pBC2SK5 вырезают с помощью рестриктазы EcoRI, достраивают при использовании ДНК-полимеразы T4 и заново лигируют в плазмиду pBC2SK-5R, у которой
отсутствует свой EcoRI-сайт. EcoRI-Dral-фрагмент, клонированный в pBCSK-5R, вырезают как Pstl-Hundlll-фрагмент и клонируют в Pstl-Hind III-сайт pUCCHL (часть полилинкера pUC19) с получением плазмиды
pUCCHL5R. Кодирующую последовательность гена GG36DAI вырезают как EcoRI-BamHI-фрагмент и клонируют в EcoRI-BamHI-сайты pUCCHL5R с получением pUCCAT. Большой EcoRI-Hindlll-фрагмент pUCCAT затем
клонируют в EcoRI-Hindlll-сайты BS2KS+ с образованием плазмиды pBCDAICAT.
Для получения одноцепочечной ДНК бактерии E.coli, содержащие pBCDAICAT, инфицируют фагом R408 (Stratagene, San Diego, CA), следуя методике, описанной Russel, М. , Kidd, S. and Kelley, M.R., Gene, 45:333-338, 1986. После получения одноцепочечной ДНК-матрицы, проводят мутагенез с помощью стандартных методов, описанных выше в примере 2. Получение различных мутантов подробно описано ниже в иллюсстративных целях.
Для получения B.lentus (GG36) N76D/S103A/V104I/L217H EcoRI-BamHi-фрагмент ДНК,
кодирующий GG36 N76D/S103A/V1041 используют для конструирования pUCCAT (см. фиг. 8) с последующим образованием плазмиды pBCDAICAT. После того, как получают одноцепочечную ДНК-матрицу, как описано выше,
используют следующий праймер для мутагенеза
****** x Clal

с целью получения L217H. Как и ранее, подчеркнутые нуклеотиды обозначают изменяемые участки, x Clal указывает на то, что Clal-сайт после осуществления мутагенеза элиминируют. Мутагенез проводят согласно методике, описанной в примере 2. После мутагенеза плазмидную ДНК в первую очередь скринируют на отсутствие сайта Clal и клоны, утратившие его, подвергают анализу, чтобы убедиться в замене L на H в положении 217 аминокислотной последовательности.
B. Получение BPN' вариантов и осуществление экспрессии в B.subtilis.
B. amyloliquefaciens (BPN') N76D/Q103A/Y104I/Y217L
получают практически так же, как описано выше, за исключением двух этапов. В первую очередь N76D вводят в BPN' Y217L с получением BNP' 76D/Y217L, а затем осуществляют вторую стадию мутагенеза для
превращения BPN' N76D/Y217L в BPN' N76D/Q103A/Y104I/Y217L. Для получения одноцепочечной ДНК-матрицы для первого этапа мутагенеза EcoRI-BamHI-фрагмент, кодирующий субтилизин BPN' Y217L (происходящий из
плазмиды Y217L, описанной Wells, J., et al., PNAS, 84, 5167, 1087) используют для получения плазмиды pUCCATFNA (см. фиг.9). Плазмиду pUCCATFNA, содержащую BPN' Y217L, используют для конструирования
плазмиды pBCFNACAT (фиг.9). Одноцепочечную ДНК получают, как описано выше. Для получения BPN' N76D/Y217L с целью внесения изменения N76D используют олигонуклеотидный праймер последовательности
****** x Xbal

Одноцепочечную ДНК затем получают из плазмиды pBCFNACAT, содержащей BPN' N76D/Y217L (плазмида pBCFNACAT после N76D-мутагенеза) и подвергают мутагенезу при использовании последовательности
****** x Pvull

с образованием BPN' N76D/Q103A/Y1041/Y217L. Все этапы клонирования, получения одноцепочечной ДНК, осуществления мутагенеза и скрининга мутантов проводят, как описано выше.
Экспрессия гена BPN' и его вариантов достигается при интегрировании плазмидной ДНК (pBCFNACAT, содержащей различные варианты BPN'-гена) непосредственно в дефектный по протеиназе штамм Bacillus subtilis, как описано в заявке США RE 34,606. Получают многочисленные варианты ферментов, как указано в примерах 2 и 5. Определяют их кинетические свойства и термоустойчивость. Кинетические свойства определяют с помощью методов, описанных в примере 3. Результаты исследований приведены в таблице V. Стабильность исследуют, как описано ниже. Результаты приведены в таблице VI.
Методика определения термоустойчивости.
Очищенный фермент переводят в 0,1 М глициновый буфер, pH 10,0, с 0,01%-ным Твином-80 путем нанесения фермента на колонку, содержащую Сефадекс G-25 и уравновешенную указанным буфером, с последующей элюцией фермента с колонки данным буфером. Переведенный в буфер фермент добавляют в пробирку, содержащую 0,1 М глицин, 0,01%-ный Твин-80, pH 10,0 до конечной концентрации фермента 15 мкг/мл. Затем пробирку помещают в термостат при 60oC.
Во время инкубации при 60oC в различные временные интервалы отбирают аликвоты фермента и сразу же исследуют их на энзиматическую активность, добавляя указанные аликвоты в 1-см кювету, содержащую 1,2 мМ синтетического пептидного субстрата сукцинил-L-Ala-L-Ala-L-Pro- L-Phe-p-нитроанилида, растворенного в 0,1 М трис-HCl буфере, pH 8,6. Затем кюветы помещают в термостат при 25oC. Первоначальную линейную скорость реакции как функцию времени определяют спектрофотометрически, измеряя поглощение продукта реакции p-нитроанилина при 410 нм.
Период полужизни, определяемый как промежуток времени, в течение которого происходит 50%-ная инактивация фермента, вычисляют по первому участку графика зависимости скорости реакции от времени инкубации при 60oC.
Результаты, приведенные в табл. VI, выражены в процентном отношении периода полужизни полученных вариантов к периоду полужизни субтилизина Bacillus lentus (GG36) в идентичных условиях.
Пример 6. Тестирование отмывающей способности.
Отмывающую способность вариантов, описанных в предыдущих примерах, определяют по степени удаления загрязнителей (кровь/молоко/уголь) с образцов хлопковой ткани EMPA 116 (Testfabrics Inc., Middlsex, NJ 07030).
Шесть образцов ткани EMPA 116 с зубчатыми краями размером 3 x 4-1/2 дюйма помещают в
специальные сосуды модели 7243S Terg-O-Tometer (United States TestingCo. , Inc. , Hoboken.NJ), содержащие 1000 мл воды с жесткостью 15 gpg (Ca++: Mg++::3:1::вес:вес), 7 г
детергента и соответствующее количество фермента. Основным детергентом является детергент WFK1 (wfk-Testgewebe Gmbh, Adlerstrasse 42, Postfach 1307 62, D-47759 Krefeld, Germany):
Компонент
- % конечного содержания
Цеолит A - 25
Сульфат натрия - 25
Сода Ash - 10
Линейный алкилбензенсульфонат - 8,8
Спиртовой этоксилат (7-8 EO) - 4,5
Натриевое мыло - 3
Силикат натрия (SiO2:Na2O::3,3:1) - 3
К этому базовому детергенту добавляют следующие соединения:
Компонент - % конечного
содержания
Перборат моногидрат натрия - 13
Сополимер (Сокалан CP5) - 4
TAED (Микон АТС Зеленый) - 3
Фермент - 0,5
Краситель (Тинопал AMS-GX) - 0,2
Перборат моногидрат натрия получают от фирмы Degussa Corporation, Ridgefield-Park, NJ 07760. Сокалан CP5 получают от фирмы BASF Corporation, Parsipanny, NJ 07054. Микон ATC Зеленый (TAED,
тетраацетилэтилендиамин) получают от фирмы Warwick International, Limited, Mostyn, Holywell, Clwyd CH8 9HE, England. Тинопал AMS-GX получают от фирмы Ciba-Geigy Corporation, Greensboro, NC 27419.
Шесть образцов ткани EMPA 116 обрабатывают детергентом в присутствии фермента в течение 30 мин при 60oC и затем последовательно отмывают два раза в течение 5 мин в 1000 мл воды. Ферменты добавляют до конечной концентрации 0,05-1 ppm для получения стандартных кривых и 0,25 ppm для обычных исследований. Образцы ткани высушивают и разглаживают под давлением и области пятен исследуют с помощью L-величины по L*a*b*-шкале прибора Minolta Chroma Meter, Model CR-200 (Minolta Corporation, Ramsey, NJ 07446). Отмывающую способность ферментов выражают в процентах по отношению к протеиназе B. lentus (GG36) и вычисляют как отношение количества протеиназы B.lentus (GG36) к количеству протеиназы-варианта, которое необходимо для проявления такой же активности, умноженное на 100. Результаты исследований приведены в таблице VII.
Пример 7. Стабильность протеина в жидкой среде с детергентом.
Сравнение стабильности протеиназ в жидкой среде с детергентом проводят в отношении субтилизина Bacillus lentus и его варианта N76D/S103A/V104I, как описано ниже. Для эксперимента используют коммерческий расфасованный жидкий детергент для прачечных Tide Ultra, выпускаемый компанией Procter and Gamble, США. Чтобы инактивировать содержащиеся в детергенте протеиназы, его прогревают в течение 4,5 часов при 96 С. Затем к охлажденному до комнатной температуры детергенту добавляют концентрированные препараты (20 г/л) субтилизина В. lentus и его варианта N76D/S103A/V104I до конечной концентрации 0,3 г/л. Далее детергент, содержащий протеиназы, инкубируют на термостатированной водяной бане при 50oC. Из пробирок отбирают аликвоты исследуемого раствора через 0, 24, 46, 76 и 124 ч и исследуют на энзиматическую активность в 1-см кюветах, содержащих 1,2 мМ синтетического пептидного субстрата сук-Ala-Ala-Pro-phe-p-нитроанилида, растворенного в 0,1 М Трис-HCl буфере, pH 6,8, помещенных в термостат при 25oC. Первоначальную линейную скорость реакции как функцию времени определяют спектрофотометрически, измеряя поглощение продукта реакции р-нитроанилина при 410 нм. Как показано на фиг.10, вариант субтилизина N76D/S103A/V104I проявляет гораздо большую стабильность по сравнению с нативным ферментом B.lentus. Период полураспада в детергенте Tide Ultra, определенный в специфических условиях теста, составляет 45 ч для субтилизина B.lentus и 125 ч для его варианта N76D/S103A/V104I.
При описании изобретения использовался одно- или трехбуквенный аминокислотный код. Расшифровка кода приведена в книге Dale.J.W. (1989), Molecular Genetics of Bacteria, John Wiley & Sons, Ltd., Приложение В.
Несмотря на то, что выше были изложены предпочтительные варианты осуществления изобретения, для специалиста в данной области исследований очевидно, что после оценки изобретения в целом, могут быть осуществлены его различные изменения и эквивалентные модификации без выхода за рамки объема притязаний, изложенного в формуле.
Реферат
Изобретение характеризует модифицированную карбонилгидролазу. В аминокислотной последовательности субтилизина заменены 76 аминокислотный остаток и по меньшей мере еще один аминокислотный остаток. Модификация позволяет повысить протолитическую активность фермента. 4 с. и 7 з.п. ф-лы, 10 ил., 7 табл.


Комментарии