Новая вирусная векторная конструкция для нейронспецифического оптимизированного непрерывного синтеза dopa in vivo - RU2606012C2
Код документа: RU2606012C2
Чертежи











































Описание
Настоящая заявка соответствует международной заявке, согласно которой испрашивается приоритет по предварительной заявке на выдачу патента США №61/259502. Все патентные и непатентные ссылки, процитированные в настоящей заявке, тем самым включены посредством ссылки во всей их полноте.
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к вирусным векторным конструкциям, в частности к одновекторным rAAV конструкциям, содержащим полинуклеотидные последовательности, кодирующие два полипептида, подлежащих дифференциальной экспрессии в клетке-мишени. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанный вектор, к доставке в ткань головного мозга человека и к медицинскому применению указанного вектора для лечения заболеваний, связанных с катехоламиновой дисфункцией. В частности, настоящее изобретение относится к лечению заболеваний, связанных с недостаточностью допамина, таких как болезнь Паркинсона и родственные нарушения.
Предшествующий уровень техники настоящего изобретения
Болезнь Паркинсона поражает людей возрастом от 30 лет и старше: Средний возраст больных, у которых начинается заболевание, составляет приблизительно 60 лет. Основными клиническими симптомами являются ригидность, брадикинезия и тремор в покое. Кроме того, при заболевании может проявляться ряд других симптомов, таких как гипотония, когнитивное нарушение, постуральная неустойчивость и многих других.
Это заболевание преимущественно является нарушением базальных ганглиев, вызванным дегенерацией нигростриарной допаминергической системы в головном мозге (нервные клетки, использующие допамин (DA) в качестве вещества их передачи сигнала, расположенные в черном веществе ствола головного мозга с проецированием на скорлупу и хвостатое ядро). Нарушение развивается в течение многих лет.
В настоящее время стандартное лечение основано на замещении допамина введением L-DOPA (который превращается в допамин в головном мозге) или других стимулирующих допаминовый рецептор средств. Хотя стратегии современного лечения, направленные на замещение недостаточности допамина, зачастую очень эффективны в ранней фазе заболевания (до 7-10 лет), в конце концов, большинство пациентов начинают испытывать ослабление ответа на лечение и усиление побочных эффектов. Наиболее проблемными из них является L-DOPA-индуцированные дискинезии, которые появляются в результате лечения существующим лекарственным средством выбора - L-DOPA или агонистами допамина. Поскольку пациенты с болезнью Паркинсона, как правило, живут со своим заболеванием все дольше в связи с улучшением лечения в последние годы, L-DOPA-индуцированная дискинезия представляет собой растущую проблему, особенно для пациентов с ранним началом заболевания. Сегодня существуют несколько вариантов лечения дискинезии, но они часто сложны, и доступность их ограничена.
Один подход, который был протестирован на доклинических моделях животных болезни Паркинсона, представляет собой усовершенствование классической фармакологической стратегии замены допамина с использованием подхода генной терапии для достижения локального замещения допамина в скорлупе и хвостатом ядре, где наиболее сильно проявляется недостаточность допамина. Такой подход называется «стратегией замещения фермента». Обоснование этого метода лечения связано с клиническими наблюдениями пациентов с болезнью Паркинсона (PD), которые позволяют предположить, что резкие патологические непроизвольные движения (т.е. дискинезии), индуцированные пероральным лекарственным препаратом L-DOPA, могут быть облегчены с помощью агонистов L-DOPA или DA, введенных инфузией либо внутривенно, либо дуоденально. Таким образом, нынешняя гипотеза заключается в том, что дискинезии развиваются, по меньшей мере частично, из-за периодической, импульсной доставки DA, к чему приводит схема перорального приема L-DOPA. Эти пациенты выигрывают от непрерывной стимуляции DA, также благодаря резкому сокращению общего времени, проведенного в «выключенном» состоянии.
Три различных фермента необходимы для продуцирования допамина, а именно тирозингидроксилаза (ТН), GTP -циклогидролаза 1 (GCH1) и декарбоксилаза ароматических аминокислот (AADC). Два первых регулируют продуцирование L-DOPA из тирозина (аминокислоты, имеющейся в пище), тогда как AADC превращает L-DOPA в допамин. Ни один из этих ферментов не является уникальным для допаминергических нейронов, и также может присутствовать в недопаминергических клетках. Добавление этих ферментов в денервированную область-мишень может привести к локальному продуцированию L-DOPA или допамина. Преимущество этой стратегии может заключаться в обеспечении константного продуцирования L-DOPA по сравнению с традиционными пероральными методами лечения, при которых содержание L-DOPA в плазме крови (а также содержание в головном мозге) колеблется. Это также локализует лечение в области головного мозга, где нужна замена, тогда как другие части организма не подвергаются лечения, что дает благоприятное отношение эффекта к побочному эффекту.
В опубликованных доклинических данных, полученных с использованием этого подхода, представлены следующие наблюдения:
1. Экспрессия всех трех генов может быть индуцирована в скорлупе и хвостатом ядре путем трансдукции с использованием нескольких rAAV векторов [Kaplitt МГ, et al.: Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian brain; Nat Genet 1994 8 148-54; Mandel RJ, et al.: Characterization of intrastriatal recombinant adeno-associated virus-mediated gene transfer of human tyrosine hydroxylase and human GTP-cyclohydrolase I in a rat model of Parkinson's disease; J Neurosci 1998 18 4271-84; Shen Y, et al.: Triple transduction with adeno-associated virus vectors expressing tyrosine hydroxylase, aromatic-L-amino-acid decarboxylase, and GTP cyclohydrolase I for gene therapy of Parkinson's disease; Hum Gene Ther 2000 11 1509-19].
2. Эффективность TH зависит от GCH1 (которая продуцирует кофактор тетрагидробиоптерин, ВН4). Mandel и сотрудники показали это путем измерения содержания L-DOPA с использованием микродиализа [Mandel RJ, et al.: Characterization of intrastriatal recombinant adeno-associated virus-mediated gene transfer of human tyrosine hydroxylase and human GTP-cyclohydrolase I in a rat model of Parkinson's disease; J Neurosci 1998 18 4271-84].
3. На обезьяньей модели болезни Паркинсона (МРТР-модель) экспрессия AADC может приводить к более эффективному превращению перорального L-DOPA, и благодаря этому механизму улучшается функция по показателю двигательной активности UPDRS обезьяны (UPDRS является стандартной шкалой клинической оценки симптомов Паркинсона) [Bankiewicz KS, et al.: Long-term clinical improvement in MPTP-lesioned primates after gene therapy with AAV-hAADC; Mol Ther 2006 14 564-70].
4. Экспрессия всех трех генов может привести к улучшению функции и на крысиных моделях [Shen Y, et al.: Triple transduction with adeno-associated virus vectors expressing tyrosine hydroxylase, aromatic-L-amino-acid decarboxylase, and GTP cyclohydrolase I for gene therapy of Parkinson's disease; Hum Gene Ther 2000 11 1509-19], и на обезьяньих моделях [Muramatsu S, et al.: Behavioral recovery in a primate model of Parkinson's disease by triple transduction of striatal cells with adeno-associated viral vectors expressing dopamine-synthesizing enzymes. Hum Gene Ther 2002 13 345-54] болезни Паркинсона.
5. Экспрессия ТН и GCH1 является достаточной для достижения содержания L-DOPA в полосатом теле, которое может привести к функциональному улучшению на крысиной модели болезни Паркинсона и, кроме того, может значительно снизить индуцированную L-DOPA дискинезию [Kirik D, et al.: Reversal of motor impairments in parkinsonian rats by continuous intrastriatal delivery of L-dopa using rAAV-mediated gene transfer; Proc Natl Acad Sci 2002 99 4708-13; Carlsson et al.: Reversal of dyskinesias in an animal model of Parkinson's disease by continuous L-DOPA delivery using rAAV vectors; Brain 2005 128 559-69]. Однако эти исследования были проведены с использованием двух отдельных векторов AAV серотипа 2, которые содержали либо ген GCH1, либо ген ТН, оба под контролем большого синтетического промотора (промотора b-актина цыпленка, содержащего гамма-глобулиновый интрон кролика, предшествующего энхансерному элементу из цитомегаловирусного промотора, названного промотором b-актина цыпленка СВА). Таким образом, не было никакой возможности контролировать отношение экспрессии двух генов на клеточном уровне; промотор не дает возможность экспрессии, ограниченной нейронами.
В отношении текущего состояния известного уровня техники в области настоящего изобретения в Sun et al. (2004) описан отличный от AAV вирусный вектор экспрессии с двумя единицами транскрипции, каждая из которых регулируется нейронспецифическим промотором. Относительный уровень транскрипции двух единиц не описан. In vitro присутствуют сопоставимые количества клеток, экспрессирующих ТН и GCH-1 при трансдукции вектором и 3-гена, и 4-гена. В обоих случаях ТН и GCH-1 находятся на разных транскриптах. В векторе 4-гена GCH-1 транслируется с сайта IRES (после ORF VMAT-2).
В Shen et al. (2000) описана котрансдукция клеток НЕК-293 AAV-TH, AAV-AADC и AAV-GCH-1. В титриметрическом исследовании клетки 293 трансдуцировали AAV-TH и AAV-AADC и варьирующими количествами AAV-GCH-1. Результаты показали повышение содержания и L-DOPA, и допамина с повышением титра AAV-GCH-1. AAV-GCH-1 тестировали при титрах вплоть до таких же, что и для AAV-TH. Описанные отношения составляют 1:10, 1:2 и 1:1 (AAV-GCH-1:AAV-TH). In vivo генную терапию проводили с отношением двух векторов 1:1 (с AAV-AADC и без такового).
Kirik et al., 2002, и Carlsson et al., 2005, описывают совместное введение смеси 1:1 AAV-TH и AAV-GCH1, при котором титр AAV-TH приблизительно в 3,5 раза превышает AAV-GCH-1 (отношение 1:3,5). Ни в одной из этих ссылок не говорится, почему было использовано это отношение.
В патенте США №7419829 (Oxford Biomedica) описан мутированный элемент WPRE и его применение в трехгенном векторе (EIAV) с ТН, AADC и GCH-1, разделенными последовательностями IRES. Элемент WPRE усиливает экспрессию трех генов в той же степени.
В WO 96/05319 (Arch Development) описаны двухцистронные векторы либо с сайтом IRES, либо с промотором в 5' LTR ретровируса, который контролирует экспрессию цистрона и в 5'-3'-направлении, и в 3'-5'-направлении. В эксперименте с двойной трансдукцией фибробластов описана активность ТН, составляющая в 242,6 пмоль/мг/минута, и активность GCH1, составляющая в 35,8 пмоль/мг/минута. Это выражается в отношении 1:6,8 по активности между двумя ферментами. Кроме того, в ссылке описана оптимальная концентрация ВН4 (500 QM) для достижения максимальной активности ТН. Максимальная концентрация L-DOPA в трансдуцированных ТН клетках превышала 50 QM ВН4 и далее при повышении концентраций ВН4 не повышалась.
Ни в одной из упомянутых ссылок не описан вектор AAV с конструкцией, кодирующей и ТН, и GCH-1. Все одновекторные системы, известные из предшествующего уровня техники, кодирующие и ТН, и GCH-1, были выполнены на вирусных векторах, которые содержат гораздо большие фрагменты нуклеиновой кислоты. Большинство одновекторных систем, известных из предшествующего уровня техники, дополнительно содержат конструкцию экспрессии, кодирующую AADC. AAV векторы для клинических целей предоставляют преимущества по сравнению с одновекторными системами на основе HSV, EIAV и ретровируса. Кроме того, отсутствие AADC также является преимуществом по сравнению с известным уровнем техники, поскольку это приводит к образованию L-DOPA в трансдуцированных клетках вместо DA.
Краткое раскрытие настоящего изобретения
Целью настоящего изобретения является разработка новых молекулярных инструментов для лечения нарушений, для которых существующие стратегии лечения недостаточны, или существующее лечение которых связано с серьезными побочными эффектами, и/или при которых у пациента развивается резистентность к указанному лечению. Более конкретно, настоящее изобретение относится к новой конструкции экспрессии, регулирующей содержание ферментов, вовлеченных в биосинтез катехоламина, таким образом, применимой в способе восстановления нормального катехоламинового баланса у нуждающегося в этом субъекта. В частности, настоящее изобретение относится к применению указанной конструкции экспрессии в способе лечения нервных нарушений, предпочтительно неизлечимых дегенеративных нервных нарушений, при которых большинство пациентов испытывают ослабление реакции на лечение и усиление побочных эффектов при длительном лечении.
Настоящее изобретение относится преимущественно к лечению болезни Паркинсона, при которой современная стратегия лечения предусматривает введение L-DOPA или других стимулирующих допаминовый рецептор средств. Существующее лечение является эффективным, особенно на ранней фазе заболевания, но при длительном лечении у большинства пациентов развивается индуцированная L-DOPA дискинезия. Считается, что развитие дискинезии связано с доставкой, не являющейся непрерывной, L-DOPA или других стимулирующих допаминовый рецептор агентов. Главной целью в соответствии с настоящим изобретением является усовершенствование современного лечения путем доставки соединений, необходимых для лечения, в частности, болезни Паркинсона, местно, куда необходимо, и с постоянными скоростями, что уменьшает любые побочные эффекты.
Настоящее изобретение относится к одновекторной системе экспрессии, содержащей два полинуклеотида, кодирующие два полипептида, подлежащие местному введению в центральную нервную систему, причем указанная векторная система экспрессии способна дифференциально экспрессировать два кодируемых полипептида для получения точной пропорции экспрессируемых полипептидов, необходимой для оптимального лечения данного нервного нарушения.
Согласно первому аспекту настоящее изобретение относится к одновекторной системе экспрессии, содержащей
a) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связана с указанной первой и указанной второй нуклеотидными последовательностями, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывает указанную первую и указанную вторую нуклеотидные последовательности, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
Согласно другому аспекту настоящее изобретение относится к одновекторной системе экспрессии, содержащей
а) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связывает указанную первую и указанную вторую нуклеотидные последовательности, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывает указанную первую и указанную вторую нуклеотидные последовательности, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
Согласно некоторым вариантам осуществления вектором может быть вектор на основе аденоассоциированного вируса (AAV). Согласно предпочтительным вариантам осуществления настоящее изобретение относится к регуляторным элементам, таким как посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE), в векторной конструкции для регулирования дифференциальной экспрессии кодируемых полипептидов. Согласно некоторым вариантам осуществления дифференциальная экспрессия полипептидов может быть выгодной для постоянного потока DOPA при назначенном лечении болезни Паркинсона. Она также может быть выгодной для функционирования указанного вектора в клетках млекопитающих, предпочтительно в нервных клетках.
Одновекторная конструкция, с которой возможна дифференциальная экспрессия двух или более кодирующих полипептид полинуклеотидов, также может быть использована для других применений, таких как лечение других нарушений, при которых желательна специфическая стехиометрия между двумя или более полипептидами.
Согласно другому аспекту настоящее изобретение относится к способу определения отношения экспрессии полипептида GTP-циклогидроксилазы 1 (SEQ ID NO. 1, 2, 3, 4, 5 и 6) и полипептида тирозингидроксилазы (SEQ ID NO. 7, 8, 9, 10, 11, 12, 13 и 14), соответственно, или их вариантов, причем указанный полипептид кодируется вектором, как определено в настоящем документе, предусматривающим измерение:
a. ферментной активности полипептидов, или
b. количества продуцированного ВH4, или
c. экспрессируемого количества указанных полипептидов, или
d. содержания транскрибированной мРНК, соответствующей полипептиду GTP-циклогидроксилазы 1 и полипептиду тирозингидроксилазы, соответственно.
Согласно некоторым вариантам осуществления настоящего изобретения отношение предпочтительно измеряется путем определения количества экспрессируемой мРНК, более предпочтительно путем определения количества экспрессируемого белка или путем определения активности экспрессируемых ферментов ТН (тирозингидроксилазы) и GCH1 (полипептида GTP-циклогидроксилазы 1). Отношение экспрессируемых ферментов ТН и GCH1 составляет от 15:1 до 1:1, предпочтительно от 10:1 до 3:1, более предпочтительно от 8:1 до 3:1, более предпочтительно от 7:1 до 4:1, такое как от 7:1 до 5:1, например, 6:1 (подробнее на фигуре 3).
Согласно другому аспекту настоящее изобретение относится к выделенной клетке-хозяину, содержащей вектор, как определено в настоящем документе выше.
Согласно следующим аспектам настоящее изобретение относится к медицинским применениям векторной системы экспрессии в соответствии с настоящим изобретением, полинуклеотида вектора и кодируемого полипептида.
Предпочтительно медицинским применением является применение для лечения заболевания, нарушения или повреждения нервной системы, более предпочтительно для лечения дегенеративных нервных нарушений, таких как болезнь Паркинсона.
Согласно следующим аспектам настоящее изобретение относится к выделенной клетке-хозяину, трансформированной или трансдуцированной вектором в соответствии с настоящим изобретением, и к линии упаковывающих клеток, способной продуцировать инфекционный вирион в соответствии с настоящим изобретением.
Согласно одному аспекту вектор в соответствии с настоящим изобретением применяют в качестве лекарственного препарата.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей вектор, как определено в настоящем документе выше, и фармацевтически приемлемый носитель или разбавитель.
Согласно одному аспекту фармацевтическую композицию применяют в способе лечения болезни Паркинсона, причем указанная композиция содержит одновекторную систему экспрессии и состав для доставки указанного вектора в базальные ганглии, причем указанная одновекторная система экспрессии содержит
a) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связана с указанной первой и указанной второй нуклеотидными последовательностями, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
Согласно другому аспекту настоящее изобретение относится к способу введения фармацевтической композиции в соответствии с настоящим изобретением, причем указанную фармацевтическую композицию вводят инъекцией, перорально, например, таблеткой, аэрозолем, кожно или ингаляцией. Указанной инъекцией предпочтительно является интракраниальная, интрацеребральная, интравитреальная, интраназальная, внутривенная, внутримышечная, интраспинальная, внутрибрюшинная, подкожная или болюсная, или длительная инъекция.
Также предусмотрен набор, содержащий фармацевтическую композицию в соответствии с настоящим изобретением, причем указанный набор также содержит инструкции по введению фармацевтической композиции в соответствии с настоящим изобретением.
Описание графических материалов
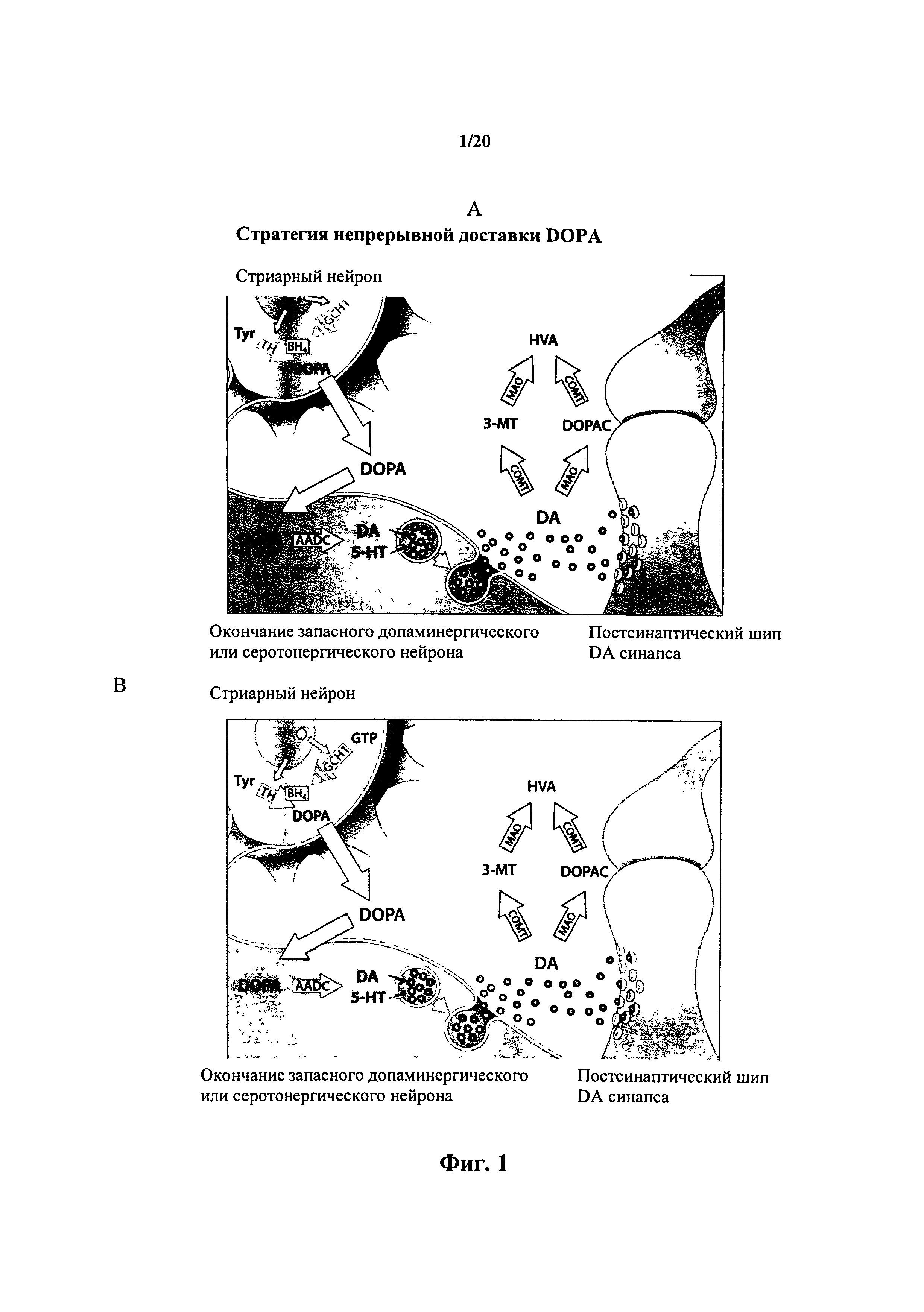
На фигуре 1 представлен (А) обзор стратегии непрерывной доставки DOPA в соответствии с настоящим изобретением; (В) сравнительный пример с использованием традиционной двухвекторной системы, не характеризующейся возможностью контролировать относительные уровни экспрессии GCH и ТН.
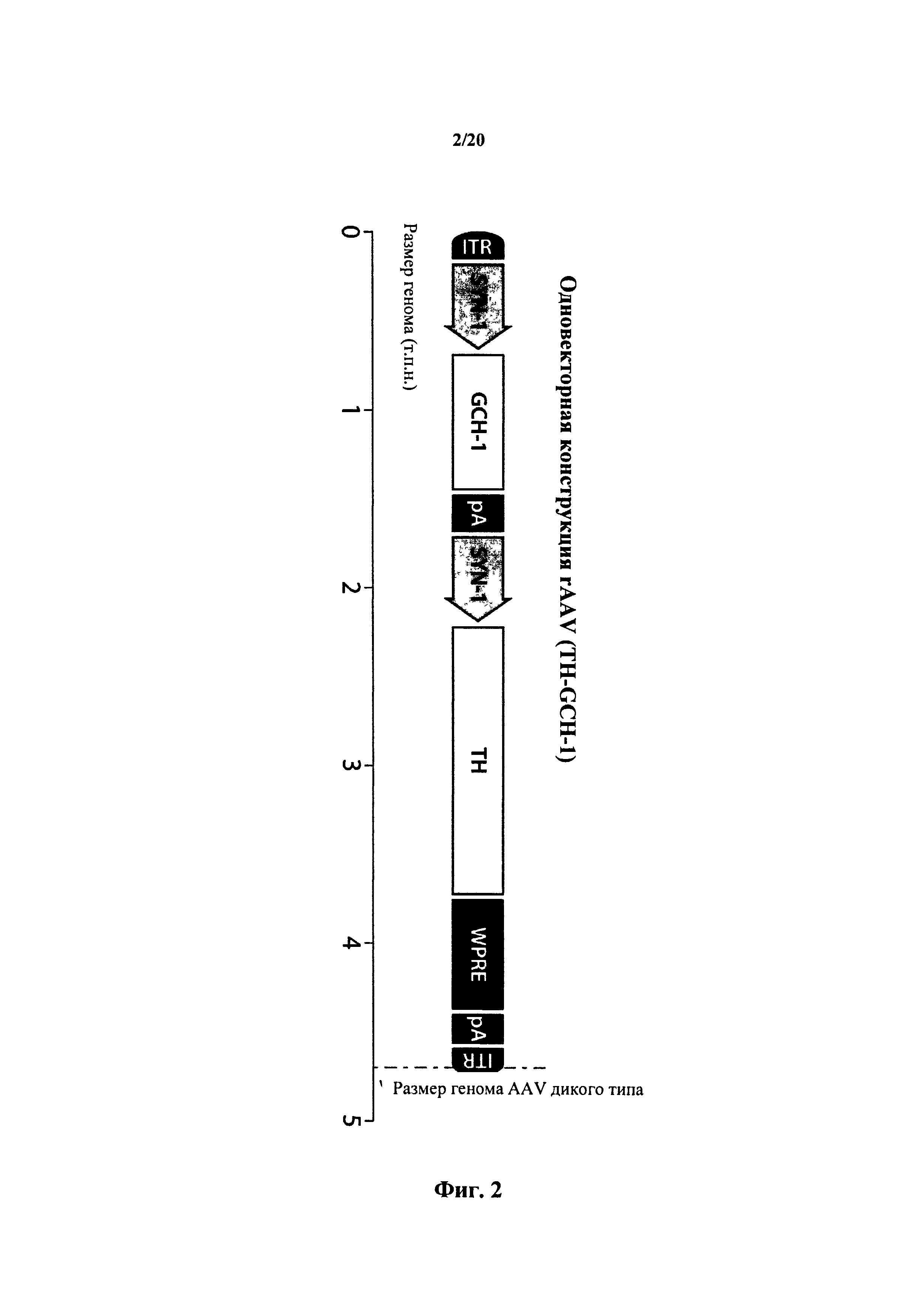
На фигуре 2 представлены векторные конструкции. Генная конструкция создана для экспрессии и тирозингидроксилазы (ТН), и GTP циклогидролазы 1 (GCH-1) из одновекторного генома. Для достижения усиленной экспрессии гена ТН по сравнению с геном GCH1 добавляли посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE). Оба гена управлялись промотором синапсина 1 (SYN-1) человека, и направленная миграция усиливалась с использованием последовательности полиаденилирования SV40 (рА). Полную генную последовательность встраивали между обращенными концевыми повторами (ITR) из серотипа 2 AAV.
На фигуре 3 представлено моделирование зависимости ВН4 и GCH1 для функции ТН. Значения данных in vivo и in vitro измерений ферментной активности ТН вместе с полуколичественными вестерн-блоттингами для измерений белка ТН в 6 группах, причем векторы rAAV5-TH и rAAV5-GCH1 смешивали в варьирующих отношениях, унифицировали в одну переменную считывания путем нормализации величин к Z-показателям. Это дает безразмерную величину, которую затем можно будет непосредственно сравнивать и моделировать, (а) Отдельные Z-показатели in vivo и in vitro ферментной активности ТН и содержания белка ТН нанесены на график как функция синтеза ВН4 в обедненном DA полосатом теле после трансдукции rAAV5-TH и rAAV5-GCH1. Эта операция показала, что результаты трех анализов фактически слились в один общий профиль при нанесении на график как функция содержания ВН4 в полосатом теле. (b) Содержание ВН4 в полосатом теле нанесено на график как функция инъецированного gc rAAV5-GCH1. Содержание ВН4 в полосатом теле не повышалось линейно с повышением титров rAAV5-GCH1, но вместо этого демонстрировало четкую корреляцию при содержании выше 3,6×109 gc. (с) Группировка Z-показателей трех тестов фермент ной функции ТН на одной модел и нанесены на график как функция содержания ВН4 в полосатом теле, (d) Средние Z-показатели трех тестов функции ТН нанесены на график как функция геномных копий инъецированного rAAV5-GCH1. Жирные линии на B-D представляют нелинейное приближение, достигнутое после применения корреляционной модели у=Ах/(В+х)+С с использованием модифицированного алгоритма Левенберга-Марквардта.
На фигуре 4 представлено восстановление двигательной функции. Животных с полной односторонней денервацией DA тестировали с использованием ряда поведенческих тестов. На основе их характеристики в тестах «цилиндр» (а) и индуцированных лекарственным средством вращений (d, е) они либо подвергались ложному хирургическому вмешательству (группа Les-Sham), либо получали терапевтический отдельный вектор rAAV (TH-GCH1). Полное восстановление наблюдали в группе TH-GCH1 в течение 5 недель в тесте «цилиндр» (а) и тесте с шаганием (b). Оно сохранялось в течение всего эксперимента. Оно также наблюдалось в тесте «коридор» (с), тогда как восстановление было частичным при индуцированных амфетамином (d) и апоморфином (е) вращениях. Восстановление комплексной двигательной функции, такой как в тесте с лестницей, также было значительным (f). * = значительно отличается от группы Les-Sham.
На фигуре 5 представлен посмертный анализ трансгенной экспрессии и синтеза DA. Через шесть месяцев после инъекции rAAV у поврежденных 6-OHDA животных оценивали функцию одного вектора TH-GCH1 rAAV биохимически и с использованием иммуногистохимии. Иммуногистохимический анализ показал явную экспрессию обоих трансгенов ТН (а) и GCH1 (b). Эта экспрессия была связана с очень эффективным продуцированием и DOPA (закрашенный столбик в с), и ВН4 (закрашенный столбик в d) в гораздо более высокой степени, чем в интактном полосатом теле (незакрашенный столбик в d). Содержание допамина также было в значительной степени восстановлено (е), содержание промежуточного метаболита DOPAC восстанавливалось до 50% от нормы (f), а содержание конечного метаболита HVA (g) повышалось в два раза по сравнению с нормальным содержанием.
На фигуре 6 представлена векторная карта с конструкцией одного варианта осуществления настоящего изобретения.
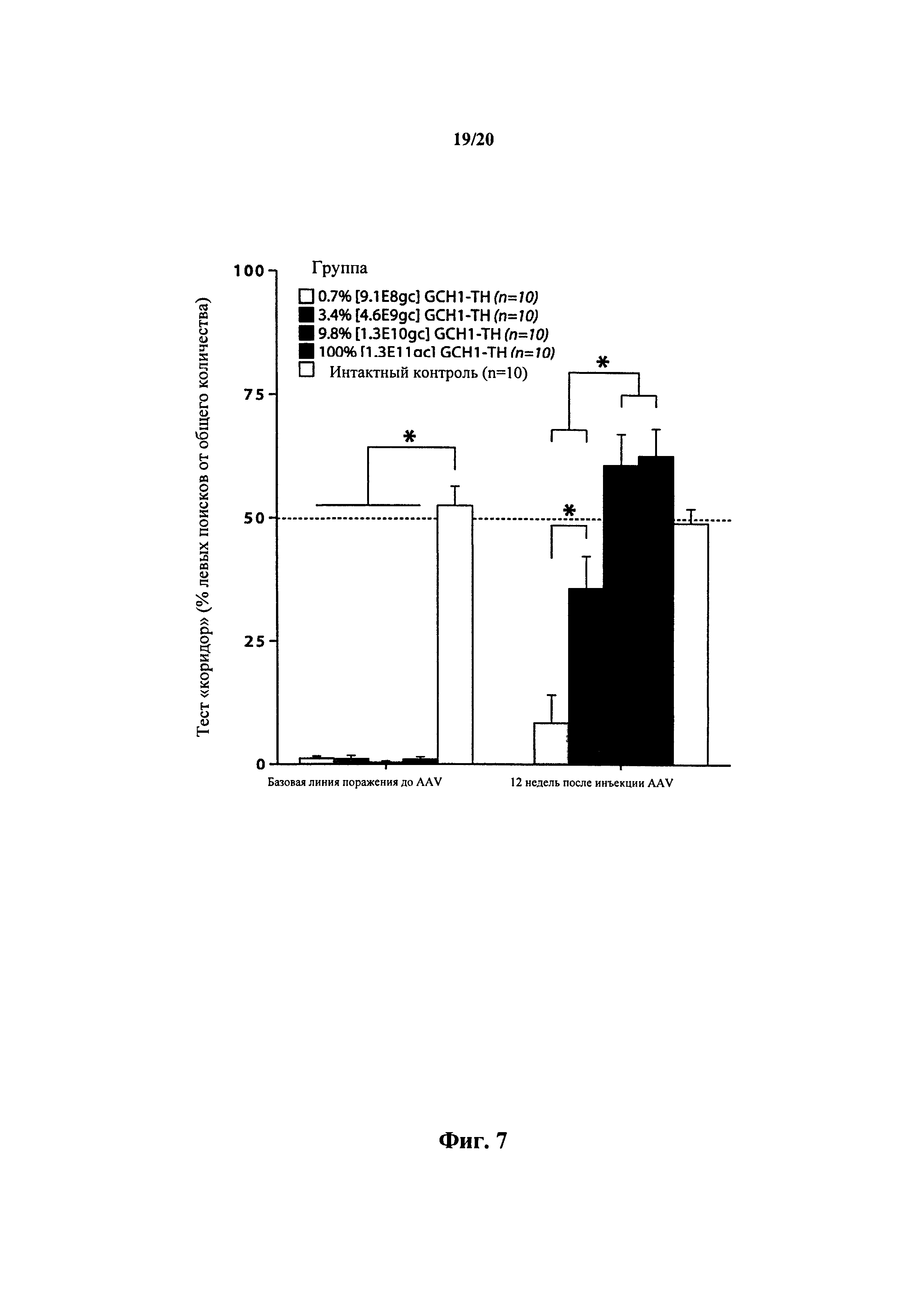
На фигуре 7 представлена зависимость дозы от реакции по отношению к восстановлению двигательной функции. Животных с полной односторонней денервацией DA тестировали в тесте «коридор» до инъекции AAV (обозначенная базовая линия повреждения). Затем их делили на четыре группы на основе их характеристик. Затем все поврежденные животные получали стереотаксическую инъекцию равного объема вектора rAAV5-TH:GCH1 [5 мкл], но с повышающейся концентрацией. В результате этого образовались следующие четыре группы дозирования: 0,7% [9,1×108 gc], 3,4% [4,6×109 gc], 9,8% [1,3×1010 gc], 100% [1,3×1011 gc]. Включали равную по размеру интактную одновозрастную контрольную группу в качестве стандартной для всех временных точек. Затем животных повторно подвергли тесту «коридор» через 12 недель после инъекции AAV. Полное восстановление наблюдали в двух опытных группах, которые получали более высокие концентрации векторов, т.е. понижение до дозы вектора 1,3×1010 gc rAAV5-TH:GCH1.4,6×109 gc давало 50% восстановление, тогда как восстановление от дозы 9,1×108 gc было значительно ниже. * = значительно отличается при двойном факторном ANOVA с последующим апостериорным критерием подлинной значимости Тьюки.
На фигуре 8 представлена количественная оценка с помощью микродиализа межклеточного содержания допамина. Животных с полной, односторонней денервацией DA делили на две группы (группу TH-GCH1 и только с повреждением 6-OHDA). Затем животные группы TH-GCH1 получали стереотаксическую инъекцию полного титра вектора rAAV5-TH:GCH1. Также в исследование включали неповрежденных интактных одновозрастных животных (интактный контроль). По меньшей мере через 6 месяцев количественно оценивали межклеточное содержание допамина с использованием микродиализа в режиме реального времени. Межклеточное содержание допамина было понижено почти на 90% в контрольной группе с повреждением. С другой стороны, после инъекции rAAV5-TH:GCH1 межклеточное содержание допамина было восстановлено до значения, более чем вдвое выше, чем у интактных животных. * = значительно отличается от контроля с повреждением при двойном факторном ANOVA с последующим апостериорным критерием подлинной значимости Тьюки.
Определения
Агонист: Термин «агонист» при использовании в настоящем документе относится к лекарственному средству, которое связывается с рецептором клетки и запускает ответ клетки.
Биологически активный: Термин «биологически активный» при использовании в настоящем документе по отношению к ферментам, кодируемым векторной конструкцией в соответствии с настоящим изобретением, относится к ферментной активности указанных ферментов, означая способность катализировать определенную ферментативную реакцию. В частности, биологическая активность относится к ферментной активности тирозингидроксилазы (ТН) и GTP-циклогидролазы (GCH-1).
Биологически активный фрагмент: Термин «биологически активный фрагмент» при использовании в настоящем документе относится к части полипептида, включая ферменты, обладающей той же биологической активностью, что и полноразмерный полипептид. Биологическая активность фрагмента может быть меньше, больше или равной ферментной активности нативного полноразмерного полипептида.
Биологически активный вариант: Термин «биологически активный вариант» при использовании в настоящем документе относится к полипептидной части белка, такого как фермент, обладающего той же биологической активностью, что и нативный полноразмерный белок. Биологическая активность фрагмента может быть меньше, больше или равной ферментной активности нативного полноразмерного полипептида.
Катехоламиновая дисфункция: Термин «катехоламиновая дисфункция» при использовании в настоящем документе относится к патологиям в синтезе катехоламина, регуляции, хранении, высвобождении, захвате или метаболизме по сравнению с теми же параметрами у здорового субъекта. В частности, катехоламиновой дисфункцией является допаминовая дисфункция, такая как недостаточность допамина. Специалист в данной области сможет диагностировать катехоламиновую дисфункцию.
Когнитивное нарушение: Термин «когнитивное нарушение» при использовании в настоящем документе относится к состоянию с низкой психической функцией, связанной со спутанностью, потерей памяти и трудностью концентрации.
Консервативная замена: Термин «консервативная аминокислотная замена», определенный в настоящем документе, относится к замене, с помощью которой одна аминокислота заменяется другой с одной или несколькими общими химическими и/или физическими характеристиками. Аминокислоты могут быть сгруппированы согласно общим характеристикам. Консервативной аминокислотной заменой является замена одной аминокислоты в заданной группе аминокислот на отличную аминокислоту в той же группе, причем аминокислоты в заданных группах проявляют подобные или по сути аналогичные характеристики.
Нарушение: Термин «нарушение» при использовании в настоящем документе относится к заболеванию или медицинской проблеме и является нарушающим функции организма патологическим состоянием организма, связанным со специфическими симптомами и признаками. Оно может быть вызвано внешними факторами, такими как инвазивные организмы, или оно может быть вызвано внешними дисфункциями, такими как ослабленное продуцирование или транспорт катехоламина. В частности, нарушением при использовании в настоящем документе является дисфункция продуцирования допамина или патологическая физиологическая концентрация допамина.
Экспрессия: Термин «экспрессия» последовательности нуклеиновой кислоты, кодирующей полипептид, означает транскрипцию такой последовательности нуклеиновой кислоты, как и мРНК, и/или транскрипцию и трансляцию такой последовательности нуклеиновой кислоты, что приводит к продуцированию определенного белка.
Кассета экспрессии: Термин «кассета экспрессии» при использовании в настоящем документе относится к геномной последовательности, которая обеспечивает все элементы, необходимые для синтеза белка in vivo. Она может содержать без ограничения последовательность, которая управляет транскрипцией от ДНК до мРНК, т.е. промоторную последовательность, открытую рамку считывания, которая содержит геномную последовательность для интересующего белка и 3'-нетранслируемую область, которая способствует полиаденилированию мРНК.
Функциональный в клетках млекопитающих: Термин «функциональный в клетках млекопитающих» при использовании в настоящем документе относится к последовательности, например, нуклеотидной последовательности, такой как вектор, который при введении в клетку млекопитающего приводит к трансляции в биологически активный полипептид.
Генная терапия: Термин «генная терапия» при использовании в настоящем документе относится к инсерции генов в клетки и ткани субъекта для лечения заболевания.
Последовательность нуклеиновой кислоты: Термин последовательность нуклеиновой кислоты при использовании в настоящем документе относится к одноцепочечной или двухцепочечной цепи двух или более нуклеотидных оснований, включая без ограничения дезоксирибонуклеиновую кислоту (ДНК), рибонуклеиновую кислоту (РНК), аналоги либо ДНК, либо РНК, мРНК и кДНК.
Функционально связанный: Термин «функционально связанный» при использовании в настоящем документе означает, что последовательность нуклеиновой кислоты, кодирующая один или несколько интересующих полипептидов, и транскрипционные регуляторные последовательности соединены таким образом, чтобы обеспечить экспрессию последовательности нуклеиновой кислоты при введении в клетку.
Болезнь Паркинсона: Термин «болезнь Паркинсона» (также известна как паркинсонова болезнь, или PD) при использовании в настоящем документе относится к дегенеративному нарушению центральной нервной системы, при котором часто нарушаются двигательные навыки, речь и другие функции больного. Болезнь Паркинсона принадлежит к группе состояний, названных нарушениями движения. Она характеризуется мышечной ригидностью, тремором, замедлением физического движения и, в крайних случаях, утратой физического движения. PD может быть как хронической, так и прогрессирующей.
Фармацевтическое средство: Термины «фармацевтическое средство», или «лекарственное средство», или «лекарственный препарат» относится к любому терапевтическому или профилактическому средству, которое может быть использовано в лечении (в том числе профилактике, диагностике, облегчении или излечении) расстройства, физического недостатка, состояния, заболевания или повреждения у пациента. Терапевтически применимые генетические детерминанты, пептиды, полипептиды и полинуклеотиды могут быть включены в значение термина фармацевтическое или лекарственное средство. Как определено в настоящем документе, «терапевтическое средство», «фармацевтический средство» или «лекарственное средство» или «лекарственный препарат» являются типом биологически активного средства.
Фармацевтическая композиция: или лекарственное средство, лекарственный препарат или средство относится к любому химическому или биологическому веществу, соединению или композиции, способным индуцировать желаемый терапевтический эффект при введении должным образом пациенту. Некоторые лекарственные средства представляют собой твердое вещество в неактивной форме, которое превращается in vivo в метаболит с фармацевтической активностью. Для целей настоящего изобретения термины «фармацевтическая композиция» и «лекарственный препарат» охватывает как неактивное лекарственное средство, так и активный метаболит.
Полипептид: Термин «полипептид» при использовании в настоящем документе относится к молекуле, содержащей по меньшей мере две аминокислоты. Аминокислоты могут быть природными или синтетическими. «Олигопептиды» определены в настоящем документе как полипептиды, характеризующиеся длиной не более 100 аминокислот. Термин «полипептид» также предполагает белки, т.е. функциональные биомолекулы, содержащие по меньшей мере один полипептид; при содержании по меньшей мере двух полипептидов они могут формировать комплексы, могут быть ковалентно связанными или могут быть нековалентно связанными. Полипептиды в белке могут быть гликозилированными и/или липидированными и/или могут содержать простетические группы.
Полинуклеотид: Термин «полинуклеотид» при использовании в настоящем документе относится к молекуле, которая является молекулой органического полимера, состоящей из нуклеотидных мономеров, ковалентно связанных в цепь. «Полинуклеотид» при использовании в настоящем документе относится к молекуле, содержащей по меньшей мере две нуклеиновые кислоты. Нуклеиновые кислоты могут быть природного происхождения или модифицированными, такими как закрытые нуклеиновые кислоты (LNA) или пептидонуклеиновые кислоты (PNA). Полинуклеотид при использовании в настоящем документе обычно относится к
i) полинуклеотиду, содержащему заданную кодирующую последовательность, или
ii) полинуклеотиду, кодирующему заданную аминокислотную последовательность, или
iii) полинуклеотиду, кодирующему фрагмент полипептида, кодируемого полинуклеотидами (i) или (ii), причем указанный фрагмент обладает по меньшей мере одной заданной активностью, как определено в настоящем документе; и
iv) полинуклеотиду, комплементарная нить которого гибридизируется при жестких условиях с полинуклеотидом, определенным в каком-либо из (i), (ii) и (iii), и кодирует полипептид или его фрагмент, обладающий по меньшей мере одной заданной активностью, как определено в настоящем документе; и
v) полинуклеотиду, содержащему нуклеотидную последовательность, которая является вырожденной в нуклеотидную последовательность полинуклеотидов (iii) или (iv);
или к комплементарной нити такого полинуклеотида.
Промотор: Термин «промотор» при использовании в настоящем документе относится к области ДНК, которая способствует транскрипции конкретного гена. Промоторы, как правило, располагаются рядом с регулируемыми ими генами в той же цепи и в 5'-3'-направлении.
Белок: Термин «белок» при использовании в настоящем документе относится к органическому соединению, также известному как полипептид, которое является пептидом, содержащим по меньшей мере две аминокислоты, но предпочтительно более двух аминокислот. Родовой термин «аминокислота» предусматривает и природные и неприродные аминокислоты, любая из которых может характеризоваться «D» или «L» изомерной формой.
Идентичность последовательностей: Идентичность последовательностей определяется в одном варианте осуществления с использованием фрагментов пептидов-модуляторов активности пронейротрофина, содержащих по меньшей мере 25 смежных аминокислот и характеризующихся аминокислот ной последовательностью, которая по меньшей мере на 80%, так, например, на 85%, например, на 90%, так, например, на 95%, например, на 99% идентична аминокислотной последовательности любой из SEQ ID NO в соответствии с настоящим изобретением, причем процент идентичности определяется согласно алгоритму GAP, BESTFIT или FASTA программного обеспечения Wisconsin Genetics Software Package Release 7.0, с использованием «весов» гэпов по умолчанию.
Следующие выражения используются для описания взаимоотношений последовательностей между двумя или более полинуклеотидами: «заданная последовательность», «окно сравнения», «идентичность последовательностей», «процентное отношение идентичности последовательностей» и «существенная идентичность».
«Заданная последовательность» представляет собой определяемую последовательность, используемую в качестве основы для сравнения последовательностей; заданной последовательностью может быть подмножество более крупной последовательности, например, как полноразмерный сегмент ДНК или генная последовательность, приведенная в перечне последовательностей, такая как полинуклеотидная последовательность, выбранная из группы, состоящей из SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22, или может содержать полную ДНК или генную последовательность. Как правило, заданная последовательность характеризуется длиной по меньшей мере 20 нуклеотидов, зачастую длиной по меньшей мере 25 нуклеотидов и часто длиной по меньшей мере 50 нуклеотидов.
Поскольку каждый из двух полинуклеотидов может (1) содержать последовательность (т.е. часть полной полинуклеотидной последовательности), которая подобна у двух полинуклеотидов, и может (2) дополнительно содержать последовательность, которая дивергентна у двух полинуклеотидов, сравнения последовательностей между двумя (или более) полинуклеотидами, как правило, выполняется путем сравнения последовательностей двух полинуклеотидов по «окну сравнения» для идентификации и сравнения локальных областей подобия последовательностей. «Окно сравнения» при использовании в настоящем документе относится к концептуальному сегменту по меньшей мере 20 позиций смежных нуклеотидов, причем полинуклеотидная последовательность может сравниваться с заданной последовательностью по меньшей мере 20 смежных нуклеотидов, и причем часть полинуклеотидной последовательности в окне сравнения может содержать 20 процентов или меньше добавлений или делеций (т.е. гэпов) по сравнению с заданной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей.
Оптимальное выравнивание последовательностей для выравнивания по окну сравнения может быть проведено с помощью алгоритма локальной гомологии (Smith and Waterman Adv. Appl. Math. 2:482 (1981)), алгоритма выравнивания областей гомологии (Needleman and Wunsch, J. Mol. Biol. 48:443 (1970)), методом поиска подобия (Pearson and Lipman, Proc. Natl. Acad. Sci. (USA) 85:2444 (1988)) путем компьютерной реализации этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package Release 7.0 (Genetics Computer Group, 575 Science Dr., Madison, Wis.), GENEWORKS™ или пакетах программ MACVECTOR®) или с использованием программы контроля и построения наилучшего выравнивания (т.е. получения наиболее высокого процента гомологии по окну сравнения), достигаемого различными методами.
Термин «идентичность последовательностей» означает, что две полинуклеотидные последовательности являются идентичными (т.е. на нуклеотидном уровне) в окне сравнения. Термин «процент идентичности последовательностей» означает процент, который вычисляют путем сравнения двух оптимально выравниваемых последовательностей по окну сравнения; определения числа положений, в которых встречаются идентичное основание нуклеиновой кислоты (например, А, Т, С, G, U или I) в обеих последовательностях с получением числа соответствующих положений; деления этого числа соответствующих положений на общее число положений в окне сравнения (т.е. на размер окна); и умножения полученного результата на 100 с получением процента идентичности последовательностей. Термин «значительная идентичность» при использовании в настоящем документе означает характеристику полинуклеотидной последовательности, причем полинуклеотид содержит последовательность, которая характеризуется по меньшей мере 85 процентной идентичностью последовательностей, предпочтительно по меньшей мере 90-95 процентной идентичностью последовательностей, чаще по меньшей мере 99 процентной идентичностью последовательностей по сравнению с заданной последовательностью по окну сравнения по меньшей мере из 20 позиций нуклеотидов, зачастую по окну по меньшей мере из 25-50 нуклеотидов, причем процент идентичности последовательностей вычисляют путем сравнения заданной последовательности с последовательностью, которая может включать делеции или добавления, которые в целом составляют 20 процентов или менее по сравнению с заданной последовательностью в окне сравнения. Заданной последовательностью может быть подмножество более крупной последовательности, например, как полноразмерный сегмент полинуклеотидных последовательностей SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21 или SEQ ID NO: 22, иллюстрированных в настоящем документе.
Применительно к полипептидам степень идентичности аминокислотных последовательностей является функцией числа идентичных аминокислот в общих для аминокислотных последовательностей положениях. Степень гомологии или подобия аминокислотных последовательностей является функцией числа аминокислот, т.е. структурно родственных, в общих для аминокислотных последовательностей положениях.
Термин «неродственная» или «негомологичная» последовательность означает последовательность, которая характеризуется менее чем 40-процентной идентичностью с другой последовательностью, даже предпочтительно менее чем 25-процентной идентичностью с полипептидами в соответствии с настоящим изобретением. Термин «значительная идентичность» означает, что две пептидных последовательности при оптимальном выравнивании, таком как с помощью программ GAP или BESTFIT с использованием «весов» гэпов по умолчанию, характеризуются по меньшей мере 80 процентной идентичностью последовательностей, предпочтительно по меньшей мере 90 процентной идентичностью последовательностей, более предпочтительно по меньшей мере 95 процентной идентичностью последовательностей или больше (например, 99 процентной идентичностью последовательностей). Предпочтительно положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами.
Консервативные аминокислотные замены относятся к взаимозаменяемости остатков, характеризующихся подобными боковыми цепями. Например, группа аминокислот, характеризующихся алифатическими боковыми цепями, содержит глицин, аланин, валин, лейцин и изолейцин; группа аминокислот, характеризующихся алифатическими-гидроксильными боковыми цепями, содержит серин и треонин, группа аминокислот, характеризующихся содержащими амид боковыми цепями, содержит аспарагин и глутамин; группа аминокислот, характеризующихся ароматическими боковыми цепями, содержит фенилаланин, тирозин и триптофан; группа аминокислот, характеризующихся основными боковыми цепями, содержит лизин, аргинин и гистидин; и группа аминокислот, характеризующихся содержащими серу боковыми цепями, содержит цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин.
Кроме того, варианты также определены на основе заданного числа консервативных аминокислотных замен, как определено в настоящем документе ниже. Консервативная аминокислотная замена при использовании в настоящем документе относится к замене одной аминокислоты (в заданной группе аминокислот) на другую аминокислоту (в той же группе), причем аминокислоты проявляют подобные или существенно подобные характеристики.
В значении термина «консервативная аминокислотная замена», применяемом в настоящем документе, одна аминокислота может быть замещена на другую в группах аминокислот, показанных в настоящем документе ниже:
i) аминокислоты, содержащие полярные боковые цепи (Asp, Glu, Lys, Arg, His, Asn, Gln, Ser, Thr, Tyr и Cys);
ii) аминокислоты, содержащие неполярные боковые цепи (Gly, Ala, Val, Leu, Ile, Phe, Trp, Pro и Met);
iii) аминокислоты, содержащие алифатические боковые цепи (Gly, Ala Val, Leu, Ile);
iv) аминокислоты, содержащие циклические боковые цепи (Phe, Tyr, Trp, His, Pro);
v) аминокислоты, содержащие ароматические боковые цепи (Phe, Tyr, Trp);
vi) аминокислоты, содержащие кислые боковые цепи (Asp, Glu);
vii) аминокислоты, содержащие основные боковые цепи (Lys, Arg, His);
viii) аминокислоты, содержащие амидные боковые цепи (Asn, Gln);
ix) аминокислоты, содержащие гидроксильные боковые цепи (Ser, Thr);
x) аминокислоты, содержащие боковые цепи, содержащие серу (Cys, Met);
xi) нейтральные, слабо гидрофобные аминокислоты (Pro, Ala, Gly, Ser, Thr);
xii) гидрофильные, кислые аминокислоты (Gln, Asn, Glu, Asp) и
xiii) гидрофобные аминокислоты (Leu, Ile, Val).
Следовательно, вариант или его фрагмент в соответствии с настоящим изобретением может содержать в одном и том же варианте последовательности или его фрагментах или среди различных вариантов последовательности или их фрагментов по меньшей мере одну замену, например, множество замен, введенных независимо друг от друга.
Из вышеуказанного видно, что один и тот же вариант или его фрагмент может содержать более чем одну консервативную аминокислотную замену из более чем одной группы консервативных аминокислот, как определено в настоящем документе выше.
Добавлением или делецией по меньшей мере одной аминокислоты может быть добавление или делеция предпочтительно от 2 до 250 аминокислот, такие как от 10 до 20 аминокислот, например, от 20 до 30 аминокислот, такие как от 40 до 50 аминокислот. Однако в соответствии с настоящим изобретением также предусмотрены добавления или делеции более чем 50 аминокислот, такие как добавления от 50 до 100 аминокислот, добавление от 100 до 150 аминокислот, добавление от 150 до 250 аминокислот. Делецией и/или добавлением независимо друг от друга могут быть делеция и/или добавление внутрь последовательности и/или на конце последовательности.
Полипептидные фрагменты в соответствии с настоящим изобретением, включая какие-либо их функциональные эквиваленты, в одном варианте осуществления могут содержать менее чем 250 аминокислотных остатков, такие как менее чем 240 аминокислотных остатков, например, менее чем 225 аминокислотных остатков, такие как менее чем 200 аминокислотных остатков, например, менее чем 180 аминокислотных остатков, такие как менее чем 160 аминокислотных остатков, например, менее чем 150 аминокислотных остатков, такие как менее чем 140 аминокислотных остатков, например, менее чем 130 аминокислотных остатков, такие как менее чем 120 аминокислотных остатков, например, менее чем 110 аминокислотных остатков, такие как менее чем 100 аминокислотных остатков, например, менее чем 90 аминокислотных остатков, такие как менее чем 85 аминокислотных остатков, например, менее чем 80 аминокислотных остатков, такие как менее чем 75 аминокислотных остатков, например, менее чем 70 аминокислотных остатков, такие как менее чем 65 аминокислотных остатков, например, менее чем 60 аминокислотных остатков, такие как менее чем 55 аминокислотных остатков, например, менее чем 50 аминокислотных остатков.
«Функциональная эквивалентность», используемая в соответствии с настоящим изобретением, согласно одному предпочтительному варианту осуществления означает ссылку на соответствующую функциональность заданного фрагмента последовательности.
Функциональные эквиваленты или варианты ТН или GCH-1, как будет понятно, показывают аминокислотные последовательности, немного отличающиеся от предпочтительной заданной последовательности ТН или GCH-1, поскольку повышается число и объем инсерций, делеций и замен, в том числе консервативных замен. Это различие измеряется как уменьшение гомологии между предпочтительной заданной последовательностью и фрагментом или функциональным эквивалентом.
Все фрагменты или функциональные эквиваленты SEQ ID NO: SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14 включены в объем настоящего изобретения, независимо от степени гомологии, которую они показывают относительно заданных последовательностей ТН и GCH-1, раскрытых в настоящем документе. Причиной вышеупомянутого является то, что некоторые области ТН и GCH-1 могут быть легко мутабельными или могут быть полностью удалены без какого-либо существенного влияния на активность связывания полученного фрагмента.
Функциональный вариант, полученный заменой, может проявлять ту или иную форму или степень нативной активности ТН и GCH-1, и все еще является гомологичным, если остатки, содержащие функционально подобные боковые цепи аминокислоты замещены. «Функционально подобный» в этом отношении относится к преобладающим характеристикам боковых цепей, таким как гидрофобные, основные, нейтральные или кислотные, или присутствию или отсутствию стерического объема. Следовательно, в одном варианте осуществления настоящего изобретения степень идентичности не является основным критерием фрагмента, являющегося вариантом или функциональным эквивалентом предпочтительного заданного фрагмента в соответствии с настоящим изобретением.
Гомология между аминокислотными последовательностями может быть рассчитана с использованием хорошо известных оценочных матриц, таких как какая-либо из BLOSUM 30, BLOSUM 40, BLOSUM 45, BLOSUM 50, BLOSUM 55, BLOSUM 60, BLOSUM 62, BLOSUM 65, BLOSUM 70, BLOSUM 75, BLOSUM 80, BLOSUM 85 и BLOSUM 90.
Фрагменты, разделяющие гомологию с фрагментами из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13 и SEQ ID NO: 14, соответственно, должны рассматриваться как попадающие в объем настоящего изобретения, если они предпочтительно по меньшей мере приблизительно на 90 процентов гомологичные, например, по меньшей мере на 92 процентов гомологичные, такие как по меньшей мере на 94 процентов гомологичные, например, по меньшей мере на 95 процентов гомологичные, такие как по меньшей мере на 96 процентов гомологичные, например, по меньшей мере на 97 процентов гомологичные, такие как по меньшей мере на 98 процентов гомологичные, например, по меньшей мере на 99 процентов гомологичные с указанными последовательностями заданных фрагментов, соответственно. Согласно одному варианту осуществления настоящего изобретения процентные отношения гомологии относится к процентным отношениям идентичности.
Дополнительными факторами, которые могут приниматься во внимание при определении функциональной эквивалентности в соответствии со значением, используемым в настоящем документе, являются i) способность антисыворотки выявлять фрагмент ТН или GCH-1 в соответствии с настоящим изобретением или ii) способность функционально эквивалентного фрагмента ТН или GCH-1 конкурировать с соответствующим фрагментом ТН или GCH-1 в анализе. Один способ определения последовательности иммуногенно активных аминокислот в известной аминокислотной последовательности были описаны Geysen в патенте США №5595915, который включен в настоящий документ посредством ссылки.
Следующий надлежащим образом адаптированный способ определения взаимосвязей структуры и функции пептидных фрагментов описан в патенте США №6013478, который включен в настоящий документ посредством ссылки. Кроме того, способы анализа связывания аминокислотной последовательности с рецепторной частью известны специалисту.
Кроме консервативных замен, введенных в какое-либо положение предпочтительного заданного полипептида ТН или GCH или его фрагмента, также может быть желательным введение неконсервативных замен в любое одно или несколько положений такого полипептида.
Неконсервативная замена, ведущая к образованию функционально эквивалентного фрагмента ТН или GCH-1, будет, например, i) значительно отличаться по полярности, например, остаток с неполярной боковой цепью (Ala, Leu, Pro, Trp, Val, Ile, Leu, Phe или Met) замещен остатком с полярной боковой цепью, таким как Gly, Ser, Thr, Cys, Tyr, Asn или Gln, или заряженной аминокислотой, такой как Asp, Glu, Arg или Lys, или заряженный или полярный остаток замещен неполярным остатком; и/или ii) значительно отличаться по своему эффекту на ориентацию остова полипептида, например, замена Pro или Gly другим остатком или замена на Pr о или Gly; и/или iii) значительно отличаться по электрическому заряду, например, замена отрицательно заряженного остатка, такого как Glu или Asp на положительно заряженный остаток, такой как Lys, His или Arg (и наоборот); и/или iv) значительно отличаться по стерическому объему, например, замена объемистого остатка, такого как His, Trp, Phe или Tyr, на остаток, характеризующийся меньшей боковой цепью, например, Ala, Gly или Ser (и наоборот).
Варианты, полученные заменой аминокислот, в одном предпочтительном варианте осуществления, могут быть выполнены на основе значений гидрофобности и гидрофильности и относительном подобии заместителей боковых цепей аминокислот, в том числе заряд, размер и т.п. Типичные аминокислотные замены, которые принимают во внимание различные вышеупомянутые характеристики, хорошо известны специалисту в данной области и содержат: аргинин и лизин; глутамат и аспартат; серии и треонин; глутамин и аспарагин; а также валин, лейцин и изолейцин.
В дополнение к вариантам, описанным в настоящем документе, стерически подобные варианты могут быть приготовлены для имитации основных частей структуры варианта, и такие соединения также могут быть использованы тем же образом, что и варианты в соответствии с настоящим изобретением. Это может быть достигнуто методиками моделирования и химического конструирования, известными специалисту в данной области. Следует иметь в виду, что все такие стерически подобные конструкции попадают в объем настоящего изобретения.
В следующем варианте осуществления настоящее изобретение относится к функциональным вариантам, содержащим замещенные аминокислоты, содержащие значения гидрофильности или индексы гидропатичности, которые находятся в пределах +/- 4,9, например, в пределах +/- 4,7, такие как в пределах +/- 4,5, например, в пределах +/- 4,3, такие как в пределах +/- 4,1, например, в пределах +/- 3,9, такие как в пределах +/- 3,7, например, в пределах +/- 3,5, такие как в пределах +/- 3,3, например, в пределах +/- 3,1, такие как в пределах +/- 2,9, например, в пределах +/- 2,7, такие как в пределах +/- 2,5, например, в пределах +/- 2,3, такие как в пределах +/- 2,1, например, в пределах +/- 2,0, такие как в пределах +/- 1,8, например, в пределах +/- 1,6, такие как в пределах +/- 1,5, например, в пределах +/- 1,4, такие как в пределах +/- 1,3 например, в пределах +/- 1,2, такие как в пределах +/- 1,1, например, в пределах +/- 1,0, такие как в пределах +/- 0,9, например, в пределах +/- 0,8, такие как в пределах +/- 0,7, например, в пределах +/- 0,6, такие как в пределах +/- 0,5, например, в пределах +/- 0,4, такие как в пределах +/- 0,3, например, в пределах +/- 0,25, такие как в пределах +/- 0,2 значения аминокислоты, которую она заменила.
Важность индексов гидрофильности и гидропатичности аминокислот в обеспечении интерактивной биологической функции белка хорошо известна в уровне техники (Kyte & Doolittle, 1982, и Норр, в патенте США №4554101, который включен в настоящий документ посредством ссылки).
Значениями индекса гидропатичности аминокислоты при использовании в настоящем документе являются: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серии (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5) (Kyte & Doolittle, 1982).
Значениями гидрофильности аминокислоты являются: аргинин (+3.0); лизин (+3,0); аспартат (+3,0 +/-,1); глутамат (+3,0 +/-,1); серии (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5+/-,1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5); триптофан (-3,4) (патент США №4554101).
Кроме пептидильных соединений, описанных в настоящем документе, стерически подобные соединения могут быть приготовлены для имитации основных частей структуры пептида, и такие соединения также могут быть использованы тем же образом, что и пептиды в соответствии с настоящим изобретением. Это может быть достигнуто методиками моделирования и химического конструирования, известными специалисту в данной области. Например, превращение в сложный эфир и другие алкилирования могут быть использованы для модификации аминоконцов, например, диаргининового пептидного остова, для имитации тетрапептидной структуры. Следует иметь в виду, что все такие стерически подобные конструкции попадают в объем настоящего изобретения.
Пептиды с N-концевыми алкилированиями и С-концевыми превращениями в сложный эфир также охватываются настоящим изобретением. Функциональные эквиваленты также содержат гликозилированные и ковалентные или агрегационные конъюгаты, образованные с теми же или другими фрагментами ТН или GCH-1 и/или молекулами ТН или GCH-1, в том числе димеры или неродственные химические части. Такие функциональные эквиваленты получаются путем связывания функциональностей с группами, которые находятся во фрагменте, в том числе на любом одном или обоих N- и С-концах, с помощью средств, известных в уровне техники.
Функциональные эквиваленты, таким образом, могут содержать фрагменты, конъюгированные с алифатическими или ацильными сложными эфирами или амидами карбоксильного конца, алкиламинами или остатками, содержащими карбоксильные боковые цепи, например, конъюгаты с алкиламинами на остатках аспарагиновой кислоты; О-ацильные производные содержащих гидроксильные группы остатков и N-ацильные производные амино-концевой аминокислоты или содержащих амино-группы остатков, например, конъюгаты с fMet-Leu-Phe или иммуногенные белки. Производные ацильные группы выбраны из группы алкильных частей (включающих С3-С10 нормальный алкил), тем самым формируется алканоильный продукт, и карбоциклических или гетероциклических соединений, тем самым формируется ароильный продукт. Реактивные группы предпочтительно являются бифункциональными соединениями, известными per se для применения в сшивании белков с нерастворимыми матрицами через реактивные боковые группы.
Ковалентные или агрегационные функциональные эквиваленты и их производные применимы в качестве реагентов в иммуноанализах или для процедур афинной очистки. Например, фрагмент ТН или GCH-1 в соответствии с настоящим изобретением может быть переведен в нерастворимую форму путем ковалентной связи с цианогенной активированной бромидом сефарозой способами, известными per se, или адсорбирован на полиолефиновых поверхностях, либо с глутаральдегидным сшиванием или без такового, для применения в анализе или очистке антител против ТН или против GCH-1 или клеточных поверхностных рецепторов. Фрагменты также могут быть помечены выявляемой группой, например, помечены радиоактивной меткой с помощью процедуры с хлорамином Т, ковалентно связаны с хелатами редкоземельных элементов или конъюгированы с другой флуоресцентной частью, для применения, например, в диагностических анализах.
Мутагенез предпочтительного заданного фрагмента ТН или GCH-1 может быть проведен созданием аминокислотных инсерций, обычно составляет порядка приблизительно от 1 до 10 аминокислотных остатков, предпочтительно приблизительно от 1 до 5 аминокислотных остатков, или делеций из приблизительно от 1 до 10 остатков, такой как из приблизительно от 2 до 5 остатков.
В одном варианте осуществления фрагмент ТН или GCH-1 синтезирован путем автоматизированного синтеза. Может быть использована любая из коммерчески доступных твердофазных техник, таких как способ твердофазного синтеза Merrifield, при котором аминокислоты последовательно добавляются в увеличивающуюся аминокислотную цепь (см. Merrifield, J. Am. Chem. Soc. 85:2149-2146, 1963).
Оснащение для автоматизированного синтеза полипептидов коммерчески доступно от поставщиков, таких как Applied Biosystems, Inc. of Foster City, Калифорния, и, как правило, может эксплуатироваться согласно инструкциям производителя. Твердофазный синтез будет обеспечивать включение желательных аминокислотных замен в любой фрагмент ТН или GCH-1 в соответствии с настоящим изобретением. Следует иметь в виду, что замены, делеций, инсерций или любая их субкомбинация могут быть объединены для получения окончательной последовательности функционального эквивалента. Следует понимать, что инсерций содержат амино-концевые и/или карбоксил-концевые слияния, например, с гидрофобным или иммуногенным белком или носителем, таким как любой полипептид или скелетная структура, способная служить носителем.
Также представлены олигомеры, в том числе димеры, включая гомодимеры и гетеродимеры фрагментов ТН и/или GCH-1 в соответствии с настоящим изобретением, которые попадают в объем настоящего изобретения. Функциональные эквиваленты и варианты ТН или GCH-1 могут быть получены как гомодимеры или гетеродимеры с другими аминокислотными последовательностями или с нативными последовательностями ТН или GCH-1. Гетеродимеры предусматривают димеры, содержащие иммунореактивные фрагменты ТН, а также фрагменты GCH-1, которые должны или не должны проявлять какую-либо биологическую активность.
Имитационное хирургическое вмешательство также известно как плацебо хирургическое вмешательство и является оперативным вмешательством, которое не включает этап, который считается терапевтически необходимым. В контролируемых исследованиях имитационное хирургическое вмешательство проводится в контрольной популяции для оценки эффекта вмешательства в исследовании путем нейтрализации эффекта плацебо и уменьшения ошибки. Однако в отличие от плацебо, как правило, на примере инертной «сахарной пилюли», имитационное хирургическое вмешательство включает реальное хирургическое вмешательство, чтобы компенсировать эффект анестезии, травмы разреза и до- и послеоперационного ухода, а также для поддержания иллюзии реальной операции. В настоящей заявке имитационное хирургическое вмешательство выполняли в контрольной группе животных, названной «группа Les-Sham».
Подробное раскрытие настоящего изобретения
Стехиометрическая взаимосвязь между уровнями экспрессии ТН и GCH1 для оптимальной доставки DOPA была слабо исследована в головном мозге. На сегодняшний день в большинстве исследований с использованием доставки ТН и GCH1 применялась схема без контролирования их относительных уровней экспрессии. Для синтеза DOPA ферменту ТН необходим кофактор ВН4. ВН4 синтезируется из GTP в трехстадийной ферментной реакции, где GCH1 является первым и ограничивающим скорость ферментом. Следующие два фермента экспрессируются убиквитарно. Существует целый ряд причин для внимательного рассмотрения этого процесса. Во-первых, активность фермента ТН сложно регулируется, и стабильность белка ТН регулируется также. Одним фактором, который влияет на активность, является окружающее количество ВН4. Если слишком мало ВН4, то фермент не может эффективно работать, а слишком много ВН4 может ингибировать функцию.
Во-вторых, хотя одна молекула ВН4 расходуется на каждое превращение тирозина в DOPA, фермент GCH1 никогда не расходуется. В качестве субстрата GTP достаточно в клетке, необходимость экспрессии GCH1 может быть много меньше, чем экспрессии ТН. Непрерывная доставка DOPA зависит от нескольких факторов, способствующих созданию условий для оптимальной функциональности фермента ТН.
Результаты, полученные авторами настоящего изобретения, подтверждают, что активация фермента ТН сопровождает трехэтапную кинетическую взаимосвязь с количествами экспрессированной GCH1. На начальном этапе с отношением GCH1:TH, доходящим до 1:7, и функция ТН, и синтез ВН4 повышаются линейно с увеличением содержания GCH1. На втором этапе, когда содержание GCH1 далее повышается, до 5,5 × 109 геномных копий GCH1 (до содержания, соответствующего отношению 1:3 GCH1:TH), повышение содержания ВН4 продолжается линейно, но функция ТН начинает медленно показывать признаки насыщения. На третьем этапе насыщение становится очевидным как для функции ТН, так и для синтеза ВН4 при увеличении титров rAAV5-GCH1 сверх 5,5×109 геномных копий Взятые вместе, эти данные показывают, что рабочий диапазон отношения GCH1:ТН от 1:3 до 1:7 может привести к эффективному синтезу DOPA, где функция ТН оптимизирована.
Следовательно, в некоторых вариантах осуществления ген ТН экспрессирован на приблизительно в 3-7 раз более высоком содержании, чем GCH1. Кроме того, с использованием векторов и способов, а также векторов, описанных в настоящем документе, стабильное хорошо определяемое отношение уровней экспрессии трансгенов может быть поддержано для обеспечения прогнозируемых и оптимизированных уровней экспрессии in vivo.
В более ранних стратегиях использовали либо двухвекторторную конструкцию, либо одновекторные мультицистронные векторы. Применение отдельных вирусных векторов, причем каждый из которых кодирует один из генов, отличается рядом ограничений. Во-первых, «продукт» в реальности представляет собой два лекарственных средства, каждый со своим собственным вариантом получения. Поскольку это трудно оценить in vitro, получение клинического уровня может быть очень затруднительным. Во-вторых, хотя в общем масштабе паттерн экспрессии двух генов может выглядеть похожим, число копий двух векторов в отдельной клетке может значительно варьировать, в результате чего уровни синтеза DOPA варьируют. Кроме того, эффект может быть усугублен тем, что многие клетки не получают ничего или получают только один из генов, и, следовательно, проявляют очень ограниченный синтез DOPA, если таковой имеется.
Более привлекательным подходом является слияние генов в один вектор, поскольку два гена всегда будут экспрессированы в одной и той же клетке, и будет только один «продукт». Однако этот подход осложнен тем, что генные последовательности слишком большие для встраивания в определенные векторные конструкции, например, рекомбинантный вектор AAV. Способность к упаковке AAV оптимизирована по размеру генома AAV дикого типа (4,7 т.п.н.). Если рекомбинантный геном значительно превышает этот размер, титры продуцирования и in vivo эффективность сильно понижаются.
В генной терапии предпочтительным типом вирусного вектора является AAV. AAV является полезным для генной терапии, благодаря ряду особенностей. Особое значение имеет отсутствие у вируса дикого типа патогенности. Он также может инфицировать неделящиеся клетки и может обеспечивать длительную стабильную экспрессию генов. Желаемый ген вместе с промотором для управления транскрипцией может быть встроен между обращенными концевыми повторами (ITR), которые помогают в формировании конкатемера в ядре, после чего одноцепочечная векторная ДНК превращается ДНК-полимеразными комплексами клетки-хозяина в двухцепочечную ДНК. Векторы основанной на AAV генной терапии образуют эписомальные конкатемеры в ядре клетки-хозяина. AAV также обладает очень низкой иммуногенностью, вероятно, ограниченной образованием нейтрализующих антител, в то время как они не индуцируют четко определенный цитотоксический ответ.Эти особенности делают AAV привлекательным кандидатом для генной терапии, в частности, центральной нервной системы (CNS).
В то время как путь синтеза допамина, как принято считать, предусматривает два главных фермента ТН и AADC, авторы настоящего изобретения показали в настоящем документе, что генная терапия с использованием вектор а или векторов, которые экпрессируют ТН и GCH1, без экспрессии AADC, может обеспечить симптоматическое и/или терапевтическое облегчение. Это имеет исключительно важное значение, так как ограниченная способность к упаковке определенных вирусных векторов, таких как вектор AAV, препятствует или ограничивает включение всех трех генов ТН, GCH1 и AADC. Более того, комбинация двух генов ТН и GCH1 невозможна с традиционной геномной конструкцией двухцистронного вектора. Хотя можно укоротить фермент ТН на N-конце для уменьшения размера гена, это происходит за счет удаления собственного механизма безопасности ингибирования по типу обратной связи и фосфорилирования. Такой укороченный фермент будет оставаться эффективным даже в периоды времени, когда цитозольные концентрации DA будут достигать до токсических уровней. Это не происходит в случае с полноразмерной к ДНК ТН, используемой в настоящем изобретении.
Определенные варианты осуществления, описанные в настоящем документе, предусматривают радикально различные плазмидные конструкции. Например, вместо обеспечения экспрессии двух генов путем применения сайта внутренней посадки рибосомы в определенных вариантах осуществления используется двойная кассета экспрессии с двумя промоторами. С синтетическими промоторами слияния, традиционно используемыми в генной терапии, такими как синтетический промотор b-актина цыпленка, содержащий интрон гамма-глобулина кролика, предшествующий энхансерному элементу из промотора цитомегаловируса (названный промотор b-актина цыпленка, СВА), такая плазмидная конструкция была бы невозможна. Применение небольшого сильного эндогенного промотора сделало возможным такой подход различных плазмидных конструкций.
Одновекторная система экспрессии
В некоторых вариантах осуществления настоящее изобретение относится к одновекторной системе экспрессии, содержащей два полинуклеотида, кодирующих два полипептида, разработанных для дифференциальной экспрессии (описано на фигуре 2). Два кодируемых полипептида тирозингидроксилазы (ТН) и GTP-циклогидролазы 1 (GCH1) предпочтительно могут быть экспрессированы с отношением от 3:1 до 7:1.
Вместе с другими полипептидами ТН и GCH1 являются незаменимыми ферментами в продуцировании допамина, поскольку они регулируют продуцирование L-DOPA из тирозина. В синтез допамина вовлечены и другие факторы, но стехиометрическая взаимосвязь между ТН и GCH1 может быть ограничительным фактор в этом процессе.
Поэтому основной целью в соответствии с настоящим изобретением является создание векторной конструкции, которая обеспечивает оптимизированные пропорции ТН и GCH1. Более того, настоящее изобретение обеспечивает способ доставки векторной конструкции локально для ограничения усиленного продуцирования допамина в клетки, нуждающиеся в этом.
Вирусные векторы
В целом, генная терапия направлена на передачу нового генного материала в клетки пациента с терапевтической пользой для пациента в результате. Эта польза заключается в лечении или профилактике широкого диапазона заболеваний, нарушений и других состояний.
Генная терапия может быть разделена на два отдельных типа: генная терапия с использованием клеток зародышевой линии, причем генный материал передается в зародышевых клетках и, таким образом, будет наследоваться, и генная терапия с использованием соматических клеток, причем генный материал передается в соматических клетках и, таким образом, не будет наследоваться.
Подходы генной терапии ex vivo предусматривают модификацию выделенных клеток, таких как стволовые клетки, которые могут быть инфузированы, трансплантированы или иным путем пересажены пациенту. См., например, патенты США №№4868116, 5399346 и 5460959. Генная терапия in vivo наоборот направлена непосредственно на мишеневую ткань пациента-хозяина in vivo.
Вирусные векторы являются используемыми инструментами для доставки генного материала в организм хозяина. Вирусами, используемыми в качестве векторов передачи генов, являются паповавирус, аденовирус, вирус коровьей оспы, аденоассоциированный вирус (AAV), вирус герпеса и ретровирусы, такие как ВИЧ, SIV, FIV, EIAV, MoMLV.
Предпочтительными вирусами для лечения нарушений центральной нервной системы являются лентивирусы и аденоассоциированные вирусы. Оба типа вирусов могут встраиваться в геном без клеточных делений, и оба типа были тестированы в доклинических исследованиях на животных для выявления в нервной системе, в частности, в центральной нервной системе.
Предпочтительным типом вирусного вектора является AAV. AAV представляет интерес для генной терапии, благодаря ряду особенностей. Главной среди них является очевидное отсутствие патогенности вируса дикого типа, и то, что он также может инфицировать неделящиеся клетки. Геном AAV дикого типа наиболее часто встраивается в определенный сайт (обозначенный AAVS1) в хромосоме 19 человека, тогда как случайные включения в геном происходят с незначительной частотой. Особенности делают его до некоторой степени более прогнозируемым, чем ретровирусы, которые представляют опасность случайной инсерции и мутагенеза. С AAV в качестве векторов генной терапии, однако, такая способность встраиваться может быть элиминирована путем удаления rep и cap из ДНК вектора. Поскольку гены rep и cap не имеют функционального значения у вирусного вектора с недостаточностью репликации, они могут быть элиминированы из векторного генома. Вместо этих генов AAV дикого типа может быть встроен желаемый(ые) ген(ы) вместе с управляющим транскрипцией гена промотором между обращенными концевыми повторами (ITR). ITR важны для упаковки вирусного вектора векторной ДНК и способствуют образованию конкатемеров в ядре, после того, как одно цепочечная векторная ДНК превращается ДНК-полимеразными комплексами клетки-хозяина в двухцепочечную ДНК.
Векторы генной терапии на основе AAV могут формировать эписомальные конкатемеры в ядре клетки-хозяина. В неделящихся клетках эти конкатемеры могут оставаться интактными на протяжении жизни клетки-хозяина. В делящихся клетках ДНК AAV может быть потеряна вследствие клеточного деления, поскольку эписомальная ДНК не реплицируется вместе с ДНК клетки-хозяина. Случайное встраивание ДНК AAV в геном хозяина является низким, но может быть выявлено. AAV характеризуется низкой иммуногенностью, вероятно, с ограниченным образованием нейтрализующих антител, в то время как они не индуцируют четко определяемый цитотоксический ответ. Эти особенности вместе со способностью инфицировать покоящиеся клетки представляют некоторые их преимущества над аденовирусами в качестве векторов для генной терапии человека. Эти особенности делают AAV привлекательным кандидатом для создания вирусных векторов для генной терапии центральной нервной системы (CNS).
Вирусные векторы, в том числе векторы AAV, обладают определенными способностями клонирования, т.е. они способны нести определенное количество полинуклеотидов. Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к вирусному вектору со способностью к упаковке, варьирующей от 1 до 40 т.п.н., такой как от 1 до 30 т.п.н., например, от 1 до 20 т.п.н., такой как от 1 до 15 т.п.н., например, от 1 до 10 т.п.н., такой как от 1 до 8 т.п.н., например, от 2 до 7 т.п.н., такой как от 3 до 6 т.п.н., например, от 4 до 5 т.п.н. В предпочтительном варианте осуществления настоящее изобретение относится к вектору AAV со способность к упаковке 4,8 т.п.н.
В настоящее время существуют по меньшей мере 11 серотипов AAV. Наиболее изучен серотип 2, и AAV2 характеризуется естественным тропизмом по отношению, например, к скелетным мышцам, клеткам гладкой мускулатуры сосудов, гепатоцитам и особенно нейронам. Однако и другие серотипы доказали свою эффективность в качестве инструментов для генной терапии; например, AAV6 представляется особенно полезным в инфицировании эпителиальных клеток дыхательных путей, AAV7 обладает высокой скоростью трансдукции мышиных клетках скелетной мускулатуры (подобно AAV1 и AAV5), AAV8 является особенно полезным в трансдуцировании гепатоцитов, a AAV1 и 5 эффективны в доставке гена в сосудистые эндотелиальные клетки.
Гуморальный иммунитет, инициированный инфекцией AAV дикого типа, считается весьма обычным явлением. Ассоциированная нейтрализующая активность ограничивает полезность наиболее часто используемого серотипа AAV2 в определенных применениях. Следовательно, большинство клинических испытаний в настоящее время выполняются по доставке AAV2 в мозг - орган, относительно привилегированный иммунологически.
Кроме того, использование различных серотипов AAV возможно с комбинированием различных серотипов, такое как использование плазмиды одного серотипа, упакованной в капсид другого серотипа.
В одном варианте осуществления аденоассоциированным вектором (AAV) в соответствии с настоящим изобретением является вектор AAV2.
В следующем варианте осуществления вектор AAV2 упакован в капсид AAV, отличный от капсида AAV2.
В еще одном варианте осуществления вектор AAV2 упакован в капсид AAV5.
Векторы AAV могут быть получены с использованием двух главных принципов: трансфекции монослойной культуры линии клеток человека или свободно плавающих клеток насекомых. Монослойные клеточные культуры трансфицируются путем осаждения фосфата кальция, липофекцией или другими средствами со смесью двух или трех плазмидных препаратов, содержащих трансферную плазмиду с векторным геномом, и одну или две хелперных плазмиды, содержащих необходимые гены для синтеза векторного капсида. Для культур клеток насекомых этот процесс, как правило, заменяется трансфекцией клеток с использованием бакуловирусных конструкций, которые обладают теми же функциями. Затем клетки, супернатант или и то, и другое собирают для очистки и концентрации вектора. Это может быть достигнуто с помощью какой-либо комбинации очистки в градиенте плотности хлорида цезия или йодиксанола, ионообменной хроматографии, гель-фильтрации, аффинной хроматографии и ультрацентрифугирования. Способы получения AAV описаны в уровне техники, например, в патентах США №№5677158, 6309634 и 6451306 описываются примеры доставки AAV в центральную нервную систему.
Следовательно, в основном аспекте настоящее изобретение относится к одновекторной системе экспрессии, содержащей
a) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывает указанную первую и указанную вторую нуклеотидные последовательности, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
В одном варианте осуществления вектора, описанного в настоящем документе выше, полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, экспрессированный указанной первой кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, экспрессированный указанной второй кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14.
В другом варианте осуществления вектора, определенного в настоящем документе выше, полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант экспрессирован, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанный полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, экспрессированный указанной второй кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14.
В другом варианте осуществления вектора, определенного в настоящем документе выше, кодируемый полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, SEQ ID NO. 6, и причем кодируемый полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14.
В другом варианте осуществления вектора, определенного в настоящем документе выше, полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, и SEQ ID NO. 6, и причем кодируемый полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14.
В некоторых вариантах осуществления включение гена AADC в вектор может быть неблагоприятным по какой-либо из ряда причин. Во-первых, создается новая система, которая без модуляции может превращать тирозин в допамин. Так как трансдуцированные клетки в полосатом теле лишены механизмов блокирования допамина в везикулах, допамин может быстро накапливаться в цитозоле. Если фермент ТН остается с N-концевым регуляторным доменом, продуцированный допамин может непосредственно ингибировать синтез DOPA путем отрицательной обратной связи, что может серьезно ограничивать эффективность лечения. С другой стороны, если фермент ТН укорочен, содержание допамина в цитозоле может быстро повышаться, поскольку трансдуцированные клетки также лишены механизмов для высвобождения допамина. Такие повышения допамина в цитозоле, как показали, приводят к дегенерации стриарных нейронов, что может не только исключить симптоматическое облегчение, но и превратить болезнь Паркинсона в мультисистемную атрофию (MSA), нечувствительное к L-DOPA нарушение, с отсутствием альтернатив лечения.
Во-вторых, включение гена AADC также может влиять на реакцию пациента на пероральную фармакотерапию L-DOPA. Известно, что одним из основных побочных эффектов фармакотерапии L-DOPA является дискинезия. Предполагается, что это происходит, по меньшей мере частично, в связи с колебаниями содержания допамина в полосатом теле, вызванными путем пульсирующего введения. Если скорость превращения L-DOPA в допамин повышается фокально в полосатом теле, может усугубить колебания, а также увеличить дискинезию. На самом деле это наблюдается на моделях животных, трансдуцированных геном AADC.
Исключение гена AADC, с другой стороны, может обеспечить «челночный» перенос DOPA из стриарных нейронов посредством доступных больших аминокислотных транспортеров и тем самым обеспечить механизм безопасности, поскольку доступный фермент AADC может регулировать скорость превращения. Нейроны с активностью эндогенного фермента AADC также могут обладать способностью хранения и высвобождения допамина, таким образом, снижая риск допаминовой токсичности.
Таким образом, в некоторых вариантах осуществления вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC).
Таким образом, в другом основном аспекте настоящее изобретение относится к одновекторной системе экспрессии, содержащей
а) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательность, и причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
В другом аспекте настоящее изобретение относится к одновекторной системе экспрессии, содержащей
а) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 75% идентичен, такой как по меньшей мере на 80% идентичен, например, по меньшей мере на 90% идентичен, такой как по меньшей мере на 92% идентичен, например, по меньшей мере на 95% идентичен, такой как по меньшей мере на 97% идентичен, например, по меньшей мере на 98% идентичен, такой как по меньшей мере на 99% идентичен, например, по меньшей мере на 99,5% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 75% идентичен, такой как по меньшей мере на 80% идентичен, например, по меньшей мере на 90% идентичен, такой как по меньшей мере на 92% идентичен, например, по меньшей мере на 95% идентичен, такой как по меньшей мере на 97% идентичен, например, по меньшей мере на 98% идентичен, такой как по меньшей мере на 99% идентичен, например, по меньшей мере на 99,5% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 75% идентичен, такой как по меньшей мере на 80% идентичен, например, по меньшей мере на 90% идентичен, такой как по меньшей мере на 92% идентичен, например, по меньшей мере на 95% идентичен, такой как по меньшей мере на 97% идентичен, например, по меньшей мере на 98% идентичен, такой как по меньшей мере на 99% идентичен, например, по меньшей мере на 99,5% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14, причем вектором является аденоассоциированный вектор (AAV), или
с) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 75% идентичен, такой как по меньшей мере на 80% идентичен, например, по меньшей мере на 90% идентичен, такой как по меньшей мере на 92% идентичен, например, по меньшей мере на 95% идентичен, такой как по меньшей мере на 97% идентичен, например, по меньшей мере на 98% идентичен, такой как по меньшей мере на 99% идентичен, например, по меньшей мере на 99,5% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 75% идентичен, такой как по меньшей мере на 80% идентичен, например, по меньшей мере на 90% идентичен, такой как по меньшей мере на 92% идентичен, например, по меньшей мере на 95% идентичен, такой как по меньшей мере на 97% идентичен, например, по меньшей мере на 98% идентичен, такой как по меньшей мере на 99% идентичен, например, по меньшей мере на 99,5% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
В одном варианте осуществления вектором в соответствии с настоящим изобретением является минимально интегрирующийся вектор.
В одном варианте осуществления вектором в соответствии с настоящим изобретением является вектор, описанный на фигуре 6.
В одном варианте осуществления вектор, как определено в настоящем документе выше, обладает способностью к упаковке от 1 до 40 т.п.н., например, от 1 до 30 т.п.н., такой как от 1 до 20 т.п.н., например, от 1 до 15 т.п.н., такой как от 1 до 10, например, от 1 до 8 т.п.н., такой как от 2 до 7 т.п.н., например, от 3 до 6 т.п.н., такой как от 4 до 5 т.п.н.
В предпочтительном варианте осуществления вектор, как определено в настоящем документе выше, обладает способностью к упаковке от 4,5 до 4,8 т.п.н.
В одном варианте осуществления вектором в соответствии с настоящим изобретением является вирусный вектор, причем указанный вектор выбран из группы, состоящей из аденоассоциированного вектора (AAV), лентивирусного вектора, аденовирусного вектора и ретровирусного вектора.
В предпочтительном варианте осуществления вектором является аденоассоциированный вектор (AAV).
Даже если векторы AAV являются предпочтительными, другие векторы могут быть использованы в соответствии с настоящим изобретением. Таким образом, в другом варианте осуществления вектором в соответствии с настоящим изобретением является плазмидный вектор.
В еще одном варианте осуществления вектором в соответствии с настоящим изобретением является синтетический вектор.
В одном варианте осуществления вектор является функциональным в клетках млекопитающих. В одном варианте осуществления вектор является функциональным только в клетках млекопитающих.
В одном варианте осуществления настоящее изобретение относится к вектору на основе любого серотипа AAV, идентифицированного у людей, отличных от человека приматов, других видов млекопитающих, или их химерных вариантов.
В предпочтительном варианте осуществления настоящее изобретение относится к вектору на основе векторов AAV любого серотипа, модифицированного для экспрессии измененных или новых белков оболочки. В более предпочтительном варианте осуществления настоящее изобретение относится к вектору AAV, более предпочтительно вектору AAV серотипа 2, более предпочтительно к вектору AAV серотипа 2, упакованному в капсид AAV серотипа 5. При отборе капсида два фактора могут способствовать выбору предпочтительного серотипа. Первый заключается в присутствии нейтрализующих антител для эквивалентов дикого типа. Было показано, что наиболее распространенным серотипом в различных человеческих популяциях является серотип 2. Таким образом, важно применять серотип, который обладает наименьшей гомологией капсида с серотипом 2 и другими серотипами. Серотип 5 выделяется тем, что он обладает только 53-57% гомологией капсидных последовательностей с другими серотипами AAV 1-9 (Daya and Berns. Gene therapy using adeno-associated virus vectors. ClinMicrobiol Rev (2008) vol.21 (4) pp.583-93). Вторым фактором, который может способствовать распространению трансдукции в мозге человека, являются остатки клеточной поверхности, к которым векторный капсид проявляет аффинность. При этом серотип 2 AAV характеризуется сильной аффинностью к гепаран-сульфатному протеогликану (HSPG), а серотип AAV5 - нет. Это может способствовать распространению, поскольку HSPG присутствует в изобилии в мозге.
Экспрессия гена управляется на уровнях транскрипции, трансляции или посттрансляции. Инициация транскрипции является ранним и важным событием в экспрессии гена. Она зависит от промоторных и энхансерных последовательностей и подвергается влиянию специфических клеточных факторов, которые воздействуют на эти последовательности. AAV может быть сконструирован с содержанием одного или нескольких полинуклеотидов различного происхождения. Векторная конструкция может содержать один или несколько промоторов. В одном варианте осуществления настоящего изобретения указанный(ые) промотор(ы) является(являются) специфическим(ми) для клеток млекопитающего, выбранных без ограничения из группы, состоящей из нервных клеток человека, в том числе нейронов человека, клеток яичника китайского хомячка, СНО-К1, клеток почки новорожденного хомяка, фибробластов 3Т3 мыши, линий клеток африканской зеленой мартышки, феохромоцитомы надпочечника крысы, клеток АТ3, клеток глиальной опухоли крысы, нервных клеток крысы и гиппокампальных клеток крысы.
В предпочтительном варианте осуществления настоящее изобретение относится к вектору, содержащему геномную последовательность, где экспрессия ферментов регулируется одним или несколькими промоторами, которые обеспечивают высокую экспрессию в нейронах, таких как, например, стриарные нейроны. В более предпочтительном варианте осуществления указанный(ые) промотор(ы) является(являются) нейронспецифическим(ми). В наиболее предпочтительном варианте осуществления указанным(ми) промотором(ами) является(являются) промотор(ы) синапсина человека.
В одном варианте осуществления первым и/или вторым промотором конструкции экспрессии в соответствии с настоящим изобретением, как определено в настоящем документе выше, является промотор, специфический для клеток млекопитающих.
В следующем варианте осуществления указанной клеткой млекопитающего является нервная клетка. В еще одном варианте осуществления указанной нервной клеткой является нейрон.
В одном варианте осуществления и указанным первым, и указанным вторым промоторами являются промоторы синапсина 1.
В другом варианте осуществления один из указанного первого или указанного второго промоторов является промотор синапсина 1.
В одном варианте осуществления промотором, применяемым в соответствии с настоящим изобретением, является конститутивный промотор, причем указанный конститутивно активный промотор выбран из группы, состоящей из CAG, CMV, UbiC человека, RSV, ЕF-1альфа, SV40, Mt1.
В другом варианте осуществления промотором является индуцибельный промотор, причем указанный индуцибельный промотор выбран из группы, состоящей из Tet-On, Tet-Off, Mo-MLV-LTR, Mx1, прогестерона, RU486 и рапамицин-индуцибельного промотора.
Промотором в соответствии с настоящим изобретением может быть конститутивный промотор, включая без ограничения группу, состоящую из промотора CAG, промотора CMV, промотор UbiC человека, промотора RSV, промотора EF-1альфа, промотора SV40 и промотора Mt1.
Кроме промоторов вектор экспрессии также может содержать одну или несколько последовательностей полиаденилирования. Последовательность полиаденилирования необходима для продуцирования зрелой мРНК для трансляции транскрибированного продукта в полипептид. В одном варианте осуществления настоящего изобретения последовательность полиаденилирования функционально связана с последовательностью, кодирующей ТН или GCH-1, в соответствии с настоящим изобретением. В более предпочтительном варианте осуществления 5'-конец последовательности полиаденилирования функционально связан с 3'-концом последовательности, кодирующей ТН или GCH-1, в соответствии с настоящим изобретением. В более предпочтительном варианте осуществления указанной последовательностью полиаденилирования является последовательность полиаденилирования SV40.
В одном варианте осуществления настоящего изобретения либо указанная первая кассета экспрессии, либо указанная вторая кассета экспрессии содержит последовательность полиаденилирования.
В другом варианте осуществления настоящего изобретения и указанная первая кассета экспрессии, и указанная вторая кассета экспрессии содержат последовательности полиаденилирования.
В одном варианте осуществления последовательностью полиаденилирования является последовательность полиаденилирования SV40, причем 5'-конец указанной последовательности полиаденилирования функционально связан с 3' первой и/или указанной второй нуклеотидной последовательности, определенной в настоящем документе выше.
В одном варианте осуществления настоящего изобретения указанная первая нуклеотидная последовательность, кодирующая полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, содержит последовательность SEQ ID NO. 18.
В другом варианте осуществления настоящего изобретения указанная вторая нуклеотидная последовательность, кодирующая полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, содержит последовательность SEQ ID NO. 21.
IRES является аббревиатурой для сайта внутренней посадки рибосомы, который представляет собой нуклеотидную последовательность, обеспечивающую инициацию трансляции в середине последовательности мРНК как часть более значительного процесса синтеза белка. В одном варианте осуществления сайт внутренней посадки рибосомы (IRES) также может быть включен в конструкцию вектора экспрессии в соответствии с настоящим изобретением.
Для встраивания генных последовательностей в ДНК хозяина вирусы часто применяют последовательности ДНК, которые повторяются тысячи раз, так называемые повторы или концевые повторы, включающие длинные концевые повторы (LTR) и обращенные концевые повторы (ITR), причем указанные последовательности повторов могут быть как 5'-, так и 3'-концевыми повторами. ITR способствуют образованию конкатемера в ядре, после того, как одноцепочечная векторная ДНК превращается ДНК-полимеразными комплексами клетки-хозяина в двухцепочечную ДНК. ITR последовательности могут быть получены из вирусных векторов, предпочтительно AAV, более предпочтительно AAV2.
В одном варианте осуществления кассеты экспрессии вектора в соответствии с настоящим изобретением содержат 5'-концевой повтор и 3'-концевой повтор.
В одном варианте осуществления указанные 5'- и 3'-концевые повторы выбраны из обращенных концевых повторов (ITR) и длинных концевых повторов (LTR).
В одном варианте осуществления указанными 5'- и 3'-концевыми повторами являются обращенные концевые повторы (ITR) AAV.
В еще одном варианте осуществления указанные обращенные концевые повторы содержат последовательности SEQ ID NO. 15 и SEQ ID NO. 16.
Вектор экспрессии также может содержать один или несколько энхансеров или регуляторных элементов, таких как посттранскрипционные регуляторные элементы, для повышения или регулирования уровня экспрессии трансгенов. Это означает, что экспрессия одной или нескольких полинуклеотидных последовательностей, содержащихся в вирусном векторе, может быть усиленной или ослабленной по сравнению с эффективностью экспрессии в векторе без энхансеров и/или регуляторов. Путем использования указанных энхансеров и/или регуляторов также можно дифференциально экспрессировать два или более генов, включенных в вектор. Таким образом, можно направить энхансер или регулятор на определенную полинуклеотидную последовательность в векторе с двумя или более полинуклеотидными последовательностями. Энхансерами и регуляторами являются без ограничения SP163, инсулин П-интрон крысы или другие интроны, энхансер CMV и инсулятор [бета]-глобина цыпленка или другие инсуляторы.
В предпочтительном варианте осуществления полинуклеотидные последовательности в соответствии с настоящим изобретением регулируются посттранскрипционным регуляторным элементом, включенным в вектор. В более предпочтительном варианте осуществления указанным регуляторным элементом является посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE). В более предпочтительном варианте осуществления указанный WPRE регулирует отношение экспрессии между двумя полинуклеотидами в соответствии с настоящим изобретением, предпочтительно путем повышения экспрессии ТН.
В одном варианте осуществления настоящего изобретения указанная вторая нуклеотидная последовательность функционально связана с посттранскрипционным регуляторным элементом, причем указанным посттранскрипционным регуляторным элементом может быть Посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE), причем указанный посттранскрипционный регуляторный элемент вируса гепатита сурков может содержать последовательность SEQ ID NO. 22.
В одном конкретном варианте осуществления экспрессия двух полипептидов в соответствии с настоящим изобретением наблюдается при отношении, где экспрессия ТН выше экспрессии GCH1. В предпочтительном варианте осуществления отношение TH:GCH 1 составляет от 1:1 до 50:1, такое как от 1:1 до 45:1, например, от 1:1 до 40:1, такое как от 1:1 до 35:1, например, от 1:1 до 30:1, такое как от 1:1 до 29:1, например, от 1:1 до 28:1, такое как от 1:1 до 27:1, например, от 1:1 до 26:1, такое как от 1:1 до 25:1, например, от 1:1 до 24:1, такое как от 1:1 до 23:1, например, от 1:1 до 22:1, такое как от 1:1 до 21:1, например, от 1:1 до 20:1, такое как от 1:1 до 19:1, например, от 1:1 до 18:1, такое как от 1:1 до 17:1, например, от 1:1 до 16:1, такое как от 1:1 до 15:1, например, от 1:1 до 14:1, такое как от 1:1 до 13:1, например, от 1:1 до 12:1, такое как от 1:1 до 11:1, например, от 1:1 до 10:1, такое как от 1:1 до 9:1, такое как от 1:1 до 8:1, например, от 1:1 до 7:1, такое как 7:1, например, 6:1, такое как 5:1, например, 4:1, такое как 3:1, например, от 2:1 до 8:1, такое как от 3:1 и 7:1.
Для контроля того, что отношение экспрессии находится в желаемом диапазоне, существует несколько вариантов. Содержание мРНК, присутствующей в образце, может быть измерено с помощью RT PCR. При RT-PCR используется пара праймеров, которые комплементарны определяемой последовательности в каждой из двух цепей кДНК. Затем эти праймеры удлиняются ДНК-полимеразой, и после каждого цикла создается копия цепи, что ведет к логарифмической амплификации. RT-PCR предусматривает три главных этапа. Первым этапом является обратная транскрипция, при котором РНК обратно транскрибируется в кДНК с использованием обратных транскриптаз и праймеров. Следующий этап предусматривает денатурирование dsDNA с получением двух отдельных цепей, праймеры снова могут связываться при более низких температурах, и начинается новая цепная реакция. Конечным этапом амплификации PCR является удлинение DNA из праймеров, которое выполняется термостабильной Taq ДНК-полимеразой. Ампликоны могут быть визуализированы, поскольку амплификация выполняется с использованием флуоресцентной репортерной молекулы.
Количество белка может быть измерено несколькими способами. Содержание полинуклеотидов может быть определено радиоиммунным анализом (RIA). RIA является очень чувствительной методикой, применяемой для измерения концентраций антигенов без необходимости применения биоанализа. Для выполнения радиоиммуноанализа известное количество антигена делают радиоактивным, зачастую путем мечения его гамма-радиоактивными изотопами йода, присоединенными к тирозину. Затем такой радиомеченный антиген смешивают с известным количеством антитела против этого антигена, и в результате они химически связываются друг с другом. Затем добавляют образец сыворотки крови пациента, содержащей неизвестное количество того же антигена. Это приводит к тому, что немеченый (или «холодный») антиген из сыворотки крови конкурирует с радиомеченным антигеном за сайты связывания антитела. Поскольку концентрация «холодного» антигена повышена, он связывается с антителом больше, вытесняя радиомеченный вариант и снижая отношение связанного с антителом радиомеченного антигена к свободному радиомеченному антигену. Затем связанные антигены отделяют от несвязанных антигенов и измеряют радиоактивность свободного антигена, оставшегося в супернатанте. Затем с использованием известных стандартов можно создать кривую связывания, которая представляет количество антигена, которое будет получено, в сыворотке крови пациента.
Также может быть использован фермент-связанный иммуносорбентный анализ (ELISA). ELISA является количественной методикой, применяемой для выявления присутствия белка или любого другого антигена в образце. При ELISA неизвестное количество антигена фиксируют на поверхности, а затем специфическое антитело промывают над поверхностью так, что оно может связываться с антигеном. Это антитело связывается с ферментом, а на конечном этапе добавляют вещество, которое фермент может превратить в некий выявляемый сигнал. Существует несколько типов ELISA, в том числе непрямой ELISA, «сэндвич»-ELISA, конкурентный ELISA и обратный ELISA. Также могут быть использованы другие иммуноанализы, такие как хемилюминесцентные иммунометрические анализы и усиленные диссоциацией лантанидные иммуноанализы. Также для определения белка применяются нефелометрия и турбидиметрия.
Другим способом определения количества белка являются способы на основе хроматографии, более конкретно жидкостная хроматография. Аффинная хроматография основана на селективном нековалентном взаимодействии между аналитом и определенными молекулами. В ионообменной хроматографии используются механизмы ионного обмена для разделения аналитов. В ионообменной хроматографии используется заряженная стационарная фаза для разделения заряженных соединений. В традиционных способах стационарной фазой является ионообменная смола, которая несет заряженные функциональные группы, которые взаимодействуют с противоположно заряженными группами соединения, подлежащего удержанию. Хроматография по размеру молекул (SEC) хорошо известна как гель-проникающая хроматография (GPC) или гель-фильтрационная хроматография. SEC используется для разделения молекул по их размеру (или более точно по их гидродинамическому диаметру или гидродинамическому значению). Меньшие молекулы способны проходить через поры среды и, поэтому, дольше элюируются, тогда как более крупные молекулы не пропускаются из пор и элюируются быстрее. Обращенно-фазовая хроматография представляет собой процедуру элюирования, при которой подвижная фаза значительно более полярна, чем стационарная фаза. Следовательно, сначала элюируются полярные соединения, тогда как неполярные соединения остаются.
Альтернативные способы предусматривают электрофорез. При электрофорезе используется движение диспергированных частиц относительно жидкости под воздействием электрического поля. Кроме того, частицы движутся со скоростью согласно их относительному заряду. Более конкретно, могут быть использованы следующие электрофоретические способы для выявления CD163: электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), ракетный иммуноэлектрофорез, аффинный иммуноэлектрофорез и изоэлектрическое фокусирование.
Проточная цитометрия также может быть использована для определения количества белка. При проточной цитометрии луч света отдельной длины волны направляют на гидродинамически сфокусированный поток жидкости. Ряд детекторов (некоторые флуоресцентные) нацеливают на точку, в которой поток проходит через луч света: один - на линии с лучом света, и несколько детекторов - перпендикулярно ему. Каждая суспендированная частица от 0,2 до 150 микрометров, проходя через луч, рассеивает светопределенным образом, и флуоресцентные химические соединения, обнаруженные в частице или присоединенные к частице, могут быть возбуждены в излучаемом свете при большей длине волны, чем у источника света. Эта комбинация рассеянного и флуоресцентного света воспринимается детекторами, и тогда путем анализа колебаний в яркости на каждом детекторе можно получать различные типы информации о физической и химической структуре каждое отдельной частицы. Технология Luminex основана методике покрывания микросфер специфическими реагентами для захвата определенного антигена из образца. MS является аналитической методикой для определения композиции элементов образца или молекулы. Она также используется для выяснения химических структур молекул, таких как белки и другие химические соединения. Принцип MS заключается в ионизации химических соединений для образования заряженных молекул или фрагментов молекул и измерения их отношений массы к заряду.
Ферментативная активность может быть измерена рядом способов. Все ферментные анализы измеряют либо потребление субстрата, либо продуцирование продукта за время. В целом, наиболее часто используются четыре типа экспериментов: эксперименты с начальной скоростью, эксперименты с кривой процесса, эксперименты кинетики переходного процесса или релаксационные эксперименты. Эти анализы предусматривают спектрофотометрические, флуорометрические, калориметрические, хемилюминесцентные, рассеивания света, радиометрические, хроматографические и колориметрические анализы, такие как анализ МТТ.
Таким образом, в одном варианте осуществления отношение экспрессии определяется измерением количества кодирующего ТН полинуклеотида в сравнении с количеством присутствующего кодирующего GCH1 полинуклеотида, более предпочтительно количество мРНК ТН в сравнении с количеством мРНК GCH1. В другом варианте осуществления измеряется экспрессия полипептидов ТН и GCH1 с помощью количества экспрессируемого белка. В еще одном предпочтительном варианте осуществления отношение экспрессии определяется измерением ферментной активности полипептидов ТН и CGH1.
В одном варианте осуществления настоящего изобретения отношение TH:GCH1 составляет по меньшей мере 3:1, такое как по меньшей мере 4:1, например, по меньшей мере 5:1, такое как по меньшей мере 6:1, например, по меньшей мере 7:1, такое как по меньшей мере 10:1, например, 15:1, такое как 20:1, например, 25:1, такое как 30:1, например, 35:1, такое как 40:1, например, 45:1, такое как 50:1.
В предпочтительном варианте осуществления настоящего изобретения отношение TH:GCH1 составляет 7:1.
В одном варианте осуществления отношение между уровнями экспрессии ТН и GCH1 в соответствии с настоящим изобретением определяется измерением активности экспрессированных ферментов ТН и GCH1.
В другом варианте осуществления отношение между уровнями экспрессии ТН и GCH1 в соответствии с настоящим изобретением определяется измерением количества тетрагидробиоптерина (ВН4), промежуточного продукта в биосинтезе катехоламина/допамина.
В другом варианте осуществления отношение между уровнями экспрессии ТН и GCH1 в соответствии с настоящим изобретением определяется измерением количества транскрибированной мРНК.
В другом варианте осуществления отношение между уровнями экспрессии ТН и GCH1 в соответствии с настоящим изобретением определяется измерением количества экспрессируемого белка.
Тирозингидроксилаза
Тирозингидроксилаза, сокращенно ТН, является монооксигеназой, которая катализирует превращение тирозина в 3,4-дигидроксифенилаланин (DOPA), предшественник допамина. Активность ТН модифицируется транскрипционными и посттрансляционными механизмами в ответ на изменения в окружающей среде, а также на нервные и гормональные стимулы. Наиболее сильная регуляция активности ТН происходит посредством посттрансляционной модификации белка путем фосфорилирования.
Как упоминалось, основной функцией тирозингидроксилазы является превращение тирозина в допамин. ТН, прежде всего, обнаруживается в допаминергических нейронах, но не ограничивается этим. Ген ТН важен в эмбриональном развитии, поскольку нокаутный по ТН генотип является летальным на 14 день развития эмбриона у мышей, тогда как гетерозиготные мыши с мутацией ТН развиваются нормально только с незначительным понижением содержания катехоламина.
Фермент ТН является высоко специфическим, не принимая индольных производных, что является необычным, поскольку многие другие ферменты, вовлеченные в продуцирование катехоламинов, это делают.Как ограничивающий скорость фермент в синтезе катехоламинов, ТН играет ключевую роль в физиологии адренергических нейронов. Катехоламины, такие как допамин, являются главными участниками в передаче сигнала указанных адренергических нейронов. Нарушение функции адренергических нейронов обычно приводит к возникновению нескольких нейродегенеративных нарушений, таких как периферическая невропатия, боковой амиотрофический склероз, болезнь Альцгеймера, болезнь Паркинсона, болезнь Гентингтона, ишемический удар, острое повреждение головного мозга, острое повреждение спинного мозга, опухоли нервной системы, рассеянный склероз, травма или повреждение периферического нерва, воздействие нейротоксинов, метаболические заболевания, такие как диабет или почечные дисфункции, и повреждение, вызванное инфекционными агентами, или нарушения настроения, такие как депрессии. ТН, введенная с конструкциями и способами в соответствии с настоящим изобретением, может быть использована в лечении болезни Паркинсона.
Полинуклеотидная последовательность, кодирующая ТН в соответствии с настоящим изобретением, изложена в SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14. В предпочтительном варианте осуществления настоящее изобретение относится к SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11 и SEQ ID NO. 12 и вариантам последовательности полинуклеотида, кодирующего полипептид ТН, характеризующийся идентичностью последовательностей по меньшей мере 70% к указанной SEQ ID NO., более предпочтительно 75% идентичностью последовательностей, например, по меньшей мере 80% идентичностью последовательностей, такой как по меньшей мере 85% идентичность последовательностей, например, по меньшей мере на 90% идентичность последовательностей, такой как по меньшей мере на 95% идентичность последовательностей, например, по меньшей мере на 96% идентичность последовательностей, такой как по меньшей мере на 97% идентичность последовательностей, например, по меньшей мере на 98% идентичность последовательностей, такой как по меньшей мере на 99% идентичность последовательностей с SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11 и SEQ ID NO. 12.
Полинуклеотид, кодирующий ТН, содержащуюся в векторной конструкции в соответствии с настоящим изобретением, также может кодировать биологически активные фрагменты или варианты полипептида ТН.
В предпочтительном варианте осуществления такие фрагменты или варианты полинуклеотида ТН, кодируемого в соответствии с настоящим изобретением, содержат по меньшей мере 50 смежных аминокислот, такие как 75 смежных аминокислот, например, 100 смежных аминокислот, такие как 150 смежных аминокислот, например, 200 смежных аминокислот, такие как 250 смежных аминокислот, например, 300 смежных аминокислот, такие как 350 смежных аминокислот, например, 400 смежных аминокислот, такие как 450 смежных аминокислот, причем любая аминокислота, определенная в рассматриваемой последовательности, меняется на отличную аминокислоту, при условии, что не более 15 из аминокислот в указанном фрагменте или варианте изменены таким образом.
Также предусматриваются мутированные и замещенные варианты SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14 и кодируемый полипептид ТН в соответствии с настоящим изобретением. В одном варианте осуществления замены в аминокислотной последовательности являются консервативными, причем аминокислота замещена другой аминокислотой с подобными химическими и/или физическими характеристиками. Мутации могут происходить в одном или нескольких сайтах в SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14 и/или в кодируемом полипептиде ТН. В предпочтительном варианте осуществления настоящее изобретение относится к любой мутации, которая делает ТН биологически активной, такой как, например, нейтральные мутации или молчащие мутации. В более предпочтительном варианте осуществления настоящее изобретение относится к мутациям, при которых изменен один или несколько из остатков серина S8, S19, S31, S40 или S404.
В одном варианте осуществления биологически активные фрагмент, экспрессированный векторной конструкцией в соответствии с настоящим изобретением, содержит по меньшей мере 50 смежных аминокислот, причем любая аминокислота, определенная в выбранной последовательности, меняется на отличную аминокислоту, при условии, что не более 15 аминокислотных остатков в последовательности изменены таким образом.
В одном варианте осуществления полипептид тирозингидроксилазы (ТН), экспрессированный векторной конструкцией в соответствии с настоящим изобретением, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 75% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 80% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно меньшей мере на 85% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно меньшей мере на 90% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 95% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 96% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 97% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 98% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно по меньшей мере на 99% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14, более предпочтительно на 100% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14.
В одном варианте осуществления биологически активным фрагментом, экспрессированным векторной конструкцией в соответствии с настоящим изобретением, является каталитический домен тирозингидроксилазы.
В одном варианте осуществления биологически активным фрагментом, экспрессированным векторной конструкцией в соответствии с настоящим изобретением, является мутированный полипептид тирозингидроксилазы, причем один или несколько из остатков S19, S31, S40 или S404 изменены на другой аминокислотный остаток.
GTP-циклогидролаза 1
GTP-циклогидролаза 1 (GCH1) является членом семейства ферментов GTP-циклогидролаз. GCH1 является частью путей биосинтеза фолата и биоптерина. GCH1 является первым и ограничивающим скорость ферментом в биосинтезе тетрагидробиоптерина (ВН4), катализирующим превращение GTP в 7,8-DHNP-3'-TP. ВH4 является важным кофактором, необходимым для гидроксилазы ароматических аминокислот (АААН) в биосинтезе моноаминных нейротрансмиттеров: серотонина (5-гидрокситриптамина (5-НТ)), мелатонина, допамина, норадреналина и адреналина. Мутации в этом гене связаны со злокачественной фенилкетонурией и гиперфенилаланинемией, а также L-DOPA-отзывчивой дистонией. Описаны несколько альтернативно сплайсированных вариантов транскриптов, кодирующих различные изоформы; однако не все из вариантов дают функциональный фермент.
GCH1 характеризуются рядом клинических проявлений, включая некоторые нарушения. Дефекты в GCH1 вызывают недостаточность GTP-циклогидролазы 1 (GCH1D; также известную как атипичная тяжелая фенилкетонурия из-за недостаточности GTP-циклогидролазы 1). GCH1D является одной из причин злокачественной гиперфенилаланинемии из-за недостаточности тетрагидробиоптерина. Она также отвечает за дефективную нейротрансмиссию из-за истощения нейротрансмиттеров - допамина и серотонина, что приводит к заболеваниям, таким как болезнь Паркинсона. Основными симптомами являются: психомоторное замедление, тонические нарушения, конвульсии, сонливость, раздражительность, патологические движения, гипертермия, гиперсаливация и трудность глотания. Некоторые пациенты могут характеризоваться фенотипом промежуточной тяжести между тяжелой гиперфенилаланинемией и типом 5 умеренной дистонии (дистония-паркинсонизм с дневным колебанием). В этом промежуточном фенотипе заметна двигательная задержка, но нет психической отсталости, и лишь минимальная, если такая имеется, гиперфенилаланинемия. Дефекты в GCH1 являются причиной типа 5 дистонии (DYT5); также известной как прогрессирующая дистония с дневным колебанием, аутосомно-доминантный синдром Сегавы или дистония-паркинсонизм с дневным колебанием. DYT5 является DOPA-отзывчивой дистонией. Дистония определяется наличием устойчивых непроизвольных мышечных сокращений, часто приводящих к патологическим позам. DYT5, как правило, проявляется в детском возрасте как проблемы ходьбы, вызванные дистонией нижних конечностей, с обострением дистонии к вечеру. Она характеризуется постуральными и двигательными нарушениями, показывающими заметное дневное колебание. Повороты туловища являются неестественными. Симптомы облегчаются после сна и усугубляются при усталости и физических упражнениях. Существует положительный ответ на L-DOPA без побочных эффектов. Введенная GCH1 с конструкциями и способами в соответствии с настоящим изобретением может быть использована в лечении болезни Паркинсона.
Полинуклеотидная последовательность, кодирующая GCH1 в соответствии с настоящим изобретением, изложена в SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6. В предпочтительном варианте осуществления настоящее изобретение относится к SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4 и вариантам последовательности полинуклеотида, кодирующего полипептид GCH1, характеризующийся идентичностью последовательностей по меньшей мере 70% с SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4, более предпочтительно 75% идентичностью последовательностей, например, по меньшей мере 80%) идентичностью последовательностей, такой как по меньшей мере 85% идентичность последовательностей, например, по меньшей мере 90% идентичность последовательностей, такой как по меньшей мере 95% идентичность последовательностей, например, по меньшей мере 96% идентичность последовательностей, такой как по меньшей мере 97% идентичность последовательностей, например, по меньшей мере 98% идентичность последовательностей, такой как по меньшей мере 99% идентичность последовательностей с SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3 и SEQ ID NO. 4.
Полинуклеотид, кодирующий GCH1, содержащийся в векторной конструкции в соответствии с настоящим изобретением, также может кодировать биологически активные фрагменты или варианты полипептида GCH1.
В предпочтительном варианте осуществления такие фрагменты или варианты полинуклеотида GCH1, кодируемого в соответствии с настоящим изобретением, содержат по меньшей мере 50 смежных аминокислот, такие как 75 смежных аминокислот, например, 100 смежных аминокислот, такие как 150 смежных аминокислот, например, 200 смежных аминокислот, такие как 250 смежных аминокислот, причем любая аминокислота, определенная в рассматриваемой последовательность, меняется на отличную аминокислоту, при условии, что не более 15 из аминокислот в указанном фрагменте или варианте изменены таким образом.
Также предусматриваются мутированные и замещенные варианты SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6 и кодируемого полипептида GCH1 в соответствии с настоящим изобретением. В одном варианте осуществления замены в аминокислотной последовательности являются консервативными, причем аминокислота замещается отличной аминокислотой с подобными химическими и/или физическими характеристиками. Мутации могут происходить в одном или нескольких сайтах в SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6 и/или в кодируемом полипептиде GCH1. В предпочтительном варианте осуществления настоящее изобретение относится к любой мутации, которая делает GCH1 биологически активной, такой как, например, нейтральные мутации или молчащие мутации.
В одном варианте осуществления биологически активный фрагмент, экспрессированный векторной конструкцией в соответствии с настоящим изобретением, содержит по меньшей мере 50 смежных аминокислот, причем любая аминокислота, определенная в выбранной последовательности, меняется на отличную аминокислоту, при условии, что не более 15 аминокислотных остатков в последовательность изменены таким образом.
В одном варианте осуществления полипептид GTP-циклогидролазы 1 (GCH1), экспрессированный векторной конструкцией в соответствии с настоящим изобретением, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 75% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 80% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно меньшей мере на 85% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно меньшей мере на 90% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 95% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 96% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 97% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 98% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно по меньшей мере на 99% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, более предпочтительно на 100% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6.
Мишеневые ткани для лечения нейродегенеративных нарушений
Одной задачей в лечении нейродегенеративных заболеваний является локальное применение лекарственного препарата, чтобы избежать многочисленных побочных эффектов. В настоящее время большинство лекарственных препаратов для лечения нарушений мозга вводятся таким путем, чаще всего пероральным, что они достигают всего мозга. Более того, при пероральной доставке лекарственные препараты будут достигать мишеневых областей пульсирующим образом, при котором колеблющееся содержание может создавать проблему для пациента.
Важным параметром для генной терапии in vivo является выбор приемлемой мишеневой ткани. Для лечения болезни Паркинсона скорлупа и хвостатое ядро представляют особый интерес.Более конкретно, лечение должно быть сосредоточено на допаминергических нейронах области pars compacta в черном веществе.
При болезни Паркинсона, полагают, что дискинезия, которая часто сопровождает длительное лечение современным лекарственным средством выбора, L-DOPA, является результатом колеблющегося содержания лекарственного средства в головном мозге.
Одним подходом, который тестировали на доклинических животных моделях болезни Паркинсона, является улучшение замещающей допамин стратегии с помощью использования подхода генной терапии, при котором замещение допамина может быть проведено локально в скорлупе и хвостатом ядре, где недостаточность допамина наиболее выражена. Этот подход назван «стратегией замещения фермента». Обоснование этого метода лечения связано с клиническими наблюдениями пациентов с PD, которые подтверждают, что тяжелые дискинезии, индуцированные пероральным лекарственным препаратом L-DOPA, могут быть облегчены L-DOPA, инфузированным либо внутривенным, либо дуоденальным путем. Таким образом, современная гипотеза заключается в том, что дискинезии развиваются, по меньшей мере частично, из-за прерывистой, импульсной подачи DA, что происходит из-за пероральной доставки L-DOPA.
Вместо подачи допамина или L-DOPA генная терапия обеспечивает регуляцию ферментов, которые продуцируют допамин.
Таким образом, в конкретном варианте осуществления настоящего изобретения полинуклеотиды, кодирующие ферменты ТН и GCH1, доставляются в мозг больного, подлежащего лечению от болезни Паркинсона. В предпочтительном варианте осуществления указанные полинуклеотиды доставляются в одном векторе AAV. В более предпочтительном варианте осуществления указанный вектор, содержащий указанные полинуклеотиды, доставляется в мозг указанного больного, предпочтительно в хвостатое ядро и/или скорлупу. В еще более предпочтительном варианте осуществления указанный вектор доставляется так, что он эффективен в допаминергических нейронах области pars compacta в черном веществе.
Протокол дозирования и доставки
Важным параметром является дозировка ТН и GCH1, подлежащих доставке в мишеневую ткань. В этом отношении «единичная дозировка» в целом относится к концентрации ТН и GCH1 / мл композиции ТН и GCH1. Для вирусных векторов концентрация ТН и GCH1 может определяться числом вирусных частиц на мл нейротропной композиции. Оптимально для доставки ТН и GCH1 с использованием вирусного вектора экспрессии каждая единичная дозировка ТН и GCH1 будет содержать от 2,5 до 25 мкл композиции ТН и GCH1, причем композиция содержит вирусный вектор экспрессии в фармацевтически приемлемой жидкости и обеспечивает от 1010 до 1015 экспрессирующих ТН и GCH1 вирусных частиц на мл композиции ТН и GCH1 (проиллюстрировано на фигуре 7). Такие высокие титры особенно применимы для аденоассоциированного вируса, такого как вектор AAV, описанный в соответствии с настоящим изобретением. В примере 2 описывается режим дозировки вектора в соответствии с настоящим изобретением.
В одном варианте осуществления дозировка вектора, вводимого пациенту, нуждающемуся в этом, составляет от 1,5×1010 и 2,2×1012 геномных копий вектора на миллилитр серого вещества скорлупы.
В другом варианте осуществления дозировка вектора для применения в получении лекарственного препарата для лечения катехоламиновой дисфункции составляет от 1,5×1010 и 2,2×1012 геномных копий вектора на миллилитр серого вещества скорлупы больного, которому назначается для введения вектор.
В предпочтительном варианте осуществления сайтом введения является полосатое тело мозга, в частности, хвостатое ядро и/или скорлупа. Инъекция в скорлупу может метить мишеневые сайты, расположенные в различных отдаленных областях мозга, например, бледный шар, миндалевидное тело, субталамическое ядро или черное вещество. В предпочтительном варианте осуществления мишеневый(ые) сайт(ы) представляет(ют) собой черное вещество, более предпочтительно область pars compacta в черном веществе. Инъекция также может быть осуществлена как в полосатое тело, так и в черное вещество.
В данном мишеневом сайте векторная система может трансдуцировать мишеневую клетку. Мишеневой клеткой может быть клетка, обнаруженная в нервной ткани, такая как нейрон, астроцит, олигодендроцит, клетка микроглии или эпендима. В предпочтительном варианте осуществления мишеневой клеткой является нейрон, в частности, допаминергический нейрон области pars compacta в черном веществе.
Векторная система предпочтительно вводится прямой инъекцией. Способы для инъекции в мозг (в частности, в полосатое тело) хорошо известны в уровне техники (Bilang-Bleuel et al. (1997), Proc. Acad. Nati. Sci. USA 94:8818-8823; Choi-Lundberg et al. (1998) Exp.Neurol. l54:261-275; Choi-Lundberg et al. (1997), Science 275:838-841; и Mandel et al. (1997)), Proc. Acad. Natl. Sci. USA 94:14083-14088). Могут быть проведены стереотаксические инъекции.
Специалисту в данной области будет понятно, что способ прямой доставки, использованный в соответствии с настоящим изобретением, избавляется от ограничения фактора риска, связанного с генной терапией in vivo. В соответствии с настоящим изобретением доставка является прямой, и сайты доставки выбираются так, что диффузия секретируемых Th и GCH1 происходит в контролированной и заданной области мозга для оптимизации контакта с мишеневыми нейронами, тогда как минимизируется контакт с немишеневыми клетками.
Модификации свойств векторного капсида могли бы позволить нацеливание вектора на стриарную область также после интратекальной (IT) инъекции или инъекции в желудочки мозга (ICV). Это может быть достигнуто модификацией специфических доменов капсида. Например, мутация аминокислоты в положении 587 может устранить аффинность связывания HSPG серотипа 2 AAV и открыть для связывания с другими остатками клеточной поверхности, которые могут быть специфическими к типу клеток. Другой альтернативный подход заключается в создании химерных серотипов AAV, которые могли бы наследовать различные свойства связывания от двух смешанных серотипов.
Фармацевтические препараты
Для получения композиции ТН и GCH1 для применения в соответствии с настоящим изобретением кодирующие ТН и GCH1 вирусные векторы экспрессии могут быть помещены в фармацевтически приемлемую суспензию, раствор или эмульсию. Приемлемые среды содержат солевой раствор и липосомные препараты.
Более конкретно, фармацевтически приемлемые носители могут содержать стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители предусматривают воду, спиртовые/водные растворы, эмульсии или суспензии, в том числе солевой раствор и буферную среду. Парентеральные среды предусматривают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла.
Внутривенные среды предусматривают жидкие и питательные наполнители, электролитные наполнители (такие как на основе декстрозы Рингера) и т.п.
Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатирующие средства, инертные газы и т.п. Кроме того, композиция трансгенов ТН и GCH1 может быть лиофилизирована с использованием средств, хорошо известных в уровне техники, для последующего восстановления и применения в соответствии с настоящим изобретением. Система коллоидной дисперсии также может быть использована для мишеневой генной доставки.
Системы коллоидной дисперсии содержат макромолекулярные комплексы, микросферы, гранулы и системы на основе липидов, в том числе эмульсии масло-вводе, мицеллы, смешанные мицеллы и липосомы. Липосомы представляют собой искусственные мембранные везикулы, которые применяются как везикулы доставки in vitro и in vivo. Показано, что большие однослойные везикулы (LUV) с диапазоном размера от 0,2 до 4,0 мкм могут инкапсулировать значительное процентное отношение водного буфера, содержащего большие макромолекулы. РНК, ДНК и интактные вирионы могут быть инкапсулированы в водном внутреннем пространстве и доставлены в клетки в биологически активной форме (Fraley, et al., Trends Biochem. Sci., 6:77, 1981). Кроме клеток млекопитающего липосомы используются для доставки функционально кодирующих трансгенов в клетки растений, дрожжей и бактерий. Для того, чтобы липосомы могли быть эффективной средой для передачи генов, они должны обладать следующими характеристиками: (1) инкапсулирование генов, кодирующих ТН и GCH1, с высокой эффективностью без ущерба их биологической активности; (2) предпочтительное и значительное связывание с мишеневой клеткой по сравнению с немишеневыми клетками; (3) доставка водного содержимого везикула в цитоплазму мишеневой клетки с высокой эффективностью и (4) точная и эффективная экспрессия генетической информации (Mannino, et al., Biotechniques, 6:682, 1988).
Примерами липидов, применимых в получении липосом, являются фосфатидильные соединения, такие как фосфатидилглицерин, фосфатидилхолин, фосфатидилсерин, фосфатидилэтаноламин, сфинголипиды, цереброзиды и ганглиозиды. Особенно применимыми являются диацилфосфатидилглицерины, в которых липидный компонент содержит от 14 до 18 атомов углерода, в частности, от 16 до 18 атомов углерода, и является насыщенным. Типичные фосфолипиды содержат яичный фосфатидилхолин, дипалмитоилфосфатидилхолин и дистеароил фосфатидилхолин.
Нацеливание липосом может быть классифицировано на основе анатомических и механических факторов. Анатомическая классификация основана на уровне селективности, например, специфическая для органа, специфическая для клетки и специфическая для органеллы. Механическое нацеливание может отличаться на основе того, является ли оно пассивным или активным. При пассивном нацеливании используются естественная склонность липосом распределяться в клетки ретикуло-эндотелиальной системы (RES) в органах, которые содержат синусоидные капилляры.
Активное нацеливание, с другой стороны, предусматривает изменение липосомы путем соединения липосомы со специфическим лигандом, таким как моноклональное антитело, сахар, гликолипид или белок, или путем изменения композиции или размера липосомы для осуществления нацеливания на органы и типы клеток, отличные от сайтов локализации, встречающихся в природе.
Поверхность мишеневой системы доставки гена может быть модифицирована рядом способов. В случае липосомной мишеневой системы доставки группы липидов могут быть встроены в липидный бислой липосомы для поддержания нацеливающего лиганда в стабильной ассоциации с липосомным бислоем. Различные связывающие группы могут быть использованы для соединения липидных цепей в нацеливающий лиганд.
Таким образом, в одном аспекте настоящее изобретение относится к фармацевтической композиции для применения в способе лечения болезни Паркинсона, причем указанная композиция содержит одновекторную систему экспрессии и состав для доставки указанного вектора в базальные ганглии, причем указанный одновекторная система экспрессии содержит
a) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, при условии, что указанный вектор не содержит нуклеотидную последовательность, кодирующую полипептид декарбоксилазы ароматических аминокислот (AADC), или
b) первую и вторую кассеты экспрессии, причем указанная первая кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью, кодирующей полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем вектором является аденоассоциированный вектор (AAV), или
c) кассету экспрессии, содержащую промотор, первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанный промотор функционально связан с указанной первой нуклеотидной последовательностью, и причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, или
d) кассету экспрессии, содержащую первую нуклеотидную последовательность, нуклеотидную последовательность инициации трансляции, такую как сайт внутренней посадки рибосомы (IRES), и вторую нуклеотидную последовательность, причем указанная нуклеотидная последовательность инициации трансляции связывается с указанной первой и указанной второй нуклеотидными последовательностями, и причем последовательность, содержащая указанную первую нуклеотидную последовательность, связанную с указанной нуклеотидной последовательностью инициации трансляции, связанной с указанной второй нуклеотидной последовательностью, фланкирована 5'- и 3'-концевыми повторами, и причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, и причем указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, причем указанные концевые повторы содержат последовательность, способную управлять экспрессией функционально связанного полипептида.
В одном варианте осуществления настоящего изобретения полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант, экспрессированный указанной первой кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ I D NO. 3, SEQ I D NO. 4, SEQ ID NO. 5 и SEQ I D NO. 6, и причем полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, экспрессированный указанной второй кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14.
В одном варианте осуществления настоящего изобретения полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант экспрессирован, причем указанный полипептид или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем указанный полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, экспрессированный указанной второй кассетой экспрессии, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12, SEQ ID NO. 13 и SEQ ID NO. 14.
В одном варианте осуществления настоящего изобретения полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5, SEQ ID NO. 6, и причем кодируемый полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14.
В одном варианте осуществления настоящего изобретения полипептид GTP-циклогидролазы 1 (GCH1) или его биологически активный фрагмент или вариант по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 1, SEQ ID NO. 2, SEQ ID NO. 3, SEQ ID NO. 4, SEQ ID NO. 5 и SEQ ID NO. 6, и причем кодируемый полипептид тирозингидроксилазы (ТН) или его биологически активный фрагмент или вариант, по меньшей мере на 70% идентичен полипептиду, выбранному из группы, состоящей из SEQ ID NO. 7, SEQ ID NO. 8, SEQ ID NO. 9, SEQ ID NO. 10, SEQ ID NO. 11, SEQ ID NO. 12 SEQ ID NO. 13 и SEQ ID NO. 14.
В одном варианте осуществления настоящего изобретения фармацевтическая композиция, как определено в настоящем документе выше, содержит маннит, гепарин или контрастные средства для МРТ на основе гадолиния.
В другом варианте осуществления фармацевтическая композиция, как определено в настоящем документе выше, содержит трофические факторы или обратимо действующие ингибиторы протеасом.
Медицинское применение и способы лечения
В одном аспекте вектор в соответствии с настоящим изобретением, используется в качестве лекарственного препарата.
В одном аспекте настоящее изобретение относится к применению вектора, как определено в настоящем документе выше, для получения лекарственного препарата для лечения заболевания, связанного с катехоламиновой дисфункцией.
В одном аспекте настоящее изобретение относится к вектору, как определено в настоящем документе выше, для применения в способе лечения заболевания, связанного с катехоламиновой дисфункцией.
В одном аспекте настоящее изобретение относится к способу лечения заболевания, связанного с катехоламиновой дисфункцией, у пациента, нуждающегося в этом, причем указанный способ предусматривает введение указанному пациенту вектора, как определено в настоящем документе выше.
В одном варианте осуществления настоящего изобретения катехоламиновой дисфункцией является недостаточность катехоламина.
В следующем варианте осуществления настоящего изобретения катехоламиновой дисфункцией является избыток катехоламина.
В одном предпочтительным варианте осуществления недостаточностью катехоламина является недостаточность допамина.
В другом варианте осуществления избытком катехоламина является избыток допамина.
В одном варианте осуществления указанным заболеванием, связанным с катехоламиновой дисфункцией, является заболевание, нарушение или повреждение центральной и/или периферической нервной системы.
В следующем варианте осуществления указанным заболеванием, нарушением или повреждением центральной и/или периферической нервной системы является нейродегенеративное нарушение.
В другом варианте осуществления указанным, заболеванием, связанным с катехоламиновой дисфункцией, является заболевание базальных ганглиев.
В одном варианте осуществления заболевание, излечимое с использованием вектора в соответствии с настоящим изобретением, выбрано из группы, состоящей из болезни Паркинсона (PD), DOPA-чувствительной дистонии, ADHD, шизофрении, депрессии, сосудистого паркинсонизма, эссенциального тремора, хронического стресса, генных аномалий допаминового рецептора, хронического употребления опиода, кокаина, спирта или конопли, недостаточности надпочечников, гипертензии, недостаточности норадреналина, посттравматического стрессового нарушения, пристрастия к азартным играм, деменции, деменции с тельцами Леви.
В предпочтительном варианте осуществления нейродегенеративным нарушением, излечимым с использованием вектора в соответствии с настоящим изобретением, является болезнь Паркинсона (PD).
В одном аспекте настоящее изобретение относится к применению вектор а в соответствии с настоящим изобретением для получения лекарственного препарата для лечения нарушения нервной системы. Нарушением нервной системы может быть нарушение периферической нервной системы или центральной нервной системы.
Под лечением подразумевается не только излечение, а также предотвращение (не абсолютное предотвращение) или профилактическое лечение. Лечение также может быть улучшающим (не абсолютным улучшением) или симптоматическим.
Предпочтительно нарушением CNS является нейродегенеративное или нервное заболевание, в одном предпочтительном варианте осуществления настоящего изобретения нейродегенеративным заболеванием является болезнь Паркинсона.
Заболевания нервной системы можно лечить путем введения больному, нуждающемуся в этом, терапевтически эффективного количества вирусного вектора в соответствии с настоящим изобретением; или терапевтически эффективного количества фармацевтической композиции в соответствии с настоящим изобретением.
Фармацевтическая композиция
Следовательно, в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей вектор, как определено в настоящем документе выше, и фармацевтически приемлемый носитель или разбавитель.
В одном варианте осуществления настоящего изобретения рН фармацевтической композиции, как определено в настоящем документе выше, составляет от рН 4 до рН 9.
В другом варианте осуществления инъекцией фармацевтической композиции является интракраниальное, интрацеребральное, внутривенное, интравитреальное, интраназальное, внутримышечное, интраспинальное, внутрибрюшинное, подкожное, болюсное или непрерывное введение.
В одном варианте осуществления указанная фармацевтическая композиция приготавливается для введения путем инъекции, подъязычной таблетки или аэрозоля, кожного введения или ингаляции.
В одном варианте осуществления фармацевтическая композиция, как определено в настоящем документе выше, приготавливается для введения путем инъекции, суппозитория, перорального введения, подъязычной таблетки или аэрозоля, подкожного введения, ингаляции или для локального введения с использованием имплантируемой биологически совместимой капсулы.
В следующем варианте осуществления инъекция представляет собой внутривенное, внутримышечное, интраспинальное, внутриперитонеальное, подкожное, болюсное или непрерывное введение.
В одном варианте осуществления фармацевтическая композиция вводится с интервалами от 30 минут до 24 часов.
В другом варианте осуществления фармацевтическая композиция вводится с интервалами от 1 до 6 часов.
В одном варианте осуществления настоящего изобретения длительность лечения составляет от 6 до 72 часов.
В одном важном аспекте в соответствии с настоящим изобретением лечение длится пожизненно.
В следующем варианте осуществления фармацевтическая композиция, как определено в настоящем документе выше, приготавливается для введения путем инъекции, суппозитория, перорального введения, подъязычной таблетки или аэрозоля, подкожного введения, ингаляции или для локального введения с использованием имплантируемой биологически совместимой капсулы.
В одном варианте осуществления дозировка активного ингредиента, т.е. вектора, в фармацевтической композиции в соответствии с настоящим изобретением составляет от 10 мкг до 500 мг на кг массы тела, такая как от 20 мкг до 400 мг, например, от 30 мкг до 300 мг, такая как от 40 мкг до 200 мг, например, от 50 мкг до 100 мг, такая как от 60 мкг до 90 мкг, например, от 70 мкг до 80 мкг.
В следующем варианте осуществления фармацевтическая композиция в соответствии с настоящим изобретением вводится с интервалами от 72 часов до по меньшей мере 7 дней, таким как 80 часов, например, 96 часов, таким как 5 дней, например, 6 дней, таким как один раз в неделю.
В следующем варианте осуществления фармацевтическая композиция в соответствии с настоящим изобретением вводится с интервалами от 7 дней до 1 месяца, таким как один раз каждые две недели, например, каждые 3 недели.
Имплантируемые клетки-хозяева
В одном аспекте настоящее изобретение относится к выделенной клетке-хозяину, содержащей вектор, как определено в настоящем документе выше.
В одном аспекте настоящее изобретение относится к выделенным клеткам-хозяевам, трансдуцированным вектором в соответствии с настоящим изобретением. Эти клетки предпочтительно являются клетками-хозяевами млекопитающих, поскольку способны корректно секретировать и процессировать кодируемые ТН и GCH1.
Предпочтительные виды представляют собой группу, состоящую из грызуна (мышь, крыса), кролика, собаки, кошки, свиньи, обезьяны, человека.
Примеры первичных культур и клеточных линий, которые являются хорошими кандидатами для трансдукции векторами в соответствии с настоящим изобретением, представляют собой группу, состоящую из СНО, НЕК293, COS, РС12, HiB5, RN33b, нервных клеток, эмбриональных клеток, ARPE-19, MDX12, С2С12, HeLa, HepG2, стриарньгх клеток, нейронов, астроцитов, интернейронов.
В одном варианте осуществления клетка-хозяин в соответствии с настоящим изобретением выбрана из группы, состоящей из эукариотических клеток, предпочтительно клеток млекопитающего, более предпочтительно клеток примата, более предпочтительно клеток человека.
В другом варианте осуществления клетка-хозяин в соответствии с настоящим изобретением выбрана из группы, состоящей из клеток яичника китайского хомячка, СНО-К1, клеток почки новорожденного хомяка, фибробластов 3Т3 мыши, линий клеток африканской зеленой мартышки, феохромоцитомы надпочечника крысы, клеток АТ3, клеток глиальной опухоли крысы, нервных клеток крысы и гиппокампальных клеток крысы.
Примеры
Пример 1: Эффект одного вектора rAAV на непрерывную доставку DOPA на животной модели болезни Паркинсона Материалы и способы
Экспериментальный план
Все крысы в эксперименте ниже (за исключением животных в интактных контрольных группах) получали одностороннюю инъекцию 6-OHDA в медиальный пучок переднего мозга (MFB) для достижения полного поражения нигростриального пути. С четвертой по пятую недели после поражения всех пораженных животных обследовали в тесте вращения после теста индуцированного амфетамином вращения [Ungerstedt and Arbuthnott: Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system; Brain Res 1970 24 485-93]. Только животные, проявляющие>6,0 полных оборота тела/минута в направлении истощенной по DA стороны, были включены в исследование (n=54).
Двадцать крыс с подтвержденным поражением от 6-OHDA были распределены в две группы (Les-Sham и TH-GCH1) на основании их характеристики в тестах «цилиндр» и в амфетамин- и апоморфин-индуцированных вращениях (фиг.3). На 6 неделе после поражения животные в группе TH-GCH1 получали стереотаксическую инъекцию 3,5×1010 gc вектора rAAV5-TH:GCH1, а контрольная группа испытывала имитационное хирургическое вмешательство, которое предусматривало вскрытие кожи черепа и сверление отверстия в соответствующем сайте без проникновения через твердую мозговую оболочку. Животных вновь тестировали с использованием тех же тестов вращения, индуцируемого лекарственным средством, на 5 и 10 неделях после инъекции rAAV. На 5, 9 и 13 неделях после rAAV животных оценивали на том же оборудовании - ротометре без предварительного фармакологического стимула (спонтанное вращение). Тест «цилиндр» также повторяли на 5, 12 и 14 неделях после инъекции. С целью исследования эффекта лечения на моторное научение, сенсомоторную интеграцию, а также двигательную функцию, обучение в тестах с шаганием, лестницей и «коридор» начинали, как только терапевтический эффект лечения хорошо проявлялся. Тест с шаганием выполняли на 5, 10 и 12 неделях после инъекции rAAV. Тест с лестницей выполняли в одном сеансе тестов в течение 21 дня между 22-24 неделями после трансдукции. Затем животных подвергали тесту «коридор» и забивали на 28 неделе.
Сорок крыс с подтвержденным поражением от 6-OHDA распределяли в четыре группы на основании их характеристики в тесте «цилиндр», тесте с шаганием и тесте «коридор». На 6 неделе после поражения животных стереотаксически инъецировали равным объемом вектора rAAV5-TH:GCH1 (5 мкл). Четыре группы получали препараты вектора увеличивающейся концентрации, что привело к следующим четырем группам по дозе: 0,7% [9,1×108 gc] GCH1-TH (n=10), 3,4% [4,6×109 gc] GCH1-TH (n=10), 9,8% [1,3×1010 gc] GCH1-TH (n=10), 100% [1,3×1011 gc] GCH1-TH (n=10). Включали равную по размеру интактную, одновозрастную, контрольную группу в качестве стандартной (n=10). Животных оценивали в тесте «коридор» на пятой неделе после поражения от 6-OHDA (перед инъекцией AAV) и 12 неделе после AAV.
Восемь животных с подтвержденным поражением от 6-OHDA разделяли на две группы (Les-Sham и TH-GCH1) на основании их характеристики в тестах «коридор» и индуцированного амфетамином вращения. Животные в группе TH-GCH1 получали стереотаксическую инъекцию полного титра вектора AAV5-TH:GCH1, как описано ниже, и оценивались с использованием микродиализа в режиме реального времени минимум через 6 месяцев после инъекции AAV. Всех животных декапитировали, мозги быстро удаляли, стриарную ткань иссекали, а затем быстро замораживали для биохимического анализа. Средний мозг постфиксировали в 4% параформальдегиде (PFA) для подтверждения поражения от 6-OHDA. Конструкция вектора
Вирусными векторами, использованными в этом исследовании, были псевдотипированные векторы rAAV2/5, в которых интересующий трансген был фланкирован с помощью обращенных концевых повторов AAV2, упакованного в капсид AAV5 (в настоящем документе упоминается просто как rAAV). В соответствии с настоящим изобретением конструировали новую плазмиду, экспрессирующую оба трансгена ТН и GCH1. В данном случае две кассеты экспрессии сливали в одну плазмиду AAV2, ТН и GCH1 экспрессировали с использованием промотора синапсина 1 (Syn-1) человека. Ген GCH1 сопровождался поздней последовательностью SV40 poly-А, которая затем предшествовала второму промотору Syn-1, контролирующему экспрессию гена ТН. Для достижения превосходящей экспрессии гена ТН над GCH1 направленную миграцию мРНК ТН улучшали путем добавления посттранскрипционного регуляторного элемента вируса гепатита сурков (WPRE). Полную последовательность завершали ранней последовательностью SV40 poly-A (фиг.1). Векторы rAAV получали с использованием способа двойной трансфекции с соответствующей трансферной плазмидой и хелперной плазмидой, содержащими основные гены упаковки аденовируса, как ранее описано [Grimm et al.: Novel tools for production and purification of recombinant adenoassociated virus vectors; Hum Gene Ther 1998 18 2745-60; Hauswirth et al.: Production and purification of recombinant adeno-associated virus; Meth Enzymol 2000 316 743-61]. Затем их очищали с помощью ступенчатых градиентов йодиксанола и колоночной хроматографии на сефарозе Q, как подробно описано в других источниках [Ulusoy et al.: Dose Optimization for Long-term rAAV-mediated RNA Interference in the Nigrostriatal Projection Neurons; Mol Ther 2009 17 1574-84]. Суспензию очищенного вирусного вектора титровали с использованием количественной PCR TaqMan, как описано в других источниках [Ulusoy et al.: Dose Optimization for Long-term rAAV-mediated RNA Interference in the Nigrostriatal Projection Neurons; Mol Ther 2009 17 1574-84], но с праймерами и зондом, нацеленными на последовательность WPRE. Конечный титр инъецируемой суспензии вектора составлял 1,0×1013 gc/мл.
Хирургические процедуры
Все хирургические процедуры проводили при анестезии, индуцированной смесью 20:1 фентанила и дормитора (Apoteksbolaget, Sweden), инъецируемой i.p. при общем объеме приблизительно 6 мл/кг. Инъекции проводили с использованием 10 мкл гамильтоновского шприца животному, помещенному в стереотаксическую рамку (Stoelting, Wood Dale, IL). Переднезадние (АР) и срединно-боковые (ML) координаты рассчитывали, исходя из брегмы, а дорсовентральные (DV) координаты - исходя из площади твердой мозговой оболочки [Watson and Paxinos: The rat brain in stereotaxic coordinates; Academic Press San Diego 1986].
Поражения от 6-OHDA. Животные получали инъекции 6-OHDA (Sigma-Aldrich AB, Sweden) в правый MFB (14 мкг свободного основания в солевом растворе аскорбата (0,02%), инъецируемого при концентрации 3,5 мкг/мкл) для достижения полного поражения нигростриального пути [Ungerstedt and Arbuthnott: Quantitative recording of rotational behavior in rats after 6-hydroxy-dopamine lesions of the nigrostriatal dopamine system; Brain Res 1970 24 485-93]. Инъекцию проводили по следующей координате: АР: - 4,4 мм; МЛ: - 1,2 мм и DV: - 7,8 мм с зубчатой рейкой, установленной на - 2,4 мм [Carlsson et al.: Serotonin neuron transplants exacerbate L-DOPA-induced dyskinesias in a rat model of Parkinson's disease; J Neurosci 2007 27 8011-22]. Инъекцию выполняли с помощью 26-калиберной иглы, присоединенной к гамильтоновскому шприцу, со скоростью инъекции 1 мкл/минута, иглу удерживали на месте в течение дополнительных 3 минут, затем ее медленно вынимали.
Инъекции вектора rAAV. Животные в группе лечения вектором получали стереотаксическую инъекцию 5 мкл векторов rAAV5 в суспензии лактата Рингера. Инъекции выполняли как одно 1,5 мкл и одно 1 мкл внесение по каждому из двух путей иглы по следующим координатам: (1) АР:+1,0 мм; МЛ: - 2,6 мм и DV: - 4,5, - 3,5 мм и (2) АР: 0 мм; МЛ: - 3,2 мм и DV: - 5,0, - 4,0 мм с зубчатой рейкой, установленной на -2,4 мм. Инъекцию выполняли с использованием оттянутого стеклянного капилляра (внешнего диаметра 60-80 мкм), установленного на 22-калиберной игле, присоединенной к гамильтоновскому шприцу. Скорость инъекции составляла 0,4 мкл/минута, и иглу удерживали на месте в течение 1 минуты после первого внесения и 3 минуты после осуществления второго внесения, а затем ее медленно вынимали из паренхимы мозга.
Поведенческие тесты
Индуцированное лекарственным средством вращение оценивали, измеряя левые и правые полные обороты тела с использованием автоматизированных ротометрических чаш (AccuScan Instruments Inc., Columbus, Ohio) после инъекции либо D-амфетамина сульфата (2,5 мг/кг, i.p.; Apoteksbolaget, Sweden), либо апоморфина НСl (0,05 мг/кг, s.c; Sigma-Aldrich АВ, Sweden) и контролируя в течение 90 и 40 минут, соответственно. Оценки вращательной асимметрии выражали как общее количество 360° оборотов/минута, а ипсилатеральные вращения (т.е. в направлении инъецируемой стороны) определяли как положительное значение.
Тест «цилиндр», оценивающий асимметрию использования передних конечностей, проводили в целом, как описано [Kirik et al.: Growth and functional efficacy of intrastriatal nigral transplants depend on the extent of nigrostriatal degeneration; J Neurosci 2001 21 2889-96], с незначительными модификациями [Schallert and Tillerson: Innovative models of cns disease: from molecule to therapy. Intervention strategies for degeneration of dopamine neurons in parkinsonism: optimising behavioral assessment of outcome; 1999 131-51]. Крыс помещали отдельно в 20 см стеклянный цилиндр и позволяли свободно двигаться, при этом проводили запись с помощью цифровой видеокамеры. Два зеркала помещали перпендикулярно за стеклянным цилиндром, что позволяло четко видеть всю поверхность цилиндра на экране. Животных оставляли в цилиндре до тех пор, пока не отмечали по меньшей мере 20 касаний стенки цилиндра. Постановку и использование передних конечностей на стенке цилиндра в ходе этого исследовательского этапа затем оценивали в режиме реального времени с использованием покадрового анализа наблюдателем, не имеющим информации о групповой принадлежности животных. Лапу, используемую в ходе 20 контактов со стенками цилиндра во время вертикальной стойки, оценивали, и представляли касания левой передней лапы как процентное отношение к общему числу касаний. В этом тесте нормальных животных оценивали в среднем как 50%.
Тест с шаганием (акинезия передних конечностей). Акинезия передних конечностей оценивалась исследователем, не имеющим информации о групповой принадлежности отдельных крыс, с использованием теста с шаганием, первоначально описанного [Schallert et al.: Excessive bracing reactions and their control by atropine and L-DOPA in an animal analog of Parkinsonism; Exp Neurol 1979 64 33-43], модифицированного для теста с боковым шаганием [Olsson et al.: Forelimb akinesia in the rat Parkinson model: differential effects of dopamine agonists and nigral transplants as assessed by a new stepping test; J Neurosci 1995 15 3863-75] и примененного, как ранее описано [Winkler et al.: L-DOPA-induced dyskinesia in the intrastriatal 6-hydroxydopamine model of parkinson's disease: relation to motor and cellular parameters of nigrostriatal function; Neurobiol Dis 2002 10 165-86]. Кратко, исследователь прочно удерживал крысу обеими руками, отрывая ее задние лапы и одну переднюю лапу от стола, но давая возможность нефиксированной лапе контактировать с поверхностью стола. Затем животное перемещали на определенном расстоянии 90 см через поверхность стола с медленным постоянным шагом 5 секунд. Исследователь дважды оценивал количество установочных боковых шагов в направлении передней части и задней части, и рассчитывал среднее значение. Животных обучали в течение 4 дней в течение третьей недели после поражения от 6-OHDA. Средний балл дней 5-7, когда животные достигали стабильной базовой характеристики, составлял конечное зависимое переменное значение. Данные от этой временной точки составляли базовую оценку до лечения. Таким образом, среднее трех последних дней использовали как оценку характеристики до лечения. В трех следующих сеансах тестов через 6-, 9- и 12-недель после инъекции rAAV животных сначала приучали к тесту в течение одного или двух дней, а затем их оценивали в течение трех последующих дней.
Тест с лестницей использовали для оценки требующих опыта способностей передних конечностей к доставанию и захватыванию с использованием модифицированной версии изначальной схемы теста, описанной в [Montoya et al.: The "staircase test": a measure of independent forelimb reaching and grasping abilities in rats; J Neurosci Methods 1991 36 219-28], как ранее описано [Winkler et al.: Intranigral transplants of GAB A-rich striatal tissue induce behavioral recovery in rat Parkinson model and promote the effects obtained by intrastriatal dopaminergic transplants; Exp Neurol 1999 155 165-86].
Гранулы сахара (TestDiet, Richmond, VA) помещали на ступеньки двойной лестницы, разделенной широкой центральной платформой (35 мм), все заключали в маленькую плексигласовую коробку (285×60×90 мм). Животных лишали корма на 48 часов перед первым днем теста и держали на ограниченном потреблении пищи (6-8 г/день) в период теста с приемом корма только после дневного сеанса теста. Тест с лестницей выполняли как отдельный сеанс через 21 неделю после инъекций rAAV. Животных обучали в тесте с лестницей в течение 21 последовательного дня (15 минут/день) с 10 гранулами сахара, помещенными на каждую ступеньку 2-5 по обеим сторонам (всего 40 гранул/сторона), при этом день 1 определяли как первый день, когда крысы начинали доставать гранулы сахара. Данные дней 11-15 использовали как оценку стабильной характеристики. В дни 16-18 и 19-21 гранулы сахара помещали только на левой и правой полке, соответственно, ставя перед крысами задачу вынужденного выбора. Требующую опыта передних конечностей характеристику выражали как число съеденных гранул (взятых - упавших) на паркинсоновской (левой) стороне. Частоту ошибок определяли как процентное отношение упавших ((взятые - съеденные/взятые)×100).
Тест «коридор» выполняли на 5 неделе после поражения от 6-OHDA MFB перед инъекцией AAV (определяли базовую линию поражения), на неделе 12 или неделе 25 после инъекций AAV, как ранее описано [Dowd et al.: The Corridor Task: a simple test of lateralised response selection sensitive to unilateral dopamine deafferentation and graft-derived dopamine replacement in the striatum; Brain Res Bull 2005 68 24-30] для исследования латерализованной сенсомоторной реакции выбора. Кратко, крыс помещали в конец коридора (150 см × 7 см × 23 см) с 10 смежными парами крышек, равномерно распределенными по полу. Каждую крышку заполняли 5-10 гранулами сахара. Поиск определяли каждый раз, когда крыса утыкала свой нос в определенную чашку, независимо от того съедала ли она какие-либо гранулы. Повторные посещения без чередования с другими поисками не оценивали. Каждую крысу тестировали до тех пор, пока 20 поисков не были выполнены, или до истечения максимального времени 5 минут. Крыс ограничивали в корме до и в ходе тестирования, как описано выше в тесте с лестницей, и приучали в течение 10 минут 2 дня в коридоре с гранулами сахара, распределенными по полу. Для уменьшения исследовательского поведения крыс помещали в пустой коридор перед оцениванием. Затем крыс оценивали в течение 4 дней, а результаты представляли как среднее последних 2 дней. Данные выражали как число контралатеральных поисков, как процентное отношение всех выполненных поисков.
Биохимические анализы
Двенадцать крыс забивали путем декапитации, после чего мозг удаляли и делали срезы по корональным осям в двух частях с использованием шаблона мозга. Затем стриарную ткань из каждого полушария передней части быстро иссекали, замораживали отдельно на сухом льду и хранили при -80°С до дальнейшего анализа. Каудальную часть, содержащую области среднего мозга - заднего мозга, постфиксировали в 4% параформальдегиде (PFA) в течение 24 часов при 4°С, а затем хранили в 25% сахарозе в течение по меньшей мере 24 часов. Иссеченную ткань мозга гомогенизировали и готовили с использованием модифицированной версии предварительно описанного протокола, который облегчает выявление моноаминов и ВН4 с помощью жидкостной хроматографии высокого разрешения (HPLC), in vitro активности ТН и анализа вестерн-блоттинга в одном и том же образце [Romero-Ramos et al.: Low selenium diet induces tyrosine hydroxylase enzyme in nigrostriatal system of the rat; Brain Res Mol Brain Res 2000 84 7-16]. Кратко, ткань гомогенизировали на льду в Tris-ацетатном буфере (5 мкл/мг, 20 мМ, рН 6,1) с использованием ультразвукового дезинтегратора. Затем сто мкл гомогената пипетировали в равном количестве 0,8 мМ ледяной перхлорной кислоты для измерений HPLC. Оставшийся гомогенат центрифугировали в течение 10 минут при 17000 × g при 4°С. Затем сорок мкл супернатанта разводили в 10 мкл Tris-ацетатного буфера (20 мМ, рН 6,1), содержащего 0,6% Triton Х-100, и хранили при -20°С для анализа in vitro активности ТН.
Микродиализный эксперимент (фиг.8) выполняли при анестезии изофлураном. Микродиализную пробу с полупроницаемой мембраной длиной 3 мм (PES мембрана с отсечением 35 кДа, Microbiotech АВ) вставляли в правое (пораженное и трансдуцированное) полосатое теле с координатами АР: +0,5 мм; МЛ: - 2,9 мм и DV: - 4,25, - 3,5 мм и (2) АР: 0 мм; МЛ: - 3,2 мм и DV: - 5,5 с зубчатой рейкой, установленной на - 2,4 мм. Пробу нагнетали с использованием CSF при скорости потока загрузки 0,67 мкл/минута петлевых дозаторов, непосредственно соединенных с оборудованием HPLC-EC, обеспечивающим анализ с временным разрешением 15 минут.DA и метаболиты выявляли и количественно оценивали, как описано ранее (Ulusoy et al. Presynaptic dopaminergic compartment determines the susceptibility to L-DOPA-induced dyskinesia in rats. Proc Natl Acad Sci USA (2010) vol.107 (29) pp.13159-64). Данные представляли как среднее трех последовательных измерений, взятых минимум через один час приведения в равновесие после имплантации зонда.
HPLC анализ моноаминов и ВН4
Тканевой гомогенат в перхлорной кислоте инкубировали на льду в течение по меньшей мере 20 минут перед центрифугированием (15 минут при 9000 × g при 4°С). Супернатант фильтровали через фильтры Ватмана в течение дополнительных 2 минут при 9000 × g. Затем образец разводили 1:4 фильтрованной через Mili-Q деионизированной водой и хранили при -80°С до анализа. Тканевые экстракты затем анализировали с помощью HPLC-EC в трех отдельных измерениях для (1) DA и серотонина (5-НТ); (2) DOPA и (3) ВН4. Для каждого измерения 25 мкл каждого образца инъецировали с помощью охлажденного автоматического пробоотборника (Spark Holland Midas) в электрохимический детектор (ESA Coulochem III), соединенный с защитной ячейкой (ESA 5020) и аналитической ячейкой стеклоуглеродного электрода (ESA 5011). Для выявления DA/5-HT и DOPA колонку с обращенной фазой С18 (3 мкм ReproSil-pur, 04,6 мм, длиной 150 мм, Chrompack) использовали для разделения соединений, тогда как для выявления ВН4 его наносили на другую колонку с обращенной фазой С18 (5 мкм ReproSil-pur, ∅ 4,6 мм, длиной 250 мм, Chrompack) с предшествующей колонкой С8 (5 мкм ReproSil 80, ∅ 4,6 мм, длиной 33 мм, Chrompack).
Подвижная фаза для выявления DA/5-HT содержала 60 мМ ацетата натрия, 90 мкМ Na2-EDTA, 460 мкМ 1-октансульфоновой кислоты в 9% метаноле, причем рН доводили до 4,2. Для выявления DOPA она содержала 100 мМ NaH2PO4, доведенного до рН 3,0 с помощью Н3РО4, 90 мкМ Na2-EDTA, 1 мМ октилсульфата натрия в 10% метаноле. Подвижную фазу, используемую для выявления ВН4, с другой стороны, модифицировали по отношению к предварительно описанному протоколу ЕС выявления ВН4 [Howells and Hyland: Direct analysis of tetrahydrobiopterin in cerebrospinal fluid by high-performance liquid chromatography with redox electrochemistry: prevention of autoxidation during storage and analysis; Clin Chim Acta 1987 167 23-30], и она состояла из 50 мМ ацетата натрия, 5 мМ лимонной кислоты, 48 мкМ EDTA, 160 мкМ DTE в 5% метаноле, рН 5,2. Подвижные фазы доставляли при скорости потока 500 мкл/минута для катехоламинов и 1 мл/минута для ВН4. Идентификацию пиков и количественную оценку проводили с использованием программного пакета Clarity Chromatographic (DataApex, Prague, Czech Republic).
Гистологический анализ
Восемь животных глубоко анестезировали с помощью передозировки пентобарбитала натрия (Apoteksbolaget, Sweden) и транскардиально перфузировали 50 мл физиологического солевого раствора с последующими 250 мл свежеприготовленной ледяной 4% PFA в 0,1 М фосфатном буфере, доведенном до pH = 7,4. Мозги удаляли и постфиксировали в течение 2 часов в том же растворе перед криопротекцией в 25% сахарозе в течение 24-48 часов до приготовления срезов. Фиксированные мозги и постфиксированные области среднего мозга нарезали на 40 мкм коронарные срезы на полу-автоматизированном замораживающем микротоме (Microm НМ 450), объединяли в 6 серий и хранили в растворе антифриза (0,5 М натрий-фосфатного буфера, 30% глицерина и 30% этиленгликоля) при -20°С до дальнейшей обработки. Иммуногистохимию выполняли с использованием антител, индуцированных против ТН (кроличий IgG 1:10000 Pel-Freez, Rogers, AR) и GCH1 (изготовленный по заказу кроличий IgG, 1:5000). Окрашивание визуализировали с использованием биотинилированных вторичных антител (антитело козы против иммуноглобулина кролика ВА1000, Vector Laboratories, Burlingame, С А) с последующей 1-часовой инкубацией с авидин-биотин-пероксидазным раствором (ABC Elite, Vector Laboratories), развивающим с помощью 3,3'-диаминобензидина в 0,01% Н2О2 цветную реакцию.
Пример 2: Расчеты дозировки
Сведения в исследованиях на грызунах с использованием опосредованной одним вектором AAV доставки DOPA в крысиной модели полной допаминовой денервации позволили точно определить диапазон дозы, необходимой для функционального восстановления. Путем тщательной оценки обнаружили, что доза 9,1×108 gc GCH1-TH (определяемая как 0,7%, таблица 1А) приводила к существенному восстановлению у 2 из 10 животных в тесте «коридор». Следующая доза 4,6×109 gc GCH1-TH (3,4%) приводила к восстановлению у 8 из 10 животных, тогда как две самые высокие тестированные дозы, 1,3×1010 gc GCH1-TH (9,8%) и 1,3×1011 gc GCH1-TH (100%), обеспечили общее восстановление у 10 из 10 животных в этом тесте. Однако 100% доза приводила к более быстрому полному восстановлению уже на третьей неделе после хирургического вмешательства.
Для расчетов эквивалентов дозировки у отличных от человека приматов и у людей коэффициент пересчета для путаменальной области рассчитывали на основании литературных данных по MR и гистологической оценки (таблица 1В). Эти данные обеспечивают коэффициент пересчета между грызунами и людьми 1:60. Эта схема позволяет расчет эквивалента общей дозы между видами (таблица 1С), а также подтверждает, что такие дозы являются реалистичными на основании достигаемых в настоящий момент титров вирусного продуцирования. На основании допускаемого титра продуцирования 3×1013 gc/мл инъецируемая доза на скорлупу человека будет составлять от 1,82 мкл до 260 мкл (таблица 1D).
Для определений, которые отрегулированы по индивидуальным различиям пациентов по объему скорлупы и массе тела, дозу повторно определяли как gc/см3серого вещества скорлупы или на кг веса тела (таблица 1Е). Кроме того, эквиваленты на мкг одноцепочечной ДНК (ssDNA) векторного препарата получили на основе молекулярной массы векторного генома (1,4 г/мкмоль).
Таблица 1. Определение диапазона терапевтической дозы
Средняя масса пациента 74 кг рассчитана из ссылок (3,4, 5). Молекулярная масса генома вирусного вектора рассчитана как 1,4 г/мкмоль.
При определении дозы в соответствии с настоящим изобретением опирались на следующие ссылки:
(1) Chakos et al. Striatal enlargement in rats chronically treated with neuroleptic. Biol Psychiatry (1998) vol.44 (8) pp.675-84.
(2) Yin et al. Striatal volume differences between non-human and human primates. J Neurosci Methods (2009) vol.176 (2) pp.200-5.
(3) Beyer et al. Weight change and body composition in patients with Parkinson's disease. J Am Diet Assoc (1995) vol.95 (9) pp.979-83.
(4) Uc et al. Predictors of weight loss in Parkinson's disease. MovDisord (2006) vol.21 (7) pp.930-6.
(5) Delikanaki-Skaribas et al. Daily energy expenditure, physical activity, and weight loss in Parkinson's disease patients. MovDisord (2009) vol.24 (5) pp.667-71.
Все экспериментальные процедуры, выполненные и представленные в настоящем документе, одобрены Комитетом по этике использования лабораторных животных области Lund-Malmö. Номера разрешений Комитета по этике: М59-06 и М267-08.
Пример 3: Последовательности, предусмотренные в соответствии с настоящим изобретением
SEQ ID NO 1: GTP-циклогидролаза 1 (человек)
SEQ ID NO 2: GTP-циклогидролаза 1 изоформа GCH-2 (человек)
SEQ ID NO 3: GTP-циклогидролаза 1 изоформа GCH-3 (человек)
SEQ ID NO 4: GTP-циклогидролаза 1 изоформа GCH-4 (человек)
SEQ ID NO 5: GTP-циклогидролаза 1 (крыса)
SEQ ID NO 6: GTP-циклогидролаза 1 (мышь)
SEQ ID NO 7: тирозин-3-гидроксилаза (человек)
SEQ ID NO 8: тирозин-3-монооксигеназа (человек)
SEQ ID NO 9: тирозингидроксилаза (человек)
SEQ ID NO 10: тирозингидроксилаза (человек)
SEQ ID NO 11: тирозин-3-монооксигеназа (человек)
SEQ ID NO 12: тирозин-3-монооксигеназа (человек)
SEQ ID NO 13: тирозин-3-гидроксилаза (крыса)
SEQ ID NO 14: тирозин-3-гидроксилаза (мышь)
SEQ ID NO 15: левая концевая последовательность аденоассоциированного вируса 2 SEQ ID NO 16: правая концевая последовательность аденоассоциированного вируса 2 SEQ ID NO 17: промоторная последовательность синапсина 1 (SYN1) Homo sapiens SEQ ID NO 18: GTP-циклогидролаза 1 (GCH1) Homo sapiens, вариант 1 транскрипта SEQ ID NO 19: ранняя последовательность поли-аденилирования вируса обезьяны 40 SEQ ID NO 20: поздняя последовательность поли-аденилирования вируса обезьяны 40 SEQ ID NO 21: тирозингидроксилаза (ТН) Homo sapiens, вариант 2 транскрипта SEQ ID NO 22: последовательность посттранскрипционного регуляторного элемента вируса гепатита В сурков (WHV8)
SEQ ID NO 1: GTP-циклогидролаза 1 (человек)

SEQ ID NO 2: GTP-циклогидролаза 1 изоформа GCH-2 (человек)

SEQ ID NO 3: GTP-циклогидролаза 1 изоформа GCH-3 (человек)

SEQ ID NO 4: GTP-циклогидролаза 1 изоформа GCH-4 (человек)

SEQ ID NO 5: GTP-циклогидролаза 1 (крыса)

SEQ ID NO 6: GTP-циклогидролаза 1 (мышь)

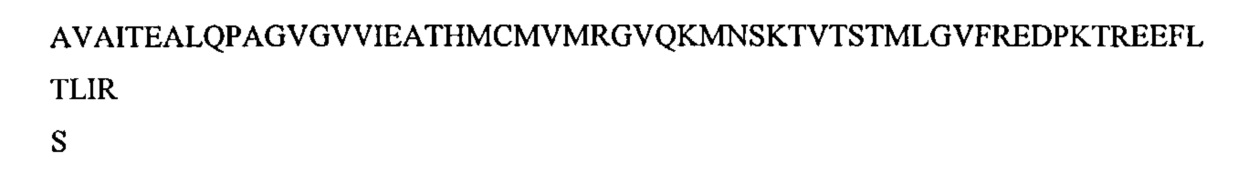
SEQ ID NO 7: тирозин-3-гидроксилаза (человек)

SEQ ID NO 8: тирозин-3-монооксигеназа (человек)


SEQ ID NO 9: тирозингидроксилаза (человек)

SEQ ID NO 10: тирозингидроксилаза (человек)


SEQ ID NO 11: тирозин-3-монооксигеназа (человек)


SEQ ID NO 12: тирозин-3-монооксигеназа (человек)

SEQ ID NO 13: тирозин-3-гидроксилаза (крыса)


SEQ ID NO 14: тирозин-3-гидроксилаза (мышь)

SEQ ID NO 15: Левая концевая последовательность аденоассоциированного вируса 2

SEQ ID NO 16: Правая концевая последовательность аденоассоциированного вируса 2
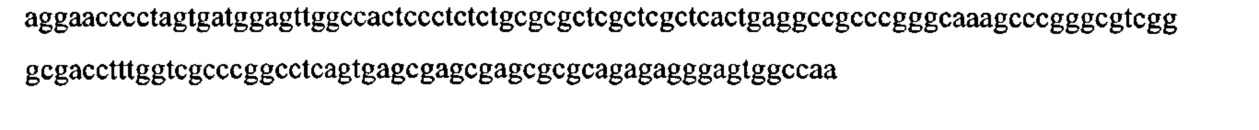
SEQ ID NO 17: Промоторная последовательность синапсина 1 (SYN1) Homo sapiens

SEQ ID NO 18: GTP-циклогидролаза 1 (GCH1) Homo sapiens, вариант 1 транскрипта
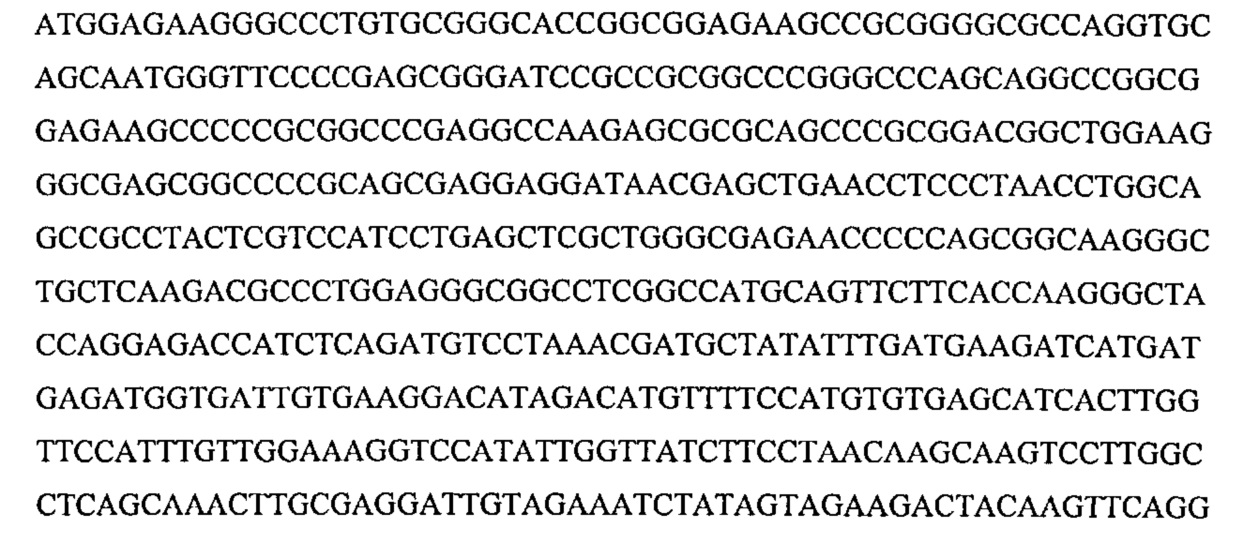

SEQ ID NO 19: Ранняя последовательность поли-аденилирования вируса обезьяны 40

SEQ ID NO 20: Поздняя последовательность поли-аденилирования вируса обезьяны 40

SEQ ID NO 21: Тирозингидроксилаза (ТН) Homo sapiens, вариант 2 транскрипта


SEQ ID NO 22: Последовательность посттранскрипционного регуляторного элемента вируса гепатита В сурков (WHV8)

Реферат
Изобретения касаются двухцистронного вектора экспрессии, его применения для облегчения болезни Паркинсона, фармацевтической композиции и способа определения соотношения экспрессии полипептида GTP-циклогидроксилазы 1 и полипептида тирозингидрокислазы, экспрессируемых указанным двухцистронным вектором. Представленный вектор содержит первую верхнюю по ходу транскрипции кассету экспрессии и вторую нижнюю по ходу транскрипции кассету экспрессии. Указанная первая верхняя по ходу транскрипции кассета экспрессии содержит нуклеотидную последовательность, содержащую первую промоторную последовательность, функционально связанную с первой нуклеотидной последовательностью, причем указанная первая нуклеотидная последовательность кодирует полипептид GTP-циклогидролазы 1 (GCH1; ЕС 3.5.4.16). Указанная вторая нижняя по ходу транскрипции кассета экспрессии содержит нуклеотидную последовательность, содержащую вторую промоторную последовательность, функционально связанную со второй нуклеотидной последовательностью. Указанная вторая нуклеотидная последовательность кодирует полипептид тирозингидроксилазы (ТН; ЕС 1.14.16.2). Причем вектором является аденоассоциированный вектор (AAV) и указанная вторая нуклеотидная последовательность функционально связана с посттранскрипционным регуляторным элементом вируса гепатита сурков (WPRE). Указанный первый и указанный второй промоторы являются промоторами синапсина 1, указанные первая верхняя по ходу транскрипции и вторая нижняя по ходу транскрипции кассеты содержат последовательность полиаденилирования, а кассеты экспрессии указанного двухцистронного вектора экспрессии содержат
Формула
Документы, цитированные в отчёте о поиске
Днк-фрагмент, кодирующий нейротропный фактор мозга (bdnf), белок bdnf и способ его получения

Комментарии